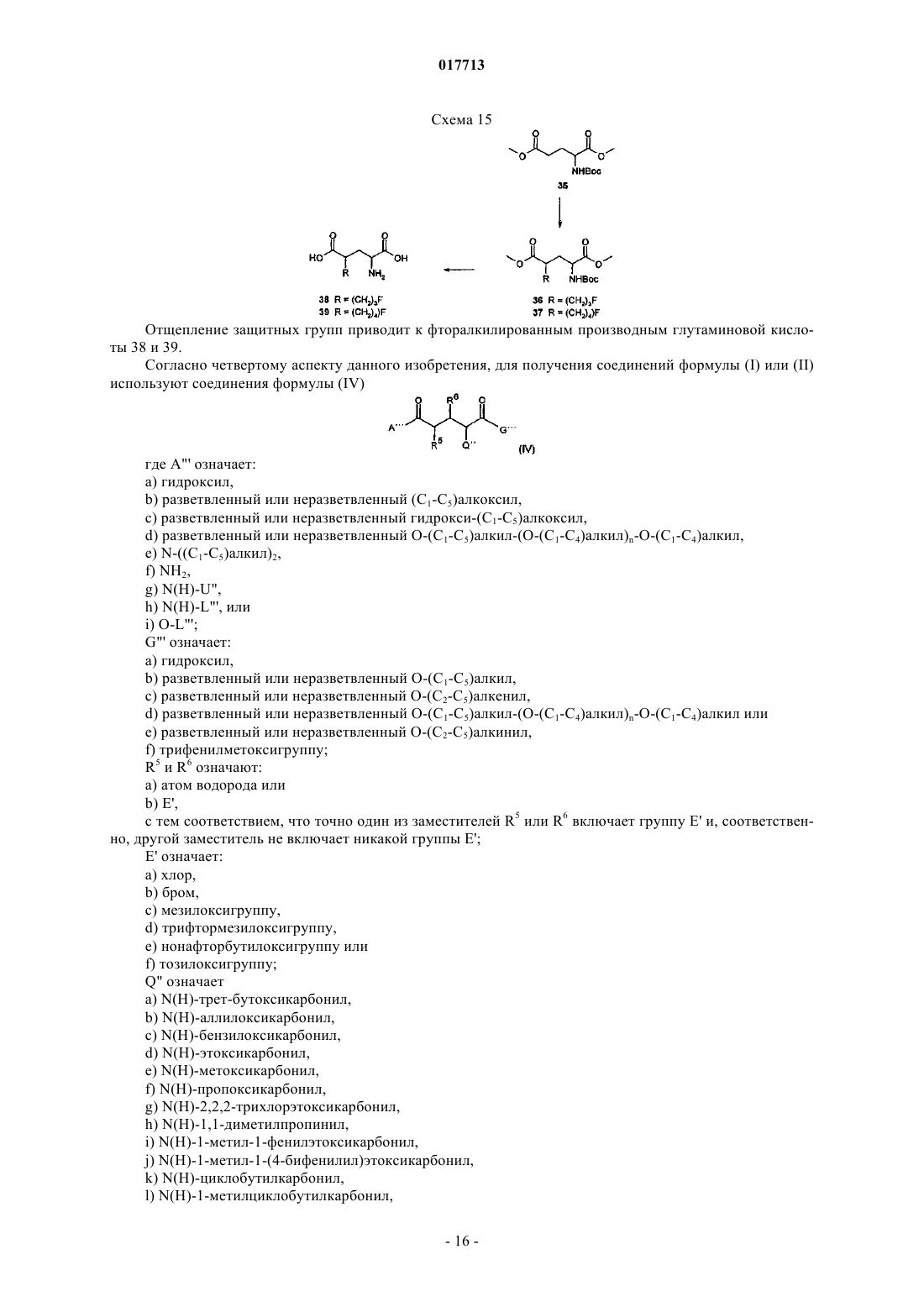
[f-18]-меченая l-глутаминовая кислота, [f-18]-меченый l-глутамин, их производные и их применение, а также способ их получения
Номер патента: 17713
Опубликовано: 28.02.2013
Авторы: Грэхэм Кит, Белоконь Юрий Николаевич, Шмитт-Виллих Хериберт, Динкельборг Лудгер, Красикова Раиса Николаевна, Леманн Лутц, Фрибе Маттиас, Берндт Матиас, Кузнецова Ольга Федоровна
Формула / Реферат
1. Соединения общей формулы (I)
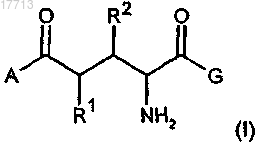
где А означает:
a) гидроксил,
b) метоксигруппу,
c) этоксигруппу,
d) пропоксигруппу,
e) NMe2,
f) NEt2 или
g) NH2;
G означает:
a) гидроксил,
b) метоксигруппу или
c) этоксигруппу;
R1 и R2 означают:
a) атом водорода,
b) 18F,
c) разветвленный или неразветвленный 18F-(C1-C5)-алкоксил,
d) разветвленный или неразветвленный 18F-(C1-C5)-алкил,
при условии, что один из заместителей R1 или R2 обязательно включает изотоп 18F, а другой заместитель в каждом случае не включает изотоп 18F;
и его диастереомеры и энантиомеры.
2. Соединения по п.1, отличающиеся тем, что А означает ОН, метоксигруппу или NH2.
3. Соединение по п.1 или 2, отличающееся тем, что А означает ОН.
4. Соединение по п.1 или 2, отличающееся тем, что А означает NH2.
5. Соединения по пп.1-4, отличающиеся тем, что R1 и R2 выбирают из группы, состоящей из атома водорода, 18F, 18F-метоксигруппы, 18F-этоксигруппы, 18F-пропоксигруппы, 18F-метила, 18F-этила и 18F-пропила, при условии, что один из заместителей R1 или R2 обязательно включает 18F-изотоп и, соответственно, другим заместителем является водород.
6. Соединение по пп.1-4, отличающееся тем, что R1 означает 18F и R2 означает водород.
7. Соединение по пп.1-4, отличающееся тем, что R2 означает 18F и R1 означает водород.
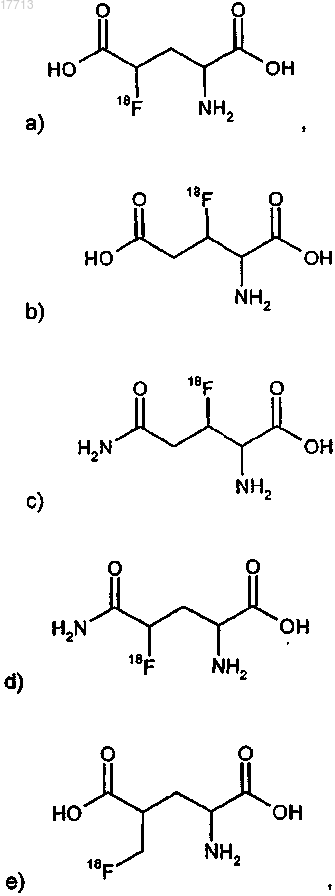
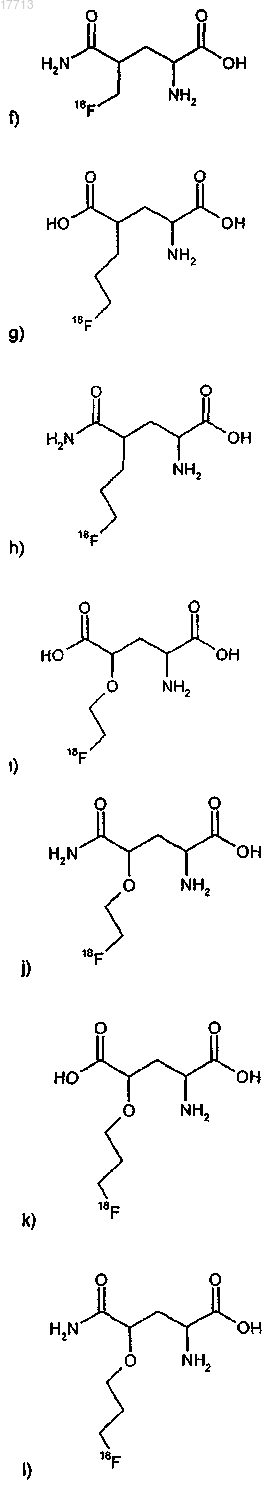
8. Соединение по п.1, выбираемое из группы соединений формулы
9. Соединения общей формулы (II)
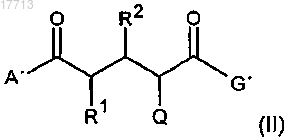
где А' означает:
a) гидроксил,
b) метоксигруппу,
c) этоксигруппу,
d) трет-бутоксигруппу,
e) NMe2,
f) NEt2,
g) NH2,
h) N(H)-U;
G' означает:
a) гидроксил,
b) OZ',
c) метоксигруппу,
d) этоксигруппу,
e) трет-бутоксигруппу,
f) изопропоксигруппу или
g) O-C2H4-OMe;
R1 и R2 означают:
a) атом водорода,
b) 18F,
c) разветвленный или неразветвленный 18F-(C1-C5)-алкоксил,
d) разветвленный или неразветвленный 18F-(C1-C5)-алкил,
при условии, что точно один из заместителей R1 или R2 обязательно включает изотоп 18F, а другой заместитель в каждом случае не включает изотоп 18F;
Q означает:
a) N(Н)-трет-бутоксикарбонил,
b) N(Н)-аллилоксикарбонил,
c) N(Н)-бензилоксикарбонил,
d) N(Н)-этоксикарбонил,
e) N(Н)-метоксикарбонил,
f) N(Н)-пропоксикарбонил,
g) N(H)-2,2,2-трихлорэтоксикарбонил,
h) N(Н)-1,1-диметилпропинил,
i) N(H)-1-метил-1-фенилэтоксикарбонил,
j) N(Н)-1-метил-1-(4-бифенилил)этоксикарбонил,
k) N(Н)-циклобутилкарбонил,
l) N(H)-1-метилциклобутилкарбонил,
m) N(Н)-винилкарбонил,
n) N(Н)-аллилкарбонил,
o) N(Н)-адамантилкарбонил,
р) N(Н)-дифенилметилкарбонил,
q) N(Н)-циннамилкарбонил,
r) N(Н)-формил,
s) N(Н)-бензоил,
t) N(Н)-тритил,
u) N(H)-п-метоксифенилдифенилметил,
v) N(Н)-ди(п-метоксифенил)фенилметил,
w)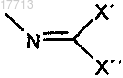
или
х) N-(трет-бутоксикарбонил)2;
U означает:
a) трет-бутоксикарбонил,
b) аллилоксикарбонил,
c) бензилоксикарбонил,
d) этоксикарбонил,
e) метоксикарбонил или
f) пропоксикарбонил;
X' и X", независимо друг от друга, означают:
a) разветвленный или неразветвленный (C1-C5)алкил или
b) замещенный или незамещенный арил; и
Z' означает Ni2+, Mg2+, Ca2+, Na+ и K+;
и его диастереомеры и энантиомеры.
10. Соединения по п.9, отличающиеся тем, что А' означает ОН, метоксигруппу, этоксигруппу, трет-бутокигруппу, -NH-трет-бутоксикарбонил или NH2.
11. Соединения по п.9 или 10, отличающиеся тем, что А' означает этоксигруппу.
12. Соединения по пп.9-11, отличающиеся тем, что А' означает NH2.
13. Соединения по пп.9-12, отличающиеся тем, что R1 и R2 выбирают из группы, состоящей из атома водорода, 18F, 18F-метоксигруппы, 18F-этоксигруппы, 18F-пропоксигруппы, 18F-метила, 18F-этила и 18F-пропила, с тем соответствием, что один из заместителей R1 или R2 обязательно включает 18F-изотоп и, соответственно, другим заместителем является водород.
14. Соединение по пп.9-13, отличающееся тем, что R1 означает 18F и R2 означает водород.
15. Соединение по пп.9-13, отличающееся тем, что R2 означает 18F и R1 означает водород.
16. Соединение по пп.9-15, отличающееся тем, что G' выбирают из группы, состоящей из ОН, этоксигруппы, метоксигруппы и OZ'.
17. Соединение по пп.9-16, отличающееся тем, что G' означает этоксигруппу.
18. Соединение по пп.9-17, отличающееся тем, что Z' означает Ni2+.
19. Соединение по пп.9-18, отличающееся тем, что Q выбирают из группы, состоящей из N(Н)-трет-бутоксикарбонила, N(Н)-бензилоксикарбонила и
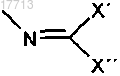
где X и X', независимо друг от друга, означают:
a) разветвленный или неразветвленный (C1-C5)-алкил или
b) замещенный или незамещенный арил.
20. Соединение по пп.9-19, отличающееся тем, что Q означает N(H)-трет-бутоксикарбонил.
21. Соединение по пп.9-20, отличающееся тем, что Q означает
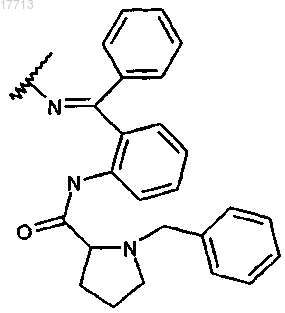
22. Соединение по п.9, выбираемое из группы соединений формулы
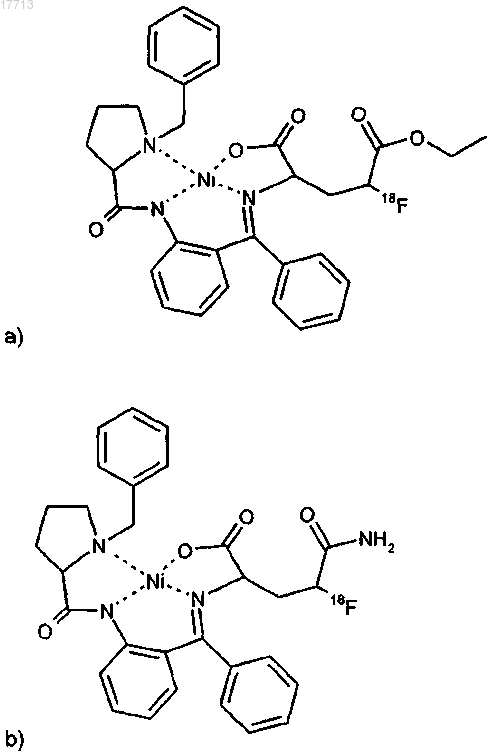
23. Способ получения соединений общей формулы (I) по пп.1-8 путем осуществления кислотного отщепления защитной группы на соединении формулы (II) по пп.9-22, причем кислота является органической кислотой или неорганической кислотой.
24. Способ получения соединений общей формулы (II) по пп.9-22 путем реакции соединения формулы (III) по п.28 и [F-18]-фторида.
25. Применение соединения по пп.1-22 в качестве лекарственного средства для лечения опухолевых заболеваний.
26. Применение соединения по пп.1-22 для диагностики опухолевых заболеваний.
27. Применение соединений по пп.1-22 для получения фармацевтического препарата для диагностики опухолевых заболеваний.
28. Соединения формулы (III)
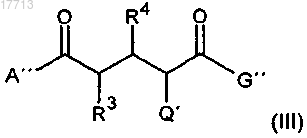
где А" означает:
a) гидроксил,
b) метоксигруппу,
c) этоксигруппу,
d) трет-бутоксигруппу,
e) NMe2,
f) NEt2,
g) NH2 или
h) N(H)-U';
G" означает:
a) гидроксил,
b) OZ",
c) метоксигруппу,
d) этоксигруппу,
e) трет-бутоксигруппу,
f) изопропоксигруппу или
g) O-C2H4-OMe;
R3 и R4 означают:
a) атом водорода,
b) OH,
c) разветвленный или неразветвленный Е-(C1-C5)-алкоксил или
d) разветвленный или неразветвленный Е-(C1-C5)-алкил,
при условии, что один из заместителей R3 или R4 обязательно включает группу Е, а другой заместитель в каждом случае не включает группу Е;
Е означает:
a) хлор,
b) бром,
c) мезилоксигруппу,
d) трифтормезилоксигруппу,
e) нонафторбутилоксигруппу или
f) тозилоксигруппу;
Q' означает:
a) N(Н)-трет-бутоксикарбонил,
b) N(Н)-аллилоксикарбонил,
c) N(Н)-бензилоксикарбонил,
d) N(Н)-этоксикарбонил,
e) N(Н)-метоксикарбонил,
f) N(Н)-пропоксикарбонил,
g) N(Н)-2,2,2-трихлорэтоксикарбонил,
h) N(Н)-1,1-диметилпропинил,
i) N(H)-1-метил-1-фенилэтоксикарбонил,
j) N(Н)-1-метил-1-(4-бифенилил)этоксикарбонил,
k) N(Н)-циклобутилкарбонил,
l) N(H)-1-метилциклобутилкарбонил,
m) N(Н)-винилкарбонил,
n) N(Н)-аллилкарбонил,
о) N(Н)-адамантилкарбонил,
р) N(Н)-дифенилметилкарбонил,
q) N(Н)-циннамилкарбонил,
r) N(Н)-формил,
s) N(Н)-бензоил,
t) N(Н)-тритил,
u) N(H)-п-метоксифенилдифенилметил,
v) N(H)-ди(п-метоксифенил)фенилметил,
w)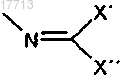
или
x) N-(трет-бутоксикарбонил)2;
U' означает:
a) трет-бутоксикарбонил,
b) аллилоксикарбонил,
c) бензилоксикарбонил или
d) этоксикарбонил;
X' и X", независимо друг от друга, означают:
a) разветвленный или неразветвленный (C1-C5)-алкил и
b) замещенный или незамещенный арил; и
Z" означает Ni2+, Mg2+, Ca2+, Na+ и K+;
и его диастереомеры и энантиомеры.
29. Применение соединений формулы (IV) для получения соединений формулы (I) или (II):

где
А"' означает:
a) гидроксил,
b) метоксигруппу,
c) этоксигруппу,
d) трет-бутоксигруппу,
e) NMe2,
f) NEt2,
g) NH2 или
h) N(H)-U'';
G"' означает:
a) гидроксил,
b) OZ',
c) метоксигруппу,
d) этоксигруппу,
e) трет-бутоксигруппу,
f) изопропоксигруппу или
g) О-С2Н4-ОМе;
R5 и R6 означают:
a) атом водорода или
b) Е',
при условии, что один из заместителей R5 или R6 обязательно представляет собой Е', а другой заместитель представляет собой атом водорода;
Е' означает:
a) хлор,
b) бром,
c) мезилоксигруппу,
d) трифтормезилоксигруппу,
е) нонафторбутилоксигруппу или
f) тозилоксигруппу;
Q" означает:
a) N(Н)-трет-бутоксикарбонил,
b) N(Н)-аллилоксикарбонил,
c) N(Н)-бензилоксикарбонил,
d) N(Н)-этоксикарбонил,
e) N(Н)-метоксикарбонил,
f) N(Н)-пропоксикарбонил,
g) N(H)-2,2,2-трихлорэтоксикарбонил,
h) N(Н)-1,1-диметилпропинил,
i) N(H)-1-метил-1-фенилэтоксикарбонил,
j) N(Н)-1-метил-1-(4-бифенилил)этоксикарбонил,
k) N(Н)-циклобутилкарбонил,
l) N(H)-1-метилциклобутилкарбонил,
m) N(Н)-винилкарбонил,
n) N(Н)-аллилкарбонил,
о) N(Н)-адамантилкарбонил,
р) N(Н)-дифенилметилкарбонил,
q) N(Н)-циннамилкарбонил,
r) N(Н)-формил,
s) N(Н)-бензоил,
t) N(H)-тритил,
u) N(H)-п-метоксифенилдифенилметил,
v) N(Н)-ди(п-метоксифенил)фенилметил,
w)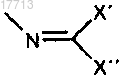
или
х) N-(трет-бутоксикарбонил)2;
L"' означает:
a) метил,
b) этил,
c) пропил или
d) изопропил;
U" означает:
a) трет-бутоксикарбонил,
b) аллилоксикарбонил,
c) бензилоксикарбонил,
d) этоксикарбонил,
e) метоксикарбонил или
f) пропоксикарбонил;
X' и X", независимо друг от друга, означают:
a) разветвленный или неразветвленный (C1-C5)-алкил и
b) замещенный или незамещенный арил,
Z' означает Ni2+, Mg2+, Ca2+, Na+ и K+;
и его диастереомеры и энантиомеры.
Текст
[F-18]-МЕЧЕНАЯ L-ГЛУТАМИНОВАЯ КИСЛОТА, [F-18]-МЕЧЕНЫЙ L-ГЛУТАМИН,ИХ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ, А ТАКЖЕ СПОСОБ ИХ ПОЛУЧЕНИЯ(71)(73) Заявитель и патентовладелец: БАЙЕР ШЕРИНГ ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE); УЧРЕЖДЕНИЕ РОССИЙСКОЙ АКАДЕМИИ НАУК ИНСТИТУТ ЭЛЕМЕНТООРГАНИЧЕСКИХ СОЕДИНЕНИЙ ИМ. А.Н. НЕСМЕЯНОВА РАН (ИНЭОС РАН); ИНСТИТУТ МОЗГА ЧЕЛОВЕКА РОССИЙСКОЙ АКАДЕМИИ НАУК Описаны соединения и синтез [F-18]-меченой L-глутаминовой кислоты, [F-18]-меченого Lглутамата, их производные формулы (I) и их применения. 017713 Изобретение относится к охарактеризованным в формуле изобретения объектам, а именно, [F-18]меченой L-глутаминовой кислоте и [F-18]-меченому L-глутамину общей формулы (I), их прозводным, а также их применению и способу их получения. Ранний диагноз злокачественных опухолевых заболеваний играет очень важную роль для прогноза выживания онкологических больных. В случае этого диагноза важным вспомогательным средством являются неинвазивные, диагностические способы визуализации. В последние годы в этом отношении оказалась особенно полезной прежде всего РЕТ-технология (позитронная эмиссионная томография). Чувствительность и специфичность РЕТ-технологии зависит, по существу, от используемого, дающего сигнал вещества (радиоактивный индикатор) и его распределения в организме. В поисках пригодных радиоактивных индикаторов пытаются использовать определенные свойства опухолей, которые отличают опухолевую ткань от окружающей здоровой ткани. Предпочтительным коммерчески доступным используемым изотопом, который находит применение в случае PET, является 18F. В случае 18F за счет его короткого периода полураспада менее 2 ч предъявляются особые требования в отношении получения пригодных радиоактивных индикаторов. Дорогостоящие, длительные пути синтеза и очистки при использовании этого изотопа являются невозможными, так как иначе значительная доля радиоактивности изотопа уже исчезает, прежде чем можно использовать радиактивный индикатор для диагноза. Поэтому зачастую невозможно применять известные пути синтеза для нерадиоактивных фторировании в случае синтеза 18Fрадиоактивных индикаторов. Далее, высокая удельная активность 18F (примерно 80 ГБк/нмоль) приводит к очень незначительным количествам вещества, [18F]-фторида, для синтеза радиактивного индикатора,что снова обусловливает предельный избыток предшественника и делает непредусматриваемым успех базирующейся на нерадиактивных реакциях фторирования стратегии радиосинтеза. Позитронная эмиссионная томография на основе FDG ([18F]2-фтордезоксиглюкоза) представляет собой в значительной степени принимаемое во внимание и широко известное вспомогательное средство при диагнозе и дальнейшем клиническом наблюдении опухолевых заболеваний. Злокачественные опухоли конкурируют с организмом-хозяином в отношении обеспечения глюкозой для снабжения питательным веществом (Warburg О. "Uber den Stoffwechsel der Carcinomzelle", Biochem. Zeitschrift, 152, 309-339Development", Clin. Cancer Res., 11(8), 2785-2807 (2005. При этом опухолевые клетки, по сравнению с окружающими клетками нормальной ткани, обычно обладают повышенным метаболизмом глюкозы. Это используется при применении фтордезоксиглюкозы (FDG), производного глюкозы, которое усиленно транспортируется в клетки, однако, там после фосфорилирования метаболически блокируется в видеFDG-6-фосфата ("Варбург-эффект"). 18F-Меченая FDG поэтому является эффективным радиоактивным индикатором для детекции опухолевых заболеваний у пациентов посредством РЕТ-технологии. В поисках новых радиоактивных индикаторов для PET в самое последнее время также используют в возрастающей степени аминокислоты для получения изображения с помощью 18F-PET (например, (обзор): Eur.J. Nucl. Med. Mol. Imaging, 29(5), 681-690 (2002, май. При этом пригодны некоторые из 18F-меченых аминокислот для определения соотношения скоростей в случае белкового синтеза, в большинстве случаев другие производные, но для определения прямого поглощения клеткой в случае опухоли. ИзвестныеF-меченые аминокислоты производятся, например, от тирозиновой, фенилаланиновой, пролиновой, аспарагиновой и неприродных аминокислот (например, J. Nucl. Med., 32, 1338-1346 (1991); J. Nucl. Med.,37, 320-325 (1996); J. Nucl. Med., 42, 752-754 (2001); или J. Nucl. Med., 40, 331-338 (1999. Глутаминовая кислота и глутамин в качестве 18F-меченых производных являются неизвестными, тогда как нерадиоактивные фторированные производные глутамина и глутаминовой кислоты известны; так, например, таковые, которые содержат фтор в -положении (например, (обзор): Amino Acids, 24(3), 245-261 (2003, апрель или в -положении (например, Tetrahedron Lett., 30(14), 1799-1802 (1989); J. Org. Chem., 54(2), 498500 (1989); Tetrahedron: Asymmetry, 12(9), 1303-1312 (2001. В прошлом уже сообщалось о производных глутаминовой кислоты, которые в случае защитных групп для химических функциональных групп и в - или -положении обладают удаляемой группой. Так,имеется информация о глутамате в виде мезилата, соответственно, бромида в -положении кислотные группы и аминогруппы которых снабжены сложноэфирными, соответственно, Z-защитными группами (J.Chem. Soc. Perkin Trans., 1, 1323-1328(1986, или, например, о -хлорглутаминовой кислоте без защитных групп (Synthesis, 44-46 (1973. О подобных производных, в случае которых, однако, в -положении расположены удаляемые группы, также неоднократно сообщалось: например, Chem. Pharm. Bull., 17(5), 879-885Chem. Pharm. Bull., EN, 17(5), 873-878 (1969); патент Франции 1461184; патент Японии 13142. Современные радиоактивные индикаторы для PET, которые используют в случае диагностики опухолей, обладают некоторыми бесспорными недостатками: так, FDG хотя и накапливается предпочтительно в таких клетках с повышенным метаболизмом глюкозы, однако, также в случае других патологических и физиологических состояний повышенный метаболизм глюкозы происходит в причастных к этому клетках и тканях, например, в очагах инфекции или при заживлении раны (обобщено в J. Nucl.Med. Technol., 33, 145-155 (2005. Часто всегда еще трудно решить, действительно ли определяемое с помо-1 017713 щью FDG-PET повреждение неопластического происхождения или объясняется другими физиологическими или патологическими состояниями ткани. В целом, диагностируемость с помощью FDG-PET в онкологии имеет чувствительность на 84% и специфичность на 88% (Gambhir и др. "A tabulated summary of the FDG PETliterature", J. Nucl. Med., 42, 1-93S (2001. Опухоли в головном мозге, например, только очень трудно можно определять вследствие высокого накопления FDG в здоровой ткани головного мозга. До сих пор известные 18F-меченые аминокислотные производные в некоторых случаях хорошо пригодны для детектирования опухолей в головном мозге обзор): Eur. J. Nucl. Med. Mol. Imaging, 29(5),681-690 (2002, май, однако, в случае других опухолей они не могут конкурировать со свойствами получения изображения за счет "Гольд-стандарта" [18F]2-FDG. Метаболическое накопление и ретенция меченых до сих пор с помощью 18F аминокислот в опухолевой ткани, как правило, ниже, чем в случае FDG. Сверх того, доступность изомерночистых 18F-меченых неароматических аминокислот является химически в наивысшей степени претенциозной. Подобно как в случае глюкозы, также в случае глутаминовой кислоты и глутамина описан повышенный метаболизм в пролиферирующих опухолевых клетках (Medina, J. Nutr., 1131, 2539S-2542S(2001); Souba, Ann. Surg., 218, 715-728 (1993. Повышенная скорость в случае синтезов белков и нуклеиновых кислот, а также выработка энергии per se считаются причинами усиленного потребления глутамина опухолевыми клетками. Синтез соответствующих 11 С- и 14 С-меченых, также идентичных природному субстрату соединений уже описан в литературе (например, Antoni "Enzyme Catalyzed Synthesis of L-[4-C11]Aspartate and L-[5-C-11]Glutamate", J. Labelled Compd. Radiopharm., 44(4), 287-294 (2001); и Buchanan"The biosynthesis of showdomycin: studies with stable isotopes and the determination of principal precursors",J. Chem. Soc. Chem. Commun., EN, 22, 1515-1517 (1984. Первые указания с 11 С-меченым соединением не свидетельствуют ни о какой значительной аккумуляции в опухоли. Задачей настоящего изобретения является получение новых соединений, которые в [18F]-меченой форме пригодны для базирующегося на PET диагноза. Задача решается благодаря предлагаемому согласно изобретению получению [18F]-меченой Lглутаминовой кислоты и [18F]-меченого L-глутамина, а также их производных согласно общей формуле(I), включая их диастереомеры и энантиомеры:a) атом водорода,b) 18F,c) разветвленный или неразветвленный 18F-(C1-C5)-алкоксил,d) разветвленный или неразветвленный 18F-(C1-C5)-алкил,при условии, что один из заместителей R1 или R2 обязательно включает изотоп 18F, а другой заместитель в каждом случае не включает изотопа 18F; и причем все возможные диастереомеры и энантиомеры являются частью настоящего объекта изобретения. Особенно предпочтительные соединения согласно изобретению формулы (I) отличаются тем, что А означает:c) NH2. Предпочтительные соединения согласно изобретению формулы (I) отличаются тем, что А означает ОН. Предпочтительные соединения согласно изобретению формулы (I) отличаются тем, что А означает NH2. Особенно предпочтительные соединения согласно изобретению формулы (I) отличаются тем, что G означает:-2 017713 Предпочтительные соединения согласно изобретению формулы (I) отличаются тем, что R1 и R2 означают:h) 18F-пропил; с тем соответствием, что один из заместителей R1 или R2 обязательно включает 18F-изотоп и, соответственно, другим заместителем является водород. Следующие предпочтительные соединения согласно изобретению формулы (I) отличаются тем, чтоe) 18F-этил; с тем соответствием, что один из заместителей R1 или R2 обязательно включает 18F-изотоп и, соответственно, другим заместителем является водород. Особенно предпочтительные соединения согласно изобретению формулы (I) отличаются тем, чтоc) 18F-метил; с тем соответствием, что один из заместителей R1 или R2 обязательно включает 18F-изотоп и, соответственно, другим заместителем является водород. Особенно предпочтительные соединения согласно изобретению формулы (I) отличаются тем, чтоR1 выбирают из группы, состоящей из ОН, СН 3, С 2 Н 5 и С 3 Н 7, и R2 означает 18F. Особенно предпочтительные соединения согласно изобретению формулы (I) отличаются тем, чтоR2 выбирают из группы, состоящей из ОН, СН 3, С 2 Н 5 и С 3 Н 7, и R1 означает 18F. Особенно предпочтительные соединения согласно изобретению формулы (I) отличаются тем, чтоR1 означает Н и R2 означает 18F. Особенно предпочтительные соединения согласно изобретению формулы (I) отличаются тем, чтоR1 означает 18F и R2 означает Н. Все возможные диастереомеры и знантиомеры предпочтительных соединений формулы (I) являются частью настоящего объекта изобретения. Далее, особенно предпочтительно любое отдельное из соединений из следующей группы, причем все возможные диастереомеры и энантиомеры являются частью настоящего объекта изобретения:-3 017713 Способ получения предлагаемых согласно изобретению соединений общей формулы (I) отличается тем, что соединение формулы (I) высвобождают из соединения-предшественника соединения формулы(II) после введения 18F-изотопа. Согласно второму аспекту, таким образом, настоящее изобретение относится к соединениям формулы (II)a) атом водорода,b) 18F,c) разветвленный или неразветвленный 18F-(C1-C5)-алкоксил,d) разветвленный или неразветвленный 18F-(C1-C5)-алкил,при условии, что точно один из заместителей R1 или R2 обязательно включает изотоп 18F, а другой заместитель в каждом случае не включает изотопа 18F; Q означает:X' и X", независимо друг от друга, означают:a) разветвленный или неразветвленный (C1-C5)алкил илиb) замещенный или незамещенный арил; иZ' означает Ni2+, Mg2+, Ca2+, Na+ и K+; и все возможные диастереомеры и энантиомеры являются частью настоящего объекта изобретения. Особенно предпочтительные соединения согласно изобретению формулы (II) отличаются тем, что А' означает этоксигруппу. Особенно предпочтительные соединения согласно изобретению формулы (II) отличаются тем, что А' означает NH2. Другие предпочтительные соединения согласно изобретению формулы (II) отличаются тем, что G' означает:d) этоксигруппу. Особенно предпочтительные соединения согласно изобретению формулы (II) отличаются тем, чтоG' означает этоксигруппу. Предпочтительные соединения согласно изобретению формулы (II) отличаются тем, что R1 и R2 означают:h) 18F-пропил; с тем соответствием, что точно один из заместителей R1 или R2 обязательно включает 18F-изотоп и,соответственно, другим заместителем является водород. Следующие предпочтительные соединения согласно изобретению формулы (II) отличаются тем,что R1 и R2 означаютe) 18F-этил; с тем соответствием, что точно один из заместителей R1 или R2 обязательно включает 18F-изотоп и,соответственно, другим заместителем является водород. Особенно предпочтительные соединения, согласно изобретению, формулы (II) отличаются тем, чтоc) 18F-метил; с тем соответствием, что точно один из заместителей R1 или R2 обязательно включает 18F-изотоп и,соответственно, другим заместителем является водород. Особенно предпочтительные соединения, согласно изобретению, формулы (II) отличаются тем, чтоb) Особенно предпочтительные соединения согласно изобретению формулы (II) отличаются тем, что Предпочтительные соединения согласно изобретению формулы (II) отличаются тем, что U означает:c) этоксикарбонил. Другие предпочтительные соединения согласно изобретению формулы (II) отличаются тем, что U означает:b) этоксикарбонил. Особенно предпочтительные соединения согласно изобретению формулы (II) отличаются тем, чтоU означает трет-бутоксикарбонил. Другие предпочтительные соединения согласно изобретению формулы (II) отличаются тем, что X' иX" независимо друг от друга означают:a) разветвленный или неразветвленный (C1-C5)алкил илиb) замещенный или незамещенный арил. Особенно предпочтительные соединения согласно изобретению формулы (II) отличаются тем, чтоX' и X" означают фенил, соответственно, замещенный в положении 2 фенил. Предпочтительные соединения согласно изобретению формулы (II) отличаются тем, чтоZ' выбирают из группы, состоящей из Na+, K+, Са 2+ и Mg2+; причем все возможные диастереомеры и энантиомеры предпочтительных соединений согласно изобретению формулы (II) являются частью настоящего объекта изобретения. Далее, особенно предпочтительно любое отдельное из соединений из следующей группы, причем все возможные диастереомеры и энантиомеры являются частью настоящего объекта изобретения: Способ получения предлагаемых согласно изобретению соединений общей формулы (II) отличается тем, что большинство соединений формулы (II) можно получать из соединения-предшественника соединения формулы (III) после введения 18F-изотопа. Согласно третьему аспекту, настоящее изобретение относится к соединениям формулы (III):a) атом водорода,b) OH,c) разветвленный или неразветвленный Е-(C1-C5)-алкоксил, илиd) разветвленный или неразветвленный Е-(C1-C5)-алкил,при условии, что один из заместителей R3 или R4 обязательно включает группу Е, а другой заместитель в каждом случае не включает группы Е; Е означает:X' и X" независимо друг от друга означают:a) разветвленный или неразветвленный (C1-C5)алкил иb) замещенный или незамещенный арил; иZ" означает Ni2+, Mg2+, Ca2+, Na+ и K+; и все возможные диастереомеры и энантиомеры являются частью настоящего объекта изобретения.d) NH2. Другие предпочтительные соединения согласно изобретению формулы (III) отличаются тем, что G" означает:c) метоксигруппу. Предпочтительные соединения согласно изобретению формулы (III) отличаются тем, что R3 и R4 означают:g) E-пропил; с тем соответствием, что один из заместителей R3 или R4 обязательно включает группу Е и, соответственно, другим заместителем является водород. Следующие предпочтительные соединения, согласно изобретению, формулы (III) отличаются тем,что R3 и R4 означают:d) Е-этил; с тем соответствием, что один из заместителей R3 или R4 обязательно включает группу Е и, соответственно, другим заместителем является водород. Особенно предпочтительные соединения согласно изобретению формулы (III) отличаются тем, чтоb) Е-метил; с тем соответствием, что один из заместителей R3 или R4 обязательно включает группу Е и, соответственно, другим заместителем является водород. Другие предпочтительные соединения согласно изобретению формулы (III) отличаются тем, что Е означает:b) мезилоксигруппу. Предпочтительные соединения согласно изобретению формулы (III) отличаются тем, что Q' означает Другие предпочтительные соединения согласно изобретению формулы (III) отличаются тем, что U' означает:b) бензилоксикарбонил. Особенно предпочтительные соединения согласно изобретению формулы (III) отличаются тем, чтоU' означает трет-бутоксикарбонил. Особенно предпочтительные соединения согласно изобретению формулы (III) отличаются тем, чтоX' и X" означают фенил, соответственно, замещенный в положении 2 фенил. Предпочтительные соединения согласно изобретению формулы (III) отличаются тем, что Z" означает Ni2+. Причем все возможные диастереомеры и энантиомеры предпочтительных соединений формулы(III) являются частью настоящего объекта изобретения. Понятие"арил", так как оно в данном контексте используется само по себе или в качестве части другой группы, относится к моноциклическим или бициклическим ароматическим группам, которые могут включать от шести до двенадцати атомов углерода в цикле, такими как, например, фенил или нафтил, и в положении 2 могут быть любым образом замещены. Арильные группы могут быть замещены в любом пригодном месте, которое приводит к стабильному соединению, одним или несколькими остатками из следующей группы: гидроксил, галоген, (C1-C5)алкил, (C1-С 5)алкоксил, цианогруппа, CF3, нитрогруппа. В качестве заместителей можно назвать метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, гидроксил, фтор, хлор, бром, метил, этил, пропил, изопропил или трифторметил. Под галогеном нужно понимать, соответственно, фтор, хлор, бром или иод. Понятие "алкил", так как оно в данном контексте используется само по себе или в качестве части другой группы, относится к (C1-C6)алкильным группам, которые могут быть линейными или разветвленными и означают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил или н-пентил, 2,2 диметилпропил, 2-метилбутил или 3-метилбутил. Предпочтительным является метил или этил. Под алкилом нужно понимать, соответственно, линейный или разветвленный алкильный остаток, как, например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил или гексил, гептил, октил, нонил, децил, ундецил, додецил. Алкенильные заместители являются, соответственно, линейными или разветвленными, причем, например, можно назвать следующие остатки: винил, пропен-1-ил, пропен-2-ил, бут-1-ен-1-ил, бут-1-ен-2 ил, бут-2-ен-1-ил, бут-2-ен-2-ил, 2-метилпроп-2-ен-1-ил, 2-метилпроп-1-ен-1-ил, бут-1-ен-3-ил, этинил,проп-1-ин-1-ил, бут-1-ин-1-ил, бут-2-ин-1-ил, бут-3-ен-1-ил, аллил. Алкинильные группы могут быть линейными или разветвленными и означают, например, СС,-СН 2-ССН, -СС-СН 3, -CH(CH3)-CCH, -СС-СН 2(СН 3), -С(СН 3)-ССН, -СС-СН(СН 3)2-, -СН(СН 3)СС-СН 3, -СН 2-СС-СН 2(СН 3).(С 1-С 5)-Алкоксильные группы могут быть линейными или разветвленными и означают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу,трет-бутоксигруппу или н-пентоксигруппу, 2,2-диметилпропоксигруппу, 2-метилбутоксигруппу или 3 метилбутоксигруппу. Предпочтительной является метоксигруппа или этоксигруппа. Гетероарильный остаток включает, соответственно, 5-16 атомов в цикле и вместо атома углерода может содержать один или несколько одинаковых или разных гетероатомов, таких как кислород, азот или сера, в цикле и может быть моно-, би- или трициклическим и дополнительно может быть, соответственно, бензоконденсированным. Например, можно назвать тиенил, фуранил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил,изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил и т.д.; и их бензопроизводные, такие как, например, бензофуранил, бензотиенил, бензотиазол, бензоксазолил, бензимидазолил, индазолил, индолил, изоиндолил и т.д.; или пиридил, пиридазинил, пиримидинил, пиразинил, триазинил и т.д. и их бензопропизводные, такие как, например, хинолил, изохинолил и т.д.; или азоцинил, индолизинил и т.д. и их бензопроизводные; или хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил, нафтиридинил,птеридинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, ксантенил, оксепинил. Изобретение относится также к Ni2+-комплексу, содержащему шиффово основание соединения формулы (I) и соединения (S)-2-[N-(N-бензилпропил)амино]бензофенон, как таковому, и к его примене-9 017713 нию для получения соединения формулы (I). Далее, изобретение также относится к Ni2+-комплексу, содержащему шиффово основание соединения-предшественника соединения формулы (I) и соединения (S)-2-[N-(N-бензилпропил)амино]бензофенон, как таковому, и к его применению для получения соединения формулы (I). Предлагаемые согласно изобретению соединения, такие как, например, 4-фтор-L-глутаминовая кислота и 4-фтор-L-глутамин, можно получать, например, как представлено на схеме 1, путем катализируемого металлом асимметрического синтеза при использовании Ni2+-комплекса содержащего глицин шиффова основания и (S)-2-[N-(N-бензилпропил)амино]бензофенона (ВРВ) (1)3, а также этилового эфира При этом С-С-связывание может осуществляться как в протонных, так и также в апротонных растворителях. Реакцию можно проводить в мягких условиях, например при комнатной температуре, или при повышенных температурах. При этом добавление основания является вспомогательным. Так, например, можно использовать диизопропиламин, диизопропилэтиламин, триэтиламин или подобное. Реакционную смесь предпочтительно перемешивают в течение 1-3 ч и затем снова смешивают с этилбромакрилатом или бромакриламидом. За протеканием реакции можно следить с помощью тонкослойной хроматографии(ТСХ). Для этой цели пригодны, в частности, системы силикагель/этилацетат/хлороформ. После добавления этилбромакрилата или -бромакриламида и перемешивания по меньшей мере в течение 1 ч,реакция в значительной степени завершается. Реакционную смесь затем нейтрализуют путем добавления органической или неорганической кислоты (или комбинации из обеих), как, например, уксусная кислота,муравьиная кислота, трифторуксусная кислота, трихлоруксусная кислота, пропионовая кислота, соляная кислота, серная кислота, хлорная кислота, фосфорная кислота и т.д. Ni-комплекс этилового эфира 4 бромглутаминовой кислоты можно выделять из реакционной смеси путем экстракции. Для этой цели пригодны, например, органические галогенированные или негалогенированные растворители, как, например, хлороформ, дихлорметан, простые диалкиловые эфиры, этилацетат, алканы и т.д. После высушивания органической фазы с помощью осушителя (например, сульфат натрия, сульфат кальция или подобное) ее концентрируют досуха в вакууме. Путем препаративной тонкослойной хроматографии (например, на силикагеле при использовании смеси растворителей из этилацетата и CHCl3 в соотношении 1:1) можно констатировать смесь стереоизомерных комплексов, как 3 (S,S,S) и 3 (S,R,S/R). Комплекс 3 (S,S,R) можно выделять, например, при использовании вышеуказанной разделительной системы со значением Rf, равным 0,49. Комплексы 3 можно элюировать с силикагеля, например, с помощью МеОН, EtOH и т.д. и затем очищать путем колоночной хроматографии, например, на сефадексе при использовании смесей EtOH/C6H6. Полученный комплекс затем можно использовать для дальнейших реакций замещения в случае замещенного бромом атома углерода. Предлагаемое согласно изобретению соединение-предшественник 3 путем нуклеофильного замещения с помощью [18F]F- можно переводить в соответствующее фторированное соединениепредшественник 4. Для этого комплексы 3 в присутствии основания, как, например, NBu4OH,(NBu4)2CO3, K2CO3 и т.д., можно вводить во взаимодействие с соответствующим раствором фторида. Реакцию предпочтительно проводят при повышенной температуре. Добавление краун-эфиров, как, например, криптофикс (К 2.2.2), может положительно влиять на реакцию, особенно в комбинации с K2CO3 в качестве катализирующего основания.- 10017713 Фторированные соединения, 4-фторглутаминовую кислоту или 4-фторглутамин, можно высвобождать из соответствующих комплексов 3 путем обработки кислотами, такими как, например, соляная кислота, фосфорная кислота, хлорная кислота, серная кислота и т.д. При этом приходят как к отщеплению аминокислотного производного, так и также к расщеплению сложного эфира в положении 5 при применении 5-метилового эфира 4-фторглутаминовой кислоты. 4-Фторглутаминовую кислоту можно подвергать предварительной очистке при использовании картуша (например, QMA (Waters), LiChrolut (VWR/Merck) или WHAT6803-2005 SPE COLSAX(VWR/Merck). Отделение от примесей (комплексное соединение 3,4,4-бромглутаминовая кислота и т.д.) можно осуществлять посредством высокоэффективной жидкостной хроматографии (ВЭЖХ). Пригодными ВЭЖХ-системами, например, могут быть: колонка: содержащий аминогруппы силикагель (например,Zorbax-NH2); элюент: 20 мМ NaH2PO4 в воде; объемная скорость потока: 4 мл/мин. Очищенное соединение 5 можно концентрировать путем пригодного удаления ВЭЖХ-растворителя и использовать для применения в рамках данного изобретения. Удаление ВЭЖХ-растворителя можно осуществлять различным образом. Пригодным является концентрирование при использовании роторного испарителя при пониженном давлении, нагревание образца в нагревательном блоке в токе азота и т.д. или нанесение на картуш концентратора (например, С-18 SepPack и т.д.), с последующим элюированием при использовании небольшого количества EtOH/водного раствора хлорида натрия или подобным образом с дальнейшим последующим концентрированием вышеуказанными способами. Предлагаемые согласно изобретению соединения, в случае которых [F-18]-изотоп также находится в положении 4 скелета молекулы глутаминовой кислоты (5), также можно получать как представлено на схеме 2. Так, например, осуществляют кислотное отщепление защитных групп соединения 6 для получения предлагаемого согласно изобретению соединения, 4-фторметилглутаминовой кислоты (5). Схема 2 При этом можно использовать различные органические кислоты (например, трифторуксусную кислоту), прежде всего, однако, неорганические кислоты, такие как, например, бромоводородная кислота,соляная кислота, серная кислота, хлорная кислота или фосфорная кислота. Очистка предлагаемого согласно изобретению соединения 5 формулы (I) возможна путем ВЭЖХ, причем, в принципе, могут быть предварительно и как последующие дополнительные включены различные стадии очистки, например очистка при использовании картуша RP-C18 или других разделительных материалов. Радиохимическое фторирование тозилата 7, синтез которого осуществляют аналогично описанному в литературе способу (X. Zhang, Tetrahedron Lett., 42, 5335-5338 (2001, исходя из соединения 8 (N.Sharma и др., Tetrahedron Lett., 45, 1403-1406 (2004, для получения [F-18]-меченого производного глутаминовой кислоты 6 осуществляют согласно известным специалисту в данной области способам (см. схему 3). Схема 3 При этом соединение 7 в присутствии основания, такого как, например, тетраалкиламмонийкарбонат и тетраалкилфосфонийкарбонат и карбонат калия и т.д., можно вводить во взаимодействие с соответствующим раствором [F-18]-фторида. Реакцию предпочтительно проводят при повышенных температурах. Добавление краун-эфиров, таких как, например, криптофикс (К 2.2.2), может положительно влиять на реакцию, особенно в комбинации с K2CO3 в качестве катализирующего основания. Возможными растворителями являются предпочтительно апротонные, однако, также протонные растворители или, однако, можно использовать апротонные добавки к растворителю, как, например, вода. Обычно для радиохимического фторирования с помощью [F-18]-фториданионов используют ацетонитрил, диметилсульфоксид или диметилформамид в качестве оптимальных растворителей. Предлагаемые согласно изобретению соединения, такие как 6, можно подвергать очистке путем ВЭЖХ и/или при использовании картушей,- 11017713 причем, в принципе, могут быть предварительно и как последующие дополнительные включены различные стадии очистки, например, очистка при использовании картуша RP-C18 или других разделительных материалов. Получение справочных [F-19]-соединений 10 и 11 осуществляют, как представлено на схеме 4. Схема 4 Так, например, соединение 10 можно получать путем окисления фторпролинового производного 9. Справочное вещество с открытой цепью 11 можно получать путем раскрытия цикла соединения 10. Далее, предлагаемые согласно изобретению соединения 5 также можно получать непосредственно из циклического соединения 8 (схема 3) при использовании описанных условий фторирования. Отщепление защитных групп, соответственно, раскрытие цикла можно осуществлять аналогично условиям для кислотного отщепления защитных групп (схема 2). Для этого можно использовать различные органические кислоты (такие как, например, трифторуксусная кислота), прежде всего, однако, неорганические кислоты, такие как, например, бромоводородная кислота, соляная кислота, серная кислота,хлорная кислота или фосфорная кислота. Далее, щелочное раскрытие цикла также возможно при использовании гидроксида лития, гидроксида натрия, гидроксида калия и т.д. (S. Baker и др., Tetrahedron Lett.,39, 2815-2818 (1998. Предлагаемые согласно изобретению соединения, в случае которых [F-18]-изотоп находится в положении, например в случае 3-фторглутаминовой кислоты (12), можно получать как представлено на схеме 5. Так, например, осуществляют кислотное отщепление защитных групп от соединения 13 для получения предлагаемого согласно изобретению соединения 3-фторглутаминовой кислоты (12). Схема 5 При этом можно использовать различные органические, прежде всего, однако, неорганические кислоты, такие как, например, бромоводородная кислота, соляная кислота, серная кислота, хлорная кислота или фосфорная кислота. Отщепление защитных групп в сильно щелочных условиях при использовании,например, раствора гидроксида натрия или раствора гидроксида калия является менее благоприятным, в принципе, однако, также применяемым и осуществляемым. Очистка предлагаемого согласно изобретению соединения 12 формулы (I) возможна путем ВЭЖХ, причем, в принципе, могут быть предварительно и как последующие дополнительные включены различные стадии очистки, как, например, очистка при использовании картуша RP-C18 или других разделительных материалов. Радиохимическое фторирование тозилата 14, синтез которого описан в литературе (Chem. Pharm.Bull., 17(5), 879-885 (1969, для получения [F-18]-меченого производного глутаминовой кислоты 13 осуществляют известными специалисту в данной области способами (см. схему 6). Схема 6 При этом соединение 14 в присутствии основания, как, например, тетраалкиламмонийкарбонат и тетраалкилфосфонийкарбонат и карбонат калия и т.д., можно вводить во взаимодействие с соответствующим раствором [F-18]-фторида. Реакцию предпочтительно проводят при повышенных температурах. Добавление краун-эфиров, как, например, криптофикс (К 2.2.2), может положительно влиять на реакцию,особенно в комбинации с K2CO3 в качестве катализирующего основания. Возможными растворителями являются предпочтительно апротонные, однако, также протонные растворители или, однако, можно использовать апротонные добавки к растворителю, такие как, например, вода. Обычно для радиохимического фторирования с помощью [F-18]-фториданионов используют ацетонитрил, диметилсульфоксид или диметилформамид в качестве оптимальных растворителей. Соединение 13 обычно не нужно подвергать никакой очистке, а можно немедленно подвергать обработке способами, описанными для превращения 13 в 12. Очистка соединения 13, однако, в принципе возможна, предпочтительно, при использовании препаративной ВЭЖХ с неполярной фазой, как, например, RP-C18. Сверх того, также возможна очистка- 12017713 при использовании картушей. Предлагаемые согласно изобретению соединения, в случае которых [F-18]-изотоп расположен через метиленовую группу в положении 4 скелета молекулы глутаминовой кислоты, как, например, в случае 4[F-18]-фторметилглутаминовой кислоты (15), можно получать как представлено на схеме 7. Так, например, осуществляют кислотное отщепление защитных групп от соединения 16 для получения предлагаемого согласно изобретению соединения 4-[F-18]-фторметилглутаминовой кислоты (15). Схема 7 При этом можно использовать различные органические кислоты (как, например, трифторуксусная кислота), прежде всего, однако, неорганические кислоты, как, например, бромоводородная кислота, соляная кислота, серная кислота, хлорная кислота или фосфорная кислота. Очистка предлагаемого согласно изобретению соединения 16 формулы (I) возможна путем ВЭЖХ, причем, в принципе, могут быть предварительно и как последующие дополнительные включены различные стадии очистки, например,очистка при использовании картуша RP-C18 или других разделительных материалов. Радиохимическое фторирование тозилата 17, синтез которого осуществляют аналогично описанному в литературе способу (Chem. Pharm. Bull., 17(5), 879-885 (1969, исходя из соединения 18 (Tetrahedron, 45(5), 1453-1464 (1989, для получения [F-18]-меченого производного глутаминовой кислоты 16 осуществляют известными специалисту в данной области способами (см. схему 8). Схема 8 При этом соединение 17 в присутствии основания, как, например, тетраалкиламмонийкарбонат и тетраалкилфосфонийкарбонат и карбонат калия и т.д., можно вводить во взаимодействие с соответствующим раствором [F-18]-фторида. Реакцию предпочтительно проводят при повышенных температурах. Добавление краун-эфиров, как, например, криптофикс (К 2.2.2), может положительно влиять на реакцию,особенно в комбинации с K2CO3 в качестве катализирующего основания. Возможными растворителями являются предпочтительно апротонные, однако, также протонные растворители или, однако, можно использовать апротонные добавки к растворителю, как, например, вода. Обычно для радиохимического фторирования с помощью [F-18]-фториданионов используют ацетонитрил, диметилсульфоксид или диметилформамид в качестве оптимальных растворителей. Соединение 16 обычно не нужно подвергать никакой очистке, а можно немедленно подвергать обработке способами, описанными для превращения 16 в 15. Очистка соединения 16, однако, в принципе возможна, предпочтительно, при использовании препаративной ВЭЖХ с неполярной фазой, например, RP-C18. Предлагаемые согласно изобретению соединения, в случае которых [F-18]-изотоп расположен через алкоксильную группу в положении 4 скелета молекулы глутаминовой кислоты, как, например, в случае 4-[F-18]-фторэтоксиглутаминовой кислоты (20), можно получать как представлено на схеме 9. Так, например, осуществляют кислотное отщепление защитных групп от соединения 21 или 22 для получения предлагаемого согласно изобретению соединения 4-[F-18]-фторэтоксиглутаминовой кислоты (20). Схема 9- 13017713 При этом можно использовать различные органические кислоты (такие как, например, трифторуксусная кислота), прежде всего, однако, неорганические кислоты, такие как, например, бромоводородная кислота, соляная кислота, серная кислота, хлорная кислота или фосфорная кислота. Далее, также возможно щелочное раскрытие цикла соединения 21 при использовании гидроксида лития, гидроксида натрия, гидроксида калия и т.д. (S. Baker и др., Tetrahedron Lett., 39, 2815-2818 (1998. Очистка предлагаемого согласно изобретению соединения 20 формулы (I) возможна с помощью ВЭЖХ, причем, в принципе, могут быть предварительно и как последующие дополнительные включены различные стадии очистки, например, очистка при использовании картуша RP-C18 или других разделительных материалов. Радиохимическое фторирование тозилата 23, синтез которого осуществляют аналогично описанному в литературе способу (N. Sharma и др., Tetrahedron Lett., 45, 1403-1406 (2004, исходя из соединения 24, для получения [F-18]-меченого производного глутаминовой кислоты 21 осуществляют известными специалисту в данной области способами (см. схему 10). Схема 10 При этом соединение 21 в присутствии основания, такого как, например, тетраалкиламмонийкарбонат и тетраалкилфосфонийкарбонат и карбонат калия и т.д., можно вводить во взаимодействие с соответствующим раствором [F-18]-фторида. Реакцию предпочтительно проводят при повышенных температурах. Добавление краун-эфиров, таких как, например, криптофикс (К 2.2.2), может положительно влиять на реакцию, особенно в комбинации с K2CO3 в качестве катализирующего основания. Возможными растворителями являются предпочтительно апротонные, однако, также протонные растворители или, однако, можно использовать апротонные добавки к растворителю, как, например, вода. Обычно для радиохимического фторирования с помощью [F-18]-фториданионов используют ацетонитрил, диметилсульфоксид или диметилформамид в качестве оптимальных растворителей. Соединение 21 обычно не нужно подвергать никакой очистке, а можно немедленно подвергать обработке способами, описанными для превращения 21 в 20. Очистка соединения 21, однако, в принципе возможна, предпочтительно, при использовании препаративной ВЭЖХ с неполярной фазой, как, например, RP-C18. Кроме того, возможна очистка при использовании картушей. Радиохимическое фторирование тозилата 25, синтез которого осуществляют аналогично описанному в литературе способу (X. Zhang, Tetrahedron Lett., 42, 5335-5338 (2001, исходя из соединения 23, для получения [F-18]-меченого производного глутаминовой кислоты 22 осуществляют известными специалисту в данной области способами (см. схему 11). Схема 11 При этом соединение 25 в присутствии основания, такого как, например, тетраалкиламмонийкарбонат и тетраалкилфосфонийкарбонат и карбонат калия и т.д., можно вводить во взаимодействие с соответствующим раствором [F-18]-фторида. Реакцию предпочтительно проводят при повышенных температурах. Добавление краун-эфиров, таких как, например, криптофикс (К 2.2.2), может положительно влиять на реакцию, особенно в комбинации с K2CO3 в качестве катализирующего основания. Возможными растворителями являются предпочтительно апротонные, однако, также протонные растворители или, однако, можно использовать апротонные добавки к растворителю, как, например, вода. Обычно для радиохимического фторирования с помощью [F-18]-фториданионов используют ацетонитрил, диметилсульфоксид или диметилформамид в качестве оптимальных растворителей. Соединение 22 обычно не нужно подвергать никакой очистке, а можно немедленно подвергать обработке способами, описанными для превращения 22 в 20. Очистка соединения 22, однако, в принципе возможна, предпочтительно, при использовании препаративной ВЭЖХ с неполярной фазой, такой как, например, RP-С 18. Кроме того, возможна очистка при использовании картушей. Синтез справочных 19F-соединений 26, 27 и 28 можно осуществлять как представлено на схеме 12. Схема 12- 14017713 Соединение 26 можно получать путем алкилирования и окисления гидроксипролинового производного 24. Путем раскрытия цикла производного пироглутамина 26 получают справочное соединение с открытой цепью 27. Кислотное отщепление защитных групп приводит к производному глутаминовой кислоты 28. Предлагаемые согласно изобретению соединения, в случае которых [F-18]-изотоп расположен через алкильную группу в положении 4 скелета молекулы глутаминовой кислоты, как, например, в случае 4-[F18]-фторпропилглутаминовой кислоты (29) или 4-[F-18]-фторбутилглутаминовой кислоты (30), можно получать как представлено на схеме 13. Так, например, осуществляют кислотное отщепление защитных групп от соединений 31 или 32 для получения предлагаемого согласно изобретению соединения, 4-[F18]-фторпропилглутаминовой кислоты (29) или 4-[F-18]-фторбутилглутаминовой кислоты (30). Схема 13 При этом можно использовать различные органические кислоты (как, например, трифторуксусная кислота), прежде всего, однако, неорганические кислоты, как, например, бромоводородная кислота, соляная кислота, серная кислота, хлорная кислота или фосфорная кислота. Очистка предлагаемых согласно изобретению соединений 29 и 30 формулы (I) возможна путем ВЭЖХ, причем, в принципе, могут быть предварительно и как последующие дополнительные включены различные стадии очистки, как, например, очистка при использовании картуша RP-C18 или других разделительных материалов. Радиохимическое фторирование бромида 33 или тозилата 34, синтез которых осуществляют аналогично описанному в литературе способу (S. Hanessian и др., J. Org. Chem., 70, 5070-5085 (2005, исходя из соединения 35, для получения [F-18]-меченых производных глутаминовой кислоты 31 и 32 осуществляют известными специалисту в данной области способами (см. схему 14). Схема 14 При этом соединения 33 и 34 в присутствии основания, как, например, тетраалкиламмонийкарбонат и тетраалкилфосфонийкарбонат и карбонат калия и т.д., можно вводить во взаимодействие с соответствующим раствором [F-18]-фторида. Реакцию предпочтительно проводят при повышенных температурах. Добавление краун-эфиров, как, например, криптофикс (К 2.2.2), может положительно влиять на реакцию,особенно в комбинации с K2CO3 в качестве катализирующего основания. Возможными растворителями являются предпочтительно апротонные, однако, также протонные растворители или, однако, можно использовать апротонные добавки к растворителю, как, например, вода. Обычно для радиохимического фторирования с помощью [F-18]-фториданионов используют ацетонитрил, диметилсульфоксид или диметилформамид в качестве оптимальных растворителей. Соединения 31 и 32 обычно не нужно подвергать никакой очистке, а можно немедленно подвергать обработке способами, описанными для превращения 31 в 29, соответственно, 32 в 30. Очистка соединений 31, соответственно, 32, однако, в принципе возможна, предпочтительно, при использовании препаративной ВЭЖХ с неполярной фазой, как, например, RP-C18. Синтез справочных 19F-соединений 36 и 37 можно осуществлять путем алкилирования производного глутаминовой кислоты 35 (схема 15). Отщепление защитных групп приводит к фторалкилированным производным глутаминовой кислоты 38 и 39. Согласно четвертому аспекту данного изобретения, для получения соединений формулы (I) или (II) используют соединения формулы (IV)a) гидроксил,b) разветвленный или неразветвленный (С 1-С 5)алкоксил,c) разветвленный или неразветвленный гидрокси-(C1-C5)алкоксил,d) разветвленный или неразветвленный О-(C1-C5)алкил-(O-(C1-C4)алкил)n-О-(С 1-С 4)алкил,e) N-C1-C5)алкил)2,f) NH2,g) N(H)-U",h) N(H)-L"', илиa) гидроксил,b) разветвленный или неразветвленный О-(С 1-С 5)алкил,c) разветвленный или неразветвленный О-(С 2-С 5)алкенил,d) разветвленный или неразветвленный О-(C1-C5)алкил-(O-(C1-C4)алкил)n-O-(C1-C4)алкил илиe) разветвленный или неразветвленный О-(С 2-С 5)алкинил,f) трифенилметоксигруппу;b) Е',с тем соответствием, что точно один из заместителей R5 или R6 включает группу Е' и, соответственно, другой заместитель не включает никакой группы Е'; Е' означает:a) разветвленный или неразветвленный (С 1-С 5)-алкил,b) разветвленный или неразветвленный (С 2-С 5)-алкенил,c) разветвленный или неразветвленный (С 1-С 5)-алкил-(О-(C1-С 4)-алкил)n-O-(C1-C4)-алкил илиd) разветвленный или неразветвленный (С 2-С 5)-алкинил;X' и X" независимо друг от друга означаютa) разветвленный или неразветвленный (С 1-С 5)-алкил,b) замещенный или незамещенный арил,c) аралкил илиd) гетероарил; причем n=0, 1, 2 или 3,и все возможные диастереомеры и энантиомеры являются частью настоящего объекта изобретения. Способ получения предлагаемых согласно изобретению соединений общей формулы (I) или (II) отличается тем, что большинство соединений формулы (I) или (II) можно получать из соединенияпредшественника соединений формулы (IV) после введения 18F-изотопа. Настоящее изобретение относится к соединениям общей формулы (IV). Согласно пятому аспекту изобретения для получения соединений формулы (I) или (II) используют соединения формулы (V)a) гидроксил,b) разветвленный или неразветвленный О-(С 1-С 5)алкил,c) разветвленный или неразветвленный О-(С 2-С 5)алкенил,d) разветвленный или неразветвленный О-(C1-C5)алкил-(O-(С 1-С 4)-алкил)n-O- (C1-C4)алкил,e) разветвленный или неразветвленный О-(С 2-С 5)алкинил илиb) Е',с тем соответствием, что точно один из заместителей R5 или R6 включает группу Е' и, соответственно, другой заместитель означает водород; Е' означает:s) N-бензоил; причем n=0, 1, 2 или 3,и все возможные диастереомеры и энантиомеры являются частью настоящего объекта изобретения. Способ получения предлагаемых согласно изобретению соединений общей формулы (I) или (II) отличается тем, что большинство соединений формулы (I) или (II) можно получать из соединенияпредшественника соединений формулы (V) после введения 18F-изотопа. Настоящее изобретение относится к соединениям общей формулы (V). Предпочтительными для введения 18F-изотопа являются 4,7,13,16,21,24-гексаокса-1,10-диазабицикло[8,8,8]гексакозан K18F (соль краун-эфира криптофикс K18F), K18F, H18F, KH18F2, Cs18F, Na18F или[F-18]-тетраалкиламмонийфторид (например, [F-18]-тетрабутиламмонийфторид). Настоящее изобретение относится к соединениям общей формулы (I) или (II) и способам, причем используют изотопы фтора 18F и 19F. Если в соединении, объекте настоящего изобретения, формулы (I), формулы (II), формулы (III),формулы (IV) или формулы (V) имеется, соответственно, один или несколько хиральных центров, то все варианты этого изомера, включая оба энантиомера и все возможные диастереомеры, должны быть включены в объект настоящего изобретения. Соединения, которые содержат по меньшей мере один хиральный центр, можно использовать в виде рацемической смеси, в случае необходимости, в виде смеси диастереомеров или диастереомернообогащенной смеси или в виде энантиомернообогащенной смеси. Рацемическую, энантиомернообогащенную смесь или смесь диастереомеров в случае необходимости можно разделять в соответствии с известными специалисту методами, так что энантиомеры или диастереомеры можно использовать индивидуально. В тех случаях, в которых имеется двойная углерод-углеродная связь, оба изомера "цис" и "транс" являются частью настоящего изобретения. В тех случаях, в которых могут существовать таутомерные формы, как, например, кетоенольная таутомерия, все таутомерные формы включены в настоящее изобретение, причем эти формы могут находиться в равновесии или,предпочтительно, в одной форме. Соединения общей формулы (I) или (II) и их предпочтительные варианты осуществления используют в качестве лекарственных средств. Предлагаемые согласно изобретению соединения общей формулы (I) или (II) и их предпочтительные варианты осуществления используют при диагнозе физиологических или патологических состояний. Эти соединения предпочтительно находят применение при неинвазивном, базирующемся на PET диагнозе в случае человеческого или животного организма. Особенно предпочтительно предлагаемые согласно изобретению соединения общей формулы (I) или (II) и их предпочтительные варианты осуществления находят применение при диагнозе опухолевых заболеваний. Примерами таких опухолевых заболеваний являются злокачественные опухоли желудочнокишечного или колоректального тракта, печени, поджелудочной железы, почек, мочевого пузыря, щитовидной железы, предстательной железы, эндометрия, яичников, яичек; меланома; мелкоклеточная и немелкоклеточная бронхиальная карцинома, диспластическая оральная карцинома слизистой оболочки,инвазивный оральный рак; рак молочной железы, включая гормонзависимый и гормоннезависимый рак молочной железы; карцинома плоского эпителия, неврологические раковые заболевания, включая нейробластому, глиому, астроцитому, остеосаркому, менингиому; саркома мягких тканей; гемангиома и эндокринные опухоли, включая аденомы гипофиза, хромоцитомы, парагангиомы, гематологические опухолевые заболевания, включая лимфому и лейкемии; или метастазы одной из вышеуказанных опухолей. Предлагаемые согласно изобретению соединения общей формулы (I) или (II) и их предпочтительные варианты осуществления используют для получения лекарственного средства в целях диагноза опухолевых заболеваний. Примерами таких опухолевых заболеваний являются злокачественные опухоли- 18017713 желудочно-кишечного или колоректального тракта, печени, поджелудочной железы, почек, мочевого пузыря, щитовидной железы, предстательной железы, эндометрия, яичников, яичек; меланома; мелкоклеточная и немелкоклеточная бронхиальная карцинома, диспластическая оральная карцинома слизистой оболочки, инвазивный оральный рак; рак молочной железы, включая гормонзависимый и гормоннезависимый рак молочной железы; карцинома плоского эпителия, неврологические раковые заболевания,включая нейробластому, глиому, астроцитому, остеосаркому, менингиому; саркома мягких тканей; гемангиома и эндокринные опухоли, включая аденомы гипофиза, хромоцитомы, парагангиомы, гематологические опухолевые заболевания, включая лимфому и лейкемии; или метастазы одной из вышеуказанных опухолей. Настоящее изобретение относится к фармацевтическим препаратам, которые содержат по меньшей мере одно соединение формулы (I) или (II), а также фармацевтически приемлемый носитель. Для применения соединений формулы (I) или (II) в качестве лекарственного средства их доводят до формы фармацевтического препарата, который, наряду с биологически активным веществом, содержит пригодные для энтерального или парентерального применения фармацевтические, органические или неорганические, инертные носители, как, например, вода, желатин, гуммиарабик, лактоза, крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли и т.д. Настоящее изобретение относится к комплекту (набору), содержащему по меньшей мере одно соединение формулы (I), (II), (III), (IV) или (V). Примеры Пример 1. Синтез 4-[F-18]-фторгутаминовой кислоты.Am. Chem. Soc, 107, 4252 (1985) или Tetrahedron Asymmetry, 9, 4249 (1998 в EtOH (0,4 мл) при комнатной температуре. Реакционную смесь перемешивают в течение 30 мин и затем смешивают со свежеперегнанным сложным эфиром 2 (0,04 мл, 0,33 ммоль) (Gazz. Chim. Ital., 111, 249 (1961. За протеканием реакции следят с помощью тонкослойной хроматографии (ТСХ) (SiQ2, AcOEt/CHCl3=1:1). По окончании реакции (примерно 2,5 ч) реакционную смесь нейтрализуют путем добавления АсОН (1,5 мл; 2%). После этого добавляют CHCl3 (15 мл), промывают водой (315 мл), органическую фазу отделяют, сушат надNa2SO4 и концентрируют досуха в вакууме. Препаративная ТСХ (SiO2, AcOEt/CHCl3=1:1) показывает смесь комплексов 3 (S,S,S) и 3 (S,R,S/R) в соотношении 11:1 и выход 28% (Rf=0,52). Комплекс 3 (S,S,R) имеет Rf-значение, равное 0,49. Комплекс 3 (S,S,R) элюируют с силикагеля с помощью МеОН (340 мл) и затем очищают путем колоночной хроматографии на сефадексе при использовании смесиC32H32BrN3NiO5 (%): С 56,75; Н 4,7 6; Br 11,80; N 6,20; Ni 8,67. 4-[F-19]Фтор-L-глутаминовая кислота (нерадиоактивный стандарт для ВЭЖХ-идентификации 4-[F18]-фтор-L-глутаминовой кислоты). Конденсация Ni-BPB-Gly с этиловым эфиром 2-фторакриловой кислоты. К суспензии 3 г (6 ммоль) Ni-BPB-Gly в 15 мл МеОН при комнатной температуре добавляют 1 мл(7,2 ммоль) (изопропил)2NH. Реакционную смесь перемешивают в течение 30 мин и затем смешивают с 3,7 мл (30 ммоль) этилового эфира 2-фторакриловой кислоты. За протеканием реакции следят с помощью ТСХ на SiO2 (AcOEt/CHCl3=2:3). Спустя примерно 250 ч реакция заканчивается. После этого смесь нейтрализуют путем добавления 42 мл 2%-ного водного раствора АсОН, смешанного с 25 мл МеОН. Полученная смесь диастереомерных комплексов Ni-BPB-4-F-GluOMe выпадает в осадок. Осадок отфильтровывают и промывают водой (330 мл). Полученный твердый комплекс суспендируют в CCl4 и концен- 19017713 трируют досуха в вакууме. Эту процедуру повторяют три раза, чтобы освободить смесь от воды. Комплексы очищают путем колоночной хроматографии (SiO2, 320 см AcOEt/CHCl3=3:2). Основная фракция, 2,66 г, (4,4 ммоль, 74%) содержит смесь Ni-BPB-(2S, 4R)-4-F-GluOMe и Ni-BPB(2S,4S)-4-F-GluOMe в соотношении 1,5/1. Температура плавления: 191-193 С; []D25=+24,77 (c=0,5,CHCl3). Элементный анализ: найдено (%): С 61,76; Н 5,02; N 6,94; Ni 9,20; рассчитано для C31H30FN3NiO5(%): С 61,82; Н 5,02; N 6,98; Ni 9,74. Разделения комплексов достигают путем разделения с помощью колоночной хроматографии на[]D25=+26,41 (с=0,039, МеОН). Элементный анализ: найдено (%): С 61,63; Н 4,86; N 6,84; рассчитано для C31H30FN3NiO5 (%): С 61,82; Н 5,02; N 6,98. Разложение комплекса и выделение аминокислоты. В круглодонной колбе, 2,75 г (4,57 ммоль) Ni-BPB-4-F-GluOMe-комплекса растворяют в 30 мл МеОН и при перемешивании смешивают с 5,5 мл 6 н. HCl. Реакционную смесь кипятят с обратным холодильником в течение 15-20 мин, концентрируют досуха, разбавляют с помощью 50 мл воды, отфильтровывают гидрохлорид ВРВ и осторожно промывают 330 мл воды. Объединенные фильтраты содержат аминокислоту, остатки ВРВ и Ni2+-соли, и с помощью водного раствора аммиака устанавливают значение рН, равное 5. ВРВ-остатки удаляют путем экстракции с помощью CHCl3 (330 мл). Объединенные водные фазы концентрируют досуха, смешивают с 3 мл 6 н. HCl и кипятят с обратным холодильником в течение 1 ч. Раствор затем концентрируют досуха, остаток растворяют в 5 мл Н 2 О и с помощью 5%-ного водного раствора аммиака устанавливают значение рН, равное 4. Аминокислоту выделяют путем ионообменной хроматографии при использовании Dowex-колонки 50w8 в Н+-форме (элюент: 5%-ный водный раствор NH3).[F-18]-Радиомечение. Мишень: малообъемная мишень Зильбера низкого давления (1 мл), заполненная с помощью [O-18] воды, для 18O(p,n)18F-реакции; циклотрон: Scanditronix MC 17; бомбардировка протонами при 17 МэВ.WATO23525) путем добавления [F-18]/[O-18]-таргетного раствора. Картуш предварительно кондиционируют с помощью раствора K2CO3 (10 мл; 0,5 М), затем деионизированной водой (15 мл).[F-18]-Радиоактивный комплекс: [F-18]-фторид (15-300 мКи) элюируют из QMA-картуша с помощью раствора для промывки (2 мл, MeCN (2 мл)/тетрабутиламмонийкарбонат (ТВАС, 0,015 мл, 20%-ный водный раствор, рН 8). Элюат вносят в пробирку емкостью 5 мл и растворитель удаляют путем азеотропной дистилляции при температуре 130 С в токе азота. Нуклеофильное замещение: реакционный сосуд с высушенным [F-18]-ТВА-фторидом охлаждают до температуры 80 С (предшествующая стадия) и добавляют раствор предшественника 3 (S,S,R) (5 мг вMeCN (0,5 мл. Реакционную смесь выдерживают в течение 5-10 мин при температуре 80 С. Пробу реакционной смеси исследуют путем радио-ТСХ (силикагелевая пластина (Merck), элюент: этилацетат/хлороформ/уксусная кислота (4:1:1. Базируясь на этих данных радио-ТСХ определяют включениеHCl (6 н., 0,3-0,5 мл) добавляют к раствору в MeCN [F-18]-глутаматникелевого предшественника и при температуре 140 С обрабатывают в течение 5 мин. Пробу полученной реакционной смеси анализируют путем радио-ТСХ (силикагель, элюент: н-бутанол/уксусная кислота/вода (12/3/5. ТСХ-Анализ осуществляют при использовании ТСХ-сканера MiniGita (Raytest, Германия). Разложение 18F-фторированного Ni-комплекса и высвобождение 4-[18F] фторглутаминовой кислотыHCl (2 н., 0,3-0,5 мл) добавляют к раствору в MeCN [F-18]-глутаматникелевого предшественника и при температуре 140 С обрабатывают в течение 5 мин. Затем нейтрализуют с помощью раствора гидроксида натрия (2 н, 0,8-1,0 мл). Пробу полученной реакционной смеси анализируют путем радио-ТСХ (силикагель, элюент: н-бутанол/уксусная кислота/вода (12/3/5. ТСХ-Анализ осуществляют при использовании ТСХ-сканера MiniGita (Raytest, Германия). Предварительная очистка: сырой продукт после обработки с помощью НСl (предыдущая стадия)- 20017713 обрабатывают с помощью 1 мл воды и помещают на анионообменный картуш (Waters, SAX-OH-форма). 80% радиоактивных продуктов удерживаются на картуше. Радиоактивные продукты элюируют из картуша с помощью водного раствора хлорида натрия (0,4 М, 2 мл). Пробу анализируют посредством ВЭЖХ. Идентификация путем радио-ВЭЖХ: насос: Gilson 305; дозатор: Rheodyne (петля дозатора 20 мкл); колонка: Zorbax-NH2, 4,6150 мм; подвижная фаза:NaH2PO4 (10 мМ)/фосфорная кислота, рН 3; объемная скорость потока: 1 мл/мин; УФ-абсорбционный детектор: Gilson 116 в сочетании с радиодетекторомBeckinan 170; УФ-детектирование: 210 нм. Rt: F-19-стандарт рац.)-4-F-Glu-гидрохлорид (смесь диастереомеров: 1:5; описание см. выше: 12,22 мин. (УФ); детектирование радиоактивности (Beckman): 12,64 мин. Получают отдельный радиоактивный пик, который соэлюируют вместе со справочным соединением. Идентификация путем радио-ТСХ: пластина из силикагеля (60 меш), растворитель нбутанол/уксусная кислота/Н 2 О (12:3:5). Детектирование: фосфор-томография: Sl Molecular Dynamics. фиг. 1. ВЭЖХ-Очистка: насос: Gilson 305; дозатор: Rheodyne (петля дозатора 20 мкл); колонка: ZorbaxNH2, 4,6150 мм; подвижная фаза: NaH2PO4 (10 мМ)/фосфорная кислота, рН=3; объемная скорость потока: 1 мл/мин.; УФ-абсорбционный детектор: Gilson 116 в сочетании с радиодетектором Beckman 170; УФ-детектирование: 210 нм. Получают отдельный радиоактивный пик, который соэлюируют вместе со справочным соединением. Если образовавшийся продукт очищают с помощью ВЭЖХ, можно отказаться от вышеописанной предварительной очистки при использовании анионообменного картуша. Продукт можно получать с радиохимической чистотой 90% и радиоактивностью 15-200 мКи (с поправкой на разложение). Пример 2. Синтез 2-амино-4-[F-19]фторглутамина (ВЭЖХ-стандарт). К раствору 0,27 г (0,448 ммоль) Ni-BPB-4-F-GluOMe (М=602,28, получают по аналогии с методикой примера 1) в 7 мл МеОН добавляют жидкий аммиак (18 г). Реакционный раствор выдерживают в течение 2 ч при комнатной температуре. Раствор концентрируют в вакууме и остаток очищают путем препаративной ТСХ (SiO2,CHCl3/Me2CO=3:1). Затем продукт очищают далее при использовании сефадекса LH-20 (C6H6/EtOH=3:1). Получают 0,15 г (0,255 ммоль), 57%) Ni-BPB-4-F-Gln (молекулярная масса 587,28). Синтез 2-амино-4-[F-18]-фторглутамина.QMA-картуша с помощью раствора для промывки (2 мл, MeCN (2 мл)/тетрабутиламмоний-карбонат(ТВАС, 0,015 мл, 20%-ный водный раствор, рН 8. Элюат вносят в пробирку емкостью 5 мл и растворитель удаляют путем азеотропной дистилляции при температуре 130 С в токе азота. Нуклеофильное замещение: реакционный сосуд с высушенным [F-18]-ТВА-фторидом охлаждают до температуры 80 С (предшествующая стадия) и добавляют раствор предшественника Ni-BPB-4-BrGluOMe (5 мг в MeCN (0,5 мл. Реакционную смесь выдерживают в течение 5-10 мин при температуре 80 С. Пробу реакционной смеси исследуют путем радио-ТСХ (силикагелевая пластина (Merck), элюент: этилацетат/хлороформ/уксусная кислота (4:1:1. Базируясь на этих данных радио-ТСХ, определяют включение [F-18] в Ni-BPB-4-F-GluOMe, составляющее 40-60%.[F-18]-Радиоактивный комплекс Ni-BPB-4-F-Gln. К раствору Ni-BPB-4-F-GluOMe (5-50 мКи) в 0,5 мл бутанола добавляют смесь из 1 мл третбутанола и вводят 1 г осушенного NH3 (осушен с помощью NaOH). Реакционную смесь нагревают в течение 7 мин при температуре 42 С до тех пор, пока более не будут обнаруживать никакого сложноэфирного комплекса (ТСХ, пластина из силикагеля (Merck), элюент: этилацетат/хлороформ/уксусная кислота(4/1/1. Реакция протекает количественно и приводит к получению 4-40 мКи Ni-BPB-4-F-Gln. Разложение 18F-фторированного комплекса Ni-BPB-4-F-Gln и высвобождение 4-[18F]фторглутаминовой кислоты HCl (2 н., 0,3-0,5 мл) добавляют к раствору в MeCN [F-18]-Ni-BPB-4-F-Glnпредшественника и при температуре 140 С обрабатывают в течение 5 мин. Затем нейтрализуют с помощью раствора гидроксида натрия (2 н., 0,8-1,0 мл). Пробу полученной реакционной смеси анализируют путем радио-ТСХ (силикагель, элюент: н-бутанол/уксусная кислота/вода (12/3/5. ТСХ-Анализ осуществляют при использовании ТСХ-сканера MiniGita (Raytest, Германия). Предварительная очистка. Сырой продукт после обработки с помощью HCl (предыдущая стадия) обрабатывают с помощью 1 мл воды и помещают на анионообменный картуш (Waters, SAX-OH-форма). 70% Радиоактивных продуктов удерживаются на картуше. Радиоактивные продукты элюируют из картуша с помощью водного раствора NaCl (0,4 М, 2 мл). Пробу анализируют посредством ВЭЖХ. Идентификация путем радио-ВЭЖХ: насос: Gilson 305; дозатор: Rheodyne (петля дозатора 20 мкл); колонка: Zorbax-NH2, 4,6150 мм; подвижная фаза: NaH2PO4 (10 мМ)/фосфорная кислота, рН 3; объемная скорость потока: 1 мл/мин; УФ-абсорбционный детектор: Gilson 116 в сочетании с радиодетектором(УФ); детектирование радиоактивности (Beckman): 8,45 мин. Получают отдельный радиоактивный пик,- 21017713 который соэлюируют вместе со справочным соединением. ВЭЖХ-Очистка: насос: Gilson 305; дозатор: Rheodyne (петля дозатора 20 мкл); колонка: ZorbaxNH2, 4,6150 мм; подвижная фаза: NaH2PO4 (10 мМ)/фосфорная кислота, рН 3; объемная скорость потока: 1 мл/мин.; УФ-абсорбционный детектор: Gilson 116 в сочетании с радиодетектором Beckman 170; УФ-детектирование: 210 нм. Получают отдельный радиоактивный пик, который соэлюируют вместе со справочным соединением. Если образовавшийся продукт очищают с помощью ВЭЖХ, можно отказаться от вышеописанной предварительной очистки при использовании анионообменного картуша. Продукт можно получать с радиохимической чистотой 90% и радиоактивностью 3-31 мКи (с поправкой на разложение). Пример 3. Синтез 2-амино-3-[F-18]-фторпентандикарбоновой кислоты. К смеси из 60 мкл водного 20%-ного раствора тетрабутиламмонийкарбоната в 1,5 мл ацетонитрила(1,0 мл) добавляют раствор [F-18]-фторида (33 мкл, 789 МБк). Растворитель удаляют при температуре печи 120 С в токе азота путем испарения. Добавляют 1 мл безводного ацетонитрила и снова удаляют путем выпаривания. Эту последнюю стадию повторяют еще раз. К остатку добавляют раствор 3 мг диэтилового эфира 2-бензилоксикарбониламино-3-(толуоилсульфонилокси)пентандикарбоновой кислоты(Chem. Pharm. Bull., 17(5), 879-885 (1969 в 0,3 мл безводного ацетонитрила и тщательно перемешивают. После нагревания при температуре 90 С в течение 15 мин добавляют 2 мл 40%-ного водного раствора бромоводорода. Реакционную смесь перемешивают в течение 30 мин при повышенном давлении и при температуре печи 130 С. Сырой продукт анализируют путем радиоанализа при использовании ВЭЖХ: насос: Gilson 305; дозатор: Rheodyne (петля дозатора 20 мкл); колонка: Zorbax-NH2, 4,6150 мм; подвижная фаза: NaH2PO4Gilson 116 в сочетании с радиодетектором Beckman 170; УФ-детектирование: 210 нм. Справочное 19Fсоединение (J. Org. Chem., 50(17), 3163-3167 (1985. (УФ); детектирование радиоактивности (Beckman). Получают отдельный радиоактивный пик, который соэлюируют вместе со справочным соединением. Очистку [F-18]-меченого соединения осуществляют посредством ВЭЖХ-очистки: насос: Gilson 305; дозатор: Rheodyne (петля дозатора 20 мкл); колонка: Zorbax-NH2, 4,6150 мм; подвижная фаза:NaH2PO4 (10 мМ)/фосфорная кислота, рН 3; объемная скорость потока: 1 мл/мин; УФ-абсорбционный детектор: Gilson 116 в сочетании с радиодетектором Beckman 170; УФ-детектирование: 210 нм. Получают отдельный радиоактивный пик, который элюируют одновременно со справочным 19F-соединением (J.Org. Chem., 50(17), 3163-3167 (1985. Если образовавшийся продукт очищают с помощью ВЭЖХ, можно отказаться от вышеописанной предварительной очистки при использовании анионообменного картуша. Продукт можно получать с радиохимической чистотой примерно 92% и радиоактивностью 103 МБк. Пример 4. Ди-трет-бутил-N-тритилглутамат. К гидрохлориду ди-трет-бутилглутаминовой кислоты (20,0 г, 68 ммоль, SIGMA, номер по каталогу:G-7501), растворенному в MeCl2 (100 мл), добавляют триэтиламин (40 мл) и тритилхлорид (19,0 г, 68,5 ммоль). Раствор перемешивают при комнатной температуре в течение 24 ч и затем промывают насыщенным раствором карбоната натрия (3) и водой (3). Органическую фазу сушат над MgSO4, растворитель удаляют в вакууме и образовавшееся масло, окрашенное в оранжевый цвет, очищают флэшхроматографией на силикагеле при использовании смеси гексан/MeCl2 (30:70). Полученное твердое вещество белого цвета, содержащее продукт, осаждали в тритил-ОН. Этот тритиловый спирт выкристаллизовывают путем растворения полученной смеси в минимальном количестве MeCl2 и добавления гексана. После отфильтровывания и удаления смеси растворителей получают бесцветное масло. Выход: 6,0 г(18%). ТСХ: Rf=0,5 (дихлорметан). Элементный анализ для C32H39NO4: найдено (%): С 76,4; Н 7,6; N 2,9; рассчитано (%): С 76,6; Н 7,8; N 2,8. трет-Бутил-2-тритил-4-карбо-трет-бутилокси-5-гидроксипентаноат. н-Бутиллитий (5,0 мл, 11 ммоль) при температуре 0 С добавляют к раствору циклогексилизопропиламина (3,0 мл, 15 ммоль) в гексане (50 мл) в трехгорлой колбе. Раствор перемешивают в течение 30 мин при температуре 0 С, затем охлаждают до температуры -78 С и смешивают с раствором ди-трет-бутилN-тритилглутамата (5,0 г, 10 ммоль) в гексане (50 мл). Колбу снабжают трубкой для ввода газа и связывают со сборником, который содержит параформ-альдегид и подвод для аргона. После образования карбаниона параформальдегид нагревают до температуры 180 С и образующийся газообразный формальдегид в токе аргона в течение 30 мин вводят в реакционный сосуд. При этом температуру бани поддерживают при -78 С. После этого охлаждающую баню удаляют, реакционную смесь медленно нагревают до комнатной температуры и отфильтровывают для удаления остатков параформальдегида. Фильтрат вводят в насыщенный водный раствор хлорида аммония и экстрагируют диэтиловым эфиром (3 250 мл). Объединенные органические фазы сушат над сульфатом магния и растворитель затем удаляют в вакууме. Образовавшееся желтоватое масло очищают флэш-хроматографией (этилацетат/MeCl2 (10:90. После удаления смеси растворителей получают бесцветное масло. Выход: 1,2 г (25%). ТСХ: Rf=0,3 (MeCl2). Элементный анализ для C33H41NO5: найдено (%): С 74,5; Н 7,6; N 2,8; рассчитано (%): С 74,6; Н 7,8; N 2,6.- 22017713 Пентаноат трет-бутил-2-тритил-4-карбо-трет-бутилокси-5-толуоилсульфокислоты. трет-Бутил-2-тритил-4-карбо-трет-бутилокси-5-гидрокси-гептаноат (532 мг, 1,00 ммоль) растворяют в MeCl2 (6 мл) и пиридине (1,2 мл). Затем добавляют п-толуолсульфонилхлорид (118 мг, 0,62 ммоль) и диметиламинопиридин (13,4 мг, 0,11 ммоль) и реакционную смесь перемешивают в атмосфере азота в течение ночи при комнатной температуре. Реакционную смесь экстрагируют этилацетатом (3), объединенные органические фазы сушат над сульфатом натрия и растворитель удаляют при использовании роторного испарителя. Сырой продукт растворяют в небольшом количестве MeCl2, наносят на NH2 материал и очищают колоночной хроматографией при использовании смеси этилацетат/гексан (8:2). Выход: 339 мг (70%). Элементный анализ для C40H47NO7: найдено (%): С 70,3; Н 7,1; N 2,2; S 5,0; рассчитано (%) : С 70,1; Н 6,9; N 2,0; S 4,7. трет-Бутил-2-тритил-4-карбо-трет-бутилокси-5-фторпентаноат (ВЭЖХ-стандарт). Безводный тетрабутиламмонийфторид (102 мг, 0,4 ммоль) добавляют к раствору гептаноата (2S)трет-бутил-2-тритил-4-карбо-трет-бутилокси-5-толуилсульфокислоты (54 мг, 0,08 ммоль) в безводном ТГФ (3 мл). Смесь кипятят с обратным холодильником в течение 4 ч. После охлаждения реакционной смеси до комнатной температуры смесь смешивают с MeCl2 и экстрагируют водой (3). Путем препаративной тонкослойной хроматографии (MeCl2/МеОН (90:10 получают продукт в виде желтоватого масла. Выход: 22 мг (51%). Элементный анализ для C33H40NO4: найдено (%): С 74,4; Н 7,7; N 2,8; рассчитано[F-18]-Фторид получают по [O-18](р,n)[F-18]-реакции в циклотроне. Раствор изотопов наносят наSep-Pack Light QMA-картуш и высушивают в токе воздуха. [F-18]-Фторид элюируют из картуша при использовании криптофикс 2.2.2/K2CO3-раствора (22 мг К 2.2.2; 4,6 мг K2CO3, 2 мл, MeCN (1,77 мл), вода(0,23 мл. Растворитель удаляют при температуре 120 С в токе аргона. Остаток дважды подвергают азотропной перегонке с 1 мл безводного MeCN при температуре 120 С в токе аргона. Раствор тозилатного предшественника гептаноата (2S)-трет-бутил-2-тритил-4-карбо-трет-бутилокси-5-толуоилсульфокислоты(4 мг) в MeCN (0,2 мл) вводят в сосуд с высушенным [F-18]-фторидом. Реакционную смесь нагревают при температуре 120 С в течение 10 мин. Затем растворитель удаляют в токе аргона. Растворитель(MeCN) удаляют в токе азота и остаток обрабатывают с помощью 6 н НС 1 (0,3-0,5 мл) при температуре 140 С в течение 5 мин. Пробу полученной реакционной смеси анализируют посредством радио-ТСХ (силикагель, элюент: н-бутанол/уксусная кислота/вода (12:3:5. ТСХ-анализ осуществляют при использовании ТСХ-сканера MiniGita (Raytest, Германия). Предварительная очистка. Сырой продукт после обработки с помощью HCl (предыдущая стадия) обрабатывают с помощью 1 мл воды и наносят на картуш анионообменника (Waters, SAX-OH-форма). 80% радиоактивных продуктов удерживаются на картуше. Радиоактивные продукты элюируют из картуша при использовании водного раствора NaCl (0,4 М, 2 мл). Пробу анализируют посредством ВЭЖХ. Идентификация путем радио-ВЭЖХ: насос: Gilson 305; дозатор: Rheodyne (петля дозатора 20 мкл); колонка: Zorbax-NH2, 4,6150 мм; подвижная фаза: NaH2PO4 (10 мМ)/фосфорная кислота, рН 3; объемная скорость потока: 1 мл/мин; УФ-абсорбционный детектор: Gilson 116 в сочетании с радиодетектором(УФ); детектирование радиоактивности (Beckman): 14,68 мин. Получают отдельный радиоактивный пик,который соэлюируют вместе со справочным соединением. ВЭЖХ-Очистка: насос: Gilson 305; дозатор: Rheodyne (петля дозатора 20 мкл); колонка: ZorbaxNH2, 4,6150 мм; подвижная фаза: NaH2PO4 (10 мМ)/фосфорная кислота, рН=3; объемная скорость потока: 1 мл/мин; УФ-абсорбционный детектор: Gilson 116 в сочетании с радиодетектором Beckman 170; УФдетектирование: 210 нм. Получают отдельный радиоактивный пик, который соэлюируют вместе со справочным соединением. Если образовавшийся продукт очищают с помощью ВЭЖХ, можно отказаться от вышеописанной предварительной очистки при использовании анионообменного картуша. Продукт можно получать с радиохимической чистотой 90% и радиоактивностью 20-200 мКи (с поправкой на разложение). Пример 5. Синтез 1-трет-бутилового эфира-2-метилового эфира 4-метансульфонилокси-5 оксопирролидин-1,2-дикарбоновой кислоты (8 а) (согласно N. Sharma и др., Tetrahedron Lett., 45, 14031406 (2004. К 5,78 г (17,9 ммоль) метилового эфира Вос-гамма-MsO-пролина в 230 мл этилацетата добавляют раствор 15,29 г (71,5 ммоль) пер-иодата натрия и 0,18 г (0,87 ммоль) гидрата хлорида рутения-(III) в 230 мл воды. Смесь выдерживают в течение трех дней при интенсивном перемешивании и при комнатной температуре. Затем фазы разделяют, водную фазу дважды экстрагируют этилацетатом (по 80 мл) и объединенные органические фазы перемешивают в течение 30 мин с 50 мл изопропанола. Сушат над сульфатом магния, фильтруют и растворитель удаляют в вакууме. Сырой продукт очищают колоночной хроматографией (силикагель, гексан/этилацетат=от 6,5:3,5 до 5:5). Получают 1,29 г (20%) 1-трет-бутилового эфира-2-метилового эфира 4-метансульфонилокси-5-оксопирролидин-1,2-дикарбоновой кислоты (8 а) в виде бесцветного твердого вещества.- 23017713 Элементный анализ для C12H19NO8S: найдено (%): С 42,90; Н 5,68; N 4,14; рассчитано (%): С 42,73; Н 5,68; N 4,15. Синтез диметилового эфира 2-трет-бутоксикарбониламино-4-метансульфонилоксипентандикарбоновой кислоты (7 а) (согласно X. Zhang, Tetrahedron Lett., 42, 5335-5338 (2001. 600 мг (1,78 ммоль) 1 трет-Бутилового эфира-2-метилового эфира 4-метансульфонилокси-5-оксопирролидин-1,2-дикарбоновой кислоты растворяют в 7,5 мл дихлорметана. Добавляют 1,5 мл метанола и 12,3 мг (0,089 ммоль) карбоната калия. Полученную смесь перемешивают в течение трех часов при комнатной температуре. Затем растворитель удаляют в вакууме и сырой продукт очищают колоночной хроматографией (силикагель, дихлорметан/метанол=от 99,7:0,3 до 99,6:0,4). Получают 608 мг (83%) диметилового эфира 2-третбутоксикарбониламино-4-метансульфонилоксипентан-дикарбоновой кислоты (7 а) в виде бесцветного масла. Элементный анализ для C13H23NO9S: найдено (%): С 42,10; Н 6,29; N 3,69; рассчитано (%): С 42,27; Н 6,28; N 3,79.[F-18]-Фторид получают по [O-18](р,n)[F-18]-реакции в циклотроне. Раствор изотопов (2,47 ГБк) наносят на Sep-Pack Light QMA-картуш. [F-18]-Фторид элюируют из картуша при использовании криптофикс 2.2.2/K2CO3-раствора (5 г К 2.2.2; 1 мг K2CO3, MeCN (1,5 мл), вода (0,5 мл. Растворитель удаляют при температуре 120 С в токе азота при добавке ацетонитрила (трижды по 1 мл). Добавляют 5 мг (13,6 мкмоль) диметилового эфира 2-трет-бутоксикарбониламино-4-метансульфонилоксипентандикарбоновой кислоты (7 а) в 1 мл ацетонитрила и полученную смесь перемешивают в течение 10 мин при температуре 100 С. После охлаждения до температуры примерно 60 С смесь помещают на картуш Silica-Plus. Промежуточный продукт 6 а очищают путем ВЭЖХ (С 18, ацетонитрил/вода). ВЭЖХ-Фракцию разбавляют водой (примерно 50 мл) и наносят на С 18-картуш. Промежуточный продукт элюируют с помощью 1 мл ацетонитрила. При времени синтеза 64 мин получают 533 МБк (34%, ТСХ) диметилового эфира 2-трет-бутоксикарбониламино-4-[F-18]-фторпентандикарбоновой кислоты (6 а). Синтез 4-[F-18]-фторглутаминовой кислоты (5) путем удаления защиты от диметилового эфира 2 трет-бутоксикарбониламино-4-[F-18]-фторпентандикарбоновой кислоты (6 а). 533 МБк диметилового эфира 2-трет-бутоксикарбониламино-4-[F-18]-фторпентандикарбоновой кислоты (6 а) в 1 мл ацетонитрила смешивают с 0,5 мл 4 н. HCl. Смесь нагревают в течение 5 мин в открытой пробирке при перемешивании при температуре 140 С (температура масляной бани). Добавляют следующие 0,5 мл 4 н. НСl и смесь нагревают в течение 5 мин в закрытой пробирке при перемешивании при температуре 140 С (температура масляной бани). После охлаждения до комнатной температуры раствор нейтрализуют путем добавления примерно 1,5 мл 2 н. раствора NaOH. Диметиловый эфир 2-трет-бутоксикарбониламино-4-[F-18]-фторпентандикарбоновой кислоты (6 а) может количественно (ТСХ) превращаться в 4-[F-18]-фторглутаминовую кислоту (5). Пример 6. [F-18]-Мечение 1-трет-бутилового эфира-2-метилового эфира 4-метансульфонилокси-5 оксопирролидин-1,2-дикарбоновой кислоты (8 а).[F-18]-Фторид получают по [O-18](p,n)[F-18]-реакции в циклотроне. Раствор изотопов (3,27 ГБк) наносят на Sep-Pack Light QMA-картуш [F-18]-Фторид элюируют из картуша при использовании криптофикс 2.2.2/K2CO3-раствора (5 г К 2.2.2; 1 мг K2CO3, MeCN (1,5 мл), вода (0,5 мл. Растворитель удаляют при температуре 120 С в токе азота при добавке ацетонитрила (трижды по 1 мл). Добавляют 5 мг (14,9 мкмоль) 1-трет-бутилового эфира-2-метилового эфира 4-метансульфонилокси-5-оксопирролидин-1,2-дикарбоновой кислоты (8 а) в 1 мл ацетонитрила и полученную смесь перемешивают в течение 10 мин при температуре 100 С. После охлаждения до температуры примерно 60 С смесь наносят на картуш Silica-Plus. Промежуточный продукт очищают путем ВЭЖХ (С 18, ацетонитрил/вода). ВЭЖХ-Фракцию разбавляют водой (примерно 50 мл) и наносят на С 18-картуш. Промежуточный продукт элюируют с помощью 1 мл ацетонитрила. При времени синтеза 95 мин получают 421 МБк (23%, ТСХ) 1-трет-бутилового эфира-2-метилового эфира 4-[F-18]-фтор-5-оксопирролидин-1,2-дикарбоновой кислоты. Синтез 4-[F-18]-фторглутаминовой кислоты (5) путем удаления защиты от 1-трет-бутилового эфира-2-метилового эфира 4-[F-18]-фтор-5-оксопирролидин-1,2-дикарбоновой кислоты. 221 МБк 1-трет-Бутилового эфира-2-метилового эфира 4-[F-18]-фтор-5-оксопирролидин-1,2 дикарбоновой кислоты, содержащегося в 0,5 мл ацетонитрила, смешивают с 0,5 мл 6 н. HCl. Смесь нагревают в течение 10 мин при перемешивании при температуре 130 С (температура масляной бани). После охлаждения до комнатной температуры раствор нейтрализуют путем добавления примерно 600 мкл 4 н раствора NaOH. Получают 172 МБк (91%, ТСХ) 4-[F-18]-фторглутаминовой кислоты (5). Пример 7. Синтез 1-трет-бутилового эфира-2-метилового эфира 4-[2-(толуол-4-сульфонилокси) этокси]пирролидин-1,2-дикарбоновой кислоты.- 24017713 К суспензии 0,65 г (15 ммоль) гидрида натрия в диметилформамиде (ДМФА) (20 мл) добавляют раствор 2,45 г (10,0 ммоль) 1-трет-бутилового эфира-2-метилового эфира 4-[гидрокси]пирролидин-1,2 дикарбоновой кислоты (24) в ДМФА (10 мл). Спустя 15 мин добавляют раствор 5,56 г (15,0 ммоль) 1,2 этандиолбистозилата в ДМФА (10 мл). Смесь затем в 3 порции по 45 мин подвергают превращению при температуре 100 С при облучении микроволнами. Смесь концентрируют и смешивают с водой и этилацетатом. После разделения фаз водную фазу экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Сырой продукт очищают колоночной хроматографией (силикагель, гексан/этилацетат). Получают 1,2 г (27%) 1-третбутилового эфира-2-метилового эфира 4-[2-(толуол-4-сульфонилокси)этокси]пирролидин-1,2-дикарбоновой кислоты. Элементный анализ для C20H29NO8S: найдено (%): С 54,20; Н 6,66; N 3,23; рассчитано (%): С 54,16; Н 6,59; N 3,16. Синтез 1-трет-бутилового эфира-2-метилового эфира 5-оксо-4-[2-(толуол-4-сульфонилокси)этокси] пирролидин-1,2-дикарбоновой кислоты (23). К 0,44 г (1 ммоль) 1-трет-бутилового эфира-2-метилового эфира 4-[2-(толуол-4-сульфонилокси) этокси]пирролидин-1,2-дикарбоновой кислоты в 20 мл дихлорметана добавляют раствор 1,07 г (5,0 ммоль) периодата натрия и 0,338 г (0,15 ммоль) гидрата хлорида рутения-(III) в 12,5 мл воды. Смесь выдерживают при интенсивном перемешивании в течение трех дней при комнатной температуре. Затем фазы разделяют, водную фазу экстрагируют дважды этилацетатом (по 20 мл) и объединенные органические фазы перемешивают в течение 30 мин с 5 мл изопропанола. Сушат над сульфатом магния, фильтруют и растворитель удаляют в вакууме. Сырой продукт очищают колоночной хроматографией (силикагель, гексан/этилацетат). Получают 0,11 г (24%) 1-трет-бутилового эфира-2-метилового эфира 5-оксо-4[2-(толуол-4-сульфонилокси)этокси]пирролидин-1,2-дикарбоновой кислоты (23) в виде бесцветного масла. Элементный анализ для C20H27NO9S: найдено (%): С 52,37; Н 6,02; N 3,11; рассчитано (%): С 52,51; Н 5,95; N 3,06. Синтез диметилового эфира 2-трет-бутоксикарбониламино-4-[2-(толуол-4-сульфонилокси)этокси] пентандикарбоновой кислоты (25). 100 мг (0,22 ммоль) 1-трет-Бутилового эфира-2-метилового эфира 5-оксо-4-[2-(толуол-4 сульфонилокси)этокси]пирролидин-1,2-дикарбоновой кислоты растворяют в 3 мл дихлорметана. Добавляют 1 мл метанола и 6 мг (0,04 ммоль) карбоната калия. Полученную смесь перемешивают в течение трех часов при комнатной температуре. Затем растворитель удаляют в вакууме и сырой продукт очищают колоночной хроматографией (силикагель, дихлорметан/метанол). Получают 97 мг (91%) диметилового эфира 2-трет-бутоксикарбониламино-4-[2-(толуол-4-сульфонилокси)этокси]пентандикарбоновой кислоты (25) в виде бесцветного масла. Элементный анализ для C21H31NO10S: найдено (%): С 51,48; Н 6,36; N 2,88; рассчитано (%): С 52,52; Н 6,38; N 2,86.[F-18]-Фторид получают по [O-18](р,n)[F-18]-реакции в циклотроне. Раствор изотопов (1,57 ГБк) наносят на Sep-Pack Light QMA-картуш. [F-18]-Фторид элюируют из картуша при использовании криптофикс 2.2.2/K2CO3-раствора (5 г К 2.2.2; 1 мг K2CO3, MeCN (1,5 мл),вода (0,5 мл. Растворитель удаляют при температуре 120 С в токе азота при добавке ацетонитрила(трижды по 1 мл). Добавляют 5 мг (10,2 мкмоль) диметилового эфира 2-трет-бутоксикарбониламино-4-[2-(толуол-4 сульфонилокси)этокси]пентандикарбоновой кислоты (25) в 1 мл ацетонитрила, и полученную смесь перемешивают в течение 10 мин при температуре 100 С. После охлаждения до температуры примерно 60 С смесь наносят на картуш Silica-Plus. Промежуточный продукт очищают путем ВЭЖХ (С 18, ацетонитрил/вода). ВЭЖХ-фракцию разбавляют водой (примерно 50 мл) и наносят на С 18-картуш. Промежуточный продукт элюируют с помощью 1 мл ацетонитрила. При времени синтеза 78 мин получают 337 МБк (35%, ТСХ) диметилового эфира 2 трет-бутоксикарбониламино-4-(2-[F-18]-фторэтокси)пентандикарбоновой кислоты (22). Синтез 2-амино-4-(2-[F-18]-фторэтокси)пентандикарбоновой кислоты (20) путем удаления защиты от диметилового эфира 2-трет-бутоксикарбониламино-4-(2-[F-18]-фторэтокси]пентандикарбоновой кислоты (22). 337 МБк Диметилового эфира 2-трет-бутоксикарбониламино-4-(2-[F-18]-фторэтокси)пентандикарбоновой кислоты (22) в 1 мл ацетонитрила смешивают с 0,5 мл 4 н. HCl. Смесь нагревают в течение 10 мин при перемешивании при температуре 130 С (температура масляной бани). После охлаждения до комнатной температуры раствор нейтрализуют путем добавления примерно 700 мкл 2 н. раствора NaOH. Получают 288 МБк (98%, ТСХ) 2-амино-4-(2-[F-18]-фторэтокси)пентандикарбоновой кислоты (20). Синтез 1-трет-бутилового эфира-2-метилового эфира 4-(2-фторэтокси)пирролидин-1,2-дикарбо- 25017713 новой кислоты. К суспензии 0,65 г (15 ммоль) гидрида натрия в ДМФА (20 мл) добавляют раствор 2,45 г (10,0 ммоль) 1-трет-бутилового эфира-2-метилового эфира 4-[гидрокси]пирролидин-1,2-дикарбоновой кислоты (24) в ДМФА (10 мл). Спустя 15 мин добавляют раствор 1,90 г (15,0 ммоль) 1-бром-2-фторэтана в ДМФА (10 мл). Смесь затем в 3 порции по 45 мин подвергают превращению при температуре 100 С при облучении микроволнами. Смесь концентрируют и смешивают с водой и этилацетатом. После разделения фаз водную фазу экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, фильтруют и растворитель удаляют в вакууме. Сырой продукт очищают колоночной хроматографией (силикагель, гексан/этилацетат). Получают 2,10 г (48%) 1-трет-бутилового эфира-2 метилового эфира 4-(2-фторэтокси)пирролидин-1,2-дикарбоновой кислоты. Элементный анализ для C13H22FNO5: найдено (%): С 53,48; Н 7,70; N 4,85; рассчитано (%): С 53,60; Н 7,61; N 4,81. 1-трет-Бутиловый эфир-2-метиловый эфир 4-(2-фторэтокси)-5-оксо-пирролидин-1,2-дикарбоновой кислоты (26). К 1,45 г (5 ммоль) 1-трет-бутилового эфира-2-метилового эфира 4-(2-фторэтокси)пирролидин-1,2 дикарбоновой кислоты в 80 мл дихлорметана добавляют раствор 4,3 г (20,0 ммоль) периодата натрия и 1,7 г (0,6 ммоль) гидрата хлорида рутения-(III) в 50 мл воды. Смесь выдерживают при интенсивном перемешивании в течение трех дней при комнатной температуре. Затем фазы разделяют, водную фазу экстрагируют дважды этилацетатом (по 25 мл) и объединенные органические фазы перемешивают в течение 30 мин с 10 мл изопропанола. Сушат над сульфатом магния, фильтруют и растворитель удаляют в вакууме. Сырой продукт очищают колоночной хроматографией (силикагель, гексан/этилацетат). Получают 0,26 г (17%) 1-трет-бутилового эфира-2-метилового эфира 4-(2-фторэтокси)-5-оксопирролидин-1,2 дикарбоновой кислоты (26). Элементный анализ для C13H20FNO8: найдено (%): С 51,18; Н 6,55; N 3,54; рассчитано (%): С 51,14; Н 6,60; N 4,59. Диметиловый эфир 2-трет-бутоксикарбониламино-4-(2-фторэтокси)пентандикарбоновой кислоты(27). 150 мг (0,49 ммоль) 1-трет-Бутилового эфира-2-метилового эфира 4-(2-фторэтокси)-5 оксопирролидин-1,2-дикарбоновой кислоты (26) растворяют в 5 мл дихлорметана. Добавляют 2 мл метанола и 6 мг (0,04 ммоль) карбоната калия. Полученную смесь перемешивают в течение трех часов при комнатной температуре. Затем растворитель удаляют в вакууме и сырой продукт очищают колоночной хроматографией (силикагель, дихлорметан/метанол). Получают 145 мг (88%) диметилового эфира 2 трет-бутоксикарбониламино-4-(2-фторэтокси)пентандикарбоновой кислоты (27). Элементный анализ для C14H24FNO7: найдено (%): С 40,06; Н 7,11; N 4,12; рассчитано (%): С 49,85; Н 7,17; N 4,15. 2-Амино-4-(2-фторэтокси)пентандикарбоновая кислота (28). 100 мг Диметилового эфира 2-трет-бутоксикарбониламино-4-(2-фторэтокси)пентандикарбоновой кислоты (27) растворяют в 50 мл метанола и при перемешивании смешивают с 1 мл 6 н, HCl. Реакционную смесь кипятят с обратным холодильником в течение 15-20 мин, концентрируют досуха, разбавляют с помощью 50 мл воды, гидрохлорид отфильтровывают и осторожно промывают 3 раза по 5 мл воды. Аминокислоту 28 выделяют посредством ионообменной хроматографии при использовании колонки Dowex 50w8 в Н+-форме (элюент: 5%-ный водный раствор NH3). Пример 8. Синтез диметилового эфира 2-(3-бромпропил)-4-трет-бутоксикарбониламинопентандикарбоновой кислоты (33) (согласно S. Hanessian и др., J. Org. Chem., 70, 5070-5085 (2005. К раствору 1,00 г (3,63 ммоль) диметилового эфира N-Boc-глутаминовой кислоты (26) в безводном ТГФ (20 мл) при температуре -78 С добавляют LiHMDS (7,8 мл, 1 М раствор в ТГФ). Полученную смесь перемешивают в течение 45 мин при температуре -78 С. Затем, при температуре -78 С, медленно прикапывают раствор 1,10 г (5,45 ммоль) 1,3-дибромпропана в ТГФ (10 мл). Смесь перемешивают в течение 60 мин. Реакцию гасят путем добавления раствора хлорида аммония, реакционную смесь нагревают до комнатной температуры и экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Растворитель удаляют в вакууме, и сырой продукт очищают колоночной хроматографией (силикагель, этилацетат/гексан=от 10:90 до 40:60). Получают 0,490 г (34%) диметилового эфира 2-(3-бромпропил)-4-трет-бутоксикарбониламинопентандикарбоновой кислоты (33) в виде бесцветного масла. Элементный анализ для C15H26BrNO6: найдено (%): С 45,21; Н 6,53; N 3,60; рассчитано (%): С 45,46; Н 6,61; N 3,53.[F-18]-Фторид получают по [O-18](р,n)[F-18]-реакции в циклотроне. Раствор изотопов (1,33 ГБк) наносят на Sep-Pack Light QMA-картуш. [F-18]-Фторид элюируют из картуша при использовании криптофикс 2.2.2/K2CO3-раствора (5 г К 2.2.2; 1 мг K2CO3, MeCN (1,5 мл), вода (0,5 мл. Растворитель удаля- 26017713 ют при температуре 120 С в токе азота при добавке ацетонитрила (трижды по 1 мл). Добавляют 5 мг (12,6 мкмоль) диметилового эфира 2-(3-бромпропил)-4-трет-бутоксикарбониламинопентандикарбоновой кислоты (33) в 1 мл ацетонитрила и полученную смесь перемешивают в течение 10 мин при температуре 100 С. После охлаждения до температуры примерно 60 С смесь наносят на картуш Silica-Plus. Промежуточный продукт очищают путем ВЭЖХ (С 18, ацетонитрил/вода). ВЭЖХ-фракцию разбавляют водой (примерно 50 мл) и наносят на С 18-картуш. Промежуточный продукт элюируют с помощью 1 мл ацетонитрила. При времени синтеза 90 мин получают 346 МБк (46%, ТСХ) диметилового эфира 2 трет-бутоксикарбониламино-4-(3-[F-18]-фторпропил)пентандикарбоновой кислоты (31). Синтез 2-амино-4(3-[F-18]-фторпропил)пентандикарбоновой кислоты (29) путем удаления защиты от диметилового эфира 2-трет-бутоксикарбониламино-4-(3-[F-18]-фторпропил)пентандикарбоновой кислоты (31). 346 МБк диметилового эфира 2-трет-бутоксикарбониламино-4-(3-[F-18]-фторпропил)пентандикарбоновой кислоты (3) в 1 мл ацетонитрила смешивают с 0,5 мл 4 н. HCl. Смесь нагревают в течение 10 мин при перемешивании при температуре 130 С (температура масляной бани). После охлаждения до комнатной температуры раствор нейтрализуют путем добавления примерно 650 мкл 2 н. раствора NaOH. Получают 288 МБк (96%, ТСХ) 2-амино-4-(3-[F-18]-фторпропил)пентандикарбоновой кислоты (29). Синтез диметилового эфира 2-трет-бутоксикарбониламино-4-(3-фторпропил)пентандикарбоновой кислоты (36) (согласно S. Hanessian и др., J. Org. Chem., 70, 5070-5085 (2005. К раствору 1,00 г (3,63 ммоль) диметилового эфира N-Boc-глутаминовой кислоты (26) в безводном ТГФ (20 мл) при температуре -78 С добавляют LiHMDS (7,8 мл, 1 М раствор в ТГФ). Полученную смесь перемешивают в течение 45 минут при температуре -78 С. Затем, при температуре -78 С, медленно прикапывают раствор 0,77 г (5,45 ммоль) 1-бром-3-фторпропана в ТГФ (10 мл). Смесь перемешивают в течение 60 мин. Реакцию гасят путем добавления раствора хлорида аммония, реакционную смесь нагревают до комнатной температуры и экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Растворитель удаляют в вакууме и сырой продукт очищают колоночной хроматографией (силикагель, этилацетат/гексан=от 10:90 до 40:60). Получают 0,318 г (29%) диметилового эфира 2-трет-бутоксикарбониламино-4-(3 фторпропил)пентандикарбоновой кислоты (36). Элементный анализ для C15H26FNO6: найдено (%): С 53,88; Н 7,87; N 4,13; рассчитано (%): С 53,72; Н 7,81; N 4,18. 2-Амино-4-(2-фторпропил)пентандикарбоновая кислота (38). 200 мг диметилового эфира 2-трет-бутоксикарбониламино-4-(3-фторпропил)пентандикарбоновой кислоты (36) растворяют в 75 мл МеОН и при перемешивании смешивают с 1,5 мл 6 н. HCl. Реакционную смесь кипятят с обратным холодильником в течение 15-20 мин, концентрируют досуха, разбавляют с помощью 50 мл воды, гидрохлорид отфильтровывают и осторожно промывают 310 мл воды. Аминокислоту 38 выделяют посредством ионообменной хроматографии при использовании колонки Dowex 50w8 в Н+ -форме (элюент: 5%-ный водный раствор NH3). Пример 9. Синтез диметилового эфира 2-трет-бутоксикарбониламино-4-[4-(толуол-4-сульфонилокси)бутил]пентандикарбоновой кислоты (34) (согласно S. Hanessian и др., J. Org. Chem., 70, 5070-5085(2005. К раствору 1,00 г (3,63 ммоль) диметилового эфира N-Boc-глутаминовой кислоты (35) в безводном ТГФ (20 мл) при температуре -78 С добавляют LiHMDS (7,8 мл, 1 М раствор в ТГФ). Полученную смесь перемешивают в течение 45 мин при температуре -78 С. Затем, при температуре -78 С, медленно прикапывают раствор 2,17 г (5,45 ммоль) 1,4-бутандиолдитозилата в ТГФ (10 мл). Смесь перемешивают в течение 60 мин. Реакцию гасят путем добавления раствора хлорида аммония, реакционную смесь нагревают до комнатной температуры и экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Растворитель удаляют в вакууме и сырой продукт очищают колоночной хроматографией (силикагель, этилацетат/гексан=от 10:90 до 20:80). Получают 0,418 г (23%) диметилового эфира 2-трет-бутоксикарбониламино-4-[4-(толуол-4 сульфонилокси)бутил]пентандикарбоновой кислоты (34). Элементный анализ для C23H35NO9S: найдено (%): С 54,9; Н 7,1; N 2,7; рассчитано (%): С 55,07; Н 7,03; N 2,79.[F-18]-Фторид получают по [O-18](р,n)[F-18]-реакции в циклотроне. Раствор изотопов (3,08 ГБк) наносят на Sep-Pack Light QMA-картуш. [F-18]-Фторид элюируют из картуша при использовании криптофикс 2.2.2/K2CO3-раствора (5 г К 2.2.2; 1 мг K2CO3, MeCN (1,5 мл), вода (0,5 мл. Растворитель удаляют при температуре 120 С в токе азота при добавке ацетонитрила (трижды по 1 мл). Добавляют 5 мг (10,0 мкмоль) диметилового эфира 2-трет-бутоксикарбониламино-4-[4-(толуол-4 сульфонилокси)бутил]пентандикарбоновой кислоты (34) в 1 мл ацетонитрила и полученную смесь пере- 27017713 мешивают в течение 10 мин при температуре 100 С. После охлаждения до температуры примерно 60 С смесь наносят на картуш Silica-Plus. Промежуточный продукт очищают путем ВЭЖХ (С 18, ацетонитрил/вода). ВЭЖХ-фракцию разбавляют водой (примерно 50 мл) и наносят на С 18-картуш. Промежуточный продукт элюируют с помощью 1 мл ацетонитрила. При времени синтеза 92 мин получают 812 МБк (48%, ТСХ) диметилового эфира 2 трет-бутоксикарбониламино-4-(4-[F-18]-фторбутил)пентандикарбоновой кислоты (32). Синтез 2-амино-4-(4-фторбутил)пентандикарбоновой кислоты (30) путем удаления защиты от диметилового эфира 2-трет-бутоксикарбониламино-4-(4-[F-18]-фторбутил)пентандикарбоновой кислоты(32). 812 МБк диметилового эфира 2-трет-бутоксикарбониламино-4-(4-[F-18]-фторбутил)пентандикарбоновой кислоты (32) в 1 мл ацетонитрила смешивают с 0,5 мл 4 н. HCl. Смесь нагревают в течение 10 мин при перемешивании при температуре 130 С (температура масляной бани). После охлаждения до комнатной температуры раствор нейтрализуют путем добавления примерно 700 мкл 2 н. раствора NaOH. Получают 691 МБк (97%, ТСХ) 2-амино-4-(4-фторбутил)пентандикарбоновой кислоты (30). Синтез диметилового эфира 2-трет-бутоксикарбониламино-4-(3-фторбутил)пентандикарбоновой кислоты (37) (согласно S. Hanessian и др., J. Org. Chem., 70, 5070-5085 (2005. К раствору 1,00 г (3,63 ммоль) диметилового эфира N-Boc-глутаминовой кислоты (26) в безводном ТГФ (20 мл) при температуре -78 С добавляют LiHMDS (7,8 мл, 1 М раствор в ТГФ). Полученную смесь перемешивают в течение 45 мин при температуре -78 С. Затем, при температуре -78 С, медленно прикапывают раствор 0,84 г (5,45 ммоль) 1-бром-3-фторпропана в ТГФ (10 мл). Смесь перемешивают в течение 60 мин. Реакцию гасят путем добавления раствора хлорида аммония, нагревают до комнатной температуры и экстрагируют дихлорметаном. Объединенные органические фазы промывают насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Растворитель удаляют в вакууме, и сырой продукт очищают колоночной хроматографией (силикагель, этилацетат/гексан=от 10:90 до 40:60). Получают 0,596 г (47%) диметилового эфира 2 трет-бутоксикарбониламино-4-(3-фторбутил)пентандикарбоновой кислоты (37). Элементный анализ для C16H28FNO6: найдено (%): С 54,94; Н 8,01; N 4,04; рассчитано (%): С 55,00; Н 8,08; N 4,01. 2-Амино-4-(2-фторпропил)пентандикарбоновая кислота (39). 300 мг диметилового эфира 2-трет-бутоксикарбониламино-4-(3-фторбутил)пентандикарбоновой кислоты (37) растворяют в 100 мл метанола и при перемешивании смешивают с 5 мл 6 н. HCl. Реакционную смесь кипятят с обратным холодильником в течение 15-20 мин, концентрируют досуха, разбавляют с помощью 100 мл воды, гидрохлорид отфильтровывают и осторожно промывают 325 мл воды. Аминокислоту 38 выделяют посредством ионообменной хроматографии при использовании колонки Dowex 50w8 в Н+-форме (элюент: 5%-ный водный раствор NH3). Пример 10. Биологическая характеристика. Для оценки поглощения опухолевыми клетками [18F]глутаминовой кислоты осуществляли эксперименты в отношении поглощения клетками в случае человеческих клеток А 549 (немелкоклеточная бронхиальная карцинома) и НТ 29 (рак ободочной кишки). Поглощение опухолевыми клетками производных глутаминовой кислоты сравнивали с [18F]FDG (Гольд-стандарт для онкологических РЕТ-исследований). Результаты представлены на фиг. 1. Фиг. 2 - сравнение зависимого от времени поглощения опухолевыми клетками [18F]-4-глутаминовой кислоты [20-35 мкМ] (слева) и [F-18]-FDG [2 мкМ] (справа) в случае А 549-клеток. Клетки инкубировали с 250 кБк/лунка. Для экспериментов по вытеснению использовали L-глутаминовую кислоту (1 мМ), соответственно, глюкозу (5 мМ) (среднее значениестандартное отклонение, n=3). Неожиданно высокое поглощение [18F]-4-глутаминовой кислоты в случае опухолевых клеток А 549 и НТ 29 показывает, что эти фторированные производные глутаминовой кислоты должны обладать потенциалом в отношении визуализации опухоли в смысле изобретения. Аналогичные результаты в отношении поглощения достигнуты в случае [18F]-4-глутамина, 2 амино-4-(2-[F-18]-фторэтокси)пентандикарбоновой кислоты и 2-амино-4-(3-[F-18]-фторпропил)пентандикарбоновой кислоты. Для оценки накопления в опухоли и распределения в ткани у подопытных животных подвергали тестированию [18F]-4-глутаминовую кислоту при использовании мышиной модели F9-тератокарциномы у NMRI-"голых" мышей и мышиной модели B16F1-меланомы у C57BI6-мышей. Для этого 1106 клеток (F9), соответственно, 5105 клеток (B16F1) суспендировали в 100 мкл забуференном фосфатом физиологическим растворе поваренной соли и вводили подкожно в правый, с задней стороны, бок соответствующего вида подопытного животного (NMRI для F9 и C57-BI6 для B16F1)(Berndorff и др., Clin. Cancer Res., 11, 2005 (2005. Спустя 14 суток (F9), соответственно, 10 суток (В 16) опухоли достигали размера примерно 80-100 мм 2. [18F]-4-Глутаминовую кислоту (370 кБк, в 100 мкл физиологического раствора поваренной соли) вводили внутривенно в хвостовую вену. Спустя, соответственно, 15, 60 и 120 минут животных умерщвляли, извлекали ткани органов и опухолевые ткани, взвеши- 28
МПК / Метки
МПК: A61K 51/04, C07C 251/24, C07B 59/00, C07C 309/73, C07C 229/24, C07D 207/16, C07C 271/22, A61K 31/195
Метки: l-глутамин, l-глутаминовая, производные, применение, способ, получения, также, f-18]-меченый, f-18]-меченая, кислота
Код ссылки
<a href="https://eas.patents.su/30-17713-f-18-mechenaya-l-glutaminovaya-kislota-f-18-mechenyjj-l-glutamin-ih-proizvodnye-i-ih-primenenie-a-takzhe-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">[f-18]-меченая l-глутаминовая кислота, [f-18]-меченый l-глутамин, их производные и их применение, а также способ их получения</a>
Предыдущий патент: Композиции для разжижения и осахаривания крахмала, основанные на активности пуллуланазы, и способы получения пептидов с активностью пуллуланазы
Следующий патент: Модуляторы tgr5 и способы их применения
Случайный патент: Композиции для ингаляции