2,3-дигидробензо[1,4]диоксин-2-илметиловые производные в качестве α2с антагонистов для применения в лечении заболеваний периферической и центральной нервной системы
Номер патента: 17554
Опубликовано: 30.01.2013
Авторы: Хольм Патрик, Руммакко Петтери, Дин Белл Дэвид, Карльялайнен Арто, Толванен Арто, Вольфарт Герд
Формула / Реферат
1. Соединение формулы I
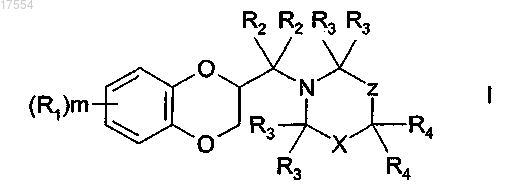
где X представляет собой C(R5)(R6) или C(R7)(R8);
Z представляет собой -[C(R4)2]n- или одинарную связь;
R1 представляет собой, независимо в каждом случае, гидрокси, (C1-C6)алкил, (C1-C6)алкокси, галоген, галоген(C1-С6)алкил, фенил(C1-C6)алкокси, (C1-C6)алкокси-(C=O)-, CN, NO2, NH2, моно- или ди(C1-C6)алкиламино или карбокси;
R2 представляет собой, независимо в каждом случае, H;
R3 представляет собой, независимо в каждом случае, H;
R4 представляет собой, независимо в каждом случае, H, гидрокси, (C1-C6)алкил;
R5 представляет собой H или гидрокси;
или R4 и R5, присоединенные к соседним атомам углерода кольца, образуют связь между атомами углерода кольца, к которым они присоединены;
R6 представляет собой фенил, незамещенный или замещенный 1 или 2 заместителем(ями) R9;
R7 представляет собой Н, (C1-C6)алкил, гидрокси(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкил или (C1-C6)алкокси-(C=O)-;
или R4 и R7, присоединенные к соседним атомам углерода кольца, образуют связь между атомами углерода кольца, к которым они присоединены;
R8 представляет собой гидрокси, (C1-C6)алкил, (С2-C6)алкенил, (C1-C6)алкокси, галоген, гидрокси(C1-C6)алкил, галоген(C1-C6)алкил, гидрокси(C1-C6)алкокси, галоген(C1-С6)алкокси, (C1-C6)алкокси(C1-C6)алкил, (С2-С6)алкенилокси(С1-С6)алкил, (C1-C6)алкил-(C=O)-, (C1-C6)алкокси-(C=O)-, (C1-С6)алкокси-(C=O)-(C1-C6)алкил, (C1-C6)алкил-S-, (C1-C6)алкил-(C=O)-O-, (C1-C6)алкил-(C=O)-O-(C1-C6)алкил, гидрокси-(С=О)-(C1-С6)алкокси, гидрокси-(С=О)-(C1-C6)алкокси(C1-C6)алкил, (C1-С6)алкокси-(C=O)-(C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкил-S-(C1-C6)алкил, гидрокси(C1-C6)алкил-S-(C1-C6)алкил, (C1-C6)алкокси(C1-С6)алкил-S-(C1-C6)алкил, (C1-C6)алкил-(С=О)-S-(C1-C6)алкил, (C1-C6)алкил-O-(O=S=O)-(C1-C6)алкил, (C1-C6)алкил-(O=S=O)-O-(C1-C6)алкил, гидрокси(C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкокси(C1-C6)алкил, галоген(C1-С6)алкокси(C1-C6)алкил, CN, (R10)2N-, (R10)2N-(C1-C6)алкил, (R10)2N-(C=O)-, карбокси, R11-(O=S=O)-, R11-(O=S=O)-O- или (C1-C6)алкокси-(C1-C6)алкокси;
или R4 и R8, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное фенильное кольцо, где указанное фенильное кольцо является незамещенным или замещенным 1 или 2 заместителем(ями), каждый из которых независимо представляет собой гидрокси, (C1-C6)алкил, (C1-C6)алкокси, гидрокси(C1-C6)алкил, галоген(C1-C6)алкил, (C1-C6)алкокси (C1-С6)алкил, (C1-C6)алкил-(C=O)- или (C1-C6)алкокси-(C=O)-;
или R4 и R8, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное 5- или 6-членное насыщенное или ненасыщенное карбоциклическое кольцо, где указанное карбоциклическое кольцо является незамещенным или замещенным 1 или 2 заместителем(ями), каждый из которых независимо представляет собой гидрокси, (C1-C6)алкил, (C1-C6)алкокси, гидрокси(C1-C6)алкил, галоген(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкил-(C=O)-, (C1-C6)алкокси-(C=O)- или оксо;
R9 представляет собой, независимо в каждом случае, гидрокси, (C1-C6)алкил, (C1-C6)алкокси, галоген, гидрокси(C1-C6)алкил, галоген(C1-C6)алкил, гидрокси(C1-C6)алкокси, галоген(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкил, (С2-С6)алкенилокси(C1-C6)алкил, (C1-C6)алкил-(C=O)-, (C1-C6)алкокси-(C=O)-, (C1-C6)алкокси-(C=O)-(C1-C6)алкил, (C1-C6)алкил-(C=O)-O-, (C1-C6)алкил-(C=O)-O-(C1-C6)алкил, гидрокси-(C=O)-(C1-C6)алкокси, гидрокси-(C=O)-(C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкокси-(C=O)-(C1-C6)алкокси(C1-C6)алкил, гидрокси(C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкокси(C1-C6)алкил, галоген(C1-C6)алкокси(C1-C6)алкил, CN, (R10)2N-, (R10)2N-(C1-C6)алкил, (R10)2N-(С=О)-, карбокси, R11-(O=S=O)- или R11-(O=S=O)-O-;
или R9 и R9, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное 5- или 6-членное ненасыщенное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранных из О и S, где указанное гетероциклическое кольцо является незамещенным или замещенным 1 или 2 заместителем(ями), каждый из которых независимо представляет собой гидрокси, (C1-С6)алкил, (C1-C6)алкокси, гидрокси(C1-C6)алкил, галоген(C1-С6)алкил, (C1-C6)алкокси(C1-C6)алкил, (C1-С6)алкил-(С=О)- или (C1-С6)алкокси-(С=О)-;
R10 представляет собой, независимо в каждом случае, H;
R11 представляет собой, независимо в каждом случае, (C1-C6)алкил или галоген(C1-C6)алкил;
m равно 0, 1 или 2 и
n равно 1 или 2;
или его фармацевтически приемлемая соль;
при условии, что соединение не представляет собой
1-(6-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметилпиперидин,
1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметилпиперидин,
1-[1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-ил)этил]-3,5-диметилпиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметилпиперидин,
1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3,3-диметилпиперидин,
1-(6-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3,3-диметилпиперидин,
1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин,
1-(6-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин,
метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты,
метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,5,6-тетрагидропиридин-3-карбоновой кислоты,
метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-4-гидрокси-1,2,5,6-тетрагидропиридин-3-карбоновой кислоты,
2-(2,3-дигидробензо[1,4]диоксин-2-илметил)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин,
2-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4-тетрагидроизохинолин или
1-(2,3-дигидробензо[1,4]диоксин-2-илметил-3-(3-трифторметилфенил)пирролидин.
2. Соединение по п.1, где Z представляет собой -[C(R4)2]n- и n равно 1.
3. Соединение по любому из пп.1 или 2, где R4 представляет собой, независимо в каждом случае, Н.
4. Соединение по любому из пп.1-3, где m равно 0.
5. Соединение по любому из пп.1-3, где m равно 1 и R1 представляет собой гидрокси, (С1-С6)алкил или галоген.
6. Соединение по любому из пп.1-5, где X представляет собой С(R5)(R6).
7. Соединение по любому из пп.1-6, где R5 представляет собой Н.
8. Соединение по любому из пп.1-7, где
R6 представляет собой фенил, замещенный 1 заместителем R9; и
R9 представляет собой гидрокси, (C1-C6)алкил, (C1-C6)алкокси, галоген, гидрокси(C1-C6)алкокси или (R10)2N-.
9. Соединение по любому из пп.1-5, где X представляет собой C(R7)(R8).
10. Соединение по п.9, где R7 представляет собой H или (C1-C6)алкил.
11. Соединение по любому из пп.9 или 10, где R8 представляет собой гидрокси(C1-C6)алкил, гидрокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкил или гидрокси(C1-C6)алкокси(C1-C6)алкил.
12. Соединение по п.1, где
X представляет собой C(R5)(R6) или C(R7)(R8);
Z представляет собой -[C(R4)2]n- или одинарную связь;
R1 представляет собой, независимо в каждом случае, гидрокси, (C1-C6)алкил, (C1-C6)алкокси, галоген, фенил(C1-C6)алкокси или NO2;
R2 представляет собой, независимо в каждом случае, H;
R3 представляет собой, независимо в каждом случае, H;
R4 представляет собой, независимо в каждом случае, H, гидрокси или (C1-C6)алкил;
R5 представляет собой Н;
или R4 и R5, присоединенные к соседним атомам углерода кольца, образуют связь между атомами углерода кольца, к которым они присоединены;
R6 представляет собой фенил, незамещенный или замещенный 1 или 2 заместителем(ями) R9;
R7 представляет собой Н, (C1-C6)алкил, гидрокси(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкил или (C1-C6)алкокси-(C=O)-;
или R4 и R7, присоединенные к соседним атомам углерода кольца, образуют связь между атомами углерода кольца, к которым они присоединены;
R8 представляет собой гидрокси, (C1-C6)алкил, (С2-С6)алкенил, (C1-C6)алкокси, галоген, гидрокси(C1-C6)алкил, галоген(C1-C6)алкил, гидрокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкил, (С2-C6)алкенилокси(C1-C6)алкил, (C1-C6)алкил-(C=O)-, (C1-C6)алкокси-(C=O)-, (C1-C6)алкокси-(C=O)-(C1-C6)алкил, (C1-C6)алкил-(C=O)-O-(C1-C6)алкил, гидрокси-(C=O)-(C1-C6)алкокси(C1-С6)алкил, (C1-C6)алкокси-(C=O)-(C1-C6)алкокси(C1-C6)алкил, гидрокси(C1-C6)алкил-S-(C1-C6)алкил, (C1-C6)алкил-(C=O)-S-(C1-C6)алкил, (C1-C6)алкил-(O=S=O)-O-(C1-C6)алкил, гидрокси(C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкокси(C1-C6)алкил, галоген(C1-C6)алкокси(C1-C6)алкил, CN, (R10)2N-(C1-C6)алкил, (R10)2N-(C=O)-, карбокси или (C1-C6)алкокси-(C1-C6)алкокси;
или R4 и R8, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное фенильное кольцо, где указанное фенильное кольцо является незамещенным или замещенным 1 или 2 заместителем(ями), каждый из которых независимо представляет собой гидрокси(C1-C6)алкил или (C1-C6)алкокси-(C=O)-;
или R4 и R8, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное 6-членное насыщенное карбоциклическое кольцо, где указанное карбоциклическое кольцо является незамещенным;
R9 представляет собой, независимо в каждом случае, гидрокси, (C1-C6)алкил, (C1-C6)алкокси, галоген, гидрокси(C1-C6)алкил, галоген(C1-C6)алкил, гидрокси(C1-C6)алкокси, галоген(C1-C6)алкокси, (C1-C6)алкокси-(C=O)-, (C1-C6)алкил-(C=O)-O-, гидрокси-(C=O)-(C1-C6)алкокси, CN, (R10)2N-, (R10)2N-(C=O)-, R11-(O=S=O)- или R11-(O=S=O)-O-;
или R9 и R9, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное 5- или 6-членное ненасыщенное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, выбранных из О, где указанное гетероциклическое кольцо является незамещенным;
R10 представляет собой, независимо в каждом случае, H,
R11 представляет собой, независимо в каждом случае, (C1-С6)алкил или галоген(C1-C6)алкил;
m равно 0, 1 или 2 и
n равно 1 или 2.
13. Соединение по п.12, где
X представляет собой C(R5)(R6) или C(R7)(R8);
Z представляет собой -[C(R4)2]n-;
R1 представляет собой, независимо в каждом случае, гидрокси, (C1-C6)алкил или галоген;
R2 представляет собой, независимо в каждом случае, H;
R3 представляет собой, независимо в каждом случае, H;
R4 представляет собой, независимо в каждом случае, H;
R5 представляет собой Н;
R6 представляет собой фенил, незамещенный или замещенный 1 или 2 заместителем(ями) R9;
R7 представляет собой (C1-C6)алкил;
R8 представляет собой гидрокси(C1-C6)алкил, гидрокси(C1-С6)алкокси, (C1-C6)алкокси(C1-C6)алкил или гидрокси(C1-C6)алкокси(C1-C6)алкил,
R9 представляет собой, независимо в каждом случае, гидрокси, (C1-C6)алкил, (C1-C6)алкокси, галоген, гидрокси(C1-С6)алкокси или (R10)2N-;
R10 представляет собой, независимо в каждом случае, Н,
m равно 0 или 1;
n равно 1.
14. Соединение по п.12, где
X представляет собой C(R5)(R6) или C(R7)(R8);
Z представляет собой одинарную связь;
R1 представляет собой, независимо в каждом случае, гидрокси, (С1-С6)алкил или галоген;
R2 представляет собой, независимо в каждом случае, H;
R3 представляет собой, независимо в каждом случае, H;
R4 представляет собой, независимо в каждом случае, H;
R5 представляет собой Н;
R6 представляет собой фенил, незамещенный или замещенный 1 или 2 заместителем(ями) R9;
R7 представляет собой H или (C1-C6)алкил;
R8 представляет собой гидрокси(C1-C6)алкил, гидрокси(C1-С6)алкокси, (C1-C6)алкокси(C1-C6)алкил или гидрокси(C1-С6)алкокси(C1-C6)алкил,
R9 представляет собой, независимо в каждом случае, гидрокси, (C1-C6)алкил, (C1-C6)алкокси, галоген, гидрокси(C1-C6)алкокси или (R10)2N-;
R10 представляет собой, независимо в каждом случае, Н,
m равно 0 или 1;
n равно 1.
15. Соединение по п.1, где соединение представляет собой
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-5-фенил-1,2,3,6-тетрагидропиридин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-фенилпиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(2-метоксифенил)пиперидин,
3-(4-хлорфенил)-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(3-метоксифенил)пиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-п-толилпиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(4-метоксифенил)пиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-o-толилпиперидин,
4-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(3-фторфенил)пиперидин,
3-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,
2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,
(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-фторфенил)пиперидин,
(S*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-фторфенил)пиперидин,
(R*)-1-[{S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-фторфенил)пиперидин,
(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-фторфенил)пиперидин×HCl,
(S*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-фторфенил)пиперидин,
(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(4-фторфенил)пиперидин,
(S*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(4-фторфенил)пиперидин,
(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-трифторметилфенил)пиперидин,
(S*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-трифторметилфенил)пиперидин,
(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(4-трифторметилфенил)пиперидин,
(S*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(4-трифторметилфенил)пиперидин,
(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-метоксифенил)пиперидин,
(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-метоксифенил)пиперидин×HCl,
(S*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-метоксифенил)пиперидин,
(R*)-3-{1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фенол,
(R*)-3-{1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фенол×HCl,
(3-{(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фенил)метанол,
3-{(S)-1-[(R*)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фениловый эфир уксусной кислоты×HCl,
2-(3-{(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фенокси)этанол,
3-(3-{(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фенокси)пропан-1-ол,
3-{(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фениловый эфир трифторметансульфоновой кислоты,
(3-{(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фенокси)уксусная кислота,
3-{(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}бензонитрил,
3-бензо[1,3]диоксол-5-ил-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин,
3-[(R*)-1-((S)-6-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,
(S)-2-[(R*)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-6-ол,
3-[(R*)-1-((S)-7-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,
(S)-3-[(R*)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-6-ол,
3-[(R*)-1-((S)-8-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,
(S)-3-[(R*)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-5-ол,
(R*)-3-[1-((S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-5-метил-1,2,3,6-тетрагидропиридин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметил-1,2,3,6-тетрагидропиридин,
[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,5,6-тетрагидропиридин-3-ил]метанол,
2-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4,5,6,7,8-октагидроизохинолин,
2-(2,3-дигидробензо[1,4]диоксин-2-илметил)декагидроизохинолин,
этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты,
[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]метанол,
этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-карбоновой кислоты,
этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-карбоновой кислоты,
[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]метанол,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметил-3-метилпиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этоксиметил-3-метилпиперидин,
3-хлорметил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин,
2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]пропан-2-ол,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(1-метокси-1-метилэтил)-3-метилпиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-гидроксиметил-3-метилпиперидин-4-ол,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметиловый эфир уксусной кислоты,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметиловый эфир метансульфоновой кислоты,
[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]метанол,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этил-3-метоксиметилпиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметоксиметил-3-метилпиперидин,
1-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]этанон,
1-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]этанол,
3-аллилоксиметил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин,
2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-илметокси]этанол,
3-аллилоксиметил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин,
этиловый эфир 3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты,
[3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]метанол,
3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметилпиперидин,
3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этоксиметилпиперидин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метил-3-(2,2,2-трифторэтоксиметил)пиперидин,
2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметокси]этанол,
этиловый эфир [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]уксусной кислоты,
2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]этанол,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(2-метоксиэтил)пиперидин,
амид 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбонитрил,
С-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]метиламин,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ол,
метиловый эфир 2-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4-тетрагидроизохинолин-8-карбоновой кислоты,
[2-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4-тетрагидроизохинолин-8-ил]метанол,
этиловый эфир (S)-1-((R)-2,3-дигидробензо[1,4]диоксин-2-карбонил)-3-метилпиперидин-3-карбоновой кислоты,
(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-карбоксилат лития,
{(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-ил}метанол,
2-{(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметокси}этанол,
D-тартрат 2-{(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметокси}этанола,
(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-метоксиэтоксиметил)-3-метилпиперидин,
(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метил-3-(2,2,2-трифторэтоксиметил)пиперидин,
(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметиловый эфир метансульфоновой кислоты,
S-{(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметил}овый эфир тиоуксусной кислоты,
2-{(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметилсульфанил}этанол,
трет-бутиловый эфир {(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметокси}уксусной кислоты,
{(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметокси}ацетат натрия,
2-[(S)-1-((S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметокси]этанол,
этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-фторпиперидин-3-карбоновой кислоты,
[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-фторпиперидин-3-ил]метанол,
этиловый эфир (S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-карбоновой кислоты,
[(S)-1-((S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]метанол,
(S)-1-((S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметил-3-метилпиперидин,
(S)-1-((S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметил-3-метилпиперидин×HCl,
(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метоксиметил-3-метилпиперидин,
3-{(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фениламин,
оксалат (R*)-3-{1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-ил}фенола,
(S)-2-[(R*)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-5-ол,
1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-метоксифенил)пирролидин,
(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-фторэтоксиметил)-3-метилпиперидин×HCl,
(R*)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-фторметоксифенил)пиперидин,
метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пирролидин-3-карбоновой кислоты,
[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пирролидин-3-ил]метанол,
2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пирролидин-3-илметокси]этанол,
метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпирролидин-3-карбоновой кислоты,
[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпирролидин-3-ил]метанол,
2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпирролидин-3-илметокси]этанол,
1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметил-3-метилпирролидин или
3-[(R)-1-((S)-7-нитро-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол.
16. Применение соединения по любому из пп.1-15 в качестве лекарственного средства для лечения заболеваний или состояний периферической или центральной нервной системы, где α2C антагонисты показаны как полезные.
Текст
2,3-ДИГИДРОБЕНЗО[1,4]ДИОКСИН-2-ИЛМЕТИЛОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ 2 С АНТАГОНИСТОВ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ ПЕРИФЕРИЧЕСКОЙ И ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ где X, Z, R1-R4 и m имеют значения, определенные в формуле изобретения, проявляют 2C антагонистическую активность и, таким образом, являются применимыми для лечения заболеваний и состояний периферической и центральной нервной системы. 017554 Область техники, к которой относится изобретение Настоящее изобретение относится к фармакологически активным 3-замещенным 1-(2,3 дигидробензо[1,4]диоксин-2-илметил)азациклам или их фармацевтически приемлемым солям и сложным эфирам, а также к фармацевтическим композициям, содержащим их, и их применению в качестве антагонистов 2C. Предпосылки создания изобретения Широкоизвестным и общепринятым в данной области техники является то, что соединения, проявляющие -адренергическую активность, могут быть использованы для лечения широкого разнообразия заболеваний и состояний периферической нервной системы и центральной нервной системы (ЦНС). На основании фармакологического принципа -адренергические рецепторы могут быть разделены на 1 и 2 адренорецепторы, каждый из которых дополнительно может быть разделен на подтипы. У человека были обнаружены три генетически кодированных подтипа, а именно 2A, 2B и 2C адренорецепторы. Четвертый фармакологически определенный подтип, а именно 2D адренорецептор, известен у некоторых других млекопитающих и грызунов. Он соответствует генетически определенному 2A адренорецептору. Подтипы адренорецептора 2 имеют различное распределение в тканях и функциональные роли. Например, в то время как 2A адренорецепторы широко представлены в различных тканях, 2C адренорецепторы концентрируются в ЦНС и, очевидно, играют роль в модуляции специфических ЦНСопосредованных поведенческих и физиологических ответов. В данной области техники известны некоторые соединения, которые являются неспецифическими для любых из вышеупомянутых подтипов 2, и некоторые соединения, которые являются специфическими для определенных подтипов 2. Например, атипамезол, раскрытый в EP 183492 A1 (соединениеXV на стр. 13), представляет собой неспецифический 2 антагонист. Соединения, которые представляют собой селективные антагонисты для подтипа 2C и являются подходящими для лечения психического расстройства, например расстройства высшей нервной деятельности, вызванного стрессом, раскрыты вUS 5902807. Такими соединениями являются, например, MK-912 и BAM-1303. Производные имидазола,обладающие агонистической активностью к 2B или 2B/2C адренорецепторам, раскрыты в WO 99/28300. Производные хинолина, подходящие в качестве 2 антагонистов, раскрыты в WO 01/64645 и WO 2004/067513. Производные арилхинолизина, подходящие в качестве 2 антагонистов, раскрыты в WO 03/082866. В целях возможности уменьшения риска неблагоприятных явлений во время лечения будет желательной увеличенная селективность 2 антагонистов. Например, использование неселективных 2 антагонистов характеризуется побочными эффектами, такими как повышение артериального давления, частоты сердечных сокращений, секреции слюны, желудочно-кишечной секреции и тревога. Также будет желательной увеличенная активность 2C антагонистов в целях возможности снижения необходимой дозы. Как известно, 3-замещенные 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)азациклы, 1-(6-третбутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметилпиперидин,1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметилпиперидин, 1-[1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин 2-ил)этил]-3,5-диметилпиперидин, 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметилпиперидин,1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3,3-диметилпиперидин, 1-(6-трет-бутил-2,3 дигидробензо[1,4]диоксин-2-илметил)-3,3-диметилпиперидин,1-(7-трет-бутил-2,3-дигидробензо[1,4] диоксин-2-илметил)-3-метилпиперидин,1-(6-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3 метилпиперидин и 1-[1-(6-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-ил)этил]-3,5-диметилпиперидин раскрыты в WO 90/02122. Метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3 карбоновой кислоты, метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-4-оксопиперидин-3 карбоновой кислоты, метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,5,6-тетрагидропиридин-3-карбоновой кислоты и метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-4 гидрокси-1,2,5,6-тетрагидропиридин-3-карбоновой кислоты раскрыты в US 4957928. 2-(2,3 Дигидробензо[1,4]диоксин-2-илметил)-6,7-диметокси-1-метил-1,2,3,4-тетрагидроизохинолин и 2-(2,3 дигидробензо[1,4]диоксин-2-илметил)-6,7-диметокси-1,2,3,4-тетрагидроизохинолин раскрыты в DD 250930 A1. 2-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4-тетрагидроизохинолин раскрыт в J. Org.Chem., 26 (1961) 339. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил-3-(3-трифторметилфенил)пирролидин раскрыт в US 3644414. Краткое изложение сущности изобретения Целью настоящего изобретения является предоставление дополнительных 2C антагонистов, которые могут быть использованы для лечения заболеваний или состояний периферической или центральной нервной системы, где 2C антагонисты показаны как полезные. Соответственно, целью настоящего изобретения является предоставление дополнительных соединений, используемых в качестве 2C антагонистов при лечении млекопитающих. Кроме того, предоставляются фармацевтические композиции, содер-1 017554 жащие соединения по настоящему изобретению. 2 антагонисты по настоящему изобретению имеют улучшенную селективность к 2C подтипу адренорецепторов и/или увеличенную активность. Подробное описание изобретения Настоящее изобретение относится к новым 2C антагонистам, имеющим общую формулу IR5 представляет собой H или гидрокси; или R4 и R5, присоединенные к соседним атомам углерода кольца, образуют связь между атомами углерода кольца, к которым они присоединены;R6 представляет собой фенил, незамещенный или замещенный 1 или 2 заместителем(ями) R9;R7 представляет собой Н, (C1-C6)алкил, гидрокси(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкил или (C1C6)алкокси-(C=O)-; или R4 и R7, присоединенные к соседним атомам углерода кольца, образуют связь между атомами углерода кольца, к которым они присоединены;R8 представляет собой гидрокси, (C1-C6)алкил, (C2-C6)алкенил, (C1-C6)алкокси, галоген, гидрокси(C1-C6)алкил,галоген(C1-C6)алкил,гидрокси(C1-C6)алкокси,галоген(C1-С 6)алкокси,(C1C6)алкокси(C1-C6)алкил, (С 2-С 6)алкенилокси(C1-C6)алкил, (C1-C6)алкил(C=O)-, (C1-C6)алкокси(C=O)-,(C1-С 6)алкокси-(C=O)-(C1-C6)алкил, (C1-C6)алкил-S-, (C1-C6)алкил-(C=O)-O-, (C1-C6)алкил-(C=O)-O-(C1C6)алкил, гидрокси(C=O)-(C1-С 6)алкокси, гидрокси(C=O)-(C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкокси(С=О)-(C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкил-S-(C1-C6)алкил, гидрокси(C1-C6)алкил-S-(C1-C6)алкил,(C1-C6)алкокси(C1-C6)алкил-S-(C1-C6)алкил,(C1-C6)алкил-(С=О)-S-(C1-C6)алкил,(C1-С 6)алкил-O(O=S=O)-(C1-C6)алкил, (C1-C6)алкил-(O=S=O)-O-(C1-С 6)алкил, гидрокси(C1-C6)алкокси(C1-C6)алкил, (C1C6)алкокси(C1-С 6)алкокси(C1-C6)алкил, галоген(C1-C6)алкокси(C1-C6)алкил, CN, (R10)2N-, (R10)2N-(C1C6)алкил, (R10)2N-(C=O)-, карбокси, R11-(O=S=O)-, R11-(O=S=O)-O- или (C1-C6)алкокси(C1-C6)алкокси; или R4 и R8, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное фенильное кольцо, где указанное фенильное кольцо является незамещенным или замещенным 1 или 2 заместителем(ями), каждый из которых независимо представляет собой гидрокси, (C1-C6)алкил, (C1-C6)алкокси, гидрокси(C1-C6)алкил, галоген(C1-С 6)алкил, (C1-C6)алкокси(C1-С 6)алкил, (C1-C6)алкил-(C=O)- или (C1-C6)алкокси-(C=O)-; или R4 и R8, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное 5- или 6-членное насыщенное или ненасыщенное карбоциклическое кольцо, где указанное карбоциклическое кольцо является незамещенным или замещенным 1 или 2 заместителем(ями), каждый из которых независимо представляет собой гидрокси, (C1-C6)алкил, (C1-C6)алкокси, гидрокси(C1-C6)алкил, галоген(C1-C6)алкил, (C1-C6)алкокси(C1 С 6)алкил, (C1-C6)алкил-(C=O)-, (C1-C6)алкокси(С=О)- или оксо;(C1-C6)алкил, гидрокси(C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкокси(C1-C6)алкил, галоген(C1-C6)алкокси(C1-C6)алкил, CN, (R10)2N-, (R10)2N-(C1-C6)алкил, (R10)2N-(C=O)-, карбокси, R11(O=S=O)- или R11-(O=S=O)-O-; или R9 и R9, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное 5- или 6-членное ненасыщенное гетероциклическое кольцо, содержащее 1 или 2 гетероатом(а), выбранных из O и S, где указанное гетероциклическое кольцо является незамещенным или замещенным 1 или 2 заместителем(ями), каждый из которых независимо представляет собой гидрокси, (C1-С 6)алкил, (C1-C6)алкокси, гидрокси(C1-C6)алкил, галоген(C1-С 6)алкил, (C1-C6)алкокси(C1-C6)алкил, (C1-C6)алкил(C=O)- или (C1-C6)алкокси(C=O)-;n равно 1 или 2; или его фармацевтически приемлемым солям; при условии, что соединение не представляет собой 1-(6-трет-бутил-2,3-дигидробензо[1,4]диоксин 2-илметил)-3,5-диметилпиперидин, 1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметилпиперидин, 1-[1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-ил)этил]-3,5-диметилпиперидин, 1(2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметилпиперидин,1-(7-трет-бутил-2,3-дигидробензо[1,4]диоксин-2-илметил-3-(3-трифторметилфенил)пирролидин. В возможной подгруппе соединений формулы I Z представляет собой -[C(R4)2]n- и n равно 1. В другой возможной подгруппе соединений формулы I n равно 2. В дополнительно возможной подгруппе соединений формулы I Z представляет собой одинарную связь. В дополнительно возможной подгруппе соединений формулы I R4 представляет собой, независимо в каждом случае, H, гидрокси или (C1-C6)алкил. В дополнительно возможной подгруппе соединений формулы I m равно 0. В дополнительно возможной подгруппе соединений формулы I m равно 1. В другой возможной подгруппе соединений формулы I R1 представляет собой гидрокси, (С 1 С 6)алкил или галоген. В дополнительно возможной подгруппе соединений формулы I X представляет собой C(R5)(R6). В дополнительно возможной подгруппе соединений формулы I R5 представляет собой H. В другой возможной подгруппе соединений формулы I R6 представляет собой фенил, замещенный 1 заместителем R9; и(R10)2N-. В дополнительно возможной подгруппе соединений формулы I X представляет собой C(R7)(R8). В другой возможной подгруппе соединений формулы I R7 представляет собой H или (C1-C6)алкил. В другой возможной подгруппе соединений формулы I R8 представляет собой гидрокси(C1C6)алкил, гидрокси(C1-C6)алкокси, (C1-C6)алкокси(C1-C6)алкил или гидрокси(C1-C6)алкокси(C1-C6)алкил. В другой возможной подгруппе соединений формулы I X представляет собой C(R5)(R6) илиR5 представляет собой Н; или R4 и R5, присоединенные к соседним атомам углерода кольца, образуют связь между атомами углерода кольца, к которым они присоединены;R6 представляет собой фенил, незамещенный или замещенный 1 или 2 заместителем(ями) R9;R7 представляет собой Н, (C1-C6)алкил, гидрокси(C1-C6)алкил, (C1-C6)алкокси(C1-C6)алкил или (C1C6)алкокси-(C=O)-; или R4 и R7, присоединенные к соседним атомам углерода кольца, образуют связь между атомами углерода кольца, к которым они присоединены;-3 017554 или R4 и R8, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное фенильное кольцо, где указанное фенильное кольцо является незамещенным или замещенным 1 или 2 заместителем(ями), каждый из которых независимо представляет собой гидрокси(C1-C6)алкил или (C1-C6)алкокси(C=O)-; или R4 и R8, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное 6-членное насыщенное карбоциклическое кольцо, где указанное карбоциклическое кольцо является незамещенным;R9 представляет собой, независимо в каждом случае, гидрокси, (C1-C6)алкил, (C1-C6)алкокси, галоген, гидрокси(C1-С 6)алкил, галоген(C1-C6)алкил, гидрокси(C1-C6)алкокси, галоген(C1-C6)алкокси, (C1C6)алкокси(С=О)-, (C1-C6)алкил(С=О)-O-, гидрокси(C=O)-(C1-C6)алкокси, CN, (R10)2N-, (R10)2N-(C=O)-,R11-(O=S=O)- или R11-(O=S=O)-O-; или R9 и R9, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное 5- или 6-членное ненасыщенное гетероциклическое кольцо, содержащее 1 или 2 гетероатом(а), выбранных из O, где указанное гетероциклическое кольцо является незамещенным;n равно 1 или 2. В дополнительно возможной подгруппе соединений формулы I X представляет собой C(R5)(R6) илиR6 представляет собой фенил, незамещенный или замещенный 1 или 2 заместителем(ями) R9;n равно 1. В дополнительно возможной подгруппе соединений формулы I X представляет собой C(R5)(R6) илиZ представляет собой одинарную связь;R6 представляет собой фенил, незамещенный или замещенный 1 или 2 заместителем(ями) R9;n равно 1. В дополнительно возможной подгруппе соединений формулы I соединение представляет собой 1(2,3-дигидробензо[1,4]диоксин-2-илметил)-5-фенил-1,2,3,6-тетрагидропиридин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-фенилпиперидин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(2-метоксифенил)пиперидин,3-(4-хлорфенил)-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(3-метоксифенил)пиперидин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-n-толилпиперидин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(4-метоксифенил)пиперидин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-о-толилпиперидин,-4 017554 4-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(3-фторфенил)пиперидин,3-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-фторфенил)пиперидин,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-фторфенил)пиперидин,(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-фторфенил)пиперидин,(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-фторфенил)пиперидинHCl,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-фторфенил)пиперидин,(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(4-фторфенил)пиперидин,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(4-фторфенил)пиперидин,(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-трифторметилфенил)пиперидин,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-трифторметилфенил)пиперидин,(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(4-трифторметилфенил)пиперидин,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(4-трифторметилфенил)пиперидин,(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-метоксифенил)пиперидин,(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-метоксифенил)пиперидинHCl,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-метоксифенил)пиперидин,(R)-3-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенол,(R)-3-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенолHCl,(3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенил)метанол,3-(S)-1-[(R)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфениловый эфир уксусной кислотыHCl,2-(3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенокси)этанол,3-(3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенокси)пропан-1-ол,3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфениловый эфир трифторметансульфоновой кислоты,(3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенокси)уксусную кислоту,3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илбензонитрил,3-бензо[1,3]диоксол-5-ил-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин,3-[(R)-1-S)-6-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,(5)-2-[(R)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-6-ол,3-[(R)-1-S)-7-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,(S)-3-[(R)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-6-ол,3-[R)-1-S)-8-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,(S)-3-[(R)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-5-ол,(R)-3-[1-S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-5-метил-1,2,3,6-тетрагидропиридин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3,5-диметил-1,2,3,6-тетрагидропиридин,[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,5,6-тетрагидропиридин-3-ил]метанол,2-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4,5,6,7,8-октагидроизохинолин,2-(2,3-дигидробензо[1,4]диоксин-2-илметил)декагидроизохинолин,этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты,[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]метанол,этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-карбоновой кислоты,этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-карбоновой кислоты,[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]метанол,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметил-3-метилпиперидин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этоксиметил-3-метилпипери 2-илметидин,3-хлорметил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин,2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]пропан-2-ол,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(1-метокси-1-метилэтил)-3-метилпиперидин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-гидроксиметил-3-метилпиперидин-4-ол,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметиловый эфир уксусной кислоты,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметиловый эфир метансульфоновой кислоты,[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]метанол,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этил-3-метоксиметилпиперидин,-5 017554 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметоксиметил-3-метилпиперидин,1-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]этанон,1-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]этанол,3-аллилоксиметил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин,2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-илметокси]этанол,3-аллилоксиметил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин,этиловый эфир 3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты,[3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]метанол,3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметилпиперидин,3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этоксиметилпиперидин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метил-3-(2,2,2-трифторэтоксиметил)пиперидин,2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметокси]этанол,этиловый эфир [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]уксусной кислоты,[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]этанол,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-(2-метоксиэтил)пиперидин,амид 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбонитрил,С-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]метиламин,1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ол,метиловый эфир 2-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4-тетрагидроизохинолин-8 карбоновой кислоты,[2-(2,3-дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4-тетрагидроизохинолин-8-ил]метанол,этиловый эфир(S)-1-R)-2,3-дигидробензо[1,4]диоксин-2-карбонил)-3-метилпиперидин-3 карбоновой кислоты,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-карбоксилат лития,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметанол,2-(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметоксиэтанол,D-тартрат 2-(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметоксиэтанола,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-метоксиэтоксиметил)-3-метилпиперидин,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метил-3-(2,2,2-трифторэтоксиметил)пиперидин,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметиловый эфир метансульфоновой кислоты,S-(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметиловый эфир тиоуксусной кислоты,2-(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметилсульфанилэтанол,трет-бутиловый эфир (S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин 3-илметоксиуксусной кислоты,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметоксиацетат натрия,2-[(S)-1-S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметокси] этанол,этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-фторпиперидин-3-карбоновой кислоты,[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-фторпиперидин-3-ил]метанол,этиловый эфир (S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-карбоновой кислоты,[(S)-1-S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]метанол,(S)-1-S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметил-3-метилпиперидин,(S)-1-S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметил-3-метилпиперидинHCl,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]-диоксин-2-ил)метил]-3-метоксиметил-3-метилпиперидин,3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфениламин,оксалат (R)-3-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенола,(S)-2-[(R)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-5-ол,1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-метоксифенил)пирролидин,(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(2-фторэтоксиметил)-3-метилпиперидинHCl,(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-фторметоксифенил)пиперидин,-6 017554 метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пирролидин-3-карбоновой кислоты,[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пирролидин-3-ил]метанол,2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пирролидин-3-илметокси]этанол,метиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпирролидин-3-карбоновой кислоты,[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпирролидин-3-ил]метанол,2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпирролидин-3-илметокси]этанол,(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметил-3-метилпирролидин или 3-[(R)-1-S)-7-нитро-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол. Для специалиста в данной области техники очевидно, что в соединениях формулы I, если заместители R9 и R9, присоединенные к соседним атомам углерода кольца, образуют вместе с атомами углерода кольца, к которым они присоединены, конденсированное 5- или 6-членное ненасыщенное карбоциклическое кольцо или конденсированное 5- или 6-членное ненасыщенное гетероциклическое кольцо, то указанное карбоциклическое кольцо или гетероциклическое кольцо может иметь дополнительные ненасыщенные связи в дополнение к ненасыщенной связи между атомами углерода кольца, к которым присоединены указанные заместители. Термины, используемые в данном описании, имеют значения, указанные ниже. Термин "по меньшей мере один", используемый в значениях ниже, относится к одному или нескольким значениям, таким как один. Например, термин "по меньшей мере один галоген" относится к одному или нескольким галогенам, таким как один галоген. Термин "гидрокси", используемый в данном описании как таковой или как часть другой группы,относится к -OH-группе. Термин "(C1-C6)алкил", используемый в данном описании как таковой или как часть другой группы,относится к насыщенной углеводородной группе с прямой или разветвленной цепью, имеющей 1, 2, 3, 4,5 или 6 атом(ов) углерода. Примеры, представляющие (C1-C6)алкил, включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил и н-гексил. Термин "(C1-C6)алкокси", используемый в данном описании как таковой или как часть другой группы, относится к (C1-C6)алкильной группе, которая, как определено в данном описании, присоединена к исходному фрагменту молекулы через атом кислорода. Примеры, представляющие (C1-C6)алкокси, включают, но не ограничиваются ими, метокси, этокси, н-пропокси, н-бутокси, изобутокси, втор-бутокси,трет-бутокси, 2,2-диметилпропокси, 3-метилбутокси и н-гексокси. Термин "гало" или "галоген", используемый в данном описании как таковой или как часть другой группы, относится к фтору, хлору, брому или йоду. Термин "галоген(C1-C6)алкил", используемый в данном описании, относится по меньшей мере к одному галогену, как определено в данном описании, присоединенному к исходному фрагменту молекулы через (C1-C6)алкильную группу, как определено в данном описании. Если имеется несколько галогенов,то галогены могут быть одинаковыми или различными. Примеры, представляющие галоген(C1-C6)алкил, включают, но не ограничиваются ими, фторметил,хлорметил, дифторметил, трифторметил, 2-хлорэтил, 3-бромпропил и 2-хлорпропил. Термин "фенил(C1-C6)алкокси", используемый в данном описании, относится по меньшей мере к одной фенильной группе, присоединенной к исходному фрагменту молекулы через группу (C1C6)алкокси, как определено в данном описании. Примеры, представляющие фенил(C1-C6)алкокси, включают, но не ограничиваются ими, фенилметокси, 2-фенилэтокси и 3-фенилпропокси. Термин "амино", используемый в данном описании как часть другой группы, относится к группе-NH2. Термин "моно(C1-C6)алкиламино", используемый в данном описании, относится к одной (C1C6)алкильной группе, как определено в данном описании, присоединенной к исходному фрагменту молекулы через аминогруппу, как определено в данном описании. Примеры, представляющие моно(C1C6)алкиламино, включают, но не ограничиваются ими, N-метиламино, N-этиламино и N-бутиламино. Термин "ди(C1-C6)алкиламино", используемый в данном описании, относится к двум (C1C6)алкильным группам, как определено в данном описании, присоединенным к исходному фрагменту молекулы через аминогруппу, как определено в данном описании. (C1-C6)алкильные группы могут быть одинаковыми или различными. Примеры, представляющие ди(C1-C6)алкиламино, включают, но не ограничиваются ими, N,N-диметиламино и N,N-диэтиламино. Термин "карбокси", используемый в данном описании, относится к группе -COOH. Термин "(С 2-C6)алкенил", используемый в данном описании как таковой или как часть другой группы, относится к углеводородной группе с прямой или разветвленной цепью, имеющей 2, 3, 4, 5 или 6 атомов углерода и содержащей по меньшей мере одну двойную связь углерод-углерод. Примеры, представляющие (С 2-С 6)алкенил, включают, но не ограничиваются ими, этенил и проп-2-енил. Термин "гидрокси(C1-C6)алкил", используемый в данном описании как таковой или часть другой группы, относится по меньшей мере к одной гидроксигруппе, как определено в данном описании, при-7 017554 соединенной к исходному фрагменту молекулы через (C1-C6)алкильную группу, как определено в данном описании. Примеры, представляющие гидрокси(C1-C6)алкил, включают, но не ограничиваются ими, гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 2,2-дигидроксиэтил, 1-гидроксипропил, 3-гидроксипропил,1-гидрокси-1-метилэтил и 1-гидрокси-1-метилпропил. Термин "гидрокси(С 2-C6)алкенил", используемый в данном описании, относится по меньшей мере к одной гидроксигруппе, как определено в данном описании, присоединенной к исходному фрагменту молекулы через (C2-C6)алкенильную группу, как определено в данном описании. Примеры, представляющие гидрокси(C2-C6)алкенил, включают, но не ограничиваются ими, 1-гидроксиэтенил, 2-гидроксиэтенил и 1-гидроксипроп-2-енил. Термин "(C1-C6)алкокси(C1-C6)алкил", используемый в данном описании как таковой или как часть другой группы, относится по меньшей мере к одной группе (C1-C6)алкокси, как определено в данном описании, присоединенной к исходному фрагменту молекулы через (C1-C6)алкильную группу, как определено в данном описании. Если имеется несколько групп (C1-C6)алкокси, то группы (C1-C6)алкокси могут быть одинаковыми или различными. Примеры, представляющие (C1-C6)алкокси(C1-C6)алкил, включают, но не ограничиваются ими, метоксиметил, этоксиметил, пропоксиметил, 2-метоксиэтил, 2-этоксиэтил, 2,2-диметоксиэтил, 1-метил-2 пропоксиэтил, 1-метокси-1-метилэтил и 4-метоксибутил. Термин "(С 2-C6)алкенилокси", используемый в данном описании как часть другой группы, относится к (С 2-С 6)алкенильной группе, как определено в данном описании, присоединенной к исходному фрагменту молекулы через атом кислорода. Примеры, представляющие (С 2-C6)алкенилокси, включают, но не ограничиваются ими, этенилокси, проп-2-енилокси, буте-2-нилокси и гекс-3-енилокси. Термин "(С 2-C6)алкенилокси(C1-C6)алкил", используемый в данном описании, относится по меньшей мере к одной группе (C2-C6)алкенилокси, как определено в данном описании, присоединенной к исходному фрагменту молекулы через (C1-C6)алкильную группу, как определено в данном описании. Если имеется несколько групп (C2-C6)алкенилокси, то группы (C2-C6)алкенилокси могут быть одинаковыми или различными. Примеры, представляющие (C2-C6)алкенилокси(C1-C6)алкил, включают, но не ограничиваются ими, проп-2-енилоксиметил и этенилоксиэтил. Термин "гидрокси(C1-C6)алкокси", используемый в данном описании как таковой или как часть другой группы, относится по меньшей мере к одной гидроксигруппе, как определено в данном описании,присоединенной к исходному фрагменту молекулы через группу (C1-C6)алкокси, как определено в данном описании. Примеры, представляющие гидрокси(C1-C6)алкокси, включают, но не ограничиваются ими, гидроксиметокси, дигидроксиметокси, 2-гидроксиэтокси, 2-гидроксипропокси, 3-гидроксипропокси, 2-гидроксибутокси и 2-гидрокси-1-метилэтокси. Термин "(C1-C6)алкокси(C1-C6)алкокси", используемый в данном описании как таковой или как часть другой группы, относится по меньшей мере к одной группе (C1-C6)алкокси, как определено в данном описании, присоединенной к исходному фрагменту молекулы через группу (C1-C6)алкокси, как определено в данном описании. Группы (C1-C6)алкокси могут быть одинаковыми или различными. Примеры, представляющие (C1-C6)алкокси(C1-C6)алкокси, включают, но не ограничиваются ими, метоксиметокси, пропоксиметокси, 2-метоксиэтокси, 2-этоксиэтокси, 2-бутоксиэтокси, 2,2-диметоксиэтокси, 1 метил-2-пропоксиэтокси, 2-метоксипропокси и 4-метоксибутокси. Термин "галоген(C1-C6)алкокси", используемый в данном описании как таковой или как часть другой группы, относится по меньшей мере к одному галогену, как определено в данном описании, присоединенному к исходному фрагменту молекулы через группу (C1-C6)алкокси, как определено в данном описании. Если имеется несколько галогенов, то галогены могут быть одинаковыми или различными. Примеры, представляющие галоген(C1-C6)алкокси, включают, но не ограничиваются ими, фторметокси,хлорметокси, дифторметокси, трифторметокси, 2-бромэтокси, 2,2,2-трихлорэтокси, 3-бромпропокси, 2 хлорпропокси и 4-хлорбутокси. Термин "оксо", используемый в данном описании, относится к группе =O. Выражение "соединения по изобретению", используемое в данном описании, относится к соединениям формулы I. Фармацевтически приемлемые соли, например соли металлов и кислотно-аддитивные соли с органическими и неорганическими кислотами, известны в области фармацевтики. Примеры, представляющие фармацевтически приемлемые соли металлов, включают, но не ограничиваются ими, соли лития, натрия,калия, кальция, магния, алюминия и цинка. Примеры, представляющие фармацевтически приемлемые кислотно-аддитивные соли, включают, но не ограничиваются ими, хлориды, бромиды, сульфаты, нитраты, фосфаты, сульфонаты, метансульфонаты, формиаты, тартраты, малеаты, цитраты, бензоаты, салицилаты, аскорбаты, ацетаты и оксалаты. Фармацевтически приемлемые сложные эфиры, если они являются подходящими, могут быть получены известными способами с использованием фармацевтически приемлемых кислот, которые являются традиционными в области фармацевтики и сохраняют фармакологические свойства в несвязанной форме. Неограничивающие примеры этих сложных эфиров включают сложные эфиры алифатических или-8 017554 ароматических спиртов. Примеры, представляющие фармацевтически приемлемые сложные эфиры,включают, но не ограничиваются ими, метиловый, этиловый, н-пропиловый, изопропиловый, нбутиловый, изобутиловый, втор-бутиловый, трет-бутиловый и бензиловый сложные эфиры. Настоящее изобретение включает в свой объем все возможные геометрические изомеры, напримерZ- и E-изомеры (цис- и транс-изомеры), соединений, а также все возможные оптические изомеры, например диастереомеры и энантиомеры, соединений. Кроме того, настоящее изобретение включает в свой объем как индивидуальные изомеры, так и любые их смеси, например рацемические смеси. Индивидуальные изомеры могут быть получены с использованием соответствующих изомерных форм исходных веществ, или они могут быть разделены после получения конечного соединения в соответствии с традиционными способами разделения. Для разделения оптических изомеров, например энантиомеров, из их смеси могут быть использованы традиционные способы разделения, например фракционированная кристаллизация. Соединения формулы I могут быть получены посредством разнообразных синтетических путей,аналогично или в соответствии со способами, известными в литературе, используя подходящие исходные вещества. Исходные вещества, изображенные ниже в формулах A, B, C и D, являются коммерчески доступными или могут быть получены посредством синтетических путей, известных в литературе. Подходящие исходные вещества, содержащие бензодиоксановый фрагмент, представляют собой соединения формул A и B где R1 и m определены выше и L представляет собой уходящую группу, например галоген, мезилат или тозилат. 2,3-Дигидробензо[1,4]диоксин-2-карбоновая кислота (формула A) является коммерчески доступной и может быть легко разделена на ее энантиомеры, как описано в Tetrahedron: Asymmetry, 16 (2005) 1639. Соединения формулы В могут быть получены в соответствии с известными способами. Подходящие исходные вещества, содержащие фрагмент азацикла, представляют собой подходящие замещенные пиперидины или гомопиперидины, а также в некоторых случаях пиридины. Такие соединения представляют собой соединения формул C, D и E где X и Z определены выше, R означает R6 или R8, определенные выше, и R' и R" означают алкильные группы. Несмотря на то, что их формулы не показаны, гетероциклические кольца в соединениях формулC, D и E могут содержать дополнительные подходящие заместители. Соединения формулы E, имеющие два заместителя, присоединенных к одному и тому же атому углерода, могут быть получены, например,посредством -алкилирования подходящих карбоксилатов пиперидина, как описано в Orq. Lett., 7, (2005) 55, или посредством создания пиперидинового кольца из соответствующего предшественника с открытой цепью, например восстановлением подходящего алкилированного 2-цианоацетата. Сложноэфирная группа в соединениях формулы Е может трансформироваться в дальнейшем в широкое многообразие других функциональных групп. Как правило, соединения формулы I могут быть получены аналогично или согласно схеме 1, где X и Z определены выше. Другой путь получения промежуточных амидов схемы 1, где Z представляет собой одинарную связь, осуществляется посредством реакции подходящего амина и подходящего итеконатного аналога,как описано в J. Org. Chem., 26 (1961) 1519-1524. Дополнительный путь получения соединений формулы I показан на схеме 2, где X, Z, R1 и m определены выше. Схема 2 Соединения формулы I, где R5 или R7 представляют собой Н, могут быть получены посредством Nалкилирования подходящих замещенных пиридинов с последующим восстановлением, как продемонстрировано на схеме 3, где R1, m, L и R определены выше. Схема 3 Разделение соединений формулы I, которые представляют собой рацематы, может быть проведено,если это желательно, например, путем преобразования рацемического соединения в смесь его диастереомерных солей в результате реакции с оптически активной кислотой и последующего разделения диастереомеров кристаллизацией. Примеры, представляющие указанные оптически активные кислты, включают, но не ограничиваются ими, D-винную кислоту и дибензоил-D-винную кислоту. Специалист в данной области представляет себе, что любое исходное вещество или промежуточное соединение в реакциях, описанных выше, может быть защищено, если необходимо, способом, известным в технике. С любой защищенной функциональной группы защита может быть впоследствии снята способом, известным в технике. Подразумевается, что пути синтеза, описанные выше, иллюстрируют получение соединений формулы I, и получение никоим образом не ограничивается ими, например, также имеются другие возможные способы синтеза, которые находятся в пределах обычных познаний специалиста в данной области. Соединения формулы I могут быть преобразованы, если желательно, в форму их фармацевтически приемлемой соли или сложного эфира с использованием способов, известных в технике. Настоящее изобретение будет раскрыто более подробно с помощью следующих примеров. Примеры предназначены только для иллюстративных целей и не ограничивают объем настоящего изобретения,определяемый формулой изобретения. Аббревиатуры: ДХМ - дихлорметан, DIPEA - N,N-диизопропилэтиламин, ДМФА - N,N-диметилформамид, EtOAc - этилацетат, IPA - изопропанол, ЖХ-МС - жидкостная хроматография-масс-спектрометрия, КТ - комнатная температура, ТГФ - тетрагидрофуран, ТСХ - тонкослойная хроматография. Колоночную хроматографию выполняли на силикателе 60, полученном от Merck, или использовали- 10017554 аппарат CombiFlash вместе с колонками Redisep, предоставленными Teledyne ISCO. Микроволновое нагревание выполняли с использованием микроволнового реактора Emrys Optimiser от Personal Chemistry или микроволнового реактора Initiator 2.0 от Biotage. Структуры продуктов подтверждали данными 1 Н ЯМР. Спектр измеряли на аппарате Bruker Avance 400. ЖХ-МС анализы выполняли с помощью Waters 2690 Alliance HPLC и одноквадрупольного масс-спектрометра Waters Micromass ZQ4000 с использованием ЕРИ. Получение исходных веществ 3-(Пиперидин-3-ил)фенолHBr может быть получен из 3-(3-метоксифенил)пиперидина, как описано в J. Med. Chem., 24 (1981) 1475. 2-(Пиперидин-3-ил)фенолHBr получали путем нагревания 3-(2-метоксифенил)пиперидинаHCl (46 мг, 0,20 ммоль) с 48% HBr в микроволновом реакторе при 120C в течение 1 ч. После упаривания получали 61 мг указанного в заголовке соединения. 4-(Пиперидин-3-ил)фенолHBr получали путем нагревания 3-(4-метоксифенил)пиперидинHCl (46 мг, 0,20 ммоль) с 48% HBr в микроволновом реакторе при 120C в течение 1 ч. После упаривания получали 53 мг указанного в заголовке соединения.(R)-3-(3-метоксифенил)пиперидин получали кристаллографическим разделением с D-(-)-винной кислотой, как описано для аналогичного субстрата в Tetrahedron Lett., 35 (1994) 9063.(R)-3-(пиперидин-3-ил)фенолHBr или HCl получали из (R)-3-(3-метоксифенил)пиперидина способом, описанным выше для рацемата. Концентрированную HCl можно использовать вместо 48% HBr.(R)-2,3-дигидробензо[1,4]диоксин-2-карбоновую кислоту получали из коммерчески доступного рацемата, как описано в Tetrahedron: Asymmetry, 16 (2005) 1639.(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид может быть получен путем нагревания (R)2,3-дигидробензо[1,4]диоксин-2-карбоновой кислоты при 70C в присутствии избытка тионилхлорида в течение 1-8 ч. Может быть добавлено каталитическое количество ДМФА. Упариванием досуха получают указанное в заголовке соединение с высоким выходом.(R)-(7-фтор-2,3-дигидробензо[1,4]диоксин-2-ил)метиловый эфир метансульфоновой кислоты получали в четыре стадии из 5'-фтор-2'-гидроксиацетофенона в соответствии с аналогичными способами,описанными в литературе (J. Med. Chem., 30 (1987) 814 и US 5935973). Получение промежуточных соединений Промежуточное соединение А 1. (R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(R)-3-(2-фторфенил)пиперидин-1-ил]метанон. Промежуточное соединение А 2. (R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(S)-3-(2-фторфенил)пиперидин-1-ил]метанон.(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (46 мг, 0,23 ммоль) в ДХМ (1 мл) добавляли к холодному раствору 3-(2-фторфенил)пиперидинаHCl (50 мг, 0,23 ммоль) и ДХМ (1 мл). Добавляли триэтиламин (56 мг, 0,55 ммоль). Смесь перемешивали в течение 50 мин. Добавляли воду (1 мл) и водную фазу экстрагировали ДХМ (31 мл). Объединенные органические слои абсорбировали на диоксиде кремния. Смесь очищали методом флэш-хроматографии, используя гептан/EtOAc в качестве элюента. Первый элюированный диастереомер собирали с получением 24 мг A1 (ротамерная смесь). 1 Н ЯМР (CDCl3):1,63-1,73 (м, 1H), 1,79-1,96 (м, 2H), 2,03-2,14 (м, 1H), 2,63-2,75 (м, 0,5H), 2,80 (т,0,5H), 2,98-3,16 (м, 1,5H), 3,20 (т, 0,5H), 4,14-4,26 (м, 1H), 4,29-4,38 (м, 1H), 4,48-4,55 (м, 1H), 4,67-4,75 (м,1H), 4,84-4,93 (м, 1 Н), 6,78-7,06 (м, 7H), 7,26-7,33 (м, 1H). Второй элюированный диастереомер собирали с получением 25 мг A2 (ротамерная смесь). 1 Н ЯМР (CDCl3):1,60-1,76 (м, 1H), 1,78-1,95 (м, 2H), 2,02-2,13 (м, 1H), 2,62-2,71 (м, 0,7H), 2,80 (т,0,3H), 2,98-3,35 (м, 2H), 4,14-4,25 (м, 1H), 4,29-4,39 (м, 1H), 4,45-4,57 (м, 1H), 4,65-4,74 (м, 1H), 4,76-4,82(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (46 мг, 0,23 ммоль) в ДХМ (1 мл) добавляли к холодному раствору 3-(3-фторфенил)пиперидинаHCl (50 мг, 0,23 ммоль) и ДХМ (1 мл). Добавляли триэтиламин (56 мг, 0,55 ммоль) и смесь перемешивали в течение 50 мин. После водной обработки, как описано для промежуточного соединения A1, неочищенную смесь очищали методом флэш-хроматографии,используя гептан/EtOAc в качестве элюента. Первый элюированный диастереомер собирали с получением 29 мг A3. 1H ЯМР (CDCl3):1,61-2,00 (м, 2H), 2,06-2,17 (м, 1H), 2,58-2,82 (м, 2H), 3,04-3,12 (м, 0,7H), 3,183,28 (т, 0,3H), 4,10-4,25 (м, 2H), 4,27-4,39 (м, 1H), 4,46-4,54 (м, 1H), 4,65-4,76 (м, 1H), 4,84-4,90 (м, 1 Н),6,80-7,06 (м, 7H), 7,26-7,33 (м, 1H). Второй элюированный диастереомер собирали с получением 19 мг А 4. 1(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (46 мг, 0,23 ммоль) в ДХМ (1 мл) добавляли к холодному раствору 3-(4-фторфенил)пиперидинаHCl (50 мг, 0,23 ммоль) и ДХМ (1 мл). Добавляли триэтиламин (56 мг, 0,55 ммоль) и смесь перемешивали в течение 50 мин. После водной обработки, как описано для промежуточного соединения А 1, неочищенную смесь очищали методом флэш-хроматографии,используя гептан/EtOAc в качестве элюента. Далее первый элюированный диастереомер собирали с получением 37 мг А 5. 1(м, 4H), 6,98-7,05 (м, 2H), 7,15-7,24 (м, 2H). Второй элюированный диастереомер собирали с получением 20 мг А 6. 1(м, 0,7H), 4,86-4,93 (м, 0,3H), 6,81-7,30 (м, 8H). Промежуточное соединение А 7. (R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(R)-3-(3-гидроксифенил) пиперидин-1-ил]метанон. Промежуточное соединение А 8. (R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(S)-3-(3-гидроксифенил) пиперидин-1-ил]метанон. Смесь (R)-2,3-дигидробензо[1,4]диоксин-2-карбоновой кислоты (5,06 г, 28,1 ммоль), толуола (25 мл) и тионилхлорида (6,68 мл, 56,2 ммоль) нагревали при кипении с обратным холодильником. Через 1,5 ч реакционную смесь охлаждали и упаривали досуха. К упаренному, остатку добавляли толуол и упаривали досуха. Упаренный остаток в ТГФ (10 мл) медленно добавляли к смеси гидрохлорида (R)-3(пиперидин-3-ил)фенола (5,0 г, 2 3,4 ммоль), карбоната калия (4,85 г, 35,1 ммоль), воды (16,5 мл) и ТГФ(33,5 мл). После добавления реакционную смесь перемешивали при КТ в течение 10 мин, слои разделяли и органическую фазу промывали водным раствором NaCl. Органическую фазу упаривали досуха и упаренный остаток кристаллизовали из этилацетата с получением 6,79 г А 7. 1(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (475 мг, 2,4 ммоль) в ДХМ (4 мл) добавляли к смеси 3-(пиперидин-3-ил)фенолаHBr (259 мг, 1,06 ммоль), триэтиламина (307 мг, 3,01 ммоль) и ДХМ (4 мл). Смесь перемешивали в течение 2 ч, после чего добавляли 1 М HCl (5 мл). Фазы разделяли и органическую фазу абсорбировали на диоксиде кремния. Смесь очищали методом флэш-хроматографии, используя гептан/EtOAc в качестве элюента. Фракции, содержащие второй элюированный диастереомер,собирали. Выделенный продукт (199 мг) представлял собой соединение, которое ацилировано как по амину, так и по фенолу. Сложноэфирную связь гидролизовали обработкой соединения двумя эквивалентами KOH в MeOH (5 мл) в течение 1 ч. Смесь упаривали досуха, неочищенный продукт поглощали(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (44 мг, 0,22 ммоль) в ДХМ (1 мл) добавляли к смеси 3-(3-трифторметилфенил)пиперидинаHCl (50 мг, 0,19 ммоль) и ДХМ (1 мл). Добавляли триэтиламин (54 мг, 0,53 ммоль) и смесь перемешивали в течение 1 ч. Добавляли 1 М HCl (2 мл) и фазы разделяли. Органическую фазу абсорбировали на диоксиде кремния и неочищенную смесь очищали методом флэшхроматографии, используя гептан/EtOAc в качестве элюента. Фракции, содержащие первый элюированный диастереомер, собирали с получением 30 мг А 9. 1(м, 4H), 7,40-7,56 (м, 4H). Второй элюированный диастереомер собирали с получением 19 мг А 10. 1(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (44 мг, 0,22 ммоль) растворяли в ДХМ (4 мл). Добавляли 3-(4-трифторметилфенил)пиперидинHCl (51 мг, 0,19 ммоль) и триэтиламин. Смесь перемешивали в течение 1 ч, добавляли 1 М HCl (2 мл) и фазы разделяли. Органическую фазу абсорбировали на диоксиде кремния и смесь очищали методом флэш-хроматографии, используя гептан/EtOAc в качестве элюента. Фракции, содержащие первый элюированный диастереомер, собирали с получением 21 мг A11. 1 Н ЯМР (CDCl3):1,64-2,01 (м, 3H), 2,07-2,18 (м, 1H), 2,62-2,75 (м, 1H), 2,77-2,88 (м, 1H), 3,07-3,18(м, 1 Н), 6,77-6,99 (м, 4H), 7,32-7,42 (м, 2H), 7,55-7,65 (м, 2H). Второй элюированный диастереомер собирали с получением 21 мг А 12. 1 Н ЯМР (CDCl3):1,59-1,97 (м, 3H), 2,06-2,19 (м, 1H), 2,59-3,36 (м, 3H), 4,16-4,26 (м, 1H), 4,33-4,40(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (3,04 г, 15,3 ммоль) растворяли в ДХМ (50 мл). Добавляли (R)-3-(3-метоксифенил)пиперидин (2,92 г, 15,3 ммоль) и триэтиламин (1,87 г, 18,36 ммоль). После перемешивания в течение 40 мин смесь промывали водой (50 мл), 1 М Na2CO3 (50 мл) и 1 М HCl (50 мл). После сушки (Na2SO4) и упаривания получали 5,12 г А 13. 1 Н ЯМР (CDCl3):1,58-1,99 (м, 3H), 2,06-2,17 (м, 1H), 2,58-2,82 (м, 2H), 3,05-3,17 (м, 0,6H), 3,203,29 (м, 0,4H), 3,80 (с, 3H), 4,15-4,23 (м, 1H), 4,27-4,39 (м, 1H), 4,48-4,52 (м, 1H), 4,65-4,77 (м, 1H), 4,844,90 (м, 1H), 6,71-6,96 (м, 7H), 7,23-7,30 (м, 1H).(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (54 мг, 0,27 ммоль) растворяли в ДХМ (4 мл). Добавляли 3-(3-метоксифенил)пиперидинHCl (72 мг, 0,26 ммоль) и триэтиламин (59 мг, 0,58 ммоль). После перемешивания в течение 1 ч кислотной обработкой, как описано выше, получали неочищенный продукт, который очищали методом флэш-хроматографии, используя гептан/EtOAc в качестве элюента. Второй элюированный диастереомер собирали с получением 19 мг А 14. 1BH3 ТГФ (1MB ТГФ, 5-7 экв.) и смесь перемешивали при 60-90C, используя микроволновое нагревание или масляную баню (время реакции от 20 мин вплоть до 16 ч). Образование амин-борановых комплексов регистрировали по ТСХ или ЖХ-МС. В баню со льдом добавляли охлажденную смесь 1 М HCl в большом избытке и смесь перемешивали при 40-60C в течение 20 мин - 12 ч. Протекание гидролиза боранкомплексов регистрировали по ТСХ или ЖХ-МС. Смесь помещали на баню со льдом и добавляли твердый KOH или Na2CO3 до тех пор, пока смесь не станет щелочной. ТГФ удаляли выпариванием до или после добавления основания. Оставшуюся водную фазу экстрагировали EtOAc или ДХМ. Органические фазы собирали, сушили (Na2SO4) и упаривали досуха. Неочищенный продукт очищали методом колоночной хроматографии, используя градиент EtOAc/гептан, с добавлением 1% триэтиламина или без него,или кристаллизацией из подходящего растворителя. Получение соединений по изобретению Пример 1. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-5-фенил-1,2,3,6-тетрагидропиридин. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (500 мг, 2,18 ммоль) и 3-фенилпиридина (339 мг, 2,18 ммоль) в ксилоле (2 мл) нагревали при кипении с обратным холодильником в течение 4 ч. После охлаждения растворитель декантировали с получением неочищенной масляной соли пиридиния, которую растворяли в МеОН (5 мл). К охлажденной смеси добавляли малыми порциями NaBH4 (330 мг, 4 экв.). После перемешивания в течение 2 ч при КТ выпаривали МеОН, добавляли воду и смесь экстрагировали EtOAc. Сушкой (Na2SO4) и упариванием получали неочищенный продукт, который очищали методом флэш-хроматографии (гептан/EtOAc). 1- 13017554 Воспроизводили вышеуказанную методику, за исключением того, что неочищенную соль пиридиния гидрировали в MeOH при нормальном давлении (6,5 ч, КТ), используя PtO2 в качестве катализатора. После щелочной обработки неочищенный продукт очищали методом флэш-хроматографии(м, 5H). Пример 3. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-(2-метоксифенил)пиперидин. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (34 мг, 0,15 ммоль), 3-(2-метоксифенил)пиперидинаHCl (38 мг, 0,165 ммоль) и триэтиламина (41 мг, 0,39 ммоль) в ацетонитриле (2 мл) нагревали в микроволновом реакторе при 110-150C в течение 90 мин. После упаривания досуха неочищенный продукт очищали методом флэш-хроматографии, используя градиент гептана и EtOAc в качестве элюента, с получением 12 мг указанного в заголовке соединения. 1(34 мг,0,15 ммоль),3-(4 хлорфенил)пиперидина (38 мг, 0,165 ммоль) и триэтиламина (38 мг, 0,38 ммоль) в ацетонитриле (2 мл) нагревали в микроволновом реакторе при 110-150C в течение 290 мин. После упаривания досуха неочищенный продукт очищали методом флэш-хроматографии, используя градиент гептана и EtOAc в качестве элюента, с получением 36 мг указанного в заголовке соединения. 1(м, 1H), 2,66-2,75 (м, 1H), 2,77-2,86 (м, 1H), 2,90-2,97 (м, 1H), 2,99-3,08 (м, 1H), 3,95-4,03 (м, 1H), 4,264,37 (м, 2H), 6,78-6,91 (м, 4H), 7,13-7,20 (м, 2H), 7,23-7,30 (м, 2H). Пример 5. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-(3-метоксифенил)пиперидин. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (36 мг, 0,16 ммоль), 3-(3-метоксифенил)пиперидинаHCl (36 мг, 0,16 ммоль) и триэтиламина (40 мг, 0,39 ммоль) в ацетонитриле (2 мл) нагревали в микроволновом реакторе при 140-150C в течение 300 мин. После упаривания досуха неочищенный продукт очищали методом флэш-хроматографии, используя градиент гептана и EtOAc в качестве элюента, с получением 17 мг указанного в заголовке соединения. 1(м, 1H), 2,68-2,75 (м, 1H), 2,76-2,87 (м, 1H), 2,91-3,02 (м, 1H), 3,03-3,09 (м, 1H), 3,80 (с, 3H), 3,95-4,04 (м,1H), 4,28-4,38 (м, 2H), 6,74-6,90 (м, 7H), 7,22 (т, 1H). Пример 6. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-п-толилпиперидин. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (36 мг, 0,16 ммоль), 3-(4-метилфенил)пиперидинаHCl (35 мг, 0,16 ммоль) и триэтиламина (38 мг, 0,38 ммоль) в ацетонитриле (2 мл) нагревали в микроволновом реакторе при 140-150C в течение 9 ч. Смесь абсорбировали на диоксиде кремния и очищали методом флэш-хроматографии, используя градиент гептана и EtOAc в качестве элюента, с получением 20 мг указанного в заголовке соединения. 1(м, 1H), 4,27-4,37 (м, 2H), 6,79-6,90 (м, 4H), 7,09-7,15 (м, 4H). Пример 7. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-(4-метоксифенил)пиперидин. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (35 мг, 0,15 ммоль), 3-(4-метоксифенил)пиперидинаHCl (38 мг, 0,17 ммоль) и триэтиламина (41 мг, 0,39 ммоль) в ацетонитриле (2 мл) нагревали в микроволновом реакторе при 160C в течение 3 ч. Смесь абсорбировали на диоксиде кремния и очищали методом флэш-хроматографии, используя градиент гептана и EtOAc в качестве элюента, с получением 18 мг указанного в заголовке соединения. 1(м, 1H), 2,66-2,82 (м, 2H), 2,90-2,99 (м, 1H), 2,99-3,09 (м, 1H), 3,78 (с, 3H), 3,93-4,03 (м, 1H), 4,26-4,38 (м,2H), 6,80-6,93 (м, 6H), 7,10-7,20 (м, 2H). Пример 8. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-o-толилпиперидин. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (35 мг, 0,15 ммоль), 3-(2-метилфенил)пиперидинаHCl (35 мг, 0,16 ммоль) и триэтиламина (38 мг, 0,38 ммоль) в ацетонитриле (2 мл) нагревали в микроволновом реакторе при 140-150C в течение 12,5 ч. Смесь абсорбировали на диоксиде кремния и очищали методом флэш-хроматографии, используя градиент гептана и EtOAc в качестве элюента, с получением 29 мг указанного в заголовке соединения. 1(м, 4H). Пример 9. 4-[1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (47 мг, 0,20 ммоль), 4-(пиперидин-3-ил)фенолаHBr (53 мг, 0,20 ммоль) и KHCO3 (84 мг, 0,84 ммоль) в ацетонитриле (2 мл) нагревали в микроволновом реакторе при 160C в течение 6,5 ч. Смесь абсорбировали на диоксиде кремния и очищали методом флэш-хроматографии, используя градиент ДХМ и MeOH в качестве элюента, с получением 6 мг указанного в заголовке соединения. 1(м, 2H), 3,89-3,96 (м, 1H), 4,24-4,29 (м, 1H), 4,39-4,39 (м, 1H), 6,68-6,73 (м, 2H), 6,76-6,84 (м, 4H), 7,017,08 (м, 2H). Пример 10. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-(3-фторфенил)пиперидин. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (340 мг, 0,48 ммоль), 3-(3-фторфенил)пиперидина (323 мг, 2,50 ммоль) и триэтиламина (455 мг, 4,50 ммоль) в ацетонитриле (3 мл) нагревали в микроволновом реакторе при 140C в течение 60 мин. Смесь абсорбировали на диоксиде кремния и очищали методом флэш-хроматографии, используя градиент гептана и EtOAc в качестве элюента, с получением 213 мг указанного в заголовке соединения. 1(м, 1H), 2,67-2,75 (м, 1H), 2,79-2,89 (м, 1H), 2,89-2,99 (м, 1H), 2,99-3,09 (м, 1H), 3,95-4,04 (м, 1H), 4,284,38 (м, 2H), 6,80-6,98 (м, 6H), 6,97-7,01 (м, 7H), 7,21-7,29 (м, 1H). Пример 11. 3-[1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (54 мг, 0,24 ммоль), 3-(пиперидин-3-ил)фенолаHBr (60 мг, 0,23 ммоль) и KHCO3 (84 мг, 0,84 ммоль) в ацетонитриле (2 мл) нагревали в микроволновом реакторе при 160C в течение 5,5 ч. Смесь абсорбировали на диоксиде кремния и очищали методом флэш-хроматографии, используя градиент ДХМ и MeOH (1% триэтиламин) в качестве элюента, с получением 74 мг указанного в заголовке соединения. 1(м, 1H), 2,66-2,75 (м, 1H), 2,77-2,86 (м, 1H), 2,90-2,97 (м, 1H), 2,99-3,08 (м, 1H), 3,95-4,03 (м, 1H), 4,264,37 (м, 2H), 6,78-6,91 (м, 4H), 7,13-7,20 (м, 2H), 7,23-7,30 (м, 2H). Пример 12. 2-[1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (54 мг, 0,24 ммоль), 2-(пиперидин-3 ил)фенолаHBr (61 мг, 0,24 ммоль) и KHCO3 (84 мг, 0,84 ммоль) в ацетонитриле (2 мл) нагревали в микроволновом реакторе при 160C в течение 5,5 ч. Смесь абсорбировали на диоксиде кремния и очищали методом флэш-хроматографии, используя градиент ДХМ и MeOH (1% триэтиламин) в качестве элюента,с получением 11 мг указанного в заголовке соединения. 1(10 мг,0,0035 ммоль) обрабатывали ВН 3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 2,7 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(S)-3-(2-фторфенил)пиперидин-1-ил]метанон (25 мг, 0,073 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 18 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(R)-3-(3-фторфенил)пиперидин-1-ил]метанон (1,21 г, 3,51 ммоль) обрабатывали ВН 3 ТГФ согласно вышеописанной общей методике. Получали 1,28 г неочищенного продукта. 1(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-фторфенил)пиперидин (1,28 г, 3,91 ммоль) обрабатывали большим избытком смеси 8% HCl/EtOAC и упаривали досуха. Неочищенную соль растворяли в кипящей смеси EtOAc/IPA. Осадок образовывался при охлаждении. Фильтрованием получали 657 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(S)-3-(3-фторфенил)пиперидин-1-ил]метанон (19 мг, 0,056 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 11 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(R)-3-(4-фторфенил)пиперидин-1-ил]метанон (20 мг, 0,058 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 16 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(S)-3-(4-фторфенил)пиперидин-1-ил]метанон (20 мг, 0,058 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали указанное в заголовке соединение. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(R)-3-(3-трифторметилфенил)пиперидин-1-ил]метанон (30 мг, 0,077 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 16 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(S)-3-(3-трифторметилфенил)пиперидин-1-ил]метанон (29 мг, 0,074 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 15 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(R)-3-(4-трифторметилфенил)пиперидин-1-ил]метанон (18 мг, 0,046 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 7,6 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(S)-3-(4-трифторметилфенил)пиперидин-1-ил]метанон (13 мг, 0,033 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 6 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-R)-3-(3-метоксифенил)пиперидин-1-ил]метанон (21 мг,0,059 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 7,0 мг указанного в заголовке соединения. 1(м, 1H), 2,67-2,75 (м, 1H), 2,75-2,85 (м, 1H), 2,91-2,84 (м, 1H), 3,02-3,10 (м, 1H), 3,80 (с, 3H), 3,95-4,01 (м,1H), 4,28-4,35 (м, 2H), 6,73-6,92 (м, 7H), 7,19-7,25 (м, 1H). Пример 25. (R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-метоксифенил)пиперидинHCl. Неочищенный (R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-(3-метоксифенил)пиперидин (2,5 г) трижды обрабатывали смесью 8% HCl/EtOAc и упаривали досуха. После кристаллизации из горячей смеси EtOAc/IPA (10 мл/2,5 мл) получали 1,24 г указанного в заголовке соединения в виде почти белых кристаллов. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(S)-3-(3-метоксифенил)пиперидин-1-ил]метанон (21 мг,0,059 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Методом флэшхроматографии получали 7,0 мг указанного в заголовке соединения. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(R)-3-(3-гидроксифенил)пиперидин-1-ил]метанон (17,8 г,54,7 ммоль) обрабатывали BH3 ТГФ согласно вышеописанной общей методике. Кристаллизацией из горячего EtOH получали 8,5 г указанного в заголовке соединения в виде почти белых кристаллов. 1(R)-2,3-дигидробензо[1,4]диоксин-2-ил-[(R)-3-(3-гидроксифенил)пиперидин-1-ил]метанон (200 мг,0,615 ммоль) растворяли в EtOAc (4 мл). Добавляли избыток смеси 1 М HCl/диэтиловый эфир. Осадок фильтровали с получением 172 мг желательной соли. 1 Н ЯМР (CDCl3):1,52-1,62 (м, 1H), 1,89-2,11 (м, 2H), 2,35-2,53 (м, 1H), 2,69-2,96 (м, 2H), 3,10-3,21(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (240 мг, 1,21 ммоль) в ДХМ (5 мл) добавляли к охлажденной льдом смеси метилового эфира 3-(пиперидин-3-ил)бензойной кислоты (267 мг, 1,21 ммоль), триэтиламина (59 мг, 0,58 ммоль) и ДХМ (10 мл). После перемешивания в течение 2 ч при КТ смесь промывали 1 М HCl (10 мл) и 1 М Na2CO3. Органическую фазу сушили над Na2SO4, упаривали досуха и остаток очищали методом флэш-хроматографии, используя гептан/EtOAc в качестве элюента. Первый элюированный диастереомер собирали с получением 98 мг указанного в заголовке соединения. 1LiAlH4 (26 мг, 0,680 ммоль) и смесь перемешивали при КТ в течение 2 ч. Медленно добавляли воду (1 мл), 1 М NaOH (1 мл) и снова воду (1 мл). Смесь фильтровали через целит и упаривали. Методом флэшхроматографии, используя градиент гептан/EtOAc, получали 3,5 мг указанного в заголовке соединения. 1- 17017554 эфир уксусной кислотыHCl. Ацетилхлорид (58 мг, 0,74 ммоль) добавляли к раствору (R)-3-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенола (198 мг, 0,608 ммоль) и триэтиламина (75 мг, 0,74 ммоль) в ДХМ (5 мл). Смесь перемешивали в течение 40 мин, промывали водой, сушили над Na2SO4 и упаривали досуха. Неочищенный продукт обрабатывали избытком смеси EtOAc/HCl и упаривали досуха. Перекристаллизацией из горячей смеси EtOAc/IPA получали 60 мг указанного в заголовке соединения. 1(28 мг, 0,20 ммоль), 2-хлорэтанол и MeCN (2 мл) нагревали с использованием микроволнового излучения при 80-105C в течение 6 ч. Растворитель удаляли и остаток поглощали ДХМ. Данный раствор промывали водой и 1 М NaOH и упаривали досуха. Методом флэш-хроматографии (гептан/EtOAc) получали 3 мг указанного в заголовке соединения. 1(R)-3-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенол (208 мг, 0,64 ммоль), K2CO3 (103 мг, 0,74 ммоль), 3-бром-1-пропанол (86 мг, 0,62 ммоль) и MeCN (5 мл) нагревали с использованием микроволнового излучения при 105C в течение 6 ч. Добавляли еще K2CO3 (103 мг) и 3 бром-1-пропанол (86 мг) и нагревание продолжали в течение 2 ч. Растворитель удаляли и остаток поглощали ДХМ. Этот раствор промывали водой и 1 М NaOH и упаривали досуха. Методом флэш-хроматографии (гептан/EtOAc) получали 76 мг указанного в заголовке соединения. 1(R)-3-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенол (1,77 г, 5,44 ммоль) растворяли в ДХМ (10 мл) в инертной атмосфере. Добавляли триэтиламин (0,58 г, 5,71 ммоль) и смесь охлаждали до -30C. По каплям добавляли ангидрид трифторметансульфоновой кислоты (1,61 г,5,71 ммоль). Охлаждающую баню удаляли и смесь перемешивали в течение 1 ч. Смесь промывали водой(201 мг, 0,62 ммоль) в безводном ДМФА (2 мл) добавляли NaH (60% раствор в масле, 30 мг, 0,75 ммоль) в атмосфере азота и смесь перемешивали при 0C в течение 5 мин, затем давали натреться до КТ и дополнительно перемешивали в течение 2,5 ч. Реакционную смесь охлаждали до 0C, добавляли этилбромацетат (106 мг, 0,62 ммоль) и смесь перемешивали при КТ в течение ночи. Добавляли трет-бутоксид калия (69 мг, 0,61 ммоль) и смесь перемешивали в течение 3 ч при КТ и фильтровали. Осадок растворяли в безводном МеОН, раствор фильтровали и упаривали досуха с получением 170 мг указанного в заголовке соединения. 1(м, 6H), 7,11 (т, 1 Н, J=6,8 Гц). Пример 35. 3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илбензонитрил. Смесь 3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенилового эфира трифторметансульфоновой кислоты (51 мг, 0,11 ммоль), цианида трибутилолова (142 мг, 0,45 ммоль) и тетракис(трифенилфосфин)палладия (189 мг, 0,164 ммоль) в 1,2-дихлорэтане (15 мл) нагревали- 18017554 в микроволновом реакторе при 80C в течение 80 ч. Твердый осадок отфильтровывали и смесь упаривали досуха. Остаток перерастворяли в ДХМ, фильтровали и дважды промывали 1 М HCl. Объединенные органические фазы промывали насыщенным раствором соли, сушили (Na2SO4) и упаривали досуха. Неочищенный продукт очищали методом флэш-хроматографии, первоначально используя градиент ДХМ и МеОН, а затем используя градиент гептана и EtOAc в качестве элюента, с получением 2,8 мг указанного в заголовке соединения. 1(м, 2H), 2,89-3,10 (м, 3H), 3,93-3,98 (м, 1H), 4,26-4,35 (м, 1H), 4,35-4,40 (м, 1H), 6,76-6,84 (м, 3H), 7,437,60 (м, 5H). Пример 36. 3-Бензо[1,3]диоксол-5-ил-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин. 3-Бензо[1,3]диоксол-5-илпиридин. Смесь 3,4-(метилендиокси)фенилбороновой кислоты (500 мг, 3,0 ммоль), 3-бромпиридина (290 мкл,476 мг, 3,0 ммоль), 2 М Na2CO3 (3,05 мл, 6,0 ммоль), тетракис(трифенилфосфин)палладия (35 мг, 0,03 ммоль), EtOH (0,75 мл) и толуола (3 мл) нагревали в микроволновом реакторе при 120C в течение 40 мин. Добавляли другую порцию 3,4-(метилендиокси)фенилбороновой кислоты (250 мг, 1,5 ммоль) и смесь нагревали с использованием микроволнового излучения при 120C в течение 10 мин. Реакционную смесь фильтровали и слои разделяли. Органическую фазу экстрагировали дважды 1 М HCl. Все водные фазы объединяли, подщелачивали 5 М NaOH и экстрагировали дважды EtOAc. Объединенные органические фазы сушили (Na2SO4), фильтровали и упаривали с получением 585 мг указанного в заголовке соединения. 1(м, 1H), 7,99-8,03 (м, 1H), 8,52 (дд, 1 Н, J=1,77, 4,80 Гц), 8,84 (дд, 1 Н, J=2,65, 0,88 Гц). 3-Бензо[1,3]диоксол-5-илпиперидинHCl. 3-Бензо[1,3]диоксол-5-илпиридин (578 мг, 2,9 ммоль), гидрат PtO2 (58 мг), метанол (20 мл) и концентрированную HCl (2 мл) загружали в реакционную сосуд Парра и гидрировали (55 фунтов на кв. дюйм) в течение 4 ч. Реакционную смесь фильтровали и упаривали досуха. Неочищенный продукт кристаллизовали из смеси EtOAc/IPA с получением 226 мг указанного в заголовке соединения. 1(3-Бензо[1,3]диоксол-5-илпиперидин-1-ил-(R)-2,3-дигидробензо[1,4]диоксин-2-илметанон. Смесь (R)-2,3-дигидробензо[1,4]диоксин-2-карбоновой кислоты (167 мг, 0,93 ммоль), тионилхлорида (338 мкл, 551 мг, 4,63 ммоль) и безводного толуола нагревали при 95C в течение 1,5 ч и затем упаривали досуха. Добавляли толуол и упаривание повторяли. Упаренный остаток растворяли в ДХМ (2 мл) и медленно добавляли к холодному раствору (0C) 3-бензо[1,3]диоксол-5-илпиперидинаHCl (224 мг, 0,93 ммоль) и DIPEA (0,324 мл, 240 мг, 1,85 ммоль) в ДХМ (5 мл). Реакционную смесь перемешивали в течение 1 ч 45 мин при КТ. Добавляли воду, слои разделяли и органическую фазу промывали дважды 1 МHCl и насыщенным NaHCO3. Органическую фазу сушили (Na2SO4), фильтровали и упаривали с получением 290 мг указанного в заголовке соединения. 1(3-Бензо[1,3]диоксол-5-илпиперидин-1-ил-(R)-2,3-дигидробензо[1,4]диоксин-2-илметанон (285 мг,0,77 ммоль) растворяли в безводном ДМФА (2,5 мл) и 1M ВН 3 ТГФ (3,10 мл, 3,10 ммоль) медленно добавляли в атмосфере азота. Реакционную смесь перемешивали в течение 4,5 ч при КТ и затем охлаждали до 0C. Медленно добавляли воду, смесь подщелачивали 2,5 М NaOH и экстрагировали три раза EtOAc. Объединенные органические фазы сушили (Na2SO4), фильтровали и упаривали досуха. Неочищенный продукт растворяли в метаноле (25 мл) и медленно добавляли 5 М HCl (1,5 мл). Смесь перемешивали в течение 1 ч при КТ и затем при 60C в течение 2 ч. Реакционную смесь упаривали досуха, перерастворяли в EtOAc и промывали дважды 1 М Na2CO3 и водой. Объединенные органические фазы сушили(м, 1H), 2,66-2,81 (м, 2H), 2,90-2,98 (м, 1H), 2,98-3,07 (м, 1H), 3,94-4,03 (м, 1H), 4,27-4,36 (м, 2H), 5,92 (с,2H), 6,66-6,71 (м, 1H), 6,72-6,76 (м, 2H), 6,79-6,90 (м, 4H). Пример 37. 3-[(R)-1-S)-6-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3 ил]фенол. 1-[4-Бензилокси-2-R)-1-оксиранилметокси)фенил]этанон. К перемешиваемому раствору 1-(4-(бензилокси)-2-гидроксифенил)этанона (3,36 г, 13,9 ммоль) в безводном ДМФА (15 мл) добавляли NaH (0,62 г, 15,5 ммоль). Смеси давали перемешиваться при КТ в течение 30 мин и по каплям добавляли раствор (R)-оксиран-2-илметил-4-метилбензолсульфоната (3,17 г,- 19017554 13,9 ммоль) в ДМФА при КТ. Смесь медленно нагревали до 60C и перемешивали в течение 3 ч. Реакцию гасили добавлением воды (80 мл) и экстрагировали три раза EtOAc. Объединенные органические слои экстрагировали дважды водным 1 М NaOH и промывали водой и насыщенным раствором соли. Органический слой сушили Na2SO4 и концентрировали. Полученный неочищенный продукт очищали методом колоночной хроматографии со смесью EtOAc/гептан (1:1) в качестве элюента, получая указанное в заголовке соединение (2,64 г) в виде твердого вещества белого цвета. 1H ЯМР (CDCl3):2,63 (с, 3H), 2,76 (м, 1H), 2,94 (т, 1H), 3,39 (м, 1H), 3,96 (дд, 1H), 4,32 (дд, 1H),5,10 (с, 2H), 6,52 (д, 1H), 6,62 (дд, 1H), 7,34-7,44 (м, 5H), 7,84 (д, 1H). 4-Бензилокси-2-R)-1-оксиранилметокси) фениловый эфир уксусной кислоты. К перемешиваемому раствору 1-[4-бензилокси-2-R)-1-оксиранилметокси)фенил]этанона (1,62 г,5,43 ммоль) в ДХМ (60 мл) добавляли м-хлорпербензойную кислоту (2,15 г) и твердый NaHCO3 (3,24 г). Перемешивание продолжали при 40C в течение 1 ч. Смесь фильтровали и фильтрат однократно промывали 10% раствором NaHSO4, а затем дважды раствором NaHCO3. Органический слой промывали водой и насыщенным раствором соли, сушили Na2SO4. Растворитель удаляли при пониженном давлении. Полученный неочищенный продукт (1,34 г) был достаточно чистым для использования на следующей стадии. 1S)-6-Бензилокси-2,3-дигидробензо[1,4]диоксин-2-ил)метанол. К перемешиваемому раствору 4-бензилокси-2-R)-1-оксиранилметокси)фенилового эфира уксусной кислоты (1,34 г, 4,26 ммоль) в ТГФ (30 мл) добавляли водный 2 М NaOH (2,45 мл). Смесь перемешивали в течение ночи при КТ, ТГФ удаляли при пониженном давлении и добавляли воду (50 мл). Затем водный раствор экстрагировали три раза EtOAc и объединенные экстракты промывали водой и насыщенным раствором соли. Органический слой сушили (Na2SO4) и упаривали в вакууме. Неочищенный продукт (1,07 г) использовали без очистки. 1(R)-6-Бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметиловый эфир метансульфоновой кислоты. К перемешиваемому раствору неочищенного S)-6-бензилокси-2,3-дигидробензо[1,4]диоксин-2 ил)метанола (1,65 г, 6,06 ммоль) в безводном ДХМ (10 мл) добавляли триэтиламин (0,88 мл). Смесь охлаждали до 0C и в реакционную смесь медленно по каплям добавляли метансульфонилхлорид (0,49 мл). Смесь перемешивали при КТ в течение 1 ч и затем добавляли 10 мл водной 1 М HCl. Смесь экстрагировали дважды ДХМ. Объединенные органические слои промывали водой и насыщенным раствором соли,сушили Na2SO4. Растворители удаляли при пониженном давлении и неочищенный продукт (2,22 г) кристаллизовали из IPA (15 мл), получая твердое вещество белого цвета (1,50 г). 1H ЯМР (CDCl3):3,08 (с, 3H), 4,11 (м, 1H), 4,28 (д, 1H), 4,42 (с, 3H), 4,98 (с, 2H), 6,51-6,55 (м, 2H),6,79 (д, 1H), 7,31-7,42 (м, 5H). 3-[(R)-1-S)-6-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол. К раствору (R)-6-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметилового эфира метансульфоновой кислоты (129 мг, 0,368 ммоль) и (R)-3-(пиперидин-3-ил)фенолаHBr (100 мг, 0,387 ммоль) в ацетонитриле добавляли твердый KI (40 мг) и NaHCO3 (98 мг 1,162 ммоль). Смесь нагревали с использованием микроволнового излучения при 150C в течение 1 ч. Твердый продукт отфильтровывали и растворитель выпаривали при пониженном давлении. Остаток растворяли в ДХМ и промывали дважды водой и насыщенным раствором соли. Органическую фазу сушили (Na2SO4) и упаривали в вакууме. Остаток очищали методом колоночной флэш-хроматографии (EtOAc/гептан) с получением желательного продукта (66,2 мг). 1H ЯМР (CDCl3):1,42-1,49 (м, 1H), 1,74-1,77 (м, 2H), 1,91 (д, 1H), 2,14-2,20 (м, 2H), 2,59 (дд, 1H),2,68-2,73 (дд, 1H), 2,79-2,85 (м, 1H), 2,97 (д, 1H), 3,13 (д, 1H), 3,96 (дд, 1H), 4,24-4,29 (м, 2H), 4,96 (с, 2H),6,46 (дд, 1H), 6,53 (д, 1H), 6,66-6,80 (м, 4H), 6,75 (1 Н, м), 7,17 (т, 1H), 7,30-7,42 (м, 5H). Пример 38. (S)-2-[(R)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-6-ол. К 10% раствору Pd/C (33 мг) в EtOAc (10 мл) добавляли 3-[(R)-1-S)-6-бензилокси-2,3 дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол (66 мг, 0,125 ммоль). Смесь перемешивали в атмосфере водорода в течение 3 ч при нормальном давлении. Смесь затем фильтровали и упаривали с получением масла. После растирания с диэтиловым эфиром получали указанное в заголовке соединение в виде твердого вещества белого цвета (40 мг). 1H ЯМР (ДМСО-d6):1,30-1,40 (м, 1H), 1,53-1,69 (м, 2H), 1,78 (д, 1H), 2,04-2,11 (м, 2H), 2,56 (м,2H), 2,61-2,67 (м, 1H), 2,90 (дд, 2H), 3,89 (дд, 1H), 4,21-4,26 (м, 2H), 6,20-6,25 (м, 2H), 6,57-6,68 (м, 4H),7,06 (т, 1H), 8,90 (с, 1H), 9,21 (с, 1H). Пример 39. 3-[(R)-1-S)-7-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3 ил]фенол. 1-[5-Бензилокси-2-R)-1-оксиранилметокси)фенил]этанон. К перемешиваемому раствору 1-(5-бензилокси-2-гидроксифенил)этанона (3,0 г, 12,4 ммоль) в без- 20017554 водном ДМФА (15 мл) добавляли NaH (0,55 г, 13,6 ммоль). Смеси давали перемешиваться при КТ в течение 30 мин и затем нагревали до 60C. Раствор (R)-оксиран-2-илметил 4-метилбензолсульфоната (2,83 г, 12,4 ммоль) в ДМФА добавляли по каплям при 60C в течение 1 ч. Затем перемешивание продолжали при 60C в течение 3 ч. Охлажденную реакцию гасили добавлением воды (80 мл) и экстрагировали три раза EtOAc. Объединенные органические слои экстрагировали дважды водным 1 М NaOH и промывали водой и насыщенным раствором соли. Органический слой сушили Na2SO4 и концентрировали. Полученный неочищенный продукт очищали методом колоночной хроматографии со смесью EtOAc/толуол в качестве элюента, получая указанное в заголовке соединение (2,35 г) в виде твердого вещества белого цвета. 1H ЯМР (CDCl3):2,67 (с, 3H), 2,75 (м, 1H), 2,93 (т, 1H), 3,37-3,40 (м, 1H), 3,96 (дд, 1H), 4,32 (дд,1H), 5,04 (с, 2H), 6,89 (д, 1H), 7,08 (дд, 1H), 7,32-7,43 (м, 6H). 5-Бензилокси-2-R)-1-оксиранилметокси)фениловый эфир уксусной кислоты. К перемешиваемому раствору 1-[5-бензилокси-2-R)-1-оксиранилметокси)фенил]этанона (1,0 г,3,36 ммоль) в ДХМ (20 мл) добавляли м-хлорпербензойную кислоту (1,24 г) и твердый NaHCO3 (3,24 г). Смесь перемешивали при КТ в течение 3 дней. Смесь фильтровали и фильтрат промывали однократно 10% раствором NaHSO4 и затем дважды раствором NaHCO3. Органический слой промывали водой и насыщенным раствором соли и сушили Na2SO4. Растворитель удаляли при пониженном давлении. Остаток растирали с эфиром, получая указанное в заголовке соединение (0,55 г) в виде твердого вещества белого цвета, которое использовали без очистки. 1S)-7-бензилокси-2,3-дигидробензо[1,4]диоксин-2-ил)метанол. К перемешиваемому раствору 5-бензилокси-2-R)-1-оксиранилметокси)фенилового эфира уксусной кислоты (0,5 г, 1,59 ммоль) в ТГФ (10 мл) добавляли водный 2 М NaOH (1,04 мл). После перемешивания в течение ночи при КТ ТГФ удаляли при пониженном давлении и добавляли воду (20 мл). Водный раствор затем дважды экстрагировали EtOAc. Объединенные органические слои промывали водой и насыщенным раствором соли, сушили (Na2SO4) и упаривали в вакууме. Неочищенный продукт (0,45 г) использовали без очистки. 1(R)-7-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметиловый эфир метансульфоновой кислоты. Получали согласно методике, описанной выше для (R)-6-бензилокси-2,3-дигидробензо[1,4]диоксин 2-илметилового эфира метансульфоновой кислоты. 1(м, 2H), 6,81 (д, 1H), 7,32-7,37 (м, 5H). 3-[(R)-1-S)-7-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол. Получали согласно методике, описанной выше для 3-[(R)-1-S)-6-бензилокси-2,3 дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенола. 1(дд, 1H), 2,83 (т, 1H), 3,01 (д, 1H), 3,11 (д, 1H), 3,90 (дд, 1H), 4,18 (дд, 1H), 4,33-4,38 (м, 1H), 4,99 (с, 2H),6,43-6,78 (м, 6H), 7,14 (т, 1H), 7,28-7,41 (м, 5H). Пример 40. (S)-3-[(R)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-6 ол. Получали согласно методике, описанной выше для (S)-2-[(R)-3-(3-гидроксифенил)пиперидин-1 илметил]-2,3-дигидробензо[1,4]диоксин-6-ола. 1 Н ЯМР (ДМСО-d6):1,33-1,37 (м, 2H), 1,57-1,79 (м, 2H), 2,02-2,12 (м, 1H), 2,55-2,67 (м, 2H), 2,91(R)-8-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметиловый эфир метансульфоновой кислоты. Получали согласно методике, описанной выше для (R)-6-бензилокси-2,3-дигидробензо[1,4]диоксин 2-илметилового эфира метансульфоновой кислоты. 1H ЯМР (CDCl3):2,96 (с, 3H), 4,08 (дд, 1H), 4,29 (д, 1H), 4,41-4,54 (м, 3H), 5,06 (с, 2H), 6,58 (дд,2H), 6,79 (т, 1H), 7,32-7,41 (м, 5H). 3-[(R)-1-S)-8-бензилокси-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол. Получали согласно методике, описанной выше для 3-[(R)-1-S)-6-бензилокси-2,3 дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенола. 1- 21017554 Пример 42. (S)-3-[(R)-3-(3-гидроксифенил)пиперидин-1-илметил]-2,3-дигидробензо[1,4]диоксин-5-ол. Получали согласно методике, описанной выше для (S)-2-[(R)-3-(3-гидроксифенил)пиперидин-1 илметил]-2,3-дигидробензо[1,4]диоксин-6-ола. 1(т, 1H), 3,32-3,35 (м, 2H), 3,89 (дд, 1H), 4,25 (дд, 1H), 4,48 (т, 1H), 6,42 (дд, 1H), 6,54 (дд, 1H), 6,69-6,77 (м,2H), 6,85-6,87 (м, 2H), 7,23 (т, 1H), 8,2-8,9 (шир.с, 2H). Пример 43. (R)-3-[1-S)-7-фтор-2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]фенол. Смесь (R)-(7-фтор-2,3-дигидробензо[1,4]диоксин-2-ил)метилового эфира метансульфоновой кислоты (51 мг, 0,19 ммоль), (R)-3-(пиперидин-3-ил)фенолаHBr (50 мг, 0,19 ммоль) и NaHCO3 (33 мг, 0,39 ммоль) в ДМФА (3,5 мл) нагревали при 120C в течение 1,5 ч. Воду (10 мл) добавляли к охлажденной смеси, которую затем экстрагировали EtOAc (310 мл). Объединенные органические слои промывали несколько раз водой и окончательно дважды насыщенным раствором соли. Сушкой (Na2SO4), фильтрованием и выпариванием растворителя получали неочищенный продукт, который перекристаллизовывали из EtOH с получением 24 мг указанного в заголовке соединения в виде твердого вещества белого цвета. 1H ЯМР (CDCl3):1,35-1,82 (м, 4H), 1,92 (шир.д, 1H), 2,10-2,22 (м, 2H), 2,58 (дд, J=13,2 и 6 Гц, 1H),2,69 (дд, J=13,2 и 6 Гц, 1H), 2,75-2,85 (м, 1H), 2,95 (шир.д, 1H), 3,06 (шир.д, 1H), 3,92-3,99 (м, 1H), 4,254,37 (м, 2H), 6,50-6,82 (м, 6H), 7,17 (дд, J=7,5 Гц, 1H). Пример 44. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-5-метил-1,2,3,6-тетрагидропиридин. 2-Бромметил-2,3-дигидробензо[1,4]диоксин (500 мг, 2,18 ммоль) и 3-пиколин (203 мг, 2,18 ммоль) нагревали при кипении с обратным холодильником в ксилоле (2 мл) в течение 4 ч. После охлаждения растворитель декантировали с получением неочищенной маслянистой соли пиколиния, которую растворяли в MeOH (5 мл). В смесь, охлажденную льдом, добавляли малыми порциями NaBH4 (330 мг, 4 экв.). После перемешивания в течение 2 ч при КТ выпаривали МеОН, добавляли воду и смесь экстрагировалиEtOAc. Сушкой (Na2SO4), фильтрованием и упариванием получали неочищенный продукт, который очищали методом флэш-хроматографии (гептан/EtOAc). 1H ЯМР (CDCl3):1,65 (с, 3H), 2,10-2,18 (м, 2H), 2,50-2,80 (м, 4H), 2,86-3,04 (м, 2H), 3,95-4,05 (м,1H), 4,28-4,40 (м, 2H), 5,45 (м, 1H), 6,77-6,90 (м, 4H). Пример 45. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3,5-диметил-1,2,3,6-тетрагидропиридин. Следуя вышеописанной методике, 2-бромметил-2,3-дигидробензо[1,4]диоксин (856 мг, 3,73 ммоль) и 3,5-лутидин (400 мг, 3,73 ммоль) нагревали при кипении с обратным холодильником в ксилоле (2 мл) в течение 4,5 ч. Восстановлением неочищенной соли лутидиния с использованием NaBH4 в MeOH получали неочищенный указанный в заголовке продукт, который очищали методом флэш-хроматографии (гептан/EtOAc). 1H ЯМР (CDCl3):0,95 (д, J=7 Гц, 3H), 1,64 (с, 3H), 2,08 (м, 1H), 2,35 (м, 1H), 2,60-3,08 (м, 5H), 3,954,03 (м, 1H), 4,28-4,37 (м, 2H), 5,31 (с, 1H), 6,78-6,90 (м, 4H). Пример 46. [1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-1,2,5,6-тетрагидропиридин-3-ил]метанол. Как описано выше, 2-бромметил-2,3-дигидробензо[1,4]диоксин (500 мг, 2,18 ммоль) и пиридин-3 илметанол (238 мг, 2,18 ммоль) нагревали при кипении с обратным холодильником в ксилоле (2 мл) в течение 4 ч. Восстановлением неочищенной соли пиридиния с использованием NaBH4 в MeOH получали неочищенный указанный в заголовке продукт, который очищали методом флэш-хроматографииH ЯМР (CDCl3):2,15-2,25 (м, 2H), 2,55-2,82 (м, 4H), 3,03-3,18 (м, 2H), 3,95-4,05 (м, 1H), 4,03 (с,2H), 4,27-4,40 (м, 2H), 5,75 (м, 1H), 6,77-6,90 (м, 4H). Пример 47. 2-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4,5,6,7,8-октагидроизохинолин. Как описано выше, 2-бромметил-2,3-дигидробензо[1,4]диоксин (500 мг, 2,18 ммоль) и 5,6,7,8 тетрагидроизохинолин (290 мг, 2,18 ммоль) нагревали при кипении с обратным холодильником в ксилоле (2 мл) в течение 4 ч. Восстановлением неочищенной соли тетрагидроизохинолиния с использованиемNaBH4 в MeOH получали неочищенный указанный в заголовке продукт, который очищали методом флэш-хроматографии (гептан/EtOAc). 1(195 мг, 0,68 ммоль) гидрировали в MeOH (20 мл) при нормальном давлении (12 ч, 50C) с получением неочищенного указанного в заголовке соединения, которое очищали методом флэш-хроматографии (гептан/EtOAc). 1 Н ЯМР (CDCl3):1,15-1,95 (м, 12H), 2,10-2,42 (м, 2H), 2,45-2,80 (м, 4H), 3,92-4,02 (м, 1H), 4,18-4,36- 22017554 мл, 17,02 ммоль) в ДМФА (15 мл) добавляли DIPEA (7,5 мл). Реакционную смесь облучали в микроволновом реакторе при 110C в течение 3 мин. Затем добавляли воду (20 мл). Реакционную смесь экстрагировали ДХМ (320 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и упаривали с получением неочищенного указанного в заголовке соединения, которое очищали методом колоночной хроматографии (ДХМ/МеОН, 95:5). 1 Н ЯМР (ДМСО-d6):1,14 (т, 3H), 1,14-1,46 (м, 5H), 2,10-2,80 (м, 6H), 3,94 (м, 1H), 4,05 (м, 2H), 4,28(м, 2H), 6,82 (м, 4H). Пример 50. [1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]метанол. К суспензии LiAlH4 (0,11 г, 2,78 ммоль) в безводном ТГФ (1 мл) добавляли этиловый эфир 1-(2,3 дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты (0,17 г, 0,55 ммоль) в безводном ТГФ (10 мл). Реакционную смесь нагревали при кипении с обратным холодильником в течение 2 ч. При охлаждении медленно добавляли воду и реакционную смесь экстрагировали EtOAc (320 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и фильтрат упаривали с получением указанного в заголовке соединения. 1H ЯМР (ДМСО-d6):0,90 (м, 1H), 1,48 (м, 1H), 1,64 (м, 3H), 1,70-2,20 (м, 3H), 2,80 (м, 2H), 3,20 (м,3H), 3,95 (дд, 1H), 4,30 (м, 2H), 4,36 (м, 1H), 6,82 (м, 4H). Пример 51. Этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3 карболовой кислоты. К раствору этилового эфира 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты (10,05 г, 32,90 ммоль) в безводном ТГФ (100 мл) при -78C медленно добавляли LDA (20,1 мл,1,8 М). Реакционную смесь перемешивали при данной температуре в течение 1 ч. Затем добавляли метилйодид (2,25 мл, 36,21 ммоль), удаляли охлаждающую баню и продолжали перемешивание в течение 10 ч. После добавления воды реакционную смесь экстрагировали EtOAc (325 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, которое очищали методом колоночной хроматографии (EtOAc/гептан, 70:30). 1H ЯМР (ДМСО-d6):1,06 (с, 3H), 1,15 (т, 3H), 1,58 (м, 2H), 1,94 (м, 1H), 2,10 (м, 2H), 2,40-2,70 (м,4H), 3,01 (дд, 1H), 3,94-4,05 (м, 3H), 4,28 (м, 2H), 6,85 (м, 4H). Пример 52. Этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3 карбоновой кислоты. Получали согласно методике,описанной выше для этилового эфира 1-(2,3 дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-карбоновой кислоты, за исключением того,что этилйодид использовали вместо метилйодида. 1H ЯМР (ДМСО-d6):0,74 (т, 3H), 1,04 (м, 1H), 1,10-1,20 (м, 3H), 1,38 (м, 1H), 1,48-1,62 (м, 3H),1,90-2,02 (м, 3H), 2,40-2,82 (м, 3H), 3,05 (м, 1H), 3,80-4,12 (м, 3H), 4,20-4,32 (м, 2H), 6,82 (м, 4H). Пример 53. [1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]метанол. К суспензии LiAlH4 (0,59 г, 15,54 ммоль) в безводном ТГФ (45 мл) добавляли этиловый эфир 1-(2,3 дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-карбоновой кислоты (1,0 г, 3,13 ммоль) в безводном ТГФ (5 мл). Реакционную смесь нагревали при кипении с обратным холодильником в течение 1 ч. Медленно добавляли воду и реакционную смесь экстрагировали EtOAc (320 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением желательного продукта, который очищали методом колоночной хроматографии (EtOAc/гептан, 50:50). 1H ЯМР (ДМСО-d6):0,85 (с, 3H), 1,06 (м, 1H), 1,31 (м, 1H), 1,50 (м, 2H), 1,85-2,45 (м, 6H), 3,22 (м,2H), 3,95 (м, 1H), 4,30 (м, 2H), 4,40 (м, 1H), 6,86 (м, 4H). Пример 54. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-метоксиметил-3-метилпиперидин. Раствор [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]метанола (0,1 г, 0,36 ммоль) в ТГФ (5 мл) добавляли к NaH (60% в масле, 79,0 мг, 1,79 ммоль), который предварительно промывали гептаном. Реакционную смесь перемешивали при 70C в течение 1 ч и затем охлаждали до КТ с последующим добавлением по каплям раствора метилйодида (0,034 мл, 0,54 ммоль) в ТГФ (1 мл). Перемешивание продолжали в течение 1 ч. Медленно добавляли воду и реакционную смесь экстрагировали ДХМ (320 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, которое очищали методом колоночной хроматографии (ДХМ/MeOH; 90:10). 1H ЯМР (ДМСО-d6):0,88 (с, 3H), 1,08 (м, 1H), 1,35 (м, 1H), 1,49 (м, 2H), 1,85-2,45 (м, 6H), 3,15 (м,2H), 3,31 (с, 3H), 3,95 (м, 1H), 4,27 (м, 2H), 6,86 (м, 4H). Пример 55. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-этоксиметил-3-метилпиперидин. Получали согласно методике, описанной для 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3 метоксиметил-3-метилпиперидина, за исключением того, что использовали этилйодид вместо метилйодида. 1- 23017554 Смесь оксихлорида фосфора (1,93 мл, 0,02 ммоль) и [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)3-метилпиперидин-3-ил]метанола (0,2 г, 0,72 ммоль) нагревали при кипении с обратным холодильником в течение 3 ч. Избыток оксихлорида фосфора выпаривали. Медленно добавляли воду и реакционную смесь делали щелочной водным NaOH и экстрагировали ДХМ (35 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, которое очищали методом колоночной хроматографии (ДХМ/MeOH, 90:10). 1H ЯМР (ДМСО-d6):0,93 (с, 3H), 1,19 (м, 1H), 1,50 (м, 3H), 1,85-2,45 (м, 6H), 3,66 (м, 2H), 3,95 (м,1H), 4,31 (м, 2H), 6,83 (м, 4H). Пример 57. 2-[1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]пропан-2-ол. К раствору этилового эфира 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3 карбоновой кислоты (1,13 г, 3,53 ммоль) в безводном ТГФ (50 мл) в атмосфере азота при 0C добавляли по каплям раствор метилмагнийхлорида в ТГФ (3,53 мл, 3,0 М). Полученный в результате раствор нагревали при кипении с обратным холодильником в течение 2,5 ч. Затем медленно добавляли воду при охлаждении, продукт экстрагировали ДХМ и очищали методом колоночной хроматографии (ДХМ/MeOH,95:5) с получением указанного в заголовке соединения. 1(1,54 мл). Реакционную смесь перемешивали при КТ в течение 5 ч. Реакционную смесь поглощали водой, подщелачивали водным NaOH и экстрагировали ДХМ с получением метилового эфира 1-(2,3 дигидробензо[1,4]диоксин-2-карбонил)-4-оксопиперидин-3-карбоновой кислоты. Смесь данного продукта (0,2 г, 0,62 ммоль), K2CO3 (0,17 г, 1,23 ммоль) и метилйодида (0,08 мл, 1,25 ммоль) в ацетоне (20 мл) облучали в микроволновом реакторе при 56C в течение 90 мин. Добавляли воду и реакционную смесь экстрагировали EtOAc (35 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением метилового эфира 1-(2,3-дигидробензо[1,4]диоксин-2-карбонил)-3 метил-4-оксопиперидин-3-карбоновой кислоты, который окончательно восстанавливали с использованием LiAlH4 в ТГФ, получая указанное в заголовке соединение. 1H ЯМР (ДМСО-d6):0,88 (с, 3H), 1,06 (м, 1H), 1,15-3,80 (м, 11H), 3,95 (м, 1H), 4,32 (м, 2H), 4,42 (м,1H), 6,84 (м, 4H). Пример 60. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметиловый эфир уксусной кислоты. К раствору [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]метанола (0,5 г,1,80 ммоль), пиридина (0,29 мл) и ДХМ (40 мл) при 0C добавляли уксусный ангидрид (0,34 мл). Реакционную смесь перемешивали при КТ в течение 6 ч. Медленно добавляли воду и реакционную смесь экстрагировали ДХМ (320 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением указанного в заголовке соединения. 1H ЯМР (ДМСО-d6):0,85 (с, 3H), 1,08 (м, 1H), 1,33 (м, 1H), 1,50 (м, 2H), 1,85-2,45 (м, 7H), 2,49 (с,3H), 3,95 (м, 1H), 4,25-4,39 (м, 3H), 6,83 (м, 4H). Пример 61. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметиловый эфир метансульфоновой кислоты. К раствору [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]метанола (0,92 г,3,31 ммоль) в ДХМ (40 мл) при 0C добавляли метансульфонилхлорид (0,51 мл). Реакционную смесь перемешивали при КТ в течение 12 ч. Реакционную смесь подщелачивали 2 М NaOH и затем экстрагировали ДХМ (320 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением указанного в заголовке соединения. 1(м, 1H), 4,29 (м, 2H), 6,81 (м, 4H). Пример 62. [1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]метанол. Получали согласно методике, описанной для [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3 метилпиперидин-3-ил]метанола,за исключением того,что этиловый эфир 1-(2,3- 24017554 дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-карбоновой кислоты использовали вместо этилового эфира 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-карбоновой кислоты. 1(0,11 мл). Реакционную смесь перемешивали при КТ в течение 16 ч. Добавляли воду и продукт экстрагировали ДХМ (320 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением указанного в заголовке соединения. 1H ЯМР (ДМСО-d6):0,91 (с, 3H), 1,09 (м, 1H), 1,26 (м, 1H), 1,39 (м, 1H), 1,51 (м, 2H), 2,07-2,39 (м,4H), 3,23-3,32 (м, 6H), 3,95 (м, 1H), 4,28 (м, 2H), 4,54 (м, 2H), 6,81 (м, 4H). Пример 65. 1-[1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]этанон. Воспроизводили методику, описанную для 2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3 метилпиперидин-3-ил]пропан-2-ола, за исключением того, что в качестве исходного вещества использовали этиловый эфир 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-карбоновой кислоты и использовали только один вместо трех эквивалентов метилмагнийбромида. 1 Н ЯМР (ДМСО-d6):0,65 (т, 3H), 0,96 (м, 1H), 1,10-1,80 (м, 5H), 2,05 (м, 3H), 2,11 (с, 3H), 2,53 (м,1H), 2,66 (м, 1H), 3,15 (дд, 1H), 3,93 (м, 1H), 4,34 (м, 1H), 4,34 (м, 1H), 6,82 (м, 4H). Пример 66. 1-[1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]этанол. К суспензии LiAlH4 (0,10 г, 2,58 ммоль) в безводном ТГФ (4 мл) добавляли 1-[1-(2,3 дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]этанон (0,08 г, 0,26 ммоль) в безводном ТГФ (3 мл). Реакционную смесь нагревали при кипении с обратным холодильником в течение 1,5 ч. Медленно добавляли воду и реакционную смесь экстрагировали EtOAc (310 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением желательного продукта, который очищали методом колоночной хроматографии (EtOAc/гептан, 50:50). 1H ЯМР (CDCl3):0,80 (т, 3H), 1,16 (м, 4H), 1,18-1,90 (м, 5H), 1,97-2,27 (м, 3H), 2,25 (м, 2H), 2,94 (м,2H), 3,97 (м, 2H), 4,31 (м, 2H), 6,83 (м, 4H). Пример 67. 3-Аллилоксиметил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин. Воспроизводили методику, описанную для 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этил-3 метоксиметилпиперидина, за исключением того, что использовали аллилбромид вместо метилйодида. 1(м, 3H), 4,27 (м, 2H), 5,11 (т, 1H), 5,23 (дд, 1H), 5,87 (м, 1H), 6,84 (м, 4H). Пример 68. 2-[1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-илметокси]этанол. К раствору [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-ил]метанола (0,40 г,1,37 ммоль) в ДХМ (1,5 мл) добавляли 50% NaOH (6 мл), гидросульфат тетрабутиламмония (0,46 г, 1,37 ммоль) и трет-бутилбромацетат (5,35 г, 27,45 ммоль). Реакционную смесь перемешивали при КТ в течение 24 ч. Добавляли воду, реакционную смесь экстрагировали EtOAc (310 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением 3-(2-третбутоксиэтоксиметил)-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидина. Данное неочищенное промежуточное соединение (0,20 г, 0,50 ммоль) в безводном ТГФ (2 мл) затем добавляли к суспензии LiAlH4 (0,19 г, 5,00 ммоль) в безводном ТГФ (4 мл). Реакционную смесь нагревали при кипении с обратным холодильником в течение 1,5 ч. Медленно добавляли воду и реакционную смесь экстрагировали EtOAc (310 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением неочищенного продукта, который очищали методом колоночной хроматографии (EtOAc/гептан, 50:50). 1(м, 4H), 3,28 (м, 2H), 3,38 (м, 2H), 3,47 (м, 2H), 3,95 (м, 1H), 4,27 (м, 2H), 4,46 (м, 1H), 6,81 (м, 4H). Пример 69. 3-Аллилоксиметил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин. Воспроизводили методику, описанную выше для 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3 метоксиметил-3-метилпиперидина, за исключением того, что аллилбромид использовали вместо метилйодида. 1 Н ЯМР (CDCl3):0,95 (с, 3H), 1,12 (м, 1H), 1,42 (м, 1H), 1,55 (м, 3H), 2,05-2,62 (м, 7H), 3,21-3,32 (м,2H), 4,00 (м, 1H), 4,31 (м, 1H), 4,35 (м, 1 Н), 5,14 (д, 1H), 5,25 (д, 1H), 5,90 (м, 1H), 6,83 (м, 4H).- 25017554 Пример 70. Этиловый эфир 3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3 карбоновой кислоты. Воспроизводили методику, описанную выше для этилового эфира 1-(2,3-дигидробензо[1,4]диоксин 2-илметил)-3-этилпиперидин-3-карбоновой кислоты, за исключением того, что аллилбромид использовали вместо метилйодида. 1(м, 2H), 5,03 (м, 2H), 5,62 (м, 1H), 6,78 (м, 4H). Пример 71. [3-Аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]метанол. Получали из этилового эфира 3-аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3 карбоновой кислоты, используя методику, описанную для [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)3-метилпиперидин-3-ил]метанола. 1H ЯМР (ДМСО-d6):1,15-1,52 (м, 5H), 1,98-2,50 (м, 6H), 3,10 (м, 2H), 3,26 (м, 3H), 3,30 (м, 1H),3,95 (м, 1H), 4,27 (м, 2H), 5,00 (шир.д, 1H), 5,02 (м, 1H), 5,79 (м, 1H), 6,81 (м, 4H). Пример 73. 3-Аллил-1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этоксиметилпиперидин. Воспроизводили методику, описанную для 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3 метоксиметил-3-метилпиперидина, за исключением того, что этилйодид использовали вместо метилйодида. 1(м, 2H), 3,98 (м, 1H), 4,28 (м, 2H), 5,03 (м, 2H), 5,78 (м, 1H), 6,84 (м, 4H). Пример 74. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-метил-3-(2,2,2-трифторэтоксиметил) пиперидин. Смесь 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметилового эфира метансульфоновой кислоты (0,35 г, 0,98 ммоль), K2CO3 (0,68 г) и трифторэтанола (4 мл) облучали в микроволновом реакторе при 150C в течение 10 мин. Добавляли воду и реакционную смесь экстрагировали ДХМ (220 мл). Объединенные органические фазы сушили над Na2SO4, фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, которое очищали методом колоночной хроматографии (ДХМ/MeOH, 90:10). 1H ЯМР (ДМСО-d6):0,89 (м, 3H), 1,10 (м, 1H), 1,25-1,60 (м, 4H), 2,01-2,50 (м, 4H), 3,39 (м, 1H),3,48 (м, 2H), 3,80-4,10 (м, 3H), 4,28 (м, 2H), 6,81 (м, 4H). Пример 75. 2-[1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-илметокси]этанол. Получали из [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метилпиперидин-3-ил]метанола, используя методику, описанную выше для 2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-этилпиперидин-3-илметокси]этанола. 1H ЯМР (CDCl3):0,96 (с, 3H), 1,16 (м, 1H), 1,40 (м, 1H), 1,59 (м, 2H), 2,16 (д, 1H), 2,30 (шир.с, 1H),2,46 (д, 1H), 2,47-2,50 (м, 3H), 3,26 (д, 1H), 3,39 (дд, 1H), 3,45 (д, 1H), 3,52 (м, 2H), 3,70 (м, 2H), 4,29 (м,2H), 6,83 (м, 4H). Пример 76. Этиловый эфир [1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]уксусной кислоты. К смеси 2-бромметил-2,3-дигидробензо[1,4]диоксина (1,34 г, 5,84 ммоль), этилового эфира пиперидин-3-илуксусной кислоты (1,0 г, 5,84 ммоль) в ацетонитриле (25 мл) добавляли K2CO3 (0,81 г, 5,84 ммоль) и KI (0,97 г, 5,84 ммоль). Реакционную смесь нагревали с использованием микроволнового излучения при 82C в течение 8 ч. Затем добавляли воду (100 мл). Реакционную смесь экстрагировали ДХМ(350 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, которое очищали методом колоночной хроматографии(м, 2H), 3,93 (дд, 1H), 4,04 (кв, 2H), 4,29 (м, 2H), 6,81 (м, 4H). Пример 77. 2-[1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]этанол. К суспензии LiAlH4 (0,12 г, 3,16 ммоль) в безводном ТГФ (4 мл) добавляли этиловый эфир [1-(2,3 дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]уксусной кислоты (2,0 г 0,62 ммоль) в безводном ТГФ (2 мл). Реакционную смесь нагревали при кипении с обратным холодильником в течение 1,5 ч. Медленно добавляли воду и реакционную смесь экстрагировали EtOAc (320 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и фильтрат упаривали с получением желательного продукта, который очищали методом колоночной хроматографии (EtOAc/гептан, 50:50). 1H ЯМР (ДМСО-d6):0,84 (м, 1H), 1,14-2,03 (м, 8H), 2,52 (м, 2H), 2,74-2,87 (м, 2H), 3,42 (м, 2H),- 26017554 3,94 (дд, 1H), 4,29 (м, 3H), 6,81 (м, 4H). Пример 78. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-3-(2-метоксиэтил)пиперидин. К раствору 2-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]этанола (0,1 г, 0,36 ммоль) в ТГФ (5 мл) добавляли NaH (79,0 мг, 1,79 ммоль), который предварительно промывали гептаном. Реакционную смесь перемешивали при 70C в течение 1 ч с последующим добавлением по каплям раствора йодметана (0,034 мл, 0,54 ммоль) в ТГФ (1 мл). Перемешивание продолжали в течение 1 ч. Медленно добавляли воду и реакционную смесь экстрагировали ДХМ (320 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, которое очищали методом колоночной хроматографии (ДХМ/MeOH, 90:10). 1KI (0,72 г, 4,36 ммоль). Реакционную смесь нагревали при кипении с обратным холодильником в течение 2 ч. Затем добавляли воду (100 мл). Реакционную смесь экстрагировали EtOAc (35 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, которое очищали методом колоночной хроматографии (EtOAc/гептан, 50:50). 1H ЯМР (ДМСО-d6):1,40-1,80 (м, 4H), 1,80-2,40 (м, 3H), 2,50-2,80 (м, 4H), 3,94 (м, 1H), 4,30 (м,2H), 6,83 (м, 4H), 7,31 (с, 2H). Пример 80. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбонитрил. Тионилхлорид (20 мл) добавляли при охлаждении к амиду 1-(2,3-дигидробензо[1,4]диоксин-2 илметил)пиперидин-3-карбоновой кислоты (2,34 г, 8,4 6 ммоль). Реакционную смесь нагревали при кипении с обратным холодильником в течение 3 ч. Избыток тионилхлорида выпаривали. К остатку медленно добавляли воду, смесь подщелачивали водным NaOH и экстрагировали ДХМ (35 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, которое очищали методом колоночной хроматографииH ЯМР (ДМСО-d6):1,20 (м, 1H), 1,40-1,70 (м, 5H), 2,50-2,62 (м, 5H), 3,98 (м, 1H), 4,32 (м, 2H),6,82 (м, 4H). Пример 81. С-[1-(2,3-дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ил]метиламин. К суспензии LiAlH4 (0,62 г, 16,30 ммоль) в безводном ТГФ (15 мл) добавляли амид 1-(2,3 дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-карбоновой кислоты (0,45 г, 1,63 ммоль) в безводном ТГФ (5 мл). Реакционную смесь нагревали с использованием микроволнового излечения при 66C в течение 1 ч. Медленно добавляли воду и смесь экстрагировали EtOAc (320 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и фильтрат упаривали с получением желательного продукта,который очищали методом колоночной хроматографии (ДХМ/MeOH, 98:2). 1 Н ЯМР (ДМСО-d6):0,84 (м, 1H), 1,40-1,80 (м, 7H), 2,01 (м, 1H), 2,33 (м, 2H), 2,70-2,90 (м, 3H),3,30 (шир.с, 1H), 3,94 (м, 1H), 4,28 (м, 2H), 6,83 (м, 4H). Пример 82. 1-(2,3-Дигидробензо[1,4]диоксин-2-илметил)пиперидин-3-ол. Смесь 2-бромметил-2,3-дигидробензо[1,4]диоксина (2,26 г, 9,88 ммоль), пиперидин-3-ола (1,0 г,9,88 ммоль) и K2CO3 (6,8 г, 49,43 ммоль) в ДМФА (30 мл) нагревали с использованием микроволнового излучения при 153C в течение 120 мин, получая неочищенное указанное в заголовке соединение после обычной обработки. Продукт очищали методом колоночной хроматографии (ДХМ/MeOH, 98:2). 1(0,61 г, 4,41 ммоль). Реакционную смесь нагревали с использованием микроволнового излучения при 140C в течение 10 мин. Затем добавляли воду и смесь экстрагировали ДХМ (35 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и фильтрат упаривали с, получением указанного в заголовке соединения, которое очищали методом колоночной хроматографии (ДХМ/MeOH, 95:5). 1[2-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4-тетрагидроизохинолин-8 ил]метанол. К суспензии LiAlH4 (0,20 г, 5,44 ммоль) в безводном ТГФ (10 мл) добавляли метиловый эфир 2-(2,3 дигидробензо[1,4]диоксин-2-илметил)-1,2,3,4-тетрагидроизохинолин-8-карбоновой кислоты (0,18 г, 0,54 ммоль). Реакционную смесь нагревали с использованием микроволнового излучения при 80C в течение- 27017554 10 мин. При охлаждении медленно добавляли воду (10 мл) с последующей экстракцией EtOAc (35 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и фильтрат упаривали с получением указанного в заголовке соединения, которое очищали методом колоночной хроматографии(кв, 1H), 5,01 (т, 1H), 6,84 (м, 4H), 7,01 (д, 1H), 7,10 (т, 1H), 7,16 (д, 1H). Ссылочный пример 85. Этиловый эфир (S)-1-R)-2,3-дигидробензо[1,4]диоксин-2-карбонил)-3 метилпиперидин-3-карбоновой кислоты. Этиловый эфир 3-метилпиперидин-3-карбоновой кислоты. Этил-5-хлор-2-циано-2-метилпентаноат (DE 3139301 A1) (10,43 г, 51,2 ммоль), гидрат PtO2 (1,16 г) и концентрированную HCl (12,5 мл) в абсолютном EtOH (125 мл) перемешивали и нагревали при 40C в атмосфере азота при нормальном давлении в течение 2 ч. Охлажденный раствор фильтровали. После выпаривания растворителя остаток растворяли в абсолютном EtOH (125 мл). Раствор охлаждали на ледяной бане и добавляли триэтиламин (9,8 г, 96,8 ммоль). После добавления смесь перемешивали при КТ в течение 16 ч в атмосфере азота. Растворитель и триэтиламин выпаривали, остаток растворяли в ДХМ(100 мл) и экстрагировали 1 М HCl (3100 мл). После разделения слоев добавляли лед (150 г) и 5 М NaOH(100 мл) к водному слою, который затем экстрагировали ДХМ (360 мл). Объединенные экстракты сушили, фильтровали и упаривали досуха с последующей дистилляцией в вакууме (т.кип. 62-65C/2 мбар),получая 6,0 г указанного в заголовке соединения в виде бесцветной жидкости. 1H ЯМР (CDCl3):1,09 (с, 3H), 1,27 (т, 3H), 1,33-1,57 (м, 4H), 2,17 (м, 1H), 2,41 (д, 1H), 2,58 (м, 1H),2,92 (м, 1H), 3,32 (дд, 1H), 4,17 (м, 2H). Этиловый эфир (S)-3-метилпиперидин-3-карбоновой кислоты. Указанное в заголовке соединение выделяют из вышеуказанного рацемата в соответствии со способом, описанным в Org. Lett., 7 (2005) 55. Этиловый эфир (S)-1-(R)-2,3-дигидробензо[1,4]диоксин-2-карбонил)-3-метилпиперидин-3-карбоновой кислоты.(R)-2,3-дигидробензо[1,4]диоксин-2-карбонилхлорид (6,05 г, 30,5 ммоль) в ДХМ (20 мл) добавляли к перемешиваемой смеси этилового эфира (S)-3-метилпиперидин-3-карбоновой кислоты (5,0 г, 29,2 ммоль), DIPEA (5,5 мл, 31,7 ммоль) и ДХМ (30 мл), предварительно охлажденной ниже 5C. Охлаждающую ванну удаляли и перемешивание продолжали при КТ в течение 1 ч. Реакционную смесь промывали дважды 1 М HCl, дважды насыщенным водным NaHCO3 и дважды водой и сушили Na2SO4. Растворитель выпаривали с получением 9,66 г указанного в заголовке соединения. 1(5 мл) нагревали с использованием микроволнового излучения при 100C в течение 26 ч. Смесь фильтровали и упаривали досуха. Остаток растворяли в воде, промывали дважды EtOAc и водную фазу упаривали досуха с получением 353 мг указанного в заголовке соединения. 1(м, 1H), 2,09-2,18 (м, 1H), 2,21-2,30 (м, 1H), 2,37-2,50 (м, 3H), 2,60-2,69 (м, 1H), 3,96-4,03 (м, 1H), 4,184,26 (м, 1H), 4,30-4,37 (дд, 1 Н, J=2,4, 11,2 Гц), 6,76-6,86 (м, 4H). Пример 87. (S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметанол. Смесь этилового эфира (S)-1-R)-2,3-дигидробензо[1,4]диоксин-2-карбонил)-3-метилпиперидин-3 карбоновой кислоты (27,7 г, 83,1 ммоль) и ТГФ (150 мл) добавляли к охлажденной (0C) смеси безводного ТГФ (150 мл) и LiAlH4 (10 г, 264 ммоль). Реакционную смесь нагревали при кипении с обратным холодильником в течение 2 ч, после чего ее охлаждали до КТ и добавляли воду. Смесь экстрагировали дважды EtOAc и сушили Na2SO4. Растворитель выпаривали с получением 21,93 г указанного в заголовке соединения. 1(5,12 г, 18,5 ммоль), 50% NaOH (125 мл) и бромида тетрабутиламмония (0,585 г, 1,8 ммоль) перемешивали при КТ в течение 15 мин и затем нагревали до 60C. В реакционную смесь добавляли 2-(2 бромэтокси)тетрагидропиран (11,3 г, 54,0 ммоль) при 60C в течение 2 ч. После добавления реакционную- 28017554 смесь перемешивали при 60C в течение 5 ч. Реакционную смесь охлаждали ниже КТ и добавляли насыщенный раствор соли и воду. Реакционную смесь экстрагировали три раза толуолом. Толуольные фазы объединяли и промывали дважды водой и однократно насыщенным раствором соли, сушили (Na2SO4) и упаривали с получением (S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метил-3-[2-(тетрагидропиран-2-илокси)этоксиметил]пиперидина. Для удаления группы ТНР данное соединение перемешивали в воде (100 мл) и концентрированной HCl (10 мл) при КТ в течение 3 ч. Реакционную смесь промывали дважды толуолом и pH водной фазы доводили до 11-12 с помощью NaOH. Щелочную фазу экстрагировали дважды толуолом. Объединенные экстракты промывали дважды водой и однократно насыщенным раствором соли и сушили (Na2SO4). Толуол выпаривали и к остатку добавляли EtOAc. EtOAc выпаривали с получением 4,74 г неочищенного указанного в заголовке соединения. Смесь неочищенного указанного в заголовке соединения (4,6 г, 14,3 ммоль), EtOAc (50 мл) и (-)-ди-п-толуол-1-винной кислоты(5,53 г, 14,3 ммоль) перемешивали при 60C в течение 1 ч. Реакционную смесь охлаждали до КТ и перемешивали в течение нескольких часов. Осадок отфильтровывали, промывали EtOAc и сушили в вакууме при 80C. Неочищенный продукт (8,9 г, 12,6 ммоль) перекристаллизовывали из IPA (90 мл) с получением 7,5 г ди-п-толуол-L-тартратной соли 2-(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметоксиэтанола. Данную соль перемешивали с EtOAc (50 мл) и водой (50 мл). ВеличинуpH смеси доводили до 9 (1 М NaOH) и перемешивание продолжали при КТ в течение 30 мин. Фазы разделяли и водную фазу экстрагировали дважды EtOAc. Органические слои объединяли, сушили (Na2SO4) и упаривали с получением 3,4 г чистого указанного в заголовке соединения. 1H ЯМР (CDCl3):0,96 (с, 3H), 1,11-1,18 (м, 1H), 1,39-1,45 (м, 1H), 1,56-1,62 (м, 2H), 2,09-2,62 (м,7H), 3,27-3,29 (д, 1H), 3,44-3,46 (д, 1H), 3,51-3,55 (м, 2H), 3,69-3,72 (м, 2H), 3,97-4,02 (м, 1H), 4,24-4,33 (м,2H), 6,80-6,88 (м, 4H). Пример 89. D-тартрат 2-(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметоксиэтанола. Смесь 2-(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметокси этанола (3,1 г, 9,6 ммоль) и ацетона (30 мл) нагревали до 50C и добавляли D-винную кислоту (1,45 г, 9,7 ммоль) малыми порциями при 50C. Реакционную смесь нагревали при кипении с обратным холодильником в течение 1 ч, после чего смесь охлаждали до КТ и растворитель выпаривали. Остаток сушили в вакууме при 40C с получением 4,17 г указанной в заголовке соли. 1(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3 илметанола, используя методику для получения 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3 метоксиметил-3-метилпиперидина, за исключением того, что 1-бром-2-метоксиэтан использовали вместо метилйодида. 1(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3 илметанола, как описано для 1-(2,3-дигидробензо[1,4]диоксин-2-илметил)-3-метил-3-(2,2,2-трифторэтоксиметил)пиперидина. 1H ЯМР (CDCl3):0,96 (с, 3H), 1,14 (м, 1H), 1,42 (м, 1H), 1,56 (м, 3H), 2,10 (дд, 1H), 2,40 (д, 1H),2,52 (м, 3H), 3,45 (дд, 1H), 3,53 (т, 1H), 3,81 (кв, 2H), 3,98 (м, 1H), 4,30 (м, 2H), 6,83 (м, 4H). Пример 92. (S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметиловый эфир метансульфоновой кислоты. Смесь 3-(R)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]пиперидин-3-илфенола (1,05 г,3,79 ммоль) и триэтиламина (212 мкл, 0,585 г, 5,78 ммоль) в ДХМ охлаждали до 0C и добавляли метансульфонилхлорид (448 мкл, 0,66 г, 5,78 ммоль) в ДХМ (1 мл). Смесь перемешивали при КТ в течение 2 ч. Реакционную смесь гасили водой и дважды промывали насыщенным водным NaHCO3. Органическую фазу сущили (Na2SO4) и упаривали досуха с получением 1,048 г указанного в заголовке соединения. 1S-(S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3 илметиловый эфир тиоуксусной кислоты. Смесь (S)-1-[(S)-1-(2,3-дигидробензо[1,4]диоксин-2-ил)метил]-3-метилпиперидин-3-илметилового эфира метансульфоновой кислоты (927 мг, 2,61 ммоль), тиоуксусной кислоты (373 мкл, 399 мг, 5,24 ммоль) и K2CO3 (721 мг, 5,22 ммоль) в ДМФА (35 мл) нагревали при 95C в течение 10 ч. Смесь упари- 29
МПК / Метки
МПК: C07D 405/06, A61K 31/357, A61P 25/00
Метки: alpha;2с, лечении, периферической, нервной, антагонистов, качестве, производные, системы, заболеваний, центральной, 2,3-дигидробензо[1,4]диоксин-2-илметиловые, применения
Код ссылки
<a href="https://eas.patents.su/30-17554-23-digidrobenzo14dioksin-2-ilmetilovye-proizvodnye-v-kachestve-alpha2s-antagonistov-dlya-primeneniya-v-lechenii-zabolevanijj-perifericheskojj-i-centralnojj-nervnojj-sistemy.html" rel="bookmark" title="База патентов Евразийского Союза">2,3-дигидробензо[1,4]диоксин-2-илметиловые производные в качестве α2с антагонистов для применения в лечении заболеваний периферической и центральной нервной системы</a>


































