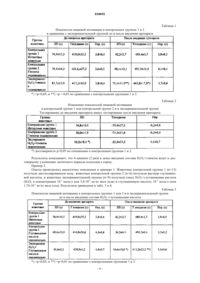
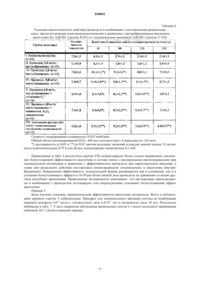
Фармацевтическое средство для эндоназального применения при лечении болезней и нарушений центральной нервной системы
Формула / Реферат
1. Фармацевтическое средство эндоназального применения для лечения болезней и нарушений центральной нервной системы, представляющее собой смесь, содержащую биологически активные вещества, действующие на центральную нервную систему, и вещества, действующее на слизистую оболочку носа, в качестве которых используют кислородные анион-радикалы и/или активные продукты оксида азота.
2. Фармацевтическое средство по п.1, отличающееся тем, что в качестве веществ, действующих на слизистую оболочку носа, используют пергидроксилрадикалы, перекись водорода, гидропероксидные радикалы или их гидратные кластеры.
3. Фармацевтическое средство по п.1, отличающееся тем, что в качестве веществ, действующих на слизистую оболочку носа, используют формы моноксида азота (NO) и их предшественники или продукты превращений.
4. Фармацевтическое средство по п.1, отличающееся тем, что в качестве веществ, действующих на слизистую оболочку носа, используют биохимические, физиологические вазодилататоры, преимущественно аргинин, брадикинин, мочевину или производные (дериваты) эйкозотриеновой кислоты.
5. Фармацевтическое средство по п.1, отличающееся тем, что концентрация веществ, действующих на слизистую оболочку носа, составляет от 10-12 до 10-1 моль/л, преимущественно 10-5 моль/л.
6. Фармацевтическое средство по п.1, отличающееся тем, что в качестве биологически активных веществ, действующих на центральную нервную систему, используют лекарственные средства или метаболиты.
7. Фармацевтическое средство по п.6, отличающееся тем, что содержит лекарственные средства в дозе от 0,001 до 100 мг в одной дозируемой единице.
8. Фармацевтическое средство по п.6, отличающееся тем, что содержит метаболиты в дозе от 0,0001 до 100 мг в одной дозируемой единице.
9. Фармацевтическое средство по п.6, отличающееся тем, что в качестве лекарственных средств используют промедол, метамизол, фенобарбитал, метадон, трамадол, ацетилсалициловую кислоту или силденафил.
10. Фармацевтическое средство по п.6, отличающееся тем, что в качестве метаболитов используют триптофан, гамма-аминомасляную кислоту, окситоцин, дерморфин, циклический АМФ, глюкозу, дофамин или L-ДОПА.
11. Фармацевтическое средство по п.1, отличающееся тем, что биологически активные вещества, действующие на центральную нервную систему, содержатся в составе липосом и/или наносом.
12. Фармацевтическое средство по п.1, отличающееся тем, что дополнительно содержит фармацевтически приемлемые вспомогательные вещества.
13. Фармацевтическое средство по п.12, отличающееся тем, что в качестве вспомогательных веществ используют стабилизаторы, антиоксиданты, регуляторы рН, осморегуляторы и антимикробные вещества.
14. Фармацевтическое средство по п.1, отличающееся тем, что оно представляет собой спрей.
Текст
010692 Изобретение касается фармацевтического средства, содержащего вещества, действующие на центральную нервную систему, к которому добавлено вещество, активно действующее на слизистую оболочку полости носа, и предназначенного для эндоназального применения. Терапевтическое участие кислородных радикалов и/или продуктов их последующего превращения и для лечения бронхиальной астмы (N. Goldstein расщепления известно. Известно, например, применениеu.a., Adjuvante Inhalationstherapie des Asthma bronchiale mit exogenem Superoxid; Phys. Rehab. Kur. Med. 7,1997, 138-140). Известно также, что ингаляция газофазного супероксида или перекиси водорода в низких концентрациях усиливает болеутоляющее действие аналгетиков, вводимых энтерально, или парентерально, или внутрибрюшинно, как это описано Гольдштейном и др. (см. Goldstein et al., Exogenous gaseoussuperoxide potentiates the antinociceptive effect of opioid analgesic agents, Inflamm. Res., 45, 1996, 473-478) и известно из патента DE 19514522. Кроме того, из патента DE 19708643 известно терапевтическое применение газофазного супероксида или перекиси водорода при лечении болезни Паркинсона. Одним из принципиально возможных методов лечения и регуляции функций организма млекопитающих является прямая стимуляция или воздействие на лимбическую и ретикулярную системы мозга,осуществляемые путем воздействия на гипоталамус. Гипоталамус является важной частью мозга, ответственной за регуляцию внутренней среды и поддержание гомеостаза организма. Интегративные функции гипоталамуса охватывают вегетативные, соматические и гормональные реакции организма, особенно регуляцию активности желез внутренней и внешней секреции, регуляцию сна/бодрствования, восприятия боли, чувства жажды и голода, гормональную регуляцию, эмоциональные и другие реакции. Особенности его строения и функций делают гипоталамус мишенью для адекватного и неинвазивного, нетравматичного метода для лечения и для воздействия на различные нарушенные функции организма. Специальные нейроны гипоталамуса имеют хеморецепторную функцию. Они чувствительны к изменениям физиологически важных параметров крови и ликвора. Тем самым, они способны к рецепции информационных сигналов из внутренней среды организма и из окружающей среды. Информационные сигналы из внутренней среды организма далее передаются посредством простых метаболитов, например таких,как аминокислоты, углеводы, пептиды, нуклеотиды. В передаче таких сигналов участвуют также гормоны и их производные, медиаторы и/или нейротрансмиттеры и другие природные и искусственные регуляторы. Информационные сигналы из внешней среды, например из вдыхаемого воздуха, воспринимаются гипоталамусом с помощью экстерорецепторов носовой полости и вызывают соответствующие реакции организма. Тем самым, гипоталамус является подходящим местом воздействия лекарств и метаболических молекул для регуляции физиологических эффектов. В отличие от приема внутрь (энтерального) или парентерального метода применения лекарств, их эндоназальное применение в более низких, чем общепринятые, концентрациях и дозах может иметь ряд преимуществ. К этим преимуществам относится, в первую очередь, уменьшение токсических эффектов или побочных действий. Другим важным преимуществом назальных аппликаций лекарств является их неинвазивный характер. В патенте DE 19514522 С 1 описано потенцирование аналгетиков исключительно в сочетании с АРК(активные анион-радикалы кислорода). При этом речь идет исключительно о раздельном применении АРК (интраназально) и аналгетиков (внутрибрюшинно или перорально), и при этом аналгетики интраназально не применяются. Практическое применение этих средств является сложным, так как они основаны на двух следующих одно за другим применениях, а именно на раздельном введении АРК и аналгетиков,и при этом достигается умеренное усиление болеутоляющего действия, в то время как терапевтическое интраназальное применение АРК при лечении болезни Паркинсона является на удивление успешным. Из патента DE 69321458 Т 2 известно применение средств, способствующих абсорбции. Правда, при этом речь идет о форме, способствующей применению (лекарства), но не о потенцировании действия ограниченного круга аналгетиков. Для терапевтического применения опиоидных аналгетиков используются исключительно полярные метаболиты, а именно глюкурониды опиоидных аналгетиков, которые могут проявлять более высокую эффективность по сравнению с исходными веществами (морфин, кодеин, леворфанол и др.). При этом болеутоляющее действие может развиваться при концентрации морфин 6-глюкуронида в 0,15 мг/кг веса тела. Для терапевтического применения описано использование исключительно полярных метаболитов опиоидных аналгетиков, которые, однако, сами по себе являются непригодными для проявления болеутоляющего действия морфина. Далее, лекарственная форма аналгетиков может быть реализована только в сочетании (в связи) со средствами, способствующими абсорбции,образованными катионическим полимером, биосвязывающим средством, поверхностно-активным средством, жирной кислотой, хелатообразователем, растворимым в слизи средством, циклодекстрином или содержащим микрокапсулы препаратом. Наконец, в патенте DE 69017690 Т 2 речь идет об одной из форм введения, однако, не о потенцировании действия различных лекарственных веществ или метаболитов. Описанные смеси состоят из усилителей абсорбции, а именно из неионных поверхностно-активных средств или из производных желчных солей и лекарства, такого как инсулин или кальцитонин. Далее, в литературе описаны попытки прямого эндоназального применения лекарств. Так, известно-1 010692 эндоназальное введение 6-глюкуронида морфина с целью уменьшения побочного действия лекарства(Ilium L. et al., 1996; Biopharm. Drug Dispos., 17 (8): 717-724). В другом примере описано эндоназальное применение бромокриптина, которое было предпринято с намерением уменьшения побочных эффектов на желудочно-кишечный тракт (Cicinelli E. et al., 1996, J.Endocrinol. Invest. 19 (7): 427-432). Гипоталамус является подходящей мишенью для воздействия на центральную нервную систему эндоназально применяемыми лекарствами, как это описано у Ilium L. et al., (1996), а также Bechgaard Е. etal. (J. Pharm. Pharmacol., 1997, 49 (8): 747-750). Далее, из патента RU-PS 2149043 известен метод лечения церебральной ангиодистонии посредством эндоназальной аппликации аэрозоля, содержащего литуитрин. В ряде случаев эндоназально применяются также естественные гормоны или их синтетические аналоги и/или производные. В качестве примера известны эстрены, которые непрямым образом воздействуют на гипоталамус. В патенте WO 9610032, авторы: D. Berliner et al., описано применение стероидов,например 1,3,5(10)-16-эстратетраен-3-ола, которые способны возбуждать нейроэпителиальные рецепторы слизистой носа и которые вводятся через полость носа реципиентов. Известно также эндоназальное применение норпрегнана для регуляции сексуального поведения. Существенным недостатком описанных до сих пор лекарств для эндоназального применения с действием на центральную нервную систему является их недостаточная лечебная эффективность. В основе низкой эффективности известных в настоящее время эндоназально применяемых лекарств лежит, очевидно, недостаточная чувствительность рецепторных структур органов-мишеней, в первую очередь ядер гипоталамуса и других структур мозга, или высокий порог возбуждения участвующих рецепторов. Поэтому эндоназальные аппликации лекарств с действием на центральную нервную систему находят до сих пор лишь ограниченное применение. Задачей предложенного изобретения является повышение эффективности лекарств, метаболитов и/или других ранее описанных типов активных веществ, которые служат для лечения нарушений центральной нервной системы, для значительного уменьшения обычно применяемого дозирования лекарств,достижения их более быстрого, пролонгированного действия. Решение этой задачи достигается применением комбинированного состава из свободнорадикальных продуктов и биологически активных веществ, действие которых они потенцируют, причем потенцирование осуществляется в комбинации с кислородными анион-радикалами (АРК) и/или активными продуктами оксида азота. Применение такого подхода, в дальнейшем сокращенно АДСНС (активно действующие на слизистую полости носа субстанции), позволило создать фармацевтическое средство, с помощью которого, прежде всего, сенсибилизируется слизистая носа пациента. Это делает возможным применение различных веществ,включая метаболиты. При этом потенцирование достигается не только в комбинации с АРК, но такжеNO-активными продуктами. Используется исключительно комбинированный состав свободнорадикальных продуктов с биологически активными субстанциями. Тем самым, практическое применение является значительно более простым, и достигается значительно более высокое болеутоляющее действие при одинаковой дозировке, или достигаются одинаковые эффекты при значительно более низких дозах аналгетиков. Далее, становится возможным вводить в виде назального спрея или назальной мази фармацевтически активные вещества, которые обычно должны применяться в виде таблеток, капель, уколов или т.п. Тем самым, фармацевтически активные действующие вещества могут применяться в значительно меньших дозировках и, тем не менее, вызывают одинаковое действие, как при до сих пор обычно применяемых высоких дозировках. Для выполнения лекарственной формы предусмотрено, что АДСНС являются кислородными радикалами и/или продуктами их превращений или распада, а именно пергидроксилрадикалами (ROO), перекисью водорода, гидропероксидными радикалами (HO2) или их гидратными кластерами, а также что субстанции, активно действующие на слизистую оболочку полости носа, являются формами монооксида азота (NO) и его предшественниками или продуктами превращений. Дальнейшие предпочтительные мероприятия описаны в нижеприведенной патентной формуле. Более подробно изобретение будет описано ниже. Неожиданным образом было обнаружено, что путем добавления так называемых вазоактивных или активно действующих на слизистую оболочку полости носа субстанций к лекарствам, которые воздействуют на центральную нервную систему, может быть достигнуто значительное повышение эффективности соответствующего лекарства, если лекарство и АДСНС вводятся в виде смеси. Под лежащим в основе изобретения понятием вазоактивных или активно действующих на слизистую полости носа субстанций подразумеваются, в частности, кислородные радикалы или радикалообразователи O2-, H2O2, O2H, их гидратные кластеры или также синглетный кислород 1O2, а также вазоактивные формы NO и биохимические вещества, такие как аргинин, брадикинин, мочевина, которые в контексте изобретения проявляют аналогичное физиологическое действие. Существенным для изобретения является то, что кислородные анион-радикалы вводятся одновременно с лекарством в форме эндоназально вводимой смеси, предпочтительно в жидкой форме. При этом кислородные анион-радикалы или оксид азота в связи с их метастабильным состоянием смешиваются с соответствующим лекарством непосредственно перед введением фармацевтического состава.-2 010692 Образование кислородных анион-радикалов в предлагаемом изобретении возможно путем химического или ферментативного генерирования, например, ксантиноксидазой (Fridovich, I., (1970), "Quantitativeaspects of the production of superoxide anion radical by milk xanthine oxidase." J. Biol. Chem. 245, 4053). Точно так же кислородные анион-радикалы могут быть произведены физически, например, с помощью генератора супероксида (изобретатель: Goldstein N., патент DE 19512228, 1995). Образование NO-продуктов в предлагаемом изобретении возможно путем химического или ферментативного генерирования, например, NO-синтазой. В одной из форм исполнения водный раствор соответствующего лекарства непосредственно перед применением смешивается с соответствующим количеством раствора Н 2 О 2 10-5 моль/л. В завершение,смесь вводится в форме назального спрея или в другой форме доставки. Объем однократной дозируемой единицы назального спрея составляет от 50 до 500 мкл раствора или смеси лекарства и кислородных радикалов как вазоактивных веществ. Преимущественно объем однократной дозируемой единицы назального спрея составляет 100-200 мкл. При этом концентрация перекиси водорода в дозируемой единице составляет от 10-12 до 10-1 моль/л,предпочтительно от 10-8 до 10-2 моль/л и наиболее предпочтительно 10-5 моль/л. Абсолютное количество лекарства в однократной дозируемой единице составляет от 0,0001 до 100 мг, предпочтительно 0,1-10 мг. В одной из других форм исполнения в качестве источника кислородных анион-радикалов применяется смесь из ксантиноксидазы и ксантина. Раствор ксантиноксидазы и ксантина соответствующей активности или концентрации смешивается непосредственно перед введением с раствором соответствующего лекарства. Объем однократной дозируемой единицы назального спрея составляет между 50 и 500 мкл раствора или смеси лекарства и ксантина/ксантиноксидазы. Преимущественно объем однократной дозируемой единицы назального спрея составляет 200 мкл. При этом концентрация ксантиноксидазы составляет между 0,01 и 10 мг/мл, предпочтительно между 0,05 и 5 мг/мл и наиболее предпочтительно между 0,1 и 1 мг/мл. Концентрация ксантина составляет между 0,1 и 100 мг/мл, предпочтительно между 1 и 50 мг/мл и наиболее предпочтительно между 5 и 25 мг/мл. Абсолютное количество лекарства в однократной дозируемой единице составляет от 0,0001 до 100 мг,предпочтительно 10 мг. С учетом множества индивидуальных показателей при лечении болезней центральной нервной системы (индивидуальная фармакокинетика лекарства, причина нарушения и т.д.), точные данные об обычно принятой дозировке какого-либо лекарства могут быть найдены на основе сравнительных величин доз, которые были получены индивидуумом. Эффект нового типа, лежащий в основе предлагаемого изобретения, состоит, среди прочего, в синергетическом, терапевтическом действии вазоактивных веществ, например кислородных анион-радикалов и/или продуктов их превращений или распада, и применяемого лекарства при совместном интраназальном введении, так что доза лекарства, требуемая для достижения определенного эффекта, может быть уменьшена как минимум на 50%. Для достижения лежащего в основе изобретения синергетического эффекта подходящими являются, например, лекарства промедол, метамизол, фенобарбитал, дерморфин, дофамин, метадон, трамадол,виагра или клонидин. Следующие примеры демонстрируют новые эффекты действия комбинации этих вазоактивных веществ, например анион-радикалов кислорода или радикалов азота с соответствующими лекарственными веществами, соответственно предлагаемому изобретению. Были исследованы регуляторные или терапевтические эффекты на соответствующие функции здорового и больного организма животных и/или людей. Пример 1. Следующие эксперименты на крысах показывают, что при эндоназальной аппликации состава из Н 2 О 2 в концентрации 10-5 моль/л (3,410-4 мг/кг веса тела) и глюкозы в дозе 20 мг (то есть 100 мг/кг веса тела) пищевая мотивация у исследуемых животных значительно уменьшилась. Эксперименты были проведены на самцах белых крыс. Животные контрольной группы 1 (n=13) получали дистиллированную воду, животные контрольной группы 2 (n=7) получали раствор глюкозы, и животные опытной группы(n=9) получали состав H2O2+глюкоза. Длительность наблюдений была 17 суток. В первые 11 суток животных подвергали контролируемой частичной пищевой депривации (20 г сухой кормовой смеси на животное). В течение первой недели эксперимента оценивали исходный уровень пищевой мотивации в отсутствие изучаемого препарата. Были исследованы следующие показатели: латентный период (ЛП) подхода к корму после его предоставления, в секундах; время поедания корма, в секундах (Т поедания); число перерывов в приеме корма (Пер.). После второй недели без изменения условий кормления животным вводили препарат 2 раза в день в дозе 20 мкл на животное и продолжали регистрацию всех показателей. После второй недели животных кормили ad libidum. Введение препарата и регистрация показателей оставались при этом без изменений. Результаты исследования приведены в табл. 1 и 2. В этих и других таблицах все результаты приведены как среднеестандартная ошибка.-3 010692 Таблица 1 Показатели пищевой мотивации в контрольных группах 1 и 2 в сравнении с экспериментальной группой до и после введения препарата) =р 0,05; и ) =р 0,01 по сравнению с контрольными группами 1 и 2. Таблица 2 Изменение показателей пищевой мотивации в контрольной группе 1 или контрольной группе 2 и в экспериментальной группе Тестирование до введения препарата минус тестирование после введения препарата) достоверность р 0,05 по отношению к контрольным группам 1 и 2. Результаты показывают, что 4-дневное (2 раза в день) введение состава H2O2+глюкоза ведет к достоверному удлинению латентного периода подходов к корму. Пример 2. Опыты проводились аналогично описанным в примере 1. Животные контрольной группы 1 (n=13) получали дистиллированную воду, животные контрольной группы 2 (n=6) получали раствор глутаминовой кислоты, и животные экспериментальной группы (n=9) получали смесь H2O2+глутаминовая кислота(H2O2 в концентрации 10-5 моль/л или 3,410-4 мг/кг веса тела) и глутаминовую кислоту 10-3 моль/л (или 1,7410-2 мг/кг веса тела). Результаты приведены в табл. 3 и 4. Таблица 3 Показатели пищевой мотивации в контрольных группах 1 или 2 и в экспериментальной группе до и после введения состава H2O2+глутаминовая кислота-4 010692 Таблица 4 Изменение показателей пищевой мотивации в контрольных группах 1 или 2 и в экспериментальной группе Тестирование до введения препарата минус тестирование после введения препарата) достоверность р 0,05 и ) р 0,01 по отношению к контрольным группам. Результаты показали, что введение состава H2O2+глутаминовая кислота приводило к значительному увеличению латентного периода подходов к корму и к укорочению времени кормления. Далее, было показано, что введение смеси кислородных радикалов в форме H2O2 в концентрации 10-5 моль/л и глутаминовой кислоты (10-3 моль/л) проявляет тормозящее действие на пищевую мотивацию опытных животных. Пример 3. На 6 добровольцах было проведено плацебо контролируемое исследование. Испытуемым 2-3 раза в день эндоназально вводили состав H2O2+глюкоза, содержавший 6,810-7 мг H2O2 и 0,01 г глюкозы. Исследование было проведено на здоровых добровольцах обоего пола с повышенной массой тела. Средний возраст испытуемых составил у женщин 49,48,1 лет, у мужчин 52,25,8 лет. Результаты снижения веса тела приведены в табл. 5. Таблица 5 Динамика снижения веса тела у испытуемых (смешанная группа, 4 женщины) как результат эндоназальной аппликации состава H2O2+глюкоза, содержавшего 6,810-7 мг H2O2 и 0,01 г глюкозы) достоверность р 0,05 по отношению к группе плацебо; ) достоверность р 0,05 по отношению к начальному весу тела в данной группе. Результаты показывают, что введение состава H2O2/глюкоза в сравнении с плацебо ведет к подавлению аппетита и закономерному снижению веса тела. Пример 4. Было исследовано антиноцицептивное или болеутоляющее действие промедола (тримеперидин) в результате эндоназальной аппликации комбинации H2O2+промедол. Эксперименты были поставлены на половозрелых самцах беспородных белых крыс. В болевом тесте измеряли величину критического давления (ВКД) на заднюю лапу крысы. Контролируемое давление на лапу в процессе проведения тестаRandal-Selitto создавали с помощью аналгезиметра фирмы Ugo Basile. Примерами для сравнения к заявляемому изобретенному составу служили, с одной стороны, внутрибрюшинное введение промедола без добавления кислородных анион-радикалов и, с другой стороны,внутрибрюшинное введение промедола с дополнительным введением кислородных анион-радикалов, вопервых, путем ингаляции с помощью описанного в патенте DE 4112459 А 1 ингаляционного устройства и, во вторых, путем отдельного эндоназального введения жидкого раствора перекиси водорода в концентрации 10-5 моль/л. В соответствии с заявляемым изобретением введенное лекарство состояло из смеси ксантиноксидаза/ксантин и промедола в дозах 5, 2, 1 и 0,1 мг на кг массы тела животных. Результаты приведены в табл. 6.-5 010692 Таблица 6 Усиление аналгетического действия промедола в комбинации с кислородными радикалами; здесь: продукты реакции ксантиноксидаза/ксантин в сравнении с внутрибрюшинным введением аналгетика без АДСНС (группы II-IV) и с эндоназальным введением АДСНС (группы V-VII) Скорость генерирования супероксида: 0,025 мкМ/мин. Общий объем апплицированной H2O2: 440 мкл (соответствует 4 впрыскам по 110 мкл).) достоверность р 0,05 и ) р 0,01 против исходных значений в каждой данной группе; ) активность ксантиноксидазы 0,79 Ед/мг белка; концентрация гипоксантина 0,1 мМ. Приведенные в табл. 6 результаты (группа VII) демонстрируют более сильно выраженное увеличение болеутоляющей эффективности аналгетика в составе смеси с кислородными анион-радикалами при эндоназальной аппликации в сравнении с эффективностью промедола при парентеральном введении, а также при раздельном действии кислородных анион-радикалов (эндоназально) и аналгетика (внутрибрюшинно). Повышенная эффективность эндоназальной формы раскрывается как в удлинении, так и в усилении болеутоляющего эффекта в 10-50 раз более низкой дозе промедола по сравнению со всеми другими способами применения. Приведенные эксперименты показывают, что кислородные анион-радикалы в комбинации с промедолом потенцируют или сверхаддитивно усиливают болеутоляющий эффект аналгетика. Пример 5. Было изучено усиление терапевтической эффективности аналгетика метамизола. Всего в наблюдениях приняли участие 5 добровольцев. Препарат для эндоназального введения состоял из комбинации перекиси водорода (10-6 моль/л, соответствует дозе 6,810-7 мг) и метамизола (доза 10 мг). Результаты обобщены в табл. 7. У всех пациентов наблюдения проводились спустя 6 ч после последнего применения-6 010692 Таблица 7 Результаты однократного эндоназального применения H2O2+метамизол у 5 пациентов с продолжительными или сильными болями Доза метамизола=10 мг Наблюдения 1-4 подтвердили эффективность способа (при применении) у людей. Наблюдение 5(без эффекта) подтвердило важную роль рецепторов полости носа в эффективности эндоназальных аппликаций лекарств. Это тем более удивительно, что ненаркотический аналгетик метамизол (Dipyron) при назальном применении оказался терапевтически недействующим. У всех пациентов применение метамизола как орально в дозе 500 мг, так и эндоназально в дозе 10 мг без добавления кислородных анион-радикалов было неэффективным. Напротив, в комбинации с кислородными анион-радикалами метамизол проявляет сильно выраженное болеутоляющее действие. Пример 6. Два следующих примера (табл. 8 и 9) демонстрируют эффективность эндоназальных аппликаций нейротрансмиттера дофамина в комбинации с различными вазоактивными веществами: L-аргинином(как биохимическим источником монооксида азота NO), а также перекисью водорода. Следует подчеркнуть, что дофамин при обычных способах введения лекарства не способен проникать через гематоэнцефалический барьер. Таблица 8 Восстановление нарушенной после введения галоперидола (100 мг/кг веса тела) спонтанной активности крыс, вызванное однократной эндоназальной аппликацией дофамина-7 010692 Пример 7. Наблюдали терапевтический эффект от эндоназального введения смеси кислородных анион-радикалов и дофамина у больных с клиническим диагнозом "болезнь Паркинсона" в продвинутых стадиях (стадии 2,0-3,0 по HoehnYahr). Всего в наблюдениях участвовали 3 пациента. Препарат для эндоназального введения представлял собой комбинацию перекиси водорода (10-7 моль/л) с дофамином (1 мг). На день клинического наблюдения все пациенты проводили регулярную стандартную терапию болезни. Результаты этих наблюдений обобщены в табл. 9. Таблица 9 Результаты наблюдений терапевтического действия однократного применения препарата Значки +, ,иобозначают очень плохую, плохую, хорошую и очень хорошую функции. В DE-PS 19708643 описано умеренное терапевтическое действие эндоназальных аппликаций супероксида или перекиси водорода у пациентов с дрожательным параличом (болезнь Паркинсона). Позднее было установлено, что лечебный эффект кислородных анион-радикалов наблюдается, преимущественно,у пациентов в начальных стадиях заболевания (стадии 1,0-1,5 по HoehnYahr). Дополнительно, в DE 19708643 было установлено, что лечебный эффект собственно АДСНС развивается лишь после 10-20 дневного лечения. Напротив, при применении данного изобретения положительный лечебный эффект у всех пациентов возникает в течение нескольких минут после воздействия и сохраняется заметным субъективно или объективно (для врача) в течение от 6 до 72 ч. Пример 8. Пациентка: 61 год; клинический диагноз: адинамическая депрессия с явлениями печального настроения. Основные клинические симптомы: апатия, печальное настроение, тревога, враждебность по отношению к членам семьи. Проводившееся лечение: антидепрессанты амитриптилин, дезипрамин, мапротилин,а также кавазедон и др. Установлен нерегулярный прием лекарств вследствие плохой переносимости. Вследствие сохраняющегося ухудшения состояния было предпринято эндоназальное введение(спрей) состава "H2O2+триптофан" с концентрацией триптофана 0,1 мг и Н 2 О 2 3,410-4 мг. Всего в течение 2 дней было проведено ежедневно по 2 эндоназальных введения спрея по 200 мкл в каждый носовой ход. Результат: через 4 ч после первой аппликации пациентка отметила субъективное улучшение психического состояния. На вторые и третьи сутки были установлены субъективно и объективно (врачом) очевидные положительные изменения. Все основные клинические симптомы заболевания практически исчезли. Пациентка сообщила о повышении работоспособности, улучшении настроения и снижении негативных эмоций. В течение последующего 3-недельного лечения эндоназальные аппликации проводились 1 раз в неделю. Отмеченное улучшенное состояние сохранялось в течение 30-дневного периода наблюдений. Побочные эффекты отмечены не были. Пример 9. Исследовали усиление аналитического действия дерморфина в комбинации с ксантиноксидазой/ ксантином в сравнении с известными внутрибрюшинным и эндоназальным методами применения дерморфина (табл. 10). Эксперименты были проведены на самцах белых беспородных крыс. Аналгезирующую активность исследовали методом отдергивания хвоста (tail flick reflex). Реакцию регистрировали спустя 1 ч после введения препаратов. Таблица 10-8 010692 Результаты показывают, что образующая кислородные анион-радикалы смесь ксантиноксидазы/ ксантина в комбинации с олигопептидом 9 DAFGYPS-NH2 (дерморфин) при эндоназальном введении значительно усиливают антиноцицептивное (аналгезирующее) действие аналгетика. Пример 10. Известно применение фенобарбитала для лечения эпилепсии. Недостатками этого лечения являются нежелательные побочные эффекты, как, например, повышение активности Р-450 в печени и модификация метаболизма многих лекарств, а также тошнота, головокружение и др. Обычным образом фенобарбитал вводится в дозе около 100 мг. Было изучено действие фенобарбитала при эндоназальном применении на белых половозрелых мышах. Сравнивали седативное и снотворное действие эндоназальной аппликации фенобарбитала без кислородных анион-радикалов с аппликацией комплекса глюкозооксидаза/глюкоза+фенобарбитал. Результаты приведены в табл. 11. Таблица 11 Усиление снотворного действия фенобарбитала в комбинации с глюкозооксидазой/глюкозой в сравнении с эндоназальной аппликацией чистого фенобарбитала) =р 0,01. Ферментативная активность глюкозооксидазы=0,66 I.E./мг; концентрация глюкозы=0,15 мМ. Пример 11. Было изучено предотвращение эпилептического припадка в начальной фазе у 19-летнего пациента с клиническим диагнозом идиопатическая эпилепсия. Симптомы, предшествующие приступу, включали повышенную возбудимость/раздражительность, признаки тонического напряжения мышц, непроизвольное мочеиспускание. Как правило, перечисленные признаки неизбежно приводили у данного пациента к развитию большого эпилептического припадка. Пациенту двукратно с интервалом в 3 мин вводили эндоназально состав из Н 2 О 2+фенобарбитал. Эффективные дозы фенобарбитала составляли в каждом случае 10 мг. Результат: спустя 3 мин после второй аппликации смеси исчезли признаки тонического напряжения мышц. Позывы к мочеиспусканию прекратились. Развилась умеренная сонливость. В течение 3 последующих суток эпилептический приступ не наступил. Пример 12. Известно, что применяемые обычно у больных мигренью лекарства, такие как эрготамин, метилсергид, трициклические антидепрессанты, карбамазепин, суматриптан и др., могут вызывать различные побочные эффекты, например тошноту, рвоту, головокружение, тремор, сонливость, кожные реакции и др. В приведенном примере были предприняты клинические опыты с целью предотвращения приступов мигрени в начальной фазе у двух пациенток в возрасте 36 и 28 лет, обе с клиническим диагнозом мигрень. Характерные симптомы, предшествовавшие приступу, были аура (у одной пациентки), нарастающие односторонние головные боли, тошнота. Развитие перечисленных симптомов у этих пациенток неизбежно приводило к приступу мигрени. Пациенткам эндоназально вводили состав H2O2+фенобарбитал. Эффективная доза фенобарбитала составляла в каждом случае 10 мг. Результат: около 5 мин после аппликации обе пациентки сообщили об ослаблении перечисленных признаков приступа мигрени. В течение последующих 72 ч новые приступы мигрени у этих пациенток не развились. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическое средство эндоназального применения для лечения болезней и нарушений центральной нервной системы, представляющее собой смесь, содержащую биологически активные вещества, действующие на центральную нервную систему, и вещества, действующее на слизистую оболочку носа, в качестве которых используют кислородные анион-радикалы и/или активные продукты оксида азота. 2. Фармацевтическое средство по п.1, отличающееся тем, что в качестве веществ, действующих на слизистую оболочку носа, используют пергидроксилрадикалы, перекись водорода, гидропероксидные-9 010692 радикалы или их гидратные кластеры. 3. Фармацевтическое средство по п.1, отличающееся тем, что в качестве веществ, действующих на слизистую оболочку носа, используют формы моноксида азота (NO) и их предшественники или продукты превращений. 4. Фармацевтическое средство по п.1, отличающееся тем, что в качестве веществ, действующих на слизистую оболочку носа, используют биохимические, физиологические вазодилататоры, преимущественно аргинин, брадикинин, мочевину или производные (дериваты) эйкозотриеновой кислоты. 5. Фармацевтическое средство по п.1, отличающееся тем, что концентрация веществ, действующих на слизистую оболочку носа, составляет от 10-12 до 10-1 моль/л, преимущественно 10-5 моль/л. 6. Фармацевтическое средство по п.1, отличающееся тем, что в качестве биологически активных веществ, действующих на центральную нервную систему, используют лекарственные средства или метаболиты. 7. Фармацевтическое средство по п.6, отличающееся тем, что содержит лекарственные средства в дозе от 0,001 до 100 мг в одной дозируемой единице. 8. Фармацевтическое средство по п.6, отличающееся тем, что содержит метаболиты в дозе от 0,0001 до 100 мг в одной дозируемой единице. 9. Фармацевтическое средство по п.6, отличающееся тем, что в качестве лекарственных средств используют промедол, метамизол, фенобарбитал, метадон, трамадол, ацетилсалициловую кислоту или силденафил. 10. Фармацевтическое средство по п.6, отличающееся тем, что в качестве метаболитов используют триптофан, гамма-аминомасляную кислоту, окситоцин, дерморфин, циклический АМФ, глюкозу, дофамин или L-ДОПА. 11. Фармацевтическое средство по п.1, отличающееся тем, что биологически активные вещества,действующие на центральную нервную систему, содержатся в составе липосом и/или наносом. 12. Фармацевтическое средство по п.1, отличающееся тем, что дополнительно содержит фармацевтически приемлемые вспомогательные вещества. 13. Фармацевтическое средство по п.12, отличающееся тем, что в качестве вспомогательных веществ используют стабилизаторы, антиоксиданты, регуляторы рН, осморегуляторы и антимикробные вещества. 14. Фармацевтическое средство по п.1, отличающееся тем, что оно представляет собой спрей.
МПК / Метки
МПК: A61K 45/08, A61K 47/16, A61K 47/08
Метки: эндоназального, применения, нарушений, болезней, фармацевтическое, центральной, лечении, средство, нервной, системы
Код ссылки
<a href="https://eas.patents.su/11-10692-farmacevticheskoe-sredstvo-dlya-endonazalnogo-primeneniya-pri-lechenii-boleznejj-i-narushenijj-centralnojj-nervnojj-sistemy.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическое средство для эндоназального применения при лечении болезней и нарушений центральной нервной системы</a>
Предыдущий патент: Комбинация дерамциклана и опиоидов в качестве обезболивающего средства
Следующий патент: 1,3-диметилбутилкарбоксанилиды для борьбы с нежелательными микроорганизмами
Случайный патент: Применение (е)-5-(4-хлорбензилиден)-2, 2-диметил-1-(1н-1,2,4-триазол-1- илметил)циклопентанола для борьбы со ржавчиной на растениях сои