Соединения азаиндазола и способы применения
Номер патента: 17278
Опубликовано: 30.11.2012
Авторы: Ли Уандонг, Пеннелл Эндрю М.К., Лелети Манмохан Р., Ксу Юань, Чен Вей, Ли Лианфа, Райт Джон Дж.Ким, Чжанг Пенгли
Формула / Реферат
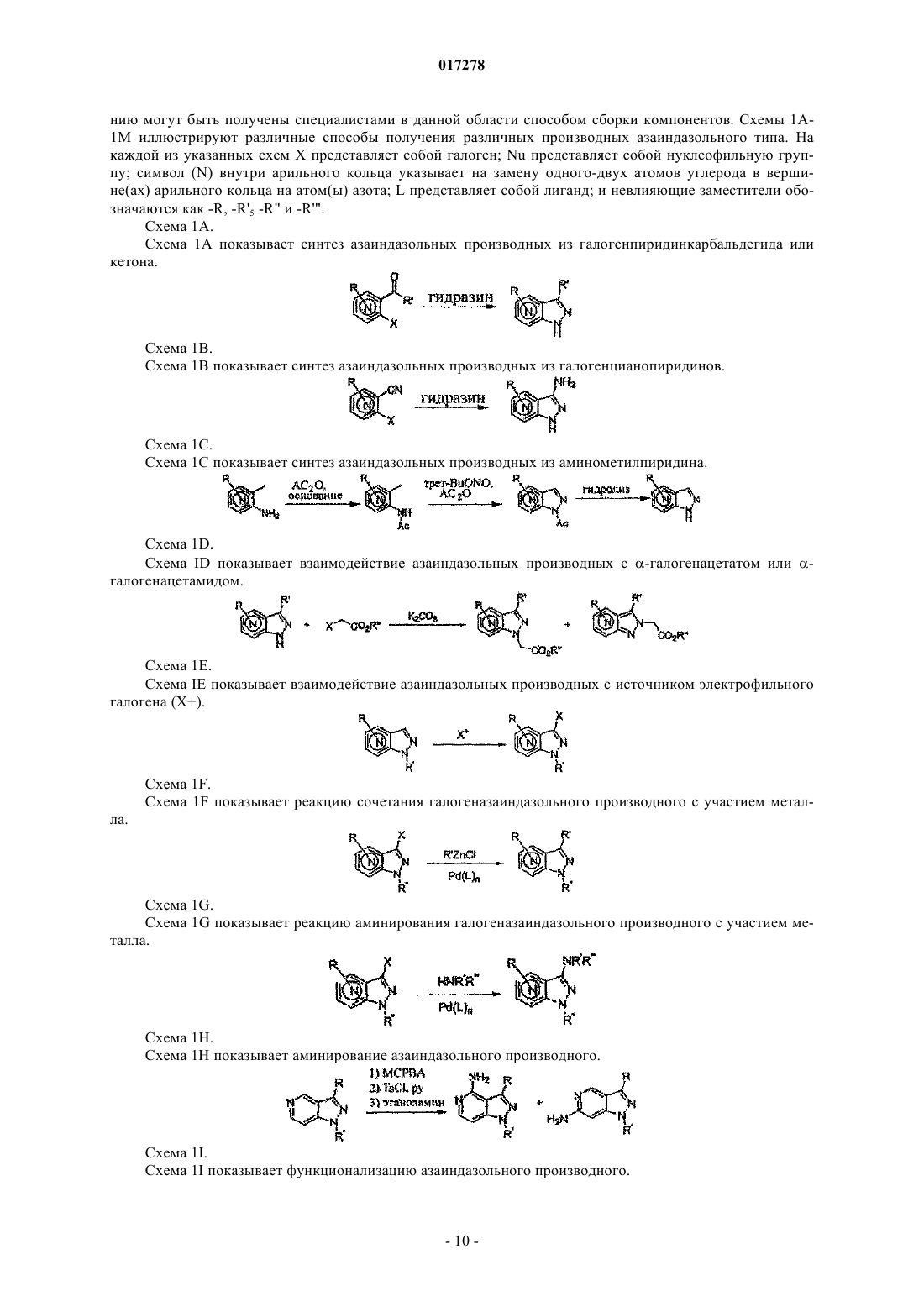
1. Соединение, имеющее формулу, выбранную из группы, состоящей из
или его фармацевтически приемлемая соль, гидрат или N-оксид, где
m является целым числом от 0 до 2;
R1 представляет собой C1-8-алкил; каждый R2a, R2c и R2d независимо выбирают из группы, состоящей из водорода, галогена, циано, -NO2, -CO2Rc, -CONRcRd, -C(O)Rc, -S(O)Re, -S(O)2Re, -S(O)3Rc, -Re, -ORc, -SRc, -NRdC(O)Rc,
-NRdC(O)2Rc, -S(O)2NRcRcRd, -NRc-C(O)NRcRd, -NH-C(NH2)=NH, -NReC(NH2)=NH, NH-C(CH2)=NRe, -NH-C(NHRe)=NH, -NReC(NHRe)=NH, -NReC(NH2)=NRe, -NH-C(NHRc)=NRe, NH-C(NReRc)=NH, -NRcS(O)2Re,
-OC(O)Rc и -NRcRd, где
в каждом из R2a, R2c и R2d каждый Rc и Rd независимо выбирают из водорода, C1-8-алкила, C1-8-галогеналкила и C3-6-циклоалкила и каждый Re независимо выбирают из группы, состоящей из C1-8-алкила, C1-8-галогеналкила, С3-6-циклоалкила;
каждую из вершин кольца а, b, c и d в формулах Ia и Ib независимо выбирают из N и C(R3a) и одна-две вершины кольца представляют собой N; а
R3a независимо выбирают из группы, состоящей из водорода, галогена, -ORf, -OC(O)Rf, -NRfRg, -SRf, -Rh,
-CN, -NO2, -CO2Rf, -CONRfRg, -C(O)Rf, -OC(O)NRfRg, -NRgC(O)Rf, -NRgC(O)2Rh, -NRf-C(O)NRfRg, -NH-C(NH2)=NH, -NRhC(NH2)=NH, -NH-C(NH2)=NRh, -NH-C(NHRh)=NH, -C(=NRf)NRgRh, -S(O)3Rf, -S(O)Rh,
-S(O)2Rh, -S(O)3Rh, -NRfS(O)2Rh, -S(O)2NRfRg, -NRfS(O)2Rh, -NRfS(O)2NRfRg, -N3, -C(C=NORf)NRfRg,
-X3SO3Rf, -X3ORf, -X3NRfRg, -Y, -X3N3, где Y выбирают из группы, состоящей из гомопиперидинила, морфолинила, тиоморфолинила, пирролидинила, пиперидинила, азетидинила, пиранила, тетрагидрофуранила, пиперазинила, фенила, тиенила, фуранила, пиридила, пиримидинила, пиразинила, пирролила, пиридизинила, пиразолила, имидазинила, тиазолила, оксазолила, изоксазолила, изотиазолила, триазолила, тетразолила и оксадиазолила, которые необязательно замещены 1-3 заместителями, независимо выбранными из группы, состоящей из галогена -ORf, -NRfRg, - CORf, -CO2Rf, -CONRfRg, -NO2, -Rh и -CN, где каждый Rf и Rg независимо выбирают из группы, состоящей из водорода, C1-8-алкила, C1-8-галогеналкила и C3-6-циклоалкила; и каждый Rh независимо выбирают из группы, состоящей из C1-8-алкила, C1-8-галогеналкила и C3-6-циклоалкила и где X3 представляет собой C1-4-алкилен.
2. Соединение по п.1, где в формуле Ib, когда R2a представляет собой Н, R2c представляет собой хлор, R2d представляет собой метокси, m равен 0, а равен N, с равен СН или N, и b и d представляют собой СН, тогда R3a не является водородом, метилом, незамещенным 2-пиридилом, незамещенным 2-пиримидинилом или незамещенным 2-оксазолилом.
3. Соединение по п.1, где конденсированное шестичленное кольцо, имеющее вершины а, b, с и d, представляет собой конденсированное кольцо пиридина, конденсированное кольцо пиримидина или его N-оксид.
4. Соединение по п.1, где конденсированное шестичленное кольцо, имеющее вершины а, b, c и d, представляет собой конденсированное кольцо пиридина или его N-оксид.
5. Соединение по п.1, где конденсированное шестичленное кольцо, имеющее вершины а, b, c и d, представляет собой конденсированное пиримидиновое кольцо или его N-оксид.
6. Соединение по п.1, где конденсированное шестичленное кольцо, имеющее вершины а, b, c и d, представляет собой конденсированное пиразиновое кольцо или его N-оксид.
7. Соединение по п.1, где конденсированное шестичленное кольцо, имеющее вершины а, b, c и d, представляет собой конденсированное пиридазиновое кольцо или его N-оксид.
8. Соединения по пп.1 или 3-7, где каждый заместитель R3a независимо выбирают из группы, состоящей из водорода, галогена, -ORf, -NRfRg, -C(O)Rf, -C(O)ORf, -S(O)Rf, -S(O)2Rf, -S(O)3Rf, -S(O)3Rh, -X3C(O)2Rf, X3S(O)3Rf, -S(O)2NRfRg, -X3S(O)2NRfRg, -Rh, -CN, X3NRfRg, NRgC(O)Rf, X3N3 и Y, где Y представляет собой пяти-шестичленное арильное, пяти-шестичленное гетероарильное кольцо или трех-восьмичленное гетероциклоалкильное кольцо, выбранное из группы, состоящей из гомопиперидинила, морфолинила, тиоморфолинила, пирролидинила, пиперидинила, азетидинила, пиранила, тетрагидрофуранила, пиперазинила, фенила, пиридила, оксазолила, пиримидинила, оксадиазолила, имидазолила, пиразолила, триазолила и тиазолила, необязательно, замещенного одним-тремя заместителями, выбранными из группы, состоящей из галогена, -ORf, -NRfRg, -Rh, -CN, где каждый Rf и Rg независимо выбирают из числа водорода, C1-6-алкила, C1-6-галогеналкила и C3-6-циклоалкила, и каждый Rh независимо выбирают из группы, состоящей из C1-6-алкила, C1-6-галогеналкила и C3-6-циклоалкила.
9. Соединение по п.1, где а представляет собой N, а каждый b, с и d представляет собой C(R3a).
10. Соединение по п.1, где а и с представляют собой N, а каждый b и d представляет собой C(R3a).
11. Соединение по пп.1, 9 или 10, где m равно 0-1.
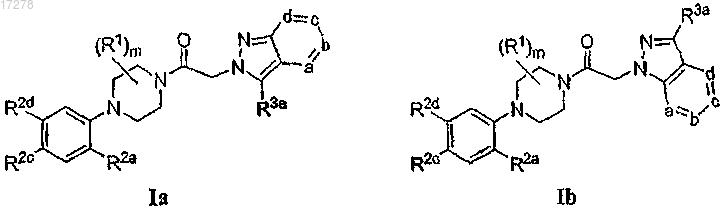
12. Соединение по п.9, имеющее формулу Ib.
13. Соединение по п.10, имеющее формулу Ib.
14. Соединение по пп.1, 10 или 11, где одна из указанных групп R3a представляет собой -Y, где Y выбран из группы, состоящей из фенила, пиридила, пиримидинила, тиазолила, оксазолила и оксадиазолила, каждый из которых необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, -ORf, -NRfRg, -CORf, -CO2Rf, -CONRfRg, -NO2, -Rh и -CN, где каждый Rf и Rg независимо выбирают из группы, состоящей из Н, C1-8-алкила, C3-6-циклоалкила и C1-8-галогеналкила, и каждый Rh независимо выбирают из группы, состоящей из C1-8-алкила, C3-6-циклоалкила и C1-8-галогеналкила.
15. Соединение по п.1, где m равно 0 или 1 и R2a представляет собой водород.
16. Соединение по п.1, где R2a выбирают из группы, состоящей из водорода, F, Cl, Br и I.
17. Соединение по п.1, где группа R3a, фрагмент у пиразольного кольца, представляет собой водород, галоген, хлор, фтор, бром, оксазолил, пиридил, пиримидинил, оксадиазолил, тиазолил, -Rh или циано.
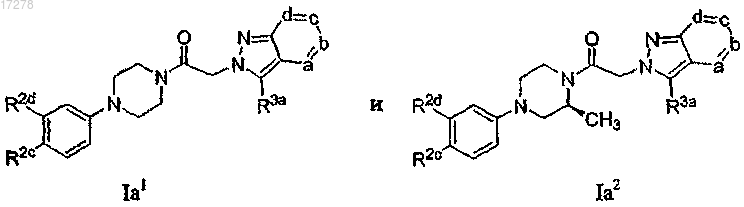
18. Соединение по п.1, где R1 представляет собой метил и m равно 0-2.
19. Соединение по п.1 или 15, где по меньшей мере один из указанных заместителей R3a выбирают из группы, состоящей из галогена, C1-4-алкила и C1-4-галогеналкина, где алифатические части необязательно замещены 1-3 заместителями, выбранными из группы, состоящей из -ОН, -ORo, -OC(O)NHR°, -OC(O)N(R°)2, -SH, -SR°, -S(O)R°, -S(O)2R°, -SO2NH2, -S(O)2NHR°, -S(O)2N(R°)2, -NHS(O)2R°, -NR°S(O)2R°, -C(O)NH2,
-C(O)NHR°, -C(O)N(R°)2, -C(O)R°, -NHC(O)R°, -NR°C(O)R°, - NHC(O)NH2, -NR°C(O)NH2, -NR°C(O)NHR°,
-NHC(O)NHR°, -NR°C(O)N(R°)2, -NHC(O)N(R°)2, -CO2H, -CO2R°, -NHCO2R°, -NR°CO2R°, -CN, -NO2 -NH2,
-NHR°, -N(R°)2, -NR°S(O)NH2 и -NR°S(O)2NHR°, где каждый R° представляет собой независимо незамещенный C1-6-алкил.
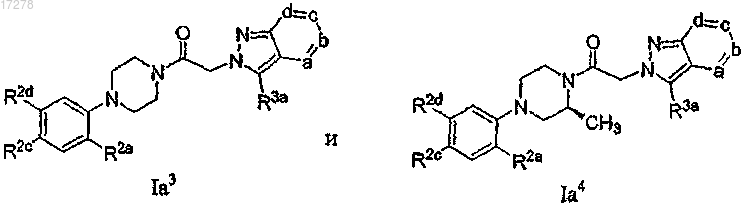
20. Соединение по п.1 или 19, где R2c выбирают из группы, состоящей из F, Cl, Br, CN, NO2, -СО2СН3,
-С(О)СН3 и -S(O)2CH3.
21. Соединение по п.1 или 20, где R2d выбирают из группы, состоящей из -SRc, -O-X2-ORc, -X2-ORc,
-OC(O)Rc, -NRcRd, -Re и -ORc.
22. Соединение по п.1, где каждый R2c и R2d независимо выбирают из группы, состоящей из водорода, галогена F, Cl, Br, I и ORc.
23. Соединение по п.13, имеющее формулу, выбранную из группы, состоящей из
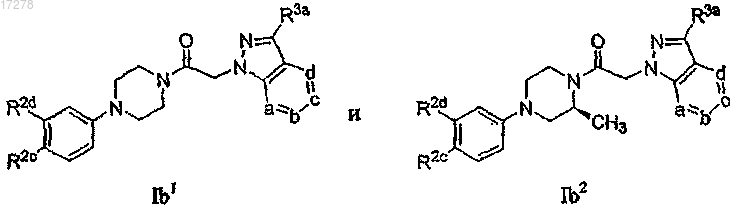
или его N-оксид, где в указанных формулах R2c представляет собой галоген, циано или нитро; R2d выбирают из числа -SRc, -OX2-ORc, -X2-ORc, -Re, -ORc и -NRdC(O)Rc; каждую из вершин кольца a, b, с и d независимо выбирают из числа N и C(R3a), и одна-две из указанных вершин кольца представляет собой N; и каждый R3a независимо выбирают из группы, состоящей из водорода, галогена, C3-6-гетероциклоалкила, -S(O)2Rh, C1-6-алкила, C1-6-галогеналкила, C3-6-циклоалкила, амино, морфолинила, фенила, пиридила, пиримидинила, оксазолила, оксадиазолила, изоксазолила и тиазолила.
24. Соединение по п.23, где вершина кольца а представляет собой N.
25. Соединение по п.23, где вершина кольца b представляет собой N.
26. Соединение по п.23, где вершина кольца с представляет собой N.
27. Соединение по п.23, где вершина кольца d представляет собой N.
28. Соединение по п.13, имеющее формулу, выбранную из группы, состоящей из
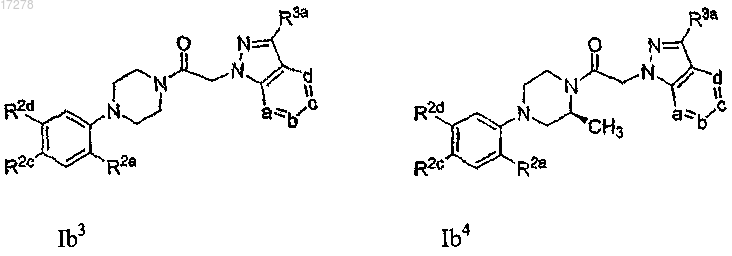
или его N-оксид; где R2c представляет собой галоген, циано или нитро; R2d выбирают из числа -SRc, -O-X2-ORc, -X2-ORc, -Re, -ORc, -NRcRd, -NRcS(O)2Re и -NRdC(O)Rc; R2a выбирают из группы, состоящей из F, Cl, Br, I, -CO2Me, -CONH2, CN, оксазолила, -CH2NH2, -CH2NHMe, -CH2NMe2 и -CH=N-OH; каждую из вершин кольца а, b, с и d независимо выбирают из числа N и C(R3a), и одна-две из указанных вершин кольца представляет собой N; и каждый R3a независимо выбирают из группы, состоящей из водорода, галогена,
C1-6-алкила, C1-6-галогеналкила, C3-6-циклоалкила, -S(O)2Rh, амино, морфолинила, фенила, пиридила, пиримидинила, оксадиазолила, оксазолила, изоксазолила и тиазолила.
29. Соединение по п.28, где вершина кольца а представляет собой N.
30. Соединение по п.28, где вершина кольца b представляет собой N.
31. Соединение по п.28, где вершина кольца с представляет собой N.
32. Соединение по п.28, где вершина кольца d представляет собой N.
33. Соединение по п.12, имеющее формулу, выбранную из группы, состоящей из
или его N-оксид; где в указанных формулах R2c представляет собой галоген, циано или нитро; R2d выбирают из числа -SRc, -O-X2-ORc, -X2-ORc, -Re, -ORc и -NRdC(O)Rc; каждую из вершин кольца а, b, c и d независимо выбирают из числа N и C(R3a), и одна-две из указанных вершин кольца представляет собой N; и каждый R3a независимо выбирают из группы, состоящей из водорода, галогена, C1-6-алкила, C1-6-галогеналкила, C3-6-циклоалкила, -S(O)2Rh, амино, морфолинила, фенила, пиридила, пиримидинила, оксазолила, оксадиазолила, изоксазолила и тиазолила.
34. Соединение по п.33, где вершина кольца а представляет собой N.
35. Соединение по п.33, где вершина кольца b представляет собой N.
36. Соединение по п.33, где вершина кольца с представляет собой N.
37. Соединение по п.33, где вершина кольца d представляет собой N.
38. Соединение по п.12, имеющее формулу, выбранную из группы, состоящей из
или его N-оксид; где в указанных формулах R2c представляет собой галоген, циано или нитро; R2d выбирают из числа -SRc, -O-X2-ORc, -X2-ORc, -Re, -ORc и -NRdC(O)Rc; R2a выбирают из группы, состоящей из F, Cl, Br, I, -CO2Me, -CONH2, CN, оксазолила, -CH2NH2, -CH2NHMe, -CH2NMe2 и -CH=N-OH; каждую из вершин кольца а, b, c и d независимо выбирают из числа N и C(R3a), и одна-две из указанных вершин кольца представляет собой N; и каждый R3a независимо выбирают из группы, состоящей из водорода, галогена,
C1-6-алкила, C1-6-галогеналкила, C3-6-циклоалкила, -S(O)2Rh, амино, морфолинила, фенила, пиридила, пиримидинила, оксазолила, оксадиазолила, изоксазолила и тиазолила.
39. Соединение по п.38, где вершина кольца а представляет собой N.
40. Соединение по п.38, где вершина кольца b представляет собой N.
41. Соединение по п.38, где вершина кольца с представляет собой N.
42. Соединение по п.38, где вершина кольца d представляет собой N.
43. Соединение по п.1, где указанное соединение выбирают из группы соединений, включающей
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1-илэтанон
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-2-илэтанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-хлорпиразоло[3,4-b]пиридин-2-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(пиразоло[3,4-b]пиразин-1-ил-7-оксид)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(пиразоло[3,4-b]пиразин-1-ил-7-оксид)этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[3,4-b]пиридин-1-илэтанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[3,4-b]пиридин-2-илэтанон,
2-(3-аминопиразоло[3,4-b]пиридин-1-ил)-1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-хлорпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-метилпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-b]пиридин-2-илэтанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-b]пиридин-1-илэтанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[4,3-с]пиридин-1-илэтанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-2-илэтанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-пиридин-2-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-тиазол-2-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-b]пиридин-1-илэтанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-b]пиридин-2-илэтанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-метилпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-оксазол-2-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-фторпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-оксазол-2-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-2-илэтанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-1-илэтанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-b]пиридин-1-илэтанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-тиазол-2-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-пиридин-2-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-метилпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-метилпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-тиазол-2-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-{2-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил}-1Н-пиразоло[3,4-b]пиридин-3-карбонитрил,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(пиразоло[3,4-b]пиридин-1-ил-2-оксид)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-метилпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-метилпиразоло[3,4-b]пиридин-2-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-морфолин-4-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-1-илэтанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(пиразоло[3,4-с]пиридин-1-ил-6-оксид)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-хлорпиразоло[4,3-с]пиридин-2-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-иодпиразоло[3,4-b]пиридин-2-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-иодопиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-метансульфонилпиразоло[3,4-b]пиридин-1-ил)этанон,
2-(3-азидометилпиразоло[3,4-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,
(1-{2-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил}-1Н-пиразоло[3,4-b]пиридин-3-ил)метансульфоновая кислота,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(5-хлорпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-хлорпиразоло[3,4-d]пиримидин-2-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-хлорпиразоло[3,4-d]пиримидин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-метоксипиразоло[3,4-d]пиримидин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-хлорпиразоло[3,4-b]пиридин-2-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-хлорпиразоло[3,4-b]пиридин-1-ил)этанон,
2-(6-азидопиразоло[3,4-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,
2-(6-аминопиразоло[3,4-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,
2-(7-азидопиразоло[3,4-с]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,
2-(7-аминопиразоло[3,4-с]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-оксазол-2-илпиразоло[3,4-b]пиридин-2-ил)этанон,
2-(5-амино-3-метилпиразоло[3,4-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-метил-5-нитропиразоло[3,4-b]пиридин-1-ил)этанон,
2-(3-амино-6-метилпиразоло[3,4-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-[1,2,4]оксадиазол-3-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-{2-[4-(4-хлоро-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил}-N-гидрокси-1H-пиразоло[3,4-b]пиридин-3-карбоксамидин,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-[1,2,4]оксадиазол-3-илпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-[3-(5-метил[1,2,4]оксадиазол-3-ил)пиразоло[3,4-b]пиридин-1-ил]этанон,
N-(1-{2-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил}-1Н-пиразоло[3,4-b]пиридин-6-ил)ацетамид,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-метансульфонилпиразоло[3,4-b]пиридин-1-ил)этанон,
2-(3-аминометилпиразоло[3,4-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,
1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-иодпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-иодпиразоло[3,4-b]пиридин-1-ил)этанон,
1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-(3-оксазол-2-илпиразоло[3,4-b]пиридин-1-ил)этанон,
или их фармацевтически приемлемых солей и N-оксидов.
44. Соединение по п.1, где указанное соединение выбирают из группы соединений, включающей
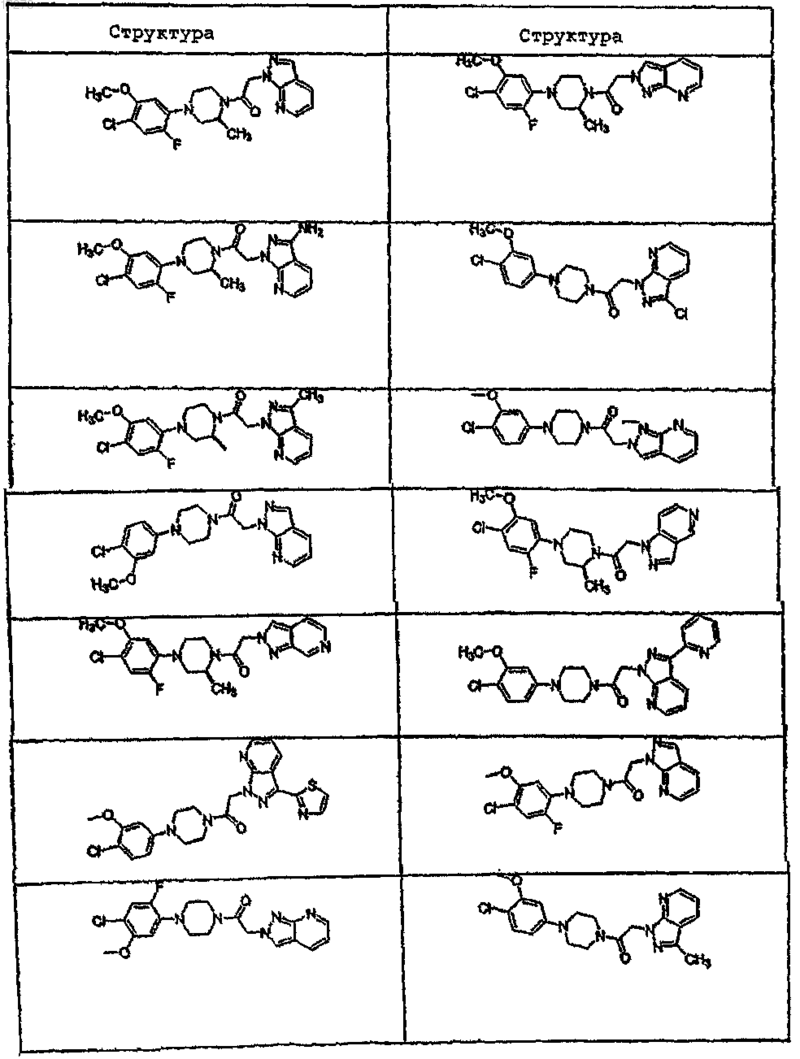
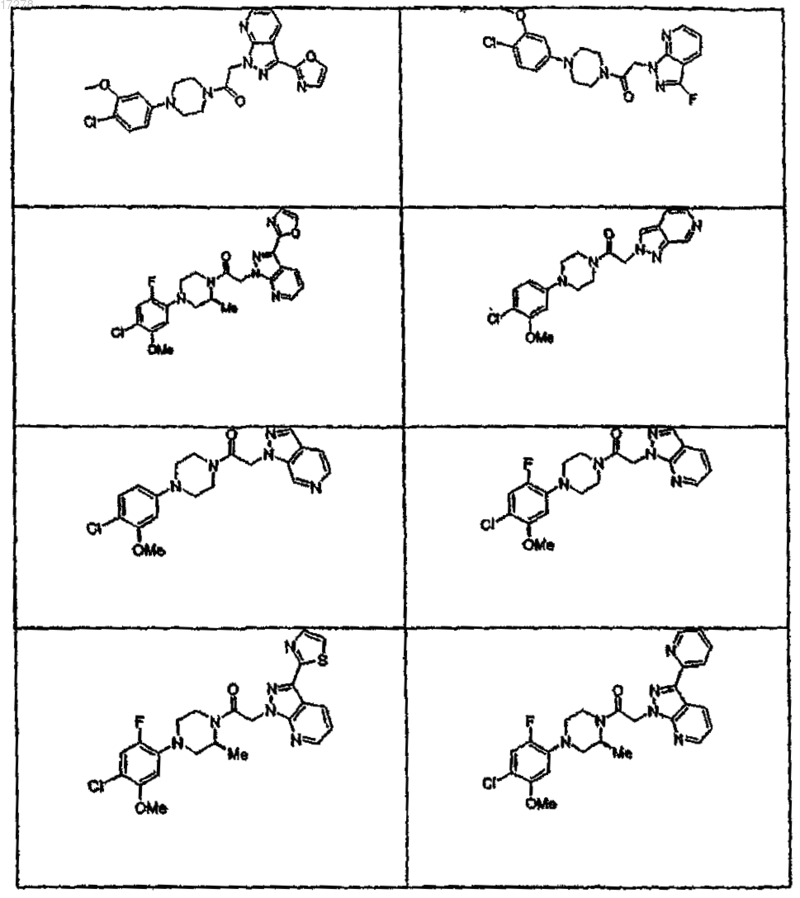
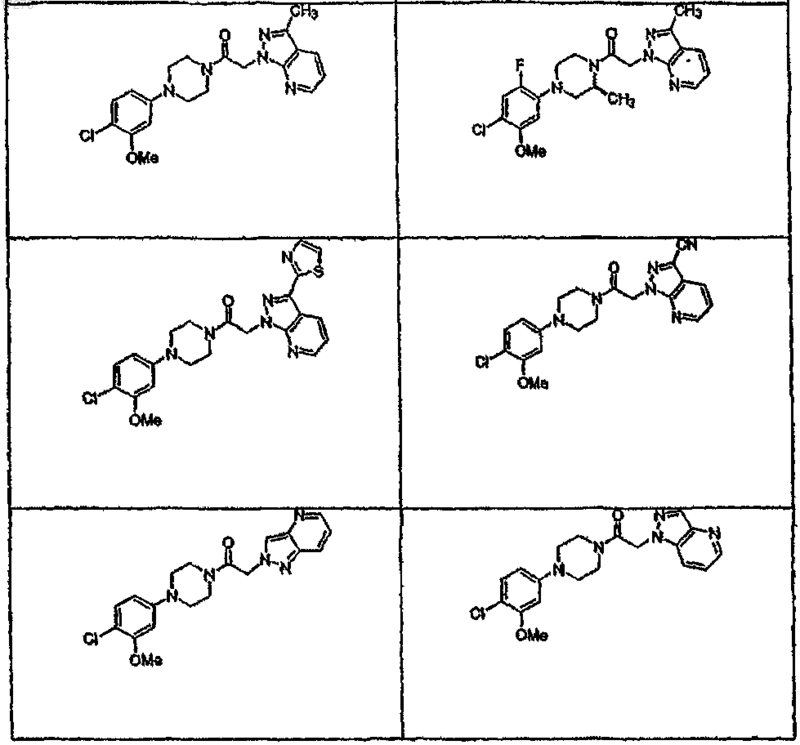
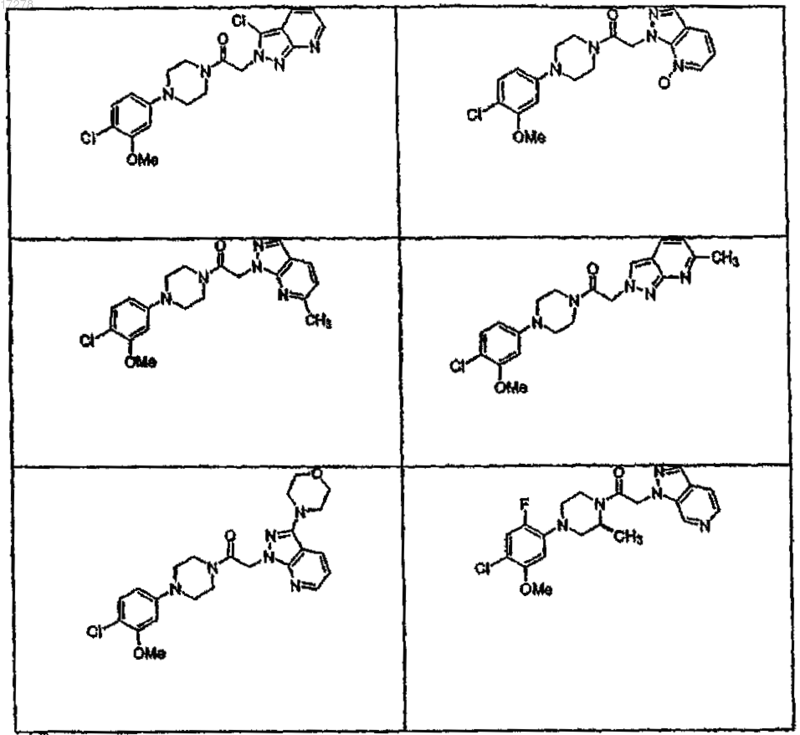
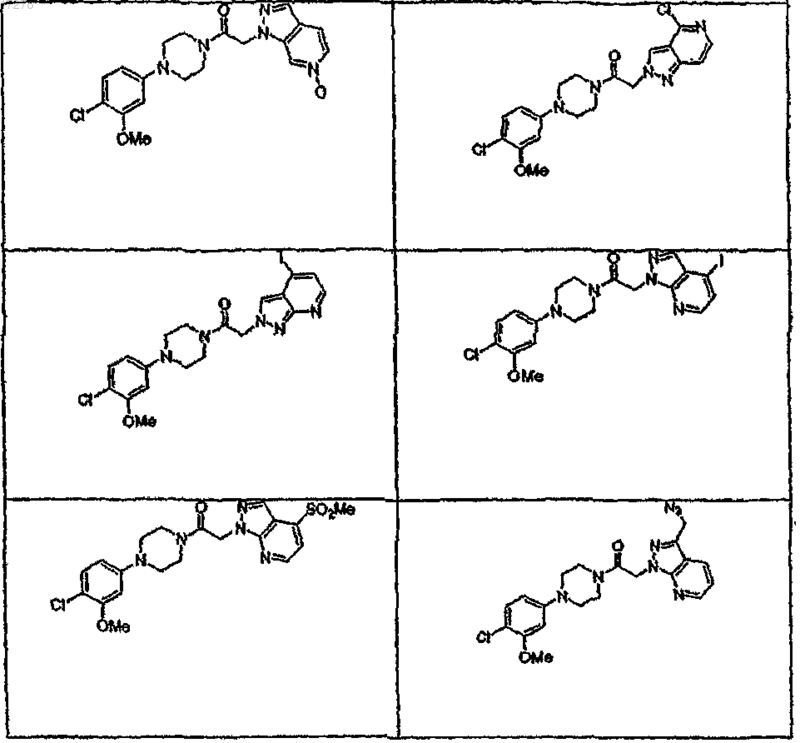

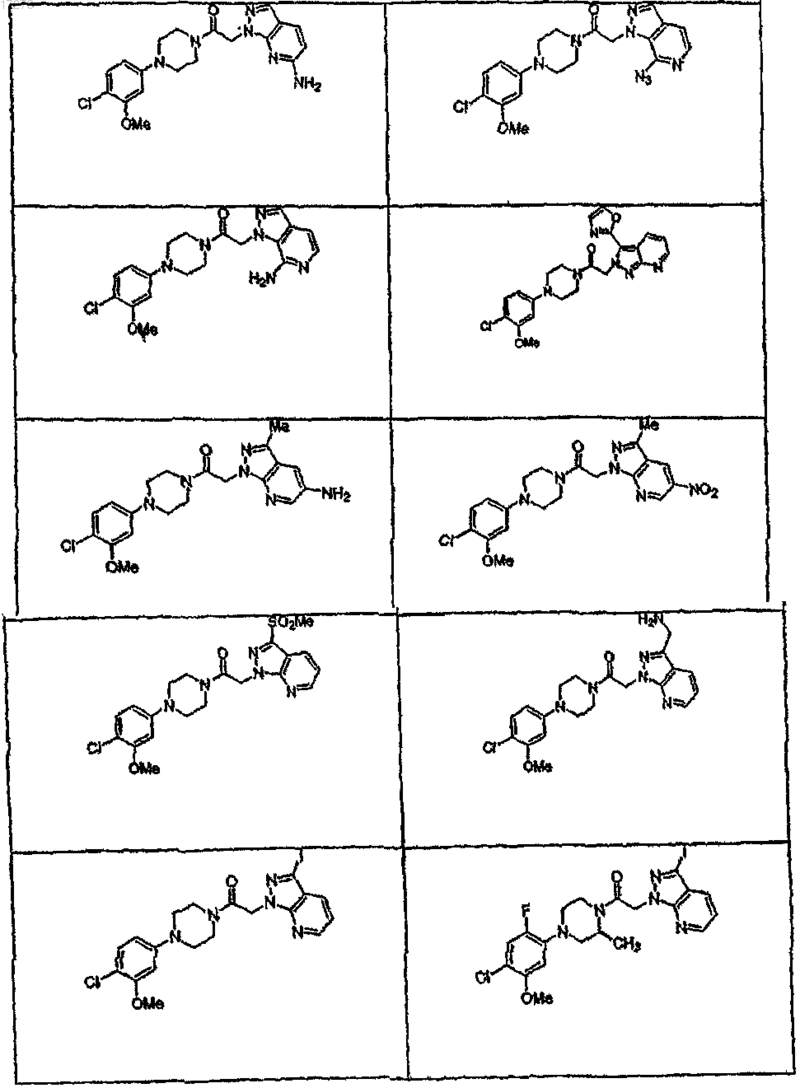
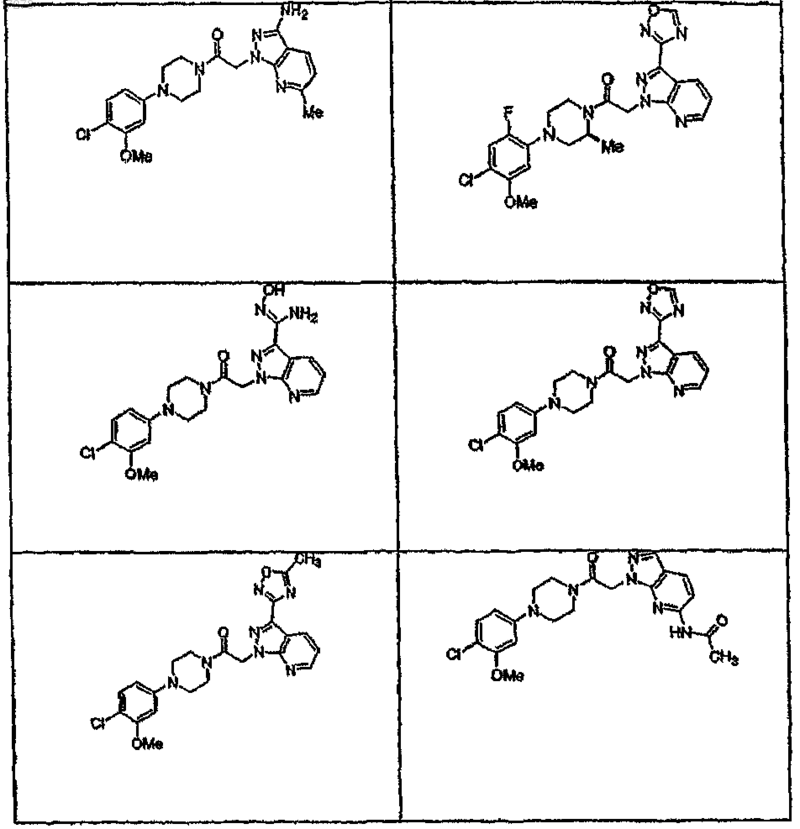
45. Соединение по п.1, где R3a выбирают из группы, состоящей из водорода, галогена, ORf, -NRfRg, -Rh, -Y,
-CN, X3N3, SO2Rh, X3NRfRg, X3Y, -S(O)3Rf, -C(C=NORf)NRfRg, -NO2 и NRgC(O)Rf, где Y представляет собой необязательно замещенную группу, выбранную из группы, состоящей из фенила, пиридила, пиримидинила, оксазолила, тиазолила, оксадиазолила и морфолинила, и Rh представляет собой необязательно замещенную группу, выбранную из группы, состоящей из C1-8-алкила, C1-8-галогеналкила и C3-8-циклоалкила, и каждый Rf и Rg независимо является необязательно замещенной группой, выбранной из группы, состоящей из водорода, C1-8-алкила, C1-8-галогеналкила и C3-8-циклоалкила.
46. Соединение по п.45, где R3a выбирают из группы, состоящей из водорода, фтора, хлора, брома, иода, амино, -CH3, оксазолила, тиазолила, пиридила, пиримидинила, морфолинила, оксодиазолила, -NHC(O)CH3,
-CN, CH2N3, CH2SO3H, NO2, -(C=NOH)NH2, -S(O)2CH3 и CH2NH2.
47. Соединение по п.1, где R2a выбирают из группы, состоящей из водорода, F, Cl, Br и I.
48. Соединение по п.1, где каждый R2c и R2d независимо выбирают из группы, состоящей из водорода, галогена, F, Cl, Br, I и ORc.
49. Фармацевтическая композиция, содержащая фармацевтически приемлемый эксципиент или носитель и соединение по п.1, в форме, подходящей для перорального применения, таблеток, пилюль, лепешек, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий или мягких капсул, сиропов, эликсиров, растворов, буккальных лепешек, пероральных гелей, жевательных резинок, жевательных таблеток, шипучих порошков и таблеток, или в форме стерильных растворов для инъекций, или масляных суспензий, или в форме суппозиториев, или в сочетанной форме с полимерным носителем в виде стента или стентового трансплантационного устройства.
50. Фармацевтическая композиция по п.49, где указанную композицию формируют в виде стента или стентового трансплантационного устройства.
51. Способ лечения опосредуемых CCR1 заболеваний или состояний, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп.1-48 или фармацевтической композиции по пп.49, 50.
52. Способ по п.51, где указанное опосредуемое CCR1 заболевание или состояние представляет собой воспалительное состояние.
53. Способ по п.51, где указанное опосредуемое CCR1 заболевание или состояние представляет собой иммунорегуляторное нарушение.
54. Способ по п.51, где указанное опосредуемое CCR1 заболевание или состояние выбирают из группы, состоящей из ревматоидного артрита, рассеянного склероза, отторжения трансплантанта, рестеноза, дерматита, экземы, крапивной лихорадки, васкулита, воспалительного кишечного заболевания, пищевой аллергии, астмы, болезни Альцгеймера, болезни Паркинсона, псориаза, красной волчанки, остеоартрита, инсульта и энцефаломиелита.
55. Способ по п.51, где указанный способ введения является пероральным, парентеральным, ректальным, трансдермальным, сублингвальным, назальным или местным.
56. Способ по п.51, где указанное соединение вводят в комбинации с противовоспалительным агентом, аналгетиком, антипролиферативным агентом, ингибитором метаболизма, ингибитором миграции лейкоцитов или иммуномодулятором.
Текст
ИСПРАВЛЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Описываются соединения общей формулы Ia и Ib которые действуют как потенциальные антагонисты рецептора CCR1 и имеют противовоспалительную активность in vivo. Соединения, в целом, представляют собой арилпиперазиновые производные и применимы в фармацевтических композицях, способах лечения опосредуемых CCR1 заболеваний и как контрольные соединения в анализах для идентификации конкурентных антагонистов CCR1. Примечание: библиография отражает состояние при переиздании 017278 Перекрестная ссылка на родственную заявку Данная заявка подтверждает преимущество американской предварительной заявки 60/693 525, дата подачи 22 июня 2005, содержание которой полностью включается в данное изобретение для любых целей. Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, фармацевтическим композициям, содержащим одно или более таких соединений или их фармацевтически приемлемых солей, которые являются эффективными для ингибирования связывания различных хемокинов, таких как MIP-1, лейкотактина, MPIF-1 и RANTES с рецептором CCR1. Являясь антагонистами или модуляторами CCR1 рецептора, соединения и композиции имеют применимость при лечении воспалительных и иммунных нарушений и заболеваний. Уровень техники Человеческое здоровье зависит от способности организма определять и разрушать чужеродные патогены, которые иначе могут значительно истощать ресурсы индивидуума и/или индуцировать болезнь. Иммунная система, которая содержит лейкоциты (белые клетки крови (WBC): Т и В лимфоциты, моноциты, макрофаги, гранулоциты, NK клетки, тучные клетки, дендритные клетки и производные иммунных клеток (например, остеокласты), лимфоидные ткани и лимфоидные сосуды, представляет защитную систему организма. Для борьбы с инфекцией белые кровяные клетки циркулируют по всему организму для детектирования патогенов. При детектировании патогена клетки врожденного иммунитета и цитотоксические Т клетки, в особенности, мигрируют к месту инфекции для разрушения патогена. Хемокины действуют как молекулярные маяки для формирования и активации иммунных клеток, таких как лимфоциты, моноциты и гранулоциты, идентифицирующие место, где существует патоген. Несмотря на регулирование патогенов иммунной системой, могут развиваться некоторые неподходящие хемокиновые сигналы, которые могут способствовать началу или поддержанию воспалительных нарушений, таких как ревматоидный артрит, рассеянный склероз и другие. Например, при ревматоидном артрите нерегулируемое хемокиновое аккумулирование в костных суставах привлекает и активирует просачивание макрофагов и Т-клеток. Активность этих клеток индуцирует синовиальную клеточную пролиферацию, которая приводит, по меньшей мере, частично к воспалению и возможной потере костной и хрящевой массы (см. DeVries, M.E., et al., Semin Immunol 11(2):95-104 (1999. Признаком некоторых демиелинизирующих заболеваний, таких как рассеянный склероз, является хемокинопосредуемая моноцитно/макрофаговая и Т клеточная миграция в центральную нервную систему (см. Kennedy, et al., J.Clin. Immunol. 19(5): 273-279 (1999. Хемокиновая миграция деструктивных WBC к трансплантантам подразумевает их последующее отторжение. См. DeVries, M.E., et al., ibid. Так как хемокины играют центральную роль в развитии воспаления и формировании лимфоцитов, способность специфически манипулировать их активностью имеет огромное значение для облегчения и лечения заболеваний, которые в настоящее время не имеют удовлетворительного способа лечения. Кроме этого, может быть минимизировано отторжение трансплантантов без обобщенных и сложных воздействий дорогих иммунодепрессантов. Хемокины - группа из более чем 40 малых пептидов (7-10 кд) связываются с рецепторами, экспрессируемыми, в основном, на WBCs или производных иммунных клеток, и вызывают прохождение сигнала через G-протеин-связанные сигнальные каскады для реализации их хемоаттрактантных и хемостимулирующих функций. Рецепторы могут связывать более одного лиганда, например, рецептор CCR1 связывает RANTES (регулирующий активацию нормальных экспрессируемх Т клеток), М 1 Р-1 а (макрофаговый воспалительный белок), MPIF-1/CKP8 и лейкотактиновые хемокины (среди других с меньшими афинностями). На сегодняшний день известно 24 хемокиновых рецептора. Полный ряд хемокинов, мультидентатных лигандсвязывающих рецепторов и различные рецепторные профили иммунных клеток позволяют тщательно контролировать и определять иммунные отклики. См. Rossi, et al., Ann. Rev. Immunol. 18(1): 217-242 (2000). Активность хемокинов можно регулировать модуляцией их соответствующих рецепторов, излечивая родственные воспалительные и иммунологические заболевания и создавая возможность трансплантации органов и тканей. Рецептор CCR1 и его хемокиновые лиганды, включая, например MIP-1, MPEF-1/CK8, лейкотактин и RANTES, представляют важные терапевтические цели (см., Saeki, et al., Current Pharmaceutical Design 9:1201-1208 (2003, поскольку они имеют отношение к ревматоидному артриту, отторжению трансплантантов (см. DeVries, M.E., et al., ibid.) и рассеянному склерозу (см. Fischer, et al., J.Neuroimmunol. 110(1-2): 195-208 (2000); Izikson, et al., J. Exp. Med. 192(7): 1075-1080 (2000); и Rottman, et al., Eur. J. Immunol. 30(8):2372-2377 (2000). Действительно, были открыты функционально блокирующие антитела,модифицированные лиганды хемокиновых рецепторов и малые органические молекулы, некоторые из которых продемонстрировали успешное предотвращение или лечение некоторых хемокинопосредованных заболеваний (обзор Rossi, et al., ibid). Значительным является то, что в экспериментальной модели ревматоидного артрита наблюдается уменьшение развития болезни при введении блокирующего передачу сигнала модифицированного лиганда RANTES (см. Plater-Zybeik, et al., Immunol Lett. 57(1-3):117-120(1997. Несмотря на то, что терапии с функционально блокирующими антителами и малыми пептидами являются многообещающими, они страдают от опасностей деградации, очень короткого периода полувыведения после введения и чрезмерных затрат на развитие, производство и характеризацию большинства белков. Малые органические молекулы являются предпочтительными, поскольку они часто имеют более длительный период полувыведения in vivo, требуют меньших доз для эффективного действия, часто могут вводиться перорально и, следовательно, являются менее дорогими. Некоторые органические антагонисты CCR1 были описаны ранее (смотри, Hesselgesser, et al., J. Biol. Chem. 273(25): 15687-15692(2000); и Liang, et al, Eur. J. Pharmacol. 389(1): 41-49 (2000. Принимая во внимание эффективность, продемонстрированную при лечении заболевания на животных моделях (см. Liang, et al., J. Biol. Chem. 275(25): 19000-19008 (2000, исследования продолжили для идентификации других соединений, которые могут применяться для лечения заболеваний, опосредуемых передачей сигнала CCR1. Сущность изобретения Настоящее изобретение относится к соединениям формулы, выбранной из группы, состоящей из или его фармацевтически приемлемая соль, гидрат или N-оксид, гдеm является целым числом от 0 до 2;R1 представляет собой C1-8-алкил; каждый R2a, R2c и R2d независимо выбирают из группы, состоящей из водорода, галогена, циано, -NO2, -CO2Rc, -CONRcRd, -C(O)Rc, -S(O)Re, -S(O)2Re, -S(O)3Rc, -Re, -ORc, -SRc,-NRdC(O)Rc, -NRdC(O)2Rc, -S(O)2NRcRcRd, -NRc-C(O)NRcRd, -NH-C(NH2)=NH, -NReC(NH2)=NH, NHC(CH2)=NRe, -NH-C(NHRe)=NH, -NReC(NHRe)=NH, -NReC(NH2)=NRe, -NH-C(NHRc)=NRe, NH-C(NReRc)=NH,-NRcS(O)2Re, -OC(O)Rc и -NRcRd, где в каждом из R2a, R2c и R2d каждый Rc и Rd независимо из выбирают из водорода, C1-8-алкила, C1-8 галогеналкила и C3-6-циклоалкила; и каждый Re независимо выбирают из группы, состоящей из C1-8 алкила, C1-8-галогеналкина, C3-6-циклоалкила; каждую из вершин кольца а, b, с и d в формулах Ia и Ib независимо выбирают из N и C(R3a), и однадве вершины кольца представляют собой N; аR3a независимо выбирают из группы, состоящей из водорода, галогена, -OR, -OC(O)Rf, -NRfRg, -SRf,h-R , -CN, -NO2, -CO2Rf, -CONRfRg, -C(O)Rf, -OC(O)NRfRg, -NRgC(O)Rf, -NRgC(O)2Rh, -NRf-C(O)NRfRg,-NH-C(NH2)=NH, -NRhC(NH2)=NH, -NH-C(NH2)=NRh, -NH-C(NHRh)=NH, -C(=NRf)NRgRh, -S(O)3Rf,-S(O)Rh, -S(O)2Rh, -S(O)3Rh, -NRfS(O)2Rh, -S(O)2NRfRg, -NRfS(O)2Rh, -NRfS(O)2NRfRg, -N3,-C(C=NORf)NRfRg, -X3SO3Rf, -X3ORf, -X3NRfRg, -Y, -X3N3, где Y выбирают из группы, состоящей из гомопиперидинила, морфолинила, тиоморфолинила, пирролидинила, пиперидинила, азетидинила, пиранила, тетрагидрофуранила, пиперазинила, фенила, тиенила, фуранила, пиридила, пиримидинила, пиразинила, пирролила, пиридизинила, пиразолила, имидазинила, тиазолила, оксазолила, изоксазолила, изотиазолила, триазолила, тетразолила и оксадиазолила, которые необязательно замещены 1-3 заместителями,независимо выбранными из группы, состоящей из галогена -ORf, -NRfRg, -CORf, -CO2Rf, -CONRfRg,-NO2, -Rh и -CN, где каждый Rf и Rg независимо выбирают из группы, состоящей из водорода, C1-8-алкила, C1-8 галогеналкина и C3-6-циклоалкила; и каждый Rh независимо выбирают из группы, состоящей из C1-8 алкила, C1-8-галогеналкина и C3-6-циклоалкила и где X3 представляет собой C1-4-алкилен. Кроме соединений, представленных в данном описании, настоящее изобретение также относится к фармацевтическим композициям, содержащим одно или более таких соединений, а также к способам применения таких соединений в терапевтических способах, главным образом для лечения заболеваний,связанных с активностью передачи сигнала CCR1. Подробное описание изобретенияI. Аббревиатуры и определения Термин "алкил" сам по себе или в качестве части другого заместителя обозначает, если не оговорено иное, линейный или разветвленный углеводородный радикал, имеющий число обозначенных углеродных атомов (т.е. C1-8 обозначает от одного до восьми атомов углерода). Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, н-пентил, нгексил, н-гептил, н-октил и подобные. Термин "алкенил" обозначает ненасыщенную алкильную группу,имеющую одну или более двойных связей. Аналогично, термин "алкинил" обозначает ненасыщенную алкильную группу, имеющую одну или более тройных связей. Примеры таких ненасыщенных алкильных групп включают винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4 пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры. Термин "циклоалкил" обозначает углеводородные кольца, имеющие указанное число кольцевых атомов (например, C3-6 цикло-2 017278 алкил) и являющиеся полностью насыщенными или имеющими не более одной двойной связи между атомами кольца. "Циклоалкил" также обозначает бициклические и полициклические углеводородные кольца, такие как, например, бицикло[2.2.1]гептан, бицикло[2.2.2]октан и т.д. Термин "гетероциклоалкил" обозначает циклоалкильную группу, которая содержит от одного до пяти гетероатомов, выбранных из числа N, О и S, где атомы азота и серы, необязательно, окислены, и атом(ы) азота, необязательно кватернизованы. Гетероциклоалкил может быть моноциклической, бициклической или полициклической кольцевой системой. Неограничивающие примеры гетероалкильных групп включают пирролидинил,пиперидинил, имидазолидинил, пиразолидин, бутиролактам, валеролактам, имидазолидинон, гидантоин,диоксолан, фталимид, пиперидин, 1,4-диоксан, морфолин, тиоморфолин, тиоморфолин-8-оксид, тиоморфолин-S,S-оксид, пиперазин, пиран, пиридон, 3-пирролин, тиопиран, пирон, тетрагидрофуран, тетрагидротиофен, хинуклидин и подобные. Гетероциклоалкильная группа может быть присоединена к остальной части молекулы через кольцевой атом углерода или гетероатом. Термин "алкилен" сам по себе или как часть другого заместителя обозначает двухвалентный радикал, образованный от алкана, например, -СН 2 СН 2 СН 2 СН 2-. Обычно алкильная (или алкиленовая) группа имеет от 1 до 24 атомов углерода, причем группы, имеющие 10 углеродных атомов или менее, являются предпочтительными по настоящему изобретению. "Низший алкил" или "низший алкилен" представляет собой алкильную или алкиленовую группу с более короткой цепью, обычно имеющую четыре или менее атомов углерода. Аналогично, "алкенилен" и "алкинилен" обозначают незамещенные формы "алкилена",содержащие двойные или тройные связи, соответственно. Термины "алкокси," "алкиламино" и "алкилтио" (или тиоалкокси) применяются в их традиционном смысле и обозначают алкильные группы, присоединенные к остальной части молекулы через атом кислорода, аминогруппу или атом серы, соответственно. Кроме того, в случае диалкиламиногрупп алкильные части могут быть одинаковыми или различными и также могут быть объединены с образованием 3-7 членного кольца с атомом азота, к которому они присоединяются. Соответственно, группа, представленная как -NRaRb, включает пиперидинил, пирролидинил, морфолинил, азетидинил и подобные. Термины "гало" или "галоген" сами по себе или как части другого заместителя обозначают, если не указано иное, атом фтора, хлора, брома или иода. Кроме того, термины, такие как "галогеналкил" включают моногалогеналкил и полигалогеналкил. Например, термин "C1-4 галогеналкил" включает трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и подобные. Термин "арил" обозначает, если не оговорено иное, полиненасыщенную, обычно ароматическую,углеводородную группу, которая может быть моноциклической или полициклической (до трех колец),которые являются конденсированными или ковалентно связанными. Термин "гетероарил" обозначает арильные группы (или кольца), которые содержат от одного до пяти гетероатомов, выбранных из числаN, О и S, где атомы азота и серы, необязательно, окислены, и атом(ы) азота, необязательно, квартеризован(ы). Гетероарильная группа может быть присоединена к остальной части молекулы через гетероатом. Нелимитирующие примеры арильных групп включают фенил, нафтил и бифенил, в то же время нелимитирующие примеры гетероарильных групп включают пиридил, пиридазинил, пиразинил, пиримидинил,триазинил, хинолинил, хиноксалинил, хиназолинил, цинолинил, фталазинил, бензотриазинил, пуринил,бензимидазолил, бензопиразолил, бензотриазолил, бензисоксазолил, изобензофурил, изоиндолил, индолизинил, бензотриазинил, тиенопиридинил, тиенопиримидинил, пиразолопиримидинил, имидазопиридинил, бензотиаксолил, бензофуранил, бензотиенил, индолил, хинолил, изохинолил, изотиазолил, пиразолил, индазолил, птеридинил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиадиазолил,пирролил, тиазолил, фурил, тиенил и подобные. Заместители для каждой вышеуказанной арильной и гетероарильной кольцевой системы выбирают из группы приемлемых заместителей, описанных ниже. Для краткости, термин "арил", используемый в сочетании с другими терминами (например, арилокси, арилтиокси, арилалкил), включает как арильные, так и гетероарильные кольца, определенные выше. Таким образом, термин "арилалкил" включает такие радикалы, в которых арильная группа присоединена к алкильной группе (например, бензил, фенетил, пиридилметил и подобные). Вышеуказанные термины (например, "алкил," "арил" и "гетероарил") в некоторых воплощениях будут включать как замещенные, так и незамещенные формы указанных радикалов. Предпочтительные заместители для каждого типа радикалов приводятся ниже. Вкратце, термины арил и гетероарил будут обозначать замещенные или незамещенные варианты, как показано ниже, в то же самое время термин"алкил" и родственные алифатические радикалы обозначают незамещенные варианты, если не указано,что они являются замещенными. Заместители для алкильных радикалов (включая группы, часто называемые как алкилен, алкенил,алкинил и циклоалкил) могут быть различными группами, выбранными из числа -галогена, -OR', -NR'R",-SR', -SiR'R"R, -OC(O)R', -C(O)R', -CO2R', -CONR'R", -OC(O)NR'R", -NR"C(O)R', -NR'-C(O)NR"R"',-NR"C(O)2R', -NH-C(NH2)=NH, -NR'C(NH2)=NH, -NH-C(NH2)=NR', -S(O)R', -S(O)2R', -S(O)2NR'R",-NR'S(O)2R", -CN и -NO2, в количестве от нуля до (2m'+1), где m' представляет собой общее число атомов углерода в таких радикалах. R', R" и R'", каждый независимо, представляют собой водород, незамещенный C1-8-алкил, незамещенный гетероалкил, незамещенный арил, арил, замещенный одним-тремя атома-3 017278 ми галогена, незамещенным C1-8-алкилом, C1-8-алкокси или C1-8-тиоалкоксигруппами или незамещенные арил-C1-4-алкильные группы. Когда R' и R" присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием 3-, 4-, 5-, 6- или 7-членного кольца. Например, -NR'R" включает 1-пирролидинил и 4-морфолинил. Аналогично, заместители для арильной и гетероарильной групп варьируют и обычно выбирают из числа -галогена, -OR', -OC(O)R', -NR'R", -SR', -R', -CN, -NO2, -CO2R', -CONR'R", -C(O)R', -OC(O)NR'R",-NR"C(O)R', -NR"C(O)2R', -NR'-C(O)NR"R'", -NH-C(NH2)=NH, -NR'C(NH2)=NH, -NH-C(NH2)=NR', -S(O)R',-S(O)2R', -S(O)2NR'R", -NR'S(O)2R", -N3, перфтор(С 1-С 4)алкокси и перфтор(С 1-С 4)алкила, в количестве, колеблющемся от 0 до общего числа свободных валентностей в ароматической кольцевой системе; и где R', R" и R'" независимо выбирают из водорода, C1-8 алкила, C3-6 циклоалкила, C2-8 алкенила, C2-8 алкинила, незамещенного арила и гетероарила, (незамещенного арил)-C1-4 алкила и незамещенного арилокси-C1-4 алкила. Другие подходящие заместители включают каждый из вышеуказанных арильных заместителей, присоединенных к кольцевому атому алкиленовой линкерной группой с 1-4 атомами углерода. Два заместителя у соседних атомов арильного или гетероарильного кольца можно, необязательно,заменить на заместитель формулы -T-C(O)-(CH2)q-U-, где Т и U, независимо, представляют собой -NH-,-О-, -СН 2- или одинарную связь, и q представляет собой целое число от 0 до 2. В качестве альтернативы,два заместителя у соседних атомов арильного или гетероарильного кольца можно, необязательно, заменить на заместитель формулы -А-(СН 2)r-В-, где А и В независимо представляют собой -СН 2-, -О-, -NH-,-S-, -S(O)-, -S(O)2-, -S(O)2NR'- или одинарную связь, и r представляет собой целое число от 1 до 3. Одна из одинарных связей нового кольца, образованная таким образом, может быть, необязательно, заменена на двойную связь. В качестве альтернативы, два заместителя у соседних атомов арильного или гетероарильного кольца можно, необязательно, заменить на заместитель формулы -(CH2)s-X-(CH2)t, где s и t,независимо, представляют собой целые числа от 0 до 3, и X представляет собой -О-, -NR'-, -S-, -S(O)-,-S(O)2- или -S(O)2NR'-. Заместитель R' в -NR'- и -S(O)2NR'- выбирают из числа водорода или незамещенного C1-6 алкила. Используемый в данном описании термин "гетероатом" включает кислород (О), азот (N), серу (S) и кремний (Si). Термин "фармацевтически приемлемые соли" включает соли активных соединений, которые получают с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей в соединениях, описанных в заявке. Когда соединения по настоящему изобретению содержат относительно кислотные функциональные группы, можно получить соли присоединения оснований, которые можно получить взаимодействием нейтральной формы таких соединений с подходящим количеством требуемого основания или в чистом виде или в подходящем инертном растворителе. Примеры солей,образованных с фармацевтически приемлемыми неорганическими основаниями, включают соли алюминия, аммония, кальция, меди, железа II, железа III, лития, магния, марганца III, марганца VI, калия, натрия, цинка и подобные. Соли, образованные с фармацевтически приемлемыми органическими основаниями, включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, амины природного происхождения и подобные, такие как аргинин, бетаин, кофеин, холин,N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин,этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперадин, полиаминовые смолы, прокаин,пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и подобные. Когда соединения по настоящему изобретению содержат относительно основные функциональные группы, можно получить соли присоединения кислот, которые можно получить взаимодействием нейтральной формы таких соединений с подходящим количеством требуемой кислоты или в чистом виде или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислот включают соли, образованные с неорганическими кислотами, такими как хлороводородная, бромоводородная, азотная, угольная, моногидроугольная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, иодоводородная или фосфористая кислоты и подобными, также как и соли, образованные с относительно нетоксичными органическими кислотами, такими как уксусная, пропионовая, изобутановая, малоновая, бензойная, янтарная, субериновая, фумаровая, миндальная, фталевая, бензолсульфоновая, п-толуолсульфоновая, лимонная, винная, метансульфоновая и подобные. Также включаются соли аминокислот, такие как аргинат и подобные и соли органических кислот, таких как глюкуроновая или галактуроновая кислоты и подобные (см, например, Berge, S.M. et al., "Pharmaceutical Salts", Journal ofPharmaceutical Science, 1977, 66, 1-19). Некоторые конкретные соединения по настоящему изобретению содержат как основные, так и кислотные функциональные группы, которые позволяют превращать соединения в соли присоединения либо оснований, либо кислот. Нейтральные формы соединений могут быть регенерированы взаимодействием соли с основанием или кислотой и выделением исходного соединения обычным способом. Исходное соединение отличается от его различных солей некоторыми физическими свойствами, такими как растворимость в полярных растворителях, но в других отношениях соли эквивалентны исходной форме соединения для целей настоящего изобретения.-4 017278 Кроме солевых форм, настоящее изобретение относится к соединениям, которые находятся в форме пролекарств. Пролекарства соединений, описанных в данном описании, представляют собой такие соединения, которые легко подвергаются химическим изменениям в физиологических условиях с образованием соединений по настоящему изобретению. Кроме того, пролекарства могут превращаться в соединения по настоящему изобретению химическими и биохимическими способами в окружающей среде exvivo. Например, пролекарства могут медленно превращаться в соединения по настоящему изобретению,когда они помещаются в трансдермальный резервуар с подходящим ферментом или химическим реагентом. Некоторые соединения по настоящему изобретению могут существовать в несольватированных формах, также как и в сольватированных формах, включая гидратированные формы. Обычно сольватированные формы являются эквивалентными несольватированным и включаются в область настоящего изобретения. Некоторые соединения по настоящему изобретению могут существовать в нескольких кристаллческих или аморфных формах. Обычно все физические формы являются эквивалентными для применений, которые рассматривает настоящее изобретение, и включаются в объем настоящего изобретения. Некоторые соединения по настоящему изобретению имеют асимметричные углеродные атомы (оптические центры) или двойные связи; рацематы, диастереомеры, геометрические изомеры, региоизомеры и индивидуальные изомеры (например, разделенные энантиомеры) - все такие соединения включаются в объем настоящего изобретения. Соединения по настоящему изобретению также могут содержать неприродные пропорции атомных изотопов одного или более атомов, которые составляют такие соединения. Например, соединения могут быть радиоактивно мечеными радиоактивными изотопами, такими как,например, тритий (3 Н), иод-125 (125I) или углерод-14 (14 С). Все изотопные варианты соединений по настоящему изобретению, радиоактивные или нет, включаются в объем настоящего изобретения.II. Общие положения Настоящее изобретение исходит из открытия, что соединения формулы 1 а или Ib (также как и подчиненных формул Ia1-4 и Ib1-4) действуют как потенциальные антагонисты рецептора CCR1. Соединения проявляют in vivo противовоспалительную активность. Соответственно, соединения, описанные в данной заявке, применимы в фармацевтических композициях, способах лечения CCR1-опосредуемых заболеваний и в качестве контрольных соединений в анализах для определения конкурентных антагонистовIII. Соединения В одном аспекте настоящее изобретение относится к соединениям формулы, выбранной из группы,состоящей из или его фармацевтически приемлемая соль, гидрат или N-оксид, гдеm является целым числом от 0 до 2;R1 представляет собой C1-8-алкил; каждый R2a, R2c и R2d независимо выбирают из группы, состоящей из водорода, галогена, циано, -NO2, -CO2Rc, -CONRcRd, -C(O)Rc, -S(O)Re, -S(O)2Re, -S(O)3Rc, -Re,-ORc, -SRc, -NRdC(O)Rc, -NRdC(O)2Rc, -S(O)2NRcRcRd, -NRc-C(O)NRcRd, -NH-C(NH2)=NH,-NReC(NH2)=NH, NH-C(CH2)=NRe, -NH-C(NHRe)=NH, -NReC(NHRe)=NH, -NReC(NH2)=NRe, -NHC(NHRc)=NRe, NH-C(NReRc)=NH, -NRcS(O)2Re, -OC(O)Rc и -NRcRd, где в каждом из R2a, R2c и R2d каждый Rc и Rd независимо из выбирают из водорода, C1-8-алкила, C1-8 галогеналкила и C3-6-циклоалкила; и каждый Re независимо выбирают из группы, состоящей из C1-8 алкила, C1-8-галогеналкина, C3-6-циклоалкила; каждую из вершин кольца а, b, с и d в формулах Ia и Ib независимо выбирают из N и C(R3a), и однадве вершины кольца представляют собой N; аR3a независимо выбирают из группы, состоящей из водорода, галогена, -ORf, -OC(O)Rf, -NRfRg,f-SR , -Rh, -CN, -NO2, -CO2Rf, -CONRfRg, -C(O)Rf, -OC(O)NRfRg, -NRgC(O)Rf, -NRgC(O)2Rh, -NRfC(O)NRfRg, -NH-C(NH2)=NH, -NRhC(NH2)=NH, -NH-C(NH2)=NRh, -NH-C(NHRh)=NH, -C(=NRf)NRgRh,-S(O)3Rf, -S(O)Rh, -S(O)2Rh, -S(O)3Rh, -NRfS(O)2Rh, -S(O)2NRfRg, -NRfS(O)2Rh, -NRfS(O)2NRfRg, -N3,-C(C=NORf)NRfRg, -X3SO3Rf, -X3ORf, -X3NRfRs, -Y, -X3N3, где Y выбирают из группы, состоящей из гомопиперидинила, морфолинила, тиоморфолинила, пирролидинила, пиперидинила, азетидинила, пиранила,тетрагидрофуранила, пиперазинила, фенила, тиенила, фуранила, пиридила, пиримидинила, пиразинила, пирролила, пиридизинила, пиразолила, имидазинила, тиазолила, оксазолила, изоксазолила, изотиазолила, триазолила, тетразолила и оксадиазолила, которые необязательно замещены 1-3 заместителями,-5 017278 независимо выбранными из группы, состоящей из галогена -ORf, -NRfRg, -CORf, -CO2Rf, -CONRfRg, -NO2,-Rh и -CN, где каждый Rf и Rg независимо выбирают из группы, состоящей из водорода, C1-8-алкила, C1-8 галогеналкина и C3-6-циклоалкила; и каждый Rh независимо выбирают из группы, состоящей из C1-8 алкила, C1-8-галогеналкина и C3-6-циклоалкила и где X3 представляет собой C1-4-алкилен. В другом воплощении в соединении формулы Ib, когда R2a представляет собой Н, R2C представляет собой хлор, R2d представляет собой метокси, m равен 0, а равен N, с равен СН или N, и b и d представляют собой СН, тогда R3a не является водородом, метилом, незамещенным 2-пиридилом, незамещенным 2 пиримидинилом или незамещенным 2-оксазолилом. В другом воплощении в соединении по изобретению конденсированное шестичленное кольцо,имеющее вершины а, b, с и d, представляет собой конденсированное кольцо пиридина, конденсированное кольцо пиримидина, или его N-оксид или это конденсированное шестичленное кольцо, имеющее вершины а, b, с и d, представляет собой конденсированное кольцо пиридина, или его N-оксид, или конденсированное шестичленное кольцо, имеющее вершины а, b, с и d, представляет собой конденсированное пиримидиновое кольцо, или его N-оксид, или конденсированное пиразиновое кольцо, или его Nоксид, или конденсированное пиридазиновое кольцо, или его N-оксид. В другом варианте каждый заместитель R3a в соединении независимо выбирают из группы, состоящей из водорода, галогена, -ORf, -NRfRg, -C(O)Rf, -C(O)ORf, -S(O)Rf, -S(O)2Rf, -S(O)3Rf, -S(O)3Rh,-X3C(O)2Rf, X3S(O)3Rf, -S(O)2NRfRg, -X3S(O)2NRfRg, -Rh, -CN, X3NRfRg, NRgC(O)Rf, X3N3 и Y, где Y представляет собой пяти-шестичленное арильное, пяти-шестичленное гетероарильное кольцо или трехвосьмичленное гетероциклоалкильное кольцо, выбранное из группы, состоящей из гомопиперидинила,морфолинила, тиоморфолинила, пирролидинила, пиперидинила, азетидинила, пиранила, тетрагидрофуранила, пиперазинила, фенила, пиридила, оксазолила, пиримидинила, оксадиазолила, имидазолила, пиразолила, триазолила и тиазолила, необязательно, замещенного одним-тремя заместителями, выбранными из группы, состоящей из галогена, -ORf, -NRfRg, -Rh, -CN, где каждый Rf и Rg независимо выбирают из числа водорода, C1-6-алкила, C1-6-галогеналкила и C3-6-циклоалкила, и каждый Rh независимо выбирают из группы, состоящей из C1-6-алкила, C1-6-галогеналкила и C3-6-циклоалкила. В еще одном аспекте а в соединении представляет собой N, а каждый b, с и d представляет собой(C(R3a). В другом аспекте а и с в соединении представляет собой N, каждый b и d представляет собой(C(R3a), m равно 0-1. Предпочтительно соединение имеет формулу Ib. В другом аспекте в соединении по изобретению одна из групп R3a представляет собой -Y, где Y выбран из группы, состоящей из фенила, пиридила, пиримидинила, тиазолила, оксазолила и оксадиазолила,каждый из которых необязательно, замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, -ORf, -NRfRg, -CORf, -CO2Rf, -CONRfRg, -NO2, -Rh и -CN, где каждый Rf и Rg независимо выбирают из группы, состоящей из Н, C1-8-алкила, C3-6-циклоалкила и C1-8-галогеналкина, и каждыйRh независимо выбирают из группы, состоящей из C1-8-алкила, C3-6-циклоалкила и C1-8-галогеналкила В еще одном аспекте в соединении m равно 0 или 1, a R2a представляет собой водород или R2a выбирают из группы, состоящей из водорода, F, Cl, Br и I. Предпочтительно группа R3a фрагмент у пиразольного кольца представляет собой водород, галоген,хлор, фтор, бром, оксазолил, пиридил, пиримидинил, оксадиазолил, тиазолил, -Rh или циано. Предпочтительно R1 представляет собой метил и m равно 0-2. Предпочтительно по меньшей мере один из указанных заместителей R3a выбирают из группы, состоящей из галогена, C1-4-алкила и C1-4- галогеналкина, где алифатические части, необязательно, замещены 1-3 заместителями, выбранными из группы, состоящей из -ОН, -ORo, -OC(O)NHR, -OC(O)N(R)2,-SH, -SR, -S(O)R, -S(O)2R, -SO2NH2, -S(O)2NHR, -S(O)2N(R)2, -NHS(O)2R, -NRS(O)2R, -C(O)NH2,-C(O)NHR, -C(O)N(R)2, -C(O)R, -NHC(O)R, -NRC(O)R, -NHC(O)NH2, -NRC(O)NH2,-NRC(O)NHR, -NHC(O)NHR, -NRC(O)N(R)2, -NHC(O)N(R)2, -CO2H, -CO2R, -NHCO2R,-NRCO2R, -CN, -NO2, -NH2, -NHR, -N(R)2, -NRS(O)NH2 и -NRS(O)2NHR, где каждый R представляет собой, независимо, незамещенный C1-6-алкил;R2d выбирают из группы, состоящей из -SRc, -O-X2-ORc, -X2-ORc, -OC(O)Rc, -NRcRd, -Re и -ORc; каждый R2c и R2d независимо выбирают из группы, состоящей из водорода, галогена F, Cl, Br, I иOR . В одном из вариантов соединение имеет формулу, выбранную из группы, состоящей изR2d выбирают из числа -SRc, -OX2-ORc, -X2-ORc, -Re, -ORc и -NRdC(O)Rc; каждую из вершин кольцаa, b, с и d независимо выбирают из числа N и C(R3a), и одна-две из указанных вершин кольца представляют собой N; и каждый R3a независимо выбирают из группы, состоящей из водорода, галогена, C3-6 гетероциклоалкила, -S(O)2Rh, C1-6-алкила, C1-6-галогеналкина, C3-6-циклоалкила, амино, морфолинила,фенила, пиридила, пиримидинила, оксазолила, оксадиазолила, изоксазолила и тиазолила. Предпочтительно в соединении формулы 1b' и 1b" вершина кольца а представляет собой N, и/или вершина кольца b представляет собой N, и/или вершина кольца с представляет собой N, и/или вершина кольца d представляет собой N. В другом варианте соединение имеет формулу, выбранную из группы, состоящей из или его N-оксид; где R2c представляет собой галоген, циано или нитро; R2d выбирают из числа -SRc,-O-X -ORc, -X2-ORc, -Re, -ORc, -NRcRd, -NRcS(O)2Re и -NRdC(O)Rc; R2a выбирают из группы, состоящей изF, Cl, Br, I, -CO2Me, -CONH2, CN, оксазолила, -CH2NH2, -CH2NHMe, -CH2NMe2 и -CH=N-OH; каждую из вершин кольца а, b, c и d независимо выбирают из числа N и C(R3a), и одна-две из указанных вершин кольца представляют собой N; и каждый R3a независимо выбирают из группы, состоящей из водорода,галогена, C1-6-алкила, C1-6-галогеналкина, С 3-6-циклоалкила, -S(O)2Rh, амино, морфолинила, фенила, пиридила, пиримидинила, оксадиазолила, оксазолила, изоксазолила и тиазолила. Предпочтительно в соединении формулы 1b3 и в 1b4 вершина кольца а представляет собой N и/или вершина кольца b представляет собой N, и/или вершина кольца с представляет собой N, и/или вершина кольца d представляет собой N. В еще одном варианте соединение имеет формулу, выбранную из группы, состоящей из 2 или его N-оксид, где в указанных формулах R2c представляет собой галоген, циано или нитро; R2d выбирают из числа -SRc, -O-X2-ORc, -X2-ORc, -Re, -ORc и -NRdC(O)Rc; каждую из вершин кольца a, b, с иd независимо выбирают из числа N и C(R3a), и одна-две из указанных вершин кольца представляют собойN; и каждый R3a независимо выбирают из группы, состоящей из водорода, галогена, C1-6-алкила, C1-6 галогеналкина, C3-6-циклоалкила, -S(O)2Rh, амино, морфолинила, фенила, пиридила, пиримидинила, оксазолила, оксадиазолила, изоксазолила и тиазолила. Предпочтительно в соединении формулы 1 а 1 и 1 а 2 вершина кольца а представляет собой N, и/или вершина кольца b представляет собой N, и/или вершина кольца с представляет собой N, и/или вершина кольца d представляет собой N. В еще одном аспекте соединение имеет формулу, выбранную из группы, состоящей из или его N-оксид, где в указанных формулах R2c представляет собой галоген, циано или нитро; R2d выбирают из числа -SRc, -O-X2-ORc, -X2-ORc, -Re, -ORc и -NRdC(O)Rc; R2a выбирают из группы, состоящей из F, Cl, Br, I, -СО 2 Ме, -CONH2, CN, оксазолила, -CH2NH2, -CH2NHMe, -CH2NMe2 и -CH=N-OH каж-7 017278 дую из вершин кольца а, b, c и d независимо выбирают из числа N и C(R3a), и одна-две из указанных вершин кольца представляют собой N; и каждый R3a независимо выбирают из группы, состоящей из водорода, галогена, C1-6-алкила, C1-6-галогеналкила, C3-6-циклоалкила, -S(O)2Rh, амино, морфолинила, фенила, пиридила, пиримидинила, оксазолила, оксадиазолила, изоксазолила и тиазолила. Предпочтительно в соединении формулы 1 а 3 и 1 а 4 вершина кольца а представляет собой N, и/или вершина кольца b представляет собой N, и/или вершина кольца с представляет собой N, и/или вершина кольца d представляет собой N. Наиболее предпочтительными соединениями по изобретению являются: 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1-ил-этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-2-ил-этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-хлорпиразоло[4,3-b]пиридин-2-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(пиразоло[4,3-b]пиразин-1-ил-7-оксид)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(пиразоло[4,3-b]пиразин-1-ил-7-оксид)этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1 илэтанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-2 илэтанон,2-(3-аминопиразоло[4,3-b]пиридин-1-ил)-1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин 1-ил]этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-хлорпиразоло [4,3-b]пиридин-1-ил)этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-метил-пиразоло[3,4-b]пиридин 1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-2-ил-этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1-ил-этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[4,3-с]пиридин-1 илэтанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-2 илэтанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-пиридин-2-ил-пиразоло[4,3-b]пиридин-1 ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-тиазол-2-ил-пиразоло[4,3-b]пиридин-1 ил)этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1-илэтанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-2-илэтанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-метилпиразоло[4,3-b]пиридин-1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-оксазол-2-ил-пиразоло[4,3-b]пиридин-1 ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-фторпиразоло[4,3-b]пиридин-1-ил)этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-оксазол-2-ил-пиразоло[4,3b]пиридин-1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло [3,4-с]пиридин-2-ил-этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-1-ил-этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1-илэтанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-тиазол-2-ил-пиразоло[4,3b]пиридин-1-ил)этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-пиридин-2-илпиразоло[4,3b]пиридин-1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-метилпиразоло[4,3-b]пиридин-1-ил)этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-метил-пиразоло[3,4-b]пиридин 1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-тиазол-2-ил-пиразоло[4,3-b]пиридин-1 ил)этанон,1-2-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил-1 Н-пиразоло[3,4-b]пиридин-3 карбонитрил,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(пиразоло[4,3-b]пиридин-1-ил-2-оксид)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-метилпиразоло[4,3-b]пиридин-1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-метилпиразоло[4,3-b]пиридин-2-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-морфолин-4-ил-пиразоло[3,4-b]пиридин-1 ил)этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-1 илэтанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(пиразоло[3,4-с]пиридин-1-ил-6-оксид)этанон,-8 017278 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-хлорпиразоло [4,3-с]пиридин-2-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-иодпиразоло[4,3-b]пиридин-2-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-иодопиразоло[4,3-b]пиридин-1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-метансульфонил-пиразоло[3,4-b]пиридин-1 ил)этанон,2-(3-азидометилпиразоло[4,3-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,(1-2-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил-1 Н-пиразоло[3,4-b]пиридин-3-ил)метансульфоновая кислота,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(5-хлорпиразоло[4,3-b]пиридин-1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-хлорпиразоло[3,4-с 1]пиримидин-2-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-хлорпиразоло[3,4-d]пиримидин-1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-метоксипиразоло[3,4-d]пиримидин-1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-хлорпиразоло[4,3-b]пиридин-2-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-хлорпиразоло[4,3-b]пиридин-1-ил)этанон,2-(6-азидопиразоло[4,3-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,2-(6-аминопиразоло[4,3-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,2-(7-азидопиразоло [3,4-с]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,2-(7-аминопиразоло [3,4-с]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-оксазол-2-илпиразоло[4,3-b]пиридин-2-л)этанон,2-(5-амино-3-метилпиразоло[4,3-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1 ил]этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-метил-5-нитропиразоло[3,4-b]пиридин-1 ил)этанон,2-(3-амино-6-метилпиразоло[4,3-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1 ил]этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-[1,2,4]оксадиазол-3-илпиразоло[4,3-b]пиридин-1-ил)этанон,1-2-[4-(4-хлоро-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил-N-гидрокси-1 Н-пиразоло[4,3b]пиридин-3-карбоксамидин,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-[1,2,4]оксадиазол-3-ил-пиразоло[3,4-b]пиридин 1-ил)этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-[3-(5-метил[1,2,4]оксадиазол-3-ил)пиразоло[4,3b]пиридин-1-ил]этанон,N-(1-2-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил-1 Н-пиразоло[3,4-b]пиридин-6 ил)ацетамид,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-метансульфонилпиразоло[3,4-b]пиридин-1 ил)этанон,2-(3-аминометилпиразоло[4,3-b]пиридин-1-ил)-1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]этанон,1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-иодпиразоло[4,3-b]пиридин-1-ил)этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3-иодпиразоло[3,4-b]пиридин-1 ил)этанон,1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-(3-оксазол-2-ил-пиразоло[3,4-b]пиридин-1 ил)этанон. или их фармацевтически приемлемых солей и N-оксидов. Другими предпочтительными соединениями являются соединения, приведенные в табл. 2 и их фармацевтически приемлемые соли и N-оксиды. Еще в одном варианте в соединении R3a выбирают из группы, состоящей из водорода, галогена,fY представляет собой необязательно замещенную группу, выбранную из группы, состоящей из фенила,пиридила, пиримидинила, оксазолила, тиазолила, оксадиазолила и морфолинила, и Rh представляет собой необязательно замещенную группу, выбранную из группы, состоящей из C1-8-алкила, C1-8 галогеналкила и C3-8-циклоалкила, и каждый Rf и Rg независимо является необязательно замещенной группой, выбранной из группы, состоящей из водорода, C1-8-алкила, C1-8-галогеналкила и C3-8 циклоалкила. Предпочтительно R3a выбирают из группы, состоящей из водорода, фтора, хлора, брома,иода, амино, -CH3, оксазолила, тиазолила, пиридила, пиримидинила, морфолинила, оксодиазолила,-NHC(О)CH3, -CN, CH2N3, CH2SO3H, NO2, -(C=NOH)NH2, -S(O)2CH3 и CH2NH2. В другом аспекте R2a выбирают из группы, состоящей из водорода, F, Cl, Br и I. В еще одном аспекте каждый R2c и R2d независимо выбирают из группы, состоящей из водорода, галогена, F, Cl, Br, I и ORc. Получение соединений Как показано в примерах ниже, соединения и промежуточные соединения по настоящему изобрете-9 017278 нию могут быть получены специалистами в данной области способом сборки компонентов. Схемы 1 А 1 М иллюстрируют различные способы получения различных производных азаиндазольного типа. На каждой из указанных схем X представляет собой галоген; Nu представляет собой нуклеофильную группу; символ (N) внутри арильного кольца указывает на замену одного-двух атомов углерода в вершине(ах) арильного кольца на атом(ы) азота; L представляет собой лиганд; и невлияющие заместители обозначаются как -R, -R'5 -R" и -R'". Схема 1 А. Схема 1 А показывает синтез азаиндазольных производных из галогенпиридинкарбальдегида или кетона. Схема 1 В. Схема 1 В показывает синтез азаиндазольных производных из галогенцианопиридинов. Схема 1 С. Схема 1 С показывает синтез азаиндазольных производных из аминометилпиридина. Схема 1D. Схема ID показывает взаимодействие азаиндазольных производных с -галогенацетатом или галогенацетамидом. Схема 1E. Схема IE показывает взаимодействие азаиндазольных производных с источником электрофильного галогена (Х+). Схема 1F. Схема 1F показывает реакцию сочетания галогеназаиндазольного производного с участием металла. Схема 1G. Схема 1G показывает реакцию аминирования галогеназаиндазольного производного с участием металла. Схема 1 Н. Схема 1H показывает аминирование азаиндазольного производного. Схема 1I. Схема 1I показывает функционализацию азаиндазольного производного. Схема 1J. Схема 1J показывает синтез пиразолопиразинового производного. Схема 1K. Схема 1K показывает синтез пиразолопиримидинового производного. Схема 1L. Схема 1L показывает синтез пиразолопиримидинового производного.IV. Фармацевтические композиции Кроме соединений, описанных выше, композиции для CCR1 модуляции активности у человека и животных обычно будут содержать фармацевтические носители или разбавители. Термин "композиция", использующийся в данном описании, описывает продукт, содержащий специфические ингредиенты в специфических количествах, так же как и любой продукт, который получают напрямую или косвенно из комбинации специфических ингредиентов в специфических количествах. Под"фармацевтически приемлемым" подразумевают, что носитель, разбавитель или эксципиент должен быть совместимым с другими ингредиентами препарата и неопасным для его реципиента. Фармацевтические композиции для введения соединений по изобретению традиционно могут быть представлены в стандартной лекарственной форме и могут быть получены любым способом, хорошо известным в технике фармации и доставки. Все способы включают стадию введения активного ингредиента в сочетании с носителем, который состоит из одного или более вспомогательных ингредиентов. В основном, фармацевтические композиции получают равномерным и тщательным введением активного ингредиента в сочетании с жидким носителем или тонко измельченным твердым носителем или тем и другим, и затем, при необходимости, придание формы продукту в требуемый препарат. Активное целевое соединение включают в фармацевтическую композицию в количестве, достаточном для получения требуемого воздействия на процесс или состояние заболевания. Фармацевтические композиции, содержащие активные ингредиенты, могут быть в форме, подхо- 11017278 дящей для перорального применения, например, в форме таблеток, пилюль, лепешек, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий и самоэмульсий, как описано в американской патентной заявке 2002-0012680, твердых или мягких капсул, сиропов, эликсиров, растворов,буккальных лепешек, пероральных гелей, жевательных резинок, жевательных таблеток, шипучих порошков и таблеток. Композиции, предназначенные для перорального применения, могут быть получены в соответствии с любым способом, известным в технике для производства фармацевтических композиций, и такие композиции могут содержать один или более агентов, выбраных из группы, состоящей из подсластителей, ароматизаторов, красителей, антиоксидантов и консервантов, для получения фармацевтически элегантных и аппетитных препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые подходят для производства таблеток. Такие эксципиенты могут быть, например, инертными разбавителями, такими как целлюлоза, диоксид кремния, оксид алюминия, карбонат кальция, карбонат натрия, глюкоза, маннит, сорбитол, лактоза, фосфат кальция или фосфат натрия; гранулирующими или способствующими рассыпанию агентами, как,например, картофельный крахмал, кукурузный крахмал, или альгиновая кислота; связующими агентами,как, например, PVP, целлюлоза, PEG, крахмал, желатин или аравийская камедь, и смазывающими агентами, как, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без оболочки или в оболочке, энтеросолюбильной или иной, нанесенной известными методами, для отсрочки рассыпания и абсорбци в желудочно-кишечном тракте, и тем самым обеспечения пролонгированного действия в течение более длительного периода времени. Например, в качестве материала для замедления может применяться моностеарат глицерина или дистеарат глицерина. Таблетки также могут быть покрыты оболочками в соответствии со способами, описанными в американских патентах 4256108; 4166452 и 4265874, для образования осмотических терапевтических таблеток с регулируемым высвобождением. Препараты для перорального применения также могут быть в виде твердых желатиновых капсул, в которых активный ингредиент смешивают с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешивают с водной или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом. Кроме того, могут быть получены эмульсии с несмешивающимися с водой ингредиентами, такими как масла, и стабилизированы поверхностно-активными веществами, такими как моноглицериды, эфиры PEG и подобные. Водные суспензии содержат активные материалы в смеси с эксципиентами, подходящими для производства водных суспензий. Такие эксципиенты представляют собой суспендирующие агенты, например, натрийкарбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и аравийскую камедь; диспергирующие агенты или смачиватели могут быть природными фосфатидами, например лецитином, или продуктами конденсации алкиленоксида с жирными кислотами, например полиоксиэтиленстеаратом, или продуктами конденсации этиленоксида с длинноцепными алифатическими спиртами, например гептадекаэтиленоксицетанолом, или продуктами конденсации этиленоксида с неполными эфирами жирных кислот и гексита, такими как полиоксиэтиленсорбитола моноолеат, или продуктами конденсации этиленоксида с неполными эфирами жирных кислот и ангидридов гексита, например полиэтиленсорбитола моноолеатом. Водные суспензии также могут содержать один или более консервантов, например этил или н-пропил пгидроксибензоат, один или более красителей, одну или более отдушек и один или более подсластителей,таких как сахароза или сахарин. Масляные суспензии можно получить суспендированием активного ингредиента в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загустители, например пчелиный воск, твердый парафин или цетиловый спирт. Для получения приятного перорального препарата могут применяться подсластители, такие как указанные выше, и ароматизаторы. Такие композиции могут сохраняться за счет добавления антиоксиданта, такого как аскорбиновая кислота. Диспергируемые порошки и гранулы, подходящие для получения водных суспензий добавлением воды, предоставляют активный ингредиент в виде смеси с диспергирующим или смачивающим агентом,суспендирующим агентом и одним или более консервантом. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты представлены агентами, указанными выше. Также могут присутствовать другие эксципиенты, например подсластители, ароматизаторы и красители. Фармацевтические композиции по изобретению также могут быть в форме эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, например жидкий парафин, или их смеси. Подходящими эмульгаторами могут быть природные смолы, например аравийская камедь или трагакантовая камедь, природные фосфатиды, например соя, лецитин, и эфиры или неполные эфиры жирных кислот и ангидридов гексита,например сорбитана моноолеат, и продукты конденсации указанных неполных эфиров с этиленоксидом,например полиоксиэтиленсорбитана моноолеат. Эмульсии также могут содержать подсластители и ароматизаторы. Сиропы и эликсиры можно получить с подсластителями, например глицерином, пропиленгликолем,- 12017278 сорбитолом или сахарозой. Такие составы также могут содержать уменьшающее раздражение средство,консервант, отдушку и краситель. Растворы для перорального применения могут быть получены в комбинации, например, с циклодекстрином, PEG и поверхностно-активными веществами. Фармацевтические композиции могут быть в форме стерильных растворов для инъекций или масляных суспензий. Такую суспензию можно получить в соответствии с известным уровнем техники с применением тех диспергирующих или смачивающих и суспендирующих агентов, которые указаны выше. Стерильный препарат для инъекций также может быть стерильным раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, раствором в 1,3 бутандиоле. Среди приемлемых носителей и растворителей, которые могут применяться, находятся вода,раствор Рингера и изотонический раствор хлорида натрия. Кроме того, обычно в качестве растворителя или суспендирующей среды применяют стерильные жирные масла. Для такой цели можно применять любое мягкое жирное масло, включая синтетические моно-или диглицериды. Кроме того, для инъекционных составов находят применение жирные кислоты, такие как олеиновая кислота. Соединения по настоящему изобретению также могут вводиться в форме суппозиториев для ректального введения лекарства. Такие композиции можно получить смешиванием лекарства с подходящим нераздражающим эксципиентом, который является твердым при обычных температурах, но становится жидким при ректальной температуре и будет, таким образом, плавиться в прямой кишке с высвобождением лекарства. Такие материалы включают кокосовое масло и полиэтиленгликоли. Кроме того, соединения могут вводиться окулярно посредством растворов или мазей. Кроме этого может выполняться трансдермальная доставка соединений по изобретению посредством иотофоретических пэтчей и подобных. Для местного применения используют кремы, мази, желе, растворы или суспензии и т.д., содержащие соединения по настоящему изобретению. В данном описании местное применение также подразумевает применение для промывания полости рта и полоскания. Соединения по данному изобретению также можно сочетать с носителем, который представляет собой подходящие полимеры в качестве целенаправленных лекарственных носителей. Такие полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный пальмитоильными остатками. Кроме того, соединения по изобретению можно сочетать с носителем, который представляет собой класс биоразлагаемых полимеров, применимых для получения лекарства с регулируемым высвобождением, например полимолочной килотой, полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислоты, полиэпсилонкапролактоном, полигидроксибутановой кислотой,сложными полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и сшитыми или амфифильными блок-сополимерами гидрогелей. Полимеры и полупроницаемые полимерные матрицы можно формировать в изделия, такие как клапаны, стенты, трубки, протезы и подобные. В одном воплощении изобретения соединение по изобретению сочетают с полимером или полупроницаемой полимерной матрицей, которые формируют в виде стентового или стенттрансплантационного устройства.V. Способы лечения заболеваний, модулируемых CCR1 В еще одном аспекте настоящее изобретение обеспечивает способы лечения CCR1-опосредуемых состояний или заболеваний введением субъекту, имеющему такое заболевание или состояние, терапевтически эффективного количества соединения формулы I, описанного выше. Под "субъектом", как определено в данном описании, понимают животных, таких как млекопитающие, включая, но, не ограничиваясь перечисленным, приматов (например, людей), коров, овец, коз, лошадей, собак, кошек, кроликов,мышей и подобных.CCR1 обеспечивает мишень для влияния на или промотирования специфических аспектов функций иммунных клеток, или, в общем, влияния на функции, связанные с экспрессией CCR1 в широком интервале типов клеток у млекопитающего, такого как человек. Соединения, которые ингибируют CCR1, являются особенно применимыми для модуляции функции моноцитов, макрофагов, лимфоцитов, гранулоцитов, NK клеток, тучных клеток, дендритных клеток, нейрофилов и некоторых клеток-производных от иммунноцитов (например, остеокластов) для терапевтических целей. Соответственно, настоящее изобретение касается соединений, которые применимы для предотвращения и/или лечения широкого спектра воспалительных и иммунорегуляторных нарушений и заболеваний (см. Saeki, et al., Current Pharmaceutical Design 9:1201-1208 (2003. Например, соединение, которое ингибирует одну или более функций CCR1, может вводиться для ингибирования (то есть уменьшения или предотвращения) воспаления или клеточной инфильтрации,связанных с иммунным расстройством. В результате, может ингибироваться один или более воспалительных процессов, таких как лейкоцитарная эмиграция или инфильтрация, хемотаксис, экзоцитоз (например, ферментов, гистамина) или воспалительное высвобождение медиаторов. Например, по способу по настоящему изобретению можно ингибировать моноцитарную инфильтрацию в место воспаления(например, пораженный сустав при артрите или в ЦНС при МС). Аналогично, соединение, которое промотирует одну или более функций CCR1, вводят для стимуляции (индуцирования или усиления) воспалительной реакции, такой как лейкоцитарная эмиграция, хемотаксис, экзоцитоз (например, ферментов, гистамина), или высвобождения медиатора воспаления, что- 13017278 приводит к полезной стимуляции воспалительного процесса. Например, моноциты могут усиливать борьбу с бактериальными инфекциями. Заболевания и состояния, связанные с воспалением, иммунными нарушениями и инфекцией, могут лечиться с применением способа по настоящему изобретению. В предпочтительном воплощении заболевание или состояние представляет собой состояние, при котором действия иммунных клеток, таких как моноциты, макрофаги, лимфоциты, гранулоциты, NK клетки, тучные клетки, дендритные клетки, нейрофилы или некоторые клетки-производные от иммунноцитов (например, остеокласты), должны быть ингибированы или промотированы для модуляции воспалительной или аутоиммунной реакции. В одной группе воплощений заболевания или состояния, включая хронические заболевания людей и других субъектов, можно лечить модуляторами функции CCR1. Такие заболевания или состояния включают (1) аллергические заболевания, такие как системная анафилаксия или гиперчувствительность,лекарственные аллергии, аллергии на укусы насекомых и пищевые аллергии, (2) воспалительные кишечные заболевания, такие как болезнь Крона, язвенный колит, илеит и энтерит, (3) вагинит, (4) псориаз и воспалительные дерматозы, такие как дерматиты, экзема, атопические дерматиты, аллергические контактные дерматиты, крапивная лихорадка и зуд, (5) васкулит, (6) спондилоартропатии, (7) склеродерму,(8) астму и респираторные аллергические заболевания, такие как аллергическая астма, аллергический ринит, гиперчувствительность легких и подобные, (9) аутоиммунные заболевания, такие как фибромиалгия, склеродерма, анкилозный спондилит, юношеский RA, болезнь Стилла, многосуставной ювенильныйRA, малосуставной юношеский RA, ревматическая полиалгимия, ревматоидный артрит, псориатический артрит, остеоартрит, многосуставной артрит, рассеянный склероз, системная красная волчанка, диабет типа I, диабет типа II, гломерулонефрит и подобные, (10) отторжение имплантанта (включая отторжение аллотрансплантата и состояние трансплантат против хозяина) и (11) другие заболевания, при которых нежелательные воспалительные отклики или иммунные нарушения должны быть ингибированы, такие как сердечно-сосудистые заболевания, включая атеросклероз и рестеноз, миозит, нейродегенеративные заболевания (например, болезнь Альцгеймера), энцефалит, менингит, гепатит, нефрит, сепсис, саркоидоз,аллергический конъюнктивит, отит, хроническая обструктивная болезнь, синусит, синдром Бехчета и подагра, и (12) иммуноопосредованные пищевые аллергии, такие как глютеновая болезнь. В другой группе воплощений заболевания или состояния можно лечить модуляторами функцииCCR1. Примеры заболеваний, которые можно вылечивать модуляторами функции CCR1, включают онкозаболевания, сердечно-сосудистые заболевания, заболевания, в которых играют роль ангиогенез или неоваскуляризация (неопластические заболевания, ретинопатия и дегенерация желтого пятна), инфекционные заболевания (вирусные инфекции, например, ВИЧ-инфекция, и бактериальные инфекции) и иммунодепрессивные заболевания, такие как состояния при трансплантации органов и кожи. Термин "состояние при трансплантации органов" подразумевает включение состояний при трансплантации костного мозга и твердого органа (например, почки, печени, легкого, сердца, поджелудочной железы или их сочетания). Соединения по настоящему изобретению, соответственно, применимы для предотвращения и лечения широкого ряда воспалительных и иммунорегуляторных нарушений и заболеваний. В зависимости от заболевания, которое лечат, и состояния субъекта, соединения по настоящему изобретению можно вводить перорально, парентерально (например, внутримышечно, внутрибрюшинно,внутривенно, ICV, интрацистернальной инъекцией или вливанием, подкожным вливанием или вживлением), имплантацией (например, когда соединение сочетается со стентовым устройством), ингаляционно, назально, вагинально, ректально, сублингвально или местными способами введения и можно включать в состав, как индивидуально, так и в смеси подходящих стандартных лекарственных форм, содержащих традиционные нетоксичные, фармацевтически приемлемые носители, адъюванты и среды, подходящие для каждого пути введения. При лечении или предупреждении состояний, которые требуют модуляции хемокинового рецептора, подходящий уровень дозы обычно будет составлять от около 0,001 до 100 мг на кг массы тела пациента в день, который может быть введен в виде однократной дозы или нескольких доз. Предпочтительно уровень дозы будет от около 0,01 до около 25 мг/кг в день; более предпочтительно от около 0,05 до около 10 мг/кг в день. Подходящий уровень дозы может быть от около 0,01 до 25 мг/кг в день, от около 0,05 до 10 мг/кг в день или от около 0,1 до 5 мг/кг в день. Внутри этого интервала доза может составлять 0,005-0,05, 0,05-0,5 или 0,5-5,0 мг/кг в день. Для перорального введения композиции предпочтительно предоставляются в форме таблеток, содержащих 1,0-1000 мг активного ингредиента, в частности, 1,0,5,0, 10,0, 15,0, 20,0, 25,0, 50,0, 75,0, 100,0, 150,0, 200,0, 250,0, 300,0, 400,0, 500,0, 600,0, 750,0, 800,0, 900,0 и 1000,0 мг активного ингредиента для симптоматического регулирования дозы для пациента, которому назначают лечение. Соединение можно вводить по режиму от 1 до 4 раз в день, предпочтительно один или два раза в день. Должно быть понятно, однако, что специфический уровень дозы и частота приема для любого конкретного пациента может варьироваться и будет зависеть от многочисленных факторов, включая активность конкретного применяемого соединения, метаболическую стабильность и длительность действия данного соединения, возраст, массу тела, наследственные характеристики, общее состояния здоровья,- 14017278 пол и диету субъекта, также как и режим и время введения, скорость выделения, комбинацию лекарств и тяжесть конкретного состояния субъекта, подвергающегося терапии. Заболевания и состояния, связанные с воспалением, иммунным нарушением, инфекцией и раком,можно лечить или предотвращать соединениями, композициями и способами по настоящему изобретению. Соединения и композиции по настоящему изобретению можно комбинировать с другими соединениями и композициями, имеющими родственную применимость для предотвращения и лечения интересующего состояния или заболевания, такого как воспалительные или аутоиммунные состояния и заболевания, включая воспалительные кишечные заболевания, ревматоидный артрит, остеоартрит, псориатический артрит, полиартрит, рассеянный склероз, аллергические заболевания, псориаз, атопический дерматит, астму и патологии, отмеченные выше. Например, при лечении или предотвращении воспаления или аутоиммунности, или, например, артрита, связанного с потерей костной массы, соединения и композиции по настоящему изобретению можно применять в сочетании с противовоспалительным агентом или аналгетиком, таким как опиатный агонист, ингибитором липоксигеназы, таким как ингибитор 5-липоксигеназы, ингибитором циклооксигеназы, таким как ингибитор циклооксигеназы-2, ингибитором интерлейкина, таким как ингибитор интерлейкина-1, антагонистом NMDA, ингибитором оксида азота или ингибитором синтеза оксида азота, нестероидным противовоспалительным агентом или цитокинсупрессирующим противовоспалительным агентом, например, таким соединением, как ацетаминофенон, аспирин, кодеин, фентанил, ибупрофен,индометацин, кеторолак, морфин, напроксен, фенацетин, пироксикам, стероидный аналгетик, суфентанил, синлиндак, тенидап и подобные. Аналогично, соединения и композиции по настоящему изобретению можно вводить с аналгетиками, перечисленными выше; потенциатором, таким как кофеин, антагонистом H2 (например, ранитидином), симетиконом, гидроксидом алюминия или магния; противоотечным средством, таким как фенилэферин, фенилпропаноламин, псевдоэфедрин, оксиметазолин, эфинеферин,нафазолин, ксилометазолин, пропилгекседрин или леводезоксиэфедрин; средством против кашля, таким как кодеин, гидрокодон, карамифен, карбетапентан или декстрометорфан; диуретиком и седативным или неседативным антигистамином. Также соединения и композиции по настоящему изобретению можно применять в комбинации с другими лекарствами, которые применяются для лечения, предупреждения, подавления или облегчения заболеваний или состояний, для которых применяются соединения и композиции по настоящему изобретению. Такие другие лекарства можно вводить способом и в количестве, в котором они традиционно применяются, одновременно или последовательно с соединением или композицией по настоящему изобретению. Когда соединение или композиция по настоящему изобретению применяется одновременно с одним или более другими лекарственными средствами, предпочтительной является фармацевтическая композиция, содержащая такие другие лекарственные средства в дополнение к соединению или композиции по настоящему изобретению. Соответственно, фармацевтическая композиция по настоящему изобретению включает такие композиции, которые также содержат один или несколько других активных ингредиентов или терапевтических агентов, дополнительно к соединению или композиции по настоящему изобретению. Примеры других терапевтических агентов, которые можно комбинировать с соединением или композицией по настоящему изобретению и вводить либо отдельно, либо в одних и тех же фармацевтических композициях, включают, но не ограничиваются перечисленным (а) VLA-4 антагонистов, (b) кортикостероиды, такие как беклометазон, метилпреднизолон, бетаметазон, преднизон, пренизолон, дексаметазон, флутиказон, гидрокортизон, будезонид, триамцинолон, салметерол, салбутамол,форметерол; (с) иммунодепрессанты, такие как циклоспорин (циклоспорин A, Sandimmine, Neoral),такролимус (FK-506, Prograf), рапамицин (сиролимус, Rapamune) и другие иммунодепрессанты типаFK-506, и микофенолят, например, микофетил мофелита (CellCept); (d) антигистамины (HIгистаминные антагонисты), такие как бромофенирамин, хлорфенирамин, дексхлоифенирамин, трипролидин, клемастин, дифенгидрамин, дифенилпиралин, трипеленнамин, гидроксизин, метдилазин, прометазин, тримепразин, азатадин, ципрогептадин, антазолин, фенираминпериламин, астемизол, терфенадин,лоратадин, цетиризин, фексофенадин, дескарбоэтоксилоратадин и подобные; (е) нестероидные противоастматические средства (например, тербуталин, метапротеренол, фенотерол, изоэтарин, альбутерол, битолтерол и пирбутерол), теофеллин, кромолин натрия, атропин, ипратропиума бромид, антагонисты лейкотриена (например, зафмилукаст, монтелукаст, пранлукаст, иралукаст, побилукаст и SKB-106,203), ингибиторы биосинтеза лейкотриена (зилеутон, BAY-1005); (f) нестероидные противовоспалительные средства (NSAID), такие как производные пропионовой кислоты (например, алминопрофен, беноксапрофен, буклоксиновая кислота, карпрофен, фенбуфен, фенопрофен, флупрофен, флурбипрофен, ибупрофен, индопрофен, кетопрофен, рниропрофен, нарпроксен, оксапрозин, пирпрофен, пранопрофен, супрофен, тиапрофеновая кислота и тиоксапрофен), производные уксусной кислоты (например, индометацин,ацеметацин, алклофенак, клиданак, диклофенак, фенклофенак, фенклозиновая кислота, фентиазак, фурофенак, ибуфенак, изоксепак, окспинак, сулиндак, тиопинак, толметин, зидометацин и зомепирак), производные фенаминовой кислоты (например, флуфенаминовая кислота, меклофенаминовая кислота, ме- 15017278 фенаминовая кислота, нифлуминовая кислота и толфенаминовая кислота), производные бифенилкарбоновой кислоты (например, дифлунизал и флуфенизал), оксикамы (например, изоксикам, пироксикам,судоксикам и теноксикам), салицилаты (например, ацетилсалициловая кислота и сульфазалазин) и пиразолоны (например, апазон, безпиперилон, фепразон, мофебутазон, оксифенбутазон и фенилбутазон); (g) ингибиторы циклооксигеназы-2 (СОХ-2), такие как целекоксиб (Celebrex) и рофекоксиб (Vioxx); (h) ингибиторы фосфодиэстеразы типа IV (PDE IV); (i) соединения золота, такие как ауранофин и ауротиоглюкоза, (j) этанерсепт (Enbrel), (k) лечебные антитела, такие как ортоклон (ОКТ 3), даклизумаб (Zenapax), базиликсимаб (Simulect) и инфликсимаб (Remicade), (1) другие антагонисты хемокиновых рецепторов, особенно CCR5, CXCR2, CXCR3, CCR2, CCR3, CCR4, CCR7, CX3CR1 и CXCR6; (m) смазывающие средства или мягчитель, такие как вазелин и ланолин, (п) кератолитические средства (например,тазаротен), (о) производные витамина D3, например, кальципотриен или кальципотриол (Dovonex), (p)PUVA, (q) антралин (Drithrocreme), (r) этритинат (Tegison) и изотретиноин и (s) лечебные средства против рассеянного склероза, такие как интерферон -1 (Betaseron), интерферон -1 (Avonex), азатиоприн (Imurek, Imuran), глатирамера ацетат (Сарохопе), глюкокортикоид (например, преднизолон) и циклофосфамид, (t) DMARDS, такой как метотрексат, (u) другие соединения, такие как 5 аминосалициловая кислота и ее пролекарства; гидрохлорохин; D-пеницилламин; антиметаболиты, такие как азатиоприн, 6-меркаптопурин и метотрексат; ингибиторы синтеза ДНК, такие как гидроксимочевина,и разрушители микротрубочек, такие как колхицин. Массовое соотношение соединения по настоящему изобретению к второму активному ингредиенту может варьироваться и будет зависеть от эффективной дозы каждого ингредиента. Обычно будет применяться эффективная доза каждого ингредиента. Так, например, когда соединение по настоящему изобретению комбинируют с NSAID, массовое отношение соединения по настоящему изобретению к NSAID, как правило, будет колебаться от около 1000:1 до около 1:1000, предпочтительно от около 200:1 до около 1:200. Комбинации соединения по настоящему изобретению и других активных ингредиентов также, обычно, будут находиться в вышеуказанном интервале,но в каждом случае должны применяться эффективные дозы каждого ингредиента.VI. Примеры Следующие примеры иллюстрируют, но не ограничивают заявляемое изобретение. Реагенты и растворители, применяемые ниже, можно получить из коммерческих источников, таких как Aldrich Chemical Co. (Milwaukee, Wisconsin, USA). 1 Н-ЯМР спектры записывали на ЯМРспектрометре Varian Mercury, 400 МГц. Значимые пики получали относительно ТМС и приводили в порядке мультиплетности (с-синглет; д-дублет; т-триплет; к-квадруплет; м-мультиплет) и числа протонов. Результаты масс-спектрометрии представлены как отношение массы заряда с последующей относительной распространенностью каждого иона (в круглых скобках). В примерах одно значение m/e представлено для М+Н (или, как показано, М-Н) иона, содержащего самые общераспространенные атомные изотопы. Набор изотопов соответствует ожидаемой формуле во всех случаях. Анализ масс-спектрометрией с ионизацией электронным распылением (ESI) проводили на масс-спектрометре с ионизацией электронным распылением Hewlett-Packard MSD с применением ВЭЖХ HP 1100 для доставки образца. Обычно аналит растворяли в метаноле в 0,1 мг/мл и вводили 1 мкл с растворителем для доставки в массспектрометр, который сканировал от 100 до 1500 Да. Все соединения можно анализировать в положительном режиме ESI с применением смеси ацетонитрил/вода с 1% муравьиной кислотой в качестве растворителя для доставки. Соединения, приведенные ниже, также можно анализировать в режиме негативного ESI с применением 2 мМ NH4OAc в смеси ацетонитрил/вода в качестве системы для доставки. Соединения в объеме данного изобретения можно синтезировать так, как описано ниже, с применением различных реакций, известных специалистам в данной области. Примеры применяемых путей синтеза азаиндазольных производных и некоторых соединений по изобретению показаны ниже или по всей настоящей заявке. В описаниях синтеза, которые следуют, некоторые арилпиперазиновые и гетероароматические элементы-предшественники получают из коммерческих источников. Такие коммерческие источники включают Aldrich Chemical Co., Acros Organics, Ryan Scientific Incorporated, Oakwood ProductsIncorporated, Lancaster Chemicals, Sigma Chemical Co., Lancaster Chemical Co., TCI-America, Alfa Aesar,Davos Chemicals и GFS Chemicals. Некоторые релевантные арилпиперазины могут быть коммерчески доступны. Другие можно получить так, как описано в заявке на патент США 11/008 774, включенной в качестве ссылки. Для соединения арилпиперазиновых и гетероароматических элементов также можно применять стандартные химические реактивы (которые могут быть коммерчески доступны или получены способами, приведенными ниже) с использованием оптимизированного подходящим образом линкера, такого как ацетильное звено, как описано в данном изобретении. Специалистам в данной области также будет понятно, что для синтеза целевых соединений по данному изобретению можно использовать альтернативные способы и что подходы, описанные в данном изобретении, не являются исчерпывающими, но обеспечивают наиболее широко применяемые и практические пути синтеза, представляющие интерес. Некоторые молекулы, заявленные в данной заявке на патент, могут существовать в различных энантиомерных и диастереомерных формах, и все такие варианты указанных соединений включены в- 16017278 заявку. Региоизомерия представляет собой широкоизвестное свойство в органической химии и особенно обычное по отношению к некоторым структурным типам, приведенным в данном описании. Специалистам в данной области будет понятно в отношении соединений, описанных в данном описании, что реакции сочетания с гетероароматическими кольцевыми системами могут приводить или к одному или к смеси определяемых региоизомеров. Дается детальное описание экспериментальных процедур, которые применяются для синтеза ключевых соединений в этом тексте, и получаемые молекулы описываются физическими данными, идентифицирующими их, так же как и структурными описаниями, связанными с ними. Специалистам в данной области также будет понятно, что в процессе стандартной обработки в органической химии часто применяются кислоты и основания. Иногда во время экспериментальных процедур по данной заявке на патент получают соли исходных соединений, если соединения обладают необходимой присущей кислотностью или основностью. Пример 1. Синтез 1 Н-пиразоло[4,3-b]пиридина 2-Хлор-3-формилпиридин (15,02 г, 106 ммоль, 1 экв), гидразин (10 мл, избыток) и диоксан (90 мл) смешивают в запаянной трубке и нагревают при 150 С в течение 16 ч. После охлаждения до комнатной температуры растворитель выпаривают в вакууме и получают сырой остаток, который разбавляют дихлорметаном (600 мл). Органический раствор промывают водой (50 мл), рассолом (50 мл) и сушат над безводным сульфатом натрия. Растворитель удаляют в вакууме и получают 1H-пиразоло[4,3-b]пиридин в виде желтого порошка, который применяют без дальнейшей очистки: ЖХМС (ES) М+Н 120,3, Rf 0,20 мин (Agilent Zorbax SB-C18, 2.150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1 мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрил/94,9% воды,В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 2. Синтез 3-тиазол-2-ил-1 Н-пиразоло[4,3-b]пиридина К суспензии 2-хлор-3-[(2-тиазолил)карбонил]пиридина (257,5 мг, 1,2 ммоль, 1 экв) в диоксане (3 мл) в запаянной трубке добавляют гидразин (2 мл). Смесь греют при 150 С в течение ночи, охлаждают до rt и концентрируют в вакууме, и получают сырой остаток. Полученный остаток разбавляют дихлорметаном (300 мл), промывают водой (50 мл) и рассолом (50 мл). Органический слой отделяют, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме и получают 3-тиазол-2-ил-1H-пиразоло[4,3b]пиридин (212,3 мг) в виде желтого порошка, который применяют без дальнейшей очистки: ЖХМС(ES), М+Н 203,5, Rf 2,68 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5 мин градиент от 20% до 100% В с 1,1 мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9 ацетонитрила). Пример 3. Синтез 1H-пиразоло[4,3-b]пиридин-3-иламина. 2-Хлор-3-цианопиридин (2,77 г), гидразин (5 мл) и диоксан (100 мл) смешивают в запаянной трубке и греют при 150 С в течение 16 час. Реакционную смесь охлаждают до rt, концентрируют в вакууме, и получают сырой остаток. Полученный остаток растворяют в этилацетате (100 мл) и промывают насыщенным раствором NaCl (50 мл). Органический слой сушат над сульфатом натрия, фильтруют и концентрируют в вакууме, и получают 1H-пиразоло [4,3-b]пиридин-3-иламин в виде желтого твердого вещества, которое применяют без дальнейшей очистки. Пример 4. Синтез 1H-пиразоло [3,4-с] пиридина. Получение 3-N-ацетиламино-4-метилпиридина. К раствору 3-амино-4-метилпиридина (540,2 мг, 5,0 ммоль, 1 экв) в дихлорметане (20 мл) добавляют пиридин (0,8 мл, 10,0 ммоль, 2 экв) и уксусный ангидрид (0,57 мл, 6,0 ммоль, 1,2 экв). Полученный раствор перемешивают при комнатной температуре в течение 16 ч и концентрируют в вакууме для получения сырого остатка. Остаток разбавляют дихлорметаном (200 мл) и промывают насыщенным водным раствором бикарбоната натрия (50 мл) и рассолом (50 мл). Органический слой отделяют, сушат над сульфатом натрия и концентрируют в вакууме, и получают 3-ацетиламино-4-метилпиридин (400,2 мг) в виде желтого твердого вещества, которое применяют без дальнейшей очистки.- 17017278 Получение 1-пиразоло[3,4-с]пиридин-1-илэтанона К суспензии 3-ацетиламино-4-метилпиридина (301,5 мг, 2,0 ммоль, 1 экв) в толуоле (3 мл) добавляют трет-бутил нитрит (трет-BuONO) (420 мкл, 3,2 ммоль, 1,6 экв), уксусный ангидрид (560 мкл, 6,0 ммоль, 3 экв) и ацетат калия (235,2 мг, 2,4 ммоль, 1,2 экв). Полученную смесь греют при 80 С 2 ч, охлаждают до rt и разбавляют этилацетатом (200 мл). Смесь промывают насыщенным раствором бикарбоната натрия (50 мл), водой (50 мл) и рассолом (50 мл). Органический слой сушат над сульфатом натрия и концентрируют в вакууме, и получают сырой остаток. Остаток очищают флэш-хроматографией (диоксид кремния, 15% этилацетата/гексан - 50% этилацетата/гексан) и получают 1-пиразоло[3,4-с]пиридин-1-илэтанон (20,2 мг), который применяют без дальнейшей очистки. Синтез 1 Н-пиразоло[3,4-с]пиридина К раствору 1-пиразоло[3,4-с]пиридин-1-ил-этанона (20,2 мг, 0,17 ммоль, 1 экв) в тетрагидрофуране(2 мл) и метаноле (0,5 мл) добавляют водный раствор гидроксида натрия (2 М, 0,25 мл). Реакционный раствор перемешивают при комнатной температуре в течение 1 ч и затем концентрируют в вакууме с образованием сырого остатка. Сырой остаток разбавляют водой (20 мл) и экстрагируют дихлорметаном(2100 мл). Объединенные органические слои промывают рассолом, сушат над сульфатом натрия и концентрируют в вакууме с получением 1 Н-пиразоло[3,4-с]пиридина в виде белого порошка, который применяют без дальнейшей очистки. ЖХМС (ES), М+Н 120.3, Rf 0,22 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20% до 100% В с 1,1 мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9 % ацетонитрила). Пример 5. Синтез 3-иод-1H-пиразоло[4,3-b] пиридина К раствору 1 Н-пиразоло[4,3-b]пиридина (500,0 мг, 4,2 ммоль, 1 экв) в ДМФА (10 мл) при 0 С добавляют иод (2,13 г, 8,4 ммоль, 2 экв) и гидроксид калия (943 мг, 16,8 ммоль, 4 экв). Полученную смесь нагревают до rt и перемешивают 1 ч. Реакционный раствор медленно гасят насыщенным раствором тиосульфата натрия (Na2S2O5) (10 мл) и экстрагируют этилацетатом (2200 мл). Объединенные органические слои промывают водой (350 мл), рассолом (50 мл), сушат над сульфатом натрия и концентрируют в вакууме с получением 3-иод-1 Н-пиразоло[4,3-b]пиридина (1,02 г) в виде желтого порошка, который применяют без дальнейшей очистки. ЖХМС (ES), М+Н 246,2, Rf 2,17 мин (Agilent Zorbax SB-C18,2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5- мин градиент от 20% до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% вода/94,9% ацетонитрила). Пример 6. Синтез 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1-илэтанона и 1-[4-(4-хлоро-2-фторо-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2 пиразоло[4,3-b]пиридин-2-илэтанона(20,00 г, 143,2 ммоль, 10 экв) растворяют в диметилформамиде (ДМФА) (10 мл) и греют при 80 С 1 ч,затем охлаждают до комнатной температуры. Полученную смесь разбавляют этилацетатом (300 мл) и промывают водой (3150 мл) и рассолом (100 мл). Органический слой сушат (Na2SO4) и концентрируют в вакууме с получением сырого остатка. Сырой остаток очищают флэш-хроматографией (диоксид кремния, 100% этилацетат с 1% триэтиламина - 100% ацетона с 1% триэтиламина), и получают 1-[4-(4-хлор 2-фтор-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1-илэтанон (2,3 г) и 1-[4(4-хлоро-2-фторо-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-2-илэтанон(2,5 г). Для 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1 илэтанона; ЖХМС (ES), М+Н 418,5, Rf 2,34 мин (Agilent Zorbax SB-C18,2.150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20% до 100% В с 1,1 мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрил). Для 1-[4-(4-хлоро-2-фторо-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-2 илэтанона. ЖХМС (ES), М+Н 418,5, Rf 2,00 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, от 2,5 мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Получение 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-(3-иодпиразоло[4,3b]пиридин-1-ил)этанона. Данное соединение синтезируют согласно процедуре синтеза, описанной в примере 6. Синтез 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-(3-оксазол-2-илпиразоло[4,3-b]пиридин-1-ил)этанона К раствору оксазола (40 мкл, 0,54 ммоль, 3 экв) в тетрагидрофуране (1 мл) в атмосфере азота по каплям добавляют н-бутил литий (2,5 М в гексане, 220 мкл, 0,54 ммоль, 3 экв). Полученную смесь перемешивают при -78 С дополнительно 30 мин, затем прибавляют ZnCl2 (0,5M в ТГФ, 1,5 мл, 0,72 ммоль, 4 экв). Реакционный раствор нагревают до 0 С и перемешивают 1 ч, затем добавляют 1-[4-(4-хлор-2-фтор 5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-(3-иодпиразоло[3,4-b]пиридин-1-ил)этанон (100,2 мг,0,18 ммоль, 1 экв) и тетракис(трифенилфосфин) палладия (22,3 мг, 0,018, 0,1 экв). Затем реакционную смесь кипятят с обратным холодильником в течение 48 ч, охлаждают до rt и разбавляют этилацетатом(150 мл). Реакционную смесь промывают водой (20 мл), рассолом (20 мл), сушат над сульфатом натрия и концентрируют в вакууме с получением сырого продукта. Очистка препаративной ВЭЖХ дает требуемый продукт 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-(3-оксазол-2-илпиразоло[4,3-b]пиридин-1-ил)этанон в виде белого порошка (38,5 мг). ЖХМС (ES), М+Н 485,5, Rf 2,56 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1 мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды,В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 8. Синтез 1-[4-(4-хлоро-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-1 илэтанона и 1-[4-(4-хлоро-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-2-илэтанона. Два названных в заголовке соединения синтезируют в соответствии с процедурой синтеза, описанной в примере 6. Для 1-[4-(4-хлоро-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-1 илэтанона. 1 Н ЯМР (400 МГц, CDCl3)8,57 (dd, 1H), 8,1 1(s, 1H), 8,09 (dd, 1H), 7,22(d, 1H), 7,17 (dd, 1H), 6,49 Два названных в заголовке соединения синтезируют в соответствии с процедурой, описанной в примере 6. Для 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-пиразоло[4,3 с]пиридин-1-илэтанона: ЖХМС (ES), М+Н 418,5, Rf 1,74 мин (Agilent Zorbax SB-C18, 2,150 мм, 5,- 19017278 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20% до 100% В с 1,1 мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Для 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2 пиразоло[4,3-с]пиридин-2-илэтанона. ЖХМС (ES) М+Н 418,5, Rf 1,69 мин (Agilent Zorbax SB-C18,2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20% до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 11. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-1 илэтанона и 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-2-илэтанона. Два названных в заголовке соединения синтезируют в соответствии с процедурой, описанной в примере 6. Для 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-1-илэтанона. 1 Н ЯМР Два названных в заголовке соединения синтезируют в соответствии с процедурой, описанной в примере 6. Для 1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-пиразоло[3,4-b]пиридин-1 илэтанона: ЖХМС (ES), М+Н, 404,5, Rf 2,14 мин (Agilent Zorbax SB-C18, 2.150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20% до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9 ацетонитрила %). Для 1-[4-(4-хлор-2-фтор-5-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-2-илэтанона: ЖХМС(ES) М+Н, 404,5, Rf 1,76 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5 мин градиент от 20% до 100% В с 1,1 мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% вода, В=0,1% муравьиной кислоты/5% воды/94,9 % ацетонитрила). Пример 13. Синтез 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)метилпиперазин-1-ил]-2-(3-тиазол-2 ил-пиразоло[4,3-b]пиридин-1-ил)этанона Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 6. ЖХМС (ES) М+Н 501,5, Rf 2,82 мин (Agilent Zorbax SB-C18, 2,1 50 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9 % ацетонитрила). Пример 14. Синтез 3-пирид-2-ил-1H-пиразоло [4,3-b]пиридина Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 2. Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 6. ЖХМС (ES), М+Н 495,54, Rf 2,73 мин (Agilent Zorbax SB-C18, 2,1 50 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% вода/94,9% ацетонитрила). Пример 16. Синтез 3-хлор-1 Н-пиразоло[4,3-b]пиридина 1 Н-Пиразоло[4,3-b]пиридин (89 мг) и N-хлорсукцинимид (220 мг) смешивают в CH2Cl2 (4 мл) и греют при 45 С в течение 16 час, затем охлаждают до комнатной температуры. Полученную смесь очищают флэш-хроматографией (силикагель, 50% гексана/этилацетат) и получают 3-хлор-1 Н-пиразоло[4,3b]пиридин. Пример 17. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-хлорпиразоло[3,4b]пиридин-1-ил)этанона. Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 6. ЖХМС (ES), М+Н 420,5, Rf 2,37 мин (Agilent Zorbax SB-C18, 2,1 50 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5 мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% вода, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 18. Синтез 3-метил-1H-пиразоло[4,3-b]пиридина К раствору 2-хлор-3-цианопиридина (139 мг) в тетрагидрофуране (5 мл) при 0 С добавляют по каплям раствор MeMgBr (3M в эфире, 0,67 мл). Полученную смесь нагревают до rt и перемешивают 3 ч. Реакционный раствор охлаждают до 0 С, и добавляют к нему водный раствор HCl (2 М, 5 мл). Затем реакционный раствор перемешивают дополнительно в течение 16 ч при комнатной температуре и нейтрализуют добавлением насыщенного раствора бикарбоната натрия (NaHCO3). Реакционный раствор фильтруют для удаления любого осадка, и фильтрат промывают этилацетатом (310 мл) и водным солевым раствором (NaCl) (10 мл). Органический слой сушат над сульфатом натрия (Na2SO4), фильтруют и концентрируют в вакууме и получают 3-ацетил-2-хлорпиридин в виде желтого порошка, который применяют без дальнейшей очистки. Названное в заголовке соединение (3-метил-1H-пиразоло[4,3-b]пиридин) синтезируют из 3-ацетил-2-хлорпиридина в соответствии с процедурой, описанной в примере 2. Пример 19. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-метилпиразоло[3,4b]пиридин-1-ил)этанона. Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 6. ЖХМС (ES), М+Н 400,5, Rf 2,12 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1 мин-промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 20. Синтез 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]-2-(3 метилпиразоло[4,3-b]пиридин-1-ил)этанона. Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 6. ЖХМС (ES), М+Н 463,5, Rf 2,32 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20% до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% вода/94,9% ацетонитрила). Пример 22. Синтез 1-[4-(4-хлоро-3-метоксифенил)пиперазин-1-ил]-2-(3-тиазол-2-ил-пиразо][4,3b]пиридин-1-ил)этанона. Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 6. ЖХМС (ES) М+Н 469,5, Rf 2,43 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20% до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% вода, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 23. Синтез 2-(3-аминопиразоло[4,3-b]пиридин-1-ил)-1-[4-(4-хлор-2-фтор-5-метоксифенил)2-метилпиперазин-1-ил]этанона. 1 Н-пиразоло[4,3-b]пиридин-3-иламин (67 мг), 2-хлор-1-[4-(4-хлор-2-фтор-5-метоксифенил)-2 метилпиперазин-1-ил]этанон (167 мг) и K2CO3 (414 мг) смешивают в ДМФА (1 мл) и греют при 80 С 2 ч,затем охлаждают до комнатной температуры. Полученную смесь очищают препаративной ВЭЖХ и получают 2-(3-аминопиразоло[3,4-b]пиридин-1-ил)-1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-метилпиперазин-1-ил]этанон в виде желтого порошка. ЖХМС (ES), М+Н 433,5, Rf 2,06 мин (Agilent Zorbax SB-C18,2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 24. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-оксазол-2-ил-пиразоло[4,3b]пиридин-1-ил)этанона Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 7. ЖХМС (ES) М+Н 453,5, Rf 2,20 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20% до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9 % ацетонитрила). Пример 25. Синтез 3-фтор-1 Н-пиразоло[4,3-b]пиридин Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 5 с применением SelectFluor (1-хлорметил-4-фтор-1,4-диазониабицикло[2.2.2]октанбис(тетрафторборат в качестве электрофила. Пример 26. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-фторпиразоло[3,4- 22017278 Названное в заголовке соединение синтезируют в соответствии с процедурой, описанной в примере 6. ЖХМС (ES), М+Н 404,5, Rf 2,27 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 27. Синтез 1-2-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил-1 Н-пиразоло [4,3b] пиридин-3-карбонитрила(128 мг) и CuCN (112 мг) смешивают в N-метилпиридоне (NMP) (1 мл) и греют при 165 С 16 ч, затем охлаждают до комнатной температуры. Реакционную смесь очищают препаративной ВЭЖХ и получают 1-2[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-оксоэтил-1 Н-пиразоло[4,3-b]пиридин-3-карбонитрил в виде белого порошка. ЖХМС (ES), М+Н 411,5, Rf 2,33 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С,скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 28. Синтез 1 Н-пиразоло[4,3-b]пиридина Два названных в заголовке соединения синтезируют в соответствии с процедурой, описанной в примере 6. Для 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-пиразоло[4,3-b]пиридин-1-илэтанона: 1 Н ЯМР (400 Гц, ДМСО-6)8,71 (dd, 1H), 8,26 (s, 1H), 8.04 (dd, 1 Н), 7,36 (dd, 1H), 7,20 (d, 1H), 6,69 Получение этилового эфира пиразоло[4,3-b]пиридин-2-илуксусной кислоты Данное соединение синтезируют в соответствии с процедурой, описанной в примере 6, с примене- 23017278 нием этилового эфира хлоруксусной кислоты вместо 2-хлор-1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)метилпиперазин-1-ил]этанона. Получение этилового эфира (3-хлорпиразоло[4,3-b]пиридин-2-ил)уксусной кислоты: К раствору этилового эфира пиразоло[4,3-b]пиридин-2-илуксусной кислоты 57 (40,2 мг, 0,2 ммоль,1 экв) в 1 мл дихлорметана добавляют NCS (32,7 мг, 1,2 ммоль, 1,2 экв). Полученную смесь греют до 70 С 30 мин, охлаждают до rt и разбавляют 100 мл дихлорметана. Органический раствор промывают 50 мл насыщенного водного раствора бикарбоната натрия и 50 мл рассола. Органический слой отделяют и сушат над сульфатом натрия. Выпаривание растворителя в вакууме дает 46,7 мг этилового эфира (3 хлор-пиразоло[3,4-b]пиридин-2-ил)уксусной кислоты в виде желтого твердого вещества. Синтез 2-(3-хлорпиразоло[4,3-b]пиридин-2-ил)уксусной кислоты Этиловый эфир (3-хлор-пиразоло[4,3-b]пиридин-2-ил)уксусной кислоты обрабатывают IN раствором гидроксида лития (LiOH) (1 экв) в 1 мл МеОН, и получают 2-(3-хлорпиразоло[3,4-b]пиридин-2 ил)уксусную кислоту, которую применяют непосредственно в следующих реакциях без дальнейшей очистки. ЖXMC(ES), M+H 212,0, Rf 0,34 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35C, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1 мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 31. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-хлорпиразоло[3,4b]пиридин-2-ил)этанона. Названное в заголовке соединение синтезируют в стандартных условиях получения амидов с применением гексафторфосфата 2-(7-аза-1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (HATU) в качестве реагента сочетания. ЖXMC(ES), M+H 420,4, Rf 2,17 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С,скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). Пример 32. Синтез 2-(пиразоло[4,3-b]пиридин-1-ил-7-оксид)уксусной кислоты Получение этилового эфира 2-(пиразоло[4,3-b]пиридин-1-ил-7-оксид)уксусной кислоты. К раствору этилового эфира пиразоло[4,3-b]пиридин-1-ил-уксусной кислоты (205,4 мг, 1 ммоль, 1 экв) в 10 мл дихлорметана при 0 С добавляют мета-хлорпероксибензойную кислоту (м-СРВА) (345,3 мг, 1,5 ммоль, 1,5 экв). Полученную смесь нагревают до rt и реакционную смесь перемешивают в течение ночи. К реакционной смеси добавляют 1 мл пиридина, и смесь перемешивают еще 30 мин перед удалением растворителя и получением остатка. Остаток разбавляют 200 мл дихлорметана и промывают водным 1N растворомNaOH (10 мл 2) и рассолом (20 мл). Органический слой отделяют и сушат над сульфатом натрия. Упаривание в вакууме дает этиловый эфир 2-(пиразоло[4,3-b]пиридин-1-ил-7-оксид)уксусной кислоты в виде бледно желтого твердого вещества, которое применяется без дальнейшей очистки. ЖXMC(ES), M+H 222,4, Rf 1,48 мин (Agilent Zorbax Названное в заголовке соединение синтезируют в стандартных условиях получения амидов так, как описано в примере 43, с применением HATU в качестве реагента сочетания. ЖХМС(ES), М+Н 402,5, Rf 1,54 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды,В=0,1% муравьиной кислоты/5% вода/94,9% ацетонитрила). 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-метилпиразоло[3,4 2-Хлор-3-циано-6-пиколин восстанавливают гидридом диизобутилалюминия (DIBAL-H) в соответствии с литературной методикой (Baker et. al., J. Org. Chem., 1980, 45, 1354-1362.) и затем проводят конденсацию с гидразином, как описано в примере 1, для получения соответствующего 6-метил-1Hпиразоло[4,3-b]пиридина, который затем подвергают алкилированию по методике, описанной в примере 6, и получают соединение в виде белого порошка. ЖХМС (ES), М+Н 400,5, Rf 2,161 мин (Agilent Zorbax Получение этилового эфира (6-метил-пиразоло[4,3-b]пиридин-2-ил)уксусной кислоты. К раствору 1 Н-6-метилпиразоло[4,3-b]пиридина (1 ммоль, 1 экв) в 3 мл ТГФ порциями добавляют NaH (1,5 ммоль,1,5 экв) при 0 С в атмосфере азота. Полученную смесь перемешивают при 0 С 10 мин, затем медленно добавляют избыток 2-хлорэтилацетата при 0 С. Полученную смесь медленно нагревают до rt и перемешивают еще 2 ч. К реакционной смеси добавляют насыщенный водн. раствор NH4Cl, и водную смесь экстрагируют 300 мл EtOAc. Органический экстракт отделяют и промывают насыщ. водн. раствором бикарбоната натрия и рассолом, фильтруют и сушат над сульфатом натрия. Органический растворитель удаляют в вакууме и сырой остаток очищают хроматографией на силикагеле, и получают 50,2 мг требуемого продукта. ВЭЖХ, время удерживания = 0,78 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин, 2,5-мин градиент от 20% до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила). МС (ES), М+Н ожидаемый = 220,1, найденный = 220,4. Получение (6-метилпиразоло[4,3-b]пиридин-2-ил)уксусной кислоты. Данное соединение синтезируют по стандартной методике гидролиза сложных эфиров, как описано в примере 30, с применением 1NLiOH в качестве основания. Выделенный продукт применяют на следующей стадии без очистки. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(6-метилпиразоло[3,4-b]пиридин-2-ил)этанона. Названное в заголовке соединение синтезируют по стандартной методике пептидного сочетания с применением HATU в качестве агента сочетания. 1 Н ЯМР (400 МГц, CDCl3)8,04 (s, 1 Н), 7,96 (d, 1H), 7,20 (d, 1H), 6,95 (d, 1H), 6,45(d, 1H), 6,40 (dd,1H), 5,29 (s, 2 Н), 3,92 (m, 2 Н), 3,88(s, 3H), 3,78 (m, 2 Н), 3,13 (m, 4 Н). ЖХМС, найдено для (М+Н)+ 400,5. Пример 36. Синтез 1-[4-(4-хлоро-3-метоксифенил)пиперазин-1-ил]-2-(3-морфолин-4-илпиразоло[4,3-b]пиридинин-1-ил)этанона(102,4 мг), морфолина (0,20 мл), ксантфоса (35 мг), Pd2(dba)3 (18,3 мг) и Cs2CO3 (97 мг) в ТГФ (1 мл) греют при 80 С в течение 12 час. Реакционную смесь охлаждают до комнатной температуры, разбавляютEtOAc (3 мл) и фильтруют. Фильтрат упаривают в вакууме. Сырой остаток очищают флэшхроматографией (диоксид кремния, гексан/EtOAc) и получают названное в заголовке соединение в виде белого порошка. ЖХМС (ES), М+Н 471,6, Rf 2,043 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С, скорость потока 1 мл/мин, 2,5-мин градиент от 20 до 100% В с 1,1-мин промывкой 100% В; А=0,1% муравь- 25017278 иной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% вода/94,9% ацетонитрила). Пример 37. Синтез 1-[4-(4-хлор-2-фтор-5-метоксифенил)-2-(S)-метилпиперазин-1-ил]-2-пиразоло[3,4-с]пиридин-1-ил-этанона Смесь 6-азаиндазола (119 мг) и Н 2 О 2 (0,2 мл) в уксусной кислоте (5 мл) греют при 60 С 2 ч. Полученную смесь охлаждают до rt и концентрируют в вакууме. Сырой остаток растворяют в EtOAc (10 мл),промывают насыщ. водным раствором NaHCO3 (3 мл), сушат (Na2SO4), фильтруют и упаривают в вакууме. Сырой продукт (N-оксид) подвергают алкилированию по методике, описанной в примере 6, для получения названного в заголовке продукта в виде белого порошка. ЖХМС (ES), М+Н 402,4, Rf 2,147 мин Получение 1 Н-4-хлор-пиразоло[4,3-с]пиридина К смеси 2-хлор-4-иодпиридин-3-карбальдегида (6,24 ммоль, 1 экв.) и 5 мл этанола добавляют 4 мл гидразина (избыток), и полученную смесь перемешивают при rt 6 ч. Реакционный раствор концентрируют в вакууме и сырой продукт разбавляют 50 мл воды и экстрагируют 500 мл дихлорметана. Затем органический слой промывают рассолом, сушат над безводным сульфатом натрия, фильтруют и концентрируют с получением сырого остатка. Сырой остаток растворяют в 10 мл дихлорметана и перемешивают 5 мин. Выпавшее в осадок твердое вещество отделяют фильтрацией, промывают 2 мл дихлорметана и сушат в вакууме и получают 350,2 мг 1 Н-4-хлорпиразоло[4,3-с]пиридина. ВЭЖХ, время удерживания = 0,44 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин, 2,5 минутный градиент от 20 до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES): М+Н ожидаемый = 154,0, найденный =154,3. Синтез 1-(4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-хлорпиразоло[4,3-с]пиридин-2-ил)этанона Названное в заголовке соединение синтезируют по стандартной методике алкилирования, приведенной в примере 6, с применением 1 Н-4-хлор-пиразоло[4,3-с]пиридина. 1 Н ЯМР (400 МГц, CDCl3)8,18 (d, 1H), 7,31(dd, 1H), 7,21 (d, 1H), 6,47 (d, 1H), 6,42 (dd, 1H), 5,28 (s,2H), 3,88 (s, 3H), 3,77 (m, 4H), 3,14 (m, 4 H). ЖХМС, найдено для (М+Н)+ 420,4. Пример 40. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-иодпиразоло[4,3-с]пиридин 1-ил)этанона и 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-иодпиразоло[4,3-с]пиридин-2-ил)этанона- 26017278 Получение 1H-4-иодпиразоло[3,4,b]пиридина К смеси 2-хлоро-4-иодпиридин-3-карбальдегида (6,24 ммоль, 1 экв) и 5 мл этанола добавляют 4 мл гидразина (избыток) и полученную смесь перемешивают при комнатной температуре 6 ч. Реакционную смесь концентрируют в вакууме и сырой продукт разбавляют 50 мл воды и экстрагируют 500 мл дихлорметана. Органический слой промывают рассолом, сушат над безводным сульфатом натрия и концентрируют в вакууме, и получают сырой остаток. К полученному остатку добавляют 10 мл дихлорметана, полученную смесь перемешивают 5 мин, при этом выпадает осадок нежелательного изомера циклизации (1H-4-хлор-пиразоло[4,3,с]пиридина), который удаляют фильтрованием. Фильтрат концентрируют в вакууме и очищают на колонке с силикагелем (от 35% ацетона до 50% ацетона в гексане), и получают 250,0 мг 1 Н-4-иодпиразоло[3,4,с]пиридина с чистотой около 85%, который применяют без дальнейшей очистки. ВЭЖХ, время удерживания = 1,22 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20 до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES) М+Н ожидаемый = 246,0, найденный =246,1. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-иодпиразоло[4,3-с]пиридин-1-ил)этанона и 1[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-иод-пиразоло[4,3-с]пиридин-2-ил)этанона Названные в заголовке соединения синтезируют по стандартной методике алкилирования, описанной в примере 6. Для 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(4-иодпиразоло[4,3-с]пиридин-1 ил)этанона. ВЭЖХ время удерживания = 2,50 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20 до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES) М+Н ожидаемый = 512,0, найденный = 512,4; для 1-[4-(4-хлор-3 метоксифенил)пиперазин-1-ил]-2-(4-иодпиразоло[4,3-с]пиридин-2-ил)этанона: ВЭЖХ, время удерживания = 2,23 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин,2,5-минутный градиент от 20% до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС(0,1 ммоль, 1 экв), CuI (0,3 ммоль, 3 экв.) и NaSO2Me (0,3 ммоль, 1 экв) в 1 мл ДМСО греют при 80 С 2 ч. Реакционный раствор охлаждают до rt и разбавляют 20 мл насыщ. водн. раствора NH4Cl и 200 мл EtOAc. Разбавленную смесь энергично перемешивают 2 ч. Затем органический слой отделяют, промывают рассолом, сушат над сульфатом натрия, фильтруют, концентрируют в вакууме и получают сырой продукт. Очистка ВЭЖХ дает 40,2 мг требуемого продукта. 1 Н ЯМР (400 МГц, CDCl3)8,76 (d, 1H), 8,49(d, 1H),7,65 (d, 1H), 7,23 (d, 1H), 6,50 (d, 1H), 6,44 (dd, 1H), 5,53 (s, 2H), 3,89 (s, 3H), 3,79 (m, 4H), 3,22 (m+s,4H+3H). ЖХМС найдено для (М+Н)+: 464,4. Пример 42. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-амидометил-пиразоло[4,3b]пиридин-1-ил)этанона Получение этилового эфира (3-метилпиразоло[4,3-b]пиридин-1-ил)уксусной кислоты. Данное соединение синтезируют, следуя стандартной методике алкилирования, подобной описанной в примере 6. ВЭЖХ, время удерживания = 2,06 минут (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20% до 100% В с 1,1-минутной промывкой 100% В(А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES), М+Н ожидаемый = 220,1, найденный = 220,4. Получение этилового эфира [3-(бромометил)пиразоло[4,3-b]пиридин-1-ил)уксусной кислоты. Смесь(3-метилпиразоло[4,3-b]пиридин-1-ил)этилацетата (2,5 ммоль, 1 экв.), NBS (3,0 ммоль, 1,2 экв.) и пероксида бензоила (0,05 ммоль, 0,02 экв.) в 10 мл CCl4 кипятят с обратным холодильником в течение 1,5 ч. Полученную смесь охлаждают до rt и разбавляют 500 мл EtOAc. Затем полученный раствор промывают 100 мл насыщ. водного раствора бикарбоната натрия, рассолом, сушат над безводным сульфатом натрия,- 27017278 фильтруют и концентрируют в вакууме. Сырой остаток очищают хроматографией на силикагеле (от 20%EtOAc в гексане до 35% EtOAc в гексане) и получают 450,2 мг требуемого продукта. ВЭЖХ, время удерживания = 2,50 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20 до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES), М+Н ожидаемый = 298,0, найденный =298,3. Получение этилового эфира (3-азидопиразоло[4,3-b]пиридин-1-ил)уксусной кислоты Смесь этилового эфира (3-(бромометил)пиразоло[4,3-b]пиридин-1-ил)уксусной кислоты (0,5 ммоль,1 экв.) и азида натрия (1 ммоль, 2 экв.) в 1 мл ДМФА греют при 80 С 1 ч. Полученную смесь охлаждают до rt, разбавляют 150 мл EtOAc, промывают водой (40 мл 3), рассолом, сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Растворитель удаляют в вакууме и получают 135,2 мг требуемого продукта: ВЭЖХ время удерживания = 1,84 мин (Agilent Zorbax SB-C18, 2,150 мм, 5,35 С) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20 до 100% В с 1,1 минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES), М+Н ожидаемый = 261,1, найденный =261,4. Получение [3-(азидометил)пиразоло[4,3-b]пиридин-1-ил)уксусной кислоты Данное соединение синтезируют по стандартной методике гидролиза, описанной в примере 30, с применением 1N LiOH. ВЭЖХ, время удерживания = 1,94 мин (Agilent Zorbax SB-C18, 2,150 мм, 5,35 С) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20 до 100% В с 1,1 минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES), М+Н ожидаемый = 233,1, найденный =233,4. Получение 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-азидо метилпиразоло[4,3-b]пиридин-1-ил)этанона Данное соединение синтезируют по стандартной методике пептидного сочетания, как описано ниже в примере 43, с применением HATU в качестве реактива сочетания. ВЭЖХ, время удерживания = 2,36 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин, 2,5 минутный градиент от 20 до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% вода/94,9% ацетонитрила); МС (ES) М+Н ожидаемый = 441,2, найденный = 441,5. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-амидометилпиразо ло[4,3-b]пиридин-1-ил)этанона К раствору 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-азидометилпиразоло[4,3-b]пиридин 1-ил)этанона (0,21 ммоль, 1 экв) в 2 мл ТГФ по каплям при комнатной температуре добавляют растворHCl соли трис(2-карбоксиэтил)фосфина в 0,5 мл воды. Полученную смесь перемешивают при rt 30 мин. Реакционный раствор концентрируют в вакууме и сырой остаток разбавляют 150 мл дихлорметана, промывают 25 мл воды, рассолом и сушат над сульфатом натрия. Растворитель удаляют в вакууме и сырой остаток очищают ВЭЖХ, и получают 26,2 мг конечного продукта. 1(dd, 1H), 5,40 (s, 2H), 4,25 (s, 2H), 3,89 (s, 3H), 3,77 (m, 4H), 3,19 (m, 4H). ЖХМС наблюдают для (М+Н)+ 416,4. Пример 43. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-сульфоновая кислотаметилпиразоло[4,3-b]пиридин-1-ил)этанона Получение этилового эфира [3-(сульфоновая кислота-метил)пиразоло[3,4-b]пиридин-1-ил]уксусной кислоты. Смесь этилового эфира (3-(бромметил)пиразоло[3,4-b]пиридин-1-ил)уксусной кислоты (0,13 ммоль, 1 экв.) и сульфита натрия (1,8 ммоль, избыток) в смеси 1 мл ДМФА и 0,5 мл воды греют при 80 С в течение одного часа. Полученный раствор охлаждают до rt и растворитель удаляют в вакууме. Остаток экстрагируют смесью 1:1 МеОН : CH2Cl2 (30 мл 3). Объединенные органические экстракты сушат в вакууме и сырой остаток применяют без дальнейшей очистки. ВЭЖХ, время удерживания = 1,63 мин(Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20 до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES), М+Н ожидаемый = 300,1, найденный =300,5.- 28017278 Получение [3-(сульфоновая кислота-метил)пиразоло[4,3-b]пиридин-1-ил]уксусной кислоты Данное соединение синтезируют по стандартной методике гидролиза, описанной в примере 30, с применением 1 N LiOH в качестве основания. Сырой продукт применяют без дальнейшей очистки. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-сульфоновая кислотаметил)пиразоло[4,3-b]пиридин-1-ил)этанона Смесь сульфоновой кислоты (100,2 мг, содержит значительное количество неорганической соли),2HCl соли 1H-4-(4-хлор-3-метоксифенил)пиперазина (0,37 ммоль, избыток) и HATU (0,37, избыток) суспендируют в 3 мл пиридина и перемешивают при rt 3 ч. Растворитель пиридин удаляют в вакууме и сырой остаток экстрагируют дихлорметаном (10 мл 3). Органические экстракты удаляют и сырой остаток очищают ВЭЖХ и получают 10 мг 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-сульфоновая кислота-метилпиразоло[4,3-b]пиридин-1-ил)этанона. ВЭЖХ, время удерживания = 0,28 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20 до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES), М+Н ожидаемый = 480,1,найденный = 480,5. Пример 44. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил)-2-(5-хлорпиразоло[3,4b]пиридин-1-ил)этанона Получение этилового эфира (3-иод-5-хлорпиразоло[4,3-b]пиридин-1-ил)уксусной кислоты К раствору этилового эфира (3-иод-5-пиразоло[4,3-b]пиридин-1-ил)уксусной кислоты (0,61,1 экв) в 2 мл ДМФА добавляют N-хлорсукцинимид (NCS) (0,73, 1,2 экв) в твердом виде. Полученную смесь греют при 70 С 3 ч. Реакционную смесь охлаждают до rt и разбавляют 250 мл EtOAc. Затем разбавленную смесь промывают водой (100 мл 3), рассолом, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Сырой остаток очищают хроматографией на силикагеле (от 15% EtOAc до 75% EtOAc в гексане) и получают 100,4 мг конечного продукта в виде белого твердого вещества. ВЭЖХ, время удерживания = 2,48 минут (Agilent Zorbax SB-C18, 2,1 50 мм, 5, 35C) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20% до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС (ES) М+Н ожидаемый = 365,9, найденный =366,3. Получение (3-иод-5-хлорпиразоло[4,3-b]пиридин-1-ил)уксусной кислоты Данное соединение синтезируют по стандартной методике гидролиза, описанной в примере 30, с применением 1N LiOH. ВЭЖХ время удерживания = 1,78 минут (Agilent Zorbax SB-C18, 2,150 мм, 5,35C) с использованием скорости потока 1 мл/мин, 2,5-минутный градиент от 20 до 100% В с 1,1 минутной промывкой 100% В; А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% вода/94,9% ацетонитрила); МС (ES), М+Н ожидаемый = 337,9, найденный =337,9. Получение 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-иод-5-хлорпира золо[4,3-b]пиридин-1-ил)этанона Названное в заголовке соединение синтезируют по стандартной методике пептидного сочетания,как описано в примере 43, с применением HATU в качестве реагента сочетания. ВЭЖХ время удерживания = 2,71 мин (Agilent Zorbax SB-C18, 2,150 мм, 5, 35 С с использованием скорости потока 1 мл/мин,2,5-минутный градиент от 20% до 100% В с 1,1-минутной промывкой 100% В (А=0,1% муравьиной кислоты/5% ацетонитрила/94,9% воды, В=0,1% муравьиной кислоты/5% воды/94,9% ацетонитрила); МС(ES), М+Н ожидаемый = 546,0, найденный = 546,4. Синтез 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил)-2-(5-хлорпиразоло[3,4-b]пиридин-1-ил)этанона К раствору 1-[4-(4-хлор-3-метоксифенил)пиперазин-1-ил]-2-(3-иод-5-хлорпиразоло[3,4-b]пиридин 1-ил)этанона (0,037 ммоль, 1 экв) в 1,5 мл дихлорметана в атмосфере азота, охлажденному до -40 С, по каплям добавляют 30 мкл 2,0 М раствора изопропилмагнийхлорида (0,056 ммоль, 1,5 экв) в ТГФ. Полученную смесь перемешивают 30 мин при -40 С, и затем по каплям добавляют водный (водн.) раствор хлорида аммония при низкой температуре. Реакционный раствор нагревают до rt, разбавляют 200 млEtOAc, промывают 50 мл воды, рассолом, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Сырой остаток очищают ВЭЖХ и получают 5 мг конечного продукта. 1
МПК / Метки
МПК: A61K 31/496, C07D 487/06
Метки: соединения, применения, способы, азаиндазола
Код ссылки
<a href="https://eas.patents.su/30-17278-soedineniya-azaindazola-i-sposoby-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения азаиндазола и способы применения</a>
Предыдущий патент: Устройство и способ очистки от волокон компонента бытового прибора для обработки белья
Следующий патент: Бивалентные миметики smac и их применения
Случайный патент: Складной опалубочный блок для возведения стен