1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин в качестве соединения с сочетанием активности в отношении повторного захвата серотонина, 5-нт3 и 5-нт1а для лечения когнитивного нарушения
Номер патента: 15287
Опубликовано: 30.06.2011
Авторы: Йергенсен Мортен, Фальд Андре, Лопес Де Диего Хейди, Стенсбель Тине Брайан, Бродерсен Йерген, Хольм Рене, Мур Николас, Мерк Арне, Мили Майкл Дж., Ринггорд Лоне Мунк, Бан-Андерсен Бенни, Рок Майкл Харолд
Формула / Реферат
1. 1-[2-(2,4-Диметилфенилсульфанил)фенил]пиперазин и его фармацевтически приемлемые соли, причем соединение является кристаллическим.
2. Соединение по п.1, представляющее собой соль бромисто-водородоной кислоты, хлористо-водородной кислоты, мезилатную соль, соль фумаровой кислоты, малеиновой кислоты, мезовинно-каменной кислоты, L-(+)-винно-каменной кислоты, D-(-)-винно-каменной кислоты, сульфат, фосфат или нитрат.
3. Соединение по п.2, имеющее порошковую рентгенограмму (XRPD), как показано на любой из фиг. 1-17.
4. Соединение по п.1, которое представляет собой соль 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина с бромисто-водородной кислотой в кристаллической форме.
5. Соединение по п.4, имеющее отражения XRPD приблизительно при 6,89, 9,73, 13,78 и 14,64 (°2q).
6. Соединение по п.4, имеющее XRPD, как показано на фиг. 3.
7. Соединение по п.5, имеющее распределение размера частиц, соответствующее:
D98%: 650-680 мкм; D50%: 230-250 мкм; D5%: 40-60 мкм;
D98%: 370-390 мкм; D50%: 100-120 мкм; D5%: 5-15 мкм;
D98%: 100-125 мкм; D50%: 15-25 мкм; D5%: 1-3 мкм или
D98%: 50-70 мкм; D50%: 3-7 мкм; D5%: 0,5-2 мкм.
8. Применение соединения по любому из пп.1-7 в терапии.
9. Фармацевтическая композиция для лечения когнитивного нарушения, содержащая соединение по любому из пп.1-7 совместно с фармацевтически приемлемым эксципиентом.
10. Композиция по п.9, содержащая соединение по п.4 или 5.
11. Способ лечения заболевания, выбранного из аффективных нарушений, депрессии, общего депрессивного нарушения, послеродовой депрессии, депрессии, ассоциированной с биполярным нарушением, болезни Альцгеймера, психоза, злокачественной опухоли, связанного со старением заболевания или болезни Паркинсона, тревожности, общего тревожного нарушения, социального тревожного нарушения, обсессивно-компульсивного нарушения, панического нарушения, панических атак, фобии, социальной фобии, агорафобии, недержания мочи при напряжении, рвоты, IBS, нарушений питания, хронической боли, частичного ответа, лечения устойчивой депрессии, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, злоупотребления психоактивными веществами и алкоголем или зависимости от алкоголя или лекарственных средств, включающий введение терапевтически эффективного количества соединения по любому из пп.1-7 пациенту, нуждающемуся в этом.
12. Применение соединения по любому из пп.1-7 для получения лекарственного средства для лечения аффективных нарушений, депрессии, общего депрессивного нарушения, послеродовой депрессии, депрессии, ассоциированной с биполярным нарушением, болезни Альцгеймера, психоза, злокачественной опухоли, связанного со старением заболевания или болезни Паркинсона, тревожности, общего тревожного нарушения, социального тревожного нарушения, обсессивно-компульсивного нарушения, панического нарушения, панических атак, фобии, социальной фобии, агорафобии, недержания мочи при напряжении, рвоты, IBS, нарушений питания, хронической боли, частичного ответа, лечения устойчивой депрессии, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, злоупотребления психоактивными веществами и алкоголем или зависимости от алкоголя или лекарственных средств.
13. Способ получения 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина
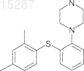
включающий реакцию соединения II
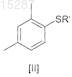
где R' представляет собой водород или одновалентный ион металла,
с соединением формулы III
![]()
где X1и Х2 независимо представляют собой галоген,
и с соединением формулы IV
![]()
где R представляет собой водород или защитную группу,
в присутствии растворителя, основания и палладиевого катализатора, состоящего из соединения палладия и фосфинового лиганда при температуре между 60 и 130°С.
14. Способ по п.13, где соединение II и соединение III подвергают реакции с образованием соединения формулы
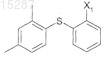
которое необязательно выделяют и очищают, с последующей его реакцией с соединением IV.
15. Способ по п.13, где соединение II, соединение III и соединение IV смешивают вместе в начале процесса.
16. Способ по любому из пп.13-15, где X1 и Х2независимо представляют собой Br или I.
17. Способ по любому из пп.13-16, где соединение палладия выбрано из Pddba2, Pd(OAc)2 и Pd2dba3.
18. Способ по любому из пп.13-17, где указанный фосфиновый лиганд выбран из
2,2'-бис-дифенилфосфанил-[1,1']бинафталенила (rac-BINAP);
1,1'-бис-(дифенилфосфино)ферроцена (DPPF);
бис-(2-дифенилфосфинофенил)эфира (DPEphos);
три-трет-бутилфосфина (соли Fu);
бифенил-2-ил-ди-трет-бутилфосфина;
бифенил-2-ил-дициклогексилфосфина;
(2'-дициклогексилфосфанилбифенил-2-ил)диметиламина;
[2'-(ди-трет-бутилфосфанил)бифенил-2-ил]диметиламина и
дициклогексил-(2',4',6'-трипропилбифенил-2-ил)фосфана.
19. Способ по любому из пп.13-18, где указанное основание выбрано из NaO(t-Bu), KO(t-Bu), Cs2CO3, DBU и DABCO.
20. Способ по любому из пп.13-19, где R представляет собой водород.
21. Способ по любому из пп.13-20, где R' представляет собой водород.
22. Способ по п.15, где 2-5 экв. NaO(t-Bu), 2-5 экв. пиперазина, 0,2-0,6 мол.% Pddba2 и 0,6-1 мол.% rac-BINAP диспергируют в толуоле с получением смеси А', к этой смеси добавляют приблизительно 1 экв. 2-бромйодбензола с получением смеси В', затем добавляют 1 экв. 2,4-диметилтиофенола и полученную смесь нагревают до температуры кипячения с обратным холодильником в течение 3-7 ч с получением 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина.
23. Способ по п.22, где указанную полученную смесь нагревают до температуры кипячения с обратным холодильником в течение 4-6 ч, затем полученный продукт подвергают реакции с водной HBr с получением соответствующей аддитивной соли бромисто-водородной кислоты.
24. Способ получения аддитивной соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина с бромисто-водородной кислотой, при котором 2-5 экв. NaO(t-Bu), 2-5 экв. пиперазина, 0,2-0,6 мол.% Pddba2 и 0,6-1 мол.% rac-BINAP диспергируют в толуоле с получением смеси А', к этой смеси добавляют приблизительно 1 экв. 2-бромйодбензола с получением смеси В', затем к этой смеси добавляют 1 экв. 2,4-диметилтиофенола и полученную смесь нагревают до температуры кипячения с обратным холодильником в течение 4-6 ч с получением 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина, который далее подвергают реакции с водной бромисто-водородной кислотой.
Текст
1-[2-(2,4-ДИМЕТИЛФЕНИЛСУЛЬФАНИЛ)ФЕНИЛ]ПИПЕРАЗИН В КАЧЕСТВЕ СОЕДИНЕНИЯ С СОЧЕТАНИЕМ АКТИВНОСТИ В ОТНОШЕНИИ ПОВТОРНОГО ЗАХВАТА СЕРОТОНИНА, 5-НТ 3 И 5-НТ 1 А ДЛЯ ЛЕЧЕНИЯ КОГНИТИВНОГО НАРУШЕНИЯ 1-[2-(2,4-Диметилфенилсульфанил)фенил]пиперазин проявляет мощную активность на SERT,5-НТ 3 и 5-HT1A и, таким образом, может быть пригодным для лечения когнитивного нарушения,особенно у пациентов с депрессией. Бан-Андерсен Бенни, Фальд Андре, Мерк Арне, Лопес Де Диего Хейди, Хольм Рене,Стенсбель Тине Брайан, Ринггорд Лоне Мунк, Мили Майкл Дж., Рок Майкл Харолд, Бродерсен Йерген, Йергенсен Мортен 015287 Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, которые проявляют активность в отношении ингибирования повторного захвата серотонина в сочетании с активностью в отношении рецептора серотонина 1 А (5-HT1A) и рецептора серотонина 3 (5-HT3) и которые, по существу, пригодны для лечения связанных с ЦНС заболеваний. Предпосылки изобретения Селективные ингибиторы повторного захвата серотонина (SSRI) многие годы были лекарственными средствами первого выбора для лечения некоторых связанных с ЦНС заболеваний, в частности депрессии, тревожности и социальных фобий, поскольку они являются эффективными, хорошо переносимыми и обладают благоприятным профилем безопасности по сравнению с применяемыми ранее соединениями, т.е. с классическими трициклическими соединениями. Тем не менее, медикаментозное лечение с использованием SSRI затрудняет значительная доля неотвечающих пациентов, т.е. пациентов, которые не отвечают на лечение SSRI или отвечают на него только в ограниченной степени. Более того, как правило, эффект лечения SSRI не начинает проявляться в течение нескольких недель лечения. В целях преодоления некоторых из этих недостатков лечения SSRI психиаторы иногда применяют стратегии усиления. Усиление антидепрессантов можно обеспечивать, например, комбинированием со стабилизаторами настроения, такими как карбонат лития или трийодтиронин, или посредством одновременного применения электрошока. Известно, что сочетание ингибирования транспортера серотонина (SERT) с активностью в отношении одного или нескольких рецепторов серотонина может быть преимущественным. Ранее было выявлено, что сочетание ингибитора повторного захвата серотонина с соединением, имеющим антагонистический или обратный агонистический эффект на 5-HT2C (соединения, имеющие отрицательную эффективность на рецептор 5-HT2C) обеспечивает значительное повышение уровня 5-HT (серотонина) в терминальных областях при измерении в экспериментах с микродиализом (WO 01/41701). Это может привести к более быстрому появлению эффекта антидепрессанта в клинике и к усилению или потенциированию терапевтического эффекта ингибитора повторного захвата серотонина (SRI). Аналогично, было описано, что сочетание пиндолола, который является частичным агонистом 5-HT1A, с ингибитором повторного захвата серотонина приводит к быстрому появлению эффекта [Psych.Res., 125, 81-86, 2004]. Связанные с CNS заболевания, например, такие как депрессия, тревожность и шизофрения, часто сопровождаются другими нарушениями или дисфункциями, такими как когнитивные расстройства или нарушения [Scand. J. Psych., 43, 239-251, 2002; Am. J. Psych., 158, 1722-1725, 2001]. Полагают, что в нейрональные процессы, регулирующие познание, вовлечено несколько нейротрансмиттеров. В частности, холинергическая система играет значительную роль в познании, и соединения, влияющие на холинергическую систему, таким образом, потенциально пригодны для лечения когнитивного нарушения. Известно, что соединения, влияющие на рецептор 5-HT1A и/или рецептор 5-HT3, влияют на холинергическую систему, и они самостоятельно могут быть пригодны для лечения когнитивного нарушения. Таким образом, можно ожидать, что соединение, проявляющее активность рецептора 5-HT1A и/или 5-HT3, является пригодным для лечения когнитивного нарушения. Соединение, которое, более того, проявляет активность SERT, может быть особенно пригодным для лечения когнитивного нарушения у пациентов с депрессией, поскольку такое соединение также может обеспечить быстрое начало лечения депрессии. В WO 03/029232 описано, например, соединение 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин (пример 1 е) в качестве соединения, имеющего активность SERT. Сущность изобретения Авторы настоящего изобретения неожиданно обнаружили, что 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин приводит к сочетанию ингибирования SERT, антагонизма 5-HT3 и частичного агонизма 5-HT1A. Таким образом, в одном варианте осуществления настоящее изобретение относится к соединению I, которое представляет собой 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин, и к его фармацевтически приемлемым солям при условии, что указанное соединение не является свободным основанием в некристаллической форме. В одном варианте осуществления настоящее изобретение относится к применению соединения I в терапии. В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение I. В одном варианте осуществления настоящее изобретение относится к терапевтическим способам,включающим введение эффективного количества соединения I пациенту, нуждающемуся в этом. В одном варианте осуществления настоящее изобретение относится к применению соединения I для получения лекарственного средства.-1 015287 Краткий перечень чертежей фиг. 1 - XRPD кристаллического основания; фиг. 2 - XRPD альфа-формы соли бромисто-водородной кислоты; фиг. 3 - XRPD бета-формы соли бромисто-водородной кислоты; фиг. 4 - XRPD гамма-формы соли бромисто-водородной кислоты; фиг. 5 - XRPD гемигидрата соли бромисто-водородной кислоты; фиг. 6 - XRPD смеси этилацетатного сольвата и альфа-формы соли бромисто-водородной кислоты; фиг. 7 - XRPD соли хлористо-водородной кислоты; фиг. 8 - XRPD моногидрата соли хлористо-водородной кислоты; фиг. 9 - XRPD мезилатной соли; фиг. 10 - XRPD соли фумаровой кислоты; фиг. 11 - XRPD соли малеиновой кислоты; фиг. 12 - XRPD соли мезовинно-каменной кислоты; фиг. 13 - XRPD соли L-(+)-винно-каменной кислоты; фиг. 14 - XRPD соли D-(-)-винно-каменной кислоты; фиг. 15 - XRPD сульфатной соли; фиг. 16 - XRPD фосфатной соли; фиг. 17 - XRPD нитратной соли; фиг. 18 - эффект соединений по настоящему изобретению в тесте с внутрикожным введением формалина. На оси X показано вводимое количество соединения; на оси Y показано количество времени (с),потраченного на вылизывание лапы; фиг. 18 а - ответ в периоде 0-5 мин; фиг. 18b - ответ в периоде 20-30 мин; фиг. 19 а - внеклеточные уровни ацетилхолина в префронтальной коре у свободно передвигающихся крыс при введении соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина с HBr; фиг. 19b - внеклеточные уровни ацетилхолина в вентральном гиппокампе у свободно передвигающихся крыс при введении соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина с HBr; фиг. 20 - эффект соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина с HBr на выработку ситуативного условно-рефлекторного страха у крыс Sprague-Dawley при введении за 60 мин до обучения. Замирание оценивали в течение 58 с периода привыкания перед шоком лап US (обучение перед шоком)(белые столбцы). Замирание определяли через 24 ч после обучения (тест ретенции) (черные столбцы); фиг. 21 - эффект соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина с HBr на выработку ситуативного условно-рефлекторного страха у крыс Sprague-Dawley при введении за 1 ч до теста ретенции. Замирание оценивали в течение 58 с перед шоком лап US (обучение) (белые столбцы). Замирание определяли через 24 ч после обучения (тест ретенции) (черные столбцы); фиг. 22 - эффект АА 21004 на выработку ситуативного условно-рефлекторного страха у крысSprague-Dawley при введении сразу после обучения. Замирание оценивали в течение 58 с перед шоком лап US (обучение перед шоком) (белые столбцы). Замирание определяли через 24 ч после обучения (тест ретенции) (черные столбцы). Подробное описание изобретения Настоящее изобретение относится к соединению I, 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазину, структура которого представляет собой и к его фармацевтически приемлемым солям, при условии, что соединение I не является свободным основанием в некристаллической форме. В одном варианте осуществления указанные фармацевтически приемлемые соли представляют собой кислотно-аддитивные соли кислот, которые являются нетоксичными. Указанные соли включают соли, полученные из органических кислот, таких как малеиновая, фумаровая, бензойная, аскорбиновая,янтарная, щавелевая, бис-метиленсалициловая, метансульфоновая, этандисульфоновая, уксусная,пропионовая, винно-каменная, салициловая, лимонная, глюконовая, молочная, яблочная, миндальная,коричная, цитраконовая, аспарагиновая, стеариновая, пальмитиновая, итаконовая, гликолевая,п-аминобензойная, глутаминовая, бензолсульфоновая, теофиллинуксусная кислоты, а также 8-галотеофиллины, например, 8-бромтеофиллин. Также указанные соли можно получать из неорганических солей, таких как соли хлористо-водородной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислот. Конкретно упоминаются соли, полученные из метансульфоновой, малеиновой,-2 015287 фумаровой, мезовинно-каменной, (+)-винно-каменной, (-)-винно-каменной, хлористо-водородной, бромисто-водородной, серной, фосфорной и азотной кислот. Отдельно упоминается соль бромистоводородной кислоты. Пероральные дозированные формы, в частности таблетки, часто являются предпочтительными для пациентов и врача вследствие простоты введения и, следовательно, лучшего соблюдения схемы лечения. Для таблеток предпочтительно, чтобы активные ингредиенты были кристаллическими. В одном варианте осуществления соединения по настоящему изобретению являются кристаллическими. В одном варианте осуществления кристаллы по настоящему изобретению представляют собой сольваты, т.е. кристаллы, где молекулы растворителя образуют часть кристаллической структуры. Сольват может быть образован из воды, в этом случае сольваты часто называют гидратами. Альтернативно,сольваты могут быть образованы из других растворителей, например, таких как этанол, ацетон или этилацетат. Точное количество сольвата часто зависит от условий. Например, гидраты, как правило, будут терять воду при повышении температуры или при снижении относительной влажности. В одном варианте осуществления соединения по настоящему изобретению представляют собой несольватированные кристаллы. Некоторые соединения являются гигроскопическими, т.е. поглощают воду под воздействием влажности. Гигроскопичность, как правило, считают нежелательным свойством соединений, которые предназначены для присутствия в фармацевтическом составе, в частности в сухом составе, таком как таблетки. В одном варианте осуществления настоящее изобретение относится к кристаллам с низкой гигроскопичностью. Для пероральных дозированных форм с использованием кристаллических активных ингредиентов также является преимущественным, если указанные кристаллы являются строго определенными. В данном контексте термин "строго определенный", в частности, означает, что стехиометрия является строго определенной, т.е. что соотношение между образующими соль ионами представляет собой соотношение между небольшими числами, такое как 1:1, 1:2, 2:1, 1:1:1 и т.д. В одном варианте осуществления соединения по настоящему изобретению являются строго определенными кристаллами. Кристаллические соединения по настоящему изобретению могут существовать более чем в одной форме, т.е. они могут существовать в полиморфных формах. Полиморфные формы существуют, если соединение может кристаллизоваться более чем в одной форме. Подразумевается, что настоящее изобретение охватывает такие полиморфные формы либо в качестве чистых соединений, либо в качестве их смесей. В одном варианте осуществления соединения по настоящему изобретению находятся в очищенной форме. Подразумевается, что термин "очищенная форма" указывает на то, что соединение, по существу,не содержит другие соединения или другие формы того же соединения, в зависимости от обстоятельств. В одном варианте осуществления настоящее изобретение относится к кристаллическим солям соединений по настоящему изобретению с XRPD, как показано на фиг. 1-17, и в частности на фиг. 2-5. В таблице показаны основные отражения XRPD для соединений по настоящему изобретению. Выбранные рентгеновские пиковые положения (2), все значения 0,1-3 015287 Как следует, например, из фиг. 2-5, соединения по настоящему изобретению, в случае соли бромисто-водородной кислоты, могут существовать в нескольких формах, т.е. быть полиморфными. Полиморфные формы имеют различные свойства, как показано в примере 4d. Бета-форма соли бромистоводородной кислоты является более стабильной, как показано, по более высокой температуре плавленияDSC и более низкой растворимости. Более того, бета-форма обладает привлекательным сочетанием низкой гигроскопичности и растворимости, которое делает это соединение особенно пригодным для изготовления таблеток. Таким образом, в одном варианте осуществления настоящее изобретение относится к соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина и бромисто-водородной кислоты с отражениями XRPD приблизительно при 6,89, 9,73, 13,78 и 14,62 (2), и в частности с XRPD, как показано на фиг. 3. Растворимость активного ингредиента также имеет значение для выбора дозированной формы, поскольку она может иметь прямое влияние на биодоступность. Полагают, что для пероральных дозированных форм, как правило, является благоприятным более высокая растворимость активного ингредиента, поскольку она повышает биодоступность. Кортикальная и гиппокампальная холинергическая нейротрансмиссия имеет большое значение для познания, и ряд доклинических наблюдений указывает на важность рецептора серотонина 1 АBAYX3702 повышает выход ацетилхолина из коры и гиппокампа у крыс. Интересно, что антагонист 5-HT1A WAY-100635 способен устранять эффект BAYX3702, показывая, что эффект BAYX3702 опосредуется 5-HT1A. В ряде исследований описан эффект модуляторов 5-HT1A на когнитивное нарушение. A. Meneses вNeurobiol. Learn. Memory, 71, 207-218, 1999 описывает, что частичный агонист 5-HT1A -8-гидрокси-2(ди-н-пропиламино)тетралин, HCl (8-OH-DPAT) способствует консолидации обучения у нормальных крыс и нормализует когнитивные функции у крыс с когнитивными нарушениями. Эти доклинические наблюдения также, как оказалось, отразились в клинике. Т. Sumiyoshi в Am. J.Psych., 158, 1722-1725, 2001 описывает исследование, где пациенты получали типичные антипсихотические средства, такие как галоперидол, сульпирид и пимозид, все из которых лишены активности 5-HT1A,в сочетании с плацебо или тандоспироном, который является агонистом 5-HT1A. У пациентов, которые помимо антипсихотического средства получали тандоспирон, было показано улучшение в их познавательной работе, в то время как у пациентов, которые получали плацебо, не было показано улучшения. Аналогично, атипичные антипсихотические средства, такие как клозапин, которые также являются агонистами 5-HT1A, усиливают познание у пациентов с шизофренией, в то время как типичные антипсихотические средства, такие как галоперидол, которые не обладают активностью 5-HT1A, не усиливают его,Y. Chung, Brain Res., 1023, 54-63, 2004. Как упоминалось выше, полагают, что холинергическая система вовлечена в нейрональные процессы, регулирующие познание, и холинергическая система может подвергаться ингибиторному контролю посредством рецептора серотонина 3 (5-HT3) [(Giovannini et al., J. Pharmacol. Exp. Ther. 1998, 285:12191225; Costall and Naylor, Current Drug Targets - CNSNeurobiol. Disord. 2004, 3: 27-37)]. В тесте обучения у мышей, в усиленном чередующемся задании с Т-образным лабиринтом и в задании на отличие объектов и переделку навыка у мартышек ондансетрон снижал нарушения, вызванные мускариновым антагонистом, скополамином, или очаги повреждения холинергических каскадов, возникающие из базального ядра (Barnes et al., Pharmacol. Biochem. Behav. 1990, 35:955-962; Carey et al.,Pharmacol. Biochem. Behav. 1992, 42:75-83). Boast et al. (Neurobiol. Learn Mem. 1999, 71:259-271) использовали МК-801, неконкурентный антагонист рецептора NMDA, для прекращения когнитивной работы у крыс, обученных на задании с отсроченным, не совпадающим с образцом радиальном лабиринте. Было показано, что ондансетрон блокирует когнитивное нарушение. Более того, в исследовании амнестического эффекта этанола у мышей в задании пассивного избегания этот амнестический эффект этанола практически восстанавливался до нормы посредством ондансетрона (Napiorkowska-Pawlak et al., Fundam.Clin. Pharmacol. 2000, 14:125-131). Таким образом, облегчение холинергической трансмиссии посредством антагонизма 5-HT3 после нарушения холинергической системы в доклинических моделях (Diez-Arizaet al., Psychopharmacology, 2003, 169:35-41; Gil-Bea et al., Neuropharmacol. 2004, 47:225-232) подтверждает основание для применения этого лечения в целях терапии когнитивных нарушений. В рандомизированном двойном слепом перекрестном исследовании у здоровых мужчин оценка вербальной и пространственной памяти и фиксированного внимания показала, что антагонист 5-HT3,алосетрон, ослабляет индуцируемый скополамином дефицит вербальной и пространственной памятиRacagni and Langer, Basel Karger, p. 89-93). В заключение полагают, что соединения, проявляющие частичную агонистическую активность 5-HT1A в сочетании с антагонистической активностью 5-HT3, являются особенно пригодными для лечения когнитивного нарушения. Соединения, которые, более того, проявляют ингибирование повторного захвата серотонина, могут быть особенно пригодными для лечения когнитивного нарушения, ассоциированного с депрессией, поскольку ингибирование повторного захвата серотонина в сочетании с частич-4 015287 ным агонизмом 5-HT1A приведет к более быстрому появлению эффекта лечения депрессии. Как показано в примере 1, соединения по настоящему изобретению представляют собой мощные ингибиторы транспортера серотонина человека, т.е. они ингибируют повторный захват серотонина. Более того, соединения являются мощными антагонистами рецептора 5-HT3 мышей, крыс, морских свинок и собак. Было выявлено, что соединения являются антагонистами рецептора 5-HT3 человека, клонированного в ооциты, в низких концентрациях (IC50 приблизительно 30 нМ), в то время как в более высоких концентрациях соединения проявляют агонистические свойства (ED50=2,1 мкМ). Последующее применение соединений по настоящему изобретению в высокой концентрации не показало какого-либо агонистического ответа, что может быть следствием быстрого уменьшения чувствительности или прямого антагонизма in vitro. Таким образом, при низких концентрациях соединения по настоящему изобретению проявляют выраженный антагонизм рецептора 5-HT3 человека, как выявлено для рецептора 5-HT3 из других видов. Соединения по настоящему изобретению связываются с рецептором 5-HT1A с очень низкой аффинностью в гомогенате головного мозга как крыс, так и мышей. Однако соединения по настоящему изобретению связываются с рецептором 5-HT1A человека с Ki, составляющей 40 нМ. Более того, функциональные данные показывают, что соединения по настоящему изобретению являются частичными агонистами рецептора 5-HT1A человека, проявляющими эффективность, составляющую 85%. Ожидается, что активность по настоящему изобретению на SERT, рецепторы 5-HT3 и 5-HT1A вносит вклад в профиль соединения у человека in vivo. Как показано в примере 26, соединения по настоящему изобретению приводят к повышению внеклеточного уровня ацетилхолина в префронтальной коре и вентральном гиппокампе у крыс. Ожидают,что эти доклинические данные перейдут в клинический эффект при лечении когнитивных нарушений,что можно сравнить с применением ингибиторов ацетилхолинэстеразы при лечении когнитивных нарушений, например при болезни Альцгеймера. Дальнейшее подтверждение этого мнения можно найти в примере 27, где данные показывают, что соединения по настоящему изобретению усиливают ситуативную память у крыс. В целом, фармакологический профиль соединений по настоящему изобретению в сочетании с эффектами на уровни ацетилхолина и память у крыс строго подтверждает, что соединения по настоящему изобретению пригодны для лечения когнитивного нарушения. В одном варианте осуществления настоящее изобретение относится к способу лечения когнитивных расстройств или когнитивного нарушения, причем указанный способ включает введение терапевтически эффективного количества соединения по настоящему изобретению пациенту, нуждающемуся в этом. Когнитивные расстройства или когнитивное нарушение включают изменение когнитивных функций или когнитивных доменов, например рабочей памяти, внимания и активного внимания, вербального обучения и памяти, зрительного обучения и памяти, рассуждения и способности решать задачи, например, организующей функции, скорости обработки информации и/или социального познания. В частности, на когнитивные расстройства или когнитивное нарушение могут указывать расстройства внимания,расстроенное мышление, медленное мышление, трудность понимания, слабая концентрация, нарушение способности решать задачи, слабая память, трудность выражения мыслей и/или трудность интеграции мыслей, ощущений и поведения или трудность торможения несущественных мыслей. Подразумевается,что термины "когнитивные расстройства" и "когнитивное нарушение" указывают на одно и то же, и их используют взаимозаменяемо. В одном варианте осуществления у указанного пациента также диагностировано другое нарушение ЦНС, такое как аффективные нарушения, такие как депрессия; генерализованная депрессия; общее депрессивное нарушение; тревожные нарушения, включающие общее тревожное нарушение и паническое нарушение; обсессивно-компульсивное нарушение; шизофрения; болезнь Паркинсона; деменция; СПИДдеменция; ADHD; ассоциированное со старением нарушение памяти или болезнь Альцгеймера. Когнитивное нарушение относится к классическим признакам депрессии, например, такой как общее депрессивное нарушение. Когнитивные нарушения могут быть в некоторой степени вторичными относительно депрессии в том смысле, что улучшение депрессивного состояния также приведет к улучшению когнитивного нарушения. Однако также существует убедительное доказательство того, что когнитивные нарушения, в действительности, не зависят от депрессии. Например, исследования показали длительное когнитивное нарушение при выздоровлении от депрессии [J. Nervous Mental. Disease, 185, 748-754, 197]. Более того,дифференциальный эффект антидепрессантов на депрессию и когнитивные нарушения обеспечивает дальнейшее подтверждение представления о том, что депрессия и когнитивное нарушение являются независимыми, хотя и часто совместными, состояниями. Несмотря на то что лекарственные средства на основе серотонина и норадреналина обеспечивают сравнимое улучшение симптомов депрессии, некоторые исследования показали, что модулирование норадренергической системы не улучшает когнитивные функции настолько, насколько модулирование серотонина [Brain Res. Bull, 58, 345-350, 2002; Hum.-5 015287 Полагают, что лечение когнитивного нарушения у пациентов с депрессией введением соединений по настоящему изобретению имеет конкретные преимущества. Ожидают, что многогранная фармакология соединений по настоящему изобретению, в частности в отношении SERT, 5-HT3 и 5-HT1A, приведет к улучшению когнитивного функционирования в сочетании с быстрым началом лечения депрессивного состояния. Когнитивное нарушение является особенно важным фактором у пожилых людей. Когнитивное нарушение в норме возрастает с возрастом и, кроме того, при депрессии. Таким образом, в одном варианте осуществления пациент, подлежащий лечению от когнитивного нарушения, является пожилым человеком, в частности пожилым человеком с депрессией. Когнитивные функции, как упомянуто выше, часто нарушаются у пациентов с шизофренией. Исследования также привели к выводу, что когнитивное функционирование ассоциировано с профессиональным функционированием при шизофрении [Scizophrenia Res., 45, 175-184, 2000]. В одном варианте осуществления пациентом, подлежащим лечению от когнитивного нарушения, является шизофреник. Антагонисты рецептора 5-HT3, кроме того, были предложены для лечения заболеваний, таких как рвота,индуцированная химиотерапией рвота, пристрастия, злоупотребление психоактивными веществами,боль, синдром раздраженной кишки (IBS), шизофрения и нарушения питания [Eur. J. Pharmacol., 560, 1-8,2007; Pharmacol. Therapeut., 111, 855-876, 2006; Alimentary Pharmacol. Ther., 24, 183-205, 2006]. Клинические исследования показывают, что сочетание миртазипина и SSRI является лучшим, чемSSRI отдельно в отношении лечения пациентов с депрессией с недостаточным клиническим ответом (устойчивой к лечению депрессией, TRD или рефрактерной депрессией) [Psychother. Psychosom., 75, 139153, 2006]. Миртазапин представляет собой антагонист 5-HT2 и 5-HT3, который обосновывает представление, что соединения по настоящему изобретению пригодны для лечения TRD. Приливы крови являются симптомом, ассоциированным с менопаузальным переходом. Некоторые женщины могут страдать этим настолько, что это мешает сну или активности, главным образом, и что им необходимо лечение. Замещающая гормональная терапия эстрогеном является общепринятой практикой в течение десятилетий, однако в последнее время внимание сосредоточено на побочных эффектах, таких как рак молочной железы и сердечные явления. Клинические испытания SSRI показали, что эти соединения оказывают эффект на приливы крови, хотя меньший, чем эстроген [J. Am. Med. Ass., 295, 2057-2071,2006]. Однако лечение приливов соединениями, ингибирующими повторный захват серотонина, например соединениями по настоящему изобретению, может быть альтернативным лечением для женщин, которые не могут или не будут принимать эстроген. Апноэ во сне, или обструктивный синдром апноэ-гипопноэ во сне, или обструктивное нарушенное дыхание во сне представляет собой нарушение, эффективную фармакотерапию которого еще предстоит идентифицировать. Однако некоторые исследования на животных позволяют предположить, что антагонисты 5-HT3, например соединения по настоящему изобретению, могут быть эффективны для лечения этих заболеваний [Sleep, 21, 131-136, 1998; Sleep, 8, 871, 878, 2001]. В одном варианте осуществления настоящее изобретение относится к способу лечения заболевания,выбранного из аффективных нарушений, депрессии, общего депрессивного нарушения, послеродовой депрессии, депрессии, ассоциированной с биполярным нарушением, болезни Альцгеймера, психоза, злокачественной опухоли, связанного со старением заболевания или болезни Паркинсона, тревожности, общего тревожного нарушения, социального тревожного нарушения, обсессивно-компульсивного нарушения, панического нарушения, панических атак, фобии, социальной фобии, агорафобии, недержания мочи при напряжении, рвоты, IBS, нарушений питания, хронической боли, частичного ответа, лечения устойчивой депрессии, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, злоупотребления психоактивными веществами и алкоголем или зависимости от алкоголя или лекарственных средств, причем способ включает введение терапевтически эффективного количества соединения по настоящему изобретению пациенту, нуждающемуся в этом. В одном варианте осуществления у указанного пациента, которого лечат от любого из приведенных выше заболеваний, исходно диагностировано указанное заболевание. Хорошо известно, что лечение, в общем, антидепрессантами, в частности SSRI, может быть ассоциировано с половой дисфункцией, которая часто приводит к прекращению лечения. Вплоть до 30-70% пациентов, которых лечат SSRI, описывают нарушения половой функции [J. Clin. Psych., 66, 844-848,2005], причем эти дефекты включают снижение полового влечения, замедление, снижение или отсутствие оргазмов, сниженное возбуждение и эректильную дисфункцию. В клинических испытаниях лечению соединениями по настоящему изобретению подвергали всего 114 субъектов; среди этих 114 субъектов только один субъект привел описание половой дисфункции. Эти данные подтверждают, что клиническое вмешательство с использованием соединений по настоящему изобретению ассоциировано с удивительно небольшим количеством дефектов полового функционирования.-6 015287 Как упоминалось выше, соединения по настоящему изобретению особенно пригодны для лечения хронической боли. Хроническая боль включает показания, такие как фантомная боль конечности, невропатическая боль, диабетическая невропатия, постгерпетическая невралгия (PHN), запястный туннельный синдром (CTS), HIV-невропатия, синдром комплексной регионарной боли (CPRS), тригеминальная невралгия/невралгия тройничного нерва/tic douloureux, хирургическое вмешательство (например, постоперационные анальгетики), диабетическая васкулопатия, резистентность капилляров или диабетические симптомы, ассоциированные с инсулитом, боль, ассоциированная со стенокардией, боль, ассоциированная с менструацией, боль, ассоциированная со злокачественной опухолью, зубная боль, головная боль,мигрень, тензионная головная боль, тригеминальная невралгия, синдром височно-нижнечелюстного сустава, мышечное повреждение с миофасциальной болью, синдром фибромиалгии, боль костей и суставов(остеоартрит), ревматоидный артрит, ревматоидный артрит и отек вследствие травмы, ассоциированной с ожогами, растяжения или боль костей при переломах вследствие остеоартрита, остеопороза, метастазов в кости или неизвестных причин, подагра, фиброзит, миофасциальная боль, компрессионный синдром верхней апертуры грудной клетки, боль в верхней части спины или боль в нижней части спины (где боль в спине является следствием системного, регионарного или первичного заболевания спинного мозга (радикулопатии), боль в тазу, сердечная боль в груди, несердечная боль в груди, ассоциированная с повреждением спинного мозга (SCI) боль, центральная постинсультная боль, невропатия при злокачественной опухоли, боль при СПИД, боль в случае серповидных клеток или гериатрическая боль. Данные, представленные в примере 16, показывают, что соединения по настоящему изобретению пригодны для лечения боли и что они даже могут оказывать болеутоляющий эффект, кроме того, исследования невропатической боли в модели на животных подтверждают это наблюдение."Терапевтически эффективное количество" соединения, как используют в настоящем документе,означает количество, достаточное для излечения, смягчения или частичной остановки клинических проявлений данного заболевания и его осложнений при терапевтическом вмешательстве, включающем введение указанного соединения. Количество, достаточное для достижения этого, определяют как "терапевтически эффективное количество". Эффективные количества для каждой цели будут зависеть от тяжести заболевания или повреждения, а также от массы и общего состояния здоровья субъекта. Будет понятно,что определение пригодной дозировки можно проводить с использованием общепринятого экспериментирования, посредством конструирования матрицы значений и тестирования различных точек в матрице,все это находится в пределах квалификации подготовленного терапевта. Термин "лечение" и "проведение лечения", как используют в настоящем документе, означает управление течением и уход за пациентом в целях борьбы с состоянием, таким как заболевание или нарушение. Подразумевают, что термин включает полный спектр способов лечения данного состояния, от которого страдает пациент, таких как введение активного соединения для смягчения симптомов или осложнений, для замедления прогрессирования заболевания, нарушения или состояния, для смягчения или облегчения симптомов и осложнений и/или для излечения или устранения заболевания, нарушения или состояния, а также для профилактики состояния, где профилактику понимают как обслуживание и уход за пациентом в целях борьбы с заболеванием, состоянием или нарушением, и включают введение активных соединений для предотвращения возникновения симптомов или осложнений. Тем не менее, профилактическое (превентивное) и терапевтическое (лечебное) лечения являются двумя отдельными аспектами настоящего изобретения. Пациент, подлежащий лечению, предпочтительно представляет собой млекопитающее, в частности человека. Как правило, лечение по настоящему изобретению будет вовлекать ежесуточное введение соединений по настоящему изобретению. Оно может включать введение один раз в сутки, или введение два раза в сутки, или даже более частое введение. В одном варианте осуществления настоящее изобретение относится к применению соединения по настоящему изобретению для изготовления лекарственного средства для лечения аффективных нарушений, депрессии, общего депрессивного нарушения, послеродовой депрессии, депрессии, ассоциированной с биполярным нарушением, болезни Альцгеймера, психоза, злокачественной опухоли, связанного со старением заболевания или болезни Паркинсона, тревожности, общего тревожного нарушения, социального тревожного нарушения, обсессивно-компульсивного нарушения, панического нарушения, панических атак, фобии, социальной фобии, агорафобии, недержания мочи при напряжении, рвоты, IBS, нарушений питания, хронической боли, частичного ответа, лечения устойчивой депрессии, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, злоупотребления психоактивными веществами и алкоголем или зависимости от алкоголя или лекарственных средств. В одном варианте осуществления настоящее изобретение относится к соединениям по настоящему изобретению для применения в целях лечения заболевания, выбранного из аффективных нарушений,депрессии, общего депрессивного нарушения, послеродовой депрессии, депрессии, ассоциированной с биполярным нарушением, болезни Альцгеймера, психоза, локачественной опухоли, связанного со старением заболевания или болезни Паркинсона, тревожности, общего тревожного нарушения, социального тревожного нарушения, обсессивно-компульсивного нарушения, панического нарушения, панических-7 015287 атак, фобии, социальной фобии, агорафобии, недержания мочи при напряжении, рвоты, IBS, нарушений питания, хронической боли, частичного ответа, лечения устойчивой депрессии, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, злоупотребления психоактивными веществами и алкоголем или зависимости от алкоголя или лекарственных средств. Эффект соединений по настоящему изобретению на познание у человека можно оценивать рядом способов. Эффект можно оценивать в тестах, где здоровым добровольцам вводят соединение, а затем измеряют когнитивную работу в признанных тестах, например, таких как тест аудиторно-вербального обучения (AVLT), висконсинский тест сортировки карточек (WCST) или фиксированное внимание,[Psycopharmacol., 163, 106-110, 2002; Psychiatry Clin. Neurosci., 60, 70-76, 2006]. Эффект, безусловно, также можно оценивать у пациентов, страдающих когнитивным нарушением, с использованием того же набора тестов. Альтернативно, можно использовать когнитивные модели, где когнитивное нарушение индуцируют у здоровых добровольцев и где измеряют восстанавливающий эффект соединений по настоящему изобретению. Когнитивное нарушение может быть индуцировано, например, скополамином, лишением сна, алкоголем и истощением триптофана. Фармацевтические составы по настоящему изобретению можно получать общепринятыми в данной области способами. Конкретно упоминаются таблетки, которые можно получать смешиванием активного ингредиента с обычными адъювантами и/или разбавителями и последующим прессованием смеси в общепринятом таблетирующем устройстве. Примеры адъювантов или разбавителей включают безводный водородфосфат кальция, PVP, сополимеры PVP-VA, микрокристаллическую целлюлозу, натрия крахмала гликолят, кукурузный крахмал, маннит, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и т.п. Можно использовать любые другие адъюванты или добавки, обычно применяемые для таких целей, такие как красители, вкусовые добавки, консерванты и т.д., при условии, что они совместимы с активными ингредиентами. Растворы для инъекций можно получать растворением активного ингредиента и возможных добавок в части растворителя для инъекции, предпочтительно в стерильной воде, доведением раствора до требуемого объема, стерилизацией раствора и заполнением им пригодных ампул и флаконов. Можно добавлять любую пригодную добавку, обычно используемую в данной области, такую как изменяющие тоничность средства, консерванты, антиоксиданты и т.д. Фармацевтические композиции по настоящему изобретению или композиции, которые изготавливают в соответствии с этим изобретением, можно вводить любым пригодным способом, например перорально в форме таблеток, капсул, порошков, сиропов и т.д. или парентерально в форме растворов для инъекции. Для изготовления таких композиций можно использовать способы, хорошо известные в данной области, и можно использовать любые фармацевтически приемлемые носители, разбавители, эксципиенты или другие добавки, обычно используемые в данной области. Удобно, чтобы соединения по настоящему изобретению вводили в единичной дозированной форме,содержащей указанные соединения в количестве приблизительно 1-50 мг. Полагают, что верхняя граница определяется зависимостью концентрации от активности 5-HT3. Общая суточная доза, как правило,находится в диапазоне приблизительно 1-20 мг, таком как приблизительно от 1 до 10 мг, приблизительно 5-10 мг, приблизительно 10-20 мг или приблизительно 10-15 мг соединения по настоящему изобретению. Конкретно упоминаются суточные дозы, составляющие 5, 10, 15 или 20 мг. Таблетки, содержащие соединение по настоящему изобретению, могут быть удобным образом получены влажной грануляцией. С использованием этого способа сухие твердые вещества (активные ингредиенты, наполнитель, связующее вещество и т.д.) смешивают и смачивают водой или другим смачивающим веществом (например, спиртом) и из смоченных твердых веществ создают агломераты или гранулы. Влажную компоновку продолжают до тех пор, пока не достигают требуемого гомогенного размера частиц, после чего высушивают гранулированный продукт. Соединения по настоящему изобретению,как правило, смешивают с моногидратом лактозы, кукурузным крахмалом и коповидоном в мешалке с большими усилиями сдвига совместно с водой. После образования гранул эти грануляты можно просеивать в сите с пригодным размером отверстий сита и высушивать. Затем полученные высушенные грануляты смешивают с микрокристаллической целлюлозой, кроскармеллозой натрия и стеаратом магния,после чего таблетки прессуют. Альтернативно, влажное гранулирование соединений по настоящему изобретению можно осуществлять с использованием маннита, кукурузного крахмала и коповидона, и эти грануляты смешивают с микрокристаллической целлюлозой, натрия крахмала гликолятом и стеаратом магния перед прессованием таблеток. Альтернативно, влажную грануляцию соединений по настоящему изобретению можно обеспечивать с использованием безводного водородфосфата кальция, кукурузного крахмала и коповидона, и эти грануляты смешивают с микрокристаллической целлюлозой, натрия крахмала гликолятом (тип А), тальком и стеаратом магния перед прессованием таблеток. Коповидон представляет собой сополимер PVP-VA.-8 015287 В одном варианте осуществления соединение по настоящему изобретению представляет собой соль бромисто-водородной кислоты, например, в бета-форме, и пригодные таблетки могут иметь следующий состав - указанные проценты представляют собой % вес./вес. В частности, таблетки могут иметь следующий состав: В одном варианте осуществления соединение по настоящему изобретению представляет собой соль бромисто-водородной кислоты, например, в бета-форме, и пригодные таблетки могут иметь следующий состав:-9 015287 В частности, таблетки могут иметь следующий состав: В одном варианте осуществления соединение по настоящему изобретению представляет собой соль бромисто-водородной кислоты, и пригодные таблетки могут иметь следующий состав:- 10015287 В частности, таблетки могут иметь следующий состав: Таблетки с различными количествами активного соединения, такими как количества, соответствующие, например 2,5, 5, 10, 20, 25, 30, 40, 50, 60 или 80 мг свободного основания, можно получать выбором правильного количества соединения по настоящему изобретению в сочетании с таблеткой соответствующего размера. Размер кристаллов, используемых для получения таблеток, содержащих соединения по настоящему изобретению, является важным. Если кристаллы являются слишком маленькими, они могут прилипать к поршню в таблетирующих устройствах. С другой стороны, они также не могут быть слишком большими. Скорость растворения в кишечнике снижается при увеличении размера кристаллов. Таким образом, если кристаллы являются слишком большими, они могут ухудшить биодоступность соединений. Распределение размеров частиц можно описать с использованием квантилей, например, D5%, D10%, D50%, D90%,D95% и D98%. Как используют в настоящем документе, "распределение размера частиц" означает суммарное объемное распределение размера эквивалентных сферических диаметров, как определяют посредством лазерной дифракции при рассеивающем давлении 1 бар в оборудовании Sympatec Helos. В одном варианте осуществления кристаллы соединения по настоящему изобретению, в частности бета-формы соли бромисто-водородной кислоты, имеют распределение размера частиц, соответствующее D98%: 650-680 мкм; D50%: 230-250 мкм; D5%: 40-60 мкм. В следующем варианте осуществления распределение размера частиц соответствуетD98%: 370-390 мкм; D50%: 100-120 мкм; D5%: 5-15 мкм. В следующем варианте осуществления, распределение размера частиц соответствуетD98%: 100-125 мкм; D50%: 15-25 мкм; и D5%: 1-3 мкм. В следующем варианте осуществления, распределение размера частиц соответствуетD98%: 50-70 мкм; D50%: 3-7 мкм; D5%: 0,5-2 мкм. Свободное основание по настоящему изобретению можно получать, как описано вWO 2003/029232. Соли по настоящему изобретению можно получать растворением свободного основания в пригодном растворителе, добавлением соответствующей кислоты, с последующим осаждением. Осаждение можно проводить либо посредством добавления второго растворителя, и/либо выпаривания,и/либо охлаждения. Альтернативно, свободное основание по настоящему изобретению и, в конечном итоге, соединения по настоящему изобретению можно синтезировать в катализируемой палладием реакции, как описано ниже. Образования ароматических связей углерод-гетероатом можно достигать нуклеофильным ароматическим замещением или опосредуемыми медью реакциями Ульмана. Позднее было показано, что палладий является мощным катализатором образования таких связей, в частности образования связей C-N иC-S, см. например, US 5573460. В одном варианте осуществления настоящее изобретение относится к процессу получения причем процесс включает реакцию соединения II где R' представляет собой водород или ион одновалентного металла, с соединением формулы III где X1 и Х 2 независимо представляют собой галоген, и соединения формулы IV где R представляет собой водород или защитную группу, в присутствии растворителя, основания и палладиевого катализатора, состоящего из источника палладия и фосфинового лиганда при температуре между 60 и 130 С. В одном варианте осуществления процесс разделен на подпроцессы, где соединение II и соединение Затем это соединение необязательно очищают до пригодной степени, а затем подвергают реакции с соединением IV с получением 4-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина. Однореакторные синтезы, т.е. синтезы, где все участники реакции смешивают вместе в начале реакции или процесса, являются особенно пригодными вследствие присущей им простоты. С другой стороны, количество возможных нежелательных побочных реакций значительно повышается, что также означает, что число и/или количество нежелательных побочных продуктов может возрастать и, соответственно, снижается выход требуемого продукта. Для настоящего процесса, в частности, можно наблюдать, что пиперазин имеет два атома азота, каждый из которых может потенциально участвовать в образовании связи C-N. Неожиданно было выявлено, что настоящий процесс можно проводить в качестве однореакторного синтеза, т.е. процесса, где с самого сначала смешивают соединение II, соединение III и соединение VI, сохраняя высокий выход чистого соединения. Соединение II представляет собой тиол или соответствующий тиолат. Исходя из профессиональной гигиены, является благоприятной перспектива применения тиолата, такого как тиолат Li+, Na+ или K+,для избегания проблем с запахом, ассоциированным с тиолами. Тем не менее, в одном варианте осуществления R' представляет собой водород. Соединение III представляет собой активированный 1,2-дигалогеном бензол, и галогены могут представлять собой любой из Cl, Br и I. В частности, соединение II представляет собой 1-бром-2 йодбензол или 1,2-дибромбензол. Растворитель, используемый в процессе по настоящему изобретению, можно выбирать из апротонных органических растворителей или смесей таких растворителей с температурой кипения в пределах диапазона температур реакции, т.е. 60-130 С. Как правило, растворитель выбран из толуола, ксилола,триэтиламина, трибутиламина, диоксана, N-метилпирролидона или из любой их смеси. Конкретно, в качестве растворителя упоминается толуол. Центральным для настоящего процесса является применение палладиевого катализатора, без которого реакции не протекают. Палладиевый катализатор состоит из источника палладия и фосфинового лиганда. Пригодные источники палладия включают палладий с различными степенями окисления, например, такими как 0 и II. Примерами источников палладия, которые можно использовать в процессе по настоящему изобретению, являются Pd2dba3, Pddba2 и Pd(OAc)2. dba является сокращением дибензилиденацетона. Конкретно упоминается Pddba2 и Pd2dba3. Источник палладия, как правило, применяют в количестве 0,1-10 мол.%, таком как 1-10 мол.%, таком как 1-5 мол.%. На протяжении этого описания мол.% вычисляют относительно лимитирующего участника реакции. Известно множество фосфиновых лигандов, как монодентатных, так и бидентатных. Пригодные фосфиновые лиганды включают: рацемический 2,2'-бис-дифенилфосфанил-[1,1']бинафталенил (rac-BINAP); 1,1'-бис-(дифенилфосфино)ферроцен (DPPF); бис-(2-дифенилфосфинофенил)эфир (DPEphos); три-трет-бутилфосфин (соль Fu); бифенил-2-ил-ди-трет-бутилфосфин; бифенил-2-ил-дициклогексилфосфин;- 12015287 Более того, вместо фосфиновых лигандов можно использовать карбеновые лиганды, например, такие как хлорид 1,3-бис-(2,6-диизопропилфенил)-3 Н-имидазол-1-ил. В одном варианте осуществления фосфиновый лиганд представляет собой rac-BINAP, DPPF или DPEphos, в частности rac-BINAP. Фосфиновый лиганд, как правило, наносят в количестве между 0,1 и 10 мол.%, таком как 1 и 5 мол.%, как правило, приблизительно 1-2 мол.%. Основание добавляют в реакционную смесь для повышения рН. В частности, пригодными являются основания, выбранные из NaOt-Bu, KOt-Bu и Cs2CO3. Также можно применять органические основания,такие как 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU) и 1,4-диазабицикло[2,2,2]октан (DABCO). Конкретно упоминаются NaO(t-Bu) и KO(t-Bu). Как правило, основание добавляют в количестве приблизительно 1-5 экв., таком как 1-3 экв., таком как 2-3 экв. Соединение IV представляет собой соединение пиперазина. Пиперазин имеет два атома азота, только один из которых участвует в образовании связи C-N. В одном варианте осуществления образования связей второго атома азота избегают с использованием монозамещенного пиперазина, т.е. варианта осуществления где R представляет собой защитную группу. В данной области известно множество защитных групп, и пригодные примеры включают boc, Bn, Cbz, С(=O)O и Me, в частности boc. Bn является сокращением бензила; boc является сокращением трет-бутилоксикарбонила и cbz является сокращением бензилоксикарбонила. Если в реакциях используют защищенный пиперазин, защитную группу необходимо удалять в последующей стадии, как правило, посредством добавления водной кислоты. Если в качестве защитной группы используют метил, метил можно удалять реакцией с карбаматом и последующим удалением этой группы. Неожиданно было выявлено, что незащищенный пиперазин можно использовать также без образования нежелательных связей со вторым атомом азота. Защищенный и незащищенный пиперазин имеет различную растворимость в различных растворителях; в качестве примера пиперазин практически нерастворим в толуоле, в то время как boc-защищенный пиперазин высоко растворим в толуоле. В норме,ожидается, что для успешной реакции требуется, чтобы все участники реакции были хорошо растворимыми в применяемом растворителе. Тем не менее, было выявлено, что процесс по настоящему изобретению протекает с высоким выходом в случае толуола, в качестве растворителя, и незащищенного пиперазина, т.е. в варианте осуществления, где R представляет собой водород. Таким образом, в одном варианте осуществления растворителем является толуол и соединение IV представляет собой пиперазин. В следующем варианте осуществления это сочетание условий используют в однореакторном синтезе. В одном варианте осуществления температура проведения процесса составляет приблизительно 80 С - приблизительно 120 С. В одном варианте осуществления 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин получают в процессе, включающем следующие стадии:a) растворение или диспергирование 1-1,5 экв. соединений II, III и IV в толуоле с получением смеси А;b) добавление 1-2 мол.% Pddba2 и 1-2 мол.% rac-BINAP совместно с 2-3 экв. NaOt-Bu, необязательно диспергированными или растворенными или диспергированными в толуоле, к смеси А с получением смеси В, которую нагревают приблизительно до 100 С до полного превращения соединения II и III, как правило, в течение 5-10 ч;c) повышение температуры смеси, полученной на стадии b), приблизительно до 120 С до полного превращения соединения IV, как правило, в течение 16-32 ч;d) необязательно удаление защитной группы добавлением водной кислоты, если соединение III представляет собой защищенный пиперазин. Необязательно, в представленную выше последовательность стадий реакции можно включать стадии очистки. В одном варианте осуществления 1-1,5 экв. 2,4-диметилтиола, 1-бром-2-йодбензола (или 1,2-дибромбензола) и пиперазина диспергируют в толуоле, а затем добавляют 2-5, например, 3 экв.NaOt-Bu и 1-2 мол.% Pd2dba3 и rac-BINAP, диспергированных в толуоле, с получением смеси,которую кипятят с обратным холодильником в течение 2-10 ч, как правило, 3-5 ч, с получением 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина. Необязательно, этот продукт можно далее подвергать реакции с водной HBr с получением соответствующей аддитивной соли бромисто-водородной кислоты. В одном варианте осуществления 2-5 экв. NaOt-Bu, 2-5 экв. пиперазина, 0,2-0,6 мол.% Pddba2 и 0,6-1 мол.% rac-BINAP диспергируют в толуоле с получением смеси А', и к этой смеси добавляют приблизительно 1 экв. 2-бром-йодбензола с получением смеси В', и к этой смеси добавляют 1 экв. 2,4-диметилтиофенола и полученную смесь нагревают до температуры кипячения с обратным холодильником в течение 3-7 ч,например в течение 4-6 ч,с получением 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина. Необязательно, этот продукт можно далее подвергать реакции с водной HBr с получением соответствующей аддитивной соли бромисто-водородной кислоты.- 13015287 В некоторых случаях может быть желательным получение кислотно-аддитивной соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина, а не свободного основания. Кислотно-аддитивные соли можно получать в следующей стадии процесса, в которой полученное свободное основание подвергают реакции с соответствующей кислотой, например, такой как фумаровая кислота, серная кислота,хлористо-водородная кислота или бромисто-водородная кислота. Кислоту можно добавлять непосредственно в реакционную смесь или, альтернативно, перед такой стадией свободное основание можно исходно очищать до пригодной степени. Если свободное основание выделено в качестве сухого соединения,может быть необходимым применение растворителя в целях переведения свободного основания в раствор перед реакцией с кислотой. В одном варианте осуществления водную бромисто-водородную кислоту добавляют непосредственно в реакционную смесь без исходной очистки свободного основания. В процессах, где используют защищенный пиперазин, защитную группу необходимо удалять посредством добавления водной кислоты, как объяснено выше. В одном варианте осуществления указанная водная кислота может быть выбрана для достижения двух превращений, т.е. удаления защитной группы из защищенного пиперазина и образования кислотно-аддитивной соли. В частности, для удаления защитной группы из пиперазина и для получения аддитивной соли бромисто-водородной кислоты в одной стадии процесса можно использовать бромисто-водородную кислоту. Для всех реакций и реакционных смесей, упомянутых в настоящем документе, может быть преимущественным продувать их инертным газом или подвергать реакции под слоем инертного газа. Примером недорогого и легко доступного инертного газа является азот. Все ссылки, включая публикации, патентные заявки и патенты, цитированные в настоящем документе, включены в настоящий документ в качестве ссылок в полном объеме и в той степени, как если бы было указано, что каждая ссылка отдельно и конкретно включена в качестве ссылки и приведена в ее полном объеме в настоящем документе (до максимальной степени, допускаемой законом), независимо от какого-либо отдельно предоставленного включения конкретных документов, сделанного в другой части настоящего документа. Применение формы единственного числа и сходных объектов ссылки в контексте описания настоящего изобретения следует истолковывать как охватывающее как единственное, так и множественное число, если нет иных указаний в настоящем документе или если контекст явно этому не противоречит. Например, выражение "соединение" следует понимать как указания на различные соединения по настоящему изобретению или конкретный описанный аспект, если нет иных указаний. Если нет иных указаний, все точные значения, представленные в настоящем документе, отражают соответствующие приблизительные значения (например, можно считать, что все точные иллюстративные значения, представленные в отношении конкретного фактора или значения, также относятся к соответствующему приблизительному значению, модифицированному посредством "приблизительно", когда это целесообразно). Приведенное в настоящем документе описание любого аспекта или аспекта настоящего изобретения с использованием терминов, таких как "содержащий", "имеющий", "включающий" или"охватывающий" со ссылкой на элемент или элементы, предназначено для предоставления основания для сходного аспекта или аспекта настоящего изобретения, который "состоит из", "по существу, состоит из" этого конкретного элемента или элементов или "по существу, содержит" их, если нет иных указаний или если контекст явно этому не противоречит (например, композицию, описанную в настоящем документе как содержащую конкретный элемент, следует также понимать как описание композиции, состоящей из этого элемента, если нет иных указаний или если контекст явно этому не противоречит). Примеры Способы анализа. Спектры 1 Н ЯМР регистрируют при 500,13 МГц на устройстве Bruker Avance DRX500. В качестве растворителя используют диметилсульфоксид (99,8%D) и в качестве внутреннего контрольного стандарта используют тетраметилсилан (TMS). Температуры плавления измеряют с использованием дифференциальной сканирующей калориметрии (DSC). Оборудование представляет собой TA-Instruments DSC-Q1000, калиброванное на 5/мин,дающее температуру плавления в качестве исходного значения. Приблизительно 2 мг образца нагревают при 5/мин в неплотно закрытом контейнере в потоке азота. Термогравиметрический анализ (TGA), используемый для оценки содержания растворитель/вода в сухом материале, проводят с использованием TA-Instruments TGA-Q500. 1-10 мг образца нагревают при 10/мин в открытом контейнере в потоке азота. Порошковые рентгенограммы получали на рентгеновском дифрактометре PANalytical X'Pert PRO с использованием излучения CuK1. Измерение для образцов проводили в режиме отражения в диапазоне 2 5-40 с использованием устройства для детекции X'celerator.- 14015287 Пример 1. Фармакология рецептора in vitro. Транспортер серотонина крысы: IC50 5,3 нМ (блокада захвата 5-HT). Транспортер серотонина человека: IC50 40 нМ (блокада захвата 5-HT). Рецептор 5-HT1A человека: Ki 40 нМ с частичным агонизмом (эффективность 85%). Рецептор 5-HT3A крысы: IC50 0,2 нМ (антагонизм в функциональном анализе). Рецептор 5-HT3A человека: IC50 приблизительно 20 нМ (антагонизм в функциональном анализе). При более высокой концентрации соединение проявляет агонистическую активность с ED50 2,1 мкМ. Соединение по настоящему изобретению также показало высокую аффинность к рецептору 5-НТ 3 человека в анализе связывания in vitro (Ki 4,5 нМ). Пример 2. Когнитивные эффекты. Как рассмотрено выше, соединения по настоящему изобретению взаимодействуют с холинергической системой, и можно ожидать увидеть эффект в одной из следующих моделей in vivo. Серийный тест времени реакции с пятью альтернативами (5-CSRT), который является пригодным для демонстрации эффекта на длительное внимание. Пространственный тест с Y-образным лабиринтом, который пригоден для того, чтобы показать эффекты на кратковременную, длительную и рабочую память. Тест переключения внимания, который пригоден для того, чтобы показать эффекты на организующую функцию, т.е. на мотивировку и решение задач. Пример 3 а. Получение свободного основания соединения I. 10,0 г гидробромида 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина обрабатывали перемешанной смесью из 100 мл 3 М NaOH и 100 мл этилацетата в течение 10 мин. Органическую фазу отделяли, промывали 100 мл 15 мас.% NaCl (водного), сушили над MgSO4, фильтровали и концентрировали в вакууме с получением 7,7 г (98%) основания соединения I в виде прозрачного бесцветного масла. ЯМР согласуется со структурой. Пример 3b. Получение кристаллического основания соединения I. 3,0 г бесцветного масла 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина обрабатывали 70 мл ацетонитрила и нагревали до температуры кипячения с обратным холодильником. Почти прозрачный раствор фильтровали и прозрачный фильтрат охлаждали самопроизвольно, причем вскоре после фильтрации начиналось осаждение. Смесь перемешивали при комнатной температуре (22 С) в течение 2 ч и продукт выделяли фильтрацией и сушили в вакууме (40 С) в течение ночи. Выделяли 2,7 г кристаллического основания в виде белого твердого вещества (90%). ЯМР согласуется со структурой. Элементный анализ: 72,40%С, 9,28%N, 7,58%H (теория: 72,26%С,9,36%N, 7,42%H). Пример 3 с. Характеристика кристаллического основания соединения I. Основание, получаемое по примеру 3b, является кристаллическим (XRPD) - см. фиг. 1. Оно имеет температуру плавления 117 С. Оно не является гигроскопическим и имеет растворимость в воде 0,1 мг/мл. Пример 4 а. Получение альфа-формы соли соединения I с бромисто-водородной кислотой. 2,0 г 1-[2-(2, 4-диметилфенилсульфанил)фенил]пиперазина растворяли в 30 мл горячего этилацетата и добавляли 0,73 мл 48 мас.% HBr (водной). Это добавление приводило к образованию жидкой массы и для обеспечения надлежащего перемешивания добавляли дополнительные 10 мл этилацетата. Массу перемешивали при комнатной температуре в течение 1 ч. Фильтрация и высушивание в вакууме (20 С) в течение ночи приводили к 2,0 г продукта в виде белого твердого вещества (80%). ЯМР согласуется со структурой. Элементный анализ: 57,05%С, 7,18%N, 6,16%H (теория для соли 1:1: 56,99%С, 7,39%N, 6,11%H). Пример 4b. Характеристика альфа-формы гидробромида соединения I. Альфа-форма гидробромида, полученного по примеру 4 а, является кристаллической (XRPD) - см. фиг. 2. Она имеет температуру плавления 226 С. Она поглощает приблизительно 0,3% воды под воздействием высокой относительной влажности и имеет растворимость в воде 2 мг/мл. Пример 4 с. Получение бета-формы соли соединения I c бромисто-водородной кислотой. 49,5 г бесцветного масла 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина растворяли в 500 мл этилацетата и добавляли 18,5 мл 48 мас.% HBr (водной). Это добавление приводило к образованию жидкой массы, которую перемешивали в течение ночи при комнатной температуре. Фильтрация и высушивание в вакууме (50 С) в течение ночи приводили к 29,6 г продукта в виде белого твердого вещества(47%). ЯМР согласуется со структурой. Элементный анализ: 56,86%С, 7,35%N, 6,24%H (теория для соли 1:1: 56,99%С, 7,39%N, 6,11%H). Пример 4d. Характеристика бета-формы гидробромида соединения I. Бета-форма гидробромида, полученная по примеру 4 с, является кристаллической (XRPD) - см. фиг. 3. Она имеет температуру плавления 231 С. Она поглощает приблизительно 0,6% воды под воздействием высокой относительной влажности и имеет растворимость в воде 1,2 мг/мл.- 15015287 Пример 4 е. Получение гамма-формы соли соединения I с бромисто-водородной кислотой. К 1,0 г гидробромида 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина, полученного по примеру 4 а, добавляли 20 мл воды и нагревали до 85 С. Раствор был практически прозрачным. Добавление 1 капли HBr обеспечивало его прозрачность. HBr добавляли, пока наблюдали точку помутнения. Раствор охлаждали до комнатной температуры и высушивали. ЯМР согласуется со структурой. Элементный анализ: 56,63%С, 7,18%N, 6,21%Н (теория для соли 1:1: 56,99%С, 7,39%N, 6,11%H). Пример 4f. Характеристика гамма-формы гидробромида соединения I. Гидробромид, полученный по примеру 6 е, является кристаллическим (XRPD) - см. фиг. 4. КриваяDSC показывает некоторые термические явления приблизительно при 100 С; вероятно изменение формы кристалла. Далее, он плавится приблизительно при 220 С. Он поглощает приблизительно 4,5% воды под воздействием высокой относительной влажности и при 30% RH при комнатной температуре поглощается приблизительно 2% воды. Пример 4g. Получение гидрата гидробромида соединения I. К 1,4 г масла 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина добавляли 20 мл воды и нагревали до 60 С. рН доводили до 1 с использованием 48% HBr. Раствор охлаждали до комнатной температуры и высушивали. ЯМР согласуется со структурой. Элементный анализ: 55,21%С, 7,16%N, 6,34%H (теория для гемигидрата соли 1:1: 55,68%С, 7,21%N, 6,23%H). Пример 4h. Характеристика гемигидрата гидробромида соединения I. Гидрат, полученный по примеру 4g, является кристаллическим (XRPD) - см. фиг. 5. Содержание воды строго зависит от относительной влажности. При комнатной температуре и 95% RH содержание воды составляет приблизительно 3,7%. Дегидратация происходит посредством нагревания приблизительно до 100 С. Пример 4i. Получение этилацетатного сольвата соли соединения I с бромисто-водородной кислотой. 0,9 г масла 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина растворяли в 35 мл этилацетата и добавляли 0,5 мл 48 мас.% HBr (водной). Это добавление приводило к образованию жидкой массы, которую перемешивали в течение ночи при комнатной температуре. Фильтрация и промывание 30 мл диэтилового эфира с последующим высушиванием в вакууме (50 С) в течение ночи приводили к 1,0 г EtOAcсольвата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина HBr (65%). ЯМР согласуется со структурой. Элементный анализ: 56,19%С, 6,60%N, 6,56%H (теория для соли 1:1 при коррекции по 8% этилацетата и 0,5% воды, как определено посредством TGA и KF: 56,51%С,6,76%N, 6,38%H). Пример 4j. Характеристика этилацетатного сольвата гидробромида соединения I. Этилацетатный сольват, полученный по примеру 4i, является кристаллическим (XRPD) - см. фиг. 6. Партия содержит смесь сольвата и альфа-формы соединения I, вероятно вследствие того, что высушивание вызывает частичную десольватацию. Десольватация начинается при 75 С при нагревании 10/мин. После десольватации образуется альфа-форма. При воздействии высокой относительной влажности этилацетат заменяется водой, которая высвобождается при последующем снижении влажности. Полученное твердое вещество является гигроскопическим и поглощает 3,2% воды при высокой относительной влажности. Пример 5 а. Получение соли соединения I с хлористо-водородной кислотой. 1,0 г масла 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина растворяли в 20 мл этилацетата с использованием слабого нагревания (30 С). Когда получали прозрачный раствор, медленно добавляли раствор 2 М HCl в диэтиловом эфире до тех пор, пока значение рН не составило приблизительно 1-2. В ходе добавления наблюдали самопроизвольное осаждение. После окончания добавления суспензию перемешивали в течение 1 ч, а затем белый осадок выделяли фильтрацией и сушили в вакууме (40 С) в течение ночи. Выделили 1,1 г гидрохлорида 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (99%). ЯМР согласуется со структурой. Элементный анализ: 64,18%С, 8,25%N, 6,96%H (теория для соли 1:1 после коррекции по 0,66% воды, как определено посредством TGA: 64,13%C, 8,31%N, 6,95%H). Пример 5b. Характеристика гидрохлорида соединения I. Гидрохлорид, полученный по примеру 5 а, является кристаллическим (XRPD) - см. фиг. 7. Он имеет температуру плавления 236 С. Он поглощает приблизительно 1,5% воды под воздействием высокой относительной влажности и имеет растворимость в воде 3 мг/мл. Пример 5 с. Получение моногидрата гидрохлорида соединения I. 11,9 г масла 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина растворяли в 100 мл этанола с использованием нагревания. После получения гомогенного раствора добавляли 3,5 мл концентрированной HCl (водной), вызывающей немедленное осаждение белого твердого вещества. Суспензию перемешивали сначала в течение 5 мин, а затем на ледяной бане в течение другого часа, а затем фильтровали. Белое твердое вещество промывали с использованием 100 мл свежего холодного этанола (помещенного в морозилку при -18 С на 2 ч), 50 мл ацетона и в конце 50 мл диэтилового эфира, а затем сушили в вакуу- 16015287 ме (50 С) в течение ночи. Выделили 5,1 г 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина HCl(38%). ЯМР согласуется со структурой. Элементный анализ: 61,23%С, 7,91%N, 7,16%Н (теория для моногидрата соли 1:1: 61,26%С, 7,94%N, 7,14%H). Пример 5d. Характеристика моногидрата гидрохлорида соединения I. Моногидрат гидрохлорида, полученный по примеру 5 с, является кристаллическим (XRPD) - см. фиг. 8. Его дегидратация происходит, начиная приблизительно от 50 С. При дальнейшем нагревании происходят некоторые термические явления, вероятно перестроение, и он плавится приблизительно при 230 С с последующей перекристаллизацией и плавлением приблизительно при 236 С. Он не поглощает дополнительное количество воды под воздействием высокой относительной влажности, и связанная гидратом вода не высвобождается, пока относительная влажность не снизится до менее 10% RH при комнатной температуре. Он имеет растворимость в воде приблизительно 2 мг/мл. Пример 6 а. Получение мезилатной соли соединения I. 1,0 г масла 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина растворяли в 20 мл этилацетата посредством нагревания (70 С). Когда получали прозрачный раствор, медленно добавляли 0,35 г метансульфоновой кислоты (1,1 экв.). После окончания добавления раствор охлаждали на льду и медленно добавляли диэтиловый эфир, вызывая осаждение продукта. Суспензию перемешивали в течение 2 ч на льду, а затем белый осадок выделяли фильтрацией и сушили в вакууме (40 С) в течение ночи. Выделили 1,1 г мезилата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (85%). ЯМР согласуется со структурой. Элементный анализ: 57,81%С, 6,81%N, 6,68%H (теория для соли 1:1: 57,81%С, 7,10%N, 6,64%H). Пример 6b. Характеристика мезилата соединения I. Мезилат, полученный по примеру 7 а, является кристаллическим (XRPD) - см. фиг. 9. Он имеет температуру плавления 163 С. Он является гигроскопическим (поглощает приблизительно 8% воды при воздействии относительной влажности 80% и посредством этого превращается в гидратированную форму). Последние 6% поглощенной воды не высвобождаются до тех пор, пока относительная влажность не достигает менее 10% RH. Он имеет очень высокую растворимость в воде (45 мг/мл). Пример 7 а. Получение фумарата соединения I. 5,5 г масла 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина нагревали до температуры кипячения с обратным холодильником в смеси 50 мл метанола и 50 мл этилацетата. Раствор оставляли немного охладиться, а затем добавляли 2,1 г фумаровой кислоты, вызывая экзотермическую реакцию и осаждение белого твердого вещества. Суспензию перемешивали, позволяя охлаждаться до комнатной температуры, а затем в течение 2 ч в морозилке при -18 С. Белое твердое вещество собирали фильтрацией и промывали 20 мл холодного этилацетата, а затем сушили в вакууме (50 С) в течение ночи. Выделили 3,1 г продукта (44%). ЯМР согласуется со структурой. Элементный анализ: 63,42%С, 6,64%N, 6,42%Н (теория для соли 1:1: 63,74%С, 6,76%N, 6,32%Н). Пример 7b. Характеристика фумарата соединения I. Фумарат, полученный по примеру 7 а, является кристаллическим (XRPD) - см. фиг. 10. Он имеет температуру плавления 194 С. Растворимость в воде составляет 0,4 мг/мл. Пример 8 а. Получение малеата соединения I. 2,5 г масла 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина растворяли в 50 мл этилацетата и нагревали до 60 С, а затем добавляли 1,1 г малеиновой кислоты. Смесь снова нагревали до температуры кипячения с обратным холодильником в течение 5 мин и оставляли охлаждаться до комнатной температуры при перемешивании. В ходе охлаждения начиналось осаждение, и его заканчивали 4 ч в морозилке (-18 С). Белое твердое вещество собирали фильтрацией и промывали 50 мл диэтилового эфира, а затем сушили в вакууме (50 С) в течение ночи. Это привело к 1,3 г малеата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (38%), который перекристаллизовывали обработкой 40 мл этилацетата и 5 мл метанола при кипячении с обратным холодильником. Прозрачный раствор охлаждали до комнатной температуры с последующими 2 ч в морозилке (-18 С), а затем фильтровали и промывали два раза 10 мл холодного этилацетата с последующим высушиванием в вакууме (50 С) в течение двух суток. Выделили 0,9 г малеата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (69%). ЯМР согласуется со структурой. Элементный анализ: 63,57%С, 6,79%N, 6,39%H (теория для соли 1:1: 63,74%С, 6,76%N, 6,32%H). Пример 8b. Характеристика малеата соединения I. Малеат, полученный по примеру 8 а, является кристаллическим (XRPD) - см. фиг. 11. Он имеет температуру плавления 152 С. Растворимость в воде составляет 1 мг/мл.- 17015287 Пример 9 а. Получение мезотартрата соединения I. 11,1 мл 0,30 М раствора 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина в ацетоне обрабатывали 0,5 г мезовинно-каменной кислоты, растворенной в 5 мл ацетона. Смесь перемешивали при комнатной температуре в течение 30 мин, в ходе которых происходило осаждение. Фильтрация и промывание сначала 5 мл ацетона, а затем 3 мл диэтилового эфира приводили к продукту в виде белого твердого вещества, который сушили в вакууме (50 С) в течение ночи. Выделили 1,4 г мезотартрата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (93%). ЯМР согласуется со структурой. Элементный анализ: 58,58%С, 6,29%N, 6,40%H (теория для соли 1:1: 58,91%С, 6,25%N, 6,29%H). Пример 9b. Характеристика мезотартрата соединения I. Мезотартрат, полученный по примеру 9 а, является кристаллическим (XRPD) - см. фиг. 12. Он имеет температуру плавления 164 С. Растворимость в воде составляет 0,7 мг/мл. Пример 10 а. Получение L-(+)-тартрата соединения I. 11,1 мл 0,30 М раствора 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина в ацетоне обрабатывали 0,5 г L-(+)-винно-каменной кислоты, растворенной в 5 мл ацетона. Смесь перемешивали при комнатной температуре в течение 30 мин, в ходе которых происходило осаждение. Фильтрация и промывание сначала 5 мл ацетона, а затем 3 мл диэтилового эфира привели к продукту в виде белого твердого вещества, который сушили в вакууме (50 С) в течение ночи. Выделили 1,2 г (+)-тартрата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин (81%). ЯМР согласуется со структурой. Элементный анализ: 58,86%С, 6,30%N, 6,38%H (теория для соли 1:1: 58,91%С, 6,25%N, 6,29%H). Пример 10b. Характеристика L-(+)-тартрата соединения I.L-(+)-тартрат, полученный по примеру 10 а, является кристаллическим (XRPD) - см. фиг. 13. Он имеет температуру плавления 171 С. Растворимость в воде составляет 0,4 мг/мл. Пример 11 а. Получение D-(-)-тартрата соединения I. 11,1 мл 0,30 М раствора 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина в ацетоне обрабатывали 0,5 г D-(-)-винно-каменной кислоты, растворенной в 5 мл ацетона. Смесь перемешивали при комнатной температуре в течение 30 мин, в ходе которых происходило осаждение. Фильтрация и промывание сначала 5 мл ацетона, а затем 3 мл диэтилового эфира привели к продукту в виде белого твердого вещества, который сушили в вакууме (50 С) в течение ночи. Выделили 1,0 г D-(-)-тартрата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (68%). ЯМР согласуется со структурой. Элементный анализ: 58,90%С, 6,26%N, 6,35%H (теория для соли 1:1: 58,91%С, 6,25%N, 6,29%Н). Пример 11b. Характеристика D-(-)-тартрата соединения I.D-(+)-тартрат, полученный по примеру 11 а, является кристаллическим (XRPD) - см. фиг. 14. Он имеет температуру плавления 175 С. Растворимость в воде составляет 0,4 мг/мл. Пример 12 а. Получение сульфата соединения I. 11,1 мл 0,30 М раствора 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина в ацетоне обрабатывали 2,2 мл 3 М раствора H2SO4 (водной). Смесь перемешивали при комнатной температуре в течение 30 мин, а затем на ледяной бане в течение других 4 ч, а затем происходило и завершалось осаждение. Фильтрация и промывание сначала 5 мл ацетона, а затем 3 мл диэтилового эфира приводили к продукту в виде белого твердого вещества, который сушили в вакууме (50 С) в течение ночи. Выделили 0,51 г сульфата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (39%). ЯМР согласуется со структурой. Элементный анализ: 54,53%С, 7,22%N, 6,28%H (теория для соли 1:1: 54,52%С, 7,07%N, 6,10%H). Пример 12b. Характеристика сульфата соединения I. Сульфат, полученный по примеру 12 а, является кристаллическим (XRPD) - см. фиг. 15. Он имеет температуру плавления 166 С. Растворимость в воде составляет 0,1 мг/мл. Пример 13 а. Получение фосфата соединения I. 11,1 мл 0,30 М раствора 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина в ацетоне обрабатывали 0,2 мл 65% Н 3 РО 4 (водной). Смесь перемешивали при комнатной температуре в течение 30 мин, в ходе которых происходило охлаждение. Фильтрация и промывание сначала 5 мл ацетона, а затем 3 мл диэтилового эфира привели к продукту в виде белого твердого вещества, который сушили в вакууме(94%). ЯМР согласуется со структурой. Элементный анализ: 54,21%С, 7,15%N, 6,43%H (теория для соли 1:1: 54,53%С, 7,07%N, 6,36%H). Пример 13b. Характеристика фосфата соединения I. Фосфат, полученный по примеру 13 а, является кристаллическим (XRPD) - см. фиг. 16. Он имеет температуру плавления 224 С. Растворимость в воде составляет 1 мг/мл.- 18015287 Пример 14 а. Получение нитрата соединения I. 11,1 мл 0,30 М раствора 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина в ацетоне обрабатывали 0,2 мл 16,5 М HNO3 (водной). Смесь перемешивали при комнатной температуре в течение 30 мин, в ходе которых происходило осаждение. Фильтрация и промывание сначала 5 мл ацетона, а затем 3 мл диэтилового эфира приводили к продукту в виде белого твердого вещества, который сушили в вакууме(73%). ЯМР согласуется со структурой. Элементный анализ: 59,80%С, 11,67%N, 6,51%H (теория для соли 1:1: 59,81%С, 11,63%N, 6,41%Н). Пример 14b. Характеристика нитрата соединения I. Нитрат, полученный по примеру 14 а, является кристаллическим (XRPD) - см. фиг. 17. Он не плавится, а разлагается в экзотермической реакции приблизительно при 160 С. Растворимость в воде составляет 0,8 мг/мл. Пример 15. Таблетка. В примерах, представленных ниже, показаны репрезентативные примеры того, каким образом можно получать таблетки, содержащие соединения по настоящему изобретению. Во всех примерах использовали бета-форму соли бромисто-водородной кислоты. Пример 15 а. 63,55 г соли бромисто-водородной кислоты, 923,65 г Lactosum 350 М, 461,8 г кукурузного крахмала и 76,0 г Kollidon VA64 смешивали в течение 2 мин в мешалке с большим усилием сдвига Diosna PP1 со скоростью лопасти 1000 об/мин. Далее, скорость лопасти снижали до 800 об/мин и в течение 1 мин добавляли 220 г воды. Компоновку проводили в течение 7 мин и полученные гранулы пропускали через сито размером 4000 мкм. Гранулы сушили и пропускали через сито размером 710 мкм. 1383,5 г полученных гранул смешивали с 400 г Avicel PH200 и 60 г Ac-Di-Sol. После смазывания смеси смешиванием с 15 г стеарата магния порошковую смесь переносили в таблетирующий пресс. Изготавливали таблетки,имеющие намеченную массу сердцевины 200 мг и диаметр 8 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 5 мг. Пример 15b. 317,75 г соли бромисто-водородной кислоты, 754,15 г Lactosum 350M, 377,1 г кукурузного крахмала и 76,0 г Kollidon VA64 смешивали в течение 2 мин в мешалке с большим усилием сдвига Diosna PP1 со скоростью лопасти 1000 об/мин. Далее, скорость лопасти снижали до 800 об/мин и в течение 1 мин добавляли 210 г воды. Компоновку проводили в течение 7 мин и полученные гранулы пропускали через сито размером 4000 мкм. Гранулы сушили и пропускали через сито размером 710 мкм. 1386,2 г полученных гранул смешивали с 400 г Avicel PH200 и 60 г Ac-Di-Sol. После смазывания смеси смешиванием с 15 г стеарата магния порошковую смесь переносили в таблетирующий пресс. Изготавливали таблетки,имеющие намеченную массу сердцевины 200 мг и диаметр 8 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 25 мг. Пример 15 с. 32,2 г соли бромисто-водородной кислоты, 944,82 г Lactosum 350 М, 472,4 г кукурузного крахмала и 76,0 г Kollidon VA64 смешивали в течение 2 мин в мешалке с большим усилием сдвига Diosna PP1 со скоростью лопасти 1000 об/мин. Далее, скорость лопасти снижали до 800 об/мин и в течение 1 мин добавляли 220 г воды. Компоновку проводили в течение 7 мин и полученные гранулы пропускали через сито размером 4000 мкм. Гранулы сушили и пропускали через сито размером 710 мкм. 1317 г полученных гранул смешивали с 400 г Avicel PH200 и 60 г Ac-Di-Sol. После смазывания смеси смешиванием с 15 г стеарата магния порошковую смесь переносили в таблетирующий пресс. Изготавливали таблетки,имеющие намеченную массу сердцевины 208 мг и диаметр 8 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 2,5 мг. Пример 15d. 540,85 г соли бромисто-водородной кислоты, 953,00 г Pearlitol 50C, 296,22 г кукурузного крахмала и 70,5 г Kollidon VA64 смешивали в течение 2 мин в мешалке с большим усилием сдвига AeromaticFielder PMA1 со скоростью лопасти 1000 об/мин. Далее, скорость лопасти снижали до 800 об/мин и в течение 1 мин добавляли 241,87 г воды. Компоновку проводили в течение 7 мин и полученные гранулы пропускали через сито размером 4000 мкм. Гранулы сушили и пропускали через сито размером 710 мкм. 1500 г полученных гранул смешивали с 531,91 г Avicel PH200 и 85,11 г Primojel. После смазывания смеси смешиванием с 10,64 г стеарата магния порошковую смесь переносили в таблетирующий пресс. Изготавливали таблетки, имеющие намеченную массу сердцевины 125 мг и диаметр 6 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 25 мг.- 19015287 Пример 15 е. 270,45 г соли бромисто-водородной кислоты, 772,0 г Pearlitol 50C, 386,41 г кукурузного крахмала и 70,5 г Kollidon VA64 смешивали в течение 2 мин в мешалке с большим усилием сдвига Aeromatic-FielderPMA1 со скоростью лопасти 1000 об/мин. Далее, скорость лопасти снижали до 800 об/мин и в течение 1 мин добавляли 195 г воды. Компоновку проводили в течение 5,5 мин и полученные гранулы пропускали через сито размером 4000 мкм. Гранулы сушили и пропускали через сито размером 710 мкм. 1200,3 г полученных гранул смешивали с 425,5 г Avicel PH200 и 68,09 г Primojel. После смазывания смеси смешиванием с 8,8 г стеарата магния порошковую смесь переносили в таблетирующий пресс. Изготавливали таблетки, имеющие намеченную массу сердцевины 100 мг и диаметр 6 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 10 мг. Пример 15f. 504,85 г свободного основания, 552,95 г Pearlitol 50C, 276,53 г кукурузного крахмала и 65,7 гKollidon VA64 смешивали в течение 2 мин в мешалке с большим усилием сдвига Aeromatic-Fielder PMA1 со скоростью лопасти 1000 об/мин. Далее, скорость лопасти снижали до 800 об/мин и в течение 1 мин добавляли 182 г воды. Компоновку проводили в течение 5,5 мин и полученные гранулы пропускали через сито размером 4000 мкм. Гранулы сушили и пропускали через сито размером 710 мкм. 1250,7 г полученных гранул смешивали с 443,31 г Avicel PH200 и 70,8 г Primojel. После смазывания смеси смешиванием с 8,92 г стеарата магния порошковую смесь переносили в таблетирующий пресс. Изготавливали таблетки, имеющие намеченную массу сердцевины 250 мг и диаметр 8 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 50 мг. Пример 15g. 135,23 г соли бромисто-водородной кислоты, 863,2 г Pearlitol 50C, 432,69 г кукурузного крахмала и 70,66 г Kollidon VA64 смешивали в течение 2 мин в мешалке с большим усилием сдвигаAeromatic-Fielder PMA1 со скоростью лопасти 1000 об/мин. Далее, скорость лопасти снижали до 800 об/мин и в течение 1 мин добавляли 195 г воды. Компоновку проводили в течение 5,5 мин и полученные гранулы пропускали через сито размером 4000 мкм. Гранулы сушили и пропускали через сито размером 710 мкм. 1200 г полученных гранул смешивали с 425,28 г Avicel PH200 и 68,2 г Primojel. После смазывания смеси смешиванием с 8,58 г стеарата магния порошковую смесь переносили в таблетирующий пресс. Изготавливали таблетки, имеющие намеченную массу сердцевины 100 мг и диаметр 6 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 5 мг. Пример 15h. 67,6 г соли бромисто-водородной кислоты, 908,0 г Pearlitol 50 С, 453,9 г кукурузного крахмала и 70,51 г Kollidon VA64 смешивали в течение 2 мин в мешалке с большим усилием сдвига Diosna PP1 со скоростью лопасти 1000 об/мин. Далее, скорость лопасти снижали до 800 об/мин и в течение 1 мин добавляли 195 г воды. Компоновку проводили в течение 5,5 мин и полученные гранулы пропускали через сито размером 4000 мкм. Гранулы сушили и пропускали через сито размером 710 мкм. 1325 г полученных гранул смешивали с 531,91 г Avicel PH200 и 85,11 г Primojel. После смазывания смеси смешиванием с 10,64 г стеарата магния порошковую смесь переносили в таблетирующий пресс. Изготавливали таблетки, имеющие намеченную массу сердцевины 207,8 мг и диаметр 7 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 5 мг. Пример 15i. 2290,1 г соли бромисто-водородной кислоты, 17568 г безводного водородфосфата кальция, 8783 г кукурузного крахмала и 1510 г коповидона смешивали в течение 3 мин в мешалке с большим усилием сдвига Aeromatic-Fielder РМА 100 со скоростью лопасти 200 об/мин. Далее, добавляли 5130 г воды в течение 2 мин со скоростью лопасти 150 об/мин. Компоновку проводили в течение 15 мин и полученные гранулы пропускали через коническую мельницу, работающую приблизительно при 2700 об/мин с экраном размером 9,525 мм. Гранулы сушили и пропускали через коническую мельницу, работающую при 1500 об/мин с экраном размером 2,388 мм. 28747 г полученных гранул смешивали с 11250 г микрокристаллической целлюлозы, 1350 г натрия крахмала гликолята (тип А) и 1800 г талька. После смазывания смеси смешиванием с 450 г стеарата магния порошковую смесь переносили в таблетирующий пресс. Изготавливали таблетки, имеющие намеченную массу сердцевины 125 мг и диаметр 6 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 5 мг. Кроме того, изготавливали таблетки, имеющие намеченную массу сердцевины 250 мг и диаметр 8 мм, с получением таблеток с намеченным содержанием свободного основания, соответствующим 10 мг. Пример 16. Болевые эффекты в тесте внутрикожного введения формалина у мышей. В этой модели мышам проводили инъекцию формалина (4,5%, 20 мкл) в левую заднюю лапу. Раздражение, вызванное инъекцией формалина, приводит к характерной двухфазной поведенческой реакции, которую количественно выражают посредством количества времени, потраченного на вылизывание поврежденной лапы. Первая фаза (0-10 мин) представляет собой прямое химическое раздражение и ноцицепцию, в то время как вторая (20-30 мин), как полагают, отражает боль невропатического происхождения. Две фазы разделяются периодом покоя, в ходе которого поведение возвращается к норме. Эффективность тестируемых соединений в отношении снижения болезненных стимулов оценивают подсче- 20015287 том количества времени, потраченного на вылизывание поврежденной лапы в двух фазах. Соединения по настоящему изобретению показали значимое снижение показателей боли второй фазы (фиг. 18b), указывая на эффективность против боли невропатического происхождения. Более того,соединения по настоящему изобретению показали значимое снижение показателей первой фазы(фиг. 18 а), указывая на большее обезболивающее действие в наиболее высокой дозе. В общем, эти результаты указывают на то, что соединения по настоящему изобретению, вероятно, являются эффективными в отношении лечения связанных с болью нарушений. Пример 17.DPEPhos (0,71 ммоль; 1 мол.%). Реакционную смесь перемешивали в течение 5 мин, в ходе которых цвет менялся от темно-красного до оранжевого. Добавляли 8,7 г KOBut (78 ммоль) и сразу образовывалась гетерогенная смесь. Суспензию нагревали до 100 С в атмосфере азота. Через 1 ч смесь охлаждали до 0 С и перемешивали в течение 2 ч, а затем смесь фильтровали через целит. Осадок на фильтре промывали 250 мл толуола и объединенные фильтраты выпаривали с получением 21 г оранжево-красного масла(выход 99%), для которого была показана 96% чистота на ВЭЖХ и GC-MS. Пример 18. 500 мл толуола помещали в 1-л круглую колбу с тремя горлышками с механической мешалкой и добавляли 203 мг Pddba2 (0,35 ммоль; 0,1 мол.%) и 760 мг DPEPhos (1,5 ммоль; 0,4 мол.%). Темнокрасный раствор продували азотом в течение 5 мин, а затем добавляли 100 г 2-бромйодбензола(353 ммоль) и 48,9 г 2,4-диметилтиофенола (353 ммоль). Добавление 43,6 г KOBut (389 ммоль) приводило к экзотермической реакции, повышающей температуру от 20 до 36 С, одновременно с образованием гетерогенной смеси. Суспензию нагревали до 100 С в атмосфере азота. Через 7 ч смесь охлаждали до 0 С и перемешивали в течение 2 ч, а затем смесь фильтровали через целит. Осадок на фильтре промывали 2200 мл толуола и объединенные фильтраты выпаривали с получением 104 г оранжевого масла (выход 105%), для которого была показана 97% чистота на ВЭЖХ и ЯМР подтвердил требуемую структуру. Масло затвердевало при стоянии при комнатной температуре. Пример 19. Раствор 10 г 1-(2-бромфенилсульфанил)-2,4-диметилбензола (34 ммоль) в 50 мл сухого толуола добавляли 7 г boc-пиперазина (38 ммоль), дегазированного азотом в течение 5 мин, добавляли 312 мгPd2dba3 (2 мол.%) и 637 мг rac-BINAP (3 мол.%), дегазировали в течение других 5 мин, а затем добавляли 3,9 г ButONa (41 ммоль) и нагревали до 80 С в течение 15 ч. Реакционную смесь охлаждали до RT и экстрагировали дважды 20 мл 15% рассола, сушили надNa2SO4) добавляли активированный уголь, кипятили с обратным холодильником в течение 15 мин,- 21015287 фильтровали через целит и выпаривали с получением 14,2 г коричневого масла(4-[2-(2,4-диметилфенилсульфанил)фенил]-boc-пиперазин), обладающего 95% частотой, определенной посредством ЯМР. Неочищенное масло растворяли в 200 мл МеОН и 20 мл 6 М HCl (водной) и кипятили с обратным холодильником в течение 1 ч, после чего ВЭЖХ показала полное удаление защитной группы. После охлаждения до RT метанол удаляли посредством вакуума на роторном испарителе, добавляли 20 мл концентрированного NaOH (рН измеряли до 13-14), после чего перемешивали в течение 15 мин со 100 мл EtOAc. Органическую фазу собирали и экстрагировали два раза 30 мл 15% рассола, сушили надNa2SO4 и добавляли 5,2 г фумаровой кислоты (44 ммоль) в 30 мл МеОН. В процессе нагревания до температуры кипячения с обратным холодильником образуется гомогенный раствор, из которого происходит быстрое осаждение, либо при дальнейшем нагревании, либо при охлаждении. Осадок собирали, промывали 20 мл EtOAc и 20 мл ацетона, сушили в вакууме с получением 9,3 г фумарата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (22 ммоль) в виде белого порошка в общим выходом 66% с чистотой 99,5% при LC-MS. Пример 20.(21 ммоль; 5 мол.%). Реакционную смесь перемешивают в течение 5 мин, в ходе которых цвет меняется с темно-красного на оранжевый. Добавляли 61 г NaOBut (636 ммоль) и 200 мл толуола и сразу образовывалась гетерогенная смесь. Суспензию нагревали до 80 С в атмосфере азота. Через 10 ч смесь охлаждают до 60 С, а затем добавляют массу из 102,6 г boc-пиперазина (551 ммоль) и других 61 г NaOBut(636 ммоль) в 500 мл толуола. Реакционную смесь продували азотом, а затем добавляли другую часть 4,6 г Pddba2 (8 ммоль; 2 мол.%) и 13,1 г rac-BINAP (21 ммоль; 5 мол.%). Смесь нагревали до температуры кипячения с обратным холодильником на этот раз (110 С) в течение других 6 ч или до тех пор, пока ВЭЖХ не показывала полное превращение. Реакционную смесь охлаждали на льду в течение 2 ч, а затем смесь фильтровали через целит. Осадок на фильтре промывали 2200 мл толуола и объединенные фильтраты выпаривали с получением 242 г красного масла. Масло растворяли в 1000 мл МеОН и медленно добавляли 115 мл 48 мас.% HBr (водной), а затем нагревали до температуры кипячения с обратным холодильником в течение 2 ч, после чего посредством ВЭЖХ выявляли полное удаление защитных групп. Смесь охлаждали, добавляли 1000 мл EtOAc и МеОН удаляли посредством испарения. Добавление 1000 мл Et2O привело к осаждению. Перемешивание продолжали при комнатной температуре в течение 2 ч, а затем массу оставляли в морозилке в течение ночи (-18 С). Фильтрация и промывание два раза 200 мл Et2O приводили к 172 г коричневого твердого вещества после высушивания в вакууме при 40 С. Коричневое твердое вещество обрабатывали 1500 мл кипящей H2O в течение 1 ч, а затем охлаждали до комнатной температуры в течение других 2 ч. Фильтрация и высушивание в вакууме при 40 С привели к 98 г гидробромида 4-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (61%). Пример 21. 102 г 2-бромйодбензола (362 ммоль) и 50 г 2,4-диметилтиофенола (362 ммоль) растворяют в 1000 мл толуола. К этому раствору добавляли 81 г boc-пиперазин (434 ммоль), а затем 2,08 г Pddba2(1 мол.%) и 4,51 г rac-BINAP (2 мол.%). Смесь продували азотом в течение 5 мин, а затем добавляли массу из 87 г NaOBut (905 ммоль) в 300 мл толуола. Суспензию нагревали до 100 С в атмосфере азота в течение ночи. Анализ GCMS показал полное превращение в промежуточный продукт(1-(2-бромфенилсульфанил)-2,4-диметилбензол) и температуру повышали до температуры кипячения с обратным холодильником (120 С) в течение других 24 ч. Анализ ВЭЖХ показал полное превращение в промежуточное соединение (1-boc-4-[2-(2,4- диметилфенилсульфанил)фенил]пиперазин). Реакционную смесь охлаждали на льду в течение 1 ч, а затем смесь фильтровали. Осадок на фильтре промывали 2200 мл толуола и к объединенным фильтратам добавляли 80 мл 48 мас.% HBr (водной), а затем нагревали до температуры кипячения с обратным холодильником в течение 18 ч, после чего посредством ВЭЖХ выявляли полное удаление защитных групп. Смесь охлаждали на льду в течение 2 ч и фильтровали. Коричневое твердое вещество растворяли в 1000 мл кипящей Н 2 О в течение 1 ч совместно с активи- 22015287 рованным углем (25 г), фильтровали в горячем состоянии и оставляли охлаждаться. Осадок собирали фильтрацией и высушиванием в вакууме при 40 С в течение ночи, что приводило к 49 г гидробромида 4-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (36%) в виде белого твердого вещества. Пример 22. 500 мл толуола помещали в 1-л круглую колбу с тремя горлышками с механической мешалкой и добавляли 809 мг Pd2dba3 (0,88 ммоль; 0,5 мол.%) и 952 мг DPEPhos (1,77 ммоль; 0,5 мол.%). Темнокрасный раствор продували азотом в течение 5 мин, а затем добавляли 100 г 2-бромйодбензола(353 ммоль) и 48,9 г 2,4-диметилтиофенола (353 ммоль). Добавление 43,6 г KOBut (389 ммоль) приводило к экзотермической реакции, повышающей температуру от 20 до 42 С, одновременно с образованием гетерогенной смеси, и цвет менялся с темно-красного на оранжевый/коричневый. Суспензию нагревали до 100 С в атмосфере азота. Только через 20 мин ВЭЖХ показала полное превращение в 1-(2-бромфенилсульфанил)-2,4-диметилбензол. Смесь охлаждали до 40 С, добавляли 600 мл 15 мас.%NaCl и перемешивали в течение 5 мин. Органическую фазу разделяли и водную фазу промывали 2100 мл толуола. Объединенные органические фазы промывали 100 мл 2 М HCl (водной), 100 мл 15 мас.% NaCl, сушили над Na2SO4, кипятили с обратным холодильником в течение 15 мин с активированным углем (10 г), фильтровали два раза и выпаривали с получением 107,3 г оранжево-красного масла(103%), которое, как было выявлено посредством ВЭЖХ, было на 98% чистым. В раствор 90 г оранжево-красного масла (307 ммоль) в 500 мл сухого толуола добавляли 57 гboc-пиперазина (307 ммоль), дегазировали азотом в течение 5 мин, добавляли 1,4 г Pd2dba3 (1,53 ммоль; 0,5 мол.%) и 2,9 г rac-BINAP (4,6 ммоль; 1,5 мол.%), дегазировали в течение других 2 мин, а затем добавляли 35,4 г ButONa (368 ммоль) и нагревали до 80 С в течение 18 ч. ВЭЖХ показала полное превращение и реакционную смесь охлаждали до RT, фильтровали и осадок на фильтре промывали 2100 мл толуола. Объединенные фильтраты экстрагировали два раза 2150 мл 15 мас.% NaCl, сушили над Na2SO4, добавляли активированный уголь, кипятили с обратным холодильником в течение 30 мин, фильтровали два раза и выпаривали с получением 140,7 г коричневого масла (4-[2-(2,4-диметилфенилсульфанил)фенил]boc-пиперазин). Неочищенное масло растворяли в 300 мл МеОН и 200 мл 6 М HCl (водной) и кипятили в течение 1 ч, после чего ВЭЖХ показала полное удаление защитных групп. После охлаждения до RT метанол удаляли посредством вакуума на роторном испарителе, добавляли 200 мл концентрированногоNaOH (pH измеряли до 13-14), после чего смесь перемешивали в течение 15 мин с 1000 мл EtOAc. Органическую фазу собирали и экстрагировали 300 мл 15 мас.% рассола, сушили над Na2SO4 и добавляли к раствору 46,3 г фумаровой кислоты (399 ммоль) в 300 мл МеОН. Смесь нагревали до температуры кипячения с обратным холодильником, охлаждали до комнатной температуры, а затем оставляли в морозилке в течение ночи (-18 С). Осадок собирали, промывали 100 мл EtOAc и 100 мл ацетона, сушили в вакууме(50 С) с получением 103,2 г фумарата 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина (249 ммоль) в виде белого порошка с общим выходом 81% с чистотой 99% при LC-MS. Фумарат превращали в свободное основаниеEtOAc/H2O/концентрированный NaOH, органическую фазу промывали рассолом, сушили с использованием Na2SO4, фильтровали и к фильтрату добавляли 34 мл 48 мас.% HBr (водной), вызывая осаждение белого твердого вещества. Твердое вещество собирали, обрабатывали 1000 мл кипящей Н 2 О, которая при охлаждении до комнатной температуры образовывала жидкую массу. Конечный продукт (гидробромид 1-[2-(2,4- диметилфенилсульфанил)фенил]пиперазина) собирали фильтрацией и сушили в вакууме (50 С) с получением 83 г белого порошка (общий выход 71%), CHN (теоретический) 56,99; 6,11; 7,39; CHN (выявленный) 57,11; 6,15; 7,35.rac-BINAP (21,84 ммоль) перемешивали с 4 л толуола в течение 50 мин. Затем добавляли 840 г 2-бромйодбензола (2,97 моль) совместно с 1,5 л толуола и перемешивание продолжали в течение 30 мин. Затем в конце добавляли 390,8 г 2,4-диметилтиофенола (2,83 моль) с 1,5 л толуола. Суспензию нагревали до температуры кипячения с обратным холодильником и кипячение с обратным холодильником продолжали в течение 5 ч. Реакционную смесь охлаждали в течение ночи. Добавляли 2 л воды и перемешивали в течение 1 ч, а затем смесь фильтровали через вспомогательное фильтровальное вещество. Затем фильтрат промывали 31 л рассола. Затем объединенные водные фазы экстрагировали 600 мл толуола. Затем объединенные фазы толуола нагревали до 70 С, а затем добавляли 329,2 мл 48 мас.% HBr (водной) и 164,6 мл воды. Смесь охлаждали до комнатной температуры в течение ночи. Конечный продукт (гидробромид 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина) собирали фильтрацией и сушили в вакууме (60 С) с получением 895 г (выход 84%). Пример 24.(362 ммоль) с 50 мл толуола. Суспензию нагревали до температуры кипячения с обратным холодильником и кипячение с обратным холодильником продолжали в течение ночи. Анализ ВЭЖХ показал полное превращение в промежуточный продукт (1-(2-бромфенилсульфанил)-2,4-диметилбензол). Реакционную смесь охлаждали до RT и фильтровали через вспомогательное фильтровальное вещество. Фильтрат добавляли к смеси 40,76 г NaOBut (424,1 ммоль), 42,2 г пиперазина (489,9 ммоль), 0,33 г Pd(dba)2(0,57 ммоль) и 0,68 г rac-BINAP (1,09 ммоль) и нагревали до температуры кипячения с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали в течение ночи. Добавляли 100 мл воды и водную фазу разделяли. Органическую фазу фильтровали через вспомогательное фильтровальное вещество,а затем фильтрат промывали 380 мл солевого раствора. Затем объединенные водные фазы экстрагировали 50 мл толуола. Затем объединенные фазы толуола нагревали до 70 С, а затем добавляли 16,5 мл 48 мас.% HBr (водной) и 8,25 мл воды. Смесь охлаждали до комнатной температуры в течение ночи. Конечный продукт (гидробромид 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина) собирали фильтрацией и сушили в вакууме (60 С) с получением 40,18 г не совсем белого порошка (выход 75%). Пример 25. 40,76 г NaOBut (424,1 ммоль), 0,33 г Pd(dba)2 (0,57 ммоль) и 0,68 г rac-BINAP (1,09 ммоль) перемешивали с 200 мл толуола. Добавляли 42 г 2-бромйодбензола (148,5 ммоль) и 19,54 г 2,4-диметилтиофенола (141,4 ммоль) с 50 мл толуола. Суспензию нагревали до температуры кипячения с обратным холодильником и кипячение с обратным холодильником продолжали в течение ночи. Анализ ВЭЖХ показал полное превращение в промежуточный продукт (1-(2-бромфенилсульфанил)-2,4 диметилбензол). Реакционную смесь охлаждали до 50 С и добавляли 42,2 г пиперазина (489,9 ммоль) совместно со 100 мл толуола. Смесь нагревали до температуры кипячения с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали до RT в течение ночи. Добавляли 100 мл воды и реакционную смесь фильтровали через вспомогательное фильтровальное вещество. Затем осадок на фильтре промывали 50 мл толуола. Водную фазу отделяли и органическую фазу затем промывали 325 мл рассола и 25 мл воды. Затем объединенные водные фазы экстрагировали 30 мл толуола. Затем объединенные фазы толуола нагревали до 70 С, а затем добавляли 16,46 мл 48 мас.% HBr (водной) и 8,23 мл воды. Смесь- 24015287 охлаждали до комнатной температуры в течение ночи. Конечный продукт (гидробромид 1-[2-(2,4 диметилфенилсульфанил)фенил]пиперазина) собирали фильтрацией и сушили в вакууме (60 С) с получением 46,8 г (выход 87%). Пример 26. Эффекты на внеклеточные уровни ацетилхолина в головном мозге свободно передвигающихся крыс. Способы. Животным вводили 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин, соль HBr. Животные. Использовали самцов крыс Sprague-Dawley с исходной массой 275-300 г. Животных содержали с 12-часовым циклом свет/темнота в контролируемых условиях постоянной внутренней температуры(212 С) и влажности (555%) с питанием и водопроводной водой, доступными без ограничений. Эксперименты с хирургической операцией и микродиализом. Крысам проводили анестезию посредством гипнорма/дормикума (2 мл/кг) и интрацеребральные направляющие канюли (СМА/12) стереотаксически имплантировали в головной мозг, нацеливаясь на помещение конца зонда для диализа в вентральный гиппокамп (координаты: 5,6 мм; позади брегмы; латерально -5,0 мм, на 7,0 мм вентральнее твердой оболочки) или на префронтальную кору (координаты: 3,2 мм впереди брегмы; латерально, 0,8 мм; на 4,0 мм вентральнее твердой оболочки). Для фиксации направляющих канюль использовали анкерный винт и акриловый цемент. Температуру тела животных подвергали мониторингу посредством ректального детектора и поддерживали при 37 С. Крысам позволяли выздоравливать после хирургической операции в течение 2 суток, их содержали в клетках по отдельности. В день эксперимента через направляющую канюлю вводили зонд для микродиализа (СМА/12,диаметр 0,5 мм, длина 3 мм). Зонды соединяли через двухканальное поворотное соединение с микроинъекционным дозатором. Перфузию зонда для микродиализа фильтрованным раствором Рингера (145 мм NaCl, 3 мМ KCl, 1 мМMgCl2, 1,2 мМ CaCl2, содержащим 0,5 мкМ неостигмин) начинали вскоре после введения зонда в головной мозг и продолжали в ходе эксперимента с постоянной скоростью потока, составляющей 1 мкл/мин. После 180 мин стабилизации начинали эксперименты. Диализаты собирали каждые 20 мин. После экспериментов животных умерщвляли, их головной мозг извлекали, замораживали и разрезали для проверки помещения зонда. Соединение растворяли в 10% HPbetaCD и инъецировали подкожно (2,5-10 мг/кг). Дозы выражают в мг соли/кг массы тела. Соединение вводили в объеме 2,5 мл/кг. Анализ ацетилхолина диализата. Концентрацию ацетилхолина (ACh) в диализатах анализировали посредством ВЭЖХ с электрохимической детекцией с использованием подвижной фазы, состоящей из 100 мМ водородфосфата динатрия, 2,0 мМ октансульфоновой кислоты, 0,5 мМ хлорида тетраметиламмония и 0,005% MB (ESA), рН 8,0. Предколоночный ферментный реактор (ESA), содержащий иммобилизованную холиноксидазу, удалял холин из инъецированного образца (10 мкл) перед разделением ACh на аналитической колонке(ESA ACH-250); скорость потока 0,35 мл/мин, температура 35 С. После аналитической колонки образец пропускали через послеколоночный твердофазный реактор (ESA), содержащий иммобилизованную ацетилхолинэстеразу и холиноксидазу. Последний реактор превращал ACh в холин, а затем холин в бетаин и H2O2. Последний из них подвергали электрохимической детекции с использованием платинового электрода (аналитическая ячейка: ESA, model 5040). Представление данных. В экспериментах с однократной инъекцией среднее значение для 3 последовательных образцов Ach,непосредственно предшествующих введению соединения, служило в качестве исходного уровня для каждого эксперимента, и данные преобразовывали в проценты от исходных (средние исходные значения до инъекции, нормализованные к 100%). Результаты. Соединение значимо повышало внеклеточные уровни ACh в префронтальной коре крысы и в вентральном гиппокампе - см. фиг. 19 а и 19b. Пример 27. Выработка ситуативного условно-рефлекторного страха у крыс. Соединение, вводимое в настоящем эксперименте, представляло собой 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин, соль HBr. Авторы настоящего изобретения исследовали эффект соединения на обучение, консолидацию и воспроизведение ситуативного условно-рефлекторного страха у крыс. В парадигме выработки условнорефлекторного страха животных обучают ассоциировать нейтральную окружающую среду (контекст,обучающая камера, CS) с вызывающим отвращение опытом (электрический шок лап, US). В ходе повторного воздействия обучающей камеры животные проявляют замирание, которое считают прямым показателем связанной со страхом памяти [Pavlov, J. Biol. Sci., 15, 177-182, 1980]. Нейроанатомия выработки ситуативного условно-рефлекторного страха была тщательно исследована и несколько исследований показали, что гиппокамп и мозжечковая миндалина необходимы для формирования этой памяти- 25015287 Животные и лекарственные средства. Использовали взрослых самцов крыс Sprague-Dawley (массой 250-300 г в момент обучения) изCharles River Laboratories, которых содержали по два на клетку с 12-часовым циклом свет/темнота. Пища и вода были доступны без ограничений. Крыс использовали через 1 неделю после получения. Соединение растворяли в 10% HPbetaCD и инъецировали подкожно. Лекарственное средство вводили в объеме 2,5 мл/кг. Устройство. Обучение и тестирование проводили в звукоизолирующей камере (302040 см), находящейся в изолированной комнате и соединенной с вентиляционной системой. Освещение обеспечивали посредством белого света (60 Вт). Пол камеры состоял из металлической сетки, соединенной с генератором электрошока. Перед обучением и тестированием камеру очищали 70% раствором этанола. Видеокамера позволяла наблюдение за поведением и запись сеанса обучения для отдельного анализа. Тест обучения и ретенции. В ходе обучения животным позволяли свободно исследовать новую окружающую среду в течение периода привыкания, составляющего 1 мин, который завершали с одновременным единичным неизбежным шоком лап (безусловный раздражитель, US), через электрифицированную решетку пола. Шок лап имел длительность 2 с и интенсивность 0,75 мА. Животные оставались в камере для выработки условных рефлексов в течение других 60 с после US. Замирание оценивали в ходе первых 58 с (предшоковое обучение; причем экспериментатор не имел информации о группах) для определения исходных реакций замирания на окружение. В конце обучения животных осторожно извлекали и помещали в их домашние клетки. Через 24 ч тех же животных повторно помещали в обучающие условия (камера для выработки условных рефлексов на страх) и проводили тест ретенции в течение 2 мин. В ходе этого периода шок лап не применяли. Замирание оценивали в ходе всего периода тестирования экспериментатором, не имеющим информации о группах, и представляли в качестве процентной доли от общего периода тестирования. Результаты и обсуждение. Эффект соединения на ситуативное познание страха у крыс. Эффект соединения на ситуативное познание страха у крыс исследовали в отношении (i) обучения(лекарственное средство применяли до обучения, фиг. 20); (ii) воспроизведения воспоминания (лекарственное средство применяли перед тестом, фиг. 21) и (iii) консолидации (лекарственное средство применяли сразу после обучения, фиг. 22). В первой группе экспериментов соединение (1, 5 и 10 мг/кг) вводили за 1 ч перед сеансом обучения. На фиг. 20 изображены приобретение замирания в ходе обучения (за 58 с перед шоком стопы) и тест ретенции через 24 ч. Были выявлены следующие данные: соединение не влияет на исходное замирание перед воспроизведением шока лап в любой тестируемой дозе; соединение в дозе 5 мг/кг имело тенденцию к повышению времени, потраченного на замирание в ходе теста ретенции через 24 ч после обучения (39,2413,76%, n=6 против 24,304,40%, n=16 у животных, которым вводили носитель). Соединение в дозе 10 мг/кг значимо повышает время, потраченное на замирание в ходе теста на ретенцию через 24 ч после обучения (52,155,68%, n=10 против 24,304,40%, n=16 у животных, которым вводили носитель, р 0,01). Модель формирования условных рефлексов на страх, как описано на фиг. 20, является стандартным способом, описанным в литературе, для исследования обучения и памяти. В целях дальнейшего прояснения острых эффектов этого лекарственного средства на воспроизведение памяти соединение(5, 10 и 20 мг/кг) применяли за 1 ч перед тестом ретенции. Было выявлено, что соединение ингибирует проявление замирания в дозе 5 мг/кг в ходе теста памяти (12,86+3,57%, n=9 против 33,614,29%, n=13 у животных, которым вводили носитель, р 0,05) (фиг. 21). Как описано выше, соединение самостоятельно не влияет на исходный уровень замирания до начала US (фиг. 20), таким образом, наиболее вероятная гипотеза состоит в том, что эффект, наблюдаемый на фиг. 21, является следствием анксиолитического эффекта. Приобретенную память оценивают с помощью замирания, реакции, которую снижают соединения с потенциальными анксиолитическими эффектами. Этот эксперимент демонстрирует, что соединение, вводимое непосредственно перед воспроизведением памяти, имеет анксиолитическую эффективность, таким образом, мало вероятно, что повышенное замирание, показанное на фиг. 20, является следствием анксиогенного эффекта соединения. В целях подтверждения того что соединение не является анксиогенным, а обладает прокогнитивным потенциалом, соединение вводили через 5, 10 и 20 мг/кг после сеанса обучения. Затем в ряде экспериментов соединение не включали ни в процессе обучения, ни на протяжении теста ретенции. Здесь было выявлено, что соединение в дозе 5 мг/кг значимо усиливает время, потраченное в ходе теста ретенции,через 24 ч после сеанса обучения (45,584,50%, n=8 против 25,263,57%, n=19 у животных, которым вводили носитель, р 0,05). Процентная доля времени, потраченного на замирание в ходе повторного воздействия условий, описана в качестве показателя связанной со страхом памяти [Pavlov, J. Biol. Sci, 15,- 26015287 177-182, 1980], которая усиливается у крыс, которым вводили соединение, по сравнению с животными,которым вводили носитель (фиг. 20 и 21). Взятые вместе, эти данные показывают, что соединение усиливает ситуативную память. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 1-[2-(2,4-Диметилфенилсульфанил)фенил]пиперазин и его фармацевтически приемлемые соли,причем соединение является кристаллическим. 2. Соединение по п.1, представляющее собой соль бромисто-водородоной кислоты, хлористоводородной кислоты, мезилатную соль, соль фумаровой кислоты, малеиновой кислоты, мезовиннокаменной кислоты, L-(+)-винно-каменной кислоты, D-(-)-винно-каменной кислоты, сульфат, фосфат или нитрат. 3. Соединение по п.2, имеющее порошковую рентгенограмму (XRPD), как показано на любой из фиг. 1-17. 4. Соединение по п.1,которое представляет собой соль 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина с бромисто-водородной кислотой в кристаллической форме. 5. Соединение по п.4, имеющее отражения XRPD приблизительно при 6,89, 9,73, 13,78 и 14,64 (2). 6. Соединение по п.4, имеющее XRPD, как показано на фиг. 3. 7. Соединение по п.5, имеющее распределение размера частиц, соответствующее:D98%: 50-70 мкм; D50%: 3-7 мкм; D5%: 0,5-2 мкм. 8. Применение соединения по любому из пп.1-7 в терапии. 9. Фармацевтическая композиция для лечения когнитивного нарушения, содержащая соединение по любому из пп.1-7 совместно с фармацевтически приемлемым эксципиентом. 10. Композиция по п.9, содержащая соединение по п.4 или 5. 11. Способ лечения заболевания, выбранного из аффективных нарушений, депрессии, общего депрессивного нарушения, послеродовой депрессии, депрессии, ассоциированной с биполярным нарушением, болезни Альцгеймера, психоза, злокачественной опухоли, связанного со старением заболевания или болезни Паркинсона, тревожности, общего тревожного нарушения, социального тревожного нарушения, обсессивно-компульсивного нарушения, панического нарушения, панических атак, фобии, социальной фобии, агорафобии, недержания мочи при напряжении, рвоты, IBS, нарушений питания, хронической боли, частичного ответа, лечения устойчивой депрессии, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, злоупотребления психоактивными веществами и алкоголем или зависимости от алкоголя или лекарственных средств, включающий введение терапевтически эффективного количества соединения по любому из пп.1-7 пациенту, нуждающемуся в этом. 12. Применение соединения по любому из пп.1-7 для получения лекарственного средства для лечения аффективных нарушений, депрессии, общего депрессивного нарушения, послеродовой депрессии,депрессии, ассоциированной с биполярным нарушением, болезни Альцгеймера, психоза, злокачественной опухоли, связанного со старением заболевания или болезни Паркинсона, тревожности, общего тревожного нарушения, социального тревожного нарушения, обсессивно-компульсивного нарушения, панического нарушения, панических атак, фобии, социальной фобии, агорафобии, недержания мочи при напряжении, рвоты, IBS, нарушений питания, хронической боли, частичного ответа, лечения устойчивой депрессии, когнитивного нарушения, ADHD, меланхолии, PTSD, приливов, апноэ во сне, пристрастия к алкоголю, никотину или углеводам, злоупотребления психоактивными веществами и алкоголем или зависимости от алкоголя или лекарственных средств. 13. Способ получения 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина включающий реакцию соединения II где R' представляет собой водород или одновалентный ион металла,с соединением формулы III где X1 и Х 2 независимо представляют собой галоген,и с соединением формулы IV где R представляет собой водород или защитную группу,в присутствии растворителя, основания и палладиевого катализатора, состоящего из соединения палладия и фосфинового лиганда при температуре между 60 и 130 С. 14. Способ по п.13, где соединение II и соединение III подвергают реакции с образованием соединения формулы которое необязательно выделяют и очищают, с последующей его реакцией с соединением IV. 15. Способ по п.13, где соединение II, соединение III и соединение IV смешивают вместе в начале процесса. 16. Способ по любому из пп.13-15, где X1 и Х 2 независимо представляют собой Br или I. 17. Способ по любому из пп.13-16, где соединение палладия выбрано из Pddba2, Pd(OAc)2 и Pd2dba3. 18. Способ по любому из пп.13-17, где указанный фосфиновый лиганд выбран из 2,2'-бис-дифенилфосфанил-[1,1']бинафталенила (rac-BINAP); 1,1'-бис-(дифенилфосфино)ферроцена (DPPF); бис-(2-дифенилфосфинофенил)эфира (DPEphos); три-трет-бутилфосфина (соли Fu); бифенил-2-ил-ди-трет-бутилфосфина; бифенил-2-ил-дициклогексилфосфина;[2'-(ди-трет-бутилфосфанил)бифенил-2-ил]диметиламина и дициклогексил-(2',4',6'-трипропилбифенил-2-ил)фосфана. 19. Способ по любому из пп.13-18, где указанное основание выбрано из NaO(t-Bu), KO(t-Bu),Cs2CO3, DBU и DABCO. 20. Способ по любому из пп.13-19, где R представляет собой водород. 21. Способ по любому из пп.13-20, где R' представляет собой водород. 22. Способ по п.15, где 2-5 экв. NaO(t-Bu), 2-5 экв. пиперазина, 0,2-0,6 мол.% Pddba2 и 0,6-1 мол.%rac-BINAP диспергируют в толуоле с получением смеси А', к этой смеси добавляют приблизительно 1 экв. 2-бромйодбензола с получением смеси В', затем добавляют 1 экв. 2,4-диметилтиофенола и полученную смесь нагревают до температуры кипячения с обратным холодильником в течение 3-7 ч с получением 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина. 23. Способ по п.22, где указанную полученную смесь нагревают до температуры кипячения с обратным холодильником в течение 4-6 ч, затем полученный продукт подвергают реакции с водной HBr с получением соответствующей аддитивной соли бромисто-водородной кислоты. 24. Способ получения аддитивной соли 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина с бромисто-водородной кислотой, при котором 2-5 экв. NaO(t-Bu), 2-5 экв. пиперазина, 0,2-0,6 мол.%Pddba2 и 0,6-1 мол.% rac-BINAP диспергируют в толуоле с получением смеси А', к этой смеси добавляют приблизительно 1 экв. 2-бромйодбензола с получением смеси В', затем к этой смеси добавляют 1 экв. 2,4-диметилтиофенола и полученную смесь нагревают до температуры кипячения с обратным холодильником в течение 4-6 ч с получением 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазина, который далее подвергают реакции с водной бромисто-водородной кислотой.
МПК / Метки
МПК: A61K 31/495, A61P 25/34, A61P 25/36, C07D 295/08, A61P 25/28, A61P 25/24, A61P 25/18, A61P 25/32, A61P 25/22
Метки: качестве, 5-нт1а, 5-нт3, сочетанием, когнитивного, захвата, повторного, активности, лечения, 1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин, соединения, нарушения, серотонина, отношении
Код ссылки
<a href="https://eas.patents.su/30-15287-1-2-24-dimetilfenilsulfanilfenilpiperazin-v-kachestve-soedineniya-s-sochetaniem-aktivnosti-v-otnoshenii-povtornogo-zahvata-serotonina-5-nt3-i-5-nt1a-dlya-lecheniya-kognitivnogo-nar.html" rel="bookmark" title="База патентов Евразийского Союза">1-[2-(2,4-диметилфенилсульфанил)фенил]пиперазин в качестве соединения с сочетанием активности в отношении повторного захвата серотонина, 5-нт3 и 5-нт1а для лечения когнитивного нарушения</a>
Предыдущий патент: Циклопропилконденсированные индолбензазепиновые ингибиторы белка ns5b вируса гепатита с
Следующий патент: Дозирующее устройство
Случайный патент: Пищевая композиция, обладающая диетическими и профилактическими свойствами (варианты), и включающие ее функциональные пищевые продукты, в том числе напитки












