Стабилизированное антитело и многовалентная антигенсвязывающая молекула на его основе, способы получения и использования вышеназванного стабилизированного антитела
Номер патента: 15992
Опубликовано: 30.01.2012
Авторы: Ву Сюфен, Кроунер Лиза Дж., Ван Норман, Демарест Стивен, Миллер Брайан Роберт, Луговской Алексей Александрович, Глейзер Скотт, Снайдер Вильям Б.
Формула / Реферат
1. Способ получения стабилизированного антитела или его антигенсвязывающего фрагмента с улучшенными биофизическими свойствами, которые содержат стабилизированный VH домен и стабилизированный VL домен, полученные из VH и VL доменов антитела-кандидата, в котором
выравнивают исправленный исходный набор аминокислотных последовательностей, которые относятся к надсемейству иммуноглобулинов (Ig), с получением набора выравнивания,
затем определяют ковариацию между по меньшей мере двумя позициями аминокислотных остатков с получением набора ковариаций,
идентифицируют нековарьирующие аминокислотные остатки в VH или VL доменах антитела-кандидата, причем нековарьирующими аминокислотными остатками являются те, которые не соответствуют ни одной ковариации в наборе ковариаций,
после этого заменяют по меньшей мере один нековарьирующий аминокислотный остаток в VH или VL доменах антитела-кандидата аминокислотным остатком в соответствующем положении набора выравнивания, который соответствует по меньшей мере одной ковариации в наборе ковариаций, с получением стабилизированного антитела или его фрагмента.
2. Способ по п.1, в котором биофизическое свойство выбрано из группы, включающей термическую стабильность, профиль рН развертывания, стабильное удаление гликозилирования, растворимость, биохимическую функцию и их комбинации.
3. Способ по п.1, в котором стабилизированное антитело или его антигенсвязывающий фрагмент выбраны из группы, включающей доменное антитело, гуманизированное антитело, человеческое антитело, нечеловеческое моноклональное антитело, химерное антитело, биспецифичное антитело, scFv антитело, scFv-содержащее антитело, антитело с удаленным доменом и комбинации любых фрагментов указанных антител.
4. Способ по п.1, в котором аминокислотные остатки в наборе ковариаций представляют собой часть структурного признака, выбранного из группы, включающей дисульфидный мостик, солевой мостик, фрагмент лигандсвязывающего кармана или поверхности, Ван-дер-Ваальсовы взаимодействия, водородные связи и/или заряд-зарядное взаимодействие.
5. Способ по п.1, в котором аминокислотные последовательности в наборе выравнивания обладают менее чем 95% идентичностью по отношению друг к другу.
6. Способ по п.1, в котором получение исправленного исходного набора включает
создание набора трехмерных структур Ig-укладки, причем указанные структуры Ig-укладки выбраны из группы, включающей укладку V-класса, I-класса, С1-класса и С2-класса и комбинации указанных классов Ig-укладки,
фильтрование указанного набора структур Ig-укладки исключением структур Ig-укладки, которые содержат последовательности с разрывами, 100% идентичностью, аберрантной длиной или показывающие неправильную укладку,
проведение структурного выравнивания между структурами Ig-укладки внутри отфильтрованного набора структур,
проведение выравниваний последовательностей из структурных выравниваний, при котором аминокислоты из последовательности одной структуры выравнивают с аминокислотами из последовательности второй структуры на основе кратчайшего расстояния между α-углеродами полипептидных каркасов,
построение скрытых марковских моделей (НММ), основанных на структурных выравниваниях последовательностей для одного из классов Ig-укладки,
проведение поиска в базе данных белковых последовательностей с использованием по меньшей мере одной НММ, специфичной для класса Ig-укладки, при котором извлекаются записи о хранящихся в базе данных белковых последовательностях, совпадающих по НММ, и
валидацию отнесения класса Ig-укладки белковых последовательностей, записи о которых извлечены в результате проведения поиска с использованием по меньшей мере одной НММ, при помощи аннотированной базы данных белковых доменов, где указанные извлеченные записи о последовательностях-кандидатах Ig-укладки белка сохраняются только в том случае, если их отнесение к классу Ig-укладки в аннотированной базе данных белковых доменов является статистически значимым.
7. Способ по п.1, в котором выравнивание дополнительно включает удаление лишних или имеющих высокую степень сходства аминокислотных последовательностей из набора выравнивания и удаление столбцов в выравнивании, которые не совпадают в НММ-профиле.
8. Способ по п.1, в котором определение ковариации включает по меньшей мере одну стадию, выбранную из группы, включающей идентификацию разрывов как признаков аминокислот различного типа, определение веса аминокислот, причем указанное определение отлично от определения веса уникальности по Хеникову, фильтрацию коварьирующих пар, в которой не используются средние идентичности последовательностей (SAI), отсечение по событию, при котором коварьирующие пары не регистрируются, если только они не наблюдались некоторое минимальное количество раз, и при котором отсечение по событию происходит по меньшей мере примерно 2 раза, и комбинацию двух или более указанных стадий.
9. Способ по п.1, в котором определение ковариации включает определение статистической значимости вариации с использованием χ2-анализа.
10. Способ по п.9, в котором значения χ2 определяют при помощи формулы, основанной на событиях.
11. Способ по п.10, в котором указанная формула имеет следующий вид:
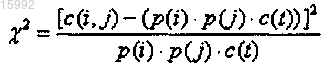
где p(i) и p(j) представляют собой частоты встречаемости аминокислотных остатков любых двух интересующих типов в положениях i и j соответственно в выровненном наборе последовательностей;
c(i, j) представляет собой количество случаев присутствия p(i) и p(j) в одной и той же последовательности;
c(t) представляет собой общее количество последовательностей в выровненном наборе последовательностей,
при этом частоты встречаемости аминокислотных остатков представляют собой количество случаев присутствия аминокислотного остатка определенного типа в определенном положении в выровненном наборе последовательностей, разделенное на общее количество последовательностей в выровненном наборе.
12. Способ по п.1, в котором определение ковариации включает определение коэффициента корреляции (φ) по формуле
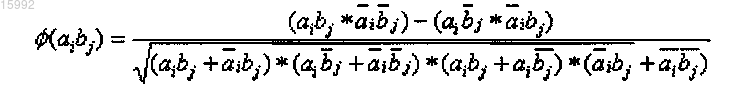
где aibj - количество случаев присутствия аминокислотных остатков типа а или b в одной и той же последовательности в положениях i и j соответственно;
- количество случаев отсутствия аминокислотных остатков обоих типов в одной и той же последовательности;
j - количество случаев присутствия аминокислотного остатка типа а при отсутствии аминокислотного остатка типа b;
- количество случаев отсутствия аминокислотного остатка типа а при наличии аминокислотного остатка типа b,
при этом коэффициент корреляции (φ) определяет статистическую достоверность ковариации.
13. Способ по п.1, в котором определение ковариации включает в себя определение ковариационных счетов только для тех ковариаций, которые удовлетворяют пороговому значению статистической достоверности.
14. Способ по п.13, в котором ковариационные счета определяют только для тех ковариаций, которые обладают значением выше или ниже порогового значения χ2 или значения φ.
15. Способ по п.14, в котором положениям аминокислотных остатков последовательности-кандидата присваивают положительные специфические ковариационные счета для положительных ковариаций, коэффициент корреляции φ которых составляет от примерно +0,25 до примерно +1,0.
16. Способ по п.14, в котором положениям аминокислотных остатков последовательности-кандидата присваивают отрицательные специфические ковариационные счета для отрицательных ковариаций, коэффициент корреляции φ которых составляет от примерно -0,25 до примерно -1,0.
17. Способ по п.1, который дополнительно включает получение структурных моделей доменов VH или VL образца антител и доменов VH или VL антитела-кандидата, идентификацию аминокислотных остатков области белок-белкового взаимодействия в домене VH или VL образца антитела, которые важны для стабилизации указанной области, идентификацию каркасных аминокислотных остатков, которые коварьируют с идентифицированными аминокислотными остатками области контакта, и замещение по меньшей мере одного соответствующего остатка области контакта или каркасной области домена VH или VL антитела-кандидата на соответствующие идентифицированные аминокислотные остатки указанных областей.
18. Способ по п.17, в котором VH домен или VL домен образца антитела обладает укладкой надсемейства Ig.
19. Способ по п.17, в котором аминокислотные остатки области контакта расположены в области контакта VH/VL доменов VH домена или VL домена антитела-кандидата.
20. Способ по п.1, который дополнительно включает определение консенсусного счета по меньшей мере для одного положения аминокислотного остатка доменов VH или VL антитела-кандидата, комбинирование консенсусных счетов с данными набора ковариации и выбор замен аминокислотных остатков, предсказанных для стабилизации VH домена или VL домена антитела-кандидата, причем выбор основан на комбинации консенсусных счетов с данными ковариации.
21. Способ по п.20, в котором определение консенсусного счета включает получение исправленного исходного набора полипептидных последовательностей, принадлежащих к надсемейству Ig, выравнивание последовательностей исходного набора с получением набора выравнивания и определение частоты встречаемости исследуемого аминокислотного остатка для каждого положения внутри VH домена или VL домена антитела-кандидата, при котором частота определяется путем суммирования количества случаев наличия указанного аминокислотного остатка в соответствующем положении среди последовательностей выровненного набора и деления полученного значения на общее количество последовательностей в исходном наборе.
22. Способ по п.21, который включает
определение консенсусной последовательности, в которой аминокислотный остаток в каждом положении последовательности соответствует наиболее распространенному аминокислотному остатку для данного положения в выровненном наборе,
определение частоты встречаемости консенсусной аминокислоты для каждого аминокислотного положения внутри консенсусной полипептидной последовательности, при котором частота определяется путем суммирования количества случаев наличия указанного аминокислотного остатка в соответствующем положении среди последовательностей выровненного набора и деления полученного значения на общее количество последовательностей в исходном наборе, и
деление частоты исследуемого аминокислотного остатка на частоту консенсусного аминокислотного остатка с получением консенсусного счета.
23. Стабилизированное антитело или его антигенсвязывающий фрагмент, полученные способом по любому из пп.1-22, которые включают стабилизированные домены VH и VL и по меньшей мере одну замену нековарьирующего аминокислотного остатка коварьирующим в соответствующем положении.
24. Антитело или его антигенсвязывающий фрагмент по п.23, термическая стабильность которых, измеренная как T50, по меньшей мере на 10°С выше, чем термическая стабильность соответствующего антитела-кандидата.
25. Антитело или его антигенсвязывающий фрагмент по п.23, термическая стабильность которых, измеренная как Т50, превышает 67°С по результатам анализа термической проверки.
26. Антитело или его антигенсвязывающий фрагмент по п.23, которые имеют домены VH и VL со стабилизированной областью контакта между ними и по меньшей мере одну стабилизирующую замену по сравнению с антителом-кандидатом в аминокислотном положении непосредственно в области контакта.
27. Антитело или его антигенсвязывающий фрагмент по п.23, которые являются молекулами scFv, включающими линкер, соединяющий между собой домены VH и VL.
28. Антитело или его антигенсвязывающий фрагмент по п.27, в которых линкер содержит SEQ ID NO: 21 или SEQ ID NO: 20.
29. Антитело или его антигенсвязывающий фрагмент по любому из пп.23-28, термическая стабильность которых измеряется методом дифференциальной сканирующей калориметрии (ДСК), спектроскопии кругового дихроизма (КД), флуоресцентной эмиссионной спектроскопии, спектроскопии ядерного магнитного резонанса (ЯМР) или посредством анализа термической проверки.
30. Многовалентная антигенсвязывающая молекула, которая включает стабилизированное антитело или его антигенсвязывающий фрагмент по любому из пп.23-29, которые генетически гибридизованы со вторым антителом или его антигенсвязывающим фрагментом.
31. Полинуклеотид, кодирующий стабилизированное антитело или его антигенсвязывающий фрагмент по любому из пп.23-29 или молекулу по п.30.
32. Вектор, содержащий полинуклеотид по п.31.
33. Изолированная клетка-хозяин, которая содержит вектор по п.32.
34. Способ продуцирования стабилизированной связывающей молекулы, в котором выращивают клетку-хозяин по п.33 в культуральной среде и очищают стабилизированную связывающую молекулу.
35. Способ продуцирования стабилизированной молекулы в условиях крупномасштабного производственного процесса, в котором выращивают клетку-хозяин по п.34 в условиях, пригодных для крупномасштабного производства и сбора популяции стабилизированных молекул.
36. Применение стабилизированного антитела или его антигенсвязывающего фрагмента по любому из пп.23-29 или многовалентной антигенсвязывающей молекулы по п.30 в качестве средства при лечении субъекта, при котором лечение с помощью указанных стабилизированных молекул способно облегчить состояние субъекта.
37. Применение по п.36, в котором указанный субъект страдает от заболевания или расстройства, выбранного из группы, включающей рак, аутоиммунное расстройство или заболевание и неврологическое расстройство или заболевание.
Текст
Дата публикации и выдачи патента Номер заявки СТАБИЛИЗИРОВАННОЕ АНТИТЕЛО И МНОГОВАЛЕНТНАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА НА ЕГО ОСНОВЕ, СПОСОБЫ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ ВЫШЕНАЗВАННОГО СТАБИЛИЗИРОВАННОГО АНТИТЕЛА Демарест Стивен, Глейзер Скотт,Миллер Брайан Роберт, Ву Сюфен,Снайдер Вильям Б., Ван Норман,Кроунер Лиза Дж., Луговской Алексей Александрович (US) Попеленский Н.К. (RU)factor receptor 2. J. Immunol Methods, 1999 Nov 19; 230(1-2):159-71, реферат [он-лайн] [найдено 2009-01-21]. Найдено из базы данных PubMed Изобретение основано, по крайней мере, частично на разработке стабилизированных связывающих молекул, состоящих из или включающих стабилизированные молекулы scFv, а также способы приготовления таких стабилизированных молекул.[он-лайн] [найдено 2009-01-21]. Найдено из базы данных PubMed[найдено 2009-01-21]. Найдено из базы данныхprotein structure. Bioinformatics, 2003 Sep 22; 19(14): 1748-59, реферат [он-лайн] [найдено 2009-01-21]. Найдено из базы данных PubMedstability by phage display. J. Mol Biol, 1999 Nov 19; 294(1):163-80, реферат [он-лайн] [найдено 2009-01-21]. Найдено из базы данных PubMedprotein. J. Mol Biol, 2002 Mar 15; 317(1):85-94,реферат, [он-лайн] [найдено 2009-01-21]. Найдено из базы данных PubMedMar 30; 307(3):913-28, реферат [он-лайн] [найдено 2009-01-21]. Найдено из базы данных PubMed(71)(73) Заявитель и патентовладелец: БАЙОДЖЕН АЙДЕК ЭМЭЙ ИНК. 015992 Область техники, к которой относится изобретение Настоящее изобретение относится к стабилизированным молекулам scFv, содержащим ее химерным белкам и стабилизированной многовалентной антигенсвязывающей молекуле, популяции стабилизированных молекул scFv, популяциям стабилизированных многовалентных антигенсвязывающих молекул, молекуле нуклеиновой кислоты, кодирующей стабилизированную молекулу scFv, и клетке-хозяину,включающей вектор с указанной нуклеиновой кислотой, способу получения стабилизированной связывающей молекулы, способу получения стабилизированной молекулы scFv (варианты), способу стабилизации молекулы scFv, способам получения стабилизированного химерного белка, способу получения стабилизированного многовалентного антитела, способу повышения стабильности многовалентной молекулы, способу получения библиотеки, включающей стабилизированную молекулу scFv, способу получения полипептида надсемейства иммуноглобулинов и полипептиду, полученному вышеуказанным способом, способу получения антитела или модифицированного антитела с повышенной стабильностью,способу прогнозирования стабильности белка-кандидата, способу лечения субъекта с помощью связывающей молекулы, а также графическому интерфейсу для пользователя. Сведения о предшествующем уровне техники В настоящее время признано, что стабильность белков является центральной проблемой при разработке и масштабировании белков, например молекул антител. Тяжелые и легкие цепи вариабельных последовательностей доменов антител находятся под селективным давлением, и их последовательность может сильно отличаться от одного антитела к другому (Wu и Kabat, 1970). В геном человека входит множество функциональных вариабельных тяжелых (40; Tomlinson et al., 1992; Tomlinson et al., 1994;Lefranc, 1998) и вариабельных лямбда (30; Williams et al., 1996; Kawasaki, et al., 1997) генов зародышевой линии. Способность иммунной системы создавать большое количество комбинаций тяжелых и легких вариабельных цепей является одним из механизмов создания многообразия антител (Edelman, 1959;Franek, 1961). Разнообразие достигается также включением вариабельного соединяющего пептидного участка, J-соединяющего пептида (плюс D-соединяющего пептида для тяжелых доменов) между вариабельным и константным доменами (Leder, 1982). После выбора зародышевого антитела против конкретного антигена В-клетки, экспрессирующие антитела с отобранными зародышевыми линиями вариабельного домена и (D-)J-соединяющие пептиды, подвергаются процессу гиперсоматической мутации в вариабельных доменах тяжелых и легких цепей с целью повышения сродства антитела по отношению к антигену (Leder, 1982; Tomlinson et al., 1996). Кроме того, обычно наблюдаются гиперсоматические включения или делеции в вариабельных доменах, хотя и значительно реже гиперсоматических мутаций(de Wildt et al., 1999). Таким образом, созревшее антитело против конкретного антигена характеризуется уникальными последовательностями вариабельных доменов, необязательно оптимизированных в отношении стабильности. Низкая стабильность может повлиять на способность антитела или домена антитела правильно свертываться при экспрессии в различных клеточных системах, например в системах экспрессии бактерий или млекопитающих. Неправильное свертывание или низкая стабильность также могут привести к появлению популяций нефункционального материала (Martsev et al., 1998) и/или антител с тенденцией к образованию больших растворимых агрегатов, потенциально опасных или иммуногенных при терапевтическом применении. Другие связанные со стабильностью проблемы включают рефолдинг, деградацию, нарушения авидности, агрегацию или потерю активности при хранении. Проблемы стабильности не ограничиваются природными антителами, они могут иметь место и в сконструированных антигенсвязывающих молекулах, таких как библиотеки рекомбинантных антителReiter и Pastan, 1996), а также сконструированные или гуманизированные терапевтические антитела для производственных и клинических целей (Ewert et al., 2004; Carter and Merchant, 1997). Проблемы стабильности могут возникать также и в поливалентных формах антител, таких как биспецифичные молекулы. Хотя из-за терапевтического применения у людей биспецифичные антитела нежелательны, их образование непредсказуемо. Например, биспецифичные антитела могут приводить к существенному снижению термической стабильности, выходу продукта или образованию агрегатов низкого молекулярного веса. Неестественные изменения доменов VH и VL могут возникать также при гуманизации антител грызунов. Обычно гуманизацию проводят, прививая определяющие комплементарность участки (CDR) грызунов на наиболее похожие человеческие зародышевые домены вариабельных цепей (Hurle и Gross,1994). Выбранные для гуманизации зародышевые линии могут использоваться иммунной системой не слишком часто, и для достижения адекватного связывания антигена часто бывает необходимо провести изменения в базовой структуре. Нестабильность белков приводит к множеству проблем, включая одну или более из следующих: непригодность для масштабного производства в биореакторах (например, из-за низкого выхода, конечного содержания нежелательных сопутствующих продуктов, таких как несобранный продукт и/или агрегированный материал), трудности очистки, а также непригодность для фармацевтического приготовле-1 015992 ния и использования (например, из-за большого количества продуктов распада, низкого качества продуктов и/или неблагоприятных фармакокинетических свойств). Нестабильность вариабельных доменов антител, Fabs, Fvs или одноцепочечного Fvs (scFvs) может приводить к множеству таких проблем. Конструкты scFv, в особенности, демонстрируют проблемы стабильности, растворимости, экспрессии, агрегации, образования продуктов распада, а также общей способности к образованию в системах экспрессии бактерий и млекопитающих (см. Worn и Pluckthun, 2001). Кроме того, включение молекул scFv в ранее стабильные рекомбинантные антитела часто приводит к появлению этих нежелательных характеристик у новых продуктов. Таким образом, в настоящее время наблюдается потребность в разработке новых усовершенствованных способов прогнозирования стабильности белков, таких как антитела, а также улучшенных, стабильных антигенсвязывающих молекул, пригодных для масштабного производства. Существует также потребность в разработке усовершенствованных способов масштабируемого производства популяции стабильных антигенсвязывающих молекул, пригодных для применения в области фармацевтики. Сущность изобретения Настоящее изобретение относится, по меньшей мере частично, к разработке улучшенных полипептидных композиций, например молекул с улучшенным связыванием, включающих или состоящих из молекул scFv с улучшенной стабильностью, а также к способам их приготовления. В соответствии с одним аспектом изобретение относится к популяции стабилизированных молекулscFv, в которой стабилизированные молекулы scFv включают:i) scFv-линкер, расположенный между доменами VH и VL, где домены VH и VL связаны дисульфидным мостиком, образованным между аминокислотой VH домена и аминокислотой VL домена, и где домены VH и VL молекул scFv характеризуются TM выше 55 С; илиii) scFv-линкер, расположенный между доменами VH и VL, где домены VH и VL связаны дисульфидным мостиком, образованным между аминокислотой VH домена и аминокислотой VL домена, и где молекулы scFv характеризуются Т 50 выше 49 С. В соответствии с другим своим аспектом изобретение относится к стабилизированной молекулеVH и VL, где домены VH и VL связаны дисульфидным мостиком, образованным между аминокислотой VH домена 44 и аминокислотой VL домена 100;ii) домены VH и VL, где молекула включает по меньшей мере одну замену, выбранную из нижеследующей группы: а) замену аминокислотного остатка в положении Кэбата 13 домена VH; б) замену аминокислотного остатка в положении Кэбата 16 домена VH; в) замену аминокислотного остатка в положении Кэбата 46 домена VL; г) замену аминокислотного остатка в положении Кэбата 49 домена VL; д) замену аминокислотного остатка в положении Кэбата 50 домена VL; е) замену аминокислотных остатков в положениях Кэбата 49 и 50 домена VL; ж) замену аминокислотного остатка в положении Кэбата 101 домена VH; з) замену аминокислотного остатка в положении Кэбата 20 домена VH; и) замену аминокислотного остатка в положении Кэбата 48 домена VH; к) замену аминокислотного остатка в положении Кэбата 3 домена VL; л) замену аминокислотного остатка в положении Кэбата 55 домена VH; м) замену аминокислотного остатка в положении Кэбата 67 домена VH; н) замену аминокислотного остатка в положении Кэбата 6 домена VH; о) замену аминокислотного остатка в положении Кэбата 32 домена VH; п) замену аминокислотного остатка в положении Кэбата 49 домена VH; р) замену аминокислотного остатка в положении Кэбата 43 домена VH; с) замену аминокислотного остатка в положении Кэбата 72 домена VH; т) замену аминокислотного остатка в положении Кэбата 79 домена VH; у) замену аминокислотного остатка в положении Кэбата 50 домена VL; ф) замену аминокислотного остатка в положении Кэбата 75 домена VL; х) замену аминокислотного остатка в положении Кэбата 80 домена VL; ц) замену аминокислотного остатка в положении Кэбата 83 домена VL; илиiii) VH домен и VL домен со стабилизированной областью контакта между VH и VL молекулы scFv,где полученная молекула включает по меньшей мере одну замену в аминокислотной последовательности непосредственно в области контакта и/или аминокислотной последовательности, обеспечивающей взаимодействие между VH и VL, где по меньшей мере одно положение аминокислотного остатка выбрано из группы, включающей 47 Н, 37 Н, 45 Н, 46 Н, 51 Н, 59 Н, 109 Н, 14 Н, 26 Н, 27 Н, 40 Н, 69 Н, 103 Н, 29 Н, 38 Н,44 Н, 49 Н, 55 Н, 63 Н, 54 Н, 68 Н, 72 Н, 74 Н, 79 Н, 82bH, 8 Н, 32 Н, 39 Н, 41 Н, 62 Н, 85 Н, 91 Н, 24 Н, 60 Н, 37L,36L, 44L, 59L, 57L, 64L, 46L, 48L, 63L, 67L, 68L, 39L, 45L, 47L, 54L, 56L, 79L, 85L, 98L, 58L, 74L, 77L,83L, 89L и 104L в соответствии с нумерацией Кэбата, и где Т 50 стабилизированной молекулы scFv боль-2 015992 ше, чем у молекулы scFv без такой замены. В соответствии с другим аспектом изобретение относится к стабилизированной молекуле scFv,включающей scFv-линкер (Gly4Ser)4, расположенный между VH доменом и VL доменом, где домены VH иVL связаны дисульфидным мостиком, образованным между аминокислотным остатком домена VH и аминокислотным остатком домена VL. В соответствии с другим аспектом изобретение относится к стабилизированной молекуле scFv,включающей домены VH и VL и по меньшей мере одну замену, выбранную из следующей группы:a) замену аминокислотного остатка в положении Кэбата 16 домена VH, например, на глутамат или глютамин и замену аминокислотного остатка в положении Кэбата 46 домена VL, например, на лизин;b) замену аминокислотного остатка в положении Кэбата 16 домена VH, например, на глутамат или глютамин, замену аминокислотного остатка в положении Кэбата 46 домена VL, например, на лизин и замену аминокислотного остатка в положении Кэбата 55 домена VH, например, на глицин; а такжеc) замену аминокислотного остатка в положении Кэбата 16 домена VH, например, на глутамат или глютамин, замену аминокислотного остатка в положении Кэбата 46 домена VL, например, на лизин, замену аминокислотного остатка в положении Кэбата 55 домена VH, например, на глицин и замену аминокислотного остатка в положении Кэбата 101 домена VH, например, на аспарагиновую кислоту. В соответствии с другим аспектом стабилизированная молекула scFv характеризуется эквивалентом стабильности, соответствующим обычному фрагменту Fab, в условиях термической проверки. В соответствии с одним аспектом стабильность определяют, измеряя способность связываться с молекулой-мишенью. В соответствии с одним аспектом молекула scFv включает аминокислотную последовательность,закодированную нуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NO: 9,14, 16 и 18. В соответствии с одним аспектом молекула scFv включает аминокислотную последовательность,выбранную из группы, включающей SEQ ID NO: 10, 15, 17 и 19. В соответствии с другим аспектом изобретение относится к химерному белку, включающему стабилизированную молекулу scFv. В соответствии с одним аспектом химерный белок включает по меньшей мере два сайта связывания антигена. В соответствии с другим аспектом изобретение относится к популяции стабилизированных многовалентных антигенсвязывающих молекул, где стабилизированные связывающие молекулы включают по меньшей мере одну стабилизированную молекулу scFv, содержащую scFv-линкер, расположенный между доменами VH и VL, где домены VH и VL связаны дисульфидным мостиком, образованным между аминокислотой в домене VH и аминокислотой в домене VL, и где популяция стабилизированных связывающих молекул включает мономерные растворимые белки, из которых в агрегированной форме находится не более 10%. В соответствии с одним аспектом стабилизированные многовалентные антигенсвязывающие молекулы экспрессируются в клетках СНО или NSO. В соответствии с другим аспектом изобретение относится к популяции стабилизированных многовалентных антигенсвязывающих молекул, где каждая многовалентная антигенсвязывающая молекула включает:i) по меньшей мере одну молекулу scFv, содержащую scFv-линкер, расположенный между доменами VH и VL, где домены VH и VL связаны дисульфидным мостиком, образованным между аминокислотой в домене VH и аминокислотой в домене VL, и где TM доменов VH и VL по меньшей мере одной молекулыii) по меньшей мере одну молекулу scFv, содержащую scFv-линкер, расположенный между доменами VH и VL, где домены VH и VL связаны дисульфидным мостиком, образованным между аминокислотой в домене VH и аминокислотой в домене VL, и Т 50 по меньшей мере одной молекулы scFv многовалентной антигенсвязывающей молекулы превышает 49 С. В соответствии с другим аспектом изобретение относится к стабилизированной многовалентной антигенсвязывающей молекуле, включающей:i) по меньшей мере одну стабилизированную молекулу scFv, где стабилизированная молекула scFv содержит (Gly4Ser)n scFv-линкер, расположенный между доменами VH и VL, и где домены VH и VL связаны дисульфидным мостиком;ii) по меньшей мере одну стабилизированную молекулу scFv, содержащую (Gly4Ser)n scFv-линкер,расположенный между доменами VH и VL, где домены VH и VL связаны дисульфидным мостиком, образованным между аминокислотным остатком 44 домена VH и аминокислотным остатком 100 домена VL;iii) по меньшей мере одну стабилизированную молекулу scFv, где стабилизированная молекула scFv включает по меньшей мере одну замену, выбранную из нижеследующей группы: а) замену аминокислотного остатка в положении Кэбата 13 домена VH; б) замену аминокислотного остатка в положении Кэбата 16 домена VH; в) замену аминокислотного остатка в положении Кэбата 46 домена VL;-3 015992 г) замену аминокислотного остатка в положении Кэбата 49 домена VL; д) замену аминокислотного остатка в положении Кэбата 50 домена VL; е) замену аминокислотных остатков в положениях Кэбата 49 и 50 домена VL; ж) замену аминокислотного остатка в положении Кэбата 101 домена VH; з) замену аминокислотного остатка в положении Кэбата 20 домена VH; и) замену аминокислотного остатка в положении Кэбата 48 домена VH; к) замену аминокислотного остатка в положении Кэбата 3 домена VL; л) замену аминокислотного остатка в положении Кэбата 55 домена VH; м) замену аминокислотного остатка в положении Кэбата 67 домена VH; н) замену аминокислотного остатка в положении Кэбата 6 домена VH; о) замену аминокислотного остатка в положении Кэбата 32 домена VH; п) замену аминокислотного остатка в положении Кэбата 49 домена VH; р) замену аминокислотного остатка в положении Кэбата 43 домена VH; с) замену аминокислотного остатка в положении Кэбата 72 домена VH; т) замену аминокислотного остатка в положении Кэбата 79 домена VH; и) замену аминокислотного остатка в положении Кэбата 50 домена VL; ф) замену аминокислотного остатка в положении Кэбата 75 домена VL; х) замену аминокислотного остатка в положении Кэбата 80 домена VH; ц) замену аминокислотного остатка в положении Кэбата 83 домена VH, а такжеiv) VH домен и VL домен со стабилизированным областью контакта между VH и VL молекулы scFv,где полученная молекула включает по меньшей мере одну замену в аминокислотной последовательности непосредственно в области контакта и/или аминокислотной последовательности, обеспечивающей взаимодействие между VH и VL, где по меньшей мере одно положение аминокислотного остатка выбрано из группы, включающей 47 Н, 37 Н, 45 Н, 46 Н, 51 Н, 59 Н, 109 Н, 14 Н, 26 Н, 27 Н, 40 Н, 69 Н, 103 Н, 29 Н, 38 Н,44 Н, 49 Н, 55 Н, 63 Н, 54 Н, 68 Н, 72 Н, 74 Н, 79 Н, 82bH, 8 Н, 32 Н, 39 Н, 41 Н, 62 Н, 85 Н, 91 Н, 24 Н, 60 Н, 37L,36L, 44L, 59L, 57L, 64L, 46L, 48L, 63L, 67L, 68L, 39L, 45L, 47L, 54L, 56L, 79L, 85L, 98L, 58L, 74L, 77L,83L, 89L и 104L в соответствии с нумерацией Кэбата. В соответствии с другим аспектом изобретение относится к стабилизированной многовалентной антигенсвязывающей молекуле, включающей:i) по меньшей мере одну стабилизированную молекулу scFv, включающую линкер (Gly4Ser)4 scFv между VH доменом и VL доменом, где домены VH и VL связаны дисульфидным мостиком между аминокислотным остатком домена VH и аминокислотным остатком домена VL;ii) по меньшей мере одну стабилизированную молекулу scFv, включающую линкер scFv с аминокислотной последовательностью (Gly4Ser)n, расположенной между VH доменом и VL доменом, где домены VH и VL связаны дисульфидным мостиком между аминокислотным остатком 44 домена VH и аминокислотным остатком 100 домена VL; а такжеiii) по меньшей мере одну стабилизированную молекулу scFv, где стабилизированная молекула scFv включает по меньшей мере одну серию замен, выбранную из следующей группы: а) замену аминокислотного остатка (например, глутамина) в положении Кэбата 3 домена VL, например, на аланин, серин, валин, аспарагиновую кислоту или глицин; б) замену аминокислотного остатка (например, серина) в положении Кэбата 46 домена VL, например, на лейцин; в) замену аминокислотного остатка (например, серина) в положении Кэбата 49 домена VL, например, на тирозин или серин; г) замену аминокислотного остатка (например, серина или валина) в положении Кэбата 50 доменаVL, например, на серин, треонин, аргинин, аспарагиновую кислоту, глицин или лизин; д) замену аминокислотного остатка (например, серина) в положении Кэбата 49 и (например, серина) в положении Кэбата 50 домена VL соответственно на тирозин и серин; на тирозин и треонин; на тирозин и аргинин; тирозин и глицин; серин и аргинин; или серин и лизин; е) замену аминокислотного остатка (например, валина) в положении Кэбата 75 домена VL, например, на изолейцин; ж) замену аминокислотного остатка (например, пролина) в положении Кэбата 80 домена VL, например, на серин или глицин; з) замену аминокислотного остатка (например, фенилаланина) в положении Кэбата 83 домена VL,например, на серин, аланин, глицин или треонин; и) замену аминокислотного остатка (например, глутаминовой кислоты) в положении Кэбата 6 домена VH, например, на глутамин; к) замену аминокислотного остатка (например, лизина) в положении Кэбата 13 домена VH, например, на глутамат; л) замену аминокислотного остатка (например, серина) в положении Кэбата 16 домена VH, например, на глутамат или глутамин; м) замену аминокислотного остатка (например, валина) в положении Кэбата 20 домена VH, напри-4 015992 мер, на изолейцин; н) замену аминокислотного остатка (например, аспарагина) в положении Кэбата 32 домена VH, например, на серин; о) замену аминокислотного остатка (например, глутамина) в положении Кэбата 43 домена VH, например, на лизин или аргинин; п) замену аминокислотного остатка (например, метионина) в положении Кэбата 48 домена VH, например, на изолейцин или глицин; р) замену аминокислотного остатка (например, серина) в положении Кэбата 49 домена VH, например, на глицин или аланин; с) замену аминокислотного остатка (например, валина) в положении Кэбата 55 домена VH, например, на глицин; т) замену аминокислотного остатка (например, валина) в положении Кэбата 67 домена VH, например, на изолейцин или лейцин; у) замену аминокислотного остатка (например, глутаминовой кислоты) в положении Кэбата 72 домена VH, например, на аспартат или аспарагин; ф) замену аминокислотного остатка (например, фенилаланина) в положении Кэбата 79 домена VH,например, на серин, валин или тирозин; а также х) замену аминокислотного остатка (например, пролина) в положении Кэбата 101 домена VH, например, на аспарагиновую кислоту. В соответствии с другим аспектом изобретение относится к многовалентной антигенсвязывающей молекуле, включающей по меньшей мере одну стабилизированную молекулу scFv, которая включает по меньшей мере одну серию замен, выбранную из нижеследующей группы: а) замену аминокислотного остатка в положении Кэбата 16 домена VH, например, на глутамат или глутамин и замену аминокислотного остатка в положении Кэбата 46 домена VL, например, на лизин; б) замену аминокислотного остатка в положении Кэбата 16 домена VH, например, на глутамат или глутамин, замену аминокислотного остатка в положении Кэбата 46 домена VL, например, на лизин и замену аминокислотного остатка в положении Кэбата 55 домена VH, например, на глицин; а также в) замену аминокислотного остатка в положении Кэбата 16 домена VH, например, на глутамат или глутамин, замену аминокислотного остатка в положении Кэбата 46 домена VL, например, на лизин; замену аминокислотного остатка в положении Кэбата 55 домена VH, например, на глицин и замену аминокислотного остатка в положении Кэбата 101 домена VH, например, на аспарагиновую кислоту. В соответствии с одним вариантом осуществления по меньшей мере одна стабилизированная молекула scFv генетически гибридизована с антителом. В соответствии с другим вариантом осуществления две стабилизированные молекулы scFv генетически гибридизованы с антителом. В соответствии с одним вариантом осуществления по меньшей мере одна стабилизированная молекула scFv генетически гибридизована с карбоксиконцом легкой или тяжелой цепи антитела. В соответствии с одним вариантом осуществления по меньшей мере одна стабилизированная молекула scFv генетически гибридизована с N-концом легкой или тяжелой цепи антитела. В соответствии с одним вариантом осуществления связывающая молекула по изобретению включает по меньшей мере один сайт связывания, который связывается с молекулой, предпочтительно экспрессируемой в раковых клетках. В соответствии с одним вариантом осуществления домен VH молекулы scFv изобретения получают из антитела ВНА 10. В соответствии с одним вариантом осуществления домен VL молекулы scFv по изобретению получают из антитела ВНА 10. В соответствии с одним вариантом осуществления связывающая молекула по изобретению включает по меньшей мере один сайт связывания, специфичный длямолекулы, выбранной из группы, включающей HER1, HER3, CD80, CD86, PD-1, CTLA4, В 7-Н 4, RON, CD200, CD4, BAF R, EGFR, IGFR,VEGFR, членов семейства рецепторов TNF, рецептора Tie, MET, IGF1, IGF2, TNF, лиганда TNF, IL-6,TWEAK, Fn14, CD20, CD23, CRIPTO, HGF, альфа 4 бета 1 интегрина, альфа 5 бета 1 интегрина, альфа 6 бета 4 интегрина и альфа 5 бета 6 интегрина. В соответствии с одним вариантом осуществления связывающая молекула по изобретению включает по меньшей мере один сайт связывания, который связывается с молекулой, принимающей участие в модулировании иммунных ответов. В соответствии с одним вариантом осуществления молекула представляет собой рецептор Fc. В соответствии с одним вариантом осуществления связывающая молекула по изобретения включает по меньшей мере один сайт связывания, который связывается с молекулой, принимающей участие в модулировании ангиогенеза. В соответствии с одним вариантом осуществления связывающая молекула по изобретению связывается с VEGF или ангиопоэтином. В соответствии с одним вариантом осуществления связывающая молекула по изобретению включает по меньшей мере один сайт связывания, который связывается с неврологической мишенью.-5 015992 В соответствии с одним вариантом осуществления связывающая молекула по изобретению полиспецифична. В соответствии с одним вариантом осуществления связывающая молекула по изобретению биспецифична. В соответствии с другим вариантом осуществления связывающая молекула по изобретению связывается с двумя членами семейства рецепторов TNF. В соответствии с одним вариантом осуществления связывающая молекула по изобретению связывается с LTR и Trail R2. В соответствии с одним вариантом осуществления связывающая молекула по изобретению включает молекулу ВНА 10 scFv, генетически гибридизованную с антителом 14 А 2. В соответствии с одним вариантом осуществления связывающая молекула по изобретению включает тяжелую цепь, последовательность которой выбрана из группы, включающей SEQ ID NO: 33, SEQ IDNO: 35, SEQ ID NO: 37, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53 и SEQ ID NO: 55. В соответствии с одним вариантом осуществления связывающая молекула по изобретению включает нуклеотидную последовательность, которая кодирует полипептид молекулы по любому из пунктов формулы изобретения 4-8, 11, 12 и 18-22. В соответствии с одним вариантом осуществления изобретение относится к молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность, которая кодирует стабилизированную молекулу scFv, или к связывающей молекуле, включающей стабилизированную молекулу scFv по изобретению. В соответствии с одним вариантом осуществления молекула нуклеиновой кислоты представлена в векторе. В соответствии с другим вариантом осуществления изобретение относится к клетке-хозяину,включающей такой вектор. В соответствии с одним вариантом осуществления клетка-хозяин представляет собой клетку млекопитающего, например клетку СНО или NSO. В соответствии с одним вариантом осуществления изобретение относится к популяции связывающих молекул, включающих молекулы scFv, причем эта популяция включает по меньшей мере на 10% меньше агрегатов по сравнению с клетками-хозяевами, экспрессирующими популяцию связывающих молекул, которые содержат обычные молекулы scFv. В соответствии с одним вариантом осуществления изобретение относится к способу получения стабилизированной связывающей молекулы, в котором выращивание клетки-хозяина осуществляют в условиях, необходимых для продуцирования связывающих молекул. В соответствии с одним вариантом осуществления на каждый литр культуральной среды, включающей клетки-хозяева, продуцируется по меньшей мере 10 мг стабилизированных связывающих молекул, при этом в такой среде не более 10% связывающих молекул присутствует в агрегированной форме. В соответствии с одним вариантом осуществления изобретение относится к способу лечения субъекта, для которого лечение связывающей молекулой по изобретению может оказаться эффективным, в котором указанному субъекту вводят связывающую молекулу. В соответствии с одним вариантом осуществления субъект страдает от заболевания или расстройства, выбранного из группы, включающей рак, аутоиммунное заболевание или расстройство и неврологическое заболевание или расстройство. В соответствии с одним вариантом осуществления изобретение относится к способу стабилизации молекулы scFv, включающему генетическую гибридизацию VH домена и VL домена с использованием линкера (Gly4Ser)n scFv и конструирование домена VH так, чтобы он включал остаток цистеина в положении 44 аминокислотной последовательности, а также конструирование домена VL так, чтобы он включал остаток цистеина в положении 100 аминокислотной последовательности с получением стабилизированной молекулы scFv. В соответствии с одним аспектом изобретение относится к способу продуцирования стабилизированного поливалентного антитела со стабилизированной молекулой scFv, в котором осуществляют генетическую гибридизацию стабилизированной молекулы scFv с N-концом или С-концом легкой или тяжелой цепи молекулы антитела. В соответствии с одним аспектом изобретение относится к относится к способу продуцирования стабилизированной молекулы scFv, в котором осуществляют замещение по меньшей мере одного аминокислотного остатка области контакта VH/VL молекулы scFv и/или по меньшей мере одного аминокислотного остатка каркаса VH/VL молекулы scFv, улучшающего термическую стабильность доменов VH и VL молекулы scFv по сравнению с обычной молекулой scFv. В соответствии с еще одним аспектом изобретение относится к способу продуцирования стабилизированной молекулы scFv, в котором осуществляют замещение по меньшей мере одного аминокислотного остатка VH домена или VL домена, который коварьируется с двумя или более аминокислотными остатками области контакта между доменами VH и VL. В соответствии с еще одним аспектом изобретение относится к способу продуцирования стабилизированного химерного белка, включающего молекулу scFv; в котором осуществляют замещение по меньшей мере одного аминокислотного остатка в области контакта VH/VL молекулы scFv и/или по меньшей мере одного аминокислотного остатка каркаса VH/VL молекулы scFv, а также генетическую гибри-6 015992 дизацию молекулы scFv с полипептидом с получением стабилизированного химерного белка. В соответствии с еще одним аспектом изобретение относится к способу повышения стабильности поливалентной молекулы, с по меньшей мере одной молекулой scFv, в котором по меньшей мере в одной молекуле scFv проводят по меньшей мере одну стабилизирующую мутацию, что и приводит к повышению стабильности многовалентной молекулы. В соответствии с еще одним аспектом изобретение относится к способу повышения стабильности молекулы scFv, в котором проводят по меньшей мере одну стабилизирующую мутацию в молекулу scFv,что и приводит к повышению стабильности молекулы scFv. В соответствии с еще одним аспектом изобретение относится к способу крупномасштабного продуцирования стабилизированных химерных белков, включающему:(а) проведение исследования термической стабильности молекулы scFv с целью определить ее термическую стабильность;(б) сравнение термической стабильности предполагаемой молекулы scFv с подходящим контролем с целью идентифицировать стабилизированную молекулу scFv, термическая стабильность которой повышена, по сравнению с контролем;(в) отбор стабилизированных молекул scFv, обнаруженных на этапе (b);(г) генетическую гибридизацию по меньшей мере одной стабилизированной молекулы scFv с белком с получением стабилизированного химерного белка;(д) трансфицирование клетки-хозяина от млекопитающего молекулой нуклеиновой кислоты, кодирующей стабилизированный химерный белок;(е) культивирование клетки-хозяина, полученной на этапе (f), в условиях, при которых экспрессируется стабилизированный химерный белок, где стабилизированный химерный белок экспрессируется не более чем с 10% агрегацией при выращивании в 10 л или более культуральной среды. В соответствии с еще одним аспектом изобретение относится к способу определения термической стабильности укладки (фолдинг) белка из полипептидного надсемейства иммуноглобулинов (Ig), включающего предполагаемые кандидаты аминокислотных последовательностей, который включает следующие этапы:(а) выравнивание соответствующего референсного набора последовательностей, соответствующих укладке Ig полипептида;(б) расчет ковариации между аминокислотными остатками последовательностей выравнивания с данными ковариации;(в) определение счета ковариации, специфического для положения в последовательностикандидате, на основании данных ковариации; а также(г) сохранение или вывод специфического для положения аминокислоты счета ковариации последовательности как степени стабильности полипептида. В соответствии с одним вариантом осуществления способ включает повторное проведение по меньшей мере этапов с) и d) для множества полипептидов надсемейства иммуноглобулинов (Ig). В соответствии с еще одним аспектом способ дополнительно включает этап выбора из множества представителей полипептидов надсемейства иммуноглобулинов (Ig) полипептида для получения, на основании специфического для положения в последовательности счета ковариации последовательности-кандидата. В соответствии с другим вариантом осуществления способ дополнительно включает этап получения отобранного полипептида надсемейства Ig и его продуцирования для терапевтического использования. В соответствии с другим вариантом осуществления полипептид надсемейства Ig получают из белка,выбранного из группы, включающей иммуноглобулин или его антигенсвязывающий фрагмент, рецептор иммуноглобулина, белок клеточной адгезии, интегрин, аллерген, рецептор Т-клеток, а также главный комплекс гистосовместимости (МНС). В соответствии с одним вариантом осуществления полипептид надсемейства Ig выбран из группы,включающей вариабельную область тяжелой цепи (VH), вариабельную область легкой цепи (VL), а также одноцепочечное антитело (scFv). В соответствии с другим вариантом осуществления укладка Ig выбрана из группы, включающей укладки V-класса, укладки 1-класса, укладки C1-класса и укладки С 2-класса. В соответствии с одним вариантом осуществления разнообразие исследуемого набора сравнения или выравнивания составляет не менее 50%. В соответствии с одним вариантом осуществления каждая последовательность в выравнивании характеризуется менее чем 90% идентичностью с каждой другой последовательностью в выравнивании. В соответствии с другим вариантом осуществления по меньшей мере одна последовательность берется из представителей млекопитающих и по меньшей мере одна последовательность берется не из представителей млекопитающих. В соответствии с одним вариантом осуществления остаткам в последовательности-кандидате назначается положительный специфический для последовательности счет ковариации для удовлетворения положительным ковариациям, включающимся в соответствующих положениях в выравнивании.-7 015992 В соответствии с одним вариантом осуществления остаткам в последовательности-кандидате назначается отрицательный специфический для последовательности счет ковариации для удовлетворения отрицательным ковариациям, включающимся в соответствующих положениях в выравнивании. В соответствии с одним вариантом осуществления положительная ковариация характеризуется коэффициентом ассоциации фиприблизительно от +0,25 до +1,0. В соответствии с одним вариантом осуществления отрицательная ковариация характеризуется коэффициентом ассоциации фиприблизительно от -0,25 до -1,0. В соответствии с одним вариантом осуществления выравнивание выбрано из группы, включающей основанное на структуре выравнивание последовательности, основанное на последовательности выравнивание последовательности, а также основанное на структуре структурное выравнивание. В соответствии с одним вариантом осуществления специфический для положения счет ковариации определяют для всех возможных пар остатков для каждого положения остатка в выравнивании. В соответствии с одним вариантом осуществления выравнивание получают путем (i) генерации модели Hidden Markov Model (HMM) из начального выравнивания; (ii) запроса дополнительных последовательностей с НММ и (iii) выравнивания дополнительных последовательностей с начальным выравниванием. В соответствии с одним аспектом изобретение относится к компьютерной программе или компьютерному программному продукту, а также к предназначенному для чтения на компьютере носителю,включающим набор выполняемых процессором команд, следуя которым компьютер и осуществляет реализацию способа по изобретению. В соответствии с еще одним аспектом изобретение относится к компьютерной программе или компьютерному программному продукту, а также к предназначенному для чтения на компьютере носителю,пригодным для использования в электронных устройствах, включающих данные, требуемые для выравнивания по способу изобретения. В соответствии с еще одним аспектом изобретение относится к компьютерной программе или компьютерному программному продукту, а также к предназначенному для чтения на компьютере носителю,который пригоден для использования в электронных устройствах, включающих данные ковариации, способа изобретения. В соответствии с одним аспектом изобретение относится к устройству, предназначенному для реализации способа изобретения. В соответствии с одним аспектом изобретение относится к системе в компьютерном устройстве,включающей:(i) начальный этап накопления последовательности;(ii) место хранения, пригодное для хранения информации о последовательностях из выравнивания,в соответствии с пунктами формулы;(iii) средство анализа, которое программно анализируют ковариацию между парами остатков в выравнивании с целью получения данных ковариации;(iv) устройство вывода, связанное с указанным электронным устройством, на которое будут выводиться вышеупомянутые данные ковариации. В соответствии с одним аспектом изобретение относится к носителю в компьютерном устройстве,хранящему исполняемые команды, требуемые для выполнения любого этапа способа изобретения. В соответствии с еще одним вариантом осуществления данные по частоте использования остатков составляют матрицу, включающую (i) непрерывные фрагменты из аминокислотных остатков, соответствующих полипептидной последовательности; и (ii) частоты использования остатков для остатков каждого типа и каждого их положения. В соответствии с еще одним вариантом осуществления частоту использования остатков отображают символически. В соответствии с одним вариантом осуществления представлены все 20 аминокислот, пробелы и неясные остатки. В соответствии с одним вариантом осуществления частота использования остатков коррелирует с размером символа. В соответствии с одним вариантом осуществления частота использования остатков положительно коррелирует с размером символа. В соответствии с одним вариантом осуществления (i) положения остатков отображаются в столбцах; a (ii) частоты использования остатков располагаются в строках. В соответствии с другим вариантом осуществления ковариацию между ковариантными остатками отображают в виде сетки наложений. В соответствии с одним аспектом изобретение относится к графическому пользовательскому интерфейсу, с помощью которого графически отображается (i) графическая сетка, включающая набор данных о частоте использования остатков для набора последовательностей полипептидов сравнения; и(ii) наложение ковариаций. В соответствии с одним вариантом осуществления область контакта также включает (iii) отображе-8 015992 ние интересующей последовательности. В соответствии с одним аспектом изобретение относится к способу продуцирования полипептида надсемейства иммуноглобулинов (Ig) с улучшенным биофизическим свойством, который включает следующие этапы:(a) осуществление выравнивания набора последовательностей сравнения, соответствующих Igукладке полипептида;(b) расчет ковариации между остатками последовательностей выравнивания с целью идентифицировать коварьирующие остатки;(с) замещение остатков полипептида, которые не удовлетворяют ковариации коварьирующим остатком из соответствующего положения выравнивания. В соответствии с другим вариантом осуществления биофизическое свойство выбрано из группы,включающей термическую стабильность, профиль развертывания под действием рН, стабильное устранение гликозилирования, растворимость, биохимическую функцию и их комбинации. В соответствии с одним вариантом осуществления биохимическая функция выбрана из группы,включающей распознавание белковой мишени или химического объекта, где химический объект выбран из группы, включающей фосфат, метил, ацетил, липид, детергент, ион металла, галоген, РНК, ДНК, олигонуклеотид и олигонуклеозид. В соответствии с одним вариантом осуществления полипептид надсемейства Ig получают из белка,выбранного из группы, включающей антитело или его антигенсвязывающий фрагмент, иммуноглобулиновый рецептор, белок клеточной адгезии, интегрин, аллерген, рецептор Т-клеток и молекулу главного комплекса гистосовместимости (МНС). В соответствии с одним вариантом осуществления полипептид надсемейства Ig выбирают из группы, включающей вариабельную область тяжелой цепи (VH), вариабельную область легкой цепи (VL), а также одноцепочечное антитело (scFv). В соответствии с одним вариантом осуществления укладка Ig выбрана из группы, включающей укладки V-класса, укладки 1-класса, укладки С 1-класса и укладки С 2-класса. В соответствии с другим вариантом осуществления полипептид надсемейства Ig представляет собой модифицированное антитело, выбранное из группы, включающей доменное антитело, гуманизированное антитело, человеческое антитело, нечеловеческое моноклональное антитело, химерное антитело,биспецифичное антитело, scFv-содержащее антитело и антитело с удаленным доменом. В соответствии с одним вариантом осуществления коварьирующие остатки входят в состав структурного элемента, выбранного из группы, включающей дисульфидный мостик, солевой мостик, фрагмент лигандсвязывающего кармана или поверхности, а также сеть Ван-Дер-Ваальса, водородный мостик и/или взаимодействия заряд-заряд. В соответствии с другим вариантом осуществления изобретение относится к способу получения антитела или модифицированного антитела с улучшенной стабильностью, в котором осуществляют следующие этапы:(а) создание структурной модели образца антитела высокого разрешения, стабильность которого подтверждена экспериментально;(б) использование структурной модели для идентификации области контакта VH/VL и/или каркасных остатков области контакта в образце антитела;(в) использование гомологичной модели для идентификации соответствующих остатков области контакта VH/VL антитела или модифицированного антитела, которые важны для стабилизации указанной области контакта, а также(г) замещение соответствующих остатков области контакта VH/VL антитела или модифицированного антитела на остатки области контакта белка образца. В соответствии с одним вариантом осуществления остаток области контакта белка образца накрывает собой по меньшей мере 10 2 площади поверхности в области контакта. В соответствии с одним вариантом осуществления модифицированное антитело выбрано из группы, включающей доменное антитело, гуманизированное антитело, человеческое антитело, нечеловеческое моноклональное антитело, химерное антитело, биспецифичное антитело, scFv-содержащее антитело, химерное антитело, а также антитело с удаленным доменом. В соответствии с другим аспектом изобретение относится к полипептидам, полученным способом по изобретению. В соответствии с одним вариантом осуществления полипептид обладает улучшенным биофизическим свойством, выбранным из группы, включающей термическую стабильность, профиль развертывания под действием рН, стабильное устранение гликозилирования, растворимость, биохимическую функцию и их комбинации. В соответствии с одним вариантом осуществления биохимическая функция представляет собой сродство к лиганду или специфичность. В соответствии с другим вариантом осуществления изобретение относится к способу создания библиотеки, включающей стабилизированную молекулу scFv, который включает:(а) создание набора последовательностей сравнения, соответствующих последовательности вариабельного домена молекулы scFv;(b) идентификацию аминокислоты внутри вариабельного домена, отсутствующей в наборе сравнения или встречающейся там с низкой частотой; а также(c) комбинирование этой информации с данными ковариации, предполагая, что модификация аминокислоты, идентифицированной в наборе сравнения с низкой частотой, может удовлетворить существующим ограничениям ковариации внутри вариабельного домена; а также(d) замещение аминокислоты этапа (b) стабилизированной аминокислотой-кандидатом с целью создания библиотеки, включающей стабилизированную молекулу scFvs. В соответствии с одним вариантом осуществления аминокислота этапа (b) характеризуется консенсусным счетом менее 0,5. В соответствии с другим вариантом осуществления аминокислота этапа (b) присутствует в менее чем 10% последовательностей набора сравнения. В соответствии с другим вариантом осуществления аминокислота этапа (b) представляет собой неконсенсусный остаток. В соответствии с одним вариантом осуществления стабилизированная аминокислота-кандидат находится в соответствующем положении в наборе сравнения. В соответствии с еще одним вариантом осуществления стабилизированная аминокислота-кандидат представляет собой консенсусную аминокислоту. В соответствии с одним вариантом осуществления стабилизированную аминокислоту-кандидата можно обнаружить путем анализа 3-D структуры вариабельной области последовательности. В соответствии с другим вариантом осуществления стабилизированную аминокислоту-кандидата идентифицируют расчетом упаковки боковых цепей. В соответствии с еще одним аспектом изобретение относится к способу продуцирования стабилизированной молекулы scFv, который включает:(b) скрининг библиотеки scFv анализа в жестких температурных условиях с целью идентифицировать молекулы-кандидаты scFv;(c) сравнение термической стабильности молекул-кандидатов scFv из библиотеки scFv с подходящим контролем, в котором повышение термической стабильности молекулы-кандидата scFv относительно контроля характеризует молекулу-кандидата scFv как стабилизированную молекулу scFv. В соответствии с другим аспектом изобретение относится к стабилизированной молекуле scFv,идентифицированной с помощью способа по изобретению, или к химерному белку, включающему стабилизированную молекулу scFv по изобретению. В соответствии с другим аспектом изобретение относится к способу прогнозирования стабильности белка-кандидата, включающего аминокислотную последовательность, в состав которой входят последовательности доменов-кандидатов, при этом указанный способ включает:(a) создание набора сравнения аминокислотных последовательностей, соответствующих последовательности домена-кандидата белка-кандидата;(b) определение частот встречаемости остатков в индивидуальных положениях аминокислот исследуемой последовательности домена с целью получения консенсусного счета; а также(c) использование консенсусного счета для прогнозирования стабильности белка-кандидата, где консенсусный счет коррелирует со стабильностью белка-кандидата. В соответствии с другим аспектом изобретение относится к способу прогнозирования стабильности белка-кандидата, который включает:(a) создание набора последовательностей сравнения, соответствующих исследуемой последовательности домена белка-кандидата;(b) определение частот встречаемости остатков в индивидуальных положениях аминокислот в исследуемой последовательности домена с получением консенсусного счета и(c) использование консенсусного счета для прогнозирования стабильности белка-кандидата, где консенсусный счет коррелирует со стабильностью белка-кандидата. В соответствии с другим аспектом изобретение относится к способу прогнозирования стабильности белка-кандидата, в котором осуществляют следующие этапы:(а) создание набора последовательностей сравнения, соответствующих исследуемой последовательности домена белка-кандидата;(b) определение частот встречаемости остатков в положениях аминокислот в исследуемой последовательности домена с получением консенсусного счета;(c) определение частот встречаемости остатков в соответствующих положениях аминокислот в последовательности набора сравнения с получением среднего консенсусного счета;(d) сравнение консенсусного счета со средним консенсусным счетом с получением счета последовательности и(e) использование консенсусного счета для прогнозирования стабильности белка-кандидата, где консенсусный счет непосредственно коррелирует со стабильностью белка-кандидата. В соответствии с еще одним аспектом изобретение относится к способу прогнозирования стабиль- 10015992 ности антитела-кандидата или модифицированного антитела-кандидата, в котором осуществляют следующие этапы:(a) создание набора сравнения последовательностей VH домена, соответствующих исследуемой последовательности VH домена антитела-кандидата или модифицированного антитела;(b) определение частот встречаемости аминокислотных остатков в положениях исследуемой последовательности VH домена с получением консенсусного счета;(c) определение частот встречаемости остатков в соответствующих положениях аминокислот в последовательности набора сравнения с получением среднего консенсусного счета;(d) сравнение консенсусного счета со средним консенсусным счетом с получением счета последовательности; а также(e) использование консенсусного счета для прогнозирования стабильности антитела-кандидата или модифицированного антитела, где консенсусный счет непосредственно коррелирует со стабильностью антитела-кандидата или модифицированного антитела. В соответствии с одним вариантом осуществления набор сравнения включает последовательности белков с таким же типом укладки, что и у белка-кандидата. В соответствии с другим вариантом осуществления набор сравнения включает ортологичные последовательности. В соответствии с одним вариантом осуществления набор сравнения включает последовательности человека, например последовательность VH человека того же класса Кэбата. В соответствии с одним вариантом осуществления набор сравнения включает зародышевые последовательности VH человека. В соответствии с одним вариантом осуществления исследуемая последовательность домена представляет собой фрагмент последовательности домена белка-кандидата. В соответствии с одним вариантом осуществления консенсусный счет определяют для каждого положения в исследуемой последовательности и на основании этих данных получают общий консенсусный счет, причем общий консенсусный счет коррелирует со стабильностью белка. В соответствии с другим вариантом осуществления общий консенсусный счет рассчитывают по следующей формуле: где score - счет ci(r) соответствует частоте встречаемости консенсусных аминокислотных остатков в положении консенсусной последовательности;hi(r) равняется частоте исследуемых аминокислотных остатков в положении исследуемой последовательности;i соответствует количеству аминокислотных положений в пределах исследуемой последовательности. В соответствии с одним вариантом осуществления стабильность белка определяют, сравнивая консенсусный счет белка-кандидата с консенсусным счетом подходящего контроля. В соответствии с другим вариантом осуществления стабильность белка определяют, сравнивая консенсусный счет белка-кандидата с идеальным консенсусным счетом белка-кандидата. В соответствии с еще одним вариантом осуществления стабильность белка определяют, сравнивая консенсусный счет белка-кандидата с подходящим контролем. В соответствии с еще одним вариантом осуществления стабильность белка определяют, сравнивая счет последовательности антитела-кандидата или модифицированного антитела с подходящим контролем. В соответствии с одним вариантом осуществления белок представляет собой полидоменный белок,причем последовательность домена-мишени получают из наименее стабильного домена полидоменного белка. В соответствии с другим вариантом осуществления белок представляет собой модифицированное антитело, выбранное из группы, включающей антитело верблюда, гуманизированное антитело, человеческое антитело, нечеловеческое моноклональное антитело, химерное антитело, биспецифичное антитело, scFv-содержащее антитело и антитело с удаленным доменом. В соответствии с другим вариантом осуществления изобретение относится к способу отбора белков-кандидатов для экспрессии, включающему определение стабильности белка-кандитата способом по изобретению, где белок-кандитат отбирается для экспрессии, если его консенсусный счет или счет последовательности прогнозирует высокую стабильность. В соответствии с другим аспектом изобретение относится к способу отбора белков-кандидатов для экспрессии, включающему определение стабильности белка-кандитата способом по изобретению, в котором белок-кандитат отбирается для экспрессии, если его специфический для положения в последовательности счет ковариации прогнозирует высокую стабильность. В соответствии с другим аспектом изобретение относится к способу отбора исследуемой последо- 11015992 вательности вариабельной области акцепторного иммуноглобулина для использования при гуманизации антитела донора, причем этот способ включает определение стабильности последовательностикандидата способом по изобретению, где последовательность-кандидат отбирают, если ее счет последовательности прогнозирует высокую стабильность. В соответствии с еще одним аспектом изобретение относится к способу отбора исследуемой последовательности вариабельной области акцепторного иммуноглобулина для использования при гуманизации антитела донора, причем этот способ включает определение стабильности последовательностикандидата способом по изобретению, где последовательность-кандидат отбирают, если ее специфический для положения в последовательности счет ковариации прогнозирует высокую стабильность. В соответствии с другим вариантом осуществления исследуемая последовательность представляет собой зародышевую последовательность человека. Перечень фигур, чертежей и иных материалов На фиг. 1 показана последовательность ДНК (SEQ ID NO: 3), кодирующая обычный конструкт ВНА 10 scFv, который включает линкер (Gly4Ser)3 (выделен полужирным шрифтом). На фиг. 2 показана последовательность (SEQ ID NO: 4), кодирующая обычный конструкт ВНА 10scFv. На фиг. 3, 4 отражены результаты измерения способом дифференциальной сканирующей калориметрии (ДСК) очищенных обычных фрагментов Fab или scFv последовательности ВНА 10. На фиг. 3 показаны результаты ДСК-анализа, в котором сравнивали развертывание обычных фрагментов Fab илиscFv последовательности ВНА 10. На фиг. 4 показаны результаты ДСК-анализа очищенного ВНА 10 scFv при скорости сканирования 1 и 2 С/мин. На фиг. 5 показана последовательность ДНК (SEQ ID NO: 9), кодирующая стабилизированный дисульфидом между VH44/VL100 BHA10 scFv конструкт, включающий линкер (Gly4Ser)3 (показан полужирным шрифтом). На фиг. 6 показана аминокислотная последовательность (SEQ ID NO: 10) стабилизированного дисульфидом между VH44/VL100 BHA10 scFv конструкта. Цистеиновые остатки, формирующиеVH44/VL100 дисульфидный мостик, выделены полужирным шрифтом и курсивом. На фиг. 7 показана последовательность ДНК (SEQ ID NO: 14), кодирующая стабилизированный ВНА 10 scFv конструкт, включающий линкер (Gly4Ser)4 (показан полужирным шрифтом). На фиг. 8 показана аминокислотная последовательность (SEQ ID NO: 15) (Gly4Ser)4 BHA10 scFv конструкта. Пояснение такое же, как и для фиг. 7. На фиг. 9 показана последовательность ДНК (SEQ ID NO: 16), кодирующая ВНА 10 scFv конструкт,включающий линкер (Gly4Ser)5 (показан полужирным шрифтом). На фиг. 10 показана аминокислотная последовательность (SEQ ID NO: 17) (Gly4Ser)5 BHA10 scFv конструкта. Аннотация такая же, что и для фиг. 9. На фиг. 11 отражены результаты анализа Вестерн Блот (вестерн-блоттинг), в котором сравнивались уровни экспрессии обычного ВНА 10 scFv (полоса 1) и стабилизированной ВНА 10 молекулы scFvs изобретения (полосы 2-4). Каждый образец подвергался электрофорезу как в восстанавливающих (левая панель), так и в невосстанавливающих (правая панель) условиях. На фиг. 12 показана последовательность ДНК (SEQ ID NO: 18), кодирующая стабилизированный дисульфидом между VH44/VL100 BHA10 scFv конструкт, включающий линкер (Gly4Ser)4 (показан полужирным шрифтом). На фиг. 13 показана аминокислотная последовательность (SEQ ID NO: 19) стабилизированного дисульфидом между VH44/VL100 и (Gly4Ser)4 ВНА 10 scFv конструкта. Цистеиновые остатки, формирующие VH44/VL100 дисульфидный мостик, выделены полужирным шрифтом и курсивом. Пояснение такое же, как и для фиг. 12. На фиг. 14 отражены результаты анализа термической проверки, в ходе которого термическую стабильность стабилизированной ВНА 10 молекулы scFvs изобретения сравнили с традиционной ВНА 10 молекулой scFv. В подписях к фигуре указана температура, при которой 50% молекул scFv сохраняют свою связывающую активность (Т 50). На фиг. 15 отражены результаты анализа способом дифференциальной сканирующей калориметрии(ДСК), выполненного с обычными ВНА 10 scFv и ВНА 10 VH44:VL100/(Gly4Ser)4 scFv. На фиг. 16 показаны результаты связывания гидрофобного флуоресцентного красителя 1-анилино 8-нафталинсульфоната (ANS) с обычным ВНА 10 scFv, ВНА 10 (Gly4Ser)4 scFv и ВНА 10VH44:VL100/(Gly4Ser)4 scFv. На фиг. 17, 18 отражены результаты анализа частоты остатков доменов ВНА 10 VH и VL. На фиг. 17 перечислены положения ВНА 10 VH из библиотеки для скрининга на основании анализа частоты остатков последовательностей вариабельного домена IgG. На фиг. 18 перечислены положения ВНА 10 VL из библиотеки для скрининга на основании анализа частоты остатков последовательностей вариабельного домена IgG. На фиг. 19 отражены результаты анализа термической проверки, в ходе исследовали влияние стабилизирующих мутаций ВНА 10 scFv на термическую стабильность и аддитивность стабилизирующих- 12015992 мутаций (GS3 означает (G4S)3 и GS4 означает (G4S)4; SS означает сульфидную связь). На фиг. 20 показан пример стабилизированного LTR/TRAIL-R2 биспецифичного антитела (антитела "Геркулес") изобретения. Антитела Геркулес образуют гибридизацией стабилизированной молекулы ВНА 10 scFv изобретения с антителом 14 А 2 IgG. Молекулу scFv можно гибридизовать с С- или Nконцом тяжелой цепи (С-Геркулес или МН-Геркулес) или с N-концом легкой цепи (NL-Геркулес). На фиг. 21, 22 схематически отображены последовательные ПЦР-реакции, используемые для гибридизации обычных и сконструированных ВНА 10 scFv с аминоконцом (фиг. 21) или карбоксиконцом(фиг. 22) тяжелой цепи 14 А 2. На фиг. 23 показана последовательность ДНК (SEQ ID NO: 28) химерной легкой цепи 14 А 2, включающей сигнальный пептид (подчеркнуто). На фиг. 24 показана аминокислотная последовательность (SEQ ID NO: 29) химерной легкой цепи 14 А 2. На фиг. 25 показана последовательность ДНК (SEQ ID NO: 30) тяжелой цепи обычного ВНА 10 scFvNH-Геркулес. На фиг. 26 показана аминокислотная последовательность (SEQ ID NO: 31) тяжелой цепи обычного ВНА 10 scFv NH-Геркулес. На фиг. 27 показана последовательность ДНК (SEQ ID NO: 32) тяжелой цепи ВНА 10 scFv (Gly4Ser)4NH-Геркулес. На фиг. 28 показана аминокислотная последовательность (SEQ ID NO: 33) тяжелой цепи ВНА 10scFv (Gly4Ser)4 NH-Геркулес. На фиг. 29 показана последовательность ДНК (SEQ ID NO: 34) тяжелой цепи ВНА 10 scFvVH44:VL100 N-Геркулес. На фиг. 30 показана аминокислотная последовательность (SEQ ID NO: 35) тяжелой цепи ВНА 10scFv VH44:VL100 NH-Геркулес. На фиг. 31 показана последовательность ДНК (SEQ ID NO: 36) тяжелой цепи ВНА 10 scFvVH44;VL100/(Gly4Ser)4 NH-Геркулес. На фиг. 32 показана аминокислотная последовательность (SEQ ID NO: 37) тяжелой цепи ВНА 10scFv VH44:VL100/(Gly4Ser)4 NH-Геркулес. На фиг. 33 показана последовательность ДНК (SEQ ID NO: 44) тяжелой цепи обычной ВНА 10 scFv С-Геркулес. На фиг. 34 показана аминокислотная последовательность (SEQ ID NO: 45) тяжелой цепи обычной ВНА 10 scFv С-Геркулес. На фиг. 35 показана последовательность ДНК (SEQ ID NO: 46) тяжелой цепи ВНА 10 scFv (Gly4Ser)4 С- Геркулес. На фиг. 36 показана аминокислотная последовательность (SEQ ID NO: 47) тяжелой цепи ВНА 10scFv (Gly4Ser)4 С-Геркулес. На фиг. 37 показана последовательность ДНК (SEQ ID NO: 48) тяжелой цепи ВНА 10 scFvVH44:VL100 С-Геркулес. На фиг. 38 показана аминокислотная последовательность (SEQ ID NO: 49) тяжелой цепи ВНА 10scFv VH44:VL100 С-Геркулес. На фиг. 39 показана последовательность ДНК (SEQ ID NO: 50) тяжелой цепи ВНА 10 scFvVH44:VL100/(Gly4Ser)4 С-Геркулес. На фиг. 40 показана аминокислотная последовательность (SEQ ID NO: 51) тяжелой цепи ВНА 10scFv VH44:VL100/(Gly4Ser)4 С-Геркулес. На фиг. 41 показаны результаты анализа Вестерн Блот кратковременно экспрессируемых С- и NHГеркулес биспецифичных антител в клетках СНО. Левая панель содержит анализ в невосстанавливающих условиях, а правая - в восстанавливающих условиях. На фиг. 42, 43 показаны результаты анализа ELISA, оценивающего активность связывания стабилизированных антител Геркулес настоящего изобретения с рецепторами LTR. На фиг. 42 отражены результаты со стабилизированными антителами С-Геркулес. На фиг. 43 показаны результаты со стабилизированными антителами N-Геркулес. Сокращение "wt" означает обычное антитело NH Геркулес. "GS4" означает стабилизированное антитело NH Геркулес, включающее стабилизированную (Gly4Ser)4 scFv."ds" соответствует стабилизированному антителу NH Геркулес, включающему стабилизированную scFv сVH44/VL100 дисульфидным линкером. На фиг. 44, 45 показаны результаты анализа ELISA, оценивающего активность связывания стабилизированных антител Геркулес настоящего изобретения с рецепторами TRAIL R2. На фиг. 44 отражены результаты со стабилизированными антителами С-Геркулес. На фиг. 45 показаны результаты со стабилизированными антителами NH-Геркулес. Сокращение "wt" означает обычное антитело NH Геркулес. "GS4" означает стабилизированное антитело NH Геркулес, включающее стабилизированную (Gly4Ser)4scFv. "ds" соответствует стабилизированному антителу NH Геркулес, включающему стабилизированную scFv с- 13015992 На фиг. 46 показаны результаты SEC анализа стабилизированных биспецифичных антител СГеркулес после хроматографии белка А. На фиг. 47, 48 показаны результаты SDS-PAGE анализа очищенных стабилизированных биспецифичных антител Геркулес. На фиг. 47 отображены результаты для биспецифичных антител NH-Геркулес. На фиг. 48 отображены результаты для биспецифичных антител С-Геркулес. В каждую полосу загружали по 5 мкг образца. На фиг. 49 показаны результаты аналитического SEC анализа очищенных стабилизированных биспецифичных антител N-Геркулес. Панель А отображает профиль N-Геркулес с VH44:VL100 BHA10 scFv после хроматографии Белка А, а панель В - после препаративного SEC. Панель С отображает профиль NГеркулес с VH44:VL100/(G4S)4 BHA10 scFv после хроматографии Белка А, а панель D - после препаративного SEC. На фиг. 50 показаны результаты аналитического SEC анализа очищенных стабилизированных биспецифичных антител С-Геркулес. Панель А отображает профиль С-Геркулес с VH44:VL100 ВНА 10 scFv после хроматографии белка А, а панель В - после препаративного SEC. Панель С отображает профиль СГеркулес с VH44:VL100/(G4S)4 ВНА 10 scFv после хроматографии белка А, а панель D - после препаративного SEC. На фиг. 51 показаны результаты анализа способом дифференциальной сканирующей калориметрииscFv. На фиг. 52 показаны результаты анализа ELISA, оценивающего активность биспецифичного связывания стабилизированных антител Геркулес настоящего изобретения с рецепторами TRAIL-R2 и LTRIg. "N-Геркулес" Cys и C-Геркулес"Cys представляют собой антитела Геркулес, включающие NH- или С-концевые scFv с дисульфидной связью VH44/VL100. "N-Геркулес"Cys и N-Геркулес" DM" представляют собой антитела Геркулес, включающие NH- или С-концевые scFv с дисульфидной связьюVH44/VL100 и линкером (Gly4Ser)4. Пентамер СВЕ 11 представляет собой контрольное антитело с неспецифичной LTR-связывающей активностью. На фиг. 53-56 отображены эффекты стабилизированных N- и С-Геркулес биспецифичных антител на рост клеток опухолей. На фиг. 53-56 показаны эффекты на рост опухолевых клеток WiDr, опухолевых клеток Me 180, MDA231 и HUVEC соответственно. Фиг. 57 представляет собой схематическую диаграмму стабилизированных двухцепочечных димерных мини-тел, включающих стабилизированные scFv. Пример мини-тела включает первый цепочечный фрагмент, включающий стабилизированный scFv со специфичностью связывания к антигену TRAIL R2,и второй цепочечный фрагмент, включающий стабилизированный scFv со специфичностью связывания к антигену LTR. Ориентация доменов VH и VL в scFv может меняться, и соответствующие специфичности связывания также могут быть изменены. Фиг. 58 представляет собой схематическую диаграмму стабилизированного биспецифичного двухцепочечного димерного тетравалентного мини-тела (стабилизированного биспецифичного N-scFv тетравалентного мини-тела), включающего стабилизированные фрагменты scFv изобретения, соединенные с аминоконцом. Пример стабилизированного димерного тетравалентного мини-тела включает первый цепочечный фрагмент, включающий два стабилизированных scFvs со специфичностью связывания к антигену TRAIL R2, и второй цепочечный фрагмент, включающий два стабилизированных scFvs со специфичностью связывания к антигену LTR. Возможны также и другие конфигурации, например, можно так сконструировать биспецифичное тетравалентное мини-тело, что каждый такой фрагмент будет содержать два стабилизированных фрагмента scFv с различными специфичностями. В соответствии с другим аспектом ориентацию доменов VH и VL в scFv можно изменить. В соответствии с другим вариантом осуществления scFv стабилизировано меньше всех. Фиг. 59 представляет собой схематическую диаграмму примера стабилизированного биспецифичного двухцепочечного димерного тетравалентного мини-тела (стабилизированного биспецифичного CscFv тетравалентного мини-тела), включающего стабилизированные фрагменты scFv изобретения, соединенные с обоими карбоксильными концами бивалентного мини-тела. Пример стабилизированного димерного тетравалентного мини-тела включает первый цепочечный фрагмент, включающий два стабилизированных scFvs со специфичностью связывания к антигену TRAIL R2, и второй цепочечный фрагмент, включающий два стабилизированных scFvs со специфичностью связывания к антигену LTR. Возможны также и другие конфигурации, например, можно так сконструировать биспецифичное двухцепочечное димерное тетравалентное мини-тело, что каждая такая цепочка будет содержать два стабилизированных фрагмента scFv с различными специфичностями. В соответствии с другим вариантом осуществления ориентацию доменов VH и VL в scFv можно изменить. В соответствии с другим вариантом осуществления scFv стабилизировано меньше всех. Фиг. 60 представляет собой схематическую диаграмму стабилизированного биспецифичного четырехцепочечного димерного диатела, включающего стабилизированные scFv изобретения. Возможны также и другие конфигурации, например, можно так сконструировать стабилизированное биспецифич- 14015992 ное двухцепочечное димерное тетравалентное мини-тело, что каждое такое плечо будет содержать стабилизированные фрагменты scFv с различными специфичностями. Ориентацию доменов VH и VL можно изменить. В соответствии с другим вариантом осуществления scFv стабилизировано меньше всех. Фиг. 61 представляет собой схематическую диаграмму стабилизированного биспецифичного четырехцепочечного димерного тетравалентного scFv антитела (стабилизированного C-scFv тетравалентного антитела), включающего стабилизированные scFv, соединенные с карбоксильным концом CH3 и пептидом, присоединенным к шарниру. Ориентацию доменов VH и VL в стабилизированном scFv можно изменить. Альтернативно, стабилизированные scFv фрагменты можно присоединять к аминоконцу либо тяжелой, либо легкой цепи с образованием NH-scFv тетравалентных антител или NL-scFv тетравалентных антител соответственно. Фиг. 62 представляет собой схематическую диаграмму стабилизированного четырехцепочечного тетравалентного биспецифичного антитела scFv без домена CH3 (стабилизированного C-scFv тетравалентного биспецифичного антитела с удаленным доменом CH3), включающего стабилизированное антитело scFv, присоединенное к карбоксильному концу CH3 и пептидом, присоединенным к шарниру. Каждый участок тяжелой цепочки биспецифичного антитела включает область Fv со специфичностью связывания к антигену TRAIL R2 и стабилизированную область scFv со специфичностью связывания к антигену LTR. Ориентацию VH и VL доменов в стабилизированном scFv можно изменять и менять соответствующие антигенсвязывающие специфичности. В соответствии с другим вариантом осуществленияscFv стабилизировано меньше всех. Фиг. 63 представляет собой схематическую диаграмму стабилизированного четырехцепочечного тетравалентного биспецифичного антитела scFv с удаленным доменом CH3 (стабилизированного NH-scFv тетравалентного биспецифичного антитела с удаленным доменом CH3), включающего стабилизированное антитело scFv, присоединенное к аминоконцу VH и включающее пептид, присоединенный к шарниру. Каждый участок тяжелой цепи биспецифичного антитела включает область Fv со специфичностью связывания к антигену TRAIL R2 и стабилизированную область scFv со специфичностью связывания к антигену LTR. Ориентацию VH и VL доменов в стабилизированном scFv можно изменять и менять соответствующие антигенсвязывающие специфичности. В соответствии с другим вариантом осуществленияscFv стабилизировано меньше всех. Фиг. 64 представляет собой схематическую диаграмму стабилизированного четырехцепочечного тетравалентного биспецифичного антитела scFv с удаленным доменом CH3 (стабилизированного NL-scFv тетравалентного биспецифичного антитела с удаленным доменом CH3), включающего стабилизированное антитело scFv, присоединенное к аминоконцу VL и включающее пептид, присоединенный к шарниру. Каждый участок тяжелой цепи биспецифичного антитела включает область Fv со специфичностью связывания к антигену TRAIL R2 и стабилизированную область scFv со специфичностью связывания к антигену LTR. Ориентацию VH и VL доменов в стабилизированном scFv можно изменять и менять соответствующие антигенсвязывающие специфичности. В соответствии с другим вариантом осуществленияscFv стабилизировано меньше всех. На фиг. 65 изображены кривые Т 50 ВНА 10 scFv дикого типа (закрашенные кружки) по сравнению со стабилизирующими мутациями ВНА 10 scFV, включающими VL-S46L (фиг. 65 А, пустые кружки), VHV55G (фиг. 65 В, пустые кружки) и VH P101D (фиг. 65C, пустые кружки). На фиг. 66, 67 изображены кривые ДСК VH-(GS)4-VL-6His BHA10 scFv дикого типа (серая линия) по сравнению с ВН 10 scFv, включающими стабилизирующие мутации VL S46L (черная линия) (фиг. 66) и VH V55G (черная линия) (фиг. 67). На фиг. 68 изображены кривые ДСК VH-(GS)4-VL-6His BHA10 scFv дикого типа (серая линия) по сравнению с ВН 10 scFv, включающими стабилизирующую мутацию VH-P101D (черная линия). На фиг. 69 изображен анализ SDS-PAGE scFv дикого типа ("WT (G4S)X3") и стабилизированного мутантного scFv. Все мутантные scFv содержат связывающий пептид типа Gly-Ser и формулы (Gly4Ser)4 между N-концом VH и С-концом VL ("(G4S)X4"). Показана идентичность scFv в каждой полосе. Полосы 12-14 содержат ВНА 10 scFv с дисульфидным мостиком между VH44 и VL100. (G4S)Х 4/дисульфид стабилизирующие scFv обозначены как "DM", что означает "double mutant" (двойной мутант). Две последние полосы включают заданные мутации, которые также стабилизировали связанные через дисульфиды scFv. На фиг. 70, 71 изображены кривые ДСК ВНА 10 scFv дикого типа scFv ("VH-(GS)4-VL-6His") (пунктирная линия), VH S16E мутантное scFv (тонкая серая линия), VL S46L мутантное scFv (тонкая черная линия), VH V55G мутантное scFv (толстая серая линия), а также VH P101D мутантное scFv (толстая черная линия). На фиг. 71 показана зависящая от температуры флуоресценция 10 мМ ANS в PBS (пустые кружки) или в присутствии ВНА 10 scFv дикого типа ("VH-(GS)4-VL-6His") (закрашенные серые кружки),VH S16E мутантных scFv (ромбики), VL S46L мутантных scFv (квадратики), VH V55G мутантных scFv(обратные треугольники), а также VH P101D мутантных scFv (треугольники). Проведенные через кривые линии построены на основании модели развертывания с двумя состояниями. На фиг. 72, 73 показана флуоресценция ANS при 15 С в присутствии scFvs дикого типа и мутантных. Индуцированная каждым scFv флуоресценция ANS нанесена на график против ТМ домена VH того- 15015992 же scFv, как определено способом ДСК (фиг. 72) и температурозависимым увеличением флуоресценцииANS, вызванным развертыванием каждой scFv (фиг. 73). На фиг. 74-76 представлены данные гель-хроматографии (SEC) высоких концентраций стабилизированного N-Геркулес (XWU028; ВНА 10 scFv VH44:VL100/(Gly4Ser)4N-Геркулес; фиг. 74), стабилизированного С-Геркулес (XWU036; ВНА 10 scFv VH44:VL100/(Gly4Ser)4 С-Геркулес; фиг. 75), а также антител ВНА 10 дикого типа (фиг. 76) в шести временных точках (Т=0, Т=1 неделя, Т=2 недели, Т=1 месяц,Т=2 месяца и Т=3 месяца) и низких температурах (2-8 С). По оси X отложено время (минуты), по оси у mAU (единицы поглощения) при 280 нм. За время эксперимента значительных изменений в профиле элюирования отмечено не было. На фиг. 77 представлены данные анализа SDS-PAGE для XWU028 и XWU036 до хранения и через 3 месяца после их передачи на хранение при 2-8 С. Панель А. Ранее восстановленные образцы были окислены до первоначального состояния (обозначены как "NR"). Предполагаемая молекулярная масса,MW, 200 кДа, наблюдалась для биспецифических образцов. ВНА 10 показал свою ожидаемуюXWU036. Полосы 9-10 соответствуют образцам ВНА 10 IgG. Панель В. Образцы восстановили DTT (обозначены как "Red", восстановленные). Предполагаемая молекулярная масса для тяжелой цепи составляет 75 кДа, а для легкой цепи 25 кДа, они наблюдались для биспецифичных образцов в восстановительных условиях. Тяжелые и легкие цепи ВНА 10 показали свои ожидаемые MW 50 и 25 кДа соответственно в восстановительных условиях. Панели 1, 2, 6 и 7 соответствуют образцам XWU028. Панели 3, 4, 8 и 9 соответствуют образцам XWU036. Панели 5 и 10 соответствуют образцам ВНА 10 IgG. На фиг. 78, 79 показаны данные интактного масс-анализа для XWU028 (панель А) и XWU036 (панель В) при Т=0, Т=1 месяц и Т=3 месяца. Для каждого белка наблюдалось несколько пиков из-за высокого уровня сиалилирования N-связанных углеводов в CH3. Распределение углеводов биспецифичных антител типично для стандартных белков IgG1. На фиг. 80, 81 отображены результаты сэндвич-анализа ELISA, в котором измерялось биспецифичное связывание образцов сыворотки, включающей N-концевой Геркулес (XWU028; фиг. 74) или Сконцевой Геркулес (XWU036; фиг. 75), с рецепторами TRAIL-R2 и LTR. Фиг. 82 отражает результаты эксперимента по оценке относительной активности in vivo стабилизированных биспецифичных антител (XWU028 (ромбики) и XWU036 (пустые квадратики, моноспецифичных антител, вводившихся по отдельности (hCBE11 (закрашенные треугольники) и hBHA10 (обращенные треугольники) и ch14 А 2 (ромбики и совместно (пустые треугольники) против мышиной модели ксенотрансплантата. Введения начались на день 13. hCBE11 v. VC: P0,001; hBHA10 v. VC: P0,001;hBHA10: P0,01; Геркулес-II XWU036 v. Ch14 А 2: Р 0,05; комбо v. V.C. : Р 0,001. На фиг. 83 показана последовательность ДНК (SEQ ID NO: 52) тяжелой цепи С-Геркулес ВНА 10scFv VH S16E+VL S46L биспецифичного антитела. На фиг. 84 показана аминокислотная последовательность (SEQ ID NO: 53) тяжелой цепи СГеркулес ВНА 10 scFv VH S16E+VL S46L биспецифичного антитела. На фиг. 85 показана последовательность ДНК (SEQ ID NO: 54) тяжелой цепи С-Геркулес ВНА 10scFv VH44-VL100/VH S16E+VL S46L биспецифичного антитела. На фиг. 86 показана аминокислотная последовательность (SEQ ID NO: 55) тяжелой цепи СГеркулес ВНА 10 scFv VH44-VL100/VH S16E+VL S46L биспецифичного антитела. На фиг. 87 показаны результаты аналитической гель-хроматографии (SEC) элюатов белка А из супернатантов, включающих С-Геркулес со стабилизированным VH S16E+VL S46L ВНА 10 scFv (XWU054) и С-Геркулес с обычным ("WT") BHA10 scFv. На фиг. 88, 89 показаны гели SDS-PAGE очищенного С-концевого Геркулес с VH S16E+VL S46L ВНА 10 scFv (фиг. 88) и очищенного С-концевого Геркулес с VH44:VL100/VH S16 Е+VL S46L BHA10 scFv(фиг. 89). На фиг. 90, 91 показаны профили элюирования аналитической SEC для С-концевого Геркулес с VHscFv (фиг. 91) после первоначального этапа очистки белка. На фиг. 92, 93 показаны результаты in vitro анализов пролиферации опухолевых клеток, демонстрирующих активность С-концевого Геркулес с VH S16E+VL S46L ВНА 10 scFv (XWU054) и С-концевого Геркулес с VH44:VL100/VH S16E+VL S46L ВНА 10 scFv (XWU055). Клеткам MDA231 (фиг. 92) и WiDr(фиг. 93) вводили антитела. Активность для антител Геркулес сравнивали со стабилизированнымиXWU036 биспецифичными антителами и соответствующими моноспецифичными антителами (hBHA10 и ch14A2), вводившимися по отдельности или совместно. На фиг. 94 отображена кривая развертывания ДСК для BIIB7 IgG1, сделанная в условиях, идентичных тем, что использовались для остальных человеческих (гуманизированных) антител 18 BIIB (сплошная линия). Индивидуальные Fab, CH3 и CH3 переходы, хорошо заметные на кривой ДСК, помечены и представлены пунктирными линиями.- 16015992 На фиг. 95 показана кривая развертывания ДСК антител BIIB7 в форматах IgG1 и IgG4. На фиг. 96 показаны кривые термического развертывания четырех человеческих (гуманизированных) антител IgG1: BIIB16, BIIB6, BIIB4 и BIIB1. Переходы при развертывании между CH3 и CH3 доменами для всех четырех конструктов IgG1 идентичны, но переходы при развертывании Fab высоковариабельны. На фиг. 97 представлены результаты консенсусного счета для 182 вариабельных последовательностей доменов человеческих антител человеческих антител и консенсусных последовательностей индивидуальных подклассов. А. Счеты последовательностей подкласса VH, полученные способом анализа частоты остатков в базе данных VH млекопитающих. В. Распределение счетов последовательности сравнения VH из NCBI. Счеты последовательностей VH кластеризованы в соответствии с подклассом С. Счеты последовательностей подкласса VK, полученные способом анализа частоты остатков в базе данных млекопитающих VK. D. Распределение счетов из последовательности VK сравнения из NCBI. Счеты последовательностей VK кластеризованы в соответствии с подклассом. На фиг. 98, 99 представлены двумерные графики, на которых сравниваются счеты последовательностей для антител 18 BIIB с соответствующими температурами Fab ТМ, измеренными способом ДСК. Фиг. 98 отражает счеты BIIB1-18 VH против Fab TM. Идентичность каждой точки включается в табл. 20. Значения VH BIIB15 и BIIB16 содержат необычные включения/делеции в своих областях CDR. Результаты для BIIB15 и BIIB16 показаны в виде квадратиков. TM для BIIB18 искусственно помечен как 57,2 С(чтобы привести в соответствие с минимальным измеренным ТМ из BIIB17), так как его собственную ТМ измерить не удалось в виду отсутствия экспрессии. Вероятно, ТМ для BIIB18 будет значительно меньше,так как его счет последовательности чрезвычайно мал, и он не может экспрессироваться. Данные Fab для(А), если не считать счетов для VK. На фиг. 100 показаны репрезентативные структуры V-класса, С-класса и I-класса укладки Ig. На фиг. 101 отображена гистограмма длин последовательностей V-, I-, С 1- и С 2-классов укладок Ig,полученных из SCOP. На фиг. 102 показан вывод NAPMAP Visual Tool, включающий фрагмент платформы выравнивания, на котором накладываются данные ковариационного анализа. Платформа отображает колонки(столбцы), включающие все аминокислотные остатки, включая пропуски (тип остатка), для каждого положения в вариабельной области ( положения остатка). На фиг. 103 показано наложение статистик ковариации укладки Ig на шаблон NAPMAP. Интересующая последовательность представлена в виде изогнутой линии, проходящей через соответствующие аминокислоты. Ковариации показаны в виде прямых полосок между соответствующими коварьирующими аминокислотными остатками. На фиг. 104 показаны детали ковариационного анализа ВНА 10 VL с выделением ковариации междуTyr в положении Кэбата 36 (положение остатка 48) и мутации SerLeu в положении Кэбата 46 (положение остатка 67), как описано в примере 7. На фиг. 105 показаны детали ковариационного анализа ВНА 10 VH с выделением конфликтующей ковариации между Val в положении Кэбата 67 (положение остатка 100), Thr в положении Кэбата 70(положение остатка 104) и мутации MetLeu в положении Кэбата 80 (положение остатка 116). На фиг. 106 показана последовательность одноцепочечной ДНК (SEQ ID NO: 63) тяжелой цепи Сконцевого тетравалентного антитела PRIMATIZED р 5 Е 8, включающего обычный scFv. На фиг. 107 показана аминокислотная последовательность (SEQ ID NO: 64) тяжелой цепи Сконцевого тетравалентного антитела PRIMATIZED р 5 Е 8, включающего обычный scFv. На фиг. 108 показана последовательность одноцепочечной ДНК (SEQ ID NO: 65) легкой цепиPRIMATIZED p5E8. Последовательность сигнального пептида выделена. На фиг. 109 показана аминокислотная последовательность (SEQ ID NO: 66) легкой цепиPRIMATIZED p5E8. На фиг. 110 показана последовательность одноцепочечной ДНК (SEQ ID NO: 67) обычнойPRIMATIZED p5E8 (VL/VH) scFv. Последовательность сигнального пептида выделена. На фиг. 111 показана аминокислотная последовательность (SEQ ID NO: 68) обычнойPRIMATIZED p5E8 (VL/VH) scFv. На фиг. 112 показана последовательность одноцепочечной ДНК (SEQ ID NO: 69) обычнойPRIMATIZED p5E8 (VH/VL) scFv. На фиг. 113 (SEQ ID NO: 70) показана аминокислотная последовательность обычнойPRIMATIZED p5E8 (VH/VL) scFv. На фиг. 114 показаны кривые Т 50 обычной р 5 Е 8 (VH/VL) scFv (закрашенные кружки) по сравнению с обычной р 5 Е 8 (VL/VH) scFv (пустые кружки). На фиг. 115 показаны результаты исследования по оценке относительной стабильности in vivo стабилизированных биспецифичных антител "Геркулес-II" (XWU036 (закрашенные кружки и моноспеци- 17015992 фичных антител, вводившихся по отдельности (hBHA10 (обращенные закрашенные треугольники) иch14 А 2 (закрашенные ромбы и совместно (пустые обращенные треугольники) на мышиной модели опухолевых ксенотрансплантантов рака молочной железы человека (MDA-MB-231). На фиг. 116, 117 показаны остатки VH, участвующие в ковариационной сети, которые важны для поддержания области контакта (фиг. 116), и остатки области контакта, участвующие в создании прямых контактов с областью контакта VH/VL и которые непосредственно отображаются на поверхность доменаVH (фиг. 117). Стрелки указывают на положение остатков вне фактической области контакта, которые по данным ковариационного анализа важны для стабилизации взаимодействия VH/VL и для стабильностиVH/VL. Локализация гипервариабельных остатков CDR3, осуществляющих непосредственные контакты в области контакта между VH и VL, выделена рамкой. На фиг. 118, 119 показаны остатки VL, участвующие в ковариационной сети, которые важны для поддержки области контакта (фиг. 118), и остатки области контакта, участвующие в создании прямых контактов с областью контата VH/VL и которые непосредственно отображаются на поверхность VL(фиг. 119). Стрелки указывают на положение остатков вне фактической области контакта, которые по данным ковариационного анализа важны для стабилизации взаимодействия VH/VL и для стабильностиVH/VL. Локализация гипервариабельных остатков CDR3, осуществляющих непосредственные контакты в области контакта между VH и VL, выделена рамкой. На фиг. 120 показан пример окружающих условий, подходящих для практического осуществления аспекта изобретения. Фиг. 121 представляет собой блок-схему последовательности действий, которых надо придерживаться в соответствии с аспектом изобретения, чтобы определить счет ковариации последовательности,который можно затем использовать как меру стабильности полипептида. Фиг. 122 представляет собой блок-схему последовательности действий, которых надо придерживаться в соответствии с аспектом изобретения, чтобы определить консенсусный счет и затем использовать его для прогнозирования стабильности белка-кандидата. Фиг. 123 представляет собой блок-схему последовательности действий, которых надо придерживаться в соответствии с аспектом изобретения, чтобы определить средний консенсусный счет и затем использовать его для прогнозирования стабильности белка-кандидата. Фиг. 124 представляет собой блок-схему последовательности действий, которых надо придерживаться в соответствии с аспектом изобретения, чтобы с помощью остатка замещения полипептида определить для него улучшенную последовательность. Фиг. 125(А-В) показывают аминокислотные последовательности стабилизированных ВНА 10 scFV,включающих S46L(VL) стабилизирующую мутацию (SEQ ID NO: 137) и V55G(VH) стабилизирующую мутацию (SEQ ID NO: 138). Стабилизирующая мутация заключена в рамку. Ведущая последовательность, gly/ser-соединяющий пептид и домен CH1 выделены нижним подчеркиванием, полужирным шрифтом и курсивом соответственно. На фиг. 126 отображена гистограмма коэффициентов корреляции f-значений, вычисленных для каждого остатка внутри группы данных для С-класса. Сведения, подтверждающие возможность осуществления изобретения Изобретение основано, по крайней мере частично, на разработке стабилизированных связывающих мишень молекул, включающих стабилизированные молекулы scFv и способы приготовления таких стабилизированных связывающих молекул. Кроме того, настоящее изобретение относится также к способам конструирования стабильных белков, таких как молекулы антител. Стабилизированные молекулы scFv настоящего изобретения особенно эффективны при создании стабильных полиспецифичных, например биспецифичных, молекул. Стабилизированные связывающие молекулы изобретения, например полиспецифичные связывающие молекулы, могут быть стабильно экспрессированы в культуре, подходят для крупномасштабного изготовления и стабильны in vivo. Изобретение основано, по крайней мере частично, на разработке стабилизированных связывающих молекул,состоящих из или включающих стабилизированную молекулу scFv, и на способах получения таких связывающих молекул. Кроме того, настоящее изобретение относится также к способам конструирования стабильных белков и прогнозирования стабильности белков, таких как молекулы антител. Перед тем как приступить к более детальному описанию изобретения, далее для удобства приводится значение некоторых терминов.I. Определения. Термин "молекула scFv" здесь включает связывающие молекулы, состоящие из одного вариабельного домена легкой цепи (VL) или его фрагмента и одного вариабельного домена тяжелой цепи (VH) или его фрагмента, где каждый вариабельный домен или его фрагмент получают из одних и тех же или различных антител. Молекула scFv предпочтительно включает линкер scFv, расположенный между VH доменом и VL доменом. Молекула scFv известна в уровне техники и описана, например, в патенте США 5892019 (Но et al.), 1989. Gene 77:51; Bird et al. 1988 Science 242:423; Pantoliano et al. 1991. Biochemistry 30:10117; Milenic et al. 1991. Cancer Research 51:6363; Takkinen et al. 1991. Protein Engineering 4:837. Термин "линкер scFv" здесь означает объект, расположенный между доменами VL и VH молекулыscFv. Предпочтительно линкеры scFv поддерживают молекулу scFv в антигенсвязывающей конформации. В соответствии с одним вариантом осуществления линкер scFv включает или состоит из пептидного линкера scFv. В соответствии с некоторыми аспектами пептидный линкер scFv включает или состоит из связывающего пептида Gly-Ser. В соответствии с другими аспектами линкер scFv включает дисульфидную связь. Термин "связывающий пептид Gly-Ser" означает пептид, состоящий из остатков глицина и серина. Пример связывающего пептида Gly-Ser включает аминокислотную последовательность (Gly4Ser)n. В соответствии с одним вариантом осуществления n=1. В соответствии с одним вариантом осуществленияn=2. В соответствии с другим вариантом осуществления n=3. В соответствии с предпочтительным вариантом осуществления n=4, т.е. (Gly4Ser)4. В соответствии с другим вариантом осуществления n=5. В соответствии с еще одним вариантом осуществления n=6. Еще один пример связывающего пептида Gly-Ser включает аминокислотную последовательностьSer(Gly4Ser)n. В соответствии с одним вариантом осуществления n=1. В соответствии с одним вариантом осуществления n=2. В соответствии с предпочтительным вариантом осуществления n=3. В соответствии с другим вариантом осуществления n=4. В соответствии с другим вариантом осуществления n=5. В соответствии с еще одним вариантом осуществления n=6. Термин "дисульфидный мостик" в настоящем изобретении означает ковалентную связь, образованную двумя атомами серы. Аминокислота цистеин включает тиоловую группу, которая может сформировать дисульфидную связь или мостик со второй тиольной группой. Термин "обычная молекула scFv" здесь означает молекулу scFv, которая не является стабилизированной молекулой scFv. Например, в типичной обычной молекуле отсутствуют стабилизирующие мутации, и включается домен VH и VL, связанные линкером (G4S)3."Стабилизированная молекула scFv" изобретения - молекула scFv, включающая по меньшей мере одно изменение по сравнению с обычной молекулой scFv, которое приводит к стабилизации молекулыscFv. Здесь термин "стабилизирующая мутация" включает мутацию, придающую улучшенную белковую стабильность (например, термическую стабильность) молекуле scFv и/или более крупному белку, включающему указанную молекулу scFv. В соответствии с одним вариантом осуществления стабилизирующая мутация включает замещение дестабилизирующей аминокислоты другой аминокислотой, которая сообщает белку улучшенную стабильность (здесь "стабилизирующая аминокислота"). В соответствии с одним вариантом осуществления длина линкера scFv в стабилизирующей мутации оптимизирована. В соответствии с одним вариантом осуществления стабилизированная молекула scFv изобретения включает одну или более аминокислотных замен. Например, в соответствии с одним вариантом осуществления стабилизирующая мутация включает замену по меньшей мере одного аминокислотного остатка, приводящую к повышению стабильности области контакта VH и VL молекулы scFv. В соответствии с одним вариантом осуществления аминокислота находится внутри области контакта В соответствии с другим вариантом осуществления аминокислота поддерживает взаимодействие между VH и VL. В соответствии с другим вариантом осуществления стабилизирующая мутация включает замену по меньшей мере одного аминокислотного остатка в домене VH или домене VL, коварьирующими с двумя или более аминокислотами области контакта между доменами VH и VL. В соответствии с другим вариантом осуществления при стабилизирующей мутации вводится по меньшей мере один остаток цистеина (т.е. он встраивается в один или более домен VH или VL), так что домены VH и VL связаны по меньшей мере одним дисульфидным мостиком между аминокислотами домена VH и аминокислотами домена VL. В соответствии с некоторыми предпочтительными аспектами стабилизированная молекула scFv изобретения характеризуется оптимизированной длиной линкера scFv, а также у нее замещен по меньшей мере один аминокислотный остаток и/или домены VH и VL связаны дисульфидным мостиком между аминокислотой домена VH и аминокислотой домена VL. В соответствии с одним вариантом осуществления в молекуле scFv можно сделать более одной описанной здесь стабилизирующей мутации. В соответствии с одним вариантом осуществления одна или более стабилизирующая мутация, сделанная в молекуле scFv, одновременно повышает термическую стабильность доменов VH и VL молекулыscFv по сравнению с обычной молекулой scFv. Предпочтительно, если популяция одной или более стабилизированных молекул scFv изобретения экспрессируется как популяция мономерных, стабильных белков. В соответствии с одним вариантом осуществления в агрегированной форме присутствует не более 10% молекул. В соответствии с одним вариантом осуществления стабилизированная молекула scFv популяции может содержать ту же стабилизирующую мутацию или комбинацию стабилизирующих мутаций. В соответствии с другими аспектами индивидуальные стабилизированные молекулы scFv популяции содержат различные стабилизирующие мутации. Стабилизированная молекула scFv может быть использована одна для связывания целевых молекул, а может быть связана с другим полипептидом с образованием стабилизирующей связывающей молекулы, включающей стабилизированную молекулу scFv. Например, связывающая молекула по изобретению может содержать молекулу scFv, связанную с второй молекулой scFv или не с молекулой scFv,например с молекулой, которая нарушает специфичность связывания, такой как антитело.- 19015992 Термин "стабильность белка" в настоящем изобретении означает признанную в уровне техники характеристику сохранения одного или более физических свойств белка при изменении условий окружающей среды (например, на повышение или снижение температуры). В соответствии с одним вариантом осуществления физическое свойство представляет собой поддержание ковалентной структуры белка (например, отсутствие протеолитического расщепления, нежелательного окисления или деаминирования). В соответствии с другим вариантом осуществления физическое свойство представляет собой нахождение белка в правильно уложенном состоянии (например, отсутствии растворимых или нерастворимых агрегатов или преципитатов). В соответствии с одним вариантом осуществления стабильность белка измеряют, анализируя биофизическое свойство белка, например термическую стабильность, профиль развертывания как функцию от рН, стабильное удаление гликозилирования, растворимость, биохимическую функцию (например, способность связываться с белком (например, лигандом, рецептором, антигеном и т.д.) или химической группой и т.д.) и/или их комбинации. В соответствии с другим вариантом осуществления биохимическая функция определяется по сродству связывания при взаимодействии. В соответствии с одним вариантом осуществления характеристикой стабильности белка является его термическая стабильность, т.е. сопротивляемость температурным изменениям. Стабильность можно измерять способами, известными в уровне техники и/или описанными там. Домены VL и VH молекулы scFv получают из одной или более молекул антитела. Специалист понимает также, что вариабельные области молекул scFv изобретения можно модифицировать так, что их аминокислотная последовательность будет отличаться от молекулы антитела, из которой они были взяты. Например, в соответствии с одним вариантом осуществления, можно произвести нуклеотидные или аминокислотные замены, ведущие к консервативным замещениям или изменениям в аминокислотных остатках (например, в аминокислотных остатках CDR и/или каркаса). Альтернативно или в дополнение,в аминокислотных остатках CDR можно произвести мутации с целью оптимизации связывания антигенов, используя при этом известные технологии. Связывающие молекулы изобретения сохраняют способность связываться с антигеном. Термин "производный от" ("полученный из") указанного белка означает происхождение полипептида. В соответствии с одним вариантом осуществления полипептидная или аминокислотная последовательность, производная от конкретного исходного полипептида, представляет собой последовательность вариабельной области (например, VH или VL) или родственную им последовательность (например, каркасный область или CDR). В соответствии с одним вариантом осуществления аминокислотная последовательность, производная от конкретного исходного полипептида, не является сплошной. Например, в соответствии с одним вариантом осуществления, из исходного антитела можно получить одну, две, три,четыре, пять или шесть областей CDR. В соответствии с одним вариантом осуществления полипептидная или аминокислотная последовательность, производная от конкретного исходного полипептида или аминокислотной последовательности, включает аминокислотную последовательность, практически идентичную исходной последовательности или ее фрагменту, где фрагмент включает по меньшей мере 3-5 аминокислот, 5-10 аминокислот, по меньшей мере 10-20 аминокислот, по меньшей мере 20-30 аминокислот или по меньшей мере 30-50 аминокислот, или которую специалист может иным способом идентифицировать как происходящую от исходной последовательности. Выделенную молекулу нуклеиновой кислоты, кодирующую стабилизированную молекулу scFv или ее фрагмент, можно создать, вводя одну или несколько нуклеотидных замен, вставок или делеций в нуклеотидную последовательность обычной молекулы scFv или иммуноглобулина, из которого она была получена, так что в кодируемом белке образуется одна или более замен, вставок или делеций. Мутации можно вводить стандартными технологиями, такими как сайт-направленный мутагенез и ПЦРопосредованный мутагенез. В соответствии с одним вариантом осуществления консервативные аминокислотные замены производят в одном или более остатках несущественных аминокислот. "Консервативной аминокислотной заменой" называется такая замена, при которой аминокислотный остаток заменяется на другой аминокислотный остаток с такой же боковой цепью. В уровне техники определены семейства аминокислотных остатков с одинаковыми боковыми цепями, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-ветвящиеся боковые цепи (например, треонин, валин,изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, аминокислотный остаток в полипептиде иммуноглобулина можно заменить другим аминокислотным остатком из того же семейства боковых цепей. В соответствии с другим вариантом осуществления строку аминокислот можно заменить структурно похожей строкой, отличающейся только порядком и/или композицией членов семейства боковых цепей. В соответствии с другим вариантом осуществления мутацию вводят для того, чтобы ввести по меньшей мере одну молекулу цистеина в домены VH иVL и, таким образом, ввести дисульфидную связь в молекулу scFv. В соответствии с другим вариантом осуществления аминокислоту из обычной молекулы scFv можно заместить на аминокислоту с такими же физическими (например, пространственными) или функциональными свойствами. Предпочтительно,- 20015992 чтобы аминокислотные замены в обычной молекуле scFv были бы совместимы с целостностью области контакта VL/VH, конформациями CDR и упаковкой VH и/или VL. Альтернативно, в соответствии с другим вариантом осуществления мутации можно вводить случайным образом по всей или части кодирующей последовательности иммуноглобулина. Стабилизированная молекула scFv изобретения или полипептиды, включающие стабилизированную молекулу scFv, представляют собой связывающие молекулы, т.е. они связываются с целевой интересующей молекулой, например с антигеном. Когда стабилизированная молекула scFv изобретения сплавляется с другой молекулой, вторая молекула может также вносить дополнительную специфичность связывания в химерный белок. Связывающие молекулы изобретения состоят из молекулы scFv (например,доменов VH и VL, соединенных линкером scFv) или содержат стабилизированную молекулу scFv изобретения. В соответствии с одним вариантом осуществления связывающие молекулы изобретения моновалентны, т.е. содержат один целевой сайт связывания (например, это имеет место в случае молекулыscFv). В соответствии с одним вариантом осуществления связывающие молекулы изобретения поливалентны, т.е. содержат более одного целевого сайта связывания. В соответствии с другим вариантом осуществления связывающие молекулы содержат по меньшей мере два сайта связывания. В соответствии с другим вариантом осуществления связывающие молекулы содержат два сайта связывания. В соответствии с одним вариантом осуществления связывающие молекулы содержат три сайта связывания. В соответствии с другим вариантом осуществления связывающие молекулы содержат четыре сайта связывания. В соответствии с другим вариантом осуществления связывающие молекулы содержат более четырех сайтов связывания. В соответствии с одним вариантом осуществления связывающие молекулы изобретения представляют собой мономеры. В соответствии с другим вариантом осуществления связывающие молекулы изобретения представляют собой полимеры. Например, в соответствии с одним вариантом осуществления связывающие молекулы изобретения представляют собой димеры. В соответствии с одним вариантом осуществления димеры изобретения представляют собой гомодимеры, включающие две идентичные мономерные субъединицы. В соответствии с другим вариантом осуществления димеры изобретения представляют собой гетеродимеры, включающие две не идентичные мономерные субъединицы. Субъединицы димера могут содержать одну или более полипептидных цепей. Например, в соответствии с одним вариантом осуществления димеры содержат по меньшей мере две полипептидные цепи. В соответствии с одним вариантом осуществления димеры содержат две полипептидные цепочки. В соответствии с другим вариантом осуществления димеры содержат четыре полипептидные цепи (например, как в случае молекул антител). Термин "валентность" здесь означает количество потенциальных мишеньсвязывающих сайтов в полипептиде. Каждый такой сайт специфически связывает одну молекулу мишени или специфический сайт на молекуле мишени. Если полипептид включает более одного сайта связывания мишени, то каждый такой сайт может специфично связываться с одной и той же или с различными молекулами (например,может связываться с различными молекулами, например, различными антигенами или различными эпитопами одной молекулы). Термин "специфичность" означает способность специфично связываться (например, иммунореагировать) с данной мишенью. Полипептид может быть моноспецифичным и содержать один или более сайтов связывания, которые специфично связываются с мишенью, или полипептид может быть полиспецифичным (например, биспецифичным или триспецифичным) и содержать два или более сайтов связывания, которые специфично связываются с одной или различными мишенями. Специфическое связывание может быть привнесено стабизированной молекулой scFv изобретения и/или группой не-scFv, с которой соединена молекула scFv изобретения. В соответствии с одним вариантом осуществления связывающая молекула по изобретению полиспецифична. Например, в соответствии с одним вариантом осуществления полиспецифичная связывающая молекула по изобретению представляет собой биспецифичную молекулу (например, антитело, минитело, антитело с удаленным доменом или химерный белок, однодоменное антитело (например, верблюда,акулы, человека), включающее по меньшей мере одну стабилизированную молекулу scFv), обладающую специфичностью связывания по меньшей мере с двумя мишенями, например более чем с одной молекулой мишени или более чем с одним эпитопом одной молекулы мишени. В соответствии с одним вариантом осуществления полиспецифичная молекула включает по меньшей мере один сайт связывания, специфичный для молекулы с функцией восстановления или элиминирования или для молекулы-мишени в клетке. В соответствии с другим вариантом осуществления полиспецифичная молекула включает по меньшей мере один сайт связывания, специфичный для молекулы с функцией восстановления или элиминирования, и по меньшей мере один сайт связывания, специфичный для лекарства. В соответствии с еще одним вариантом осуществления полиспецифичная молекула включает по меньшей мере один сайт связывания, специфичный для молекулы с функцией восстановления или элиминирования, и по меньшей мере один сайт связывания, специфичный для пролекарства. В соответствии с одним вариантом осуществления полиспецифичная молекула включает одну спе- 21015992 цифичность для растворимых молекул и одну специфичность для молекул клеточной поверхности. В соответствии с другим вариантом осуществления полиспецифичная молекула включает две специфичности связывания для двух мишеней в одной или более растворимых молекулах. В соответствии с другим вариантом осуществления полиспецифичная молекула включает две специфичности связывания для двух мишеней в одной или более молекулах клеточной поверхности (которые могут присутствовать в одной или более клетках). В соответствии с одним вариантом осуществления связывающие молекулы содержат по меньшей мере один сайт связывания мишени, специфичный для молекулы, опосредующей биологические эффекты (например, модулирующей активацию клеток (например, путем связывания с рецептором клеточной поверхности, что приводит к передаче или ингибированию активирующего или ингибирующего сигнала), что приводит к смерти клетки (например, в результате индуцированного клеточного сигнала, комплементарной фиксации или экспозиции дополнительной функции на связывающейся молекуле), или модулирует заболевание или расстройство у субъекта (например, опосредуя или стимулируя уничтожение клеток, стимулируя лизис фибриновых тромбов или их образование, либо модулируя количество биодоступного вещества (например, усиливая или уменьшая количество у субъекта такого лиганда, какTNF. В соответствии с другим вариантом осуществления связывающие молекулы изобретения связываются по меньшей мере с одной мишенью, трансдуцирующей сигнал в клетку, например, путем связывания с рецептором клеточной поверхности, таким как рецептор семейства TNF. Выражение "трансдуцирует сигнал" означает, что, связываясь с клеткой, связывающая молекула преобразует внеклеточное влияние на рецептор клеточной поверхности в клеточный ответ, например, модулируя путь трансдукции сигнала. В соответствии с одним вариантом осуществления связывающие молекулы связываются по меньшей мере с одной мишенью, специфичной для молекулы с функцией восстановления или элиминирования, например с антигеном клеточной поверхности или с растворимым антигеном. В соответствии с одним вариантом осуществления связывание связывающей молекулы с мишенью приводит к восстановлению или элиминированию мишени, например, из ткани или из кровотока. В соответствии с другим вариантом осуществления связывающие молекулы содержат по меньшей мере один сайт связывания, специфичный для молекулы, которая может быть использована для детекции целевой молекулы (например,для детекции примеси или диагностики состояния или расстройства). В соответствии с еще одним вариантом осуществления связывающая молекула по изобретению включает по меньшей мере один сайт связывания, который нацеливает связанную молекулу в специфичную область организма субъекта (например, в опухолевую клетку или тромб). В соответствии с предпочтительным вариантом осуществления полиспецифичная молекула представляет собой тетравалентное антитело с четырьмя сайтами связывания. Тетравалентная молекула может быть биспецифичной и бивалентной по каждой специфичности. Далее приводится более подробное описание примеров биспецифичных молекул. Предпочтительные связывающие молекулы изобретения содержат аминокислотные последовательности каркаса и константной области, производные от аминокислотных последовательностей человека. Однако связывающиеся полипептиды могут содержать последовательности каркаса и/или константной области производные от других видов млекопитающих. Например, в некоторых применениях могут использоваться связывающие молекулы, включающие последовательности мыши. В соответствии с одним вариантом осуществления в состав молекулы связывания может входить выделенная у приматов (например, не человека) каркасная область, фрагмент тяжелой цепи и/или концевой участок. В соответствии с одним вариантом осуществления в каркасной области связывающегося полипептида может присутствовать одна или несколько мышиных аминокислот, например, каркасная аминокислотная последовательность человека или человекообразной обезьяны может содержать одну или более аминокислотных обратный мутаций, в которых присутствуют соответствующие остатки мышиных аминокислот, и/или содержать одну или более мутаций в различных аминокислотных остатках, не обнаруживаемых в исходных мышиных антителах. Предпочтительные связывающиеся молекулы изобретения менее иммуногенны, чем мышиные антитела."Слитый" белок, или химерный белок, включает первую аминокислотную последовательность, связанную со второй аминокислотной последовательностью, причем эти последовательности в природе друг с другом не связаны. Они, обычно, могут существовать в составе различных белков, которые затем можно соединить в составе химерного белка, или они могут существовать в составе одного белка, но в химерном белке их взаимное расположение будет другим. Химерный белок можно приготовить, например,в ходе химического синтеза или путем создания и трансляции полинуклеотида, кодирующего требуемые пептидные участки,расположенные требуемым образом. Термин "гетерологичный" применяется к полинуклеотиду или полипептиду, он означает, что полинуклеотид или полипептид является производным от объекта, отличающегося по генотипу от объекта, с которым производится сравнение. Например, гетерологичный полинуклеотид или антиген можно получить из различных видов животных, различных клеточных типов индивидуума или из клеток одного или- 22015992 различных типов различных индивидуумов. Термин "лигандсвязывающий домен" или "лигандсвязывающий фрагмент" здесь означает любой нативный рецептор (например, рецептор клеточной поверхности) или любую область или производное рецептора, сохраняющие, по меньшей мере, качественную способность к связыванию лиганда и предпочтительно биологическую активность соответствующего нативного рецептора. Термин "рецепторсвязывающий домен" или "рецепторсвязывающий фрагмент" здесь означает любой нативный лиганд или любую область или производное лиганда, сохраняющие, по меньшей мере,качественную способность к связыванию с рецептором и предпочтительно биологическую активность соответствующего нативного лиганда. В соответствии с одним вариантом осуществления связывающие молекулы изобретения представляют собой молекулы стабилизированных антител или иммуноглобулинов, например, природные молекулы антител или иммуноглобулинов (или их антигенсвязывающих фрагментов) или генетически сконструированные молекул антител, связывающие антиген тем же способом, что и молекулы антител, и включающих молекулу scFv изобретения. Термин "иммуноглобулин" в настоящем изобретении включает полипептид с комбинацией двух тяжелых и двух легких цепей, независимо от того, обладает ли он какой-либо специфичной иммунореактивностью. "Антитела" - такие сборки, которые проявляют значимую специфичную иммунореактивность по отношению к интересующему антигену (например, к антигену, связанному с опухолями). Антитела и иммуноглобулины содержат легкие и тяжелые цепи с или без ковалентных связей между ними. Основные структуры иммуноглобулинов в системах позвоночных сравнительно хорошо изучены. Как более подробно будет рассматриваться ниже, общий термин "иммуноглобулин" включает пять различных классов, которые можно различить биохимически. Все пять классов антител входят в область действия настоящего изобретения, но следующее ниже обсуждение в основном относится к классу IgG иммуноглобулинов. Молекула IgG иммуноглобулина содержат две идентичные легкие полипептидные цепи с молекулярным весом приблизительно 23000 Да и две идентичные тяжелые цепи весом 5300070000. Четыре цепи соединяются дисульфидными мостиками в "Y" конфигурации, причем легкие цепи обхватывают тяжелые цепи, начиная от "рта" буквы "Y" и продолжаясь в вариабельную область. Легкие и тяжелые цепи содержат области структурной и функциональной гомологии. Термины"константный" и "вариабельный" используются функционально. В этом отношении необходимо понимать, что вариабельный домен как легких (VL), так и тяжелых (VH) фрагментов цепи определяет узнавание и специфичность антигена. Наоборот, константные домены легкой (CL) и тяжелой цепи (CH1, CH3 или CH3) несут в себе важные биологические свойства, такие как секреция, трансплацентарная подвижность, связывание рецептора Fc, комплементарное связывание и подобные им. Согласно действующему соглашению номера константных областей доменов возрастают по мере их удаления от антигенсвязывающего сайта или N-конца антитела. N-конец представляет собой вариабельную область, а С-конец константную область, домены CH3 и CL, фактически, содержат карбоксиконцы тяжелой и легкой цепи соответственно. Стабилизирующие мутации в молекуле scFv могут быть в составе как аминокислотCDR, так и каркасных областей вариабельных тяжелых и/или легких цепей scFv. Термин "аминокислотные остатки вариабельной области CDR" включает аминокислоты в CDR (области, определяющие комплементарность), обнаруженные способами, основанными на структуре или последовательности. Термин"CDR" или "область, определяющая комплементарность" здесь означает несплошные узнающие антиген сайты из вариабельной области полипептидов тяжелых и легких цепей. Эти конкретные области были описаны в работах Kabat et al., J. Biol. Chem. 252, 6609-6616 (1977) и Kabat et al., Sequences of protein ofMol. Biol. 262:732-745 (1996), причем определения включают наложения или подмножества аминокислотных остатков, наблюдаемые при их сравнении друг с другом. Для сравнения далее приводятся окружающие CDR аминокислотные остатки, определенные в каждой из приведенных выше ссылок. Предпочтительно определять термин CDR по способу Кэбата (Kabat), основанному на сравнении последовательностей. Нумерация остатков соответствует номенклатуре Kabat et al., supra. Нумерация остатков соответствует номенклатуре Chothia et al., supra. 3 Нумерация остатков соответствует номенклатуре MacCallum et al., supra. Термин "аминокислотные остатки каркаса (framework, FM) вариабельной области" означает аминокислотные остатки каркасной области цепи Ig. Термин "каркасная область" или "область FR" здесь включает аминокислотные остатки, входящие в состав вариабельной области, но не являющиеся частьюCDR (например, в соответствии с определением CDR по Кэбату). Таким образом, каркас вариабельной области включает от 100 до 200 аминокислотных остатков, но включает только аминокислоты, не входящие в состав CDR. В качестве конкретного примера вариабельной области тяжелой цепи и CDR в соответствии с определением по Кэбату можно сказать, что каркасная область 1 соответствует домену вариабельной области, охватывающему аминокислотные остатки 1-30; каркасная область 2 соответствует домену вариабельной области, охватывающему аминокислотные остатки 36-49; каркасная область 3 соответствует домену вариабельной области, охватывающему аминокислотные остатки 66-94, и каркасная область 4 соответствует домену вариабельной области, охватывающему аминокислотные остатки от 103 до конца вариабельной области. Каркасные области легкой цепи распределены по CDR вариабельных областей легкой цепи аналогичным образом. Точно так же на основании определений CDR, сделанных в работах Chothia et al. или McCallum et al., можно распределить границы каркасных областей по соответствующим концам CDR, как описано выше. В соответствии с предпочтительными аспектами областиCDR определяются по Кэбату. В природных антителах шесть областей CDR в каждом мономерном антителе представляют собой короткие несмежные последовательности аминокислот, специфично так расположенные, чтобы сформировать антигенсвязывающий сайт в трехмерной конфигурации антитела в водной среде. Оставшаяся часть тяжелых и легких цепей вариабельных доменов демонстрирует меньше межмолекулярной вариабельности в своей аминокислотной последовательности и потому называется каркасными областями. В основном каркасные области находятся в конфигурации -листа, a CDR образует петли, которые соединяют, а в некоторых случаях формируют часть этой структуры. Таким образом, эти каркасные области формируют структуру (каркас, scaffold), обеспечивающую правильную ориентацию шести областей CDR путем межцепочечных нековалентных взаимодействий. Антигенсвязывающий сайт, сформированный правильно расположенными CDR, определяет поверхностную комплементарность эпитопу иммунореактивного антигена. Эта комплементарная поверхность стимулирует нековалентное связывание антитела с иммунореактивным эпитопом антигена. Специалист легко может идентифицировать положения областейCDR. Как уже упоминалось, структура субъединиц и трехмерная конфигурация константных областей различных классов иммуноглобулинов хорошо известны. Здесь термин "VH домен" включает аминоконцевой вариабельный домен тяжелой цепи иммуноглобулина. Термин "VL домен" включает аминоконцевой вариабельный домен легкой цепи иммуноглобулина. Термин "фрагмент" означает часть или фрагмент полипептида (например, антитела или его цепи),включающую меньше аминокислотных остатков, чем интактный или полный полипептид. Термин "антигенсвязывающий фрагмент" означает полипептидный фрагмент иммуноглобулина или антитела, которое связывает антиген или конкурирует с интактным антителом (т.е. с интактным антителом, из которого они были получены) за связывание антигена (т.е. специфичное связывание). Здесь термин "фрагмент" молекулы антитела включает антигенсвязывающие фрагменты антител, например легкую цепь антитела(VL), тяжелую цепь антитела (VH), одноцепочечное антитело (scFv), фрагмент F(ab')2, фрагмент Fab,фрагмент Fd, фрагмент Fv, однодоменный фрагмент антитела (DAb). Фрагменты можно получить, например, химической или ферментативной обработкой интактного или полного антитела или его цепи, а также рекомбинантными способами. 2- 24015992 Термин "сайт связывания" здесь означает область полипептида, ответственную за селективное связывание с интересующей молекулой мишени (например, с антигеном, лигандом, рецептором, субстратом или ингибитором). Домены связывания содержат по меньшей мере один сайт связывания мишени. Примеры доменов связывания включают вариабельный домен антитела, рецепторсвязывающий домен лиганда, лигандсвязывающий домен рецептора или ферментативный домен. Связывающие молекулы изобретения могут быть изготовлены способами, известными в уровне техники. В соответствии с одним вариантом осуществления полипептиды изобретения "производят рекомбинантно", т.е. с использованием технологии рекомбинантной ДНК. Примеры технологий получения таких молекул подробнее рассматриваются ниже. В соответствии с одним вариантом осуществления связывающая молекула по изобретению представляет собой природное антитело, с которым сплавляется стабилизированная молекула scFv. В соответствии с одним вариантом осуществления связывающая молекула по изобретению представляет собой модифицированное антитело, с которым сплавляется стабилизированная молекула scFv. Термин "модифицированное антитело" включает здесь синтетические формы антител, измененные таким способом,которого нет в природе. В соответствии с другим вариантом осуществления связывающая молекула по изобретению представляет собой химерный белок, включающий по меньшей мере одну молекулу scFv. В соответствии с предпочтительными аспектами полипептид изобретения не индуцирует вредных иммунных ответов у людей. В соответствии с одним вариантом осуществления связывающая молекула по изобретению включает константную область, например константную область тяжелой цепи. В соответствии с одним вариантом осуществления такая константная область модифицирована по сравнению с константной областью дикого типа. Это означает, что описанные здесь полипептиды изобретения могут содержать изменения или модификации в одной или более из трех тяжелых цепей константных областей доменов (CH1, CH3 или CH3) и/или в легких цепях константных областей доменов (CL). Примеры модификаций включают замены, делеции или вставки одной или более аминокислот в одном или более доменах. Такие изменения можно включать для оптимизации эффекторной функции, времени полужизни и т.д. Термин "злокачественность" означает здесь недоброкачественную опухоль или рак. Термин "рак" включает злокачественность, характеризующуюся нарушением регуляции или неконтролируемым клеточным ростом. Примеры рака включают карциномы, саркомы, лейкемии и лимфомы. Термин "рак" включает первичные злокачественные опухоли (например, в которых клетки еще не успели мигрировать от первоначальной опухоли к другим местам организма) и вторичные злокачественные опухоли (например, возникшие из метастаз, в результате миграции опухолевых клеток от первоначальной опухоли к другим участкам организма). Термин "сконструированный" означает результат манипулирования нуклеотидными или полипептидными молекулами синтетическими средствами (например, рекомбинантными технологиями, синтезом пептидов in vitro, ферментативным или химических сопряжением пептидов или комбинацией описанных способов). Предпочтительно, если связывающие молекулы изобретения приготовлены с помощью таких способов. Термины "связанный", "слитый" или "сплавленный" используются здесь попеременно, заменяя друг друга. Они означают соединение двух элементов или компонентов любыми средствами, включая химическое конъюгирование или рекомбинантные средства. Предпочтительно, если полипептиды гибридизованы генетически, т.е. с использованием рекомбинантных технологий ДНК. "Гибридизация в рамке" означает объединение двух или более открытых рамок считывания (OPC, open reading frames (ORF с образованием сплошной более длинной ОРС способом, сохраняющим корректную рамку считывания первоначального ОРС. Так, полученный химерный белок представляет собой один белок, включающий два или более сегментов, соответствующих полипептидам, кодируемым первоначальной ОРС (эти сегменты,обычно, таким способом в природе не соединяются). Хотя рамка считывания при этом будет сплошной на протяжении гибридизованных сегментов, сами сегменты могут быть физически или пространственно разделены, например, линкерной последовательностью scFv в рамке. В контексте полипептидов "линейная последовательность" или "последовательность" представляют собой порядок аминокислот в полипептиде в направлении к амино- или С-концу, причем соседние остатки в этой последовательности в первичной структуре белка следуют подряд друг за другом. Фраза "субъект, для которого лечение связывающей молекулой по изобретению может оказаться эффективным" включает субъекты, например млекопитающих, которые получают пользу от введения связывающей молекулы, используемой, например, для детекции антигена, распознаваемого связывающей молекулой (например, в диагностической процедуре), и/или от лечения связывающей молекулой для уменьшения или уничтожения мишени, распознаваемой связывающей молекулой. Например, в соответствии с одним вариантом осуществления субъект может получить пользу от уменьшения количества или элиминирования растворимых или нерастворимых молекул из крови или сыворотки (например, выведение оттуда токсина или патогена) или от уменьшения количества или элиминирования популяции клеток, экспрессирующих мишень (например, опухолевых клеток). Как более подробно описано ниже, связывающая молекула может использоваться в неконъюгированной форме или быть конъюгированной,- 25015992 например, с детектируемой группой, лекарством, пролекарством или изотопом. Термин "TNF-рецептор" или "член семейства TNF-рецепторов" относится к любому рецептору,принадлежащему надсемейству рецепторов фактора некроза опухолей (Tumor Necrosis Factor ("TNF". Члены надсемейства TNF-рецепторов (Members of the TNF Receptor Superfamily ("TNFRSF" характеризуются внеклеточным участком, включающим два или более обогащенных цистеином домена (длиной около 40 аминокислот каждый), собранных в виде цистеиновых клубков (см. Dempsey et al., CytokineGrowth Factor Rev. (2003). 14(3-4): 193-209). После связывания с родственными TNF-лигандами, рецепторы TNF трансдуцируют сигналы, прямо или косвенно взаимодействуя с цитоплазматическими адапторными белками, называемыми TRAF (TNF receptor associate factors, факторы, ассоциированные с рецепторами TNF). TRAF могут индуцировать активацию нескольких киназных каскадов, которые окончательно ведут к активации путей трансдукции сигнала, таких как NF-KappaB, JNK, ERK, р 38 и PI3K, которые, в свою очередь, регулируют клеточные процессы, от иммунной функции и дифференциации тканей до апоптоза. Нуклеотидные и аминокислотные последовательности нескольких членов семейства рецепторовTNF известны в уровне техники и содержат по меньшей мере 29 генов человека: TNFRSF1A (TNFR1,известный также как DR1, CD120a, TNF-R-I p55, TNF-R, TNFRI, TNFAR, TNF-R55, p55TNFR, p55R илиTNFR60, GenBank Gl4507575; см. также US 5395760), TNFRSF1B (CD120b, известный также как р 75,TNF-R, TNF-R-II, TNFR80, TNFR2, TNF-R75, TNFBR или p75TNFR; GenBank GI4507577), TNFRSF3(Lymphotoxin Бета Receptor (LTR), известные также как TNFR2-RP, CD18, TNFR-RP, TNFCR, а такжеTNF-R-III; GI4505038 и 20072212), TNFRSF4 (OX40, известный также как АСТ 35, TXGP1L, илиCD134 антиген; GI4507579 и 8926702), TNFRSF5 (CD40, известный также как р 50 или Вр 50; GI4507581 и 23312371), TNFRSF6 (FAS, известный также как FAS-R, DcR-2, DR2, CD95, АРО-1 или АРТ 1; GenBank GI4507583, 23510421, 23510423, 23510425, 23510427, 23510429, 23510431 и 23510434), TNFRSF6B (DcR3, DR3; GenBank GI4507569, 23200021, 23200023, 23200025, 23200027,23200029, 23200031, 23200033, 23200035, 23200037 и 23200039), TNFRSF7 (CD27, известный также как Тр 55 или S152; GenBank GI4507587), TNFRSF8 (CD30, известный также как Ki-1, или D1S166E; GenBank GI4507589 и 23510437), TNFRSF9 (4-1-ВВ, известный также как CD137 или ILA; GI5730095 и 728738), TNFRSF10A (TRAIL-R1, известный также как DR4 или Аро 2; GenBank GI21361086),TNFRSF10B (TRAIL-R2, известный также как DR5, KILLER, TRICK2A или TRICKB; GenBank GI22547116 и 22547119), TNFRSF10C (TRAIL-R3, известный также как DcR1, LIT или TRID; GenBankGI22547121), TNFRSF10D (TRAIL-R4, известный также как DcR2 или TRUNDD), TNFRSF11 А(RANK; GenBank GI4507565; см. патенты США 6562948; 6537763; 6528482; 6479635; 6271349; 6017729), TNFRSF11B (остеопротегерин (OPG), известный также как OCIF или TR1; GI38530116,22547122 и 33878056), TNFRSF12 (Translocating chain-Association Membrane Protein (TRAMP), известный также как DR3, WSL-1, LARD, WSL-LR, DDR3, TR3, APO-3, Fn14, or TWEAKR; GenBank GI7706186;Entry Mediator (HVEM), известный также как ATAR, TR2, LIGHTR или HVEA; GenBank GI23200041,12803895 и 3878821), TNFRSF16 (Low-Affinity Nerve Growth Factor Receptor (LNGFR), рецептор фактора роста нервов низкого сродства, известный также как Neurotrophin Receptor или p75(NTR); GenBank GI128156 и 4505393), TNFRSF17 (ВСМ, известный также как ВСМА; GI23238192), TNFRSF18 (AITR,известный также как GITR; GenBank GI4759246, 23238194 и 23238197), TNFRSF19 (Troy/Trade, известный также как TAJ; GenBank GI23238202 и 23238204), TNFRSF20 (RELT, известный также какFLJ14993; GI21361873 и 23238200), TNFRSF21 (DR6), TNFRSF22 (SOBa, известный также как Tnfrh2 или 2810028K06Rik), а также TNFRSF23 (mSOB, известный также как Tnfrh1). Другие члены семействаTNF-рецепторов включают EDAR1 (рецептор эктодисплазина А, известный также как Downless (DL),ED3, ED5, ED1R, EDA3, EDA1R, EDA-A1R; GenBank GI11641231; патент США 6355782), XEDAR(известный также как EDA-A2R; GenBank GI11140823) и CD39 (GI2135580 и 765256). Термин "TNF-лиганд" или "член семейства TNF-лигандов" означает лиганд, принадлежащий к надсемейству фактора некроза опухолей (TNF). TNF-лиганды связываются с отдельными рецепторами надсемейства TNF-рецепторов и обладают 15-25% гомологией друг с другом (Gaur et al., Biochem.Pharmacol. (2003), 66(8): 1403-8). Нуклеотидные и аминокислотные последовательности некоторых лигандов надсемейства TNF-рецепторов ("TNFSF") хорошо известны в уровне техники и включают по меньшей мере 16 человеческих генов: TNFSF1 (также известный как лимфотоксин- (LTA), TNF илиAPRIL), TNFSF14 (также известный как LIGHT, LTg или HVEM-L; Gl25952144 и 25952147),TNFSF15 (также известный как TL1 или VEGI) или TNFSF16 (также известный как AITRL, TL6, hGITRL или GITRL; GI4827034). Другие члены семейства TNF-лигандов включают EDAR1 и XEDAR лигандGI4505469), NTF5 (GI5453808), BDNF (GI25306267, 25306235, 25306253, 25306257, 25306261,25306264; IFRD1 (GI4504607. Термин "ТМ", называемый также "температура перехода", обозначает температуру, при которой 50% макромолекулы, например связывающей молекулы, становится денатурированной, и считается стандартным параметром при описании термической стабильности белка. Термин "поддерживающий остаток" ("каркасный остаток") означает аминокислотные остатки или их положения, не входящие в состав области контакта (например, области контакта VH/VL), но важные в его обеспечении. Эти аминокислотные остатки не взаимодействуют с остатками области контакта соответствующего домена физически и не присутствуют на поверхности области контакта, но тем не менее они важны для создания правильного структурного контекста остатков области контакта. Например, такие аминокислотные остатки поддерживают взаимодействие между VH и VL. Если два или более аминокислотных положения в последовательности полипептида-кандидата обычно появляются совместно, то говорят, что они коварьируют ("коварьирующие положения остатков" или "ковариантные положения остатков"). Ковариация между двумя или более положениями аминокислотных остатков наблюдается, когда тип аминокислоты в первом положении зависит от типа аминокислоты, расположенной во втором положении. Это означает, что, если одна указанная аминокислота располагается в первом положении последовательности, во втором положении обычно будет располагаться вторая конкретная аминокислота. Термин "укладка Ig" включает домен белка, принадлежащего к иммуноглобулиновому надсемейству. Как хорошо известно, укладка Ig является отличительным признаком этого надсемейства (см., например, Bork, P., Holm, LSander, С. 1994. The Immunoglobulin Fold. J. Mol. Biol. 242, 309-320). Соответствующие структуры для каждого класса укладки Ig приведены на фиг. 100.II. Стабилизированные молекулы scFvs. В соответствии с одним вариантом осуществления связывающая молекула по изобретению представляет собой стабилизированную молекулу scFv. Стабилизированная молекула scFvs изобретения может содержать scFv линкер между доменами VH и VL, где домены VH и VL связаны дисульфидной связью между аминокислотой домена VH и аминокислотой домена VL. В соответствии с другими аспектами стабилизированная молекула scFvs изобретения включает scFv линкер оптимизированной длины и состава. В соответствии с еще одними аспектами стабилизированная молекула scFvs изобретения включает VH или VL домен, включающие по меньшей мере одну стабилизирующую аминокислотную замену (замены). В соответствии с еще одним вариантом осуществления стабилизированная молекула scFv изобретения включает по меньшей мере две указанные стабилизирующие характеристики. Стабилизированные молекулы scFv изобретения обладают улучшеной стабильностью. В соответствии с одним вариантом осуществления популяции стабилизированных молекул scFv изобретения или включающих их полипептидов экспрессируются как мономерные, растворимые белки, не более 10% которых находится в димерной, тетрамерной или агрегированной другим способом форме. В соответствии с другим вариантом осуществления популяции стабилизированных молекул scFv изобретения содержатVH и VL домены с ТМ более 55 С. В соответствии с другим вариантом осуществления популяции стабилизированных молекул scFv изобретения характеризуются Т 50 больше 49 С. В соответствии с другим вариантом осуществления популяции стабилизированных молекул scFv изобретения характеризуются Т 50 больше 40, 41, 42, 43, 44, 45, 46, 47 или 48 С. В соответствии с еще одним вариантом осуществления популяции стабилизированных молекул scFv изобретения характеризуются Т 50 больше 50, 51, 52, 53, 54,55, 56, 57, 58 или 49 С. Молекула scFvs изобретения связывается с интересующей мишенью. Домены VH и VL, из которых получают scFv, могут быть производными от одних и тех же или различных антител. В соответствии с другим вариантом осуществления VH или VL для использования в стабилизированных scFv изобретения могут содержать одну или более областей CDR, связывающихся с интересующей мишенью, а другие домены VH или VL могут быть производными от других антител или быть синтетическими. В соответствии с другим вариантом осуществления связывающая молекула по изобретению включает по меньшей мере один CDR антитела, о котором известно, что оно связывается с интересующей мишенью. В соответствии с предпочтительным вариантом осуществления связывающая молекула по изобретению включает по меньшей мере два CDR данного антитела. В соответствии с другим вариантом осуществления связывающая молекула по изобретению включает по меньшей мере три CDR данного антитела. В соответствии с другим вариантом осуществления связывающая молекула по изобретению включает по мень- 27015992 шей мере четыре CDR данного антитела. В соответствии с другим вариантом осуществления связывающая молекула по изобретению включает по меньшей мере пять CDR данного антитела. В соответствии с другим вариантом осуществления связывающая молекула по изобретению включает по меньшей мере шесть CDR данного антитела. В соответствии с предпочтительным вариантом осуществления связывающая молекула по изобретению включает по меньшей мере один VH домен антитела, о котором известно, что оно связывается с интересующей мишенью. В соответствии с предпочтительным вариантом осуществления связывающая молекула по изобретению включает по меньшей мере один VL домен данного антитела. В соответствии с другим предпочтительным вариантом осуществления связывающая молекула по изобретению включает по меньшей мере один VH домен и один VL домен антитела, о котором известно, что оно связывается с интересующей мишенью. Молекулу scFv можно сконструировать в ориентации VH-линкер-VL или VL-линкер-VH. Стабильность молекул scFv изобретения или включающих их химерных белков можно оценить с точки зрения биофизических свойств (например, термической стабильности) обычной (нестабилизированной) молекулы scFv или связывающей молекулы, включающей обычную молекулу scFv. В соответствии с одним вариантом осуществления связывающая молекула изобретения характеризуется термической стабильностью, большей приблизительно на 0,1, 0,25, 0,5, 0,75, 1, 1,25, 1,5, 1,75, 2, 3, 4, 5, 6,7, 8, 9 или 10 С, чем контрольная связывающая молекула (например, обычная молекула scFv). Стабилизированная молекула scFvs изобретения включает и такие молекулы, которые были идентифицированы с помощью способа изобретения и описаны здесь в разделе III. В соответствии с другими аспектами стабилизированная молекула scFv изобретения включает scFv линкер с оптимизированной длиной и/или аминокислотным составом. Предпочтительные scFv линкеры изобретения улучшают термическую стабильность связывающей молекулы изобретения по меньшей мере приблизительно на 2 или 3 по сравнению с обычной связывающей молекулой. В соответствии с одним вариантом осуществления связывающая молекула по изобретению характеризуется улучшенной на 1 С термической стабильностью по сравнению с обычной связывающей молекулой. В соответствии с другим вариантом осуществления связывающая молекула по изобретению характеризуется улучшенной на 2 С термической стабильностью по сравнению с обычной связывающей молекулой. В соответствии с другим вариантом осуществления связывающая молекула по изобретению характеризуется улучшенной на 4, 5, 6 С термической стабильностью по сравнению с обычной связывающей молекулой. Сравнения можно проводить, например, между молекулой scFv изобретения и молекулами scFv, приготовленными с помощью описанных здесь способов из уровня техники, а также между фрагментами молекул scFvs и fab антитела, из которого были получены scFv VH и VL. Термическую стабильность можно измерить известными в уровне техники способами. Например, в соответствии с одним вариантом осуществления можно измерить ТМ. Способы измерения ТМ и другие способы определения стабильности белков подробнее будут описаны ниже. В соответствии с одним вариантом осуществления scFv линкер состоит из аминокислотной последовательности (Gly4Ser)4 или включает эту последовательность. Другие примеры линкеров включают или состоят из последовательностей (Gly4Ser)3 и (Gly4Ser)5. Длина scFv линкеров изобретения может быть различной. В соответствии с одним вариантом осуществления длина scFv линкера изобретения составляет приблизительно от 5 до 50 аминокислот. В соответствии с другим вариантом осуществления длина scFv линкера изобретения составляет приблизительно от 10 до 40 аминокислот. В соответствии с другим вариантом осуществления длина scFv линкера изобретения составляет приблизительно от 15 до 30 аминокислот. В соответствии с другим вариантом осуществления длина scFv линкера изобретения составляет приблизительно от 17 до 28 аминокислот. В соответствии с другим вариантом осуществления длина scFv линкера изобретения составляет приблизительно от 19 до 26 аминокислот. В соответствии с другим вариантом осуществления длина scFv линкера изобретения составляет приблизительно от 21 до 24 аминокислот.scFv линкеры можно включать в полипептидные последовательности известными способами. Например, в соответствии с одним вариантом осуществления можно использовать ПЦР мутагенез. Сделанные модификации подтвержают анализом последовательности ДНК. Плазмидная ДНК может использоваться для трансформации клеток-хозяев, обеспечивающей стабильную продукцию получаемых полипептидов. В соответствии с некоторыми аспектами стабилизированные молекулы scFv изобретения содержат по меньшей мере одну дисульфидную связь (мостик), соединяющую аминокислоту домена VL и аминокислоту домена VH. Для обеспечения дисульфидной связи необходимо наличие остатков цистеина. Дисульфидные связи могут быть включены в молекулу scFv изобретения, например, чтобы соединить FR4 из VL и FR2 из VH или FR2 из VL и FR4 из VH. Примеры положений для дисульфидной связи включают 43, 44, 45, 46, 47, 103, 104, 105 и 106 из VH и 42, 43, 44, 45, 46, 98, 99, 100 и 101 из VL в соответствии с нумерацией Кэбата. Примеры комбинаций аминокислотных положений, мутировавших на цистеиновые остатки, включают VH44-VL100, VH105-VL43, VH105-VL42, VH44-VL101, VH106-VL43, VH104-VL43, VH44VL99, VH45-VL98, VH46-VL98, VH103-VL43, VH103-VL44 и VH103-VL45. В соответствии с одним вариантом осуществления дисульфидная связь соединяет VH аминокислоту- 28015992 44 и VL аминокислоту 100. Модификации в генах, которые кодируют домены VH и VL, можно сделать, используя технологии,известные в уровне техники, например сайт-направленный мутагенез. В соответствии с одним вариантом осуществления стабилизированная молекула scFv изобретения включает scFv линкер с аминокислотной последовательностью (Gly4Ser)4 между доменами VH и VL, где эти домены связаны дисульфидным мостиком между аминокислотой в положении 44 VH и аминокислотой в положении 100 VL. В соответствии с другими аспектами стабилизированные молекулы scFv изобретения содержат одну или более стабилизирующих мутаций в вариабельном домене (VH или VL) scFv. В соответствии с одним вариантом осуществления стабилизирующая мутация выбрана из следующей группы: а) замена аминокислоты (например, глутамина) в положении Кэбата 3 VL, например, на аланин, серин, валин, аспарагиновую кислоту или глицин; б) замена аминокислоты (например, серина) в положении Кэбата 46 VL, например, на лейцин; в) замена аминокислоты (например, серина) в положении Кэбата 49 VL, например, на тирозин или серин; г) замена аминокислоты (например, серина или валина) в положении Кэбата 50 VL, например, на серин, треонин, аргинин, аспарагиновую кислоту или лизин; д) замена аминокислоты (например, серина) в положении Кэбата 49 и (например, серина) в положении Кэбата 50 VL соответственно на тирозин и серин, тирозин и треонин, тирозин и аргинин, тирозин и глицин, серин и аргинин или серин и лизин; е) замена аминокислоты (например, валина) в положении Кэбата 75 VL, например, на изолейцин; ж) замена аминокислоты (например, пролина) в положении Кэбата 80 VL, например, на серин или глицин; з) замена аминокислоты (например, фенилаланина) в положении Кэбата 83 VL, например, на серин,аланин, глицин или треонин; и) замена аминокислоты (например, глутаминовой кислоты) в положении Кэбата 6 VH, например, на глутамин; к) замена аминокислоты (например, лизина) в положении Кэбата 13 VH, например, на глутамат; л) замена аминокислоты (например, серина) в положении Кэбата 16VH, например, на глутамат или глутамин; м) замена аминокислоты (например, валина) в положении Кэбата 20 VH, например, на изолейцин; н) замена аминокислоты (например, аспарагина) в положении Кэбата 32 VH, например, на серин; о) замена аминокислоты (например, глутамина) в положении Кэбата 43 VH, например, на лизин или аргинин; п) замена аминокислоты (например, метионина) в положении Кэбата 48 VH, например, на изолейцин или глицин; р) замена аминокислоты (например, серина) в положении Кэбата 49 VH, например, на глицин или аланин; с) замена аминокислоты (например, валина) в положении Кэбата 55 VH, например, на глицин; т) замена аминокислоты (например, валина) в положении Кэбата 67 VH, например, на изолейцин или лейцин; и) замена аминокислоты (например, глутаминовой кислоты) в положении Кэбата 72 VH, например,на аспартат или аспарагин; ф) замена аминокислоты (например, фенилаланина) в положении Кэбата 79 VH, например, на серин,валин или тирозин; а также х) замена аминокислоты (например, пролина) в положении Кэбата 101 VH, например, на аспарагиновую кислоту. В соответствии с одним из аспектов стабилизированная молекула scFv изобретения включает две или более стабилизирующих мутаций, описанных в пунктах а)-х) выше. В соответствии с одним из аспектов стабилизированная молекула scFv изобретения включает замену аминокислотного остатка в положении Кэбата 49 VL, например, на тирозин или серин и замену аминокислотного остатка в положении Кэбата 50 VL, например, на треонин, аргинин, аспарагиновую кислоту или лизин. В соответствии с другим вариантом осуществления стабилизированная молекула scFv изобретения включает замену аминокислотного остатка в положении Кэбата 16 VH, например, на глутамат и глутамин и замену аминокислотного остатка в положении Кэбата 46 VL, например, на лизин. В соответствии с другим вариантом осуществления связывающая молекула по изобретению включает замену аминокислотного остатка в положении Кэбата 16 VH, например, на глутамат или глутамин; замену аминокислотного остатка в положении Кэбата 46 VL, например, на лизин и замену аминокислотного остатка в положении Кэбата 55 VH, например, на глицин. В соответствии с другим вариантом осуществления связывающая молекула по изобретению включает замену аминокислотного остатка в положении Кэбата 16 VH, например, на глутамат или глутамин; замену аминокислотного остатка в положении Кэбата 46 VL, например, на лизин; замену аминокислотного остатка в положении Кэбата 55 VH, например, на глицин и замену аминокислотного
МПК / Метки
МПК: A61K 39/395, C07K 16/28, G06F 17/00, C07K 16/24, C07K 16/20, C12P 21/00
Метки: антигенсвязывающая, стабилизированное, использования, вышеназванного, многовалентная, антитела, способы, получения, основе, стабилизированного, антитело, молекула
Код ссылки
<a href="https://eas.patents.su/30-15992-stabilizirovannoe-antitelo-i-mnogovalentnaya-antigensvyazyvayushhaya-molekula-na-ego-osnove-sposoby-polucheniya-i-ispolzovaniya-vyshenazvannogo-stabilizirovannogo-antitela.html" rel="bookmark" title="База патентов Евразийского Союза">Стабилизированное антитело и многовалентная антигенсвязывающая молекула на его основе, способы получения и использования вышеназванного стабилизированного антитела</a>
Предыдущий патент: Закрепленные на матрице пептидомиметики
Следующий патент: Сборная панель для домостроения и способ изготовления такой панели
Случайный патент: Способ и устройство для автоматизированных переговоров между сторонами


































