Стабилизированные фармацевтические композиции, содержащие фезотеродин
Номер патента: 15909
Опубликовано: 30.12.2011
Авторы: Ирнгартингер Майке, Линднер Ханс, Паулус Керстин, Арт Кристоф, Коменда Михаэль, Бикане Фатима, Мика Ханс-Юрген
Формула / Реферат
1. Фармацевтическая композиция, содержащая фезотеродин или его фармацевтически приемлемые соль или сольват и фармацевтически приемлемый стабилизатор, где указанный стабилизатор выбран из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта, декстрозы и их комбинаций.
2. Фармацевтическая композиция по п.1, где указанный стабилизатор представляет собой ксилит, сорбит или полидекстрозу.
3. Фармацевтическая композиция по п.1, где указанный стабилизатор представляет собой ксилит.
4. Фармацевтическая композиция по любому из пп.1-3, где соотношение фезотеродин/стабилизатор составляет от 1:1 до 1:20.
5. Фармацевтическая композиция по любому из пп.1-4, содержащая соль фезотеродина с собственным рН в воде 3-5.
6. Фармацевтическая композиция по п.5, где соль фезотеродина представляет собой соль ди- или трикарбоновой кислоты либо частично гидрогенизированной ди- или трикарбоновой кислоты.
7. Фармацевтическая композиция по любому из пп.1-6, содержащая гидрофумарат фезотеродина.
8. Фармацевтическая композиция по п.7, представленная в стандартной лекарственной форме и характеризующаяся тем, что гидрофумарат фезотеродина присутствует в количестве от 0,5 до 12 мг на единицу дозы.
9. Фармацевтическая композиция по любому из пп.1-8, получаемая способом, включающим по меньшей мере одну стадию гранулирования.
10. Фармацевтическая композиция по п.9, где гранулирование представляет собой влажное гранулирование.
11. Фармацевтическая композиция по п.10, где гранулирование проводят в присутствии воды.
12. Фармацевтическая композиция по любому из пп.1-11, где указанная фармацевтическая композиция дополнительно содержит агент для длительного высвобождения.
13. Фармацевтическая композиция по п.12, где агент для длительного высвобождения представляет собой простой или сложный эфир целлюлозы или их смесь.
14. Фармацевтическая композиция по п.13, где агент для длительного высвобождения представляет собой гидроксипропилметилцеллюлозу.
15. Фармацевтическая композиция по любому из пп.12-14, где агент для длительного высвобождения содержится в количестве 20-80% (мас./мас.), предпочтительно 25-65%, более предпочтительно 30-65% и еще более предпочтительно 35-55% (мас./мас.) от всей композиции.
16. Фармацевтическая композиция по любому из пп.12-15, демонстрирующая кумулятивное высвобождение фезотеродина (в процентах по массе от теоретического количества фезотеродина в композиции) в анализе растворения in vitro в соответствии с Фармакопеей США 711 (USP 711) (в фосфатном буфере, рН 6,8, 37°С, при 75 об/мин) следующим образом:
высвобождение фезотеродина через 1 ч составляет от 5 до 30%, предпочтительно от 6 до 26%;
высвобождение фезотеродина через 2 ч составляет от 15 до 40%, предпочтительно от 18 до 38%;
высвобождение фезотеродина через 4 ч составляет от 35 до 65%, предпочтительно от 36 до 56%;
высвобождение фезотеродина через 16 ч составляет по меньшей мере 75%, предпочтительно по меньшей мере 80%.
17. Фармацевтическая композиция, содержащая:
а) 0,3-5,0% (мас./мас.) гидрофумарата фезотеродина;
б) 5-25% (мас./мас.) сорбита или ксилита;
в) 20-40% (мас./мас.) смеси, содержащей 45-80% (мас./мас.) моногидрата лактозы и 55-20% (мас./мас.) микрокристаллической целлюлозы;
г) 20-65% гидроксипропилметилцеллюлозы;
д) 1-5% (мас./мас.) дибегената глицерина и
е) 1-5% (мас./мас.) талька.
18. Фармацевтическая композиция по п.17, содержащая:
а) 4,0 мг гидрофумарата фезотеродина;
б) 32-40 мг ксилита (со средним размером частиц 0,001-0,30 мм);
в) 15-130 мг MICROCELACÒ 100;
г) 65-75 мг гидроксипропилметилцеллюлозы (НРМС) с номинальной вязкостью 100000 мПа×с при растворении (2 мас.%) в воде;
д) 65-75 мг НРМС с номинальной вязкостью 4000 мПа×с при растворении (2 мас.%) в воде;
е) 8-12 мг дибегената глицерина;
ж) 7-10 мг талька и, возможно,
з) покрытие.
19. Фармацевтическая композиция по п.17, содержащая:
а) 8,0 мг гидрофумарата фезотеродина;
б) 65-80 мг ксилита (со средним размером частиц 0,001-0,30 мм);
в) 70-85 мг MICROCELACÒ 100;
г) 110-130 мг НРМС с номинальной вязкостью 100000 мПа×с при растворении (2 мас.%) в воде;
д) 20-30 мг НРМС с номинальной вязкостью 4000 мПа×с при растворении (2 мас.%) в воде;
е) 8-12 мг дибегената глицерина;
ж) 7-10 мг талька и, возможно,
з) покрытие.
20. Способ лечения пациента, страдающего гиперактивным мочевым пузырем, введением терапевтически эффективного количества фармацевтической композиции по любому из пп.1-19.
21. Способ по п.20, где у пациента есть симптомы, выбранные из группы, состоящей из недержания мочи, неотложного недержания мочи, неотложного позыва к мочеиспусканию и/или повышенной частоты мочеиспускания.
22. Применение вещества, выбранного из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта и декстрозы, для стабилизации фармацевтической композиции, содержащей фезотеродин или его фармацевтически приемлемые соль или сольват.
23. Способ изготовления фармацевтической композиции, включающий смешивание фезотеродина или его фармацевтически приемлемых соли или сольвата со стабилизатором, выбранным из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта, декстрозы и их комбинаций.
24. Способ по п.23, дополнительно включающий стадию гранулирования.
25. Способ по п.24, где гранулирование представляет собой влажное гранулирование.
26. Способ по любому из пп.23-25, включающий
гранулирование фезотеродина или его фармацевтически приемлемых соли или сольвата со стабилизатором, выбранным из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта, декстрозы и их комбинаций, в присутствии воды;
высушивание гранулята;
смешивание высушенных гранулятов по меньшей мере с одним другим эксципиентом с образованием смеси для прессования;
прессование смеси для прессования с образованием желаемой формы и
возможно, нанесение покрытия.
27. Способ изготовления фармацевтической композиции, содержащей фезотеродин или его фармацевтически приемлемые соль или сольват и фармацевтически приемлемый стабилизатор, включающий следующие стадии:
изготовление бинарного гранулята из 1 мас.ч. фезотеродина и 9 мас.ч. полиола, сахара или сахарного спирта;
хранение указанного гранулята в следующих трех условиях:
а) 25°С и относительной влажности 60% (60% r.Н.) в закрытых флаконах в течение 6 недель,
б) 40°С и 75% r.Н. в закрытых флаконах в течение 6 недель,
в) 40°С и 75% r.Н. в открытых флаконах в течение 6 недель;
определение содержания активного метаболита формулы (II)
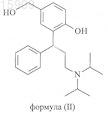
посредством высокоэффективной жидкостной хроматографии (HPLC) способом площадь-процент ("area-% method") и
выбор из указанных полиолов, сахаров или сахарных спиртов стабилизатора, ограничивающего образование активного метаболита формулы (II) во время хранения по меньшей мере в двух из приведенных выше условий следующим образом:
1) 1 мас.% или менее в условиях хранения (а),
2) 2 мас.% или менее в условиях хранения (б),
3) 2 мас.% или менее в условиях хранения (в),
и смешивание фезотеродина или его фармацевтически приемлемых соли или сольвата с выбранным стабилизатором.
28. Способ по п.27, где фармацевтическая композиция содержит соль фезотеродина с собственным рН в воде 3-5.
29. Способ по п.27, где фармацевтическая композиция содержит соль фезотеродина и ди- или трикарбоновой кислоты или частично гидрогенизированной ди- или трикарбоновой кислоты.
30. Способ по п.27, где фармацевтическая композиция содержит гидрофумарат фезотеродина.
Текст
ИСПРАВЛЕННОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Изобретение относится к фармацевтической композиции, содержащей фезотеродин или его фармацевтически приемлемые соль или сольват и стабилизатор, выбранный из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта и декстрозы. Примечание: библиография отражает состояние при переиздании(71)(73) Заявитель и патентовладелец: ШВАРЦ ФАРМА АГ (DE) 015909 Область изобретения Патент в целом относится к фармацевтической композиции, содержащей фезотеродин или его фармацевтически приемлемые соль или сольват, и к способу ее изготовления. Предшествующий уровень техники Фезотеродин представляет собой международное непатентованное название (МНН) соединения формулы (I), которое химически может быть описано как 2-[(1R)-3-(диизопропиламино)-1 фенилпропил]-4-(гидроксиметил)фенилизобутират. Фезотеродин представляет собой инновационное лекарственное средство для лечения гиперактивного мочевого пузыря, недержания мочи и других дисфункций мочевыводящих путей. Он раскрыт, среди прочего, в ЕР 1077912 В 1, относящемся к новым производным 3,3-дифенилпропиламинов. В ЕР 1230209 В 1 раскрыты стабильные соли указанных новых производных 3,3-дифенилпропиламинов, включая гидрофумарат фезотеродина. Гиперактивный мочевой пузырь (ГМП) представляет собой чрезвычайно распространенное расстройство, поражающее 17% взрослого населения в крупных европейских странах. ГМП может возникать в любом возрасте и у лиц любого пола, хотя его частота выше в популяции старшего возраста и в женской популяции. ГМП представляет собой расстройство функции мочевого пузыря, приводящее к симптомам неотложного позыва к мочеиспусканию, с неотложным недержанием мочи или без него, и обычно включает повышенную частоту мочеиспускания и никтурию. Это расстройство обусловлено спастическими сокращениями мышцы-детрузора мочевого пузыря, приводящими к устойчивому высокому давлению в мочевом пузыре и срочной необходимости мочеиспускания. Это может быть обусловлено несколькими причинами, такими как травматическое или токсическое повреждение нервов (например, травмой живота, травмой таза или хирургической операцией на нем, камнями в мочевом пузыре, неблагоприятными эффектами лекарственных средств), неврологическими заболеваниями (например, поражениями спинного мозга, рассеянным склерозом, болезнью Паркинсона, чрезмерным высвобождением нейромедиаторов в мочевом пузыре) или миогенной нестабильностью (например, гипертрофией мочевого пузыря, обусловленной инфравезикальной обструкцией или инфекцией мочевыводящих путей). В некоторых случаях возможно лечение ГМП без фармакотерапии, с применением тренировок,пессариев, имплантатов, терапии на основе биологической обратной связи или поведенческой терапии. Но в большинстве случаев фармакотерапия является лучшим вариантом. Было обнаружено, что антимускариновые агенты особенно эффективны для лечения ГМП. В течение нормального мочеиспускания ацетилхолин, высвобождаемый из постганглионарных парасимпатических нейронов, действует на мускариновые рецепторы гладкой мышцы-детрузора в мочевом пузыре, стимулируя сокращения. Антимускариновые агенты нарушают это действие, уменьшая, таким образом, сокращения детрузора. Тем не менее,несмотря на наличие множества различных антимускариновых лекарственных средств, врачи и пациенты остаются неудовлетворенными существующими на данный момент способами лечения вследствие неблагоприятных явлений и/или недостаточной эффективности. Таким образом, необходимы новые агенты с улучшенной безопасностью и эффективностью для более эффективного лечения ГМП. Фезотеродин известен в данной области техники в отношении его эффективности в лечении недержания мочи. Тем не менее, фезотеродин может демонстрировать значимую деградацию в стрессовых условиях, например, во влажной среде и при повышенной температуре. Полагают, что гидролиз и окисление являются одними из основных механизмов, приводящих к деградации. Таким образом, может быть желательным разработать новые фармацевтические композиции, содержащие фезотеродин, являющиеся более стабильными в отношении деградации в течение продолжительного периода времени даже в стрессовых условиях. С этой целью в настоящее время было неожиданно обнаружено, что некоторые фармацевтические эксципиенты способны значимо замедлять деградацию фезотеродина в стрессовых условиях. Краткое изложение сущности изобретения Согласно настоящему изобретению предложена фармацевтическая композиция, содержащая фезотеродин или его фармацевтически приемлемые соль или сольват и фармацевтически приемлемый стабилизатор, где указанный стабилизатор выбран из группы, состоящей из ксилита, сорбита, полидекстрозы,изомальта, декстрозы и их комбинаций. В частности, предложена фармацевтическая композиция, где указанный стабилизатор представляет собой ксилит, сорбит или полидекстрозу. Ксилит является наиболее предпочтительным. Другой пред-1 015909 почтительный стабилизатор представляет собой сорбит. Другой предпочтительный стабилизатор представляет собой полидекстрозу. В одном аспекте предложена фармацевтическая композиция, где соотношение фезотеродин/стабилизатор составляет от 1:1 до 1:20. В другом аспекте предложена фармацевтическая композиция, содержащая соль фезотеродина с собственным рН в воде 3-5. В частности, предложена фармацевтическая композиция, где соль фезотеродина представляет собой соль ди- или трикарбоновой кислоты либо частично гидрогенизированной ди- или трикарбоновой кислоты. В еще одном аспекте предложена фармацевтическая композиция, содержащая гидрофумарат фезотеродина. В частности, предложена фармацевтическая композиция, представленная в стандартной лекарственной форме и характеризующаяся тем, что гидрофумарат фезотеродина присутствует в количестве от 0,5 до 12 мг на единицу дозы. В другом аспекте предложена фармацевтическая композиция, получаемая способом, включающим по меньшей мере одну стадию гранулирования. В частности, предложена фармацевтическая композиция, где гранулирование представляет собой влажное гранулирование. Более конкретно, предложена фармацевтическая композиция, где гранулирование проводят в присутствии воды. В одном аспекте предложена фармацевтическая композиция, где указанная фармацевтическая композиция дополнительно содержит агент для длительного высвобождения. В частности, предложена фармацевтическая композиция, где агент для длительного высвобождения представляет собой простой или сложный эфир целлюлозы или их смесь. Более конкретно, предложена фармацевтическая композиция, где агент для длительного высвобождения представляет собой гидроксипропилметилцеллюлозу. Предпочтительно, предложена фармацевтическая композиция, где указанный агент для длительного высвобождения содержится в количестве 20-80% (масс/масс), предпочтительно 25-65%, более предпочтительно 30-65% и еще более предпочтительно 35-55% (масс./масс.) от всей композиции. В одном аспекте предложена фармацевтическая композиция, демонстрирующая кумулятивное высвобождение фезотеродина (в процентах по массе от теоретического количества фезотеродина в композиции) в анализе растворения in vitro в соответствии с Фармакопеей США 711 (USP 711) (в фосфатном буфере, рН 6,8, 37 С, при 75 об/мин) следующим образом: высвобождение фезотеродина через 1 ч составляет от 5 до 30%, предпочтительно от 6 до 26%; высвобождение фезотеродина через 2 ч составляет от 15 до 40%, предпочтительно от 18 до 38%; высвобождение фезотеродина через 4 ч составляет от 35 до 65%, предпочтительно от 36 до 56%; высвобождение фезотеродина через 16 ч составляет по меньшей мере 75%, предпочтительно по меньшей мере 80%. Кроме того, согласно настоящему изобретению предложена фармацевтическая композиция, содержащая: а) 0,3-5,0% (мас./мас.) гидрофумарата фезотеродина; б) 5-25% (мас./мас.) сорбита или ксилита; в) 20-40% (мас./мас.) смеси, содержащей 45-80% (мас./мас.) моногидрата лактозы и 55-20%(мас./мас.) микрокристаллической целлюлозы; г) 20-65% гидроксипропилметилцеллюлозы; д) 1-5% (мас./мас.) дибегената глицерина и е) 1-5% (мас./мас.) талька. В одном аспекте указанная выше фармацевтическая композиция содержит: а) 4,0 мг гидрофумарата фезотеродина; б) 32-40 мг ксилита (со средним размером частиц 0,001-0,30 мм); в) 115-130 мг MICROCELAC 100; г) 65-75 мг гидроксипропилметилцеллюлозы (НРМС) с номинальной вязкостью 100000 мПас при растворении (2 мас.%) в воде; д) 65-75 мг НРМС с номинальной вязкостью 4000 мПас при растворении (2 мас.%) в воде; е) 8-12 мг дибегената глицерина; ж) 7-10 мг талька и, возможно,з) покрытие. В другом аспекте указанная выше фармацевтическая композиция содержит: а) 8,0 мг гидрофумарата фезотеродина; б) 65-80 мг ксилита (со средним размером частиц 0,001-0,30 мм); в) 70-85 мг MICROCELAC 100;-2 015909 г) 110-130 мг НРМС с номинальной вязкостью 100000 мПас при растворении (2 мас.%) в воде; д) 20-30 мг НРМС с номинальной вязкостью 4000 мПас при растворении (2 мас.%) в воде; е) 8-12 мг дибегената глицерина; ж) 7-10 мг талька и, возможно,з) покрытие. Кроме того, согласно настоящему изобретению предложен способ лечения пациента, страдающего гиперактивным мочевым пузырем, введением терапевтически эффективного количества фармацевтической композиции по изобретению. В частности, предложен способ лечения, где у пациента есть симптомы, выбранные из группы, состоящей из недержания мочи, неотложного недержания мочи, неотложного позыва к мочеиспусканию и/или повышенной частоты мочеиспускания. Согласно настоящему изобретению также предложено применение вещества, выбранного из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта и декстрозы, для стабилизации фармацевтической композиции, содержащей фезотеродин или его фармацевтически приемлемые соль или сольват. Изобретение также относится к способу изготовления фармацевтической композиции, включающему смешивание фезотеродина или его фармацевтически приемлемых соли или сольвата со стабилизатором, выбранным из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта, декстрозы и их комбинаций. В частности, предложен указанный выше способ, дополнительно включающий стадию гранулирования. Более предпочтительно, гранулирование в указанном выше способе представляет собой влажное гранулирование. В одном аспекте предложен способ, включающий: гранулирование фезотеродина или его фармацевтически приемлемых соли или сольвата со стабилизатором, выбранным из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта, декстрозы и их комбинаций, в присутствии воды; высушивание гранулята; смешивание высушенных гранулятов с по меньшей мере одним другим эксципиентом с образованием смеси для прессования; прессование смеси для прессования с образованием желаемой формы; и,возможно, нанесение покрытия. Согласно настоящему изобретению также предложен способ изготовления фармацевтической композиции, содержащей фезотеродин или его фармацевтически приемлемые соль или сольват и фармацевтически приемлемый стабилизатор, включающий следующие стадии: изготовление бинарного гранулята из 1 части по массе фезотеродина и 9 частей по массе полиола,сахара или сахарного спирта; хранение указанного гранулята в следующих трех условиях: а) 25 С и относительной влажности 60% (60% r.Н.) в закрытых флаконах в течение 6 недель,б) 40 С и 75% r.Н. в закрытых флаконах в течение 6 недель,в) 40 С и 75% r.Н. в открытых флаконах в течение 6 недель; определение содержания активного метаболита формулы (II) посредством высокоэффективной жидкостной хроматографии (HPLC) способом площадь-процент ("area-% method") формула (II) и выбор из указанных полиолов, сахаров или сахарных спиртов стабилизатора, ограничивающего образование активного метаболита формулы (II) во время хранения в по меньшей мере двух из приведенных выше условий следующим образом: 1) 1 мас.% или менее в условиях хранения (а),2) 2 мас.% или менее в условиях хранения (б),3) 2 мас.% или менее в условиях хранения (в),и смешивание фезотеродина или его фармацевтически приемлемых соли или сольвата с выбранным стабилизатором. Предпочтительно, такой стабилизатор выбран из полиолов, сахаров и сахарных спиртов. Наиболее предпочтительно этот стабилизатор представляет собой ксилит, сорбит, полидекстрозу, изомальт, декстрозу или их комбинации, и еще более предпочтительно ксилит, сорбит или полидекстрозу. В одном аспекте предложенного выше способа фармацевтическая композиция содержит соль фезотеродина с собственным рН в воде 3-5. Собственный рН представляет собой значение рН, которое может-3 015909 быть измерено после растворения 1 мас.% соли фезотеродина в воде при 25 С. В другом аспекте предложенного способа фармацевтическая композиция содержит соль фезотеродина и ди- или трикарбоновой кислоты или частично гидрогенизированной ди- или трикарбоновой кислоты. В дополнительном аспекте предложенного способа фармацевтическая композиция содержит гидрофумарат фезотеродина. Фармацевтическая композиция по настоящему изобретению является предпочтительно подходящей для перорального введения. Подходящие и предпочтительные пероральные лекарственные формы фармацевтических композиций по настоящему изобретению представляют собой таблетки, грануляты и таблетки, покрытые оболочкой. Капсулы, лепешки и другие твердые лекарственные формы для перорального введения также включены в объем настоящего изобретения. Также раскрыта фармацевтическая композиция, как определено выше, содержащая фезотеродин или его фармацевтически приемлемые соль или сольват, фармацевтически приемлемый стабилизатор,как определено выше, и по меньшей мере один дополнительный эксципиент, предпочтительно по меньшей мере один тип гидроксипропилметилцеллюлозы. В еще одном аспекте изобретение относится к фармацевтической композиции для перорального введения фезотеродина или его фармацевтически приемлемых соли или сольвата, которая может быть получена гранулированием фезотеродина подходящим эксципиентом, предпочтительно фармацевтически приемлемым стабилизатором, выбранным из ксилита, сорбита, полидекстрозы, изомальта и декстрозы, и наиболее предпочтительно ксилитом. Гранулят может затем быть смешан с по меньшей мере одним дополнительным эксципиентом, предпочтительно по меньшей мере одним типом гидроксипропилметилцеллюлозы, и, возможно, другими эксципиентами. В другом аспекте раскрыта фармацевтическая композиция, содержащая фезотеродин или его фармацевтически приемлемые соль или сольват, где указанная фармацевтическая композиция может быть твердой и может быть подходящей для перорального введения. Фезотеродин или его соль могут быть встроены в гелевую матрицу, образованную по меньшей мере одним типом агента для длительного высвобождения, способного набухать в воде, такого как сложный или простой эфир целлюлозы, и предпочтительно образованную по меньшей мере одним типом гидроксипропилметилцеллюлозы (гипромеллозы) и, возможно, дополнительными эксципиентами. Более предпочтительно фезотеродин и стабилизатор могут быть встроены в гелевую матрицу, образованную по меньшей мере одним типом гидроксипропилметилцеллюлозы (гипромеллозы) и, возможно, дополнительными эксципиентами. В определенных воплощениях соль фезотеродина может представлять собой соль многоосновной кислоты, предпочтительно с собственным рН в воде в пределах приблизительно 3-5 (при измерении в воде при 25 С в концентрации 1 мас.%). Примеры могут быть выбраны из группы многоосновных неорганических кислот, таких как, например, серная кислота и фосфорная кислота, или многоосновных органических кислот. Предпочтительные примеры представляют собой соли ди- или трикарбоновых кислот,как например малеат фезотеродина, оксалат фезотеродина, цитрат фезотеродина, фталат фезотеродина,фумарат фезотеродина, сукцинат фезотеродина, тартрат фезотеродина, малонат фезотеродина, малат фезотеродина и тому подобное. В определенных воплощениях соль фезотеродина может представлять собой соль частично гидрогенизированной ди- или трикарбоновой кислоты, в частности соль с собственным рН в воде 3-5, в частности от 3 до 4, более предпочтительно от 3,25 до 3,75, как например гидрофумарат или гидромалеат. Особенно предпочтительная соль представляет собой гидрофумарат фезотеродина. В еще одном аспекте раскрыта фармацевтическая композиция, как описано выше, содержащая фумарат фезотеродина в качестве фармацевтически приемлемой соли и предпочтительно гидрофумарат фезотеродина. В другом аспекте раскрыта фармацевтическая композиция, как описано выше, содержащая гидрофумарат фезотеродина в качестве фармацевтически приемлемой соли в количестве приблизительно 0,528 или 0,5-20 мг, предпочтительно приблизительно 1-16 мг, более предпочтительно приблизительно 1-12 мг, еще более предпочтительно приблизительно 1-8 мг и особенно предпочтительно приблизительно 2, 4 или 8 мг на единицу дозы (исходя из содержания фезотеродина или его соли, например, гидрофумарата фезотеродина). Также раскрыт способ лечения пациентов, страдающих гиперактивным мочевым пузырем и имеющих симптомы, такие как недержание мочи, конкретно, неотложное недержание мочи, неотложный позыв к мочеиспусканию и/или повышенная частота мочеиспускания, введением терапевтически эффективного количества любой из композиций, описанных здесь. В частности, раскрыт способ лечения пациентов, страдающих гиперактивным мочевым пузырем, у которых могут быть симптомы, такие как недержание мочи, неотложное недержание мочи, неотложный позыв к мочеиспусканию и/или частое мочеиспускание, введением стандартной лекарственной формы композиций фезотеродина, описанных здесь. Стандартная лекарственная форма может содержать приблизительно 0,5-28 или 0,5-20 мг фезотеродина,предпочтительно приблизительно 1-16 мг, более предпочтительно приблизительно 1-12 мг, еще более предпочтительно приблизительно 1-8 мг и особенно предпочтительно приблизительно 2, 4 или 8 мг на-4 015909 единицу дозы (исходя из содержания фезотеродина или его соли, например, гидрофумарата фезотеродина). Стандартную лекарственную форму можно вводить пациенту один раз в сутки или, в некоторых случаях, по необходимости, более чем один раз в сутки, как подходит. Более того, в данной заявке раскрыт способ изготовления фармацевтической композиции, как описано выше, включающий изготовление смеси фезотеродина или его фармацевтически приемлемой соли и фармацевтически приемлемого стабилизатора, как определено выше. Эти компоненты могут затем быть смешаны с по меньшей мере одним типом гидроксипропилметилцеллюлозы, и, возможно, другими эксципиентами. Возможно, полученная композиция может быть спрессована в таблетки и снабжена покрытием. Один предпочтительный способ изготовления фармацевтической композиции, содержащей фезотеродин, включает гранулирование композиции, содержащей фезотеродин или его фармацевтически приемлемую соль, и фармацевтически приемлемый стабилизатор, как определено выше, и последующее смешивание образованного таким образом гранулята с по меньшей мере одним типом гидроксипропилметилцеллюлозы, и, возможно, другими эксципиентами. Полученная композиция может затем быть спрессована в таблетки и снабжена покрытием. Способ гранулирования может быть осуществлен в процессе сухого гранулирования, без добавления жидкости, или, предпочтительно, в присутствии жидкости, такой как вода ("влажное гранулирование"). При влажном гранулировании, например, фезотеродин или его фармацевтически приемлемая соль и стабилизатор, как определено выше, могут быть смешаны в присутствии воды. Затем гранулят может быть высушен. Этот высушенный гранулят может затем быть смешан с по меньшей мере одним дополнительным эксципиентом, предпочтительно по меньшей мере одним типом гидроксипропилметилцеллюлозы, и, возможно, другими эксципиентами. Неожиданно было обнаружено, что влажное гранулирование может быть проведено без увеличения деградации фезотеродина вследствие гидролиза сложноэфирной связи. По этой же причине было еще более неожиданно, что фезотеродин более стабилен в композиции, изготовленной в присутствии воды,например, влажным гранулированием, чем в композиции, изготовленной сухим гранулированием (см.,например, табл. 9) или сухим смешиванием и прессованием эксципиентов (см. табл. 8). Краткое описание графических материалов На фиг. 1 показаны профили растворения in vitro фармацевтических композиций, содержащих фезотеродин, в расчете на 4 мг таблетку. На фиг. 2 показаны профили растворения in vitro фармацевтических композиций, содержащих фезотеродин, в расчете на 8 мг таблетку. Подробное описание изобретения в наиболее общем аспекте данной заявки предложена фармацевтическая композиция, содержащая фезотеродин или его фармацевтически приемлемую соль и фармацевтически приемлемый стабилизатор. Фезотеродин если в контексте не указано другое, при использовании здесь термин "фезотеродин" включает фармацевтически приемлемые сольваты 2-[(1R)-3-(диизопропиламино)-1-фенилпропил] -4(гидроксиметил)фенилизобутирата (формула (I, в частности, гидраты фезотеродина. "Фезотеродин" также включает фармацевтически приемлемые соли 2- [(1R)-3-(диизопропиламино)-1-фенилпропил]-4(гидроксиметил)фенилизобутирата (формула (I, в частности, гидрофумарат, а также свободное основание. В данной заявке указанные количества относятся к фезотеродину в используемой форме, то есть или свободного основания, или соли. Фезотеродин представляет собой сложный эфир, чувствительный к гидролизу после введения invivo, а также в процессе хранения в стрессовых условиях, с образованием основного продукта (2-[(1R)-3(диизопропиламино)-1-фенилпропил]-4-(гидроксиметил)фенола) (формула (II, называемого здесь "активным метаболитом" и соответствующего следующей структуре: В данной заявке термин "продукт гидролиза" относится к активному метаболиту формулы (II). Другие продукты деградации также могут быть результатом метаболизма и/или деградации фезотеродина. При использовании здесь "все продукты деградации" будут включать, по меньшей мере частично, продукт гидролиза. Содержание недеградировавшего фезотеродина, а также относительные количества заданных продукта гидролиза и всех продуктов деградации, могут быть определены посредством HPLC способом площадь-процент. В этом способе площадь-процент соотношение недеградировавшего фезотеродина определяют сравнением площади соответствующего HPLC-пика с общей площадью всех сигналов вHPLC-профиле, которые могут относиться к фезотеродину и продуктам его гидролиза и/или деградации. Стабилизатор"Фармацевтически приемлемый" стабилизатор представляет собой стабилизатор, не являющийся биологически или иным образом нежелательным, то есть этот стабилизатор может быть введен индивиду, не вызывая значимых нежелательных биологических эффектов или не взаимодействуя губительным образом с каким-либо из компонентов композиции, в которой он содержится."Стабилизатор" при использовании здесь в качестве термина обозначает вещество, в частности фармацевтически приемлемый эксципиент, ингибирующее, предотвращающее, замедляющее или уменьшающее деградацию фезотеродина по сравнению с фезотеродином при отсутствии этого вещества в определенных условиях. При использовании здесь термин "стабилизатор" также включает комбинацию двух или более стабилизаторов по изобретению. В качестве примера можно упомянуть комбинацию ксилита и сорбита или комбинацию ксилита, сорбита и полидекстрозы, или комбинацию ксилита и полидекстрозы. Определить, является ли определенный эксципиент подходящим в качестве стабилизатора по настоящему изобретению, можно, например, следующим способом. Сначала изготавливают гранулят. 1 массовый эквивалент фезотеродина или его соли, предпочтительно гидрофумарата фезотеродина,и 9 массовых эквивалентов эксципиента взвешивают раздельно. Если эксципиент агломерирован, его пропускают через сито (1,5 мм). Фезотеродин и эксципиент пропускают через сито (0,8 мм). Фезотеродин и эксципиент переносят в подходящий гранулятор (например, гранулятор с мешалкой с большим усилием сдвига, такой как изготавливаемые Lodige, Type Diosna P1/6) при температуре ниже приблизительно 35 С и смешивают в течение 1 минуты. Приблизительно 5,5 мас.% очищенной воды добавляют к сухой смеси во время перемешивания. Смесь перемешивают с использованием вибратора в течение приблизительно от 90 до 120 с. Смеситель опорожняют и содержимое переносят на просеиватель для образования влажного гранулята, который затем пропускают через сито или фильтр (4,0 мм). Просеянный гранулят высушивают на подносах при приблизительно 45 С в течение как минимум 8 часов в сушильной камере/сушильном шкафу до содержания воды не более приблизительно 0,5%. Высушенный гранулят пропускают через сито (от 0,5 до 1,0 мм). Высушенный гранулят затем перемешивают (при скорости приблизительно 8 об/мин) в течение 5 минут. Одну часть гранулята исследуют для определения исходного количества продукта гидролиза и деградации, в то время как другую часть хранят в открытых флаконах, как описано выше, и затем исследуют для определения конечного количества продукта гидролиза и деградации. Партии этого гранулята затем хранят в следующих трех условиях, соответственно: а) 25 С и 60% r.Н. в закрытых флаконах в течение 6 недель,б) 40 С и 75% r.Н. в закрытых флаконах в течение 6 недель,в) 40 С и 75% r.Н. в открытых флаконах в течение 6 недель. Содержание активного метаболита формулы (II) определяют посредством HPLC способом площадь-процент. В этом способе площадь-процент количество активного метаболита определяют сравнением площади соответствующего HPLC-пика с общей площадью всех сигналов в HPLC-профиле, которые могут относиться к фезотеродину и продуктам его гидролиза и/или деградации. Согласно изобретению вещество представляет собой стабилизатор, если оно ограничивает образование активного метаболита формулы (II) во время хранения в по меньшей мере двух из приведенных выше условий (а), (б) и (в) следующим образом: а) приблизительно 1 мас.% или менее, предпочтительно 0,5 мас.% или менее и особенно предпочтительно 0,36 масс.% или менее,б) приблизительно 2 мас.%) или менее, предпочтительно 1 мас.% или менее и особенно предпочтительно 0,5 масс.% или менее,в) приблизительно 2 мас.%) или менее, предпочтительно 1,5 мас.% или менее и особенно предпочтительно 0,58 мас.% или менее. Стабилизаторы согласно настоящему изобретению могут, например, быть выбраны из определенных сахаров, сахарных спиртов, полиолов или их производных, удовлетворяющих вышеупомянутым критериям. Особенно предпочтительные стабилизаторы выбраны из ксилита, сорбита, полидекстрозы,изомальта и декстрозы. Ксилит является одним предпочтительным стабилизатором. Эти вещества способны ингибировать, предотвращать, замедлять или уменьшать гидролиз фезотеродина до активного метаболита формулы (II) и, таким образом, действуют как стабилизаторы. Таким образом, изобретение относится к фармацевтическим композициям, содержащим фезотеродин и стабилизатор, выбранный из ксилита, сорбита, полидекстрозы, изомальта и декстрозы, и наиболее предпочтительно ксилит, где фезотеродин защищен от гидролиза в различных стрессовых условиях (см., например, табл. 6 и 7). Также в качестве стабилизаторов предпочтительны такие вещества, которые способны уменьшать-6 015909 дестабилизирующий эффект некоторых других эксципиентов, таких как лактоза, на фезотеродин. Стабилизаторы по настоящему изобретению также могут ингибировать, предотвращать, замедлять или уменьшать деградацию других сложноэфирных соединений, чувствительных к гидролизу. В частности, стабилизаторы по изобретению полезны для стабилизации сложных эфиров активного метаболита фезотеродина формулы (II). Таким образом, другой аспект данного изобретения относится к применению вещества, выбранного из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта и декстрозы, для стабилизации фармацевтической композиции, содержащей в качестве активного ингредиента сложноэфирное соединение, чувствительное к гидролизу, в частности сложный эфир активного метаболита фезотеродина формулы (II), и предпочтительно такой сложный эфир, как указано ниже, или его фармацевтически приемлемые соль или сольват. Сложные эфиры активного метаболита фезотеродина формулы (II), которые могут быть стабилизированы таким образом, включают следующие соединения: а) фенольные моноэфиры формулы (III) где R1 представляет собой C1111-С 6666 алкил или фенил; б) идентичные сложные диэфиры формулы (IV) где каждый R1 является таким, как определено выше; в) смешанные сложные диэфиры формулы (V) где R1 является таким, как определено выше, R2 представляет собой водород, C1-С 6 алкил или фенил, при условии, что R1 и R2 различны; г) бензиловые моноэфиры формулы (VI) где R1 является таким, как определено выше; д) внутримолекулярные циклические сложные диэфиры формул (VII) и (VIII)-7 015909 где о и р одинаковы или различны, и представляют собой число метиленовых звеньев -(СН 2)- и могут варьировать от 0 до 6; и е) сложные эфиры неорганических кислот, как например, 2-(3-диизопропиламино-1-фенилпропил)4-сульфооксиметилфениловый эфир -бензойной кислоты; и их соли с физиологически приемлемыми кислотами, их свободные основания и, если соединения могут быть представлены в форме оптических изомеров, рацемическую смесь и индивидуальные энантиомеры. В еще одном аспекте данная заявка также включает фармацевтическую композицию, содержащую такой сложный эфир, как определено выше, или его фармацевтически приемлемые соль или сольват, и фармацевтически приемлемый стабилизатор, выбранный из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта, декстрозы и их комбинаций. Предпочтительные фармацевтические композиции представляют собой таковые, содержащие:(а) фенольный моноэфир формулы (III), как определено выше, особенно предпочтительно фенольный моноэфир, где R1 представляет собой линейный или разветвленный С 3-6 алкил, или его фармацевтически приемлемые соль или сольват; и(б) фармацевтически приемлемый стабилизатор, где указанный стабилизатор выбран из группы, состоящей из ксилита, сорбита, полидекстрозы, изомальта, декстрозы и их комбинаций. В одном аспекте настоящего изобретения фармацевтическая композиция, содержащая сложный эфир, как описано выше, предпочтительно фенольный моноэфир формулы (III), и стабилизатор, содержит указанный сложный эфир в форме соли, предпочтительно соли ди- или трикарбоновой кислоты либо частично гидрогенизированной ди- или трикарбоновой кислоты, где указанная соль указанного сложного эфира имеет собственный рН в воде, близкий к рН-оптимуму стабильности соответствующего сложного эфира, например, рН приблизительно 3-5. Типичные фармацевтические композиции Типичные неисчерпывающие примеры различных стабилизированных композиций могут быть описаны следующим образом. Фармацевтическая композиция, содержащая фезотеродин и стабилизатор, как определено выше, где фезотеродин стабилен в отношении деградации при приблизительно 40 С, 75% r.Н. в открытом флаконе,таким образом, что через приблизительно 12 недель при приблизительно 40 С, 75% r.Н. в открытом флаконе фармацевтическая композиция содержит по меньшей мере приблизительно 85, 86, 87, 88, 89 или приблизительно 90% фезотеродина. Более предпочтительно такая фармацевтическая композиция содержит по меньшей мере приблизительно 89% фезотеродина после хранения в таких условиях. Фармацевтическая композиция, содержащая фезотеродин и стабилизатор, как определено выше, где фезотеродин стабилен в отношении деградации при приблизительно 40 С, 75% r.Н. в открытом флаконе,таким образом, что через приблизительно 6 недель при приблизительно 40 С, 75% r.Н. в открытом флаконе фармацевтическая композиция содержит не более чем приблизительно 7, 6, 5, 4,9, 4,8, 4,7, 4,6, 4,5 или 4,4% активного метаболита формулы (II). Фармацевтическая композиция, содержащая фезотеродин и стабилизатор, как определено выше, где фезотеродин стабилен в отношении деградации при приблизительно 40 С, 75% r.Н. в закрытом флаконе,таким образом, что через приблизительно 6 недель при приблизительно 40 С, 75% r.Н. в закрытом флаконе фармацевтическая композиция содержит не более чем приблизительно 2,5, 2,2, 2,1, 2, 1,9, 1,8, 1,7,1,6, 1,5, 1,4, 1,3, 1,2, 1,1 или 1% активного метаболита формулы (II). Более предпочтительно такая фармацевтическая композиция содержит не более чем приблизительно 1,09% активного метаболита формулы (И) после хранения в таких условиях. Фармацевтическая композиция, содержащая фезотеродин и стабилизатор, как определено выше, где фезотеродин стабилен в отношении деградации при приблизительно 25 С, 60% r.Н. в закрытом флаконе,таким образом, что через приблизительно 6 недель при приблизительно 25 С, 60% r.Н. в закрытом флаконе фармацевтическая композиция содержит не более чем приблизительно 1,0, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4,0,3, 0,2 или 0,1% активного метаболита. Более предпочтительно такая фармацевтическая композиция содержит не более чем приблизительно 0,18% активного метаболита формулы (II) после хранения в таких условиях. В предпочтительных воплощениях стабилизатор, используемый в фармацевтической композиции,содержащей фезотеродин, может представлять собой полидекстрозу, сорбит или особенно предпочтительно ксилит. Грануляты Как упомянуто выше, фармацевтическая композиция по настоящему изобретению может быть представлена в форме гранулята. Гранулят может, возможно, содержать по меньшей мере один дополнительный эксципиент. Было обнаружено, что в то время как фезотеродин сам по себе после приблизительно 12 недель при приблизительно 40 С, относительной влажности (r.Н.) 75% в открытых флаконах был подвержен деградации в такой степени, что только приблизительно 50% исходного фезотеродина сохранялось в недеградированной форме, в грануляте фезотеродина и ксилита, после приблизительно 12 недель в таких же условиях, в недеградированной форме сохранялось приблизительно 93% исходного ко-8 015909 личества фезотеродина. Таким образом, представлены типичные неисчерпывающие примеры гранулятов фезотеродина. Гранулят фезотеродина и стабилизатора, как определено выше, где фезотеродин в грануляте стабилен в отношении деградации при приблизительно 40 С, 75% r.Н. в открытом флаконе, таким образом,что через приблизительно 6 недель при приблизительно 40 С, 75% r.Н. в открытом флаконе гранулят содержит не более чем приблизительно 2, 1,5, 1, 0,9, 0,8, 0,7, 0,6 или 0,5 активного метаболита формулы(II) по массе. Более предпочтительно такой гранулят содержит не более чем приблизительно 0,58 активного метаболита формулы (II) после хранения в таких условиях. Гранулят фезотеродина и стабилизатора, как определено выше, где фезотеродин в грануляте стабилен в отношении деградации при приблизительно 40 С, 75% r.Н. в закрытом флаконе, таким образом, что через приблизительно 6 недель при приблизительно 40 С, 75% r.Н. в закрытом флаконе гранулят содержит не более чем приблизительно 2, 1,5, 1, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4, .0,3 или 0,2% активного метаболита формулы (II). Более предпочтительно такой гранулят содержит не более чем приблизительно 0,23% активного метаболита формулы (II) после хранения в таких условиях. Гранулят фезотеродина и стабилизатора, как определено выше, где фезотеродин в грануляте стабилен в отношении деградации при приблизительно 25 С, 60% r.Н. в закрытом флаконе, таким образом, что через приблизительно 6 недель при 25 С, 60% r.Н. в закрытом флаконе гранулят содержит не более чем приблизительно 1,0, 0,9, 0,8, 0,7, 0,6, 0,5, 0,4, 0,3, 0,2 или 0,1% активного метаболита формулы (II). Более предпочтительно такой гранулят содержит не более чем приблизительно 0,36%, еще более предпочтительно не более чем приблизительно 0,12% активного метаболита формулы (II) после хранения в таких условиях. В предпочтительных воплощениях гранулят включает полидекстрозу, сорбит или особенно предпочтительно ксилит в качестве стабилизатора. Кроме того, предложены грануляты фезотеродина, образованные способом гранулирования, предпочтительно влажного гранулирования, с использованием подходящего эксципиента, такого как стабилизатор, как определено выше. Гранулят, изготовленный на такой стадии гранулирования, предпочтительно имеет соотношение фезотеродин/стабилизатор приблизительно 1-30% (мас./мас.), более предпочтительно приблизительно 120% (мас./мас.), более предпочтительно приблизительно 3-15% (мас./мас.) и еще более предпочтительно приблизительно 5-10% (мас./мас.). В особенно предпочтительном воплощении гранулят включает соотношение фезотеродин/ксилит или фезотеродин/сорбит приблизительно 1-30% (мас./мас.), предпочтительно приблизительно 1-20% (мас./мас.), более предпочтительно приблизительно 3-15% (мас./мас.) и еще более предпочтительно приблизительно 5-10% (мас./мас.). Средний размер гранулята можно контролировать обычными методиками, такими как просеивание или измельчение, и типично он может составлять менее чем приблизительно 4 мм, предпочтительно менее чем приблизительно 2 мм, более предпочтительно менее чем приблизительно 1 мм и еще более предпочтительно менее чем приблизительно 0,75 мм, например, приблизительно 0,5 мм. Грануляты фезотеродина, как описано здесь, особенно если они изготовлены способом влажного гранулирования, неожиданно стабильны во влажных стрессовых условиях. Грануляты могут дополнительно быть обработаны и включены в фармацевтические композиции, которые также неожиданно стабильны. Также было неожиданно обнаружено, что гранулирование фезотеродина или ксилитом, или сорбитом обеспечивает повышенную стабильность в течение процесса гранулирования по сравнению с гранулированием фезотеродина или маннитом, или мальтитом. Когда фезотеродин гранулировали раздельно с этими четырьмя сахарными спиртами и тестировали на степень гидролиза или полной деградации, произошедших во время гранулирования, было обнаружено, что гранулирование ксилитом или сорбитом приводило к меньшему количеству продуктов деградации, чем гранулирование маннитом или мальтитом. Гранулирование ксилитом или сорбитом приводило к образованию от приблизительно 0,06% до приблизительно 0,07% продуктов гидролиза и всех продуктов деградации, в то время как гранулирование маннитом или мальтитом приводило к образованию от приблизительно 0,42% до приблизительно 0,73% продуктов гидролиза и продуктов полной деградации (см. табл. 7). Неожиданно высокие результаты, наблюдаемые для гранулирования с ксилитом или сорбитом,также наблюдали при использовании гранулятов фезотеродина с ксилитом или сорбитом для изготовления фармацевтических композиций. Фармацевтические композиции в форме таблеток, которые были изготовлены с использованием гранулятов фезотеродина, включавших ксилит или сорбит, продемонстрировали значительно меньшее содержание продуктов гидролиза и продуктов полной деградации (приблизительно от 0,06 до 0,11%), чем таблетки, изготовленные с использованием гранулятов фезотеродина,включавших маннит или мальтит (приблизительно от 1,1 до 1,7%) (см. табл. 8). Различие между сорбитом и маннитом особенно неожиданно,поскольку эти два сахарных спирта являются изомерами. В другом воплощении согласно настоящему изобретению предложено применение гранулятов, содержащих фезотеродин и стабилизатор, как описано здесь, для лечения недержания мочи, конкретно,-9 015909 неотложного недержания мочи, неотложного позыва к мочеиспусканию и/или частого мочеиспускания, и изготовления лекарственного средства для лечения таких состояний. Предпочтительно грануляты, используемые для изготовления лекарственного средства (такого как, например, таблетка), содержат сахар,сахарный спирт, полиол или их производное (такие как, например, ксилит, сорбит, полидекстроза, изомальт или декстроза). Лекарственное средство может быть представлено в форме, например, гранулята,капсулы, таблетки или таблетки, покрытой оболочкой. Композиции с длительным высвобождением В еще одном воплощении предложена твердая фармацевтическая композиция для перорального введения фезотеродина или его фармацевтически приемлемых соли или сольвата, предпочтительно гидрофумарата фезотеродина, которая может быть получена смешиванием гранулята, описанного здесь, с по меньшей мере одним дополнительным эксципиентом, предпочтительно с по меньшей мере одним типом агентов для длительного высвобождения, таким как гидроксипропилметилцеллюлоза (НРМС), и, возможно, другими эксципиентами. В другом аспекте активный ингредиент (фезотеродин или его фармацевтически приемлемая соль) встроен в гелевую матрицу, образованную агентом для длительного высвобождения, как описано ниже,предпочтительно гелевой матрицей, образованной по меньшей мере одним типом агента для длительного высвобождения, способного набухать в воде, таким как сложный или простой эфир целлюлозы, и предпочтительно образованной по меньшей мере одним типом НРМС. Более предпочтительно, гранулят, содержащий активный ингредиент (фезотеродин или его фармацевтически приемлемую соль) и стабилизатор, как определено выше, встроены в гелевую матрицу, образованную по меньшей мере одним типом НРМС. Такая композиция, содержащая фезотеродин, стабилизатор и гелевую матрицу, образованную по меньшей мере одним типом НРМС, предпочтительно разработана для высвобождения фезотеродина в течение длительного периода времени, предпочтительно для того, чтобы сделать возможным пероральное введение один раз в сутки. Подходяще, такая композиция для введения один раз в сутки содержит по меньшей мере приблизительно 20% НРМС по массе от общей массы композиции и более предпочтительно по меньшей мере приблизительно 25% (мас./мас.), как например от 25 до 65%, и еще более предпочтительно по меньшей мере приблизительно 30% (мас./мас.), как например от 30 до 65%, и особенно предпочтительно по меньшей мере приблизительно 35% (мас./мас.), как например от 35 до 55% НРМС. В клинических исследованиях и/или исследованиях биоэквивалентности было показано, что особенно предпочтительные композиции по настоящему изобретению, такие как, например, композиции"А", "Б", "В", "Г", "Д", "Е", "Ж" и "3", приведенные в табл. 1 и 2 экспериментальной части настоящей заявки, эффективны для введения один раз в сутки у человека. Все они демонстрируют специфический профиль высвобождения фезотеродина в анализах растворения in vitro. Эти композиции и другие композиции, демонстрирующие соответствующие профили растворения, образуют другое воплощение настоящего изобретения. Особенно предпочтительные фармацевтические композиции, содержащие фезотеродин, демонстрируют кумулятивное высвобождение фезотеродина (в процентах по массе от теоретического количества фезотеродина в композиции) в анализе растворения in vitro в соответствии с Фармакопеей США 711(USP 711) (в фосфатном буфере, рН 6,8, 37 С, при 75 об/мин) следующим образом: высвобождение фезотеродина через 1 ч составляет от приблизительно 5 до приблизительно 30%,предпочтительно от приблизительно 6 до приблизительно 26%; высвобождение фезотеродина через 2 ч составляет от приблизительно 15% до приблизительно 40%,предпочтительно от приблизительно 18% до приблизительно 38%; высвобождение фезотеродина через 4 ч составляет от приблизительно 35% до приблизительно 65%,предпочтительно от приблизительно 36% до приблизительно 56%; высвобождение фезотеродина через 16 ч составляет по меньшей мере приблизительно 75%, предпочтительно по меньшей мере приблизительно 80%. Гелевая матрица для высвобождения фезотеродина предпочтительно образована агентом для длительного высвобождения, особенно таковым, способным набухать при контакте с водой, в количестве приблизительно 20-80% (масс/масс), предпочтительно приблизительно 25-65%, более предпочтительно 30-65%, и еще более предпочтительно приблизительно 35-55% (мас./мас.) от всей композиции. Гелевая матрица может, возможно, содержать дополнительные ингредиенты. В частности, наполнитель, такой как лактоза и/или микрокристаллическая целлюлоза, также может быть встроен в матрицу. В другом воплощении твердая композиция фезотеродина содержит по меньшей мере два типа гидроксипропилметилцеллюлозы (НРМС). Эти два типа НРМС могут быть химически идентичными, но отличаться своей вязкостью при растворении в воде в стандартных условиях. Альтернативно, могут быть использованы два химически различных типа НРМС. Особенно предпочтительная композиция может быть получена, когда один тип НРМС имеет номинальную вязкость приблизительно 100000 мПас (то есть, 10000020000 мПас), и другой имеет номинальную вязкость приблизительно 4000 мПас (то есть, 40001000 мПас) при растворении в воде при- 10015909 приблизительно 22 С в концентрации приблизительно 2% по массе. В одном предпочтительном воплощении соотношение фезотеродина или его фармацевтически активных соли или сольвата и НРМС составляет от приблизительно 1:80 до приблизительно 1:5 (мас./мас.). Еще более предпочтительны массовые соотношения от приблизительно 1:70 до приблизительно 1:10(мас./мас.) и еще более предпочтительно от приблизительно 1:40 до приблизительно 1:15 (мас./мас.). Другое предпочтительное воплощение представляет собой твердую фармацевтическую композицию, содержащую от приблизительно 0,25 до приблизительно 10% (мас./мас.) фезотеродина или его фармацевтически приемлемых соли или сольвата. Наиболее предпочтительные композиции включают фезотеродин в количестве от приблизительно 0,5 до приблизительно 4% (мас./мас.). Предпочтительная композиция может дополнительно содержать один или более дополнительный эксципиент (эксципиенты), такой как один или более наполнитель (наполнители), связывающее вещество (вещества) и/или смазывающее вещество (вещества), и особенно предпочтительными из них являются лактоза, микрокристаллическая целлюлоза, тальк и дибегенат глицерина. Компоненты фармацевтической композиции Композиции предпочтительно изготавливают в стандартной лекарственной форме. Каждая стандартная лекарственная форма может содержать от приблизительно 0,5 до 20 мг, предпочтительно приблизительно 1-8 мг, и более предпочтительно приблизительно 2, 4 или 8 мг фезотеродина или его фармацевтически приемлемой соли, такой как, например, гидрофумарат. Термин "стандартная лекарственная форма" относится к физически дискретным единицам, подходящим в качестве однократных доз для людей или других млекопитающих, причем каждая единица содержит, кроме подходящих фармацевтических эксципиентов, предопределенное количество фезотеродина или его соли, которое, согласно вычислениям, оказывает желаемый терапевтический эффект. Наиболее предпочтительны твердые лекарственные формы (такие как таблетки, таблетки, покрытые оболочкой, грануляты и капсулы), требующие для достижения желаемого терапевтического эффекта введения пациенту только один раз в сутки. Фармацевтические эксципиенты, которые могут присутствовать в композициях, описанных здесь,включают агенты для длительного высвобождения ("SR"-агенты), разрыхлители, наполнители и смазывающие вещества. Также могут быть включены другие эксципиенты. Агенты для длительного высвобождения ("SR"-агенты) Если фармацевтическая композиция по настоящему изобретению представляет собой композицию с длительным высвобождением, она будет обычно содержать один или более агентов для длительного высвобождения. Подходящие агенты для длительного высвобождения предпочтительно представляют собой таковые, набухающие при контакте с водой, такие как поливинилпирролидон, прежелатинизированный крахмал, полиметакрилат, поливинилацетат, декстраны, крахмал, целлюлоза и простые и сложные эфиры целлюлозы, такие как метилцеллюлоза, метилэтилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза или карбоксиметилцеллюлоза либо их смеси. Предпочтительные примеры агентов для длительного высвобождения представляют собой гидроксипропилметилцеллюлозу (НРМС) или смеси различных НРМС. НРМС может действовать и как связывающее вещество, и как агент для длительного высвобождения. НРМС предпочтительно присутствует в количестве, делающем возможным образование гелевой матрицы, из которой постепенно высвобождается активный ингредиент. В предпочтительном воплощении используют два типа гидроксипропилметилцеллюлозы с различной вязкостью. В этих смесях одна НРМС может иметь высокую вязкость и одна НРМС может иметь низкую вязкость.(приблизительно 2% по массе) в воде. "НРМС с низкой вязкостью" относится к НРМС, имеющим при комнатной температуре номинальную вязкость от приблизительно 3000 до приблизительно 20000 и предпочтительно приблизительно 4000 мПас (то есть, 40001000 мПас) при растворении (приблизительно 2 мас.%) в воде. Предпочтительно степень замещения метокси-группами в используемых НРМС составляет от приблизительно 15 до приблизительно 35% и особенно предпочтительно от приблизительно 18 до приблизительно 30%, в то время как степень замещения гидроксипропокси-группами составляет предпочтительно от приблизительно 5 до приблизительно 14% и более предпочтительно от приблизительно 7 до приблизительно 12%. Подходящие марки обнаружены, например, в METHOCEL E4M,METHOCEL K4M, METHOCEL K15M и METHOCEL K100M, доступных от Dow Chemical Company. Особенно предпочтительные торговые марки представляют собой METHOCEL К 100 М, имеющую номинальную вязкость приблизительно 100000 мПас, и METHOCEL K4M, имеющую номинальную вязкость приблизительно 4000 мПас Массовые соотношения METHOCEL K100M и К 4 М, используемые в композициях и препаратах, описанных здесь, могут находиться в пределах от приблизительно 20:1 до приблизительно 1:2, и предпочтительно находятся в пределах от приблизительно 10:1 до приблизи- 11015909 тельно 1:1,5, и еще более предпочтительно находятся в пределах от приблизительно 7:1 до приблизительно 1:1,3. В одном воплощении может быть использован один определенный тип НРМС, такой как, например,НРМС с номинальной вязкостью от приблизительно 50000 до приблизительно 120000 мПас, где НРМС с вязкостью от приблизительно 50000 до приблизительно 100000 мПас является предпочтительной. Разрыхлители Кроме того, композиции и препараты, описанные здесь, могут также содержать разрыхлители, такие как прежелатинизированный крахмал, крахмалгликолят натрия, микрокристаллическая целлюлоза,натрий-карбоксиметилцеллюлоза (CMC-Na), поперечно сшитая CMC-Na, полакрилин калия, низкозамещенная гидроксипропилцеллюлоза или их смеси. Присутствие разрыхлителя в композициях и препаратах, описанных здесь, не является необходимым, но может быть желательным. Наполнители/связывающие вещества Фармацевтические композиции, описанные здесь, могут дополнительно содержать наполнители и/или связывающие вещества, такие как микрокристаллическая целлюлоза, порошкообразная целлюлоза,прессуемый сахар, крахмал (например, кукурузный крахмал или картофельный крахмал), прежелатинизированный крахмал, фруктоза, сахароза, декстроза, декстраны, другие сахара, такие как сахароза, силиконизированная микрокристаллическая целлюлоза, гидрофосфат кальция, дигидрат гидрофосфата кальция, дигидрат гидрофосфата кальция, фосфат кальция, лактат кальция или их смеси. Предпочтительно, эксципиенты включают по меньшей мере один наполнитель, выбранный из микрокристаллической целлюлозы и моногидрата лактозы. Более предпочтительно, в качестве эксципиента используют смесь лактозы и микрокристаллической целлюлозы в соотношении от приблизительно 1:1 до приблизительно 3:1 (мас./мас.). Особенно предпочтительным эксципиетом является MICROCELAC 100, представляющая собой совместно обработанную смесь моногидрата лактозы и микрокристаллической целлюлозы в соотношении 3:1, причем оба компонента фармакопейного качества, полученную комбинированной распылительной сушкой. И свойства лактозы как наполнителя, и связывающую способность микрокристаллической целлюлозы синергетически совместно обрабатывают с образованием одного эксципиента, придающего композиции улучшенные реологические свойства и лучшие характеристики при таблетировании. Композиции, описанные здесь, могут также содержать связывающие вещества, такие как производные целлюлозы (например, метилцеллюлоза и натрий-карбоксиметилцеллюлоза), желатин, глюкоза, лактоза, сахароза, полиэтиленгликоль, полиметакрилаты, гидроксипропилцеллюлоза, сахарные спирты,прежелатинизированный крахмал и альгинат натрия. Они могут быть полезны для образования гранулятов. Некоторые из предпочтительных стабилизаторов, такие как ксилит и сорбит, также обладают связывающими свойствами. Если для образования гранулятов используют связывающие вещества, они могут предпочтительно быть использованы в виде частиц со средним размером приблизительно 1-300 мкм, более предпочтительно приблизительно 1-200 мкм и еще более предпочтительно приблизительно 5-100 мкм. Наиболее предпочтительно, размер связывающих частиц должен быть менее чем приблизительно 1 мм. Например, если для образования гранул используют ксилит, подходящие марки обеспечиваютXYLITAB 300 или XYLITOL CM50 (оба изготовленные Xyrofin Oy, Kotka, Finland и запущенные в серийное производство Danisco), и XYLITOL 90 (изготовленный Roquette GmbH, Germany). Смазывающие вещества Композиции и препараты, описанные здесь, могут также содержать смазывающие вещества, антиадгезионные вещества и/или скользящие вещества, такие как стеариновая кислота, стеарат магния, стеарат кальция, лаурилсульфат натрия, гидрогенизированное растительное масло, гидрогенизированное касторовое масло, стеарилфумарат натрия, макроголи, дибегенат глицерина, тальк, кукурузный крахмал,диоксид кремния или их смеси. Предпочтительные смазывающие вещества представляют собой тальк и дибегенат глицерина. При использовании здесь термин "дибегенат глицерина" следует рассматривать как синоним "глицерилбегената". Покрытия Возможно, композиции и препараты, описанные здесь, включая ядра/таблетки, могут быть покрыты обычными материалами, используемыми для покрытия оболочкой, например, как описано в Pharmaceutical Coating Technology, 1995, под редакцией Graham Cole. Композиции, покрытые оболочкой, обычно содержат следующие компоненты: полимер (полимеры), пластификатор (пластификаторы), краситель(красители)/замутнитель (замутнители), наполнитель (наполнители). Незначительные количества корригентов, сурфактантов и восков также могут быть использованы в растворе или суспензии для пленочной оболочки. Большинство полимеров, используемых в пленочных оболочках, представляют собой или производные целлюлозы, такие как простые эфиры целлюлозы, или акриловые полимеры и сополимеры. Иногда встречаются полиэтиленгликоли с высокой молекулярной массой, поливинилпирролидон,поливиниловый спирт и воскообразные вещества.- 12015909 Типичные простые эфиры целлюлозы представляют собой гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и метилцеллюлозу. Акриловые полимеры включают группу синтетических полимеров с разнообразными функциональными группами. Некоторые из них могут быть дополнительно модифицированы для усиления набухания и проницаемости введением материалов, таких как водорастворимые простые эфиры целлюлозы и крахмалы, с целью обеспечения полной распадения/растворения оболочки. Обычно используемые пластификаторы могут быть классифицированы на три группы: полиолы(глицерин, пропиленгликоль, макроголи), органические сложные эфиры (сложные эфиры фталевой кислоты, дибутилсебацетат, сложные эфиры лимонной кислоты, триацетин), масла/глицериды (касторовое масло, ацетилированные моноглицериды, фракционированное кокосовое масло). Красители/замутнители классифицируют на несколько групп: органические красители и лаки на их основе, неорганические красители, натуральные красители. Различные вещества из каждой группы могут также быть комбинированы в определенных соотношениях. Один подходящий состав суспензии для покрытия (рассчитанный по сухому веществу) включает приблизительно 1-99 мас.% полимера, предпочтительно приблизительно 1-95% полимера,приблизительно 1-50 мас.% пластификатора, предпочтительно приблизительно 1-40% пластификатора приблизительно 0,1-20% красителя/замутнителя, предпочтительно приблизительно 0,1-10% красителя/замутнителя. Пленочные оболочки могут быть изготовлены из готовых для изготовления препаратов, имеющихся в продаже. Одним предпочтительным материалом для пленочной оболочки является OPADRY, в частности OPADRY blue, представляющий собой смесь из 6 компонентов, а именно, поливинилового спирта (агента, образующего оболочку), полиэтиленгликоля (ПЭГ) (пластификатора), лецитина (смягчителя),талька (смазывающего вещества), диоксида титана (белого пигмента), индигокармин-алюминиевого лака(красителя). В зависимости от желаемой непрозрачности предпочтительное количество покрытия составляет приблизительно 4-6 мас./мас.% таблетки, предпочтительно приблизительно 4,5%. Дисперсная система или суспензия для покрытия пленочной оболочкой может быть изготовлена с использованием различных растворителей (воды, спиртов, кетонов, сложных эфиров, хлорированных углеводородов), но вода является предпочтительной. В то время как покрытие может, в принципе, быть использовано для изменения высвобождения активного ингредиента из композиции, покрытие фармацевтической композиции по настоящему изобретению предпочтительно не изменяет или существенно не изменяет профиль высвобождения фезотеродина. Предпочтительно покрытие наносят на композицию фезотеродина только для удобства пациента, то есть,для улучшения манипулирования с конечной таблеткой и ее внешности. Предпочтительные количества ингредиентов. Теперь будут описаны предпочтительные типичные, неограничивающие примеры твердых фармацевтических композиций. Все проценты указаны по массе (масс/масс), относящейся к общей массе композиции, если не указано иное. Одно воплощение относится к фармацевтической композиции, содержащей приблизительно 0,3-5,0% (мас./мас.) фезотеродина или его соли, предпочтительно гидрофумарата фезотеродина; приблизительно 5-25% (мас./мас.) стабилизатора, например, ксилита, сорбита, полидекстрозы, изомальта или декстрозы; стабилизатор предпочтительно имеет средний размер частиц приблизительно 0,001-0,30 мм; приблизительно 20-40%) (мас./мас.) наполнителей и/или связывающих веществ, таких как моногидрат лактозы и микрокристаллическая целлюлоза; приблизительно 20-65% (мас./мас.) гидроксипропилметилцеллюлозы и предпочтительно приблизительно 25-65%, более предпочтительно 30-65% и еще более предпочтительно приблизительно 35-55%(масс./масс.) гидроксипропилметилцеллюлозы; приблизительно 1-10% (мас./мас.) смазывающих веществ, таких как дибегенат глицерина и/или тальк. Более предпочтительна фармацевтическая композиция, содержащая: приблизительно 0,3-5,0% (мас./мас.) фезотеродина или его соли, предпочтительно гидрофумарата фезотеродина; приблизительно 5-25%) (мас./мас.) стабилизатора, например, ксилита, сорбита, полидекстрозы,изомальта или декстрозы (предпочтительно имеющих средний размер частиц 0,001-0,30 мм); приблизительно 20-40% (мас./мас.) смеси, содержащей приблизительно 45-80%, предпочтительно приблизительно 75% (мас./мас.) моногидрата лактозы и приблизительно 55-20%), предпочтительно приблизительно 25% (мас./мас.), микрокристаллической целлюлозы; приблизительно 20-65%, предпочтительно приблизительно 25-65%, более предпочтительно 30-65% и еще более предпочтительно приблизительно 35-55% (мас./мас.) гидроксипропилметилцеллюлозы; приблизительно 1-10% (мас./мас.) смазывающих веществ, таких как дибегенат глицерина и/или- 13015909 тальк. В другом конкретном воплощении фармацевтическая композиция содержит: приблизительно 0,5-4,0% (мас./мас.) гидрофумарата фезотеродина; приблизительно 5-25% (мас./мас.) стабилизатора, например, ксилита, сорбита, полидекстрозы, изомальта или декстрозы (предпочтительно имеющих средний размер частиц приблизительно 0,001-0,30 мм); приблизительно 20-40% (мас./мас.) смеси, содержащей приблизительно 45-80%, предпочтительно приблизительно 75% (мас./мас.) моногидрата лактозы и приблизительно 55-20%, предпочтительно приблизительно 25% (мас./мас.), микрокристаллической целлюлозы; приблизительно 15-55% и предпочтительно приблизительно 15-40% (мас./мас.) гидроксипропилметилцеллюлозы с высокой вязкостью; приблизительно 5-30% и предпочтительно приблизительно 5-25% (мас./мас.) гидроксипропилметилцеллюлозы с низкой вязкостью; приблизительно 1-5% (мас./мас.) дибегената глицерина; и приблизительно 1-5% (мас./мас.) талька. На такую композицию может, возможно, быть нанесено покрытие. Один предпочтительный материал для пленочного покрытия представляет собой OPADRY, но известны и другие покрытия. Еще одно воплощение относится к фармацевтической композиции, содержащей: приблизительно 0,1-10%, предпочтительно приблизительно 0,2-7%, более предпочтительно 0,3-5% и более предпочтительно приблизительно 0,5-4,0%) фезотеродина или его соли, предпочтительно гидрофумарата; приблизительно 20-65%, предпочтительно приблизительно 25-65%, более предпочтительно приблизительно 30-65% и еще более предпочтительно приблизительно 35-55%) НРМС, где НРМС может включать два или более различных типа, таких как НРМС с высокой вязкостью (например, METHOCELK100M) и НРМС с низкой вязкостью (например, METHOCEL K4M); соотношение НРМС с высокой вязкостью и НРМС с низкой вязкостью может составлять от приблизительно 20:1 до приблизительно 1:2(масс./масс.), и предпочтительно составляет от приблизительно 10:1 до приблизительно 1:1,5(масс./масс.), и еще более предпочтительно составляет приблизительно от 7:1 до 1:1,3 (мас./мас.); приблизительно 1-45%, предпочтительно приблизительно 2-35% и более предпочтительно приблизительно 5-25% стабилизатора, например, ксилита, сорбита, полидекстрозы, изомальта или декстрозы; приблизительно 10-70%, предпочтительно приблизительно 15-50% и более предпочтительно приблизительно 20-40% наполнителя; и приблизительно 0,5-10%, предпочтительно приблизительно 1-8% и более предпочтительно приблизительно 2-7% смазывающего вещества. Особенно предпочтительная твердая фармацевтическая композиция содержит (мас./мас.): и, возможно, фармацевтически приемлемое покрытие. В этом особенно предпочтительном воплощении предпочтительный средний размер частиц ксилита составляет приблизительно 1-300 мкм, более предпочтительно приблизительно 1-200 мкм и еще более предпочтительно приблизительно 5-100 мкм. В наиболее предпочтительном воплощении размер всех частиц должен предпочтительно быть менее чем 1 мм. Такие же общие и предпочтительные размеры частиц также применимы к другим стабилизаторам по изобретению. Другое предпочтительное воплощение представляет собой таблетку, покрытую оболочкой, содержащую ядро, дополнительно содержащее: и покрытие, предпочтительно OPADRY, предпочтительно в количестве от приблизительно 10 до 20 мг и более предпочтительно приблизительно 15 мг OPADRY. Другое предпочтительное воплощение представляет собой таблетку, покрытую оболочкой, содержащую ядро, дополнительно содержащее: и покрытие, предпочтительно OPADRY, предпочтительно в количестве от приблизительно 10 до 20 мг и более предпочтительно приблизительно 15 мг OPADRY. Фармацевтические композиции, в дополнение, могут содержать незначительные количества (менее чем приблизительно 3% и более предпочтительно менее чем приблизительно 1 мас.%) примесей. Более того, композиции предпочтительно содержат не более чем приблизительно 5 мас.% воды, которая может быть использована в процессе изготовления. В еще одном воплощении оно представляет собой таблетку, покрытую оболочкой, содержащую ядро, содержащее: и покрытие, предпочтительно OPADRY, предпочтительно в количестве от приблизительно 10 до 20 мг и более предпочтительно приблизительно 15 мг OPADRY. В еще одном воплощении оно представляет собой таблетку, покрытую оболочкой, содержащую ядро, содержащее: и покрытие, предпочтительно OPADRY, предпочтительно в количестве от приблизительно 10 до 20 мг и более предпочтительно приблизительно 15 мг OPADRY. Способ изготовления Настоящие фармацевтические композиции могут быть изготовлены известными способами, например, прессованием или гранулированием. При изготовлении фармацевтических композиций фезотеродин или его фармацевтически приемлемые соль или сольват обычно могут быть смешаны с эксципиентом или смесью эксципиентов или разбавлены эксципиентом или смесью эксципиентов, или включены в эксципиент или смесь эксципиентов. Грануляты, содержащие фезотеродин или его фармацевтически приемлемые соль или сольват, могут быть изготовлены гранулированием, например, сухим гранулированием или, предпочтительно,; влажным гранулированием. Влажное гранулирование обычно проводят добавлением жидкости, например, воды, к смеси активного ингредиента (например, фезотеродина или его солей или сольватов) и дополнительных эксципиентов для образования гранулятов (например, сахарного спирта, выбранного из сорбита и ксилита) и, затем, гранулированием влажной смеси. В одном воплощении увлажнение смеси фезотеродина и сорбита или ксилита может быть проведено на обычном оборудовании для гранулирования, таком как смеситель с большим усилием сдвига (например, Lodige MGT 250) или распылительная сушилка с псевдоожиженным слоем (например, GlattGPCG 60/90), распылением жидкости, такой, как например этанол, изопропанол, водные растворы этанола или изопропанола, или предпочтительно воды или водной жидкости для гранулирования, на смесь фезотеродина и сорбита или ксилита обычными фармацевтическими способами. Увлажнение может также быть проведено непосредственным добавлением жидкости, такой как вода или водная жидкость для гранулирования, к указанной выше смеси в процессе смешивания в подходящем устройстве для смешивания, например, грануляторе с мешалкой с большим усилием сдвига. Термин "водная жидкость для гранулирования" относится к водной дисперсной системе, содержащей очищенную или деминерализованную воду (Ph.Eur.) в качестве жидкости и твердое вещество, диспергированное, суспендированное или растворенное в жидкости. Смешивание эксципиентов самих по себе или с фезотеродином может быть осуществлено в обычных устройствах, используемых для смешивания порошков, например, неподвижными (пассивными) мешалками, мешалками с псевдоожиженным слоем, диффузионными, двухконусными диффузионными,двухконусными, трубчатыми, кубическими, планетарными, Y-образными, V-образными мешалками или мешалками с большим усилием сдвига. Для высушивания влажного гранулята могут быть использованы обычные системы для высушивания, такие как сушилки с псевдоожиженным слоем или сушильные камеры. В способах, как описано выше, прессование, в частности, с образованием таблеток, может быть осуществлено с использованием автоматической ротационной таблеточной машины от различных изготовителей оборудования для использования в фармацевтической промышленности. Для нанесения пленочной оболочки может быть использовано обычное оборудование, такое как система для нанесения покрытия Driacoater 1200 или другие обычные дражировочные котлы, используемые в фармацевтической промышленности. Способ изготовления фармацевтической композиции можно проводить как способ влажного или сухого гранулирования или как способ прямого прессования. Неожиданно было определено, что фезотеродин особенно стабилен в фармацевтической композиции, изготовленной в присутствии жидкости, предпочтительно воды, и особенно если фармацевтическая композиция, содержащая фезотеродин, изготовлена способом влажного гранулирования, особенно пред- 16015909 почтительно, если вода использована в качестве жидкости в способе влажного гранулирования. Поскольку фезотеродин содержит сложноэфирную функциональную группу, ожидали, что воздействие воды на фезотеродин приведет к большему гидролизу сложного эфира, чем отсутствие воздействия воды на фезотеродин. Таким образом, до работы авторов изобретения, ожидали, что способы влажного гранулирования приведут к большему гидролизу, чем способы сухого гранулирования. Вместо этого,неожиданно, например, фармацевтические композиции фезотеродина и ксилита в форме таблеток, которые были изготовлены способом, включающим влажное гранулирование, тестировали на стабильность в течение 6 недель при 40 С, 75% r.Н. в закрытых флаконах, и было обнаружено, что они содержат лишь приблизительно 0,5% продукта гидролиза (то есть, активного метаболита) и лишь приблизительно 0,7% продуктов полной деградации (см. табл. 8). Напротив, было обнаружено, что таблетки, содержащие фезотеродин и ксилит, которые были изготовлены прямым прессованием (то есть, способом, не включающим влажное гранулирование) и которые хранили в тех же условиях, содержали приблизительно 1,3% продукта гидролиза (то есть, активного метаболита) и приблизительно 2,1% продуктов полной деградации (см. табл. 8). Соответственно, другое воплощение, представленное здесь, представляет собой фармацевтическую композицию, содержащую фезотеродин и ксилит, содержащую не более чем приблизительно 0,5% (и, в частности, не более чем приблизительно 0,48%) продукта гидролиза (то есть, активного метаболита) и не более чем приблизительно 0,7% (и, в частности, не более чем приблизительно 0,68%) продуктов полной деградации после хранения в течение 6 недель при приблизительно 40 С, 75% r.Н. в закрытых флаконах. Фармацевтические композиции фезотеродина и ксилита в форме таблеток, которые были изготовлены способом, включающим влажное гранулирование, тестировали на стабильность в течение 6 месяцев при комнатной температуре в закрытых флаконах, и было обнаружено, что они содержат лишь приблизительно 0,2% продукта гидролиза (то есть, активного метаболита) (по массе по сравнению с фезотеродином) и лишь приблизительно 1,3% продуктов полной деградации (см. табл. 9). Напротив, было обнаружено, что таблетки, содержащие фезотеродин и ксилит, которые были изготовлены сухим гранулированием и которые хранили в тех же условиях, содержат приблизительно 0,8% продукта гидролиза (то есть, активного метаболита) и приблизительно 1,7% продуктов полной деградации (по массе по сравнению с фезотеродином) (см. табл. 9). Соответственно, здесь также предложена фармацевтическая композиция, содержащая фезотеродин и ксилит, содержащая не более чем приблизительно 0,2% (и, в частности, не более чем приблизительно 0,27%) продукта гидролиза (то есть, активного метаболита) и не более чем приблизительно 1,3% (и, в частности, не более чем приблизительно 1,33%) продуктов полной деградации после хранения в течение 6 месяцев при комнатной температуре в закрытых флаконах. Также предложен улучшенный способ изготовления гранулята фезотеродина и стабилизатора, как определено выше, включающий стадию влажного гранулирования фезотеродина и стабилизатора. Подобным образом, предложен гранулят фезотеродина и стабилизатора, как определено выше, получаемый или полученный способом, включающим стадию влажного гранулирования фезотеродина и стабилизатора, как определено выше. В предпочтительном воплощении, при влажном гранулировании используют воду. Способ влажного гранулирования может включать:(а) получение смеси фезотеродина и стабилизатора, как определено выше;(б) добавление воды к смеси для образования влажной смеси; и(в) гранулирование влажной смеси. Соотношение фезотеродинхтабилизатор в смеси стадии (а) может составлять от приблизительно 1:1 до приблизительно 1:20 и более предпочтительно составляет от приблизительно 1:1 до приблизительно 1:10. В предпочтительном воплощении способ влажного водного гранулирования включает обеспечение фезотеродина, возможно, микронизированного, или его фармацевтически приемлемых соли или сольвата; гранулирование указанного фезотеродина или его указанных соли или сольвата совместно с подходящими эксципиентами, такими как, например, стабилизатор, как определено выше, с использованием воды или дисперсной системы на водной основе в качестве жидкости для гранулирования с получением гранулята; смешивание указанного выше, возможно, с НРМС и/или другими эксципиентами, с образованием смеси для прессования; прессование смеси для прессования с образованием желаемой формы; и,возможно, нанесение покрытия. В еще одном воплощении фармацевтическую композицию, содержащую фезотеродин или его фармацевтически приемлемые соли, изготавливают следующим образом:(а) обеспечением сухой смеси фезотеродина и сахара, сахарного спирта, полиола или их производного, предпочтительно выбранного из ксилита, сорбита, полидекстрозы, изомальта и декстрозы;(б) добавлением жидкости, предпочтительно воды, к смеси, полученной на стадии (а), с образова- 17015909 нием влажной смеси;(д) смешиванием гранулятов с по меньшей мере одним другим эксципиентом, предпочтительно по меньшей мере одним типом гидроксипропилметилцеллюлозы, с образованием смеси гранулятов и по меньшей мере одного другого эксципиента, предпочтительно гидроксипропилметилцеллюлозы, и, возможно, добавлением дополнительных эксципиентов;(е) прессованием смеси гранулятов и по меньшей мере одного другого эксципиента, предпочтительно гидроксипропилметилцеллюлозы, с образованием таблеток; и(ж) покрытием таблеток. Фармацевтические композиции, описанные здесь в форме таблетки или, возможно, таблетки, покрытой оболочкой, неожиданно стабильны в жестких условиях (40 С, относительной влажности 75%). Срок хранения предпочтительной композиции при комнатной температуре может составлять 2 года. Примеры 1. Изготовление гранулята влажным гранулированием. Раздельно взвешивали 6,4 кг гидрофумарата фезотеродина и 57,6 кг ксилита. Если ксилит был агломерирован, его пропускали через сито (1,5 мм). Гидрофумарат фезотеродина и ксилит пропускали через сито (0,8 мм). Вещества переносили в подходящий гранулятор с мешалкой с большим усилием сдвига (например,Lodige Diosna V25 или Lodige Diosna P1/6) и перемешивали в течение 1 мин. 3,6 л очищенной воды добавляли к сухой смеси во время перемешивания. Смесь перемешивали с использованием вибратора в течение от 90 до 120 с. Смеситель опорожняли и содержимое переносили на просеиватель. Влажный гранулят пропускали через сито или фильтр (4,0 мм). Просеянный гранулят высушивали на подносах при 45 С в течение как минимум 8 ч в сушильной камере/сушильном шкафу до содержания воды не более 0,5%. Высушенный гранулят пропускали через сито (от 0,5 до 1,0 мм). Перемешивание (скорость: 8 об/мин) проводили в течение 5 мин. 2. Изготовление смеси для прессования. 2.1. 4 мг таблетки с длительным высвобождением (SR-таблетки). 16,0 кг гранулята и 48,6 кг MIGROCELAC 100 пропускали через сито (от 0,5 до 1,0 мм) (например, FREWITT), переносили в контейнер для смешивания и перемешивали (скорость: 8 об/мин) в течение 10 мин. 28,0 кг гипромеллозы (например, METHOCEL K100M), 28,0 кг гипромеллозы (например,METHOCEL K4M), 4,0 кг дибегената глицерина и 3,4 кг талька добавляли к предварительно полученной смеси и перемешивали (скорость: 8 об/мин) в течение 1 мин. Смесь пропускали через сито (от 0,5 до 1,0 мм) (например, FREWITT) в контейнер для смешивания. Перемешивание (скорость: 8 об/мин) проводили в течение от 10 до 30 мин. 2.2. 8 мг SR-таблетки. 32,0 кг гранулята и 31,0 кг MICROCELAC 100 пропускали через сито (от 0,5 до 1,0 мм) (например, FREWITT), переносили в контейнер для смешивания и перемешивали (скорость: 8 об./мин) в течение 10 мин. 48,0 кг гипромеллозы (например, METHOCEL K100M), 9,6 кг гипромеллозы (например,METHOCEL K4M), 4,0 кг дибегената глицерина и 3,4 кг талька добавляли к предварительно полученной смеси и перемешивали (скорость: 8 об/мин) в течение 1 мин. Смесь пропускали через сито (от 0,5 до 1,0 мм) (например, FREWITT) в контейнер для смешивания. Перемешивание (скорость: 8 об/мин) проводили в течение от 10 до 30 мин. 3. Таблетирование. Конечную смесь для прессования переносили в ротационную таблеточную машину и прессовали с получением овальных двояковыпуклых таблеток. 4. Покрытие.OPADRY и очищенную воду добавляли в сосуд в условиях перемешивания. Смесь перемешивали в течение по меньшей мере 1 ч. Затем суспензию пропускали через сито подходящего размера (например, 300 мкм) и переносили в резервуар для растворения дражировочного котла (например, Driacoater 1200). Пленочную оболочку наносили на ядра в условиях постоянного перемешивания суспензии до тех пор, пока масса одной таблетки, покрытой оболочкой, не достигала 335 мг. 5. Типичные составы композиций с длительным высвобождением.q.s. = quantum satis = сколько требуетсяудалена в процессе сушки влажного гранулята или в процессе покрытия оболочкой до общей остаточной влажности приблизительно 2,5-3,5%. Величины представлены в миллиграммах. Таблица 2. Состав 8 мг SR-таблеток фезотеродинаq.s. = quantum satis = сколько требуетсяудалена в процессе сушки влажного гранулята или в процессе покрытия оболочкой до общей остаточной влажности приблизительно 2,5-3,0%. Величины представлены в миллиграммах. 6. Тесты на стабильность. а) Хранение таблеток в закрытых контейнерах. Композиции в форме таблеток из примеров А, Е и Ж, содержащие 4, 8 и 8 мг гидрофумарата фезотеродина соответственно, тестировали на стабильность. Результаты показаны в табл. 3 ниже.- 19015909 Недеградировавший фезотеродин в таблетках измеряли посредством HLPC в следующих условиях и рассматривали как показатель стабильности. Колонка: Prontosil Spheribond CN, 5 мкм, 250 мм 4 мм или эквивалент. Компонент А: вода/трифторуксусная кислота 1000/1 (об./об.). Компонент Б: ацетонитрил/трифторуксусная кислота 1000/1 (об./об.). Градиентный профиль: Скорость потока: 1,2 мл/мин. Температура колонки: 35 С. Наносимый объем: 75 мкл. Длина волны при детектировании: 220 нм. Время удерживания активного метаболита составляло приблизительно 4,7 мин; коэффициент чувствительности детектора: 1,5. Оценку результатов HPLC проводили способом площадь-процент. Среднее содержание продукта гидролиза или деградации (мас.%), наблюдаемые после хранения при 25 С, 60% r.Н. в закрытых контейнерах (25 мл флаконах из коричневого стекла, закупоренных пластиковой крышкой и парафиновым уплотнением, без какого-либо влагопоглотителя), для соответствующих композиций показано в таб.3 ниже. Таблица 3% гидролиза = продукт гидролиза фезотеродина (активный метаболит) (% по массе)% деградации = полная деградация фезотеродина (% по массе) б) Хранение в открытых флаконах. Гидрофумарат фезотеродина, гранулят, содержащий гидрофумарат фезотеродина и ксилит в массовом соотношении 10:90, а также композицию, содержащую гидрофумарат фезотеродина и ксилит, хранили в открытых флаконах (25 мл флаконах из коричневого стекла) в течение вплоть до 12 недель при 40 С и 75% r.Н. Результаты показаны в табл. 4 ниже. Деградацию фезотеродина определяли посредством HPLC. Для определения продуктов деградации при тестировании стабильности гидрофумарата фезотеродина использовали следующие условия. Колонка: Polaris С 18-Ether, 3 мкм, 250 мм 4,6 мм. Элюент А: вода/метансульфоновая кислота 1000:0,5 (об./об.). Элюент Б: ацетонитрил/метансульфоновая кислота 1000:0,5 (об./об.). Типичный градиентный профиль. Температура колонки: 35 С. Скорость потока: 1,2 мл/мин. Длина волны при детектировании: 220 нм. Наносимый объем: 20 мкл.- 20015909 Время удерживания активного метаболита составляло приблизительно 4,1 мин (относительное время удерживания (rrt) = 0,50); коэффициент чувствительности детектора: 1,4. Оценку результатов HPLC проводили способом площадь-процент. Сравнение наблюдаемого среднего содержания недеградировавшего фезотеродина в грануляте, содержащем фезотеродин, и соответствующей композиции по сравнению с чистым фезотеродином после открытого хранения в стрессовых условиях изложено в Таблице 4, где величины указаны в процентах гидрофумарата фезотеродина, сохранившегося в различные моменты времени. Таблица 4 в) Стабильность смесей фезотеродина с сахарными спиртами. Смеси гидрофумарата фезотеродина с ксилитом, сорбитом, маннитом и мальтитом хранили в течение 6 недель и 3 месяцев, соответственно, в закрытых флаконах при 25 С и 60% r.Н, в закрытых флаконах при 40 С и 75% r.Н. или в открытых флаконах при 40 С и 75% r.Н. и затем тестировали на стабильность, измеряя долю недеградировавшего фезотеродина. Изначально доля недеградировавшего фезотеродина в смесях составляла 99,7%. В табл. 5 а показано, что в то время как фезотеродин стабилизирован в отношении деградации в открытых флаконах, когда он смешан с ксилитом или сорбитом, он разлагается быстрее, когда он смешан с маннитом и мальтитом. В табл. 5 б показано, что лактоза дестабилизирует фезотеродин, в то время как ксилит способен снижать дестабилизирующий эффект лактозы. Таблица 5 б. Недеградировавший фезотеродин в смесях через 6 недель и 3 месяца, соответственно г) Деградация фезотеродина в процессе изготовления гранулята. Грануляты фезотеродина с различными сахарами, сахарными спиртами, полиолами или их производными изготавливали, как описано в примере 1. После изготовления гранулятов и через шесть недель и 3 месяцев хранения, соответственно, в различных условиях определяли деградацию фезотеродина в гранулятах. Результаты представлены в табл. 6.% гидролиза = продукт гидролиза фезотеродина (активный метаболит) (мас.%);% деградации = продукты полной деградации фезотеродина (мас.%); nd = не определено;измерено при 30 С, 65% r.Н. д) Деградация фезотеродина в процессе изготовления таблеток. Грануляты фезотеродина с различными сахарами и сахарными спиртами изготавливали, как описано в примере 1. Эти грануляты затем использовали для изготовления 4 мг таблеток в соответствии с примером 2.1 и с составом, приведенным в "Примере В" в таблице 1, а также где ксилит заменен маннитом,мальтитом, собритом или лактозой. После изготовления таблеток и после шести недель и 3 месяцев хранения, соответственно, в различных условиях степень деградации фезотеродина определяли измерением- 23015909 недеградировавшей доли фезотеродина. Результаты показаны в табл. 7. Таблица 7. Деградация фезотеродина в таблетках с гранулятами различных сахаров и сахарных спиртов% гидролиза = продукт гидролиза фезотеродина (активный метаболит) (мас.%);% деградации = продукты полной деградации фезотеродина (мас.%). е) Стабильность фезотеродина в таблетках после влажного гранулирования по сравнению с прямым прессованием таблетки с составом "Примера В" табл. 1 получали или (а) способом по примерам 1 и 2.1,то есть, влажным гранулированием фезотеродина и ксилита, или (б) прямым прессованием всех эксципиентов. Таблетки затем подвергали тестированию на стабильность в течение 6 недель и 3 месяцев, соответственно, при 40 С, 75% r.Н. в закрытых флаконах. Результаты показаны в табл. 8. Таблица 8. Сравнение стабильности фезотеродина в таблетках в течение 6 недель и 3 месяцев, соответственно, в стрессовых условиях после (а) влажного гранулирования или (б) прямого прессования в присутствии ксилита Гидролиз по массе относится к проценту по массе активного метаболита. Полная деградация по массе относится к проценту по массе продуктов полной деградации фезотеродина. ж) Стабильность фезотеродина в таблетках после сухого гранулирования.- 24015909 Таблетки с составом "Примера В" табл. 1 изготавливали следующим образом: 3,5 кг гидрофумарата фезотеродина смешивали с 31,5 кг ксилита и просеивали через 0,032" (0,081 см) сито. Смесь подвергали сухому прессованию с использованием вальцового устройства для прессования при давлении 1250 фунт/кв. дюйм (8618,8 кПа). Прессованные ленты гранулировали с использованием сита 20 меш в осцилляторном грануляторе. Материал затем просеивали через 0,040".(0,102 см) колосниковое сито (grater screen). Добавляли и перемешивали 33,91 кг MICROCELAC 100 и 15,09 кг гипромеллозы К 100 М. После просеивания через 0,040" смесь подвергали сухому прессованию при 700 фунт/кв. дюйм (4826,5 кПа). После прессования материал гранулировали с использованием осцилляторного сита 16 меш и в завершение с использованием 0,062" (0,158 см) колосникового сита. Добавляли 37,41 кг гипромеллозы К 100 М, 0,5 кг гипромеллозы K4M и 3,72 кг талька, перемешивали и смесь просеивали через 0,062" колосниковое сито. После последующего перемешивания добавляли 4,38 кг глицерилбегената и смесь перемешивали с образованием смеси для прессования. Конечную смесь для прессования переносили в ротационную таблеточную машину и прессовали с образованием овальных двояковыпуклых таблеток.OPADRY и очищенную воду добавляли в емкость при перемешивании. Смесь перемешивали в течение по меньшей мере 1 ч. Затем суспензию пропускали через сито подходящего размера (например,300 мкм) и переносили в резервуар для растворения дражировочного котла (например, Driacoater 1200). Пленочную оболочку наносили на ядра при постоянном перемешивании суспензии до тех пор, пока масса одной таблетки, покрытой оболочкой, не достигала 335 мг. Таблетки подвергали тестированию на стабильность при комнатной температуре в течение 6 месяцев в закрытых флаконах. В табл. 9 показан результат тестирования композиции, изготовленной сухим гранулированием, на стабильность по сравнению с композицией, изготовленной влажным гранулированием в соответствии с примером 1. Таблица 9 Гидролиз по массе относится к проценту по массе активного метаболита. Полная деградация по массе относится к проценту по массе продуктов полной деградации фезотеродина. 7. Профиль растворения in vitro фармацевтических композиций, содержащих. различные количества НРМС Определяли профили растворения in vitro таблеток фезотеродина с различным содержанием НРМС. Состав таблеток показан в табл. 10 ниже. Таблица 10 Профили растворения in vitro определяли следующими аналитическими способами. Тестирование 4 мг и 8 мг SR-таблеток фезотеродина в отношении высвобождения лекарственного средства Параметры растворения Величины относятся к проценту высвобождения гидрофумарата фезотеродина. Общее количество гидрофумарата фезотеродина в таблетках составляло 4 мг. На основании этих профилей растворения композиции с содержанием НРМС более 30% (композиции "И" и "М") наиболее предпочтительны. Другой композицией, соответствующей наиболее предпочтительному профилю растворения, была композиция "П", приведенная в таблице 11 в ниже. 8. Сравнение эффективности, переносимости и безопасности композиций гидрофумарата фезотеродина и толтеродина. Было проведено рандомизированное, двойное слепое, с двойной имитацией, плацебоконтролируемое и активно контролируемое исследование у взрослых людей-субъектов мужского и женского пола. Пациентам с гиперактивным мочевым пузырем перорально вводили 4 мг и 8 мг гидрофумарата фезотеродина один раз в сутки и сравнивали с плацебо-контролем и активным контролем (4 мг/сутки толтеродина с длительным высвобождением (ER-толтеродина. Композиции с фезотеродином представляли собой следующие: 4 мг: пример А в соответствии с табл. 1, приведенной здесь; 8 мг: примеры Е и Ж в соответствии с табл. 2, приведенной здесь. Исследование проводили в 19 странах. Всего были рандомизированы 1135 субъектов и 1103 субъекта были включены во все анализируемое множество ("full analysis set"): 279 в группу лечения плацебо,265 в группу лечения 4 мг фезотеродина, 276 в группу лечения 8 мг фезотеродина и 283 в группу лечения 4 мг ER-толтеродина. Средний возраст субъектов составлял 57 лет. Всего 81% составляли женщины, и 97% составляли люди, принадлежащие к европейской расе. Значимых различий между группами лечения в отношении пола, расы, возраста или массы тела/индекса массы тела (BMI) не было. Результаты по эффективности продемонстрировали статистически значимые (во всех случаях р 0,001) улучшения по сравнению с плацебо на момент окончания лечения по основным переменным, запрашиваемым как Управлением по контролю за продуктами и лекарствами США (USFDA) (изменение среднего числа мочеиспусканий за 24 ч и изменение среднего числа эпизодов неотложного недержания мочи за 24 ч), так и Европейскими распорядительными органами ("European regulatory authorities") (изменение среднего числа мочеиспусканий за 24 ч и ответ на лечение (переменная да/нет), полученный на основании 4-разрядной шкалы эффекта лечения ("4-category Treatment Benefit Scale"). Уменьшения числа мочеиспусканий и эпизодов неотложного недержания мочи за 24 ч в группах 8 мг/сутки и 4 мг/сутки фезотеродина были существенно выше, чем в группе плацебо. Уровни ответа на лечение также были выше на момент окончания лечения в группах обеих доз фезотеродина по сравнению с плацебо. Для ERтолтеродина были показаны статистически значимые (во всех случаях р 0,008) улучшения по сравнению с плацебо на момент окончания лечения в отношении упомянутых выше основных переменных. В отношении всех основных переменных для 4 мг/сутки фезотеродина было продемонстрировано незначительно более высокое численное изменение по сравнению с плацебо, чем для ER-толтеродина. Это численное различие было более выражено для 8 мг/сутки фезотеродина. Всего 1132 субъекта были включены в множество для анализа безопасности ("safety set"): 283 в группу лечения плацебо, 272 в группу лечения 4 мг/сутки фезотеродина, 287 в группу лечения 8 мг/сутки фезотеродина и 290 в группу лечения 4 мг/сутки ER-толтеродина. Наиболее частыми нежелательными явлениями были типичные из наблюдаемых у пациентов, принимающих имеющиеся в продаже антимускариновые средства. Сухость во рту наблюдали чаще у субъектов, которых лечили фезотеродином, и субъектов, которых лечили толтеродином, по сравнению с субъектами, которых лечили плацебо (фезотеродин 4 мг/сутки 22%, фезотеродин 8 мг/сутки 34%, толтеродин 4 мг/сутки 17%, плацебо 7%). Запор наблюдали чаще у субъектов, которых лечили фезотеродином, и субъектов, которых лечили толтеродином,по сравнению с субъектами, которых лечили плацебо (фезотеродин 4 мг/сутки 3%, фезотеродин 8 мг/сутки 5%, толтеродин 4 мг/сутки 3%, плацебо 1%). Сухой кератоконъюнктивит наблюдали чаще у субъектов, которых лечили фезотеродином, и субъектов, которых лечили толтеродином, по сравнению с субъектами, которых лечили плацебо (фезотеродин 4 мг/сутки 2%, фезотеродин 8 мг/сутки 4%, толтеро- 27015909 дин 4 мг/сутки 1%, плацебо 0%). Частота сухости в горле была низкой во всех группах (фезотеродин 4 мг/сутки 1%, фезотеродин 8 мг/сутки 3%, толтеродин 4 мг/сутки 1%, плацебо 0%), также как частота задержки мочи (фезотеродин 4 мг/сутки 1%, фезотеродин 8 мг/сутки 1%, толтеродин 4 мг/сутки 0%, плацебо 0%) и снижения остроты зрения (фезотеродин 4 мг/сутки 1%, фезотеродин 8 мг/сутки 1%, толтеродин 4 мг/сутки 1%, плацебо 2%). Краткое изложение результатов процедуры закрытого тестирования представлено в табл. 12. Таблица 12 Краткое изложение статистических анализов основных переменных эффективности с применением процедуры закрытого тестирования (FAS с LOCF в SP583)FAS - все анализируемое множество, LOCF - перенос данных последнего наблюдения. Число мочеиспусканий и эпизодов неотложного недержания мочи анализировали с использованием модели ANCOVA с терминами для лечения и области, и исходного значения как независимой переменной. Ответ на лечение анализируют с применением метода аппроксимации нормальным распределением для двоичных данных. б Значимо на основании процедуры закрытого тестирования. Каждую стадию тестировали с использованием 0,05 двустороннего критерия (0,025 одностороннего). Если результат не был значимым на какой-либо стадии, то все стадии после нее признавали статистически незначимыми. в Значимо на основании процедуры закрытого тестирования. Если обе величины р на стадии 1 менее 0,05 при использовании двустороннего критерия (0,025 при использовании одностороннего критерия), то результаты для 8 мг статистически значимы. Если стадия 1 статистически значима и обе величины р на стадии 2 менее 0,05 при использовании двустороннего критерия (0,025 при использовании одностороннего критерия), то результаты для 4 мг статистически значимы. Примечание. Все результаты представлены на момент окончания лечения с использованием LOCF для отсутствующих значений. Для анализа USFDA все 4 р-величины в процедуре закрытого тестирования были меньше 0,05. Таким образом, для обеих доз фезотеродина (4 мг и 8 мг/сутки) было показано статистически значимое улучшение по сравнению с плацебо на момент окончания лечения для переменных мочеиспускания и неотложного недержания мочи. Аналогично, для анализа Европейских распорядительных органов все 4 р-величины в процедуре закрытого тестирования были меньше 0,05. Таким образом, для обеих доз фезотеродина (4 мг и 8 мг/сутки) было показано статистически значимое улучшение по сравнению с плацебо на момент окончания лечения для переменных мочеиспускания и ответа на лечение. а ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая фезотеродин или его фармацевтически приемлемые соль или сольват и фармацевтически приемлемый стабилизатор, где указанный стабилизатор выбран из группы,состоящей из ксилита, сорбита, полидекстрозы, изомальта, декстрозы и их комбинаций.- 28015909 2. Фармацевтическая композиция по п.1, где указанный стабилизатор представляет собой ксилит,сорбит или полидекстрозу. 3. Фармацевтическая композиция по п.1, где указанный стабилизатор представляет собой ксилит. 4. Фармацевтическая композиция по любому из пп.1-3, где соотношение фезотеродин/стабилизатор составляет от 1:1 до 1:20. 5. Фармацевтическая композиция по любому из пп.1-4, содержащая соль фезотеродина с собственным рН в воде 3-5. 6. Фармацевтическая композиция по п.5, где соль фезотеродина представляет собой соль ди- или трикарбоновой кислоты либо частично гидрогенизированной ди- или трикарбоновой кислоты. 7. Фармацевтическая композиция по любому из пп.1-6, содержащая гидрофумарат фезотеродина. 8. Фармацевтическая композиция по п.7, представленная в стандартной лекарственной форме и характеризующаяся тем, что гидрофумарат фезотеродина присутствует в количестве от 0,5 до 12 мг на единицу дозы. 9. Фармацевтическая композиция по любому из пп.1-8, получаемая способом, включающим по меньшей мере одну стадию гранулирования. 10. Фармацевтическая композиция по п.9, где гранулирование представляет собой влажное гранулирование. 11. Фармацевтическая композиция по п.10, где гранулирование проводят в присутствии воды. 12. Фармацевтическая композиция по любому из пп.1-11, где указанная фармацевтическая композиция дополнительно содержит агент для длительного высвобождения. 13. Фармацевтическая композиция по п.12, где агент для длительного высвобождения представляет собой простой или сложный эфир целлюлозы или их смесь. 14. Фармацевтическая композиция по п.13, где агент для длительного высвобождения представляет собой гидроксипропилметилцеллюлозу. 15. Фармацевтическая композиция по любому из пп.12-14, где агент для длительного высвобождения содержится в количестве 20-80% (мас./мас.), предпочтительно 25-65%, более предпочтительно 3065% и еще более предпочтительно 35-55% (мас./мас.) от всей композиции. 16. Фармацевтическая композиция по любому из пп.12-15, демонстрирующая кумулятивное высвобождение фезотеродина (в процентах по массе от теоретического количества фезотеродина в композиции) в анализе растворения in vitro в соответствии с Фармакопеей США 711 (USP 711) (в фосфатном буфере, рН 6,8, 37 С, при 75 об/мин) следующим образом: высвобождение фезотеродина через 1 ч составляет от 5 до 30%, предпочтительно от 6 до 26%; высвобождение фезотеродина через 2 ч составляет от 15 до 40%, предпочтительно от 18 до 38%; высвобождение фезотеродина через 4 ч составляет от 35 до 65%, предпочтительно от 36 до 56%; высвобождение фезотеродина через 16 ч составляет по меньшей мере 75%, предпочтительно по меньшей мере 80%. 17. Фармацевтическая композиция, содержащая: а) 0,3-5,0% (мас./мас.) гидрофумарата фезотеродина; б) 5-25% (мас./мас.) сорбита или ксилита; в) 20-40% (мас./мас.) смеси, содержащей 45-80% (мас./мас.) моногидрата лактозы и 55-20%(мас./мас.) микрокристаллической целлюлозы; г) 20-65% гидроксипропилметилцеллюлозы; д) 1-5% (мас./мас.) дибегената глицерина и е) 1-5% (мас./мас.) талька. 18. Фармацевтическая композиция по п.17, содержащая: а) 4,0 мг гидрофумарата фезотеродина; б) 32-40 мг ксилита (со средним размером частиц 0,001-0,30 мм); в) 115-130 мг MICROCELAC 100 (смесь моногидрата лактозы и микрокристаллической целлюлозы в соотношении 3:1); г) 65-75 мг гидроксипропилметилцеллюлозы (НРМС) с номинальной вязкостью 100000 мПас при растворении (2 мас.%) в воде; д) 65-75 мг НРМС с номинальной вязкостью 4000 мПас при растворении (2 мас.%) в воде; е) 8-12 мг дибегената глицерина; ж) 7-10 мг талька и, возможно,з) покрытие. 19. Фармацевтическая композиция по п.17, содержащая: а) 8,0 мг гидрофумарата фезотеродина; б) 65-80 мг ксилита (со средним размером частиц 0,001-0,30 мм); в) 70-85 мг MICROCELAC 100; г) 110-130 мг НРМС с номинальной вязкостью 100000 мПас при растворении (2 мас.%) в воде; д) 20-30 мг НРМС с номинальной вязкостью 4000 мПас при растворении (2 мас.%) в воде;
МПК / Метки
МПК: A61K 9/16, A61P 13/10, A61K 31/222
Метки: фезотеродин, фармацевтические, содержащие, композиции, стабилизированные
Код ссылки
<a href="https://eas.patents.su/30-15909-stabilizirovannye-farmacevticheskie-kompozicii-soderzhashhie-fezoterodin.html" rel="bookmark" title="База патентов Евразийского Союза">Стабилизированные фармацевтические композиции, содержащие фезотеродин</a>
Предыдущий патент: Инсектицидный белок в.thuringiensis cry1a.105, кодирующий его полинуклеотид и их применение
Следующий патент: Производные бензотиазинона и их применение в качестве антибактериальных средств
Случайный патент: Петля для дверки духового шкафа












