Производные спиропиперидина и их использование в качестве терапевтических агентов
Номер патента: 1574
Опубликовано: 25.06.2001
Авторы: Харрисон Тимоти, Кулаговский Януш Йозеф, Свейн Кристофер Джон, Холлингворт Грегори Джон, Эллиотт Джейсон Мэттью, Вилльямс Брайан Джон, Джексон Филип Стефен, Кертис Нил Рой, Сьюард Эйлин Мэри, Бейкер Рэймонд
Формула / Реферат
1. Соединение формулы (I)
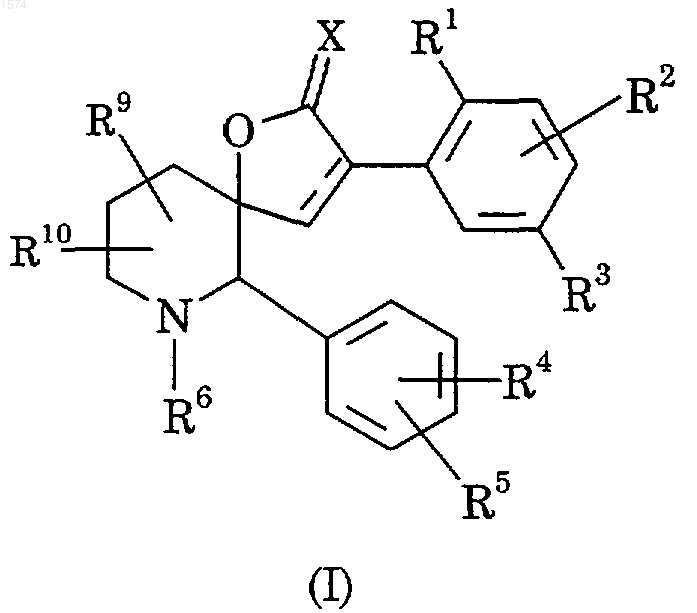
где R1 означает водород, гидрокси, C1-6-алкил, С2-6-алкенил, С3-7-циклоалкил, С3-7-циклоалкил-С1-4-алкил, C1-6-алкокси, фтор-С1-6-алкокси, C1-6-алкокси-С1-4-алкил, С1-б-алкокси-С1-4-алкокси, фтор-С1-6-алкокси-С1-4-алкил, С2-6-алкенилокси, С3-7-циклоалкокси, С3-7-циклоалкил-С1-4-алкокси, фенокси, бензилокси, циано, галоген, NRaRb, SRa, SORa, SO2Ra, OSO2Ra, NRaCOR14, CORa, CO2Ra или CONRaRb, где Ra и Rb независимо друг от друга означают водород, C1-4-алкил- или фтор-С1-4-алкилгруппу;
R2 означает водород, галоген, C1-6-алкил- или C1-6-алкоксигруппу;
или, если R2 находится рядом с R1, они могут вместе образовать 5- или 6-членное насыщенное или ненасыщенное кольцо, содержащее один или два атома, выбранных из азота, кислорода и серы, причем в кольце может быть заместитель из группы, выбранной из C1-4-алкил, СF3, =O или =S;
R3 означает водород, галоген, C1-6-алкил, фтор-C1-6-алкил, C1-6-алкокси, фтор-C1-6-алкокси, С3-7-циклоалкил, С3-7-циклоалкил-С1-4-алкил, циано, SRa, SORa, SO2Ra, NRaRb, NRaCOR14, CORa, CO2Ra, CONRaRb или C1-4-алкилгруппу, замещенную цианогруппой, CO2Ra или CONRaRb, где Ra и Rb принимают указанные значения;
R4 означает водород, галоген, C1-6-алкил, C1-6-алкокси, СF3, ОСF3, NO2, CN, SRa, SORa, SO2Ra, CO2Ra, CONRaRb, С2-6-алкенил, С2-6-алкинил- или C1-4-алкилгруппу, замещенную C1-4-алкоксигруппой, где Ra и Rb принимают указанные значения;
R5 означает водород, галоген, C1-6-алкил, СF3 или C1-6-алкокси, замещенный C1-4-алкоксигруппой;
R6 означает водород, CORa, СО2Ra, COCONRaRb, COCO2Ra, C1-6-алкил, необязательно замещенный группой, выбранной из (СО2Ra, CONRaRb, гидрокси, CN, CORa, NRaRb, C(NOH)NRaRb, СОNH-фенил-(С1-4-алкил-), СОСО2Ra, CONHNRaRb, C(S)NRaRb, CONRaC1-6-алкил-R12, CONR13C2-6-алкенил, CONR13C2-6-aлкинил, COCONRaRb, CONRaC(NRb)NRaRb, CONRa-гетероарил и фенил, необязательно замещенной одним, двумя или тремя заместителями, выбранными из C1-6-алкил, C1-6-алкокси, галогена и трифторметила, где гетероарил представляет собой группу, выбранную из пирролила, фуранила, тиенила, пиридила, пиразолила, имидазолила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиразинила, пиримидинила, пиридазинила, триазолила, оксадиазолила, тиадиазолила, триазинила и тетразолила;
или R6 означает группу формулы -CH2Cу CCH2NR7R8, где R7 и R8 принимают указанные ниже значения;
или R6 означает C1-6-алкил, необязательно замещенный оксогруппой, замещенный гетероциклом, выбранным из группы, включающей
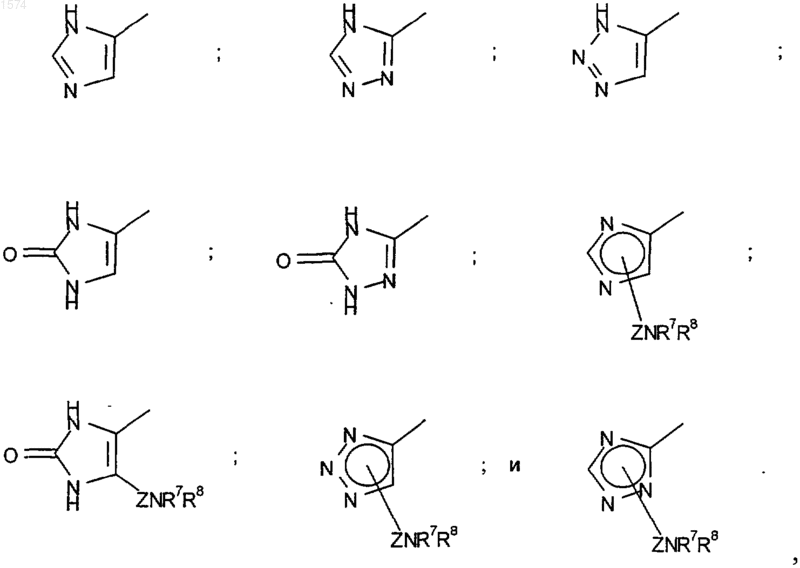
где Z означает C1-6-алкилен или С3-6-циклоалкил;
R7 означает водород или C1-4-алкил, С3-7-циклоалкил, С3-7-циклоалкил-C1-4-алкил или С2-4-алкил, замещенный C1-4-алкокси или гидрокси;
R8 означает водород или C1-4-алкил, С3-7-циклоалкил, С3-7-циклоалкил-C1-4-алкил или С2-4-алкил, замещенный С1-4-алкокси, гидрокси или гетероалифатическим кольцом, выбранным из группы, включающей пирролидино, пиперидино, пиперазино, морфолино и тиоморфолино;
или R7, R8 и атом азота, к которому они присоединены, образуют гетероалифатическое кольцо, выбираемое из группы, включающей азетидинил, пирролидинил, пиперидил, морфолино, тиоморфолино, пиперазино и пиперазино, замещенную при атоме азота C1-4-алкилгруппой либо С2-4-алкилгруппой, замещенной гидрокси- или C1-2-алкоксигруппой, причем указанное гетероалифатическое кольцо необязательно замещено одной или двумя, группами, выбранными из гидрокси или C1-4-алкокси, необязательно замещенной C1-4-алкокси- или гидроксигруппой;
или R7, R8 и атом азота, к которым они присоединены, образуют неароматическую азабициклическую кольцевую систему, выбранную из 5-азабицикло[2.1.1]гексила, 5-азабицикло[2.2.1]гептила, 6-азабицикло[3.2.1]-октила, 2-азабицикло[2.2.2]октила, 6-азабицикло[3.2.2]нонила, 6-азабицикло[3.3.1]нонила, 6-азабицикло[3.2.2]децила, 7-азабицикло[4.3.1]децила, 7-азабицикло[4.4.1]ундецила и 8-азабицикло[5.4.1]додецила;
или Z, R7 и атом азота, к которому они присоединены, образуют гетероалифатическое кольцо, выбираемое из группы, включающей азетидинил, пирролидинил, пиперидил и морфолино;
R9 и R10 каждый независимо друг от друга означают водород, галоген, C1-6-алкил, СН2ОRe, оксо, CO2Ra или CONRaRb, где Ra и Rb имеют указанные значения, a Re означает водород, C1-6-алкил или фенил;
R12 означает ORa, CONRaRb или гетероарил, где гетероарил определен как указано выше;
R13 означает водород или C1-6-алкил;
R14 означает C1-6-алкил , C1-6-алкокси, фтор-С1-6-алкил или фенил;
Х означает атом кислорода или два атома водорода; и
пунктир означает необязательную двойную связь;
или их фармацевтически приемлемые соли.
2. Соединение по п.1, где R1 означает гидрокси, C1-6-алкил, С2-6-алкенил, C1-6-алкокси, фтор-С1-6-алкокси, С2-6-алкенилокси, С3-7-циклоалкокси, С3-7-циклоалкил-С1-4-алкокси, циано, NRaRb, SRа, OSO2Rа, или R1 вместе с группой R2 образуют 5-членное насыщенное кольцо, содержащее один атом кислорода.
3. Соединение по п.1 или 2, где R2 означает водород, атом фтора или хлора.
4. Соединение по любому из пп.1-3, где R3 означает водород, галоген, фтор-С1-6-алкил, фтор-С1-6-алкокси, циано, NRaRb или NRаСOR14.
5. Соединение по любому из пп.1-4, где R4 означает атом водорода или фтора.
6. Соединение по любому из пп.1-5, где R5 означает атом водорода.
7. Соединение по любому из пп.1-6, где R6 означает атом водорода или C1-6-алкилгруппу, замещенную 5-членным гетероциклом, содержащим 2 или 3 атома азотр, как определено в п.1.
8. Соединение по любому из пп.1-7, где один из R9 и R10 означает водород.
9. Соединение по любому из пп.1-8, где Х означает два атома водорода.
10. Соединение по любому из пп.1-9, где двойная связь, представленная пунктиром, отсутствует.
11. Соединение по п.1, имеющее формулу (Iа)
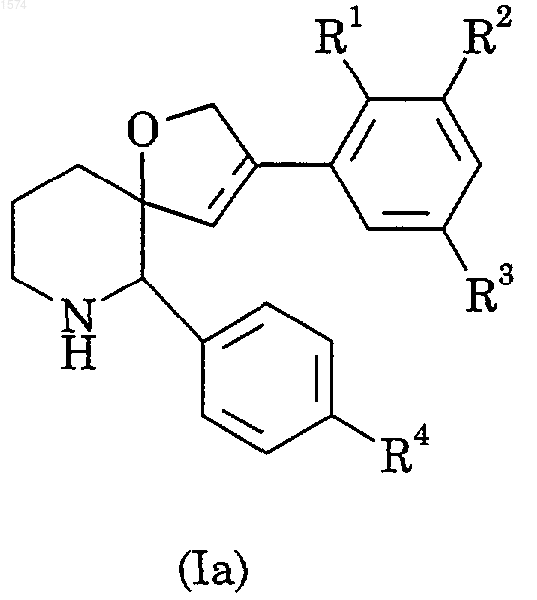
где R1, R2, R3, R4 и пунктир имеют значения, как определено в п.1, или его фармацевтически приемлемая соль.
12. Соединение по п.1, где R1 означает водород, гидрокси, C1-6-алкил, С2-6-алкенил, С3-7-циклоалкил, С3-7-циклоалкил-С1-4-алкил, C1-6-алкокси, фтор-C1-6-алкокси, С1-6-алкокси-С1-4-алкил, С1-6-алкокси-С1-4-алкокси, фтор-С1-6-алкокси-С1-4-алкил, С2-6-алкенилокси, С3-7-циклоалкокси, С3-7-циклоалкил-С1-4-алкокси, фенокси, бензилокси, циано, галоген, NRaRb, SRa, SORa, SO2Ra, OSO2Ra, NRaCOR14, CORa, CO2Ra или CONRaRb, где Ra и Rb, каждый независимо друг от друга, означают водород, C1-4-алкил или фтор-С1-4-алкил;
R2 означает водород или галоген;
или, если R2 находится рядом с R1, они могут вместе образовать 5-членное ненасыщенное кольцо, содержащее атом кислорода;
R3 означает водород, галоген, C1-6-алкил, фтор-С1-6-алкил, C1-6-алкокси, фтор-С1-6-алкокси, С3-7-циклоалкил, С3-7-циклоалкил-С1-4-алкил, циано, SRa, SORа, SO2Rа, NRaRb, NRaCOR14, CORa, CO2Ra, CONRaRb или C1-4-алкил, замещенный цианогруппой, СО2Ra или CONRaRb, где Ra и Rb имеют указанные выше значения;
R4 означает водород или галоген;
R5 означает водород;
R6 означает водород или R6 означает C1-6-алкил, замещенный гетероциклом, выбранным из группы, включающей
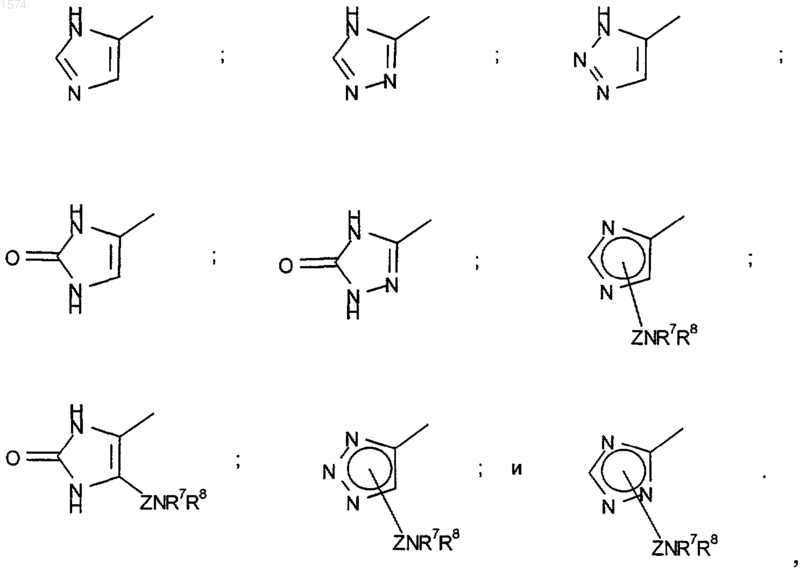
R7 означает водород или C1-4-алкил;
R8 означает водород или C1-4-алкил;
R9 и R10 каждый независимо друг от друга означают водород;
R14 означает C1-6-алкил, C1-6-алкокси, фтор-С1-6-алкил или фенил;
Х означает атом кислорода или два атома водорода;
Z означает C1-6-алкилен; и
пунктир обозначает необязательную двойную связь;
или его фармацевтически приемлемая соль.
13. Соединение по п.1, выбранное из группы, включающей
(5R,6S)-3-(2-метокси-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-(2-метокси-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(2-метокси-5-трифторметоксифенил)-6-фенил-7-(1,2,4-триазолил-3-метилен)-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-(2-изопропокси-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(5R,6S)-3-(2-аллилокси-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(5R,6S)-3-(5-трифторметокси-2,3-дигидробензофуран-7-ил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(5R,6S)-3-(2-метокси-5-(2,2,2-трифторэтокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(5R,6S)-3-(2,5-бис(2,2,2-трифторэтокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(5R,6S)-3-(2-дифторметокси-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(5R,6S)-3-(2-(2,2,2-трифторэтокси)-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-(2-изопропокси-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(5-трифторметокси-2,3-дигидробензофуран-7-ил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(2-метокси-5-(2,2,2-трифторэтокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(2,5-бис(2,2,2-трифторэтокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(2-дифторметокси-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(2-(2,2,2-трифторэтокси)-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(2-(2,2,2-трифторэтокси)-5-фторфенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-(5-метансульфонил-2-метоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-(5-метансульфонил-2-метоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-[2-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-[2-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]-декан;
(5R,6S)-3-[2-циклобутокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-[2-циклобутокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-(2-(2-фторэтокси)-5-(трифторметокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-(2-(2-фторэтокси)-5-(трифторметокси)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-(2-(этен-1-ил)-5-(трифторметокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-(2-этил-5-(трифторметокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-(2-бензилокси-5-(трифторметокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-(2-гидрокси-5-(трифторметокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(2-(этен-1-ил)-5-(трифторметокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-(2-метоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-(2-метоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(2-метокси-5-(трифторметокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]декан-2-он;
(5R,6S)-N-[4-мeтoкcи-3-(6-фeнил-1-oкca-7-aзacпиpo[4.5]дeк-3-eн-3-ил)фенил]трифторацетамид;
(3S,5R,6S)-N-[4-мeтoкcи-3-(6-фeнил-1-oкca-7-aзacпиpo[4.5]дeкaн-3-ил)фенил]трифторацетамид;
(3S,5R,6S)-метил-N-[4-метокси-3-(6-фенил-1-окса-7-азаспиро[4.5]декан-3-ил)фенил]-N-(метил)карбамат;
(5R,6S)-N-[4-мeтoкcи-3-(6-фeнил-1-oкca-7-aзacпиpo[4.5]дeк-3-eн-3-ил)-фeнил]-N-(мeтил)тpифтopaцeтaмид;
(3S,5R,6S)-N-[4-мeтoкcи-3-(6-фeнил-1-oкca-7-aзacпиpo[4.5]дeкaн-3-ил)-фeнил]-N-(метил)трифторацетамид;
(5R,6S)-N-[4-изопропокси-3-(6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен-3-ил)фенил]-N-(метил)трифторацетамид;
(3S,5R,6S)-N-[4-изопропокси-3-(6-фенил-1-окса-7-азаспиро[4.5]декан-3-ил)фенил]-N-(метил)трифторацетамид;
(5R,6S)-N-[4-(дифтopмeтoкcи)-3-(6-фeнил-1-oкca-7-aзacпиpo[4.5]дeк-3-eн-3-ил)фенил]-N-(метил)трифторацетамид;
(3S,5R,6S)-N-[4-(дифтopмeтoкcи)-3-(6-фeнил-1-oкca-7-aзacпиpo[4.5]дeкaн-3-ил)фенил]-N-(метил)трифторацетамид;
(5R,6S)-N-[4-метокси-3-(6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен-3-ил)фенил]-N-(2,2,2-тpифтopэтил)aцeтaмид;
(3S,5R,6S)-N-[4-метокси-3-(6-фенил-1-окса-7-азаспиро[4.5]декан-3-ил)фенил]-N-(2,2,2-трифторэтил)ацетамид;
(3S,5R,6S)-N-[4-метокси-3-(6-фенил-1-окса-7-азаспиро[4.5]декан-3-ил)фенил]-N-(метил)бензамид;
(5R,6S)-3-[5-метиламино-2-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-[5-метиламино-2-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-N-метил-N-[3-(6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен-3-ил)-4-(трифторметокси)фенил]трифторацетамид;
(3S,5R,6S)-N-мeтил-N-[3-(6-фeнил-1-oкca-7-aзacпиpo[4.5]дeкaн-3-ил)-4-(трифторметокси)фенил]трифторацетамид;
(5R,6S)-3-[2-этокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро-[4.5]дек-3-ен;
(3S,5R,6S)-3-[2-этокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-[2-(трифторметилтио)фенил]-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-[2-(трифторметилтио)фенил]-6-фенил-1-окса-7-азаспиро[4.5]-декан;
(5R,6S)-3-[2-(2,2,2-трифторэтокси)-5-(трифторметил)фенил]-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-[2-(2,2,2-трифторэтокси)-5-(трифторметил)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-[2-изопропокси-5-(трифторметил)фенил]-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-[2-изопропокси-5-(трифторметил)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-[2-циклопропил-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(5-бром-2-изопропоксифенил]-6-фенил-1-окса-7-азаспиро[4.5]-декан;
(3S,5R,6S)-3-(5-циано-2-изопропоксифенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-[5-циано-2-(дифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-[5-циано-2-(2,2,2-трифторэтокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-[5-циано-2-(циклобутилокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-3-[2-циано-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-[2-(циклопропилметилокси)-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-[2-метокси-5-(трифторметил)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-[2-метокси-5-(трифторметил)фенил]-6-фенил-1-окса-(1,2,4-триазолил-3-метил)-7-азаспиро[4.5]декан;
(5R,6S)-3-(2-метансульфонилфенил)-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-(2-метансульфонилфенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-метил-[4-гидрокси-3-(6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен-3-ил)фенил]этаноат;
(3S,5R,6S)-метил-[4-гидрокси-3-(6-фенил-1-окса-7-азаспиро[4.5]дек-3-ил)фенил]этаноат;
(3S,5R,6S)-3-[5-(цианометил)-2-метоксифенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-[4-метокси-3-(6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен-3-ил)фенил]карбоксамид;
(3S,5R,6S)-[4-метокси-3-(6-фенил-1-окса-7-азаспиро[4.5]декан-3-ил)фенил]карбоксамид;
(3S,5R,6S)-3-(5-циано-2-метоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(5R,6S)-метил-[4-метокси-3-(6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен-3-ил)фенил]этаноат;
(3S,5R,6S)-3-(5-(трифторметокси)-2-(трифторметилсульфонилокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-7-{[5-(диметиламинометил)-1Н-[1,2,3]триазол-4-ил]метил}-3-[2-изопропокси-5-(трифторметил)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-[5-фтор-2-(2,2,2-трифторэтокси)фенил]-6-фенил-1-окса-7-(1,2,4-триазолил-3-метил)-7-азаспиро[4.5]декан;
(5R,6S)-3-[2-диметиламино-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]дек-3-ен;
(3S,5R,6S)-3-[2-диметиламино-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
или его фармацевтически приемлемая соль.
14. Соединение по п.1, выбранное из группы, включающей
(3R,5R,6S)-3-(2-метокси-5-(трифторметокси)фенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3,6-бис(фенил)-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-(2-метоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-7-бензил-3-(2-метокси-5-трифторметоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-(2-метокси-5-(трифторметил)фенил)-6-фенил-1-окса-7-азаспиро[,4.5]декан;
(3R,5R,6S)-3-[2-гидрокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-(5-гидрокси-2-изопропоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2,4-бис(метокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-дифторметокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-изопропокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-(этен-1-ил)-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-(2,2,2-трифторэтокси)-5-(трифторметил)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2,5-бис(дифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[5-фтор-2-(дифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[5-фтор-2-(2,2,2-трифторэтокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-(5-фтор-2-изопропоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-изопропокси-5-(2,2,2-трифторэтокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2,5-бис(изопропокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]-декан;
(3R,5R,6S)-3-(5-хлор-2-метоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]-декан;
(3R,5R,6S)-3-[2-(2,2,2-трифторэтокси)-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-(циклопропилметокси)-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-бензилокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[5-(дифторметокси)-2-(2,2,2-трифторэтокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-(2,2-дифторэтокси)-5-(дифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-(циклобутокси)-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-(2-метоксиэтокси)-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[5-(трифторметокси)-2-(трифторметилсульфонилокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-(2,2-дифторэтокси)-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-циклопропил-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-(5-циано-2-гидроксифенил)-6-фенил-1-окса-7-азаспиро[4.5]-декан;
(3R,5R,6S)-3-[5-циано-2-(2,2,2-трифторэтокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[5-циано-2-изопропоксифенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-(этен-1-ил)-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-ацетил-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-формил-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[3-фтор-2-метокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-циано-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-этил-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-(6-фтор-2-метоксифенил)-6-фенил-1-окса-7-азаспиро[4.5]-декан;
или его фармацевтически приемлемая соль.
15. Соединение по п.1, выбранное из группы, включающей
(3S,5R,6S)-3-[2-циклопропокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-циклопропокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3S,5R,6S)-3-(2-циклопропокси-5-(трифторметил)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-циклопропокси-5-(дифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-циклопропокси-5-(трифторметокси)фенил]-6-(4-фтор-фенил)-1-окса-7-азаспиро[4.5]декан;
(3R,5R,6S)-3-[2-циклопропокси-5-(трифторметил)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан;
или его фармацевтически приемлемая соль.
16. Соединение по п.15, которое представляет собой (3R,5R,6S)-3-[2-циклопропокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан,
или его фармацевтически приемлемая соль.
17. Соединение по п.16, которое представляет собой (3R,5R,6S)-3-[2-циклопропокси-5-(трифторметокси)фенил]-6-фенил-1-окса-7-азаспиро[4.5]декан гидрохлорид.
18. Применение соединения по любому из пп.1-17 в качестве антагонистов тахикинина при терапевтическом лечении.
19. Фармацевтическая композиция, отличающаяся тем, что включрхт соединение по любому из пп.1-17 в сочетании с фармацевтически приемлемым носителем или эксципиентом.
20. Способ лечения или профилактики рвоты, отличающийся тем, что нуждающемуся в том пациенту вводят снижающее тахикинин количество соединения по любому из пп.1-17.
21. Способ лечения или профилактики депрессии, отличающийся тем, что нуждающемуся в том пациенту вводят снижающее тахикинин количество соединения по любому из пп.1-17.
22. Способ лечения или профилактики состояния тревоги, отличающийся тем, что нуждающемуся в том пациенту вводят снижающее тахикинин количество соединения по любому из пп.1-17.
23. Применение соединения по любому из пп.1-17 в производстве медикамента для лечения или профилактики рвоты.
24. Применение соединения по любому из пп.1-17 в производстве медикамента для лечения или профилактики депрессии.
25. Применение соединения по любому из пп.1-17 в производстве медикамента для лечения или профилактики состояния тревоги.
26. Способ получения соединения по п.1, в котором отсутствует двойная связь, обозначенная пунктиром, отличающийся тем, что восстанавливают соединение формулы (IIA)
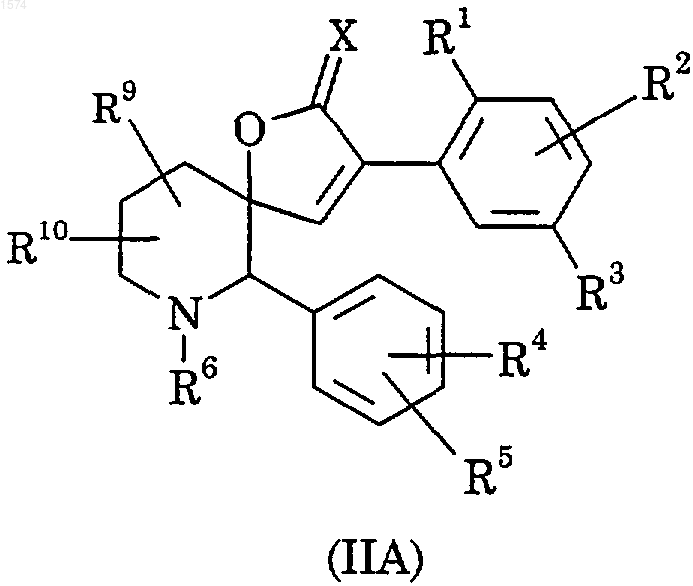
где R1, R2, R3, R4, R5, R6, R9, R10 и Х имеют значения, указанные в п.1;
причем указанный способ включает, при необходимости, дальнейшее удаление любой имеющейся защитной группы;
и в случае, когда соединение формулы (I) получают в виде смеси энантиомеров или диастереомеров, смесь необязательно разделяют с получением нужного энантиомера;
и/или, если желательно, полученное соединение формулы (I) или его соль подвергают превращению в его фармацевтически приемлемую соль.
27. Способ получения соединения по п.1, в котором отсутствует двойная связь, обозначенная пунктиром, и Х означает два атома водорода, отличающийся тем, что восстанавливают соединение формулы (IIB)
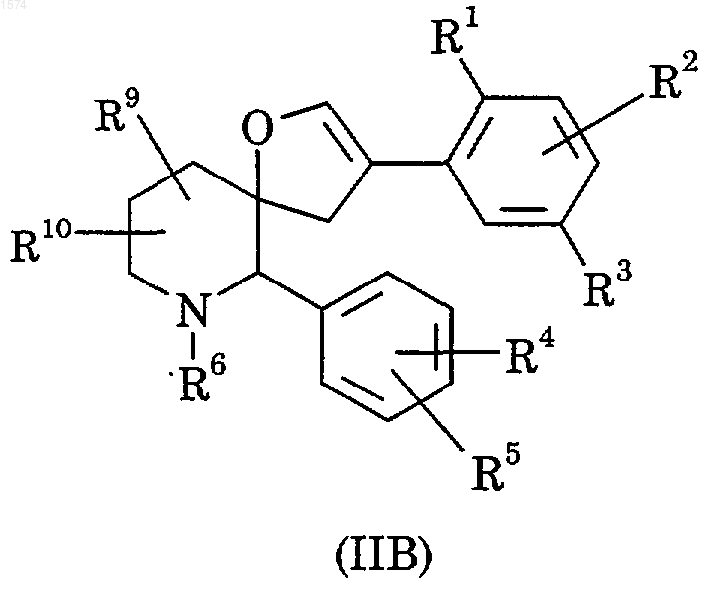
причем указанный способ включает, при необходимости, дальнейшее удаление любой имеющейся защитной группы;
и в случае, когда соединение формулы (I) получают в виде смеси энантиомеров или диастереомеров, смесь необязательно разделяют с получением нужного энантиомера;
и/или, если желательно, полученное соединение формулы (I) или его соль подвергают превращению в его фармацевтически приемлемую соль.
28. Способ получения соединения по п.1, отличающийся тем, что подвергают взаимодействию соединение формулы (V)
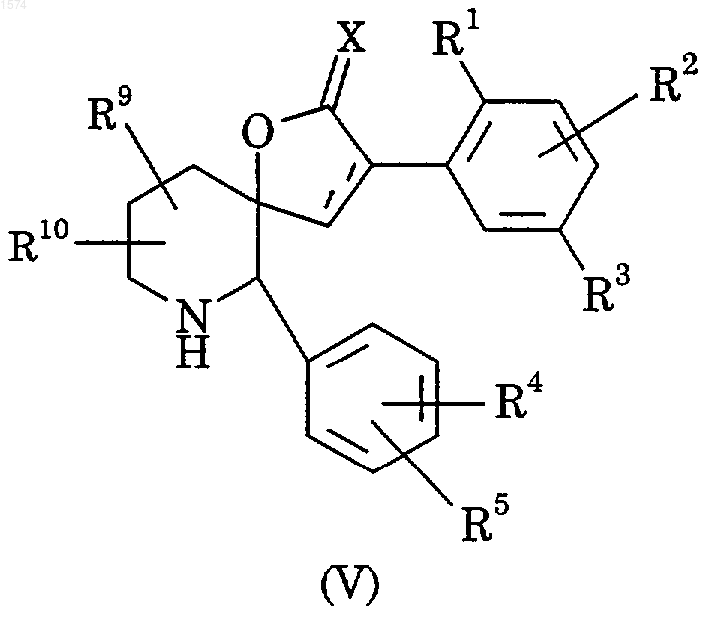
с соединением формулы (VI)
LG - R6a (VI),
где R6a означает группу формулы R6, как определено в п.1 (иную, чем Н), или ее группу-предшественника, а LG представляет собой уходящую группу; и если R6a означает группу-предшественник, превращают ее в группу R6;
причем указанный способ включает, при необходимости, дальнейшее удаление любой имеющейся защитной группы;
и в случае, когда соединение формулы (I) получают в виде смеси энантиомеров или диастереомеров, смесь необязательно разделяют с получением нужного энантиомера;
и/или, если желательно, полученное соединение формулы (I) или его соль подвергают превращению в его фармацевтически приемлемую соль.
29. Способ получения соединения по п.1, в котором R1 означает C1-6-алкокси, фтор-С1-6-алкокси, С2-6-алкенокси, С3-7-циклоалкокси, С3-7-циклоалкил-С1-4-алкокси или бензилокси, отличающийся тем, что подвергают взаимодействию соединение формулы (VII)
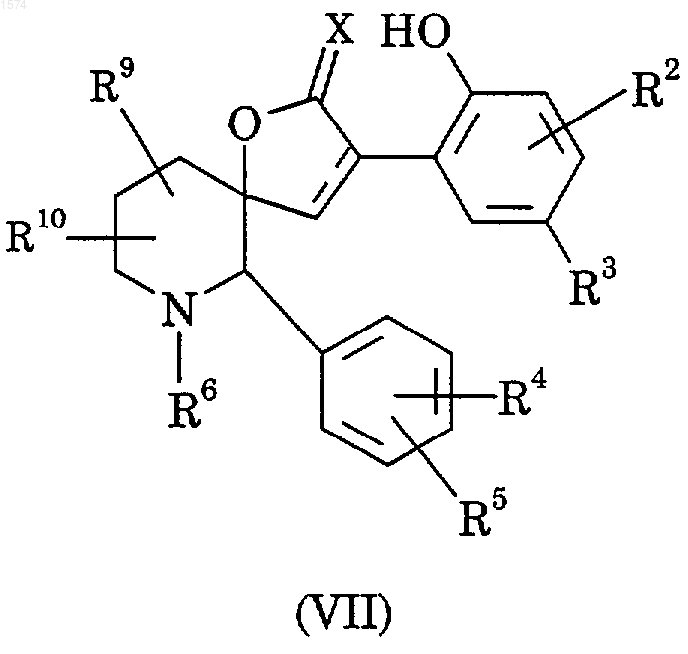
с соответствующим алкил-, фторалкил-, алкенил-, циклоалкил-, циклоалкилалкил- или аралкилгалогенидом в присутствии основания;
причем указанный способ включает, при необходимости, дальнейшее удаление любой имеющейся защитной группы;
и в случае, когда соединение формулы (I) получают в виде смеси энантиомеров или диастереомеров, смесь необязательно разделяют с получением нужного энантиомера;
и/или, если желательно, полученное соединение формулы (I) или его соль подвергают превращению в его фармацевтически приемлемую соль.
30. Способ получения соединения по п.1, отличающийся тем, что подвергают циклизации соединение формулы (VIII)
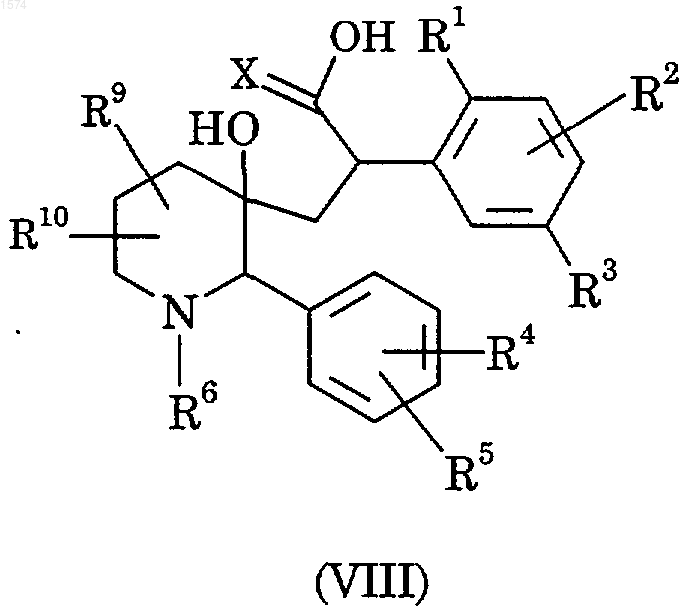
используя реагенты дегидратации;
причем указанный способ включает, при необходимости, дальнейшее удаление любой имеющейся защитной группы;
и в случае, когда соединение формулы (I) получают в виде смеси энантиомеров или диастереомеров, смесь необязательно разделяют с получением нужного энантиомера;
и/или, если желательно, полученное соединение формулы (I) или его соль подвергают превращению в его фармацевтически приемлемую соль.
31. Способ получения соединения по п.1, в котором отсутствует двойная связь, обозначенная пунктиром, отличающийся тем, что подвергают взаимодействию соединение формулы (X)
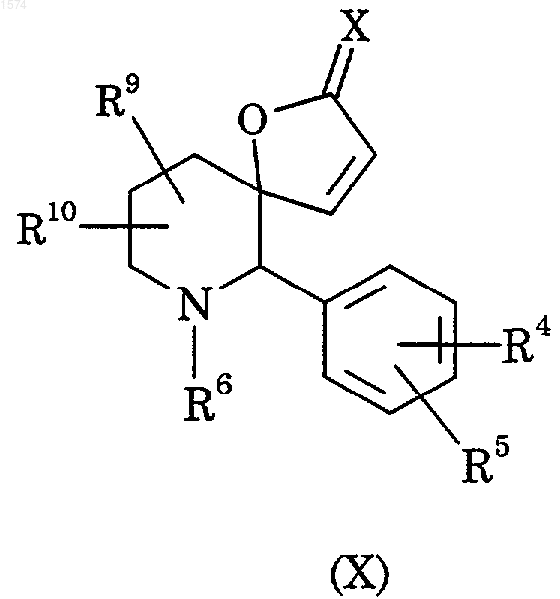
с соединением формулы (IV) в условиях при реакции восстановления по Геку (Heck);
причем указанный способ включает, при необходимости, дальнейшее удаление любой имеющейся защитной группы;
и в случае, когда соединение формулы (I) получают в виде смеси энантиомеров или диастереомеров, смесь необязательно разделяют с получением нужного энантиомера;
и/или, если желательно, полученное соединение формулы (I) или его соль подвергают превращению в его фармацевтически приемлемую соль.
32. Способ получения соединения по п.1, отличающийся тем, что подвергают взаимодействию соединение формулы (XX)
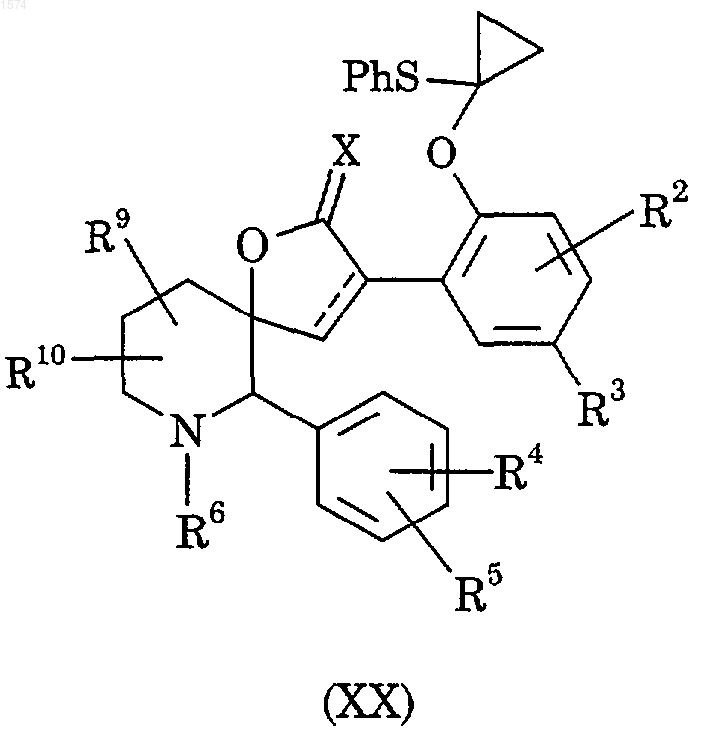
с нафталинидом лития;
причем указанный способ включает, при необходимости, дальнейшее удаление любой имеющейся защитной группы;
и в случае, когда соединение формулы (I) получают в виде смеси энантиомеров или диастереомеров, смесь необязательно разделяют с получением нужного энантиомера;
и/или, если желательно, полученное соединение формулы (I) или его соль подвергают превращению в его фармацевтически приемлемую соль.
Текст
1 Настоящее изобретение относится к классу азациклических соединений, которые могут быть использованы в качестве антагонистов тахикинина. Более конкретно, соединения по настоящему изобретению являются спирозамещенными азациклическими производными. В описании международной публикацииWO 94/20500 патентной заявки РСТ (публикация от 15.09.1994) раскрыты спироазациклические производные в качестве антагонистов вещества Р. В частности, WO 94/20500 относится к спироциклическим производным пиперидина,содержащим 1,8-диазаспиро[5.5]ундекановое ядро. Нами обнаружен следующий класс непептидных соединений, являющихся сильными антагонистами тахикининов, особенно вещества Р. Кроме того, соединения по настоящему изобретению проявляют высокую гепатическую стабильность по данным, например, микросомного анализа печени. Более того, благодаря уникальному содержанию циклопропилового эфира, предпочтительный подкласс соединений по настоящему изобретению проявляет легкую пероральную биоусвояемость наряду с высоким сродством к человеческому NK1-рецептору. Настоящее изобретение охватывает соединения формулы (I) где R1 означает водород, гидрокси, C1-6-алкил,С 2-6-алкенил, С 3-7-циклоалкил, С 3-7-циклоалкилС 1-4-алкил, C1-6-алкокси, фтор-С 1-6-алкокси, С 1-6 алкокси-С 1-4-алкил,С 1-6-алкокси-С 1-4-алкокси,фтор-С 1-6-алкокси-С 1-4-алкил, С 2-6-алкенилокси,С 3-7-циклоалкокси, С 3-7-циклоалкил-С 1-4-алкокси, фенокси, бензилокси, циано, галоген, NRaRb,SRa, SORa, SO2Ra, OSO2Ra, NRaCOR14, CORa,CO2Ra или CONRaRb, где Ra и Rb независимо друг от друга означают водород, С 1-4-алкил- или фтор-С 1-4-алкилгруппу;R2 означает водород, галоген, C1-6-алкилили C1-6-алкоксигруппу; или, если R2 находится рядом с R1, они могут вместе образовать 5- или 6-членное насыщенное или ненасыщенное кольцо, содержащее один или два атома, выбранных из азота, кислорода и серы, причем в кольце может быть заместитель из группы, выбранной из C1-4-алкил,СF3, =O или =S;R6 означает водород, CORa, CO2Ra, COCONRaRb, COCO2Ra, C1-6-алкил, необязательно замещенный группой, выбранной из (CO2Ra,CONRaRb, гидрокси, CN, CORa, NRaRb,C(NOH)NRaRb, СОNН-фенил-(C1-4-алкил-), СОСО 2Ra, CONHNRaRb, C(S)NRaRb, CONRaC1-6aлкил-R12, CONR13C2-6-алкенил, CONR13C2-6 алкинил, COCONRaRb, CONRaC(NRb)NRaRb,CONRa гетероарил и фенил, необязательно замещенной одним, двумя или тремя заместителями, выбранными из C1-6-алкил, C1-6-алкокси,галогена и трифторметила; или R6 означает группу формулы-CH2CCCH2NR7R8, где R7 и R8 принимают указанные ниже значения; или R6 означает C1-6-алкил, необязательно замещенный оксогруппой, замещенной 5 членным гетероциклом из числа указанных на с. 5 описания, содержащим 2 или 3 атома азота,необязательно замещенным =O и необязательно замещенным группой формулы -NR7R8, гдеR7 означает водород или C1-4-алкил, С 3-7 циклоалкил, С 3-7-циклоалкил-C1-4-алкил или С 2-4-алкил, замещенный C1-4-алкокси или гидрокси;R8 означает водород или C1-4-алкил, С 3-7 циклоалкил, С 3-7-циклоалкил-C1-4-алкил или С 2-4-алкил, замещенный C1-4-алкокси, гидрокси или гетероалифатическим кольцом, выбранным из группы, включающей пирролидино, пиперидино, пиперазино, морфолино и тиоморфолино; или R7, R8 и атом азота, к которому они присоединены, образуют гетероалифатическое кольцо, выбираемое из группы, включающей азетидинил, пирролидинил, пиперидил, морфолино, тиоморфолино, пиперазино и пиперазино,замещенную при атоме азота C1-4-алкилгруппой либо С 2-4-алкилгруппой, замещенной гидроксиили C1-2-алкоксигруппой, причем указанное гетероалифатическое кольцо необязательно замещено одной или двумя группами, выбранными из гидрокси или C1-4-алкокси, необязательно замещенной C1-4-алкокси- или гидроксигруппой; или R7, R8 и атом азота, к которым они присоединены, образуют неароматическую аза 3 бициклическую кольцевую систему из 6-12 кольцевых атомов; или Z, R7 и атом азота, к которому они присоединены, образуют гетероалифатическое кольцо, выбираемое из группы, включающей азетидинил, пирролидинил, пиперидил и морфолино;R9 и R10 каждый независимо друг от друга означают водород, галоген, C1-6-алкил, CH2ORe,оксо, СО 2Ra или CONRaRb, где Ra и Rb имеют указанные значения, a Re означает водород, C1-6 алкил или фенил;R13 означает водород или C1-6-алкил;R14 означает C1-6-алкил, C1-6-алкокси, фторС 1-6-алкил или фенил; Х означает атом кислорода или два атома водорода; и пунктир означает необязательную двойную связь; или фармацевтически приемлемые их соли. Одним конкретным подклассом соединения формулы (I) является подкласс, в которомR1 обозначает C1-6-алкокси, фтор-С 1-6 алкокси, С 1-6-алкокси-С 1-4-алкил, фтор-С 1-6 алкокси-С 1-4-алкил,С 2-6-алкенилокси,С 3-7 циклоалкокси, фенокси, бензилокси, циано, галоген или NRaRb, где Ra и Rb каждый независимо друг от друга обозначают водород или C1-4 алкил;R4 обозначает водород, галоген, C1-6-алкил-, C1-6-алкокси-, СF3, ОСF3, NO2, CN, SRa,SORa, SO2Ra, CO2Ra, CONRaRb, С 2-6-алкенил-,C2-6-алкинил- или C1-4-алкилгруппу-, замещенную C1-4-алкоксигруппой, где Ra и Rb каждый независимо друг от друга означают водород или С 1-4-алкилгруппу; Х означает два атома водорода; и фармацевтически приемлемые их соли. Предпочтителен класс таких соединений формулы (I), в которой R1 обозначает гидрокси, C1-6 алкил, С 2-6-алкенил, C1-6-алкокси, фтор-С 1-6 алкокси, С 2-6-алкенилокси, С 3-7-циклоалкокси,С 3-7-циклоалкил-С 1-4-алкокси, циано, NRaRb,SRa, OSO2Ra, или R1 вместе с группой R2 образуют 5-членное насыщенное кольцо, содержащее один атом кислорода. Особенно предпочтителен класс таких соединений формулы (I), где R1 обозначает C1-6 алкокси, фтор-C1-6-алкокси или С 3-7-циклоалкоксигруппу, особенно метокси, трифторметокси, 2,2,2-трифторэтокси, 2,2-дифторэтокси,2-фторэтокси, циклопропокси или циклобутоксигруппу. Наиболее предпочтительным R1 является метокси- или циклопропоксигруппа. 4 Следующий предпочтительный класс соединений по настоящему изобретению такой,где R1 означает циклопропоксигруппу. Другой предпочтительный класс соединений формулы (I) такой, где R2 означает водород,атом фтора или хлора, особенно атом водорода. Еще один предпочтительный класс соединений формулы (I) такой, где R3 означает водород, галоген, фтор-С 1-6-алкил, фтор-C1-6 алкокси-, циано, NRaRb или NRaCOR14 (где R14 предпочтительно означает метил, метокси,трифторометил или фенилгруппу). Также предпочтительным является класс соединений формулы (I), где R3 означает атом галогена или фтор-С 1-6-алкоксигруппу, особенно фтор-, трифторметокси- или 2,2,2-трифторэтоксигруппу. Наиболее предпочтительным R1 является трифторметоксигруппа. Иным предпочтительным является класс соединений формулы (I), где R4 означает атом водорода или атом фтора. Другой предпочтительный класс соединений формулы (I), где R5 означает атом водорода. Еще один предпочтительный класс соединений формулы (I), где R6 означает атом водорода. Также предпочтителен класс соединения формулы (I), где R6 означает C1-6-алкилгруппу, в частности СН 2, СН(СН 3) и СН 2 СН 2 и, особенно,CH2, замещенный 5-членным гетероциклом,содержащим 2 или 3 атома азота, как указано ранее. В частности, 5-членный цикл означает гегероцикл, выбранный из группы, включающей Другой предпочтительный класс соединений формулы (I), где один из R9 и R10 означает водород и, особенно, где и R9, и R10 оба являются атомами водорода. 5 Следующий предпочтительный класс соединений формулы (I), где Х означает два атома водорода. Предпочтительно, чтобы двойная связь,представленная пунктиром, отсутствовала. Одной предпочтительной группой соединений по настоящему изобретению являются соединения формулы (Iа) и фармацевтически приемлемые их соли где R1, R2, R3, R4 и пунктир имеют значения,определенные для формулы (I). Что касается соединений формулы (I), Z(если присутствует) может быть линейной, разветвленной или циклической группой. Подходящая Z содержит 1-4 атома углерода, наиболее подходящая - 1-2 атома углерода. Особенно подходящей группой Z является СН 2. Что касается соединений формулы (I), R7 может быть C1-4-гидроксилом или С 2-4 алкилгруппой, замещенной гидроксилом илиC1-2-алкоксигруппой, R8 может быть C1-4 алкилгруппой или С 2-4-алкилгруппой, замещенной гидроксилом или C1-2-алкоксигруппой, илиR7 и R8 могут быть связаны таким образом, чтобы они с атомом азота, к которому они присоединены, образовали азетидинил-, пирролидинил-, пиперидил-, морфолино-, тиоморфолино-,пиперазино- или пиперазиногруппу, атом азота которой замещен C1-4-алкилгруппой или С 2-4 алкилгруппой, замещенной гидрокси- или C1-2 алкоксигруппой. Если группа NR7R8 обозначает гетероалифатическое кольцо из 4-7 атомов в кольце и упомянутое кольцо содержит двойную связь, то наиболее предпочтительным является 3 пирролин. Если группа NR7R8 обозначает неароматическую азабициклическую кольцевую систему,такая система может состоять из 6-12, предпочтительнее - из 7-10 атомов в кольце. Подходящие циклы включают 5-азабицикло[2.1.1]гексил,5-азабицикло[2.2.1]гептил,6-азабицикло[3.2.1]октил,2-азабицикло[2.2.2]октил,6-азабицикло[3.2.2]нонил,6-азабицикло[3.3.1]нонил,6-азабицикло[3.2.2]децил,7-азабицикло[4.3.1]децил,7-азабицикло[4.4.1]ундецил и 8-азабицикло[5.4.1]додецил, особенно 5-азабицикло[2.2.1]гептил и 6-азабицикло[3.2.1]октил. 6 Когда R8 обозначает С 2-4-алкилгруппу, замещенную 5- или 6-членным гетероалифатическим кольцом, содержащим один или два гетероатома, выбранные из N, О и S, то соответствующие кольца включают пирролидино, пиперидино, пиперазино, морфолино или тиоморфолино. Наиболее предпочтительными являются гетероалифатические кольца, содержащие азот,особенно пирролидиновые и морфолиновые кольца. Наиболее предпочтительные частицыZNR7R8 включают те, в которых Z представляет собой СН 2 или СН 2 СН 2 и NR7R8 представляет собой амино-, метиламино-, диметиламино-,диэтиламино-, азетидинил-, пирролидино- и морфолиногруппу. В частности, Z предпочтительно означаетCH2, a NR7R8 -диметиламино-, азетидинил- или пирролидино-, особенно, диметиламиногруппу. Когда происходит какое-нибудь изменение более одного раза в формуле (I) или в какомлибо заместителе, они в каждом отдельном случае определяются независимо от их определения в любом другом случае. Здесь термин "алкил" или "алкокси" в качестве группы или части группы означает, что группа является линейной или разветвленной. Примеры соответствующих алкилгрупп охватывают метил, этил, н-пропил, н-пропил, н-бутил,вторбутил и третбутил. Примеры соответствующих алкоксигрупп охватывают метокси,этокси, н-пропокси, н-пропокси, н-бутокси,вторбутокси и третбутокси. Термины "фтор-С 1-6-алкил" и "фтор-С 1-6 алкокси" здесь означают C1-6-алкил- или C1-6 алкоксигруппу, в которых один или более(предпочтительно 1-3) атомов водорода заменены атомами фтора. Аналогично, термин "фторС 1-4-алкил" означает C1-4-алкилгруппу, в которой один или более (предпочтительно 1-3) атомов водорода заменены атомами фтора. Наиболее предпочтительными являются фтор-С 1-3 алкил и фтор-С 1-3-алкоксигруппы, например,СF3, СН 2 СН 2F, CH2CHF2, СН 2 СF3, ОСF3,ОСН 2 СН 2F, OCH2CHF2 или ОСН 2 СF3, а особенно предпочтительными СF3, ОСF3 и ОСН 2 СF3. Здесь указанные циклоалкилгруппы могут быть представлены, например, циклопропил-,циклобутил-, циклопептил- или циклогексилгруппой. Соответствующей циклоалкилгруппой может быть, например, циклопропилметилгруппа. Аналогично, указанные здесь циклоалкоксигруппы могут быть представлены, например,циклопропокси- или циклобутоксигруппой. Здесь термины "алкенил" и "алкинил" в качестве группы или части группы означают,что группа является линейной или разветвленной. Примеры соответствующих алкенилгрупп охватывают винил- и аллилгруппу. Соотвествующая алкинилгруппа представлена пропаргилгруппой. 7 Термин "гетероарил" в качестве группы или части группы здесь означает 5- или 6 членное гетероароматическое кольцо, содержащее 1-4 гетероатома, выбранных из N, О и S. Конкретные примеры таких групп включают пирролил, фуранил, тиенил, пиридил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразинил, пиримидинил,пиридазинил, триазолил, оксадиазолил, тиадиазолил, триазинил и тетразолилгруппу. Употребляемый термин "галоген" означает фтор, хлор, бром и йод. Самыми пригодными галогенами являются фтор и хлор, из них фтор более предпочтителен, если не указано иначе. Специфические соединения по настоящему изобретению охватывают 8 фармацевтически приемлемые их соли. Другие специфические соединения по настоящему изобретению включают(3R,5R,6S)-3-(2-метокси-5-трифторметоксифенил)-6-фенил-1-окса-7-(третбутоксикарбонил)-азаспиро[4.5]декан-2-он; и фармацевтически приемлемые их соли. Следующие специфические соединения по настоящему изобретению включают[4.5]декан; и фармацевтически приемлемые их соли. В другом варианте настоящего изобретения соединения формулы (I) могут быть получены в виде фармацевтически приемлемой соли,особенно соли, образованной прибавлением кислоты. Для использования в медицинских целях нужно, чтобы соли соединений формулы (I) были нетоксичными фармацевтически приемлемыми солями. Другие соли, тем не менее, могут быть использованы для получения соединений по настоящему изобретению или их нетоксических фармацевтически приемлемых солей. Пригодные фармацевтически приемлемые соли соединений по настоящему изобретению включают образованные прибавлением кислот соли,которые могут быть получены, например, смешиванием раствора соединения по настоящему изобретению с раствором фармацевтически приемлемой кислоты, такой как соляная кислота, фумаровая, п-толуолсульфокислота, малеиновая, янтарная, уксусная, лимонная, винная,углекислота, фосфорная или серная кислота. Соли аминогрупп могут представлять собой четвертичные аммониевые соли, в которых атом 9 азота аминогруппы несет соответствующую органическую группу, такую как алкил, алкенил, алкинил или аралкил. Кроме того, если соответствующие соединения по настоящему изобретению проявляют кислотность, их фармацевтически приемлемые соли могут охватывать соли металлов, такие как соли щелочных металлов, т.е. натриевые или калиевые соли, и соли щелочно-земельных металлов, например кальциевые или магниевые соли. Соли могут быть получены обычными способами, такими как взаимодействие свободной щелочной формы продукта с одним или более эквивалентами соответствующей кислоты в растворителе или среде, в которых соль нерастворима, либо в растворителе, как, например,вода, который удаляют в вакууме или сухим вымораживанием; либо обменом анионов имеющейся соли на иной анион на соответствующей ионообменной смоле. Настоящее изобретение охватывает лекарства-предшественники вышеуказанного соединения формулы (I). В общем случае, эти лекарства-предшественники будут функциональными производными соединений формулы (I), легко поддающимися превращению in vivo в нужные соединения формулы (I). Обычные процедуры выделения и получения соответствующих предшественников-производных описаны, например, в "Design of Prodrugs", ed. H. Bundgaard,Elsevier, 1985. Предшественником может быть фармакологически неактивное производное биологически активного вещества ("родительское лекарство" или "родительская молекула") с необходимостью трансформации в организме с выделением активного лекарства, обладающего лучшими свойствами доставки, чем родительская молекула предшественника. Трансформация invivo, например, может быть результатом некоторых метаболических процессов, таких как химический или ферментный гидролиз карбоксильных, фосфатных или сульфатных сложных эфиров, либо восстановлением или окислением чувствительных функциональных групп. Настоящее изобретение охватывает сольваты соединений формулы (I) и их солей, например гидраты. Соединения по настоящему изобретению имеют, по меньшей мере, три центра асимметрии и, соответственно, могут существовать и в виде энантиомеров, и в виде диастереоизомеров. Все такие изомеры и их смеси следует считать охваченными настоящим изобретением. Предпочтительные соединения формулы(I) и (Iа), в которых необязательная двойная связь отсутствует, стереохимически будут соответствовать 3-, 5-, 6-позициям, как в соединении по примеру 124 (т.е. 3-(S), 5-(R) и 6-(S. Например, как показано в формуле (Ib) Наиболее предпочтителен класс соединений формулы (I) и (Iа), в которых необязательная двойная связь отсутствует, со стереохимией 3-(R), 5-(R), 6-(S) (как у соединения по примеру 214), т.е. как показано в формуле (Iс) Например, 3-(R)- соединение по примеру 214 обладает большей эффективностью, чем его 3-(S)- эпимер, пример 124. Необходимо иметь в виду, что перечисленные предпочтительные определения различных заместителей можно брать по одному или в комбинации и использовать в общей формуле соединений по настоящему изобретению также как и в предпочтительных классах соединений,представленных формулой (Iа), формулой (Ib) и формулой (Iс). Далее настоящее изобретение представляет фармацевтические композиции, содержащие одно или более соединений формулы (I) наряду с фармацевтически приемлемым носителем или эксципиентом (индифферентной средой). Предпочтительно, когда композиции по настоящему изобретению представляют собой единичную дозу в форме таблеток, пилюль, капсул, порошка, гранул, растворов или суспензий либо суппозиторов, предназначенных для перорального, парентерального или ректального применения или для ингаляций или вдувания в полости тела. Для получения твердых композиций, таких как таблетки, основной активный ингредиент смешивают с фармацевтическим носителем,например, обычными ингредиентами таблеток,такими как кукурузный крахмал, лактоза, сахароза, сорбитол, тальк, стеариновая кислота,стеарат магния, дикальция фосфат или смола, и с другими фармацевтическими разбавителями,например водой, чтобы получить твердую композицию предварительной рецептуры, содержащую гомогенную смесь соединения по настоящему изобретению или нетоксичную фармацевтически приемлемую его соль. Указывая на гомогенность таких композиций предварительной рецептуры, имеется в виду, что активный ингредиент во всей композиции распределен равномерно, так что композицию можно легко разделить на единичные дозы одинаковой 11 эффективности, например, на таблетки, пилюли и капсулы. Тогда эта твердая композиция предварительной рецептуры разделяется на единичные дозы вышеуказанных форм так, чтобы в каждой было от 0,1 до 500 мг активного ингредиента по настоящему изобретению. Таблетки или пилюли новой композиции могут быть покрыты оболочкой или приготовлены иначе, чтобы продлить действие лекарственной формы. Например, таблетки или пилюли в своем составе могут содержать внутренний компонент и внешний компонент дозы, причем последний образует оболочку для первого. Два компонента могут быть разделены внутренним слоем, который создал бы препятствие внутреннему компоненту от распада в желудке и позволил бы ему попасть неповрежденным в двенадцатиперстную кишку или замедлил бы его выделение. В качестве таких внутренних слоев или оболочек можно использовать разные материалы, включая множество полимерных кислот и их смесей с такими материалами как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы, которые могут содержать новые композиции по настоящему изобретению,предназначенные для перорального применения или в виде инъекций, включают водные растворы, ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, сезамовое масло, кокосовое масло или арахисовое масло, а также эликсиры и подобные фармацевтические носители. Соответствующие диспергирующие или суспендирующие агенты для водных суспензий включают синтетические и натуральные смолы, такие как смола астрагала, аравийская камедь, алгинат, декстран, карбоксиметилцеллюлоза натрия,метилцеллюлоза, поливинил-пирролидон или желатина. Предпочтительные композиции для инъекций включают такие композиции, которые в своем составе в качестве активного ингредиента содержат соединение формулы (I), либо ассоциированное с поверхностно-активным агентом(эмульсия вода-масло или масло-вода). Соответствующие поверхностно-активные агенты включают, в частности, неионные агенты, такие как полиэтиленсорбитаны (например,Tween 20, 40, 60, 80 или 85) или другие сорбитаны (например, Span 20, 40, 60, 80 или 85). Композиции с поверхностно-активным веществом обычно содержат 0,05-5% поверхностноактивного агента, предпочтительно 0,1-2,5%. Необходимо отметить, что могут быть добавлены и другие ингредиенты, например, маннитол или другие фармацевтически приемлемые носители, если необходимо. Соответствующие эмульсии могут быть получены из коммерчески доступных жирных 12 эмульсий, таких как Intralipid, Liposyn, Infonutrol, Lipofundin и Lipiphysan. Активный ингредиент может быть либо растворен в предварительно смешанной эмульсионной композиции либо, альтернативно, он может быть растворен в масле (например, соевом, подсолнечном, хлопковом, сезамовом, кукурузном или миндальном масле), и затем эмульсия получена смешиванием с фосфолипидом (например, яичными фосфолипидами, соевыми фосфолипидами или соевым лецитином) и водой. Необходимо подчеркнуть, что могут быть добавлены и другие ингредиенты, например, глицерин или глюкоза, для регулирования свойств эмульсии. Соответствующие эмульсии обычно содержат до 20% масла, например, от 5 до 20%. Предпочтительно, чтобы в эмульсии капли жира имели величину от 0,1 до 1,0 м, в частности - от 0,1 до 0,5 м, и рН было бы в пределах от 5,5 до 8,0. Особенно предпочтительны эмульсионные композиции, приготовленные путем смешивания соединения формулы (I) с Intralipid либо с его компонентами (соевое масло, яичные фосфолипиды, глицерин и вода). Композиции для ингаляции включают растворы и суспензии в фармацевтически приемлемых водных или органических растворителях либо их смесях, а также порошки. Жидкие или твердые композиции могут содержать соответствующие фармацевтически приемлемые эксципиенты, как выше указано. Предпочтительно композиции применяются перорально или назально-респираторным путем для достижения локального либо систематического эффекта. Композиции в, предпочтительно, стерильных фармацевтически приемлемых растворителях могут быть распылены при помощи инертного газа. Распыляемые растворы можно вдыхать прямо из распылительного аппарата, либо распылительный аппарат может быть присоединен к лицевой маске, к тампону или к дыхательному аппарату с позитивным давлением. Композиции в виде раствора, суспензии или порошка могут применяться, предпочтительно, перорально,либо назально, используя аппараты, которые подают смесь нужным способом. Далее настоящее изобретение представляет способ получения фармацевтической композиции, содержащей соединение формулы (I),включающий сочетание соединения формулы(I) с фармацевтически приемлемым носителем или эксципиентом. Соединения формулы (I) важны при лечении многих клинических состояний, для которых характерен избыток активности тахикинина, особенно вещества Р. Так, например, избыток активности тахикинина, особенно вещества Р, приводит к различным расстройствам центральной нервной системы. Такие расстройства охватывают расстройства, связанные с настроением, такие как депрессия, или, конкретнее, де 13 прессивные расстройства, например, единичные эпизодические либо повторяющиеся нарастающие депрессивные расстройства, и дистимические (психические) расстройства или биполярные расстройства, например, биполярное I расстройство, биполярное II расстройство, и циклотимия (маниакально депрессивный психоз); беспокойства, такие как паническое беспокойство с агорафобией или без нее, агорафобия (боязнь пространства), не имеющая анамнеза панического беспокойства, специфические фобии,например, специфическая боязнь животных,социальные фобии, навязчивые идеи, стрессовые расстройства, охватывающие посттравматические стрессы и острое стрессовое расстройство, а также общие беспокойства; шизофрению и другие психические расстройства, например,расстройства шизофренического типа, шизоэмоциальные расстройства, маниакальные расстройства, кратковременные расстройства психики, расстройства разделения психики и расстройства психики с маниями и галлюцинациями; бред, слабоумие и потерю памяти и другие расстройства познавательных способностей или невродегенеративные расстройства, такие как болезнь Альцгеймера, старческое слабоумие,слабоумие типа Альцгеймера, васкулярное слабоумие и другие слабоумия, например, вызванные СПИДом, травмой головы, болезнью Паркинсона, болезнью Хантингтона, болезнью Пика, болезнью Крейтцфельдта-Якоба, или имеющими сложную этиологию; болезнь Паркинсона и другие внепирамидные нарушения двигательной системы, такие как вызванное медикаментами нарушение двигательной способности,например, вызванный невролептиками паркинсонизм, невролептический злокачественный синдром, вызванная невролептиками острая дистония, острая акатизия, невролептиками индуцированная запоздалая дискинезия и медикаментами вызванная постуральная дрожь; расстройства, обусловленные привязанностью к определенному веществу, вызванные потреблением алкоголя, амфетаминов (либо аналогов амфетаминов), кофеина, конопли, кокаина, галлюциногенов, вдыхаемых ингалянтов и аэрозольных носителей, никотина, опиатов, производных фенилглицидина, успокоительных, гипнотических веществ и транквилизаторов, причем расстройства, обусловленные привязанностью к веществу, охватывают зависимость и злоупотребление, интоксикацию, воздержание,интоксикационный бред, бред при воздержании,постоянное слабоумие, психические расстройства, нарушение настроения, беспокойства, сексуальную дисфункцию и нарушения сна; эпилепсию, синдром Дауна; нервное истощение,заболевания, такие как MS, ALS и другие невропатологические расстройства, такие как периферийная невропатия, например, диабетическая и вызванная химиотерапией невропатия, и постгерпетическая невралгия, невралгия трой 001574 14 ничного нерва, сегментная или межреберная невралгия и другие невралгии; и цереброваскулярные расстройства, вызванные острым или хроническим цереброваскулярным повреждением, таким как церебральный инфаркт, спинномозговое кровотечение или церебральная эдема. Активность тахикинина и, особенно, вещества Р также ответственна за восприятие болевых ощущений. Поэтому соединения по настоящему изобретению будут полезны для профилактики и лечения заболеваний и состояний,в которых доминирует боль, включая повреждения мягких тканей и периферические повреждения, такие как острая травма, остеоартрит, ревматоидный артрит, мускуло-скелетная боль,особенно после травмы, боль в спине, миофасциальные болезненные синдромы, головная боль, эпизиотомическая боль и боль при ожогах; глубокая боль и боль внутренних органов, такая как боль сердца, мускульная боль, глазная боль,орофасциальная боль, например, зубная боль,боли живота, гинекологическая боль, например,дисменоррея, и боль при родах; боль, связанная с повреждениями периферийного нерва, например, ущемление нерва и разрыв плечевого сплетения, ампутация, периферические невропатии,болезненный тик, атипичные фасциальные боли,повреждение корня нерва и арахноидитис; боль,связанная с карциномой, часто называемая раковой болью; боли центральной нервной системы, такая как боль при повреждении спинного мозга или мозгового ствола; боли нижней части спины; воспаление седалищного нерва; анкилозный спондилит, подагра; и боль зарубцевавшегося шрама. Антагонисты тахикинина и, особенно, вещества Р также могут быть использованы для лечения респираторных заболеваний, особенно тех, которые связаны с повышенной секрецией слизи, такие как хроническое закупорирование воздушных каналов, бронхопневмония, хронический бронхит, кистозный фиброз и астма,синдром респираторного недомогания у взрослых и спазм бронхов; воспалительные заболевания, такие как воспаление кишечника, псориаз,фиброзит, остеоартрит, ревматоидный артрит,зуд и солнечный ожог; аллергии, такие как экзема и ринит; расстройства из-за чрезмерной чувствительности, такие как из-за ядовитого плюща; глазные болезни, такие как конъюктивит, весенний конъюктивит и т.п.; офтальмические состояния, связанные с клеточной пролиферацией, такой как пролиферативное заболевание сетчатки и стекловидного тела, хитреоретинопатия; кожные заболевания, такие как контактный дерматит, смещенный дерматит, крапивница, и другие экзематоидные дерматиты. Антагонисты тахикинина и, особенно, вещества Р также могут быть использованы для лечения новообразований, включая опухоли грудной железы, невроганглиобластомы и мел 15 коклеточные карциномы, такие как мелкоклеточный рак легких. Антагонисты тахикинина и, особенно, вещества Р также могут быть использованы для лечения гастроинтестинальных (GI) расстройств, охватывая воспалительные расстройства и заболевания гастроинтестинального тракта, такие как гастрит, гастродуоденальные язвы,карцинома желудка, лимфома желудка, расстройства, связанные с нервной регуляцией внутренних органов, язвенный колит, заболевание Крона, синдром раздраженного кишечника и рвота, включая острую, запаздывающую или опережающую рвоту, такую как рвота, вызванная химиотерапией, радиацией, токсинами, вирусными и бактериальными инфекциями, беременностью, вестибулярными расстройствами,например, тошнотой при движении, головокружением и болезнью Меньера, хирургическим вмешательством, мигренью, перепадами внутричерепного давления, желудочно-пищеводным рефлюксом, кислотным расстройством пищеварения, злоупотреблением пищей и напитками,кислотным желудком, изжогой или отрыжкой,изжогой, например, эпизодической, ночной или вызванной пищей, и диспепсия. Антагонисты тахикинина и, особенно, вещества Р могут быть использованы также для лечения многих состояний, включая связанные со стрессом соматические расстройства; рефлекс симпатической дистрофии, такой как синдром плеча/руки; обратные иммунологические реакции, такие как отторжение трансплантированной ткани или расстройства, связанные с иммунным усилением или подавлением, такие как системная красная волчанка; транссудация плазмы, возникшая из-за химиотерапии цитокинами, расстройства функций мочевого пузыря,такие как цистит, повышенная рефлексия детрузора и недержание мочи; фиброзные и коллагеновые нарушения, такие как склеродерма и эозинофильный фасциолиоз; расстройства циркуляции крови, возникшие из-за вазодилации и ангиоспастических заболеваний, таких как ангина, васкулярная головная боль, мигрень и болезнь Рейнода; и боль либо болезненные ощущения, связанные с какими-либо вышеуказанными состояниями, особенно с трансмиссией боли при мигрени. Соединения формулы (I) также ценны при лечении смешанных вышеуказанных состояний,особенно при лечении смешанных послеоперационной боли с послеоперационной тошнотой и рвотой. Соединения формулы (I) особенно показаны для лечения рвоты, охватывая острую, запаздывающую или опережающую рвоту, такую как рвота, вызванная химиотерапией, радиацией, токсинами, беременностью, вестибулярными расстройствами, движением, хирургией, мигренью и перепадами внутричерепного давления. Более конкретно, соединения формулы (I) ис 001574 16 пользуются для лечения рвоты, вызванной противоопухолевыми (цитотоксичными) агентами,включая те, которые обычно применяются при химиотерапии рака, и рвоты, вызванной другими фармакологическими агентами, например,ролипрамом. Примеры таких химиотерапевтических агентов охватывают агенты алкилирования, например, азотистые ипритные соединения, соединения этиленимина, алкилсульфонаты и другие соединения, проявляющие способность алкилирования, также как нитрозокарбамид, цисплатин и дакарбазин; антиметаболиты, например, антагонисты фолиевой кислоты, пурина или пиримидина; ингибиторы митоза, например,винаконовые алкалоиды и производные подофиллотоксина; и цитотоксические антибиотики. Конкретные примеры химиотерапевтических агентов описаны, например: D.J. Stewart вInc., Boca Raton, Florida, USA (1991) с. 177-203,особенно с. 188. Обычно используемые химиотерапевтические агенты включают цисплатин,дакарбазин (DTIC), дактиномицин, мехлорэтамин (азотистый иприт), стептозоцин, циклофосфамид, кармустин (BCNU) ломустин(1984) 68 (1), 163-172]. Соединения формулы (I) также полезны при лечении рвоты, индуцированной радиацией,включая радиационную терапию, применяемую при лечении рака, либо радиационной усталости; а также при лечении послеоперационной тошноты и рвоты. Необходимо заметить, что соединения формулы (I) могут быть представлены вместе с другим терапевтическим агентом в виде общего комбинированного препарата одновременного,раздельного или последовательного применения при облегчении рвоты. Такие комбинированные препараты могут быть, например, в форме двойной упаковки. Следующий аспект настоящего изобретения составляют соединения формулы (I) в сочетании с 5-НТ 3 антагонистом, таким как ондансетрон, гранисетрон либо трописетрон, или другие противорвотные медикаменты, например, антагонист допамина, такой как метоклопрамид или домперидон, или агонисты GАВАB рецептора,такие как баклофен. Кроме того, соединение формулы (I) либо в одиночку, либо в сочетании с одним или более других противорвотных терапевтических агентов, может быть назначен в комбинации с противоспалительным кортикостероидом, таким как дексаметазон, бетаметазон, триамцинолон, ацетонид триамцинолона,флунисолид, будесонид, либо с другими агента 17 ми, такими как описано в патентах США 2789118, 2990401, 3048581, 3126375, 3929768,3996359, 3928326 и 3749712. Дексаметазон(Decadron) является наиболее предпочтительным. Кроме того, соединение формулы (I) может быть назначено в сочетании с таким химиотерапевтическим агентом, как алкилирующий агент, антиметаболит, ингибитор митоза или цитотоксический антиобиотик, как указано выше. Обобщая, необходимо заметить, что все доступные формы дозировки общеизвестных терапевтических агентов пригодны для их применения в таких сочетаниях. На опытах с хорьком, вызывая рвоту цисплатином по описанию F.D. Tattersall et al, в Еur.J. Pharmacol., (1993) 250, R5-R6, установлено,что соединение по настоящему изобретению уменьшает признаки отрыжки и рвоты, вызванной цисплатином. Соединения формулы (I) также особенно полезны при лечении боли или восприятия болевых ощущений и/или воспаления и расстройств, связанных, например, с невропатией,таких как диабетом и химиотерапией вызванная невропатия, постгерпетические и другие невралгии, астма, остеоартрит, ревматоидный артрит и головная боль, включая мигрень, острая и хроническая напряженная головная боль, кластерная головная боль, проходящая боль нижней челюсти и боль синусов верхней челюсти. Соединения формулы (I) также особенно полезны при лечении депрессии, включая депрессивные расстройства, например, единичные эпизодические или повторяющиеся серьезные депрессивные расстройства, и дистимические расстройства, депрессивный невроз, и невротическую депрессию; меланхолическую депрессию, включая анорексию, потерю веса, бессонницу и раннее утреннее бодрствование, и психомоторное торможение; атипичную депрессию(или реактивную депрессию), включая повышенный аппетит, сонливость, психомоторное возбуждение или раздражительность, беспокойство и фобии; сезонное эмоциальное расстройство; или биполярные расстройства или маниакальную депрессию, например, биполярное I расстройство, биполярное II расстройство и циклотимическое расстройство. Настоящее изобретение далее представляет соединение формулы (I) для использования в терапии. Согласно дальнейшему или другому варианту, настоящее изобретение представляет собой соединение формулы (I), предназначенное для использования в изготовлении медикамента для лечения физиологических расстройств, связанных с избытком тахикининов, особенно вещества Р. Настоящее изобретение также представляет собой способ лечения или профилактики физиологических расстройств, связанных с избытком тахикининов, особенно вещества Р, кото 001574 18 рый включает назначение пациенту количества соединения формулы (I) либо композиции, содержащей соединение формулы (I), необходимое для уменьшения количества тахикинина. По следующему варианту настоящего изобретения может быть желательно лечить вышеуказанные состояния при помощи сочетания соединения по настоящему изобретению и одного или более других фармакологически активных агентов, пригодных для лечения специфического состояния. Соединение формулы (I) и другой фармакологически активный агент(ы) могут быть назначены пациенту одновременно,последовательно или в их сочетании. Так, например, для лечения респираторных заболеваний, таких как астма, соединение формулы (I) может быть использовано вместе с бронхорасширяющим,таким как агонист 2 адренергического рецептора или антагонист тахикинина, которые воздействуют на NK-2 рецепторы. Соединение формулы (I) и бронхорасширяющие можно назначать пациенту одновременно, последовательно или в их сочетании. Также соединение по настоящему изобретению можно употреблять с антагонистами лейкотриена, такими как антагонист леукотриенаD4, такой как соединение, выбранное из соединений, раскрытых в описаниях Европейских патентов 0480717 и 0604114 и в описаниях патентов США 4859692 и 5270324. Эта комбинация особенно показана при лечении респираторных заболеваний, таких как астма, хронический бронхит или кашель. Настоящее изобретение соответственно представляет способ лечения респираторного заболевания, такого как астма, который включает назначение пациенту, который в том нуждается, эффективного количества соединения формулы (I) и эффективного количества бронхорасширяющего. Также настоящее изобретение предлагает композицию, содержащую соединение формулы(I), бронхорасширяющее и фармацевтически приемлемый носитель. Необходимо заметить, что при лечении или профилактике мигрени можно использовать соединение по настоящему изобретению вместе с другими противомигреневыми агентами, такими как эрготамины или 5-HT1 агонисты, особенно, суматриптан, наратриптан, золматриптан или ризатриптан. Аналогично, при лечении поведенческой гипералгезии, можно использовать соединение по настоящему изобретению наряду с антагонистом N-метил-D-аспартата (NMDA), таким как дизоцилпин. При лечении или профилактике воспалительных состояний в нижней части уринарного тракта, особенно цистита, соединение по настоящему изобретению может быть использовано вместе с противоспалительным агентом, например, антагонистом рецептора брадикинина. 19 Также изобретение предлагает композицию, содержащую соединение формулы (I),бронхорасширяющее и фармацевтически приемлемый носитель. Следует подчеркнуть, что при лечении или профилактике боли или восприятии болевых ощущений, соединение по настоящему изобретению можно применять вместе с другими обезболивающими, такими как ацетаминофен (парацетамол), аспирин и другие NSAIDs и, в частности, опиатные обезболивающие, особенно морфин. Специфические противовоспалительные агенты включают диклофенак, ибупрофен, индометацин, кетопрофен, напроксен, пироксикам и сулиндак. Соответствующие опиатные обезболивающие, употребляемые в сочетании с соединением по настоящему изобретению, включают морфин, кодеин, дигидрокодеин, диацетилморфин, гидрокодон, гидроморфон, леворфанол, оксиморфон, алфентанил, бупренорфин, буторфанол, фентанил, суфентанил, меперидин, метадон, налбуфин, пропоксифен и пентазоцин; или фармацевтически приемлемые их соли. Предпочтительные соли этих опиатных обезболивающих включают сульфат морфина,гидрохлорид морфина, тартрат морфина, фосфат кодеина, сульфат кодеина, битартрат дигидрокодеина, гидрохлорид диацетилморфина, битартрат гидрокодона, гидрохлорид гидроморфона, тартрат леворфанола, гидрохлорид оксиморфона, гидрохлорид алфентанила, гидрохлорид бупренорфина, тартрат буторфанола, цитрат фентанила, гидрохлорид меперидина, гидрохлорид метадона, гидрохлорид налбуфина, гидрохлорид пропоксифена, напсилат пропоксифена(2-нафталинсульфокислота (1:1) моногидрат), и гидрохлорид пентазоцина. Поэтому в следующем варианте настоящего изобретения предлагается фармацевтическая композиция, содержащая соединение по настоящему изобретению и обезболивающие, вместе, по крайней мере, с одним фармацевтически приемлемым носителем или эксципиентом. Следующий вариант настоящего изобретения предлагает продукт, содержащий соединение по настоящему изобретению и обезболивающие в виде комбинированного препарата,предназначенного для одновременного, раздельного или последовательного употребления при лечении или профилактике боли и восприятия болезненных ощущений. Следует заметить, что при лечении депрессии или беспокойства, соединение по настоящему изобретению можно использовать в сочетании с другими антидепрессантами или агентами против беспокойства. Подходящие классы антидепрессантного агента включают ингибиторы обмена норепинефрина, селективные ингибиторы обмена серотонина (SSRI), ингибиторы моноаминооксидазы(МАOI), обратимые ингибиторы моноаминоок 001574 20 сидазы (RIMA), ингибиторы обмена серотонина и норадреналина (SNRI), антагонисты освобождающего фактора кортикотропина (CRF), антагонисты -адренорецептора и нетипичные антидепрессанты. Соответствующие ингибиторы обмена норепинефрина включают трициклические соединения с третичным амином и трициклические соединения с вторичным амином. Соотвествующие примеры трициклических соединений с третичным амином включают амитриптилин,кломипрамин, доксепин, имипрамин и тримипрамин, и фармацевтически приемлемые их соли. Соотвествующие примеры трициклических соединений с вторичным амином включают амоксапин, дезипрамин, мапротилин, нортриптилин и протриптилин, и фармацевтически приемлемые их соли. Соотвествующие селективные ингибиторы обмена серотонина включают флуоксетин, флувоксамин, пароксетин и сертралин, и фармацевтически приемлемые их соли. Соотвествующие ингибиторы моноаминооксидазы включают изокарбоксазид, фенелзин,транилципрамин и селегилин, и фармацевтически приемлемые их соли. Соответствующие обратимые ингибиторы моноаминооксидазы включают моклобемид и фармацевтически приемлемые соли. Соотвествующие ингибиторы обмена серотонина и норадреналина, которые можно использовать в настоящем изобретении, включают венлафаксин и фармацевтически приемлемые соли. Соотвествующие CRF антагонисты охватывают соединения, описанные в международных патентных публикациях WO 94/13643, WO 94/13644, WO 94/13661, WO 94/13676 и WO 94/13677. Соотвествующие нетипичные антидепрессанты включают бупропион, литий, нефазодон,тразодон и вилоксазин и фармацевтически приемлемые их соли. Подходящие классы агента против беспокойства охватывают бензодиазепины и 5-HT1A агонисты или антагонисты, особенно 5-HT1A частичные агонисты, и антагонисты фактора,освобождающего кортикотропин (CRF). Соотвествующие бензодиазепины включают алпразолам, хлордиазепоксид, клоназепам,хлоразепат, диазепам, халазепам, лоразепам,оксазепам и празепам, и фармацевтически приемлемые их соли. Соотвествующие агонисты или антагонисты 5-HT1A рецептора включают, особенно, частичные агонисты 5-HT1A рецептора буспирон,флесиноксан, гепирон и ипсапирон и фармацевтически приемлемые их соли. Таким образом, в следующем варианте настоящего изобретения представляется фармацевтическая композиция, содержащая соединение по настоящему изобретению и антидепрес 21 сант либо агент против беспокойства вместе с,по крайней мере, одним фармацевтически приемлемым носителем или эксципиентом. В другом аспекте настоящего изобретения предлагается продукт, содержащий соединение по настоящему изобретению и антидепрессант либо агент против беспокойства в виде комбинированого препарата, предназначенного для одновременного, раздельного или последовательного использования при лечении или профилактике депрессии и/или беспокойства. Необходимо заметить, что при лечении и профилактике расстройств питания, включая переедание (ожирение), нервозную булимию и расстройства принудительного питания, соединение по настоящему изобретению можно использовать в сочетании с другими аноректическими агентами. Настоящее изобретение соответственно предлагает применение соединения формулы (I) и аноректического агента для изготовления медикамента, предназначенного для лечения или профилактики расстройств питания. Также настоящее изобретение предлагает способ лечения или профилактики расстройств питания, который включает назначение пациенту, нуждающемуся в лечении, таких количеств соединения формулы (I) и аноректического агента, чтобы вместе они обеспечили эффективную помощь. В ином варианте настоящего изобретения предлагается фармацевтическая композиция,содержащая соединение формулы (I) и аноректический агент вместе с, по крайней мере, одним фармацевтически приемлемым носителем или эксципиентом. Следует заметить, что соединение формулы (I) и аноректический агент могут быть представлены в виде комбинированного препарата,предназначенного для одновременного, раздельного или последовательного использования при лечении или профилактике расстройств питания. Такой комбинированный препарат может быть в форме двойной упаковки. В следующем варианте предлагается продукт, содержащий соединение формулы (I) и аноректический агент в виде комбинированного препарата, предназначенного для одновременного, раздельного или последовательного использования при лечении или профилактике расстройств питания. В ином варианте настоящего изобретения предлагается применение соединения формулы(I) и аноректического агента для изготовления медикамента, предназначенного для лечения или профилактики ожирения. Настоящее изобретение также представляет собой способ лечения или профилактики ожирения, который включает назначение пациенту, нуждающемуся в лечении, таких количеств соединения формулы (I) и аноректическо 001574 22 го агента, которые вместе обеспечили бы эффективную помощь. В варианте настоящего изобретения предлагается применение соединения формулы (I) и аноректического агента для изготовления медикамента, предназначенного для лечения или профилактики нервозной булимии. Также настоящее изобретение предлагает способ лечения или профилактики нервозной булимии, который включает назначение пациенту, нуждающемуся в лечении, таких количеств соединения формулы (I) и аноректического агента, которые обеспечили бы эффективную помощь. В следующем варианте настоящего изобретения предлагается применение соединения формулы (I) и аноректического агента для изготовления медикамента, предназначенного для лечения или профилактики расстройств принудительного питания. Настоящее изобретение также предлагает способ лечения или профилактики расстройств принудительного питания, который включает назначение пациенту, нуждающемуся в лечении, таких количеств соединения формулы (I) и аноректического агента, которые обеспечили бы эффективную помощь. В варианте настоящего изобретения предлагается применение соединения формулы (I) и аноректического агента для изготовления медикамента, уменьшающего общую массу жиров в организме тучных млекопитающих, особенно человека. Настоящее изобретение также предлагает способ уменьшения общей массы жиров в организме тучных млекопитающих, особенно человека, который включает назначение пациенту,нуждающемуся в лечении, таких количеств соединения формулы (I) и аноректического агента,которые обеспечили бы эффективную помощь. Подходящие аноректические агенты, используемые в сочетании с соединением по настоящему изобретению, включают, но не ограничиваются ими, аминорекс, амфехлорал, амфетамин, бензфетамин, хлорфентермин, клобензорекс, клофорекс, кломинорекс, клортермин,цислекседрин, дексфенфлурамин, декстроамфетамин, диэтилпропион, дифеметоксидин, Nэтиламфетамин, фенбутразат, фенфлурамин,фенизорекс, фенпропорекс, флудорекс, флуминорекс, фурфурилметиламфетамин, левамфетамин, левофацетоперан, мазиндол, мефенорекс,метамфепрамон, метамфетамин, норпсевдоэфедрин, пенторекс, фендиметразин, фенметразин, фентермин, фенилпропаноламин, пицилорекс и сибутрамин; и фармацевтически приемлемые их соли. Предпочтительные аноректические агенты включают амфетамин и его производные, например, амфетамин, бензфетамин, хлорфентермин, клобензорекс, клофорекс, клортермин,дексфенфлурамин, декстроамфетамин, диэтил 23 пропион, N-этиламфетамин, фенфлурамин,фенпропорекс, фурфурилметиламфетамин, левамфетамин, мефенорекс, метамфепрамон, метамфетамин, норпсевдоэфедрин, пенторекс,фендиметразин, фенметразин, фентермин, фенилпропаноламин, пицилорекс и сибутрамин; и фармацевтически приемлемые их соли. Наиболее пригодным классом аноректических агентов являются галогенированные производные амфетамина, включая хлорфентермин,клофорекс, хлортермин, дексфенфлурамин,фенфлурамин, пицилорекс и сибуграмин; и фармацевтически приемлемые их соли. Для использования в комбинации с соединением по настоящему изобретению наиболее предпочтительны галогенированные производные амфетамина, включающие фенфлурамин и дексфенфлурамин, и фармацевтически приемлемые их соли. Следует подчеркнуть, что для лечения или профилактики ожирения соединения по настоящему изобретению могут быть также использованы в комбинации с селективным ингибитором обмена серотонина (SSRI). Настоящее изобретение предлагает, соответственно, применение соединения формулы(I) и SSRI для изготовления медикамента, предназначенного для лечения или профилактики ожирения. Настоящее изобретение также предлагает способ лечения или профилактики ожирения,который включает назначение пациенту, нуждающемуся в лечении, такого количества соединения формулы (I) и SSRI, чтобы вместе они обеспечили эффективную помощь. В другом варианте настоящего изобретения предлагается фармацевтическая композиция для лечения и профилактики ожирения, содержащая соединение формулы (I) и SSRI, вместе с,по крайней мере, одним фармацевтически приемлемым носителем или эксципиентом. Необходимо заметить, что соединение формулы (I) и SSRI могут присутствовать в виде комбинированного препарата, предназначенного для одновременного, раздельного или последовательного использования при лечении или профилактике ожирения. Такие комбинированные препараты могут быть, например, в форме двойной упаковки. В следующем варианте настоящего изобретения поэтому предлагается продукт, содержащий соединение формулы (I) и SSRI в форме комбинированного препарата, предназначенного для одновременного, раздельного или последовательного использования при лечении или профилактике ожирения. В другом варианте настоящего изобретения предлагается применение соединения формулы (I) и SSRI для изготовления медикамента,уменьшающего общую массу жиров в организме тучных млекопитающих, особенно человека. 24 Настоящее изобретение также предлагает способ уменьшения общей массы жиров в организме млекопитающих, особенно человека, который включает назначение млекопитающему такого количества соединения формулы (I) иSSRI, чтобы вместе они обеспечили эффективную помощь. В другом варианте настоящего изобретения предлагается фармацевтическая композиция для уменьшения общей массы жиров в организме тучных млекопитающих, особенно человека,содержащая соединения формулы (I) и SSRI вместе с, по крайней мере, одним фармацевтически приемлемым носителем или эксципиентом. Подходящие селективные ингибиторы обмена серотина, которые можно использовать в комбинации с соединением по настоящему изобретению, включают флуоксетин, флувоксамин,пароксетин и сертралин, и фармацевтически приемлемые их соли. Здесь термин "ожирение" указывает на состояние, когда млекопитающее имеет Индекс массы тела (BMI), по меньшей мере, равный 25,9, который рассчитывается как вес, деленный на рост в квадрате (кг/м 2). Обычно у лиц,имеющих нормальный вес, значение BMI находится в пределах от 19,9 до менее 25,9. Ожирение может быть предопределено генетически, либо зависеть от внешних факторов. Примеры расстройств, которые обусловливают ожирение или являются его причиной, включают переедание и булимию, поликистозное заболевание яичников, краниофарингиому, синдром Прадера-Вилли, синдром Фроухлича, диабет II степени, недостаток гормона роста (GHнедостаточность), нормальный вариант низкого телосложения, синдром Тернера и другие патологические состояния, при которых проявляется уменьшенная метаболическая активность или недостаточный расход остаточной энергии в процентах от общей безжирной массы, например, у детей, страдающих острой лимфобластической лейкемией."Лечение" (ожирения) означает здесь уменьшение BMI млекопитающих до менее 25,9 и поддержание такого веса, по крайней мере, 6 месяцев. Результат лечения соответственно состоит в уменьшении потребляемой млекопитающим пищи или калорий."Профилактика" (ожирения) означает предотвращение такого состояния, когда лечение назначается прежде достижения состояния ожирения. Более того, когда лечение применяется к уже тучным лицам, ожидается, что такое лечение предотвратит (либо предотвратит прогрессирующее развитие) медицинские компликации,причиной которых является ожирение, например, артериосклероз, диабет II степени, поликистозное заболевание яичников, кардиоваскулярные болезни, остеоартрит, дерматологические расстройства, гипертензия, устойчивость 25 инсулину, гиперхолестеролемия, гипертриглицеридемия и желчно-каменная болезнь. Таким образом, с одной стороны, настоящее изобретение касается сдерживания и/или полного подавления липогенеза у тучных млекопитающих, т.е. скопления излишков липидов в клетках жиров, что является одним из главных примет тучных людей и животных; а также уменьшения общего веса тела. С другой стороны, изобретение улучшает состояния, которые являются последствием болезни, например,предупреждая или останавливая развитие поликистозного заболевания яичников таким образом, чтобы пациент излечился от бесплодия, и увеличивая чувствительность к инсулину и/или уменьшая или исключая необходимость потребления инсулина страдающими диабетом, например, при приступах диабета у взрослых либо диабете II степени. Следующий аспект настоящего изобретения касается применения соединения формулы(I) для достижения хронобиологического (сдвиг суточного фазового ритма) эффекта и облегчения расстройств суточного ритма у млекопитающих. Далее настоящее изобретение охватывает применение соединения формулы (I) для блокады зависящих от освещения эффектов фазового сдвига у млекопитающих. Затем настоящее изобретение касается применения соединения формулы (I) для усиления или улучшения качества сна, особенно, увеличивая эффективность сна и поддерживая состояние сна, также как и для предотвращения и лечения расстройств и нарушений сна у млекопитающих. В предпочтительном варианте настоящее изобретение представляет способ для ускорения или замедления фаз суточного ритма, который включает назначение соответствующего количества соединения формулы (I) или фармацевтически приемлемой ее соли. Соответствующее количество соединения формулы (I) назначается, например, для предотвращения или лечения следующих состояний с целью получить хронобиологические эффекты и/или облегчить нарушения суточного фазового ритма расстройства графика сон-бодрствование; усталость долгого перелета; посменная работа; лица с плохой адаптацией к графику работаотдых; медицинские работники, няни, пожарники, полицейские и все те, кто должны быть бодрыми и легко пробуждаться в вечернее или ночное время, или те, которым нельзя спать в отдельные периоды из-за занимаемой должности или ответственности; занятые в животноводстве; пехота или другие военные, которым в высшей степени важно бодрствование и способность легко пробуждаться, и те, кому нельзя спать во время такой службы; подводники или люди, проводящие испытания, исследования или имеющие производственные цели под водой; минеры, спелеологи, исследователи или 26 находящиеся под землей; астронавты на околоземной орбите или отправленные в окололунное пространство или на другие планеты либо за пределы Солнечной системы, или тренирующиеся для таких миссий; слепые либо ослабленного зрения, или личности, постоянно или временно имеющие ослабленную способность различать свет и мрак; психиатрические пациенты; страдающие бессонницей; находящиеся в коматозном состоянии, или те, кого необходимо поддерживать без сознания в медицинских,психиатрических или других целях; жители Дальнего Севера или Антарктики, или лица,проживающие в климатических условиях, аномального количества света или мрака; страдающие от сезонного эмоционального расстройства(SAD), зимней депрессии или других форм депрессии; пожилые люди; страдающие болезнью Альцгеймера или другими формами слабоумия; пациенты, нуждающиеся в принятии медикаментов в установленное время суточного цикла; пациенты, страдающие синдромом замедленной фазы сна, синдромом ускоренной фазы сна или синдромом не 24-часовой фазы сна; и пациенты,страдающие первичной или вторичной бессонницей или бессонницей, связанной с суточным ритмом. Настоящее изобретение полезно, например, для предотвращения или лечения состояний, связанных с суточной ритмичностью,также как и с психическими и физическими расстройствами, связанными с путешествиями через зоны времени и с чередованием графика сменной работы. В предпочтительном варианте настоящее изобретение представляет способ профилактики или лечения расстройств суточного ритма у млекопитающих, включая синдром перемены зоны времени (долгий перелет), расстройство сна из-за сменной работы, синдром замедленной фазы сна, синдром ускоренной фазы сна и расстройство типа не 24-часового снабодрствования, который включает назначение млекопитающему эффективного количества соединения формулы (I) или фармацевтически приемлемой его соли. В другом предпочтительном варианте настоящее изобретение предлагает способ, сокращения времени между тренировками для лиц,нуждающихся в перемене суточных ритмов с последующим сдвигом цикла сонбодрствование, который включает назначение лицам соответствующего количества соединения формулы (I) или фармацевтически приемлемой его соли. В более предпочтительном варианте настоящее изобретение предлагает способ облегчения воздействия долгого перелета на путешествующих, особенно млекопитающих, который включает назначение путешествующим увеличивающего бодрость количества соединения формулы (I) или фармацевтически приемлемой его соли. Цель этого варианта заключается в 27 том, чтобы помочь организму приспособиться психологически к переменам ритма сна и питания при пересечении нескольких временных зон. В ином более предпочтительном варианте настоящее изобретение предлагает способ приспособления внутреннего суточного времени индивида, например, посменных работников,переходящих с дневного графика на ночной или наоборот, который состоит в назначении лицам соотвествующего количества соединения формулы (I) или фармацевтически приемлемой его соли. Настоящее изобретение далее намечает применение соединения формулы (I) или фармацевтически приемлемой его соли для усиления или улучшения качества сна, также как и для профилактики и лечения расстройств сна и нарушений сна у млекопитающих. В частности,настоящее изобретение предлагает способ усиления и улучшения качества сна путем увеличения эффективности и поддержки состояния сна. Кроме того, настоящее изобретение представляет способ профилактики и лечения расстройств и нарушений сна у млекопитающих, который включает назначение соединения формулы (I) или фармацевтически приемлемой его соли. Настоящее изобретение полезно для лечения расстройств сна, включая расстройства засыпания и поддержки состоянию сна (бессонница)("DIMS"), которые могут быть обусловлены психофизиологическими причинами, также как и быть последствием психиатрических расстройств (в частности, связаны с беспокойством), из-за потребления лекарств и алкоголя и злоупотребления ими (особенно, на стадии прекращения этих привычек), приступы DIMS в детстве, ночной миоклонус и "дергающиеся" ноги, и неспецифические REM расстройства,появляющиеся с возрастом. Настоящее изобретение, обеспечивает такие результаты, которые можно отнести за счет повышения качества сна увеличение ценности сна, которая рассчитывается как время сна субъекта, деленное на время, в которое субъект старается заснуть; уменьшение латентности сна(время, необходимое на засыпание); уменьшение числа пробуждений во время сна; сокращение времени, израсходованного на пробуждение после наступления сна; увеличение общего времени сна; увеличение количества и процентной доли REM сна; увеличение продолжительности и частоты REM сна; сокращение фрагментацииREM сна; увеличение количества и процентной доли медленной фазы сна (т.е. 3 или 4 фазы); увеличение количества и процентной доли 2 фазы сна; сокращение числа пробуждений, особенно, ранним утром; увеличение времени дневного бодрствования; и увеличение поддержки состояния сна. Вторичные преимущества, обусловленные настоящим изобретением, 001574 28 включают повышенную познавательную функцию и увеличенную емкость памяти. Настоящее изобретение затем полезно при профилактике и лечении расстройств и нарушений сна, включая проблемы, связанные с бессонницей, повышенной сонливостью, остановкой дыхания при сне, нарколепсией, ночным миоклонусом, с помехами REM сна, усталостью долгого перелета, нарушением сна у работающих посменно, дисомнией, ночными страхами,бессонницей, связанной с депрессией или с расстройствами эмоций/настроения, дисфункциями, связанными со сном (парасомния), также как и со сном при ходьбе и недержанием мочи, а также расстройствами, возникающими при старении. В общем случае, расстройства и нарушения сна характеризуются трудностью засыпания либо поддержания состояния сна или недостаточностью сна либо недостаточно восстанавливающим сном. Кроме того, некоторые лекарства также могут быть причиной уменьшения REM сна (как побочный эффект), и настоящее изобретение может помочь скорректировать такие расстройства сна. Настоящее изобретение может быть полезным при лечении таких синдромов, как фибромиалгия, которая проявляется в невосстанавливающем сне и болезненности мышц или в остановке дыхания во время сна. Специалистам очевидно, что настоящее изобретение не ограничивается только расстройствами или нарушениями сна, но и также применимо к большому разнообразию состояний, которые являются последствием сниженного качества сна. Соединения формулы (I) могут применяться одни или в сочетании с другими агентами,которые известны своей полезностью для изменения суточных ритмов либо при повышении эффективности сна. Например, соединения формулы (I) могут назначаться в сочетании с другими соединениями, которые известны как полезные для подавления или стимулирования образования мелатонина, включая мелатонергические агенты, норадренергические и серотонергические блокаторы обмена, альфа-1 норадренергические агонисты, ингибиторы моноаминооксидазы, бета-адренергические блокаторы и бензодиазепины, как, например, атенолол; или с другими соединениями, известными как стимуляторы образования мелатонина,включая трициклические антидепрессанты и альфа-2-адренергические антагонисты; или с предшественниками мелатонина, как, например,триптофан, 5-гидроксигриптофан, серотонин иN-ацетилсеротонин; так же как и с аналогами мелатонина, агонистами мелатонина и антагонистами мелатонина. Кроме того, соединения формулы (I) могут быть назначены в сочетании с другими соединениями, которые известны как полезные для повышения качества сна и профилактики и лечения расстройств и нарушений сна, включая, например, успокоительные, гип 29 нотики, транквилизаторы, антипсихотики, агенты против беспокойства, минорные транквилизаторы, агонисты и антагонисты мелатонина,мелатонин, мелатонергические агенты, бензодиазепины, барбитураты, 5-НТ-2 антагонисты, и т.п., как, например: адиназолам, аллобарбитал,алонимид, алпразолам, амитриптилин, амобарбитал, амоксапин, бентазепам, бензоктамин,бротизолам, бупропион, бусприон, бутабарбитал, буталбитал, капурид, карбохлорал, хлорал бетаина, хлоралгидрат, хлордиазепоксид, кломипрамин, клоперидон, клораземат, клоретат,клозапин, кипразепам, дезипрамин, декскламол,диазепам, дихроралфеназон, дивалпроэкс, дифенгидрамин, доксепин, эстазолам, этхлорвинол, этомидат, фенобам, флунитразепам, флуразепам, флувоксамин, флуоксетин, фозазепам,глутетимид, галазепам, гидроксизин, имипрамин, литий, лоразепам, лорметазепам, мапротилин, меклоквалон, мелатонин, мефобарбитал,мепробамат, метакувалон, мидафлур, мидазолам, нефазодон, нисобамат, нитразепам, нортриптилин, оксазепам, паралдегид, пароксетин,пентобарбитал, перлапин, перфеназин, фенелзин, фенобарбитал, празепам, прометазин, пропофол, протриптилин, квазепам, реклазепам,ролетамид, секобарбитал, сертралин, супроклон,темазепам, тиоридазин, траказолат, транилкипромаин, тразодон, триазолам, трепипам, трицетамид, триклофос, трифлуоперазин, триметозин,тримипрамин, улдазепам, валпроат, венлафаксин, золеплон, залазепам, золпидем, их соли, и их комбинации и т.п. Соединения формулы (I) могут быть назначены в сочетании с применением физических методов, как, например, со световой терапией или электрической стимуляцией. В частности,соединения формулы (I) могут быть назначены в сочетании со спланированным назначением яркого света, с воздействием света обычной яркости, приглушенного света или темноты (или даже со сном). В одном варианте настоящего изобретения соединение формулы (I) назначалось наряду с индивидуальной темной одеждой или красными защитными очками во время применения препарата для того, чтобы получить дополнительные эффекты от лечения темнотой. В другом варианте настоящего изобретения лица носили темные очки в перерывах между приемами соединения формулы (I), чтобы избежать влияния внешнего течения времени, учитывая сдвиг фазы, обусловливаемый соединением формулы (I). Аналогично можно использовать воздействие яркого света наряду с назначением соединения формулы (I). Границы настоящего изобретению также охватывают использование соединения формулы (I) в одиночку либо в сочетании с другими агентами для регулирования суточных ритмов,либо для профилактики или лечения расстройств или нарушений сна у млекопитающих. 30 Здесь термин "млекопитающие" охватывает экономически значимых животных, таких как быки, овцы и свиньи, особенно тех, которых выращивают на мясо, а также домашних животных, спортивных животных, животных зоологического сада, и людей, последних предпочтительно. Следует заметить, что используя описанную здесь какую-либо комбинацию, как соединение формулы (I), так и другой активный агент(ы) должны быть назначены пациенту в подходящие периоды времени. Соединения могут находиться в том же самом фармацевтически приемлемом носителе и, таким образом,вводиться одновременно. Они могут быть в отдельных фармацевтических носителях, как, например, обычные пероральные формы дозировки, которые принимают одновременно. Термин"сочетание" также относится к случаю, когда соединения пребывают в раздельных формах дозировки и их принимают последовательно. Например, один активный компонент может быть назначен в виде таблетки и затем, в подходящий период времени, может быть назначен второй активный компонент либо в виде пероральной формы дозировки, например таблетки,либо в виде быстрорастворимой пероральной формы. "Быстрорастворимая пероральная форма" означает пероральную форму, которая, попав на язык пациента, растворяется за 10 с."Подходящий период времени" означает период времени, который не превышает около 1 ч. Например, если первый активный компонент дается в виде таблетки, тогда второй активный компонент должен быть назначен не позднее 1 ч либо в той же самой лекарственной форме, либо в другой, которая обеспечивает эффективную доставку медикамента. Превосходный фармакологический профиль соединений по настоящему изобретению предоставляет возможность их терапевтического использования малыми дозировками, таким образом минимизируя риск нежелательных побочных эффектов. При лечении состояний, связанных с избытком тахикининов, соответствующий дозировочный уровень варьирует от 0,001 до 50 мг/кг в день, в частности - от 0,01 до 25 мг/кг, как, например, 0,05 до 10 мг/кг в день. Например, при лечении состояний, охватывающих невротрансмиссию болезненных ощущений, соответствующий уровень дозировки варьирует от 0,001 до 25 мг/кг в день, предпочтительно от 0,005 до 10 мг/кг в день, и особенно от 0,005 до 5 мг/кг в день. Соединения могут назначаться в режиме от 1 до 4 раз в день,предпочтительно один или два раза в день. При лечении рвоты, используя составы для инъекций, соответствующие дозировочные уровни колеблются от 0,001 до 10 мг/кг в день,предпочтительно от 0,005 до 5 мг/кг в день и особенно от 0,01 до 1 мг/кг в день. Соединения 31 могут назначаться в режиме от 1 до 4 раз в день,предпочтительно один или два раза в день. Следует заметить, что количество соединения формулы (I), необходимое при любом лечении, будет зависеть не только от различных выбранных соединений и композиций, но и от способа назначения, природы состояния, требующего лечения, и от возраста и состояния пациента, и должно строго контролироваться лечащим врачом. В соответствии с общим способом (А.1),соединения формулы (I), в которых двойная связь, представленная пунктиром, отсутствует,могут быть получены восстановлением соответствующего соединения формулы (I), где пунктир означает двойную связь, ниже представленного формулой (IIА) где R1, R2, R3, R4, R5, R6, R9, R10 и Х имеют значения, указанные для формулы (I). Соответствующие условия восстановления включают каталитическое гидрирование при использовании металлического катализатора,например, палладия или платины либо их гидроксидов или оксидов, предпочтительно, в соответствующем спиртовом растворителе, например, в метаноле или в этаноле, или в сложном эфире, например, в этилацетате, или в органической кислоте, например, в уксусной кислоте, или в их смеси; или восстановление с использованием трифторуксусной кислоты и триэтилсилана. Аналогично, согласно общему способу(А.2), соединения формулы (I), в которых двойная связь, обозначенная пунктиром, отсутствует, и Х означает два атома водорода, могут быть получены восстановлением соединения формулы (IIB) при использовании условий реакции, описанных выше в способе (А.1). Согласно другому общему способу (В), соединения формулы (I), в которых пунктир означает двойную связь (т.е. соединение формулы(IIА), представленное выше), могут быть получены при взаимодействии соединения формулы в котором R50 означает отщепляемую группу,такую как трифлат (-ОSО 2 СF3) либо атом галогена, например хлор, бром или йод, особенно трифлат, бром или йод. Реакцию проводят обычно в присутствии хлорида лития и катализатора переходного металла, например, трифенилфосфина палладия(0). Соответствующие растворители, используемые в реакции, включают ароматические углеводороды, например толуол, полярные апротонные растворители, например диметилформамид или эфиры, например диоксан; реакцию проводят в интервале термператур от 80 С до дефлегмационной температуры растворителя. Согласно другому общему способу (С) соединения формулы (I) могут быть получены путем превращения соответствующего соединения формулы (I), где R6 означает Н, ниже представленного формулой (V)(VI),6a где R означает группу формулы R6, как определено для формулы (I) (иную чем Н) или предшественника, а LG представляет уходящую группу, такую как алкил- или арилсульфонилоксигруппу (например, мезилат или тозилат) или атом галогена (например, бром, хлор или йод); и, если R6a означает группу предшественника,превращают ее в группу R6 (в этом процессе любая реактивная группа может быть блокирована (защищена) и позднее деблокирована, если необходимо. Эта реакция может быть проведена обычным способом, например, в органическом рас 33 творителе, таком как диметилформамид, в присутствии кислотного акцептора, например, карбоната калия. В международной патентной публикацииWO 95/18124 описаны другие методы введения группы R6. Согласно другому общему способу (D) соединения формулы (I), где R1 означает C1-6 алкокси, фтор-С 1-6-алкокси, С 2-6-алкенокси, С 3-7 циклоалкокси, С 3-7-циклоалкил-С 1-4-алкокси или бензилокси, могут быть получены путем превращения соединения формулы (I), где Р 1 означает гидрокси, ниже представленного формулой При реакции с соответствующим алкил,фтороалкил, алкенил, циклоалкил, циклоалкилалкил или аралкилгалогенидом, особенно, с йодидом, в присутствии основания. Соответствующие основания включают гидриды щелочных металлов, например гидрид натрия, в соответствующем растворителе, например в диметилформамиде. Реакцию обычно проводят при комнатной температуре. Согласно иному общему способу (Е) соединения формулы (I) могут быть получены путем циклизации соединения формулы (VIII) используя соответствующие реагенты дегидратации, например, метансульфонилхлорид или бензолсульфонилхлорид, в присутствии пиридина или триэтиламина. Реакцию обычно проводят в интервале температур от 0 до 100 С,предпочтительно от комнатной температуры до 80 С, используя соответствующий органический растворитель, например, дихлорметан, если необходимо. Промежуточные соединения формулы(VIII) являются наиболее предпочтительными для контроля стереохимии 3 позиции соединений формулы (I). Согласно следующему общему способу (F) соединения формулы (I), где пунктир обозначает двойную связь (т.е. соединение формулы IIА,вышеуказанное), могут быть получены путем дегидратации соединения формулы (IX) используя трифторуксусную кислоту в качестве кислоты. Реакцию обычно проводят в интервале температур от 0 С до комнатной температуры,используя соответствующий органический растворитель, например дихлорметан. Согласно другому общему способу (G) соединения формулы (I), где двойная связь, обозначенная пунктиром, отсутствует, могут быть получены из соединения формулы (X) и соединения формулы (IV), где Hal в соединении формулы (IV) означает хлор, бром или йод,предпочтительно йод, при помощи восстанавливающей реакции Гека (Heck), используя палладиевый катализатор, например ацетат палладия, с, например, три-о-толилфосфином, диметилформамидом и трибутиламином или хлоридом тетрабутиламмония и диметилформамидом,и восстанавливающим агентом, предпочтительно муравьиной кислотой либо ее солью, например, формиатом калия. Согласно иному общему способу (Н) соединения формулы (I) могут быть получены из соединения формулы (XX) при реакции с нафталенидом лития в тетрагидрофуране. Реакцию предпочтительно проводят при пониженной температуре, например, при-78 С. Дополнительные детали соответствующих процедур представлены в сопровождающих примерах. Соединения формулы (IIВ) могут быть получены методом общего способа (F), описанного выше, при условии, что Х в соединении формулы (IX) означает два атома водорода. Промежуточные соединения формулы (V) могут быть получены способом, похожим на 35 описанный в общем процессе (В), предпочтительно, с аминоблокирующей группой на азоте пиперидина в соединении формулы (III). Соответствующие аминоблокирующие группы включают алкоксикарбониловые группы, например, трет-бутоксикарбонил и трихлорэтоксикарбонил, аралкилоксикарбониловые группы,например, бензилоксикарбонил, или аралкиловые группы, например, бензил. Удаление защитной группы проводят обычными процедурами, например, трет-бутоксикарбониловые группы могут быть удалены в кислотных условиях, например, в присутствии трифторуксусной кислоты; трет-бутоксикарбониловые группы вместе с бензилоксикарбониловыми и бензиловыми группами также могут быть удалены путем гидрогенолиза в присутствии катализатора, например, палладия; и трихлорэтоксикарбониловые группы могут быть удалены при помощи цинковой пыли. Соединения формулы (III) могут быть получены из соединения формулы (XII) 36 метансульфокислоты. Реакция обычно проводится в соответствующем растворителе, в таком как сложный эфир, например, тетрагидрофуран,при пониженной температуре, например, при-80 С. Соединения формулы (XIII) могут быть получены из соединения формулы (XIV) при следующей очередности реакций (схема А или схема В) либо аналогичными методами (с оговоркой, что R9 и R10 не означают оксо). Схема А в котором R50 определено ранее (и предпочтительно означает группу трифлата либо атом брома или йода), путем реакции с соединением формулы (R45)3Sn-Sn(R45)3, например, с гексаметилом дистаннана. Реакцию обычно проводят в присутствии основания, например, карбоната лития, и катализатора, например, трифенилфосфина палладия (O). Соотвествующие растворители, используемые в реакции, включают сложные эфиры, например, тетрагидрофуран; реакция проводится в интервале температур от комнатной температуры до 100 С, например, при 60 С. Соединения формулы (XII), где Х обозначает два атома водорода, могут быть получены из соединения формулы (XIII) путем энолизации кетона в присутствии основания, например, гексаметилдисилазида натрия с последующей реакцией с реагентом, способным вводить соответствующую отщепляемую группу, например, где R50 означает -OSO2 СF3, используя 2-[N,N-бис(трифторметилсульфонил) амино]-5-хлорпиридин или ангидрид трифтор В предпочтительном варианте вышеуказанных способов R6 означает бензил. Реакцией восстановления, описанной выше как способ (А) получения соединений формулы (I), можно обычным способом заменить бензиловую группу атомом водорода. Из представленного описания видно, что соединения формулы (I), в которых R6 означает атом водорода, являются наиболее предпочтительными предшественниками других соединений формулы (I). В другом способе соединения формулы(III), где Х означает два атома водорода, могут быть получены при следующей очередности реакций (схема С) либо аналогичными методами (с оговоркой, что R9 и R10 не означают оксо). В ином предпочтительном варианте вышеуказанных способов R6 замещают аминоблокирующей группой,в частности,третбутоксикарбонилом, которую обычным способом удаляют перед восстановлением структуры 7-азаспиро[4.5]дек-3-ена (общий способ (А. Соединения формулы (VII) могут быть получены из соответствующего фенольного предшественника (либо из блокированного его производного, например, бензилокси), используя методы способов (А), (В) или (С). Соединения формулы (VIII), где Х означает два атома водорода, могут быть получены путем восстановления соединения формулы (I),где Х означает атом кислорода, используя, например, боргидрид, такой как боргидрид лития,либо триэтилборгидрид лития в тетрагидрофуране, либо гидрид, такой как литийалюминийгидрид или гидрид диизобутилалюминия. Соединения формулы (I), где Х означает атом кислорода, могут быть получены восстановлением соединения формулы (IIА), где Х означает атом кислорода, используя, например,ацетат палладия и формиат калия в соответствующем растворителе, например, диметилформамиде, при повышенной температуре, например, при 80 С; или путем каталитического гидрирования с гидроксидом палладия или платины на углероде, предпочтительно, в соответствующем спиртовом растворителе, например, в метаноле, либо в сложном эфире, например, этилацетате, либо в органической кислоте, например, в уксусной кислоте, либо их смеси; или используя боргидрид натрия и хлорид никеля. В другом способе соединения формулы(VIII) могут быть получены при реакции соединения формулы (XIV) с реактивом Гриньяра формулы (XV) в которой R60 означает соответствующую гидроксигруппу, предпочтительно бензил, a Hal означает атом галогена, предпочтительно хлор,после чего следует удаление защитной группы. Использование хирального промежуточного соединения формулы (XV) является наиболее пригодным для контроля стереохимии 3 позиции соединений формулы (I). Соединения формулы (XV) могут быть получены обычными хорошо известными в этой области способами либо на основании описанных примеров. В следующем варианте способа соединения формулы (VIII) могут быть получены путем восстановления соединения формулы (XVI) используя, например, каталитическое гидрирование в присутствии металлического катализатора, например, палладия или платины либо их гидроксидов или оксидов, предпочтительно в соответствующем растворителе, таком как спирт, например метанол, сложный эфир, например этилацетат, или органическая кислота,например уксусная кислота, или их смеси. Соединения формулы (XVI) могут быть получены из соединения формулы (XVII) реакцией с соединением формулы (IV), используя восстанавливающие условия Гека, как описано выше в общем способе (G). Соединения формулы (XVII) могут быть получены из соединений формулы (XIV), а, например, реактив Гриньяра - из о-триметилсилилпропаргилового спирта, используя обычную методику, с последующим удалением блокирующей группы, защищающей гидроксигруппу. Согласно другому методу соединения формулы (VIII) могут быть получены из соединения формулы (XVIII) реакцией с бораном в присутствии тетрагидрофурана с последующей окислительной обработкой, используя, например, перекись водорода и гидроксид натрия. Соединения формулы (XVIII) могут быть получены из соединения формулы (XIV), а, например, реактив Гриньяра - из 2-арил-3-бром-1 пропена, используя обычную методику. Соединения формулы (IX) можно получить реакцией соединения формулы (XIII) с реактивом Гриньяра, полученным из соединения формулы (IV), предпочтительно используя магний и бромид формулы (IV). Реакция присоединения обычно проводится при пониженной температуре, например, при 0 С, используя соответствующий растворитель, такой как эфир,например, диэтиловый эфир. Соединения формулы (X) можно получить,например, превращением станнана формулы(III) в соответствующий йодид при взаимодействии с йодом при пониженной температуре,например, при -78 С, в соответствующем растворителе, например, дихлорметане. Потом йод может быть замещен, чтобы получить соединение формулы (X), при взаимодействии, например, с ,'-азо-изобутиронитрилом и гидридом трибутилолова в соответствующем растворителе, например, толуоле, при повышенной температуре, например, при 100 С. Альтернативно, соединения формулы (X) можно получить при циклизации соединения формулы (XIX) используя дегидратационные условия, описанные выше для общего способа (Е), либо используя трифенилфосфин и диэтилазодикарбоксилат в соответствующем растворителе, например, в тетрагидрофуране. Соединения формулы (XIX) можно получить частичным восстановлением ацетиленового соединения формулы (XVII). Реакцию обычно проводят каталитическим гидрированием,используя металлический катализатор, например, палладий на карбонате кальция, в присутствии [катализаторного] яда свинца (например, 001574 40 катализатора Линдлара). Другие пригодные методы будут специалистам очевидны. Соединения формулы (XX) можно получить из соединения формулы (VII) при реакции с (1-йод-циклопроп-1-ил)фенилсульфидом. Следует отметить, что соединения формулы (I), в которых R6 имеет =O или =S заместитель, может существовать в таутомерных формах. Все такие таутомерные формы и их смеси охватываются настоящим изобретением. Наиболее подходящим =O или =S заместителем в R6 является =O заместитель. Если промежуточные соединения выше представленной формулы (IV) коммерчески недоступны, они могут быть получены, например,из соответствующего фенольного производного,используя, например, процедуры, описанные в сопровождающих примерах, либо при помощи альтернативных процедур, понятных специалистам. Во время выполнения любой из вышеуказанных последовательностей реакций синтеза необходимо и/или желательно предохранить чувствительные или реактивные группы на любых затрагиваемых молекулах. Этого можно достичь при помощи обычных защитных групп,как описано в Protective Groups in OrganicGroups in Organic Synthesis, John WileySons,1991. Защитные группы могут быть удалены известными методами при помощи обычных последовательных стадий. Соединения, представленные в примерах настоящего изобретения, были исследованы методами, описанными в международной патентной публикации WO 93/01165, с. 36-39. Указанным методом установлено, что соединения являются активными, имея IС 50 к NK1 рецептору меньше 100 нМ. Наиболее предпочтительный подкласс 3(R)-эпимеров соединений по настоящему изобретению в общем является в 2-5 раз родственнее к человеческому NК-1-рецептору, чем соответствующие 3(S)-эпимеры. Чтобы рассеять сомнения, во всех случаях номенклатура, принятая в данном описании изобретения, основана на следующей структуре Следующие примеры иллюстрируют получение соединений по настоящему изобретению,не ограничивая объема изобретения. Пример синтеза 1. (2S)-1-трет-Бутоксикарбонил-2-фенилпиперидин-3-он. К охлажденному до (-70 С) раствору оксалилхлорида (13,95 мл, 20,30 г, 160 ммоль) в ди 41 хлорметане (350 мл) по каплям добавляют диметилсульфоксид (20,80 мл, 22,90 г, 29,3 ммоль) в дихлорметане (75 мл). Смесь 15 мин перемешивают при -70 С, затем по каплям добавляют(2S,3S)-1-трет-бутоксикарбонил-3-гидрокси-2 фенилпиперидин (полученный методом, описанным в Европейской патентной заявке 0528495-А; 36,91 г, 133 ммоль) в дихлорметане(150 мл). Смесь 20 мин перемешивают при температуре -70 С, затем дают подогреться до температуры -30 С. Смесь затем охлаждают до температуры -50 С и медленно добавляют триэтиламин (55,95 мл, 40,45 г, 400 ммоль). Смеси дают подогреться до 0 С и разбавляют охлажденным льдом раствором дихлорметана (250 мл). Смесь промывают ледяным водным раствором лимонной кислоты (5%, 2300 мл) и водой (300 мл), высушивают (MgSО 4), а растворитель удаляют под уменьшенным давлением,получая целевое соединение в виде желтого масла (42,3 г), который немедленно используют без дальнейшей очистки. 1 Н ЯМР (250 мГц, CDCl37.5-7.3 (5 Н,м), 5.8 (1 Н, ш. с), 4.2 (1 Н, ш. с), 3.4 (1 Н, м), 2.6(2 Н, м), 2.0 (2 Н, м), и 1.54 (9 Н, с). Пример синтеза 2. (2S,3R)-1-трет-Бутоксикарбонил-3-гидрокси-3-(2-метилен-3-феноксипропил)-2-фенилпиперидин. К раствору (2S)-1-трет-бутоксикарбонил-2 фенилпиперидин-3-она (пример синтеза 1) в ТГФ (3 мл) медленно прибавляют раствор 3(хлормагний)-2-(феноксиметил)-1-пропена в ТГФ (0,91 М, 3 мл) (Louw et. al. Tetrahedron, 48,6087-6104, 1992, полученный из 2,74 ммоль 3 хлор-2-(феноксиметил)-1-пропена). Смесь 1 ч перемешивают при комнатной температуре,затем добавляют насыщенный раствор хлористого аммония (20 мл) и смесь экстрагируют этилацетатом (20 мл). Органическую фазу промывают рассолом, высушивают (MgSO4), а растворитель выпаривают при уменьшенном давлении. Остаток очищают при помощи хроматографии на колонке с силикагелем, элюируя гексаном/этилацетатом (100:0, повышая до 80:20) и получая целевое соединение. 1 Н ЯМР (360 мГц, CDCl3)7.48 (2 Н, д, J 6.9 Гц), 7.35-7.2 (6 Н, м), 6.9-6.88 (3 Н, м), 5.4(пример синтеза 2; 1,53 г, 3,62 ммоль) в ТГФ (20 мл) добавляют п-бутиллитий (2,5 М в гексане,1,45 мл, 3,62 ммоль), затем раствор хлорида цинка (0,5 М в ТГФ, 7,24 мл, 3,62 ммоль). Рас 001574 42 твору дают согреться до комнатной температуры и добавляют тетракис(трифенилфосфин) палладий (0) (0,23 г, 0,2 ммоль). Смесь обезгаживают барботированием азота и 16 ч нагревают, используя обратный холодильник. Смесь охлаждают, а растворитель удаляют под уменьшенным давлением. Осадок фракционируют между этилацететом и 2 М NaOH. Органическую фазу промывают насыщенным рассолом, высушивают (MgSО 4) и очищают при помощи хроматографии на колонке с силикагелем (элюируя гексаном, содержащим увеличивающиеся пропорции этилацетата от 0 до 5%). Упариванием фракций получают (5R,6S,)-3-метилен-6-фенил 1-окса-7-(трет-бутоксикарбонил)азаспиро[4,5] декан. 1 Н ЯМР (360 мГц, CDCl3)7.58 (2 Н, д, J 8.4 Гц), 7.32-7.21 (3 Н, м), 5.23 (1 Н, с), 5.06 (1 Н,м), 4.97 (1 Н, м), 4.39 (2 Н, АВ д, J 13.3 Гц), 3.99(5R,6S)-3-метилен-6-фенил-1-окса-7-(третбутоксикарбонил)азаспиро[4.5]декана (пример синтеза 3; 0,665 г) в СН 2 Сl2 (5 мл) и метаноле (5 мл) 45 мин барботируют смесь озона и кислорода. К раствору, очищенному азотом, добавляют диметилсульфид (0,5 мл) и 16 ч перемешивают при комнатной температуре в атмосфере азота. Растворитель удаляют под вакуумом, а остаток фракционируют этилацетатом и водой. Органическую фазу высушивают (MgSO4), выпаривают, а осадок очищают при помощи хроматографии на колонке с силикагелем (элюируя гексаном, содержащим увеличивающуюся пропорцию этилацетата от 0 до 10%). Выпариванием фракций получают целевое соединение. 1H ЯМР (250 мГц, СDСl3)7.58 (2 Н, д,76.2 Гц), 7.37-7.26 (3 Н, м), 5.3 (1 Н, с), 4.15 и 4.09 (2 Н, АВ д, J 17.4 Гц), 3.97 (1 Н, м), 2.80 (1 Н,т. д, J 12.9, 4.0 Гц), 2.74 и 2.48 (2 Н, АВ д, J 18.1 Гц), 2.29 (2 Н, м), 1.88-1.63 (2 Н, м), и 1.44 (9 Н,с). m/z (ES+) 332 (М+1). Пример синтеза 5. (5R,6S)-3-Трифторметилсульфонилокси-6-фенил-1-окса-7-(третбутоксикарбонил)азаспиро[4.5]дек-3-ен. К охлажденному (-80 С) раствору 1 М гексаметилдисилазида натрия (0,38 мл, 0,38 ммоль) в ГТФ добавляют раствор (5R,6S)-3-кето-6 фенил-1-окса-7-(трет-бутоксикарбонил)азаспиро[4.5]декана (пример синтеза 4; 0,105 мг, 0,319 ммоль) в ТГФ (3 мл). Раствор перемешивают 1 ч при температуре (-80 С), затем прибавляют раствор 2-[N,N'-бис(трифторметилсульфонил)амино]-5-хлорпиридина (0,163 г, 0,415 ммоль) в ТГФ (3 мл). Раствор перемешивают 30 мин при 43 температуре -80 С, затем 30 мин при комнатной температуре, реакцию прекращают прибавлением насыщенного раствора хлористого аммония и этилацетата. Высушенную (MgSO4) органическую фазу очищают при помощи хроматографии на колонке с силикагелем (элюируя гексаном, содержащим увеличивающиеся количества этилацетата от 0 до 5%). Выпариванием фракций получают целевое соединение. 1(пример синтеза 5; 0,482 г, 1,04 ммоль) хлористого лития (0,264 г, 6,25 ммоль), углекислого лития (0,076 г) и гексаметилдистаннана (0,96 г,2,9 ммоль) в ТГФ (10 мл) прибавляют трифенилфосфинпалладий (0) (0,06 г). Раствор обезгаживают и затем 5 ч выдерживают при температуре 60 С в атмосфере азота. Добавляют воду(20 мл) и этилацетат (20 мл) и высушенную органическую фазу очищают при помощи хроматографии на колонке с силикагелем (элюируя гексаном, содержащим увеличивающиеся количества этилацетата от 0 до 5%). Выпариванием фракций получают целевое соединение в виде твердого кристаллического вещества. 1 Н ЯМР (360 мГц, СDСl3)7.25 (2 Н, д, J 7.3 Гц), 7.1-7.0 (3 Н, м), 5.83 (1H, t, J 2.5 Гц), 4.78(1 Н, д. д, J 6.16, 13.4 Гц), 2.95 (1H, т. д, J 13.3,4.5 Гц), 1.84 (1 Н, м), 1.68 (1H, м), 1.60 (2 Н, м),1.19 (9 Н, с) и 0.0 (6 Н, с). Пример синтеза 7. (2S,3R)-1-трет-Бутоксикарбонил-3-(3-гидроксипропин-1-ил)-2-фенилпиперидин-3-ол. К охлажденному (-10 С) раствору бромистого этилмагния (1 М в тетрагидрофуране, 160 мл, 160 ммоль) добавляют о-триметилсилилпропаргиловой спирт (24,51 мл, 20,47 г, 160 мл). Смесь 20 мин перемешивают при температуре 0 С, затем 2 ч при комнатной температуре. Смесь охлаждают до -10 С и по каплям в течение 30 мин добавляют раствор (2S)-1-третбутоксикарбонил-2-фенилпиперидин-3-она(200 мл) (внутренняя температура ниже -5 С). Смесь при комнатной температуре перемешивают 14 ч, выливают воду (300 мл) с насыщенным водным хлористым аммонием (300 мл) и экстрагируют этилацетатом (2300 мл). Объединенные органические фракции промывают рассолом (300 мл), высушивают (MgSO4), а рас 001574 44 творитель удаляют под уменьшенным давлением. Осадок растворяют в этилацетате (500 мл) и по каплям добавляют раствор фтористого тетрабутиламмония (1 М в тетрагидрофуране, 160 мл,160 ммоль). Смесь 30 мин перемешивают при комнатной температуре, добавляют воду (300 мл) и разделяют слои. Водный слой экстрагируют этилацетатом (2300 мл), объединенные фракции промывают водой (300 мл) и рассолом(300 мл), высушивают (MgSO4), а растворитель выпаривают под уменьшенным давлением, получая целевое соединение в виде оранжевого масла. Сырое вещество очищают при помощи флеш-хроматографии на силикагеле, элюируя гексаном/ЕtOАс (90:10 повышая до 25:75); получают целевое соединение в виде янтарного масла (32,2 г). 1(внутренняя температура ниже 25 С) по каплям в течение 15 мин добавляют гидрид трибутилолова (35,78 мл, 38,71 г, 133 ммоль). Смесь 1 ч перемешивают при комнатной температуре,затем растворитель удаляют под уменьшенным давлением. Остаток растворяют в тетрагидрофуране (600 мл) и добавляют трифенилфосфин(34,88 г, 133 ммоль). Перемешивая и охлаждая по каплям добавляют раствор диэтилазодикарбоксилата (20,94 мл, 23,16 г, 133 ммоль) в тетрагидрофуране (150 мл) и смесь 1 ч перемешивают при комнатной температуре. Растворитель удаляют под уменьшенным давлением, добавляют ацетонитрил (600 мл) и смесь экстрагируют гексаном (8150 мл). Гексановые фракции объединяют, а растворитель удаляют под уменьшенным давлением. Остаток очищают при помощи флеш-хроматографии на колонке с силикагелем,элюируя дихлорметаном/этилацетатом (100:0 повышая до 99:1), получают целевое соединение в виде желтого масла(6 Н, м), и 0.86-0.99 (15 Н, м). Пример синтеза 9. (2S,3R)-Этил-3-(1-третбутоксикарбонил-3-гидрокси-2-фенилпиперидин-3-ил)пропионат. К охлажденному (-78 С) раствору этилпропионата (0,370 мл, 3,64 ммоль) в тетрагидрофуране (10 мл) медленно добавляют нбутиллитий (2,28 мл, 1,6 М раствор в гексанах,3,64 ммоль). Окончив добавление, раствор еще 10 мин перемешивают при температуре -78 С,затем добавляют (2S)-l-трет-бутоксикарбонил-2 фенилпиперидин-3-он (пример синтеза 1; 1,0 г,3,64 ммоль) в тетрагидрофуране (10 мл), поддерживая температуру ниже -75 С. Смесь перемешивают еще 10 мин, затем подогревают до-60 С, и добавляют ледяную уксусную кислоту(1 мл). Смесь подогревают до комнатной температуры и сливают в насыщенный водный бикарбонат натрия (20 мл). Органическую фракцию отделяют, а водную фракцию экстрагируют этилацетатом (20 мл). Объединенные органические фракции высушивают (Na2SО 4), а растворитель удаляют под уменьшенным давлением. Остаток очищают при помощи флешхроматографии на колонке с силикагелем,элюируя гексаном/ЕtOАс (90:10), получают целевое соединение в виде смолы (801 мг, 59%). 1(0) (50 мг) в толуоле (10 мл) в течение 30 мин обезгаживают азотом. По каплям добавляют гидрид трибутилолова (0,405 мМ, 1,5 ммоль) и полученную смесь 2 ч перемешивают при температуре 23 С. Растворитель удаляют под уменьшенным давлением и остаток переносят в этилацетат (50 мл). Смесь промывают насыщенным водным бикарбонатом натрия (50 мл),высушивают (Na2SО 4), а растворитель удаляют под уменьшенным давлением. Остаток очищают при помощи флеш-хроматографии на колонке с силикагелем, получая целевое соединение в виде смолы (538 мг, 0,87 ммоль, 62%). 1 Н ЯМР (250 мГц, СDСl3)7.63 (1H, с),7.30 (5 Н, м), 5.11 (1H, с), 4.17 (1H, м), 3.10 (1H,м), 2.19 (1H, м), 1.80 (3 Н, м), 1.30-1.50 (12 Н, м),1.40 (9 Н, с), 1.02 (6 Н, м), и 0.88 (9 Н, т, J 7.22 Гц). m/z (ES+) 619 (М+1). Пример синтеза 11. 2-Бром-4-(трифторметокси)фенол. 46 К охлажденному (0 С) раствору 4 трифторметоксифенола (35,6 г, 0,2 моль в хлороформе (280 мл) по каплям добавляют раствор брома (32 г, 0,2 моль в хлороформе (50 мл). Раствор перемешивают 1 ч при температуре 0 С и 2 ч при комнатной температуре. Добавляют дихлорметан (200 мл) и воду (400 мл), и органическую фазу в дальнейшем промывают водой (400 мл), рассолом (200 мл) и высушивают (Na2SO4). Растворитель удаляют, а остаток очищают дистиллированием под уменьшенным давлением,получая целевое соединение. 1(60 мл) добавляют метилйодид (14,94 мл, 0,24 моль). Раствор 15 ч перемешивают при комнатной температуре, пропуская азот, затем добавляют воду (400 мл) и диэтиловый эфир (200 мл),и органическую фазу промывают водой (4200 мл), насыщенным NaHCO3 (2200 мл), рассолом (200 мл), а растворитель удаляют под вакуумом. Остаток очищают при помощи хроматографии на колонке с силикагелем, элюируя этилацетатом в гексане (0-2%), получая целевое соединение. 1(1,1 г, 7,8 ммоль) в диметилформамиде (15 мл) добавляют 2-бромпропан (0,55 мл, 5,9 ммоль). Раствор в атмосфере азота перемешивают 14 ч при комнатной температуре. К раствору добавляют воду (200 мл) и этилацетат (370 мл), и органическую фазу промывают водой (100 мл),рассолом (100 мл) и высушивают (MaSO4). Растворитель удаляют под вакуумом, а остаток очищают при помощи хроматографии на колонке с силикагелем (элюируя 5% этилацетатом в гексане), получая целевое соединение. 1(8,6 г, 0,06 моль) в диметилформамиде (100 мл) добавляют бромистый аллил (4 мл, 0,045 моль). Раствор перемешивают 4 ч при комнатной температуре в атмосфере азота, затем добавляют воду (400 мл) и этилацетат (3100 мл), и объе 47 диненную органическую фазу промывают водой(200 мл), насыщенным рассолом (200 мл), высушивают (MgSO4), a растворитель удаляют под вакуумом. Остаток очищают при помощи хроматографии на колонке с силикагелем (элюируя 5% этилацетатом в гексане), получая целевое соединение в виде желтого масла. 1(пример синтеза 14; 8,6 г) 7 ч нагревают при температуре 200 С, а охлажденный остаток очищают при помощи хроматографии на силикагеле (элюируя 1% этилацетатом в гексане),получают 2-бром-6-(проп-2-енил)-4-трифторметоксифенол в виде желтого масла. 1 Н ЯМР (250 мГц, СDСl3)3.43 (2 Н, д, J 6.6 Гц), 5.13 (2 Н, м), 5.60 (1H, с), 5.98 (1H, м),6.98 (1H, д, J 2.4 Гц), и 7.24 (1H, д, 2.4 Гц). Пример синтеза 16. 2-Бром-6-(2 гидроксиэтил)-4-трифторметоксифенол. Через охлажденный (-78 С) раствор 2 бром-6-(проп-2-енил)-4-трифторметоксифенола(пример синтеза 15; 5,9 г, 0,02 моль) в дихлорметане (30 мл) и метаноле (30 мл) 4 ч барботируют смесь озона и кислорода. После 1 ч очистки раствора азотом добавляют боргидрид натрия (0,755 г) и смесь 15 ч перемешивают при комнатной температуре. Растворитель удаляют под вакуумом, а остаток фракционируют этилацетатом и водой, содержащей 2 М НСl (20 мл). Органическую фазу промывают насыщенным рассолом, высушивают (MgSO4), а растворитель удаляют под вакуумом. Остаток очищают при помощи хроматографии на колонке с силикагелем (элюируя 20% этилацетатом в гексане), получая целевое соединение. 1(6,11 г, 0,0234 моль) в тетрагидрофуране (40 мл) добавляют диэтилазодикарбоксилат (3,7 мл,0,0234 моль). Раствор перемешивают 30 мин,затем добавляют раствор 2-бром-6-(2 гидроксиэтил)-4-трифторметоксифенола (пример синтеза 16; 5,4 г, 0,018 моль) в тетрагидрофуране. Раствор перемешивают 15 ч при комнатной температуре, а затем растворитель удаляют под вакуумом. Остаток растворяют в этилацетате и раствор промывают водой, насыщенным рассолом, высушивают (MgSO4). После удаления растворителя под вакуумом, остаток очищают при помощи хроматографии на сили 001574 48 кагеле (элюируя 10% этилацетатом в гексане),получая целевое соединение в виде розового масла. 1 Н ЯМР (250 мГц, CDCl3)2.93 (2 Н, т, J 5.6 Гц), 3.98 (2 Н, т, J 5.4 Гц), 6.96 (1 Н, д, J 2.5 Гц), и 7.30 (1 Н, д, J 2.4 Гц). Пример синтеза 18. 1-Бензилокси-4-(2,2,2 трифторэтокси)бензол. К раствору 4-бензилоксифенола (5 г) и 2,2,2-трифторэтил-p-толуолсульфоната (5 г) в диметилформамиде (50 мл) добавляют гидрид натрия (60% дисперсия в масле, 2,3 г) и раствор 16 ч нагревают при температуре 110 С. Смесь охлаждают, разбавляют водой и продукт экстрагируют этилацетатом. Органическую фазу промывают водой, рассолом и высушивают(MgSO4). Растворитель удаляют под вакуумом и остаток хроматографируют на силикагеле(элюируя 10% диэтиловым эфиром/гексаном),получая целевое соединение в виде твердого вещества с т.пл. 72-74 С. Пример синтеза 19. 4-(2,2,2-Трифторэтокси)фенол. Раствор 1-бензилокси-4-(2,2,2-трифторэтокси)бензола (пример синтеза 18; 5 г) и палладия (10% на углероде; 0,1 г) в метаноле (50 мл) гидрируют 12 ч при 50 фунтов/дюйм 2 (3,52 кг/см 2). Раствор фильтруют и растворитель удаляют под вакуумом, получая целевое соединение в виде бесцветного твердого вещества с т.пл. 60-64 С. Пример синтеза 20. 2-Бром-4-(2,2,2 трифторэтокси)фенол. К охлажденному (0 С) раствору 4-(2,2,2 трифторэтокси)фенола (пример синтеза 19) в смеси уксусной кислоты и хлороформа (20 мл; 1:1) добавляют раствор брома (0,83 г) в хлороформе (5 мл). Смесь 10 мин перемешивают и разбавляют хлороформом, затем промывают водой (250 мл), высушивают (MgSO4) и упаривают, получая целевое соединение в виде масла. 1H ЯМР (250 мГц, СDСl3)4.33 (2 Н, кв, J 8 Гц), 6.83 (1 Н, д. д, J 2.8, 8.8 Гц), 6.97 (1 Н, д, J 8.8 Гц), и 7.10 (1 Н, д, J 2.8 Гц). Пример синтеза 21. 2-Бром-4-(2,2,2 трифторэтокси)анизол. К раствору 2-бром-4-(2,2,2-трифторэтокси) фенола (пример синтеза 20; 0,6 г) в ацетоне добавляют К 2 СО 3 (1 г) и йодистый метил (1 мл). Раствор 1 ч нагревают с обратным холодильником и затем выпаривают под вакуумом. Остаток фракционируют между этилацетатом и водой и органическую фазу в дальнейшем промывают водой и насыщенным рассолом. После высушивания (MgSO4) растворитель удаляют под вакуумом, получая целевое соединение в виде желтого масла. 1 49 Пример синтеза 22. 2,5-Бис(2,2,2 трифторэтокси)бромбензол. К раствору 2-бром-4-(2,2,2-трифторэтокси) фенола (пример синтеза 20; 0,83 г, 3,06 ммоль) и гидрида натрия (60% в масле, 0,367 г, 9,18 ммоль) в диметилформамиде (10 мл) добавляют 2,2,2-трифторэтил-p-толуолсульфонат (1,17 г,4,6 ммоль). Смесь 10 ч нагревают при температуре 100 С, охлаждают и разбавляют этилацетатом и водой. Органическую фазу промывают водой, насыщенным рассолом, высушивают(MgSO4) и выпаривают под вакуумом. Остаток очищают при помощи хроматографии на силикагеле (элюируя 2% этилацетатом в гексане),получая целевое соединение в виде масла. 1H ЯМР (250 мГц, СDСl3)4.32 (4 Н, м),6.89 (2 Н, м), и 7.20 (1 Н, д, J 4.1 Гц). Пример синтеза 23. 2-Бром-1(дифторметокси)-4-(трифторметокси)бензол. К раствору 2-бром-4-(трифторметокси) фенола (пример синтеза 11; 5,14 г) в диметилформамиде медленно добавляют гидрид натрия(0,96 г, 60% в масле). После 20-минутного перемешивания через раствор медленной струeй 10 мин барботируют хлордифторметан. Смесь 2 ч нагревают при температуре 60 С, охлаждают, разбавляют водой и раствор экстрагируют диэтиловым эфиром (2100 мл). Органические фазы объединяют, промывают водой, насыщенным рассолом, высушивают (MgSO4) и выпаривают под вакуумом. Остаток хроматографируют на силикагеле (элюируя гексаном), получая целевое соединение в виде твердого вещества. 1H ЯМР (250 мГц, СDСl3)6.53 (1 Н, т, J 7.2 Гц), 7.17-7.29 (2 Н, м), и 7.51 (1 Н, д, J 2.5 Гц). Пример синтеза 24. 2-Бром-1-(2,2,2 трифторэтокси)-4-(трифторметокси)бензол. К раствору 2-бром-4-трифторметоксифенола (пример синтеза 11; 2 г) и 2,2,2 трифторэтил-п-толуолсульфоната в диметилформамиде (30 мл) медленно добавляют гидрид натрия (2 г, 60% в масле) и смесь 12 ч нагревают при температуре 110 С. Смесь охлаждают, разбавляют водой (300 мл) и экстрагируют этилацетатом (250 мл). Органические фазы промывают водой, насыщенным рассолом и высушивают (MgSO4). Растворитель удаляют под вакуумом, а остаток хроматографируют на силикагеле(элюируя диэтиловым эфиром/гексаном (1:10, получая целевое соединение в виде бесцветного масла. 1H ЯМР (250 мГц, СDСl3)4.40 (2 Н, кв, J 8 Гц), 6.95 (1 Н, д, J 9 Гц), 7.15-7.20 (1 Н, м), и 7.487.49 (1 Н, м). Пример синтеза 25. 2-Бром- 4-фтор-(2,2,2 трифторэтокси)бензол. К раствору 2-бром-4-фторфенола (4 г) и 2,2,2-трифторэтокси-п-толуолсульфоната (5 г) в диметилформамиде (40 мл) медленно добавляют гидрид натрия (1 г, 60% в масле) и смесь 12 ч нагревают при температуре 110 С. Раствор ох 001574 50 лаждают, разбавляют водой (500 мл), и продукт экстрагируют этилацетатом (2150 мл). Органическую фазу промывают насыщенным раствором NaHCO3, водой, насыщенным рассолом и высушивают (MgSO4). Растворитель удаляют под вакуумом, а остаток хроматографируют на силикагеле(элюируя диэтиловым эфиром/гексаном (1:5, получая целевое соединение в виде бесцветного масла. 1 Н ЯМР (250 мГц, СDСl3)4.36 (2 Н, кв, J 8 Гц), 6.91-7.05 (2 Н, м), и 7.33 (1 Н, д. д, J 8, 3 Гц). Пример синтеза 26. 4-(Метансульфонил) фенол. К охлажденному (ледяная баня) раствору 4-(метилмеркапто)фенола (5 г, 36 ммоль) в воде(290 мл) добавляют оксон (65,8 г, 0,108 моль) в воде (290 мл). Полученный раствор 48 ч перемешивают при комнатной температуре и затем концентрируют под вакуумом. Остаток разбавляют водой(100 мл) и экстрагируют дихлорметаном (10100 мл). Объединенные органические слои высушивают над сульфатом натрия, растворитель удаляют под вакуумом, получая целевое соединение в виде прозрачного масла (5,66 г, 92%). 1H ЯМР (250 мГц, СDСl3)7.80-7.75 (2 Н,д, J 11.7 Гц), 7.28 (1 Н, ш. с), 7.01-6.96 (2 Н, д, J 11.7 Гц), и 3.08 (3 Н, с). Пример синтеза 27. 2-Бром-4-(метансульфонил)фенол. К перемешиваемому раствору 4(метансульфонил)фенола (пример синтеза 26; 3 г, 17,45 ммоль) по каплям добавляют раствор брома (0,9 мл, 17,45 ммоль) в ледяной уксусной кислоте (10 мл). Полученный раствор 16 ч перемешивают при комнатной температуре. По каплям добавляют бром (0,45 мл) в ледяной уксусной кислоте (5 мл) и раствор перемешивают 2 ч. Избыток уксусной кислоты и брома удаляют под вакуумом, а остаток азеотропируют толуолом, получая желаемое соединение в виде не чисто белого твердого вещества (3,54 г, 81%). 1H ЯМР (250 мГц, СDСl3)8.06-8.05 (1 Н,д, J 2.3 Гц), 7.73-7,69 (1H, д. д, J 8.6, 2.3 Гц),7.06-7.02 (1H, д, J 8.6 Гц), и 3.06 (3 Н, с). Пример 28. 2-Бром-4-(метансульфонил) анизол. К раствору 2-бром-4-(метансульфонил) фенола (пример синтеза 27; 3,5 г, 14 ммоль) в диметилформамиде (50 мл) добавляют углекислый калий (2,31 г, 16,8 ммоль). Полученный раствор 30 мин перемешивают и добавляют йодистый метил (1,04 мл, 16,8 ммоль). После 1 ч перемешивания раствор сливают в воду (200 мл) и экстрагируют этилацетатом (2100 мл). Объединенные органические фракции промывают водой и высушивают над сульфатом натрия. Удалив растворитель под вакуумом, получают белое твердое вещество, из которого при перекристаллизации из диэтилового эфира получают целевое соединение (2,02 г).(3 Н, с). Пример синтеза 29. 3-Бром-4-(циклобутилокси)трифторанизол. 2-Бром-4-(трифторметокси)фенол (пример синтеза 11; 1,5 г, 5,83 ммоль) и циклобутилбромид (3,0 г, 17,5 ммоль) растворяют в диметилформамиде (10 мл). Добавляют углекислый калий (4,85 г, 35 ммоль) и раствор 16 ч перемешивают при температуре 50 С. Раствору дают остыть до комнатной температуры, сливают в 10% раствор лимонной кислоты (50 мл) и экстрагируют этилацетатом (2100 мл). Объединенные органические слои промывают водой и высушивают над сульфатом натрия. Удалив растворитель под вакуумом, получают масло, которое хроматографируют на силикагеле в 10% этилацетате/гексане, получая целевое соединение в виде масла (1,65 г, 91%). 1(2 Н, м), и 1.92-1.55 (2 Н, м). Пример синтеза 30. 2-(2-Гидроксиэтокси)5-(трифторметокси)бромбензол. Получают из соединения по примеру синтеза 14 соответственно методике примера синтеза 16. 1H ЯМР (360 мГц, СDСl3)2.20 (1H, т, J 6.3 Гц), 4.0 (2 Н, кв, J 5.6 Гц), 4.13 (2 Н, кв, J 4.2 Гц), 6.91 (1H, д, J 9 Гц), 7.15 (1H, м), и 7.45 (1 Н,д, J 2.3 Гц). Пример синтеза 31. 2-(2-Фторэтокси)-5(трифторметокси)бромбензол. К охлажденной (-78 С) суспензии 2-(2 гидроксиэтокси)-5-(трифторметокси)бромбензола (пример синтеза 30; 8,9 г, 30 ммоль) в дихлорметане (80 мл) добавляют диэтиламиносерный трифторид (3,88 мл, 31,5 ммоль). Раствор 2 ч перемешивают при комнатной температуре,затем реакцию прекращают, по каплям добавляя воду (100 мл). Органический слой отделяют,промывают рассолом (100 мл), высушивают(MgSO4) и выпаривают под вакуумом. Очищают на силикагеле, элюируя 15-20% этилацетатом в гексане и получают целевое соединение в виде прозрачного масла (1,9 г, 15%). 1H ЯМР (360 мГц, СDСl3)4.23 (1 Н, м),4.31 (1H, м), 4.37 (1 Н, м), 4.86 (1H, м), 6.90 (1 Н,м), 7.15 (1H, м), и 7.47 (1H, т, J 0.7 Гц). Пример синтеза 32. 2-Бром-4-(трифторметокси)фенилтрифторметансульфонат. К охлажденному (0 С) раствору 2-бром-4(трифторметокси)фенола (пример синтеза 11; 10 г, 40 ммоль) в пиридине (20 мл) добавляют трифторметансульфоновый ангидрид (7,2 мл, 44 ммоль) и смесь 2 ч перемешивают при комнатной температуре. Смесь разбавляют насыщенным сульфатом меди (II) (80 мл) и экстрагируют 1 52 этилацетатом (360 мл). Объединенные органические фракции промывают водой (80 мл),рассолом (80 мл), высушивают (MgSO4) и упаривают под вакуумом. Очищая на силикагеле,элюируя гексаном, получают целевое соединение в виде прозрачного масла (13,1 г, 85%). 1 Н ЯМР (250 мГц, СDСl3)7.28 (1H, м),7.40 (1H, д, J 9.1 Гц), и 7.58 (1H, д, J 2.8 Гц). Пример синтеза 33. 2-(Этен-1-ил)-5(трифторметокси)бромбензол. Смесь, содержащую 2-бромо-4-(трифторметокси)фенилтрифторметансульфонат (пример синтеза 32; 1,8 г, 4,6 ммоль), винилтрибутилолово (1,61 г, 5,1 ммоль) и хлорид лития (1,18 г,27,6 ммоль) в N,N-диметилформамиде (20 мл),обезгаживают перед добавлением дихлорбис(трифенилфосфин)палладия(II). После дальнейшего обезгаживания реакционную смесь 14 ч нагревают при температуре 110 С. Раствор фракционируют между водой (70 мл) и этилацетатом (350 мл). Объединенные органические фракции промывают рассолом (50 мл), высушивают (MgSO4) и упаривают под вакуумом. Очищая на силикагеле, элюируя гексаном, получают целевое соединение в виде прозрачного маслаH ЯМР (250 мГц, СDСl3)5.40 (1H, д. д, J 9.1 Гц, J 1.8 Гц), 5.70 (1H, д. д, J 10.5 Гц, J 0.5 Гц), 7.0 (1H, м), 7.16 (1H, м), 7.44 (1H, д, J 1.4 Гц), и 7.56 (1H, д, J 8.7 Гц). Пример синтеза 34. 2-Бензилокси-5(трифтормегокси)бромбензол. 2-Бром-4-(трифторметокси)фенол (пример синтеза 11; 5 г, 20 ммоль) растворяют в N,Nдиметилформамиде (60 мл), добавляют углекислый калий (5,4 г, 40 ммоль), затем бензилбромид (3,5 мл, 30 ммоль) и смесь перемешивают 15 ч при комнатной температуре. Смесь разбавляют водой (150 мл) и экстрагируют этилацетатом (360 мл). Объединенные органические фракции промывают водой (100 мл), рассолом(100 мл), высушивают (MgSO4) и упаривают под вакуумом. Очищая на силикагеле, элюируя 2 и 5% этилацетатом в гексане, получают целевое соединение в виде прозрачного масла (6,7 г,96%). 1H ЯМР (250 мГц, СDСl3)5.47 (2 Н, с),7.23 (1 Н, д, J 9 Гц), 7.43 (1 Н, д. д, J 8.2, 2.9 Гц), и 7.75 (6 Н, м). Пример синтеза 35. 2-Бром-(трифторметил)фенол. Получают из 4-(трифторметил)фенола соответственно методике примера синтеза 11. 1 53 углекислый калий (6,8 г). Смесь 3 ч перемешивают при температуре 60 С. Смесь разбавляют водой (200 мл) и экстрагируют этилацетатом. Органическую фракцию высушивают (MgSO4),а растворитель упаривают под уменьшенным давлением. Остаток очищают при помощи хроматографии на колонке с силикагелем, элюируя гексаном/этилацетатом (99:1 повышая до 95:5); получают целевое соединение. 1(1H, д, J 1.7 Гц). Пример синтеза 37. (3S,5R,6S)-3-(2 Метокси-5-трифторметоксифенил)-6-фенил-1 окса-7-(трет-бутоксикарбонил)азаспиро[4,5] декан-3-ол. 2-Бром-4-трифторметиксианизол (пример синтеза 12; 417 мг, 1,54 ммоль) порциями добавляют к магнию (41 мг, 1,7 ммоль) в диэтиловом эфире в атмосфере азота и смесь кратковременно нагревают с обратным холодильником после каждой добавленной порции. Окончив добавление, смесь 30 мин нагревают с обратным холодильником, вследствие чего основная часть магния растворяется. Раствор охлаждают до комнатной температуры и по каплям добавляют к охлажденному (0 С) раствору (5R,6S)-3-кето 6-фенил-1-окса-7-(трет-бутоксикарбонил)азаспиро[4,5]декана (пример синтеза 4; 212 мг, 0,64 ммоль) в диэтиловом эфире (10 мл). Смесь 10 мин перемешивают при температуре 0 С, и в течение ночи - при комнатной температуре. Добавляют насыщенный водный хлористый аммоний (40 мл) и смесь экстрагируют этилацетатом(240 мл). Объединенные органические фракции промывают рассолом (20 мл), высушивают(MgSO4) и растворитель упаривают под уменьшенным давлением. Остаток очищают при помощи хроматографии на колонке с силикагелем,элюируя этилацетатом/гексаном (1:5), образованием целевого соединения в виде бледной пены(3 мл) при комнатной температуре добавляют муравьиную кислоту (138 мл, 3,77 ммоль) и полученную смесь 5 ч нагревают при температуре 70 С. Смесь охлаждают, фильтруют, разбавляют этилацетатом (50 мл), промывают водой (100 мл), соляной кислотой (2 М, 50 мл) и насыщенным водным хлоридом натрия (50 мл), высушивают (MgSO4), а растворитель упаривают под уменьшенным давлением. Остаток хроматографируют на силикагеле, элюируя гексаном/этилацетатом (60:40), получая целевое соединение в виде желтого стекла (220 мл, 35%). 1(2 мл) в метаноле (10 мл) добавляют гидроокись палладия (II) на углероде (20%, 78 мг) и смесь 5 ч при перемешивании гидрируют при 50 фунтов/дюйм 2 (3,52 кг/см 2). Смесь фильтруют, а растворитель упаривают под уменьшенным давлением. Остаток разбавляют этилацетатом(20 мл), промывают насыщенным раствором углекислого натрия (10 мл), высушивают(MgSO4), а растворитель упаривают под уменьшенным давлением. Остаток очищают при помощи препаративной тонкослойной хроматографии на силикагеле, элюируя гексаном/этилацетатом (80:20); получают целевое соединение в виде смеси 2'R и 2'S эпимеров в соотношении 1:3 (22 мг, 28%). 1(3 Н, м, 3R и 3S изомеры), 3.04-3.20 (1H, м, 3R и 3S изомеры), 1.64-2.40 (8 Н, м, 3R и 3S изомеры),1.32 (9 Н, с, 3S изомер), и 1.27 (9 Н, с, 3R изомер). m/z (ES+) 442 (М+1). Пример синтеза 40. 2-Бром-4-нитрофенол. К перемешиваемому раствору 4-нитрофенола (50 г) в ледяной уксусной кислоте (400 мл) по каплям добавляют бром (27 мл) и смесь 18 ч перемешивают при комнатной температуре. Растворитель упаривают под уменьшенным 55 давлением, а остаток кристаллизируют из дихлорметана:гексана, получая целевое соединение в виде бесцветного твердого вещества (67 г). 1(пример синтеза 40; 2,5 г), 2-йодопропан (2,2 г) и углекислый калий (5 г) в ацетоне (30 мл), 18 ч нагревают с обратным холодильником. Растворитель упаривают под уменьшенным давлением, добавляют воду и смесь экстрагируют этилацетатом. Органическую фракцию промывают водой и рассолом, высушивают (MgSO4), а растворитель упаривают под уменьшенным давлением. Остаток очищают при помощи флешхроматографии на колонке с силикагелем,элюируя гексаном/ЕtOАс (90:10), получая целевое соединение (2,8 г, 94%). 1 Н ЯМР (250 мГц, СDСl3)8.46 (1H, с),8.20 (1H, м), 6.93 (1H, м), 4.75 (1H, м), и 1.42(6 Н, д, J 7.5 Гц). Пример синтеза 42. 2-(Дифторметокси)-5 нитробромбензол. Получают из соединения по примеру синтеза 40 соответственно методике примера синтеза 23. 1H ЯМР (360 мГц, СDСl3)8.54 (1H, д, J 2.6 Гц), 8.22 (1H, д. д, J 9.0, 2.6 Гц), 7.38 (1H, д, J 9.0 Гц), и 6.68 (1H, т, J 71.7 Гц). Пример синтеза 43. 3-Бром-4-метоксианилин. Смесь, содержащую 3-бром-4-метоксинитробензол (15 г, 64,6 ммоль) и порошок железа (27,3 г, 0,49 моль) в воде (100 мл) и ледяной уксусной кислоты (25 мл), нагревают 2 ч с обратным холодильником. Смесь охлаждают и фильтруют через прокладку Нуflо, промывают 25% уксусной кислотой/водой. Фильтрат экстрагируют этилацетатом (2250 мл), объединенные органические фракции высушивают(Na2SO4), а растворитель упаривают под уменьшенным давлением. Остаток очищают при помощи флеш-хроматографии на силикагеле,элюируя гексаном/ЕtOАс (60:40), получая целевое соединение в виде коричневого твердого вещества (10,32 г, 79%). m/z (ES+) 202 (М+1). Пример синтеза 44. 3-Бром-4-изопропоксианилин. Получают из соединения по примеру синтеза 41 соответственно методике примера синтеза 43. 1 56 Получают из соединения по примеру синтеза 42 соответственно методике примера синтеза 43. Пример синтеза 46. 3-Бром-4-(трифторметокси)анилин. 4-Трифторметоксинитробензол (4,1 г) суспендируют в воде (16 мл) и концентрированной серной кислоте (16 мл) и при перемешивании нагревают до температуры 80 С. В течение 3 ч порциями добавляют бромат калия (3,7 г) и смесь еще 2 ч нагревают при температуре 80 С. Смесь охлаждают до комнатной температуры и сливают на лед (100 г). Смесь экстрагируют этилацетатом и объединенные органические фракции высушивают (MgSO4), a растворитель упаривают под уменьшенным давлением. Остаток растворяют в уксусной кислоте (2,5 мл) и в воде (10 мл) и добавляют порошок железа(2,0 г). Смесь кипятят 2 ч с обратным холодильником, охлаждают до комнатной температуры и фильтруют через Celite. Фильтрат экстрагируют этилацетатом и объединенные органические фракции высушивают (MgSO4), a растворитель упаривают под уменьшенным давлением. Остаток очищают при помощи хроматографии на колонке с силикагелем, элюируя гексаном/ЕtOАс (3:1); получают целевое соединение в виде желтого масла. 1H ЯМР (СDСl3)6.57 (1 Н, д. д), 6.9 (1 Н,д), 7.06 (1H, д. д). Пример синтеза 47. N-(3-Бром-4-метоксифенил)трифторацетамид. К перемешиваемому, охлажденному (0 С) раствору 3-бром-4-метоксианилина (пример синтеза 43; 24,7 ммоль) и триэтиламина (3,44 мл, 24,7 ммоль) в дихлорметане (50 мл) медленно добавляют ангидрид трифторуксусной кислоты (3,5 мл, 24,7 ммоль). Смесь 2 ч перемешивают при комнатной температуре, разбавляют дихлорметаном (200 мл) и промывают водой(2200 мл). Органическую фракцию высушивают (Na2SO4), а растворитель упаривают под уменьшенным давлением. Остаток очищают при помощи флеш-хроматографии на колонке с силикагелем, элюируя гексаном/ЕtOАс (85:15 повышая до 75:25); получают целевое соединение в виде бесцветного твердого вещества (4,4,60%). 1N-(3-Бром-4 изопропоксифенил)трифторацетамид. Получают из соединения по примеру синтеза 44 соответственно методике примера синтеза 43. 1N-[3-Бром-4(дифторметокси)фенил]трифторацетамид. Получают из соединения по примеру синтеза 45 соответственно методике примера синтеза 43. 1H ЯМР (250 мГц, СDСl3)8.01 (1H, ш. с),7.94 (1H, д, J 2.6 Гц), 7.53 (1H, д. д, J 8.9, 2.6 Гц),7.26 (1H, д, J 8.9 Гц), и 6.53 (1H, т, J 73.1 Гц). Пример синтеза 50. N-[3-Бром-4-(трифторметокси)фенил]трифторацетамид. Получают из соединения по примеру синтеза 46 соответственно методике примера синтеза 47. 1H ЯМР (360 мГц, СDСl3)8.24 (1H, ш. с),7.97 (1H, д, J 2.6 Гц), 7.59 (1H, д. д, J 8.9, 2.6 Гц),и 7.34 (1H, д, J 8.9 Гц). Пример синтеза 51. N-Метил-3-бром-4(трифторметокси)анилин. К перемешиваемому, охлажденному (0 С) раствору N-[3-бром-4-(трифторметокси)фенил] трифторацетамида (пример синтеза 50; 6,3 г,18,0 ммоль) в диметилформамиде (50 мл) добавляют гидрид натрия (60% дисперсия в минеральном масле, 870 мг, 21,7 ммоль). Смесь 20 мин перемешивают при температуре 0 С и в течение 5 мин добавляют йодистый метил (1,35 мл, 21,7 ммоль). Смесь 45 мин перемешивают при температуре 0 С и 4 ч - при комнатной температуре. Добавляют воду (100 мл) и смесь экстрагируют этилацетатом (3100 мл). Объединенные органические фракции промывают водой (3100 мл), рассолом (100 мл), высушивают (MgSO4), а растворитель упаривают под уменьшенным давлением. Остаток очищают при помощи хроматографии на колонке с силикагелем, элюируя гексаном/СН 2 Сl2 (3:1 повышая до 1:1), получают целевое соединение в виде желто-коричневого масла (1,20 г, 25%). 1H ЯМР (250 мГц, СDСl3)7.11 (1H, д. кв,J 8.9, 1.2 Гц), 6.86 (1H, д, J 2.8 Гц), 6.56 (1H, д. д,J 8.9, 2.8 Гц), и 2.83 (3 Н, с). Пример синтеза 52. N-(3-Бром-4-метоксифенил)-N-(метил)трифторацетамид. К перемешиваемому, охлажденному (0 С) раствору N-(3-бром-4-метоксифенил)трифторацетамид (пример синтеза 43; 2,98 г, 10 ммоль) в диметилформамиде (30 мл) добавляют гидрид натрия (60% дисперсия в минеральном масле,0,48 г, 12 ммоль). Смесь перемешивают 30 мин при температуре 0 С, затем добавляют йодистый метил (0,75 мл, 1,70 г, 12 ммол). Смесь перемешивают 30 мин при температуре 0 С,затем 3 ч при комнатной температуре. Добавляют воду (50 мл) и смесь экстрагируют этилацетатом (350 мл). Объединенные органические фракции промывают водой (450 мл) и рассолом (50 мл), высушивают (MgSO4), а растворитель упаривают под уменьшенным давлением. Остаток очищают при помощи флешхроматографии на силикагеле, элюируя гексаном/СН 2 Сl2 (50:50, повышая до 30:70); получа 001574 58 ют целевое соединение в виде бесцветного твердого вещества (2,72 г, 87%). 1H ЯМР (250 мГц, СDСl3)7.46 (1H, д, J 2.4 Гц), 7.18 (1H, д. д, J 8.7, 2.4 Гц), 6.91 (1H, д, J 8.7 Гц), 3.94 (3 Н, с), и 3.32 (3 Н, с). Пример синтеза 53. N-(3-Бром-4-изопропоксифенил)-N-(метил)трифторацетамид. Получают из соединения по примеру синтеза 48 соответственно методике примера синтеза 52. 1N-[3-Бром-4(дифторметокси)фенил]-N-(метил)трифторацетамид. Получают из соединения по примеру синтеза 49 соответственно методике примера синтеза 52. 1N-[3-Бром-4(трифторметокси)фенил]-N-(метил)трифторацетамид. Получают из соединения по примеру синтеза 51 соответственно методике примера синтеза 47. 1H ЯМР (250 мГц, СDСl3)7.59 (1H, д, J 2.3 Гц), 7.39 (1H, ш. д, J 9 Гц), 7.27 (1H, ш. д, J 9 Гц), и 3.36 (3 Н, с). Пример синтеза 56. 2-Метокси-5-(2,2,2 трифторэтиламино)бромбензол. К раствору N-(3-бром-4-метоксифенил) трифторацетамида (пример синтеза 52; 2,0 г, 6,7 ммоль) в тетрагидрофуране (20 мл) добавляют комплекс борана-диметилсульфида (2 М в ТГФ,6,7 мл, 13,4 ммоль) и смесь 18 ч нагревают с обратным холодильником. Смесь охлаждают, и растворитель удаляют под уменьшенным давлением, получая целевое соединение в виде желтого масла (2,1 г). 1(1,9 мл, 1,37 г, 13,4 ммоль) в дихлорметане добавляют ангидрид уксусной кислоты (1,26 мл,13,4 ммоль) и смесь 18 ч нагревают с обратным холодильником. Смесь охлаждают и растворитель удаляют под уменьшенным давлением. Добавляют 1,2-дихлорэтан (20 мл) и смесь 24 ч нагревают с обратным холодильником. Затем добавляют ангидрид уксусной кислоты (0,6 мл) и триэтиламин (0,95 мл) и смесь 24 ч нагревают 59 с обратным холодильником; смесь охлаждают и разбавляют дихлорметаном (100 мл). Смесь разбавляют водой (350 мл) и рассолом (50 мл),высушивают (MgSO4) и растворитель удаляют под уменьшенным давлением. Остаток растирают этилацетатом, твердое вещество собирают и высушивают под вакуумом, получая целевое соединение в виде грязно-белого твердого вещества (1,28 г, 59%). 1H ЯМР (360 мГц, СDСl3)7.44 (1H. д, J 2.5 Гц), 7.17 (1H, д. д, J 8.7, 2.5 Гц), 6.93 (1 Н, д, J 8.7 Гц), 4.29 (2 Н, кв, J 8.8 Гц), 3.94 (3 Н, с), и 1.90 (3 Н, м). m/z (ES+) 326, 328 (М+1). Пример синтеза 58. 2-Этокси-5(трифторметокси)бромбензол. 2-Бром-4-трифторметоксифенол (пример синтеза 11; 1 г) растворяют в N,Nдиметилформамиде (12 мл) и добавляют углекислый калий (1,07 г). Добавляют йодэтан (0,78 мл) и смесь перемешивают при комнатной температуре. Добавляют воду (150 мл) и этилацетат и разделяют слои. Органическую фазу промывают рассолом, высушивают (MgSO4), a растворитель удаляют под уменьшенным давлением. Остаток очищают при помощи флешхроматографии на колонке с силикагелем,элюируя гексаном/ЕtOАс (100:0 повышая до 95:5); получают целевое соединение в виде бесцветного масла (1,02 г). 1H ЯМР (250 мГц, СDСl3)1.47 (3 Н, т, J 7.0 Гц), 4.09 (2 Н, кв, J 7.0 Гц), 6.85 (1H, д, J 9.0 Гц), 7.11 (1H, м), и 7.43 (1H, м). Пример синтеза 59. 2-(Трифторметилтио) бромбензол. Раствор 2-бромтиофенола (2 г) и триэтиламина (2,2 мл) в N,N-диметилформамиде в течение 5 мин очищают азотом, добавляют метилвиологендихлорид и смесь насыщают газообразным трифторметилйодидом. Спустя 40 мин смесь сливают на лед и экстрагируют диэтиловым эфиром. Органическую фазу высушивают(MgSO4) и растворитель удаляют под уменьшенным давлением. Остаток очищают при помощи флеш-хроматографии на колонке с силикагелем, элюируя гексаном, получая целевое соединение в виде бесцветного масла (0,8 г). 1H ЯМР (250 мГц, СDСl3)7.30-7.42 (2 Н,м) и 7.70-7.81 (2 Н, м). Пример синтеза 60. 2-Бром-1-(2,2,2 трифторэтокси)-4-(трифторметил)бензол. Получают из соединения по примеру синтеза 35 соответственно методике примера синтеза 22. 1H ЯМР (250 мГц, СDСl3)4.45 (2 Н, кв, J 7.9 Гц), 6.97 (1H, д, J 8.6 Гц), 7.58 (1H, д. д, J 10.7, 1.5 Гц), и 7.85 (1H, д, J 1.4 Гц). Пример синтеза 61. 1-Изопропокси-2 бром-4-(трифторметил)бензол. Получают из соединения по примеру синтеза 35 соответственно методике примера синтеза 41.H ЯМР (360 мГц, СDСl3)1.40 (6 Н, д, J 6.1 Гц), 4.64 (1 Н, септет, J 6.1 Гц), 6.94 (1 Н, д, J 8.8 Гц), 7.49 (1 Н, д. д, J 8.9, 2.1 Гц), и 7.78 (1 Н,д, J 1.9 Гц). Пример синтеза 62. 2-Бензилоксибромбензол. К смеси 2-бромфенола (10 г, 58 ммоль) и углекислого калия (64 г) в ДМФ (70 мл) добавляют бензилбромид (27,5 мл) и смесь 72 ч перемешивают при комнатной температуре. Смесь сливают в воду и экстрагируют этилацетатом(2 Х). Объединенные органические фракции промывают водой, высушивают (Na2SO4) и растворитель удаляют под уменьшенным давлением. Остаток очищают при помощи флешхроматографии на колонке с силикагелем,элюируя гексаном/ЕtOАс (98:2); получают целевое соединение (2,9 г). 1(50 мл) медленно добавляют хлористый оксалил(1,13 мл, 1,65 г, 13 ммоль) и смесь 10 мин перемешивают при температуре 0 С, затем 2 ч при комнатной температуре. Через смесь 10 мин барботируют аммиак, добавляют дихлорметан и смесь промывают водой, высушивают (MgSO4),а растворитель удаляют под уменьшенным давлением, получая целевое соединение в виде бесцветного твердого вещества (2,80 г, 86%). 1 Н ЯМР (250 мГц, ДМСО-d6)8.23 (1H, д,J 2.2 Гц), 8.08 (1H, ш. с), 8.03 (1H, д. д, J 8.6, 2.3 Гц), 7.47 (1H, ш. с). 7.30 (1H, д, J 8.6 Гц), и 4.03(3 Н, с). Пример синтеза 64. Метил-3-бром-4 гидроксибензоат. К раствору 3-бром-4-гидроксибензойной кислоты (10,0 г, 46 ммоль) в метаноле (100 мл) добавляют серную кислоту (конц., 10 мл) и смесь 72 ч перемешивают при комнатной температуре. Растворитель удаляют под уменьшенным давлением и остаток растворяют в этилацетате (250 мл). Смесь промывают насыщенным водным бикарбонатом натрия (2250 мл), сушат (MgSO4), а растворитель удаляют под уменьшенным давлением; получают целевое соединение в виде бесцветного твердого вещества (8,83 г, г, 86%). 1
МПК / Метки
МПК: A61P 1/08, C07D 491/10, A61K 31/4355
Метки: использование, агентов, производные, спиропиперидина, терапевтических, качестве
Код ссылки
<a href="https://eas.patents.su/30-1574-proizvodnye-spiropiperidina-i-ih-ispolzovanie-v-kachestve-terapevticheskih-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные спиропиперидина и их использование в качестве терапевтических агентов</a>
Предыдущий патент: Состав для очистки кожи, способы его приготовления и использования
Следующий патент: Дугогасительная камера для высоковольтного выключателя
Случайный патент: Устройство пространственной полевой физиотерапии


































