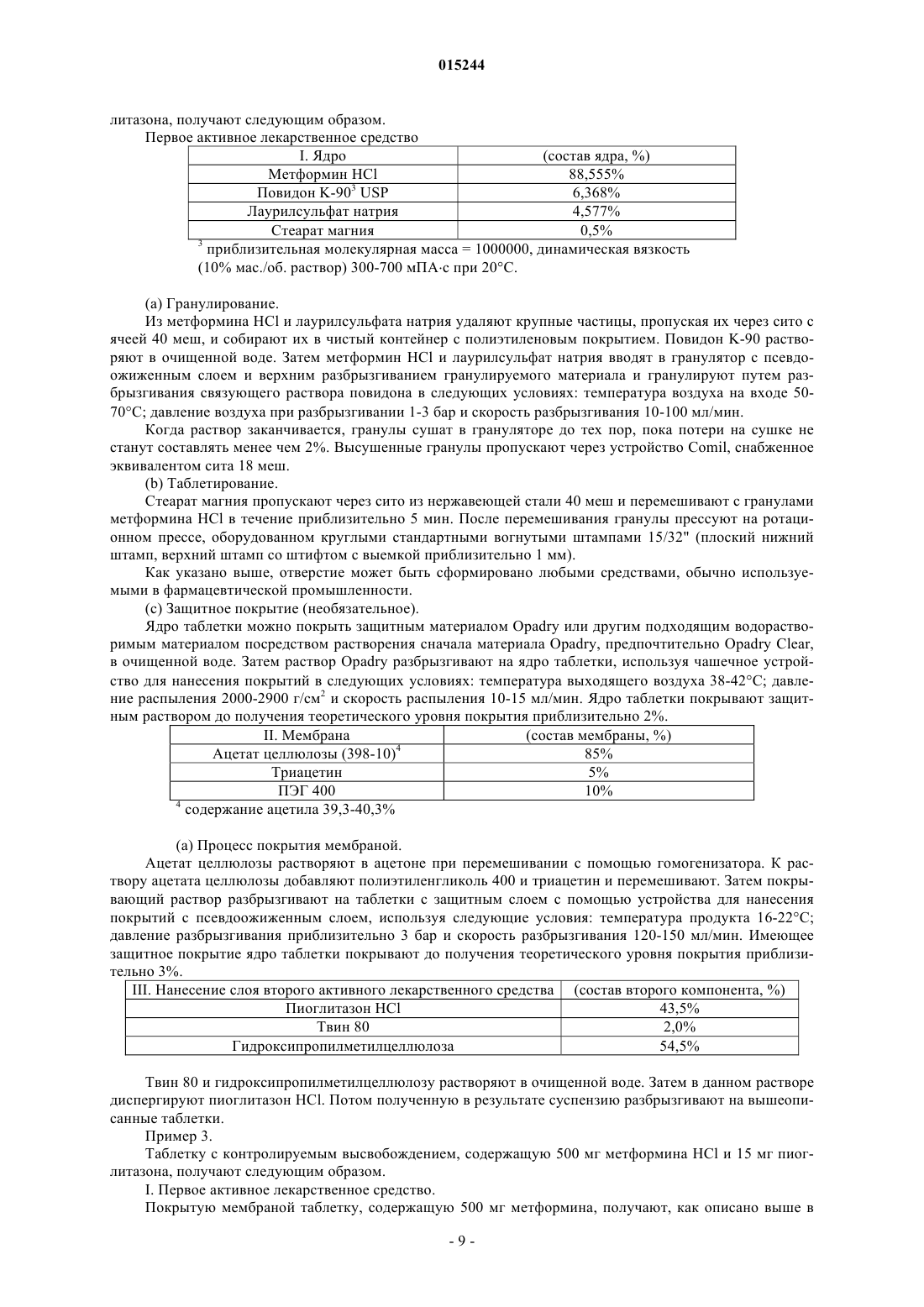
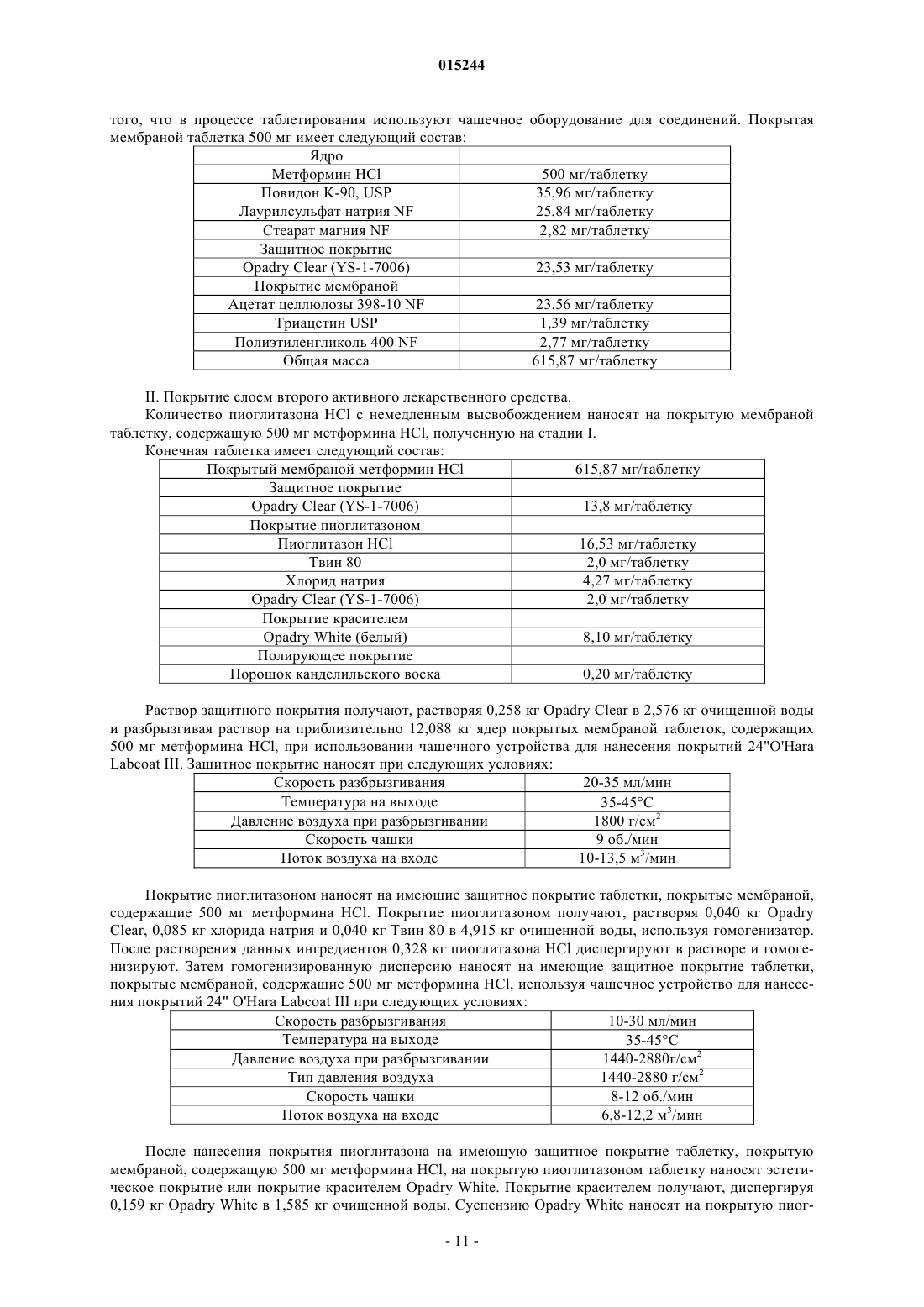
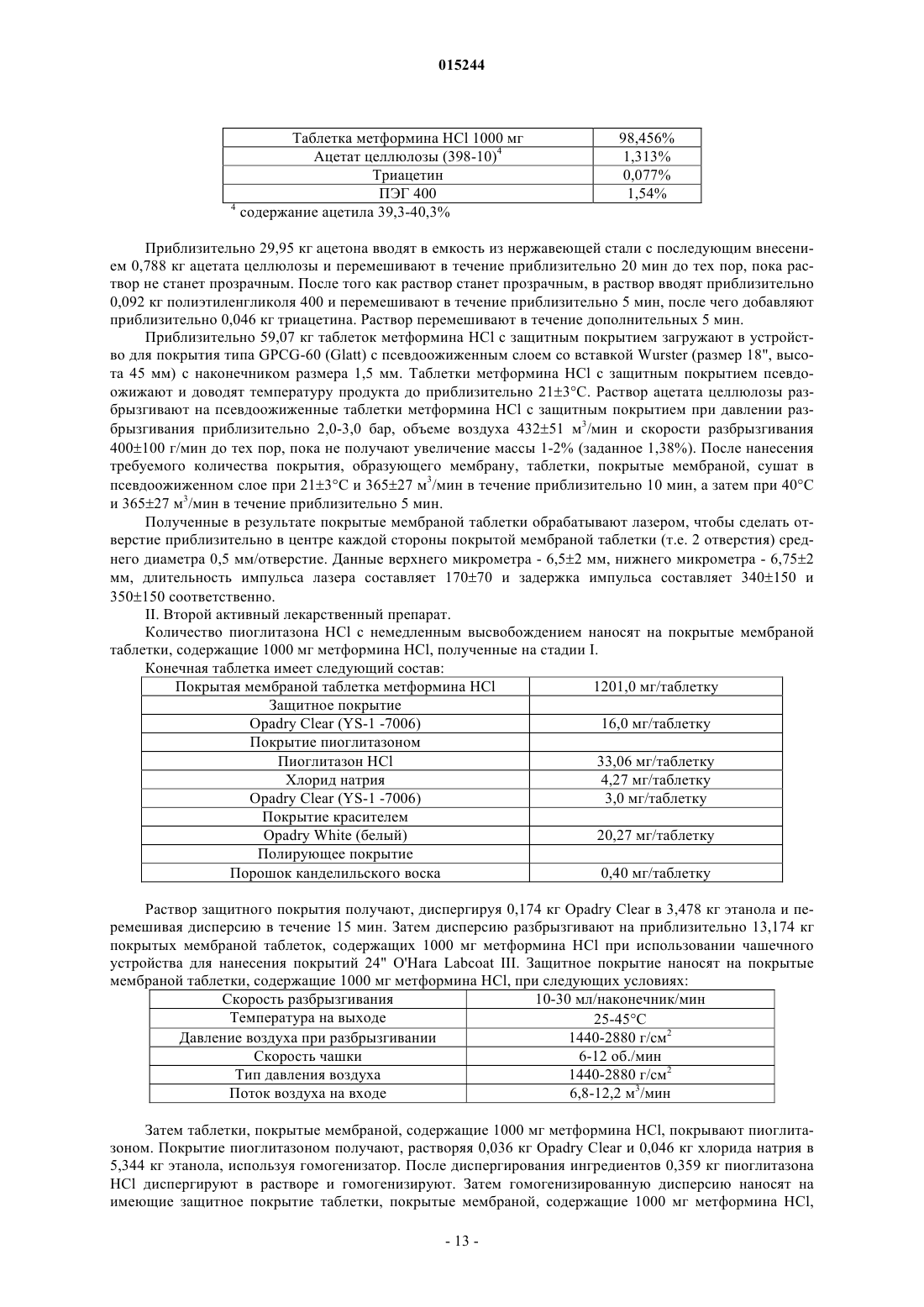
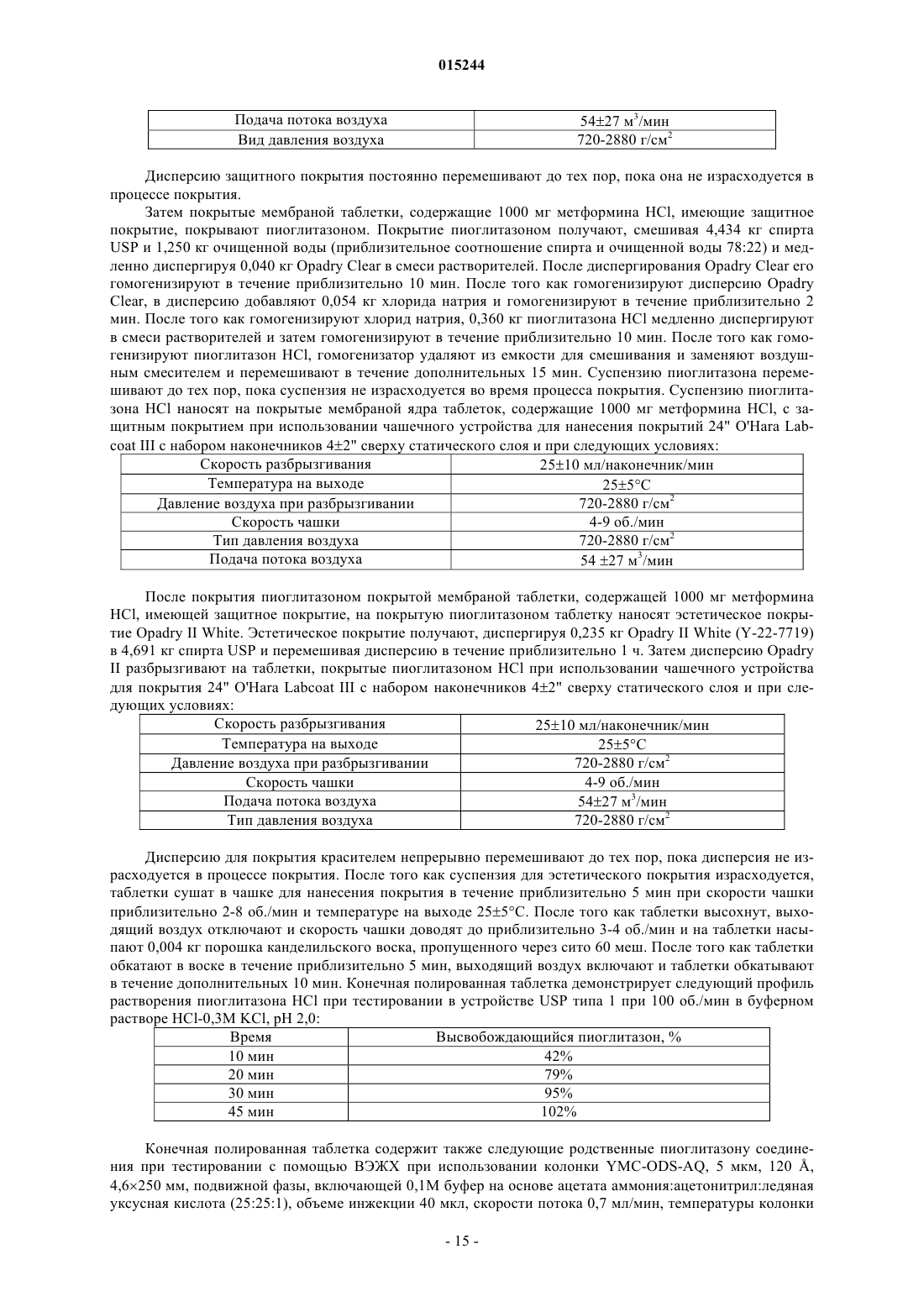
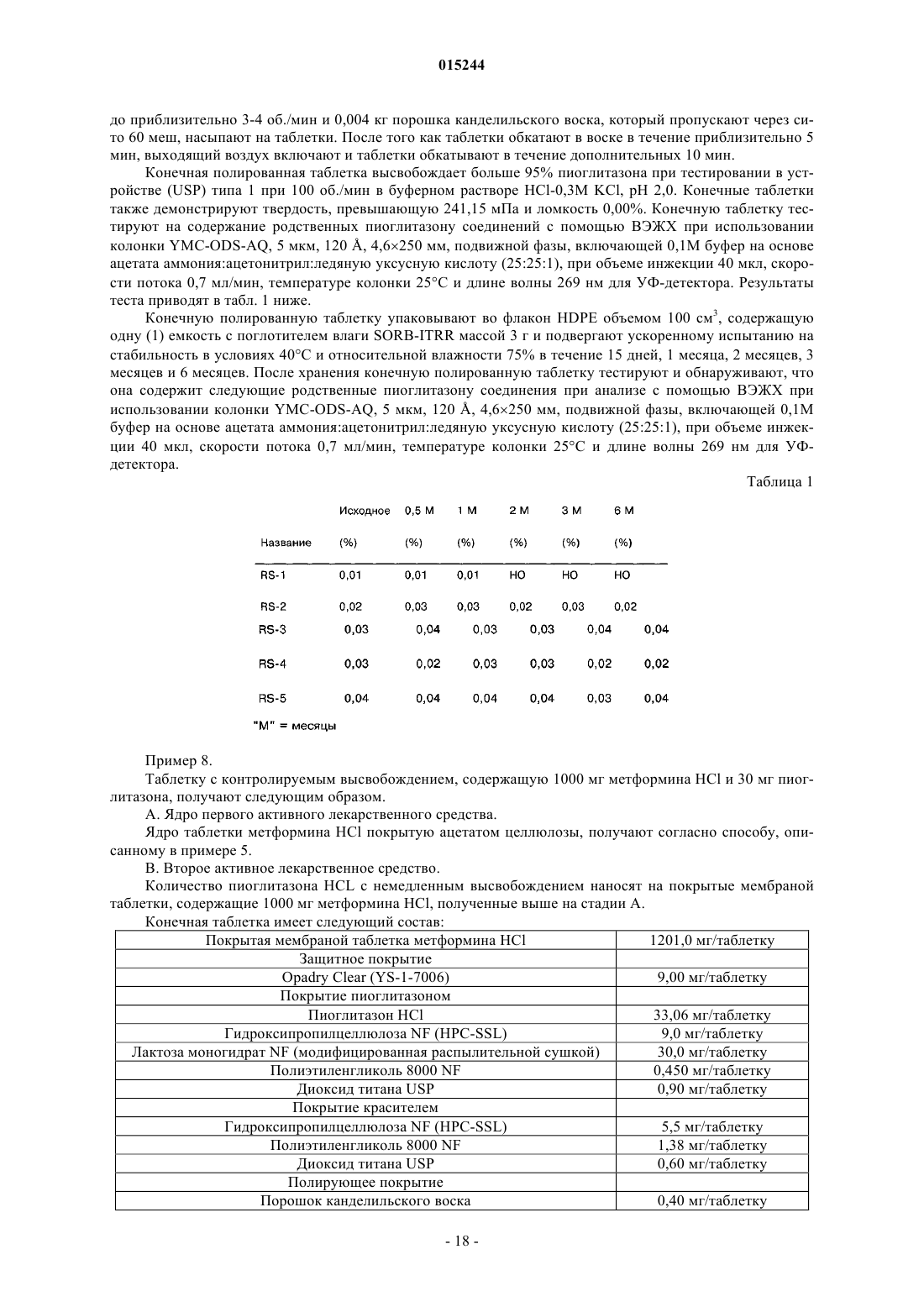
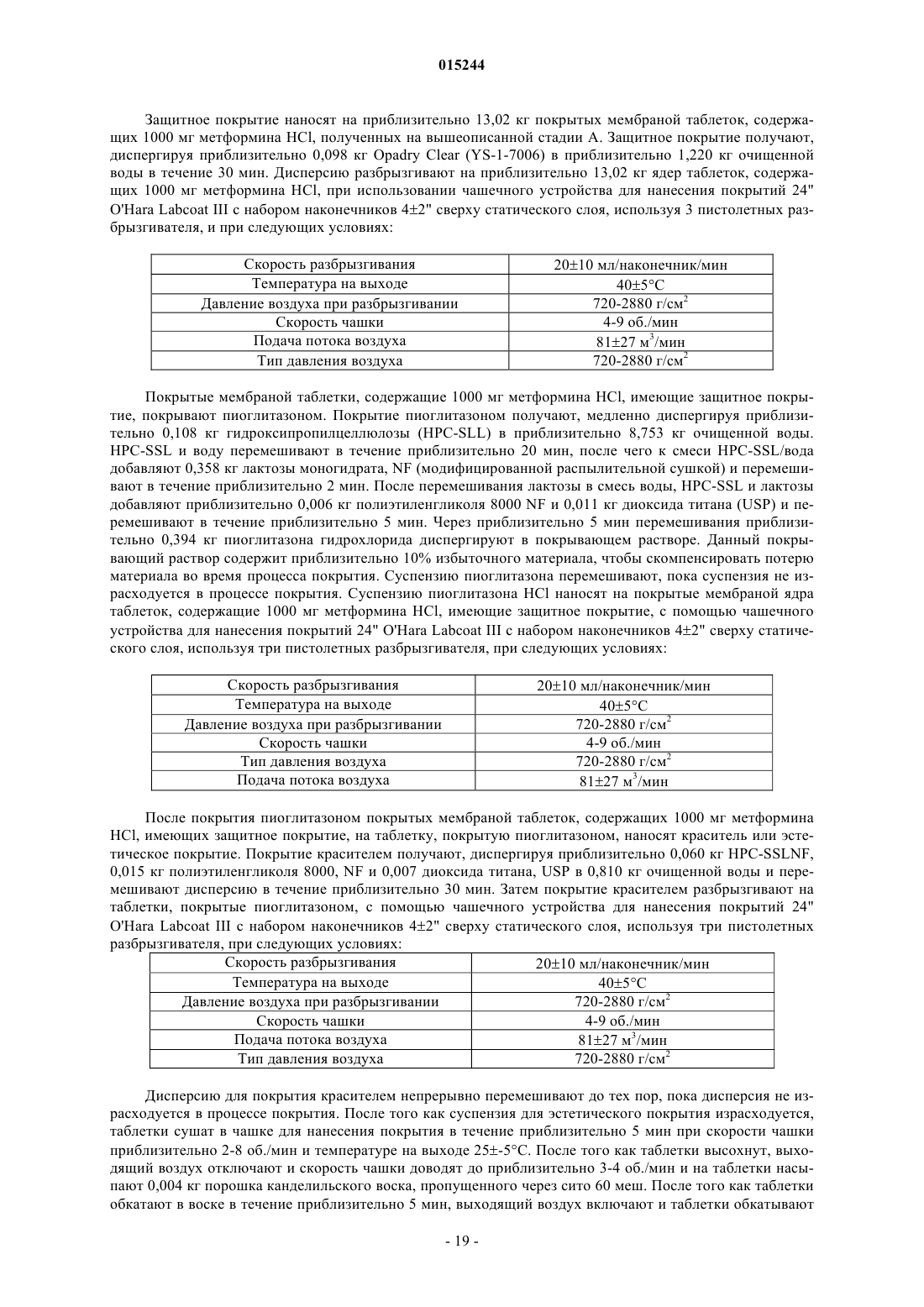
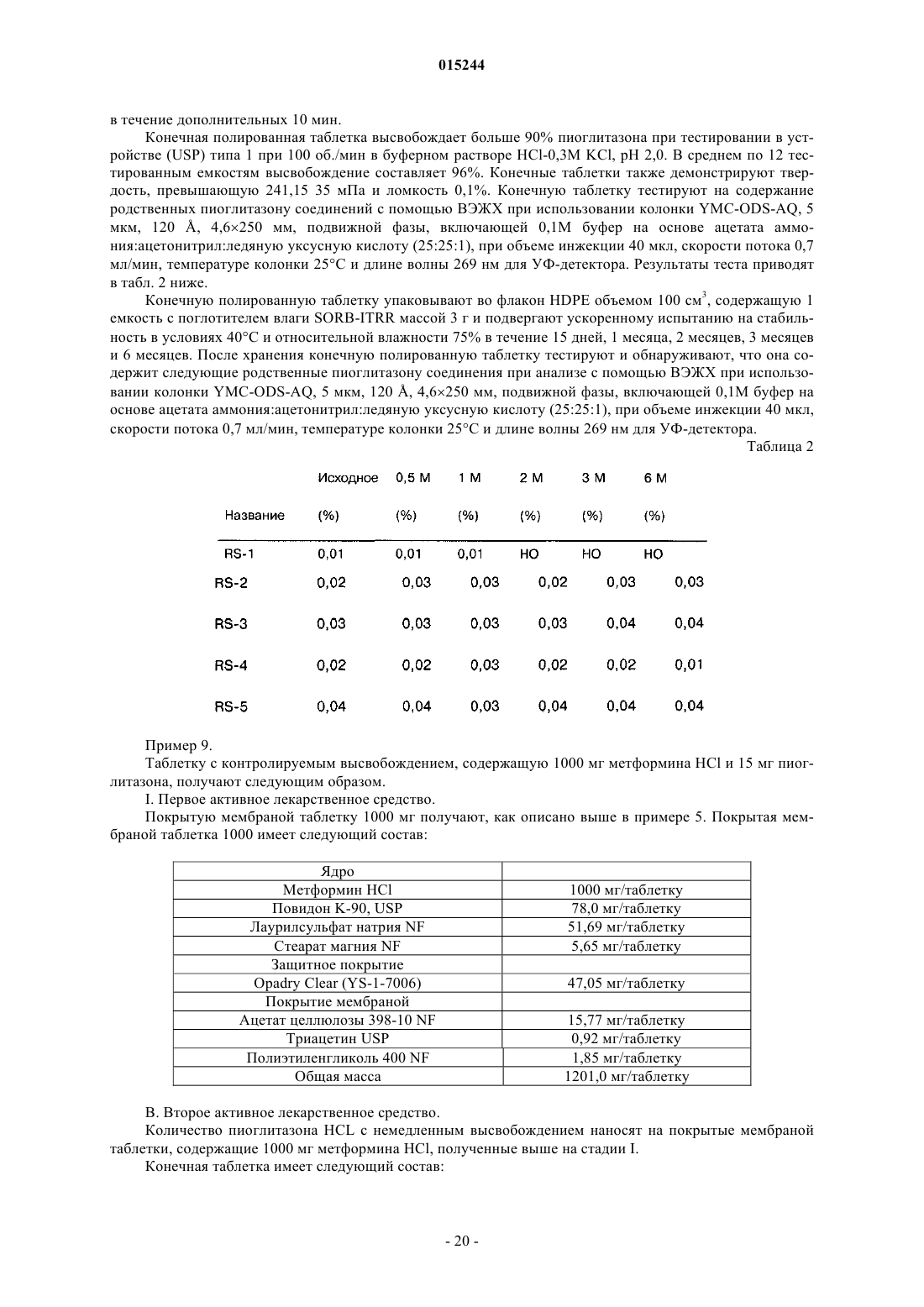
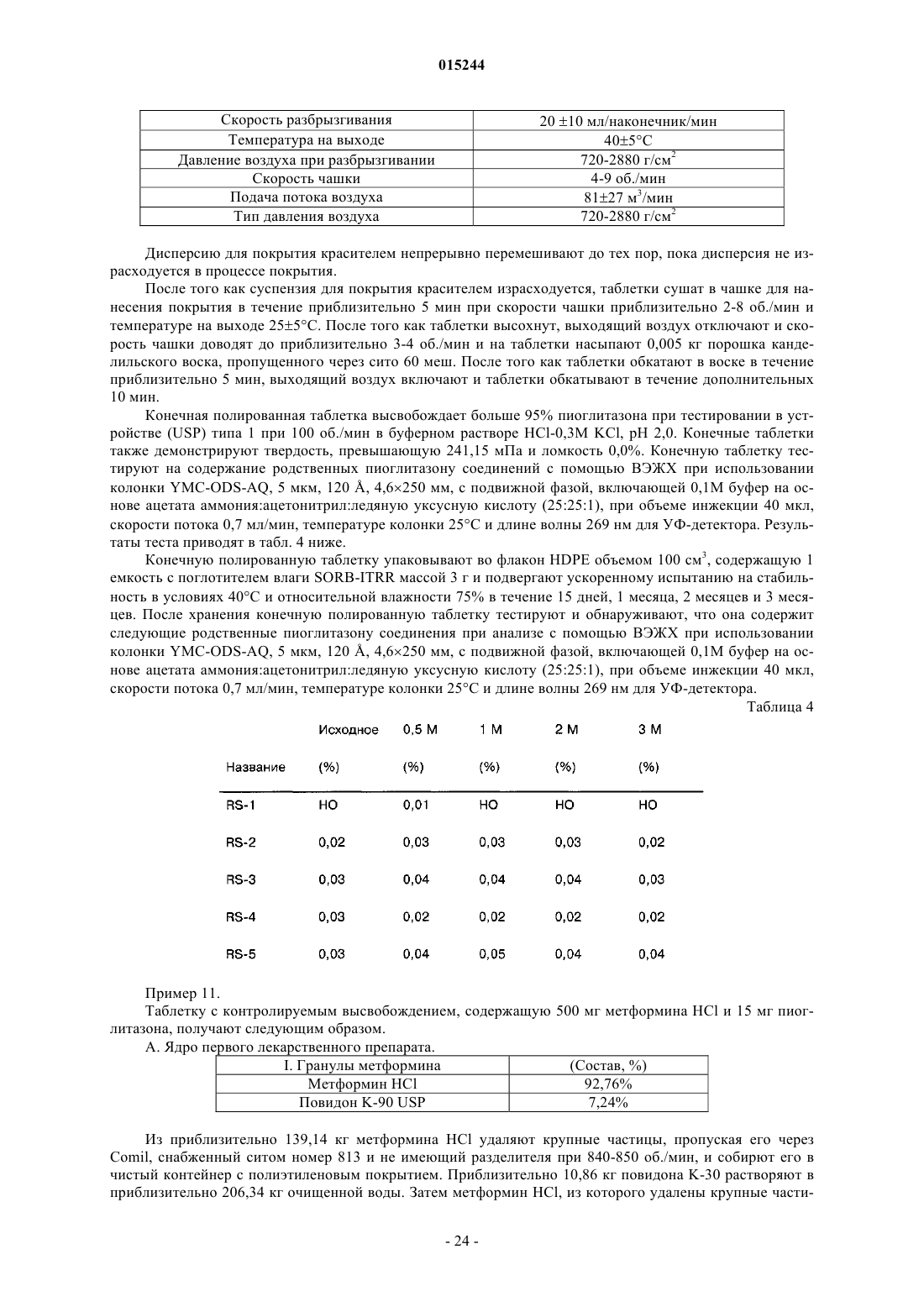
Фармацевтическая дозированная форма (варианты) с контролируемым высвобождением метформина в комбинации с гидрохлоридом пиоглитазона
Номер патента: 15244
Опубликовано: 30.06.2011
Авторы: Лодин Анкали, Кардинал Джек Р., Нанджа Авинаш, Окоти Казухиро
Формула / Реферат
1. Фармацевтическая дозированная форма, содержащая первое и второе активное лекарственное средство, включающая
ядро с контролируемым высвобождением, которое окружено мембраной с замедленным высвобождением, контролирующей высвобождение лекарственного средства таким образом, что максимальный уровень указанного лекарства в плазме достигается через приблизительно 6-12 ч после введения указанной дозированной формы вместе с едой и только одно активное лекарственное средство, включающее метформин или его фармацевтически приемлемую соль, и
слой немедленного высвобождения, который окружает ядро с контролируемым высвобождением и содержит гидрохлорид пиоглитазона и водорастворимый связующий агент с низкой вязкостью, который демонстрирует вязкость менее 10 мПа×с при тестировании в виде 2% водного раствора при 20°C,
в которой по меньшей мере 90% гидрохлорида пиоглитазона высвобождается из указанной фармацевтической дозированной формы в пределах 30 мин при тестировании согласно стандартам качества фармацевтических продуктов США (USP) 26 при использовании устройства 1 при 100 об/мин, 37°C и 900 мл 0,3М буфера KCl-HCl, pH 2,0, и в которой общее количество примесей гидрохлорида пиоглитазона, выбранных из группы, состоящей из (+/-)-5-[п-[2-(5-этил-2-пиридил)этокси]бензил]-5-гидрокси-2,4-тиазолидиндиона, (Z)-5-[п-[2-(5-этил-2-пиридил)этокси]бензилиден]-2,4-тиазолидиндиона, (+/-)-5-[п-[2-(5-этил-2-пиридил)этокси]бензил]-3-[2-(5-этил-2-пиридил)этил]-2,4-тиазолидиндиона, (+/-)-этил-2-карбамоилтио-3-[4-[2-(5-этил-2-пиридил)этокси]]фенилпропионата и этил-3-п-[2-(5-этил-2-пиридил)этокси]фенилпропионата, не превышает 0,6% по результатам высокоэффективной жидкостной хроматографии.
2. Форма по п.1, отличающаяся тем, что по меньшей мере 95% гидрохлорида пиоглитазона высвобождается из дозированной формы в пределах 45 мин при тестировании согласно стандартам качества фармацевтических продуктов США (USP) 26 при использовании устройства 1 при 100 об/мин, 37°C и 900 мл 0,3М буфера KCl-HCl, pH 2,0.
3. Форма по п.1, отличающаяся тем, что по меньшей мере 100% гидрохлорида пиоглитазона высвобождается из дозированной формы в пределах 45 мин при тестировании согласно стандартам качества фармацевтических продуктов США (USP) 26 при использовании устройства 1 при 100 об/мин, 37°C и 900 мл 0,3М буфера KCl-HCl, pH 2,0.
4. Форма по п.1, отличающаяся тем, что по меньшей мере 95% гидрохлорида пиоглитазона высвобождается из дозированной формы в пределах 40 мин при тестировании согласно стандартам качества фармацевтических продуктов США (USP) 26 при использовании устройства 1 при 100 об/мин, 37°C и 900 мл 0,3М буфера KCl-HCl, pH 2,0.
5. Форма по п.1, отличающаяся тем, что по меньшей мере 100% гидрохлорида пиоглитазона высвобождается из дозированной формы в пределах 40 мин при тестировании согласно стандартам качества фармацевтических продуктов США (USP) 26 при использовании устройства 1 при 100 об/мин, 37°C и 900 мл 0,3М буфера KCl-HCl, pH 2,0.
6. Форма по п.1, отличающаяся тем, что по меньшей мере 95% гидрохлорида пиоглитазона высвобождается из дозированной формы в пределах 30 мин при тестировании согласно стандартам качества фармацевтических продуктов США (USP) 26 при использовании устройства 1 при 100 об/мин, 37°C и 900 мл 0,3М буфера KCl-HCl, pH 2,0.
7. Форма по п.1, отличающаяся тем, что по меньшей мере 100% гидрохлорида пиоглитазона высвобождается из дозированной формы в пределах 30 мин при тестировании согласно стандартам качества фармацевтических продуктов США (USP) 26 при использовании устройства 1 при 100 об/мин, 37°C и 900 мл 0,3М буфера KCl-HCl, pH 2,0.
8. Форма по п.1, отличающаяся тем, что указанное ядро с контролируемым высвобождением представляет собой осмотическую таблетку.
9. Форма по п.8, отличающаяся тем, что осмотическая таблетка снабжена ядром, содержащим 50-98% гидрохлорида метформина, 0,1-40% связующего агента, 0-20% компонента, усиливающего всасывание, и 0-5% скользящего вещества, необязательно защитным покрытием, окружающим ядро, и мембраной с замедленным высвобождением, содержащей 50-99% полимера, 0-40% агента, усиливающего поток, и 0-25% пластификатора, причем мембрана имеет по меньшей мере один проход, сформированный в ней для высвобождения указанного гидрохлорида метформина.
10. Форма по п.1, отличающаяся тем, что ядро, по существу, свободно от какого-либо гелеобразующего или расширяющегося полимера.
11. Форма по п.9, отличающаяся тем, что водорастворимый связующий агент имеет вязкость от 2 до 6 мПа×с при тестировании в виде 2% водного раствора при 20°C.
12. Форма по п.9, отличающаяся тем, что водорастворимый связующий агент представляет собой гидроксипропилцеллюлозу.
13. Форма по п.11, отличающаяся тем, что водорастворимый связующий агент представляет собой гидроксипропилцеллюлозу.
14. Фармацевтическая дозированная форма, содержащая первое и второе активное лекарственное средство, включающая
ядро с контролируемым высвобождением, которое окружено мембраной с замедленным высвобождением, контролирующей высвобождение лекарственного средства таким образом, что максимальный уровень указанного лекарства в плазме достигается через приблизительно 6-12 ч после введения указанной дозированной формы вместе с едой и только одно активное лекарственное средство, включающее метформин или его фармацевтически приемлемую соль, и
слой немедленного высвобождения, который окружает ядро с контролируемым высвобождением и содержит гидрохлорид пиоглитазона и водорастворимый связующий агент с низкой вязкостью, который демонстрирует вязкость от 2 до 6 мПа×с при тестировании в виде 2% водного раствора при 20°C,
в которой по меньшей мере 90% гидрохлорида пиоглитазона высвобождается из указанной фармацевтической дозированной формы в пределах 30 мин при тестировании согласно стандартам качества фармацевтических продуктов США (USP) 26 при использовании устройства 1 при 100 об/мин, 37°C и 900 мл 0,3М буфера KCl-HCl, pH 2,0, и в которой общее количество примесей гидрохлорида пиоглитазона, выбранных из группы, состоящей из (+/-)-5-[п-[2-(5-этил-2-пиридил)этокси]бензил]-5-гидрокси-2,4-тиазолидиндиона, (Z)-5-[п-[2-(5-этил-2-пиридил)этокси]бензилиден]-2,4-тиазолидиндиона, (+/-)-5-[п-[2-(5-этил-2-пиридил)этокси]бензил]-3-[2-(5-этил-2-пиридил)этил]-2,4-тиазолидиндиона, (+/-)-этил-2-карбамоилтио-3-[4-[2-(5-этил-2-пиридил)этокси]]фенилпропионата и этил-3-п-[2-(5-этил-2-пиридил)этокси]фенилпропионата, не превышает 0,6% при определении посредством высокоэффективной жидкостной хроматографии.
15. Форма по п.14, отличающаяся тем, что общее количество примесей гидрохлорида пиоглитазона не превышает 0,5%.
16. Форма по п.1, отличающаяся тем, что общее количество примесей гидрохлорида пиоглитазона не превышает 0,5%.
17. Форма по п.14, отличающаяся тем, что количество каждой отдельной родственной гидрохлориду пиоглитазона примеси в конечной дозированной форме не превышает 0,25%.
18. Форма по п.17, отличающаяся тем, что количество каждой отдельной родственной гидрохлориду пиоглитазона примеси в конечной дозированной форме не превышает 0,20%.
19. Форма по п.18, отличающаяся тем, что количество каждой отдельной родственной гидрохлориду пиоглитазона примеси в конечной дозированной форме не превышает 0,10%.
20. Форма по п.14, отличающаяся тем, что ядро с контролируемым высвобождением представляет собой осмотическую таблетку.
21. Форма по п.20, отличающаяся тем, что осмотическая таблетка снабжена ядром, содержащим 50-98% гидрохлорида метформина, 0,1-40% связующего агента, 0-20% компонента, усиливающего всасывание, и 0-5% скользящего вещества, необязательно защитным покрытием, окружающим ядро, и мембраной с замедленным высвобождением, содержащей 50-99% полимера, 0-40% агента, усиливающего поток, и 0-25% пластификатора, причем мембрана имеет по меньшей мере один проход, сформированный в ней для высвобождения гидрохлорида метформина.
22. Форма по п.14, отличающаяся тем, что ядро, по существу, свободно от какого-либо гелеобразующего или расширяющегося полимера.
23. Форма по п.14, отличающаяся тем, что водорастворимый связующий агент имеет вязкость от 2 до 6 мПа×с при тестировании в виде 2% водного раствора при 20°C.
24. Форма по п.14, отличающаяся тем, что водорастворимый связующий агент представляет собой гидроксипропилцеллюлозу.
25. Форма по п.23, отличающаяся тем, что водорастворимый связующий агент представляет собой гидроксипропилцеллюлозу.
Текст
ФАРМАЦЕВТИЧЕСКАЯ ДОЗИРОВАННАЯ ФОРМА (ВАРИАНТЫ) С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ МЕТФОРМИНА В КОМБИНАЦИИ С ГИДРОХЛОРИДОМ ПИОГЛИТАЗОНА В данном материале раскрыта и описана фармацевтическая дозированная форма, содержащая компонент с контролируемым высвобождением, включающий антигипергликемический лекарственный препарат, в частности метформин или его фармацевтически приемлемую соль, в комбинации со вторым компонентом с немедленным высвобождением, включающим производное тиазолидиндиона, в частности пиоглитазона гидрохлорид. 015244 Область техники, к которой относится изобретение Настоящее изобретение относится к фармацевтической дозированной форме с контролируемым высвобождением антигипергликемического лекарственного средства в комбинации с тиазолидиндионовым производным. В частности, настоящее изобретение относится к пероральной дозированной форме, содержащей бигуанид, например метформин или буформин или его фармацевтически приемлемую соль,например метформин гидрохлорид или соли метформина, в комбинации с тиазолидиндионовым производным. Сведения о предшествующем уровне техники Настоящее изобретение относится к фармацевтической дозированной форме, включающей антигипергликемическое лекарственное средство в комбинации с тиазолидиндионовым производным. Более подробно настоящее изобретение относится к пероральной дозированной форме, содержащей бигуанид,например метформин или буформин или его фармацевтически приемлемую соль, например метформин гидрохлорид или соли метформина, описанные в патентах США 3957853 и 4080472, которые включены в данном контексте в виде ссылки, в комбинации с тиазолидиндионовым производным, как описано в патенте США 4687777, также включенным в данном контексте в виде ссылки. Для получения фармацевтических дозированных форм с контролируемым и замедленным высвобождением использовали многие методы с целью поддержания терапевтических сывороточных уровней лекарственных средств и снижения до минимума эффектов пропусков доз лекарственных препаратов,вызванных отсутствием удобства для пациента. Например, описаны таблетки с замедленным высвобождением, которые имеют осмотически активное ядро лекарственного препарата, окруженное полупроницаемой мембраной. Данные таблетки действуют, давая возможность водному компоненту жидкости, такой как желудочная или кишечная жидкость,проникать через покрывающую мембрану и растворять активный ингредиент, чтобы полученный в результате раствор лекарственного средства мог проникать через проход в покрывающей мембране. Альтернативно, если активный ингредиент не растворим в проникающей жидкости, его можно протолкнуть через проход с помощью расширяющегося агента, такого как гидрогель. Некоторые репрезентативные примеры данных осмотических таблеточных систем можно найти в патентах США 3845770, 3916899, 4034758, 4077407 и 4783337. В патенте США 3952741 описано осмотическое устройство, в котором активный агент высвобождается из ядра, окруженного полупроницаемой мембраной только после того, как в мембране развивается достаточное давление, чтобы разрушить мембрану в непрочной части мембраны. Основное осмотическое устройство, описанное в вышеприведенных патентах, со временем было усовершенствовано в попытке обеспечить повышенный контроль высвобождения активного ингредиента. Например, патенты США 4777049 и 4851229 описывают осмотические устройства дозированный формы, включающие полупроницаемую стенку, окружающую ядро. Ядро включает активный ингредиент и модулирующий агент, причем модулирующий агент вызывает высвобождение активного ингредиента через проход в полупроницаемой мембране в импульсном режиме. Дальнейшие усовершенствования включают модификации, относящиеся к полупроницаемой мембране, окружающей активное ядро,таким как варьирование соотношений компонентов, которые образуют мембрану, см., например, патенты США 5178867, 4587117 и 4522625, или повышение числа покрытий, окружающих активное ядро,см., например, патенты США 5650170 и 4892739. Ряд составов с контролируемым или замедленным высвобождением, в которых используют антигипергликемические лекарственные препараты, такие как метформин гидрохлорид, ограничен использованием расширяющегося или гелеобразующегося агента для контроля высвобождения лекарственного средства из дозированной формы. Примерами данного ограниченного исследования являются описание заявки WO 96/08243 и описание на вкладыше к продукту GLUCOPHAGEXR, который представляет собой продукт метформина HCl с контролируемым высвобождением, коммерчески производимый фирмой Bristol-Myers Squibb Co. Тиазолидиндионовые производные описаны в патенте США 4687777. Терапевтическая ценность данных соединений в комбинированной терапии описана, кроме того, в патентах США 5859037,5952356, 5965584, 6150384 и 6172090. Однако ни один из данных патентов не описывает дозированную форму, обладающую преимуществами представленного изобретения. В области техники представлены фармацевтические дозированные формы, включающие комбинации антигипергликемических лекарственных средств и тиазолидиндионовых производных. Например,заявка EPO 0749751 (которая включена в данном контексте в виде ссылки) описывает фармацевтические композиции, включающие агент, повышающий чувствительность к инсулину, который может представлять собой тиазолидиндионовое соединение, в комбинации с другими антидиабетическими агентами. Более подробно в заявке EPO 0749751 описывают, что предпочтительным агентом, усиливающим чувствительность к инсулину, является пиоглитазон, который может быть в комбинации с другими антидиабетическими препаратами, такими как метформин, фенформин или буформин, и, кроме того, что данные лекарственные препараты могут сочетаться (быть связанными и/или покрытыми) с принятыми наполнителями для маскирования вкуса и обеспечения поведения замедленного высвобождения. Другим приме-1 015244 ром комбинации антигипергликемических лекарственных средств и тиазолидиндионовых производных является патент США 6011049 (который включен в данном контексте в виде ссылки). В данном патенте описана единая фармацевтическая композиция, которая включает пиоглитазон или тролитазон и метформин в формах с медленным высвобождением, таких как осмотические насосы или кожные пластыри. Другие комбинации антигипергликемических лекарственных препаратов и тиазолидиндионовых производных можно найти в патентах США 6524621, 6475521, 6451342 и 6153632 и патентных заявках PCTWO 01/3594 и WO 01/3594, которые включены в данном контексте в виде ссылки. В области техники известны также WO 99/47125 и патент США 6099862, которые раскрывают осмотическую таблетку метформина с покрытием, обеспечивающим немедленное высвобождение,включающую антигипергликемическое или гипогликемическое лекарственное средство. Хотя в предшествующем уровне техники описаны фармацевтические дозированные препараты, которые включают как антигипергликемическое соединение, так и тиазолидиндионовые производные, настоящее изобретение дает множество преимуществ относительно описаний, соответствующих предшествующему уровню техники, как будет описано ниже. Объектом настоящего изобретения является предложение дозированной формы, включающей первое активное лекарственное вещество, которое приготовлено так, чтобы обеспечить доставку с контролируемым или замедленным высвобождением. Предпочтительно, когда первое активное лекарственное средство представляет собой антигипергликемическое соединение. Кроме того, настоящее изобретение предлагает второе активное лекарственное средство, которое предпочтительно представляет собой тиазолидиндионовое производное. Новая дозированная форма, описанная в данном контексте, обеспечивает доставку первого и второго лекарственных средств так, чтобы биодоступность каждого лекарственного средства не снижалась в присутствии пищи. Другой объект настоящего изобретения состоит в получении дозированной формы, как описано выше, предусматривающей доставку первого активного лекарственного средства как препарата антигипергликемического соединения с контролируемым или замедленным высвобождением, причем указанный механизм контролируемого или замедленного высвобождения не регулируется расширяющимся полимером, в комбинации с доставкой второго активного лекарственного средства, содержащего тиазолидиндионовое производное, путем немедленного высвобождения. Кроме того, следующим объектом настоящего изобретения является получение дозированной формы, как описано выше, предусматривающей доставку первого активного лекарственного средства как препарата антигипергликемического соединения с контролируемым или замедленным высвобождением в комбинации с доставкой второго активного лекарственного средства, содержащего тиазолидиндионовое производное, путем немедленного высвобождения, которое может обеспечить постоянные и неимпульсные терапевтические уровни указанного антигипергликемического лекарственного средства у животного или человека, нуждающихся в данном лечении, в период от 8 до 24 ч. Дополнительным объектом настоящего изобретения является получение дозированной формы, предусматривающей доставку первого активного лекарственного средства как препарата с контролируемым или замедленным высвобождением антигипергликемического соединения в комбинации с доставкой второго активного лекарственного средства, содержащего тиазолидиндионовое производное, путем немедленного высвобождения, которая обеспечивает максимальные уровни антигипергликемического соединения в плазме приблизительно через 6-12 ч после введения после приема пищи и максимальные уровни тиазолидиндионового производного в плазме через 1-4 ч после введения дозы. Кроме того, объектом настоящего изобретения является получение дозированной формы, включающей первое активное лекарственное средство в виде фармацевтической таблетки с ядром с контролируемым или замедленным высвобождением, имеющей гомогенное осмотическое ядро, причем компонент осмотического ядра может быть сделан с использованием обычных технологий прессования таблеток. Дополнительным объектом настоящего изобретения является получение дозированной формы, предусматривающей доставку первого активного лекарственного средства как препарата с контролируемым или замедленным высвобождением антигипергликемического соединения в комбинации с доставкой второго активного лекарственного средства, содержащего тиазолидиндионовое производное, путем немедленного высвобождения, что обеспечивает максимальные уровни антигипергликемического соединения в плазме приблизительно через 6-12 ч после введения и максимальные уровни тиазолидиндионового производного в плазме приблизительно через 1-4 ч после введения дозы, когда продукт дозируют после приема пищи. Следующим объектом настоящего изобретения является получение дозированной формы,включающей антигипергликемическое лекарственное средство в виде компонента для контролируемого или замедленного высвобождения и тиазолидиндионовое производное в виде компонента для немедленного высвобождения, причем не менее 80% общего количества тиазолидиндионового производного высвобождается из дозированной формы в пределах 30 мин или меньше. Следующим дополнительным объектом настоящего изобретения является получение стабильной при хранении дозированной формы, включающей антигипергликемическое лекарственное средство в виде компонента для контролируемого или замедленного высвобождения и тиазолидиндионовое производное в виде компонента для немедленного высвобождения, причем общее количество родственных-2 015244 тиазолидиндиону соединений или примесей составляет не больше чем 0,6% через два года хранения, и ни одно индивидуальное близкое соединение или примесь не составляет больше чем 0,2%. Сущность изобретения Настоящее изобретение относится к фармацевтической дозированной форме, включающей первое активное лекарственное средство, предпочтительно антигипергликемическое лекарственное средство, в комбинации со вторым активным лекарственным средством, предпочтительно тиазолидиндионовым производным. Более подробно, настоящее изобретение относится к пероральной дозированной форме,включающей первое активное лекарственное средство, представляющее бигуанид, такой как метформин или его фармацевтически приемлемую соль, например метформин гидрохлорид или соли метформина, в комбинации со вторым активным лекарственным препаратом, содержащим тиазолидиндионовое производное, такое как пиоглитазон, в частности пиоглитазона гидрохлорид. Вышеуказанные объекты соответствуют дозированной форме, включающей первое и второе активное лекарственное средство, причем первое активное лекарственное средство приготовлено в виде ядра с контролируемым высвобождением,которое окружено мембраной с замедленным высвобождением, контролирующей высвобождение лекарственного средства таким образом, что максимальный уровень указанного лекарства в плазме достигается через приблизительно 6-12 ч после введения указанной дозированной формы вместе с едой. Второй активный ингредиент представляет собой слой немедленного высвобождения, который окружает ядро с контролируемым высвобождением и содержит гидрохлорид пиоглитазона и водорастворимый связующий агент с низкой вязкостью, который демонстрирует вязкость менее 10 мПаc при тестировании в виде 2% водного раствора при 20C. В одном варианте осуществления второе активное лекарственное средство с немедленным высвобождением должно обеспечить максимальные уровни в плазме тиазолидиндионового производного, в частности гидрохлорида пиоглитазона (Tmax), в пределах 1-12 ч, предпочтительно 1-4 ч, тогда как средство с контролируемым высвобождением, в частности метформин или его фармацевтически приемлемая соль, может обеспечить максимальные уровни в плазме (Tmax) антигипергликемического компонента в пределах 6-12 ч после введения дозы вслед за приемом пищи. Предпочтительно, когда по меньшей мере 90% гидрохлорида пиоглитазона высвобождается из указанной фармацевтической дозированной формы в пределах 30 мин при тестировании согласно стандартам качества фармацевтических продуктов США (USP) 26 при использовании устройства 1 при 100 об./мин, 37C и 900 мл 0,3 М буфера KCl-HCl, pH 2,0, и когда общее количество примесей гидрохлорида пиоглитазона, выбранных из группы, состоящей из (+/-)-5-[п-[2-(5-этил-2-пиридил)этокси]бензил]-5 гидрокси-2,4-тиазолидиндиона, (z)-5-[п-[2-(5-этил-2-пиридил)этокси]бензилиден]-2,4-тиазолидиндиона,(+/-)-5-[п-[2-(5-этил-2-пиридил)этокси]бензил]-3-[2-(5-этил-2-пиридил)этил]-2,4-тиазолидиндиона, (+/-)этил-2-карбамоилтио-3-[4-[2-(5-этил-2-пиридил)этоксифенилпропионата и этил-3-п-[2-(5-этил-2 пиридил)этокси]фенилпропионата не превышает 0,6% по результатам высокоэффективной жидкостной хроматографии. Предпочтительно, когда дозированную форму, соответствующую данному изобретению, можно вводить один раз в сутки, предпочтительно одновременно или после приема пищи и наиболее предпочтительно одновременно или после ужина. Данная дозированная форма может обеспечить терапевтические уровни антигипергликемического лекарственного средства в течение дня при максимальных уровнях в плазме (Tmax), достигаемых через 6-12 ч после введения вместе с приемом пищи. Сведения, подтверждающие возможность осуществления изобретения Данное изобретение относится к фармацевтическому препарату или дозированной форме, содержащей первое активное лекарственное средство, представляющее антигипергликемическое лекарственное средство, в комбинации со вторым активным лекарственным средством, представляющим тиазолидиндионовое производное. Предпочтительно, когда антигипергликемическое лекарственное средство представляет собой бигуанид, например метформин или буформин или его фармацевтически приемлемую соль. Антигипергликемическое лекарственное средство доставляют путем контролируемого высвобождения из ядра таблетки, предпочтительно ядра осмотической таблетки, содержащей или не содержащей гелеобразующий или набухающий полимер. Ядро таблетки должно включать антигипергликемическое лекарственное средство и по меньшей мере один фармацевтически приемлемый наполнитель. В одном варианте осуществления настоящего изобретения ядро таблетки включает антигипергликемическое лекарственное средство, связующий агент и компонент, усиливающий всасывание, и предпочтительно,когда ядро таблетки имеет полимерное покрытие, образующее мембрану вокруг таблетки, в котором сделано отверстие для создания одного прохода на каждой из сторон мембраны. Второе активное лекарственное средство включает тиазолидиндионовое производное, и предпочтительно при нанесении на мембрану ядра таблетки обеспечивается немедленное или контролируемое высвобождение указанного тиазолидиндионового производного. Термин "антигипергликемические лекарственные средства или препараты", как используют в данном описании, относится к лекарственным средствам, которые используют для контроля или лечения инсулиннезависимого сахарного диабета (NIDDM). Антигипергликемические лекарственные препараты-3 015244 включают бигуаниды, такие как метформин, фенформин или буформин или т.п. и их фармацевтически приемлемые соли, изомеры или производные. Термин "тиазолидиндионовое производное", как используют в данном описании, относится к лекарственным препаратам, которые используют для контроля или лечения NIDDM. Они включают, но без ограничения перечисленными, троглитазон, росиглитазон, пиоглитазон, циглитазон и т.п. и их фармацевтически приемлемые соли, изомеры или производные. Термин "связующий агент" относится к любому общеизвестному фармацевтически приемлемому связующему компоненту, такому как поливинилпирролидон, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, этилцеллюлоза, полиметакрилат, поливиниловый спирт и т.п. Можно также использовать смеси вышеуказанных связующих агентов. Предпочтительные связующие агенты представляют собой водорастворимые материалы, такие как поливинилпирролидон, имеющий средневзвешенную молекулярную массу 25000-3000000. Связующий агент может включать приблизительно от примерно 0 до примерно 40% от общей массы ядра и предпочтительно от примерно 3 до примерно 15% от общей массы ядра. В одном варианте осуществления использование связующего агента в ядре является необязательным. В предпочтительном варианте осуществления ядро может необязательно включать компонент, усиливающий всасывание. Компонент, усиливающий всасывание, может представлять собой любой тип компонента, усиливающего всасывание, общеизвестного в уровне техники, такой как жирная кислота,поверхностно-активное вещество (анионное, катионное, амфотерное), хелатирующий агент, желчная соль или их смеси. Примерами некоторых предпочтительных компонентов, усиливающих всасывание,являются лецитин, жирные кислоты, такие как каприновая кислота, олеиновая кислота и их моноглицериды, поверхностно-активные вещества, такие как лаурилсульфат натрия, таурохолат натрия и полисорбат 80, хелатирующие агенты, такие как лимонная кислота, фитиновая кислота, этилендиаминтетрауксусная кислота (EDTA) и этиленгликоль-бис(-аминоэтиловый эфир)-N,N,N,N-тетрауксусная кислота(EGTA). Ядро может включать от приблизительно 0 до приблизительно 20% компонента, усиливающего всасывание, основываясь на общей массе ядра, и наиболее предпочтительно от приблизительно 2 до приблизительно 10% от общей массы ядра. В одном варианте осуществления настоящего изобретения, в котором не используют гелеобразующий или набухающий полимер, предпочтительно, когда ядро, соответствующее настоящему изобретению, сформировано посредством гранулирования антигипергликемического лекарственного средства со связующим агентом и прессования гранул с добавлением скользящего вещества и компонента, усиливающего всасывание, в таблетку. Ядро можно также сформировать с помощью сухого гранулирования ингредиентов ядра путем пропускания их через валиковый уплотнитель и прессования гранул в таблетки с добавлением скользящего вещества. Для таблетирования можно также использовать прямое прессование. В области техники общеизвестны другие способы гранулирования. Кроме того, в составе, соответствующем данному изобретению, можно также использовать другие наполнители, такие как скользящие вещества, пигменты или красители. Термин "гелеобразующий или набухающий полимер" относится к полимерам, которые образуют гель, набухают или расширяются в присутствии воды или биологических жидкостей. Репрезентативными примерами гелеобразующих или набухающих полимеров являются высокомолекулярная гидроксипропилметилцеллюлоза (такая как METHOCEL K100M, которая коммерчески производится фирмой DowCOAGULANT). Другие гелеобразующие или набухающие полимеры описаны в патенте США 4522625(который включен в данном контексте в виде ссылки). Ядро, сформированное, как описано в данном контексте, может быть покрыто мембраной или покрытием с замедленным высвобождением. Материалами, которые используют при формировании мембраны или покрытия с замедленным высвобождением, являются этилцеллюлоза, сложные эфиры целлюлозы, сложные диэфиры целлюлозы, сложные триэфиры целлюлозы, простые эфиры целлюлозы, сложные-простые эфиры целлюлозы, ацилат целлюлозы, диацелат целлюлозы, триацилат целлюлозы, ацетат целлюлозы, диацетат целлюлозы, триацетат целлюлозы, ацетат пропионат целлюлозы и ацетат бутират целлюлозы. Другие подходящие полимеры описаны в патентах США 3845770, 3916899, 4008719,4036228 и 4612008 (которые включены в данном контексте в виде ссылки). Наиболее предпочтительным материалом для мембраны или покрытия с замедленным высвобождением является ацетат целлюлозы с содержанием ацетила 39,3-40,3%, и он коммерчески производится фирмой Eastman Fine Chemicals. В альтернативном варианте осуществления мембрана или покрытие с замедленным высвобождением могут включать один из вышеописанных полимеров и агент, усиливающий поток. Агент, усиливающий поток, может увеличивать объем жидкости, поглощаемой ядром, создавая возможность для того,чтобы дозированная форма выделяла в основном весь антигипергликемический лекарственный препарат через проход и/или пористую мембрану. Агент, усиливающий поток, может представлять собой водорастворимый материал или кишечный материал. Примерами предпочтительных материалов, которые используют в качестве усилителей потока, являются хлорид натрия, хлорид калия, сахароза, сорбит, ман-4 015244 нит, полиэтиленгликоли (ПЭГ), пропиленгликоль, гидроксипропилцеллюлоза, гидроксипропилметил целлюлоза, гидроксипропилметилцеллюлоза фталат, ацетатфталатцеллюлозы, поливиниловые спирты,сополимеры метакриловой кислоты, полоксамеры (такие как LUTROL F68, LUTROL F127, LUTROLF108, которые коммерчески производятся фирмой BASF) и их смеси. Предпочтительным усилителем потока является ПЭГ 400. Усилитель потока может также представлять собой лекарственный препарат, который является водорастворимым, такой как метформин или его фармацевтически приемлемые соли, либо усилитель потока может представлять собой лекарственный препарат, который растворим в среде кишки. Если усилитель потока представляет собой лекарственный препарат, настоящая дозированная форма обладает дополнительным преимуществом в плане обеспечения немедленного высвобождения лекарственного препарата, который выбран в качестве усилителя потока. Агент, усиливающий поток, включает от приблизительно 0 до приблизительно 40% от общей массы покрытия, наиболее предпочтительно от приблизительно 2 до приблизительно 20% от общей массы покрытия. Агент, усиливающий поток, растворяется или вытекает из мембраны или покрытия с замедленным высвобождением с образованием каналов в мембране или покрытии с замедленным высвобождением, которые дают возможность жидкости войти в ядро и растворить активный ингредиент. Мембрану или покрытие с замедленным высвобождением можно также сформировать с использованием общеизвестного наполнителя, такого как пластификатор. Некоторые общеизвестные пластификаторы включают адипат, азелаинат, бензоат, цитрат, стеарат, изоэбуцинат, себацинат, триэтилцитрат, трин-бутилцитрат, ацетилтри-н-бутилцитрат, сложные эфиры лимонной кислоты и пластификаторы, описанные в Encyclopedia of Polymer Science and Technology (Энциклопедии по науке и технологии полимеров), т. 10 (1969), изданной John WileySons. Предпочтительными пластификаторами являются триацетин, полиэтиленгликоли (ПЭГ) (т.е. ПЭГ 400, ПЭГ 8000), ацетилированный моноглицерид, масло из виноградных косточек, оливковое масло, кунжутное масло, ацетилтрибутилцитрат, ацетилтриэтилцитрат,глицеринсорбит, диэтилоксалат, диэтилмалат, диэтилфумарат, дибутилсукцинат, диэтилмалонат, диоксилфталат, дибутилсебацинат, триэтилцитрат, трибутилцитрат, глицеролтрибутират и т.п. В зависимости от конкретного пластификатора могут быть использованы количества от приблизительно 0 до приблизительно 25% и предпочтительно от приблизительно 2 до приблизительно 15% пластификатора, основываясь на общей массе мембраны или покрытия с замедленным высвобождением. Как правило, мембрана или покрытие с замедленным высвобождением вокруг ядра будут включать от приблизительно 1% до приблизительно 10% и предпочтительно от приблизительно 2% до приблизительно 5%, основываясь на общей массе ядра и покрытия. В предпочтительном варианте осуществления мембрана или покрытие с замедленным высвобождением, окружающие ядро, включают, кроме того, проход, который обеспечивает возможность контролируемого высвобождения лекарственного средства из ядра. Как используют в данном контексте, термин"проход" включает щель, отверстие, высверленное отверстие, прорезь, ослабленный участок или разрушаемый элемент, такой как желатиновая пробка, которая разрушается с образованием осмотического прохода для высвобождения антигипергликемического лекарственного средства из дозированной формы. Проходы, используемые в соответствии с данным изобретением, хорошо известны и описаны в патентах США 3845770, 3916899, 4034758, 4077407, 4783337 и 5071607. Независимо от антигипергликемического агента присутствует второе активное лекарственное средство, предпочтительно тиазолидиндионовое производное. Данное второе активное лекарственное средство может быть получено в такой форме, чтобы обеспечить немедленное высвобождение тиазолидиндионового производного. В одном варианте осуществления настоящего изобретения тиазолидиндионовое производное используют в форме слоя на ядре с контролируемым или замедленным высвобождением антигипергликемического лекарственного средства. В слое тиазолидиндионового производного используют связующий агент и другие принятые фармацевтические наполнители, такие как компоненты, усиливающие всасывание, поверхностно-активные вещества, пластификаторы, пеногасители и комбинации вышеуказанного. Компонент, усиливающий всасывание, может присутствовать в слое тиазолидиндионового производного в количестве до приблизительно 30% мас./мас. относительно массы тиазолидиндионового производного. Связующий агент может присутствовать в количестве до 150% мас./мас. от тиазолидиндионового производного. В одном варианте осуществления связующий компонент в слое тиазолидиндионового производного представляет собой водорастворимый связующий компонент, предпочтительно водорастворимый связующий компонент, образующий пленку, который имеет низкую вязкость,как правило, меньше чем 50 мПас, предпочтительно меньше чем 25 мПАс и наиболее предпочтительно меньше чем 10 мПас при тестировании в виде 2% водного раствора при 20C. Примером данного водорастворимого связующего компонента является гидроксипропилцеллюлоза, доступная в фирме NipponSoda Co., Ltd. of Japan под торговым названием HPC-SSL и HPC-SL, которая имеет заявленную вязкость 2-3 мПас и 3-6 мПас соответственно. Если в слое тиазолидиндионового производного используют поверхностно-активное вещество, предпочтительно, когда поверхностно-активное вещество представляет собой неионогенное поверхностно-активное вещество, такое как полоксамер. Состав второго активного-5 015244 лекарственного средства с немедленным высвобождением может быть введен в единую дозированную форму путем нанесения на мембрану или покрытие с замедленным высвобождением с помощью принятых методов. Альтернативно, он может быть введен любым фармацевтически приемлемым методом в единую дозированную форму с первым активным лекарственным средством. Введение второго активного лекарственного средства можно осуществить, но без ограничения перечисленным, методами, выбранными из группы, состоящей из наслоения лекарственного препарата, ламинирования, сухого прессования, осаждения и печатания. Когда тиазолидиндионовое производное наносят на мембрану или покрытие с замедленным высвобождением ядра осмотической таблетки, тиазолидиндионовое покрытие следует наносить из покрывающего раствора или суспензии, в которых используют водный растворитель, органический растворитель или смесь водного и органического растворителя. Типичные органические растворители включают ацетон, изопропиловый спирт, метанол и этанол. При использовании смеси водного и органического растворителей соотношение воды и органического растворителя должно лежать в интервале от 98:2 до 2:98,предпочтительно от 50:50 до 2:98, наиболее предпочтительно от 30:70 до 20:80 и в идеальном случае от приблизительно 25:75 до 20:80. При использовании смешанной системы растворителей количество связующего компонента, необходимого для нанесения тиазолидиндионового производного на мембрану или покрытие с замедленным высвобождением, может быть уменьшено. Например, удачные покрытия были получены из смешанной системы растворителей, в которой соотношение связующего компонента и тиазолидиндионового производного составляет от 1:9 до 1:11. Хотя приемлемые покрытия можно получить,когда тиазолидиндионовое покрытие наносят непосредственно на мембрану или покрытие с замедленным высвобождением, предпочтительный подход состоит в том, чтобы сначала покрыть мембрану или покрытие с замедленным высвобождением защитным слоем перед нанесением тиазолидиндионового покрытия. Как используют в данном контексте, защитный слой представляет собой покрытие, которое не содержит активный фармацевтический ингредиент и которое быстро диспергируется или растворяется в воде. Может быть необходимо нанести приблизительно 5-20% избыток, предпочтительно приблизительно 10-15% избыток раствора для покрытия тиазолидиндионом, чтобы учесть потери в процессе нанесения покрытия. Раствор или суспензия для покрытия тиазолидиндионом могут также включать поверхностноактивное вещество и агент, формирующий поры. Формирующий поры агент предпочтительно представляет собой водорастворимый материал, такой как хлорид натрия, хлорид калия, сахароза, сорбит, маннит, полиэтиленгликоли (ПЭГ) и пропиленгликоль. В альтернативном варианте осуществления дозированная форма, соответствующая настоящему изобретению, может также включать эффективное при немедленном высвобождении количество антигипергликемического лекарственного препарата. Эффективное при немедленном высвобождении количество антигипергликемического лекарственного средства можно нанести на мембрану или покрытие с замедленным высвобождением либо его можно ввести в мембрану или покрытие с замедленным высвобождением. Кроме того, для оптимизации вышеперечисленных составов, представленных в данном изобретении, могут быть использованы различные разбавители, наполнители, скользящие вещества, красители,пигменты, диспергирующие агенты и т.п., которые описаны в справочнике Remington's PharmaceuticalSciences (Справочник по фармацевтическим наукам Ремингтона) (1995). Бигуаниды, такие как метформин, обычно вводят в дозированных формах, содержащих 500, 750,850 и 1000 мг. Тиазолидиндионовые производные, например, пиоглитазон, обычно вводят в дозированных формах, содержащих 15, 30 и 45 мг. Настоящее изобретение предназначено для того, чтобы охватывать вышеперечисленные терапевтические комбинации без представления специального примера каждой возможной комбинации соединений и количеств их соответственных доз. Предпочтительный вариант осуществления дозированной формы будет иметь следующую композицию. Первое активное лекарственное средство ЯДРО: Количество (% ядра) лекарственное средство 50-98%-6 015244 Второе активное лекарственное средство Количество (% общей дозированной формы) лекарственное средство 0,1-20%(предпочтительно 0,1-15%) Дозированные формы, полученные в соответствии с настоящим изобретением, демонстрируют следующий профиль растворения при тестировании согласно стандартам качества фармацевтических продуктов США (Фармакопеи, USP) с помощью устройства типа 2 при 75 об./мин в 900 мл жидкости, имитирующей жидкость кишки (pH 7,5, фосфатный буфер) и при 31C. Высвобождение первого активного лекарственного средства Обнаружено, что выбор наполнителей для использования в тиазолидиндионом компоненте дозированной формы может сильно влиять на характеристики высвобождения, активность и стабильность тиазолидиндиона. Вследствие этого в альтернативном варианте осуществления настоящего изобретения состав тиазолидиндионового компонента, соответствующего настоящему изобретению, следует выбирать так, чтобы не меньше чем 85%, предпочтительно не меньше чем 90% и наиболее предпочтительно не меньше чем 95% тиазолидиндиона высвобождалось из дозированной формы в пределах 45 мин, предпочтительно в пределах 40 мин и наиболее предпочтительно в пределах 30 мин при тестировании согласно стандартам USP 26 с помощью устройства 1 при использовании 100 об./мин, 37C и 900 мл 0,3 М буфера KCl-HCl, pH 2,0. Кроме того, наполнители, предназначенные для применения в тиазолидиндионовом компоненте дозированной формы, следует выбирать так, чтобы суммарно соединения, родственные тиазолидиндиону,или примеси в конечной дозированной форме составляли не более чем 0,6%, предпочтительно не более чем 0,5% и наиболее предпочтительно не более чем 0,25% и каждое отдельное родственное тиазолидиндиону соединение или примесь в конечной дозированной форме составляло не более чем 0,25%, предпочтительно не более чем 0,2% и наиболее предпочтительно не более чем 0,1%. Родственные тиазолидиндиону соединения или примеси в конечной дозированной форме определяют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), используя колонку YMC-ODS-AQ, 5 мкм, 120 ,4,6250 мм или равноценную колонку, подвижную фазу 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяная уксусная кислота (25:25:1), объем инжекции приблизительно 40 мкл, скорость потока 0,7 мл/мин, температуру колонки 25C и длину волны 269 нм для УФ-детектора. Примеры Примеры представлены для иллюстрации произведения и никоим образом не предназначены для ограничения объема притязаний.-7 015244 Пример 1. Таблетку с контролируемым высвобождением, содержащую 850 мг метформина HCl и 15 мг пиоглитазона, получают следующим образом. Первое активное лекарственное средство(% состава ядра) Метформин HCl 90,54% Повидон K-301 USP 4,38% Фосфорно-кислый натрий 4,58% Стеарат магния 0,5% 1 приблизительная молекулярная масса = 50000; динамическая вязкость (10% мас./об.,раствор при 20C) = 5,5-8,5 мПАс.(a) Гранулирование. Из метформина HCl удаляют крупные частицы, пропуская через сито с ячеей 40 меш, и собирают его в чистый контейнер с полиэтиленовым покрытием. Повидон K-30 и фосфорно-кислый натрий растворяют в очищенной воде. Затем метформин HCl с удаленными крупными частицами вводят в гранулятор с псевдоожиженным слоем и верхним разбрызгиванием гранулируемого материала и гранулируют путем разбрызгивания связующего раствора повидона и фосфорно-кислого натрия в следующих условиях: температура воздуха на входе 50-70C; давление воздуха при разбрызгивании 1-3 бар и скорость разбрызгивания 10-100 мл/мин. Когда раствор заканчивается, гранулы сушат в грануляторе до тех пор, пока потери на сушке не станут составлять менее чем 2%. Высушенные гранулы пропускают через устройство, снабженное эквивалентом сита 18 меш.(b) Таблетирование. Стеарат магния пропускают через сито из нержавеющей стали 40 меш и перемешивают с гранулами метформина HCl в течение приблизительно 5 мин. После перемешивания гранулы прессуют на ротационном прессе, оборудованном круглыми стандартными вогнутыми штампами 15/32" (плоский нижний штамп, верхний штамп со штифтом с выемкой приблизительно 1 мм). Как указано выше, отверстие может быть сформировано любыми средствами, обычно используемыми в фармацевтической промышленности.(c) Защитное покрытие (необязательное). Ядро таблетки можно покрыть защитным материалом Opadry или другим подходящим водорастворимым материалом посредством растворения сначала материала Opadry, предпочтительно Opadry Clear,в очищенной воде. Затем раствор Opadry разбрызгивают на ядро таблетки, используя чашечное устройство для нанесения покрытий в следующих условиях: температура выходящего воздуха 38-42C; давление распыления 2000-2900 г/см 2 и скорость распыления 10-15 мл/мин. Ядро таблетки покрывают защитным раствором до получения теоретического уровня покрытия приблизительно 2-4%.(a) Процесс покрытия мембраной. Ацетат целлюлозы растворяют в ацетоне при перемешивании с помощью гомогенизатора. К раствору ацетата целлюлозы добавляют полиэтиленгликоль 400 и перемешивают до получения прозрачного раствора. Затем раствор для покрытия прозрачной мембраной разбрызгивают на таблетки с защитным слоем с помощью устройства для нанесения покрытий с псевдоожиженным слоем, используя следующие условия: температура продукта 16-22C; давление при разбрызгивании приблизительно 3 бар и скорость разбрызгивания 120-150 мл/мин. Имеющее защитное покрытие ядро таблетки покрывают до получения теоретического уровня покрытия приблизительно 3%.III. Нанесение слоя второго активного(состав второго компонента, %) лекарственного средства Пиоглитазон HCl 43,5% Твин 80 2,0% Гидроксипропилметилцеллюлоза 54,5% Твин 80 и гидроксипропилметилцеллюлозу растворяют в очищенной воде. Затем в данном растворе диспергируют пиоглитазон HCl. Потом полученную в результате суспензию разбрызгивают на вышеописанные таблетки, покрытые мембраной. Пример 2. Таблетку с контролируемым высвобождением, содержащую 850 мг метформина HCl и 15 мг пиог-8 015244 литазона, получают следующим образом. Первое активное лекарственное средство(состав ядра, %) Метформин HCl 88,555% Повидон K-903 USP 6,368% Лаурилсульфат натрия 4,577% Стеарат магния 0,5% 3 приблизительная молекулярная масса = 1000000, динамическая вязкость(a) Гранулирование. Из метформина HCl и лаурилсульфата натрия удаляют крупные частицы, пропуская их через сито с ячеей 40 меш, и собирают их в чистый контейнер с полиэтиленовым покрытием. Повидон K-90 растворяют в очищенной воде. Затем метформин HCl и лаурилсульфат натрия вводят в гранулятор с псевдоожиженным слоем и верхним разбрызгиванием гранулируемого материала и гранулируют путем разбрызгивания связующего раствора повидона в следующих условиях: температура воздуха на входе 5070C; давление воздуха при разбрызгивании 1-3 бар и скорость разбрызгивания 10-100 мл/мин. Когда раствор заканчивается, гранулы сушат в грануляторе до тех пор, пока потери на сушке не станут составлять менее чем 2%. Высушенные гранулы пропускают через устройство Comil, снабженное эквивалентом сита 18 меш.(b) Таблетирование. Стеарат магния пропускают через сито из нержавеющей стали 40 меш и перемешивают с гранулами метформина HCl в течение приблизительно 5 мин. После перемешивания гранулы прессуют на ротационном прессе, оборудованном круглыми стандартными вогнутыми штампами 15/32" (плоский нижний штамп, верхний штамп со штифтом с выемкой приблизительно 1 мм). Как указано выше, отверстие может быть сформировано любыми средствами, обычно используемыми в фармацевтической промышленности.(c) Защитное покрытие (необязательное). Ядро таблетки можно покрыть защитным материалом Opadry или другим подходящим водорастворимым материалом посредством растворения сначала материала Opadry, предпочтительно Opadry Clear,в очищенной воде. Затем раствор Opadry разбрызгивают на ядро таблетки, используя чашечное устройство для нанесения покрытий в следующих условиях: температура выходящего воздуха 38-42C; давление распыления 2000-2900 г/см 2 и скорость распыления 10-15 мл/мин. Ядро таблетки покрывают защитным раствором до получения теоретического уровня покрытия приблизительно 2%.(a) Процесс покрытия мембраной. Ацетат целлюлозы растворяют в ацетоне при перемешивании с помощью гомогенизатора. К раствору ацетата целлюлозы добавляют полиэтиленгликоль 400 и триацетин и перемешивают. Затем покрывающий раствор разбрызгивают на таблетки с защитным слоем с помощью устройства для нанесения покрытий с псевдоожиженным слоем, используя следующие условия: температура продукта 16-22C; давление разбрызгивания приблизительно 3 бар и скорость разбрызгивания 120-150 мл/мин. Имеющее защитное покрытие ядро таблетки покрывают до получения теоретического уровня покрытия приблизительно 3%.III. Нанесение слоя второго активного лекарственного средства (состав второго компонента, %) Пиоглитазон HCl 43,5% Твин 80 2,0% Гидроксипропилметилцеллюлоза 54,5% Твин 80 и гидроксипропилметилцеллюлозу растворяют в очищенной воде. Затем в данном растворе диспергируют пиоглитазон HCl. Потом полученную в результате суспензию разбрызгивают на вышеописанные таблетки. Пример 3. Таблетку с контролируемым высвобождением, содержащую 500 мг метформина HCl и 15 мг пиоглитазона, получают следующим образом.I. Первое активное лекарственное средство. Покрытую мембраной таблетку, содержащую 500 мг метформина, получают, как описано выше в-9 015244 примере 2, за исключением того, что в процессе таблетирования используют чашечное оборудование для соединений. Покрытая мембраной таблетка, содержащая 500 мгметформина, имеет следующий состав: Ядро Метформин HCl 500 мг/таблетку Повидон K-90 , USP 35,96 мг/таблетку Лаурилсульфат натрия NF 25,84 мг/таблетку Стеарат магния NF 2,82 мг/таблетку Защитное покрытиеOpadry Clear (YS-1 -7006) 23,53 мг/таблетку Покрытие мембраной Ацетат целлюлозы 398-10 NF 23,56 мг/таблетку Триацетин USP 1,39 мг/таблетку Полиэтиленгликоль 400 NF 2,77 мг/таблетку Общая масса 615,87 мг/таблеткуII. Покрытие слоем второго активного лекарственного средства. Количество пиоглитазона HCl с немедленным высвобождением наносят на покрытую мембраной таблетку, содержащую 500 мг метформина HCl, полученную на стадии I. Конечная таблетка имеет следующий состав. Покрытый мембраной метформин HCl 615,87 мг/таблетку Покрытие пиоглитазоном Пиоглитазон HCl 16,53 мг/таблетку Твин 80 2,0 мг/таблетку Полипласдон XL 15,0 мг/таблеткуOpadry White (белый) 10,0 мг/таблетку Полирующее покрытие Порошок канделильского воска 2,0 мг/таблетку Покрытие пиоглитазоном наносят непосредственно на покрытые мембраной таблетки, содержащие 500 мг метформина HCl. Покрытие пиоглитазоном получают, растворяя 0,252 кг Opadry Clear, 0,269 кг Полипласдона XL и 0,036 кг Твин 80 в 9,908 кг очищенной воды, используя гомогенизатор. После растворения ингредиентов 0,296 кг пиоглитазона HCl диспергируют в растворе и гомогенизируют. Затем гомогенизированную дисперсию наносят непосредственно на покрытые мембраной таблетки, содержащие 500 мг метформина HCl, используя чашечное устройство для нанесения покрытий 24" O'Hara Labcoat III при следующих условиях: Скорость разбрызгивания 15-27 мл/мин Температура на выходе 42-47C Давление воздуха при разбрызгивании 1800 г/см 2 Скорость чашки 5-9 об./мин Поток воздуха на входе 8,1-10,8 м 3/мин После нанесения покрытия пиоглитазона на покрытую мембраной таблетку, содержащую 500 мг метформина HCl, на покрытую пиоглитазоном таблетку наносят эстетическое покрытие или покрытие красителем Opadry White. Покрытие красителем получают, диспергируя 0,179 кг Opadry White в 1,791 кг очищенной воды. Суспензию Opadry White наносят на покрытую пиоглитазоном таблетку, используя чашечное устройство для нанесения покрытий 24" O'Hara Labcoat III при следующих условиях: Скорость разбрызгивания 20-35 мл/мин Температура на выходе 35-45C Давление воздуха при разбрызгивании 1800 г/см 2 Скорость чашки 9 об./мин Поток воздуха на входе 10-13,5 м 3/мин После покрытия красителем таблетки полируют, используя 0,036 кг порошка канделильского воска. Пример 4. Таблетку с контролируемым высвобождением, содержащую 500 мг метформина HCl и 15 мг пиоглитазона, получают следующим образом.I. Первое активное лекарственное средство. Покрытую мембраной таблетку 500 мг получают, как описано выше в примере 2, за исключением- 10015244 того, что в процессе таблетирования используют чашечное мембраной таблетка 500 мг имеет следующий состав: Ядро Метформин HCl Повидон K-90, USP Лаурилсульфат натрия NF Стеарат магния NF Защитное покрытиеOpadry Clear (YS-1-7006) Покрытие мембраной Ацетат целлюлозы 398-10 NF Триацетин USP Полиэтиленгликоль 400 NF Общая массаII. Покрытие слоем второго активного лекарственного средства. Количество пиоглитазона HCl с немедленным высвобождением наносят на покрытую мембраной таблетку, содержащую 500 мг метформина HCl, полученную на стадии I. Конечная таблетка имеет следующий состав: Покрытый мембраной метформин HCl 615,87 мг/таблетку Защитное покрытиеOpadry Clear (YS-1-7006) 13,8 мг/таблетку Покрытие пиоглитазоном Пиоглитазон HCl 16,53 мг/таблетку Твин 80 2,0 мг/таблетку Хлорид натрия 4,27 мг/таблеткуOpadry White (белый) 8,10 мг/таблетку Полирующее покрытие Порошок канделильского воска 0,20 мг/таблетку Раствор защитного покрытия получают, растворяя 0,258 кг Opadry Clear в 2,576 кг очищенной воды и разбрызгивая раствор на приблизительно 12,088 кг ядер покрытых мембраной таблеток, содержащих 500 мг метформина HCl, при использовании чашечного устройства для нанесения покрытий 24"O'HaraLabcoat III. Защитное покрытие наносят при следующих условиях: Скорость разбрызгивания 20-35 мл/мин Температура на выходе 35-45C Давление воздуха при разбрызгивании 1800 г/см 2 Скорость чашки 9 об./мин Поток воздуха на входе 10-13,5 м 3/мин Покрытие пиоглитазоном наносят на имеющие защитное покрытие таблетки, покрытые мембраной,содержащие 500 мг метформина HCl. Покрытие пиоглитазоном получают, растворяя 0,040 кг OpadryClear, 0,085 кг хлорида натрия и 0,040 кг Твин 80 в 4,915 кг очищенной воды, используя гомогенизатор. После растворения данных ингредиентов 0,328 кг пиоглитазона HCl диспергируют в растворе и гомогенизируют. Затем гомогенизированную дисперсию наносят на имеющие защитное покрытие таблетки,покрытые мембраной, содержащие 500 мг метформина HCl, используя чашечное устройство для нанесения покрытий 24" O'Hara Labcoat III при следующих условиях: Скорость разбрызгивания 10-30 мл/мин Температура на выходе 35-45C Давление воздуха при разбрызгивании 1440-2880 г/см 2 Тип давления воздуха 1440-2880 г/см 2 Скорость чашки 8-12 об./мин Поток воздуха на входе 6,8-12,2 м 3/мин После нанесения покрытия пиоглитазона на имеющую защитное покрытие таблетку, покрытую мембраной, содержащую 500 мг метформина HCl, на покрытую пиоглитазоном таблетку наносят эстетическое покрытие или покрытие красителем Opadry White. Покрытие красителем получают, диспергируя 0,159 кг Opadry White в 1,585 кг очищенной воды. Суспензию Opadry White наносят на покрытую пиог- 11015244 литазоном таблетку при использовании условий, аналогичных описанным выше для нанесения защитного покрытия. После покрытия красителем таблетки полируют, используя 0,004 кг порошка канделильского воска. Пример 5. Таблетку с контролируемым высвобождением, содержащую 1000 мг метформина HCl и 30 мг пиоглитазона получают следующим образом.I. Первое активное лекарственное средство. А. Ядро(состав ядра, %) Метформин HCl 88,07% Повидон K-90 3 USP 6,87% Лаурилсульфат натрия 4,55% Стеарат магния 0,5% 3 приблизительная молекулярная масса = 1000000, динамическая вязкость(10% мас./об. раствор) 300-700 мПас при 20C Приблизительно 206,34 кг очищенной воды вносят в емкость из нержавеющей стали, после чего вносят приблизительно 10,86 кг повидона K-90. Раствор перемешивают при скорости приблизительно 330-360 об./мин в течение приблизительно 45 мин или до полного растворения повидона. Приблизительно 139,14 кг метформина HCl пропускают через Comil, снабженный ситом 813 без прокладки при 840850 об./мин. Просеянный метформин HCl загружают в устройство для покрытия типа GPCG-60 (Glatt) с псевдоожиженным слоем со вставкой Wurster (размер 32" высота 35 мм) с тремя наконечниками размера 1,5 мм. Метформин HCl псевдоожижают и доводят температуру продукта до приблизительно 38-43C. Раствор повидона разбрызгивают на псевдоожиженный метформин HCl при давлении разбрызгивания приблизительно 2,5-3,0 бар и скорости насоса: 0-15 мин 491-515 г/мин (заданная 500 г/мин) 16-30 мин 680-710 г/мин (заданная 700 г/мин) 31-45 мин 860-910 г/мин (заданная 900 г/мин) 46-60 мин 1090-1170 г/мин (заданная 1100 г/мин) 61 мин до конца 1170-1220 г/мин (заданная 1200 г/мин) Когда раствор повидона заканчивается, гранулы сушат в псевдоожиженном слое при приблизительно 57,1 кг/см 3 и температуре воздуха на входе 60C до тех пор, пока потери на сушке (LOD) не превысят 2%. Полученные в результате гранулы пропускают через устройство Comil, оборудованное ситом из нержавеющей стали 1143 и прокладкой 075 при скорости 1086-1088 об./мин с получением приблизительно 150 кг гранул метформина HCl. Процесс гранулирования повторяют второй раз, получая приблизительно 300 кг гранул метформина HCl. Приблизительно 300 кг гранул метформина вносят в смеситель Слент-Кона объемом 50 кубических футов (0,043 м 3) вместе с приблизительно 14,38 кг лаурилсульфата натрия и перемешивают в течение приблизительно 20 мин. Приблизительно 1,58 кг стеарата магния пропускают через сито из нержавеющей стали 40 меш, затем добавляют к смеси в смесителе Слента-Кона. Полученную в результате смесь перемешивают в течение приблизительно 5 мин, затем прессуют в таблетки, используя обычный таблеточный пресс, оборудованный круглым чашечным штампом для соединений 1/2", давление при предварительном прессовании составляет 6 и давление при основном прессовании составляет 38. Полученные в результате таблетки имеют массу, лежащую в интервале от 1044 г до приблизительно 1226 г при заданной массе 1135 г, твердость 137,80-206,70 мПа (заданная 192,92 мПа) и ломкость менее или равную 0,8%. В. Защитное покрытие. На приблизительно 57,61 кг ядер таблеток, полученных выше, наносят защитный слой материалаOpadry или другого подходящего водорастворимого материала, сначала растворяя материал Opadry,предпочтительно приблизительно 3,98 кг Opadry Clear YS-1-7006) в приблизительно 21,49 кг очищенной воды. Затем раствор Opadry разбрызгивают на ядро таблетки при использовании чашечного устройства для покрытия O'Hara Labcoat III с чашкой 36", 3 пистолетами-распылителями в следующих условиях: температура воздуха на выходе 40-47C; давление при разбрызгивании 3600720 г/см 2, скорость разбрызгивания 18060 г/мин/3 пистолета-распылителя, скорость чашки 4-8 об./мин и объем воздуха 270 54 м 3/мин. Ядро таблетки покрывают защитным раствором до тех пор, пока не получают теоретический уровень покрытия приблизительно 2,8-4,4%. С. Покрытие мембраной. Покрытие мембраной из ацетата целлюлозы наносят на ядра таблеток метформина HCl с защитным покрытием для получения таблеток метформина HCl, покрытых мембраной следующего состава: Таблетка метформина HCl 1000 мг Ацетат целлюлозы (398-10)4 Триацетин ПЭГ 400 4 содержание ацетила 39,3-40,3% Приблизительно 29,95 кг ацетона вводят в емкость из нержавеющей стали с последующим внесением 0,788 кг ацетата целлюлозы и перемешивают в течение приблизительно 20 мин до тех пор, пока раствор не станет прозрачным. После того как раствор станет прозрачным, в раствор вводят приблизительно 0,092 кг полиэтиленгликоля 400 и перемешивают в течение приблизительно 5 мин, после чего добавляют приблизительно 0,046 кг триацетина. Раствор перемешивают в течение дополнительных 5 мин. Приблизительно 59,07 кг таблеток метформина HCl с защитным покрытием загружают в устройство для покрытия типа GPCG-60 (Glatt) с псевдоожиженным слоем со вставкой Wurster (размер 18", высота 45 мм) с наконечником размера 1,5 мм. Таблетки метформина HCl с защитным покрытием псевдоожижают и доводят температуру продукта до приблизительно 213C. Раствор ацетата целлюлозы разбрызгивают на псевдоожиженные таблетки метформина HCl с защитным покрытием при давлении разбрызгивания приблизительно 2,0-3,0 бар, объеме воздуха 43251 м 3/мин и скорости разбрызгивания 400100 г/мин до тех пор, пока не получают увеличение массы 1-2% (заданное 1,38%). После нанесения требуемого количества покрытия, образующего мембрану, таблетки, покрытые мембраной, сушат в псевдоожиженном слое при 213C и 36527 м 3/мин в течение приблизительно 10 мин, а затем при 40C и 36527 м 3/мин в течение приблизительно 5 мин. Полученные в результате покрытые мембраной таблетки обрабатывают лазером, чтобы сделать отверстие приблизительно в центре каждой стороны покрытой мембраной таблетки (т.е. 2 отверстия) среднего диаметра 0,5 мм/отверстие. Данные верхнего микрометра - 6,52 мм, нижнего микрометра - 6,752 мм, длительность импульса лазера составляет 17070 и задержка импульса составляет 340150 и 350150 соответственно.II. Второй активный лекарственный препарат. Количество пиоглитазона HCl c немедленным высвобождением наносят на покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, полученные на стадии I. Конечная таблетка имеет следующий состав: Покрытая мембраной таблетка метформина HCl 1201,0 мг/таблетку Защитное покрытиеOpadry Clear (YS-1 -7006) 16,0 мг/таблетку Покрытие пиоглитазоном Пиоглитазон HCl 33,06 мг/таблетку Хлорид натрия 4,27 мг/таблеткуOpadry White (белый) 20,27 мг/таблетку Полирующее покрытие Порошок канделильского воска 0,40 мг/таблетку Раствор защитного покрытия получают, диспергируя 0,174 кг Opadry Clear в 3,478 кг этанола и перемешивая дисперсию в течение 15 мин. Затем дисперсию разбрызгивают на приблизительно 13,174 кг покрытых мембраной таблеток, содержащих 1000 мг метформина HCl при использовании чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III. Защитное покрытие наносят на покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, при следующих условиях: Скорость разбрызгивания 10-30 мл/наконечник/мин Температура на выходе 25-45C Давление воздуха при разбрызгивании 1440-2880 г/см 2 Скорость чашки 6-12 об./мин Тип давления воздуха 1440-2880 г/см 2 Поток воздуха на входе 6,8-12,2 м 3/мин Затем таблетки, покрытые мембраной, содержащие 1000 мг метформина HCl, покрывают пиоглитазоном. Покрытие пиоглитазоном получают, растворяя 0,036 кг Opadry Clear и 0,046 кг хлорида натрия в 5,344 кг этанола, используя гомогенизатор. После диспергирования ингредиентов 0,359 кг пиоглитазонаHCl диспергируют в растворе и гомогенизируют. Затем гомогенизированную дисперсию наносят на имеющие защитное покрытие таблетки, покрытые мембраной, содержащие 1000 мг метформина HCl,- 13015244 используя чашечное устройство для нанесения покрытий 24"O'Hara Labcoat III при следующих условиях: Скорость разбрызгивания 10-30 мл/наконечник/мин Температура на выходе 25-45C Давление воздуха при разбрызгивании 1440-2880 г/см 2 Скорость чашки 6-12 об./мин Тип давления воздуха 1440-2880 г/см 2 Поток воздуха на входе 6,8-12,2 м 3/мин После покрытия пиоглитазоном на покрытую пиоглитазоном таблетку наносят эстетическое покрытие или покрытие красителем Opadry II White. Покрытие красителем получают, диспергируя 0,220 кгOpadry II White в 4,407 кг этанола. Суспензию Opadry II White наносят на покрытые пиоглитазоном таблетки с помощью чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III, используя условия, аналогичные описанным выше для нанесения защитного покрытия. После покрытия красителем таблетки полируют, используя 0,004 кг порошка канделильского воска. Пример 6. Таблетку с контролируемым высвобождением, содержащую 1000 мг метформина HCl и 30 мг пиоглитазона, получают следующим образом.I. Первое активное лекарственное средство. Покрытую мембраной таблетку 1000 мг получают, как описано выше в примере 5. Покрытая мембраной таблетку 1000 мг имеет следующий состав: Ядро Метформин HCl 1000 мг/таблетку Повидон K-90, USP 78,0 мг/таблетку Лаурилсульфат натрия NF 51,69 мг/таблетку Стеарат магния NF 5,65 мг/таблетку Защитное покрытиеOpadry Clear (YS-1-7006) 47,05 мг/таблетку Покрытие мембраной Ацетат целлюлозы 398-10 NF 15,77 мг/таблетку Триацетин USP 0,92 мг/таблетку Полиэтиленгликоль 400 NF 1,85 мг/таблетку Общая масса 1201,0 мг/таблеткуII. Второе активное лекарственное средство. Количество пиоглитазона HCl с немедленным высвобождением наносят на покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, полученные на стадии I. Конечная таблетка имеет следующий состав: Покрытая мембраной таблетка метформина HCl 1201,0 мг/таблетку Защитное покрытиеOpadry Clear (YS-1-7006) 21,0 мг/таблетку Покрытие пиоглитазоном Пиоглитазон HCl 33,06 мг/таблетку Хлорид натрия 5,00 мг/таблеткуOpadry White (белый) 21,54 мг/таблетку Полирующее покрытие Порошок канделильского воска 0,40 мг/таблетку На покрытую мембраной таблетку, содержащую 1000 мг метформина HCl, наносят защитное покрытие. Защитное покрытие получают, диспергируя 0,229 кг Opadry Clear в 4,573 кг спирта USP и перемешивая дисперсию в течение 15 мин. Затем дисперсию разбрызгивают на приблизительно 13,08 кг ядер таблеток, содержащих 1000 мг метформина HCl при использовании чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя и при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Подача потока воздуха Вид давления воздуха Дисперсию защитного покрытия постоянно перемешивают до тех пор, пока она не израсходуется в процессе покрытия. Затем покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, имеющие защитное покрытие, покрывают пиоглитазоном. Покрытие пиоглитазоном получают, смешивая 4,434 кг спиртаUSP и 1,250 кг очищенной воды (приблизительное соотношение спирта и очищенной воды 78:22) и медленно диспергируя 0,040 кг Opadry Clear в смеси растворителей. После диспергирования Opadry Clear его гомогенизируют в течение приблизительно 10 мин. После того как гомогенизируют дисперсию OpadryClear, в дисперсию добавляют 0,054 кг хлорида натрия и гомогенизируют в течение приблизительно 2 мин. После того как гомогенизируют хлорид натрия, 0,360 кг пиоглитазона HCl медленно диспергируют в смеси растворителей и затем гомогенизируют в течение приблизительно 10 мин. После того как гомогенизируют пиоглитазон HCl, гомогенизатор удаляют из емкости для смешивания и заменяют воздушным смесителем и перемешивают в течение дополнительных 15 мин. Суспензию пиоглитазона перемешивают до тех пор, пока суспензия не израсходуется во время процесса покрытия. Суспензию пиоглитазона HCl наносят на покрытые мембраной ядра таблеток, содержащие 1000 мг метформина HCl, с защитным покрытием при использовании чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя и при следующих условиях: Скорость разбрызгивания 2510 мл/наконечник/мин Температура на выходе 255C Давление воздуха при разбрызгивании 720-2880 г/см 2 Скорость чашки 4-9 об./мин Тип давления воздуха 720-2880 г/см 2 Подача потока воздуха 54 27 м 3/мин После покрытия пиоглитазоном покрытой мембраной таблетки, содержащей 1000 мг метформинаHCl, имеющей защитное покрытие, на покрытую пиоглитазоном таблетку наносят эстетическое покрытие Opadry II White. Эстетическое покрытие получают, диспергируя 0,235 кг Opadry II White (Y-22-7719) в 4,691 кг спирта USP и перемешивая дисперсию в течение приблизительно 1 ч. Затем дисперсию OpadryII разбрызгивают на таблетки, покрытые пиоглитазоном HCl при использовании чашечного устройства для покрытия 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя и при следующих условиях: Скорость разбрызгивания 2510 мл/наконечник/мин Температура на выходе 255C Давление воздуха при разбрызгивании 720-2880 г/см 2 Скорость чашки 4-9 об./мин Подача потока воздуха 5427 м 3/мин Тип давления воздуха 720-2880 г/см 2 Дисперсию для покрытия красителем непрерывно перемешивают до тех пор, пока дисперсия не израсходуется в процессе покрытия. После того как суспензия для эстетического покрытия израсходуется,таблетки сушат в чашке для нанесения покрытия в течение приблизительно 5 мин при скорости чашки приблизительно 2-8 об./мин и температуре на выходе 255C. После того как таблетки высохнут, выходящий воздух отключают и скорость чашки доводят до приблизительно 3-4 об./мин и на таблетки насыпают 0,004 кг порошка канделильского воска, пропущенного через сито 60 меш. После того как таблетки обкатают в воске в течение приблизительно 5 мин, выходящий воздух включают и таблетки обкатывают в течение дополнительных 10 мин. Конечная полированная таблетка демонстрирует следующий профиль растворения пиоглитазона HCl при тестировании в устройстве USP типа 1 при 100 об./мин в буферном растворе HCl-0,3M KCl, pH 2,0: Время Высвобождающийся пиоглитазон, % 10 мин 42% 20 мин 79% 30 мин 95% 45 мин 102% Конечная полированная таблетка содержит также следующие родственные пиоглитазону соединения при тестировании с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 ,4,6250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяная уксусная кислота (25:25:1), объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуры колонкиRS-5 представляет собой этил-3-п-[2-(5-этил-2-пиридил)этокси]фенилпропионат. Конечную полированную таблетку упаковывают во флакон HDPE объемом 100 см 3, содержащую одну (1) емкость с поглотителем влаги SORB-ITRR массой 2 г и подвергают ускоренному испытанию на стабильность в условиях 40C и относительной влажности 75% в течение 3 месяцев. После хранения конечную полированную таблетку тестируют и демонстрируют следующий профиль растворения пиоглитазона HCl при тестировании в устройстве USP типа 1 при 100 об./мин в буферном растворе HCl-0,3M Конечная полированная таблетка после хранения содержит также следующие родственные пиоглитазону соединения при тестировании с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6 250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяная уксусная кислота (25:25:1), объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуры колонки 25C и длины волны 269 нм для УФ-детектора.A. Ядро первого активного лекарственного средствва. Таблетку метформина HCl, покрытую ацетатом целлюлозы, получают, как описано в примере 5.B. Второе активное лекарственное средство. Количество пиоглитазона HCl с немедленным высвобождением наносят на покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, полученные выше на стадии A. Конечная таблетка имеет следующий состав: Покрытая мембраной таблетка метформина HCl Защитное покрытиеOpadry Clear (YS-1-7006) Покрытие пиоглитазоном Пиоглитазон HCl Гидроксипропилцеллюлоза NF (HPC-SSL) Лактоза моногидрат NF(модифицированная распылительной сушкой) Полиэтиленгликоль 8000 NF Диоксид титана USP Полирующее покрытие Порошок канделильского воска Защитное покрытие наносят на приблизительно 12,09 кг покрытых мембраной таблеток, содержащих 1000 мг метформина HCl, полученных на вышеописанной стадии A. Защитное покрытие получают,диспергируя приблизительно 0,91 кг Opadry Clear (YS-1-7006) в приблизительно 1,133 кг очищенной воды в течение 30 мин. Дисперсию разбрызгивают на приблизительно 12,09 кг ядер таблеток, содержащих 1000 мг метформина HCl, при использовании чашечного устройства для нанесения покрытий 24"O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя три пистолетных разбрызгивателя, и при следующих условиях: Скорость разбрызгивания 2010 мл/наконечник/мин Температура на выходе 405C Давление воздуха при разбрызгивании 720-2880 г/см 2 Скорость чашки 4-9 об./мин Подача потока воздуха 8127 м 3/мин Тип давления воздуха 720-2880 г/см 2 Покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, имеющие защитное покрытие, покрывают пиоглитазоном. Покрытие пиоглитазоном получают, медленно диспергируя приблизительно 0,104 кг гидроксипропилцеллюлозы NF (HPC-SLL) в приблизительно 8,499 кг очищенной воды.HPC-SSL и воду перемешивают в течение приблизительно 20 мин, затем к смеси HPC-SSL/вода добавляют 0,347 кг лактозы моногидрата, NF (модифицированной распылительной сушкой) и перемешивают в течение приблизительно 2 мин. После перемешивания лактозы в смесь воды, HPC-SSL и лактозы добавляют приблизительно 0,005 кг полиэтиленгликоля 8000 NF и 0,010 кг диоксида титана (USP) и перемешивают в течение приблизительно 5 мин. Через приблизительно 5 мин перемешивания приблизительно 0,383 кг пиоглитазона гидрохлорида диспергируют в растворе для покрытия. Данный раствор для покрытия содержит приблизительно 15% избыточного материала, чтобы скомпенсировать потерю материала во время процесса покрытия. Суспензию пиоглитазона перемешивают, пока суспензия не израсходуется в процессе покрытия. Суспензию пиоглитазона HCl наносят на покрытые мембраной ядра таблеток, содержащие 1000 мг метформина HCl, имеющие защитное покрытие, с помощью чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя,используя три пистолетных разбрызгивателя, и при следующих условиях: Скорость разбрызгивания 2010 мл/наконечник/мин Температура на выходе 405C Давление воздуха при разбрызгивании 720-2880 г/см 2 Скорость чашки 4-9 об./мин Тип давления воздуха 720-2880 г/см 2 Подача потока воздуха 8127 м 3/мин После сушки таблеток с пиоглитазоном выходящий воздух выключают, и скорость чашки доводят- 17015244 до приблизительно 3-4 об./мин и 0,004 кг порошка канделильского воска, который пропускают через сито 60 меш, насыпают на таблетки. После того как таблетки обкатают в воске в течение приблизительно 5 мин, выходящий воздух включают и таблетки обкатывают в течение дополнительных 10 мин. Конечная полированная таблетка высвобождает больше 95% пиоглитазона при тестировании в устройстве (USP) типа 1 при 100 об./мин в буферном растворе HCl-0,3M KCl, pH 2,0. Конечные таблетки также демонстрируют твердость, превышающую 241,15 мПа и ломкость 0,00%. Конечную таблетку тестируют на содержание родственных пиоглитазону соединений с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Результаты теста приводят в табл. 1 ниже. Конечную полированную таблетку упаковывают во флакон HDPE объемом 100 см 3, содержащую одну (1) емкость с поглотителем влаги SORB-ITRR массой 3 г и подвергают ускоренному испытанию на стабильность в условиях 40C и относительной влажности 75% в течение 15 дней, 1 месяца, 2 месяцев, 3 месяцев и 6 месяцев. После хранения конечную полированную таблетку тестируют и обнаруживают, что она содержит следующие родственные пиоглитазону соединения при анализе с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФдетектора. Таблица 1A. Ядро первого активного лекарственного средства. Ядро таблетки метформина HCl покрытую ацетатом целлюлозы, получают согласно способу, описанному в примере 5.B. Второе активное лекарственное средство. Количество пиоглитазона HCL с немедленным высвобождением наносят на покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, полученные выше на стадии A. Конечная таблетка имеет следующий состав: Покрытая мембраной таблетка метформина HCl 1201,0 мг/таблетку Защитное покрытиеOpadry Clear (YS-1-7006) 9,00 мг/таблетку Покрытие пиоглитазоном Пиоглитазон HCl 33,06 мг/таблетку Гидроксипропилцеллюлоза NF (HPC-SSL) 9,0 мг/таблетку Лактоза моногидрат NF (модифицированная распылительной сушкой) 30,0 мг/таблетку Полиэтиленгликоль 8000 NF 0,450 мг/таблетку Диоксид титана USP 0,90 мг/таблетку Покрытие красителем Гидроксипропилцеллюлоза NF (HPC-SSL) 5,5 мг/таблетку Полиэтиленгликоль 8000 NF 1,38 мг/таблетку Диоксид титана USP 0,60 мг/таблетку Полирующее покрытие Порошок канделильского воска 0,40 мг/таблетку- 18015244 Защитное покрытие наносят на приблизительно 13,02 кг покрытых мембраной таблеток, содержащих 1000 мг метформина HCl, полученных на вышеописанной стадии A. Защитное покрытие получают,диспергируя приблизительно 0,098 кг Opadry Clear (YS-1-7006) в приблизительно 1,220 кг очищенной воды в течение 30 мин. Дисперсию разбрызгивают на приблизительно 13,02 кг ядер таблеток, содержащих 1000 мг метформина HCl, при использовании чашечного устройства для нанесения покрытий 24"O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя 3 пистолетных разбрызгивателя, и при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Подача потока воздуха Тип давления воздуха Покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, имеющие защитное покрытие, покрывают пиоглитазоном. Покрытие пиоглитазоном получают, медленно диспергируя приблизительно 0,108 кг гидроксипропилцеллюлозы (HPC-SLL) в приблизительно 8,753 кг очищенной воды.HPC-SSL и воду перемешивают в течение приблизительно 20 мин, после чего к смеси HPC-SSL/вода добавляют 0,358 кг лактозы моногидрата, NF (модифицированной распылительной сушкой) и перемешивают в течение приблизительно 2 мин. После перемешивания лактозы в смесь воды, HPC-SSL и лактозы добавляют приблизительно 0,006 кг полиэтиленгликоля 8000 NF и 0,011 кг диоксида титана (USP) и перемешивают в течение приблизительно 5 мин. Через приблизительно 5 мин перемешивания приблизительно 0,394 кг пиоглитазона гидрохлорида диспергируют в покрывающем растворе. Данный покрывающий раствор содержит приблизительно 10% избыточного материала, чтобы скомпенсировать потерю материала во время процесса покрытия. Суспензию пиоглитазона перемешивают, пока суспензия не израсходуется в процессе покрытия. Суспензию пиоглитазона HCl наносят на покрытые мембраной ядра таблеток, содержащие 1000 мг метформина HCl, имеющие защитное покрытие, с помощью чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя три пистолетных разбрызгивателя, при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Тип давления воздуха Подача потока воздуха После покрытия пиоглитазоном покрытых мембраной таблеток, содержащих 1000 мг метформинаHCl, имеющих защитное покрытие, на таблетку, покрытую пиоглитазоном, наносят краситель или эстетическое покрытие. Покрытие красителем получают, диспергируя приблизительно 0,060 кг НРС-SSLNF,0,015 кг полиэтиленгликоля 8000, NF и 0,007 диоксида титана, USP в 0,810 кг очищенной воды и перемешивают дисперсию в течение приблизительно 30 мин. Затем покрытие красителем разбрызгивают на таблетки, покрытые пиоглитазоном, с помощью чашечного устройства для нанесения покрытий 24"O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя три пистолетных разбрызгивателя, при следующих условиях: Скорость разбрызгивания 2010 мл/наконечник/мин Температура на выходе 405C Давление воздуха при разбрызгивании 720-2880 г/см 2 Скорость чашки 4-9 об./мин Подача потока воздуха 8127 м 3/мин Тип давления воздуха 720-2880 г/см 2 Дисперсию для покрытия красителем непрерывно перемешивают до тех пор, пока дисперсия не израсходуется в процессе покрытия. После того как суспензия для эстетического покрытия израсходуется,таблетки сушат в чашке для нанесения покрытия в течение приблизительно 5 мин при скорости чашки приблизительно 2-8 об./мин и температуре на выходе 25-5C. После того как таблетки высохнут, выходящий воздух отключают и скорость чашки доводят до приблизительно 3-4 об./мин и на таблетки насыпают 0,004 кг порошка канделильского воска, пропущенного через сито 60 меш. После того как таблетки обкатают в воске в течение приблизительно 5 мин, выходящий воздух включают и таблетки обкатывают- 19015244 в течение дополнительных 10 мин. Конечная полированная таблетка высвобождает больше 90% пиоглитазона при тестировании в устройстве (USP) типа 1 при 100 об./мин в буферном растворе HCl-0,3M KCl, pH 2,0. В среднем по 12 тестированным емкостям высвобождение составляет 96%. Конечные таблетки также демонстрируют твердость, превышающую 241,15 35 мПа и ломкость 0,1%. Конечную таблетку тестируют на содержание родственных пиоглитазону соединений с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Результаты теста приводят в табл. 2 ниже. Конечную полированную таблетку упаковывают во флакон HDPE объемом 100 см 3, содержащую 1 емкость с поглотителем влаги SORB-ITRR массой 3 г и подвергают ускоренному испытанию на стабильность в условиях 40C и относительной влажности 75% в течение 15 дней, 1 месяца, 2 месяцев, 3 месяцев и 6 месяцев. После хранения конечную полированную таблетку тестируют и обнаруживают, что она содержит следующие родственные пиоглитазону соединения при анализе с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл,скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Таблица 2I. Первое активное лекарственное средство. Покрытую мембраной таблетку 1000 мг получают, как описано выше в примере 5. Покрытая мембраной таблетка 1000 имеет следующий состав: Ядро Метформин HCl Повидон K-90, USP Лаурилсульфат натрия NF Стеарат магния NF Защитное покрытиеOpadry Clear (YS-1-7006) Покрытие мембраной Ацетат целлюлозы 398-10 NF Триацетин USP Полиэтиленгликоль 400 NF Общая масса В. Второе активное лекарственное средство. Количество пиоглитазона HCL с немедленным высвобождением наносят на покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, полученные выше на стадии I. Конечная таблетка имеет следующий состав: Покрытая мембраной таблетка метформина HCl Защитное покрытиеOpadry Clear (YS-1-7006) Покрытие пиоглитазоном Пиоглитазон HCl Хлорид натрияOpadry II White (YS-22-7719) Полирующее покрытие Порошок канделильского воска Защитное покрытие наносят на покрытую мембраной таблетку, содержащую 1000 мг метформинаHCl. Защитное покрытие получают, диспергируя 0,249 кг Opadry Clear в 4,981 кг спирта USP и перемешивая дисперсию в течение 15 мин. Затем дисперсию разбрызгивают на приблизительно 14,24 кг ядер таблеток, содержащих 1000 мг метформина HCl, при использовании чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя 3 пистолетных разбрызгивателя, и при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Подача потока воздуха Тип давления воздуха Дисперсию защитного покрытия непрерывно перемешивают до тех пор, пока она не израсходуется в процессе покрытия. Покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, имеющие защитное покрытие, покрывают пиоглитазоном. Покрытие пиоглитазоном получают, смешивая 3,793 кг спирта USP и 1,07 кг очищенной воды и медленно диспергируя 0,024 кг Opadry Clear в смеси растворителей. После диспергирования Opadry Clear его гомогенизируют в течение приблизительно 10 мин. После того как гомогенизируют дисперсию Opadry Clear, в дисперсию добавляют 0,032 кг хлорида натрия и гомогенизируют в течение приблизительно 2 мин. После того как гомогенизируют хлорид натрия, 0,212 кг пиоглитазона HCl медленно диспергируют в смеси растворителей и затем гомогенизируют в течение приблизительно 10 мин. После того как гомогенизируют пиоглитазон HCl, гомогенизатор удаляют из емкости для смешивания и заменяют воздушным смесителем и перемешивают в течение дополнительных 15 мин. Суспензию пиоглитазона перемешивают до тех пор, пока суспензия не израсходуется во время процесса покрытия. Данный покрывающий раствор содержит избыток материала приблизительно 8%, чтобы компенсировать потерю материала в процессе покрытия. Суспензию пиоглитазона HCl наносят на покрытые мембраной ядра таблеток, содержащие 1000 мг метформина HCl, с защитным покрытием при использовании чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, 3 пистолетных разбрызгивателей и при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Тип давления воздуха Подача потока воздуха После покрытия пиоглитазоном покрытой мембраной таблетки, содержащей 1000 мг метформинаHCl, имеющей защитное покрытие, на покрытую пиоглитазоном таблетку наносят краситель или эстетическое покрытие Opadry II White. Эстетическое покрытие получают, диспергируя 0,255 кг Opadry IIWhite (Y-22-7719) в 5,109 кг спирта USP и перемешивая дисперсию в течение приблизительно 1 ч. Затем дисперсию Opadry II разбрызгивают на таблетки, покрытые пиоглитазоном HCl, при использовании чашечного устройства для покрытия 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя 3 пистолетных разбрызгивателей и при следующих условиях:- 21015244 Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Подача потока воздуха Тип давления воздуха Дисперсию для покрытия красителем непрерывно перемешивают до тех пор, пока дисперсия не израсходуется в процессе покрытия. После того как суспензия для эстетического покрытия израсходуется,таблетки сушат в чашке для нанесения покрытия в течение приблизительно 5 мин при скорости чашки приблизительно 2-8 об./мин и температуре на выходе 255C. После того как таблетки высохнут, выходящий воздух отключают и скорость чашки доводят до приблизительно 3-4 об./мин и на таблетки насыпают 0,004 кг порошка канделильского воска, пропущенного через сито 60 меш. После того как таблетки обкатают в воске в течение приблизительно 5 мин выходящий воздух включают и таблетки обкатывают в течение дополнительных 10 мин. Конечная полированная таблетка высвобождает в среднем 95% пиоглитазона при тестировании в устройстве USP типа 1 при 100 об./мин в буферном растворе HCl-0,3M KCl, pH 2,0. Конечная таблетка также демонстрирует твердость, превышающую 241,15 мПа и ломкость 0,00%. Конечную таблетку тестируют на содержание родственных пиоглитазону соединений с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм с подвижной фазой, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл,скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Результаты теста приводят в табл. 3 ниже. Конечную полированную таблетку упаковывают во флакон HDPE объемом 100 см 3, содержащую 1 емкость с поглотителем влаги SORB-ITRR массой 2 г и подвергают ускоренному испытанию на стабильность в условиях 40C и относительной влажности 75% в течение одного месяца. После хранения конечную полированную таблетку тестируют и обнаруживают, что она содержит следующие родственные пиоглитазону соединения при анализе с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм с подвижной фазой, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Таблица 3A. Ядро первого активного лекарственного средства. Покрытую ацетатом целлюлозы таблетку метформина HCl получают, как описано в примере 5.B. Второе активное лекарственное средство. Количество пиоглитазона HCl с немедленным высвобождением наносят на покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, полученные выше на стадии A. Конечная таблетка имеет следующий состав: Покрытая мембраной таблетка метформина HCl Защитное покрытие 015244 Пиоглитазон HCl Гидроксипропилцеллюлоза NF (HPC-SSL) Лактоза моногидрат NF (модифицированная распылительной сушкой) Полиэтиленгликоль 8000 NF Диоксид титана USP Покрытие красителем Гидроксипропилцеллюлоза NF (HPC-SSL) Полиэтиленгликоль 8000 NF Диоксид титана (USP) Полирующее покрытие Порошок канделильского воска Защитное покрытие наносят на приблизительно 14,36 кг покрытых мембраной таблеток, содержащих 1000 мг метформина HCl, полученных на вышеописанной стадии A. Защитное покрытие получают,диспергируя приблизительно 0,108 кг Opadry Clear (YS-1-7006) в приблизительно 1,345 кг очищенной воды в течение 30 мин. Затем дисперсию разбрызгивают на приблизительно 14,36 кг ядер таблеток, содержащих 1000 мг метформина HCl, при использовании чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя 3 пистолетных разбрызгивателя, и при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Подача потока воздуха Тип давления воздуха Покрытые мембраной таблетки, содержащие 1000 мг метформина HCl, имеющие защитное покрытие, покрывают пиоглитазоном. Покрытие пиоглитазоном получают, медленно диспергируя приблизительно 0,059 кг гидроксипропилцеллюлозы (HPC-SLL) в приблизительно 6,034 кг очищенной воды.HPC-SSL и воду перемешивают в течение приблизительно 20 мин, после чего к смеси HPC-SSL/вода добавляют 0,197 кг лактозы моногидрата, NF (модифицированной распылительной сушкой) и перемешивают в течение приблизительно 2 мин. После перемешивания лактозы в смесь воды, HPC-SSL и лактозы добавляют приблизительно 0,003 кг полиэтиленгликоля 8000 NF и 0,006 кг диоксида титана (USP) и перемешивают в течение приблизительно 5 мин. Через приблизительно 5 мин перемешивания приблизительно 0,217 кг пиоглитазона гидрохлорида диспергируют в покрывающем растворе. Данный покрывающий раствор содержит приблизительно 10% избыточного материала, чтобы скомпенсировать потерю материала во время процесса покрытия. Суспензию пиоглитазона перемешивают, пока суспензия не израсходуется в процессе покрытия. Суспензию пиоглитазона HCl наносят на покрытые мембраной ядра таблеток, содержащие 1000 мг метформина HCl, имеющие защитное покрытие, с помощью чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя 3 пистолетных разбрызгивателя, при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Тип давления воздуха Подача потока воздуха После покрытия пиоглитазоном покрытых мембраной таблеток, содержащих 1000 мг метформинаHCl, имеющих защитное покрытие, на таблетку, покрытую пиоглитазоном, наносят краситель или эстетическое покрытие. Покрытие красителем получают, диспергируя приблизительно 0,066 кг HPC-SSL,NF, 0,016 кг полиэтиленгликоля 8000, NF и 0,007 диоксида титана, USP в 0,894 кг очищенной воды и перемешивают дисперсию в течение приблизительно 30 мин. Затем покрытие красителем разбрызгивают на таблетки, покрытые пиоглитазоном HCl, с помощью чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя 3 пистолетных разбрызгивателя и при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Подача потока воздуха Тип давления воздуха Дисперсию для покрытия красителем непрерывно перемешивают до тех пор, пока дисперсия не израсходуется в процессе покрытия. После того как суспензия для покрытия красителем израсходуется, таблетки сушат в чашке для нанесения покрытия в течение приблизительно 5 мин при скорости чашки приблизительно 2-8 об./мин и температуре на выходе 255C. После того как таблетки высохнут, выходящий воздух отключают и скорость чашки доводят до приблизительно 3-4 об./мин и на таблетки насыпают 0,005 кг порошка канделильского воска, пропущенного через сито 60 меш. После того как таблетки обкатают в воске в течение приблизительно 5 мин, выходящий воздух включают и таблетки обкатывают в течение дополнительных 10 мин. Конечная полированная таблетка высвобождает больше 95% пиоглитазона при тестировании в устройстве (USP) типа 1 при 100 об./мин в буферном растворе HCl-0,3M KCl, pH 2,0. Конечные таблетки также демонстрируют твердость, превышающую 241,15 мПа и ломкость 0,0%. Конечную таблетку тестируют на содержание родственных пиоглитазону соединений с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм, с подвижной фазой, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл,скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Результаты теста приводят в табл. 4 ниже. Конечную полированную таблетку упаковывают во флакон HDPE объемом 100 см 3, содержащую 1 емкость с поглотителем влаги SORB-ITRR массой 3 г и подвергают ускоренному испытанию на стабильность в условиях 40C и относительной влажности 75% в течение 15 дней, 1 месяца, 2 месяцев и 3 месяцев. После хранения конечную полированную таблетку тестируют и обнаруживают, что она содержит следующие родственные пиоглитазону соединения при анализе с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм, с подвижной фазой, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл,скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Таблица 4A. Ядро первого лекарственного препарата.Comil, снабженный ситом номер 813 и не имеющий разделителя при 840-850 об./мин, и собирют его в чистый контейнер с полиэтиленовым покрытием. Приблизительно 10,86 кг повидона K-30 растворяют в приблизительно 206,34 кг очищенной воды. Затем метформин HCl, из которого удалены крупные части- 24015244 цы, вводят в гранулятор с псевдоожиженным слоем и верхним разбрызгиванием гранулируемого материала (Glatt Brand GPCG-60) и гранулируют путем разбрызгивания связующего раствора повидона и воды в следующих условиях: температура продукта приблизительно 38-43C, температура воздуха на входе 60-95C; давление воздуха при разбрызгивании 2,5-3 бар и скорость разбрызгивания 500 г/мин (491515 г/мин) в течение первых 15 мин, 700 г/мин (680-710 г/мин) в течение 15-30 мин, 900 г/мин (860-910 г/мин) в течение 30-45 мин, 1100 г/мин (1090-1 170 г/мин) в течение 45-60 мин и приблизительно 1200 г/мин (1170-1220 г/мин) в течение остального времени разбрызгивания. После завершения разбрызгивания связующего раствора гранулы сушат в псевдоожиженном слое до тех пор, пока потери на сушке(LOD) не станут составлять менее чем 2%. После того как гранулы высохнут, их пропускают через Comil, снабженный ситом из нержавеющей стали номер 1143 и разделителем No 075, при скорости 1086-1088 об./мин. Вышеописанный процесс повторяют во второй раз, получая в целом приблизительно 300 кг гранул метформина.II. Смесь метформина Гранулы метформина HCl 94,95% Лаурилсульфат натрия NF 4,55% Стеарат магния NF 0,50% Приблизительно 300 кг гранул метформина, полученных выше на стадии 1, вносят в наклонный конический смеситель объемом 50 кубических футов (0,014 м 3) вместе с приблизительно 14,38 кг лаурилсульфата натрия NF и перемешивают в течение приблизительно 20 мин. Затем приблизительно 1,58 кг стеарата магния NF пропускают через сито из нержавеющей стали 40 меш и вносят в наклонный конический смеситель и перемешивают в течение дополнительных 5 мин. Из смеси прессуют непокрытые ядра метформина, используя ротационный пресс, оборудованный круглыми штампами для соединений 15/32", давление при предварительном прессовании составляет 96,46 мПа и давление при основном прессовании составляет 234,26 мПа. Полученные в результате таблетки имеют массу, лежащую в интервале 523-613 г при заданной массе 568 г, твердость 96,46-179,14 мПа (заданная 137,80 мПа) и ломкость менее или равную 0,8%.III. Таблетки метформина с защитным покрытием Непокрытые таблетки метформина HCl На приблизительно 57,61 кг непокрытых таблеток, полученных выше на стадии II, получают защитный слой путем нанесения раствора приблизительно 2,388 кг Opadry Clear YS-1-7006) и приблизительно 21,50 кг очищенной воды, используя чашечное устройство для покрытия. Чашечное устройство для покрытия представляет собой O'Hara Labcoat III 90 см с тремя пистолетами-распылителями на расстоянии 20-27,5 см от слоя. Используют следующие условия покрытия: Температура воздуха на выходе Давление при разбрызгивании Объем воздуха Скорость разбрызгивания Скорость чашкиIV Мембрана Таблетки метформина с защитным покрытием Ацетат целлюлозы (398-10)2 Триацетин ПЭГ 400 2 содержание ацетила 39,3-40,3%(a) Процесс покрытия мембраной. Приблизительно 51,06 кг ацетона вводят в емкость из нержавеющей стали с последующим внесением 2,281 кг ацетата целлюлозы и перемешивают в течение приблизительно 20 мин до тех пор, пока раствор не станет прозрачным. После того как раствор станет прозрачным, в раствор вводят приблизительно 0,269 кг полиэтиленгликоля 400 и перемешивают в течение приблизительно 5 мин, после чего добавляют приблизительно 0,135 кг триацетина. Раствор перемешивают в течение дополнительных 5 мин. Приблизительно 59,07 кг таблеток метформина HCl с защитным покрытием загружают в устройство для покрытия типа GPCG-60 (Glatt) с псевдоожиженным слоем со вставкой Wurster (размер 18" высота 45 мм) с наконечником размера 1,5 мм. Таблетки метформина HCl с защитным покрытием псевдо- 25015244 ожижают и доводят температуру продукта до приблизительно 213C. Раствор ацетата целлюлозы разбрызгивают на псевдоожиженные таблетки метформина HCl с защитным покрытием при давлении разбрызгивания приблизительно 2,0-3,0 бар, объеме воздуха 43251 м 3/мин и скорости разбрызгивания 400100 г/мин, до тех пор, пока не получают увеличение массы 3-5% (заданное 3,8%). После нанесения требуемого количества покрытия, образующего мембрану, таблетки, покрытые мембраной, сушат в псевдоожиженном слое при 213C и 32427 м 3/мин в течение приблизительно 10 мин, а затем при 40C и 32427 м 3/мин в течение приблизительно 5 мин. Полученные в результате покрытые мембраной таблетки обрабатывают лазером, чтобы сделать отверстие в приблизительном центре с каждой стороны покрытой мембраной таблетки (т.е. 2 отверстия) среднего диаметра 0,5 мм/отверстие. Данные верхнего микрометра - 5,42 мм, нижнего микрометра 6,752 мм, длительность импульса лазера составляет 17070 и задержка импульса составляет 290150.B. Второй активный лекарственный препарат. Количество пиоглитазона HCl с немедленным высвобождением наносят на покрытые мембраной таблетки, содержащие 500 мг метформина HCl, полученные на стадии A. Конечная таблетка имеет следующий состав: Покрытая мембраной таблетка метформина HCl Защитное покрытиеOpadry Clear (YS-1-7006) Покрытие пиоглитазоном Пиоглитазон HCl Хлорид натрияOpadry II White (YS-22-7719) Полирующее покрытие Порошок канделильского воска Защитное покрытие наносят на покрытую мембраной таблетку, содержащую 500 мг метформинаHCl. Защитное покрытие получают, диспергируя 0,243 кг Opadry Clear в 3,473 кг спирта USP и перемешивая дисперсию в течение 15 мин. Затем дисперсию разбрызгивают на приблизительно 13,08 кг ядер таблеток, содержащих 500 мг метформина HCl, при использовании чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя 3 пистолетных разбрызгивателя, и при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха разбрызгивания Скорость чашки Подача потока воздуха Тип давления воздуха Дисперсию защитного покрытия непрерывно перемешивают до тех пор, пока она не израсходуется в процессе покрытия. Покрытые мембраной таблетки, содержащие 500 мг метформина HCl, имеющие защитное покрытие, покрывают пиоглитазоном. Покрытие пиоглитазоном получают, смешивая 5,656 кг спирта USP и 1,595 кг очищенной воды и медленно диспергируя 0,045 кг Opadry Clear в смеси растворителей. После диспергирования Opadry Clear его гомогенизируют в течение приблизительно 10 мин. После того как гомогенизируют дисперсию Opadry Clear, в дисперсию добавляют 0,061 кг хлорида натрия и гомогенизируют в течение приблизительно 2 мин. После того как гомогенизируют хлорид натрия, 0,402 кг пиоглитазона HCl медленно диспергируют в смеси растворителей и затем гомогенизируют в течение приблизительно 10 мин. После того как гомогенизируют пиоглитазон HCl, гомогенизатор удаляют из емкости для смешивания и заменяют воздушным смесителем и перемешивают в течение дополнительных 15 мин. Суспензию пиоглитазона перемешивают до тех пор, пока суспензия не израсходуется во время процесса покрытия. Данный покрывающий раствор содержит избыток материала приблизительно 15%, чтобы компенсировать потерю материала в процессе покрытия. Суспензию пиоглитазона HCl наносят на покрытые мембраной ядра таблеток, содержащие 500 мг метформина HCl, с защитным покрытием при использовании чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, с 3 пистолетными разбрызгивателями и при следующих условиях:- 26015244 Скорость разбрызгивания Температура на выходе Давление воздуха разбрызгивания Скорость чашки Тип давления воздуха Подача потока воздуха После покрытия пиоглитазоном покрытой мембраной таблетки, содержащей 1000 мг метформинаHCl, имеющей защитное покрытие, на покрытую пиоглитазоном таблетку наносят краситель или эстетическое покрытие Opadry II White. Эстетическое покрытие получают, диспергируя 0,228 кг Opadry IIWhite (Y-22-7719) в 3,253 кг спирта USP и перемешивая дисперсию в течение приблизительно 1 ч. Затем дисперсию Opadry II разбрызгивают на таблетки, покрытые пиоглитазоном HCl, при использовании чашечного устройства для покрытия 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя с 3 пистолетными разбрызгивателями и при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха разбрызгивания Скорость чашки Подача потока воздуха Тип давления воздуха Дисперсию для покрытия красителем непрерывно перемешивают до тех пор, пока дисперсия не израсходуется в процессе покрытия. После того как суспензия для эстетического покрытия израсходуется,таблетки сушат в чашке для нанесения покрытия в течение приблизительно 5 мин при скорости чашки приблизительно 2-8 об./мин и температуре на выходе 255C. После того как таблетки высохнут, выходящий воздух отключают и скорость чашки доводят до приблизительно 3-4 об./мин. и на таблетки насыпают 0,004 кг порошка канделильского воска, пропущенного через сито 60 меш. После того как таблетки обкатают в воске в течение приблизительно 5 мин выходящий воздух включают и таблетки обкатывают в течение дополнительных 10 мин. Конечная полированная таблетка высвобождает в среднем 95% пиоглитазона при тестировании в устройстве USP типа 1 при 100 об./мин в буферном растворе HCl-0,3M KCl, pH 2,0. Конечные таблетки также демонстрируют твердость, превышающую 241,15 мПа и ломкость 0,00%. Конечную таблетку тестируют на содержание родственных пиоглитазону соединений с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Результаты теста приводят в табл. 5 ниже. Конечную полированную таблетку упаковывают во флакон HDPE объемом 100 см 3, содержащую 1 емкость с поглотителем влаги SORB-ITRR массой 1 г и подвергают ускоренному испытанию на стабильность в условиях 40C и относительной влажности 75% в течение одного месяца. После хранения конечную полированную таблетку тестируют и обнаруживают, что она содержит следующие родственные пиоглитазону соединения при анализе с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Таблица 5A. Ядро первого активного лекарственного препарата. Ядро, содержащее 500 мг метформина HCl и ацетат целлюлозы, получают, как описано в примере 11.B. Второй активный лекарственный препарат. Количество пиоглитазона HCl с немедленным высвобождением наносят на покрытые мембраной таблетки, содержащие 500 мг метформина HCl, полученные выше на стадии A. Конечная таблетка имеет следующий состав: Покрытая мембраной таблетка метформина HCl Защитное покрытиеOpadry Clear (YS-1-7006) Покрытие пиоглитазоном Пиоглитазон HCl Гидроксипропилцеллюлоза NF (HPC-SSL) Лактоза моногидрат NF (модифицированная распылительной сушкой) Полиэтиленгликоль 8000 NF Диоксид титана USP Покрытие красителем Гидроксипропилцеллюлоза NF (HPC-SSL) Полиэтиленгликоль 8000 NF Диоксид титана USP Полирующее покрытие Порошок канделильского воска Защитное покрытие наносят на приблизительно 12,36 кг покрытых мембраной таблеток, содержащих 500 мг метформина HCl, полученных на вышеописанной стадии A. Защитное покрытие получают,диспергируя приблизительно 0,090 кг Opadry Clear (YS-1-7006) в приблизительно 1,124 кг очищенной воды в течение 30 мин. Затем дисперсию разбрызгивают на приблизительно 12,36 кг ядер таблеток, содержащих 500 мг метформина HCl, при использовании чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя 3 пистолетных разбрызгивателя, и при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Подача потока воздуха Тип давления воздуха Покрытые мембраной таблетки, содержащие 500 мг метформина HCl, имеющие защитное покрытие, покрывают пиоглитазоном. Покрытие пиоглитазоном получают, медленно диспергируя приблизительно 0,134 кг гидроксипропилцеллюлозы (HPC-SLL) в приблизительно 13,692 кг очищенной воды.HPC-SSL и воду перемешивают в течение приблизительно 20 мин, после чего к смеси HPC-SSL/вода добавляют 1,119 кг лактозы моногидрата, NF (модифицированной распылительной сушкой) и перемешивают в течение приблизительно 2 мин. После перемешивания лактозы в смесь воды, HPC-SSL и лактозы добавляют приблизительно 0,007 кг полиэтиленгликоля 8000 NF и 0,013 кг диоксида титана USP и перемешивают в течение приблизительно 5 мин. Через приблизительно 5 мин перемешивания приблизительно 0,370 кг пиоглитазона гидрохлорида диспергируют в покрывающем растворе. Данный покрывающий раствор содержит приблизительно 12% избыточного материала, чтобы скомпенсировать потерю материала во время процесса покрытия. Суспензию пиоглитазона перемешивают, пока суспензия не израсходуется в процессе покрытия. Суспензию пиоглитазона HCl наносят на покрытые мембраной ядра таблеток, содержащие 500 мг метформина HCl, имеющие защитное покрытие, с помощью чашечного устройства для нанесения покрытий 24" O'Hara Labcoat III с набором наконечников 42" сверху статического слоя, используя 3 пистолетных разбрызгивателя, при следующих условиях: Скорость разбрызгивания Температура на выходе Давление воздуха при разбрызгивании Скорость чашки Тип давления воздуха Подача потока воздуха После покрытия пиоглитазоном покрытых мембраной таблеток, содержащих 500 мг метформинаHCl, имеющих защитное покрытие, на таблетку, покрытую пиоглитазоном, наносят краситель или эстетическое покрытие. Покрытие красителем получают, диспергируя приблизительно 0,055 кг HPC-SSL NF,0,014 кг полиэтиленгликоля 8000 NF и 0,006 диоксида титана USP в 0,747 кг очищенной воды и перемешивают дисперсию в течение приблизительно 30 мин. Затем покрытие красителем разбрызгивают на таблетки, покрытые пиоглитазоном HCl, с помощью чашечного устройства для нанесения 24" O'HaraLabcoat III с набором наконечников 42" сверху статического слоя, используя 3 пистолетных разбрызгивателя и при следующих условиях: Скорость разбрызгивания 20 10 мл/наконечник/мин Температура на выходе 405C Давление воздуха при разбрызгивании 720-2880 г/см 2 Скорость чашки 4-9 об./мин Подача потока воздуха 8127 м 3/мин Тип давления воздуха 720-2880 г/см 2 Дисперсию для покрытия красителем непрерывно перемешивают до тех пор, пока дисперсия не израсходуется в процессе покрытия. После того как суспензия для покрытия красителем израсходуется, таблетки сушат в чашке для нанесения покрытия в течение приблизительно 5 мин при скорости чашки приблизительно 2-8 об./мин и температуре на выходе 40-5C. После того как таблетки высохнут, выходящий воздух отключают и скорость чашки доводят до приблизительно 3-4 об./мин и на таблетки насыпают 0,004 кг порошка канделильского воска, пропущенного через сито 60 меш. После того как таблетки обкатают в воске в течение приблизительно 5 мин, выходящий воздух включают и таблетки обкатывают в течение дополнительных 10 мин. Конечная полированная таблетка высвобождает больше 95% пиоглитазона при тестировании в устройстве USP типа 1 при 100 об./мин в буферном растворе HCl-0,3M KCl, pH 2,0. Конечные таблетки также демонстрируют твердость, превышающую 241,15 мПа и ломкость 0,01%. Конечную таблетку тестируют на содержание родственных пиоглитазону соединений с помощью ВЭЖХ при использовании колонки YMC-ODS-AQ, 5 мкм, 120 , 4,6250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония:ацетонитрил:ледяную уксусную кислоту (25:25-1), при объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора. Результаты теста приводят в табл. 6 ниже. Конечную полированную таблетку упаковывают во флакон HDPE объемом 100 см 3, содержащую 1 емкость с поглотителем влаги SORB-ITRR массой 3 г и подвергают ускоренному испытанию на стабильность в условиях 40C и относительной влажности 75% в течение 1 месяца и 2 месяцев. После хранения конечную полированную таблетку тестируют и обнаруживают, что она содержит следующие родственные пиоглитазону соединения при анализе с помощью ВЭЖХ при использовании колонки YMC-ODSAQ, 5 мкм, 120 , 4,6250 мм, подвижной фазы, включающей 0,1 М буфер на основе ацетата аммония: ацетонитрил:ледяную уксусную кислоту (25:25:1), при объеме инжекции 40 мкл, скорости потока 0,7 мл/мин, температуре колонки 25C и длине волны 269 нм для УФ-детектора.
МПК / Метки
Метки: контролируемым, метформина, пиоглитазона, варианты, форма, фармацевтическая, гидрохлоридом, высвобождением, дозированная, комбинации
Код ссылки
<a href="https://eas.patents.su/30-15244-farmacevticheskaya-dozirovannaya-forma-varianty-s-kontroliruemym-vysvobozhdeniem-metformina-v-kombinacii-s-gidrohloridom-pioglitazona.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая дозированная форма (варианты) с контролируемым высвобождением метформина в комбинации с гидрохлоридом пиоглитазона</a>
Предыдущий патент: Способ повышения урожайности кукурузы
Следующий патент: Пестицидные тиазолилоксизамещенные фениламидиновые производные
Случайный патент: Определение местоположения неработающих продуктивных пластов углеводородов