Композиция, содержащая фентермин и избирательный агонист рецептора 5ht2c и ее применение
Номер патента: 15012
Опубликовано: 29.04.2011
Авторы: Бихан Доминик П., Бьеннинг Кристина, Смит Брайан М.
Формула / Реферат
1. Композиция, содержащая фентермин и избирательный агонист рецептора 5НТ2С.
2. Композиция по п.1, где указанный избирательный агонист рецептора 5НТ2С представляет собой (R)-1-(5-хлор-2-фторфенил)-2-метилпиперазин.
3. Композиция по п.1, где указанный избирательный агонист рецептора 5НТ2С представляет собой соединение формулы (I)
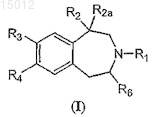
или его фармацевтически приемлемые соль, сольват или гидрат,
где R1представляет собой Н или C1-8 алкил;
R2 представляет собой C1-8 алкил, -СН2-О-С1-8 алкил, -C(=O)-O-C1-8 алкил, -С(=O)-NH-C1-8 алкил, ОН или СН2ОН;
R2a представляет собой Н;
или R2и R2a вместе формируют -СН2-СН2-;
каждый из R3 и R4независимо представляет собой Н, галоген, пергалогеналкил, CN, OR5, SR5, NHR5, N(R5)2, ОН, арил или гетероарил, где указанный арил может необязательно являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может необязательно являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила;
или R3и R4 вместе с атомами, к которым они присоединены, могут формировать 5- или 6-членное гетероциклическое кольцо, обладающее одним атомом O;
каждый из R5 независимо представляет собой C1-8 алкил, С2-8 алкенил, арил, гетероарил, арилалкил, гетероарилалкил или пергалогеналкил или аллил и
R6 представляет собой Н или C1-8 алкил.
4. Композиция по п.3,
где R3представляет собой галоген, пергалогеналкил, CN, SR5, NHR5, N(R5)2, арил, или гетероарил, где указанный арил может необязательно являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может необязательно являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила; и
R4 представляет собой Н, галоген, пергалогеналкил, CN, SR5, NHR5, N(R5)2, арил или гетероарил, где указанный арил может необязательно являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может необязательно являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила;
где гетероарил представляет собой пирролил, пиразолил, имидазолил, триазолил, тетразолил, пиридил, пиримидинил, фуранил, пиранил, тиенил, бензимидазолил, хинолинил, изохинолинил, оксазолил, тиазолил или тиадиазолил.
5. Композиция по п.3 или 4, где R1 представляет собой Н.
6. Композиция по п.3 или 4, где R1 представляет собой метил.
7. Композиция по любому из пп.3-6, где R2 представляет собой метил, этил, н-пропил или изопропил.
8. Композиция по любому из пп.3-6, где R2 представляет собой метил или этил.
9. Композиция по любому из пп.3-6, где R2 и R2a вместе формируют -СН2СН2-.
10. Композиция по любому из пп.3-9, где R3 представляет собой хлор.
11. Композиция по любому из пп.3-9, где R3 представляет собой бром.
12. Композиция по любому из пп.3-9, где R3 представляет собой пергалогеналкил.
13. Композиция по любому из пп.3-9, где R3 представляет собой CF3.
14. Композиция по любому из пп.3-9, где R3 выбран из группы, состоящей из тиенила, фуранила, пирролила, пиразолила и имидазолила.
15. Композиция по любому из пп.3-14, где R4 выбран из группы, состоящей из тиенила, фуранила, пирролила, пиразолила и имидазолила, необязательно замещенных одним или двумя заместителями, выбранными из галогена или метила.
16. Композиция по любому из пп.3-14, где R4 представляет собой фенил, необязательно замещенный не более чем двумя заместителями, выбранными из C1-8 алкила, галогена и алкокси.
17. Композиция по п.3,
где R2представляет собой метил, этил, изопропил или СН2ОН или R2 и R2a, вместе взятые, формируют
-СН2СН2-;
R3 представляет собой галоген или 5-членное гетероарильное кольцо, обладающее не более чем двумя гетероатомами, выбранными из О, N и S, и не более чем двумя заместителями, выбранными из галогена и C1-8 алкила;
R4 представляет собой Н, 5-членное гетероарильное кольцо, обладающее не более чем двумя гетероатомами, выбранными из О, N и S, и не более чем двумя заместителями, выбранными из галогена и C1-8 алкила, или фенил, необязательно, замещенный не более чем двумя заместителями, выбранными из C1-8 алкила, галогена и алкокси;
R6 представляет собой Н или метил.
18. Композиция по п.3,
где R1представляет собой Н или C1-8 алкил;
R2 представляет собой C1-8 алкил, -CH2-O-C1-8 алкил, -С(=O)-O-C1-8 алкил, -С(=O)-NH-C1-8 алкил, ОН или СН2ОН;
R2a представляет собой Н;
или R2и R2a вместе формируют -СН2-СН2-;
R3 представляет собой галоген, пергалогеналкил или 5-членное гетероарильное кольцо, обладающее не более чем двумя гетероатомами, выбранными из O, N и S;
R4 представляет собой Н, галоген, пергалогеналкил, CN, OR5, SR5, NHR5, N(R5)2, ОН, арил, или гетероарил, где указанный арил может необязательно являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может необязательно являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила;
или R3и R4 вместе с атомами, к которым они присоединены, могут формировать 5- или 6-членное гетероциклическое кольцо, обладающее одним атомом О;
каждый из R5 независимо представляет собой C1-8 алкил, С2-8 алкенил, арил, гетероарил, арилалкил, гетероарилалкил или пергалогеналкил или аллил; и
R6 представляет собой Н или C1-8 алкил,
при условии, что,
если R6не является Н, тогда R4не может являться Н; и
если R1и R2 представляют собой метил и R4 представляет собой Н, тогда R3 не может являться имидазолом, замещенным имидазолом или производным имидазола;
и где арил обозначает моноциклическую или полициклическую ароматическую группу, обладающую от 3 до 14 атомов углерода;
гетероарил обозначает моноциклическую или полициклическую ароматическую группу, обладающую от 3 до 14 атомов углерода и от 1 до 4 гетероатомов в кольце, выбранных из О, N и S;
алкокси обозначает -О-алкил, где алкил обозначает метил, этил, н-пропил, изопропил, циклопропил, н-бутил, втор-бутил, трет-бутил, циклобутил, циклопропилметил, н-пентил, изопентил, трет-пентил, циклопентил, циклопентилметил, н-гексил или циклогексил;
C1-8 алкил обозначает неразветвленную, разветвленную или циклическую углеводородную группу, обладающую от 1 до 8 атомов углерода;
С2-8 алкенил обозначает неразветвленную, разветвленную или циклическую углеводородную группу, обладающую от 2 до 8 атомов углерода и по меньшей мере одной двойной связью.
19. Композиция по п.3,
где R1представляет собой Н;
R2 представляет собой метил;
R3 представляет собой хлор, бром или тиенил;
R4 представляет собой пиразолил-3-ил или фенил, где указанный пиразолил-3-ил необязательно обладает не более чем двумя заместителями, выбранными из галогена и C1-8 алкила, и указанный фенил необязательно обладает одним галогеновым заместителем; и
R6 представляет собой Н;
или его фармацевтически приемлемые соль, сольват или гидрат.
20. Композиция по п.3,
где R1представляет собой Н или Me;
R2 представляет собой Me, Et или ОН;
R2a представляет собой Н;
R3 представляет собой F, Cl, Br, I, CF3или 2-хлорфенил;
R4 представляет собой Н и
R6 представляет собой Н.
21. Композиция по п.3,
где R1представляет собой Н;
R2 представляет собой C1-8 алкил;
R2a представляет собой Н;
R3 представляет собой галоген;
R4 представляет собой Н и
R6 представляет собой Н.
22. Композиция по п.1 или 3, где указанный избирательный агонист рецептора 5HT2C выбран из группы, состоящей из
8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина;
8-бром-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина;
8-иод-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина;
8-трифторметил-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина;
8-трифторметил-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина;
8-хлор-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина;
8-бром-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина;
8-иод-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина;
7,8-дихлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина;
7,8-дихлор-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина;
8-хлор-7-фтор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина;
8-хлор-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и
8-хлор-7-фтор-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина;
или их фармацевтически приемлемых солей, сольватов или гидратов.
23. Композиция по п.1 или 3, где указанный избирательный агонист рецептора 5HT2C представляет собой (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин, или его фармацевтически приемлемые соль, сольват или гидрат.
24. Композиция по п.1, где указанный избирательный агонист рецептора 5HT2C представляет собой 8-хлор-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин, или его фармацевтически приемлемые соль, сольват или гидрат.
25. Композиция по любому из пп.1-24, где фентермин и избирательный агонист рецептора 5HT2C вводят как отдельные единицы.
26. Композиция по любому из пп.1-24, где фентермин и избирательный агонист рецептора 5HT2C объединены в одну единицу.
27. Фармацевтическая композиция, содержащая композицию по любому из пп.1-26 и фармацевтически приемлемый носитель.
28. Фармацевтическая композиция по п.27 для применения в способе лечения организма человека или животного.
29. Фармацевтическая композиция по п.27 для применения в способе лечения связанного с 5HT2C расстройства организма человека или животного.
30. Фармацевтическая композиция по п.27 для применения в способе профилактики или лечения ожирения у млекопитающего.
31. Фармацевтическая композиция по п.27 для применения в способе уменьшения потребления пищи у млекопитающего.
32. Фармацевтическая композиция по п.27 для применения в способе вызывания насыщения у млекопитающего.
33. Фармацевтическая композиция по п.27 для применения в способе контроля прироста массы у млекопитающего.
34. Фармацевтическая композиция по пп.28 и 29 для применения, где лечение является лечением у человека.
35. Фармацевтическая композиция по пп.30-33 для применения, где млекопитающим является человек.
36. Фармацевтическая композиция по любому из пп.27-35, где фентермин и избирательный агонист рецептора 5НТ-2С представлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим.
37. Фармацевтическая композиция по любому из пп.27-35, где количество фентермина и количество избирательного агониста рецептора 5HT2C по отдельности являются недостаточно эффективными терапевтически для вызывания насыщения у указанного млекопитающего.
38. Способ уменьшения потребления пищи у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и количество фентермина, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим.
39. Способ по п.38, где количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1Н-3-бензазепина и количество фентермина по отдельности являются недостаточно эффективными терапевтически для уменьшения потребления пищи указанным млекопитающим.
40. Способ вызывания насыщения у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1Н-3-бензазепина и количество фентермина, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для вызывания насыщения у указанного млекопитающего.
41. Способ по п.40, где количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1Н-3-бензазепина и количество фентермина по отдельности являются недостаточно эффективными терапевтически для вызывания насыщения у указанного млекопитающего.
42. Способ контроля прироста массы у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и количество фентермина по отдельности, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для контроля прироста массы у указанного млекопитающего.
43. Способ по п.42, где количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1Н-3-бензазепина и количество фентермина по отдельности являются недостаточно эффективными терапевтически для контроля прироста массы у указанного млекопитающего.
44. Способ профилактики или лечения ожирения, включающий введение пациенту терапевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и количество фентермина, где указанный (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим.
45. Способ по п.44, где количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1Н-3-бензазепина и количество фентермина по отдельности являются недостаточно эффективными терапевтически для уменьшения потребления пищи указанным млекопитающим.
46. Способ по любому из пп.38-45, где (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1Н-3-бензазепин и фентермин вводятся как отдельные единицы.
47. Способ по любому из пп.38-45, где (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1Н-3-бензазепин и фентермин вводятся как одна единица.
48. Применение композиции по любому из пп.1-26 для получения лекарственного средства для применения в профилактике или лечении связанного с 5HT2C расстройства организма человека или животного.
49. Применение композиции по любому из пп.1-26 для получения лекарственного средства для применения в профилактике или лечении ожирения у млекопитающего.
50. Применение композиции по любому из пп.1-26 для получения лекарственного средства для применения в способе уменьшения потребления пищи у млекопитающего.
51. Применение композиции по любому из пп.1-26 для получения лекарственного средства для применения в способе вызывания насыщения у млекопитающего.
52. Применение композиции по любому из пп.1-26 для получения лекарственного средства для применения в способе контроля прироста массы у млекопитающего.
53. Единичная дозированная форма композиции по любому из пп.1-26.
54. Единичная дозированная форма фармацевтической композиции по любому из пп.27-37.
55. Дозированная форма по п.53 или 54, где фентермин и избирательный агонист рецептора 5HT2Cпредставлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим.
Текст
КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ФЕНТЕРМИН И ИЗБИРАТЕЛЬНЫЙ АГОНИСТ РЕЦЕПТОРА 5HT2C, И ЕЕ ПРИМЕНЕНИЕ Настоящее изобретение относится к композиции, содержащей фентермин и избирательный агонист рецептора 5 НТ 2 С. Кроме того, изобретение относится к композиции, содержащей фентермин и избирательный агонист рецептора 5 НТ 2 С, обладающий формулой (I), или его фармацевтически приемлемые соль, сольват или гидрат. Данные композиции являются применимыми в фармацевтических композициях, применение которых включает лечение ожирения. 015012 Область изобретения Настоящее изобретение относится к соединениям, действующим как модуляторы рецепторов 5HT2C, содержащим соединения композициям и способам применения соединений и композиций. Предпосылки изобретения Ожирение представляет собой опасное для жизни расстройство, при котором существует увеличенный риск заболеваемости и смертности, возникающий из-за сопутствующих заболеваний, таких как диабет II типа, гипертензия, инсульт, рак и заболевание желчного пузыря. В настоящее время ожирение является основной проблемой здравоохранения в западном мире и все в большей степени в некоторых странах третьего мира. Увеличение числа людей с ожирением главным образом обусловлено увеличивающимся предпочтением продуктов питания с высоким содержанием жира, а также уменьшением активности в жизни большинства людей. В последние 10 лет существовало 30% увеличение заболеваемости ожирением в США, так что в настоящее время приблизительно 30% популяции США считают сейчас страдающими ожирением. Классифицировать кого-либо как страдающего избыточной массой или ожирением, как правило,можно на основании его индекса массы тела (BMI), который вычисляют делением массы тела (кг) на квадрат роста (м 2). Таким образом, единицами BMI являются кг/м 2, и возможно вычислить диапазонBMI, связанный с минимальной смертностью в каждое десятилетие жизни. Избыточную массу определяют как BMI в диапазоне 25-30 кг/м 2, а ожирение как BMI выше, чем 30 кг/м 2 (см. табл. 1 ниже). Таблица 1 Классификация массы по индексу массы тела (BMI) С увеличением BMI существует увеличенный риск смерти от множества причин, независимых от других факторов риска. Наиболее частыми заболеваниями, связанными с ожирением, являются сердечнососудистое заболевание (особенно гипертензия), диабет (ожирение усиливает развитие диабета), заболевание желчного пузыря (в частности, рак) и заболевания репродуктивной системы. Исследования показали, что даже умеренное уменьшение массы тела может соответствовать значительному снижению риска коронарной болезни сердца. Однако существуют проблемы с определением BMI в том отношении, что он не учитывает соотношение массы тела, являющейся мышечной, по отношению к жиру (жировой ткани). Чтобы это учитывать, ожирение можно определять также на основании содержания жира в организме: более 25% у мужчин и более 30% у женщин. Ожирение также значительно увеличивает риск развития сердечно-сосудистых заболеваний. Коронарная недостаточность, атероматозное заболевание и сердечная недостаточность занимают важнейшее место из сердечно-сосудистых осложнений, вызванных ожирением. Определили, что если бы целая популяция обладала идеальной массой, риск коронарной недостаточности уменьшился бы на 25%, а риск сердечной недостаточности и острых сосудистых мозговых расстройств уменьшился бы на 35%. Заболеваемость коронарными заболеваниями удваивается у субъектов младше 50 лет с 30% избыточной массой. Пациент с диабетом сталкивается с уменьшенной на 30% продолжительностью жизни. После возраста 45 лет люди с диабетом по сравнению с людьми без диабета с вероятностью, приблизительно в 3 раза большей, страдают от серьезного заболевания сердца и с вероятностью, вплоть до пяти раз большей,страдают от инсульта. Эти результаты подчеркивают взаимосвязь между факторами риска для диабета и коронарной болезни сердца, и потенциальное значение комплексного подхода к предупреждению этих состояний, основанного на предупреждении ожирения (Perry I.J., et al., BMJ 310, 560-564 (1995. Диабет вовлечен также в развитие почечной недостаточности, заболеваний глаз и проблем нервной системы. Почечная недостаточность, называемая также нефропатией, возникает, когда фильтрующий механизм почек поврежден, и белок просачивается в мочу в избыточных количествах и в конечном счете почка отказывает. Диабет является также ведущей причиной повреждения сетчатки на задней стенке глаза и увеличивает риск катаракты и глаукомы. Наконец, диабет связан с повреждением нервов, особенно в ногах и подошвах, что мешает способности чувствовать боль и способствует серьезным инфекциям. Взятые вместе, осложнения диабета являются одними из основных в стране причин смерти. Первым направлением лечения является предложение пациентам диеты и образа жизни так, чтобы-1 015012 уменьшить содержание жира в их диете и увеличить их физическую активность. Однако многие пациенты находят это сложным и для поддержания результатов этих усилий нуждаются в дополнительной помощи лечением лекарственным средством. Большинство продаваемых в настоящее время продуктов являлись неудачными в качестве лекарственных средств для ожирения из-за нехватки эффективности или недопустимых профилей побочных эффектов. Наиболее удачным лекарственным средством до настоящего времени являлся действующий опосредованно агонист 5-гидрокситриптамина (5-НТ) d-фенфлурамин (Redux), однако сообщения о дефектах сердечного клапана у вплоть до трети пациентов привели к его снятию FDA в 1998 г. Кроме того, недавно в США и Европе выпущены два лекарственных средства: орлистат (Xenical),лекарственное средство, предупреждающее всасывание жира посредством ингибирования панкреатической липазы, и сибутрамин (Reductil), ингибитор повторного поглощения 5-НТ/норадреналина. Однако побочные эффекты, связанные с этими продуктами, могут ограничивать их долговременное использование. Опубликовано, что лечение Xenical индуцирует желудочно-кишечные расстройства у некоторых пациентов, в то время как сибутрамин связан с повышенным кровяным давлением у некоторых пациентов. Нейротрансмиссия серотонина (5-НТ) играет важную роль во множестве физиологических процессов как при психических, так и при психиатрических расстройствах. 5-НТ вовлечен в регуляцию пищевого поведения. По-видимому, 5-НТ действует, вызывая чувство заполненности или насыщения, так что есть прекращают ранее и потребляют меньше калорий. Показано, что стимулирующее действие 5-НТ на рецептор 5 НТ 2 С играет важную роль в контроле принятия пищи и в действии d-фенфлурамина против ожирения. Так как рецептор 5HT2C экспрессируется в мозге с высокой плотностью (в частности, в лимбических структурах, экстрапирамидных путях, таламусе и гипоталамусе, т.е. PVN и DMH, и преимущественно в хориоидном сплетении) и экспрессируется с низкой плотностью или отсутствует в периферических тканях, избирательный агонист рецептора 5HT2C может являться более эффективным и безопасным средством против ожирения. Мыши с нокаутом 5HT2C обладают избыточной массой с когнитивными нарушениями и предрасположенностью к судорогам. Считают, что 5HT2C может играть роль в обсессивно-компульсивном расстройстве, некоторых формах депрессии и эпилепсии. Соответственно, агонисты могут обладать противопаническими свойствами и свойствами, полезными для лечения сексуальной дисфункции. В общем, рецептор 5 НТ 2 С представляет собой рецептор-мишень для лечения ожирения и психиатрических расстройств, и можно видеть, что существует необходимость в избирательных агонистах 5 НТ 2 С, безопасно снижающих потребление пищи и массу тела. Настоящее изобретение направлено на эти, так же как и на другие важные цели. Сущность изобретения В первом аспекте изобретение относится к композиции, содержащей фентермин и избирательный агонист рецептора 5HT2C. Во втором аспекте изобретение относится к композиции по первому аспекту, где избирательный агонист рецептора 5 НТ 2 С представлен формулой (I) или его фармацевтически приемлемая соль, сольват или гидрат,где R1 представляет собой Н или C1-8 алкил;R2a представляет собой Н; или R2 и R2a вместе формируют -СН 2-СН 2-; каждый из R3 и R4 независимо представляет собой Н, галоген, пергалогеналкил, CN, OR5, SR5,NHR5, N(R5)2, ОН, арил или гетероарил, где указанный арил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может, необязательно, являться замещенным не более чем двумя заместителями,выбранными из галогена и C1-8 алкила; или R3 и R4 вместе с атомами, к которым они присоединены, могут формировать 5- или 6-членное гетероциклическое кольцо, обладающее одним атомом О; каждый из R5 независимо представляет собой C1-8 алкил, C1-8 алкенил, арил, гетероарил, арилалкил,гетероарилалкил или пергалогеналкил или аллил и-2 015012 В третьем аспекте изобретение относится к композиции по второму аспекту, гдеR3 представляет собой галоген, пергалогеналкил, CN, SR5, NHR5, N(R5)2, арил или гетероарил, где указанный арил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила; иR4 представляет собой Н, галоген, пергалогеналкил, CN, SR5, NHR5, N(R5)2, арил или гетероарил,где указанный арил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила; где гетероарил представляет собой пирролил, пиразолил, имидазолил, триазолил, тетразолил, пиридил, пиримидинил, фуранил, пиранил, тиенил, бензимидазолил, хинолинил, изохинолинил, оксазолил,тиазолил или тиадиазолил. В четвертом аспекте изобретение относится к композиции по второму или третьему аспекту, где R1 представляет собой Н. Кроме того, четвертый аспект относится к композиции по второму или третьему аспекту, где R1 представляет собой метил. В пятом аспекте изобретение относится к композиции по второму, третьему или четвертому аспекту, где R2 представляет собой метил, этил, n-пропил или изопропил. Кроме того, пятый аспект относится к композиции по второму, третьему или четвертому аспекту, где R2 представляет собой метил или этил. Кроме того, пятый аспект относится к композиции по второму, третьему или четвертому аспекту, где R2 и R2a вместе формируют -CH2CH2-. В шестом аспекте изобретение относится к композиции по второму-пятому аспекту, где R3 представляет собой хлор. Кроме того, шестой аспект относится к композиции по второму-пятому аспекту, гдеR3 представляет собой бром. Кроме того, шестой аспект относится к композиции по второму-пятому аспекту, где R3 представляет собой пергалогеналкил. Шестой аспект относится к композиции по второмупятому аспекту, где R3 представляет собой CF3. Кроме того, шестой аспект относится к композиции по второму-пятому аспекту, где R3 выбран из группы, состоящей из тиенила, фуранила, пирролила, пиразолила и имидазолила. В седьмом аспекте изобретение относится к композиции по второму-шестому аспекту, где R4 выбран из группы, состоящей из тиенила, фуранила, пирролила, пиразолила и имидазолила, необязательно,замещенных одним или двумя заместителями, выбранными из галогена или метила. Кроме того, седьмой аспект относится к композиции по второму-шестому аспекту, где R4 представляет собой фенил, необязательно, замещенный не более чем двумя заместителями, выбранными из C1-8 алкила, галогена и алкокси. В восьмом аспекте изобретение относится к композиции по второму аспекту, гдеR3 представляет собой галоген или 5-членное гетероарильное кольцо, обладающее не более чем двумя гетероатомами, выбранными из О, N и S, и не более чем двумя заместителями, выбранными из галогена и C1-8 алкила;R4 представляет собой Н, 5-членное гетероарильное кольцо обладающее не более чем двумя гетероатомами, выбранными из О, N и S, и не более чем двумя заместителями, выбранными из галогена и C1-8 алкила, или фенил, необязательно, замещенный не более чем двумя заместителями, выбранными из C1-8 алкила, галогена и алкокси;R6 представляет собой Н или метил; или фармацевтически приемлемая соль, сольват или гидрат. Кроме того, восьмой аспект относится к композиции по второму аспекту, гдеR4 представляет собой пиразолил-3-ил или фенил, где указанный пиразолил-3-ил, необязательно,обладает не более чем двумя заместителями, выбранными из галогена и C1-8 алкила, и указанный фенил,необязательно, обладает одним галогеновым заместителем; иR6 представляет собой Н; или фармацевтически приемлемая соль, сольват или гидрат. Кроме того, восьмой аспект относится к композиции по второму аспекту, гдеR6 представляет собой Н. Кроме того, восьмой аспект относится к композиции по второму аспекту, гдеR6 представляет собой Н. В девятом аспекте изобретение относится к композиции по первому или второму аспекту, где указанный избирательный агонист рецептора 5HT2C выбран из группы, состоящей из 8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-бром-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-иод-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-трифторметил-1-метил-2,3,4, 5-тетрагидро-1H-3-бензазепина; 8-трифторметил-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-хлор-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-бром-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-иод-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 7,8-дихлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 7,8-дихлор-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-хлор-7-фтор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-хлор-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и 8-хлор-7-фтор-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; или их фармацевтически приемлемых солей, сольватов или гидратов. Кроме того, девятый аспект относится к композиции по первому или второму аспекту, где указанный избирательный агонист рецептора 5HT2C представляет собой (R)-8-хлор-1-метил-2,3,4,5-тетрагидро 1H-3-бензазепин или его фармацевтически приемлемые соль, сольват или гидрат. В десятом аспекте изобретение относится к композиции по первому-девятому аспекту, дополнительно содержащей фармацевтически приемлемый носитель. В одиннадцатом аспекте изобретение относится к способу уменьшения потребления пищи млекопитающим, включающему введение указанному млекопитающему фармацевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепина и количество фентермина, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим. В одном из вариантов осуществления количество (R)-8 хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и количество фентермина по отдельности являются недостаточно эффективными терапевтически для уменьшения потребления пищи указанным млекопитающим. В двенадцатом аспекте изобретение относится к способу вызывания насыщения у млекопитающего,включающему введение указанному млекопитающему фармацевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и количество фентермина, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для вызывания насыщения у указанного млекопитающего. В одном из вариантов осуществления, количество (R)-8-хлор-1-метил-2,3,4,5 тетрагидро-1 Н-3-бензазепина и количество фентермина по отдельности являются недостаточно эффективными терапевтически для вызывания насыщения у указанного млекопитающего. В тринадцатом аспекте изобретение относится к способу контроля прироста массы млекопитающего, включающему введение указанному млекопитающему фармацевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и фентермина, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для контроля прироста массы у указанного млекопитающего. В одном из вариантов осуществления, количество (R)-8-хлор-1-метил-2,3,4,5 тетрагидро-1 Н-3-бензазепина и количество фентермина по отдельности являются недостаточно эффективными терапевтически для контроля прироста массы у указанного млекопитающего. В четырнадцатом аспекте изобретение относится к способу профилактики или лечения ожирения,включающему введение пациенту, нуждающемуся в таких профилактике или лечении, фармацевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро 1H-3-бензазепина и количество фентермина, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3 бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим. В одном из вариантов осуществления, количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепина и количество фентермина по отдельности являются недостаточно эффективными терапевтически для уменьшения потребления пищи указанным млекопитающим. В некоторых вариантах осуществления некоторые из вышеупомянутых способов по изобретению-4 015012 дополнительно включают стадию идентификации субъекта, где указанный субъект нуждается в уменьшении потребления пищи, контроле прироста массы или лечении ожирения, где указанную стадию идентификации проводят перед введением указанному субъекту указанного фармацевтически эффективного количества указанного соединения или композиции по изобретению. Авторы настоящего изобретения сохраняют за собой право исключить любые одно или несколько соединений из любого варианта осуществления по изобретению. Кроме того, автор настоящего изобретения сохраняет за собой право исключить любое расстройство из любого варианта осуществления по изобретению. Краткое описание фигур На фиг. 1A-1G показаны эффекты семи различных соединений-агонистов рецептора 5 НТ 2 С, описанных в изобретении, на потребление пищи голодавшими крысами; на фиг. 2 - сверхаддитивный (синергический) эффект фентермина и избирательного агониста рецептора 5 НТ 2 С 8-хлор-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (Cmpd А) на питание у крыс; на фиг. 3 А и 3 В - сверхаддитивный (синергический) эффект фентермина и избирательного агониста рецептора 5 НТ-2 С (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепина (Cmpd В) на потребление пищи у самок (фиг. 3 А) и самцов (фиг. 3 В) крыс; на фиг. 4 А и 4 В - сверхаддитивный (синергический) эффект фентермина и избирательного агониста рецептора 5HT2C (R)-1-(5-хлор-2-фторфенил)-2-метилпиперазина (Cmpd С) на потребление пищи у самок(фиг. 4 А) и самцов (фиг. 4 В) крыс. Подробное описание изобретения Настоящее изобретение относится к комбинации соединений-агонистов рецептора 5HT2C с другими веществами для уменьшения связанного с конкретным рецептором 5HT2C поведения, такого как питание. В то время как соединения-агонисты 5HT2C, описанные в изобретении, можно применять как единственное активное вещество в фармацевтическом препарате (т.е. монотерапия), их можно успешно применять в комбинации с другими активными ингредиентами (т.е., комбинированная терапия), которые могут способствовать терапевтическому эффекту соединения. Таким образом, один аспект настоящего изобретения относится к способам профилактики и/или лечения связанного с рецептором 5HT2C состояния, такого как ожирение или связанное с ним состояние, включающим введение нуждающемуся в указанных профилактике и/или лечении индивидууму комбинации, содержащей количество избирательного агониста рецептора 5HT2C в комбинации с каким-то количеством одного или нескольких дополнительных фармацевтических средств, как описано здесь. В одном из вариантов осуществления количество избирательного агониста рецептора 5HT2C и количество одного или нескольких дополнительных фармацевтических средств сами по себе являются недостаточно эффективными терапевтически для профилактики и/или лечения состояния, однако при объединении эти соединения действуют синергически для предотвращения или лечения состояния. Подходящие фармацевтические средства, которые можно применять в комбинации с избирательными агонистам рецептора 5HT2C включают, например, средства против ожирения, такие как ингибиторы секреции аполипопротеина-В/микросомального белка, переносящего триглицериды (аро-В/МТР),агонисты MCR-4, агонисты холецистокинина-А (CCK-A), серотонин и ингибиторы повторного поглощения норэпинефрина (например, сибутрамин), симпатомиметические средства, агонисты 3 адренергических рецепторов, агонисты допамина (например, бромкриптин), аналоги рецептора меланоцитостимулирующего гормона, антагонисты рецептора каннабиноида 1 [например, SR141716: N(пиперидин-1-ил)-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метил-1H-пиразол-3-карбоксамид], антагонисты меланиноконцентрирующего гормона, лептины (белок ОВ), аналоги лептина, агонисты рецептора лептина, антагонисты галанина, ингибиторы липазы (такие как тетрагидролипстатин, т.е. орлистат), анорексигенные средства (такие как агонист бомбезина), антагонисты нейропептида-Y, тиромиметические средства, дегидроэпиандростерон или его аналог, агонисты или антагонисты глюкокортикоидного рецептора, антагонисты рецептора орексина, белковые антагонисты связывания урокортина, агонисты рецептора глюкагонподобного пептида-1, цилиарные нейротрофические факторы (такие как Axokine,доступный из Regeneron Pharmaceuticals, Inc., Tarrytown, NY и ProcterGamble Company, Cincinnati,OH), агути-родственные белки человека (AGRP), антагонисты рецептора грелина, антагонисты или обратные агонисты рецептора гистамина 3, агонисты рецептора нейромедина U, норадренергические анорексигенные средства (например, фентермин, мазиндол и т.п.) и средства для подавления аппетита (например, бупропион). Другие средства против ожирения, включая средства, описанные ниже, являются хорошо известными или будут легко очевидны в свете настоящего описания обычному специалисту в данной области. В некоторых вариантах осуществления средства против ожирения выбраны из группы, состоящей из фентермина, орлистата, сибутрамина, бромкриптина, эфедрина, лептина и псевдоэфедрина. В одном из вариантов осуществления средство против ожирения представляет собой фентермин. В дополнительном варианте осуществления композиции по настоящему изобретению и комбинированную терапию-5 015012 применяют вместе с упражнениями и/или целесообразной диетой. Будет понятно, что объем комбинированной терапии соединениями по настоящему изобретению с другими средствами против ожирения, анорексигенными средствами, средствами для подавления аппетита и родственными средствами не является ограниченным перечисленными выше средствами, но включает, в принципе, любую комбинацию с любым фармацевтическим средством или фармацевтической композицией, применяемой для лечения индивидуумов с избыточной массой и ожирением. Другие подходящие фармацевтические средства, помимо средств против ожирения, которые можно применять в комбинации с соединениями по настоящему изобретению, включают средства, применяемые для лечения сопутствующих заболеваний. Например, у индивидуумов с избыточной массой или ожирением увеличен риск заболеваемости и смертности, происходящей от сопутствующих заболеваний,таких как, в качестве неограничивающих примеров, застойная сердечная недостаточность, диабет II типа,атеросклероз, дислипидемия, гиперинсулинемия, гипертензия, устойчивость к инсулину, гипергликемия,ретинопатия, нефропатия и невропатия. Лечение одного или нескольких заболеваний, упомянутых здесь,включает применение одного или нескольких фармацевтических средств, известных в данной области,принадлежащих к классам лекарственных средств, относящихся в качестве неограничивающих примеров, к следующим: сульфонилмочевины, меглитиниды, бигуаниды, ингибиторы -глюкозидазы, агонисты рецептора-,активируемого пролифератором пероксисом (т.е. PPAR-), инсулин, аналоги инсулина, ингибиторыHMG-CoA-редуктазы, понижающие уровень холестерина лекарственные средства (например, фибраты,включающие фенофибрат, безафибрат, гемфиброзил, клофибрат и т.п.; вещества, усиливающие экскрецию желчной кислоты, включающие холестирамин, колестипол и т.п.; статины и ниацин), антитромбоцитарные средства (например, аспирин и антагонисты рецептора аденозиндифосфата, включающие клопидогрель, тиклопидин и т.п.), ингибиторы ангиотензинпревращающего фермента, антагонисты рецептора ангиотензина II и адипонектин. Будет понятно, что объем комбинированной терапии соединениями по настоящему изобретению с другими фармацевтическими средствами не является ограниченными средствами, перечисленными здесь, выше или ниже, но включает в принципе любую комбинацию с любым фармацевтическим средством или фармацевтической композицией, применяемыми для лечения заболеваний, состояний или расстройств, связанных у индивидуумов с избыточной массой и ожирением. Комбинированную терапию использовали для лечения заболеваний; однако, объединять лекарственные средства следует с осторожностью, так как конкретные лекарственные средства могут взаимодействовать опасным образом. Как правило, ожидают, что два средства, лечащие одно и то же состояние,приведут к аддитивному эффекту, что означает, что степень эффекта составляет сумму эффектов каждого лекарственного средства в отдельности. Авторы настоящего изобретения описывают здесь, что комбинация избирательного агониста 5HT2C и другого лекарственного средства, такого как фентермин, может оказывать сверхаддитивный или синергический эффект на потребление пищи (см. фиг. 2, 3 А и В, 4 А и В). Синергический эффект означает, что уменьшение потребления пищи, наблюдаемое при комбинированной терапии, превышает уменьшение, наблюдаемое при сложении уменьшения потребления пищи от каждого соединения. Одним преимуществом использования синергической комбинированной терапии является то, что для достижения значительного уменьшения потребления пищи требуется меньше каждого соединения и, следовательно, меньше побочных эффектов может возникать в результате лечения. В некоторых случаях при более низких используемых дозах не наблюдали побочных эффектов. Также в некоторых случаях профиль побочных эффектов одного лекарственного средства может уменьшать или уравновешивать профиль побочных эффектов другого лекарственного средства. Например, одно из лекарственных средств может вызывать повышенное кровяное давление, а другое лекарственное средство вызывать пониженное кровяное давление, так что комбинированная терапия не влияет на кровяное давление. Другим потенциальным преимуществом комбинированной терапии является то, что поскольку требуется меньше соединения, можно уменьшить стоимость терапии. В настоящей заявке приведено в качестве ссылки полное содержание предварительной заявки США 60/372058, поданной 12 апреля 2002 г.; предварительной патентной заявки США 60/405495, поданной 23 августа 2002 г.; предварительной патентной заявки США 60/434 607, поданной 18 декабря 2002 г.; не предварительной патентной заявки США 10/410991, поданной 10 апреля 2003 г., и не предварительной патентной заявки США 10/917979, поданной 13 августа 2004 г. Данная заявка притязает на приоритет предварительной заявки США 60/638667, поданной 23 декабря 2004 г., и предварительной заявки США 60/688901, поданной 8 июня 2005 г., и они приведены здесь полностью в качестве ссылки. В одном из аспектов изобретение относится к композиции, содержащей фентермин и избирательный агонист рецептора 5HT2C. Фентермин (1,1-диметил-2-фенилэтиламин) включает производные фентермина или его фармацевтически приемлемые соли, такие как в качестве неограничивающих примеров хлорфентермин (2-(4-хлорфенил)-1,1-диметилэтиламин) и т.п. В одном из вариантов осуществления фентермин присутствует в-6 015012 форме соли с HCl. Как применяют здесь, термин агонист предназначен для обозначения веществ, которые при их связывании с рецептором активируют внутриклеточный ответ или усиливают связывание GTP с мембранами. В контексте настоящего изобретения фармацевтическую композицию, содержащую агонист рецептора 5HT2C по изобретению можно применять для модулирования активности рецептора 5HT2C,уменьшения потребления пищи, включая насыщение (т.е. чувство наполнения), контроля прироста массы, лечения ожирения, уменьшения массы тела и/или влияния на метаболизм, так что реципиент теряет массу и/или поддерживает массу. Такие фармацевтические композиции можно применять в случае расстройств и/или заболеваний, где прирост массы является компонентом заболевания и/или расстройства,таких как, например, ожирение. Термин антагонист предназначен для обозначения веществ, которые конкурентно связываются с рецептором в том же участке, что и агонисты (например, эндогенный лиганд), но не активируют внутриклеточный ответ, вызываемый активной формой рецептора, и, таким образом, могут ингибировать внутриклеточные ответы от агонистов или частичных агонистов. Антагонисты не уменьшают фоновый внутриклеточный ответ в отсутствие агониста или частичного агониста. Как применяют здесь, термин избирательный агонист рецептора 5HT2C обозначает соединениеагонист, которое является избирательным для рецептора 5HT2C по сравнению с другими рецепторами,уменьшающими потребление пищи. Например, избирательный агонист рецептора 5HT2C обладает значительно более высокой аффинностью связывания с рецептором 5HT2C, чем с другим рецептором, который может уменьшать потребление пищи, таким как рецептор 5HT1b. Таким образом, например, избирательный агонист рецептора 5 НТ 2 С может обладать аффинностью связывания для рецептора 5HT2C, в 10, 20,30, 40, 50, 60, 70, 80, 90, 100 или 150 раз или более превышающей аффинность связывания для другого рецептора, такого как рецептор 5HT1b. Как понятно специалисту в данной области, избирательность можно определить, например, с использованием анализа связывания рецептора или функционального анализа. Одним способом оценки избирательности является проведение анализа кормления, как описано здесь (см. пример 2) с потенциальным избирательным агонистом рецептора 5HT2C и затем испытания животных с избирательным антагонистом 5HT2C, например SB 242084 (Sigma). Если эффект на потребление пищи прекращался (или очень значительно уменьшался), тогда полагали, что эффект проявлялся через рецептор 5HT2C, а не через другой рецептор. Термин избирательный агонист рецептора 5HT2C не включает такие соединения, как дексфенфлурамин, которые являются 5 НТ-высвобождающими средствами, или такие соединения, как флуоксетин,которые являются ингибиторами поглощения 5 НТ. Кроме того, термин избирательный агонист рецептора 5HT2C не включает не избирательные агонисты 5 НТ, такие как m-хлорфенилпиперазин (mCPP) илиm-трифторметилфенилпиперазин (TFMPP), которые обладают значительными эффектами на рецептор 5HT1b. Например, TFMPP вызывает уменьшенное потребление пищи; однако, уменьшение потребления пищи не прекращается при добавлении избирательного антагониста 5HT2C, такого как SB 242084. Как описано здесь, композиции по изобретению могут содержать фентермин и избирательный агонист рецептора 5HT2C. Фентермин и избирательный агонист рецептора 5HT2C можно вводить как отдельные единицы, или фентермин и избирательный агонист рецептора 5HT2C можно объединять для формирования одной единицы. Например, фентермин и избирательный агонист рецептора 5HT2C можно вводить в виде двух отдельных пилюль или капсул, или их можно объединять для получения одной пилюли или капсулы. Изобретение также относится к композиции, содержащей фентермин и избирательный агонист рецептора 5HT2C, где избирательный агонист рецептора 5 НТ 2 С представлен формулой (I) или его фармацевтически приемлемой соли, сольвату или гидрату, гдеR3 и R4 независимо представляют собой Н, галоген, пергалогеналкил, CN, OR5, SR5, NHR5, N(R5)2,ОН, арил или гетероарил, где указанный арил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может, необязательно, являться замещенным не более чем двумя заместителями, выбранны-7 015012 ми из галогена и C1-8 алкила; или R3 и R4 вместе с атомами, к которым они присоединены, могут формировать 5- или 6-членное гетероциклическое кольцо, обладающее одним атомом О; каждый из R5 независимо представляет собой C1-8 алкил, C1-8 алкенил, арил, гетероарил, арилалкил,гетероарилалкил или пергалогеналкил или аллил иR6 представляет собой Н или C1-8 алкил. Некоторые варианты осуществления по настоящему изобретению относятся к композиции, содержащей фентермин и избирательный агонист рецептора 5HT2C, где избирательный агонист рецептора 5HT2C представлен формулой (I) или его фармацевтически приемлемым соли, сольвату или гидрату, гдеR3 представляет собой галоген, пергалогеналкил, CN, SR5, NHR5, N(R5)2, арил, или гетероарил, где указанный арил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила;R4 представляет собой Н, галоген, пергалогеналкил, CN, SR5, NHR5, N(R5)2, арил или гетероарил,где указанный арил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила; каждый из R5 независимо представляет собой C1-8 алкил, C1-8 алкенил, арил, гетероарил, арилалкил,гетероарилалкил, или пергалогеналкил, или аллил; иR6 представляет собой Н или C1-8 алкил; где гетероарил представляет собой пирролил, пиразолил, имидазолил, триазолил, тетразолил, пиридил, пиримидинил, фуранил, пиранил, тиенил, бензимидазолил, хинолинил, изохинолинил, оксазолил,тиазолил или тиадиазолил; или их фармацевтически приемлемым соли, сольвату или гидрату при условии, что:(i) если R6 не является Н, тогда ни R3, ни R4 не могут являться Н;(iii) если R1 и R2 представляют собой метил, и R4 представляет собой Н, тогда R3 не может являться имидазолом, замещенным имидазолом, или производным имидазола. Некоторые варианты осуществления по настоящему изобретению относятся к композиции, содержащей фентермин и избирательный агонист рецептора 5HT2C, где избирательный агонист рецептора 5HT2C представлен формулой (I)R3 представляет собой галоген, пергалогеналкил или 5-членное гетероарильное кольцо, обладающее не более чем двумя гетероатомами, выбранными из О, N и S;R4 представляет собой -Н, галоген, пергалогеналкил, CN, SR5, NHR5, N(R5)2, арил, или гетероарил,где указанный арил может, необязательно, являться замещенным не более чем двумя заместителями, вы-8 015012 бранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила; илиR3 и R4 вместе с атомами, к которым они присоединены, формируют 5- или 6-членное гетероциклическое кольцо, обладающее одним атомом 0; каждый из R5 независимо представляет собой C1-8 алкил, C1-8 алкенил, арил, гетероарил, арилалкил,гетероарилалкил или пергалогеналкил или аллил; иR6 представляет собой -Н или C1-8 алкил; или его фармацевтически приемлемым соли, сольвату или гидрату; при условии, что если R6 не является -Н, тогда R4 не может являться -Н; и если R1 и R2 представляют собой метил и R4 представляет собой -Н, тогда R3 не может являться имидазолом, замещенным имидазолом или производным имидазола; и где арил обозначает моноциклическую или полициклическую ароматическую группу, обладающую от 3 до 14 атомов углерода; гетероарил обозначает моноциклическую или полициклическую ароматическую группу, обладающую от 3 до 14 атомов углерода, и от 1 до 4 гетероатомов в кольце, выбранных из О, N, и S; алкокси обозначает -О-алкил, где алкил обозначает метил, этил, н-пропил, изопропил, циклопропил, н-бутил, втор-бутил, трет-бутил, циклобутил, циклопропилметил, н-пентил, изопентил, трет-пентил,циклопентил, циклопентилметил, н-гексил или циклогексил;C1-8 алкил обозначает неразветвленную, разветвленную или циклическую углеводородную группу,обладающую от 1 до 8 атомов углерода;C1-8 алкенил обозначает неразветвленную, разветвленную или циклическую углеводородную группу, обладающую от 1 до 8 атомов углерода и по меньшей мере одной двойной связью; алкил, отличный от C1-8 алкила, обозначает метил, этил, п-пропил, изопропил, циклопропил, нбутил, втор-бутил, трет-бутил, циклобутил, циклопропилметил, н-пентил, изопентил, трет-пентил, циклопентил, циклопентилметил, н-гексил или циклогексил. Понятно, что соединения формулы (I) могут обладать одним или несколькими хиральными центрами и существовать как энантиомеры или диастереомеры. Понятно, что изобретение распространяется на все такие энантиомеры, диастереомеры и их смеси, включая рацематы. Формула (I) и формулы в дальнейшем в этом документе предназначены, чтобы представлять все отдельные изомеры и их смеси, если не указано или не показано иначе. Понятно также, что конкретные признаки по изобретению, которые для ясности описаны в контексте отдельных вариантов осуществления, могут также присутствовать в комбинации в одном варианте осуществления. С другой стороны, различные признаки по изобретению, которые для краткости описаны в контексте одного варианта осуществления, могут также присутствовать по отдельности или в любой подходящей подкомбинации. Все комбинации вариантов осуществления, касающиеся химических групп,представленных переменными (например, R1, R2, R2a, R3, R4, R5, R6 и т.д.), содержащимися в общей химической формуле, описанной здесь [например, формула (I) и т.д.], конкретно охвачены настоящим изобретением так же, как если бы они были явно раскрыты, в случае, если такие комбинации охватывают соединения, которые приводят к устойчивым соединениям (то есть соединениям, которые можно выделить, охарактеризовать и проверить по биологической активности). Кроме того, все подкомбинации химических групп, перечисленных в вариантах осуществления, описывающих такие переменные, так же как все подкомбинации применений и медицинских показаний, описанных здесь, также конкретно охвачены настоящим изобретением, так же, как если бы каждая из таких подкомбинаций химических групп и подкомбинаций применений и медицинских показаний была явно раскрыта здесь. Как применяют здесь, замещенный означает, что по меньшей мере один атом водорода в химической группе замещают не относящимся к водороду заместителем или группой, где не относящийся к водороду заместитель или группа может являться моновалентным или двухвалентным. Когда заместитель или группа является двухвалентным, понятно, что эту группу дополнительно замещают другим заместителем или группой. Когда химическая группа здесь является замещенной, она может являться замещенной вплоть до полной валентности; например, метильная группа может являться замещенной 1, 2,или 3 заместителями, метиленовая группа может являться замещенной 1 или 2 заместителями, фенильная группа может являться замещенной 1, 2, 3, 4, или 5 заместителями, нафтильная группа может являться замещенной 1, 2, 3, 4, 5, 6, или 7 заместителями и т.п. Подобным образом, замещенный одним или несколькими заместителями относится к замещению группы от одного заместителя вплоть до общего числа заместителей, физически возможных у этой группы. Кроме того, когда группа является замещенной более чем одной группой, они могут являться идентичными или могут отличаться. Как применяют здесь, термин алкил предназначен для обозначения углеводородных групп, включая неразветвленные, разветвленные и циклические углеводороды, включая в качестве неограничивающих примеров метил, этил, н-пропил, изопропил, циклопропил, н-бутил, втор-бутил, трет-бутил, цикло-9 015012 бутил, циклопропилметил, н-пентил, изопентил, трет-пентил, циклопентил, циклопентилметил, н-гексил,циклогексил и т.п. Следует понимать, что на всем протяжении данного описания термин алкил предназначен, чтобы охватывать как нециклические углеводородные группы, так и циклические углеводородные группы. В некоторых вариантах осуществления соединений по изобретению алкильные группы являются не циклическими. В дополнительных вариантах осуществления алкильные группы являются циклическими, и в дополнительных вариантах осуществления алкильные группы являются как циклическими, так и не циклическими. Где не указано предпочтений, термин алкил предназначен для обозначения групп, являющихся как циклическими, так и не циклическими. Как применяют здесь, термин алкенил предназначен для обозначения углеводородных соединений, включая неразветвленные, разветвленные и циклические углеводороды, содержащие по меньшей мере одну двойную связь, включая в качестве неограничивающих примеров аллил, 2-метилаллил, 4-бут 3-енил, 4-гекс-5-енил, 3-метил-бут-2-енил, циклогекс-2-енил и т.п. Как применяют здесь, термин галоген, как обычно, обозначает элементы седьмого периода, включая F, Cl, Br и I. Термин алкокси предназначен для обозначения заместителей формулы -О-алкил, включая -Оаллил. Термин низший при использовании в связи с такими заместителями, как алкил, обозначает 6 атомов углерода или менее. Термин арилалкил или аралкил предназначен для обозначения алкильной группы, несущей арильный заместитель, например бензильной группы. Термин алкиларил или алкарил предназначен для обозначения арильной группы, несущей алкильный заместитель, например 4-метилфенильной группы. Как применяют здесь, термин арил предназначен для обозначения моноциклических и полициклических ароматических групп. Хотя арильные группы могут содержать настолько мало, как 3 атома углерода, предпочтительные арильные группы обладают от 6 до приблизительно 14 атомов углерода,более предпочтительно от 6 до приблизительно 10 атомов углерода. Арильные группы включают в качестве неограничивающих примеров фенил, нафтил, антрацил, фенантрил и пиренил. Термин гетероарил предназначен для обозначения арильной группы, содержащей по меньшей мере один и предпочтительно от одного до четырех гетеро (т.е. не относящихся к углероду, например О,N или S) атомов. Примерами гетероарильных групп являются радикалы, полученные из 5- и 6-членных арильных циклических соединений, обладающих от одного до четырех атомов азота, серы и/или кислорода, например пиррола, пиразола, имидазола, триазола, тетразола, пиридина, пиримидина, фурана, пирана, тиофена, бензимидазола, хинолина, изохинолина, оксазола, тиазола и тиадиазола. Как применяют здесь, термин гетероарилалкил означает алкильную группу, несущую гетероарильный заместитель, например группу, обладающую структурой -СН 2-пиррол-2-ил. Термин замещенный тиазол означает радикал, полученный из тиазола, несущий по меньшей мере одну замещающую группу. Термин производное тиазола означает конденсированную циклическую систему, в которой одно из конденсированных колец представляет собой тиазол. Термин замещенный имидазол означает радикал, полученный из имидазола, несущий по меньшей мере одну замещающую группу. Термин производное имидазола означает конденсированную циклическую систему, в которой одно из конденсированных колец представляет собой имидазол. Конкретные заместители соединений, описанных здесь, можно, необязательно, дополнительно замещать, т.е. они, необязательно, могут нести дополнительные замещающие группы. Некоторые предпочтительные замещающие группы включают галоген, низший алкил (включая в качестве неограничивающих примеров метил, этил, изопропил, циклопропил, трет-бутил и метилциклопропил), алкокси, моно-,ди- или тригалоалкокси (например, -О-СХ 3, где X представляет собой галоген), -(СН 2)yNH2,-(CH2)yNHBoc, -N(R4a)(R4b), фенил, метоксифенил и нафтил. В различных местах настоящего описания заместители соединений по изобретению описаны по группам или диапазонам. Конкретно подразумевают, что изобретение относится ко всем до единой отдельным подкомбинациям членов таких групп и диапазонов. Например, термин C1-8 алкил конкретно предназначен для отдельного описания метила, этила, С 3 алкила, С 4 алкила, С 5 алкила, С 6 алкила, С 7 алкила и C8 алкила. Кроме того, соединения по настоящему изобретению включают все их фармацевтически приемлемые соли, сольваты и в частности гидраты; включая в качестве неограничивающих примеров фентермин,производные фентермина (например, хлорфентермин), избирательные агонисты рецептора 5HT2C (например, соединения формулы (I и т.п. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5HT2C представлен формулой (I), гдеR3 представляет собой галоген, пергалогеналкил, CN, SR5, NHR5, N(R5)2, арил или гетероарил, где указанный арил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила; иR4 представляет собой Н, галоген, пергалогеналкил, CN, SR5, NHR5, N(R5)2, арил или гетероарил,где указанный арил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из C1-8 алкила, галогена, пергалогеналкила и алкокси, и указанный гетероарил может, необязательно, являться замещенным не более чем двумя заместителями, выбранными из галогена и C1-8 алкила; где гетероарил представляет собой пирролил, пиразолил, имидазолил, триазолил, тетразолил, пиридил, пиримидинил, фуранил, пиранил, тиенил, бензимидазолил, хинолинил, изохинолинил, оксазолил,тиазолил или тиадиазолил. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5HT2C представлен формулой (I), где R1 представляет собой Н. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R1 представляет собой метил. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R2 представляет собой метил, этил, н-пропил или изопропил. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R2 представляет собой метил или этил. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R2 и R2a вместе формируют -СН 2 СН 2-. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R3 представляет собой хлор. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R3 представляет собой бром. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R3 представляет собой пергалогеналкил. В некоторых вариантах осуществления R3 представляет собой CF3. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R3 выбран из группы, состоящей из тиенила, фуранила, пирролила, пиразолила и имидазолила. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R4 выбран из группы, состоящей из тиенила, фуранила, пирролила, пиразолила и имидазолила, необязательно, замещенных одним или двумя заместителями, выбранными из галогена или метила, или где R4 представляет собой фенил, необязательно, замещенный не более чем двумя заместителями, выбранными из C1-8 алкила, галогена и алкокси. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R2 представляет собой метил, этил, изопропил, или СН 2 ОН; или R2 и R2a вместе взятые формируют -CH2CH2-. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R3 представляет собой галоген или 5-членное гетероарильное кольцо, обладающее не более чем двумя гетероатомами, выбранными из О, N и S, и не более чем двумя заместителями, выбранными из галогена и C1-8 алкила. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R4 представляет собой Н, 5-членное гетероарильное кольцо,обладающее не более чем двумя гетероатомами, выбранными из О, N и S, и не более чем двумя заместителями, выбранными из галогена и C1-8 алкила, или фенил, необязательно, замещенный не более чем двумя заместителями, выбранными из C1-8 алкила, галогена и алкокси. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R6 представляет собой Н или метил. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R1 представляет собой Н. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R2 представляет собой метил. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R3 представляет собой хлор, бром или тиенил. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R4 представляет собой пиразолил-3-ил или фенил, где указанный пиразолил-3-ил, необязательно, обладает не более чем двумя заместителями, выбранными из галогена и C1-8 алкила, и указанный фенил, необязательно, обладает одним галогеновым заместителем. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R6 представляет собой Н. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R1 представляет собой Н или Me. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R2 представляет собой Me, Et или ОН.- 11015012 В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где: R2a представляет собой Н. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R3 представляет собой F, Cl, Br, I, CF3 или 2-хлорфенил. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R4 представляет собой Н. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R6 представляет собой Н. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R1 представляет собой Н. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R2 представляет собой C1-8 алкил. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R2a представляет собой Н. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R3 представляет собой галоген. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R4 представляет собой Н. В некоторых вариантах осуществления по настоящему изобретению избирательный агонист рецептора 5 НТ 2 С представлен формулой (I), где R6 представляет собой Н. Изобретение относится к композиции, содержащей фентермин и избирательный агонист рецептора 5 НТ 2 С, как описано здесь, где указанный избирательный агонист рецептора 5 НТ 2 С выбран из группы,состоящей из 8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-бром-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-иод-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-трифторметил-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-трифторметил-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-хлор-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-бром-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-иод-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 7,8-дихлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 7,8-дихлор-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-хлор-7-фтор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина; 8-хлор-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и 8-хлор-7-фтор-1-этил-2,3,4,5-тетрагидро-1H-3-бензазепина; или их фармацевтически приемлемых соли, сольвата или гидрата. Соединения по изобретению могут содержать один или несколько асимметрических атомов углерода, так что соединения могут существовать в различных стереоизомерных формах. Соединения могут представлять собой, например, рацематы или оптически активные формы. Оптически активные формы можно получить разделением рацематов или ассиметрическим синтезом. В некоторых вариантах осуществления соединения формулы (I) представляют собой R-энантиомеры. В некоторых вариантах осуществления соединения формулы (I) представляют собой S-энантиомеры. В некоторых вариантах осуществления соединения формулы (I) представляют собой различные смеси энантиомеров. В одном из вариантов осуществления изобретение относится к композиции, содержащей фентермин и избирательный агонист рецептора 5 НТ 2 С, где указанный избирательный агонист рецептора 5 НТ 2 С представляет собой (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин или его фармацевтически приемлемые соль, сольват или гидрат. Соединения и композиции по изобретению могут, необязательно, существовать в форме фармацевтически приемлемых солей, включая фармацевтически приемлемые кислотно-аддитивные соли, полученные из фармацевтически приемлемых не токсичных кислот, включая неорганические и органические кислоты. Такие кислоты включают уксусную, бензолсульфоновую, бензойную, камфорсульфоновую,лимонную, этенсульфоновую, дихлоруксусную, муравьиную, фумаровую, глюконовую, глутаминовую,гиппуровую, бромисто-водородную, соляную, изэтионовую, молочную, малеиновую, яблочную, миндальную, метансульфоновую, муциновую, азотную, щавелевую, памовую, пантотеновую, фосфорную,янтарную, серную, виннокаменную, щавелевую, р-толуолсульфоновую и т.п., такие как те, фармацевтически приемлемые соли которых перечислены в Journal of Pharmaceutical Science, 66, 2 (1977) и приведены здесь в качестве ссылки. Кислотно-аддитивные соли можно получить как непосредственные продукты синтеза соединений. Альтернативно, свободное основание можно растворить в подходящем растворителе, содержащем подходящую кислоту, и выделить соль посредством выпаривания растворителя или разделения соли и растворителя другим образом. Можно получать сольваты соединений по данному изобретению с общепри- 12015012 нятыми низкомолекулярными растворителями с использованием способов, известных специалисту в данной области. Композиции по изобретению можно удобно вводить в форме однократной дозы, и их можно получить любым из способов, хорошо известных в области фармацевтики, например, как описано в Remington's Pharmaceutical Sciences (Mack Pub. Co., Easton, PA, 1980). Изобретение относится также к композициям по изобретению, как описано выше, дополнительно содержащим фармацевтически приемлемый носитель. Например, изобретение относится к композиции,содержащей фентермин и (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин или его фармацевтически приемлемые соль, сольват или гидрат и фармацевтически приемлемый носитель. Таким образом,изобретение относится к фармацевтической композиции, содержащей фентермин и избирательный агонист 5 НТ 2 С. Фармацевтическая композиция представляет собой композицию, содержащую по меньшей мере один активный ингредиент и по меньшей мере один ингредиент, который не является активным ингредиентом (в качестве неограничивающих примеров наполнитель, краситель или устройство для замедленного высвобождения), благодаря которому композиция является пригодной для применения для заданного эффективного исхода у млекопитающего (в качестве неограничивающих примеров у человека). По дополнительному аспекту изобретения композиции по изобретению предназначены для применения в терапии. Композиции можно применять для профилактики или лечения расстройств, связанных с функцией рецептора 5HT2C. По дополнительному аспекту изобретения предусмотрено применение композиции по изобретению в изготовлении лекарственного средства для профилактики или лечения описанных здесь расстройств. В предпочтительном варианте осуществления предусмотрено применение композиции по изобретению в изготовлении лекарственного средства для профилактики или лечения ожирения. Полученные здесь данные поддерживают заключение, что описанные в настоящее время композиции по изобретению являются полезными для лечения или профилактики клинического ожирения или расстройств избыточной массы у млекопитающих, включая, в качестве неограничивающих примеров,человека. Композиции по настоящему изобретению можно вводить пероральным, подъязычным, парентеральным, ректальным, местным введением или посредством трансдермального пластыря. Трансдермальные пластыри высвобождают лекарственное средство с контролируемой скоростью посредством представления лекарственного средства для всасывания эффективным способом с минимальной деградацией лекарственного средства. Как правило, трансдермальные пластыри выполнены в виде непроницаемого защитного слоя, клея, склеивающего при одном надавливании, и съемной защитной пленки. Обычный специалист в данной области хорошо поймет и оценит способы, пригодные для изготовления трансдермального пластыря с желаемой эффективностью на основании нужд специалиста. Кроме нейтральных форм композиций по настоящему изобретению, посредством соответствующего добавления ионизируемого заместителя, не изменяющего рецепторную специфичность соединения,можно получить также физиологически приемлемые соли композиций и использовать в качестве терапевтических средств. Для достижения желаемого биологического эффекта будут необходимы различные количества композиций по настоящему изобретению. Количество будет зависеть от таких факторов, как конкретная композиция, применение, для которого она предназначена, способы введения и состояние леченого индивидуума - все эти параметры дозирования соответствуют уровню обычного специалиста в области медицины. Можно ожидать, что обычная доза попадет в диапазон от 0,001 до 200 мг на килограмм массы тела млекопитающего. Например, обычная доза может попасть в диапазон 0,001-0,01, 0,010,1, 0,1-1, 1-10, 10-100, или 100-200 мг на килограмм массы тела млекопитающего. Единица дозирования может содержать от 1 до 200 мг композиции по настоящему изобретению, и ее можно вводить один или более раз в сутки как однократную или множественные дозы. Например, единицы дозирования могут содержать 1-10, 10-50, 50-100, 100-150 или 150-200 мг композиции по изобретению, и их можно вводить один или более раз в сутки как однократную или множественные дозы. Композиции по настоящему изобретению можно объединять с носителем в твердой или жидкой форме в составе единицы дозирования. Фармацевтический носитель должен являться совместимым с другими ингредиентами в композиции и должен являться переносимым отдельным реципиентом. В фармацевтическую композицию по изобретению можно включать другие физиологически активные ингредиенты, если желательно, и если такие ингредиенты являются совместимыми с другими ингредиентами в композиции. Составы можно получать любым подходящим способом, как правило, однородным смешиванием активного соединения(соединений) с жидкими или тонко измельченными твердыми носителями,или и с теми, и с другими в требуемых соотношениях, и затем, если необходимо, формованием полученной смеси в желаемую форму. Общепринятые наполнители, такие как связующие, наполнители, подходящие смачивающие средства, смазывающие вещества для таблетирования и дезинтегрирующие средства можно использовать в таблетках и капсулах для перорального введения. Жидкие препараты для перорального введения могут существовать в форме растворов, эмульсий, водных или масляных суспензий и сиропов. Альтернативно,пероральные препараты могут существовать в форме сухого порошка, который перед использованием- 13015012 можно разводить водой или другим подходящим жидким носителем. К жидким препаратам можно добавлять дополнительные добавки, такие как суспендирующие или эмульгирующие средства, неводные носители (включая пищевые масла), консерванты и ароматизаторы и красители. Формы для парентерального дозирования можно получить растворением соединения по изобретению в подходящем жидком носителе и стерилизацией раствора фильтрованием перед заполнением и запечатыванием подходящего флакона или ампулы. Это представляет собой только несколько примеров из множества подходящих способов получения форм дозирования, хорошо известных в данной области. Указано, что композиции по изобретению предназначены для применения не только для человека,но также для других, не относящихся к человеку млекопитающих. Действительно, недавние успехи в области ветеринарии позволяют рассматривать использование композиции по изобретению для лечения ожирения у домашних животных (например, кошек и собак), и у других домашних животных, у которых не наблюдают заболевания или расстройства (например, предназначенные в пищу животные, такие как коровы, куры, рыба и т.д.). Обычным специалистам в данной области можно легко доверить понимание полезности таких композиций в таких условиях. Избирательные агонисты рецептора 5 НТ 2 С формулы (I) в композициях можно легко получить согласно множеству синтетических манипуляций, которые все будут знакомы специалисту в данной области. Типичный общий синтез представлен ниже на схеме I. Схема I Общая схема реакции Специалисты в данной области будут принимать во внимание, что широкое множество соединений избирательных агонистов рецептора 5 НТ 2 С, описанных в изобретении, можно получить по схеме I. Например, начиная с соответствующим образом замещенного 2-фенилэтиламинового соединения А', обладающего любым из широкого множества заместителей R1 и R2, можно получить соответствующий 7 и/или 8-замещенный 1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин (соединение Н). N-Алкилирование можно осуществлять, например, обработкой избытком параформальдегида (для метилирования) или альдегида высшего порядка с последующим восстановлением NaBH3CN согласно общему способу из примеров синтеза 9 и 10 ниже. Кроме того, начиная с соответствующим образом замещенного 1-алкил-2 фенилэтиламинового соединения А', обладающего любым из широкого множества заместителей R1 и R2,- 14015012 можно получить соответствующее 7- и/или 8-замещенное 2,5-диалкил-2,3,4,5-тетрагидро-1H-3 бензазепиновое соединение. Для синтеза многих соединений по изобретению могут требоваться защитные группы для защиты различных функциональных групп или группы в течение синтеза. Типичные защитные группы, подходящие для широкого множества синтетических превращений, описаны в Greene and Wuts, ProtectiveGroups in Organic Synthesis, 2d ed, John WileySons, New York, 1991, полное содержание которого приведено здесь в качестве ссылки. Изобретение относится к способу уменьшения потребления пищи млекопитающим, включающему введение указанному млекопитающему фармацевтически эффективного количества комбинации, содержащей избирательный агонист рецептора 5 НТ 2 С и количество фентермина, где указанные избирательный агонист рецептора 5 НТ 2 С и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим. Например, изобретение относится к способу уменьшения потребления пищи млекопитающим, включающему введение указанному млекопитающему фармацевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и количество фентермина, где указанные (R)8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах,чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим. В одном из вариантов осуществления количество избирательного агониста рецептора 5 НТ 2 С, например(R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и/или количество фентермина, является терапевтически эффективным (т.е. обладающим статистически значимым эффектом) для уменьшения потребления пищи указанным млекопитающим, и соединения представлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим. В одном из вариантов осуществления количество избирательного агониста рецептора 5 НТ 2 С, например (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и/или количество фентермина, являются недостаточно эффективными терапевтически для уменьшения потребления пищи указанным млекопитающим. Как применяют здесь, недостаточно эффективный терапевтически означает, что агонист 5 НТ 2 С и/или фентермин представлены в таких количествах, которые не оказывают статистически значимого эффекта на измеряемый параметр. Например, количество избирательного агониста рецептора 5 НТ 2 С, например (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и/или количество фентермина,может являться не эффективным терапевтически для уменьшения потребления пищи указанным млекопитающим. Поскольку комбинация избирательного агониста рецептора 5 НТ 2 С и фентермина оказывает синергический эффект (см., например, фиг. 2, фиг. 3 А и В, и фиг. 4 А и В), комбинированная терапия может являться терапевтически эффективной, в то время как каждое из соединений по отдельности является недостаточно эффективным терапевтически (включая пример, когда соединение или соединения являются неэффективными). В способе лечения используют терапевтически эффективную дозу комбинации избирательного агониста рецептора 5 НТ 2 С и фентермина. Изобретение относится также к способу вызывания насыщения у млекопитающего, включающему введение указанному млекопитающему фармацевтически эффективного количества комбинации, содержащей количество избирательного агониста рецептора 5 НТ 2 С и количество фентермина, где указанные избирательный агонист рецептора 5 НТ 2 С и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для вызывания насыщения у указанного млекопитающего. Например, изобретение относится к способу вызывания насыщения у млекопитающего, включающему введение указанному млекопитающему фармацевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и/или количество фентермина, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для вызывания насыщения у указанного млекопитающего. В одном из вариантов осуществления количество избирательного агониста рецептора 5 НТ 2 С, например (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и/или количество фентермина являются недостаточно эффективными или неэффективными терапевтически для вызывания насыщения у указанного млекопитающего. Кроме того, изобретение относится к способу контроля прироста массы у млекопитающего, включающему введение указанному млекопитающему фармацевтически эффективного количества комбинации, содержащей количество избирательного агониста рецептора 5 НТ 2 С и количество фентермина, где указанные избирательный агонист рецептора 5 НТ 2 С и фентермин представлены в таких количествах,чтобы оказывать синергический эффект для контроля прироста массы у указанного млекопитающего. Например, изобретение относится к способу контроля прироста массы у млекопитающего, включающему введение указанному млекопитающему фармацевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и/или количество фентермина, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для контроля прироста массы у указанного млекопитающего. В одном из вариантов осуществления количество избирательного агониста рецептора 5 НТ 2 С, например (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и/или количество- 15015012 фентермина являются недостаточно эффективными или неэффективными терапевтически для контроля прироста массы у указанного млекопитающего. Кроме того, изобретение относится к способу профилактики или лечения ожирения или связанного с ним состояния, включающему введение пациенту, нуждающемуся в таких профилактике или лечении,терапевтически эффективного количества комбинации, содержащей количество избирательного агониста рецептора 5 НТ 2 С и количество фентермина, где указанные избирательный агонист рецептора 5 НТ 2 С и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим. Например, изобретение, кроме того, относится к способу профилактики или лечения ожирения или связанного с ним состояния, включающему введение пациенту, нуждающемуся в таких профилактике или лечении, терапевтически эффективного количества комбинации, содержащей количество (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и количество фентермина, где указанные (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин и фентермин представлены в таких количествах, чтобы оказывать синергический эффект для уменьшения потребления пищи указанным млекопитающим. В одном из вариантов осуществления количество избирательного агониста рецептора 5 НТ 2 С, например (R)-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина и/или количество фентермина являются недостаточно эффективными или неэффективными терапевтически для уменьшения потребления пищи указанным млекопитающим. Состояния, связанные с ожирением, включают , например, диабет II типа, атеросклероз, высокое кровяное давление, синдром X и т.п. В некоторых вариантах осуществления расстройство представляет собой ожирение. Изобретение относится также к описанным выше способам, дополнительно включающим стадию идентификации субъекта, где указанный субъект нуждается в профилактике или лечении ожирения или связанного с ним состояния, где указанную стадию идентификации проводят перед введением указанному субъекту терапевтически эффективного количества указанных соединений. Один из аспектов настоящего изобретения относится к способу лечения ожирения или связанного с ним состояния, включающему введение субъекту, страдающему от такого состояния, терапевтически эффективного количества композиции, содержащей избирательный агонист рецептора 5 НТ 2 С и фентермин, как описано здесь, предпочтительно в форме фармацевтической композиции. Один из аспектов настоящего изобретения относится к композиции, содержащей избирательный агонист рецептора 5 НТ 2 С и фентермин, для применения в способе терапевтического лечения организма человека или животного. Например, изобретение относится к композиции по изобретению для применения в способе терапевтического лечения связанного с 5 НТ 2 С расстройства организма человека или животного. Изобретение относится также к композиции по изобретению для применения в способе профилактики или лечения ожирения у млекопитающего, для применения в способе уменьшения потребления пищи млекопитающим, для применения в способе вызывания насыщения у млекопитающего и/или для применения в способе контроля прироста массы у млекопитающего. Один из аспектов настоящего изобретения относится к композиции по изобретению для изготовления лекарственного средства для применения в терапевтической профилактике или лечении связанного с 5 НТ 2 С расстройства организма человека или животного. Например, один аспект настоящего изобретения относится к композиции, содержащей избирательный агонист рецептора 5 НТ 2 С и фентермин, для изготовления лекарственного средства для применения в профилактике или лечении ожирения или связанных с ним состояний. В некоторых вариантах осуществления расстройство представляет собой ожирение. Кроме того, например, изобретение относится к композиции по изобретению для изготовления лекарственного средства для применения в способе уменьшения потребления пищи млекопитающим, для изготовления лекарственного средства для применения в способе вызывания насыщения у млекопитающего, и/или для изготовления лекарственного средства для применения в способе контроля прироста массы у млекопитающего. В некоторых вариантах осуществления изобретение относится к способам облегчения симптома любого из заболеваний, состояний или расстройств, упомянутых здесь. Как будет понятно, стадии способов по настоящему изобретению не нуждаются в проведении какого-либо конкретного числа раз или в какой-либо конкретной последовательности. Дополнительные цели,преимущества и новые признаки по данному изобретению станут очевидными специалистам в данной области после изучения следующих его примеров, которые предназначены, чтобы являться иллюстративными, и не предназначены, чтобы являться ограничивающими. Примеры Примеры синтеза Пример 1. (R,S)-8-Бром-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин.- 16015012 Раствор 3-метоксифенэтиламина (10,0 г, 64,0 ммоль) в дихлорметане (150 мл), охлаждали до 0 С и обрабатывали пиридином (6,5 мл, 83,5 ммоль) с последующим добавлением по каплям трифторуксусного ангидрида (17,9 г, 83,5 ммоль) и полученную смесь перемешивали в течение 3 ч при нагревании до 20 С. Смесь продуктов растворяли в EtOAc (500 мл), последовательно промывали 10% водной HCl (100 мл), водой (100 мл), солевым раствором (100 мл), сушили Na2SO4 и концентрировали до получения 15,8 г желтого масла. 1 Н ЯМР (400 МГц, CDCl3)7,26 (дд, J=8,8 Гц, 1 Н), 6,81 (д, J=8 Гц, 1 Н), 6,77 (д, J=8 Гц, 1 Н), 6,72 (с,1 Н), 6,30 (шир.с, 1 Н), 3,80 (с, 3 Н), 3,62 (дд, J=7,7 Гц, 2 Н), 2,86 (дд, J=7,7 Гц, 2 Н.N-Трифторацетил-2-иод-5-метоксифенэтиламин. Раствор N-трифторацетил-3-метоксифенэтиламина (15,8 г, 64 ммоль) в метаноле (325 мл) охлаждали -78 С и обрабатывали СаСО 3 (14,7 г, 145 ммоль), затем раствором ICl (29 г, 181 ммоль) в метаноле (40 мл). Реакционной смеси позволяли нагреваться до 20 С при перемешивании в течение ночи и затем фильтровали, концентрировали, растворяли в EtOAc (200 мл), дважды промывали 5% водным бисульфитом натрия (100 мл), один раз солевым раствором (100 мл), сушили Na2SO4 и концентрировали до получения 23,8 г твердого белого порошка. 1N-Аллил,N-трифторацетил-2-иод-5-метоксифенэтиламин. Раствор N-трифторацетил-2-иод-5-метоксифенэтиламина (23,8 г, 63,8 ммоль) в толуоле (425 мл) последовательно обрабатывали K2CO3 (12,4 г, 89,8 ммоль), KOH (11,6 г, 207 ммоль), n-Bu4NBr (2,2 г, 6,9 ммоль) и аллилбромидом (10,7 г, 89,8 ммоль). Смесь перемешивали при 80 С в течение 3,5 ч, охлаждали до 20 С, подкисляли 10% водной HCl, разделяли и водную фазу экстрагировали простым эфиром (500 мл). Объединенные органические фазы промывали солевым раствором (200 мл), сушили Na2SO4 и концентрировали до получения 20,5 г коричневого масла. 1N-Трифторацетил-7-метокси-1-метилен-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-аллил,N-трифторацетил-2-иод-5-метоксифенэтиламина (20,5 г, 50 ммоль) в диметилформамиде (250 мл) обрабатывали KOAc (14,6 г, 149 ммоль), n-Bu4NBr (16,0 г, 50 ммоль), PPh3 (1,3 г, 5,0 ммоль), Pd(OAc)2 (0,56 г, 2,5 ммоль) и перемешивали в течение ночи при 90 С. Смесь продуктов охлаждали до 20 С, фильтровали, растворяли в воде (500 мл) и экстрагировали простым эфиром (3500 мл). Объединенные органические фазы промывали водой (100 мл), солевым раствором (100 мл), сушилиN-Трифторацетил-7-метокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-метокси-1-метилен-2,3,4,5-тригидро-1H-3-бензазепина (6,6 г, 23,2 ммоль) в этаноле (100 мл) обрабатывали 10% Pd/C (0,75 г, 2,3 ммоль) и перемешивали в течение ночи в атмосфере водорода. Смесь продуктов фильтровали через слой целита и оксида кремния и растворитель удаляли до получения 6,27 г твердого белого вещества. 1 Н ЯМР (400 МГц, CDCl3, смесь ротамеров)7,10 (м, 1 Н), 6,74 (м, 1 Н), 6,68 (м, 1 Н), 4,1-3,8 (шир.м,2 Н), 3,8 (с, 3 Н), 3,5 (м, 1,5 Н), 3,4 (м, 0,5 Н), 3,2-2,9 (шир.м, 4 Н), 1,32 (м, 3 Н).N-Трифторацетил-8-бром-7-метокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (1,25 г, 4,35 ммоль) в ацетонитриле (40 мл) обрабатывали N-бромсукцинимидом (0,8 52 г, 4,79 ммоль) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в EtOAc (200 мл), промывали насыщенным водным бисульфитом натрия (100 мл) и солевым раствором (100 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографией (15% EtOAc в гексане, оксид кремния) получали 1,55 г прозрачного масла. 1- 17015012 при 20 С. Смесь продуктов растворяли в воде (100 мл), дважды экстрагировали EtOAc (100 мл), объединенные органические фазы промывали солевым раствором (100 мл), сушили Na2SO4 и концентрировали до получения 0,687 г прозрачного масла. 1N-Трифторацетил-8-хлор-7-метокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (0,900 г, 2,67 ммоль) в ацетонитриле (30 мл) обрабатывали N-хлорсукцинимидом (0,357 г, 2,67 ммоль) и перемешивали в течение ночи при 70 С. Смесь продуктов растворяли в воде (100 мл), дважды экстрагировали EtOAc(100 мл), объединенные органические фазы промывали солевым раствором (100 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографией (20% EtOAc в гексане, оксид кремния) получали 0,399 г прозрачного масла. 1 Н ЯМР (400 МГц, CDCl3, смесь ротамеров)7,17 (с, 1 Н), 6,68 (м, 1 Н), 3,88 (с, 3 Н), 3,78 (м, 1 Н),3,6-3,3 (м, 2 Н), 3,2-2,9 (м, 4 Н), 1, 34 (м, 3 Н).MS, рассчитанный для C14H15ClF3NO2+H: 322, наблюдаемый: 322. 8-Хлор-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-8-хлор 7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (0,399 г,1,24 ммоль) в метаноле (20 мл) обрабатывали 15% водным NaOH (20 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (100 мл), дважды экстрагировали EtOAc (100 мл), объединенные органические фазы промывали солевым раствором (100 мл), сушили Na2SO4 и концентрировали до получения 0,306 г желтого твердого вещества. 1N-Трифторацетил-8-иод-7-метокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (1,50 г, 5,22 ммоль) в метаноле (70 мл) обрабатывали СаСО 3 (1,06 г, 10,44 ммоль), затем раствором ICl (1,70 г, 10,44 ммоль) в метаноле (10 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов фильтровали,концентрировали, растворяли в EtOAc (200 мл), дважды экстрагировали 5% водным бисульфитом натрия(100 мл), один раз солевым раствором (100 мл), сушили Na2SO4 и концентрировали. Флэшхроматографией (15% EtOAc в гексане, оксид кремния) получали 1,54 г твердого белого вещества. 1MS, рассчитанный для C14H15F3INO2+H: 414, наблюдаемый: 414. 8-Иод-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-8-иод-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (0,600 г,1,45 ммоль) в метаноле (20 мл) обрабатывали 15% водным NaOH (20 мл) и перемешивали в течение 3 ч при 50 С. Смесь продуктов растворяли в воде (100 мл), дважды экстрагировали EtOAc (100 мл), объединенные органические фазы промывали солевым раствором (100 мл), сушили Na2SO4 и концентрировали до получения 0,425 г желтого твердого вещества. 1- 18015012 Раствор N-трифторацетил-8-бром-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (1,50 г,4,10 ммоль) в дихлорметане (80 мл) обрабатывали по каплям BBr3 (9,4 мл 1,0 М раствора в CH2Cl2, 9,4 ммоль) и смесь перемешивали в течение ночи при нагревании до 20 С. Избыток BBr3 инактивировали,добавляя по каплям воду, смесь растворяли в простом эфире (200 мл), промывали Na2CO3 (100 мл) и солевым раствором (100 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографией (15% EtOAc в гексане, оксид кремния) получали 1,25 г пены твердого белого вещества. 1H ЯМР (400 МГц, CDCl3, смесь ротамеров)7,25 (с, 1 Н), 6,79 (м, 1 Н), 3,79 (м, 1 Н), 3,7-3,3 (м, 2 Н),3,2-2,8 (м, 4 Н), 1,32 (м, 3 Н). 8-Бром-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-бром-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (0,655 г,1,89 ммоль) в метаноле (20 мл) обрабатывали 15% водным NaOH (20 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (100 мл), дважды экстрагировали EtOAc (100 мл), объединенные органические фазы промывали солевым раствором (100 мл), сушили Na2SO4 и концентрировали до получения 0,460 г прозрачного масла. 1N-Трифторацетил-7-аллилокси-8-бром-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-бром-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (0,150 г,0,426 ммоль) в дихлорметане (5 мл) обрабатывали аллилбромидом (0,155 г, 1,28 ммоль) и DBU (0,195 г,1,28 ммоль) и затем перемешивали 2 ч при 20 С. Смесь продуктов растворяли в EtOAc (50 мл), промывали 5% водной HCl (20 мл), солевым раствором (20 мл), сушили Na2SO4 и концентрировали. Флэшхроматографией (15% EtOAc в гексане, оксид кремния) получали 0,149 г прозрачного масла. 1 Н ЯМР (400 МГц, CDCl3, смесь ротамеров)7,34 (с, 1 Н), 6,65 (м, 1 Н), 6,04 (м, 1 Н), 5,47 (д, J=17 Гц, 1 Н), 5,30 (д, J=9 Гц, 1 Н), 4,59 (с, 2 Н), 3,80 (м, 1 Н), 3,6-3,3 (м, 3 Н), 3,2-2,8 (м, 4 Н), 1,31 (м, 3 Н).MS, рассчитанный для C16H17BrF3NO2+H: 392, наблюдаемый: 392. 7-Аллилокси-8-бром-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-аллилокси-8-бром-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (1,18 г,3,00 ммоль) в метаноле (35 мл) обрабатывали 15% водным NaOH (35 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (200 мл), дважды экстрагировали EtOAc (200 мл), объединенные органические фазы промывали солевым раствором (100 мл), сушили Na2SO4 и концентрировали до получения 0,880 г прозрачного масла. 1N-Трифторацетил-7-бензилокси-8-бром-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-бром-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепина (0,075 г,0,213 ммоль) в дихлорметане (5 мл) обрабатывали бензилбромидом (0,072 г, 0,64 ммоль), DBU (0,100 г,0,64 ммоль) и перемешивали 2 ч при 20 С. Смесь продуктов растворяли в EtOAc (50 мл), промывали 5% водной HCl (20 мл), солевым раствором (20 мл), сушили Na2SO4 и концентрировали. Флэшхроматографией (15% EtOAc в гексане, оксид кремния) получали 0,081 г прозрачного масла.MS, рассчитанный для C20H19BrF3NO2+H: 442, наблюдаемый: 442. 7-Бензилокси-8-бром-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-7-бензилокси-8-бром-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (0,81 г, 1,83 ммоль) в метаноле (20 мл) обрабатывали 15% водным NaOH (20 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (200 мл), дважды экстрагировали EtOAc (200 мл),объединенные органические фазы промывали солевым раствором (100 мл), сушили Na2SO4 и концентрировали до получения 0,412 г прозрачного масла. 1N-Трифторацетил-8-бром-7-этокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-бром-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (0,015 г,0,043 ммоль) в дихлорметане (1 мл) обрабатывали этилиодидом (0,016 г, 0,102 ммоль), DBU (0,016 г,0,102 ммоль) и перемешивали 2 ч при 20 С. Смесь продуктов растворяли в EtOAc (10 мл), промывали 5% водной HCl (5 мл), солевым раствором (5 мл), сушили Na2SO4 и концентрировали. Флэшхроматографией (15% EtOAc в гексане, оксид кремния) получали 0,010 г прозрачного масла. 8-Бром-7-этокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-бром-7-этокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (0,010 г,0,026 ммоль) в метаноле (1 мл) обрабатывали 15% водным NaOH (1 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (3 мл), дважды экстрагировали EtOAc (5 мл), объединенные органические фазы промывали солевым раствором (3 мл), сушили Na2SO4 и концентрировали до получения 0,007 г прозрачного масла. 1(0,048 г, 0,205 ммоль) и перемешивали 2 ч при 20 С. Смесь продуктов растворяли в EtOAc (10 мл), промывали 5% водной HCl (5 мл), солевым раствором (5 мл), сушили Na2SO4 и концентрировали. Флэшхроматографией (15% EtOAc в гексане, оксид кремния) получали 0,014 г прозрачного масла.(0,014 г, 0,035 ммоль) в метаноле (1 мл) обрабатывали 15% водным NaOH (1 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (3 мл), дважды экстрагировали EtOAc (5 мл),объединенные органические фазы промывали солевым раствором (3 мл), сушили Na2SO4 и концентрировали до получения 0,008 г прозрачного масла. 1 Раствор 8-бром-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (6 мг, 0,022 ммоль) в метаноле (1 мл) обрабатывали избытком параформальдегида, 1,0M HCl в простом эфире (0,004 мл, 0,004 ммоль), NaBH3CN (1,0 мг, 0,013 ммоль) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в 5% водном NaOH (5 мл), экстрагировали 3 раза CH2Cl2 (5 мл каждый раз), объединенные органические фазы сушили Na2SO4 и концентрировали. Флэш-хроматографией (10% MeOH в CH2Cl2, оксид кремния) получали 5 мг прозрачного масла. 1 Раствор 8-бром-7-метокси-1-метил-1,2,4,5-тетрагидро-3H-3-бензазепина (6 мг, 0,022 ммоль) в метаноле (1 мл) обрабатывали пропионовым альдегидом (5,0 мг, 0,067 ммоль), 1,0 М HCl в простом эфире(0,004 мл, 0,004 ммоль), NaBH3CN (1,0 мг, 0,013 ммоль) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в 5% водном NaOH (5 мл), экстрагировали 3 раза CH2Cl2 (5 мл каждый раз), объединенные органические фазы сушили Na2SO4 и концентрировали. Флэш-хроматографией (10% МеОН вN-Трифторацетил-7-гидрокси-8-иод-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-иод-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (80 мг,0,19 ммоль) в дихлорметане (3 мл) обрабатывали BBr3 (0,40 мл 1,0 М раствора в CH2Cl2, 0,40 ммоль) и перемешивали в течение ночи при 20 С. Избыток BBr3 инактивировали водой и смесь продуктов растворяли в простом эфире (20 мл), промывали Na2CO3 (10 мл) и солевым раствором (10 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографией (15% EtOAc в гексане, оксид кремния) получали 74 мг твердого белого вещества.MS, рассчитанный для C13H13F3INO2+H: 400, наблюдаемый: 400. 7-Гидрокси-8-иод-1-метил-1,2,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-гидрокси-8-иод-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (25 мг,0,063 ммоль) в метаноле (2 мл) обрабатывали 15% водным NaOH (2 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (5 мл), дважды экстрагировали EtOAc (5 мл), объединенные органические фазы промывали солевым раствором (5 мл), сушили Na2SO4 и концентрировали до получения 13 мг твердого белого вещества. 1 Н ЯМР (400 МГц, CD3OD)7,46 (с, 1 Н), 6,64 (с, 1 Н), 3,16 (м, 3 Н), 2,94 (м, 3 Н), 2,81 (м, 1 Н), 1,35 (д,J=7 Гц, 3 Н).N-Трифторацетил-7-аллилокси-8-иод-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-гидрокси-8-иод-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (30 мг,0,075 ммоль) в дихлорметане (2 мл) обрабатывали аллилбромидом (18 мг, 0,15 ммоль), DBU (23 мг, 0,15 ммоль) и перемешивали 2 ч при 20 С. Смесь продуктов растворяли в EtOAc (10 мл), промывали 5% водной HCl (5 мл), солевым раствором (5 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографиейMS, рассчитанный для C16H17F3INO2+H: 440, наблюдаемый: 440. 7-Аллилокси-8-иод-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-аллилокси-8-иод-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (23 мг,0,058 ммоль) в метаноле (2 мл) обрабатывали 15% водным NaOH (2 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (5 мл), дважды экстрагировали EtOAc (5 мл), объединенные органические фазы промывали солевым раствором (5 мл), сушили Na2SO4 и концентрировали до получения 18 мг твердого белого вещества.- 21015012 Раствор N-трифторацетил-7-аллилокси-8-иод-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (158 мг,0,360 ммоль) в диметилформамиде (4 мл) обрабатывали KOAc (106 мг, 1,08 ммоль), n-Bu4NBr (116 мг,0,360 ммоль), PPh3 (13 мг, 0,036 ммоль), Pd(OAc)2 (4 мг, 0,018 ммоль) и перемешивали в течение ночи при 100 С. Смесь продуктов фильтровали, добавляли воду (10 мл) и затем дважды экстрагировали EtOAc(10 мл). Объединенные органические фазы промывали солевым раствором (10 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографией (5% EtOAc в гексане, оксид кремния) получали 15 мг прозрачного масла.MS, рассчитанный для C16H16F3NO2+H: 312, наблюдаемый: 312. 3,5-Диметил-6,7,8,9-тетрагидро-5H-1-окса-7-аза-циклогептаинден. Раствор N-трифторацетил-3,5-диметил-6,7,8,9-тетрагидро-5 Н-1-окса-7-аза-циклогептаиндена (15 мг,0,048 ммоль) в метаноле (2 мл) обрабатывали 15% водным NaOH (2 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (5 мл), дважды экстрагировали EtOAc (5 мл), объединенные органические фазы промывали солевым раствором (5 мл), сушили Na2SO4 и концентрировали до получения 10 мг твердого белого вещества. 1 Н ЯМР (400 МГц, CDCl3)7,25 (с,1 Н), 7,12 (с, 1 Н), 7,09 (с, 1 Н), 3,12 (м, 1 Н), 2,97 (м, 4 Н), 2,85 (м,1 Н), 2,64 (шир.м, 1 Н), 2,15 (с, 3 Н), 1,34 (д, J=8 Гц, 3 Н).N-Трифторацетил-8-хлор-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-хлор-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (48 мг,0,15 ммоль) в дихлорметане (2 мл) обрабатывали BBr3 (0,30 мл 1,0 М раствора в CH2Cl2, 0,30 ммоль) и перемешивали в течение ночи при 20 С. Избыток BBr3 инактивировали водой и полученную смесь растворяли в простом эфире (20 мл), промывали Na2CO3 (10 мл) и солевым раствором (10 мл), сушилиNa2SO4 и концентрировали. Флэш-хроматографией (15% EtOAc в гексане, оксид кремния) получали 24 мг твердого белого вещества.N-Трифторацетил-7-аллилокси-8-хлор-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-хлор-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (24 мг,0,078 ммоль) в дихлорметане (2 мл) обрабатывали аллилбромидом (18 мг, 0,15 ммоль), DBU (23 мг, 0,15 ммоль) и перемешивали 2 ч при 20 С. Смесь продуктов растворяли в EtOAc (10 мл), промывали 5% водной HCl (5 мл), солевым раствором (5 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографией(15% EtOAc в гексане, оксид кремния) получали 23 мг твердого белого вещества.MS, рассчитанный для C16H17CIF3NO2+H: 348, наблюдаемый: 348. 7-Аллилокси-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-7-аллилокси-8-хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (23 мг,0,066 ммоль) в метаноле (2 мл) обрабатывали 15% водным NaOH (2 мл) и перемешивали в течение ночи при 20C. Смесь продуктов растворяли в воде (5 мл), дважды экстрагировали EtOAc (5 мл), объединенные органические фазы промывали солевым раствором (5 мл), сушили Na2SO4 и концентрировали до получения 19 мг твердого белого вещества. 1N-Трифторацетил-7-метокси-1-метил-8-(2-тиенил)-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторметилацетил-8-бром-7-метокси-1-метил-1,2,4,5-тетрагидро-3H-3-бензазепина (51 мг, 0,14 ммоль) в 1,4-диоксане (2 мл) обрабатывали тиофен-2-бороновой кислотой (36 мг, 0,28 ммоль),K2CO3 (58 мг, 0,42 ммоль), водой (0,1 мл), Pd(PPh3)4 (16 мг, 0,014 ммоль) и перемешивали в течение ночи при 100 С. Смесь продуктов растворяли в EtOAc, фильтровали, адсорбировали на оксиде кремния и очищали флэш-хроматографией (10% EtOAc в гексане, оксид кремния), получая 28 мг желтого твердого вещества.- 22015012 50 С. Смесь продуктов растворяли в воде (5 мл), дважды экстрагировали EtOAc (5 мл), объединенные органические фазы промывали солевым раствором (5 мл), сушили Na2SO4 и концентрировали до получения 18 мг желтого масла. 1 Н ЯМР (400 МГц, CDCl3)7,45 (д, J=4 Гц, 1 Н), 7,39 (с, 1 Н), 7,27 (д, J=6 Гц, 1 Н), 7,07 (дд, J=4, 6 Гц,1 Н), 6,71 (с, 1 Н), 3,90 (с, 3 Н), 3,1-2,9 (м, 6 Н), 2,80 (м, 1 Н), 2,22 (шир.с, 1 Н), 1,38 (д, J=7 Гц, 3 Н).N-Трифторацетил-8-циано-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-8-бром-7-метокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепина (18 мг,0,05 ммоль) в диметилформамиде (1 мл) обрабатывали CuCN (20 мг, 0,24 ммоль) и смесь обрабатывали микроволнами при 200 С в течение 0,5 ч. Смесь продуктов растворяли в воде (5 мл), дважды экстрагировали EtOAc (5 мл), объединенные органические фазы промывали солевым раствором (5 мл), сушилиMS, рассчитанный для C15H15F3N2O2+H: 313, наблюдаемый: 313. 8-Циано-7-метокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-циано-7-метокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (10 мг,0,032 ммоль) в метаноле (2 мл) обрабатывали 15% водным NaOH (2 мл) и перемешивали 1 ч при 50 С. Смесь продуктов растворяли в воде (5 мл), дважды экстрагировали EtOAc (5 мл), объединенные органические фазы промывали солевым раствором (5 мл), сушили Na2SO4 и концентрировали до получения 6,0 мг твердого белого вещества. 1N-Трифторацетил-1-циклопропил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор диэтилцинка (1 мл, 1M в гексане) в дихлорметане (1 мл) при 0 С обрабатывали трифторуксусной кислотой в дихлорметане (0,5 мл) и смесь перемешивали в течение 15 мин. Затем добавляли дииодметан (0,280 г, 1,0 ммоль) в дихлорметане (0,5 мл) и перемешивали в течение 15 мин. Добавляли Nтрифторацетил-7-метокси-1-метилен-2,3,4,5-тетрагидро-1H-3-бензазепин (0,075 г, 0,26 ммоль) в дихлорметане (1 мл) и смесь перемешивали в течение 30 мин при 0 С и затем в течение 2 ч при 20 С. Смесь продуктов инактивировали водным насыщенным NH4Cl (5 мл), дважды экстрагировали CH2Cl2 (20 мл),промывали насыщенным водным NaHCO3 (10 мл), промывали Н 2 О (10 мл) и концентрировали. Флэшхроматографией (7% EtOAc в гексане, оксид кремния) получали 0,050 г твердого белого вещества.N-Трифторацетил-8-бром-1-циклопропил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-1-циклопропил-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепина (0,025 г,0,08 ммоль) в ацетонитриле (1 мл) обрабатывали N-бромсукцинимидом (0,032 г, 0,18 ммоль) и перемешивали в течение 2 ч при 50 С. Смесь продуктов концентрировали и затем очищали флэшхроматографией (10% EtOAc в гексане, оксид кремния), получая 0,014 г твердого белого вещества.(0,014 г, 0,037 ммоль) в метаноле (1 мл) обрабатывали 15% водным NaOH (1 мл) и перемешивали в течение 2 ч при 50 С. Смесь продуктов растворяли в солевом растворе (10 мл), дважды экстрагировалиEtOAc (10 мл), сушили MgSO4 и концентрировали до получения 0,008 г прозрачного масла. 1 Н ЯМР (400 МГц, CD3OD)7,26 (с, 1 Н), 6,78 (с, 1 Н), 3,83 (с, 3 Н), 3,02 (м, 2 Н), 2,92 (м, 2 Н), 2,67 (с,2 Н), 0,91 (м, 2 Н), 0,85 (м, 2 Н).N-Трифторацетил-1-гидроксиметил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-метокси-1-метилен-2,3,4,5-тетрагидро-1H-3-бензазепина (0,100 г, 0,35 ммоль) в тетрагидрофуране (1 мл) обрабатывали комплексом BH3-THF (0,36 мл, 1M в THF) и перемешивали в течение 30 мин при 20 С. Последовательно добавляли воду (0,5 мл), насыщенный водный NaHCO3 (0,5 мл) и 30% Н 2 О 2 (0,2 мл) и реакционную смесь перемешивали в течение 30 мин при 20 С. Смесь продуктов растворяли вEtOAc (10 мл), промывали солевым раствором (10 мл) и концентрировали. Флэш-хроматографией (33%(0,035 г, 0,12 ммоль ) в ацетонитриле (1 мл) обрабатывали N-бромсукцинимидом (0,025 г, 0,14 ммоль) и перемешивали в течение 30 мин при 20 С. Смесь продуктов концентрировали и затем очищали флэшхроматографией (33% EtOAc в гексане, оксид кремния), получая 0,019 г прозрачного масла.(0,009 г, 0,024 ммоль) в метаноле (1 мл) обрабатывали 15% водным NaOH (1 мл) и перемешивали в течение 1 ч при 50 С. Смесь продуктов растворяли в солевом растворе (5 мл), дважды экстрагировали EtOAc(5 мл), сушили MgSO4 и концентрировали до получения 0,006 г прозрачного масла. 1N-Кротил,N-трифторацетил-2-иод-5-метоксифенэтиламин. Раствор N-трифторацетил-2-иод-5-метоксифенэтиламина (6,68 г, 17,9 ммоль) в толуоле (100 мл) обрабатывали K2CO3 (3,22 г, 23,3 ммоль), KOH (3,01 г, 53,7 ммоль), n-Bu4NBr (0,580 г, 1,80 ммоль) и бромидом кротила (3,15 г, 23,3 ммоль). Смесь перемешивали при 75 С в течение 16 ч, охлаждали до 20 С, растворяли Et2O (500 мл), промывали 10% водной HCl (500 мл) и концентрировали. Флэш-хроматографией (10% EtOAc в гексане, оксид кремния) получали 5,22 г прозрачного масла.N-Трифторацетил-1-этилен-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-кротил,N-трифторацетил-2-иод-5-метоксифенэтиламина (5,20 г, 12,2 ммоль) в диметилформамиде (80 мл) обрабатывали KOAc (3,59 г, 36,6 ммоль), n-Bu4NBr (3,93 г, 12,2 ммоль), PPh3 (0,320 г,1,22 ммоль), Pd(OAc)2 (0,137 г, 0,61 ммоль) и перемешивали в течение ночи при 90 С. Смесь продуктов охлаждали до 20 С, растворяли в воде (200 мл), дважды экстрагировали простым эфиром (500 мл), объединенные органические фазы дважды промывали солевым раствором (200 мл) и концентрировали. Флэш-хроматографией (10% EtOAc в гексане, оксид кремния) получали 2,29 г прозрачного масла, состоящего из смеси изомеров олефинов.N-Трифторацетил-1-этил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-1-этилен-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепина (2,29 г, 7,65 ммоль) в метаноле (100 мл) обрабатывали 10% Pd/C (4,0 г, 0,77 ммоль и перемешивали в течение ночи в атмосфере водорода. Смесь продуктов фильтровали через слой целита и оксида кремния и удаляли растворитель до получения 2,14 г прозрачного масла.N-Трифторацетил-8-бром-1-этил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторолацетил-1-этил-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепина (0,710 г, 2,36 ммоль) в ацетонитриле (20 мл) обрабатывали N-бромсукцинимидом (0,504 г, 2,83 ммоль) и перемешивали в течение ночи при 20 С. Смесь продуктов концентрировали, растворяли EtOAc (100 мл), промывали водой (50 мл) и солевым раствором (50 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографиейMS, рассчитанный для C15H17BrF3NO2+H: 380, наблюдаемый: 380. 8-Бром-1-этил-1-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-бром-1-этил-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепина (0,561 г,1,48 ммоль) в метаноле (30 мл) обрабатывали 15% водным NaOH (30 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в солевом растворе (100 мл), дважды экстрагировали EtOAc (200 мл), сушили MgSO4 и концентрировали до получения 0,412 г прозрачного масла. 1 Н ЯМР (400 МГц, CD3OD)7,24 (с, 1 Н), 6,76 (с, 1 Н), 3,83 (с, 3 Н), 3,02 (м, 3 Н), 2,91 (с, 1 Н), 2,852,76 (м, 3 Н), 2,63 (м, 1 Н), 1,78 (м, 1 Н), 1,72 (м, 1 Н), 0,94 (дд, J=8,8 Гц, 3 Н).N-Трифторацетил-8-хлор-1-этил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-1-этил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепина (0,600 г, 1,99 ммоль) в ацетонитриле (20 мл) обрабатывали N-хлорсукцинимидом (0,057 г, 0,32 ммоль) и перемешивали в течение ночи при 60 С. Смесь продуктов концентрировали, растворяли EtOAc (100 мл), промывали водой (50 мл) и солевым раствором (50 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографиейMS, рассчитанный для C15H17ClF3NO2+H: 336, наблюдаемый: 336. 8-Хлор-1-этил-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-8-хлор-1-этил-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепина (0,421 г,1,25 ммоль) в метаноле (30 мл) обрабатывали 15% водным NaOH (30 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в солевом растворе (100 мл), дважды экстрагировали EtOAc (200 мл), сушили MgSO4 и концентрировали до получения 0,241 г прозрачного масла. 1N-(3-Метилбут-2-енил),N-трифторацетил-2-иод-5-метоксифенэтиламин. Раствор N-трифторацетил-2-иод-5-метоксифенэтиламина (0,700 г, 1,88 ммоль) в толуоле (25 мл) обрабатывали K2CO3 (0,340 г, 2,4 ммоль), KOH (0,210 г, 3,76 ммоль), n-Bu4NBr (0,060 г, 0,19 ммоль) и 4 бром-2-метил-2-бутеном (0,364 г, 2,4 4 ммоль). Смесь перемешивали при 80 С в течение 3 ч, охлаждали до 20 С, растворяли в простом эфире (100 мл), промывали 10% HCl (50 мл) и концентрировали. Флэшхроматографией (10% EtOAc в гексане, оксид кремния) получали 0,272 г прозрачного масла. 1N-Трифторацетил-1-изопропилен-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-(3-метилбут-2-енил),N-трифторацетил-2-иод-5-метоксифенэтиламина (0,0272 г, 0,62 ммоль) в диметилформамиде (12 мл) обрабатывали KOAc (0,183 г, 1,86 ммоль), n-Bu4NBr (0,200 г, 0,062 ммоль), PPh3 (0,016 г, 0,062 ммоль), Pd(OAc)2 (0,183 г, 1,86 ммоль) и перемешивали в течение ночи при 90 С. Смесь продуктов охлаждали до 20 С, растворяли в воде (50 мл), дважды экстрагировали простым эфиром (50 мл), объединенные органические фазы промывали солевым раствором (50 мл) и концентрировали. Флэш-хроматографией (10% EtOAc в гексане, оксид кремния) получали 0,096 г прозрачного масла.N-Трифторацетил-1-изопропил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-1-изопропилен-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепина (0,096 г,0,31 ммоль) в этаноле (2 мл) обрабатывали 10% Pd/C (0,033 г, 0,031 ммоль и перемешивали в течение ночи в атмосфере водорода. Смесь продуктов фильтровали через слой целита и оксида кремния и растворитель удаляли до получения 0,091 г прозрачного масла.- 25015012 Раствор N-трифторолацетил-1-изопропил-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепина (0,091 г,0,29 ммоль) в ацетонитриле (3 мл) обрабатывали N-бромсукцинимидом (0,057 г, 0,32 ммоль) и перемешивали в течение ночи при 20 С. После удаления растворителя флэш-хроматографией (10% EtOAc в гексане, оксид кремния) получали 0,056 г прозрачного масла.(0,013 г, 0,03 ммоль) в метаноле (0,5 мл) обрабатывали 15% водным NaOH (0,5 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в солевом растворе (5 мл), дважды экстрагировалиEtOAc (5 мл), сушили MgSO4 и концентрировали до получения 0,10 г прозрачного масла. 1(0,041 г, 0,10 ммоль) в дихлорметане (1 мл) обрабатывали BBr3 (0,32 мл, 1,0 М раствор в CH2Cl2) и перемешивали в течение ночи при 20 С. Избыток BBr3 инактивировали водой и полученную смесь растворяли в простом эфире (50 мл), дважды промывали насыщенным водным Na2CO3 (20 мл) и концентрировали. Флэш-хроматографией (20% EtOAc в гексане, оксид кремния) получали 0,037 г прозрачного масла.(0,018 г, 0,047 ммоль) в метаноле (1 мл) обрабатывали 15% водным NaOH (1 мл) и перемешивали в течение 3 ч при 50 С. В смеси продуктов доводили рН до 7-8 10% водной HCl, экстрагировали три разаEtOAc (50 мл), сушили MgSO4 и концентрировали до получения 0,013 г твердого белого вещества. 1(0,017 г, 0,045 ммоль) в дихлорметане (1 мл) обрабатывали триамидом N-трет-бутил-N,N,N',N',N,Nгексаметилфосфоримидовой кислоты (0,016 г, 0,068 ммоль), аллилбромидом (0,011 г, 0,09 ммоль) и перемешивали в течение 3 ч при 20 С. Смесь продуктов растворяли в 10% водной HCl, дважды экстрагировали дихлорметаном (20 мл) и концентрировали. Флэш-хроматографией (10% EtOAc в гексане, оксид кремния) получали 0,011 г прозрачного масла.(0,011 г, 0,026 ммоль) в метаноле (0,5 мл) обрабатывали 15% водным NaOH (0,5 мл) и перемешивали в течение 3 ч при 50 С. Смесь продуктов растворяли в солевом растворе (5 мл), дважды экстрагировалиEtOAc (5 мл), сушили MgSO4 и концентрировали до получения 0,010 г прозрачного масла. 1N-Трифторацетил-1-(3-метоксифенил)-2-пропиламин. Раствор 1-(3-метоксифенил)-2-пропиламина (3,59 г, 21,7 ммоль) в дихлорметане (75 мл) при 0 С обрабатывали пиридином (2,1 мл, 28,2 ммоль), трифторуксусным ангидридом (5,9 г, 28,2 ммоль) и затем перемешивали в течение 3 ч при нагревании до 20C. Смесь продуктов растворяли в EtOAc (300 мл), последовательно промывали 10% водной HCl (100 мл), водой (100 мл), солевым раствором (100 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографией (20% EtOAc в гексане, оксид кремния) получали 4,29 г желтого твердого вещества. 1N-Трифторацетил-1-(2-иод-5-метоксифенил)-2-пропиламин. Раствор N-трифторацетил-1-(3-метоксифенил)-2-пропиламина (4,29 г, 15,7 ммоль) в метаноле (100 мл) охлаждали до -78C и обрабатывали СаСО 3 (3,17 г, 31,4 ммоль), затем раствором ICl (6,37 г, 39,3 ммоль) в метаноле (50 мл). Реакционной смеси позволяли нагреваться до 20 С при перемешивании в течение ночи. Смесь продуктов фильтровали, концентрировали, растворяли в EtOAc (200 мл), дважды промывали 5% водным бисульфитом натрия (100 мл), один раз солевым раствором (100 мл), сушили Na2SO4 и концентрировали до получения 6,72 г твердого белого порошка.(450 мл) обрабатывали K2CO3 (2,82 г, 20,4 ммоль), KOH (2,45 г, 47,1 ммоль), n-Bu4NBr (0,506 г, 1,57 ммоль) и аллилбромидом (2,47 г, 20,4 ммоль) и перемешивали в течение ночи при 80 С. Смесь продуктов подкисляли 10% водной HCl, разделяли, водную фазу экстрагировали простым эфиром (500 мл), объединенные органические фазы промывали солевым раствором (200 мл), сушили Na2SO4 и концентрировали до получения 4,45 г коричневого масла.N-Трифторацетил-7'-метокси-4-метил-1-метилен-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-аллил,N-трифторацетил-1-(2-иод-5-метоксифенил)-2-пропиламина (4,45 г, 10,8 ммоль) в диметилформамиде (120 мл) обрабатывали KOAc (3,17 г, 32,3 ммоль), n-Bu4NBr (3,47 г, 10,8 ммоль),PPh3 (0,283 г, 1,08 ммоль), Pd(OAc)2 (0,242 г, 1,08 ммоль) и перемешивали в течение ночи при 80 С. Смесь продуктов охлаждали до 20 С, фильтровали, растворяли в воде (200 мл), экстрагировали простым эфиром (3200 мл), объединенные органические фазы промывали водой (100 мл), солевым растворомN-Трифторацетил-1,4-диметил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-7-метокси-4-метил-1-метилен-2,3,4,5-тетрагидро-1H-3-бензазепина (1,39 г, 4,64 ммоль) в этаноле (40 мл) обрабатывали 10% Pd/C (0,49 г, 0,46 ммоль) и перемешивали в течение ночи в атмосфере водорода. Смесь продуктов фильтровали через слой целита и оксида кремния и затем концентрировали. Флэш-хроматографией (20% EtOAc в гексане, оксид кремния) получали 0,77 г прозрачного масла. 1 Н ЯМР (400 МГц, CDCl3, смесь ротамеров)7,06 (м, 1 Н), 6,71 (м, 1 Н), 6,63 (м, 1 Н), 4,38 (шир.м,1 Н), 3,8 (с, 3 Н), 3,6 (м, 1 Н), 3,25 (м, 1 Н), 3,18 (шир.м, 2 Н), 2,72 (м, 1 Н), 1,34 (м, 3 Н), 1,22 (м, 3 Н).N-Трифторацетил-8-бром-1,4-диметил-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-1,4-диметил-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепина (0,452 г, 1,50 ммоль) в ацетонитриле (20 мл) обрабатывали N-бромсукцинимидом (0,294 г, 1,65 ммоль) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в EtOAc (100 мл), промывали бисульфитом натрия (50 мл) и солевым раствором (50 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографией(20% EtOAc в гексане, оксид кремния) получали прозрачное масло. 1 Н ЯМР (400 МГц, CDCl3, смесь ротамеров)7,32 (с, 1 Н), 6,62 (м, 1 Н), 4,37 (м, 1 Н), 3,87 (с, 3 Н),3,81 (м, 1 Н), 3,28-3,10 (м, 3 Н), 2,73 (м, 1 Н), 1,31 (м, 3 Н), 1,25 (м, 3 Н). 8-Бром-1,4-диметил-7-метокси-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-трифторацетил-8-бром-1,4-диметил-7-метокси-2,3,4,5-тетрагидро-1H-3-бензазепина (21 мг, 0,055 ммоль) в метаноле (2 мл) обрабатывали 15% водным NaOH (2 мл) и перемешивали в течение ночи при 20 С. Смесь продуктов растворяли в воде (5 мл), дважды экстрагировали EtOAc (10 мл), объединенные органические фазы промывали солевым раствором (10 мл), сушили Na2SO4 и концентрировали до получения 11 мг прозрачного масла. 1(0,383 г, 1,01 ммоль) в дихлорметане (30 мл) обрабатывали BBr3 (2,35 мл 1,0 М раствора в CH2Cl2, 2,35 ммоль) и перемешивали в течение ночи при нагревании до 20 С. Избыток BBr3 инактивировали водой и полученную смесь растворяли в простом эфире (100 мл), промывали насыщенным водным Na2CO3 (50 мл) и солевым раствором (50 мл), сушили Na2SO4 и концентрировали. Флэш-хроматографией (15%(0,037 г, 0,246 ммоль) и перемешивали 2 ч при 20 С. Смесь продуктов растворяли в EtOAc (10 мл), промывали 5% водной HCl (2 мл), солевым раствором (5 мл), сушили Na2SO4 и концентрировали. Флэшхроматографией (15% EtOAc в гексане, оксид кремния) получали 0,028 г прозрачного масла. 1 Н ЯМР (400 МГц, CDCl3, смесь ротамеров)7,32 (с, 1 Н), 6,62 (м, 1 Н), 6,02 (м, 1 Н), 5,45 (д, J=17 Гц, 1 Н), 5,30 (д, J=11 Гц, 1 Н), 4,58 (с, 2 Н), 4,36 (м, 1 Н), 3,62 (м, 1 Н), 3,23 (м, 1 Н), 3,11 (м, 1 Н), 2,81 (д,J=10 Гц, 1 Н), 2,70 (м, 1 Н), 1,34 (м, 3 Н), 1,21 (м, 3 Н). 7-Аллилокси-8-бром-1,4-диметил-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор(0,028 г, 0,069 ммоль) в метаноле (2 мл) обрабатывали 15% водным NaOH (2 мл) и перемешивали в течение 3 ч при 20 С. Смесь продуктов растворяли в воде (10 мл), дважды экстрагировали EtOAc (10 мл),объединенные органические фазы промывали солевым раствором (10 мл), сушили Na2SO4 и концентрировали до получения 0,020 г прозрачного масла. 1 Н ЯМР (400 МГц, CDCl3)7,30 (с, 1 Н), 6,64 (с, 1 Н), 6,06 (м, 1 Н), 5,47 (д, J=17 Гц, 1 Н), 5,30 (д, J=11 Гц, 1 Н), 4,56 (с, 2 Н), 3,03 (м, 2 Н), 2,90 (дд, J=9,14 Гц, 1 Н), 2,80 (м, 1 Н), 2,65 (д, J=14 Гц, 1 Н), 2,55 (дд,J=10, 14 Гц, 1 Н), 1,77 (шир.с, 1 Н), 1,30 (д, J=7 Гц, 3 Н), 1,20 (д, J=6 Гц, 3 Н). Пример 26. (R,S)-8-Хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин.N-Трифторацетил-4-хлорофенэтиламин. Раствор 4-хлорофенэтиламина (1,0 г, 6,4 ммоль) в дихлорметане (20 мл) охлаждали до 0 С, обрабатывали пиридином (1,0 мл, 12,8 ммоль), трифторуксусным ангидридом (1,6 г, 7,7 ммоль) и затем перемешивали в течение 1 ч при нагревании до 20 С. Смесь продуктов растворяли в EtOAc (100 мл), последовательно промывали 10% водной HCl (50 мл), водой (50 мл), солевым раствором (50 мл), сушилиNa2SO4 и концентрировали до получения 1,6 г твердого белого вещества.N-Трифторацетил-2-иод-4-хлорофенэтиламин. Раствор N-трифторацетил-4-хлорофенэтиламина (1,6 г, 6,4 ммоль) в дихлорметане (20 мл) обрабатывали бис(пиридин)иод(I) тетрафторборатом (2,6 г, 7,0 ммоль), CF3SO3H (2,1 г, 14,1 ммоль) и перемешивали в течение ночи при 20C. Смесь продуктов концентрировали, растворяли в EtOAc (100 мл), дважды промывали 5% водным бисульфитом натрия (50 мл), дважды насыщенным водным NaHCO3, (50 мл), один раз солевым раствором (50 мл), сушили Na2SO4 и концентрировали до получения 0,94 г прозрачного масла.N-Аллил,N-трифторацетил-2-иод-4-хлорофенэтиламин. Раствор N-трифторацетил-2-иод-4-хлорофенэтиламина (0,94 г, 2,4 ммоль) в толуоле (25 мл) обрабатывали последовательно K2CO3 (0,43 г, 3,12 ммоль), KOH (0,40 г, 7,2 ммоль), n-Bu4NBr (0,077 г, 0,24 ммоль) и аллилбромидом (0,43 г, 3,6 ммоль). Смесь перемешивали при 80 С в течение 3,5 ч, охлаждали до 20 С и подкисляли 10% водной HCl. Фазы разделяли, водную фазу экстрагировали простым эфиром (100 мл), объединенные органические фазы промывали солевым раствором (50 мл), сушили Na2SO4 и концентрировали до получения 0,76 гN-Трифторацетил-8-хлор-1-метилен-2,3,4,5-тетрагидро-1 Н-3-бензазепин. Раствор N-аллил,N-трифторацетил-2-иод-4-хлорофенэтиламина (0,76 г, 1,8 ммоль) в диметилформамиде (20 мл) обрабатывали KOAc (0,53 г, 5,4 ммоль), n-Bu4NBr (0,58 г, 1,8 ммоль), PPh3 (0,047 г, 0,18 ммоль), Pd(OAc)2 (0,041 г, 0,18 ммоль) и перемешивали в течение ночи при 105 С. Смесь продуктов охлаждали до 20 С, фильтровали, растворяли в воде (100 мл), экстрагировали простым эфиром (3100 мл),объединенные органические фазы промывали водой (100 мл), солевым раствором (100 мл), сушилиMS, рассчитанный для C13H13ClF3NO+H: 292, наблюдаемый: 292. 8-Хлор-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-8-хлор-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепина (65 мг, 0,22 ммоль) в метаноле (2 мл) обрабатывали 15% водным NaOH (2 мл) и перемешивали в течение 3,5 ч при 60 С. Смесь продуктов концентрировали, экстрагировали 3 раза CH2Cl2 (5 мл), сушили Na2SO4 и концентрировали до получения 35 мг прозрачного масла. 1MS, рассчитанный для C11H14CIN+H: 196, наблюдаемый: 196. Дополнительный синтез указанного в заголовке соединения и соли HCl опубликован в публикации РСТ WO 2005/019179. Пример 27. (R,S)-7-(2-Метил-2 Н-пиразол-3-ил)-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин.N-Трифторацетил-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-7-метокси-1-метил-2,3,4,5-тетрагидро-1 Н-3-бензазепина (0,506 г, 1,76 ммоль) в дихлорметане (20 мл) обрабатывали BBr3 (4,1 мл 1,0 М раствора в CH2Cl2, 4,1 ммоль) и перемешивали в течение ночи при нагревании до 20 С. Избыток BBr3 инактивировали водой и полученную смесь растворяли в простом эфире (200 мл), промывали Na2CO3 (100 мл) и солевым раствором (100 мл),сушили Na2SO4 и концентрировали. Флэш-хроматографией (15% EtOAc в гексане, оксид кремния) получали 0,460 г пены твердого белого вещества.N-Трифторацетил-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин,О-трифторметансульфонат. Раствор N-трифторацетил-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина (460 мг, 1,76 ммоль) в дихлорметане (15 мл) обрабатывали пиридином (417 мг, 5,27 ммоль), трифторметансульфоновым ангидридом (991 мг, 3,52 ммоль) и перемешивали 1,5 ч при 20 С. Смесь продуктов растворяли в дихлорметане (100 мл), промывали водой (50 мл), 5% водной HCl (50 мл), насыщенным водным NaHCO3N-Трифторацетил-7-(2-метил-2 Н-пиразол-3-ил)-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепин. Раствор N-трифторацетил-7-гидрокси-1-метил-2,3,4,5-тетрагидро-1H-3-бензазепина, О-трифторметансульфоната (100 мг, 0,25 ммоль) в диметилформамиде (2 мл) обрабатывали (2-метил-2 Н-пиразол-3 ил)-3-н-бутилтином (138 мг, 0,37 ммоль), LiCl (21 мг, 0,50 ммоль), Pd(PPh3)2Cl2 (35 мг, 0,05 ммоль) и перемешивали при 100 С в течение 4 ч. Смесь продуктов растворяли в EtOAc (20 мл), дважды промывали водой (10 мл), один раз солевым раствором (10 мл), сушили Na2SO4 и концентрировали. Флэшхроматографией (30% EtOAc в гексане, оксид кремния) получали 80 мг прозрачного масла.
МПК / Метки
МПК: A61P 3/04, A61K 31/55, A61K 31/135
Метки: содержащая, композиция, фентермин, рецептора, избирательный, агонист, 5ht2c, применение
Код ссылки
<a href="https://eas.patents.su/30-15012-kompoziciya-soderzhashhaya-fentermin-i-izbiratelnyjj-agonist-receptora-5ht2c-i-ee-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция, содержащая фентермин и избирательный агонист рецептора 5ht2c и ее применение</a>


































