Гетероциклические соединения, применяемые для лечения воспалительных и аллергических нарушений
Номер патента: 14956
Опубликовано: 29.04.2011
Авторы: Гопалан Баласубраманиан, Каираткар-Джоши Неелима, Гарат Лаксмикант Атмарам
Формула / Реферат
1. Соединение формулы (1)
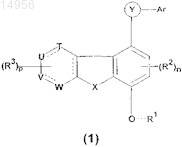
где R1представляет собой C1-С8алкил, который может содержать в качестве заместителя галоген;
каждый из R2 и R3представляет собой водород;
T представляет собой C или N;
U представляет собой C, N или NRa;
V представляет собой C, N или NRa;
W представляет собой C или C(=O) и
X представляет собой O или N(С1-С8алкил), N(C3-С12циклоалкил(C1-C8)алкил) или N(C6-С14арил(С1-C8)алкил);
каждый из Ra представляет собой независимо водород, С1-С8алкил, C3-C12циклоалкил, C6-С14арил, который может содержать в качестве заместителя галоген; или -C(O)O-Rb;
каждый из Rb представляет собой независимо С1-С8алкил;
Ar представляет собой пиридил, который может содержать в качестве заместителя галоген;
n представляет собой целое число от 0 до 2;
p представляет собой целое число от 0 до 4;
каждая пунктирная линия [----] в цикле представляет собой возможную связь и
Y представляет собой -C(O)NH;
или таутомер, региоизомер, стереоизомер, энантиомер, диастереомер, фармацевтически приемлемую соль или N-оксид указанного соединения.
2. Соединение по п.1, отличающееся тем, что Ar представляет собой пиридил или пиридил-N-оксид, который может содержать в качестве заместителя галоген.
3. Соединение по п.2, отличающееся тем, что Ar представляет собой

4. Соединение по любому из пп.1-3, отличающееся тем, что U и V представляют собой N, а T и W представляют собой C.
5. Соединение по любому из пп.1-3, отличающееся тем, что T и V представляют собой N, a U и W представляют собой C.
6. Соединение по любому из пп.1-3, отличающееся тем, что T, V и W представляют собой C и U представляет собой N.
7. Соединение по любому из пп.1-3, отличающееся тем, что T, V и W представляют собой C и U представляет собой NRa.
8. Соединение по любому из пп.1-3, отличающееся тем, что T, U и W представляют собой C и V представляет собой NRa.
9. Соединение по любому из пп.1-3, отличающееся тем, что T и U представляют собой C, V представляет собой NRa и W представляет собой -C=O.
10. Соединение по любому из пп.7-9, отличающееся тем, что Ra представляет собой водород.
11. Соединение по любому из пп.7-9, отличающееся тем, что Ra представляет собой метил.
12. Соединение по любому из пп.7-9, отличающееся тем, что Ra представляет собой -COO-трет-бутил (трет-бутилоксикарбонил).
13. Соединение по любому из пп.7-9, в котором Ra представляет собой -COOEt (-COOCH2CH3).
14. Соединение по любому из пп.1-13, отличающееся тем, что X представляет собой O.
15. Соединение по любому из пп.1-13, отличающееся тем, что X представляет собой S.
16. Соединение по любому из пп.1-15, отличающееся тем, что X представляет собой N(С1-С8алкил), N(C3-С12циклоалкил(С1-C8)алкил) или N(C6-С14арил(С1-C8)алкил).
17. Соединение по п.16, отличающееся тем, что X представляет собой N(метил).
18. Соединение по п.16, отличающееся тем, что X представляет собой N(циклопропилметил).
19. Соединение по п.16, отличающееся тем, что X представляет собой N(бензил).
20. Соединение по п.1, отличающееся тем, что R1представляет собой -CH3.
21. Соединение по п.1, отличающееся тем, что R1представляет собой -CHF2.
22. Соединение по любому из пп.1-21, отличающееся тем, что n представляет собой 0.
23. Соединение по любому из пп.1-22, отличающееся тем, что p представляет собой 0.
24. Соединение по п.1, выбранное из группы, включающей
N9-(3,5-дихлор-4-пиридил)-6-метоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамид;
2-этил-5-(4-нитрофенил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-2,5-дикарбоксилат;
5-(3,5-дихлор-4-пиридилкарбамоил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-2-карбоксилат;
N5-(3,5-дихлор-4-пиридил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-5-карбоксамида гидрохлорид;
этил-9-(3,5-дихлор-4-пиридилкарбамоил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]фуро[3,2-c]пиридин-2-карбоксилат;
трет-бутил-9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-5-метил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-2-карбоксилат;
трет-бутил-9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-5-бензил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-2-карбоксилат;
трет-бутил-9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-5-циклопропилметил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-2-карбоксилат;
N9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-5-метил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол гидрохлорид;
N9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-5-бензил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол гидрохлорид;
N9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-2,5-метил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол;
N9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-2-метил-5-бензил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол;
трет-бутил-9-(4-пиридинилкарбамоил)-6-метокси-5-метил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-2-карбоксилат;
N-(3,5-дихлорпиридин-4-ил)-2-(этоксикарбонил)-8-метокси-1,2,3,4-тетрагидро[1]бензофуро[2,3-c]пиридин-5-карбоксамид;
N-(3,5-дихлорпиридин-4-ил)-8-метокси-1,2,3,4-тетрагидро[1]бензофуро[2,3-c]пиридин-5-карбоксамид гидрохлорид;
N-(3,5-дихлорпиридин-4-ил)-6-метокси-1,2,3,4-тетрагидро[1]бензофуро[3,2-c]пиридин-9-карбоксамид гидрохлорид;
N-(3,5-дихлорпиридин-4-ил)-2,9-диметил-8-метокси-1-оксо-1,2,3,4-тетрагидро-b-карболин-5-карбоксамид;
3,5-дихлор-4-(6-дифторметоксибензо[4,5]фуро[2,3-d]пиридазин-9-илкарбоксамидо)-1-пиридиниумолат;
3,5-дихлор-4-(6-дифторметоксибензо[4,5]фуро[3,2-c]пиридин-9-илкарбоксамидо)-1-пиридиниумолат;
натриевая соль 3,5-дихлор-4-(6-дифторметоксибензо[4,5]фуро[3,2-c]пиридин-9-илкарбоксамидо)-1-пиридиниумолата;
N9-(3,5-дихлор-4-пиридил)-6-дифторметокси-3-этил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамид;
N9-(3,5-дихлор-4-пиридил)-3-(4-хлорфенил)-6-дифторметокси-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамид;
N9-(3,5-дихлор-4-пиридил)-6-дифторметокси-3-бутил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
N9-(3,5-дихлор-4-пиридил)-6-дифторметокси-3-циклопентил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
или фармацевтически приемлемые соли указанных соединений.
25. Соединение, выбранное из группы, включающей
N9-(3,5-дихлор-4-пиридил)-6-метоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамид;
N9-(3,5-дихлор-4-пиридил)-6-дифторметоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамид;
или фармацевтически приемлемые соли указанных соединений.
26. Соединение по п.25, отличающееся тем, что представляет собой натриевую соль N9-(3,5-дихлор-4-пиридил)-6-метоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамида или натриевую соль N9-(3,5-дихлор-4-пиридил)-6-дифторметоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамида.
27. Соединение, выбранное из группы, включающей
N9-(3,5-дихлор-4-пиридил)-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксамид;
N9-(3,5-дихлор-4-пиридил)-6-дифторметоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксамид;
или фармацевтически приемлемые соли указанных соединений.
28. Соединение по п.27, отличающееся тем, что представляет собой натриевую соль N9-(3,5-дихлор-4-пиридил)-6-дифторметоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксамид.
29. Соединение, которое представляет собой
этил-4-формил-7-метокси-3-метилбензо[b]фуран-2-карбоксилат;
2-этоксикарбонил-7-метокси-3-метилбензо[b]фуран-4-карбоновую кислоту;
2-этил-4-метил-7-метокси-3-метилбензо[b]фуран-2,4-дикарбоксилат;
2-этил-4-метил-3-бромметил-7-метоксибензо[b]фуран-2,4-дикарбоксилат;
2-этил-4-метил-3-формил-7-метилбензо[b]фуран-2,4-дикарбоксилат;
метил-7-метокси-2-метилбензо[b]фуран-4-карбоксилат;
метил-2-бромметил-7-метоксибензо[b]фуран-4-карбоксилат;
метил-2-формил-7-метоксибензо[b]фуран-4-карбоксилат;
(Z)-3-(7-метокси-4-метилоксикарбонилбензо[b]фуран-2-ил)-2-пропеновую кислоту;
метил-2-[((Z)-2-азидокарбонил)-1-этенил]-7-метоксибензо[b]фуран-4-карбоксилат;
2-этоксикарбонил-7-гидрокси-3-метилбензо[b]фуран-4-карбоновую кислоту;
2,4-диэтил-7-гидрокси-3-метилбензо[b]фуран-2,4-дикарбоксилат;
2,4-диэтил-7-дифторметокси-3-метилбензо[b]фуран-2,4-дикарбоксилат;
диэтил-3-бромметил-7-дифторметоксибензо[b]фуран-2,4-дикарбоксилат,
диэтил-7-дифторметокси-3-формилбензо[b]фуран-2,4-дикарбоксилат;
2-(7-метокси-1-бензофуран-2-ил)этанамин;
этил-2-(7-метокси-1-бензофуран-2-ил)этилкарбамат;
7-гидрокси-2-метилбензо[b]фуран-4-карбальдегид;
7-циклопентилокси-2-метилбензо[b]фуран-4-карбальдегид;
7-циклопентилокси-2-метилбензо[b]фуран-4-карбоновую кислоту;
метил-7-циклопентилокси-2-метилбензо[b]фуран-4-карбоксилат;
метил-7-циклопентилокси-2-бромметилбензо[b]фуран-4-карбоксилат;
метил-2-формил-7-циклопентилоксибензо[b]фуран-4-карбоксилат;
(Z)-3-(7-циклопентилокси-4-метилоксикарбонилбензо[b]фуран-2-ил)-2-пропеновую кислоту;
метил-2-[((Z)-2-азидокарбонил)-1-этенил]-7-метоксибензо[b]фуран-4-карбоксилат;
2-(7-метоксибензол[b]тиофен-3-ил)ацетамид;
2-(7-метоксибензол[b]тиофен-3-ил)этиламин;
этил-2-(7-метоксибензол[b]тиофен-3-ил)этилкарбамат;
этил-2-(7-метокси-1-бензофуран-3-ил)этилкарбамат или
1-метил-3-(2-метокси-5-карбметоксифенилгидразоно)пиперидин-2-он.
30. Соединение, которое представляет собой
метил(6-метокси-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин)-9-карбоксилат;
метил(4-хлор-6-метоксибензо[4,5]фуро[2,3-d]пиридазин)-9-карбоксилат;
метил(6-метоксибензо[4,5]фуро[2,3-d]пиридазин)-9-карбоксилат;
6-метоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоновую кислоту;
4-нитрофенил-6-метоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
6-метокси-3,4-дигидробензо[4,5]фуро[3,2-d]пиримидин-4-он;
4-хлор-6-метоксибензо[4,5]фуро[3,2-d]пиримидин;
6-метоксибензо[4,5]фуро[3,2-d]пиримидин;
9-бром-6-метоксибензо[4,5]фуро[3,2-d]пиримидин;
6-метоксибензо[4,5]фуро[3,2-d]пиримидин-9-илцианид;
6-метоксибензо[4,5]фуро[3,2-d]пиримидин-9-карбоновую кислоту;
4-нитрофенил-6-метоксибензо[4,5]фуро[3,2-d]пиримидин-9-карбоксилат;
этил-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-2-карбоксилат;
этил-5-формил-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-2-карбоксилат;
2-этоксикарбонил-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-5-карбоновую кислоту;
2-этил-5-(4-нитрофенил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-2,5-дикарбоксилат;
2-этил-5-(4-нитрофенил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-2,5-дикарбоксилат;
этил-6-дифторметокси-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
этил-4-хлор-6-дифторметоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
этил-6-дифторметоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
6-дифторметоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоновую кислоту;
4-нитрофенил 6-дифторметоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
2-трет-бутилоксикарбонил-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-5-карбоновую кислоту;
2-(трет-бутил)-5-(4-нитрофенил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-2,5-дикарбоксилат;
трет-бутил-5-(3,5-дихлор-4-пиридилкарбамоил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-2-карбоксилат;
2-этилоксикарбонил-6-метокси-1,2,3,4-тетрагидро[1]бензофуро[3,2-c]пиридин;
2-этоксикарбонил-6-метокси-1,2,3,4-тетрагидро[1]бензофуро[3,2-c]пиридин-9-карбальдегид;
2-этоксикарбонил-6-метокси-1,2,3,4-тетрагидро[1]бензофуро[3,2-c]пиридин-9-карбоновую кислоту;
4-нитрофенил-(2-этоксикарбонил-6-метокси-1,2,3,4-тетрагидро[1]бензофуро[3,2-c]пиридин)-9-карбоксилат;
метил-1-гидрокси-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат;
метил-1-хлор-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат;
метил-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат;
6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоновую кислоту;
4-нитрофенил-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат;
этил-8-метокси-3,4-дигидро[1]бензофуро[2,3-c]пиридин-2(1H)-карбоксилат;
этил-5-формил-8-метокси-3,4-дигидро[1]бензофуро[2,3-c]пиридин-2(1H)-карбоксилат;
2-(этоксикарбонил)-8-метокси-1,2,3,4-тетрагидро[1]бензофуро[2,3-c]пиридин-5-карбоновую кислоту;
4-нитрофенил-2-(этоксикарбонил)-8-метокси-1,2,3,4-тетрагидро[1]бензофуро[2,3-c]пиридин-5-карбоксилат;
2-(трет-бутоксикарбонил)-8-метокси-1,2,3,4-тетрагидро[1]бензофуро[2,3-c]пиридин-5-карбоновую кислоту;
4-нитрофенил-2-(трет-бутилоксикарбонил)-8-метокси-1,2,3,4-тетрагидро[1]бензофуро[2,3-c]пиридин-5-карбоксилат;
6-метокси-1,2,3,4-тетрагидро[1]бензофуро[3,2-c]пиридин-9-карбоновую кислоту;
2-(трет-бутоксикарбонил)-6-метокси-1,2,3,4-тетрагидро[1]бензофуро[3,2-c]пиридин-9-карбоновую кислоту;
4-нитрофенил-2-(трет-бутилоксикарбонил)-6-метокси-1,2,3,4-тетрагидро[1]бензофуро[3,2-c]пиридин-9-карбоксилат;
метил-1-гидрокси-6-циклопентилоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат;
метил-1-хлор-6-гидроксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат;
метил-1-хлор-6-дифторметилоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат;
метил-6-дифторметилоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат;
6-дифторметилоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоновую кислоту;
4-нитрофенил-6-дифторметилоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат;
2-трет-бутил-9-метил-6-метокси-1,3,4,5-тетрагидро-2H-пиридо[4,3-b]индол-2,9-дикарбоксилат;
2-трет-бутил-9-метил-6-метокси-5-метил-1,3,4,5-тетрагидро-2H-пиридо[4,3-b]индол-2,9-дикарбоксилат;
2-трет-бутилоксикарбонил-6-метокси-5-метил-1,3,4,5-тетрагидро-2H-пиридо[4,3-b]индол-9-карбоновая кислота;
2-трет-бутил-9-(4-нитрофенил)-6-метокси-5-метил-1,3,4,5-тетрагидро-2H-пиридо[4,3-b]индол-9-дикарбоксилат;
трет-бутил-9-(3,5-дихлор-4-пиридинилкарбамоил)-6-метокси-5-метил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-2-карбоксилат;
метил-8-метокси-1-оксо-1,2,3,4-тетрагидро-b-карболин-5-карбоксилат;
метил-8-метокси-9-метил-1-оксо-1,2,3,4-тетрагидро-b-карболин-5-карбоксилат;
метил-8-метокси-2,9-диметил-1-оксо-1,2,3,4-тетрагидро-b-карболин-5-карбоксилат;
8-метокси-2,9-диметил-1-оксо-1,2,3,4-тетрагидро-b-карболин-5-карбоновую кислоту;
п-нитрофенил-8-метокси-2,9-диметил-1-оксо-1,2,3,4-тетрагидро-b-карболин-5-карбоксилат;
этил-6-дифторметокси-3-этил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
6-дифторметокси-3-этил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоновую кислоту;
4-нитрофенил-6-дифторметокси-3-этил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
этил-3-(4-хлорфенил)-6-дифторметокси-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
3-(4-хлорфенил)-6-дифторметокси-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоновую кислоту;
4-нитрофенил-(4-хлорфенил)-6-дифторметокси-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
этил-6-дифторметокси-3-бутил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
6-дифторметокси-3-бутил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоновая кислота;
4-нитрофенил-6-дифторметокси-3-бутил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
этил-6-дифторметокси-3-циклопентил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат;
6-дифторметокси-3-циклопентил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоновую кислоту или
4-нитрофенил-6-дифторметокси-3-циклопентил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат.
31. Соединение формулы
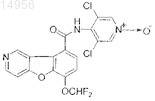
или фармацевтически приемлемая соль указанного соединения.
32. Соединение формулы
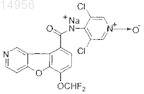
или фармацевтически приемлемая соль указанного соединения.
33. Фармацевтическая композиция, содержащая соединение по пп.1-28 и по меньшей мере один фармацевтически приемлемый наполнитель.
34. Фармацевтическая композиция, содержащая соединение по п.31 или 32 и по меньшей мере один фармацевтически приемлемый наполнитель.
35. Способ лечения воспалительного заболевания, нарушения или состояния, которое характеризуется нежелательной воспалительной иммунной реакцией или которое связано с нежелательной воспалительной иммунной реакцией, или заболевания, нарушения или состояния, вызванного избыточной секрецией TNF-a и PDE-4 или связанного с избыточной секрецией TNF-a и PDE-4, который включает введение терапевтически эффективного количества соединения по пп.1-28 пациенту, который нуждается в таком лечении.
36. Способ лечения воспалительного состояния или иммунного нарушения, включающий введение терапевтически эффективного количества соединения по пп.1-28 пациенту, который нуждается в таком лечении.
37. Способ по п.36, отличающийся тем, что воспалительное состояние или иммунное нарушение представляет собой астму, бронхиальную астму, хроническое обструктивное заболевание легких, аллергический ринит, эозинофильную гранулему, нефрит, ревматоидный артрит, муковисцидоз, хронический бронхит, рассеянный склероз, болезнь Крона, псориаз, крапивницу, весенний конъюнктивит у взрослых, респираторный дистресс-синдром, ревматоидный спондилит, остеоартрит, подагрический артрит, увеит, аллергический конъюнктивит, воспалительные состояния кишечника, язвенный колит, экзему, атопический дерматит и хроническое воспаление.
38. Способ по п.36, отличающийся тем, что воспалительное состояние или иммунное нарушение представляет собой воспалительное состояние или иммунное нарушение легких, суставов, глаз, кишечника, кожи или сердца.
39. Способ по п.38, отличающийся тем, что воспалительное состояние представляет собой астму или хроническое обструктивное заболевание легких.
40. Способ ослабления воспаления в пораженном органе или ткани путем доставки в орган или ткань терапевтически эффективного количества соединения по пп.1-28.
41. Способ лечения заболевания центральной нервной системы, включающий введение терапевтически эффективного количества соединения по пп.1-28 пациенту, который нуждается в таком лечении.
42. Способ по п.41, отличающийся тем, что заболевание центральной нервной системы представляет собой депрессию, амнезию, деменцию, болезнь Альцгеймера, сердечную недостаточность, шок или сосудистое заболевание головного мозга.
43. Способ лечения инсулинорезистентного диабета, включающий введение терапевтически эффективного количества соединения по пп.1-28 пациенту, который нуждается в таком лечении.
44. Способ лечения по п.35, отличающийся тем, что указанное соединение представляет собой соединение по п.31 или 32.
45. Способ лечения по п.37, отличающийся тем, что указанное соединение представляет собой соединение по п.31 или 32.
46. Способ лечения астмы или хронического обструктивного заболевания легких, включающий введение терапевтически эффективного количества соединения по п.31 или 32 пациенту, который нуждается в таком лечении.
47. Способ лечения ревматоидного артрита, включающий введение терапевтически эффективного количества соединения по п.31 или 32 пациенту, который нуждается в таком лечении.
Текст
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ И АЛЛЕРГИЧЕСКИХ НАРУШЕНИЙ Настоящее изобретение относится к новым ингибиторам фосфодиэстеразы 4 типа (PDE-4) формулы (1) а также их таутомерам, энантиомерам, диастереомерам, региоизомерам, стереоизомерам, фармацевтически приемлемым солям и соответствующим N-оксидам указанных веществ, а также к фармацевтическим композициям, содержащим указанные соединения, которые применимы для лечения аллергических и воспалительных состояний, включающих астму, хронический бронхит,атопический дерматит, крапивницу, аллергический ринит, аллергический конъюнктивит, весенний конъюнктивит, эозинофильную гранулему, псориаз, ревматоидный артрит, септический шок,язвенный колит, болезнь Крона, реперфузионное поражение миокарда и реперфузионное поражение мозга, хронический гломерулонефрит, эндотоксический шок и респираторный дистресссиндром у взрослых. 014956 Перекрестные ссылки на родственные заявки Настоящая заявка испрашивает приоритет на основании предварительной Индийской патентной заявки 1352/MUM/2004 от 17 декабря 2004 г. и предварительной патентной заявки США 60/637232 от 17 декабря 2004 г. Все вышеуказанные заявки полностью включены в настоящее описание посредством ссылки. Область техники Настоящее изобретение относится к новым трициклическим ингибиторам фосфодиэстеразы-4(PDE-4), а также их аналогам, таутомерам, энантиомерам, диастереомерам, региоизомерам, стереоизомерам, полиморфным модификациям, фармацевтически приемлемым солям, соответствующим N-оксидам и фармацевтически приемлемым сольватам указанных веществ, к фармацевтическим композициям, содержащим указанные соединения, и к их применению для лечения состояний, опосредуемых ингибированием PDE-IV, таких как астма и хроническое обструктивное заболевание легких (ХОЗЛ). Предпосылки создания изобретения Воспаление дыхательных путей характеризуется рядом серьезных заболеваний легких, включающих астму и хроническое обструктивное заболевание легких (ХОЗЛ). Явления, приводящие к обструкции дыхательных путей, включают отек дыхательных путей, проникновение воспалительных клеток в легкие, выработку различных медиаторов воспаления и выделение избыточного количества слизи. Дыхательные пути пациентов, страдающих астмой, пропитаны воспалительными лейкоцитами, большую часть которых составляют эозинофилы. Величина астматической реакции связана с количеством эозинофилов, присутствующих в легких. В легких пациентов, страдающих астмой, были обнаружены высокие концентрации эозинофилов, в то время как в легких обычных людей эозинофилы содержатся в чрезвычайно малых количествах. Они способны лизировать и активировать клетки, а также разрушать ткани. При активации они синтезируют и высвобождают воспалительные цитокины, например IL-1, IL-3 и TNF-, и воспалительные медиаторы,такие как PAF, LTD4, а также их кислородные производные, которые могут вызывать отеки и бронхоконстрикцию. Известно также, что в патогенезе ряда аутоиммунных и воспалительных заболеваний участвует фактор некроза опухолей (tumor necrosis factor TNF-). Таким образом, управление сигнальной функцией цитокинов или протеканием биосинтетических реакций, связанных с этими белками, может обеспечить положительный терапевтический эффект при указанных болезненных состояниях. Было убедительно показано, что выработка TNF- в провоспалительных клетках становится менее выраженной при повышении уровня внутриклеточного циклического аденозин-3',5'-монофосфата (cAMP). Этот вторичный мессенджер регулируется ферментами семейства фосфодиэстеразы (PDE). Ферменты фосфодиэстеразы играют неотъемлемую роль в механизмах клеточной сигнализации путем гидролиза cAMP и cGP с образованием их неактивных 5'-форм. Таким образом, ингибирование PDE-ферментов приводит к повышению концентраций cAMP и/или cGP и изменяет внутриклеточную реакцию на дополнительные клеточные сигналы путем воздействия на процессы, медиаторами которых являются циклические нуклеотиды. Поскольку полагают, что эозинофилы являются критическими провоспалительными мишенями астмы, идентификация экспрессии семейства генов PDE-4 в эозинофилах приводит к PDE-4, как к потенциальной терапевтической мишени астмы [Rogers, D.F., Giembycz, M.A., Trends Pharmacol. Sci, 19, 160-164(1998); Barnes, P.J., Trends Pharmacol. Sci, 19, 415-423 (1998)]. На основании последовательностей аминокислот и/или последовательности ДНК, специфичности субстрата и чувствительности к фармакологическим агентам, у млекопитающих выделяют десять семейств циклических нуклеотидных фосфодиэстераз (PDEs) [Soderling, S.H., Bayuga, S.J. и Beavo, J.A.,Proc. Natl. Acad. Sci., USA, 96.7071-7076 (1999); Fujishige, K, Kotera, J., Michibata, H., Yuasa, K., Takebayashi, Si, Okamura, K. и Omori, K., J. Biol. Chem., 274, 18438-18445 (1999)]. Многие типы клеток выделяют более одной PDE; распределение изоэнзимов между клетками также изменяется в широких пределах. Таким образом, разработка высокоселективных по отношению к изоэнзимам ингибиторов PDE обеспечивает уникальную возможность для селективного управления различными патофизиологическими процессами. Фосфодиэстераза 4 типа (PDE-4) представляет собой фермент, который регулирует деятельность клеток, вызывающих воспаление легких. PDE-4, специфичный к cAMP- и независимый от Ca+2- фермент,представляет собой ключевой изофермент при гидролизе cAMP в мастоцитах, базофилах, эозинофилах,моноцитах и лимфоцитах. Взаимосвязь между повышением концентрации cAMP в клетках воспаления и релаксацией гладкой мускулатуры дыхательных путей и замедлением высвобождения медиаторов вызывает широкий интерес в создании ингибиторов PDE-4 [Trophy,T.J., Am. J. Respir. Crit. Care Med., 157,351-370 (1998)]. Избыточная или нерегулируемая выработка TNF- связана с опосредованием или обострением ряда нежелательных физиологических состояний, например остеоартрита и других артритных состояний, септического шока, эндотоксического шока, респираторного дистресс-синдрома и резорбции костей. Так как TNF- также участвует в появлении и развитии аутоиммунных заболеваний, ингибиторыPDE-4 могут найти применение в качестве терапевтических агентов для лечения ревматоидного артрита,рассеянного склероза и болезни Крона [Nature Medicine, 1, 211-214 (1995) и там же, 244-248].-1 014956 Лекарственные препараты, способные селективно ингибировать PDE-4, вызывают сильный интерес, который обусловлен несколькими факторами. Распределение PDE-4 в тканях свидетельствует о том,что патологии, относящиеся к центральной нервной и иммунной системам, можно лечить селективными ингибиторами PDE-4. Кроме того, повышение внутриклеточной концентрации cAMP, очевидное биохимическое следствие ингибирования PDE-4, было охарактеризовано в иммунокомпетентных клетках, в которых оно действует как дезактивирующий сигнал. Недавно в семейство PDE-4 были включены еще четыре подтипа - от PDE-4A до PDE-4D, каждый из которых кодируется определенным геном (British Journal of Pharmacology; 1999; v. 128; p. 1393-1398). Было показано, что повышение уровней cAMP внутри этих клеток приводит к подавлению клеточной активации, что, в свою очередь, замедляет выработку и высвобождение провоспалительных цитокинов, например TNF-. Так как полагают, что эозинофилы являются критическими провоспалительными мишенями астмы, определение экспрессии семейства генов PDE-4 в эозинофилах приводит к PDE-4, как к потенциальной терапевтической мишени астмы. К сожалению, применимость нескольких ингибиторов PDE-4 ограничена из-за наличия у них нежелательного профиля побочных эффектов, которые включают тошноту и рвоту (из-за воздействия PDE-4 на центральную нервную систему), а также выделение желудочной кислоты из-за воздействия PDE-4 на париетальные гландулоциты кишечника (Barnette, M.S., Grous, M., Cieslinsky, L.B., Burman, M., Christensen, S.B., Trophy, T.J., J. Pharmacol. Exp. Ther., 273, 1396-1402 (1995. Один из самых первых ингибиторов PDE-4, Rolipram, был изъят из клинической разработки из-за наличия у него совершенно неприемлемых побочных воздействий (Zeller E. et. al., Pharmacopsychiatr., 17, 188-190 (1984), полностью включено в настоящее описание поредством ссылки). Недавно были обнаружены серьезные побочные эффекты нескольких молекулярных ингибиторов PDE-4 при клинических испытаниях на людях. На PDE-4 млекопитающих имеются два центра связывания, которые могут связываться с молекулами ингибитора. Кроме того, PDE-4 существует в двух различных формах, которые представлены разными конформациями. Они были названы PDE-4H центр связывания Rolipram с высокой степенью сродства и PDE-4L центр связывания Rolipram с низкой степенью сродства [Jacobitz, S., McLaughlin,M.M., Livi, G.P., Burman, M., Trophy, T.J., Mol. Pharmacol., 50, 891-899 (1996)]. Было показано, что некоторые побочные эффекты (рвота и выделение желудочной кислоты) связаны с ингибированием PDE-4H,в то время как некоторые полезные воздействия связаны с ингибированием PDE-4L. Также было обнаружено, что человеческая рекомбинантная PDE-4 существует в четырех изоформах A, B, C и D [Muller,T., Engels, P., Fozard, J.R., Trends Pharmacol. Sci., 17, 294-298 (1996)]. Было обнаружено, что соединения,обладающие большей PDE-4D изоэнзимной селективностью по отношению изоэнзимов A, B или C,имеют меньшее количество побочных эффектов, чем Rolipram [Hughes. В. et.al., Br. J. Pharmacol., 1996,118, 1183-1191]. Таким образом, селективные ингибиторы изоэнзима PDE-4D обладают терапевтической эффективностью при лечении воспалительных заболеваний, например астмы и других респираторных заболеваний, но не вызывают нежелательных побочных эффектов, которые характерны для ранее известных неселективных ингибиторов PDE-4. Несмотря на то, что несколько исследовательских групп во всем мире пытаются разработать высокоселективные ингибиторы изоэнзимов PDE-4, до недавнего времени их успехи были весьма ограниченными. Известны различные соединения, которые проявляют ингибирующую активность в отношении Такие соединения как "Ariflo" формулы A, разработанное SmithKline Beecham, Roflumilast формулы-2 014956 клинических испытаний на людях. Другие соединения, которые проявляют потенциальную активность в ингибировании PDE-4, включают соединение CDP-840 формулы B, разработанное Celltech, соединениеH, разработанное Wyeth. Однако полагают, что из-за проблем, связанных с эффективностью и побочными эффектами, соединения Ariflo, CDP-840 и Вау-19-8004 были изъяты из клинических испытаний, где их испытывали в качестве возможных медикаментов для лечения астмы. Другие соединения формул C иF в настоящее время находятся на стадии 1 клинических испытаний. В Международных патентных заявках Nos. WO 2004/037805 и 2004/089940 описаны трициклические соединения, применяемые для лечения воспалительных и аллергических заболеваний. Краткое описание изобретения Настоящее изобретение относится к новым гетероциклическим соединениям, которые ингибируют в которой R1 представляет собой C1-С 8 алкил, который может содержать в качестве заместителя галоген; каждый из R2 и R3 представляет собой водород;X представляет собой O или N(C1-С 8 алкил), N(C3-С 12 циклоалкил(С 1-C8)алкил) или N(C6-С 14 арил(C1C8)алкил); каждый из Ra представляет собой независимо водород, C1-С 8 алкил, C3-С 12 циклоалкил, C6-С 14 арил,который может содержать в качестве заместителя галоген; или -C(O)O-Rb; каждый из Rb представляет собой независимо C1-С 8 алкил;Ar представляет собой пиридил, который может содержать в качестве заместителя галоген;n представляет собой целое число от 0 до 2;p представляет собой целое число от 0 до 4; каждая пунктирная линия [] в цикле представляет собой возможную связь;Y представляет собой -C(O)NH; или таутомер, региоизомер, стереоизомер, энантиомер, диастереомер, полиморф, фармацевтически приемлемую соль, N-оксид или фармацевтически приемлемый сольват указанного соединения. Другим предпочтительным соединением является соединение формулы I, в котором Ar представляет собой пиридил или пиридил-N-оксид, который может содержать в качестве заместителя галоген. Также предпочтительным является соединение формулы I, в котором Ar представляет собой Дополнительно предпочтительным является соединение формулы I, в котором оба U и V представляют собой N, а оба T и W представляют собой C. Дополнительно предпочтительным является соединение, отвечающее формуле I, в котором T и V оба представляют собой N, a U и W оба представляют собой C. Дополнительно предпочтительным является соединение формулы I, в котором T, V и W представляют собой C, и U представляет собой N. Дополнительно предпочтительным является соединение формулы I, в котором T, V и W представ-3 014956 ляют собой C, и U представляет собой NRa. Дополнительно предпочтительным является соединение формулы I, в котором T, U и W представляют собой C, и V представляет собой NRa. Дополнительно предпочтительным является соединение формулы I, в котором T и U представляют собой C, V представляет собой NRa, и W представляет собой C(=O). Дополнительно предпочтительным является соединение формулы I или любой из вышеуказанных предпочтительных примеров реализации, в котором T, U, V или W представляют собой NRa и в которомRa представляет собой водород. Более предпочтительно T и W не являются NRa. Дополнительно предпочтительным является соединение формулы I или любой из вышеуказанных предпочтительных примеров реализации, в котором T, U, V или W представляют собой NRa и в которомRa представляет собой метил. Более предпочтительно T и W не являются NRa. Дополнительно предпочтительным является соединение формулы I или любой из вышеуказанных предпочтительных примеров реализации, в котором T, U, V или W представляют собой NRa и в которомRa представляет собой -COO-трет-бутил (трет-бутилоксикарбонил). Более предпочтительно T и W не являются NRa. Дополнительно предпочтительным является соединение формулы I или любой из вышеуказанных предпочтительных примеров реализации, в котором T, U, V или W представляют собой NRa и в которомRa представляет собой -COOEt. Более предпочтительно T и W не являются NRa. Дополнительно предпочтительным является соединение формулы I, в котором X представляет собой O. Дополнительно предпочтительным является соединение формулы I, в котором X представляет собой N(C1-С 8 алкил), N(C3-С 12 циклоалкил(С 1-C8)алкил) или N(C6-С 14 арил(С 1-C8)алкил). Дополнительно предпочтительным является соединение формулы I, в котором X представляет собой N(метил). Дополнительно предпочтительным является соединение формулы I, в котором X представляет собой N(циклопропилметил). Дополнительно предпочтительным является соединение формулы I, в котором X представляет собой N(бензил). Дополнительно предпочтительным является соединение формулы I, в котором R1 представляет собой -CH3. Дополнительно предпочтительным является соединение формулы I, в котором R1 представляет собой -CHF2. Дополнительно предпочтительным является соединение формулы I, в котором n равно 0. Дополнительно предпочтительным является соединение формулы I, в котором p равно 0. Дополнительно предпочтительным является соединение формулы I, в котором Y представляет собой -C(O)NH-. В соответствии с одним из предпочтительных примеров реализации соединение имеет формулу в которой каждый из U и V независимо представляет собой C, N или NRa (где Ra определен выше), с тем условием, что по меньшей мере один из U и V представляет собой N или NRa; обе пунктирные линии представляют собой связи или обе пунктирные линии отсутствуют; каждый из R1, R2 и R3 определен выше иAr, R4, n и p определены выше, или фармацетически приемлемую соль указанного соединения. В соответствии с более предпочтительным примером реализации n и p равны 0, а R1 представляет собой С 1-С 8 алкил, который может содержать в качестве заместителя галоген (предпочтительно CH3 илиCHF2). Ra может представлять собой, например, -COO-Rb, где Rb представляет собой C1-С 8 алкил. Предпочтительно Ar представляет собой пиридил или пиридил-N-оксид, который может содержать в качестве заместителя галоген. В соответствии с одним из примеров реализации Ar представляет собой-4 014956 В соответствии с другим предпочтительным примером реализации соединение отвечает формуле в которой либо (i) U представляет собой N, V представляет собой N или C и обе пунктирные линии представляют собой связи, либо (ii) U представляет собой NRa (где Ra определен выше), V представляет собой C и обе пунктирные линии отсутствуют; каждый из R1, R2 и R3 определен выше иAr, n и p определены выше, или фармацетически приемлемая соль указанного соединения. В соответствии с более предпочтительным примером реализации n и p равны 0 и R1 представляет собой C1-С 8 алкил, который может содержать в качестве заместителя галоген. Ra может представлять собой, например, -COO-Rb, где Rb представляет собой C1-С 8 алкил. Предпочтительно Ar представляет собой пиридил или пиридил-N-оксид, который может содержать в качестве заместителя галоген. В соответствии с одним из примеров реализации Ar представляет собой Следует понимать, что некоторые соединения формулы (1) могут содержать один или несколько асимметрично замещенных атомов углерода. Наличие одного или нескольких таких центров асимметрии в соединениях формулы (1) может приводить к существованию стереоизомеров, и в каждом случае следует понимать, что настоящее изобретение включает все такие стереоизомеры, включая энантиомеры и диастереомеры, а также их смеси, включая рацемические смеси. Соединения, предлагаемые согласно настоящему изобретению, формулы (1) также могут содержать там, где это возможно, геометрические изомеры E и Z, которые включают как отдельный изомер, так и смеси обоих изомеров. Другой пример реализации настоящего изобретения представляет собой фармацевтическую композицию, содержащую одно или несколько гетероциклических соединений, предлагаемых согласно настоящему изобретению, и фармацевтически приемлемый наполнитель (например, фармацевтически приемлемый носитель или разбавитель). Фармацевтическая композиция может представлять собой, например, дозированную лекарственную форму (например, таблетку или капсулу). Соединения формулы (1) регулируют или ингибируют выработку TNF-, поскольку они являются ингибиторами PDE-4 и, следовательно, они могут быть применены для лечения аллергических и воспалительных заболеваний, включающих астму, хронический бронхит, атопический дерматит, крапивницу,аллергический ринит, аллергический конъюнктивит, весенний конъюнктивит, эозинофильную гранулему, псориаз, ревматоидный артрит, септический шок, диабет, язвенный колит, болезнь Крона, реперфузионные поражения миокарда и головного мозга, хронический гломерулонефрит, эндотоксический шок и респираторный дистресс-синдром у взрослых. Соединения, предлагаемые согласно настоящему изобретению, в частности, применимы при лечении астмы и хронического обструктивного заболевания легких(ХОЗЛ). Другой пример реализации настоящего изобретения представляет собой способ лечения воспалительного заболевания, нарушения или состояния, отличающегося нежелательной воспалительной иммунной реакцией или связанного с нежелательной воспалительной иммунной реакцией, или заболевания или состояния, вызванного избыточной секрецией TNF- и PDE-4 или связанного с избыточной секрецией TNF- и PDE-4, у пациента, который нуждается в таком лечении, путем введения пациенту терапевтически эффективного количества ингибитора PDE-4 или фармацевтической композиции, предлагаемой согласно настоящему изобретению. Другой пример реализации настоящего изобретения представляет собой способ лечения воспалительного состояния или иммунного нарушения у пациента, который нуждается в таком лечении, путем введения пациенту терапевтически эффективного количества соединения формулы (1) или фармацевтической композиции, предлагаемой согласно настоящему изобретению. Неограничивающие примеры воспалительных состояний или иммунных нарушений, которые можно лечить с помощью ингибиторовPDE-4, предлагаемых согласно настоящему изобретению, включают астму, бронхиальную астму, хрони-5 014956 ческое обструктивное заболевание легких, аллергический ринит, эозинофильную гранулему, нефрит,ревматоидный артрит, муковисцидоз, хронический бронхит, рассеянный склероз, болезнь Крона, псориаз, крапивницу, весенний конъюнктивит у взрослых, респираторный дистресс синдром, ревматоидный спондилит, остеоартрит, подагрический артрит, увеит, аллергический конъюнктивит, воспалительные состояния кишечника, язвенный колит, экзему, атопический дерматит и хроническое воспаление. Неограничивающие примеры предпочтительных воспалительных состояний включают аллергические воспалительные состояния. Дополнительно предпочтительными являются воспалительные состояния и иммунные нарушения легких, суставов, глаз, кишечника, кожи или сердца. Дополнительно предпочтительными являются воспалительные состояния, выбранные из группы,включающей астму и хроническое обструктивное заболевание легких. Другой пример реализации настоящего изобретения представляет собой способ ослабления воспаления в пораженном органе или ткани путем доставки в орган или ткань терапевтически эффективного количества ингибитора PDE-4 или фармацевтической композиции, предлагаемой согласно настоящему изобретению. Другой пример реализации настоящего изобретения представляет собой способ лечения заболевания центральной нервной системы пациента, который нуждается в таком лечении, путем введения пациенту терапевтически эффективного количества ингибитора PDE-4 или фармацевтической композиции,предлагаемой согласно настоящему изобретению. Неограничивающие примеры предпочтительных заболеваний центральной нервной системы включают депрессию, амнезию, слабоумие, болезнь Альцгеймера, сердечную недостаточность, шок и сосудистые заболевания головного мозга. Другой пример реализации настоящего изобретения представляет собой способ лечения инсулинорезистентного диабета у пациента, который нуждается в таком лечении, путем введения пациенту терапевтически эффективного количества ингибитора PDE-4 или фармацевтической композиции, предлагаемой согласно настоящему изобретению. Настоящее изобретение также относится к способам получения новых гетероциклических соединений формулы (1), определенной выше. Подробное описание изобретения Термин алкил относится к неразветвленному или разветвленному углеводородному радикалу, состоящему только из атомов углерода и водорода, не содержащему ненасыщенных связей, включающему от одного до восьми атомов углерода, который соединен с остальной частью молекулы одинарной связью и представляет собой, например, метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил и 1,1-диметилэтил (трет-бутил). Термин алкенил относится к алифатической углеводородной группе, содержащей двойную связь углерод-углерод, которая может включать неразветвленную или разветвленную углеродную цепь, содержащую от 2 до примерно 10 атомов углерода, и представлять собой, например, этенил, 1-пропенил, 2 пропенил (аллил), изопропенил, 2-метил-1-пропенил, 1-бутенил и 2-бутенил. Термин алкинил относится к неразветвленному или разветвленному гидрокарбильному радикалу,включающему по меньшей мере одну тройную связь углерод-углерод и содержащему от 2 до примерно 12 атомов углерода (предпочтительными являются радикалы, содержащие от 2 до 10 атомов углерода),который представляет собой, например, этинил, пропинил и бутинил. Термин алкокси относится к алкильной группе, определенной выше, соединенной через кислородную связь к остатку молекулы. Неограничивающие примеры таких групп включают -OCH3 и -OC2H5. Термин алкилкарбонил относится к алкильной группе, определенной выше, присоединенной через карбонильную связь к остатку молекулы. Неограничивающие примеры таких групп включают-C(O)CH3 и -C(O)C2H5. Термин алкоксикарбонил относится к алкоксигруппе, определенной выше, соединенной через карбонильную связь с остатком молекулы. Неограничивающие примеры таких групп включают C(O)OCH3 и -C(O)-OC2H5. Термин алкилкарбонилокси относится к алкилкарбонильной группе, определенной выше, соединенной через кислородную связь к остатку молекулы. Неограничивающие примеры таких групп включают -O-C(O)CH3 и -O-C(O)C2H5. Термин алкиламино относится к алкильной группе, определенной выше, соединенной через аминную связь к остатку молекулы. Неограничивающие примеры таких групп включают -NH2CH3,-NH(CH3)2 и -N(CH3)3. Термин циклоалкил относится к неароматической моно- или полициклической системе, содержащей от 2 до приблизительно 12 атомов углерода, например, представляющей собой циклопропил,циклобутил, циклопентил и циклогексил. Неограничивающие примеры полициклических циклоалкильных групп включают пергидронафтильную, адамантильную и норборнильную группы, соединенные мостиковыми связями циклические группы или спиробициклические группы, например спиро(4,4)нон-2-6 014956 ил. Термин циклоалкилалкил относится к содержащему цикл радикалу, включающему от 3 до примерно 8 атомов углерода, непосредственно присоединенному к алкильной группе, которая в свою очередь присоединена к основной структуре любым атомом углерода алкильной группы, если это приводит к образованию стабильной структуры. Неограничивающие примеры таких групп включают циклопропилметил, циклобутилэтил и циклопентилэтил. Термин циклоалкенил относится к содержащему цикл радикалу, включающему от 3 до примерно 8 атомов углерода, включающему по меньшей мере одну двойную связь углерод-углерод, который представляет собой, например, циклопропенил, циклобутенил и циклопентенил. Термин циклоалкенилалкил относится к содержащему цикл радикалу, включающему от 3 до примерно 8 атомов углерода и по меньшей мере одну двойную связь углерод-углерод, непосредственно присоединенному к алкильной группе, которая в свою очередь присоединена к основной структуре любым атомом углерода алкильной группы, если это приводит к образованию стабильной структуры. Неограничивающие примеры таких групп включают циклопропенилметил, циклобутенилэтил и циклопентенилэтил. Термин арил относится к ароматическому радикалу, содержащему от 6 до 14 атомов углерода, который представляет собой, например, фенил, нафтил, тетрагидронафтил, инданил и бифенил. Термин арилалкил относится к арильной группе, определенной выше, непосредственно связанной с алкильной группой, определенной выше, например -CH2C6H5 и -C2H5C6H5. Термин гетероцикл относится к стабильному циклическому радикалу, содержащему от 3 до 15 членов, который состоит из атомов углерода и от одного до пяти гетероатомов, выбранных из группы,включающей азот, фосфор, кислород и серу. В соответствии с целями настоящего изобретения гетероциклический радикал может быть моноциклической, бициклической или трициклической системой, которая может включать конденсированные циклические системы, циклические системы, соединенные мостиковой связью или спироциклические системы; при этом атомы азота, фосфора, кислорода или серы в гетероциклическом радикале могут быть окислены до различных степеней окисления. Кроме того, атом азота может быть четвертичным и циклический радикал может быть частично или полностью насыщенным (т.е. гетероароматическим). Неограничивающие примеры таких гетероциклических радикалов включают азетидинил, акридинил, бензодиоксолил, бензодиоксанил, бензофуранил, карбазолил, циннолинил, диоксоланил, индолизинил, нафтгидринил, пергидроазепинил, феназинил, фенотиазинил, феноксазинил, фталазинил, пиридил, птеридинил, пуринил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетразолил, имидазолил, тетрагидроизохинолинил, пиперидинил, пиперазинил, 2 оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, пирролил, 4 пиперидонил, пирролидинил, пиразинил, пиримидинил, пиридазинил, оксазолил, оксазолинил, оксазолидинил, триазолил, инданил, изоксазолил, изоксазолидинил, морфолинил, тиазолил, тиазолинил, тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, индолил, изоиндолил, индолинил, изоиндолинил,октагидроиндолил, октагидроизоиндолил, хинолил, изохинолил, декагидроизохинолил, бензимидазолил,тиадиазолил, бензопиранил, бензотиазолил, бензооксазолил, фурил, тетрагидрофуранил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, диоксафосфоланил, оксадиазолил, хроманил и изохроманил. Гетероциклический радикал может быть соединен с основной структурой через любой гетероатом или атом углерода, если это приводит к образованию стабильной структуры. Термин гетероарил относится к ароматическому гетероциклическому радикалу. Гетероарильный циклический радикал может быть соединен с основной структурой через любой гетероатом или атом углерода, если это приводит к образованию стабильной структуры. Термин гетероарилалкил относится к ароматическому гетероарильному циклическому радикалу,определенному выше, непосредственно связанному с алкильной группой. Гетероарилалкильный радикал может быть соединен с основной структурой через любой атом углерода алкильной группы, если это приводит к образованию стабильной структуры. Термин гетероциклил относится к гетероциклическому радикалу, определенному выше. Гетероциклический радикал может быть соединен с основной структурой через любой гетероатом или атом углерода, если это приводит к образованию стабильной структуры. Термин гетероциклилалкил относится к гетероциклическому радикалу, определенному выше, непосредственно связанному с алкильной группой. Гетероциклилалкильный радикал может быть соединен с основной структурой через любой атом углерода алкильной группы, если это приводит к образованию стабильной структуры. Термин цикл или циклическое ядро относится к циклической структуре, содержащей 3-10 атомов углерода. Термин защитная группа или ЗГ относится к заместителю, который используют для блокировки или защиты некоторой функциональной группы, в то время как остальные функциональные группы соединения могут оставаться реакционноспособными. Например, группа, защищающая аминогруппу,-7 014956 представляет собой заместитель, присоединенный к аминогруппе, который блокирует или защищает аминогруппу в соединении. Неограничивающие примеры подходящих групп для защиты аминогруппы включают ацетильную, трифторацетильную, трет-бутоксикарбонильную (BOC), бензилоксикарбонильную (CBz) и 9-флуоренилметиленоксикарбонильную (Fmoc) группы. Аналогично, группа, защищающая гидроксигруппу, представляет собой заместитель, присоединенный к гидроксигруппе, который блокирует или защищает гидроксигруппу в соединении. Неограничивающие примеры подходящих групп для защиты гидроксигруппы включают ацетильную, бензильную, тетрагидропиранильную и силильную группы. Группа, защищающая карбоксильную группу относится к заместителю в карбоксильной группе, который блокирует или защищает карбоксильную группу. Неограничивающие примеры подходящих групп для защиты карбоксильной группы включают -CH2CH2SO2Ph, цианоэтил-, 2-(триметилсилил)этил-,2-(триметилсилил)этоксиметил-, 2-(п-толуолсульфонил)этил-, 2-(п-нитрофенилсульфенил)этил-, 2(дифенилфосфино)этил- и нитроэтил. Общее описание защитных групп и их применения рассмотрено в публикации T.W. Greene, Protective Groups in Organic Synthesis, John WileySons, New York, 1991. Термин галоген относится к радикалу фтора, хлора, брома или йода. Если не указано иного, термин замещенный, используемый в настоящем описании, относится к замещению любым одним или несколькими из перечисленных заместителей: гидроксигруппой, галогеном, цианогруппой, нитрогруппой, оксо (=O), тио (=S), замещенным или незамещенным алкилом, замещенной или незамещенной алкоксигруппой, замещенным или незамещенным алкенилом, замещенным или незамещенным алкинилом, замещенным или незамещенным арилом, замещенным или незамещенным арилалкилом, замещенным или незамещенным циклоалкилом, замещенным или незамещенным циклоалкилалкилом, замещенным или незамещенным циклоалкенилом, замещенным или незамещенным циклоалкениалкилом, замещенной или незамещенной аминогруппой, замещенным или незамещенным гетероарилом, замещенным или незамещенным гетероарилалхилом, замещенным или незамещенным гетероциклом, замещенным или незамещенным гетероциклилалкилом, замещенным или незамещенным гуанидином, -COORx, -C(O)Rx, -C(S)Rx, -C(O)NRxRy, -C(O)ONRxRy, -NRxCONRyRz, -N(Rx)SORy,-N(Rx)SO2Ry, -(=N-N(Rx)Ry), -NRxC(O)ORy, -NRxRy, -NRxC(O)Ry, -NRxC(S)Ry, -NRxC(S)NRyRz, -SONRxRy,-SO2NRxRy, -ORx, -ORxC(O)NRyRz, -ORxC(O)ORy, -OC(O)Rx, -OC(O)NRxRy, -RxNRyC(O)Rz, -RxORy,-RxC(O)ORy, -RxC(O)NRyRz, -RxC(O)Ry, -RxOC(O)Ry, -SRx, -SORx, -SO2Rx и -ONO2, где Rx, Ry и Rz независимо выбирают из группы, включающей водород, замещенный или незамещенный алкил, замещенную или незамещенную алкоксигруппу, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенную или незамещенную аминогруппу, замещенный или незамещенный гетероарил, замещенный гетероциклилалкил, замещенный или незамещенный гетероарилалкил, или замещенный или незамещенный гетероцикл. В соответствии с одним из примеров реализации, заместители в вышеуказанных замещенных группах не могут быть замещены дополнительно. Например, если заместитель в замещенном алкиле представляет собой замещенный арил, то заместителем на замещенном ариле не может быть замещенный алкенил. Фармацевтически приемлемые соли, являющиеся частью настоящего изобретения, включают соли,полученные из неорганических оснований (например, Li, Na, K, Ca, Mg, Fe, Cu, Zn и Mn), соли органических оснований (например, N,N'-диацетилэтилендиамина, глюкамина, триэтиламина, холина, гидроксида, дициклогексиламина, метформина, бензиламина, триалкиламина, тиамина и подобных оснований),соли хиральных оснований (например, алкилфениламина, глицинола, фенилглицинола и подобных оснований), соли природных аминокислот (например, глицина, аланина, валина, лейцина, изолейцина, норлейцина, тирозина, цистина, цистеина, метионина, пролина, гидроксипролина, гистидина, омитина, лизина, аргинина, серина и подобных кислот), соли синтетических аминокислот (например, D-изомеров или замещенных аминокислот), соли гуанидина, соли замещенного гуанидина (заместители которого выбраны из группы, включающей нитрогруппу, аминогруппу, алкил, алкенил или алкинил), соли аммония, соли замещенного аммония и соли алюминия. Другие фармацевтически приемлемые соли включают соли присоединения кислот (если таковые существуют), такие как сульфаты, нитраты, фосфаты, перхлораты, бораты, гидрогалогениды, ацетаты, тартраты, малеаты, цитраты, фумараты, сукцинаты, пальмоаты,метансульфонаты, бензоаты, салицилаты, бензолсульфонаты, аскорбаты, глицерофосфаты, кетоглутараты и подобные им соли. Неограничивающие примеры других фармацевтически приемлемых солей включают четвертичные аммониевые соли соединений, предлагаемых согласно настоящему изобретению, с алкилгалогенидами или алкилсульфатами (например, MeI и (Me)2SO4). Фармацевтически приемлемые сольваты могут представлять собой гидраты или включать другие растворители кристаллизации, например спирты. Фармацевтически приемлемые сольваты включают гидраты и другие растворители кристаллизации(например, спирты). Соединения, предлагаемые согласно настоящему изобретению, могут образовывать сольваты с низкомолекулярными растворителями, согласно способам, известным в данной области техники.-8 014956 Термин лечение заболевания, нарушения или состояния включает:(1) предотвращение и задержку появления клинических симптомов заболевания, нарушения или состояния, развивающихся у пациента, который может страдать или быть предрасположенным к появлению заболевания, нарушения или состояния, но пока не испытывает или проявляет клинических или субклинических симптомов заболевания, нарушения или состояния;(2) ингибирование заболевания, нарушения или состояния, т.е. прекращение или облегчение развития заболевания или по меньшей мере одного клинического или субклинического симптома этого заболевания; или(3) ослабление заболевания, т.е. регрессия заболевания, нарушения или состояния или по меньшей мере одного из его клинических или субклинических симптомов. Польза, оказываемая пациенту, подвергаемому лечению, является либо статистически значимой,либо по меньшей мере воспринимаемой пациентом или врачом. Термин пациент включает млекопитающих (в особенности, людей) и других животных, например домашних животных (например, домашних любимцев, включая котов и собак) и недомашних животных(например, диких животных). Термин терапевтически эффективное количество означает количество соединения, которое при введении пациенту для лечения заболевания, нарушения или состояния, достаточно для осуществления такого лечения. Терапевтически эффективное количество может изменяться в зависимости от вида соединения, заболевания и тяжести заболевания, а также от возраста, массы, физического состояния и восприимчивости пациента, подвергаемого лечению. Доставка терапевтически эффективного количества активного ингредиента в конкретную область организма реципиента означает создание терапевтически эффективной концентрации активного ингредиента в крови в этой конкретной области организма. Это может быть достигнуто, например, за счет локального или системного введения активного ингредиента в организм реципиента. Классические симптомы острого воспаления включают покраснение, повышенную температуру,припухлость и боль в пораженной области, а также прекращение выполнения пораженным органом его функций. Симптомы и признаки воспаления, связанного с конкретным состоянием, включают ревматоидный артрит - боль, припухлость, жар и неприятные ощущения в пораженных суставах; общая и утренняя ригидность; инсулинозависимый сахарный диабет - это состояние может приводить ко множеству осложнений,включающих воспаления, включая ретинопатию, невропатию, нефропатию; заболевание коронарной артерии, болезнь периферических сосудов и сосудистые заболевания головного мозга; аутоиммунный тиреоидит - слабость, запоры, нехватка воздуха, отечность лица, рук и ступней, периферийные отеки, брадикардия; рассеянный склероз - мышечная спастичность, затуманенность зрения, головокружение, слабость конечностей, парестезию; увеоретинит - ухудшение ночного зрения, потеря периферического зрения; красная волчанка - боль в суставах, сыпь, фоточувствительность, лихорадка, мышечная боль, отеки кистей рук и лица, аномальный анализ мочи (гематурия, цилиндрурия, протеинурия), гломерулонефрит,когнитивная дисфункция, тромбоз сосудов, перикардит; склеродерма - виброболезнь, припухлости кистей рук, рук, ног и лица, утолщения кожи, боль, отеки и ригидность пальцев и коленей, дисфункции желудочно-кишечного тракта, рестриктивный лгочный процесс, перикардит, почечная недостаточность; другие артритные состояния, отягощенные воспалительным процессом, например ревматоидный спондилит, остеоартрит, септический артрит и полиартрит - лихорадка, боль, отеки, слабость; другие воспалительные нарушения мозга, например, менингит, болезнь Альцгеймера, СПИД, слабоумие при энцефалите - фотофобия, когнитивная дисфункция, потеря памяти; другие воспалительные процессы глаз, например ретиниты - понижение остроты зрения; воспалительные кожные нарушения, такие как экзема, другие дерматиты (например, атопические,контактные), псориаз, ожоги, вызванные УФ-излучением (солнечные лучи и подобные источники УФ света) - эритема, боль, шелушение, отек, неприятные ощущения; воспалительные заболевания кишечника, такие как болезнь Крона, язвенный колит - боль, диарея,запор, ректальное кровотечение, лихорадка, артрит; астма - одышка, хрипы; другие аллергические нарушения, такие как аллергический ринит - чихание, зуд, выделение слизи; состояния, связанные с острыми травмами, такие как церебральное поражение с последующим ударом - потеря чувствительности, потеря моторики, потеря сознания; поражение сердечной ткани, обусловленное ишемической болезнью миокарда - боль, одышка; поражения легких, например, встречающиеся при респираторном дистресс-синдроме у взрослых одышка, гипервентиляция легких, пониженное усвоение кислорода, легочные инфильтраты;-9 014956 воспаление, сопровождающее инфекцию, например сепсис, септический шок, токсический шок лихорадка, дыхательная недостаточность, тахикардия, гипотензия, лейкоцитоз; другие воспалительные состояния, связанные с конкретными органами или тканями, такие как нефрит (например, гломерулонефрит) - олигурия, аномальный анализ мочи; воспаление аппендикса - лихорадка, боль, неприятные ощущения, лейкоцитоз; подагра - боль, неприятные ощущения, отеки и эритема пораженного сустава, повышенное содержание мочевой кислоты в сыворотке крови и/или моче; воспаление желчного пузыря - абдоминальные боли и неприятные ощущения, лихорадка, тошнота,лейкоцитоз; хроническое обструктивное заболевание легких - одышка, хрипы; застойная сердечная недостаточность - одышка, хрипы, периферические отеки; диабет II типа - осложнения, затрагивающие рецепторы, включающие сердечно-сосудистые заболевания, поражения сосудов глаз, носа и периферических сосудов, фиброз легких - гипервентиляция легких, одышка, пониженное усвоение кислорода; сосудистые заболевания, такие как атеросклероз и рестеноз - боль, потеря чувствительности, снижение пульса, потеря функций и аллоиммунитет, приводящий к отторжению трансплантата - боль, неприятные ощущения, лихорадка. Неограничивающие примеры субклинических симптомов включают диагностические признаки воспаления, появление которых может предшествовать проявлению клинических симптомов. Один класс субклинических симптомов включает иммунологические симптомы, например инвазию или накопление в органе или ткани провоспалительных лимфоидных клеток, или локальное или периферическое присутствие активированных провоспалительных лимфоидных клеток, распознающих патогенный фактор или антиген, специфичный для органа или ткани. Активация лимфоидных клеток может быть определена при помощи способов, известных в данной области техники. Соединения, предлагаемые согласно настоящему изобретению, эффективны в широком диапазоне доз. Например, при лечении взрослых людей могут быть применены дозы примерно от 0,05 примерно до 1000 мг, предпочтительно примерно от 0,1 примерно до 500 мг в сутки. Наиболее предпочтительная доза составляет примерно от 0,5 примерно до 250 мг в сутки. При выборе режима для пациента часто необходимо начинать с более высокой дозы, и когда состояние оказывается под контролем, снижать дозу. Точная доза зависит от вида введения лекарства, желаемого вида терапии, формы приема лекарства, пациента, подвергаемого лечению, и массы тела пациента, подвергаемого лечению, а также от предпочтений и опыта лечащего врача или ветеринара. Обычно соединения, предлагаемые согласно настоящему изобретению, вводят в дозированную лекарственную форму, включающую примерно от 0,05 примерно до 1000 мг активного ингредиента вместе с фармацевтически приемлемым носителем. Обычно дозируемые лекарственные формы, подходящие для перорального, назального, пульмонального или трансдермального введения, включают примерно от 0,05 примерно до 1000 мг, предпочтительно примерно от 0,5 примерно до 250 мг соединений, смешанных с фармацевтически приемлемым носителем или разбавителем. Некоторые неограничивающие примеры соединений, предлагаемых согласно настоящему изобретению, указаны ниже: 1) N9-(3,5-дихлор-4-пиридил)-6-метоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамид; 2) N9-(3,5-дихлор-4-пиридил)-6-метоксибензо[4,5]фуро[3,2-d]пиримидин-9-карбоксамид; 3) N9-(3,5-дихлор-4-пиридил)-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксамид; 4) N9-(3,5-дихлор-4-пиридил)-6-дифторметоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамид; 5) N9-(3,5-дихлор-4-пиридил)-6-дифторметоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксамид натрия; 6) 2-этил-5-(4-нитрофенил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-2,5-дикарбоксилат; 7) 5-(3,5-дихлор-4-пиридилкарбамоил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин 2-карбоксилат; 8) N5-(3,5-дихлор-4-пиридил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]тиено[2,3-c]пиридин-5-карбоксамида гидрохлорид; 9) этил-9-(3,5-дихлор-4-пиридилкарбамоил)-8-метокси-1,2,3,4-тетрагидробензо[4,5]фуро[3,2-c]пиридин-2-карбоксилат; 10) трет-бутил-9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-5-метил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-2-карбоксилат; 11) трет-бутил-9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-5-бензил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-2-карбоксилат; 12) трет-бутил-9-(3,5-дихлор-4-пиридилкарбамоил)-6-метокси-5-циклопропилметил-1,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-2-карбоксилат; 13)N9-(3,5-дихлор-4-пиридил)-6-дифторметокси-3-циклопентил-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилат и фармацевтически приемлемые соли указанных соединений (если соединение описано в виде свободного основания) или свободное основание и другие фармацевтически приемлемые соли указанного соединения (если соединение описано в виде соли). Способы получения Соединения формулы (I) могут быть получены в соответствии со следующими способами. Если не указано иного, символы Ar, T, U, V, W, X, Y, R1, R2 и R3, используемые в нижеследующих формулах,должны представлять те же группы, что и группы, описанные выше для соединений формулы (1). В одном из примеров реализации соединения формулы (1), где Y представляет собой -CONR4, T иW представляют собой C, U и V представляют собой N, пунктирные линии [] в цикле представляют собой двойные связи, p=0 и Ar, X, R1, R2, R3 и n рассмотрены в общем описании, могут быть получены в соответствии с общей схемой синтеза I. В вышеуказанной схеме замещенное подходящим образом соединение (10) может вступать в реакцию с 2-хлорацетоацетатом, например, в присутствии основания (например, гидроксида натрия или подобного ему основания) с образованием интермедиата формулы (11), который затем может претерпевать циклизацию, например, в кислой среде (например, под действием полифосфорной кислоты (РРА) или метансульфоновой кислоты или подобных им соединений) с образованием интермедиата формулы (12). Затем интермедиат формулы (12) может быть подвергнут формилированию, например, дихлорметилметиловым эфиром в присутствии хлорида олова с образованием интермедиата формулы (13). Затем интермедиат формулы (13) может быть окислен до интермедиата формулы (14), представляющего собой карбоновую кислоту, например, при помощи таких окислителей, как хлорит натрия или перманганат калия. Затем интермедиат формулы (14) может быть подвергнут этерификации с образованием интермедиата формулы (15). Затем интермедиат формулы (15) может быть превращен в интермедиат формулы(17) через образование интермедиата формулы (16) при помощи реакции радикального бромирования с последующей реакцией окисления, например, щелочным ДМСО. Полученный таким образом интермедиат (17) может реагировать с гидразин-гидратом с образованием интермедиата формулы (18), который может быть подвергнут ароматизации при помощи способов, известных в данной области техники, например, при действии оксихлорида фосфора с образованием интермедиата формулы (19). Интермедиат(19) затем превращают в интермедиат формулы (21). Интермедиат формулы (21) может быть получен,например, дехлорированием, например, при гидрировании на палладиевом катализаторе (в результате чего получают интермедиат формулы (20 с последующим гидролизом. Целевые соединения (1) могут быть получены при взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (21) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА или диизопропилэтиламина в ТГФ). В другом примере реализации соединения формулы (1), в которых Y представляет собой -CONR4, T представляет собой C, W представляет собой C=O, U представляет собой N, V представляет собой NRa,пунктирная линия [] между V и W в цикле отсутствует, оставшиеся пунктирные линии представляют собой двойные связи, p=0 и Ar, X, R1, R2, R3, Ra и n рассмотрены в общем описании, могут быть получены в соответствии с общей схемой синтеза Ia. В вышеуказанной схеме интермедиат (17 а) может взаимодействовать с гидразин-гидратом с образованием интермедиата формулы (18 а). Интермедиат (18 а) затем может взаимодействовать с соединением формулы Ra-G (где G представляет собой уходящую группу) с образованием интермедиата формулы(19 а). Интермедиат формулы (19 а) может быть гидролизован с образованием интермедиата формулы(20 а). Целевое соединение формулы (1) может быть получено при взаимодействии галогенангидрида или смешанного ангидрида или активного сложного эфира интермедиата формулы (20 а) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА или диизопропилэтиламина в ТГФ). В другом примере реализации соединения формулы (1), где Y представляет собой -CONR4, T представляет собой C, W представляет собой C=O, U представляет собой N, V представляет собой NRa, пунктирная линия [] между V и W в цикле отсутствует, оставшиеся пунктирные линии представляют собой двойные связи, p=0 и Ar, X, R1, R2, R3, Ra и n рассмотрены в общем описании, могут быть получены в соответствии с общей схемой синтеза Ib. Схема Ib В вышеуказанной схеме интермедиат (17 а) может взаимодействовать с интермедиатом общей формулы NH2-NHRa с образованием интермедиата формулы (19 а). Интермедиат формулы (19 а) затем может быть гидролизован с образованием интермедиата формулы (20 а). Целевое соединение формулы (1) может быть получено при взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (20 а) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА или диизопропилэтиламина в ТГФ). В другом примере реализации соединения формулы (1), где Y представляет собой -CONR4, T и V представляют собой N, U и W представляют собой C, пунктирные линии [] в цикле представляют собой двойные связи, p=0 и Ar, X, R1, R2, R3 и n рассмотрены в общем описании, могут быть получены в соответствии с общей схемой синтеза II. В вышеуказанной общей схеме II замещенный подходящим образом ароматический альдегид (22) может быть превращен в интермедиат формулы (23), например, при взаимодействии с этилбромацетатом в присутствии основания, такого как карбонат калия или подобного ему основания. Формильная группа интермедиата (23) затем может быть превращена в цианогруппу в соответствии со стандартным переходом альдегид-оксим-нитрил через интермедиат формулы (24) с образованием интермедиата формулы(25). Циклизация, например, в присутствии подходящего амида, такого как формамид или ацетамид, может приводить к образованию интермедиата (26). Интермедиат формулы (26) может быть превращен в интермедиат формулы (28). Например, обработка интермедиата (26) хлорокисью фосфора приводит к образованию интермедиата формулы (27), а его последующее дехлорирование, например, при гидрировании в присутствии палладиевого катализатора на угле может привести к образованию интермедиата формулы (28). Интермедиат (28) затем может быть подвергнут бромированию, например, бромом в уксусной кислоте с образованием интермедиата (29) с последующей заменой брома цианидом, например, с использованием цианида меди в ДМФА, с образованием интермедиата (30). Гидролиз, например, при воздействии серной кислоты приводит к образованию промежуточной карбоновой кислоты формулы(31). Целевые соединения (1) могут быть получены при взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (31) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы(например, в присутствии гидрида натрия в ДМФА, или диизопропилэтиламина в ТГФ, или в подобных условиях). В другом примере реализации целевые соединения формулы (1), где Y представляет собой -CONR4,пунктирные линии [] в цикле представляют собой двойные связи и Ar, T, U, V, W, X, R1, R2 и R3 рассмотрены в общем описании, могут быть получены в соответствии с общей схемой синтеза III. Общая схема III В вышеуказанной общей схеме III интермедиат (34) может быть получен при взаимодействии соединения формулы (32) (в котором Z1 представляет собой Br или I и Z2 представляет собой F или Cl) с соединением формулы (33) (в котором FG представляет собой алкил, формил, ацетил, циано- или сложноэфирную группу), например, в подходящей основной среде, такой как в присутствии карбоната калия в ДМФА. Интермедиат формулы (34) затем может быть подвергнут циклизации с образованием интермедиата формулы (35), например, при использовании солей палладия или солей никеля. Функциональная группа (FG) в интермедиате формулы (35) затем может быть превращена в карбоксильную группу (еслиFG представляет собой алкил, формил или ацетил, то она может быть окислена, или, если FG представляет собой циано- или сложноэфирную группу, то она может быть гидролизована до карбоксильной группы) с образованием интермедиата формулы (36). Целевые соединения формулы (1) могут быть получены при взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (36) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА, или диизопропилэтиламина в ТГФ, или в подобных условиях). В другом примере реализации целевые соединения формулы (1), где Y представляет собой-CONR4, пунктирные линии [] между T и U и между V и W в цикле отсутствуют, пунктирные линии в центральном цикле представляют собой двойные связи и Ar, T, U, V, W, X, R1, R2 и R3 рассмотрены в общем описании, могут быть получены в соответствии с общей схемой синтеза IV. Общая схема IV В вышеуказанной схеме интермедиат формулы (39) может быть получен при взаимодействии подходящим образом замещенного или незамещенного интермедиата формулы (37) (где Z представляет собой галоген) с подходящим образом замещенным арильным интермедиатом (38), например, в подходящей основной среде, такой как в присутствии карбоната калия в ДМФА. Интермедиат (39) может быть подвергнут циклизации, например, в стандартной кислой среде под действием полифосфорной кислоты(РРА) или метансульфоновой кислоты с образованием интермедиата формулы (40), который далее может быть подвергнут формилированию, например с использованием стандартных, описанных в литературе способов, таких как воздействие дихлорметилметилового эфира в присутствии кислоты Льюиса (например, хлорида олова), с образованием интермедиата формулы (41). Формильная группа интермедиата формулы (41) затем может быть окислена до карбоксильной группы с образованием интермедиата (42). Целевые соединения формулы (1) могут быть получены при взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (42) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА, или диизопропилэтиламина в ТГФ, или в подобных условиях). В другом примере реализации целевые соединения формулы (1), где Y представляет собой-CONR4, U представляет собой N; T, V и W представляют собой C, пунктирные линии [] в цикле представляют собой двойные связи, p=0 или 1 и Ar, X, R1, R2 и R3 и n рассмотрены в общем описании, могут быть получены в соответствии с общей схемой синтеза V. Общая схема V В вышеуказанной схеме V, интермедиат (43) может быть получен при взаимодействии интермедиата формулы (38) с пропаргилбромидом, например, в присутствии подходящего основания, такого как- 15014956 карбонат калия. Интермедиат формулы (43) может быть подвергнут циклизации, например, в присутствии фторида цезия с образованием интермедиата (44). Интермедиат (45) может быть получен путем формилирования интермедиата (44), например, при воздействии дихлорметилметилового эфира в присутствии хлорида олова (IV). Интермедиат (45) может быть окислен, например, окислителем (например, хлоритом натрия, перманганатом калия или пероксидом водорода) с последующей этерификацией с образованием интермедиата формулы (46), в котором R7 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный арил или замещенный или незамещенный арилалкил. Интермедиат формулы (48) может быть затем получен путем бромирования интермедиата формулы (46), например, NBS (N-бромсукцинимидом) с образованием интермедиата формулы (47) с последующим окислительным дебромированием, например, диметилсульфоксидом в присутствии основания, например карбоната натрия. Интермедиат (48) может быть превращен в интермедиат формулы (49), например, при воздействии малоновой кислоты в присутствии основания, например пиперидина. Азидо-интермедиат формулы (50) затем может быть получен путем обработки интермедиата (49), например, этилхлороформатом с последующим воздействием азида натрия. Азидоинтермедиат (50) может быть подвергнут циклизации, например при температуре 180C или выше с образованием интермедиата формулы (51). Интермедиат (51) может быть превращен, например, обработкой оксихлоридом фосфора, в интермедиат формулы (52). Восстановительное дехлорирование интермедиата (52), например, на Pd/C или никеле Ренея приводит к образованию интермедиата (53). Гидролиз интермедиата формулы (53), например, в присутствии основания, такого как гидроксид натрия или подобного ему основания, приводит к образованию интермедиата формулы (54). Целевые соединения формулы (1) могут быть получены пери взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (54) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА или диизопропилэтиламина в ТГФ, или в подобных условиях). В другом примере реализации целевые соединения формулы (1), где Y представляет собойU и между V и W в цикле отсутствуют, остальные пунктирные линии представляют собой связи, p=0 или 1 и Ar, X, R1, R2, R3, Ra и n рассмотрены в общем описании, могут быть получены в соответствии с общей схемой синтеза VI. Общая схема VI В вышеуказанной схеме VI интермедиат (55) может быть получен при взаимодействии интермедиата формулы (38) с 4-хлорэтилацетоацетатом, например, в присутствии подходящего основания, такого как карбонат калия. Интермедиат (55) может быть подвергнут циклизации, например, в присутствии полифосфорной кислоты или серной кислоты с образованием интермедиата формулы (56). Этот интермедиат может быть превращен в промежуточный амид формулы (57), например, при воздействии аммиака(например, в метаноле). Восстановление промежуточного амида (57) с использованием восстановителей,например боргидрида в ТГФ или алюмогидрида лития, приводит к образованию промежуточного амина формулы (58). Интермедиат формулы (60) может быть получен путем обработки промежуточного амина(58), например этилхлороформатом, с образованием интермедиата формулы (59) с последующей циклизацией, например, в присутствии формальдегида и кислотного катализатора, например птолуолсульфокислоты. Интермедиат (60) может быть подвергнут формилированию, например, с использованием стандартных условий, таких как воздействие дихлорметилметилового эфира в присутствии хлорида олова (IV) с образованием интермедиата формулы (61). Интермедиат (61) может быть окислен,например, окислителем, таким как хлорит натрия, перманганат калия или пероксид водорода, с образо- 16014956 ванием интермедиата формулы (62). Этилкарбаматная группа интермедиата (62) может быть превращена в трет-бутилкарбаматную группу, например, при основном гидролизе с последующей обработкой, например BOC-ангидридом с образованием интермедиата формулы (63). Целевые соединения формулы (1) могут быть получены при взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (63) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА, или диизопропилэтиламина в ТГФ, или в подобных условиях). В другом примере реализации интермедиат (58) может быть получен в соответствии с общей схемой VIA. Общая схема VIA В вышеуказанной схеме VIA обработка интермедиата (64), например, циануксусной кислотой в присутствии ацетата аммония может приводить к образованию промежуточного нитрила (65), который при восстановлении восстановителем, например алюмогидридом лития, боргидридом или при гидрировании на Pd/C, может быть превращен в промежуточный амин (58). Интермедиат (58) затем может быть превращен в соединения формулы (1) способом, описанным для схемы VI. В другом примере реализации целевые соединения формулы (1), где Y представляет собой -CONR4,U представляет собой -NRa, T=V=W и представляет собой C, пунктирные линии [] между T и U и между V и W в цикле отсутствуют, оставшаяся пунктирная линия представляет собой связь, p=0 или 1 и Ar,X, R1, R2, R3, Ra и n рассмотрены в общем описании, могут быть получены в соответствии с общей схемой VII. Общая схема VII В вышеуказанной схеме VII обработка промежуточного ароматического альдегида формулы (22),например, этилбромацетатом в присутствии основания, например карбоната калия, может приводить к образованию интермедиата формулы (66), который при восстановлении восстановителем, например,алюмогидридом лития, боргидридом или Pd/C, может приводить к образованию промежуточного спирта формулы (67). Интермедиат (67) затем может быть превращен в промежуточный нитрил формулы (69) через промежуточный хлорид формулы (68) при обработке последнего хлорирующим агентом, например, метансульфонилхлоридом в триэтиламине или тионилхлоридом, с последующей обработкой цианирующим агентом, например цианидом натрия. Промежуточный нитрил (69) далее может быть восстановлен до амина формулы (70) восстановителем, например, алюмогидридом лития, боргидридом или гидрированием на Pd/C. Трициклический интермедиат формулы (72) может быть получен обработкой промежуточного амина формулы (70), например этилхлороформиатом, с образованием интермедиата формулы(71) с последующей циклизацией, например, в присутствии формальдегида и кислотного катализатора,например п-толуолсульфокислоты. Интермедиат (72) может быть подвергнут формилированию, напри- 17014956 мер, с использованием стандартных условий, таких как воздействие дихлорметилметилового эфира в присутствии хлорида олова (IV) с образованием интермедиата формулы (73). Интермедиат (73) может быть окислен окислителем, таким как хлорит натрия, перманганат калия или пероксид водорода, с образованием кислоты формулы (74). Этилкарбаматная группа интермедиата (74) может быть превращена в трет-бутилкарбаматную группу, например, при основном гидролизе с последующей обработкой, например, BOC-ангидридом с образованием интермедиата формулы (75). Целевые соединения формулы (1) могут быть получены при взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (63) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА, или диизопропилэтиламина в ТГФ, или в подобных условиях). В другом примере реализации целевые соединения формулы (1), где Y представляет собой-CONR4, V представляет собой -NRa, W представляет собой -C(=O), T и U представляют собой C, пунктирные линии [] между T и U и между V и W в цикле отсутствуют, оставшаяся пунктирная линия представляет собой двойную связь, p=0 или 1 и Ar, X, R1, R2, R3, Ra и n рассмотрены в общем описании,могут быть получены в соответствии с общей схемой синтеза VIII. Общая схема VIII В вышеуказанной схеме VIII взаимодействие интермедиата формулы (76) с интермедиатом формулы (77) может приводить к образованию интермедиата формулы (78), который при циклизации, катализируемой кислотой, может приводить к образованию интермедиата формулы (79). Взаимодействие интермедиата (79) с интермедиатом формулы Ra-G, в котором G представляет собой уходящую группу (например, Ra-G может быть алкилгалогенидом (например, иодметаном, этилбромидом и подобными группами в присутствии основания (например, гидрида натрия или карбоната калия) приводит к образованию интермедиата формулы (80). Гидролиз интермедиата (80), например, в присутствии основания, такого как гидроксид натрия, приводит к образованию кислоты формулы (81). Целевые соединения формулы (1) могут быть получены при взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (81) с подходящим амином формулы ArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА, или диизопропилэтиламина в ТГФ, или в подобных условиях). В другом примере реализации целевые соединения формулы (1), где Y представляет собой -CONR4,U представляет собой -NRa, S(O)m или O, T, V и W представляют собой C, пунктирные линии [] междуT и U и между V и W в цикле отсутствуют, оставшаяся пунктирная линия представляет собой двойную связь, p=0, X представляет собой NRb и Ar , R1, R2, R3, Rb и n рассмотрены в общем описании, могут быть получены в соответствии с общей схемой IX. Общая схема IX В вышеуказанной схеме IX интермедиат формулы (82) может быть получен путем восстановления интермедиата формулы (77), в котором R7 представляет собой замещенный или незамещенный алкил,замещенный или незамещенный арил или замещенный или незамещенный арилалкил. Интермедиат (82) затем может быть обработан интермедиатом формулы (83) (в котором U=NRa, S(O)m или O), который- 18014956 затем подвергают индольной циклизации по Фишеру с образованием интермедиата формулы (84). Взаимодействие интермедиата (84) с интермедиатом формулы Rb-G, в котором G представляет собой уходящую группу (например Rb-G может представлять собой алкилгалогенид (например, иодметан, этилбромид и подобные группы в присутствии основания (например, гидрида натрия или карбоната калия) приводит к образованию интермедиата формулы (85). Гидролиз интермедиата (85), например, в присутствии основания, такого как гидроксид натрия, приводит к образованию кислоты формулы (86). Целевые соединения формулы (1) могут быть получены при взаимодействии галогенангидрида, или смешанного ангидрида, или активного сложного эфира интермедиата формулы (86) с подходящим амином формулыArNHR4, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА, или диизопропилэтиламина в ТГФ, или в подобных условиях). В другом примере реализации целевые соединения формулы (1), где Y представляет собой SO2NR4 и Ar, T, U, V, W, X, R1, R2 и R3 определены в общем описании, пунктирные линии [] в циклах представляют собой двойные связи, p=0 и n=0-2, могут быть приготовлены в соответствии со следующей общей схемой. Схема X В вышеуказанной схеме X, интермедиат формулы (87), в котором T, U ,V, W, R1, R2, R3, n и p определены выше, может быть превращен в интермедиат формулы (88), например при воздействии хлорсульфоновой кислоты. Целевые соединения формулы (1) могут быть получены при взаимодействии интермедиата формулы (88) с подходящим амином формулы ArNHR4, например с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА или диизопропилэтиламина в ТГФ или в подобных условиях). В другом примере реализации, соединения формулы (1), где Y представляет собой -NR4SO2 или 4-NR CO и Ar, T, U, V, W, X, R1, R2 и R3 определены в общем описании, пунктирные линии [] в циклах представляют собой двойные связи, p=0, и n=0-2, могут быть приготовлены в соответствии со схемой XI. Схема XI В вышеуказанной схеме XI интермедиат формулы (87), в котором T, U, V, W, R1, R2, R3, n и p определены выше, может быть превращен в интермедиат формулы (89) путем обработки нитрующей смесью,например HNO3/H2SO4. Интермедиат формулы (89) затем может быть восстановлен подходящим восстановителем (например, H2/Pd/C или Ni Ренея/NH2NH2) до интермедиата формулы (90). Целевые соединения формулы (1) могут быть получены при взаимодействии интермедиата формулы (90) с подходящим интермедиатом формулы ArSO2Cl или ArCOCl, например, с использованием стандартных основных условий, известных из литературы (например, в присутствии гидрида натрия в ДМФА, или диизопропилэтиламина в ТГФ, или в подобных условиях). Целевые соединения формулы (1), полученные в соответствии с любой из вышеуказанных схем, затем могут быть превращены в их соли и/или N-оксиды и, при необходимости, полученные соли соединений формулы (1) затем превращают в свободные соединения. N-окисление может быть проведено любым способом, известным в данной области техники, например при воздействии мхлорпероксибензойной кислоты в дихлорметане при комнатной температуре. Вещества, предлагаемые согласно настоящему изобретению, могут быть выделены и очищены в соответствии с любым способом, известным в данной области техники, например удалением растворителя в вакууме и перекристаллизацией полученного остатка из подходящего растворителя, или при помощи одного из традиционных способов очистки, например колоночной хроматографии на подходящем- 19014956 наполнителе. Соли могут быть получены растворением свободного соединения в подходящем растворителе, например хлорированном углеводороде, таком как метиленхлорид или хлороформ, или низкомолекулярном алифатическом спирте (например, этаноле, изопропаноле), который содержит нужную кислоту или основание или к которому затем добавляют нужную кислоту или основание. Соли могут быть выделены фильтрованием, переосаждением, осаждением при добавлении нерастворяющего эти соли растворителя или испарением растворителя. При подщелачивании или подкислении полученные соли могут быть превращены в свободные соединения, которые, в свою очередь, могут быть превращены в соли. Хлорированный растворитель, который может быть применен, может быть выбран из дихлорметана, 1,2-дихлорэтана, хлороформа, четыреххлористого углерода и подобных им веществ. Аароматические растворители, которые мсгут быть применены, могут быть выбраны из бензола и толуола. Спиртовые растворители, которые могут быть применены, могут быть выбраны из метанола, этанола, н-пропанола,изопропанола, трет-бутанола и подобных им веществ. В общем случае, соединения, полученные в соответствии с вышеописанными способами, могут быть выделены в чистом виде при помощи известных методик, например кристаллизации из таких растворителей, как пентан, диэтиловый эфир, изопропиловый эфир, хлороформ, дихлорметан, этилацетат,ацетон, метанол, этанол, изопропанол, вода или их сочетания, или при помощи колоночной хроматографии на оксиде алюминия или силикагеле с элюированием колонки такими растворителями, как гексан,петролейный эфир, хлороформ, этилацетат, ацетон, метанол или их сочетаниями. Различные полиморфные модификации соединения формулы (1), являющиеся частью настоящего изобретения, могут быть получены кристаллизацией соединения формулы (1), в различных условиях; например, при использовании для кристаллизации различных обычно применяемых растворителей или их смесей, при кристаллизации при различных температурах, различных режимах охлаждения, от очень быстрого до медленного охлаждения во время кристаллизации. Полиморфные модификации также могут быть получены нагреванием или плавлением соединения с последующим постепенным или быстрым охлаждением. Присутствие полиморфных модификаций может быть определено с помощью твердофазной ЯМР спектроскопии, ИК спектроскопии, дифференциальной сканирующей калориметрии, рентгеноструктурного анализа в порошках и другими способами. Фармацевтические композиции Настоящее изобретение также обеспечивает фармацевтические композиции, содержащие одно или несколько соединений формулы (1) (включая производные, аналоги, таутомерные формы, стереоизомеры, полиморфные модификации, энантиомеры и диастереомеры) и фармацевтически приемлемые соли указанных соединений (и фармацевтически приемлемые сольваты) в сочетании с фармацевтически приемлемым наполнителем, например фармацевтически приемлемым носителем или разбавителем. Фармацевтические композиции могут быть приготовлены в виде дозированных лекарственных форм, например, таблеток, капсул, порошков, сиропов, растворов, суспензий и подобных им форм. Фармацевтические композиции могут содержать подходящие твердые или жидкие носители или разбавители, или могут находиться в подходящей стерильной среде для получения инъекционных растворов или суспензий. Для перорального введения соединения формулы (1) могут быть смешаны с подходящим твердым, жидким носителем или разбавителем, получая капсулы, таблетки, порошки, сиропы, растворы,суспензии и подобные им формы. При необходимости, фармацевтические композиции могут содержать дополнительные компоненты, например вкусовые добавки, подсластители, наполнители и подобные им компоненты. Для парентерального введения соединения формулы (1) могут быть смешаны со стерильной водной или органической средой с образованием растворов или суспензий для инъекций. Например,наряду с водными растворами водорастворимых фармацевтически приемлемых солей соединения формулы (1), образованные присоединением кислот, или солей, образованных основаниями, могут быть использованы растворы в кунжутном или арахисовом масле, водном пропиленгликоле и подобных растворителях. Растворы для инъекций, приготовленные таким способом, затем могут быть введены внутривенно, внутрибрюшинно, подкожно или внутримышечно. Соединения также могут быть введены ингаляцией, если они предназначены для введения в дыхательные пути. Например, соединение формулы (1) может быть введено путем дыхательной ингаляции в виде аэрозоля под давлением. Соединение формулы (1) после его гомогенизации предпочтительно тонко измельчать, например, в лактозе, глюкозе, высших жирных кислотах, натриевой соли диоктилсульфоянтарной кислоты или наиболее предпочтительно в карбоксиметилцеллюлозе для получения микрочастиц,размеры большинства которых составляют 5 мкм или менее. Для приготовления составов для ингаляции аэрозоль может быть смешан с газообразным или жидким вытеснителем для распыления активного вещества. Может быть применен ингалятор, распылитель или пульверизатор. Такие устройства известны,см., например, Newman et al., Thorax, 1985, 40:61-676 и Berenberg, M., J. Asthma USA, 1985, 22:87-92,полностью включенные в настоящее описание посредством ссылки. Также может быть использован распылитель Брда. См. также патенты США 6402733, 6273086 и 6228346, полностью включенные в настоящее описание посредством ссылки. Соединение структуры (1), применяемое для ингаляции, предпочтительно приготавливают в виде сухого порошка в мелкодисперсном состоянии. Соединения, пред- 20014956 лагаемые согласно настоящему изобретению, также могут быть применены в ингаляторе с дозатором в соответствии со способами, описанными в патенте США 6131566, полностью включенном в настоящее описание посредством ссылки. Кроме соединений формулы (1), фармацевтические композиции, предлагаемые согласно настоящему изобретению, также могут содержать один или несколько известных терапевтических агентов, или композиции могут быть введены совместно с одним или несколькими известными терапевтическими агентами. Способы лечения Фармацевтические композиции, предлагаемые согласно настоящему изобретению, могут быть использованы для лечения аллергических нарушений. Соединения формулы (1) регулируют или ингибируют выработку TNF-, поскольку они являются ингибиторами PDE-4, и, следовательно, они могут быть применены для лечения ряда аллергических и воспалительных заболеваний, включающих астму, хронический бронхит, атопический дерматит, крапивницу, аллергический ринит, аллергический конъюнктивит, весенний конъюнктивит, эозинофильную гранулему, псориаз, ревматоидный артрит, септический шок, диабет, язвенный колит, болезнь Крона, реперфузионные поражения миокарда и головного мозга, хронический гломерулонефрит, эндотоксический шок и респираторный дистресс-синдром у взрослых. Соединения, предлагаемые согласно настоящему изобретению, в частности, применимы при лечении астмы и хронического обструктивного заболевания легких (ХОЗЛ). Другой пример реализации настоящего изобретения представляет собой способ лечения воспалительного заболевания, нарушения или состояния, отличающегося нежелательной воспалительной иммунной реакцией или связанного с нежелательной воспалительной иммунной реакцией, или заболевания или состояния, вызванного избыточной секрецией TNF- и PDE-4 или связанного с избыточной секрецией TNF- и PDE-4, у пациента, который нуждается в таком лечении, путем введения пациенту терапевтически эффективного количества ингибитора PDE-4 или фармацевтической композиции, предлагаемой согласно настоящему изобретению. Другой пример реализации настоящего изобретения представляет собой способ лечения воспалительного состояния или иммунного нарушения у пациента, который нуждается в таком лечении, путем введения пациенту терапевтически эффективного количества соединения формулы (1) или фармацевтической композиции, предлагаемой согласно настоящему изобретению. Неограничивающие примеры воспалительных состояний или иммунных нарушений, которые могут подвергаться лечению ингибиторамиPDE-4, предлагаемыми согласно настоящему изобретению, включают астму, бронхиальную астму, хроническое обструктивное заболевание легких, аллергический ринит, эозинофильную гранулему, нефрит,ревматоидный артрит, муковисцидоз, хронический бронхит, рассеянный склероз, болезнь Крона, псориаз, крапивницу, весенний конъюнктивит у взрослых, респираторный дистресс-синдром, ревматоидный спондилит, остеоартрит, подагрический артрит, увеит, аллергический конъюнктивит, воспалительные состояния кишечника, язвенный колит, экзему, атопический дерматит и хроническое воспаление. Неограничивающие примеры предпочтительных воспалительных состояний включают аллергические воспалительные состояния. Также предпочтительными являются воспалительные состояния и иммунные нарушения легких,суставов, глаз, кишечника, кожи или сердца. Также предпочтительными являются воспалительные состояния, выбранные из группы, включающей астму и хроническое обструктивное заболевание легких. Другой пример реализации настоящего изобретения представляет собой способ ослабления воспаления в пораженном органе или ткани путем доставки в орган или ткань терапевтически эффективного количества ингибитора PDE-4 или фармацевтической композиции, предлагаемой согласно настоящему изобретению. Другой пример реализации настоящего изобретения представляет собой способ лечения заболевания центральной нервной системы пациента, который нуждается в таком лечении, путем введения пациенту терапевтически эффективного количества ингибитора PDE-4 или фармацевтической композиции,предлагаемой согласно настоящему изобретению. Неограничивающие примеры предпочтительных заболеваний центральной нервной системы включают депрессию, амнезию, слабоумие, болезнь Альцгеймера, сердечную недостаточность, шок и сосудистые заболевания головного мозга. Другой пример реализации настоящего изобретения представляет собой способ лечения инсулинорезистентного диабета у пациента, который нуждается в таком лечении, путем введения пациенту терапевтически эффективного количества ингибитора PDE-4 или фармацевтической композиции, предлагаемой согласно настоящему изобретению. Следующие примеры являются иллюстративными и никоим образом не ограничивают область, защищаемую настоящим изобретением. Стадия 1. Этил-2-(2-метоксифенокси)-3-оксобутаноат: Смесь гваякола (20.0 г, 186.9 ммоль) и гидроксида натрия (8,9 г, 224,4 ммоль) в бензоле (300 мл) кипятили с обратным холодильником в течение 3-4 ч. Затем реакционную смесь охладили до комнатной температуры и к ней по каплям добавили 2-хлорэтилацетоацетат (37 г, 224,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. К реакционной смеси добавили воду (300 мл),подкислили разбавленной HCl и экстрагировали этилацетатом (3100 мл). Объединенные органические фазы промывали водой (3100 мл) и сушили над безводным сульфатом натрия. После концентрирования органического экстракта сырую массу очищали при помощи колоночной хроматографии на силикагеле,элюируя смесью 10% этилацетата в петролейном эфире. Получили 15,0 г чистого продукта в виде бледно-желтого масла. ИК (KBr): 3067, 2983, 2942, 2839, 1750, 1730, 1660, 1593, 1500, 1457, 1259, 1206, 1178, 1114, 1092,1026, 750 см-1. 1H ЯМР (300 МГц, CDCl3)1,26 (т, 3H), 2,43 (с, 3H), 3,84 (с, 3H), 4,22 (кв, 2H), 5,022 (с, 1H), 6,847,08 (м, 4H). Стадия 2. Этил-7-метокси-3-метилбензо[b]фуран-2-карбоксилат. Этил-2-(2-метоксифенокси)-3-оксобутаноат (12,0 г, 47,8 ммоль) добавили при перемешивании к полифосфорной кислоте при 80-90C. После завершения реакции реакционную смесь охладили до комнатной температуры и к реакционной смеси добавили лед (250 г). Органическую массу экстрагировали дихлорметаном (3100 мл). Объединенные органические фазы промывали водой (3100 мл), а затем солевым раствором (100 мл) и сушили над безводным сульфатом натрия. После концентрации органической массы получили коричневое твердое вещество (8,5 г). ИК (KBr): 3078, 3061, 3002, 2978, 2931, 2908, 1719, 1586, 1500, 1397, 1384, 1306, 1280, 1182, 1164,1150, 1047, 1020, 853, 789, 741 см-1. 1(50 мл) охладили до -10-0C. К реакционной смеси прибавили одной порцией хлорид олова(IV) (11,3 г,42,7 ммоль) при -10-0C. Затем при той же температуре по каплям добавили дихлорметилметиловый эфир (3,6 г, 31,95 ммоль). К реакционной смеси добавили воду (200 мл) и дихлорметан удалили в вакууме. Полученное твердое вещество отфильтровали и сушили с отсасыванием жидкости. Твердое вещество очищали колоночной хроматографией, элюируя смесью 10% этилацетата в петролейном эфире. Получили 3,3 г чистого продукта в виде бледно-желтого твердого вещества. ИК(KBr): 3051, 2986, 2968, 2937, 2866, 1707, 1680, 1609, 1573, 1463, 1367, 1337, 1287, 1294, 1264,1166, 1083, 1045, 938, 783 см-1. 1H ЯМР (300 МГц, ДМСО-d6)1,60 (т, 3H), 2,83 (с, 3H), 4,06 (с, 3H), 4,40 (кв, 2H), 7,33 (д, 1H, J = 8,4 Гц), 7,95 (д, 1H, J = 8,7 Гц), 10,23 (с, 1H). Стадия 4. 2-Этоксикарбонил-7-метокси-3-метилбензо[b]фуран-4-карбоновая кислота Раствор этил-4-формил-7-метокси-3-метилбензо[b]фуран-2-карбоксилата (3,0 г, 11,4 ммоль) в ацетоне (30 мл) охладили до 10-20C. К реакционной смеси одной порцией при 10-20C добавили сульфаминовую кислоту (1,55 г, 17,1 ммоль). Затем при той же температуре к реакционной смеси по каплям добавили раствор хлорита натрия (1,6 г, 17,1 ммоль) в воде (10 мл). Затем к реакционной смеси добавили воду (100 мл). Ацетон удалили в вакууме. Полученное твердое вещество отфильтровали и сушили с отсасыванием жидкости. Получили твердое вещество желтого цвета (3,0 г). 1H ЯМР (300 МГц, ДМСО-d6)1,34 (т, 3H), 2,69 (с, 3H), 4,01 (с, 3H), 4,38 (кв, 2H), 7,18 (д, 1H, J = 8,4 Гц), 7,82 (д, 1H, J = 8,7 Гц), 12,9 (с, 1H). Стадия 5. 2-Этил-4-метил-7-метокси-3-метилбензо[b]фуран-2,4-дикарбоксилат Смесь 2-этоксикарбонил-7-метокси-3-метилбензо[b]фуран-4-карбоновой кислоты (3.0 г, 10.79 ммоль) и карбоната калия (7,4 г, 54,0 ммоль) в N,N-диметилформамиде (30 мл) нагревали до кипения при 80-90C. Затем к реакционной смеси при 80-90C по каплям добавили диметилсульфат (4,6 г, 32,3 ммол). Реакционную смесь охладили до комнатной температуры. К реакционной смеси добавили воду (300 мл) и подкислили разбавленной HCl. Полученный осадок отфильтровали и сушили в сушильном шкафу. Получили твердое вещество желтого цвета (2,8 г). ИК (KBr): 2978, 2937, 1702, 1615, 1573, 1441, 1432, 1342, 1297, 1266, 1240, 1177, 11129, 1083, 1043,- 22014956 1012, 930, 850, 781 см-1. 1(д, 1H, J = 8,4 Гц), 7,83 (д, 1H, J = 8,4 Гц). Стадия 6. 2-Этил-4-метил-3-бромметил-7-метоксибензо[b]фуран-2,4-дикарбоксилат Смесь 2-этил-4-метил-7-метокси-3-метилбензо[b]фуран-2,4-дикарбоксилата (2,80 г, 9,5 ммоль), Nбромсукцинимида (2,04 г, 1,1 ммоль) и бензоилпероксида (0,45 г, 1,9 ммоль) в четыреххлористом углероде (30 мл) нагревали до кипения при 80-90C. К реакционной смеси прибавили воду (100 мл). Органическую массу экстрагировали дихлорметаном (350 мл). Объединенные органические фазы промывали водой (350 мл), а затем солевым раствором (100 мл) и сушили над безводным сульфатом натрия. После концентрации органической массы, получили 3,2 г твердого коричневого вещества. ИК (KBr): 3076, 2984, 2957, 2852, 1727, 1711, 1617, 1574, 1426, 1373, 1272, 1297, 1228, 1193, 1142,1023, 920, 774, 657 см-1. 1(д, 1H, J = 8,4 Гц), 7,93 (д, 1H, J = 8,4 Гц). Стадия 7. 2-Этил-4-метил-3-формил-7-метилбензо[b]фуран-2,4-дикарбоксилат Смесь йодида калия (1,71 г, 10,3 ммоль) и карбоната натрия (1,82 г, 17,2 ммоль) в диметилсульфоксиде (20 мл) нагревали до 80-90C в атмосфере азота. Затем к реакционной смеси одной порцией при той же температуре добавили 2-этил-4-метил-3-бромметил-7-метоксибензо[b]фуран-2,4-дикарбоксилат (3,2 г,8,6 ммоль). Реакционную смесь охладили до комнатной температуры и к реакционной смеси добавили воду (200 мл). Органическую массу экстрагировали дихлорметаном (3100 мл). Объединенные органические фазы промывали водой (3100 мл), а затем солевым раствором (100 мл) и сушили над безводным сульфатом натрия. После концентрации органической массы в вакууме сырую массу очищали колоночной хроматографией, элюируя смесью 20% этилацетата в петролейном эфире. Получили 568 мг чистого продукта в виде бледно-желтого твердого вещества. ИК (KBr): 2986, 2960, 1721, 1706, 1615, 1581, 1515, 1434, 1375, 1339, 1280, 1231, 1194, 1178, 1026,920, 778 см-1. 1H ЯМР (300 МГц, ДМСО-d6)1,35 (т, 3H), 3,80 (с, 3H), 4,06 (с, 3H), 4,42 (кв, 2H), 7,31 (д, 1H, J = 8,4 Гц), 7,88 (д, 1H, J = 8,4 Гц), 10,51 (с, 1H). Стадия 8. Метил-(6-метокси-4-оксо-3,4-дигидробензо[4,5]фуро[2,3-d]пиридазин)-9-карбоксилат К раствору 2-этил-4-метил-3-формил-7-метилбензо[b]фуран-2,4-дикарбоксилата (568 мг, 1,8 ммоль) в этаноле (20 мл) добавили при комнатной температуре гидразин-гидрат (185 мг, 3,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3-4 ч. К реакционной смеси добавили воду (100 мл), и полученное твердое вещество отфильтровали и сушили с отсасыванием жидкости. Твердое вещество сушили в сушильном шкафу. Получили белое твердое вещество (397 мг). ИК (KBr): 3168, 3078, 3006, 2951, 2909, 2347, 1698, 1591, 1281, 1028, 981, 921 см-1. 1(396 мг, 1,44 ммоль) в оксихлориде фосфора (10 мл) нагревали до кипения при 120-130C. Реакционную смесь охладили до 0-10C. К реакционной смеси при 0-10C по каплям добавили воду (100 мл). Полученный осадок отфильтровали и сушили в сушильном шкафу. Получили твердое желтое вещество (390 мг). 1H ЯМР (300 МГц, ДМСО-d6)4,04 (с, 3H), 4,14 (с, 3H), 7,61 (д, 1H, J = 8,4 Гц), 8,24 (д, 1H, J = 8,4 Гц), 10,35 (с, 1H). Стадия 10. Метил-(6-метоксибензо[4,5]фуро[2,3-d]пиридазин)-9-карбоксилат Суспензию метил-4-хлор-6-метоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилата (390 мг, 1,33 ммоль), каталитического количества водного аммиака и 10%-ного палладия на угле (180 мг) в метаноле(30 мл) гидрировали при давлении водорода, равном 2,04 атм (30 psi), при комнатной температуре. Протекание реакции контролировали при помощи TCX. По окончании реакции смесь отфильтровали через слой целита. Слой промывали метанолом (310 мл). Фильтрат концентрировали в вакууме. Получили 210 мг желтого твердого вещества. ИК(KBr): 3113, 2950, 2852, 1711, 1624, 1588, 1438, 1301, 1298, 1117, 1021, 979, 842 см-1. 1H ЯМР (300 МГц, ДМСО-d6)4,04 (с, 3H), 4,13 (с, 3H), 7,57 (д, 1H, J = 8,4 Гц), 8,22 (д, 1H, J = 8,4 Гц), 10,01 (с, 1H), 10,40 (с, 1H). Стадия 11. 6-Метоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоновая кислота Смесь метил-6-метоксибензо[4,5]фуро[2,3-d]пиридазин-9-карбоксилата (210 мг, 0,81 ммоль) и гидроксида натрия (65 мг, 1,64 ммоль) в метаноле (20 мл) нагревали до кипения при 60-70C в течение 3-4 ч. Реакционную смесь концентрировали в вакууме. Затем к реакционной смеси добавили воду (50 мл), и смесь подкислили разбавленной HCl. Полученный осадок отфильтровали и сушили в сушильном шкафу. Получили 200 мг твердого вещества желтоватого цвета.(300 мл) перемешивали при комнатной температуре в течение 6-7 ч. Реакционную смесь концентрировали в вакууме. Затем к реакционной смеси добавили воду (50 мл) и смесь подкислили разбавленной HCl. Полученный осадок отфильтровали и сушили в сушильном шкафу. Получили 190 мг твердого вещества желтоватого цвета. ИК (KBr): 3109, 2940, 2858, 2346, 1740, 1591, 1517, 1352, 1270, 1217, 1117, 1130, 1013, 975 см-1. 1-10-0C в атмосфере азота. Затем в атмосфере азота при той же температуре одной порцией добавили гидрид натрия (15 мг, 0,38 ммоль). Реакционную смесь охладили до 0-10C. К реакционной смеси по каплям добавили воду (300 мл) при 0-10C и смесь подкислили разбавленной HCl. Полученный осадок отфильтровали и сушили в сушильном шкафу. Твердое вещество очищали колоночной хроматографией,элюируя смесью 20% ацетона в хлороформе. Получили 18 мг чистого продукта в виде беловатого твердого вещества. ИК (KBr): 3195, 3045, 3028, 2937, 2842, 2344, 1655, 1596, 1490, 1303, 1286, 1122, 1024, 981, 812 см-1. 1 Стадия 1. Этил-2-(2-формил-6-метоксифенокси)ацетат Смесь o-ванилина (5,0 г, 32,9 ммоль), этилбромацетата (8,24 г, 49,3 ммоль) и карбоната калия (9,1 г,65,8 ммоль) в N,N-диметилформамиде (50 мл) нагревали до 80-90C в течение 3-4 ч. Реакционную смесь охладили до комнатной температуры. К реакционной смеси прибавили воду (300 мл) и смесь подкислили разбавленной HCl. Полученное твердое вещество отфильтровали, сушили с отсасыванием жидкости и затем сушили в сушильном шкафу. Получили 8,5 г чистого продукта в виде бледно-желтого твердого вещества. Т.пл.: 65,5-68C. ИК (KBr): 2997, 2978, 2948, 2914, 1756, 1693, 1587, 1482, 1399, 1380, 1260, 1233, 1173, 1055, 908,780, 746 см-1. 1H ЯМР (300 МГц, ДМСО-d6)1,17 (т, 3H), 3,86 (с, 3H), 4,13 (кв, 2H), 4,88 (с, 1H), 7,31 (т, 1H, J = 7,8 Гц), 7,12 (дд, 1H, J = 7,8, 1,5 Гц), 7,34 (дд, 1H, J = 7,8, 1,5 Гц), 10,51 (с, 1H). Стадия 2a. Этил-2-(2-циано-6-метоксифенокси)ацетат К смеси бикарбоната натрия (4,47 г, 53,2 ммоль) и гидроксиламин гидрохлорида (2,96 г, 42,6 ммоль) в этаноле (30 мл) при комнатной температуре при перемешивании добавили суспензию этил-2-(2 формил-6-метоксифенокси)ацетата (8,40 г, 35,5 ммоль) в этаноле (50 мл). К реакционной смеси добавили воду (100 мл), смесь подкислили разбавленной HCl и этанол удалили в вакууме. Полученное твердое вещество отфильтровали и сушили с отсасыванием жидкости. Получили бледно-желтое твердое вещество (7,8 г). Т.пл. 79-81C. ИК (KBr): 3256, 2990, 1752, 1582, 1478, 1254, 1224, 1197, 1179, 1060, 966, 783, 744 см-1. 1- 24014956 Операция 2b. Раствор диметиламинопиридина (3,73 г, 30,65 ммоль) в дихлорметане (30 мл) охладили до -10-0C. К реакционной смеси при -10-0C в атмосфере азота по каплям добавили тионилхлорид (7,95 г, 67,39 ммоль). Затем при той же температуре в атмосфере азота по каплям добавили раствор оксима (из стадии 2a) (7,75 г, 30,63 ммоль) в дихлорметане (50 мл). Через 15 мин по каплям добавили раствор диметиламинопиридина (5,6 г, 45,93 ммоль) в дихлорметане (50 мл). К реакционной смеси добавили воду (200 мл) и смесь подщелачивали насыщенным раствором бикарбоната натрия. Органическую массу экстрагировали дихлорметаном (3150 мл). Объединенные органические фазы промывали водой (3150 мл), а затем солевым раствором (100 мл) и сушили над безводным сульфатом натрия. После концентрации органической массы получили 7,0 г коричневого твердого вещества. Т.пл. 61-62C. ИК (KBr): 3082, 2971, 2943, 2843, 2236, 1752, 1579, 1476, 1442, 1381, 1307, 1284, 1263, 1189, 1090,1071, 1053, 1019, 787, 751 см-1. 1H ЯМР (300 МГц, ДМСО-d6)1,20 (т, 3H), 3,84 (с, 3H), 4,16 (кв, 2H), 4,91 (с, 1H), 7,23 (т, 1H, J = 7,8 Гц), 7,31 (дд, 1H, J = 7,8, 1,5 Гц), 7,40 (дд, 1H, J = 7,8, 1,5 Гц). Стадия 3. 6-Метокси-3,4-дигидробензо[4,5]фуро[3,2-d]пиримидин-4-он Этил-2-(2-циано-6-метоксифенокси)ацетат (6,95 г, 29,5 ммоль) нагревали в формамиде (35 мл) при 180-200C в течение 12-14 ч. Протекание реакции контролировали при помощи TCX. Реакционную смесь охладили до комнатной температуры. К реакционной смеси прибавили воду (100 мл). Полученное твердое вещество отфильтровали и сушили с отсасыванием жидкости. Получили желтое твердое вещество(дд, 1H, J = 7,8, 1,5 Гц), 8,24 (с, 1H), 12,99 (ушир. с, 1H). Стадия 4. 4-Хлор-6-метоксибензо[4,5]фуро[3,2-d]пиримидин Суспензию 6-метокси-3,4-дигидробензо[4,5]фуро[3,2-d]пиримидин-4-она (3,45 г, 1,44 ммоль) в оксихлориде фосфора (30 мл) нагревали до кипения при 120-130C. Реакционную смесь охладили до 010C. К реакционной смеси по каплям добавили воду (100 мл) при 0-10C. Полученный осадок отфильтровали и сушили в сушильном шкафу. Получили желтое твердое вещество (3,25 г). Т.пл. 174,5-176C. ИК (KBr): 2936, 1638, 1596, 1587, 1543, 1381, 1278, 1134, 1058, 931, 764 см-1. 1H ЯМР (300 МГц, ДМСО-d6)4,06 (с, 3H), 7,65 (м, 2H), 7,80 (дд, 1H, J = 7,8, 1,5 Гц), 9,02 (с, 1H). Стадия 5. 6-Метоксибензо[4,5]фуро[3,2-d]пиримидин Суспензию 4-хлор-6-метоксибензо[4,5]фуро[3,2-d]пиримидина (3,2 г, 13,63 ммоль), каталитического количества водного аммиака и 10%-ного палладия на угле (680 мг) в метаноле (40 мл) гидрировали при давлении водорода, равном 2,04 атм (30 psi), при комнатной температуре. Реакционную смесь отфильтровали через слой целита. Слой промывали метанолом (310 мл). Фильтрат концентрировали в вакууме. Получили 2,9 г желтого твердого вещества. Т.пл. 140-142C. ИК (KBr): 2923, 1637, 1597, 1584, 1561, 1396, 1293, 1277, 1180, 1098, 1032, 910, 840, 756 см-1. 1H ЯМР (300 МГц, ДМСО-d6)4,04 (с, 3H), 7,50 (м, 2H), 7,80 (дд, 1H, J = 7,8, 1,5 Гц), 9,24 (с, 1H),9,34 (с, 1H). Стадия 6. 9-Бром-6-метоксибензо[4,5]фуро[3,2-d]пиримидин Смесь 6-метоксибензо[4,5]фуро[3,2-d]пиримидина (2,0 г, 10,0 ммоль) и железа (0,042 г, 0,82 ммоль) в ледяной уксусной кислоте нагревали до 80-90C. Затем к реакционной смеси при той же температуре по каплям добавили бром (3,2 г, 20,0 ммоль). Реакционную смесь охладили до комнатной температуры и к реакционной смеси при 0-10C добавили по каплям воду (100 мл). Полученный осадок отфильтровали,промывали водой и сушили в сушильном шкафу. Получили желтое твердое вещество (2,25 г). Бледножелтое твердое вещество. Т.пл. 194-196C. ИК (KBr): 3056, 2935, 1631, 1586, 1558, 1500, 1455, 1402, 1384, 1286, 1262, 1213, 1093, 1032, 893,828, 791 см-1. 1(0,625 г, 6,989 ммоль) в N-метилпирролидине (10 мл) нагревали до 180-190C в течение 3-4 ч. Реакционную смесь охладили до комнатной температуры. Реакционную смесь остановили добавлением водного раствора FeCl3 (0,625 г), добавили воду (50 мл) и органическую массу экстрагировали дихлорметаном(650 мл). Объединенные органические фазы промывали водой (3100 мл), а затем солевым раствором(100 мл) и сушили над безводным сульфатом натрия. После концентрации органического раствора, неочищенную массу очищали при помощи колоночной хроматографии на силикагеле, элюируя смесью 5% этилацетата в хлороформе. Получили 0,807 г чистого продукта в виде бледно-желтого твердого вещества. Т.пл.: разлагается выше 268C. ИК (KBr): 3104, 3019, 2943, 2226, 1628, 1395, 1293, 1190, 1028, 904, 825 см-1. 1H ЯМР (300 МГц, ДМСО-d6)4,13 (с, 3H), 7,62 (д, 1H, J = 8,4 Гц), 8,10 (д, 1H, J = 8,4 Гц), 9,38 (с,1H), 9,49 (с, 1H). Стадия 8. 6-Метоксибензо[4,5]фуро[3,2-d]пиримидин-9-карбоновая кислота Раствор 6-метоксибензо[4,5]фуро[3,2-d]пиримидин-9-ил-цианида (600 мг, 2,66 ммоль) в 50% серной кислоте (5 мл H2SO4 + 5 мл воды) нагревали до кипения при 140-150C. Протекание реакции контролировали при помощи TCX. По окончании реакции реакционную смесь охладили до 0-10C. К реакционной смеси при 0-10C добавили по каплям воду (100 мл). Полученный осадок отфильтровали и сушили в сушильном шкафу. Твердое вещество очищали при помощи колоночной хроматографии на силикагеле,элюируя смесью 10% ацетона в хлороформе. Получили белое твердое вещество (400 мг). Т.пл.: разлагается выше 280C. ИК (KBr): 3067, 2918, 2710, 2639, 2517, 1697, 1627, 1579, 1554, 1442, 1384, 1294, 1255, 1123, 1026,898, 769 см-1. 1H ЯМР (300 МГц, ДМСО-d6)4,13 (с, 3H), 7,55 (д, 1H, J = 8,4 Гц), 8,01 (д, 1H, J = 8,4 Гц), 9,27 (с,1H), 9,43 (с, 1H), 13,5 (ушир. с, 1H). Стадия 9. 4-Нитрофенил-6-метоксибензо[4,5]фуро[3,2-d]пиримидин-9-карбоксилат Смесь 6-метоксибензо[4,5]фуро[3,2-d]пиримидин-9-карбоновой кислоты (100 мг, 0,409 ммоль) и каталитического количества ДМФА в тионилхлориде (5 мл) кипятили с обратным холодильником в течение 3-4 ч. Тионилхлорид удалили в вакууме. К концентрированной массе при комнатной температуре в атмосфере азота добавили тетрагидрофуран (5 мл). К реакционной смеси в атмосфере азота при комнатной температуре добавили раствор п-нитрофенола (85 мг, 0,613 ммоль) в тетрагидрофуране (5 мл). Затем при комнатной температуре в атмосфере азота добавили триэтиламин (82 мг, 0,818 ммоль). К реакционной смеси при комнатной температуре добавили воду. Полученное твердое вещество отфильтровали и очищали при помощи колоночной хроматографии на силикагеле, элюируя смесью 10% этилацетата в хлороформе. Получили желтоватое твердое вещество (96 мг). Т.пл. - разлагается выше 260C. ИК (KBr): 2925, 1727, 1627, 1592, 1518, 1392, 1351, 1291, 1265, 1229, 1124, 1024, 900, 873, 806 см-1. 1-10-0C в атмосфере азота. Затем одной порцией при той же температуре в атмосфере азота добавили гидрид натрия (21 мг, 0,54 ммоль). Реакционную смесь охладили до 0-10C. К реакционной смеси при 010C по каплям добавили воду (300 мл) и смесь подкислили разбавленной HCl. Полученный осадок отфильтровали и сушили в сушильном шкафу. Твердое вещество очищали колоночной хроматографией,элюируя смесью 20% этилацетата в хлороформе. Получили 25 мг чистого продукта в виде беловатого твердого вещества. Т.пл.: разлагается выше 260C. ИК (KBr): 3171, 3097, 2919, 2849, 1680, 1622, 1597, 1508, 1400, 1282, 1119, 1022, 903, 806 см-1. 1 Стадия 1. 1-Метокси-2-(2-пропенилокси)бензол К хорошо перемешиваемому раствору гваякола (10,0 г, 80,55 ммоль) и пропаргилбромида (11,5 г,96,66 ммоль) в ДМФА (100 мл) добавили безводный K2CO3 (22,0 г, 161,2 ммоль) и смесь перемешивали при комнатной температуре в течение 3-4 ч. Затем смесь отфильтровали для удаления неорганического материала. Фильтрат концентрировали в вакууме и разбавляли водой (250 мл). Затем его экстрагировали этилацетатом (3100 мл). Объединенные органические слои промывали водой (2100 мл) и сушили над- 26014956 безводным сульфатом натрия. При удалении растворителя в вакууме получили продукт (13,0 г) в виде коричневого масла. ИК (чистый): 3438, 2949, 1728, 1619, 1589, 1426, 1291, 1107, 1001, 957, 825, 758 см-1. 1H ЯМР (300 МГц, d6-ДМСО): 2,49 (с, 1H), 3,86 (с, 3H), 4,76 (с, 2H), 6,95 (м, 4H). Стадия 2. 7-Метокси-2-метилбензо[b]фуран К хорошо перемешиваемому раствору 1-метокси-2-(2-пропенилокси)бензола (из стадии 1) (13,0 г,80,24 ммоль) в N,N-диэтиланилине (130 мл) добавили фторид цезия (15,85 г, 104 ммоль) и смесь нагревали до 215-220C в течение 4-5 ч. Реакционную смесь охладили до комнатной температуры и добавили 10%-ный водный раствор HCl (1,0 л), а затем добавили этилацетат (300 мл). Смесь отфильтровали через слой целита. Органический слой отделяли, промывали водой (2100 мл) и сушили над безводным сульфатом натрия. При удалении растворителя в вакууме получили неочищенный продукт (11,0 г) в виде темно-коричневого масла. Затем его очищали при помощи колоночной хроматографии на силикагеле,элюируя смесью петролейный эфир:этилацетат (9:1), в результате чего получили продукт в виде бледножелтого масла (4,6 г). ИК (чистый): 3440, 2952, 1725, 1627, 1599, 1421, 1285, 1118, 1005, 951, 818, 748 см-1. 1H ЯМР (300 МГц, d6-ДМСО): 2,47 (с, 3H), 4,00 (с, 3H), 6,36 (с, 1H), 7,06 (м, 3H). Стадия 3. 7-Метокси-2-метилбензо[b]фуран-4-карбоксальдегид К хорошо перемешиваемому раствору 7-метокси-2-метилбензо[b]фурана (из стадии 2) (6,5 г, 40,07 ммоль) в ДХМ (дихлорметане) (70,0 мл) добавили хлорид олова(II) (17,7 г, 68,26 ммоль), а затем медленно добавили 1,1-дихлорметилметиловый эфир (4,6 г, 40,07 ммоль) при -10-0C и смесь перемешивали в течение 1-2 ч. Затем при интенсивном перемешивании добавили ледяную воду (100 мл), органический слой отделяли, промывали водой (250 мл) и сушили над безводным сульфатом натрия. При удалении растворителя получили неочищенный продукт (7,0 г). Неочищенный продукт очищали колоночной хроматографией на силикагеле, элюируя смесью петролейный эфир:этилацетат (9:1), в результате чего получили продукт в виде бледно-желтого масла (2,3 г). Т.пл.: 167-170C. ИК (чистый): 3468, 3017, 1741, 1677, 1595, 1512, 1399, 1242, 1175, 1098, 937, 755 см-1. 1H ЯМР (300 МГц, d6-ДМСО)2,50 (с, 3H), 4,03 (с, 3H), 7,09 (д, 1H, J = 8,1 Гц), 7,12 (с, 1H), 7,81 (д,1H, J = 8,4 Гц), 10,00 (с, 1H). Стадия 4. 7-Метокси-2-метилбензо[b]фуран-4-карбоновая кислота К хорошо перемешиваемому раствору 7-метокси-2-метилбензо[b]фуран-4-карбоксальдегида (из стадии 3) (4,0 г, 21,05 ммоль) в ацетоне (40,0 мл) добавили раствор сульфаминовой кислоты (2,4 г, 25,26 ммоль) в воде (10,0 мл), а затем при 5-10C добавили раствор хлорита натрия (2,8 г, 31,57 ммоль). К реакционной смеси добавили ледяную воду (250 мл) и выделившийся продукт отфильтровали и сушили при 60-70C, получая интермедиат-4 (3,2 г) в виде белого твердого вещества. Т.пл.: 228-233C. ИК (чистый): 3400, 1681, 1577, 1449, 1227, 1185, 1096, 966 см-1. 1H ЯМР (300 МГц, d6-ДМСО)2,47 (д, 3H, J = 9,6 Гц), 3,98 (с, 3H), 6,93 (д, 1H, J = 9,0 Гц), 6,96 (с,1H), 7,81 (д, 1H, J = 8,4 Гц), 12,66 (ушир. с, 1H). Стадия 5. Метил-7-метокси-2-метилбензо[b]фуран-4-карбоксилат К хорошо перемешиваемой суспензии 7-метокси-2-метилбензо[b]фуран-4-карбоновой кислоты (из стадии 4) (4,5 г, 24,21 ммоль) и порошкообразного карбоната калия (7,5 г, 54,61 ммоль) в ацетоне (740,0 мл) добавили диметилсульфат (4,1 г, 32,76 ммоль) и кипятили с обратным холодильником в течение 2-3 ч. Реакционную смесь охладили до комнатной температуры и к ней добавили воду (500 мл). Выделившийся органический материал экстрагировали этилацетатом (3100 мл). Объединенные органические слои промывали водой (2100 мл) и сушили над безводным сульфатом натрия. При удалении растворителя в вакууме получили продукт (4,0 г) в виде вязкого коричневого масла. Т.пл.: 127-129C. ИК (Чистый): 3435, 1625, 1511, 1434, 1281, 1129, 1096, 940, 772 см-1. 1H ЯМР (300 МГц, d6-ДМСО)2,48 (д, 3H, J = 9,6 Гц), 3,86 (с, 3H), 3,99 (с, 1H), 6,97 (д, 1H, J = 9,0 Гц), 6,99 (с, 1H), 7,83 (д, 1H, J = 8,4 Гц). Стадия 6. Метил-2-бромметил-7-метоксибензо[b]фуран-4-карбоксилат К хорошо перемешиваемому кипящему раствору 2,2'-азо-бис-изобутиронитрил (AIBN) (40,0 мг,1,0%) и N-бромсукцинимида (3,4 г, 19,05 ммоль) в четыреххлористом углероде (60,0 мл) добавили метил-7-метокси-2-метилбензо[b]фуран-4-карбоксилат (из стадии 5) (4,0 г, 18,16 ммоль) и кипятили в течение 2-3 ч. Реакционную смесь охладили до комнатной температуры и профильтровали через слой целита. Фильтрат концентрировали в вакууме, получая продукт (3,1 г) в виде коричневого масла. Полученный продукт использовали в следующей стадии без дальнейшей очистки. Стадия 7. Метил-2-формил-7-метоксибензо[b]фуран-4-карбоксилат К хорошо перемешиваемому раствору метил-2-бромметил-7-метоксибензо[b]фуран-4-карбоксилата- 27014956 натрия (1,64 г, 15,55 ммоль) при 90-95C и перемешивали в течение 2-3 ч. Реакционную смесь охладили до комнатной температуры, разбавляли водой (300 мл) и экстрагировали этилацетатом (3100 мл). Объединенные органические слои промывали водой (250 мл) и сушили над безводным сульфатом натрия. При удалении растворителя получили неочищенный продукт (2,9 г) в виде вязкого коричневого масла. Очистка колоночной хроматографией на силикагеле с элюированием смесью хлороформ:этилацетатH ЯМР (300 МГц, d6-ДМСО)3,92 (с, 3H), 4,06 (с, 1H), 7,32 (д, 1H, J = 9,0 Гц), 8,03 (д, 1H, J = 8,4 Гц), 8,24 (с, 1H), 9,94 (с, 1H). Стадия 8. (Z)-3-(7-метокси-4-метилоксикарбонилбензо[b]фуран-2-ил)-2-пропеновая кислота К хорошо перемешиваемому раствору метил-2-формил-7-метоксибензо[b]фуран-4-карбоксилата (из стадии 7) (2,0 г, 8,53 ммоль) в толуоле (50,0 мл) добавили малоновую кислоту (1,33 г, 12,80 ммоль) и пиперидин (0,5 мл). Реакционную смесь затем кипятили с обратным холодильником в течение 3-4 ч. Реакционную смесь охладили до комнатной температуры, подкислили 10% водным раствором HCl и экстрагировали этилацетатом (2100 мл). Объединенные органические слои промывали водой (2100 мл) и сушили над безводным сульфатом натрия. При удалении растворителя в вакууме получили продукт (1,8 г) в виде светло-желтого твердого вещества. Т.пл.: 175-178C. ИК (чистый): 3435, 1716, 1630, 1509, 1404, 1335, 1289, 1215, 1145, 1031, 951, 757 см-1. 1H ЯМР (300 МГц, d6-ДМСО)3,88 (с, 3H), 4,04 (с, 1H), 6,50 (с, 1H, J = 15,9 Гц), 7,15 (д, 1H, J = 5,7 Гц), 7,66 (д, 1H, J = 15,6 Гц), 7,92 (д, 1H, J = 8,4 Гц), 12,75 (ушир. с, 1H). Стадия 9. Метил-2-[(Z)-2-азидокарбонил)-1-этенил]-7-метоксибензо[b]фуран-4-карбоксилат К хорошо перемешиваемому раствору (Z)-3-(7-метокси-4-метилоксикарбонилбензо[b]фуран-2-ил)2-пропеновой кислоты (из стадии 8) (1,6 г, 5,79 ммоль) и триэтиламина (1,0 мл) в дихлорметане (15 мл) добавили раствор этилхлороформиата (940 мг, 8,68 ммоль) в дихлорметане (5,0 мл) при -10C и перемешивали в течение 2-3 ч. К реакционной смеси добавили воду (50,0 мл); органическую фазу отделили и сушили над безводным сульфатом натрия. При удалении растворителя в вакууме получили интермедиат 9 в виде маслянистого остатка (1,5 г). К хорошо перемешиваемому раствору этого остатка (1,5 г, 4,31 ммоль) в ацетоне (15,0 мл) добавили при 5-10C раствор азида натрия (1,0 г, 15,38 ммоль) в воде (5,0 мл) и перемешивали в течение 2-3 ч. Реакционную смесь разбавили холодной водой (100 мл) и фильтровали,получая промежуточный азид в виде желтого твердого вещества (1,3 г). Стадия 10. Метил-1-гидрокси-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат К хорошо перемешиваемому кипящему раствору три-(н-бутил)амина (2,0 мл) в дифениловом эфире(25,0 мл) добавили раствор метил-2-[(Z)-2-азидокарбонил-1-этенил]-7-метоксибензо[b]фуран-4 карбоксилата (из стадии 9) (1,3 г) в дифениловом эфире (50,0 мл) и кипятили с обратным холодильником в течение 1-1,5 ч. Избыток дифенилового эфира удалили в вакууме и полученный остаток обрабатывали петролейным эфиром (325 мл), получая интермедиат 11 в виде желтого твердого вещества (1,1 г). Т.пл.: 205-207C. ИК (чистый): 3434, 1715, 1661, 1516, 1433, 1287, 1215, 1117, 1014, 755 см-1. 1(1,1 г) и оксихлорида фосфора (25 мл) кипятили с обратным холодильником в течение 15-16 ч. Избыток оксихлорида фосфора удалили в вакууме. Полученный остаток разбавили водой (10,0 мл) и довели до щелочной реакции твердым карбонатом натрия. Выделившееся твердое вещество отфильтровали, промывали водой и сушили, получая неочищенный интермедиат 12 (1,0 г) в виде твердого коричневого вещества. Очистка колоночной хроматографией на силикагеле с элюированием смесью хлороформ:этилацетат (9:1) привела к получению чистого интермедиата-12 (350 мг) в виде светло-желтого твердого вещества. Т.пл.: 195-197C. ИК(см-1): 1718, 1668, 1507, 1421, 1271, 1223, 1109, 1001, 756 см-1. 1H ЯМР (300 МГц, d6-ДМСО)3,89 (с, 3H), 4,06 (с, 1H), 7,43 (д, 1H, J = 8,4 Гц), 7,65 (д, 1H, J = 8,4 Гц), 7,95 (д, 1H, J = 5,4 Гц), 8,55 (д, 1H, J = 5,4 Гц). Стадия 12. Метил-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат Смесь метил-1-хлор-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилата (из стадии 11) (330 мг), 10% Pd на угле (50 мг), триэтиламина (2,0 мл) и ДМФА (10,0 мл) гидрировали в аппарате Парра при давлении газообразного водорода, равном 3,40-3,74 атм (50-55 psi). Катализатор отфильтровывали и фильтрат концентрировали в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле с элюированием смесью хлороформ:ацетон (8:2), получая интермедиат-13 (200 мг) в видеH ЯМР (300 МГц, d6-ДМСО)4,00 (с, 3H), 4,09 (с, 1H), 7,41 (д, 1H, J = 8,4 Гц), 7,89 (д, 1H, J = 5,7 Гц), 8,13 (д, 1H, J = 9,0 Гц), 8,73 (д, 1H, J = 5,4 Гц), 9,94 (с, 1H). Стадия 13. 6-Метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоновая кислота Смесь метил-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилата (из стадии 12) (200 мг, 0,77 ммоль), метанола (5,0 мл) и гидроксида натрия (160 мг, 3,88 ммоль) кипятили в течение 2-3 ч. Избыток метанола удалили под уменьшенным давлением; остаток разбавляли водой (5,0 мл) и подкисляли уксусной кислотой до рН 5-6. Полученное твердое вещество отфильтровали и сушили, получая интермедиат 14 (130 мг) в виде беловатого твердого вещества. Т.пл.:260C. ИК (чистый): 3433, 2075, 1634, 1288, 1219, 1115, 1017, 771 см-1. 1H ЯМР (300 МГц, d6-ДМСО)4,19 (с, 3H), 7,41 (д, 1H, J = 8,4 Гц), 7,89 (д, 1H, J = 5,7 Гц), 8,13 (д,1H, J = 9,0 Гц), 8,73 (д, 1H, J = 5,4 Гц), 10,12 (с, 1H), 12,8 (ушир. с, 1H). Стадия 14. 4-Нитрофенил-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксилат Смесь 6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоновой кислоты (из стадии 13) (65 мг, 0.178 ммоль), п-нитрофенола (37 мг, 0,267 ммоль), EDCI (51 мг, 0,267 ммоль), 4,4-диметиламинопиридина (2,0 мг, 0,017 ммоль) в ДМФА (3,0 мл) нагревали до 70-75C в течение 4-5 ч. Остаток, полученный после удаления растворителя в вакууме, обработали водой (5,0 мл), получая интермедиат 15 (55 мг) в виде желтого твердого вещества. Т.пл.:250C. ИК(см-1): 3433, 2075, 1634, 1534, 1318, 1276, 1223, 1109, 1013, 776 см-1. 1H ЯМР (300 МГц, d6-ДМСО)4,14 (с, 3H), 7,51 (д, 1H, J = 8,4 Гц), 7,76 (д, 2H, J = 8,4 Гц), 7,92 (д,1H, J = 5,7 Гц), 8,41 (м, 3H), 8,73 (д, 1H, J = 5,4 Гц), 9,87 (с, 1H). Стадия 15. N9-(3,5-дихлор-4-пиридил)-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9-карбоксамид К хорошо перемешиваемому раствору 4-нитрофенил-6-метоксибензо[4,5]фуро[3,2-c]пиридин-9 карбоксилата (из стадии 14) (55 мг, 0,15 ммоль) и 4-амино-3,5-дихлорпиридина (50 мг, 0,30 ммоль) в ДМФА (2,0 мл) добавили гидрид натрия (60% дисперсию в минеральном масле) (18 мг, 0,45 ммоль) при-5C и смесь перемешивали в течение 30-40 мин. Избыток ДМФА удалили под уменьшенным давлением,полученный остаток разбавляли водой (5 мл) и подкисляли уксусной кислотой до рН 5-6. Полученное твердое вещество отфильтровали, промывали водой и сушили, получая продукт (27 мг) в виде беловатого твердого вещества. Т.пл.: 260C. ИК (чистый): 3434, 1657, 1631, 1559, 1494, 1394, 1287, 1179, 1097, 892, 771 см-1. 1 Стадия 1. 2-этоксикарбонил-7-гидрокси-3-метилбензо[b]фуран-4-карбоновая кислота Раствор 2-Этил-4-метил-7-метокси-3-метилбензо[b]фуран-2,4-дикарбоксилата (из стадии 5 примера 1) (13,0 г), п-тиокрезолата натрия (20,26 г, 1,5 экв.) и триамида гексаметилфосфорной кислоты (24,80 г,1,5 экв.) нагревали в сухом толуоле до температуры кипения в атмосфере азота в течение 2-6 ч. Реакционную смесь охладили до комнатной температуры, добавили воду и водный слой промывали дихлорметаном. Водный слой подкислили при 10-15C концентрированной соляной кислотой. Выпавший продукт отфильтровали и сушили. Т.пл.: выше 270C. Стадия 2. 2,4-Диэтил-7-гидрокси-3-метилбензо[b]фуран-2,4-дикарбоксилат Раствор 2-этоксикарбонил-7-гидрокси-3-метилбензо[b]фуран-4-карбоновой кислоты (из стадии 1)(13 г) и конц. H2SO4 в этаноле нагревали до кипения. Протекание реакции контролировали при помощиTCX. По окончании реакции реакционную смесь концентрировали в вакууме. Затем к реакционной смеси добавили воду (500 мл) и полученный осадок отфильтровали и сушили в сушильном шкафу. Неочищенное твердое вещество очищали при помощи колоночной хроматографии на силикагеле, элюируя смесью 20% этилацетата в хлороформе. Получили 6,5 г желтоватого твердого вещества. Т.пл.: 195-197C.
МПК / Метки
МПК: A61K 31/407, A61K 31/343, A61K 31/38, C07D 491/04, A61P 29/00, C07D 471/04, C07D 495/04
Метки: соединения, аллергических, воспалительных, лечения, гетероциклические, применяемые, нарушений
Код ссылки
<a href="https://eas.patents.su/30-14956-geterociklicheskie-soedineniya-primenyaemye-dlya-lecheniya-vospalitelnyh-i-allergicheskih-narushenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклические соединения, применяемые для лечения воспалительных и аллергических нарушений</a>
Предыдущий патент: Производные фталазина в качестве ингибиторов parp
Следующий патент: Дикетопиперазиновые и пиперидиновые производные в качестве противовирусных агентов
Случайный патент: Нетоксичный, недорогой буровой раствор


































