Соединения и способы модуляции fxr
Номер патента: 14720
Опубликовано: 28.02.2011
Авторы: Доти Роберт Энтони, Варшавски Алан М., Ститс Райан Эдвард, Белл Майкл Грегори, Ма Тяньвэй, Ландер Питер Амброз, Стельзер Линдсэй Скотт, Даулинг Мэттью Скотт, Мэнтло Натан Брайан, Генин Майкл Джеймс, Очоада Джейсон Мэттью
Формула / Реферат
1. Соединение формулы
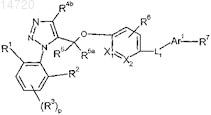
в которой р равен 0, 1 или 2;
X1 представляет собой С или N и X2представляет собой С или N при условии, что как X1, так и X2 одновременно не являются N;
R1 и R2независимо выбраны из группы, включающей водород, C1-C3-алкил, C1-C3-галогеналкил, C1-C3-тиогалогеналкил, C1-C3-алкоксигруппу, C1-C3-галогеналкоксигруппу и галоген;
R3 независимо выбран из группы, включающей водород, C1-C3-алкил, C1-C3-галогеналкил, C1-C3-алкоксигруппу, C1-C3-галогеналкоксигруппу и галоген;
R4b выбран из группы, включающей водород, C1-C3-алкил, C1-C3-галогеналкил, C3-C6-циклоалкил и C4-C5-алкилциклоалкил;
R5 и R5a независимо выбраны из группы, включающей водород и C1-C3-алкил;
R6 выбран из группы, включающей водород, C1-C3-алкил, C1-C3-галогеналкил, галоген и -NO2;
L1 выбран из группы, включающей химическую связь, CRa=CRb, этинил, C1-C3-алкил-S-, C1-C3-алкил-О-, N(Rc)-C1-C3-алкил и -C1-C3-алкил-N(Rc)-, где Ra и Rb независимо выбраны из группы, включающей водород и C1-C3-алкил, и Rc независимо выбран из группы, включающей Н, C1-C5-алкил, C1-C3-алкилфенил и C4-C8-алкилциклоалкил;
Ar1 выбран из группы, включающей индолил, бензотиенил, бензоизотиазолил, индазолил, нафтил, фенил, пиридинил, пиразолил, пирролил, тиенил, тиазолил и фуранил, каждый из которых может иметь в качестве заместителя одну или две группы, независимо выбранные из группы, включающей гидрокси, C1-C3-алкил, C1-C3-галогеналкил, галоген, C2-C4-алкенил, C2-C4-алкинил, C1-C4-алкокси, -OC1-C2-алкилфенил и NHC(O)R10;
R7 выбран из группы, включающей -COOH, -C1-C3-алкил-COOH, -O-C1-C3-алкил-COOH, -C3-C8-циклоалкил-COOH и -CONR11R11;
каждый из R10 независимо выбран из группы, включающей водород, C1-C3-алкил и фенил;
каждый из R11 независимо представляет собой водород или C1-C5-алкил;
или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1, в котором
р равен 0 или 1;
как X1, так и X2 представляет собой С, или X1 представляет собой N и X2представляет собой С;
R1 и R2независимо выбраны из группы, включающей водород, фтор, хлор, CF3, SCF3, OCF3;
R3 представляет собой водород, фтор, хлор, C1-C3-алкил, CF3, SCF3или OCF3;
R4b представляет собой Н, C1-C3-алкил, C1-C3-галогеналкил, C1-C3-галогеналкоксигруппу или C3-C4-циклоалкил;
каждый из R5 и R5a независимо выбран из Н или C1-C3-алкила;
группа Ar1представляет собой фенил, индолил, пиридинил, пирролил, тиенил, нафтил, тиазолил, фуранил, пиразолил, индазолил, бензоизотиазолил и бензотиенил, каждый из которых может иметь в качестве заместителя одну или две группы, независимо выбранные из C1-C5-алкила, C1-C3-алкокси, C1-C2-галогеналкокси и C1-C3-галогеналкила;
R6 представляет собой водород, метил, этил или хлор;
L1 представляет собой химическую связь, этенил, -CH(CH3)-S-, C(CH3)2-S-, -СН2О-, -СН2СН2О-, -СН(CH3)-O-, -CH(CH3)CH2-O-, -CH(CH2CH3)-O-, -CH2NH-, -CH2CH2NH-, -N(Rc)CH2-, N(Rc)CH2CH2- или N(Rc)CH2CH2CH2-; где Rc представляет собой водород, C1-C2-алкил, бензил или -СН2СН2-O-СН2-;
R7 представляет собой COOH, -CH2COOH, -СН(СН3)COOH, -циклопропил-COOH, -С(СН3)2COOH, CONH2, C(O)NHCH3или C(O)NHCH2CH3;
R10 представляет собой водород или C1-C2-алкил;
R11 представляет собой водород или C1-C2-алкил.
3. Соединение по п.1, в котором
как X1, так и Х2 представляет собой С;
р равен 1;
R1 и R2независимо выбраны из группы, включающей хлор, фтор, трифторметил, тиотрифторметил и трифторметокси;
R3 представляет собой водород;
R4b представляет собой трифторметил, изопропил или циклопропил;
L1 представляет собой этенил, ацетилен, -N(CH3)СН2- или -N(СН3)СН2СН2-;
как R5, так и R5a представляет собой водород;
R6 представляет собой водород, метил, хлор или бром;
Ar1 представляет собой фенил, индолил, индазолил, бензотиенил или бензоизотиазолил, каждый из которых может иметь в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и
R7 представляет собой COOH.
4. Соединение по п.1, в котором
как X1, так и Х2 представляет собой С;
р равен 1;
R1 и R2независимо выбраны из группы, включающей хлор, фтор, трифторметил, тиотрифторметил и трифторметоксигруппу;
R3 представляет собой водород;
R4b представляет собой трифторметил, изопропил или циклопропил;
L1 представляет собой -N(CH3)CH2- или -N(СН3)СН2СН2-;
как R5, так и R5a представляет собой водород;
R6 представляет собой водород, метил, этил или хлор;
Ar1 представляет собой фенил, бензоизотиазолил, индазолил, индолил или бензотиенил, каждый из которых может иметь в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и
R7 представляет собой COOH.
5. Соединение по п.1 или 4, в котором
как X1, так и Х2 представляет собой С;
р равен 1;
R1 и R2независимо выбраны из группы, включающей водород, хлор, фтор, трифторметил, тиотрифторметил и трифторметокси;
R3 представляет собой водород;
R4b представляет собой трифторметил, изопропил или циклопропил;
L1 представляет собой -N(CH3)СН2- или -N(CH3)СН2СН2-;
как R5, так и R5a представляет собой водород;
R6 представляет собой водород, метил, этил или хлор;
Ar1 представляет собой фенил, необязательно имеющий в качестве заместителя группу, выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и
R7 представляет собой COOH.
6. Соединение по п.1, в котором
как X1, так и Х2 представляет собой С;
р равен 1;
R1 и R2независимо выбраны из группы, включающей водород, хлор, фтор, трифторметил, тиотрифторметил и трифторметокси;
R3 представляет собой водород;
R4b представляет собой трифторметил, изопропил или циклопропил;
L1 представляет собой химическую связь, -N(CH3)СН2- или -N(СН3)СН2СН2-;
как R5, так и R5a представляет собой водород;
R6 представляет собой водород, метил, этил или хлор;
Ar1 представляет собой фенил, бензоизотиазолил, индазолил, индолил или бензотиенил, каждый из которых может иметь в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси;
и R7представляет собой COOH.
7. Соединение по п.1 или 4, в котором
как X1, так и Х2 представляет собой С;
р равен 1;
R1 и R2независимо выбраны из группы, включающей водород, хлор, фтор, трифторметил, тиотрифторметил и трифторметокси;
R3 представляет собой водород;
R4b представляет собой трифторметил, изопропил или циклопропил;
L1 представляет собой -N(CH3)СН2- или -N(СН3)СН2СН2-;
как R5, так и R5a представляет собой водород;
R6 представляет собой водород, метил, этил или хлор;
Ar1 представляет собой бензоизотиазолил, индазолил, индолил или бензотиенил, каждый из которых может иметь в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси;
и R7представляет собой COOH.
8. Соединение по п.1, в котором
как X1, так и Х2 представляет собой С;
р равен 1;
R1 и R2независимо выбраны из группы, включающей водород, хлор, фтор, трифторметил, тиотрифторметил и трифторметокси;
R3 представляет собой водород;
R4b представляет собой трифторметил, изопропил или циклопропил;
L1 представляет собой химическую связь;
как R5, так и R5a представляет собой водород;
R6 представляет собой водород, метил, этил или хлор;
Ar1 представляет собой фенил, бензоизотиазолил, индазолил, индолил или бензотиенил, каждый из которых может иметь в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси;
и R7представляет собой COOH.
9. Соединение по п.1, в котором
как X1, так и X2 представляет собой С;
р равен 1;
R1 и R2независимо выбраны из группы, включающей водород, хлор, фтор, трифторметил, тиотрифторметил и трифторметокси;
R3 представляет собой водород;
R4b представляет собой трифторметил, изопропил или циклопропил;
L1 представляет собой химическую связь;
как R5, так и R5a представляет собой водород;
R6 представляет собой водород, метил, этил или хлор;
Ar1 представляет собой фенил, который может иметь в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси;
и R7представляет собой COOH.
10. Соединение, выбранное из группы, включающей
4-[({4-[3-(2,6-дихлорфенил)-5-трифторметил-3H-[1,2,3]триазол-4-илметокси]-2-метилфенил}метиламино) метил]-2-метилбензойную кислоту,
3-[({4-[3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2-метилфенил}метиламино)метил]бензойную кислоту,
3-[({4-[5-изопропил-3-(2-трифторметоксифенил)-3H-[1,2,3]триазол-4-илметокси]-2-метилфенил}метиламино)метил]бензойную кислоту,
4-[({4-[5-изопропил-3-(2,6-дихлорфенил)-3H-[1,2,3]триазол-4-илметокси]-2-метилфенил}метиламино) метил]бензойную кислоту,
4-[({4-[5-циклопропил-3-(2,6-дихлорфенил)-3H-[1,2,3]триазол-4-илметокси]-2-метилфенил}метиламино) метил]-2-метилбензойную кислоту,
3-[({4-[3-(2-хлор-6-фторфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2-метилфенил}метиламино) метил]бензойную кислоту,
4-[({6-[5-изопропил-3-(2-трифторметоксифенил)-3H-[1,2,3]триазол-4-илметокси]-2-метилпиридин-3-ил}метиламино)метил]-2-метилбензойную кислоту,
или фармацевтически приемлемая соль указанного соединения.
11. Соединение 4-[({4-[3-(2,6-дихлорфенил)-5-трифторметил-3H-[1,2,3]триазол-4-илметокси]-2-метилфенил}метиламино)метил]-2-метилбензойная кислота.
12. Соединение 6-{4-[3-(2,6-дихлорфенил)-5-трифторметил-3H-[1,2,3]триазол-4-илметокси]-2-метилфенил}-1-изопропил-1Н-индазол-3-карбоновая кислота.
13. Соединение 6-{4-[5-циклопропил-3-(2,6-дихлорфенил)-3H-[1,2,3]триазол-4-илметокси]-2-метилфенил}-1-изопропил-1Н-индазол-3-карбоновая кислота.
14. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 и носитель, разбавитель или наполнитель.
15. Применение соединения по любому из пп.1-13 для получения лекарственного средства для лечения заболеваний, опосредованных FXR.
Текст
В изобретении предложены соединения формулы где переменные являются такими, как определено в данном описании, а также фармацевтические композиции, содержащие указанные соединения, и способы их применения. Предложенные согласно изобретению соединения и композиции полезны в лечении дислипидемии и родственных заболеваний.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 014720 Область изобретения Настоящее изобретение относится к области медицинской органической химии, фармакологии и медицины. В частности, настоящее изобретение относится к новым соединениям, полезным для лечения заболеваний, связанных с дислипидемией. Уровень техники Дислипидемия и заболевания, связанные с дислипидемией, например атеросклероз, ишемическая болезнь сердца, инсульт и другие, являются основными причинами смерти, возникновения других заболеваний и экономических потерь. Общепризнано, что липиды плазмы, особенно фракции холестерина,играют значительную роль в нормальном функционировании сердечно-сосудистой системы. Поэтому желательна модуляция липидов плазмы, таких как триглицериды, ЛПВП-холестерин (холестерин липопротеинов высокой плотности) и ЛПНП-холестерин (холестерин липопротеинов низкой плотности), оказывающая благоприятное действие. В настоящее время прилагаются значительные усилия для получения безопасных и эффективных соединений для лечения заболеваний, связанных с дислипидемией. Например, в международной заявкеWO 2004/048349 А 1 описаны соединения, полезные в качестве агонистов фарнезоидного Х-рецептора(FXR). Агонисты FXR являются лигандами ядерного рецептора, который регулирует транскрипцию генов,контролирующих метаболизм триглицеридов, холестерина и углеводов. Ввиду того, что попытки, предпринятые для получения таких соединений, не привели к желаемому результату, существует необходимость в обнаружении и разработке соединений, которые должны являться (1) высокоактивными, (2) эффективными (согласно экспериментам на in vivo моделях) и/или (3) селективными агонистами FXR. Такие соединения были ли бы полезны в лечении расстройств, характеризующихся нежелательным липидным профилем или являющихся следствием такого профиля, и включают дислипидемию, атеросклероз,диабет и родственные заболевания. В настоящем изобретении предложены соединения, которые, как считается, должны являться (1) высокоактивными, (2) эффективными (согласно экспериментам на in vivo моделях) и/или (3) селективными агонистами FXR. Краткое изложение сущности изобретения Настоящее изобретение относится к соединению формулыX1 представляет собой С или N и Х 2 представляет собой С или N при условии, что X1 и X2 одновременно не являются N;R1 и R2 независимо выбраны из группы, состоящей из атома водорода, C1-C3-алкила, C1-C3 галогеналкила, C1-C3-тиогалогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси и атома галогена;R3 независимо выбран из группы, состоящей из атома водорода, C1-C3-алкила, C1-C3-галогеналкила,C1-C3-алкокси, C1-C3-галогеналкокси и атома галогена;R4b выбран из группы, состоящей из атома водорода, C1-C3-алкила, C1-C3-галогеналкила, C3-C6 циклоалкила и C4-C5-алкилциклоалкила;R5 и R5a независимо выбраны из группы, состоящей из атома водорода и C1-C3-алкила;R6 выбран из группы, состоящей из атома водорода, C1-C3-алкила, C1-C3-галогеналкила, атома галогена и -NO2;L1 выбран из группы, состоящей из связи, CRa=CRb, этинила, C1-C3-алкил-S-, C1-C3-алкил-О-, N(Rc)C1-C3-алкила и -C1-C3-алкил-N(Rc)-, где Ra и Rb независимо выбраны из группы, состоящей из атома водорода и C1-C3-алкила, и Rc независимо выбран из группы, состоящей из Н, C1-C5-алкила, C1-C3 алкилфенила и С 4-С 8 алкилциклоалкила;Ar1 выбран из группы, состоящей из индолила, бензотиенила, бензоизотиазолила, индазолила, нафтила, фенила, пиридинила, пиразолила, пирролила, тиенила, тиазолила и фуранила, каждый из которых,необязательно, имеет в качестве заместителей одну или две группы, независимо выбранные из группы,состоящей из гидрокси, C1-C3-алкила, C1-C3-галогеналкила, атома галогена, C2-C4-алкенила, C2-C4 алкинила, C1-C4-алкокси, -OC1-C2-алкилфенила и NHC(O)R10;R7 выбран из группы, состоящей из -COOH, -C1-C3-алкил-COOH, -O-C1-C3-алкил-COOH, -C3-C8 циклоалкил-COOH и -CONR11R11; каждый R10 независимо выбран из группы, состоящей из атома водорода, C1-C3-алкила и фенила;-1 014720 каждый R11 независимо представляет собой водород или C1-C5-алкил; или его фармацевтически приемлемой соли. Соединения согласно настоящему изобретению являются агонистами FXR. Соединения по настоящему изобретению являются полезными для изменения липидного профиля в лечебных целях, включая,без ограничения, снижение уровня общего холестерина, снижение уровня ЛПНП-холестерина, снижение уровня ЛПОНП-холестерина (холестерина липопротеинов очень низкой плотности), повышение уровня ЛПВП (липопротеинов высокой плотности), снижение уровня триглицеридов, и для синтеза продукции инсулина в соответствии с уровнем глюкозы в лечебных целях. Соответственно в настоящем изобретении предложен способ лечения состояний, опосредуемых FXR, таких как дислипидемия и заболевания,связанные с дислипидемией, включающий введение терапевтически эффективного количества соединения по настоящему изобретению нуждающемуся в этом пациенту. В настоящем изобретении также предложена фармацевтическая композиция, содержащая соединение по настоящему изобретению и фармацевтически приемлемый носитель. Настоящее изобретение также относится к применению соединения по настоящему изобретению для получения лекарственного средства. Подробное описание изобретения Термин "дислипидемия" в контексте данного описания относится к аномальному профилю или количеству липидов и липопротеинов в крови и к болезненным состояниям, приводящим к такому нарушению, вызванным или ухудшенным таким нарушением или сопутствующим такому нарушению (см. Dorland's Illustrated Medical Dictionary, 29th edition, W.B. Saunders publishing Company, New York, NY). Болезненные состояния, входящие в определение дислипидемии, в контексте данного описания включают гиперлипидемию, гипертриглицеридемию (hypertriglyceremia), низкий уровень ЛПВП в плазме, высокий уровень ЛПНП (липопротеинов низкой плотности) в плазме, высокий уровень ЛПОНП (липопротеинов очень низкой плотности) в плазме, холестаз печени и гиперхолестеринемию. Фраза "заболевания, связанные с дислипидемией" в контексте данного описания относится к заболеваниям, включающим атеросклероз, тромбоз, ишемическую болезнь сердца, инсульт и гипертензию,но не ограниченным ими. Заболевания, связанные с дислипидемией, также включают нарушения обмена веществ, такие как ожирение, диабет, резистентность к инсулину и их осложнения. Осложнения диабета включают, без ограничения, диабетическую ретинопатию. В контексте данного описания термин "пациент" относится к человеку, домашним животным (например, собакам и кошкам и т.п.) и домашнему скоту. Термины "лечение", "получать лечение" и "лечить" включают ослабление, остановку, сдерживание,замедление и обращение прогрессирования дислипидемии и заболеваний, связанных с дислипидемией,или уменьшение тяжести их патологических симптомов. В контексте данного описания термин "терапевтически эффективное количество" означает количество соединения по изобретению, которое является частью одобренной схемы лечения или определено квалифицированным медицинским работником как достаточное в соответствии с предписанием для лечения состояния или его вредных действий, описанных в данном изобретении. Термин "фармацевтически приемлемый" в контексте данного описания используется в качестве характеристики и означает, по существу, невредный для принимающего пациента. Термин "C1-C3-алкил" означает линейный или разветвленный углеводородный фрагмент, содержащий от 1 до 3 атомов углерода, и включает метил, этил, н-пропил и изопропил. Специалисту в данной области техники должно быть понятно, что термин "C1-C3-алкил" является синонимом термина "C1-C3 алкилен", означающего бирадикал, когда группа "C1-C6-алкил" расположена между двумя группами таким образом, что она становится бирадикалом. Аналогично, термины "C1-C4-алкил", или "C1-C5-алкил",или "C1-C6" относятся к алкильной группе с линейной или разветвленной углеводородной цепью, содержащей соответственно 1-4, или 1-5, или 1-6 атомов углерода. Термин "C2-C4-алкенил", или подобные термины, означает линейный или разветвленный углеводородный фрагмент, имеющий по меньшей мере одну двойную связь и содержащий от 2 до 4 атомов углерода. Примеры включают винил, пропенил, 2-бутенил, но не ограничены ими. Термин "C2-C4-алкинил", или подобные термины, означает линейный или разветвленный углеводородный фрагмент, имеющий по меньшей мере одну тройную связь и содержащий от 2 до 4 атомов углерода. Примеры включают винил, пропинил, 2-бутинил и т.п., но не ограничены ими. Термин "C3-C6-циклоалкил" относится к насыщенному карбоциклическому кольцу, содержащему от 3 до 6 атомов углерода (или сколько указано), и включает циклопропил, циклопентил и циклогексил,но не ограничен ими. Аналогично, термин "C3-C8-циклоалкил" относится к насыщенному карбоциклическому кольцу, содержащему от 3 до 8 атомов углерода, и включает циклопропил, циклопентил и циклогексил, но не ограничен ими. Термин "C4-C5-алкилциклоалкил" в контексте данного описания относится к такой комбинации алкильной и циклоалкильной групп, в которой общее количество атомов углерода составляет 4-5. Например, C4-C5-алкилциклоалкил включает -СН 2-циклопропил, т.е. метилциклопропил, который представляет собой С 4-алкилциклоалкил.-2 014720 Термин "галоген" означает атомы галогенов, включая йод, хлор, бром и фтор. Термин "C1-C3-галогеналкил" относится к C1-C3-алкильной (или как указано) группе, имеющей в качестве заместителей один, два, три или более атомов галогена, как указано или химически целесообразно. Примеры C1-C3-галогеналкила включают трифторметил, хлорэтил и 2-хлорпропил, но не ограничены ими."C1-C3-алкоксигруппа представляет собой C1-C3-алкильный фрагмент, присоединенный через атом кислорода. Примеры алкоксигрупп включают метокси (-ОМе(ОСН 3, этокси (-OEt(-OCH2CH2, пропокси (-OPr(-ОСН 2 СН 2 СН 2, изопропокси (-OiPr(-OCHCH3CH3 и т.д., но не ограничены ими. Термин "-C1-C3-алкил-О-", другое название алкилокси, означает алкильную группу (C1-C5-алкил или как указано), заканчивающуюся атомом кислорода, в отличие от алкокси (-O-C1-C5-алкил), при чтении слева направо. Например, такие радикалы или группы, как -CH2O-, -CH2CH2O- и -СН(СН 3)O-, в данном описании классифицированы как алкилоксигруппы. Термин "C1-C3-галогеналкокси" относится к C1-C3-алкокси, где один или более чем один атом водорода в алкильной части группы замещен атомами галогенов. Примеры C1-C3-галогеналкоксигрупп включают дифторметокси, трифторметокси, 2-галогенэтокси, 2,2,2-трифторэтокси и т.д., включая все подобные группы, имеющие указанное количество атомов углерода. Подразумевается, что когда Ar1 представляет собой бициклическое кольцо, присоединение Ar1 к кольцу, содержащему R6, может происходить по любому атому углерода бициклического кольца, если не указано иное. Соединение согласно изобретению может быть представлено любым его изомером, каждый из которых является объектом изобретения. Некоторые соединения согласно изобретению могут иметь один или более чем один хиральный центр и соответственно могут существовать в виде оптически активных форм. Точно так же, соединения согласно изобретению могут иметь алкенильные группы и соответственно могут существовать в виде геометрических изомеров. Все такие изомеры, а также их смеси входят в объем настоящего изобретения. Если требуется конкретный стереоизомер, он может быть получен с помощью методик, хорошо известных в данной области техники. Предпочтительные варианты реализации изобретения Предпочтительно каждый из X1 и X2 представляет собой С. Также предпочтительно, если в соединении согласно изобретению X1 представляет собой N. Предпочтительно р имеет значение 0 или 1. Более предпочтительно, когда р имеет значение 0. Предпочтительно каждая из групп R1 и R2 независимо выбрана из группы, состоящей из атома водорода, C1-C3-алкила, C1-C3-галогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси, -SC1-C3-алкила, -SC1C3-галогеналкила и атома галогена. Более предпочтительно, если группы R1 и R2 независимо выбраны из группы, состоящей из атома водорода, атома хлора, атома фтора, CF3, OCF3 и SCF3. Предпочтительно группа R3 выбрана из группы, состоящей из атома водорода, C1-C3-алкила, C1-C3 галогеналкила, C1-C3-алкокси, C1-C3-галогеналкокси и атома галогена. Более предпочтительно, если группа R3 выбрана из группы, состоящей из атома водорода, атома хлора, атома фтора, CF3, OCF3 и SCF3. Наиболее предпочтительно, если R3 представляет собой атом водорода или отсутствует. Предпочтительно R4b независимо выбран из Н, метила, этила, пропила, изопропила, циклопропила,CF3 и метилциклопропила. Более предпочтительно, когда R4b представляет собой CF3, изопропил или циклопропил. Предпочтительно каждый из R5 и R5a независимо выбран из группы, состоящей из атома водорода,метила и этила. Более предпочтительно, когда каждый из R5 и R5a представляет собой водород. Предпочтительно группа R6 выбрана из группы, состоящей из атома водорода, атома галогена, C1C3-алкила, C2-C3-алкенила, гидрокси, -NO2 и -OC1-C2-алкила. Более предпочтительно, когда группа R6 выбрана из группы, состоящей из атома водорода, атома галогена, метила и метокси. Наиболее предпочтительно, когда R6 представляет собой атом водорода, атом хлора или метил. Предпочтительные L1. Предпочтительно L1 выбран из группы, состоящей из связи, СН=СН, этинила, -CH2S-, -С(СН 3)2-S-,-СН(СН 2 СН 3)S-,-CH(CH3)S-,-CH(CH3)CH2-S-,-CH(CH3)CH2O-,-С(СН 3)2O-,-СН(CH3)O-,-CH(CH2CH3)O-, -N(Rc)(CH2)m- и -(СН 2)m-N(Rc)-, где Rc представляет собой атом водорода или C1-C3 алкил, m имеет значение 1, 2 или 3. Более предпочтительно, когда L1 представляет собой связь, СН=СН,-N(CH3)CH2, -N(CH3)CH2CH2 или -N(СН 3)СН 2 СН 2 СН 2-. Особенно предпочтительно, когда L1 представляет собой связь, -N(CH3)CH2 или -N(CH3)CH2. Наиболее предпочтительно, когда L1 представляет собой-N(CH3)CH2 или -N(СН 3)СН 2 СН 2. Предпочтительно группа Ar1 выбрана из группы, состоящей из необязательно замещенных индолила, индазолила, тиенила, бензотиенила, бензизотиазолила, фенила, пиридинила, пирролила, тиазолила и фуранила. Более предпочтительно группа Ar1 выбрана из группы, состоящей из необязательно замещенных бензотиенила, индолила, индазолила, бензоизотиазолила и фенила. Особенно предпочтительно, когда Ar1 представляет собой фенил, индолил, бензотиенил или бензоизотиазолил. Предпочтительно Ar1 может иметь в качестве необязательных заместителей одну или две группы, независимо выбранные из группы, состоящей из атома галогена, C1-C3-алкила, C1-C3-алкокси, C1-C3-галогеналкокси и C1-C3-3 014720 галогеналкила. Предпочтительно заместитель R7 представляет собой COOH или CONHR11. Более предпочтительно,когда R7 представляет собой COOH или CONH2, -CONHCH3 или CONHC2H5. Наиболее предпочтительно,когда R7 представляет собой COOH. Предпочтительно R10 представляет собой атом водорода или C1-C3-алкил. Предпочтительно R11 представляет собой C1-C3-алкил. Также предпочтительным является соединение согласно изобретению, где р имеет значение 0 или 1; каждый из X1 и Х 2 представляет собой С, или X1 представляет собой N, а Х 2 представляет собой С;R1 и R2 независимо выбраны из группы, состоящей из атома водорода, атома фтора, атома хлора,CF3, SCF3, OCF3;R3 представляет собой атом водорода, атом фтора, атом хлора, C1-C3-алкил, CF3, SCF3 или OCF3;R4b представляет собой Н, C1-C3-алкил, C1-C3-галогеналкил, C1-C3-галогеналкокси или C3-C4 циклоалкил; каждый из R5 и R5a независимо выбран из Н или C1-C3-алкила; группа Ar1 представляет собой фенил, индолил, пиридинил, пирролил, тиенил, нафтил, тиазолил,фуранил, пиразолил, индазолил, бензоизотиазолил и бензотиенил, каждый из которых, необязательно,имеет в качестве заместителей одну или две группы, независимо выбранные из C1-C5-алкила, C1-C3 алкокси, C1-C2-галогеналкокси и C1-C3-галогеналкила;R6 представляет собой атом водорода, метил, этил или атом хлора;N(Rc)CH2CH2CH2-, где Rc представляет собой атом водорода, C1-C2-алкил, бензил или -СН 2 СН 2-O-СН 2-;R10 представляет собой атом водорода или C1-C2-алкил иR11 представляет собой атом водорода или C1-C2-алкил. Также предпочтительным является соединение согласно изобретению, где каждый из X1 и Х 2 представляет собой С; р имеет значение 0; R1 и R2 независимо выбраны из группы, состоящей из атома хлора,атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; каждый из R5 и R5a представляет собой атом водорода; L1 представляет собой этенил, ацетилен, -N(CH3)CH2- или -N(CH3)СН 2 СН 2-; R6 представляет собой атом водорода, метил, атом хлора или атом брома; Ar1 представляет собой фенил,индолил, индазолил, бензотиенил или бензоизотиазолил, каждый из которых, необязательно, имеет в качестве заместителя группу, выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и R7 представляет собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из Х 1 и X2 представляет собой С; р имеет значение 0; R1 и R2 независимо выбраны из группы, состоящей из атома хлора,атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой-N(CH3)СН 2- или -N(CH3)СН 2 СН 2-; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой фенил, бензоизотиазолил,индазолил, индолил или бензотиенил, каждый из которых, необязательно, имеет в качестве заместителя группу, выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и R7 представляет собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из X1 и X2 представляет собой С; р имеет значение 0; R1 и R2 независимо выбраны из группы, состоящей из атома водорода, атома хлора, атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой -N(CH3)СН 2- или -N(CH3)СН 2 СН 2-; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой фенил, необязательно имеющий в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и R7 представляет собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из X1 и Х 2 представляет собой С; р имеет значение 0; R1 и R2 независимо выбраны из группы, состоящей из атома водорода, атома хлора, атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой связь, -N(CH3)CH2- или -N(CH3)СН 2 СН 2-; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атома хлора; Ar1 представляет собой фенил,бензоизотиазолил, индазолил, индолил или бензотиенил, каждый из которых, необязательно, имеет в качестве заместителя группу, выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и R7 представляет собой COOH.-4 014720 Также предпочтительным является соединение согласно изобретению, где каждый из X1 и Х 2 представляет собой С; р имеет значение 0; R1 и R2 независимо выбраны из группы, состоящей из атома хлора,атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой этенил,-N(CH3)CH2- или -N(СН 3)СН 2 СН 2-; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой фенил, тиенил, пирролил,фуранил или тиазолил, каждый из которых, необязательно, имеет в качестве заместителя группу, выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и R7 представляет собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из X1 и Х 2 представляет собой С; р имеет значение 0; R1 и R2 независимо выбраны из группы, состоящей из атома водорода, атома хлора, атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой связь, -СН(CH3)O, -CH(CH3)CH2O, -CH(CH3)S, -C(CH3)2S, -CH2-NH- и -CH2N(CH3)-; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой фенил, бензоизотиазолил, индазолил, индолил или бензотиенил, каждый из которых, необязательно, имеет в качестве заместителя группу, выбранную из метила, этила,пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и R7 представляет собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из X1 и Х 2 представляет собой С; р имеет значение 0; R1 и R2 независимо выбраны из группы, состоящей из атома хлора,атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой этенил,-СН(СН 3)O, -СН(CH3)CH2O, -CH(CH3)S, -C(CH3)2S, -CH2-NH- и -CH2N(CH3)-; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой фенил, тиенил, пирролил, фуранил или тиазолил, каждый из которых, необязательно,имеет в качестве заместителя группу, выбранную из метила, этила, пропила, изопропила, циклопропила,метокси, этокси, изопропокси и циклопропокси; и R7 представляет собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из Х 1 и Х 2 представляет собой С; р имеет значение 1; R1 и R2 независимо выбраны из группы, состоящей из атома водорода, атома хлора, атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой -N(CH3)CH2- или -N(CH3)СН 2 СН 2-; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой бензоизотиазолил, индазолил, индолил или бензотиенил, каждый из которых, необязательно, имеет в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси,этокси, изопропокси и циклопропокси; и R7 представляет собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из X1 и Х 2 представляет собой С; р имеет значение 1; R1 и R2 независимо выбраны из группы, состоящей из атома водорода, атома хлора, атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой связь; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой фенил, бензоизотиазолил, индазолил, индолил или бензотиенил, каждый из которых, необязательно, имеет в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и R7 представляет собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из Х 1 и Х 2 представляет собой С; р имеет значение 1; R1 и R2 независимо выбраны из группы, состоящей из атома водорода, атома хлора, атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой связь; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой фенил, необязательно, имеющий в качестве заместителя группу, выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси,изопропокси и циклопропокси; и R7 представляет собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из X1 и X2 представляет собой С; р имеет значение 1; R1 и R2 независимо выбраны из группы, состоящей из атома хлора,атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой этенил; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой фенил, тиенил, пирролил, фуранил или тиазолил, каждый из которых, необязательно, имеет в качестве заместителя группу, независимо выбранную из метила, этила,пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и R7 представляет-5 014720 собой COOH. Также предпочтительным является соединение согласно изобретению, где каждый из X1 и Х 2 представляет собой С; р имеет значение 1; R1 и R2 независимо выбраны из группы, состоящей из атома хлора,атома фтора, трифторметила, тиотрифторметила и трифторметокси; R3 представляет собой атом водорода; R4b представляет собой трифторметил, изопропил или циклопропил; L1 представляет собой этенил,-N(CH3)CH2- или -N(СН 3)СН 2 СН 2-; каждый из R5 и R5a представляет собой атом водорода; R6 представляет собой атом водорода, метил, этил или атом хлора; Ar1 представляет собой фенил, тиенил, пирролил,фуранил или тиазолил, каждый из которых, необязательно, имеет в качестве заместителя группу, независимо выбранную из метила, этила, пропила, изопропила, циклопропила, метокси, этокси, изопропокси и циклопропокси; и R7 представляет собой COOH. Соединения согласно настоящему изобретению могут быть получены с помощью ряда методик, известных в данной области техники, и методик, описанных ниже. Продукты, получаемые на каждой стадии нижеприведенной схемы, могут быть выделены с использованием стандартных методик, включая экстракцию, упаривание, осаждение, хроматографию, фильтрацию, растирание, кристаллизацию и т.п. На нижеприведенной схеме все заместители, если не указано иное, являются такими, как определено ранее, и подходящие реагенты являются хорошо известными и апробированными в данной области техники. Схема 1 На схеме 1 показано взаимодействие подходящего соединения формулы (1) с подходящим соединением формулы (2) с образованием соединения формулы (I). Реакция, приведенная на схеме 1, может быть осуществлена с использованием по меньшей мере двух вариантов синтеза, описанных ниже. Согласно первому варианту синтеза подходящее соединение формулы (1) представляет собой соединение, в котором R1, R2, R3, р, R4b, R5 и R5a являются такими, как определено в описании формулы (I),и Y представляет собой -ОН, а подходящее соединение формулы (2) представляет собой соединение, в котором R6, R7, каждый X, L1 и Ar1 являются такими, как определено в описании формулы (I), или имеется группа, которую можно превратить в R7, такой, как определено в описании формулы (I), например,путем образования сложного эфира, амида, сульфонамида или кислоты. Например, проводят реакцию Мицунобу между соединением формулы (1) и соединением формулы(2) с использованием подходящего диазо-реагента, такого как ДЭАД (диэтилазодикарбоксилат) илиADDP и т.п., и подходящего фосфинового реагента, такого как трифенилфосфин или трибутилфосфин и т.п. Такие реакции проводят в подходящем растворителе, таком как толуол, тетрагидрофуран и т.п. Реакции обычно проводят при температуре от приблизительно 0 до 50 С. Типичное стехиометрическое соотношение компонентов в данной реакции составляет, в расчете на один эквивалент соединения формулы(1), приблизительно 1-2 экв. соединения формулы (2) и приблизительно 1-2 экв. диазо-реагента и 1-2 экв. фосфинового реагента. Согласно второму варианту синтеза подходящее соединение формулы (1) представляет собой соединение, в котором R1, R2, R3, р, R4b, R5 и R5a являются такими, как определено в данном изобретении, иY представляет собой уходящую группу, а подходящее соединение формулы (2) является таким, как определено выше. Подходящие уходящие группы хорошо известны в данной области техники и включают галогениды, в частности хлор, бром и йод; и эфиры сульфокислот, такие как брозил, тозил, метансульфонил и трифторметансульфонил. Например, соединение формулы (1) подвергают взаимодействию с соединением формулы (2) в подходящем растворителе, таком как ацетонитрил, диметилформамид, тетрагидрофуран, пиридин, метилэтилкетон и т.п. Как легко понять, в данной реакции обычно используется избыток подходящего основания, в том числе гидрида натрия, карбоната калия, карбоната натрия, карбоната цезия, бикарбоната натрия, триэтиламина, диизопропилэтиламина. Такие реакции обычно проводят при температуре в диапазоне от приблизительно комнатной температуры до приблизительно температуры дефлегмации выбранного растворителя и обычно используют от приблизительно 1 до 2 экв. соединения формулы (2). В качестве необязательной стадии может быть введена стадия получения фармацевтически приемлемой соли соединения формулы (I). Получение таких солей хорошо известно и апробировано в данной области техники. Как легко понять, соединения формул (1) и (2) могут быть легко получены с помощью методик, хорошо известных и апробированных в данной области техники, включая методики и подходы, аналогич-6 014720 ные приведенным в данном описании. Например, соединения формулы (1) получают путем взаимодействия необязательно замещенного фенилазида с ацетиленовым сложным эфиром и последующего восстановления или с защищенным гидроксиацетиленом и необязательно превращения в соединение, содержащее уходящую группу, а соединения формулы (2) получают путем образования углерод-углеродной связи, восстановительного аминирования, реакции сочетания и т.д. Также показано, что стадии, требуемые для получения соединения формулы (2), могут быть выполнены в любом порядке, например, после взаимодействия частично синтезированного соединения формулы (2) с соединением формулы (1) выполняют стадию образования углерод-углеродной связи, восстановительного аминирования, реакцию сочетания и т.д., приводящие к получению соединения формулы (I). Как легко понять, стадии, необходимые для получения соединения формулы (I), определяются конкретным соединением, которое должно быть синтезировано, исходным соединением и относительной лабильностью замещаемых фрагментов. Также предполагается, что при выполнении вышеприведенных реакций могут оказаться необходимыми или полезными различные стадии введения и снятия защитных групп. Методики выбора и использования подходящих защитных групп хорошо известны и апробированы в данной области техники (см., например, Protecting Groups in Organic Synthesis, Theodora Greene (Wiley-Interscience. Настоящее изобретение дополнительно проиллюстрировано нижеприведенными примерами и приготовлениями. Данные примеры и приготовления являются только иллюстрацией изобретения и предполагается, что они никоим образом не ограничивают объем изобретения. Термины, использованные в разделах "Приготовления" и "Примеры", употребляются в их обычных значениях, если не указано иное. Хроматография везде выполнена с использованием силикагеля, если не указано иное. Анализ Протоколы и результаты описанных ниже исследований, демонстрирующие полезность, in vitro и invivo эффективность соединений и/или способов настоящего изобретения, приведены с целью иллюстрации и предполагается, что они никоим образом не ограничивают объем изобретения. Аббревиатуры, использованные в данном описании, определены следующим образом. "ЛПНП" означает липопротеин низкой плотности; "ЛПВП" означает липопротеин высокой плотности; "ЛПОНП" означает липопротеин очень низкой плотности; "LDLR-/-" означает дефицит рецепторов липопротеинов низкой плотности; "DMEM" означает модифицированную по способу Дульбекко среду Игла; "GAPDH" означает глицеральдегид-3-фосфат-дегидрогеназу; "Na-КМЦ" означает натрий-карбоксиметилцеллюлозу; "SLS" означает лаурилсульфат натрия; "FPLC" означает жидкостную экспресс-хроматографию белков; "PBS" означает фосфатно-солевой буфер; "ЛПОНП-Х" означает холестерин липопротеинов очень низкой плотности; "ЛПВП-Х" означает холестерин липопротеинов высокой плотности.FXR является ключевым прямым регулятором транскрипции гена SHP (Small Heterodimer Partner),регистрационный номер (accession number) NM021969, нетипичного представителя семейства ядерных рецепторов, у которого отсутствует ДНК-связывающий домен. SHP взаимодействует с несколькими обычными и сиротскими рецепторами суперсемейства ядерных рецепторов, включающего ретиноидные рецепторы и рецептор тиреоидного гормона. SHP ингибирует потенциал трансактивации членов суперсемейства, с которыми он взаимодействует. Установлено, что как FXR, так и SHP контролирует гены,ответственные за катаболизм холестерина в печени, синтез триглицеридов и транспорт желчных кислот. Поскольку FXR напрямую трансактивирует транскрипцию гена SHP, активацию самого FXR лигандами можно оценить количественно с помощью методики, основанной на использовании разветвленной ДНК(bDNA) SHP. Соответственно увеличение экспрессии мРНК SHP, определяемое по увеличению сигналаbDNA-, указывает на связывание FXR с агонистом. Клетки гепатокарциномы человека Huh7, выращенные в DMEM:F12 с 10% эмбриональной телячьей сывороткой, высевали в 96-луночные планшеты с плотностью 1105/лунка. После инкубации на протяжении ночи клетки обрабатывали в течение 24 ч исследуемыми соединениями в различных концентрациях. Выполняли bDNA-анализ в соответствии с протоколом производителя (Panomics, Fremont, CA) для набора QuantiGene High Volume Kit. После стимуляции клеток соединением согласно изобретению клетки лизировали с использованием буфера для лизиса QuantiGene, содержащего олигонуклеотиды мРНК SHP, описанные ниже. Олигонуклеотидные реагенты (усилители захвата (capture extender (СЕ,усилители метки (label extender (LE и блокаторы (blocker (BL, подходящие для bDNA-анализа мРНКSHP человека, могут быть сконструированы и синтезированы Panomics (Fremont, CA). После добавления буфера для лизиса пробы инкубировали в течение 15 мин при 37 С, затем из каждой лунки 100 мкл лизата переносили в соответствующие лунки планшета для захвата. Планшет для захвата инкубировали в течение ночи при 53 С. Планшет для захвата дважды промывали буфером для промывания QuantiGene, затем добавляли 100 мкл/лунка реагента-амплификатора QuantiGene. Планшет инкубировали в течение 60 мин при 46 С, затем дважды промывали. Анализируемую мРНК метили путем добавления 100 мкл буфера QuantiGene, содержащего меченый зонд, затем инкубировали в течение 60 мин при 46 С. Планшет для за-7 014720 хвата дважды промывали и добавляли 100 мкл/лунка субстрата QuantiGene и усиливающего реагентаQuantiGene. Планшеты инкубировали при 37 С в течение 30 мин и затем считывали с использованием люменметра (Packard Fusion Alpha, время регистрации - 1 с) для регистрации люминесцентного сигнала. Рассчитывали величину EC50, т.е. отношение фактического ответа к максимальному ответу. Согласно результатам вышеприведенного анализа соединения, рассматриваемые в разделе "Примеры", являются эффективными модуляторами FXR и имеют ЕС 50 2 мкМ или менее. Например, соединение примера 42,вызывающее активацию гена SHP, имеет ЕС 50 приблизительно 370 нМ. Модуляции липидов LDLR-/- сыворотки. Перед началом исследования в течение двух недель проводили акклиматизацию животных. Мышей помещали в поликарбонатные камеры с крышками-светофильтрами, по одному животному в каждую камеру, где поддерживали светотемновой цикл 12:12 ч (включение света в 6:00 утра) и температуру 21 С. Животные получали без ограничения деионизированную воду и в течение двух недель получали без ограничения корм в соответствии с диетой TD 88137 ("western diet") (42% жиров, 0,15% холестерина,Harlan Teklad). Самцов LDLR-/- мышей в возрасте десяти недель разделяли на группы (по пять животных в каждой группе) на основе уровней триглицеридов и холестерина в сыворотке. В течение семи суток разные группы животных один раз в сутки посредством перорального зондового кормления получали различные дозы исследуемого соединения в растворе в 5% EtOH/5% Solutol, содержащем Na-КМЦ (1%),SLS (0,5%), антивспенивающий агент (0,05%), повидон (0,085%). В конце этого семидневного периода животных подвергали эвтаназии в камере с CO2 и собирали кровь путем пункции сердца. С использованием стандартного биохимического анализатора для клинических исследований и соответствующих реагентов [Hitachi 912 instrument с наборами реагентов (Roche, Indianapolis, IN)] измеряли уровень триглицеридов, глюкозы и общего холестерина в сыворотке. Пробы пула сыворотки анализировали методомFPLC, определяя содержание холестерина липопротеинов (ЛПОНП, ЛПНП, ЛПВП) во фракциях путем разделения на колонке для эксклюзионной хроматографии со встроенной системой для определения холестерина. Липопротеины разделяли путем жидкостной экспресс-хроматографии белков, и содержание холестерина определяли с помощью встроенной системы регистрации. Вкратце, пробы плазмы объемом 35 мкл/50 мкл пробы пула наносили на колонку для эксклюзионной хроматографии Superose 6 HR 10/30(Amersham Pharmacia Biotech, Piscataway, NJ) и элюировали PBS, pH 7,4 (разбавленным 1:10), содержащим 5 мМ ЭДТА, при 0,5 мл/мин. Реагент для регистрации холестерина от Roche Diagnostics (Indianapolis, IN) при 0,16 мл/мин смешивали с элюатом через Т-образное соединение; затем данную смесь пропускали через сетчатый трубчатый химический реактор (knitted tubing reactor) 15 м 0,5 мм (Aura Industries,New York, NY), погруженный в водяную баню, имеющую температуру 37 С. Окрашенный продукт, получаемый в присутствии холестерина, регистрировали в потоке при 505 нм, и аналоговое напряжение регистрирующего устройства преобразовывали в цифровой сигнал, который регистрировали и анализировали. Строили график изменения напряжения, соответствующего изменению концентрации холестерина, со временем и вычисляли площадь под кривой, соответствующей элюции ЛПОНП-С и ЛПВП-С, с использованием программы Turbochrome (версия 4,12F12) (PerkinElmer, Norwalk, СТ). Согласно результатам данного анализа при введении исследованных соединений согласно изобретению в дозе 10 мг/кг снижение уровня общего холестерина достигало 84%, а триглицеридов - 86%. Более конкретно при введении дозы 10 мг/кг соединение примера 13 снижает уровень общего холестерина на 60% и триглицеридов на 63%. Конечно, конкретная доза вводимого соединения согласно изобретению зависит от конкретных обстоятельств, связанных с данным случаем, например, от вводимого соединения, пути введения, состояния здоровья пациента и патологического состояния, которое лечат. Типичная суточная доза обычно содержит нетоксичное количество соединения по настоящему изобретению и составляет от приблизительно 0,1 до приблизительно 1000 мг/сутки. Соединения по данному изобретению могут быть введены разными путями, включая пероральный,ректальный, трансдермальный, подкожный, внутривенный, внутримышечный и интраназальный. Предпочтительно данные соединения готовят в виде препарата перед введением, выбор препарата обычно находится в компетенции лечащего врача. Соответственно согласно другому аспекту данного изобретения предложена фармацевтическая композиция, содержащая эффективное количество соединения по изобретению или его фармацевтически приемлемой соли, и фармацевтически приемлемый носитель,разбавитель или эксципиент. Специалист в области приготовления препаратов может легко выбрать нужную форму и путь введения в зависимости от конкретных характеристик выбранного соединения, расстройства или состояния,которые лечат, стадии расстройства или состояния и других имеющих к этому отношение обстоятельств(Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (1990. Фармацевтические композиции по настоящему изобретению могут быть адаптированы для разных путей введения и могут быть введены пациенту, например, в форме таблеток, капсул, облаток, пастилок (paper), лепешек, вафель (wafer), эликсиров, мазей, чрескожных пластырей, аэрозолей, в форме для ингаляции, в форме суппозиториев, растворов и суспензий. Общее содержание активных ингредиентов в такой композиции составляет от-8 014720 0,1 до 99,9% от массы препарата. Соединения согласно изобретению могут быть приготовлены в виде препарата в форме эликсиров или растворов для традиционного перорального введения или в форме растворов, подходящих для парентерального введения, например, для внутримышечного, подкожного или внутривенного введения. Кроме того, данные соединения могут быть приготовлены в виде лекарственных форм с замедленным высвобождением и подобных препаратов. Данные препараты могут быть приготовлены таким образом,что высвобождение активного ингредиента будет иметь исключительно, или предпочтительно, конкретную физиологическую локализацию и, необязательно, происходить в течение определенного периода времени. Покрытия, оболочки и защитные матриксы могут быть изготовлены, например, из полимерных веществ или восков. Приготовление и примеры Изобретение дополнительно проиллюстрировано нижеприведенными приготовлениями и примерами. Аббревиатуры, используемые в данном описании ниже, определены согласно Aldrichimica Acta,Vol. 17,1, 1984. Другие аббревиатуры определены следующим образом. "МеОН" означает метанол;"EtOH" означает этанол; "EtOAc" означает этилацетат; "Et2O" означает диэтиловый эфир; "hex" означает гексан; "DCE" означает дихлорэтан; "TMSCHN2" означает (триметилсилил)диазометан; "ADDP" означает 1,1-(азодикарбонил)дипиперидин; "dppf" означает дифенилфосфиноферроцен; "dba" означает дибензилидинацетон; "ТГФ" означает тетрагидрофуран; "TBAF" означает тетрабутиламмония фторид; "ОАс" означает ацетат; "DCE" означает дихлорэтан. Названия всех соединений генерированы с использованием программы ChemDraw Ultra 7.0 от CambridgeSoft Corporation, Cambridge, MA. Приготовления Приготовление 1. 2-Азидо-1,3-дихлорбензол. Методика 1. К раствору 2,6-дихлоранилина (2,00 г) в этилацетате (40 мл), имеющему температуру 0 С, добавляли концентрированную соляную кислоту (12 мл). Данную реакционную смесь перемешивали в течение 10 мин. К полученному раствору в течение 3 мин добавляли раствор нитрита натрия (2,55 г) в воде(7,5 мл). После завершения добавления реакционную смесь дополнительно перемешивали в течение 30 мин. В течение 5 мин добавляли раствор азида натрия (2,41 г) в воде (8 мл). Через 30 мин добавляли буфер, имеющий pH 7 (50 мл), и реакционную смесь переносили в делительную воронку. Слои разделяли и водный слой экстрагировали этилацетатом. Органические слои объединяли и промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,11 г). 1 Н ЯМР (400 МГц, CDCl3)7,3-7,27 (д, 2 Н), 7,07-7,02 (т, 1 Н). Методика 2. Раствор 2,6-дихлоранилина (100 г, 617 ммоль) в МТВЕ (метил-трет-бутиловом эфире) (1 л) добавляли в течение 30 мин через капельную воронку к имеющемуся в продаже хлористому водороду(600 мл). Полученную белую суспензию перемешивали в течение 15 мин и охлаждали до 0 С. Добавляли по каплям через капельную воронку раствор нитрита натрия (42,5 г, 617 ммоль) в воде (150 мл). После перемешивания при 0 С в течение 30 мин добавляли раствор азида натрия (40,1 г, 617 ммоль) в воде(150 мл). После завершения добавления (45 мин) смесь перемешивали при 5-10 С в течение 30 мин. Реакционную смесь подщелачивали (pH 12) 50% водным раствором NaOH и перемешивали еще в течение 30 мин. Фазы разделяли и водный слой три раза экстрагировали МТВЕ. Объединенные органические слои сушили над сульфатом магния и фильтровали. К органическому слою добавляли толуол (1 л) и данный раствор концентрировали при пониженном давлении до объема 760 мл с получением указанного в заголовке соединения (115 г, 100% превращение, 0,8 М раствор) в виде раствора в толуоле.ES/MS (масс-спектрометрия с электрораспылением): (масса/заряд) 188 (М+1). Следующие соединения получали, по существу, в соответствии с методикой получения 2-азидо-1,3 дихлорбензола (методика 1) с использованием подходящего исходного вещества. Приготовление 1 А. 2-Азидо-1-хлор-3-фтор-бензол. Приготовление 1 Б. 1-Азидо-2-трифторметоксибензол. Приготовление 1 В. 1-Азидо-2-трифторметилбензол. Приготовление 2. 2-Азидометил-1,3-дихлорбензол. К раствору 2,6-дихлорбензилбромида (0,50 г) в диметилформамиде (5 мл) добавляли азид натрия(0,41 г). Данную реакционную смесь нагревали до 55 С в течение ночи. Полученный раствор охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток растворяли в этилацетате, промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,37 г). 1 Н ЯМР (400 МГц, CDCl3)7,45-7,40 (д, 2 Н), 7,30-7,25 (т, 1 Н), 4,73 (с, 2 Н). Приготовление 3. 4-Метилпент-2-иновой кислоты этиловый эфир.(9,33 мл) и реакционную смесь дополнительно перемешивали в течение 1,5 ч. Реакционную смесь оставляли нагреваться до комнатной температуры и гасили насыщенным раствором хлорида аммония. Реакционную смесь два раза экстрагировали этилацетатом. Органические слои объединяли, промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (11,5 г). 1 Н ЯМР (400 МГц, CDCl3)3,75 (с, 3H), 2,8-2,65 (м, 1 Н), 1,25-1,23 (д, 6 Н). Следующее соединение получали, по существу, в соответствии с методикой получения 4 метилпент-2-иновой кислоты этилового эфира с использованием подходящего исходного вещества. Приготовление 3A. Циклопропилпропиновой кислоты метиловый эфир. Приготовление 4. 3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-карбоновой кислоты этиловый эфир. Раствор 2-азидо-1,3-дихлорбензола (1,0 г) и 4-метилпент-2-иновой кислоты этилового эфира (1,8 г) в толуоле (5 мл) нагревали до 120 С в течение ночи. Наблюдали образование двух региоизомеров в соотношении от 1:1 до 3:1 в пользу желаемого продукта. Реакционную смесь концентрировали при пониженном давлении и остаток очищали путем флэш-хроматографии с использованием для элюирования 5% этилацетата в гексанах. 1H ЯМР (400 МГц, CDCl3)7,48 (д, 2 Н), 7,42 (т, 1 Н), 4,22 (кв., 2 Н), 3,64 (м, 1 Н), 1,46 (д, 6 Н), 1,15 (т,3H). Следующие соединения получали с помощью методик, аналогичных описанным выше методикам получения 3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-карбоновой кислоты этилового эфира,с использованием подходящего исходного вещества. Приготовление 4 А. 5-Циклопропил-3-(2,6-дихлорфенил)-3H-[1,2,3]триазол-4-карбоновой кислоты метиловый эфир. Приготовление 4 Б. 3-(2,6-Дихлорфенил)-5-метил-3H-[1,2,3]триазол-4-карбоновой кислоты метиловый эфир. Приготовление 4 В. 3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-карбоновой кислоты этиловый эфир. Приготовление 4 Г. 5-Изопропил-3-(2-трифторметоксифенил)-3H-[1,2,3]триазол-4-карбоновой кислоты этиловый эфир. Приготовление 4 Д. 5-Изопропил-3-(2-трифторметилфенил)-3H-[1,2,3]триазол-4-карбоновой кислоты этиловый эфир. Приготовление 4 Е. 5-Циклопропил-3-(2,6-дихлорфенил)-3H-[1,2,3]триазол-4-карбоновой кислоты метиловый эфир. Приготовление 4 Ж. 5-Циклопропил-3-(2-трифторметоксифенил)-3H-[1,2,3]триазол-4-карбоновой кислоты этиловый эфир (64%).ES/MS: (масса/заряд) 342,0 (М+1). Приготовление 5. [3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-ил]метанол. К раствору 3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-карбоновой кислоты этилового эфира (2,88 г) в ТГФ (25 мл), имеющему температуру 0 С, добавляли 1 М DIBAL в толуоле (38 мл). Данную реакционную смесь оставляли нагреваться до комнатной температуры. После завершения реакции реакционную смесь медленно гасили водой и подкисляли 1 н. HCl. Полученный раствор два раза экстрагировали этилацетатом. Объединенные органические слои промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,26 г).ES/MS:(масса/заряд) 284 (М+0), 286 (М+2); т.пл. (температура плавления): 154-155 С. Следующие соединения получали, по существу, в соответствии с методикой получения [3-(2,6 дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-ил]метанола с использованием подходящего исходного вещества. Приготовление 5 А. [3-(2,6-Дихлорфенил)-5-метил-3H-[1,2,3]триазол-4-ил]метанол. 1ES/MS: (масса/заряд) 300,0 (М+1). Приготовление 6. 5-Хлорметил-1-(2,6-дихлорфенил)-4-изопропил-1 Н-[1,2,3]триазол. К раствору [3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-ил]метанола (0,100 г) в дихлорметане (2 мл) и четыреххлористом углероде (2 мл) добавляли трифенилфосфин (0,275 г). После завершения реакции реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в дихлорметане, пока не достигали растворимости, необходимой для загрузки на колонку, и очищали путем гель-фильтрации, используя для элюирования 10% этилацет в толуоле, с получением желаемого продукта (0,091 г, 86%). 1H ЯМР (400 МГц, CDCl3)7,58-7,54 (д, 2 Н), 7,52-7,50 (т, 1 Н), 4,48 (с, 2 Н), 3,24-3,21 (м, 1 Н), 1,511,49 (д, 6 Н). Приготовление 7. 3-(2,6-Дихлорфенил)-3H-[1,2,3]триазол-4-карбальдегид. Стадия А. Раствор 2-азидо-1,3-дихлорбензола (4,00 г, 1 экв.) и 3-триметилсиланилпроп-2-ин-1-ола (6,29 мл,2 экв.) в толуоле (10 мл) нагревали до 120 С в течение 23 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры и разбавляли 100 мл метиленхлорида. Данный раствор адсорбировали на кизельгуре и очищали путем флэш-хроматографии, используя для элюирования гексаны/этилацетат (85:1520:80), с получением [3-(2,6-дихлорфенил)-3H-[1,2,3]триазол-4-ил]метанола (2,30 г, 44%) в виде не совсем белого твердого вещества. Стадия Б. К раствору [3-(2,6-дихлорфенил)-3H-[1,2,3]триазол-4-ил]метанола (1,87 г, 1 экв.) в метиленхлориде(110 мл) добавляли окислитель Десс-Мартина (4,20 г, 1,3 экв.). Данную реакционную смесь оставляли перемешиваться при комнатной температуре в течение 3 ч. Согласно результатам ТСХ (тонкослойной хроматографии) реакция не была завершена. Реакционную смесь обрабатывали окислителем ДессМартина (1,20 г). Реакционную смесь оставляли перемешиваться при комнатной температуре дополнительно в течение 2 ч. Затем реакционную смесь обрабатывали 80 мл 1,5 н. гидроксида натрия и 40 мл диэтилового эфира. Полученный раствор оставляли перемешиваться при комнатной температуре в течение 10 мин. Реакционную смесь разбавляли 120 мл воды и три раза экстрагировали хлороформом. Объединенные органические слои сушили над сульфатом магния и фильтровали через подушку силикагеля с использованием для элюирования смеси хлороформ/этилацетат (3:1, 200 мл). Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,76 г, 94%) в виде белого твердого вещества. Приготовление 8. Метансульфоновой кислоты 3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол 4-илметиловый эфир. К раствору [3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-ил]метанола (0,100 г) в дихлорметане (2 мл) добавляли Et3N (0,25 мл), затем метансульфонилхлорид (0,075 мл). Данную реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли этилацетатом (20 мл) и промывали водой (220 мл). Органический слой сушили (Na2SO4) и концентрировали при пониженном давлении с получением указанного в заголовке соединения (101 мг). 1(д, 6 Н). Приготовление 9. 5-(4-Бром-3-метилфеноксиметил)-1-(2,6-дихлорфенил)-4-изопропил-1 Н[1,2,3]триазол. К раствору [3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-ил]метанола (300 мг, 1,05 ммоль) в толуоле (4 мл) добавляли 4-бром-3-метилфенол (196 мг, 1,05 ммоль) и три-н-бутилфосфин (394 мкл,1,58 ммоль). Реакционную смесь охлаждали до 0 С. К реакционной смеси добавляли 1,1'(азокарбонил)дипиперидин (399 мг, 1,58 ммоль) и данную реакционную смесь нагревали до комнатной температуры. Через 6 ч реакционную смесь концентрировали и остаток хроматографировали, используя для элюирования 10-20% EtOAc/гексаны, с получением указанного в заголовке соединения (324 мг,68%).LC-ES/MS (жидкостная хроматография/масс-спектрометрия с электрораспылением): (масса/заряд) 455,7 (М+1). Следующие соединения получали, по существу, в соответствии с методикой получения 5-(4-бром 3-метилфеноксиметил)-1-(2,6-дихлорфенил)-4-изопропил-1 Н-[1,2,3]триазола с использованием подходящего исходного вещества. Приготовление 9 А. 1-(2,6-Дихлорфенил)-5-(4-иодфеноксиметил)-4-изопропил-1 Н-[1,2,3]триазол.ES/MS: (масса/заряд) 590,8 (М+1). Приготовление 10. 1-4-[3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2 метилфенилэтанол. К раствору 1-4-[3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2 метилфенилэтанона (314 мг, 0,751 ммоль) в ТГФ/МеОН (6 мл/1 мл), имеющему температуру 0 С, добавляли боргидрид натрия (116 мг, 3,04 ммоль). Данную реакционную смесь нагревали до комнатной температуры в течение ночи. Реакционную смесь концентрировали и остаток распределяли между EtOAc(100 мл) и 1 н. HCl (20 мл). Водный слой экстрагировали EtOAc (100 мл) и объединенные органические слои промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали путем хроматографии (40 г SiO2; 20-40% EtOAc/гексаны) с получением указанного в заголовке соединения (298 мг, 94%).LC-ES/MS: (масса/заряд) 419,7 (М+1). Следующее соединение получали, по существу, в соответствии с методикой получения 1-4-[3-(2,6 дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2-метилфенилэтанола с использованием подходящего исходного вещества. Приготовление 10 А. 1-4-[3-(2-Хлор-6-фторфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2 метилфенилэтанол. Приготовление 11. 2-4-[3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2 метилфенилпропан-2-ол. К раствору 1-4-[3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2 метилфенилэтанона (500 мг, 1,19 ммоль) в ТГФ (12 мл), имеющему температуру -78 С, по каплям добавляли бромид метилмагния (2,0 мл, 5,98 ммоль, 3,0 М в ТГФ). Данную реакционную смесь нагревали до комнатной температуры. Через 4 ч реакционную смесь охлаждали до 0 С, гасили путем добавленияNH4Cl и нагревали до комнатной температуры. Реакционную смесь концентрировали и остаток распределяли между Et2O и 1 н. HCl. Водный слой экстрагировали Et2O и объединенные органические слои промывали солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали,используя для элюирования 0-30% EtOAc/гексан, с получением указанного в заголовке соединения(414 мг, 80%). 1 Н ЯМР (400 МГц, CDCl3)7,49-7,46 (м, 2 Н), 7,43-7,38 (м, 1 Н), 7,23-7,19 (м, 2 Н), 6,70 (д, 1 Н, J=8,8 Гц), 4,89 (с, 2 Н), 3,20 (sept, 1H, J=6,6 Гц), 2,04 (с, 3H), 1,53 (с, 6 Н), 1,45 (д, 6 Н, J=6,6 Гц). Следующие соединения получали, по существу, в соответствии с методикой получения 2-4-[3-(2,6 дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2-метилфенилпропан-2-ола с использованием подходящего исходного вещества. Приготовление 11 А. 2-4-[3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]фенилпропан-2-ол. 1(м, 2 Н), 6,70 (д, 1 Н, J=8,8 Гц), 4,89 (с, 2 Н), 3,21 (sept, 1 Н, J=7,0 Гц), 2,04 (с, 3H), 1,54 (с, 6 Н), 1,45 (д, 6 Н,J=7,0 Гц). Приготовление 12. 3-Метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенол. Смесь трициклогексилфосфина (525 мг, 1,87 ммоль), палладий-бис-(дибензилидин)ацетона (460 мг,0,801 ммоль) и диоксана (200 мл) перемешивали при комнатной температуре в течение получаса. Добавляли 4-бром-3-метилфенол (5,00 г, 26,7 ммоль), пинаколборан (7,45 г, 40,1 ммоль) и ацетат калия (3,93 г,40,1 ммоль). Данную реакционную смесь нагревали до 80 С в течение 20 ч и охлаждали до комнатной температуры. Реакционную смесь разбавляли водой и экстрагировали эфиром. Объединенные эфирные фракции промывали солевым раствором, сушили (MgSO4) и упаривали. Остаток очищали с использованием флэш-хроматографии на силикагеле, используя для элюирования 0-2% MeOH/CH2Cl2, с получением указанного в заголовке соединения (1,6 г, 47%). В результате второй очистки загрязненных фракций путем флэш-хроматографии дополнительно получали 2,76 г указанного в заголовке соединения и в це- 12014720 лом получали 4,36 г (выход 70%) указанного в заголовке соединения.ES/MS: (масса/заряд) 233,3 (М-1). Приготовление 13. 6-Бром-1 Н-индол-3-карбоновой кислоты метиловый эфир. К раствору 6-броминдол-3-карбоновой кислоты (960 мг, 4,00 ммоль) в метаноле (9,5 мл) в течение 2 мин добавляли (триметилсилил)диазометан (2,0 М раствор в гексанах, приблизительно 9 мл) при комнатной температуре. Полученную желтую смесь концентрировали при пониженном давлении. Остаток перерастворяли в метаноле и концентрировали при пониженном давлении. Данную процедуру повторяли несколько раз с получением указанного в заголовке соединения в виде твердого вещества (100%).ES/MS: (масса/заряд) 256,0 (М+2). Следующее соединение получали, по существу, в соответствии с методикой получения 6-бром-1 Ниндол-3-карбоновой кислоты метилового эфира с использованием подходящего исходного вещества. Приготовление 13 А. 6-Бром-бензо[b]тиофен-2-карбоновой кислоты метиловый эфир. 1H ЯМР (400 МГц, CDCl3)7,99 (м, 2 Н), 7,70 (д, 1 Н), 7,50 (д, 1 Н), 3,92 (с, 3H). Приготовление 14. 6-Бром-1-метил-1 Н-индол-3-карбоновой кислоты метиловый эфир. К смеси 5-бром-1 Н-индол-3-карбоновой кислоты метилового эфира (100 мг, 0,394 ммоль), карбоната калия (163 мг, 1,18 ммоль) в ДМФА (N,N-диметилформамиде) добавляли иодметан (30 мкл,0,47 ммоль). Данную реакционную смесь перемешивали в течение 1,5 ч. Добавляли еще одну порцию иодметана (10 мкл) и реакционную смесь перемешивали в течение 30 мин. Реакционную смесь разбавляли дихлорметаном и фильтровали. Фильтрат концентрировали в условиях глубокого вакуума, разбавляли этилацетатом и концентрировали с получением 105 мг (99%) указанного в заголовке соединения.ES/MS: (масса/заряд) 270,0 (М+2). Следующее соединение получали, по существу, в соответствии с методикой получения 6-бром-1 метил-1 Н-индол-3-карбоновой кислоты метилового эфира с использованием подходящего исходного вещества. Приготовление 14 А. 6-Бром-1-изопропил-1 Н-индол-3-карбоновой кислоты метиловый эфир. 1H ЯМР (400 МГц, CDCl3)8,02 (д, 1 Н), 7,88 (с, 1 Н), 7,53 (с, 1 Н), 7,33 (дд, 1 Н), 4,64-4,33 (м, 1 Н),3,88 (с, 3H), 1,52 (д, 6 Н). Приготовление 15. 6-(4-Гидрокси-2-метилфенил)-1-метил-1 Н-индол-3-карбоновой кислоты метиловый эфир. Смесь 3-метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенола (105 мг, 0,448 ммоль), (6 бром-1 Н-индол-3-ил)уксусной кислоты метилового эфира (100 мг, 0,373 ммоль), тетракис(трифенилфосфин)палладия(0) (25 мг, 0,021 ммоль), ДМФА (1,2 мл), этанола (0,6 мл) и 2 М водного раствора карбоната калия (0,6 мл) нагревали до 80 С в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и подкисляли 1 н. HCl. Полученный раствор экстрагировалиCH2Cl2. Объединенные органические слои сушили над безводным сульфатом магния и концентрировали. Остаток очищали путем радиальной хроматографии с использованием для элюирования CH2Cl2. Вторую очистку загрязненных фракций проводили путем радиальной хроматографии, используя для элюирования 2% МеОН-CH2Cl2, с получением (78 мг, 74%) указанного в заголовке соединения.LC-ES/MS: (масса/заряд) 296,0 (М+1). Следующие соединения получали, по существу, в соответствии с методикой получения 6-(4 гидрокси-2-метилфенил)-1-метил-1 Н-индол-3-карбоновой кислоты метилового эфира с использованием подходящего исходного вещества. Приготовление 15 А. 6-(4-Гидрокси-2-метилфенил)бензо[b]тиофен-3-карбоновой кислоты метиловый эфир. Приготовление 15 Б. 6-(4-Гидрокси-2-метилфенил)бензо[b]тиофен-2-карбоновой кислоты метиловый эфир (использование смеси (7:3) 6-бромбензо[b]тиофен-3-карбоновой кислоты метилового эфира и 6-бромбензо[b]тиофен-2-карбоновой кислоты метилового эфира).ES/MS: (масса/заряд) 297,3 (М-1). Приготовление 16. 2- и 3-Ацетил-6-бромбензотиофен. К раствору 6-бромбензотиофена (20 г, 93,8 ммоль) и ацетилхлорида (8,84 г, 112,6 ммоль) в 1,2 дихлорэтане (120 мл) добавляли по каплям при комнатной температуре в атмосфере азота тетрахлорид олова (1M в дихлорметане, 112,6 ммоль, 112,6 мл). После завершения добавления данную реакционную- 13014720 смесь перемешивали при комнатной температуре в течение ночи. Смесь вливали в баню с ледяной водой и экстрагировали дихлорметаном. Органическую фазу промывали насыщенным раствором NaHCO3, водой и солевым раствором, сушили над MgSO4 и упаривали при пониженном давлении. Неочищенный остаток очищали путем флэш-хроматографии на силикагеле с использованием для элюирования в качестве элюента смеси гексан/EtOAc (6:1). Указанное в заголовке соединение (12 г, 50%) получали в виде смеси (7:3) двух изомеров: 3-ацетил-6-бромбензотиофена и 2-ацетил-6-бромбензотиофена.ES/MS: (масса/заряд) 256 (М+2). Приготовление 17. 6-Бромбензотиофен-3-карбоновая кислота и 6-бромбензотиофен-2-карбоновая кислота. К раствору гидроксида натрия (13,64 г, 341 ммоль) в воде (94 мл), имеющему температуру 0 С, медленно добавляли бром (21,92 г, 137,18 ммоль). Реакционную смесь перемешивали при 0 С в течение 15 мин. К реакционной смеси по каплям добавляли раствор смеси 3-ацетил-6-бромбензотиофена и 2 ацетил-6-бромбензотиофена (10,00 г, 39,19 ммоль) в диоксане (75 мл). Данную реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли раствор NaHSO3 (40%, 50 мл), затем HCl(10 мл) с получением твердого оранжевого вещества. Полученное твердое вещество отфильтровывали и промывали водой, затем гексанами с получением 7 г (70%) смеси двух кислот: 6-бромбензотиофен-3 карбоновой кислоты и 6-бромбензотиофен-2-карбоновой кислоты в соотношении 7:3.ES/MS: (масса/заряд) 258 (М+2). Приготовление 18. 6-Бромбензотиофен-3-карбоновой кислоты метиловый эфир и 6 бромбензотиофен-2-карбоновой кислоты метиловый эфир. Раствор смеси 6-бромбензотиофен-3-карбоновой кислоты и 6-бромбензотиофен-2-карбоновой кислоты (6,5 г, 25,28 ммоль) и серной кислоты (4,65 г, 47,43 ммоль) в МеОН (100 мл) нагревали до 65 С в течение ночи. Наблюдали образование светло-коричневого твердого вещества. Раствор охлаждали до комнатной температуры, и образовавшееся твердое вещество отфильтровывали и промывали МеОН с получением 5,6 г (83%) смеси 6-бромбензотиофен-3-карбоновой кислоты метилового эфира и 6 бромбензотиофен-2-карбоновой кислоты метилового эфира в соотношении 7:3.ES/MS: (масса/заряд) 272 (М+2). Приготовление 19. 2'-Бром-4'-гидроксибифенил-4-карбоновой кислоты метиловый эфир. Стадия А. К 4'-метокси-2'-нитробифенил-4-карбоновой кислоты метиловому эфиру (4,00 г), суспендированному в этаноле (150 мл) и этилацетате (150 мл), добавляли 5% палладий на углероде (0,300 г). Данную реакционную смесь помещали в атмосферу водорода (50 psi (фунт-сила на квадратный дюйм), 3,45105 Па) и встряхивали на аппарате Парра. Через 18 ч реакционную смесь дегазировали азотом и фильтровали через подушку силикагеля с использованием для элюирования 700 мл этилацетата и 600 мл метиленхлорида. Фильтрат упаривали с получением 2'-амино-4'-метоксибифенил-4-карбоновой кислоты метилового эфира(3,52 г, 99%) в виде белого твердого вещества. Стадия Б. К раствору нитрита натрия (1,40 г) в диметилсульфоксиде (50 мл) добавляли 2'-амино-4'метоксибифенил-4-карбоновой кислоты метиловый эфир (2,61 г). Через 5 мин реакционную смесь обрабатывали раствором 4,7 мл бромисто-водородной кислоты (48%) в 50 мл диметилсульфоксида. Данную реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли раствором, полученным путем растворения 20,0 г карбоната калия в 400 мл воды. Данный продукт экстрагировали пять раз метиленхлоридом. Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток хроматографировали, используя для элюирования гексаны/этилацетат (99:1-86:14), с получением 2'-бром-4'метоксибифенил-4-карбоновой кислоты метилового эфира (1,00 г, 31%) в виде белого твердого вещества. Стадия В. К раствору 2'-бром-4'-метоксибифенил-4-карбоновой кислоты метилового эфира (0,200 г) в метиленхлориде (5 мл), имеющему температуру 0 С, добавляли трибромид бора (0,176 мл). Температуру реакционной смеси поддерживали при 0 С в течение 2 ч. Реакционную смесь медленно гасили путем добавления 50 мл метанола, разбавляли 150 мл 2 н. соляной кислоты и три раза экстрагировали метиленхлоридом. Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,180 г, 94%). Приготовление 20. 4'-Гидрокси-2'-метилбифенил-4-карбоновой кислоты метиловый эфир. К раствору 4-бром-3-метилфенола (0,300 г, 1 экв.) в ДМФА (5 мл) добавляли 4-метиловый эфир фенилбороновой кислоты (0,58 г, 2 экв.), dppf (0,27 г, 0,3 экв.), ацетат палладия (0,036 г, 0,1 экв.) и карбонат цезия (1,04 г, 2 экв.). Данную реакционную смесь нагревали до 75 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли водой. Полученный раствор экстрагировали этилацетатом. Объединенные органические слои объединяли и промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Неочищенный остаток очищали путем флэш-хроматографии, используя для элюирования 3% этилацетат в толуоле, с получением желаемого продукта (0,224 г, 58%).ES/MS: (масса/заряд) 241,3 (М-1). Соединения, приведенные в следующем списке, получали, по существу, в соответствии с методикой получения 4'-гидрокси-2'-метилбифенил-4-карбоновой кислоты метилового эфира с использованием подходящего исходного вещества. Приготовление 20 А. 4'-Гидрокси-3'-метилбифенил-4-карбоновой кислоты метиловый эфир. Приготовление 20 Б. 2'-Хлор-4'-гидроксибифенил-4-карбоновой кислоты метиловый эфир. Приготовление 20 В. 2'-Фтор-4'-гидроксибифенил-4-карбоновой кислоты метиловый эфир. Приготовление 20 Г. 4'-Гидрокси-2'-трифторметилбифенил-4-карбоновой кислоты метиловый эфир. Приготовление 20 Д. 4'-Гидрокси-2'-нитробифенил-4-карбоновой кислоты метиловый эфир. Приготовление 21. Трифторметансульфоновой кислоты 2-(4-метоксифенил)бензо[b]тиофен-6 иловый эфир. К раствору 2-(4-метоксифенил)бензо[b]тиофен-6-ола (512 мг, 2 ммоль) в дихлорметане (20 мл) при 0 С добавляли триэтиламин (0,58 мл, 5 ммоль) и ангидрид трифторметансульфокислоты (0,67 мл,4 ммоль). Данную реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали и остаток перерастворяли в EtOAc, промывали 1 н. NaOH,затем 1 н. HCl. Органический слой концентрировали с получением указанного в заголовке соединения(800 мг). Приготовление 22. 2-(4-Метоксифенил)бензо[b]тиофен-6-карбоновой кислоты метиловый эфир. Смесь трифторметансульфоновой кислоты 2-(4-метоксифенил)бензо[b]тиофен-6-илового эфира(750 мг), ацетата палладия (43 мг), 1,4-бис-(дифенилфосфино)бутана (97 мг), триэтиламина (1,4 мл) в МеОН (8 мл) и ДМСО (12 мл) перемешивали в атмосфере окиси углерода (100 psi (6,895105 Па при 80 С в течение 4 ч. Реакционную смесь фильтровали через подушку кизельгура и полученный фильтрат концентрировали. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования 0-20% EtOAc в гексанах, с получением указанного в заголовке соединения (500 мг, 87%).LC-ES/MS: (масса/заряд) 321 (M+Na). Приготовление 23. 2-(4-Гидроксифенил)бензо[b]тиофен-6-карбоновой кислоты метиловый эфир. К раствору 2-(4-метоксифенил)бензо[b]тиофен-6-карбоновой кислоты метилового эфира (500 мг,1,7 ммоль) в дихлорметане (15 мл) при 0 С добавляли BBr3 (4,2 мл, 1 M в дихлорметане). Данную реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Реакцию останавливали путем добавления метанола и концентрировали при пониженном давлении. Остаток распределяли между EtOAc и 1 н. HCl. Органический слой концентрировали и остаток очищали путем хроматографии,используя для элюирования 0-25% EtOAc в гексанах, с получением указанного в заголовке соединенияLC-ES/MS: (масса/заряд) 283 (М-1). Приготовление 24. 5-(4-Гидрокси-2-метилфенил)-4-метилтиофен-2-карбоновой кислоты метиловый эфир. Стадия А. Смесь 4-метокси-2-метилфенилбороновой кислоты (912 мг, 6 ммоль), 5-бром-4-метилтиофен-2 карбоновой кислоты метилового эфира (1,1 г, 5 ммоль) и K2CO3 (1,38 г, 10 ммоль) в толуоле (30 мл) и воде (5 мл) барботировали N2 в течение 15 мин, затем добавляли тетракис(трифенилфосфин)палладий(289 мг, 0,25 ммоль). Данную реакционную смесь перемешивали при 80 С в атмосфере N2 в течение ночи. Реакционную смесь фильтровали через подушку кизельгура с использованием для элюированияEtOAc. Объединенный фильтрат концентрировали и остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования 0-15% EtOAc в гексанах, с получением 5-(4-метокси-2 метилфенил)-4-метилтиофен-2-карбоновой кислоты метилового эфира (540 мг, 39%). 1(1 н., 5,0 мл) и данную смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь гасили путем добавления метанола и упаривали. Остаток очищали путем колоночной хроматографии на силикагеле, используя для элюирования 0-20% EtOAc в гексанах, с получением указанного в заголовке соединения (420 мг, 82%). 1(ушир.с, 1 Н), 3,88 (с, 3H), 2,15 (с, 3H), 2,02 (с, 3H). Следующие соединения получали, по существу, в соответствии с методикой получения 5-(4 гидрокси-2-метилфенил)-4-метилтиофен-2-карбоновой кислоты метилового эфира с использованием подходящего исходного вещества. Приготовление 24 А. 5-(4-Гидроксифенил)тиофен-2-карбоновой кислоты метиловый эфир. 1H ЯМР (ДМСО-d6)9,87 (с, 1 Н), 7,74 (д, 1 Н, J=4,0 Гц), 7,57 (д, 2 Н, J=8,8 Гц), 7,40 (д, 1 Н, J=4,0 Гц),- 15014720 6,83 (д, 2 Н, J=8,8 Гц), 3,81 (с, 3H). Приготовление 24 Б. 5-(4-Гидрокси-2-метилфенил)тиофен-2-карбоновой кислоты метиловый эфир. 1 Н ЯМР (ДМСО-d6)9,71 (с, 1 Н), 7,76 (д, 1 Н, J=3,5 Гц), 7,26 (д, 1 Н, J=8,4 Гц), 7,17 (д, 1 Н, J=4,0 Гц),6,72 (д, 1 Н, J=2,6 Гц), 6,67 (дд, 1 Н, J=2,6, J=8,4 Гц), 3,81 (с, 3H), 2,32 (с, 3H). Приготовление 25. 4-[(4-Гидрокси-2-метилфенил)метиламино]метилбензойной кислоты метиловый эфир. К раствору 4-амино-3-метилфенола (1,0 г, 8,12 ммоль) в МеОН (77 мл), имеющему температуру окружающей среды, добавляли 4-формилбензойной кислоты метиловый эфир (1,47 г, 8,93 ммоль) и декаборан (329 мг, 2,68 ммоль). Реакционную смесь перемешивали при комнатной температуре. Через 2 ч в реакционную смесь добавляли формальдегид (1,23 мл, 16,93 ммоль, 37% в воде) и декаборан (329 мг,2,68 ммоль). Данную реакционную смесь перемешивали в течение ночи. Затем реакционную смесь концентрировали при пониженном давлении и остаток очищали путем хроматографии с получением указанного в заголовке соединения (2,07 г, 90%).LC-ES/MS: (масса/заряд) 286,2 (М+1). Следующее соединение получали, по существу, в соответствии с методикой получения 4-[(4 гидрокси-2-метилфенил)метиламино]метилбензойной кислоты метилового эфира с использованием подходящего исходного вещества. Приготовление 25 А. 3-[(4-Гидрокси-2-метилфенил)метиламино]метилбензойной кислоты метиловый эфир (74%).LC-ES/MS: (масса/заряд) 286,2 (М+1). Приготовление 25 Б. 4-[(4-Гидрокси-2-метилфенил)метиламино]метил-2-трифторметилбензойной кислоты метиловый эфир (выход 35%).LC-ES/MS: (масса/заряд) 340,0 (М+1). Приготовление 26. 3-[2-(2-Хлор-4-гидроксифенил)винил]бензойной кислоты метиловый эфир. К раствору 3-винилбензойной кислоты метилового эфира (0,300 г) в диметилформамиде (3 мл) добавляли 4-бром-3-метилфенол (0,35 г), три(ортотолуил)фосфин (0,06 г), Pd(dba)2 (0,032 г) и триэтиламин(0,26 мл). Данную реакционную смесь нагревали до 100 С в течение ночи. После охлаждения до комнатной температуры растворитель выпаривали при пониженном давлении. Остаток растворяли в этилацетате, промывали водой и солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали путем хроматографии на силикагеле, используя для элюирования сначала толуол (300 мл), затем 10% этилацетат в толуоле (250 мл), с получением указанного в заголовке соединения (0,210 г). 1H ЯМР (400 МГц, CDCl3)8,20 (с, 1 Н), 7,95-7,93 (д, 1 Н), 7,71-7,69 (д, 1 Н), 7,53-7,51 (д, 1 Н), 7,487,44 (т, 1 Н), 7,38-7,34 (д, 1 Н), 6,96-6,92 (д, 1 Н), 6,77-6,72 (м, 2 Н), 5,26 (уш, с, 1 Н), 3,99 (с, 3H), 2,43 (с,3H). Приготовление 27. 2-Триметилсиланилэтинилбензойной кислоты метиловый эфир. К раствору 2-йод-бензойной кислоты метилового эфира (792 мг, 3,02 ммоль) в ДМФА (10 мл) добавляли триметилсилилацетилен (854 мкл, 6,04 ммоль) и триэтиламин (2,95 мл, 21,1 ммоль). Реакционную смесь дегазировали в течение 20 мин в потоке азота. Добавляли дихлор(бистрифенилфосфен)палладий(II) (212 мг, 0,302 ммоль, 10 мол.%) и иодид меди(I) (58 мг, 0,302 ммоль,10 мол.%) и данную реакционную смесь нагревали до 80 С. Через 3 ч реакционную смесь концентрировали и остаток хроматографировали, используя для элюирования 0-5% EtOAc/гексаны, с получением указанного в заголовке соединения (597 мг, 85%). ГХ/МС (газовая хроматография/масс-спектрометрия): 232. Соединения, приведенные в следующем списке, получали, по существу, в соответствии с методикой получения 2-триметилсиланилэтинилбензойной кислоты метилового эфира с использованием подходящего исходного вещества. Приготовление 27 А. 3-Триметилсиланилэтинилбензойной кислоты метиловый эфир. ГХ/МС: 232; 4. Приготовление 27 Б. Триметилсиланилэтинилбензойной кислоты метиловый эфир. ГХ/МС: 232. Приготовление 28. 2-Этинилбензойной кислоты метиловый эфир. К раствору 2-триметилсиланилэтинилбензойной кислоты метилового эфира (540 мг, 2,32 ммоль) в смеси ацетонитрил/вода (20 мл/5 мл) добавляли фторид цезия (1,41 г, 9,30 ммоль). Данную реакционную смесь перемешивали при комнатной температуре. Через 4 ч реакционную смесь концентрировали и остаток распределяли между EtOAc (100 мл) и 0,2 н. HCl (30 мл). Водный слой экстрагировали EtOAc(100 мл) и объединенные органические слои промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Остаток хроматографировали, используя для элюирования 0-5%EtOAc/гексаны, с получением указанного в заголовке соединения (358 мг, 96%). ГХ/МС: 160. Следующее соединение получали, по существу, в соответствии с методикой получения 2-этинил- 16014720 бензойной кислоты метилового эфира с использованием подходящего исходного вещества. Приготовление 28 А. 3-Этинилбензойной кислоты метиловый эфир. ГХ/МС: 160. Приготовление 28 Б. 4-Этинилбензойной кислоты метиловый эфир. ГХ/МС: 160. Приготовление 29. (4-Меркаптофенил)уксусной кислоты метиловый эфир. К раствору 4-меркаптофенилуксусной кислоты (5,0 г, 29,72 ммоль) в МеОН (250 мл), имеющему температуру окружающей среды, добавляли серную кислоту (1,25 мл). Данную реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и остаток распределяли между Et2O и водой. Водный слой экстрагировали Et2O и объединенные органические слои промывали солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали,используя для элюированя 0-30% EtOAC/гексан, с получением указанного в заголовке соединенияH ЯМР (400 МГц, CDCl3)7,21 (д, 2 Н, J=7,9 Гц), 7,12 (д, 2 Н, J=8,4 Гц), 3,66 (с, 3H), 3,54 (с, 2 Н). Приготовление 30. 3-(4-Гидрокси-2-метилбензиламино)бензойной кислоты этиловый эфир. Стадия А. Смесь 2-метил-4-бензилоксибензальдегида (1,22 г, 5,39 ммоль) и этил-3-аминобензоата (912 мг,5,52 ммоль) в ледяной уксусной кислоте (40 мл) перемешивали в течение 30 мин. К этой смеси добавляли триацетоксиборгидрид натрия (1,25 г, 5,90 ммоль). Через 20 ч смесь концентрировали и распределяли между этилацетатом и насыщенным раствором бикарбоната натрия. Слои разделяли и водный слой экстрагировали этилацетатом (2). Объединенные этилацетатные слои сушили (MgSO4) и концентрировали. Остаток очищали путем флэш-хроматографии на 120 г силикагеля, используя градиент этилацетата в гептане, с получением бензильного промежуточного соединения (1,6 г, 80%). Стадия Б. В атмосфере азота к раствору полученного на стадии А бензильного промежуточного соединения(471 мг, 1,25 ммоль) в этилацетате (20 мл) добавляли 10% палладий на углероде (80 мг). Реакционный сосуд откачивали и заполняли водородом (из баллона), данную реакционную смесь перемешивали в атмосфере водорода в течение ночи. Смесь фильтровали на кизельгуре и концентрировали при пониженном давлении с получением указанного в заголовке продукта (300 мг, 84%). МС: 284,3 (М-1). Следующее соединение получали, по существу, в соответствии с методикой получения 3-(4 гидрокси-2-метилбензиламино)бензойной кислоты этилового эфира с использованием подходящего исходного вещества. Приготовление 30 А. 4-(4-Гидрокси-2-метилбензиламино)бензойной кислоты метиловый эфирES/MS: (масса/заряд) 270,3 (М-1). Приготовление 31. 1-4-[3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2 метилфенилэтанон. К суспензии 4'-гидрокси-2'-метилацетофенона (969 мг, 6,45 ммоль), [3-(2,6-дихлорфенил)-5 изопропил-3H-[1,2,3]триазол-4-ил]метанола (1,85 г, 6,45 ммоль), три-н-бутилфосфина (2,42 мл,9,73 ммоль) в толуоле (20 мл), имеющей температуру 0 С, добавляли ADDP (2,46 г, 9,73 ммоль). Данную реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали и остаток хроматографировали, используя для элюирования 0-30%(с, 3H), 2,06 (с, 3H), 1,46 (д, 6 Н, J=7,0 Гц). Соединения, приведенные в следующем списке, получали, по существу, в соответствии с методикой получения 1-4-[3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2-метилфенилэтанона с использованием подходящего исходного вещества. Приготовление 31 А. 1-4-[3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]фенилэтанон (88%),1ES/MS: (масса/заряд) (35Cl) 463 (М+1). Приготовление 32. 2-4-[3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2 метилфенилпропан-2-ол. К раствору 1-4-[3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2 метилфенилэтанона (500 мг, 1,19 ммоль) в ТГФ (12 мл), имеющему температуру -78 С, по каплям добавляли бромид метилмагния (2,0 мл, 5,98 ммоль, 3,0 М в ТГФ). Данную реакционную смесь нагревали до комнатной температуры. Через 4 ч реакционную смесь охлаждали до 0 С, гасили путем добавленияNH4Cl и нагревали до комнатной температуры. Реакционную смесь концентрировали и остаток распределяли между Et2O и 1 н. HCl. Водный слой экстрагировали Et2O и объединенные органические слои промывали солевым раствором, сушили (MgSO4), фильтровали, концентрировали и хроматографировали,используя для элюирования 0-30% EtOAC/гексан, с получением указанного в заголовке соединенияH ЯМР (400 МГц, CDCl3)7,49-7,46 (м, 2 Н), 7,43-7,38 (м, 1 Н), 7,23-7,19 (м, 2 Н), 6,70 (д, 1 Н,J=8,8 Гц), 4,89 (с, 2 Н), 3,20 (sept, 1H, J=6,6 Гц), 2,04 (с, 3H), 1,53 (с, 6 Н), 1,45 (д, 6 Н, J=6,6 Гц). Соединения, приведенные в следующем списке, получали, по существу, в соответствии с методикой получения 2-4-[3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2-метилфенилпропан-2-ола с использованием подходящего исходного вещества. Приготовление 32 А. 2-4-[3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]фенилпропан-2-ол (63%). 1(м, 2 Н), 6,70 (д, 1 Н, J=8,8 Гц), 4,89 (с, 2 Н), 3,21 (sept, 1 Н, J=7,0 Гц), 2,04 (с, 3H), 1,54 (с, 6 Н), 1,45 (д, 6 Н,J=7,0 Гц). Приготовление 33. 4-Формил-2-метилбензойной кислоты метиловый эфир. Стадия А. К раствору 4-йод-3-метилбензойной кислоты (5,2 г, 20 ммоль) в ТГФ (30 мл) по каплям добавляли 2,0 М боран-диметилсульфидный комплекс в ТГФ (40,0 мл, 80 ммоль). Данную реакционную смесь перемешивали в течение ночи. Реакционную смесь осторожно гасили метанолом (20 мл) при 0 С и смесь упаривали досуха при пониженном давлении. Остаток распределяли между EtOAc (80 мл) и водой(60 мл). Органическую фазу промывали солевым раствором (60 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии(AnaLogix, градиент EtOAc/гексан) с получением (4-йод-3-метилфенил)метанола в виде белого твердого вещества (4,7 г, 95%). 1H ЯМР (CDCl3) (м.д.): 2,4 (3H, с), 4,55 (2 Н, с), 6,8-7,75 (3H, м). Стадия Б. В реактор Парра из жаропрочного сплава "Хастеллой" с реакционным объемом 50 мл, предназначенный для работы под давлением, загружали ацетат палладия (0,161 г, 0,7 ммоль), 1,4-бис(дифенилфосфино)бутан (DPPB) (0,363 г, 0,85 ммоль), (4-йод-3-метилфенил)метанол (1,80 г, 7,25 ммоль),сухой метанол (10,0 мл), сухой триэтиламин (5,25 мл, 37,7 ммоль) и сухой ацетонитрил (15,0 мл). Реакционный резервуар откачивали и промывали азотом (4). Затем реакционный резервуар откачивали и промывали окисью углерода (4). Реакционный резервуар заполняли окисью углерода (100 psi, 690 кПа),герметизировали и реакционную смесь перемешивали при 100 С в течение 4 ч, поддерживая давление окиси углерода на уровне 100 psi (690 кПа) Реакционную смесь охлаждали до температуры окружающей среды и из реакционного резервуара удаляли окись углерода. Проводили фильтрацию и фильтрат концентрировали с получением остатка. Остаток распределяли между EtOAc (50 мл) и водой (50 мл). Органическую фазу промывали солевым раствором (50 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии с получением 4 гидроксиметил-2-метилбензойной кислоты метилового эфира в виде сиропа (1,18 г, 90%). ЖХ-МС (жидкостная хроматография-масс-спектрометрия): 181,3 (М+1). Стадия В. К раствору 4-гидроксиметил-2-метилбензойной кислоты метилового эфира (0,49 г, 2,7 ммоль) в метиленхлориде (8,0 мл), имеющему температуру 0 С, последовательно добавляли бикарбонат натрия(0,46 г, 5,4 ммоль) и периодинан Десса-Мартина (0,14 г, 3,3 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 1,0 ч и гасили водой (2,0 мл). Смесь распределяли между CH2Cl2 (30 мл) и водой (30 мл). Органическую фазу промывали солевым раствором (30 мл), сушили(Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали пу- 18014720 тем флэш-хроматографии с получением указанного в заголовке соединения в виде сиропа (0,35 г, 72%). 1H ЯМР (CDCl3) (м.д.): 2,6 (3H, с), 3,85 (3H, с), 7,65-8,0 (3H, т), 10,0 (1 Н, с). Указанное в заголовке соединение получали, по существу, как описано в методике синтеза 4 формил-2-метилбензойной кислоты метилового эфира, с использованием подходящего исходного вещества. Приготовление 33A. 4-Формил-2-трифторметилбензойной кислоты метиловый эфир (1,29 г, 92%).LC-ES/MS: (масса/заряд) 233,3 (М+1). Приготовление 34. 4-Формил-2-метилбензойной кислоты метиловый эфир. В автоклав Парра с реакционным объемом 1 л в атмосфере N2 загружали ацетат палладия(II) (2,19 г,0,0097 моль) и бутил-1-диадамантилфосфин (10,42 г, 0,291 моль) в толуоле (100 мл). К данной смеси добавляли 4-бром-2-метилбензойной кислоты метиловый эфир (222 г, 0,969 моль), тетраметилэтилендиамин (97,1 мл, 0,63 экв.) и толуол (325 мл). Автоклав закрывали и удаляли из атмосферы N2. В автоклаве устанавливали постоянное давление SynGas (эквимолярная смесь СО/Н 2, 75 psi, 5,17105 Па). Реакционную смесь перемешивали в течение 18 ч при 85 С. Неочищенную реакционную смесь фильтровали через подушку кизельгура и промывали CH2Cl2 до получения прозрачного фильтрата. Растворитель удаляли при пониженном давлении с получением красного масла (86%), которое при стоянии кристаллизовалось. 1H ЯМР (400 МГц, CDCl3)10,0 (с, 1 Н), 7,9 (д, 1 Н), 7,78 (м, 2 Н), 3,81 (с, 3H), 2,57 (с, 3H). Приготовление 35. 2-Бутокси-4-формилбензойной кислоты метиловый эфир. Стадия А. К смеси 2-гидрокси-4-метилбензойной кислоты метилового эфира (1,0 г, 6,0 ммоль), трифенилфосфина (1,9 г, 7,2 ммоль) и н-бутанола (0,89 г, 12,0 ммоль) в ТГФ (10,0 мл), имеющей температуру 0 С, по каплям добавляли DIAD (диизопропилазодикарбоксилат) (1,45 г, 7,2 ммоль). Данную смесь перемешивали при комнатной температуре в течение ночи. Смесь упаривали досуха при пониженном давлении. Остаток распределяли между EtOAc (50 мл) и водой (50 мл). Органическую фазу промывали солевым раствором (50 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии с получением 2-бутокси-4-метилбензойной кислоты метилового эфира в виде сиропа (1,0 г, 74%). ЖХ-МС: 223,3 (М+1). Стадия Б. Смесь 2-бутокси-4-метилбензойной кислоты метилового эфира (0,85 г, 3,8 ммоль), дибензоилпероксида (100 мг) и NBS (N-бромсукцинимида) (0,68 г, 3,8 ммоль) в CCl4 (20 мл) нагревали до 70 С в течение ночи. Твердое вещество отфильтровывали и фильтрат концентрировали до остатка. Остаток очищали путем флэш-хроматографии с получением 4-бромметил-2-бутоксибензойной кислоты метилового эфира в виде сиропа (0,6 г, 52%). ЖХ-МС: 301,0 (М+1). Стадия В. Смесь 4-бромметил-2-бутоксибензойной кислоты метилового эфира (0,0500 г, 1,67 ммоль), ТГФ(10 мл), H2O (10 мл) и LiOH (0,160 г, 6,68 ммоль) перемешивали при 50 С в течение ночи. Смесь подкисляли 1,0 М HCl и полученный продукт экстрагировали EtOAc (40 мл). Органическую фазу промывали солевым раствором (20 мл) и сушили (Na2SO4). Проводили фильтрацию и фильтрат концентрировали при пониженном давлении до остатка. Остаток растворяли в CH2Cl2 (10 мл) и MeOH (10 мл) и обрабатывали 2,0 М TMSCHN2 в гексане (5,0 мл, 10 ммоль) при комнатной температуре в течение 30 мин. После концентрации остаток очищали путем флэш-хроматографии с получением 2-бутокси-4 гидроксиметилбензойной кислоты метилового эфира в виде сиропа (270 мг, 68%).LC-ES/MS: 239,3 (М+1). Стадия Г. К раствору 2-бутокси-4-гидроксиметилбензойной кислоты метилового эфира (0,270 г, 1,13 ммоль) в метиленхлориде (10 мл), имеющему температуру 0 С, последовательно добавляли бикарбонат натрия(0,14 г, 1,7 ммоль) и периодинан Десса-Мартина (0,58 г, 1,4 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 1,0 ч и гасили водой (10 мл). Реакционную смесь распределяли между CH2Cl2 (30 мл) и водой (20 мл). Органическую фазу промывали солевым раствором(20 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии с получением указанного в заголовке соединения в виде сиропаLC-ES/MS: 237,3 (М+1). Приготовление 36. [4-(трет-Бутилдиметилсиланилокси)-2-метилфенил]метиламин. Стадия А. К суспензии 4-амино-3-метилфенола (10,8 г, 88 ммоль) в ТГФ (80 мл) и насыщенном растворе бикарбоната натрия (50 мл) по каплям добавляли бензилхлорформиат (18,0 г, 105 ммоль). Данную реакционную смесь перемешивали в течение 1,0 ч. Две фазы разделяли и органическую фазу концентрировали- 19014720 до остатка. Остаток распределяли между EtOAc (100 мл) и 5% HCl (50 мл). Органическую фазу промывали солевым раствором (100 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии с получением (4-гидрокси-2 метил)карбаминовой кислоты бензилового эфира в виде коричневого твердого вещества (21,0 г, 93%).LC-ES/MS: 258,3 (М+1), 256,0 (М-1). Стадия Б. К раствору (4-гидрокси-2-метил)карбаминовой кислоты бензилового эфира (21,0 г, 81,7 ммоль) и имидазола (6,7 г, 98 ммоль) в ДМФА (100 мл), имеющему температуру 0 С, добавляли раствор третбутилдиметилсилилхлорида (14,8 г, 98 ммоль) в ДМФА (20 мл). После добавления смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли при пониженном давлении с получением остатка, который распределяли между EtOAc (100 мл) и 5% HCl (50 мл). Органическую фазу промывали солевым раствором (100 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии с получением [4-(третбутилдиметилсиланилокси)-2-метилфенил]карбаминовой кислоты бензилового эфира в виде желтоватого твердого вещества (28,8 г, 95%).LC-ES/MS: 372,3 (М+1). Стадия В. К раствору [4-(трет-бутилдиметилсиланилокси)-2-метилфенил]карбаминовой кислоты бензилового эфира (18 г, 48,5 ммоль) в ДМФА (100 мл), имеющему температуру 0 С, добавляли порциями гидрид натрия (60% дисперсия в масле, 2,3 г, 58 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 30 мин, затем добавляли иодметан (8,2 г, 58 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли при пониженном давлении с получением остатка, который распределяли между EtOAc (100 мл) и водой (100 мл). Органическую фазу промывали солевым раствором (100 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии с получением [4-(третбутилдиметилсиланилокси)-2-метилфенил]метилкарбаминовой кислоты бензилового эфира в виде маслаLC-ES/MS: 386,0 (М+1). Стадия Г. Смесь [4-(трет-бутилдиметилсиланилокси)-2-метилфенил]метилкарбаминовой кислоты бензиловового эфира (14,0 г, 36,0 ммоль) и палладия на углероде (10% по массе, 0,5 г) в метаноле (100,0 мл) перемешивали в атмосфере водорода (баллон) при комнатной температуре в течение ночи. Проводили фильтрацию и фильтрат концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии с получением указанного в заголовке соединения в виде масла (7,4 г, 81%).LC-ES/MS: 252,3 (М+1). Приготовление 37. 4-([4-(трет-Бутилдиметилсиланилокси)-2-метилфенил]метиламинометил)-2 метилбензойной кислоты метиловый эфир. К раствору [4-(трет-бутилдиметилсиланилокси)-2-метилфенил]метиламина (0,64 г, 2,6 ммоль) и 4 формил-2-метилбензойной кислоты метилового эфира (0,38 г, 2,1 ммоль), уксусной кислоты (0,25 г,4,2 ммоль) в 1,2-дихлорэтане (10,0 мл) добавляли порциями триацетоксиборгидрид натрия (0,89 г,4,2 ммоль). Данную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили 5% водным раствором бикарбоната натрия (5 мл) и распределяли между EtOAc (60 мл) и водой (50 мл). Органический слой промывали солевым раствором (50 мл), сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали путем колоночной флэш-хроматографии с получением указанного в заголовке соединения в виде сиропа (1,0 г, 95%).LC-ES/MS: (масса/заряд) 414,3 (М+1). Приготовление 38. 2-Бутокси-4-([4-(трет-бутилдиметилсиланилокси)-2-метилфенил]метиламинометил)бензойной кислоты метиловый эфир. Указанное в заголовке соединение получали путем восстановительного аминирования с участием[4-(трет-бутилдиметилсиланилокси)-2-метилфенил]метиламина и 2-бутокси-4-формилбензойной кислоты метилового эфира, по существу, как описано в методике синтеза 4-([4-(третбутилдиметилсиланилокси)-2-метилфенил]метиламинометил)-2-метилбензойной кислоты метилового эфира, с использованием подходящего исходного вещества, В результате этой процедуры указанное в заголовке соединение получали в виде сиропа.LC-ES/MS: (масса/заряд) 472,3 (М+1). Приготовление 39. 4-[(4-Гидрокси-2-метилфенил)метиламино]метил-2-метилбензойной кислоты метиловый эфир. К раствору 4-([4-(трет-бутилдиметилсиланилокси)-2-метилфенил]метиламинометил)-2-метилбензойной кислоты метилового эфира (1,0 г, 2,1 ммоль) в ТГФ (20,0 мл) добавляли 1,0 М TBAF (тетрабутиламмония фторид)/ТГФ (3,2 мл, 3,2 ммоль) при комнатной температуре. Данную реакционную смесь перемешивали в течение 1,0 ч. Реакционную смесь распределяли между EtOAc (30 мл) и водой (30 мл).- 20014720 Органическую фазу промывали солевым раствором (30 мл), сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии с получением указанного в заголовке соединения в виде масла (0,45 г, 62%).LC-ES/MS: 300,3 (М+1), 298,3 (М-1). Приготовление 40. 2-Бутокси-4-[(4-гидрокси-2-метилфенил)метиламино]метилбензойной кислоты метиловый эфир. Указанное в заголовке соединение (200 мг, 55%) получали, по существу, как описано в методике синтеза 4-[(4-гидрокси-2-метилфенил)метиламино]метил-2-метилбензойной кислоты метилового эфира, с использованием подходящего исходного вещества.LC-ES/MS: 358,3 (М+1). Приготовление 41. 3-(2,6-Дихлорфенил)-5-трифторметил-3H-[1,2,3]триазол-4-карбоновой кислоты этиловый эфир. Смесь 2-азидо-1,3-дихлорбензола (25,0 г, 132,9 ммоль) и 4,4,4-трифтор-бут-2-иновой кислоты этилового эфира (26,5 г, 159,6 ммоль) в толуоле (30 мл) нагревали при 80 С в течение 18 ч. На 25-й минуте наблюдалось сильное выделение тепла. Реакционную смесь не нагревали, пока выделение тепла не снижалось. Наблюдали образование двух региоизомеров в соотношении от 1:1 до 3:1 в пользу желаемого продукта. Реакционную смесь концентрировали при пониженном давлении с получением 51 г неочищенного вещества, которое очищали путем колоночной хроматографии, используя градиент 35-60% ДХМ (дихлорметана) в гексанах, с получением указанного в заголовке соединения (28 г, 59%).ES/MS: (масса/заряд) 353,0 (М+1). Следующее соединение получали, по существу, в соответствии с методикой получения 3-(2,6 дихлорфенил)-5-трифторметил-3H-[1,2,3]триазол-4-карбоновой кислоты этилового эфира с использованием подходящего исходного вещества. Приготовление 41 А. 3-(2-Трифторметоксифенил)-5-трифторметил-3H-[1,2,3]триазол-4-карбоновой кислоты этиловый эфир (42%).ES/MS: (масса/заряд) 370,0 (М+1). Приготовление 42. [3-(2,6-Дихлорфенил)-5-трифторметил-3H-[1,2,3]триазол-4-ил]метанол. К раствору 3-(2,6-дихлорфенил)-5-трифторметил-3H-[1,2,3]триазол-4-карбоновой кислоты этилового эфира (28 г, 79 ммоль) в ТГФ (200 мл), имеющему температуру 0 С, добавляли по каплям 1 М DIBAL(166 мл, 166 ммоль), поддерживая температуру ниже 5 С. После добавления баню удаляли и реакционную смесь перемешивали в течение 18 ч. Реакционную смесь охлаждали до 0 С и добавляли диэтиловый эфир (300 мл). Реакционную смесь гасили путем добавления по каплям 1 н. HCl (250 мл), поддерживая температуру ниже 15 С. Слои разделяли и водный слой промывали этиловым эфиром (100 мл). Органические слои объединяли, промывали водой, солевым раствором и сушили над Na2SO4. Органический слой концентрировали досуха с получением указанного в заголовке соединения (24 г, 97%) и использовали без дополнительной очистки.ES/MS: (масса/заряд) 312,0 (М+1). Следующее соединение получали, по существу, в соответствии с методикой получения [3-(2,6 дихлорфенил)-5-трифторметил-3H-[1,2,3]триазол-4-ил]метанола с использованием подходящего исходного вещества. Приготовление 42 А. [3-(2-Трифторметоксифенил)-5-трифторметил-3H-[1,2,3]триазол-4-ил]метанолES/MS: (масса/заряд) 328,0 (М+1). Приготовление 43. 4-Йод-3-трифторметилбензойная кислота. 4-Амино-3-трифторметилбензойную кислоту (1,8 г, 8,8 ммоль) суспендировали в концентрированной HCl (30 мл). По каплям при 0 С добавляли раствор нитрита натрия (0,76 г, 11,0 ммоль) в воде(15 мл). Данную смесь перемешивали при 0-10 С в течение 30 мин. Добавляли по каплям раствор йодистого калия (14,6 г, 88 ммоль) в воде (25 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. Полученный продукт экстрагировали EtOAc (80 мл), промывали солевым раствором (80 мл), сушили(Na2SO4), фильтровали и концентрировали при пониженном давлении до остатка. Остаток очищали путем флэш-хроматографии, используя градиент (EtOAc/гексан), с получением указанного в заголовке соединения (2,4 г, 86%) в виде твердого вещества.ES/MS: (масса/заряд) 255,0 (М-1). Приготовление 45. 6-(4-Гидрокси-2-метилфенил)бензо[d]изотиазол-3-карбоновая кислота. К дегазированному раствору 6-бромбензо[d]изотиазол-3-карбоновой кислоты (0,42 г, 1,54 ммоль),3-метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил-фенола (0,54, 2,31 ммоль), 2-дициклогексилфосфино-2',6'-диметокси-1,1'-бифенила (0,064 г, 0,154 ммоль) и фосфата калия (0,71 г, 3,1 ммоль) в диоксане (8 мл) и воде (4 мл) добавляли Pd(OAc)2 (6,5 мг, 0,03 ммоль). Данную реакционную смесь снова де- 21014720 газировали и нагревали до 80 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Полученное вещество разбавляли EtOAc и 1 н. HCl. Слои разделяли и концентрировали при пониженном давлении. Неочищенное вещество разбавляли 20 мл МеОН и 2 мл H2SO4 и нагревали до температуры дефлегмации в течение 2 ч. Реакционную смесь концентрировали на силикагеле и очищали, используя градиент 20-50% EtOAc в гексанах, с получением указанного в заголовке соединения (0,12 г, выход 26%).ES/MS: (масса/заряд) 300,0 (М+1). Приготовление 46. 6-Бром-1 Н-индазол-3-карбоновой кислоты метиловый эфир. Указанное в заголовке соединение получали из 6-бром-1 Н-индол-2,3-диона, по существу, как описано в методике 4 WO 2005092890.ES/MS: (масса/заряд) 254,0 (М+1). Приготовление 47. 6-Бром-1-изопропил-1 Н-индазол-3-карбоновой кислоты метиловый эфир. Указанное в заголовке соединение получали, по существу, как описано в методике 1d WO 2005/080389, но с использованием 6-бром-1 Н-индазол-3-карбоновой кислоты метилового эфира вместо 1 Н-индазол-3-карбоновой кислоты метилового эфира.ES/MS: (масса/заряд) 296,0 (М+1). Приготовление 48. 6-Бром-1-метил-1 Н-индазол-3-карбоновой кислоты метиловый эфир. Указанное в заголовке соединение получали, по существу, как описано в методике синтеза 6-бром 1-изопропил-1 Н-индазол-3-карбоновой кислоты, но с использованием 6-бром-1 Н-индазол-3-карбоновой кислоты метилового эфира вместо 1 Н-индазол-3-карбоновой кислоты метилового эфира и иодметана вместо 2-иодпропана.(0,61 г, 2,4 ммоль), 3-метил-4-4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил-фенола (0,84, 3,6 ммоль), 2 дициклогексилфосфино-2',6'-диметокси-1,1'-бифенила (0,098 г, 0,240 ммоль) и фосфата калия (1,0 г,4,8 ммоль) в диоксане (10 мл) и воде (5 мл) дегазировали и обрабатывали Pd(OAc)2 (27 мг, 0,12 ммоль). Данную реакционную смесь снова дегазировали и нагревали до 90 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, концентрировали на силикагеле при пониженном давлении и очищали путем флэш-хроматографии, используя градиент 10-30% EtOAc в гексанах, с получением указанного в заголовке соединения (0,53 г, 75%).ES/MS: (масса/заряд) 297,0 (М+1). Приготовление 50. 6-(4-Гидрокси-2-метилфенил)-1-изопропил-1 Н-индазол-3-карбоновой кислоты метиловый эфир. Указанное в заголовке соединение (2,88 г, 98%) получали, по существу, в соответствии с методикой синтеза 6-(4-гидрокси-2-метилфенил)-1-метил-1 Н-индазол-3-карбоновой кислоты за исключением того,что на стадии конечной очистки использовали градиент 20-60% EtOAc в гексанах.ES/MS: (масса/заряд) 325,0 (М+1). Приготовление 51. 4-Амино-3-фторфенол. Смесь 3-фтор-4-нитрофенола (2,20 г, 14,0 ммоль) и 25 мл этилацетата обезгаживали при пониженном давлении и три раза промывали азотом. Добавляли 10% по массе (220 мг) палладия на угле. Смесь обезгаживали при пониженном давлении и три раза промывали азотом. Смесь обезгаживали при пониженном давлении и промывали водородом. Смесь перемешивали в атмосфере водорода (баллон) в течение ночи. Затем смесь фильтровали на кизельгуре и концентрировали с получением указанного в заголовке соединения (1,7 г, 96%) в виде коричневого твердого вещества. 1H ЯМР (400 МГц, ДМФА-d7)8,75 (с, 1 Н), 6,78 (м, 1 Н), 6,40 (м, 1 Н), 6,50 (м, 1 Н), 4,38 (с, 2 Н). Приготовление 52. 4-[(2-Фтор-4-гидроксифениламино)метил]-2-метилбензойной кислоты метиловый эфир. Смесь 4-амино-3-фторфенола (900 мг, 7,08 ммоль) и 4-формил-2-метилбензойной кислоты метилового эфира (1,23 г, 6,90 ммоль) в 35 мл уксусной кислоты перемешивали в течение 2 ч при комнатной температуре. Добавляли триацетоксиборгидрид натрия (3,20 г, 15,1 ммоль) и перемешивали при комнатной температуре. После завершения реакции смесь концентрировали при пониженном давлении и распределяли между этилацетатом и насыщенным водным раствором бикарбоната натрия. Водный слой отделяли и экстрагировали этилацетатом (3). Объединенные этилацетатные слои сушили (MgSO4) и концентрировали при пониженном давлении. Остаток очищали на силикагеле (120 г), используя для элюирования градиент этилацетата в гептане (10-60%), с получением указанного в заголовке соединения(1,89 г, 6,53 ммоль) и 37% формальдегида (2,0 мл) в уксусной кислоте (20 мл) перемешивали в течение 40 мин. Добавляли триацетоксиборгидрид натрия (2,80 г, 13,2 ммоль), и перемешивали при комнатной температуре. После завершения реакции смесь концентрировали и распределяли между этилацетатом и насыщенным водным раствором бикарбоната натрия. Водный слой отделяли и экстрагировали этилацетатом (3). Объединенные этилацетатные слои сушили (MgSO4) и концентрировали при пониженном давлении. Остаток очищали на силикагеле (120 г), используя для элюирования градиент этилацетата в гептане (10-60%), с получением указанного в заголовке соединения (1,0 г, 51%) в виде белого твердого вещества.LC-ES/MS: (масса/заряд) 304,0 (М+1). Приготовление 54. Этил 4,4,4-трифтор-2-(трифенилфосфоранилиден)ацетоацетат. К суспензии (карбэтоксиметил)трифенилфосфония бромида (1000 г, 2,28 моль) в 5 л ТГФ при 2 С в атмосфере азота добавляли триэтиламин (642 мл, 4,57 моль). Данную смесь перемешивали в течение 30 мин при 2 С и затем через капельную воронку в течение 40 мин добавляли ангидрид трифторуксусной кислоты (357 мл, 2,51 моль). Эту смесь оставляли перемешиваться в течение 2 ч и осадок отфильтровывали. Жидкость, полученную после фильтрования, концентрировали при пониженном давлении с получением желтого маслянистого остатка. Данный остаток растирали с водой (3 л) с получением кристаллического твердого вещества, которое собирали путем фильтрации. Полученное твердое вещество промывали водой и сушили под вакуумом в течение ночи. Затем твердое вещество перекристаллизовывали из смеси МеОН-вода с получением указанного в заголовке соединения в виде белого твердого веществаES/MS: (масса/заряд) 446 (М+1). Приготовление 55. 4,4,4-Трифтор-2-бутиновой кислоты этиловый эфир. Смесь этил 4,4,4-трифтор-2-(трифенилфосфоранилиден)ацетоацетата (270 г, 617 ммоль) и карбоната калия (54 г, 490 ммоль) нагревали при температуре от 160 до 225 С в течение 3 ч под вакуумом(2-3 мбар, 2-3102 Па). Указанное в заголовке соединение подвергали дистилляции и собирали в холодную ловушку с получением указанного в заголовке соединения (85 г, 83%) в виде слегка желтого масла.ES/MS: (масса/заряд) 167 (М+1). Приготовление 56. 4-Бром-2-метилбензойной кислоты метиловый эфир. К раствору 4-бром-2-метилбензойной кислоты (500 г, 2,32 моль) в метаноле (2500 мл) при 5 С добавляли ацетилхлорид (199 мл, 2,79 моль). Смесь подвергали температурной обработке при 65 С в течение 7 ч. Смесь охлаждали до комнатной температуры и добавляли карбонат натрия (19 г, 0,18 моль). Данную реакционную смесь перемешивали в течение 15 мин. Полученную суспензию фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток распределяли между МТВЕ(400 мл) и водой (400 мл). Органическую фазу промывали солевым раствором, сушили над сульфатом магния и концентрировали с получением указанного в заголовке соединения (520 г) в виде золотистого масла.ES/MS: (масса/заряд) 216 (М+1). Приготовление 57. 4-Формил-2-метилбензойной кислоты метиловый эфир. Смесь 4-бром-2-метилбензойной кислоты метилового эфира (513 г, 2,24 моль), тетраметилэтилендиамина (209 мл, 1,39 моль), ацетата палладия (5 г), cataCXium A (23 г) в толуоле (3000 мл) загружали в реакционный резервуар. Реакционный резервуар заполняли SynGas (100 psi, 690 кПа). Смесь нагревали до 85 С и в течение ночи поддерживали давление SynGas на уровне 100 psi (690 кПа). Через 18 ч реакционную смесь охлаждали до комнатной температуры, фильтровали через подушку кизельгура и концентрировали с получением масла. Данный остаток растирали с гептаном с получением указанного в заголовке соединения в виде желтого твердого вещества, которое фильтровали и промывали гептаномES/MS: (масса/заряд) 179 (М+1). Приготовление 58. 4-4-Гидрокси-2-метилфениламино)метил)-2-метилбензойной кислоты метиловый эфир. К суспензии 4-формил-2-метилбензойной кислоты метилового эфира (350 г, 1,96 моль) в уксусной кислоте (3100 мл) при комнатной температуре добавляли 4-амино-мета-крезол (242 г, 1,96 моль). Порциями добавляли триацетоксиборгидрид натрия (728 г, 3,44 моль), поддерживая температуру ниже 30 С путем использования бани с ледяной водой. После перемешивания в течение ночи реакционную смесь концентрировали при пониженном давлении. Остаток доводили до pH 5 с использованием водного насыщенного раствора бикарбоната натрия. Полученное твердое вещество отфильтровывали, промывали водой и сушили под вакуумом в течение ночи с получением указанного в заголовке соединения (460 г,82%) в виде коричневого порошка.- 23014720 эфира (250 г, 0,88 моль) в формальдегиде (435 мл, 37% в воде) при комнатной температуре по каплям добавляли муравьиную кислоту (165 мл, 4,37 мл). Данную реакционную смесь перемешивали в течение ночи. К реакционной смеси добавляли 1 М HCl (600 мл) и смесь экстрагировали МТВЕ. Водную фазу доводили 6 М NaOH до pH 8 и экстрагировали МТВЕ (21000 мл). Органические слои объединяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью подушки силикагеля, используя для элюирования 10% EtOAc/гексаны, с получением указанного в заголовке соединения (127 г, 48%) в виде белого твердого вещества.ES/MS: (масса/заряд) 300 (М+1). Приготовление 60. 5-Бромметил-1-(2,6-дихлорфенил)-4-трифторметил-1 Н-[1,2,3]триазол. К суспензии [3-(2,6-дихлорфенил)-5-трифторметил-3H-[1,2,3]триазол-4-ил]метанола (13 г, 41,69 ммоль) в дихлорметане (80 мл) добавляли трифенилфосфин (16,4 г, 62,5 ммоль). Смесь охлаждали до 0 С и добавляли тетрабромметан (20,7 г, 62,5 ммоль). Данную реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. Растворитель выпаривали при пониженном давлении и остаток очищали путем флэш-хроматографии, используя для элюирования гексаны/EtOAc (95:5-8:2), с получением указанного в заголовке соединения (15,6 г, выход 96%). 4'-[3-(2,6-Дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2'-метилбифенил-4 карбоновая кислота. Стадия А. К раствору 5-хлорметил-1-(2,6-дихлорфенил)-4-изопропил-1 Н-[1,2,3]триазола (0,1 г, 0,328 ммоль) в диметилформамиде (3 мл) добавляли 4'-гидрокси-2'-метилбифенил-4-карбоновой кислоты метиловый эфир (0,079 г, 0,326 ммоль) и карбонат цезия (0,21 г, 0,646 ммоль). Данную реакционную смесь нагревали до 55 С в течение 2,5 ч и охлаждали до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в смеси 1 н. соляной кислоты и этилацетата. Слои разделяли и водную фазу снова экстрагировали этилацетатом. Органические слои объединяли и промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением 4'-[3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2'метилбифенил-4-карбоновой кислоты метилового эфира.ES/MS: (масса/заряд) (35Cl/37Cl) 510,2/512,2 (М+1). Стадия Б. Раствор 4'-[3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2'-метилбифенил-4 карбоновой кислоты метилового эфира (4,55 г, 1 экв.) и 1 н. NaOH (44,6 мл, 5 экв.) в МеОН (200 мл) нагревали до 75 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток растворяли в воде (200 мл) и данный раствор подкисляли 5 н.HCl. Полученный осадок фильтровали и сушили при пониженном давлении с получением указанного в заголовке соединения (4,21 г, 95%).ES/MS: (масса/заряд) (35Cl/37Cl) 496,3/498 (М+1). Следующие соединения, приведенные в табл. 1, получали, по существу, в соответствии с методикой получения 4'-[3-(2,6-дихлорфенил)-5-изопропил-3H-[1,2,3]триазол-4-илметокси]-2'-метилбифенил-4 карбоновой кислоты с использованием подходящего исходного вещества.- 25014720 Стадия А. К раствору 3-(2-(4-гидрокси-2-метилфенил)винил)бензойной кислоты метилового эфира (0,094 г,0,351 ммоль) и (3-(2,6-дихлорфенил)-5-изопропил-3H-(1,2,3)триазол-4-ил)метанола (0,100 г, 0,351 ммоль) в ТГФ (3 мл) добавляли трифенилфосфин (0,184 г, 0,702 ммоль) и диэтилазодикарбоксилат (0,120 г, 0,720 ммоль). Данную реакционную смесь перемешивали в течение ночи. Реакционную смесь распределяли между эфиром и водой. Органический слой промывали солевым раствором и сушили над сульфатом натрия. Органические слои фильтровали и концентрировали. Неочищенное твердое вещество очищали путем флэш-хроматографии, используя в качестве элюента смесь гексан:этилацетат (2:1), с получением 3(2-(4-(3-(2,6-дихлорфенил)-5-изопропил-3H-(1,2,3)триазол-4-илметокси)-2-метилфенил)винил)бензойной кислоты метилового эфира (0,04 г).ES/MS: (масса/заряд) (35Cl/37Cl) 535,8/538,2 (М+1). Стадия Б. К раствору 3-(2-(4-(3-(2,6-дихлорфенил)-5-изопропил-3H-(1,2,3)триазол-4-илметокси)-2 метилфенил)винил)бензойной кислоты метилового эфира (0,025 г, 0,046 ммоль) в ТГФ (3 мл) добавляли гидроксид лития (0,005 г, 0,21 ммоль). Данную реакционную смесь нагревали до 55 С. Степень незавершенности реакции определяли путем ТСХ по присутствию исходного вещества (1:1 гексан/этилацетат). Добавляли дополнительную порцию гидроксида лития (0,050 г) и реакционную смесь нагревали до 60 С в течение 3 ч. Реакционную смесь гасили путем добавления водного раствора 1 н. HCl и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке соединения.ES/MS: (масса/заряд) 521,8 (М+1). Следующие соединения, приведенные в табл. 2, получали, по существу, в соответствии с методикой получения 3-(2-(4-(3-(2,6-дихлорфенил)-5-изопропил-3H-(1,2,3)триазол-4-илметокси)-2-метилфенил)винил)бензойной кислоты с использованием подходящего исходного вещества. Таблица 2
МПК / Метки
МПК: C07D 403/12, C07D 401/12, A61P 3/06, C07D 409/12, C07D 249/12, A61K 31/4192
Метки: соединения, способы, модуляции
Код ссылки
<a href="https://eas.patents.su/30-14720-soedineniya-i-sposoby-modulyacii-fxr.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения и способы модуляции fxr</a>
Предыдущий патент: Пиперидинилзамещённые пирролидиноны в качестве ингибиторов 11-бета-гидроксистероид дегидрогеназы 1
Следующий патент: Контейнер и способ его изготовления
Случайный патент: Устройство для фрикционного взаимодействия с трубными изделиями












