Модулятор рецепторов глюкокортикостероидов и его применение
Формула / Реферат
1. Соединение, которое представляет собой (Е)-N-{3-[1-(8-хлор-11Н-10-окса-1-азадибензо[a,d] циклогептен-5-илиден)пропил]фенил}метансульфонамид, или его фармацевтически приемлемая соль.
2. Соединение по п.1, которое представляет собой (E)-N-{3-[1-(8-хлор-11Н-10-окса-1-азадибензо[a,d] циклогептен-5-илиден)пропил]фенил}метансульфонамид.
3. Соль по п.1, которая представляет собой (Е)-N-{3-[1-(8-хлор-11Н-10-окса-1-азадибензо[a,d]циклогептен-5-илиден)пропил]фенил}метансульфонамид×HBr, (E)-N-{3-[1-(8-хлор-11Н-10-окса-1-азадибензо[a,d]циклогептен-5-илиден)пропил]фенил}метансульфонамид×HCl или (Е)-N-{3-[1-(8-хлор-11Н-10-окса-1-азадибензо [a,d]циклогептен-5-илиден)пропил]фенил}метансульфонамид×H2SO4(2:1).
4. Применение соединения или соли по любому из пп.1-3 для производства лекарственного средства для лечения ревматоидного артрита, остеоартрита, ревматического полиартрита, астмы, аллергического ринита, системной красной волчанки, хронического обструктивного заболевания легких, болезни Крона, воспалительного заболевания кишечника или язвенного колита.
5. Применение по п.4, где заболевание представляет собой ревматоидный артрит.
6. Фармацевтическая композиция, включающая соединение или соль по любому из пп.1-3 в сочетании с одним или более фармацевтически приемлемым носителем, наполнителем или разбавителем.
7. Фармацевтическая композиция для лечения ревматоидного артрита, включающая соединение или соль по любому из пп.1-3 в сочетании с одним или более фармацевтически приемлемым носителем, наполнителем или разбавителем.
8. Применение соединения или соли по любому из пп.1-3 в терапии.
9. Применение соединения или соли по любому из пп.1-3 для лечения ревматоидного артрита.
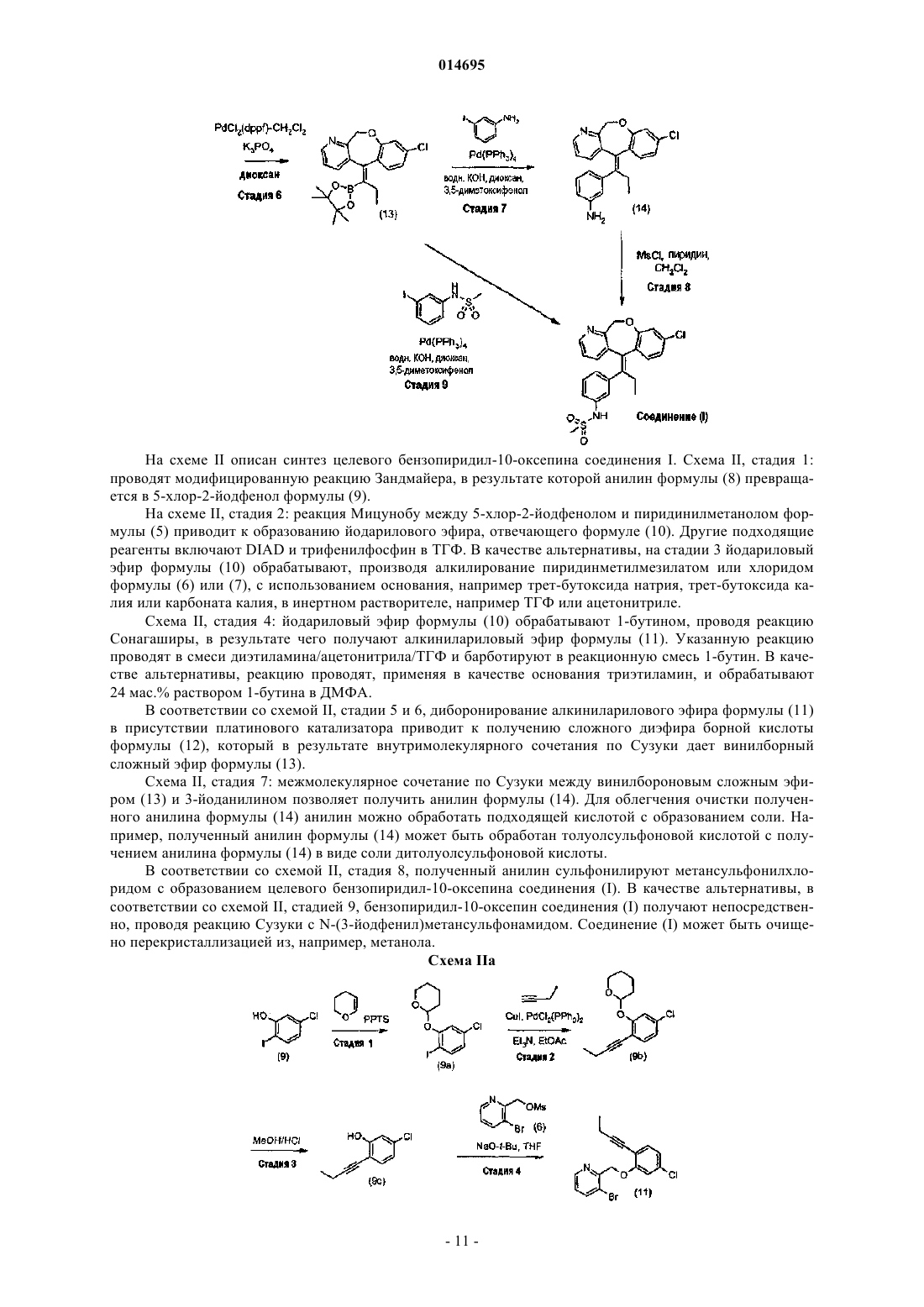
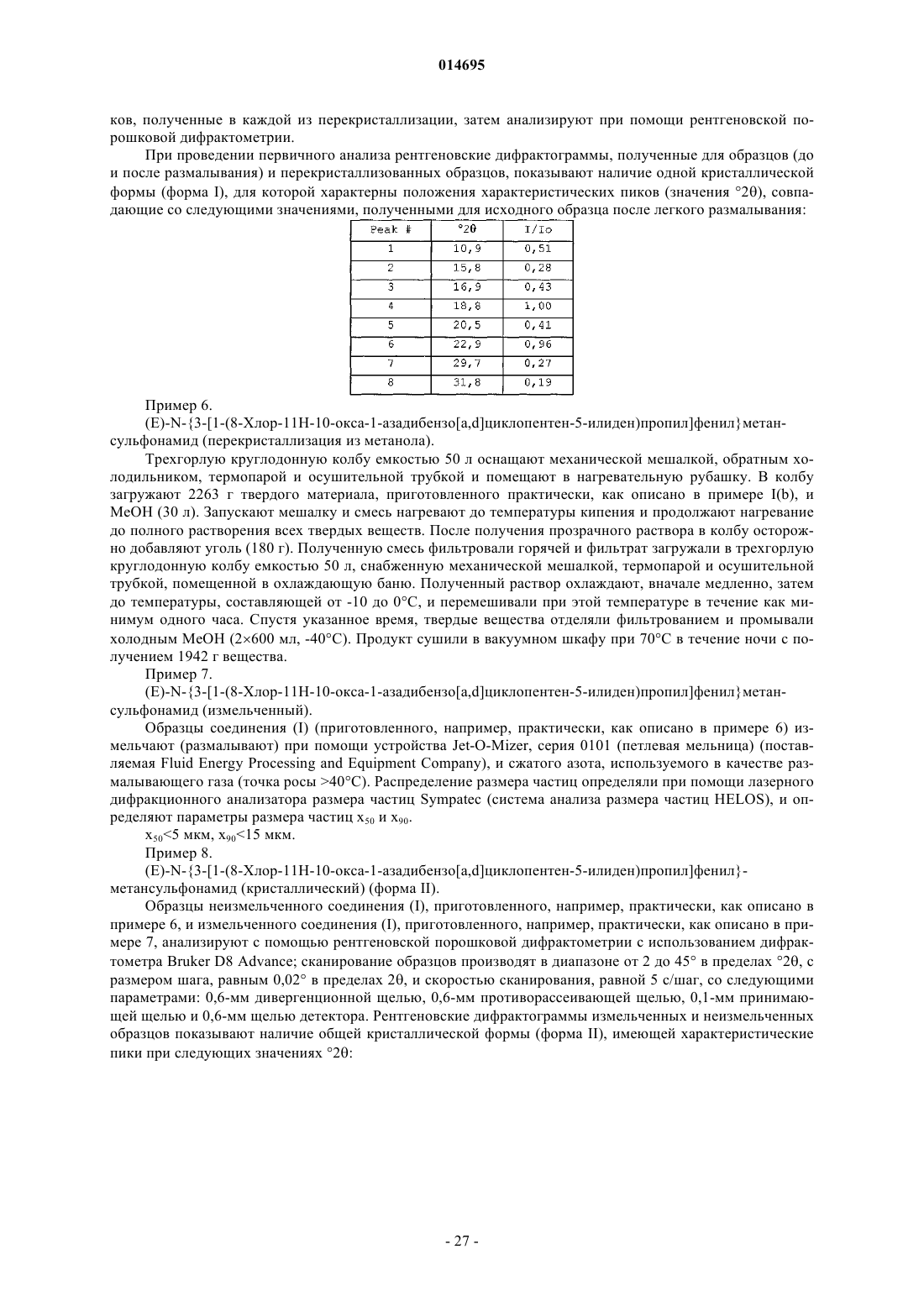
Текст
(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Карсон Мэттью Уилльям, Коулан Майкл Джозеф (US) Представитель: Настоящее изобретение относится к соединению (I) или фармацевтически приемлемой соли указанного соединения; фармацевтическим композициям, включающим соединение (I) в сочетании с одним или более фармацевтически приемлемым носителем, наполнителем или разбавителем; а также к способам лечения воспалительных или иммунных расстройств, включающим введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения (I) или фармацевтически приемлемой соли указанного соединения. 014695 Область техники Настоящее изобретение относится к трициклическим соединениям, которые применяют в качестве терапевтических агентов при лечении воспалительных и иммунных расстройств, чувствительных к воздействию стероидных глюкокортикоидов, к фармацевтическим композициям, включающим указанные соединения, к способам применения указанных соединений для лечения воспалительных и иммунных расстройств у пациентов, а также к промежуточным соединениям и способам, применяемым для синтеза указанных соединений. Уровень техники Более пятидесяти лет природные, а также синтетические стероидные глюкокортикоиды (например,кортизол, кортизон, преднизолон, дексаметазон) широко применяются для лечения острых и хронических воспалительных и иммунных расстройств. В частности, глюкокортикоиды прописывают для лечения ревматоидного артрита, острого артрита, ревматического полиартрита, астмы, аллергического ринита, системной красной волчанки, хронического обструктивного заболевания легких, болезни Крона, воспалительных заболеваний кишечника и язвенного колита. Тем не менее, применение глюкокортикоидов часто связано с возникновением острых, а иногда и необратимых побочных эффектов, таких как потеря костной ткани/остеопороз, гипергликемия, сахарный диабет, гипертония, глаукома, атрофия мышечных тканей, синдром Кушинга и психозы. Таким образом, существует необходимость в разработке альтернативных способов лечения, обеспечивающих положительное воздействие стероидных глюкокортикоидов,но обладающих пониженным риском развития или возникновения связанных с лечением побочных эффектов. Фармакологическое действие глюкокортикоидов обусловлено их способностью регулировать транскрипцию генов после образования комплекса с рецепторами глюкокортикоидов (РГ). Такой комплекс РГ-глюкокортикоид воздействует на транскрипцию генов через различные механизмы. Во-первых,после связывания глюкокортикоида, РГ, находящийся в составе комплекса, перемещается к ядру, где он действует как димер, связывающий элементы ДНК, чувствительные к глюкокортикоидным гормонам(GRE, ГЧЭ), находящиеся в промоторных областях определенных генов. После этого образованный комплекс РГ-глюкокортикоид/ГЧЭ активирует (трансактивация) или ингибирует транскрипцию близко расположенных генов. С другой стороны, комплекс РГ-глюкокортикоид может снижать транскрипцию гена согласно механизму, который не включает связывание с ДНК. В этом механизме, который называется трансрепрессией и имеет место после связывания глюкокортикоида, РГ в составе комплекса проникает в ядро, где он действует как мономер, непосредственно взаимодействуя (по механизму белок-белкового взаимодействия) с другими факторами транскрипции, подавляя их способность индуцировать транскрипцию гена и, таким образом, подавляя экспрессию белка. Кроме того, поиск лигандов для РГ, которые могли бы заменить стероидные глюкокортикоиды, затруднен тем, что и другие рецепторы стероидных гормонов, например рецептор андрогенов (РА), рецептор минералокортикоидов (РМ) и рецептор прогестерона (РП), которые являются медиаторами других физиологических процессов, имеют области связывания лигандов, гомологичные областям РГ. В результате, лиганды РГ могут обладать способностью к перекрестному реагированию с указанными рецепторами. Таким образом, заменитель стероидных глюкокортикоидов должен иметь более высокую аффинность связывания с РГ, чем связывания с рецепторами других стероидных гормонов. Недавние исследования показали возможность идентификации лигандов РГ, обладающих мощными противовоспалительными свойствами по сравнению с их способностью вызывать побочные эффекты,связанные с лечением глюкокортикоидами. Давно известно, что глюкокортикоиды подавляют эндогенную выработку белков воспаления, таких как интерлейкин-6 (IL-6) и фактор некроза опухолей альфа(TNF). Важно отметить, что, как ранее сообщали, действия лигандов, селективно воздействующих согласно механизму, независимому от связывания ДНК РГ, достаточно для лечения воспалительных заболеваний (Reichardt et al., EMBO J., 20: 7168-7173 (2001. Кроме того, ранее сообщали, что многие побочные эффекты терапии глюкокортикоидами (например, гипергликемия, сахарный диабет, глаукома и атрофия мышечной ткани), опосредованы механизмами трансактивации, которые вступают в действие после связывания РГ с ДНК (см. Shacke et al., Pharmacol.Therap., 96(1): 23-43 (2002. В связи с вышесказанным, особенно желательным представляется обнаружение агента, способного различать опосредуемую РГ трансрепрессию и опосредуемую РГ трансактивацию. Кроме того, особенно желательным также представляется обнаружение агента, проявляющего ограниченную способность к модулированию транскрипционной активности рецепторов других стероидных гормонов (т.е. агента, проявляющего свойства агониста, частичного агониста, частичного антагониста или антагониста). Таким образом, задачей настоящего изобретения является обеспечение агента, который связывается с РГ с большей аффинностью, чем с рецепторами других стероидных гормонов. Более конкретно, задачей настоящего изобретения является обеспечение агента, который связывается с РГ с аффинностью, в 30 раз большей, чем с РА, РМ и РП. Другой задачей настоящего изобретения является обеспечение агента, обладающего мощными противовоспалительными свойствами по сравнению с его способностью вызывать побочные эффекты, связанные с лечением глюкокортикоидами. Более конкретно, задачей настоящего изобретения является обеспечение агента, обладающего мощными противовоспалительными-1 014695 свойствами по сравнению с его способностью вызывать потерю костной ткани или остеопороз. Другой задачей настоящего изобретения является обеспечение агента, который бы проявлял ограниченную способность к модулированию активности рецепторов других стероидных гормонов. Трициклические модуляторы ГР известны в данной области. Например, в заявке WO 04/052847 описана группа модуляторов рецепторов трициклических стероидных гормонов, пригодных для лечения расстройств, чувствительных к модуляции рецепторов минералокортикоидов или глюкокортикоидов. В заявке WO 99/33786 описаны производные трифенилпропанамида, связывающиеся с рецептором глюкокортикоидов и обладающие противовоспалительными свойствами. Сущность изобретения Было обнаружено, что путем выбора одного из соединений, описанных в заявке WO 04/052847, которое ниже обозначено как соединение (I), был идентифицирован новый терапевтический агент, обладающий уникальным профилем активности, который позволяет предположить, что указанный агент особенно подходит для лечения воспалительных и иммунных расстройств, чувствительных к воздействию стероидных глюкокортикоидов. Соответственно настоящее изобретение относится к соединению (I) Е)-N-3-[1-(8-хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5 илиден)пропил]фенилметансульфонамид) или его фармацевтически приемлемой соли. В одном из конкретных примеров осуществления настоящее изобретение относится к соединению(I) в кристаллической форме. В другом примере осуществления настоящее изобретение относится к способу лечения воспалительного или иммунного расстройства, в частности ревматоидного артрита, включающему введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения (I) или его фармацевтически приемлемой соли. В другом примере осуществления настоящее изобретение относится к применению соединения (I) или его фармацевтически приемлемой соли для производства лекарственного средства для лечения воспалительного или иммунного расстройства, в частности ревматоидного артрита. Кроме того, настоящее изобретение относится к применению соединения (I) или его фармацевтически приемлемой соли в терапии. В другом примере осуществления настоящее изобретение относится к фармацевтической композиции, включающей соединение (I) или его фармацевтически приемлемую соль в сочетании с одним или несколькими фармацевтически приемлемыми носителями, наполнителями или разбавителями. В предпочтительном примере осуществления настоящее изобретение относится к фармацевтической композиции для лечения ревматоидного артрита, включающей соединение (I) или его фармацевтически приемлемую соль в сочетании с одним или несколькими фармацевтически приемлемыми носителями, наполнителями или разбавителями. Кроме того, настоящее изобретение также относится к новым промежуточным соединениям и способам синтеза соединения (I). Подробное описание изобретения Настоящее изобретение относится к соединению (I), которое обладает профилем активности, который делает его особенно подходящим для лечения воспалительных и иммунных расстройств, чувствительных к воздействию стероидных глюкокортикоидов. Как было показано исследованиями in vitro и invivo, соединение (I) связывается с РГ с большей аффинностью, чем с рецепторами других стероидных гормонов, и проявляет мощные противовоспалительные свойства, в сравнении с его способностью вызывать побочные эффекты, связанные с лечением глюкокортикоидами. Кроме того, соединение (I) проявляет лишь ограниченную способность модулировать активность рецепторов других стероидных гормонов,таких как РА, РМ и РП. Кроме того, как показано ниже, соединение (I) обладает дополнительными техническими преимуществами и полезными свойствами, необходимыми для решения других проблем, возникающих в отраслях, связанных как с лечением пациентов, так и фармацевтическими разработками. Настоящее изобретение также относится к применению соединения (I) для лечения воспалительных и иммунных расстройств, чувствительных к воздействию стероидных глюкокортикоидов. Неограничивающие примеры таких расстройств включают ревматоидный артрит, остеоартрит, ревматический полиартрит, астму, аллергический ринит, системную красную волчанку, хроническую обструктивную болезнь легких, болезнь Крона, воспалительные заболевания кишечника и язвенный колит. Расстройством, для-2 014695 лечения которого особенно подходит соединение (I), является ревматоидный артрит. Ревматоидный артрит (РА) представляет собой хроническое расстройство, характеризующееся стойким воспалением синовиальной ткани сустава и развивающееся в возрасте от 30 до 50 лет. РА представляет собой наиболее часто встречающуюся форму воспалительного артрита, которой согласно оценками страдает 0,8% мирового населения; при этом вероятность развития этого заболевания у женщин в два раза больше, чем у мужчин (Rindfleisch et al., Am. Fam. Physician, 72(6): 1037-1047 (2005. Применение соединения (I) для лечения воспалительных и иммунных расстройств также предположительно связано со снижением предрасположенности, вероятности развития или частоты побочных эффектов, обычно ассоциируемых с лечением глюкокортикоидами. Одним из таких побочных эффектов лечения глюкокортикоидами является потеря костной ткани/остеопороз или остеопороз, вызываемый глюкокортикоидами (ОПВГ). ОПВГ представляет собой наиболее распространенную причину остеопороза, вызываемого лекарственными препаратами и, как было показано, встречается у более чем 50% пациентов, подвергаемых хроническому (т.е. продолжающемуся более шести месяцев) лечению глюкокортикоидами (Feldstein et al., Osteoporos. Int., 16: 2168-2174 (2005. В частности, применение соединения(I) предположительно связано с пониженной предрасположенностью, вероятностью развития или частотой случаев потери костной ткани или остеопороза. Если не указано другое, настоящее изобретение включает фармацевтически приемлемые соли соединения (I), а также сольваты свободного основания соединения (I) или их фармацевтически приемлемые соли. В соответствии с настоящим описанием термин "фармацевтически приемлемая соль" относится к солям соединения (I), которые, по существу, не токсичны для живых организмов. Примеры фармацевтически приемлемых солей и способов их получения известны в данной области техники. См., например, Stahl et al., "Handbook of Pharmaceutical Salts: Properties, Selection and Use", VCHA/Wiley-VCH,(2002); Gould, P.L., "Salt selection for basic drugs", International Journal of Pharmaceutics, 33: 201-217 (1986);Process Research and Development, 4: 427-435 (2000). Особого упоминания заслуживают соли соляной кислоты, соли бромисто-водородной кислоты и полусульфаты (гемисульфаты); тем не менее, очевидно,что предпочтительным является использование свободного основания соединения (I). Как используется в настоящем изобретении термин "пациент" относится к человеку или млекопитающему, не являющемуся человеком, например к собаке, кошке, корове, обезьяне, лошади или овце. В частности, термин "пациент" относится к человеку. В соответствии с настоящим описанием термин "лечение (лечить)" (или "терапия") включает недопущение, предотвращение, сдерживание, замедление, остановку, обращение прогрессирования или тяжести симптома или расстройства. Соединение (I) или его фармацевтически приемлемую соль можно использовать для введения в виде компонента фармацевтической композиции. Таким образом, фармацевтические композиции, включающие соединение (I) или его фармацевтически приемлемую соль в сочетании с одним или несколькими фармацевтически приемлемыми носителями, наполнителями или разбавителями представляют собой важный вариант осуществления настоящего изобретения. Примеры фармацевтических композиций и способов их приготовления также хорошо известны в данной области техники. См., например, REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY, A. Gennaro, et al., eds., 19th ed., Mack Publishing (1995). Неограничивающие примеры композиций, включающих соединение (I), включают соединение (I) в суспензии с 1% натрий-карбоксиметилцеллюлозы, 0,25% полисорбата 80 и 0,05% антивспенивателя Antifoam 1510 (Dow Corning); соединение (I) в форме наносуспензии с 1% натрийкарбоксиметилцеллюлозы, 0,25% полисорбата 80 и 0,05% антивспенивателя Antifoam 1510 (Dow Corning); и соединение (I) в форме суспензии с 0,5% метилцеллюлозы, 1% лаурилсульфата натрия и 0,1% антивспенивателя Antifoam 1510 в 0,01 н. HCl. Некоторые примеры композиций, содержащих соединение(I), приведены ниже. Соединение (I) в составе раствора для перорального введения Например, 50,0 г гидроксипропилциклодекстрина (HPCD) (Roquette) добавляют в мензурку емкостью 500 мл, а затем добавляют приблизительно 400 мл воды для смачивания и смесь перемешивают при помощи магнитной мешалки в течение приблизительно 30 мин до растворения HPCD. К раствору НРCD добавляют 50,0 мг соединения (I), например, в микронизированной форме, смесь накрывают и продолжают перемешивание (приблизительно 2 ч) до растворения соединения. При перемешивании к смеси добавляют вкусовую добавку со вкусом мяты перечной (0,15 мл) и продолжают перемешивание до распределения добавки. Раствор переносят в мерную колбу и добавляют дополнительное коли-3 014695 чество воды для смачивания, доводя конечный объем до 500 мл. Соединение (I) в суспензионном носителе для перорального введения Например, 1,25 г Твин 80 (Fluka) добавляют в мензурку емкостью 500 мл, а затем добавляют 7,5 г гидроксипропилметилцеллюлозы (Methocel E5-LV, Colorcon) и 0,4 г натрий-сахарина (Sigma). В мензурку добавляют приблизительно 300 мл воды для смачивания, смесь накрывают и перемешивают на магнитной мешалке до полного растворения реагентов. В 100-мл мензурке взвешивают 50,0 г жидкого сорбита (Fluka), которую затем добавляют в раствор гидроксипропилметилцеллюлозы (мензурку емкостью 100 мл споласкивают водой и эту воду добавляют к раствору гидроксипропилметилцеллюлозы). При перемешивании к смеси добавляют вкусовую добавку со вкусом мяты перечной (0,15 мл), а затем 0,25 мл антивспенивателя Antifoam 1510 (Dow Corning) при постоянном перемешивании в течение приблизительно 10 мин. Раствор переносят в мерную колбу и добавляют дополнительное количество воды для смачивания, доводя конечный объем до 500 мл. Готовую основу для суспензии закупоривают во флаконы с закручивающимися пробками и хранят до момента использования. Для приготовления суспензии, содержащей соединение (I), сначала в чистый флакон добавляют требуемое количество соединения (I) (например, 1-200 мг, например, в микронизированной форме). Весь объем суспензионного носителя осторожно встряхивают, а затем 10 мл носителя добавляют во флакон,содержащий соединение (I). Затем флакон закупоривают и сильно встряхивают до размешивания соединения (I), затем отставляют приблизительно на одну минуту до начала использования. В качестве альтернативы, необходимое количество соединения (I) можно поместить в чистый флакон, содержащий 10 мл основы суспензии, после чего флакон встряхивают, как указано выше. Тем не менее, очевидно, что предпочтительная композиция согласно настоящему изобретению включает соединение (I) или его фармацевтически приемлемую соль в составе капсулы или таблетки. Соединение (I) или композиции, включающие соединение (I), можно вводить любым способом, который обеспечивает биодоступность соединения (I), включая пероральный и парентеральный способы. Например, соединение (I) или композиции, включающие соединение (I), можно вводить пероральным,подкожным, внутримышечным, внутривенным, трансдермальным, топическим, интраназальным, ректальным, буккальным и другими подобными путями. В качестве альтернативы, соединение можно вводить путем непрерывного вливания (инфузии). Тем не менее, очевидно, что предпочтительным способом введения является пероральный. Как используется в настоящем описании термин "эффективное количество" относится к количеству или дозе соединения (I), которые после однократного или многократного введения пациенту обеспечивает желаемое воздействие (эффект) на пациента, проходящего диагностику или лечение. Эффективное количество сможет определить специалист-диагност на основании ряда факторов, включающих вид млекопитающего, размер, возраст и общее состояние здоровья млекопитающего; конкретное заболевание; фазу или тяжесть заболевания; ответную реакцию конкретного пациента; конкретное вводимое соединение; способ введения; характеристики биодоступности вводимого препарата; выбранный режим дозирования; и применение сопутствующего медикаментозного лечения. В качестве неограничивающего примера типичного эффективного количества соединения (I) можно привести дозировку 1-200 мг/сутки. Биологическая активность Соединение (I) обладает особым профилем активности в испытаниях in vitro, который позволяет предположить, что соединение (I) особенно подходит для лечения воспалительных и иммунных расстройств, чувствительных к действию классических глюкокортикоидов. Например, при проведении анализа связывания меченных радиоизотопами лигандов на клетках HEK293, экспрессирующих РГ, РМ, РА и РП человека, соединение (I) связывалось с РГ с Ki менее приблизительно 0,50 нМ. Кроме того, соединение (I) связывается РГ с аффинностью, приблизительно в 30 раз большей, чем аффинность связывания с любым из РМ, РА и РП. При проведении всех анализов клеточной трансрепрессии, опосредуемой рецептором глюкокортикоидов, с использованием клеток-фибробластов кожи человека CCD-39 SK и моноцитов U937, соединение (I) действовало как мощный и эффективный транспрессор (приблизительно более 90% максимального ингибирования) эндогенной выработки IL-6 и TNF. Важно, что в функцио-4 014695 нальном анализе трансактивации, опосредуемой РГ, соединение (I) проявляет лишь частичную активность агониста (приблизительно менее 50% максимальной эффективности) в индуцировании транскрипции генов, опосредуемой РГ/ГЧЭ. Таким образом, соединение (I) демонстрирует дифференцированный профиль, т.е. индуцирует полную трансрепрессию, опосредуемую РГ, и лишь частично индуцирует трансактивацию, опосредуемую РГ/ГЧЭ. Кроме того, в исследованиях воздействия на функциональную модуляцию по отношению к рецепторам других стероидов, соединение (I) проявляет лишь ограниченную активность в модуляции экспрессии генов, опосредуемой РА, РМ и РП. В моделях как острого, так и хронического воспаления на животных, в которых сравнивали воздействие соединения (I) и стероидного глюкокортикоида, соединение (I) демонстрировало мощное противовоспалительное действие. Например, в опытах с крысами, у которых введением каррагенана вызывали острый отек лапы, пероральное введение соединения (I) замедляло развитие указанного острого отека пропорционально вводимой дозе соединения и также замедляло продуцирование интерлейкина-1-бета(IL-1) и цитокина, вырабатываемых в ходе воспалительной реакции. Эти результаты лучше результатов,полученных с использованием преднизолона, который в подобных условиях оказывает в 5 раз менее эффективное воздействие. С другой стороны, при исследовании в моделях образования костной ткани у животных соединение(I) проявляет меньшую способность к индуцированию РГ-опосредуемых эффектов на кость. Например, в анализе остеокальцина в сыворотке крови мышей, в котором сравнивали воздействие соединения (I) и преднизолона (в дозах, приблизительно равных ED50 для соединения (I) и преднизолона в исследовании воспаления у животных), было показано, что соединение (I) вызывает меньшее сокращение выработки остеокальцина сыворотки крови, который является признанным маркером формирования костей. Ниже описаны типичные процедуры проведения указанных анализов in vitro и in vivo на животных. В настоящем описании "Kd" обозначает равновесную константу диссоциации для комплекса лигандрецептор; Ki" обозначает равновесную константу диссоциации для комплекса лекарственное средстворецептор и является показателем концентрации лекарственного средства, которая связывается с половиной центров связывания в равновесии; IC50 обозначает концентрацию агента, которая соответствует 50% максимальной ингибирующей ответной реакции, возможной для указанного агента, или, в качестве альтернативы, обозначает концентрацию агента, обеспечивающую 50% замещение лиганда, связанного с рецептором; ЕС 50" обозначает концентрацию агента, которая соответствует 50% от максимальной ответной реакции, возможной для указанного агента; и ED50" обозначает дозу вводимого терапевтического агента, которая соответствует 50% от максимальной ответной реакции, возможной для указанного агента. Анализ связывания с ядерными рецепторами гормонов Для проведения анализа на конкурентное связывание типа рецептор-лиганд, проводимого с целью определения значений Ki, использовали лизаты клеток эмбриональных клеток почки человека HEK293,проявляющих сверхэкспрессию РГ человека (рецептора глюкокортикоидов), РА (рецептора андрогенов),РМ (рецептора минералокортикоидов) или РП (рецептора прогестерона). Вкратце, анализы на конкурентное связывание с рецепторами стероидов проводили в буферном растворе, содержащем 20 мМ буфера HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновой кислоты) (pH 7,6), 0,2 мМ ЭДТК, 75 мМ NaCl, 1,5 мМ MgCl2, 20% глицерина, 20 мМ молибдата натрия, 0,2 мМ ДТТ (дитиотреитола), 20 мкг/мл апротинина и 20 мкг/мл лейпептина. Обычно, анализы на связывание со стероидными рецепторами включают использование меченных радиоизотопами лигандов, например, для связывания с РГ используют 0,3 нМ [3 Н]-дексаметазон, для связывания с РА используют 0,36 нМ [3 Н]метилтриенолон, для связывания с РМ используют 0,25 нМ [3 Н]-альдостерон и для связывания с ПР используют 0,29 нМ [3H]-метилтриенолон, и, кроме того, на одну лунку добавляют либо 20 мкг лизата 293 РГ, либо 22 мкг лизата 293-РА, либо 20 мкг лизата 293-РМ, либо 40 мкг лизата 293-ПР. Обычно тесты проводят на 96-луночных планшетах. Тестируемые конкурирующие соединения добавляют в различных концентрациях, составляющих приблизительно от 0,01 нМ до 10 мкМ. Неспецифическое связывание определяют в присутствии 500 нМ дексаметазона в случае связывания с РГ, 500 нМ альдостерона в случае связывания с РМ или 500 нМ метилтриенолона в случае связывания с РА и ПР. Реакционные смеси для определения связывания (140 мкл) инкубируют в течение ночи при 4 С, затем в каждую реакционную смесь добавляют 70 мкл холодного буферного раствора, содержащего активированный уголь и декстран(который содержит 0,75 г активированного угля и 0,25 г декстрана 50 мл буфера для анализа). Планшеты встряхивают в течение 8 мин на орбитальном встряхивателе при 4 С. Затем планшеты центрифугируют при скорости 3000 об/мин при 4 С в течение 10 мин. Затем аликвоту реакционной смеси для анализа на связывание объемом 120 мкл переносят в другой 96-луночный планшет и в каждую лунку добавляют по 175 мкл сцинтилляционной жидкости Wallac Optiphase Hisafe 3. Планшеты запечатывают и активно встряхивают на орбитальном встряхивателе. После инкубации в течение 2 ч планшеты считывают на счетчике Wallac Microbeta. Полученные данные используют для расчета оценочной IC50 и процентного ингибирования при 10 мкМ. Значения Kd для [3 Н]-дексаметазона для связывания с РГ, для [3 Н]-метилтриенолона для связывания с РА, для [3 Н]-альдостерона для связывания с РА или [3 Н]-метилтриенолона для связывания с РП-5 014695 определяют связыванием с насыщением. Значения IC50 для соединений переводят в Ki, используя уравнение Ченга-Прюсова. Специалисту в данной области техники должны быть известны и другие протоколы проведения анализа связывания, аналогичные описанным выше. При проведении анализа по существу, как описано выше, соединение (I) демонстрирует следующий профиль связывания рецепторов.(значения Ki представляют собой среднее из 5 отдельных определений) Чтобы продемонстрировать способность соединений согласно настоящему изобретению к модулированию активности рецепторов стероидных гормонов (т.е. способности быть агонистом, частичным агонистом, частичным антагонистом или антагонистом), было проведено биотестирование, в ходе которого определяли функциональную модуляцию экспрессии целевого гена в клетках, временно трансфецированных белком-рецептором ядра и конструкцией "чувствительный к гормону элемент - репортерный ген" (hormone response element-reporter gene construct). Растворители, реагенты и лиганды, применяемые в функциональном анализе, можно легко получить в коммерческих организациях, либо их можно самостоятельно приготовить специалист в данной области техники. Анализ модуляции функции ядерных рецепторов гормонов Клетки почки эмбриона человека HEK293 трансфецировали рецептором стероидных гормонов и плазмидами репортерного гена, используя реактив для трансфецирования Fugene (Roche Diganostics). Коротко говоря, репортерную плазмиду, содержащую две копии пробазина АЧЭ (чувствительный к андрогену элемент 5'GGTTCTTGGAGTACT3' (SEQ ID NO:1 и промотор ТК (тимидин-киназы) в 3'-5'направлении (upstream) от кДНК репортера-люциферазы, трансфецировали в клетки HEK293, при этом плазмида конститутивно (постоянно) экспрессировала человеческий рецептор андрогенов (РА) при участии промотора вируса ЦМВ (цитомегаловирус). Репортерная плазмида, содержащая две копии ГЧЭ(чувствительный к глюкокортикоидам элемент 5'TGTACAGGATGTTCT'3 (SEQ ID NO:2 и промотор ТК в 3'-5'-направлении от кДНК репортера люциферазы, трансфецировали плазмидой, конститутивно экспрессирующей один из рецептора глюкокортикоидов человека (РГ), рецептора металлокортикоидов человека (РМ) или рецептора прогестерона человека (РП) при использовании вирусного промотера ЦМВ. Трансфецирование клеток производили в Т 150-см колбах в среде DMEM (модифицированная по Дульбекко среда Игла), содержащей 5% очищенной углем фетальной сыворотки крупного рогатого скота(ЭБС). После инкубации в течение ночи трансфецированные клетки трипсинизировали, помещали в 96 луночные планшеты, содержащие среду DMEM, включающую 5% очищенной углем ФБС, инкубировали в течение 4 ч и затем добавляют различные концентрации испытуемых соединений, составляющие приблизительно от 0,01 нМ до 10 мкМ. При исследованиях антагонистической активности в среду добавляют низкие концентрации агонистов каждого соответствующего рецептора (0,25 нМ дексаметазона для РГ, 0,3 нМ метилтриенолона для РА, 0,05 нМ промегестона для РП и 0,05 нМ альдостерона для РМ) и определяют способность испытуемого соединения антагонизировать ответную реакцию агониста. Инкубацию с испытуемыми соединениями производили в течение 24 ч, затем клетки лизировали и при помощи стандартных методик определяли активность люциферазы. Для определения значений ЕС 50 данные аппроксимировали четырехпараметрической логистической кривой. Определяли процентную эффективность (соединения, вызывающие максимальные ответы при насыщении) или максимальную процентную стимуляцию (соединения, вызывающие максимальные ответы в отсутствие насыщения) по отношению к максимальной стимуляции, полученной при использовании следующих стандартных агонистов: 100 нМ метилтриенолона для определения РА, 30 нМ промегестона для определения РП, 30 нМ альдостерона для определения РМ и 100 нМ дексаметазона для определения РГ. Значения IC50 можно определить аналогичным образом, при использовании данных анализа антагонистической активности. Также можно определить процентное ингибирование относительно ответной реакции в присутствии только агониста согласно методике, описанной выше. Специалисту в данной области техники должны быть известны способы проведения функциональных анализов модуляции ядерных рецепторов гормонов, аналогичные описанным выше. Путем анализа,по существу, в соответствии с процедурами, описанными выше, было обнаружено, что соединение (I) обладает следующим профилем активации транскрипции, опосредуемой РГ человека, РА человека, РМ человека и РП человека: н.о." показывает значения, превышающие 10 мкМ;процентная эффективность при 10 мкМ.(значения ЕС 50 и % эффективности представляют собой средние значения по 3 отдельным тестам).-6 014695 Исследование трансрепрессии, опосредуемой рецепторами глюкокортикоидов 1. Секреция IL-6 в фибробластах CCD-39SK человеческой кожи, происходящая под действием IL-1. Вкратце, клетки-фибробласты CCD-39SK кожи человека (20000 клеток/лунка), предоставленные американской коллекцией типовых культур (АТСС), Manassas, VA. USA (ATCCпо каталогу CRL1501) высевали в 96-луночные планшеты, заполненные средой SF-GM (MEM) (ATCC, номер по каталогу 30-20030), содержащей 10% эмбриональной бычьей сыворотки (ФБС), 100 Ед./мл пенициллина,100 мкг/мл стрептомицина и 2 ммол/л L-глутамина. Клетки выдерживали во влажной камере, содержащей 5% CO2, при 37 С. В лунки планшета добавляют различные концентрации тестируемых соединений,причем конечная концентрация составляла примерно от 4,65 пМ (пикомоль) до 4,64 мкМ. В качестве положительного контроля использовали 0,1 мкМ дексаметазона. Спустя один час после обработки тестируемым соединением, добавляют IL-1 в конечной концентрации, составляющей 1 нг/мл, и реакционную смесь инкубировали в течение ночи. Концентрации IL-6 измеряли при помощи набора ELISA (RD Systems, Inc., Minneapolis, MN, USA), используя стандартные методики. Вкратце, отбирали по 10 мкл надосадочной жидкости из каждой лунки и добавляют 90 мкл буферного раствора для анализа. КонцентрацииIL-6 определяли путем считывания интенсивности поглощения при 450 нм. Строили стандартную кривую зависимости поглощения от концентрации IL-6 и использовали ее для определения концентрацииIL-6 в экспериментальных образцах. 2. Секреция TNF- (фактора некроза опухолей-альфа) в клетках U937, дифференцированных в присутствии РМА (форбол-12-миристат-13-ацетат), происходящая под действием ЛПС (липосахаридов). Клетки-предшественники моноцитов человека U937 (АТССпо каталогу CRL-1593.2) выращивали в полной среде RPMI 1640 (АТССпо каталогу 30-2001), содержащей 10% фетальной бычьей сыворотки (ФБС). Для проведения дифференцировки моноцитов в прилипающие макрофаги клетки U937 промывали фосфатно-солевым буферным раствором (не содержащим кальция и магния) и повторно суспендировали в свежей среде RPMI, содержащей 20 нМ форбол-12-миристат-13-ацетата (РМА) в течение ночи. После проведения дифференцировки различные концентрации тестируемых соединений добавляют к клеткам, находящимся в 96-луночном планшете; концентрации составляли приблизительно от 4,65 пМ до 4,64 мкМ. После 1-часовой обработки тестируемым соединением добавляют ЛПС в конечной концентрации, составляющей 100 нг/мл, и инкубируют реакционную смесь в течение ночи. Секрецию TNF- определяли при помощи набора ELISA (RD Systems, Inc., Minneapolis, MN,USA), с использованием стандартных методик. Вкратце, 25 мкл не содержащей клеток надосадочной жидкости, переносили в другой 96-луночный планшет и добавляют 75 мкл буферного раствора для анализа. Количество TNF- определяли путем считывания поглощения при 450 нМ. Строили стандартную кривую зависимости поглощения от концентрации TNF- и использовали ее для определения концентрации TNF- в экспериментальных образцах. По существу, следуя процедурам, описанным выше, обнаружили, что соединение (I) вызывает приблизительно 90% или более максимального ингибирования эндогенной экспрессии IL-6 и TNF- при значениях EC50, составляющих приблизительно 4,8 и 30 нМ соответственно (данные анализа IL-6 представляют собой среднее по 22 отдельным измерениям; данные анализа TNF- представляют собой среднее по 6 отдельным измерениям). Животные модели 1. Отек конечности, вызванный действием каррагенана (ОВК, СРЕ). Каррагенаны представляют собой группу полисахаридов, которые вызывают у животных острую воспалительную реакцию. Основные признаки воспаления, включающие отек, повышенную чувствительность к боли и покраснение, развиваются на участке инъекции непосредственно после введения указанных веществ. Модель ОВК (Winter et al., Proc. Soc. Exp. Biol. Med. 111, 544-547, 1962) представляет собой общепризнанную модель развития воспаления, и ее можно использовать для оценки противовоспалительного действия лигандов рецепторов глюкокортикоидов. Для оценки противовоспалительного действия соединения (I) соединение (I) вводили в носитель,включающий 0,5% карбоксиметилцеллюлозы и 0,25% Твин 80, и затем вводили перорально через зонд самцам крыс Sprague-Dawley (180-200 г) (Harlan Industries, Indianapolis, IN.). Группе сравнения в том же носителе вводили перорально преднизолон. Спустя 2 ч в надплюсневую область задней конечности крысам вводили 1% каррагенан в 50 мкл 0,9% апирогенного солевого раствора. Спустя 3 ч после введения каррагенана крыс умерщвляли в атмосфере CO2. Конечности отделяли и взвешивали на микровесах. Затем конечности немедленно помещали в жидкий азот до полного замораживания. На замороженных конечностях делали несколько надрезов и центрифугировали для извлечения экссудатов. Затем в экссудате при помощи набора ELISA (RD Systems, Inc.,по каталогу RLB00) согласно стандартным методикам определяли концентрации IL-1, цитокина, выделяемого при развитии воспалительной реакции. Общий белок конечности измеряли при помощи набора для определения белка (Pierce Biotechnology, Inc., Rockford, IL., USA,по каталогу 1856210) и абсолютный уровень IL-1 нормализовали, в результате чего получали значение концентрации как нанограммы IL-1 мг общего белка. Соединение (I) ингибировало вызываемое каррагенаном увеличение массы конечности с концен-7 014695 трацией ED50, приблизительно равной 1,2 мг/кг. Соединение (I) также снижало уровни IL-1 в жидкости,выделяемой тканями (экссудате), с ED50, приблизительно равной 0,31 мг/кг. С другой стороны, введение преднизолона в данной схеме исследования ингибирует увеличение массы конечности с ED50, приблизительно равной 6,6 мг/кг, и снижает уровни IL-1 с ED50, составляющий приблизительно менее 1 мг/кг(значения ED50 представляют собой среднее по 5 отдельным измерениям). 2. Определение остеокальцина в сыворотке крови. Потери костной ткани/остеопороз и связанный с ними риск переломов является обычным и серьезным побочным эффектом, наблюдаемым при лечении глюкокортикоидами. Как полагают, остеопороз,вызываемый глюкокортикоидами, по меньшей мере, частично возникает из-за ингибирования образования костной ткани. Определение концентрации остеокальцина, который является биологическим показателем синтеза костной ткани, в сыворотке крови представляет собой общепризнанный способ установления вредного воздействия лечения глюкокортикоидами на костную ткань (см. Pearce et al., J. Clin. Endocrino. Metab. 83: 801-806 (1998. Для определения воздействия соединения на образование костной ткани соединение (I) вводили в носитель, включающий 5% карбоксиметилцеллюлозы и 0,25% Твин 80, и в течение семи суток вводили перорально через зонд 16-недельным самцам мышей Swiss-Web (Harlan Industries, Indianapolis, IN). Группе сравнения в том же носителе перорально вводили преднизолон. Сыворотку крови собирали спустя 24 ч после введения последней дозы, и определяли уровень остеокальцина в ней при помощи набора для конкурентного радиоиммунного анализа (РИА) (Biomedical Technologies, Inc., Stoughton, MA), адаптированного для 96-луночного формата. Вкратце, каждую лунку планшета типа Multiscreen (MAHVN45, Millipore, Bedford, MA), содержащую 2,5 мкл сыворотки крови мыши, 2,5 мкл антител козы против остеокальцина мыши, 0,625 мкл нормальной сыворотки крови козы и 119,375 мкл буфера РИА (0,1225 МNaCl, 0,01 М NaH2PO4, pH 7,4, 0,025 М тетранатриевой соли ЭДТК, 0,1% (мас./об.) бычьего сывороточного альбумина (BSA, БСА) и 0,1% (мас./об.) Твин-20) инкубировали при 4 С в течение 18 ч на орбитальном встряхивателе при скорости 80 об/мин. После добавления остеокальцина мыши, содержащего 0,2 мкКи/мл [125I] в 25 мкл буфера РИА в каждую лунку, планшеты инкубировали в течение 24 ч при 4 С на орбитальном встряхивателе при скорости 80 об/мин. Комплекс осаждали в течение 2 ч при 25 С путем добавления IgG осла к антителам козы (1:30) в 0,2 М Na2HPO4, pH 7,4, 5% (мас./об.) полиэтиленгликоля,125 мкл/лунка. Осадок собирали путем вакуумного фильтрования и один раз промывали 100 мкл/лунку дистиллированной Н 2 О. Прокалывали фильтры и измеряли радиоактивность на гамма-счетчике (Cobra II,Packard Instruments, Meriden, CT). Радиоактивность фильтров, на которых фильтровали пробы, была обратно пропорциональна концентрации остеокальцина в сыворотке. Для расчета концентрации остеокальцина в пробах использовали стандартную кривую для очищенного остеокальцина мышей. Сравнение суточных дозировок, приближающихся к значениям ED50, определенным в модели ОВК(1 мг/кг/сутки соединения (I) и 10 мг/кг/сутки преднизолона), показывает, что соединение (I) вызывает меньшее снижение уровней остеокальцина в сыворотке крови, чем преднизолон (концентрации остеокальцина в сыворотке крови представляют собой среднее по 6 отдельным измерениям). Как было установлено, соединение (I) имеет дополнительные технические эффекты или полезные свойства, которые отвечают другим ограничениям, существующим в области терапии пациентов и фармацевтических разработок. Например, соединение (I) продемонстрировало хорошую биодоступность и хорошее распределение в плазме после перорального введения подопытным животным. В дополнении,соединение (I) лишь незначительно метаболизируется при инкубации с культурой гепатоцитов человекаin vitro. Кроме того, профили метаболизма в плазме крови крыс, собак и обезьян, полученные после введения соединения (I) in vivo, показали, что соединение (I) является основной формой в кровеносной системе при отсутствии других метаболитов в плазме крови обезьян. Кроме того, определения генотоксичного потенциала, проведенные in vitro и in vivo, показали, что соединение (I) является не генотоксичным. С учетом этих и других свойств, можно полагать, что соединение (I) особенно подходит для лечения хронических воспалительных и иммунных расстройств, которые часто требуют хронического приема терапевтического агента. Кроме свойств, полезных для лечения пациентов, соединение (I) обладает дополнительными преимуществами, которые способствуют его применению в фармацевтике. Например, соединение (I) можно выделить в кристаллической форме. Очевидно, что кроме желательных биологических свойств, терапевтический агент должен обладать определенными физическими характеристиками. В частности, желательно применение стабильных кристаллических твердых веществ, поскольку с ними особенно удобно работать при проведении химического синтеза, очистки, хранения и введения в лекарственное средство или лекарственную форму. В настоящем описании термин "кристаллическая форма" относится к твердой форме химического вещества,которая имеет отчетливое кристаллическое строение, которое отличает данную твердую форму от других форм того же элементного состава. В настоящем описании термин "по существу чистая кристаллическая форма" относится к чистой кристаллической форме химического вещества, включающей приблизительно более 95% конкретной кристаллической формы, и предпочтительно приблизительно более 98% кон-8 014695 кретной кристаллической формы. Конкретную кристаллическую форму можно охарактеризовать и, таким образом, отличить от других твердых форм того же химического вещества при помощи традиционных методик, включающих рентгеновскую порошковую дифрактометрию (РПД), спектроскопические методы (например, инфракрасную (ИК) спектроскопию или ядерную магнитно-резонансную (ЯМР) спектроскопию) и термические методики (например, дифференциальную сканирующую калориметрию (ДСК), термогравиметрический анализ (ТГА) или дифференциальный термический анализ (ДТА. Несмотря на то что РПД является особенно полезным методом получения характеристик кристаллических форм химического вещества,следует понимать, что реальные интенсивности пиков на дифрактограмме в различных опытах с одной и той же кристаллической формой могут быть различными, в зависимости от конкретного анализируемого образца, прибора, растворителя или применяемой методики. Кроме того, следует понимать, что реальные положения пиков, полученные при анализе одной и той же кристаллической формы, выраженные в 2,могут быть различными в зависимости от конкретного опыта (например, 0,1), но при этом относительная картина местоположения пиков остается, по существу, одинаковой для всех спектров одной кристаллической формы. В соответствии с настоящим изобретением соединение (I) получают в кристаллической форме. Более конкретно, в соответствии с настоящим изобретением получают свободное основание соединения (I) в кристаллической форме, имеющей характеристические пики при 2, приблизительно равном. 10,9,18,8 и 22,9 (форма I в описанных ниже примерах). Кроме того, в соответствии с настоящим изобретением получают свободное основание соединения (I) в кристаллической форме, имеющей характеристические пики при 2, приблизительно равном 4,5, 9,0, 11,5 и 14,7 (форма II в описанных ниже примерах). Более конкретно, в соответствии с настоящим изобретением каждую из форм I и II соединения (I) получают, по существу, в кристаллической форме. Кроме того, соединение (I) негигроскопично и стабильно в условиях, включающих повышенную температуру, относительную влажность и освещение. Для специалиста в данной области также очевидно, что на растворение фармацевтического агентаin vivo, а, следовательно, и на его всасывание, влияет размер частиц фармацевтического агента. В соответствии с настоящим описанием термин "размер частиц" относится к диаметру частицы фармацевтического агента, определяемому при помощи традиционных методик, например, рассеяния лазерного света,лазерной дифракции, дифракции Ми, фракционирования потока в седиментационном поле, фотонной корреляционной спектроскопии и подобным им методикам. При низкой растворимости фармацевтических агентов малый или пониженный диаметр частиц может способствовать растворению, и, таким образом, увеличению всасывания агента (Amidon et al., Pharm. Research, 12; 413-420 (1995. Способы уменьшения или контролирования размера частиц (измельчения) традиционно известны и включают помол с использованием шаровой мельницы, штифтовой дробилки, вихревой мельницы, влажное измельчение и подобные им способы. Другой способ регулирования размера частиц включает приготовление фармацевтического агента в виде наносуспензии. Было обнаружено, что химический синтез соединения (I) приводит к получению кристаллических частиц определенного размера. В частности, образцы свободного основания соединения (I), приготовленные, по существу, в соответствии с примером 1(а), описанным ниже, имеют средний размер частиц,составляющий менее 20 мкм, и размер d90 частиц (т.е. 90% всех частиц имеют размер d90 или менее), составляющий менее 50 мкм (размер частиц определяли при помощи лазерного дифракционного анализатора размера частиц Beckman Coulter LS13 320). Кроме того, измельченные образцы свободного основания соединения (I), приготовленные, по существу, в соответствии с примерами 6 и 7, описанным ниже,имеют размер x50 частиц (т.е. 50% всех частиц имеют размер х 50 или менее), составляющий менее 10 мкм, и размер х 90 частиц (т.е. 90% всех частиц имеют размер х 90 или менее), составляющий менее 20 мкм (размер частиц определяли при помощи лазерного дифракционного анализатора размера частицSympatec (система HELOS для анализа размера частиц. Таким образом, один из конкретных примеров осуществления настоящего изобретения относится к свободному основанию соединения (I) или фармацевтической композиции, включающей свободное основание соединения (I), в которой средний размер частиц соединения (I) составляет менее 20 мкм и размер d90 частиц составляет менее 50 мкм. Более конкретный пример осуществления относится к свободному основанию соединения (I) или фармацевтической композиции, включающей свободное основание соединения (I), в которой средний размер частиц соединения (I) составляет менее 15 мкм и размер d90 частиц составляет менее 40 мкм. Еще более конкретный пример осуществления относится к свободному основанию соединения (I) или фармацевтической композиции, включающей свободное основание соединения (I), в которой средний размер х 50 частиц соединения (I) составляет менее 10 мкм и размер x50 частиц составляет менее 20 мкм. Еще более конкретный пример осуществления относится к свободному основанию соединения (I) или фармацевтической композиции, включающей свободное основание соединения (I), в которой средний размер х 50 частиц соединения (I) составляет менее 5 мкм и размер х 90 частиц составляет менее 15 мкм. Кроме того, в приведенных ниже примерах описано получение соединения (I) в виде наносуспензии. Способы получения соединения (I) известны в данной области техники. Например, в WO 04/052847-9 014695 описаны общие процедуры, которые можно применять для этой цели. Кроме того, в WO 05/066161 описаны дополнительные общие процедуры, которые можно использовать для этой цели. Приведенные ниже схемы, промежуточные соединения и примеры также иллюстрируют настоящее изобретение и представляют собой типичные способы синтеза соединения (I). Реактивы и исходные материалы легко доступны, их также сможет синтезировать специалист в данной области техники. Следует понимать, что приведенные ниже схемы, промежуточные соединения и примеры показаны лишь для иллюстрации настоящего изобретения, а не с целью ограничения области его применения, и что специалист в данной области техники сможет осуществить различные изменения и модификации. В соответствии с настоящим описанием ДМСО" означает диметилсульфоксид; DIAD" - диизопропилазодикарбоксилат; ADDP" - 1,1'-(азодикарбонил)дипиперидин; ТГФ - тетрагидрофуран; ДМФА" - диметилформамид; TMSCN - триметилсилилцианид; ТЭА" или Et3N - триэтиламин; ДМЭ - 1,2-диметоксиэтан; AcOEt" - этилацетат; "pyr" - пиридин; "MsCl" - метансульфонилхлорид; На схеме I описано получение промежуточных пиридиновых соединений (5), (6) и (7). Схема I, стадия 1: 3-бромпиридин (1) окисляют до 3-бромпиридин-N-оксида (2). Схема I, стадия 2: замещение цианидом приводит к получению 3-бромпиридин-2-карбонитрила (3). Нитрил формулы (3) гидролизуют на стадии 3 с получением карбоновой кислоты и этерифицируют с применением кислотного катализатора с получением сложного эфира формулы (4). Схема I, стадия 4: полученный сложный эфир восстанавливают до пиридинилметанола, отвечающего формуле (5), с использованием боргидрида натрия. Полученный пиридинилметанол превращают в мезилат формулы (6) с использованием метансульфонилхлорида (стадия 5) или в пиридинилметилхлорид формулы (7) с применением тионилхлорида (стадия 6). Схема II На схеме II описан синтез целевого бензопиридил-10-оксепина соединения I. Схема II, стадия 1: проводят модифицированную реакцию Зандмайера, в результате которой анилин формулы (8) превращается в 5-хлор-2-йодфенол формулы (9). На схеме II, стадия 2: реакция Мицунобу между 5-хлор-2-йодфенолом и пиридинилметанолом формулы (5) приводит к образованию йодарилового эфира, отвечающего формуле (10). Другие подходящие реагенты включают DIAD и трифенилфосфин в ТГФ. В качестве альтернативы, на стадии 3 йодариловый эфир формулы (10) обрабатывают, производя алкилирование пиридинметилмезилатом или хлоридом формулы (6) или (7), с использованием основания, например трет-бутоксида натрия, трет-бутоксида калия или карбоната калия, в инертном растворителе, например ТГФ или ацетонитриле. Схема II, стадия 4: йодариловый эфир формулы (10) обрабатывают 1-бутином, проводя реакцию Сонагаширы, в результате чего получают алкинилариловый эфир формулы (11). Указанную реакцию проводят в смеси диэтиламина/ацетонитрила/ТГФ и барботируют в реакционную смесь 1-бутин. В качестве альтернативы, реакцию проводят, применяя в качестве основания триэтиламин, и обрабатывают 24 мас.% раствором 1-бутина в ДМФА. В соответствии со схемой II, стадии 5 и 6, диборонирование алкиниларилового эфира формулы (11) в присутствии платинового катализатора приводит к получению сложного диэфира борной кислоты формулы (12), который в результате внутримолекулярного сочетания по Сузуки дает винилборный сложный эфир формулы (13). Схема II, стадия 7: межмолекулярное сочетание по Сузуки между винилбороновым сложным эфиром (13) и 3-йоданилином позволяет получить анилин формулы (14). Для облегчения очистки полученного анилина формулы (14) анилин можно обработать подходящей кислотой с образованием соли. Например, полученный анилин формулы (14) может быть обработан толуолсульфоновой кислотой с получением анилина формулы (14) в виде соли дитолуолсульфоновой кислоты. В соответствии со схемой II, стадия 8, полученный анилин сульфонилируют метансульфонилхлоридом с образованием целевого бензопиридил-10-оксепина соединения (I). В качестве альтернативы, в соответствии со схемой II, стадией 9, бензопиридил-10-оксепин соединения (I) получают непосредственно, проводя реакцию Сузуки с N-(3-йодфенил)метансульфонамидом. Соединение (I) может быть очищено перекристаллизацией из, например, метанола. Схема IIa- 11014695 На схеме IIa описан альтернативный синтез алкиниларилового эфира формулы (11). На схеме IIa, стадия 1: осуществляют защиту 5-хлор-2-йодфенола формулы (9) с получением тетрагидропиранового (ТГП) эфира формулы (9 а). Реакцию проводят в инертном растворителе, например дихлорметане, в присутствии кислотного катализатора, например п-толуолсульфоната пиридиния. 3,4 Дигидро-2H-пиран добавляют при температуре, равной приблизительно 30 С или ниже, и затем реакцию проводят в течение от 10 до 24 ч приблизительно при комнатной температуре. На схеме IIa, стадия 2: йодбензол формулы (9 а) обрабатывают 1-бутином по реакции Сонагаширы с получением алкинилбензола формулы (9b). Реакцию проводят, используя триэтиламин, инертный растворитель,например этилацетат,и палладиевый катализатор,например дихлор-бис(трифенилфосфин)палладий(II) и йодид меди (I). 1-Бутин добавляют при температуре приблизительно от 0 до 10 С и реакцию проводят в течение приблизительно от 10 до 24 ч, приблизительно при комнатной температуре. После обработки продукт можно очистить путем хроматографии на силикагеле и перекристаллизации из гептана/триэтиламина. На стадии 3 снимают защиту с ТГП эфира формулы (9b), используя кислотные условия, и получают алкинилфенол формулы (9 с). В частности, для создания нужных условий используют каталитическое количество минеральной кислоты, например соляной кислоты, в спиртовом растворителе, например метаноле. Реакцию проводят в течение времени, составляющего от 30 мин до 6 ч при температуре, составляющей от 0 С до комнатной температуры. На схеме IIa, стадия 4: алкинилфенол формулы (9 с) алкилируют пиридинметилмезилатом формулы(6) с использованием основания, например трет-бутоксида натрия, трет-бутоксида калия или карбоната калия в инертном растворителе, например ТГФ или ацетонитриле. Для создания нужных условий используют, например, трет-бутоксид натрия в ТГФ, который добавляют к раствору мезилата и фенола при температуре ниже 0 С, и затем перемешивают при комнатной температуре в течение времени, составляющего от 24 до 72 ч. После экстракционной обработки продукт перекристаллизовывают из этанола. Схема III- 12014695 На схеме III описан альтернативный синтез целевого бензопиридил-10-оксепина соединения (I). На схеме III, стадия 1, реакция Сонагаширы между триметилсилил(ацетиленом) и 3-йоднитроанилином формулы (15) приводит к получению триметилсилилалкина формулы (16), который после десилилирования превращают в алкин формулы (17) в соответствии со схемой III, стадия 2. На схеме III, стадия 3, используя типичные условия реакции Сонагаширы, проводят реакцию соединения (17) с пиридинилметанолом формулы (18), в результате чего получают диарилалкин формулы(19). Схема III, стадия 4, реакция Мицонобу, между диарилалкином (19) и 5-хлор-2-йодфенолом формулы (9) приводит к получению биарилалкинилйодарилового эфира формулы (20). Типичные условия включают использование трифенилфосфина и DIAD в метиленхлориде. Схема III, стадия 5, биарилалкинилйодарил (20) превращают в пиридилоксепин формулы (21) в присутствии тримерного винилборного ангидрида посредством катализируемой палладием внутримолекулярной каскадной реакции Хека-Сузуки. Оптимизированные условия включают медленное добавление борного ангидрида к смеси биарилалкинилйодарила (20), 2 мол.% ацетата палладия (II), 2 эквивалента карбоната натрия в смеси 4:1 (объемн.) ДМЭ:вода при 90 С. На схеме III, стадия 6, однореакторное гидрирование на Pd/C двойной связи и нитрогруппы пиридилоксепина (21) приводит к получению анилина формулы (14). В соответствии со схемой III, стадия 7,полученный анилин сульфонилируют метансульфонилхлоридом в присутствии пиридинового основания с получением целевого бензопиридил-10-оксепина соединения (I). Инструментальный анализ Исследования методом газовой хроматографии-масс-спектрометрии (ГХ-МС) (GC-MS) можно провести на приборе HP 6890 Series GC-MS (70 эВ), снабженном капиллярной колонкой Agilent размерами 0,25-мм 15-м 0,25 мкм, с использованием температурного программирования (подъем 60-280 С в течение 7,3 мин, затем 280 С в течение 2 мин). Исследования методом жидкостной хроматографии и массспектрометрии (ЖХ-МС) (LC-MS) можно проводить на приборе Agilent 1100 Series HPLC с использованием колонки Waters Xterra MS C18 размерами 4,6-мм 50-мм 3,5-мкм и химической ионизации при атмосферном давлении (APCI). Обычно исследования проводят, используя градиент, составляющий от 80% смеси метанол/вода до 100% метанола. В качестве альтернативы анализ ЖХ-МС можно проводить на колонке Waters XTerra C18 2,150 мм 3,5 мкм и с применением ионизации электрораспылением. Система растворителей представляет собой 5-100% ацетонитрил/МеОН (50/50) с добавлением 0,2% формиата NH4. Спектры 1 Н ЯМР можно получить на спектрометре Varian 400 МГц при температуре окружающей среды. Данные представлены в следующем виде: химические сдвиги выражены в миллионных долях(м.д.) по отношению к внутреннему стандарту (татраметилсилан) на шкале , расщепление (ушир = широкий, с = синглет, д = дублет, т = триплет, кв = квартет, квн = квинтет и м = мультиплет), интегрирование, константа взаимодействия (Гц) и соотнесение. Рентгеновские порошковые дифрактограммы (РПД) могут можно получить на порошковом дифрактометре Bruker D8 Advance XRPD, снабженным источником CuK (=1,54056 ангстрем) и электронным твердофазным детектором, работающим при 40 кВ и 40 мА. Каждый образец сканируют в диапазоне от 4 до 40 в пределах 2, при шаге, равном 0,02, в диапазоне 2, и скорости сканирования, равной 3 с/шаг, при контролируемой изменяемой ширине (v12) дивергенционной и принимающей щелей, а также при ширине щели детектора, равной 0,2 мм. В качестве альтернативы, рентгеновский порошковый дифракционный анализ (РПД) можно провести на дифрактометре Bruker D8 Advance при сканировании образцов в интервале между 2 и 45 в пределах 2, при размере шага, равном 0,02 в пределах 2, и скорости сканирования, равной 5 с/шаг, со следующими параметрами: 0,6-мм дивергенционной щелью, 0,6-мм противорассеивающей щелью, 0,1-мм принимающей щелью и 0,6-мм щелью детектора. Дифференциальную сканирующую алориметрию (ДСК) можно осуществить на установке Mettler-Toledo DSC (Model 822). Образцы нагревают в закрытых алюминиевых чашках, в которых проделано маленькое отверстие, поднимая температуру от 30 до 300 С при скорости 5 С/мин и продувке азотом со скоростью 50 мл/мин. Дифференциальный термический анализ (ДТА) и термогравиметрический анализ (ТГА) можно выполнять на установках Mettler Toledo DTA и TGA (ModelTGA/SDTA 851). Образцы нагревают в закрытых алюминиевых чашках, в которых проделано маленькое отверстие, поднимая температуру от 25 до 300-350 С при скорости 10 С/мин и продувке азотом со скоростью 50 мл/мин. Температуру ТГА калибруют при помощи стандарта алюминий/индий, т.пл.=156,6 и 660,3 С. Массовую калибровку производят при помощи стандартов, прилагаемых поставщиком, и проверяют при помощи десольватации безводного цитрата натрия. Названия соединений, получаемых согласно настоящему изобретению, получают с помощью программы ChemDraw Ultra, версия 7.0.1. 2-Амино-5-хлорфенол (5,7 г, 40 ммоль) растворяли в смеси ДМСО/вода/H2SO4 (200/60/140 мл) и охлаждают до 0 С. К полученному раствору добавляют нитрит натрия (4,1 г, 60 ммоль) в воде (20 мл) и смесь перемешивают в течение 1 ч при 0 С. К полученной смеси добавляют йодид калия (19,9 г, 120 ммоль) в воде (20 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют еще одну часть йодида калия (19,9 г, 120 ммоль) в воде (20 мл) и смесь перемешивают при комнатной температуре в течение 1 ч. Смесь разбавляли этилацетатом, промывали водой, насыщенным водным раствором сульфата натрия и рассолом. Органическую часть сушили на MgSO4, фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали испарительной хроматографией (BiotageSi65M, 20% этилацетат/гексан) с получением 8,09 г (79%) указанного в заголовке соединения в виде розового твердого вещества. ГХ-МС m/e 254 [М]-. Альтернативная процедура. Трехгорлую круглодонную колбу емкостью 50 л оснащали механической мешалкой, капельной воронкой, вводом для азота, осушительной трубкой и термопарой и помещали в охлаждающую баню. В колбу загружают воду (4,5 л), запускают мешалку и охлаждают реакционную смесь до 0 С. В смесь по каплям добавляют серную кислоту (3,7 л), поддерживая температуру 30 С. Затем в колбу загружали 2 амино-5-хлорфенол (1500 г), поддерживая температуру 30 С в течение 20 мин. Затем добавляют по каплям ДМСО (12 л), поддерживая температуру 30 С в течение одного часа. Реакционную смесь охлаждают до температуры, равной от -5 до 0 С. В смесь по каплям добавляют раствор нитрита натрия (1082 г) в воде (6 л), поддерживая температуру 0 С в течение 1 ч и 45 мин. По завершении добавления реакционную смесь перемешивают в течение как минимум 1 ч при температуре, составляющей 0 С. Трехгорлую круглодонную колбу емкостью 50 л оснащают механической мешалкой, капельной воронкой, вводом для азота, осушительной трубкой и термопарой и помещают в нагревательную рубашку. В колбу загружают йодид калия (6,9 кг) и воду (7,5 л), запускают мешалку, и реакцию нагревают до температуры,составляющей от 48 до 50 С. Затем в колбу порциями загружают раствор диазотирования 2-амино-5 хлорфенола, поддерживая температуру от 48 до 50 С, используя два конденсатора для отвода газов. Реакционную смесь нагревают в течение 2 ч при температуре от 48 до 50 С. Спустя указанное время, нагревание прекращают, и реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Протекание реакции отслеживают по данным ТСХ (гептан:EtOAc, 9:1). Исходный продукт наблюдают при Rf=0,3, а продукт при Rf=0,6. Реакцию считают завершенной после исчезновения пятна исходного материала. По завершении реакции, реакционную смесь разбавляют МТВЕ (16 л) и перемешивают в течение 20 мин. Реакционную смесь переносят в делительную воронку, и органический слой отделяют от водного слоя. Органический слой промывают раствором Na2S2O3 (3 кг) и водой (12 л) и перемешивают в течение 5-10 мин. Органический слой отделяют, и ту же процедуру промывания повторяют еще два раза. Органический слой отделяют от водных слоев, и все промывные воды отбрасывают. Органический слой промывают насыщенным водным раствором бикарбоната натрия (4 л). Органический слой отделяют от водного слоя, и органический слой промывают рассолом (4 л). Органический слой отделяют и сушат над сульфатом магния, обрабатывают углем, фильтруют и концентрируют. Полученный остаток испаряют совместно с гептаном (1 л), используя масляный насос для удаления остаточных растворителей. Оставшееся коричневое масло (2880 г) растворяют в гептане (1 мл/г), и раствор помещают на ночь в холодильник. Твердые вещества отделяют фильтрованием, промывают холодным гептаном(2600 мл, 0 С) и сушат в вакуумном шкафу при температуре окружающей среды в течение ночи. Получают желтоватые твердые вещества. Промежуточное соединение 2. 3-Бромпиридин 1-оксид Метилтриоксорений (100 мг, 0,401 ммоль) растворяют в дихлорметане (40 мл) и добавляют 3 бромпиридин (15,8 г, 100 ммоль), а затем 30% водный Н 2 О 2 (22,7 мл). Двухфазную смесь перемешивают при комнатной температуре. Спустя 18 ч добавляют MnO2 (25 мг, 0,29 ммоль) и смесь перемешивают при комнатной температуре в течение 2 ч. Смесь экстрагируют дихлорметаном и объединенные экстракты промывают рассолом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении с получением 9,52 г (55%) указанного в заголовке соединения в виде оранжевого масла. ГХ-МС m/е 174 [М-Н]-.- 14014695 Альтернативная процедура. Трехгорлую круглодонную колбу емкостью 22 л оснащают механической мешалкой и термопарой. В колбу загружают 3-бромпиридин (3169 г, 20 моль), дихлорметан (8,2 л) и метилтриоксорений (10 г). Реакционную смесь охлаждают до 18 С, используя баню с холодной водой из-под крана, и порциями,приблизительно в течение 15 мин, добавляют 30% водный раствор пероксида водорода (3,07 л, 30 моль). Реакция слегка экзотермична, так что для поддержания температуры, составляющей 20-25 С, в охлаждающую баню добавляют лед. Реакционную смесь оставляют при перемешивании в течение ночи в бане при комнатной температуре (баню не снимают). Протекание реакции отслеживают по данным ТСХ (гептан:EtOAc, 1:1). Наблюдали, что исходный 3-бромпиридин показывает Rf=0,6, а продукт Rf=0,1. Следы исходного материала могут присутствовать даже после перемешивания, продолжающегося в течение ночи, и реакционную смесь либо обрабатывают, либо перемешивают еще в течение 8-24 ч. Как только реакцию считают завершенной, добавляют небольшими порциями диоксид марганца (31 г, 10 мкм) со скоростью, позволяющей контролировать вспенивание и поддерживать температуру равной 20-25 С. Если температура повышается, то в воду охлаждающей бани может быть добавлен лед. Если наблюдается вспенивание, то может быть добавлено дополнительное количество диоксид марганца. Если после добавления свежей порции диоксида марганца вспенивание не наблюдается, то добавляют твердый хлорид натрия (860 г) и реакционную смесь перемешивают еще в течение 30 мин при комнатной температуре. Реакционную смесь переносят в делительную воронку, и органический слой отделяют. Водный слой экстрагируют дихлорметаном (32,5 л). Вещества, экстрагированные из каждого органического слоя,могут быть подвергнуты мониторингу с использованием ТСХ. Если после последней экстракции присутствует продукт, то водный слой может быть профильтрован, затем может быть добавлено дополнительное количество хлорида натрия (500 г), с последующим перемешиванием до полного растворения соли. Затем водный слой экстрагируют дихлорметаном (32 л). Объединенные органические растворы сушат над сульфатом магния, фильтруют и концентрируют. В колбе остается бледно-желтое масло. Этот продукт может быть непосредственно использован для приготовления 3-бромпиридин-2-карбонитрила. Промежуточное соединение 3. 3-Бромпиридин-2-карбонитрил 3-Бромпиридин-1-оксид (9,4 г, 54 ммоль) растворяют в ацетонитриле (60 мл) и добавляют триэтиламин (15 мл), а затем триметилсилилцианид (21,7 мл, 163 ммоль). Полученную смесь нагревают до температуры, составляющей 100 С, и перемешивают в течение 16 ч. Смесь охлаждают до 0 С, выливают в 250 мл 5 М водного NaOH и экстрагируют дихлорметаном. Объединенные экстракты промывают рассолом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Полученный продукт очищают испарительной хроматографией (Biotage Si65M, 20% этилацетат/гексан) с получением 7,8 г(79%) указанного в заголовке соединения в виде желтого вещества. ГХ-МС m/e 182, 184 [M]-. Альтернативная процедура. Трехгорлую круглодонную колбу емкостью 50 л оснащают механической мешалкой, термопарой,вводом для азота, эффективным обратным холодильником и осушительной трубкой (во время добавления триметилсилилцианида осушительную трубку не используют). В колбу загружают 3778 г (приблизительно 20 моль) сырого 3-бромпиридин-N-оксида (приготовленного, например, практически, как описано в альтернативной процедуре для промежуточного соединения 2), ацетонитрил (19 л) и триэтиламин(6,667 л, 50 моль). Реакционную смесь нагревают до температуры слабого кипения, составляющей приблизительно 70-73 С, а затем через капельную воронку добавляют чистый триметилсилилцианид (6,667 л, 50 моль) в течение 10-15 мин интервалов, всего в течение 3 ч. После добавления каждой порции триметилсилилцианида реакция начинает бурно кипеть (при испарении паров для завершения реакции может понадобиться дополнительное количество триметилсилилцианида). После завершения добавления реакционную смесь перемешивают при кипячении в течение 20 ч, подбирая скорость нагревания так,чтобы поддерживать кипение. Протекание реакции отслеживают по данным ТСХ (гептан:EtOAc 1:1). Когда реакцию считают завершенной, реакционную смесь охлаждают до 0-10 С. Затем в течение 30 мин добавляют струей 50% водный раствор NaOH (7,2 кг) в воде (9 л), что приводит к разогреванию. Температура поднимается до 20-25 С, и реакционную смесь перемешивают в течение 30 мин при 15-25 С. Реакционную смесь переносят в делительную воронку и отделяют органический слой. Органический слой промывают рассолом (4 л) и объединенные водные слои экстрагируют EtOAc (33 л). Объединенные органические слои промывают рассолом (3 л), обрабатывают углем, сушат над сульфатом магния,фильтруют и концентрируют. Полученные твердые вещества (приблизительно 3,8 кг) растворяют вEtOAc (25 л, при некотором нагревании), сушат над сульфатом магния, обрабатывают углем, фильтруют и концентрируют. Полученные желтоватые/коричневые твердые вещества растворяют в этаноле (7 л) при нагревании. Полученный раствор переносят в чашку и оставляют при комнатной температуре на ночь.- 15014695 Спустя указанное время, твердые вещества отделяют фильтрованием и промывают холодным этанолом на фильтре (21 л, -20 С). Твердые вещества растворяют в EtOAc (от 20 до 25 л), раствор сушат над сульфатом магния, обрабатывают углем для обесцвечивания и затем фильтруют. Осадок на фильтре промывают EtOAc (22 л), фильтраты объединяют и концентрируют досуха. Оставшиеся твердые вещества (2,7 кг) испаряют совместно с EtOH (1 л). Затем твердые вещества растворяют в EtOH (6 л) при нагревании. Прозрачный раствор образуется приблизительно при 70 С, и раствор затем охлаждают до 05 С и перемешивают в течение 2 ч при этой температуре. Твердые вещества отделяют фильтрованием,промывают холодным этанолом (21 л, 0-5 С) и затем гептаном (1 л, 0-5 С) и сушат в вакуумном шкафу при 40 С. Промежуточное соединение 4. Метиловый эфир 3-бромпиридин-2-карбоновой кислоты 3-Бромпиридин-2-карбонитрил (14,7 г, 80,3 ммоль) растворяют в концентрированной HCl (50 мл) и нагревают до 110 С в течение 18 ч. Смесь охлаждают до 0 С, фильтруют, промывают небольшим количеством эфира и сушат в сушильном шкафу при пониженном давлении. Полученное коричневое твердое вещество растворяют в метаноле (80 мл), добавляют по каплям концентрированную H2SO4(6,6 мл) и раствор нагревают до 90 С в течение 16 ч. Метанол удаляют при пониженном давлении, добавляют насыщенный водный раствор бикарбоната натрия до получения основного рН и смесь экстрагируют этилацетатом. Объединенные экстракты промывают рассолом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении с получением 12,8 г (74%) указанного в заголовке соединения в виде белого твердого вещества. ГХ-МС m/е 215, 217 [М]-. Альтернативная процедура. Трехгорлую круглодонную колбу емкостью 50 л оснащают механической мешалкой, термопарой,вводом для азота и обратным холодильником. В колбу загружают HCl (20 л) и 3-бромпиридин-2 карбонитрил (6790 г, 37,1 моль) (приготовленный, например, практически, как описано в альтернативной процедуре для промежуточного соединения 3). Реакционную смесь нагревают до кипения, исходный продукт растворяется, и образуется розовая суспензия. Реакционную смесь перемешивают при кипячении в течение 20 ч. Протекание реакции отслеживают по данным ТСХ (гептан:EtOAc, 1:1). Исходный продукт отсутствует при Rf=0,5, и промежуточный амид отсутствует при Rf=0,15. Когда реакцию считают завершенной, реакционную смесь охлаждают до 0-5 С и затем перемешивают при этой температуре в течение 3 ч. Спустя указанное время, твердые вещества отделяют фильтрованием (не промывать и отжимать на фильтре). Полученное твердое вещество (3-бромпиридин-2-карбоновая кислота) сушат в вакуумном шкафу при 50 С с использованием соответствующей ловушки, поскольку во влажном продукте присутствует HCl. Трехгорлую круглодонную колбу емкостью 50 л оснащают механической мешалкой, термопарой и обратным холодильником. В колбу загружают МеОН (25,5 л) и 3-бромпиридин-2-карбоновую кислоту (5,098 кг), а затем HCl (15 мл). Реакционную смесь нагревают до температуры кипения, приблизительно составляющей 64-65 С, и перемешивают при этой температуре в течение 9 ч. Реакционную смесь оставляют охлаждаться до 40-50 С и затем концентрируют до получения пасты. В делительную воронку емкостью 50 л загружают воду (12 л) и твердый NaHCO3 (2338 г) и смесь перемешивают в течение 10-15 мин. Остаток от концентрированной пасты добавляют порциями к перемешиваемому раствору бикарбоната натрия с такой скоростью, чтобы контролировать вспенивание. После добавления всего остатка в воронку загружают EtOAc (10 л) и перемешивают в течение 10-15 мин. Водный слой отделяют и органический слой промывают насыщенным водным раствором бикарбоната натрия (1 л), затем сушат над сульфатом магния, фильтруют и концентрируют. Объединенные водные слои экстрагируют EtOAc(22 л) и объединенные органические слои промывают насыщенным водным раствором бикарбоната натрия (1 л), затем сушат над сульфатом магния, фильтруют и концентрируют вместе с первым экстрактом. Получают бледно-желтое масло, которое затвердевает при охлаждении. Полученный продукт сушат в вакуумном шкафу в течение ночи при комнатной температуре. Промежуточное соединение 5. Метиловый эфир 3-бромпиридин-2-карбоновой кислоты (12,8 г, 5 9,2 ммоль) растворяют в метаноле (150 мл) и охлаждают до 0 С. К полученной смеси добавляют NaBH4 (11,2 г, 296 ммоль) порциями по 1,0 г. Смесь нагревают до комнатной температуры и перемешивают в течение 3 ч. Метанол удаляют при пониженном давлении, добавляют этилацетат, и раствор промывают насыщенным водным раствором хлорида аммония и рассолом. Органическую часть сушат над MgSO4, фильтруют и концентрируют при- 16014695 пониженном давлении с получением 6,8 г (62%) указанного в заголовке соединения в виде белого твердого вещества. ГХ-МС m/е 187, 189 [M]-. Альтернативная процедура. Две трехгорлых круглодонных колбы емкостью 50 л оснащают механической мешалкой, термопарой, вводом для азота и осушительной трубкой. В каждую колбу загружают метиловый эфир 3 бромпиридин-2-карбоновой кислоты (1886 г, 8,73 моль) (приготовленный, например, практически, как описано в альтернативной процедуре для промежуточного соединения 4) и MeOH (19 л). Реакционную смесь охлаждают до температуры от -5 до 5 С при помощи бани, содержащей МеОН/сухой лед, при этом сухой лед добавляют порциями, чтобы не переохладить смесь. В каждую колбу порциями по 100 г загружают боргидрид натрия (приблизительно 1651 г, 43,64 моль), поддерживая температуру от -5 до 5 С и давая температуре установиться перед добавлением каждой порции. По завершении добавления бани с МеОН заменяют ледяной водой. Реакционную смесь перемешивают в течение 6-8 ч при 0-5 С, стараясь поддерживать температуру, равную 0-5 С, при необходимости добавляя в баню лед. Протекание реакции отслеживают по данным ТСХ (гептан:EtOAc, 1:1). При Rf=0,6 не должно быть пятна исходного материала, а при Rf=0,1-0,5 должно быть пятно продукта. Когда реакцию считают завершенной, бани с ледяной водой заменяют банями со льдом/МеОН или MeOH/сухим льдом. Добавляют ацетон (4,5 л в каждую колбу) с такой скоростью, чтобы поддерживать температуру ниже 10 С в течение добавления первой половины и равной 10-20 С в течение добавления второй части. По окончании добавления ацетона реакция может быть оставлена при перемешивании на ночь в бане с ледяной водой или можно приступать к обработке. Каждую реакционную смесь разбавляют водой (5 л в каждую колбу) и реакционную смесь концентрируют почти досуха. Полученный твердый остаток разбавляют водой (всего 15 л) и EtOAc(20 л), смеси переносят в фарфоровый стакан емкостью 15 галлонов. К полученной смеси добавляют 50% раствор гидроксида натрия (2 кг) и смесь/суспензию перемешивают в течение 20-30 мин при комнатной температуре. Смесь фильтруют и осадок на фильтре промывают EtOAc (22 л), оставляя твердые вещества. Объединенные фильтраты переносят в делительную воронку, и органические слои отделяют, сушат над сульфатом магния, фильтруют и концентрируют. Водный слой оставляют. Твердые вещества, полученные при фильтровании, и водный слой загружают в фарфоровый стакан емкостью 15 галлонов, заполненный водой (15 л) и EtOAc (15 л). Смесь перемешивают в течение 20-30 мин при комнатной температуре. Спустя указанное время, смесь фильтруют, органический слой отделяют и сушат над сульфатом магния, фильтруют и концентрируют вместе с первым экстрактом. При необходимости экстракцию повторяют. Объединенный концентрированный фильтрат (3,12 кг розоватого масла) можно хранить в холодной комнате, или он может быть очищен немедленно. Концентрированный профильтрованный остаток (3,12 кг) растворяют в EtOAc (6 л) при необходимости при нагревании. Полученный розоватый раствор разбавляют гептаном (6 л), и полученный раствор загружают на подушку из силикагеля (5,5 кг, d=24 дюйма, h=2 дюйма, предварительно загруженную смесью гептана (9 л) и EtOAc (1 л и элюируют смесью гептан:EtOAc, 8:2 (приблизительно 30 л), затем смесью гептан:EtOAc, 7:3 (приблизительно 40 л). Фракции отслеживают при помощи ТСХ (гептан:EtOAc, 1:1). Фракции с продуктом концентрируют до состояния суспензии, но не досуха. Суспензию охлаждают до 0-5 С и перемешивают при этой температуре в течение одного часа. Спустя указанное время, твердые вещества отделяют фильтрованием, промывают гептаном (0-5 С, 2 л) и затем сушат в вакуумном шкафу при 25 С до постоянной массы. Промежуточное соединение 6. 3-Бром-2-(5-хлор-2-йодфеноксиметил)пиридин(3-Бромпиридин-2-ил)метанол (3,4 г, 18 ммоль) и 2-йод-5-хлорфенол (4,5 г, 18 ммоль) растворяют в бензоле (60 мл) и охлаждают до 0 С. К полученному раствору добавляют трибутилфосфин (15 мл,90 ммоль) и 1,1'-(азодикарбонил)дипиперидин (ADDP) (6,6 г, 18 ммоль) и смесь нагревают при 40 С в течение 3 ч. Реакционную смесь разбавляют этилацетатом, промывают насыщенным водным NH4Cl и рассолом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают испарительной хроматографией (Biotage Si65M, 15% этилацетат/гексан) с получением 3,77 г (51%) указанного в заголовке соединения в виде белого твердого вещества. ГХ-МС m/е 296, 298 [М-1]-. Альтернативный способ алкилирования.(3-Бромпиридин-2-ил)метанол (7,39 г, 39,30 ммоль) и триэтиламин (7,15 мл, 51,3 ммоль) смешивают в тетрагидрофуране (70 мл) в атмосфере азота. Раствор охлаждают до 0,6 С на ледяной бане. В течение 20 мин по каплям добавляют метансульфонилхлорид (3,35 мл, 43,28 ммоль), контролируя тепловыделение, так что внутренняя температура не превышает 5 С. После добавления реакцию перемешивают на ледяной бане. Спустя 20 мин анализ ЖХВР показал полное исчезновение (3-бромпиридин-2 ил)метанола. Гидрохлорид триэтиламина фильтруют через фриттованную стеклянную воронку и промывают холодным ТГФ (50 мл). Фильтрат ТГФ, содержащий мезилат, помещают в атмосферу азота и силь- 17014695 но охлаждают на ледяной бане. Добавляют 2-йод-5-хлорфенол (10,00 г, 39,30 ммоль), а затем добавляют трет-бутоксид натрия (4,10 г, 41,38 ммоль) двумя равными порциями, что сопровождается умеренным нагреванием приблизительно на 5 С в течение каждого добавления. Ледяную баню удаляют и реакцию оставляют при перемешивании в течение ночи. Реакцию тушат водой (50 мл) и нижний водный слой оставляют для медленного разделения. Органическую часть промывают рассолом (25 мл) и затем рассол и водные порции подвергают обратной экстракции ТГФ (10 мл). Органические части объединяют и сушат над сульфатом натрия, фильтруют и концентрируют с получением ржаво-оранжевого твердого вещества. Это твердое вещество растворяют в дихлорметане (25 мл) и хроматографируют на автоматизированном хроматографе AnaLogix Inc., Intelliflash 180, версия 1.8.0, используя градиент 10-20% этилацетат/гексаны в течение 35 мин с получением 11,0 г (65%) продукта в виде желтого вещества. 1 3-Бром-2-(5-хлор-2-йодфеноксиметил)пиридин (3,8 г, 8,9 ммоль) помещают в колбу, выдерживающую давление, растворяют в смеси диэтиламин:ацетонитрил:ТГФ (18 мл:4 мл:4 мл) и дегазируют азотом в течение 15 мин. Через раствор пропускают избыток 1-бутина, а затем добавляют CuI (507 мг,2,66 ммоль) и PdCl2(PPh3)2 (623 мг, 0,888 ммоль). Смесь перемешивают при комнатной температуре в течение 1 ч. Смесь затем разбавляют эфиром и промывают насыщенным водным раствором хлорида аммония и рассолом. Органическую часть сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают испарительной хроматографией (Biotage Si65M, 30% гексан/CH2Cl2, затем 20% этилацетат/гексан) с получением 2,3 г (75%) указанного в заголовке соединения в виде бледнооранжевого твердого вещества. ЖХ-МС m/e 351 [M]+. Альтернативная процедура. 3-Бром-2-(5-хлор-2-йодфеноксиметил)пиридин (5,00 г, 11,54 ммоль) суспензируют в триэтиламине(60 мл, 430,5 ммоль) и дегазируют. Добавляют 1-бутин (2,6 г, 11,54 ммоль) (24% мас./мас. в ДМФА), а затем добавляют бис-(трифенилфосфин)палладий(II)хлорид (410 мг, 0,584 ммоль) и йодид меди (I) (220 мг, 1,16 ммоль). Реакцию оставляют при перемешивании в течение ночи. Реакцию разбавляют бутилтрет-метиловым эфиром (50 мл) и тушат раствором NH4Cl (50 мл), что сопровождается небольшим разогреванием, равным 3 С, и перемешивают в течение 30 мин. Водный слой удаляют, и органические вещества промывают 5 Н HCl (80 мл) для удаления ТЭА из органического слоя. Кислотный слой (pH 2) удаляют, и органический слой промывают рассолом, сушат, фильтруют и испаряют до темно-коричневого масла. Это масло хроматографируют на автоматизированном хроматографе AnaLogix Inc., Intelliflash 180, версия 1.8.0, используя градиент от 0 до 10% этилацетата в гептане в течение 5 мин, выдерживают в течение 5 мин, и применяют градиент от 10 до 20% этилацетата в гептане в течение 10 мин. Получают оранжевое твердое вещество (4,0 г), которое представляет собой смесь исходного материала и ожидаемого продукта. Этот продукт перекристаллизовывают из гептана с получением 3,1 г смеси исходного материала (6% по данным ЖХВР) и ожидаемого продукта. 1H ЯМР (ДМСО)1,05 (3 Н, т), 2,33 (2 Н, кв), 5,31 (2 Н, с), 6,96 (1H, дд), 7,22 (1 Н, м), 7,31 (1 Н, д),7,37 (1 Н, дд), 8,15 (1H, дд), 8,57 (1 Н, дд). Продукт содержит 6% исходного материала, что было подтверждено анализом ЖХВР: колонка Zorbax Eclipse XDB-C8; растворитель - градиент от 50% ацетонитрила в воде (с добавлением 0,01% ТФУК) до 80% ацетонитрила. TR продукта = 6,15 мин. Альтернативный синтез. А. Получение 2-(5-хлор-2-йодфенокси)тетрагидропирана. Трехгорлую круглодонную колбу емкостью 22 л снабжают механической мешалкой, капельной воронкой, вводом для азота, осушительной трубкой и термопарой и помещают в охлаждающую баню. В колбу загружают 5-хлор-2-йодфенол (2290 г, 9 моль) (приготовленный, например, практически, как описано в альтернативной процедуре для промежуточного соединения 1), дихлорметан (11,45 л) и п-толуолсульфонат пиридиния (45,2 г, 0,18 моль), и в колбу добавляют по каплям приблизительно в течение одного часа 3,4-дигидро-2H-пиран (1211 г, 14,4 моль). Во время добавления наблюдается небольшое тепловыделение, и для поддержания температуры охлаждающей бани 30 С в баню добавляют холодную водопроводную воду. По завершении добавления реакционную смесь перемешивают в течение как минимум 12 ч при температуре окружающей среды. Протекание реакции отслеживают по данным ТСХ (гептан:EtOAc, 9:1). Исходный продукт наблюдают при Rf=0,2 и продукт при Rf=0,5. Если присутствует бо- 18014695 лее следового количества исходного материала, то реакцию можно оставить перемешиваться еще в течение 4 ч. По завершении реакции смесь промывают насыщенным водным раствором бикарбоната натрия(1,5 л), органический слой отделяют от водного слоя, водный слой экстрагируют дихлорметаном (1 л) и объединенные органические слои сушат над сульфатом натрия, обрабатывают углем, фильтруют и концентрируют. Полученное коричневое масло испаряют совместно с толуолом для удаления возможных остатков 3,4-дигидро-2H-пирана. Продукт растворяют в триэтиламине (4,5 л) с получением мутного раствора, который фильтруют и осадок на фильтре промывают триэтиламином (200 мл). Продукт затем используют в виде раствора в триэтиламине в следующей реакции. В. Получение 2-(2-бут-1-инил-5-хлорфенокси)тетрагидропирана. Продукт, растворенный в триэтиламине, полученный в предыдущей реакции, загружают в трехгорлую круглодонную колбу емкостью 50 л, снабженную механической мешалкой, вводом для азота, осушительной трубкой и термопарой, и помещенную в охлаждающую баню. В колбу загружают триэтиламин (4,28 л), этилацетат (8,78 л), дихлор-бис-(трифенилфосфин)палладий (126,3 г, 0,18 моль) и йодид меди(I) (34,3 г, 0,18 моль) и реакционную смесь перемешивают и охлаждают до 0-10 С под слоем азота(замечание: сначала продукт может быть растворен в 9 л триэтиламина в соответствии с частью А без последующего добавления дополнительного количества триэтиламина, как описано выше). Спустя указанное время, ток азота прекращают и в колбу при помощи стеклянной погружной трубки, помещенной ниже поверхности реакционной смеси, загружают 1-бутин (681,5 г, 12,6 моль), поддерживая температуру 10 С в течение всех трех часов добавления. По завершении добавления охлаждающую баню удаляют и реакционную смесь перемешивают в течение как минимум 12 ч при комнатной температуре. Протекание реакции отслеживают путем ТСХ (гептан:EtOAc, 9:1). Исходный продукт наблюдают при Rf=0,6 и продукт - при Rf=0,5. Когда реакцию считают завершенной, реакционную смесь фильтруют, осадок на фильтре промывают EtOAc (31 л), снимая вакуум во время каждой промывки. Все органические части объединяют и концентрируют до получения коричневого масла. Остаток разбавляют гептаном (5 л) и триэтиламином (25 мл). Продукт очищают на колонке с силикагелем (3 кг силикагеля предварительно загружают в гептан (5 л) и триэтиламин (60 мл), d=8 дюймов, h=18 дюймов). Сырой продукт загружают в раствор и элюируют последовательно гептаном (9 л)/0,2% EtOAc, гептаном (9 л)/3% EtOAc и гептаном(9 л)/4% EtOAc. Соответствующие фракции объединяют с получением коричневого масла (2644 г, неочищенное). Это масло растворяют в гептане (1 мл/г) и триэтиламине (20 мл), и раствор помещают в морозильник. Твердые вещества разделяются спустя приблизительно 12 ч. Жидкость декантируют, твердые вещества взвешивают и растворяют в гептане (1 мл/г) и триэтиламине (20 мл). Для получения чистого продукта (2003 г) кристаллизацию повторяют. Дополнительная очистка. Твердые вещества растворяют в дихлорметане (2 мл/г) и полученный раствор загружают в подходящую трехгорлую круглодонную колбу, снабженную механической мешалкой, вводом для азота и осушительной трубкой, помещенную в охлаждающую баню. Добавляют функционализованный тиолом по кремнию силикагель (загрузка 1,33 ммоль/г) и полученную суспензию перемешивают в течение как минимум 12 ч при комнатной температуре. Спустя указанное время, суспензию фильтруют, осадок на фильтре промывают дихлорметаном (3500 мл) и объединенные фильтраты концентрируют с получением янтарного масла. Это масло растворяют в гептане (1 мл/г) и помещают в морозильник на ночь. Жидкость с твердых веществ декантируют и затем сушат в вакуумном шкафу при температуре окружающей среды, 1 мм рт.ст. в течение как минимум 18 ч. С. Получение 2-бут-1-инил-5-хлорфенола. Трехгорлую круглодонную колбу емкостью 22 л снабжают механической мешалкой, капельной воронкой, вводом для азота, термопарой и осушительной трубкой, помещают в охлаждающую баню. В колбу загружают МеОН (2,3 л) и HCl (9 мл), запускают мешалку и охлаждают реакционную смесь до 1020 С. Широкогорлую круглодонную колбу емкостью 20 л оснащают механической мешалкой и помещают в нагревательную рубашку, и в колбу загружают 2-(2-бут-1-инил-5-хлорфенокси)тетрагидропиран(2313 г, 8,736 моль) и MeOH (3,47 л). Для растворения твердых веществ применяют осторожное нагревание и колбу промывают МеОН (70 мл). Этот раствор загружают в трехгорлую круглодонную колбу через капельную воронку, поддерживая температуру 20 С в течение 45 мин. Охлаждение прекращают и реакционную смесь перемешивают в течение как минимум 30 мин. Протекание реакции отслеживают по данным ТСХ (гептан:EtOAc, 9:1). Исходный продукт наблюдают при Rf=0,6 и продукт - при Rf=0,5. Когда реакцию считают завершенной, реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия (300 мл) и перемешивают в течение 5-10 мин при комнатной температуре. Спустя указанное время реакционную смесь концентрируют для удаления МеОН. Оставшееся масло (2118 г) разбавляют МТВЕ (4 л) и промывают раствором рассола (1,5 л). Органический слой отделяют и водный слой экстрагируют МТВЕ (21 л). Объединенные органические порции сушат над сульфатом магния,фильтруют и концентрируют. Продукт затем испаряют совместно с толуолом (2800 мл) и используют непосредственно.- 19014695 Трехгорлую круглодонную колбу емкостью 50 л снабжают механической мешалкой, капельной воронкой, вводом для азота, термопарой и осушительной трубкой и помещают в охлаждающую баню. В колбу загружают (3-бромпиридин-2-ил)метанол (приготовленный, например, практически, как описано в альтернативной процедуре для промежуточного соединения 5) (1837 г, 9,769 моль), ТГФ (14,7 л) и триэтиламин (1,53 л, 11,01 моль), и реакционную смесь охлаждают до температуры, составляющей от -5 до 5 С. Чистый метансульфонилхлорид (1155 г, 10,09) добавляют по каплям в течение 1,5 ч, поддерживая температуру 5 С, до образования белой суспензии. Полученную суспензию перемешивают в течение одного часа при температуре, составляющей от -5 до 0 С, и протекание реакции отслеживают по данным ТСХ (дихлорметан:МеОН, 20:1). Исходный продукт наблюдают при Rf=0,5 и продукт-мезилат - приRf=0,95. Когда реакцию считают завершенной, реакционную смесь фильтруют и осадок на фильтре промывают холодным ТГФ (0-5 С, 32 л). Трехгорлую круглодонную колбу емкостью 50 л снабжают механической мешалкой, капельной воронкой, вводом для азота, термопарой и осушительной трубкой и помещают в охлаждающую баню. После споласкивания колбы ТГФ (70 мл) в колбу загружают объединенные фильтраты, содержащие 3-бромпиридин-2-илметиловый эфир метансульфоновой кислоты и 2-бут-1-инил-5-хлорфенол (8,736 моль,0,95 экв.) (приготовленный, например, практически, как описано в стадии С). Запускают мешалку и реакционную смесь охлаждают до температуры, составляющей от -15 до 0 С. В смесь порциями в течение 40 мин, поддерживая температуру 0 С, добавляют трет-бутоксид натрия (969,7 г, 10,09 моль). Реакцию оставляют нагреваться до комнатной температуры при перемешивании в течение как минимум 48 ч до получения мутного коричневато-желтого раствора. Протекание реакции отслеживают по данным ТСХ(гептан:EtOAc, 1:1). Мезилат наблюдают при Rf=0,1 и продукт - при Rf=0,5. Когда реакцию считают завершенной, реакционную смесь разбавляют водой (5 л), органический слой отделяют от водного слоя, и органический слой концентрируют до получения плотной суспензии. Водный слой экстрагируют МТВЕ(22 л) и органический слой отделяют. Концентрированную суспензию растворяют в МТВЕ (12 л), объединяют с предыдущими экстрактами (4 л) и перемешивают до растворения всех твердых веществ. Органический слой промывают рассолом (3 л), отделяют, сушат над сульфатом магния, обрабатывают углем,фильтруют и концентрируют. Продукт затем испаряют совместно с EtOH (1 л), с получением беловатого твердого вещества (3581 г). Это твердое вещество перекристаллизовывают из EtOH (2,5 л, 0,7 мл/г) при перемешивании и охлаждении до температуры, составляющей от -5 до 5 С в течение одного часа. Твердые вещества отделяют фильтрованием и промывают холодным EtOH (2900 мл, от -20 до -10 С). Продукт сушат в вакуумном шкафу при 30 С с использованием масляного насоса. Промежуточное соединение 8.(65 мл) и дегазируют пропусканием азота через раствор в течение 15 мин. К раствору добавляют бис(пинокалато)диборон (1,8 г, 7,2 ммоль) и Pt(PPh3)4 (653 мг, 0,525 ммоль). Полученную смесь нагревают до 80 С в течение 24 ч, охлаждают до комнатной температуры, разбавляют этилацетатом, промывают рассолом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении, с получением твердого вещества. Это твердое вещество растворяют в эфире, фильтруют и концентрируют при пониженном давлении с получением 3,61 г (91%) указанного в заголовке соединения в виде желтого вещества, которое используют без дальнейшей очистки. ЖХ-МС m/e 605 [М]+. Альтернативная процедура. Трехгорлую круглодонную колбу емкостью 50 л снабжают механической мешалкой, вводом для азота под жидкость, термопарой и осушительной трубкой и помещают в охлаждающую баню. В колбу загружают ДМФА (27 л), 3-бром-2-(2-бут-1-инил-5-хлор-феноксиметил)пиридин (3381 г, 9,642 моль)(приготовленный, например, практически, как описано в альтернативном синтезе промежуточного соединения 7), и полученный раствор перемешивают при комнатной температуре, пропуская сильный ток газообразного азота в течение как минимум одного часа. Спустя указанное время в колбу одной порцией загружают бис-(пинаколатодибор) (2522 г, 9,93 моль), и полученный раствор перемешивают при комнатной температуре, пропуская сильный ток газообразного азота в течение по меньшей мере 15 мин. В колбу загружают тетракис(трифенилфосфин)платину(0) (24 г, 0,019 ммоль) и погружную трубку заменяют- 20014695 нормальным вводом для азота. Реакционную смесь нагревают до температуры, составляющей 80 С, и перемешивают при этой температуре в течение 8-10 ч. Протекание реакции отслеживают по данным ТСХ (гептан:EtOAc). При Rf=0,4 не должно быть пятна исходного материала и при Rf=0,35 должно быть пятно продукта. Когда реакцию считают завершенной, реакционную смесь охлаждают до комнатной температуры. Реакционную смесь разбавляют МТВЕ (20 л), а затем добавляют 10% водный раствор NaCl(25 л). Органический слой отделяют от водного слоя и промывают 10% водным раствором NaCl (10 л). Органический слой отделяют и сушат над сульфатом магния, фильтруют и концентрируют. Водные слои объединяют и экстрагируют МТВЕ (5 л). Экстракты МТВЕ промывают 10% водным раствором NaCl(3 л), сушат над сульфатом магния, фильтруют и концентрируют вместе с первым экстрактом до получения плотной пасты. Добавляют изопропиловый спирт (7 л) и продолжают концентрацию для удаления оставшегося МТВЕ. Полученную суспензию перемешивают на охлаждающей бане в течение как минимум одного часа при комнатной температуре. Спустя указанное время, твердые вещества отделяют фильтрованием и осадок на фильтре промывают изопропиловым спиртом (21,5 л). Твердые вещества сушат в вакуумном шкафу при 40-45 С в течение как минимум 18 ч с использованием масляного насоса. Промежуточное соединение 9.(Z)-2-2-[1,2-бис-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бут-1-енил]-5-хлор-феноксиметил 3-бромпиридин (3,6 г, 6,0 ммоль) растворяют в диоксане (600 мл) и дегазируют пропусканием азота через раствор в течение 15 мин. В смесь добавляют размолотый K3PO4 (3,8 г, 18 ммоль), а затемPdCl2dppfCH2Cl2 (488 мг, 0,598 ммоль). Суспензию нагревают до 80 С в течение 22 ч, охлаждают до комнатной температуры, промывают рассолом, сушат над MgSO4 и концентрируют при пониженном давлении с получением твердого вещества. Твердое вещество растворяют в этилацетате, фильтруют под действием силы тяжести и концентрируют при пониженном давлении с получением 2,37 г (приблизительно 100%) указанного в заголовке соединения, которое используют без дальнейшей очистки. ЖХ-МС m/e 398 [М+Н]+. Альтернативный синтез. Две трехгорлые круглодонные колбы емкостью 50 л снабжают механической мешалкой, трубкой для ввода азота, термопарой, обратным холодильником и осушительной трубкой каждую и помещают в нагревательные рубашки. В каждую колбу загружают 1,4-диоксан (по 26 л в каждую), (Z)-2-2-[1,2-бис(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бут-1-енил]-5-хлор-феноксиметил-3-бромпиридин (приготовленный, например, практически, как описано в альтернативной процедуре для промежуточного соединения 8) (по 2610 г в каждую) и порошкообразный карбонат калия (по 1790 г в каждую). Полученную суспензию перемешивают при комнатной температуре, барботируя сильный ток газообразного азота в течение по меньшей мере 2 ч. Спустя указанное время, в колбы загружают [1,1'-бис-(дифенилфосфино)ферроцен]дихлорпалладий(II) в виде комплекса с дихлорметаном (1:1) (по 176,3 г в каждую) и погружную трубку заменяют нормальным вводом для азота. Реакционную смесь нагревают до температуры,составляющей 80 С, и перемешивают при этой температуре в течение как минимум 20 ч. Наблюдают образование темной коричневой суспензии. Протекание реакции отслеживают по данным ТСХ(гептан:EtOAc, 1:1). Следы исходного материала присутствуют при Rf=0,7, a пятно продукта - при Rf=0,6. Если присутствует более следового количества исходного материала, то добавляют дополнительное количество карбоната калия (по 596,5 г в каждую колбу, всего 1193 г). Реакционные смеси перемешивают в течение 4 ч при 80 С. Когда реакции считают завершенными, реакционные смеси охлаждают до 60 С или перемешивают до достижения комнатной температуры. Реакционные смеси фильтруют и осадки на фильтрах промывают 1,4-диоксаном (33 л) и EtOAc (33 л). Объединенные фильтраты концентрируют до получения твердых веществ. Полученные темные твердые вещества растворяют в EtOAc (20 л) и полученный раствор промывают 15% водным раствором NaCl (5 л). Смесь перемешивают (используя делительную воронку). Расслоение не происходит. Смесь собирают в чашки и добавляют диатомитовую землю (1 кг в каждую чашку), содержимое чашек перемешивают, и всю смесь фильтруют для удаления твердых веществ, которые затрудняют расслоение. Осадок на фильтре промывают EtOAc (31 л). Фильтраты объединяют и органический слой отделяют. Органический слой промывают 15% водным растворомNaCl (5 л). Затем органические слои объединяют, сушат над сульфатом магния, фильтруют и концентрируют. Испаряют совместно с 1,4-диоксаном (2 л) с получением коричневатого твердого остатка.(40 мл/15 мл) и дегазируют пропусканием азота через раствор в течение 15 мин. К полученной смеси добавляют Pd(PPh3)4 (689 мг, 0,596 ммоль) и раствор нагревают до 80 С в течение 18 ч. Раствор охлаждают до комнатной температуры, разбавляют этилацетатом, промывают водой, насыщенным водным раствором хлорида аммония и рассолом, сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают испарительной хроматографией (Biotage Si65M, 3% этанол/CHCl3), а затем ионообменной хроматографией (разделяют на две порции, BondElut SCX, испаряют со смесью 80/20 CH2Cl2/метанол, элюируют смесью 80/20 CH2Cl2/2,0 М NH3 в метаноле) и еще раз очищают испарительной хроматографией (Biotage Si40M, от 40% этилацетата/гексана до 80% этилацетата в гексане) с получением 1,01 г (38%) указанного в заголовке соединения в виде белого твердого вещества. ЖХ-МС m/e 441 [М+Н]+. Промежуточное соединение 10. В круглодонную 4-горлую колбу емкостью 12 л, снабженную механической мешалкой, обратным холодильником и термопарой загружают в атмосфере азота раствор гидроксида калия (500 г, 8,91 моль) в воде (1,50 л). К раствору добавляют 3-йоданилин (128 г, 585 ммоль), (Z)-8-хлор-5-[1-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)пропилиден]-5,11-дигидро-10-окса-1-азадибензо[a,d]циклогептан(232 г, 583 ммоль), 1,4-диоксан (2,40 л) и 3,5-диметоксифенол (454 г, 2,92 моль), что приводит к образованию темной коричневой смеси. Эту смесь дегазируют через трехходовой клапан, помещенный на обратном холодильнике. Через трехходовой клапан в течение приблизительно 3 мин создают обычный вакуум. Затем откачанную колбу продувают азотом. Процедуру повторяют всего три раза. Добавляют твердый тетракис(трифенилфосфин)палладий (20,4 г, 17,5 ммоль) и повторяют процедуру дегазации. Полученную темно-коричневую смесь нагревают до 80 С в течение 2 ч. Реакционную смесь охлаждают до 40 С и загружают в колбу емкостью 22 л, снабженную нижним отводом, в которой содержится 15% раствор NaCl(2,5 л). Полученную смесь перемешивают в течение 10 мин и слои разделяют. Органический слой второй раз промывают 15% раствором NaCl (2,5 л). Органический слой отделяют и концентрируют в вакууме с получением плотное темное масло. К нему добавляют 2 л гептана и концентрируют в вакууме для удаления остаточного диоксана. Продукт очищают крупномасштабной хроматографией на силикагеле, используя стеклянную воронку с пористым фильтром размером 10 дюймов (приблизительно 25 см), заполненную 3 кг силикагеля, смоченного гептаном. Продукт растворяют в гептане (приблизительно 500 мл) и наносят на силикагель. Применяя небольшой вакуум, продукт загружают на силикагель, используя в качестве элюента 3 л гептана. Подвижную фазу заменяют смесью гептан:EtOAc (9:1) и для сбора 3,5-л фракций используют градиент гептан:EtOAc (1:1). Фракции отслеживают путем ТСХ (1:1 EtOAc:гептан,SiO2, Rf=0,45). Фракции, содержащие целевой продукт, объединяют и концентрируют в вакууме с получением темно-зеленого масла. К этому маслу добавляют гептан (2 л), и затем продукт концентрируют в вакууме с получением 201,3 г (95%) темно-зеленого твердого вещества. ЖХ-ES/MC m/e 363,2 [М+Н]+. Альтернативная процедура. Соль (Е)-3-[1-(8-Хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фениламина и дитолуолсульфоновой кислоты (5765 г) (приготовленная, например, практически, как описано ниже в- 22014695 альтернативном синтезе для промежуточного соединения 11), суспендируют в воде (12 л) и EtOAc (12 л),используя делительную воронку емкостью 40 л. К смеси за один раз добавляют 50% раствор NaOH(4,8 кг). Полученную суспензию перемешивают до полного растворения твердых веществ. Органический слой отделяют и промывают 5% водным раствором NaOH (1 л). Объединенные водные слои экстрагируют EtOAc (22 л). Органический слой отделяют и промывают 5% водным раствором NaOH (500 мл). Объединенные органические слои сушат сульфатом магния, обрабатывают углем и фильтруют. Полученный фильтрат разбавляют гептаном (16 л) с получением раствора в смеси гептан:EtOAc, 1:1. Продукт очищают, используя подушку силикагеля (6 кг силикагеля предварительно загружают в гептан:EtOAc,1:1, (8 л), диаметр = 18 дюйма, высота = 3 дюйма). Неочищенный продукт загружают в раствор и элюируют гептаном:EtOAc, 1:1 (приблизительно 40-50 л), затем гептаном:EtOAc, 1:3 (приблизительно 20-30 л), и затем гептаном:EtOAc, 1:9, (10-20 л). Фракции, содержащие продукт, определяют путем ТСХ(EtOAc, 100%). При Rf=0,0 наблюдают примесь. Пятно продукта наблюдают при Rf=0,4. Фракции, содержащие продукт, объединяют и концентрируют до получения пасты. Полученный остаток разбавляют гептаном (2-3 л). Суспензию перемешивают в течение 30 мин при комнатной температуре, твердые вещества отделяют фильтрованием и промывают гептаном (21,5 л). Твердое вещество сушат в вакуумном шкафу при 40-45 С в течение ночи. Пример 1(а) (из промежуточного соединения 10). В 5-литровую 4-горлую круглодонную колбу, снабженную механической мешалкой и термопарой,в атмосфере азота, загружают твердый (Е)-3-[1-(8-хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5 илиден)пропил]фениламин (198 г, 545 ммоль), пиридин (67,0 мл, 828 ммоль) и дихлорметан (1,6 л). К темно-зеленой реакционной смеси добавляют по каплям в течение 20 мин из капельной воронки раствор метансульфонилхлорида (51,0 мл, 658 ммоль) в дихлорметане (400 мл). В течение всего добавления наблюдают выделение тепла с подъемом температуры на 6,9 С. По завершении добавления реакционную смесь перемешивают в течение 16 ч при температуре окружающей среды. Смесь загружают в колбу емкостью 22 л с нижним отводом, содержащую 10%-ный раствор лимонной кислоты (2 л). Полученную смесь перемешивают в течение 15 мин, и при отстаивании слои разделяются. Органический слой промывают 15% раствором NaCl. Органический слой загружают в атмосфере азота в 5-литровую 4-горлую колбу, снабженную механической мешалкой. Темно-красный раствор обрабатывают активированным углемDARCO (200 г), Na2SO4 (200 г) и ТМТ (тринатриевая соль тритиоциануровой кислоты, гидрат) (50 г). Смесь перемешивают в течение 18 ч при температуре окружающей среды и затем фильтруют через 2 дюймовый (приблизительно 5 см) слой диатомитовой земли (Hy-flo Supercel). Фильтрат концентрируют в вакууме с получением твердой белой пены. К этой пене добавляют изопропиловый спирт (1 л,5 объемов) и суспензию перемешивают при 40 С в течение одного часа. Плотную смесь охлаждают до температуры окружающей среды. Твердое вещество фильтруют в вакууме при помощи воронки Бюхнера через слой полипропилена. Полученный продукт сушат при 70 С в течение 16 ч в обычном вакууме с получением 171,85 г (71,4%) белого кристаллического продукта. ЖХ-ES/MC m/e 441,2 [M+H]+, 439,1 [М-Н]-. Анал.: рассчитано для C23H21N2ClO3S: С 62,65; H 4,80; N 6,35. Найдено: С 62,81; Н 4,82; N 6,20. Промежуточное соединение 11. Названное соединение приготовлено практически по прописи для промежуточного соединения 10 с использованием 3-йоданилина (13,72 г, 62,64 ммоль) и (Z)-8-хлор-5-[1-(4,4,5,5-тетраметил[1,3,2]- 23014695 диоксаборолан-2-ил)пропилиден]-5,11-дигидро-10-окса-1-азадибензо[a,d]циклогептана (24,91 г, 62,64 ммоль). По завершении реакции смесь охлаждают до 40 С. К смеси добавляют воду (250 мл), 15% раствор рассола (50 мл) и бутил-трет-метиловый эфир (250 мл). Верхний органический слой отделяют и водный слой экстрагируют бутил-трет-метиловым эфиром (100 мл). Органический раствор пропускают через слой оксида кремния, находящийся в предварительно заполненной 70-мм воронке Бюхнера SUPELCO. Фильтрат концентрируют с получением 42,45 г масла. К этому маслу добавляют EtOAc(200 мл), а затем при перемешивании в течение 18 ч моногидрат толуолсульфоновой кислоты (23,83 г). Коричневатый осадок фильтруют и промывают EtOAc (100 мл), а затем гептаном (50 мл) и 1:1EtOAc/гептаном (50 мл). Продукт сушат в обычном вакууме при 50 С в течение 18 ч с получением 34,43 г (выход: 77,7 мас.%). ЖХ-ES/MC m/e 362 [М+]; 1H ЯМР ДМСО 0,8 (т, 3 Н), 2,22 (с, 6 Н), 2,6 (м, 1 Н), 2,65 (м, 1 Н), 5,1 (д, 1 Н), 5,88 (д, 1 Н), 7-7,5 (Ar и NH3, 21H), 8,2 (д, 1 Н). Альтернативный синтез. Две трехгорлые круглодонные колбы емкостью 50 л снабжают механической мешалкой, вводом для азота, термопарой, обратным холодильником и осушительной трубкой каждую и помещают в охлаждающие бани. В каждую колбу загружают воду (8,5 л в каждую колбу) и гидроксид калия (2422 г в каждую колбу) и смеси перемешивают в течение 5-15 мин до растворения твердых веществ и стабилизации температуры (приблизительно 40 С). Смеси охлаждают до 20-30 С под слоем азота. Спустя указанное время, колбы помещают в нагревательные рубашки и в каждую колбу загружают 1,4-диоксан (3 л в каждую колбу), 3-йоданилин (945,5 г, 4,317 моль в каждую колбу) и разделенный поровну раствор (Z)-8 хлор-5-[1-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)пропилиден]-5,11-дигидро-10-окса-1-азадибензо[a,d]циклогептана (по расчету 8,634 моль,1 эквивалентов) (приготовленный практически, как описано в альтернативном синтезе промежуточного соединения 9) в 1,4-диоксане (15 л, 7,5 л в каждую колбу), а затем добавляют 3,5-диметоксифенол (3328 г, 21,585 моль в каждую колбу) и тетракис(трифенилфосфин)палладий(0) (149,58 г, 0,26 моль в каждую колбу). Реакционные смеси нагревают до 80 С и перемешивают при этой температуре в течение 2 ч. Наблюдают образование темного раствора. Протекание реакции отслеживают по данным ТСХ в гептане:EtOAc, 1:1. При Rf=0,6 не должно быть пятна исходного материала. При Rf=0,2 должно быть пятно продукта. Когда реакции считают завершенными, реакционные смеси оставляют охлаждаться до комнатной температуры. Реакционные смеси разбавляют водой и МТВЕ (8 л). Органический слой отделяют и водный слой экстрагируют МТВЕ (42 л). Объединенные органические слои промывают раствором рассола (5 л), сушат над сульфатом магния,обрабатывают углем, фильтруют и концентрируют. Совместное испарение с EtOAc (1,5 л) позволяет получить светло-коричневое масло (4080 г). Трехгорлую круглодонную колбу емкостью 50 л снабжают механической мешалкой, вводом для азота и осушительной трубкой и помещают в охлаждающую баню. В колбу загружают моногидрат птолуолсульфоновой кислоты (4106 г, 21,585 моль,2,5 экв.) и EtOAc (15 л), запускают мешалку и наблюдают образование белой суспензии. Полученное коричневое масло растворяют в EtOAc (16,3 л, 4 мл/г) и этот раствор добавляют порциями (сначала быстро, а затем, когда выпадает твердое вещество, медленно) к суспензии моногидрата п-толуолсульфоновой кислоты в EtOAc. Полученную серо-коричневую суспензию перемешивают в течение 12 ч при комнатной температуре. Спустя указанное время твердые вещества отделяют фильтрованием и промывают EtOAc (32 л, при комнатной температуре). Полученные твердые вещества переносят в чашку и размешивают с EtOAc (14 л), затем твердые вещества отделяют фильтрованием. Твердые вещества переносят в чашку и снова размешивают с изопропиловым спиртом(14 л), а затем отделяют фильтрованием. Трехгорлую круглодонную колбу емкостью 50 л снабжают механической мешалкой, обратным холодильником, вводом для азота и осушительной трубкой и помещают в нагревательную рубашку. В колбу загружают полученные твердые вещества и изопропиловый спирт (12 л). Полученную суспензию нагревают до температуры кипения в течение 30 мин, охлаждают до комнатной температуры и отделяют фильтрованием твердые вещества. Полученные твердые вещества затем промывают изопропиловым спиртом комнатной температуры (22 л), EtOAc (22 л) и гептаном(22 л), затем сушат в вакуумном шкафу при температуре от 40 до 45 С в течение ночи. Получают серокоричневое твердое вещество. Пример 1(b).(Е)-N-3-[1-(8-Хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид. Трехгорлую круглодонную колбу емкостью 50 л снабжают механической мешалкой, вводом для азота, термопарой и осушительной трубкой и помещают в охлаждающую баню. В колбу добавляют (Е)3-[1-(8-хлор-11H-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фениламин (1800 г, 4,96 моль)(приготовленный практически по прописи для промежуточного соединения 10 в соответствии с альтернативной процедурой), дихлорметан (18 л) и пиридин (588,5 г, 7,44 моль). Реакционную смесь охлаждают до температуры, составляющей от 0 до 5 С, и в смесь добавляют по каплям в течение приблизительно- 24014695 20-30 мин, поддерживая температуру 5 С, чистый метансульфонилхлорид (681,8 г, 5,952 моль). По завершении добавления реакционную смесь перемешивают при температуре, составляющей от 0 до 5 С, в течение одного часа. Охлаждающую баню удаляют и реакцию перемешивают при комнатной температуре в течение как минимум 12 ч. Протекание реакции отслеживают путем ТСХ (чистый EtOAc). Когда реакцию считают завершенной, реакционную смесь промывают 10% водным раствором лимонной кислоты (14 л), используя 40-литровую делительную воронку. Водный слой подвергают обратной экстракции дихлорметаном (1,5 л). Объединенные органические слои промывают 10% водным раствором лимонной кислоты (2 л). Водный слой подвергают обратной экстракции дихлорметаном (1,5 л). Объединенные органические слои промывают 15% водным раствором хлорида натрия (5 л) и водный слой подвергают обратной экстракции дихлорметаном (1,5 л). Объединенные органические слои промывают полунасыщенным водным раствором бикарбоната натрия (5 л). Промывку бикарбонатом натрия следует проводить в течение как минимум 30 мин. Водный слой подвергают обратной экстракции дихлорметаном (1,5 л). Объединенные органические слои сушат над сульфатом натрия и фильтруют. Трехгорлую круглодонную колбу емкостью 50 л снабжают механической мешалкой, вводом для азота, термопарой и осушительной трубкой и помещают в охлаждающую баню. Раствор в дихлорметане, содержащий продукт, загружают в колбу, затем туда помещают тринатриевую соль тритиоциануровой кислоты (630 г,0,35 г/г исходного материала), сульфат натрия (3,6 кг, 2 г/г исходного материала) и древесный уголь(180 г, 0,1 г/г исходного материала). Суспензию перемешивают в течение 12 ч при комнатной температуре. Затем суспензию фильтруют и осадок на фильтре размешивают с дихлорметаном (33 л). Фильтраты объединяют и концентрируют до получения беловатого твердого вещества. Продукт сушат в вакуумном шкафу при 40 С в течение ночи. Пример 1(с) (из промежуточного соединения 11).(Е)-N-3-[1-(8-Хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид. Часть А. В 250-мл круглодонную колбу, снабженную магнитной мешалкой, загружают промежуточное соединение 11 (3,14 г, 5,09 ммоль) и метиленхлорид (70 мл). К полученной смеси порциями в течение 5 мин добавляют 15% раствор карбоната натрия. Смесь перемешивают в течение 30 мин. Нижний органический слой отделяют и сушат безводным MgSO4. Смесь фильтруют и осадок на фильтре промывают метиленхлоридом (10 мл). Фильтрат концентрируют на роторном испарителе при температуре бани, равной 50 С, с получением 1,85 г масла. Часть В. В отдельный 250-мл 3-горлый реакционный сосуд добавляют раствор масла (1,85 г), полученного в соответствии с частью А, растворенного в метиленхлориде (65 мл) и пиридине (0,62 мл, 7,64 ммоль). Реакционный раствор затем перемешивают в течение 5 мин. Затем туда в течение 5 мин добавляют метансульфонилхлорид (0,46 мл, 6,12 ммоль), растворенный в метиленхлориде (5 мл). Реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Протекание реакции отслеживают при помощи ЖХВР и после исчезновения промежуточного соединения 11 тушат 10% раствором лимонной кислоты(10 мл). Реакционную смесь перемешивают в течение 5 мин. Добавляют деионизованную воду (20 мл) и после перемешивания в течение 20 мин нижний органический слой отделяют. Органический слой обрабатывают активированным углем DARCO (2,0 г) в течение 20 мин. Смесь фильтруют через диатомитовую землю и осадок на фильтре промывают метиленхлоридом (20 мл). Фильтрат концентрируют на роторном испарителе с получением 1,84 г указанного в заголовке соединения. ЖХ-ES/MC m/e 440 [M+]; 1(Е)-N-3-[1-(8-хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид (251 мг, 0,57 ммоль) смешивают с ацетоном (4 мл) в сцинтилляционном флаконе. Образец нагревают при перемешивании приблизительно до 55 С. Добавляют 1 молярный эквивалент серной кислоты (0,25 М). Через несколько часов нагревания до повышенной температуры при перемешивании образец оставляют охлаждаться приблизительно до 25 С при перемешивании в течение ночи. Осадок не образовывался, и образец испаряли досуха в токе азота. К полученному остатку при перемешивании и нагревании приблизительно до 55 С добавляют ацетон (2 мл) с получением суспензии. Добавляют дополнительное количество ацетона (1 мл) с получением прозрачного раствора. Образец испаряют досуха в токе азота. К полученному остатку при перемешивании и нагревании приблизительно до 55 С добавляют ацетон (2 мл) с получением суспензии. Образец оставляют охлаждаться при перемешивании приблизительно до 25 С в течение ночи. Полученную суспензию отделяют путем вакуумного фильтрования и твердое вещество оставляют сушиться на воздухе. Характеристики температуры плавления ма- 25014695 териала определяют при помощи дифференциального термического анализа (ДТА). Начало плавления = 139 С; пик плавления = 148 С. По данным ЖХВР (Waters 2695 (Alliance) модель с автоинжектором, колонка Chromolith Performance RP-18, элюирование смесью от 5% ацетонитрил/вода (с добавлением 0,1% ТФУК) до 100% ацетонитрила (с добавлением 0,1% ТФУК) со скоростью 1 мл/мин, снабженный детектором ESA Corona для подсчета противоионов) продукт представляет собой гемисульфат, и было обнаружено, что продукт содержит 56,7% от теоретического количества моносоли. Свободное основание было обнаружено при помощи УФ-спектрометрии (245 нм, детектор PDA Waters 996), и было обнаружено, что интенсивность сигнала составляет 89,5% от интенсивности стандартной кривой. Это соответствует следующему стехиометрическому соотношению: 2 моль свободного основания:1 моль H2SO4 (гемисульфатная соль). Пример 3.(Е)-N-3-[1-(8-Хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид (183 мг, 0,42 ммоль) смешивают с этанолом (5 мл) в сцинтилляционном флаконе. Образец при перемешивании нагревают до температуры приблизительно 75 С. Добавляют 1 молярный эквивалент HBr (0,25 М). Через несколько часов нагревания до повышенной температуры при перемешивании образец оставляют охлаждаться приблизительно до 25 С при перемешивании в течение ночи. Осадок не образовывался и образец испаряли досуха в токе азота. К полученному остатку добавляют "влажный" EtOAc (6 мл), который готовили промыванием EtOAc водой в делительной воронке, что приводит к получению смеси приблизительного состава 3% воды/EtOAc. Полученную суспензию перемешивают и нагревают приблизительно при 65 С в течение нескольких часов. Образец оставляют охлаждаться приблизительно до 25 С при перемешивании в течение ночи. Полученное твердое вещество отделяют от суспензии путем вакуумного фильтрования и оставляют сушиться на воздухе. Характеристики температуры плавления материала определяют при помощи дифференциального термического анализа (ДТА). Начало плавления = 227 С; пик плавления = 233 С. Пример 4.(Е)-N-3-[1-(8-хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид (218 мг, 0,49 ммоль) смешивают с этанолом (5 мл) в сцинтилляционном флаконе. Образец при перемешивании нагревают до температуры приблизительно 75 С. Добавляют 1 молярный эквивалент HCl (1N). Через несколько часов нагревания до повышенной температуры при перемешивании,образец оставляют охлаждаться приблизительно до 25 С при перемешивании в течение ночи. Осадок не образовывался, и образец испаряли досуха в токе азота. К полученному остатку добавляют "влажный"EtOAc (6 мл), который готовили промыванием EtOAc водой в делительной воронке, что приводит к получению смеси приблизительного состава 3% воды/EtOAc. Полученную суспензию перемешивают и нагревают приблизительно при 65 С в течение нескольких часов. Образец оставляют охлаждаться приблизительно до 25 С при перемешивании в течение ночи. Полученное твердое вещество отделяют от суспензии путем вакуумного фильтрования и оставляют сушиться на воздухе. Характеристики температуры плавления материала определяют при помощи дифференциального термического анализа (ДТА). Разложение при 180 С. Пример 5.(Е)-N-3-[1-(8-Хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид (кристаллический) (форма I). Первичный анализ. Образец (Е)-N-3-[1-(8-хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамида, приготовленного практически, как описано в примере I(а), анализировали при помощи дифференциальной сканирующей калориметрии (ДСК) и рентгеновской порошковой дифрактометрии (РПД) (до и после легкого размалывания). ДСК: начало 189,79 С; пик 109,91 С. Перекристаллизация. Образцы метансульфонамида, полученные в соответствии с примером I(а), (приблизительно 50 мг) растворяют в изопропиловом спирте, изопропилацетате, ацетонитриле, метаноле, этаноле (абсолютном),этаноле (96%) и ацетоне постепенным добавлением растворителей при перемешивании при комнатной температуре до полного растворения. В тех случаях, когда остаются нерастворенные частицы, раствор нагревают до температуры приблизительно 50 С. Каждый раствор затем оставляют в открытом флаконе при комнатной температуре и перемешивании до прохождения кристаллизации (от нескольких часов до ночи). Испарение продолжают до получения достаточного количества кристаллов, т.е. до тех пор, пока не останется приблизительно 0,5 мл раствора (для ацетонового раствора - приблизительно 0,2 мл). После того, как образуется достаточное количество кристаллов, растворы фильтруют, и полученные порошки сушат на стеклянных пластинах в течение ночи на воздухе при комнатной температуре. Образцы порош- 26014695 ков, полученные в каждой из перекристаллизации, затем анализируют при помощи рентгеновской порошковой дифрактометрии. При проведении первичного анализа рентгеновские дифрактограммы, полученные для образцов (до и после размалывания) и перекристаллизованных образцов, показывают наличие одной кристаллической формы (форма I), для которой характерны положения характеристических пиков (значения 2), совпадающие со следующими значениями, полученными для исходного образца после легкого размалывания:(Е)-N-3-[1-(8-Хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид (перекристаллизация из метанола). Трехгорлую круглодонную колбу емкостью 50 л оснащают механической мешалкой, обратным холодильником, термопарой и осушительной трубкой и помещают в нагревательную рубашку. В колбу загружают 2263 г твердого материала, приготовленного практически, как описано в примере I(b), и МеОН (30 л). Запускают мешалку и смесь нагревают до температуры кипения и продолжают нагревание до полного растворения всех твердых веществ. После получения прозрачного раствора в колбу осторожно добавляют уголь (180 г). Полученную смесь фильтровали горячей и фильтрат загружали в трехгорлую круглодонную колбу емкостью 50 л, снабженную механической мешалкой, термопарой и осушительной трубкой, помещенной в охлаждающую баню. Полученный раствор охлаждают, вначале медленно, затем до температуры, составляющей от -10 до 0 С, и перемешивали при этой температуре в течение как минимум одного часа. Спустя указанное время, твердые вещества отделяли фильтрованием и промывали холодным МеОН (2600 мл, -40 С). Продукт сушили в вакуумном шкафу при 70 С в течение ночи с получением 1942 г вещества. Пример 7.(Е)-N-3-[1-(8-Хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид (измельченный). Образцы соединения (I) (приготовленного, например, практически, как описано в примере 6) измельчают (размалывают) при помощи устройства Jet-O-Mizer, серия 0101 (петлевая мельница) (поставляемая Fluid Energy Processing and Equipment Company), и сжатого азота, используемого в качестве размалывающего газа (точка росы 40 С). Распределение размера частиц определяли при помощи лазерного дифракционного анализатора размера частиц Sympatec (система анализа размера частиц HELOS), и определяют параметры размера частиц x50 и x90.(Е)-N-3-[1-(8-Хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид (кристаллический) (форма II). Образцы неизмельченного соединения (I), приготовленного, например, практически, как описано в примере 6, и измельченного соединения (I), приготовленного, например, практически, как описано в примере 7, анализируют с помощью рентгеновской порошковой дифрактометрии с использованием дифрактометра Bruker D8 Advance; сканирование образцов производят в диапазоне от 2 до 45 в пределах 2, с размером шага, равным 0,02 в пределах 2, и скоростью сканирования, равной 5 с/шаг, со следующими параметрами: 0,6-мм дивергенционной щелью, 0,6-мм противорассеивающей щелью, 0,1-мм принимающей щелью и 0,6-мм щелью детектора. Рентгеновские дифрактограммы измельченных и неизмельченных образцов показывают наличие общей кристаллической формы (форма II), имеющей характеристические пики при следующих значениях 2:(Е)-N-3-[1-(8-Хлор-11 Н-10-окса-1-азадибензо[a,d]циклопентен-5-илиден)пропил]фенилметансульфонамид в виде наносуспензии. Приблизительно 579 мг соединения I, исходный размер d90 частиц которого составлял 32 мкм (исходный размер частиц определяли при помощи лазерного дифракционного анализатора размера частицBeckman Coulter LS13 320), суспензировали в 174 мл носителя, включающего 1% натрийкарбоксиметилцеллюлозы, 0,25% полисорбата 80 и 0,05% антивспенивателя Antifoam 1510, в 250-мл флаконе из пирекса, предназначенном для среды 1395. Композицию затем подвергали действию ультразвука на ультразвуковом устройстве Branson Sonifer 250 в течение 46 мин с использованием зонда длиной 0,5 дюймов при выходной мощности, составляющей приблизительно 86% от максимальной. Размер частиц соединения I в композиции, подвергнутой воздействию ультразвука, определяли с помощью анализатора размера частиц Horiba LA-920: средний размер частиц: 3,8 мкм; размер d90 частиц: 6,5 мкм. Для получения наносуспензии композицию, подвергнутую воздействию ультразвука, затем гомогенизировали при помощи микрофлюидизатора Microfluidics M-110S, снабженного JR30, 75 мкм, реакционной камерой и охлаждающим змеевиком. Охлаждающий змеевик погружали в водяную баню, температуру в которой поддерживали равной 20-30 С, за исключением коротких промежутков времени, когда температуру понижали до 14 С или повышали до 39 С. Перепад давлений устанавливали равным 100 psi(приблизительно 6,89 бар, 689475,7 Па), что соответствует давлению 23000 psi (230006894,757 Па=158579411 Па), прилагаемому к композиции. Композиция находилась в загрузочной воронке емкостью 1 л; ее загружали в микрофлюидизатор через нижнюю часть загрузочной воронки и возвращали,загружая сверху в жидкость, находящуюся в загрузочной воронке, через отвод для продукта и несколько силиконовых трубок. Композицию, находящуюся в загрузочной воронке, также перемешивали стандартной пропеллерной мешалкой. Полный объем композиции пропускали через реакционную камеру 81 раз. Конечный размер частиц соединения I в наносуспензии определяли с помощью анализатора размера частиц Horiba LA-920: средний размер частиц: 0,430 мкм; размер d90 частиц: 0,594 мкм. Список последовательностей(Е)-N-3-[1-(8-хлор-11 Н-10-окса-1 азадибензо[a,d]циклогептен-5-илиден)пропил]фенилметансульфонамид, или его фармацевтически приемлемая соль. 2. Соединение по п.1, которое представляет собой (E)-N-3-[1-(8-хлор-11 Н-10-окса-1 азадибензо[a,d]циклогептен-5-илиден)пропил]фенилметансульфонамид. 3. Соль по п.1,которая представляет собой(2:1). 4. Применение соединения или соли по любому из пп.1-3 для производства лекарственного средства для лечения ревматоидного артрита, остеоартрита, ревматического полиартрита, астмы, аллергического ринита, системной красной волчанки, хронического обструктивного заболевания легких, болезни Крона, воспалительного заболевания кишечника или язвенного колита. 5. Применение по п.4, где заболевание представляет собой ревматоидный артрит. 6. Фармацевтическая композиция, включающая соединение или соль по любому из пп.1-3 в сочетании с одним или более фармацевтически приемлемым носителем, наполнителем или разбавителем. 7. Фармацевтическая композиция для лечения ревматоидного артрита, включающая соединение или соль по любому из пп.1-3 в сочетании с одним или более фармацевтически приемлемым носителем, наполнителем или разбавителем. 8. Применение соединения или соли по любому из пп.1-3 в терапии. 9. Применение соединения или соли по любому из пп.1-3 для лечения ревматоидного артрита.
МПК / Метки
МПК: C07D 491/044, A61K 31/4745, A61P 19/02
Метки: модулятор, применение, глюкокортикостероидов, рецепторов
Код ссылки
<a href="https://eas.patents.su/30-14695-modulyator-receptorov-glyukokortikosteroidov-i-ego-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Модулятор рецепторов глюкокортикостероидов и его применение</a>
Предыдущий патент: Производные карбазола в качестве функциональных 5-ht6 лигандов
Следующий патент: Peg – илированный паратиреоидный гормон в качестве модулятора рецептора паратиреоидного гормона и его применение
Случайный патент: Замещенные имидазольные производные, содержащие их фармацевтические композиции и их применение в качестве ингибиторов ртразы