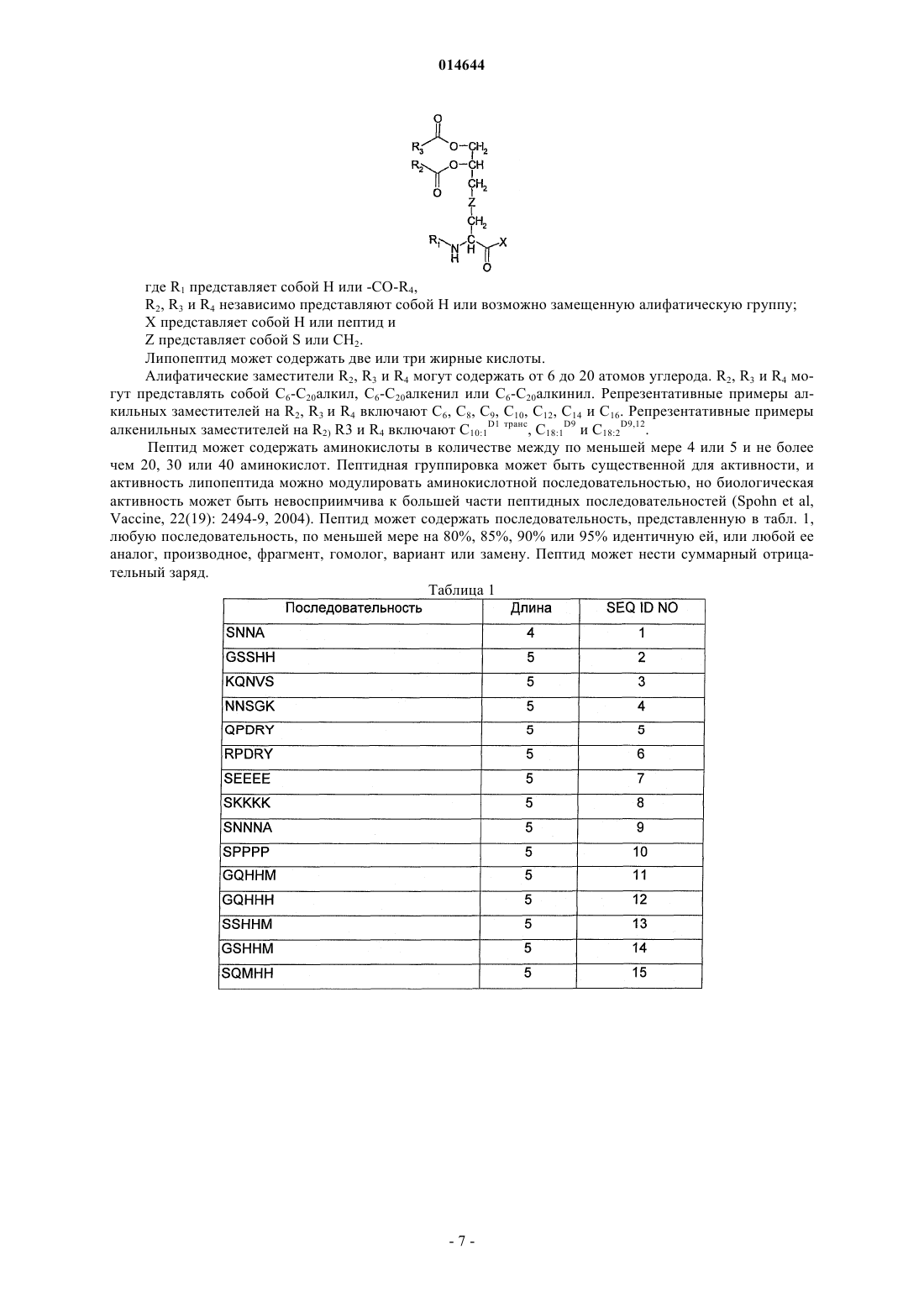
Способы защиты от апоптоза с применением липопептидов
Формула / Реферат
1. Способ защиты млекопитающего от эффектов радиоактивного облучения вызывающего апоптоз, при котором указанному млекопитающему вводят композицию, содержащую фармацевтически эффективное количество липопептида, имеющего формулу

где R1представляет собой Н или -CO-R4,
R2, R3и R4 независимо представляют собой Н или С8-С16алифатическую группу;
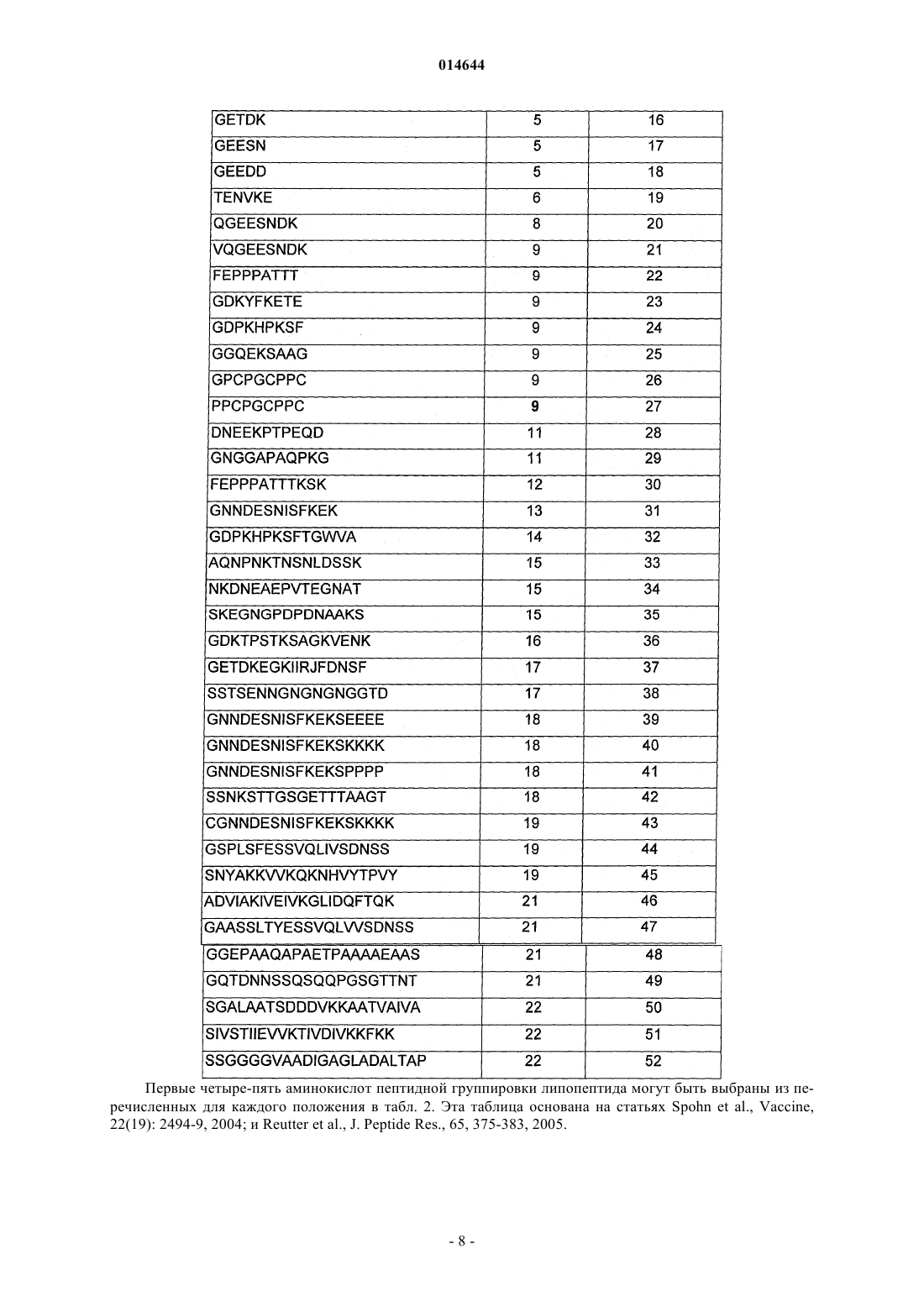
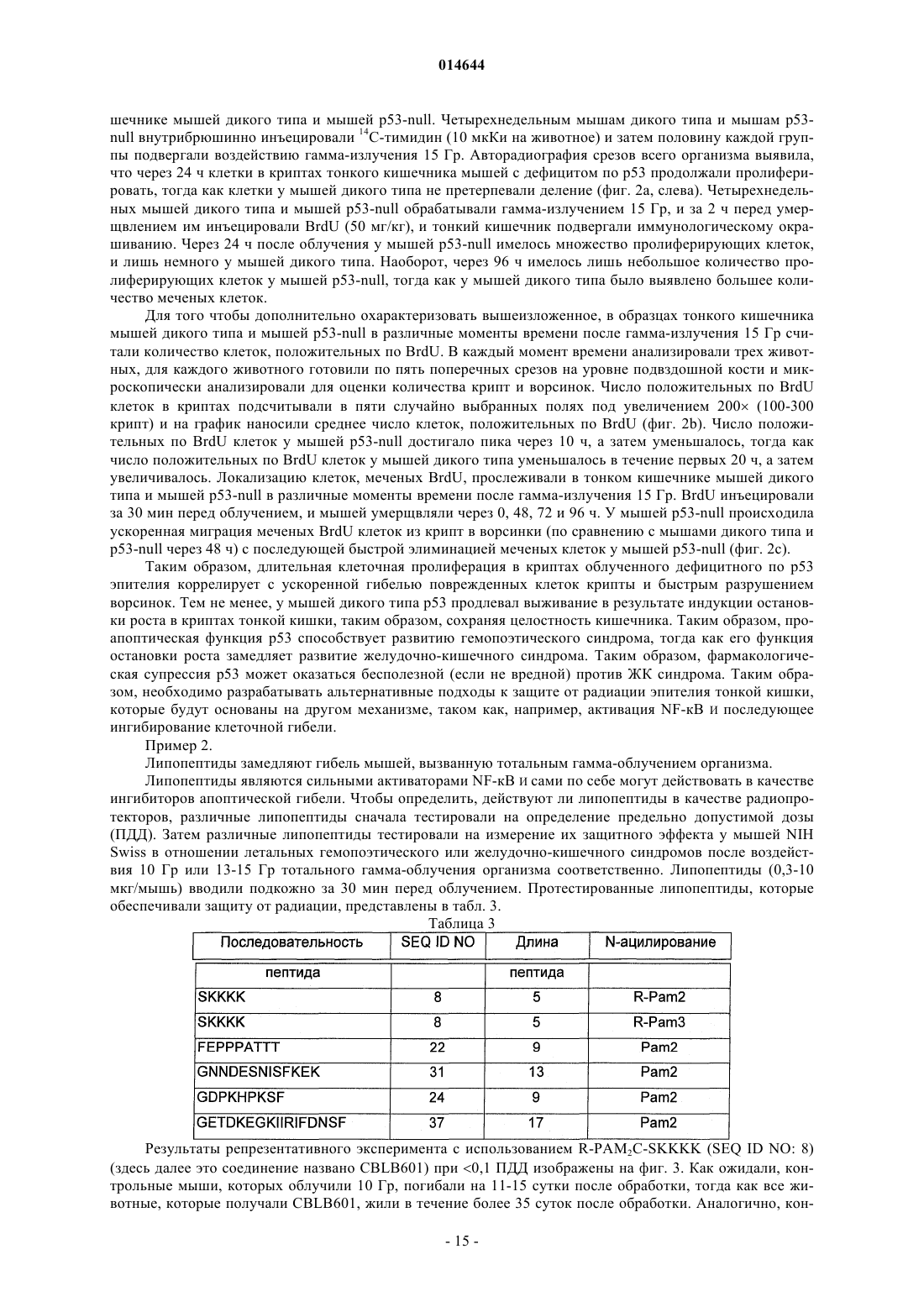
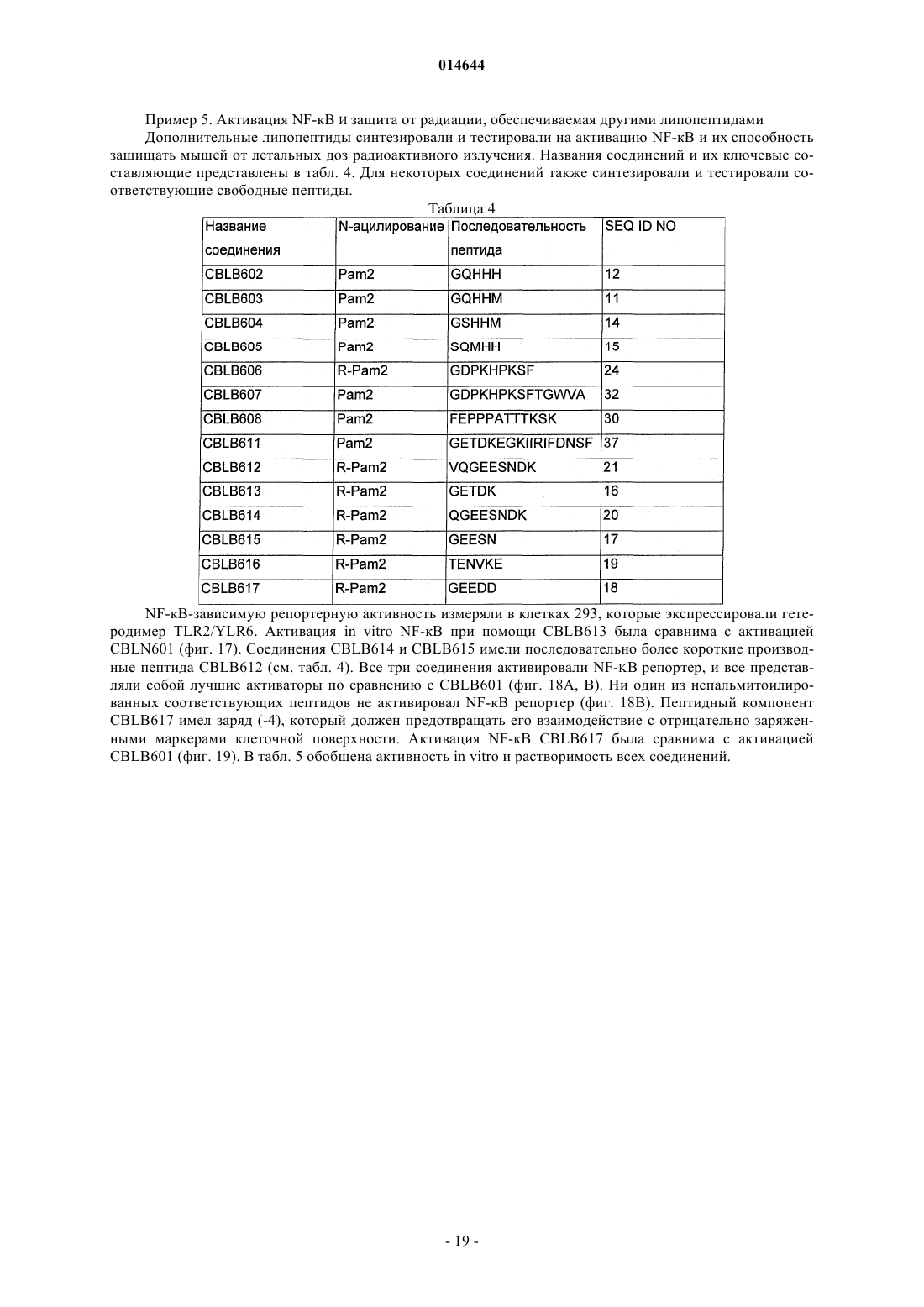
X представляет собой пептид, который включает любую из последовательностей SEQ ID NO: 1-52, или первые 4-5 аминокислот в нем выбраны из перечисленных в нижеследующей таблице:
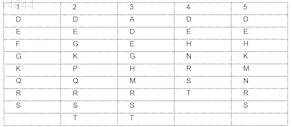
и Z представляет собой S или СН2.
2. Способ по п.1, где пептид представляет собой SEQ ID NO: 21.
3. Способ по п.1, где первые пять аминокислот пептида выбраны из аминокислот в положениях, указанных в табл. 2.
4. Способ по п.1, где пептид содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 8, 16, 17, 18, 20 и 21 и их производного, где производное включает модификацию, выбранную из группы, состоящей из гликозилирования, слияния с ковалентной модификацией N- или С-конца, полиэтиленгликоля (ПЭГ), липидного остатка, алкилирования, другого пептида, полипептида или химического вещества, присоединенного через функциональную группу боковой цепи аминокислоты.
5. Способ по п.4, где R1 представляет собой Н и R2и R3 представляют собой C16алифатические группы.
6. Способ по п.1, где соединение представляет собой RR или RS стереоизомер или их смесь.
7. Способ по п.1, где композицию вводят в комбинации с радиопротектором.
8. Способ по п.7, где радиопротектор представляет собой антиоксидант.
9. Способ по п.8, где антиоксидант выбран из группы, состоящей из амифостина и витамина Е.
10. Способ по п.7, где радиопротектор представляет собой цитокин.
11. Способ по п.10, где цитокин представляет собой фактор стволовых клеток.
12. Способ по п.7, где радиопротектор представляет собой флагеллин.
13. Способ по п.7, где радиопротектор представляет собой латентный трансформирующий фактор роста b (TGFb).
14. Способ по п.7, где радиопротектор представляет собой активатор toll-подобного рецептора (TLR).
15. Способ по п.1, где апоптоз вызывается в ткани, выбранной из группы, состоящей из селезенки, тимуса, желудочно-кишечного (ЖК) тракта, легких, почек, печени, сердечно-сосудистой системы, эндотелия кровеносных сосудов, центральной и периферической нервной системы, кроветворных клеток-предшественников (костный мозг), иммунной системы, волосяных фолликулов и половой системы.
16. Соединение формулы
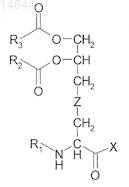
где R1представляет собой Н или -CO-R4,
R2, R3и R4 независимо представляют собой Н или С8-С16алифатическую группу;
X представляет собой пептид, который включает любую из последовательностей SEQ ID NO: 1-52, или первые 4-5 аминокислот в нем выбраны из перечисленных в нижеследующей таблице:
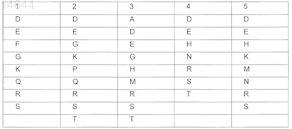
и Z представляет собой S или СН2,
при условии, что, если R2 и R3 оба представляют собой алифатическую группу СН3(СН2)14и Z представляет собой S, то X не представляет собой пептид, который включает последовательность SEQ ID NO: 24 или SEQ ID NO: 31.
Текст
СПОСОБЫ ЗАЩИТЫ ОТ АПОПТОЗА С ПРИМЕНЕНИЕМ ЛИПОПЕПТИДОВ Описано применение липопептидов в качестве индукторов NF-кВ для защиты млекопитающих от действий апоптоза.(71)(73) Заявитель и патентовладелец: КЛИВЛЭНД БИОЛАБС ИНК.; КЛИВЛЭНД КЛИНИК ФАУНДЕЙШН (US) 014644 Область изобретения Изобретение относится к применению индукторов ядерного фактора NF-кВ для защиты млекопитающих от действий апоптоза. Более конкретно данное изобретение относится к применению индукторов NF-кВ ДЛЯ защиты млекопитающих от воздействия стресса, такого как облучение и терапии рака. Предшествующий уровень техники В прогрессирование от нормальных клеток к раковым вовлечена утрата отрицательных механизмов регуляции роста, включающая устойчивость к стимулам-ингибиторам роста и отсутствие зависимости от факторов роста и гормонов. Традиционные терапии рака, которые базируются на облучении или цитотоксических лекарственных средствах, основаны на различиях в регуляции роста между нормальными и злокачественными клетками. Традиционные терапии рака подвергают клетки тяжелому генотоксическому стрессу. В этих условиях деление большинства нормальных клеток блокируется, и поэтому они выживают, в то время как опухолевые клетки продолжают делиться и погибают. Однако природа общепринятых стратегий терапии рака такова, что риску подвергаются как нормальные быстро делящиеся ткани, так и подверженные апоптозу ткани. Повреждение этих нормальных быстро делящихся клеток является причиной хорошо известных побочных эффектов терапии рака (чувствительными тканями являются кроветворные органы, тонкая кишка, волосяные фолликулы). Естественная чувствительность таких тканей осложняется тем фактом, что раковые клетки часто приобретают дефекты механизмов суицида (апоптоза), и те терапевтические процедуры, которые вызывают гибель клеток в нормальных чувствительных тканях, могут не быть столь же эффективными в отношении раковых клеток. Обычно предпринимаемые попытки свести к минимуму побочные эффекты терапий рака основаны на (а) придании опухолевым клеткам большей восприимчивости к лечению, (б) придании терапиям рака большей специфичности в отношении опухолевых клеток, или (в) стимулировании регенерации нормальных тканей после лечения (например, с использованием эритропоэтина, колониестимулирующего фактора гранулоцитов-макрофагов (GM-CSF) и фактора роста кератиноцитов (KGF. Тем не менее, каждый из этих подходов обладает ограниченной эффективностью. В результате сохраняется потребность в терапевтических агентах для уменьшения побочных эффектов, связанных с химиотерапией и лучевой терапией при лечении рака. Данное изобретение удовлетворяет этим потребностям и обеспечивает другие связанные с этим преимущества. Краткое изложение сущности изобретения Предложен способ защиты млекопитающего от одного или более чем одного состояния или терапии, которые запускают апоптоз. Млекопитающему может быть введена композиция, содержащая фармацевтически приемлемое количество соединения формулыR1 представляет собой Н или -CO-R4,R2, R3 и R4 независимо представляют собой Н или возможно замещенную С 8-С 16 алифатическую группу;Z представляет собой S или СН 2. Пептид может содержать последовательность, представленную в SEQ ID NO: 1-52. Первые пять аминокислот пептида могут быть выбраны из аминокислот в положениях, представленных в табл. 2. Соединение может представлять собой RR или RS стереоизомер или их смесь. Соединение также может иметь формулу-1 014644 Состояние, которое запускает апоптоз, может представлять собой облучение, ранение, отравление,инфекцию или температурный шок. Лечение, которое запускает апоптоз, может представлять собой лечение рака. Лечение рака может представлять собой химиотерапию или лучевую терапию. Ткань, в которой запускается апоптоз, может представлять собой селезенку, тимус, желудочно-кишечный (ЖК) тракт,легкие, почки, печень, сердечно-сосудистую систему, эндотелий кровеносных сосудов, нервную систему(центральную или периферическую), кроветворные клетки-предшественники (костный мозг), иммунную систему, волосяные фолликулы или половую систему. Соединение может быть введено в комбинации с радиопротектором. Радиопротектор может представлять собой антиоксидант, такой как амифостин или витамин Е. Радиопротектор также может представлять собой цитокин, такой как фактор стволовых клеток. Радиопротектор также может представлять собой флагеллин, латентный трансформирующий фактор роста(TGF - transforming growth factor ) или активатор toll-подобного рецептора (TLR - toll-like receptor). Краткое описание графических материалов Фиг. 1 иллюстрирует, что дефицит р 53 ускоряет развитие вызванного радиоактивным облучением желудочно-кишечного синдрома у мышей. На панели А представлены графики процента выживания мышей, подвергнутых воздействию тотального гамма-облучения организма 9, 12,5, 25 или 52,5 Грэй(Гр) после предварительной обработки ингибитором р 53 пифитрином-альфа (PFT) или ДМСО (диметилсульфоксид; контроль). Мышей-нуль мутантов по р 53 (p53-null) также подвергали воздействию фракционированной кумулятивной дозы облучения 12,5 Гр (52,5 Гр). На панели В представлены графики процента выживания мышей дикого типа и мышей p53-null после воздействия низкой (10 Гр) или высокой (15 Гр) дозы тотального гамма-облучения организма. На панели С представлен график, иллюстрирующий процент выживания мышей, подвергнутых воздействию тотального гамма-облучения организма 15 Гр после восстановления костным мозгом (КМ) от мышей дикого типа (p53-wt) или p53-null. На панели D представлены окрашенные гематоксилином-эозином парафиновые срезы кишки от мышей дикого типа и мышей p53-null в указанные моменты времени после гамма-облучения 15 Гр. Вставки через 24 ч демонстрируют окрашивание областей крипт TUNEL. Фиг. 2 иллюстрирует динамику клеточной пролиферации и выживания в тонкой кишке мышей дикого типа и p53-null. На панели А (левой) показаны авторадиограммы тотальных срезов организма мышей дикого типа и p53-null, которым инъецировали 14 С-тимидин, которых обрабатывали или не обрабатывали 15 Гр гамма-облучения. Стрелка указывает на кишку. На панели А (правой) показаны микрофотографии включения BrdU в тонкую кишку мышей дикого типа и p53-null в различные моменты времени после гамма-облучения 15 Гр. Области изображений через 96 ч показаны при большем увеличении. На панели В представлен график количества BrdU-положительных клеток/крипта в тонкой кишке мышей дикого типа и p53-null в различные моменты времени после гамма-облучения 15 Гр. На панели С представлены микрофотографии меченых BrdU клеток в тонкой кишке мышей дикого типа и p53-null в различные моменты времени после гамма-облучения 15 Гр. BrdU инъецировали за 30 мин перед облучением, и мышей умерщвляли в указанные моменты времени. Фиг. 3 иллюстрирует эффект радиационной защиты соединения CBLB601. Изображены графики процента выживания мышей, подвергнутых воздействию тотального гамма-облучения организма 9, 12,5,25 или 52,5 Гр после предварительной обработки CBLB601 или фосфатно-солевым буферным раствором (ФСБ). Фиг. 4 иллюстрирует изменения размера селезенки после воздействия тотального гамма-облучения организма 13 Гр после предварительной обработки CBLB601 или ФСБ. Слева представлен график массы селезенки мышей, обработанных ФСБ или CBLB601, а справа представлены изображения селезенки контрольных мышей или обработанных мышей. Фиг. 5 иллюстрирует определение оптимального времени для внутрибрюшинной инъекцииCBLB601. На панели А представлен график процента выживания мышей, подвергнутых воздействию тотального облучения организма 10 Гр (ТОО) после внутрибрюшинного введения ФСБ или CBLB601 за 24, 6, 1 или 0,5 ч до облучения. На панели В представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутрибрюшинного введения ФСБ или CBLB601 за 96, 72, 48, 24 или 1 ч до облучения. Фиг. 6 иллюстрирует определение оптимальной дозы CBLB601. На панели А представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутрибрюшинного введения ФСБ или 1, 3, 10, 20, 30 мкг CBLB601/мышь за 24 ч до облучения. На панели В представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутрибрюшинного введения ФСБ или 0,1, 0,3, 1, 3, 10 или 15 мкг CBLB601/мышь за 24 ч до облучения. Фиг. 7 иллюстрирует определение дозы облучения, защищенной CBLB601. На панели А представлен график процента выживания мышей, подвергнутых воздействию ТОО 10, 11, 12, 13, 14 или 15 Гр после внутрибрюшинного введения ФБР за 24 ч до облучения. На панели В представлен график процента выживания мышей, подвергнутых воздействию ТОО 10, 11, 12, 13, 14 или 15 Гр после внутрибрюшинного введения 3 мкг CBLB601/мышь за 24 ч до облучения.-2 014644 Фиг. 8 иллюстрирует эффект радиационной защиты внутримышечного введения CBLB601. Представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутрибрюшинного введения ФСБ или внутримышечного введения 1, 3 или 10 мкг CBLB601/мышь за 24 ч до облучения. Фиг. 9 иллюстрирует выживание после различных доз облучения и различных доз CBLB601. Представлен график процента выживания мышей, подвергнутых воздействию ТОО 10, 11 или 12 Гр после внутримышечного введения ФСБ или 0,3, 1, 3, 10 или 30 мкг CBLВ 601/мышь за 24 ч до облучения. Фиг. 10 сравнивает выживание после различных доз CBLB601, введенных различными путями. Представлена столбчатая диаграмма процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутрибрюшинного или внутримышечного введения различных доз CBLB601 за 24 ч до облучения. Фиг. 11 сравнивает выживание после различных доз CBLB601, выраженных в мкг/кг, введенных различными путями. Представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутрибрюшинного или внутримышечного введения различных доз CBLB601 за 24 ч до облучения. Фиг. 12 иллюстрирует определение оптимального времени для внутримышечной инъекцииCBLB601. На панели А представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутримышечного введения ФСБ или 3 мкг CBLB601/мышь за 24, 6, 3 или 1 ч до облучения, либо через 1 или 3 ч после облучения. На панели В представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутримышечного введения ФСБ или 3 мкгCBLB601/мышь за 48, 36, 24, 12 или 6 ч до облучения. На панели С представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутримышечного введения ФСБ или 1, 3, 10 или 30 мкг CBLB601/мышь через 1 ч после облучения. Фиг. 13 сравнивает выживание в зависимости от времени введения и пути введения CBLB601. Представлена столбчатая диаграмма процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутрибрюшинного или внутримышечного введения 3 мкг CBLB601/мышь в различные моменты времени до облучения. Фиг. 14 иллюстрирует определение коэффициента модификации дозы на сутки 30 (КМД 30) дляCBLB601 в оптимальных с точки зрения защиты от радиации состояниях. Представлен график процента выживания мышей, подвергнутых воздействию различных доз облучения после внутримышечного введения ФБР или 3 мкг CBLB601/мышь за 24 ч до облучения. Фиг. 15 демонстрирует график средней массы селезенок облученных контрольных мышей и мышей, обработанных CBLB601. На график нанесено отношение массы селезенок на массу тела для мышей,подвергнутых воздействию ТОО 0, 6 или 10 Гр после внутримышечного введения ФСБ или 3 мкгCBLB601/мышь за 24 ч до облучения. Фиг. 16 представляет иммунные ответы у мышей, обработанных CNLB601, которых иммунизировали флагеллином через 8, 18 или 20 недель после облучения. На панели А показан иммунный ответ различных групп через один месяц после первой иммунизации. На панели В показан иммунный ответ различных групп через один месяц после первого отбора крови. На панели С показан второй иммунный ответ на флагеллин различных групп через 10 суток после третьей иммунизации. Фиг. 17 представляет собой график активации репортера NF-KB различными дозами CBLB613 иCBLB601 в клетках 293, экспрессирующих гетеродимер TLR2/TLR6. Фиг. 18 демонстрирует активацию репортера NF-KB различными соединениями CBLB в клетках 293, экспрессирующих гетеродимер TLR2/TLR6. Панель А демонстрирует активацию NF-кВ различными дозами CBLB601, CBLB612, CBLB614 или CBLB615. Панель В демонстрирует активацию NF-KB различными дозами CBLB601, CBLB612, CBLB614, или CBLB615 и отсутствие активации соответствующими свободными пептидами. Фиг. 19 представляет собой график активации репортера NF-KB различными дозами CBLB617 иCBLB601 в клетках 293, экспрессирующих гетеродимер TLR2/TLR6. Фиг. 20 иллюстрирует активность радиационной защиты CBLB613. Представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутримышечного введения ФСБ или 0,3, 1, 3, 10, 30 или 82,5 мкг CBLВ 613/мышь за 24 ч до облучения. Фиг. 21 иллюстрирует активность радиационной защиты CBLB612, CBLB614, и CBLB615. Представлен график процента выживания мышей, подвергнутых воздействию ТОО 10 Гр после внутримышечного введения ФСБ или различных доз CBLB612, CBLB614 или CBLB615 за 24 ч до облучения. Фиг. 22 иллюстрирует смягчающую активность CBLB612. Представлен график процента выживания мышей, обработанных 50 мкг CBLВ 612/мышь или ФСБ через 1 ч после воздействия ТОО 8,5, 9 или 10 Гр. Подробное описание изобретения Здесь предложен способ защиты нормальных клеток и тканей от апоптоза, вызванного различными стрессами. Нормальной функцией апоптоза является "очистка" тканей от раненных или генетически поврежденных клеток, тогда как цитокины мобилизуют систему защиты организма от стресса. Однако в-3 014644 условиях тяжелого повреждения оба механизма ответа на стресс сами могут действовать как причины смерти. Например смертность от облучения может возникать в результате массивного апоптоза, возникающего в кроветворной, иммунной и пищеварительной системах. Существует два основных механизма контроля апоптоза в клетке: биохимический путь р 53 (проапоптический) и NF-кВ (антиапоптический). Регуляция обоих биохимических путей в опухолях часто нарушается: р 53 может быть утрачен, в то время как NF-кВ может стать конститутивно активным. Следовательно, ингибирование р 53 и/или активация NF-кВ В нормальных клетках может обеспечить их защиту от гибели, вызванной стрессами. Такой подход к терапиям рака не делает опухолевые клетки более устойчивыми к терапии, поскольку в них регуляция этих механизмов контроля уже нарушена. Эти данные опровергают традиционный взгляд на р 53 и NF-кВ, которые рассматривают в качестве мишеней для активации и репрессии соответственно. Как описано здесь, активность NF-кВ можно индуцировать для защиты нормальных клеток от апоптоза. Посредством индукции активности NF-кВ у млекопитающего нормальные клетки могут быть защищены от апоптоза, приписываемого клеточному стрессу. Как только нормальные клетки восстанавливаются от стресса, активность NF-кВ может быть восстановлена до нормальных уровней. Посредством временной индукции активности NF-KB клетки могут быть защищены от различных стрессов. Это может обеспечить контроль как воспалительных ответов, так и выбора клеток поврежденных тканей и органов пути жизни или гибели. Защитная роль NF-кВ может быть опосредована транскрипционной активацией множества генов,кодирующих: (а) антиапоптические белки, блокирующие оба основных пути апоптоза, (б) цитокины и факторы роста, индуцирующие пролиферацию и выживание гемопоэтических и других стволовых клеток, и (в) белки, являющиеся мощными антиоксидантами, утилизирующими реактивные формы кислорода, такие как марганецзависимая супероксиддисмутаза MnSOD (SOD-2). Таким образом, например,путем временной активации NF-кВ для радиационной защиты можно достичь не только подавления апоптоза у пациентов, страдающих раком, но также способности к снижению вероятности вторичного возникновения рака благодаря его одновременным иммуностимулирующим эффектам, которые могут быть достигнуты, если активация NF-кВ опосредована Toll-подобными рецепторами. Другим привлекательным свойством биохимического пути NF-кВ В качестве мишени является его активация различными природными факторами. Среди них можно отметить различные обусловленные патогенами молекулярные паттерны (PAMP,pathogen-associated molecular patterns). PAMP присутствуют только в микроорганизмах и не обнаружены в организме хозяина, они характерны для больших групп патогенов и не могут легко подвергаться мутациям. Они распознаются Toll-подобными рецепторами (TLR), которые являются ключевыми чувствительными элементами врожденного иммунитета.TLR действуют как первый предупреждающий механизм иммунной системы посредством индукции миграции и активации иммунокомпетентых клеток непосредственно или путем высвобождения цитокина. TLR представляют собой мембранные рецепторы типа I, о которых известно, что они действуют в виде гомо- и гетеродимеров. При связывании лиганда TLR рекрутируют белок MyD88, который является необходимым адаптером передачи сигнала для большинства TLR. Последующий каскад передачи сигнала приводит к эффектам, включающим: (1) активацию пути NF-кВ И (2) активацию протеинкиназ,активируемых митогенами (МАРК), включающих N-концевую киназу Jun (JNK). В отличие от цитокинов множество РАМР обладают незначительным действием помимо активации TLR, и поэтому маловероятно, что они дают побочные эффекты. Кроме того, многочисленные TLT (TLR1-TLR10) присутствуют у людей. В соответствии с их функцией активации иммуноцитов все TLR экспрессируются в селезенке и лейкоцитах периферической крови наряду с более TLR-специфичными паттернами экспрессии в других лимфоидных органах и подгруппах лейкоцитов. Все TLR также экспрессируются в эндотелиальных клетках и клетках эпителия слизистых оболочек кожи и дыхательных, кишечных и мочеполовых путей. 1. Определения Должно быть понятно, что используемая здесь терминология предназначена только для целей описания конкретных воплощений и не предназначена для ограничения объема изобретения. Необходимо отметить, что используемые в описании и прилагаемой формуле изобретения формы единственного числа также включают и формы множественного числа, если в контексте четко не указано иное. Термин "вводить", используемый для описания дозировки агента, индуцирующего активность NFкВ, означает однократную дозу или многократные дозы этого агента. Используемый здесь термин "алифатический" относится к неразветвленной, разветвленной или циклической углеводородной группе, которая может быть замещенной или незамещенной, и которая может быть насыщенной или ненасыщенной, но которая не является ароматической. Термин "алифатический" дополнительно включает алифатические группы, которые содержат атомы кислорода, азота, серы или фосфора, замещающие один или более чем один атом углерода углеводородной цепи. Используемый здесь самостоятельно или в комбинации термин "алкил" относится к разветвленной или неразветвленной насыщенной алифатической группе. Типичные примеры алкильных групп включа-4 014644 ют метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, октил, децил, тетрадецил, гексадецил, эйкозил, тетракозил и тому подобное, но не ограничены ими. Используемый здесь самостоятельно или в комбинации термин "алкенил" относится к разветвленной или неразветвленной ненасыщенной алифатической группе, содержащей по меньшей мере одну углерод-углеродную двойную связь, которая может возникать в любой стабильной точке вдоль цепи. Репрезентативные примеры алкенильных групп включают этенил, Е- и Z-пентенил, деценил и тому подобное, но не ограничены ими. Используемый здесь самостоятельно или в комбинации термин "алкинил" относится к разветвленной или неразветвленной ненасыщенной алифатической группе, содержащей по меньшей мере одну углерод-углеродную тройную связь, которая может возникать в любой стабильной точке вдоль цепи. Репрезентативные примеры алкинильных групп включают этинил, пропинил, пропаргил, бутинил, гексинил, децинил и тому подобное, но не ограничены ими. Используемый в контексте пептида или полипептида термин "аналог" обозначает пептид или полипептид, содержащий одну или более чем одну нестандартную аминокислоту или другие структурные вариации из обычного набора аминокислот. Используемый здесь термин "антитело" обозначает антитело, принадлежащее к классам иммуноглобулинов IgG, IgM, IgA, IgD или IgE, или его фрагменты или производные, включающие Fab, F(ab')2,Fd, а также одноцепочечные антитела, диатела, антитела двойной специфичности, бифункциональные антитела и их производные. Антитело может представлять собой моноклональное антитело, поликлональное антитело, афинно очищенное антитело или их смеси, которые проявляют достаточную связывающую специфичность по отношению к желаемому эпитопу или последовательности, образованной от него. Антитело также может представлять собой химерное антитело. Можно получить производное антитела путем присоединения одной или более чем одной химической, пептидной или полипептидной группировки, известной из уровня техники. Антитело может быть конъюгировано с химической группировкой. Используемый здесь термин "апоптоз" относится к форме клеточной гибели, которая включает прогрессирующее сокращение объема клетки с сохранением целостности цитоплазматических органелл; конденсацию хроматина (то есть конденсацию ядра), что наблюдают с помощью световой или электронной микроскопии; и/или расщепление ДНК на фрагменты размера нуклеосомы, определяют с помощью анализов седиментации при центрифугировании. Клеточная гибель происходит, когда нарушается целостность клеточной мембраны (то есть пузырчатость мембраны), с поглощением интактных клеточных фрагментов ("апоптозных телец") фагоцитами. Используемый здесь термин "рак" обозначает любое состояние, характеризующееся устойчивостью к апоптическим стимулам. Используемый здесь термин "лечение рака" обозначает любое лечение рака, известное в данной области техники, включающее химиотерапию и лучевую терапию, но не ограниченное ими. Используемый для описания введения агента, индуцирующего активность NF-кВ, и дополнительного лечения, термин "комбинация с" означает, что агент может быть введен до, вместе или после дополнительного лечения, либо в сочетании с ним. Используемый в контексте пептида или полипептида термин "производное" обозначает пептид или полипептид, отличающийся чем-либо, кроме первичной структуры (аминокислоты или аналоги аминокислот). В качестве иллюстрации, производные могут отличаться гликолизированием, представляющим собой одну из форм пострансляционной модификации. Например, пептиды или полипептиды могут проявлять паттерны гликолизования, обусловленные экспрессией в гетерологичных системах. Если при этом сохраняется по меньшей мере одна из биологических активностей, эти пептиды или полипептиды представляют собой производные по изобретению. Другие производные включают слитые пептиды или слитые полипептиды, имеющие ковалентно модифицированный N- или С-конец, ПЭГилированные пептиды или полипептиды, пептиды или полипептиды, ассоциированные с липидными группировками, алкилированные пептиды или полипептиды, пептиды или полипептиды, соединенные через функциональную группу боковой цепи аминокислоты с другими пептидами, полипептидами или химическими соединениями, и дополнительные модификации, известные в области техники, но не ограничены ими. Термин "фрагмент", использованный в контексте пептида или полипептида, может обозначать пептид длиной от примерно 6 до примерно 10 аминокислот. Фрагмент может иметь длину 6, 7, 8, 9 или 10 аминокислот. Термин "гомолог", использованный в контексте пептида или полипептида, обозначает пептид или полипептид, имеющий общий эволюционный предшественник. Использованный здесь термин "насыщенный" относится к группе, в которой все доступные валентные связи атомов углеродной цепи присоединены к другим атомам. Использованный здесь термин "замещенный" относится к группе, в которой один или более чем один атом водорода или другой атом удален с атома углерода и замещен еще одной группой. Замещенные группы здесь могут быть замещены заместителями в количестве от одного до пяти или от одного до трех. Репрезентативные примеры таких заместителей включают, но не ограничены ими, алифатические-5 014644 группы, ароматические группы, алкил, алкенил, алкинил, арил, алкокси, галогено, арилокси, карбонил,акрил, циано, амино, нитро, фосфатсодержащие группы, серосодержащие группы, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, ациламино, амидино, имино, алкилтио, арилтио, тиокарбоксилат, алкилсульфинил, трифторметил,азидо, гетероциклил, алкиларил, гетероарил, семикарбазидо, тиосемикарбазидо, малеимидо, оксимино,имидат, циклоалкил, циклоалкилкарбонил, диалкиламино, арилциклоалкил, арилкарбонил, арилалкилкарбонил, арилциклоалкилкарбонил, арилфосфинил, арилалкилфосфинил, арилциклоалкилфосфинил,арилфосфонил, арилалкилфосфонил, арилциклоалкилфосфонил, арилсульфонил, арилалкилсульфонил,арилциклоалкилсульфонил, их комбинации и их замещения. Термин "лечить" или "лечение", относящиеся к защите млекопитающего от состояния, обозначают предупреждение, подавление, остановку или устранение этого состояния. Предупреждение состояния включает введение млекопитающему композиции по данному изобретению до возникновения этого состояния. Подавление состояния включает введение млекопитающему композиции по данному изобретению после возникновения состояния, но до его клинического проявления. Остановка состояния включает введение млекопитающему композиции по данному изобретению после клинического проявления этого состояния с тем, чтобы ослабить или поддерживать это состояние. Устранение состояния предполагает введение млекопитающему композиции по данному изобретению после клинического проявления этого состояния с тем, чтобы млекопитающее больше не страдало этим состоянием. Используемый здесь термин "раковая клетка" обозначает любую клетку, характеризующуюся устойчивостью к апоптическим стимулам. Используемый здесь термин "ненасыщенный" относится к группе, в которой по меньшей мере одна доступная валентная связь из двух соседних атомов углеродной цепи не присоединена к другим атомам. Используемый здесь термин "незамещенный" относится к группе, которая не имеет каких-либо дополнительных групп, присоединенных к ней или замещающих ее. Используемый здесь в контексте пептида или полипептида термин "вариант" обозначает пептид или полипептид, который отличается по аминокислотной последовательности инсерцией, делецией или консервативной заменой аминокислот, но сохраняет по меньшей мере одну биологическую активность. Для целей изобретения "биологическая активность" включает способность к связыванию специфичным антителом, но не ограничена этим. Консервативную замену аминокислоты, то есть замещение аминокислоты другой аминокислотой с подобными свойствами (например гидрофильностью, степенью заряженности и распределением заряженных участков), рассматривают в области техники как типично включающую минорную замену. Эти минорные замены можно частично идентифицировать путем рассмотрения гидропатического индекса аминокислот, как понятно в данной области техники (Kyte et al., J. Mol. Biol.,157:105-132, 1982). Гидропатический индекс аминокислоты основан на определении ее гидрофобности и заряда. В данной области техники известно, что аминокислоты с подобными гидропатическими индексами могут быть заменены и все же сохранять функцию белка. В одном аспекте заменены аминокислоты,обладающие гидропатическими индексами 2. Гидрофильность аминокислот также можно использовать для выявления замен, которые приведут в результате к белкам, сохраняющим биологическую функцию. Рассмотрение гидрофильности аминокислот в контексте пептида позволяет рассчитать наибольшую локальную среднюю гидрофильность этого пептида, полезный критерий, который, как сообщали, хорошо коррелирует с антигенностью и иммуногенностью (патент США 4554101, включенный здесь путем ссылки). Замена аминокислот, обладающих подобными значениями гидрофильности, может привести в результате к пептидам, сохраняющим биологическую активность, например имунногеность, как понятно в данной области техники. В одном аспекте замену осуществляют аминокислотами, имеющими значения гидрофильности в пределах 2 друг относительно друга. Как на индекс гидрофобности, так и на значение гидрофильности аминокислот влияет конкретная боковая цепь этой аминокислоты. Понятно, что в соответствии с этим наблюдением замены аминокислот, совместимые с биологической функцией, зависят от относительного подобия аминокислот и, в частности, боковых цепей этих аминокислот, что проявляется гидрофобностью, гидрофильностью, зарядом, размером и другими свойствами. 2. Липопептиды Липопептид может быть использован в качестве агента для индукции активности NF-кВ. Липопептиды представляют собой часть наружных мембран грамотрицательных бактерий, грамположительных бактерий и микоплазм. Бактериальные липопептиды не обладают общей гомологией последовательности, но характеризуются необычной N-концевой аминокислотой 5'-(2,3-дигидроксипропил)-L-цистеином,которая ацилирована двумя или тремя жирными кислотами. Бактериальные липопептиды являются сильными иммуномодуляторами, которые активируют ранние ответы в организме хозяина после инфекции путем передачи сигнала через гетеродимеры TLR2-TLR1 или TLR2-TLR6, приводя к активации NFкВ И продуцирования цитокинов. Синтетические аналоги N-концевых липопептидов природных липопептидов являются сильными активаторами TLR и NF-кВ, а также иммуноадъювантами in vivo и in vitro. Липопептид может представлять собой соединение формулы: где R1 представляет собой Н или -CO-R4,R2, R3 и R4 независимо представляют собой Н или возможно замещенную алифатическую группу;Z представляет собой S или СН 2. Липопептид может содержать две или три жирные кислоты. Алифатические заместители R2, R3 и R4 могут содержать от 6 до 20 атомов углерода. R2, R3 и R4 могут представлять собой С 6-С 20 алкил, С 6-С 20 алкенил или С 6-С 20 алкинил. Репрезентативные примеры алкильных заместителей на R2, R3 и R4 включают С 6, С 8, С 9, С 10, C12, С 14 и C16. Репрезентативные примеры алкенильных заместителей на R2) R3 и R4 включают C10:1D1 транс, C18:1D9 и C18:2D9,12. Пептид может содержать аминокислоты в количестве между по меньшей мере 4 или 5 и не более чем 20, 30 или 40 аминокислот. Пептидная группировка может быть существенной для активности, и активность липопептида можно модулировать аминокислотной последовательностью, но биологическая активность может быть невосприимчива к большей части пептидных последовательностей (Spohn et al,Vaccine, 22(19): 2494-9, 2004). Пептид может содержать последовательность, представленную в табл. 1,любую последовательность, по меньшей мере на 80%, 85%, 90% или 95% идентичную ей, или любой ее аналог, производное, фрагмент, гомолог, вариант или замену. Пептид может нести суммарный отрицательный заряд. Таблица 1 Первые четыре-пять аминокислот пептидной группировки липопептида могут быть выбраны из перечисленных для каждого положения в табл. 2. Эта таблица основана на статьях Spohn et al., Vaccine,22(19): 2494-9, 2004; и Reutter et al., J. Peptide Res., 65, 375-383, 2005. Липопептид может представлять собой RR- или RS-стереоизомер, либо их смесь в отношении стереохимии N-концевой липоаминокислоты. Липопептид может быть растворим в воде. 3. Лечение стресса Агент, который индуцирует активность NF-кВ, МОЖНО применять для защиты нормальных клеток от состояний или терапий, вызывающих клеточный стресс, таким образом запуская апоптоз. Типичные примеры состояний или способов лечения включают лечение рака, например лучевую терапию или химиотерапию; температурный шок; воздействие вредной дозы радиации, например на сотрудников атомных электростанций, оборонной промышленности или радиофармацевтического производства, или солдат, клеточное старение, ранение, отравление и инфекция. Агент можно вводить одновременно или поочередно с другими терапиями. Используемый здесь термин "одновременный" или "одновременно" означает, что агент и другую терапию можно вводить с интервалом 48 ч, предпочтительно 24 ч, более предпочтительно 12 ч, еще более предпочтительно 6 ч и наиболее предпочтительно 3 ч и менее чем 3 ч. Используемый здесь термин "поочередно" обозначает введение агента в моменты времени, отличающиеся от другой терапии и при определенной частоте относительно повторного введения. Агент можно вводить в любой момент времени до воздействия стресса, включая, но не ограничиваясь, примерно за 48, 46, 44, 42, 40, 38, 36, 34, 32, 30, 28, 26, 24, 22, 20, 18, 16, 14, 12, 10, 8, 6, 4, 3, 2 или 1 ч до воздействия. Агент можно вводить в любой момент после воздействия стресса, включая, но не ограничиваясь, примерно через 1, 2, 3, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44,46, 48 ч после воздействия. а. Конститутивно активный рак NF-KB Состояние может представлять собой конститутивно активный рак NF-KB. Агент, который индуцирует активность NF-KB, можно вводить в комбинации с терапией рака, такой как химиотерапия или лучевая терапия. Лечение рака может включать введение цитотоксического агента или цитостатического агента, либо их комбинации. Цитотоксические агенты препятствуют размножению раковых клеток посредством:(1) подавления способности клеток к репликации ДНК и (2) индукции клеточной гибели и/или апоптоза в раковых клетках. Цитостатические агенты действуют посредством модулирования, препятствования или подавления процессов клеточного преобразования сигнала, регулирующего клеточную пролиферацию. Классы соединений, которые можно применять в качестве цитотоксических агентов, включают следующие: алкилирующие агенты (включающие без ограничения азотистые иприты, производные этиленимина, алкилсульфонаты, нитрозомочевины и триазены): урамустин, хлорметин, циклофосфамид (Cytoxan), ифосфамид, мелфалан, хлорамбуцил, пипоброман, триэтиленмеламин, триэтилентиофосфорамин, бусульфан, кармустин, ломустин, стрептозоцин, дакарбазин и темозоломид; антиметаболиты(включающие без ограничения антагонисты фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозиндезаминазы): метотрексат, 5-фторурацил, флоксуридин, цитарабин, 6 меркаптопурин, 6-тиогуанин, флударабина фосфат, пентостатин и гемцитабин; натуральные продукты и их производные (например алкалоиды барвинка, противоопухолевые антибиотики, ферменты, лимфокины и эпиподофиллотоксины): винбластин, винкристин, виндезин, блеомицин, дактиномицин, даунорубицин, доксорубицин, эпирубицин, идарубицин, цитозин-арабинозид, паклитаксел (паклитаксел имеется в продаже под товарным знаком Таксол), митрамицин, дезоксикоформицин, митомицин-с, 1 аспарагиназа, интерфероны (предпочтительно интерферон(IFN-, этопозид и тенипозид. Другими цитотоксическими агентами, воздействующими на пролиферацию, являются навельбин,СРТ-11, анастразол, летразол, капецитабин, релоксафин, циклофосфамид, ифосамид и дролоксафин. Агенты, действующие на микротрубочки, препятствуют клеточному митозу и хорошо известны в-9 014644 данной области техники благодаря их цитотоксической активности. Агенты, действующие на микротрубочки, которые можно применять, включают, но не ограничены ими, аллоколхицин (NSC 406042), галихондрин В (NSC 609395), колхицин (NSC 757), производные колхицина (например, NSC 33410), доластатин 10 (NSC 376128), майтанзин (NSC 153858), ризоксин (NSC 332598), паклитаксел (Таксол 1, NSC 125973), производные Таксол (например, NSC 608832), тиоколхицин (NSC 361792), тритилцистеин(NSC 83265), винбластина сульфат (NSC 49842), винкристина сульфат (NSC 67574), натуральные и синтетические эпотилоны, включающие без ограничения эпотилон А, эпоптилон В и дискодермолид (см.Service (1996) Science, 274: 2009), эстрамустин, нокодазол, МАР 4 и тому подобное. Примеры таких агентов также описаны в статьях Bulinski (1997) J. Cell Sci. 110: 3055-3064; Panda (1997) Proc. Natl. Acad. Sci.Vasquez (1997) Mol. Biol. Cell. 8: 973-985; а также Panda (1996) J. Biol. Chem 271: 29807-29812. Пригодными также являются цитотоксические агенты, такие как эпидофиллотоксин, противоопухолевый фермент; ингибитор топоизомеразы; прокарбазин; митоксантрон; координационные комплексы платины, такие как цисплатин и карбоплатин; модификаторы биологического ответа; ингибиторы роста; антигормональные терапевтические агенты; лейковорин; тегафур и гемопоэтические факторы роста. Цитостатические агенты, которые можно применять, включают, но не ограничены ими, гормоны и стероиды (включая синтетические аналоги): 17 этинилэстрадиол, диэтилстильбэстрол, тестостерон,преднизон, флуоксиместерон, дромостанолона пропионат, тестолактон, мегестролацетат, метилпреднизолон, метилтестостерон, преднизолон, триамицинолон, хлортрианизен, гидроксипрогестерон, аминоглютетимид, эстрамустин, медроксипрогестеронацетат, лейпролид, флутамид, торемифен и золадекс. Также включены другие цитостатические агенты, препятствующие росту сосудов, такие как ингибиторы матриксных металлопротеиназ, а также другие ингибиторы фактора роста эндотелия сосудов(VEGF), такие как антитела к VEGF и малые молекулы, такие как ZD6474 и SU6668. Также можно применять антитела к рецептору человеческого эпидермального фактора роста типа 2 (анти-Her-2) от Genentech. Подходящим ингибитором рецептора эпидермального фактора роста (EGFR) является ЕКВ-569 (необратимый ингибитор). Также включено антитело С 225 Imclone, иммуноспецифичное к EGFR, и ингибиторы src. Также пригодным для применения в качестве цитостатического агента Casodex (бикалутамид, Astra Zeneca), который запрещает пролиферацию андрогензависимых карцином. Еще одним примером цитостатического агента является антиэстроген Тамоксифен, ингибирующий пролиферацию или рост эстрогензависимого рака молочной железы. Ингибиторы преобразования пролиферативных сигналов в клетке являются цитостатическими агентами. Репрезентативные примеры включают ингибиторы эпидермального фактора роста, ингибиторы Нег-2, ингибиторы МЕК-1 киназы, ингибиторы МАРК киназы,ингибиторы фосфатидилинозитола 3 (PI3), ингибиторы Src-киназы, а также ингибиторы фактора роста тромбоцитов PDGF. Лечение рака может включать лучевую терапию. Лучевая терапия может представлять собой дистанционную лучевую терапию, внутреннюю лучевую терапию или конформационную лучевую терапию,в которой используют компьютер для придания формы потоку лучей, соответствующей форме опухоли. Радиация, используемая в лучевой терапии, может иметь происхождение из различных источников,включая рентгеновские лучи, пучок электронов или гамма-излучение. Дозы и экспозиция применения радиоактивного излучения во время лучевой терапии может и должна варьировать в зависимости от локализации и стадии рака. Агент, который индуцирует активность NF-кВ, можно вводить с радиопротектором (см. раздел 3 г) в комбинации с лучевой терапией, как описано выше. Рак, который можно лечить, включает, но не ограничен: карциному, включая рак мочевого пузыря(в том числе ускоренный и метастатический рак мочевого пузыря), молочной железы, толстой кишки(включая колоректальный рак), почки, печени, легкого (включая мелкоклеточный и немелкоклеточный рак легкого и аденокарциному легкого), яичника, простаты, семенника, мочеполовых путей, лимфатической системы, гортани, поджелудочной железы (включая экзокринную ациноцитарную карциному), полости рта, глотки, пищевода, желудка, тонкой кишки, толстой кишки, прямой кишки, желчного пузыря,шейки матки, щитовидной железы и кожи (включая плоскоклеточную карциному); гемопоэтические опухоли лимфоидного ряда, включающие лейкоз, острый лимфолейкоз, острый лимфобластный лейкоз,В-клеточную лимфому, Т-клеточную лимфому, ходжкинскую лимфому, неходжкинскую лимфому, злокачественный ретикулоэндотелиоз, гистиоцитарную лимфому, лимфому Беркитта; гемопоэтические опухоли миелоидного ряда, включающие острые и хронические миелогенные лейкозы, миелодиспластический синдром, миелоидный лейкоз, а также промиелоцитарный лейкоз; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и невриномы; опухоли мезенхимального происхождения, включая фибросаркому, рабдомиосаркому и остеосаркому, а также другие виды опухолей, включая меланому, пигментную ксеродерму, кератоактантому, семиному, фолликулярный рак щитовидной железы и тератокарциному.- 10014644 б. Лечение побочных эффектов терапии рака Состояние может также представлять собой повреждение нормальной ткани, характерное для лечения конститутивно активного рака NF-кВ. Агент, который индуцирует активность NF-кВ, можно вводить в комбинации с терапией рака, как описано выше. в. Модулирование клеточного старения Состояние может также представлять собой клеточное старение. г. Облучение Состояние также может представлять собой воздействие облучения. Воздействие ионизирующего излучения (ИИ) может быть кратковременным или длительным, оно может быть приложено в виде однократной дозы или многократных доз, тотально (на весь организм) или локально. Таким образом, ядерные аварии или военные действия могут включать воздействие однократной высокой дозы облучения всего организма (иногда за этим следует длительное отравление радиоактивными изотопами). Подобным образом однократную дозу облучения, как правило, применяют для предварительной обработки пациентов с трансплантацией костного мозга, когда необходимо подготовить кроветворные органы хозяина к пересадке донорского костного мозга путем "очищения" их от клеток-предшественников крови хозяина. На молекулярном и клеточном уровне радиоактивные частицы могут приводить к разрывам в ДНК и поперечной сшивке между молекулами ДНК, повреждению белков, клеточных мембран и других макромолекулярных структур. Ионизирующая радиация также может вызывать вторичное повреждение клеточных компонентов путем образования свободных радикалов и реактивных форм кислорода (ROS). Множество систем репарации противостоят этому повреждению, такие как несколько биохимических путей репарации ДНК, которые восстанавливают целостность и точность ДНК, и химические соединения-антиоксиданты и ферменты, которые утилизуют свободные радикалы и ROS и восстанавливают окисленные белки и липиды. Клеточные системы контроля присутствуют для обнаружения дефектов ДНК и тормозят прохождение клеточного цикла до восстановления повреждения или принятия решения о направлении клетки на остановку роста или достижение программируемой клеточной гибели (апоптоза). На уровне организма немедленные эффекты низких или умеренных уровней радиации, в основном,вызваны клеточной гибелью, которая приводит к вызванному радиацией воспалению. При более высоких уровнях радиации так называемые гемопоэтические и желудочно-кишечные синдромы приводят к смерти, вызванной краткосрочным облучением. Гемопоэтический синдром характеризуется утратой кроветворных клеток и их предшественников, таким образом делая невозможной регенерацию кровеносной и лимфатической системы. Смерть обычно наступает в результате инфекции (вследствие подавления иммунитета), кровотечения и/или анемии. Желудочно-кишечный синдром характеризуется массовой клеточной гибелью в кишечном эпителии, преимущественно в тонкой кишке, с последующим разрушением стенки кишечника и смертью от бактериемии и сепсиса. Гемопоэтический синдром проявляется при более низких дозах облучения и приводит к более замедленной смерти, чем желудочно-кишечный синдром. Очень высокие дозы облучения могут вызвать почти мгновенную смерть вследствие дегенерации нейронов. Организмы, пережившие период острой токсичности, вызванной облучением, могут страдать от долгосрочных последствий, которые включают вызванный облучением канцерогенез и фиброз, развивающийся в облученных органах (например почках, печени или легком) в течение нескольких месяцев или даже лет после облучения. Индукторы NF-кВ обладают сильной активностью, способствующей выживанию на клеточном уровне, и могут быть применены для лечения эффектов событий естественного облучения, воздействия низких доз радиации, радиации, применяемой как часть терапии рака, или ядерных аварий. Кроме того,поскольку индукторы NF-кВ действуют посредством механизмов, отличающихся от известных в настоящее время радиопротекторов, их можно применять в комбинации с другими радиопротекторами,таким образом, значительно увеличивая масштаб защиты от ионизирующего излучения. Исторически сложилось, что радиопротекторы, как правило, представляют собой антиоксиданты и агенты, утилизующие свободные радикалы, как синтетические, так и природные. Более недавно к перечню радиопротекторов добавлены цитокины и факторы роста; считают, что механизм их радиопротекторного действия является следствием их эффекта, способствующего восстановлению восприимчивых тканей. Однако нет четкого функционального разграничения между двумя группами радиопротекторов, тем не менее, поскольку некоторые цитокины индуцируют экспрессию клеточных белков-антиоксидантов,таких как марганецзависимая супероксиддисмутаза (MnSOD) и металлотионеин, их применение может быть благоприятным. Радиопротекторы могут представлять собой любой агент, который лечит эффекты радиационного воздействия, включающий, но не ограниченный ими, антиоксиданты, агенты, утилизующие свободные радикалы, цитокины, флагеллин и латентный TGF. Антиоксиданты и агенты, утилизующие свободные радикалы, которые можно применять, включают тиолы, такие как цистеин, цистеамин, глутатион и билирубин; амифостин (WR-2721); витамин А, витамин С, витамин Е и флавоноиды, такие как Индийский базилик священный (Ocimum sanctum), ориентин и виценин, но не ограничены ими. Цитокины и факто- 11014644 ры роста обеспечивают радиационную защиту путем восполнения и/или защиты радиочувствительных популяций стволовых клеток. Цитокины, которые можно применять, включают фактор стволовых клеток(SCF, c-kit лиганд), Flt-3 лиганд, фрагмент интерлейкина-1 IL-1b-rd и фактор роста кератиноцитов (KGF). Некоторые другие факторы, хотя по природе не являются цитокинами, стимулируют пролиферацию иммуноцитов, и, следовательно, их можно применять. Они включают 5-AED (5-андростендиол), который представляет собой стероид, стимулирующий экспрессию цитокинов, и синтетические соединения, такие как трихлор(диоксоэтилен-O,O'-)теллурат аммония (AS-101). Латентный TGF, флагеллин и производные флагеллина являются сильными индукторами активности NF-кВ, как показано в Международных патентных заявкахPCT/US2004/040656 иPCT/US2004/040753 и в патентной заявке США 60/693826, содержание которых включено здесь путем ссылки. 4. Композиция Здесь также предложены композиции, содержащие терапевтически эффективное количество индуктора NF-кВ. Композиция может представлять собой фармацевтическую композицию, которую можно готовить, используя способы, хорошо известные в данной области техники. Как описано выше, композицию, содержащую индуктор NF-кВ, можно вводить млекопитающему для лечения состояний, обусловленных апоптозом, включая, но не ограничиваясь, воздействие радиации, побочные эффекты терапий рака, стресс и старение клеток. Композиция может также содержать дополнительные агенты, включающие, но не ограниченные ими, радиопротектор или химиотерапевтическое лекарственное средство. а. Введение Предложенные здесь композиции можно вводить любым способом, включающим, но не ограниченным, пероральное, парентеральное, подъязычное, чрескожное, ректальное введение, введение через слизистые оболочки, местное введение, введение путем ингаляции, трансбуккальное введение или их сочетания. Парентеральное введение включает, но не ограничено, внутривенное, внутриартериальное,внутрибрюшинное, подкожное, внутримышечное, внутриоболочечное и внутрисуставное. Для ветеринарного применения композицию можно вводить в пригодном для приема препарате в соответствии с обычной ветеринарной практикой. Ветеринар легко может определить режим дозировки и путь введения,наиболее пригодный для конкретного животного. б. Препарат Предложенные здесь композиции могут находиться в форме таблеток или пастилок, приготовленных общепринятым способом. Например таблетки и капсулы для перорального введения могут содержать общепринятые эксципиенты, включающие, но не ограниченные ими, связующие вещества, наполнители, смазывающие агенты, разрыхлители и увлажняющие агенты. Связующие вещества включают, но не ограничены ими, сироп, аравийскую камедь, желатин, сорбит, трагакантовую камедь, крахмальный клейстер и поливиниллпирролидон. Наполнители включают, но не ограничены ими, лактозу, сахар, микрокристаллическую целлюлозу, кукурузный крахмал, ортофосфат кальция и сорбит. Смазывающие агенты включают, но не ограничены ими, стеарат магния, стеариновую кислоту, тальк, полиэтиленгликоль и диоксид кремния. Разрыхлители включают, но не ограничены ими, картофельный крахмал и крахмал гликолят натрия. Увлажняющие агенты включают, но не ограничены ими, лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известными в данной области техники. Предложенные здесь композиции также могут представлять собой жидкие препараты, включающие, но не ограниченные ими, водные или масляные суспензии, растворы, эмульсии, сиропы и эликсиры. Препараты композиций также можно готовить в виде сухого продукта для восстановления водой или другим подходящим разбавителем перед применением. Такие жидкие препараты могут содержать добавки, включающие, но не ограниченные ими суспендирующие агенты, эмульгаторы, неводные разбавители и консерванты. Суспендирующие агенты включают, но не ограничены ими, сироп сорбита, метилцеллюлозу, глюкозный/сахарный сироп, желатин, гидроксиэтилцеллюлозу, карбоксиметилцеллюлозу, гель стеарата алюминия, а также гидрогенизированные пищевые жиры. Эмульгаторы включают, но не ограничены ими, лецитин, сорбитанмоноолеат и аравийскую камедь. Неводные разбавители включают, но не ограничены ими, пищевые масла, миндальное масло, фракционированное кокосовое масло, масляные эфиры, пропиленгликоль и этиловый спирт. Консерванты включают, но не ограничены ими, метил- или пропил-пара-гидроксибензоат и сорбиновую кислоту. Препараты предложенных здесь композиций также можно готовить в виде суппозиториев, которые могут содержать основы суппозиториев, включающие, но не ограниченные ими, масло какао или глицериды. Препараты предложенных здесь композиций также можно готовить для ингаляции, которая может находиться в форме, включающей без ограничения раствор, суспензию или эмульсию, которую можно вводить в виде сухого порошка или в форме аэрозоля с использованием пропеллента, такого как дихлордифторметан или трихлорфторметан. Предложенные здесь композиции также можно готовить в виде чрескожных препаратов, содержащих водные или неводные разбавители, включающих, но не ограниченных ими, кремы, мази, лосьоны, пасты, лекарственные пластыри, накладки или мембраны. Препараты предложенных здесь композиций также можно готовить для парентерального введения,- 12014644 включающего, но не ограниченного, инъекцию или непрерывную инфузию. Препараты для инъекции могут находиться в форме суспензий, растворов или эмульсий в масляных или водных разбавителях, а также могут содержать агенты для изготовления препаратов, включающие, но не ограниченные ими,суспендирующие, стабилизирующие и диспергирующие агенты. Композиция также может быть предложена в форме порошка для восстановления подходящим разбавителем, включающим, но не ограниченным, стерильную апирогенную воду. Препараты предложенных здесь композиций также можно готовить в форме депонированного препарата, который можно вводить путем имплантации или внутримышечной инъекции. Эти препараты композиций можно готовить с подходящими полимерными или гидрофобными веществами (такими как,например, эмульсия в приемлемом масле), ионообменными смолами или в виде умеренно растворимых производных (таких как, например умеренно растворимая соль). в. Дозировка Терапевтически эффективное количество агента, необходимое для применения в терапии, зависит от природы состояния, подлежащего лечению, промежутка времени, в течение которого желательна индукция активности NF-кВ, а также возраста и состояния пациента, и в конечном счете определяется лечащим врачом. Тем не менее, в общем, дозы, применяемые для лечения взрослого человека, обычно находятся в интервале от 0,001 до примерно 200 мг/кг в сутки. Доза может составлять от примерно 1 мкг/кг до примерно 10 мкг/кг в сутки. Желаемую дозу для удобства можно вводить в виде разовой дозы или в виде дробных доз, которые вводят через соответствующие интервалы времени, например две, три, четыре или более чем четыре субдозы в сутки. Часто желательны или требуются дробные дозы, поскольку активность NF-кВ В нормальных клетках может снижаться после того, как агент больше не вводят. Дозировка индуктора NF-кВ может быть любой, включая, но не ограничиваясь, примерно 1 мкг/кг,25 мкг/кг, 50 мкг/кг, 75 мкг/кг, 100 мкг/кг, 125 мкг/кг, 150 мкг/кг, 175 мкг/кг, 200 мкг/кг, 225 мкг/кг, 250 мкг/кг, 275 мкг/кг, 300 мкг/кг, 325 мкг/кг, 350 мкг/кг, 375 мкг/кг, 400 мкг/кг, 425 мкг/кг, 450 мкг/кг, 475 мкг/кг, 500 мкг/кг, 525 мкг/кг, 550 мкг/кг, 575 мкг/кг, 600 мкг/кг, 625 мкг/кг, 650 мкг/кг, 675 мкг/кг, 700 мкг/кг, 725 мкг/кг, 750 мкг/кг, 775 мкг/кг, 800 мкг/кг, 825 мкг/кг, 850 мкг/кг, 875 мкг/кг, 900 мкг/кг, 925 мкг/кг, 950 мкг/кг, 975 мкг/кг или 1 мг/кг. 5. Способы скрининга Предложенный здесь способ также относится к способам идентификации агентов, индуцирующих активность NF-кВ. Агент, индуцирующий активность NF-кВ, может быть идентифицирован способом,при котором добавляют предполагаемый индуктор активности NF-кВ в систему экспрессии, активируемую NF-кВ, сравнивают уровень экспрессии, активируемой NF-кВ, С контролем, посредством чего идентифицируют индуктор активности NF-кВ ПО способности увеличивать уровень системы экспрессии, активируемой NF-KB. Агенты-кандидаты могут присутствовать в библиотеке (то есть коллекции соединений). Такие агенты могут, например, кодироваться молекулами ДНК в экспрессионной библиотеке. Агенты-кандидаты могут присутствовать в кондиционированных средах или клеточных экстрактах. Другие подобные агенты включают соединения, известные в данной области техники как "малые молекулы", имеющие молекулярную массу менее 105 Да, предпочтительно менее 104 Да, более предпочтительно менее 103 Да. Такие агенты-кандидаты могут быть предложены в виде элементов комбинаторной библиотеки, которая включает синтетические агенты (например, пептиды), полученные в соответствии с множеством предварительно определенных химических реакций. Обычному специалисту в данной области техники понятно, что различный набор таких библиотек может быть получен в соответствии с общепринятыми методиками, и элементы библиотеки агентов-кандидатов можно подвергать скринингу одновременно или последовательно, как описано здесь. Способы скрининга могут быть проведены в различных форматах, включающих анализы in vitro,клеточный и in vivo. Для клеточного анализа можно использовать любые клетки. Предпочтительно клетки, которые можно использовать, включают клетки млекопитающих, более предпочтительно человеческие клетки и клетки приматов, отличающихся от человека. Скрининг на клеточной основе можно проводить с использованием генетически модифицированных клеток опухолей, экспрессирующих суррогатные маркеры активации NF-кВ. Такие маркеры включают, но не ограничены ими, бактериальную ргалактозидазу, люциферазу и зеленый флуоресцентный белок с энхансером (EGFP). Уровень экспрессии суррогатного маркера можно измерять, используя методики, стандартные в данной области техники,включающие, но не ограниченные ими, колориметрию, люминометрию и флуориметрию. Условия, при которых предполагаемые модуляторы добавляют в клетку, например путем смешивания, представляют собой условия, при которых клетка может претерпевать апоптоз или передачу сигнала, если другие регуляторные соединения, препятствующие апоптозу или передаче сигнала, по существу,отсутствуют. Эффективные условия включают, но не ограничены ими, подходящую среду, температуру,рН и кислородные условия, позволяющие клеткам расти. Подходящей средой обычно является твердая или жидкая среда, содержащая факторы роста и источники ассимилируемого углерода, азота и фосфатов,а также подходящие соли, минералы, металлы и другие питательные вещества, такие как витамины, и включает эффективную среду, в которой можно культивировать клетку таким образом, что она будет- 13014644 демонстрировать апоптозу или передачу сигнала. Например, для клеток млекопитающих среды могут включать модифицированную Дульбекко среду Игла, содержащую 10% фетальную сыворотку теленка. Клетки можно культивировать в различных контейнерах, включая, но не ограничиваясь, флаконы для культуры тканей, пробирки, микротитрационные планшеты и чашки Петри. Культивирование проводят при температуре, рН и содержании диоксида углерода, пригодных для клеток. Такие условия культивирования также находятся в пределах компетенции специалистов в данной области техники. Способы добавления предполагаемого модулятора в клетку включают электропорацию, микроинъекцию, клеточную экспрессию (то есть использование экспрессионной системы, включающих молекулы депротеинизированных нуклеиновых кислот, рекомбинантный вирус, ретровирусные экспрессионные векторы и аденовирусную экспрессию), использование агентов для образования ионной пары, а также использование детергентов для улучшения клеточной проницаемости. Настоящее изобретение имеет множество аспектов, которые проиллюстрированы приведенными ниже примерами, не ограничивающими объем настоящего изобретения. Пример 1. Дефицит р 53 ускоряет развитие желудочно-кишечного (ЖК) синдрома у мышей Основная причина смерти млекопитающих от действия ионизирующего излучения (ИИ) зависит от дозы облучения. При дозах вплоть до 9-10 Гр мыши погибают через 12-20 дней, в основном, от летального истощения костного мозга, то есть гемопоэтического (ГП) синдрома. При этой дозе облученных мышей можно спасти от смерти путем трансплантации костного мозга. Животные, получившие дозу 13-15 Гр, погибают в течение 7-12 дней после обработки (то есть до того, как они могли бы умереть от гемопоэтического синдрома) от осложнений повреждения тонкой кишки, то есть желудочно-кишечного(ЖК) синдрома. Известно, что пролиферация эпителиальных клеток тонкой кишки ограничена криптами,где расположены стволовые клетки и ранние пролиферирующие клетки-предшественники. После пары клеточных делений уже дифференцированные потомки стволовых клеток крипт поднимаются по ворсинкам и отпадают с их кончиков. В тонком кишечнике мыши все "путешествие" клетки (от пролиферативного компартмента до кончика ворсинки) обычно занимает от 3 до 5 суток. Хотя реакция тонкого кишечника на гамма-излучение хорошо изучена на патоморфологическом уровне, до сих пор остается неясной точная причина летального эффекта ЖК синдрома, включая первичное событие. Смерть может наступить как прямое следствие повреждения эпителиальных клеток крипт с последующим оголением ворсинок, что приводит к жидкостному и электролитическому дисбалансу, бактериемии и эндотоксемии. Помимо воспалительного и стромального ответов, эндотелиальные дисфункции, по видимому, являются важными факторами, вносящими вклад в летальный исход. Как при ГП, так и при ЖК синдроме летальное повреждение ткани возникает в результате массивного зависимого от р 53 апоптоза. Кроме того, продемонстрировано, что зависимая от р 53 утрата волос(алопеция) возникает в результате экспериментальной химиотерапии или облучения. Таким образом, повидимому, р 53 может играть роль в сенсибилизации клеток к генотоксическому стрессу. Для исследования роли р 53 в вызванной радиоактивным излучением смерти мышей обрабатывали низкомолекулярным ингибитором р 53, пифитрином-альфа (PFT) (Komarov et al., Science 285: 1733-7,1999), непосредственно перед гамма-излучением. Мышам C57B1/6J (если не указано иное, здесь и далее использовали самцов в возрасте 6-8 недель) внутрибрюшинно инъецировали 10 МГ/КГ PFTa, а затем облучали с использованием источника цезия 137 Shepherd 4000 Ки при мощности дозы 4 Гр в минуту. PFTa защищал мышей от разовой дозы гамма-излучения 9 Гр или фракционированной кумулятивной дозы радиоактивного излучения 12,5 Гр (5 х 2,5 Гр). Напротив, PFTa не обладал эффектом на выживание мышей, обработанных разовыми высокими дозами, то есть 12,5 или 25 Гр ИИ (фиг. 1 а). Для дополнительного исследования роли р 53 в ЖК синдроме мышей дикого типа и мышей с дефицитом р 53 подвергали воздействию низкой (10 Гр) и высокой (15 Гр) доз гамма-излучения. Как изображено на фиг. 1b, мыши с дефицитом по р 53 были устойчивы к низким дозам облучения, которые убивают посредством ГП синдрома, но гораздо более чувствительны к более высоким дозам облучения, которые убивают посредством ЖК синдрома. Парафиновые срезы тонкой кишки мышей дикого типа и мышей-нуль мутантов по р 53, окрашенные гематоксилином-эозином, спустя 0, 24, 48, 72 и 96 ч после дозы гамма-излучения 15 Гр представлены на фиг. 1d. Мыши с дефицитом по р 53 демонстрировали ускоренное повреждение эпителиальных клеток. Окрашивание крипт TUNEL (через 24 ч) выявило, что апоптоз был очевиден у мышей дикого типа,но не для дефицитного по р 53 эпителия. Для дополнительного исследования этого мышей дикого типа подвергали тотальному облучению организма 11 Гр, а затем через 12 ч им инъецировали 1,5107 клеток костного мозга мышей дикого типа или сингенных мышей C57B1/6J p53-null (Эта доза радиации вызывала 100% летальность у не восстановленных контрольных мышей). Через два месяца после полного восстановления кроветворения две группы животных обрабатывали 15 Гр тотального гамма-облучения организма. Как изображено на фиг. 1 с, отсутствовало различие в уровне смерти между двумя группами мышей, которые отличались по р 53 статусу их костного мозга (обе группы имели клетки тонкого кишечника дикого типа). Динамику клеточной пролиферации и выживание клеток дополнительно исследовали в тонком ки- 14014644 шечнике мышей дикого типа и мышей p53-null. Четырехнедельным мышам дикого типа и мышам p53null внутрибрюшинно инъецировали 14 С-тимидин (10 мкКи на животное) и затем половину каждой группы подвергали воздействию гамма-излучения 15 Гр. Авторадиография срезов всего организма выявила,что через 24 ч клетки в криптах тонкого кишечника мышей с дефицитом по р 53 продолжали пролиферировать, тогда как клетки у мышей дикого типа не претерпевали деление (фиг. 2 а, слева). Четырехнедельных мышей дикого типа и мышей p53-null обрабатывали гамма-излучением 15 Гр, и за 2 ч перед умерщвлением им инъецировали BrdU (50 мг/кг), и тонкий кишечник подвергали иммунологическому окрашиванию. Через 24 ч после облучения у мышей p53-null имелось множество пролиферирующих клеток,и лишь немного у мышей дикого типа. Наоборот, через 96 ч имелось лишь небольшое количество пролиферирующих клеток у мышей p53-null, тогда как у мышей дикого типа было выявлено большее количество меченых клеток. Для того чтобы дополнительно охарактеризовать вышеизложенное, в образцах тонкого кишечника мышей дикого типа и мышей p53-null в различные моменты времени после гамма-излучения 15 Гр считали количество клеток, положительных по BrdU. В каждый момент времени анализировали трех животных, для каждого животного готовили по пять поперечных срезов на уровне подвздошной кости и микроскопически анализировали для оценки количества крипт и ворсинок. Число положительных по BrdU клеток в криптах подсчитывали в пяти случайно выбранных полях под увеличением 200 (100-300 крипт) и на график наносили среднее число клеток, положительных по BrdU (фиг. 2b). Число положительных по BrdU клеток у мышей p53-null достигало пика через 10 ч, а затем уменьшалось, тогда как число положительных по BrdU клеток у мышей дикого типа уменьшалось в течение первых 20 ч, а затем увеличивалось. Локализацию клеток, меченых BrdU, прослеживали в тонком кишечнике мышей дикого типа и мышей p53-null в различные моменты времени после гамма-излучения 15 Гр. BrdU инъецировали за 30 мин перед облучением, и мышей умерщвляли через 0, 48, 72 и 96 ч. У мышей p53-null происходила ускоренная миграция меченых BrdU клеток из крипт в ворсинки (по сравнению с мышами дикого типа иp53-null через 48 ч) с последующей быстрой элиминацией меченых клеток у мышей р 53-null (фиг. 2 с). Таким образом, длительная клеточная пролиферация в криптах облученного дефицитного по р 53 эпителия коррелирует с ускоренной гибелью поврежденных клеток крипты и быстрым разрушением ворсинок. Тем не менее, у мышей дикого типа р 53 продлевал выживание в результате индукции остановки роста в криптах тонкой кишки, таким образом, сохраняя целостность кишечника. Таким образом, проапоптическая функция р 53 способствует развитию гемопоэтического синдрома, тогда как его функция остановки роста замедляет развитие желудочно-кишечного синдрома. Таким образом, фармакологическая супрессия р 53 может оказаться бесполезной (если не вредной) против ЖК синдрома. Таким образом, необходимо разрабатывать альтернативные подходы к защите от радиации эпителия тонкой кишки,которые будут основаны на другом механизме, таком как, например, активация NF-кВ И последующее ингибирование клеточной гибели. Пример 2. Липопептиды замедляют гибель мышей, вызванную тотальным гамма-облучением организма. Липопептиды являются сильными активаторами NF-кВ И сами по себе могут действовать в качестве ингибиторов апоптической гибели. Чтобы определить, действуют ли липопептиды в качестве радиопротекторов, различные липопептиды сначала тестировали на определение предельно допустимой дозы(ПДД). Затем различные липопептиды тестировали на измерение их защитного эффекта у мышей NIHSwiss в отношении летальных гемопоэтического или желудочно-кишечного синдромов после воздействия 10 Гр или 13-15 Гр тотального гамма-облучения организма соответственно. Липопептиды (0,3-10 мкг/мышь) вводили подкожно за 30 мин перед облучением. Протестированные липопептиды, которые обеспечивали защиту от радиации, представлены в табл. 3. Таблица 3 Результаты репрезентативного эксперимента с использованием R-PAM2C-SKKKK (SEQ ID NO: 8)(здесь далее это соединение названо CBLB601) при 0,1 ПДД изображены на фиг. 3. Как ожидали, контрольные мыши, которых облучили 10 Гр, погибали на 11-15 сутки после обработки, тогда как все животные, которые получали CBLB601, жили в течение более 35 суток после обработки. Аналогично, кон- 15014644 трольные мыши, которых облучали 13 Гр, погибали на 6-10 сутки после обработки, тогда как все животные за исключением одного, которые получали CBLB601, жили в течение более 35 суток после обработки. Радиопротекторную способность CBLB601 дополнительно анализировали путем измерения действия радиации на размер селезенки. Как изображено на фиг. 4, мыши, которых обрабатывали CBLB601, демонстрировали значительно меньшее сокращение размера селезенки. CBLB601 также защищал тимус от радиоактивного излучения (данные не представлены). Способность CBLB601 к эффективной защите спленоцитов, поддержанию быстрого восстановления тимуса и защите ЖК тракта от радиационного повреждения свидетельствует о том, что липопептиды можно применять в качестве радиопротекторов. Пример 3. Радиопротекторная эффективность разовой дозы CBLB601 против тотального гаммаоблучения организмаCBLB601, представляющий собой R-Pam2-липопептид с пептидной группировкой, состоящей из CSKKKK (SEQ ID NO: 8), отбирали для более подробной характеристики в качестве радиопротектора,основываясь на его способности к активации NF-кВ И предварительных полученных in vivo данных по радиационной защите у мышей NIH-SWISS (см. пример 2). Задачи этого исследования заключались в определении оптимальной дозы, пути введения и момента введения CBLB601 для того, чтобы он служил в качестве радиопротектора. Использовали самок мышей ICR в возрасте 10-15 недель, где на группу или условия использовали по 10-15 животных. Дозу, обеспечивающую уровень отсутствия очевидных вредных эффектов (NOAEL), определяли путем внутрибрюшинной (i.p.) инъекции мышам ICR возрастающими дозами CBLB601 (0,3, 1, 3, 10, 30,60, 100 мкг/мышь). Контрольным мышам инъецировали ФСБ. За мышами наблюдали в течение двух недель. В течение первой недели их ежесуточно взвешивали. Отсутствовали различия в массе между мышами, обработанными CBLB601, и контрольными мышами. Смертность обнаруживали через 1-2 суток после обработки 100 мкг CBLB601/мышь, но не при какой-либо из меньших доз. Тем не менее, при дозе 60 мкг мыши демонстрировали симптомы болезненного состояния, такие как низкая подвижность и неухоженный мех, примерно через 3-4 суток после обработки. При дозе 30 мкг не обнаружены заметные различия между обработанными и контрольными мышами. Таким образом, определили, что NOAEL дляCBLB601 составляет 30 мкг/мышь. Оптимальную схему внутрибрюшинного введения CBLB601 определяли путем инъекции соединения в различные моменты времени перед облучением. Ранее обнаружили, что CBLB601 обеспечивал защиту от 10 Гр, но не от более высоких доз облучения (см. Пример 2). Таким образом, все эксперименты по оптимизации проводили при дозе тотального облучения организма (ТОО) 10 Гр. В качестве исходной дозы была выбрана доза 3 мкг CLB601/мышь (1/10 NOAEL). Таким образом, 3 мкг CBLB601 инъецировали мышам ICR i.p. за 0,5, 1, 6 и 24 ч или 1, 24, 48, 72, 96 ч перед 10 Гр ТОО (как описано в примере 1). После облучения за мышами наблюдали в течение 30 суток и регистрировали их выживание. Результаты этих экспериментов обобщены на фиг. 5. Инъекция CBLB601 за 24 ч перед облучением ясно обеспечивала наилучшую защиту от радиации (90-100% выживание в течение 30 суток). Когда соединение вводили за 48 ч перед облучением, защита от радиации составляла примерно 30%. Введение CBLB601 за 1 ч перед облучением приводило к несовместимым результатам, которые находились в интервале от 80% защиты в одном из экспериментов (фиг. 5 В) почти до отсутствия защиты (20%) в другом эксперименте(фиг. 5 А). Никакой защиты от радиации не обнаруживали, когда лекарственное средство вводили за 0,5 ч(10%), 6 ч (20%), 72 ч и 96 ч до ТОО. Для определения оптимальной радиопротекторной дозы CBLB601 момент инъекции и уровень облучения поддерживали постоянными, тогда как доза CBLB601 варьировала. Мышам ICR инъецировалиi.p. 1,3, 10, 20 или 30 мкг CBLB601/мышь или 0,1, 0,3, 1, 3, 10 или 15 CBLB601/мышь за 24 ч перед облучением (10 Гр ТОО), и за их выживанием следили в течение 30 суток. Наилучшая защитная доза составляла 3 мкг/мышь, обеспечивая 100% выживание (фиг. 6 А и В). Почти подобная эффективность была достигнута при дозах 1 и 10 мкг/мышь, которые защищали 90% мышей (в одном из экспериментов). Наоборот, более высокие дозы CBLB601 (20 и 30 мкг/мышь) приводили к ускоренной смертности при введении в сочетании с облучением по сравнению с инъекцией ФСБ контрольным мышам. Некоторые симптомы этой комбинированной токсичности можно было обнаружить уже при дозе 10 мкг/мышь. Таким образом, определили, что оптимальная защитная доза CBLB601 составляет 3 мкг/мышь. Таким образом,хотя, по-видимому, CBLB601 обеспечивал радиопротекторное действие в дозе в 10-30 раз меньше, чемNOAEL, границы безопасности CBLB601 были значительно снижены, когда CBLB601 вводили в сочетании с облучением. Для определения уровня радиации, от которого защищал CBLB601, мышей, обработанных радиопротекторным агентом, и контрольных мышей подвергали воздействию возрастающих уровней ТОО. Группам мышей ICR инъецировали i.p. 3 мкг CBLВ 601/мышь или ФСБ, а затем через 24 ч они получали дозы ТОО 10, 11, 12, 13, 14 и 15 Гр. Выживание регистрировали в течение 30 суток. Фиг. 7 А демонстрирует зависимую от дозы радиации смертность у мышей, которым инъецировали ФСБ. Все мыши, которых облучали 10-11 Гр ТОО, погибали на 12-14 день после облучения, что было типичным для смерти вследствие нарушения кроветворения. Все мыши, которые получали 14-15 Гр ТОО, погибали на 7-9 день после облучения, что было типичным для смертности от вызванного радиацией повреждения кишечника.- 16014644 Мыши, которых облучали 12-13 Гр ТОО, погибали в течение промежуточного времени, что было типично для смешанной этиологии смертности, вызванной радиацией. Фиг. 7 В демонстрирует зависимую от дозы радиации смертность мышей, предварительно обработанных CBLB601. Мыши, которым инъецировали 3 мкг CBLB601 за 24 ч перед облучением, как ожидали, были полностью защищены от 10 Гр ТОО. Несмотря на очевидные различия в выживании между контрольными и обработанными мышами, защитные эффекты CBLB601 не достигали статистической значимости при данной постановке эксперимента. Для достижения статистически значимого 10% различия между контрольными и обработаннымиCBLB601 мышами необходимо использовать экспериментальные группы, состоящие по меньшей мере из 50 мышей. Хотя CBLB601 спасал 100% мышей от 10 Гр ТОО, его защитное действие при 11 Гр ТОО составляло лишь 20%. Отсутствовала защита от облучения при уровнях выше 11 Гр, что свидетельствовало о том, что CBLB601 не был способен защищать животных от желудочно-кишечной составляющей радиотоксичности. Кроме того, при дозах облучения 11,12 и 13 Гр мыши, обработанные CBLB601, погибали при ускоренной кинетике, то есть подобно тем, которые получали дозу 14-15 Гр, по сравнению с контрольными мышами, которым инъецировали ФСБ. Вышеизложенное может указывать на комбинированную токсичность лекарственного средства и облучения. Таким образом, по-видимому, при более высоких уровнях облучения CBLB601 не обеспечивал защиту и был также более токсичен.CBLB601 вводили внутримышечно для определения оптимального пути введения этого соединения(в особенности, поскольку этот путь введения может представлять собой предпочтительный путь введения для людей). Фиг. 8 демонстрирует уровни выживания мышей, которым внутримышечно (i.m.) инъецировали 1, 3 или 10 мкг CBLB601/мышь за 24 ч перед облучением. Все три дозы CBLB601 обеспечивали защиту от радиации; и отсутствовали симптомы комбинированной токсичности при i.m. дозе 10 мкг/мышь, как было обнаружено для i.p. дозы 10 мкг/мышь (фиг. 6). В другом эксперименте возрастающие дозы CBLB601, вводимые i.m., тестировали в отношении доз 10, 11 и 12 Гр ТОО (фиг. 9). Отсутствовал статистически значимый сдвиг в сторону повышенной смертности у мышей, которым инъецировали более высокие дозы (10, 30 мкг) CBLB601 перед воздействием 10 Гр ТОО. Сводные результаты по зависимой от дозы защите от радиации для CBLB610, вводимому i.p. или i.m. за 24 ч до 10 Гр ТОО,представлены на фиг. 10. В соответствии с этими данными можно сделать заключение, что i.m. путь введения был столь же эффективен, что и i.p. путь, и оптимальная доза (3 мкг/мышь) была одинаковой для обоих путей введения. Кроме того, сделали заключение, что i.m. введение может быть более безопасным,поскольку имеет более высокий терапевтический индекс (токсичная доза/эффективная доза): 10-30 дляi.m. введения (фиг. 8 и 9: 30 мкг/мышь/1-2 мкг/мышь) по сравнению с 3-10 для i.p. введения (фиг. 6: 10 мкг/мышь/1-3 мкг/мышь). Дополнительно, перерасчет эффективной дозы на массу тела выявил меньший диапазон для внутрибрюшинного введения по сравнению с внутримышечным введением; т.е. 90-110 мкг/кг для i.p. доставки и 60-115 мкг/кг для i.m. доставки (фиг. 11). Оптимальную схему внутримышечного введения CBLB601 определяли путем варьирования времени между введением лекарственного средства и облучением. Мышам ICR инъецировали i.m. 3 мкгCBLB601/мышь за 24 ч, 6 ч, 3 ч и 1 ч перед ТОО и +1 ч, +3 ч после ТОО (фиг. 12 А), а также за 48 ч, 36 ч,24 ч, 12 ч и 6 ч перед ТОО (фиг. 12 В). Эти эксперименты выявили, что, по аналогии с внутрибрюшинным путем доставки оптимальное время для внутримышечной доставки CBLB601 составляло 24 ч до 10 Гр ТОО. Внутримышечное введение 3 мкг CBLB610/мышь после (1 ч и 3 ч) 10 Гр ТОО не оказывало защитного эффекта (фиг. 12 А). Кроме того, более высокие дозы CBLB601 (10 и 30 мкг/мышь), инъецированные i.m. через 1 ч после 10 Гр ТОО, вызывали повышенные уровни комбинированной токсичности (фиг. 13 С). Эти данные обобщены на фиг. 13. Для определения КМД (коэффициента модификации дозы) 3 мкг CBLВ 601/мышь инъецировалиi.m. за 24 ч перед облучением, и контрольным мышам инъецировали ФСБ. Как группа, которой вводили лекарственное средство, так и контрольная группа получили разовую дозу ТОО, охватывающую интервал дозы, который приводит к 10-90% смертности в пределах выбранных интервалов времени (7 суток для смерти от желудочно-кишечного синдрома и 30 суток для смерти от гемопоэтического синдрома). Строили графики зависимости процента смертности от дозы радиации и рассчитывали LD50/7 и LD50/30(соответственно средняя летальная доза LD50 для 7 суток и 30 суток) с использованием статистического анализа ProBit или Logit. КМД (также известный как коэффициент уменьшения дозы, КУД) рассчитывали как отношение LD50 радиации для групп мышей, обработанных CBLB601, и LD50 радиации для групп мышей, обработанных разбавителем, для выбранного периода выживания 7 или 30 суток. Для расчета КМД 30, который представляет собой КМД на 30 сутки после облучения, определяли значения LD50/30 радиации для мышей, обработанных ФСБ или 3 мкг CBLB601. Для этого группы, которым инъецировали ФСБ, облучали дозами 6, 6,5, 7 и 7,7 Гр ТОО, а группы, которым инъецировали CBLB601, облучали дозами 10,10,5, 11, 11,5 и 12 Гр ТОО. LDV для CBLB601 рассчитывали с использованием анализа ProBit и оценили, что оно находится в интервале 11,07-11,61 Гр при среднем значении примерно 11,32 Гр (см. фиг. 14). Тем не менее, несогласованность в ответе на некоторые дозы облучения (7 Гр, по-видимому,является нетоксичной, тогда как 6,5 Гр вызывала 60% смертность в течение 30 суток) у контрольных мышей препятствовала точному расчету КМД 30 для CBLB601. Тем не менее, ожидали, что LD50/30 для мышей ICR составляет примерно 7 Гр [среднее значение для большинства линий мышей; Monobe et al.,- 17014644Radiother Oncology 73 Suppl 2: S12709, 2004)]. Таким образом, значение КМД 30 для CBLB601 грубо оценивали как примерно 1,6. Пример 4. Иммунный статус мышей, спасенных от летальных доз ТОО с помощью CBLB601 Мыши, которых спасли после 10 Гр ТОО путем введения CBLB601, могли иметь нарушение иммунной системы и следовательно, могли утратить "нормальную" жизнь. Для проверки статуса их иммунной системы мышей ICR подвергали воздействию летальной (10 Гр) или нелетальной (6 Гр) дозы ТОО через 24 ч после инъекции (i.m.) 3 мкг CBLB601/мышь или ФСБ. Группы из пяти мышей для каждого условия умерщвляли каждые трое суток, и селезенки и тимусы извлекали и взвешивали. Массы селезенок нормализовали по массе тела соответствующих животных, и эти результаты представлены на фиг. 15. Мышам, обработанным ФСБ, которых подвергали воздействию 6 Гр радиации, требовалось примерно 13-14 суток для восстановления их селезенок до нормальной массы, тогда как мыши, обработанныеCBLB601, которых подвергали воздействию 6 Гр радиации, имели нормальные массы селезенки на сутки 8. Животные, которым инъецировали ФСБ, не выживали после 10 Гр ТОО, тогда как мыши, которым инъецировали CBLB601, не только выживали после летальной дозы радиации, но у них также полностью восстанавливались массы селезенок на 13-14 день после облучения. Для восстановления тимусов до нормальной массы потребовался более длительный период времени (примерно 30 суток) (данные не представлены). Селезенки и тимусы контрольных мышей и мышей, которым инъецировали CBLB601, исследовали микроскопически на морфологические изменения на 3, 10 и 30 сутки после облучения. На 3 сутки после облучения в селезенках и тимусах контрольных мышей и мышей, обработанных CBLB601, которых подвергали 10 Гр тотального облучения организма, выявили вызванные радиоактивным излучением повреждения, включающие умеренно тяжелое или тяжелое лимфоидное истощение селезенки и тимуса и тяжелую атрофию красной пульпы селезенки. На 10-е сутки после облучения животные, обработанныеCBLB601, продемонстрировали улучшение по сравнению с контрольными животными в восстановлении после атрофии красной пульпы селезенки; все животные, обработанные CBLB601, показали мультифокальное внекостномозговое кроветворение (МВК) от слабого до умеренного, тогда как ни в одном из контролей не выявлено МВК. На сутки 10 не было данных по восстановлению истощения белой пульпы селезенки ни в одной из групп. Регенеративная лимфоидная гиперплазия в тимусе была очевидна в обеих группах на сутки 10, причем регенерация была несколько более усилена в контрольной группе по сравнению с мышами, обработанными CBLB601. На 30 сутки после облучения все животные имели нормальную красную пульпу селезенки, большая часть животных демонстрировала полное или почти полное восстановление элементов лимфоидной системы, и все животные, по существу, имели нормальные тимусы. Для тестирования иммунного ответа мышей, которых спасли от летальной дозы гамма-облучения(10 Гр ТОО) с помощью CBLB601, несколько групп таких мышей подвергали иммунизации сильным антигеном, представляющим собой флагеллин Salmonella. Мышей сначала иммунизировали на 8, 18 или 20 недели после облучения, когда они имели возраст соответственно 18, 25 и 33 недели. Необлученных необработанных мышей в возрасте 29 недель использовали в качестве положительного контроля на иммунный ответ. Мыши получали бустер-дозу флагеллина через неделю после первой иммунизации и еще одну бустер-дозу через три недели после 2-й бустер-иммунизации; в сыворотке крови мышей измеряли титры антител против флагеллина. Для тестирования вторичного иммунного ответа у мышей вновь отбирали кровь через месяц для того, чтобы удостовериться в снижении титров антител. За этим следовала 3-я бустер-иммунизация путем инъекции антигена, и измерение титров антител против флагеллина осуществляли через 10 суток. В момент 3-й бустер-иммунизации возраст облученных мышей составлял 38,30 и 23 недели, а возраст контрольных мышей составлял 34 недели. Иммунный ответ через месяц после первой иммунизации (три недели после первой бустериммунизации) представлен на фиг. 16 А. У обработанных CBLN601 облученных мышей развивался устойчивый гуморальный иммунный ответ против флагеллина, который не отличался от иммунного ответа у необработанных контрольных мышей. Также оказывается, что уровень иммунного ответа не зависел от периода времени, который протекал после облучения, поскольку все группы демонстрировали хороший ответ. Хотя существовали некоторые индивидуальные вариации в 20-недельной группе после облучения,хорошо известно, что иммунный ответ может быть нарушен у более старых животных. Титры антител вновь контролировали через месяц после первого забора крови, и они были все еще повышены в течение семи недель после иммунизации (фиг. 16 В). Вторичный иммунный ответ (фиг. 16 С) был сильнее первого иммунного ответа (фиг. 16 А). Эти данные являются сильным свидетельством в пользу того, чтоCBLB601 не только спасал мышей от летального ТОО, но также давал возможность для полного восстановления функциональной иммунной системы.- 18014644 Пример 5. Активация NF-кВ И защита от радиации, обеспечиваемая другими липопептидами Дополнительные липопептиды синтезировали и тестировали на активацию NF-кВ и их способность защищать мышей от летальных доз радиоактивного излучения. Названия соединений и их ключевые составляющие представлены в табл. 4. Для некоторых соединений также синтезировали и тестировали соответствующие свободные пептиды. Таблица 4NF-кВ-зависимую репортерную активность измеряли в клетках 293, которые экспрессировали гетеродимер TLR2/YLR6. Активация in vitro NF-кВ при помощи CBLB613 была сравнима с активациейCBLN601 (фиг. 17). Соединения CBLB614 и CBLB615 имели последовательно более короткие производные пептида CBLB612 (см. табл. 4). Все три соединения активировали NF-KB репортер, и все представляли собой лучшие активаторы по сравнению с CBLB601 (фиг. 18 А, В). Ни один из непальмитоилированных соответствующих пептидов не активировал NF-кВ репортер (фиг. 18 В). Пептидный компонентCBLB617 имел заряд (-4), который должен предотвращать его взаимодействие с отрицательно заряженными маркерами клеточной поверхности. Активация NF-кВ CBLB617 была сравнима с активацией Также тестировали радиопротекторную активность in vivo некоторых соединений. Мышам ICR внутримышечно инъецировали различные дозы тестируемых соединений, а затем через 24 часа мышей подвергали воздействию 10 Гр ТОО. Выживание контролировали в течение 30 суток. Фиг. 20 демонстрирует защитную активность CBLB613. Дозы 10, 30 и 82,5 мкг CBLB613/мышь обеспечивали 100% защиту и были нетоксичны в сочетании с радиоактивным излучением (в противоположность CBLB601). Родственные соединения CBLB612, CBLB614 и CBLB615 тестировали на радиопротекторную активность против 10 Гр ТОО. Дозы 1, 3, 10 и 30 мкг/мышь (CBLB612 также тестировали при 60 мкг/мышь) инъецировали мышам ICR i.m. за 24 ч до облучения. Как изображено на фиг. 21, все три соединения обеспечивали 90-100% защиту от радиации при введении при наивысших дозах. Защита от радиации очевидно зависела от дозы при отсутствии токсичности в сочетании с радиоактивным излучением. Эффективность соединений была следующей: CBLB612CBLB614CBLB615. Радиопротекторная активность CBLB617 в настоящее время проходит оценку с использованием стандартной методики. Через 13 суток не наблюдалось видимой токсичности при наивысшей дозе (87,5 мкг/мышь), хотя выживание составляло 7-90% при дозах 10-87,5 мкг/мышь, соответственно. В заключение, CBLB612 и CBLB613 являются значительно лучшими радиопротекторными агентами по сравнению с CBLB601, и они обладают более высокими терапевтическими индексами (примерно 20 для CBLB612 и CBLB613 по сравнению с 3 для CBLB601). Также исследовали способность CBLB612 служить в качестве средства, смягчающего поражения от более низкой дозы радиации. Для этого 50 мкг CBLB612/мышь внутримышечно инъецировали через 1 ч после воздействия 8,5, 9 или 10 Гр ТОО. Обработка CBLB612 увеличивала уровень выживания при каждой дозе облучения (фиг. 22). Например, при 8,5 Гр 90% мышей, обработанных CBLB612, и 50% мышей,обработанных ФСБ, выживало до 27 суток (р=0,03), и при 9 Гр 70% мышей, обработанных CBLB612, и 50% мышей, обработанных ФСБ, выживало до 27 суток (р=0,0006). Не наблюдали различий между мышами, обработанными CBLB612, и контрольной группой при более низких дозах радиации ввиду низкой выживаемости контрольных мышей (не изображено). Эти данные свидетельствуют о том, что CBLB612 может служить в качестве средства, смягчающего действие радиоактивного излучения, а также в качестве радиопротекторного агента.
МПК / Метки
МПК: A61K 38/07, A61K 38/02, A61P 35/00, A61K 38/08, A61K 38/16, A61K 38/10
Метки: липопептидов, апоптоза, применением, защиты, способы
Код ссылки
<a href="https://eas.patents.su/30-14644-sposoby-zashhity-ot-apoptoza-s-primeneniem-lipopeptidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы защиты от апоптоза с применением липопептидов</a>
Предыдущий патент: Способ получения растительного сырья, обогащенного глюкозамином, и растительный экстракт, обогащенный глюкозамином
Следующий патент: Циклопентадиенильно-флуоренильные лиганды с углеродными мостиками
Случайный патент: Электропарогенератор