Индукторы апоптоза, содержащие их противораковые и канцеростатические средства, способ индуцирования апоптоза, полисахариды и способы их получения
Номер патента: 3902
Опубликовано: 30.10.2003
Авторы: Като Икуносин, Китано Хидео, Катаяма Каору, Кодзима Каору, Ю Фу-Гонг, Кимура Хитоми, Симанака Казуо, Сакай Такеси, Накаяма Синдзи, Наканиси Йосикуни, Томинага Таканари, Икай Кацусиге
Формула / Реферат
1. Индуктор апоптоза, включающий сульфированный(ые) фукозусодержащий(ие) полисахарид(ы) и/или продукт(ы) его(их) расщепления, причем указанный(ые) сульфированный(ые) фукозусодежащий(ие) полисахарид(ы) имеет(ют) следующие физико-химические свойства:
(а) составляющий его(их) сахарид содержит уроновую кислоту и
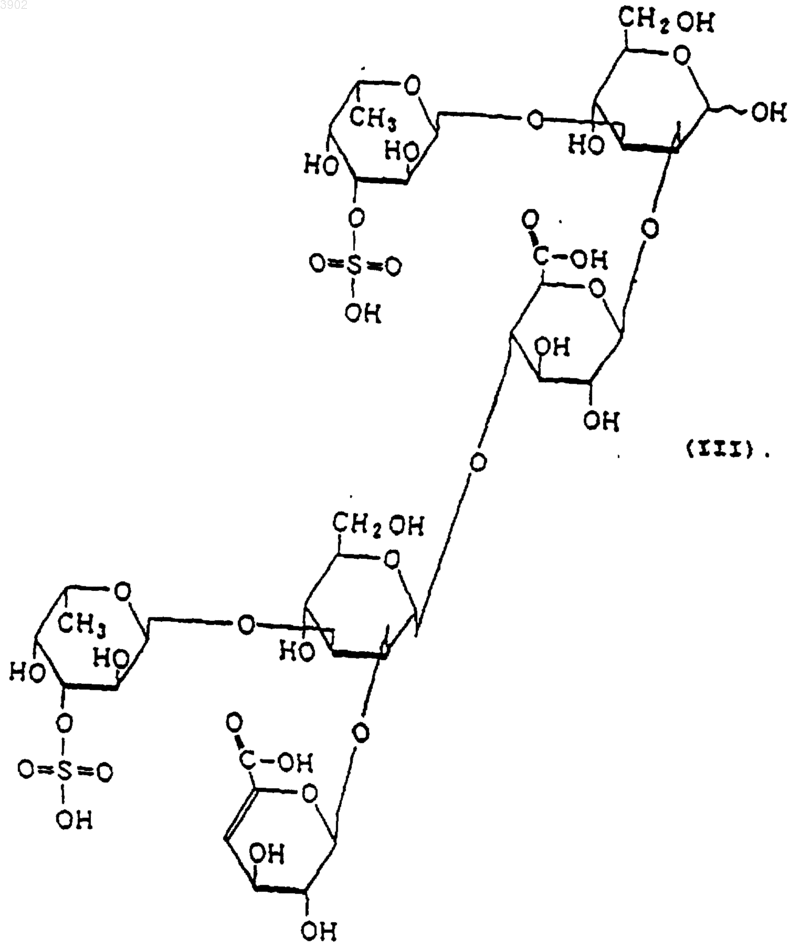
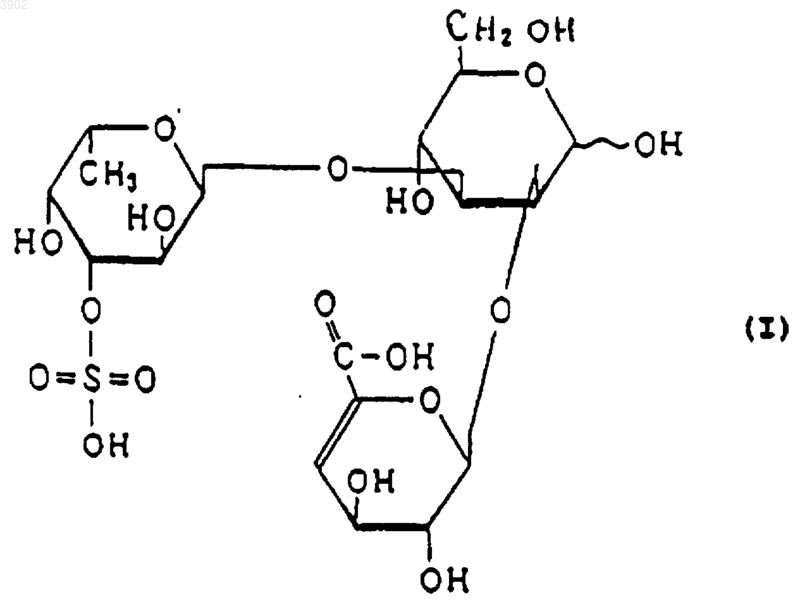
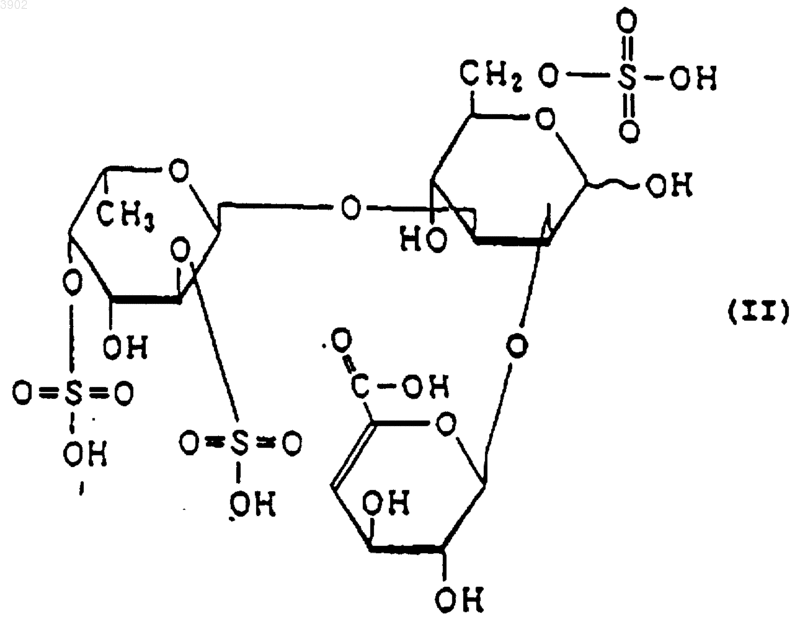
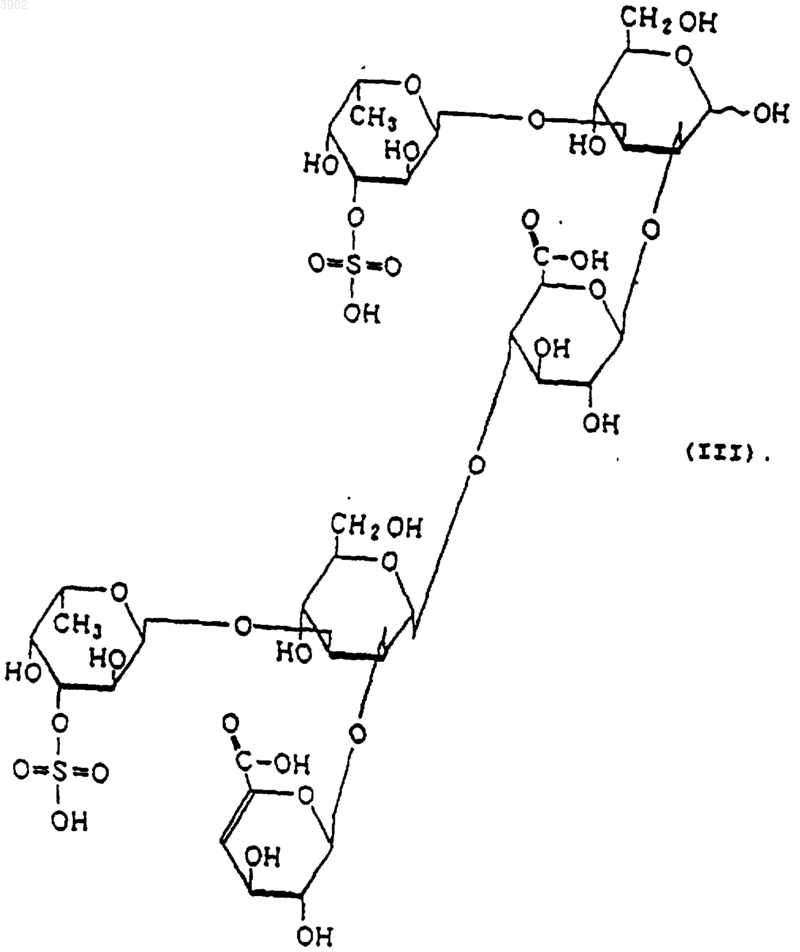
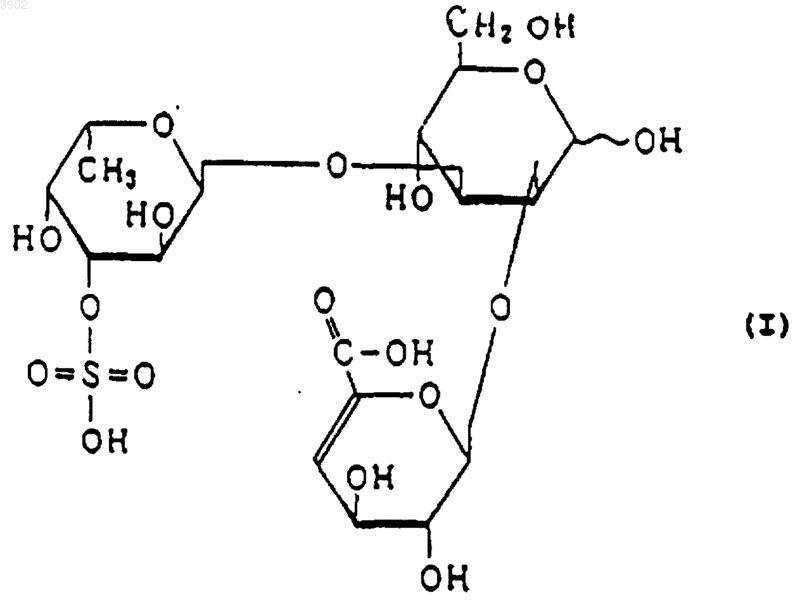
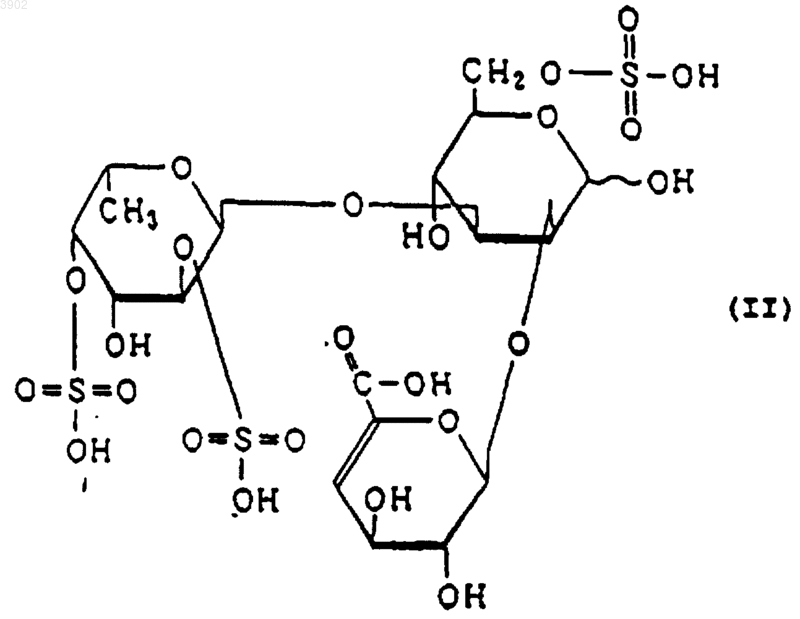
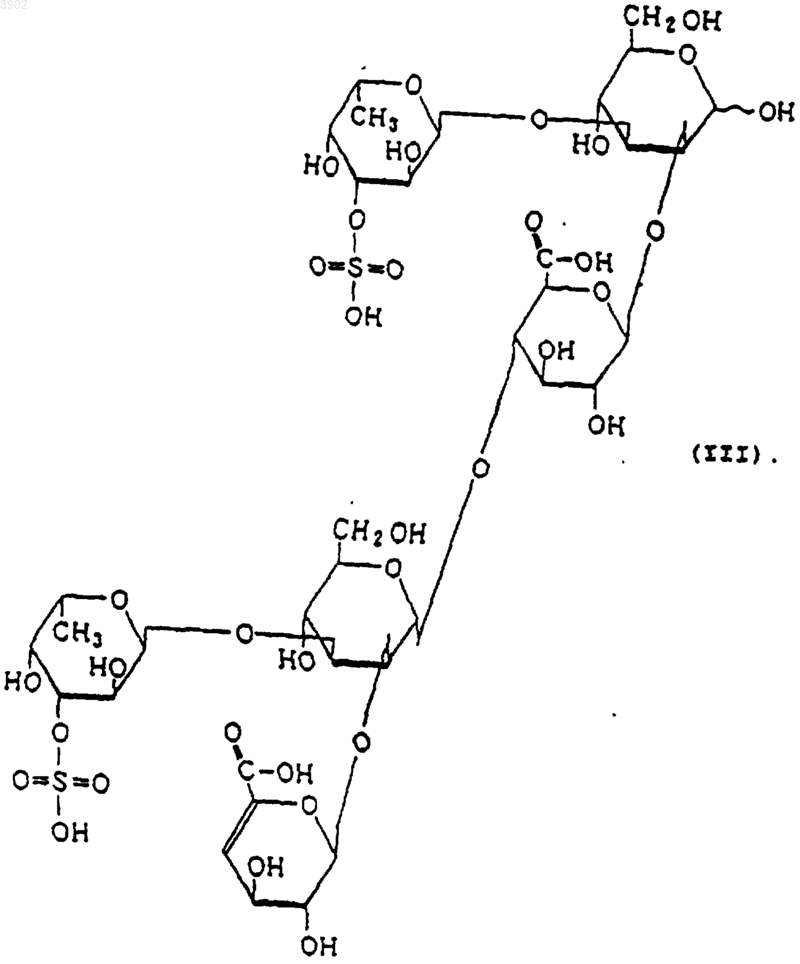
(б) будучи расщепленным(и) фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402), образует, по крайней мере, одно из соединений, выбранных из соединений, представленных следующими формулами (I), (II) и (III):
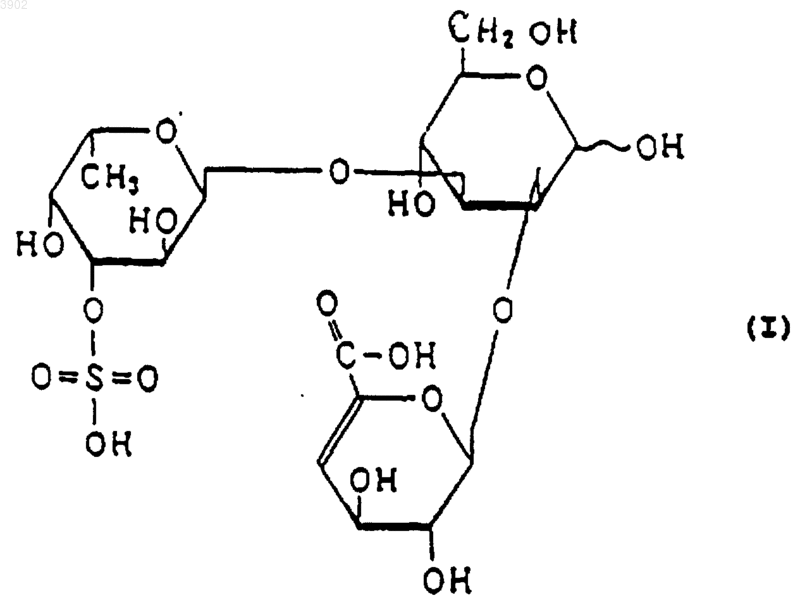
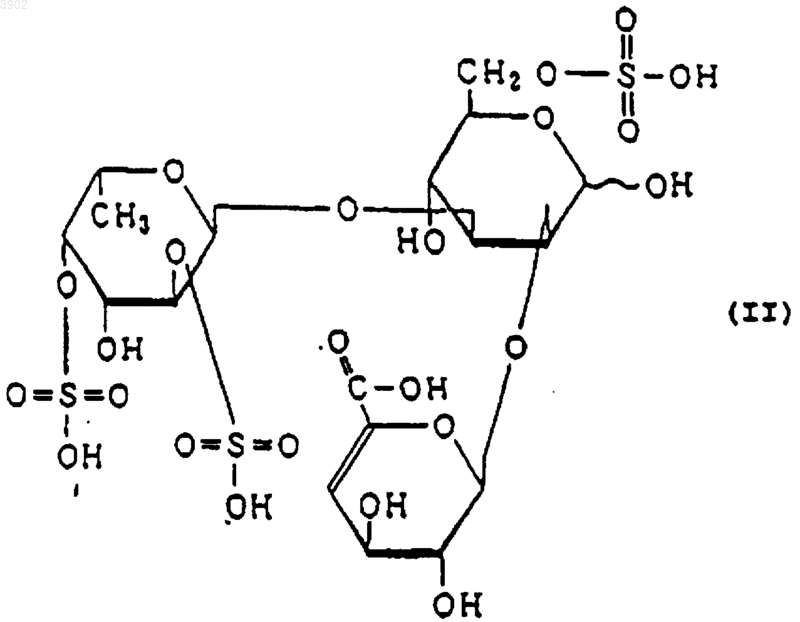
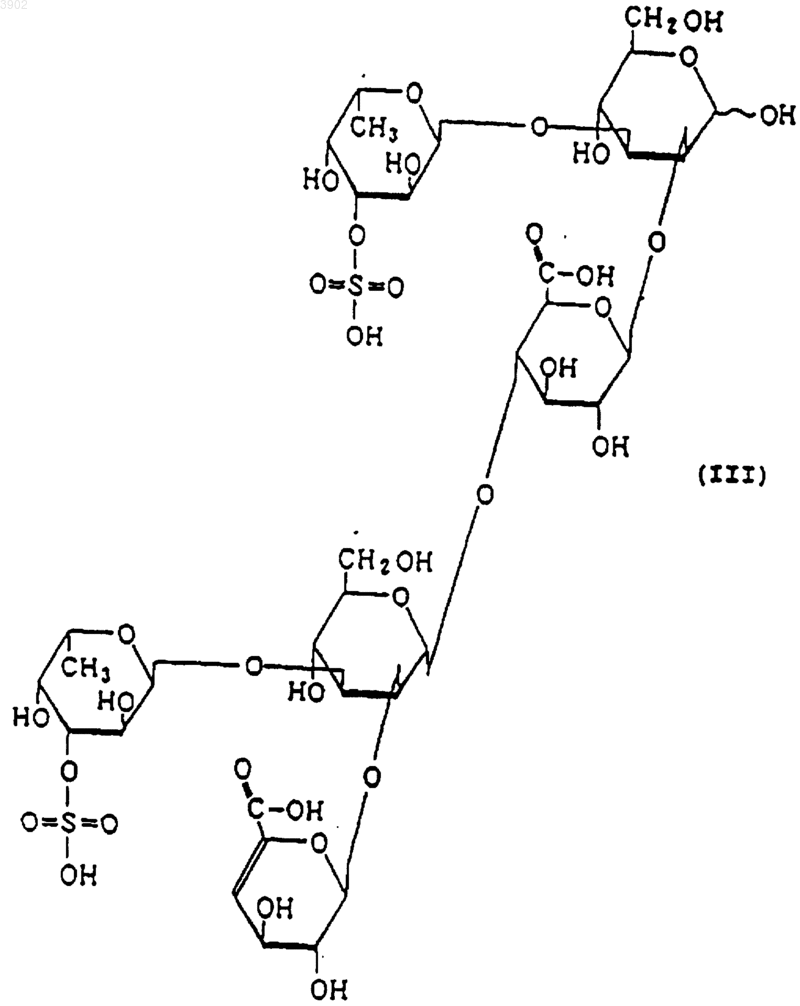
2. Индуктор апоптоза, содержащий сульфированный(ые) фукозусодержащий(ие) полисахарид(ы) и/или продукты его(их) расщепления, причем указанный(ые) сульфированный(ые) фукозусодержащий(ие) полисахарид(ы), имеет(ют) следующие физико-химические свойства:
(а) составляющий его(их) сахарид, в основном, свободен от уроновой кислоты;
(б) в основном, не способен расщепляться фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402);
(в) способен расщепляться ферментом, продуцируемым Alteromonas sp. SN-1009 (FERM BP-5747), осуществляющим эндорасщепление сульфированного фукозусодержащего полисахарида;
(г) образует осадок с избытком хлорида цетилпиридиния при концентрации соли около 1,5 М.
3. Индуктор апоптоза по п.1, в котором указанный продукт расщепления является соединением, выбранным из соединений, представленных следующими формулами (I), (II) и (III):
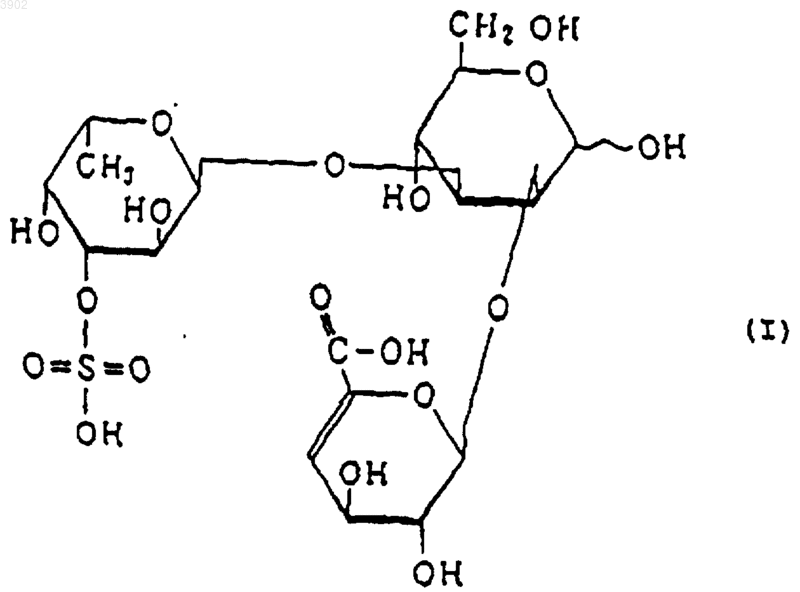
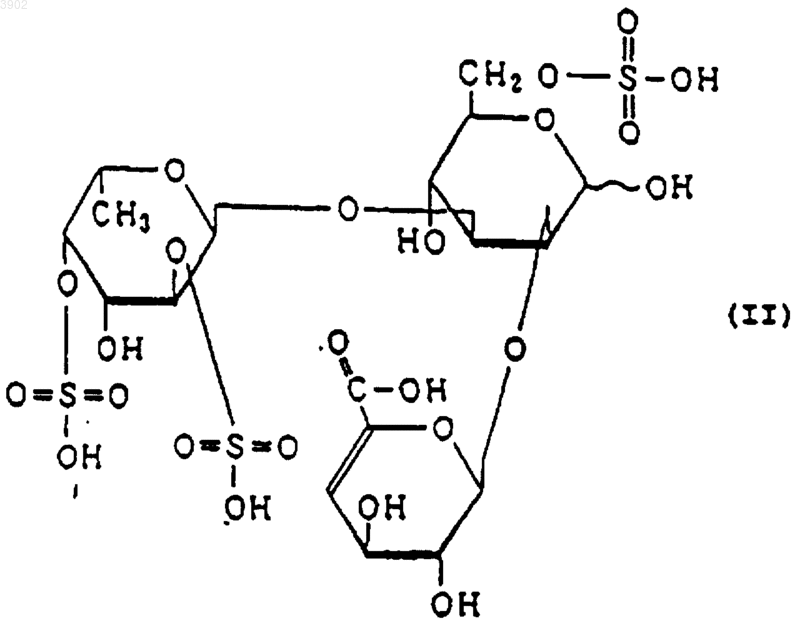
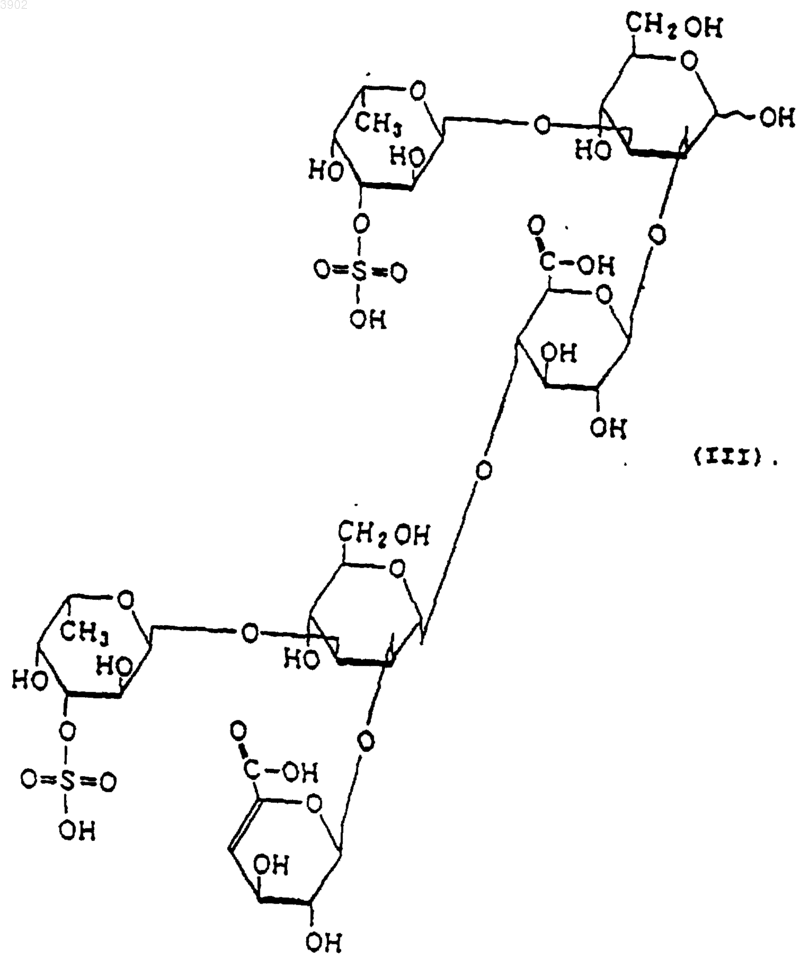
4. Индуктор апоптоза по п.2, который является продуктом расщепления, полученным обработкой сульфированного(ых) фукозусодержащего(их) полисахарида(ов) ферментом, осуществляющим эндорасщепление сульфированного фукозусодержащего полисахарида, продуцируемым Alteromonas sp. SN-1009 (FERM BP-5747) и действующим на сульфированные фукозусодержащие полисахариды и расщепляющим указанные сульфированные фукозусодержащие полисахариды, имеющие следующие физико-химические свойства:
(а) составляющий их сахарид, в основном, свободен от уроновой кислоты; и
(б) в основном, не способен расщепляться фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402), причем указанный фермент имеет
оптимальное значение pH, составляющее приблизительно от 7 до 8, и
оптимальную температуру действия в диапазоне приблизительно от 30 до 35шC.
5. Индуктор апоптоза по п.2, содержащий продукт расщепления, получаемый обработкой сульфированного фукозусодержащего полисахарида фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402), и не удаляемый ультрафильтрационной мембраной с размером пор 100000.
6. Индуктор апоптоза по п.2, содержащий продукт расщепления, который получают инкубацией Flavobacterium sp. SA-0082 (FERM BP-5402) в присутствии сульфированного фукозусодержащего полисахарида и фракционированием из полученной таким образом культуральной среды и который не удаляется ультрафильтрационной мембраной с размером пор 100000.
7. Индуктор апоптоза по п.2, содержащий продукт расщепления, полученный расщеплением сульфированного фукозусодержащего полисахарида кислотой.
8. Индуктор апоптоза по п.7, в котором указанный продукт расщепления представляет собой продукт расщепления, подвергнутый фракционированию по молекулярным массам.
9. Индуктор апоптоза по любому из пп.1, 2, 5, 6, 7, в котором указанный сульфированный фукозусодержащий полисахарид и/или продукт(ы) его расщепления происходит(ят) из Kjellmaniella crassifolia, Laminaria japonica, Fucus visiculosus, Undaria pinnatifida или Stichopus japonicus.
10. Способ индуцирования апоптоза, который включает использование в качестве активного ингредиента сульфированного(ых) фукозусодержащего(их) полисахарида(ов) и/или продукта(ов) его(их) расщепления, причем указанный(ые) сульфированный(ые) фукозусодержащий(ие) полисахарид(ы) имеет(ют) следующие физико-химические свойства:
(а) составляющий его(их) сахарид содержит уроновую кислоту и
(б) при расщеплении фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402), образует, по крайней мере, одно из соединений, выбранных их соединений, представленных следующими формулами (I), (II) и (III):
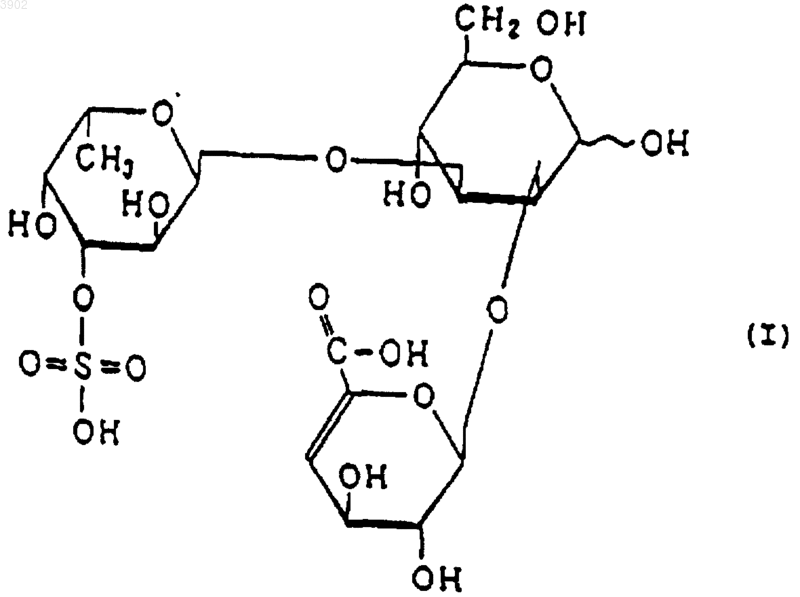
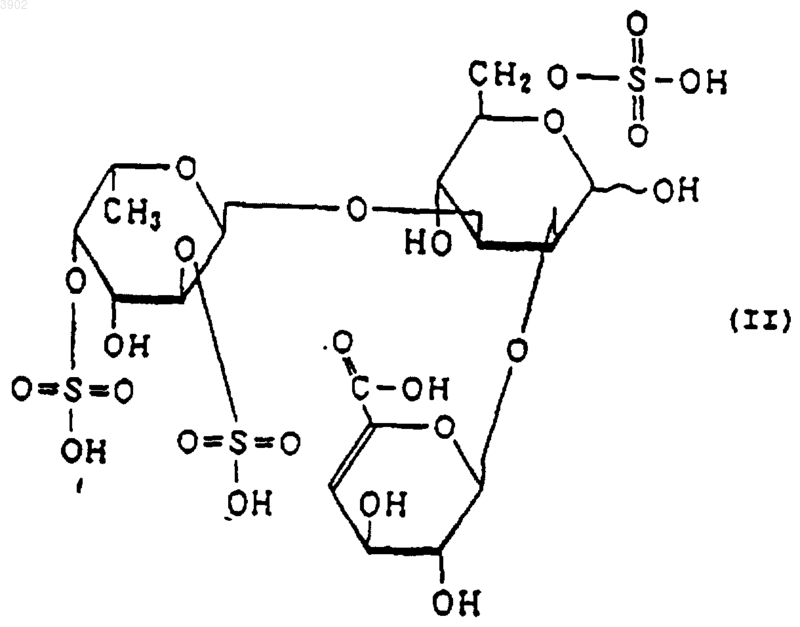
11. Способ индуцирования апоптоза, включающий использование в качестве активного ингредиента сульфированного(ых) фукозусодержащего(их) полисахарида(ов) и/или продукта(ов) его(их) расщепления, причем указанный(ые) сульфированный(ые) фукозусодержащий(ие) полисахарид(ы) имеет(ют) следующие физико-химические свойства:
(а) составляющий его(их) сахарид, в основном, свободен от уроновой кислоты;
(б) в основном, не способен расщепляться фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402);
(в) способен расщепляться ферментом, продуцируемым Alteromonas sp. SN-1009 (FERM BP-5747), осуществляющим эндорасщепление сульфированного фукозусодержащего полисахарида;
(г) образует осадок с избытком хлорида цетилпиридиния при концентрации соли около 1,5 М.
12. Способ индуцирования апоптоза по п.10, в котором указанный продукт расщепления представляет собой соединение, выбранное из соединений, представленных следующими формулами (I), (II) и (III):
13. Способ индуцирования апоптоза по п.11, в котором указанный(ые) продукт(ы) расщепления, полученный(ые) обработкой сульфированного(ых) фукозусодержащего(их) полисахарида(ов) ферментом, продуцируемым Alteromonas sp. SN-1009 (FERM BP-5747), осуществляющим эндорасщепление сульфированного фукозусодержащего полисахарида и действующим на сульфированные фукозусодержащие полисахариды и расщепляющим указанные сульфированные фукозусодержащие полисахариды, имеют следующие физико-химические свойства:
(а) составляющий их сахарид, в основном, свободен от уроновой кислоты и
(б) в основном, не способен расщепляться фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402);
причем указанный фермент имеет
оптимальное значение pH, составляющее приблизительно от 7 до 8, и
оптимальную температуру действия в диапазоне от приблизительно 30 до 35шC.
14. Способ индуцирования апоптоза по п.11, который включает использование в качестве активного ингредиента продукта расщепления, полученного обработкой сульфированного фукозусодержащего полисахарида фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402) и не удаляемого ультрафильтрационной мембраной с размером пор 100000.
15. Способ индуцирования апоптоза по п.11, включающий использование в качестве активного ингредиента продукта расщепления, который получают инкубацией Flavobacterium sp. SA-0082 (FERM BP-5402) в присутствии сульфированного фукозусодержащего полисахарида и фракционированием из полученной таким образом культуральной среды и который не удаляется ультрафильтрационной мембраной с размером пор 100000.
16. Способ индуцирования апоптоза по п.11, включающий использование в качестве активного ингредиента продукта расщепления, полученного расщеплением сульфированного фукозусодержащего полисахарида кислотой.
17. Способ индуцирования апоптоза по п.16, в котором указанный продукт расщепления представляет продукт расщепления, подвергнутый фракционированию по молекулярным массам.
18. Способ индуцирования апоптоза по любому из пп.10, 11, 14, 15, 16, в котором указанный сульфированный фукозусодержащий полисахарид и/или продукт(ы) его расщепления происходят из Kjellmaniella crassifolia, Laminaria japonica, Fucus visiculosus, Undaria pinnatifida или Stichopus japonicus.
19. Противораковое лекарственное средство, содержащее индуктор апоптоза по любому из пп.1-9.
20. Канцеростатическое лекарственное средство, содержащее индуктор апоптоза по любому из пп.1-9.
21. Сульфированные фукозусодержащие полисахариды, имеющие следующие физико-химические свойства:
(1) составляющий их сахарид содержит уроновую кислоту и
(2) будучи расщепленным фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402), образует, по крайней мере, одно из соединений, выбранных из соединений, представленных следующими формулами (I), (II) и (III):
22. Способ получения сульфированных фукозусодержащих полисахаридов по п.21, который включает стадию обработки смеси сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, химическим соединением, способным агрегировать кислые полисахариды в присутствии солей, и удаление осадка.
23. Способ получения сульфированных фукозусодержащих полисахаридов по п.21, который включает стадию обработки смеси сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, анионообменной смолой в присутствии двухвалентного катиона для поглощения целевых полисахаридов.
24. Способ получения сульфированных фукозусодержащих полисахаридов по п.21, включающий стадию удаления из них сопутствующих красящих веществ с помощью полисахаридного вещества или вещества, имеющего анионообменную группу.
25. Сульфированные фукозусодержащие полисахариды, имеющие следующие физико-химические свойства:
(а) составляющий их сахарид, в основном, свободен от уроновой кислоты;
(б) в основном, не способен расщепляться фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402);
(в) способен расщепляться ферментом, продуцируемым Alteromonas sp. SN-1009 (FERM BP-5747), осуществляющим эндорасщепление сульфированных фукозусодержащих полисахаридов;
(г) образует осадок с избытком хлорида цетилпиридиния при концентрации раствора соли около 1,5 М.
26. Способ получения сульфированных фукозусодержащих полисахаридов по п.25, включающий стадию обработки смеси сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, расщепляющим ферментом, способным расщеплять сульфированные фукозусодержащие полисахариды, содержащие уроновую кислоту, или микроорганизмом, продуцирующим указанный фермент для поглощения целевых сульфированных фукозусодержащих полисахаридов.
27. Способ получения сульфированных фукозусодержащих полисахаридов по п.25, включающий стадию обработки смеси сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, химическим соединением, способным агрегировать кислые полисахариды в присутствии солей, осаждая тем самым целевые полисахариды.
28. Способ получения сульфированных фукозусодержащих полисахаридов по п.25, включающий стадию обработки смеси сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, анионообменной смолой в присутствии двухвалентного катиона для поглощения целевых полисахаридов.
29. Способ получения сульфированных фукозусодержащих полисахаридов по п.25, включающий стадию удаления из них сопутствующих красящих веществ с помощью полисахаридного вещества или вещества, имеющего анионообменную группу.
30. Способ получения смеси сульфированных фукозусодержащих полисахаридов, включающий экстракцию смесей сульфированных фукозусодержащих полисахаридов, содержащих сульфированную фукозу, из морских водорослей, при совместном присутствии ионов ацетата и кальция.
Текст
1 Область изобретения Это изобретение относится к индукторам апоптоза, противораковым лекарственным средствам и канцеростатическим лекарственным средствам, которые могут быть использованы как лекарственные препараты. Кроме того,обеспечивается способ индуцирования апоптоза, который используют, например, для выяснений механизма апоптоза и скрининга ингибиторов индукции апоптоза. Также обеспечиваются очищенные сульфированные фукозусодержащие полисахариды и продукты их расщепления и фермент, расщепляющий сульфированный фукозусодержащий полисахарид, который используют для получения продуктов расщепления сульфированного фукозусодержащего полисахарида, и изучения их структур. Предшествующий уровень техники В последние годы апоптоз (самодеструктивная гибель клетки или суицидальная гибель клетки) привлекает внимание, в связи с рассмотрением гибели клеточной ткани. Считается, что апоптоз представляет гибель, врожденно программируемую в генах,отличную от некроза, означающего патологическую смерть клетки. А именно, некоторые внешние или внутренние факторы приводят в действие активацию генов, программирующих апоптоз. На основе этих генов, впоследствии генный белок программированной гибели биосинтезируется и разлагается клетками per se,тем самым вызывая гибель. Целенаправленный апоптоз в требуемой ткани или клетках имеет большое значение, поскольку тем самым могут быть спонтанно удалены ненужные или патогенные клетки из живого тела. Проблемы, подлежащие решению с помощью изобретения Данное изобретение ставит своей целью разработку высокобезопасных соединений, обладающих действием индуцировать апоптоз и тем самым предоставлять индукторы апоптоза,противораковые лекарственные средства и канцеростатические лекарственные средства, содержащие эти соединения, и способ индуцирования апоптоза путем использования этих соединений в качестве активного ингредиента. Кроме того, данное изобретение имеет своей целью разработку фермента, способного расщеплять соединения данного изобретения, который полезен при получении продуктов расщепления этих соединений. Способ решения этих проблем В общем, первый аспект данного изобретения относится к индукторам апоптоза, которые содержат сульфированный фукозусодержащий полисахарид(ы) и/или продукт(ы) его(их) расщепления. Второй аспект данного изобретения относится к способу индуцирования апоптоза, который включает использование в качестве актив 003902 2 ного ингредиента сульфированного фукозусодержащего полисахарида(ов) и/или продукта(ов) его(их) расщепления. Третий аспект данного изобретения относится к противораковым лекарственным средствам, содержащим индуктор апоптоза первого аспекта данного изобретения. Четвертый аспект данного изобретения относится к канцеростатическим лекарственным препаратам, содержащим индуктор апоптоза первого аспекта данного изобретения. Пятый аспект данного изобретения относится к сульфированным фукозусодержащим полисахаридам, имеющим следующие физикохимические свойства:(a) составляющий их сахарид содержит уроновую кислоту, и Шестой аспект данного изобретения относится к сульфированным фукозусодержащим полисахаридам, имеющим следующие физикохимические свойства:(б) они, в основном, не способны расщепляться фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM BP-5402);(FERM BP-5747), осуществляющим эндорасщепление сульфированного фукозусодержащего полисахарида;(г) образует осадок с избытком хлорида цетилпиридиния при концентрации соли около 1,5 М. Седьмой аспект данного изобретения относится к способу получения сульфированных фукозусодержащих полисахаридов пятого аспекта данного изобретения, который включает стадию обработки смеси сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, химическим соединением, способным агрегировать кислые полисахариды в присутствии солей, и удаление осадка. Восьмой аспект данного изобретения относится к способу получения сульфированных фукозусодержащих полисахаридов пятого аспекта данного изобретения, который включает стадию обработки сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, анионообменной смолой в присутствии двухвалентного катиона, получая тем самым целевые полисахариды. Девятый аспект данного изобретения относится к способу получения сульфированных фукозусодержащих полисахаридов пятого аспекта данного изобретения, который включает стадию удаления из них сопутствующих красящих веществ, используя полисахарид или вещество, имеющее анионообменную группу. Десятый аспект данного изобретения относится к способу получения сульфированных фукозусодержащих полисахаридов шестого аспекта данного изобретения, который включает стадию обработки сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, расщепляющим ферментом, способным расщеплять сульфированные фукозусодержащие полисахариды, содержащие уроновую кислоту, или микроорганизмом, содержащим этот фермент, и тем самым получая сульфированные фукозусодержащие целевые полисахариды. Одиннадцатый аспект данного изобретения относится к способу получения сульфированных фукозусодержащих полисахаридов шестого аспекта данного изобретения, который включает стадию обработки сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, химическим соединением, способным вызвать агрегирование кислых полисахаридов в присутствии солей, тем самым осаждая целевые полисахариды. 4 Двенадцатый аспект данного изобретения относится к способу получения сульфированных фукозусодержащих полисахаридов шестого аспекта данного изобретения, который включает стадию обработки сульфированных фукозусодержащих полисахаридов, происходящих из морских водорослей или голотурии, анионообменной смолой в присутствии двухвалентного катиона, получая тем самым целевые полисахариды. Тринадцатый аспект данного изобретения относится к способу получения сульфированных фукозусодержащих полисахаридов шестого аспекта данного изобретения, который включает стадию удаления сопутствующих красящих веществ, используя полисахарид или вещество,имеющее анионообменную группу. Четырнадцатый аспект данного изобретения относится к способу получения смеси сульфированных фукозусодержащих полисахаридов,который включает экстракцию смесей сульфированных фукозусодержащих полисахаридов из морских водорослей при совместном присутствии ацетатного и кальциевого ионов. Изобретателями успешно получены различные очищенные сульфированные фукозусодержащие полисахариды и продукты их расщепления и затем исследованы биологические активности этих веществ. В результате этого было обнаружено, что эти вещества индуцируют апоптоз злокачественных клеток и оказывают сильное противораковое действие. Кроме того,было установлено, что сульфированные фукозусодержащие полисахариды и/или продукты их расщепления имеют сильное канцеростатическое действие. Кроме того, с их помощью удается выделить фермент, способный расщеплять сульфированные фукозусодержащие полисахариды, и этот фермент является полезным при получении продуктов расщепления по данному изобретению. Краткое описание рисунков На фиг. 1 представлены степени осаждения сульфированных фукозусодержащих полисахаридов; на фиг. 2 представлено молекулярномассовое распределение сульфированного фукозусодержащего полисахарида-U, определенное способом гель-фильтрации с использованием Sephacryl S-500; на фиг. 3 представлен ИК-спектр сульфированного фукозусодержащего полисахарида-U; на фиг. 4 представлен 1H ЯМР спектр сульфированного фукозусодержащего полисахарида-U; на фиг. 5 представлена картина элюирования сахаридного соединения (а), являющегося пиридил-(2)-аминированным (РА-а), которое элюировано из L-колонки; на фиг. 6 представлена картина элюирования сахаридного соединения (b), являющегося 5 пиридил-(2)-аминированным (РА-b), которое элюировано из L-колонки; на фиг. 7 представлена картина элюирования сахаридного соединения (с), являющегося пиридил-(2)-аминированным (РА-с), которое элюировано из L-колонки; на фиг. 8 представлен масс-спектр (отрицательное измерение) сахаридного соединения(с); на фиг. 14 представлен 1H ЯМР-спектр сахаридного соединения (а); на фиг. 15 представлен 1H ЯМР-спектр сахаридного соединения (b); на фиг. 16 представлен 1H ЯМР-спектр сахаридного соединения (с); на фиг. 17 представлено молекулярномассовое распределение сульфированного фукозусодержащего полисахарида-F, определенное способом гель-фильтрации с использованием Sephacryl S-500; на фиг. 18 представлен ИК-спектр сульфированного фукозусодержащего полисахарида-F. на фиг. 19 представлен 1 Н ЯМР спектр сульфированного фукозусодержащего полисахарида-F; на фиг. 20 представлен график, который показывает зависимость относительной активности фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, полученного с помощью данного изобретения, от значения рН; на фиг. 21 представлен график, который показывает зависимость относительной активности фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, полученного с помощью данного изобретения, от температуры; на фиг. 22 представлено молекулярномассовые распределения сульфированного фукозусодержащего полисахарида-F, определенные способом гель-фильтрации с использованием Cellulofine GCL-300, до и после деградации ферментом, расщепляющим эндосульфированный фукозусодержащий полисахарид, полученным с помощью данного изобретения; на фиг. 23 представлен график, который показывает зависимость относительной актив 003902 6 ности фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, полученного с помощью данного изобретения, от концентрации иона кальция в реакционной смеси; на фиг. 24 представлены молекулярномассовые распределения сульфированного фукозусодержащего полисахарида-F, который деградирован ферментом, расщепляющим эндосульфированный фукозусодержащий полисахарид, полученный с помощью данного изобретения методом гель-фильтрации, определенного способом гель-фильтрации с использованиемCellulofine GCL-300, в примере 19-(6); на фиг. 25 представлен ИК-спектр сульфированного фукозусодержащего полисахарида-F,который деградирован ферментом, расщепляющим эндосульфированный фукозусодержащий полисахарид, полученным с помощью данного изобретения; на фиг. 26 представлен 1H ЯМР-спектр сульфированного фукозусодержащего полисахарида-F, который деградирован ферментом,расщепляющим эндосульфированный фукозусодержащий полисахарид, полученным с помощью данного изобретения; на фиг. 27 представлены зависимости между временем инкубации и количеством жизнеспособных клеток в культуральной среде HL-60 клеток, к которой были добавлены сульфированные фукозусодержащие полисахариды, полученные в примерах 1, 15 и 18 в таком количестве, чтобы получить концентрацию 1 мг/мл; на фиг. 28 представлены зависимости между временем инкубации и количеством жизнеспособных клеток в культуральной средеMOLT-3 клеток, к которой были добавлены сульфированные фукозусодержащие полисахариды, полученные в примере 1, сульфированный фукозусодержащий полисахарид-F, полученный в примере 12 и сульфированные фукозусодержащие полисахариды, полученные в примерах 15 и 17, и сульфат декстрана; на фиг. 29 представлены зависимости между временем инкубации и количеством жизнеспособных в культуральной среде НСТ 116 клеток, к которой были добавлены препарат, содержащий сульфированный фукозусодержащий полисахарид, полученный в примере 1, смесь сульфированных фукозусодержащих полисахаридов, полученная в примере 1, сульфированный фукозусодержащий полисахарид-U и сульфированный фукозусодержащий полисахарид-F,F-Fd-1, F-Fd-2, F-Fd-3 и F-Fd-4, полученные в примере 12, сульфированные фукозусодержащие полисахариды, полученные в примере 15, и гепарин декстран сульфат; на фиг. 30 представлены зависимости между временем инкубации и количеством жизнеспособных в культуральной среде НСТ 116 клеток, к которой добавлен препарат сульфированного фукозусодержащего полисахарида, полу 7 ченный в примере 1 при различных концентрациях; на фиг. 31 представлены зависимости между временем инкубации и количеством жизнеспособных клеток в культуральной среде AGS клеток, к которой добавлен препарат сульфированного фукозусодержащего полисахарида, полученный в примере 1 при различных концентрациях; на фиг. 32 представлены зависимости между временем инкубации и количеством жизнеспособных клеток в культуральной среде SW 480 клеток, к которой добавлен препарат сульфированного фукозусодержащего полисахарида, полученный в примере 1 при различных концентрациях; на фиг. 33 представлены зависимости между временем инкубации и количеством жизнеспособных клеток в культуральной среде WiDr клеток, к которой добавлены препарат сульфированного фукозусодержащего полисахарида,полученный в примере 1, сульфированный фукозусодержащий полисахарид-F, F-Fd-3 и F-Fd4, полученные в примере 12 и сульфированные фукозусодержащие полисахариды, полученные в примере 15; на фиг. 34 представлены зависимости между временем инкубации и количеством жизнеспособных клеток в культуральной среде WiDr клеток, к которой добавлен препарат сульфированного фукозусодержащего полисахарида, полученный в примере 1 при различных концентрациях. Способ осуществления изобретения Далее, данное изобретение будет описано более подробно. Сульфированные фукозусодержащие полисахариды, подлежащие использованию в данном изобретении, особенно не ограничиваются. Например, могут быть использованы полисахариды, имеющие происхождение из Fucusjaponica, Undaria pinnatifida и других бурых водорослей (Phaeophyta). Известно, что голотурис(морской огурец) содержит сульфированные фукозусодержащие полисахариды в своей соматической стенке. Возможно также в данном изобретении использовать сульфированные фукозусодержащие полисахариды, происходящие из морского огурца. Кроме того, в данном изобретении могут быть использованы продукты расщепления сульфированных фукозусодержащих полисахаридов. Сульфированные фукозусодержащие полисахариды можно расщеплять например, при помощи химических способов расщепления, таких как обработка кислотой,физических способов расщепления, таких как ультразвуковая обработка, или при помощи способов ферментативного расщепления. Настоящими изобретателями было установлено, что когда сульфированные фукозусодержащие полисахариды и/или продукты их 8 расщепления, описанные выше, добавляют к культуральной среде злокачественных клеток,злокачественные клетки претерпевают апоптоз в пределах от одного до нескольких дней после добавления. Они также подтвердили, что сульфированные фукозусодержащие полисахариды и/или продукты их расщепления не демонстрируют токсичность по отношению к нормальным клеткам. Используемый здесь термин сульфированный фукозусодержащий полисахарид означает полисахарид, имеющий сульфированную фукозу в своей молекуле, без особого ограничения. Примеры его включают полисахариды, содержащиеся в бурых водорослях и морском огурце [Tatorui Kagaku, supervised by TokuroK.K., Desember 15, 1955, р.319, р.321]. Сульфированные фукозусодержащие полисахариды,происходящие из бурых водорослей, обычно называют фукоиданом, фукоидином и фуканом. Хотя известно, что существует несколько молекулярных видов их, эти сульфированные фукозусодержащие полисахариды часто называют фукоиданом в целом. Например, сообщается,что фукоидан, производимый Sigma Chemical[Carbohydrate Research, 255, 213-224 (1994)],включая группу, содержащую фукозу как основной компонент, и другую группу, содержащую несколько % уроновой кислоты и имеющую высокое содержание фукозы и маннозы в качестве составляющих сахаридов. Сообщается,что эти сульфированные фукозусодержащие полисахариды имеют различные биологические активности, например, потенцирующую макрофаговую активность, ингибирующую канцерогенный метастаз и ингибирующую коагуляцию крови. Однако сульфированные фукозусодержащие полисахариды включают различные молекулярные виды и, поэтому, необходимо разделить и очистить сульфированные фукозусодержащие полисахариды для того, чтобы выяснить, какая молекулярная разновидность действительно имеет определенную активность. Сульфированные фукозусодержащие полисахариды включают полисахариды, которые, в основном, свободны от уроновой кислоты и содержат фукозу в качестве основного компонента составляющих сахаридов, и полисахариды, которые содержат несколько % уроновой кислоты и имеют высокое содержание фукозы и маннозы в качестве составляющих сахаридов. В дальнейшем, сульфированные фукозусодержащие полисахариды, в основном, свободные от уроновой кислоты, будут называть сульфированным фукозусодержащим полисахаридом-F, полисахариды, содержащие уроновую кислоту,будут называться сульфированным фукозусодержащим полисахаридом-U и смесь этих сульфированных фукозусодержащих полисахаридов 9 называют смесью сульфированных фукозусодержащих полисахаридов. Хотя способы для разделения сульфированного фукозусодержащего полисахарида-F и сульфированного фукозусодержащего полисахарида-U известны, такие как фракционирование и разделение по молекулярной массе с использованием анионообменной смолы известны,при их использовании может быть достигнуто только недостаточное разделение, что затрудняет получение сульфированных фукозусодержащих полисахаридов в большом масштабе в качестве лекарственных средств или функциональной пищи (питания). Известно также, что окрашивающие вещества трудно полностью удалить из сульфированных фукозусодержащих полисахаридов. Коммерчески доступные продукты фукоидана, и т.п. также загрязнены окрашивающими веществами. Обычно, эти окрашивающие вещества,которые состоят из полифенольных полимеров,являются высоко реакционноспособными и ингибируют различные ферментативные реакции или рост клеток. Кроме того, эти окрашивающие вещества иногда необратимо адсорбируются на полимерах (смолах) или контейнерах, сделанных из полимеров, будучи в контакте с ними. Таким образом, требуется устранить эти высоко реакционноспособные окрашивающие вещества из сульфированных фукозусодержащих полисахаридов для того, чтобы тщательно изучить биологические активности сульфированных фукозусодержащих полисахаридов и предотвратить контейнеры или полимеры от загрязнения. Известно, что когда смесь сульфированных фукозусодержащих полисахаридов экстрагируют из, например, бурых водорослей или их остатка промывки спиртом, загрязнение экстракта альгиновой кислотой можно ингибировать добавлением растворимого ацетата бария,хлорида бария, хлорида кальция или т.п., что облегчает последующую очистку. Однако добавление растворимой соли бария делает обработку отработанного раствора затруднительной. С другой стороны, хлорид кальция вызывает изменение значения рН при смешении с морскими водорослями, что делает необходимым регулирование рН для того, чтобы получить недеградируемые сульфированные фукозусодержащие полисахариды. На стадии регулирования значения рН, иногда наблюдают, что морские водоросли становятся вязкими и агрегируют. В таком случае, эффективность последующей экстракции понижается или разделение твердое вещество/жидкость, в частности,фильтрация, затрудняется. Хотя полезность сульфированных фукозусодержащих полисахаридов в данной области была ожидаемой, не имеется как товарного продукта сульфированного фукозусодержащего полисахарида-F или сульфированного фукозу 003902 10 содержащего полисахарида-U с достаточным фракционированием по молекулярному виду,так и сообщения по способу эффективного получения сульфированных фукозусодержащих полисахаридов. Кроме того, товарные сульфированные фукозусодержащие полисахариды содержат высоко реакционноспособные окрашивающие вещества, описанные выше. Хотя сульфированные фукозусодержащие полисахариды имеют различные активности, до сих пор не получено ни существенно очищенного сульфированного фукозусодержащего полисахарид-F, ни сульфированного фукозусодержащего полисахарида-U из-за трудности в их фракционном получении, как описано выше. Однако данное изобретение обеспечивает,в основном, очищенный сульфированный фукозусодержащий полисахарид-U, подходящий способ экстракции его же и способ получения сульфированного фукозусодержащего полисахарида-U. Данное изобретение, кроме того,обеспечивает сульфированный фукозусодержащий полисахарид-U, из которого удалены высоко реакционноспособные окрашивающие вещества, трудно удаляемые из сульфированных фукозусодержащих полисахаридов в обычных,инигибирующих ферментативных реакциях, и загрязняющие полимеры, и т. д. Данное изобретение, кроме того, обеспечивает, в основном, очищенный сульфированный фукозусодержащий полисахарид-F, подходящий метод экстракции его и способ получения сульфированного фукозусодержащего полисахарида-F. Кроме того, данное изобретение обеспечивает сульфированный фукозусодержащий полисахарид-F, из которого удалены высоко реакционноспособные окрашивающие вещества, трудно удаляемые из сульфированных фукозусодержащих полисахаридов в обычных, ингибирующих ферментативных реакциях, и загрязняющие полимеры, и т.д. В качестве сульфированных фукозусодержащих полисахаридов, подлежащих использованию в данном изобретении, могут быть использованы вещества, содержащие сульфированный фукозусодержащий полисахарид, такие как бурые водоросли и морской огурец, которые, например, сушат, как таковые, и измельчают. Альтернативно, может быть использован экстракт, содержащий сульфированный фукозусодержащий полисахарид, получаемый из вещества, содержащего сульфированный фукозусодержащий полисахарид, либо как такового, либо в очищенном состоянии. Экстракт, содержащий сульфированный фукозусодержащий полисахарид, можно получить и очистить любым широко известным методом без ограничения. Продукты расщепления сульфированных фукозусодержащих полисахаридов, подлежащие использованию в данном изобретении,представляют продукты, полученные путем 11 расщепления сульфированных фукозусодержащих полисахаридов при помощи ферментативных, химических или физических способов, и могут быть использованы широко известные ферментативные, химические или физические способы. Сульфированные фукозусодержащие полисахариды и продукты расщепления сульфированных фукозусодержащих полисахаридов,подлежащие использованию в данном изобретении, включают фармацевтически приемлемые их соли. Примеры бурых водорослей, содержащих сульфированные фукозусодержащие полисахариды, из которых можно получить сульфированный фукозусодержащий полисахарид, включают бурые водоросли, описанные в ColoredSachio Yamada, written by Sokichi Segawa, Hoikusha Publishing Co., Ltd., 22-52 (1977)], такие как Fucus vesiculosus, Kjellmaniella crassifolia,Laminaria japonica и Undaria pinnatifida. В качестве морского огурца, содержащего сульфированные фукозусодержащие полисахариды, из которого можно получить сульфированные фукозусодержащие полисахариды, можно использовать, например, те, которые описаны в выложенной Японской патентной заявке 91027/1992, такие как Stichopus japonicus иHolothuria Leucospilota. Сульфированный фукозусодержащий полисахарид несет в своей молекуле сульфатные группы, которые взаимодействуют с различными основаниями, образуя при этом соли. Эти сульфированные фукозусодержащие полисахариды и продукты их расщепления становятся стабильными при превращении их в соли. Их обычно выделяют в форме натриевых и/или калиевых солей или т.п. Соли этих веществ могут быть превращены в свободные сульфированные фукозусодержащие полисахариды и свободные продукты их расщепления путем обработки катионо-обменной смолой, такой как Dowex 50W. Кроме того, эти соли могут быть подвергнуты реакциям солевого обмена обычным способом,превращая их при этом в различные требуемые соли, при необходимости. В качестве солей сульфированных фукозусодержащих полисахаридов и продуктов их расщепления, можно использовать фармацевтически приемлемые соли,например, соли щелочных металлов, таких как калий и натрий, соли щелочно-земельных металлов, таких как кальций, магний и барий, соли органических оснований, такие как соли пиридиния, и аммония. Порошок, содержащий сульфированные фукозусодержащие полисахариды, можно получить путем сушки бурых водорослей, морского огурца и т.п., содержащих сульфированные фукозусодержащие полисахариды, и последующего измельчения. 12 Экстракт, содержащий сульфированные фукозусодержащие полисахариды, можно получить путем экстракции порошка, содержащего сульфированные фукозусодержащие полисахариды, горячей водой или разбавленной кислотой. Чтобы экстрагировать вещества, содержащие сульфированные фукозусодержащие полисахариды, температуру и время экстракции целесообразно выбирать в зависимости от цели(назначения), соответственно в диапазонах от 0 до 200 С и от 1 до 360 мин. Температуру и время экстракции обычно выбирают в диапазоне от 10 до 150 С, предпочтительно от 50 до 130 С, и в диапазоне от 5 до 240 мин, предпочтительно от 10 до 180 мин, соответственно. В качестве способа очистки экстракта с тем, чтобы повысить содержание сульфированного фукозусодержащего полисахарида, можно использовать, например, фракционирование сульфированных фукозусодержащих полисахаридов с использованием хлорида кальция, ацетата бария, и т.д.; фракционирование сульфированных фукозусодержащих полисахаридов с использованием кислого полисахаридного агглютинирующего (склеивающего) средства, такого как цетилпиридиний хлорид; фракционирование сульфированных фукозусодержащих полисахаридов с использованием кислого полисахаридного агглютинирующего (склеивающего) средства в присутствии солей; гельфильтрацию; и ионообменную хроматографию. При необходимости, очистку можно выполнить,комбинируя эти техники. Сульфированные фукозусодержащие полисахариды можно подвергнуть расщеплению способами, широко известными для расщепления сульфированных фукозусодержащих полисахаридов, например, используя фермент, расщепляющий сульфированный фукозусодержащий полисахарид, расщепление кислотой, и обработку ультразвуком. Продукты расщепления можно очистить в соответствии со способами,описанными выше. Бурые водоросли обычно содержат ряд сульфированных фукозусодержащих полисахаридов. Бурые водоросли, подлежащие использованию в данном изобретении, особенно не ограничиваются. Например, можно использовать бурые водоросли, такие как Fucus vesiculosus,Kjellmaniella crassifolia, Laminaria japonica и Undaria pinnatifida и другие бурые водоросли. Чтобы получить сульфированные фукозусодержащие полисахариды, бурые водоросли сначала экстрагируют водным растворителем. Морские водоросли, подлежащие экстрагированию, могут быть свежими водорослями. Однако, целесообразно, чтобы до получения экстракта, бурые водоросли были высушены,превращены в порошок, промыты 60-100% спиртом или ацетоном или вымочены в водном растворе, содержащем формальдегид, ацеталь 13 дегид, глутаральдегид, аммиак или т.п., поскольку тем самым можно значительно снизить загрязнение сульфированных фукозусодержащих полисахаридов окрашивающими веществами. Когда сульфированные фукозусодержащие полисахариды экстрагируют из, например, бурых водорослей или их остатка промывки спиртом, загрязнение экстракта альгиновой кислотой можно ингибировать добавлением растворимого ацетата бария, хлорида бария, хлорида кальция или т.п., что облегчает последующую очистку. По причине, описанной выше, предпочтительно экстрагировать сульфированные фукозсодержащие полисахариды 1 мМ-1 М раствором ацетата кальция при температуре от 50 до 130 С. Когда водоросли толстые и порошок состоит из больших частиц, иногда наблюдают,что изначально используя раствор ацетата натрия при концентрации 0,2 М и выше, можно достичь лишь низкой эффективности экстракции. В таком случае, рекомендуется, чтобы сульфированные фукозусодержащие полисахариды сначала экстрагировали водой и затем к экстрагированному добавляют ацетат кальция с последующим удалением осажденной таким образом альгиновой кислоты. Когда сульфированные фукозусодержащие полисахариды должны экстрагироваться вместе с альгиновой кислотой или когда следует получить частично деградированные продукты на стадии экстракции, то растворитель и условия для экстракции особенно не ограничиваются. В таком случае, можно использовать воду, водные растворы нейтральных солей, таких как хлорид натрия и хлорид магния, при различных концентрациях, кислые водные растворы, например,лимонной кислоты, фосфорной или хлористоводородной кислоты, при различных концентрациях, и щелочные водные растворы, например,гидроксида натрия и гидроксида калия, при различных концентрациях. Кроме того, туда могут быть добавлены буферы и консерванты. Также,значение рН экстракта, температура экстракции и время экстракции особенно не ограничены. Однако сульфированные фукозусодержащие полисахариды обычно малоустойчивы к кислотам и щелочам. Таким образом, имеется тенденция к легко протекаемому расщеплению, когда используют кислый или щелочной раствор. Произвольные продукты расщепления можно получить, контролируя температуру нагревания,время нагревания, значение рН, и т.д. Например,среднюю молекулярную массу, молекулярномассовое распределение и т.п. продуктов расщепления можно контролировать, осуществляя гель-фильтрацию, обработку мембраной для фракционирования по молекулярным массам, и т.д. Другими словами, молекулярные массы и сахаридные композиции сульфированного фукозусодержащего полисахарида-U и сульфиро 003902 14 ванного фукозусодержащего полисахарида-F данного изобретения варьируются в зависимости от времени сбора сульфированных фукозусодержащих полисахаридов, используемого способа сушки, используемого способа хранения веществ и условий экстракции сульфированных фукозусодержащих полисахаридов, таких как условия нагревания и значение рН. Например, сульфированные фукозусодержащие полисахариды гидролизуются кислотами. В щелочных условиях, с другой стороны, расщепление сульфированных фукозусодержащих полисахаридов протекает в результате -элиминирования уроновой кислоты. Таким образом, молекулярные массы и молекулярно-массовые распределения сульфированного фукозусодержащего полисахарида-U и сульфированного фукозусодержащего полисахарида-F, описанных здесь, являются, каждый, одним лишь примером их. Молекулярная масса и молекулярномассовое распределение можно легко варьировать, контролируя условия обработки сульфированных фукозусодержащих полисахаридов, Например, сульфированный фукозусодержащий полисахарид-U и сульфированный фукозусодержащий полисахарид-F с приблизительно от 1000 до 10000 молекулярно-массовым распределением можно получить путем нагревания исходного вещества при 100 С в течение 1 ч в слабо щелочных условиях и используя на стадии обессоливания молекулярно-ситовую мембрану с размером пор 300. Сульфированный фукозусодержащий полисахарид-U и сульфированный фукозусодержащий полисахарид-F данного изобретения с произвольной молекулярной массой и молекулярно-массовым распределением можно получить, подбирая надлежащим образом условия обработки. Альгиновая кислота и нейтральные сахариды могут быть удалены из вышеупомянутого экстракта бурых водорослей, например, путем добавления кислого полисахаридного агглютинирующего (склеивающего) средства, такого как цетилпиридиний хлорид, в присутствии солей, таких как хлорид натрия, при концентрации от 0,2 до 0,6 М до тех пор, пока больше не образуется осадок, и затем собирая осадок. Если требуется, осадок промывают раствором солей, таким как 0,2-0,6 М хлорид натрия, и цетилпиридиний хлорид, содержавшийся в осадке, отмывают насыщенным спиртовым раствором хлорида натрия, получая тем самым смесь сульфированных фукозусодержащих полисахаридов. Чтобы устранить окрашивающие вещества из полученной таким образом смеси сульфированных фукозусодержащих полисахаридов, осадок можно растворить и затем обработать анионообменной смолой или полисахаридной смолой или подвергнуть ультрафильтрации. В том случае, когда осадок обессоливают и сушат вымораживанием, можно получить сухой препарат. 15 Настоящими изобретателями было установлено, что сульфированный фукозусодержащий полисахарид-F и сульфированный фукозусодержащий полисахарид-U данного изобретения демонстрируют совершенно различное поведение по отношению к кислому полисахаридному агглютинирующему средству в присутствии одной или нескольких солей при концентрации 0,6-3 М. Например, сульфированный фукозусодержащий полисахарид-U данного изобретения может быть выделен из водного раствора смеси сульфированных фукозусодержащих полисахаридов, используя способ данного изобретения. Сначала, одну или несколько солей добавляют к водному раствору смеси сульфированных фукозусодержащих полисахаридов таким образом, чтобы получить общую концентрацию соли 0,6-2 М. В качестве солей, подлежащих добавлению, можно использовать, например,хлорид натрия и хлорид кальция, без ограничения. Обычно, сульфированный фукозусодержащий полисахарид-F данного изобретения может быть отделен от сульфированного фукозусодержащего полисахарида-U данного изобретения при концентрации соли приблизительно 1,5 М (см. фиг. 1, которая будет представлена здесь ниже). Например, концентрацию вышеупомянутой соли(ей) доводят до 1,5 М и затем добавляют кислое полисахаридное агглютинирующее средство, такое как цетилпиридиний хлорид, до тех пор, пока больше не образуется осадок. Таким образом, осаждают сульфированный фукозусодержащий полисахарид-F. Путем удаления осадка, можно получить раствор сульфированного фукозусодержащего полисахарида-U данного изобретения. Этот раствор концентрируют, при необходимости, и затем сульфированный фукозусодержащий полисахарид-U, содержавшийся в нем, осаждают, добавляя, например, туда в 4 раза больше этанола. Затем, цетилпиридиний хлорид в осадке отмывают насыщенным спиртовым раствором хлорида натрия, получая тем самым сульфированный фукозусодержащий полисахарид-U данного изобретения. Полученный таким образом сульфированный фукозусодержащий полисахарид-U может быть растворен и затем подвергнут ультрафильтрации, чтобы тем самым удалить из него окрашивающие вещества. Путем обессоливания и сушки вымораживанием сульфированного фукозусодержащего полисахарида-U, можно получить сухой препарат. Можно также добавлять консерванты и т.п. во время этого способа. Когда требуется эффективно получить только сульфированный фукозусодержащий полисахарид-F данного изобретения, концентрация соли на стадии агглютинации, например,цетилпиридиний хлоридом, регулируют не до 0,2-0,6 М, а до, например, 2 М. Таким образом,полученный осадок содержит исключительно 16 сульфированный фукозусодержащий полисахарид-F данного изобретения. Изобретателями было установлено, что когда сульфированные фукозусодержащие полисахариды очищают, используя анионообменную смолу в присутствии двухвалентного катиона,количество сульфированных фукозусодержащих полисахаридов, адсорбированных на единицу поверхности смолы, можно увеличить и тем самым можно более эффективно разделить сульфированные фукозусодержащие полисахариды. Чтобы получить сульфированный фукозусодержащий полисахарид-U данного изобретения, используя способ данного изобретения, к смеси сульфированных фукозусодержащих полисахаридов добавляют химическое вещество,служащее в качестве источника двухвалентного катиона, при концентрации 1 мМ или более. Затем, анионообменную смолу уравновешивают раствором, содержащим двухвалентный катион предпочтительно при концентрации 1 мМ или более и при этом вышеупомянутая смесь сульфированных фукозусодержащих полисахаридов адсорбируется. После тщательного промывания анионообменной смолы раствором, используемым для уравновешивания сульфированные фукозусодержащие полисахариды проявляют при помощи элюирования с линейным градиентом, например хлоридом натрия. В практике этого способа, можно добавлять двухвалентный катион так, чтобы получить концентрацию 1 мМ или более. В том случае когда сульфированный фукозусодержащий полисахарид-U данного изобретения должен адсорбироваться колонкой,концентрацию предпочтительно устанавливают менее чем 0,5 М. В качестве химического вещества, служащего как источник двухвалентного катиона, подлежащего использованию в этом способе, соли кальция и соли бария проявляют особенно превосходное действие. Однако данное изобретение не ограничивается ими, и могут использоваться сульфат магния, хлорид марганца, и т.д. Когда получают смесь сульфированных фукозусодержащих полисахаридов из бурых водорослей обычным способом, полученная смесь загрязнена высоко реакционноспособными окрашивающими веществами, которые загрязняют смолы и полимерные контейнеры, которые находятся в контакте с ними, или ингибируют ферментативные реакции или рост клеток,как описано выше. Обнаружено, что эти окрашивающие вещества можно легко удалить посредством связывания или адсорбции полисахаридным веществом или веществом, несущим анионообменную группу. Другими словами, эти высоко реакционноспособные окрашивающие вещества можно легко устранить путем добавления к раствору, содержащему сульфированные фукозусодержащие полисахариды, полисахаридных полимеров, таких как GCL-2000 (производимого Selkagaku Kogyo), Sephacryl S-500, 17Co., Ltd.), перемешивания и затем удаления, или пропускания раствора, содержащего сульфированные фукозусодержащие полисахариды, через колонку, наполненную этими веществами. Однако анионообменная смола также связывается с сульфированными фукозусодержащими полисахаридами. Таким образом, предпочтительно контролировать концентрацию соли до приблизительно 2 М на стадии адсорбции окрашивающих веществ. Сульфированный фукозусодержащий полисахарид-U данного изобретения может быть получен, например, способом, описанным в примере 6. Ниже будут проиллюстрированы физико-химические свойства этого сульфированного фукозусодержащего полисахарида-U,хотя для этой цели сульфированным фукозусодержащим полисахаридом-U данного изобретения не ограничиваются. На фиг. 1 представлена степень осаждения сульфированного фукозусодержащего полисахарида-U данного изобретения и сульфированного фукозусодержащего полисахарида-F данного изобретения, полученных в примере 8,при различных концентрациях хлорида натрия в присутствии избытка цетилпиридиний хлорида. На фиг. 1 ордината относится к степени осаждения (%), а абсцисса относится к концентрации (М) хлорида натрия. Сплошная линия и незаполненный круг обозначают степень осаждения сульфированного фукозусодержащего полисахарида-U данного изобретения при различных концентрациях хлорида натрия, в то время как пунктирная линия и незаполненный треугольник обозначают степень осаждения сульфированного фукозусодержащего полисахарида-F данного изобретения при различных концентрациях хлорида натрия (М). Степени осаждения определяют при температуре раствора 37 С следующим образом. Сульфированный фукозусодержащий полисахарид-U и сульфированный фукозусодержащий полисахарид-F данного изобретения,каждый, растворяют в воде и 4 М хлорида натрия при концентрации 2%. Затем эти растворы смешивают при различных соотношениях, тем самым, получая 125-мкл порции сульфированного фукозусодержащего полисахарида-U и сульфированного фукозусодержащего полисахарида-F растворов, имеющие различные концентрации хлорида натрия. Затем цетилпириди 003902 18 ний хлорид растворяют в воде и 4 М хлорида натрия при концентрации 2,5% и полученные растворы смешивают при различных соотношениях, получая 1,25% растворы цетилпиридиний хлорида с различными концентрациями хлорида натрия. Требуется в 3,2 раза больше, по объему,1,25% раствора цетилпиридиний хлорида для полного осаждения сульфированного фукозусодержащего полисахарида-U и сульфированного фукозусодержащего полисахарида-F, каждого,растворенного в воде при концентрации 2%. К 125-мкл порциям 2% растворов сульфированного фукозусодержащего полисахарида-U и сульфированного фукозусодержащего полисахарида-F с различными концентрациями хлорида натрия добавляют 400-мкл порции растворов цетилпиридиний хлорида с различными концентрациями хлорида натрия. После тщательного перемешивания и выдерживания при стоянии в течение 30 мин каждую смесь центрифугируют и определяют содержание сахарида в супернатанте по фенолсернокислотному методу [Analytical Chemistry, 28, 350 (1956)], а затем рассчитывают степень осаждения каждого сульфированного фукозусодержащего полисахарида при каждой концентрации хлорида натрия. Молекулярную массу полученного таким образом сульфированного фукозусодержащего полисахарида-U данного изобретения измеряют методом гель-фильтрации с использованиемSephacryl S-500. В результате, получают молекулярно-массовое распределение с максимумом приблизительно 190 000 (фиг. 2). На фиг. 2 ордината относится к содержанию сахарида в образце, определенному фенолсернокислотным методом, выраженному как поглощение при 480 нм, а абсцисса относится к номеру фракции. Гель-фильтрацию осуществляют в следующих условиях: размер колонки: 3,08 х 162,5 см; растворитель: 10 мМ натрий фосфатный буфер (рН 6,0), содержащий 0,2 М хлорида натрия и 10% этанола; скорость потока: 1,5 мл/мин; концентрация образца: 0,25%; объем образца: 20 мл; и молекулярно-массовый стандарт: ShodexSTANDARD P-82 (производ. Showa Denco, К.К.) Затем анализируют компоненты сульфированного фукозосодержащего полисахарида-U данного изобретения, полученного таким образом. Сначала, определяют содержание фукозы в соответствии со способом, описанным в Journalof Biological Chemistry, 175, 595 (1948). Затем,полученный сухой препарат сульфированного фукозусодержащего полисахарида-U растворяют в IN хлористо-водородной кислоте, получая концентрацию 0,5%, и обрабатывают при 110 С в течение 2 ч, гидролизуя тем самым до составляющих моносахаридов. В дальнейшем, реду 19Takara Shuzo Co., Ltd.) и соотношение составляющих моносахаридов в композиции анализируют ВЭЖХ (HPLC). ВЭЖХ осуществляют в следующих условиях: Установка: Колонка: Элюент: Детектирование:PALPAK Тип А (4,6 мм х 150 мм,произв. Takara Shuzo Co., Ltd.); 700 мМ смеси боратный буфер (рН 9,0):ацетонитрил = 9 : 1; Флуорометрический детектор F-1150 Затем определяют содержание уроновой кислоты согласно методу, описанному в Analytical Biochemistry, 4, 330 (1962). Далее, содержание серной кислоты определяют согласно методу, описанному в Biochemical Journal, 84, 106 (1962). В результате, установлено, что составляющими сахаридами полученного выше сульфированного фукозусодержащего полисахарида-U являются фукоза, манноза, галактоза, глюкоза, рамноза, ксилоза и уроновая кислота, и никаких других нейтральных сахаридов, в основном, там не содержится. Соотношение основных компонентов в композиции, выраженное в молях, является следующим: фукоза : манноза : галактоза : уроновая кислота : сульфогруппа = приблизительно 10 : 7 : 4 : 5 : 20. Затем, ИК-спектр кальциевой соли сульфированного фукозусодержащего полисахарида-U получают на инфракрасном спектрометре с преобразованием Фурье типа JIR-DIAMOND 20(произв. JEOL Ltd.). Таким образом получен спектр, показанный на фиг. 3. На фиг. 3 ордината относится к пропусканию (%), а абсцисса относится к волновому числу (см-1) . 1H ЯМР спектр кальциевой соли сульфированного фукозусодержащего полисахарида-U данного изобретения получают на спектрометре ядерного магнитного резонанса Модель JNM500 (500 мГц; произв. JEOL Ltd.). Таким образом получен спектр, показанный на фиг. 4. На фиг. 4, по ординате отложена интенсивность сигнала, а по абсциссе отложен химический сдвиг (м.д.) (ррм) Химические сдвиги в 1 20 При измерении на высокоскоростном, высокочувствительном поляриметре SEPA-300(произв. Horiba Seisakusho), высушенный вымораживанием продукт сульфированного фукозусодержащего полисахарида-U данного изобретения имеет удельное вращение -53,6. Настоящими изобретателями идентифицирована структура полученного таким способом сульфированного фукозусодержащего полисахарида-U данного изобретения следующим способом. Деградация (расщепление) сульфированного фукозусодержащего полисахарида-U деградирующим ферментом, способным деградировать сульфированный фукозусодержащий полисахарид-U, и очистка продукта деградации. Очищенный сульфированный фукозусодержащий полисахарид-U обрабатывают эндофукоиданазой, как будет описано в дальнейшем,и продукты деградации очищают. А именно, 16 мл 1% раствора сульфированного фукозусодержащего полисахарида-U, 12 мл 50 мМ фосфатного буфера (рН 8,0), 4 мл 4 М раствора хлорида натрия и 8 мл 32 мЕ/мл раствора эндофукоиданазы смешивают вместе и реакцию проводят при 25 С в течение 48 ч. Установлено, что поглощение реакционной смеси при 230 нм увеличивается по мере протекания реакции, тем самым подтверждая развитие деградации сульфированного фукозусодержащего полисахарида-U этим ферментом. После обессоливания с помощью Micro Acilyzer G3 (произв. AsahiChemical Industry Co., Ltd.), реакционную смесь разделяют на три фракции (а), (b), и (с), и очищают DEAE-Sepharose FF. Вышеупомянутую эндофукоиданазу получают следующим способом. Штамм, подлежащий использованию при получении этого фермента, может быть произвольным штаммом, поскольку он способен продуцировать эндофукоиданазу. В качестве конкретного примера, можно указать Flavobacterium sp. SA-0082 (FERM ВР-5402). Этот штамм, который выделен данными изобретателями из морской воды в Aomori, имеет следующие микологические свойства. 1. Штамм Flavobacterium sp. SA-0082 а. Морфологические свойства(1) Область температур роста: способен расти при 37 С или ниже, соответствующий диапазон температур роста составляет от 15 до 28 С(13) Потребность в солевой среде Рост в свободной от NaCl среде: Рост в 1% NaCl среде: Рост в среде морской воды: +(15) GC содержание во внутриклеточной ДНК: 32%(19) Скольжение: нет Полагают, что этот штамм является бактерией, аналогичной Flavobacterium aquatile и FlavobacteriumBergay's Manual of Systematic Bacteriology, 1,(1984) Bergay's Manual of Determinative Bacteriology, j), (1994). Однако этот штамм отличается от первого по неспособности образовывать какую-либо кислоту путем метаболизма сахарозы,неспособен разлагать казеин, способен разлагать эскулин, способен переводить в жидкое состояние желатин и позитивен к уреазе, и от последнего по неспособности разлагать казеин и медленно расти при 37 С. Таким образом, этот штамм был идентифицирован как бактерия,принадлежащая к роду Flavobacterium и ее назвали Flavobacterium sp. SA-0082. Вышеуказанный штамм называют Flavobacterium sp. SA-0082 и он депонирован в National Institute of Bioscience and Human Technology, Agency of Industrial Science and Technology(1-3, Higashi 1-chome, Tsukuba-shi, Ibaraki-ken 305, JAPAN) под номером в каталоге FERM P14872 с 29 марта 1995 года и депонирован в National Institute of Bioscience and HumanTechnology, как описано выше, под номером в каталоге FERM ВР-5402 (причем перенос в международное депонирование запрошен 15 февраля 1996 г.). Питательные вещества, подлежащие добавлению в среду для инкубации этого штамма,могут быть произвольными питательными веществами, поскольку применяемый штамм может их утилизировать, продуцируя эндофукоиданазу. Соответствующие примеры источника 22 углерода включают фукоидан, порошок морских водорослей, альгиновую кислоту, фукозу,глюкозу, маннит, глицерин, сахарозу, мальтозу,лактозу и крахмал, в то время как примеры источника азота включают дрожжевой экстракт,пептон, касамино (casamino) кислоты, экстракт замоченной кукурузы (corn steep liquor), мясной экстракт, обезжиренная соя, сульфат аммония и хлорид аммония. Кроме того, среда может содержать неорганические вещества и соли металлов, такие как соли натрия, фосфаты, соли калия, соли магния и соли цинка. Выход эндофукоиданазы, полученной инкубацией штамма, варьируется в зависимости от условий инкубации. В целом, предпочтительно,чтобы температура инкубации находилась в диапазоне от 15 до 30 С и значение рН среды находилось в диапазоне от 5 до 9. Выход эндофукоиданазы достигает максимума при инкубации штамма при аэрации и перемешивании в течение 5-72 ч. Как нечто само собой разумеющееся, условия инкубации соответственно выбирают в зависимости от применяемого штамма, состава среды и т.д. так, чтобы достичь максимальный выход. Эндофукоиданаза содержится как в клетках, так и в культуральном супернатанте. Вышеупомянутую Flavobacterium sp. SA0082 инкубируют в соответствующей среде и клетки собирают и разрушают способом, обычно применяемым для разрушения клеток, таким как ультразвуковая обработка. Таким образом можно получить экстракт, свободный от клеток. В дальнейшем, экстракт очищают с помощью процедуры очистки, обычно применяемой в данной области, тем самым получая препараточищенный фермент. Например, очистку можно осуществить путем обессоливания, ионнообменной хроматографии, колоночной хроматографией с носителем с гидрофобной связью,гель-фильтрацией или т. п., тем самым получая очищенную эндофукоиданазу, свободную от любой другой фукоиданазы. Культуральный супернатант, полученный удалением клеток из вышеупомянутой культуральной среды, также содержит большое количество этого фермента (внеклеточный фермент),который можно очистить такими же способами,как способы, применяемые для очистки внутриклеточного фермента. Далее будет дан пример очистки эндофукоиданазы.Flavobacterium sp. SA-0082 (FERM BP5402) инокулируют в 600 мл среды, включающей искусственную морскую воду (рН 7,5, произв. Jamarin Laboratory), содержащую 0,25% глюкозы, 1,0% пептона и 0,05% дрожжевого экстракта, которую пипетируют в 2-х литровую колбу Эрленмейера и стерилизуют при 120 С в течение 20 мин. Затем штамм инкубируют в нем при 24 С в течение 24 ч, тем самым получая семенную культуру. В 30-ти литровый сосуд 23 ферментер загружают 20 л среды, включающей искусственную морскую воду (рН 7,5, произв.(КМ 70 произв. Shin-Etsu Chemical Co., Ltd.) и стерилизуют при 120 С в течение 20 мин. После охлаждения, среду инокулируют 600 мл вышеупомянутой семенной культуры, которую затем инкубируют в ней при 24 С в течение 24 ч в условиях аэрации при скорости 10 л/мин и перемешивании при 125 об/мин. После завершения инкубации культуральную среду центрифугируют, тем самым собирая клетки. Эти клетки суспендируют в 20 мМ ацетатфосфатного буфера (рН 7,5), содержащего 200 мМ хлорида натрия, разрушают ультразвуковой обработкой и центрифугируют, получая тем самым экстракт клеток. Эндофукоиданаза в этом клеточном экстракте показывает активность 5 мЕ/мл среды. К этому экстракту добавляют сульфат аммония, так чтобы в конце концов установить 90% насыщение. После растворения путем перемешивания, смесь центрифугируют и осадок суспендируют в таком же буфере, как вышеупомянутый буфер, в котором суспендировали клетки. Затем суспензию тщательно диализуют против 20 мМ ацетат-фосфатного буфера (рН 7,5), содержащего 50 мМ хлорида натрия. После удаления образованного при диализе осадка центрифугированием, его адсорбируют DEAESepharose FF колонкой, которую уравновешивают 20 мМ ацетат-фосфатным буфером (рН 7,5), содержащим 50 мМ хлорида натрия. Затем адсорбированное вещество хорошо промывают тем же самым буфером и проявляют с помощью элюирования линейным градиентом хлорида натрия от 50 до 600 мМ. Активные фракции объединяют и туда добавляют хлорид натрия,получая финальную концентрацию 4 М. Затем его адсорбируют Phenyl Sepharose CL-4B колонкой, которую уравновешивают 20 мМ ацетатфосфатным буфером (рН 8,0), содержащим 4 М хлорида натрия. Затем адсорбированное вещество хорошо промывают тем же самым буфером и выделяют с помощью элюирования линейным градиентом хлорида натрия от 4 до 1 М. Активные фракции объединяют и концентрируют при помощи ультрафильтра. Далее, подвергают гель фильтрации с использованием Sephacryl S-300,уравновешивая 10 мМ фосфатным буфером,содержащим 50 мМ хлорида натрия. Активные фракции объединяют. Молекулярная масса фермента, определенная из времени удерживания в Sephacryl S-300 составляет около 460 000. Далее, активную фракцию диализуют против 10 мМ фосфатного буфера (рН 7), содержащего 250 мМ хлорида натрия. Раствор фермента адсорбируют Mono Q HR5/5 колонкой, которую уравновешивают 10 мМ фосфатным буфером 24 Адсорбированное вещество хорошо промывают тем же самым буфером и выделяют с помощью элюирования линейным градиентом хлорида натрия от 250 до 450 мМ. Активные фракции объединяют, получая тем самым очищенный фермент. В табл. 1 суммированы результаты вышеупомянутых стадий очистки. Стадия Клеточный экстракт Аммоний сульфат обессоливание Активность этого фермента определяют следующим образом. 50 мкл 2,5% раствора фукоидана, происходящего от Kjellmaniella crassifolia, 10 мкл этого фермента и 60 мкл 83 мМ фосфатного буфера (рН 7,5), содержащего 667 мМ хлорида натрия, смешивают вместе и реакцию проводят при 37 С в течение 3 ч. Затем 105 мкл реакционной смеси смешивают с 2 мл воды при перемешивании и измеряют поглощение(AT) при 230 нм. В качестве контролей применяют реакционную смесь, полученную тем же самым способом, но замещая фермент только вышеупомянутым буфером, применяемым для растворения фермента, и другую реакционную смесь, полученную тем же самым способом, но замещая раствор фукоидана только водой, и измеряют также их поглощения (АВ 1 и АВ 2). Количество фермента, с помощью которого 1 мкмоль гликозидных связей между маннозой и уроновой кислотой может быть эксклюзивно расщеплено в одну минуту, принимают за одну Е. Расщепленные таким образом связи определяют, считая миллимолярный молекулярный коэффициент экстинкции ненасыщенной уроновой кислоты, получаемой в реакции элиминирования, как 5,5. Активность фермента определяют в соответствии со следующим уравнением: Активность (Е/мл) = (AT - АВ 1 - АВ 2) х 2,105 х 120/ 2,105: объем (мл) образца, поглощение которого подлежит измерению; 120: объем (мкл) реакционной смеси с ферментом; 5,5: миллимолярный молекулярный коэффициент экстинкции (/мМ) ненасыщенной уроновой кислоты при 230 нм; 105: объем (мкл) реакционной смеси, применяемой для разбавления; 0,01: объем (мл) фермента и 180: время реакции (мин). 25 Белок определяют, измеряя поглощение раствора фермента при 280 нм, и рассчитывают,принимая поглощение 1 мг/мл раствора белка,равным 1,0. Фукоидан, происходящий от Kjellmaniellacrassifolia, применяемый в качестве субстрата,получают следующим способом. Сухую Kjellmaniella crassifolia размалывают при помощи свободной мельницы (free mill)(произв. Nara Kikai Seisakusho) и обрабатывают 10 объемами 85% метанола при 70 С в течение 2 ч. Затем фильтруют и остаток затем обрабатывают 10 объемами метанола при 70 С в течение 2 ч. После фильтрации, к остатку добавляют 20 объемов воды. Затем смесь обрабатывают при 100 С в течение 3 ч и фильтруют, получая экстракт. Концентрацию соли экстракта доводят до такого же уровня, как концентрация 400 мМ раствора хлорида натрия. Затем туда добавляют цетилпиридиний хлорид до тех пор, пока не перестанет образовываться осадок. После центрифугирования, осадок тщательно промывают этанолом, тем самым полностью удаляя цетилпиридиний хлорид. Далее, его подвергают обессоливанию и удалению низкомолекулярных веществ, используя ультрафильтр (исключение молекулярной массы ультрафильтрационной мембраной: 100 000, произв. Amicon). Полученный таким образом осадок удаляют с помощью центрифугирования. Супернатант сушат вымораживанием, получая очищенный Kjellmaniellacrassifolia фукоидан. Анализ структуры продукта реакции-фермента. Вышеупомянутая эндофукоиданаза представляет фермент, который эксклюзивно деградирует 14 связь между D-маннозой и Dглюкуроновой кислотой в сульфированном фукозусодержащем полисахариде-U. Когда полученный выше сульфированный фукозусодержащий полисахарид-U обрабатывают этим ферментом, образуются олигосахариды, имеющие структуры, представленные следующими формулами (I), (II) и (III): Ниже будет дано детальное описание. Порция каждой из трех вышеупомянутых трех фракций (а), (b) и (с), отделенной и очищенной с помощью DEAE-Sepharose FF, является пиридил-(2)-аминированной (РА) по редуцированному концу при использовании GlycoTAG и GlycoTAG Reagent Kit с получением РА сахаридов (РА-а), (РА-b) и (РА-с), которые затем анализируют с помощью ВЭЖХ. ВЭЖХ осуществляют в следующих условиях:(i) ВЭЖХ анализ с использованием колонки для молекулярно-массового фракционирования: установка: модель L-6200 (произв. Hitachi,Ltd.); колонки : SHODEX SB-803 (4,6 мм х 250 мм, про-изв. Showa Denco, К.К.); элюент: 0,2 М смеси хлорид натрия : диметилсульфоксид = 9:1; детектирование: флуорометрический детектор F-1150 (произв. Hitachi, Ltd.), длина волны возбуждения 320 нм, длина волны флуоресценции 400 нм; скорость потока: 1 мл/мин; и температура колонки: 50 С.(ii) ВЭЖХ анализ с использованием колонки с обращенной фазой: установка: модель L-6200 (произв. Hitachi,Ltd.); колонка: L-колонка (4,6 мм х 250 мм, произв. Kagaku Yakuhin Kensa Kyokai); элюент: 50 мМ уксусная кислота : триэтиламин (рН 5,5); детектирование: флуорометрический детектор F-1150 (произв. Hitachi, Ltd.), длина волны возбуждения 320 нм, длина волны флуоресценции 400 нм; скорость потока: 1 мл/мин; и температура колонки: 40 С. На фиг. 5, 6 и 7, соответственно, показаны ВЭЖХ картины элюирования пиридил-(2)аминированных сахаридных соединений (РА-а),(РА-b) и (РА-с). На каждой фигуре ордината относится к относительной интенсивности флуоресценции, а абсцисса относится к времени удерживания (мин). 27 Ниже иллюстрируются физические свойства соединений (а), (b) и (с), то есть, соединений, представленных формулами (I), (II) и (III). На фиг. (8), (9) и (10), соответственно, показаны масс-спектры соединений (а), (b) и (с), а на фиг. 11, 12 и 13, соответственно, показаны масс-спектры соединений (а), (b) и (c). На каждой фигуре ордината относится к относительной интенсивности (%), а абсцисса относится к значению м/z. Кроме того, на фиг. 14, 15 и 16, соответственно, показаны 1H ЯМР-спектры соединений(а), (b) и (с). На каждой фигуре ордината относится к интенсивности сигнала, абсцисса относится к химическому сдвигу (м.д.) Химические сдвиги в 1H ЯМР выражают,принимая химический сдвиг HOD равным 4, 65(м.д.) Физические свойства соединения (а): Молекулярная масса: 564; МС м/z: 563 [М-Н+]-; МС/МС м/z: 97 [HSO4]-, 157 [ненасыщенная D-глюкуроновая кислота-Н 2 О-Н+], 175 [ненасыщенная D-глюкуроновая кислота-Н+]-, 225[L-фукоза сульфат-Н 2 О-Н+]-, 243 [L-фукоза сульфат-Н+]-, 319 [ненасыщенная D-глюкуроновая кислота, связанная с О-маннозой-Н 2 О-Н+]- ,405 [М-ненасыщенная D-глюкуроновая кислотаН+]-, 483 [М-SО 3-Н+]-. 1 ЯМР (D2O): В описании приняты следующие сокращения для ЯМР данных: Физические свойства соединения (b): Молекулярная масса: 724 МС м/Z: 723 [М-Н+]-, 361 [М-2 Н+]2-. МС/МС м/z: 97 [HSO4]-, 175 [ненасыщенная D-глюкуроновая кислота-Н+], 243 [L-фукоза сульфат-H+]-, 321 [M-SO3-2H+]2-, 405 [Мненасыщенная D-глюкуроновая кислота-2SO3H+]-, 417 [M-L-фyкoзa-2SO3-H+]-. 1 Н ЯМР (D2 О):5.66 (1H, d, J=3.4 Hz, 4"H), 5.27 (1H, d, J=7.3 Hz, 1"-H), 5.22 (1H, d, J=1.8 Физические свойства соединения (с): Молекулярная масса: 1128; МС м/z: 1127 [М-Н+]-; МС/МС м/z: 97 [НSO4]-, 175 [ненасыщенная D-глюкуроновая кислота-Н+]-, 225 [L-фукозаD-маннозы, одна молекула ненасыщенной Dглюкуроновой кислоты и одна молекула Dглюкуроновой кислоты). Сульфат: две молекулы (в 3-положении каждой L-фукозы). Пики 1H-ЯМР приписаны, соответственно,положениям, обозначенным цифрами в следующей формуле (VI): Когда полученный таким образом сульфированный фукозусодержащий полисахарид-U обрабатывают вышеупомянутой эндофукоиданазой, по мере протекания реакции происходит элиминирование и таким образом поглощение при 230 нм увеличивается. Все основные продукты реакции несут ненасыщенные гексуронатные группы, что подтверждает, что полученный сульфированный фукозусодержащий полисахарид-U имеем сахарную цепь, состоящую из гексуроновой кислоты и маннозы, альтернативно связанных одна с другой. Поскольку фукоза содержится в качестве основного составляющего сахарида, полученный сульфированный фукозусодержащий полисахарид-U склонен к деградации кислотами, по сравнению с обычными полисахаридами. С другой стороны, известно, что связи гексуроновых кислот и маннозы относительно высоко устойчивы к кислотам. Изобретатели попытались идентифицировать гексуроновую кислоту в сахарной цепи,которая состоит из гексуроновой кислоты и маннозы, альтернативно связанных одна с другой, и содержится в смеси сульфированных фу 003902 30 козусодержащих полисахаридов, происходящей из Kjellmaniella crassifolia, нижеследующим способом со ссылкой на способ, описанный вCarbohydrate Research, 125, 283-290 (1984). Сначала, сульфированную фукозусодержащую полисахаридную смесь растворяют в 0,3 М щавелевой кислоте и обрабатывают при 100 С в течение 3 ч. Затем ее подвергают фракционированию по молекулярным массам и фракции с молекулярной массой 3 000 или более объединяют. Затем ее в дальнейшем обрабатывают анионообменной смолой и адсорбированные вещества собирают. Полученное таким образом вещество сушат вымораживанием и гидролизуют 4N хлористо-водородной кислотой. После доведения значения рН до 8, его пиридил-(2)-аминируют и уроновую кислоту анализируют методом ВЭЖХ. ВЭЖХ осуществляют в следующих условиях: установка: модель L-6200 (произв. Hitachi,Ltd.); колонка: PALPAK Тип N (4,6 мм х 250 мм,произв. Takara Shuzo Co., Ltd.); элюент: 200 мМ уксусная кислотатриэтиламиновый буфер (рН 7,3): ацетонитрил= 25:75; детектирование: флуорометрический детектор F-1150 (произв. Hitachi, Ltd.), длина волны возбуждения: 320 нм, длина волны флуоресценции: 400 нм; скорость потока: 0,8 мл/мин и температура колонки: 40 С. В качестве стандартов для РА гексуроновых кислот используют стандарты, полученные пиридил-(2)-аминированием глюкуроновой кислоты, производимой Sigma Chemical Co., галактуроновой кислоты, производимой WakoChemical Co., и маннуроновой кислоты и гулуроновой кислоты, полученной гидролизом альгиновой кислоты (произв. Wako Pure ChemicalIndustries, Ltd.), с последующим разделением при помощи анионообменной смолы со ссылкой на способ, описанный в Acta Chemica Scandinavica, 15, 1397-1398 (1961). В результате, установлено, что глюкуроновая кислота только одна содержится в виде гексуроновой кислоты в сахарной цепи в вышеупомянутой смеси сульфированных фукозусодержащих полисахаридов. Далее, глюкуроновую кислоту в гидролизате вышеупомянутой сахарной цепи отселяют от D-маннозы, используя анионообменную смолу, и сушат вымораживанием. Затем измеряют ее удельное вращение. Таким образом установлено, что глюкуроновая кислота представляет декстровращающую глюкуроновую кислоту, то есть, D-глюкуроновую кислоту. Далее, сульфированную фукозусодержащую полисахаридную смесь, происходящую отKjellmaniella crassifolia, обрабатывают вышеупомянутой эндофукоиданазой и затем гидролизуют, используя щавелевую кислоту, аналогично вышеупомянутому случаю. Однако никакого полимера, имеющего D-глюкуроновую кислоту и D-маннозу, альтернативно связанных одна с другой, не обнаружено. На основе этих результатов устанавливают, что вышеупомянутая эндофукоиданаза расщепляет путем реакции элиминирования сульфированные фукозусодержащие полисахариды,имеющие структуру скелета, состоящую из Dглюкуроновой кислоты и D-маннозы, альтернативно связанных одна с другой. Далее, полимер, полученный деградацией с помощью щавелевой кислоты, подвергают ЯМР анализу, тем самым изучая аномерную конфигурацию мест связывания D-глюкуроновой кислоты и D-маннозы и гликозидную связь. Данные ЯМР-анализа полимера являются следующими. Химические сдвиги в 1 Н ЯМР выражают, принимая химический сдвиг метильной группы в триэтиламине равным 1,13 (м.д.) а химические сдвиги в 13 С ЯМР выражают, принимая химический сдвиг метильной группы в триэтиламине равным 9,32 м.д. 1 Что касается конфигурации в 1-положенииD-глюкуроновой кислоты, то ее идентифицируют как -D-глюкуроновую кислоту, ее вицинальной константы (постоянной) связывания 7,6 Гц. Что касается конфигурации в 1-положенииD-маннозы, то ее идентифицируют как -Dманнозу, вследствие ее химического сдвига 5,25 м.д. Способы связывания составляющих сахаридов анализируют методом НМВС, то есть,методом определения 1H-гетероядерной связи.DQF-COSY и НОНАНА методы применяют при отнесении в 1 Н ЯМР, в то время как HSQC метод применяют при отнесении в 13 С ЯМР. В НМВС спектре взаимодействующие пики наблюдают между 1-Н и 4'-С с между 4'-Н и 32 1-С, и между 1'-Н и 2-С с между 2-Н и 1'-С. Эти факты указывают, что D-глюкоза связана в 2 положении D-маннозы через -связь, в то время как D-манноза связана в 4-положении D-глюкуроновой кислоты через -связь. Принимая во внимание вышеупомянутые результаты, обнаружено, что соединение (а) имеет структуру, где ненасыщенная D-глюкуроновая кислота и L-фукоза, имеющая связанную с ней сульфогруппу, связаны с Dманнозой, которая имеет редуцированный конец; соединение (b) имеет структуру, где ненасыщенная D-глюкуроновая кислота и L-фукоза,имеющая две связанные с ней сульфогруппы,связаны с D-маннозой, которая имеет редуцированный конец и имеет сульфогруппу, связанную с ней; и соединение (с) имеет структуру, где Dглюкуроновая кислота и L-фукоза, имеющая связанную с ней сульфогруппу, связаны с Dманнозой, которая имеет редуцированный конец, и с этой D-глюкуроновой кислотой связанаD-манноза и, в свою очередь, с этой ненасыщенной D-маннозой дополнительно связаны ненасыщенная D-глюкуроновая кислота и Lфукоза, имеющая сульфогруппу, связанную с ней. Как обсуждено выше, полученный сульфированный фукозусодержащий полисахарид-U имеет структуру, где D-глюкуроновая кислота иD-манноза альтернативно связаны одна с другой, и L-фукоза связана, по крайней мере, с одной D-маннозой. Кроме того, он имеет частичную (фрагмент) структуру, представленную следующей общей формулой (VIII), где, по крайней мере,одна из спиртовых гидроксильных групп сульфирована и n равно целому числу 1 или более: Данное изобретение обеспечивает сульфированный фукозусодержащий полисахарид-U,который был отделен от сульфированного фукозусодержащего полисахарида-F данного изобретения, и очищен. Сульфированный фукозусодержащий полисахарид-U данного изобретения содержит уроновую кислоту в виде его составляющего сахарида и деградируется фукоиданазой, полученной с помощью Flavobacterium sp.SA-0082 (FERM BP-5402), с получением, по крайней мере, одного соединения, выбранного из соединений, представленных вышеупомянутыми формулами (I), (II) и (III). Сульфированный фукозусодержащий полисахарид-U данного изобретения не ограничен молекулярной массой, молекулярно-массовым распределением 33 или сахаридной композицией. А именно, можно получить сульфированный фукозусодержащий полисахарид-U, имеющий произвольную молекулярную массу и молекулярно-весовое распределение, и можно получить сульфированные фукозусодержащие полисахариды, имеющие определенным образом прогнозируемые физико-химические свойства. Сульфированный фукозусодержащий полисахарид-U данного изобретения не имеет такого сильного антикоагулянтного действия,как действие, показанное сульфированным фукозусодержащим полисахаридом-F. Таким образом, могут быть разработаны сульфированные фукозусодержащие полисахариды, в основном,не проявляющие антикоагулянтную активность. Сульфированный фукозусодержащий полисахарид-U данного изобретения может использоваться в виде очищенных сульфированных фукозусодержащих полисахаридов, в противораковых средствах, антиметастатических средствах, канцеростатических агентах и т.п. Кроме того, он полезен в качестве антигена против антисульфированного фукозусодержащего полисахаридного антитела. Кроме того, можно получить олигосахариды, такие как олигосахариды, имеющие структуры вышеуказанных формул (I), (II) и (III), из сульфированного фукозусодержащего полисахарида-U. А именно,его используют для получения этих новых соединений. Ниже описывается сульфированный фукозусодержащий полисахарид-F данного изобретения и способ его получения. Сульфированный фукозусодержащий полисахарид-F данного изобретения можно получить, используя способ данного изобретения следующим образом. Смесь сульфированных фукозусодержащих полисахаридов обрабатывают расщепляющим ферментом, способным деградировать сульфированный фукозусодержащий полисахарид-U. После завершения ферментативной реакции, деградированный таким образом сульфированный фукозусодержащий полисахарид-U удаляют ультрафильтрацией, и т.д. В качестве вышеупомянутого расщепляющего фермента можно использовать любой фермент, который может селективно деградировать сульфированный фукозусодержащий полисахарид-U. В качестве его конкретного примера можно указать вышеупомянутую эндофукоиданазу, продуцируемую Flavobacterium sp. SA0082 (FERM BP-5402). При обработке этим ферментом, концентрация субстрата, температура, значение рН и т.д. могут быть подобраны соответственно так,чтобы обеспечить преимущественно протекание ферментативной реакции. Обычно желательно,чтобы концентрация субстрата варьировалась в диапазоне от приблизительно 0,1 до 10%, температура варьировалась от приблизительно 20 до 40 С и значение рН варьировалось от приблизительно 6 до 9. 34 Можно также микроорганизм, способный продуцировать расщепляющий фермент, имеющий способность деградировать сульфированный фукозусодержащий полисахарид-U, подвергнуть инкубации в среде, в которую добавлена смесь сульфированных фукозусодержащих полисахаридов, и затем сульфированный фукозусодержащий полисахарид-F подвергнуть очистке из этой среды. Микроорганизм, подлежащий использованию, может быть произвольным микроорганизмом, который способен продуцировать расщепляющий фермент, имеющий способность деградировать сульфированный фукозусодержащий полисахарид-U. В качестве конкретного его примера, можно указать микроорганизм Flavobacterium sp. SA-0082 (FERM BP5402), описанный выше, и Fucoidanobacter marinus SI-0098 (FERM-5403). Питательные вещества, подлежащие добавлению в среду, могут быть произвольными,поскольку используемый штамм может утилизовать их для того, чтобы продуцировать расщепляющий фермент. Соответствующие примеры источника углерода включают фукоидан,порошок морских водорослей, альгиновую кислоту, фукозу, глюкозу, маннит, глицерин, сахарозу, мальтозу, лактозу и крахмал, в то время как примеры источника азота включают дрожжевой экстракт, пептон, casamino кислоты, экстракт замоченной кукурузы, мясной экстракт,обезжиренную сою, сульфат аммония и хлорид аммония. Среда может дополнительно содержать неорганические вещества и соли металла,такие как соли натрия, фосфаты, соли калия,соли магния и соли цинка. Не говоря уже о том, что условия инкубации следует подбирать в зависимости от используемого штамма, состава среды, и т.д. так,чтобы достичь максимального уровня активности расщепления сульфированного фукозусодержащего полисахарида-U. Вообще говоря,инкубацию можно осуществлять при температуре от 15 до 30 С и при рН среды от 5 до 9 в условиях аэрации/перемешивании в течение от 5 до 72 ч. После завершения инкубации, компоненты в среде, другие чем сульфированный фукозусодержащий полисахарид-F, а именно, таким образом деградированный сульфированный фукозусодержащий полисахарид-U и т.д., могут быть удалены, например, ультрафильтрацией. Этот штамм Fucoidanobacter marinus SI0098, который был выделен настоящими изобретателями из морской воды Aomori, имеет следующие микологические свойства. 1. Fucoidanobacter marinus SI-0098 штамм. а. Морфологические свойства(1) Область температур роста : способен расти при 37 С, соответствующий диапазон температур роста в пределах от 15 до 28 С;(12) Потребность в солевой среде Рост в свободной от NaCl среде : Рост в 1% NaCl среде: Рост в среде морской воды: +(14) GC содержание во внутриклеточной ДНК: 61%(19) Цвет колонии: нет образования характерного пигмента колонии(22) Жгутик: полярный монотрихат Согласно классификации, описанной в(1994), этот штамм попадает в группу 4 (Грамотрицательные аэробные бациллы и кокки). Однако этот штамм значительно отличается от бактерий, относящихся к группе 4, по имеющемуся менахинону 7 в электронной транспортной цепи и содержанию 61% GC. В основном грамотрицатальные бактерии имеют убихинон в электронной транспортной цепи, в то время как грамположительные бактерии имеют менахинон. Хотя грамотрицательные бактерии, относящиеся к родам Flavobacterium и Cytophaga,имеют исключительно менахинон в электронной транспортной цепи, они сильно отличаются по GC содержанию от вышеупомянутого штамма, такого как Cytophaga arvensicola, который является почвенной бактерией и содержит от 43 до 46% GC, и Cytophaga diffluens, С. fermentans,С. marina и С. uliginosa, которые являются морскими бактериями, каждая из которых содержит 42% GC. Когда этот штамм сравнивают по гомологии в 16SрДНК (16SrDNA) последовательности со штаммами, которые были идентифицированы, то даже наиболее гомологичный 36 штамм (Verrucomicrobium spinosum) показывает гомологию 76,6%. Широко известно, что две бактерии с гомологией 90% или менее, одна от другой отличаются по роду. Таким образом,изобретатели пришли к выводу, что этот штамм представляет новую бактерию, не принадлежащую ни к одному из существующих родов, и его назвали Fucoidanobacter marinus SI-0098. Вышеуказанный штамм называют Fucoidanobacter marinus SI-0098 и он депонирован в National Institute of Bioscience and Human Technology, Agency of Industrial Science andFERM P-14873 с 29 марта 1995 года и депонирован в National Institute of Bioscience and Human Technology, как описано выше, под номером в каталоге FERM BP-5403 (причем перенос в международное депонирование запрошен 15 февраля 1996 г.). Как описано выше, изобретателями было установлено, что сульфированный фукозусодержащий полисахарид-F и сульфированный фукозусодержащий полисахарид-U данного изобретения демонстрируют совершенно различные друг от друга поведения по отношению к полисахаридному агглютинирующему средству в присутствии одной или более солей при концентрации от 0,6 до 3 М. Например, сульфированный фукозусодержащий полисахарид-F данного изобретения может быть выделен из водного раствора смесей сульфированных фукозусодержащих полисахаридов, используя способ данного изобретения. Сначала, одну или более солей добавляют к водному раствору смеси сульфированных фукозусодержащих полисахаридов таким образом,чтобы получить суммарную концентрацию соли от 0,6 до 3 М. В качестве солей, подлежащих добавлению, можно использовать, например,хлорид натрия и хлорид кальция без ограничения. После доведения концентрации соли, кислый полисахаридный коагулирующий агент,такой как цетилпиридиний хлорид, добавляют до тех пор, пока осадок больше не будет образовываться. Затем осадки собирают, получая тем самым сульфированный фукозусодержащий полисахарид-F данного изобретения. Однако следует обратить внимание на точку, где сульфированный фукозусодержащий полисахарид-F может с трудом образовывать какой-либо осадок в случае цетилпиридиний хлорида, когда концентрация вышеупомянутой соли превышает 2 М. Обычно, сульфированный фукозусодержащий полисахарид-F данного изобретения можно отделить от сульфированного фукозусодержащего полисахарида-U при концентрации соли приблизительно 1,5 М (смотри,иллюстрацию фиг .1). После промывания осадка, при необходимости, цетилпиридиний хлорид в осадке вымывают с помощью смеси натрий хлорид 37 насыщенный спирт, получая тем самым сульфированный фукозусодержащий полисахарид-F данного изобретения. Осадок можно растворить и подвергнуть ультрафильтрации, чтобы удалить окрашивающие вещества из полученного таким образом сульфированного фукозусодержащего полисахарида-F данного изобретения. Возможно также обессоливание и сушка вымораживанием осадка с получением сухого препарата. Кроме того, в процессе можно добавить консервант или т.п. Настоящими изобретателями также обнаружено, что когда сульфированные фукозусодержащие полисахариды очищают, используя анионообменную смолу, как описано выше, сосуществование двухвалентного катиона вызывает количественное увеличение сульфированных фукозусодержащих полисахаридов, адсорбированных на единицу поверхности смолы, и таким образом сульфированные фукозусодержащие полисахариды можно выделить более эффективно. Чтобы получить сульфированный фукозусодержащий полисахарид-F данного изобретения, используя способ данного изобретения, к смеси сульфированных фукозусодержащих полисахаридов добавляют химическое вещество,служащее в качестве источника двухвалентного катиона, предпочтительно при концентрации 1 мМ или более. Затем, анионообменную смолу уравновешивают раствором, содержащим двухвалентный катион предпочтительно при концентрации 1 мМ или более, и при этом вышеупомянутая смесь сульфированных фукозусодержащих полисахаридов адсорбируется. После тщательного промывания анионообменной смолы используемым раствором при уравновешивании сульфированный фукозусодержащий полисахарид-F выделяют при помощи элюирования линейным градиентом, например, хлорида натрия. В практике данного способа, двухвалентный катион может быть добавлен так, чтобы получить концентрацию 1 мМ или больше. В качестве химического вещества, выполняющего роль источника двухвалентного катиона, подлежащего использованию в данном способе,соли кальция и соли бария демонстрируют особенно превосходные действия. Однако данное изобретение не ограничивается этими веществами и могут быть также использованы сульфат магния, хлорид марганца, и т.д. Сульфированный фукозусодержащий полисахарид-F данного изобретения можно получить, например, способом, описанным в примере 8. Ниже будут иллюстрированы физикохимические свойства этого сульфированного фукозусодержащего полисахарида-F,хотя сульфированный фукозусодержащий полисахарид-F данного изобретения не ограничивается им. Молекулярная масса полученного таким образом сульфированного фукозусодержащего полисахарида-F определяют с помощью метода 38 гель-фильтрации с использованием Sepharyl S500. В результате этого, он показывает молекулярно-массовое распределение вблизи приблизительно 190 000 (фиг. 17). На фиг. 17 ордината относится к содержанию сахарида в образце,определенному по фенол-сернокислотному способу, и выраженному как поглощение при 480 нм, в то время как абсцисса соответствует номеру фракции. Гель-фильтрацию осуществляют в следующих условиях: размер колонки: 3,08 х 162,5 см; растворитель: 10 мМ натрий фосфатный буфер (рН 6,0), содержащий 0,2 М хлорида натрия и 10% этанола; скорость потока: 1,5 мл/мин; концентрация образца: 0,25%; объем образца: 20 мл; стандарт молекулярной массы: ShodexSTANDARD P-82 (производимый Showa Denko,К.К.). Затем анализируют компоненты полученного таким образом сульфированного фукозусодержащего полисахарида-F данного изобретения. Сначала, содержание фукозы определяют в соответствии со способом, описанным в Journalof Biological Chemistry, 175, 595 (1948). Затем, сухой препарат полученного таким образом сульфированного фукозусодержащего полисахарида-F растворяют в IN хлористоводородной кислоте, получая концентрацию 0,5%, и обрабатывают при 110 С в течение 2 ч, гидролизуя тем самым его на составляющие моносахариды. В дальнейшем, редуцированные концы моносахаридов, полученных гидролизом, пиридил-(2)-аминируют (ПА) путем использованияGlycoTAG и GlycoTAG Reagent Kit и соотношение составляющих моносахаридов в композиции анализируют при помощи ВЭЖХ. ВЭЖХ осуществляют в следующих условиях: установка: модель L-6200 (произв. Hitachi,Ltd.); колонка: PALPAK Тип А (4,6 мм х 150 мм); элюент: 700 мМ боратный буфер (рН 9,0): ацетонитрил = 9:1; детектирование: флуореметрический детектор F-1150 (произв. Hitachi, Ltd.), длина волны возбуждения: 310 нм, длина волны флуоресценции: 380 нм; скорость протока: 0,3 мл/мин; и температура колонки: 65 С. Затем содержание уроновой кислоты определяют согласно методу, описанному в Analytical Biochemistry, 4, 330 (1962). В дальнейшем, содержание серной кислоты определяют в соответствии с методом, описанным в Biochemical Journal, 84, 106 (1962). В результате, установлено, что составляющими сахаридами полученного выше сульфированного фукозусодержащего полисахарида-F являются фукоза и галактоза при молярном 39 отношении приблизительно 10:1. Ни уроновая кислота, ни какие-либо другие нейтральные сахариды, в основном, в нем не содержатся. Молярное отношение фукозы к сульфату составляет приблизительно 1:2. Затем, 16 мл 1% раствора фукоидана-F, 12 мл 50 мМ фосфатного буфера (рН 8,0), 4 мл 4 М хлорида натрия и 8 мл 32 мЕ/мл раствора вышеупомянутой эндофукоиданазы, происходящей от Flavobacterium sp. SA-0082 (FERM BP-5402),смешивают вместе и подвергают взаимодействию при 25 С в течение 48 ч. В результате, продукт расщепления не образуется и субстрат не деградирует. ИК-спектр кальциевой соли сульфированного фукозусодержащего полисахарида-F получают на инфракрасном спектрометре с Фурье преобразованием типа JIR-DIAMOND 20 (произв. JEOL Ltd.). Так получен спектр, показанный на фиг. 18. На фиг. 18 ордината соответствует пропусканию (%), а абсцисса соответствует волновому числу (см-1). 1H ЯМР спектр натриевой соли сульфированного фукозусодержащего полисахарида-F данного изобретения получают на спектрометре ядерного магнитного резонанса Модель JNM500 (500 мГц; произв. JEOL Ltd.). Так получен спектр, показанный на фиг. 19. На фиг. 19 по ординате отложена интенсивность сигнала, а по абсциссе отложен химический сдвиг (м.д.). Химические сдвиги в 1H ЯМР выражают, используя в качестве эталона химический сдвиг HOD, равный 4,65 м.д. 1H ЯМР (D2O):5,30 (Н в 1-положении фукозы), 1,19 (Н в СН 3 при 5-положении фукозы). При измерении на высокоскоростном, высокочувствительном поляриметре SEDA-300(произв. Horiba Seisakusho), высушенный вымораживанием продукт сульфированного фукозусодержащего полисахарида-F имеет удельное вращение -135. Данное изобретение обеспечивает сульфированный фукозусодержащий полисахарид-F,который был отделен от сульфированного фукозусодержащего полисахарида-U данного изобретения и очищен. Сульфированный фукозусодержащий полисахарид-F данного изобретения, в основном, не содержит уроновой кислоты в качестве составляющего сахарида и он не деградируется фукоиданазой, продуцируемой Flavobacterium sp. SA-0082 (FERM-5402). Сульфированный фукозусодержащий полисахарид-F данного изобретения не ограничивается по молекулярной массе, молекулярно-массовому распределению или составу сахарида. А именно,можно получить сульфированный фукозусодержащий полисахарид-F, имеющий произвольную молекулярную массу и молекулярномассовое распределение, и могут предусматриваться сульфированные фукозусодержащие по 003902 40 лисахариды, имеющие определенным образом прогнозируемые физико-химические свойства,такие как состав сахаридов и редуцированный конец и чрезвычайно высокая степень сульфирования. Будучи отделенным от сульфированного фукозусодержащего полисахарида-U, который,в основном, не имеет антикоагулянтной активности, сульфированный фукозусодержащий полисахарид-F данного изобретения имеет сильную антикоагулянтную активность. Таким образом, сульфированный фукозусодержащий полисахарид-F и/или продукты его расщепления могут использоваться в антикоагулянтных агентах в виде очищенных сульфированных фукозусодержащих полисахаридов и, кроме того, они полезны в качестве антигена против антитела антисульфированного фукозусодержащего полисахарида. Когда сульфированные фукозусодержащие полисахариды или продукты их расщепления согласно данному изобретению добавляют при концентрации 1 мкг/мл или более к культуральной среде злокачественных клеток, злокачественные клетки претерпевают апоптоз на протяжении от одного до нескольких дней после добавления. Другими словами, сульфированные фукозусодержащие полисахариды и продукты их расщепления имеют сильное действие, вызывая апоптоз. На нормальные клетки эти вещества не оказывают ни какого-либо вызывающего апоптоз действия, ни токсичности. В частности,сульфированные фукозусодержащие полисахариды, происходящие из пригодных в пищу бурых водорослей и морского огурца, и продукты их расщепления высоко безопасны. Чтобы получить индуктор апоптоза данного изобретения, сульфированные фукозусодержащие полисахариды и продукты их расщепления используют в качестве активного ингредиента и комбинируют с широкоизвестными фармацевтическими носителями. В общем, сульфированные фукозусодержащие полисахариды и/или продукты их расщепления смешивают с фармацевтически приемлемыми жидкими или твердыми носителями. После необязательного добавления растворителей, диспергирующих средств, эмульгаторов, буферов, стабилизаторов, наполнителей, связующих, дезинтеграторов, смазывающих средств и т.п., смесь перерабатывают в твердые препараты, такие как таблетки, гранулы, порошки, дусты, капсулы или т.п., или жидкие препараты, такие как растворы,суспензии, эмульсия и т.п. Альтернативно, ее можно переработать в сухой препарат, который может быть переведен в жидкое состояние добавлением соответствующего носителя в него до использования. Индуктор апоптоза данного изобретения можно применять либо перорально, либо парентерально, например с помощью инъекции или внутривенного капельного вливания. 41 Фармацевтические носители могут быть надлежащим образом подобраны в зависимости от пути введения и лекарственной формы, описанной выше. В случае оральных лекарственных средств, можно использовать, например, крахмал, лактозу, сахарозу, маннит, карбоксиметилцеллюлозу, кукурузный крахмал и неорганические соли. При получении оральных лекарственных средств, можно добавить связующие,дезинтеграторы, поверхностно-активные вещества, смазывающие вещества, улучшающие текучесть, корригенты, окрашивающие вещества,отдушки и т.п. Конкретными примерами этих добавок являются следующие. Связующее: крахмал, декстрин, порошкообразная аравийская камедь, желатин, гидроксипропилкрахмал, метилцеллюлоза, натрий карбоксиметилцеллюлоза, гидроксипропилцеллюлоза, кристаллическая целлюлоза, этилцеллюлоза, поли(винилпирролидон) и макрогол. Дезинтегратор: крахмал, гидроксипропилкрахмал, натрий карбоксиметилцеллюлоза,кальций карбоксиметилцеллюлоза, карбоксиметилцеллюлоза и низкозамещенная гидроксипропилцеллюлоза. Поверхностно-активное вещество: натрийлаурилсульфат, соевый лецитин, сахарозные сложные эфиры жирных кислот и полисорбат 80. Смазывающее вещество: тальк, воски, гидрированные масла растительного происхождения, сахарозные сложные эфиры жирных кислот, стеарат магния, стеарат кальция, стеарат алюминия и полиэтиленгликоль. Вещества, повышающие текучесть: легкая безводная кремневая кислота, сухой гель гидроксида алюминия, синтетический алюмосиликат и силикат магния. Примеры жидких препаратов для орального применения включают суспензии, эмульсии,сиропы и эликсиры, причем каждый необязательно содержит корригенты и красители. С другой стороны, парентеральные препараты могут быть получены путем растворения или суспендирования сульфированных фукозусодержащих полисахаридов и/или продуктов их расщепления, которые являются активным ингредиентом данного изобретения, в разбавителях, таких как дистиллированная вода для инъекции, физиологический соляной раствор, водный раствор глюкозы, растительные масла для инъекции, кунжутное масло, арахисовое масло,соевое масло, кукурузное масло, пропиленгликоль, полиэтиленгликоль или т.п., обычным способом и добавлением, при необходимости,бактерицидов, стабилизаторов, тонизирующих средств, смягчающих средств и т.д. Индуктор апоптоза данного изобретения применяют путем введения способом, подходящим для лекарственной формы. Способ введения особенно не ограничен. А именно, может быть выбрано внутреннее применение, наруж 003902 42 ное применение или инъекция. Инъекции могут вводиться, например, внутривенно, внутримышечно, подкожно или интрадермально. Препараты для наружного применения включают суппозитории. Доза индуктора апоптоза данного изобретения особенно не конкретизируется, но она может определяться в зависимости от лекарственной формы, способа введения, цели использования, и возраста, веса тела, состояний и т.д. пациента. В общем, доза может быть определена так, чтобы взрослый пациент получал от 1 до 1 000 мг/день, предпочтительно от 10 до 200 мг/день, активного ингредиента. Само собой разумеется, доза варьируется в зависимости от различных факторов. Так, в некоторых случаях достаточно использовать дозу меньше, чем вышеупомянутый уровень, а в других случаях требуется доза, превышающая вышеупомянутый уровень. Противораковое лекарственное средство можно получить, используя предлагаемые сульфированный фукозусодержащий полисахарид-U, и сульфированный фукозусодержащий полисахарид-F и/или продукты их расщепления,которые имеют противораковое действие, в качестве активного ингредиента, комбинируя их с широкоизвестными фармацевтическими носителями и затем подвергая эту смесь переработке в лекарственный препарат. Противораковое лекарственное средство можно получить способом, описанным выше. В общем, сульфированные фукозусодержащие полисахариды и/или продукты их расщепления данного изобретения смешивают с фармацевтически приемлемыми жидкими или твердыми носителями. После необязательного добавления растворителей, диспергирующих средств, эмульгаторов, буферов,стабилизаторов, наполнителей, связующих, дезинтеграторов, смазывающих средств и т.п.,смесь подвергают переработке в твердые препараты, такие как таблетки, гранулы, порошки,дусты, капсулы или т.п., или в жидкие препараты, такие как растворы, суспензии, эмульсия или т.п. Альтернативно, смесь можно подвергнуть переработке в сухой препарат, который может быть переведен в жидкое состояние добавлением в него соответствующего носителя до использования. Противораковое лекарственное средство данного изобретения можно применять либо перорально, либо парентерально, например с помощью инъекции или внутривенного капельного вливания. Фармацевтические носители могут быть надлежащим образом подобраны в зависимости от пути введения и лекарственной формы в соответствии со случаем вышеупомянутого индуктора апоптоза. Противораковое лекарственное средство данного изобретения применяют при помощи соответствующего пути введения, подходящего 43 для данной лекарственной формы. Способ введения особенно не ограничен. А именно, может быть выбрано внутреннее применение, наружное применение или инъекция. Инъекции могут вводиться, например, внутривенно, внутримышечно, подкожно или интрадермально. Препараты для наружного применения включают суппозитории. Доза противоракового лекарственного средства данного изобретения особенно не конкретизируется, но она может определяться в зависимости от лекарственной формы, способа введения, цели использования, и возраста, веса тела, состояний и т.д. пациента. В общем, доза может быть определена так, чтобы взрослый пациент получал от 1 до 1000 мг/день, предпочтительно от 10 до 200 мг/день, активного ингредиента. Само собой разумеется, доза варьируется в зависимости от различных факторов. Так, в некоторых случаях достаточно использовать дозу меньше, чем вышеупомянутый уровень, а в других случаях требуется доза, превышающая вышеупомянутый уровень. Лекарственное средство данного изобретения можно применять орально, как таковое. Альтернативно, его можно добавлять в произвольную пищу или питье для каждодневного потребления. Канцеростатическое лекарственное средство можно получить, используя сульфированные фукозусодержащие полисахариды и/или продукты их расщепления, которые имеют канцеростатическое действие, в качестве активного ингредиента, комбинируя их с широкоизвестными фармацевтическими носителями и затем подвергая эту смесь переработке в лекарственный препарат. Канцеростатическое лекарственное средство можно получить способом, описанным выше. В общем, сульфированные фукозусодержащие полисахариды и/или продукты их расщепления данного изобретения смешивают с фармацевтически приемлемыми жидкими или твердыми носителями. После необязательного добавления растворителей, диспергирующих средств, эмульгаторов, буферов, стабилизаторов, наполнителей, связующих, дезинтеграторов, смазывающих средств и т.п., смесь подвергают переработке в твердые препараты, такие как таблетки, гранулы, порошки, дусты, капсулы или т.п., или в жидкие препараты, такие как растворы, суспензии, эмульсия или т.п. Альтернативно, смесь можно подвергнуть переработке в сухой препарат, который может быть разжижен добавлением в него соответствующего носителя до использования. Канцеростатическое лекарственное средство данного изобретения можно применять либо перорально, либо парентерально, например с помощью инъекции или внутривенного капельного вливания. Фармацевтические носители могут быть надлежащим образом подобраны в зависимости 44 от пути введения и лекарственной формы в соответствии со случаем вышеупомянутого индуктора апоптоза. Канцеростатическое лекарственное средство данного изобретения применяют при помощи соответствующего пути введения, подходящего для лекарственной формы. Способ введения особенно не ограничен. А именно, может быть выбрано внутреннее применение, наружное применение или инъекция. Инъекции могут вводиться, например, внутривенно, внутримышечно, подкожно или интрадермально. Препараты для наружного применения включают суппозитории. Доза канцеростатического лекарственного средства данного изобретения особенно не конкретизируется, но она может определяться в зависимости от лекарственной формы, способа введения, цели использования, и возраста, веса тела, состояний и т.д. пациента. В общем, доза может быть определена так, чтобы взрослый пациент получал от 1 до 1000 мг/день, предпочтительно от 10 до 200 мг/день, активного ингредиента. Само собой разумеется, доза варьируется в зависимости от различных факторов. Так, в некоторых случаях достаточно использовать дозу меньше, чем вышеупомянутый уровень, а в других случаях требуется доза, превышающая вышеупомянутый уровень. Лекарственное средство данного изобретения можно применять орально, как таковое. Альтернативно, его можно добавлять в произвольную пищу или питье для каждодневного потребления. Сульфированные фукозусодержащие полисахариды и продукты их расщепления согласно данному изобретению являются веществами природного происхождения и они не проявляют токсичности при оральном введении мышам. Лекарственные средства данного изобретения, как ожидают, могут быть использованы в качестве лечебных средств при инфекционных заболеваниях, иммунной депрессии, гипериммунности, рака, вирусных заболеваний и т.п. Также, их можно использовать для предупреждения образования злокачественной опухоли,поддерживая состояние здоровья. Способ индуцирования апоптоза данного изобретения используют, например, для изучения механизмов биологической защиты, иммунных функций и отношений к злокачественному новообразованию и вирусным заболеваниям, или разработки индукторов апоптоза. В частности, сульфированные фукозусодержащие полисахариды и продукты их расщепления согласно данному изобретению, полученные из съедобных бурых водорослей или морского огурца, которые принимали в виде пищи на протяжении длительного времени, являются высоко безопасными при оральном применении. Вследствие высоких молекулярных масс сульфированных полисахаридов, сульфирован 45 ные фукозусодержащие полисахариды не могут быть использованы, как таковые, в качестве лекарственных средств, но их можно подвергнуть расщепления до некоторой степени, увеличив тем самым их антигенность, гомогенность, антикоагулянтную активность и т.д. Данное изобретение обеспечивает фермент, способный селективно деградировать только сульфированный фукозусодержащий полисахарид-F, и продукты расщепления сульфированного фукозусодержащего полисахарида-F, полученные обработкой сульфированного фукозусодержащего полисахарида-F этим ферментом. Штамм, подлежащий использованию в данном изобретении, может представлять любой Alteromonas, поскольку он может продуцировать фермент, расщепляющий эндсульфированный фукозусодержащий полисахарид. В качестве конкретного примера штамма, способного продуцировать фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид, можно указать Alteromonas sp. SA-1009. Продукты расщепления сульфированного фукозусодержащего полисахарида-F данного изобретения можно получить обработкой сульфированного фукозусодержащего полисахарида-F ферментом, расщепляющим эндосульфированный фукозусодержащий полисахарид, происходящим от этого штамма. Этот штамм, который впервые был выделен настоящими изобретателями из морской воды в Aomori, имеет следующие микологические свойства. а. Морфологические свойства(1) Область температур роста: соответствующий диапазон температур роста составляет от 15 до 30 С, не способен расти при 4 С или 40 С.(14) Потребность в солевой среде Рост в свободной от NaCl среде: Рост в 1% NaCl среде: Рост в среде морской воды: +(16) GC содержание во внутриклеточной ДНК: 36%(18) Цвет колонии: нет образования характерного пигмента(21) Жгутик: полярный монотрихат Согласно классификации, описанной вBergay's Manual of Systematic Bacteriology, 1,343-352 (1984) и Bergay's Manual of Determinative Bacteriology, 9 75, 132-133 (1994), этот штамм идентифицирован как бактерия, принадлежащая роду Alteromonas. Однако физиологические свойства этого штамма не соответствуют ни одной из бактерий, описанных там. Также он показывает низкое GC содержание. Таким образом, его называют Alteromonas sp. SN-1009. Вышеуказанный штамм идентифицируют как Alteromonas sp. SN-1009 и он депонирован вNational Institute of Bioscience and HumanTechnology (1-3, Higashi 1-chome, Tsukuba-shi,Ibaraki-ken 305, JAPAN) под регистрационным номером FERM P-15436 с 13 февраля 1996 г. и депонирован в National Institute of Bioscience andHuman-Technology, как описано выше, под регистрационным номером FERM BP-5747 (причем перенос в международное депонирование запрошен 15 ноября 1996 г.). Питательные вещества, подлежащие добавлению к среде для инкубирования этого штамма, могут быть произвольными питательными веществами, поскольку штамм может их утилизировать, продуцируя фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид, данного изобретения. Соответствующие примеры источника углерода включают сульфированные фукозусодержащие полисахариды, порошок морских водорослей,альгиновую кислоту, фукозу, галактозу, глюкозу, маннит, глицерин, сахарозу и мальтозу, в то время как примеры источника азота включают дрожжевой экстракт, пептон, касамино (casamino) кислоты, экстракт замоченной кукурузы, 47 мясной экстракт, обезжиренная соя, сульфат аммония и хлорид аммония. Кроме того, среда может содержать неорганические вещества и соли металлов, такие как соли натрия, фосфаты,соли калия, соли магния и соли цинка. Кроме того, этот штамм растет очень хорошо в морской воде или искусственной морской воде, содержащей вышеуказанные питательные вещества. При инкубации штамма, продуцирующего фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид, данного изобретения, выход варьируется в зависимости от условий инкубации. Вообще говоря, максимальный выход фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, может быть достигнут инкубацией штамма при температуре от 15 до 30 С и при значении рН среды от 6 до 9 в условиях аэрации/перемешивании в течение от 5 до 72 ч. Не говоря уже о том, что условия инкубации должны подбираться в зависимости от используемого штамма, состава среды, и т.д. для того, чтобы выход фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, данного изобретения мог достичь максимального уровня. Фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид, данного изобретения содержится как в клетках, так и в культуральном супернатанте. Вышеупомянутый Alteromonas sp. SN-1009 инкубируют в соответствующей среде и клетки собирают и разрушают способом, обычно используемым для разрушения клеток, таким как обработка ультразвуком. Таким образом получают свободный от клеток экстракт. В дальнейшем, экстракт очищают при помощи техники очистки, обычно используемой в данной области, получая тем самым препарат очищенного фермента. Например, очистку можно осуществлять путем обессоливания, ионообменной хроматографии, колоночной хроматографии с гидрофобными носителем, гельфильтрации или т.п., получая при этом очищенный фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид, данного изобретения, свободный от какой-либо другой фукоиданазы. Культуральный супернатант, полученный путем удаления клеток из вышеупомянутой культуральной среды, кроме того, содержит большое количество этого фермента, который можно очистить теми же самыми способами,как способы, применяемые для очистки внутриклеточного фермента. Химические и физико-химические свойства фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, данного изобретения являются следующими:(i) функция: действие на сульфированные фукозусодержащие полисахариды, имеющие 48 следующие физико-химические свойства, т.е.,на сульфированный фукозусодержащий полисахарид-F и деградация этого сульфированного фукозусодержащего полисахарида-F:sp. SA-0082 (FERM BP-5402); но отсутствие действия на сульфированные фукозусодержащие полисахариды, имеющие следующие физико-химические свойства,т.е., на сульфированный фукозусодержащий полисахарид-U:(ii) оптимальное значение рН: находится в диапазоне от приблизительно рН 7 до 8 (фиг. 20). Фиг. 20 представляет график, который показывает взаимосвязь между относительной активностью этого фермента и рН значением,где ордината соответствует относительной активности (%), в то время как абсцисса соответствует рН значению. Сплошную линию получают, используя сульфированный фукозусодержащий полисахарид-F с РА- редуцированным 49 концом (PA-FF) в качестве субстрата, в то время как пунктирную линию получают, используя сульфированный фукозусодержащий полисахарид-F, как будет описано в (V)-(2) в дальнейшем, в качестве субстрата.(iii) оптимальная температура: находится в диапазоне от приблизительно 30 до 35 С (фиг. 21). Фиг. 21 представляет график, который показывает взаимосвязь между относительной активностью этого фермента и температурой,где ордината соответствует относительной активности (%), в то время как абсцисса соответствует температуре (С). Сплошную линию получают, используя сульфированный фукозусодержащий полисахарид-F с РА-редуцированным концом (PA-FF) в качестве субстрата, в то время как пунктирную линию получают, используя сульфированный фукозусодержащий полисахарид-F, как будет описано в (V)-(2), как будет описано в дальнейшем, в качестве субстрата.(iv) молекулярная масса: молекулярная масса этого фермента, определенная гельфильтрацией с использованием Sephacryl S-200(v) способ измерения ферментативной активности. Активность фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, данного изобретения измеряют следующим способом. Сначала, сульфированный фукозусодержащий полисахарид-F и PA-FF, служащие в качестве субстрата фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, данного изобретения, получают в нижеследующих стадиях (1)-(3).Nara Kikai Seisakusho) и обрабатывают 4,5 объемами 80% этанола при 80 С в течение 2 ч. Затем фильтруют и остаток подвергают вышеуказанным процедурам, т.е. экстракции 80% этанолом и фильтрации трижды, получая тем самым 1,870 г остатка после промывания спиртом. К этому остатку добавляют 36 л воды и смесь подвергают обработке при 100 С в течение 2 ч и затем фильтруют, получая тем самым экстракт. Концентрацию соли в экстракте доводят до того же уровня, что и концентрация 400 мМ раствора хлорида натрия. Затем 5% цетилпиридиний хлорида добавляют туда до тех пор, пока осадок больше не образуется. После центрифугирования, осадок повторно промывают 80% этанолом для того, чтобы полностью удалить цетилпиридиний хлорид. Затем, его растворяют в 3 л 2 М раствора хлорида натрия. После удаления не 003902DEAE-Celluiofine A-800 колонку, уравновешенную 2 М хлоридом натрия, и фракцию, проходящую через нее, обессоливают и вещества с низкой молекулярной массой удаляют оттуда,используя ультрафильтрационную мембрану(исключение мембраной молекулярной массы: 100000). Полученный таким образом осадок удаляют центрифугированием. Супернатант сушат вымораживанием, получая 82,2 г очищенной смеси Kjellmaniella crassifolia сульфированных фукозусодержащих полисахаридов.(2) Получение сульфированного фукозусодержащего полисахарида-F: 6 г вышеупомянутой смеси сульфированных фукозусодержащих полисахаридов, происходящей от Kjellmanieila crassifolia, растворяют в 600 мл 20 мМ ацетата натрия (рН 6,0), содержащего 0,2 М хлорида кальция. Затем раствор подают в 3600 мл DEAE-Sepharose FF колонку,предварительно уравновешенную 20 мМ ацетата натрия (рН 6,0), содержащего 0,2 М хлорида натрия. Затем колонку тщательно промывают 20 мМ ацетата натрия (рН 6,0), содержащего 0,2 М хлорида кальция, и выделяют элюированием с линейным градиентом хлорида натрия от 0 до 2 М. Фракции сульфированного фукозусодержащего полисахарида-F, элюированные при концентрации хлорида натрия 0,75 М и выше,собирают и обессоливают, используя ультрафильтр, снабженный ультрафильтрационной мембраной с исключением по молекулярной массе 100 000. После сушки вымораживанием получают 3,3 г высушенного вымораживанием препарата сульфированного фукозусодержащего полисахарида-F.(3) Получение PA-FF: 12 мг вышеупомянутого высушенного вымораживанием препарата сульфированного фукозусодержащего полисахарида-F растворяют в 480 мкл воды и 12-мкл порции полученного раствора пипетируют в 36 трубок. После высушивания вымораживанием редуцированный конец пиридил-(2)-аминируют (РА), используяGlycoTAG и GlycoTAG Reagent Kit, получая тем самым PA-FF. Полученный таким образом PAFF растворяют в 10 мМ растворе ацетата аммония, содержащем 15 мл 10% метанола и подвергают гель фильтрации, используя CellulofineGCL-300 колонку (40 х 900 мм). Высокомолекулярные фракции собирают и обессоливают,тщательно диализуя с использованием мембраны для диализа с размером пор 3500. Затем, это концентрируют до 5 мл с помощью испарителя,получая тем самым PA-FF, подлежащий использованию в качестве субстрата фермента, расще 51 пляющего эндосульфированный фукозусодержащий полисахарид-F данного изобретения. Количество PA-FF, полученного таким образом, определяют как приблизительно 40 нмоль путем сравнения с интенсивностью флуоресценции меченой пиридил-(2)-аминированной фукозы (произв. Takara Shuzo Co., Ltd.; длина волны возбуждения: 320 нм, длина волны флуоресценции: 400 нм). Используя сульфированный фукозусодержащий полисахарид-F, полученный с помощью вышеупомянутых стадий (1) и (2), активность фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид-F, данного изобретения определяют следующим образом. А именно, 12 мкл 2,5% раствора сульфированного фукозусодержащего полисахарида-F,6 мкл 1 М раствора хлорида натрия, 12 мкл 1 М раствора хлорида натрия, 72 мкл буфера (рН 7,5), содержащего 50 мМ уксусной кислоты,имидазол и Трис гидрохлорид, и 18 мкл фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид-F данного изобретения смешивают вместе и подвергают взаимодействию при 30 С в течение 3 ч. Затем реакционную смесь обрабатывают при 100 С в течение 10 мин и центрифугируют. Затем степень расщепления измеряют, анализируя 100 мкл порцию реакционной смеси методом ВЭЖХ. В качестве контролей можно использовать реакционную смесь, полученную тем же самым способом, но заменяя фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид, данного изобретения буфером, используемым для растворения фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, данного изобретения в нем, и другую реакционную смесь, полученную тем же самым способом, но заменяя раствор сульфированного фукозусодержащего полисахарида-F только водой. Эти контроли также анализируют с помощью ВЭЖХ. Количество фермента, с помощью которого фукозильные связи в 1 мкмоль сульфированного фукозусодержащего полисахарида-F можно расщепить за 1 мин, принимают за одну Е. Расщепленные таким образом фукозильные связи рассчитывают согласно следующему уравнению: Активность (Е/мл) ==MF: средняя молекулярная масса субстрата(сульфированный фукозусодержащий полисахарид-F); М: средняя молекулярная масса реакционного продукта;(MF/M) -1: число расщеплений ферментом в одной молекуле сульфированного фукозусодержащего полисахарида-F; 180: время реакции (мин); 0,01: объем (мл) раствора фермента; и 0,12: объем (мл) всей реакционной смеси. ВЭЖХ осуществляют в следующих условиях: установка: модель L-6200 (произв. Hitachi,Ltd.); колонка: OHpack KB-8 04 (8 мм х 300 мм,произв. Showo Denko K.K.); элюент: 25 мМ имидазольный буфер (рН 8), содержащий 5 мМ азида натрия, 25 мМ хлорида кальция и 50 мМ хлорида натрия; детектирование: дифференциальный рефрактометрический детектор (Shodex RI-71, произв. Showa Denko K.K.); скорость потока: 1 мл/мин; температура колонки: 25 С Чтобы измерить среднюю молекулярную массу продукта реакции, пуллулан (pullulan) с известной молекулярной массой (Стандарт Р-82,произв. Showa Denko K.K.) анализируют методом ВЭЖХ в тех же самых условиях, как условия, описанные выше. Затем, получают кривую,показывающую взаимосвязь между молекулярной массой пуллулана и временем удерживания на OHpack КВ-804 и ее применяют в качестве стандартной кривой для определения молекулярной массы вышеупомянутого продукта ферментативной реакции. Используя PA-FF, полученный в вышеописанных стадиях (1)-(3), определяют активность фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, данного изобретения следующим способом. А именно, 2 мкл 8 пмоль/мкл раствора PaFF, 5 мкл 1 М раствора хлорида кальция, 10 мкл раствора 1 М хлорида натрия, 23 мкл воды, 50 мкл буфера (рН 8,2), содержащего 50 мМ уксусной кислоты, имидазол и Трис гидрохлорид, и 10 мкл фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид,данного изобретения смешивают вместе и подвергают взаимодействию при 30 С в течение 3 ч. Затем реакционную смесь обрабатывают при 100 С в течение 10 мин и центрифугируют. Затем степень расщепления измеряют методом ВЭЖХ, используя 80 мкл полученного таким образом образца. В качестве контролей можно использовать реакционную смесь, полученную тем же самым способом, но заменяя фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид данного изобретения, буфером, используемым для растворения фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид данного изобретения в нем,и другую реакционную смесь, полученную тем же самым способом, но заменяя PA-FF раствор только водой. Эти контроли также анализируют с помощью ВЭЖХ. 53 Количество фермента, с помощью которого фукозильные связи в 1 мкмоль сульфированного фукозусодержащего полисахарида можно расщепить за 1 мин, принимают за одну Е. Расщепленные таким образом фукозильные связи рассчитывают согласно следующему уравнению: Активность (Е/мл) = 16 х 10-6 х(MF/M)-1 х 1/(180 х 0,01) 16 х 10-6: количество (мкмоль) PA-FF, добавленного к реакционной системе;MF: средняя молекулярная масса субстрата(сульфированный фукозусодержащий полисахарид-F); М: средняя молекулярная масса реакционного продукта;(MF/M) -1: число расщеплений ферментом в одной молекуле сульфированного фукозусодержащего полисахарида-F; 180: время реакции (мин); и 0,01: объем (мл) раствора фермента. ВЭЖХ осуществляют в следующих условиях: установка: модель L-6200 (произв. Hitachi,Ltd.); колонка: OHpack SB-803 (8 мм х 300 мм,произв. Showo Denko К. К.); элюент: 200 мМ раствор хлорида натрия,содержащий 5 мМ азида натрия и 10% диметилсульфоксида; детектирование: флуорометрический детектор F-1150 (произв. Hitachi, Ltd.), длина волны возбуждения: 320 нм, длина волны флуоресценции: 400 нм; скорость протока: 1 мл/мин; и температура колонки: 50 С. Чтобы измерить среднюю молекулярную массу продукта реакции, редуцированный конец меченого пуллулана с известной молекулярной массой (Стандарт Р-82, произв. Showa Denko К.К.) пиридил-(2)-аминируют (РА), используяGlycoTAG и GlycoTAG Reagent Kit, получая тем самым РА-пуллуланы различных молекулярных масс. Эти РА-пуллуланы различных молекулярных масс анализируют методом ВЭЖХ в тех же самых условиях, как условия, описанные выше. Затем, получают кривую, показывающую взаимосвязь между молекулярной массой пуллулана и временем удерживания на OHpack SB-803 и применяют в качестве стандартной кривой для определения молекулярной массы вышеупомянутого продукта ферментативной реакции. Белок определяют путем измерения поглощения раствора фермента при 280 нм. Расчет проводят, принимая поглощение 1 мг/мл раствора белка за 1,0. Изобретателями был выяснен механизм действия фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид,данного изобретения следующим способом.(1) Деградация сульфированного фукозусодержащего полисахарида-F ферментом, рас 003902 54 щепляющим эндосульфированный фукозусодержащий полисахарид, и получение продукта расщепления: Очищенный сульфированный фукозусодержащий полисахарид-F, происходящий от Kjellmaniella crassifolia, обрабатывают ферментом, расщепляющим эндосульфированный фукозусодержащий полисахарид, данного изобретения, тем самым получая продукты его расщепления. Сначала получают фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид. А именно, Alteromonas sp. SN1009 (FERM BP-5747) инокулируют в 600 мл среды, содержащей искусственную морскую воду (рН 8,2, произв. Jamarin Laboratory), содержащую 0,25% глюкозы, 1,0% пептона и 0,05% экстракта дрожжей, которую пипетируют в 2-х литровую колбу Эрленмейера и стерилизуют при 120 С в течение 20 мин. Затем штамм инкубируют в ней при 25 С в течение 26 ч, получая посевную культуру. В 30-ти литровый ферментер подают 20 л среды, включающей искусственную морскую воду (рН 8,0), содержащую 1,0% пептона, 0,02% экстракта дрожжей, 0,2% вышеупомянутого сульфированного фукозусодержащего полисахарида-F, происходящего от Kjellmaniella crassifolia, и 0,01% противовспенивающего средства (КМ 70, произв.Shin-Etsu Chemical Co., Ltd.), и стерилизуют при 120 С в течение 20 мин. После охлаждения,среду инокулируют с 600 мл вышеупомянутой посевной культурой, которую затем инкубируют при 24 С в течение 24 ч в условиях аэрации при скорости 10 л/мин и перемешивании при 250 об/мин. После завершения инкубации, культуральную среду центрифугируют, получая клетки и культуральный супернатант. Полученный таким образом культуральный супернатант концентрируют с помощью ультрафильтра, исключающего фракцию с молекулярной массой 10000 и высаливают, используя 85% сульфат аммония. Полученный таким образом осадок собирают центрифугированием и тщательно диализуют против 20 мМ Трис гидрохлорид буфера (рН 8,2), содержащего искусственную морскую воду, разбавленную в 10 раз. Таким образом получают 600 мл неочищенного фермента. 40 мл полученного таким образом неочищенного фермента, 44 мл искусственной морской воды, 510 мг вышеупомянутого сульфированного фукозусодержащего полисахарида-F и 36 мл воды смешивают вместе и рН смеси доводят до 8. После взаимодействия при 25 С в течение 48 ч, реакционную смесь подвергают гель-фильтрации, используя Cellulofine GCL300 и таким образом разделяют на четыре фракции, которые называют, в порядке молекулярной массы, как F-Fd-1 (молекулярная масса: более чем 25000), F-Fd-2 (молекулярная масса: 12000-25000), F-Fd-3 (молекулярная масса: 6500-12000) и F-Fd-4 (молекулярная масса: 6500 55 или менее). Эти фракции обессоливают и сушат вымораживанием, получая 170, 270, 300 и 340 мг сухих препаратов, соответственно. Фиг. 22 показывает результаты гельфильтрации с помощью Cellulofine GCL-300 продуктов ферментативного переваривания сульфированного фукозусодержащего полисахарида-F, т.е., продуктов расщепления. На фиг. 22 ордината соответствует поглощению при 480 нм (развитие окраски определялось фенолсернокислотным методом), в то время как абсцисса соответствует номеру фракции. Каждая фракция имеет 10 мл элюата. Колонка имеет объем 1 075 мл и в качестве элюента используют 0,2 М раствор ацетата аммония, содержащего 10% этанола. На фиг. 22 незаполненный кружок показывает результат гель-фильтрации сульфированного фукозусодержащего полисахарида-F, который был подвергнут расщеплению ферментом, в то время как сплошной треугольник относится к результатам гель-фильтрации сульфированного фукозусодержащего полисахарида-F до ферментативного расщепления. Вышеупомянутые результаты CellulofineGCL-300 гель-фильтрации указывают, что продукт реакции фермента, расщепляющего эндосульфированный фукозусодержащий полисахарид, данного изобретения демонстрирует молекулярно-массовое распределение в пределах от 1 000 до 30 000.(2) Анализ на сахарид с редуцированным концом и состав нейтральных сахаридов в продукте ферментативной реакции: Порцию каждой из вышеупомянутых F-Fdl, F-Fd-2, F-Fd-3 и F-Fd-4 отбирают на пробу и редуцированный конец их пиридил-(2)аминируют (РА), используя набор реагентовClycoTAG и GlycoTAG Reagent Kit. Полученные таким образом (PA-F-Fd-1), (PA-F-Fd-2), (PA-FFd-3) и (PA-F-Fd-4) гидролизуют, обрабатывая 4N хлористо-водородной кислотой при 100 С в течение 3 ч и сахариды с редуцированным концом исследуют ВЭЖХ. ВЭЖХ осуществляют в следующих условиях: установка: модель L-6200 (произв. Hitachi,Ltd.); колонка: PALPAK Type A (4,6 мм х 150 мм, произв. Takara Shuzo Co., Ltd.); элюент: 700 мМ боратный буфер (рН 9,0) : ацетонитрил =9 :1; детектирование: флуорометрический детектор F-1150 (произв. Hitachi, Ltd.), длина волны возбуждения: 310 нм, длина волны флуоресценции: 380 нм; скорость потока: 0,3 мл/мин; температура колонки : 65 С. В результате обнаружено, что (PA-F-Fd-1),(PA-F-Fd-2), (PA-F-Fd-3) и (PA-F-Fd-4) -все несут фукозу в виде сахарида с редуцированным концом. 56 Кроме того, составы нейтральных сахаридов F-Fd-1, F-Fd-2, F-Fd-3 и F-Fd-4 определяют следующим способом. Используемый в качестве субстрата сульфированный фукозусодержащий полисахарид-F гидролизуют серной кислотой и редуцированные концы составляющих сахаридов его пиридил-(2)-аминируют (РА), используя набор реагентов GlycoTAG и GlycoTAG ReagentKit, и затем анализируют при помощи ВЭЖХ в тех же самых условиях, что используют при анализе вышеуказанных продуктов. В результате обнаружены только фукоза и галактоза,имеющие L- и D-конфигурации, соответственно. Таким образом, в отношении продуктов(ферментативной реакции) рассматриваются только L-фукоза и D-галактоза. А именно, содержание D-галактозы, которая является одним из составляющих сахаридов,определяют следующим способом. Используя FKit Лактоза/Галактоза (произв. BoehringerMannheim-Yamanouchi), в соответствии с описанием производителя конструируют реакционную систему, с помощью которой можно определить только D-галактозу. Раздельно F-Fd-1, FFd-2, F-Fd-3 и F-Fd-4 гидролизуют 4N хлористоводородной кислотой при 100 С в течение 2 ч и, после нейтрализации, подвергают определению в этой реакционной системе. С другой стороны, содержание L-фукозы,которая является другим составляющим сахаридом, определяют следующим способом. В соответствии со способом, описанным в ClinicalChemistry, 36, 474-476 (1990), F-Fd-1, F-Fd-2, FFd-3 и F-Fd-4 гидролизуют 4N хлористоводородной кислотой при 100 С в течение 2 ч и после нейтрализации подвергают определению в этой реакционной системе. В результате обнаружено, что F-Fd-1, F-Fd2, F-Fd-3 и F-Fd-4 показывают отношение Lфукозы к D-галактозе 100:44, 100:27, 100:5 и 100:1, соответственно. Эти результаты можно суммировать следующим образом. Фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид, данного изобретения действует на сульфированный фукозусодержащий полисахарид-F и гидролизует фукозильные связи, тем самым образуя продукты расщепления с молекулярной массой приблизительно от 1000 до 30000. Среди этих продуктов расщепления продукт, имеющий более высокую молекулярную массу, показывает большее содержание галактозы. Все эти продукты расщепления имеют Lфукозу в качестве редуцированного конца. Затем, исследуют специфичность субстрата этого фермента путем обработки сульфированного фукозусодержащего полисахарида-U ферментом, расщепляющим эндосульфированный фукозусодержащий полисахарид, данного изобретения. А именно, 12 мкл 2,5% раствора сульфированного фукозусодержащего полисахарида-U, 57 6 мкл 1 М раствора хлорида кальция, 12 мкл 1 М раствора хлорида натрия, 72 мкл 50 мМ имидазольного буфера (рН 7,5) и 18 мкл фермента,расщепляющего эндосульфированный фукозусодержащий полисахарид, данного изобретения(1,6 мЕ/мл) смешивают вместе и подвергают взаимодействию при 30 С в течение 3 ч. Затем реакционную смесь обрабатывают при 100 С в течение 10 мин и центрифугируют. Затем измеряют степень расщепления, анализируя 100-мкл порцию реакционной смеси методом ВЭЖХ. В качестве контроля можно использовать реакционную смесь, полученную тем же самым способом, но заменяя в ней фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид, данного изобретения буфером, используемым для растворения фермента,расщепляющего эндосульфированный фукозусодержащий полисахарид, данного изобретения. Этот контроль также анализируют с помощью ВЭЖХ. ВЭЖХ осуществляют в следующих условиях: установка: модель L-6200 (произв. Hitachi,Ltd.); колонка: OHpack KB-8 04 (8 мм х 300 мм,произв. Showo Denko К. К.); элюент: 25 мМ имидазольный буфер (рН 8),содержащий 5 мМ азида натрия, 25 мМ хлорида кальция и 50 мМ хлорида натрия; детектирование: дифференциальный рефрактометрический детектор (Shodex RI-71, произв. Showa Denko К. К.); скорость протока: 1 мл/мин; температура колонки: 25 С. В результате, сульфированный фукозусодержащий полисахарид-U совсем не деградируется ферментом, расщепляющим эндосульфированный фукозусодержащий полисахарид, данного изобретения. Как описано выше, данное изобретение относится к ферментативной композиции, содержащей вышеуказанный фермент, расщепляющий эндосульфированный фукозусодержащий полисахарид, и источник кальция. Примеры источника кальция, который может быть использован в твердой композиции,включают соли кальция, такие как хлорид кальция, карбонат кальция, ацетат кальция, оксид кальция, гидроксид кальция и их гидраты. В жидкой композиции, где источник кальция растворен, суспендирован или эмульгирован в растворителе, таком как вода или спирт, с другой стороны, источник кальция может быть либо таким соединением, как цитированные выше,либо соединением, способным ионизоваться,например, при растворении. Эти источники кальция являются эффективными в активации или стабилизации фермента. 58 Соответственно, вышеупомянутая ферментативная композиция может дополнительно содержать добавки, обычно используемые в данной области в зависимости от цели, пока при этом не ухудшаются вышеупомянутые действия источника кальция. Продукты расщепления сульфированного фукозусодержащего полисахарида-F можно получить путем обработки вещества, содержащего сульфированный фукозусодержащий полисахарид-F, ферментом, расщепляющим эндосульфированный фукозусодержащий полисахарид,данного изобретения, в качестве вещества, содержащего сульфированный фукозусодержащий полисахарид-F, можно использовать, например,очищенный продукт сульфированного фукозусодержащего полисахарида-F, вышеуказанную смесь сульфированных фукозусодержащих полисахаридов или экстракт бурых водорослей с водным растворителем. Вещество, содержащее сульфированный фукозусодержащий полисахарид-F, можно растворить стандартным способом. Хотя сульфированные фукозусодержащие полисахариды могут быть растворены в растворе при наивысшей концентрации, концентрацию обычно подбирают, учитывая способность к обработке и титр фермента. Растворитель для раствора сульфированного фукозусодержащего полисахарида-F может быть соответственно выбран из воды, буферов и т.п., в зависимости от цели. рН раствора обычно находится внутри области нейтрального рН и ферментативную реакцию обычно осуществляют при приблизительно 30 С. Молекулярную массу продуктов расщепления можно регулировать, контролируя количество фермента, время реакции и т.д. Затем, продукты расщепления подвергают фракционированию по молекулярным весам,получая тем самым продукты расщепления сульфированного фукозусодержащего полисахарида-F с более равномерным распределением молекулярной массы. Фракционирование по молекулярной массе можно осуществлять, применяя обычно используемые техники, такие как гель-фильтрация или использование мембраны для фракционирования по молекулярной массе. При необходимости, продукты расщепления могут быть дополнительно подвергнуты очистке, например, с помощью ионообменной смолы или активированного угля. Если требуется, продукты расщепления могут быть также обессолены, стерилизованы и высушены вымораживанием с получением сухого препарата продуктов расщепления данного изобретения. Примеры Далее, для иллюстрации данного изобретения более подробно, а не с целью ограничения, приводятся нижеследующие примеры, в которых процентные отношения даны по весу. Пример 1. 59 2 кг тщательно высушенной Kjellmaniellacrassifolia размалывают при помощи мельницы(произв. Nara Kikai Seisakusho). Полученный таким образом сухой порошок суспендируют в 9 л 80% этанола и обрабатывают при 80 С в течение 2 ч. Затем смесь фильтруют через фильтровальную бумагу, получая тем самым осадок. Этот осадок повторно промывают этанолом и фильтруют трижды таким же способом, как описано выше, получая остаток после промывания этанолом. Этот остаток суспендируют в 40 л воды, обрабатывают при 95 С в течение 2 ч и фильтруют. Остаток промывают горячей водой,получая тем самым 36 л экстракта, содержащего сульфированные фукозу содержащие полисахариды Kjellmaniella crassifolia. 1,8 л полученного таким образом экстракта сушат вымораживанием, получая тем самым 15,4 г препарата сульфированного фукозусодержащего полисахарида. К оставшемуся экстракту добавляют хлорид натрия, до получения концентрации 0,4 М. Далее,туда добавляют 5% цетилпиридиний хлорид до тех пор, пока не прекратиться образование осадка. Затем осадки собирают центрифугированием и суспендируют в 3 л 0,4 М водного раствора хлорида натрия с последующим центрифугированием и промывкой. После трехкратного повторения этой процедуры промывки, к осадку добавляют 1 л 4 М водного раствора хлорида натрия. После хорошего перемешивания,туда добавляют этанол, получая концентрацию 80%. Затем смесь перемешивают и центрифугируют, получая тем самым осадок. Осадок суспендируют в 80% этаноле и центрифугируют. Эти процедуры повторяют до тех пор, пока поглощение супернатанта при 260 нм не достигнет 0. Осадок растворяют в 3 л 2 М водного раствора хлорида натрия. После удаления нерастворимых веществ центрифугированием, туда добавляют 100 мл DEAE-Cellulofine A-800 (произв. Seikagaku Kogyo), уравновешенной 2 М водным раствором хлорида натрия. Далее, добавленную выше смолу удаляют фильтрацией. Фильтрат подают в DEAE-Cellulofine A-800 колонку,уравновешенную 2 М водным раствором хлорида натрия, и неадсорбированную фракцию подвергают ультрафильтрации, используя ультрафильтр, снабженный полыми волокнами с исключением молекулярной массы 100 000, тем самым полностью удаляя окрашивающие вещества и хлорид натрия. Далее, нерастворимые вещества удаляют центрифугированием с последующей фильтрацией и сушкой вымораживанием. Высушенная вымораживанием смесь сульфированных фукозусодержащих полисахаридов весит 76 г. Пример 2. 2 кг тщательно высушенной Laminaria japonica размалывают при помощи мельницы(произв. Nara Kikai Seisakusho). Полученный таким образом сухой порошок суспендируют в 9 л 80% этанола и обрабатывают при 80 С в тече 003902 60 ние 2 ч. Затем смесь фильтруют через фильтровальную бумагу, получая тем самым осадок. Этот осадок повторно промывают этанолом и фильтруют трижды таким же способом, как описано выше, получая тем самым остаток после промывания этанолом. Этот остаток суспендируют в 40 л воды, обрабатывают при 95 С в течение 2 ч и фильтруют. Остаток промывают горячей водой, получая тем самым 36 л экстракта, содержащего сульфированные фукозусодержащие полисахариды Laminaria japonica. К экстракту добавляют хлорид натрия, получая концентрацию 0,4 М. Далее туда добавляют 5% цетилпиридиний хлорид до тех пор, пока не прекратиться образование осадка. Затем осадки собирают центрифугированием и суспендируют в 3 л 0,3 М водного раствора хлорида натрия с последующим центрифугированием и промывкой. После трехкратного повторения этой процедуры промывки, к осадку добавляют 1 л 4 М водного раствора хлорида натрия. После хорошего перемешивания, туда добавляют этанол,получая концентрацию 80%. Затем смесь перемешивают и центрифугируют, получая тем самым осадок. Осадок суспендируют в 80% этаноле и центрифугируют. Эти процедуры повторяют до тех пор, пока поглощение супернатанта при 260 нм не достигает 0. Осадок растворяют в 3 л 2 М водного раствора хлорида натрия. После удаления нерастворимых веществ центрифугированием, туда добавляют 100 мл DEAECellulofine А-800 (произв. Seikagaku Kogyo),уравновешенного 2 М водным раствором хлорида натрия и перемешивают. Далее, добавленную выше смолу удаляют фильтрацией. Фильтрат подают в DEAE-Cellulofine А-800 колонку,уравновешенную 2 М водным раствором хлорида натрия, и неадсорбированную фракцию подвергают ультрафильтрации, используя ультрафильтр, снабженный полыми волокнами с исключением молекулярной массы 100 000 или меньше, тем самым полностью удаляя окрашивающие вещества и хлорид натрия. Далее, нерастворимые вещества удаляют центрифугированием и фильтрацией с последующей сушкой вымораживанием. Высушенная вымораживанием смесь сульфированных фукозусодержащих полисахаридов весит 52 г. Пример 3. Экстракция смеси Laminaria japonica сульфированных фукозусодержащих полисахаридов. 2 кг тщательно высушенной Laminaria japonica размалывают при помощи мельницы(произв. Nara Kikai Seisakusho). Полученный таким образом сухой порошок суспендируют в 9 л 80% этанола и обрабатывают при 80 С в течение 2 ч. Затем смесь фильтруют через фильтровальную бумагу, получая тем самым осадок. Этот осадок повторно промывают этанолом и фильтруют трижды таким же способом, как описано выше, получая тем самым остаток после промывания этанолом. Этот остаток суспен
МПК / Метки
МПК: A61K 31/715, A61P 35/00, C08B 37/00
Метки: противораковые, индукторы, средства, способ, полисахариды, канцеростатические, способы, апоптоза, содержащие, индуцирования, получения
Код ссылки
<a href="https://eas.patents.su/30-3902-induktory-apoptoza-soderzhashhie-ih-protivorakovye-i-kancerostaticheskie-sredstva-sposob-inducirovaniya-apoptoza-polisaharidy-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Индукторы апоптоза, содержащие их противораковые и канцеростатические средства, способ индуцирования апоптоза, полисахариды и способы их получения</a>
Предыдущий патент: Способ обнаружения активности гепараназы млекопитающих и набор для осуществления способа
Следующий патент: Способ получения композиции для лечения, ухода и защиты кожи детей и взрослых
Случайный патент: Способ защиты радиолокационных станций от противорадиолокационных ракет с использованием передающих устройств малой мощности и устройство для его осуществления












