Ингибиторы ns-3 сериновой протеазы hcv
Номер патента: 14584
Опубликовано: 30.12.2010
Авторы: Кварнстрем Ингемар, Валльберг Ханс, Торстенссон Фредрик, Самуэльссон Бертиль, Росенквист Оса, Йоханссон Пер-Ола
Формула / Реферат
1. Соединение формулы VI
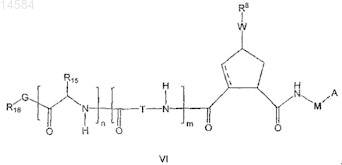
где - - - представляет необязательную двойную связь;
А является С(=O)OR1или С(=O)NHSO2R2, где
R1 является водородом или C1-С6алкилом;
R2 является C1-С6алкилом или циклопропилом, необязательно замещенным метилом;
М является CR7R7', где R7является C1-С6алкилом; R7' является Н или взятый вместе с R7 образует циклопропил, необязательно замещенный винилом или группой J;
W является -O-, -OC(=O)NH- или -OC(=O)-;
R8 представляет собой хинолинил, изохинолинил, бензопиримидил, фенил, индолил, изоиндолил, бензоморфолинил; причем любая из R8 групп может быть необязательно моно-, ди- или тризамещена группой R9, где
R9 представляет собой фенил, тиазолил, оксазолил, имидазолил, пиперазинил, морфолинил, пирролидинил, пиперидинил, пиразолил, галоген, трифторметил, С1-С4алкил, С1-С4алкиламино, С1-С2алкокси, пиридинил; где указанная группа R9 необязательно замещена группой R10; где
R10 является С1-С4алкилом, С1-С4алкиламино, циклопропилом;
Т является -CHR11-;
R11 является C1-С6алкилом;
J, если присутствует, является C5-С6алкиленовой или С5-С6алкениленовой цепью, идущей от М до Ry с образованием макроцикла;
m=n=0 или m=n=1;
R15 является циклогексилом;
G является -O-, -NRy-;
Ry является H, C1-С3алкилом или Ry является J;
R16 является C1-С6алкилом;
или его фармацевтически приемлемые соли.
2. Соединение по п.1, где m=0 и n=0.
3. Соединение по п.1, где Ry является J, тем самым определяя макроциклическое соединение.
4. Соединение по п.1, где m=1 и n=1.
5. Соединение по любому из пп.1-4, где W является -О-.
6. Соединение по п.1, где R10 является метилом, этилом, изопропилом, трет-бутилом, C1-С3алкиламино.
7. Соединение по п.1, где R8 является хинолинилом, который является незамещенным, моно- или дизамещенным группой R9.
8. Соединение по п.7, где R8 является
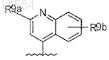
где R9a является C1-С6алкилом; C1-С6алкокси; С1-С4алкиламино; амино, фенилом или тиазолилом, необязательно замещенным группой R10;
R10 является С1-С4алкилом, С1-С4алкиламино и
R9b является С1-С4алкилом, С1-С4алкокси, амино, ди(С1-С4алкил)амино.
9. Соединение по п.8, где R9a является фенилом или тиазолилом, любой из которых необязательно замещен группой R10, таким как определен выше.
10. Соединение по п.9, где R9a выбирают из группы, включающей
![]()
где R10 является Н, С1-С4алкилом, амино, необязательно моно- или дизамещенным С1-С4алкилом.
11. Соединение по п.8, где R9a является фенилом, необязательно замещенным С1-С4алкилом; C1-С6алкокси или галогеном.
12. Соединение по п.7, где R8 является
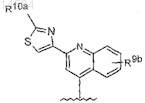
где R10a является Н,. С1-С4алкилом, амино, необязательно моно- или дизамещенным С1-С4алкилом и
R9b является С1-С6алкилом, С1-С4алкокси, амино, ди(С1-С4алкил)амино.
13. Соединение по п.8, где R9b является метокси.
14. Соединение по п.1, где А является С(=O)NHSO2R2.
15. Соединение по п.14, где R2 является метилом или циклопропилом.
16. Соединение по п.1, где J является мононенасыщенной.
17. Соединение по п.1 формулы VIhe

где R16 является Н или C1-С6алкилом; где
J является одиночной 5- или 6-членной насыщенной или частично ненасыщенной алкиленовой цепью, образуя, таким образом, макроцикл с 14 или 15 атомами в кольце;
А является C(=O)OR1или С(=O)NHSO2R2,
W является -O- или -OC(=O)NH-;
R1, R2, R8, R9и R10 являются такими, как определено выше.
18. Соединение по п.17, где J содержит одну двойную связь, расположенную через один атом углерода от функциональной группы R7 циклоалкила.
19. Соединение по п.17, где R8 является
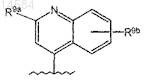
где R9a и R9b имеют значения, определенные в п.8.
20. Соединение по п.19, где R9a является
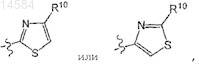
где R10 является Н, С1-С4алкилом, амино, амино; моно- или дизамещенным С1-С4алкилом.
21. Соединение по п.19, где А является С(=O)NHSO2R2.
22. Соединение по п.21, где R2 является метилом или циклопропилом, замещенным метилом.
23. Соединение по п.1 формулы
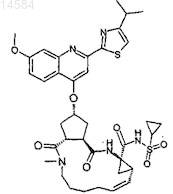
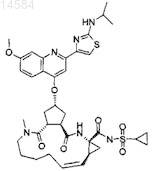
24. Соединение по п.1 формулы
25. Фармацевтическая композиция, содержащая соединение по любому из пп.1-24 и фармацевтически приемлемый носитель.
26. Фармацевтическая композиция по п.25, также содержащая дополнительный HCV антивирусный агент, выбранный из ингибиторов полимеразы на основе нуклеозидного аналога, ингибиторов протеазы, рибавирина и интерферона.
27. Применение соединения по любому из пп.1-24 при изготовлении лекарственного средства для профилактики или лечения флавивирусных инфекций, включая HCV.
Текст
Описаны пептидомиметические соединения, которые ингибируют NS-3 протеазу вируса гепатита С (HCV). Соединения имеют формулу определение переменных которой представлено в описании. Соединения включают карбоциклическую единицу Р 2 в сочетании с новыми связями с теми частями ингибитора, которые более отдалены от номинального места расщепления природного субстрата, где связь имеет обратную ориентацию пептидных связей на удаленной стороне по отношению к тем, которые проксимальны к месту расщепления. 014584 Область техники Данное изобретение относится к новым ингибиторам NS-3 сериновой протеазы флавивируса HCV и к способам их применения при лечении или профилактике HCV. Предшествующий уровень техникиNS-3 сериновая протеаза HCV представляет собой многофункциональный белок, который содержит домен сериновой протеазы и домен геликазы РНК. Кофактор протеазы NS4A, который представляет собой относительно небольшой белок, безусловно требуется для усиления активности сериновой протеазы.NS-3 сериновая протеаза играет существенную роль в жизненном цикле вируса. Из результатов исследования места связывания субстрата, показанных рентгеноструктурным анализом, видно, что место связывания NS-3 протеазы крайне ограничено и незащищено от растворителя, что делает создание ингибитора маленькой молекулы сложной проблемой. Полагают, что два ингибитора протеазы HCV проходят стадию клинических испытаний, а именноWO 0387092. Ряд подобных пептидомиметических ингибиторов протеазы HCV также предложен в академической и патентной литературе. Общим для большинства таких пептидомиметиков известного уровня техники является присутствие производного L-пролина в положении Р 2 ингибитора и взаимодействие с S2 подсайтом фермента протеазы HCV. В BILN-2061 L-пролин замещен в положении 4 хинолиновым простым эфиром, a VX-950 содержит карбоциклическое кольцо, сконденсированное с кольцомL-аминокислоты, связанные с пептидом в положении Р 3, а также большинство предложенных ингибиторов также включают дополнительные производные L-аминокислоты в положениях Р 4, Р 5 и Р 6. Стало очевидным, что продолжительное введение BILN-2061 или VX-950 вызывает появление мутантов HCV, которые устойчивы к соответствующим лекарственным средствам, так называемых мутантов, "избегающих лекарственное средство". Такие мутанты, "избегающие лекарственное средство", имеют характерные мутации в геноме протеазы HCV, в особенности D168V, D168Y и/или A165S. Таким образом, полагают, что принципы лечения HCV имеют сходство с лечением ВИЧ, при котором легко возникают "избегающие лекарственное средство" мутации. Следовательно, существует необходимость в дополнительных лекарственных средствах с другой формой устойчивости, которые позволят обеспечивать лечение пациентам с отсутствием эффекта, и вполне вероятно, что в будущем комбинированная терапия с применением множества лекарственных средств станет нормой даже для лечения первой линии. Опыт, полученный для лекарственных средств против ВИЧ, в частности для ингибиторов протеазы ВИЧ, акцентирует внимание на том, что режимы субоптимальной фармакокинетики и комплексного дозирования быстро дадут непреднамеренные недостаточные совпадения. Это, в свою очередь, означает,что 24-часовая самая низкая концентрация (минимальная концентрация в плазме) для соответствующих лекарственных средств, вводимых в режиме ВИЧ, часто падает ниже порога IC90 или ED90 для больших периодов суток. Считается, что 24-часовой самый низкий уровень, составляющий, по крайней мере, IC50 и более реально IC90 или ED90, является существенным для замедления развития мутантов, "избегающих лекарственное средство", и достижения необходимой фармакокинетики и метаболизма лекарственного средства, и такой самый низкий уровень позволяет поставить четкую задачу при создании лекарственных средств. Сильная пептидомиметическая природа ингибиторов протеазы HCV известного уровня техники с множеством пептидных связей в исходных конфигурациях создает фармакокинетические препятствия для эффективных режимов дозирования. Сущность изобретения Согласно первому аспекту данного изобретения представлены соединения формулы VIR4 является галогеном, амино или ОН илиR2, R3 и R4', каждый необязательно, замещены от 1 до 3 заместителями, независимо выбранными из группы, включающей галоген, оксо, нитрил, азидо, нитро, C1-C6-алкил, C0-C3-алкилкарбоциклил,C0-C3-алкилгетероциклил, NH2C(=O)-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y-C(=O)NRaRb, Y-NRaC(=O)Rb,Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb и Y-NRaC(=O)ORb;Y независимо является связью или C1-C3-алкиленом;R7 является C1-C6-алкилом, C0-C3-алкил-C3-C7-циклоалкилом или C2-C6-алкенилом, любой из которых необязательно замещен от 1 до 3 атомами галогена или амино, -SH или C0-C3-алкилциклоалкильной группой или R7 является J;R7' является Н или взятый вместе с R7 образует С 3-С 6-циклоалкильное кольцо, необязательно замещенное R7'a, где R7'a является C1-C6-алкилом, C3-C5-циклоалкилом, C2-C6-алкенилом, любой из которых может быть необязательно замещен галогеном; или R7'a является J;Rz является Н или вместе с отмеченным звездочкой атомом углерода образует олефиновую связь;R8 является системой колец, включающей 1 или 2 насыщенных, частично насыщенных или ненасыщенных кольца, каждое из которых содержит 4-7 атомов в кольце и каждое из которых содержит от 0 до 4 гетероатомов, выбранных из S, О и N, где система колец необязательно отделяется от WR8 является C1-C6-алкилом; любая из R8 групп может быть необязательно моно-, ди- или тризамещена R9;R9 независимо выбирают из группы, включающей галоген, оксо, нитрил, азидо, нитро, C1-C6-алкил,C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, NH2CO-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb,Y-C(=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb иY-NRaC(=O)ORb; где указанная карбоциклильная или гетероциклильная группа необязательно замещенаR11 является Н, C1-C6-алкилом, C0-C3-алкилкарбоциклилом, C0-C3-алкилгетероциклилом, любой из которых может быть замещен галогеном, оксо, нитрилом, азидо, нитро, C1-C6-алкилом,C0-C3-алкилкарбоциклилом, C0-C3-алкилгетероциклилом, NH2CO-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb,Y-C(=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb иJ, если присутствует, является одиночной 3-10-членной насыщенной или частично ненасыщенной алкиленовой цепью, идущей от R7/R7' циклоалкила или от атома углерода, к которому присоединен R7, до одного из Rd, Rj, Rx, Ry, или R11 с образованием макроцикла, где цепь необязательно прерывается от 1 до 3 гетероатомами, независимо выбранными из -O-, -S-или -NR12- и где от 0 до 3 атомов углерода в цепи необязательно замещены R14;R14 независимо выбирают из группы, включающей Н, C1-C6-алкил, C1-C6-галоалкил, C1-C6-алкокси,гидрокси, галоген, амино, оксо, тио и C1-C6-тиоалкил;R15 является Н, C1-C6-алкилом, C0-C3-алкилкарбоциклилом, C0-C3-алкилгетероциклилом,любой из которых может быть замещен галогеном, оксо, нитрилом, азидо, нитро, C1-C6-алкилом,C0-C3-алкилкарбоциклилом, C0-C3-алкилгетероциклилом, NH2CO-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb,Y-C(=O)NRaRb, Y-NRaC(=O)Rb, Y-NHS(=O)pRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb иC1-C6-алкилом,C0-C3-алкилкарбоциклилом,C0-C3-алкилгетероциклилом, любой из которых может быть замещен галогеном, оксо, нитрилом, азидо,нитро, C1-C6-алкилом, C0-C3-алкилкарбоциклилом, C0-C3-алкилгетероциклилом, NH2CO-, Y-NRaRb,Y-O-Rb, Y-C(=O)Rb, Y-C(=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb,Y-C(=O)ORb и Y-NRaC(=O)ORb; или их фармацевтически приемлемые соли или пролекарства. Не претендуя на теорию и на определение экспериментальных способов связывания с определенными переменными, понятийные концепции Р 1, Р 2, Р 3 и Р 4 в данном описании представлены только для удобства и имеют в основном их обычные значения, показанные в SchechterBerger (1976), Biochem.Biophys. Res. Comm. 27 157-162, и означают те положения ингибитора, которые предположительно заполняют S1, S2, S3 и S4 подсайты фермента соответственно, где S1 является соседним к месту расщепления и S4 удален от места расщепления. Независимо от способа связывания компоненты, определенные в формуле VI и т.д., попадают в объем данного изобретения. Например, полагают, что концевая группаR16-G может взаимодействовать с S3 и S4 подсайтами, особенно когда m и/или n равно 0. Различные варианты данного изобретения могут быть номинально представлены какR16-G-P4-P3-P2-P1, где Р 3 и/или Р 4 могут отсутствовать. Р 1, Р 3 и Р 4, каждый, представляют собой функциональный блок, состоящий из производного природной или неприродной аминокислоты, Р 2 представляет собой замещенный карбоциклический остаток и R16-G является концевой группой. Функциональные блоки обычно связаны между собой амидными связями, которые реверсированы относительно друг друга на каждой стороне функционального блока Р 2 в соединениях в соответствии с данным изобретением. Другие аспекты данного изобретения включают фармацевтические композиции, содержащие соединение в соответствии с данным изобретением, такое как определено выше, и фармацевтически приемлемый носитель или разбавитель. Соединения и композиции в соответствии с данным изобретением применяются в способах медицинского лечения или профилактики HCV инфекций у человека. Следовательно, другой аспект изобретения включает применение соединения, такого как определено выше, в терапии, например при изготовлении лекарственного средства для профилактики или лечения флавивирусных инфекций у человека или животных. Примеры флавивирусов включают BVDV, тропическую лихорадку и особенно - HCV. В соединениях в соответствии с данным изобретением амидная связь, связывающая Р 2 и Р 3 вместе,реверсирована по отношению к амидной связи, связывающей Р 1 и Р 2, т.е. производные аминокислоты Р 1 и Р 3 на каждой стороне каркаса Р 2, оба сопряжены через функциональные аминогруппы с кислотными группами на каждой стороне каркаса Р 2. Это означает, что боковые цепи Р 3 и Р 4 (включая концевую группу R16 до той степени, пока она взаимодействует с S3 или S4) указывают на противоположные направления по сравнению с природным пептидным субстратом. Другим последствием реверсированных аминокислот Р 3 и Р 4 является то, что боковые цепи этих аминокислот смещены на один атом снаружи по сравнению с природным пептидным субстратом. Изменение направления боковых цепей Р 3 и Р 4 таким образом, как полагают, благоприятствует неприродным D стереохимиям для заполняющих ниши групп (например, боковых цепей) Р 3, и/или Р 4,и/или R16. Конечно, такие соединения обычно являются высокоактивными и попадают в объем данного изобретения. Однако неожиданно было обнаружено, что даже соединения в соответствии с данным изобретением, имеющие поковые цепи L-аминокислоты в Р 3 и/или Р 4, демонстрируют хорошую активность, несмотря на то, что соответствующие объекты должны подходить к карману S3 или S4 с различных углов относительно природного пептидного субстрата. Следовательно, L-стереохимия в R11 и/илиR15 и/или соответствующая конфигурация в R16 к мимической L-стереохимии является преимущественным аспектом данного изобретения. Различный угол подхода к S3 и/или S4 карманам также играет роль в способности соединений в соответствии с данным изобретением избегать форм устойчивости, демонстрируемых ингибиторами протеазы HCV известного уровня техники, которые до настоящего времени имеют обычную пептидную основную цепь из остатков природных или неприродных L-аминокислот. Что касается обратной транскриптазы ВИЧ, которая известна как быстрый генератор мутантов, "избегающих лекарственное средство" при селективном воздействии антивирусной терапии, NS5A РНК-зависимая РНК полимераза HCV имеет очень слабую подтвержденную способность к считыванию. Это, в свою очередь, означает, что полимераза HCV в значительной степени подвержена ошибке и похоже, что характерные формы устойчивости возникают, когда противовирусные средства для HCV вводят в течение длительных периодов. Даже перед началом очевидно, что BILN 2061 с практически полностью пептидной основной цепью (хотя и макрокристаллизованной) и ингибитор NS-3 протеазы VX-950 от Vertex с линейной пептидной основной цепью в Р 3 и Р 4 быстро вызывают характерные устойчивые мутации в положениях 155, 156 или 168 NS3 протеазы (Lin et al. J. Biol. Chem. 2004, 279(17):17808-17).-3 014584 Предпочтительная группа соединений в соответствии с данным изобретением включает те, в которых Р 1 является производным гидразина, где М является NRu, где Ru обычно является Н илиC1-C3-алкилом. Соединения, в которых М является CR7R7', являются другим предпочтительным аспектом данного изобретения. Предпочтительные варианты, в которых M является CR7R7' в формуле VI, включают формулу VIA Предпочтительные значения для q' и k в формуле VI включают 1:1, 1:2, 1:3, 2:2, 2:3, более предпочтительно 0:2 и 0:0 наиболее предпочтительно, 0:1, где предпочтительные соединения содержат одну из следующих частичных структур: особенно где Rz является Н или Rq является Н или метилом. Соединения в соответствии с данным изобретением могут содержать обе Р 3 и р 4 функциональные группы, где m и n оба равны 1. Предпочтительные варианты формулы VI, включающей обе Р 3 и р 4 функциональные группы, включают формулы VIda-VIdb: Альтернативные варианты включают структуры, соответствующие формулам VIda и VIdb, где М является NRu. Альтернативные конфигурации соединений в соответствии с данным изобретением включают P3,но не включают Р 4 функциональную группу, где m равно 1 и n рано 0. Предпочтительные варианты формулы VI, содержащие Р 3, но не содержащие Р 4 функциональную группу, включают формулы VIeaVIeb: Альтернативные варианты включают структуры, соответствующие формулам VIea и VIeb, где М является NRu. Другие альтернативные конфигурации соединений в соответствии с данным изобретением включают те, в которых m и n равны нулю и, таким образом, группы R16-G примыкают к Р 2, но, как отмечено выше, концевая группа R16-G может взаимодействовать предпочтительно с S3 и/или S4.-4 014584 Предпочтительные варианты формулы VI, в которых m и n равны нулю, включают формулу VIfa Альтернативные варианты включают структуры, соответствующие формуле Vlfa, где М являетсяNRu. Соединения в соответствии с данным изобретением могут содержать линейные молекулы, как показано выше. Альтернативно, в вариантах, где R7 и R7' вместе являются спироциклоалкильной группой,такой как спироциклопропил, соединения в соответствии с данным изобретением могут имеь конфигурацию в виде макроциклов, в которых связующая группа J находится между одним из Rj, Rx, Ry, Rd илиR11 формулы VI. Альтернативно, макроцикл J может идти от атома углерода, соседнего к R7, к одному изRj, Rx, Ry, Rd или Ru. Предпочтительные варианты макроциклических структур формулы VI, в которых m равно 0 и n равно 1, включают формулы VIga-VIgc:-5 014584 Предпочтительные варианты макроциклических структур формулы VI, включающих обе Р 3 и Р 4 функциональные группы, например, где оба m и n равны 1, включают формулы VIha-VIhc ниже: Соответствующие структуры, в которых J связана с атомом углерода, соседним к R7, также являются предпочтительными. Предпочтительные варианты макроциклических структур формулы VI, где обе Р 3 и Р 4 функциональные группы отсутствуют, например где оба m и n равны 0, включают формулы VIhe-VIhf: Соответствующие структуры, в которых J связана с атомом углерода, соседним к R7, также являются предпочтительными. В общем, в необязательных макроциклических структурах, таких как показаны выше, связующая группа J содержит от 3 до 10 атомов в цепи, предпочтительно от 4 до 7 атомов в цепи, более предпочтительно от 5 до 6 атомов в цепи и является насыщенной или частично ненасыщенной алкиленовой цепью,где алкиленовая цепь включает от 1 до 3 ненасыщенных связей между соседними атомами углерода,обычно одну ненасыщенность. Длина цепи, конечно, зависит от того, идет ли J от Rd, Rj, Rx, Ry, R11 или атома углерода, соседнего к R7. Подходящие цепи подробно описаны в WO 00/59929. Обычно J доводят до нужного размера таким образом, чтобы обеспечить макроцикл с 13-16 атомами в кольце (включая атомы в P1, P2 и, если присутствует, Р 3 группах, принадлежащих к кольцу). Предпочтительно J доводят до нужного размера таким образом, чтобы получить макроцикл с 14-15 атомами в кольце. Предпочтительно J-цепь содержит один или два гетероатома, выбранных из О, S, NH,N-C1-C6-алкила или N-C(=O)-C1-C6-алкила. Более предпочтительно J-цепь необязательно содержит один гетероатом, выбранный из NH или N-C(=O)-C1-C6-алкила, наиболее предпочтительно N(Ac). Наиболее предпочтительно цепь, содержащая атом азота, является насыщенной. В альтернативном варианте J содержит один гетероатом, выбранный из О или S. Цепь может быть замещена R14, таким как Н или метил.-6 014584 Обычно связующая структура J является насыщенной. Альтернативно, J содержит от 1 до 3, предпочтительно одну двойную связь, обычно расположенную через один атом углерода от функциональной группы R7 циклоалкила, если присутствует. Двойная связь может быть цис- или транс-. Характерные примеры J включают пентилен, гексилен, гептилен, любой из которых замещенC1-C6-тиоалкилом; пентен-3-ил, гексен-4-ил, гептен-5-ил, где 3, 4 или 5 относятся к двойной связи между атомами углерода 3 и 4, 4 и 5 и т.д. Предпочтительные R7 и R7' группы включают те, в которых R7' является Н и R7 является н-этилом, н-пропилом, циклопропилом, циклопропилметилом, циклобутилом, циклобутилметилом,2,2-дифторэтилом или меркаптометилом. Предпочтительные варианты включают те, в которых R7 является н-пропилом или 2,2-дифторэтилом. Альтернативные предпочтительные конфигурации для R7 и R7' включают те, в которых R7' является Н и R7 является C3-C7-циклоалкилом или C1-C3-алкил-C3-C7-циклоалкилом. Другие предпочтительные конфигурации для R7 и R7' включают те, в которых R7' является Н и R7 является J. Альтернативно, R7 и R7' вместе образуют спироциклоалкильную функциональную группу, такую как спироциклобутильное кольцо, и более предпочтительно спироциклопропильное кольцо. "Спиро" в этом контексте означает, что циклоалкильное кольцо делит один атом углерода с пептидной основной цепью соединения. Кольцо замещено или не замещено. Предпочтительные заместители включают моноили дизамещения группой R7'a, где R7'a является C1-C6-алкилом, C3-C5-циклоалкилом или C2-C6 алкенилом, любой из которых необязательно замещен галогеном. Альтернативно, заместителем может быть связующая группа J, описанная выше. Предпочтительные стереохимии для спироциклопропильного кольца определены ниже. Особенно предпочтительные заместители включают R7'a, такой как этил, винил, циклопропил (т.е. спироциклопропильный заместитель к "спиро" циклоалкильному кольцу R7/R7'), 1- или 2-бромэтил,1- или 2-фторэтил, 2-бромвинил или 2-фторэтил. В одном из вариантов данного изобретения А является -CR4R4', как подробно показано в РСТ/ЕР 03/10595, содержание которого включено сюда в качестве ссылки. Предпочтительные R4' группы включают C1-C6-алкил, такой как метил, этил, пропил, этенил и-CHCHCH3. Альтернативные предпочтительные R4' группы включают арил или гетероарил, такой как необязательно замещенный фенил, пиридил, тиазолил или бензимидазолил, или C1-C3-алкиларил илиC1-C3-алкилгетероарил, где алкильная группа является метилом, этилом, пропилом, этенилом и-CHCHCH3. Предпочтительные арильные группы включают необязательно замещенный фенил, бензотиазол и бензимидазол. Предпочтительные R4 группы включают -NH2, фтор или хлор. Альтернативные предпочтительные 4R группы включают -ОН и особенно=O. Альтернативным вариантом для А является C(=O)NHR3, где R3 является необязательно замещенным C0-C3-алкиларилом, C0-C3-алкилгетероарилом, -O-C0-C3-алкиларилом, -O-C0-C3-алкилгетероарилом. Подходящие заместители представлены в разделе определений ниже. Альтернативной предпочтительной конфигурацией для А является C(=O)OR1, особенно где R1 является C1-C6-алкилом, таким как метил, этил или трет-бутил, наиболее предпочтительно водородом. Особенно предпочтительной конфигурацией для А является С(=O)NHSO2R2, особенно где R2 является необязательно замещенным C1-C6-алкилом, предпочтительно метилом, или необязательно замещенным C3-C7-циклоалкилом, предпочтительно циклопропилом, или необязательно замещеннымC0-C6-алкиларилом, предпочтительно необязательно замещенным фенилом. Подходящие заместители представлены в разделе определений ниже. Заместитель -W-R8 в циклической группе Р 2 может содержать любой из заместителей пролина, которые подробно описаны в WO 00/59929, WO 00/09543, WO 00/09558, WO 99/07734, WO 99/07733,WO 02/60926, WO 03/35060, WO 03/53349, WO 03/064416, WO 03/66103, WO 03/064455, WO 03/064456,WO 03/62265, WO 03/062228, WO 03/87092, WO 03/99274, WO 03/99316, WO 03/99274, WO 04/03670,WO 04/032827, WO 04/037855, WO 04/43339, WO 04/92161, WO 04/72243, WO 04/93798. WO 04/93915,WO 04/94452, WO 04/101505, WO 04/101602, WO 04/103996, WO 04113365 и подобных. Предпочтительные функциональные группы W включают такие значения W, как -OC(=O)NH-,-OC(=O)-, -NH-, -NR8'-, -NHS(O)0-или -NHC(=O)-, особенно -OC(=O)NH- или -NH-. ПредпочтительныеR8 группы для таких W функциональных групп включают необязательно замещенный-7 014584 В этой публикации также описаны альтернативные группы -W-R8, например C1-C6-алкил, такой как этил, изопропил, C0-C3-алкилкарбоциклил, такой как циклогексил, 2,2-дифторэтил, -C(=O)NRc, где Rc является C1-C6-алкилом, C0-C3-алкилциклопропилом, C0-C3-алкилиларилом или C0-C3-алкилгетероциклилом. Предпочтительные функциональные группы W включают -S- и особенно -O-. Предпочтительные значения для R8 в таких вариантах включают C0-C3-алкиларил или C0-C3-алкилгетероарил, любой из которых необязательно моно-, ди- или тризамещен R9, гдеR9 является C1-C6-алкилом, C1-C6-алкокси, NO2, ОН, галогеном, трифторметилом, амино или амидо (такими как амино или амидо необязательно моно- или дизамещенные C1-C6-алкилом),C0-C3-алкиларилом, C0-C3-алкилгетероарилом, карбоксилом, арилом или гетероарилом, необязательно замещенными R10;R10 является C1-C6-алкилом, C3-C7-циклоалкилом, C1-C6-алкокси, амино (таким как амино, моноили дизамещенным C1-C6-алкилом), амидо (таким как C1-C3-алкиламид), сульфонил-C1-C3-алкилом, NO2,ОН, галогеном, трифторметилом, карбоксилом или гетероарилом. Обычно C0-C3-алкильный компонент группы R8, такой как C0-C3-алкиларил или С 0-С 3-алкилгетероарил, является метилом и предпочтительно отсутствует, т.е. С 0. Арильный или гетероарильный компонент подробно описан в разделе определений ниже. Предпочтительные R9 включают C1-C6-алкил, C1-C6-алкокси, амино (такой как ди(C1-C3 алкил)амино), амид (такой как -NHC(О)-C1-C6-алкил или С(=O)NH-C1-C3-алкил), арил или гетероарил,где арильная или гетероарильная группа необязательно замещена R10; где R10 является C1-C6-алкилом,C3-C7-циклоалкилом, C1-C6-алкокси, амино (таким как моно- или ди-C1-C3-алкиламино), амидо (таким как -NHC(О)-C1-C3-алкил или С(=O)NH-C1-C6-алкил), галогеном, трифторметилом или гетероарилом. Предпочтительные R10 включают C1-C6-алкил, C1-C6-алкокси, амино, амидо (такой как-NHC(O)-C1-C6-алкил или С (=O) NHC1-C6-алкил), галоген или гетероарил. Особенно предпочтительные R10 включают метил, этил, изопропил, трет-бутил, метокси, хлор, амино, амидо (такой как -NHC(O)-C1-C3-алкил или С(=O)NH-C1-C6-алкил) или C1-C3-алкилтиазол. Предпочтительные варианты R8 включают 1-нафтилметил, 2-нафтилметил, бензил, 1-нафтил,2-нафтил или хинолинил, любой из которых незамещен или моно- или дизамещен R9, таким как определен выше, в частности 1-нафтилметил или хинолинил незамещен или моно- или дизамещен R9, таким как определен выше. Предпочтительным R8 является где R9a является C1-C6-алкилом; C1-C6-алкокси; тио-C1-C3-алкилом; амино, необязательно замещенным C1-C6-алкилом; C0-C3-алкиларилом;или C0-C3-алкилгетероарилом, C0-C3-алкилгетероциклилом, где указанные арил, гетероарил или гетероциклил необязательно замещены R10, где R10 является C1-C6 алкилом, C3-C7-циклоалкилом, C1-C6-алкокси, амино, амидо, гетероарилом или гетероциклилом; иR9b является C1-C6-алкилом, C1-C6-алкокси, амино, амидо, NO2, OH, галогеном, трифторметилом,карбоксилом. Предпочтительные R9a включают арил или гетероарил, все необязательно замещенные R10, таким как определен выше, особенно если R9a выбирают из группы, включающейC(=O)N(C1-C3-алкил)2), NO2, ОН, галогеном, трифторметилом или карбоксилом. В описанных в предыдущем абзаце вариантах R9b предпочтительно является C1-C6-алкокси, предпочтительно метокси. Другая R8 группа, например группа, в которой W является простым эфиром, имеет формулуRa' является Н, C1-C6-алкилом, C0-C3-алкилциклоалкилом, C1-C6-алкилокси, гидрокси или амином иC0-C3-алкилгетероциклилом. особенно предпочтительным простым эфирным заместителем является 7-метокси-2-фенилхинолин-4-илокси. Если W является связью, то R8 предпочтительно является замещенной или незамещенной кольцевой гетероциклической системой, описанной в WO 2004/072243 или WO 2004/113665. Характерные примеры R8, если W является связью, включают следующие ароматические соединения, которые необязательно могут быть замещены: 1H-пиррол, 1H-имидазол, 1H-пиразол,фуран, тиофен, оксазол, тиазол, изоксазол, изотиазол, пиридин, пиндазин, пиримидин, пиразин,фталазин, хиноксалин, хиназолин, хинолин, циннолин, 1H-пирроло[2,3-b]пиридин, 1H-индол,1H-бензоимидазол, 1H-индазол, 7H-пурин, бензотиазол, бензооксазол, 1H-имидазо[4,5-с]пиридин,1H-имидазо[4,5-b]пиридин,1,3-дигидробензоимидазол-2-он,1,3-дигидробензоимидазол-2-тион,2,3-дигидро-1 Н-индол, 1,3-дигидроиндол-2-он, 1H-индол-2,3-дион, 1,3-дигидробензоимидазол-2-он,1H,1H-пирроло[2,3-c]пиридин, бензофуран, бензо[b]тиофен, бензо[d]изоксазол, бензо[d]изотиазол,1H-хинолин-2-он, 1H-хинолин-4-он, 1H-хиназолин-4-он, 9H-карбазол, 1H-хиназолин-2-он. Дополнительные характерные примеры R8, если W является связью, включают следующие неароматические соединения, которые могут быть необязательно замещены: азиридин, азетидин, пирролидин,4,5-дигидро-1H-пиразол, пиразолидин, имидазолидин-2-он, имидазолидин-2-тион, пирролидин-2-он,пирролидин-2,5-дион, пиперидин-2,6-дион, пиперидин-2-он, пиперазин-2,6-дион, пиперазин-2-он, пиперазин, морфолин, тиоморфолин-1,1-диоксид, пиразолидин-3-он, имидазолидин-2,4-дион, пиперидин,тетрагидрофуран, тетрагидропиран, [1,4]диоксан, 1,2,3,6-тетрагидропиридин. Предпочтительные значения R8, если W являются связью, включают тетразол и его производные. Тетразольная группа связана с циклическим каркасом Р 2 и необязательно замещена, как показано нижеR1 выбирают из группы включающей Н, C1-C6-алкил, карбоциклил, C0-C3-арил,C0-C3-гетероциклил. Характерные примеры замещенных тетразолов описаны в табл. 1 WO 2004/072243 и формулах,представленных ниже там же, или в WO 2004/113665.-9 014584 Другие предпочтительные значения R8, если W является связью, включают триазол и его производные. Триазольная группа связана с циклическим каркасом P2 и необязательно замещена, как показано ниже где X и Y независимо выбирают из группы, включающей Н, галоген, C1-C6-алкил,C0-C3-карбоциклил, -СН 2-амино, -СН 2-ариламино, -СН 2-диариламино, -(С=О)-амино, -(С=О)-ариламино,-(С=О)-диариламино, C0-C3-арил, C0-C3-гетероциклил, или, альтернативноX и Y, взятые вместе с атомами углерода, к которым они присоединены, образуют циклическую группу, выбранную из группы, включающей арил и гетероарил. Характерные примеры замещенных триазолов описаны в табл. 2 WO 2004/072243 и формулах,представленных ниже там же, или в WO 2004/113665. Другие предпочтительные значения R8, если W является связью, включают пиридазинон и его производные. Пиридазиноновая группа связана с циклическим каркасом Р 2 и необязательно замещена, как показано ниже где X, Y и Z независимо выбирают из группы, включающей Н, N3, галоген, C1-C6-алкил,карбоциклил, амино, C0-C3-арил, -S-арил, -О-арил, -NH-арил, диариламино, дигетероариламино,C0-C3-гетероциклил, -S-гетероарил, -О-гетероарил, NH-гетероарил, или, альтернативно, X и Y или Y и Z,взятые вместе с атомами углерода, в которым они присоединены, образуют арильную или гетероарильную циклическую группу. Характерные примеры замещенных пиридазинонов описаны в табл. 3 WO 2004/072243 и формулах,представленных ниже там же, или в WO 2004/113665. Предпочтительные Р 3 группы, т.е. если m равно 1, имеют сходство с природными или неприродными аминокислотами, особенно алифатическими аминокислотами, такими как L-валил, L-лейцил,L-изолейцил или L-т-лейцил. Другие предпочтительные Р 3 группы, как показано в WO 02/01898,включают C0-C3-алкилциклоалкилаланин, особенно циклогексилаланин, необязательно замещенныйCO2Rg, где Rg является Н, C1-C6-алкилом, C0-C3-алкиларилом, С 0-С 3-алкилгетероциклилом,C0-C3-алкилциклоалкилом или амином; или N-ацетилпиперидин или тетрагидропиран. Предпочтительные R11 группы включают C1-C6-алкил, C0-C3-алкилкарбоциклил, например C0-C3-алкил-C3-C7 циклоалкилил, C0-C3-алкиларил или С 0-С 3-алкилгетероарил, любой из которых необязательно замещен гидрокси, галогеном, амино, C1-C6-алкокси, C1-C6-тиоалкилом, C(=O)OR14, карбоксилом, (C1-C6 алкокси)карбонилом, арилом, гетероарилом или гетероциклилом, особенно если заместителем является гидрокси или C(=O)OR14. Особенно предпочтительные R11 включают трет-бутил, изобутил, циклогексил, фенилэтил,2,2-диметилпропил, циклогексилметил, фенилметил, 2-пиридилметил, 4-гидроксифенилметил или карбоксилпропил. Наиболее предпочтительные R11 значения включают трет-бутил, изобутил или циклогексил. Один из вариантов данного изобретения включает соединения, в которых P4 отсутствует (т.е. n равно 0) и в которых функциональная группа Р 3 не содержит карбонил, т.е. U отсутствует. Характерные структуры имеют формулу IiR11' является C1-C6-алкилом, предпочтительно C3-C5 разветвленным алкилом, таким как боковые цепи L-валила, L-лейцила, L-изолейцила или L-т-лейцила; или C0-C2-алкил-C3-C7-циклоалкилом, таким как циклогексил или циклогексилметил;Rba является C1-C6-алкилом, C0-C3-алкилгетероциклилом, C0-C3-алкилкарбоциклилом. Альтернативно, соединения частичной структуры Ii могут быть макроциклизованы между подходящим значением R7 и одним из Rx, Ry или R11'.- 10014584 Характерные варианты Р 3 групп, которые не содержат функциональную карбоксигруппу (т.е. переменная U отсутствует), включают формулы VIia-VIid: где Ar является карбоциклилом или гетероциклилом, особенно арилом или гетероарилом, любой из которых необязательно замещен R9. Хотя частичные структуры формул VIia-Viid показаны в контексте соединения, в котором k равно 1 и q' равно 0, должно быть понятно, что такие конфигурации формулы VIi существуют также для других значений q' и k. Также, хотя частичные структуры формул VIic и VIid показывают, что R11 группа соответствует лейцину, должно быть понятно, что эти конфигурации применяются к другим группам R11,особенно к тем, которые имеют сходство с боковыми цепями природных или неприродныхR15 в соединениях в соответствии с данным изобретением, в которых n равно 1, предпочтительно является необязательно замещенным C1-C6-алкилом или C0-C3-алкилкарбоциклилом, напримерC0-C3-алкил-C3-C7-циклоалкилом, любой из которых может быть необязательно замещен. Предпочтительные Р 4 группы обычно являются аналогами природных или неприродных аминокислот, особенно алифатических аминокислот, таких как L-валил, L-лейцил, L-изолейцил, L-т-лейцил или Lциклогексилаланин, и, таким образом, предпочтительные R15 группы включают циклогексил, циклогексилметил, трет-бутил, изопропил или изобутил. Предпочтительные значения G включают -NRy-, особенно если Ry является метилом или предпочтительно Н или гидразином. Другие предпочтительные значения G включают О, тем самым определяя сложный эфир с карбонилом группы Р 4 (если присутствует) или карбонилом группы Р 3 (если присутствует) или простой эфир в вариантах, в которых отсутствует группа U. Обычные фармацевтически приемлемые концевые группы простых или сложных эфиров для R16 включают C1-C6-алкил (особенно метил или трет-бутил),C0-C3-алкилгетероциклил (особенно пиридил, бензимидазолил, пиперидил, морфолинил, пиперазинил) или C0-C3-алкилкарбоциклил (особенно фенил, бензил, инданил), любой из которых необязательно замещен гидрокси, галогеном, амино или C1-C6-алкокси. Предпочтительные соединения в соответствии с данным изобретением могут включать гидразиновую функциональную группу, например если Т является -NRd- и m равно 1; где n равно 0 или 1. Альтернативно, особенно если m равно нулю, G может быть -NRjNRj-, таким как -NHNH-. Соединения обычно не содержат гидразин в обоих G и Т. Предпочтительные гидразины в формуле VI, где m и n равны 0,включают соединения частичных структур VIja и Vijb где R16' может являться алкилом (или C1-C3-алкилгетероциклилом, или C1-C3-алкилкарбоциклилом),в котором первый атом углерода алкила замещен оксогруппой, определяя функциональную группу кето,и R16' является остатком алкильной, алкилгетероциклильной или алкилкарбоциклильной группы. Формула VIjb отображает вариант, в котором R16 является метиленовой группой, атом углерода которой замещен оксозаместителем, и также -ORb, где Rb такой, как определен выше, обычно C1-C6-алкил,такой как трет-бутил, C0-C3-алкилгетероциклил, такой как пиридил, или C0-C3-алкилкарбоциклил, такой как бензил или фенил, любой из которых необязательно замещен так, как определено выше. Соединения частичной структуры VIja и VIjb могут быть линейными молекулами, как показано (оба Rj являются Н),или предпочтительно одна из изображенных Rj групп может быть макроциклизована через J с соответствующей R7 группой.- 11014584 Альтернативные гидразины формулы VI, в которых m равно 1, включают частичные структуры VIjc и VIjd где G, R15, R16, Rx, Rd, Rq, Rz и Ru такие, как определены для формулы VI. Соединения частичных структур VIjc и VIjd могут быть линейными молекулами, как показано (обаRx и Rd являются Н), или предпочтительно одна из изображенных Rx или Rd групп может быть макроциклизована через J с соответствующей R7 группой. Хотя формулы VIja-Vijd изображены с 5-членным карбоциклическим кольцом в качестве Р 2 каркаса, должно быть понятно, что данный аспект изобретения также адаптирован к другим конфигурациям q' и k. Предпочтительные варианты формул VIja-Vijd включают те, в которых Rq и Rz являются Н, или те,в которых Rz является олефиновой связью и Rq является C1-C3-алкилом. Альтернативные гидразиноподобные конфигурации возникают, когда G является амино, m и n равны 0 и R16 является N-связанным ненасыщенным гетероциклом, как определено выше, например пиридилом или пиримидилом, или насыщенным гетероциклом, как определено выше, таким как пиперазинил,пиперидинил и особенно морфолинил. Примеры таких вариантов включают формулы VIjc и VIjd Соединения частичных структур VIjc и VIjd могут быть линейными молекулами, как показано, или предпочтительно Rx может быть макроциклизована через J с соответствующей R7 группой. Хотя эти частичные структуры изображены с 5-членным карбоциклическим кольцом в качестве P2 каркаса, должно быть понятно, что такие конфигурации могут применяться для других значений q' и k. Кроме того, такие конфигурации могут применяться для других N-связанных гетероциклов так же, как и для R16. Возвращаясь к формуле VI в общем, предпочтительные R16 группы для соединений в соответствии с данным изобретением включают 2-инданол, инданил, 2-гидрокси-1-фенилэтил, 2-тиофенметил, циклогексилметил, 2,3-метилендиоксибензил, циклогексил, фенил, бензил, 2-пиридилметил, циклобутил, изобутил, н-пропил, метил или 4-метоксифенилэтил. Предпочтительные R16 группы включают 2-инданол, индан, 2-гидрокси-1-фенилэтил,2-тиофенметил, 2,3-метилендиоксибензил или циклогексилметил. Неприродные аминокислоты включают L-аминокислоты, в которых боковая цепь не является одной из 20 природных аминокислот. Примеры неприродных аминокислот включаютL-бета-метилсульфонилметилаланин,L-циклогексилаланин, L-третичный-лейцин, L-норлейцин, L-норвалин, L-орнитин, L-саркозин,L-цитурлин, L-гомофенилаланин, L-гомосерин, L-бета-(1-нафтил)аланин, L-бета-(2-нафтил)аланин и т.д. Неприродные аминокислоты также включают D-аминокислоты, соответствующие 20 природным аминокислотам, и D-аминокислоты, имеющие другие боковые цепи, такие как перечислены выше."C1-C6-Алкил" (также обозначенный как C1-C6-алк или применяемый в названиях соединений, таких как C1-C6-алкилокси и т.д.) в данном описании включает прямые и разветвленные алифатические углеродные цепи, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, пентил,изопентил, гексил, и их любые простые изомеры. Алкильная группа может иметь ненасыщенную связь. Кроме того, любой атом С в C1-C6-алкиле может быть необязательно замещен одним, двумя или,где это позволяет валентность, тремя галогенами. С 1-С 4-алкил и C1-С 5-алкил имеют соответствующие С 1-С 6-алкилу значения, при необходимости, скорректированные по числу атомов углерода."C1-C3-Алкил" в данном описании включает метил, этил, пропил, изопропил, циклопропил, любой из которых может быть необязательно замещен или прерван гетероатомом, как описано в предыдущем параграфе, или в случае С 2 или С 3 иметь ненасыщенную связь, такую как СН 2=СН."С 1-C3-Алкилен" в данном описании относится к двухвалентной C1-C3-алкилдиильной группе,включающей пропилен, этилен и особенно метилен."Галоген" в данном описании означает F, Cl, Вг, I, особенно хлор и предпочтительно фтор."С 0-С 3-Алкиларил" в данном описании включает арильную группу, такую как фенил, нафтил или фенил, сконденсированный с С 3-С 7-циклоалкилом, например инданил, где арил связан непосредственно(т.е. С 0) или через промежуточную метильную, этильную, пропильную или изопропильную группы, определенные для C1-C3-алкилена выше. Если не указано иначе, арил и/или его сконденсированная циклоалкильная группа необязательно замещены 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6-алкила, C1-C6-алкокси, С 1-С 6-алкокси-С 1-С 6-алкила, C1-C6-алканоила, амино,азидо, оксо, меркапто, нитро С 0-C3-алкилкарбоциклила, С 0-C3-алкилгетероциклила."С 0-C3-Алкил-C3-С 7-циклоалкил" в данном описании включает C3-С 7-циклоалкильную группу, такую как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил, где циклоалкил связан непосредственно (т.е. С 0) или через промежуточную метильную, этильную или пропильную группы,определенные для C1-C3-алкилена выше. Циклоалкильная группа может иметь ненасыщенную связь. Если не указано иначе, циклоалкильная группа необязательно замещена 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкокси-С 1-С 6-алкила,C1-C6-алканоила, амино, азидо, оксо, меркапто, нитро-С 0-C3-алкилкарбоциклила, С 0-C3-алкилгетероциклила."С 0-C3-Алкилкарбоциклил" в данном описании включает С 0-C3-алкиларил и С 0-C3-алкил-C3-С 7 циклоалкил. Если не указано иначе, арильная или циклоалкильная группы необязательно замещены 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6-алкила, C1-C6 алкокси, С 1-С 6-алкокси-С 1-С 6-алкила, C1-C6-алканоила, амино, азидо, оксо, меркапто, нитро, С 0-C3 алкилкарбоциклила и/или С 0-C3-алкилгетероциклила."С 0-C3-Алкилгетероциклил" в данном описании включает моноциклическое, насыщенное или ненасыщенное кольцо, содержащее гетероатом, такое как пиперидинил, морфолинил, пиперазинил,пиразолил, имидазолил, оксазолил, изоксазолил, тиазинолил, изотиазолил, тиазолил, оксадиазолил,1,2,3-триазолил, 1,2,4-триазолил, тетразолил, фуранил, тиенил, пиридил, пиримидил, пиридазинил, пиразолил или любую из указанных групп, сконденсированную с фенильным кольцом, такую как хинолинил,бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазонолил, бензизотиазонолил, бензотиазолил,бензоксадиазолил, бензо-1,2,3-триазолил, бензо-1,2,4-триазолил, бензотетразолил, бензофуранил, бензотиенил, бензопиридил, бензопиримидил, бензопиридазинил, бензопиразолил и т.д., где кольцо связано непосредственно (т.е. С 0) или через промежуточную метильную, этильную, пропильную или изопропильную группы, определенные для C1-C3-алкилена выше. Любое такое ненасыщенное кольцо, имеющее ароматический характер, может быть обозначено как гетероарил в данном описании. Если не указано иначе, гетерокольцо и/или его сконденсированная фенильная часть необязательно замещены 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6-алкила, C1-C6-алкокси,С 1-С 6-алкокси-С 1-С 6-алкила, C1-C6-алканоила, амино, азидо, оксо, меркапто, нитро, С 0-C3-алкилкарбоциклила, С 0- C3-алкилгетероциклила."Гетероциклил" и "гетероарил" имеют соответствующие значения, т.е. где связь С 0-C3-алкил отсутствует. Обычно гетероциклильная и карбоциклильная группы в объеме представленных выше определений представляют собой моноциклическое кольцо, имеющее 5 или особенно 6 атомов в кольце, или бициклическую кольцевую структуру, включающую 6-членное кольцо, сконденсированное с 4-, 5- или 6-членным кольцом. Обычно такие группы включают C3-С 8-циклоалкил, фенил, бензил, тетрагидронафтил, инденил, инданил, гетероциклил, такой как азепанил, азоканил, пирролидинил, пиперидинил, морфолинил, тиоморфолинил, пиперазинил, индолинил, пиранил, тетрагидропиранил, тетрагидротиопиранил, тиопиранил,фуранил, тетрагидрофуранил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, имидазолил, пиридинил, пиримидинил, пиразинил, пиридазинил, тетразолил, пиразолил, индолил, бензофуранил, бензотиенил, бензимидазолил, бенэтиазолил, бензоксазолил, бензизоксазолил, хинолинил, тетрагидрохинолинил,изохинолинил, тетрагидроизохинолинил, хиназолинил, тетрагидрохиназолинил и хиноксалинил, любой из которых может быть необязательно замещен, как определено выше. Насыщенная гетероциклическая группа включает радикалы, такие как пирролинил, пирролидинил,пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил, пиранил, тиопиранил, пиперазинил, индолинил, азетидинил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрофуранил, гексагидропиримидинил, гексагидропиридазинил, 1,4,5,6-тетрагидропиримидиниламин, дигидрооксазолил,1,2-тиазинанил-1,1-диоксид, 1,2,6-тиадиазинанил-1,1-оксид, изотиазолидинил-1,1-оксид и имидазолидинил-2,4-дион, а ненасыщенный гетероцикл включает радикалы ароматического характера, такие как фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тетразолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, индолизинил, индолил, изоиндолил. В каждом случае гетероцикл может быть сконденсирован с фенильным- 13014584 кольцом с образованием бициклической кольцевой системы. Синтез. Синтез соединений в соответствии с данным изобретением может проводиться различными химическими способами в растворе, или в твердой фазе, или в их сочетании. Сначала могут быть получены подходящим образом защищенные отдельные функциональные блоки. Затем они могут быть соединены вместе, т.е. Р 2+Р 1 Р 2-Р 1. Альтернативно, предшественники функциональных блоков могут быть соединены вместе и модифицированы на последующей стадии синтеза последовательности ингибитора. Затем другие функциональные блоки, предшественники функциональных блоков или предварительно полученные большие фрагменты желаемой структуры могут быть соединены в растущую цепь, напримерR16-G-P3+C(=O)-P2-P1R16-G-P3-C(=O)-Р 2-Р 1 или R16-G-P4-P3+C(=O)-P2-P1R16-G-34-Р 3-С(=О)-Р 2-Р 1. Сочетание двух аминокислот, аминокислоты и пептида или двух пептидных фрагментов может проводиться с применением стандартных методик сочетания, таких как азидный метод, метод смешанного ангидрида угольной-карбоновой кислоты (изобутилхлорформиат), карбодиимидный (дициклогексилкарбодиимид, диизопропилкарбодиимид или растворимый в воде карбодиимид) метод, метод активированного сложного эфира (п-нитрофениловый эфир, эфир N-гидроксисукцинимидный эфир), K-метод с применением реагента Вудварда, карбонилдиимидазольный метод, метод фосфорных реагентов или окислительно-восстановительный метод. Некоторые из этих методов (особенно карбодиимидный метод) могут быть улучшены добавлением 1-гидроксибензотриазола или 4-ДМАП. Эти реакции сочетания могут проводиться в эфирном растворе (жидкая фаза) или твердой фазе. Более подробно, стадии сочетания включают дегидратационное сочетание свободного карбоксила одного реагента со свободной аминогруппой другого реагента в присутствии связующего агента с получением связующей амидной связи. Описание таких связующих агентов имеется в основных учебных пособиях по химии пептидов, например в пособии М. Bodanszky, "Peptide Chemistry", 2nd rev ed.,Springer-Verlag, Berlin, Germany, (1993), далее обозначенном как Bodanszky, содержание которого включено сюда посредством ссылки. Примеры подходящих связующих агентов включают N,N'-дициклогексилкарбодиимид,1-гидроксибензотриазол в присутствии N,N'-дициклогексилкарбодиимида или N-этил-N'-[(3 диметиламино)пропил]карбодиимид. Практичным и полезным связующим агентом является коммерчески доступный гексафторфосфат (бензотриазол-1-илокси)-трис-(диметиламино)фосфония сам по себе или в присутствии 1-гидроксибензотриазола или 4-ДМАП. Другим практичным и полезным связующим агентом является коммерчески доступный тетрафторборат 2-(1 Н-бензотриазол-1-ил)-N,N,N',N'тетраметилурония. Еще одним практичным и полезным связующим агентом является коммерчески доступный гексафторфосфат О-(7-азабензотризол-1-ил)-N,N,N',N'-тетраметилурония. Реакцию сочетания проводят в инертном растворителе, например дихлорметане, ацетонитриле или диметилформамиде. Избыток третичного амина, например диизопропилэтиламина, N-метилморфолина,N-метилпирролидина или 4-ДМАП, добавляют для поддержания рН реакционной смеси на уровне около 8. Температура реакции обычно составляет от 0 до 50 С, и время реакции обычно составляет от 15 мин до 24 ч. Функциональные группы составляющих аминокислот обычно должны быть защищены во время реакции сочетания для избежания образования нежелательных связей. Применяемые защитные группы перечислены в пособиях Greene, "Protective Groups in Organic Chemistry", John WileySons, New York(1981) и "The Peptides: Analysis, Synthesis, Biology". Vol. 3, Academic Press, New York (1981), далее обозначенных как Greene, описание которых включено сюда в качестве ссылок.-Карбоксильную группу С-концевого остатка обычно защищают как сложный эфир, который может быть расщеплен с получением карбоновой кислоты. Применяемые защитные группы включают: 1) алкиловые сложные эфиры, такие как метиловый, триметилсилиловый и трет-бутиловый; 2) аралкиловые сложные эфиры, такие как бензиловый и замещенный бензиловый; или 3) сложные эфиры, которые могут быть расщеплены слабым основанием или мягкими восстановительными средствами, такие как трихлорэтиловый и фенациловый сложные эфиры.-Аминогруппа каждой связуемой аминокислоты обычно защищена. Может применяться любая защитная группа, известная в данной области техники. Примеры таких групп включают: 1) ацильные группы, такие как формил, трифторацетил, фталил и п-толуолсульфонил; 2) ароматические карбаматные группы, такие как бензилоксикарбонил (Cbz или Z) и замещенные бензилоксикарбонилы и 9-фторенилметилоксикарбонил (Fmoc); 3) алифатические карбаматные группы, такие как трет-бутоксикарбонил (Boc), этоксикарбонил,диизопропилметоксикарбонил и аллилоксикарбонил; 4) циклические алкилкарбаматные группы, такие как циклопентилоксикарбонил и адамантилоксикарбонил; 5) алкильные группы, такие как трифенилметил и бензил; 6) триалкилсилил, такой как триметилсилил; и- 14014584 7) тиолсодержащие группы, такие как фенилтиокарбонил и дитиасукциноил. Предпочтительными -аминозащитными группами являются либо Boc, либо Fmoc. Многие производные аминокислот, защищенные подходящим для пептидного синтеза образом, являются коммерчески доступными.-Аминозащитную группу отщепляют перед последующей стадией сочетания. Если применяется группа Boc, методы выбора включают трифторуксусную кислоту, чистую или в дихлорметане, или HCl в диоксане или в этилацетате. Полученную аммониевую соль затем нейтрализуют либо до сочетания, либо во время его применением основных растворов, таких как водные буферы или третичные амины в дихлорметане или ацетонитриле или диметилформамиде. Если применяется группа Fmoc, предпочтительными реагентами являются пиперидин или замещенный пиперидин в диметилформамиде, но может применяться любой вторичный амин. Снятие защитной группы проводят при температуре от около 0 С до комнатной температуры, обычно 20-22 С. Любая из природных или неприродных аминокислот, имеющая функциональные группы в боковых цепях, обычно защищена во время получения пептида с помощью любой из приведенных выше групп. Специалист в данной области техники поймет, что выбор и применение соответствующих защитных групп для таких функциональных групп боковых цепей зависит от аминокислоты и присутствия других защитных групп в пептиде. При выборе таких защитных групп желательно, чтобы группа не удалялась во время снятия защиты и сочетания -аминогруппы. Например, если в качестве -аминозащитной группы применяется Boc, подходят следующие защитные группы боковых цепей: п-толуолсульфонильные (тозильные) группы могут применяться для защиты аминобоковых цепей аминокислот, таких как Lys и Arg; ацетамидометильная, бензильная (Bn) или трет-бутилсульфонильная группы могут применятся для защиты сульфидсодержащих боковых цепей цистеина; простые бензиловые (Bn) эфиры могут применяться для защиты гидроксисодержащих боковых цепей серина, треонина или гидроксипролина и сложные бензиловые эфиры могут применяться для защиты карбоксисодержащих боковых цепей аспарагиновой кислоты или глутаминовой кислоты. Если для защиты -амина выбирают Fmoc, обычно приемлемы защитные группы на основе третбутила. Например, Boc может применяться для лизина и аргинина, трет-бутиловый простой эфир - для серина, треонина и гидроксипролина и трет-бутиловый сложный эфир - для аспарагиновой кислоты и глутаминовой кислоты. Трифенилметильная (тритильная) группа может применяться для защиты сульфидсодержащей боковой цепи цистеина. Как только последовательность ингибитора завершена, любые защитные группы удаляют методами, которые определяются выбором защитных групп. Эти методы хорошо известны в данной области техники. Введение заместителя Р 2. Группа R8 может быть связана с каркасом P2 на любой подходящей стадии синтеза соединений в соответствии с данным изобретением. Одним из подходов является первоначальное счетание группы R8 с каркасом Р 2 с последующим присоединением других желаемых функциональных блоков, например Р 1 и,необязательно, Р 3 и Р 4. Другой подход включает сочетание P1, P2 и, если присутствуют, Р 3 и Р 4 групп с применением незамещенного каркаса Р 2, и добавление группы R8 после этого. Соединения, в которых W является О и R8 является алкилом, C0-C3-алкилкарбоциклилом,C0-C3-алкилгетероциклилом, могут быть получены по методике, описанной E.M. Smoth et al. (J. Med.Chem. (1988), 31, 875-885), как изображено на схеме 1, которая иллюстрирует методику с применением насыщенного каркаса Р 2 где q' равно 0 и k равно 1. Схема 1 Обработка соединения, содержащего незамещенный каркас Р 2 (1 а), которое может быть получено,как описано ниже, основанием, таким как гидрид натрия или трет-бутоксид калия, в растворителе, таком как диметилформамид, с последующим взаимодействием полученного алкоксида с алкилирующим агентом, R8-X, где X является подходящей уходящей группой, такой как галогенид, мезилат, трифлат или тозилат, дает желаемое замещенное производное (1b). Альтернативно, если X является ОН или SH, P2 заместитель может быть введен реакцией Мицунобу взаимодействием гидроксигруппы соединения 1 а с желаемым спиртом или тиолом в присутствии трифенилфосфина и активирующего агента, такого как диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD) или подобные (Mitsunobu, 1981, Synthesis, January, 1-28; Rano et al., TetrahedronTetrahedron Lett., 1994, 35, 27, 4705-4706). Спирт (1a) альтернативно может быть обработан фосгеном с получением соответствующего хлорформиата, который при взаимодействии с амином, R8NH2 в присутствии основания, такого как гидрокарбонат натрия или триэтиламин, дает карбаматы, т.е. W является -OC(=O)NH-, в то время как реакция спирта (1 а) с ацилирующим агентом R8-CO-X, таким как ангидрид кислоты или галогенангидрид кислоты, например хлорангидрид кислоты, дает сложные эфиры, т.е. W является -OC(=O)-. Различные спирты R8-OH и алкилирующие агенты R8-X описаны в WO 00/09543 и WO 00/59929. Пример синтеза, в котором R8 является замещенным производным хинолина, показан на схеме 2. Схема 2 Ацилирование по Фриделю-Крафту подходящим образом замещенного анилина (2 а), который либо коммерчески доступен, либо описан в литературе, с применением ацилирующего агента, такого как ацетилхлорид или подобные, в присутствии трихлорида бора и трихлорида алюминия в растворителе, таком как дихлорметан, дает (2b). Сочетание (2b) с гетероциклической карбоновой кислотой (2 с) в основных условиях, таких как пиридин, в присутствии активирующего агента для карбоксилатной группы, например POCl3, с последующим замыканием кольца и дегидрированием в основных условиях, таких как третбутоксид калия в трет-бутаноле, дает производное хинолина (2 е). Производное хинолина (2 е) может сочетаться по реакции Мицунобу со спиртом, как описано выше, или гидроксигруппа может быть замещена подходящей уходящей группой, такой как галогенид, такой как хлорид, бромид или йодид, обработкой хинолина (2 е) подходящим галогенирующим агентом, например фосфорилхлоридом или подобным. Множество карбоновых кислот общей структуры (2 с) может применяться в схеме 2. Эти кислоты коммерчески доступны или описаны в литературе. Пример получения производных 2-(замещенного)аминокарбоксиаминотиазола по методике, описанной Berdikhina et al. Chem. Heterocycl. Compd (Emgl. Transl.) (1991), 427-433, показан на схеме 3. Схема 3 Тиомочевина (3 с) с различными алкильными заместителями R' может быть получена реакцией соответствующего амина (3 а) с трет-бутилизотиоцианатом в присутствии основания, такого как диизопропилэтиламин, в растворителе, таком как дихлорметан, с последующим удалением третбутильной группы в кислых условиях. Последующая конденсация производного тиомочевины (3 с) с 3-бромпировиноградной кислотой дает кислоту (3d). Функциональные блоки Р 2, в которых заместитель R8 присоединен через амин, амид, мочевину или сульфонамид, могут быть получены из замещенных карбоциклов, полученных, например, превращением гидроксигруппы соответствующего гидроксипроизводного в азидную группу, например превращением гидроксигруппы в подходящую уходящую группу, такую как мезилат или галоген, такой как хлорид, с последующим замещением уходящей группы азидом или применением агента переноса азида, такого как дифенилфосфорилазид (DPPA). Восстановление азида каталитическим гидрированием или любым другим подходящим способом восстановления дает амин. Аминопроизводное может быть подвергнуто взаимодействию в реакции замещения с алкилирующим агентом общей формулы R8-X, где R8 и X такие,как описаны для схемы 1, с получением функциональных блоков Р 2 для применения при получении соединений общей формулы VI, в которых W является -NH-. Реакция аминозамещенного карбоцикла с кислотой общей формулы R8-COOH в стандартных условиях сочетания амида дает соединения, в которых заместитель R8 связан через амидную связь, в то время как реакция аминозамещенного карбоцикла с соответствующим производным сульфоновой кислоты, R8-S(O)2-X, где X является уходящей группой, например хлоридом, в присутствии основания дает сульфонамиды. Соединения, в которых связь между циклическим каркасом и заместителем R8 состоит из группы мочевины, может, например, быть получена обработкой аминозамещенного карбоцикла фосгеном с получением соответствующего хлоркарбамата с последующей реакцией с желаемым амином. Альтернативно, аминозамещенный карбоцикл может быть подвергнут взаимодействию с карбамоилхлоридом или изоцианатом желаемого заместителя R8 с полу- 16014584 чением мочевинной связи. Должно быть очевидно, что соответствующие реакции применимы и для Р 2 групп с другими размерами колец и типами замещения. Соединения, в которых гетероциклическая группа R8 присоединена непосредственно к циклическому каркасу Р 2, т.е. W является связью в общей формуле VI, могут быть получены, например, реакцией замещения, в которой подходящая уходящая группа, такая как галогенид или мезилат или подобная, в каркасе Р 2 замещается на желаемую группу R8, такую как гетероциклическая группа. Альтернативно,группа R8 может быть введена реакцией Мицунобу, в которой гидроксигруппа предшественника Р 2 взаимодействует с атомом азота гетероциклической группы R8W является связью. Соединения, в которых производное тетразола присоединено к одному из атомов углерода кольца,обычно получают встраиванием тетразольной группы непосредственно в предшественник Р 2. Это может быть достигнуто, например, превращением гидроксигруппы предшественника Р 2 в цианогруппу с последующим взаимодействием с азидным реагентом, таким как азид натрия. Производные триазола также могут быть встроены непосредственно в предшественник Р 2, например превращением гидроксигруппы предшественника Р 2 в азидную группу с последующей реакцией 3+2 циклоприсоединения полученного азида и подходящего производного алкина. Структурно различные тетразолы для применения в описанных выше реакциях замещения или Мицунобу могут быть получены взаимодействием коммерчески доступных соединений нитрила с азидом натрия. Производные триазола могут быть получены реакцией соединения алкина и триметилсилилазида. Применяемые соединения алкина либо доступны коммерчески, либо могут быть получены, например,реакцией Соногашира, т.е. реакцией первичного алкина, галогенида арила и триэтиламина в присутствииPdCl2(PPh)3 и CuI, как описано, например, у А. Elangovan, Y.-H. Wang, Т.-I. Но, Org. Lett., 2003, 5, 18411844. Гетероциклический заместитель также может быть модифицирован при присоединении к функциональному блоку Р 2 либо до, либо после сочетания функционального блока Р 2 с другими функциональными блоками. Эти методы и другие альтернативы получения соединений, в которых W является связью и R8 является необязательно замещенным гетероциклом, подробно описаны в WO 2004/072243. Соединения, имеющие альтернативный размер колец и/или положение заместителя W-R8 в карбоциклическом производном на схеме 1, также могут применяться при получении соединений в соответствии с данным изобретением. Синтез и введение функциональных блоков Р 1. Аминокислоты, применяемые для получения фрагментов Р 1, либо коммерчески доступны, либо описаны в литературе, см., например, WO 00/09543 и WO 00/59929 от Boehringer-Ingelheim илиUS 2004/0048802 от BMS. На схеме 4 показан пример получения производного сульфонамида, применяемого в качестве функционального блока Р 1, и последующего сочетания с функциональным блоком Р 2. Схема 4 Сульфонамидная группа может быть введена в подходящим образом защищенную аминокислоту(4 а) обработкой аминокислоты связующим агентом, например N,N'-карбонилдиимидазолом (CDI) или подобными, в растворителе, таком как ТГФ, с последующим взаимодействием с желаемым сульфонамидом (6b) в присутствии сильного основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Альтернативно, аминокислота может быть обработана желаемым сульфонамидом (4b) в присутствии основания, такого как диизопропилэтиламин, с последующей обработкой связующим агентом, таким какPyBOP для введения сульфонамидной группы. Удаление аминозащитной группы стандартными методами и последующее сочетание с функциональным блоком Р 2, полученным, как описано ниже, с применением стандартных методов получения амидной связи, таких как применение связующего агента, такого как гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), в присутствии основания, такого как диизопропиламин, в растворителе, таком как диметилформамид, дает 4 е. Альтернативно, сульфонамидная группа может быть введена на последующей стадии синтеза, например на последней стадии. В этом случае аминокислоту с обратным способом защиты, т.е. с незащищенной функциональной аминогруппой и защищенной функциональной кислотной группой, сочетают с функциональной кислотной группой Р 2 функционального блока с применением стандартных условий сочетания пептидов, например, описанных выше. Удаление защитной группы кислоты с применением подходящих условий для данной защитной группы с последующим сочетанием сульфонамида, как описано выше,дает соединение 4 е. Функциональные блоки Р 1 для получения соединений общей формулы VI, в которых А является сложным эфиром или амидом, могут быть получены взаимодействием аминокислоты (4 а) с соответствующим амином или спиртом в стандартных условиях для получения амида или сложного эфира. Соединения общей формулы I, в которых А является CR4R4', могут быть получены сочетанием соответствующих функциональных блоков Р 1 с функциональным блоком Р 2, как описано у Oscarsson et al. Bioorg.Med. Chem. 2003, 11(13), 2955-2963 и РСТ/ЕР 03/10595, поданной 23.09.2003 г., содержание которых включено в описание посредством ссылок. Соединения, содержащие азапептидный остаток Р 1, т.е. V является NRu в общей формуле VI, могут быть получены с применением подходящей Р 1 азааминоацильной группы при сочетании с фрагментом Р 2. Получение азааминоацильных групп описано у M.D. Bailey et al. в J. Med. Chem., 47, (2004), 37883799 и пример получения показан на схеме 5. Схема 5 где R1 такой, как определен для R1, но не является H, Введение подходящей N-связанной боковой цепи, Ru, в коммерчески доступный третбутилгидразин может быть проведено, например, реакцией восстановительного аминирования с соответствующим альдегидом или кетоном, как описано на схеме 19, что дает N-алкилированный карбазат (5 а). Конденсация 5 а с желаемым хлорформиатом в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как ТГФ, дает 5b. Группа R1 затем может быть необязательно удалена с применением соответствующих условий, зависящих от определенной R1, таких как каталитическое гидрирование для R1', являющейся бензилом, что дает соответствующие кислоты. Дальнейшее взаимодействие полученной кислоты с желаемым сульфонамидом, как описано на схеме 4, дает функциональные блоки с концевым сульфонамидом. Альтернативно, взаимодействие карбазата 5 а с изоцианатом, R3-N=C=O, дает функциональные блоки для получения соединений общей формулы VI, в которых M является NRu и А является CONR3.- 18014584 Синтез концевых Р 3 и Р 4-Р 3 функциональных блоков. Функциональные блоки R16-G-P3 и R16-G-P4-P3 могут быть получены, как описано на схеме 6. Схема 6(R16-NHRy) с применением стандартных условий сочетания пептидов, например с применением связующих агентов, таких как HATU, DCC, HOBt или подобные, в присутствии основания, такого как DIEA илиDMAP, в растворителе, таком как дихлорметан, хлороформ или диметилформамид или их смеси, и условий получения сложного эфира, подобных получению амидов, т.е. G является NHRy (6b). Альтернативно, взаимодействие аминокислоты (6 а) с соединением общей формулы R16-X, где R16 такой, как определен выше, и X является уходящей группой, такой как галогенид, в присутствии основания, такого как карбонат цезия или оксид серебра (I), дает сложные эфиры, т.е. G является О (6b). С другой стороны,аминокислота (6 а) может сочетаться с другой подходящим образом О-защищенной аминокислотой (6d) с применением стандартных условий сочетания пептидов, как описано выше, с получением (6 е). Замена группы сложного эфира подходящей концевой группой (6b) дает фрагмент (6f), применяемый для получения соединений в соответствии с данным изобретением, в которых m и n равны 1. Если G является N-Ry, концевые Р 3 или Р 2 функциональные блоки также могут быть получены на твердых подложках, как представлено на схеме 7. Схема 7 Подходящая N-защищенная, например защищенная Boc, аминокислота (7 а) может быть иммобилизована на твердой подложке, в данном случае представленной смолой Agronaut PS-TFP, взаимодействием аминокислоты с желаемой твердой подложкой в присутствии связующего агента, такого какN,N'-диизопропилкарбодиимид, и основания, такого как DMAP, в растворителе, таком как дихлорметан и диметилформамид. Иммобилизованная аминокислота (7b) затем может быть отделена от подложки подходящей концевой группой (7 с), тем самым давая фрагменты (7d), применяемые для получения соединений в соответствии с данным изобретением, в которых m или n равно 1. Необязательно, аминозащитная группа может быть удалена с последующим сочетанием с подходящей аминокислотой с применением стандартных методов, с получением фрагментов, применяемых для получения соединений в соответствии с данным изобретением, в которых m и n равны 1.- 19014584 Получение и введение функциональных блоков Р 2. Типовой метод получения соединений, содержащих 5-членный насыщенный каркас Р 2, показан на схеме 8. Схема 8 где Rx' и T' имеют такие же определения, как Rx и Т соответственно, но не являются частью макроцикла;A' является защищенной карбоновой кислотой, замещенным амидом или сульфонамидом илиCR4R4'. Циклический каркас (8b) может быть получен, например, из 3,4-бис-(метоксикарбонил)циклопентанона (8 а), как описано у Rosenquist et al. в Acta Chem. Scand. 46 (1992), 1127-1129, восстановлением кетогруппы с применением восстановительного агента, такого как боргидрид натрия, в растворителе,таком как метанол, с последующим гидролизом сложных эфиров и, наконец, замыканием кольца в уксусном ангидриде в присутствии пиридина. Полученная бициклическая кислота (8b) затем может сочетаться с функциональной группой амина желаемого фрагмента Р 3 (8 с), фрагмента Р 3-Р 4 или концевой группы R16-NHRy, с применением обычных условий сочетания пептидов, таких как HATU и диизопропиламин, в растворителе, таком как диметилформамид, с получением (8d). Разрыв лактона (8d) с применением, например, гидроксида лития дает кислоту, которая затем может быть сочетаться с аминогруппой функционального блока Р 1 или предшественника желаемого фрагмента Р 1 (8 е) с применением обычных условий сочетания пептидов. Заместитель R8 в карбоцикле может быть введен, например, реакцией Мицунобу с подходящим спиртом, как описано выше, или любым другим подходящим методом, описанным выше. Если R7, R7' и А' содержат функциональные группы, они необязательно подходящим образом защищены методами, известными специалистам в данной области техники, см., например, Bodanzky илиGreene, цитированные выше. На схеме 9 показан альтернативный способ получения соединений формулы VI, содержащих насыщенный каркас Р 2, где функциональные блоки вводят в обратном порядке, т.е. фрагмент Р 1 вводят перед добавлением концевой группы, Р 3 или Р 3-Р 4 функциональных блоков. Схема 9 где Rx' и T' имеют такие же определения, как Rx и Т соответственно, но не являются частью макроцикла; А' является защищенной карбоновой кислотой, замещенным амидом или сульфонамидом или- 20014584 Защита кислотной группы (9 а), например в виде трет-бутилового эфира, обработкой ди-третбутилдикарбонатом в присутствии основания, такого как диметиламинопиридин и триэтиламин, в растворителе, таком как дихлорметан, дает сложный эфир (9b). Разрыв лактона и сочетание с функциональным блоком Р 1 (9 с), как описано на схеме 13, или непосредственно с аминогруппой фрагмента Р 1 дает(9d). Введение заместителя R8, как описано выше, с последующим удалением защитной группы кислоты обработкой сложного эфира в кислых условиях, таких как трифторуксусная кислота и триэтилсилан, в растворителе, таком как метиленхлорид, и, наконец, сочетанием с функциональным блоком Р 3 (9 е),функциональным блоком Р 3-Р 4 или концевой группой R16-NHRy, как описано выше, дает (9f). Если R7,R7' и А' содержат функциональные группы, они необязательно подходящим образом защищены методами, известными специалистам в данной области техники, см., например, Bodanzky или Greene, цитированные выше. Ненасыщенный каркас P2, применяемый при получении соединений формулы VI, может быть получен, как показано с циклопентеном ниже. Циклопентеновый каркас обычно получают, как описано на схеме 10. Схема 10 Реакция бромирования-элеминирования 3,4-бис-(метоксикарбонил)циклопентанона (10 а), как описано Dolby et al. в J. Org. Chem. 36 (1971), 1277-1285, с последующим восстановлением функциональной кетогруппы с применением восстанавливающего агента, такого как боргидрид натрия, дает ненасыщенное гидроксисоединение (10b). Селективный гидролиз сложного эфира с применением, например гидроксида лития, в растворителе, таком как смесь диоксана и воды, дает гидроксизамещенное производное сложного моноэфира (10 с). Ненасыщенный каркас Р 2, в котором Rq отличен от водорода, такой как метилированный циклопентеновый каркас, может быть получен, как показано на схеме 11. Схема 11 Окисление коммерчески доступного 3-метил-3-бутен-1-ола (11 а) с применением окислительного агента, такого как хлорхромат пиридиния, с последующей обработкой ацетилхлоридом, бромом и метанолом дает -бром сложный эфир (11 с). Полученный сложный эфир (11 с) затем может быть подвергнут взаимодействию с енолятом (11 е), полученным, например, обработкой соответствующего сложного третбутилового эфира основанием, таким как диизопропиламид лития, в растворителе, таком как тетрагидрофуран, с получением алкилированного соединения (11f). трет-Бутиловый эфир (11 е) может быть получен обработкой соответствующей коммерчески доступной кислоты (11d), в которой L' равно от 1 до 3,ди-трет-бутилдикарбонатом в присутствии основания, такого как диметиламинопиридин. Циклизация(11f) реакцией метатезиса олефина, проводимой как описано выше, дает производное циклопентена(11g). Стереоселективное эпоксидирование (11g) может проводиться с применением метода асимметричного эпоксидирования по Якобсену с получением эпоксида (11h). Наконец, добавление основания, такого как DBN (1,5-диазабицикло[4.3.0]нон-5-ен) дает спирт (11i). Необязательно, двойная связь соединения (11i) может быть восстановлена, например, каталитическим гидрированием с применением катализатора, такого как палладий на угле, что дает соответствующее насыщенное соединение.- 21014584 Полученные циклические каркасы затем могут применяться, как описано выше, для завершения последовательности ингибитора. Пример показан на схеме 12. Схема 12 где Rx' и Т' имеют такие же определения, как Rx и Т соответственно, но не являются частью макроцикла;A' является защищенной карбоновой кислотой, замещенным амидом или сульфонамидом илиCR4R4'. Аминогруппа функционального блока Р 1 или его подходящего предшественника (12b) может сочетаться с кислотой производного циклопентена (12 а) с применением стандартных условий сочетания амида, таких как применением HATU в присутствии основания, такого как диизопропилфениламин или подобные, с последующим введением заместителя R8, например, в условиях Мицунобу, как описано выше,с получением (12d). Гидролиз оставшегося сложного эфира и последующее сочетание амида желаемых Р 3 или Р 3-Р 4 функциональных блоков (12 е), необязательно с последующими манипуляциями с частью Р 1, дают соединения, содержащие циклопентен, (12f) согласно общей формуле VI. Если R7, R7' и A' содержат функциональные группы, они необязательно подходящим образом защищены методами, известными специалистам в данной области техники, см., например, Bodanzky или Greene, цитированные выше. Соединения, имеющие гидразинсодержащие концевые группы, присоединенные непосредственно к Р 2 группе, т.е. Р 3 и Р 4 отсутствуют и G является NRjNRj, могут быть получены, как показано на схеме 13. Схема 13 где A' является защищенной карбоновой кислотой, замещенным амидом или сульфонамидом илиCR4R4'. Взаимодействие трет-бутилкарбазата (13 а), необязательно замещенного алкилом на одном или обоих атомах азота, с кислотой (13b) в условиях сочетания пептидов, таких как HATU и DIEA, в растворителе, таком как ДМФ, дает 9 Ас. Необязательно удаление группы Boc стандартными методами, такими как обработка кислотой, например ТФК, в подходящем растворителе, таком как дихлорметан, дает производное, содержащее гидразин (13d). Альтернативно, любое подходящее производное гидразина, такое как морфолин-1-иламин, пиперидин-1-иламин или подобное, может быть связано с кислотой (13b) вместо производного трет-бутилкарбазата.- 22014584 Полученные соединения далее могут быть увеличены присоединением Р 3 или Р 4-Р 3 функционального блока к первичному амину соединения 13d, например, как показано на схеме 14. Схема 14 где R11' имеет такое же определение, как R11, но не является частью макроцикла; А' является защищенной карбоновой кислотой, замещенным амидом или сульфонамидом илиal., J. Org. Chem. (2001), 66, 7303-7312) дает соответствующее -бромосоединение (14b), которое при взаимодействии с описанным выше производным (13d) дает производное, содержащее гидразин (14 с). Соединения, не содержащие карбоксигруппу в блоке Р 3, могут быть получены, как показано на схеме 15, на которой представлено производное циклопентана в качестве каркаса P2. Схема 15 где R11' имеет такое же определение, как R11, но не является частью макроцикла; А' является защищенной карбоновой кислотой, замещенным амидом или сульфонамидом илиCR4R4. Кислота (15 а) может сочетаться с производным аминоазида (15b), полученным методами, известными в литературе, с применением стандартных условий сочетания пептидов, с получением производного амида (15 с). Восстановление функциональной группы азида, например, связанным полимером трифенилфосфином в растворителе, таком как метанол, или любым другим подходящим методом восстановления дает промежуточное соединение (15d), которое далее подвергают взаимодействию с кислотой в условиях сочетания пептидов или с амином в условиях восстановительного аминирования с получением амидов и вторичных аминов соответственно.- 23014584 На схеме 16 показан метод получения соединений, не содержащих карбоксигруппу в блоке Р 3. Схема 16 где R11' имеет такое же определение, как R11, но не является частью макроцикла; А' является защищенной карбоновой кислотой, замещенным амидом или сульфонамидом илиCR4R4'. Вместо применения производного азида (15b) согласно схеме 15 может применяться соответствующее, необязательно защищенное, гидроксипроизводное (16b) для сочетания с кислотой (16 а), таким образом давая первичный спирт. Спирт (16 с) затем, после необязательного снятия защиты, может быть окислен подходящим окисляющим агентом, например периодинаном Десса-Мартина, с получением соответствующего альдегида. Взаимодействие альдегида с желаемым амином в реакции восстановительного аминирования с применением реагента, такого как, например, связанный полистиролом цианоборгидрид, в растворителе,таком как ТГФ, дает производные амина (16 е). Альтернативно, спирт (16 с) может быть подвергнут взаимодействию с подходящим ацилирующим или алкилирующим агентом в соответствующих условиях с получением соединений сложного и простого эфира соответственно, т.е. G является О в общей формуле VI. Последующее взаимодействие полученного спирта с подходящим ацилирующим или алкилирующим агентом с применением соответствующих условий дает соединения сложного и простого эфира соответственно, т.е. G является О в общей формуле VI. Хотя на схемах 15 и 16 представлено производное циклопентана, т.е. q' равно 0 и k равно 1 в формуле VI, должно быть очевидно, что соответствующая методология применима к другим соединениям формулы VI. Если R7, R7' и А' содержат функциональные группы, они необязательно подходящим образом защищены методами, известными специалистам в данной области техники, см., например, Bodanzky илиGreene, цитированные выше. Получение макроциклических соединений. Соединения в соответствии с данным изобретением, в которых алкиленовая цепь идет от R7/R7' циклоалкила до Rx, Rd или R11, тем самым образуя макроцикл, могут быть получены, как описано ниже. Подходящие P1, P2 и Р 3 функциональные блоки или их предшественники сочетают вместе с применением методик, описанных выше, с последующей реакцией замыкания кольца (макроциклизации). Заместитель W-R8 в функциональном блоке Р 2 может быть введен реакцией Мицунобу, как описано выше, до или после образования макроцикла или компоновка может быть произведена с требуемым замещенным аналогом пролина или карбоциклом. Для макроциклических структур, идущих от R7/R7' циклоалкила доR11, Р 3 аминокислоты, содержащие подходящие боковые цепи, могут быть получены, как описано в WO 00/59929. Типовой метод получения макроциклических соединений показан на схеме 17, которая иллюстрирует методику, применяемую к соединению, имеющему спироциклопропил Р 1, где макроцикл вводит Р 3 боковую цепь. где n=1, 2, 3, 4, 5, 6,7. Сочетание производного кислоты (17 а) с соответствующей, защищенной по кислотной группе, аминокислотой (17b) с применением стандартных условий сочетания пептидов, как описано выше, дает(17 с). Образование макроцикла затем может быть проведено реакцией метатезиса олефина с применением катализатора на основе Ru, такого как один из описанных у Miller, S.J., Blackwell, H.E.; Grubbs, R.H. J.Am. Chem. Soc. 121 (1999), 791-799 и Huang et al., J. Am. Chem. Soc. 121 (1999), 2674-2678. Также должно быть понятно, что катализаторы, содержащие другие переходные металлы, такие как Мо, могут применяться в этой реакции. Необязательно, двойную связь восстанавливают и/или этиловый эфир гидролизуют стандартными методами гидрирования и/или гидролиза соответственно, хорошо известными в данной области техники. Альтернативно, метиловый эфир может быть селективно гидролизован с последующим сочетанием с R16-G-P4 функциональным блоком в стандартных условиях сочетания пептидов. Стадия макроциклизации, описанная на схеме 17, также может применяться к соответствующим карбоциклическим аналогам, описанным выше. Если связь содержит атом азота, замыкание кольца может быть проведено восстановительным аминированием, как описано в WO 00/59929. Макроциклические соединения, не содержащие циклопропильную группу в части Р 1, т.е. макроциклические кольца, идущие непосредственного от пептидного каркаса на атоме углерода, соседнем кR7, могут быть получены методами, описанными здесь. Пример, в котором 5-членное производное циклоалкила применяется в качестве Р 2 каркаса, показан на схеме 18. Схема 18 где A' является защищенной карбоновой кислотой, защищенным амидом или сульфонамидом;- 25014584 Сочетание подходящего производного аллилглицина (18 а) с функциональной группой кислоты в каркасе Р 2 (18b) с применением стандартных условий сочетания пептидов дает производное амида (18 с). Гидролиз эфирной группы с последующей реакцией сочетания пептидов с олефин-замещенной аминокислотой (18Ad) дает соединением амида (18 е). Затем проводят реакцию обмена с замыканием кольца с применением, например, катализатора Говейда-Граббса, что дает макроциклическое соединение (18f). Хотя на схеме 18 показан синтез с применением каркаса Р 2 с незамещенной гидроксигруппой,должно быть понятно, что заместитель R8 может быть введен на любой удобной стадии синтеза, например, как описано на схемах 9 и 10, или он может быть введен после реакции обмена, т.е. в соединение 18f, с применением любого из описанных здесь способов. Функциональные блоки, применяемые при получении соединений, в которых макроцикл идет от атома азота амида в фрагменте Р 3, т.е. Rx является J в общей формуле VI, или при получении соединений, в которых фрагменты Р 3 и р 4 отсутствуют, т.е. m и n равны 0 и G является NRj в общей формуле VI,могут быть получены, как показано на схеме 18 В. Схема 18 В где n=1, 2, 3, 4, 5, 6, 7, 8. Карбамат 18 Ва, который коммерчески доступен или может быть легко получен, например, взаимодействием желаемого алкиламина с ди-трет-бутилдикарбонатом, может быть подвергнут взаимодействию с соответствующим -ненасыщенным спиртом в условиях Мицунобу с получением алкилированного карбамата (18Bb). Обработка 18Bb в кислых условиях, таких как, например, обработка трифторуксусной кислотой в растворителе, таком как дихлорметан, дает свободный амин (18 Вс), который может быть связан с фрагментом Р 2 с применением любой из описанных выше методик. Макроциклические структуры, содержащие гидразиновую группу, т.е. Т является NRd или m и n равны 0 и G является NRjNRj в общей формуле VI, могут быть получены связыванием подходящего производного N-алкилированного карбазата с фрагментом Р 2. Производные алкилированного карбазата могут быть получены, например, как описано на схеме 19. Схема 19 Окисление соответствующего спирта (19 а), проводимое подходящим методом окисления, таким как, например, с применением оксида N-метилморфолина и перрутената тетрапропиламмония в растворителе, таком как дихлорметан, дает альдегид (19b). Восстановительное алкилирование третбутилкарбазата с полученным альдегидом дает желаемый N-алкилированный связующий блок (19 с). Альтернативно, любое желаемое производное гидразина, такое как морфолин-1-иламин, пиперидин-1 иламин или подобные, может применяться вместо трет-бутилкарбазата в реакции с альдегидом 19b. На схеме 20 проиллюстрированы синтетические последовательности для функциональных блоков для получения соединений, в которых "внешний" азот гидразиновой группы алкилирован либо-ненасыщенной алкильной цепью, подходящей для последующего образования макроцикла, либо любой другой подходящей алкильной группой.n=1, 2, 3, 4, 5, 6, 7. Реакция подходящим образом замещенного производного гидразина, например трет-бутилового эфира (1,3-диоксо-1,3-дигидроизоиндол-2-ил)карбаминовой кислоты (20 а), который может быть легко получен специалистом в данной области техники, с желаемым спиртом, R-OH, в условиях Мицунобу,дает N-алкилированное соединение гидразина (20b). Удаление фталимидогруппы, проводимое обработкой гидразином или его производным, таким как гидрат гидразина или ацетат гидразина, дает карбазат(20 с). Полученный первичный амин затем может сочетаться с любым желаемым фрагментом P2 с применением любого метода, описанного выше, с получением 20d ил, альтернативно, он может быть далее алкилирован с применением, например, метода восстановительного аминирования, описанного на схеме 19, с последующим сочетанием с фрагментом Р 2, как описано выше, с получением 20 е. На схеме 21 представлено сочетание гидразинсодержащего функционального блока Р 3 с циклопентановым каркасом с последующей макроциклизацией. Схема 21 Сочетание производного карбазата (21b) с функциональным блоком Р 1-Р 2 (21 а) с применением стандартных условий сочетания пептидов дает промежуточное соединение (21 с). Замыкание кольца (21 с) реакцией метатезиса олефина, как описано на схеме 18, дает макроциклическое соединение (21d). Термин "N-защитная группа" или "N-защита" в данном описании относится к тем группам, которые предназначены для защиты N-конца аминокислоты или пептида или для защиты аминогруппы от нежелательных реакций во время синтеза. Широко применяемые N-защитные группы описаны в Greene,"Protective Groups in Organic Synthesis" (John WileySons, New York, 1981), которая включена сюда посредством ссылки; N-защитные группы включают ацильные группы, такие как формил, ацетил,пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил,фталил, о-нитрофеноксиацетил, -хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и подобные; сульфонильные группы, такие как бензолсульфонил, п-толуолсульфонил и подобные; группы, образующие карбамат, такие как бензилоксикарбонил, п-хлорбензилоксикарбонил,п-метоксибензоилоксикарбонил, п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5 диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1-метилэтокси- 27014584 карбонил, ,-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутоксикарбонил, диизопропилметоксикарбонил,изопропилоксикарбонил, этоксикарбонил, метоксикарбонил,аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, фторенил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил,фенилтиокарбонил и подобные; алкильные группы, такие как бензил, трифенилметил, бензилоксиметил и подобные; и силильные группы, такие как триметилсилил и подобные. Предпочтительные N-защитные группы включают Fmoc, формил, ацетил, бензоил, пивалоил, трет-бутилацетил, фенилсульфонил, бензил, трет-бутоксикарбонил (ВОС) и бензилоксикарбонил (Cbz). Гидроксизащитные группы в данном описании относятся к заместителям, которые защищают гидроксильные группы от нежелательных реакций во время синтеза, такие как O-защитные группы, описанные в Greene, "Protective Groups in Organic Synthesis" (Lohn WileySons, New York, 1981). Гидроксизащитные группы включают замещенные метиловые эфиры, например метоксиметил, бензилоксиметил,2-метоксиэтоксиметил, 2-(триметилсилил)этоксиметил, трет-бутил и другие низшие алкиловые эфиры,такие как изопропил, этил и особенно метил, бензил и трифенилметил; тетрагидропираниловые эфиры; замещенные этиловые эфиры, например 2,2,2-трихлорэтил; силиловые эфиры, например триметилсилил,трет-бутилдиметилсилил и трет-бутилдифенилсилил; и сложные эфиры, полученные взаимодействием гидроксильной группы с карбоновой кислотой, например ацетат, пропионат, бензоат и подобные. При лечении состояний, вызванных флавивирусом, таких как HCV, соединения формулы VI обычно вводят в количестве, дающем уровень в плазме от около 100 до 500 нМ, предпочтительно от 300 до 2000 нМ. Это соответствует дозировке, в зависимости от биодоступности композиции, порядка 0,01-10 мг/кг/день, предпочтительно 0,1-2 мг/кг/день. Типовая доза для нормального взрослого человека составляет около 0,05-5 г в день, предпочтительно от 0,1 до 2 г, более предпочтительно от 500 до 700 мг,от одной до четырех дозированных единиц в день. Как и для любого другого фармацевтического средства, дозировка зависит от размера и условий метаболизма пациента, а также от тяжести инфекции и должна быть скорректирована с учетом сопутствующего лечения. Как принято на практике при проведении антивирусной терапии, соединения формулы I обычно назначают совместно с другими терапиями HCV для избежания образования мутантов "избегающих лекарственное средство". Примеры таких дополнительных антивирусных HCV терапий включают рибавирин, интерфероны,в том числе пегилированные интерфероны. Кроме того, ряд аналогов нуклеозидов и ингибиторов протеазы находятся на стадии клинических или предклинических разработок и могут рассматриваться как возможные варианты для совместного введения с соединениями в соответствии с данным изобретением. Следовательно, другой аспект данного изобретения включает композицию, содержащую соединение формулы I и по крайней мере одно другое HCV антивирусное лекарственное средство в единой дозированной единице, такой как дозированные формы, описанные ниже, но предпочтительно в виде пероральных таблеток или капсул либо жидкой суспензии или раствора для перорального введения или введения инъекцией. Другой аспект данного изобретения включает способ лечения или профилактики флавивирусных инфекций, таких как HCV, включающий последовательное или одновременное введение соединения формулы I и по крайней мере одного другого HCV антивирусного лекарственного средства. Связанный с этим аспект данного изобретения относится к набору для пациента, содержащему первую фармацевтическую композицию предпочтительно в единичной дозированной форме, соединения формулы I и вторую фармацевтическую композицию другого HCV антивирусного лекарственного средства обычно также в единичной дозированной форме и обычно в отдельном контейнере в этом наборе для пациента. Набор также содержит инструкции, напечатанные на упаковке, или на контейнерах, или на листке-вкладыше, по одновременному или последовательному применению соответствующих фармацевтических композиций. Многие пациенты с HCV имеют другие инфекции или подвержены легкому заражению другими инфекционными заболеваниями. Следовательно, другой аспект данного изобретения относится к комбинированной терапии, включающей соединение в соответствии с данным изобретением, совместно составленное в композицию в одной дозированной форме или в одной упаковке по крайней мере с одним другим противоинфекционным фармацевтическим средством. Соединение в соответствии с данным изобретением и по крайней мере одно другое пртивоинфекционное средство вводятся одновременно или последовательно обычно в дозах, соответствующих дозам, применяемым при монотерапии для конкретного агента. Однако определенные противоинфекционные средства могут вызывать синергетическую реакцию, что позволяет вводить один или оба активных ингредиента в меньшей дозе по сравнению с соответствующей монотерапией. Например, для лекарственных средств, склонных к быстрому метаболизму Сур 3 А 4, совместное введение с ингибитором ВИЧ протеазы ритонавиром позволяет снизить режим дозирования. Обычные коинфекции или суперинфекции с HCV включают вирус гепатита В или ВИЧ. Следовательно, соединения в соответствии с данным изобретением преимущественно вводят совместно (в той же дозированной единице, в одной упаковке или отдельно прописанными дозированными единицами) по крайней мере с одним ВИЧ антивирусным средством и/или по крайней мере одним HBV антивирусным- 28014584 средством. Характерные ВИЧ антивирусные средства включают NRTI, такие как аловудин (FLT), зудовудин(AZT, ZDV), ставудин (d4T, Zerit), залцитабин (ddC), диданозин (ddI, Videx), абакавир (ABC, Ziagen),ламивудин (3 ТС, Epivir), эмтрицитабин (FTC, Emtriva), рацевир (рацемический FTC), адефовир (ADV),энтакавир (BMS 200475), аловудин (FLT), тенофовир дизопроксил фумарат (TNF, Viread), амдоксавирPfizer), GW-695634 (GW-8248; GSK), MIV-150 (Medivir), MV026048 (R-1495; MedivirAB/Roche),NV-0522 (Idenix Pharm.), R-278474 (JohnsonJohnson), RS-1588 (Idenix Pharm.), TMC-120/125 (JohnsonJohnson), TMC-125 (R-165335; JohnsonJohnson), UC-781 (Biosyn Inc.) и YM215389 (Yamanoushi). Характерные ингибиторы протеазы ВИЧ включают РА-457 (Panacos), KPC-2 (Kucera Pharm.),5-HGTV-43 (Enzo Biochem), ампренавир (VX-478, Agenerase), атазанавир (Reyataz), индинавира сульфат(Vertex/GSK). Другие ВИЧ антивирусные средства включают ингибиторы проникновения, включая ингибиторы слияния, ингибиторы рецептора CD4, ингибиторы корецептора CCR5 и ингибиторы корецептора CXCR4 или их фармацевтически приемлемые соли или пролекарства. Примеры ингибиторов проникновения включают AMD-070 (AMD11070; AnorMed), BlockAide/CRPharm), PR0542 (Progenies Pharm.), SCH-D (SCH-417690; Schering-Plough), T-1249 (R724; Roche/Trimeris),TAK-220 (Takeda Chem. Ind.), TNX-355 (Tanox) и UK-427,857 (Pfizer). Примеры ингибиторов интегразы включают L-870810 (MerckCo.), c-2507 (MerckCo.) иS(RSC)-1838 (shionogi/GSK). Примеры HBV антивирусных средств включают адефовир дипивоксил (Hepsera) и особенно ламивудин и 2'3'-дидезокси-3'-фторгуанозин (FLG) и его пролекарства, такие как MIV-210, 5'-О-валил-Lлактиловое пролекарство FLG. Такие последние HBV антивирусные средства особенно удобны, так как они также активны против ВИЧ. Хотя возможно вводить активный агент в чистом виде, предпочтительно чтобы он присутствовал в виде части фармацевтической композиции. Такие композиции содержат определенный выше активный агент вместе с одним или более приемлемыми носителями или эксципиентами и, необязательно, другими терапевтическими ингредиентами. Носители должны быть приемлемы в смысле совместимости с другими ингредиентами композиции и не причинять вред пациенту. Композиции включают такие, которые подходят для ректального, назального, местного (включая буккальное и подъязычное), вагинального или парентерального (включая подкожное, внутримышечное,внутривенное и внутрикожное) введения, но предпочтительно композиция предназначена для перорального введения. Композиции удобно могут быть представлены в единичной дозированной форме, например таблетках и капсулах с замедленным высвобождением, и могут быть получены любыми методами,хорошо известными в области фармацевтики. Такие методы включают стадию объединения определенного выше активного агента и носителя. В общем композиции готовят однородным и тщательным объединением активного агента с жидкими носителями или тонкоизмельченными твердыми носителями либо обоими и затем, при необходимости, продукту придают форму. В данном изобретении представлены способы получения фармацевтических композиций, включающие объединение соединения формулы VI или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем или наполнителем. Если получение фармацевтических композиций включает тщательное смешивание фармацевтических эксципиентов и активного ингредиента в виде соли,часто предпочтительно применять эксципиенты, которые не являются основными по природе, т.е. либо кислые, либо нейтральные. Композиции для перорального введения в соответствии с данным изобретением могут быть представлены в виде отдельных единиц, таких как капсулы, пастилки или таблетки,каждая из которых содержит предопределенное количество активного агента; в виде порошка или гранул; в виде раствора или суспензии активного агента в водной жидкости и неводной жидкости или в виде жидкой эмульсии "масло-в-воде" или жидкой эмульсии "вода-в-масле" и в виде болюсов и т.д.
МПК / Метки
МПК: C07D 417/14, A61P 31/12, C07K 5/02, A61K 31/47, C07D 401/12, C07D 245/04, C07D 487/04
Метки: ингибиторы, протеазы, сериновой
Код ссылки
<a href="https://eas.patents.su/30-14584-ingibitory-ns-3-serinovojj-proteazy-hcv.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы ns-3 сериновой протеазы hcv</a>
Предыдущий патент: Композиция для получения спеченного постоянного магнита, спеченный постоянный магнит и способ его получения
Следующий патент: Способ определения полоксамеров
Случайный патент: Ингибиторы гидролазы амидов жирных кислот












