Производные хинолина в качестве антибактериальных средств
Номер патента: 14423
Опубликовано: 30.12.2010
Авторы: Гийемон Жером Эмиль Жорж, Мерпул Ливен, Бакс Лео Якобус Йозеф, Андрис Кунрад Йозеф Лодевейк Марсель, Коул Анил, Лансуа Давид Франсис Ален, Мотт Магали Мадлен Симон, Доранж Исмет
Формула / Реферат
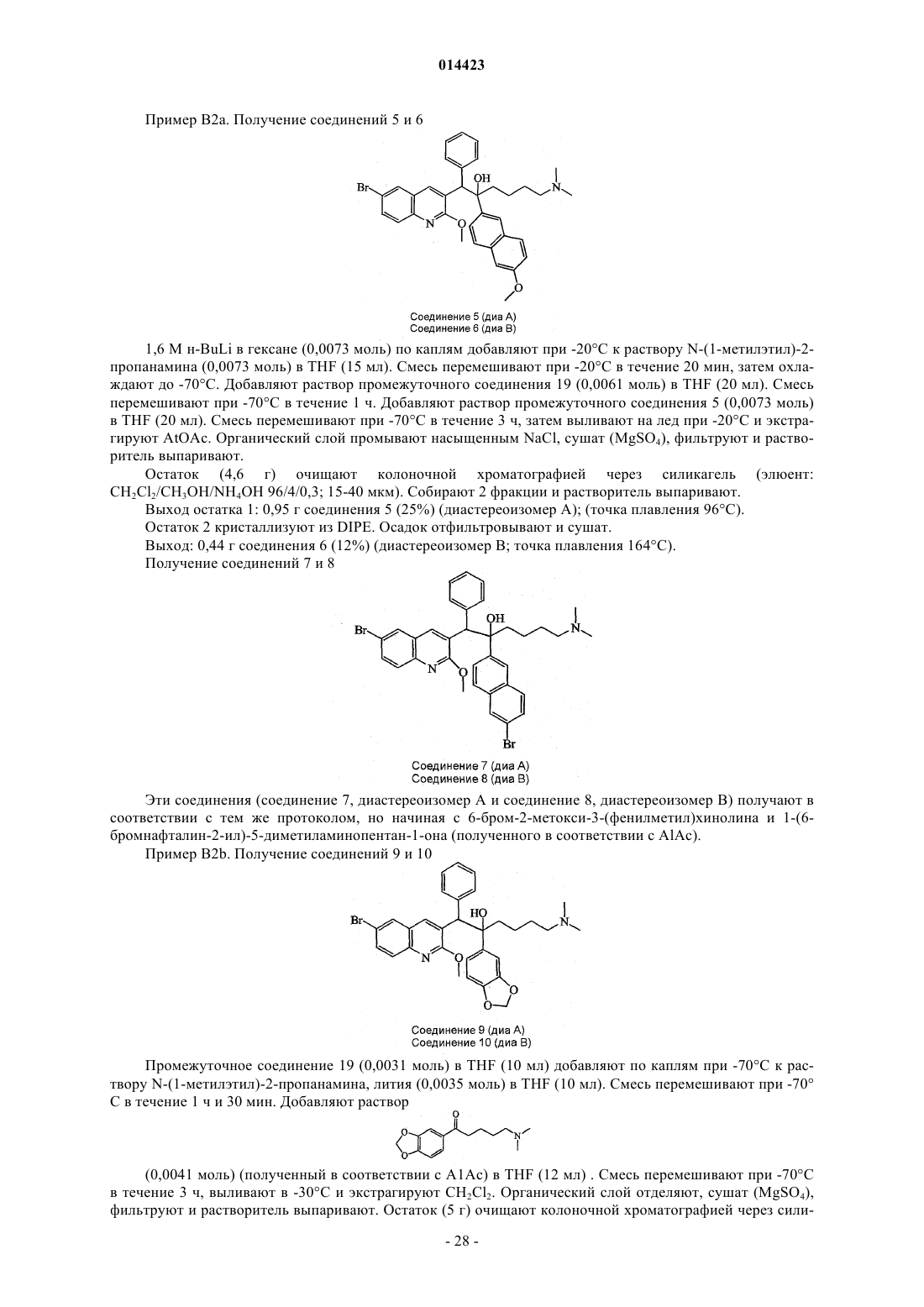
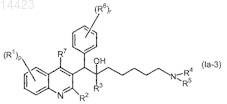
1. Применение соединения для изготовления лекарственного средства для лечения бактериальной инфекции, причем указанное соединение представляет собой соединение формулы (Ia)
его фармацевтически приемлемую кислотно- или основно-аддитивную соль, его стереохимически изомерные формы или его N-оксидные формы,
где R1представляет собой водород, галоген, Ar, Het или алкил;
р представляет собой целое число, равное 1, 2, 3 или 4;
R2 представляет собой алкилокси, алкилтио или радикал формулы
![]()
где Y представляет собой О;
R3 представляет собой алкил, Ar, Ar-алкил, Het или Het-алкил;
q представляет собой целое число, равное 1, 2 или 3;
каждый R4и R5 независимо представляет собой водород, алкил или бензил; или
R4 и R5, взятые вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролидинила, пиперидинила, пиперазинила и морфолинила, необязательно замещенного алкилом или моно- или диалкиламино;
R6 представляет собой водород, галоген, Ar, алкил или алкилокси;
r представляет собой целое число, равное 1, 2, 3, 4 или 5;
R7 представляет собой водород;
алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; где каждый атом углерода может быть необязательно замещен гидрокси, алкилокси или оксо;
Ar представляет собой гомоцикл, выбранный из группы фенила, нафтила, каждый гомоцикл необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы галогена, алкила или алкилокси;
Het представляет собой фуранил, пиридинил или бензо[1,3]диоксолил;
галоген замещен заместителем, выбранным из группы фтор-, хлор-, бром- и йод-; и
при условии, что бактериальная инфекция отличается от микобактериальной инфекции.
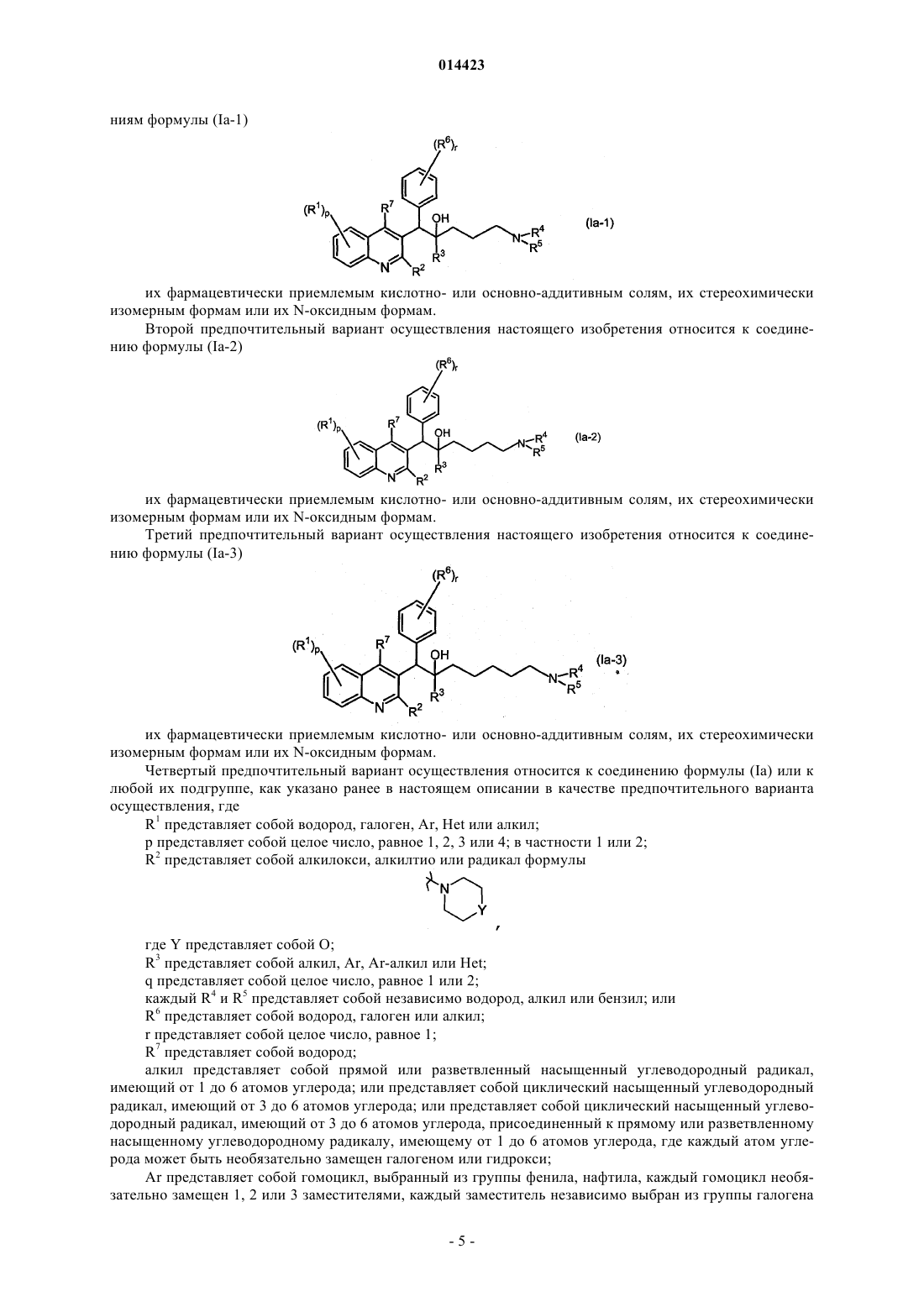
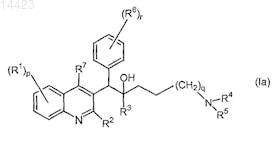
2. Применение по п.1, где соединение формулы (Ia) представляет собой соединение формулы
его фармацевтически приемлемую кислотно- или основно-аддитивную соль, его стереохимически изомерную форму или его N-оксидную форму.
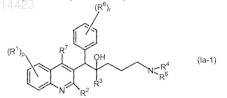
3. Применение по п.1, где соединение формулы (Ia) представляет собой соединение формулы
его фармацевтически приемлемую кислотно- или основно-аддитивную соль, его стереохимически изомерную форму или его N-оксидную форму.
4. Применение по п.1, где соединение формулы (Ia) представляет собой соединение формулы
его фармацевтически приемлемую кислотно- или основно-аддитивную соль, его стереохимически изомерную форму или его N-оксидную форму.
5. Применение по любому из предшествующих пунктов, где R1 представляет собой водород, галоген, Ar или Het.
6. Применение по п.5, где R1 представляет собой галоген или Het.
7. Применение по п.6, где R1 представляет собой галоген.
8. Применение по любому из предыдущих пунктов, где р=1.
9. Применение по любому из предыдущих пунктов, где R2 представляет собой алкилокси или алкилтио.
10. Применение по п.9, где R2 представляет собой C1-4алкилокси.
11. Применение по любому из предыдущих пунктов, где R3 представляет собой Ar, Het, Ar-алкил или Het-алкил.
12. Применение по любому из пп.1-10, где R3 представляет собой С1-4алкил, нафтил, фенил, необязательно замещенный алкилом или алкилокси, пиридинилом, бензо[1,3]диоксолилом, -СН2-(СН2)n-R3a, где R3a представляет собой циклогексил, фенил, нафтил или фуранил, причем R3a необязательно замещен алкилом, и где n=0 или 1.
13. Применение по п.12, где R3 представляет собой нафтил или фенил.
14. Применение по любому из предыдущих пунктов, где каждый R4и R5 представляет собой независимо водород или С1-4алкил.
15. Применение по любому из предыдущих пунктов, где R6 представляет собой водород или галоген.
16. Применение по любому из пп.1-14, где R6 представляет собой водород.
17. Применение по любому из предыдущих пунктов, где r=1.
18. Применение по п.1, где соединение представляет собой соединение формулы (Ia), где R1представляет собой водород, галоген, алкил, Ar или Het; p=l; R2представляет собой алкилокси, алкилтио, или радикал формулы
![]()
R3 представляет собой алкил, Ar, Het, Ar-алкил или Het-алкил; q=1, 2 или 3; каждый из R4 и R5представляет собой независимо водород, алкил или бензил; или R4 и R5, взятые вместе с атомом N, к которому они присоединены, образуют радикал, выбранный из группы пирролидинила, пиперидинила, пиперазинила или морфолинила, необязательно замещенного алкилом или моно- или ди(алкил)амино; R6представляет собой водород, галоген, алкилокси, алкил или фенил, необязательно замещенный алкилокси; r=1 или 2; R7 представляет собой водород.
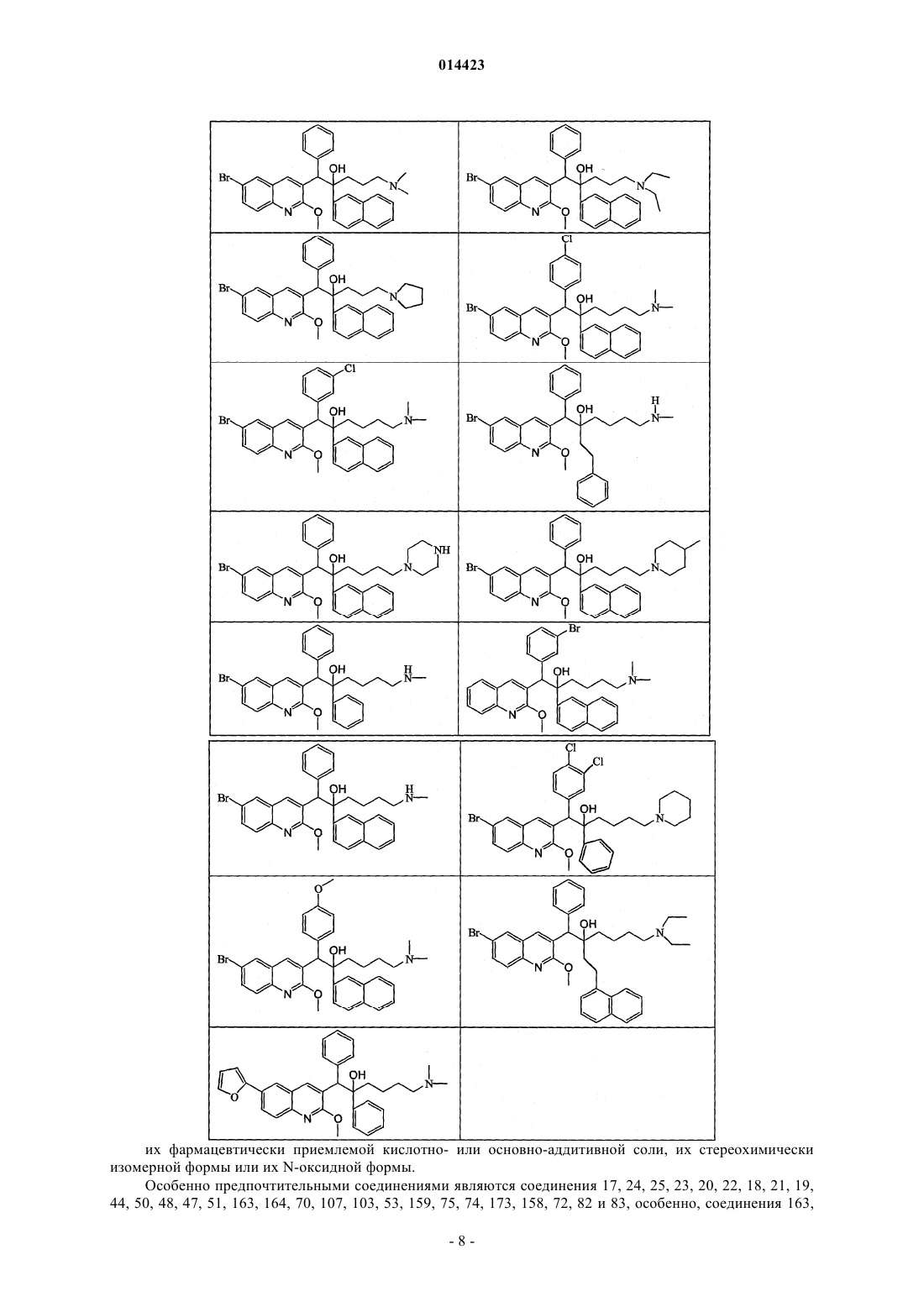
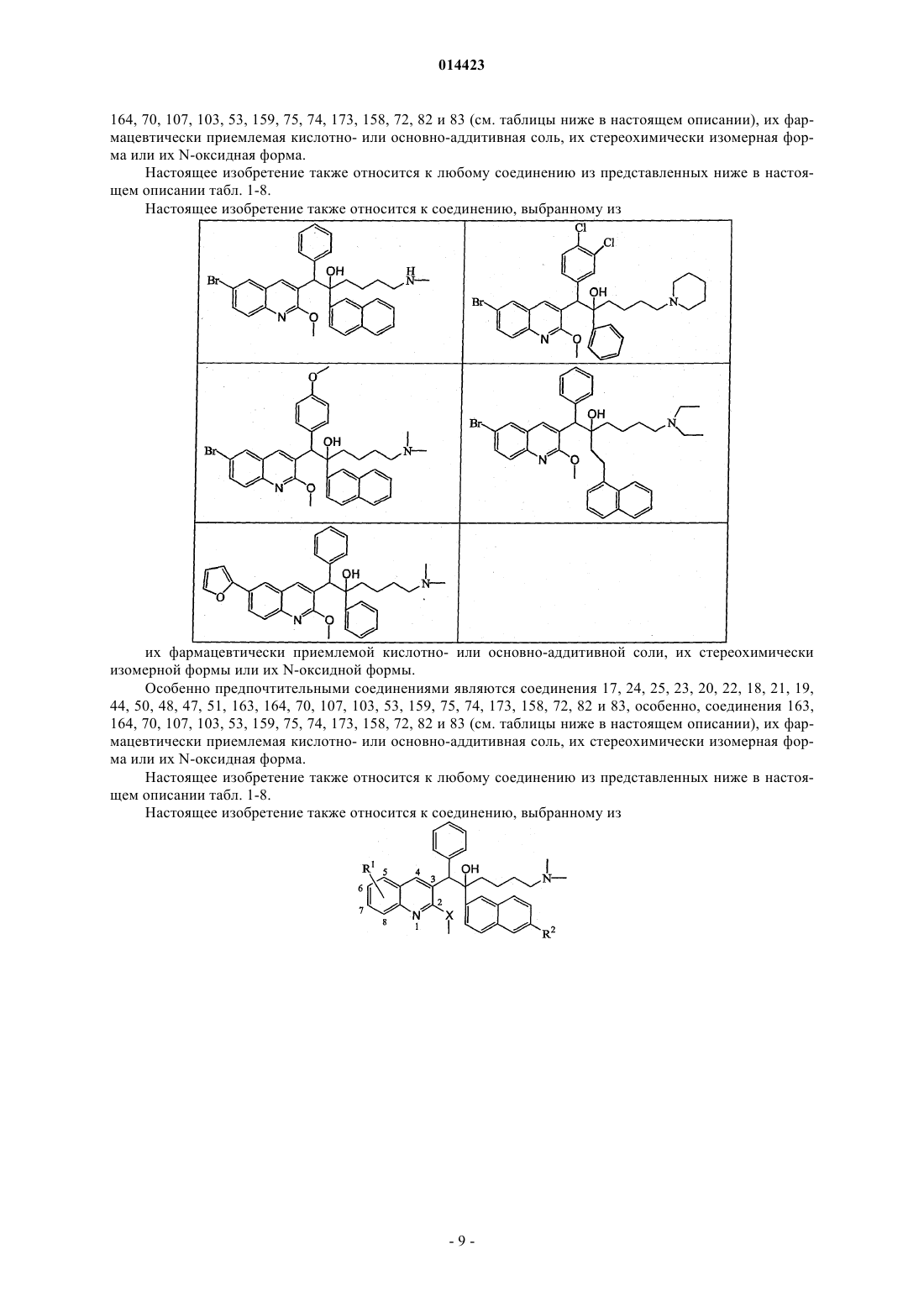
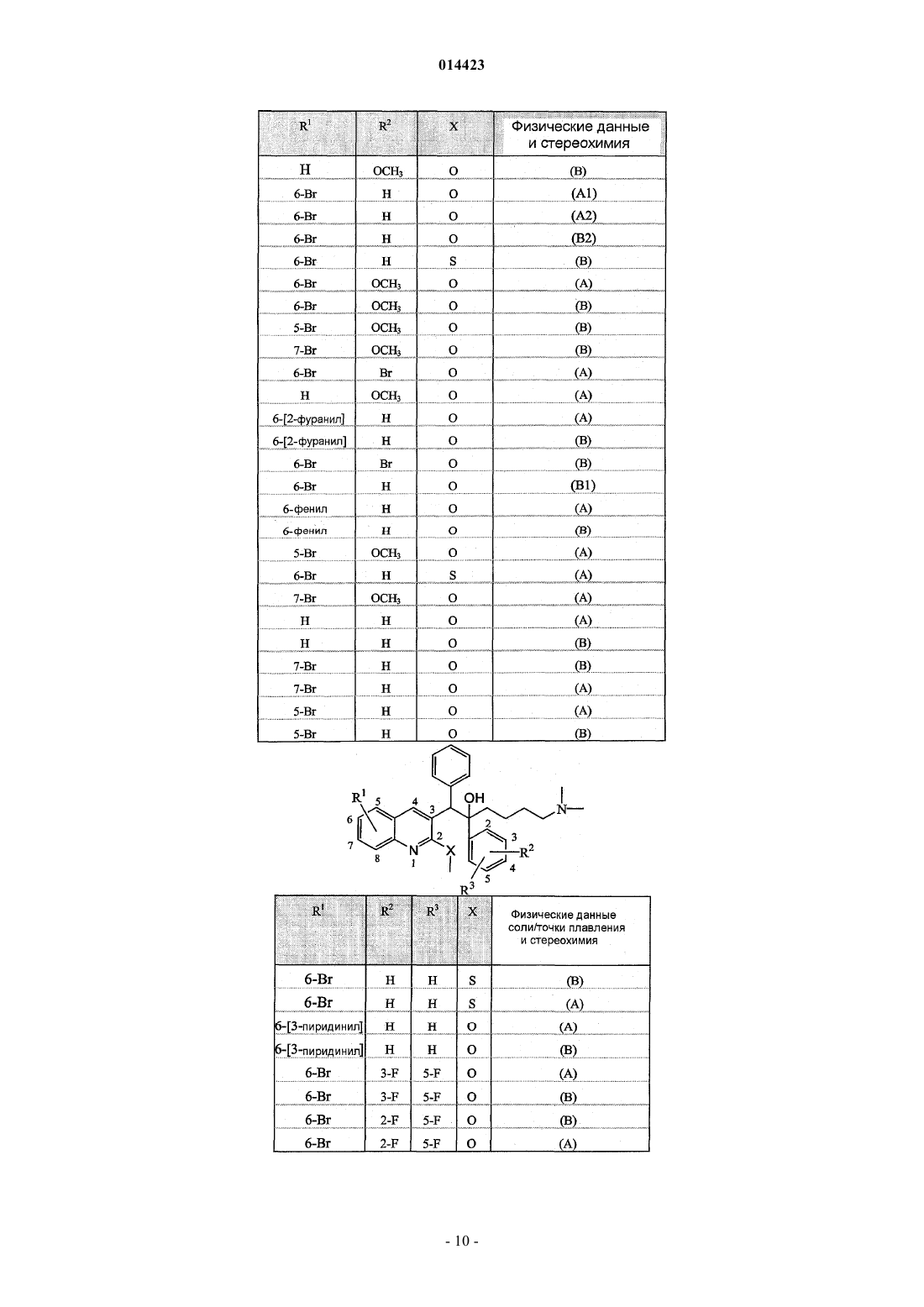
19. Применение по п.1, где соединение выбирают из следующих соединений:
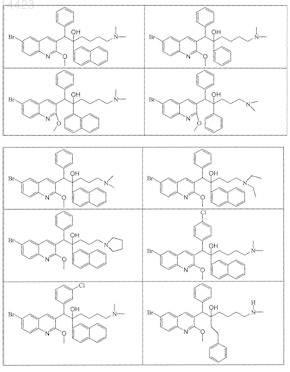
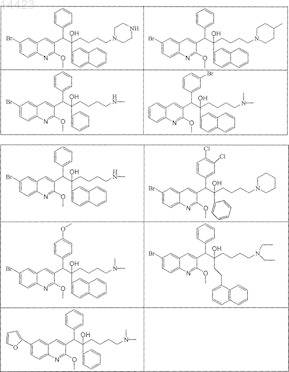
его фармацевтически приемлемой кислотно- или основно-аддитивной соли, его стереохимически изомерной формы или его N-оксидной формы.
20. Применение по пп.1-9,11,13 и 15-18, где алкил представляет собой C1-6алкил.
21. Применение по любому из предыдущих пунктов, где бактериальная инфекция представляет собой инфекцию грамположительной бактерией.
22. Применение по п.21, где грамположительная бактерия представляет собой Staphylococcus aureus или Streptococcus pneumoniae.
23. Соединение, где соединение выбирают из
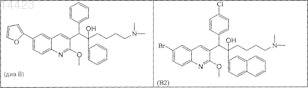

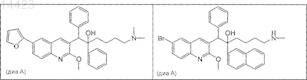
его фармацевтически приемлемой кислотно- или основно-аддитивной соли, его стереохимически изомерной формы или его N-оксидной формы.
24. Комбинация (а) соединения по п.23 и (b) одного или нескольких других антибактериальных средств при условии, что одно или несколько других антибактериальных средств отличаются от антимикобактериальных средств.
25. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество (а) соединения по п.23 и (b) одного или нескольких других антибактериальных средств при условии, что одно или несколько других антибактериальных средств отличаются от антимикобактериальных средств.
26. Применение комбинации по п.24 или фармацевтической композиции по п.25 для лечения бактериальной инфекции.
27. Продукт, содержащий: (а) соединение по п.23 и (b) одно или несколько других антибактериальных средств при условии, что одно или несколько других антибактериальных средств отличаются от антимикобактериальных средств в качестве комбинированного препарата для одновременного, отдельного или последовательного применения при лечении бактериальной инфекции.
28. Способ получения соединения формулы (Ia), отличающийся тем, что промежуточное соединение формулы (IV) взаимодействует с амином формулы HNR4R5 в присутствии СО или Н2, подходящего катализатора, необязательно, второго катализатора, подходящего лиганда и подходящего растворителя
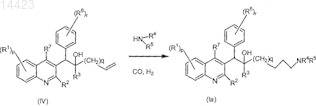
где R1, R2, R3, R4, R5, R6, R7, р и r имеют значения, определенные в п.1, и где q=0, 1 или 2.
29. Применение по любому из пп.1-21 и 26, где бактериальная инфекция представляет собой инфекцию Staphylococci, Enterococci или Streptococci.
30. Применение по любому из пп.1-21 и 26, где бактериальная инфекция представляет собой устойчивый к метилицину штамм Staphylococcus aureus (MRSA), устойчивый к метилицину коагулазно-отрицательный стафилококк (MRSA), устойчивый к пенициллину штамм Enterococcus faecium.
31. Применение по любому из пп.1-21 и 26, где бактериальная инфекция представляет собой устойчивый к метилицину штамм Staphylococcus aureus (MRSA).
Текст
Медведев В.Н. (RU) Применение соединения для изготовления лекарственного средства для лечения бактериальной инфекции при условии, что бактериальная инфекция не является микобактериальной инфекцией,где указанное соединение представляет собой соединение формулы (Ia), причем указанное соединение представляет собой соединение формулы (Ia) его фармацевтически приемлемую кислотно- или основно-аддитивную соль, его стереохимически изомерные формы, или его N-оксидные формы, где R1 представляет собой водород, галоген, Ar, Het или алкил; р представляет собой целое число, равное 1, 2, 3 или 4; R2 представляет собой алкилокси, алкилтио или радикал формулы где Y представляет собой О; R3 представляет собой алкил, Ar, Ar-алкил, Het или Het-алкил; q представляет собой целое число, равное 1, 2 или 3; каждый R4 и R5 независимо представляет Андрис Кунрад Йозеф Лодевейк Марсель,Коул Анил (BE), Гийемон Жером Эмиль Жорж, Лансуа Давид Франсис Ален, Мотт Магали Мадлен Симон (FR), Доранж Исмет (SE), Бакс Лео Якобус Йозеф, Мерпул Ливен (BE) собой водород, алкил или бензил; или R4 и R5, взятые вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролидинила,пиперидинила, пиперазинила и морфолинила, R6 представляет собой водород, галоген, Ar, алкил или алкилокси; необязательно замещенный алкилом или моно- или диалкиламино; r представляет собой целое число, равное 1, 2, 3, 4 или 5; R7 представляет собой водород; алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов 014423 Настоящее изобретение относится к применению производных хинолина для изготовления лекарственного средства для лечения бактериальной инфекции. Устойчивость к антибиотическим средствам первой линии является возникающей проблемой. Некоторые важные примеры включают устойчивый к пенициллину Streptococcus pneumoniae, устойчивые к ванкомицину энтерококки, устойчивый к метициллину Staphylococcus aureus, устойчивые к множеству антибиотиков сальмонеллы. Проявление устойчивости к антибиотическим средствам влечет за собой тяжелые последствия. Инфекции, вызванные резистентными микробами, не реагируют на лечение, приводя к длительному заболеванию и повышая риск смерти. Неудачное лечение также способствует увеличению заразного периода болезни, в результате чего увеличивается число инфицированных людей, перемещающихся в обществе,и, таким образом, подвергая общую популяцию риску заражения инфекцией устойчивым штаммом. Стационары являются решающим компонентом проблемы устойчивости к противомикробным средствам во всем мире. Сочетание у высоко восприимчивых пациентов интенсивного и длительного применения противомикробных средств и перекрестной инфекции привело к возникновению инфекций с высоко устойчивыми бактериальными патогенами. Самолечение противомикробными средствами представляет собой еще один основной фактор, способствующий развитию устойчивости. Самостоятельно применяемые противомикробные средства могут не требоваться, часто вводятся в неадекватных дозах или могут не содержать адекватные количества активного препарата. Другой важной проблемой является выполнение пациентами рекомендуемого лечения. Пациенты забывают принимать медикаментозные средства, прерывают свое лечение, когда они начинают лучше себя чувствовать, или могут быть не в состоянии провести полный курс, создавая посредством этого идеальную среду для адаптации микробов, а не их уничтожения. Ввиду возникающей устойчивости к множеству антибиотиков, врачи сталкиваются с инфекциями, в отношении которых нет эффективного лечения. Заболеваемость, смертность и финансовые затраты при таких инфекциях создают возрастающую нагрузку на системы здравоохранения во всем мире. Поэтому существует большая потребность в новых соединениях для лечения бактериальных инфекций, особенно для лечения инфекций, вызванных устойчивыми штаммами. В WO 2004/011436 раскрыты замещенные производные хинолина, обладающие активностью против микобактерий, в частности против Mycobacterium tuberculosis. Одно определенное соединение этих замещенных производных хинолина описано в Science (2005), 307, 223-227. В настоящее время было обнаружено, что производные хинолина, описанные в WO 2004/011436,проявляют активность против бактерий, отличных от микобактерий. Поэтому настоящее изобретение относится к применению соединения для изготовления лекарственного средства для лечения бактериальной инфекции, причем указанное соединение представляет собой соединение формулы (Ia) или (Ib) его фармацевтически приемлемую кислотно- или основно-аддитивную соль, его стереохимически изомерные формы или его N-оксидные формы, гдеR1 представляет собой водород, галоген, Ar, Het или алкил; р представляет собой целое число, равное 1, 2, 3 или 4;R2 представляет собой алкилокси, алкилтио или радикал формулыq представляет собой целое число, равное 1, 2 или 3; каждый R4 и R5 представляет собой независимо водород, алкил или бензил; илиR4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролидинила, пиперидинила, пиперазинила, пиридазинила и морфолинила, необязательно замещенного алкилом, или моно- или диалкиламино;r представляет собой целое число, равное 1, 2, 3, 4 или 5;-1 014423 алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал,имеющий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; где каждый атом углерода может быть необязательно замещен гидрокси, алкилокси или оксо;Ar представляет собой гомоцикл, выбранный из группы фенила, нафтила, каждый гомоцикл необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы галогена,алкила или алкилокси, фуранила, пиридинила; или бензо[1,3]диоксолила; галоген замещен заместителем, выбранным из группы фтор-, хлор-, бром- и йод-; и при условии, что бактериальная инфекция отличается от микобактериальной инфекции. Настоящее изобретение также относится к способу лечения бактериальной инфекции у млекопитающего, в частности у конкретного теплокровного животного, конкретнее, у человека, включающему введение млекопитающему эффективного количества соединения по изобретению. В рамках настоящей заявки, алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода; где каждый атом углерода может быть необязательно замещен гидрокси, алкокси или оксо. Предпочтительно алкил представляет собой метил, этил или циклогексилметил, предпочтительнее метил или этил. Предпочтительным вариантом осуществления алкила во всех определениях, использованных в настоящем описании ранее или в последующем, является C1-6 алкил, который представляет прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода, такой как, например, метил, этил, пропил, 2-метилэтил, пентил, гексил и им подобный. Предпочтительной подгруппой C1-6 алкила является С 1-4 алкил, который представляет прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 4 атомов углерода, такой как, например, метил, этил, пропил, 2 метилэтил и ему подобный. В рамках настоящей заявки Ar представляет собой гомоцикл, выбранный из группы фенила, нафтила, где каждый необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы галоген-, алкила или алкилокси. Предпочтительно Ar представляет собой нафтил или фенил, каждый необязательно замещен 1 или 2 заместителями, независимо выбранными из галоген или алкилокси. В рамках настоящей заявки Het представляет собой фуранил, пиридинил или бензо[1,3]диоксолила. Предпочтительно Het представляет собой фуранил, пиперидинил, пиридинил или бензо[1,3]диоксолил. В рамках настоящей заявки галоген представляет собой заместитель, выбранный из группы фтор-,хлор-, бром- и йод-, а галоген-алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал, имеющий от 1 до 6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, или циклический насыщенный углеводородный радикал,имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода, где один или более атомов углерода замещены одним или более атомами галогена. Предпочтительно галоген представляет собой бром-, фторили хлор-, а предпочтительно галоген-алкил представляет собой полигалоген-C1-6 алкил, который определен как моно- или полигалогензамещенный C1-6 алкил, например метил с одним или более атомами фтора, например дифторметил или трифторметил, 1,1-дифторэтил и им подобные. В случае, если более чем один атом галогена присоединен к алкильной группе в пределах определения галогеналкила или полигалоген-C1-6 алкила, они могут быть одинаковыми или различными. В определении Het имеется в виду включение всех возможных изомерных форм гетероциклов, например пирролил включает 1 Н-пирролил и 2 Н-пирролил.Ar или Het, перечисленные в определениях заместителей соединений формулы (Ia) (см., например,R3), как указано выше или ниже в настоящем описании, могут быть присоединены к остальной части молекулы формулы (Ia), как целесообразно, через любой кольцевой атом углерода или гетероатом, если нет других определений. Линии, проведенные от заместителей в кольцевые системы, указывают на то, что связь может быть присоединена к любому из подходящих кольцевых атомов. Для терапевтического применения соли соединений формулы (Ia) представляют собой те, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например при получении или очистке фармацевтически приемлемого соединения. Все соли, фармацевтически приемлемые или не приемлемые, включены в сферу настоящего изобретения. Указанные в настоящем описании выше или ниже фармацевтически приемлемые аддитивные соли-2 014423 предназначены для включения терапевтически активных нетоксичных кислотно-аддитивных солевых форм, которые способны образовывать соединения формулы (Ia). Последние можно легко получить обработкой основной формы такими соответствующими кислотами, как неорганические кислоты, например, гидрогалогенные кислоты, например хлористо-водородная кислота, бромисто-водородная кислота и им подобные; серная кислота; азотная кислота; фосфорная кислота и им подобные; или органические кислоты, например уксусная, пропаноевая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая,щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, 2-гидрокси-1,2,3 пропантрикарбоновая,метансульфоновая,этансульфоновая,бензолсульфоновая,4-метилбензолсульфоновая, циклогексансульфамовая, 2-гидроксибензойная, 4-амино-2-гидроксибензойная и подобные кислоты. Наоборот, солевые формы могут быть превращены обработкой щелочью в форму свободного основания. Соединения формулы (Ia), содержащие кислотные части, могут быть превращены в их терапевтически активные нетоксические аддитивные солевые формы металлов или аминов обработкой соответствующими органическими и неорганическими основаниями. Соответствующие основные солевые формы включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и им подобные, соли с органическими основаниями, например первичные, вторичные и третичные алифатические и ароматические амины, такие как метиламин, этиламин,пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин,дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин,триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, N-метил-Dглюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол, соли гидрабамина и соли с аминокислотами, такими, как, например, аргинин, лизин и им подобные. Наоборот, солевые формы могут быть превращены обработкой кислотой в форму свободной кислоты. Термин аддитивная соль также включает гидраты и аддитивные формы, которые способны образовывать соединения формулы (Ia). Примерами таких форм являются, например, гидраты, алкоголяты и им подобные.N-оксидные формы настоящих соединений предназначены для включения соединений формулы (Ia) или (Ib), где один или несколько третичных атомов азота окислены в так называемый N-оксид. Соединения формулы (Ia) могут быть превращены в соответствующие N-оксидные формы в соответствии с известными в данной области процедурами превращения трехвалентного азота в его Nоксидную форму. Указанную реакцию N-окисления можно в целом проводить взаимодействием исходного материала формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота или галогензамещенная бензолкарбопероксикислота,например 3-хлорбензолкарбопероксоевую кислоту, пероксоалканоевые кислоты, например пероксоуксусную кислоту, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например,вода, низшие спирты, например этанол и им подобные, углеводороды, например толуол, кетоны, например 2-бутанон, галогенизированные углеводороды, например дихлорметан, и смеси таких растворителей. Следует понимать, что некоторые из соединений формулы (Ia) и их N-оксиды или аддитивные соли могут содержать один или более центров хиральности и существовать в виде стереохимически изомерных форм. Соединения любой из формул (Ia) и некоторые из промежуточных соединений неизменно имеют по меньшей мере 2 стереогенных центра в своей структуре, которые могут привести по меньшей мере к 4 стереохимически различным структурам. Используемый выше и ниже в настоящем описании термин стереохимически изомерные формы определяет все возможные стереоизомерные формы, которые могут иметь соединения формулы (Ia) и ихN-оксиды, аддитивные соли или физиологически функциональные производные. При отсутствии других упоминаний или указаний, химическое обозначение соединений обозначает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. В частности, стереогенные центры могут иметь R- или Sконфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь или цис-, или транс-конфигурацию. Соединения, охватывающие двойные связи, могут иметь Е(entgegen) или Z (zusammen)-стереохимию у указанной двойной связи. Термины цис, транс, R, S, Е и Z хорошо известны специалисту в данной области. Очевидно, что стереохимически изомерные формы соединений формулы (Ia) предназначены для включения в объем настоящего изобретения. В соответствии с переводом номенклатуры CAS, когда в молекуле присутствуют два стереогенных центра известной абсолютной конфигурации, дескриптор R или S присваивается (на основании правила последовательности Cahn-Ingold-Prelog) хиральному центру с самым низким номером, эталонному цен-3 014423 тру. Конфигурация второго стереогенного центра указывается с использованием относительных дескрипторов [R,R] или [R,S], где R всегда определяется как эталонный центр и [R,R] указывает центры с одинаковой хиральностью, a [R,S] указывает центры различной хиральности. Например, если хиральный центр с самым низким номером в молекуле имеет S конфигурацию, а второй центр представляет собой R, то стереодескриптор определялся бы как S-[R,S]. Если используются и положение заместителя самого высокого приоритета на асимметричном атоме углерода в кольцевой системе, имеющего самый маленький номер, всегда произвольно находится в положении средней плоскости, определяемой кольцевой системой. Положение заместителя самого высокого приоритета на другом асимметричном атоме углерода в кольцевой системе относительно положения заместителя самого высокого приоритета на эталонном атоме обозначается как , если он находится на той же стороне средней плоскости, определяемой кольцевой системой, или , если он находится на другой стороне средней плоскости, определяемой кольцевой системой. Когда указана определенная стереоизометрическая форма, это означает, что указанная форма по существу свободна, т.е. связана менее чем с 50%, предпочтительно менее чем с 20%, предпочтительнее менее чем с 10%, еще предпочтительнее менее чем с 5%, еще предпочтительнее менее чем с 2%, а наиболее предпочтительно менее чем с 1% другого изомера (изомеров). Таким образом, когда соединение формулы (Ia), например, определено как (S,R), это значит, что соединение, по существу, свободно от изомера (R,S). Соединения формулы (Ia) можно синтезировать в форме рацемических смесей энантиомеров, которые могут быть отделены друг от друга в соответствии с процедурами, известными в данной области. Рацемические соединения формулы (Ia) можно превратить в соответствующие диастереомерные солевые формы взаимодействием с подходящей хиральной кислотой. Указанные диастереомерные солевые формы в последующем разделяются, например, селективной или фракционной кристаллизацией, и энантиомеры высвобождаются из них щелочью. Альтернативный путь разделения энантиомерных форм соединений формулы (Ia) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов при условии, что взаимодействие происходит стереоспецифически. Предпочтительно, если желателен определенный стереоизомер, то указанное соединение будет синтезировано стереоспецифическими способами получения. В этих способах будут преимущественно использоваться энантиомерно чистые исходные материалы. Изобретение также включает производные соединения (обычно называемые пролекарствами) фармакологически активных соединений в соответствии с изобретением, которые разрушаются in vivo с выходом соединений в соответствии с изобретением. Пролекарства обычно (но не всегда) имеют более низкую активность у целевых рецепторов, чем соединения, на которые они распадаются. Пролекарства особенно полезны, когда желательное соединение имеет химические или физические свойства, которые делают его введение трудным или неэффективным. Например, желаемое соединение может быть лишь слабо растворимо, оно может плохо переноситься через эпителий слизистых оболочек, или оно может иметь нежелательно короткий период полувыведения из плазмы. Дополнительное обсуждение проблемы пролекарств можно найти в Stella, V. J. et al., "Prodrugs", Drug Delivery Systems, 1985, pp. 112-176, иDrugs, 1985, 29, pp. 455-473. Пролекарственные формы фармакологически активных соединений в соответствии с изобретением будут в целом представлять собой соединения в соответствии с формулой (Ia) и (Ib), их фармацевтически приемлемые кислотно- или основно-аддитивные соли, их стереохимически изомерные формы, их таутомерные формы и их N-оксидные формы, имеющие кислотную группу, которая этерифицирована или амидирована. В такие этерифицированные кислотные группы включены группы формулы -COORx, гдеRx представляет собой C1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы -CONRYRZ, где RY представляет собой Н, C1-6 алкил, фенил или бензил, a RZ представляет собой -ОН, Н, C1-6 алкил, фенил или бензил. Соединения в соответствии с изобретением, имеющие аминогруппу, могут быть дериватизированы кетоном или альдегидом, таким как формальдегид, для образования основания Маннича. Это основание гидролизуется кинетикой первого порядка в водном растворе. При использовании в настоящем описании, термин соединения формулы (Ia) предназначен также для включения их фармацевтически приемлемых кислотно- или основно-аддитивных солей, их Nоксидных форм или их стереохимически изомерных форм. Особый интерес представляют соединения формулы (Ia) или которые являются стереохимически чистыми. Первый предпочтительный вариант осуществления настоящего изобретения относится к соедине-4 014423 ниям формулы (Ia-1) их фармацевтически приемлемым кислотно- или основно-аддитивным солям, их стереохимически изомерным формам или их N-оксидным формам. Второй предпочтительный вариант осуществления настоящего изобретения относится к соединению формулы (Ia-2) их фармацевтически приемлемым кислотно- или основно-аддитивным солям, их стереохимически изомерным формам или их N-оксидным формам. Третий предпочтительный вариант осуществления настоящего изобретения относится к соединению формулы (Ia-3) их фармацевтически приемлемым кислотно- или основно-аддитивным солям, их стереохимически изомерным формам или их N-оксидным формам. Четвертый предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, гдеR1 представляет собой водород, галоген, Ar, Het или алкил; р представляет собой целое число, равное 1, 2, 3 или 4; в частности 1 или 2;R2 представляет собой алкилокси, алкилтио или радикал формулыq представляет собой целое число, равное 1 или 2; каждый R4 и R5 представляет собой независимо водород, алкил или бензил; илиr представляет собой целое число, равное 1;R7 представляет собой водород; алкил представляет собой прямой или разветвленный насыщенный углеводородный радикал,имеющий от 1 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода; или представляет собой циклический насыщенный углеводородный радикал, имеющий от 3 до 6 атомов углерода, присоединенный к прямому или разветвленному насыщенному углеводородному радикалу, имеющему от 1 до 6 атомов углерода, где каждый атом углерода может быть необязательно замещен галогеном или гидрокси;Ar представляет собой гомоцикл, выбранный из группы фенила, нафтила, каждый гомоцикл необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы галогенаHet представляет собой фуранил, пиридинила или бензо[1,3]диоксолила; и галоген представляет собой заместитель, выбранный из группы фтор-, хлор-, бром- и йод-. Пятый предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где R1 представляет собой водород, галоген, Ar, Het или алкил; предпочтительно R1 представляет собой водород, галоген, Ar или Het, в частности R1 представляет собой водород, галоген, фенил фуранил или пиперидинил; предпочтительнее R1 представляет собой галоген или Het; наиболее предпочтительно R1 представляет собой галоген, в частности бром. Шестой предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где р=1; предпочтительно, где р=1, a R1 не представляет собой водород. Седьмой предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где р=1, а указанный заместитель R1 помещен в положение 5, 6 или 7 хинолинового кольца; предпочтительно в положение 6. Восьмой предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где R2 представляет собой алкилокси или алкилтио, или радикал формулы предпочтительно R2 представляет собой алкилокси или алкилтио; еще более предпочтительнее алкилокси, в частности С 1-4 алкилокси; наиболее предпочтительно R2 представляет собой метилокси. Девятый предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где R3 представляет собой Ar, Het, Ar-алкил, Het-алкил или алкил, каждый необязательно замещенный 1 или 2 заместителями, причем этот заместитель предпочтительно представляет собой галоген, алкил, галогеналкил или алкилокси, в частности R3 представляет собой С 1-4 алкил, нафтил, фенил,необязательно замещенный алкилом или алкилокси, пиридинилом, бензо[1,3]диоксолилом, -СН 2-(СН 2)nR3a где R3a представляет собой циклогексил, фенил, нафтил или фуранил, причем R3a необязательно замещен алкилом, и где n=0 или 1; предпочтительно R3 представляет собой Ar, Het или Ar-алкил, каждый необязательно замещенный 1 или 2 заместителями, причем этот заместитель предпочтительно представляет собой галоген, галогеналкил или алкилокси, предпочтительно представляет собой галоген или алкилокси, наиболее предпочтительно представляет собой галоген; предпочтительно R3 представляет собойAr или Het, каждый необязательно замещенный 1 или 2 заместителями, выбранными из галогена или алкилокси; предпочтительнее R3 представляет собой нафтил, фенил или Het; еще предпочтительнее R3 представляет собой нафтил, фенил, пиридинил или бензо[1,3]диоксолил; наиболее предпочтительно R3 представляет собой нафтил, в частности 1-нафтил или 2-нафтил, или фенил. Другой предпочтительный вариант осуществления представляет собой вариант, когда R3 представляет Ar-алкил, необязательно замещенный галогеном, алкилом, галогеналкилом или алкилокси. Десятый предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где каждый R4 и R3 представляют собой независимо водород, алкил или бензил; предпочтительно водород или алкил, в частности водород или С 1-4 алкил; предпочтительнее С 1-4 алкил; наиболее предпочтительно метил. Одиннадцатый предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где R4 и R5, взятые вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролидинила, пиперидинила, пиперазинила и морфолинила,необязательно замещенного алкилом или моно- или диалкиламино; предпочтительно R4 и R5, взятые вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролидинила, пиперидинила, пиперазинила или морфолинила, необязательно замещенного алкилом или моно- или диалкиламино. Двенадцатый предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где R6 представляет собой водород, галоген, алкилокси, алкил или фенил, необязательно замещенный алкилокси; предпочтительно R6 представляет собой водород, алкил, алкилокси или галоген; предпочтительнее R6 представляет собой водород или галоген; наиболее предпочтительно R6 представляет собой водород.-6 014423 Тринадцатый предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где r=1 или 2; предпочтительно r=1. Четырнадцатый предпочтительный вариант осуществления относится к соединению формулы (Ia) или к любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, где применимо одно или более, предпочтительно все из следующих определений:R1 представляет собой водород, галоген, С 1-4 алкил, фенил, фуранил или пиперидинил; предпочтительно R1 представляет собой галоген или Het, в частности бром- или фуранил;R2 представляет собой алкилокси или алкилтио, в частности, С 1-4 алкилокси или С 1-4 алкилтио;R3 представляет собой алкил, Ar, Het, Ar-алкил или Het-алкил; в частности С 1-4 алкил, нафтил, фенил, необязательно замещенный алкилом или алкилокси, пиридинилом, бензо[1,3]диоксолилом, -СН 2(СН 2)n-R3a, где R3a представляет собой циклогексил, фенил, нафтил или фуранил, причем R3a необязательно замещен алкилом, и где n=0 или 1;q=1, 2 или 3; в частности 1 или 2; каждый из R4 и R5 представляет собой независимо водород, алкил или бензил, в частности, водород или С 1-4 алкил; илиR4 и R5, взятые вместе с атомом N, к которому они присоединены, образуют радикал, выбранный из группы пирролидинила, пиперидинила, пиперазинила или морфолинила, необязательно замещенного алкилом, амино или моно- или ди(алкил)амино;R6 представляет собой водород, галоген, алкилокси, алкил или фенил; предпочтительно водород или галоген; предпочтительнее водород;R7 представляет собой водород. Пятнадцатый предпочтительный вариант осуществления представляет собой применение соединений формулы (Ia) или любой его подгруппы, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, для изготовления лекарственного средства для лечения инфекции грамположительной и/или грамотрицательной бактерией. Шестнадцатый предпочтительный вариант осуществления представляет собой применение соединений формулы (Ia) или любой его подгруппы, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, для изготовления лекарственного средства для лечения инфекции грамположительной бактерией. Семнадцатый предпочтительный вариант осуществления представляет собой применение соединений формулы (Ia) или любой его подгруппы, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, для изготовления лекарственного средства для лечения инфекции грамотрицательной бактерией. Восемнадцатый предпочтительный вариант осуществления представляет собой применение соединений формулы (Ia) или любой его подгруппы, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, для изготовления лекарственного средства для лечения бактериальной инфекции, где соединение формулы (Ia) имеет IC9015 мкл/мл против по меньшей мере одной бактерии, в частности грамположительной бактерии, предпочтительно IC9010 мкл/мл, предпочтительнееIC905 мкл/мл; причем величина IC90 определяется, как описано ниже в настоящем описании. Предпочтительно в соединениях формулы (Ia) или в любой их подгруппе, как указано ранее в настоящем описании в качестве предпочтительного варианта осуществления, термин алкил представляет С 1-6 алкил, предпочтительнее С 1-4 алкил. Предпочтительные соединения выбраны из следующих: их фармацевтически приемлемой кислотно- или основно-аддитивной соли, их стереохимически изомерной формы или их N-оксидной формы. Особенно предпочтительными соединениями являются соединения 17, 24, 25, 23, 20, 22, 18, 21, 19,44, 50, 48, 47, 51, 163, 164, 70, 107, 103, 53, 159, 75, 74, 173, 158, 72, 82 и 83, особенно, соединения 163,-8 014423 164, 70, 107, 103, 53, 159, 75, 74, 173, 158, 72, 82 и 83 (см. таблицы ниже в настоящем описании), их фармацевтически приемлемая кислотно- или основно-аддитивная соль, их стереохимически изомерная форма или их N-оксидная форма. Настоящее изобретение также относится к любому соединению из представленных ниже в настоящем описании табл. 1-8. Настоящее изобретение также относится к соединению, выбранному из их фармацевтически приемлемой кислотно- или основно-аддитивной соли, их стереохимически изомерной формы или их N-оксидной формы. Особенно предпочтительными соединениями являются соединения 17, 24, 25, 23, 20, 22, 18, 21, 19,44, 50, 48, 47, 51, 163, 164, 70, 107, 103, 53, 159, 75, 74, 173, 158, 72, 82 и 83, особенно, соединения 163,164, 70, 107, 103, 53, 159, 75, 74, 173, 158, 72, 82 и 83 (см. таблицы ниже в настоящем описании), их фармацевтически приемлемая кислотно- или основно-аддитивная соль, их стереохимически изомерная форма или их N-оксидная форма. Настоящее изобретение также относится к любому соединению из представленных ниже в настоящем описании табл. 1-8. Настоящее изобретение также относится к соединению, выбранному из их фармацевтически приемлемой кислотно- или основно-аддитивной соли, их стереохимически изомерной форме, их таутомерной форме или их N-оксидной форме. В частности, настоящее изобретение также относится к соединению, выбранному из его фармацевтически приемлемой кислотно- или основно-изомерной форме, его таутомерной форме или его N-оксидной форме. Настоящее изобретение также относится к соединению, выбранному из его фармацевтически приемлемой кислотно- или основно-изомерной форме, его таутомерной форме или его N-оксидной форме. Предпочтительно соединение формулы (Ia) или (Ib) представляет собой определенный диастереоизомер (по существу свободный от другого диастереоизомера (диастереоизомеров. В случае, когда соединение формулы (Ia) или (Ib) имеет два хиральных центра, это означает, что соединение представляет собой рацемическую смесь (R,S) и (S,R) энантиомеров или рацемическую смесь (R,R) и (S,S) энантиомера. Далее в настоящем описании рацемически смеси 2 энантиомеров указаны как диастереоизомер А или В. То, указана ли рацемическая смесь как А или В, зависит от того, выделена ли она первой в протоколе синтеза (т.е. А) или второй (т.е. В). Предпочтительнее соединение формулы (Ia) или (Ib) представляет собой определенный энантиомер (по существу, свободный от других энантиомеров). В случае, когда соединение формулы (Ia) или (Ib) имеет два хиральных центра, это означает, что соединение представляет собой (R,S), (S,R), (R,R) или (S,S) энантиомер. Далее в настоящем описании энантиомеры указаны как А 1, А 2, В 1 или В 2. То, указан ли энантиомер как А 1, А 2, В 1 или В 2, зависит от того, выделен ли он первым или вторым в протоколе синтеза. Соединения формулы (Ia) или (Ib) можно получить в соответствии со способами, описанными в WO 2004/011436, который включен в настоящее описание в качестве ссылки. В целом, соединения в соответствии с изобретением можно получить последовательностью стадий, каждая из которых известна специалисту в данной области. В частности, соединения формулы (Ia) можно получить взаимодействием промежуточного соеди- 12014423 нения формулы (II) с промежуточным соединением формулы (III) в соответствии со следующей схемой реакции (Ia) с использованием n-BuLi в присутствии подходящего растворителя, такого как, например, тетрагидрофуран, и подходящего основания, такого как, например, диизопропиламин, где все переменные величины определены как в формуле (Ia) . Перемешивание может увеличить скорость реакции. Реакцию можно подходяще проводить при температуре в интервале от -20 до -70 С. Такую же процедуру взаимодействия можно использовать для синтеза промежуточных соединений формулы (I-b). Соединения формулы (Ia) можно также получить в соответствии со следующей схемой реакции Ib где все переменные величины такие, как определено выше в настоящем описании. На схеме lb промежуточное соединение формулы (IV), где q=0, 1 или 2, взаимодействует с первичным или вторичным амином HNR4R5 в присутствии подходящего катализатора, такого как, например, Rh(cod)2BF4, необязательно, в присутствии второго катализатора (для восстановления), такого как, например, Ir(cod)2BF4, в присутствии подходящего лиганда, такого как, например, Xantphos, в подходящем растворителе, таком как, например, тетрагидрофуран, и спирта, например метанола, в присутствии СО и Н 2 (под давлением) при повышенной температуре. Эта реакция предпочтительно проводится для промежуточных соединений формулы (IV), где q=1. Соединения формулы (Ia) можно также получить в соответствии со следующей схемой реакции 1 с где все переменные величины такие, как определено выше в настоящем описании. На схеме 1 с,промежуточное соединение формулы (V), где W2 представляет подходящую уходящую группу, такую как, например, галоген, например хлор- или бром-, взаимодействует с подходящим первичным или вторичным амином HNR4R5. Такую же процедуру взаимодействия можно использовать для синтеза промежуточных соединений формулы (I-b). Исходные материалы и промежуточные соединения формулы (II) и (III) представляют собой соединения, которые или имеются в продаже, или могут быть получены в соответствии с обычными процедурами взаимодействия, общеизвестными в данной области. Например, промежуточные соединения формул от (II-а) до (II-d) можно получить в соответствии со следующей схемой реакции (2): где все переменные величины определены как в формуле (Ia). Схема реакции (2) включает стадию(а), на которой соответствующим образом замещенный анилин взаимодействует с соответствующим ацилхлоридом, таким как 3-фенилпропионилхлорид, 3-фторбензолпропионилхлорид или пхлорбензолпропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего реакционно-инертного растворителя, такого как метиленхлорид или этиленхлорид. Реакцию можно подходящим образом проводить при температуре в интервале от комнатной температуры до температуры дефлегмации. На следующей стадии (b) аддукт, полученный на стадии (а), взаимодействует с фосфорилхлоридом. (POCl3) в присутствии N,N-диметилформамида (формилирование Vilsmeier-Haask с последующей циклизацией) Реакцию можно подходящим образом проводить при температуре в интервале от комнатной температуры до температуры дефлегмации. На следующей стадии (с-1), определенная R2-группа, где R2 представляет собой, например C1-6 алкилокси радикал вводится взаимодействием промежуточного соединения, полученного на стадии (b) с OC1-6 алкилом в присутствии подходящего растворителя, такого как, например, НО-С 1-6 алкил. Промежуточное соединение, полученное на стадии (b), может быть также превращено в промежуточное соединение, где R2 представляет собой, например, радикал C1-6 алкилтио взаимодействием с S=C(NH2)2 в присутствии подходящего растворителя, такого как, например, спирт, например этанол (стадия (с-2 с последующим взаимодействием с С 1-6 алкил-1 в присутствии подходящего основания, такого как K2CO3, и подходящего растворителя, такого как, например, 2-пропанон. Промежуточное соединение, полученное на стадии (b), может также быть превращено в промежуточное соединение, где R2 представляет собойN(R2a) (алкил), где R2a представляет собой водород или алкил, взаимодействием с подходящей сольюNH(R2a) (алкила) в присутствии подходящего основания, такого как, например, карбонат калия, и подходящего растворителя, такого как, например, ацетонитрил (стадия (с-3. Промежуточное соединение, полученное на стадии (b), может также быть превращено в промежуточное соединение, где R2 представляет собой алкилоксиалкилокси, необязательно замещенный алкилокси, причем указанный R2 представленR2b, взаимодействием с алкилоксиалкилом, необязательно замещенным алкилокси, в присутствии NaH и подходящего растворителя, такого как, например, тетрагидрофуран (стадия (с-4. Промежуточные соединения в соответствии с формулой (II-е) можно получить в соответствии со следующей схемой взаимодействия (3), где на первой стадии (а) замещенный индол-2,3-дион взаимодействует с замещенным 3-фенилпропиональдегидом в присутствии подходящего основания, такого как гидроксид натрия (реакция Pfitzinger) , после чего соединение карбоновой кислоты на следующей стадии(b) декарбоксилируется при высокой температуре в присутствии подходящего реакционно-инертного растворителя, такого как дифенилэфир. Очевидно, что в представленных выше и следующих реакциях продукты реакций могут быть выделены из реакционной среды, и при необходимости, кроме того, очищены в соответствии с методологией,в целом известной в данной области, такой как экстракция, кристаллизация и хроматография. Кроме того, очевидно, что продукты реакции, которые существуют в более чем одной энантиомерной форме,можно выделить из их смеси известными методиками, в частности препаративной хроматографией, такой как препаративная ВЭЖХ, хиральная хроматография. Отдельные диастереоизомеры или отдельные энантиомеры можно также получить сверхкритической жидкостной хроматографией (SFC). Промежуточные соединения формулы (III) представляют собой соединения, которые или имеются в продаже, или могут быть получены в соответствии с обычными процедурами взаимодействия, общеизвестными в данной области. Например, промежуточные соединения формулы (III) можно получить в соответствии со следующей схемой взаимодействия (4) Схема взаимодействия (4) включает стадию (а), на которой R3, например соответствующим образом замещенный Ar, в частности соответствующим образом замещенный фенил или нафтил, взаимодействует путем реакции Friedel-Craft с соответствующим ацилхлоридом, таким как 5-хлорвалерилхлорид, или 4-хлорбутирилхлорид, в присутствии подходящей кислоты Lewis, такой как, например, AlCl3, FeCl3,SnCl4, TiCl4 или ZnCl2, и подходящего реакционно-инертного растворителя, такого как метиленхлорид или этиленхлорид. Взаимодействие можно подходяще проводить при температуре в интервале от комнатной температуры до температуры дефлегмации. На следующей стадии (b) аминогруппа (-NR4R5) вводится взаимодействием промежуточного соединения, полученного на стадии (а), с первичным или вторичным амином HNR4R5, в присутствии подходящего растворителя, такого как, например, ацетонитрил,и подходящего основания, такого как, например K2CO3. Промежуточные соединения формулы (III) можно получить в соответствии со следующей схемой взаимодействия (5): Схема взаимодействия (5) включает стадию (а), на которой R3-С(=O)-Н, например, соответствующий замещенный Ar карбоксальдегид, конкретнее, соответствующим образом замещенный фенил или нафтилкарбоксальдегид, взаимодействует с соответствующим промежуточным соединением формулы(IV), таким как, например, 1-бром-4-хлорбутан, в присутствии реагента Григнарда и подходящего рас- 15014423 творителя, такого как, например, простой диэтиловый эфир, тетрагидрофуран. Реакцию можно подходяще проводить при низкой температуре, например 5 С. На следующей стадии (b) окисление выполняется в присутствии реагента Джонса в подходящем растворителе, таком как, например, ацетон. На следующей стадии (с) аминогруппа (-NR4R5) вводится взаимодействием промежуточного соединения, полученного на стадии (b), с первичным или вторичным амином NR4R5 в присутствии подходящего растворителя,такого как, например, ацетонитрил, и подходящего основания, такого как, например, K2CO3. Промежуточные соединения формулы (III) можно получить в соответствии со следующей схемой взаимодействия (6): Схема взаимодействия (6) включает стадию (а), на которой, например, подходящая кислота взаимодействует с NH(CH3) (OCH3) в присутствии 1,1'-карбонилдиимидазола и подходящего растворителя, такого как, например, CH2Cl2. На следующей стадии (b) продукт, полученный на стадии (а), взаимодействует с подходящими реагентами Григнарда, например 4-хлорбутилмагнийбромидом в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. На следующей стадии (с) аминогруппа(-NR4R5) вводится взаимодействием промежуточного соединения, полученного на стадии (b), с первичным или вторичным амином HNR4R5 в присутствии подходящего растворителя, такого как, например,ацетонитрил, и подходящего основания, такого как, например, K2CO3. Промежуточные соединения формулы (IV) могут быть получены в соответствии со следующей схемой реакции 7: Схема взаимодействия 7 включает стадию взаимодействия соответствующим образом замещенного хинолина, где W1 представляет подходящую уходящую группу, такую как, например, галоген, например бром, с соответствующим образом замещенным дезоксибензоином в присутствии подходящего катализатора, такого как, например, диацетат палладия, подходящего глянцевателя, такого как, например, XPHOS, подходящего основания, такого как, например, карбонат цезия, подходящего растворителя, такого как, например, ксилол, в потоке N2. На следующей стадии (b) продукт, полученный на стадии (а), взаимодействует с подходящими реагентами Григнарда (например, СН 2=СН-СН-(СН 2)q-Mg-Br, таким как,например, аллилмагнийбромид), в подходящем растворителе, таком как, например, тетрагидрофуран. Промежуточные соединения формулы (V) могут быть получены в соответствии со следующей схемой реакции 8: В схеме взаимодействия 8 промежуточное соединение формулы (II) взаимодействует с промежуточным соединением формулы (VI) (его синтез показан на схемах 4, 5 и 6) в присутствии n-BuLi в подходящем растворителе, таком как, например, тетрагидрофуран, и подходящего основания, такого как,например, диизопропиламин. Перемешивание может увеличить скорость взаимодействия. Взаимодействие можно подходяще проводить при температуре в интервале от -20 до -70 С. Настоящее изобретение также относится к соединению формулы (V) где W2 представляет подходящую уходящую группу, такую как, например, галоген, например,бром- или хлор-, и R1, R2, R3, R6, R7, q, р и r имеют значения, определенные для соединений формулы (Ia). Альтернативно, настоящее изобретение также относится к соединению формулы (VII) где W2 представляет подходящую уходящую группу, такую как, например, галоген, например,бром- или хлор-, и R1, R2, R3, R6, R7, R8, R9, q, р и r имеют значения, определенные для соединений формулы (Ib). Соединения формулы (Ia) и (Ib) могут быть также превращены друг в друга в соответствии с известными в данной области реакциями трансформации функциональных групп, включающими те, которые описаны ниже в настоящем описании. Например, соединения формулы (Ia) и (Ib), где R1 представляет собой галоген, в частности бром-,могут быть превращены в соединения формулы (Ia) и (Ib), где R1 представляет собой водород, взаимодействием с HCOONH4 в присутствии подходящего катализатора, такого как, например, палладий или уголь, и в присутствии подходящего растворителя, такого как, например, спирт, например метанол. Соединения формулы (Ia) и (Ib), где R1 или R6 представляет собой галоген, в частности бром-, могут быть превращены в соединение формулы (Ia) и (Ib), где R1 или R6 представляет собой Ar или Het, взаимодействием с Ar-В(ОН)2, соответственно, Het-В(ОН)2, в присутствии Pd(PPh3)4 или Pd(PPh3)4Cl2, подходящего основания, такого как, например K2CO3 или Na2CO3, и подходящего растворителя, такого как,например, 1,2-диметоксиэтан или спирт, например, метанол. Соединения формулы (Ia) и (Ib), где R1 представляет собой галоген, в частности бром, могут быть также превращены в соединение формулы (Ia) и (Ib), где R1 представляет собой Het, взаимодействием с в присутствии Pd(PPh3)4, подходящего основания, такого как, например, K2CO3, и подходящего растворителя, такого как, например, 1,2-диметоксиэтан или спирт, например метанол. Соединения формулы (Ia) и (Ib), где R1 представляет собой галоген, в частности бром-, могут быть также превращены в промежуточное соединение, где R1 представляет собой формил, взаимодействием сN,N-диметилформамидом в присутствии n-BuLi и подходящего растворителя, такого как, например, тет- 17014423 рагидрофуран. Эти промежуточные соединения могут затем превращаться в соединение формулы (Ia) и(Ib), где R1 представляет собой -СН 2-ОН, взаимодействием с подходящим восстанавливающим агентом,таким как, например, NaBH4, и в присутствии подходящего растворителя, такого как, например, спирт,например метанол и тетрагидрофуран. Соединения формулы (Ia) и (Ib), где R4 представляет собой бензил, могут быть превращены в соединение формулы (Ia) и (Ib), где R4 представляет собой водород, взаимодействием с 1 хлорэтилхлорформиатом в подходящем растворителе, таком как, например, 1,2-дихлорэтан. В целом, бактериальные патогены могут классифицироваться или как грамположительные или как грамотрицательные патогены. Антибиотические соединения с активностью против как грамположительных, так и грамотрицательных патогенов в целом рассматриваются как имеющие широкий спектр активности. Соединения по настоящему изобретению рассматриваются как активные против грамположительных и/или грамотрицательных бактериальных патогенов. В частности, настоящие соединения активны против по меньшей мере одной грамположительной бактерии, предпочтительно против нескольких грамположительных бактерий, предпочтительнее против одной или нескольких грамположительных бактерий и/или одной или нескольких грамотрицательных бактерий. Настоящие соединения имеют бактерицидную или бактериостатическую активность. Примеры грамположительных и грамотрицательных аэробных и анаэробных бактерий включаютaeruginosa; и Escherichia, например Е. coli. Грамположительные патогены, например стафилококки, энтерококки и стрептококки, особенно важны ввиду развития устойчивых штаммов, инфекции которыми и трудно лечить, и которые трудно искоренить, например из больничной среды после их обоснования. Примерами таких штаммов являются устойчивый к метициллину Staphylococcus aureus (MRSA), устойчивые к метициллину коагулазо-отрицательные стафилококки (MRCNS), устойчивый к пенициллинуStaphylococcus pneumoniae и множественно устойчивый Enterococcus faecium. Соединения по настоящему изобретению также проявляют активность против устойчивых бактериальных штаммов. Соединения по настоящему изобретению особенно активны против Streptococcus pneumoniae и/илиStaphylococcus aureus, включая устойчивый Staphylococcus aureus, такой как, например, устойчивый к метициллину Staphylococcus aureus (MRSA), особенно, против Staphylococcus aureus, включая устойчивый Staphylococcus aureus. Настоящие соединения имеют особенно высокую активность против SPN 6305 (Streptococcus pneumoniae (АТСС 6305 и/или SPN 29213 (Staphylococcus aureus (АТСС 29213. В частности, соединения по настоящему изобретению активны в отношении тех бактерий, жизнеспособность которых зависит от должного функционирования FIF0 АТФ-синтазы. Без связи с какойлибо теорией, считается, что активность настоящих соединений заключается в ингибировании FIFO АТФ-синтазы. В частности, ингибировании комплекса F0 FIFO АТФ-синтазы, конкретнее, в ингибировании субъединицы С комплекса F0 FIF0 АТФ-синтазы, ведущем к уничтожению бактерий истощением содержания клеточного АТФ бактерии. При использовании в настоящем описании выше и ниже указания, что соединения могут лечить бактериальную инфекцию, означает, что соединения могут лечить инфекцию одним или несколькими бактериальными штаммами. При использовании в настоящем описании выше и ниже указания, что бактериальная инфекция отлична от микобактериальной инфекции, это означает, что бактериальная инфекция отличается от инфекции одним или несколькими штаммами Mycobacteria. Точная дозировка и частота введения соединений по настоящему изобретению зависит от конкретного используемого соединения формулы (Ia) или (Ib), конкретного состояния, тяжести состояния, возраста, массы тела, пола, рациона, времени введения и общего физического состояния конкретного пациента, подвергаемого лечению, способа введения, а также других медикаментозных средств, которые может принимать индивидуум, как хорошо известно специалисту в данной области техники. Кроме того,очевидно, что эффективное суточное количество может снижаться или увеличиваться, в зависимости от реакции подвергаемого лечению субъекта и/или в зависимости от оценки врача, назначающего соединения по настоящему изобретению. Соединения по настоящему изобретению можно вводить в фармацевтически приемлемой форме,необязательно, в фармацевтически приемлемом носителе. Соединения и композиции, включающие эти соединения, можно вводить местно, локально или системно. Системное применение включает любой способ введения соединения в ткани организма, например подоболочечное, эпидуральное, внутримышечное, трансдермальное, внутривенное, внутрибрюшинное, подкожное, сублингвальное, ректальное и пероральное введение. При необходимости, можно подобрать конкретную дозировку подлежащего введению антибактериального средства, а также длительность лечения. Бактериальные инфекции, которые можно лечить соединениями по настоящему изобретению,включают, например, инфекции центральной нервной системы, инфекции наружного уха, инфекции- 18014423 среднего уха, такие как острый средний отит, инфекции центральных пазух, глазные инфекции, инфекции ротовой полости, такие как инфекции зубов, десен и слизистой оболочки, инфекции верхних дыхательных путей, инфекции нижних дыхательных путей, инфекции мочеполовых путей, желудочнокишечные инфекции, гинекологические инфекции, септицемию, инфекции костей и суставов, инфекций кожи и кожных структур, бактериальный эндокардит, ожоги, антибактериальную профилактику при операциях и антибактериальную профилактику у пациентов с угнетенным иммунитетом, таких как пациенты, получающие противораковую химиотерапию, или пациентов после трансплантации органов. Учитывая то обстоятельство, что соединения формулы (Ia) или (Ib) активны против бактериальных инфекций, соединения по настоящему соединению могут комбинироваться с другими антибактериальными средствами для эффективной борьбы с бактериальной инфекцией. Поэтому настоящее изобретение также относится к комбинации (а) соединения формулы (Ia) или(Ib) и (b) одного или нескольких других антибактериальных средств, при условии, что одно или несколько других антибактериальных средств отличаются от антимикобактериальных средств. Настоящее изобретение также относится к комбинации (а) соединения формулы (Ia) или (Ib) и (b) одного или нескольких других антибактериальных средств при условии, что одно или несколько других антибактериальных средств отличаются от антимикобактериальных средств, для применения в качестве лекарственного препарата. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество (а) соединения формулы (Ia) или (Ib) и(b) одного или нескольких других антибактериальных средств при условии, что одно или несколько других антибактериальных средств отличаются от антимикобактериальных средств, также охватывается настоящим изобретением. Настоящее изобретение также относится к применению комбинации или фармацевтической композиции, как определено выше, для лечения бактериальной инфекции. Фармацевтическая композиция по настоящему изобретению может иметь различные фармацевтические формы в зависимости от пути введения. В качестве соответствующих композиций можно привести все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению эффективное количество конкретных соединений, необязательно в форме кислотно-аддитивной соли, в качестве активного ингредиента комбинируется в тщательной смеси с фармацевтически приемлемым носителем, причем носитель может принимать широкое разнообразие форм, в зависимости от желаемой для введения формы препарата. Эти фармацевтические композиции желательны в стандартных лекарственных формах, подходящих, в частности, для введения перорально или парентеральной инъекцией. Например, при получении композиции в пероральной лекарственной форме, можно использовать любую из обычных фармацевтических сред,таких как, например, вода, гликоли, масла, спирты и им подобные, в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазывающие агенты, связывающие агенты, разрыхляющие агенты и им подобные, в случае порошков, пилюль, капсул и таблеток. Таблетки и капсулы, ввиду легкости их введения, представляют наиболее преимущественные пероральные стандартные лекарственные формы, и в этом случае, очевидно используются твердые фармацевтические носители. Для парентеральных композиций, носитель будет обычно включать стерильную воду, по меньшей мере, в большой части,хотя могут быть включены другие ингредиенты, например, для содействия растворимости. Например,можно получить инъецируемые растворы, в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Можно также получить инъецируемые суспензии, и в этом случае можно использовать соответствующие жидкие носители, суспендирующие агенты и им подобные. Включены также твердые формы препаратов, которые предназначены для превращения незадолго до применения в жидкие формы препаратов. В зависимости от способа введения фармацевтическая композиция будет предпочтительно включать от 0,05 до 99 мас.%, предпочтительнее от 0,1 до 70 мас.% активных ингредиентов и от 1 до 99,95 мас.%, предпочтительнее от 30 до 99,9 мас.% фармацевтически приемлемого носителя, причем все процентные доли основаны на общей массе композиции. Специалист в данной области может определить отношение между массами соединения формулы(Ia) или (Ib) и (b) другим антибактериальным средством (средствами) при представлении в виде комбинации. Указанное соотношение и точная дозировка и частота введения зависит от конкретного соединения формулы (Ia) или (Ib) и другого используемого антибактериального средства (средств), конкретного подвергаемого лечению состояния, тяжести подвергаемого лечению состояния, возраста, массы, пола,рациона, времени введения и общего физического состояния конкретного пациента, способа введения, а также другого медикаментозного средства, которое может принимать индивидуум, как хорошо известно специалистам в данной области. Кроме того, очевидно, что эффективное суточное количество можно снижать или увеличивать, в зависимости от реакции подвергаемого лечению субъекта, и/или в зависимости от оценки врача, назначающего соединения по настоящему изобретению. Соединения формулы (Ia) или (Ib) и одного или нескольких других антибактериальных средств- 19014423 можно комбинировать в одном препарате, или их можно составлять в отдельные препараты с тем, чтобы их можно было вводить одновременно, отдельно или последовательно. Таким образом, настоящее изобретение также относится к продукту, содержащему (а) соединение формулы (Ia) или (Ib) и (b) одно или несколько других антибактериальных средств, при условии, что это одно или несколько других антибактериальных средств отличаются от антимикобактериальных средств, в качестве комбинированного препарата для одновременного, отдельного или последовательного применения при лечении бактериальной инфекции. Фармацевтическая композиция может дополнительно содержать различные другие ингредиенты,известные в данной области, например смазывающее вещество, стабилизирующий агент, забуферивающий агент, эмульгирующий агент, агент, регулирующий вязкость, поверхностно-активное вещество,консервант, ароматизирующий агент или красящий агент. Особенно предпочтительно составлять указанные выше фармацевтические композиции в стандартную лекарственную форму для легкости введения и однородности дозировки. Используемая в настоящем изобретении стандартная лекарственная форма относится к физически дискретным единицам, подходящим в качестве унитарных дозировок, причем каждая единица содержит заданное количество активного ингредиента, рассчитанное для получения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с бороздками или покрытием), капсулы, пилюли, пакетики порошка, вафли,суппозитории, и их отдельные, множественные формы. Суточная дозировка соединения в соответствии с изобретением будет конечно варьироваться в зависимости от используемого соединения, способа введения, желаемого лечения и указанного бактериального заболевания. Другие антибактериальные средства, которые можно комбинировать с соединениями формулы (I),представляют собой антибактериальные средства, известные в данной области. Другие антибактериальные средства включают антибиотики -лактамовой группы, такие как натуральные пенициллины, полусинтетические пенициллины, натуральные цефалоспорины, полусинтетические цефалоспорины, цефамицины, 1-оксацефемы, клавулиновые кислоты, пенемы, карбапенемы, нокардицины, монобактамы; тетрациклины, антигидротетрациклины, антрациклины; аминогликозиды; нуклеозиды, такие как N-нуклеозиды, С-нуклеозиды,карбоциклические нуклеозиды, бластицидин S; макролиды, такие как 12-членные кольцевые макролиды, 14-членные кольцевые макролиды, 16-членные кольцевые макролиды; ансамицины; пептиды,такие как блеомицины, грамицидины, полимиксины, бацитрацины, крупнокольцевые пептидные антибиотики, содержащие лактонные связи, актиномицины, амфомицин, капреомицин, дистамицин, эндурацидины, микамицин, неокарзиностатин, стендомицин, биомицин, виргиниамицин; циклогексимид; циклосерин; вариотин; саркомицин А; новобиоцин; гризеофульвин; хлорамфеникол; митомицины; фумагиллин; моненсины; пирролнитрин; фосфомицин; фузидовую кислоту, D-(п-гидроксифенил)глицин; Dфенилглицин; энедиины. Определенные антибиотики, которые могут комбинироваться с настоящими соединениями формулы (Ia) или (Ib) представляют собой, например, бензилпенициллин (калий, прокаин, бензатин), феноксиметилпенициллин (калий), фенетициллин калий, пропициллин, карбенициллин (динатрий, фенилнатрий,инданилнатрий), сулбенциллин, тикарциллин динатрий, метициллин натрий, оксациллин натрий, клоксациллин натрий, диклоксациллин, флуклоксациллин, ампициллин, мезлоциллин, пиперациллин натрий,амоксициллин, циклациллин, гектациллин, сулбактам натрий, талампициллин гидрохлорид, бакампициллин гидрохлорид, пивмециллинам, цефалексин, цефаклор, цефалоглицин, цефадроксил, цефрадин,цефроксадин, цефапирин натрий, цефалотин натрий, цефацетрил натрий, цефсулодин натрий, цефалоридин, цефатризин, цефоперазон натрий, цефамандол, вефотиам гидрохлорид, цефазолин натрий, цефтизоксим натрий, цефотаксим натрий, цефменоксим гидрохлорид, цефуроксим, цефриаксон натрий, цефтазидим, цефокситин, цефметазол, цефотетан, латамоксеф, клавулиновую кислоту, имипенем, азтреонам,тетрациклин, хлортетрациклин гидрохлорид, диметилхлортетрациклин, окситетрациклин, метациклин,доксициклин, ролитетрациклин, миноциклин, даунорубицин гидрохлорид, доксорубицин, акларубицин,канамицин сульфат, беканамицин, тобрамицин, гентамицин сульфат, дибекацин, амикацин, микрономицин, рибостамицин, неомицин сульфат, паромомицин сульфат, стрептомицин сульфат, дигидрострептомицин, дестомицин А, гигромицин В, апрамицин, сисомицин, нетилмицин сульфат, спектиномицин гидрохлорид, астромицин сульфат, валидамицин, касугамицин, полиоксин, бластицидин S, эритромицин,эритромицин эстолат, олеандомицин фосфат, трацетилолеандомицин, китасамицин, джозамицин, спирамицин, тилосин, ивермектин, мидекамицин, блеомицин сульфат, пепломицин сульфат, грамицидин S,полимиксин В, бацитрацин, колистин сульфат, колистинметансульфонат натрия, энрамицин, микамицин,виргиниамицин, капреомицин сульфат, биомицин, энвиомицин, ванкомицин, актиномицин D, неокарзиностатин, бестатин, пепстатин, моненсин, ласалоцид, салиномицин, амфотерицин В, нистатин, натамицин, трихомицин, митрамицин, линкомицин, клиндамицин, клиндамицин пальмитат гидрохлорид, флавофосфолипол, циклосерин, пекилоцин, гризеофульвин, хлорамфеникол, хлорамфеникол пальмитат, митомицин С, пирролнитрин, фосфомицин, фузидовую кислоту, бикозамицин, тиамулин, сикканин.- 20014423 Экспериментальная часть Абсолютная стереохимическая конфигурация содержащегося в них стереогенного атома (атомов) углерода некоторых соединений не была экспериментально определена. В этих случаях стереохимически изомерная форма, которая была сначала выделена, обозначена как А, а вторая - как В, без дальнейшей ссылки на действительную стереохимическую конфигурацию. Однако указанные изомерные формы А и В могут быть однозначно охарактеризованы специалистом в данной области с использованием известных в данной области способов, таких как, например, дифракция рентгеновского излучения. В случае, когда А и В представляют собой стереоизомерные смеси, их можно дополнительно разделить, посредством чего соответствующие первые выделенные фракции обозначаются соответственно как А 1 и В 1, а вторые соответственно как А 2 и В 2, без дальнейшей ссылки на действительную стереохимическую конфигурацию. Однако указанные изомерные формы А 1, А 2 и В 1, В 2 могут быть однозначно охарактеризованы специалистом в данной области с использованием известных в данной области способов, таких как, например, дифракция рентгеновского излучения. Далее в настоящем описании "THF" обозначает тетрагидрофуран, "DIPE" обозначает простой диизопропиловый эфир, "DME" обозначает 1,2-диметоксиэтан, "DMF" обозначает N,N-диметилформамид,"CDI" обозначает 1,1'-карбонилбис-1 Н-имидазол. А. Получение промежуточных соединений Пример А 1 А. а) Получение промежуточного соединения 1 К перемешанному раствору реагента Григнарда при 5 С, полученного в результате превращенийMg (0,14 моль) и 1-бром-4-хлорбутана (0,14 моль) в простом диэтиловом эфире (150 мл), добавляют по каплям раствор 2-нафтилкарбоксальдегида (0,0935 моль) в THF (150 мл). После перемешивания смеси в течение 4 ч при 5 С медленно добавляют раствор хлорида аммония (10% водный). Органический слой отделяют, промывают рассолом, сушат над сульфатом магния, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией через силикагель (элюент: циклогексан/EtOAc : 99/10; 1540 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 8,2 г промежуточного соединения 1 (35%).b) Получение промежуточного соединения 2 Реагент Джонса (0,024 моль), полученный растворением 40 г CrO3 в 80 мл воды и 20 мл концентрированной серной кислоты, добавляют по каплям к охлажденному раствору промежуточного соединения 1 (0,061 моль) в ацетоне (120 мл). После добавления реакционную смесь перемешивают в течение 1 ч при 0 С. Добавляют воду и смесь экстрагируют простым диэтиловым эфиром. Органический слой отделяют, промывают рассолом, сушат над сульфатом магния, фильтруют и растворитель выпаривают. Выход: 3,8 г промежуточного соединения 2 (96%). с) Получение промежуточного соединения 3 а Смесь промежуточного соединения 2 (0,0308 моль), диметиламина гидрохлорида (0,123 моль) и карбоната калия (0,154 моль) в ацетонитриле (150 мл) кипятят с обратным холодильником в течение ночи, затем охлаждают до комнатной температуры, выливают в воду и экстрагируют простым диэтиловым эфиром. Органический слой экстрагируют 1 Н HCl, подщелачивают 3 Н NaOH и экстрагируют простым диэтиловым эфиром. Промывают рассолом, сушат над сульфатом магния, фильтруют и растворитель выпаривают. Выход: 4,2 г промежуточного соединения 3 а (53%).d) Получение промежуточного соединения 3b Промежуточное соединение 3b получают в 3 стадии в соответствии с тем же протоколом, как промежуточное соединение 3 а, но начиная с 1-бром-5-хлорпентана и 2-нафтилкарбоксальдегида.- 21014423 е) Получение промежуточного соединения 3 с Смесь промежуточного соединения 2b (0,0153 моль) (см. пример А 1 В), N-метилбензиламина(0,0168 моль) и карбоната калия (0,022 9 моль) в ацетонитриле (30 мл) при кипячении с обратным холодильником в течение 72 ч, затем охлаждают, до комнатной температуры, выливают в воду и экстрагируют EtOAc. Органический слой экстрагируют 1 Н HCl. Полученный водный слой подщелачивают 3 НNaOH и экстрагируют простым диэтиловым эфиром. Органический слой отделяют, промывают рассолом, сушат над сульфатом магния, фильтруют и растворитель выпаривают. Выход: 2,9 г промежуточного соединения 3 с (68%).f) Получение промежуточного соединения 3dg) Получение промежуточного соединения 3 е Промежуточное соединение 3 е получают в соответствии с тем же протоколом, что и промежуточное соединение 3 с. Выход: 1,2 г промежуточного соединения 3 е (96%). Пример А 1 В. Получение промежуточного соединения 2 а Раствор нафталина (0,156 моль) в CH2Cl2 (100 мл) по каплям добавляют к смеси 5 хлорвалерилхлорида (0,156 моль) и хлорида алюминия (0,172 моль) в CH2Cl2 (100 мл) при 0 С. Смесь перемешивают в течение 2 ч при комнатной температуре, затем выливают в ледяную воду и экстрагируют CH2Cl2. Органический слой отделяют, промывают K2CO3 10%, сушат над сульфатом магния, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией через силикагель(элюент: CH2Cl2/циклогексан: 40/60; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 20 г промежуточного соединения 2 а (52%). Промежуточное соединение 2b получают в соответствии с тем же протоколом, но начиная с бензола. Промежуточные соединения 2 а и 2b можно превратить в аминопроизводное (N(СН 3)2) в соответствии с протоколом, описанным в примере A1c. Пример А 2. а) Получение промежуточного соединения 4 Раствор 2-метоксинафталина (0,19 моль) в CH2Cl2 (100 мл) по каплям добавляют к смеси 5 хлорвалерилхлорида (0,19 моль) и хлорида алюминия (0,2 08 моль) в CH2Cl2 (2 00 мл) при 0 С. Смесь перемешивают в течение 2 ч при при 0 С, затем выливают в ледяную воду и экстрагируют CH2Cl2. Органический слой отделяют, промывают K2CO3 10%, сушат над сульфатом магния, фильтруют и растворитель выпаривают. Остаток собирают в простой диизопропиловый эфир, фильтруют и сушат в вакууме. Выход: 27,9 г промежуточного соединения 4 (59%).b) Получение промежуточного соединения 5 Промежуточное соединение 5 получают в соответствии с тем же протоколом, как промежуточное соединение 3 а, но начиная с промежуточного соединения 4. Пример A3. а) Получение промежуточного соединения 6 К раствору бензолпропаноевой кислоты (20 г, 0,13 моль) в CH2Cl2 (200 мл) добавляют CDI (32,4 г,0,26 моль, 2 эквивалента) при 5 С. Смесь перемешивают при 5 С в течение 1 ч. Добавляют N,Одиметилгидроксиламин (гидрохлорид) (19,6 г, 0,26 моль, 2 эквивалента) в течение ночи при комнатной температуре. Реакционную смесь гасят водным раствором HCl (1 Н). Смесь экстрагируют CH2Cl2. Отделенный органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией через силикагель (элюент: CH2Cl2; SiO2 15-40 мкм). Выход: 26 г промежуточного соединения 6.b) Получение промежуточного соединения 7 Промежуточное соединение 6 добавляют при 0 С к смеси 4-хлорбутилмагнийбромида (1,5 эквивалента) в THF (35 мл). Затем смесь кипятят с обратным холодильником в течение 5 ч и гасят NH4Cl. Смесь экстрагируют EtOAc. Отделенный органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 20,5 г промежуточного соединения 7 (количественный выход). с) Получение промежуточного соединения 8 Смесь промежуточного соединения 7 (20,5 г, 0,09 моль), N-метилбензиламина (11,7 мл, 0,09 моль, 1 эквивалент), K2CO3 (13,8 г, 0,1 моль, 1 эквивалент) в ацетонитриле (200 мл) кипятят с обратным холодильником в течение ночи. Затем смесь охлаждют до комнатной температуры и добавляют воду и Et2O. Смесь экстрагируют Et2O. Отделенный органический слой промывают водным раствором HCl (1 Н), а затем водным раствором NaOH (3 Н). Выход: 7,86 г промежуточного соединения 8 (29%).d) Получение промежуточного соединения 9 Промежуточное соединение 9 получают в соответствии с такой же процедурой как промежуточное соединение 8. Выход: 10% Пример А 4. а) Получение промежуточного соединения 10 Бензолпропаноилхлорид (0,488 моль) добавляют по каплям при комнатной температуре к раствору- 23014423 4-бромбензоламина (0,407 моль) в Et3N (70 мл) и CH2Cl2 (700 мл) и смесь перемешивают при комнатной температуре в течение ночи. Смесь выливают в воду и концентрируют NH4OH и экстрагируют CH2Cl2. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток кристаллизуют из простого диэтилового эфира. Остаток (119,67 г) собирают в CH2Cl2 и промывают 1 Н HCl. Органический слой сушат (MgSO4) , фильтруют и растворитель выпаривают. Выход: 107,67 г промежуточного соединения 10.b) Получение промежуточного соединения 11 Реакцию проводят дважды. POCl3 (1,225 моль) добавляют по каплям при 10 С к DMF (0,525 моль). Затем по каплям добавляют промежуточное соединение 10 (0,175 моль) при комнатной температуре. Смесь перемешивают в течение ночи при 80 С, выливают на лед и экстрагируют CH2Cl2. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 77,62 г промежуточного соединения 11 (67%). с) Получение промежуточного соединения 12 Смесь промежуточного соединения 11 (0,045 моль) и тиомочевины (0,05 моль) в этаноле (150 мл) перемешивают и кипятят с обратным холодильником в течение 8 ч и затем доводят до комнатной температуры. Добавляют раствор КОН (0,068 моль) в воде (15 мл). Смесь перемешивают и кипятят с обратным холодильником в течение 1 ч и выливают на лед. Осадок отфильтровывают, промывают H2O и сушат. Выход: 11 г промежуточного соединения 12 (74%).d) Получение промежуточного соединения 13CH3I (0,037 моль) медленно добавляют при комнатной температуре к смеси промежуточного соединения 12 (0,033 моль) и K2CO3, (0,037 моль) в 2-пропаноне (150 мл). Смесь перемешивают при комнатной температуре в течение 8 ч, выливают в H2O и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 11,2 г. Часть этой фракции (2 г) кристаллизуют из простого диэтилового эфира. Осадок отфильтровывают и сушат. Выход: 1,45 г промежуточного соединения 13 (70%). Пример А 5. а) Получение промежуточного соединения 14 Бензолпропаноилхлорид (0,67 моль) добавляют по каплям при 5 С к смеси 4-бромбензоламина(0,58 моль) и Et3N (0,72 моль) в CH2Cl2 (1000 мл). Смесь перемешивают при комнатной температуре в течение 4 ч, выливают в ледяную воду и NH4OH. Органический слой промывают 1 Н HCl, затем 10%b) Получение промежуточных соединений 15 и 16POCl3 (2,3 моль) добавляют по каплям при 5 С к DMF (0,98 моль). Смесь доводят до комнатной температуры. Добавляют промежуточное соединение 14 (0,33 моль). Смесь перемешивают при 85 С в течение 6 ч, затем охлаждают до комнатной температуры, выливают в ледяную воду. Добавляют CH2Cl2. Оба слоя перемешивают в течение 2 ч. Смесь экстрагируют CH2Cl2. Органический слой промываютK2CO3 10%, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (84 г) очищают колоночной хроматографией через силикагель (элюент: CH2Cl2/циклогексан 30/70; 20-45 мкм). Желаемые фракции- 24014423 собирают и растворитель выпаривают. Выход: 34,1 г промежуточного соединения 15 (31%) и 9 г промежуточного соединения 16 (8%). с-1) Получение промежуточного соединения 17 Смесь промежуточного соединения 15 (0,1 моль) и NaOCH3 (0,53 моль) в метаноле (340 мл) перемешивают и кипятят с обратным холодильником в течение 20 ч, затем охлаждают до комнатной температуры, выливают в ледяную воду и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Выход: 79% промежуточного соединения 17 (температура плавления 100 С). с-2) Получение промежуточного соединения 18 Промежуточное соединение 18 получают в соответствии с тем же протоколом, как промежуточное соединение 17, но начиная с промежуточного соединения 16. Выход: 96% промежуточного соединения 18 (температура плавления 96 С). с-3) Получение промежуточного соединения 19 Смесь промежуточного соединения 11 (0,233 моль) в CH3ONa (30%) в метаноле (222,32 мл) и метанола (776 мл) перемешивают и кипятят с обратным холодильником в течение ночи, затем выливают на лед и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией через силикагель (элюент:CH2Cl2/циклогексан 20/80, а затем 100/0; 20-45 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 25 г промежуточного соединения 19 (33%) (точка плавления 84 С). с-4) Получение промежуточного соединения 20 Промежуточное соединение 20 получают в соответствии с тем же протоколом, как промежуточное соединение 19. Выход: 90%. Пример А 6. Получение промежуточного соединения 21 н-BuLi (1,6M в гексане, 4,4 мл, 0,00283 моль) добавляют по каплям при -70 С в потоке азота к раствору конечного соединения 18 (0,00283 моль) в THF (17 мл). Смесь перемешивают в течение 1 ч и 30 мин при -70 С, а затем добавляют N,N-диметилформамид (0,014 моль). Полученную смесь перемешивают в течение 2 ч при -70 С, а затем добавляют воду. Смесь экстрагируют EtOAc. Органический слой промывают водой, затем рассолом и сушат над MgSO4, фильтруют и выпаривают досуха. Остаток кристаллизуют из DIPE. Выход: 0,82 г промежуточного соединения 21 (54%).- 25014423 Пример А 7. а) Получение промежуточного соединения 22 н-BuLi (38 мл, 0,03 моль, 2 эквивалента) добавляют по каплям при -20 С к раствору диизопропиламина (8,6 мл, 0,03 моль, 2 эквивалента) в THF (30 мл) в потоке N2. Смесь перемешивают при -20 С в течение 20 мин, а затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 19 (10 г,0,015 моль) в THF (30 мл). Смесь перемешивают при -70 С в течение 1 ч, а затем добавляют раствор промежуточного соединения 2b (7,8 г, 0,019 моль, 1,3 эквивалента) в THF. Смесь перемешивают при-70 С в течение 1 ч. Добавляют воду и смесь экстрагируют EtOAc. Органический слой отделяют, промывают рассолом, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией через силикагель (элюент: циклогексан/EtOAc: 95/5; 20-45 мкм) для получения промежуточного соединения 22 (15,2 г, 95%) (смесь диа А и диа В). Пример А 8. а) Получение промежуточного соединения 23 Смесь промежуточного соединения 2 (0,00405 моль), N-(трет-бутоксикарбонил)пиперазина (0,0081 моль) и карбоната калия (0,012 моль) в ацетонитриле (12 мл) перемешивают при кипячении с обратным холодильником в течение 2 дней и затем охлаждают до комнатной температуры, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией через силикагель (элюент: гексан/EtOAc: от 5:1 до 1:1; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 0,76 г промежуточного соединения 23 (47%).b) Получение промежуточного соединения 24 Раствор промежуточного соединения 23 (0,00191 моль) и трифторуксусной кислоты (0,019 моль) вCH2Cl2 (6 мл) перемешивают при комнатной температуре в течение ночи, затем выливают в воду. Гидроксид натрия (гранулы) добавляют до получения основного рН и смесь экстрагируют CH2Cl2. Органический слой отделяют, промывают водой, сушат над MgSO4, фильтруют и растворитель выпаривают. Выход: 0,50 г промежуточного соединения 24 (88%). Пример А 9. а) Получение промежуточного соединения 25 Смесь дезоксибензоина (1 ммоль), 3-бромхинолина (1 ммоль), XPHOS (0,08 ммоль), диацетата палладия (0,04 моль), карбоната цезия (2 ммоль) в ксилоле (4 мл) продувают N2 и нагревают при 145 С в течение 20 ч. Реакционную смесь охлаждают до комнатной температуры и добавляют 2 мл H2O и 10 млCH2Cl2. Органический слой отделяют, сушат над MgSO4, фильтруют и растворитель выпаривают. Остаток очищают ВЭЖХ в обращенной фазе NH4HCO3-буфером. Выход: 87 мг (27%) промежуточного соеди- 26014423 нения 25.b) Получение промежуточного соединения 26 Промежуточное соединение 25 (0,269 ммоль) растворяют в THF (3 мл) и добавляют раствор аллилмагнийбромида (1 М в Et2O, 1 ммоль) при комнатной температуре. После перемешивания в течение 2 ч при комнатной температуре добавляют 3 мл насыщенного раствора NH4Cl и перемешивание продолжают в течение 1 ч. Смесь экстрагируют CH2Cl2, слои разделяют на эстрелюте и органический слой концентрируют в вакууме. Остаток очищают ВЭЖХ в обращенной фазе NH4HCO3-буфером. Выход: 25 мг (25%) промежуточного соединения 26. В. Получение конечных соединений Пример В 1. Получение соединений 1 и 2 1,6 М н-BuLi в гексане (0,0035 моль) по каплям добавляют при -20 С к раствору N-(1-метилэтил)-2 пропанамина (0,0035 моль) в THF (7 мл) в потоке N2. Смесь перемешивают при -20 С в течение 20 мин,затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 13 (0,003 моль) в THF (10 мл). Смесь перемешивают при -70 С в течение 1 ч. Добавляют раствор 5-(диметиламино)-1-фенил-1 пентанона (полученного в соответствии с А 1 Ас), (0,0035 моль) в THF (10 мл). Смесь перемешивают при-70 С в течение 3 ч. Добавляют H2O. Смесь экстрагируют AtOAc. Органический слой промывают насыщенным NaCl, сушат (MgSO4) , фильтруют и растворитель выпаривают. Остаток (2 г) очищают колоночной хроматографией через силикагель (элюент: CH2Cl2/CH3OH/NH4OH 94/6/0,3; 15-40 мкм). Собирают 2 фракции и растворитель выпаривают. Остаток 1 кристаллизуют из DIPE. Осадок отфильтровывают и сушат. Выход: 2% соединения 1 (диастереоизомер А). Остаток 2 кристаллизуют из DIPE. Осадок отфильтровывают и сушат. Выход: 0,174 г соединения 2 (11%) (диастереоизомер В). Получение соединений 3 и 4 1,6 М н-BuLi в гексане (0,0073 моль) по каплям добавляют при -20 С к раствору N-(1-метилэтил)-2 пропанамина (0,0073 моль) в THF (15 мл). Смесь перемешивают при -20 С в течение 20 мин, затем охлаждают до -70 С. Добавляют раствор промежуточного соединения 19 (0,0061 моль) в THF (20 мл). Смесь перемешивают при -70 С в течение 1 ч. Добавляют раствор промежуточного соединения 5 (0,0073 моль) в THF (20 мл). Смесь перемешивают при -70 С в течение 3 ч, затем выливают на лед при -20 С и экстрагируют AtOAc. Органический слой промывают насыщенным NaCl, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (4,6 г) очищают колоночной хроматографией через силикагель (элюент: Промежуточное соединение 19 (0,0031 моль) в THF (10 мл) добавляют по каплям при -70 С к раствору N-(1-метилэтил)-2-пропанамина, лития (0,0035 моль) в THF (10 мл). Смесь перемешивают при -70 С в течение 1 ч и 30 мин. Добавляют раствор(0,0041 моль) (полученный в соответствии с A1Ac) в THF (12 мл) . Смесь перемешивают при -70 С в течение 3 ч, выливают в -30 С и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Остаток (5 г) очищают колоночной хроматографией через сили- 28
МПК / Метки
МПК: A61K 31/47, A61P 31/04, C07D 215/22
Метки: производные, хинолина, средств, качестве, антибактериальных
Код ссылки
<a href="https://eas.patents.su/30-14423-proizvodnye-hinolina-v-kachestve-antibakterialnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина в качестве антибактериальных средств</a>