5,5-дизамещённые-2-амино-4-тиазолидиноны и способ их получения, фармацевтическая композиция и способ лечения
Номер патента: 14419
Опубликовано: 30.12.2010
Авторы: Юань Честер Ченьгуан, Бартбергер Майкл Д., Йохансон Ларс, Беркот Эрик, Валлгарда Йерк, Хангейт Рэнделл В., Вильямс Мередит, Хоман Эверт, Фотч Кристофер Х., Фризл Мэтью Дж., Лю Цинянь, Хэн Ньанхе, Ли Эйвен, Хенриксон Мартин, Тегли Кристофер, Ст.Джин Дэвид, Мониз Джордж А., Хуан Ци, Кэй Голин
Формула / Реферат
1. 5,5-Дизамещенные-2-амино-4-тиазолидиноны общей формулы (III)
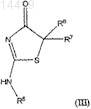
где R5 представляет собой необязательно содержащую заместители группу фенил-(CR10aR10a)1-3- и где R10a независимо выбран из группы, содержащей водород, метил, фторо, или R10a и R10a могут совместно образовывать С3-С6-циклоалкил;
R6 выбран из группы, содержащей C1-8алкил, С1-8алкоксигруппу, С3-10циклоалкил, гетероциклил, С3-10 циклоалкил-С1-8алкил, CN-C1-8алкил, арил, арил-С1-8алкил, гетероциклил-С1-8алкил и галоалкил;
R7 выбран из группы, содержащей -NR8R9, галоген, С1-8алкил, -(CR8R9)n-OR8, -S-C1-C8-алкил, С3-10 циклоалкил, гетероциклил, С3-10циклоалкил-С1-8алкил, циано-С1-8алкил, арил, арил-С1-8алкил, гетероциклил-С1-8алкил, гетероциклил-С(О)-С1-8алкил, гетероциклил-SO2-С1-8алкил, С1-8галоалкил, R8R9N-С1-8алкил, НО-С1-8алкил, -С(О)-С3-С10-циклоалкил, -С(О)-С1-С8-галоалкил, -(CR8R9)n-Y-(CR8R9)n-гетероциклил и
-(CR8R9)n-Y-(CR8R9)n-C(O)-R8 (где n находится в интервале от 0 до 5, Y представляет собой NR10, О или S);
где любой арил, алкил, гетероциклил или циклоалкил могут содержать по меньшей мере один заместитель, выбранный из группы, содержащей -С1-С8-алкил, -галоген, -ОН, -OR10, С1-С8-алкил-SO2-, -SO2-арил,
-C(O)-(CR8R9)n-карбамат, -С(О)-О-С1-С8-алкил, -С(О)-С1-С8-алкил, -C(O)-(CR8R9)n-C(O)-NR8R9, -С(О)-(CR8R9)n-NR8-С(О)-С1-С8-алкил, -C(O)-(CR8R9)n-NR8R9, -С(О)-С3-С10-циклоалкил, -С(О)-арил, -С(О)-(CR8R9)n-гетероциклил, -С1-С8-алкил-OR8, -С(О)-гало-С1-С8-алкил или -С(О)-(CR8R9)n-арил;
где любой арильный, алкильный, циклоалкильный или гетероциклильный остатки могут содержать по меньшей мере один заместитель, независимо выбранный из группы, содержащей С1-8алкил, арил, галоген,
-NR10R10, С1-С8-галоалкил, НО-С1-С8-алкил, R8R9N-С1-С8-алкил, С1-С8-алкил-OR10, -OR10, (С3-С10)циклоалкил или С1-С8-алкилсульфонил, -O-(CR8R9)n-гетероциклил, -O-(CR8R9)n-С(О)-NR8R9,
-О-(CR8R9)n-NR8R9, -Y-(CR8R9)n-NR8-С(О)-С1-С8-алкил, -Y-(CR8R9)n-гетероциклил, -O-(CR8R9)n-NR8R9, С1-С8-алкил-SO2 или -O-(CR8R9)n-N-С(О)-гетероциклил;
где R8 и R9 независимо выбраны из группы, содержащей водород, C1-C8-алкил, C1-C8-алкоксигруппу,
-NR10R10, -S-(С1-С8)алкил, арил и гетероциклил;
любая алкильная, алкокси, гетероциклильная или арильная группы могут содержать от одного до трех заместителей, выбранных из группы, содержащей галоген, незамещенный С1-С8-алкил, незамещенную С1-С8-алкоксигруппу, незамещенную С1-С8-тиоалкоксигруппу и незамещенный арил(С1-С4)алкил;
где R10 выбран из группы, содержащей водород, С1-С8-алкил, арил-С1-С8-алкил, С1-С8-алкоксигруппу,
-S-(С1-С8)алкил, гетероциклил и арил;
любая алкильная, гетероциклильная или арильная группы могут содержать от одного до трех заместителей, выбранных из группы, содержащей галоген, незамещенный С1-С8-алкил, незамещенную С1-С8-алкоксигруппу, незамещенную С1-С8-тиоалкоксигруппу и незамещенный арил(С1-С4)алкил; или
R6 и R7 совместно со связанным с ними атомом углерода образуют насыщенный, частично ненасыщенный или ненасыщенный С3-10циклоалкил или насыщенный, частично ненасыщенный или ненасыщенный С4-С14-гетероциклил;
где циклоалкил или гетероциклил могут содержать по меньшей мере один заместитель, выбранный из группы, содержащей С1-С8-алкил, арил, С1-С8-галоалкил, арил-С1-С8-алкил, С3-С10-циклоалкил, -OR8, =O, =NR8, =N-OR8, -NR8R9, -SR8, -галоген, -OC(O)R8, -C(O)R8, -CO2R8, -CONR8R9, -OC(O)NR8R9, -NR9C(O)R8,
-NR8C(O)NR8R9, -NR8SO2NR8R9, -NR8CO2R9, -NHC(NH2)=NH, -NR8C(NH2)=NH, -NHC(NH2)=NR8, -S(O)R8,
-SO2R8, -SO2NR8R9, -NR8SO2R9, -CN и -NO2;
а также фармацевтически приемлемые соли, сольваты, гидраты, геометрические изомеры, таутомеры, оптические изомеры и N-оксиды указанных соединений, с условием, что
если R6 и R7 совместно образуют циклопропильный цикл, то R5 - не бензил, и
где арил представляет собой моно- или бицикличные ароматические кольца, включающие 6-10 кольцевых атомов углерода;
гетероарил представляет собой моно-, би- или трицикличную ароматическую кольцевую систему (в которой по меньшей мере одно кольцо является ароматическим), включающую 5-10 кольцевых атомов (моно- или бицикличных), в которой по меньшей мере один кольцевой атом выбран из группы, включающей азот, серу, кислород или селен; и
гетероцикличный или гетероциклил представляют собой ненасыщенное, частично или полностью насыщенное моно-, би- или трицикличное кольцо, включающее 4-6 кольцевых атомов, имеющее по меньшей мере один гетероатом, выбранный из группы, включающей кислород, серу или азот.
2. Соединения по п.1, отличающиеся тем, что R5 представляет собой (необязательно замещенный фенил)-(С(СН3)2)-, (необязательно замещенный фенил)-(СНСН3) или бензил.
3. 5,5-Дизамещенные-2-амино-4-тиазолидиноны общей формулы (III)
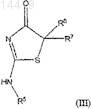
где R5выбран из группы, содержащей С1-С8-алкил, С3-10циклоалкил, С3-10циклоалкил-С1-8алкил, арил, арил-С1-8алкил, гетероциклил, гетероциклил-С1-8алкил и галоалкил;
где любая арильная, циклоалкильная или гетероциклильная группы могут содержать по меньшей мере один заместитель, выбранный из группы, содержащей С1-8алкил, арил, галоген, гало-С1-С8-алкил, НО-С1-С8-алкил, R8R9N-С1-С8-алкил, С1-С8-алкил-OR10, -OR10, (С3-С10)циклоалкил или С1-С8-алкилсульфонил;
R6 выбран из группы, содержащей С1-С8-алкил, С3-С10-циклоалкил, а также насыщенный или частично ненасыщенный гетероциклил, гетероарил и арил;
R7 выбран из группы, содержащей -NR8R9, галоген, С1-8алкил, -(CR8R9)n-OR8, -S-С1-С8-алкил, С3-10 циклоалкил, гетероциклил, С3-10циклоалкил-С1-8алкил, циано-С1-8алкил, арил, арил-С1-8алкил, гетероциклил-С1-8алкил, гетероциклил-С(О)-С1-8алкил, гетероциклил-SO2-С1-8алкил, С1-8галоалкил, R8R9N-С1-8алкил, НО-С1-8алкил, -С(О)-С3-С10-циклоалкил, -С(О)-С1-С8-галоалкил, -(CR8R9)n-Y-(CR8R9)n-гетероциклил и -(CR8R9)n-Y-(CR8R9)n-C(O)-R8 (где n находится в интервале от 0 до 5, Y представляет собой NR10, О или S);
где любой арил, алкил, гетероциклил или циклоалкил могут содержать по меньшей мере один заместитель, выбранный из группы, содержащей -С1-С8-алкил, -галоген, -ОН, -OR10, С1-С8-алкил-SO2-, -SO2-арил,
-C(O)-(CR8R9)n-карбамат, -С(О)-О-С1-С8-алкил, -С(О)-С1-С8-алкил, -C(O)-(CR8R9)n-C(O)-NR8R9,
-С(О)-(CR8R9)n-NR8-С(О)-С1-С8-алкил, -C(O)-(CR8R9)n-NR8R9, -С(О)-С3-С10-циклоалкил, -С(О)-арил,
-С(О)-(CR8R9)n-гетероциклил, -С1-С8-алкил-OR8, -С(О)-гало-С1-С8-алкил или -C(O)-(CR8R9)n-арил;
где любой арильный, алкильный, циклоалкильный или гетероциклильный остатки могут содержать по меньшей мере один заместитель, выбранный из группы, содержащей С1-8алкил, арил, галоген, -NR10R10, С1-С8-галоалкил, НО-С1-С8-алкил, R8R9N-С1-С8-алкил, С1-С8-алкил-OR10, -OR10, (С3-С10)циклоалкил или С1-С8-алкилсульфонил, -О-(CR8R9)n-гетероциклил, -О-(CR8R9)n-С(О)-NR8R9, -О-(CR8R9)n-NR8R9, -Y-(CR8R9)n-NR8-С(О)-С1-С8-алкил, -Y-(CR8R9)n-гетероциклил, -O-(CR8R9)n-NR8R9, С1-С8-алкил-SO2 или -O-(CR8R9)n-N-C(O)-гетероциклил;
где R8 и R9 независимо выбраны из группы, содержащей водород, С1-С8-алкил, С1-С8-алкоксигруппу,
-NR10R10, -S-(С1-С8)алкил, арил и гетероциклил;
любая алкильная, алкокси, гетероциклильная или арильная группы могут содержать от одного до трех заместителей, выбранных из группы, содержащей галоген, незамещенный С1-С8-алкил, незамещенную С1-С8-алкоксигруппу, незамещенную С1-С8-тиоалкоксигруппу и незамещенный арил(С1-С4)алкил;
где R10 независимо выбран из группы, содержащей водород, С1-С8-алкил, арил-С1-С8-алкил, С1-С8-алкокси,
-S-(С1-С8)алкил, гетероциклил и арил;
любая алкильная, гетероциклильная или арильная группы могут содержать от одного до трех заместителей, выбранных из группы, содержащей галоген, незамещенный С1-С8-алкил, незамещенную С1-С8-алкоксигруппу, незамещенную С1-С8-тиоалкоксигруппу и незамещенный арил(С1-С4)алкил; или
R6 и R7 совместно со связанным с ними атомом углерода образуют насыщенный, частично ненасыщенный или ненасыщенный С3-10циклоалкил или насыщенный, частично ненасыщенный или ненасыщенный С4-С14-гетероциклил;
где циклоалкил или гетероциклил могут содержать по меньшей мере один заместитель, выбранный из группы, содержащей С1-С8-алкил, арил, С1-С8-галоалкил, арил-С1-С8-алкил, С3-С10-циклоалкил, -OR8, =O, =NR8, =N-OR8, -NR8R9, -SR8, -галоген, -OC(O)R8, -C(O)R8, -CO2R8, -CONR8R9, -OC(O)NR8R9, -NR9C(O)R8,
-NR8C(O)NR8R9, -NR8SO2NR8R9, -NR8CO2R9, -NHC(NH2)=NH, -NR8C(NH2)=NH, -NHC(NH2)=NR8, -S(O)R8,
-SO2R8, -SO2NR8R9, -NR8SO2R9, -CN и -NO2;
а также фармацевтически приемлемые соли, сольваты, гидраты, геометрические изомеры, таутомеры, оптические изомеры, N-оксиды и пролекарственные формы указанных соединений с условием, что:
если R6=R7=метил, то R5 - не фенил и не 4-иодофенил,
R6=R7=фенил, то R5 - не фенил, и
если R6 и R7 совместно образуют циклопропильный цикл, то R5 - не н-бутил, циклогексил, бензил, фенил или нафтил, и
где арил представляет собой моно- или бицикличные ароматические кольца, включающие 6-10 кольцевых атомов углерода;
гетероарил представляет собой моно-, би- или трицикличную ароматическую кольцевую систему (в которой по меньшей мере одно кольцо является ароматическим), включающую 5-10 кольцевых атомов (моно- или бицикличных), в которой по меньшей мере один кольцевой атом выбран из группы, включающей азот, серу, кислород или селен; и
гетероцикличный или гетероциклил представляют собой ненасыщенное, частично или полностью насыщенное моно-, би- или трицикличное кольцо, включающее 4-6 кольцевых атомов, имеющее по меньшей мере один гетероатом, выбранный из группы, включающей кислород, серу или азот.
4. Соединения по п.3, отличающиеся тем, что R6 представляет собой С1-С8-алкил.
5. Соединения по п.3, отличающиеся тем, что R6 выбран из группы, содержащей метил, этил, н-пропил или изопропил.
6. 5,5-Дизамещенные-2-амино-4-тиазолидиноны, выбранные из группы, содержащей
2-(бицикло[2.2.1]гепт-2-иламино)-5-изопропил-1,3-тиазол-4(5Н)-он;
2-(бицикло[2.2.1]гепт-2-иламино)-5-этил-1,3-тиазол-4(5Н)-он;
2-(бицикло[2.2.1]гепт-2-иламино)-5-фенил-1,3-тиазол-4(5Н)-он;
2-(циклогексиламино)-5-этил-1,3-тиазол-4(5Н)-он;
2-(бицикло[2.2.1]гепт-2-иламино)-5,5-диметил-1,3-тиазол-4(5Н)-он;
5-изопропил-2-(трицикло[3.3.1.0~3,7~]нон-3-иламино)-1,3-тиазол-4(5Н)-он;
6-(трицикло[3.3.1.0~3,7~]нон-3-иламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он;
2-(трицикло[3.3.1.0~3,7~]нон-3-иламино)-1,3-тиазол-4(5Н)-он;
6-(циклооктиламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он;
6-(циклогептиламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он;
6-(бицикло[2.2.1]гепт-2-иламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он;
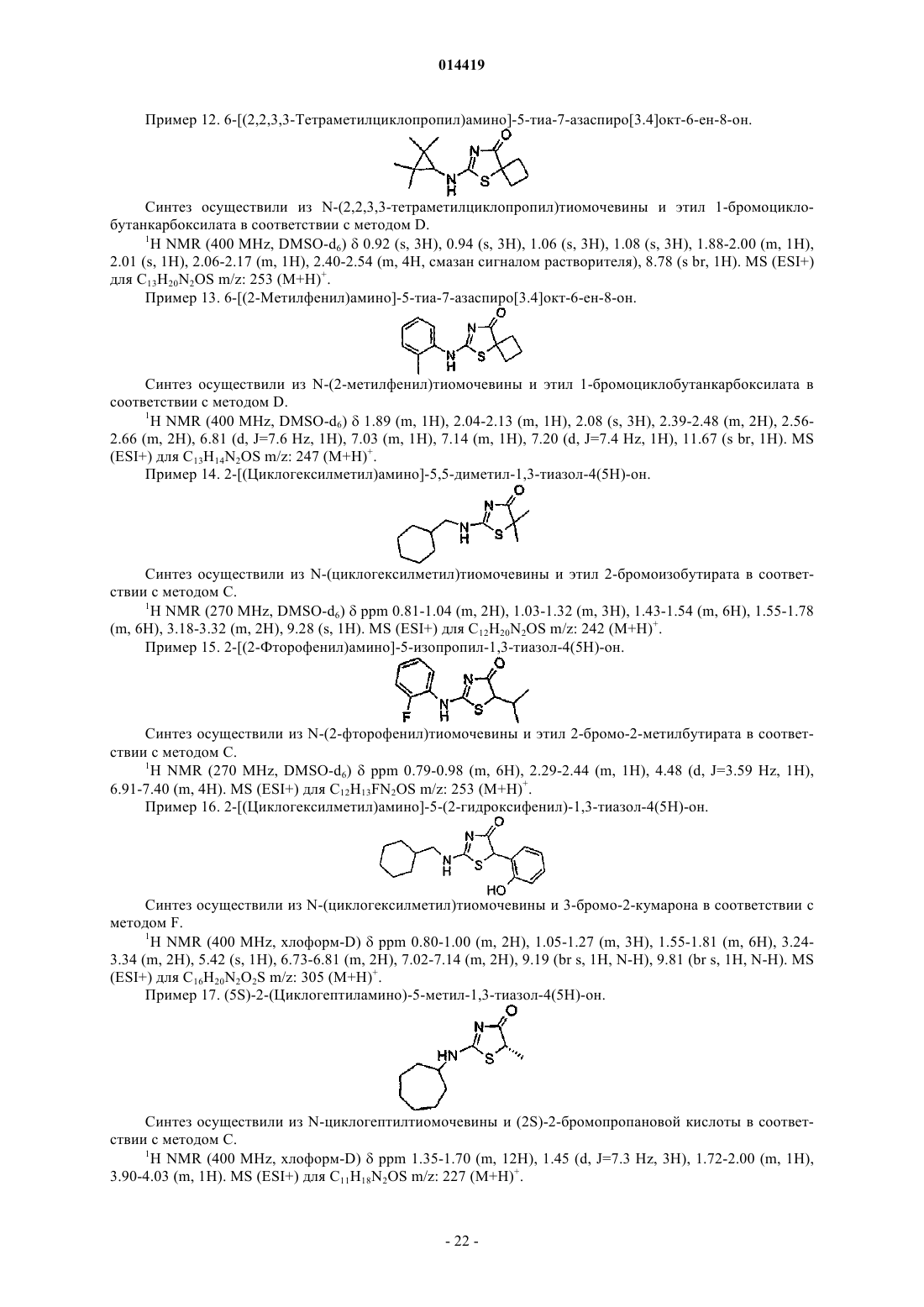
6-[(2,2,3,3-тетраметилциклопропил)амино]-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он;
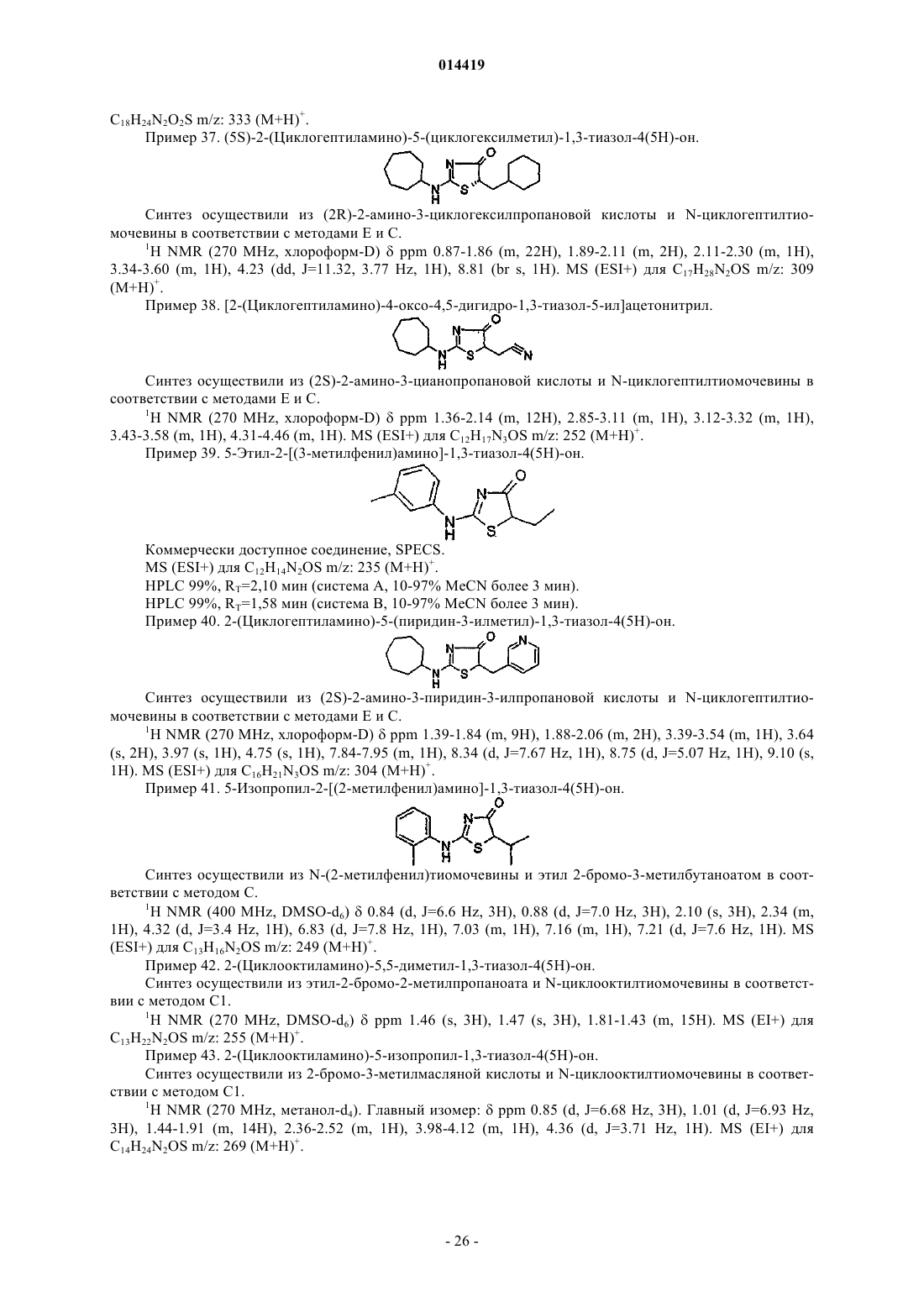
6-[(2-метилфенил)амино]-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он;
2-[(циклогексилметил)амино]-5,5-диметил-1,3-тиазол-4(5H)-он;
2-[(2-фторофенил)амино]-5-изопропил-1,3-тиазол-4(5Н)-он;
2-[(циклогексилметил)амино]-5-(2-гидроксифенил)-1,3-тиазол-4(5Н)-он;
(5S)-2-(циклогептиламино)-5-метил-1,3-тиазол-4(5Н)-он;
(5S)-2-(циклогептиламино)-5-метил-1,3-тиазол-4(5Н)-он;
2-(циклогептиламино)-5-этил-1,3-тиазол-4(5Н)-он;
2-(циклогептиламино)-5-изопропил-1,3-тиазол-4(5Н)-он;
5-трет-бутил-2-(циклогептиламино)-1,3-тиазол-4(5Н)-он;
2-(циклооктиламино)-5-этил-1,3-тиазол-4(5Н)-он;
5-изопропил-2-[(2-изопропилфенил)амино]-1,3-тиазол-4(5Н)-он;
5-этил-2-[(2-изопропилфенил)амино]-1,3-тиазол-4(5Н)-он;
2-[(2-хлорофенил)амино]-5-этил-1,3-тиазол-4(5Н)-он;
5-этил-2-[(2-метилфенил)амино]-1,3-тиазол-4(5Н)-он;
5-изопропил-2-[(2,2,3,3-тетраметилциклопропил)амино]-1,3-тиазол-4(5Н)-он;
2-(бицикло[2.2.1]гепт-2-иламино)-5-(4-гидроксибензил)-1,3-тиазол-4(5Н)-он;
5-[(циклогексилметил)амино]-4-тиа-6-азаспиро[2.4]гепт-5-ен-7-он;
2-(циклогептиламино)-5-(3,4-дигидроксибензил)-1,3-тиазол-4(5Н)-он;
2-(циклогептиламино)-5-(1Н-имидазол-4-илметил)-1,3-тиазол-4(5Н)-он;
2-(циклогептиламино)-5-изобутил-1,3-тиазол-4(5Н)-он;
2-(циклогептиламино)-5-(1Н-индол-3-илметил)-1,3-тиазол-4(5Н)-он;
2-(циклогептиламино)-5-(4-гидроксибензил)-1,3-тиазол-4(5Н)-он;
(5R)-2-(циклогептиламино)-5-(циклогексилметил)-1,3-тиазол-4(5Н)-он;
2-(циклооктиламино)-5-(4-гидроксибензил)-1,3-тиазол-4(5Н)-он;
(5S)-2-(циклогептиламино)-5-(циклогексилметил)-1,3-тиазол-4(5H)-он;
[2-(циклогептиламино)-4-оксо-4,5-дигидро-1,3-тиазол-5-ил]ацетонитрил;
2-(циклогептиламино)-5-(пиридин-3-илметил)-1,3-тиазол-4(5Н)-он;
5-изопропил-2-[(2-метилфенил)амино]-1,3-тиазол-4(5Н)-он;
2-(циклооктиламино)-5,5-диметил-1,3-тиазол-4(5Н)-он;
2-(циклооктиламино)-5-изопропил-1,3-тиазол-4(5Н)-он;
2-(бицикло[2.2.1]гепт-2-иламино)-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он;
2-(трицикло[3.3.1.0~3,7~]нон-3-иламино)-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он;
2-(циклогептиламино)-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он;
2-(циклооктиламино)-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он;
2-{[1-(4-хлорофенил)циклобутил]амино}-5-изопропил-1,3-тиазол-4(5Н)-он;
6-{[1-(4-хлорофенил)циклобутил]амино}-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он;
2-(циклогептиламино)-5,5-диэтил-1,3-тиазол-4(5Н)-он;
(5S)-5-изопропил-2-{[(2S)-2-фенилпропил]амино}-1,3-тиазол-4(5Н)-он;
(5R)-5-этил-2-{[(2S)-2-фенилпропил]амино}-1,3-тиазол-4(5Н)-он;
(5S)-5-этил-2-{[(2S)-2-фенилпропил]амино}-1,3-тиазол-4(5Н)-он;
(5R)-5-изопропил-2-{[(2R)-2-фенилпропил]амино}-1,3-тиазол-4(5Н)-он;
(5S)-5-изопропил-2-{[(2R)-2-фенилпропил]амино}-1,3-тиазол-4(5Н)-он;
(5R)-5-этил-2-{[(2R)-2-фенилпропил]амино}-1,3-тиазол-4(5Н)-он;
(5S)-5-этил-2-{[(2R)-2-фенилпропил]амино}-1,3-тиазол-4(5Н)-он;
2-анилино-5-изопропил-1,3-тиазол-4(5Н)-он;
5-изопропил-2-[(2-морфолин-4-илэтил)амино]-1,3-тиазол-4(5Н)-он;
2-(бицикло[2.2.1]гепт-2-иламино)-1-тиа-3-азаспиро[4.4]нон-2-ен-4-он;
2-(циклогептиламино)-1-тиа-3-азаспиро[4.4]нон-2-ен-4-он;
2-(циклооктиламино)-1-тиа-3-азаспиро[4.4]нон-2-ен-4-он;
2-[(2,2,3,3-тетраметилциклопропил)амино]-1-тиа-3-азаспиро[4.4]нон-2-ен-4-он;
2-[(2-хлоробензил)амино]-5-изопропил-1,3-оксазол-4(5H)-он;
2-[(4-хлоробензил)амино]-5-изопропил-1,3-оксазол-4(5Н)-он;
5-изопропил-2-[(2,2,6,6-тетраметилпиперидин-4-ил)амино]-1,3-оксазол-4(5Н)-он;
5-изопропил-2-[(2-морфолин-4-илэтил)амино]-1,3-оксазол-4(5Н)-он;
5-бензил-2-[(циклогексилметил)амино]-1,3-оксазол-4(5Н)-он;
2-(циклогептиламино)-5-изопропил-1,3-оксазол-4(5Н)-он;
2-(бицикло[2.2.1]гепт-2-иламино)-5-изопропил-1,3-оксазол-4(5Н)-он;
2-(бицикло[2.2.1]гепт-2-иламино)-5-изобутил-1,3-оксазол-4(5Н)-он;
2-(циклогептиламино)-5-изобутил-1,3-оксазол-4(5Н)-он;
5-изобутил-2-[(2-метилфенил)амино]-1,3-оксазол-4(5Н)-он,
а также фармацевтически приемлемые соли, сольваты, гидраты, геометрические изомеры, таутомеры, оптические изомеры и N-оксиды перечисленных соединений.
7. Фармацевтическая композиция, обладающая активностью в отношении человеческого фермента 11-бета-гидроксистероид дегидрогеназы первого типа (11bHSD1), отличающаяся тем, что она в качестве активного ингредиента содержит соединение по любому из пп.1-6 и фармацевтически приемлемый разбавитель или носитель.
8. Фармацевтическая композиция по п.7, отличающаяся тем, что она предназначена для орального применения.
9. Фармацевтическая композиция по п.8, отличающаяся тем, что она представлена в форме таблетки.
10. Применение соединений по любому из пп.1-6 в качестве средства при профилактике или лечении заболеваний или состояний, опосредуемых ферментом 11-b-гидроксистероид дегидрогеназой первого типа, или нуждающихся в иммуномодуляции.
11. Применение по п.10, отличающееся тем, что заболевание выбрано из группы, содержащей диабет, синдром X, ожирение, глаукому, гиперлипидемию, гипергликемию, гиперинсулинемию, гипертонию, остеопороз, деменцию, депрессию, вирусные и воспалительные заболевания.
12. Применение по п.10, отличающееся тем, что указанное состояние связано с затрудненным или нарушенным заживлением ран.
13. Применение по п.12, отличающееся тем, что состояние, связанное с затрудненным или нарушенным заживлением ран, представляет собой диабет.
14. Применение по п.12, отличающееся тем, что состояние, связанное с затрудненным или нарушенным заживлением ран, вызвано лечением глюкокортикоидами.
15. Применение по п.10, отличающееся тем, что оно предназначено для ускорения процесса заживления хронических ран, таких как диабетические, венозные или пролежневые язвы.
16. Применение по п.10, отличающееся тем, что иммуномодуляцию осуществляют при лечении таких заболеваний, как туберкулез, проказа и псориаз.
17. Применение соединения по любому из пп.1-6 в качестве средства при ингибировании фермента 11-b-гидроксистероид дегидрогеназы первого типа.
18. 5,5-Дизамещенные-2-амино-4-тиазолидиноны, выбранные из группы, содержащей
2-[1-(4-фторофенил)этиламино]-5-метил-5-(тетрагидропиран-4-илметил)тиазол-4-он;
(5S)-5-((1-ацетил-4-пиперидинил)метил)-2-((1S,4R)-бицикло[2.2.1]гепт-2-иламино)-5-метил-1,3-тиазол-4(5Н)-он;
(5R)-2-((1S,4R)-бицикло[2.2.1]гепт-2-иламино)-5-метил-5-(тетрагидро-2Н-пиран-4-илметил)-1,3-тиазол-4(5Н)-он;
(5S)-2-((1S,4R)-бицикло[2.2.1]гепт-2-иламино)-5-метил-5-тетрагидро-2Н-пиран-4-ил-1,3-тиазол-4(5Н)-он;
2-((1R,2R,4S)-бицикло[2.2.1]гепт-2-иламино)-8-окса-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он;
(5S)-2-((1S,4R)-бицикло[2.2.1]гепт-2-иламино)-5-((1-(3-фуранилкарбонил)-4-пиперидинил)метил)-5-метил-1,3-тиазол-4(5Н)-он;
2-(1-циклогексилэтиламино)-5-изопропил-5-метилтиазол-4-он;
2-(5,5-дифторобицикло[2.2.1]гепт-2-иламино)-5-изопропил-5-метилтиазол-4-он;
2-(бицикло[2.2.1]гепт-2-иламино)-5-изопропил-5-метилтиазол-4-он;
2-[1-(2-трифторометилфенил)этиламино]-8-окса-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он;
(5R)-2-((1S,2S,4R)-бицикло[2.2.1]гепт-2-иламино)-5-метил-5-(трифторометил)-1,3-тиазол-4(5Н)-он;
2-(бицикло[2.2.1]гепт-2-иламино)-5-(1-фторо-1-метилэтил)-5-метилтиазол-4-он;
2-[1-(4-фторофенил)этиламино]-5-метил-5-пиридин-4-илтиазол-4-он;
5-метил-5-пиридин-4-ил-2-[1-(2-трифторометилфенил)этиламино]тиазол-4-он;
2-[1-(2-фторофенил)этиламино]-5-метил-5-пиридин-4-илтиазол-4-он;
5-(1-фторо-1-метилэтил)-2-[1-(2-фторофенил)этиламино]-5-метилтиазол-4-он;
2-[1-(2-фторофенил)этиламино]-5-метил-5-трифторометилтиазол-4-он;
5-(1,1-дифтороэтил)-2-[1-(4-фторофенил)этиламино]-5-метилтиазол-4-он;
2-[1-(2-хлорофенил)этиламино]-5-метил-5-трифторометилтиазол-4-он;
2-[1-(4-фторофенил)этиламино]-5-метил-5-трифторометилтиазол-4-он;
2-[1-(2-хлорофенил)этиламино]-5-метил-5-трифторометилтиазол-4-он;
2-[1-(4-фторофенил)этиламино]-5-(2-метоксипиридин-4-ил)-5-метилтиазол-4-он;
5-(1,1-дифтороэтил)-2-[1-(4-фторофенил)этиламино]-5-метилтиазол-4-он и
5-(1-фторо-1-метилэтил)-2-[1-(4-фторофенил)этиламино]-5-метилтиазол-4-он,
а также фармацевтически приемлемые соли, сольваты, гидраты, геометрические изомеры, таутомеры, оптические изомеры и N-оксиды перечисленных соединений.
19. Способ получения 5,5-дизамещенные-2-амино-4-тиазолидинонов, охарактеризованных по п.1 или 3, а также фармацевтически приемлемых солей, сольватов, гидратов, геометрических изомеров, таутомеров, оптических изомеров и N-оксидов перечисленных соединений, в котором осуществляют взаимодействие указанного ниже 5-замещенного-2-амино-4-тиазолидинона с R7-LG в присутствии хирального основания по следующей схеме:

где X представляет собой S и
LG - уходящая группа,
где способ необязательно включает стадию превращения указанных веществ в указанную фармацевтически приемлемую соль, сольват, гидрат, геометрический изомер, таутомер, оптический изомер или N-оксид.
20. Способ по п.19, отличающийся тем, что LG выбран из группы, содержащей галиды, тосилаты, месилаты и трифлаты.
21. Способ по п.19, отличающийся тем, что хиральное основание представляет собой хиральное основание на основе соли лития.
22. 5,5-Дизамещенный-2-амино-4-тиазолидинон, представляющий собой 2-(циклооктиламино)-5,5-диметил-1,3-тиазол-4(5Н)-он, или его фармацевтически приемлемая соль, сольват, гидрат, геометрический изомер, таутомер, оптический изомер или N-оксид.
23. 5,5-Дизамещенный-2-амино-4-тиазолидинон, представляющий собой 5-этил-2-[(2-изопропилфенил)амино]-1,3-тиазол-4(5Н)-он, или его фармацевтически приемлемая соль, сольват, гидрат, геометрический изомер, таутомер, оптический изомер или N-оксид.
24. 5,5-Дизамещенный-2-амино-4-тиазолидинон, представляющий собой 2-(бицикло[2,2,1]гепт-2-иламино)-5-изопропил-5-метилтиазол-4-он, или его фармацевтически приемлемая соль, сольват, гидрат, геометрический изомер, таутомер, оптический изомер или N-оксид.
25. 5,5-Дизамещенный-2-амино-4-тиазолидинон, представляющий собой (S)-2-((1R,2R,4R)-5-гидроксибицикло[2,2,1]гептан-2-иламино)-5-изопропил-5-метилтиазол-4(5Н)-он, или его фармацевтически приемлемая соль, сольват, гидрат, геометрический изомер, таутомер, оптический изомер или N-оксид.
Текст
(SE), Хуан Ци, Хэн Ньанхе, Юань Честер Ченьгуан (US)(57) Настоящее изобретение относится к соединениям формулы (III), где R5, R6, R7 раскрыты в описании, а также к содержащим эти соединения фармацевтическим композициям и методам использования соединений для лечения расстройств, связанных с человеческим ферментом 11-гидроксистероид дегидрогеназой типа I и для приготовления медикаментов, действующих на человеческий фермент 11 гидроксистероид дегидрогеназу типа I. 014419 Область техники, к которой относится изобретение Настоящее изобретение относится к области биоорганической химии, фармакологии и медицины,конкретно к новым соединениям, к содержащим соединения фармацевтическим композициям, а также к использованию соединений в медицине и для приготовления медикаментов, действующих на человеческий фермент 11-бета-гидроксистероид дегидрогеназу первого типа (11HSD1). Уровень техники Гидроксистероид дегидрогеназы (Hydroxysteroid dehydrogenases, HSD) регулирует занятость и степень активации рецепторов стероидных гормонов, преобразуя последние в неактивные метаболиты. Последний обзор на эту тему содержится в работе Nobel et al., Eur. J. Biochem., 2001, 268:4113-4125. Существуют различные классы HSD. 11-бета-гидроксистероид дегидрогеназы (11-HSD) катализируют внутреннее превращение активных глюкокортикоидов (таких как кортизол и кортикостерон) в инертные формы (такие как кортизон и 11-дегидрокортикостерон). Изоформа 11-бета-гидроксистероид дегидрогеназы типа 1 (11-HSD1) экспрессируется в печени, жировой ткани, головном мозге, легких и других глюкокортикоидных тканях. Она представляет собой потенциальную мишень для терапии, направленной на лечение различных заболеваний, тяжесть которых можно ослабить снижением глюкокортикоидной активности, например диабета, ожирения, связанных с возрастом когнитивных дисфункций,Seckl et al., Endocrinology, 2001, 142:1371-1376. Различные изоферменты 17-бета-гидроксистероид дегидрогеназы (17-HSD) связываются с андрогеновыми или эстрогеновыми рецепторами, катализируя внутренние превращения различных половых гормонов, включая эстрадиол/эстрон и тестостерон/андростенедион. В настоящее время в человеческом организме обнаружено шесть изоферментов, экспрессируемых в различных тканях, включая эндометрий,молочную железу, тонкий кишечник и яички. 17-Бета-гидроксистероид дегидрогеназа типа 2 (17-HSD2) экспрессируется в человеческом эндометрии, и в соответствии с литературными данными ее активность связана с раком шейки матки, Kitawaki et al., J. Clin. Endocrin. Metab., 2000, 85:1371-3292-3296. 17-Бетагидроксистероид дегидрогеназа типа 3 (17-HSD3) экспрессируется в яичках, и модулирование ее активности может быть полезно при лечении расстройств, связанных с нарушениями функционирования гормона андрогена. Андрогены и эстрогены активны в 17-гидрокси конфигурациях; их 17-кето производные не связываются с андрогеновыми и эстрогеновыми рецепторами и потому неактивны. Превращения между активными и неактивными формами (эстрадиол/эстрон и тестостерон/андростенедион) половых гормонов катализируются ферментами семейства 17-HSD. Так 17-HSD1 катализирует образование эстрадиола в ткани молочной железы, что важно для роста злокачественных опухолей этого органа, Labrie et al., Mol.Cell. Endocrinol., 1991, 78:C113-C118. Предполагается аналогичная роль фермента 17-HSD4 в развитии рака тонкого кишечника, English et al., J. Clin. Endocrinol. Metab., 1999, 84:2080-2085. 17-HSD3 экспрессируется почти исключительно в яичках, преобразуя там андростенедион в тестостерон. Нехватка этого фермента во время развития плода ведет к мужскому псевдогермафродитизму, Geissler et al., Nat. Genet.,1994, 7:34-39. 17-HSD3 совместно с различными изоферментами 3-HSD принимают участие в сложных метаболических путях, сдвигающих равновесие между активной и неактивной формами андрогена.Penning et al., Biochem. J., 2000, 351:67-77. Таким образом, модуляция некоторых форм HSD может теоретически оказывать благоприятный эффект на лечение болезней, связанных с работой гормонов андрогена и эстрогена. 20-Гидроксистероид дегидрогеназы (20-HSD) катализируют внутренние превращения прогестинов (например, между прогестероном и 20-гидроксипрогестероном). К числу других субстратов 20HSD относятся 17-гидроксипрегненолон или 17-гидроксипрогестерон, из них получаются 20-ОН стероиды. Идентифицировано несколько изоформ 20-HSD, они экспрессируются в различных тканях,включая плаценту, яичники, яички и надпочечники, Peltoketo et al., J. Mol. Endocrinol., 1999, 23:1-11. 3-Альфа-гидроксистероид дегидрогеназы (3-HSD) катализирует взаимопревращения между андрогенами дегидротестостероном (dihydrotestosterone, DHT) и 5-андростан-3,17-диолом, а также между андрогенами DHEA и андростенедионом, играя, таким образом, важную роль в метаболизме андрогена, Ge et al., Biology of Reproduction, 1999, 60:855-860. Глюкокортикоиды, диабет и выработка глюкозы в печени Уже больше чем полстолетия назад было показано, что глюкокортикоиды играют центральную роль в развитии диабета. Например, удаление гипофиза или надпочечников у больных диабетом животных приводит к ослаблению наиболее тяжелых симптомов диабета и снижению концентрации глюкозы в крови (Long C.D. and Leukins F.D.W. (1936) J. Exp. Med., 63:465-490; Houssay B.A. (1942) Endocrinology,30:884-892). Хорошо известно также, что глюкокортикоиды позволяют проявиться влиянию глюкагона на печень. Хорошо обоснована роль 11HSD1 как важного регулятора локального эффекта глюкокортикоидов и, таким образом, производства глюкозы в печени (см., например, Jamieson et al. (2000) J. Endocrinol.,165:685-692). У здоровых добровольцев, принимавших неспецифический ингибитор 11HSD1 карбенок-1 014419 солон, повысилась чувствительность печени к инсулину (Walker B.R. et al. (1995) J. Clin. Endocrinol. Metab., 80:3155-3159). Более того, в различных экспериментах на мышах и крысах удалось установить предполагаемый механизм этого явления. В этих исследованиях обнаружили снижение уровня мРНК и активности двух ферментов, играющих ключевую роль в производстве глюкозы в печени, а именно фосфоенолпируват карбоксикиназы (phosphoenolpyruvate carboxykinase, PEPCK), которая лимитирует скорость всего глюконеогенеза, и глюкозо-6-фосфатазы (glucose-6-phosphatase, G6 Раза), катализирующей последний общий этап процессов глюконеогенеза и гликогенолиза. Наконец, содержание глюкозы в крови и ее производство в печени оказались снижены у мышей, нокаутированных по гену 11HSD1. Полученные в этой модели данные подтверждают сделанное ранее предположение, что ингибирование 11HSD1 нe приводит к гипогликемии. (Это предположение было сделано на основании того, что базальные уровни PERCK и G6 Разы регулируются независимо от глюкокортикоидов (Kotelevtsev Y. et al.,(1997) Proc. Natl. Acad. Sci., USA, 94:14924-14929. В заявке FR 2384498 описаны соединения с высоким гипогликемическим эффектом. Таким образом, лечение гипергликемии этими соединениями может привести к гипогликемии. Возможное снижение избыточного веса и связанного с ожирением риска сердечно-сосудистых заболеваний Ожирение является важным фактором в развитии синдрома X и большинства (более 80%) случаев диабета второго типа, причем особое значение имеет жир брюшины. Ожирение брюшной полости тесно связано с непереносимостью глюкозы, гиперинсулинемией, гипертриглицеридемией и другими факторами так называемого синдрома X (то есть повышенного давления крови, сниженного содержания HDL и повышенного VLDL) (MontagueO'Rahilly, Diabetes, 49:883-888, 2000). Ингибирование 11HSD1 в преадипоцитах (клетках стромы) понижает скорость их дифференциации в адипоциты. Предполагается, что это должно приводить к замедлению отложения жира (возможно, к снижению содержания жира) в сальниках (брюшной полости), то есть к ослаблению центрального ожирения (Bujalska I.J., Kumar S. andStewart P.M. (1997) Lancet, 349:1210-1213). Предполагается, что ингибирование 11HSD1 во взрослых адипоцитах должно уменьшать секрецию ингибитора активатора плазминогена 1 (plasminogen activator inhibitor 1, PAI-1), который представляет собой независимый фактор риска в развитии сердечно-сосудистых заболеваний (Halleux C.M. et al.(1999) J. Clin. Endocrinol. Metab., 84:4097-4105). Более того, имеется четко выраженная корреляция между глюкокортикоидной "активностью" и вероятностью сердечно-сосудистых заболеваний, что дает основания делать выводы о благоприятных последствиях снижения глюкокортикоидных эффектов (WalkerB.R. et al. (1998) Hypertension, 31:891-895; Fraser R. et al. (1999) Hypertension, 33:1364-1368). Адреналэктомия уменьшает влияние голодания на повышение потребности в приеме пищи и на усиление экспрессии нейропептида Y в гипоталамусе. Это поддерживает представление о роли глюкокортикоидов в стимулировании приема пищи и позволяет предположить, что ингибирование 11HSD1 в мозге может повысить ощущение сытости и уменьшить потребление пищи (Woods S.C. et al. (1998) Science, 280:1378-1383). Возможные благоприятные эффекты на поджелудочную железу Ингибирование 11HSD1 в выделенных мышиных -клетках поджелудочной железы усиливает секрецию инсулина под действием глюкозы (Davani В. et al. (2000) J. Biol. Chem., 2000, Nov. 10; 275(45):34841-4). Ранее уже было показано, что глюкокортикоиды снижают высвобождение инсулина в поджелудочной железе in vivo (Billaudel В. and Sutter B.C.J. (1979) Horm. Metab. Res., 11:555-560). Это позволяет предположить, что помимо благоприятных эффектов на печень и на процесс отложения жира,ингибирование 11HSD1 может вызывать и другие эффекты, полезные при лечении диабета. Возможные благоприятные эффекты на когнитивную способность, применение при лечении слабоумия Стресс и глюкокортикоиды влияют на когнитивную функцию (de Quervain D.J.-F., Roozendaal В.,and McGaugh J.X. (1998) Nature, 394:787-790). Фермент 11HSD1 контролирует уровень глюкокортикоидной активности в мозге и, таким образом, участвует в формировании нейротоксичности (Rajan V., Edwards С.R.W. and Seckl J.R. (1996) J. Neuroscience, 16:65-70; Seckl J.R., Front. (2000) Neuroendocrinol.,18:49-99). Неопубликованные результаты демонстрируют значительное улучшение памяти у крыс, принимавших неспецифический ингибитор 11HSD1 (J. Seckl, по результатам личного общения). На основании этой информации, а также известных сведений о роли глюкокортикоидов в мозге, можно предположить, что ингибирование 11HSD1 в мозге приведет к снижению тревожности (Tranche F. et al. (1999)Nature Genetics, 23:99-103). В целом, гипотеза заключается в том, что ингибирование 11HSD1 в человеческом мозге может предотвратить реактивацию кортизона в кортизол и защитить от вредных опосредованных глюкокортикоидами эффектов, влияющих на жизнеспособность нейронов и на другие аспекты их функционирования, включая когнитивные расстройства, депрессию и повышенный аппетит. Возможное использование ингибиторов 11HSD1 для иммуномодуляции Может показаться, что глюкокортикоиды подавляют иммунную систему. Фактически, однако, имеет место динамическое взаимодействие между иммунной системой и осью НРА (hypothalamo-pituitary-2 014419adrenal, гипоталамус-гипофиз-надпочечники) (Rook G.A.W. (1999) Baillier's Clin. Endocrinol. Metab.,13:576-581). Баланс между ответом, опосредованным клетками, и гуморальным ответом регулируется глюкокортикоидами. Высокая глюкокортикоидная активность, как, например, при стрессе, связана с гуморальным ответом. Таким образом, ингибирование фермента 11HSD1 предлагается как средство сместить ответ в сторону опосредованной клетками реакции. При некоторых заболеваниях, в том числе при туберкулезе, проказе и псориазе, иммунный ответ слишком сильно смещен в гуморальную сторону, хотя должен бы быть клеточным. Временное, локальное или системное ингибирование 11HSD1 могло бы "подтолкнуть" иммунную систему в сторону правильного реагирования (Mason D. (1991) Immunology Today, 12:57-60; Rook et al., ранее). Аналогичное применение ингибиторов 11HSD1, в данном случае временное, совместно с иммунизацией могло бы гарантировать, что при желании будет получен именно клеточный ответ. Уменьшение внутриглазного давления Согласно последним данным содержание определенных глюкокортикоидных рецепторов и ферментов 11HSD определяет восприимчивость к глаукоме (Stokes J. et al. (2000) Invest. Ophthalmol., 41:16291638). Более того, недавно предложенный новый подход к снижению внутриглазного давления связан как раз с ингибированием 11HSD1 (Walker Е.A. et al., постер Р 3-698 на съезде эндокринологов 12-15 июня 1999 года, Сан Диего). Введение карбеноксолона, неспецифического ингибитора 11HSD1, снижало внутриглазное давление у нормальных людей на 20%. Экспрессия 11HSD1 в глазу ограничена базальными клетками корнеального эпителия и непигментированным эпителием роговицы (область генерации воды), ресничным мускулом и сфинктером и расширяющими мышцами радужной оболочки. Напротив, дистантный изофермент 11HSD2 сильно экспрессируется в непигментированном ресничном эпителии и корнеальном эндотелии. Ни один из этих ферментов не был обнаружен в трабекулярной сети,являющейся центром дренажа. Таким образом, предполагается, что 11HSD1 играет роль в производстве воды, но не в дренаже. В настоящее время неизвестно, происходит ли это в результате воздействия на глюкокортикоидные, на минералокортикоидные рецепторы, или на те и другие. Уменьшение остеопороза Глюкокортикоиды играют важную роль в развитии и функционировании скелета, но их избыток нежелателен. Вызванная ими потеря костной массы связана, по крайней мере, частично с ингибированием образования костной ткани, то есть помимо прочего с подавлением пролиферации остеобластов и синтеза коллагена (Kim C.H., Cheng S.L. and Kim G.S. (1999) J. Endocrinol., 162:371-379). Негативное влияние на образование костных узелков можно блокировать, хотя бы частично, неспецифическим ингибитором карбеноксолоном, что говорит о важной роли 11HSD1 в действии глюкокортикоидов (BellowsC.G., Ciaccia A. and Heersche J.N.M. (1998) Bone, 23:119-125). Другие данные позволяют предположить,что 11HSD1 участвует в создании достаточно высокой концентрации активных глюкокортикоидов в остеокластах и усиливает, тем самым, ресорбцию костной ткани (Cooper M.S. et al. (2000) Bone, 27:375381). Все эти различные данные совместно дают возможность сделать вывод, что ингибирование 11HSD1 может быть полезно при лечении остеопороза, причем эта польза реализуется по нескольким параллельным механизмам. Уменьшение гипертонии 11-Гидроксистероид дегидрогеназа второго типа ингибируется желчными кислотами. Это приводит к сдвигу общего баланса организма в сторону образования кортизола, а не кортизона, что было показано в исследовании отношения концентраций различных метаболитов мочевой кислоты (Quattropani С.,Vogt В., Odermatt A., Dick В., Frey B.M., Frey F.J. (2001) J. Clin. Invest., Nov., 108(9):1299-305. "Уменьшенная активность 11-бета-гидроксистероид дегидрогеназы у пациентов с холестазом"). Предполагается,что снижение активности 11HSD1 в печени путем введения селективного ингибитора обращает этот дисбаланс и в краткосрочном аспекте уравновешивает такие симптомы, как гипертония, пока пациент ожидает хирургической операции по устранению причин закупорки желчи. В патенте WO 99/65884 рассматриваются ингибиторы циклинзависимых киназ, основанные на замещенном по углероду аминотиазоле. Эти соединения могут, например, применяться для лечения рака,воспалений и артрита. В патенте US 5856347 описаны антибактериальные или бактерицидные составы,содержащие производные 2-аминотиазола и/или их соли. Более того, в патенте US 5403857 рассматриваются производные бензолсульфонамида с активностью ингибиторов 5-липоксигеназы. Кроме того,тетрагидротиазоло[5,4-с]пиридины рассматриваются в работе "Болеутоляющие тетрагидротиазоло[5,4 с]пиридины", Fr. Addn. (1969), 18 р., Addn. to Fr. 1498465. CODEN: FAXXA3; FR 94123 19690704 CAN 72:100685, AN 1970:100685 CAPLUS и "4,5,6,7-тетрагидротиазоло[5,4-с]пиридины", Neth. Appl. (1967),39 p. CODEN: NAXXAN NL 6610324 19670124 CAN 68:49593, AN 1968: 49593 CAPLUS. Однако ни один из перечисленных патентов не рассматривает соединения настоящего изобретения или их использование для лечения диабета, ожирения, глаукомы, остеопороза, когнитивных или иммунных расстройств, депрессии и гипертонии. Патент WO 98/16520 рассматривает соединения, ингибирующие матриксные металлопротеиназыUS 5962490 описаны соединения с активностью антагонистов эндотелиновых рецепторов. Соединения из патента WO 00/02851 упоминаются в связи с нарушенным балансом cGMP. Ни одно из этих веществ не соответствует формуле (I) настоящего изобретения. Более того, ничего не сказано об активности этих веществ по отношению к 11HSD1. В патенте US 5783697 рассматриваются производные тиофена как ингибиторы PGE2 и LTB4. Об их активности по отношению к 11HSD1 нe сказано ничего. Патенты ЕР 0558258, ЕР 0569193 и ЕР 1069114 описывают производные изоксазола как агонисты и антагонисты эндотелина. Про активность соединений по отношению к 11HSD1 также не сказано ничего. Заживление ран Кортизол осуществляет большое количество метаболических и других функций. Множественность его эффектов можно продемонстрировать на примере пациентов с пролонгированным повышением уровня глюкокортикоидов в плазме, так называемым "синдромом Кушинга". Пациенты с таким диагнозом характеризуются пролонгированным повышением содержания глюкокортикоидов в плазме и демонстрируют нарушенную переносимость глюкозы, диабет второго типа, центральное ожирение и остеопороз. У них также отмечаются проблемы с заживлением ран и ломкая кожа (Ganong W.F. Review of Medical Physiology, 18-е изд. по ред. Stamford, Connecticut: AppletonLange; 1997). Показано, что кортикостероиды повышают риск инфицирования и замедляют заживление открытых ран (Anstead G.M. Стероиды, ретиноиды и заживление ран. Adv Wound Care, 1998; 11(6):277-85). Пациенты, которых лечат глюкокортикоидами, характеризуются 2-5-кратно повышенным риском осложнений после операций (Diethelm A.G. Хирургическая работа с осложнениями после терапии стероидами. AnnSurg., 1977; 185(3):251-63). В европейской патентной заявкеЕР 0902288 описан метод диагностирования заживляемости ран у пациента, включающий измерение содержания кортизола в этих ранах. Авторы предполагают, что повышенный уровень кортизола в раневой жидкости, по сравнению с нормальным уровнем в плазме здорового человека, характерен для больших незаживающих ран (Hutchinson Т.С., Swaniker H.P. Диагностика ран по измерению уровня кортизола в раневой жидкости. Европейская заявка на патентЕР 0902288,опубликована 17.03.1999). Фермент 11-HSD у человека катализирует превращение кортизола в кортизон и наоборот. У грызунов фермент параллельно осуществляет взаимопревращения кортикостерона и 11-дегидрокортикостерона (Frey F.J., Escher G., Frey B.M. Фармакология 11 бета-гидроксистероид дегидрогеназы. Steroids 1994; 59(2):74-9). Были охарактеризованы два изофермента 11HSD, 11-HSD1 и 11-HSD2. Они отличаются друг от друга по своим функциям и распределению в тканях (Albiston A.L., Obeyesekere V.R.,Smith R.E., Krozowski Z.S. Клонирование и распределение в тканях фермента 11 бета-гидроксистероид дегидрогеназы второго типа. Mol Cell Endocrinol, 1994; 105(2):R11-7). Как и GR, фермент 11-HSD1 экспрессируется в многочисленных тканях, таких как печень, жировая ткань, надпочечники, гонады, легкие,мозг, глаз и т.д. (Monder С., White P.C. 11 бета-гидроксистероид дегидрогеназа. Vitam Horm, 1993; 47:187-271; Stewart P.M., Krozowski Z.S. 11 бета-гидроксистероид дегидрогеназа. Vitam Horm,1999:57:249-324; Stokes J., Noble J., Brett L, Phillips C, Seckl J.R., O'Brien C. et al. Распределение глюкокортикоидных и минералокортикоидных рецепторов и 11 бета-гидроксистероид дегидрогеназы в человеческих и крысиных тканях глаза. Invest Ophthalmol Vis Sci, 2000; 41 (7):1629-38). Функция фермента 11HSD1 заключается в тонкой настройке местного действия глюкокортикоидов. Активность 11-HSD обнаружена в коже людей и грызунов, в фибробластах человека и в сумчатой ткани кожи крыс (HammamiM.M., Siiteri P.K. Регулирование 11 бета-гидроксистероид дегидрогеназной активности в фибробластах человеческой кожи: ферментативная модуляция действия глюкокортикоидов. J. Clin. Endocrinol. Metab.,1991; 73(2):326-34; Cooper M.S., Moore J., Filer A., Buckley C.D., Hewison M., Stewart P.M. 11 бетагидроксистероид дегидрогеназа в фибробластах человека: экспрессия и регуляция зависит от тканиисточника. ENDO 2003, Abstracts 2003; Teelucksingh S., Mackie A.D., Burt D., Mclntyre M.A., Brett L., Edwards C.R. Усиление активности гидрокортизона в коже под действием глицирхетиновой кислоты. Lancet, 1990; 335(8697):1060-3; Slight S.H., Chilakamarri V.K., Nasr S., Dhalla A.K., Ramires F.J., Sun Y. et al. Ингибирование спиронолактоном процесса восстановления тканей: роль минералокортикоидов в образовании фиброзной ткани. Mol. Cell. Biochem. 1998; 189(1-2):47-54). Процесс заживления раны состоит из последовательности событий, включающих воспаление, пролиферацию фибробластов, секрецию земляных субстанций, производство коллагена, ангиогенез, сокращение раны и эпителиализацию. Процесс можно разделить на три фазы: воспаление, пролиферацию и ремоделирование (обзор см. в работе Anstead et al., ранее). У перенесших операцию пациентов лечение глюкокортикоидами повышает риск инфицирования и замедляет заживление открытых ран. На животных моделях показано, что стресс неподвижности замедляет заживление ран на коже и повышает их восприимчивость к бактериальному инфицированию во время заживления. Эти эффекты удается обратить добавлением антагониста глюкокортикоидных рецепторов RU486 (Mercado A.M., Quan N., Padgett D.A., Sheridan J.F., Marucha P.Т. Стресс ограничения под-4 014419 вижности влияет на экспрессию интерлейкина-1 и фактора роста кератиноцитов в ране: гибридизационное исследование in situ. J. Neuroimmunol., 2002; 129(1-2):74-83; Rojas I.G., Padgett D.A., Sheridan J.F.,Marucha P.T. Индуцированная стрессом восприимчивость к бактериальным инфекциям в процессе заживления ран на коже. Brain Behav. Immun., 2002; 16(1):74-84). Глюкокортикоиды производят эти эффекты, подавляя воспалительный процесс, уменьшая сопротивляемость раны инфекциям, ингибируя ее сокращение и задерживая эпителиализацию (Anstead et al., ранее). Это влияние обусловлено вмешательством глюкокортикоидов в действие цитокинов и факторов роста, таких как IGF, TGF-, EGF, KGF иPDGF (Beer H.D., Fassler R., Werner S. Регулируемая глюкокортикоидами экспрессия генов при заживлении ран на коже. Vitam Horm. 2000; 59:217-39; Hamon G.A., Hunt T.K., Spencer E.M. Эффекты in vivo системного введения инсулиноподобного фактора роста I одного и в комплексе со связывающим инсулиноподобный фактор роста протеином-3 нa подавленные кортикостероидами раны. Growth Regul, 1993; 3(1):53-6; Laato M., Heino J., Kahari V.M., Niinikoski J., Gerdin В. Эпидермальный фактор роста предотвращает метилпреднизолон-индуцированное ингибирование заживления ран. J. Surg. Res., 1989; 47(4):354-9; Pierce G.F., Mustoe T.A., Lingelbach J., Masakowski V.R., Gramates P., Deuel T.F. Трансформирование фактора роста бета обращает индуцированное глюкокортикоидом замедление процесса заживления ран у крыс: возможное регулирование производимым тромбоцитами фактором роста. Proc Natl.Acad. Sci., USA, 1989; 86(7):2229-33). Показано также, что глюкокортикоиды снижают синтез коллагена в коже крыс и мышей in vivo, а также в крысиных и человеческих фибробластах (Oishi Y., Fu Z.W., Ohnuki Y., Kato H., Noguchi Т. Молекулярные основы изменения в метаболизме кожного коллагена в ответ на обработку дексаметазоном in vivo: эффекты на синтез коллагенов первого, третьего типа, коллагеназы и содержащихся в тканях ингибиторов металлопротеиназ, Br. J. Dermatol., 2002; 147(5):859-68). В патенте WO 01/90090 описаны соединения тиазола, которые ингибируют человеческий фермент 11-HSD1 и могут быть полезны при лечении таких заболеваний, как диабет, ожирение, глаукома, остеопороз, когнитивные и иммунные расстройства. Другие ингибиторы 11-HSD1 описаны в таких патентах,как, например, WO 01/90091; 01/90092; 01/90093; 01/90094; 03/043999; 03/044000; 03/044009; U.S. PatentPublication2005/009821; WO 04/103980; 04/112784; 04/112781; 04/112785; 04/112783; 04/112782; 04/113310; 04/112779 и шведская патентная заявкаSE 0400227-5, зарегистрированная 4 февраля 2004 года. Однако не было описано использование предлагаемых в настоящем изобретении ингибиторов 11-HSD1 для лечения диабета, ожирения, глаукомы, остеопороза, когнитивных и иммунных расстройств, а также для заживления ран.Okawara et al. описывает синтез тиазол-5-спиропропан-4(5 Н)-онов, хотя и не описывает их использование как ингибиторов 11-HSD1, см. J. Chem. Soc. Perkin Trans. I, 1733-1735 (1986). Раскрытие изобретения Соединения настоящего изобретения решают описанные выше проблемы. Они охватывают новый класс соединений, ингибирующих человеческий фермент 11-гидроксистероид дегидрогеназу типа I(11HSD1), и могут, таким образом, применяться для лечения заболеваний, связанных с активностью 11HSD1, включая, но не ограничиваясь, диабет, ожирение, глаукому, остеопороз, когнитивные расстройства, иммунные расстройства, гипертонию, а также могут использоваться для заживления ран. Соединения настоящего изобретения решают описанные выше проблемы. Они охватывают новый класс соединений, ингибирующих человеческий фермент 11-гидроксистероид дегидрогеназу типа I(11HSD1), и могут, таким образом, применяться для лечения заболеваний, связанных с активностью 11HSD1, включая, но не ограничиваясь, диабет, ожирение, глаукому, остеопороз, когнитивные расстройства, иммунные расстройства, гипертонию, а также могут использоваться для заживления ран. Одним из объектов настоящего изобретения является соединение общей формулы (III) где R5 выбран из группы, содержащей водород, С 1-С 8-алкилы, С 3-10 циклоалкилы, С 3-10 циклоалкилС 1-8 алкилы, арилы, арил-С 1-8 алкилы, гетероциклилы, гетероциклил-С 1-8 алкилы и галоалкилы; где любой арильный, циклоалкильный или гетероциклильный остатки могут содержать один или несколько заместителей, независимо выбранных из числа C1-8 алкилов, арилов, галогенов, гало-С 1-С 8 алкилов, НО-С 1-С 8-алкилов, R8R9N-С 1-С 8-алкилов, С 1-С 8-алкил-OR10, -OR10, (С 3-С 10)циклоалкилов или С 1-С 8-алкилсульфонилов;R7 выбран из числа -NR8R9, гало, С 1-8 алкилов, -(CR8R9)n-OR8, -S-C1-С 8-алкилов, С 3-10 циклоалкилов,гетероциклилов, С 3-10 циклоалкил-С 1-8 алкилов, циано-С 1-8 алкилов, арилов, арил-С 1-8 алкилов, гетероциклил-С 1-8 алкилов, гетероциклил-С(О)-С 1-8 алкилов, гетероциклил-SO2-С 1-8 алкилов, С 1-8 галоалкилов, R8R9NС 1-8 алкилов, НО-С 1-8 алкилов, -С(О)-С 3-С 10-циклоалкилов, -С(О)-С 1-С 8-галоалкилов, -(CR8R9)n-Y(CR8R9)n-гетероциклилов и -(CR8R9)n-Y-(CR8R9)n-C(O)-R8 (где n находится в интервале от 0 до 5, Y=NR10,О или S); где любой арильный, алкильный, гетероциклильный или циклоалкильный остаток может содержать один или несколько заместителей из числа-C(O)-(CR8R9)n-арилов,где любой арильный, алкильный, циклоалкильный или гетероциклильный остатки могут содержать один или несколько заместителей, независимо выбранных из числа С 1-8 алкилов, арилов, галогенов,-NR10R10, С 1-С 8-галоалкилов, НО-С 1-С 8-алкилов, R8R9N-С 1-С 8-алкилов, С 1-С 8-алкил-OR10, -OR10, (С 3 С 10)циклоалкилов или С 1-С 8-алкилсульфонилов, -О-(CR8R9)n-гетероциклилов, -O-(CR8R9)n-C(O)-NR8R9,-O-(CR8R9)n-NR8R9, -Y-(CR8R9)n-NR8-С(О)-С 1-С 8-алкилов, -Y-(CR8R9)n-гетероциклилов, -O-(CR8R9)nNR8R9, С 1-С 8-алкил-SO2 или -О-(CR8R9)n-N-С(О)-гетероциклилов; где R8 и R9 независимо выбраны из группы, содержащей водород, С 1-С 8-алкилы, С 1-С 8 алкоксигруппы, -NR10R10, -S-(С 1-С 8)алкилы, арилы и гетероциклилы; любой алкильный, алкокси, гетероциклильный или арильный остаток может содержать от одного до трех заместителей из числа галогенов, незамещенных С 1-С 8-алкилов, незамещенных С 1-С 8 алкоксигрупп, незамещенных С 1-С 8-тиоалкоксигрупп и незамещенных арил(С 1-С 4)алкилов; где R10 выбран из группы, содержащей водород, С 1-С 8-алкилы, арил-С 1-С 8-алкилы, С 1-С 8 алкоксигруппы, -S-(С 1-С 8)алкилы, гетероциклилы и арилы. Любой алкильный, гетероциклильный или арильный остатки могут содержать от одного до трех заместителей из числа галогенов, незамещенных С 1-С 8-алкилов, незамещенных С 1-С 8-алкоксигрупп, незамещенных С 1-С 8-тиоалкоксигрупп и незамещенных арил(С 1-С 4)алкилов; или R6 и R7 совместно со связанным с ними атомом углерода формируют насыщенный или частично или полностью ненасыщенный С 3-10 циклоалкил или насыщенный, частично или полностью ненасыщенный С 4-С 14-гетероциклил; где циклоалкил или гетероциклил могут содержать один или несколько заместителей, независимо выбранных из числа С 1-С 8-алкилов, арилов, С 1-С 8-галоалкилов, арил-С 1-С 8-алкилов, С 3-С 10 циклоалкилов, -OR8, =O, =NR8, =N-OR8, -NR8R9, -SR8, -галогенов, -OC(O)R8, -C(O)R8, -CO2R8,-CONR8R9, -OC(O)NR8R9, -NR9C(O)R8, -NR8C(O)NR8R9, -NR8SO2NR8R9, -NR8CO2R9, -NHC(NH2)=NH,-NR8C(NH2)=NH, -NHC(NH2)=NR8, -S(O)R8, -SO2R8, -SO2NR8R9, -NR8SO2R9, -CN и -NO2; и фармацевтически приемлемые соли, сольваты, гидраты, геометрические изомеры, таутомеры, оптические изомеры и N-оксиды описанных выше соединений с условием, что если R6 и R7 совместно образуют циклопропильное кольцо, то R5 не бензил. Один аспект изобретения относится к соединениям формулы (III), где R5 выбран из группы, содержащей циклогексил, циклогептил, циклооктил, 2,2,3,3-тетраметилциклопропил, 1-(4-хлорофенил)циклобутил, бицикло[2.2.1]гепт-2-ил, трицикло[3.3.1.03,7]нон-3-ил, циклогексилметил, фенил, 2-метилфенил, 3-метилфенил, 2-изопропилфенил, 2-фторофенил, 2-хлорофенил, 2-фенилпропил, 2-хлоробензил,4-хлоробензил, 4-(2,2,6,6-тетраметил)пиперидил, 2-морфолинил-4-илэтил и тетрагидропиран-4-илметил; иR6 и R7 независимо выбраны из группы, содержащей метил, этил, изопропил, изобутил, трет-бутил,циклогексилметил, цианометил, фенил, 2-гидроксифенил, бензил, 2-гидроксибензил, 4-гидроксибензил,3,4-дигидроксибензил, 1 Н-имидазол-4-илметил, индол-3-илметил, 3-пиридилметил;-6 014419 или R6 и R7 совместно со связанным с ними атомом углерода образуют циклопропил, циклобутил,циклопентил, циклогексил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 представляет собой метил, a R7 - изопропил. Еще один аспект изобретения относится к соединениям формулы (III), где R5 выбран из группы, содержащей, возможно, замещенный С 1-С 8-алкил, возможно, замещенный С 3-С 10-циклоалкил и, возможно,замещенный арил. Еще один аспект изобретения относится к соединениям формулы (III), где R5 представляет собой С 3-С 8-алкил. Еще один аспект изобретения относится к соединениям формулы (III), где R5 представляет собой,возможно, замещенный фенил-(CR10aR10a)1-3- и где R10a независимо выбран из группы, содержащей Н,метил, фторо, или две группы R10a могут совместно образовывать С 3-С 6-циклоалкильное кольцо. Еще один аспект изобретения относится к соединениям формулы (III), где R5 представляет собой(возможно, замещенный фенил)-(С(СН 3)2)-(возможно, замещенный фенил)-(СНСН 3) или бензил. Еще один аспект изобретения относится к соединениям формулы (III), где R5 представляет собой С 3-С 10-циклоалкил. Еще один аспект изобретения относится к соединениям формулы (III), где R5 выбран из группы, содержащей циклогексил, норборнил и адамантил. Еще один аспект изобретения относится к соединениям формулы (III), где R5 представляет собой норборнил. Еще один аспект изобретения относится к соединениям формулы (III), где R5 представляет собой арил. Еще один аспект изобретения относится к соединениям формулы (III), где R5 выбран из группы,возможно, замещенных фенилов. Еще один аспект изобретения относится к соединениям формулы (III), где R6 выбран из группы С 1-С 8-алкилов, С 3-С 10-циклоалкилов, а также насыщенных или частично ненасыщенных гетероциклилов,гетероарилов и арилов. Еще один аспект изобретения относится к соединениям формулы (III), где R6 представляет собой С 1-С 8-алкил. Желательно, чтобы алкил был выбран из группы, содержащей метил, этил, н-пропил и изопропил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 представляет собой С 3-С 10-циклоалкил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 выбран из группы, содержащей циклогексил, норборнил и адамантил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 представляет собой насыщенный или частично ненасыщенный пяти- или шестичленный гетероциклил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 - тетрагидрофурил,пиперидинил и тетрагидропиранил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 представляет собой пяти- или шестичленный гетероарильный цикл. Еще один аспект изобретения относится к соединениям формулы (III), где R6 - пиридил, фурил или пирролил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 - С 6-С 10-арил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 представляет собой,возможно, замещенный фенил или, возможно, замещенный бензил. Еще один аспект изобретения относится к соединениям формулы (III), где R7 выбран из группы, содержащей -NR8R9, С 1-С 8-алкоксигруппы, гетероциклилы и гетероциклил-С 1-С 8-алкилы. Еще один аспект изобретения относится к соединениям формулы (III), где R7 представляет собой 8 9-NR R . Еще один аспект изобретения относится к соединениям формулы (III), где R8 представляет собой метил, этил, изопропил или бутил. Еще один аспект изобретения относится к соединениям формулы (III), где R8 представляет собой изопропил. Еще один аспект изобретения относится к соединениям формулы (III), где R9 представляет собой метил или водород. Еще один аспект изобретения относится к соединениям формулы (III), где R7 представляет собой С 1-С 8-алкоксигруппу. Еще один аспект изобретения относится к соединениям формулы (III), где R7 - метокси-, этокси-,пропокси- или бутоксигруппа. Еще один аспект изобретения относится к соединениям формулы (III), где R7 представляет собой н-бутоксигруппу. Еще один аспект изобретения относится к соединениям формулы (III), где R7 представляет собой-7 014419 насыщенный или частично ненасыщенный пяти- или шестичленный гетероциклил. Еще один аспект изобретения относится к соединениям формулы (III), где R7 - пирролидинил, морфолинил или пиперидинил. Еще один аспект изобретения относится к соединениям формулы (III), где R7 - пиперидинил. Еще один аспект изобретения относится к соединениям формулы (III), где R7 - гетероциклил-С 1-С 8 алкил. Еще один аспект изобретения относится к соединениям формулы (III), где R7 - гетероциклил-С 1-С 3 алкил. Еще один аспект изобретения относится к соединениям формулы (III), где R7 - возможно, замещенный пиперидин-4-ил-СН 2-. Еще один аспект изобретения относится к соединениям формулы (III), где R7 представляет собой 8R -пиперидин-4-ил-СН 2-. Еще один аспект изобретения относится к соединениям формулы (III), где R6 и R7 вместе со связанным с ними атомом углерода формируют, возможно, ненасыщенный С 3-10 циклоалкил или, возможно,ненасыщенный С 4-С 14-гетероциклил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 и R7 формируют, возможно, ненасыщенный С 3-10 циклоалкил. Еще один аспект изобретения относится к соединениям формулы (III), где R6 и R7 формируют шестичленный спироцикл. Еще один аспект изобретения относится к соединениям формулы (III), где R6 и R7 формируют пятичленный спироцикл. Еще один аспект изобретения относится к соединениям формулы (III), где R6 и R7 формируют, возможно, ненасыщенный С 4-С 14-гетероциклил. Еще один аспект изобретения относится к соединениям формулы (III), где, возможно, ненасыщенный С 4-С 14-гетероциклил представляет собой шестичленную гетероциклическую спиросистему. Еще один аспект изобретения относится к соединениям формулы (III), где С 4-С 14-гетероциклил представляет собой спиросистему на основе циклического амида. Одним из аспектов изобретения являются соединения, выбранные из числа следующих: 2-(бицикло[2.2.1]гепт-2-иламино)-5-изопропил-1,3-тиазол-4(5 Н)-он,2-(бицикло[2.2.1]гепт-2-иламино)-5-этил-1,3-тиазол-4(5 Н)-он,2-(бицикло[2.2.1]гепт-2-иламино)-5-фенил-1,3-тиазол-4(5 Н)-он,2-(циклогексиламино)-5-этил-1,3-тиазол-4(5 Н)-он,2-(бицикло[2.2.1]гепт-2-иламино)-5,5-диметил-1,3-тиазол-4(5 Н)-он,5-изопропил-2-(трицикло[3.3.1.03,7]нон-3-иламино)-1,3-тиазол-4(5 Н)-он,6-(трицикло[3.3.1.03,7]нон-3-иламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он,2-(трицикло[3.3.1.03,7]нон-3-иламино)-1,3-тиазол-4(5 Н)-он,6-(циклооктиламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он,6-(циклогептиламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он,6-(бицикло[2.2.1]гепт-2-иламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он,6-[(2,2,3,3-тетраметилциклопропил)амино]-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он,6-[(2-метилфенил)амино]-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он,2-[(циклогексилметил)амино]-5,5-диметил-1,3-тиазол-4(5 Н)-он,2-[(2-фторофенил)амино]-5-изопропил-1,3-тиазол-4(5 Н)-он,2-[(циклогексилметил)амино]-5-(2-гидроксифенил)-1,3-тиазол-4(5 Н)-он,(5S)-2-(циклогептиламино)-5-метил-1,3-тиазол-4(5 Н)-он,(5R)-2-(циклогептиламино)-5-метил-1,3-тиазол-4(5 Н)-он,2-(циклогептиламино)-5-этил-1,3-тиазол-4(5 Н)-он,2-(циклогептиламино)-5-изопропил-1,3-тиазол-4(5 Н)-он,5-трет-бутил-2-(циклогептиламино)-1,3-тиазол-4(5 Н)-он,2-(циклооктиламино)-5-этил-1,3-тиазол-4(5 Н)-он,5-изопропил-2-[(2-изопропилфенил)амино]-1,3-тиазол-4(5 Н)-он,5-этил-2-[(2-изопропилфенил)амино]-1,3-тиазол-4(5 Н)-он,2-[(2-хлорофенил)амино]-5-этил-1,3-тиазол-4(5 Н)-он,5-этил-2-[(2-метилфенил)амино]-1,3-тиазол-4(5 Н)-он,5-изопропил-2-[(2,2,3,3-тетраметилциклопропил)амино]-1,3-тиазол-4(5 Н)-он,2-(бицикло[2.2.1]гепт-2-иламино)-5-(4-гидроксибензил)-1,3-тиазол-4(5 Н)-он,5-[(циклогексилметил)амино]-4-тиа-6-азаспиро[2.4]гепт-5-ен-7-он,2-(циклогептиламино)-5-(3,4-дигидроксибензил)-1,3-тиазол-4(5 Н)-он,2-(циклогептиламино)-5-(1 Н-имидазол-4-илметил)-1,3-тиазол-4(5 Н)-он,2-(циклогептиламино)-5-изобутил-1,3-тиазол-4(5 Н)-он,2-(циклогептиламино)-5-(1 Н-индол-3-илметил)-1,3-тиазол-4(5 Н)-он,2-(циклогептиламино)-5-(4-гидроксибензил)-1,3-тиазол-4(5 Н)-он,-8 014419(5R)-2-(циклогептиламино)-5-(циклогексилметил)-1,3-тиазол-4(5 Н)-он,2-(циклооктиламино)-5-(4-гидроксибензил)-1,3-тиазол-4(5 Н)-он,(5S)-2-(циклогептиламино)-5-(циклогексилметил)-1,3-тиазол-4(5 Н)-он,[2-(циклогептиламино)-4-оксо-4,5-дигидро-1,3-тиазол-5-ил]ацетонитрил,2-(циклогептиламино)-5-(пиридин-3-илметил)-1,3-тиазол-4(5 Н)-он,5-изопропил-2-[(2-метилфенил)амино]-1,3-тиазол-4(5 Н)-он,2-(циклооктиламино)-5,5-диметил-1,3-тиазол-4(5 Н)-он,2-(циклооктиламино)-5-изопропил-1,3-тиазол-4(5 Н)-он,2-(бицикло[2.2.1]гепт-2-иламино)-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он,2-(трицикло[3.3.1.03,7]нон-3-иламино)-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он,2-(циклогептиламино)-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он,2-(циклооктиламино)-1-тиа-3-азаспиро[4.5]дец-2-ен-4-он,2-[1-(4-хлорофенил)циклобутил]амино-5-изопропил-1,3-тиазол-4(5 Н)-он,6-[1-(4-хлорофенил)циклобутил]амино-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он,2-(циклогептиламино)-5,5-диэтил-1,3-тиазол-4(5 Н)-он,(5S)-5-изопропил-2-[(2S)-2-фенилпропил]амино-1,3-тиазол-4(5 Н)-он,(5R)-5-этил-2-[(2S)-2-фенилпропил]амино-1,3-тиазол-4(5 Н)-он,(5S)-5-этил-2-[(2S)-2-фенилпропил]амино-1,3-тиазол-4(5 Н)-он,(5R)-5-изопропил-2-[(2R)-2-фенилпропил]амино-1,3-тиазол-4(5 Н)-он,(5S)-5-изопропил-2-[(2R)-2-фенилпропил]амино-1,3-тиазол-4(5 Н)-он,(5R)-5-этил-2-[(2R)-2-фенилпропил]амино-1,3-тиазол-4(5 Н)-он,(5S)-5-этил-2-[(2R)-2-фенилпропил]амино-1,3-тиазол-4(5 Н)-он,2-анилино-5-изопропил-1,3-тиазол-4(5 Н)-он,5-изопропил-2-[(2-морфолин-4-илэтил)амино]-1,3-тиазол-4(5 Н)-он,2-(бицикло[2.2.1]гепт-2-иламино)-1-тиа-3-азаспиро[4.4]нон-2-ен-4-он,2-(циклогептиламино)-1-тиа-3-азаспиро[4.4]нон-2-ен-4-он,2-(циклооктиламино)-1-тиа-3-азаспиро[4.4]нон-2-ен-4-он,2-[(2,2,3,3-тетраметилциклопропил)амино]-1-тиа-3-азаспиро[4.4]нон-2-ен-4-он,2-[(2-хлоробензил)амино]-5-изопропил-1,3-оксазол-4(5 Н)-он,2-[(4-хлоробензил)амино]-5-изопропил-1,3-оксазол-4(5 Н)-он,5-изопропил-2-[(2,2,6,6-тетраметилпиперидин-4-ил)амино]-1,3-оксазол-4(5 Н)-он,5-изопропил-2-[(2-морфолин-4-илэтил)амино]-1,3-оксазол-4(5 Н)-он,5-бензил-2-[(циклогексилметил)амино]-1,3-оксазол-4(5 Н)-он,2-(циклогептиламино)-5-изопропил-1,3-оксазол-4(5 Н)-он,2-(бицикло[2.2.1]гепт-2-иламино)-5-изопропил-1,3-оксазол-4(5 Н)-он,2-(бицикло[2.2.1]гепт-2-иламино)-5-изобутил-1,3-оксазол-4(5 Н)-он,2-(циклогептиламино)-5-изобутил-1,3-оксазол-4(5 Н)-он,5-изобутил-2-[(2-метилфенил)амино]-1,3-оксазол-4(5 Н)-он,2-(бицикло[2.2.1]гепт-2-иламино)-5-изопропил-5-метил-1,3-тиазол-4(5 Н)-он,5-этил-2-[(3-метилфенил)амино]-1,3-тиазол-4(5 Н)-он,5-изопропил-2-морфолин-4-ил-1,3-оксазол-4(5 Н)-он,2-(4-бензилпиперидин-1-ил)-5-изопропил-1,3-оксазол-4(5 Н)-он,2-азокан-1-ил-5-изопропил-1,3-оксазол-4(5 Н)-он,2-[(циклогексилметил)амино]-5-фенил-1,3-оксазол-4(5 Н)-он и 2-(циклогептиламино)-5-фенил-1,3-оксазол-4(5 Н)-он,а также фармацевтически приемлемые соли, сольваты, гидраты, геометрические изомеры, таутомеры, оптические изомеры, N-оксиды и пролекарственные формы описанных соединений. Еще одним аспектом изобретения является фармацевтическая композиция, содержащая соединения формулы (III) в качестве активного ингредиента, совместно с фармацевтически приемлемым носителем или разбавителем. В соответствии с еще одним аспектом фармацевтическая композиция составляется для орального применения. В одном своем аспекте форма для орального применения представляет собой таблетку. Еще один аспект изобретения представляет собой метод профилактики или лечения заболеваний,опосредуемых 11 гидроксистероид дегидрогеназой типа I, или метод иммуномодуляции, заключающийся во введении человеку соединения формулы (III). По одному аспекту заболевание выбрано из группы, содержащей диабет, синдром X, ожирение,глаукому, гиперлипидемию, гипергликемию, гиперинсулинемию, гипертонию, остеопороз, деменцию,депрессию, вирусные заболевания и воспаления. Еще один аспект связан с лечением или профилактикой заболеваний, при которых наблюдается замедленное или нарушенное заживление ран. Еще один аспект связан с методом лечения заболеваний, при которых наблюдается замедленное-9 014419 или нарушенное заживление ран, если таким заболеванием является диабет. Еще один аспект связан с методом лечения медицинских состояний, при которых наблюдается замедленное или нарушенное заживление ран, если такое состояние вызвано приемом глюкокортикоидов. Еще один аспект связан с методом лечения, усиливающим способность к заживлению хронических ран, таких как диабетические, венные или пролежневые язвы. Еще один аспект связан с иммуномодуляцией при таких заболеваниях, как туберкулез, проказа и псориаз. Еще одним аспектом изобретения является метод ингибирования фермента 11 гидроксистероид дегидрогеназы первого типа, включающий в себя назначение эффективного количества соединения в соответствии с формулой (III) нуждающимся в таком лечении пациентам. Один аспект изобретения связан с соединениями, выбранными из группы 2-[1-(4-фторофенил)этиламино]-5-метил-5-(тетрагидропиран-4-илметил)тиазол-4-он;(5R)-2-1S,2S,4R)-бицикло[2.2.1]гепт-2-иламино)-5-метил-5-(трифторометил)-1,3-тиазол-4(5 Н)-он; 2-(бицикло[2.2.1]гепт-2-иламино)-5-(1-фторо-1-метилэтил)-5-метилтиазол-4-он; 2-[1-(4-фторофенил)этиламино]-5-метил-5-пиридин-4-илтиазол-4-он; 5-метил-5-пиридин-4-ил-2-[1-(2-трифторометилфенил)этиламино]тиазол-4-он; 2-[1-(2-фторофенил)этиламино]-5-метил-5-пиридин-4-илтиазол-4-он; 5-(1-фторо-1-метилэтил)-2-[1-(2-фторофенил)этиламино]-5-метилтиазол-4-он; 2-[1-(2-фторофенил)этиламино]-5-метил-5-трифторометилтиазол-4-он; 5-(1,1-дифтороэтил)-2-[1-(4-фторофенил)этиламино]-5-метилтиазол-4-он; 2-[1-(2-хлорофенил)этиламино]-5-метил-5-трифторометилтиазол-4-он; 2-[1-(4-фторофенил)этиламино]-5-метил-5-трифторометилтиазол-4-он; 2-[1-(2-хлорофенил)этиламино]-5-метил-5-трифторометилтиазол-4-он; 2-[1-(4-фторофенил)этиламино]-5-(2-метоксипиридин-4-ил)-5-метилтиазол-4-он; 5-(1,1-дифтороэтил)-2-[1-(4-фторофенил)этиламино]-5-метилтиазол-4-он и 5-(1-фторо-1-метилэтил)-2-[1-(4-фторофенил)этиламино]-5-метилтиазол-4-он, и фармацевтически приемлемые соли, сольваты, гидраты, геометрические изомеры, таутомеры, оптические изомеры и N-оксиды названных соединений. Еще одним объектом настоящего изобретения является фармацевтическая рецептура, включающая соединение формулы (III), используемое для лечения в качестве активного ингредиента, и фармацевтически приемлемый разбавитель или носитель. Эта рецептура, в особенности, может применяться при лечении или профилактике болезней, связанных с функционированием фермента 11 гидроксистероид дегидрогеназы первого типа, или для иммуномодуляции. Фармацевтическая рецептура может включать и второй активный ингредиент. Последний может также быть ингибитором 11 гидроксистероид дегидрогеназы первого типа, а может проявлять какую-либо другую активность. Еще один объект настоящего изобретения представляет собой метод профилактики или лечения заболеваний, опосредуемых 11 гидроксистероид дегидрогеназой типа I, а также для иммуномодуляции,заключающийся во введении нуждающемуся в таком лечении человеку эффективного количества соединения формулы (III). Еще один объект настоящего изобретения представляет собой метод ингибирования фермента 11-гидроксистероид дегидрогеназы типа I, заключающийся во введении нуждающемуся в таком лечении человеку эффективного количества соединения формулы (III). Еще один объект настоящего изобретения связан с использованием соединений, соответствующих формуле (III), для изготовления медикаментов, применяемых при профилактике или лечении заболеваний, опосредуемых 11 гидроксистероид дегидрогеназой типа I, или для иммуномодуляции. Примерами заболеваний, опосредуемых 11 гидроксистероид дегидрогеназой типа I, являются диабет, синдром X, ожирение, глаукома, остеопороз, гиперлипидемия, гипергликемия, гиперинсулинемия, гипертония, когнитивные расстройства, деменция, депрессия, нарушения иммунитета, вирусные заболевания, нарушения процесса заживления ран, а также воспалительные заболевания.- 10014419 Предпочтительным состоянием, связанным с замедленным или нарушенным заживлением ран, является диабет. Еще одно предпочтительное состояние, связанное с замедленным или нарушенным заживлением ран, бывает вызвано лечением глюкокортикоидами. Соединения, соответствующие формулам (III), могут применяться для ускорения процесса заживления хронических ран, таких как диабетические, венозные или пролежневые язвы. Предпочтительное заболевание для иммуномодуляции - туберкулез, проказа или псориаз. Кроме того, к области, охваченной настоящим изобретением, относится метод приготовления соединений формулы (III). Данный метод включает в себя использование описанных здесь промежуточных соединений и их взаимодействие с одним или более реагентами с образованием соединений формулы(III), включая любые специфически описанные здесь процессы. Использование соединений формулы (III) для изготовления медикаментов, применяемых при лечении или профилактике заболеваний, опосредуемых 11 гидроксистероид дегидрогеназой типа I, или для иммуномодуляции. В соответствии с одним аспектом заболевание выбирают из группы, включающей в себя диабет, синдром X, ожирение, глаукому, гиперлипидемию, гипергликемию, гиперинсулинемию,гипертонию, остеопороз, деменцию, депрессию, вирусные и воспалительные заболевания. В соответствии с другим аспектом медицинское состояние может включать замедленное или нарушенное заживление ран. В соответствии с другим аспектом состоянием, связанным с замедленным или нарушенным заживлением ран, является диабет. В соответствии с еще одним аспектом состояние, связанное с замедленным или нарушенным заживлением ран, может быть вызвано лечением глюкокортикоидами. Согласно еще одному аспекту изобретения соединения могут применяться для ускорения процесса заживления хронических ран, таких как диабетические, венозные или пролежневые язвы. В еще одном аспекте иммуномодуляцию можно применять при лечении таких заболеваний, как туберкулез, проказа и псориаз. Остальные особенности и преимущества изобретения станут очевидны из подробного описания и из патентной формулы. Осуществление изобретения Соединения настоящего изобретения могут назначаться по нескольким показаниям, которые подразумевают участие фермента 11 гидроксистероид дегидрогеназы первого типа. Так соединения настоящего изобретения могут применяться при лечении деменции (см. патент WO 97/07789), остеопороза (см.Canalis E., 1996, "Механизм действия глюкокортикоидов в костной ткани: роль в индуцированном глюкокортикоидами остеопорозе", Journal of Clinical Endocrinology и Metabolism, 81, 3441-3447), а также расстройств иммунной системы (см. Franchimont et al., "Ингибирование глюкокортикоидами иммунного ответа Th1: дексаметазон селективно ингибирует II-12 индуцированное фосфорилирование Stat 4 в Т-лимфоцитах", The Journal of Immunology, 2000, Feb. 15, vol. 164 (4), с. 1768-74) и описанных выше патологических состояний. Далее разъясняются различные термины, использованные совместно и по отдельности в приводившемся выше описании соединений формулы (III), и их модификаций формулы (I), (II) и (IV), которые описаны далее. Термин "арил" в настоящем описании используется для обозначения ароматических циклов (моноциклических или бициклических), содержащих от 6 до 10 атомов углерода, например фенил (Ph), нафтил и инданил (то есть 2,3-дигидроинденил), которые могут содержать C1-6 алкилы как заместители. Примерами замещенным арильных групп являются бензил и 2-метилфенил. Термин "гетероарил" в настоящем описании означает моноциклическую, би- и трициклическую ароматическую систему (один цикл обязательно должен быть ароматическим), содержащую от 5 до 14,предпочтительно от 5 до 10 атомов в цикле (то есть 5, 6, 7, 8, 9 или 10 атомов в моно- или бициклической системе), из которых один или более атомов в цикле не являются атомами углерода. Например, в циклическую систему могут входить такие атомы, как азот, сера, кислород или селен. Примерами гетероарильных циклов являются пиррол, имидазол, тиофен, фуран, тиазол, изотиазол, тиадиазол, оксазол, изоксазол, оксадиазол, пиридин, пиразин, пиримидин, пиридазин, пиразол, триазол, тетразол, хроман, изохроман, хинолин, хиноксалин, изохинолин, фталазин, цинналин, хинозолин, индол, изоиндол, бензотиофен,бензофуран, изобензофуран, бензоксазол, 2,1,3-бензоксадиазол, бензопиразол, бензотиазол, 2,1,3-бензотиазол, 2,1,3-бензоселенодиазол, бензимидазол, индазол, бензодиоксан, индан, 1,5-нафтиридин,1,8-нафтиридин, акридин, феназин и ксантен. Термины "гетероциклический" или "гетероциклил" в настоящем описании обозначают ненасыщенные, а также частично или полностью насыщенные моно-, би- и трициклы, содержащих в циклах от 4 до 14 атомов (желательно от 4 до 10 атомов), причем один или несколько входящих в циклическую систему атомов являются гетероатомами (например, кислород, сера или азот), а остальные являются атомами углерода. Например, к этой категории относятся упомянутые выше гетероарилы, а также соответствующие им частично или полностью насыщенные гетероциклы. Примерами насыщенных гетероциклов являются азетидин, пирролидин, пиперидин, пиперазин, морфолин, тиоморфолин, 1,4-оксазепан, азепан, фталимидин, индолин, изоиндолин, 1,2,3,4-тетрагидрохинолин, 1,2,3,4-тетрагидроизохинолин, 3,4-дигидро-2 Н- 11014419 1,4-бензоксазин, гексагидроазепин, 3,4-дигидро-2(1 Н)-изохинолин, 2,3-дигидро-1 Н-индол, 1,3-дигидро 2 Н-изоиндол, азокан, 1-окса-4-азаспиро[4.5]дец-4-ен, декагидроизохинолин и 1,4-диазепан. Помимо этого, у одного или нескольких атомов гетероциклильной или гетероциклической группы могут быть заместители в виде оксогрупп. В настоящей заявке С 1-8 алкил в соединениях формулы (I) может представлять собой прямую или разветвленную алкильную группу, содержащую 1-8 атомов углерода. Примерами алкильных групп являются метил, этил, н-пропил, изопропил, н-бутил, сек-бутил, трет-бутил, пентил, изопентил, гексил,изогексил, н-гептил и н-октил. В диапазон соединений, охваченных термином С 1-8 алкил, входят меньшие группы, такие как С 1-7 алкил, C1-6 алкил, С 1-5 алкил, С 1-4 алкил, С 2-8 алкил, С 2-7 алкил, С 2-6 алкил, С 2-5 алкил,С 3-7 алкил, С 4-6 алкил и т.д. В настоящей заявке С 1-8 алкокси в соединениях формулы (I) может представлять собой прямую или разветвленную алкоксигруппу, содержащую 1-8 атомов углерода. Примерами алкоксигрупп являются метокси, этокси, пропокси, изопропокси, бутокси, сек-бутокси, трет-бутокси, пентилокси, изопентилокси, гексилокси, изогексилокси, н-гептилокси и н-октилокси. В диапазон соединений, охваченных термином С 1-8 алкокси, входят меньшие группы, такие как С 1-7 алкокси, С 1-6 алкокси, С 1-5 алкокси, С 1-4 алкокси,С 2-8 алкокси, С 2-7 алкокси, С 2-6 алкокси, С 2-5 алкокси, С 3-7 алкокси, С 4-6 алкокси и т.д. В настоящей заявке С 1-8 ацил в соединениях формулы (I) может представлять собой прямую или разветвленную ацильную группу, содержащую 1-8 атомов углерода. Примерами ацильных групп являются формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, н-гексаноил, н-гептаноил и н-октаноил. В диапазон соединений, охваченных термином С 1-8 ацил, входят меньшие группы, такие как С 1-7 ацил, С 1-6 ацил, С 1-5 ацил, С 1-4 ацил, С 2-8 ацил, С 2-7 ацил, С 2-6 ацил, С 2-5 ацил, С 3-7 ацил, С 4-6 ацил и т.д. В настоящей заявке С 2-8 алкенил в соединениях формулы (I) может представлять собой прямую или разветвленную алкенильную группу, содержащую 2-8 атомов углерода. Примерами алкенильных групп являются винил, 1-пропенил, 2-пропенил, изопропенил, 1-бутенил, 2-бутенил, 1-пентенил, 2-пентенил,1-гексенил, 2-гексенил, 1-гептенил и 1-октенил. В диапазон соединений, охваченных термином С 2-8 алкенил, входят меньшие группы, такие как С 2-7 алкенил, С 2-6 алкенил, С 2-5 алкенил, С 2-4 алкенил, С 3-8 алкенил,С 3-7 алкенил, С 3-6 алкенил, С 3-5 алкенил, С 4-7 алкенил, С 5-6 алкенил и т.д. В настоящей заявке С 3-10 циклоалкил в соединениях формулы (I) может представлять собой, возможно, содержащую заместители моноциклическую, бициклическую или трициклическую алкильную группу, содержащую от 3 до 10 атомов углерода. Примерами циклоалкильных групп являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил,бицикло[2.2.1]гепт-2-ил,трицикло[3.3.1.0-3,7]нон-3-ил,(1R,2R,3R,5S)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, 1-адамантил, норадаминтил и 2,2,3,3-тетраметилциклопропил. В диапазон соединений, охваченных термином С 3-10 циклоалкил, входят меньшие группы, такие как С 3-9 циклоалкил, С 3-7 циклоалкил, С 3-6 циклоалкил, С 3-5 циклоалкил, С 4-10 циклоалкил, С 5-10 циклоалкил, С 6-10 циклоалкил, С 7-10 циклоалкил, С 8-9 циклоалкил и т.д. Помимо этого, у одного или нескольких атомов циклоалкильной группы могут быть заместители в виде оксогрупп. В настоящей заявке С 3-10 циклоалкенил в соединениях формулы (I) может представлять собой, возможно, содержащую алкильные заместители моноциклическую, бициклическую или трициклическую алкенильную группу, содержащую в целом от 3 до 10 атомов углерода. Примерами циклоалкенильных групп являются циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, циклононенил, циклодеценил и бицикло[2.2.1]гепт-5-ен-2-ил. В интервал соединений, охваченных термином С 3-10 циклоалкенил, входят меньшие группы, такие как С 3-9 циклоалкенил, С 3-8 циклоалкенил, С 3-7 циклоалкенил, С 3-6 циклоалкенил, С 3-5 циклоалкенил, С 4-10 циклоалкенил, С 5-10 циклоалкенил,С 6-10 циклоалкенил, С 7-10 циклоалкенил, С 8-9 циклоалкенил и т.д. Помимо этого, у одного или нескольких атомов циклоалкенильной группы могут быть заместители в виде оксогрупп. Термины "галоген" или "гало" в настоящем описании соответствуют фтору, хлору, брому и йоду. Термин "сульфанил" в настоящем описании означает тиогруппу. Термин "-гетеро(C1-С 8)алкил" означает структуру, в которой атом из числа азота, серы или кислорода, возможно, содержащих заместители, является точкой прикрепления к центральной молекуле и связан с C1-С 8-алкильной цепочкой. Термин "спиросистема с циклическим амидом" означает соединения, в которых заместители в пятом положении тиазолинонового или оксазолонового цикла соединены вместе, образуя еще один цикл,содержащий структуру -NR10C(O)-. Пример такого вещества показан ниже Термин "моно- или дизамещенный" в настоящем описании означает, что соответствующая функциональная группа может содержать заместители, независимо выбранные из числа С 1-8 ацилов, С 2-8 алкенилов, С 1-8-(цикло)алкилов, арилов, пиридилметилов или гетероциклических систем, таких как азетидин,- 12014419 пирролидин, пиперидин, пиперазин, морфолин и тиоморфолин, причем эти системы могут содержать С 1-8 алкилы в качестве заместителей. Выражение "возможно, моно- или дизамещенный" означает в настоящем описании, что соответствующая функциональная группа может содержать заместитель - водород. Если два или несколько описанных выше терминов используются совместно, это означает, что последующая группа содержит предыдущую в качестве заместителя. Например, выражение "С 3-10 циклоалкил-С 1-8 алкил" означает, что у С 1-8 алкильной группы имеется заместитель -С 3-10 циклоалкил. Аналогично,выражение "С 1-8 галоалкил" означает C1-8 алкильную группу с заместителем - атомом галогена. Метаболиты соединений формул (I), (II), (III) и (IV) могут принимать различные формы, настоящее изобретение включает в себя метаболиты вместе с порождающими их соединениями. В настоящей заявке термин "пролекарство" означает производную соединения, которая может гидролизоваться, окисляться или вступать в другие реакции в биологических условиях (in vivo и in vitro),образуя активное соединение. В особенности это касается производных бензамида. Примеры пролекарств включают, но не ограничиваются, производными и метаболитами производных бензамида, такими как биогидролизуемые группы (например, биогидролизуемые амиды, сложные эфиры, карбаматы,карбонаты, уреиды и фосфаты, такие как монофосфаты, дифосфаты и трифосфаты). Желательно, чтобы пролекарства на основе соединений с карбоксильными функциональными группами представляли собой низшие алкильные эфиры карбоновых кислот. Карбоксилаты обычно делают этерификацией любой из карбоксильных групп в молекуле. Пролекарства, как правило, готовят хорошо известными методами,например, описанными в книге Burger's Medicinal Chemistry and Drug Discovery, 6th ed. (Donald J. Abraham ed., 2001, Wiley) и работе "Приготовление и использование пролекарств" (Н. Bundgaard ed., 1985,Harwood Academic Publishers Gmfh). Таутомером называют один из двух или более структурных изомеров, существующих в равновесии и легко превращающихся из одной изомерной формы в другую. В данном случае таутомеры приведенных далее структур защищены настоящим изобретением Термин "гидрат" в данной заявке означает такую форму соединений, соответствующих формулам(I), (II), (III) и (IV), когда молекулы воды входят в определенном соотношении в состав кристаллической структуры соединения как ее составная часть. Термин "сольват" в данной заявке означает такую форму соединений, соответствующих формулам(I), (II), (III) и (IV), когда молекулы растворителя входят в определенном соотношении в состав кристаллической структуры соединения как ее составная часть. В зависимости от структуры фраза "фармацевтически приемлемая соль" означает здесь фармацевтически приемлемую соль неорганической кислоты или основания и производного бензамида. В качестве примеров таких солей можно назвать, например, соли щелочных и щелочно-земельных металлов или аммония, водорастворимые и водонерастворимые соли, такие как ацетаты, амсонаты (4,4-диаминостильбен-2,2-дисульфонаты), бензолсульфонаты, бензоаты, бикарбонаты, бисульфаты, битартраты, бораты,бромиды, бутираты, соли кальция, едетаты кальция, камсилаты, карбонаты, хлориды, цитраты, клавулариаты, дигидрохлориды, едетаты, едисилаты, естолаты, фиунараты, глюцептаты, глюконаты, глутаматы,гликоллиларсанилаты, гексафторофосфаты, гексилрезорцинаты, гидрабамины, гидробромиды, гидрохлориды, гидроксинафтаноаты, иодины, изотионаты, лактаты, лактобионаты, лаураты, малаты, малеаты,манделаты, месилаты, метилбромиды, метилнитраты, метилсульфаты, мукаты, нафсилаты, нитраты, сольN-метилглюкамин аммония, 3-гидрокси-2-нафтоаты, олеаты, оксалаты, пальмитаты, памоаты (1,1-метенбис-2-гидрокси-3-нафтоаты, эйнбонаты), пантотенаты, фосфаты/дифосфаты, пикраты, полигалактуронаты, пропионаты, п-толуолсульфонаты, салицилаты, стеараты, субацетаты, сукцинаты, сульфаты, сульфосаликулаты, сураматы, таннаты, тартраты, теоклаты, тосилаты, триэтилиодиды и валераты. Более того, в структуре фармацевтически приемлемой соли может быть более одного заряженного атома. В таком случае для фармацевтически приемлемой соли может потребоваться несколько противоионов. Следовательно, в состав фармацевтически приемлемой соли может входить один или более заряженных атомов и/или один или более противоионов. Термин "геометрические изомеры" означает здесь соединения с одинаковой молекулярной формулой, но атомы, в которых находятся в различных неэквивалентных положениях один по отношению к другому. Термин "оптические изомеры" означает здесь соединения с хиральными атомами, которые обладают способностью вращать плоскость поляризованного света, R/S конфигурации. В категорию оптических изомеров входят энантиомеры и диастереомеры, а также соединения, отличающиеся друг от друга- 13014419 указанием символа (D) или (L). В данной заявке используются следующие сокращения:DCM означает дихлорметан,DEAD - диэтил азокарбоксилат,DMF - диметилформамид,EDCI - 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид,эфир - диэтиловый эфир,EtOAc - этилацетат,HOBt - 1-гидроксибензотриазол,HPLC - высокоэффективную жидкостную хроматографию (ВЭЖХ),LC - жидкостную хроматографию,MeCN - ацетонитрил,DPPA - дифенилфосфорил азид,RT - комнатную температуру,SM - исходный материал,TEA - триэтиламин,THF - тетрагидрофуран. В настоящем изобретении используются только такие комбинации заместителей и условий, которые приводят к образованию стабильных соединений. Термин "стабильный" в данном описании означает соединения, достаточно стабильные, чтобы обеспечить их изготовление, и которые сохраняют свою целостность достаточно продолжительное время, чтобы могли использоваться для описанных здесь целей(например, терапевтическое назначение пациенту для лечения заболевания, ингибирование 11HSD1,лечение болезни, опосредованной 11HSD1). Термин "пролекарственная форма" в настоящем описании означает фармакологически приемлемое производное, такое как сложный эфир или амид, которое биотрансформируется в организме с образованием активного вещества (см. Goodman и Gilman's, The Pharmacological basis of Therapeutics, 8th ed.,McGraw-Hill, Int. Ed. 1992, "Биотрансформация лекарств", р. 13-15). Термин "фармацевтически приемлемый" означает в данном описании полезность в приготовлении фармацевтических композиций, которые, в общем случае, безопасны, нетоксичны, не являются нежелательными в биологическом или каком-либо другом отношении, а также полезны при использовании в ветеринарии или для использования в фармацевтике при лечении людей. Термин "фармацевтически приемлемая соль" означает в настоящем описании соли, фармацевтически приемлемые в смысле, разъясненном выше, и обладающие желательной фармакологической активностью. Такие соли включают соли присоединения кислот, образованные с органическими и неорганическими кислотами, такими как хлорид водорода, бромид водорода, иодид водорода, серная кислота, фосфорная кислота, уксусная кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, щавелевая кислота, метансульфоновая кислота, трифторуксусная кислота, фумаровая кислота, янтарная кислота,винная кислота, лимонная кислота, бензойная кислота, аскорбиновая кислота и т.п. Соли присоединения оснований образуются с органическими и неорганическими основаниями, такими как образованные натрием, аммонием, кальцием, калием, этаноламином, диэтаноламином, N-метилглюкамином, холином и подобными им. В это изобретение включены фармацевтически приемлемые соли или соединения любого описанного здесь состава. Соответствующие настоящему изобретению фармацевтические композиции содержат фармацевтически приемлемый носитель и не менее одного соединения, соответствующего описанной выше формуле(I), растворенного или диспергированного в нем в качестве активного или антимикробного ингредиента. Желательно, чтобы при введении человеку для терапевтических целей терапевтическая композиция не была иммуногенна, если она не предназначена для индуцирования иммунного ответа. Процесс приготовления фармацевтической композиции, содержащей диспергированные или растворенные активные ингредиенты, хорошо известен в фармацевтике. Обычно такие композиции готовят в виде стерильных пригодных для инъекции растворов или суспензий, водных или неводных. Однако могут быть также приготовлены твердые формы, пригодные для растворения или суспендирования непосредственно перед применением. Состав может также быть эмульсифицирован. Активный ингредиент может быть смешан с наполнителями, фармацевтически приемлемыми и совместимыми с активным ингредиентом, в количествах, пригодных для использования описанными здесь терапевтическими методами. Подходящими наполнителями являются, например, вода, физиологический раствор, декстроза, глицерин, этанол и подобные им, а также их комбинации. Кроме того, при необходимости композиции могут содержать небольшие количества вспомогательных соединений, таких как увлажняющие или эмульсифицирующие агенты, средства для создания рН-буфера и подобные им, повышающие эффективность активного ингредиента. В композиции могут присутствовать и адьюванты(вспомогательные средства). Фармацевтически приемлемые носители хорошо известны в фармацевтике. Примерами жидких но- 14014419 сителей являются стерильные водные растворы без веществ (кроме активного ингредиента и воды), растворы, содержащие буфер, например фосфат натрия при физиологическом рН, физиологический раствор или их комбинации, такие как физиологический раствор, забуференный фосфатом. Более того, водные растворы могут содержать несколько буферообразующих солей, а также такие соли, как хлориды натрия или калия, декстроза, пропиленгликоль, полиэтиленгликоль и другие вещества. Жидкие композиции могут содержать и другие жидкие фазы в дополнение к воде или для ее исключения. Примерами дополнительных жидких фаз являются глицерин, растительные масла (например,хлопковое масло), органические сложные эфиры (например, этилолеат) и водно-масляные эмульсии. Фармацевтические композиции, соответствующие одному из предпочтительных аспектов настоящего изобретения и содержащие соответствующие формуле (I) соединения, могут включать фармацевтически приемлемые соли этих соединений, как описано выше. Фармацевтически приемлемые соли - это соли присоединения кислот (формируемые со свободными аминогруппами полипептида), которые образуются с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или с такими органическими кислотами, как уксусная, винная, манделевая кислоты и подобные им. Соли со свободными карбоксильными группами могут быть получены при использовании таких неорганических оснований, как гидроксиды натрия, калия, аммония, кальция или двухвалентного железа. Могут применяться также и органические основания, например изопропиламин, триметиламин, 2-этиламиноэтанол,гистидин, прокаин и подобные им. Соответствующие предпочтительным аспектам изобретения составы могут вводиться орально, местно, внутрибрюшинно, внутрисуставно, интракраниально (внутрь черепа), интрадермально, внутримышечно, внутрь глаза, интратекально, внутривенно и подкожно. Профессионалам в области медицины известны и другие маршруты введения. Орально вводимые композиции, соответствующие настоящему изобретению, могут быть в форме таблеток, капсул, порошков, гранул, жидкостей или гелей, например это могут быть оральные, топические или стерильные парентеральные растворы или суспензии. Таблетки и капсулы для орального применения могут быть в порционной форме и содержать такие распространенные наполнители, как связывающие агенты, например сироп, гуммиарабик, желатин, сорбит, трагакант или поливинилпирролидон; собственно наполнители, например лактоза, сахар, кукурузный крахмал, фосфат или гидрофосфат кальция, крахмальный гликолят натрия, сорбит или глицин; лубриканты таблетирования, например стеарат магния, тальк, полиэтиленгликоль или диоксид кремния (возможно, в коллоидной форме); размельчители, например картофельный крахмал, или приемлемые увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой, методы для этого хорошо известны в повседневной фармацевтической практике. Жидкие составы для орального применения могут принимать форму, например, водных и масляных суспензий, растворов, эмульсий, сиропов или эликсиров, а могут представлять собой сухой продукт, предназначенный для разведения в воде или другом носителе непосредственно перед использованием. Такие жидкие составы могут содержать распространенные добавки, например агенты для суспендирования, такие как сорбит, сироп, метилцеллюлозу (возможно, в микрокристаллической форме), сироп из глюкозы, гидрогенированные съедобные желатиновые жиры; эмульсификаторы,например лецитин, моноолеат сорбита или гуммиарабик; неводные носители (включающие, возможно,съедобные масла), например, миндальное масло, фракционированное кокосовое масло; эфиры масел,например глицерин, пропиленгликоль или этиловый спирт; консерванты, например метил или пропил парагидроксибензоат или сорбиновая кислота, а также при необходимости красители и вкусовые добавки."Эффективное количество" означает количество вещества, которое вызывает терапевтический эффект у субъекта. Терапевтический эффект может быть объективным (то есть измеренным некоторым тестом или маркером) или субъективным (субъект говорит о нем или ощущает его). Соответствующая настоящему изобретению терапевтическая композиция может содержать, как правило, не менее 0,1 вес.% соединения формулы (I) по отношению к весу целой композиции. Весовой процент представляет собой отношение веса вещества к весу целой композиции. Так, например, 0,1 вес.% - это 0,1 г соединения формулы (I) на 100 г общего веса композиции. Подходящая ежедневная доза для орального введения млекопитающим, желательно людям, может очень сильно колебаться в зависимости от состояния пациента. Однако подходящая доза соединения формулы (I) может быть в диапазоне от 0,1 до 300 мг/кг веса тела. Соответствующие настоящему изобретению композиции могут применяться в ветеринарии и поэтому могут содержать приемлемый в ветеринарии наполнитель или носитель. Таким образом, соединения и композиции могут назначаться для лечения животных, например кошек, собак или лошадей. Соединения настоящего изобретения могут применяться в диагностических целях, если они находятся в меченой форме, например меченные изотопами. Настоящее изобретение включает методы приготовления соединений любой описанной здесь формы, заключающиеся во взаимодействии одного или более соединений описанного здесь строения, включая любые описанные здесь процессы. Соединения описанной здесь формулы (I) могут быть приготовлены с помощью традиционных методов (или по аналогии с ними) и в особенности в соответствии с изложенными далее методами или по аналогии с ними. Более того, фармакология in vitro была изучена с ис- 15014419 пользованием следующих методов и реагентов. Химикаты, используемые в описанных здесь синтетических маршрутах, могут включать, например,растворители, реагенты, катализаторы, защитные группы и реагенты для снятия защитных групп. Описанные здесь методы могут содержать дополнительные этапы, следующие либо до, либо после специфически описанных здесь этапов, и заключающиеся во введении или удалении подходящих защитных групп, чтобы обеспечить синтез соединений. Кроме того, с целью получения желаемых соединений различные этапы синтеза могут выполняться в альтернативной последовательности или порядке. Превращения, относящиеся к области синтетической химии, и методология работы с защитными группами(введение и снятие защиты), полезные для синтеза подходящих соединений, хорошо известны. Некоторые методы описаны, например, в следующих книгах: R. Larock, Comprehensive Organic Transformations,VCH Publishers (1989); T.W. Greene и P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John(1994) и L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley и Sons (1995) и последующих изданиях. Все упомянутые здесь публикации цитируются по ссылкам. Выражение "содержащие" означает"включающие, но не ограничивающиеся". Таким образом, могут использоваться и другие вещества, добавки и носители, не упомянутые здесь. Далее изобретение будет описано на примерах. Не следует считать, что эти примеры ограничивают область действия настоящего изобретения, они служат только для иллюстрации. Примеры Биологические примеры Сцинцилляционный анализ Scintillation Proximity Assay (SPA).[1,2(n)-3 Н]-кортизон был куплен у компании Amersham Pharmacia Biotech. Моноклональные антитела мыши против кортизола (антикортизольные антитела), клон 6D6.7 получили от компании Immunotech, а шарики (beads) для SPA, покрытые слоем моноклональных мышиных антител, куплены в компании Amersham Pharmacia Biotech. Тетранатриевая соль NADPH приобретена на фирме Calbiochem, а глюкоза-6-фосфат (G-6-P) получена в компании Sigma. Человеческий фермент 11 гидроксистероид дегидрогеназа первого типа (11HSD1) был экспрессирован в культуре Pichia pastoris. 18 глицерретиновая кислота (GA) была куплена в компании Sigma. Последовательные разбавления раствора выполнялись с помощью раскапывателя Tecan Genesis RSP 150. Исследуемые соединения растворяли в DMSO(1 мМ) и разбавляли затем в 50 мМ Tris-HCl, pH 7.2, содержащем 1 мМ EDTA. Мультипликация планшет осуществлялась на приборе WallacQuadra. Количество продукта [3 Н]кортизол, обнаруженного на шариках, определялось микропланшетным жидкостным сцинцилляционным счетчиком Top Count компании Packard. Фермантативный анализ на 11HSD1 был выполнен в 96-луночных планшетах (Packard, Optiplate) в растворе общим объемом 220 мкл, содержащем 30 мМ Tris-HCl, pH 7.2, и 1 мМ EDTA, субстрат, содержащий меченный тритием кортизон/NADPH (175 нМ/181 мкМ), G-6-P (1 мМ) и ингибиторы в стандартных разведениях от 9 до 0,14 мкМ. Реакция была инициирована добавлением человеческой 11HSD1 либо в виде клеточного гомогената Pichia pastoris, либо в виде приготовленных из Pichia pastoris микросом (концентрация фермента в реакционной смеси колебалась от 0,057 до 0,11 мг/мл). После введения всех реагентов планшеты перемешивали с помощью шейкера от 30 до 45 мин при комнатной температуре. Реакцию остановили введением 10 мкл 1 мМ стоп-раствора GA. В систему затем ввели моноклональные мышиные антитела (10 мкл 4 мкМ раствора) и затем 100 мкл шариков SPA (суспендированных в соответствии с инструкциями производителя). Чтобы узнать величину неспецифического связывания (non-specific binding, NSB), некоторые лунки были сделаны контрольными (в них отсутствовал 11HSD1). Планшеты были закрыты пластиковой пленкой и инкубированы на шейкере в течение 30 мин при комнатной температуре, после чего осуществили считывание радиоактивности. На микропланшетном жидкостном сцинцилляционном счетчике определили количество [3H]-кортизола, связавшегося с шариками. Значения Ki для ингибиторов определили с помощью программы Activity Base. Ki вычислялось,исходя из значений IC50 и Km, по уравнению Cheng и Prushoff (уравнение Михаэлиса-Ментен в случае обратимого ингибирования) следующим образом: Ki=IC50(1+[S]/Km) [Cheng Y.C., Prushoff W.H. Biochem.Pharmacol., 1973, 22, 3099-3108]. IC50 измерялись экспериментально, поскольку уменьшение количества кортизона, превращенного в кортизол, зависит от потенциала ингибирования каждого вещества. Значения Ki для ингибирования соединениями настоящего изобретения фермента 11HSD1, в среднем, колеблятся в интервале от 10 нМ до 10 мкМ. Несколько значений Ki приводятся в следующей табл. 1: Клонирование, экспрессия и очистка 11HSD1. Экспрессия и очистка мышиного фермента описана в работе J. Zhang et al. Biochemistry, 44, 2005,p. 6948-57. Экспрессия и очистка человеческого фермента осуществлялась аналогично мышиному. Ферментативный анализ IC50 и Ki соединений определялись следующим методом. 1. Каждую неделю заново готовился реакционный буфер для анализа состава рН 7.2, 50 мМ TrisHCL, 1 мМ EDTA. 2. Далее готовились следующие растворы:H-кортизон (Amersham Biosciences, 45 Ci/ммоль, 200 нМ),раствор фермента (20 нМ для людей, 10 нМ для мышей),антитела к кортизолу (East Coast Biologicals, разведение 1:50),антимышиные шарики для SPA (Amersham Biosciences, 15 мг/мл),18-глицерретиновая кислота ("GA") (Aldrich, 1 мкМ). Маточные растворы соединений (10 мМ в DMSO), последовательно разбавленные реакционным буфером. Каждое соединение изучалось в шести различных концентрациях (обычно от 10 мкМ до 0,1 нМ). Все растворы и разбавления делались в реакционном буфере. 3. Анализ проводился в белых/белых 96-луночных реакционных планшетах (Corning), объем раствора в каждой лунке был 100 мкл. 4. В каждую лунку 96-луночной планшеты вводили реакционный буфер (30 мкл), раствор соединения (10 мкл), NADPH (10 мкл) и 3 Н-кортизон (10 мкл). 5. Реакция инициировалась добавлением в лунки 40-мкл раствора фермента HSD-1. 6. Платы запечатывались лентой и инкубировались в течение одного часа при RT на орбитальном шейкере. 7. Через час ленту снимали, вводили антитело к кортизолу (антикортизол, 10 мкл), раствор GA(10 мкл) и приготовленные шарики SPA (100 мкл). 8. Платы инкубировали 30 мин на орбитальном шейкере при RT. 9. Измерение осуществлялось на ридере TopCount NXT. 10. Для построения кривой доза-эффект использовалось программное обеспечение Graphpad Prism,с помощью этой кривой вычислялись значения IC50. Исходя из полученных значений IC50 и известных значений Km для субстрата и фермента HSD1,можно вычислить значение Ki. Это делается по уравнению Chen и Prusoff Ki=IC50/[1+(substrate/Km)]. В дополнение к приведенным выше примерам все соединения настоящего изобретения продемонстрировали активность по отношению к ферменту 11HSD1 (IC50) в интервале от 10 нМ до 10 мкМ. Значение IC50 в ферментативном анализе для следующих соединений было ниже 20 нМ: 2-3-хлоро-2-метилфенил)амино)-5-(1-метилэтил)-1,3-тиазол-4(5 Н)-он; 5-метил-5-(пиридин-4-ил)-2-(2-(трифторометил)фениламино)тиазол-4(5 Н)-он; 2-2-хлорофенил)амино)-5-метил-5-фенил-1,3-тиазол-4(5 Н)-он;(R)-2-S)-1-(2-фторофенил)этиламино)-5-изопропил-5-метилтиазол-4(5 Н)-он и 2-2,4-дихлорофенил)амино)-5-(1-метилэтил)-1,3-тиазол-4(5 Н)-он. Примеры синтеза Общие схемы реакций Все коммерческие исходные материалы использовались без очистки. Если соответствующая -бромокарбоновая кислота или сложный эфир не доступны коммерчески,то указанные вещества готовили в соответствии со следующим методом.KBr (8 экв.), после чего смесь охладили на ледяной бане. Затем в смесь медленно добавили растворенный в воде NaNO2 (1,3 экв.). Смесь перемешивали на ледяной бане 4 ч, а затем позволили нагреться до комнатной температуры. Реакционную смесь далее экстрагировали EtOAc. Органическую фазу высушили над MgSO4, а затем сконцентрировали в вакууме. В результате удалось получить "сырой" продукт,использовавшийся на следующем этапе без дополнительной очистки (J. Org. Chem., 2002, 67 (11), 35953600; Xinhua Qian; Bin Zheng; Brian Burke; Manohar T. Saindane и David R. Kronenthal). Материалы и методы Спектры 1 Н ядерного магнитного резонанса (nuclear magnetic resonance, NMR) и 13 С NMR снимали на спектрометре Bruker PMR 500 при частотах 500.1 MHz и 125.1 MHz, соответственно, или на спектрометре JEOL eclipse 270 при частотах 270.0 MHz и 67.5 MHz соответственно. При записи всех спектров в качестве внутреннего стандарта использовался остаточный растворитель или тетраметилсилан (tetramethylsilane, TMS). Для снятия ИК-спектров использовался спектрометр Perkin-Elmer Spectrum 1000 FT-IR. Для получения масс-спектров (MS) по методу электрораспыления применяли масс-спектрометр AgilentMSD. Точные измерения масс выполнялись с помощью двойного зонда Micromass LCT. Элементный анализ осуществлялся с помощью инструмента Vario El, или образцы для анализа направлялись в компанию Mikro Kemi в Уппсале. Аналитическая хроматография HPLC осуществлялась на установке Agilent 1100, оборудованной системой А: АСЕ 3 (С 8, 503,0 мм) или системой В: YMC ODS-AQ, (333,0 мм). При этом использовалась элюентная система состава вода/0,1% TFA и CH3CN, 1 мл/мин, время градиента 3 мин. Препаративная хроматография HPLC осуществлялась на установке Gilson, оборудованной системой А: АСЕ 5 С 8 колонка (5020 мм) с временем градиента 5 мин, системой В: YMC ODS-AQ (15030 мм) с временем градиента 8.5 мин или системой С: YMC ODS-AQ (5020 мм) с временем градиента 5 мин. При этом использовалась элюентная система состава вода/0.1%TFA и CH3CN. Препаративная флешхроматография выполнялась в силикагеле-60 (ячейка 230-400) производства компании Merck.- 18014419 Методология синтеза Методы А или В применялись в зависимости от того, использовался ли в синтезе изотиоцианат или соответствующий амин. Эти амин или изотиоцианат были куплены либо в компании Maybridge Plc, либоSigma-Aldrich Co. Метод А. 1,0 экв. соответствующего изотиоцианата перемешивали в течение 18 ч при RT в 2 М растворе аммиака в этаноле (5 экв.). После упаривания в вакууме удалось получить неочищенный продукт, который кристаллизовали, добавив DCM. Кристаллы были собраны на фильтровальную бумагу и высушены на воздухе с получением тиомочевины. Метод В. 1,0 экв. амина и этоксикарбонилизотиоцианат (1,0 экв.) смешали в пробирке. В результате протекания чрезвычайно экзотермической реакции образовалась белая субстанция, напоминающая тесто. Эту субстанцию перенесли в 5 М раствор KOH и перемешивали 2 ч при температуре 70 С. Выполненный после этого хроматографический (LC) анализ показал, что гидролиз интермедиата завершился полностью. Смесь охладили, разбавили водой и трижды экстрагировали хлороформом. Требуемая тиомочевина была получена препаративной хроматографией этой смеси. Метод С. Тиомочевину (1,0 экв.) и -бромоэфир/-бромокислоту (1,0 экв.) растворили в ацетоне и в течение 15-72 ч выдерживали в закупоренной пробирке при температуре 60 С. Растворитель упарили, а продукт очистили кристаллизацией из МеОН с последующей препративной HPLC в обращенной фазе. Метод С 1. Тиомочевину (1,0 экв.) и -бромоэфир/-бромокислоту (1,0 экв.) размешали в воде и выдерживали в микроволновой печи один час при температуре 140 С. Водную фазу дважды экстригировали DCM. Объединенные органические фазы упарили и полученный неочищенный продукт очистили препаративной HPLC в обращенной фазе. Метод D. Тиомочевину (1,0 экв.) и -бромоэфир (1,0 экв.) растворили в 1,4-диоксане и в течение 1-11 дней выдерживали в закупоренной пробирке при температуре 100 С. Растворитель упарили, а остаток очистили препаративной HPLC в обращенной фазе. Метод D1. Тиомочевину (1,0 экв.) и -бромоэфир (1,0 экв.) растворили в THF и один день выдерживали в закупоренной пробирке при температуре 70 С. Растворитель упарили, а остаток очистили препаративнойHPLC в обращенной фазе. Метод D2. Тиомочевину (1,0 экв.) и -бромоэфир (1,0 экв.) растворили в 2-пропаноле и три дня выдерживали в закупоренной пробирке при температуре 95 С. Растворитель упарили, а остаток очистили препаративнойHPLC в обращенной фазе. Метод D3. Тиомочевину (1,0 экв.) и -бромоэфир/-бромокислоту (1,0 экв.) растворили в MeCN и три дня выдерживали в закупоренной пробирке при температуре 60 С. Растворитель упарили, а остаток очистили препаративной HPLC в обращенной фазе. Метод Е. Аминокислоту (1 экв.) суспендировали в 2,0 М H2SO4. В систему добавили KBr (8 экв.) и смесь охладили на ледяной базе. Затем в реакционную смесь медленно ввели растворенный в воде NaNO2(1,3 экв.). Продолжая охлаждение, смесь перемешивали еще 4 ч. После этого ее экстрагировали EtOAc,промыли соляным раствором и соляным раствором с Na2S2O3. Органическую фазу сконцентрировали в вакууме. Продукт реакции использовался на следующем этапе без дополнительной очистки. Метод F. Тиомочевину (1,0 экв.) и 3-бромо-2-кумарон (1,0 экв.) растворили в ацетоне и три часа выдерживали при температуре 60 С. В реакционную смесь добавили воду. Полученный осадок перекристаллизовали из системы вода/MeCN. Раствор, из которого получили осадок, сконцентрировали и осадок высушили под вакуумом. Метод G. Карбонатную соль гуанидина (1 экв.) и -гидроксиэфир (1 экв.) растворили в EtOH и кипятили 2-10 ч. Смесь затем вылили в воду и оставили на 16 ч при температуре 8 С. Продукт выделили фильтрованием. Метод Н. Аминооксазолон (1 экв.) и амин (3 экв.) добавили к 4 мл EtOH и поместили в микроволновую печь на 30 мин при температуре 130 С. Растворитель удалили под вакуумом и продукт очистили препаративной HPLC в обращенной фазе.- 19014419 Метод I. К ледяному раствору 1 экв. тиомочевины в DCM добавили 3 экв. 5% водного раствора NaOH и 2 экв. дибромобутирил хлорида, после чего добавили немного бензилтриэтиламмоний хлорида. Смеси позволили нагреться до RT и затем добавили еще 5 экв. 5% водного раствора NaOH. Фазу в DCM отделили, дважды промыли водой, высушили над MgSO4, отфильтровали и сконцентрировали. Продукт был выделен препаративной HPLC в обращенной фазе. Метод J. Кислоту (1 экв.) растворили в SOCl2 и в течение двух часов выдерживали при температуре 60 С. Затем при RT в реакционную смесь ввели NBS (2 экв.), SOCl2 и 1 каплю водного раствора HBr. Смесь кипятили 75 мин. Растворитель упарили под вакуумом, в систему добавили CCl4 и профильтровали. CCl4 удалили под вакуумом. Полученное масло растворили в EtOH и оставили на 16 ч при комнатной температуре. После этого растворитель удалили под вакуумом с получением продукта -бромоэфира. Примеры Методы A-J были использованы для приготовления соединений, соответствующих примерам 1-79,как описано далее. Пример 1. 2-(Бицикло[2.2.1]гепт-2-иламино)-5-изопропил-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-бицикло[2.2.1]гепт-2-илтиомочевины и этил 2-бромоизовалерата в соответствии с методом С. 1 Н NMR (400 MHz, DMSO-d6)ppm 0.79 (m, 3H), 0.97 (m, 3H), 1.10 (m, 3H), 1.45 (m, 4H), 1,69 (m,1H), 2.22 (m, 2H), 2.36 (m, 1H), 3.74 (m, 1H), 4.37 (m, 1H), 9.56 (s, 1H). MS (ESI+) для C13H20N2OS m/z: 253 Синтез осуществили из N-бицикло[2.2.1]гепт-2-илтиомочевины и этил 2-бромобутирата в соответствии с методом С. 1 Н NMR (400 MHz, DMSO-d6)ppm 0.90 (m, 3H), 1.03-1.23 (m, 3H), 1.35-1.56 (m, 4H), 1,65-1,84 (m,2H), 1.98 (m, 1H), 2.24 (m, 2H), 3.75 (m, 1H), 4.22-4.40 (m, 1H), 9.84 (s, 1H). MS (ESI+) для C12H18N2OS Синтез осуществили из N-бицикло[2.2.1]гепт-2-илтиомочевины и метил альфа-бромофенилацетата в соответствии с методом С. 1 Н NMR (400 MHz, DMSO-d6)ppm 1.05-1.24 (m, 3H), 1.36-1.56 (m, 4H), 1.66-1.80 (m, 1H), 2.22-2.33 Синтез осуществили из н-циклогексилтиомочевины и этил 2-бромобутирата в соответствии с методом С. Получено 201 мг вещества (75%). 1 Н NMR (400 MHz, DMSO-d6)ppm 0.91 (m, 3H), 1.05-2.06 (m, 12H), 3.76 (m, 1H), 4.36 (m, 1H),10.11 (s, 1H). MS (ESI+) для C11H18N2OS m/z: 227 (M+H)+. Пример 5. 2-(Бицикло[2.2.1]гепт-2-иламино)-5,5-диметил-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-бицикло[2.2.1]гепт-2-илтиомочевины и этил 2-бромоизобутирата в соответствии с методом С. 1 Н NMR (400 MHz, DMSO-d6)ppm 1.05-1.21 (m, 3H), 1.34-1.54 (m, 4H), 1.48 (s, 2H), 1.49 (s, 2H),- 20014419 1.50 (s, 1H), 1.51 (s, 1H), 1.67-1.74 (m, 1H), 2.18-2.28 (m, 2H), 3.20 (dd, J=7.69, 2.93 Hz, 0,25H), 3.73-3.82 Синтез осуществили из N-трицикло[3.3.1.03,7]нон-3-илтиомочевины и этил 2-бромо-3-метилбутаноата в соответствии с методом С. 1 Синтез осуществили из N-трицикло[3.3.1.03,7]нон-3-илтиомочевины и этил 1-бромоциклобутанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, DMSO-d6)1.45-1.57 (m, 4H), 1.90-2.16 (m, 8 Н), 2.22-2.27 (m, 2H), 2.44-2.55 (m,5 Н, смазан сигналом растворителя), 9.24 (s, 1H). MS (ESI+) для C15H20N2OS m/z: 277 (М+Н)+. Пример 8. 2-(Трицикло[3.3.1.03,7]нон-3-иламино)-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-трицикло[3.3.1.0-3,7]нон-3-илтиомочевины и этил бромоацетата в соответствии с методом D1. 1 Н NMR (400 MHz, DMSO-d6)1.45-1.61 (m, 4H), 1.92-2.07 (m, 6H), 2.23 (m, 1.7 Н, главный ротамер), 2.82 (m, 0.3 Н, второстепенный ротамер), 2.45 (t, J=6.7 Hz, 0.85 Н, главный ротамер), 2.66 (t, J=6.8 Hz,0.15 Н, второстепенный ротамер), 3.83 (s, 1.7 Н, главный ротамер), 4.09 (s, 0.3 Н, второстепенный ротамер),9.38 (s, 1 Н). MS (ESI+) для C12H16N2OS m/z: 237 (М+Н)+. Пример 9. 6-(Циклооктиламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он. Синтез осуществили из N-циклооктилтиомочевины и этил 1-бромоциклобутанкарбоксилата в соответствии с методом D2. 1 Н NMR (400 MHz, DMSO-d6)1.45-1.79 (m, 14H), 1.86-2.00 (m, 1 Н), 2.05-2.17 (m, 1 Н), 2.41-2.53 (m,4H, смазан сигналом растворителя), 4.01 (m, 1 Н), 9.09 (d, J=7.5 Hz, 1 Н). 13 С NMR (100 MHz, DMSO-d6)16.31, 23.07, 24.97, 26.69, 30.88, 33.52, 54.69, 60.30, 175.09, 191.25. Синтез осуществили из N-циклогептилтиомочевины и этил 1-бромоциклобутанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, DMSO-d6)1.35-1.65 (m, 10 Н), 1.83-1.97 (m, 3 Н), 2.05-2.17 (m, 1 Н), 2.41-2.53 (m,4H, смазан сигналом растворителя), 3.96 (m, 1H), 9.09 (d, J=7.5 Hz, 1 Н). MS (ESI+) для C13H20N2OS m/z: 253 (М+Н)+. Пример 11. 6-(Бицикло[2.2.1]гепт-2-иламино)-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он. Синтез осуществили из N-бицикло[2.2.1]гепт-2-илтиомочевины и этил 1-бромоциклобутанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, DMSO-d6)1.05-1.22 (m, 3 Н), 1.33-1.49 (m, 4H), 1.63-1.70 (m, 1H), 1.86-2.00 (m,1H), 2.05-2.22 (m, 3H), 2.42-2.53 (m, 4H, смазан сигналом растворителя), 3.74 (m, 1H), 8.98 (d, J=7.5 Hz,1H). MS (ESI+) для C13H18N2OS m/z: 251 (M+H)+. Синтез осуществили из N-(2,2,3,3-тетраметилциклопропил)тиомочевины и этил 1-бромоциклобутанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, DMSO-d6)0.92 (s, 3H), 0.94 (s, 3H), 1.06 (s, 3H), 1.08 (s, 3H), 1.88-2.00 (m, 1H),2.01 (s, 1H), 2.06-2.17 (m, 1H), 2.40-2.54 (m, 4H, смазан сигналом растворителя), 8.78 (s br, 1H). MS (ESI+) для C13H20N2OS m/z: 253 (М+Н)+. Пример 13. 6-[(2-Метилфенил)амино]-5-тиа-7-азаспиро[3.4]окт-6-ен-8-он. Синтез осуществили из N-(2-метилфенил)тиомочевины и этил 1-бромоциклобутанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, DMSO-d6)1.89 (m, 1H), 2.04-2.13 (m, 1H), 2.08 (s, 3H), 2.39-2.48 (m, 2H), 2.562.66 (m, 2H), 6.81 (d, J=7.6 Hz, 1H), 7.03 (m, 1H), 7.14 (m, 1H), 7.20 (d, J=7.4 Hz, 1H), 11.67 (s br, 1H). MS Синтез осуществили из N-(циклогексилметил)тиомочевины и этил 2-бромоизобутирата в соответствии с методом С. 1 Н NMR (270 MHz, DMSO-d6)ppm 0.81-1.04 (m, 2H), 1.03-1.32 (m, 3H), 1.43-1.54 (m, 6H), 1.55-1.78 Синтез осуществили из N-(2-фторофенил)тиомочевины и этил 2-бромо-2-метилбутирата в соответствии с методом С. 1 Н NMR (270 MHz, DMSO-d6)ppm 0.79-0.98 (m, 6H), 2.29-2.44 (m, 1H), 4.48 (d, J=3.59 Hz, 1H),6.91-7.40 (m, 4H). MS (ESI+) для C12H13FN2OS m/z: 253 (M+H)+. Пример 16. 2-[(Циклогексилметил)амино]-5-(2-гидроксифенил)-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-(циклогексилметил)тиомочевины и 3-бромо-2-кумарона в соответствии с методом F. 1 Н NMR (400 MHz, хлоформ-D)ppm 0.80-1.00 (m, 2H), 1.05-1.27 (m, 3H), 1.55-1.81 (m, 6H), 3.243.34 (m, 2H), 5.42 (s, 1H), 6.73-6.81 (m, 2H), 7.02-7.14 (m, 2H), 9.19 (br s, 1H, N-H), 9.81 (br s, 1H, N-H). MS Синтез осуществили из N-циклогептилтиомочевины и (2S)-2-бромопропановой кислоты в соответствии с методом С. 1 Н NMR (400 MHz, хлоформ-D)ppm 1.35-1.70 (m, 12H), 1.45 (d, J=7.3 Hz, 3H), 1.72-2.00 (m, 1H),3.90-4.03 (m, 1H). MS (ESI+) для C11H18N2OS m/z: 227 (М+Н)+. Синтез осуществили из N-циклогептилтиомочевины и (2R)-2-бромопропановой кислоты в соответствии с методом С. 1 Н NMR (400 MHz, хлороформ-D)ppm 1.36-1.70 (m, 12H), 1.45 (d, J=7.5 Hz, 3H), 1.82-1.96 (m, 1H),3.93-4.02 (m, 1H). MS (ESI+) для C11H18N2OS m/z: 111 (M+H)+. Пример 19. 2-(Циклогептиламино)-5-этил-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-циклогептилтиомочевины и 2-бромомасляной кислоты в соответствии с методом С. 1 Н NMR (270 MHz, метанол-d4)ppm 0.90-1.06 (m, 3H), 1.40-2.17 (m, 14H), 4.26 (dd, J=7.86, 4.02 Hz,1H), 4.52-4.68 (m, 1H). MS (ESI+) для C12H20N2OS m/z: 241 (M+H)+. Пример 20. 2-(Циклогептиламино)-5-изопропил-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-циклогептилтиомочевины и этил 2-бромо-2-метилбутирата в соответствии с методом С. 1 Н NMR (270 MHz, метанол-d4) смесь трех различных ротамеров 40%/30%/30% только главный; Синтез осуществили из 2-амино-3,3-диметилбутановой кислоты и N-циклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, метанол-d4)ppm 0.83-0.94 (m, 4.5 Н), 0.98-1.12 (m, 4.5 Н), 1.47-1.97 (m, 11H),2.36-2.58 (m, 1H), 4.03-4.18 (m, 1H), 4.34-4.42 (m, 1H). MS (ESI+) для C14H24N2OS m/z: 269 (М+Н)+. Пример 22. 2-(Циклооктиламино)-5-этил-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-циклооктилтиомочевины и 2-бромомасляной кислоты в соответствии с методом С 1. 1 Н NMR (270 MHz, метанол-d4)ppm 0.89-1.03 (m, 3H), 1.43-1.99 (m, 15 Н), 1.98-2.16 (m, 1H), 4.214.32 (m, 1H), 4.55-4.66 (m, 1H). MS (ESI+) для C13H22N2OS m/z: 255 (М+Н)+. Пример 23. 5-Изопропил-2-[(2-изопропилфенил)амино]-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-(2-изопропилфенил)тиомочевины и 2-бромо-3-метилмасляной кислоты в соответствии с методом С 1. 1 Н NMR (270 MHz, DMSO-d6)ppm 0.87 (dd, J=8.78, 6.80 Hz, 6H), 1.12-1.17 (m, 6H), 2.28-2.44 (m,1H), 2.93-3.09 (m, 1H), 4.40 (d, J=3.46 Hz, 1H), 6.83 (dd, J=7.24, 1.79 Hz, 1H), 7.07-7.21 (m, 2H), 7.26-7.36 Синтез осуществили из N-(2-изопропилфенил)тиомочевины и 2-бромомасляной кислоты в соответствии с методом С 1. 1 Н NMR (270 MHz, DMSO-d6)ppm 0.88 (t, J=7.30 Hz, 3H), 1.14 (d, J=6.93 Hz, 6H), 1.63-2.06 (m,2H), 2.93-3.11 (m, 1H), 4.32 (dd, J=7.36, 4.27 Hz, 1H), 6.75-6.92 (m, 1H), 7.06-7.21 (m, 2H), 7.24-7.42 (m,1H). MS (ESI+) для C14H18N2OS m/z: 263 (M+H)+. Пример 25. 2-[(2-Хлорофенил)амино]-5-этил-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-(2-хлорофенил)тиомочевины и 2-бромомасляной кислоты в соответствии с методом С 1. 1 Н NMR (270 MHz, метанол-d4)ppm 1.01-1.23 (m, 3H), 1.98-2.34 (m, 2 Н), 4.58-4.72 (m, 1 Н), 7.287.54 (m, 3 Н), 7.54-7.68 (m, 1 Н). MS (ESI+) для C11H11ClN2OS m/z: 255 (М+Н)+. Пример 26. 5-Этил-2-[(2-метилфенил)амино]-1,3-тиазол-4(5 Н)-он. Синтез осуществили из N-(2-метилфенил)тиомочевины и 2-бромомасляной кислоты в соответствии с методом С 1. 1 Н NMR (270 MHz, метанол-d4)ppm 1.07-1.18 (т, J=7.36, 7.36 Hz, 3H), 1.98-2.36 (m, 2H), 2.11-2.13 Синтез осуществили из N-(2,2,3,3-тетраметилциклопропил)тиомочевины и этил-2-бромоизовалерата в соответствии с методом С. 1 Н NMR (400 MHz, CDCl3)ppm 0.99 (d, J=6.6 Hz, 3H), 1.08-1.16 (m, 9 H), 1.20 (d, J=3.4 Hz, 6H),2.17 (s, 1H), 2.59-2.72 (m, 1H), 4.25 (d, J=3.9 Hz, 1H). MS (ES+) m/z: 255 (M+H)+. Пример 28. 2-(Бицикло[2.2.1]гепт-2-иламино)-5-(4-гидроксибензил)-1,3-тиазол-4(5 Н)-он. Синтез осуществили из (2S)-2-амино-3-(4-гидроксифенил)пропановой кислоты и N-бицикло[2.2.1]гепт-2-илтиомочевины в соответствии с методами E и С. 1 Н NMR (270 MHz, DMSO-d6)1.11 (d, J=9.65 Hz, 3H), 1.24-1.54 (m, 4H), 1.56-1.76 (m, 1H), 2.042.27 (m, 2H), 2.61-2.84 (m, 1H), 3.26 (dd, J=14.10, 3.96 Hz, 1H), 3.70 (s, 1H), 4.42-4.52 (смазан пиком HDO) Синтез осуществили из N-(циклогексилметил)тиомочевины в соответствии с методом I. Н NMR (400 MHz, хлороформ-D)ppm 0.94-1.07 (m, 2 Н), 1.10-1.36 (m, 3 Н), 1.49-1.54 (m, 2 Н), 1.661.86 (m, 8 Н), 3.19 (d, J=6.59 Hz, 2 Н). MS m/z: 239 (M+H)+. Пример 30. 2-(Циклогептиламино)-5-(3,4-дигидроксибензил)-1,3-тиазол-4(5 Н)-он. 1 Синтез осуществили из (2S)-2-амино-3-(3,4-дигидроксифенил)пропановой кислоты и N-циклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (500 MHz, растворитель)1.43-1.57 (m, 6 Н), 1.56-1.73 (m, 5 Н), 1.84-2.01 (m, 2 Н), 2.87 (dd,J=14.13, 9.42Hz, 1 Н) (1 Н незаметен на фоне пика MeOD), 3.97-4.06 (m, 1H), 4.44-4.51 (m, 1H), 6.52-6.57 Синтез осуществили из (2S)-2-амино-3-(1 Н-имидазол-4-ил)пропановой кислоты и N-циклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, метанол-d4)1.43-2.06 (m, 12H), 3.33-3.56 (m, 2H), 3.93-4.08 (m, 1 Н), 4.57-4.69 Синтез осуществили из (2S)-2-амино-4-метилпентановой кислоты и N-циклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, метанол-d4)0.91-1.04 (m, 6H), 1.43-1.86 (m, 12H), 1.92-2.12 (m, 3 Н), 3.95-4.11 Синтез осуществили из (2S)-2-амино-3-(1 Н-индол-3-ил)пропановой кислоты и N-циклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, хлороформ-D)1.27-1.80 (m, 11H), 1.84-1.99 (m, 1H), 3.23-3.40 (m, 2H), 3.76 (dd,J=15.09, 3.46 Hz, 1H), 4.65 (d, J=9.15, 3.96 Hz, 1H), 7.10-7.28 (m, 3H), 7.40 (d, J=7.92 Hz, 1H), 7.59 (d,J=7.92 Hz, 1H), 8.26 (s, 1H). MS (ESI+) для C19H23N3OS m/z: 342 (M+H)+. Пример 34. 2-(Циклогептиламино)-5-(4-гидроксибензил)-1,3-тиазол-4(5 Н)-он. Синтез осуществили из (2S)-2-амино-3-(4-гидроксифенил)пропановой кислоты и Nциклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, метанол-d4)ppm 1.37-2.07 (m, 12H), 2.91-3.11 (m, 1H), 3.32-3.43 (m, 1H), 3.864.02 (m, 1H), 4.48-4.66 (m, 1H), 6.60-6.76 (m, 2H), 6.99-7.11 (m, 2H). MS (ESI+) для C17H22N2O2S m/z: 319 Синтез осуществили из (2S)-2-амино-3-циклогексилпропановой кислоты и N-циклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, хлороформ-D)ppm 0.85-1.90 (m, 22H), 1.93-2.10 (m, 2 Н), 2.14-2.30 (m, 1 Н),3.35-3.57 (m, 1 Н), 4.23 (dd, J=11.32, 3.77 Hz, 1H). MS (ESI+) для C17H28N2OS m/z: 309 (M+H)+. Пример 36. 2-(Циклооктиламино)-5-(4-гидроксибензил)-1,3-тиазол-4(5 Н)-он. Синтез осуществили из (2S)-2-амино-3-(4-гидроксифенил)пропановой кислоты и N-циклооктилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, хлороформ-D)ppm 1.41-1.95 (m, 14H), 3.07 (dd, J=14.47, 9.65 Hz, 1H), 3.43-3.59 Синтез осуществили из (2R)-2-амино-3-циклогексилпропановой кислоты и N-циклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, хлороформ-D)ppm 0.87-1.86 (m, 22 Н), 1.89-2.11 (m, 2 Н), 2.11-2.30 (m, 1 Н),3.34-3.60 (m, 1 Н), 4.23 (dd, J=11.32, 3.77 Hz, 1H), 8.81 (br s, 1H). MS (ESI+) для C17H28N2OS m/z: 309 Синтез осуществили из (2S)-2-амино-3-цианопропановой кислоты и N-циклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, хлороформ-D)ppm 1.36-2.14 (m, 12H), 2.85-3.11 (m, 1H), 3.12-3.32 (m, 1H),3.43-3.58 (m, 1H), 4.31-4.46 (m, 1H). MS (ESI+) для C12H17N3OS m/z: 252 (M+H)+. Пример 39. 5-Этил-2-[(3-метилфенил)амино]-1,3-тиазол-4(5 Н)-он. Синтез осуществили из (2S)-2-амино-3-пиридин-3-илпропановой кислоты и N-циклогептилтиомочевины в соответствии с методами Е и С. 1 Н NMR (270 MHz, хлороформ-D)ppm 1.39-1.84 (m, 9H), 1.88-2.06 (m, 2H), 3.39-3.54 (m, 1H), 3.64 Синтез осуществили из N-(2-метилфенил)тиомочевины и этил 2-бромо-3-метилбутаноатом в соответствии с методом С. 1 Н NMR (400 MHz, DMSO-d6)0.84 (d, J=6.6 Hz, 3H), 0.88 (d, J=7.0 Hz, 3H), 2.10 (s, 3H), 2.34 (m,1H), 4.32 (d, J=3.4 Hz, 1H), 6.83 (d, J=7.8 Hz, 1H), 7.03 (m, 1H), 7.16 (m, 1H), 7.21 (d, J=7.6 Hz, 1H). MS(ESI+) для C13H16N2OS m/z: 249 (M+H)+. Пример 42. 2-(Циклооктиламино)-5,5-диметил-1,3-тиазол-4(5 Н)-он. Синтез осуществили из этил-2-бромо-2-метилпропаноата и N-циклооктилтиомочевины в соответствии с методом С 1. 1 Н NMR (270 MHz, DMSO-d6)ppm 1.46 (s, 3H), 1.47 (s, 3H), 1.81-1.43 (m, 15H). MS (EI+) дляC13H22N2OS m/z: 255 (M+H)+. Пример 43. 2-(Циклооктиламино)-5-изопропил-1,3-тиазол-4(5 Н)-он. Синтез осуществили из 2-бромо-3-метилмасляной кислоты и N-циклооктилтиомочевины в соответствии с методом С 1. 1 Н NMR (270 MHz, метанол-d4). Главный изомер:ppm 0.85 (d, J=6.68 Hz, 3H), 1.01 (d, J=6.93 Hz,3H), 1.44-1.91 (m, 14H), 2.36-2.52 (m, 1H), 3.98-4.12 (m, 1H), 4.36 (d, J=3.71 Hz, 1H). MS (EI+) для Синтез осуществили из N-бицикло[2.2.1]гепт-2-илтиомочевины и метил 1-бромоциклогексанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, CDCl3)1.12-2.44 (m, 21 Н), 3.34 (m, 1 Н). Синтез осуществили из N-трицикло[3.3.1.03,7]нон-3-илтиомочевины и метил 1-бромоциклогексанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, CDCl3)1.24-2.19 (m, 20 Н), 2.30 (m, 0.5 Н, второстепенный ротамер), 2.41 (m,1.5 Н, главный ротамер), 2.53 (m, 0.25 Н, второстепенный ротамер), 2.75 (m, 0.75 Н, главный ротамер). Синтез осуществили из N-циклогептилтиомочевины и метил 1-бромоциклогексанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, CDCl3)1.24-2.14 (m, 23 Н), 3.48 (m, 1 Н). MS (ESI+) для C15H24N2OS m/z: 281 Синтез осуществили из N-циклооктилтиомочевины и метил 1-бромоциклогексанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, CDCl3)1.24-2.13 (m, 25 Н), 3.55 (m, 1 Н). MS (ESI+) для C16H26N2OS m/z: 295 Синтез осуществили из N-[1-(4-хлорофенил)циклобутил]тиомочевины и этил 2-бромо-3-метилбутаноата в соответствии с методом D. 1 Н NMR (400 MHz, DMSO-d6)0.60 (d, J=6.5 Hz, 0.75H, второстепенный ротамер), 0.68 (d, J=6.6 Hz,2.25H, главный ротамер), 0.82 (d, J=6.8 Hz, 0.75H, второстепенный ротамер), 0.92 (d, J=6.8 Hz, 2.25H,главный ротамер), 1.77-1.87 (m, 1H), 1.93-2.03 (m, 1H), 2.21-2.33 (m, 1H), 2.42-2.65 (m, 4H, смазан сигналом растворителя), 4.14 (d, J=3.5 Hz, 0.25H, второстепенный ротамер), 0.68 (d, J=3.7 Hz, 0.75H, главный ротамер), 7.38 (m, 3H, главный ротамер), 7.45 (m, 1H, второстепенный ротамер), 9.87 (s, 1H). Синтез осуществили из N-[1-(4-хлорофенил)циклобутил]тиомочевины и этил 1-бромоциклобутанкарбоксилата в соответствии с методом D. 1 Н NMR (400 MHz, DMSO-d6)1.73-2.12 (m, 4 Н), 2.32-2.60 (m, 8 Н, смазан сигналом растворителя),7.39 (m, 3.3 Н, главный ротамер), 7.44 (гл, 0.7 Н, второстепенный ротамер), 9.83 (s, 1 Н). MS (ESI+) для Синтез осуществили из N-циклогептилтиомочевины и 2-этилмасляной кислоты в соответствии с методами J и D. 1 Н NMR (400 MHz, хлороформ-D)ppm 0.89-1.01 (m, 6 Н), 1.40-2.09 (m, 16 Н), 3.44-3.55 (m, 1 Н). Синтез осуществили из N-[(2S)-2-фенилпропил]тиомочевины и 2-бромо-3-метилмасляной кислоты в соответствии с методом D3. 1 Н NMR (270 MHz, DMSO-d6) главный ротамерppm 0.54-0.85 (m, 3 Н), 0.84-1.08 (m, 3 Н), 1.08-1.37 Синтез осуществили из N-[(2S)-2-фенилпропил]тиомочевины и 2-бромомасляной кислоты в соответствии с методом D3. 1 Н NMR (270 MHz, DMSO-d6) главный ротамерppm 0.51-0.70 (m, 3 Н), 1.10-1.36 (m, 3 Н), 1.45-1.80 Синтез осуществили из N-[(2S)-2-фенилпропил]тиомочевины и 2-бромомасляной кислоты в соответствии с методом D3. 1 Н NMR (270 MHz, DMSO-d6) главный ротамерppm 0.73-0.97 (m, 3 Н), 1.10-1.35 (m, 3 Н), 1.53-1.82 Синтез осуществили из N-[(2R)-2-фенилпропил]тиомочевины и 2-бромо-3-метилмасляной кислоты в соответствии с методом D3. 1 Н NMR (270 MHz, DMSO-d6) главный ротамерppm 0.50-0.80 (m, 3 Н), 0.84-1.06 (m, 3 Н), 1.09-1.32
МПК / Метки
МПК: C07D 277/54, A61P 3/10, A61P 3/04, A61P 31/12, A61P 3/00, C07D 263/48, A61P 29/00, A61P 19/10, A61P 3/06, A61K 31/426, A61K 31/42
Метки: композиция, фармацевтическая, получения, 5,5-дизамещённые-2-амино-4-тиазолидиноны, способ, лечения
Код ссылки
<a href="https://eas.patents.su/30-14419-55-dizameshhyonnye-2-amino-4-tiazolidinony-i-sposob-ih-polucheniya-farmacevticheskaya-kompoziciya-i-sposob-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">5,5-дизамещённые-2-амино-4-тиазолидиноны и способ их получения, фармацевтическая композиция и способ лечения</a>
Предыдущий патент: Применение ротиготина для лечения или предотвращения гибели дофаминергических нейронов
Следующий патент: Омега-3 жирные кислоты и дислипидемический агент для липидной терапии
Случайный патент: Антитела против c-kit и их применение