Замещенные бензимидазолы в качестве ингибиторов киназ
Номер патента: 14230
Опубликовано: 29.10.2010
Авторы: Макбрайд Кристофер, Амири Пэйман, Пун Даниел Дж., Субраманян Шарадха, Пик Териза Э., Айкава Мина Э., Шейфер Синтия, Доув Джеффри Х., Ливайн Барри Хейскелл, Стьюарт Даррин, Рамурти Савитри, Ренхауэ Пол А.
Формула / Реферат
1. Соединение формулы (I)
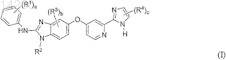
в которой R1, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, галоген, C1-C6-алкил, C1-C6-алкоксигруппу, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, C3-C8-циклоалкил, гетероциклоалкил, фенил и гетероарил;
R2 обозначает C1-C6-алкил или гало-C1-C6-алкил;
R3, каждый независимо друг от друга, выбран из группы, включающей галоген, C1-C6-алкил и C1-C6-алкоксигруппу;
R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6-алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, C1-C6-алкиламинокарбонил, карбонитрил, C3-C8-циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил;
где R1, R2, R3и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил, гало-C1-C6-алкил, C1-C6-алкоксигруппу и гало-C1-C6-алкоксигруппу;
а обозначает 1, 2, 3, 4 или 5;
b обозначает 0, 1, 2 или 3 и
с обозначает 1 или 2;
где ²гетероциклоалкил² означает циклоалкильную группу, содержащую в кольцевой структуре 3-8 атомов углерода и от 1 до 5 гетероатомов, которые выбраны из группы, включающей атомы азота, кислорода и серы, причем атомы азота и серы необязательно могут быть окислены; а
²гетероарил² означает ароматическую группу, имеющую в кольцевой структуре от 5 до 14 атомов, включая от 1 до 4 гетероатомов, которые выбраны из группы, состоящей из атомов азота, кислорода и серы, причем атомы азота и серы необязательно могут быть окислены,
или его таутомер, стереоизомер, сложный эфир или фармацевтически приемлемую соль соединения, таутомера, стереоизомера, сложного эфира.
2. Соединение по п.1, в котором R1, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, хлор, фтор, бром, метил, этил, пропил, бутил, метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, трифторметил, трифторэтил, трифторметоксигруппу, трифторэтоксигруппу, пиперидинил, C1-C6-алкилпиперидинил, пиперазинил, C1-C6-алкилпиперазинил, тетрагидрофуранил, пиридинил и пиримидинил.
3. Соединение по п.1, в котором а обозначает 1 или 2 и по меньшей мере один R1обозначает гало-C1-C6-алкил.
4. Соединение по п.3, в котором по меньшей мере один R1обозначает трифторметил.
5. Соединение по п.1, в котором R2 обозначает C1-C6-алкил.
6. Соединение по п.1, в котором R2 обозначает метил или этил.
7. Соединение по п.4, в котором R2 обозначает метил.
8. Соединение по п.1, в котором b обозначает 0 и R3 отсутствует.
9. Соединение по п.1, в котором b обозначает 1 и R3 обозначает C1-C6-алкоксигруппу.
10. Соединение по п.9, в котором R3 обозначает метоксигруппу.
11. Соединение по п.1, в котором с обозначает 1 или 2 и по меньшей мере один из R4обозначает гало-C1-C6-алкил.
12. Соединение по п.11, в котором по меньшей мере один R4обозначает трифторметил.
13. Соединение по п.1, которое имеет формулу (II)
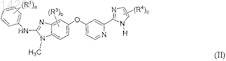
в которой R1, каждый независимо друг от друга, выбран из группы, включающей C1-C6-алкил, C1-C6-алкоксигруппу, гидроксигруппу, галоген, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, C3-C8-циклоалкил, гетероциклоалкил, фенил и гетероарил;
R3, каждый независимо друг от друга, выбран из группы, включающей галоген, C1-C6-алкил и C1-C6-алкоксигруппу;
R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6-алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, карбонитрил, C3-C8-циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил;
где R1, R2, R3и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил и C1-C6-алкоксигруппу;
а обозначает 1, 2, 3, 4 или 5;
b обозначает 0, 1, 2 или 3 и
с обозначает 1 или 2;
или его таутомер, стереоизомер, сложный эфир или фармацевтически приемлемую соль соединения, таутомера, стереоизомера, сложного эфира.
14. Соединение формулы (III)
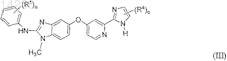
в которой R1, каждый независимо друг от друга, выбран из группы, включающей C1-C6-алкил, C1-C6-алкоксигруппу, гидроксигруппу, галоген, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, C3-C8-циклоалкил, гетероциклоалкил, фенил и гетероарил;
R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6-алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, карбонитрил, C3-C8-циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил;
где R1и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил и C1-C6-алкоксигруппу;
а обозначает 1, 2, 3, 4 или 5 и
с обозначает 1 или 2;
где ²гетероциклоалкил² означает циклоалкильную группу, содержащую в кольцевой структуре 3-8 атомов углерода и от 1 до 5 гетероатомов, которые выбраны из группы, включающей атомы азота, кислорода и серы, причем атомы азота и серы необязательно могут быть окислены; а
²гетероарил² означает ароматическую группу, имеющую в кольцевой структуре от 5 до 14 атомов, включая от 1 до 4 гетероатомов, которые выбраны из группы, состоящей из атомов азота, кислорода и серы, причем атомы азота и серы необязательно могут быть окислены,
или его таутомер, стереоизомер, сложный эфир или фармацевтически приемлемую соль соединения, таутомера, стереоизомера, сложного эфира.
15. Соединение по п.14, в котором R1 независимо выбран из группы, включающей гидроксигруппу, хлор, фтор, бром, метил, этил, пропил, бутил, метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, трифторметил, трифторэтил, трифторметоксигруппу, трифтоэтоксигруппу, пиперидинил, C1-C6-алкилпиперидинил, пиперазинил, C1-C6-алкилпиперазинил, тетрагидрофуранил, пиридинил и пиримидинил.
16. Соединение по п.15, в котором а обозначает 1 или 2 и по меньшей мере один из R1обозначает гало-C1-C6-алкил.
17. Соединение по п.16, в котором по меньшей мере один R1обозначает трифторметил.
18. Соединение по п.14, в котором а обозначает 1.
19. Соединение по п.18, в котором R1 обозначает трифторметил.
20. Соединение по п.14, в котором с обозначает 1 или 2 и по меньшей мере один из R4обозначает гало-C1-C6-алкил.
21. Соединение по п.20, в котором по меньшей мере один из R4обозначает трифторметил.
22. Соединение по п.21, в котором с обозначает 1.
23. Соединение, выбранное из группы, включающей
{1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}-(4-трифторметилфенил)амин,
(2-фтор-5-пиридин-3-илфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-фтор-5-пиридин-4-илфенил)-{1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-иламин,
(4-трет-бутилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}-(3-трифторметилфенил)амин,
(3-этилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(4-хлорфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}амин,
(4-этилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(4-хлор-3-трифторметилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(4-фтор-3-трифторметилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
{1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}-(4-трифторметоксифенил)амин,
(2-фтор-5-трифторметилфенил)-(1-метил-5-{2-[5-метил-4-(3-трифторметилфенил)-1H-имидазол-2-ил]пиридин-4-илокси}-1H-бензоимидазол-2-ил)амин,
(2-фтор-5-трифторметилфенил)-(1-метил-5-{2-[5-метил-4-(4-трифторметилфенил)-1H-имидазол-2-ил]пиридин-4-илокси}-1H-бензоимидазол-2-ил)амин,
этиловый эфир 2-{4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1Н-бензоимидазол-5-илокси] пиридин-2-ил}-5-трифторметил-1H-имидазол-4-карбоновой кислоты,
(2-{4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1H-бензоимидазол-5-илокси]пиридин-2-ил}-5-трифторметил-1Н-имидазол-4-ил)метанол,
2-{4-[1-метил-2-(4-трифторметилфениламино)-1H-бензоимидазол-5-илокси]пиридин-2-ил}-3H-имидазол-4-карбонитрил,
(3-трет-бутилфенил)-{1-метил-5-[2-(5-фенил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
{1-метил-5-[2-(5-фенил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}-(4-трифторметилсульфанилфенил)амин,
(3-трет-бутилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}амин,
[4-фтор-3-(тетрагидрофуран-3-ил)фенил]-{1-метил-5[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}амин,
(4-бромфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}амин,
(4-фтор-3-изопропилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
{1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}-(4-трифторметилсульфанилфенил)амин,
(2-фтор-5-изопропилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-фтор-5-трифторметилфенил)-{1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)-пиридин-4-илокси]-1H-бензоимидазол-2-ил}амин,
(5-трет-бутил-2-фторфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-фтор-5-трифторметилфенил)-{1-метил-5-[2-(5-метил-1H-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}амин,
(2-фтор-5-пиридин-3-илфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
2-{4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1Н-бензоимидазол-5-илокси]пиридин-2-ил}-3H-имидазол-4-карбонитрил,
(2-хлор-4-трифторметилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}амин,
(5-трет-бутил-2-хлорфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-фтор-5-пиридин-4-илфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-фтор-5-трифторметилфенил)-{1-метил-5-[2-(4-фенил-5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-хлор-5-трифторметилфенил)-{1-метил-5-[2-(4-фенил-5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
{1-метил-5-[2-(4-фенил-5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}-(3-трифторметилфенил)амин,
(3-этилфенил)-{1-метил-5-[2-(4-фенил-5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(4-трет-бутилфенил)-{1-метил-5-[2-(4-фенил-5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-хлор-5-трифторметилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-фтор-5-трифторметилфенил)-{1-метил-5-[2-(5-метил-4-фенил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-хлор-5-трифторметилфенил)-{1-метил-5-[2-(5-метил-4-фенил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(4-трет-бутилфенил)-{1-метил-5-[2-(5-метил-4-фенил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
{1-метил-5-[2-(5-метил-4-фенил-1H-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}-(3-трифторметилфенил)амин,
(5-трет-бутил-2-фторфенил)-{1-метил-5-[2-(5-метил-4-фенил-1H-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
[4-(4-метилпиперазин-1-ил)фенил]-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
метиловый эфир 2-{4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1Н-бензоимидазол-5-илокси]пиридин-2-ил}-3H-имидазол-4-карбоновой кислоты,
этиловый эфир 2-{4-[2-(2-хлор-5-трифторметилфениламино)-1-метил-1Н-бензоимидазол-5-илокси]пиридин-2-ил}-5-трифторметил-1Н-имидазол-4-карбоновой кислоты,
(2-фтор-4-трифторметилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2-хлорфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(2,5-диметоксифенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(3,5-диметоксифенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}амин,
{1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}-(2-трифторметилфенил)амин,
(2-этилфенил)-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
(4-этилпиперазин-1-ил)-(2-{4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1Н-бензоимидазол-5-илокси]пиридин-2-ил}-3H-имидазол-4-ил)метанон,
(2-гидроксиэтил)амид 2-{4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1H-бензоимидазол-5-илокси]пиридин-2-ил}-3H-имидазол-4-карбоновой кислоты,
{1-этил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}-(2-фтор-5-трифторметилфенил)амин,
(2-фтор-5-трифторметилфенил)-{6-метокси-1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)-пиридин-4-илокси]-1Н-бензоимидазол-2-ил}амин,
{6-метокси-1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}-(4-трифторметилфенил)амин,
(4-этилпиперазин-1-ил)-(2-{4-[1-метил-2-(4-трифторметилфениламино)-1Н-бензоимидазол-5-илокси]пиридин-2-ил}-3H-имидазол-4-ил)метанон,
{1-этил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}-(4-трифторметилфенил)амин,
(2-гидроксиэтил)амид 2-{4-[1-метил-2-(4-трифторметилфениламино)-1Н-бензоимидазол-5-илокси]пиридин-2-ил}-3H-имидазол-4-карбоновой кислоты,
2-{1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-иламино}-5-трифторметилфенол и
3-{1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-иламино}-6-трифторметилфенол;
или его таутомер, стереоизомер, сложный эфир или фармацевтически приемлемую соль соединения, таутомера, стереоизомера, сложного эфира.
24. Соединение по п.23 или его фармацевтически приемлемая соль, где соединение имеет формулу
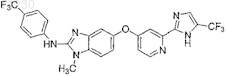
или таутомер соединения или фармацевтически приемлемая соль таутомера формулы

25. Композиция, содержащая соединение, таутомер, фармацевтически приемлемую соль или фармацевтически приемлемую соль его таутомера по п.1 или 24 в сочетании с фармацевтически приемлемым носителем.
26. Способ лечения ракового заболевания у человека или животного, заключающийся в том, что человеку или животному вводят композицию, содержащую соединение, его таутомер, фармацевтически приемлемую соль или фармацевтически приемлемую соль его таутомера по п.1 или 24.
27. Способ по п.26, в котором композиция ингибирует киназу Raf или мутантную киназу B-Raf.
28. Способ по п.26, в котором, кроме того, человеку или животному вводят по меньшей мере один дополнительный агент, предназначенный для лечения рака.
29. Способ по п.28, в котором по меньшей мере один дополнительный агент, предназначенный для лечения рака, выбирают из группы, включающей иринотекан, топотекан, гемцитабин, 5-фторурацил, леуковорин, карбоплатин, цисплантин, таксаны, тезацитабин, циклофосфамид, алкалоиды винка, иматиниб, антрациклины, ритуксимаб и трастузумаб.
30. Способ по п.26, в котором раковое заболевание представляет собой меланому.
31. Способ по п.26, в котором раковое заболевание представляет собой рак молочной железы или рак предстательной железы.
32. Применение соединения, таутомера, фармацевтически приемлемой соли или фармацевтически приемлемой соли его таутомера по п.1 или 24 для лечения рака.
33. Применение соединения, таутомера, фармацевтически приемлемой соли или фармацевтически приемлемой соли его таутомера по п.1 или 24 для приготовления лекарственного средства, предназначенного для лечения рака.
34. Способ ингибирования по меньшей мере одной сериновой/треониновой киназы в пути передачи сигнала MAPK у индивидуума или лечения биологического состояния, опосредуемого сериновой/треониновой киназой в пути передачи сигнала MAPK у индивидуума, заключающийся в том, что индивидууму вводят композицию, содержащую соединение, его таутомер, фармацевтически приемлемую соль или фармацевтически приемлемую соль его таутомера по п.1 или 24.
35. Способ по п.34, в котором композиция ингибирует киназу Raf.
36. Способ по п.34, в котором композиция ингибирует мутантную киназу B-Raf.
37. Способ по п.34, в котором биологическое состояние выбирают из группы, включающей меланому, папиллярный рак щитовидной железы, рак яичника, рак ободочной кишки, рак поджелудочной железы, рак легкого и лейкоз.
38. Способ по п.34, в котором композиция содержит {1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил}-(4-трифторметилфенил)амин или его фармацевтически приемлемую соль, таутомер или фармацевтически приемлемую соль его таутомера.
39. Способ ингибирования тирозинкиназного рецептора у индивидуума или лечения биологического состояния, опосредуемого тирозинкиназным рецептором, у индивидуума, заключающийся в том, что индивидууму вводят композицию, содержащую соединение, его таутомер, фармацевтически приемлемую соль или фармацевтически приемлемую соль его таутомера по п.1 или 24, где тирозинкиназный рецептор выбирают из группы, включающей VEGFR-2, FGFR-3, c-Kit, PDGFR-b и CSF-IR.
40. Способ по п.39, в котором биологическое состояние, выбирают из группы, включающей лейкоз тучных клеток, эритролейкоз, опухоли зародышевых клеток, мелкоклеточный рак легкого, опухоли, относящиеся к строме желудочно-кишечного тракта, острый миелолейкоз, нейробластому, меланому, множественную миелому, рак яичника и рак молочной железы.
41. Способ по п.39, в котором композиция содержит {1-метил-5-[2-(5-трифторметил-1Н-имидазол-2-ил)пиридин-4-илокси]-1Н-бензоимидазол-2-ил}-(4-трифторметилфенил)амин или его фармацевтически приемлемую соль, таутомер или фармацевтически приемлемую соль его таутомера.
Текст
В изобретении описаны новые бензимидазольные производные, композиции и способы ингибирования киназной активности, ассоциированной с онкогенезом, у человека или животного. В конкретных вариантах осуществления изобретения соединения и композиции обладают эффективностью в отношении ингибирования по меньшей мере одной сериновой/треониновой киназы или тирозинкиназного рецептора. Новые соединения и композиции можно применять индивидуально или в сочетании по меньшей мере с одним дополнительным агентом для лечения опосредуемого сериновой/треониновой киназой или тирозинкиназным рецептором заболевания, такого как рак. 014230 Перекрестная ссылка на родственные заявки Заявка на данный патент претендует на приоритет предварительных заявок на патент US серийный номер 60/712539, зарегистрированной 30 августа 2005 г., US серийный номер 60/713108, зарегистрированной 30 августа 2005 г., US серийный номер 60/731591, зарегистрированной 27 октября 2005 г., US серийный номер 60/774684, зарегистрированной 17 февраля 2006 г., каждая из которых полностью включена в настоящее описание в качестве ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к новым замещенным бензимидазольным производным, их таутомерам, стереоизомерам, полиморфам, сложным эфирам, метаболитам и пролекарствам, к фармацевтически приемлемым солям указанных соединений, их таутомерам, стереоизомерам, полиморфам, сложным эфирам, метаболитам и пролекарствам, к композициям, содержащим любой из указанных выше вариантов в сочетании с фармацевтически приемлемыми носителями, и к применению любого из вышеуказанных вариантов либо индивидуально, либо в сочетании по меньшей мере с одним дополнительным терапевтическим агентом для профилактики или лечения рака. Краткое изложение сущности изобретения Известны киназы, ассоциированные с онкогенезом, к которым относятся сериновые/треониновые киназы Raf и тирозинкиназные рецепторы (RTK). Сериновые/треониновые киназы являются основными компонентами модуля пути передачи сигнала Ras/активируемой митогеном протеинкиназы (MAPK),который контролирует комплекс программ транскрипции в ответ на экзогенные клеточные стимулы. Гены Raf кодируют высококонсервативные серин-треонинспецифические протеининазы, которые, как известно, связываются с онкогеном ras. Они являются частью пути трансдукции сигнала, который, вероятно, состоит из тирозинкиназных рецепторов, p21-ras, протеинкиназ Raf, Mek1-(активатор ERK (внеклеточная регулируемая киназа) или MAPKK)-киназы и ERK-(MAPK)-киназы, которые, в конце концов,фосфорилируют факторы транскрипции. В этом пути киназы Raf активируются Ras и фосфорилируют и активируют две изоформы киназы митогенактивируемой протеинкиназы (которую обозначают также какMek1 и Mek2), которые представляют собой треониновые/тирозиновые киназы с двойной специфичностью. Обе изоформы Mek активируют активируемые митогеном киназы 1 и 2 (MAPK, которые называют также регулируемыми внеклеточным лигандом киназой 1 и 2 или Erk1 и Erk2). MAPK фосфорилируют целый ряд субстратов, включая факторы транскрипции, и в результате принимают участие в их программах транскрипции. Киназа Raf оказывает влияние на Ras/MAPK-путь и регулирует несколько клеточных функций, таких как пролиферация, дифференцировка, выживание, онкогенная трансформация и апоптоз. В исследованиях, в которых использовали понижающую регуляцию и доминантное ингибирование мутантов Raf в клетках млекопитающих, а также в исследованиях, в которых применяли биохимические и генетические технологии для создания модельных организмов, продемонстрированы как важная роль,так и местоположение Raf в целом ряде путей передачи сигналов. Во многих случаях активация Raf рецепторами, которые симулируют фосфорилирование клеточного тирозина, зависит от активности Ras,что свидетельствует о том, что Ras осуществляет свою функцию до Raf в пути передачи сигнала. После активации Raf-1 фосфорилирует и активирует Mek1, что приводит к распространению сигнала на расположенные по его ходу эффекторы, такие как MAPK (активируемая митогеном протеинкиназа; Crews и др., Cell 74, 1993, с. 215). Сериновые/треониновые киназы Raf считаются первичными эффекторами Ras,которые участвуют в пролиферации клеток животных (Avruch и др., Trends Biochem. Sci. 19, 1994, с. 279). Киназа Raf имеет три различные изоформы Raf-1 (c-Raf), A-Raf и B-Raf, которые различаются по их способности взаимодействовать с Ras, активировать путь киназы MAPK, их распределением в тканях и субклеточной локализацией (Marias и др., Biochem. J. 351, 2000, с. 289-305; Weber и др., Oncogene 19,2000, с. 169-176; Pritchard и др., Mol. Cell. Biol. 75, 1995, с. 6430-6442). Активирующая мутация одного из генов Ras выявлена примерно в 20% всех опухолей, а активация Ras/Raf/MEK/ERK-пути выявлена примерно в 30% всех опухолей (Bos и др., Cancer Res. 49, 1989, с. 4682-4689; Hoshino и др., Oncogene 18,1999, с. 813-822). В современных исследованиях установлено, что мутация B-Raf в невусе кожи является имеющей решающее значение стадией в инициации меланоцитной неоплазии (Pollock и др., Nature Genetics 25, 2002, с. 1, 2). Кроме того, в исследованиях, проведенных в последние годы, установлено, что активирующая мутация в киназном домене B-Raf присутствует примерно в 66% меланом, 12% карцином ободочной кишки и 14% случаев рака легкого (Davies и др., Nature 417, 2002, с. 949-954; Yuen и др., Cancer Research 62, 2002, с. 6451-6455; Brose и др., Cancer Research 62, 2002, с. 6997-7000). Меланомы, которые продолжают оставаться важными заболеваниями, требующими медицинского вмешательства, представляют собой комплексное мультигенное заболевание с неблагоприятным прогнозом, прежде всего на прогрессирующей метастатической стадии. Активирующие соматические мутации проонкогена B-Raf в настоящее время описаны как характерные для различных злокачественных заболеваний и наиболее часто встречаются при меланомах. Примерно в 70% случаев меланом происходит экспрессия мутантной и активированной формы B-Raf (V600E), что делает ее прекрасной мишенью для разработки лекарственных средств. Кроме того, в других 10-15% случаев меланом происходит экспрессия мутантной N-Ras, что дополнительно демонстрирует важность MAPK-пути для роста и выживания кле-1 014230 ток меланом. Ингибиторы Ras/Raf/MEK/ERK-пути на уровне киназ Raf могут обладать эффективностью в качестве терапевтических агентов, предназначенных для лечения опухолей со сверхэкспрессирующимися и мутантными тирозинкиназными рецепторами, активированными внутриклеточными тирозинкиназами, опухолей с аномальной экспрессией Grb2 (белок-адаптер, который обеспечивает стимуляциюRas посредством фактора обмена Sos), a также опухолей, несущих активирующие мутации самой Raf. В проведенных ранее клинических опытах установлено, что ингибиторы киназы Raf-1, которые ингибируют также В-Raf, являются перспективными в качестве терапевтических агентов для терапии рака (Crump,Current Pharmaceutical Design 8, 2002, с. 2243-2248; Sebastien и др., Current Pharmaceutical Design 8, 2002,с. 2249-2253). Как было установлено, нарушение экспрессии Raf в клеточных линиях, изученное с применением технологии антисмысловой РНК, подавляет как Ras-, так и Raf-опосредуемый онкогенез (Kolch и др.,Nature 349, 1991, с. 416-428; Monia и др., Nature Medicine 2(6), 1996, с. 668-675). Установлено также, что введение деактивирующих антител к киназе Raf или коэкспрессия доминантно-негативной киназы Raf или доминантно-негативной МЕК, являющейся субстратом киназы Raf, приводит к реверсии трансформированных клеток к нормальному фенотипу по признаку роста (см., Daum и др., Trends Biochem. Sci,19, 1994, с. 474-80; Fridman и др., J. Biol. Chem. 269, 1994, с. 30105-30108). Описано несколько ингибиторов киназы Raf, которые обладают эффективностью в отношении ингибирования пролиферации опухолевых клеток в анализах in vitro и/или in vivo (см., например,US 6391636, 6358932, 6037136, 5717100, 6458813, 6204467 и 6268391). В других патентах и заявках на патент предложено применение ингибиторов киназы Raf для лечения лейкоза (см., например,US 6268391 и 6204467 и опубликованные заявки на патент США 20020137774; 20020082192; 20010016194 и 20010006975), или для лечения рака молочной железы (см., например, US 6358932,5717100, 6458813, 6268391 и 6204467, и опубликованную заявку на патент США 20010014679). В росте раковых клеток большую роль играет также ангиогенез. Известно, что, когда скопление(гнездо) раковых клеток достигает определенного размера, примерно 1-2 мм в диаметре, должна развиваться система поставки крови к раковым клеткам, необходимая для быстрого роста опухоли, поскольку диффузия оказывается недостаточной для поставки к раковым клеткам необходимого количества кислорода и питательных веществ. Таким образом, ингибирование ангиогенеза может ингибировать рост раковых клеток. Тирозинкиназные рецепторы (RTK) представляют собой трансмембранные полипептиды, которые регулируют рост и дифференцировку клеток, ремодулируя и регулируя ткань взрослого организма (Mustonen Т. и др., J. Cell Biology 129, 1995, с. 895-898; van der Geer P. и др., Ann Rev. Cell Biol. 10, 1994, с. 251-337). Известно, что полипептидные лиганды, такие как факторы роста и цитокины, активируют RTK. Путь передачи сигнала RTK включает связывание лиганда и изменение конформации в наружном домене рецептора, что приводит к димеризации рецептора (Lymboussaki A. "Vascular. Endothelial Growth Factors and their Receptors in Embryos, Adults, and in Tumors", Academic Dissertation, University of Helsinki,Molecular/Cancer Biology Laboratory and Department of Pathology, Haartman Institute, 1999; Ullrich А. и др.,Cell 61, 1990, с. 203-212). Связывание лиганда с RTK приводит к трансфосфорилированию рецептора на определенных остатках тирозина и последующей активации каталитических доменов для фосфорилирования цитоплазматических субстратов (см. там же). Для сосудистого эндотелия специфическими являются два подсемейства RTK. К ним относятся подсемейство сосудистого эндотелиального фактора роста (VEGF) и подсемейство Ti-рецептора. К классу V RTK относятся VEGFR1 (FLT-I), VEGFR2 (KDR (человеческий), FIk-I (мышиный VEGFR3 (FLT4) (Shibuya М. и др., Oncogene 5, 1990, с. 519-525; Terman В. и др., Oncogene 6, 1991, с. 1677-1683;VEGF обладают способностью индуцировать сосудистую проницаемость и пролиферацию эндотелиальных клеток, и они описаны также в качестве основного индуктора ангиогенеза и васкулогенеза (FerraraN. и др., Endocrinol. Rev. 18, 1997, с. 4-25). Известно, что VEGF специфически связывается с RTK, в том числе FLT-I и FIk-I (DeVries, C. и др., Science 255, 1992, с. 989-991; Quinn Т. и др., Proc. Natl. Acad. Sci.,90, 1993, с. 7533-1537). VEGF стимулирует миграцию и пролиферацию эндотелиальных клеток и индуцирует ангиогенез как in vitro, так и in vivo (Connolly D. и др., J. Biol. Chem. 264, 1989, с. 20017-20024;Leung D. и др., Science, 246, 1989, с. 1306-1309; Plouet J. и др., ЕМВО J. 5, 1989, с. 3801-3806). Изучение различных систем культивируемых эндотелиальных клеток позволило установить, чтоVEGFR2 опосредует большинство передающихся по ходу передачи сигнала воздействий VEGF на ангиогенез (Wey S. и др., Clinical Advances in Hematology and Oncology, 2, 2004, с. 37-45). VEGFR2 опосредуемая пролиферация эндотелиальных клеток, вероятно, включает активацию Ras/Raf/Mek/Erkпути (Veikkola Т. и др., Cancer Res 60, 2000, с. 203-212). Экспрессия VEGFR2 обнаружена при меланоме,раке молочной железы, раке мочевого пузыря, раке легкого, раке щитовидной железы, раке предстательной железы и раке яичника (см. Wey и др., выше). Установлено, что нейтрализующие моноклональные антитела к VEGFR2 (KDR) обладают эффективностью в отношении блокады ангиогенеза опухолей (см.Kim и др., Nature 362, 1993, с. 841; Rockwell и др., Mol. Cell Differ. 3, 1995, с. 315). Поскольку, как из-2 014230 вестно, ангиогенез имеет решающее значение для роста опухоли и может контролироваться VEGF иVEGF-RTK, предпринимались попытки создания соединений, ингибирующих и замедляющих ангиогенез и ингибирующих VEGF-RTK. Киназный рецептор тромбоцитарного фактора роста (PDGFR) является другим типом RTK. Экспрессия PDGF обнаружена в некоторых различных типах плотных опухолей, от глиобластом и остеосарком до карцином предстательной железы. В этих различных типах опухолей биологическая роль передачи PDGF-сигнала может варьироваться от аутокринной стимуляции роста раковых клеток до более тонких паракринных взаимодействий, включая прилегающую строму и ангиогенез. PDGF взаимодействует с тирозинкиназными рецепторами PDGFR и PDGFR. Таким образом, можно ожидать, что ингибирование киназной активности PDGFR небольшими молекулами будет оказывать воздействие на рост и ангиогенез опухоли. Киназные рецепторы фактора роста фибробластов (FGFR) представляют собой другой тип RTK. Факторы роста фибробластов относятся к семейству полипептидов факторов роста, которые принимают участие в различных видах активности, включая митогенез, ангиогенез и заживление ран. К ним относится семейство родственных, но имеющих индивидуальные различия, тирозинкиназных рецепторов,содержащих внеклеточный домен либо с 2, либо с 3 иммуноглобулин (Ig)-подобными доменами, трансмембранный домен и цитоплазматический киназный домен. Идентифицированные рецепторы фактора роста фибробластов включают FGFR1 (Ruta М. и др., Oncogene 3, 1988, с. 9-15); FGFR2 (Dionne С. и др.,Cytogenet. Cell Genet. 60, 1992, с. 34-36); FGFR3 (Keegan K. и др., Proc. Nat. Acad. Sci. 88, 1991, с. 10951099) и FGFR4 (Partanen J. и др., EMBO J. 10, 1991, с. 1347-1354). Освещена роль рецепторов факторов роста фибробластов, прежде всего FGFR3, при раке. Нарушение регуляции онкогенов путем транслокации в локус тяжелой цепи иммуноглобулина (IgH) 14q32 представляет собой инициирующий момент в патогенезе В-клеточных опухолей. При множественной миеломе транслокация в локус IgH встречается в 20-60% случаев. Для большинства транслокаций хромосомапартнер является неизвестной; для других идентифицировано широкое разнообразие хромосомпартнеров, среди которых часто встречается только одна хромосома Ilql3. Bergsagel с соавторами идентифицировали незаконное переключение рекомбинации фрагментов (определенные как содержащие последовательности только из одной области переключения) в качестве потенциальных маркеров случаев транслокации в областях переключения IgH в 15 из 21 линий миелом, включая 7 из 8 кариотипированных линий, которые имели выявляемую 14q32-транслокацию. Установлено, что эти точечные разрывы, затрагивающие 6 следующих локусов хромосомы: 4 р 16.3; 6; 8q24.13; Ilql3.3; 16q23.1 и 21q22.1 (Bergsagel и др., Proc. Nat. Acad. Sci. 93, 1996, с. 13931-13936, 1996; Chesi и др., Nature Genet. 16, 1997, с. 260-264),образуют кариотипически молчащую транслокацию t(4;14)(p16.3;q32.3) в 5 линиях клеток миелом и по меньшей мере в 3 из 10 первичных опухолей, ассоциированных с множественной миеломой, что приводит к повышенному уровню экспрессии и активации мутаций в FGFR3. Точечные разрывы на хромосоме-4 объединены в кластерную область, состоящую из 70 т.п.н., центромерную относительно FGFR3,который, вероятно, является онкогеном с нарушенной регуляцией. У двух линий миелом и одной первичной линии опухоли с указанной транслокацией избирательно экспрессируется аллель FGFR3, содержащий активирующие мутации, которые ранее идентифицированы при смертельной карликовости:tyr373 на cys, lys650 на glu и lys650 на met. Для K650 Е в экспериментах по трансфекции доказана конститутивная активация FGFR3 в отсутствии лиганда. Chesi с соавторами (1997) высказали предположение о том, что после t(4;14)-транслокации соматическая мутация при прогрессировании опухоли часто приводит к получению белка FGFR3, который обладает активностью в отсутствии лиганда.Rasmussen Т. и др. выявили частоту встречаемости от 3 до 24% t(4;14)-транслокации при множественной миеломе (Rasmussen Т. и др., Br. J. Haematol. 117, 2002, с. 626-628, 2002). Существенно меньшая частота транслокации обнаружена у пациентов с моноклональной гаммапатией неустановленной этиологии (MGUS), что позволяет предположить, что она играет роль в превращении MGUS в множественную миелому. t(4;14)-транслокация затрагивает 2 потенциальных онкогена: FGFR3 и постоянный домен множественной миеломы (MMSET). Rasmussen с соавторами (2002) определяли частоту нарушения регуляции FGFR3 и его предполагаемую роль при множественной миеломе. Они обнаружили нарушенную регуляция экспрессии FGFR3 в 16 из 110 (14,5%) образцах множественной миеломы костного мозга. Кроме того, получены дополнительные данные, демонстрирующие роль FGFR3 при карциномах(Cappellen D. и др., (Letter) Nature Genet. 23, 1999, с. 18-20). Cappellen с соавторами обнаружили экспрессию конститутивно активируемого FGFR3 в большой части двух распространенных типов эпителиального рака, а именно мочевого пузыря и шейки матки. FGFR3, вероятно, является наиболее широко распространенным мутантным онкогеном при раке мочевого пузыря, являясь мутантным более чем в 30% случаев. FGFR3, вероятно, опосредует противоположные действия, проявляя активность в качестве отрицательного регулятора роста костной ткани и в качестве онкогена при некоторых типах опухоли. Все соматические миссенс-мутации FGFR3, выявленные при таких типах рака, оказались идентичны эмбриональным активирующим мутациям, которые вызывают смертельную дисплазию (указанные авторы сообщили, наличие такой эквивалентности в двух мутациях, поскольку изоформа FGFR3b, экспрессируемая в эпителиальных клетках, содержит на 2 аминокислоты больше, чем изоформа FGFR3c, экспрессируемая в-3 014230 костной ткани). Из двух модификаций FGFR3 в эпителиальных опухолях мутация S249C оказалась наиболее широко распространенной, встречаясь в 5 из 9 случаев рака мочевого пузыря и в 3 из 3 случаев рака шейки матки. Были получены также данные, свидетельствующие о том, что активированный FGFR3 является мишенью для расщепления лизосомами посредством с-Cbl-опосредуемой убикитинизации и что активирующие мутации, обнаруженные у пациентов с ахондроплазией и родственными хондроплазиями, нарушают этот процесс, приводя к рециклизации активированных рецепторов и амплификации FGFR3 сигналов (Cho и др., Proc. Nat. Acad. Sci. 101, 2004, с. 609-614). Cho с соавторами высказали предположение о том, что этот механизм участвует в молекулярном патогенезе ахондроплазии и представляет собой потенциальную мишень для терапевтического вмешательства. Нарушение направленного переноса лизосом является аддитивным относительно других предполагаемых механизмов, предложенных для объяснения патогенеза ахондроплазии. Другие результаты свидетельствуют о том, что FGFR2 и FGFR3 являются важными факторами онкогенеза (Jang J.H. и др., "Mutations in fibroblast growth factor receptor 2 and fibroblast growth factor receptor 3 genes associated with human gastric and colorectal cancers" Cancer Res. 61(9), 2001, с. 3541-3543). С учетом их значения для множественной миеломы, рака мочевого пузыря и онкогенеза разработка ингибиторов тирозинкиназных рецепторов фактора роста фибробласта, прежде всего ингибиторов FGFR2 иFGFR3, должно иметь важное значение для лечения разных типов рака.c-Kit представляет собой другой тирозинкиназный рецептор, принадлежащий к семейству рецепторов PDGF, и он в норме экспрессируется в гематопоэтических клетках-предшественниках, тучных клетках и зародышевых клетках. Экспрессия c-kit обнаружена при нескольких типах рака, включая лейкоз тучных клеток, опухоли зародышевых клеток, мелкоклеточный рак легкого, опухоли, относящиеся к строме желудочно-кишечного тракта, острый миелолейкоз (ОМЛ), эритролейкоз, нейробластому, меланому, карциному яичника, карциному молочной железы (Heinrieh M. С. и др., J. Clin. One. 20, 6, 2002, с. 1692-1703 (обзорная статья); Smolich В.D. и др., Blood, 97, 5, с. 1413-1421). Сверхэкспрессия CSF-IR, рецептора колониестимулирующего фактора-1 (CSF-I), обнаружена при некоторых человеческих карциномах, включая карциному молочной железы, яичника, эндометрия, легкого, почки, поджелудочных желез и предстательной железы (Sapi E., Exp. Biol. Med 229, 2004, с. 1-11).CSF-IR представляет собой тирозинкиназный рецептор, который при активации его лигандом CSF-I запускает пути трансдукции сигналов, контролирующих клеточную пролиферацию и дифференцировку.CSF-IR экспрессируется в молочной железе при беременности и лактации. Аномальная экспрессия CSFIR коррелировала с 58% всех случаев рака молочной железы и 85% случаев инвазивной карциномы молочной железы (см. Sapi, выше). Продолжает сохраняться потребность в соединениях, которые ингибируют пролиферацию капилляров, ингибируют рост опухолей, способствуют лечению рака, модулируют приостановку клеточного цикла и/или ингибируют одну или несколько таких молекул, как Ras, Raf, мутант B-Raf, VEGFR2 (KDR,FIk-I), FGFR2/3, c-Kit, PDGFR, CSF-IR, и фармацевтических композициях и лекарственных средствах,которые содержат такие соединения. Сохраняется также потребность в разработке способов введения таких соединений, фармацевтических композиций и лекарственных средств пациентам и индивидуумам,которые нуждаются в этом. Краткое изложение сущности изобретения Новые замещенные бензимидазольные производные представляют собой соединения формулы (I) в которой R1, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу,галоген, C1-C6-алкил, C1-C6-алкоксигруппу, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, циклоалкил,гетероциклоалкил, фенил и гетероарил;R3, каждый независимо друг от друга, выбран из группы, включающей галоген, C1-C6-алкил и C1C6-алкоксигруппу;R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6 алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, C1-C6 алкиламинокарбонил, карбонитрил, циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил; где R1, R2, R3 и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил, гало-C1-C6-алкил, C1-C6-алкоксигруппу и гало-C1-C6-алкоксигруппу;c обозначает 1 или 2; или их таутомеры, стереоизомеры, полиморфы, сложные эфиры, метаболиты или пролекарства либо фармацевтически приемлемые соли соединений, таутомеров, стереоизомеров, полиморфов, сложных эфиров, метаболитов или пролекарств. В других вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формулы (II) в которой R1, каждый независимо друг от друга, выбран из группы, включающей C1-C6-алкил, C1C6-алкоксигруппу, гидроксигруппу, галоген, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, циклоалкил,гетероциклоалкил, фенил и гетероарил;R3, каждый независимо друг от друга, выбран из группы, включающей галоген, C1-C6-алкил и C1C6-алкоксигруппу;R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6 алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, карбонитрил,циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил; где R1, R2, R3 и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил и C1C6-алкоксигруппу;c обозначает 1 или 2; или их таутомеры, стереоизомеры, полиморфы, сложные эфиры, метаболиты или пролекарства либо фармацевтически приемлемые соли соединений, таутомеров, стереоизомеров, полиморфов, сложных эфиров, метаболитов или пролекарств. В других вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формулы (III) в которой R1, каждый независимо друг от друга, выбран из группы, включающей C1-C6-алкил, C1C6-алкоксигруппу, гидроксигруппу, галоген, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, циклоалкил,гетероциклоалкил, фенил и гетероарил;R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6 алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, карбонитрил,циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил; где R1 и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил и C1-C6 алкоксигруппу;c обозначает 1 или 2; или их таутомеры, стереоизомеры, полиморфы, сложные эфиры, метаболиты или пролекарства либо фармацевтически приемлемые соли соединений, таутомеров, стереоизомеров, полиморфов, сложных эфиров, метаболитов или пролекарств. Изобретение относится также к соединениям формулы (IV) в которой R1, каждый независимо друг от друга, выбран из группы, включающей C1-C6-алкил, C1C6-алкоксигруппу, гидроксигруппу, галоген, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, циклоалкил,гетероциклоалкил, фенил и гетероарил;R3, каждый независимо друг от друга, выбран из группы, включающей галоген, C1-C6-алкил и C1C6-алкоксигруппу;R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6 алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, C1-C6 алкиламинокарбонил, карбонитрил, циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил; где R1, R2, R3 и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил и C1C6-алкоксигруппу;b обозначает 0, 1, 2 или 3; или их таутомеры, стереоизомеры, полиморфы, сложные эфиры, метаболиты или пролекарства либо фармацевтически приемлемые соли соединений, таутомеров, стереоизомеров, полиморфов, сложных эфиров, метаболитов или пролекарств. В других вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I)-(IV), в которых R1, каждый независимо друг от друга,выбран из группы, включающей гидроксигруппу, хлор, фтор, бром, метил, этил, пропил, бутил, метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, трифторметил, трифторэтил, трифторметоксигруппу, трифторэтоксигруппу, трифторметилсульфанил, пиперидинил, C1-C6-алкилпиперидинил, пиперазинил, C1-C6-алкилпиперазинил, тетрагидрофуранил, пиридинил, пиримидинил. В других вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I)-(IV), в которых a обозначает 1 или 2 и по меньшей мере один R1 обозначает гало(C1-C6-алкил), такой как трифторметил. В других вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I) и (IV), в которых R обозначает C1-C6-алкил, такой, например, как метил или этил. В других вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул(I), (II) и (IV), в которых b обозначает 0 и, следовательно, в этом случае R3 отсутствует. В альтернативных вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I)-(IV), в которых b обозначает 1 и R3 обозначает C1-C6 алкоксигруппу, такую, например, как метоксигруппа. Еще в одном варианте осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I)-(III), в которых с обозначает 1 или 2 и по меньшей мере один R4 обозначает гало(C1-C6-алкил), такой, например,как трифторметил. Другими объектами настоящего изобретения являются способы лечения связанных с Raf заболеваний у человека или животного, нуждающегося в таком лечении, заключающиеся в том, что указанному индивидууму вводят соединение, являющееся любым вариантом настоящего изобретения, или его фармацевтически приемлемую соль формулы (I), (II), (III) или (IV) в количестве, эффективном для снижения или предупреждение роста опухоли у индивидуума. Следующими объектами настоящего изобретения являются способы лечения связанных с Raf заболеваний у человека или животного, нуждающегося в таком лечении, заключающиеся в том, что указанному индивидууму вводят соединение, являющееся любым вариантом настоящего изобретения, или его фармацевтически приемлемую соль формулы (I), (II), (III) или (IV) в количестве, эффективном для снижения или предупреждение роста опухоли у индивидуума, в сочетании по меньшей мере с одним дополнительным агентом, предназначенным для лечения рака. Другими объектами настоящего изобретения являются терапевтические композиции, содержащие по меньшей мере одно соединение или его фармацевтически приемлемую соль формулы (I), (II), (III) или(IV) в сочетании по меньшей мере с одним или несколькими дополнительными агентами, предназначенными для лечения рака, которые обычно применяют в терапии рака. Соединения, предлагаемые в изобретении, можно применять для лечения различных типов рака, включая карциномы (например, легкого,поджелудочной железы, яичника, щитовидной железы, мочевого пузыря или ободочной кишки), меланому, миелоидные нарушения (например, миелолейкоз, множественную миелому и эритролейкоз), аденомы (например, ворсинчатая опухоль ободочной кишки) и саркомы (например, остеосаркома). Другим объектом настоящего изобретения являются способы ингибирования по меньшей мере одной сериновой/треониновой киназы в пути передачи сигнала MAPK у индивидуума или лечения биологического состояния, опосредуемого сериновой/треониновой киназа пути передачи сигнала MAPK у индивидуума, заключающийся в том, что индивидууму вводят терапевтическую композицию, содержащую по меньшей мере одно соединение или его фармацевтически приемлемую соль формулы (I), (II), (III) или(IV), обладающее эффективностью в отношении ингибирования пути передачи сигнала MAPK. Терапевтические композиции можно применять для лечения пациентов, нуждающихся в лечении такими ингибиторами (например, страдающих раком, который опосредуется аномальной передачей сигнала MAPK). Одним из вариантов осуществления изобретения являются способы ингибирования киназы Raf у инди-6 014230 видуума, заключающиеся в том, что вводят терапевтическую композицию, содержащую 1-метил-5-[2(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензимидазол-2-ил-(4 трифторметилфенил)амин и его таутомер, стереоизомер, полиморф, сложный эфир, метаболит или пролекарство или фармацевтически приемлемую соль соединения, таутомера, стереоизомера, полиморфа,сложного эфира, метаболита или пролекарства. Следующим объектом настоящего изобретения являются способы ингибирования по меньшей мере одного тирозинкиназного рецептора, выбранного из группы, включающей VEGFR-2, PDGFR-, pERK,bFGF, FGFR1, FGFR2, FGFR3, c-Kit и CSF-IR, у индивидуума, или лечения биологического состояния,опосредуемого по меньшей мере одним из VEGFR-2, PDGFR-, pERK, bFGF, FGFR1, FGFR2, FGFR3, cKit и CSF-IR, заключающиеся в том, что вводят терапевтическую композицию, которая содержит по меньшей мере одно соединение или его фармацевтически приемлемую соль формулы (I), (II), (III) или(IV), обладающую эффективностью в отношении ингибирования тирозинкиназного рецептора у индивидуума. Терапевтические соединения можно применять для лечения пациентов, которые нуждаются в лечении такими ингибиторами (например, пациентов, страдающих раком, опосредуемым аномальной передачей сигнала тирозинкиназного рецептора). Одним из вариантов осуществления изобретения являются способы ингибирования тирозинкиназного рецептора, выбранного из группы, включающей VEGFR-2,PDGFR-, pERK, bFGF, FGFR1, FGFR2, FGFR3, c-Kit и CSF-IR, индивидууму, заключающиеся в том, что вводят терапевтическую композицию, которая содержит 1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2 ил)пиридин-4-илокси]-1H-бензимидазол-2-ил-(4-трифторметилфенил)амин или его таутомер, стереоизомер, полиморф, сложный эфир, метаболит или пролекарство или фармацевтически приемлемую соль соединения, таутомера, стереоизомера, полиморфа, сложного эфира, метаболита или пролекарства. Изобретение относится также к композициям, способам применения и способам приготовления, которые более подробно будут описаны ниже. Краткое описание чертежей Вышеизложенные объекты и ряд сопутствующих преимуществ настоящего изобретения станут более понятными со ссылкой на изложенное ниже подробное описание в сочетании с прилагаемыми чертежами, на которых показано: на фиг. 1 - график, свидетельствующий о снижении среднего объема опухолей человеческой меланомы линии А 375 М у мышей после обработки соединением, предлагаемым в изобретении, которое описано в примере 78; на фиг. 2 А и 2 Б - изображение результатов, полученных с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках человеческой меланомы линии А 375 М у мышей через 4 ч (фиг. 2 А) и 24 ч (фиг. 2 Б) после обработки соединением, предлагаемым в изобретении, например, описанным в примере 79; на фиг. 3 - график, свидетельствующий о снижении среднего объема опухолей человеческого рака ободочной кишки линии НТ 29 Р у мышей после обработки соединением, предлагаемым в изобретении,которое описано в примере 80; на фиг. 4 А, 4 Б и 4 В - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках человеческого рака ободочной кишки линии НТ 29 Р через 1 ч (фиг. 4 А), 4 ч (фиг. 4 Б) и 24 ч (фиг. 4 В) после обработки соединением, предлагаемым в изобретении, которое описано в примере 81; на фиг. 5 - проиллюстрирован путь передачи сигнала MAPK, включающий Ras, Raf, MEK и ERK, и предполагаемые сайты ингибирования в направлении его распространения от киназы Raf с помощью соединения из примера 1, что описано в примерах 82-86; на фиг. 6 А, 6 Б и 6 В - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в клетках линии А 375 М (фиг. 6 А), клетках линии SK-MEL2 (фиг. 6 Б) и клетках линии CHL-I cells (фиг. 6 В) через 4 ч после инкубации культуры с различными концентрациями соединения из примера 1, что описано в примере 83; на фиг. 7 А - график зависимости ответа от дозы в виде уменьшения среднего объема опухолей человеческой меланомы линии А 375 М (B-Raf V600E) у мышей после обработки оральной дозой 10 мг/кг,30 мг/кг или 100 мг/кг соединения из примера 1, что описано в примере 84; на фиг. 7 Б - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в клетках линии А 375 М у мышей через 8 ч после 14-й обработки соединением из примера 1, что описано в примере 84; на фиг. 7 В - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в клетках линии А 375 М у мышей через 24 ч после 14-й обработке соединением из примера 1, что описано в примере 84; на фиг. 7 Г - результаты, полученные с помощью ПААГ, которые свидетельствуют о модуляции маркеров, расположенных в направлении его распространения от киназы Raf, в клетках линии А 375 М через 24 ч после 14-й обработке соединением из примера 1, что описано в примере 84;-7 014230 на фиг. 8 А - график, свидетельствующий о снижении среднего объема опухолей злокачественной меланомы линии MEXF276 (B-Raf V600E) у мышей после обработки соединением из примера 1, что описано в примере 85; на фиг. 8 Б - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках линииMEXF276 у мышей через 4 ч после 20-й обработки соединением из примера 1, что описано в примере 85; на фиг. 8 В - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках линииMEXF276 через 4 ч после 20-й обработки соединением из примера 1, что описано в примере 85; на фиг. 9 А - графическое изображение ингибирования среднего объема опухолей злокачественной меланомы линии MEXF1341 (N-Ras Q61K) у мышей после обработки соединением из примера 1, что описано в примере 85; на фиг. 9 Б - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках линииMEXF1341 у мышей 4 ч после 20-й обработки соединением из примера 1, что описано в примере 85; на фиг. 9 В - изображение результатов, полученных с помощью ПААГ, которые свидетельствуют о модуляции маркеров, расположенных в направлении распространения сигнала от киназы Raf в опухолевых клетках линии MEXF1341 через 4 ч после 20-й обработки соединением из примера 1, что описано в примере 85; на фиг. 10 А - график, свидетельствующий о снижении среднего объема опухолей колоректальной карциномы линии НСТ-116 (K-Ras G13D) у мышей после обработки соединением из примера 1, что описано в примере 86; на фиг. 10 Б - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках линии НСТ-116 через 4 ч после 3-й обработки соединением из примера 1, что описано в примере 86; на фиг. 10 В - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках линии НСТ-116 через 8 ч после 3-й обработки соединением из примера 1,что описано в примере 86; на фиг. 10 Г - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках линии НСТ-116 через 24 ч после 3-й обработки соединением из примера 1, что описано в примере 86; на фиг. 11 - график, свидетельствующий о снижении среднего объема опухолей колоректальной карциномы линии НТ-29 (В-Raf V600E) у мышей после обработки соединением из примера 1, что описано в примере 86; на фиг. 12 А - график, свидетельствующий о снижении среднего объема опухолей острого миелолейкоза линии MV4-11 (FLT3 ITD) у мышей после обработки соединением из примера 1, что описано в примере 86; на фиг. 12 Б - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках линииMV4-11 у мышей через 4 ч после 3-й обработки соединением из примера 1, что описано в примере 86; на фиг. 13 - график, свидетельствующий об ингибировании VEGF-опосредуемого ангиогенеза на модели CHO-VEGF с использованием матригеля (Matrigel) после обработки 10, 30 и 100 мг/кг соединения из примера 1, что описано в примере 88; на фиг. 14 А - график, свидетельствующий о снижении среднего объема опухолей меланомы линии А 375 М у мышей после обработки 100 мг/кг соединения из примера 1 с использованием схемы введения лекарственного средства q2d, q3d или q4d, что описано в примере 89; на фиг. 14 Б - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках линии А 375 М у мышей через 8, 24, 48 ч после 5-й обработки соединением из примера 1 с использованием схемы введения лекарственного средства q2d, что описано в примере 89; на фиг. 14 В - результаты, полученные с помощью ПААГ, которые свидетельствуют об ингибировании передачи сигнала в направлении его распространения от киназы Raf в опухолевых клетках линии А 375 М у мышей через 48 ч, 72 ч и 96 ч после 3-й обработки соединением из примера 1 с использованием схемы введения лекарственного средства q4d, что описано в примере 89; и на фиг. 15 - график, демонстрирующий взаимосвязь между обработкой опухолевых клеток линии А 375 М различными концентрациями соединения из примера 1, концентрацией соединения в сыворотке через различные промежутки времени и пороговой концентрацией для модуляции мишеней, что описано в примере 90.-8 014230 Подробное описание предпочтительного варианта осуществления изобретения Одним из объектов настоящего изобретения являются замещенные бензимидазольные производные формулы (I): в которой R1, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу,галоген, C1-C6-алкил, C1-C6-алкоксигруппу, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, циклоалкил,гетероциклоалкил, фенил и гетероарил;R3, каждый независимо друг от друга, выбран из группы, включающей галоген, C1-C6-алкил и C1C6-алкоксигруппу;R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6 алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, C1-C6 алкиламинокарбонил, карбонитрил, циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил; где R1, R2, R3 и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил, гало-C1-C6-алкил, C1-C6-алкоксигруппу и гало-C1-C6-алкоксигруппу;c обозначает 1 или 2; или их таутомеры, стереоизомеры, полиморфы, сложные эфиры, метаболиты или пролекарства либо фармацевтически приемлемые соли соединений, таутомеров, стереоизомеров, полиморфов, сложных эфиров, метаболитов или пролекарств. Другими вариантами осуществления изобретения являются новые замещенные бензимидазольные производные формулы (II) в которой R1, каждый независимо друг от друга, выбран из группы, включающей C1-C6-алкил, C1C6-алкоксигруппу, гидроксигруппу, галоген, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, циклоалкил,гетероциклоалкил, фенил и гетероарил;R3, каждый независимо друг от друга, выбран из группы, включающей галоген, C1-C6-алкил и C1C6-алкоксигруппу;R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6 алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, карбонитрил,циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил; где R1, R2, R3 и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил и C1C6-алкоксигруппу;c обозначает 1 или 2; или их таутомеры, стереоизомеры, полиморфы, сложные эфиры, метаболиты или пролекарства либо фармацевтически приемлемые соли соединений, таутомеров, стереоизомеров, полиморфов, сложных эфиров, метаболитов или пролекарств. Другими вариантами осуществления изобретения являются новые замещенные бензимидазольные производные формулы (III) в которой R1, каждый независимо друг от друга, выбран из группы, включающей C1-C6-алкил, C1-9 014230R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6 алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, карбонитрил,циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил; где R1 и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил и C1-C6 алкоксигруппу; а обозначает 1, 2, 3, 4 или 5;c обозначает 1 или 2; или их таутомеры, стереоизомеры, полиморфы, сложные эфиры, метаболиты или пролекарства либо фармацевтически приемлемые соли соединений, таутомеров, стереоизомеров, полиморфов, сложных эфиров, метаболитов или пролекарств. Объектами изобретения являются также соединения формулы (IV) в которой R1, каждый независимо друг от друга, выбран из группы, включающей C1-C6-алкил, C1C6-алкоксигруппу, гидроксигруппу, галоген, C1-C6-алкилсульфанил, C1-C6-алкилсульфонил, циклоалкил,гетероциклоалкил, фенил и гетероарил;R3, каждый независимо друг от друга, выбран из группы, включающей галоген, C1-C6-алкил и C1C6-алкоксигруппу;R4, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, C1-C6 алкил, C1-C6-алкоксигруппу, галоген, карбоксил, C1-C6-алкоксикарбонил, аминокарбонил, C1-C6 алкиламинокарбонил, карбонитрил, циклоалкил, гетероциклоалкил, гетероциклоалкилкарбонил, фенил и гетероарил; где R1, R2, R3 и R4 необязательно могут быть замещены одним или несколькими заместителями, независимо друг от друга выбранными из группы, включающей гидроксигруппу, галоген, C1-C6-алкил и C1C6-алкоксигруппу;b обозначает 0, 1, 2 или 3; или их таутомеры, стереоизомеры, полиморфы, сложные эфиры, метаболиты или пролекарства либо фармацевтически приемлемые соли соединений, таутомеров, стереоизомеров, полиморфов, сложных эфиров, метаболитов или пролекарств. Другими вариантами осуществления изобретения являются новые замещенные бензимидазольные производные формул (I)-(IV), в которых R1, каждый независимо друг от друга, выбран из группы, включающей гидроксигруппу, хлор, фтор, бром, метил, этил, пропил, бутил, метоксигруппу, этоксигруппу,пропоксигруппу, бутоксигруппу, трифторметил, трифторэтил, трифторметоксигруппу, трифторэтоксигруппу, трифторметилсульфанил, пиперидинил, C1-C6-алкилпиперидинил, пиперазинил, C1-C6 алкилпиперазинил, тетрагидрофуранил, пиридинил, пиримидинил. В других вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I)-(IV), в которых а обозначает 1 или 2, и по меньшей мере один R1 обозначает гало(C1-C6-алкил),такой как трифторметил. В других вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I) и (IV), в которых R обозначает C1-C6 алкил, такой, например, как метил или этил. В других вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I), (II) и (IV), в которых b обозначает 0 и, следовательно, в этом случае R3 отсутствует. В альтернативных вариантах осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I)-(IV), в которых b обозначает 1 и R3 обозначает C1-C6-алкоксигруппу, такую, например,как метоксигруппа. Еще в одном варианте осуществления изобретения новые замещенные бензимидазольные производные представляют собой соединения формул (I)-(III), в которых с обозначает 1 или 2 и по меньшей мере один R4 обозначает гало-C1-C6-алкил, такой, например, как трифторметил. В конкретных вариантах осуществления изобретения R1, R2, R3 и R4 необязательно могут быть замещены одним-пятью заместителями, независимо друг от друга выбранными из гидроксигруппы, галогена, C1-C6-алкила, гало-C1-C6-алкила, C1-C6-алкоксигруппы и гало-C1-C6-алкоксигруппы. В конкретных вариантах осуществления изобретения R1, R2, R3 и R4 необязательно могут быть замещены одним-тремя заместителями, независимо друг от друга выбранными из гидроксигруппы, галоге- 10014230 на, C1-C6-алкила, гало-C1-C6-алкила, C1-C6-алкоксигруппы и гало-C1-C6-алкоксигруппы. В конкретных вариантах осуществления изобретения R1 независимо выбран из группы, включающей галоген, C1-C6-алкоксигруппу, гало-C1-C6-алкил, гидроксигруппу, гало-C1-C6-алкоксигруппу, галоC1-C6-алкилсульфонил, гетероарил, гало-C1-C6-алкилсульфанил, гетероциклоалкил и C1-C6 алкилгетероциклоалкил. В некоторых из таких вариантов осуществления изобретения а обозначает 1 и R1 независимо выбран из группы, включающей 2-хлор, 2-этил, 2-трифторметил, 3-трифторметил, 4 трифторметил, 3-трет-бутил, 4-трет-бутил, 3-этил, 4-этил, 4-хлор, 4-бром, 4-трифторметоксигруппу, 4 трифторметилсульфанил, 4-трифторметилсульфонил и 4-(4-метилпиперазинил). В других вариантах осуществления изобретения а обозначает 2 и R1, каждый независимо друг от друга, выбран из группы,включающей 2-фтор, 2-хлор, 2-гидроксигруппу, 2-метоксигруппу, 3-метоксигруппу, 5-метоксигруппу, 4 хлор, 4-фтор, 3-трифторметил, 4-трифторметил, 5-трифторметил, 5-пиридинил, 5-пиридинил-3-ил, 5 пиридинил-4-ил, 3-тетрагидрофуран-3-ил, 3-изопропил, 5-изопропил и 5-трет-бутил. В конкретных вариантах осуществления изобретения R4 выбран из группы, включающей C1-C6 алкил, гидрокси-C1-C6-алкил, гало-C1-C6-алкил, гало-C1-C6-алкилсульфанил, C1-C6-алкоксикарбонил, C1C6-алкилгетероциклоалкил,карбонитрил,фенил,гало-C1-C6-алкилфенил,C1-C6 алкилгетероциклоалкилкарбонил и гидрокси-C1-C6-алкиламинокарбонил. В некоторых из таких вариантов осуществления изобретения с обозначает 1 и R4 выбран из группы,включающей трифторметил, карбонитрил, фенил, трифторметилсульфанил, метоксикарбонил, 4 этилпиперазинил, 4-этилпиперазинил-1-карбонил или 2-гидроксиэтиламинокарбонил. В других вариантах осуществления изобретения с обозначает 2 и R4, каждый независимо друг от друга, выбран из группы, включающей метил, 3-трифторметилфенил, 4-трифторметилфенил, трифторметил, этоксикарбонил,гидроксиметил и фенил. Другими вариантами осуществления изобретения являются соединение или его фармацевтически приемлемая соль, где соединение имеет формулу или таутомер соединения или фармацевтически приемлемая соль таутомера формулы Другими объектами настоящего изобретения являются способы лечения связанных с Raf нарушений у человека или животного, нуждающегося в таком лечении, которые заключаются в том, что указанному индивидууму вводят соединение формулы (I), (II), (III) или (IV) в количестве, которое обладает эффективностью в отношении снижения или предупреждения роста опухоли у индивидуума. Другими объектами настоящего изобретения являются способы лечения связанных с Raf заболеваний у человека или животного, нуждающегося в таком лечении, заключающиеся в том, что индивидууму вводят соединение формулы (I), (II), (III) или (IV) в количестве, которое обладает эффективностью в отношении снижения или предупреждения роста опухоли у индивидуума, в сочетании по меньшей мере с одним дополнительным агентом, предназначенным для лечения рака. Следующими объектами настоящего изобретения являются способы лечения связанных с Raf нарушений у человека или животного, нуждающегося в таком лечении, заключающиеся в том, что вводят указанному индивидууму соединение формулы (I), (II), (III) или (IV) в количестве, которое обладает эффективностью в отношении снижения или предупреждения роста опухоли у индивидуума, в сочетании по меньшей мере с одним дополнительным агентом, предназначенным для лечения рака. Ряд приемлемых противораковых агентов, которые можно применять для совместной терапии, можно использовать в способах, предлагаемых в настоящем изобретении. Так, согласно настоящему изобретению можно применять несколько противораковых агентов, таких как (но не ограничиваясь ими) агенты, которые индуцируют апоптоз; полинуклеотиды (например, рибозимы); полипептиды (например, ферменты); лекарственные средства; биологические миметики; алкалоиды; алкилирующие агенты; противоопухолевые антибиотики; антиметаболиты; гормоны; соединения платины; моноклональные антитела, конъюгированные с противораковыми лекарственными средствами, токсины и/или радионуклиды; модификаторы биологического ответа (например, интерфероны [например, IFN-a и т.д.] и интерлейкины [например, IL-2 и т.д.] и т.д.); агенты для адоптивной иммунотерапии; гематопоэтические факторы роста; агенты, которые индуцируют дифференцировку опухолевых клеток (например, полностью транс-ретиноевая кислота и т.д.); реагенты для генной терапии; реагенты и нуклеотиды для антисмысловой терапии; противоопухолевые вакцины; ингибиторы ангиогенеза и т.п. Некоторыми другими примерами химиотерапевтических соединений и противораковых терапий, которые можно применять совместно с описанными соедине- 11014230 ниями формулы (I), (II), (III) или (IV), известны специалистам в данной области. В предпочтительных вариантах осуществления изобретения противораковые агенты, которые можно применять в сочетании с соединениями, предлагаемыми в настоящем изобретении, представляют собой агенты, которые индуцируют или стимулируют апоптоз. К агентам, которые индуцируют апоптоз,относятся (но не ограничиваясь ими) радиация; ингибиторы киназ (например, ингибитор киназного рецептора эпидермального фактора роста [EGFR], ингибитор киназного рецептора сосудистого фактора роста [VGFR], ингибитор киназного рецептора фактора роста фибробластов [FGFR], ингибитор киназного рецептора тромбоцитарного фактора роста [PGFR] и ингибиторы киназ Bcr-Abl, такие как STI-571,глевек (Gleevec) и гливек (Glivec; антисмысловые молекулы; антитела [например, херцептин (Herceptin) и ритуксан (Rituxan)]; антиэстрогены [например, ралоксифен и тамоксифен]; антиадрогены [например,флутамид, бикалутамид, финастерид, аминоглутетамид, кетоконазол и кортикостероиды]; ингибиторы циклооксигеназы 2 (СОХ-2) [например, целекоксиб (Celecoxib), мелоксикам, NS-398 и нестероидные противовоспалительные лекарственные средства (НСПВС)]; и противораковые химиотерапевтические лекарственные средства [например, иринотекан (Camptosar), CPT-I1, флударабин (Fludara), дакарбазин(DTIC), дексаметазон, митоксантрон, милотарг (Mylotarg), VP-16, цисплатина, 5-ФУ, доксирубицин, таксотер или таксол]; молекулы, участвующие в передаче сигналов в клетке; керамиды и цитокины; стауросприн и т.п. Другими объектами настоящего изобретения являются фармацевтические композиции, содержащие по меньшей мере одно соединение или его фармацевтически приемлемую соль формулы (I), (II), (III) или(IV) в сочетании с фармацевтически приемлемым носителем, которые можно применять для введения человеку или животному либо индивидуально, либо в сочетании с другими противораковыми агентами. Следующими объектами настоящего изобретения являются способы получения соединений формул(I), (II), (III) или (IV), представленных в настоящем описании. Другими объектами настоящего изобретения являются соединения, представляющие собой ингибиторы фермента Raf-киназы. Поскольку фермент представляет собой расположенный по ходу пути передачи сигнала эффектор р 21ras, ингибиторы, предлагаемые в настоящем изобретении, применяют в фармацевтических композициях, предназначенных для медицины или ветеринарии, в случаях, когда показано ингибирование пути киназы Raf, например, для лечения опухолей и/или роста раковых клеток, опосредуемого киназой Raf. В частности, соединения можно применять для лечения рака у человека или животного, например рака мыши, поскольку развитие этих типов рака зависит от каскада трансдукции сигнала белка Ras, и поэтому они чувствительны к лечению путем прерывания этого каскада посредством ингибирования активности киназы Raf. Таким образом, соединения, предлагаемые в изобретении, можно применять для лечения плотных опухолей таких, например, как саркомы (например, рак легкого, поджелудочной железы, щитовидной железы, яичника, мочевого пузыря, молочной железы, предстательной железы или ободочной кишки), меланомы, миелоидные нарушения (например, миелолейкоз, множественная миелома и эритролейкоз), аденомы (например, ворсинчатая опухоль ободочной кишки) и саркомы (например, остеосаркома). В контексте настоящего описания понятие "ингибитор Raf" относится к соединению, значение IC50,характеризующее активность в отношении киназы Raf, не превышает примерно 100 мкМ и, как правило,не превышает примерно 50 мкм, при оценке с помощью анализа с использованием фильтрации Raf/Mek,который описан в целом ниже. Предпочтительными изоформами киназы Raf, которые ингибируют соединения, предлагаемые в настоящем изобретении, являются A-Raf, B-Raf и C-Raf (Raf-1). Понятие"IC50" обозначает концентрацию ингибитора, которая снижает активность фермента (например, киназыRaf) наполовину от максимального уровня. Установлено, что репрезентативные соединения, предлагаемые в настоящем изобретении, обладают ингибирующей активностью в отношении Raf. Соединения,предлагаемые в настоящем изобретении, предпочтительно характеризуются значением IC50 в отношенииRaf, не превышающим примерно 10 мкМ, более предпочтительно не превышающим примерно 5 мкМ,еще более предпочтительно не превышающим примерно 1 мкМ и наиболее предпочтительно не превышающим примерно 200 нМ, при оценке киназной активности Raf с помощью анализов, указанных в настоящем описании. В контексте настоящего описания понятие " путь трансдукции сигнала MAPK" является сокращенным обозначением пути трансдукции сигнала активируемой митогеном протеинкиназы в модуле, состоящем из передающих сигнал молекул Ras-Raf-MEK1-ERK. Понятие "алкил" относится к насыщенным углеводородным группам, которые не содержат гетероатомов, и оно включает алкильные группы с прямой цепью, такие как метил, этил, пропил, бутил, пентил,гексил, гептил, пропил, нонил, децил, ундецил, додецил и т.п. Понятие "алкил" относится также к изомерам прямоцепочечных алкильных групп с разветвленной цепью, включая (но не ограничиваясь ими) следующие, приведенные в качестве примера группы: -CH(CH3)2, -СН(СН 3)(CH2CH3), -СН(СН 2 СН 3)2,-C(CH3)3, -C(CH2CH3)3, -CH2CH(CH3)2, -CH2CH(CH3)(CH2CH3), -CH2CH(CH2CH3)2, -CH2C(CH3)3,-CH2C(CH2CH3)3,-CH(CH3)CH(CH3)(CH2CH3),-CH2CH2CH(CH3)2,-CH2CH2CH(CH3)(CH2CH3),-CH2CH2CH(CH2CH3)2,-СН 2 СН 2 С(СН 3)3,-CH2CH2C(CH2CH3)3,-CH(CH3)CH2CH(CH3)2,-CH(CH3)CH(CH3)CH(CH3)2, -H(CH2CH3)CH(CH3)CH(CH3)(CH2CH3) и др. Так, алкильные группы вклю- 12014230 чают первичные, вторичные и третичные алкильные группы. Понятие "C1-C12-алкил" относится к алкильным группам, имеющим от одного до двенадцати атомов углерода. Понятие "C1-C6-алкил" относится к алкильным группам, имеющим от одного до шести атомов углерода. Понятие "алкенил" относится к углеводородным группам с прямой или разветвленной цепью,имеющим от 2 до 6 атомов углерода и предпочтительно от 1 до 2 ненасыщенных винильных связей(С=С). Примерами таких групп могут служить винил, аллил и бут-3-ен-1-ил. Это понятие включает цис- и транс-изомеры или смеси таких изомеров. Понятие "алкоксигруппа" относится к группе RO-, в которой R обозначает алкил. В контексте настоящего описания понятие "C1-C6-алкоксигруппа" относится к группе RO-, в которой R обозначает C1C6-алкил. Репрезентативными примерами C1-C6-алкоксигрупп являются метоксигруппа, этоксигруппа,трет-бутоксигруппа и т.п. Понятие "C1-C6-алкоксикарбонил" относится к сложному эфиру -C(=O)-OR, в котором R обозначаетC1-C6-алкил. Понятие "амидиногруппа" относится к группе -C(=NH)NH2. Понятие "амидин" относится к соединению, содержащему такую группу. В контексте настоящего описания понятие "аминокарбонил" относится к группе -C(O)-NH2. Понятие "C1-C6-алкиламинокарбонил" относится к группе -C(O)-NRR', в которой R обозначает C1C6-алкил и R' выбран из водорода и C1-C6-алкила. Понятие "карбонил" относится к двухвалентной группе -С(О)-. Понятие "карбоксил" относится к группе -С(=O)-ОН. Понятия "цианогруппа", "карбонитрил" или "нитрил" относятся к группе -CN. Понятие "карбонитрил-C1-C6-алкил" относится к C1-C6-алкилу, замещенному -CN. Понятие "циклоалкил" относится к моно- или полициклическому алкильному заместителю. Как правило, циклоалкильные группы имеют от 3 до 8 кольцевых атомов углерода. Репрезентативными циклоалкильными группами являются циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Понятия "галоген" или "гало" обозначают хлор, бром, фтор и йод. Понятие "гало-C1-C6-алкил" относится к C1-C6-алкильному радикалу, замещенному одним или несколькими атомами галогена, предпочтительно одним-пятью атомами галогена. Более предпочтительной гало-C1-C6-алкильной группой является трифторметил. Понятие "гало-C1-C6-алкилфенил" относится к фенильной группе, замещенной гало-C1-C6 алкильной группой. Понятие "гало-C1-C6-алкоксигруппа" относится к алкоксигруппе, замещенной одним или несколькими атомами галогена, предпочтительно одним-пятью атомами галогена. Более предпочтительной галоC1-C6-алкоксигруппой является трифторметоксигруппа. Понятия "гало-C1-C6-алкилсульфонил" и "гало-C1-C6-алкилсульфанил" относятся к замещению сульфонильной и сульфанильной групп гало-C1-C6-алкильными группами, где сульфонил и сульфанил имеют значения, указанные в настоящем описании. Понятие "гетероарил" относится к ароматической группе, имеющей от 1 до 4 гетероатомов в качестве кольцевых атомов в ароматическом кольце, и где остальные кольцевые атомы представляют собой атомы углерода. Пригодными гетероатомами, которые можно применять в соединениях, предлагаемых в настоящем изобретении, являются азот, кислород и сера, причем атомы азота и серы необязательно могут быть окислены. Примерами гетероарильных групп являются группы, имеющие от 5 до 14 кольцевых атомов, и они включают, например, бензимидазолил, бензтиазолил, бензоксазолил, диазапинил, фуранил,пиразинил, пиразолил, пиридил, пиридазинил, пиримидинил, пирроил, оксазолил, изоксазолил, имидазолил, индолил, индазолил, хинолинил, изохинолинил, хиназолинил, хиноксалинил, тиазолил, тиенил и триазолил. В контексте настоящего описания понятие "гетероциклоалкил" относится к циклоалкильным заместителям, которые имеют от 1 до 5, и, как правило, от 1 до 2 гетероатомов в кольцевой структуре. Пригодными гетероатомами, которые можно применять в соединениях, предлагаемых в настоящем изобретении, являются азот, кислород и сера, причем атомы азота и серы необязательно могут быть окислены. Репрезентативные гетероциклоалкильные радикалы включают, например, морфолиногруппу, пиперазинил, пиперидинил и т.п. Понятие "C1-C6-алкилгетероциклоалкил" относится к гетероциклоалкильной группе, замещенной Понятие "гидрокси-C1-C6-алкил" относится к C1-C6-алкильной группе, замещенной гидроксигруп Понятие "гидрокси-C1-C6-алкиламинокарбонил" относится к C1-C6-алкиламинокарбонильной группе, замещенной гидроксигруппой. Понятие "имидат" или "сложный эфир имидата" относится к группе -C(=NH)O- или к соединению,содержащему такую группу. Сложные эфиры имидата включают, например, сложный метиловый эфир имидата -C(=NH)OCH3. Понятие "нитрогруппа" относится к группе -NO2. В контексте настоящего описания понятие "сульфонил" относится к группе -SO2-. В контексте настоящего описания понятие "сульфанил" относится к группе -S-. Понятие "алкилсульфонил" относится к замещенному сульфонилу, имеющему структуру -SO2R12, в которой R12 обозначает алкил. Понятие "алкилсульфанил" относится к замещенному сульфанилу, имеющему структуру -SR12, в которой R12 обозначает алкил. Алкилсульфонильные и алкилсульфанильные группы, применяемые в соединениях, предлагаемых в настоящем изобретении, включают C1-C6-алкилсульфонил и C1-C6 алкилсульфанил. Так, типичные группы включают, например, метилсульфонил и метилсульфанил (т.е. группы, в которых R19 обозначает метил), этилсульфонил и этилсульфанил (т.е. группы, в которых R12 обозначает этил), пропилсульфонил и пропилсульфанил (т.е. группы, в которых R12 обозначает пропил) и т.п. Понятие "гидроксизащитная группа" относится к защитным группам для группы ОН. В контексте настоящего описания понятие относится также к защите группы ОН кислоты СООН. Пригодные гидроксизащитные группы, а также пригодные условия для защиты и удаления защиты конкретных функциональных групп хорошо известны в данной области. Например, многочисленные такие защитные группы описаны у Т.W. Greene и P.G.M. Wuts, Protecting Groups in Organic Synthesis, 3-е изд., изд-во Wiley, NewYork, 1999. Такие защитные группы представляют собой сложные C1-C6-алкиловые эфиры, сложные бензиловые эфиры, сложные пара-метоксибензиловые эфиры и т.п. Понятие "полиморф" относится к различным кристаллическим формам соединения. Полиморфы могут отличаться друг от друга различными физическими свойствами, такими, например, как различия их рентгенограмм, картин абсорбционной ИК-спектроскопии, температур плавления, стабильности или растворимости. Понятие "метаболит" относится к любому производному, образовавшемуся в организме индивидуума после введения родительского соединения. Производные могут образовываться из родительского соединения в результате различных биохимических превращений в организме индивидуума, таких, например, как окисление, восстановление, гидролиз или конъюгация, и они включают, например, оксиды и деметилированные производные. Метаболиты, соответствующие таким производным, можно получать также с помощью методов in vitro или с помощью методов синтеза. В конкретных вариантах осуществления изобретения метаболит соединения формулы (I)-(IV) представляет собой оксид. В некоторых объектах оксид представляет собой N-оксид, полученный синтезом путем обработки соединения формулы(I)-(IV) окислителем. В конкретных объектах изобретения окислитель представляет собой N-оксид Nметилморфолина или гидроперекись, такую как перекись водорода. В некоторых вариантах осуществления изобретения соединение формулы (I)-(IV) подвергают конъюгации с глюкуроновой кислотой с образованием метаболита. Другим объектом изобретения является метаболит, его таутомер или стереоизомер, имеющий структуру Понятие "необязательно замещенный" или "замещенный" относится к замещению одного или нескольких атомов водорода одновалентным или двухвалентным радикалом. Когда замещаемый фрагмент включает группу с прямой цепью, то замещение может иметь место внутри цепи (примером является 2-гидроксипропил, 2-аминобутил и т.п.) или на конце цепи (примером является 2-гидроксиэтил, 3-цианпропил и т.п.). Замещаемые фрагменты могут иметь прямоцепочечные,разветвленные или циклические конфигурации ковалентно связанных атомов углерода или гетероатомов. Подразумевается, что приведенные выше определения не включают недопустимые схемы замещения (например, метил, замещенный пятью атомами фтора или атом галогена, замещенный другим атомом галогена). Такие недопустимые схемы замещения хорошо известны специалисту в данной области.- 14014230 Специалистам в данной области должно быть также очевидно, что соединения, предлагаемые в изобретении, включая соединения формул (I), (II), (III) или (IV) или их стереоизомеры и полиморфы, а также фармацевтически приемлемые соли, сложные эфиры, метаболиты и пролекарства любого из этих соединений, можно подвергать таутомеризации, и, следовательно, они могут существовать в различных таутомерных формах, в которых протон одного атома молекулы смещается к другому атому и вследствие этого преобразуются химические связи между атомами молекул (см., например, March, Advanced OrganicChemistry: Reactions, Mechanisms and Structures, 4-е изд., изд-во John WileySons, 1992, с. 69-74). В контексте настоящего описания понятие "таутомер" относится к соединениям, образующимся в результате смещения протона, и подразумевается, что все таутомерные формы, если они могут существовать, подпадают под объем изобретения. Например, таутомер соединения приведенной ниже формулы (Ia), являющийся соединением формулы (I), в которой с обозначает 1, представляет собой соединение формулы(Ib). Аналогично этому таутомер соединения формула (IVc) представляет собой соединение формулы Соединения, предлагаемые в изобретении, включая соединения формул (I), (II), (III) или (IV) или их таутомеры и полиморфы, а также фармацевтически приемлемые соли, сложные эфиры, метаболиты и пролекарства любого из этих соединений могут содержать асимметрично замещенные атомы углерода. Наличие таких асимметрично замещенных атомов углерода может приводить к образованию соединений, предлагаемых в изобретении, в форме энантиомеров, диастероизомеров и других стереоизомеров,которые в понятиях абсолютной стереохимии можно обозначать как (R)- или (S)-формы. Таким образом,все такие возможные изомеры, индивидуальные стереоизомеры в их оптически чистых формах, их смеси, рацемические смеси (или "рацематы"), смеси диастереоизомеров, а также индивидуальные диастереоизомеры соединений, предлагаемых в изобретении, подпадают под объем настоящего изобретения. В контексте настоящего описания понятия "S"- и "R"-конфигурация имеют значения, определенные в IUPAC 1974 RECOMMENDATIONS FOR SECTION E, FUNDAMENTAL STEREOCHEMISTRY, Pure Appl.Chem. 45, 1976, с. 13-30. Понятияииспользуют для обозначения положений колец циклических соединений, -сторона рассматриваемой плоскости представляет собой сторону, на которой предпочтительный заместитель находится в положении с наименьшим номером. Заместителям, находящимся с противоположной стороны рассматриваемой плоскости, присваивается идентификатор . Следует отметить, что такое употребление отличается от того, которое используют для циклических стереопартнеров,в которых а означает "находящийся ниже плоскости" и обозначает абсолютную конфигурацию. В контексте настоящего описания понятия - и -конфигурация имеют значения, определенные в CHEMICALABSTRACTS INDEX GUIDE, приложение IV, 1987, параграф 203. Специалистам в данной области должно быть также очевидно, что соединения, предлагаемые в изобретении, включая соединения формул (I), (II), (III) или (IV), или их стереоизомеры и таутомеры, а также фармацевтически приемлемые соли, сложные эфиры, метаболиты и пролекарства любого из этих соединений, могут существовать в различных кристаллических формах (или "полиморфах"), имеющих различные физические свойства. Подразумевается, что все полиморфы соединений, предлагаемых в изобретении, включая их метаболиты, пролекарства, стереоизомеры и таутомеры, а также фармацевтически- 15014230 приемлемые соли любого из этих соединений, если они могут существовать, как в выделенной форме,так и в виде смеси, подпадают под объем изобретения. В контексте настоящего описания понятие "фармацевтически приемлемые соли" относится к нетоксичным солям кислот или щелочно-земельных металлов соединения, таутомера, стереоизомера, полиморфа, сложного эфира, метаболита, или пролекарства формул (I), (II), (III) или (IV). Эти соли можно получать in situ в процессе конечного выделения и очистки соединений формул (I), (II), (III) или (IV), или по отдельности, осуществляя взаимодействие основной или кислотной функции с пригодной органической или неорганической кислотой или основанием соответственно. Репрезентативными солями являются (но не ограничиваясь ими) следующие соли: ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат,додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат,фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, сульфат, тартрат, тиоцианат, пара-толуолсульфонат и ундеканоат. Основные азотсодержащие группы можно также кватернизировать с помощью таких агентов, как(низш.)алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамисульфаты, галогениды с длинной цепью,такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -йодиды, фенилалкилгалогениды,такие как бензил- и фенэтилбромиды и другие. При этом получают растворимые или диспергируемые в воде или масле продукты. Примерами кислот, которые можно использовать для получения фармацевтически приемлемых кислотно-аддитивных солей, являются такие неорганические кислоты, как соляная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как щавелевая кислота, малеиновая кислота, метансульфоновая кислота, янтарная кислота и лимонная кислота. Соли присоединения оснований можно получать in situ в процессе конечного выделения или очистки соединений формулы (I) или отдельно, подвергая взаимодействию фрагменты карбоновой кислоты с пригодным основанием, таким как гидроксид,карбонат или бикарбонат фармацевтически приемлемого катиона металла, или с аммиаком, или с органическим первичным, вторичным или третичным амином. Фармацевтически приемлемые соли включают(но не ограничиваясь ими) катионы щелочных или щелочно-земельных металлов, такие как натриевые,литиевые, калиевые, кальциевые, магниевые, алюминиевые соли и т.п., а также нетоксичные катионы аммония, четвертичного аммония и амина, включая (но не ограничиваясь ими) аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, этиламин и т.п. Другие репрезентативные органические амины, которые можно применять для получения солей присоединения оснований, включают диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин и т.п. Соли и препараты соединений, предлагаемых в изобретении, описаны также в предварительных заявках, озаглавленных "Formulations For Benzimidazole Pyridyl Ethers" (US серийный номер 60/832715; досье у патентного поверенного номер РР 028237.0001), зарегистрированной 21 июля 2006 г., и "Salts ofBenzimidazolyl Pyridyl Ethers and Formulations Thereof" (досье у патентного поверенного номер РР 028258.0001), зарегистрированной 30 августа 2006 г., каждая из которых полностью включена в настоящее описание в качестве ссылки. В контексте настоящего описания понятие "фармацевтически приемлемый сложный эфир" относится к сложным эфирам, которые гидролизуются in vivo, и включает сложные эфиры, которые легко расщепляются в человеческом организме с высвобождением родительского соединения или его соли. Пригодными сложноэфирными группами являются, например, группы, полученные из фармацевтически приемлемых алифатических карбоновых кислот, прежде всего алкановых, алкеновых, циклоалкановых и алкандионовых кислот, в которых каждый алкильный или алкенильный фрагмент предпочтительно имеет не более 6 атомов углерода. Примерами конкретных сложных эфиров являются формиаты, ацетаты,пропионаты, бутираты, акрилаты и этилсукцинаты. В контексте настоящего описания понятие "фармацевтически приемлемые пролекарства" относится к таким пролекарствам соединений, предлагаемых в настоящем изобретении, которые с медицинской точки зрения пригодны для контакта с тканями человека и низших животных и не вызывают чрезмерную токсичность, раздражение, аллергические реакции и т.п., характеризуются соразмерным соотношением благоприятного действия/риска и обладают эффективностью в отношении цели их применения, а также к цвиттерионным формам, если они существуют, соединений, предлагаемых в изобретении. Понятие "пролекарство" относится к соединениям, которые быстро трансформируются in vivo, высвобождая родительское соединение указанной выше формулы, например в результате гидролиза в крови. Подробное обсуждение этого вопроса дано у Т. Higuchi и V. Stella, Pro-drugs as Novel Delivery Systems, том 14 A.C.S.Pharmaceutical Association and Pergamon Press, 1987, обе публикации включены в настоящее описание в качестве ссылки. Специалистам в данной области должно быть очевидно, что соединения, предлагаемые в изобретении, включая соединения формул (I), (II), (III) или (IV), или их таутомеры, пролекарства, стереоизомеры- 16014230 и полиморфы, а также фармацевтически приемлемые соли, сложные эфиры и пролекарства любого их этих соединений могут подвергаться процессингу in vivo в результате метаболизма в организме или клетке человека или животного кроме человека с образованием фармацевтически активных метаболитов,которые сохраняют свою активность в качестве ингибиторов. Активные метаболиты соединения, предлагаемого в изобретении, можно идентифицировать с помощью стандартных методов, известных в данной области (см., например, Bertolini G. и др., J. Med. Chem. 40, 1997, с. 2011-2016; Shan D. и др., J. Pharm.Academic Publishers, 1991). Подразумевается, что индивидуальные химические соединения, которые являются активными метаболитами соединения, предлагаемого в изобретении, подпадают под объем изобретения. Понятие "рак" относится к раковому заболеванию, на которое можно оказывать благоприятное лечебное действие путем ингибирования киназы, прежде всего киназы Raf, и оно включает, например, типы рака, характеризующиеся плотными опухолями, такие, например, как карциномы (например, рак легкого, поджелудочной железы, щитовидной железы, яичника, мочевого пузыря, молочной железы, предстательной железы или ободочной кишки), меланомы, миелоидные нарушения (например, миелоидный лейкоз, множественная миелома и эритролейкоз), аденомы (например, ворсинчатая опухоль ободочной кишки) и саркомы (например, остеосаркома). В репрезентативных вариантах осуществления изобретения соединения, предлагаемые в изобретении, представляют собой, например,1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-ил-(4 трифторметилфенил)амин,(2-фтор-5-пиридин-3-илфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1 Н-бензоимидазол-2-иламин,(2-фтор-5-пиридин-4-илфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1H-бензоимидазол-2-иламин,(4-трет-бутилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-иламин,1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-ил-(3 трифторметилфенил)амин,(3-этилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-иламин,(4-хлорфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1Hбензоимидазол-2-иламин,(4-этилфенил)-1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1Hбензоимидазол-2-иламин,(4-хлор-3-трифторметилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1H-бензоимидазол-2-иламин,(4-фтор-3-трифторметилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1H-бензоимидазол-2-иламин,1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-ил-(4 трифторметоксифенил)амин,(2-фтор-5-трифторметилфенил)-(1-метил-5-2-[5-метил-4-(3-трифторметилфенил)-1 Н-имидазол-2 ил]пиридин-4-илокси-1H-бензоимидазол-2-ил)амин,(2-фтор-5-трифторметилфенил)-(1-метил-5-2-[5-метил-4-(4-трифторметилфенил)-1H-имидазол-2 ил]пиридин-4-илокси-1H-бензоимидазол-2-ил)амин,этиловый эфир 2-4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1 Н-бензоимидазол-5 илокси]пиридин-2-ил-5-трифторметил-1 Н-имидазол-4-карбоновой кислоты,(2-4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1H-бензоимидазол-5-илокси]пиридин-2-ил 5-трифторметил-1 Н-имидазол-4-ил)метанол,2-4-[1-метил-2-(4-трифторметилфениламино)-1H-бензоимидазол-5-илокси]пиридин-2-ил-3Hимидазол-4-карбонитрил,(3-трет-бутилфенил)-1-метил-5-[2-(5-фенил-1H-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-иламин,1-метил-5-[2-(5-фенил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-ил-(4 трифторметилсульфанилфенил)амин,(3-трет-бутилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-иламин,[4-фтор-3-(тетрагидрофуран-3-ил)фенил]-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2 ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-иламин,(4-бромфенил)-1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1 Н- 17014230 бензоимидазол-2-иламин,(4-фтор-3-изопропилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]1 Н-бензоимидазол-2-иламин,1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-ил-(4 трифторметилсульфанилфенил)амин,(2-фтор-5-изопропилфенил)-1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]1H-бензоимидазол-2-иламин,(2-фтор-5-трифторметилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1 Н-бензоимидазол-2-иламин,(5-трет-бутил-2-фторфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]1H-бензоимидазол-2-иламин,(2-фтор-5-трифторметилфенил)-1-метил-5-[2-(5-метил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-иламин,(2-фтор-5-пиридин-3-илфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1 Н-бензоимидазол-2-иламин,2-4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1H-бензоимидазол-5-илокси]пиридин-2-ил 3H-имидазол-4-карбонитрил,(2-хлор-4-трифторметилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1 Н-бензоимидазол-2-иламин,(5-трет-бутил-2-хлорфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]1H-бензоимидазол-2-иламин,(2-фтор-5-пиридин-4-илфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1H-бензоимидазол-2-иламин,(2-фтор-5-трифторметилфенил)-1-метил-5-[2-(4-фенил-5-трифторметил-1 Н-имидазол-2 ил)пиридин-4-илокси]-1Н-бензоимидазол-2-иламин,(2-хлор-5-трифторметилфенил)-1-метил-5-[2-(4-фенил-5-трифторметил-1 Н-имидазол-2 ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-иламин,1-метил-5-[2-(4-фенил-5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол 2-ил-(3-трифторметилфенил)амин,(3-этилфенил)-1-метил-5-[2-(4-фенил-5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-иламин,(4-трет-бутилфенил)-1-метил-5-[2-(4-фенил-5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1 Н-бензоимидазол-2-иламин,(2-хлор-5-трифторметилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1H-бензоимидазол-2-иламин,(2-фтор-5-трифторметилфенил)-1-метил-5-[2-(5-метил-4-фенил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1 Н-бензоимидазол-2-иламин,(2-хлор-5-трифторметилфенил)-1-метил-5-[2-(5-метил-4-фенил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1 Н-бензоимидазол-2-иламин,(4-трет-бутилфенил)-1-метил-5-[2-(5-метил-4-фенил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-иламин,1-метил-5-[2-(5-метил-4-фенил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-ил-(3 трифторметилфенил)амин,(5-трет-бутил-2-фторфенил)-1-метил-5-[2-(5-метил-4-фенил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1 Н-бензоимидазол-2-иламин,[4-(4-метилпиперазин-1-ил)фенил]-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1H-бензоимидазол-2-иламин,метиловый эфир 2-4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1 Н-бензоимидазол-5 илокси]пиридин-2-ил-3H-имидазол-4-карбоновой кислоты,этиловый эфир 2-4-[2-(2-хлор-5-трифторметилфениламино)-1-метил-1 Н-бензоимидазол-5 илокси]пиридин-2-ил-5-трифторметил-1 Н-имидазол-4-карбоновой кислоты,(2-фтор-4-трифторметилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4 илокси]-1 Н-бензоимидазол-2-иламин,(2-хлорфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-иламин,(2,5-диметоксифенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-иламин,(3,5-диметоксифенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1Hбензоимидазол-2-иламин,1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-ил-(2 трифторметилфенил)амин,(2-этилфенил)-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1H- 18014230 бензоимидазол-2-иламин,(4-этилпиперазин-1-ил)-(2-4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1 Н-бензоимидазол 5-илокси]пиридин-2-ил-3H-имидазол-4-ил)метанон,(2-гидроксиэтил)амид 2-4-[2-(2-фтор-5-трифторметилфениламино)-1-метил-1 Н-бензоимидазол-5 илокси]пиридин-2-ил-3H-имидазол-4-карбоновой кислоты,1-этил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-ил-(2 фтор-5-трифторметилфенил)амин,(2-фтор-5-трифторметилфенил)-6-метокси-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензоимидазол-2-иламин,6-метокси-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензоимидазол-2-ил-(4-трифторметилфенил)амин,(4-этилпиперазин-1-ил)-(2-4-[1-метил-2-(4-трифторметилфениламино)-1 Н-бензоимидазол-5 илокси]пиридин-2-ил-3H-имидазол-4-ил)метанон,1-этил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2-ил-(4 трифторметилфенил)амин,(2-гидроксиэтил)амид 2-4-[1-метил-2-(4-трифторметилфениламино)-1 Н-бензоимидазол-5 илокси]пиридин-2-ил-3H-имидазол-4-карбоновой кислоты,2-1-метил-5-[2-(5-трифторметил-1H-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2 иламино-5-трифторметилфенол и 3-1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензоимидазол-2 иламино-6-трифторметилфенол; или их таутомеры, стереоизомеры, полиморфы, сложные эфиры, метаболиты или пролекарства либо фармацевтически приемлемые соли соединений, таутомеров, стереоизомеров, полиморфов, сложных эфиров, метаболитов или пролекарств. Другими объектами настоящего изобретения являются способы получения соединений формул (I),(II), (III) или (IV) и синтетические промежуточные продукты, которые можно применять в таких способах. Настоящее изобретение относится также к способам получения соединений, предлагаемых в изобретении, и к синтетическим промежуточным продуктам, которые можно применять в таких способах,как это подробно описано ниже. Методы синтеза На схеме 1 проиллюстрирован синтез центрального фрагмента, представляющего собой простой биариловый эфир, соединений, предлагаемых в изобретении. Соединение 1.1 подвергают взаимодействию с соединением 1.2, где один из радикалов L1 или L2 обозначает галоген, а другой из радикалов L1 или L2 обозначает ОН, с получением простого эфира 1.3. Сочетание можно осуществлять в органическом растворителе, таком как ацетонитрил или диметилсульфоксид, в присутствии основания, и можно осуществлять также при повышенных температурах или температурах дефлегмации. Пригодными основаниями являются K2CO3, CaCO3, KOH, NaOH или KF-Al2O3 (Journal of Organic Chemistry, том 63,18,1998, с. 6338-6343). Группа Q в соединении 1.1 может представлять собой NH2 или предшественник аминогруппы, такой как NO2, или защищенную аминогруппу, которую можно затем превращать в аминогруппу путем восстановления или удаления защитных групп с предшественников аминогруппы соответственно. Группа Z в соединении 1.2 может представлять собой имидазолильную группу, замещенную одной или двумя группами R4, или функциональную группу, которую можно использовать для формирования такой имидазолильной группы. Пригодными функциональными группами являются альдегид или предшественник альдегида, такой как сложный эфир или карбонитрил, который затем можно превращать в альдегид. Сложноэфирные и карбонитрильные группы можно восстанавливать до альдегида с помощью восстановителя, такого как гидрид диизобутилалюминия. Z может представлять собой также группу-CH2OR5, в которой R5 обозначает гидроксизащитную группу. Альдегид можно получать на более поздней стадии путем удаления защитной группы с группы R5 и окисления образовавшегося спирта до альдегида. Превращение альдегида в замещенную имидазоильную группу проиллюстрировано на схеме 3. Другие методы формирования замещенной имидазоильной группы проиллюстрированы на схеме 6. Схема 1 На схеме 2 представлен пример синтеза конкретных простых биариловых эфиров. Следует иметь в виду, что представленные на схеме 2 схемы замещения приведены в качестве примера: Q обозначаетNO2, L1 обозначает ОН, L2 обозначает Cl и Z обозначает сложный трет-бутиловый эфир. Пример синтеза альдегида 2.7, в котором R2 обозначает метил и b обозначает О, представлен в примере 1. Амин 2.1 можно превращать в алкиламин 2.2 с помощью многочисленных известных методов. В- 19014230 одном из вариантов амин 2.1 обрабатывают уксусным ангидридом и муравьиной кислотой с получением соответствующего формамида, который можно восстанавливать до алкиламина 2.2. Пригодными восстановителями являются NaBH4 в присутствии BF3(OCH2CH3)2. В альтернативном варианте алкиламин 2.2 можно синтезировать путем взаимодействия амина 2.1 с трифторуксусным ангидридом, алкилирования соответствующего амида с помощью алкилирующего агента, такого как алкилгалогенид, и удаления трифторацетамидозащитной группы путем обработки основанием, таким как NaOH. Хлорид 2.5 можно получать путем обработки пиколиновой кислоты 2.3 избытком тионилхлорида с получением хлорангидрида 2.4, который затем обрабатывают ди-трет-бутилдикарбонатом и пиридином с получением хлорида 2.5. Путем сочетания спирта алкиламина 2.2 с хлоридом 2.5 в основных условиях получают простой эфир 2.6, который затем можно превращать непосредственно в альдегид 2.7 путем восстановления с помощью гидрида диизобутилалюминия или в две стадии путем восстановления сложного эфира 2.6 до спирта и последующего окисления до альдегида. Схема 2 На схеме 3 проиллюстрировано создание имидазольного кольца. Альдегид 2.7 можно подвергать взаимодействию с соединением 3.1, в котором Xb обозначает =O или =NHOH и R4p и R4q независимо друг от друга обозначают Н или R4, где R4 имеет указанные выше значения, при условии, что по меньшей мере один из R4p и R4q обозначает R4. Реакцию можно осуществлять в полярном растворителе, таком как смесь этилацетат/этанол, и в присутствии NH4OH с получением соединения 3.2. Нитрогруппу соединения 3.2 можно восстанавливать до аминогруппы 3.3 путем обработки восстановителем, таким как дитионит натрия (Na2S2O4). Схема 3 На схеме 4 проиллюстрировано создание бензимидазольного кольца. Диамин 3.3 подвергают взаимодействию с тиоизоцианатом 4.1, получая тиомочевину 4.2. Путем обработки соединения 4.2 десульфурирующим агентом получают соединение формулы (I). Понятие "десульфурирующий агент" относится к агентам, которые можно применять для осуществления замыкания кольца, таким как FeCl3, йодид 2 хлор-1-метилпиридиния (реагент Мукайямы), хлорид 2-хлор-1,3-диметилимидазолия, POCl3 или алкилгалогенид, такой как метилйодид. Можно использовать также модифицированные реагенты Мукайямы В альтернативном варианте соединения, предлагаемые в изобретении, можно синтезировать с использованием модифицированной последовательности реакций сочетания. На схеме 5 проиллюстрировано сочетание соединения 5.1 с соединением 5.2 с формированием связи, представляющей собой простой эфир, и сочетание соединения 5.3 с соединением 3.1 с получением имидазольного кольца в качестве предпоследней стадии получения полностью замкнутого пентациклического ядра. В промежуточных продуктах 5.1 и 5.2 один из радикалов L3 или L4 обозначает галоген, а другой из радикалов L3 или L4 обозначает ОН. Эти промежуточные продукты можно получать, как показано на приведенных выше схемах с использованием пригодных исходных материалов и/или защитных групп в соответствующих последовательностях реакций. Такие факторы известны специалисту в данной области. Например, альдегид 5.3 можно получать путем восстановления соответствующего карбонитрила, синтез которого описан в примере 60, гидридом диизобутилалюминия. Путем взаимодействия альдегида 5.3 согласно приведенной выше схеме 3 с кетоном 3.1 получают соединения формулы (I). Схема 5 Соединения, предлагаемые в изобретении, которые имеют триазольную концевую группу, можно получать, как проиллюстрировано на схеме 6, путем взаимодействия соединения 6.1, в котором Z обозначает карбонитрил, с гидразидом 6.2. Пример синтеза соединения 6.3 описан в примере 60. Схема 6 Следует иметь в виду, что имидазольные промежуточные продукты, используемые в реакциях сочетания, можно получать с помощью других путей синтеза. Один из таких примеров проиллюстрирован на схеме 7. Соединение 1.3, в котором Z обозначает CN, превращают в соединение, в котором Z обозначает амидиногруппу. Это превращение можно осуществлять путем взаимодействия соединения 1.3 с алкоксидом, таким как метоксид, с превращением карбонитрила в сложный имидатный эфир, который затем подвергают взаимодействию с аммониевым реагентом, таким как ацетат аммония или бензоат аммония, с получением амидина. Путем взаимодействия амидина с соединением (Va), в котором Ха обозначает уходящую группу, получают алкилированное и циклизованное соединение 7.2 или его таутомер. Путем нагревания соединения 7.2 удаляют воду (дегидратация) и получают промежуточный продукт 7.3. Другие условия дегидратации включают обработку соединения 7.2 органическими кислотами, такими как уксусная кислота, метансульфоновая кислота, камфорсульфоновая кислота, трифторметансульфоновая кислота и трифторуксусная кислота, а также неорганическими кислотами, такими как соляная кислота и серная кислота. Четыре реакции - образование сложного имидатного эфира, образование амидина,алкилирование/циклизацию и дегидратацию, как правило, осуществляют в виде последовательности реакций в одном сосуде. Соединения, предлагаемые в изобретении, можно применять для ингибирования in vitro или in vivo роста раковых клеток. Соединения можно использовать индивидуально или в сочетании с фармацевтически приемлемым носителем или эксципиентом. Пригодные фармацевтически приемлемые носители или эксципиенты представляют собой, например, процессирующие агенты и модификаторы введения лекарственного средства и энхансеры, такие, например, как фосфат кальция, стеарат магния, тальк, моносахариды, дисахариды, крахмал, желатин, целлюлоза, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, декстроза, гидроксипропилциклодекстрин, поливинилпирролидинон, воски с низкой температурой плавления, ионообменные смолы и т.п., а также комбинации любых двух или большего количества указанных соединений. Другие пригодные фармацевтически приемлемые эксципиенты описаны в справочнике "Remington's Pharmaceutical Sciences", изд-во Mack Pub. Co., New Jersey, 1991, включенном в настоящее описание в качестве ссылки. Эффективные количества соединений, предлагаемых в изобретении, как правило, представляют собой любые количества, достаточные для обнаруживаемого ингибирования активности Raf, которое выявляют с помощью любого из методов, представленных в настоящем описании, других методов анализа киназной активности Raf, которые известны или легко могут быть изучены обычными специалистами в данной области, или определяют по ингибированию или ослаблению симптомов рака. Количество действующего вещества, которое можно объединять с носителями с получением лекарственной формы в виде однократной дозы, должно варьироваться в зависимости от хозяина, подлежащего лечению, и конкретного пути введения. Однако следует понимать, что конкретный уровень доз для любого конкретного пациента должен зависеть от различных факторов, включая активность конкретного применяемого соединения, возраст, вес тела, общее состояние здоровья, пол, диету, время введения, путь введения, скорость экскреции, комбинацию лекарственных средств и серьезность конкретного заболевания, подлежащего лечению. Терапевтически эффективное количество в конкретной ситуации легко можно определять с помощью общепринятых экспериментов, и решение этого вопроса находится в компетенции обычного лечащего врача. Для целей настоящего изобретения под терапевтически эффективной дозой обычно подразумевают общую суточную дозу, вводимую хозяину, в виде однократных или разделенных доз в количестве, например, от 0,001 до 1000 мг/кг веса тела ежедневно, от 1,0 до 30 мг/кг веса тела ежедневно. В состав стандартной дозы могут входить такие количества составляющих, которые достаточны для получения суточной дозы. Соединения, предлагаемые в настоящем изобретении, можно вводить орально, парентерально,подъязычно, с помощью аэрозоля или спрея для ингаляции, ректально или местно в виде стандартных доз, содержащих общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители при необходимости. Местное применение может предусматривать также чрескожное введение, например, с помощью чрескожных бляшек или устройств для ионофореза. Понятие "парентеральный" в контексте настоящего описания включает подкожные инъекции, внутривенные, внутримышечные, надчревные инъекции или инфузии. Препараты для инъекций, например стерильные инъецируемые водные или масляные суспензии,можно приготавливать с помощью приемлемых известных в данной области диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций может представлять собой также стерильный инъецируемый раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например раствор в 1,3-пропандиоле. Приемлемыми наполнителями или растворителями являются стерилизованная вода, раствор Рингера или изотонический раствор хлорида натрия. Кроме того, в качестве растворителей или суспендирующих сред можно применять стерильные жирные масла. Для этой цели можно применять любую смесь жирных масел, включая синтетические моно- или диглицериды. Кроме того, в составе инъецируемых препаратов нашли применение жирные кислоты, такие как олеиновая кислота. Суппозитории для ректального введения лекарственного средства можно получать путем смешения лекарственного средства с приемлемым не взывающим раздражения эксципиентом, таким как масло какао и полиэтиленгликоли, которые находятся в твердой фазе при нормальной температуре, но находятся в жидкой фазе при температуре в прямой кишке и поэтому расплавляются в прямой кишке с высвобождением лекарственного средства.- 22014230 Твердые лекарственные формы для орального введения могут представлять собой капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах действующее вещество можно смешивать по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут содержать также согласно общепринятой практике дополнительные субстанции, отличные от инертных разбавителей, например замасливатели, такие как стеарат магния. В случае капсул, таблеток и пилюль лекарственные формы могут содержать также забуферивающие агенты. Таблетки и пилюли можно приготавливать также с энтеросолюбильными покрытиями. Жидкие лекарственные формы для орального введения могут представлять собой фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные разбавители,которые обычно применяют в данной области техники, например воду. Такие композиции могут включать также адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, циклодекстрины и подслащивающие вещества, корригенты и отдушки. Соединения, предлагаемые в настоящем изобретении, можно вводить также в форме липосом. Как известно в данной области, липосомы, как правило, получают из фосфолипидов или других липидных субстанций. Липосомы состоят из одно- или многослойных гидратированных жидких кристаллов, которые диспергированы в водной среде. Для получения липосом можно использовать любой нетоксичный физиологически приемлемый и метаболизируемый липид. Предлагаемые в настоящем изобретении композиции в форме липосом могут содержать помимо соединения, предлагаемого в настоящем изобретении, стабилизаторы, консерванты, эксципиенты и т.п. Предпочтительными липидами являются фосфолипиды и фосфатидилхолины (лецитины), как встречающиеся в естественных условиях, так и синтетические. Методы получения липосом известны в данной области (см., например, Methods in Cell Biology,том XIV, под ред. Prescott, изд-во Academic Press, New York, N.W., 1976, с. 33 и далее). Хотя соединения, предлагаемые в изобретении, можно применять в виде единственного фармацевтического агента, их можно использовать также в сочетании с одним или несколькими другими агентами, применяемыми для лечения рака. Соединения, предлагаемые в настоящем изобретении, можно применять также в сочетании с известными другими терапевтическими агентами и противораковыми агентами, и комбинации предлагаемых в настоящем изобретении соединений с другими противораковыми или химиотерапевтическими агентами подпадают под объем изобретения. Примеры таких агентов описаны в Cancer Principles and Practice of Oncology, под ред. V.Т. Devita и S. Hellman, 6-ое изд., изд-во Lippincott WilliamsWilkins Publishers, 15 февраля 2001 г. Специалист в данной области может определять,какие комбинации агентов можно применять, основываясь на конкретных характеристиках лекарственных средств и подлежащего лечению рака. К таким противораковым агентам относятся (но не ограничиваясь ими) следующие субстанции: модуляторы рецепторов эстрогена, модуляторы рецепторов андрогена, модуляторы ретиноидных рецепторов, цитотоксические/цитостатические агенты, антипролиферативные агенты, ингибиторы пренилпротеинтрансферазы, ингибиторы HMG-CoA-редуктазы и другие ингибиторы ангиогенеза, ингибиторы клеточной пролиферации и пути передачи сигналов выживания, индуцирующие апоптоз вещества и агенты, взаимодействующие с реперными точками клеточного цикла. Соединения, предлагаемые в изобретении, можно применять также в сочетании с лучевой терапией. Таким образом, согласно одному из вариантов осуществления изобретения соединения, предлагаемые в изобретении, применяют также в сочетании с известными противораковыми агентами, такими,например, как модуляторы рецепторов эстрогена, модуляторы рецепторов андрогена, модуляторы ретиноидных рецепторов, цитотоксические агенты, антипролиферативные агенты, ингибиторы пренилпротеинтрансферазы, ингибиторы HMG-CoA-редуктазы, ингибиторы ВИЧ-протеазы, ингибиторы обратной транскриптазы и другие ингибиторы ангиогенеза. К модуляторам рецепторов эстрогена относятся соединения, которые взаимодействуют или ингибируют связывание эстрогена с рецептором вне зависимости от механизма действия. Примеры модуляторов рецепторов эстрогена включают (но не ограничиваясь ими) тамоксифен, ралоксифен, идоксифен,LY353381, LY1 17081, торемифен, фулвестрант, 4-[7-2,2-диметил-1-оксопропокси-4-метил-2-[4-[2-(1 пиперидинил)этокси]фенил]-2 Н-1-бензпиран-3-ил]-фенил-2,2-диметилпропаноат, 4,4'-дигидроксибензофенон-2,4-динитрофенилгидразон и SH646. К модуляторам рецепторов андрогена относятся соединения, которые взаимодействуют или ингибируют связывание андрогена с рецептором андрогена. Репрезентативными примерами модуляторов рецепторов андрогена являются финастероид и другие ингибиторы 5-редуктазы, нилутамид, флутамид,бикалутамид, лиарозол и абиратенона ацетат. К модуляторам ретиноидных рецепторов относятся соединения, которые взаимодействуют или ингибируют связывание ретиноидов с ретиноидным рецепторов. Примерами модуляторов ретиноидных рецепторов являются бексаротен, третиноин, 13-цис-ретиноевая кислота,9-цис-ретиноевая кислота,-дифторметилорнитин,LX23-7553,транс-N-(4'гидроксифенил)ретинамид и 1H-карбоксифенилретинамид. Цитотоксические и/или цитостатические агенты представляют собой соединения, которые вызывают гибель клеток или ингибируют пролиферацию клеток, прежде всего путем непосредственного взаимодействия с клеточной функцией либо путем ингибирования, либо оказывая воздействие на митоз кле- 23014230 ток, к ним относятся алкилирующие агенты, факторы некроза опухоли, интеркаляторы, активируемые гипоксией соединения, ингибиторы микротрубок/стабилизаторов микротрубок, ингибиторы митотических кинезинов, ингибиторы киназ, участвующих в развитии митоза, антиметаболиты; модификаторы биологических ответов; гормональные/антигормональные терапевтические агенты, гематопэтические факторы роста, терапевтические агенты, меченные моноклональными антителами, ингибиторы топоизомеразы, ингибиторы протеосом и ингибиторы убикитин-лигазы. Примерами цитотоксических агентов являются (но не ограничиваясь ими) сертенеф, кахектин, ифосфамид, тасонермин, лонидамин, карбоплатин, алтретамин, преднимустин, дибромдулцитол, ранимустин, фотемустин, недаплатин, оксалиплатин,темозоломид, гептаплатин, эстрамустин, импросульфана тозилат, трофосфамид, нимустин, диброспидия хлорид, пумитепа, лобаплатин, сатраплатин, профиромицин, цисплатин, ирофулвен, дексифосфамид,цис-аминдихлор(2-метилпиридин)платина, бензилгуанин, глуфосфамид, GPX100, тетрахлорид (транс,транс, транс)-бисму(гексан-1,6-диамин)му-[диаминплатина(II)]бис[диамин(хлор)платины(II)], диаризидинилспермин, трехокись мышьяка, 1-(11-додециламино-10-гидроксиундецил)-3,7-диметилксантин, зорубицин, идарубицин, даунорубицин, бисантрен, митоксантрон, пирарубицин, пинафид, валрубицин,амрубицин, антинеопластон, 3'-деамино-3'-морфолино-13-дезоксо-10-гидроксикарминомицин, аннамицин,галарубицин,элинафид,MEN10755 и 4-деметокси-3-деамино-3-азиридинил-4 метилсульфонилдаунорубицин (см. WO 00/50032). Репрезентативным примером активируемого гипоксией соединения является тирапазамин. Ингибиторами протеосомы являются (но не ограничиваясь ими) лактацистин и бортезомиб. Примерами ингибиторов микротрубок/стабилизаторов микротрубок являются паклитаксел, виндесина сульфат, 3',4'-дидегидро-4'-дезокси-8'-норвинкалеукобластин, доцетаксол, ризоксин, доластатин, мивобулина изетионат, ауристатин, цемадотин, RPR.1 09881, BMS 184476, винфлунин,криптофицин, 2,3,4,5,6-пентафтор-N-(3-фтор-4-метоксифенил)бензола сульфонамид, ангидровинбластин,N,N-диметил-L-валил-L-валил-N-метил-L-валил-L-пролил-L-пролин-трет-бутиламид, TDX258, эпотилоны (см., например, US 6284781 и 6288237) и BMS1 88797. Репрезентативные примеры ингибиторов топоизомеразы включают топотекан, гикаптамин, иринотекан, рубитекан, 6-этоксипропионил-3',4'-Оэксобензилиденхартреусин,9-метокси-N,N-диметил-5-нитропиразол[3,4,5-k1]акридин-2-(6 Н)пропанамин, 1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1 Н,12 Н-бензо[de]пирано[3',4':b,7]индолизино[152b]хинолин-10,13(9 Н,15 Н)дион,луртотекан,7-[2-(N-изопропиламино)этил](20S)кампотецин, BNP1350, BNPI1100, BN80915, BN80942, этопосида фосфат, тенипосид, собузоксан, 2'диметиламино-2'-дезоксиэтопосид,GL331,N-[2-(диметиламино)этил]-9-гидрокси-5,6-диметил-6 Нпиридо[4,3-b]карбазол-1-карбоксамид, асулакрин, (5 а,5 аВ,8 аа,9b)-9-[2-[N-[2-(диметиламино)этил]-Nметиламино]этил]-5-[4-гидрокси-3,5-диметоксифенил]-5,5 а,6,8,8 а,9-гексагидрофуро(3',4':6,7)нафто(2,3d)-1,3-диоксол-6-он, 2,3-(метилендиокси)-5-метил-7-гидрокси-8-метоксибензо[с]фенантридиний, 6,9 бис[(2-аминоэтил)амино]бензо[g]изогуинолин-5,10-дион, 5-(3-аминопропиламино)-7,10-дигидрокси-2-(2 гидроксиэтиламинометил)-6 Н-пиразоло[4,5,1'-de]акридин-6-он,N-[1-[2(диэтиламино)этиламино]-7 метокси-9-оксо-9 Н-тиоксантен-4-илметил]формамид, N-(2-(диметиламино)этил)акридин-4-карбоксамид,6-2-(диметиламино)этил]амино]-3-гидрокси-7 Н-индено[2,1-с]хинолин-7-он и димесна. Примеры ингибиторов митотических кинезинов, таких как человеческий митотический кинезин KSP, описаны в публикациях РСТ WO 01/30768 и WO 01/98278, WO 03/050064 (19 июня 2003 г.), WO 03/050122 (19 июня 2003 г.), WO 03/049527 (19 июня 2003 г.), WO 03/049679 (19 июня 2003 г.), WO 03/049678 (19 июня 2003 г.) и WO 03/39460 (15 мая 2003 г.) и находящихся на рассмотрении заявках РСТ US 03/06403 (зарегистрирована 4 марта 2003 г.), US 03/15861 (зарегистрирована 19 мая 2003 г.), US 03/15810 (зарегистрирована 19 мая 2003 г.), US 03/18482 (зарегистрирована 12 июня 2003 г.) и US 03/18694 (зарегистрирована 12 июня 2003 г.). В одном из вариантов осуществления изобретения ингибиторы митотических кинесзинов включают (но не ограничиваясь ими) ингибиторы KSP, ингибиторы MKLP1, ингибиторы CENP-Е,ингибиторы MCAK, ингибиторы Kifl4, ингибиторы Mphosphl и ингибиторы Rab6-KIFL. Ингибиторы киназ, участвующих в развитии митоза, включают (но не ограничиваясь ими) ингибиторы aurora-киназы, ингибиторы Polo-подобных киназ (PLK) (например, ингибиторы PLK-I), ингибиторыbub-1 и ингибиторы bub-R1. Антипролиферативные агенты включают антисмысловые РНК- и ДНКолигонуклеотиды, такие как G3139, ODN698, RVASKRAS, GEM231 и INX3001, и антиметаболиты, такие как еноцитабин, кармофур, тегафур, пентостатин, доксифлуридин, триметрексат, флударабин, капецитабин, галоцитабин, цитарабина окфосфат, гидрат фостеабина натрия, ралтитрексед, палтитрексид, эмитефур, тиазофурин, децитабин, нолатрексед, пеметрексед, нелзарабин, 2'-дезокси-2'-метилиденцитидин, 2'фторметилен-2'-дезоксицитидин,N-[5-(2,3-дигидробензофурил)сульфонил]-N'-(3,4 дихлорфенил)мочевина, N6-[4-дезокси-4-[N2-[2(Е),4(Е)-тетрадекадиеноил]глициламино]-L-глицеро-В-Lманногептопиранозил]аденин, аплидин, эктеинасцидин, троксацитабин, 4-[2-амино-4-оксо-4,6,7,8 тетрагидро-3H-пиримидино[554-b][1,4]тиазин-6-ил-(S)-этил]-2,5-тиеноил-L-глутаминовая кислота, аминоптерин, 5-фторурацил, аланосин, 11-ацетил-8-(карбамоилоксиметил)-4-формил-6-метокси-14-окса-1,1 диазатетрацикло(7.4.1.0.0)-тетрадека-2,4,6-триен-9-иловый эфир уксусной кислоты, сваинсонин, лометрексол,декстразоксан,метиониназа,2'-циано-2'-дезокси-N4-пальмитоил-1-В-Dарабинофураносилцитозин и 3-аминопиридин-2-карбоксальдегидтиосемикарбазон. Примерами терапевтических агентов, меченных моноклональными антителами, являются такие терапевтические агенты,- 24014230 которые несут цитотоксические агенты или радиоизотопы, связанные с моноклональным антителом,специфическим в отношении раковой клетки или клетки-мишени. Примером является, в частности, Bexxar. Ингибиторы HMG-СоА-редуктазы представляют собой ингибиторы 3-гидрокси-3-метилглутарилСоА-редуктазы. Соединения, обладающие ингибирующей активностью в отношении HMG-CoAредуктазы, можно легко идентифицировать с помощью методов анализа, хорошо известных в данной области, таких как методы, описанные или процитированные в US 4231938 и WO 84/02131. Примерами ингибиторов HMG-CoA-редуктазы, которые можно применять, являются (но не ограничиваясь ими) ловастатин (MEV ACOR(R); см. US 4231938, 4294926 и 4319039), симвастатин (ZOCOR(R); см. US 4444784, 4820850 и 4916239), правастатин (PRAVACHOL(R); см. US 4346227, 4537859, 4410629, 5030447 и 5180589), флувастатин (LESCOL(R); см. US 5354772, 4911165, 4929437, 5189164, 5118853, 5290946 и 5356896) и аторвастатин (LIPITOR(R); см. US 5273995, 4681893, 5489691 и 5342952). Структурные формулы этих и других ингибиторов HMG-CoA-редуктазы, которые можно применять в способах, предлагаемых в настоящем изобретении, описаны на с. 87 у М. Yalpani, "Cholesterol Lowering Drugs", изд-воChemistryIndustry, 5 февраля 1996 г., с. 85-89 и в US 4782084 и 4885314. В одном из вариантов осуществления изобретения ингибитор HMG-CoA-редуктазы выбирают из ловастатина и симвастатина. К ингибиторам пренил-протеинтрансферазы относятся соединения, которые ингибирует один фермент или любую комбинацию ферментов пренил-протеинтрансфераз, включая фарнезилпротеинтрансферазу (FPT-азу), геранилгеранил-протеинтрансферазу типа I (GGPT-аза-I) и геранилгеранил-протеинтрансферазу типа II (GGPT-аза-II, называемая также Rab GGPT-азой). Примерами соединений, ингибирующих пренил-протеинтрансферазу, являются -6-[амино(4-хлорфенил)(1-метил-1 Нимидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)хинолинон, (-)-6-[амино(4-хлорфенил)(1-метил-1 Нимидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1H)-хинолинон, (+)-6-[амино(4-хлорфенил)(1-метил 1H-имидазол-5-ил)метил]-4-(3-хлорфенил)-1-метил-2(1 Н)-хинолинон,5(S)-н-бутил-1-(2,3 диметилфенил)-4-[1-(4-цианбензил)]-5-имидазолилметил-2-пиперазинон,(S)-1-(3-хлорфенил)-4-[1-(4 цианбензил)-5-имидазолилметил]-5-[2-(этансульфонил)метил)-2-пиперазинон,5(S)-n-бутил-1-(2 метилфенил)-4-[1-(4-цианбензил)-5-имидазолилметил]-2-пиперазинон,1-(3-хлорфенил)-4-[1-(4 цианбензил)-2-метил-5-имидазолилметил]-2-пиперазинон, 1-(2,2-дифенилэтил)-3-[N-(1-(4-цианбензил)1 Н-имидазол-5-илэтил)карбамоил]пиперидин,4-[4-гидроксиметил-4-(4-хлорпиридин-2 илметил)пиперидин-1-илметил]-2-метилимидазол-1-илметилбензнитрил, 4-5-[4-гидроксиметил-4-(3 хлорбензил)пиперидин-1-илметил]-2-метилимидазол-1-илметилбензнитрил,4-3-[4-(2-оксо-2 Нпиридин-1-ил)бензил]-3H-имидазол-4-илметилбензнитрил, 4-3-[4-(5-хлор-2-оксо-2 Н-[1,2']бипиридин 5'-илметил)]-3H-имидазол-4-илметилбензнитрил, 4-3-[4-(2-оксо-2 Н-[1,2']бипиридин-5'-илметил)]-3Hимидазол-4-илметилбензнитрил, 4-[3-(2-оксо-1-фенил-1,2-дигидропиридин-4-илметил)-3H-имидазол-4 илметил]бензнитрил,18,19-дигидро-19-оксо-5 Н,17 Н-6,10:12,16-диметен-1H-имидазо[4,3-с][1,11,4]диоксаазациклононадецин-9-карбонитрил, -19,20-дигидро-19-оксо-5 Н-18,21-этан-12,14-этен 19,206,10-метен-22 Н-бенз[d]имидазо[4,3-k]-[1,6,9,12]оксатриазациклооктадецин-9-карбонитрил,дигидро-19-оксо-5 Н,17 Н-18,21-этано-6,10:12,16-диметено-22 Н-имидазо[3,4h][1,8,11,14]оксатриазациклоэйкозин-9-карбонитрил и -19,20-дигидро-3-метил-19-оксо-5H-18,21 этано-12,14-этено-6,10-метено-22 Н-бенз[d]имидазо[4,3-k][1,6,9,12]оксатриазациклооктадецин-9 карбонитрил. Другие примеры ингибиторов пренил-протеинтрансфераз можно найти в следующих публикациях и патентах: WO 96/30343, WO 97/18813, WO 97/21701, WO 97/23478, WO 97/38665,WO 98/28980, WO 98/29119, WO 95/32987, US 5420245, US 5523430, US 5532359, US 5510510,US 5589485, US 5602098, публикация европейского патента 0618221, публикация европейского патента 0675112, публикация европейского патента 0604181, публикация европейского патента 0696593,WO 94/19357, WO 95/08542, WO 95/11917, WO 95/12612, WO 95/12572, WO 95/10514, US 5661152,WO 95/10515, WO 95/10516, WO 95/24612, WO 95/34535, WO 95/25086, WO 96/05529, WO 96/06138,WO 96/06193, WO 96/16443, WO 96/21701, WO 96/21456, WO 96/22278, WO 96/24611, WO 96/24612,WO 96/05168, WO 96/05169, WO 96/00736, US 5571792, WO 96/17861, WO 96/33159, WO 96/34850,WO 96/34851, WO 96/30017, WO 96/30018, WO 96/30362, WO 96/30363, WO 96/31111, WO 96/31477,WO 96/31478, WO 96/31501, WO 97/00252, WO 97/03047, WO 97/03050, WO 97/04785, WO 97/02920,WO 97/17070, WO 97/23478, WO 97/26246, WO 97/30053, WO 97/44350, WO 98/02436 и US 5532359. Роль ингибитора пренил-протеинтрансферазы в ангиогенезе описана, например, в European J. of Cancer 55(9),1999, с. 1394-1401. Ингибиторы ангиогенеза представляют собой соединения, которые ингибируют образование новых кровеносных сосудов вне зависимости от механизма действия. Примеры ингибиторов ангиогенеза включают (но не ограничиваясь ими) тирозинкиназные ингибиторы, такие как ингибиторы тирозинкиназных рецепторов FIt-I (VEGFR1) и FIk-1/KDR (VEGFR2), ингибиторы эпидермального, фибробластного или тромбоцитарного факторов роста, ингибиторы ММР (матриксная металлопротеаза), блокаторы интегрина, интерферон-альфа, интерлейкин-12, пентозанполисульфат, ингибиторы циклооксигеназ, включая нестероидные противовоспалительные лекарственные средства (НСПВС) типа аспирина и ибупрофена, а также избирательные ингибиторы циклооксигеназы-2 типа целекоксиба и рофекоксиба (PNAS, 89, 1992,- 25014230 с. 7384; JNCI 69, 1982, с. 475; Arch. Ophthalmol. 108, 1990, с. 573; Anat. Rec, (238), 1994, с. 68; FEBS Letters 372, 1995, с. 83; Clin. Orthop. 313, 1995, с. 76; J. Mol. Endocrinol. 16, 1996, с. 107; Jpn. J. Pharmacol. 75,1997, с. 105; Cancer Res. 57, 1997, с. 1625; Cell 93, 1998, с. 705; Intl. J. Mol. Med. 2, 1998, с. 715; J. Biol.Chem. 274, 1999, с. 9116), стероидные противовоспалительные лекарственные средства (такие как кортикостероиды, минералокортикоиды, дексаметазон, преднизон, преднизолон, метилпред, бетаматазон),карбоксиамидотриазол, комбретастатин А 4, скваламин, 6-O-хлорацетилкарбонилфумагиллол, талидомид, ангиостатин, тропонин-1, антагонисты ангиотензина II (см. Fernandez и др., J. Lab. Clin. Med. 105,1985, с. 141-145) и антитела к VEGF (см. Nature Biotechnology, 17, октябрь 1999 г., с. 963-968; Kim и др.,Nature, 362, 1993, с. 841-844; WO 00/44777 и WO 00/61186). Другие терапевтические агенты, которые модулируют или ингибируют ангиогенез и которые можно применять в сочетании с соединениями,предлагаемыми в настоящем изобретении, включают агенты, которые модулируют или ингибируют системы коагуляции и фибринолиза (см. обзор в Clin. Chem. La. Med. 38, 2000, с. 679-692). Примерами агентов, которые модулируют или ингибируют пути коагуляции и фибринолиза, являются (но не ограничиваясь ими) гепарин (см. Thromb. Haemost. 80, 1998, с. 10-23), низкомолекулярные гепарины и ингибиторы карбоксипептидазы U (известные также как ингибиторы активируемого активным тромбином ингибитора фибринолиза [TAFIa]) (см. Thrombosis Res. 101, 2001, с. 329-354). Ингибиторы TAFIa описаны в опубликованной заявке РСТ WO 03/013526 и US 60/349925 (зарегистрированная 18 января 2002 г.). Под объем изобретения подпадают также комбинации соединений, предлагаемых в изобретении, с НСПВС,которые являются избирательными ингибиторами СОХ-2 (к которым относят, как правило, соединения,которые обладают по меньшей мере в 100 раз более высокой специфичностью в отношении ингибирования СОХ-2 по сравнению с СОХ-1 при оценке соотношения значения IC50 для СОХ-2 по сравнению со значением IC50 для СОХ-1 с помощью клеточных или микросомальных анализов). Такие соединения включают (но не ограничиваясь ими) соединения, описанные в US 5474995, выданном 12 декабря 1995 г., US 5861419, выданном 19 января 1999 г., US 6001843, выданном 14 декабря 1999 г., US 6020343,выданном 1 февраля 2000 г., US 5409944, выданном 25 апреля 1995 г., US 5436265, выданном 25 июля 1995 г., US 5536752, выданном 16 июля 1996 г., US 5550142, выданном 27 августа 1996 г., US 5604260,выданном 18 февраля 1997 г., US 5698584, выданном 16 декабря 1997 г., US 5710140, выданном 20 января 1998 г., WO 94/15932, опубликованной 21 июля 1994 г., US 5344991, выданном 6 июня 1994 г.,US 5134142, выданном 28 июля 1992 г., US 5380738, выданном 10 января 1995 г., US 5393790, выданном 20 февраля 1995 г., US 5466823, выданном 14 ноября 1995 г., US 5633272, выданном 27 мая 1997 г., иUS 5932598, выданном 3 августа 1999 г., которые все включены в настоящее описание в качестве ссылки. Репрезентативные ингибиторы СОХ-2, которые можно применять в способах, предлагаемых в настоящем изобретении, включают 3-фенил-4-(4-(метилсульфонил)фенил)-2-(5 Н)-фуранон и 5-хлор-3-(4 метилсульфонил)фенил-2-(2-метил-5-пиридинил)пиридин. Соединения, которые описаны в качестве специфических ингибиторов СОХ-2 и которые, следовательно, можно применять согласно настоящему изобретению, и методы их синтеза можно найти в следующих патентах, находящихся в рассмотрении заявках и публикациях, которые включены в настоящее описание в качестве ссылки: WO 94/15932, опубликована 21 июля 1994 г., US 5344991, выдан 6 июня 1994 г., US 5134142, выдан 28 июля 1992,US 5380738, выдан 10 января 1995 г., US 5393790, выдан 20 февраля 1995 г., US 5466823, выдан 14 ноября 1995 г., US 5633272, выдан 27 мая 1997 г., US 5932598, выдан 3 августа 1999 г., US 5474995, выдан 12 декабря 1995 г., US 5861419, выдан 19 января 1999 г., US 6001843, выдан 14 декабря 1999 г., US 6020343,выдан 1 февраля 2000 г., US 5409944, выдан 25 апреля 1995 г., US 5436265, выдан 25 июля 1995 г., US 5536752, выдан 16 июля 1996 г., US 5550142, выдан 27 августа 1996 г., US 5604260, выдан 18 февраля 1997 г., US 5698584, выдан 16 декабря 1997 г. и US 5710140, выдан 20 января 1998 г. Другие примеры ингибиторов ангиогенеза включают (но не ограничиваясь ими) эндостатин, украин, ранпирназу, IM862,5-метокси-4-[2-метил-3-(3-метил-2-бутенил)оксиранил]-1-оксаспиро[2,5]окт-6-ил(хлорацетил)карбамат,ацетилдинаналин,5-амино-1-3,5-дихлор-4-(4-хлорбензил)фенил]метил]-1 Н-1,2,3-триазол-4 карбоксамид, СМ 101, скваламин, комбрестатин, RPI4610, NX31838, сульфированный маннопентозофосфат, 7,7-карбонилбис[имино-N-метил-4,2-пирролокарбонилимино[N-метил-4,2-пиррол]карбонилимино]бис-(1,3-нафталиндисульфонат) и 3-[(2,4-диметилпиррол-5-ил)метилен]-2-индолинон (SU5416). К агентам, которые оказывают воздействие на реперные точки клеточного цикла, относятся соединения, ингибирующие протеинкиназы, которые участвуют в трансдукции сигналов реперных точек клеточного цикла, повышая чувствительность тем самым раковых клеток к повреждающим ДНК агентам. К таким агентам относятся ингибиторы ATR, ATM, Chk1- и Chk2-киназ и ингибиторы cdk- и cdc-киназ, и их конкретными примерами являются 7-гидроксистауроспорин, флавопиридол, CYC202 (циклацел) иBMS-387032. Ингибиторы клеточной пролиферации и пути передачи сигналов выживания представляют собой фармацевтические агенты, которые ингибируют рецепторы клеточной поверхности и каскады трансдукции сигналов в направлении их распространения от этих поверхностных рецепторов. К таким агентам относятся ингибиторы ингибиторов EGFR (например, гефитиниб и эрлотиниб), ингибиторы ERB-2 (например, трастузумаб), ингибиторы IGFR, ингибиторы цитокиновых рецепторов, ингибиторы МЕТ 5, ингибиторы PI3K (например, LY294002), сериновых/треониновых киназ (включая (но не ограничиваясь- 26014230 ими) ингибиторы Akt, описанные в WO 02/083064, WO 02/083139, WO 02/083140 и WO 02/083138), ингибиторы киназы Raf (например, BAY-43-9006), ингибиторы MEK (например, CI-1040 и PD-098059) и ингибиторы mTOR (например, Wyeth CCI-779). Такие агенты включают низкомолекулярные ингибиторы и антагонисты антител. К индуцирующим апоптоз агентам относятся активаторы представителей семейства TNFрецепторов (включая TRAIL-рецепторы). В некоторых вариантах осуществления изобретения к репрезентативным агентам, которые можно применять в сочетании с соединениями, предлагаемыми в изобретении, для лечения рака, относятся, например, иринотекан, топотекан, гемицитабин, 5-фторурацил, леуковорин, карбоплатин, цисплатин, таксаны, тезацитабин, циклофосфамид, алкалоиды винка, иматиниб (гливек), антрациклины, ритуксимаб,трастузумаб, а также другие противораковые химиотерапевтические агенты. Вышеуказанные соединения, которые можно применять в сочетании с соединениями, предлагаемыми в изобретении, следует использовать в терапевтических количествах, указанных в настольном справочнике врача (PDR) 47-е изд. (1993), который включен в настоящее описание в качестве ссылки,или в таких терапевтических количествах, которые должны быть известны обычному специалисту в данной области. Соединения, предлагаемые в изобретении, и другие противораковые агенты можно вводить в рекомендованных максимальных клинических дозах или в более низких дозах. Уровень доз действующего вещества в композициях, предлагаемых в изобретении, может варьироваться так, чтобы достигать требуемого терапевтического ответа в зависимости от пути введения, серьезности заболевания и реакции пациента. Комбинацию можно вводить в виде индивидуальных композиций или в виде однократной формы лекарственного средства, содержащей оба агента. При введении в виде комбинации терапевтические агенты можно приготавливать в виде индивидуальных композиций, которые применяют в одно и то же время или в различное время, или в виде терапевтических агентов, которые можно применять в виде одной композиции. Антиэстрогены, такие как тамоксифен, ингибируют рост рака молочной железы посредством индукции приостановки клеточного цикла, для чего требуется активность ингибитора клеточного циклаp27Kip. В настоящее время установлено, что активация пути Ras-Raf-MAP-киназ изменяет статус фосфорилирования p27Kip, в результате чего его ингибирующая активность при приостановке клеточного цикла уменьшается, что приводит к устойчивости к антиэстрогенам (Donovan и др., J. Biol. Chem. 27(5),2001, с. 40888). Как описано Donovan с соавторами, ингибирование пути передачи сигнала MAPK в результате обработки ингибитором MEK изменяет статус фосфорилирования р 27 в устойчивых к гормонам линиях клеток рака молочной железы и в результате восстанавливает чувствительность к гормонам. Таким образом, согласно одному из объектов изобретения любые варианты соединений формулы (I), (II),(III) или (IV) или их таутомеры, фармацевтически приемлемые соли или фармацевтически приемлемые соли таутомеров можно использовать для лечения гормонзависимого рака, такого как рак молочной железы и предстательной железы, для реверсии устойчивости к гормона, обычно встречающейся при использовании общепринятых противораковых агентов. При гематологических формах рака, таких как хронический миелолейкоз (ХМЛ), хромосомная транслокация ответственна за конститутивно активированную тирозинкиназу BCR-AB1. Страдающие таким раком пациенты обладают чувствительностью к гливеку, низкомолекулярному ингибитору тирозинкиназы, в результате ингибирования киназной активности AbI. Однако многие пациенты, которые страдают прогрессирующей стадией заболевания, первоначально реагировали на гливек, но позднее у них наблюдался рецидив из-за обусловливающих устойчивость мутаций в киназном домене AbI. В опытах in vitro продемонстрировано, что BCR-AvI проявляют свое действие посредством характерного для киназы Raf пути. Кроме того, ингибирование более одной киназы в этом пути обеспечивает дополнительную защиту от обусловливающих устойчивость мутаций. Таким образом, согласно другому объекту изобретения любые варианты соединений формулы (I), (II), (III) или (IV) или их таутомеры, фармацевтически приемлемые соли или фармацевтически приемлемые соли таутомеров можно использовать в сочетании по меньшей мере с одним дополнительным агентом, таким как гливек, для лечения гематологических форм рака, таких как хронический миелолейкоз (ХМЛ), для реверсии или предупреждения устойчивости по меньшей мере к одному дополнительному агенту. Следующим объектом настоящего изобретения являются способы ингибирования по меньшей мере одной сериновой/треониновой киназы в пути передачи сигнала MAPK у индивидуума или лечения биологического состояния, опосредуемого сериновой/треониновой киназой пути передачи сигнала MAPK у индивидуума, заключающиеся в том, что вводят терапевтическую композицию, которая содержит по меньшей мере одно соединение формул (I), (II), (III) или (IV) или его таутомер, фармацевтически приемлемую соль или фармацевтически приемлемую соль таутомера, которая эффективно ингибирует активность по меньшей мере одной сериновой/треониновой киназы в пути передачи сигнала MAPK у индивидуума. Согласно этому объекту изобретения терапевтическую композицию можно применять для лечения пациентов, которые нуждаются в лечении такими ингибиторами (например, страдающих раком, опосре- 27014230 дуемым аномальной передачей сигнала MAPK). К типам рака, опосредуемым аномальной передачей сигнала MAPK, относятся, например, меланома, папиллярный рак, рак щитовидной железы, рак яичника,рак ободочной кишки, рак поджелудочной железы, немелкоклеточный рак легкого (NSCLC), острый лимфобластный лейкоз (ОЛЛ) и острый миелолейкоз. Аномальную передачу сигнала MAPK можно ингибировать путем введения соединения, которое ингибирует формы дикого типа или мутантные формыRas, Raf, MEK или ERK. Одним из вариантов осуществления изобретения является способ ингибирования Ras (дикого типа или мутантной Ras). Способ заключается в том, что вводят в эффективном количестве любые варианты соединения формул (I), (II), (III) или (IV) или их таутомеры, фармацевтически приемлемые соли или фармацевтически приемлемые соли таутомеров индивидууму, который нуждается в этом. Другим вариантом осуществления изобретения является способ ингибирования Raf (дикого типа или мутантной B-Raf). Способ заключается в том, что вводят в эффективном количестве любые варианты соединения формул (I), (II), (III) или (IV) или их таутомеры, фармацевтически приемлемые соли или фармацевтически приемлемые соли таутомеров индивидууму, который нуждается в этом. Еще одним вариантом осуществления изобретения является способ ингибирования MEK. Способ заключается в том, что вводят в эффективном количестве любые варианты соединения формул (I), (II),(III) или (IV) или их таутомеры, фармацевтически приемлемые соли или фармацевтически приемлемые соли таутомеров индивидууму, который нуждается в этом. Еще одним вариантом осуществления изобретения является способ ингибирования ERK. Способ заключается в том, что вводят в эффективном количестве любые варианты соединения формул (I), (II),(III) или (IV) или их таутомеры, фармацевтически приемлемые соли или фармацевтически приемлемые соли таутомеров индивидууму, который нуждается в этом. Приведенным в качестве примера соединением, которое применяют в способах этого объекта изобретения,является 1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1Hбензимидазол-2-ил-1H-(4-трифторметилфенил)амин, обладающий высокой ингибирующей активностью в отношении пути передачи сигнала MAPK, что описано ниже в примерах 82-86 и 89-90 и показано на фиг. 6-12 Б; 14 А-В и 15. Соединение является сильным ингибитором B-Raf, c-Raf, мутанта B-Raf и мутанта Ras в биохимических опытах, что видно из примера 82, в котором продемонстрировано ингибирование активности мутанта B-Raf (значение IC50 составляет 0,0053 мкМ), ингибирование активности B-Raf(значение IC50 0,068 мкМ) и ингибирование активности c-Raf (значение IC50 0,004 мкМ). Обработка соединением вызывала регресс опухоли на всех трех изученных моделях с использованием ксенотрансплантатов мутантной формы B-Raf (A375M5, MEXF276 и НТ 29), и ингибирование роста опухоли на моделях ксенотрансплантата K-Ras и N-Ras, что обобщено ниже в табл. 7 и описано в примерах 84, 85 и 86. Анализ модуляции мишеней в опухолевых клетках линий А 375N, MEXF276 и НСТ-116 после обработки 1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1H-бензимидазол-2-ил-(4 трифторметилфенил)амином позволил установить, что фосфорилирование MEK ингибировалось в зависимости от дозы и от времени, что видно из фиг. 7 Б, 8 Б и 10 В. Кроме того, обработка опухолевых клеток линий А 375N, MEXF276 и НСТ-116 соединением модулировала маркеры, расположенные в направлении распространения сигнала от Raf, включая BIM, циклин Dl, p27Kip и pAKT, что видно из фиг. 7 Г, 8 В и 9 В. Эти анализы, проведенные с использованием доклинических моделей, свидетельствуют о том, что 1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензимидазол-2-ил-(4 трифторметилфенил)амин обладает зависящей от дозы и времени способностью ингибировать как фосфорилирование мишени MEK, так и участвующие в передаче сигнала молекулы, расположенные в направлении распространения сигнала от Raf в пути MAPK. Следующим объектом настоящего изобретения являются способы ингибирования по меньшей мере одного тирозинкиназного рецептора, выбранного из группы, включающей VEGFR-2, PDGFR-, pERK,bFGF, FGFR1, FGFR2, FGFR3, c-Kit и CSF-IR, у индивидуума или лечения биологического состояния,опосредуемого по меньшей мере одним из VEGFR-2, PDGFR-, pERK, bFGF, FGFR1, FGFR2, FGFR3, cKit и CSF-IR, заключающиеся в том, что вводят терапевтическую композицию, содержащую по меньшей мере одно соединение или его фармацевтически приемлемую соль формулы (I), (II), (III) или (IV), которая эффективно ингибирует тирозинкиназный рецептор у индивидуума. Терапевтические соединения согласно этому объекту изобретения можно применять для лечения пациентов, которые нуждаются в лечении такими ингибиторами (например, страдающих раком, опосредуемым аномальной передачей сигнала тирозинкиназного рецептора). К формам рака, опосредуемым аномальной передачей сигнала тирозинкиназного рецептора, относятся, например, меланома, рак молочной железы, рак мочевого пузыря, рак легкого, рак щитовидной железы, рак предстательной железы, рак яичника, лейкоз тучных клеток, опухоли зародышевых клеток, мелкоклеточная карцинома легкого, опухоли, относящиеся к строме желудочно-кишечного тракта, острый миелолейкоз (ОМЛ), нейробластома и рак поджелудочной железы. Одним из вариантов осуществления изобретения является способ ингибирования VEGFR-2. Способ заключается в введении в эффективном количестве соединения или его фармацевтически приемлемой- 28014230 соли, относящихся к любым вариантам соединений формулы (I), (II), (III) или (IV), индивидууму, который нуждается в этом. Способ можно применять для лечения плотных опухолей путем ингибирования ангиогенеза. Следующим вариантом осуществления изобретения является способ ингибирования PDGFR-. Способ заключается в введении в эффективном количестве соединения или его фармацевтически приемлемой соли, относящихся к любым вариантам соединений формулы (I), (II), (III) или (IV), индивидууму,который нуждается в этом. Другим вариантом осуществления изобретения является способ ингибирования c-Kit. Способ заключается в введении в эффективном количестве соединения или его фармацевтически приемлемой соли, относящихся к любым вариантам соединений формулы (I), (II), (III) или (IV), индивидууму, который нуждается в этом. Еще одним вариантом осуществления изобретения является способ ингибирования CSF-IR. Способ заключается в введении в эффективном количестве соединения или его фармацевтически приемлемой соли, относящихся к любым вариантам соединений формулы (I), (II), (III) или (IV), индивидууму, который нуждается в этом. Примером соединения, которое можно применять в способах в этом объекте изобретения, является 1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Н-бензимидазол-2-ил(4 трифторметилфенил)амин, представляющий собой эффективный ингибитор тирозинкиназных рецепторов VEGFR-2, PDGFR-, pERK, bFGF, FGFR1, FGFR2, FGFR3, c-Kit and CSF-IR при оценке с помощью биохимического анализа. Соединение обладает ингибирующей активностью в отношении VEGFR-2(значение IC50 0,07 мкМ), ингибирующей активностью в отношении PDGFR- (значение IC50 0,0032 мкМ), ингибирующей активностью в отношении c-Kit (значение IC50 0,02 мкМ) и ингибирующей активностью в отношении CSF-IR (значение c 0,20 мкМ), что описано в пример 87. Кроме того, соединение индуцировало ингибирование ангиогенеза на модели in vivo, полученной с помощью матригеля, что видно из фиг. 13 и описано в примере 88. Настоящее изобретение станет более понятным путем ссылки на приведенные ниже примеры, которые даны только для иллюстрации и не направлены на ограничение настоящего изобретения. Ниже в примерах, а также в описании приведенные сокращения имеют указанные ниже значения. Понятие, которые не определены, имеют общепринятые значения.APCI - масс-спектроскопия с химической ионизацией при атмосферном давлении;EtOH - этанол; г - грамм(ы); ч - час; ЖХВР - жидкостная хроматография высокого разрешения; ИПС - изопропиловый спирт; л - литр;NaOMe - метоксид натрия; 1-PrOH - 1-пропанол; ТЭА - триэтиламин; ТФУА - трифторуксусный ангидрид; ТГФ - тетрагидрофуран. Репрезентативные боковые цепи, применяемые в соединениях, которые представлены в следующих примерах, можно получать с помощью описанных ниже процессов. Пример 1. Получение 1-метил-5-[2-(5-трифторметил-1 Н-имидазол-2-ил)пиридин-4-илокси]-1 Нбензимидазол-2-ил-(4-трифторметилфенил)амина
МПК / Метки
МПК: A61K 31/435, C07D 401/14, A61P 35/00
Метки: замещенные, бензимидазолы, ингибиторов, киназ, качестве
Код ссылки
<a href="https://eas.patents.su/30-14230-zameshhennye-benzimidazoly-v-kachestve-ingibitorov-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные бензимидазолы в качестве ингибиторов киназ</a>
Предыдущий патент: Антитело против мср-1, содержащие его композиции и способы применения антитела и композиций
Следующий патент: Комбинации, включающие ингибитор cdk и антитело фактора роста, или антимитотик
Случайный патент: 2-[5-бром-4-(4-циклопропилнафталин-1-ил)-4н-[1,2,4]триазол-3-илсульфанил] уксусная кислота и ее метиловый эфир


































