Комбинации, включающие ингибитор cdk и антитело фактора роста, или антимитотик
Номер патента: 14231
Опубликовано: 29.10.2010
Авторы: Песенти Энрико, Порро Марио Грация, Певарелло Паоло, Меркурио Чиро
Формула / Реферат
1. Комбинация, включающая соединение А формулы (I)
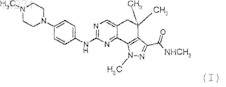
или его фармацевтически приемлемую соль и бевацизумаб или доксетаксел.
2. Комбинация по п.1, где соединение А представляет собой метиламид 8-[4-(4-метилпиперазин-1-ил)фениламино]-1,4,4-триметил-4,5-дигидро-1Н-пиразоло-[4,3-h]хиназолин-3-карбоновой кислоты или его фармацевтически приемлемую соль.
3. Фармацевтическая композиция, включающая комбинацию, как определено в любом из предыдущих пунктов, смешанную с фармацевтически приемлемым носителем, разбавителем или наполнителем.
4. Фармацевтический продукт, включающий соединение А, как определено в п.1, и бевацизумаб или доксетаксел в качестве комбинированного препарата для одновременного, последовательного или раздельного применения в терапии.
5. Применение комбинации по п.1 для получения лекарственного средства для лечения пролиферативного расстройства.
6. Применение по п.5, в котором лечение включает одновременное, последовательное или раздельное введение субъекту соединения А, как определено в п.1, и бевацизумаб или доксетаксел.
7. Способ лечения пролиферативного расстройства, включающий одновременное, последовательное или раздельное введение субъекту соединения А, как определено в п.1, и бевацизумаба или доксетаксела.
8. Способ снижения побочных эффектов, вызванных антинеопластической терапией антинеопластическим агентом у млекопитающих, включая людей, нуждающихся в этом, который включает введение указанному млекопитающему комбинации, включающей соединение А, как определено в п.1, и бевацизумаба или доксетаксела в количествах, эффективных для получения синергетического противоопухолевого эффекта.
9. Коммерческий набор, включающий в подходящем контейнере соединение А, как определено в п.1, и бевацизумаб.
10. Коммерческий набор, включающий в подходящем контейнере соединение А, как определено в п.1, и доксетаксел.
11. Коммерческий набор, включающий фармацевтическую композицию или продукт, как определено в п.3 или 4.
12. Набор по любому из пп.9-11 для одновременного, последовательного или раздельного применения в противоопухолевой терапии.
Текст
КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ ИНГИБИТОР CDK И АНТИТЕЛО ФАКТОРА РОСТА ИЛИ АНТИМИТОТИК Настоящее изобретение обеспечивает комбинацию, включающую соединение А формулы (I) или его фармацевтически приемлемую соль и антитело, ингибирующее фактор роста, или его рецептор, и/или антимитотический агент, или его производное, или пролекарство, пригодное для лечения опухолей. Химическим названием соединения А является метиламид 8-[4-(4 метилпиперазин-1-ил)фениламино]-1,4,4-триметил-4,5-дигидро-1 Н-пиразоло-[4,3-h]хиназолин-3 карбоновой кислоты.(71)(73) Заявитель и патентовладелец: НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.Р.Л. (IT) 014231 Область техники Настоящее изобретение относится, в общем, к области лечения рака и, более конкретно, обеспечивает противоопухолевую композицию, включающую ингибитор cdk и антитело, ингибирующее фактор роста, и/или антимитотическое соединение, обладающее синергетическим противоопухолевым действием. Уровень техники Хорошо известно, что развитие клеточного цикла управляется серией контрольных точек, иначе называемых точками рестрикции, которые регулируются рядом ферментов, известных как циклинзависимые киназы (cdk). В свою очередь, cdk регулируются на многих уровнях, таких как, например, связывание с циклинами. Координированная активация и инактивация различных комплексов циклин/cdk необходима для нормального развития клеточного цикла. Оба критических перехода G1-S и G2-M контролируются активацией различных комплексов циклин/cdk. Полагают, что в G1 как циклин D/cdk2, так и циклин E/cdk2 являются промежуточным звеном входа в S-фазу. Развитие S-фазы требует активности циклин A/cdk2, в то время как для входа в митоз требуется активация циклин A/cdc2 (cdk1) и циклин B/cdc2. Для общей ссылки на циклины и циклинзависимые киназы см., например, Kevin R. Webster et al., в Exp. Opin. Invest.Drugs, 1998, т. 7(6), 865-887. В опухолевых клетках контрольные точки являются дефектными, частично из-за дисрегуляции активности cdk. Например, в опухолевых клетках наблюдали измененную экспрессию циклина Е и cdk, и было показано, что делеция ингибитора cdk р 27 KIP гена у мышей приводит к более частой заболеваемости раком. Увеличивающиеся свидетельства поддерживают идею о том, что cdk являются ограничивающими скорость ферментами в развитии клеточного цикла и, по существу, представляют собой молекулярные мишени для лечебного воздействия. В частности, прямое ингибирование комплекса cdk/циклинкиназы должно быть полезным для ограничения нерегулируемой пролиферации опухолевой клетки.LIMITED) 21.05.2004 относятся к комбинациям таксана, таким как доцетаксел или паклитаксел, и росковитину, ингибитору протеинкиназы. PCT/WO 2005094830 А 13.10.2005 (PFIZER INC) описывает комбинации ингибиторов сигнальной трансдукции, таких как ингибиторы cdk. Существует постоянная необходимость в комбинациях известных противораковых лекарственных средств для оптимизации терапевтического лечения. Было показано, что некоторые пиразолохиназолины являются потенциальными ингибиторами ферментов циклинзависимых киназ, в частности cdk2. Одно из этих соединений в данный момент находится в разработке как противораковый агент. Ингибиторы cdk способны блокировать переход клеток от G2/M фазы клеточного цикла. Настоящее изобретение обеспечивает новые комбинации ингибитора cdk с известными фармацевтическими агентами, которые являются особенно пригодными для лечения пролиферативных расстройств, главным образом рака. Более конкретно, комбинации настоящего изобретения являются очень полезными в терапии в качестве противоопухолевых агентов и у них отсутствуют как токсичность, так и побочные эффекты, недостатки, связанные с имеющимися на данный момент противоопухолевыми лекарственными средствами. Раскрытие изобретения Целью настоящего изобретения в первом аспекте является обеспечение комбинации, включающей соединение А, имеющее следующую формулу (I): или его фармацевтически приемлемую соль и антитело, ингибирующее фактор роста, или его рецептор, и/или антимитотический агент, или его производное, или пролекарство. Другой аспект обеспечивает фармацевтическую композицию, включающую комбинацию в соответствии с настоящим изобретением, смешанную с фармацевтически приемлемым носителем, разбавителем или наполнителем. Дополнительный аспект относится к использованию комбинации в соответствии с настоящим изобретением для получения лекарственного средства для лечения пролиферативного расстройства. Еще один дополнительный аспект относится к фармацевтическому продукту, включающему соединение А,-1 014231 как определено выше, и антитело, ингибирующее фактор роста, или его рецептор, и/или антимитотический агент, или его производное, или пролекарство, в качестве комбинированного препарата для одновременного, последовательного или раздельного использования в терапии. Другой аспект относится к способу лечения пролиферативного расстройства, причем указанный способ включает одновременное,последовательное или раздельное введение пациенту соединения А, как описано выше, и антитела, ингибирующего фактор роста, или его рецептора, и/или антимитотического агента, или его производного, или пролекарства. Еще один аспект относится к применению соединения А, как описано выше, для получения лекарственного средства для лечения пролиферативного расстройства, в котором указанное лечение включает одновременное, последовательное или раздельное введение пациенту соединения А, как описано выше, и антитела, ингибирующего фактор роста, или его рецептора, и/или антимитотического агента, или его производного, или пролекарства. Другой аспект относится к применению соединения А, как описано выше, и антитела, ингибирующего фактор роста, или его рецептора, и/или антимитотического агента, или его производного для получения лекарственного средства для лечения пролиферативного расстройства. В настоящем описании, если не оговорено иное, соединение А является метиламидом 8-[4-(4 метилпиперазин-1-ил)фениламино]-1,4,4-триметил-4,5-дигидро-1 Н-лиразоло-[4,3-h]хиназолин-3 карбоновой кислоты. Оно может быть получено, как описано в PCT/WO 2004104007 A (PHARMACIAITALIA SPA) 02.12.2004, обладает ингибиторной активностью протеинкиназы и является, таким образом, пригодным для лечения в качестве противоопухолевого агента. В частности, предпочтительным получением соединения А является получение, описанное в примере 58 вышеупомянутой Международной патентной заявки. Фармацевтически приемлемые соли соединения А включают соли присоединения кислоты с неорганическими или органическими кислотами, например азотной, хлористо-водородной, бромистоводородной, серной, перхлорной, фосфорной, уксусной, трифторуксусной, пропионовой, гликолевой,молочной, щавелевой, малоновой, яблочной, малеиновой, винной, лимонной, бензойной, коричной, миндальной, метансульфоновой, изетионовой и салициловой кислот и т.п. В соответствии с предпочтительным воплощением изобретения антитело, ингибирующее фактор роста, или его рецептор выбраны из бевацизумаба (антитело к васкулярному эндотелиальному фактору роста), цетуксимаба, панитумумаба, матузумаба, нимотузумаба (антитела к рецептору эпидермального фактора роста), трастузумаба и пертузумаба (антитела к ErbB2). В соответствии с наиболее предпочтительным воплощением изобретения антителом, ингибирующим фактор роста, или его рецептором является бевацизумаб. Антимитотическим агентом является, например, эпотилон или таксан. Эпотилон связывается с микротрубочками и стабилизирует микротрубочки, имеет широкий диапазон противоопухолевой активности в дозах и режиме, связанных с допустимыми побочными эффектами,см. Journal of Clinical Oncology, т. 22, N10 (15 мая), 2004, с. 2015-2025. Основными характерными эпотилонами являются иксабепилон, BMS-310705, ЕРО 906 и KOS-862. Таксаны являются одним из наиболее мощных классов соединений среди химиотерапевтических средств, проявляющих широкий диапазон активности. Основными характерными таксанами являются паклитаксел и доцетаксел (см., например, обзор: Cancer, Principles and Practice of Oncology, LippincottRaven Ed. (1997), 467-483). Рандомизированные клинические исследования по оценке доцетаксела и паклитаксела в терапии первого ряда метастатического рака молочных желез, легких, яичников и пищеварительной системы, также как в адъювантной терапии лечения рака молочных желез, подтвердили, что таксаны вносят основной вклад в лечении рака; см., например, обзор: "Docetaxel for treatment of solid tumours: a systematic review of clinical data", Lancet Oncology (2005). Таксаны имеют специфический механизм действия, а именно гиперстабилизацию микротрубочек. Подробно таксаны нацелены насубъединицу гетеродимера тубулина, ключевого компонента клеточных микроканальцев. Данный механизм действия связан с остановкой клеточного цикла и апоптозом. Действие и противораковая активность паклитакселя и доцетаксела является схожей, но в то же время существуют ключевые различия, и является клинически очевидным недостаток перекрестной резистентности между таксанами. Доцетаксел проявляет большее сродство с -тубулином, нацеливаясь на формирование центросомы и действуя на клетки в трех фазах клеточного цикла (S/G2/M), в то время как паклитаксел вызывает повреждение клетки, действуя на митотическое веретено в G2 и М фазах клеточного цикла. Таким образом, в соответствии с настоящим изобретением предпочтительным антимитотическим агентом является таксан, более предпочтительны доцетаксел или паклитаксел. В настоящем изобретении соединение А, как определено выше, или его фармацевтически приемлемая соль и антитело, ингибирующее фактор роста, или его рецептор, и/или антимитотический агент, или его производное, или пролекарство присутствуют в количествах, эффективных для получения синергетического антинеопластического эффекта.-2 014231 Настоящее изобретение также обеспечивает способ снижения побочных эффектов, вызванных противоопухолевой терапией антинеопластическим агентом у млекопитающих, включая людей, в случае его необходимости, причем способ включает введение названному млекопитающему комбинации, включающей соединение А, как определено выше, и антимитотическое соединение и/или антитело, ингибирующее факторы роста или их рецепторы, как определено выше, в количествах, эффективных для получения синергетического противоопухолевого эффекта. Под термином "синергетический противоопухолевый эффект" понимают ингибирование роста опухоли, предпочтительно полную регрессию опухоли при введении эффективного количества комбинации соединения А, как описано выше, и антимитотического соединения, и/или антитела, ингибирующего факторы роста, или их рецепторы у млекопитающих, в том числе человека. Под термином "введенный" или "введение" понимают парентеральное и/или оральное введение. Под "парентеральным" понимают внутривенное, подкожное или внутримышечное введение. В способе изобретения использованное соединение А может быть введено одновременно с веществом с антимитотической активностью и/или антителами, ингибирующими факторы роста, или их рецепторами, или соединения могут быть введены последовательно в любом порядке. Следует заметить, что фактически предпочтительный способ и порядок введения будет меняться, в частности, в соответствии с конкретной формулой используемого соединения А, используемой конкретной формулой антимитотического соединения, такого как один из классов аналогов таксанов, и используемым антителом, ингибирующим фактор роста или его рецептор, конкретной модели опухоли, подвергаемой лечению, и конкретного реципиента,подвергаемого лечению. В способе настоящего изобретения для введения соединения А обычно используемый курс терапии находится в диапазоне от 5 мг/м 2 до 1,5 г/м 2 площади поверхности тела. Более предпочтительно, чтобы используемый курс терапии находился в диапазоне от 50 до 500 мг/м 2 площади поверхности тела. Соединение А может быть введено в различных лекарственных формах, например орально, в виде таблеток, капсул, таблеток, покрытых сахарозой или пленкой, жидких растворов или суспензий; ректально в виде суппозиториев; парентерально, например внутримышечно или через внутривенную, и/или интратекальную, и/или интраспинальную инъекцию или инфузию. В способе настоящего изобретения для введения антимитотических соединений, предпочтительно доцетаксела, курс обычно используемый терапии находится от примерно 50 до 100 мг/м 2 каждые три недели или от 30 мг/м 2 еженедельно. Для введения антитела, ингибирующего фактор роста, курс, обычно используемый в терапии, может находиться в диапазоне от 0,1 до 100 мг/кг. Более предпочтительно, чтобы используемый курс терапии находился в диапазоне от 1 до 20 мг/кг. Противоопухолевая терапия настоящего изобретения является особенно пригодной для лечения всех форм рака, включающих, но не ограничивающихся следующими: карцинома, такая как мочевого пузыря, молочных желез, прямой кишки, почек, печени, легких, включая мелкоклеточный рак легких,пищевода, желчного пузыря, яичников, поджелудочной железы, желудка, шейки матки, щитовидной железы, простаты и кожы, включая сквамозную клеточную карциному; кроветворные опухоли лимфатического происхождения, включая лейкемию, острую лимфоцитарную лейкемию, острую лимфобластическую лейкемию, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, лимфому волосатых клеток и лимфому Баркетта; опухоли кроветворных органов миелоидного происхождения, включая лейкемию, острую лимфоцитарную лейкемию, острую и хроническую миелоидную лейкемии, миелодисплатический синдром и промиелоцитарную лейкемию; опухоли мезенхимного происхождения, включая фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и невриномы; другие опухоли, включая меланому, семиному, тератокарциному, остеосаркому, пигментную ксеродерму, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. Как указано выше, влияние соединения А и антимитотического агента, или его производного, или пролекарства, и/или антитела, ингибирующего факторы роста или их рецепторы, значительно возрастает без увеличения параллельной токсичности. Другими словами комбинированная терапия настоящего изобретения усиливает противоопухолевый эффект соединения А, и/или антимитотического агента, или его производного, или пролекарства, и/или антитела, ингибирующего факторы роста или их рецепторы, и,таким образом, приводит к более эффективному и менее токсичному лечению опухолей. В соответствии с настоящим изобретением фармацевтические композиции являются полезными в противораковой терапии. Настоящее изобретение дополнительно обеспечивает коммерческий набор, включающий соединение А, как определено выше, и антимитотический агент, или его производное, или пролекарство. Оно также обеспечивает коммерческий набор в подходящем контейнере, включающий соединение А, как определено выше, антитело, ингибирующее фактор роста, или его рецептор. В соответствии с настоящим изобретением в наборе соединение А, как определено выше, антитело, ингибирующее фактор роста, или его рецептор, или антимитотический агент, или его производное, или пролекарство находятся в едином контейнере или в различных контейнерах.-3 014231 Другим воплощением настоящего изобретения является коммерческий набор, включающий фармацевтическую композицию или продукт, как определено выше. В соответствии с настоящим изобретением наборы предназначены для одновременного, последовательного или раздельного применения в противоопухолевой терапии. В соответствии с настоящим изобретением наборы предназначены для применения в противораковой терапии. Благодаря ключевой роли cdk в регуляции клеточной пролиферации комбинации настоящего изобретения также являются полезными при лечении различных клеточных пролиферативных расстройств,таких как, например, доброкачественная гиперплазия простаты, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, васкулярная пролиферация гладких клеток, связанная с атеросклерозом, легочный фиброз, артрит, гломерулонефрит и послеоперационный стеноз, и рестеноз. Комбинации данного изобретения, такие как модуляторы апоптоза, также могут быть полезными при лечении рака, вирусных инфекций, предупреждении развития СПИДа у ВИЧ-инфицированных пациентов, аутоиммунных заболеваний и нейродегенеративных расстройств. Активности комбинаций настоящего изобретения также показаны, например, следующими тестамиin vivo, которые предназначены для иллюстрации, но не для ограничения настоящего изобретения. Противоопухолевая эффективность in vivo при использовании моноклонального антитела Balb,Nu/Nu мужские особи мышей от Harlan (Италия) держали в клетках с крышкой из фильтровальной бумаги, пищей и стерилизованной постелью, и подкисленной водой. 2,5106 DU145 клеток карциномы простаты (от American Type Culture Collection) были подкожно введены бестимусным мышам. Данная модель опухоли была выбрана, поскольку ранее было показано, что бевацизумаб ингибирует ангиогенез и рост модели in vivo (см. для ссылки The prostate 36: 1-10, 1998). Лечение начали спустя 6 дней после инъекции опухолевых клеток, когда опухоли стали пальпируемыми. Бевацизумаб готовили непосредственно перед лечением, в то время как соединение А готовили каждые 3 дня, основываясь на известной стабильности соединения. Соединение А вводили орально в объеме 10 мл/кг в дозе 40 мг/кг дважды в день (BID) в течение 12 дней (дни от 6 до 17) . Бевацизумаб вводили внутрибрюшинно в объеме 10 мл/кг в дозе 20 мг/кг на 6, 10,14, 18 день со дня инъекции опухолевых клеток. При объединении соединение А вводили в интервале между введением бевацизумаба на 7, 8, 9, 11, 12, 13, 15, 16, 17, 19, 2 0 и 21 день. Рост опухоли и массу тела измеряли каждые 3 дня. Рост опухоли оценивали циркулем. Записывали два диаметра и вычисляли массу опухоли в соответствии со следующей формулой: длина (мм)ширина 2/2. Эффект противоопухолевого лечения оценивали как задержку начала экспоненциального роста опухоли (см. для ссылок Anticancer drugs 7: 437-60, 1996). Данная отсрочка (значение Т-С) была определена как разница во времени (в днях), необходимого для лечения группы (Т) и контрольной группы (С) опухолей для достижения заданного размера (1 г). Токсичность оценивали, основываясь на уменьшении веса тела. Результаты приведены ниже в табл. 1. Соединение А, объединенное с бевацизумабом, оказывает отчетливый синергический эффект: Т-С, наблюдаемое, когда соединение А было объединено с бевацизумабом, было выше ожидаемого при простом сложении Т-С, полученных при введении по отдельности. Ни в одной из групп лечения токсичности не наблюдали. Таблица 1 Лечения, проведенные орально, дважды в день на 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 и 17 дни.Лечения, проведенные внутрибрюшинно, на 6, 10, 14 и 18 дни.6, 10, 14 и 18 дни лечения бевацизумабом; 7, 8, 9, 11, 12, 13, 15, 16, 17, 19, 20 и 21 дни лечения соединением А. Противоопухолевая активность in vivo при использовании доцетаксела.Balb, Nu/Nu мужские особи мышей от Harlan (Италия) держали в клетках с крышкой из фильтровальной бумаги, пищей и стерилизованной постелью, и подкисленной водой. 2,5106 DU145 клеток карциномы простаты (от American Type Culture Collection) были подкожно введены мышам с атимией. Данная модель опухоли была выбрана, поскольку ранее было показано, что доцетаксел ингибирует ангиогенез и рост модели in vivo (см. для ссылки Cancer Res. 2004 Oct. 15, (64): 7426-31) и также основываясь на использовании данного лекарственного средства при раке простаты (см. для ссылки Approval summary:-4 014231 Лечение начали спустя 10 дней после инъекции опухолевых клеток, когда опухоли стали пальпируемыми. Доцетаксел готовили непосредственно перед введением, в то время как соединение А готовили каждые 3 дня, основываясь на известной стабильности соединения. Соединение А вводили орально в объеме 10 мл/кг в дозе 40 мг/кг дважды в день (BID) в течение 9 дней (дни от 10 до 18) . Доцетаксел вводили внутривенно в объеме 10 мл/кг при дозе 10 мг/кг на 10, 14,18 день со дня инъекции опухолевых клеток. В случае объединения соединение А вводили в интервале между введением доцетаксела на 11, 12, 13, 15, 16, 17, 19, 20 и 21 день. Рост опухоли и массу тела измеряли каждые 3 дня. Рост опухоли оценивали циркулем. Записывали два диаметра и вычисляли массу опухоли в соответствии со следующей формулой: длина (мм)ширина 2/2. Эффект противоопухолевого лечения оценивали как задержку начала экспоненциального роста опухоли (см. для ссылок Anticancerdrugs 7: 437-60, 1996). Данная отсрочка (значение Т-С) была определена как разница во времени (в днях),необходимого для лечения группы (Т) и контрольной группы (С) опухолей для достижения заданного размера (1 г). Токсичность оценивали, основываясь на уменьшении веса тела. Результаты приведены ниже в табл. 2. Соединение А, объединенное с доцетакселем, оказывает отчетливый синергический эффект: Т-С, наблюдаемое, когда соединение А было объединено с доцетакселем, было выше (20,37 дней) ожидаемого при простом сложении Т-С (15,27), полученных при введении по отдельности. Ни в одной из групп лечения токсичности не наблюдали. Таблица 2 Лечения, проведенные орально, дважды в день на 10, 11, 12, 13, 14, 15, 16, 17, 18 дни.Лечения, проведенные внутривенно, на 10, 14, 17 дни.10, 14 и 18 дни лечения доцетакселем; 11, 12, 13, 15, 16, 17, 19, 20 и 21 дни лечения соединением А. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Комбинация, включающая соединение А формулы (I) или его фармацевтически приемлемую соль и бевацизумаб или доксетаксел. 2. Комбинация по п.1, где соединение А представляет собой метиламид 8-[4-(4-метилпиперазин-1 ил)фениламино]-1,4,4-триметил-4,5-дигидро-1 Н-пиразоло-[4,3-h]хиназолин-3-карбоновой кислоты или его фармацевтически приемлемую соль. 3. Фармацевтическая композиция, включающая комбинацию, как определено в любом из предыдущих пунктов, смешанную с фармацевтически приемлемым носителем, разбавителем или наполнителем. 4. Фармацевтический продукт, включающий соединение А, как определено в п.1, и бевацизумаб или доксетаксел в качестве комбинированного препарата для одновременного, последовательного или раздельного применения в терапии. 5. Применение комбинации по п.1 для получения лекарственного средства для лечения пролиферативного расстройства. 6. Применение по п.5, в котором лечение включает одновременное, последовательное или раздельное введение субъекту соединения А, как определено в п.1, и бевацизумаб или доксетаксел. 7. Способ лечения пролиферативного расстройства, включающий одновременное, последовательное или раздельное введение субъекту соединения А, как определено в п.1, и бевацизумаба или доксетаксела. 8. Способ снижения побочных эффектов, вызванных антинеопластической терапией антинеопластическим агентом у млекопитающих, включая людей, нуждающихся в этом, который включает введение указанному млекопитающему комбинации, включающей соединение А, как определено в п.1, и бевацизумаба или доксетаксела в количествах, эффективных для получения синергетического противоопухолевого эффекта. 9. Коммерческий набор, включающий в подходящем контейнере соединение А, как определено в п.1, и бевацизумаб.-5 014231 10. Коммерческий набор, включающий в подходящем контейнере соединение А, как определено в п.1, и доксетаксел. 11. Коммерческий набор, включающий фармацевтическую композицию или продукт, как определено в п.3 или 4. 12. Набор по любому из пп.9-11 для одновременного, последовательного или раздельного применения в противоопухолевой терапии.
МПК / Метки
МПК: A61K 31/337, A61K 31/519, A61P 35/00, A61K 39/395
Метки: антимитотик, антитело, фактора, ингибитор, комбинации, роста, включающие
Код ссылки
<a href="https://eas.patents.su/7-14231-kombinacii-vklyuchayushhie-ingibitor-cdk-i-antitelo-faktora-rosta-ili-antimitotik.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинации, включающие ингибитор cdk и антитело фактора роста, или антимитотик</a>
Предыдущий патент: Замещенные бензимидазолы в качестве ингибиторов киназ
Следующий патент: Стабильные белковые препараты
Случайный патент: Катализатор на основе алюмината цинка и марганца, используемый для дегидрирования алканов











