Фармацевтические композиции бендамустина, предназначенные для лиофилизации
Формула / Реферат
1. Способ получения лиофилизованного препарата бендамустина или гидрохлорида бендамустина, включающий:
a) растворение бендамустина или гидрохлорида бендамустина в растворе со стабилизирующей концентрацией спиртового растворителя, содержащем примерно от 20 до 30% (об.) трет-бутанола, для получения прелиофилизационного раствора; и
b) лиофилизацию прелиофилизационного раствора;
где указанный лиофилизованный препарат бендамустина или гидрохлорида бендамустина содержит не более чем примерно 0,9% (процент площади пика бендамустина) HP1, представленного формулой (II)
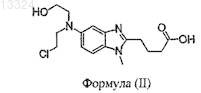
где указанное количество НР1 представляет собой количество НР1, имеющегося при высвобождении.
2. Способ получения лиофилизованного препарата бендамустина или гидрохлорида бендамустина по п.1, включающий:
a) растворение бендамустина или гидрохлорида бендамустина в растворе со стабилизирующей концентрацией спиртового растворителя, содержащем примерно от 20 до 30% (об.) трет-бутанола, для получения прелиофилизационного раствора; и
b) лиофилизацию прелиофилизационного раствора;
где указанный лиофилизованный препарат бендамустина или гидрохлорида бендамустина содержит не более чем примерно 0,5% (процент площади пика бендамустина) НР1, представленного формулой (II), где указанное количество НР1 представляет собой количество НР1, имеющегося при высвобождении.
3. Способ по п.1, где указанный трет-бутанол присутствует в концентрации примерно 30%.
4. Способ по п.1, в котором перед лиофилизацией добавляют наполнитель.
5. Способ по п.4, в котором наполнитель представляет собой маннит.
6. Способ по п.1, где концентрация бендамустина или гидрохлорида бендамустина составляет примерно от 2 до 50 мг/мл.
7. Способ по п.1, где стадия b) включает:
i) замораживание прелиофилизационного раствора до температуры ниже примерно -40°С для образования замороженного раствора;
ii) выдерживание замороженного раствора при температуре ниже -40°С в течение по меньшей мере 2 ч;
iii) повышение температуры замороженного раствора до температуры первичного высушивания примерно от -40 до -10°С для образования высушенного раствора;
iv) выдерживание в течение примерно от 10 до 70 ч;
v) повышение температуры высушенного раствора до температуры вторичного высушивания примерно от 25 до 40°С; и
vi) выдерживание от примерно 5 до примерно 40 ч для получения лиофилизованного препарата бендамустина или гидрохлорида бендамустина.
8. Способ по п.7, где указанный трет-бутанол присутствует в концентрации примерно 30%.
9. Способ по п.1, в котором стадия b) включает:
i) замораживание прелиофилизационного раствора до примерно -50°С для образования замороженного раствора;
ii) выдерживание замороженного раствора при примерно -50°С в течение по меньшей мере от 2 до примерно 4 ч;
iii) повышение температуры до температуры первичного высушивания от примерно -20°С до примерно
-12°С для получения высушенного раствора;
iv) выдерживание при температуре первичного высушивания в течение от примерно 10 до примерно 48 ч;
v) повышение температуры высушенного раствора до температуры вторичного высушивания от примерно 25 до примерно 40°С; и
vi) выдерживание при температуре вторичного высушивания в течение по меньшей мере от 5 до примерно 20 ч.
10. Способ по п.9, где указанный трет-бутанол присутствует в концентрации примерно 30%.
11. Способ по п.1, где стадия b) включает:
i) начало стадии при температуре полки примерно 5°С для загрузки;
ii) замораживание до примерно -50°С на протяжении примерно 8 ч;
iii) выдерживание при -50°С в течение примерно 4 ч;
iv) повышение температуры до примерно -20°С на протяжении примерно 3 ч;
v) выдерживание при температуре примерно -20°С в течение 6 ч;
vi) повышение температуры до примерно -15°С в течение примерно 1 ч;
vii) выдерживание при -15°С в течение примерно 20 ч;
viii) повышение температуры до примерно -12°С в течение примерно 0,5 ч;
ix) выдерживание при примерно -12°С в течение примерно 15,5 ч;
х) повышение температуры до примерно 25-40°С или более высокой в течение примерно 15 ч;
xi) выдерживание при температуре примерно 25-40°С в течение примерно 10 ч;
xii) повышение до температуры примерно 40°С на протяжении примерно 1 ч;
xiii) выдерживание при температуре примерно 40°С в течение примерно 5 ч и
xiv) выгрузка продукта при примерно 5°С и давлении примерно 13,5 футов/кв.дюйм в фармацевтически приемлемый контейнер, который герметически запечатывают; где давление во время первичного высушивания на стадиях iv, v, vi, vii, viii и ix составляет примерно 150 мкм рт.ст. и 50 мкм рт.ст. во время вторичного высушивания на стадиях х, xi, xii и xiii.
12. Лиофилизационный цикл по п.11, где стадия (х) представляет собой повышение температуры до примерно 30-35°С в течение примерно 15 ч.
13. Лиофилизованный порошок, полученный согласно лиофилизационному циклу по п.11 или 12.
14. Состав для лиофилизации, включающий бендамустин или гидрохлорид бендамустина в концентрации примерно 15 мг/мл, маннит в концентрации примерно 25,5 мг/мл, трет-бутиловый спирт в концентрации примерно 30% (об.) и воду.
15. Прелиофилизованная фармацевтическая композиция бендамустина или гидрохлорида бендамустина, содержащая примерно 15 мг/мл гидрохлорида бендамустина, примерно 25,5 мг/мл маннита, примерно 30% (об.) трет-бутилового спирта, а также воду.
16. Состав для лиофилизации, включающий бендамустин или гидрохлорид бендамустина в концентрации примерно 15 мг/мл, маннит в концентрации примерно 0-30 мг/мл, этанол в концентрации примерно 30% (об.) и воду.
17. Лиофилизованный препарат бендамустина или гидрохлорида бендамустина, полученный способом по любому из пп.1-11.
18. Лиофилизованный препарат, полученный из состава по п.14 или 16.
Текст
013324 Область техники, к которой относится изобретение Настоящее изобретение относится к области фармацевтических композиций для лечения различных болезненных состояний, в особенности неопластических заболеваний и аутоиммунных заболеваний. В частности, изобретение относится к фармацевтическим составам, включающим аналоги азотистого иприта, в т.ч. такой аналог азотистого иприта, как бендамустин, например, гидрохлорид бендамустина. Уровень техники Настоящее изобретение претендует на преимущество и приоритет заявки на патент США 60/644354, поданной 14 января 2005 г. и озаглавленной Фармацевтические композиции бендамустина,которая включена в настоящую заявку с помощью ссылки во всей ее полноте, включая иллюстративный материал и формулу изобретения. Представленное ниже описание включает информацию, которая может быть полезной для понимания настоящего изобретения. Это не является признанием того, что любая такая информация представляет собой известный уровень техники или относится к описываемому в настоящей заявке изобретению или что любая специально или неявно упоминаемая публикация представляет собой известный уровень техники. Благодаря высокой реакционной способности азотистых ипритов в водном растворе создание фармацевтических средств на их основе затруднено, и часто они поставляются для введения в лиофилизованной форме, которая требует восстановления перед введением, как правило, путем растворения в воде,квалифицированным персоналом клиники. Попадая в водный раствор, азотистые иприты подвергаются распаду за счет гидролиза, вследствие чего восстановленный продукт должен быть введен пациенту в максимально короткий срок после восстановления. Бендамустин, т.е. 4-5-[бис(2-хлорэтил)амино]-1-метил-2-бензимидазолилмасляная кислота, является нетипичной структурой с бензимидазольным циклом, включающей активный фрагмент азотистого иприта (смотрите формулу I, которая отображает гидрохлорид бендамустина). Бендамустин был впервые синтезирован в 1963 г. в Германской Демократической Республике (ГДР) и поставлялся из этой страны с 1971 по 1992 под названием Cytostasan. После этого времени он поступал на рынок Германии под торговым наименованием Ribomustin. Он широко применялся в Германии для лечения хронической лимфоцитарной лейкемии, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы и рака груди. Из-за разложения в водных растворах (что характерно и для других азотистых ипритов) бендамустин поставляется в виде лиофилизованного продукта. Применяемый в настоящее время лиофилизованный состав бендамустина (Ribomustin) содержит гидрохлорид бендамустина и маннит в стерильной лиофилизованной форме и имеет вид белого порошка, предназначенного для внутривенного применения после восстановления. Конечный лиофилизат нестабилен при действии света. Поэтому продукт хранят в стеклянных бутылях коричневого или янтарного цвета. Имеющийся в настоящее время лиофилизованный состав бендамустина содержит продукты разложения, которые могут появляться во время производства лекарственного вещества и/или во время процесса лиофилизации при получении готового лекарственного состава. В настоящее время лекарственной формой бендамустина является лиофилизованный порошок для инъекции, содержащий 100 мг лекарственного вещества на 50 мл флакон или 25 мг лекарственного вещества на 20 мл флакон. Флаконы открывают и восстанавливают препарат в момент времени, максимально близкий ко времени введения пациенту. Продукт восстанавливают добавлением 40 мл (для 100 мг разновидности) или 10 мл (для 25 мг разновидности) стерильной воды для инъекций. После этого восстановленный продукт разбавляют 500 мл q.s. 0,9% раствора хлорида натрия для инъекций. Препарат вводят путем внутривенной инфузии в течение 30-60 мин. После восстановления путем добавления 40 мл стерильной воды для инъекций, раствор бендамустина стабилен в течение 7 ч в случае хранения при комнатной температуре или в течение 6 дней, в случае хранения при 2-8 С. Смесь, полученную после разбавления 500 мл хлорида натрия, следует ввести пациенту в течение 7 ч после восстановления флакона с лиофилизованным препаратом (в предположении, что смесь хранилась при комнатной температуре). Восстановление доступного в настоящее время лиофилизованного порошка бендамустина является сложным процессом. Сообщения из клиник указывают на то, что восстановление может потребовать по меньшей мере 15 мин, причем необходимое время может достигать тридцати минут. Помимо того, что процесс восстановления продукта обременителен и отнимает много времени у работников здравоохранения, продолжительное воздействие воды на бендамустин в ходе восстановления увеличивает возмож-1 013324 ность потери эффективности и образования примесей из-за гидролиза продукта под действием воды. Таким образом, имеется потребность в лиофилизованных составах бендамустина, которые легче восстанавливаются и которые обладают лучшими свойствами с точки зрения наличия загрязнений, чем доступные в настоящее время лиофильные составы (лиофилизованные порошки) бендамустина. В германском (ГДР) патенте 34727 раскрыт способ получения -[5-бис-(хлорэтил)аминобензимидазолил-(2)]алканкарбоновых кислот, замещенных в положении 1. В германском (ГДР) патенте 80967 раскрыт пригодный для инъекции препарат гидрохлорида [1-метил-5-бис-(-хлорэтил)аминобензимидазолил-(2)]масляной кислоты. В германском (ГДР) патенте 159877 раскрыт способ получения 4-[1-метил-5-бис(2 хлорэтил)аминобензимидазолил-2]масляной кислоты. В германском (ГДР) патенте 159289 раскрыт пригодный для инъекций раствор бендамустина. Статья о продукте на основе бендамустина под названием Ribomustin (обновлено 1/2002) по адресу http://www.ribosepharm.de/pdf/ribomustin bendamustin/productmon ograph.pdf содержит информацию оNi и соавторы сообщают, что нитрозомочевина SarCNU была более стабильна в чистом третбутаноле, чем в чистой уксусной кислоте, диметилсульфоксиде, метиловом спирте, воде или смесях ТВА/вода (Ni et al. (2001) Intl.J.Pharmaceutics 226:39-46). В технике известны лиофилизованные циклофосфамиды, см., например, патенты США 5418223; 5413995; 5268368; 5227374; 5130305; 4659699; 4537883 и 5066647. Лиофилизованные ифосфамиды азотистых ипритов раскрыты в международной публикации WO 2003/066027; патентах США 6613927; 5750131; 5972912; 5227373 и 5204335.Teagarden и соавторы раскрывают лиофилизованные составы простагландина Е-1, полученные растворением PGE-1 в растворе лактозы и трет-бутилового спирта (патент США 5770230). Сущность изобретения Целью настоящего изобретения является получение стабильных фармацевтических композиций азотистых ипритов, в частности лиофилизованного бендамустина, и их применение в лечении различных болезненных состояний, в особенности неопластических заболеваний и аутоиммунных заболеваний. Одним из вариантов осуществления настоящего изобретения является фармацевтическая композиция бендамустина, содержащая не более чем примерно 0,5-0,9% (процент площади пика бендамустина на хроматограмме ВЭЖХ) соединения НР 1, представленного формулой (II): во время высвобождения или где количество НР 1 представляет собой количество НР 1, имеющееся в нулевой момент времени после восстановления лиофилизованной фармацевтической композиции бендамустина, описанной в настоящей заявке. В предпочтительном варианте осуществления изобретение относится к фармацевтической композиции бендамустина, содержащей не более чем примерно 0,5%(процент площади пика бендамустина) НР 1, предпочтительно не более чем примерно 0,45%, более предпочтительно не более чем примерно 0,40%, более предпочтительно не более чем примерно 0,35%, еще более предпочтительно не более чем 0,30%. Другой вариант осуществления настоящего изобретения представляет собой лиофилизованный препарат бендамустина, содержащий не более чем примерно 0,1-0,3% димера бендамустина, представленного формулой (III) во время высвобождения или в нулевой момент времени после восстановления. Еще один вариант осуществления настоящего изобретения представляет собой лиофилизованный препарат бендамустина, содержащий не более чем 0,5%, предпочтительно от 0,15 до 0,5% этилового эфира бендамустина, представленного формулой (IV), во время высвобождения или в нулевой момент времени после восстановления. Еще один вариант осуществления изобретения представляет собой лиофилизованный препарат бендамустина, в котором концентрация этилового эфира бендамустина (формула IV) не более чем на 0,2%, предпочтительно на 0,1% превышает концентрацию этилового эфира бендамустина, обнаруженную в лекарственном веществе, использованном для получения лиофилизованного препарата. В другом варианте осуществления настоящее изобретение относится к лиофилизованному препарату бендамустина, содержащему не более чем примерно 0,5-0,9% (процент площади пика бендамустина) НР 1 во время высвобождения лекарственного продукта. Предпочтительным вариантом осуществления является лиофилизованный препарат бендамустина, содержащий не более чем примерно 0,50% (процент площади пика бендамустина) НР 1, предпочтительно не более чем примерно 0,45%, более предпочтительно не более чем примерно 0,40%, более предпочтительно не более чем примерно 0,35%, еще более предпочтительно не более чем 0,30%. Одним из аспектов настоящего изобретения является лиофилизованный препарат бендамустина, содержащий не более чем примерно 0,5-0,9%, предпочтительно 0,5%(процент площади пика бендамустина) НР 1 во время высвобождения лекарственного продукта, если лиофилизованный препарат упакован во флакон или другой фармацевтически приемлемый контейнер. В еще одном аспекте настоящего изобретения лиофилизованные препараты бендамустина являются стабильными в отношении количества НР 1 в течение по меньшей мере 6 месяцев, предпочтительно 12 месяцев, предпочтительно 24 месяцев до примерно 36 месяцев или более при хранении при температуре примерно от 2 до 30 С. Предпочтительными температурами для хранения являются около 5 С и температура, примерно равная комнатной. Другим вариантом осуществления настоящего изобретения является дозированная лекарственная форма, которая включает фармацевтическую композицию бендамустина, содержащую не более чем примерно 0,5-0,9% НР 1, предпочтительно не более чем примерно 0,50%, предпочтительно не более чем примерно 0,45%, более предпочтительно не более чем примерно 0,40%, более предпочтительно не более чем примерно 0,35%, еще более предпочтительно не более чем 0,30%, где НР 1 представляет собой количество НР 1, имеющееся во время высвобождения или в нулевой момент времени после восстановления лиофилизованного препарата бендамустина по настоящему изобретению. В предпочтительных аспектах настоящего изобретения дозированная форма может включать от примерно 5 до примерно 500 мг бендамустина, от примерно 10 до примерно 300 мг бендамустина, примерно 25 мг бендамустина, примерно 100 мг бендамустина и примерно 200 мг бендамустина. Еще один вариант осуществления настоящего изобретения представляет собой дозированную лекарственную форму, которая включает лиофилизованный препарат бендамустина, содержащий не более чем примерно 0,5-0,9%, предпочтительно 0,5% НР 1. Предпочтительные дозированные формы могут содержать от примерно 5 до примерно 500 мг бендамустина, от примерно 10 до примерно 300 мг бендамустина, примерно 25 мг бендамустина, примерно 100 мг бендамустина и примерно 200 мг бендамустина. В еще одном варианте осуществления изобретение относится к фармацевтической композиции бендамустина, включающей бендамустин, содержащей не более чем примерно от 0,5 до 0,9% (процент площади пика бендамустина), предпочтительно не более чем примерно 0,50%, предпочтительно не более чем примерно 0,45%, более предпочтительно не более чем примерно 0,40%, более предпочтительно не более чем примерно 0,35%, еще более предпочтительно не более чем 0,30%, а также следовые количества одного или нескольких органических растворителей, где указанное количество НР 1 представляет собой количество НР 1, присутствующее во время высвобождения или в нулевой момент времени после восстановления лиофилизованной фармацевтической композиции бендамустина, раскрытой в настоящем изобретении. В других аспектах настоящего изобретения органический растворитель выбран из одного или нескольких растворителей из числа трет-бутанола, н-пропанола, н-бутанола, изопропанола, этанола,метанола, ацетона, этилацетата, диметилкарбоната, ацетонитрила, дихлорметана, метилэтилкетона, метилизобутилкетона, 1-пентанола, метилацетата, четыреххлористого углерода, диметилсульфоксида, гексафторацетона, хлорбутанола, диметилсульфона, уксусной кислоты и циклогексана. Предпочтительные органические растворители включают один или несколько растворителей из числа этанола, метанола,пропанола, бутанола, изопропанола и трет-бутанола. Более предпочтительным органическим растворителем является трет-бутанол, известный также как ТВА, т-бутанол, трет-бутиловый спирт или третичный бутиловый спирт. Настоящее изобретение включает способ получения одобрения продуктов бендамустина государственными органами, причем данное усовершенствование включает установление технических условий на высвобождение продуктов распада бендамустина на уровне менее примерно 4,0%, предпочтительно примерно от 2 до 4% (процент площади пика бендамустина) или, иными словами, способ получения-3 013324 фармацевтических композиций, описанных в настоящей заявке. Одним из аспектов настоящего изобретения является способ получения одобрения продуктов бендамустина контролирующими агентствами,который включает установление технических условий на высвобождение НР 1, не превышающее 1,5%(процент площади пика бендамустина). Продукт бендамустина по настоящей заявке содержит не более чем примерно 0,5% (процент площади пика бендамустина) НР 1 во время высвобождения. Другим вариантом осуществления является способ получения одобрения государственными органами продукта бендамустина, причем данное усовершенствование включает установление технических условий на срок хранения, согласно которым содержание продуктов распада бендамустина составляет менее чем примерно 7,0%, предпочтительно от примерно 5,0 до 7,0% (процент площади пика бендамустина) , если продукт хранят при температуре от примерно 2 до примерно 30 С. Предпочтительными температурами хранения являются примерно 5 С и температура, примерно равная комнатной. Продукт бендамустина по настоящей заявке содержит не более чем примерно 0,5% (процент площади пика бендамустина) НР 1 во время высвобождения. Другим вариантом осуществления настоящего изобретения является способ производства лиофилизованного препарата бендамустина, который включает регулирование концентрации продуктов распада бендамустина в конечном продукте, так что концентрация продуктов распада бендамустина составляет менее чем примерно 4,0%, предпочтительно не более чем примерно от 2 до 4% (процент площади пика бендамустина) при высвобождении или, другими словами, получения фармацевтических композиций,описанных в настоящей заявке. Продукт бендамустина по настоящему изобретению содержит не более чем примерно 0,5-0,9%, предпочтительно примерно 0,5% (процент площади пика бендамустина) НР 1 при высвобождении. В настоящем изобретении раскрыт способ получения лиофилизованного препарата бендамустина,который включает регулирование концентрации продуктов распада бендамустина в конечном продукте,так, чтобы при высвобождении концентрация НР 1 была менее 0,9%, предпочтительно 0,5% (процент площади пика бендамустина), и в момент истечения срока хранения продукта концентрация продуктов распада бендамустина была менее примерно 7,0%, предпочтительно не более примерно 5-7%; при условии хранения указанного продукта при температуре от примерно 2 до примерно 30 С. Другой вариант осуществления настоящего изобретения представляет собой прелиофилизационный раствор или дисперсию бендамустина, включающие один или несколько органических растворителей,причем упомянутые раствор или дисперсия включают по меньшей мере один органический растворитель в стабилизирующей концентрации, который снижает уровень распада бендамустина, так что количество НР 1, образовавшегося во время лиофилизации, за время от примерно 0 до 24 ч, не превышает примерно 0,5-0,9% (процент площади пика бендамустина), предпочтительно 0,50%, предпочтительно 0,45%, более предпочтительно 0,40%, более предпочтительно 0,35%, еще более предпочтительно 0,30%. Одним из аспектов этого варианта осуществления является лиофилизованный порошок, полученный из указанного прелиофилизационного раствора или дисперсии. Еще одним вариантом осуществления настоящего изобретения является прелиофилизационный раствор или дисперсия бендамустина, включающие один или несколько органических растворителей,причем упомянутые раствор или дисперсия включают по меньшей мере один органический растворитель в стабилизирующей концентрации, которая снижает уровень разложения бендамустина, так что количество этилового эфира бендамустина, образующегося во время лиофилизации в течение примерно 0-24 ч,не превышает примерно 0,5% (процент площади пика бендамустина). Одним из аспектов этого варианта осуществления является лиофилизованный порошок, полученный из указанного прелиофилизационного раствора или дисперсии. Еще одним вариантом осуществления настоящего изобретения является прелиофилизационный раствор или дисперсия бендамустина, включающие один или несколько органических растворителей,причем упомянутые раствор или дисперсия включают по меньшей мере один органический растворитель в стабилизирующей концентрации, которая снижает уровень распада бендамустина, так что количество этилового эфира бендамустина (отображенного формулой (IV, образующегося во время лиофилизации в течение 0-24 ч, не более чем на 0,2%, предпочтительно на 0,1% превышает концентрацию этилового эфира бендамустина, обнаруженного в лекарственном веществе, применяемом для получения прелиофилизационного раствора. Предпочтительным органическим растворителем является трет-бутанол. Кроме того, в настоящем изобретении раскрыты способы получения лиофилизованного препарата бендамустина, которые включают растворение бендамустина в спиртсодержащем растворителе, имеющем стабилизирующую концентрацию спирта от примерно 5 до примерно 100% (об./об.) для образования прелиофилизационного раствора; и лиофилизацию прелиофилизационного раствора; где лиофилизованный препарат бендамустина, полученный такими способами, содержит не более чем примерно 0,50,9%, предпочтительно 0,5% (процент площади пика бендамустина) НР 1, отображенного формулой (II),где количество НР 1 представляет собой количество НР 1, имеющееся при высвобождении или в нулевой момент времени после восстановления лиофилизованной фармацевтической композиции бендамустина. Другие концентрации спирта включают от примерно 5 до примерно 99,9%, от примерно 5 до примерно 70%, от примерно 5 до примерно 60%, от примерно 5 до примерно 50%, от примерно 5 до примерно 40%,-4 013324 от примерно 20 до примерно 35%. Предпочтительной концентрацией спирта является концентрация от примерно 20 до примерно 30%. Предпочтительные спирты включают один или несколько спиртов из числа метанола, этанола, пропанола, изопропанола, бутанола и трет-бутанола. Более предпочтительным спиртом является трет-бутанол. Предпочтительная концентрация трет-бутанола составляет от примерно 20 до примерно 30%, предпочтительно около 30%. Одним из аспектов этого варианта осуществления является добавление наполнителя до лиофилизации. Предпочтительным наполнителем является маннит. Предпочтительные прелиофилизационные концентрации бендамустина составляют от примерно 2 мг/мл до примерно 50 мг/мл. В предпочтительном способе получения лиофилизованного препарата бендамустина лиофилизация прелиофилизационного раствора включает:i) замораживание прелиофилизационного раствора до температуры ниже примерно -40 С, предпочтительно -50 С для образования замороженного раствора;ii) выдерживание замороженного раствора при температуре ниже -40 С, предпочтительно -50 С, в течение по меньшей мере 2 ч;iii) повышение температуры замороженного раствора до температуры первичного высушивания от примерно -40 до примерно -10 С для образования высушенного раствора;v) повышение температуры высушенного раствора до второй температуры высушивания от примерно 25 до примерно 40 С иvi) выдерживание от примерно 5 до примерно 40 ч для образования лиофилизованного препарата бендамустина. В более предпочтительном способе лиофилизация прелиофилизационного раствора включает:i) замораживание прелиофилизационного раствора до температуры примерно -50 С для образования замороженного раствора;ii) выдерживание замороженного раствора при температуре примерно -50 С, в течение от минимум 2 до примерно 4 ч;iii) повышение температуры замороженного раствора до первичной температуры высушивания от примерно -20 до примерно -12 С для образования высушенного раствора;iv) выдерживание при температуре первичного высушивания в течение примерно 10-48 ч;v) повышение температуры высушенного раствора до второй температуры высушивания от примерно 25 до примерно 40 С иvi) выдерживание при температуре вторичного высушивания от минимум 5 до примерно 20 ч. Предпочтительным спиртом является трет-бутанол. Предпочтительная концентрация трет-бутанола составляет от примерно 20 до примерно 30%, предпочтительно примерно 30%. Одним из аспектов этого варианта осуществления является добавление наполнителя перед лиофилизацией. Предпочтительным наполнителем является маннит. Предпочтительные прелиофилизационные концентрации бендамустина составляют от примерно 2 до примерно 50 мг/мл. Другим вариантом осуществления настоящего изобретения является лиофилизованный порошок или препарат, полученный с помощью раскрытых в настоящей заявке способов получения лиофилизованных препаратов бендамустина. Кроме того, настоящее изобретение включает составы бендамустина для лиофилизации, которые содержат наполнитель и органический растворитель в стабилизирующей концентрации. Предпочтительный состав включает бендамустин в концентрации примерно 15 мг/мл, маннит в концентрации примерно 25,5 мг/мл, трет-бутиловый спирт в концентрации примерно 30% (об.), а также воду. В этот вариант осуществления изобретения включены лиофилизованные препараты, полученные из таких составов бендамустина. В настоящее изобретение входят способы лечения медицинских состояний у пациента, которые включают введение терапевтически эффективного количества фармацевтической композиции по настоящему изобретению, если состояние может быть улучшено при лечении указанной фармацевтической композицией. Некоторые состояния, поддающиеся лечению композициями по настоящему изобретению,включают хроническую лимфоцитарную лейкемию (CLL), болезнь Ходжкина, неходжкинскую лимфому(NHL), множественную миелому (ММ), рак груди, мелкоклеточный рак легких, гиперпролиферативные расстройства и аутоиммунные заболевания. Предпочтительные состояния включают NHL, CLL, рак груди и ММ. Предпочтительные аутоиммунные заболевания включают ревматоидный артрит, множественный склероз или волчанку. В объем настоящего изобретения входит применение фармацевтических композиций или фармацевтических препаратов по настоящему изобретению с целью производства лекарственного средства для лечения у пациента медицинских состояний, определенных в настоящей заявке, причем это применение включает введение терапевтически эффективного количества фармацевтической композиций по настоящему изобретению, если состояние может быть улучшено лечением с помощью указанной фармацевтической композиции. Кроме того, в настоящее изобретение включены способы лечения, в которых фармацевтические-5 013324 композиции по настоящему изобретению применяют в сочетании с одним или несколькими антинеопластическими средствами, причем антинеопластическое средство вводят до, одновременно или после введения фармацевтической композиции по настоящему изобретению. Предпочтительными антинеопластическими средствами являются антитела, специфичные для CD20. Другим вариантом осуществления настоящего изобретения является лиофилизационный цикл для получения лиофилизованных препаратов бендамустина по настоящему изобретению. Предпочтительный лиофилизационный цикл включает: а) замораживание до температуры примерно -50 С примерно за 8 ч;b) выдерживание при -50 С в течение примерно 4 ч; с) повышение температуры до -25 С в течение примерно 3 ч;d) выдерживание при -10 С в течение 30 ч; е) повышение температуры до значения от примерно 25 до примерно 40 С или выше в течение примерно 3 ч;f) выдерживание при температуре от примерно 25 до примерно 40 С в течение примерно 25 ч;g) постепенное снижение температуры до примерно 20 С в течение 1 ч;h) выгрузку полученного препарата при температуре примерно 20 С и давлении 13,5 фунтов/кв.дюйм в фармацевтически приемлемый герметически закрытый контейнер, где давление во время первичного высушивания составляет примерно 150 мкм рт.ст. и 50 мкм рт.ст. во время вторичного высушивания. Один из аспектов этого цикла включает стадию (е), на которой температуру плавно поднимают до примерно 30-35 С в течение 3 ч и затем плавно поднимают до 40 С в течение 5 ч. Другим аспектом этого варианта осуществления является лиофилизованный порошок, полученный в результате осуществления такого лиофилизационного цикла. Более предпочтительный лиофилизационный цикл включает:i) начало цикла при температуре полки лиофилизатора примерно 5 С для загрузки исходного раствора;ii) замораживание до примерно -50 С в течение примерно 8 ч;iv) повышение температуры до примерно -20 С в течение примерно 3 ч;v) выдерживание при примерно -20 С в течение 6 ч; подъем температуры до примерно -15 С в течение примерно 1 ч;vii) подъем температуры до примерно -15 С в течение примерно 1 ч;viii) выдерживание при температуре примерно -15 С в течение примерно 20 ч;ix) повышение температуры до примерно -12 С в течение примерно 0,5 ч; х) выдерживание при температуре примерно -12 С в течение примерно 15,5 ч;xi) повышение температуры до значения от примерно 25 до примерно 40 С или выше в течение примерно 15 ч;xii) выдерживание при температуре от примерно 25 до примерно 40 С в течение примерно 10 ч;xiii) повышение температуры до примерно 40 С в течение примерно 1 ч иxiv) выдерживание при температуре примерно 40 С в течение примерно 5 ч; выгрузку при примерно 5 С и давлении примерно 13,5 футов/кв.дюйм в фармацевтически приемлемый герметично закрытый контейнер; где давление во время первичного высушивания составляет примерно 150 мкм рт.ст. и 50 мкм рт.ст. во время вторичного высушивания. В предпочтительном варианте осуществления на стадии (xi) температуру поднимают до примерно 30-35 С в течение примерно 15 ч. Кроме того, настоящее изобретение охватывает фармацевтическую дозированную форму бендамустина, содержащую не более чем примерно 0,5-0,9%, предпочтительно 0,5% НР 1 (процент площади пика бендамустина), где указанная дозированная форма включает флакон или другой фармацевтически приемлемый контейнер, причем указанное количество НР 1 представляет собой количество НР 1, имеющееся перед восстановлением или в нулевой момент времени после восстановления указанной дозированной формы. Предпочтительные концентрации бендамустина включают концентрации в диапазоне от примерно 10 до примерно 500 мг/контейнер, примерно 100 мг/контейнер, от примерно 5 мг до примерно 2 г/контейнер и примерно 170 мг/контейнер. В объем настоящего изобретения также входят прелиофилизованные фармацевтические композиции бендамустина. Предпочтительная прелиофилизованная композиция включает гидрохлорид бендамустина в количестве примерно 15 мг/мл, маннит в количестве примерно 25,5 мг/мл, трет-бутиловый спирт в количестве примерно 30% (об.) и воду. Перечисленные выше, а также другие варианты осуществления изобретения описаны далее по тексту настоящей заявки или очевидны рядовым специалистам в данной области техники на основе изложенного ниже раскрытия изобретения. Краткое описание иллюстративного материала На фиг. 1 показана растворимость бендамустина при различных температурах для двух разных рас-6 013324 творов бендамустина в трет-бутаноле. На фиг. 2 показаны результаты исследования чистоты препаратов с помощью ВЭЖХ-анализа, после выдерживания бендамустина в различных спиртах в течение 24 ч при 5 С. Результаты представлены в процентах площади пика бендамустина. На фиг. 3 - образование НР 1 (формула II) в течение 24 ч в различных смесях растворителей спирт/вода при 5 С. На фиг. 4 - образование димера (формула III) в течение 24 ч в различных смесях растворителей спирт/вода при 5 С. На фиг. 5 - лиофилизационный цикл для бендамустина с применением смеси растворителей ТВА/вода. На фиг. 6 - хроматограмма Ribomustin'а при применении способа 1 ВЭЖХ. Подробное описание изобретения В настоящем описании термины создавать состав, включать в состав относятся к получению лекарственного препарата, например, бендамустина в форме, подходящей для введения пациенту из числа млекопитающих, предпочтительно человеку. Таким образом, термин создание состава может включать добавление фармацевтически приемлемых наполнителей, разбавителей или носителей. В настоящем описании термин лиофилизованный порошок или лиофилизованный препарат относятся к любому твердому веществу, полученному лйофилизацией, т.е. высушиванием замороженного водного раствора. Водный раствор может содержать неводный растворитель, т.е. представлять собой раствор, состоящий из водного и одного или нескольких неводных растворителей (растворителя). Предпочтительно лиофилизованный препарат является таким препаратом, в котором твердое вещество получают высушиванием замороженного раствора, состоящего из водного и одного или нескольких неводных растворителей, более предпочтительно, неводный растворитель представляет собой спирт. Под стабильной фармацевтической композицией подразумевается любая фармацевтическая композиция, обладающая достаточной стабильностью, чтобы найти применение в качестве фармацевтического продукта. Предпочтительно, стабильная фармацевтическая композиция обладает достаточной стабильностью, чтобы имелась возможность хранить ее при стандартной температуре, предпочтительно в пределах от -20 до 40 С, более предпочтительно от примерно 2 до примерно 30 С, в течение приемлемого периода времени, например, срок хранения продукта не превышает одного месяца, но, как правило,шесть месяцев или более, более предпочтительно один год или более, еще более предпочтительно двадцать четыре месяца или более и еще более предпочтительно тридцать шесть месяцев или более. Срок хранения или срок истечения годности может представлять собой такое количество времени, за которое действующий ингредиент разлагается до чистоты менее 90%. Для целей настоящего изобретения термин стабильная фармацевтическая композиция относится к фармацевтической композиции с конкретными диапазонами содержания примесей, указанными в настоящем описании. Предпочтительно стабильной фармацевтической композицией является такая композиция, в которой имеется минимальное разложение действующего ингредиента, например, в ней сохраняется по меньшей мере примерно 85% не распавшегося действующего вещества, предпочтительно по меньшей мере примерно 90% и более предпочтительно по меньшей мере примерно 95%, после хранения при 2-30 С в течение 2-3 летнего периода времени. Под стабильным лиофилизованным препаратом подразумевается любой лиофилизованный препарат, имеющий достаточную стабильность, чтобы обладать применимостью в качестве фармацевтического продукта, т.е. имеющий такие же характеристики, которые приведены в настоящем описании для стабильной фармацевтической композиции. Термин распавшийся или разложившийся подразумевает, что химическая структура действующего вещества претерпела изменения. Термин терапевтически эффективное количество в настоящем описании относится к такому количеству вводимого соединения, которое должно до некоторой степени облегчить один или несколько симптомов подвергаемого лечению расстройства. Применительно к лечению новообразований, терапевтически эффективное количество относится к количеству, обладающему такими эффектами как (1) уменьшение размеров опухоли, (2) подавление (т.е. замедление до некоторой степени, предпочтительно прекращение) образования метастазов опухоли, (3) подавление до некоторой степени (т.е. замедление до некоторой степени, предпочтительно прекращение) роста опухоли и/или (4) облегчение до некоторой степени (или предпочтительно устранение) одного или нескольких симптомов, связанных с раком. Термин терапевтически эффективное количество может также относиться к предотвращению возникновения заболевания у животного, которое может быть предрасположено к этому заболеванию, но заболевание пока не возникло или не проявляются его симптомы (профилактическое воздействие). Кроме того,терапевтически эффективным количеством может быть такое количество, которое увеличивает ожидаемую продолжительность жизни пациента, пораженного расстройством в последней стадии. Типовые терапевтически эффективные дозы бендамустина для лечения неходжкинской лимфомы могут быть примерно 60-120 мг/м 2 в виде однократной дозы в течение двух дней подряд. Этот цикл можно повторять каждые три-четыре недели. При лечении хронической лимфоцитарной лейкемии (CLL) можно вводить бендамустин в количестве примерно 80-100 мг/м 2 в дни 1 и 2. Этот цикл можно повторять примерно че-7 013324 рез 4 недели. Для лечения болезни Ходжкина (стадии II-IV) бендамустин можно вводить в режимеDBVBe с даунорубицином 25 мг/м 2 в дни 1 и 15, винкристином 1,4 мг/м 2 в дни 1 и 15 и бендамустин в количестве 50 мг/м 2 в дни 1-5, с повторением цикла примерно каждые 4 недели. В случае рака груди бендамустин (120 мг/м 2) в дни 1 и 8 можно вводить в комбинации с метотрексатом 40 мг/м 2 в дни 1 и 8 и 5-фторурацилом 600 мг/м 2 в дни 1 и 8 с повторением цикла примерно каждые 4 недели. В качестве второго уровня терапии рака груди бендамустин можно вводить в количестве примерно 100-150 мг/м 2 в дни 1 и 2 с повторением цикла примерно каждые 4 недели. В настоящем описании термин неопластический относится к новообразованиям, которые являются результатом аномального роста, причем такой рост возникает из-за пролиферации клеток и не подвержен обычным ограничениям роста. Термин антинеопластическое средство в настоящем описании означает любое соединение, композицию, добавку или смесь, которые ингибируют, уничтожают, замедляют или обращают неопластический фенотип клеток. В настоящем описании термин гиперпролиферация означает избыточное размножение клеток в ответ на отдельные факторы роста. Гиперпролиферативными расстройствами являются заболевания,при которых имеет место избыточное размножение клеток в ответ на отдельные факторы роста. Примеры таких гиперпролиферативных расстройств включают диабетическую ретинопатию, псориаз, эндометриоз, рак, пятнистые дегенеративные расстройства и доброкачественные расстройства роста, такие как увеличение простаты. В настоящем описании термин флакон относится к любому контейнеру, имеющему стенку, как твердую, так и гибкую. Термин регулирование в настоящем описании означает постановку процесса под контроль на месте для облегчения достижения результатов, ради которых осуществляют регулирование. Например, в данном случае регулирование может означать исследование образцов из каждой партии или нескольких партий регулярно или случайно; установление концентрации продуктов разложения в качестве "технического условия на их выделение; выбор условий проведения процесса, например применение спиртов и/или других органических растворителей в прелиофилизационном растворе или дисперсии, так, чтобы гарантировать, что концентрация продуктов разложения действующего ингредиента не является неприемлемо высокой; и т.д. Контроль за продуктами разложения путем установления технического условия на количество выделяющихся продуктов разложения может применяться для облегчения одобрения фармацевтического продукта контролирующим агентством, как, например, управлением по контролю за продуктами питания и лекарственными средствами США и аналогичными агентствами в других странах или регионах (контролирующими агентствами). Термин фармацевтически приемлемый в настоящем описании означает, что предмет, который является фармацевтически приемлемым, например, компоненты фармацевтических композиций, включая контейнеры, не вызывают неприемлемой потери фармакологической активности или неприемлемых вредных побочных эффектов. Примеры фармацевтически приемлемых компонентов приведены в фармакопее США (USP), национальном фармакологическом справочнике (NF), одобренном решением фармакопейного съезда США в Rockville, Md. в 1990, а также справочнике по инертным ингредиентам 1990,1996, изданном управлением по контролю за продуктами питания и лекарственными средствами США(оба справочника включены в настоящую заявку с помощью ссылки, включая весь иллюстративный материал). Также могут использоваться другие классификации качества растворов или компонентов, которые удовлетворяют необходимым нормам и/или техническим условиям, которые не входят в USP/NF. Термин фармацевтическая композиция в настоящем описании будет означать композицию, которая изготовлена в таких условиях, что она подходит для введения людям, например, в условиях GMP, и содержит фармацевтически приемлемые наполнители, например не ограничиваясь перечисленными, стабилизаторы, средства для придания объема, буферы, носители, разбавители, основы, средства для увеличения растворимости и связующие средства. В настоящем описании фармацевтические композиции включают, не ограничиваясь перечисленным, прелиофилизационные растворы или дисперсии, а также жидкие формы после восстановления лиофилизованных препаратов, готовые для инъекции или инфузии. Термин дозированная лекарственная форма в настоящем описании означает раскрытую в описании фармацевтическую композицию, находящуюся в контейнере в таком количестве, которое подходит для восстановления и введения одной или нескольких доз, как правило, примерно 1-2, 1-3, 1-4, 1-5, 1-6,1-10 или примерно 1-20 доз. В настоящем описании термин дозированная лекарственная форма предпочтительно означает раскрытую в описании лиофилизованную фармацевтическую композицию в контейнере и в количестве, подходящем для восстановления и введения одной или нескольких доз, как правило, примерно 1-2, 1-3, 1-4, 1-5, 1-6, 1-10 или примерно 1-20 доз. Фармацевтическая лекарственная форма может включать флакон, или шприц, или другой подходящий фармацевтически приемлемый контейнер. Дозированная лекарственная форма, подходящая для применения в виде инъекции или инфузии,может включать стерильные водные растворы или дисперсии, или стерильные порошки, содержащие действующий ингредиент, которые приспособлены для приготовления непосредственно перед введением, или стерильные растворы или дисперсии, пригодные для инъекции или инфузии. Во всех случаях,конечная лекарственная форма должна быть стерильной, текучей и стабильной в условиях производства-8 013324 и хранения. Жидкий носитель или основа может представлять собой растворитель или жидкую дисперсионную среду, включая, например, воду, этанол, полиолы, такие как глицерин, пропиленгликоль или жидкие полиэтиленгликоли и т.п. растительные масла, нетоксичные сложные эфиры глицерина и их подходящие смеси. Предотвращение роста микроорганизмов может быть осуществлено с помощью различных антибактериальных и противогрибковых средств, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п. В настоящем описании термин наполнитель означает вещества, применяемые для включения действующих фармацевтических ингредиентов (API) в фармацевтические составы; в предпочтительном варианте осуществления наполнитель не снижает или не мешает проявлению первичного терапевтического действия API. Предпочтительно наполнитель является терапевтически инертным. Термин наполнитель охватывает носители, разбавители, основы, средства для повышения растворимости, стабилизаторы, средства для увеличения объема и связующие вещества. Наполнителями также могут являться такие вещества, которые попадают в фармацевтический состав, как косвенный или непреднамеренный результат процесса производства. Предпочтительно, наполнители утверждены или рассматриваются в качестве безопасных для введения человеку или животным, т.е. являются веществами GRAS (обычно рассматриваемые в качестве безопасных). Список веществ GRAS приведен управлением по контролю за продуктами питания и лекарственными средствами США в своде федеральных нормативных актов (CFR) в 21 CFR 182 и 21 CFR 184, которые включены в настоящую заявку с помощью ссылки. Предпочтительные наполнители включают, не ограничиваясь указанными, гекситы, в т.ч. маннит и т.п. В настоящем описании термины стабилизирующая концентрация органического растворителя или стабилизирующая концентрация спирта означают количество органического растворителя или спирта, которое уменьшает уровень разложения бендамустина, для достижения указанного в техническом условии уровня продуктов разложения в конечном лекарственном продукте. Например, что касается продукта разложения НР 1, стабилизирующая концентрация органического растворителя представляет собой такое количество последнего, которое приводит к концентрации НР 1 (в процентах от площади пика бендамустина), меньшей, чем 0,5%, предпочтительно меньшей, чем 0,45%, предпочтительно меньшей, чем 0,40%, более предпочтительно меньшей, чем 0,35%, более предпочтительно меньшей, чем 0,30% и еще более предпочтительно меньшей 0,25%. Что касается суммарной или общей концентрации продуктов разложения в конечном лекарственном продукте, стабилизирующая концентрация органического растворителя является таким количеством последнего, которое приводит к общей концентрации продуктов разложения (во время высвобождения лекарственного продукта), меньшей, чем примерно 7%(в процентах площади пика бендамустина), предпочтительно меньшей, чем примерно 6%, более предпочтительно меньшей, чем примерно 5% и еще более предпочтительно меньшей, чем примерно 4,0%. Под термином в процентах площади пика бендамустина подразумевается количество конкретного продукта разложения, например НР 1, по отношению к количеству бендамустина, определенному, например, ВЭЖХ. Термин органический растворитель подразумевает органическое вещество, обычно жидкость,способное растворять другие вещества. Термин следовые количества органического растворителя в настоящем описании означает количество растворителя, которое меньше или равно уровню, рекомендованному для фармацевтических продуктов, например, рекомендованному указаниями ICH (Международными конференциями по гармонизации, Impurities-Guidelines for Residual Solvents. Q3C. Federal Register. 1997; 62(247): 67377). Нижним пределом является наименьшее количество, которое может быть обнаружено. Термин высвобождение или при высвобождении означает лекарственный продукт, который удовлетворяет техническим условиям по выделению и может применяться для намеченной фармацевтической цели. А. Общие замечания В настоящем изобретении разработаны стабильные, фармацевтически приемлемые композиции,полученные из бендамустина. В частности, изобретение относится к составам для лиофилизации гидрохлорида бендамустина. Лиофилизованный порошок, полученный из таких составов, восстанавливается легче, чем доступный в настоящее время лиофилизованный порошок бендамустина. Кроме того, лиофилизованные продукты по настоящему изобретению обладают лучшим профилем загрязнений по сравнению с Ribomustin'ом в отношении определенных примесей, в частности НР 1, димера бендамустина и этилового эфира бендамустина, перед восстановлением, при хранении продукта лиофилизации или после восстановления и смешивания. Далее в настоящем изобретении разработаны составы бендамустина, применимые для лечения неопластических заболеваний. Составы, описанные в настоящей заявке, могут вводиться сами по себе или в комбинации с по меньшей мере одним дополнительным антинеопластическим средством и/или радиационной терапией. Одним из аспектов настоящего изобретения являются условия и средства для улучшения стабильности бендамустина до процесса лиофилизации и во время него, при хранении или при восстановлении. Антинеопластические средства, которые могут применяться в сочетании с составами по настояще-9 013324 му изобретению, включают средства, приведенные в Merck Index 11, рр 16-17, MerckCo., Inc. (1989) иThe Chemotherapy Source Book (1997). Обе книги широко признаны и легко доступны специалисту в данной области техники. Существует большое количество антинеопластических средств, доступных на коммерческой основе, проходящих клиническую оценку и доклиническую разработку, которые могли бы быть выбраны для лечения новообразований путем комбинированной лекарственной химиотерапии. Такие антинеопластические средства относятся к нескольким основным категориям, а именно можно выделить средства класса антибиотиков, лекарственные препараты, ковалентно связывающие ДНК, антиметаболиты, гормональные средства, включая глюкокортикоиды, такие как преднизон и дексаметазон, иммунологические средства, средства класса интерферона, дифференцировочные средства, такие как ретиноиды, проапоптические средства, а также категорию средств со смешанным характером действия, в которую входят такие соединения, как малые антисмысловые РНК и т.п. Альтернативно могут применяться другие неопластические средства, такие как ингибиторы матриксных металлопротеаз (ММР), имитаторы SOD или ингибиторы альфаv бета 3. Одно из семейств антинеопластических средств, которые могут применяться в комбинации с соединениями по настоящему изобретению, состоит из антинеопластических средств класса антиметаболитов. Подходящие антиметаболиты для лечения новообразований могут быть выбраны из группы, состоящей из аланозина, AG2037 (Pfizer), 5-FU-фибриногена, акантифолиевой кислоты, аминотиадиазола,бреквинар натрия, кармофура, Ciba-Geigy CGP-30694, циклопентил цитозина, цитарабин фосфата стеарата, конъюгаты цитарабина, Lilly DATHF, Merrel Dow DDFC, дезагуанина, дидеоксицитидина, дидеоксигуанозина, дидокса, Yoshitomi DMDC, доксифлуридина, Wellcome EHNA, MerckCo. ЕХ-015, фазарабина, флоксуридина, флударабин фосфата, 5-фторурацила, N-(2'-фуранидил)-5-фторурацил, Daiichi Seiyaku FO-152, изопропилпирролизина, Lilly LY-188011, Lilly LY-264618, метобензаприма, метотрексата,Wellcome MZPES, норспермидина, NCI NSC-127716, NCI NSC-264880, NCI NSC-39661, NCI NSC612567, Warner-Lambert PALA, пентостатина, пиритрексима, пликамицина, Asahi Chemical PL-AC, Takeda TAC-788, тиогуанина, тиазофурина, Erbamont TIF, триметрексата, ингибиторов тирозин киназы,ингибиторов тирозин протеин киназы, Tahio UFT и урицитина. Второе семейство антинеопластических средств, которые могут применяться в комбинации с соединениями по настоящему изобретению, состоит из средств, ковалентно связывающих ДНК. Подходящие антинеопластические средства из группы алкилирующих средств могут быть выбраны из группы,состоящей из Shionogi 254-S, аналогов альдофосфамида, алтретамина, анаксирона, Boehringer MannheimBBR-2207, бестрабуцила, будотитана, Wakunaga CA-102, карбоплатина, кармустина, Chinoin-139,Chinoin-153, хлорамбуцила, цисплатина, циклофосфамида, American Cyanamid CL-286558, Sanofi CY233, циплатата, Degussa D-19-384, Sumimoto DACHP(Myr)2, дифенилспиромустина, диплатинового цитостатика, производных дистамицина Erba, Chugai DWA-2114R, ITI E09, элмустина, Erbamont FCE24517, эстрамустин фосфата натрия, фотемустина, Unimed G-6-M, Chinoin GYKI-17230, гепсульфама,ифосфамида, ипроплатина, ломустина, мафосфамида, мелфалана, митолактола, Nippon Kayaku NK-121,NCI NSC-264395, NCI NSC-342215, оксалиплатина, Upjohn PCNU, преднимустина, Proter PTT-119, ранимустина, семустина, SmithKline SKF-101772, Yakult Honsha SN-22, спиромустина, Tanabe Seiyaku TA077, тауромустина, темозоломида, тероксирона, тетраплатина и тримеламола. Другое семейство антинеопластических средств, которые могут применяться в комбинации с соединениями, раскрытыми в настоящей заявке, состоит из антинеопластических средств класса антибиотиков. Подходящие антинеопластические средства класса антибиотиков могут быть выбраны из группы,состоящей из Taiho 4181-А, акларубицина, актиномицина D, актинопланона, аланозина, Erbamont ADR456, производных аэроплисинина, Ajinomoto AN-201-II, Ajinomoto AN-3, Nippon Soda анисомицинов,антрациклина, азиномицина-А, бисукаберина, Bristol-Myers BL-6859, Bristol-Myers BMY-25067, BristolMyers BMY-25551, Bristol-Myers BMY-26605, Bristol-Myers BMY-27557, Bristol-Myers BMY-28438, блеомицин сульфата, бриостатина-1, Tahio C-1027, калихемицина, хромохимицина, дактиномицина, даунорубицина, Kyowa Hakko DC-102, Kyowa Hakko DC-79, Kyowa Hakko DC-88A, Kyowa Hakko DC89-A1,Kyowa Hakko DC92-B, дитрисарубицина В, Shionogi DOB-41, доксорубицина, доксорубицинфибриногена, элсамицина-А, эпирубицина, эрбстатина, эзорубицина, эсперамицина-А 1, эсперамицинаA1b, Erbamont FCE-21954, Fujisawa FK-973, фостриецина, Fujisawa FR-900482, глидобактина, грегатинаА, гринкамицина, гербимицина, идарубицина, иллудинса, казусамицина, кесариродинса, Kyowa Hakko КМ-5539, Kirin Brewery KRN-8602, Kyowa Hakko KT-5432, Kyowa Hakko KT-5594, Kyowa Hakko KT6149, American Cyanamid LL-D49194, Meiji Seika ME 2303, меногарила, митомицина, митоксантрона,SmithKline M-TAG, неоенактина, Nippon Kayaku NK-313, Nippon Kayaku NKT-01, SRI International NSC357704, оксализина, оксауномицина, пепломицина, пилатина, пирарубицина, поротрамицина, пириндамицина A, Tobishi RA-I, рапамицина, ризоксина, родорубицина, сибаномицина, свенмицина (siwenmycin), Sumitomo SM-5887, Snow Brand SN-706, Snow Brand SN-07, сорангицина-А, спарсомицина,SS Pharmaceutical SS-21020, SS Pharmaceutical SS-7313B, SS Pharmaceutical SS-9816B, стеффимицина В,Tahio 4181-2, талисомицина, Takeda TAN-868A, терпентецина, тразина, трикрозарина A, Upjohn U-73975,Kyowa Hakko UCN-10028A, Fujisawa WF-3405, Yoshitomi Y-25024 и зорубицина.- 10013324 Четвертое семейство антинеопластических средств, которые могут применяться в комбинации с соединениями по настоящему изобретению, включает семейство разнообразных антинеопластических средств, выбранных из группы, состоящей из альфа-каротина, альфа-дифторметиларгинина, ацитретина,триоксида мышьяка, Avastin (бевацизумаба), Biotec AD-5, Kyorin AHC-52, алстонина, амонафида, амфетинила, амсакрина, ангиостата, анкиномицина, антинеопластона А 10, антинеопластона А 2, антинеопластона A3, антинеопластона А 5, антинеопластона AS2-1, Henkel APD, афидиколина глицината, аспарагиназы, аварола, бакхарина (baccharin), батрациклина, бенфлурона, бензотрипта, Ipsen-Beaufour BIM23015, бисантрена, Bristol-Myers BMY-40481, Vestar boron-10, бромфосфамида, Wellcome BW-502, Wellcome BW-773, карацемида, карметизола гидрохлорида, Ajinomoto CDAF, хлорсульфахиноксалона,Chemes CHX-2053, Chemex CHX-100, Warner-Lambert CI-921, Warner-Lambert CI-937, Warner-Lambert CI941, Warner-Lambert CI-958, кланфенура, клавириденона, ICN соединения 1259, ICN соединения 4711,контракана, Yakult Honsha CPT-11, криснатола, курадерма, цитохалазина В, цитарабина, цитокитина,Merz D-609, DABIS малеата, дакарбазина, дателлиптиния, дидемнина-В, эфира дигематопорфирина, дигидроленперона, диналина, дистамицина, Toyo Pharmar DM-341, Toyo Pharmar DM-75, Daiichi SeiyakuKodak TJB-29, токотриенола, топостина, Teijin TT-82, Kyowa Hakko UCN-01, Kyowa Hakko UCN-1028,украина, Eastman Kodak USB-006, винбластина сульфата, винкристина, виндезина, винестрамида, винорелбина, винтриптола, винзолидина, витанолидов и Yamanouchi YM-534, Zometa. Примерами противолучевых средств, которые могут применяться в комбинированной химиотерапии по настоящему изобретению, являются AD-5, adchnon (аденохром моногуанилгидразон метансульфонат), аналоги амифостина, детокс, димесна, 1-102, ММ-159, N-ацилированные дегидроаланины, TGFGenentech, типротимод, амифостин, WR-151327, FUT-187, трансдермальный кетопрофен, набуметон,супероксид дисмутаза (Chiron и Enzon). Способы получения указанных выше антинеопластических средств могут быть найдены в литературе. Например, способы получения доксорубицина описаны в патентах США 3 590 028 и 4 012 448. Способы получения ингибиторов матриксных металлопротеаз описаны в ЕР 780386. Способы получения ингибиторов альфаv, бета 3 описаны в WO 97/08174. Предпочтительные антинеопластические средства включают, не ограничиваясь этим, одно или несколько средств из числа даунорубицина, блеомицина, винкристина, доксорубицина, дакарбазина, преднизолона, митоксантрона, преднизона, метотрексата, 5-фторурацила, дексаметазона, талидомида, производных талидомида, 2 МЕ 2, неовастата, R 11 5777, триоксида мышьяка, бортезомиба, тамоксифена,G3139 (антисмыслового) и SU5416, митомицина, анти-CD20 антител, таких как Rituxan и R-этодолак. Предпочтительные режимы приема лекарственных средств, в рамках которых могут применяться составы по настоящему изобретению в сочетании с другими компонентами или в качестве замены одного или нескольких компонентов включают, не ограничиваясь этим, ABVD (доксорубицин, блеомицин,винкристин, дикарбазин), DBV (даунорубицин, блеомицин, винкристин), CVPP (циклофосфамид, винбластин, прокарбазин, преднизолон), СОР (циклофосфамид, винкристин, преднизолон), CHOP (циклофосфамид, доксорубицин, винкристин и преднизон) и CMF (циклофосфамид, метотрексат, 5 фторурацил). Дополнительные режимы приведены ниже в табл. А.- 11013324 Таблица А. Терапевтические режимы при лечении рака Как указывалось в настоящем описании, лиофилизованный состав бендамустина удается получить после удаления органического растворителя и воды. Наиболее типичным примером растворителя, применяемого для получения таких составов, является трет-бутанол (ТВА). Могут применяться другие орга- 13013324 нические растворители, в т.ч. этанол, н-пропанол, н-бутанол, изопропанол, этилацетат, диметилкарбонат,ацетонитрил, дихлорметан, метилэтилкетон, метилизобутилкетон, ацетон, 1-пентанол, метилацетат, метанол, четыреххлористый углерод, диметилсульфоксид, гексафторацетон, хлорбутанол, диметилсульфон,уксусная кислота, циклогексан. Указанные растворители могут применяться индивидуально или в комбинации. Пригодные для применения растворители должны образовывать стабильные растворы с бендамустином и не должны заметным образом разрушать или дезактивировать API. Растворимость бендамустина в выбранном растворителе должна быть достаточно высокой для образования коммерчески пригодных концентраций лекарственного вещества в растворителе. Кроме того, должна иметься возможность легко удалять растворитель из водной дисперсии или раствора лекарственного вещества, например при лиофилизации или вакуумной сушке. Предпочтительно, применяют раствор, имеющий концентрацию бендамустина примерно 2-80 мг/мл, предпочтительно примерно 5-40 мг/мл, более предпочтительно 5-20 мг/мл и еще более предпочтительно от 12 до 17 мг/мл. Фармацевтически приемлемый наполнитель для лиофилизации может быть растворен в водной фазе. Примеры наполнителей, применимых для целей настоящего изобретения, включают, не ограничиваясь перечисленными, фосфат натрия или калия, лимонную кислоту, винную кислоту, желатин, глицин, а также углеводы, такие как лактоза, сахароза, мальтоза, глицерин, декстроза, декстран, трегалоза и гидроксиэтилкрахмал. Предпочтительным наполнителем является маннит. Другие наполнители, которые можно применить при желании, включают такие антиоксиданты, как, не ограничиваясь перечисленным, аскорбиновая кислота, ацетилцистеин, цистеин, гидросульфит натрия, бутилгидроксианизол, бутилгидрокситолуол или альфа-токоферолацетат, или хелатообразующие реагенты. Типовой состав и лиофилизационный цикл, применяемые по настоящему изобретению, приведены ниже. Лиофилизацию можно проводить с применением стандартного оборудования, используемого для лиофилизации или вакуумной сушки. Цикл может изменяться в зависимости от оборудования и устройств, применяемых для заполнения/завершения процесса. В соответствии с типовым вариантом осуществления настоящего изобретения, во-первых, готовят водный прелиофилизационный раствор или дисперсию в фармацевтически приемлемом сосуде для составления смесей. Этот раствор подвергают асептическому фильтрованию в стерильную емкость, разливают во флаконы подходящего размера, неплотно закрывают и помещают в лиофилизатор. Применяя описанные в настоящей заявке методики лиофилизации, раствор лиофилизуют до тех пор, пока не будет достигнуто содержание влаги в диапазоне от примерно 0,1 до примерно 8,0%. Полученный в результате лиофилизации порошок, будучи лиофилизованным порошком, стабилен от примерно шести месяцев до более чем примерно 2 лет, предпочтительно более примерно 3 лет при температуре от примерно 5 до примерно 25 С и может быть легко восстановлен при добавлении стерильной воды для инъекций или другого подходящего носителя, с образованием жидких составов бендамустина, подходящих для внутреннего введения, например, парентеральной инъекцией. Для внутривенного введения восстановленный жидкий состав, т.е. фармацевтическая композиция, предпочтительно является раствором. Прелиофилизационный раствор или дисперсию обычно, во-первых, готовят в фармацевтически приемлемой емкости путем: 1) добавления к воде (примерно 65% от общего объема) наполнителя, такого как маннит (от примерно 0 до примерно 50 мг/мл) при перемешивании при комнатной температуре, 2) добавления к водному раствору органического растворителя (0,5-99,9 об.%), такого как ТВА, при перемешивании и температуре примерно 20-35 С, 3) добавления гидрохлорида бендамустина до желаемой концентрации при перемешивании, 4) добавления воды до достижения конечного объема и 5) охлаждения раствора до температуры примерно 1-30 С, предпочтительно примерно 5 С. Хотя указанные стадии приведены в определенной последовательности, предполагается, что специалист в данной области техники может при необходимости менять порядокследования стадий и количества ингредиентов. Кроме того, состав может быть приготовлен при использовании количественных соотношений веществ на массовой основе. Прелиофилизационный раствор или дисперсию можно стерилизовать перед лиофилизацией, причем стерилизацию, как правило, проводят путем асептического фильтрования, например через фильтр 0,22 мкм или менее. Можно применить несколько стерилизационных фильтров. Можно добиться стерилизации раствора или дисперсии другими способами, известными в технике, например облучением. В этом случае после стерилизации раствор или дисперсия готовы для лиофилизации. Как правило,фильтрованный раствор собирают в стерильный приемный сосуд и затем переносят в любой подходящий контейнер или контейнеры, в которых состав может быть эффективно лиофилизован. Обычно состав эффективно и рационально лиофилизовать в контейнерах, в которых продукт должен поступать на рынок, как, например, не ограничиваясь указанным, во флаконах, описанных в настоящей заявке и известных в технике. Типичный способ, применяемый для лиофилизации прелиофилизационного раствора или дисперсии, изложен ниже. Однако специалист в данной области техники понял бы, что могут быть осуществлены модификации описанного способа в зависимости от таких вещей, как, не ограничиваясь перечисленным, прелиофилизационный раствор или дисперсия и лиофилизационное оборудование. Вначале продукт помещают в лиофилизационную камеру в определенном диапазоне температур и- 14013324 затем подвергают действию температуры, значительно меньшей температуры замерзания продукта, как правило, на несколько часов. Предпочтительно температура будет около -40 С или ниже и время по меньшей мере 2 ч. После окончания замерзания камеру и конденсатор вакуумируют с помощью вакуумных насосов, причем поверхность конденсатора предварительно охлаждают циркулирующим хладагентом. Предпочтительно конденсатор должен быть охлажден до температуры ниже температуры замерзания раствора, предпочтительно до примерно -40 С, более предпочтительно до примерно -50 С или ниже,еще более предпочтительно до примерно -60 С или ниже. Кроме того, вакуумирование камеры следует продолжать до достижения давления от примерно 10 мкм рт.ст до примерно 600 мкм рт.ст., предпочтительно от примерно 50 до примерно 150 мкм рт.ст. Затем композицию, содержащую продукт, нагревают в вакууме в камере и конденсаторе. Эту операцию обычно проводят нагреванием полок в лиофилизаторе, на которых продукт остается в течение всего процесса лиофилизации при давлении в диапазоне от примерно 10 до примерно 600 мкм рт.ст. Процесс повышения температуры лучше всего проводить очень постепенно, на протяжении нескольких часов. Например, температура продукта должна быть первоначально повышена от примерно -30 С до примерно -10 С и поддерживаться в течение примерно 10-70 ч. Кроме того, температура продукта может быть повышена от температуры замерзания до примерно 25-40 С за период 30-192 ч. Для предотвращения выброса продукта лиофилизации из флаконов, полное удаление органического растворителя и воды должно быть осуществлено во время фазы первоначального высушивания. Полнота высушивания может быть подтверждена стабилизацией вакуума, температуры конденсатора и температуры полок для продукта. После первоначального высушивания температуру продукта следует повысить до примерно 2540 С и сохранять ее в течение примерно 5-40 ч. Когда цикл высушивания завершен, давление в камере может быть медленно поднято до атмосферного (или несколько меньшего) с помощью стерильного сухого газообразного азота (или эквивалентного газа). Если композиция, содержащая продукт, была лиофилизована в таких контейнерах, как флаконы,последние можно закрыть, удалить и плотно запечатать. Несколько типичных образцов можно отобрать с целью выполнения различных физических, химических и микробиологических тестов для анализа качества продукта. Лиофилизованный состав бендамустина, как правило, поступает в продажу в виде дозированной лекарственной формы. Дозированная лекарственная форма по настоящему изобретению, хотя, в основном, эта форма является флаконом, может представлять собой любой подходящий контейнер, как, например, ампулы, шприцы, флаконы с углекислотой, в которых возможно поддержание стерильной среды. Такие контейнеры могут быть стеклянными или пластмассовыми, при условии, что материал не взаимодействует с составом, содержащим бендамустин. Укупорочным средством, как правило, является пробка, наиболее типично стерильная резиновая пробка, предпочтительно пробка из бромбутилкаучука,который обеспечивает герметичное уплотнение. После лиофилизации лиофилизованным порошком бендамустина могут быть заполнены контейнеры, как, например, флаконы или, с другой стороны, в такие флаконы может быть помещен прелиофилизационный раствор, который лиофилизуют в этих флаконах, в результате чего непосредственно получают флаконы, содержащие лиофилизованный состав бендамустина. Такие флаконы после заполнения или лиофилизации в них раствора плотно закрывают пробками, получая запечатанную, стерильную дозированную лекарственную форму. Как правило, флакон должен содержать лиофилизованный порошок,включающий примерно 10-500 мг/флакон, предпочтительно примерно 100 мг/флакон, бендамустина и примерно 5 мг-2 г/флакон, предпочтительно примерно 170 мг/флакон, маннита. Лиофилизованные составы по настоящему изобретению могут быть восстановлены водой, предпочтительно стерильной водой для инъекций или другими стерильными жидкостями, такими как дополнительные растворители, с целью получения подходящего раствора бендамустина для введения путем парентеральной инъекции после дальнейшего разбавления в контейнере подходящей внутривенной смесью, например, нормальным солевым раствором. В. Растворимость Растворимость гидрохлорида бендамустина (бендамустина) в чистой воде, а также в воде с различными количествами спиртов, обычно применяемых при лиофилизации, например, метанола, этанола,пропанола, изопропанола, бутанола и трет-бутилового спирта (ТВА), определяли визуально. Количество бендамустина, необходимое для получения концентрации 15 мг/мл, смешанное с маннитом в количестве 25,5 мг/мл, смешивали с 10 мл исследуемого спиртового раствора при комнатной температуре (смотрите таблицу 1). Затем образцы охлаждали до 5 С и осматривали через 0, 3, 6 и 24 ч для выявления образования частиц и/или осадка. Результаты, приведенные в табл. 1, показывают, что растворимость бендамустина зависит от температуры и количества спирта в водных растворах. Для исследованных спиртов растворимость бендамустина увеличивалась с ростом концентрации спирта. Образование осадка также зависело от температуры и времени. С любым спиртом бендамустин не осаждался немедленно, но кристаллизовался после хранения при 5 С. Спирты различались по своему влиянию на растворимость. Не желая ограничиваться какойлибо конкретной теорией, спирты с молекулами меньшего размера, такие как метанол и этанол, облада- 15013324 ют меньшим влиянием на растворимость по сравнению со спиртами, обладающими молекулами большего размера (трет-бутанол и н-бутанол). Однако важную роль играет также форма молекулы спирта. Например, было найдено, что н-пропанол превосходит изопропанол с точки зрения предотвращения образования осадка в данной системе. Двумя спиртами с наибольшим влиянием на растворимость явились нпропанол и трет-бутанол. Таблица 1. Растворимость бендамустина в течение 24 ч в различных спиртах при хранении при 5 СCCS означает прозрачный бесцветный раствор Результаты экспериментов по количественному определению растворимости бендамустина при различных температурах для трех разных растворов приведены на фиг. 1 и в табл. 2. Использованное в эксперименте количество ТВА, а именно 20 и 30 об.%, было выбрано на основе исследований стабильности (результаты описаны ниже). Для обоих исследованных растворов растворимость бендамустина линейно снижалась с изменением температуры от 25 до 0 С. Этот эксперимент подтвердил данные, показанные в табл. 1, и подчеркнул различие в растворимости бендамустина для 20 и 30% растворов ТВА.q.s. - достаточное количество С. Стабильность Из-за нестабильности водных растворов, вызываемой гидролизом под действием воды, бендамустин требует лиофилизации, чтобы сделать продукт подходящим для фармацевтического применения. Однако во время производства лиофилизованного лекарственного продукта, перед лиофилизацией обычно требуется получать водные растворы для заполнения контейнеров. Таким образом, применение водных растворов во время получения композиций и наполнения в случае бендамустина и других азотистых ипритов может приводить к разложению лекарственного соединения. Вследствие этого, проводили оценку влияния различных спиртов на разложение бендамустина,чтобы определить, могут ли быть обнаружены составы, которые дали бы возможность увеличить время от заполнения до конца процесса лиофилизации, давая порошки лиофилизатов, которые могли бы восстанавливаться быстрее, чем существующий в настоящее время состав Ribomustin и/или обеспечивать получение препаратов бендамустина с лучшим профилем загрязнений в отношении определенных примесей, например НР 1 и димера ВМ 1 по сравнению с Ribomustin. Предпочтительно лиофилизованный препарат по настоящему изобретению стабилен с точки зрения количества НР 1, т.е. количество НР 1 заметно не возрастает (не превышает технических условий на хранение) в течение 6 месяцев, более предпочтительно 12 месяцев и еще более предпочтительно более 24 месяцев, например 36 месяцев, в случае хранения при температуре от примерно 2 до примерно 30 С,предпочтительно 5 С. В табл. 3 показаны результаты, относящиеся к стабильности бендамустина в воде без добавления спирта в течение 24 ч при 5 С. Бендамустин быстро разлагается в чистой воде и в основном образует продукт гидролиза, т.е. НР 1 (моногидроксибендамустин). Другим основным продуктом разложения, наблюдавшимся во время этого исследования, а также других исследований долговременной стабильности, являлся димер бендамустина. Димер бендамустина (ВМ 1 димер) Формула (III) Другими продуктами распада, содержавшимися в лиофилизованном продукте Ribomustin, является этиловый эфир бендамустина (ВМ 1 ЕЕ) (формула (IV и BM1DCE (формула (V. ВМ 1 ЕЕ образуется при реакции бендамустина с этиловым спиртом. Этиловый эфир бендамустина (ВМ 1 ЕЕ) Формула (IV)BM1DCE Формула(V) На фиг. 2 суммированы результаты исследования чистоты ВЭЖХ-анализом после выдерживания бендамустина в различных спиртах в течение 24 ч при 5 С. Результаты представлены в виде процентов площади того или иного пика от общей площади всех пиков. Числовые значения, отображенные на фиг. 2, приведены в табл. 3-9. Наиболее высокая чистота наблюдалась в растворах, содержащих более высокие концентрации спиртов, независимо от природы спирта. Среди исследованных спиртов наименьшее разложение бендамустина наблюдалось в растворе, содержащем примерно 30% (об.) ТВА. Среди примерно 10 и примерно 20% спиртовых растворов, наилучшие результаты в предотвращении распада бендамустина показал н-бутанол. При 20 и 30% (об.) смешивание н-бутанола с водой приводило к образованию двухфазной системы из-за нерастворимости н-бутанола в воде при этих концентрациях. На фиг. 3 и 4 показано определенное способом ВЭЖХ (как описано в настоящей заявке) количество разложившегося бендамустина, измеренное по образованию НР 1 и димера. Образование НР 1 и димера возрастает с уменьшением концентрации спирта, независимо от конкретного спирта. Это увеличение количества примесей происходит с ожидаемой зависимостью от времени (см. табл. 3-9). Трет-бутанол и н-бутанол превосходили другие спирты с точки зрения предотвращения разрушения продукта. Как видно из табл. 10, маннит не оказывал влияния на стабилизацию бендамустина трет-бутанолом. Таблица 4. Результаты ВЭЖХ, относящиеся к стабильности бендамустина в растворах этилового спирта различной концентрации в течение 24 ч. НР 1 и димер являлись примесями, количество которых увеличивалось на этой стадии.- 18013324 Таблица 5. Результаты ВЭЖХ, относящиеся к стабильности бендамустина в растворах третбутанола различной концентрации в течение 24 ч. НР 1 и димер являлись примесями, количество которых увеличивалось на этой стадии. Таблица 6. Результаты ВЭЖХ, относящиеся к стабильности бендамустина в растворах н-пропилового спирта различной концентрации в течение 24 ч. НР 1 и димер являлись примесями, количество которых увеличивалось на этой стадии.- 19013324 Таблица 7. Результаты ВЭЖХ, относящиеся к стабильности бендамустина в растворах изопропилового спирта различной концентрации в течение 24 ч. НР 1 и димер являлись примесями, количество которых увеличивалось на этой стадии. Таблица 8. Результаты ВЭЖХ, относящиеся к стабильности бендамустина в растворах метилового спирта различной концентрации в течение 24 ч. НР 1 и димер являлись примесями, количество которых увеличивалось на этой стадии.- 20013324 Таблица 9. Результаты ВЭЖХ, относящиеся к стабильности бендамустина в растворах н-бутилового спирта различной концентрации в течение 24 ч. НР 1 и димер являлись примесями, количество которых увеличивалось на этой стадии. а - оба раствора включали 2 жидких слоя/фазы в сосуде. Перед приготовлением образца растворы энергично перемешивали Результаты, приведенные в табл. 1-9, показывают, что стабильность гидрохлорида бендамустина в отношении образования НР 1 и димера улучшается с увеличением концентрации спирта. Таблица 10. Результаты ВЭЖХ, относящиеся к стабильности бендамустина в ТВА в присутствии и отсутствии маннита в течение 24 ч Примечание: Образцы, не содержавшие маннита, анализировали ВЭЖХ, используя способ на нормальной фазе, тогда как образцы, содержавшие маннит, анализировали с применением способа ВЭЖХ на обращенной фазе. Незначительное различие в результатах между двумя этими способами могло наблюдаться и в других проанализированных образцах. Р. Разработка цикла лиофилизации Готовили различные прелиофилизационные составы с различными концентрациями бендамустина,маннита и спиртов в воде. Изменяли и оптимизировали ход цикла на каждой стадии, в т.ч. для заморозки(быстрая или медленная), первичного высушивания (меняли как температуру, так и давление) и вторичного высушивания, как описано в настоящей заявке. На основании всей информации о растворимости, стабильности и легкости лиофилизации, подробно описанной выше, в число предпочтительных составов входят следующие: Примеры Следующие примеры приведены для иллюстрации некоторых аспектов настоящего изобретения и с целью содействия специалистам в данной области техники при практическом применении изобретения. Эти примеры никоим образом не следует рассматривать, как ограничение объема настоящего изобретения. Материалы: Гидрохлорид бендамустина (Degussa, партии 0206005 и 0206007) маннит, NF или эквивалентный (Mallinckrodt) дегидратированный этиловый спирт (200 градус крепости) USP или эквивалентный (Spectrum) трет-бутиловый спирт, ACS (EM Science) метанол (Spectrum и EMD) пропанол (Spectrum) изопропанол (Spectrum) бутанол (Spectrum) вода, категории для ВЭЖХ или эквивалентная (EMD) ацетонитрил, категории для ВЭЖХ или эквивалентный (EMD) трифторуксусная кислота, J.T.Baker метанол, категории для ВЭЖХ или эквивалентный (ЕМ Science, кат.МХ 0488 Р-1) трифторуксусная кислота, категории для ВЭЖХ или эквивалентная (JT Baker, кат.JT9470-01) Оборудование: ВЭЖХ система с фотодиодным матричным детектором Waters 2695 Alliance ВЭЖХ система с двойным детектором длины волны Waters 2795 Alliance аналитические весы (Mettler AG285, ID 1028) и (Mettler XS205) Способ приготовления образцов: растворяли лекарственный продукт в 200 мл МеОН. Воздействовали ультразвуком в течение 6 мин. Раствор можно вводить непосредственно в ВЭЖХ (прибл. 0,5 мг/мл). Приготовление образца для методики 4: растворяли лекарственный продукт в известном количестве- 26013324 разбавителя для достижения концентрации 4,2 мг/мл для впрыскивания непосредственно в ВЭЖХ. Может оказаться необходимым осуществить второе разбавление (для лекарственной формы 100 мг/флакон) для получения концентрации образца 4,2 мг/мл. Результаты Времена удерживания для некоторых примесей бендамустина при применении описанной выше методики 1 показаны в табл. 11. ВЭЖХ-хроматограмма Ribomustin, полученная с применением указанной здесь методики, приведена на фиг. 6. Таблица 11. Время удерживания для бендамустина и некоторых примесей при использовании ВЭЖХ по методике 1 Хотя при проведении ВЭЖХ по методике 1 можно выявить примеси, обнаруженные в бендамустине, данная методика не способна отделить потенциальную примесь, образующуюся во время анализа, а именно метиловый сложный эфир бендамустина (ВМ 1 МЕ). Разница времен удерживания ВМ 1 МЕ и димера ВМ 1 составляла лишь 0,3 мин. Для разрешения сигнала димера ВМ 1 была разработана другая методика ВЭЖХ ( 2). Методика ВЭЖХ 2 способна разделить все примеси, но требует более продолжительного времени, равного 45 мин (табл. 12). Таблица 12. Время удерживания для бендамустина и некоторых примесей при использовании ВЭЖХ по методике 2 Профиль загрязнения в различных партиях Ribomustin'а, установленный по методике 3 ВЭЖХ, показан в табл. 13. Таблица 13. Профиль загрязнения Ribomustin'а, установленный по методике 3 ВЭЖХ Пример 2. Растворимость Растворимость гидрохлорида бендамустина (бендамустин) в воде (чистой) и в воде с добавками различных количеств метанола, этанола, пропанола, изопропанола, бутанола и трет-бутилового спирта(ТВА) определяли визуально. Готовили растворы бендамустина в количестве 15 мг/мл и маннита в количестве 25,5 мг/мл в 10 мл указанных спиртовых растворов (табл. 1) при комнатной температуре. Затем образцы охлаждали до 5 С и осматривали через 0, 3, 6 и 24 ч с целью обнаружения частиц и/или осадков. Результаты, суммированные в табл. 1, показывают, что растворимость бендамустина находится в зависимости от температуры и количества спиртов в водных растворах. Для всех спиртов растворимость бендамустина увеличивалась с ростом концентрации спирта. Образование осадков также зависело от температуры и времени. Кроме того, определяли растворимость бендамустина в 20% (об.) растворе ТВА в воде, содержавшем маннит в концентрации 25,5 мг/мл, и в 30% (об.) растворе ТВА в воде, содержавшем маннит в концентрации 25,5 мг/мл (фиг. 1). Бендамустин добавляли к 4 мл каждого раствора при перемешивании до тех пор, пока он не прекращал растворяться. Насыщенные растворы оставляли перемешиваться в течение 1 часа при -8 С, 0 С, 5 С или 25 С. Образцы центрифугировали и вновь выдерживали при той же температуре в течение минимум 30 мин. Образец, который испытывали при температуре -8 С, помещали в ледяную баню, содержащую хлорид натрия, который понижал температуру ледяной бани, и измеряли температуру при извлечении образца для проведения анализа. Из каждого образца отбирали аликвоту и готовили образец для анализа ВЭЖХ. Результаты описанных экспериментов показаны на фиг. 1 и в табл. 2. Использованные в экспери- 27013324 ментах (фиг. 1) концентрации растворов ТВА, т.е. 20% (об.) и 30% (об.), были основаны на исследованиях стабильности растворов бендамустина, описанных в настоящей заявке. Как показано на фиг. 1, растворимость бендамустина линейно уменьшается с температурой (от 25 до 0 С). Растворимость бендамустина демонстрирует температурную зависимость, как при растворении в чистой воде, так и в воде со спиртом. Концентрация раствора ТВА, равная 20% (об.), вероятно, может являться нижней границей, необходимой для эффективного и устойчивого фармацевтического производства с точки зрения стабильности и растворимости бендамустина. Раствор с содержанием бендамустина 15 мг/мл близок к пределу насыщения 17,2 мг/мл бендамустина при 5 С, но превышает этот предел при 0 С. Концентрация 30% (об.) ТВА является рекомендуемой концентрацией ТВА для конечного состава,и при этой концентрации растворимость бендамустина с запасом укладывается в предел растворимости независимо от температуры. Пример 3. СтабильностьA. Стабильность в воде При комнатной температуре готовили растворы бендамустина (15 мг/мл) и маннита (25,5 мг/мл) в воде и немедленно помещали их в ледяную баню (для быстрого снижения температуры до примерно 5 С) на 10 мин и затем держали охлажденными при 5 С. Образцы каждого состава анализировали ВЭЖХ, применяя описанные в настоящей заявке методики, через 0, 3, 6 и 24 ч хранения при 5 С.B. Стабильность в спиртах При комнатной температуре готовили растворы, содержащие 15 мг/мл бендамустина, 25,5 мг/мл маннита и 1,9, 5, 10, 20 или 30% (об.) этилового спирта в воде или 5, 10, 20 или 30% (об.) ТВА, метанола,пропанола, изопропанола или бутанола в воде, помещали их в ледяную баню на 10 мин и затем держали охлажденными при 5 С. Образцы каждого состава анализировали ВЭЖХ, применяя описанные в настоящей заявке методики, через 0, 3, 6 и 24 ч хранения при 5 С.C. Результаты исследования стабильности В табл. 3 показаны результаты исследований стабильности бендамустина в воде без добавок спиртов в течение 24 ч при 5 С. Бендамустин быстро разлагается в воде, но его стабильность увеличивается с ростом концентрации спирта (фиг. 2, 3 и 4). Хотя спирты часто применяются при лиофилизации для содействия решению проблемы растворимости, влияние спиртов на стабильность бендамустина является исключительным, неожиданным и полезным при производстве препаратов бендамустина с меньшим количеством примесей, т.к. при сохранении стабильности бендамустина может применяться водный раствор. Было найдено, что ТВА является лучшим стабилизатором среди шести исследованных спиртов(фиг. 2, 3 и 4). Все спирты при концентрации 30% (об.) уменьшали образование таких примесей, как НР 1 и димер, в течение 24 ч при 5 С. Что касается ТВА, содержание НР 1 достигает лишь 0,4% в случае хранения при 5 С в течение срока до 24 ч. Более низкие концентрации спирта могут не быть эффективными при содержании бендамустина 15 мг/мл и хранении при 5 С из-за осаждения бендамустина и образования загрязняющих веществ. Пример 4. Оптимизация состава После того, как были определены растворимость и стабильность бендамустина, проводили оптимизацию состава для лиофилизации. Поскольку концентрация бендамустина была выше в насыщенном растворе в смеси 30% ТВА/вода по сравнению с другими спиртовыми растворами, ожидалось, что объем флакона, требуемого для растворения 100 мг бендамустина, будет меньше, чем для существующего в настоящее время препарата Ribomustin. Хотя насыщенный раствор бендамустина при 0 С содержит 18 мг/мл, для состава была выбрана концентрация 15 мг/мл, для компенсации незначительных различий растворимости API из-за различий в объемной чистоте API в результате различия между партиями. При концентрации бендамустина 15 мг/мл требуется 6,67 мл для получения насыщенного раствора 100 мг гидрохлорида бендамустина на флакон. Соотношение площади поверхности (сублимации) к объему является решающим для получения лиофилизованного продукта с хорошим внешним видом, который быстро высушивается в замороженном состоянии. Как правило, лиофилизованные продукты занимают от 30 до 50% объема флакона. 6,67 мл раствора занимают 30% объема 20 мл флакона,причем соотношение площади поверхности к объему составляет 0,796 см 2/мл. Маннит был выбран в качестве наполнителя, чтобы состав оставался похожим на Ribomustin. Были проведены исследования для оценки влияния маннита на растворимость бендамустина и внешний вид продукта. Маннит уменьшал растворимость бендамустина (при 15 мг/мл) в водных растворах, как этанола, так и ТВА. Например, растворы, содержавшие 5 и 10% этанола и ТВА, без маннита не выделяли осадка в течение 24 ч. Однако для образцов с маннитом (табл. 1) образование осадка наблюдалось в течение 24 ч. Осадок не выпадал из водного раствора, содержавшего 30% (об.) ТВА, 15 мг/мл бендамустина и 25,5 мг/мл маннита. Для того чтобы сохранить лепешку лиофилизованного продукта хорошей формы, устойчивую к дроблению при обработке, требовалось минимум 134 мг маннита на флакон, причем различия по этому параметру не наблюдались до содержания маннита 200 мг/флакон. Все исследованные спирты увеличивали стабильность и растворимость бендамустина. Однако была необходима значительная мольная доля спирта для воздействия на стабильность заполняющего раствора- 28013324 и легкость производства препарата. В случае спиртов с молекулами малого размера проявлялся нежелательный эффект понижения температуры замерзания объема раствора, что требовало продолжительных циклов лиофилизации при более низких температурах. Более высокие концентрации метанола и этанола приводили к образованию лепешек лиофилизатов непривлекательного вида, которые было трудно восстанавливать. Готовили и подвергали лиофилизации водные растворы, содержащие 10% этанола, 20% этанола, 10% изопропанола, 20% изопропанола или 30% ТВА, а также бендамустин (15 мг/мл) и маннит(25,5 мг/мл). Сосуды с лиофилизатами, полученными из растворов 10% этанола, 20% этанола, 10% изопропанола, 20% изопропанола, содержали либо разрушенную лепешку, либо остаток в виде пленки. Единственной растворяющей системой, обеспечившей приемлемую лепешку лиофилизата, являлся 30% ТВА. Кроме того, восстановление лиофилизатов, полученных из растворов 10% этанола, 20% этанола,10% изопропанола, 20% изопропанола, было затруднено, и продукт не растворялся полностью за время 45 мин. Возможность использования флакона меньшего размера сдерживается концентрацией или растворимостью бендамустина в водном/органическом растворе. При более низких концентрациях этанола,метанола, изопропанола и н-пропанола, которые приводят к получению лепешки лиофилизата приемлемого внешнего вида, требуются более разбавленные растворы бендамустина из-за ограниченной растворимости. Для сохранения существующей дозированной формы бендамустина с содержанием 100 мг на флакон, потребовался бы флакон, превышающий по объему 50 мл. Кроме того, исследования стабильности, описанные в настоящей заявке, показали, что при более низких концентрациях спирта химическая стабильность была недостаточной для обеспечения приемлемого времени заполнения. Одним из факторов, влияющих на легкость восстановления, является пористость продукта лиофилизации. В основном твердые вещества, осажденные в аморфном состоянии, с незначительной площадью поверхности растворяются с большим трудом. Большая часть лиофилизатов, содержащих маннит, должна восстанавливаться в течение 3-5 мин, если во время лиофилизации не образуется осадок, что часто вызывается испарением жидкости (повторное плавление). На основе опыта работы авторов с несколькими системами растворителей для лиофилизации и нежелания ограничиваться какой-либо конкретной теорией, проблемы, связанные с восстановлением Ribomustin, могут быть связаны с осаждением, вызванным повторным плавлением во время лиофилизации. Большинство органических растворителей не способствуют эффективной лиофилизации и вызывают повторное плавление из-за низких температур плавления. ТВА (трет-бутиловый спирт) имеет высокую температуру плавления и давление паров, сравнимое с давлением паров воды. ТВА удаляется за счет сублимации, а не испарения, примерно с той же скоростью, что и вода. Продукты лиофилизации, полученные с применением 30% (об.) раствора ТВА по настоящему изобретению, восстанавливаются в течение 3-10 мин, по сравнению с коммерчески доступным Ribomustin'ом, восстановление которого может занимать 30-45 мин. Исходя из растворимости, стабильности, легкости восстановления и производственных факторов,предпочтительным является следующий прелиофилизационный состав по настоящему изобретению: гидрохлорид бендамустина примерно 15 мг/мл, маннит примерно 25,5 мг/мл, трет-бутиловый спирт примерно 30% (об.) и доведение до нужного объема с применением воды для инъекций. Затем при 5 С 6,67 мл этого состава заливают в 20-мл флакон со стенками янтарного цвета, частично закрывают пробкой из бромбутилкаучука и загружают в предварительно охлажденный лиофилизатор. Пример 5. Оценка загрязнения Основные примеси, появляющиеся во время производства, смешивания, заполнения и процедуры лиофилизации Ribomustin, согласно данным ВЭЖХ-анализа (фиг. 6), представляют собой продукт гидролиза НР 1, димер бендамустина и этиловый эфир бендамустина, т.е. ВМ 1 ЕЕ. ВМ 1 ЕЕ может образовываться во время производства самого лекарственного вещества, например, при перекристаллизации и/или очистке. Известно, что ВМ 1 ЕЕ представляет собой более мощное цитотоксическое средство по сравнению с бендамустином. Проводились эксперименты для определения того, ведет ли применение 30% водного раствора ТВА для заполнения флаконов к образованию трет-бутилового эфира бендамустина. Эксперименты проводили с использованием условий традиционной реакции этерификации Фишера, необходимой для образования т-бутилового эфира бендамустина. Бендамустин нагревали в ТВА при 60 С с HCl в течение 20 ч. В этих условиях взаимодействия не наблюдалось. Этот результат показал, что образование трет-бутилового эфира бендамустина в процессе заполнения/окончательной лиофилизации было бы очень затруднено. До настоящего времени в исследованиях стабильности не наблюдалось новых примесей в лекарственном продукте, полученном из ТВА. Для содействия исследованию лекарственного продукта были разработаны пути синтеза, в которых используются более реакционноспособные источники трет-бутильного фрагмента. Была предпринята еще одна попытка получения трет-бутилового эфира путем получения ацилхлорида бендамустина. Суспензию бендамустина в метиленхлориде обрабатывали оксалилхлоридом и N,N-диметилформамидом. После образования ацилхлорида растворитель удаляли. Остаток добавляли к смеси хлористого метилена,трет-бутанола, триэтиламина и 4-диметиламинопиридина и перемешивали смесь при комнатной температуре в течение ночи. После добавления всех растворителей и очистки было получено неизвестное соединение. При исследовании ЖХ-МС молекулярная масса не соответствовала молекулярной массе трет- 29013324 бутилового эфира бендамустина, и в спектре ПМР не был обнаружен пик трет-бутила. Следовательно,данная попытка получения трет-бутилового эфира бендамустина также потерпела неудачу. Таким образом, применение ТВА в качестве дополнительного растворителя дало дополнительную выгоду, заключавшуюся том, что спирт не образовывал сложный эфир. Пример 6. Разработка лиофилизационного цикла Для оценки наиболее критических стадий лиофилизации и достижения наиболее эффективного цикла высушивания проводили большое количество лиофилизационных циклов. Осуществляли эксперименты для оценки влияния на конечный продукт скорости замораживания, температуры первичного высушивания, времени и давления.A. Скорость замораживания По сведениям литературных источников ТВА принимает различные кристаллические формы в зависимости от скорости замораживания. В некоторых растворах ТВА, чем медленнее продукт замерзает,тем быстрее он высушивается. Более крупные кристаллы, формирующиеся во время медленного замораживания, образуют поры большего размера, делающие возможной более эффективную сублимацию. Однако во время исследований составов бендамустина было обнаружено, что скорость замораживания не является критическим параметром обработки при оценке времени замораживания 2 и 8 ч.B. Первичное и вторичное высушивание Во время первых попыток осуществить лиофилизацию 30% растворов ТВА лепешка лиофилизованного продукта разрушалась, и порошок выбрасывало из сосуда. По-видимому, эти лепешки содержали аморфные частицы в лиофилизате, что указывало на повторное плавление. Это явление воспроизводилось и имело место, когда продукт достигал температуры примерно -10 С (ссылка на фиг. 5) независимо от скорости повышения температуры. Исследовали несколько переменных параметров процесса для определения причины проблемы с выбросом порошка и выявления подходящего раствора. Повышали давление от 50 мкм рт.ст. до 150 мкм рт.ст. во время первичного высушивания, но выброс порошка по-прежнему наблюдался, хотя и в меньшей степени. Затем этот эксперимент повторили, с той разницей,что скорость замораживания увеличили с 8 до 2 ч. Это изменение не оказало влияния. Затем перешли к исследованию продолжительности первичного высушивания. Например, исследовали следующий очень медленный цикл высушивания: замораживание от +25 до -50 С в течение 8 ч; выдерживание при -50 С в течение 5 ч, нагревание от -50 до -25 С и высушивание в течение 7 ч; выдерживание при -25 С в течение 12 ч, нагревание от -25 до -15 С и высушивание в течение 2 ч и выдерживание при -15 С в течение 12 ч, нагревание от -15 до 40 С в течение шести часов и выдерживание при 40 С в течение 12 ч при поддержании давления в камере во время высушивания 150 мкм рт.ст. Выброс порошка (фиг. 5) не наблюдался. Этот цикл приводил к лепешке лиофилизата хорошей формы без дробления, которая легко восстанавливалась. Не желая ограничиваться конкретной теорией, проблемы с выбросом порошка и сложности с восстановлением могли быть результатом слишком быстрого высушивания порошка, что приводило к сильному потоку паров из лепешки, а также повторного плавления. При использовании менее агрессивного цикла высушивания воспроизводимо формировалась эстетичная, стабильная и легко восстанавливающаяся лепешка. Таким образом, удаление всей несвязанной воды и третбутилового спирта перед вторичным высушиванием может предотвратить повторное плавление, а также выброс порошка. Далее лиофилизационный цикл оптимизировали в этих мягких условиях (фиг. 5). Отсутствовало немедленное образование продуктов разложения в результате высушивания при 40 С в течение времени до 20 ч.
МПК / Метки
МПК: A61P 35/02, A61K 9/19, A61P 35/00, A61K 31/4184
Метки: предназначенные, лиофилизации, фармацевтические, композиции, бендамустина
Код ссылки
<a href="https://eas.patents.su/30-13324-farmacevticheskie-kompozicii-bendamustina-prednaznachennye-dlya-liofilizacii.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции бендамустина, предназначенные для лиофилизации</a>
Предыдущий патент: Иммуноконъюгаты против интегрина, способы и варианты применения
Следующий патент: Вакцина
Случайный патент: Способ выделения сейсмических сигналов, а также определения и коррекции геометрических и статических ошибок в сейсмических данных












