Применение фармацевтической композиции для лечения диабета, метаболического синдрома, нейродегенеративных заболеваний и ожирения
Номер патента: 13214
Опубликовано: 30.04.2010
Авторы: Йоо Санг-Ку, Парк Миунггиу, Квак Таехван, Дзо Ин Геун
Формула / Реферат
1. Применение фармацевтической композиции для производства лекарственного средства для лечения и профилактики синдромов заболеваний, включающей:
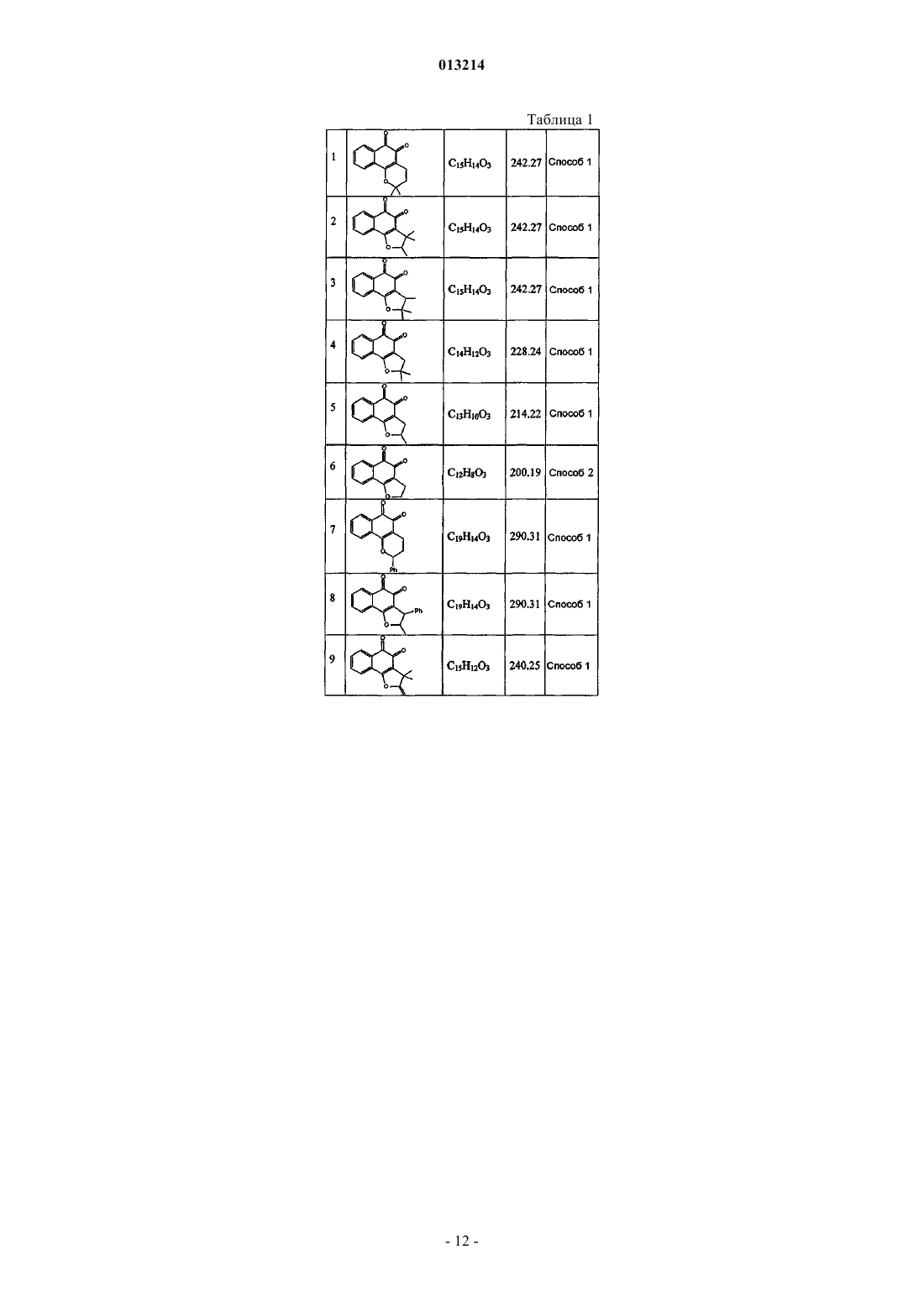
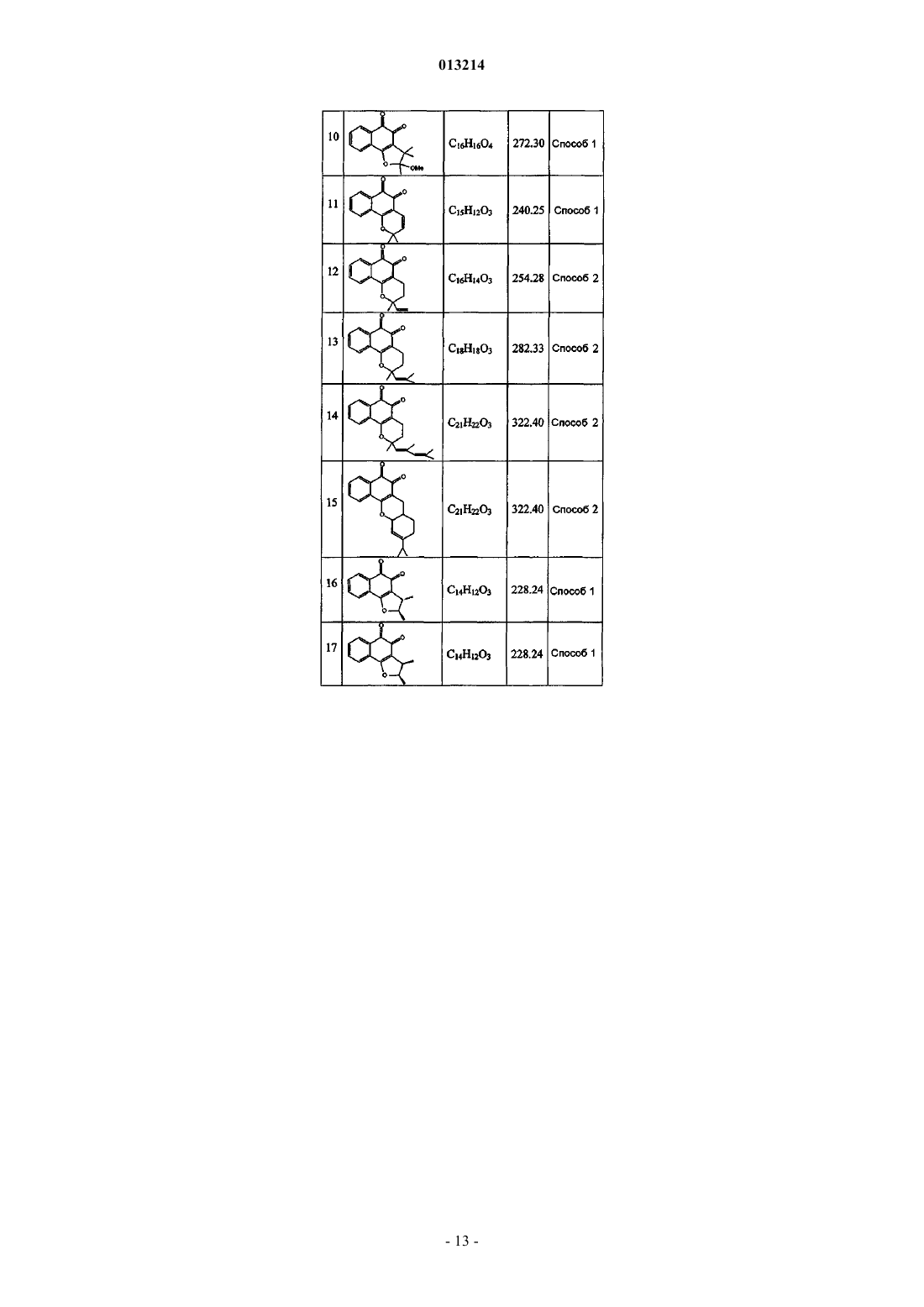
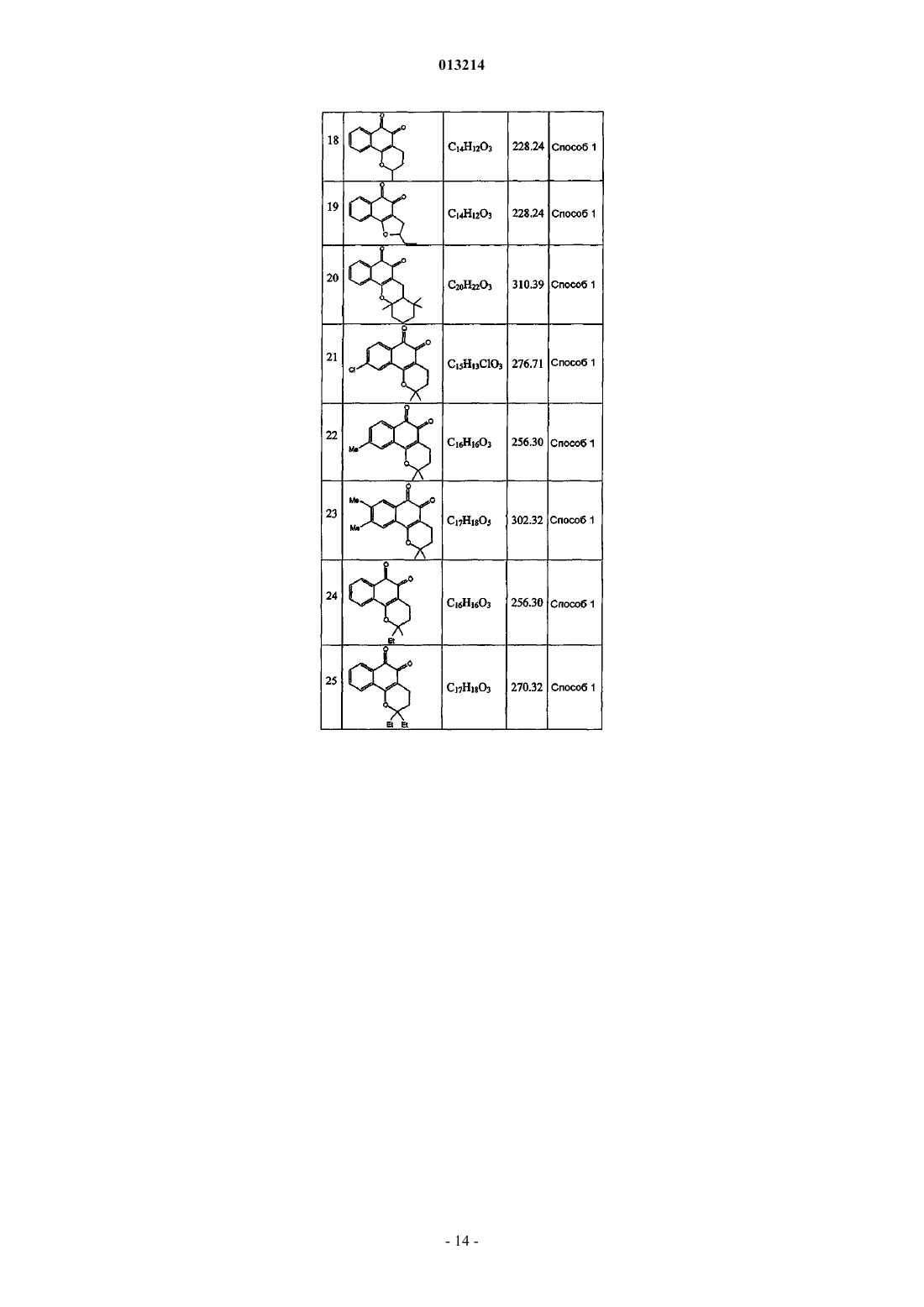
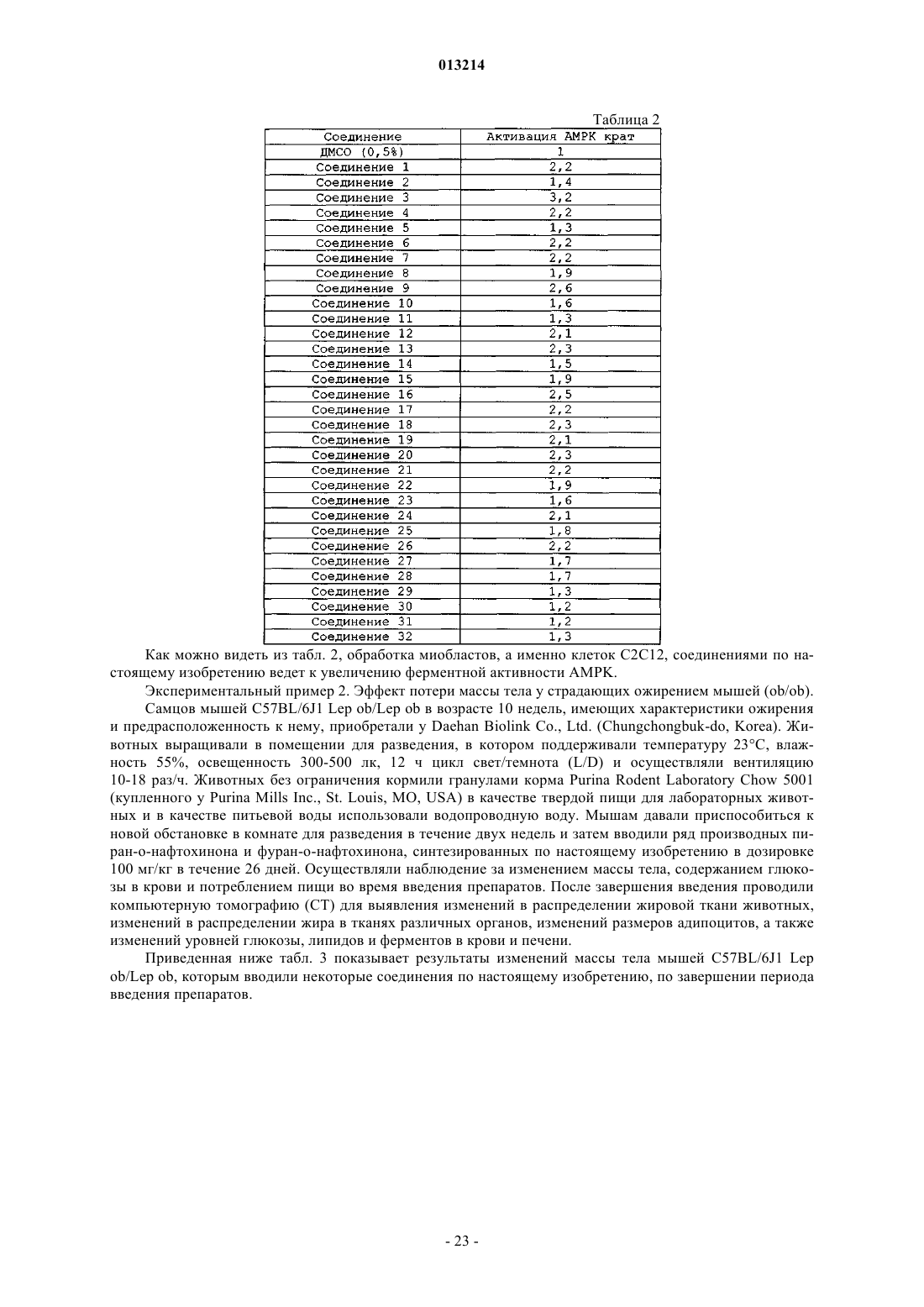
(а) терапевтически эффективное количество соединения формулы (I)
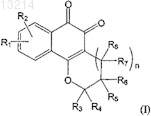
где каждый из заместителей R1 и R2независимо представляет собой водород, галоген, алкокси, гидрокси или низший алкил, включающий от 1 до 6 атомов углерода;
каждый из заместителей R3, R4, R5, R6, R7 и R8независимо представляет собой водород, гидрокси, C1-С20-алкил, алкенил или алкокси, циклоалкил, гетероциклоалкил, арил или гетероарил, или же два заместителя из числа R3-R8, взятые вместе, могут образовывать циклическую структуру; и
n означает 0 или 1, при условии, что если n равно 0, атомы углерода, расположенные рядом с фрагментом n, образуют циклическую структуру с помощью простой связи;
или фармацевтически приемлемую соль, сольват или изомер указанного соединения, и
(b) фармацевтически приемлемый носитель, разбавитель или наполнитель, или любое сочетание этих ингредиентов, где синдромом заболевания является ожирение, осложнения ожирения, заболевания печени, артериосклероз, мозговая апоплексия, инфаркт миокарда, сердечно-сосудистые заболевания, ишемические заболевания, диабет, осложнения, связанные с диабетом, или воспалительные заболевания.
2. Применение по п.1, где соединение формулы (I) выбрано из соединений формул (II) и (III)
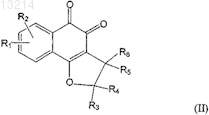
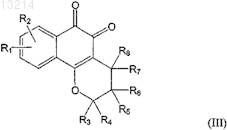
где R1, R2, R3, R4, R5, R6, R7и R8 соответствуют определениям, данным в п.1.
3. Применение композиции по п.1, где каждый из заместителей R1и R2 представляет собой водород.
4. Применение композиции по п.2, где соединение формулы (II) является соединением формулы (IIa), в котором R1, R2и R4 независимо представляют собой атомы водорода, или соединение формулы (IIb), в котором R1, R2и R6 независимо представляют собой атомы водорода
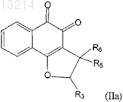
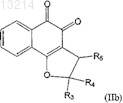
5. Применение композиции по п.2, где соединение формулы (III) является соединением формулы (IIIa), в котором R1, R2, R5, R6, R7 и R8независимо представляют собой атомы водорода
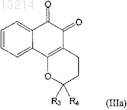
6. Применение композиции по п.1, где осложнения, связанные с диабетом, представляют собой гиперлипидемию, гипертонию, ретинопатию или почечную недостаточность.
Текст
013214 Настоящее изобретение относится к фармацевтической композиции, предназначенной для лечения и/или профилактики различных заболеваний, включая ожирение, диабет, метаболические синдромы, дегенеративные заболевания. Ожирение, т.е. состояние, при котором количество жира в теле превосходит стандартное на аномально высокую величину, относится к числу заболеваний, являющихся результатом накопления избыточных калорий в жировых тканях тела, когда поступление энергии превышает ее расходование. Вызываемые ожирением осложнения включают, например, гипертонию, инфаркт миокарда, варикоз, легочную эмболию, заболевания коронарных артерий, геморрагический инсульт, старческую деменцию, болезнь Паркинсона, диабет 2 типа, гиперлипидемию, апоплексию мозга, различные виды рака (как, например,рак матки, рак груди, рак простаты, рак ободочной кишки и т.п.), сердечные заболевания, заболевания желчного пузыря, синдром апноэ во сне, артрит, бесплодие, трофические язвы, внезапную смерть, ожирение печени, гипертрофическую кардиомиопатию (НСМ), тромбоэмболию, эзофагит, грыжу брюшной стенки (брюшную грыжу), недержание мочи, сердечно-сосудистые заболевания, заболевания эндокринной системы и т.п. (Obesity Research Vol. 12(8), 2004, 1197-1211). Диабет представляет собой системное расстройство метаболизма, возникающее под действием многочисленных факторов окружающей среды и генетических факторов и относящееся к состоянию, которое характеризуется аномально высокими уровнями глюкозы в крови из-за абсолютного или относительного дефицита инсулина в организме. Осложнения диабета включают, например, гипогликемию, кетоацидоз, гиперосмолярную кому, макрососудистые осложнения, диабетическую ретинопатию, диабетическую нейропатию, диабетическую нефропатию и т.п. Термин метаболические синдромы относится к синдромам, сопровождаемым факторами риска для здоровья, таким как гипертриглицеридемия, гипертония, расстройства метаболизма углеводов, расстройства свертывания крови и ожирение. Согласно критериям АТР III Национальной образовательной программы по холестерину (NCEP), опубликованным в 2001 г., у субъекта диагностируется метаболический синдром при наличии трех или более из следующих условий: 1) обхват талии 40 дюймов (102 см) или более у мужчин и 35 дюймов (88 см) или более у женщин (ожирение средней части тела, выраженное длиной окружности талии), 2) уровень триглицеридов около 150 мг/дл, 3) уровень липопротеинов высокой плотности (HDL) менее 40 мг/дл (мужчины) или менее 50 мг/дл (женщины), 4) кровяное давление 130/85 мм рт. ст. или более 5) уровень глюкозы в крови, измеренный натощак, превышает 110 мг/дл. Термин устойчивость к инсулину относится к явлению, которое заключается в том, что если даже инсулин и секретируется в организме в нормальных количествах, поступление глюкозы в клетки, осуществляемое при помощи инсулина, не происходит нормальным образом. Следовательно, глюкоза не может поступать в клетки из крови, что вызывает гипергликемию, и, кроме того, клетки сами по себе не могут нормально функционировать из-за недостатка глюкозы, что приводит к проявлению метаболического синдрома. Термин дегенеративные заболевания возник из данных о патологии и, следовательно, означает состояние, которое сопровождается снижением потребления кислорода и относится к дегенеративному заболеванию, при котором имеет место нарушение деятельности митохондрий, являющихся органеллами, которые вырабатывают энергию внутри клетки с использованием кислорода, кроме того, этот термин связан со старением. В качестве примеров дегенеративных заболеваний могут быть упомянуты нейродегенеративные заболевания, такие как, например, болезнь Альцгеймера, болезнь Паркинсона и болезнь Хантингтона (Korean Society of Medical Biochemistry and Molecular Biology News, 2004, 11(2), 16-22). Заболевания, возникающие из-за нарушения деятельности митохондрий, могут включать, например, набухание (увеличение объема) митохондрий вследствие нарушения потенциала мембраны митохондрий, функциональные расстройства вследствие окислительного стресса, как, например, при действии активных разновидностей кислорода или свободных радикалов, функциональные расстройства в результате действий генетических факторов и заболеваний, связанные с функциональным дефицитом механизмов окислительного фосфорилирования для выработки энергии митохондрией. Конкретные примеры заболеваний, которые развиваются под действием указанных выше патологических причин,могут включать рассеянный склероз, энцефаломиелит, церебральный радикулит, периферическую нейропатию, синдром Рейе, атаксию Фридрайха, синдром Альперса, MELAS, мигрень, психоз, депрессию,судороги и деменцию, приступ паралича, атрофию зрительного нерва, нейропатию зрительного нерва,пигментную дегенерацию сетчатки, катаракту, гиперальдостеронемию, гипопаратироидизм, миопатию,амиотрофию, миоглобинурию, гипотонию, миалгию, снижение выносливости к физической нагрузке,заболевание почечных канальцев, почечную недостаточность, печеночную недостаточность, отказ в работе печени, гепатомегалию, анемию, связанную с эритроцитами (железодефицитную анемию), нейтропению, тромбоцитопению, диарею, атрофию ворсинчатого слоя, многократную рвоту, дисфагию, запор,нейросенсорную тугоухость (SNHL), эпилепсию, задержку умственного развития, болезнь Альцгеймера,болезнь Паркинсона и болезнь Хантингтона (см., например, патент США 6183948; опубликованную патентную публикацию Кореи 2004-7005109; Journal of clinical investigation 111, 303-312, 2003; Mitochondria 74, 1188-1199, 2003; Biochimica et Biophysica acta 1658 (2004) 80-88). Упомянутые выше ожирение, диабет, метаболические синдромы, дегенеративные заболевания и за-1 013214 болевания, связанные с нарушением деятельности митохондрий, далее по тексту заявки собирательно именуются синдромами заболеваний по настоящему изобретению. Как известно, в настоящее время наиболее эффективным путем облегчения или борьбы с состояниями, связанными с такими синдромами, является увеличение физической нагрузки и потеря веса, а также регулирование рациона питания. Все пути борьбы с синдромами заболеваний по настоящему изобретению, которые считаются эффективными в настоящее время, имеют общее свойство, состоящее в том, что они содействуют энергетическому метаболизму, приводя, таким образом, к максимальному расходованию избыточной энергии в организме и предотвращению накопления энергии. Эффективное расходование этой избыточной энергии рассматривается в качестве способа лечения синдромов заболеваний по настоящему изобретению. Содействие энергетическому метаболизму является наиболее важным путем эффективного удаления избыточной энергии. Для реализации этой цели важно добиться сдерживания липогенеза, сдерживания глюконеогенеза, облегчения потребления глюкозы, содействия окислению жира, содействия биогенезу митохондрий, которые являются центральным аппаратом энергетического метаболизма, а также совместной активации факторов, имеющих отношение к стимуляции метаболизма. До сих пор мало известно о мишенях, воздействие на которые может содействовать лечению синдромов заболеваний по настоящему изобретению, в то же время известны многочисленные целевые белки или гены, воздействие на которые способствует лечению отдельных заболеваний и, следовательно,был предложен ряд способов профилактики или лечения таких заболеваний путем воздействия на соответствующие упомянутые выше целевые белки или гены. Однако до сих пор имеются возможности для дальнейшего значительного усовершенствования способов лечения даже отдельных заболеваний, таких как метаболические синдромы, в т.ч. ожирение, диабет и т.п. Несмотря на то что было проведено много исследований путей лечения заболеваний, еще нет доступных лекарств для лечения различных заболеваний, являющихся следствием избыточного поступления энергии и старения. Большая часть таких заболеваний, как ожирение, диабет, метаболические синдромы, дегенеративные заболевания и заболевания, связанные с нарушением деятельности митохондрий, т.е. значительное число заболеваний, в т.ч. синдромов по настоящему изобретению, является результатом дисбаланса энергетического метаболизма и состояния окислительно-восстановительных процессов. По этой причине в настоящем изобретении также применяется способ подтверждения наличия/отсутствия активационного воздействия на АМР-активированную протеинкиназу (AMPK), поскольку он является наиболее фундаментальным первичным тестом для подтверждения биологической эффективности соединений, представляющих интерес для лечения синдромов заболеваний по настоящему изобретению. Между тем, если AMPK активирована, это последовательно влияет на различные физиологические события по пути развития механизма действия AMPK. В связи с этим, факторы, которые должны регулироваться, а также явления экспрессии представляются следующим образом. 1. Метаболизм углеводов. В мышечной и сердечной ткани AMPK содействует мышечным сокращениям и тем самым облегчает поглощение глюкозы. Т.е. AMPK активирует GLUT1 или вызывает миграцию GLUT4 на оболочку цитоплазмы, что независимо от действия инсулина приводит к увеличению поглощения глюкозы клетками (Arch. Biochem. Biophys. 380, 347-352, 2000; J. Appl. Physiol. 91, 1073-1083, 2001). После увеличения поступления глюкозы в клетки AMPK активирует гексокиназу, тем самым увеличивая интенсивность процесса метаболизма углеводов, одновременно ингибируя синтез гликогена. Известно, что при состоянии ишемии в тканях сердца AMPK активирует процесс фосфорилирования 6-фосфофрукто-2-киназы(PFK-2) с последующей активацией метаболической каскадной реакции, ведущей к увеличению интенсивности метаболизма углеводов (Curr. Biol. 10, 1247-1255, 2000). Помимо этого были найдены подтверждения тому факту, что активация AMPK в печени ингибирует высвобождение глюкозы из гепатоцитов,и, кроме того, AMPK ингибирует активность фосфоенолпируват карбоксикиназы (PEPCK) и глюкоза-6 фосфатазы, которые являются ферментами глюконеогенеза (Diabetes 49, 896-903, 2000). Это происходит,потому что AMPK независимо принимает участие в регуляции уровня глюкозы в крови путем ингибирования высвобождения глюкозы из печени безотносительно к действию инсулина. 2. Биогенез митохондрий. Одной из важных функций митохондрий является осуществление процесса окислительного фосфорилирования, который преобразует энергию, вырабатываемую при окислении таких энергоемких метаболитов, как глюкоза и жирные кислоты, в АТФ. Известно, что проявление расстройств в деятельности митохондрий вовлечено в механизм патогенеза различных дегенеративных заболеваний, связанных со старением, таких как диабет, сердечно-сосудистые заболевания, болезнь Паркинсона и старческая деменция (Curr. Opin. Cell Biol., 15, 706-716, 2003). Peterson и соавт. (Science, 300, 1140-1142, 2003) предположили возможность того, что нарушение деятельности митохондрий является вероятной патогенной причиной синдрома устойчивости к инсулину, сообщив, что способность митохондрий к окислительному фосфорилированию ослабевает в старости примерно на 40%. Lee и соавт. (Diabetes Res. Clin. Pract.,42, 161-167, 1998) подтвердили, что уменьшение содержания митохондриальной ДНК в периферической крови начинается перед появлением диабета. Биогенезу митохондрий в мышцах, как известно, способствует адаптивная реакция, в которой метаболическая активность окислительного фосфорилирования мы-2 013214 шечных клеток увеличивается под действием хронического истощения запасов энергии и физической нагрузки. Zong и соавт. (Proc Natl. Acad. Sci USA, 99:15983-15987, 2002) при использовании трансгенных мышей, у которых AMPK была дезактивирована генетически, выяснили, что AMPK необходима для биогенеза митохондрий в скелетных мышцах в условиях, которые вызывают хронические затраты энергии. Далее, Putman и соавт. (J. Physiol., 551, 169-178, 2003) продемонстрировали подтверждение гипотезы,согласно которой AMPK в сочетании с постоянной физической нагрузкой приводят к увеличению объема митохондрий. В то же время удалось подтвердить, что AMPK увеличивает экспрессию гена коактиватора гаммарецептора, активируемого пролифератором пероксисом 1(PGC-1), который, как известно, играет важную роль в биогенезе митохондрий (Endocr. Rev., 24, 78-90, 2003). Raynald и соавт. (Am. J. Physiol. Endocrinol. Metab., 281, 1340, 2001) предположили, что ядерный респираторный фактор-1 (NRF-1), который является геном, имеющим важное значение для транскрипции белков, связанных с дыхательным аппаратом митохондрий, а также транскрипции и репликации митохондрий, играет важную роль в увеличении возможностей окисления в мышечных клетках в ответ на хронический энергетический стресс. Следовательно, NRF-1 принимает участие в увеличении биогенеза митохондрий. Кроме того, известно, что ферментная активность цитрат синтазы и 3-гидроксиацил-КоА дегидрогеназы, которая, как установлено,увеличивается при взаимодействии с высокими количествами белка USP-3 и его мРНК, а также при увеличенном объеме митохондрий возрастает за счет активации AMPK (J. Physiol. 551, 169-178, 2003). 3. AMPK и регуляция метаболизма жиров. Если рассматривать механизм участия AMPK в метаболизме жиров, AMPK вызывает фосфорилирование ацетил-КоА карбоксилазы, приводя тем самым к ингибированию синтеза жирных кислот. В связи с этим известно, что AMPK облегчает окисление жирных кислот за счет способности уменьшать внутриклеточную концентрацию малонил-КоА, который является промежуточным продуктом синтеза жирных кислот и ингибитором карнитин пальмитоил-КоА трансферазы I (СРТ I). СРТ I является ферментом,играющим важную роль в процессе окислении жирных кислот, причем известно, что жирные кислоты поступают в митохондрию и окисляются в ней под управлением малонил-КоА. Кроме того, известно, чтоAMPK за счет фосфорилирования ингибирует активность HMG-CoA редуктазы и глицерин фосфатаза ацил трансферазы (GPAT), вовлеченных в синтез холестерина и триацилглицерина (J. Biol. Chem., 277,32571-32577, 2002; J. Appl. Physiol., 92, 2475-2482, 2002). В то же время было обнаружено, что активация AMPK в печени ингибирует активность пируват киназы, синтазы жирных кислот и АСС за счет фосфорилирования белка, отвечающего за связывание с глюкозой (ChREBP) (J. Biol.Chem., 277, 3829-3835, 2002). Кроме того, активность белка-1, связывающегося с элементом, регулируемым стеролом (SREBP-1), который играет важную роль в дифференцировке адипоцитов, также ингибируется под действием AMPK, что приводит к ингибированию дифференцировки адипоцитов. 4. AMPK и регуляция синтеза белка. Что касается процесса синтеза белка, AMPK ингибирует этот процесс за счет ингибирования mTOR и p70S6K путем активирования TSC, или же AMPK ингибирует этап элонгации процесса трансляции за счет активации киназы фактора элонгации-2 (eEF2) и инактивации самого фактора eEF2 путем его фосфорилирования. Было обнаружено, что киназа eEF2 является прямым субстратом для AMPK (J. Biol.Chem., 278, 41970-41976, 2003). Выше уже обсуждалось, что AMPK, как известно, играет центральную роль в энергетическом метаболизме глюкозы, белков и жиров in vitro и in vivo. Neil и соавт. (Nature drug discovery, 3 (April), 340,2004) утверждали, что AMPK и малонил-КоА являются вероятными мишенями для лечения метаболических синдромов, и, кроме того, они заявляли, что пациенты, страдающие метаболическими синдромами,могут характеризоваться устойчивостью к инсулину, ожирением, гипертонией, дислипидемией и нарушением деятельности бета клеток поджелудочной железы, диабетом II типа и проявлениями атеросклероза. Была предложена гипотеза, что общей особенностью, связывающей эти многочисленные аномалии,является нарушение регуляции чувствительной к уровню энергии и передающей сигналы цепиAMPK/малонил-КоА. Было выдвинуто предположение, что такое нарушение регуляции ведет к изменению метаболизма жирных кислот в клетке, что, в свою очередь, вызывает аномальное накопление жира,нарушение работы клетки и, в конечном счете, заболевания. Кроме того, представлены доказательства,что факторы, активирующие AMPK, и/или уменьшающие уровни малонил-КоА, могли бы обратить вспять развитие этих аномалий и синдромов или предотвратить появление указанных заболеваний.Roger и соавт. (Cell, 117, 145-151, 2004) предположили, что AMPK может быть возможной мишенью для контроля над ожирением путем снижения активности гипоталамической AMPK, что приводит к увеличению содержания малонил-КоА, в результате чего регулируется потребность в поступлении пищи.Lee и соавт. (Nature medicine, 13 (June), 2004) предположили, что альфа-липоевая кислота может влиять на борьбу с ожирением путем подавления активности гипоталамической AMPK и таким образом регулируя аппетит. Кроме этого они сообщили, что альфа-липоевая кислота содействует метаболизму жира путем активации AMPK в мышечных тканях, а не в гипоталамусе и что альфа-липоевая кислота обладает терапевтической эффективностью для лечения ожирения благодаря тому, что она содействует-3 013214 расходованию энергии путем активации UCP-1, в частности, в адипоцитах.Diraison и соавт. (Diabetes, 53, S.84-91, 2004) сообщили, что активация AMPK в клетках поджелудочной железы ведет к четырехкратному увеличению экспрессии кишечного гормона, именуемого пептидом YY, который отвечает за управление аппетитом, и, таким образом, аппетит можно регулировать действием AMPK в других тканях помимо гипоталамуса.Nandakumar и соавт. (Progress in lipid research, 42, 238-256, 2003) выдвинули предположение, что при ишемической болезни сердца AMPK могла бы играть роль мишени в лечении поражений, вызванных ишемической реперфузией, за счет регуляции метаболизма жира и глюкозы.Min и соавт. (Am. J. Physiol. Gastrointest Liver Physiol, 287, G.1-6, 2004) сообщили, что AMPK эффективна при регулировании печени, пораженной алкоголем.Genevieve и соавт. (J. Biol. Chem., 279, 20767-74, 2004) сообщили, что активация AMPK ингибирует активность фермента iNOS, который опосредует воспаление при хронических воспалительных состояниях или эндотоксиновом шоке, в том числе при разновидностях диабета, связанных с ожирением, и, таким образом, применение AMPK будет эффективным при разработке новых лекарственных средств, имеющих механизм действия, который способен улучшить чувствительность к инсулину. Кроме того, указанные авторы сообщили, что активация AMPK оказывает влияние на ингибирование активности iNOS, и,таким образом, этот факт может найти применение в клинической практике в отношении таких болезней,как септицемия, рассеянный склероз, инфаркт миокарда, воспалительные заболевания кишечника и нарушение деятельности бета-клеток поджелудочной железы.Zing-ping и соавт. (FEBS Letters, 443, 285-289, 1999) сообщили, что AMPK активирует эндотелиальную NO синтазу в мышечных и сердечных клетках мышей с помощью фосфорилирования в присутствии Са-кальмодулина. Это означает, что AMPK вовлечена в развитие сердечных заболеваний, включая стенокардию.Javier и соавт. (GenesDevelop., 2004) сообщили, что продолжительность жизни может быть увеличена за счет ограничения потребления энергии и, такое увеличение продолжительности жизни достигается тем, что увеличивают in vivo соотношение АМФ/АТФ и, следовательно, субъединица 2 AMPK активируется под действием АМФ. Вследствие этого авторы предположили, что AMPK может играть роль средства для обнаружения связи между продолжительностью жизни, уровнем энергии и инсулиноподобной сигнальной информацией. Между тем, даньшень (кодонопсис, шалфей многокорневищный) (Salvia miltiorrhiza) широко применялся в качестве важного растительного лекарственного средства в различных районах северовосточной Азии, начиная с древних времен, причем хорошо известно, что его применение приносит прекрасные результаты при профилактике и лечении различных сердечно-сосудистых заболеваний. Сконцентрировав внимание на столь высокой терапевтической эффективности даньшеня, авторы настоящего изобретения предположили, что основные ингредиенты, входящие в состав даньшеня, являются прекрасными лекарственными веществами, способными оказывать лечебное действие при различных заболеваниях, таких как ожирение, диабет и метаболические синдромы. Смотрите, например, патенты Кореи 2003-0099556, 2003-0099557, 2003-0099657, 2003-0099658, 2004-0036195, 2004-0036197 и 2004-0050200,выданные авторам настоящего изобретения. В частности, авторы настоящего изобретения установили,что основные действующие начала даньшеня, включающие криптотаншинон, 15,16-дигидротаншинон, таншинон II-А и таншинон I могут применяться при лечении заболеваний, связанных с метаболическим синдромом. Сущность изобретения В результате целого ряда обширных и интенсивных исследований и экспериментов, основанных на фактах, которые были изложены выше, авторы настоящего изобретения недавно подтвердили, что соединения, основанные на структуре нафтохинона, как, например, -лапакон 7,8-дигидро-2,2-диметил-2 Н-нафто(2,3b)дигидропиран-7,8-дион, дуннион 2,3,3-триметил-2,3,4,5-тетрагидронафто(2,3-b)дигидрофуран-6,7-дион,-дуннион 2,3,3-триметил-2,3,4,5-тетрагидронафто(2,3-)дигидрофуран-6, 7-дион, нокардинон А, нокардинон В, ланталукратин А, ланталукратин В и ланталукратин С также могут применяться в профилактике или лечении различных заболеваний, таких как, например, ожирение, диабет, метаболические синдромы, дегенеративные заболевания и заболевания, связанные с нарушением деятельности митохондрий.-Лапакон является встречающимся в природе растительным продуктом, представляющим собой производное лапакола (нафтохинона), и его получают из дерева лапако (Tabebuia avellanedae), которое растет в Южной Америке. Дуннион и -дуннион также получены из листьев Streptocarpus dunnii родом из Южной Америки. С древних времен эти трициклические производные нафтохинона широко применя-4 013214 лись в Южной Америке в качестве противораковых лекарственных средств и в лечении болезни Чагаса,которая, как правило, встречается только в Южной Америке, и известно, что они давали прекрасные терапевтические результаты. В частности, поскольку их фармакологическое действие в качестве противораковых средств широко известно в странах Запада, эти трициклические производные нафтохинона в последнее время привлекали к себе значительное внимание специалистов. Фактически, как указано в патенте США 5969163, на основе таких трициклических производных нафтохинона многими исследовательскими группами и учреждениями в настоящее время разработано большое количество противораковых средств. Однако несмотря на ряд исследований, до сих пор остается неизвестным тот факт, что такие нафтохиноновые соединения обладают терапевтической эффективностью в лечении или профилактике ожирения, диабета, метаболических синдромов, дегенеративных заболеваний и заболеваний, связанных с нарушением деятельности митохондрий. На основании того факта, что указанные выше нафтохиноновые соединения, как, например,-лапакон, дуннион, -дуннион, нокардинон А, нокардинон В, ланталукратин А, ланталукратин В и ланталукратин С обладают основной химической структурой, сходной со структурой производных таншинона, извлеченных из даньшеня, авторы настоящего изобретения исследовали их фармакологическое действие в качестве терапевтических и профилактических средств против метаболических синдромов. То есть авторы настоящего изобретения предприняли попытку выяснить, способны ли нафтохиноновые соединения, раскрытые в настоящем изобретении, активировать AMPK в клетках и тканях. Затем для глубокого исследования терапевтического действия указанных соединений на синдромы заболеваний по настоящему изобретению, включающие ожирение, диабет, метаболические синдромы, дегенеративные заболевания и заболевания, связанные с нарушением деятельности митохондрий, основываясь на полученных результатах, авторы настоящего изобретения исследовали терапевтический эффект при лечении и/или профилактике указанных синдромов, в т.ч. ожирения, диабета и метаболических синдромов, с помощью различных экспериментов, используя мышей ob/ob, т.е. животную модель ожирения, вызванного пониженной секрецией лептина. Затем авторы настоящего изобретения подтвердили, что нафтохиноновые соединения по настоящему изобретению дают отличный результат при лечении и/или профилактике синдромов заболеваний по настоящему изобретению. На основе этих данных работа над настоящим изобретением была завершена. Таким образом, цель настоящего изобретения заключается в разработке фармацевтической композиции, включающей в качестве действующего ингредиента нафтохиноновое соединение, которое терапевтически эффективно для лечения и профилактики синдромов заболеваний по настоящему изобретению, таких как ожирение, диабет, метаболические синдромы, дегенеративные заболевания и заболевания, связанные с нарушением деятельности митохондрий. Краткое описание чертежей Указанные выше и другие цели, особенности и прочие преимущества настоящего изобретения станут ясны более отчетливо из следующего далее подробного описания изобретения, рассматриваемого в совокупности с сопроводительным иллюстративным материалом, в котором фиг. 1-3 представляют собой графики, показывающие распределение жира, выраженное в числовых величинах, в каждом из органов ob мышей C57BL/6JL Lep ob/Lep, которым вводили фармацевтические композиции по настоящему изобретению; фиг. 4 представляет собой фотографический снимок, показывающий влияние -лапакона на регуляцию фосфорилирования AMPK и АСС в клетках; фиг. 5 представляет собой фотографический снимок, показывающий влияние -лапакона на фосфорилирование эндотелиальной синтазы оксида азота (eNOS); фиг. 6 А-6 С представляют собой графики, показывающие влияние -лапакона на активацию AMPK у мышей C57BL/6; фиг. 7 представляет собой фотографический снимок, показывающий влияние -лапакона на фосфорилирование AMPK и АСС у мышей C57BL/6; фиг. 8A-8F представляют собой графики, показывающие влияние -лапакона на транскрипты экспрессии белков, вовлеченных в метаболизм липидов, у мышей C57BL/6; фиг. 9 А-9 С представляют собой графики, показывающие влияние -лапакона на транскрипты экспрессии белков, вовлеченных в метаболизм глюкозы, у мышей C57BL/6; фиг. 10 А-10 Е представляют собой графики, показывающие влияние -лапакона на транскрипты-5 013214 экспрессии белков, вовлеченных в биогенез митохондрий, у мышей C57BL/6; фиг. 11A-11F представляют собой графики, показывающие влияние -лапакона на транскрипты экспрессии белков, вовлеченных в энергетический метаболизм, у мышей C57BL/6; фиг. 12A-12F представляют собой графики, показывающие влияние -лапакона на транскрипты экспрессии белков, связанных с SIRT, у мышей C57BL/6; фиг. 13 представляют собой график, показывающий влияние -лапакона на транскрипты экспрессии генов UCP1 и UCP2 у мышей C57BL/6; фиг. 14 А и 14 В представляют собой графики, показывающие изменение массы тела и рациона питания с течением времени после введения -лапакона мышам C57BL/6 с DIO; фиг. 15 представляет собой график, сравнивающий изменения массы различных органов мышейC57BL/6 с DIO исследуемой группы и контрольной группы после введения -лапакона; фиг. 16 А-16 С представляют собой фотографические снимки, показывающие животных с полностью вскрытой брюшной полостью после введения -лапакона мышам C57BL/6 с DIO, а также результаты окрашивания масляным красным О и ЕМ исследования накопления жира в тканях печени; фиг. 17 представляет собой фотографический снимок, на котором показано сравнение результатов,относящихся к размерам адипоцитов в гонадной жировой ткани, после введения -лапакона мышамC57BL/6 с DIO; фиг. 18 представляет собой график, показывающий изменения концентрации липидов, глюкозы и гормонов в крови с течением времени, после введения -лапакона мышам C57BL/6 с DIO; фиг. 19 представляет собой фотографический снимок, на котором показано сравнение результатов окрашивания НЕ бурых жировых тканей после введения -лапакона мышам C57BL/6 с DIO; фиг. 20 представляет собой фотографический снимок, на котором показаны результаты ЕМ исследования бурой жировой ткани после введения -лапакона мышам C57BL/6 с DIO; фиг. 21 А-21 Е представляют собой графики и фотографические снимки, показывающие изменения соотношения поступления пищи/масса тела в граммах, массы тела и накопленного количества жира, а также результаты ЕМ исследования ткани после введения -лапакона мышам, дефицитным в отношении рецептора лептина (ob/ob); фиг. 22 представляет собой график, показывающий влияние -лапакона на самопроизвольную двигательную активность после введения -лапакона мышам C57BL/6 с DIO; фиг. 23 представляет собой график, показывающий влияние -лапакона на улучшение физической выносливости после введения -лапакона мышам C57BL/6 с DIO; и фиг. 24 представляет собой график, показывающий влияние -лапакона на дыхательный коэффициент (ДК) после введения -лапакона мышам C57BL/6 с DIO. Подробное описание предпочтительных вариантов осуществления В соответствии с одним из аспектов настоящего изобретения указанные выше, а также другие цели могут быть достигнуты с помощью разработки фармацевтической композиции, предназначенной для лечения и/или профилактики синдромов заболеваний по настоящему изобретению, таких как тучность,диабет, метаболические синдромы, дегенеративные заболевания и заболевания, связанные с нарушением деятельности митохондрий, включающей: (а) терапевтически эффективное количество соединения,представленного следующей формулой (I): где каждый из заместителей R1 и R2 независимо представляет собой водород, галоген, алкокси, гидрокси или низший алкил, включающий от 1 до 6 атомов углерода; каждый из заместителей R3, R4, R5, R6, R7 и R8 независимо представляет собой водород, гидрокси,C1-С 20-алкил, алкенил или алкокси, циклоалкил, гетероциклоалкил, арил или гетероарил или же два заместителя из числа R3-R8 совместно могут образовывать циклическую структуру, которая может быть насыщенной или частично или полностью ненасыщенной; иn означает 0 или 1, при условии, что если n равно 0, атомы углерода, расположенные рядом с выделенным фрагментом, образуют циклическую структуру с помощью простой связи; или фармацевтически приемлемую соль, пролекарство, сольват или изомер указанного соединения,а также(b) фармацевтически приемлемый носитель, разбавитель или наполнитель, или любое сочетание этих ингредиентов.-6 013214 Для подтверждения терапевтического и профилактического действия соединений формулы (I) на синдромы заболеваний по настоящему изобретению авторы изобретения, как будет показано ниже в экспериментальных примерах, измерили воздействие соединений формулы (I) на активность AMPK в мышечных клетках (С 2 С 12) и подавление клеточной дифференцировки в преадипоцитах (клетки 3T3-L1 иF442A) и в результате подтвердили, что указанные соединения демонстрируют превосходные результаты по активации AMPK и ингибиторное воздействие на дифференцировку адипоцитов. Кроме того, авторы изобретения дополнительно подтвердили терапевтическое и профилактическое действие соединений формулы (I) на синдромы заболеваний по настоящему изобретению, которое было изучено путем экспериментов in vivo с использованием мышей ob/ob, которые являлись моделью ожирения, мышей db/db, которые являлись моделью ожирения/диабета, DIO (ожирение, вызванное пищевым рационом) мышей, вызванного приемом жирной пищи, а также крыс Zucker fa/fa, которые служили моделью ожирения/диабета, и в результате соединения формулы (I) оказались высоко эффективными с терапевтической точки зрения. Следовательно, ожидается, что фармацевтические композиции по настоящему изобретению, включающие в качестве действующего ингредиента соединения формулы (I), смогут применяться в лечении и профилактике ряда синдромов заболеваний, указанных в настоящем изобретении, благодаря активацииAMPK. В настоящей заявке термин фармацевтически приемлемая соль относится к соли, которая не оказывает заметного раздражающего воздействия на организм, в который ее вводят, и сохраняет биологическую активность и свойства исходного соединения. Примеры фармацевтически приемлемых солей могут включать кислотно-аддитивные соли соединений формулы (I) с кислотами, способными образовывать нетоксичные кислотно-аддитивные соли, содержащие фармацевтически приемлемые анионы, например неорганическими кислотами, такими как хлористо-водородная кислота, серная кислота, азотная кислота,фосфорная кислота, бромисто-водородная кислота и йодисто-водородная кислота; органическими карбоновыми кислотами, такими как винная кислота, муравьиная кислота, лимонная кислота, уксусная кислота, трихлоруксусная кислота, трифторуксусная кислота, глюконовая кислота, бензойная кислота, молочная кислота, фумаровая кислота, малеиновая кислота и салициловая кислота; или сульфоновыми кислотами, такими как метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота и п-толуолсульфоновая кислота. Конкретные примеры фармацевтически приемлемых солей карбоновых кислот включают соли со щелочными металлами или щелочно-земельными металлами, такими как литий, натрий, калий, кальций и магний, соли с аминокислотами, такими как аргинин, лизин и гуанидин,соли с органическими основаниями, такими как дициклогексиламин, N-метил-D-глюкамин, трис(гидроксиметил)метиламин, диэтаноламин, холин и триэтиламин. Соединения формулы (I) по настоящему изобретению могут быть превращены в их соли обычными способами, хорошо известными в технике. В настоящем описании термин пролекарство означает средство, которое превращается в исходное лекарство in vivo. Пролекарства часто применяются из-за того, что в некоторых ситуациях их проще вводить, чем сами лекарственные средства. Например, пролекарства могут обладать биологической доступностью при пероральном введении, в то время как исходные соединения - нет. Кроме того, пролекарства могут иметь лучшую растворимость в фармацевтических композициях по сравнению с исходными препаратами. Неограничивающими примерами пролекарств могли бы являться соединения по настоящему изобретению, которые вводят в виде сложных эфиров (пролекарств) для облегчения транспорта через оболочки клеток, в тех случаях, когда растворимость в воде мешает подвижности молекул, но которые затем подвергаются метаболическому гидролизу до карбоновых кислот, т.е. действующих соединений, когда внутри клетки способность растворяться в воде оказывается полезной. Другим примером пролекарства мог бы служить короткий пептид (полимер аминокислот), связанный с кислотной группой,причем пептид подвергается метаболизму с выделением активного фрагмента. В настоящем описании термин сольват означает соединение по настоящему изобретению или его соль, которые, кроме того, включают стехиометрическое или нестехиометрическое количество растворителя, связанного с ними нековалентными межмолекулярными силами. Предпочтительными растворителями являются летучие, нетоксичные и/или приемлемые для введения людям. Если растворителем является вода, то сольват именуют гидратом. В настоящей заявке термин изомер означает соединения по настоящему изобретению или их соли, которые имеют одну и ту же химическую или молекулярную формулу, но оптически или пространственно отличаются друг от друга. Если не указано иное, предполагается, что термин соединение формулы (I) охватывает соединение как таковое, а также его фармацевтически приемлемые соли, пролекарства, сольваты и изомеры. Термин алкил в настоящем описании относится к алифатической углеводородной группе. Алкильный фрагмент может быть насыщенной алкильной группой, причем этот термин означает, что такая группа не содержит каких-либо алкеновых или алкиновых фрагментов. С другой стороны, алкильный фрагмент может также быть ненасыщенным алкильным фрагментом, и это означает, что он содержит хотя бы один алкеновый или алкиновый фрагмент. Термин алкеновый фрагмент относится к группе, в которой хотя бы два атома углерода образуют хотя бы одну двойную связь углерод-углерод, и-7 013214 термин алкиновый фрагмент относится к группе, в которой хотя бы два атома углерода образуют хотя бы одну тройную связь углерод-углерод. Алкильный фрагмент, независимо от того, является ли он замещенным или незамещенным, может быть разветвленным, линейным или циклическим. В настоящем описании термин гетероциклоалкил относится к карбоциклической группе, в которой один или несколько циклических атомов углерода заменены на кислород, азот или серу, и в число которых входят, не ограничиваясь перечисленным, например, фуран, тиофен, пиррол, пирролин, пирролидин, оксазол, тиазол, имидазол, имидазолин, имидазолидин, пиразол, пиразолин, пиразолидин, изотиазол, триазол, тиадиазол, пиран, пиридин, пиперидин, морфолин, тиоморфолин, пиридазин, пиримидин,пиразин, пиперазин и триазин. В настоящем описании термин арил относится к ароматической замещающей группе, которая включает хотя бы один цикл, имеющий сопряженную систему пиэлектронов и включает как карбоциклические арильные (например, фенил), так и гетероциклические арильные (например, пиридин) группы. Этот термин включает моноциклические или конденсированные полициклические (т.е. в которых оба смежных цикла включают пару соседних атомов углерода) группы. В настоящем описании термин гетероарил относится к ароматической группе, которая содержит хотя бы один гетероцикл. Примеры арилов или гетероарилов включают, не ограничиваясь перечисленным, фенил, фуран, пиран, пиридил, пиримидил и триазил. Группы R1, R2, R3, R4, R5, R6, R7 и R8 в формуле (I) по настоящему изобретению могут быть необязательно замещенными. Если они замещены, замещающая группа (группы) включает одну или несколько групп индивидуально и независимо выбранных из циклоалкила, арила, гетероарила, гетероалицикла,гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, галогена, карбонила, тиокарбонила,О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо,N-сульфонамидо, С-карбокси, О-карбокси, изоциато, тиоциато, изотиоциато, нитро, силила, тригалогенметансульфонила и амино, включая моно- и дизамещенные аминогруппы, а также защищенные производные перечисленных групп. Среди соединений формулы (I) предпочтительными являются соединения приведенных ниже формул (II)-(IV). Соединения формулы (II) представляют собой соединения, у которых n=0, соседние атомы углерода образуют циклическую структуру (фурановый цикл) с простой связью между ними и которые далее по тексту часто называются фурановыми соединениями или производными фуран-о-нафтохинона. Соединения формулы (III) представляют собой соединения, у которых n=1 и которые далее по тексту заявки часто называются пирановыми соединениями или пиран-о-нафтохинонами. В формуле (I) каждый из R1 и R2 особенно предпочтительно является водородом.-8 013214 Среди фурановых соединений формулы (II) особенно предпочтительными являются соединения формулы (IIa), в которых R1, R2 и R4 независимо представляют собой водород, или соединения формулы(IIb), в которых R1,R2 и R6 независимо представляют собой водород. Кроме того, среди пирановых соединений формулы (III) особенно предпочтительными являются соединения формулы (IIIa), в которых R1, R2, R5, R6, R7 и R8 независимо являются атомами водорода. Термин фармацевтическая композиция в настоящем описании означает смесь соединения формулы (I) и других химических веществ, таких как разбавители или носители. Фармацевтические композиции облегчают введение соединения в организм пациента. В технике известны различные способы введения соединений, и они включают, не ограничиваясь перечисленным, пероральное введение, инъекции,аэрозоли, парентеральные и топические пути введения. Фармацевтические композиции, кроме того,можно получать взаимодействием действующих соединений с кислотами, такими как хлористоводородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота,метансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Термин терапевтически эффективное количество означает количество действующего ингредиента, которое в случае введения соединения эффективно для облегчения или уменьшения до некоторой степени одного или нескольких симптомов заболевания при необходимости лечения, или для замедления появления клинических признаков или симптомов заболевания при необходимости профилактики. Таким образом, терапевтически эффективное количество относится к количеству действующего соединения,которое приводит к таким результатам, как (i) изменение скорости развития заболевания; (ii) сдерживание до определенной степени дальнейшего развития заболевания и/или (iii) облегчение до определенной степени (или предпочтительно устранение) одного или нескольких симптомов, связанных с заболеванием. Терапевтически эффективное количество в случае необходимости лечения может быть определено эмпирически, путем проведения экспериментов с соединениями с использованием известных in vivo и invitro модельных систем для того или иного заболевания. Термин носитель означает химическое соединение, которое облегчает проникновение соединения в клетки или ткани. Например, диметилсульфоксид (ДМСО) является широко применяемым носителем,поскольку он облегчает поступление в клетки и ткани организма многих органических соединений. Термин разбавитель определяет химические соединения, растворенные в воде, которые должны растворять требуемое соединение, а также стабилизировать биологически активную форму этого соединения. В технике в качестве разбавителей применяются соли, растворенные в буферных растворах. Одним из обычно применяемых буферных растворов является фосфатный буферный солевой раствор (PBS),поскольку он имитирует условия ионной силы в жидких средах организма человека. Поскольку буферные соли могут регулировать рН раствора при низких концентрациях, буферный разбавитель редко изменяет биологическую активность соединения. Соединения, описанные в настоящей заявке, могут вводиться пациенту из числа людей сами по себе или в форме фармацевтических композиций, в которых они смешаны с другими действующими ингредиентами для осуществления комбинированной терапии или с подходящими носителями, или наполнителями (наполнителем). Способы включения соединений в фармацевтические композиции и их введения могут быть найдены в "Remington's Pharmaceutical Sciences", Mack Publishing Co., Easton, PA, 18th edition,1990.-9 013214 В фармацевтических композициях по настоящему изобретению соединения формулы (I), как будет показано ниже, могут быть получены обычными способами, известными в технике, и/или различными способами, которые основаны на общих методиках и способах, применяемых в области синтетической органической химии. Способы получения, описанные ниже, являются только обычными способами и наряду с ними могут применяться и другие методики. Объем настоящего изобретения, как таковой, не ограничен способами, изложенными ниже. Способ получения 1. Синтез производных лапакола и катализируемая кислотами циклизация.-Лапакон получают в относительно небольших количествах из дерева лапако, в то время как лапакол, используемый в качестве сырья для синтеза -лапакона, получают из дерева лапако в значительно больших количествах. Поэтому способ синтеза -лапакона с использованием лапакола был разработан достаточно давно. Т.е. согласно способу L.F. Fieser, опубликованному в J. Am. Chem. Scoc., 49 (1927), 857, -лапакон получают с относительно высоким выходом, смешивая лапакол и серную кислоту и энергично перемешивая полученную смесь при комнатной температуре. Сами по себе производные трициклических нафтохинонов (пиран-онафтохиноны и фуран-о-нафтохиноны), имеющие относительно простую химическую структуру, как правило,синтезируют с относительно высокими выходами путем циклизации с применением серной кислоты в качестве катализатора, как показано ниже на схеме. На основе этого способа может быть синтезирован ряд соединений формулы (I). Более конкретно, приведенный выше способ синтеза может быть изображен следующим образом. Т.е. если 2-гидрокси-1,4-нафтохинон вводят в реакцию с различными аллилбромидами или их эквивалентами в присутствии основания, одновременно образуются продукты С-алкилирования и О-алкилирования. Кроме того, имеется возможность синтезировать любой из двух продуктов в зависимости от условий проведения реакции. Поскольку продукт О-алкилирования при кипячении с обратным холодильником в таких растворителях, как толуол или ксилол, в результате перегруппировки Кляйзена превращается в С-алкилированное производное другого типа, имеется возможность получить различные типы производных 3-замещенного-2-гидрокси 1,4-нафтохинона. Различные типы продуктов С-алкилирования, полученные таким способом, можно подвергнуть циклизации с использованием серной кислоты в качестве катализатора, за счет чего появляется возможность синтеза производных пиран-о-нафтохинона или фуран-о-нафтохинона в числе прочих соединений формулы (I). Способ получения 2. Реакция Дильса-Альдера с использованием 3-метилен-1,2,4-[3 Н]нафталинтриона. Согласно сообщению V. Nair и соавт. Tetrahedron Lett., 42 (2001), 4549-4551, различные производные пиран-о-нафтохинона могут быть относительно легко получены путем введения 3-метилен-1,2,4-[3 Н]нафталинтриона, полученного при нагревании 2-гидрокси-1,4-нафтохинона и формальдегида, в реакцию Дильса-Альдера с различными олефиновыми соединениями. Этот способ, согласно которому различные формы производных пиран-о-нафтохинона могут быть синтезированы относительно простым путем, обладает преимуществами по сравнению с циклизацией производных лапакола с применением серной кислоты в качестве катализатора. Способ получения 3. Галогеналкилирование и циклизация радикальной реакцией. Кроме того, для синтеза производных фуран-о-нафтохинона можно легко применить тот же способ, который используется в синтезе криптотаншинона и 15,16-дигидротаншинона. Т.е. согласно A.C. Baillie и соавт.(J. Chem. Soc. (С), 1968, 48-52), химические разновидности 2-галогенэтильных или 3-галогенэтильных радикалов, полученные из производных 3-галогенпропановых кислот или 4-галогенбутановых кислот, могут быть введены во взаимодействие с 2-гидрокси-1,4-нафтохиноном для получения 3-(2-галогенэтил или 3-галогенпропил)-2-гидрокси-1,4-нафтохинона, который затем подвергают циклизации в присутствии подходящего кислотного катализатора с целью получить различные производные пиран-о-нафтохинонов или фуран-о-нафтохинонов. Способ получения 4. Циклизация 4,5-бензофурандиона реакцией Дильса-Альдера. Другим способом, применяемым для синтеза криптотаншинона и 15,16-дигидротаншинона, может быть способ, разработанный J.K. Snyder и соавт. (Tetrahedron Letters, 28 (1987), 3427-3430). Согласно этому способу производные фуран-о-нафтохинона могут быть синтезированы реакцией циклоприсоединения по ДильсуАльдеру при взаимодействии 4,5-производных бензофурандиона и различных производных диенов. Кроме того, на основе указанных выше способов получения могут быть синтезированы различные производные с применением соответствующих способов синтеза в зависимости от характера заместителей. Конкретные примеры производных, полученных описанными способами, и указания на примененный способ синтеза приведены ниже в табл. 1. Конкретные методики получения будут описаны в следующих далее примерах. Фармацевтические композиции по настоящему изобретению могут производиться способами, которые сами по себе являются известными, например путем обычного смешивания, растворения, гранулирования, получения драже, растирания в порошок, эмульгирования, инкапсулирования, включения или лиофилизации. Таким образом, фармацевтические композиции для применения в соответствии с настоящим изобретением могут быть получены стандартными способами с применением одного или нескольких фармацевтически приемлемых носителей, в т.ч. наполнителей и вспомогательных веществ, которые облегчают получение препаратов для фармацевтического применения из действующих соединений. Подходящий состав зависит от выбранного пути введения. Могут применяться любые из хорошо известных методик, носителей и наполнителей, которые подходят для того или иного состава и известны в технике,например приведены в Remington's Pharmaceutical Sciences, смотрите выше. В настоящем изобретении соединения формулы (I) могут быть включены в состав препаратов для инъекции и парентерального введения в зависимости от предполагаемой цели. При получении препаратов для инъекции соединения по настоящему изобретению могут быть включены в состав водных растворов, предпочтительно физиологически совместимых буферных растворов, таких как раствор Hanks'а, раствор Ringer'а или физиологический солевой раствор. Для введения через слизистые оболочки в состав вводят проникающие средства, подходящие для барьера, который необходимо преодолеть. Такие проникающие средства, как правило, известны в технике. Составы для перорального введения могут быть легко получены смешиванием действующих соединений с фармацевтически приемлемыми носителями, хорошо известными в технике. Такие носители дают возможность получать составы, содержащие соединения по настоящему изобретению, в виде таблеток, пилюль, порошков, гранул, драже, капсул, жидкостей, гелей, сиропов, взвесей, суспензий и т.п. для перорального приема пациентом. Предпочтительными являются капсулы, таблетки, пилюли, порошки и гранулы и особенно применимыми являются капсулы и таблетки. Таблетки и пилюли предпочтительно получают с покрытием, расположенным в кишечнике Фармацевтические препараты для перорального применения могут быть получены смешиванием одного или нескольких наполнителей с одним или несколькими соединениями по настоящему изобретению, необязательно измельчением полученной смеси и обработкой смеси гранул после добавления, если это желательно, соответствующих вспомогательных веществ для получения таблеток или ядер драже. Подходящими наполнителями могут служить такие вещества, как сахара, в т.ч. лактоза, сахароза, маннит и сорбит; а также вещества типа целлюлозы,как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, смола трагаканта, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий карбоксиметилцеллюлоза и/или поливинилпирролидон (PVP). Если желательно, могут быть добавлены дезинтегрирующие- 15013214 средства, такие как поперечно-сшитый поливинилпирролидон, агар или альгиновая кислота, или ее соли,такие как альгинат натрия, вещества для скольжения, такие как стеарат магния, и носители, например связующие вещества. Фармацевтические препараты для перорального применения могут включать плотно закрытые капсулы, изготовленные из желатина, а также мягкие, запечатанные капсулы, изготовленные из желатина с добавкой пластификатора, такого как глицерин или сорбит. Плотно закрытые капсулы могут содержать действующие ингредиенты в смеси с наполнителями, как, например, лактозой, связующими веществами,например крахмалами и/или веществами для скольжения, такими как тальк или стеарат магния. В мягких капсулах действующие соединения могут быть растворены или диспергированы в подходящих растворителях, таких как жирные кислоты, жидкий парафин или жидкие полиэтиленгликоли. Дополнительно могут быть также добавлены стабилизаторы. Все составы для перорального введения должны представлять собой дозированные лекарственные формы, удобные для введения таким способом. Соединения по настоящему изобретению могут быть включены в составы для парентерального введения путем инъекции, например болюсной инъекции или длительной инфузии. Составы для инъекции могут представлять собой дозированные лекарственные формы с добавлением консервантов, например ампулы или контейнеры, содержащие большое число доз. Эти композиции могут принимать такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать средства, способствующие образованию той или иной формы, как, например, суспендирующие, стабилизирующие и/или диспергирующие средства. В качества альтернативы действующий ингредиент может иметь форму порошка для разбавления перед применением подходящим носителем, например стерильной апирогенной водой. Фармацевтические композиции, подходящие для применения по настоящему изобретению, включают композиции, в которых действующие ингредиенты содержатся в количествах, эффективных для достижения намеченной цели. Более конкретно, терапевтически эффективное количество означает количество соединения, эффективное для предотвращения, облегчения симптомов болезни или улучшения состояния, или продления срока жизни субъекта, подвергаемого лечению. Целесообразно определять терапевтически эффективное количество с использованием знаний и навыков специалиста в данной области техники, особенно с учетом подробного раскрытия изобретения, представленного в настоящей заявке. Если фармацевтическая композиция по настоящему изобретению представлена в виде дозированной лекарственной формы, соединение формулы (I) в качестве действующего ингредиента предпочтительно содержится в одной единице лекарственной формы в количестве примерно от 0,1 до 1000 мг. Количество вводимого соединения формулы (I) должно определяться лечащим врачом в зависимости от массы тела и возраста подвергаемого лечению пациента, природы и тяжести заболевания. Однако в случае взрослых пациентов, вводимая пациенту доза действующего ингредиента, как правило, находится в диапазоне примерно от 1 до 1000 мг/кг массы тела/день в зависимости от частоты и интенсивности введения. В случае внутримышечного или внутривенного введения взрослым пациентам может быть достаточно общего количества примерно от 1 до 500 мг в день в виде одной дозы, но для некоторых пациентов может быть предпочтительно применение более высокой дневной дозировки. В соответствии с другим аспектом настоящего изобретения разработано применение соединения формулы (I) с целью получения лекарственного препарата для лечения или профилактики синдромов заболеваний по настоящему изобретению. Термин синдромы заболеваний по настоящему изобретению относится к ожирению, диабету, метаболическим синдромам, дегенеративным заболеваниям и заболеваниям, связанным с нарушением деятельности митохондрий. Термин лечение синдромов заболеваний по настоящему изобретению относится к остановке или замедлению развития болезни, если лекарство вводят субъекту, у которого проявляются симптомы наступления заболевания. Термин профилактика(предотвращение) относится к остановке или замедлению наступления симптомов болезни, если лекарство вводят субъекту, у которого не проявляются симптомы наступления заболевания, но у которого существует большой риск появления заболевания. Примеры Далее, настоящее изобретение будет описано более подробно с помощью приведенных ниже примеров и экспериментальных примеров. Эти примеры приведены только для иллюстрации настоящего изобретения и не должны истолковываться как ограничивающие объем и суть настоящего изобретения. Пример 1. Синтез -лапакона (соединение 1). 17,4 г (0,10 моль) 2-гидрокси-1,4-нафтохинона растворяли в 120 мл ДМСО и в полученную смесь постепенно добавляли 0,88 г (0,11 моль) LiH. Данную операцию необходимо проводить с осторожностью из-за выделения водорода. Реакционную смесь перемешивали и после того, как водород переставал выделяться, дополнительно перемешивали еще в течение 30 мин. Затем к полученной смеси постепенно добавляли 15,9 г (0,10 моль) пренилбромида (1-бром-3-метил-2-бутен) и 3,35 г (0,025 моль) LiH. Реакционную смесь нагревали до 45 С и затем энергично перемешивали при этой температуре в течение 12 ч. Реакционную смесь охлаждали до температуры ниже 10 С и добавляли вначале 76 г льда и затем 250 мл воды. После этого постепенно добавляли 25 мл концентрированной HCl для доведения полученного рас- 16013214 твора до кислотной реакции рН 1. К реакционной смеси добавляли 200 мл EtOAc и подвергали смесь энергичному перемешиванию, в результате которого образовывался белый осадок, который не растворялся в EtOAc. Этот осадок отфильтровывали и отделяли слой EtOAc. Водный слой еще раз экстрагировали 100 мл EtOAc и объединяли с экстрагированным ранее органическим слоем. Полученный органический слой промывали 150 мл 5% NaHCO3 и концентрировали. Полученный концентрат растворяли в 200 мл CH2Cl2 и энергично встряхивали при добавлении 70 мл 2 н. водного раствора NaOH для разделения двух слоев. Далее, слой CH2Cl2 еще дважды подвергали подобной обработке 2 н. водным растворомNaOH с последующим разделением слоев (70 мл 2). После этого водные фракции объединяли вместе и доводили до кислотной реакции рН 2, в результате чего получали твердое вещество. Полученное твердое вещество отделяли фильтрованием, получая лапакол. Выделенный таким образом лапакол перекристаллизовывали из 75% EtOH. Перекристаллизованный продукт смешивали с 80 мл серной кислоты,смесь подвергали энергичному перемешиванию при комнатной температуре в течение 10 мин и к смеси для завершения реакции добавляли 200 г льда. Затем в реакционную смесь добавляли 60 мл CH2Cl2 и полученную смесь энергично встряхивали. После этого слой CH2Cl2 отделяли и промывали 5% NaHCO3. Водный слой еще раз экстрагировали, используя 30 мл CH2Cl2, промывали 5% NaHCO3 и объединяли с предыдущей порцией экстракта. Органический слой высушивали над MgSO4 и концентрировали, получая загрязненный -лапакон. Затем неочищенный -лапакон перекристаллизовывали из изопропанола,получая в результате 8,37 г чистого -лапакона. 1 Н ЯМР (CDCl3, ): 8,05 (1 Н, дд, J=1,8 Гц), 7,82 (1 Н, дд, J=1,8 Гц), 7,64 (1 Н, дт, J=1,8 Гц), 7,50 (1 Н,дт, J=1,8 Гц), 2,57 (2 Н, т, J=6,5 Гц), 1,86 (2 Н, т, J=6,5 Гц) 1,47 (6 Н, с). Пример 2. Синтез дунниона (соединение 2). В способе получения лапакола по примеру 1 отделенное твердое вещество, не растворявшееся вEtOAc, представляло собой 2-пренилокси-1,4-нафтохинон, т.е. продукт О-алкилирования, тогда как лапакол являлся продуктом С-алкилирования. Вначале выделенный 2-пренилокси-1,4-нафтохинон один раз перекристаллизовывали из EtOAc. 3,65 г (0,015 моль) очищенного таким образом твердого вещества растворяли в толуоле и кипятили раствор с обратным холодильником в течение 5 ч для осуществления перегруппировки Кляйзена. Раствор концентрировали отгонкой при пониженном давлении и затем без дальнейшей очистки смешивали с 15 мл серной кислоты. Полученную смесь энергично перемешивали при комнатной температуре в течение 10 мин и добавляли в нее 100 г льда для завершения реакции. К реакционной смеси добавляли 50 мл CH2Cl2 и энергично встряхивали. После этого отделяли слой CH2Cl2 и промывали 5% NaHCO3. Водный слой еще раз экстрагировали, используя 20 мл CH2Cl2, промывали 5%NaHCO3 и объединяли с ранее полученным экстрактом. Объединенные органические слои высушивали над MgSO4, концентрировали и очищали хроматографией на силикагеле, получая 2,32 г чистого дунниона. 1 Н ЯМР (CDC13, ): 8,05 (1 Н, д, J=8 Гц), 7,64 (2 Н, д, J=8 Гц), 7,56 (1 Н, м), 4,67 (1 Н, кв., J=7 Гц), 1,47(3 Н, д, J=7 Гц), 1,45(3 Н, с) 1,27 (3 Н, с). Пример 3. Синтез -дунниона (соединение 3). 4,8 г (0,020 моль) 2-пренилокси-1,4-нафтохинона, очищенного согласно примеру 2, растворяли в ксилоле и кипятили раствор в течение 15 ч, тем самым проводя перегруппировку Кляйзена при значительно более высокой температуре и в течение более продолжительного времени по сравнению с примером 2. При этом способе проведения реакции совместно получали -дуннион, который подвергали циклизации, и производное лапакола, которое подвергалось перегруппировке Кляйзена и в котором происходил сдвиг одной или двух метильных групп. Ксилол удаляли отгонкой при пониженном давлении и очищали остаток хроматографией на силикагеле, получая 1,65 г чистого -дунниона. 1 Н ЯМР (CDCl3, ): 8,06 (1 Н, д, J=8 Гц), 7,64 (2 Н, м), 7,57 (1 Н, м), 3,21 (1 Н, кв., J=7 Гц), 1,53 (3 Н, с),1,51 (3 Н, с) 1,28 (3 Н, д, J=7 Гц). Пример 4. Синтез соединения 4. 17,4 г (0,10 моль) 2-гидрокси-1,4-нафтохинона растворяли в 120 мл ДМСО и к полученному раствору постепенно добавляли 0,88 г (0,11 моль) LiH. Эту операцию следует проводить с осторожностью из-за выделения водорода. Реакционную смесь перемешивали и после того, как дальнейшее выделение водорода прекращалось, дополнительно перемешивали еще 30 мин. Затем к реакционной смеси постепенно добавляли 14,8 г (0,11 моль) металлилбромида (1-бром-2-метилпропена) и 3,35 г (0,025 моль) LiH. Реакционную смесь нагревали до 45 С и затем энергично перемешивали при этой температуре в течение 12 ч. Реакционную смесь охлаждали до температуры ниже 10 С и добавляли вначале 80 г льда и затем 250 мл воды. После этого постепенно добавляли 25 мл концентрированной HCl для придания полученному раствору кислой реакции рН 1. К реакционной смеси добавляли 200 мл CH2Cl2 и производили энергичное встряхивание для разделения двух слоев. Водный слой экстрагировали еще раз добавлением 70 млCH2Cl2 и полученный экстракт объединяли с полученным ранее. Данные ТСХ подтвердили образование двух новых веществ, которые были использованы далее без какого-либо разделения. Органический слой концентрировали отгонкой при пониженном давлении, остаток вновь растворяли в ксилоле и затем кипятили в течение 8 ч. При этом кипячении два вещества, обнаруженные на ТСХ, превращались в одно, что- 17013214 позволяло получить относительно чистое производное лапакола. Полученное таким способом производное лапакола смешивали с 80 мл серной кислоты, смесь подвергали энергичному перемешиванию при комнатной температуре в течение 10 мин и для завершения реакции добавляли 200 г льда. В реакционную смесь добавляли 80 мл CH2Cl2 и полученную смесь энергично встряхивали. После этого слой CH2Cl2 отделяли и промывали 5% NaHCO3. Водный слой еще раз экстрагировали, используя 30 мл CH2Cl2, промывали 5% NaHCO3 и объединяли с предыдущей порцией экстракта. Органический слой высушивали над MgSO4 и концентрировали, получая загрязненное производное -лапакона (соединение 4). Полученное таким образом производное -лапакона перекристаллизовывали из изопропанола, получая в результате 12,21 г чистого соединения 4. 1 Н ЯМР (CDCl3, ): 8,08 (1 Н, д, J=8 Гц), 7,64 (2 Н, м), 7,57 (1 Н, м), 2,95 (2 Н, с), 1,61 (6 Н, с). Пример 5. Синтез соединения 5. Соединение 5 получали тем же способом, который применяли в примере 4, за исключением того,что вместо металлилбромида использовали аллилбромид. 1 Н ЯМР (CDCl3, ): 8,07 (1 Н, д, J=7 Гц), 7,65 (2 Н, м), 7,58 (1 Н, м), 5,27 (1 Н, м), 3,29 (1 Н, дд, J=10,15 Гц), 2,75 (1 Н, дд, J=7,15 Гц), 1,59 (3 Н, д, J=6 Гц). Пример 6. Синтез соединения 6. 5,08 г (40 мМ) 3-хлорпропионилхлорида растворяли в 20 мл эфира и охлаждали до -78 С. При этой температуре к полученному раствору при энергичном перемешивании постепенно добавляли 1,95 г(25 ммоль) пероксида натрия (Na2O2) и после добавления продолжали энергичное перемешивание в течение еще 30 мин. Поднимали температуру реакционной смеси до 0 С и добавляли к ней 7 г льда, после чего дополнительно перемешивали еще 10 мин. Органический слой отделяли, еще раз промывали 10 мл холодной воды при 0 С, затем водным раствором NaHCO3 при 0 С. Органический слой отделяли, высушивали над MgSO4, концентрировали при пониженном давлении и температуре ниже 0 С, получая в результате 3-хлорпероксипропионовую кислоту. 1,74 г (10 ммоль) 2-гидрокси-1,4-нафтохинона растворяли в 20 мл уксусной кислоты и постепенно добавляли к этому раствору предварительно полученную 3-хлорпероксипропионовую кислоту при комнатной температуре. Реакционную смесь кипятили с обратным холодильником при перемешивании в течение 2 ч, затем упаривали при пониженном давлении для удаления уксусной кислоты. Остаток растворяли в 20 мл CH2Cl2 и промывали 20 мл 5% NaHCO3. Водный слой еще раз экстрагировали 20 млCH2Cl2 и объединяли с ранее полученным экстрактом. Органический слой высушивали над MgSO4 и концентрировали, получая соединение 6 в смеси с 2-(2-хлорэтил)-3-гидрокси-1,4-нафтохиноном. Эту смесь очищали хроматографией на силикагеле, получая 0,172 г чистого производного лапакона (соединение 6). 1 Н ЯМР (CDCl3, ): 8,07 (1 Н, д, J=7,6 Гц), 7,56-7,68 (3 Н, м), 4,89 (2 Н, т, J=9,2 Гц), 3,17 (2 Н, т,J=9,2 Гц). Пример 7. Синтез соединения 7. 17,4 г (0,10 моль) 2-гидрокси-1,4-нафтохинона растворяли в 120 мл ДМСО и к этой смеси постепенно добавляли 0,88 г (0,11 моль) LiH. Эту операцию следует проводить с осторожностью из-за выделения водорода. Реакционную смесь перемешивали и после того, как дальнейшее выделение водорода прекращалось, дополнительно перемешивали еще 30 мин. Затем к реакционной смеси постепенно добавляли 19,7 г (0,10 моль) циннамилбромида (3-фенилаллилбромида) и 3,35 г (0,025 моль) LiH. Реакционную смесь нагревали до 45 С и затем энергично перемешивали при этой температуре в течение 12 ч. Реакционную смесь охлаждали до температуры ниже 10 С и добавляли вначале 80 г льда и затем 250 мл воды. После этого постепенно добавляли 25 мл концентрированной HCl для придания полученному раствору кислой реакции рН 1. Добавляли 200 мл CH2Cl2 для растворения продуктов реакции и производили энергичное встряхивание для разделения двух слоев. Водный слой отбрасывали, а слой CH2Cl2 обрабатывали 2 н. водным раствором NaOH (100 мл 2), дважды проводя разделение слоев. Полученный на этом этапе после экстракции 2 н. водным раствором NaOH слой CH2Cl2 использовали в примере 8. Полученные описанным способом водные растворы объединяли и подкисляли до рН 2, используя концентрированный раствор HCl, в результате чего образовывалось твердое вещество. Полученное твердое вещество отделяли фильтрованием, получая производное лапакола. Полученное описанным способом производное лапакола перекристаллизовывали из 75% EtOH. Очищенное производное лапакола смешивали с 50 мл серной кислоты, смесь энергично перемешивали при комнатной температуре в течение 10 мин и к ней добавляли 150 г льда для завершения реакции. Добавляли 60 мл CH2Cl2 и смесь энергично встряхивали. После этого слой CH2Cl2 отделяли и промывали 5% NaHCO3. Водный слой еще раз экстрагировали 30 мл CH2Cl2, промывали 5% NaHCO3 и объединяли с ранее полученным экстрактом. Экстракты концентрировали и очищали хроматографией на силикагеле, получая 2,31 г чистого соединения 7. 1- 18013214 Пример 8. Синтез соединения 8. Оставшийся в примере 7 после экстракции 2 н. водным раствором NaOH слой CH2Cl2 концентрировали отгонкой растворителя при пониженном давлении. Полученный концентрат растворяли в 30 мл ксилола, после чего кипятили с обратным холодильником в течение 10 ч для осуществления перегруппировки Кляйзена. Смесь концентрировали отгонкой ксилола при пониженном давлении и затем без дальнейшей очистки смешивали с 15 мл серной кислоты. Полученную смесь энергично перемешивали при комнатной температуре в течение 10 мин и добавляли к ней 100 г льда для завершения реакции. К реакционной смеси добавляли 50 мл CH2Cl2 и энергично встряхивали. После этого слой CH2Cl2 отделяли и промывали 5% NaHCO3. Водный слой еще раз экстрагировали 20 мл CH2Cl2, промывали 5% NaHCO3 и объединяли с ранее полученным экстрактом. Органический слой высушивали над MgSO4, концентрировали и очищали хроматографией на силикагеле, получая 1,26 г чистого соединения 8. 1 Н ЯМР (CDCl3, ): 8,12 (1 Н, дд, J=0,8, 8,0 Гц), 7,74 (1 Н, дд, J=1,2, 7,6 Гц), 7,70 (1 Н, дт, J=1,2,7,6 Гц), 7,62 (1 Н, дт, J=1,6, 7,6 Гц), 7,27 (3 Н, м), 7,10 (2 Н, тд, J=1,2, 6,4 Гц), 5,38 (1 Н, кв.д, J=6,4, 9,2 Гц),4,61 (1 Н, д, J=9,2 Гц), 1,17 (3 Н, д, J=6,4 Гц). Пример 9. Синтез соединения 9. 3,4 г (22 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ена и 1,26 г (15 ммоль) 2-метил-3-бутин-2-ола растворяли в 10 мл ацетонитрила и полученный раствор охлаждали до 0 С. К реакционной смеси при перемешивании постепенно добавляли 3,2 г (15 ммоль) ангидрида трифторуксусной кислоты, после чего смесь продолжали перемешивать при 0 С. В другой колбе в 10 мл ацетонитрила растворяли 1,74 г(10 ммоль) 2-гидрокси-1,4-нафтохинона и 135 мг (1,0 ммоль) хлорида меди (CuCl2) и перемешивали. Этот раствор, предварительно очищенный, постепенно добавляли к реакционной смеси, которую затем кипятили с обратным холодильником в течение 20 ч. Реакционную смесь концентрировали отгонкой растворителя при пониженном давлении и затем очищали хроматографией на силикагеле, получая 0,22 г чистого соединения 9. 1 Н ЯМР (CDCl3, ): 8,11 (1 Н, дд, J=1,2, 7,6 Гц), 7,73 (1 Н, дд, J=1,2, 7,6 Гц), 7,69 (1 Н, дт, J=1,2,7,6 Гц), 7,60 (1 Н, дт, J=1,6, 7,6 Гц), 4,95 (1 Н, д, J=3,2 Гц), 4,52 (1 Н, д, J=3,2 Гц), 1,56 (6 Н, с). Пример 10. Синтез соединения 10. 0,12 г соединения 9 растворяли в 5 мл МеОН, к раствору добавляли 10 мг 5% Pd/C, после чего энергично перемешивали при комнатной температуре в течение 3 ч. Раствор фильтровали через силикагель для удаления 5% Pd/C и концентрировали отгонкой растворителя при пониженном давлении, получая соединение 10. 1 Н ЯМР (CDCl3, ): 8,05 (1 Н, тд, J=1,2, 7,6 Гц), 7,64 (2 Н, м), 7,54 (1 Н, м), 3,48 (3 Н, с), 1,64 (3 Н, с),1,42 (3 Н, с), 1,29 (3 Н, с). Пример 11. Синтез соединения 11. 1,21 г (50 ммоль) -лапакона (соединение 1) и 1,14 г (50 ммоль) DDQ (2,3-дихлор-5,6-дициано-1,4 бензохинона) растворяли в 50 мл четыреххлористого углерода и кипятили в течение 72 ч. Реакционную смесь концентрировали отгонкой растворителя при пониженном давлении и затем очищали хроматографией на силикагеле, получая 1,18 г чистого соединения 11. 1 Н ЯМР (CDCl3, ): 8,08 (1 Н, дд, J=1,2, 7,6 Гц), 7,85 (1 Н, дд, J=0,8, 7,6 Гц), 7,68 (1 Н, дт, J=1,2,7,6 Гц), 7,55 (1 Н, дт, J=1,2, 7,6 Гц), 6,63 (1 Н, д, J=10,0 Гц), 5,56 (1 Н, д, J=10,0 Гц), 1,57 (6 Н, с). Пример 12. Синтез соединения 12. 1,74 г (10 ммоль) 2-гидрокси-1,4-нафтохинона, 3,4 г (50 ммоль) 2-метил-1,3-бутадиена (изопрена),3,0 г (100 ммоль) параформальдегида и 20 мл 1,4-диоксана помещали в сосуд для работы под давлением и нагревали при перемешивании при 100 С в течение 48 ч. Реакционный сосуд охлаждали до комнатной температуры и его содержимое фильтровали. Фильтрат концентрировали отгонкой летучих компонентов при пониженном давлении и затем очищали хроматографией на силикагеле, получая 238 мг соединения 12, т.е. 2-винильного производного -лапакона. 1 Н ЯМР (CDCl3, ): 8,07 (1 Н, дд, J=1,2, 7,6 Гц), 7,88 (1 Н, дд, J=0,8, 7,6 Гц), 7,66 (1 Н, дт, J=1,2,7,6 Гц), 7,52 (1 Н, дт, J=0,8, 7,6 Гц), 5,87 (1 Н, дд, J=10,8, 17,2 Гц), 5,18 (1 Н, д, J=10,8 Гц), 5,17 (1 Н,17,2 Гц), 2,62 (1 Н, м), 2,38 (1 Н, м), 2,17 (3 Н, с), 2,00 (1 Н, м), 1,84 (1 Н, м). Пример 13. Синтез соединения 13. 1,74 г (10 ммоль) 2-гидрокси-1,4-нафтохинона, 4,8 г (50 ммоль) 2,4-диметил-1,3-пентадиена и 3,0 г(100 ммоль) параформальдегида растворяли в 20 мл 1,4-диоксана и полученную смесь кипятили с обратным холодильником при энергичном перемешивании в течение 10 ч. Реакционный сосуд охлаждали до комнатной температуры и его содержимое фильтровали для удаления параформальдегида из твердых компонентов. Фильтрат концентрировали отгонкой летучих веществ при пониженном давлении и затем очищали хроматографией на силикагеле, получая 428 мг соединения 13, т.е. производного -лапакона. 1 Н ЯМР (CDCl3, ): 8,06 (1 Н, дд, J=1,2, 7,6 Гц), 7,83 (1 Н, дд, J=0,8, 7,6 Гц), 7,65 (1 Н, дт, J=1,2,7,6 Гц), 7,50 (1 Н, дт, J=0,8, 7,6 Гц), 5,22 (1 Н, ушир.с), 2,61 (1 Н, м), 2,48 (1 Н, м), 2,04 (1 Н, м), 1,80 (3 Н, д,J=1,0 Гц), 1,75 (1 Н, м), 1,72 (1 Н, д, J=1,0 Гц), 1,64 (3 Н, с).- 19013214 Пример 14. Синтез соединения 14. 5,3 г (30 ммоль) 2-гидрокси-1,4-нафтохинона, 20,4 г (150 ммоль) 2,6-диметил-2,4,6-октатриена и 9,0 г (300 ммоль) параформальдегида растворяли в 50 мл 1,4-диоксана и полученную смесь кипятили с обратным холодильником при энергичном перемешивании в течение 10 ч. Реакционный сосуд охлаждали до комнатной температуры и его содержимое фильтровали для удаления параформальдегида из твердых компонентов. Фильтрат концентрировали отгонкой летучих веществ при пониженном давлении и затем очищали хроматографией на силикагеле, получая 1,18 г соединения 14, т.е. производного-лапакона. 1 Н ЯМР (CDCl3, ): 8,07 (1 Н, дд, J=1,2, 7,6 Гц), 7,87 (1 Н, дд, J=0,8, 7,6 Гц), 7,66 (1 Н, дт, J=1,2,7,6 Гц), 7,51 (1 Н, дт, J=0,8, 7,6 Гц), 6,37 (1 Н, дд, J=11,2, 15,2 Гц), 5,80 (1 Н, ушир.д, J=11,2 Гц), 5,59 (1 Н, д,J=15,2 Гц), 2,67 (1 Н, дд, J=4,8, 17,2 Гц), 2,10 (1 Н, дд, J=6,0, 17,2 Гц), 1,97 (1 Н, м), 1,75 (3 Н, ушир.с),1,64 (3 Н, ушир.с), 1,63 (3 Н, с), 1,08 (3 Н, д, J=6,8 Гц). Пример 15. Синтез соединения 15. 5,3 г (30 ммоль) 2-гидрокси-1,4-нафтохинона, 20,4 г (50 ммоль) терпинена и 9,0 г (300 ммоль) параформальдегида растворяли в 50 мл 1,4-диоксана и полученную смесь кипятили с обратным холодильником при энергичном перемешивании в течение 10 ч. Реакционный сосуд охлаждали до комнатной температуры и его содержимое фильтровали для удаления параформальдегида из твердых компонентов. Фильтрат концентрировали отгонкой летучих веществ при пониженном давлении и затем очищали хроматографией на силикагеле, получая 1,12 г соединения 15, т.е. тетрациклического производного о-хинона. 1 Н ЯМР (CDCl3, ): 8,06 (1 Н, д, J=7,6 Гц), 7,85 (1 Н, д, J=7,6 Гц), 7,65 (1 Н, т, J=7,6 Гц), 7,51 (1 Н, т,J=7,6 Гц), 5,48 (1 Н, ушир.с), 4,60 (1 Н, ушир.с), 2,45 (1 Н, д, J=16,8 Гц), 2,21 (1 Н, м), 2,20 (1 Н, д, J=16,8 Гц), 2,09 (1 Н, м), 1,77 (1 Н, м), 1,57 (1 Н, м), 1,07 (3 Н, с), 1,03 (3 Н, д, J=0,8 Гц), 1,01 (3 Н, д, J=0,8 Гц),0,96 (1 Н, м). Пример 16. Синтез соединений 16 и 17. 17,4 г (0,10 моль) 2-гидрокси-1,4-нафтохинона растворяли в 120 мл ДМСО и к раствору постепенно добавляли 0,88 г (0,11 моль) LiH. Эту операцию следует проводить с осторожностью из-за выделения водорода. Реакционную смесь перемешивали и после того, как дальнейшее выделение водорода прекращалось, дополнительно перемешивали еще 30 мин. Затем к реакционной смеси постепенно добавляли 16,3 г (0,12 моль) кротилбромида и 3,35 г (0,025 моль) LiH. Реакционную смесь нагревали до 45 С и затем энергично перемешивали при этой температуре в течение 12 ч. Реакционную смесь охлаждали до температуры ниже 10 С и добавляли вначале 80 г льда и затем 250 мл воды. После этого постепенно добавляли 25 мл концентрированной HCl для придания полученному раствору кислой реакции рН 1. Добавляли 200 мл СН 2 С 12 для растворения продуктов реакции и энергично встряхивали для разделения двух слоев. Водный слой отбрасывали, а слой CH2Cl2 обрабатывали 2 н. водным раствором NaOH(100 мл 2), дважды проводя разделение слоев. Полученный на этом этапе после экстракции 2 н. водным раствором NaOH слой CH2Cl2 использовали в примере 17. Полученные описанным способом водные растворы объединяли и подкисляли до рН 2, используя концентрированный раствор HCl, в результате чего образовывалось твердое вещество. Полученное твердое вещество отделяли фильтрованием, получая производное лапакола. Полученное описанным способом производное лапакола перекристаллизовывали из 75% EtOH. Очищенное производное лапакола смешивали с 50 мл серной кислоты, смесь энергично перемешивали при комнатной температуре в течение 10 мин, после чего к ней добавляли 150 г льда для завершения реакции. Добавляли 60 мл CH2Cl2, и смесь энергично встряхивали. После этого слой CH2Cl2 отделяли и промывали 5% NaHCO3. Водный слой еще раз экстрагировали 30 мл СН 2 С 12, промывали 5%NaHCO3 и объединяли с ранее полученным экстрактом. Органический слой концентрировали и очищали хроматографией на силикагеле, получая 1,78 и 0,43 г чистых соединений 16 и 17 соответственно. 1 Н ЯМР (CDCl3, ) соединения 16:8,07 (1 Н, дд, J=0,8, 6,8 Гц), 7,64 (2 Н, ушир.д, J=3,6 Гц), 7,57(1 Н, м), 5,17 (1 Н, кв.д, J=6,0, 8,8 Гц), 3,53 (1 Н, кв.д, J=6,8, 8,8 Гц), 1,54 (3 Н, д, 6,8 Гц), 1,23 (3 Н, д, 6,8 Гц). 1 Н ЯМР (CDCl3, ) соединения 17:8,06 (1 Н, д, J=0,8, 7,2 Гц), 7,65 (2 Н, ушир.д, J=3,6 Гц), 7,57 (1 Н,м), 4,71 (1 Н, квинтет, J=6,4 Гц), 3,16 (1 Н, квинтет, J=6,4 Гц), 1,54 (3 Н, д, 6,4 Гц), 1,38 (3 Н, д, 6,4 Гц). Пример 17. Синтез соединений 18 и 19. Оставшийся в примере 16 после экстракции 2 н. водным раствором NaOH слой CH2Cl2 концентрировали отгонкой растворителя при пониженном давлении. Полученный концентрат растворяли в 30 мл ксилола, после чего кипятили с обратным холодильником в течение 10 ч для осуществления перегруппировки Кляйзена. Смесь концентрировали отгонкой ксилола при пониженном давлении и затем без дальнейшей очистки смешивали с 15 мл серной кислоты. Полученную смесь энергично перемешивали при комнатной температуре в течение 10 мин и добавляли к ней 100 г льда для завершения реакции. К реакционной смеси добавляли 50 мл CH2Cl2 и энергично встряхивали. После этого слой CH2Cl2 отделяли и промывали 5% NaHCO3. Водный слой еще раз экстрагировали 20 мл CH2Cl2, промывали 5% NaHCO3 и объединяли с ранее полученным экстрактом. Органический слой высушивали над MgSO4, концентрировали и очищали хроматографией на силикагеле, получая 0,62 и 0,43 г чистых соединений 18 и 19 соот- 20013214 ветственно. 1 Н ЯМР (CDCl3, ) соединения 18: 8,06 (1 Н, дд, J=0,8, 7,2 Гц), 7,81 (1 Н, дд, J=0,8, 7,6 Гц), 7,65 (1 Н,дт, J=0,8, 7,6 Гц), 7,51 (1 Н, дт, J=0,8, 7,2 Гц), 4,40 (1 Н, м), 2,71 (1 Н, м), 2,46 (1 Н, м), 2,11 (1 Н, м), 1,71 (1 Н,м), 1,54 (3 Н, д, 6,4 Гц), 1,52 (1 Н, м). 1 Н ЯМР (CDCl3, ) соединения 19: 8,08 (1 Н, д, J=0,8, 7,2 Гц), 7,66 (2 Н, ушир.д, J=4,0 Гц), 7,58 (1 Н,м), 5,08 (1 Н, м), 3,23 (1 Н, дд, J=9,6, 15,2 Гц), 2,80 (1 Н, дд, J=7,2, 15,2 Гц), 1,92 (1 Н, м), 1,82 (1 Н, м), 1,09(3 Н, т, 7,6 Гц). Пример 18. Синтез соединения 20. 17,4 г (0,10 моль) 2-гидрокси-1,4-нафтохинона растворяли в 120 мл ДМСО и к раствору постепенно добавляли 0,88 г (0,11 моль) LiH. Эту операцию следует проводить с осторожностью из-за выделения водорода. Реакционную смесь перемешивали и после того, как дальнейшее выделение водорода прекращалось, дополнительно перемешивали еще 30 мин. Затем к реакционной смеси постепенно добавляли 21,8 г (0,10 моль) геранилбромида и 3,35 г (0,025 моль) LiH. Реакционную смесь нагревали до 45 С и затем энергично перемешивали при этой температуре в течение 12 ч. Реакционную смесь охлаждали до температуры ниже 10 С, и добавляли вначале 80 г льда и затем 250 мл воды. После этого постепенно добавляли 25 мл концентрированной HCl для придания полученному раствору кислой реакции рН 1. Добавляли 200 мл CH2Cl2 для растворения продуктов реакции и производили энергичное встряхивание для разделения двух слоев. Водный слой отбрасывали, а слой CH2Cl2 обрабатывали 2 н. водным раствором NaOH (100 мл 2), дважды проводя разделение слоев. Полученные описанным способом водные растворы объединяли и подкисляли до рН 2, используя концентрированный раствор HCl, в результате чего образовывалось твердое вещество. Полученное твердое вещество отделяли фильтрованием, получая 2-геранил-3-гидрокси-1,4-нафтохинон. Полученный описанным способом продукт без дополнительной очистки смешивали с 50 мл серной кислоты, смесь энергично перемешивали при комнатной температуре в течение 10 мин, после чего к ней добавляли 150 г льда для завершения реакции. Добавляли 60 млCH2Cl2, и смесь энергично встряхивали. После этого слой CH2Cl2 отделяли и промывали 5% NaHCO3. Водный слой еще раз экстрагировали 30 мл CH2Cl2, промывали 5% NaHCO3 и объединяли с ранее полученным экстрактом. Органический слой концентрировали и очищали хроматографией на силикагеле,получая 3,62 г чистого соединения 20. 1 Н ЯМР (CDCl3, ): 8,05 (1 Н, д, J=7,6 Гц), 7,77 (1 Н, д, J=7,6 Гц), 7,63 (1 Н, т, J=7,6 Гц), 7,49 (1 Н, т,J=7,6 Гц), 2,71 (1 Н, дд, J=6,0, 17,2 Гц), 2,19 (1 Н, дд, J=12,8, 17,2 Гц), 2,13 (1 Н, м), 1,73 (2 Н, м), 1,63 (1 Н,дд, J=6,0, 12,8 Гц), 1,59 (1 Н, м), 1,57 (1 Н, м), 1,52 (1 Н, м), 1,33 (3 Н, с), 1,04 (3 Н, с), 0,93 (3 Н, с). Пример 19. Синтез соединения 21. Соединение 21 получали тем же способом, что и в примере 1, за исключением того, что вместо 2-гидрокси-1,4-нафтохинона использовали 6-хлор-2-гидрокси-1,4-нафтохинон. 1 Н ЯМР (CDCl3, ): 8,02 (1 Н, д, J=8 Гц), 7,77 (1 Н, д, J=2 Гц), 7,50 (1 Н, дд, J=2,8 Гц), 2,60 (2 Н, т,J=7 Гц), 1,87 (2 Н, т, J=7 Гц) 1,53 (6 Н, с). Пример 20. Синтез соединения 22. Соединение 22 получали тем же способом, что и в примере 1, за исключением того, что вместо 2-гидрокси-1,4-нафтохинона использовали 2-гидрокси-6-метил-1,4-нафтохинон. 1 Н ЯМР (CDCl3, ): 7,98 (1 Н, д, J=8 Гц), 7,61 (1 Н, д, J=2 Гц), 7,31 (1 Н, дд, J=2,8 Гц), 2,58 (2 Н, т,J=7 Гц), 1,84 (2 Н, т, J=7 Гц) 1,48 (6 Н, с). Пример 21. Синтез соединения 23. Соединение 23 получали тем же способом, что и в примере 1, за исключением того, что вместо 2-гидрокси-1,4-нафтохинона использовали 6,7-диметокси-2-гидрокси-1,4-нафтохинон. 1 Н ЯМР (CDCl3, ): 7,56 (1 Н, с), 7,25 (1 Н, с), 3,98 (6 Н, с), 2,53 (2 Н, т, J=7 Гц), 1,83 (2 Н, т, J=7 Гц),1,48 (6 Н, с). Пример 22. Синтез соединения 24. Соединение 24 получали тем же способом, что и в примере 1, за исключением того, что вместо 1-бром-3-метил-2-бутена использовали 1-бром-3-метил-2-пентен. 1 Н ЯМР (CDCl3, ): 7,30-8,15 (4 Н, м), 2,55 (2 Н, т, J=7 Гц), 1,83 (2 Н, т, J=7 Гц), 1,80 (2 Н, кв., 7 Гц) 1,40 (3 Н, с), 1,03 (3 Н, т, J=7 Гц). Пример 23. Синтез соединения 25. Соединение 25 получали тем же способом, что и в примере 1, за исключением того, что вместо 1-бром-3-метил-2-бутена использовали 1-бром-3-этил-2-пентен. 1 Н ЯМР (CDCl3, ): 7,30-8,15 (4 Н, м), 2,53 (2 Н, т, J=7 Гц), 1,83 (2 Н, т, J=7 Гц), 1,80 (4 Н, кв., 7 Гц) 0,97 (6 Н, т, J=7 Гц). Пример 24. Синтез соединения 26. Соединение 26 получали тем же способом, что и в примере 1, за исключением того, что вместо 1-бром-3-метил-2-бутена использовали 1-бром-3-фенил-2-бутен. 1 Н ЯМР (CDCl3, ): 7,15-8,15 (9 Н, м), 1,90-2,75 (4 Н, м), 1,77 (3 Н, с).- 21013214 Пример 25. Синтез соединения 27. Соединение 27 получали тем же способом, что и в примере 1, за исключением того, что вместо 1-бром-3-метил-2-бутена использовали 2-бромэтилиденциклогексан. 1H ЯМР (CDCl3, ): 7,30-8,25 (4 Н, м), 2,59 (2 Н, т, J=7 Гц), 1,35-2,15 (12 Н, м). Пример 26. Синтез соединения 28. Соединение 28 получали тем же способом, что и в примере 1, за исключением того, что вместо 1-бром-3-метил-2-бутена использовали 2-бромэтилиденциклопентан. 1 Н ЯМР (CDCl3, ): 7,28-8,20 (4 Н, м), 2,59 (2 Н, т, J=7 Гц), 1,40-2,20 (10 Н, м). Пример 27. Синтез соединения 29. 8,58 г (20 ммоль) соединения 5, полученного в примере 5, растворяли в 1000 мл четыреххлористого углерода, после чего добавляли 11,4 г (50 ммоль) 2,3-дихлор-5,6-дициано-1,4-бензохинона и полученную смесь кипятили с обратным холодильником в течение 96 ч. Реакционную смесь концентрировали отгонкой растворителя при пониженном давлении и затем перекристаллизовывали полученное красное твердое вещество из изопропанола, получая 7,18 г чистого соединения 29. 1 Н ЯМР (CDCl3, ): 8,05 (1 Н, дд, J=1,2, 7,6 Гц), 7,66 (1 Н, дд, J=1,2, 7,6 Гц), 7,62 (1 Н, дт, J=1,2,7,6 Гц), 7,42 (1 Н, дт, J=1,2, 7,6 Гц), 6,45 (1 Н, кв., J=1,2 Гц), 2,43 (3 Н, д, J=1,2 Гц). Пример 28. Синтез соединения 30. Аналогично способу синтеза, опубликованному в J. Org. Chem., 55 (1990), 4995-5008, 4,5-дигидро 3-метилбензо[1,2-b]фуран-4,5-дионбензофуран-4,5-дион синтезировали с использованием п-бензохинона и 1-(N-морфолин)пропена. 1,5 г (9,3 ммоль) полученного таким способом бензофуран-4,5-диона и 3,15 г (28,2 ммоль) 1-ацетокси-1,3-бутадиена растворяли в 200 мл бензола и полученную смесь кипятили с обратным холодильником в течение 12 ч. Полученный раствор охлаждали до комнатной температуры и концентрировали отгонкой при пониженном давлении. Затем проводили хроматографию на силикагеле,получая 1,13 г чистого соединения 30. 1 Н ЯМР (CDCl3, ): 8,05 (1 Н, дд, J=1,2, 7,6 Гц), 7,68 (1 Н, дд, J=1,2, 7,6 Гц), 7,64 (1 Н, тд, J=1,2,7,6 Гц), 7,43 (1 Н, тд, J=1,2, 7,6 Гц), 7,26 (1 Н, кв., J=1,2 Гц), 2,28 (3 Н, д, J=1,2 Гц). Пример 29. Синтез соединений 31 и 32. 1,5 г (9,3 ммоль) 4,5-дигидро-3-метилбензо[1,2-b]фуран-4,5-дионабензофуран-4,5-диона и 45 г(0,6 моль) 2-метил-1,3-бутадиена растворяли в 200 мл бензола и полученную смесь кипятили с обратным холодильником в течение 5 ч. Полученный раствор охлаждали до комнатной температуры и концентрировали, полностью отгоняя растворитель при пониженном давлении. Полученный таким способом концентрат вновь растворяли в 150 мл четыреххлористого углерода, затем добавляли 2,3 г (10 ммоль) 2,3-дихлор-5,6-дициано-1,4-бензохинона и полученную смесь кипятили с обратным холодильником еще 15 ч. Реакционную смесь охлаждали и концентрировали отгонкой растворителя при пониженном давлении. Полученный концентрат очищали хроматографией на силикагеле, получая 0,13 г и 0,11 г чистых соединений 31 и 32 соответственно. 1 Н ЯМР (CDCl3, ) соединения 31: 7,86 (1 Н, с), 7,57 (1 Н, д, J=8,1 Гц), 7,42 (1 Н, д, J=8,1 Гц), 7,21 (1 Н,кв., J=1,2 Гц), 2,40 (3 Н, с), 2,28 (1 Н, д, J=1,2 Гц). 1 Н ЯМР (CDCl3, ) соединения 32: 7,96 (1 Н, д, J=8,0 Гц), 7,48 (1 Н, с), 7,23 (2 Н, м), 2,46 (3 Н, с), 2,28(1 Н, д, J=1,2 Гц). Экспериментальный пример 1. Определение активации AMPK. Миобласты, а именно С 2 С 12, культивировали в DMEM, содержащей 10% телячьей сыворотки. Когда плотность клеток достигала диапазона примерно от 85 до 90%, культуральную среду заменяли средой, содержащей 1% телячьей сыворотки, чтобы вызвать дифференцировку клеток. Подвергшиеся дифференцировке таким способом миобласты обрабатывали образцами соединений, полученных в примерах 1-29, в концентрации 5 мкг/мл и сравнивали с контрольной группой. Ферментную активность AMPK определяли следующим образом. Во-первых, клетки С 2 С 12 подвергали лизису для получения экстракта белков и затем добавляли сульфат аммония до конечной концентрации 30%, тем самым осаждая белки. Осадок белков растворяли в буфере (62,5 мМ Hepes, рН 7,2, 62,5 мМ NaCl, 62,5 мМ NaF, 1,25 мМ пирофосфат Na, 1,25 мМ EDTA, 1 мМ DTT, 0,1 мМ PMSF и 200 мкМ AMP). После этого в полученную смесь добавляли 200 мкМ пептид SAMS (HMRSAMSGLHLVKRR: подчеркнутый остаток серина является сайтом фосфорилирования, аналогичным сайту фосфорилирования в молекуле ацетил-КоА-карбоксилазы при действии AMPK) и [-32 Р]АТФ и давали пройти реакции в течение 10 мин при 30 С. После этого осуществляли нанесение пятна полученного раствора на фосфоцеллюлозную бумагу р 81. Бумагу р 81 промывали 3% раствором фосфорной кислоты и измеряли ее радиоактивность. Кроме того, для каждого соединения проводили реакцию без участия пептида SAMS и полученные исходные величины вычитали из значений, полученных описанным выше путем. Полученные в результате проведенных экспериментов результаты показаны в табл. 2. Как можно видеть из табл. 2, обработка миобластов, а именно клеток С 2 С 12, соединениями по настоящему изобретению ведет к увеличению ферментной активности AMPK. Экспериментальный пример 2. Эффект потери массы тела у страдающих ожирением мышей (ob/ob). Самцов мышей C57BL/6J1 Lep ob/Lep ob в возрасте 10 недель, имеющих характеристики ожирения и предрасположенность к нему, приобретали у Daehan Biolink Co., Ltd. (Chungchongbuk-do, Korea). Животных выращивали в помещении для разведения, в котором поддерживали температуру 23 С, влажность 55%, освещенность 300-500 лк, 12 ч цикл свет/темнота (L/D) и осуществляли вентиляцию 10-18 раз/ч. Животных без ограничения кормили гранулами корма Purina Rodent Laboratory Chow 5001(купленного у Purina Mills Inc., St. Louis, MO, USA) в качестве твердой пищи для лабораторных животных и в качестве питьевой воды использовали водопроводную воду. Мышам давали приспособиться к новой обстановке в комнате для разведения в течение двух недель и затем вводили ряд производных пиран-о-нафтохинона и фуран-о-нафтохинона, синтезированных по настоящему изобретению в дозировке 100 мг/кг в течение 26 дней. Осуществляли наблюдение за изменением массы тела, содержанием глюкозы в крови и потреблением пищи во время введения препаратов. После завершения введения проводили компьютерную томографию (СТ) для выявления изменений в распределении жировой ткани животных,изменений в распределении жира в тканях различных органов, изменений размеров адипоцитов, а также изменений уровней глюкозы, липидов и ферментов в крови и печени. Приведенная ниже табл. 3 показывает результаты изменений массы тела мышей C57BL/6J1 Lepob/Lep ob, которым вводили некоторые соединения по настоящему изобретению, по завершении периода введения препаратов. Как можно видеть из приведенной выше табл. 3, введение соединений по настоящему изобретению ведет к значительному уменьшению массы тела по сравнению с контрольной группой. На фиг. 1-3 показано распределение жира, выраженное в численных значениях для соответствующих органов мышей C57BL/6J1 Lep ob/Lep ob, которым вводили соединения, приведенные в табл. 3. Как можно видеть из графиков фиг. 1-3, экспериментальные группы, которым вводили соединения по настоящему изобретению, продемонстрировали значительное уменьшение содержания жира в тканях всех органов и, кроме того, продемонстрировали увеличение содержания бурого жира по сравнению с контрольной группой, что указывает на значительное увеличение метаболизма жира. Приведенная ниже табл. 4 показывает изменения уровней липидов и глюкозы в крови мышейC57BL/6J1 Lep ob/Lep ob, которым вводили соединения по настоящему изобретению. Таблица 4 Как можно видеть из приведенной выше табл. 4, группы, которым вводили соединения по настоящему изобретению, демонстрировали значительное снижение уровней триглицеридов, холестерина и глюкозы в крови по сравнению с контрольной группой. Экспериментальный пример 3. Регулирование фосфорилирования AMPK и АСС -лапаконом. Эксперименты данного примера осуществляли для подтверждения влияния -лапакона (соединение 1) на фосфорилирование AMPK и АСС, которые представляют собой внутриклеточные белки, регулирующие энергию. Для исследования влияния -лапакона на фосфорилирование AMP киназы и АСС (ацетил-КоА карбоксилазы), клетки HepG2 (линия клеток гепатоцеллюлярной карциномы печени человека) высевали в 6-луночный планшет при плотности 1105 клеток на лунку и культивировали в среде RPMI+10%FBS. После культивирования этих клеток в течение 24 ч культуральную среду заменяли средой RPMI, не содержащей сыворотки, и обрабатывали клетки -лапаконом (10 мкМ) в течение 30 мин, 1, 2, 4 и 6 ч соответственно, а также ДМСО (контроль). Для наблюдения фосфорилированной АСС применяли anti-ACC иanti-pS79-ACC, тогда как для наблюдения фосфорилированной AMP киназы применяли, соответственно,anti-AMPK и anti-pT172-AMPK. Как показано на фиг. 4, при действии -лапакона фосфорилированиеAMP киназы могло наблюдаться со времени начала эксперимента (30 мин), причем можно подтвердить,что такое влияние на фосфорилирование продолжалось до 6 ч. Кроме того, может быть подтверждено,что АСС, которая, как известно, является целевым белком AMP киназы, также подвергалась фосфорилированию. Эти результаты показывают, что активация AMPK под действием -лапакона может подавлять активность ацетил-КоА карбоксилазы, которая является ключевым регуляторным ферментом липогенеза.- 24013214 Экспериментальный пример 4. Влияние -лапакона на фосфорилирование эндотелиальной синтазы оксида азота (eNOS). Хорошо известно, что активация AMPK активирует NRF-1 и облегчает биогенез митохондрий. Кроме того, NO/cGMP активирует PGC-1a и NRF-1, содействуя биогенезу митохондрий. Для выяснения,способен ли -лапакон, который активирует AMPK, влиять на выработку оксида азота (NO), определяли уровень фосфорилирования, включая активность эндотелиальной синтазы оксида азота (eNOS). Для исследования фосфорилирования eNOS под действием -лапакона высевали эндотелиальные клетки пупочной вены человека (HUVEC) на 60-мм планшет с плотностью 1105 клеток и культивировали в средеEBM2+5%FBS в течение 24 ч. Культуральную среду заменяли средой ЕВМ 2, не содержащей сыворотки,и обрабатывали клетки -лапаконом (10 мМ) в течение предварительно определенного периода времени. Наблюдали фосфорилирование eNOS, используя Anti-pS1177 eNOS. Как показано на фиг. 5, фосфорилирование eNOS достигает максимума через 30 мин после обработки -лапаконом и затем постепенно уменьшается, так что через 2 ч уже не наблюдается. Увеличение фосфорилирования eNOS под действием -лапакона дает возможность терапевтического применения в случае ишемической болезни сердца и митохондриальной миопатии, а также в случае заболеваний, связанных с нарушением деятельности митохондрий (например, дегенеративных заболеваний мозга, диабета, кардиомиопатии, заболеваний, связанных со старением). Экспериментальный пример 5. Влияние -лапакона на активацию AMPK у мышей C57BL/6. Фиг. 6 показывает, что -лапакон активирует AMPK у мышей C57BL/6. Носитель и -лапакон в количестве 5 мг/кг вводили мышам C57BL/6 через хвостовую вену в течение 2 и 4 ч соответственно. Удаляли печеночные и гонадные жировые ткани и исследовали активность AMPK киназы. Степень активации выражали в величинах СРМ (отсчетов в минуту) радиоактивных изотопов. Применяя аналогичный способ, обрабатывали клетки HepG2, т.е. линию клеток, полученных из печени человека, 10 мМ-лапаконом в течение 30 мин, и затем проводили исследование активности AMPK киназы. Как можно видеть из результатов, показанных на фиг. 12, введение -лапакона ведет к увеличению активностиAMPK в жировых тканях печени и гонад, а также в гепатоцитах. Экспериментальный пример 6. Влияние -лапакона на фосфорилирование AMPK и АСС у мышейC57BL/6. Для исследования действия -лапакона против ожирения -лапакон ежедневно пероральным путем вводили мышам с ожирением, вызванным рационом питания (мышам с DIO), в дозировке 50 мг/кг и исследовали влияние -лапакона на фосфорилирование AMPK и АСС, которое играет важную роль в энергетическом метаболизме и липогенезе в печеночных и гонадных жировых тканях. Как показано на фиг. 13, с помощью Вестерн-блоттинга удалось подтвердить, что -лапакон оказывает влияние на фосфорилирование AMPK и АСС в гонадной и печеночной тканях мышей C57BL/6. Полагают, что фосфорилированная AMPK активирует метаболизм, связанный с энергией. В то же время считается, что АСС,на которую влияет активация AMPK, подвергается фосфорилированию, после чего ее липогенная активность ингибируется, что оказывает определенное влияние на метаболизм жиров, включая сдерживание ожирения. Экспериментальный пример 7. Влияние -лапакона на экспрессию генов, вовлеченных в метаболизм жиров, у мышей C57BL/6. Для исследования действия -лапакона против ожирения -лапакон ежедневно пероральным путем вводили мышам с ожирением, вызванным рационом питания (мышам с DIO), в дозировке 50 мг/кг и предпринимали попытку определения уровней мРНК ацетил КоА карбоксилазы (АСС) 1 (7,8), АСС 2 (9),синтазы жирных кислот (FAS) (10, 11), липопротеин липазы (LPL) (12-15) и стеароил-КоА десатуразы 1(SCD1) (16,17), которые участвуют в метаболизме липидов в жировой ткани печени и гонад, с помощью количественной PCR (полимеразной цепной реакции) в реальном времени. Перечисленные ферменты являются очень важными для метаболизма липидов; известно, что АСС катализирует образование малонил КоА из ацетил КоА, FAS катализирует образование пальмитата из малонил КоА и SCD1 катализирует образование мононенасыщенных жиров, играя тем самым решающую роль в образовании триацилглицерина, т.е. основного ресурса энергии. Сами по себе эти ферменты тесно связаны с ожирением, диабетом и заболеваниями, связанными с метаболизмом липидов. Как показано на фиг. 8, уровни экспрессии мРНК АСС 1 и 2, FAS, LPL и SCD1 в экспериментальной группе, которой вводили -лапакон, значительно снижены по сравнению с контрольной группой, и уровни мРНК LPL в экспериментальной группе в два раза выше по сравнению с контрольной группой. Следовательно, на основании результатов, относящихся к описанной повышенной или сниженной экспрессии генов упомянутых выше ферментов, можно сделать вывод, что -лапакон будет терапевтически эффективен для лечения метаболических синдромов. Экспериментальный пример 8. Влияние -лапакона на экспрессию генов белков, вовлеченных в метаболизм глюкозы, у мышей C57BL/6.-Лапакон ежедневно пероральным путем вводили мышам с ожирением, вызванным рационом питания (DIO) в дозировке 50 мг/кг, и измеряли уровни мРНК гексокиназы 2 (НК 2) (21,22), транспортеров- 25013214 глюкозы (GLUT 2) и (GLUT 4) (18,19,20) в жировых тканях печени и гонад с помощью количественнойPCR (полимеразной цепной реакции) в реальном времени. GLUT хорошо известен в качестве белка, который опосредует внутриклеточное поглощение и расходование глюкозы крови, в таких органах, как печень, в адипоцитах и миобластах, в то время как НК 2, т.е. фермент, относящийся к классу глюкокиназ,фосфорилирует белки, которым, таким образом, предоставляется возможность принять участие в гликолитическом пути. Как можно видеть из результатов, изображенных на фиг. 9, уровни мРНК НК 2 уменьшаются по сравнению с контрольной группой, тогда как уровни мРНК GLUT2 и GLUT4, т.е. двух ферментов, вовлеченных в перенос глюкозы, указывают на значительный рост экспрессии. Повышение уровней GLUT2 и GLUT4 облегчает внутриклеточное поглощение глюкозы крови, тем самым давая возможность применения -лапакона в качестве антидиабетического лекарственного средства. Экспериментальный пример 9. Влияние -лапакона на экспрессию генов белков, вовлеченных в биогенез митохондрий, у мышей C57BL/6.-Лапакон ежедневно пероральным путем вводили мышам с ожирением, вызванным рационом питания (DIO), в дозировке 50 мг/кг и измеряли уровни мРНК коактиватора альфа 1-рецептора, активируемого пролифератором пероксисом (PGC1) (23, 24), ядерного респираторного фактора 1 (NRF1) (25-27),фактора транскрипции митохондрий (mtTFA) (25-27) и цитохром с оксидазы (СОХ) 4 и 7 (28, 29) в жировых тканях печени и гонад с помощью количественной реакции PCR в реальном времени. Белки, показанные на фиг. 10, являются типичными представителями ферментов, ответственных за регуляцию биогенеза митохондрий, которые играют решающую роль в биосинтезе энергии в клетках, и, кроме того,известно, что они вовлечены в регуляцию различных биологических процессов. Хотя существуют незначительные отличия в количествах мРНК, соответствующих указанным ферментам, группа, которой вводили -лапакон, продемонстрировала более высокие уровни мРНК для всех ферментов по сравнению с контрольной группой. Поскольку сообщалось об аномальной активности митохондрий при ряде метаболических синдромов, эти результаты показывают возможность того, что -лапакон может быть терапевтическим средством для лечения метаболических синдромов, заболеваний, связанных с нарушением деятельности митохондрий, и заболеваний, связанных с энергетическим метаболизмом, за счет улучшения указанного явления. Экспериментальный пример 10. Влияние -лапакона на экспрессию генов, вовлеченных в энергетический метаболизм, у мышей C57BL/6.-Лапакон ежедневно пероральным путем вводили мышам с ожирением, вызванным рационом питания (DIO), в дозировке 50 мг/кг, и измеряли уровни транскриптов генов, вовлеченных в энергетический метаболизм, в жировых тканях печени и гонад, используя количественную реакцию PCR в реальном времени. Исследованные ферменты показаны на фиг. 11, где PPAR альфа и гамма являются ферментами, ответственными за транскрипционную регуляцию ферментов, вовлеченных в расходование энергии (30, 31), AMPK играет ключевую роль в поддержании гомеостаза клеточной энергии за счет чувствительности к внутриклеточному соотношению АМФ/АТФ, и АОХ катализирует активацию окислительного фосфорилирования путем окисления ацил КоА, который присутствует на определенной стадии процесса метаболизма липидов (32, 33). Кроме того, СРТ 1 также является ферментом, вовлеченным в энергетический метаболизм, и он хорошо известен в качестве фермента, который делает возможным прохождение в митохондрию ацил КоА с длинной цепью, не принимая участия в пути синтеза триацилглицерина (34, 35). В группе, которой вводили -лапакон, не менялись уровни мРНК рецептора, активируемого пролифератором пероксисом (PRAR) альфа, тогда как для PRAR гамма было продемонстрировано почти двукратное увеличение уровней соответствующей мРНК. Кроме того, даже хотя и имелись определенные различия в уровнях мРНК между ацил КоА оксидазой (АОХ), АМР-активированной протеин киназой (AMPK) альфа 1 и 2 и карнитинпальмитоил трансферазой 1, группа, которой вводили -лапакон,продемонстрировала возросшие уровни мРНК указанных ферментов по сравнению с контрольной группой. Повышенные уровни экспрессии таких генов указывают на возможность того, что -лапакон может являться терапевтическим средством для лечения заболеваний, связанных с энергетическим метаболизмом. Экспериментальный пример 11. Влияние -лапакона на экспрессию SIRT-связанных транскриптов у мышей C57BL/6.-Лапакон ежедневно пероральным путем вводили мышам с ожирением, вызванным рационом питания (DIO), в дозировке 50 мг/кг, и измеряли уровни транскриптов генов сиртуина (SIRT) (36, 37) в жировой ткани гонад в дни 7, 28 и 56 с момента введения соответственно, используя количественную реакцию PCR в реальном времени. Что касается SIRT-связанных транскриптов, показанных на фиг. 12, у человека известно 7 видов транскриптов. В частности, SIRT1 хорошо известен как фермент, имеющий отношение к долгожительству, и также сообщалось, что уровень SIRT1 значительно увеличивается при ограниченном поступлении энергии (37). Как можно видеть из фиг. 18, уровни SIRT1, SIRT3 и SIRT6 значительно увеличились, тогда как в отношении SIRT2, SIRT5 и SIRT7 не было выявлено какой-либо заметной разницы между экспериментальной и контрольной группами. Экспериментальный пример 12. Влияние -лапакона на экспрессию транскриптов генов UCP1 и-Лапакон ежедневно пероральным путем вводили мышам с ожирением, вызванным рационом питания (DIO), в дозировке 50 мг/кг и измеряли уровни транскриптов генов разобщающих белков 1 и 2(UCP 1 и 2) в жировых тканях печени и гонад, используя количественную реакцию PCR в реальном времени. UCP 1 и 2 представляют собой ферменты, которые осуществляют расходование энергии путем выработки тепла, и сообщалось, что функция этих ферментов заключается в потреблении энергии, которое не включает выработку реакционноспособных разновидностей кислорода (ROS), и, кроме того, они тесно связаны с частотой появления ожирения (38, 39). Как показано на фиг. 13, введение -лапакона вело к значительному увеличению уровней мРНК UCP 1 и 2. Эти результаты показывают возможность применения -лапакона в качестве безопасного терапевтического средства для лечения метаболических синдромов за счет уменьшения стресса, вызванного ROS, которые дополнительно вырабатываются в процессе генерации энергии. Экспериментальный пример 13. Влияние введения -лапакона на изменение массы тела и поглощение пищи с течением времени у мышей C57BL/6 с ожирением, вызванным рационом питания (DIP). На фиг. 14 показаны изменения соотношения поглощенная пища/масса тела и изменение массы тела в течение 56 дней в результате ежедневного введения -лапакона пероральным путем мышам с ожирением, вызванным рационом питания (DIO), в дозировке 50 мг/кг. Группа, которой вводили -лапакон,продемонстрировала уменьшение количества потребляемой пищи в течение первых двух недель, а затем уровень потребления пищи восстановился до значения, близкого к значению для контрольной группы. Считается, что результаты и должны быть такими в случае облегчения разложения жиров и, следовательно, выработки значительных количеств энергии. Кроме того, даже хотя мышей и кормили пищей с высоким содержанием жира, животные демонстрировали непрерывное уменьшение массы тела в течение 56 дней по сравнению с контрольной группой. Фиг. 15 представляет собой график, на котором сравниваются изменения массы различных органов в группе, которой вводили препарат и в контрольной группе после введения -лапакона мышам C57BL/6 с DIO в течение 56 дней; как показано на фиг. 15, наблюдались значительные изменения массы тканей,являющиеся следствием уменьшения содержания жира в тканях органов после введения -лапакона. На фиг. 16 А-16 С показаны животные с полностью вскрытой брюшной полостью после введения-лапакона мышам C57BL/6 с DIO в течение 56 дней, результаты окрашивания масляным красным О и ЕМ исследование накопления жира в ткани печени. Как можно видеть из фиг. 16, мыши C57BL/6, которым вводили -лапакон в течение 56 дней, демонстрировали бросающееся в глаза уменьшение количества внутреннего жира и массы тела, а также уменьшение размеров печеночной ткани, которая была окрашена в красный цвет. Чтобы подтвердить улучшение состояния ожиревшей печени на фиг. 16, накопленный в печени жир окрашивали, применяя краситель масляный красный О, и в результате было подтверждено, что содержание жира уменьшилось на 90% или более по сравнению с контрольной группой. Кроме того, результаты ЕМ исследования тканей печени продемонстрировали значительное уменьшение жировых вакуолей и запасов гликогена по сравнению с контрольной группой, восстановление нормальной формы митохондрий, значительное увеличение количества митохондрий и улучшившуюся форму эндоплазматической сети. Что касается фиг. 17, после ежедневного введения -лапакона пероральным путем мышам C57BL/6 с DIO в дозировке 50 мг/кг животных подвергли лапаротомии на 56 день введения -лапакона и осуществили окрашивание перилипина гонадной жировой ткани. Как можно видеть из фиг. 17, размер адипоцитов заметно уменьшился. На фиг. 18 показаны изменения уровней триглицеридов (TG), холестерина, свободных жирных кислот, глюкозы, инсулина, TNF, резистина и лептина в крови, отобранной на 3, 7, 14, 28 и 56 дни соответственно, при ежедневном пероральном введении -лапакона мышам C57BL/6 с DIO в дозировке 50 мг/кг. Как можно видеть из представленных данных, уровни жира и глюкозы в крови значительно улучшились и, кроме того, также улучшилась устойчивость к инсулину и устойчивость к лептину. Далее,уровень резистина, который вызывает устойчивость к инсулину, в крови также значительно улучшился. На основании этих результатов ожидается, что -лапакон будет обладать высокой эффективностью для лечения ожирения печени, гиперлипидемии, диабета типа 2 и устойчивости к инсулину. Что касается фиг. 19, после ежедневного введения -лапакона пероральным путем мышам C57BL/6 с DIO в дозировке 50 мг/кг выполняли НЕ окрашивание бурых жировых тканей на 56 день введения. Как можно видеть из фиг. 19, размер адипоцитов значительно уменьшился. На фиг. 20 показаны результаты ЕМ исследования бурой жировой ткани, отобранной на 56 день введения -лапакона пероральным путем мышам C57BL/6 с DIO в дозировке 50 мг/кг. Как можно видеть из рисунка, размер адипоцитов заметно уменьшился.- 27013214 Экспериментальный пример 14. Изменения у мышей с дефицитом рецептора лептина (ob/ob), вызываемые введением -лапакона. На фиг. 21 показаны изменение соотношения поглощаемая пища/масса тела (фиг. 21 А) и изменение массы тела (фиг. 21 В) в течение 56 дней при ежедневном пероральном введении -лапакона мышам с дефицитом рецептора лептина (ob/ob) в дозировке 150 или 200 мг/кг. Соотношение поглощение пищи/масса тела заметно уменьшилось приблизительно в течение 10 дней введения, и затем уровень поглощения пищи восстановился до значения, сходного с соответствующим значением для контрольной группы. Это произошло благодаря тому, что облегчилось расщепление жира и, следовательно, вырабатывались значительные количества энергии, несмотря на примерно равное потребление пищи. Кроме того, хотя мыши получали пищу с высоким содержанием жира, животные демонстрировали постепенную потерю массы в течение 56 дней по сравнению с контрольной группой. Эти результаты показывают,что введение -лапакона эффективно уменьшает массу тела мышей с дефицитом рецептора лептина(ob/ob), а также мышей с ожирением. Для исследования накопления жира в ткани печени животных подвергали лапаротомии через 56 дней введения -лапакона и проводили НЕ окрашивание (фиг. 21 С) и ЕМ исследование (фиг. 21D) ткани печени. На фиг. 21 С показаны результаты НЕ окрашивания ткани печени, и видно, что исчезли почти все жировые вакуоли по сравнению с контрольной группой. Такие результаты дают возможность ожидать, что введение -лапакона будет иметь высокую эффективность также и для лечения ожирения печени у мышей с дефицитом рецептора лептина (ob/ob). Результаты ЕМ исследования тканей печени, приведенные на фиг. 21D, показали значительное уменьшение жировых вакуолей и запасов гликогена по сравнению с контрольной группой, восстановление нормальной формы митохондрий, значительное увеличение количества митохондрий и улучшение формы эндоплазмической сети. Результаты ЕМ исследования мышечной ткани конечностей животных, приведенные на фиг. 21 Е,показали восстановление нормальной формы митохондрий в исследуемой группе по сравнению с необычной морфологией митохондрий, выявленной в контрольной группе, а также значительное увеличение количества митохондрий. Экспериментальный пример 15. Влияние -лапакона на спонтанную локомоторную активность. Вводили -лапакон мышам C57BL/6 с DIO и через 3 ч измеряли спонтанную локомоторную активность с использованием Versa MAX Activity MonitorsAnalyzer (AccuSan Instruments, Columbus, OH). Контрольная площадка, использованная для измерения двигательной активности животных, имела размеры 41 см 41 см. Камеру из плексигласа (высота 30 см) снабжали устройствами для формирования инфракрасных лучей с промежутками 2,5 см по осям х и у, соответственно, за счет чего на передней/задней и правой/левой сторонах камеры было расположено по 16 сканирующих лучей. Для того чтобы провести различие между спонтанным локомоторным поведением и стереотипным поведением/грумингом, измеряли активность животных, осуществляя непрерывное наложение сигналов двух разных сканирующих линий, реагирующих на действия мышей, в качестве эффективного стандарта. Группу, которой вводили -лапакон, группу, которой вводили носитель и контрольную группу, соответственно, помещали в каждое из измерительных устройств и измеряли активность и двигательную активность животных в течение 7 ч. Для приспособления животных к новой среде обитания мышей помещали в устройства за 2 ч до измерений. Как показано на фиг. 22, группа мышей, которым вводили носитель, и контрольная группа в целом не демонстрировали различий между собой, но группа, которой вводили-лапакон, показывала значительное отличие в движении и локомоторной активности животных. Экспериментальный пример 16. Влияние -лапакона на улучшение физической выносливости. Этот пример был предназначен для измерения разницы в физической выносливости мышей в тесте,связанном с плаванием. С этой целью в цилиндрическую ванночку, имеющую диаметр 9,5 см и высоту 25 см, помещали воду и вводили -лапакон мышам C57BL/6 с DIO. Через 3 ч исследуемую группу и контрольную группу одновременно помещали в отдельные цилиндрические ванночки для проведения измерений и сравнивали физическую выносливость животных указанных групп. Как показано на фиг. 23, было подтверждено, что группа, которой вводили -лапакон, продемонстрировала более чем двукратное превосходство в продолжительности плавания по сравнению с контрольной группой после однократного введения препарата. Экспериментальный пример 17. Влияние -лапакона на дыхательный коэффициент (ДК). Этот пример был предназначен для исследования влияния -лапакона на метаболизм жиров путем измерения дыхательного коэффициента (ДК). Измеряли потребление кислорода и выработку двуокиси углерода с применением непрямого калориметра с открытым контуром Oxyscan (AccuScan Instruments,Columbus, ОН). Это устройство состояло из закрытых акриловых камер (212121 см). Свежий воздух поступал в каждую камеру со скоростью 1500 мл/мин и затем О 2 и СО 2 давали пройти сквозь детекторы. Концентрацию газов регистрировали в мл/кг массы тела/мин. ДК рассчитывали как частное от деления объема выработанного СО 2 (VCO2) на объем потребленного О 2 (VO2). В отдельные аппараты помещали исследуемую группу, которой вводили -лапакон, группу, которой вводили носитель, и контрольную группу и измеряли ДК в течение 7 ч. Для привыкания животных к новой обстановке мышей помещали в устройства за 2 ч до измерений. Как показано на фиг. 24, полученные таким образом результаты под- 28013214 твердили, что группа, которой вводили -лапакон, продемонстрировала значительное отличие величины ДК по сравнению с группой, которой вводили носитель, и контрольной группой. Экспериментальный пример 18. Тест на острое токсическое действие. 1. Пероральное введение. Крыс Sprague-Dawley весом 2507 г (Jung-Ang Lab Animal Inc., Seoul, Korea) делили на 4 группы, по 10 животных в каждой, и перорально вводили им соединения 1, 2, 3, 4, 12, 13, 14, 16, 17, 24, 25 и 26 по настоящему изобретению в дозировке 50, 100 и 200 мг/кг соответственно. После перорального введения при наблюдении в течение 2 недель, независимо от того, проявлялось токсическое действие или нет, ни одно из животных во всех 4 группах не умерло и не было замечено визуально наблюдаемых симптомов по сравнению с контрольной группой, за исключением потери массы. 2. Перитонеальное введение. Крыс Sprague-Dawley весом 2556 г (Jung-Ang Lab Animal Inc., Seoul, Korea) делили на 4 группы, по 10 животных в каждой, и перитонеально вводили им соединения 1, 2, 3, 4, 12, 13, 14, 16, 17, 24, 25 и 26 по настоящему изобретению в дозировке 50, 100 и 200 мг/кг соответственно. После перитонеального введения при наблюдении в течение 2 недель, независимо от того, проявлялось токсическое действие или нет,ни одно из животных во всех 4 группах не умерло и не было замечено визуально наблюдаемых симптомов по сравнению с контрольной группой, за исключением потери массы. Полученные результаты подтверждают, что соединения по настоящему изобретению не обладают острым токсическим действием. Далее, будут описаны примеры составов фармацевтических композиций по настоящему изобретению и прикладные примеры применения соединений по настоящему изобретению в косметических изделиях. Эти примеры служат только для иллюстрации настоящего изобретения и не должны истолковываться, как ограничивающие объем и суть настоящего изобретения. Пример состава 1. Получение таблеток. Пример состава 3. Применение соединений по настоящему изобретению в косметическом лосьоне.- 29013214 Пример состава 4. Применение соединения по настоящему изобретению для косметического ухода за кожей. Промышленная применимость Как следует из предыдущего описания, ожидается, что соединения по настоящему изобретению представляют собой соединения, модулирующие активность различных генов и белков, и, следовательно, они будут терапевтически эффективны для лечения различных заболеваний и расстройств за счет регулирования уровней энергии in vivo. Применение описанных выше соединений в фармацевтических препаратах в качестве действующего ингредиента должно принести в высшей степени полезные результаты в лечении и/или профилактике различных заболеваний, как, например, ожирения, диабета, метаболических синдромов, дегенеративных заболеваний и заболеваний, связанных с нарушением деятельности митохондрий. Хотя предпочтительные варианты осуществления настоящего изобретения были раскрыты с иллюстративными целями, специалист в данной области техники поймет, что возможны различные модификации, дополнения и замены без отступления от сути и объема настоящего изобретения, что раскрыто в приложенной формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение фармацевтической композиции для производства лекарственного средства для лечения и профилактики синдромов заболеваний, включающей:(а) терапевтически эффективное количество соединения формулы (I) где каждый из заместителей R1 и R2 независимо представляет собой водород, галоген, алкокси, гидрокси или низший алкил, включающий от 1 до 6 атомов углерода; каждый из заместителей R3, R4, R5, R6, R7 и R8 независимо представляет собой водород, гидрокси,C1-С 20-алкил, алкенил или алкокси, циклоалкил, гетероциклоалкил, арил или гетероарил, или же два заместителя из числа R3-R8, взятые вместе, могут образовывать циклическую структуру; иn означает 0 или 1, при условии, что если n равно 0, атомы углерода, расположенные рядом с фрагментом n, образуют циклическую структуру с помощью простой связи; или фармацевтически приемлемую соль, сольват или изомер указанного соединения, и(b) фармацевтически приемлемый носитель, разбавитель или наполнитель, или любое сочетание этих ингредиентов, где синдромом заболевания является ожирение, осложнения ожирения, заболевания печени, артериосклероз, мозговая апоплексия, инфаркт миокарда, сердечно-сосудистые заболевания,ишемические заболевания, диабет, осложнения, связанные с диабетом, или воспалительные заболевания. 2. Применение по п.1, где соединение формулы (I) выбрано из соединений формул (II) и (III)
МПК / Метки
МПК: A61P 3/04, A61P 3/10, A61K 31/453
Метки: заболеваний, композиции, ожирения, метаболического, фармацевтической, лечения, синдрома, применение, диабета, нейродегенеративных
Код ссылки
<a href="https://eas.patents.su/30-13214-primenenie-farmacevticheskojj-kompozicii-dlya-lecheniya-diabeta-metabolicheskogo-sindroma-nejjrodegenerativnyh-zabolevanijj-i-ozhireniya.html" rel="bookmark" title="База патентов Евразийского Союза">Применение фармацевтической композиции для лечения диабета, метаболического синдрома, нейродегенеративных заболеваний и ожирения</a>
Предыдущий патент: Дозированная форма биоактивного метаболита гепирона с высокой дозировкой и длительным высвобождением, способ ее получения и способ лечения депрессии с ее использованием
Следующий патент: Приготовление катализатора
Случайный патент: Ингибиторы npy для лечения женской сексуальной дисфункции