Димерные ингибиторы ингибиторов белков апоптоза (iap)
Номер патента: 12810
Опубликовано: 30.12.2009
Авторы: Риппин Сюзан Р., Кондон Стефен М., Денг Йиджун, Лапорте Мэттью Г.
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
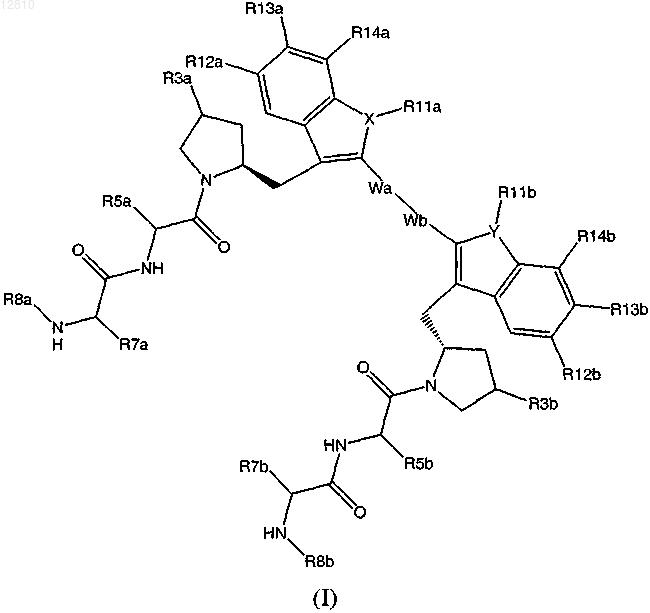
в котором R5a и R5b независимо представляют собой Н, алкил, циклоалкил или необязательно замещенный алкил, где заместители алкила выбраны из группы, состоящей из гидрокси, алкокси, арилокси и амино; либо R5a и R5b вместе образуют алкилен, гидроксизамещенный алкилен; алкенилен или -CH2SSCH2-;
R7a и R7b независимо представляют собой Н или низший алкил;
R8a и R8b независимо представляют собой Н или низший алкил;
R3a и R3b независимо представляют собой Н или гидрокси;
X и Y независимо выбраны из О или N;
R12a, R12b, R13a, R13b, R14a, R14b независимо представляют собой H, Cl, F или алкил;
Wa и Wb вместе образуют связь, алкилен, алкенилен, арил или 5-членный гетероарил, имеющий один гетероатом, выбранный из N, О или S; и
R11a и R11b независимо отсутствуют или независимо выбраны из Н, низшего алкила, гидроксиалкила, алкоксиалкила, ацетоксиалкила либо R11a и R11b вместе образуют алкилен, гидрокси-замещенный алкилен, алкинилен, алкиленокси, -С(О)СН2СН2СН2С(О)- или
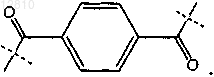
2. Соединение по п.1, включающее соединение формулы (II) или его фармацевтически приемлемую соль
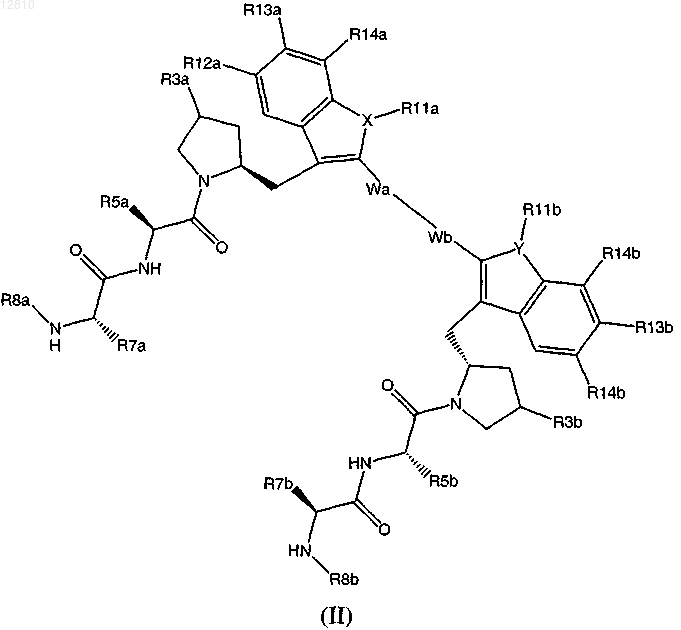
в котором каждый из R5a; R5b; R7a; R7b; R8a; R8b; R3a; R3b; X; Y; R12a; R12b; R13a; R13b; R14a; R14b; Wa; Wb; R11a и R11b имеют значения согласно п.1.
3. Соединение по п.2 или его фармацевтически приемлемая соль, в котором Wa и Wb вместе образуют связь, где каждый алкилен имеет от 1 до 10 атомов углерода, каждый гидроксизамещенный алкилен имеет от 1 до 10 атомов углерода; каждый алкенилен имеет от 2 до 10 атомов углерода; каждый алкинилен имеет от 2 до 12 атомов углерода; каждый алкиленокси имеет от 1 до 10 атомов углерода.
4. Соединение по п.3 или его фармацевтически приемлемая соль, в котором
R5a и R5b независимо представляют собой Н, низший алкил, циклогексил или необязательно замещенный низший алкил, где заместители низшего алкила выбраны из группы, состоящей из гидрокси, метокси; бутокси; бензилокси и амино;
R7a и R7b независимо представляют собой Н или низший алкил;
R8a и R8b независимо представляют собой Н или низший алкил;
где R3a и R3b независимо представляют собой Н или гидрокси;
X и Y представляют собой N;
R12a, R12b, R13a, R13b, R14a, R14b независимо представляют собой H, Cl, F или метил и
R11a и R11b независимо выбраны из Н, низшего алкила, гидроксиэтила, метоксиэтила или ацетоксиэтила.
5. Соединение по п.4 или его фармацевтически примелемая соль, в котором
R5a и R5b независимо представляют собой Н, низший алкил или необязательно замещенный низший алкил, где заместители низшего алкила выбраны из группы, состоящей из гидрокси, метокси; бутокси; бензилокси и амино; и
R11а и R11b представляют собой Н.
6. Соединение по п.4 или его фармацевтически приемлемая соль, в котором
R5a и R5b представляют собой низший алкил;
R7a, R7b, R8a и R8b представляют собой низший алкил;
R11a и R11b представляют собой Н;
R12a и R12b представляют собой F и
R13а, R13b, R14a и R14b представляют собой Н.
7. Соединение формулы (III) или его фармацевтически приемлемая соль
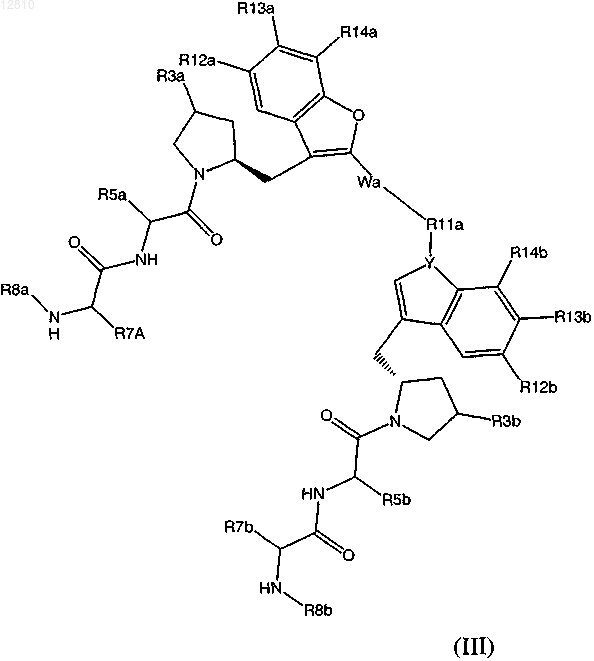
в котором
R5a и R5b независимо представляют собой Н, алкил, циклоалкил или необязательно замещенный алкил, где заместители алкила выбраны из группы, состоящей из гидрокси, алкокси, арилокси и амино; или R5a и R5b вместе образуют алкилен, гидроксизамещенный алкилен, алкенилен или -CH2SSCH2-;
R7a и R7b независимо представляют собой Н или низший алкил;
R8a и R8b независимо представляют собой Н или низший алкил;
R3a и R3b независимо представляют собой Н или гидрокси;
X и Y независимо выбирают из О или N;
R12а, R12b, R13a, R13b, R14a, R14b независимо представляют собой Н, Cl, F или алкил;
Wa и R11a вместе образуют алкилен.
8. Соединение по п.7, включающее соединение формулы (IV) или его фармацевтически приемлемую соль

в котором каждый R5a; R5b; R7a; R7b; R8a; R8b; R3a; R3b; X; Y; R12a; R12b; R13a; R13b; R14a; R14b; Wa и R11 имеют значения согласно п.7.
9. Соединение по п.8 или его фармацевтически приемлемая соль, в котором каждый алкилен имеет от 1 до 10 атомов углерода, каждый гидроксизамещенный алкилен имеет от 1 до 10 атомов углерода и каждый алкенилен имеет от 2 до 10 атомов углерода.
10. Соединение по п.1, выбранное из
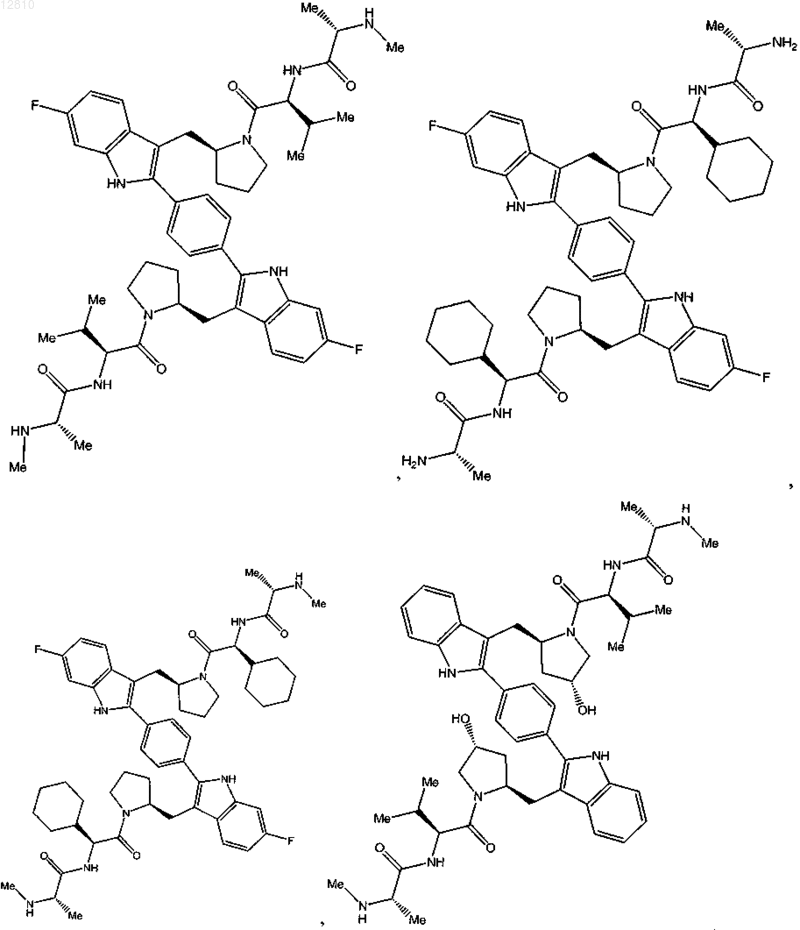

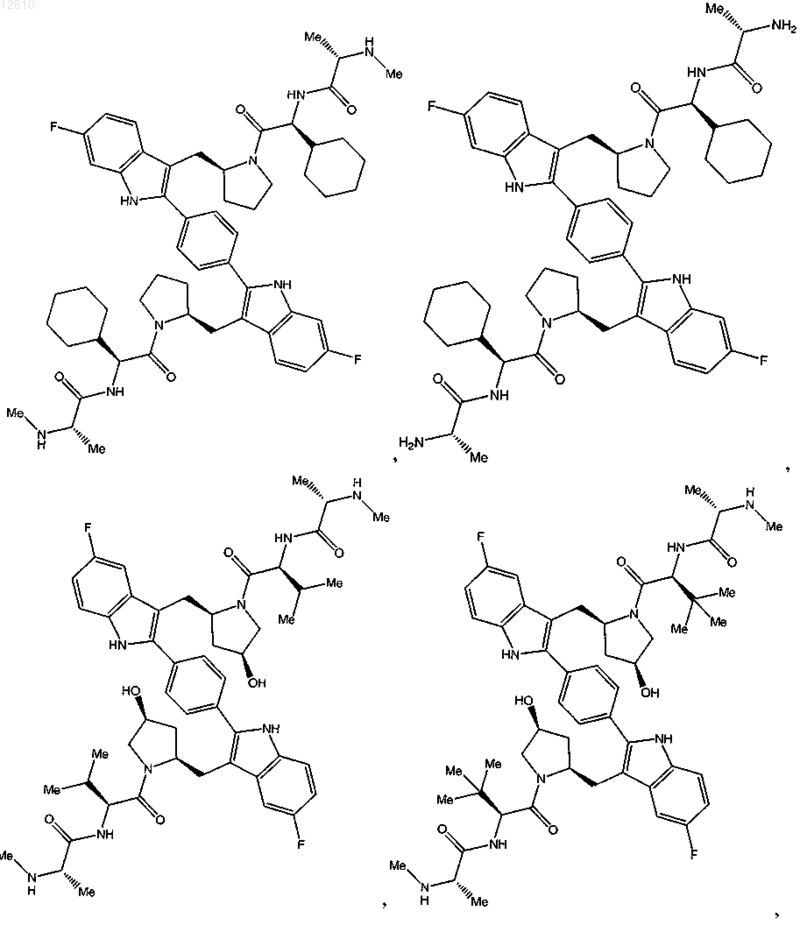
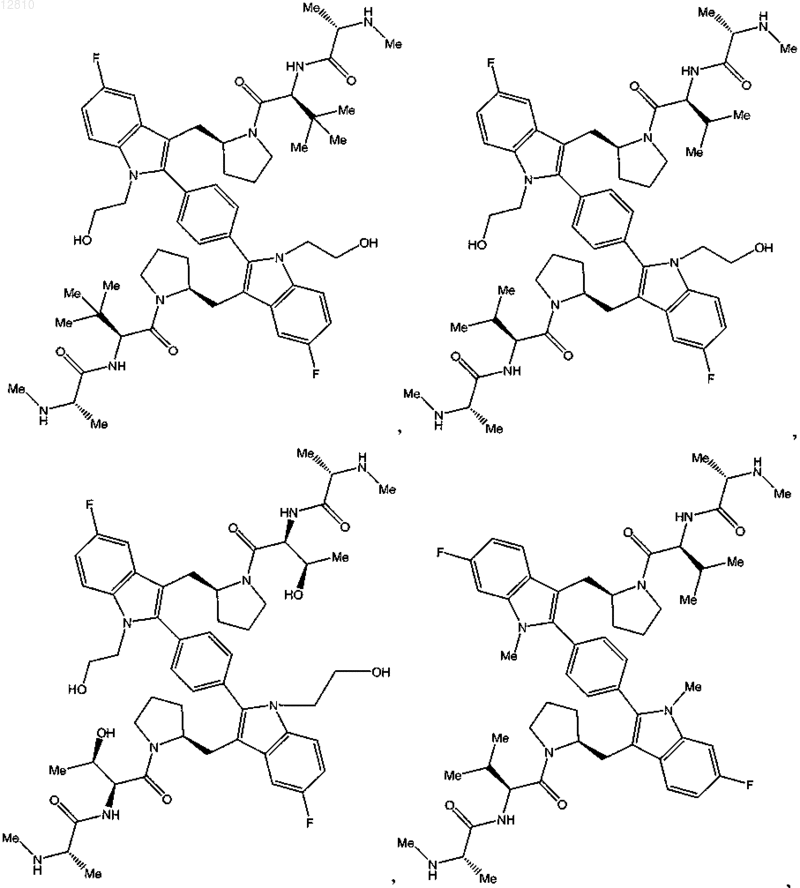
или его фармацевтически приемлемая соль.
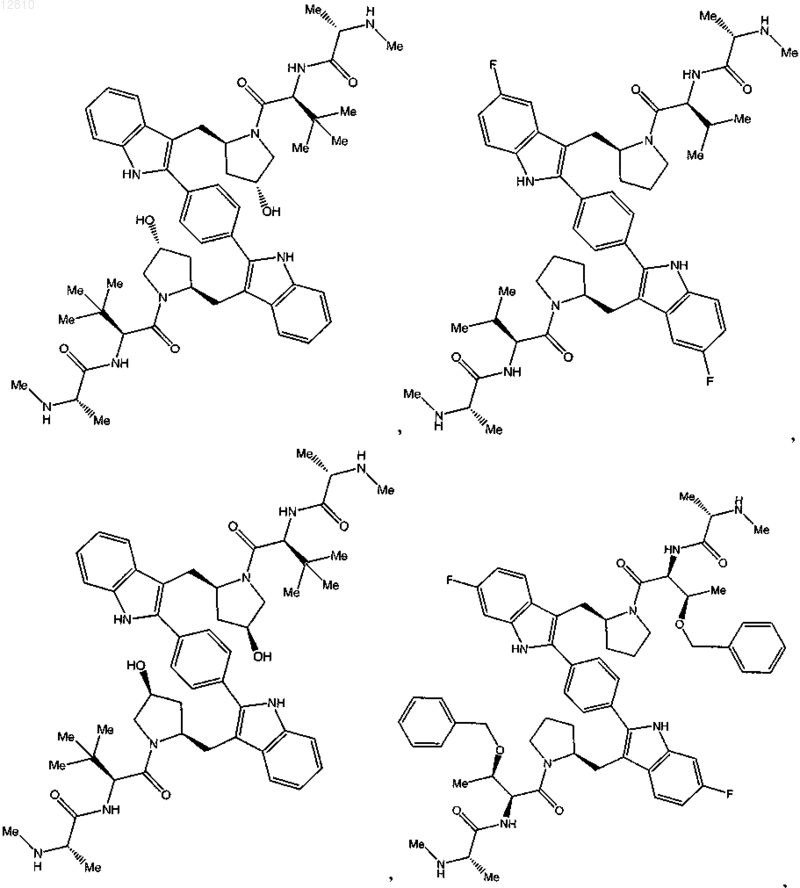
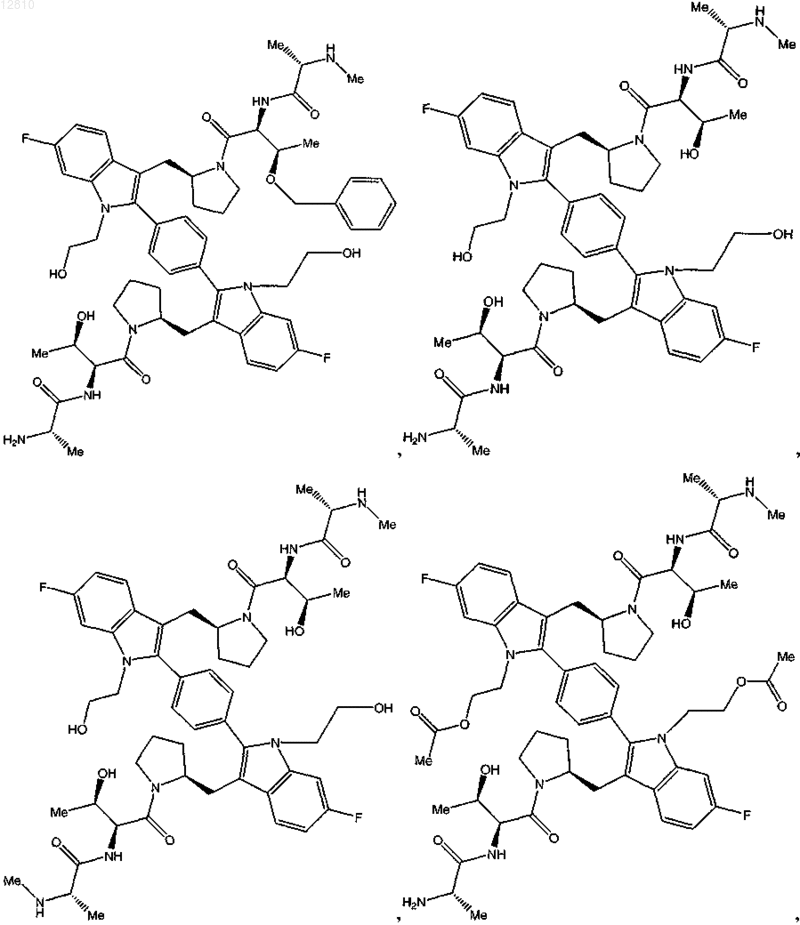
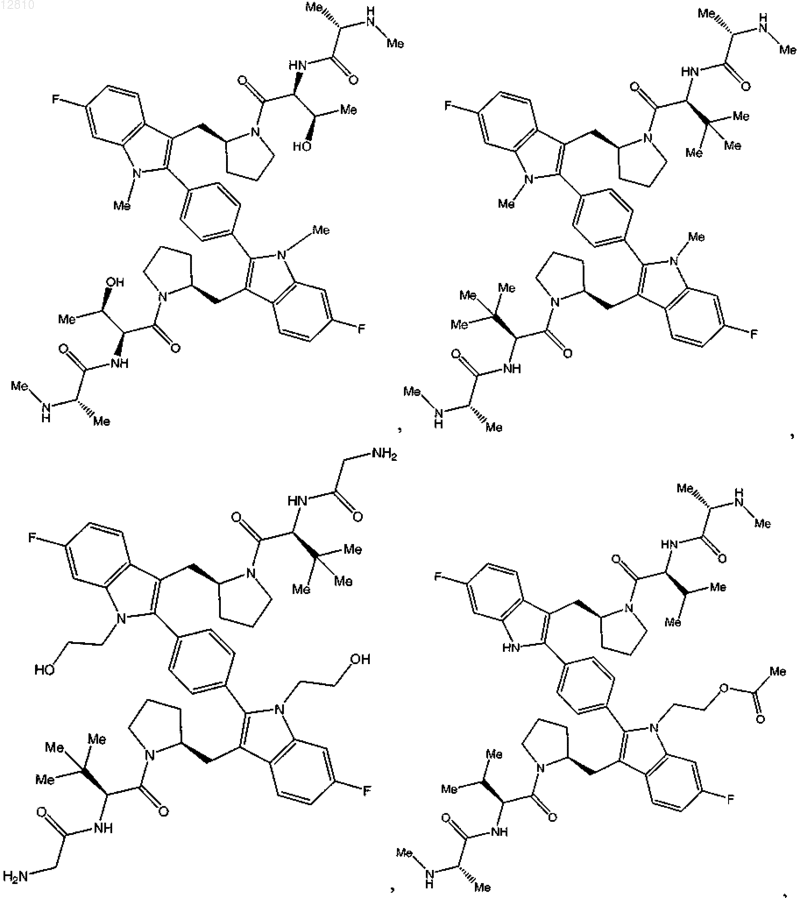
11. Соединение по п.1, выбранное из

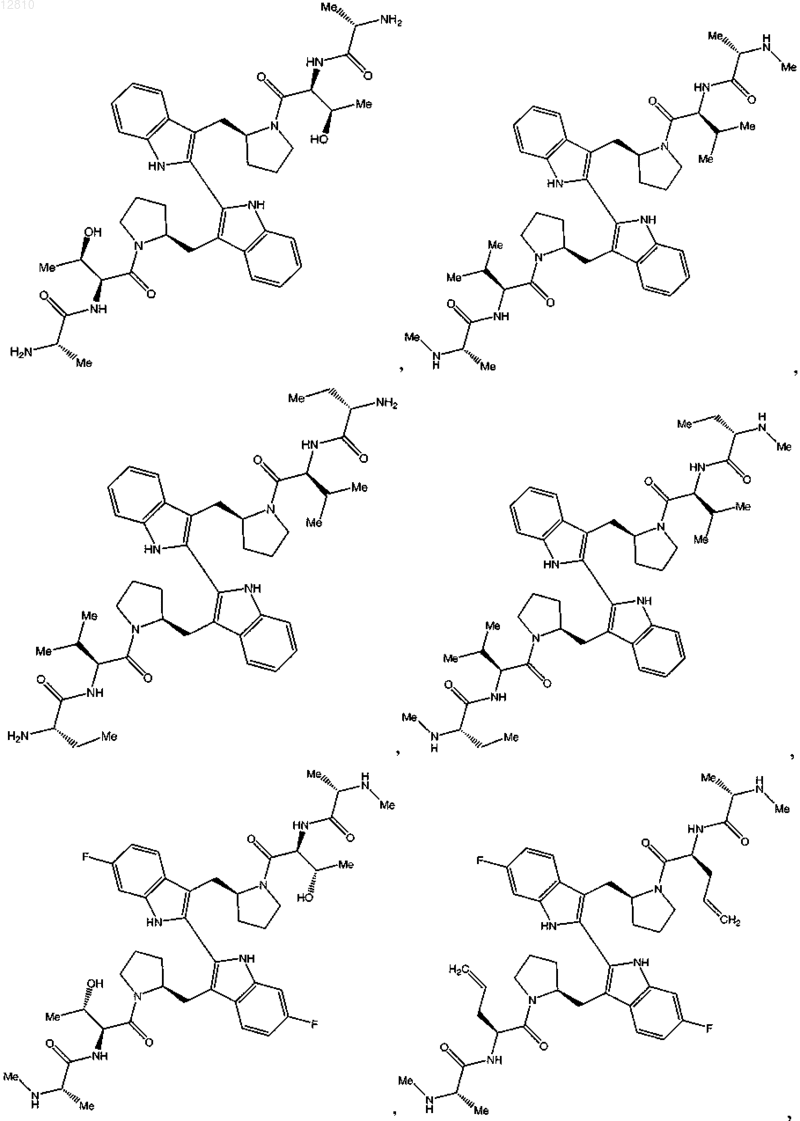

или его фармацевтически приемлемая соль.
12. Соединение по п.1, выбранное из
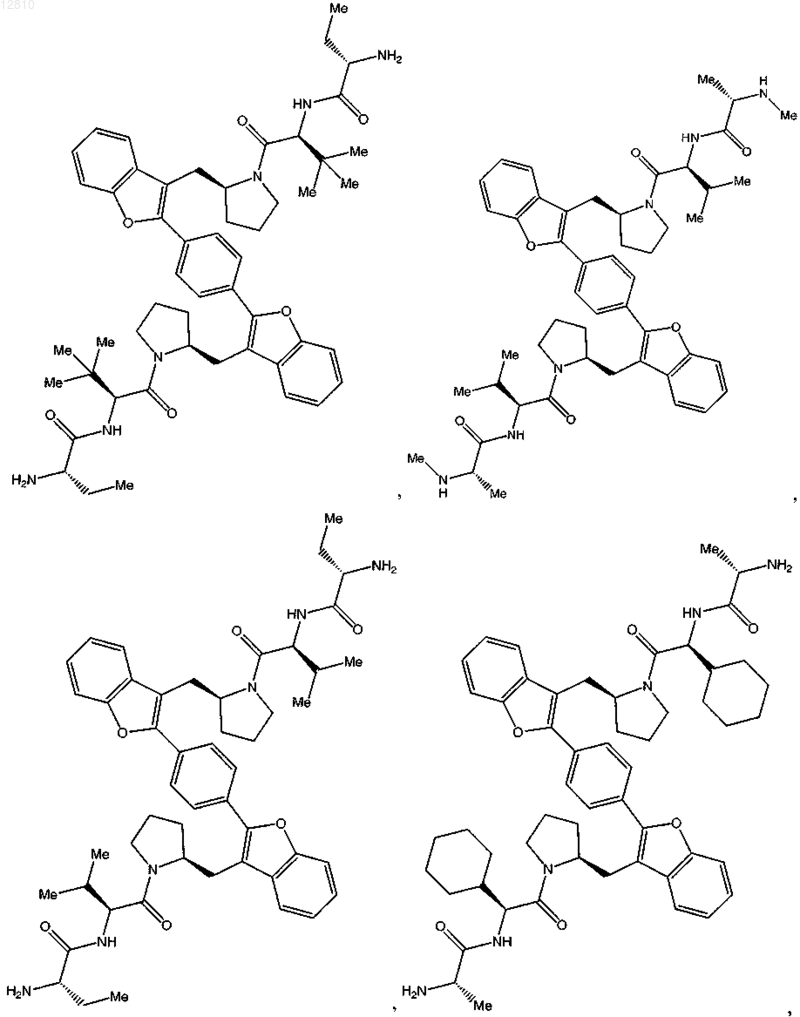
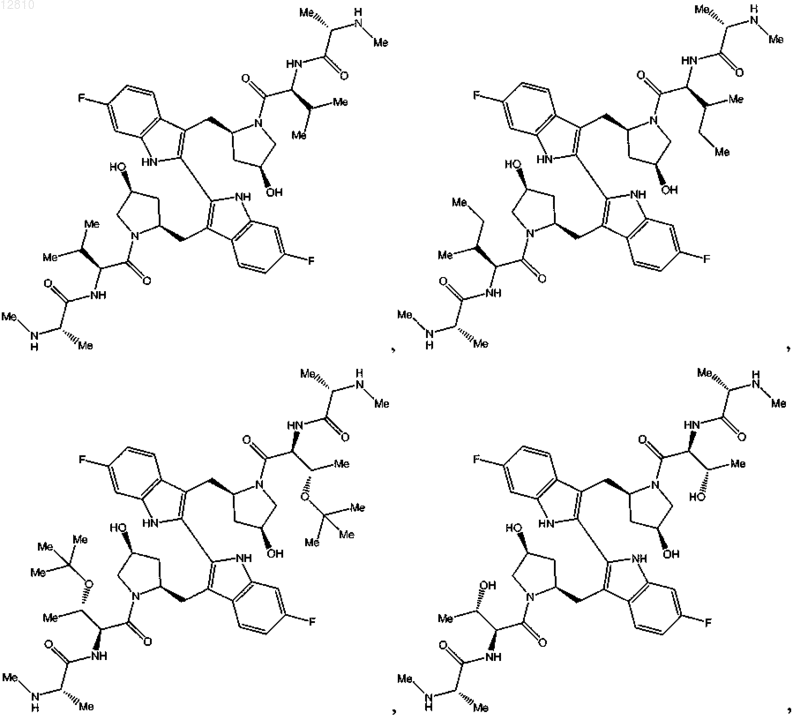
или его фармацевтически приемлемая соль.
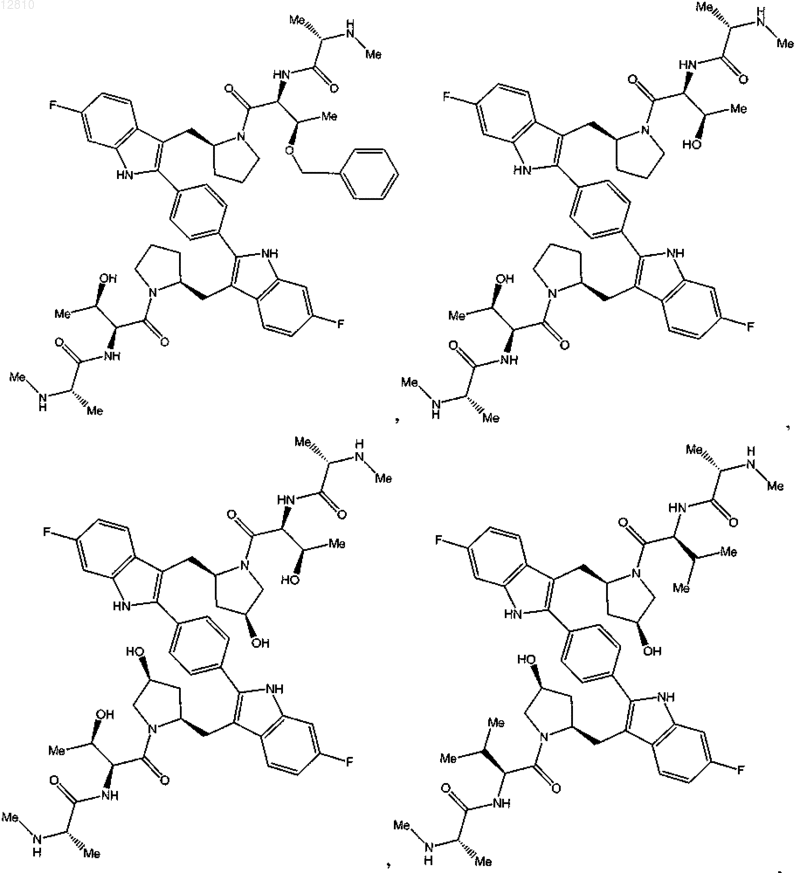
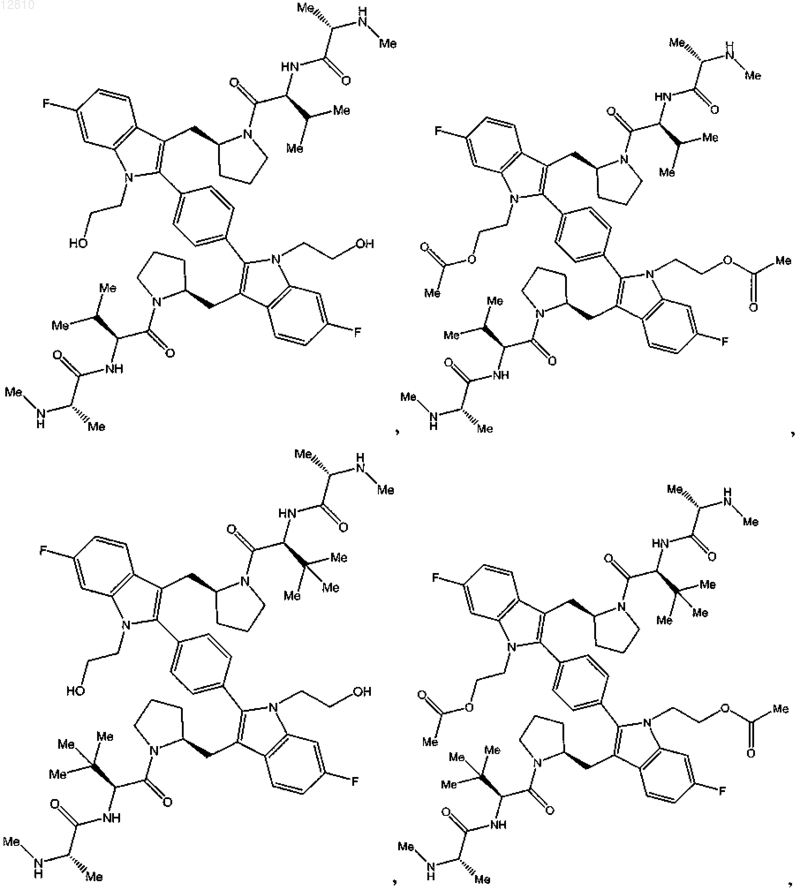
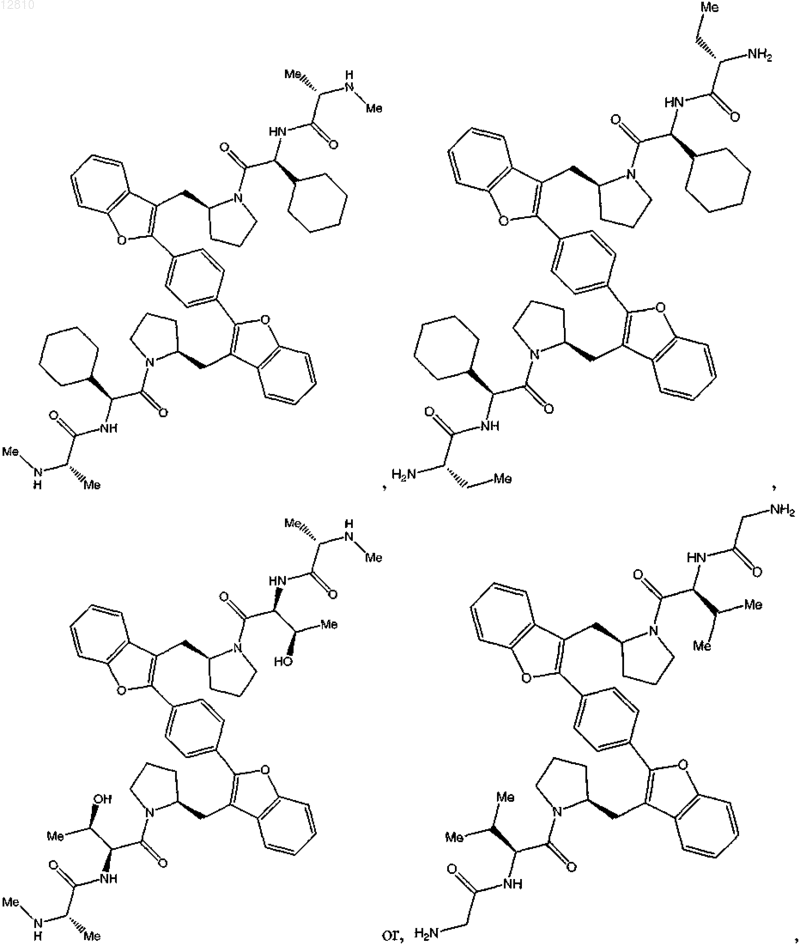
13. Соединение по п.1, выбранное из
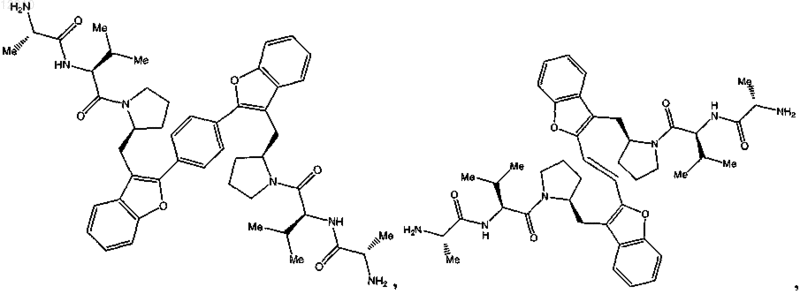
или его фармацевтически приемлемая соль.
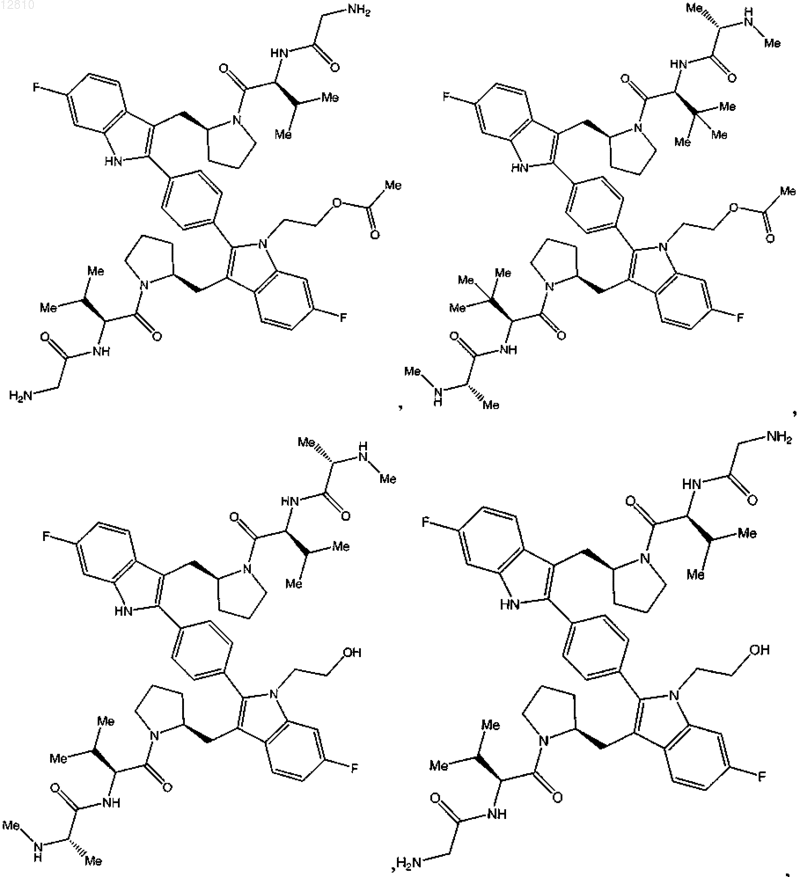
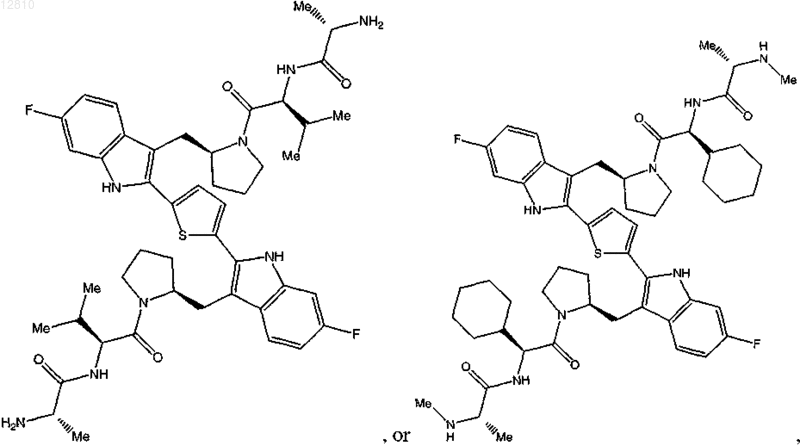
14. Соединение по п.1, выбранное из

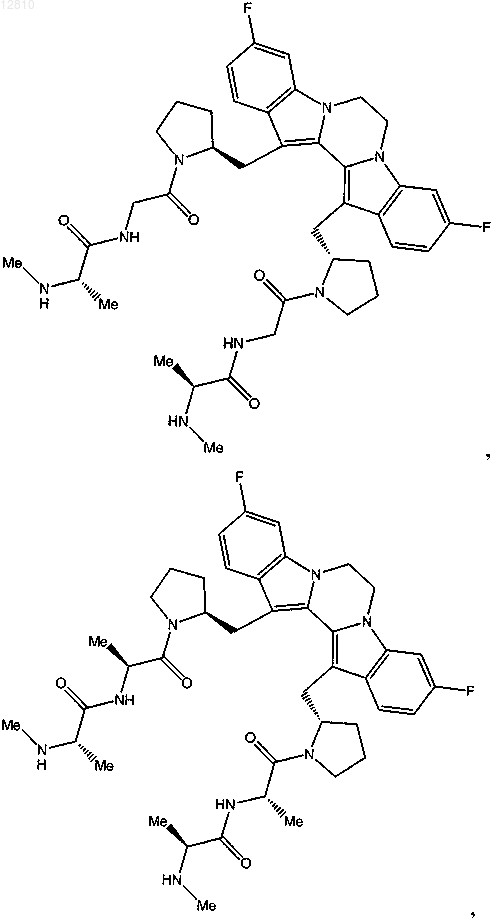
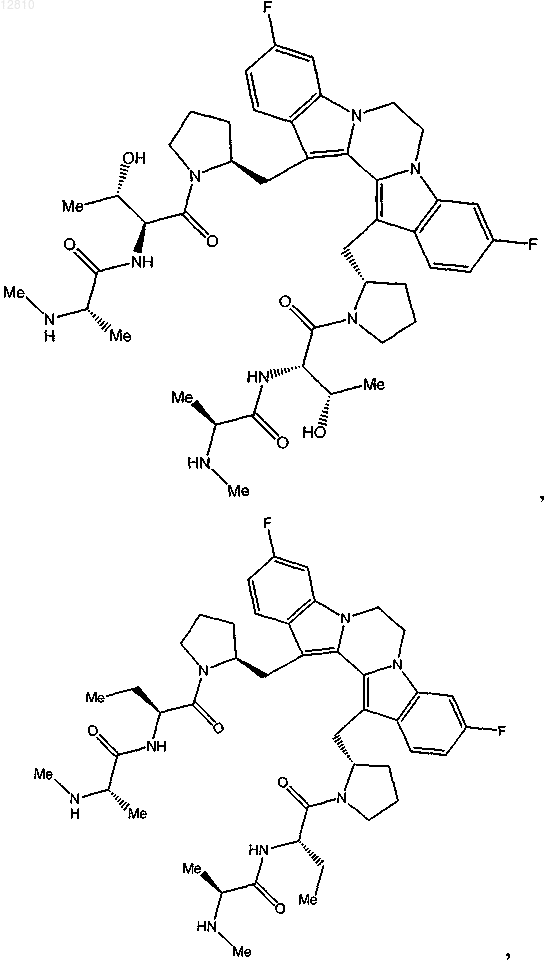
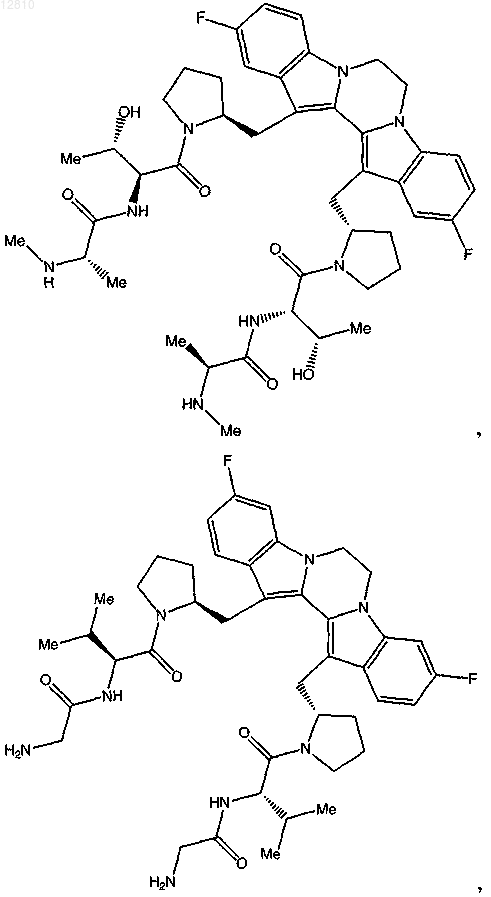
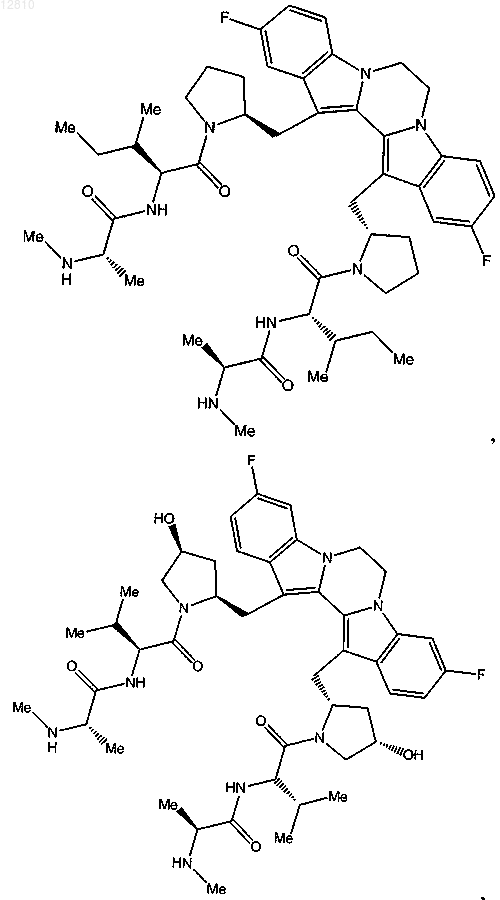
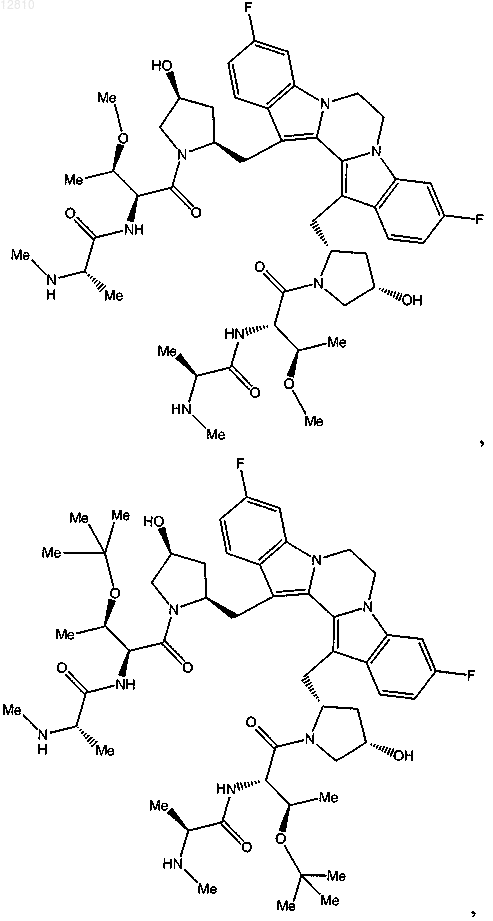
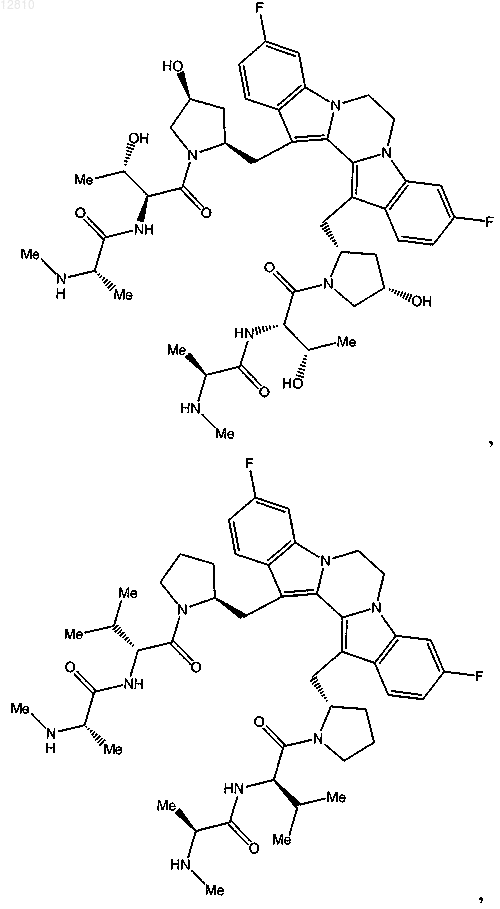
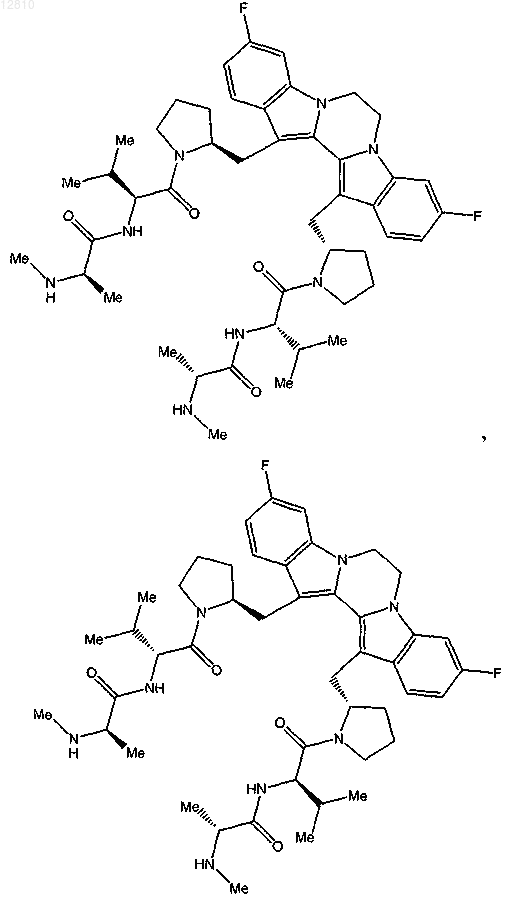
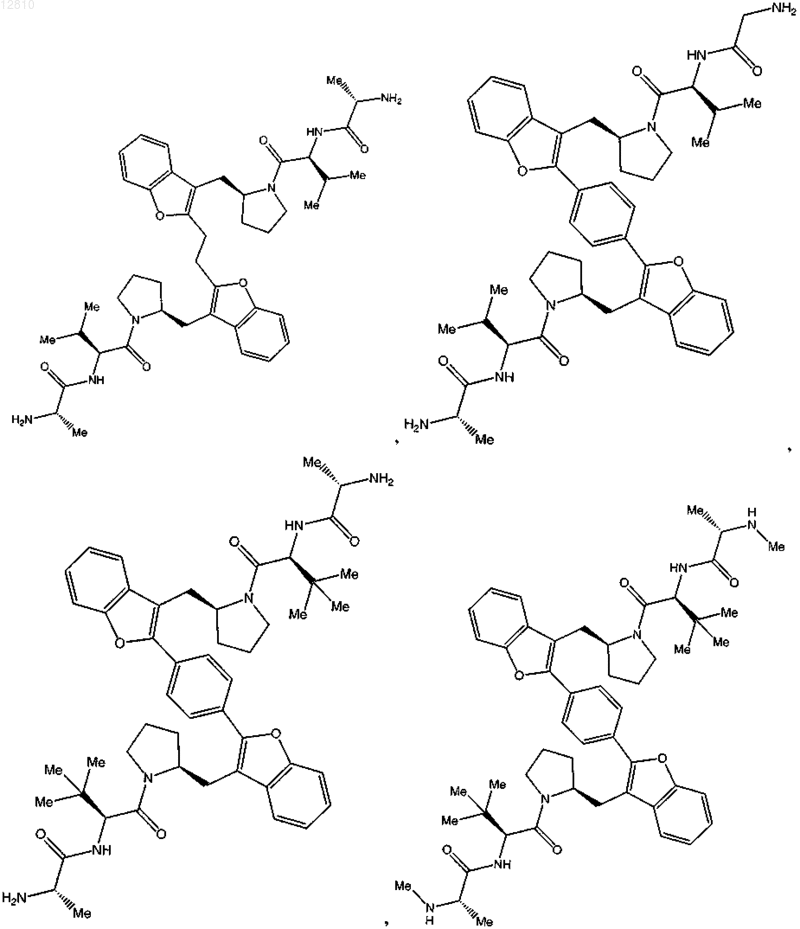
или его фармацевтически приемлемая соль.
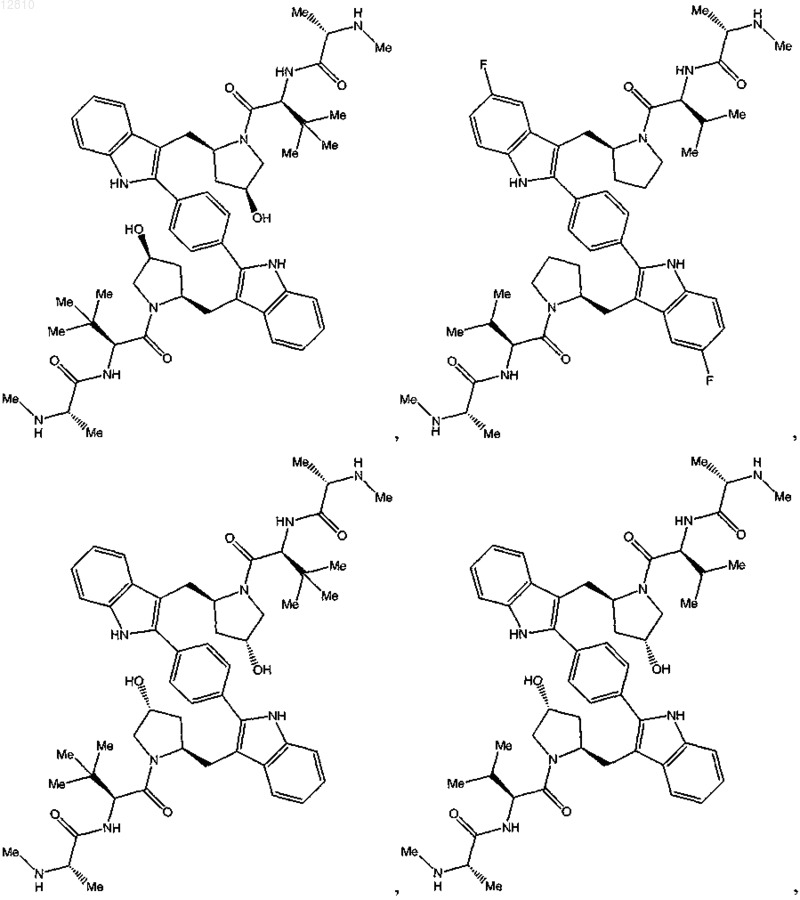
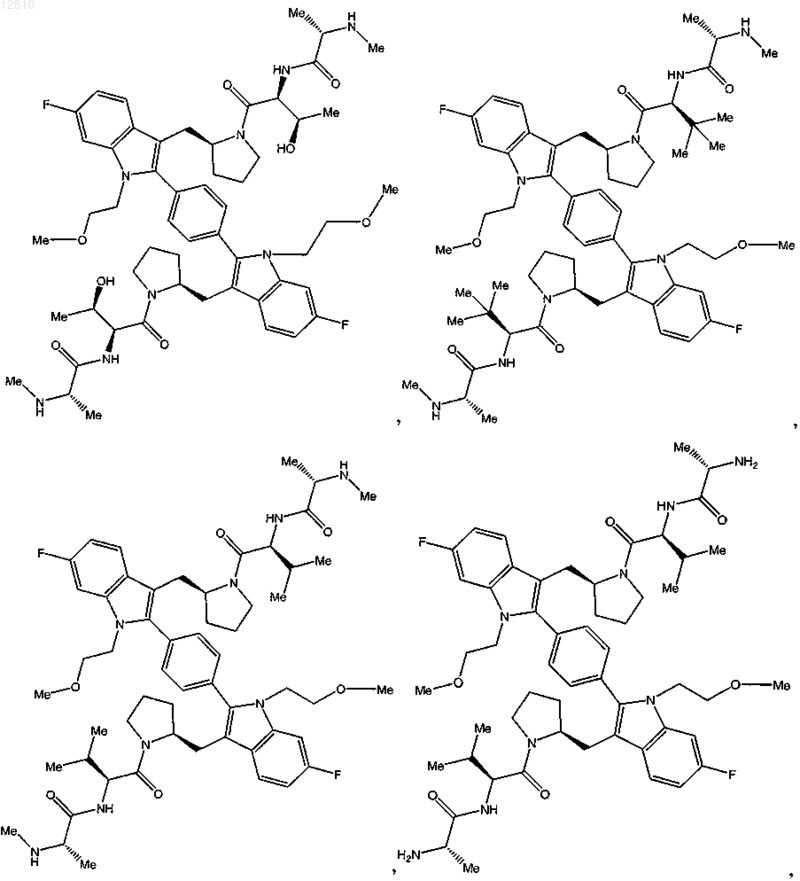
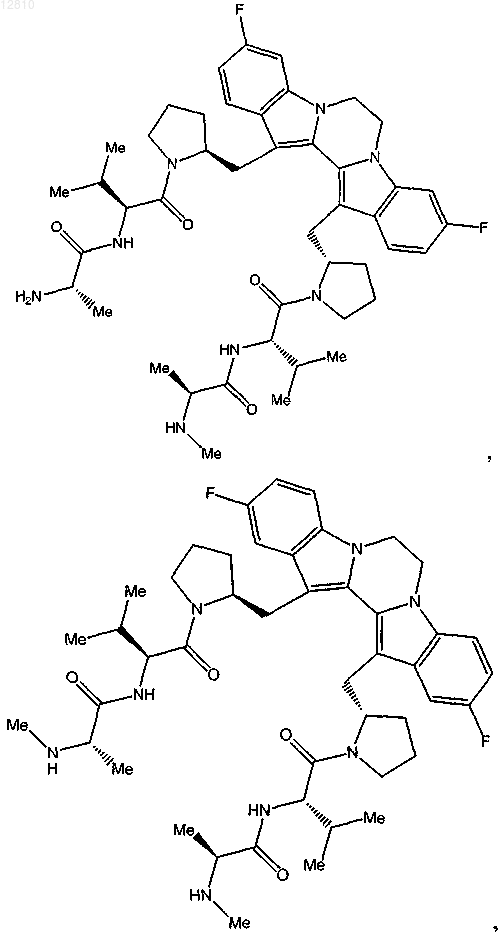
15. Соединение по п.1, выбранное из

или его фармацевтически приемлемая соль.
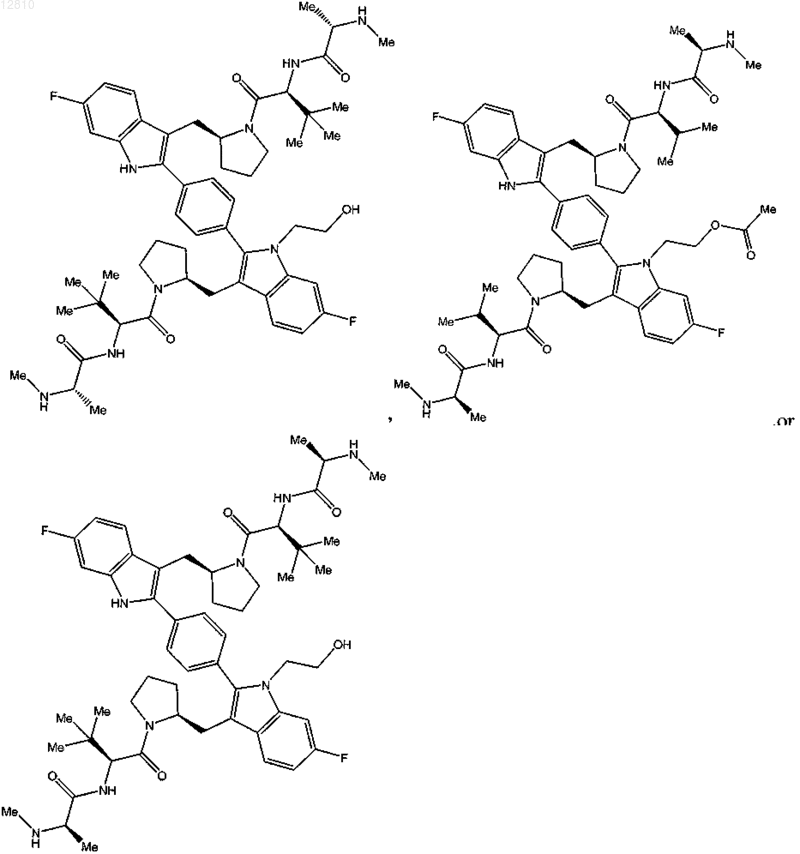
16. Соединение по п.1, выбранное из
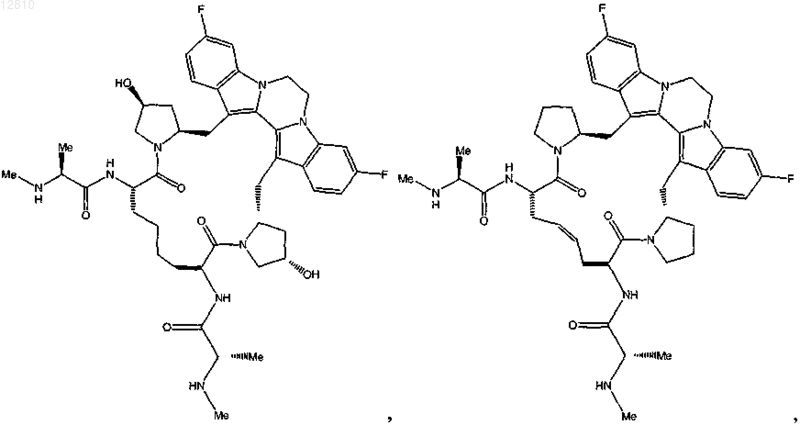
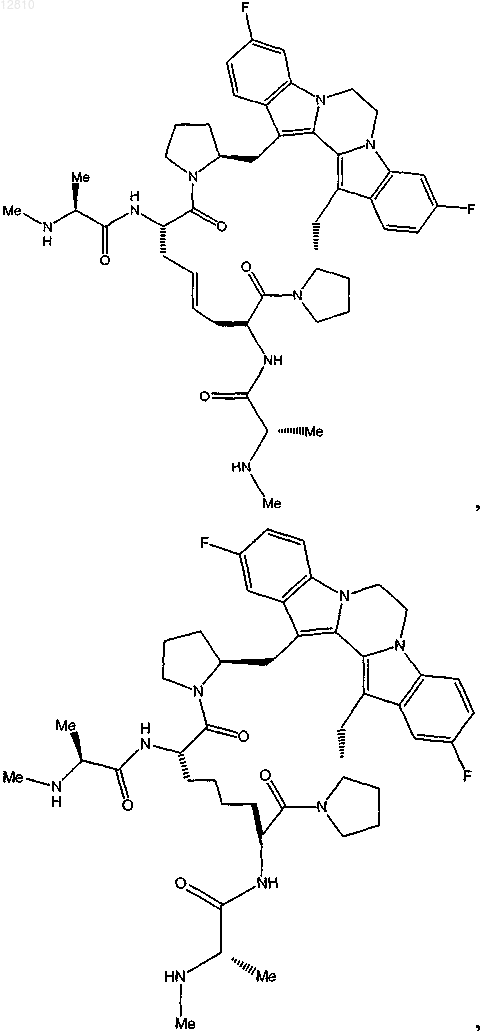
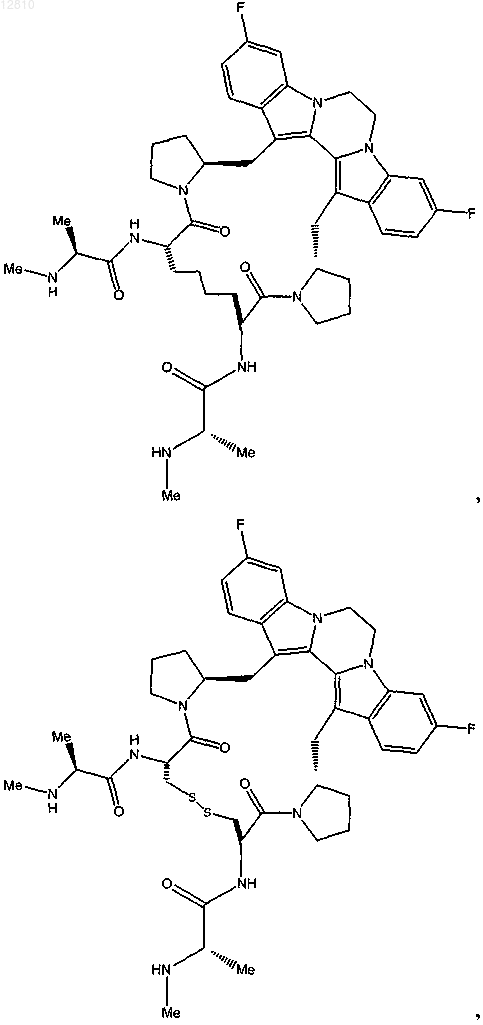
или
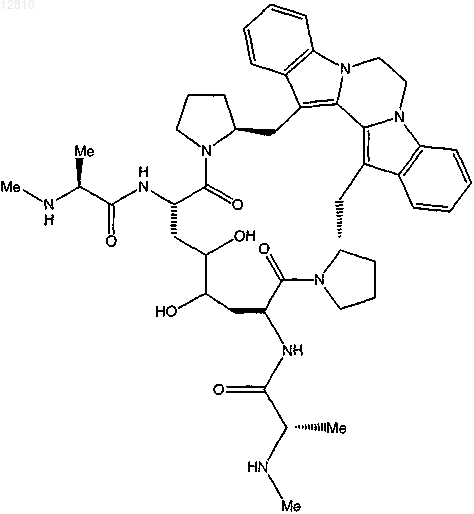
или его фармацевтически приемлемая соль.
17. Соединение по п.1, выбранное из
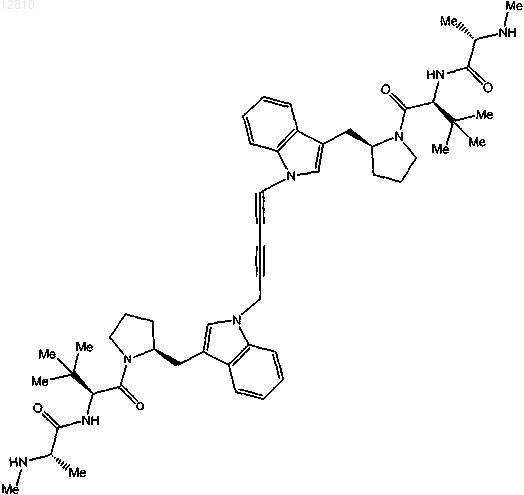
или
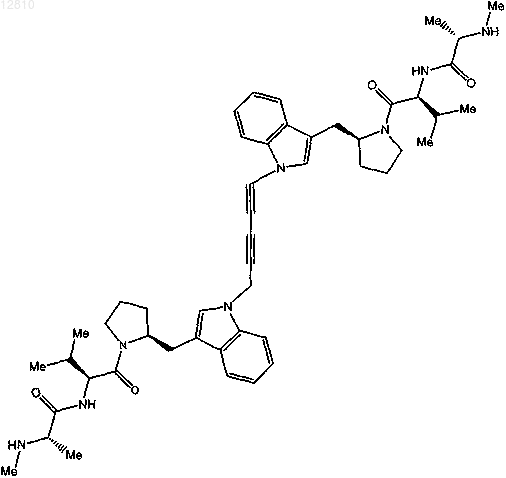
или его фармацевтически приемлемая соль.
18. Соединение по п.1, выбранное из
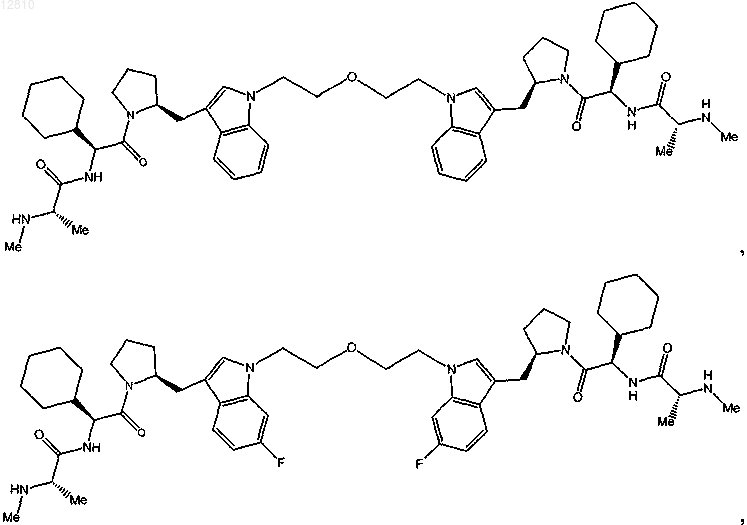
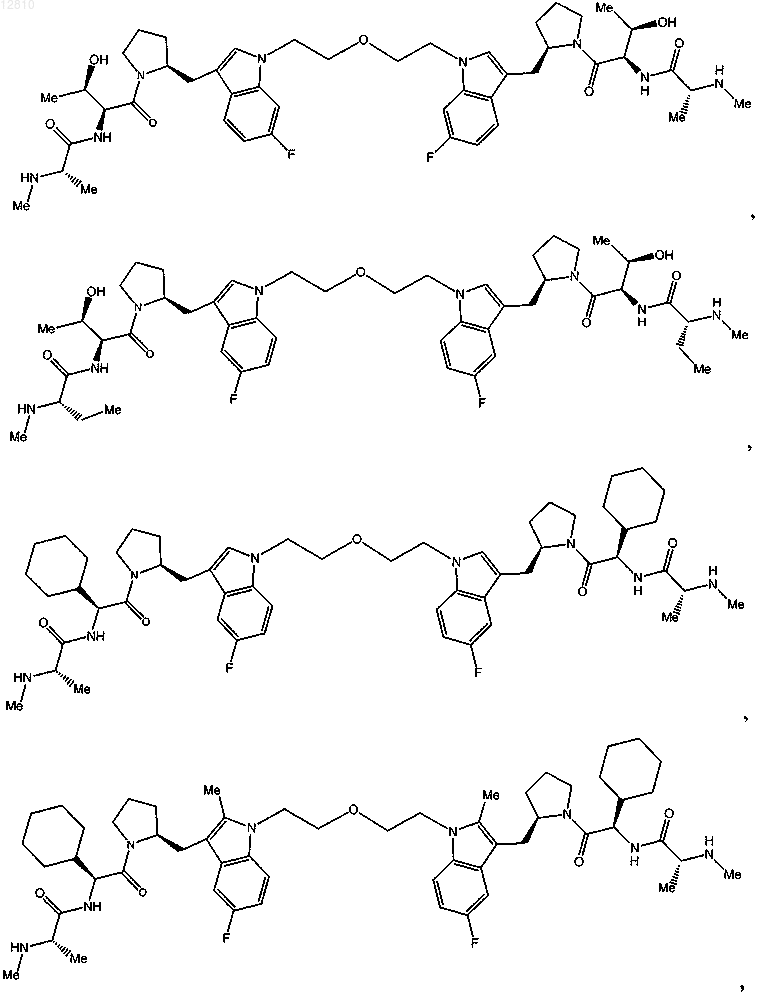
или
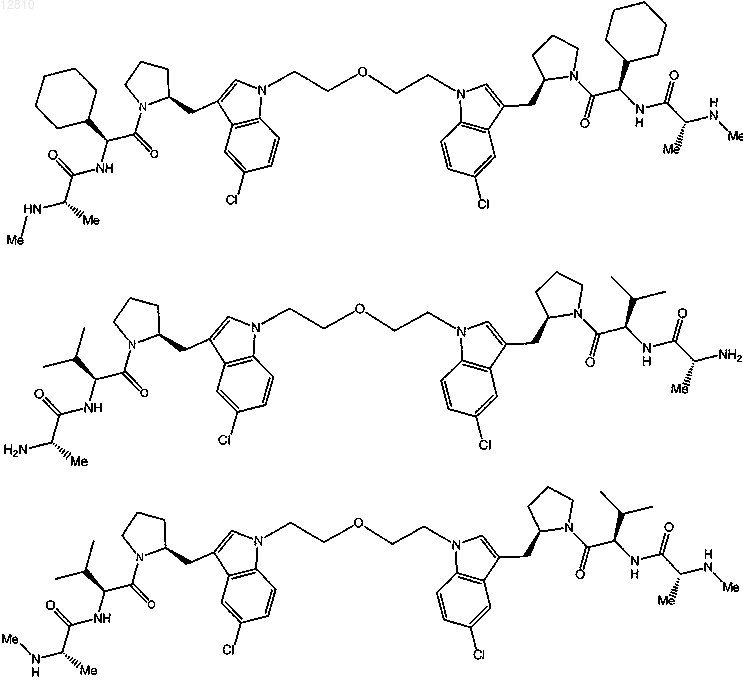
или его фармацевтически приемлемая соль.
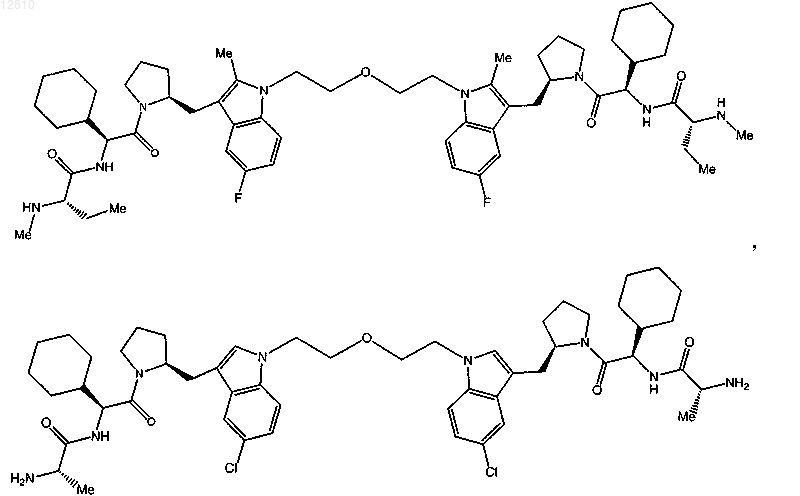
19. Соединение по п.1, выбранное из
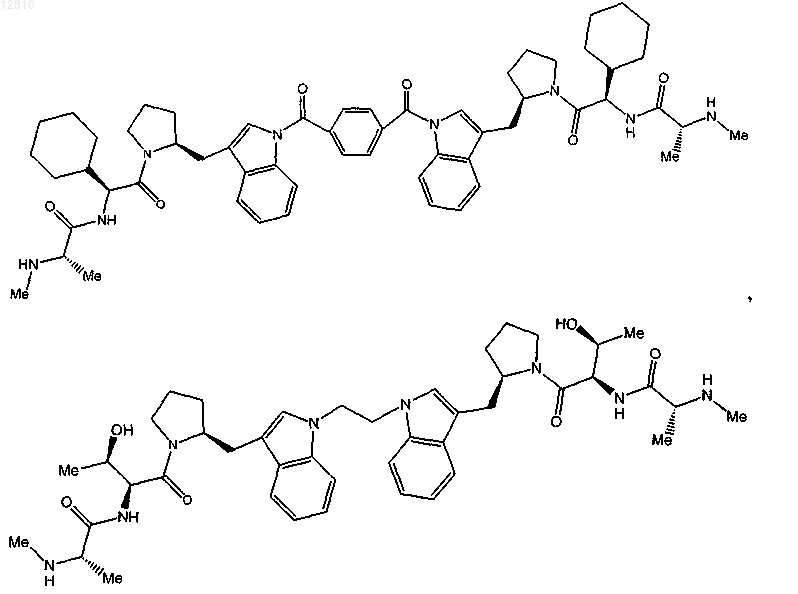
или
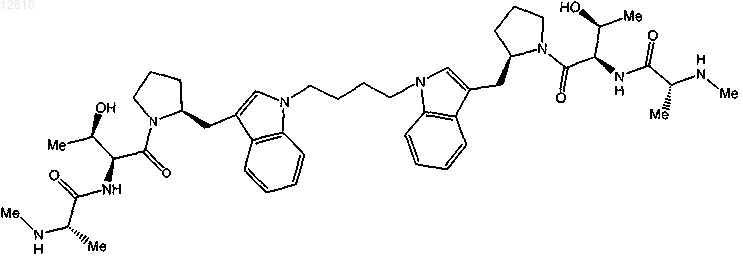
или его фармацевтически приемлемая соль.
20. Соединение по п.4, выбранное из
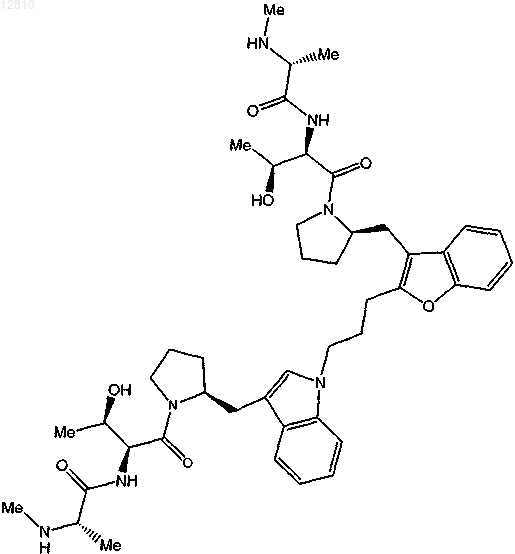
или
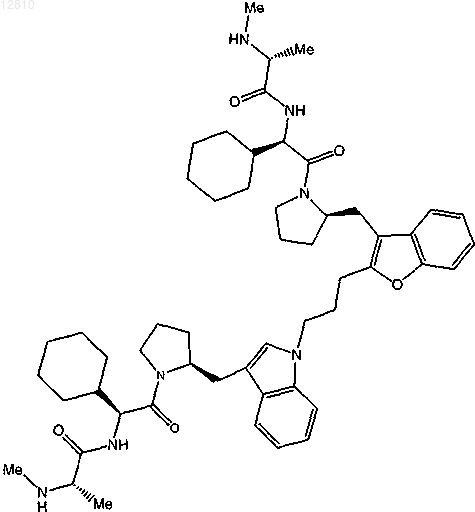
или его фармацевтически приемлемая соль.
Текст
012810 Ссылки на родственные заявки Данная заявка заявляет право на приоритет, возникающее из предварительной заявки на патент США 60/656201 "Пептидомиметики", поданной 25 февраля 2005 г., предварительной заявки на патент США 60/668344 "Иммунотерапевтические применения миметиков SMAC", поданной 5 апреля 2005 г.,предварительной заявки на патент США 60/692111 "Одиночные пептидомиметики SMAC или в сочетании с ингибиторами топоизомеразы", поданной 20 июня 2005 г., предварительной заявки на патент США 60/706649 "Пептидомиметики SMAC в качестве ингибиторов CIAP", поданной 9 августа 2005 г. и предварительной заявки на патент США 60/729853 "Одиночные пептидомиметики SMAC или в сочетании с содержащими платину соединениями и таксанами", поданной 25 октября 2005 г., которые включены в данное описание во всей их полноте путем ссылки. Предпосылки создания изобретения Апоптоз (программируемая клеточная смерть) играет основную роль в развитии и гомеостазе всех многоклеточных организмов. Апоптоз может инициироваться изнутри клетки под действием внешнего фактора, такого как хемокин (внешний путь) или внутриклеточное событие, такое как повреждение ДНК(внутренний путь). Изменения апоптопических путей влекут за собой множество патологий у людей, в т.ч. нарушения развития, рак, аутоиммунные заболевания, а также нейродегенеративные расстройства. Один из способов действия химиотерапевтических лекарств является клеточная смерть путем апоптоза. Апоптоз имеет аналогичную природу у различных видов и осуществляется в основном посредством активированных каспаз-семейства цистеиновых протеаз с аспартатной активностью их субстратов. Эти содержащие цистеин специфические к аспартату протеазы ("каспазы") продуцируются в клетках как каталитически неактивные зимогены и обрабатываются протеолитически с превращением в активные протеазы в процессе апоптоза. После активации эффекторные каспазы отвечают за протеолитическое расщепление широкого спектра клеточных мишеней, которое в конечном итоге приводит к гибели клетки. В нормальных живых клетках, не получивших апоптопического стимула, большинство каспаз остаются неактивными. В случае аберрантной активации каспаз их протеолитическая активность может ингибироваться семейством сохраняющихся в процессе эволюции белков, называемых IAP (ингибиторы белков апоптоза). Семейство белков IAP подавляет апоптоз, предотвращая активацию прокаспаз и ингибируя ферментную активность зрелых каспаз. Было обнаружено несколько отдельных IAP млекопитающих, в т.ч.XIAP, c-IAP1, c-IAP2, ML-IAP, NAIP (белок, ингибирующий нейронный апоптоз), Bruce и сурвивин, которые проявляют антиапоптотическую активность в культуре клеток. Первоначально IAP были обнаружены в бакуловирусе по их функциональной способности замещаться Р 35 белком- антиапоптогенным геном. IAP были описаны в различных организмах: от дрозофилы до человека. Известно также об их сверхэкспрессии во многих видах рака человека. В целом, IAP включают от одного до трех повторяющихся доменов (BIR) LAP IAP бакуловируса, и большинство из них имеют карбоксильный терминальный мотив RLNG. Домен BIR представляет собой связывающий цинк домен из приблизительно 70 остатков, включающий 4 альфа-спиралей и 3 бета-нитей с цистеиновыми и гистидиновыми остатками, координирующими ион цинка. Считается, что именно домен BIR вызывает антиапоптический эффект путем ингибирования каспаз и, таким образом, ингибирования апоптоза. XIAP экспрессируется повсеместно в большинстве тканей взрослых особей и эмбрионов. Было показано, что сверхэкспрессия XIAP в клетках опухолей предоставляет защиту от множества проапоптических стимуляторов и способствует резистентности к химиотерапии. Это подтверждается сильной корреляцией между уровнями белковXIAP и выживанием у пациентов с острой миелогенной лейкемией. Регулирование в сторону снижения экспрессии XIAP посредством антисмысловых олигонуклеотидов, как было показано, повышает чувствительность клеток опухоли к смерти, индуцированной широким диапазоном про-апоптических средств,как in vitro, так и in vivo. Smac/DIABLO-производные пептиды также повышают чувствительность различных клеток опухолей к апоптозу, индуцированному разными проапоптическими лекарствами. Однако в обычных клетках, получивших сигнал к апоптозу, опосредованный IAP ингибиторный эффект должен быть устранен. Это, по меньшей мере, частично осуществляет митохондриальный белокSmac (second mitochondrial activator of caspases - второй митохондриальный активатор каспаз). Smac (илиDIABLO) синтезируется как молекула предшественника из 239 аминокислот; 55 остатков на N-конце служат в качестве митохондриальной целевой последовательности, удаляемой после импорта. Зрелая форма Smac содержит 184 аминокислоты и в растворе ведет себя как олигомер. Smac и различные его фрагменты предлагались для использования в качестве мишеней для идентификации различных терапевтических средств.Smac синтезируется в цитоплазме с N-концевой митохондриальной целевой последовательностью,которая удаляется протеолитически в процессе созревания до зрелого полипептида, а затем нацеливается на внутримембранное пространство митохондрий. В момент индуцирования апоптоза Smac высвобождается из митохондрий в цитозоль вместе с цитохромом С, где и связывается с IAP и обеспечивает активацию каспаз, таким образом, устраняя ингибирующий эффект IAP на апоптоз. В то время, как цитохром С индуцирует мультимеризацию Apaf-1 для активизации прокаспазы-9 и -3, Smac устраняет ингибирующий эффект множественных IAP. Smac взаимодействует по существу со всеми IAP, которые были иссле-1 012810 дованы до настоящего времени, в т.ч XIAP, c-IAP1, c-IAP2 и ML-IAP. Таким образом, Smac выступает главным регулятором апоптоза у млекопитающих. Было показано, что Smac действует как антагонист IAP, способствующий не только протеолитической активации прокаспаз, но также и ферментной активности зрелой каспазы, которые обе зависят от его способности к физическому взаимодействию с IAP. Рентгеновская кристаллография показала, что первые четыре аминокислоты (AVPI) зрелой Smac связываются с частью IAP. Эта N-конечная последовательность существенна для связывания IAP и блокирования их антиапоптических эффектов. Основная биология антагонистов IAP свидетельствует о том, что они могут дополнять или выступать синергистами других химиотерапевтических/антинеопластических агентов и/или облучения. Химиотерапевтические/антинеопластические агенты и облучение должны индуцировать апоптоз в результате повреждения ДНК и/или нарушения клеточного метаболизма. В настоящее время разработка лекарств от рака сосредоточена на селективной активации апоптических сигнальных путей в опухолях, сохраняя при этом нормальные клетки. Сообщалось о специфичных к опухолям свойствах определенных противоопухолевых средств, таких как TRAIL. Связанный с фактором некроза опухолей индуцирующий апоптоз лиганд (Tumor necrosis factor-Related Apoptosis-InducingLigand-TRAIL) - один из нескольких элементов суперсемейства факторов некроза опухолей (TNF), индуцирующих апоптоз посредством задействования рецепторов смерти. TRAIL взаимодействует с чрезвычайно сложной системой рецепторов, которая в организме человека включает два рецептора смерти и три рецептора ловушки. TRAIL использовался как средство против рака сам по себе или в сочетании с другими средствами, включая химиотерапевтические лекарства и ионизирующее излучение. TRAIL может инициировать апоптоз в клетках, сверхэкспрессирующих факторы выживания Bcl-2 и Bcl-XL, и может представлять собой стратегию лечения опухолей, которые обрели устойчивость к химиотерапевтическим лекарствам. TRAIL связывается с родственными рецепторами и активирует каспазный каскад, используя молекулы адаптера, такие как FADD. На сегодняшний день идентифицированы пять рецепторов TRAIL. Два рецептора TRAIL-R1 (DR4) и TRAIL-R2 (DR5) опосредуют апоптическую сигнализацию, а три нефункциональных рецептора: DcR1, DcR2 и остеопротегерин (OPG) могут выполнять роль рецепторов ловушек. Средства, повышающие экспрессию DR4 и DR5, могут проявлять синергическую противоопухолевую активность в сочетании с TRAIL. Благоприятные эффекты продуцирования TRAIL были продемонстрированы при нескольких типах рака. Например, внутрипузырное вливание вакцины BCG индуцирует иммунный отклик Th1, приводящий к продуцированию антиопухолевых цитокинов, включая TRAIL, и инфильтрацию поражения иммунными клетками, являясь первой линией лечения поверхностного рака мочевого пузыря. Исследования in vitro показывают, что интерферон альфа (INF-), который в настоящее время испытывают в рамках клинических испытаний на эффективность против рака мочевого пузыря, вызывает апоптоз, опосредованный аутокринным продуцированием TRAIL в линиях клеток рака мочевого пузыря человека. Циркулирующий уровень остеопротогерина- рецептора ловушки TRAIL - также повышен у пациентов с раком мочевого пузыря и отрицательно коррелируется со стадией рака, степенью и прогнозом. Более того, было показано, что экспрессия TRAIL клетками NK (Natural Killer-"естественными киллерами") повышается при лечении IL-2 (Интерлейкином 2), а экспрессия TRAIL необходима для полных цитотоксических влияний на клетки опухоли. Цитокин IL-2 в настоящее время одобрен для лечения меланомы и рака почки. Ингибирование репликации раковых клеток и/или репарация повреждения ДНК способствует фрагментации ядерной ДНК, таким образом, индуцируя ее переход на апоптический путь. Топоизомеразы - класс ферментов, которые уменьшают сверхскручивание ДНК путем разрыва и повторного соединения одной или нескольких нитей молекулы ДНК, играют важную роль в таких клеточных процессах, как репликация и репарация ДНК. Ингибирование этого класса ферментов ослабляет способность клетки к репликации, а также репарации поврежденной ДНК и активирует внутренний апоптический путь. Главные пути, ведущие от опосредованного топоизомеразой повреждения ДНК к гибели клетки,включают активацию каспаз в цитоплазме проапоптическими молекулами, выделенными из митохондрий, такими как Smac. Задействование этих путей апоптических эффекторов строго контролируется верхними регуляторными путями, реагирующими на повреждения ДНК, индуцированными топоизомеразными ингибиторами в клетках, в которых происходит процесс апоптоза. Инициирование клеточных откликов на повреждения ДНК, индуцированные топоизомеразными ингибиторами, обеспечивается протеинкиназами, связывающимися с разрывами ДНК. Эти киназы (неограничивающие примеры которых включают Akt, JNK и Р 38), которые обычно называются "датчиками ДНК", опосредуют репарацию ДНК,остановку клеточного цикла и/или апоптоз путем фосфорилирования большого числа субстратов, в т.ч. нескольких нижних киназ. Платиновые химиотерапевтические лекарства относятся к общей группе ДНК-модифицирующих средств. ДНК-модифицирующими средствами могут выступать любые высоко реакционноспособные химические соединения, связывающиеся с различными нуклеофильными группами в нуклеиновых кислотах и белках и вызывающие мутагенные, канцерогенные или цитотоксические эффекты. ДНКмодифицирующие средства действуют посредством различных механизмов, нарушения функции ДНК и-2 012810 гибели клетки; повреждения ДНК/образования поперечных мостиков и связей между атомами в ДНК; и индуцирования ошибочного спаривания нуклеотидов, ведущего к мутациям, с достижением того же конечного результата. Три неограничивающих примера содержащих платину ДНК-модифицирующих средств - это цисплатин, карбоплатин и оксалиплатин. Считается, что цисплатин убивает раковые клетки путем связывания с ДНК и вмешательства в механизм ее репарации, приводя, в конечном итоге, к гибели клетки. Карбоплатин и оксалиплатин являются производными цисплатина и имеют такой же механизм действия. Высоко реакционноспособные платиновые комплексы образуются внутри клетки и ингибируют синтез ДНК путем ковалентного связывания с молекулами ДНК с образованием внутринитевых и межнитевых связей в ДНК. Было показано, что нестероидные противовоспалительные лекарства (NSAID) индуцируют апоптоз в колоректальных клетках. Вероятно, NSAIDS индуцирует апоптоз посредством выделения Smac из митохондрий (PNAS, 30 ноября 2004 г., том 101:16897-16902). Поэтому следует ожидать, что использование NSAID в сочетании с миметиками Smac повышает активность каждого лекарства по сравнению с активностью каждого лекарства по отдельности. В патенте США 6992063 Ши и др. (Shi et al.) "Композиции и способ регулирования апоптоза"("Compositions and method for Regulating Apoptosis"), заявка на который была подана 28 сентября 2001 г.,а патент был получен 31 января 2006 г., включенном в данное описание во всей его полноте путем ссылки, указывается, что миметики N-концевой части Smac обеспечивают полезные варианты лекарств. Кроме того, в заявке на патент США 10/777946 Маклендон и др. (McLendon et al.) "Связывающиеся с IAP транспортные молекулы и пептидомиметики для использования в способах диагностики и лечения" ("IAP-Binding Cargo Molecules and Peptidomimetics For Use In Diagnostic and TherapeuticMethods"), поданной 12 февраля 2004 г. и включенной в данное описание во всей ее полноте путем ссылки, указывается, что транспортная молекула может присоединяться к N-концевому тетрапептидному пептидомиметику Smac. Краткое описание изобретения Настоящее изобретение предлагает соединения, имитирующие третичную структуру связыванияSmac с IAP или активность N-концевой части Smac. В объем изобретения также входят стереоизомеры описанных здесь миметических соединений. Данное изобретение также предлагает способы использования этих миметиков для модулирования апоптоза, а также в терапевтических целях. Настоящее изобретение также предлагает промежуточные соединения и способы их применения для получения соединений, модулирующих апоптоз путем имитации третичной структуры связывания Smac с IAP или активности N-концевой части Smac. Соединение согласно настоящему изобретению, имеющее общую формулу (I): отличающееся тем, что R1 и R2 независимо представляют собой Н, трет-бутоксикарбонил, бензилоксикарбонил, ацетил, трифторацетил, алкил, необязательно замещенный алкил, или где R5a и R5b независимо представляют собой Н, алкил, циклоалкил, циклоалкилалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил; или каждый из них необязательно замещен гидроксилом, меркапто, галогеном, амино, карбоксилом, алкилом, галоалкилом, алкокси или алкилтио, илиR5a и R5b независимо необязательно замещены гидроксилом, меркапто, галогеном, амино, карбоксилом,алкилом, галоалкилом, алкокси или алкилтио; или, необязательно, R5a и R5b соединены алкиленовым,алкениленовым, алкиниленовым мостиком с 2-12 атомами углерода или необязательно замещенным алкиленовым, алкениленовым, алкиниленовым мостиком с 2-12 атомами углерода, где один или несколько атомов углерода замещены N, О или S;R6a и R6b независимо представляют собой Н, трет-бутоксикарбонил, бензилоксикарбонил, ацетил,трифторацетил, алкил, низший алкил, необязательно замещенный алкил, или где R7a и R7b независимо представляют собой Н, алкил, циклоалкил, галоалкил; или R8a и R7a иR8b и R7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R8a и R8b независимо представляют собой Н, гидроксил, алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил, где каждый алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил и гетероарилалкил необязательно замещен галогеном, гидроксилом, меркапто,карбоксилом, алкилом, алкокси, амино и нитро; или R8a и R7a и R8b и R7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R3a и R3b независимо представляют собой Н, галоген, алкил, арил, арилалкил, амино, ариламино,арилалкиламино, гидрокси, алкилокси, арилокси, арилалкилгидрокси, диалкиламино, амидо, сульфонамидо или амидино;m и n независимо представляют собой 0, 1, 2 или 3;X и Y независимо представляют собой О, N, S или С=С; иR9a, R9b, R10a, R10b независимо представляют собой Н, алкил, необязательно замещенный алкил,арил, гетероарил, необязательно замещенный арил, гетероарил, или R9a и R10a, независимо или параллельно с R9b и R10b могут быть связаны 4-8 необязательно замещенными атомами, такими как С, Н, О или S, с образованием ароматического или неароматического кольца; и если Wa и Wb ковалентно связаны, Wa и Wb представляют собой связь, алкиленовую, алкениленовую, алкиниленовую, арильную, арилалкиленовую, арилалкилалкиленовую, гетероарильную, гетероарилалкиленовую или необязательно замещенную алкиленовую, алкениленовую, алкиниленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода замещены N, О или S; и R11a и R11b независимо отсутствуют или представляют собой Н, алкил, необязательно замещенный алкил, гидроксиалкил, алкоксиалкил; или R11a и R11b вместе образуют алкиленовую, алкениленовую, алкиниленовую или алкилоксиалкиленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода необязательно замещены N, О или S. Если Wa и Wb не связаны ковалентно, Wa и Wb независимо представляют собой Н, Cl, Br, F, алкил,CN, СО 2 Н; и R11a и R11b вместе образуют алкиленовую, алкениленовую, алкиниленовую или алкилоксиалкиленовую цепочку с 2-12 атомами углерода или необязательно замещенную алкиленовую, алкениленовую, алкиниленовую или алкилоксиалкиленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода необязательно замещены N, О или S; или Wa является Н, Cl, Br, F, алкилом,CN, СО 2 Н, и Wb и R11a вместе представляют собой связь, алкиленовую, алкениленовую, алкиниленовую, арильную, арилалкиленовую, арилалкилалкиленовую, гетероарильную, гетероарилалкиленовую или необязательно замещенную алкиленовую, алкениленовую, алкиниленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода могут быть замещены N, О или S, и R11b отсутствует или представляет собой Н, алкил, необязательно замещенный алкил, гидроксиалкил, алкоксиалкил. Другим вариантом осуществления настоящего изобретения является терапевтическое сочетание соединений согласно настоящему изобретению с TRAIL или другими химическими или биологическими средствами, связывающимися с рецептором (или рецепторами) TRAIL и активирующими их. С недавнего времени TRAIL стал объектом пристального внимания в результате открытия того, что многие типы раковых клеток чувствительны к индуцированному TRAIL апоптозу, в то время как нормальные клетки,похоже, устойчивы к этому действию TRAIL. Устойчивые к TRAIL клетки могут появляться посредством различных механизмов, включая утрату рецептора, присутствие рецепторов ловушек или сверхэкспрессию FLIP, конкурентно связывающегося с зимогенкаспазой-8 в процессе образования DISC. При устойчивости к TRAIL миметики Smac повышают чувствительность клеток опухоли к TRAIL, приводя к улучшению показателей клеточной смерти. Ожидается, что с этим будут связаны такие клинические результаты, как усиление апоптической активности в устойчивых к TRAIL опухолях, улучшение клиниче-4 012810 ского отклика, увеличение длительности отклика и, в конечном итоге, повышение показателей выживания среди пациентов. В подтверждение этого было показано, что снижение уровней XIAP путем in vitro антисмыслового лечения вызывает повышение чувствительности устойчивых клеток меланомы и клеток рака почки к TRAIL (Чавла-Саркар и др. (Chawla-Sarkar et al.), 2004). Раскрытые здесь миметики Smac связываются с IAP и ингибируют их взаимодействие с каспазами, таким образом, усиливая индуцированный TRAIL апоптоз. В другом варианте осуществления данного изобретения миметики Smac используются в сочетании с лечением рака мочевого пузыря вакциной BCG. XIAP-номинальная мишень миметиков Smac - сверэкспессирован в значительной части видов рака мочевого пузыря. В исследованиях с использованием антисмыслового XIAP клетки рака мочевого пузыря были сенсибилизированы к химиотерапевтическим средствам, индуцирующим апоптоз клеток посредством пути TRAIL. Настоящее изобретение предлагает миметики Smac для использования вместе с BCG-терапией рака поверхности мочевого пузыря/карциномыin situ. Раскрытые здесь миметики Smac усиливают действие вакцины BCG путем усиления влиянияTRAIL, образованного в ответ на вакцину. Аналогично, миметики Smac усиливают индуцированный TRAIL апоптоз, наблюдаемый у пациентов с меланомой и раком почек, проходящих лечение IL-2. Поскольку IL-2 индуцирует активность клеток NK путем повышения экспрессии TRAIL, дополнительное лечение активатором каспазы-9, таким как миметик Smac, обеспечит более эффективный клинический отклик. В другом варианте осуществления настоящее изобретение предлагает миметики Smac, действующие синергично с ингибиторами топоизомеразы с усилением их вызывающего апоптоз действия. Ингибиторы топоизомеразы ингибируют репликацию и репарацию ДНК, таким образом, способствуя апоптозу, и применяются в качестве химиотерапевтических средств. Ингибиторы топоизомеразы способствуют повреждению ДНК путем ингибирования ферментов, необходимых для процесса репарации ДНК. Таким образом, экспорт цитохрома С и Smac из митохондрий в цитозоль клетки индуцируется повреждением ДНК, вызванным ингибиторами топоизомеразы. Ингибиторы топоизомеразы Типа I (камптотецин, топотекан, SN-38, иринотекан, топотекан, BNP 1350, 9-амино-камптотекан, луртотекан, гриматекан, эксатекан, амсакрин и дифломотекан) и Типа II(этопосид, антрацицилин, антрахинон и подофиллотоксин) демонстрируют сильное синергичное действие с миметиками Smac согласно изобретению в мультирезистентных линиях клеток глиобластомы(T98G), рака груди (MDA-MB-231), рака яичника (OVCAR-3), а также других. Другие ингибиторы топоизомеразы включают, например, Аклациномицин А, камптотецин, даунорубицин, доксорубицин, эллиптицин, эпирубицин и митаксантрон. В другом варианте осуществления изобретения химиотерапевтическое/антинеопластическое средство может быть содержащим платину соединением. В одном варианте осуществления изобретения содержащим платину соединением является цисплатин. Цисплатин может оказывать синергичное действие с пептидомиметиком Smac и усиливать ингибирование IAP, таких как (без ограничения) XIAP, cIAP-1, cIAP-2, ML-IAP и т.д. В другом варианте осуществления изобретения содержащим платину соединением является карбоплатин. Карбоплатин может оказывать синергичное действие с пептидомиметиком Smac и усиливать ингибирование IAP, включая без ограничения XIAP, cIAP-1, c-IAP-2, ML-IAP и т.д. В другом варианте осуществления изобретения содержащим платину соединением является оксалиплатин. Оксалиплатин может оказывать синергичное действие с пептидомиметиком Smac и усиливать ингибированиеIAP, включая без ограничения XIAP, cIAP-1, c-IAP-2, ML-IAP и т.д. В другом варианте осуществления изобретения химиотерапевтическое/антинеопластическое средство, оказывающее синергичное действие с соединением согласно настоящему изобретению, является таксаном. Таксаны - это антимитотические средства, митотические ингибиторы или средства полимеризации микротрубочек. Таксаны включают без ограничения доцетаксел и паклитаксел. Таксаны характеризуются как соединения, способствующие собиранию микротрубочек путем ингибирования деполимеризации тубулина, таким образом блокируя прохождение клеточного цикла через повреждение центросом, индукцию аномальных веретен и подавление динамики микротрубочек веретена. Уникальный механизм действия таксана резко отличается от других микротрубочных ядов, таких как алкалоидов барвинка, колхицина и криптофицинов, ингибирующих полимеризацию тубулина. Микротрубочки представляют собой очень динамичные клеточные полимеры, состоящие из -тубулина и соответствующих белков и играющие ключевую роль в процессе митоза путем участия в организации и функционировании веретена, обеспечивая целостность разделенной ДНК. Поэтому они являются эффективной мишенью при лечении рака. В другом варианте осуществления любое средство, активирующее внутренний апоптический путь и/или вызывающее выделение Smac или цитохрома С из митохондрий, имеет потенциал синергичного действия с миметиком Smac. Сочетание пептидомиметика Smac и химиотерапевтического/анти-неопластического средства и/или лучевой терапии любого типа, активирующих внутренние или внешние пути или выделение Smac, может обеспечить более эффективный подход к разрушению клеток опухоли. Пептидомиметики Smac взаимодействуют с такими IAP, как XIAP, cIAP-1, cIAP-2, ML-IAP и т.д. и блокируют опосредованное IAP ин-5 012810 гибирование апоптоза, в то время как химиотерапевтические/антинеопластические средства и/или лучевая терапия убивают активно делящиеся клетки путем активации внутреннего апоптического пути, приводящего к апоптозу и клеточной смерти. Согласно приведенному ниже более подробному описанию варианты осуществления данного изобретения предлагают сочетания пептидомиметика Smac и химиотерапевтического/антинеопластического средства и/или облучения, которые обеспечивают синергичное действие против нежелательной пролиферации клеток. Такое синергичное действие пептидомиметикаSmac и химиотерапевтического/антинеопластического средства и/или лучевой терапии может повысить эффективность химиотерапевтического/антинеопластического средства и/или лучевой терапии. Это обеспечит повышение действенности имеющихся на сегодняшний день химиотерапевтических/антинеопластических средств или лучевой терапии, позволяя снизить дозу химиотерапевтического/антинеопластического средства и, таким образом, обеспечить более эффективную схему применения и лучше переносимые дозы химиотерапевтического/антинеопластического средства и/или лучевой терапии. Для упрощения и иллюстрации принципы данного изобретения будут описаны со ссылкой, в основном, на его варианты осуществления. Кроме того, многочисленные конкретные сведения включены в следующее описание с целью достижения полного понимания изобретения. Однако обычному специалисту в данной области техники будет понятно, что изобретение можно применять, не ограничивая его указанными конкретными подробностями. В других случаях авторы не приводили подробное описание хорошо известных способов и структур, чтобы без необходимости не усложнять раскрытие изобретения. Описание чертежей На фиг. 1 приведен график относительной афинности к связыванию тетрапептида Smac (AVPI) и сильного миметика Smac согласно настоящему изобретению с XIAP BIR-3. Данные получены путем анализа поляризации флуоресценции. Результаты показывают 30000-кратное повышение афинности к связыванию миметика Smac по сравнению с тетрапептидом Smac. На фиг. 2 приведен график значений полужизни трех миметиков Smac согласно настоящему изобретению после однократного внутривенного введения крысе в дозе 1 мг/кг. Результаты демонстрируют,что период полужизни тестированных миметиков составляет до шести часов. На фиг. 3 приведен график, показывающий способность миметика Smac согласно настоящему изобретению селективно противодействовать пролиферации клеток рака яичника линии SK-OV-3. В этом МТТ-анализе миметик Smac демонстрирует противораковые свойства при концентрациях, не оказывающих влияние на нормальные диплоидные клетки линии MRC-5. На фиг. 4 продемонстрировано химиоусиливающее действие миметика Smac на примере клеток меланомы, которые известны своей устойчивостью против апоптического действия TRAIL. Анализы пролиферации клеток показали, что при обработке клеток рака груди линии MDA-MB-231 только пептидомиметиком Smac-соединением 1 согласно изобретению клетки проявляли устойчивость к антипролиферативному действию миметика Smac согласно изобретению. И наоборот, при использовании соединения 1 в сочетании с TRAIL наблюдали 1000-кратное повышение антипролиферативного действия,приводящее к 100-кратному повышению показателя гибели клеток, определяемого по соответствующему ослаблению образования колонии. Подробное описание Следует отметить, что используемое в настоящем описании и формуле изобретения указание на единственное число предполагает указание и на множественное число, если только контекст четко не указывает на обратное. Если не указано иное, все употребляемые здесь технические и научные термины имеют значение, обычно воспринимаемое специалистами с обычным уровнем подготовки в области техники, к которой относится данное изобретение. Хотя в практике или тестировании вариантов осуществления данного изобретения могут использоваться способы, аналогичные или эквивалентные описанным здесь, ниже описаны предпочтительные способы. Все указанные здесь публикации и ссылки включены в описание путем ссылки. Ничто из указанного здесь не должно истолковываться таким образом, что настоящее изобретение не может иметь приоритет перед приведенными описаниями по принципу более раннего изобретения. Употребляемый здесь термин "приблизительно" означает диапазон +/- 10% от указанного с ним числового значения. Таким образом, приблизительно 50% соответствует диапазону 45-55%."Алкил" означает разветвленную или неразветвленную, насыщенную или ненасыщенную (например, алкенил, алкинил) алифатическую углеводородную группу, имеющую до 12 атомов углерода, если не указано иное. При использовании в качестве части другого термина, например, "алкиламино", алкильная часть может представлять собой цепочку насыщенного углеводорода, однако, также включает цепочки ненасыщенных углеводородов, такие как "алкениламино" и "алкиниламино". Конкретные примеры алкильных групп включают метил, этил, n-пропил, изопропил, n-бутил, изо-бутил, втор-бутил, третбутил, n-пентил, 2-метилбутил, 2,2-диметилпропил, n-гексил, 2-метилпентил, 2,2-диметилбутил, nгептил, 3-гептил, 2-метилгексил и т.п. Термины "низший алкил" "С 1-С 4 алкил" и "алкил с 1-4 атомами углерода" являются синонимами и используются взаимозаменяемо для обозначения следующих соединений: метил, этил, 1-пропил, изопропил, циклопропил, 1-бутил, втор-бутил или t-бутил. Если не указано-6 012810 иного, замещенные алкильные группы могут содержать один, два, три или четыре заместителя, которые могут быть одинаковыми или различными. Примеры указанных выше замещенных алкильных групп включают без ограничения: цианометил, нитрометил, гидроксиметил, тритилоксиметил, пропионилоксиметил, аминометил, карбоксиметил, карбоксиэтил, карбоксипропил, алкилоксикарбонилметил, аллилоксикарбониламинометил, карбамоилоксиметил, метоксиметил, этоксиметил, t-бутоксиметил, ацетоксиметил, хлорметил, бромметил, йодметил, трифторметил, 6-гидроксигексил, 2,4-дихлор(n-бутил), 2 амино(изопропил), 2-карбамоилоксиэтил и т.п. Алкильная группа может быть также замещена группой карбоцикла. Примеры включают циклопропилметильную, циклобутилметильную, циклопентилметильную и циклогексилметильную группы, а также соответствующие этильные, -пропильные, -бутильные,-пентильные, -гексильные группы и т.д. Некоторые замещенные алкилы являются замещенными метилами, например, метильная группа замещена теми же заместителями, что и "замещенная Cn-Cm алкильная" группа. Примеры замещенных метильных групп включают такие группы, как гидроксиметил, защищенный гидроксиметил (например, тетрагидропиранилоксиметил), ацетоксиметил, карбамоилоксиметил, трифторметил, хлорметил, карбоксиметил, бромметил и йодметил."Амино" означает первичный (т.е. -NH2), вторичный (т.е. -NRH) и третичный (т.е. -NRR) амины. Конкретные вторичные и третичные амины представляют собой алкиламин, диалкиламин, ариламин,диариламин, арилалкиламин и диарилалкиламин. Конкретные вторичные и третичные амины представляют собой: метиламин, этиламин, пропиламин, изопропиламин, фениламин, бензиламин диметиламин,диэтиламин, дипропиламин и дизопропиламин. Используемый отдельно или как часть другого термина "арил" означает карбоциклическую ароматическую группу, слитую или нет, имеющую указанное количество атомов углерода, а при отсутствии указания - до 14 атомов углерода. Конкретные арильные группы включают фенил, нафтил, бифенил, фенантренил, нафтаценил и т.п. (см., например, Справочник по химии Ланга, под ред. Дин Ж. А., 13 ое изд.,Таблица 7-2 [1985] (Lang's Handbook of Chemistry, (Dean, J. A., ed) 13th ed. Table 7-2 [1985]. В конкретном варианте осуществления арильная группа является фенилом. Замещенный фенил или замещенный арил означает фенильную группу или арильную группу, замещенную одним, двумя, тремя, четырьмя или пятью заместителями, выбранными, если не указано иное, из галогена (F, Cl, Br, I), гидрокси, защищенного гидрокси, циано, нитро, алкила (такого как С 1-С 6 алкил), алкокси (такого как С 1-С 6 алкокси), бензилокси, карбокси, защищенного карбокси, карбоксиметила, защищенного карбоксиметила, гидроксиметила, защищенного гидроксиметила, аминометила, защищенного аминометила, трифторметила, алкилсульфониламино, арилсульфониламино, гетероциклилсульфониламино, гетероциклила, арила или других указанных групп. Одна или несколько групп метина (СН) и/или метилена (СН 2) в этих заместителях могут, в свою очередь, быть замещены группами, аналогичными указанным выше. Примеры термина "замещенный фенил" включают без ограничения моно- или ди(гало)фенильную группу, такую как 2 хлорфенил, 2-бромфенил, 4-хлорфенил, 2,6-дихлорфенил, 2,5-дихлорфенил, 3,4-дихлорфенил, 3 хлорфенил, 3-бромфенил, 4-бромфенил, 3,4-дибромфенил, 3-хлор-4-фторфенил, 2-фторфенил и т.п.; моно- или ди(гидрокси)фенильную группу, такую как 4-гидроксифенил, 3-гидроксифенил, 2,4 дигидроксифенил, их защищенные гидроксипроизводные и т.п.; нитрофенильную группу, такую как 3 или 4-нитрофенил; цианофенильную группу, например 4-цианофенил; моно- или ди(низший алкил)фенильную группу, такую как 4-метилфенил, 2,4-диметилфенил, 2-метилфенил, 4-(изопропил)фенил, 4-этилфенил, 3-(n-пропил)фенил и т.п.; моно- или ди(алкокси)фенильную группу, например 3,4-диметоксифенил, 3-метокси-4-бензилоксифенил, 3-метокси-4-(1-хлорметил)бензилоксифенил, 3 этоксифенил, 4-(изопропокси)фенил, 4-(t-бутокси)фенил, 3-этокси-4-метоксифенил и т.п.; 3- или 4 трифторметилфенил; моно- или дикарбоксифенильную или (защищенную карбокси)фенильную группу,такую как 4-карбоксифенил; моно- или ди(гидроксиметил)фенил или (защищенный гидроксиметил)фенил, такой как 3-(защищенный гидроксиметил)фенил или 3,4-ди(гидроксиметил)фенил; моно- или ди (аминометил)фенил или (защищенный аминометил)фенил, такой как 2-(аминометил)фенил или 2,4(защищенный аминометил)фенил; или моно- или ди(N-(метилсульфониламинофенил, такой как 3-(Nметилсульфониламинофенил. Также термин "замещенный фенил" обозначает дизамещенные фенильные группы, где заместители являются различными, например, 3-метил-4-гидроксифенил, 3-хлор-4 гидроксифенил, 2-метокси-4-бромфенил, 4-этил-2-гидроксифенил, 3-гидрокси-4-нитрофенил, 2 гидрокси-4-хлорфенил и т.п.; а также тризамещенные фенильные группы, в которых заместители являются различными, например, 3-метокси-4-бензилокси-6-метилсульфониламино, 3-метокси-4-бензилокси 6-фенилсульфониламино, и тетразамещенные фенильные группы, в которых заместители являются различными, такие как 3-метокси-4-бензилокси-5-метил-6-фенилсульфониламино. Конкретными замещенными фенильными группами являются: 2-хлорфенильная, 2-аминофенильная, 2-бромфенильная, 3 метоксифенильная, 3-этоксифенильная, 4-бензилоксифенильная, 4-метоксифенильная, 3-этокси-4 бензилоксифенильная, 3,4-диэтоксифенильная, 3-метокси-4-бензилоксифенильная, 3-метокси-4-(1 хлорметил)бензилоксифенильная,3-метокси-4-(1-хлорметил)бензилокси-6-метилсульфониламинофенильная группы. Слитые арильные кольца также могут быть замещены указанными здесь заместителями, например 1, 2 или 3 заместителями, таким же образом, как и замещенные алкильные группы. Употребляемый здесь термин алкиленовый радикал включает ссылку на дифункциональный насы-7 012810 щенный разветвленный или неразветвленный углеводородный радикал, содержащий 1-30 атомов углерода, и включает, например, метилен (СН 2), этилен (СН 2 СН 2), пропилен (СН 2 СН 2 СН 2), 2-метилпропилен(СН 2 СН(СН 3)СН 2), гексилен СН 2)6) и т.п. Низший алкилен включает алкиленовую группу из 1-10,предпочтительно 1-5 атомов углерода. Замещенные алкиленовые радикалы включает ссылку на дифункциональный насыщенный разветвленный или неразветвленный алкиленовый радикал или группу, включающую 1-30 атомов углерода и имеющую от 1 до 5 заместителей. Низшие замещенные алкиленовые радикалы означают группу замещенного алкиленового радикала, включающую 1-10 атомов углерода, предпочтительно 1-5 атомов углерода, и имеющую от 1 до 5 заместителей. Заместители могут включать, без ограничения, указанные для алкильных групп. Употребляемый здесь термин алкенильный радикал включает ссылку на разветвленный, циклический углеводородный или неразветвленный углеводородный радикал, содержащий 2-30 атомов углерода и включающий по меньшей мере одну двойную связь углерод-углерод, такой как этенил, n-пропенил,изопропенил, n-бутенил, изобутенил, t-бутенил, октенил, деценил, тетрадеценил, гексадеценил, эйкосенил, тетракосенил и т.п. Термин низший алкенил включает алкенильную группу из 2-10 атомов углерода,предпочтительно 2-5 атомов углерода, содержащую по меньшей мере одну двойную связь углеродуглерод. Одна или несколько двойных связей углерод-углерод могут независимо иметь цис- или трансконфигурацию. Замещенный алкенильный радикал означает группу алкенильного радикала или низшего алкенила, имеющую 1-5 заместителей, которые могут включать, без ограничения, указанные для алкильных групп. Термин алкениленовый радикал включает ссылку на дифункциональный разветвленный или неразветвленный углеводородный радикал или группу, включающую 2-30 атомов углерода и по меньшей мере одну двойную связь углерод-углерод. "Низший алкенилен" включает алкениленовую группу из 2-10,предпочтительно 2-5 атомов углерода, содержащую одну двойную связь углерод-углерод. Замещенный алкениленовый радикал означает группу алкениленового радикала или низшего алкенила, имеющую 1-5 заместителей, которые могут включать, без ограничения, указанные для алкильных групп. Термин алкинильный радикал или группа означает углеводородный радикал с неразветвленной или разветвленной цепочкой, имеющий 2-12 атомов углерода и по меньшей мере одну тройную связь, некоторые варианты осуществления включают алкинильные группы, имеющие 2-6 атомов углерода и одну тройную связь. Замещенный алкинил содержит один, два или три заместителя, определенных для замещенных алкильных групп. Алкинилен включает ссылку на дифункциональную разветвленную или неразветвленную углеводородную цепочку, включающую 2-12 атомов углерода и по меньшей мере одну тройную связь углерод-углерод; некоторые варианты осуществления включают алкиниленовые группы с 2-6 атомами углерода и одной тройной связью. Замещенный алкинилен содержит один, два или три заместителя, определенных для замещенных алкильных групп."Гетероциклическая группа", "гетероциклический", "гетероцикл", "гетероциклил" или "гетероцикло" отдельно или в качестве части сложной группы, такой как гетероциклоалкильная группа, используются взаимозаменяемо и означают любое моно-, би- или трициклическое, насыщенное или ненасыщенное, ароматическое (гетероарильное) или неароматическое кольцо с указанным количеством атомов, в общем, от 5 до приблизительно 14 атомов в кольце, где атомы в кольце представляют собой углерод и по меньшей мере один гетероатом (азот, сера или кислород). В отдельном варианте осуществления группа включает 1-4 гетероатома. Как правило, 5-членное кольцо имеет 0-2 двойные связи, а 6- или 7-членное кольцо имеет 0-3 двойные связи, гетероатомы азота или серы могут быть необязательно окислены (например, SO, SO2), а любой гетероатом азота может быть необязательно кватернизован. Некоторые неароматические гетероциклы включают: морфолинил (морфолино), пирролидинил, оксиранил, оксэтанил,тетрагидрофуранил, 2,3-дигидрофуранил, 2 Н-пиранил, тетрагидропиранил, тииранил, тиэтанил, тетрагидротиэтанил, азиридинил, азетидинил, 1-метил-2-пирролил, пиперазинил и пиперидинил. "Гетероциклоалкильная" группа является гетероциклической группой, как определено выше, ковалентно связанной с определенной выше алкильной группой. Некоторые 5-членные гетероциклы, содержащие атом серы или кислорода и от одного до трех атомов азота, включают тиазолил, такой как тиазол-2-ил и тиазол-2-ил N-оксид, тиадиазолил, такой как 1,3,4-тиадиазол-5-ил и 1,2,4-тиадиазол-5-ил, оксазолил, такой как оксазол-2-ил, и оксадиазолил, такой как 1,3,4-оксадиазол-5-ил и 1,2,4-оксадиазол-5-ил. Некоторые 5-членные гетероциклы, содержащие 2-4 атома азота, включают имидазолил, такой как имидазол-2-ил; триазолил, такой как 1,3,4-триазол-5-ил,1,2,3-триазол-5-ил и 1,2,4-триазол-5-ил, и тетразолил, такой как 1H-тетразол-5-ил. Некоторые бензослитые 5-членные гетероциклы представляют собой бензоксазол-2-ил, бензтиазол-2-ил и бензимидазол 2-ил. Некоторые 6-членные гетероциклы содержат от одного до трех атомов азота и, необязательно, атом серы или кислорода, например, пиридил, такой как пирид-2-ил, пирид-3-ил и пирид-4-ил; пиримидил,такой как пиримид-2-ил и пиримид-4-ил; триазинил, такой как 1,3,4-триазин-2-ил и 1,3,5-триазин-4-ил; пиридазинил, такой как пиридазин-3-ил, и пиразинил. Заместители для необязательно замещенных гетероциклов и дальнейшие примеры 5- и 6-членных кольцевых систем указаны в патенте США 4278793,выданном В. Друкхаймер и др. (W. Drackheimer et al.).-8 012810 Арилалкильные радикалы - это алкильные радикалы, имеющие арильный заместитель и включающие от приблизительно 6 до приблизительно 20 атомов углерода (и все сочетания и субсочетания диапазонов и конкретных количеств атомов углерода в них), предпочтительно от приблизительно 6 до приблизительно 12 атомов углерода. Арилалкильные группы могут быть необязательно замещены. Неограничивающие примеры включают бензил, нафтилметил, дифенилметил, трифенилметил, фенилэтил и дифенилэтил. Замещенная арилалкильная группа содержит один или несколько заместителей в арильной или алкильной группе, определенных для замещенных алкильных групп. Циклоалкиларильный радикал или группа означает циклоалкильный радикал, слитый с арильной группой, включая все сочетания независимо замещенных алкил циклоалкиларилов, циклоалкильных и арильных групп, имеющих два общих атома. Циклоалкильный радикал или группа, конкретнее, включает ссылку на моновалентный насыщенный карбоциклический алкильный радикал, состоящий из одного или нескольких колец и имеющий от приблизительно 3 до приблизительно 14 атомов углерода (и все сочетания и субсочетания диапазонов и конкретных количеств атомов углерода в них), предпочтительно от приблизительно 3 до приблизительно 7 атомов углерода. Многокольцевые структуры могут быть связанными мостиками или слитыми. Кольца могут быть необязательно замещенными одним или несколькими заместителями, указанными для алкильных групп. Примеры циклоалкильных групп включают без ограничения циклопропил, циклобутил,циклопентил, циклогексил, циклооктил и адамантил. Замещенная циклоалкильная группа содержит один или несколько заместителей, определенных для замещенных алкильных групп. Циклоалкилалкильные радикалы, конкретнее, означают алкильные радикалы, имеющие циклоалкильный заместитель и включающие от приблизительно 4 до приблизительно 20 атомов углерода (и все сочетания и субсочетания диапазонов и конкретных количеств атомов углерода в них), предпочтительно от приблизительно 6 до приблизительно 12 атомов углерода, и могут включать без ограничения метилциклопропильные, метилциклогексильные, изопропилциклогексильные и бутилциклогексильные группы. Циклоалкилалкильный радикал или группа могут быть необязательно замещенными одним или несколькими заместителями, указанными для алкильных групп, включающими без ограничения гидрокси,циано, алкил, алкокси, тиоалкил, гало, галоалкил, гидроксиалкил, нитро, амино, алкиламино и диалкиламино."Гетероарил" отдельно или в качестве части сложной группы, такой как гетероарилалкильная группа, означает любую моно-, би- или трициклическую ароматическую кольцевую систему с указанным количеством атомов, в которой по меньшей мере одно кольцо является 5-, 6- или 7-членным кольцом,имеющим от одного до четырех гетероатомов, выбранных из группы: азот, кислород и сера (Lang'sHandbook of Chemistry, см. выше). В определение включены любые бициклические группы, в которых любое из указанных выше гетероарильных колец слито с бензольным кольцом. Следующие кольцевые системы являются примерами гетероарильных (замещенных или незамещенных) групп, обозначенных термином "гетероарил": тиенил, фурил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, оксадиазолил, тетразолил, тиатриазолил, оксатриазолил, пиридил,пиримидил, пиразинил, пиридазинил, тиазинил, оксазинил, триазинил, тиадиазинил, оксадиазинил, дитиазинил, диоксазинил, оксатиазинил, тетразинил, тиатриазинил, оксатриазинил, дитиадиазинил, имидазолинил, дигидропиримидил, тетрагидропиримидил, тетразоло[1,5-b]пиридазинил и пуринил, а также бензо-слитые производные, например бензоксазолил, бензофурил, бензотиазолил, бензотиадиазолил,бензотриазолил, бензоимидазолил и индолил. В частности, "гетероарилы" включают 1,3-тиазол-2-ил, 4(карбоксиметил)-5-метил-1,3-тиазол-2-ил, 4-(карбоксиметил)-5-метил-1,3-тиазол-2-ила натриевую соль,1,2,4-тиадиазол-5-ил, 3-метил-1,2,4-тиадиазол-5-ил, 1,3,4-триазол-5-ил, 2-метил-1,3,4-триазол-5-ил, 2 гидрокси-1,3,4-триазол-5-ил, 2-карбокси-4-метил-1,3,4-триазол-5-ила натриевую соль, 2-карбокси-4 метил-1,3,4-триазол-5-ил, 1,3-оксазол-2-ил, 1,3,4-оксадиазол-5-ил, 2-метил-1,3,4-оксадиазол-5-ил, 2(гидроксиметил)-1,3,4-оксадиазол-5-ил, 1,2,4-оксадиазол-5-ил, 1,3,4-тиадиазол-5-ил, 2-тиол-1,3,4 тиадиазол-5-ил, 2-(метилтио)-1,3,4-тиадиазол-5-ил, 2-амино-1,3,4-тиадиазол-5-ил, 1 Н-тетразол-5-ил, 1 метил-1H-тетразол-5-ил, 1-(1-(диметиламино)эт-2-ил)-1H-тетразол-5-ил, 1-(карбоксиметил)-1H-тетразол 5-ил, 1-(карбоксиметил)-1H-тетразол-5-ила натриевую соль, 1-(метилсульфокислота)-1 Н-тетразол-5-ил,1-(метилсульфокислота)-1H-тетразол-5-ила натриевую соль, 2-метил-1H-тетразол-5-ил, 1,2,3-триазол-5 ил, 1-метил-1,2,3-триазол-5-ил, 2-метил-1,2,3-триазол-5-ил, 4-метил-1,2,3-триазол-5-ил, пирид-2-ил Nоксид, 6-метокси-2-(n-оксид)пиридаз-3-ил, 6-гидроксипиридаз-3-ил, 1-метилпирид-2-ил, 1-метилпирид-4 ил, 2-гидроксипиримид-4-ил, 1,4,5,6-тетрагидро-5,6-диоксо-4-метил-аз-триазин-3-ил, 1,4,5,6-тетрагидро 4-(формилметил)-5,6-диоксо-аз-триазин-3-ил,2,5-дигидро-5-оксо-6-гидрокси-азтриазин-3-ил,2,5 дигидро-5-оксо-6-гидрокси-аз-триазин-3-ила натриевую соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метилазтриазин-3-ила натриевую соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-аз-триазин-3-ил, 2,5-дигидро-5 оксо-6-метокси-2-метил-аз-триазин-3-ил, 2,5-дигидро-5-оксо-аз-триазин-3-ил, 2,5-дигидро-5-оксо-2 метил-аз-триазин-3-ил, 2,5-дигидро-5-оксо-2,6-диметил-аз-триазин-3-ил, тетразоло[1,5-b]пиридазин-6-ил и 8-аминотетразоло[1,5-b]-пиридазин-6-ил. Альтернативная группа "гетероарила" включает 4(карбоксиметил)-5-метил-1,3-тиазол-2-ил, 4-(карбоксиметил)-5-метил-1,3-тиазол-2-ила натриевую соль,1,3,4-триазол-5-ил, 2-метил-1,3,4-триазол-5-ил, 1H-тетразол-5-ил, 1-метил-1 Н-тетразол-5-ил, 1-(1-9 012810"Ингибитор" означает соединение, снижающее или препятствующее связыванию белков IAP с белками каспазы, снижает или предотвращает ингибирование апоптоза белком IAP или связывается с доменом BIR IAP образом, аналогичным аминоконцевой части Smac, таким образом, высвобождая Smac для ингибирования действия IAP."Фармацевтически приемлемые соли" включают кислотные и основные аддитивные соли. "Фармацевтически приемлемые кислотные аддитивные соли" означают соли, сохраняющие биологическое действие и свойства свободных оснований, не являющиеся нежелательными с биологической или иной точки зрения, образованные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и т.п, и органическими кислотами, выбранными из классов алифатических, циклоалифатических, ароматических,аралифатических, гетероциклических, карбоновых и сульфоновых органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота,малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота, глютаминовая кислота, антраниловая кислота, бензойная кислота,коричная кислота, миндальная кислота, эмбоновая кислота, фенилуксусная кислота, метансульфокислота, этансульфокислота, р-толуолсульфокислота, салициловая кислота и т.п. Термины "миметик", "пептид-миметик" и "пептидомиметик" используются здесь взаимозаменяемо и в целом означают пептидную, частично пептидную или непептидную молекулу, имитирующую третичную структуру связывания или активность выбранного нативного пептида или функциональной области белка (например, мотив связывания или активный сайт). Эти пептиды-миметики включают рекомбинантно или химически модифицированные пептиды, а также непептидные средства, такие как миметики лекарственных средств с малыми молекулами, описанные ниже. Употребляемые здесь понятия "фармацевтически приемлемый", "физиологически переносимый" и их грамматические формы, относящиеся к композициям, носителям, разбавителям и реагентам, используются взаимозаменяемо и означают материалы, которые могут вводиться млекопитающим без нежелательных физиологических последствий, таких как тошнота, головокружение, сыпь или расстройство желудка."Обеспечение" при использовании в связи с терапевтическими средствами означает введение лекарства непосредственно в ткань-мишень или на нее или введение лекарства пациенту, при котором терапевтическое средство оказывает положительное влияние на ткань-мишень. Употребляемый здесь термин "субъект" или "пациент" означает животное или млекопитающее,включая (без ограничения) человека, собаку, кошку, лошадь, корову, свинью, овцу, козу, курицу, обезьяну, кролика, крысу, мышь и т.д. Употребляемый здесь термин "терапевтический" означает средство, используемое для лечения,борьбы, облегчения, предотвращения или улучшения нежелательного состояния или болезни у пациента. Варианты осуществления данного изобретения направлены на содействие апоптозу и, таким образом,клеточной смерти. Употребляемые здесь понятия "терапевтически эффективное количество" или "эффективное количество" могут использоваться взаимозаменяемо и означают количество компонента терапевтического соединения согласно настоящему изобретению. Например, терапевтически эффективное количество терапевтического соединения - это предварительно определенное количество, рассчитанное для достижения требуемого эффекта, т.е. для того, чтобы эффективно содействовать апоптозу или повысить чувствительность клетки к апоптозу, предпочтительно, путем устранения ингибирования IAP апоптоза, более предпочтительно, путем ингибирования связывания IAP с каспазой."Миметики" или "пептидомиметики" - это синтетические соединения, имеющие трехмерную структуру (т.е. "мотив основного пептида"), основанную на трехмерной структуре выбранного пептида. Пептидный мотив обеспечивает соединению миметика требуемую биологическую активность, т.е. связывание с IAP, причем активность связывания соединения миметика по существу не снижается, и часто является такой же или большей, чем афинность к связыванию нативного пептида, на основании которого миметик был смоделирован. Например, у миметиков согласно настоящему изобретению нами было обнаружено, что Х 3 и Х 4 могут быть достаточно непохожими на пептид. Соединения пептидомиметика могут иметь дополнительные характеристики, расширяющие спектр их терапевтического применения, такие как повышенная клеточная проницаемость, большая афинность и/или авидность, а также более длительный период биологической полужизни. Стратегии создания миметика, а конкретнее, пептидомиметика хорошо известны из уровня техники- 10012810 и могут быть легко адаптированы к настоящему изобретению (см., например, Рипка и Рич, Совр. мнен. в хим. биол. 2, 441-452, 1998; Хруби и др., Совр. мнен. в хим. биол. 1, 114-119, 1997; Хруби и Бэлс, Совр. мед. химия 9, 945-970,2000 (RipkaRich, Curr. Op. Chem. Biol. 2, 441-452, 1998; Hraby et al., Curr. Op.Chem. Biol. 1, 114-119, 1997; HrubyBalse, Curr. Med. Chem. 9, 945-970, 2000. Один класс миметиков имитирует остов, полностью или частично не являющийся пептидом, однако имитирует пептидный остов атом за атомом и содержит боковые группы, которые аналогично имитируют функциональность боковых групп нативных аминокислотных остатков. Несколько типов химических связей, например, сложноэфирная, тиосложноэфирная, тиоамидная, ретроамидная, восстановленная карбонильная, диметиленовая и кетометиленовая связи известны из уровня техники как, в целом, полезные замены пептидных связей в построении протеаза-устойчивых пептидомиметиков. Другой класс пептидомиметиков включает малые непептидные молекулы, которые связываются с другим пептидом или белком, однако необязательно являются структурным миметиком нативного пептида. Еще один класс пептидомиметиков возник благодаря комбинаторной химии и созданию обширных химических библиотек. Они обычно включают новые шаблоны, которые, хотя структурно не связаны с нативными пептидами, обладают необходимыми функциональными группами, расположенными в непептидном каркасе, которые служат "топографическими" миметиками первоначального пептида (Рипка и Рич (RipkaRich), 1998, см. выше). Тетрапептидомиметики согласно изобретению относятся к типу, раскрытому и указанному в формуле изобретения патента США 6992063 на имя Ши и др. (Shi et al.). В соответствии с настоящим изобретением было показано, что связывающиеся с IAP пептиды или их миметики способны усиливать апоптоз клеток. Миметики основных связывающихся с IAP частей являются предпочтительными. Описанные здесь миметики в подходящем случае являются малыми, и поскольку структурные характеристики в отношении связывающегося с IAP желобка хорошо охарактеризованы, можно синтезировать широкий спектр соединений миметиков. Дополнительные преимущества соединений этого размера включают улучшенную растворимость в водном растворе и простоту доставки к выбранным мишеням in vivo. В одном варианте осуществления связывающиеся с IAP пептиды согласно изобретению модифицируются с образованием пептидных миметиков путем замены одной или нескольких встречающихся в природе боковых цепочек из 20 генетически кодированных аминокислот или D аминокислот другими боковыми цепочками, например, группами, такими как алкил, низший алкил, циклический 4-, 5-, 6-, 7 членный алкил, амид, амид низший алкил, амид ди(низший алкил), низший алкокси, гидрокси, карбокси и их низшие сложноэфирные производные, и 4-, 5-, 6-, 7-членными гетероциклами. Например, могут быть получены пролиновые аналоги, в которых размер кольца пролинового остатка изменяется от 5 членов до 4, 6 или 7 членов. Циклические группы могут быть насыщенными или ненасыщенными, и если они ненасыщенные - ароматическими или неароматическими. Гетероциклические группы могут содержать один или несколько гетероатомов азота, кислорода и/или серы. Примеры таких групп включают фуразанил, имидазолидинил, имидазолил, имидазолинил, изотиазолил, изоксазолил, морфолинил (например, морфолино), оксазолил, пиперазинил (например, 1-пиперазинил), пиперидил (например, 1 пиперидил, пиперидино), пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил,пиридил, пиримидинил, пирролидинил (например, 1-пирролидинил), пирролинил, пирролил, тиадиазолил, тиазолил, тиенил, тиоморфолинил (например, тиоморфолино) и триазолил. Эти гетероциклические группы могут быть замещенными или незамещенными. Если группа является замещенной, заместителем может быть алкил, алкокси, галоген, кислород или замещенный или незамещенный фенил. Пептидомиметики могут также иметь аминокислотные остатки, химически модифицированные путем фосфорилирования, сульфонирования, биотинилирования или добавления или удаления этих частей. Настоящее изобретение предлагает соединения, имитирующие третичную структуру связыванияSmac с IAP или активность N-концевой части Smac. В объем изобретения также входят стереоизомеры описанных здесь миметических соединений. Данное изобретение также предлагает способы использования этих миметиков для модулирования апоптоза, а также в терапевтических целях. Настоящее изобретение также предлагает промежуточные соединения и способы их применения для получения соединений, модулирующих апоптоз путем имитации третичной структуры связывания Smac с IAP или активности N-концевой части Smac. В соответствии с настоящим изобретением предлагаются соединения общей формулы (I): отличающиеся тем, что R1 и R2 независимо представляют собой Н, трет-бутоксикарбонил, бензилоксикарбонил, ацетил, трифторацетил, алкил, необязательно замещенный алкил, или где R5a и R5b независимо представляют собой Н, алкил, циклоалкил, циклоалкилалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил или каждый из них необязательно замещен гидроксилом, меркапто, галогеном, амино, карбоксилом, алкилом, галоалкилом, алкокси или алкилтио; илиR5a и R5b независимо необязательно замещены гидроксилом, меркапто, галогеном, амино, карбоксилом,алкилом, галоалкилом, алкокси или алкилтио; или, необязательно, R5a и R5b соединены алкиленовым,алкениленовым, алкиниленовым мостиком с 2-12 атомами углерода или необязательно замещенным алкиленовым, алкениленовым, алкиниленовым мостиком с 2-12 атомами углерода, где один или несколько атомов углерода замещены N, О или S;R6a и R6b независимо представляют собой Н, трет-бутоксикарбонил, бензилоксикарбонил, ацетил,трифторацетил, алкил, низший алкил, необязательно замещенный алкил, или где R7a и R7b независимо представляют собой Н, алкил, циклоалкил, галоалкил; или R8a и R7a иR8b и R7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R8a и R8b независимо представляют собой Н, гидроксил, алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил, где каждый алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил и гетероарилалкил необязательно замещен галогеном, гидроксилом, меркапто,карбоксилом, алкилом, алкокси, амино и нитро; или R8a и R7a и R8b и R7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R3a и R3b независимо представляют собой Н, галоген, алкил, арил, арилалкил, амино, ариламино,арилалкиламино, гидрокси, алкилокси, арилокси, арилалкилгидрокси, диалкиламино, амидо, сульфонамидо или амидино;m и n независимо представляют собой 0, 1, 2 или 3;X и Y независимо представляют собой О, N, S или С=С;R9a, R9b, R10a, R10b независимо представляют собой Н, алкил, необязательно замещенный алкил,арил, гетероарил, необязательно замещенный арил, гетероарил, или R9a и R10a, независимо или параллельно с R9b и R10b, могут быть связаны 4-8 необязательно замещенными атомами, такими как С, Н, О или S, с образованием ароматического или неароматического кольца; Если Wa и Wb ковалентно связаны, Wa и Wb представляют собой связь, алкиленовую, алкениленовую, алкиниленовую, арильную, арилалкиленовую, арилалкилалкиленовую, гетероарильную, гетероари- 12012810 лалкиленовую или необязательно замещенную алкиленовую, алкениленовую, алкиниленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода замещены N, О или S; и R11a и R11b независимо отсутствуют или представляют собой Н, алкил, необязательно замещенный алкил, гидроксиалкил, алкоксиалкил; или R11a и R11b вместе образуют алкиленовую, алкениленовую, алкиниленовую или алкилоксиалкиленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода необязательно замещены N, О или S. Если Wa и Wb не связаны ковалентно, Wa и Wb независимо представляют собой Н, Cl, Br, F, алкил,CN, CO2H; и R11a и R11b вместе образуют алкиленовую, алкениленовую, алкиниленовую или алкилоксиалкиленовую цепочку с 2-12 атомами углерода или необязательно замещенную алкиленовую, алкениленовую, алкиниленовую или алкилоксиалкиленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода необязательно замещены N, О или S; или Wa является Н, Cl, Br, F, алкилом,CN, СО 2 Н, и Wb и R11a вместе представляют собой связь, алкиленовую, алкениленовую, алкиниленовую, арильную, арилалкиленовую, арилалкилалкиленовую, гетероарильную, гетероарилалкиленовую или необязательно замещенную алкиленовую, алкениленовую, алкиниленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода могут быть замещены N, О или S; и R11b отсутствует или представляет собой Н, алкил, необязательно замещенный алкил, гидроксиалкил, алкоксиалкил. Соединения, охватываемые настоящим изобретением, включают миметики Smac и их промежуточные соединения. Настоящее изобретение включает стереоизомеры каждого из раскрытых соединений. В целом, соединения согласно настоящему изобретению включают тетрапептидные миметики Smac, ковалентно связанные димеры тетрапептидных миметиков Smac и ковалентно связанные гомодимеры тетрапептидных миметиков Smac. Гомодимеры - это миметики, в которых по существу идентичные тетрапептидные миметики ковалентно связаны. Приведенные ниже экспериментальные схемы используются для получения соединений, впервые раскрытых в РСТ публикацииWO 2004/007529, включенной сюда во всей своей полноте путем ссылки. Подходящие пептиды и пептидомиметики также описаны в заявке на патент США 11/184503, поданной 15 июля 2005 г. "Связывающиеся с IAP соединения", основанной на предварительной заявке 60/588050, поданной 15 июля 2004 г., раскрытия которых включены сюда путем ссылки во всей их полноте. Аффинность к связыванию соединений согласно настоящему изобретению к XIAP определяли методом, описанным Николовска-Колеска З. и др. (Nikolovska-Coleska, Z. et.al.) (Аналитическая биохимия(2004), том 332:261-273 (Analytical Biochemistry (2004), vol. 332:261-273, используя различные флуорогенные субстраты, и выражалась в виде значений KD. Вкратце, различные концентрации тестируемых пептидов смешивали с 5 нМ флуоресцентно меченого пептида (AbuRPF-K(5-Fam)-NH2) и 40 нМ XIAPBIR3 в течение 15 мин при комнатной температуре в 100 мкл 0,1 М буфера фосфата калия, рН 7,5, содержащем 100 мкг/мл бычьего -глобулина. После инкубации значения поляризации (mP) измеряли Victor2V, используя 485 нм активирующий фильтр и 520 нм эмиссионный фильтр. Значения IC50 определяли по графику, используя нелинейный анализ методом наименьших квадратов с помощью GraphPad Prism. Описанные здесь соединения обеспечивают значения KD в диапазоне: KD0,1 мкМ (A), KD=0,1-1 мкМNBS (3,2 г, 17,9 ммоль) добавляли к раствору, содержащему 1 (5,4 г, 17,0 ммоль) в CCl4 (50 мл). Гетерогенную реакционную смесь нагревали с обратным холодильником (80-85 С) в течение 2 ч. На этом этапе анализ ТСХ показал полное израсходование 1. [Анализ ТСХ, 4:1 гексан/EtOAc, Rf(8)=0,4;Rf(2)=0,5]. Реакционную смесь охлаждали до температуры окружающей среды, а затем выливали на колонку с силикагелем. Продукт элюировали 10-15% EtOAc/гексана с получением 4,4 г (65%) 2 в виде белого твердого вещества. Н ЯМР (DMSO, 300 МГц)11,74 (s, 1H), 7,56 (m, 1H), 7,02 (d, J=9,3 Гц, 1H), 6,88 (m, 1 Н), 3,99 (m,1H), 3,22 (m, 2 Н), 2,97 (m, 1 Н), 2,58 (dd, J= 13,5, 9,3 Гц, 1H), 1,9-1,5 (4 Н), 1,40 (s, 9H) частей на миллион. 1,4-Бис-[2-(6-фтор-1H-индол-3-илметил)пирролидин-1-карбоновой кислоты трет-бутил сложный эфир]бензол (4): Раствор, содержащий 2 (3,3 г, 8,3 ммоль), в толуоле (25 мл), EtOH (25 мл) и воде (1 мл) дегазировали под высоким вакуумом. K2CO3 (4,5 г, 32,5 ммоль), 3 (0,97 г, 5,8 ммоль) и (Ph3P)4Pd (0,29 г, 0,25 ммоль) добавляли, и полученную смесь перемешивали при 100 С в течение 5 ч. [Анализ ТСХ, 4:1 гексан/EtOAc,Rf(2) - 0,5; Rf(4)=0,3]. Реакционную смесь фильтровали через короткий слой силикагеля и промывали 5%EtOAc/гексана. Фильтрат концентрировали и неочищенный продукт очищали флэш-хроматографией на силикагеле (20% EtOAc/гексан) с получением 3,0 г (98%) 4 в виде беловатого, высоко флуоресцентного твердого вещества. 1 1,4-Бис-2-[1-(2-ацетоксиэтил)-6-фтор-1 Н-индол-3-илметил]пирролидин-1-карбоновой кислоты трет-бутил сложный эфирбензол (6): К суспензии 60% NaH (0,67 г, 17,0 ммоль) в безводном DMF (10 мл) добавляли раствор 4 (3,0 г, 4,2 ммоль) в DMF (10 мл) при 0 С. Реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч, а затем вновь охлаждали до 0 С. Раствор, содержащий 5 (2,8 г, 16,8 ммоль) в DMF (5 мл),добавляли в реакционную смесь и после добавления удаляли ледяную баню. Через 2 ч при температуре окружающей среды анализ LC/MS и ТСХ показал завершение расходования 4. [Анализ ТСХ, 4:1 гексан/EtOAc, Rf(4)=0,4; Rf(6)=0,8]. Реакционную смесь охлаждали до 0 С и добавляли насыщенный водныйNH4Cl. Продукт экстрагировали диэтиловым эфиром. Эфирные экстракты промывали водой, рассолом,сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали НФВЭЖХ (силикагель, 10-100% EtOAc/гексан более 30 мин) с получением 1,4 г 6 в виде беловатого твердого вещества. 1 Н ЯМР (CDCl3, 300 МГц)7,68 (m, 2 Н), 7,54 (s, 4 Н), 7,12 (m, 2 Н), 6,94 (m, 2 Н), 4,25 (m, 4 Н), 4,14 Уксусной кислоты 2-(2-4-[1-(2-ацетоксиэтил)-6-фтор-3-пирролидин-2-илметил-1 Н-индол-2-ил]фенил-6-фтор-3-пирролидин-2-илметилиндол-1-ил)сложный эфир (7): Раствор, содержащий 6 (1,4 г, 1,58 ммоль) в DCM (20 мл), охлаждали до 0 С. TFA (5 мл) добавляли через пипетку, и реакции давали нагреться до температуры окружающей среды и следили за ней до тех пор, пока анализ ТСХ не показал полное использование 6 (2 ч). Анализ ТСХ, 10% MeOH/DCM,Rf(6)=0,7; Rf(7)=0,2. Растворитель удаляли на роторном испарителе, а остаток растворяли в EtOAc. Раствор EtOAc дважды промывали насыщенным водным NaHCO3 и один раз рассолом. Объединенные вод- 14012810 ные промывки вновь экстрагировали EtOAc и органические экстракты сушили над безводным Na2SO4,фильтровали и концентрировали с получением 1,2 г (кол.) 7 в виде желтого твердого вещества, которое использовали без дальнейшей очистки. 1(m, 4 Н), 2,41 (m, 2 Н), 1,89 (s, 6 Н), 1,8-1,5 (m, 6 Н), 1,43 (s, 18H), 1,09 (s, 18H) частей на миллион. 1,4-Бис-уксусной кислоты 2-(3-[1-(2-трет-бутоксикарбониламино-3,3-диметилбутирил)пирролидин-2-илметил]-6-фториндол-1-ил)этил сложный эфирбензол (8): Раствор, содержащий Boc-L-трет-Leu-OH (0,82 г, 3,54 ммоль) и HATU (1,41 г, 3,70 ммоль) в безводном NMP (15 мл) охлаждали до 0 С. Через 15 мин шприцем добавляли N-метилморфолин (0,46 г, 0,5 мл, 4,54 ммоль). Через 15 мин добавляли раствор, содержащий 7 (1,10 г, 1,61 ммоль) в DCM (10 мл), и реакционной смеси давали нагреться до температуры окружающей среды в течение 16 ч. На этом этапе анализ ТСХ показал полное использование 7 [Анализ ТСХ, 2:1 гексан/EtOAc, Rf(4)=0,01; Rf(8)=0,8]. Реакционную смесь разбавляли диэтиловым эфиром и промывали один раз разбавленной водной HCl, пять раз водой для удаления избытка NMP, один раз насыщенным водным NaHCO3 и рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали НФ-ВЭЖХ (силикагель, 10-100% EtOAc/гексан в течение 30 мин) с получением 1,3 г (73%) 8 в виде беловатого твердого вещества. 1 Н ЯМР (CDCl3, 300 МГц)8,05 (dd, J=5,4, 8,4 Гц, 2 Н), 7,56 (s, 4 Н), 7,11 (dd, J=2,4, 9,9 Гц, 2 Н), 6,98 Уксусной кислоты 2-2-(4-1-(2-ацетоксиэтил)-3-[1-(2-амино-3,3-диметилбутирил)пирролидин-2 илметил]-6-фтор-1 Н-индол-2-илфенил)-3-[1-(2-амино-3,3-диметилбутирил)пирролидин-2-илметил]-6 фториндол-1-илэтил сложный эфир (9): Раствор, содержащий 8 (1,3 г, 1,17 ммоль) в DCM (5 мл), охлаждали до 0 С. 20% TFA в DCM (25 мл) добавляли через пипетку, и реакции давали нагреться до температуры окружающей среды, и следили за ней до тех пор, пока анализ ТСХ не показал полное использование 8 (2 ч). Анализ ТСХ, 10%MeOH/DCM, Rf(8)=0,7; Rf(9)=0,3. Растворитель удаляли на роторном испарителе, а остаток очищали ОФВЭЖХ (Способ: растворитель А: вода мас./0,1% об./об. НОАс, растворитель В: ACN мас./0,1% об./об. НОАс. Dynamax Microsorb С 18 60 8 , 41,4 мм 25 см; поток: 40 мл/мин; датчик: 254 нм). Содержащие продукт фракции собирали и нейтрализовали насыщенным водным NaHCO3. Продукт экстрагировали EtOAc, и органический экстракт промывали рассолом, сушили над безводным Na2SO4,фильтровали и концентрировали с получением 0,80 г (75%) 9 в виде беловатого твердого вещества. 1 Н ЯМР (CDCl3, 300 МГц)8,09 (dd, J=5,1, 8,7 Гц, 2 Н), 7,51 (s, 4 Н), 7,13 (m, 2 Н), 7,0 (m, 2 Н), 4,41(m, 2 Н), 4,25 (m, 4 Н), 4,16 (m, 4 Н), 3,6-3,0 (m, 6 Н), 2,86 (m, 2 Н), 2,39 (m, 2 Н), 1,91 (s, 6 Н), 1,8-1,4 (m,12 Н), 1,04 (s, 18H) частей на миллион. 1,4-Бис-уксусной кислоты 2-[3-(1-2-[2-(трет-бутоксикарбонилметиламино)пропиониламино]3,3-диметилбутирилпирролидин-2-илметил)-6-фториндол-1-ил]этил сложный эфирбензол (10): Раствор, содержащий Boc-L-N(Me)Ala-OH (0,27 г, 1,32 ммоль) и HATU (0,54 г, 1,43 ммоль) в безводном NMP (15 мл), охлаждали до 0 С. Через 15 мин шприцем добавляли N-метилморфолин (0,17 г, 0,2 мл, 1,68 ммоль). Через 15 мин добавляли раствор, содержащий 9 (0,50 г, 0,55 ммоль) в DCM (10 мл), и реакционной смеси давали нагреться до температуры окружающей среды в течение 16 ч. На этом этапе- 15012810 анализ ТСХ показал полное использование 9 [Анализ ТСХ, 3:2 гексан/EtOAc, Rf(9)=0,01; Rf(10)=0,5]. Реакционную смесь разбавляли диэтиловым эфиром и промывали один раз разбавленной водной HCl,пять раз водой для удаления избытка NMP, один раз насыщенным водным NaHCO3 и рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали НФ-ВЭЖХ(силикагель, 10-100% EtOAc/гексан в течение 30 мин) с получением 0,64 г (91%) 10 в виде беловатого твердого вещества. 1 Н ЯМР (CDCl3, 300 МГц)8,05 (m, 2 Н), 7,58 (br s, 4 Н), 7,13 (m, 2 Н), 6,97 (m, 2 Н), 4,75 (m, 2 Н), 4,60 1,4-Бис-уксусной кислоты 2-(3-1-[3,3-диметил-2-(2-метиламинопропиониламино)бутирил]пирролидин-2-илметил-6-фториндол-1-ил)этил сложный эфирбензол (11): Раствор, содержащий 10 (0,64 г, 0,5 ммоль) в DCM (20 мл), охлаждали до 0 С. TFA (5 мл) добавляли через пипетку, и реакции давали нагреться до температуры окружающей среды, и следили за ней до тех пор, пока анализ ТСХ не показал полное использование 10 (2 ч). Растворитель удаляли на роторном испарителе, а остаток очищали ОФ-ВЭЖХ (способ: растворитель А: вода мас./0,1% об./об. НОАс, растворитель В: ACN мас./0,1% об./об. НОАс. Dynamax Microsorb С 60 841,4 мм 25 см; поток: 40 мл/мин; датчик: 254 нм). Содержащие продукт фракции собирали и нейтрализовали насыщенным водным NaHCO4. Продукт экстрагировали EtOAc, и органический экстракт промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали с получением 0,50 г (93%) 11 в виде беловатого твердого вещества. 1H ЯМР (CDCl3, 300 МГц)8,04 (m, 2 Н), 7,83 (d, J= 9,3 Гц, 2 Н), 7,55 (m, 4 Н), 7,12 (m, 2 Н), 6,99 (m,2 Н), 4,60 (d, J= 9,3 Гц, 2 Н), 4,57 (m, 2 Н), 4,24 (m, 4 Н), 3,73 (m, 2 Н), 3,55 (m, 2 Н), 3,41 (m, 2 Н), 3,30 (m,2 Н), 3,08 (m, 2 Н), 2,40 (s, 6 Н), 2,38 (m, 2 Н), 1,87 (s, 6 Н), 1,8-1,3 (m, 16 Н), 1,04 (br s, 18H) частей на миллион. 1,4-Бис-N-(l-2-[6-фтор-1-(2-гидроксиэтил)-1 Н-индол-3-илметил]пирролидин-1-карбонил-2,2 диметилпропил)-2-метиламинопропионамидбензол (12): Водный NaOH (1M, 5 мл, избыток) добавляли при 0 С к раствору, содержащему 11 (0,48 г, 0,44 ммоль) в МеОН (5 мл). После добавления ледяную баню удаляли, а реакционную смесь перемешивали при температуре окружающей среды в течение 1 ч. Реакционную смесь разбавляли водой/EtOAc, и слои разделяли. Органическую фазу промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали ОФ-ВЭЖХ (способ: растворитель А: вода мас./0,1% об./об. НОАс,растворитель В: ACN мас./0,1% об./об. HOAc. Dynamax Microsorb C18 60 8 , 41,4 мм 25 см; поток: 40 мл/мин; датчик: 254 нм). Содержащие продукт фракции собирали, замораживали и лиофилизировали с получением 0,19 г 12 в виде хлопьевидного, белого твердого вещества. 1 Н ЯМР (CDCl3, 300 МГц)частей на миллион. 13 С ЯМР (CDCl3, 75 МГц)7,8-7,4 (m, 8 Н), 7,11 (m, 2 Н), 6,95 (m, 2 Н), 4,57 (d, J=9,3 Гц, 2 Н), 4,4-4,0R7a и R7b независимо представляют собой Н, алкил, циклоалкил, галоалкил; или R8a и R7a и R8b иR7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R8a и R8b независимо представляют собой Н, гидроксил, алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил, где каждый алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил и гетероарилалкил необязательно замещен галогеном, гидроксилом, меркапто,карбоксилом, алкилом, алкокси, амино и нитро; или R8a и R7a и R8b и R7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо; где R5a и R5b независимо представляют собой Н, алкил, циклоалкил, циклоалкилалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил; или каждый из них необязательно замещен гидроксилом, меркапто, галогеном, амино, карбоксилом, алкилом, галоалкилом, алкокси или алкилтио; или,в некоторых случаях, R5a и R5b соединены алкиленовым, алкениленовым, алкиниленовым мостиком с 212 атомами углерода или необязательно замещенным алкиленовым, алкениленовым, алкиниленовым мостиком с 2-12 атомами углерода, где один или несколько атомов углерода замещены N, О или S;R12a, R12b, R13a, R13b, R14a и R14b независимо представляют собой Н, Cl, Br, F, алкил, циклоалкил, гидрокси, алкокси, амино, алкиламино, циано или СО 2 Н;R3a и R3b независимо представляют собой Н, галоген, алкил, арил, арилалкил, амино, ариламино,арилалкиламино, гидрокси, алкилокси, арилокси, арилалкилгидрокси, диалкиламино, амидо, сульфонамидо или амидино;X и Y независимо представляют собой О, N, S или С=С;R11a и R11b отсутствуют или независимо представляют собой Н, алкил, необязательно замещенный алкил, гидроксиалкил, алкоксиалкил; или R11a и R11b вместе образуют алкиленовую, алкениленовую, алкиниленовую или алкилоксиалкиленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода могут быть замещены N, О или S;Wa и Wb вместе представляют собой связь, алкиленовую, алкениленовую, алкиниленовую, арильную, гетероарильную или необязательно замещенную алкиленовую, алкениленовую, алкиниленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода могут быть замещены N, О или S.- 21012810 Пример 2. Где R7a и R7b независимо представляют собой Н, алкил, циклоалкил, галоалкил; или R8a и R7a иR8b и R7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R8a и R8b независимо представляют собой Н, гидроксил, алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил, где каждый алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил и гетероарилалкил необязательно замещен галогеном, гидроксилом, меркапто,карбоксилом, алкилом, алкокси, амино и нитро; или R8a и R7a и R8b и R7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо; где R5a и R5b независимо представляют собой Н, алкил, циклоалкил, циклоалкилалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил; или каждый из них необязательно замещен гидроксилом, меркапто, галогеном, амино, карбоксилом, алкилом, галоалкилом, алкокси или алкилтио; или,в некоторых случаях, R5a и R5b соединены алкиленом, алкениленом, алкиниленом с 2-12 атомами углерода или необязательно замещенным алкиленовым, алкениленовым, алкиниленовым мостиком с 2-12 атомами углерода, где один или несколько атомов углерода замещены N, О или S;R12a, R12b, R13a, R13b, R14a и R14b независимо представляют собой Н, Cl, Br, F, алкил, циклоалкил, гидрокси, алкокси, амино, алкиламино, циано или СО 2 Н;R3a и R3b независимо представляют собой Н, галоген, алкил, арил, арилалкил, амино, ариламино,арилалкиламино, гидрокси, алкилокси, арилокси, арилалкилгидрокси, диалкиламино, амидо, сульфонамидо или амидино;X и Y независимо представляют собой О, N, S или С=С;R11a и R11b независимо отсутствуют или представляют собой Н, алкил, необязательно замещенный алкил, гидроксиалкил, алкоксиалкил; или R11a и R11b вместе образуют алкиленовую, алкениленовую, алкиниленовую или алкилоксиалкиленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода могут быть замещены N, О или S;Wa и Wb вместе представляют собой связь, алкиленовую, алкениленовую, алкиниленовую, арильную, гетероарильную или необязательно замещенную алкиленовую, алкениленовую, алкиниленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода могут быть замещены N, О или S.R7a и R7b независимо представляют собой Н, алкил, циклоалкил, галоалкил; или R8a и R7a и R8b иR7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R8a и R8b независимо представляют собой Н, гидроксил, алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил, где каждый алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил и гетероарилалкил необязательно замещен галогеном, гидроксилом, меркапто,карбоксилом, алкилом, алкокси, амино и нитро; или R8a и R7a и R8b и R7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R5a и R5b независимо представляют собой Н, алкил, циклоалкил, циклоалкилалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил; или каждый из них необязательно замещен гидроксилом, меркапто, галогеном, амино, карбоксилом, алкилом, галоалкилом, алкокси или алкилтио; или, в некоторых случаях, R5a и R5b соединены алкиленовым, алкениленовым, алкиниленовым мостиком с 212 атомами углерода или необязательно замещенным алкиленовым, алкениленовым, алкиниленовым мостиком с 2-12 атомами углерода, где один или несколько атомов углерода замещены N, О или S;R12a, R12b, R13a, R13b, R14a и R14b независимо представляют собой Н, Cl, Br, F, алкил, циклоалкил, гидрокси, алкокси, амино, алкиламино, циано или СО 2 Н;R3a и R3b независимо представляют собой Н, галоген, алкил, арил, арилалкил, амино, ариламино,арилалкиламино, гидрокси, алкилокси, арилокси, арилалкилгидрокси, диалкиламино, амидо, сульфонамидо или амидино;R11a и R11b независимо отсутствуют или представляют собой Н, алкил, необязательно замещенный алкил, гидроксиалкил, алкоксиалкил; или R11a и R11b вместе образуют алкиленовую, алкениленовую, алкиниленовую или алкилоксиалкиленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода могут быть замещены N, О или S;Wa и Wb вместе представляют собой связь, алкиленовую, алкениленовую, алкиниленовую, арильную, гетероарильную или необязательно замещенную алкиленовую, алкениленовую, алкиниленовую цепочку с 2-12 атомами углерода, где один или несколько атомов углерода могут быть замещены N, О или S. См.: Macor, J. E.; Blank, D. H.; Post, R. J.; Ryan, K. Tetrahedron Lett. 1992, 55(52), 8011-8014. 2-(2-Этоксикарбонилвинил)пирролидин-1-карбоновой кислоты трет-бутил сложный эфир (14): В 2 л 3-горлую круглодонную колбу, оснащенную верхней мешалкой и впускным отверстием для азота, загрузили раствор оксалилхлорида (130 мл г, 0,26 моль) в DCM (250 мл). Раствор охлаждали до-78 С. Раствор DMSO (20 мл, 0,28 моль) в DCM (30 мл) добавляли по каплям. Через 30 мин по каплям добавляли раствор спирта 13 (40 г, 0,20 моль) в DCM (200 мл). Через 30 мин в раствор добавляли TEA(140 мл, 1,00 моль). Раствор переносили в ледяную/водную баню (0 С) и перемешивание продолжали 30 мин [Обратите внимание: реакционная смесь - белая густая суспензия]. Анализ ТСХ показал отсутствие исходного материала [1:1 гексан/EtOAc, Rf(13)=0,4; Rf(альдегид)=0,6]. Реакционную смесь разбавлялиDCM сушили над Na2SO4, фильтровали и концентрировали с получением неочищенного 2-формилпирролидин-1-карбоновой кислоты трет-бутил сложного эфира (40 г) в виде масла, которое использовали без дальнейшей очистки. 1H ЯМР (CDCl3, 300 МГц)9,50 (d, J=24 Гц, 1 Н), 4,20-4,03 (m, 1H), 3,60-3,40 (m, 2 Н), 2,20-1,87 (m,4 Н), 1,43 (s, 9H) частей на миллион. В 2 л 3-горлую круглодонную колбу, оснащенную верхней мешалкой и впускным отверстием для азота, загрузили NaH (60%, 10,0 г, 0,25 моль) и безводный THF (200 мл). К перемешиваемой смеси медленно добавляли триэтилфосфоноацетат (53,8 г, 0,24 моль) в течение 20 мин. По каплям добавляли раствор неочищенного 2-формил-пирролидин-1-карбоновой кислоты трет-бутил сложный эфир (40 г, 0,20 моль) в THF (75 мл). Раствор приобрел оранжевый цвет, и перемешивание продолжали в течение 1 ч,пока анализ ТСХ не показал отсутствие оставшегося альдегида [1:1 гексан/EtOAc, Rf(альдегид)=0,6;Rf(14)=0,8]. Раствор разбавляли EtOAc и рассолом, и слои разделяли. Слой EtOAc промывали 1 М HCl,рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали с получением 14 (67 г) в виде желтого масла, которое использовали без дальнейшей очистки. 1H ЯМР (CDCl3, 300 МГц)6,92-6,76 (m, 1H), 5,82 (d, 1H), 4,56-4,32 (m, 1H), 4,25-4,12 (m, 2 Н), 3,483,27 (m, 2 Н), 2,20-1,98 (m, 1H), 1,91-1,72 (m, 2 Н), 1,43 (s, 9H), 1,25 (t, 3H) частей на миллион. 2-(3-Гидроксипропенил)пирролидин-1-карбоновой кислоты трет-бутил сложный эфир (15): В 2 л 3-горлую круглодонную колбу, оснащенную верхней мешалкой, загрузили 14 (67 г, 0,20 моль) и DCM (400 мл). Раствор охлаждали до -78 С. В этот раствор медленно добавляли бора трифторидэтерат(30 мл, 0,20 моль). Реакционную смесь перемешивали в течение 30 мин. DIBAL (1M в DCM, 600 мл, 0,6 моль) добавляли с умеренной скоростью. Раствор перемешивали при -78 С в течение 2 ч, а затем обрабатывали EtOAc (100 мл) в течение 30 мин для удаления оставшегося реагента. Реакционной смеси дали нагреться до -5 С. Реакционную смесь ОСТОРОЖНО гасили, добавляя по каплям 1 М HCl. Реакционную смесь разбавляли DCM и Н 2 О и сделали кислотной для растворения солей алюминия. Слои разделяли, и органическую фазу промывали последовательно разбавленной водной HCl, водой и рассолом. Слой DCM сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали флэш-хроматографией (SiO2, 2580% EtOAc/гексан) с получением 15 в виде желтого масла (36 г, 79%). [Анализ ТСХ, 14:1 гексан/EtOAc,Rf(14)=0,8; Rf(15)=0,2]. 1 Н ЯМР (CDCl3, 300 МГц)5,73-5,52 (m, 2 Н), 4,39-4,16 (m, 1H), 4,15-4,04 (m, 2 Н), 3,46-3,25 (m, 2 Н),2,92 (br s, 1H), 2,08-1,93 (m, 1H), 1,92-1,79 (m, 2 Н), 1,78-1,62 (m, 1H), 1,42 (s, 9H) частей на миллион. транс-2S-(3-Метансульфонилоксипропенил)пирролидин-1-карбоновой кислоты трет-бутил сложный эфир (16): В раствор 15 (19 г, 84 ммоль) в DCM (100 мл) добавляли триэтиламин (10 г, 13,9 мл, 100 ммоль). Раствор охлаждали до 0 С, и добавляли по каплям метансульфонилхлорид (9,6 г, 6,5 мл, 84 ммоль) вDCM (20 мл). Через 1 ч анализ ТСХ показал полное использование 15 [1:1 гексан/EtOAc, Rf(15)=0,2;Rf(16)=0,6]. Добавляли рассол, и продукт экстрагировали DCM (350 мл). Органические экстракты объединяли и промывали 1 N HCl, водой, рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали с получением 21,4 г 16, которое использовали без очистки. 1 2-3-[Ацетил-(2-бром-5-фторфенил)амино]пропенилпирролидин-1-карбоновой кислоты третбутил сложный эфир (18): К суспензии 60% NaH (9,2 г, 0,23 моль) в безводном DMF (150 мл) при 0 С добавляли 2-бром-5 фторацетанилид (17, 53,4 г, 0,23 моль) малыми порциями. Через 1 ч раствор неочищенного мезилата 16(приблиз. 0,19 моль) в DMF (20 мл) добавляли по каплям через воронку для добавления. Реакционной смеси дали нагреваться до температуры окружающей среды на протяжении ночи. Реакционную смесь повторно охлаждали до 0 С и осторожно гасили путем добавления рассола и нейтрализовали путем добавления разбавленной водной HCl до рН=7. Смесь разбавляли диэтиловым эфиром и водой, и слои разделяли. Органическую фазу промывали несколько раз водой, чтобы удалить DMF, а затем промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией на силикагеле (0,5-2% MeOH/DCM) с получением 66 г 18 в виде масла.[Анализ ТСХ, 1:1 гексан/EtOAc, Rf(16)=0,5; Rf(17)=0,6; Rf(18)=0,4]. 1 Н ЯМР (CDCl3, 300 МГц)7,64 (m, 1H), 7,01 (m, 2H), 5,52 (m, 1 Н), 5,39 (приблизительно dd, J=6,0,15,3 Гц, 1H), 4,77 (приблизительно dd, J=4,5, 13,8 Гц, 1H), 4,24 (m, 1H), 3,67 (приблизительно dd, J= 7,5,13,8 Гц, 1H), 3,32 (m, 2H), 1,90 (m, 1H), 1,81 (m, 3 Н), 1,75 (m, 2 Н), 1,57 (m, 1 Н), 1,43 (m, 9 Н) частей на миллион. 2-(1-Ацетил-6-фтор-1H-индол-3-илметил)пирролидин-1-карбоновой кислоты трет-бутил сложный эфир (19): В атмосфере азота раствор 18 (66 г, 0,15 моль) в безводном DMF (350 мл) загружали (n-Bu)4NCl(41,5 г, 0,15 моль), K2CO3 (20,6 г, 0,15 моль), NaHCO2 (10,2 г, 0,15 моль) и Pd(OAc)2 (3,35 г, 0,015 моль) при температуре окружающей среды. Гетерогенную смесь погрузили в предварительно нагретую (85 С) масляную баню. Через 1 ч анализ ТСХ показал некоторое оставшееся количество 18, после чего добавили еще катализатор (1 г). Через 1,5 ч добавили еще одну порцию катализатора (0,6 г). После дополнительных 1,5 ч нагревания 18 был полностью израсходован согласно анализу ТСХ [Анализ ТСХ, 2%MeOH/DCM, Rf(18)=0,7; Rf(19)=0,8]. Теплую реакционную смесь переносили в водно-ледяную баню для охлаждения, а затем разбавляли диэтиловым эфиром и фильтровали через слой целита. Твердые вещества промывали диэтиловым эфиром, а фильтрат промывали несколько раз водой для удаления DMF, а затем один раз рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали с получением 52,5 г неочищенного 19, который использовали без дальнейшей очистки. 1 Н ЯМР (CDCl3, 300 МГц)8,18 (m, 1H), 7,60 (m, 1H), 7,18 (m, 1H), 7,05 (dt, J=2,4, 8,7 Гц, 1H), 4,13(m, 1H), 3,41 (m, 1 Н), 3,33 (m, 2 Н), 3,17 (приблизительно dd, 7=14,1, 38,1 Гц, 1H), 2,61 (s, 3 Н), 1,83 (m,3 Н), 1,69 (m, 1H), 1,49 (s, 9H) частей на миллион. 2-(6-Фтор-1H-индол-3-илметил)пирролидин-1-карбоновой кислоты трет-бутил сложный эфир (20): Раствор, содержащий неочищенный 19 (48 г) в МеОН класса реактива (480 мл), охлаждали до 0 С. Водный NaOH (1M, 144 мл) добавляли одной порцией. Через 30 мин анализ ТСХ показал полное расходование исходного материала [Анализ ТСХ, 3:2 гексан/EtOAc, Rf(19)=0,7; Rf(20)=0,8]. Реакционную смесь нейтрализовали 1 N HCl, и продукт экстрагировали DCM. Экстракты DCM промывали водой, рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт собирали на 200 мл силикагеля и проводили хроматографию (80-65% гексан/EtOAc) с получением 31,7 г 20 в виде густого масла. 1 Н ЯМР (CDCl3, 300 МГц)8,11 (br s, 1H), 7,65-7,57 (m, 1H), 7,04 (m, 1H), 6,96 (s, 1H), 6,87 (t, J=2,8 Гц, 1H), 4,16-4,09 (m, 1H), 3,45-3,14 (m, 3 Н), 2,76-2,63 (m, 1H), 1,75 (br s, 4H), 1,58 (s, 9H) частей на миллион. 2-1-[2-(трет-Бутилдиметилсиланилокси)этил]-6-фтор-1 Н-индол-3-илметилпирролидин-1 карбоновой кислоты трет-бутил сложный эфир (22): В атмосфере азота добавляли раствор 20 (3,0 г, 9,42 ммоль) в безводном DMF (40 мл) через воронку для добавления в смесь 60% NaH (0,45 г, 11,3 ммоль) в DMF (10 мл) при 0 С. Через 1 ч шприцом добавляли бромид 21 (2,47 г, 2,22 мл, 10,3 ммоль) в DMF (5 мл). Через 30 мин реакционную смесь нагревали до температуры окружающей среды и перемешивали еще 30 мин. Реакцию гасили путем добавления насыщенного водного NH4Cl и разбавляли водой. Продукт экстрагировали диэтиловым эфиром, и объединенные эфирные экстракты промывали несколько раз водой для удаления DMF, рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали с получением 4,49 г (кол.) 22 в виде желтого масла,которое использовали без дальнейшей очистки. Анализ ТСХ [3:1 гексан/EtOAc, Rf(20)=0,4; Rf(22)=0,7]. 1 Н ЯМР (CDCl3, 300 МГц)7,68 (m, 1H), 7,12 (d, J=3,3 Гц, 1H), 7,03 (s, 1H), 6,98 (t, J=3,2 Гц, 1H),4,26-4,23 (m, 3 Н), 4,05-3,99 (m, 2 Н), 3,55-3,27 (m, 3 Н), 2,75 (m, 1H), 1,88 (br s, 4H), 1,67 (s, 9H), 1,33 (m,1H), 1,06-1,00 (m, 3 Н), 0,95 (s, 9H), 0,23-0,14 (m, 2 Н) частей на миллион. 2-[6-Фтор-1-(2-гидроксиэтил)-1H-индол-3-илметил]пирролидин-1-карбоновой кислоты трет-бутил сложный эфир (23): Раствор, содержащий 22 (4,49 г, 9,42 ммоль) в безводном THF (50 мл), охлаждали до 0 С. Тетра-nбутиламмонийфторид (1M в THF, 14 мл, 14 ммоль) добавляли шприцом. Через 1 ч реакция завершалась согласно анализу ТСХ [3:1 гексан/EtOAc, Rf(22)=0,7; Rf(23)=0,1], поэтому разбавляли EtOAc. РастворEtOAc дважды промывали 1 М HCl, водой, рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали с получением 3,9 г 23 (100%; загрязненного некоторыми TBS-содержащими примесями) в виде желто-коричневого масла, которое использовали без дальнейшей очистки. 1 Н ЯМР (CDCl3, 300 МГц)7,59 (br s, 1H), 7,01-6,85 (m, 3 Н), 4,19-4,10 (m, 3 Н), 3,90 (br s, 2H), 3,383,31 (m, 2 Н), 3,15 (dd, J= 1,4, 4,6 Гц, 1H), 2,68 (m, 1H), 1,79-1,72 (m, 4 Н), 1,47 (d, J= 10,9 Гц, 9 Н) частей на миллион. 2-6-Фтор-1-[2-(толуол-4-сульфонилокси)этил]-1 Н-индол-3-илметилпирролидин-1-карбоновой кислоты трет-бутил сложный эфир (12): Триэтиламин (1,13 г, 1,56 мл, 11,2 ммоль) добавляли к раствору 23 (3,4 г, 9,38 ммоль) в безводномDCM (50 мл) при 0 С, а затем добавляли p-TsCl (1,79 г, 9,38 ммоль) и DMAP (0,12 г, 0,94 ммоль). Через 30 мин реакционную смесь нагревали до комнатной температуры. По завершении расходования 23 (30 мин при температуре окружающей среды) реакционную смесь разбавляли DCM и промывали два раза 1 М HCl, рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенный тозилат очищали флэш-хроматографией на силикагеле (3:1 гексан/EtOAc) с получением 3,67 г (76%) 24 в виде белой пены, которая была гомогенной согласно анализу ТСХ [3:1 гексан/EtOAc, Rf(23)=0,1;(2,47 г, 7,75 ммоль) в DMF (30 мл) через воронку для добавления. Через 1 ч реакционную смесь переносили в -40 С баню (ACN/сухой лед). При -40 С раствор тозилата 24 (3,65 г, 7,06 ммоль) в DMF (20 мл) добавляли в холодный анионный раствор через воронку для добавления. Через 30 мин согласно анализу ТСХ наблюдали только исходные материалы, поэтому медленно нагревали до 0 С в течение 2 ч. Через 23 ч при 0 С реакцию гасили путем добавления насыщенного водного NH4Cl. Смесь разбавляли диэтиловым эфиром и водой, и слои разделяли. Эфирный слой промывали несколько раз водой, чтобы удалитьDMF, а затем один раз рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали ВЭЖХ с нормальной фазой (10-100% EtOAc/гексан в течение 30 мин) с получением 3,27 г (70%) 25 в виде белой пены, которая была гомогенной согласно анализу ТСХ [3:1 гексан/EtOAc (два проявления), Rf(20)=0,8; Rf(24)=0,55; Rf(25)=0,5]. 1 Н ЯМР (CDCl3, 300 МГц)7,61-7,52 (m, 1H), 6,82 (t, J=9,6 Гц, 1H), 6,68-6,61 (m, 1H), 6,48-6,46 (m,1H), 4,34 (s, 2 Н), 3,93 (m, 1 Н), 3,34-3,26 (m, 2 Н), 3,17-3,01 (m, 1H), 2,05 (m, 1H), 1,70-1,58 (m, 4 Н), 1,50 (s,9H) частей на миллион. 1,2-бис[2-(6-Фтор-1H-индол-3-илметил)пирролидин]этан (26): Трифторуксусную кислоту (2 мл) добавляли при 0 С к раствору, содержащему 25 (3,27 г, 4,93 ммоль) в DCM (10 мл). Через 3 ч добавляли еще одну порцию TFA (2 мл), и реакция завершалась в пределах 1 ч. Растворитель удаляли на роторном испарителе, а остаток растворяли в DCM и дважды промывали насыщенным водным NaHCO3, один раз рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали с получением 26 в виде желтой пены, которую использовали без дальнейшей очистки. 1 Н ЯМР (CDCl3, 300 МГц)7,31 (dd, J=5,1, 8,7 Гц, 1H), 6,92 (s, 1H), 6,77 (ddd, J=2,4, 9,6, 11,1 Гц,1H), 6,44 (dd, J=2,4, 9,9 Гц, 1H), 4,41 (s, 2H), 3,65-3,55 (m, 1 Н), 3,24-3,16 (m, 1 Н), 3,01-2,96 (m, 1H), 2,92(d, J=7,8 Гц, 2 Н), 2,15-1,99 (m, 1H), 1,96-1,84 (m, 2 Н), 1,76-1,67 (m, 1H) частей на миллион. 1,2-Бис 2,2,2-трифтор-1-[2-(6-фтор-1H-индол-3-илметил)пирролидин-1-ил]этанонэтан (27): При 0 С TFAA (2,17 г, 1,44 мл, 10,3 ммоль) добавляли в раствор, содержащий 26 (2,28 г, 4,93 ммоль; на основании теоретического выхода на предыдущем этапе) и TEA (2,49 г, 3,43 мл, 24,6 ммоль) вDCM (50 мл). Через 30 мин реакционную смесь разбавляли DCM и дважды промывали насыщенным водным NaHCO3, один раз рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией на силикагеле (4:1-1:1 гексан/EtOAc) с получением 2,66 г (82%, 2 этапа) 27, который был гомогенным согласно анализу ТСХ [2:1 гексан/EtOAc,Rf(26)=0,01; Rf(27)=0,5]. 1 1-(2-3,10-Дифтор-14-[1-(2,2,2-трифторацетил)пирролидин-2-илметил]-6,7-дигидропиразино[1,2-а;4,3 а']дииндол-13-илметилпирролидин-1-ил)-2,2,2-трифторэтанон (28): Ациклический димер 27 (2,66 г, 4,06 ммоль) растворяли в чистом TFA (25 мл) при температуре окружающей среды. Через 3 ч растворитель удаляли на роторном испарителе, а полученный остаток растворяли в EtOAc, дважды промывали насыщенным водным NaHCO3, один раз рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали с получением 2,65 г (кол.) диастереомерных индолилиндолинов в виде желтой пены. [Анализ ТСХ: 3:1 гексан/EtOAc, Rf(27)=0,3; Rf(индолилиндолины)=0,60,7]. В смесь неочищенных индолилиндолинов (2,65 г, 4,05 ммоль) в 1,4-диоксане (50 мл) добавлялиDDQ (1,10 г, 4,84 ммоль) одной порцией. Через 2-3 ч реакционную смесь разбавляли EtOAc и фильтровали через слой целита. Твердые вещества промывали EtOAc, а фильтрат пять раз промывали насыщенным водным NaHCO3, а затем один раз рассолом. Объединенные водные промывки вновь экстрагировали два раза EtOAc, и объединенные органические экстракты сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией на силикагеле (4:1 гексан/EtOAc) с получением 1,94 г (73%, 2 этапа) 28 в виде беловатого твердого вещества, которое было- 27012810 гомогенным согласно анализу ТСХ [2:1 гексан/EtOAc, Rf(индолилиндолины)=0,6-0,7; Rf(28)=0,55]. Обратите внимание: продукт 2,2'-бииндол (28) является весьма флуоресцентным и легко очищается путем титрования МеОН класса реактива с получением белого твердого вещества. 1 Н ЯМР (CDCl3, 300 МГц)8,06 (dd, J=5,1, 8,1 Гц, 1H), 7,03-6,93 (m, 2 Н), 4,49 (d, J=9,0 Гц, 1H), 4,40 3,10-Дифтор-13,14-бис-пирролидин-2-илметил-6,7-дигидропиразино[1,2-а;4,3-а']дииндол (29): Смесь, содержащую 28 (1,94 г, 2,97 ммоль) и K2CO3 (2,05 г, 14,8 ммоль) в МеОН (60 мл), нагревали при 60 С в течение 1,5 ч. Реакционную смесь охлаждали до температуры окружающей среды и разбавляли EtOAc и водой. Слои разделяли, и водную фазу экстрагировали три раза EtOAc. Объединенные органические экстракты промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали с получением 1,57 г (кол.) 29 в виде желтого твердого вещества, которое использовали без дальнейшей очистки. Анализ ТСХ, 1:1 гексан/EtOAc, Rf(28)=0,9; Rf(29)=0,01. 1NMP (4 мл), охлаждали до 0 С. Через 15 мин шприцом добавляли DIPEA (0,45 г, 0,61 мл, 3,50 ммоль). Через 15 мин раствор, содержащий 29 (0,70 г, 1,52 ммоль) в NMP (4 мл), добавляли и реакционной смеси давали нагреться до температуры окружающей среды в течение 2 ч. На этом этапе ТСХ показала полное использование 29 [анализ ТСХ, 2:1 гексан/EtOAc, Rf(29)=0,01; Rf(30)=0,5]. Реакционную смесь разбавляли диэтиловым эфиром и промывали один раз разбавленной водной HCl, пять раз водой для удаления избытка NMP, один раз насыщенным водным NaHCO3 и рассолом, сушили над безводным Na2SO4,фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией на силикагеле 2-Амино-1-(2-14-[1-(2-амино-3-метилбутирил)пирролидин-2-илметил]-3,10-дифтор-6,7-дигидропиразино[1,2-а;4,3-а']дииндол-13-илметилпирролидин-1-ил)-3-метилбутан-1-он (31): Раствор, содержащий 30 (1,09 г, 1,27 ммоль) в DCM (20 мл), охлаждали до 0 С. TFA (4 мл) добавляли через пипетку, и за реакцией следили до тех пор, пока анализ ТСХ не показал полное использование 30 (2 ч). Анализ ТСХ, 10% MeOH/DCM, Rf(30)=0,5; Rf(31)=0,4. Растворитель удаляли на роторном испарителе, а остаток растворяли в EtOAc. Раствор EtOAc дважды промывали насыщенным водным NaHCO3 и один раз рассолом. Объединенные водные промывки вновь экстрагировали EtOAc, и органические экстракты сушили над безводным Na2SO4, фильтровали и концентрировали с получением 0,83 г(кол.) 31 в виде желтого твердого вещества, которое использовали без дальнейшей очистки. 1 Н ЯМР (CDCl3, 300 МГц)8,09 (dd, J=5,1, 8,7 Гц, 1H), 6,97 (m, 2H), 4,52 (m, 1H), 4,50 (d, J=8,7 Гц,1H), 4,11 (m, 1H), 3,71 (br d, J=11,1 Гц, 1H), 3,51-3,32 (m, 2 Н), 2,74 (приблизительно t, J=12,6 Гц, 1 Н), 2,30(br s, 4 Н), 1,92 (m, 1H), 1,68 (m, 2 Н), 1,41 (m, 1 Н), 1,03 (m, 6 Н) частей на миллион. 13 С ЯМР (CDCl3, 75 МГц)174,3, 171,4, 160,6 (d, JC-F=232,5 Гц), 136,8 (d, JC-F=7,5 Гц), 127,4 (d, JCF=3,7 Гц), 125,0, 122,4 (d, JC-F=7,5 Гц), 109,6, 108,7 (d, JC-F=22,5 Гц), 95,2 (d, JC-F=22,5 Гц), 58,0, 47,3, 41,9,30,0, 28,5, 28,5, 24,1,19,9, 17,6 частей на миллион. Предпоследнее промежуточное вещество (32): Раствор, содержащий Boc-L-N(Me)Ala-OH (0,49 г, 2,45 ммоль) и HATU (0,98 г, 2,56 ммоль) в безводном NMP (4 мл), охлаждали до 0 С. Через 15 мин шприцом добавляли DIPEA (0,35 г, 0,47 мл, 2,69 ммоль). Через 15 мин добавляли раствор, содержащий 31 (0,77 г, 1,17 ммоль) в NMP (4 мл), и реакционной смеси давали нагреться до температуры окружающей среды в течение 2 ч. На этом этапе анализ ТСХ показал полное использование 31 [анализ ТСХ, 1:1 гексан/EtOAc, Rf(31)=0,01; Rf(32)=0,5]. Реакционную смесь разбавляли диэтиловым эфиром и промывали один раз разбавленной водной HCl, пять раз водой для удаления избытка NMP, один раз насыщенным водным NaHCO3 и рассолом, сушили над безводнымNa2SO4, фильтровали и концентрировали. Неочищенный продукт очищали флэш-хроматографией на силикагеле (1:1 гексан/EtOAc) с получением 0,92 г (76%) 32 в виде бледно-желтого твердого вещества. 1N-1-[2-(3,10-Дифтор-14-1-[3-метил-2-(2-метиламинопропиониламино)бутирил]пирролидин-2 илметил-6,7-дигидропиразино[1,2-а;4,3-а']дииндол-13-илметил)пирролидин-1-карбонил]-2-метилпропил-2-метиламинопропионамид (33): Раствор, содержащий 32 (0,92 г, 0,89 ммоль) в DCM (15 мл), охлаждали до 0 С. TFA (3 мл) добавляли через пипетку, и за реакцией следили до тех пор, пока анализ ТСХ не показал полное использование 32 (3 ч). Анализ ТСХ, 10% MeOH/DCM, Rf(32)=0,4; Rf(33)=0,3. Растворитель удаляли на роторном испарителе, а остаток растворяли в EtOAc. Раствор EtOAc дважды промывали насыщенным водным NaHCO3 и один раз рассолом. Объединенные водные промывки вновь экстрагировали EtOAc, и органические экстракты сушили над безводным Na2SO4, фильтровали и концентрировали с получением 0,73 г неочищенного 33. Неочищенный продукт очищали ОФ-ВЭЖХ (способ: растворитель А: вода мас./0,1% об./об. НОАс, растворитель В: ACN мас./0,1% об./об. НО Ac. Dynamax Microsorb С 18 60 8 , 41,4 мм 25 см; поток: 40 мл/мин; датчик: 272 нм). Содержащие продукт фракции разбавляли насыщенным водным NaHCO3 и экстрагировали EtOAc. EtOAc экстракт промывали рассолом, сушили над безводнымNa2SO4, фильтровали и концентрировали. Остаток растворяли в минимальном количестве ACN, разбавляли водой до помутнения, замораживали и лиофилизировали с получением 33 в виде хлопьевидного белого твердого вещества. 1 Н ЯМР (DMSO, 300 МГц)8,04-7,86 (m, 2H), 7,38 (приблизительно dd, J=2,3, 10,5 Гц, 1 Н), 6,90R7a и R7b независимо представляют собой Н, алкил, циклоалкил, галоалкил; или R8a и R7a и R8b иR7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R8a и R8b независимо представляют собой Н, гидроксил, алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил или гетероарилалкил, где каждый алкил, арил, арилалкил, циклоалкил, циклоалкилалкил, гетероарил и гетероарилалкил необязательно замещен галогеном, гидроксилом, меркапто,карбоксилом, алкилом, алкокси, амино и нитро; илиR8a и R7a и R8b и R7b могут независимо или вместе образовывать кольцо, такое как азиридиновое или азетидиновое кольцо;R5a и R5b независимо представляют собой Н, алкил, циклоалкил, циклоалкилалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил; или каждый из них необязательно замещен гидроксилом, меркапто, галогеном, амино, карбоксилом, алкилом, галоалкилом, алкокси или алкилтио; или,необязательно, R5a и R5b соединены алкиленовым, алкениленовым, алкиниленовым мостиком с 2-12 атомами углерода или необязательно замещенным алкиленовым, алкениленовым, алкиниленовым мостиком с 2-12 атомами углерода, где один или несколько атомов углерода могут быть замещены N, О илиR12a, R12b, R13a, R13b, R14a и R14b независимо представляют собой Н, Cl, Br, F, алкил, циклоалкил, гидрокси, алкокси, амино, алкиламино, циано или СО 2 Н; иR3a и R3b независимо представляют собой Н, галоген, алкил, арил, арилалкил, амино, ариламино,арилалкиламино, гидрокси, алкилокси, арилокси, арилалкилгидрокси, диалкиламино, амидо, сульфонамидо или амидино.
МПК / Метки
МПК: C07D 209/20, A61K 31/40, A61P 35/00
Метки: апоптоза, димерные, iap, белков, ингибиторов, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-12810-dimernye-ingibitory-ingibitorov-belkov-apoptoza-iap.html" rel="bookmark" title="База патентов Евразийского Союза">Димерные ингибиторы ингибиторов белков апоптоза (iap)</a>
Предыдущий патент: Способ сжижения природного газа и установка для его осуществления
Следующий патент: Электропривод с многоякорным генератором
Случайный патент: Резьбовое соединение для кабеля с зажимным устройством для армирования кабеля












