Терапевтические применения ингибиторов rtp801
Формула / Реферат
1. Соединение, имеющее структуру
5'(N)x-Z3' (антисмысловая цепь),
3'Z'-(N')y5' (смысловая цепь),
где каждый N и N' обозначает рибонуклеотид, который может быть модифицированным или немодифицированным в сахарном остатке и каждый из (N)x и (N')y обозначает олигомер, в котором каждый последовательный N или N' соединен с последующим N или N' ковалентной связью;
каждый из х и у обозначает целое число от 19 до 40 включительно;
каждый из Z и Z' может присутствовать или отсутствовать, но, если присутствует, обозначает dTdT и является ковалентно присоединенным на 3'-конце цепи, в которой он присутствует;
и последовательность (N) содержит последовательность, по существу, комплементарную последовательности, представленной в последовательности мРНК, кодируемой SEQ ID NO:1.
2. Соединение по п.1, в котором последовательность (N)x содержит последовательность любой из SEQ ID NO:66, 67, 72, 73, 74, 75, 76, 77, 79, 91, 92, 93, 95, 96 и 102.
3. Соединение по п.1, в котором последовательность (N)x содержит последовательность любой из SEQ ID NO:66, 74, 75, 77, 79, 91, 93 и 102.
4. Соединение по любому из пп.1-3, в котором сахарный остаток по меньшей мере в одном рибонуклеотиде является модифицированным.
5. Соединение по п.4, в котором сахарный остаток является модифицированным путем замены 2'-ОН-группы на -Н, -ОСН3, -ОСН2СН3, -ОСН2СН2СН3, -NH2 или -F.
6. Соединение по п.5, в котором -ОН является замещенным -ОСН3.
7. Соединение по п.6, в котором ковалентная связь является фосфодиэфирной связью; х=у, предпочтительно х=у=19; Z и Z' отсутвуют совместно, чередующиеся рибонуклеотиды в каждой антисмысловой и смысловой цепях содержат 2'-ОСН3 модификацию в их сахарных остатках; и рибонуклеотиды на 5'- и 3'-концах антисмысловой цепи модифицированы таким же образом, а рибонуклеотиды на 5'- и 3'-концах смысловой цепи не модифицированы.
8. Соединение по любому из пп.1-7, которое является фосфорилированным или нефосфорилированным.
9. Соединение по любому из пп.1-8, в котором динуклеотид dTdT ковалентно присоединен к 3'-концу антисмысловой цепи или смысловой цепи.
10. Соединение по любому из пп.1-9, в котором последовательность (N)x содержит последовательность, представленную в SEQ ID NO:66.
11. Соединение по любому из пп.1-7 или 10, имеющее структуру
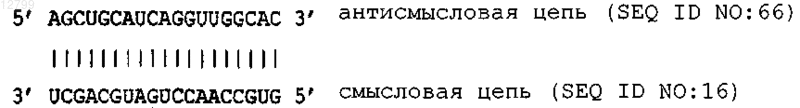
где чередующиеся рибонуклеотиды в антисмысловой и смысловой цепях содержат 2'-О-метил-модификацию в сахарном остатке рибонуклеотидов; где рибонуклеотиды на 5'- и 3'-концах антисмысловой цепи содержат 2'-О-метил-модификацию; где рибонуклеотиды на 5'- и 3'-концах смысловой цепи являются немодифицированными и где каждый рибонуклеотид на 5'- и 3'-концах каждой антисмысловой и смысловой цепи является независимо фосфорилированным или нефосфорилированным и каждая вертикальная линия представляет водородную связь между рибонуклеотидами на каждом их конце.
12. Соединение по п.11, в котором обе антисмысловая и смысловая цепи являются нефосфорилированными на 3'-конце.
13. Соединение по п.11, в котором обе антисмысловая и смысловая цепи являются нефосфорилированными на 3'- и 5'-концах.
14. Соединение по п.11, в котором обе антисмысловая и смысловая цепи являются фосфорилированными на 3'- и 5'-концах.
15. Фармацевтическая композиция, содержащая соединение по любому из пп.1-14 и фармацевтически приемлемый эксципиент.
16. Применение соединения по любому из пп.1-14 для стимуляции выздоровления пациента, страдающего респираторным нарушением, глазной болезнью или микрососудистым нарушением или повреждением или заболеванием спинного мозга.
17. Применение по п.16, в котором состояние является глазной болезнью.
18. Применение по п.17, в котором глазной болезнью является глаукома.
19. Применение по п.17, в котором глазной болезнью является дегенерация желтого пятна.
20. Применение по п.17, в котором глазной болезнью является AMD.
21. Применение по п.17, в котором глазная болезнь является обусловленной диабетом.
22. Применение по п.17 или 21, в котором глазной болезнью является диабетическая ретинопатия.
Текст
012799 По данной заявке испрашивается приоритет ЕР заявки на патент 04019405.2, поданной 16 августа 2004 года; Предварительных заявок США 60/601983, поданной 17 августа 2004 года;60/604668,поданной 25 августа 2004 года;60/609786, поданной 14 сентября 2004 года;60/638659, поданной 22 декабря 2004 года;60/664236, поданной 22 марта 2005 года, и 60/688943, поданной 8 июня 2005 года, все из которых включены в качестве ссылки в их полном объеме. Область изобретения Данное изобретение относится к новым молекулам siRNA, которые ингибируют ген RTP801, и к применению таких молекул для лечения респираторных нарушений всех типов (в том числе легочных нарушений), глазных болезней и состояний, микрососудистых нарушений, состояний, связанных с ангиогенезом и апоптозом. Уровень техники Хроническая обструктивная болезнь легких (ХОБЛ) Хроническая обструктивная болезнь легких (ХОБЛ) поражает более чем 16 миллионов американцев и является четвертой наиболее распространенной причиной смерти в Соединенных Штатах. Большинство случаев этого изнуряющего заболевания вызывает курение сигарет, но и другие факторы окружающей среды не могут быть исключены (Petty TL. 2003. Definition, epidemiology, course, and. prognosis of COPD.Clin. Cornerstone, 5-10). Эмфизема легких является основным проявлением ХОБЛ. Перманентная деструкция периферических воздушных пространств, дистальных относительно терминальных бронхиол, является отличительным признаком ХОБЛ (Tuder R.M., et al.: Oxidative stress and apoptosis interact and cause emphysema due tovascular endothelial growth factor blocade. Am J Respir Cell Mol Biol, 29:88-97; 2003). Эмфизема характеризуется также накоплением воспалительных клеток, таких как макрофаги и нейтрофилы, в бронхиолах и альвеолярных структурах (Petty, 2003). Патогенез эмфиземы является сложным и многофакторным. Было показано, что у людей недостаточность ингибиторов протеаз, продуцируемых воспалительными клетками, таких как альфа 1 антитрипсин, способствует нарушению баланса протеаз/антипротеаз, способствуя тем самым деструкции альвеолярного внеклеточного матрикса в индуцируемой сигаретным дымом (CS) эмфиземе (Eriksson, S. 1964. Pulmonary Emphisema and Alphal-Antitrypsin Deficiency. Acta Med Scand 175: 197-205. Joss, L., Pare,P.D., and Sandford, A.J. 2002. Genetic risk factors of chronic obstructive pulmonary disease. Swiss Med Wkly 132; 27-37). Металлопротеиназы матрикса (ММР) играют центральную роль в экспериментальной эмфиземе, как документировано резистентностью мышей с нокаутом металлоэластазы макрофагов против эмфиземы, вызываемой хронической ингаляцией CS (Hautamaki, et al.: Requirment for macrophage elastasefor cigarette smoke-induced emphisema in mice. Science 277:2002-2004). Кроме того, легочная сверхэкспрессия интерлейкина-13 в трансгенных мышах приводит к ММР- и катепсинзависимой эмфиземеcathepsin-dependent emphysema. J Clin Invest 106:1081-1093). Недавние исследования описывают участие апоптоза септальных клеток в деструкции легочной ткани, приводящей к эмфиземе (Rangasami Т., et al.:(5):555-62). Среди механизмов, которые лежат в основе обоих путей деструкции легких при эмфиземе, прежде всего должно быть упомянуто избыточное образование молекулярных частиц активного (реакционноспособного) кислорода (ROS). Хорошо установлено, что в крови и ткани легких курильщиков существует баланс прооксиданта/антиоксиданта (Hulea S.A., et al.: Cigarette Smoking causes biochemical changes inAm J Respir Cell Mol Biol, 29:88-97; 2003). После одного часа подвергания мышей действию CS наблюдается значительное увеличение 8-гидрокси-2'-дезоксигуанозина (8-OHdG) в альвеолярных эпителиальных клетках, в частности, типа II (см. Inhal Toxicol. 2003 Sep; 15(10):1029-38, выше).-1 012799 Сверхпродуцируемые молекулярные частицы активного (реакционноспособного) кислорода известны вследствие их цитотоксической активности, которая происходит из прямого разрушающего действия на ДНК и из активации путей трансдукции апоптотического сигнала (Takahashi A., Masuda A., Sun М., Centonze V.E., Herman В. Oxidative stress-induced apoptosis is associated in mitochondrial caspase activityM., Yodoi J. Redox control of cell death. Antioxid Redox Signal, 2002 Jun:4(3):405-14). Молекулярные частицы активного (реакционноспособного) кислорода (ROS) не только являются цитотоксичными per se, но также являются провоспалительными стимулами, являясь сильными активаторами редокс-чувствительных факторов транскрипции NFB И АР-1 (обсуждаемых в Rahman I. Oxidative stress and gene transcription in asthma and chronic obstructive pulmonary disease: antioxidant therapeutictargets. Curr Drug Targets Inflamm Allergy. 2002 Sep; 1(3):291-315). В свою очередь, оба фактора транскрипции, как предполагается, участвуют в стимуляции транскрипции провоспалительных цитокиновnovel therapeutical strategies. Cell Biol Toxicol. 1999; 15 (6):341-4; Lentsch A.B., Ward P.A. The NFkappaBb/IkappaB system in acute inflammation. Arch Immunol Ther Exp (Warsz). 2000; 48 (2):59-63) и деградирующих матрикс протеиназ (Andela V.B., Gordon А.Н., Zotalis G., Rosier R.N., Goater J.J., Lewis G.D.,Schwarz E.M., Puzas J.E., O'Keefe R.J. NFkappaB: a pivotal transcription factor in prostate cancer metastasis tomatrix metalloproteinase-9 by the proinflammatory cytokine, IL-1beta: a role for the dual signalling pathways,Akt and Erk. Genes Cells. 2003 Jun; 8(6):515-23. Провоспалительные цитокины, в свою очередь, служат аттрактантами воспалительных клеток, которые также секретируют деградирующие матрикс ферменты,цитокины и молекулярные частицы активного кислорода. Таким образом, по-видимому, патогенный фактор, такой как, например, CS, запускает патологическую сеть, в которой молекулярные частицы активного кислорода действуют в качестве главных медиаторов деструкции легких. Молекулярные частицы активного кислорода (ROS) как из вдыхаемого сигаретного дыма, так и образуемые эндогенно воспалительными клетками, способствуют увеличенной нагрузке внутрилегочного оксиданта. Одним дополнительным патогенным фактором, относящимся к патогенезу ХОБЛ, является наблюдаемая уменьшенная экспрессия VEGF и VEGFRII в легких пациентов с эмфиземой (Yasunori Kasahara,Rubin M. Tuder, Carlyne D. Cool, David A. Lynch, Sonia C. Flores, and Norbert F. Voelkel. Endothelial CellDeath and Decreased Expression of Vascular Endothelial Growth Factor and Vascular Endothelial Growth Factor Receptor 2 in Emphysema. Am J Respir Crit Care Med. Vol. 163, pp. 737-744, 2001). Кроме того, ингибирование передачи сигнала VEGF с использованием химического ингибитора VEGFR приводит к апоптозу альвеолярных септальных эндотелиальных и затем эпителиальных клеток, возможно, вследствие разрушения тесной структурной/функциональной связи обоих типов клеток в альвеолах (Yasunori Kasahara,Rubin M. Tuder, Laimute Taraseviciene-Stewart, Timothy D. Le Cras, Steven Abman, Peter K. Hirth, JohannesJ. Clin. Invest. 106:1311-1319 (2000). Voelkel N.F., Cool C.D. Pulmonary vascular involvement in chronic obstructive pulmonary disease. Eur Respir J Suppl. 2003 Nov; 46:28s-32s). Дегенерация желтого пятна сетчатки Наиболее обычной причиной пониженного лучше всего корректируемого видения у индивидуумов старше 65 лет в Соединенных Штатах является нарушение сетчатки, известное как связанная со старением дегенерация желтого пятна (сетчатки) (AMD). По мере прогрессирования AMD это заболевание характеризуется потерей острого, центрального зрения. Зоной глаза, поражаемой AMD, является желтое пятно - небольшая зона в центре сетчатки, состоящая в основном из фоторецепторных клеток. Так называемая сухая AMD, наблюдающаяся у приблизительно 85-90% пациентов с AMD, включает изменения в распределении пигмента глаза, потерю фоторецепторов и пониженную ретинальную функцию вследствие общей атрофии клеток. Так называемая влажная AMD включает пролиферацию аномальных хороидальных сосудов, приводящую к сгусткам крови или рубцам в субретинальном пространстве. Таким образом, возникновение влажной AMD происходит вследствие образования аномальной хороидальной неоваскулярной сети (хороидальной неоваскуляризации, CNV) под нейроретиной. Заново образованные сосуды являются избыточно негерметичными. Это приводит к накоплению субретинальной жидкости и крови, приводящему к потере остроты зрения. Со временем происходит полная потеря функциональной сетчатки в области, вовлеченной в дегенерацию, так как образуется большой дискообразный рубец, охватывающий сосудистую оболочку глаза и сетчатку. В то время как пациенты с сухой AMD могут сохра-2 012799 нять зрение пониженного качества, влажная AMD часто ведет к слепоте (HamdiKenney, Age-relatedMacular degeneration - a new viewpoint, Frontiers in Bioscience, e305-314, May 2003). CNV имеет место не только во влажной AMD, но также в других глазных патологиях, таких как синдром глазного гистоплазмоза, ангиоидные полосы сетчатки, разрывы в базальной пластинке (оболочке Бруха), миопическая дегенерация, глазные опухоли и некоторые дегенеративные заболевания сетчатки. Различные проведенные исследования определили несколько факторов риска для AMD, таких как курение, старение, семейный анамнез (Milton, Am J Ophthalmol 88, 269 (1979); Mitchell et al.: Ophthalmology 102, 1450-1460 (1995); Smith et al.: Ophthalmology 108, 697-704 (2001, пол (в 7 раз более высокий риск у женщин: Klein et al.: Ophthalmology 99, 933-943 (1992 и раса (представители белой расы являются наиболее восприимчивыми). Дополнительные факторы риска могут включать характеристики глаз,такие как дальнозоркость (гиперметропия) и светлые глаза, также как сердечно-сосудистое заболевание и гипертензия. Было также документировано доказательство генетического участия в возникновении прогрессирования заболевания (см. HamdiKenney выше). Две компании, Acuity Pharmaceutical и Sirna Therapeutics недавно зарегистрировали IND (IndustrialProperty) относительно молекул siRNA, ингибирующих VEGF и VEGF-R1 (Flt-1) соответственно, для лечения AMD. Эти молекулы обозначены Cand5-ингибитором и 027-ингибитором соответственно. Микрососудистые нарушения Микрососудистые нарушения состоят из широкой группы состояний, которые прежде всего поражают микроскопические капилляры и лимфатические сосуды и, следовательно, находятся вне сферы прямого хирургического вмешательства. Микрососудистое заболевание может быть в широком смысле подразделено на вазоспастическое, васкулитное и лимфатическое окклюзивное заболевание. Кроме того,многие из известных сосудистых состояний имеют микрососудистый элемент. Вазоспастическое заболевание. Вазоспастические заболевания являются группой обычных состояний, в которых по неизвестным причинам периферические вазоконстрикторные рефлексы являются гиперчувствительными. Это приводит к неуместной вазоконстрикции и ишемии тканей вплоть до потери ткани. Вазоспастические симптомы обычно связаны с температурой или с использованием вибрирующих аппаратов, но могут быть вторичными относительно других состояний. Васкулитное заболевание. Васкулитные заболевания являются заболеваниями, которые участвуют в первичном воспалительном процессе в микроциркуляции. Васкулит является обычно компонентом аутоиммунного или связанного с соединительной тканью нарушения и обычно не поддается хирургическому лечению, а требует иммуносупрессивного лечения в случае наличия тяжелых симптомов. Лимфатическое окклюзивное заболевание. Хроническое опухание нижней или верхней конечности(лимфатический отек) является результатом периферической лимфатической окклюзии. Это относительно редкое состояние, которое имеет большое количество причин, некоторые из них являются наследственными, некоторые являются приобретенными. Основными способами лечения являются правильно подобранные сжимающие предметы одежды и применение устройств с прерывистым сдавливанием. Микрососудистые патологии, связанные с диабетом Диабет является основной причиной слепоты, причиной номер один ампутаций и импотенции и одним из наиболее часто встречающихся хронических детских заболеваний. Диабет является также основной причиной почечного заболевания терминальной стадии в Соединенных Штатах с частотой распространенности 31% в сравнении с другими почечными заболеваниями. Диабет является также наиболее частым показанием для трансплантации почки, составляющим 22% всех операций по трансплантации. Обычно диабетические осложнения могут в широком смысле классифицироваться как микрососудистые или макрососудистые заболевания. Микрососудистые осложнения включают невропатию (повреждения нервов), нефропатию (заболевание почек) и нарушения зрения (например, ретинопатию,глаукому, катаракту и корнеальное заболевание (заболевание роговицы. В сетчатке, почетном клубочке и vasa nervorum подобные патофизиологические признаки характеризуют диабет-специфическое микрососудистое заболевание. Микрососудистые патологии, ассоциированные с диабетом, определяют как заболевание самых малых кровеносных сосудов (капилляров), которое может иметь место, например, у людей, которые имели диабет в течение продолжительного времени. Стенки этих сосудов становятся ненормально толстыми, но слабыми. Таким образом, они кровоточат, теряют белок и замедляют кровоток по телу. Клинические данные и данные на моделях животных показывают, что хроническая гипергликемия является центральным инициирующим фактором для всех типов диабетического микрососудистого заболевания. Продолжительность и величина гипергликемии в значительной степени коррелируют со степенью и скоростью прогрессирования диабетического микрососудистого заболевания. Хотя все диабетические клетки подвергаются действию повышенных уровней глюкозы в плазме, гипергликемическое повреждение ограничивается только теми типами клеток (например, эндотелиальными клетками), которые развивают внутриклеточную гипергликемию. Эндотелиальные клетки развивают внутриклеточную гипергликемию, так как в отличие от многих других клеток они не могут подавлять транспорт глюкозы при подвергании действию внеклеточной гипергликемии. То, что внутриклеточная гипергликемия является необходимой и достаточной для развития диабетической патологии, дополнительно демонстрируется-3 012799 фактом, что сверхэкспрессия транспортера глюкозы GLUT1 в мезангиальных клетках, культивируемых в среде с нормальной глюкозой, имитирует диабетический фенотип, индуцируя такие же увеличения в экспрессии генов коллагена типа IV, коллагена типа I и фибронектина, что и диабетическая гипергликемия. Атипичная функция эндотелиальных клеток На ранних стадиях сахарного диабета, до того как становятся очевидными структурные изменения,гипергликемия вызывает аномалии в кровообращении и сосудистой проницаемости в сетчатке, почечных клубочках и периферическом нерве vasa nervorum. Считают, что увеличение давления в кровотоке и внутрикапиллярного давления отражает индуцированное гипергликемией уменьшенное продуцирование оксида азота (NO) на эфферентной стороне капиллярного ложа и, возможно, увеличенную чувствительность к ангиотензину II. Как следствие увеличенного внутрикапиллярного давления и дисфункции эндотелиальных клеток капилляры сетчатки проявляют увеличенную утечку флуоресцеина, а гломерулярные капилляры имеют повышенную скорость экскреции альбумина (AER). Сравнимые изменения имеют место в vasa vasorum периферического нерва. На ранней стадии диабета увеличенная проницаемость является обратимой; однако по мере прогрессирования во времени она становится необратимой. Увеличенное накопление белка в стенке сосудов Общим патофизиологическим признаком диабетического микрососудистого заболевания является прогрессирующие сужение и постепенная окклюзия просветов сосудов, которое приводит к неадекватной перфузии и функции пораженных тканей. Ранняя индуцированная гипергликемией микрососудистая гипертензия и увеличенная сосудистая проницаемость способствуют необратимой окклюзии микрососудов посредством трех процессов: первым процессом является аномальная утечка периодная кислота-Шифф (PAS)-положительных,углеводсодержащих белков плазмы, которые депонируются в стенке капилляров и которые могут стимулировать периваскулярные клетки, такие как перициты и мезангиальные клетки, для высвобождения факторов роста и внеклеточного матрикса; вторым процессом является экстравазация факторов роста, таких как трансформирующий фактор роста 1 (TGF-1), который непосредственно стимулирует сверхпродукцию компонентов внеклеточного матрикса и может индуцировать апоптоз в некоторых связанных с осложнением типах клеток; третьим процессом является индуцированная гипертензией стимуляция экспрессии патологического гена эндотелиальными клетками и поддерживающими клетками, которые кодируют транспортеры глюкозы glut-1, факторы роста, рецепторы факторов роста, компоненты внеклеточного матрикса и молекулы адгезии, которые активируют циркулирующие лейкоциты. С этой концепцией согласуется наблюдение, что одностороннее уменьшение тяжести диабетического микрососудистого заболевания имеет место на стороне со стенозом глазной или почечной артерии. Потеря микрососудистых клеток и окклюзия сосудов Прогрессирующие сужение и окклюзия просветов диабетических микрососудов сопровождаются также потерей микрососудистых клеток. В сетчатке сахарный диабет индуцирует запрограммированную гибель клеток Мюллера и клеток ганглиев, перицитов и эндотелиальных клеток. В почечном клубочке снижение функции почек ассоциируется с широко распространившейся окклюзией капилляров и потерей подоцитов, но механизмы, лежащие в основе потери гломерулярных клеток, еще не известны. В vasa nervorum имеет место дегенерация эндотелиальных клеток и перицитов, и эти микрососудистые изменения,по-видимому, предшествуют развитию диабетической периферической невропатии. Многоочаговое распределение, дегенерации аксонов при диабете подтверждает причинную роль микрососудистой окклюзии, но индуцированные гипергликемией уменьшения нейротрофинов могут способствовать предотвращению нормальной репарации и регенерации аксонов. Другой обычный признак диабетического микрососудистого заболевания был назван гипергликемической памятью или персистенцией или прогрессированием индуцированных гипергликемией микрососудистых изменений во время последующих периодов нормального гомеостаза глюкозы. Наиболее ярким примером этого феномена является развитие тяжелой ретинопатии в гистологически нормальных глазах диабетических собак, которое встречается полностью во время периода 2,5 лет нормализованной глюкозы крови, за которым следует период 2,5 лет гипергликемии. Индуцированные гипергликемией увеличения транскрипции выбранных генов матрикса также сохраняются в течение недель после восстановления нормогликемии in vivo, и менее выраженное, но количественно сходное пролонгирование индуцированного гипергликемией увеличения транскрипции выбранных генов матрикса происходит в культивируемых эндотелиальных клетках. В отношении дополнительной информации см. "Shared pathophysiologic features of microvascularcomplications of diabetes" (Larsen: Williams Textbook of Endocrinology, 10th ed., Copyright 2003 Elsevier). Микрососудистые осложнения встречаются не только в явном диабете, но также вследствие нарушенной толерантности к глюкозе (IGT). Микрососудистые осложнения IGT: невропатия, ретинопатия и почечная микропротеинурия.-4 012799 Диабетическая невропатия Диабетические невропатии являются невропатическими нарушениями (повреждением периферических нервов), которые ассоциированы с сахарным диабетом. Эти состояния обычно происходят из диабетического микрососудистого повреждения, включающего малые кровеносные сосуды, которые обеспечивают кровоснабжение нервов (vasa nervorum). Относительно обычные состояния, которые могут быть ассоциированы в диабетической невропатией, включают паралич третьего нерва; мононевропатию; множественную мононевропатию; диабетическую амиотрофию; болезненную полиневропатию; автономную невропатию и торако-абдоминальную невропатию и наиболее обычную форму, периферическую невропатию, которая поражает в основном стопы и ноги. В развитии диабетической невропатии участвуют четыре фактора: микрососудистое заболевание, продвинутые гликозилированные конечные продукты,протеинкиназа С и путь полиолов. Микрососудистое заболевание в диабетической невропатии Сосудистые и невральные заболевания являются тесно связанными и переплетенными друг с другом. Кровеносные сосуды зависят от нормальной функции нервов, а нервы зависят от достаточного кровоснабжения. Первым патологическим изменением в микрососудистой сети является вазоконстрикция(сужение кровеносных сосудов). По мере прогрессирования заболевания дисфункция нервных клеток тесно коррелирует с развитием сосудистых патологий, таких как утолщение базальной мембраны капилляров и гиперплазия эндотелия, которые способствуют уменьшению кислородного потенциала и гипоксии. Нейронная ишемия является хорошо установленной характеристикой диабетической невропатии. Сосудорасширяющие агенты (вазодилататоры) (например, ингибиторы ангиотензинпревращающего фермента, альфа 1-антагонисты) могут приводить к существенным улучшениям в кровоснабжении нервных клеток, с соответствующими улучшениями скорости проводимости нервов. Таким образом, микрососудистая дисфункция происходит в ранней стадии диабета, следует параллельно с прогрессированием нейронной дисфункции и может быть достаточной для поддержания тяжести структурных, функциональных и клинических изменений, наблюдаемых в диабетической невропатии. Периферическая невропатия (ноги), сенсорно-двигательная невропатия является существенным компонентом в патогенезе язв ног в диабете. Невропатия является обычным осложнением диабета, встречающимся со временем у более половины пациентов с диабетом типа 2. Исследования проводимости нервов демонстрируют, что невропатия уже присутствует у 10-18% пациентов на момент диагностики диабета, что предполагает, что повреждение периферического нерва происходит на ранних стадиях заболевания и с более слабым нарушением гликемической регуляции. Концепция, что невропатия является ранним клиническим признаком диабета,была предложена 40 лет назад, и большинство исследований сообщают связь между IGT и невропатией. Большинство пациентов с IGT и ассоциированной невропатией имеют симметричную дистальную сенсорную полиневропатию с сильно выраженной невропатической болью. IGT-невропатия (Microvascularcomplications of impaired glucose tolerance - Perspectives in Diabetes, J. Robinson Singleton, in Diabetes December 1, 2003) является фенотипически сходной с ранней диабетической невропатией, которая также вызывает сенсорные симптомы, в том числе боль, и автономную дисфункцию. В исследовании 669 пациентов с ранней диабетической невропатией сенсорные симптомы присутствовали у 60%, импотенция почти у 40% и другое автономное участие у 33%, но доказательство двигательного участия наблюдали только у 12%. Эти клинические результаты предполагают раннее участие малых немиелинированных нервных волокон, которые приносят боль, температуру, и автономные сигналы. Прямое количественное определение немиелинированных интраэпидермальных нервных волокон из кожных биопсий показывает сходную потерю волокон и измененную морфологию у пациентов с невропатией, ассоциированной с IGT и ранним диабетом. Автономная дисфункция, в частности эректильная дисфункция, и измененная сердечная вагусная реакция являются ранними признаками невропатического повреждения при диабете. Исследование с пациентами с IGT также предполагает преобладающую вагусную вегетативную дистонию: отдельные исследования обнаружили восстановление атипичной частоты сердечных сокращений после физической нагрузки, вариабельность отношения затупленного R-R интервала к глубокому дыханию и уменьшенное отношение выдоха к вдоху (все критерии вагусной вегетативной дистонии) в большей части пациентов сIGT, чем в нормогликемических контрольных субъектах того же самого возраста. Повреждение нервов при диабете поражает двигательные, сенсорные и автономные волокна. Двигательная невропатия вызывает мьшечную слабость, атрофию и парез. Сенсорная невропатия приводит к потере защитных ощущений боли, давления и нагревания. Отсутствие боли приводит ко многим проблемам в нечувствительности стоп, в том числе образованию язв, неощутимой травмы и нейрогенной артропатии (сустава Шарко). Пациент может не стремиться к лечению до тех пор, пока рана не станет запущенной. Комбинация сенсорной и двигательной дисфункции может заставить пациента подвергать стопу атипичному стрессу, приводящему к травме, которая может приводить к инфекции. Автономная симпатическая невропатия вызывает вазодилатацию и уменьшенное потоотделение, которое приводит к теплым, чрезмерно сухим стопам, которые особенно склонны к кожным разрывам, а также функциональным изменением в микрососудистом кровоснабжении. Автономная дисфункция (и дегенерация кожных-5 012799 структур) также приводит к потере целостности кожи, которая обеспечивает идеальное место для микробной инвазии. Невропатическая стопа не изъязвляется спонтанно; скорее она является комбинацией некоторой формы травмы, сопровождающейся невропатией. Микрососудистая дисфункция встречается на ранней стадии диабета, следует параллельно с прогрессированием нервной дисфункции и может быть достаточной для поддержания тяжести структурных,функциональных и клинических изменений, наблюдаемых при диабетической невропатии. Продвинутые гликозилированные конечные продукты - повышенные внутриклеточные уровни глюкозы вызывают неферментативное ковалентное связывание связей с белками, которое изменяет их структуру, и разрушает их функцию. Предполагается, что некоторые из этих гликозилированных белков участвуют в патологии диабетической невропатии и других долгосрочных осложнениях диабета. Протеинкиназа С (РКС) - РКС участвует в патологии диабетической невропатии. Увеличенные уровни глюкозы вызывают увеличение внутриклеточного диацилглицерина, который активирует РКС. Ингибиторы РКС в моделях животных будут увеличивать скорость проводимости нервов увеличением нейронного кровоснабжения. Сенсорно-двигательная полиневропатия Более длинные нервные волокна поражаются в большей степени, чем более короткие, так как скорость проводимости нервов замедляется пропорционально длине нерва. В этом синдроме пониженное ощущение и потеря рефлексов происходит сначала в кончиках пальцев билатерально, затем простирается вверх. Это обычно описывается как перчаточно-чулочное распределение онемение, потеря чувствительности, дизестезия и ночная боль. Эта боль может ощущаться как жжение, чувство покалывания, тупая боль или ноющая боль. Чувство покалывания и иголок является обычным. Потеря проприоцепции, т.е. ощущения, где находится в пространстве конечность, проявляется в ранней стадии. Эти пациенты не могут чувствовать, когда они наступают на чужеродное тело, например на щепку, или когда возникает мозоль от плохо подходящих туфель. Вследствие этого они находятся при риске развития язв и инфекций на стопах и ногах, которые могут приводить к ампутации. Подобным образом эти пациенты могут получить многочисленные переломы колена, лодыжки или стопы и развить сустав Шарко. Потеря двигательной функции приводит к изогнутой назад контрактуре пальцев стопы, так называемым молоткообразным пальцам стопы. Эти контрактуры встречаются не только в стопе, но также и в кисти руки. Автономная невропатия Автономная нервная система состоит из нервов, обслуживающих сердце, желудочно-кишечный тракт (GI) и мочевую систему. Автономная невропатия может поражать любую из систем этих органов. Наиболее часто диагностируемой автономной дисфункцией при диабете является ортостатическая гипотензия или неприятное ощущение головокружения при вставании у пациента. В случае диабетической автономной невропатии это является следствием неспособности сердца и артерий должным образом корректировать частоту сердечных сокращений и сосудистый тонус для сохранения непрерывного и полного протекания крови к головному мозгу. Этот симптом обычно сопровождается потерей синусного респираторного изменения, т.е. обычного изменения частоты сердечных сокращений, наблюдаемого при нормальном дыхании. Когда присутствуют эти два явления, присутствует сердечная автономная невропатия. Проявления желудочно-кишечного тракта включают задержанное опорожнение желудка, гастропарез, тошноту, метеоризм и диарею. Поскольку многие диабетики принимают пероральное лекарственное средство от диабета, на абсорбцию этих лекарственных средств в сильной степени влияет опорожнение желудка. Это может приводить к гипогликемии, когда пероральный диабетический агент принимается перед едой и не всасывается до нескольких часов или иногда нескольких дней, когда уже имеется нормальный или низкий сахар в крови. Вялое движение тонкой кишки может вызывать избыточный бактериальный рост, ухудшаемый присутствием гипергликемии. Это приводит к метеоризму, газам и диарее. Симптомы мочеиспускания включают частоту мочеиспускания, острые позывы к мочеиспусканию,недержание и задержку мочи. В этом случае также вследствие задержки сладкой мочи частыми являются инфекции мочевых путей. Задержка мочи может приводить к дивертикулам мочевого пузыря, камням,рефлюкс-нефропатии. Краниальная невропатия При поражении краниальных (черепных) нервов наиболее частыми являются глазодвигательные невропатии (3-его нерва). Глазодвигательный нерв контролирует все мышцы, которые участвуют в движениях глаза, за исключением латеральной прямой и верхней косой мышц. Он служит также для сужения зрачка и поднятия верхнего века. Возникновение диабетического паралича третьего нерва является обычно внезапным, начинающимся с лобной или расположенной вокруг глазницы боли с последующей диплопией. Могут быть поражены все глазодвигательные мышцы, иннервируемые третьим нервом, за исключением тех, которые контролируют размер зрачка. Шестой нерв, отводящий нерв, который иннервирует латеральную прямую мышцу глаза (перемещает глаз латерально), также часто поражается, но участие четвертого нерва, блокового нерва, (который иннервирует переднюю косую мышцу, которая перемещает глаз вниз) является нечастым. Мононевропатии грудных или поясничных нервов могут встречаться и приводить к болезненным синдромам, которые имитируют инфаркт миокарда, холецистит-6 012799 или аппендицит. Диабетики имеют более высокую встречаемость туннельных невропатий, например запястного синдрома. Диабетическая ишемия конечностей и диабетические язвы стоп Диабет и сдавливание могут нарушать микрососудистую циркуляцию и приводить к изменениям в коже на нижних конечностях, которые в свою очередь могут приводить к образованию язв и последующей инфекции. Микрососудистые изменения приводят к микроангиопатии мышц конечностей, а также к предрасположенности к развитию периферической ишемии и уменьшенной компенсаторной реакции ангиогенеза на ишемические события. Микрососудистая патология обостряет заболевание периферических сосудов (PVD) (или заболевание периферических артерий (PAD) или артериальное заболевание нижних конечностей (LEAD) - МАКРОсосудистое осложнение - сужение артерий в ногах вследствие атеросклероза. PVD встречается на более ранней стадии диабета, является более тяжелым и широкораспространенным и часто включает интеркуррентные микроциркуляторные проблемы, поражающие ноги,глаза и почки. Язвы и гангрена ног являются частыми сопутствующими состояниями PAD. Одновременная периферическая невропатия с нарушенной чувствительностью делает стопы восприимчивыми к травме, образованию язв и инфекции. Прогрессирование PAD при диабете смешивается с таким сопутствующим патологическим процессом, как периферическая невропатия и нечувствительность стоп и нижних конечностей к боли и травме. С ухудшенной циркуляцией и ухудшенной чувствительностью происходит образование язв и инфекция. Прогрессирование до остеомиелита и гангрены может привести к необходимости ампутации. Лица с диабетом имеют в 25 раз большую вероятность, чем лица без диабета, быть подвергнутыми ампутации нижней конечности, что усиливает необходимость предотвращения язв стоп и последующей потери конечностей. Диабетические язвы стоп могут встречаться не только вместе с PAD, но могут быть также связаны с невропатией, венозной недостаточностью (варикозными венами), травмой и инфекцией. PAD способствует этим другим состояниям в продуцировании или ускорении язв стоп. Язвы стоп необязательно представляют прогрессирование PAD, так как они могут иметь место в присутствии адекватной клинической периферической артериальной перфузии. Исследования на пациентах показывают увеличенный риск образования язв стоп у пациентов с диабетом, которые имели периферическую невропатию и сильное сдавливание подошвы стопы. Частота случаев язв или поражений на стопе или лодыжках была равна 15% от всех пациентов с диабетом в исследовании на основе популяции в южном Висконсине. Эта частота случаев была более высокой для индивидуумов с диабетом, диагностированных в возрасте менее 30 лет, была слегка более высокой у мужчин (16%), чем у женщин (13%), и была более высокой у получавших инсулин пациентах с диабетом (17%), чем у пациентов, не принимавших инсулин (10%). Частота случаев увеличивалась с возрастом, особенно у пациентов с диабетом, диагностированных в возрасте менее 30 лет. В исследованиях пациентов из Европы частота случаев язв стоп у пациентов с диабетом была 3% в возрасте пациентов 50 лет, 7% в возрасте 60 лет и 14% в возрасте 80 лет. Частота случаев была большей у мужчин, чем у женщин, в возрасте 70 лет. У пациентов с диабетом ишемия и инфекция стоп являются более серьезными и даже угрожающими жизни явлениями; однако, для лечения наиболее трудным состоянием является невропатия. Медицинская и хирургическая литература, относящаяся ко всем аспектам клинических и патологических проявлений диабетической стопы, имеется в несметном количестве. Невропатия, ангиопатия, ретинопатия и нефропатия, по отдельности или в комбинации и в различных степенях тяжести могут влиять на лечение диабетических стоп. Каждый год выполняются 82000 ампутаций конечностей у пациентов с сахарным диабетом. Большинство этих ампутаций выполняются в популяции пожилых людей. Ампутации, являющиеся следствием диабета, могут возникать из множественных этиологии, включающих язвы стоп, ишемию, венозные язвы ног (т.е. язвы, вторичные относительно венозного рефлюкса) и язвы пяток (т.е. язвы, происходящие из неизлеченных пролежней в пятке). Большинство этих ампутаций происходят из образования язв. Распространенность язв стоп среди пациентов с диабетом составляет 12%. Кроме того, 20-летняя кумулятивная распространенность язв нижних конечностей у пациентов с диабетом типа 1 составляет 9,9%. Индуцированные диабетом ампутации конечностей приводят к 5-летнему коэффициенту смертности 3968% и связаны с увеличенным риском дополнительных ампутаций. Продолжительность нахождения в больнице является приблизительно на 60% более длительной среди пациентов с диабетическими язвами стоп в сравнении с пациентами без язв. Диабетическая невропатия нарушает рефлекс аксонов нейронов, который зависит от функции здорового ноцицептора (болевого рецептора) С-волокон, и вызывает локальную вазодилатацию в ответ на болевой стимул. Это состояние дополнительно ухудшает вазодилататорную реакцию, присутствующую в состояниях стресса, таких как повреждение или воспаление, в диабетической невропатической стопе. Это ухудшение может частично объяснять, почему некоторые язвы в диабетической невропатической стопе либо заживают медленно, либо не заживают вообще, несмотря на успешную реваскуляризацию нижних конечностей.-7 012799 Таким образом, наиболее обычный причинный путь для образования диабетических язв стоп может быть идентифицирован как комбинация невропатии (потери чувствительности), деформации (например,сильно выступающих метатарзальных (плюсневых) выступов) и травмы (например, из-за неподходящей обуви). Большинство хирургов предпочитают выполнять подколенное или тибиальное артериальное шунтирование вследствие худших коэффициентов выживаемости и проходимости сосудов в сравнении с более проксимальными процедурами. Сообщалось, что, если подколенное или тибиальное артериальное шунтирование неспособно восстановить пальпируемый пульс стопы, ножное (относящееся к стопе) шунтирование обеспечивает более надежную и эффективную процедуру спасения конечности для пациентов с диабетом и ишемическими ранами стоп. Даже экстенсивное многосегментное заболевание у пациентов с диабетом не является препятствием для спасения стопы. В то время как серьезные раневые осложнения могут иметь гибельные результаты, они являются нечастыми после трансплантации обходного сосудистого ножного шунта (шунтирования стопы). Было показано, что подходящий контроль предсуществующей инфекции стопы и осторожной туннелизации трансплантата является эффективным в избежании дополнительных осложнений. Ангиопластика в нижней конечности становится более прогрессивно используемой. Однако следует обратить внимание на то, что для того, чтобы ангиопластика была эффективной, должен быть доступным дистальный сосуд или питающий сосуд, если должна быть получена более проксимальная ангиопластика. Хотя диабетические язвы/патологии конечностей могут быть излечены у некоторых пациентов (посредством санации раны, обработки антибиотиками, использованием препаратов для стимуляции грануляционной ткани (нового коллагена и ангиогенеза) и уменьшения бактериальной нагрузки в ране), было бы предпочтительно иметь фармацевтическую композицию, которая могла бы лучше лечить эти состояния и/или уменьшать эти симптомы. В отношении дополнительной информации, см. American Journal of Surgery, Volume 187, Number 5Suppl 1, May 1, 2004, Copyright2004 Elsevier. Коронарная микрососудистая дисфункция в диабете Корреляция между гистопатологией и микроциркуляторной дисфункцией при диабете хорошо известна из старых экспериментальных исследований и из аутопсии, где часто обнаруживают утолщение базальной мембраны, периваскулярный фиброз, разрежение сосудов и капиллярное кровоизлияние. Подтверждение этих данных in vivo остается затруднительным, хотя недавняя статья продемонстрировала корреляцию между патологией и глазной микрососудистой дисфункцией (Am J Physio1. 2003; 285). Однако большое количество клинических исследований показывают, что не только явный диабет, но также нарушенный метаболический контроль может влиять на коронарную микроциркуляцию. (Hypert Res 2002; 25: 893). Вернер ссылался на важную статью Sambuceti et al (Circulation 2001; 104:1129), показывающую персистенцию микрососудистой дисфункции у пациентов после успешного повторного открывания связанной с инфарктом артерии, которая может объяснить увеличенную сердечно-сосудистую заболеваемость и смертность этих пациентов. Имеется накапливающееся доказательство из больших исследований острой реперфузии, что заболеваемость и смертность не связаны с самим повторным открыванием связанной с инфарктом артерии, но гораздо больше зависят от TIMI-потока (лизиса тромбов при инфаркте миокарда) +/- миокардиального прилива (Stone 2002; Feldmann Circulation 2003). Herrmann показал, среди прочих, что целостность коронарной микроциркуляции является, возможно, наиболее важным и прогностическим фактором в этом контексте (Circulation 2001). Нейтральное действие защитных устройств (нет релевантного изменения для TIMI-потока, для разрешения ST или для MACE) может указывать на то, что функциональное нарушение микроциркуляции является главной детерминантой прогноза. Имеется также увеличивающееся доказательство того, что коронарная микрососудистая дисфункция играет главную роль в необструктивной CAD. Коронарная эндотелиальная дисфункция остается сильным прогностическим показателем в этих пациентах. Диабетическая нефропатия (почечная дисфункция у пациентов с диабетом) Диабетическая нефропатия включает микроальбуминурию (эффект микрососудистого заболевания), протеинурию и ESRD. Диабет является наиболее частой причиной почечной недостаточности, являясь ответственным за более чем 40% новых случаев. Даже когда лекарственные средства и диета могут контролировать диабет, это заболевание может приводить к нефропатии и почечной недостаточности. Большинство людей с диабетом не развивают нефропатию, которая является достаточно серьезной, чтобы вызывать почечную недостаточность. Приблизительно 16 миллионов людей в Соединенных Штатах имеют диабет и приблизительно 10000 людей имеют почечную недостаточность как следствие диабета. Диабетическая ретинопатия В диабетическом состоянии гипергликемия приводит к пониженному кровотоку сетчатки, гиперпроницаемости сетчатки, задержкам проводимости нерва фоторецептора и гибели нервных клеток сетчатки. В диабете с короткой продолжительностью была идентифицирована гибель нервных клеток во внутреннем ядерном слое сетчатки. Конкретно, апоптоз был локализован в глиальных клетках, таких как клетки Мюллера и астроциты, и было показано, что он происходит в пределах 1 месяца диабета в моделиSTZ-индуцированных диабетических крыс. Причина этих событий является многофакторный, включающий активацию пути диацилглицерин/РКС, окислительный стресс и неферментативное гликозилирование. Комбинация этих событий делает сетчатку гипоксической и, в конечном счете, приводит к развитию диабетической ретинопатии. Одной из возможных связей между ретинальной ишемией и ранними изменениями в диабетической сетчатке является индуцированное гипоксией продуцирование факторов роста,таких как VEGF. В качестве главного регулятора этой гипоксической реакции был идентифицирован индуцируемый гипоксией фактор-1 (HIF-1), контролирующий гены, которые регулируют клеточную пролиферацию и ангиогенез. Предыдущие исследования продемонстрировали, что ингибирование убиквитинирования HIF-1 приводит к связыванию с отвечающими на гипоксию элементами (HRE) и продуцированию мРНК VEGF. Диабетическая ретинопатия определяется как прогрессирующая дисфункция сосудистой сети сетчатки, вызываемая хронической гипергликемией. Ключевые признаки диабетической ретинопатии включают микроаневризмы, кровоизлияния сетчатки, липидные экссудаты сетчатки, пятна типа ватных комочков, отсутствие капиллярного кровоснабжения, отек желтого пятна и неоваскуляризацию. Ассоциированные признаки включают кровоизлияние стекловидного тела, отслоение сетчатки, неоваскулярную глаукому, преждевременную катаракту и параличи черепных нервов. В Соединенных Штатах имеются 16 миллионов людей с диабетом типа 1 и типа 2. В пределах 15 лет у 80% пациентов с диабетом Типа 1 развилась диабетическая ретинопатия, тогда как у 84% пациентов с диабетом типа 2 развилась ретинопатия в пределах 19 лет. Эти цифры создают значительный рынок для терапевтических агентов, нацеленных на глазные заболевания с неоваскуляризацией. Развитие диабетической ретинопатии зависит от времени. Несмотря на оптимальный контроль сахара крови можно ожидать, что у пациентов с продолжительным заболеванием со временем разовьется некоторая форма ретинопатии. National Society to Prevent Blindless приближенно определило, что 4-6 миллионов диабетиков в США имеют диабетическую ретинопатию. Определенная приближенно ежегодная встречаемость новых случаев пролиферативной диабетической ретинопатии и диабетического отека желтого пятна равна 65000 и 75000, соответственно, с частотой случаев 700000 и 500000, соответственно. Диабетическая ретинопатия вызывает 12000-24000 новых случаев слепоты в США ежегодно. Ретинопатию лечат хирургическими способами, эффективными в снижении тяжелой потери зрения, но обработанные лазерами части сетчатки являются необратимо разрушенными. Лечение лекарственными средствами является недоступным. Микрососудистое заболевание, которое первично поражает капилляры, сахарный диабет поражает глаз разрушением сосудистой сети в конъюнктиве, сетчатке и центральной нервной системе. Пациенты могут иметь в анамнезе давнишнюю инъецированную бульбарную конъюнктиву вместе с системными жалобами на потерю массы, несмотря на более чем нормальный аппетит (полиплазию), атипичную жажду (полидипсию) и патологически частое мочеиспускание (полиурию). Колебания остроты зрения, вторичные относительно нестабильного сахара крови, являются обычным глазным симптомом. Опухание в хрусталике приводит к большим неожиданным сдвигам в дифракции, а также преждевременному образованию катаркты. Изменения остроты зрения будет зависеть от тяжести и стадии этого заболевания. В сетчатке ослабление артериол и капилляров может приводить к характерному появлению интраретинальных кровоизлияний в виде точек и пятен, экссудатов, интраретинальных микрососудистых аномалий (IRMA), микроаневризм, отека и повреждений типа ватных комочков. Пролиферативная диабетическая ретинопатия является результатом тяжелого сосудистого нарушения и видна в виде неоваскуляризации диска (NVD) зрительного нерва, неоваскуляризации в другом месте (NVE) и неоваскуляризации радужки (NVI или диабетического покраснения радужки). Неврологические осложнения включают параличи третьего, четвертого и шестого черепных нервов, а также диабетический папиллит (воспаление диска зрительного нерва) и паралич лицевого нерва. Сахарный диабет является генетически обусловленной группой заболеваний, которые имеют общую непереносимость глюкозы. Он характеризуется как нарушение метаболической регуляции в результате недостаточности или нарушения функции инсулина или недостаточности или нарушения функции клеточных рецепторов инсулина. Биохимия, включающая образование сорбита, играет роль в деструкции перицитов, которые представляют собой клетки, которые поддерживают эндотелий сосудов. Когда эти поддерживающие перициты погибают, эндотелий капилляров становится ухудшенным, что приводит к утечке крови, белка и липидов из сосудов. Это в комбинации со сгущенной, загруженной глюкозой кровью, создает сосудистую недостаточность, отсутствие перфузии капилляров, ретинальную гипоксию, измененную структуру и пониженную функцию. Образование и высвобождение вазопролиферативных факторов, которые играют роль в генезе ретинальной неоваскуляризации, является слабо понимаемым. Большинство не угрожающих зрению осложнений диабета разрешаются спонтанно на протяжении нескольких недель - месяцев после лекарственного лечения. В случаях, когда имеются большие относящиеся к рефракции изменения, пациенты могут нуждаться во временном прописывании очков до тех пор, пока рефракция не стабилизируется. Когда ретинопатия угрожает желтому пятну или когда проли-9 012799 ферируют новые кровеносные сосуды, пациент может быть направлен на лазерную фотокоагуляцию. Исследование диабетической ретинопатии (DRS) убедительно доказало, что панретинальная фотокоагуляция была успешной в уменьшении риска тяжелой потери зрения в пациентах с высоким риском. Оно определило характеристики высокого риска следующим образом: (1) неоваскуляризация (образование новых сосудов) оптического диска (NVD) в размере одной четверти - одной трети диаметра оптического диска и (2) неоваскуляризация в другом месте (NVE) с любым кровоизлиянием стекловидного тела. Диабетический отек желтого пятна (DME)DME является осложнением диабетической ретинопатии, заболеванием, поражающим кровеносные сосуды сетчатки. Диабетическая ретинопатия приводит к множественным патологиям в сетчатке, в том числе утолщению и отеку сетчатки, кровоизлияниям, затрудненному кровотоку, избыточному подтеканию жидкости из кровеносных сосудов и, в конечных стадиях, к атипичному росту кровеносных сосудов. Этот рост кровеносных сосудов может приводить к большим кровоизлияниям и тяжелому повреждению сетчатки. Когда подтекание кровеносных сосудов диабетической ретинопатии вызывает отек в желтом пятне, его называют DME. Основным симптомом DME является потеря центрального зрения. Факторы риска, ассоциированные с DME, включают слабо контролируемые уровни глюкозы крови, высокое кровяное давление, атипичную функцию почек, вызывающую задержку жидкости, высокие уровни холестерина и другие обычные системные факторы. Согласно Всемирной Организации Здравоохранения диабетическая ретинопатия является главной причиной слепоты у взрослых людей работающего возраста и главной причиной потери зрения у диабетиков. American Diabetes Association сообщает, что имеется приблизительно 18 миллионов диабетиков в Соединенных Штатах и приблизительно 1,3 миллиона вновь диагностируемых случаев диабета в Соединенных Штатах каждый год. Prevent Blindness America и the National Eye Institute оценивают приближенно, что в Соединенных Штатах имеются более 5,3 миллионов людей в возрасте 18 лет или более с диабетической ретинопатией, в том числе приблизительно 50000 с DME. CDC оценивает, что ежегодно имеются приблизительно 75000 новых случаев DME в Соединенных Штатах. Дополнительные невропатии Кроме диабета обычными причинами невропатии являются инфекция опоясывающего герпеса,хроническая или острая травма (в том числе после хирургии) и различные нейротоксины. Невропатическая боль является обычной в случае рака как прямое действие рака на периферические нервы (например, сдавливание опухолью) и в качестве побочного действия многих химиотерапевтических лекарственных средств. Микрососудистое заболевание - сосудистые и невральные заболевания являются тесно связанными и переплетенными. Кровеносные сосуды зависят от нормальной функции нервов, а нервы зависят от достаточного кровоснабжения. Первым патологическим изменением в микрососудистой сети является вазоконстрикция. По мере прогрессирования заболевания дисфункция нервных клеток тесно коррелирует с развитием сосудистых патологий, таких как утолщение базальной мембраны капилляров и гиперплазия эндотелия, которые способствуют уменьшению кислородного потенциала и гипоксии. Сосудорасширяющие агенты (вазодилататоры) (например, ингибиторы ангиотензинпревращающего фермента, альфа 1-антагонисты) могут приводить к существенным улучшениям в кровоснабжении нервных клеток с соответствующими улучшениями скорости проводимости нервов. Клинические проявления Невропатия поражает все периферические нервы: болевые волокна, двигательные нейроны, автономные нервы. Таким образом, она может необязательно поражать все органы и системы, так как все они иннервированы. Имеются несколько отдельных синдромов, основанных на пораженных системах органов и членах, но они ни в коем случае не являются исключительными. Пациент может иметь сенсорнодвигательную и автономную невропатию или любую другую комбинацию. Несмотря на успехи в понимании метаболических причин невропатии, лечения, нацеленные на прерывание этих патологических процессов, ограничивались побочными эффектами и отсутствием эффективности. Таким образом, способы лечения являются симптоматическими и не направлены на лежащие в основе невропатии проблемы. Агенты для боли, вызываемой сенсорно-двигательной невропатией, включают трициклические антидепрессанты (ТСА), ингибиторы обратного захвата серотонина (SSRI) и антиэпилептические лекарственные средства (AED). Ни один из этих агентов не обращает патологические процессы, приводящие к диабетической невропатии, и ни один из них не изменяет непреклонно ход этого заболевания. Таким образом, было бы полезно иметь фармацевтическую композицию, которая могла бы лучшим образом лечить эти состояния и/или уменьшать эти симптомы. Дополнительные ретинопатии Ретинальная микроваскулопатия (ретинопатия СПИДа) Ретинальная микроваскулопатия наблюдается в 100% пациентов со СПИДом. Она характеризуется интраретинальными кровоизлияниями, микроаневризмами, пятнами Рота, пятнами типа ватных комочков (микроповреждений слоя нервных волокон) и образованием периваскулярной оболочки. Этиология этой ретинопатии неизвестна, хотя предполагали, что она обусловлена циркулирующими иммунными комплексами, локальным высвобождением цитотоксических веществ, аномальной гемореологией и- 10012799 ВИЧ-инфекцией эндотелиальных клеток. Ретинопатия СПИДа является в настоящее время настолько обычной, что пятна типа ватных комочков у пациента без диабета или гипертензии, но при риске в отношении ВИЧ должны побудить врача провести вирусное тестирование. Специфического лечения ретинопатии СПИДа не существует, но ее продолжающееся присутствие может побудить врача к повторному испытанию эффективности ВИЧ-терапии и получению согласия на это пациента. Ретинопатия трансплантации костного мозга (ВМТ) О ретинопатии трансплантации костного мозга впервые сообщалось в 1983 году. Она обычно возникает в пределах шести месяцев, но может иметь место так поздно, как при 62 месяцах после ВМТ. Факторы риска, такие как диабет и гипертензия, могут облегчать развитие ретинопатии ВМТ повышением ишемической микроваскулопатии. Не существует возрастной, половой или расовой предрасположенности в отношении развития ретинопатии ВМТ. Пациенты обнаруживают уменьшенную остроту зрения и/или недостаточность поля зрения. Показатели задних сегментов являются обычно билатеральными и симметричными. Клинические проявления включают множественные пятна типа ватных комочков,телеангиэктазию, микроаневризмы, отек желтого пятна, твердые экссудаты и кровоизлияния сетчатки. Ангиография с флуоресцеином демонстрирует отсутствие перфузии и подтекание капилляров, интраретинальные микрососудистые отклонения от нормы, микроаневризмы и отек желтого пятна. Хотя точная этиология ретинопатии ВМТ не была выяснена, на нее, по-видимому, действуют несколько факторов: токсичность циклоспорина, облучение всего тела (TBI) и химиотерапевтические агенты. Циклоспорин является сильным иммуномодулирующим агентом, который подавляет иммунную реакцию трансплантат против хозяина. Это может приводить к повреждению эндотелиальных клеток и неврологическим побочным действиям, и вследствие этого было сделано предположение, что это может быть причиной ретинопатии ВМТ. Однако ретинопатия ВМТ может развиваться в отсутствие применения циклоспорина, и не было показано, что циклоспорин вызывает ретинопатию ВМТ в аутологичных или сингенных реципиентах костного мозга. Таким образом, циклоспорин, по-видимому, не является единственной причиной ретинопатии ВМТ. Предполагалось также, что облучение всего тела (TBI) является причиной ретинопатии ВМТ. Облучение повреждает микроваскулатуру (микроциркуляторную часть сосудистого русла) и приводит к ишемической васкулопатии. Такие переменные, как общая доза облучения и временной интервал между облучением и иссечением костного мозга, являются, по-видимому, важными. Однако ретинопатия ВМТ может встречаться у пациентов, которые не получали TBI, и ретинопатию ВМТ не наблюдают у реципиентов трансплантатов солидных органов, которые получали сходные дозы облучения. Таким образом, TBI не является единственной причиной, но является другим фактором, способствующим развитию ретинопатии ВМТ. Предполагалось, что химиотерапевтические агенты являются потенциальным фактором, способствующим развитию ретинопатии ВМТ. Лекарственные средства, такие как цисплатин, кармустин и циклофосфамид, могут вызывать глазные побочные действия, в том числе отек диска зрительного нерва, ретробульбарный неврит, недостаточность поля зрения и корковую слепоту. Было сделано предположение, что эти химиотерапевтические лекарственные средства могут предрасполагать пациентов к индуцированным облучением ретинальным повреждениям и усиливать вредное действие облучения. Обычно, пациенты с ретинопатией ВМТ имеют хороший прогноз. Эта ретинопатия обычно устраняется в пределах двух-четырех месяцев после прекращения приема или понижения дозы циклоспорина. В одном сообщении 69% пациентов испытывали полное устранение ретинальных показателей и 46% пациентов полностью восстанавливали их фоновую остроту зрения. Вследствие благоприятного прогноза и относительно не прогрессирующего характера ретинопатии ВМТ агрессивное вмешательство обычно не является необходимым. Ишемические состояния Ишемия может быть подразделена на 2 категории: первая включает ускоренный атеросклероз, который встречается обычно у пациентов с диабетом, т.е. в бедренной, подколенной и задней большеберцовой артериях. Эти сосуды часто только 1 или 2 см в диаметре могут развивать атеросклеротическую бляшку, которая серьезно уменьшает кровоток. После того как большие сосуды становятся полностью закупоренными, могут происходить инсульт, инфаркт миокарда, ишемия и неизлечимые диабетические язвы стоп. Эта форма ишемии является, по существу, заболеванием больших сосудов. Деменция после инсульта 25% людей имеют деменцию после инсульта, причем у многих других развивается деменция на протяжении 5-10 лет. Кроме того, многие индивидуумы испытывают более трудно уловимые нарушения их более высоких функций головного мозга (таких как навыки планирования и скорость переработки информации) и подвержены очень высокому риску развития после этого деменции. Очень небольшие инсульты в глубоких частях головного мозга в этом процессе (называемом микрососудистым заболеванием) являются, по-видимому, существенными в процессе, приводящем к идентифицированному распределению атрофии головного мозга, специфическому для деменции после инсульта. Глазной ишемический синдром Пациенты, страдающие глазным ишемическим синдромом (OIS), являются обычно пожилыми, в пределах возраста 50-80 лет. Мужчины поражаются в два раза более часто, чем женщины. Такой пациент лишь в редких случаях является бессимптомным. Пониженное зрение обнаруживается в 90% случаев, и- 11012799 40% пациентов имеют сопутствующую глазную боль. Может быть также сопутствующая или предшествующая история временных ишемических приступов или преходящей слепоты. Пациенты также имеют существенное известное или неизвестное системное заболевание в момент описания случая. Наиболее часто встречающимися системными заболеваниями являются гипертензия, диабет, ишемическая болезнь сердца, инсульт и периферическое сосудистое заболевание. В меньшей степени пациенты проявляют OIS как следствие гигантоклеточного артериита (GCA). Односторонние показатели присутствуют в 80% случаев. Обычные показатели могут включать запущенную одностороннюю катаракту, воспаление передней камеры глаза, бессимптомную реакцию передней камеры глаза, отек желтого пятна, расширенные, но не скрученные вены сетчатки, среднепериферические кровоизлияния в виде точек и пятен, пятна типа ватных комочков, экссудаты и неоваскуляризацию диска зрительного нерва и сетчатки. Может наблюдаться также спонтанная артериальная пульсация, повышенное внутриглазное давление и неоваскуляризация радужки и угол с неоваскулярной глаукомой (NVG). Хотя этот пациент может обнаруживать неоваскуляризацию передней камеры глаза,может иметь место гипотония глаза вследствие низкой артериальной перфузии к ресничному телу. Иногда имеется видимая ретинальная эмболия (бляшки Холенхорста). Показатели в OIS обусловлены атероматозным изъязвлением сонной артерии и стенозом в бифуркации общей сонной артерии. У пяти процентов пациентов со стенозом внутренней артерии развиваетсяOIS. Однако OIS встречается только в том случае, если степень стеноза превышает 90%. Стеноз сонной артерии уменьшает перфузионное давление на глаз, приводя к вышеупомянутым ишемическим явлениям. Как только стеноз достигает 90%, перфузионное давление в центральной ретинальной артерий (CRA) падает только до 50%. Часто уменьшенное артериальное давление проявляется в виде спонтанной пульсации CRA. Эти показатели являются вариабельными и могут включать все из приведенных выше показателей. Пациенты с OIS имеют существенное системное заболевание, которое должно быть обследовано. Сердечная смерть является первичной причиной смертности в случае пациентов с OIS - пятилетний коэффициент смертности равен 40%. По этой причине пациенты с OIS должны быть отосланы к кардиологу для полной серологии, ЭКГ, эхокардиограммы и оценки сонных артерий. Микрососудистые заболевания почки Почка участвует в ряде отдельных клиникопатологических состояний, которые влияют на системную и почечную микроциркуляторную часть сосудистого русла (микроваскулатуру). Некоторые из этих состояний характеризуются первичным повреждением эндотелиальных клеток,таким как гемолитико-уремический синдром (HUS) и тромботическая тромбоцитопеническая пурпура (ТТР).HUS и ТТР являются близкородственными заболеваниями, отличающимися микроангиопатической гемолитической анемией и вариабельными нарушениями органов. Традиционно диагноз ТТР делается,когда почечная недостаточность является преобладающим признаком этого синдрома, как это является обычным у детей. У взрослых часто преобладает неврологическое нарушение и тогда этот синдром называют ТТР. Тромботическая микроангиопатия является лежащим в основе патологическим повреждением в обоих синдромах, и клинические и лабораторные показатели в пациентах с HUS или ТТР в значительной степени перекрываются. Это побудило некоторых исследователей рассматривать эти два синдрома как непрерывное единое заболевание. Патогенез: экспериментальные данные в сильной степени предполагают, что повреждение эндотелиальных клеток является первичным событием в патогенезеHUS/TTP. Эндотелиальное повреждение запускает каскад событий, который включает локальную внутрисосудистую коагуляцию, отложение фибрина и активацию и агрегацию тромбоцитов. Конечным результатом является гистопатологический показатель тромботической микроангиопатии, общий для различных форм синдрома HUS/TPP. При отсутствии лечения HUS/TTP коэффициент смертности приближается к 90%. Поддерживающая терапия - в том числе диализ, антигипертензивные лекарственные средства, переливания крови и лечение неврологических осложнений - способствует улучшенному выживанию пациентов с HUS/TTP. Адекватный баланс жидкости и отдых пищеварительного тракта являются важными в лечении типичного HUS с диареей; лучевой (радиационный) нефрит - долгосрочные осложнения облучения почек более чем 2500 рад могут быть подразделены на пять клинических синдромов:(i) острый радиационный нефрит имеет место в приблизительно 40% пациентов после латентного периода 6-13 месяцев. Он характеризуется клинически резким возникновением гипертензии, протеинурией, отеком и прогрессирующей почечной недостаточностью, в большинстве случаев приводящим к почкам терминальной стадии;(ii) хронический радиационный нефрит, напротив, имеет латентный период, который варьируется между 18 месяцами и 14 годами после начального повреждения. Он является постепенно протекающим в начале и характеризуется гипертензией, протеинурией и постепенной потерей почечной функции;(iii) третий синдром проявляется спустя 5-19 лет после действия облучения в виде доброкачественной протеинурии с нормальной почечной функцией;(iv) четвертая группа пациентов обнаруживает только доброкачественную гипертензию спустя 2- 12012799 года - 5 лет и может иметь вариабельную протеинурию. Поздняя злокачественная гипертензия возникает спустя 18 месяцев - 11 лет после облучения у пациентов либо с хроническим радиационным нефритом,либо доброкачественной гипертензией. Удаление пораженной почки устраняет гипертензию. Сообщалось также индуцированное облучением повреждение почечных артерий с последующей гипертензией почечных сосудов;(v) синдром почечной недостаточности, аналогичный острому радиационному нефриту, :наблюдали у пациентов с трансплантацией костного мозга (ВМТ), которых лечили облучением всего тела (TBI). Сообщалось, что облучение вызывает эндотелиальную дисфункцию, но сохраняет клетки гладких мышц сосудов в ранней стадии после облучения. Облучение могло бы непосредственно повреждать ДНК, приводя к пониженной регенерации этих клеток и оголению (денудации) базальной мембраны в клубочковых капиллярах и канальцах. Каким образом это начальное повреждение со временем приводит к гломерулосклерозу, атрофии канальцев и интерстициальному фиброзу, является неясным. Постулируется, что дегенерация слоя эндотелиальных клеток может приводить к внутрисосудистому тромбозу в капиллярах и более мелких артериолах. Эта внутрипочечная ангиопатия может тогда объяснять прогрессирующий почечный фиброз и гипертензию, которые характеризуют радиационный нефрит. Недавнее исследование почек облученной мыши показало зависимое от дозы увеличение лейкоцитов в корковом веществе почки, что предполагает роль воспалительных процессов в индуцированном облучением нефрите. В других заболеваниях почек микроциркуляторная часть сосудистой сети почки участвует в аутоиммунных нарушениях, таких как системный склероз (склеродермия). Участие почек в системном склерозе проявляется в виде медленно прогрессирующего хронического почечного заболевания или в виде почечного кризиса склеродермии (SRC), который характеризуется злокачественной гипертензией и острой азотемией. Постулируется, что SRC обусловлена Рейно-подобным феноменом в почке. Тяжелый вазоспазм приводит к ишемии коркового вещества почки и усиленному продуцированию ренина и ангиотензина II, которые, в свою очередь, сохраняют навсегда почечную вазоконстрикцию. Гормональные изменения (беременность), физический и эмоциональный стресс или низкая температура могут запускать Рейно-подобный артериальный вазоспазм. Роль системы ренин-ангиотензин в сохранении почечной ишемии подтверждается значительной пользой ингибиторов АСЕ в лечении SRC. Для пациентов с SRC,у которых прогрессирует тяжелая почечная недостаточность, несмотря на антигипертензивное лечение,становится необходимым диализ. Использовали как перитонеальный диализ, так и гемодиализ. Сообщение Network The End-Stage Renal Disease (ESRD) о 311 пациенте с системным индуцированным склерозом ESRD, подвергнутом диализу между 1983 и 1985 годами, выявило коэффициент выживаемости 33% при 3 годах. На почечную микроциркуляцию может влиять также серповидно-клеточная болезнь, к которой почка особенно чувствительна вследствие низкого кислородного потенциала, достигаемого в глубоких сосудах мозгового вещества почки в результате противоточного переноса кислорода вдоль vasa recta. Более мелкие почечные артерии и артериолы могут быть также местом тромбоэмболического повреждения от холестеринсодержащего материала, смещенного со стенок крупных сосудов. Взятые в виде группы заболевания, которые вызывают преходящую или перманентную окклюзию почечной микродиркуляторной части сосудистого русла, приводят к нарушению клубочковой перфузии и, следовательно, скорости клубочкового фильтрования, создавая тем самым серьезную угрозу в отношении системного гомеостаза. Острая почечная недостаточностьARF может быть вызвана микрососудистым или макрососудистым заболеванием (окклюзией главной почечной артерии или тяжелым заболеванием абдоминальной аорты). Классические микрососудистые заболевания часто обнаруживают микроангиопатический гемолиз и острую почечную недостаточность, имеющую место вследствие тромбоза или окклюзии клубочковых капилляров, часто сопровождающуюся тромбоцитопенией. Типичные примеры этих заболеваний включают: а) тромботическую тромбоцитопеническую пурпуру - классическая пентада в тромботической тромбоцитопенической пурпуре включает лихорадку, неврологические изменения, почечную недостаточность, микроангиопатическую гемолитическую анемию и тромбоцитопению;b) гемолитический уремический синдром - гемолитический уремический синдром подобен тромботической тромбоцитопенической пурпуре, но не обнаруживает неврологических изменений; с) синдром HELLP (гемолиза, повышенных ферментов печени и низких тромбоцитов) - синдромHELLP является типом гемолитического уремического синдрома, который встречается у беременных женщин, с добавлением повышений трансаминазы. Острая почечная недостаточность может присутствовать во всех медицинских условиях, но преимущественно приобретается в больницах. Это состояние развивается у 5% госпитализированных пациентов и приблизительно 0,5% госпитализированных пациентов нуждаются в диализе. На протяжении последних 40 лет коэффициент выживаемости для острой почечной недостаточности не улучшился,прежде всего вследствие того, что пораженные пациенты являются в настоящее время более старыми и имеют больше сопутствующих патологических состояний. Инфекция ответственна за 75% смертей в слу- 13012799 чае пациентов с острой почечной недостаточностью, и сердечно-респираторные осложнения являются второй наиболее частой причиной смерти. В зависимости от тяжести почечной недостаточности, коэффициент смертности может находиться в диапазоне от 7 до 80%. Острая почечная недостаточность может быть подразделена на три категории: предпочечная, внутренняя и послепочечная ARF. ВнутренняяARF подразделена на четыре категории: канальцевое заболевание, клубочковое заболевание, сосудистое заболевание (в том числе микрососудистое) и интерстициальное заболевание. Прогрессирующее почечное заболевание Имеется доказательство, что прогрессирующее почечное заболевание характеризуется прогрессирующей потерей микроциркуляторной части сосудистого русла. Потеря микроциркуляторной части сосудистого русла коррелирует непосредственно с развитием образования клубочковых и канальцевоинтерстициальных рубцов. Этот механизм частично опосредован уменьшением эндотелиальной пролиферативной реакции, и это нарушение репарации капилляров опосредовано изменением локальной эксцрессии как ангиогенных (сосудистый эндотелиальный фактор роста), так и антиангиогенных (тромбоспондин 1) факторов в почке. Изменение в балансе ангиогенных факторов роста опосредуется как связанными с макрофагами цитокинами (интерлейкин-1), так и вазоактивными медиаторами. Наконец, существует интригующее доказательство того, что стимуляция ангиогенеза и/или репарации капилляров может стабилизировать почечную функцию и замедлять прогрессирование и что этот положительный эффект имеет место независимо от действий на ВР или протеинурию. В отношении дополнительной информации см. BrennerRector's The Kidney, 7th ed., Copyright2004 Elsevier: Chapter 33 - Microvascular diseases, of kidney и также Tiwary and Vikrant Journal of IndianAcademy of Clinical Medicine, Vol. 5, No. 1 Review Article-Sepsis and the Kidney. В заключение, можно сказать, что существующие способы терапии для профилактики и/или лечения ХОБЛ, дегенерации желтого пятна и микрососудистых заболеваний являются неудовлетворительными, и существует потребность в развитии новых соединений для этой цели. Все заболевания и показания, описанные здесь выше, а также другие заболевания и состояния, описанные здесь, такие как MI,могут также лечиться новыми соединениями этого изобретения.RTP801 О гене RTP801 было впервые сообщено правопреемником данной заявки. Патенты США с номерами 6455674, 6555667 и 6740738, все переуступленные правопреемнику данной заявки, описывают per se полинуклеотид и полипептид RTP801 и антитела, направленные против этого полипептида. RTP801 представляет уникальную генную мишень для индуцируемого гипоксией фактора-1 (HIF-1), который может регулировать индуцируемый гипоксией патогенез независимо от факторов роста, таких как VEGF. Автор данного изобретения сделал открытия, ведущие к новой концепции ингибирования генаRTP801 с целью улучшения лечения различных респираторных нарушений. Следующие заявки на патенты и публикации представляют аспекты информации уровня техникиUS 6673549 описывает комбинацию, содержащую кДНК, которые дифференциально экспрессируются в ответ на лечение стероидами. Заявка США 2003165864 относится к кДНК, которые дифференциально экспрессируются в клетках,обработанных деметилирующим ДНК агентом. Заявка США 2003108871 относится к композиции, содержащей несколько кДНК, которые дифференциально экспрессируются в культурах клеток печени С 3 А человека и якобы применимы для лечения нарушений печени. Заявка США 2002119463 описывает новую композицию, применимую для лечения и диагностики рака предстательной железы, причем указанная композиция содержит кДНК человека, которые дифференциально экспрессируются в раке предстательной железы.WO 2004018999 описывает способ оценки, характеристики, мониторинга, профилактики и лечения рака шейки матки. ЕР 1394274 относится к способу тестирования на бронхиальную астму или хроническую обструктивную болезнь легких посредством сравнения уровня экспрессии маркерного гена в биологической пробе из субъекта с уровнем экспрессии этого гена в пробе из здорового субъекта.WO 2002101075 относится к выделенной молекуле нуклеиновой кислоты, применимой для детектирования, характеристики, профилактики и лечения рака шейки матки человека.WO 2003010205 относится к ингибированию ангиогенеза для лечения заживления ран, ретинопатии, ишемии, воспаления, микроваскулопатии, заживления костей и воспаления кожи.WO 2002046465 относится к идентификации гена, участвующего в заболевании, для лечения регулируемых гипоксией состояний.WO 2002031111 относится к якобы новым полипептидам и их кодируемым белкам и, следователь- 14012799 но, обеспечены многие их применения.WO 2001077289 описывает шестьсот двадцать три полинуклеотида, полученных из различных источников тканей человека.WO 2003101283 относится к комбинации, которая содержит многие кДНК и белки, якобы дифференциально экспрессируемые в респираторных заболеваниях.JP 2003259877 относится ко многим маркерам заболевания фиброза печени.Tzipora Shoshani, et al.: Identification of a Novel Hypoxia-Inducible Factor 1-Responsive Gene, RTP801,Involved in Apoptosis. MOLECULAR AND CELLULAR BIOLOGY, Apr. 2002, p. 2283-2293; эта статья, где соавтором является автор данного изобретения, подробно описывает ген RTP801 (тогда новый HIF-1 зависимый ген).Anat Brafman, et al.: Inhibition of Oxygen-Induced retinopathy in RTP801-Deficient Mice, Invest Ophthalmol Vis Sci. 2004 Oct; 45 (10): 3796-805; также в соавторстве с автором данного изобретения; эта статья демонстрирует, что в мышах с нокаутом RTP801 гипоксия не вызывает дегенерации капиллярной сети сетчатки.p63 to Regulation of Reactive Oxygen Species. Molecular Cell, Vol. 10, 995-1005, November, 2002; эта статья демонстрирует, что сверхэкспрессия RTP801 (называемого в этой статье REDD1) приводит к увеличенному продуцированию молекулярных частиц активного кислорода.Richard D.R., Berra E., and Pouyssegur J. Non-hypoxic pathway mediates the induction of hypoxiainducible factor 1 alpha in vascular smooth muscle cells. J. Biol. Chem. 2000, Sepl; 275(35): 26765-71; эта статья демонстрирует, что HIF-1-зависимая транскрипция может быть индуцирована избыточным продуцированием молекулярных частиц активного кислорода.Rangasami Т., et al.: Genetic ablation of Nrf2 enhances susceptibility to cigarette smoke-induced emphysema in mice. Подана в Journal of Clinical Investigation. Эта работа касается мышей с нарушенной защитой против антиоксидантов (вследствие инактивации RTP801 в зародышевой линии, здесь называемогоNrf2). Сущность изобретения Данное изобретение обеспечивает новые способы и композиции для лечения микрососудистых нарушений, дегенерации желтого пятна, респираторных нарушений и повреждения или заболевания спинного мозга. В одном варианте осуществления обеспечены новые молекулы, которые ингибируют RTP801 и могут быть использованы для лечения различных заболеваний и показаний. В другом варианте осуществления данное изобретение обеспечивает способ лечения пациента,страдающего микрососудистым нарушением, дегенерацией желтого пятна или респираторным нарушением, предусматривающий введение этому пациенту фармацевтической композиции, содержащей ингибитор RTP801. Другой вариант осуществления данного изобретения относится к способу лечения пациента, страдающего ХОБЛ, предусматривающему введение этому пациенту фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора RTP801. В одном варианте осуществления этим ингибитором является молекула siRNA, антисмысловая молекула, антитело (например, нейтрализующее антитело), доминантно негативный пептид или рибозим. Другой вариант осуществления данного изобретения относится к способу лечения пациента, страдающего дегенерацией желтого пятна, предусматривающему введение этому пациенту фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора RTP801. В одном варианте осуществления этим ингибитором является молекула siRNA, антисмысловая молекула, антитело (например, нейтрализующее антитело), доминантно негативный пептид или рибозим. Другой вариант осуществления данного изобретения относится к способу лечения пациента, страдающего микрососудистым нарушением, предусматривающему введение этому пациенту фармацевтической композиции, содержащей терапевтически эффективное количество ингибитора RTP801. В одном варианте осуществления этим ингибитором является молекула siRNA, антисмысловая молекула, антитело (например, нейтрализующее антитело), доминантно негативный пептид или рибозим. Дополнительный вариант осуществления данного изобретения обеспечивает применение терапевтически эффективного количества ингибитора RTP801 для приготовления лекарственного средства для стимуляции выздоровления пациента, страдающего респираторным нарушением. В одном варианте осуществления этим респираторным нарушением является ХОБЛ, а ингибитором является предпочтительноsiRNA. Дополнительный вариант осуществления данного изобретения обеспечивает применение терапевтически эффективной дозы ингибитора RTP801 для приготовления лекарственного средства для стимуляции выздоровления пациента, страдающего дегенерацией желтого пятна. В одном варианте осуществления дегенерацией желтого пятна является AMD, а ингибитором является предпочтительно siRNA.- 15012799 Дополнительный вариант осуществления данного изобретения обеспечивает применение терапевтически эффективной дозы ингибитора RTP801 для приготовления лекарственного средства для стимуляции выздоровления пациента, страдающего микрососудистым нарушением. В одном варианте осуществления этим микрососудистым нарушением является диабетическая ретинопатия, а ингибитором является предпочтительно siRNA. Подробное описание изобретения Данное изобретение в некоторых его вариантах осуществления относится к ингибированию гена или полипептида RTP801 для лечения глазных болезней, респираторных нарушений и микрососудистых нарушений, inter alia. Как будет описано здесь, предпочтительными ингибиторами для применения с данным изобретением являются биологические молекулы. Не связывая себя теорией, авторы данного изобретения обнаружили, что RTP801 участвует в различных патологических состояниях, в том числе микрососудистых нарушениях, глазных болезнях, респираторных нарушениях и повреждении и заболевании костного мозга, и мог бы быть полезным для ингибирования RTP801 для лечения любого из указанных заболеваний или нарушений. Способы, молекулы и композиции, которые ингибируют RTP801, обсуждаются здесь подробно, и любые из указанных молекул и/или композиций могут быть с пользой использованы в лечении пациента, страдающего любым из указанных состояний. Данное изобретение обеспечивает способы и композиции для ингибирования экспрессии генаRTP801 in vivo. Обычно, этот способ включает введение олигорибонуклеотидов, таких как малые интерферирующие РНК (т.е. siRNA), которые нацелены на конкретную мРНК и гибридизуются с ней, или материала нуклеиновых кислот, который может продуцировать siRNA в клетке в количестве, достаточном для подавления экспрессии гена-мишени посредством механизма интерференции РНК. В частности, рассматриваемый способ может быть использован для ингибирования гена RTP801 для лечения респираторных нарушений, микрососудистых нарушений или глазных нарушений. Таким образом, в одном варианте осуществления данное изобретение обеспечивает способ лечения пациента, страдающего микрососудистым нарушением, глазной болезнью или респираторным нарушением, предусматривающий введение этому пациенту фармацевтической композиции, содержащей ингибитор RTP801, в терапевтически эффективном количестве, с тем, чтобы таким образом лечить пациента. Кроме того, данное изобретение обеспечивает способ лечения пациента, страдающего микрососудистым нарушением, глазной болезнью или респираторным нарушением, предусматривающий введение этому пациенту фармацевтической композиции, содержащей ингибитор RTP801, в дозе и на протяжении периода времени, достаточных для стимуляции выздоровления. Глазной болезнью может быть дегенерация желтого пятна, например связанная с возрастом дегенерация желтого пятна (AMD), inter alia. Микрососудистым нарушением может быть диабетическая ретинопатия или острая почечная недостаточность,inter alia. Респираторным нарушением может быть хроническая обструктивная болезнь легких (ХОБЛ),эмфизема, хронический бронхит, астма и рак легкого, inter alia. Ингибитор RTP801 может быть выбран из большого разнобразия молекул, в том числе, но не только, таких соединений, как полинуклеотиды,AS-фрагменты (антисмысловые фрагменты), молекулы РНК, которые нацелены на мРНК гена RTP801,такие как рибозимы или siRNA (такие как siRNA таблиц А-С и, в частности, siRNA с номерами 14, 22,23, 25, 27, 39, 41, 42, 49 и 50 таблицы А), или содержащие их экспрессирующие векторы; полипептиды,такие как доминантно негативные полипептиды, антитела (такие как антитело, которое специфически связывается с эпитопом, присутствующим в полипептиде, который содержит последовательные аминокислоты, последовательность которых представлена на фиг. 2 (SEQ ID NO:2, или, в некоторых случаях,ферменты. Кроме того, ингибитором RTP801 может быть химический ингибитор, такой как малая молекула, например химические молекулы с низкой молекулярной массой, например с молекулярной массой,меньшей чем 2000 Да. Конкретные ингибиторы RTP801 представлены ниже. Кроме того, данное изобретение обеспечивает способ лечения пациента, страдающего дегенерацией желтого пятна, ХОБЛ или диабетической ретинопатией, предусматривающий введение этому пациенту фармацевтической композиции, содержащей терапевтически эффективную дозу ингибитора RTP801,содержащего полинуклеотид, который специфически гибридизуется с мРНК, транскрибируемой из генаRTP801, и/или подавляет экспрессию гена RTP801 с тем, чтобы таким образом лечить пациента. Этим полинуклеотидом может быть siRNA, содержащая последовательные нуклеотиды, имеющие последовательность, идентичную любой из последовательностей, представленных в табл. А-С (SEQ ID NO:3-344),и, в частности, siRNA с номерами 14, 22, 23, 25, 27, 39, 41, 42, 49 и 50 табл. А. Кроме того, дополнительный вариант осуществления данного изобретения относится к способу лечения пациента, страдающего микрососудистым нарушением, респираторным нарушением или глазной болезнью, предусматривающему введение этому пациенту фармацевтической композиции, содержащей терапевтически эффективную дозу ингибитора RTP801, содержащего молекулу siRNA, необязательно молекулу siRNA, представленную в любой из табл. А-С, в дозе и на протяжении периода времени с тем,чтобы таким образом лечить пациента. Обеспечен дополнительный способ лечения пациента, страдающего микрососудистым нарушением,респираторным нарушением или глазной болезнью, предусматривающий введение этому пациенту фар- 16012799 мацевтической композиции, содержащей терапевтически эффективную дозу молекулы РНК, которая нацелена на мРНК гена RTP801, в дозе и на протяжении периода времени с тем, чтобы таким образом лечить пациента. Этой молекулой РНК может быть молекула siRNA, такая как молекула siRNA, представленная в табл. А-С, и, в частности, siRNA с номерами 14, 22, 23, 25, 27, 39, 41, 42, 49 и 50 табл. А,или рибозим. Кроме того, данное изобретение обеспечивает способ лечения пациента, страдающего респираторным нарушением, микрососудистым нарушением или глазной болезнью или любым из описанных здесь состояний, предусматривающий введение пациенту фармацевтической композиции, содержащей терапевтически эффективную дозу молекулы siRNA, которая нацелена на мРНК гена RTP801, необязательно молекулы siRNA, представленной в табл. А-С, в дозе и на протяжении периода времени с тем, чтобы таким образом лечить пациента. Кроме того, глазной болезнью может быть дегенерация желтого пятна (AMD); микрососудистым нарушением может быть диабетическая ретинопатия или острая почечная недостаточность; респираторным нарушением может быть ХОБЛ, и проявлениями ХОБЛ, подлежащими лечению, могут быть, но не только, эмфизема, хронический бронхит или и то, и другое. Лечение заболевания обозначает введение терапевтического вещества, эффективного для уменьшения симптомов, связанных с заболеванием, для ослабления тяжести или лечения этого заболевания или для предупреждения возникновения этого заболевания. Терапевтически эффективной дозой называют количество фармацевтического соединения или фармацевтической композиции, которое является эффективным для достижения улучшения у пациента или его физиологических системах, включающего, но не ограничивающегося ими, улучшенный коэффициент выживаемости, более быстрое выздоровление или улучшение или устранение симптомов и другие показатели, выбранные в качестве подходящих определяющих критериев специалистами с квалификацией в данной области. Способы лечения заболеваний, описанные здесь и включенные в данное изобретение, могут предусматривать введение ингибитора RTP801 вместе с дополнительным ингибитором RTP801, веществом,которое улучшает фармакологические свойства этого активного ингредиента, как подробно описано ниже, или дополнительным соединением, о котором известно, что оно является эффективным в лечении подлежащего лечению заболевания, такого как дегенерация желтого пятна, ХОБЛ, ARF, DR, inter alia. Под выражением вместе с имеется в виду: до, одновременно или после. Дополнительная детализация примерных объединенных терапий приведена ниже. В другом варианте осуществления данное изобретение обеспечивает применение терапевтически эффективной дозы ингибитора RTP801 для приготовления лекарственного средства для стимуляции выздоровления пациента, страдающего дегенерацией желтого пятна, ХОБЛ, ARF, DR или любой другой глазной болезнью, микрососудистым или респираторным состоянием, подробно описанным выше, и применение терапевтически эффективной дозы ингибитора RTP801 для приготовления лекарственного средства для лечения указанных заболеваний и состояний. В этом варианте осуществления ингибиторRTP801 может содержать полинуклеотид, который содержит последовательные нуклеотиды, имеющие последовательность, которая содержит антисмысловую последовательность относительно последовательности, представленной на фиг. 1 (SEQ ID NO:1). Дополнительно, ингибитором RTP801 может быть экспрессирующий вектор, содержащий полинуклеотид, имеющий последовательность, которая является антисмысловой последовательностью относительно последовательности, представленной на фиг. 1 (SEQID NO:1). Ингибитором RTP801 в соответствии с указанными применениями может также быть антитело, такое как нейтрализующее антитело, которое специфически связывается с эпитопом, присутствующим в полипептиде, который содержит последовательные аминокислоты, последовательность которых представлена на фиг. 2 (SEQ ID NO:2). Кроме того, ингибитором RTP801 может быть молекула РНК,которая нацелена на мРНК гена RTP801, необязательно siRNA, необязательно siRNA, содержащая последовательные нуклеотиды, имеющие последовательность, идентичную любой из последовательностей,представленных в табл. А-С (SEQ ID NO:3-344) и, в частности, siRNA с номерами 14, 22, 23, 25, 27, 3 9,41, 42 и 50 табл. А, или рибозим. Таким образом, в соответствии с описанной здесь информацией ингибитор RTP801, который должен быть использован с любым из описанных здесь способов, в любом из описанных здесь применений,в любой из описанных здесь фармацевтических композиций, может быть выбран из группы, состоящей из молекулы siRNA, вектора, содержащего молекулу siRNA, вектора, который может экспрессировать молекулу siRNA, и любой молекулы, которая эндогенно процессируется в молекулу siRNA. Как подробно описано здесь, указанной молекулой siRNA является предпочтительно siRNA, содержащая последовательные нуклеотиды, имеющие последовательность, идентичную любой из последовательностей, представленных в табл. А-С (SEQ ID NO:3-344), и, в частности, siRNA с номерами 14, 22, 23, 25, 27, 39, 41, 42 и 50 табл. А. Респираторным нарушением называют состояния, заболевания или синдромы дыхательной (респираторной) системы, включающие, но не ограничивающиеся ими, легочные нарушения всех типов, в том числе хроническую обструктивную болезнь легких (ХОБЛ), эмфизему, хронический бронхит, астму и рак легкого, inter alia. Эмфизема и хронический бронхит могут встречаться в виде части ХОБЛ или независимо.- 17012799 Микрососудистым нарушением называют любое состояние, которое влияет на микроскопические капилляры и лимфатические сосуды, в частности вазоспастические заболевания, васкулитные заболевания и лимфатические окклюзивные заболевания. Примеры микрососудистых нарушений включают interalia: глазные нарушения, такие как слепота преходящая (эмболическая или вторичная относительно системной красной волчанки (SLE, apla-синдром, недостаточность Prot CS и ATIII, микрососудистые патологии, обусловленные IV-применением лекарственных средств, диспротеинемию, височный артериит,переднюю ишемическую глазную невропатию, ретробульбарный неврит (первичный или вторичный относительно аутоиммунных заболеваний), глаукому, синдром фон Гиппеля-Линдау, корнеальное заболевание, отторжение корнеального трансплантата, катаракты, болезнь Илза (ретинальный васкулит), frostedbranch angiitis, операция стягивания склеры (при отслойке сетчатки), увеит, в том числе pars planitis, хороидальная меланому, аплазия зрительного нерва; ретинальные состояния, такие как окклюзия ретинальной аретрии, окклюзия ретинальной вены, ретролетальная фиброплазия (синдром Терри), ВИЧретинопатия, ретинопатия Пурчера, ретинопатия системного васкулита и аутоиммунных заболеваний,диабетическая ретинопатия, гипертоническая ретинопатия, радиационная ретинопатия, окклюзия ветвей ретинальной артерии или вены, идиопатический ретинальный васкулит, аневризмы, нейроретинит, ретинальная эмболизация, острый ретинальный некроз, ретинохороидопатия Бердшота, давняя отслойка сетчатки; системные состояния, такие как сахарный диабет, диабетическая ретинопатия (DR), связанные с диабетом микрососудистые патологии (подробно описанные здесь), синдромы повышенной вязкости,синдромы дуги аорты и глазные ишемические синдромы, каротидно-кавернозный свищ, рассеянный склероз, системная красная волчанка, артериолит с аутоантителом SS-A, острый многоочаговый геморрагический васкулит, васкулит, происходящий из инфекции, васкулит, происходящий из болезни Бехчета, саркоидоз, коагулопатии, невропатии, нефропатии, микрососудистые заболевания почки и ишемические микрососудистые состояния, inter alia. Микрососудистые нарушения могут содержать неоваскулярный элемент (элемент образования новых сосудов). Термин неоваскулярное нарушение обозначает состояния, в которых образование кровеносных сосудов (неоваскуляризация) является вредной для пациента. Примеры глазной неоваскуляризации включают ретинальные заболевания (диабетическую ретинопатию, диабетический отек желтого пятна, хроническую глаукому, отслойку сетчатки и серповидноклеточную ретинопатию); покраснение радужки; пролиферативную витреоретинопатию; воспалительные заболевания; хронический увеит; неоплазмы (ретинобластому, псевдоглиому и меланому); гетерохромный иридоциклит Фухса; неоваскулярную глаукому; корнеальную неоваскуляризацию (воспалительную, трансплантационную и связанную с развитием гипоплазию радужки); неоваскуляризацию после объединенной эктомии стекловидного тела и эктомии хрусталика; сосудистые заболевания (ретинальную ишемию, хороидальную сосудистую недостаточность, хороидальный тромбоз и ишемию сонной артерии); неоваскуляризацию зрительного нерва и неоваскуляризацию вследствие проникновения в глаз или повреждение глаза в результате ушиба(контузии). Все эти неоваскулярные состояния могут лечиться с использованием соединений и фармацевтических композиций данного изобретения. Глазной болезнью называют состояния, заболевания или синдромы глаза, включающие, но не ограничивающиеся ими, любые состояния, включающие хороидальную неоваскуляризацию (CNV), влажную и сухую AMD, синдром гистоплазмоза глаза, ангиоидные полосы сетчатки, разрывы в оболочке Бруха (базальной пластинке), миопическую дегенерацию, глазные опухоли, ретинальные дегенеративные заболевания и окклюзию ретинальной вены (RVO). Некоторые описанные здесь состояния, такие как DR,которые могут лечиться в соответствии со способами данного изобретения, рассматривались либо как микрососудистое нарушение, либо как глазная болезнь, либо и то, и другое в представленных здесь определениях. Геном RTP801 называют открытую рамку считывания кодирующей RTP801 последовательности,показанную на фиг. 1 (SEQ ID NO:1), или ее любую гомологичную последовательность, предпочтительно имеющую по меньшей мере 70%-ную идентичность, более предпочтительно 80%-ную идентичность,даже более предпочтительно 90- или 95%-ную идентичность. Это включает любые последовательности,произведенные из SEQ ID NO:1, которые были подвергнуты мутациям, изменениям или модификациям,описанным здесь. Таким образом, в предпочтительном варианте осуществления RTP801 кодируется последовательностью нуклеиновой кислоты, соответствующей SEQ ID NO:1. В данное изобретение входят также нуклеиновые кислоты, которые являются только комплементарными и идентичными, соответственно, части нуклеиновой кислоты, кодирующей RTP801, предпочтительно в виде первой цепи, и первая цепь является обычно более короткой, чем нуклеиновая кислота в соответствии с данным изобретением. Должно быть также понятно, что на основе аминокислотной последовательности RTP801 любая последовательность нуклеиновой кислоты, кодирующая такую аминокислотную последовательность, может быть представлена специалистом с квалификацией в данной области на основе генетического кода. Однако вследствие предположительного механизма действия нуклеиновых кислот по данному изобретению наиболее предпочтительно, чтобы нуклеиновая кислота, кодирующая RTP801, предпочтительно его мРНК, была нуклеиновой кислотой, присутствующей в организме, ткани и/или клетке, соответственно, в которой должна быть уменьшена экспрессия RTP801.- 18012799 Полипептидом RTP801 называют полипептид гена RTP801, и, как это понятно, этот термин включает для целей данного изобретения термины RTP779, REDD1, Ddit4, FLJ20500, Dig2 иPRF1, полученные из любого организма, необязательно человека, их сплайсинговые варианты и фрагменты, сохраняющие биологическую активность, и их гомологи, предпочтительно имеющие по меньшей мере 70%-ную, более предпочтительно по меньшей мере 80%-ную, даже более предпочтительно по меньшей мере 90- или 95%-ную гомологию с ним. Кроме того, предполагается, что этот термин включает полипептиды, происходящие из минорных изменений в кодирующей последовательности RTP801, таких как inter alia, точковые мутации, замены, делеции и инсерции, которые могут вызывать различие в немногих аминокислотах между полученным полипептидом и природно встречающимся RTP801. Полипептиды, кодируемые последовательностями нуклеиновых кислот, которые связываются с кодирующей последовательностью или геномной последовательностью RTP801 в условиях гибридизации высокой строгости, которые хорошо известны в данной области (например, см. Ausubel et al.: Current Protocols inMolecular Biology, Johm Wiley and Sons, Baltimore, Maryland (1988), дополненные в 1995 и 1998 годах),также охвачены этим термином. В этот термин включены также химически модифицированный RTP801 или химически модифицированные фрагменты RTP801, пока сохраняется биологическая активность.RTP801 предпочтительно имеет или содержит аминокислотную последовательность, соответствующуюSEQ ID NO:2. Понятно, что могут быть различия в этой аминокислотной последовательности среди различных тканей организма или среди различных организмов одного вида или среди различных видов, к которым нуклеиновая кислота по данному изобретению может быть применена в различных вариантах осуществления данного изобретения. Однако на основе обеспеченных здесь технических описаний соответствующая последовательность может быть учтена соответствующим образом при конструировании любой из нуклеиновых кислот по данному изобретению. Конкретные фрагменты RTP801 включают аминокислоты 1-50, 51-100, 101-150, 151-200 и 201-232 последовательности, показанной на фиг. 2. Дополнительные конкретные фрагменты RTP801 включают аминокислоты 25-74, 75-124, 125-174, 175-224 и 225232 последовательности, показанной на фиг. 2.RTP801 обозначает в данном контексте белок, описанный, среди других, в WO 99/09046. RTP801,который также называют RTP801, был описан в качестве транскрипционной мишени HIF-1, Shoshani T.Mol Cell, 10, 995-1005) идентифицировали RTP801 в качестве p53-зависимого гена реакции повреждения ДНК и в качестве р 63-зависимого гена, участвующего в дифференцировке эпителия. RTP801 также отражает тканеспецифический характер члена р 63 семейства р 53, является эффективным подобно ТР 63 или в дополнение к ТР 63, является ингибитором дифференцировки in vitro и участвует в регуляции молекулярных частиц активного кислорода. Кроме того, RTP801 является чувствительным к чувствительному к гипоксии фактору транскрипции, индуцируемому гипоксией фактору 1 (HIF-1) и является обычно положительно регулируемым во время гипоксии как in vitro, так и in vivo в модели ишемического инсульта животного. RTP801 функционирует, по-видимому, в регуляции молекулярных частиц активного кислорода (ROS), и уровни ROS и уменьшенная чувствительность к окислительному стрессу увеличиваются после эктопической экспрессии RTP801 (Ellisen et al.: Supra; Shoshani et al. 2002, supra). Предпочтительно, RTP801 является биологически активным белком RTP801, который предпочтительно обнаруживает по меньшей мере одну из этих характеристик, предпочтительно две или более и наиболее предпочтительно каждую и любую из этих характеристик. Родственным RTP801 геном является RTP801L, также называемый "REDD2", и он был обнаружен авторами данного изобретения. RTP801L является гомологичным RTP801 и реагирует сходным образом на окислительный стресс; таким образом, RTP801L, возможно, обладает некоторыми сходными функциями с RTP801. Не связывая себя теорией, авторы считают, что RTP801, будучи индуцируемым стрессом белком(отвечающим на гипоксию, окислительный стресс, термический стресс, ER-стресс), является фактором,действующим в тонкой настройке реакции клеток на нарушение баланса энергии. Как таковой, он является мишенью, пригодной для лечения любого заболевания, в котором клетки должны быть спасены от апоптоза вследствие стрессовых условий (например, заболеваний, сопровождающихся гибелью нормальных клеток), или в котором клетки, которые адаптированы к стрессовым условиям вследствие изменений в экспрессии RTP801, должны быть убиты. В последнем случае RTP801 может рассматриваться как фактор выживаемости для раковых клеток, и его ингибиторы могут лечить рак в виде монотерапии или в виде сенсибилизирующих лекарственных средств в комбинации с химиотерапией или лучевой терапией. Термин полинуклеотид обозначает любую молекулу, состоящую из ДНК-нуклеотидов, РНКнуклеотидов или комбинации обоих типов, т.е. которая содержит два или более из оснований гуанидина,цитозина, тимидина, аденина, урацила или инозина, inter alia. Полинуклеотид может включать природные нуклеотиды, химически модифицированные нуклеотиды и синтетические нуклеотиды или их химические аналоги. Этот термин включает олигонуклеотиды и включает нуклеиновые кислоты. Термин аминокислота относится к молекуле, которая состоит из любой из 20 природно встречающихся аминокислот, аминокислот, которые были химически модифицированы (см. ниже) или синте- 19012799 тических аминокислот. Термин полипептид относится к молекуле, состоящей из двух или нескольких аминокислотных остатков. Этот термин включает пептиды, полипептиды, белки и пептидомиметики. Пептидомиметик является соединением, содержащим непептидные структурные элементы, который способен имитировать биологическое действие (действия) природного исходного пептида. Некоторые из классических пептидных характеристик, таких как ферментативно разрезаемые пептидные связи,обычно не присутствуют в пептидомиметике. Под термином доминантно негативный пептид имеют в виду полипептид, кодируемый кДНКфрагментом, который кодирует часть белка (см. Herskowitz I.: Functional inactivation of genes by dominantnegative mutations. Nature. 1987 Sep 17-23; 329 (6136):219-22. Review; Roninson I.B. et al.: Genetic suppressor elements: new tools for molecular oncology - thirteenth Cornelius P. Rhoads Memorial Award Lecture. Cancer Res. 1995 Sep 15; 55 (18) : 4023). Этот пептид может иметь отличающуюся функцию в сравнении с белком, из которого он произведен. Он может взаимодействовать с полным белком и ингибировать его активность или он может взаимодействовать с другими белками и ингибировать их активность в ответ на полноразмерный (исходный) белок. Доминантно негативный означает, что этот пептид способен преодолеть природный исходный белок и ингибировать его активность, придавая этой клетке отличающееся свойство, такое как резистентность или сенсибилизацию в отношении смерти или любого представляющего интерес клеточного фенотипа. Для терапевтического вмешательства этот пептид сам может доставляться в качестве активного ингредиента фармацевтической композиции или эта кДНК может быть доставлена в клетку с использованием известных способов. Получение пептидов и полипептидов Полипептиды могут быть получены с использованием нескольких способов, например: 1) синтетически. Синтетические полипептиды могут быть получены с использованием коммерчески доступного прибора с использованием известной последовательности RTP801 или ее части; 2) рекомбинантные способы. Предпочтительный способ получения полипептидов RTP801 или их фрагментов заключается в клонировании полинуклеотида, содержащего кДНК гена RTP801, в экспрессирующий вектор и культивировании клетки, несущей этот вектор, таким образом, чтобы экспрессировать кодируемый полипептид, и затем очистке полученного полипептида, причем все выполняется с использованием способов, известных в данной области, как описано, например, в Marshak et al.: "Strategies for Protein Purification and Characterization. A laboratory course manual.: "CSHL Press (1996). (Кроме того, см. Bibl Haematol. 1965; 23:116574 Appl Microbiol. 1967 Jul; 15(4):851-6; Can. J. Biochem. 1968 May; 46 (5):441-4; Biochemistrty. 1968 Jul; 7Feb 20; 38 (4): 825-30). Этот экспрессирующий вектор может включать промотор для регуляции транскрипции гетерологичного материала, и этот промотор может быть конститутивным или индуцибельным промотором, чтобы сделать возможной селективную транскрипцию. Необязательно могут быть включены энхансеры,которые могут требоваться для получения необходимых уровней транскрипции. Этот экспрессирующий вектор может также включать ген для отбора. Векторы могут быть введены в клетки или ткани любым из разнообразных способов, известных в данной области. Такие способы могут быть найдены обычно в Sambrook et al.: Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York (1989, 1992), в Ausubel et al.: Current Protocols inMA (1988) и Gilboa et al.: (1986); 3) очистка из природных источников. Полипептид. RTP801 или его природно встречающиеся фрагменты могут быть очищены из природных источников (таких как ткани) с использованием многих способов, известных специалисту с обычной квалификацией в данной области, таких как, например иммунопреципитация анти-RTP801-антителом или аффинная хроматография с матриксом, связанным с любой молекулой, о которой известно, что она связывает RTP801. Очистку белка выполняют, как известно в данной области и как описано, например, в Marschak etal.: "Strategies for Protein Purification and Characterization. A laboratory course manual." CSHL Press (1996). Под биологическим эффектом RTP801 или биологической активностью RTP801 имеют в виду действие RTP801 в респираторных нарушениях, которое может быть прямым или непрямым и включает,без связывания теорией, действие RTP8013 на апоптоз альвеолярных клеток, индуцированный гипоксическими или гипероксическими условиями. Непрямое действие включает, но не ограничивается ими,связывание RTP801 с одной из нескольких молекул или действие на одну из нескольких молекул, которые участвуют в каскаде трансдукции сигнала, приводящего к апоптозу. Апоптозом называют физиологический тип смерти клеток, который возникает из активации некоторых клеточных механизмов, т.е. смерти, которая регулируется аппаратом клетки. Апоптоз может,- 20012799 например, быть результатом активации аппарата клетки внешним пусковым механизмом, например цитокином или анти-FAS-антителом, который приводит к смерти клеток, или внутренним сигналом. Термин запрограммированная смерть клеток может быть также использован взаимозаменяемо с апоптозом. Связанное с апоптозом заболевание обозначает заболевание, этиология которого связана либо полностью, либо частично с процессом апоптоза. Это заболевание может быть вызвано либо нарушением функции апоптотического процесса (например, в случае рака или аутоиммунного заболевания), либо повышенной активностью апоптотического процесса (например, в случае некоторых нейродегенеративных заболеваний). Многие заболевания, в которых участвует RTP801, являются связанными с апоптозом заболеваниями. Например, апоптоз является важным механизмом в сухой AMD, посредством которого имеет место медленная атрофия фоторецепторных и содержащих пигементы эпителиальных клеток, прежде всего в центральном (макулярном) районе сетчатки. Нейроретинальный апоптоз является также важным механизмом в диабетической ретинопатии. Ингибитор является соединением, которое способно ингибировать активность гена или продукта такого гена до степени, достаточной для достижения биологического или физиологического эффекта. Ингибитор RTP801 является соединением, которое способно ингибировать активность гена RTP801 или продукта гена RTP801, в частности гена или продукта гена RTP801 человека. Такие ингибиторы включают вещества, которые влияют на транскрипцию или трансляцию этого гена, а также вещества,которые влияют на активность продукта этого гена. Ингибитор RTP801 может быть также ингибитором промотора RTP801. Примеры таких ингибиторов могут включать, inter alia: полинуклеотиды, такие какAS-фрагменты (антисмысловые фрагменты), малая интерферирующая РНК (siRNA) или содержащие их векторы; полипептиды, такие как доминантно негативные пептиды, антитела и ферменты; каталитические РНК, такие как рибозимы; и химические молекулы с низкой молекулярной массой, например молекулярной массой ниже 2000 Да. Конкретные ингибиторы RTP801 приведены ниже. Экспрессирующий вектор является вектором, который имеет способность включения в чужеродную клетку и экспрессии гетерологичных фрагментов ДНК в чужеродной клетке. Многие прокариотические и эукариотические экспрессирующие векторы находятся в рамках квалификации специалистов в данной области. Термин антитело относится к антителу IgG, IgM, IgD, IgA и IgE, inter alia. Это определение включает поликлональные антитела или моноклональные антитела. Этот термин относится к целым антителам или фрагментам антител, содержащим антигенсвязывающий домен, например антителам без Fcчасти, одноцепочечным антителам, мини-антителам, фрагментам, состоящим, по существу, только из вариабельного антигенсвязывающего домена антитела, и т.д. Термин антитело может также относиться к антителам против полинуклеотидных последовательностей, полученных вакцинацией кДНК. Этот термин включает также фрагменты антител, которые сохраняют способность селективного связывания с их антигеном или рецептором, и примерами их являются, inter alia:(1) Fab, фрагмент, который содержит одновалентный антигенсвязывающий фрагмент молекулы антитела, который может быть получен расщеплением целого антитела ферментом папаином с получением легкой цепи и части тяжелой цепи;(2) F(ab')2, фрагмент антитела, который может быть получен обработкой целого антитела ферментом пепсином без последующего восстановления; F(ab')2 является димером двух Fab-фрагментов, удерживаемых вместе двумя дисульфидными связями;(3) Fv, определяемый как генетически сконструированный фрагмент, содержащий вариабельную область тяжелой цепи, экспрессированную в виде двух цепей; и(4) одноцепочечное антитело (SCA), определяемое как генетически сконструированная молекула,содержащая вариабельную область легкой цепи и вариабельную область тяжелой цепи, связанные подходящим полипептидным линкером в виде слитой одноцепочечной молекулы. Под термином эпитоп в контексте данного изобретения имеют в виду антигенную детерминанту на антигене, с которой связывается антитело. Эпитопные детерминанты обычно состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или сахарные боковые цепи, и обычно имеют специфические структурные характеристики, а также специфические характеристики зарядов. Получение анти-RTP801-антител Антитела, которые связываются с RTP801 или произведенным из него фрагментом, могут быть получены с использованием интактного полипептида или фрагментов, содержащих меньшие полипептиды в качестве иммунизирующего антигена. Например, может быть желательным получение антител, которые специфически связываются с N-концевым или С-концевым или любыми другими подходящими доменами RTP801. Полипептид, используемый для иммунизации животного, может быть произведен из транслированной кДНК или получен химическим синтезом и может быть необязательно конъюгирован с белком-носителем. Такие обычно используемые носители, которые химически связаны с полипептидом,включают гемоцианин фиссуреллы (KLH), тироглобулин, бычий сывороточный альбумин (БСА) и столбнячный токсоид. Затем этот связанный полипептид используют для иммунизации животного.- 21012799 Если желательно, поликлональные или моноклональные антитела могут быть дополнительно очищены, например, связыванием с матриксом и элюцией из матрикса, с которым связан полипептид или пептид, к которому были индуцированы антитела. Специалистам с квалификацией в данной области известны различные способы, обычные в иммунологии, для очистки и/или концентрирования поликлональных, а также моноклональных антител (Collgan et al.: Unit 9, Current Protocols in Immunology, WileyInterscience, 1994). Способы получения антител всех типов, в том числе фрагментов, известны в данной области (см.,например, Harlow and Lane, "Antibodies: A Laboratory Manual," Cold Spring Harbor Laboratory, New York(1988. Способы иммунизации, в том числе все необходимые стадии приготовления иммуногена в подходящем адъюванте, определения связывания антител, выделения антител, способы получения моноклональных антител и гуманизации моноклональных антител являются известными квалифицированному специалисту в данной области. Антитела могут быть гуманизированными антителами или антителами человека. Антитела могут быть гуманизированы различными способами, известными в данной области, в том числе CDRтрансплантацией (ЕР 239400; Публикация РСТ WO 91/09967; US патенты с номерами 5225539; 5530101 и 5585089), облицовкой или изменением поверхности (ЕР 592106; ЕР 519596; Padlan, Molecular Immunology 28 (4/5) : 489-498 (1991); Studnicka et al.: Protein Ingineering. 7(6):805-814 (1994); Roguska et al.: PNAS 91:969-973 (1994 и перетасовкой цепи (патент США 5565332). Моноклональные антитела по определению включают антитела, полученные из одного вида (такие как мышиные, кроличьи, козьи, крысиные антитела и антитела человека и т.д.), а также антитела, полученные из двух или большего количества видов, такие как химерные и гуманизированные антитела. Полностью человеческие антитела особенно желательны для терапевтического лечения пациентовлюдей. Антитела человека могут быть получены различными способами, известными в данной области,включающими способы фагового дисплея с использованием библиотек антител, полученных из последовательностей иммуноглобулинов человека. См. также патенты США 4444887 и 4716111 и публикации РСТ WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741, каждая из которых включена здесь в качестве ссылки в ее полном объеме. Дополнительная информация в отношении всех типов антител, в том числе гуманизированных антител, антител человека и фрагментов антител может быть найдена в WO 01/05998, которая включена здесь в качестве ссылки в ее полном объеме. Нейтрализующие антитела могут быть получены обсуждаемыми выше способами, возможно с дополнительной стадией скрининга на нейтрализующую активность, например, с использованием анализа выживаемости. Термины химическое соединение, малая молекула, химическая молекула, малая химическая молекула и малое химическое соединение используются здесь взаимозаменяемо и относятся к химическим частям молекул любого конкретного типа, которые могут быть синтетически получены или получены из природных источников и обычно имеют молекулярную массу менее чем 2000 Да, менее чем 1000 Да или даже менее чем 600 Да. Данное изобретение относится также к функциональным нуклеиновым кислотам, содержащим двухцепочечную структуру, их применению для приготовления лекарственного средства, фармацевтической композиции, содержащей такие функциональные нуклеиновые кислоты, и способу лечения пациента. Гипоксию считают ключевым элементом в патологическом механизме целого ряда заболеваний, таких как инсульт, эмфизема и инфаркт, которые ассоциированы с субоптимальной доступностью кислорода и реакциями повреждения тканей в ответ на условия гипоксии. В быстро растущих тканях, в том числе в опухоли, субоптимальная доступность кислорода компенсируется нежелательным образованием новых кровеносных сосудов (неоангиогенезом). Таким образом, по меньшей мере в случае раковых заболеваний рост сосудистой сети является нежелательным. Ввиду этого ингибирование ангиогенеза и роста сосудов, соответственно, является предметом интенсивных исследований. Уже сегодня является доступными несколько соединений, которые ингибируют нежелательный ангиогенез и рост сосудов. Некоторые из более важных соединений являются соединениями, которые ингибируют VEGF и рецептор VEGF. В обоих случаях действие VEGF устраняется либо блокированием VEGF как такового, например, с использованием антител, направленных противVEGF, таких как изучаемое Genentech антитело AVASTIN (моноклональное АВ, специфическое в отношении VEGF) (Ferrara N., Endocr Rev. 2004 Aug; 25(4):581-611), либо блокированием соответствующего рецептора, т.е. рецептора VEGF (Traxler P.; Cancer Res. 2004 Jul 15: 64(14):4931-41; или Stadler W.M. etal.: Clin Cancer Res. 2004 May 15; 10 (10): 3365-70). Однако, поскольку ангиогенез и рост сосудистой сети является очень существенными и жизненно важным процессом в любом животном и человеке, действие этого типа соединений должно быть сфокусировано в конкретном участке, где ангиогенез и рост сосудов является фактически нежелательным, что делает подходящее нацеливание и подходящую доставку решающими в связи с этим типом терапевтического подхода.- 22012799 Таким образом, целью данного изобретения является обеспечение дополнительных средств для лечения заболеваний, в которых принимает участие рост сосудистой сети и ангиогенез, соответственно. Под малой интерферирующей РНК (siRNA) имеют в виду молекулу РНК, которая уменьшает или осуществляет сайленсинг (предотвращает экспрессию) гена/мРНК ее эндогенной клеточной копии. Предполагается, что этот термин включает интерференцию РНК (RNAi). Интерференцией РНК (RNAi) называют процесс последовательность-специфического посттранскрипционного сайленсинга генов в млекопитающих, опосредуемого малыми интерферирующими РНК (siRNA). (Fire et al.: 1998, Nature 391,806). Соответствующий процесс в растениях обычно называют специфическим посттранскрипционным сайленсингом генов или сайленсингом РНК, а также называют набуханием в грибах. Реакция интерференции РНК может представлять эндонуклеазный комплекс, содержащий siRNA, обычно называемый комплексом РНК-индуцируемого сайленсинга (RISC), который опосредует расщепление одноцепочечной РНК, имеющей последовательность, комплементарную антисмысловой цепи этого siRNA-дуплекса. Расщепление РНК-мишени может иметь место в середине района, комплементарного антисмысловой цепи siRNA-дуплекса (Elbashir et al. 2001, Genes Dev., 15, 188). В отношении недавней информации по этим терминам и предполагаемым механизмам см. Bernstein E.L, Denli A.M, Hannon G.J.: The rest issilence. RNA. 2001 Nov; 7(11).:1509-21; и Nishikura K.: A short primer on RNAi: RNA-directed RNA polymerase acts as a key catalyst. Cell. 2001 Nov 16; 107 (4) 415-8. Примеры молекул siRNA, которые могут быть использованы, приведены в табл. А-С. В последние годы интерференция РНК (RNAi) появилась в качестве одного из наиболее эффективных способов инактивации генов (Nature Reviews, 2002, v. ,3, p. 737-47; Nature, 2002, v. 418, p. 244-51). В качестве одного способа он основан на способности молекул двухцепочечной РНК (dsRNA) входить в специфический белковый комплекс, где она затем действует на комплементарную клеточную РНКмишень и специфически разрушает ее. Более подробно, dsRNA расщепляется на короткие (17-29 п.н.) ингибиторные РНК (siRNA) РНК-азами типа III (DICER, Drosha, и т.д.) (Nature, 2001, v. 409, p. 363-6;Nature, 2003, 425, p. 415-9). Эти фрагменты и комплементарные мРНК узнаются специфическим белковым комплексом RISC. Весь процесс кульминируется эндонуклеазным расщеплением мРНК-мишени(Nature Reviews, 2002, v. 3, p. 737-47; Curr Opin Mol Ther. 2003 Jun; 5(3):217-24). В отношении описания как конструировать и получать siRNA к известным генам см., например,Chalk A.M., Wahlestedt С., Sonnhammer E.L Improved and automated prediction of effective siRNARNAi: a chemical modification analysis, RNA 2003 Sep; 9 (9): 1034-48 and US Patent Nos.5898031 and 6107094 (Crooke) в отношении получения модифицированных/более стабильных siRNA. Были также разработаны векторы на основе ДНК, способные генерировать. siRNA в клетках. Этот способ обычно включает транскрипцию коротких шпилечных РНК, которые эффективно процессируются с образованием siRNA в клетках. Paddison et al. PNAS 2002, 8:5515-5520; и Brummelkamp et al. Science 2002, 296:550-553. Эти сообщения описывают способы генерирования siRNA, способных специфически нацеливаться на многочисленные эндогенно и экзогенно экспрессируемые гены. В отношении доставки siRNA см., например, Shen et al. (FEBS letters 539: 111-114 (2003, Xia et al.:Acids Research 31,11: 2717-2724 (2003. siRNA недавно была успешно использована для ингибирования в приматах; в отношении дополнительных подробностей см. Tolentino et al.: Retina 24(1) February 2004siRNA данного изобретения Общие описания siRNA данного изобретения Обычно siRNA, используемые в данном изобретении, содержат рибонуклеиновую кислоту, содержащую двухцепочечную структуру, причем эта двухцепочечная структура содержит первую цепь и вторую цепь, причем первая цепь содержит первый сегмент смежных нуклеотидов и указанный первый сегмент является, по меньшей мере, частично комплементарным нуклеиновой кислоте-мишени, а вторая цепь содержит второй сегмент смежных нуклеотидов и указанный второй сегмент является, по меньшей мере, частично идентичным нуклеиновой кислоте-мишени, причем указанная первая цепь и/или указанная вторая цепь содержит множество групп модифицированных нуклеотидов, имеющих модификацию в положении 2', причем в каждой группе этой цепи модифицированные нуклеотиды фланкированы на одной или на обеих сторонах фланкирующей группой нуклеотидов, причем фланкирующие нуклеотиды,образующие фланкирующую группу нуклеотидов, являются либо немодифицированными нуклеотидами,- 23012799 либо нуклеотидами, имеющими модификацию, отличающуюся от модификации вышеупомянутых модифицированных нуклеотидов. Кроме того, указанная первая цепь и/или указанная вторая цепь может содержать указанное множество модифицированных нуклеотидов и может содержать указанное множество групп модифицированных нуклеотидов. Группа модифицированных нуклеотидов и/или группа фланкирующих нуклеотидов может содержать некоторое количество нуклеотидов, причем это количество нуклеотидов выбрано из группы, состоящей из 1-10 нуклеотидов. В связи с любыми диапазонами, указанными здесь, должно быть понятно,что каждый диапазон включает любое отдельное целое число между соответствующими числами, используемыми для определения диапазона, в том числе указанные два числа, ограничивающие указанный диапазон. Таким образом, в данном случае эта группа содержит один нуклеотид, два нуклеотида, три нуклеотида, четыре нуклеотида, пять нуклеотидов, шесть нуклеотидов, семь нуклеотидов, восемь нуклеотидов, девять нуклеотидов и десять нуклеотидов. Распределение модифицированных нуклеотидов указанной первой цепи может быть таким же, что и распределение модифицированных нуклеотидов указанной второй цепи, и может быть сопоставлено с распределением указанной второй цепи. Кроме того, распределение указанной первой цепи может быть смещено на один или несколько нуклеотидов относительно распределения второй цепи. Обсуждаемые выше модификации могут быть выбраны из группы, состоящей из амино, фтора, метокси, алкокси и алкила. Двухцепочечная структура siRNA может быть затуплена на одной стороне или на обеих сторонах. Более конкретно, эта двухцепочечная структура может быть затуплена на стороне двухцепочечной структуры, которая ограничена 5'-концом первой цепи и 3'-концом второй цепи, или эта двухцепочечная структура может быть затуплена на стороне двухцепочечной структуры, которая ограничена 3'-концом первой цепи и 5'-концом второй цепи. Кроме того, по меньшей мере одна из этих двух цепей может иметь выступ по меньшей мере одного нуклеотида на 5'-конце; этот выступ может состоять из по меньшей мере одного дезоксирибонуклеотида. По меньшей мере одна из этих цепей может также необязательно иметь выступ из по меньшей мере одного нуклеотида на 3'-конце. Длина двухцепочечной структуры этой siRNA обычно равна приблизительно 17-21 и более предпочтительно 18-19 оснований. Кроме того, длина указанной первой цепи и/или длина указанной второй цепи может независимо друг от друга быть выбрана из группы, содержащей приблизительно 15 оснований - приблизительно 23 основания, 17 оснований - 21 основание и 18 или 19 оснований. Кроме того, комплементарность между указанной первой цепью и нуклеиновой кислотой-мишенью может быть абсолютной, или дуплекс, образованный между первой цепью и нуклеиновой кислотоймишенью, может содержать по меньшей мере 15 нуклеотидов, где имеется одно ошибочное спаривание или два ошибочных спаривания между указанной первой цепью и нуклеиновой кислотой-мишенью, образующими указанную двухцепочечную структуру. В некоторых случаях как первая цепь, так и вторая цепь, каждая содержат по меньшей мере одну группу модифицированных нуклеотидов и по меньшей мере одну фланкирующую группу нуклеотидов,причем каждая группа модифицированных нуклеотидов содержит по меньшей мере один нуклеотид и каждая фланкирующая группа нуклеотидов содержит по меньшей мере один нуклеотид, причем каждая группа модифицированных нуклеотидов первой цепи сопоставляется с фланкирующей группой нуклеотидов на второй цепи, причем наиболее концевой 5'-нуклеотид первой цели является нуклеотидом группы модифицированных нуклеотидов, а наиболее 3'-концевой нуклеотид второй цепи является нуклеотидом фланкирующей группы нуклеотидов. Каждая группа модифицированных нуклеотидов может состоять из единственного нуклеотида и/или каждая фланкирующая группа нуклеотидов может состоять из единственного нуклеотида. Кроме того, может быть так, что на первой цепи нуклеотид, образующий фланкирующую группу нуклеотидов, является немодифицированным нуклеотидом, который расположен в 3'-направлении относительно нуклеотида, образующего группу модифицированных нуклеотидов, а на второй цепи нуклеотид, образующий группу модифицированных нуклеотидов, является модифицированным нуклеотидом,который расположен в 5'-направлении относительно нуклеотида, образующего фланкирующую группу нуклеотидов. Кроме того, первая цепь siRNA может содержать восемь-двенадцать, предпочтительно девятьодиннадцать групп модифицированных нуклеотидов, а вторая цепь может содержать семь-одиннадцать,предпочтительно восемь-десять групп модифицированных нуклеотидов. Первая цепь и вторая цепь могут быть связаны структурой петли, которая может состоять из полимера, не являющегося нуклеиновой кислотой, такого как, inter alia, полиэтиленгликоль. Альтернативно,эта структура петли может состоять из нуклеиновой кислоты. Кроме того, 5'-конец первой цепи siRNA может быть связан с 3'-концом второй цепи или 3'-конец первой цепи может быть связан с 5'-концом второй цепи, причем указанная связь осуществляется через представляющий собой нуклеиновую кислоту линкер, обычно имеющий длину 10-2000 нуклеооснований.- 24012799 Конкретные описания siRNA данного изобретения Данное изобретение обеспечивает соединение, имеющее структуру (структуру А): 5' (N)x - Z 3' (антисмысловая цепь),3'Z' - (N')y 5' (смысловая цепь),где каждый N и N' обозначает рибонуклеотид, который может быть модифицированным или немодифицированным в его сахарном остатке, a (N)x и (N')у обозначает олигомер, в котором каждый последовательный N или N' соединен с последующим N или N' ковалентной связью; где каждый из х и у обозначает целое число 19-40; где каждый из Z и Z' может присутствовать или отсутствовать, но, если присутствует, обозначаетdTdT и является ковалентно присоединенным на 3'-конце цепи, в которой он присутствует; и где последовательность (N)x содержит антисмысловую последовательность относительно кДНК гена RTP801. В частности, данное изобретение обеспечивает вышеуказанное соединение, в котором последовательность (N)x содержит одну или несколько антисмысловых последовательностей, присутствующих в табл. А, В и С. В частности, данное изобретение обеспечивает вышеуказанное соединение, где ковалентной связью является фосфодиэфирная связь, где х=у, предпочтительно х=у=19, где Z и Z' оба отсутствуют, где по меньшей мере один рибонуклеотид является модифицированным в его сахарном остатке в положении 2',где группой в положении 2' является метокси (2'-O-метил), где чередующиеся рибонуклеотиды являются модифицированными как в антисмысловой, так и в смысловой цепях и где рибонуклеотиды на 5'- и 3'концах антисмысловой цепи являются модифицированными в их сахарных остатках, а рибонуклеотиды на 5'- и 3'-концах смысловой цепи являются немодифицированными в их сахарных остатках. В частности, siRNA, используемая в данном изобретении, является олигорибонуклеотидом, где одна цепь содержит последовательные нуклеотиды, имеющие от 5' к 3' последовательность, представленную в SEQ ID NO:3-52 или в SEQ ID NO:103-174 или в SEQ ID NO:247-295 (которые являются смысловыми цепями), где множество оснований могут быть модифицированными, предпочтительно 2-O-метилмодификацией, или ее гомолог, где изменено основание в сегменте до 2 нуклеотидов в каждом концевом районе. Кроме того, данное изобретение обеспечивает способ лечения пациента, страдающего респираторным нарушением, глазной болезнью, микрососудистым нарушением или повреждением или заболеванием спинного мозга, предусматривающий введение этому пациенту фармацевтической композиции, содержащей соединение вышеуказанной структуры (А) (имеющей любые вышеупомянутые специфические признаки), в терапевтически эффективном количестве с тем, чтобы таким образом лечить пациента. Кроме того, данное изобретение обеспечивает применение терапевтически эффективного количества вышеуказанной структуры (А) (имеющей любые вышеупомянутые специфические признаки) для приготовления лекарственного средства для стимуляции выздоровления пациента, страдающего респираторным нарушением, глазной болезнью, микрососудистым нарушением или повреждением или заболеванием спинного мозга. Дополнительный аспект данного изобретения обеспечивает фармацевтическую композицию, содержащую соединение вышеуказанной структуры (А) для лечения любого из упомянутых здесь заболеваний и состояний. Кроме того, этот аспект обеспечивает фармацевтическую композицию, содержащую два или более соединений вышеуказанной структуры (А) для лечения любого из упомянутых здесь заболеваний и состояний, причем указанные два соединения могут быть физически смешаны вместе в фармацевтической композиции в количествах, которые генерируют одинаковую или полезную в другом отношении активность, или могут быть ковалентно или нековалентно связаны или соединены вместе линкером нуклеиновой кислоты с длиной в диапазоне 2-100, предпочтительно 2-50 или 2-30 нуклеотидов. Таким образом,такие молекулы siRNA состоят из двухцепочечной структуры нуклеиновой кислоты, описанной здесь,причем две последовательности siRNA, выбранные из табл. А-С и предпочтительно из табл. A, SEQ IDNO:14, 22, 23, 25, 27, 39, 41, 42, 49 и 50, являются ковалентно или нековалентно связанными или соединенными вместе линкером с образованием тандемной молекулы siRNA. Такие тандемные молекулыsiRNA, содержащие две последовательности siRNA, будут обычно иметь длину из 38-150 нуклеотидов,более предпочтительно 38 или 40-60 нуклеотидов и большую длину, если в эту тандемную молекулу включены более чем две последовательности siRNA. Считается, что такие тандемные молекулы также являются частью данного изобретения, и дополнительная информация, касающаяся их, приведена ниже. Указанные, объединенные или тандемные структуры имеют то преимущество, что токсичность и/или не относящиеся к нацеливанию действия каждой siRNA являются минимизированными, тогда как эффективность является увеличенной. В частности, siRNA, используемые в примерах, были модифицированы таким образом, что 2'-О-Мегруппа присутствовала на первом, третьем, пятом, седьмом, девятом, одиннадцатом, тринадцатом, пятнадцатом, семнадцатом и девятнадцатом нуклеотиде антисмысловой цепи, причем та же самая модификация, т.е. 2'-О-Му-группа, присутствовала на втором, четвертом, шестом, восьмом, десятом, двенадца- 25012799 том, четырнадцатом, шестнадцатом и восемнадцатом нуклеотиде смысловой цепи. Кроме того, следует отметить, что в случае конкретных нуклеиновых кислот по данному изобретению первый сегмент является идентичным первой цепи, а второй сегмент является идентичным второй цепи, и эти нуклеиновые кислоты являются также затупленными. siRNA была фосфорилированной, но ожидается, что нефосфорилированная версия может быть более простой для получения в крупном масштабе, и было обнаружено,что указанная нефосфорилированная REDD14, названная REDD14NP, является точно такой же биологически активной, что и REDD14, в модели CNV (см. пример 6). Последовательностью этой siRNA, используемой в экспериментах в примерах 6-8, является последовательность REDD14, т.е. последовательность, имеющая внутреннюю ссылку 14 (см. табл. А). Концевым районом этого олигонуклеотида называют основания 1-4 и/или 16-19 в 19-мерных последовательностях (табл. А и В ниже) и основания 1-4 и/или 18-21, в 21-мерных последовательностях(табл. С ниже). Дополнительно, siRNA, используемые в данном изобретении, являются олигорибонуклеотидами,причем одна цепь содержит последовательные нуклеотиды, имеющие от 5'-конца к 3'-концу последовательность, представленную SEQ ID NO:53-102, или SEQ ID NO:175-246, или SEQ ID NO:296-344 (антисмысловые цепи), или ее гомолог, в котором изменено основание в сегменте до 2 нуклеотидов в каждом концевом районе. Таким образом, в конкретных аспектах этот олигонуклеотид содержит двухцепочечную структуру, причем такая двухцепочечная структура содержит первую цепь и вторую цепь, причем первая цепь содержит первый сегмент смежных нуклеотидов, а вторая цепь содержит второй сегмент смежных нуклеотидов, причем этот первый сегмент является либо комплементарным, либо идентичным последовательности нуклеиновой кислоты, кодирующей ген RTP801, причем второй сегмент является либо идентичным, либо комплементарным последовательности нуклеиновой кислоты, кодирующейRTP801. Указанный первый сегмент содержит по меньшей мере 14 нуклеотидов, предпочтительно по меньшей мере 18 нуклеотидов и даже более предпочтительно 19 нуклеотидов или даже по меньшей мере 21 нуклеотид. В одном варианте осуществления этот первый сегмент содержит приблизительно 14-40 нуклеотидов, предпочтительно приблизительно 18-30 нуклеотидов, более предпочтительно приблизительно 19-27 нуклеотидов и наиболее предпочтительно приблизительно 19 нуклеотидов - 23 нуклеотида. В одном варианте осуществления этот второй сегмент содержит приблизительно 14-40 нуклеотидов,предпочтительно приблизительно 18-30 нуклеотидов, более предпочтительно приблизительно 19-27 нуклеотидов и наиболее предпочтительно приблизительно 19 нуклеотидов - 23 нуклеотида или даже приблизительно 19 нуклеотидов - 21 нуклеотид. В одном варианте осуществления первый нуклеотид первого сегмента соответствует нуклеотиду последовательности нуклеиновой кислоты, кодирующей RTP801,вследствие чего последний нуклеотид этого первого сегмента соответствует нуклеотиду последовательности нуклеиновой кислоты, кодирующей RTP801. В одном варианте осуществления первый сегмент содержит последовательность по меньшей мере 14 смежных нуклеотидов олигонуклеотида, причем такой олигонуклеотид выбран из группы, состоящей из SEQ ID NO:3-344, предпочтительно из группы, содержащей олигонуклеотиды, имеющие последовательность любого из последовательных номеров 14, 22,23, 25, 27, 39, 41, 42, 49 и 50 в табл. А. Дополнительные описания молекул siRNA, используемых в данном изобретении, могут обеспечивать олигорибонуклеотид, в котором динуклеотид dTdT ковалентно присоединен к 3'-концу и/или по меньшей мере в одном нуклеотиде сахарный остаток является модифицированным, возможно, модификацией, содержащей 2'-О-метил-модификацию. Кроме того, 2'-ОНгруппа может быть заменена группой или частью молекулы, выбранной из группы, состоящей из -НОСН 3, -ОСН 2 СН 3, -OCH2CH2CH3, -NH2 и F. Кроме того, предпочтительные соединения данного изобретения, как описано выше, могут быть фосфорилированными или нефосфорилированными. Кроме того, siRNA, используемые в данном изобретении, могут быть олигорибонуклеотидом, в котором в чередующихся нуклеотидах модифицированные сахара расположены в обеих цепях. Конкретно,этот олигорибонуклеотид может содержать одну из смысловых цепей, в которой сахар является немодифицированным в 5'- и 3'-нуклеотидах, или одну из антисмысловых цепей, в которой сахар модифицирован в концевых 5'- и 3'-нуклеотидах. Кроме того, дополнительные нуклеиновые кислоты, которые могут быть использованы в данном изобретении, содержат по меньшей мере 14 смежных нуклеотидов любой из SEQ ID NO:3-344 и более предпочтительно 14 смежных пар нуклеотидных оснований на любом конце двухцепочечной структуры,состоящей из первого сегмента и второго сегмента, как описано выше. Специалисту с квалификацией в данной области должно быть понятно, что при наличии потенциальной длины нуклеиновой кислоты в соответствии с данным изобретением и, в частности, отдельных сегментов, образующих такую нуклеиновую кислоту в соответствии с данным изобретением, возможны некоторые смещения относительно кодирующей последовательности гена RTP801, как показано в SEQ ID NO:1, в каждую сторону, причем такие смещения могут быть на 1, 2, 3, 4, 5 и 6 нуклеотидов в обоих направлениях, причем генерированные таким образом двухцепочечные молекулы нуклеиновых кислот будут также находиться в рамках данного изобретения. Дополнительный аспект данного изобретения относится к функциональной нуклеиновой кислоте,содержащей двухцепочечную структуру, где такая двухцепочечная структура содержит первую цепь и- 26012799 вторую цепь, причем первая цепь содержит первый сегмент смежных нуклеотидов, а вторая цепь содержит второй сегмент смежных нуклеотидов, причем этот первый сегмент является либо комплементарным, либо идентичным последовательности нуклеиновой кислоты, кодирующей RTP801, а второй сегмент является либо идентичным, либо комплементарным последовательности нуклеиновой кислоты,кодирующей RTP801. В одном варианте осуществления эта нуклеиновая кислота отрицательно регулируется RTP801,причем эта отрицательная регуляция RTP801 выбрана из группы, состоящей из отрицательной регуляции функции RTP801, отрицательной регуляции белка RTP801 и отрицательной регуляции экспрессии мРНКRTP801. В одном варианте осуществления первый сегмент содержит по меньшей мере 14 нуклеотидов,предпочтительно по меньшей мере 18 нуклеотидов и даже более предпочтительно 19 нуклеотидов. В одном варианте осуществления первый сегмент содержит приблизительно 14-40 нуклеотидов,предпочтительно приблизительно 18-30 нуклеотидов, более предпочтительно приблизительно 19-27 нуклеотидов и наиболее предпочтительно приблизительно 19 нуклеотидов - 23 нуклеотида. В одном варианте осуществления второй сегмент содержит приблизительно 14-40 нуклеотидов,предпочтительно приблизительно 18-30 нуклеотидов, более предпочтительно приблизительно 19-27 нуклеотидов и наиболее предпочтительно приблизительно 19 нуклеотидов - 23 нуклеотида. В одном варианте осуществления первый нуклеотид первого сегмента соответствует нуклеотиду последовательности нуклеиновой кислоты, кодирующей RTP801, причем последний нуклеотид первого сегмента соответствует нуклеотиду последовательности нуклеиновой кислоты, кодирующей RTP801. В одном варианте осуществления один сегмент содержит последовательность из по меньшей мере 14 смежных нуклеотидов последовательности нуклеиновой кислоты, причем такая последовательность нуклеиновой кислоты выбрана из последовательностей, описанных в табл. А-С, предпочтительно из группы, содержащей SEQ ID NO:53, 66, 67, 72, 73, 74, 75, 76, 77, 91, 92, 93, 94, 96, 101 и 102, более предпочтительно выбранных из группы, содержащей SEQ ID NO:66, 75, 79, 91, 94, 101 и 102, и наиболее предпочтительно выбранных из группы, содержащей SEQ ID NO:66, 74, 75 и 79. В одном варианте осуществления другой сегмент содержит последовательность из по меньшей мере 14 смежных нуклеотидов последовательности нуклеиновой кислоты, причем такая последовательность нуклеиновой кислоты выбрана из последовательностей, описанных в табл. А-С, предпочтительно из группы, содержащей SEQ ID NO:3, 16, 22, 23, 24, 25, 26, 27, 29, 41, 42, 43, 44, 45, 46, 51 и 52, более предпочтительно выбрана из группы, содержащей SEQ ID NO:16, 24, 25, 29, 41, 44, 51 и 52, и наиболее предпочтительно выбрана из группы, содержащей SEQ ID NO:16, 24, 25 и 29. В одном варианте осуществления первый сегмент имеет последовательность в соответствии с SEQ ID NO:53, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:3; первый сегмент имеет последовательность в соответствии с SEQ ID NO:66, а второй сегмент имеет последовательность в соответствии c SEQ ID NO:16; первый сегмент имеет последовательность в соответствии с SEQ ID NO:67, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:17; первый сегмент имеет последовательность в соответствии с SEQ ID NO:72, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:22; первый сегмент имеет последовательность в соответствии с SEQ ID NO:73, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:23; первый сегмент имеет последовательность в соответствии с SEQ ID NO:74, а второй сегмент имеет последовательность в соответствии с SEQ ID NO: 24; первый сегмент имеет последовательность в соответствии с SEQ ID NO:75, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:25; первый сегмент имеет последовательность в соответствии с SEQ ID NO:76, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:26; первый сегмент имеет последовательность в соответствии с SEQ ID NO:77, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:27; первый сегмент имеет последовательность в соответствии с SEQ ID NO:79, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:29; первый сегмент имеет последовательность в соответствии с SEQ ID NO:91, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:41; первый сегмент имеет последовательность в соответствии с SEQ ID NO:92, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:42; первый сегмент имеет последовательность в соответствии с SEQ ID NO:93, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:43; первый сегмент имеет последовательность в соответствии с SEQ ID NO:94, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:44; первый сегмент имеет последовательность в соответствии с SEQ ID NO:95, а второй сегмент имеет- 27012799 последовательность в соответствии с SEQ ID NO:45; первый сегмент имеет последовательность в соответствии с SEQ ID NO:96, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:46; первый сегмент имеет последовательность в соответствии с SEQ ID NO:101, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:51; и первый сегмент имеет последовательность в соответствии с SEQ ID NO:102, а второй сегмент имеет последовательность в соответствии с SEQ ID NO:52. В одном варианте осуществления первый сегмент имеет последовательность нуклеиновой кислоты,которая выбрана из группы, содержащей SEQ ID NO:53, 66, 72, 73, 74, 75, 76, 77, 79, 91, 92, 93, 94, 95, 96,101 и 102. Должно быть понятно, что, хотя термины первый и второй сегмент используются вместе с нуклеиновыми кислотами данного изобретения, они используются только для удобства, и любая молекула нуклеиновой кислоты этого изобретения, которая описана как имеющая первый сегмент с последовательностью X и второй сегмент с последовательностью Y, могла бы быть также описана как имеющая первый сегмент с последовательностью Y и второй сегмент с последовательностью X, пока является ясным, что один сегмент содержится в антисмысловой цепи, которая должна быть антисмысловой относительно части кодирующей последовательности гена RTP801, а другой сегмент содержится в смысловой цепи, которая должна быть комплиментарной (хотя и не на 100% комплементарной) антисмысловой цепи, в соответствии с определениями и описаниями, представленными здесь. В одном варианте осуществления первая и/или вторая цепь содержит, по меньшей мере, выступ из одного нуклеотида на 3'-конце, который является комплементарным или идентичным соответствующему нуклеотиду последовательности нуклеиновой кислоты, кодирующей RTP801. В одном варианте осуществления первая и/или вторая цепь содержит выступ из 1-15 нуклеотидов на 3'-конце, предпочтительно первая и/или вторая цепь содержит выступ из 1-10 нуклеотидов на 3'конце, более предпочтительно первая и/или вторая цепь содержит выступ из 1-5 нуклеотидов на 3'-конце и наиболее предпочтительно первая и/или вторая цепь содержит выступ из 1-2 нуклеотидов на 3'-конце. В одном варианте осуществления первая и/или вторая цепь содержит, по меньшей мере, выступ из одного нуклеотида, который является отличающимся от соответствующего нуклеотида последовательности нуклеиновой кислоты, кодирующей RTP801. В одном варианте осуществления первая цепь содержит выступ из двух нуклеотидов, которые является отличающимися от соответствующего нуклеотида последовательности нуклеиновой кислоты, кодирующей RTP801. В одном варианте осуществления первая цепь состоит только из первого сегмента. В одном варианте осуществления вторая цепь состоит только из второго сегмента. В одном варианте осуществления первый сегмент и/или первая цепь содержит рибонуклеотиды. В одном варианте осуществления второй сегмент и/или вторая цепь содержит рибонуклеотиды. В одном варианте осуществления первый сегмент и/или вторая цепь состоят из рибонуклеотидов. В одном варианте осуществления некоторые или все эти нуклеотиды являются модифицированными. В предпочтительном варианте осуществления такая модификация относится к нуклеооснованию нуклеотида, сахарной части нуклеотида и/или фосфатной части нуклеотида. В более предпочтительном варианте осуществления этой модификацией является модификация сахарной части, и эта модификация находится в положении 2', причем 2'-ОН-группа заменена группой или частью молекулы, выбранной из группы, содержащей -H-OCH3, -OCH2CH3, -OCH2CH2CH3, -NH2 и -F. В одном варианте осуществления этой модификацией является модификация нуклеооснования, или модифицированное нуклеооснование выбрано из группы, содержащей инозин, ксантин, гипоксантин, 2 аминоаденин, 6-метил-, 2-пропил- и другие алкиладенины, 5-галогенурацил, 5-галогенцитозин, 5 галогеназацитозин, 6-азацитозин, 6-азатимин, псевдоурацил, 4-тиоурацил, 8-галогенаденин, 8 аминоаденин, 8-тиоладенин, 8-тиоалкиладенины, 8-гидроксиладенин и другие 8-замещенные аденины, 8 галогенгуанины, 8-аминогуанины, 8-тиолгуанин, 8-тиоалкилгуанин, 8-гидроксилгуанин и другие замещенные гуанины, другие аза- и деазааденины, другие аза- и деазагуанины, 5-трифторметилурацил и 5 трифторцитозин. В одном варианте осуществления этой модификацией является модификация фосфатной части молекулы, причем модифицированная фосфатная часть выбрана из группы, содержащей фосфотиоат. В одном варианте осуществления первый сегмент и/или второй сегмент содержит множество групп модифицированных нуклеотидов, имеющих модификацию в положении 2', причем в этом сегменте каждая группа модифицированных нуклеотидов фланкирована на одной или на обеих сторонах фланкирующей группой нуклеотидов, причем эти фланкирующие нуклеотиды, образующие фланкирующую группу нуклеотидов, являются либо немодифицированными нуклеотидами, либо нуклеотидами, имеющими модификацию, отличающуюся от модификации модифицированных нуклеотидов. В предпочтительном варианте осуществления первый сегмент и/или второй сегмент состоит из рибонуклеотидов.- 28012799 В более предпочтительном варианте осуществления первый сегмент и второй сегмент содержат множество групп модифицированных нуклеотидов. В одном варианте осуществления первый сегмент содержит указанное множество групп модифицированных нуклеотидов. В одном варианте осуществления второй сегмент содержит указанное множество групп модифицированных нуклеотидов. В одном варианте осуществления каждая группа модифицированных нуклеотидов и/или каждая группа фланкирующих нуклеотидов содержит некоторое количество нуклеотидов, причем это количество нукдеотидов выбрано из группы, содержащей 1 нуклеотид - 10 нуклеотидов. В одном варианте осуществления первый сегмент содержит первое распределение модифицированных нуклеотидов, а второй сегмент содержит второе распределение модифицированных нуклеотидов. В одном варианте осуществления первое распределение является тем же самым распределением,что и второе распределение. В другом варианте осуществления первое распределение сопоставляется со вторым распределением. В предпочтительном варианте осуществления первое распределение смещено на один или несколько нуклеотидов относительно второго распределения. В одном варианте осуществления каждая из групп модифицированных нуклеотидов состоит из одного модифицированного нуклеотида и каждая из групп фланкирующих нуклеотидов состоит из одного немодифицированного нуклеотида, имеющего модификацию, которая является отличающейся от модификации модифицированных нуклеотидов. В предпочтительном варианте осуществления модифицированный нуклеотид имеет группу -ОМе в положении 2'. В предпочтительном варианте осуществления фланкирующим нуклеотидом является рибонуклеотид, который имеет 2'-ОН-группу. В одном варианте осуществления первый сегмент начинается с модифицированного нуклеотида на 5'-конце и каждый другой нуклеотид этого сегмента является также модифицированным нуклеотидом,тогда как второй нуклеотид от 5'-конца и каждый другой нуклеотид является немодифицированным нуклеотидом или нуклеотидом, имеющим модификацию, которая является отличающейся от модификации. этого модифицированного нуклеотида (модифицированных нуклеотидов). В одном варианте осуществления первый сегмент находится в антисмысловой ориентации относительно последовательности нуклеиновой кислоты, кодирующей RTP801. Дополнительный аспект данного изобретения относится к фармацевтической композиции, содержащей нуклеиновую кислоту в соответствии с первым аспектом данного изобретения и/или вектор в соответствии со вторым аспектом данного изобретения и предпочтительно фармацевтически приемлемый носитель; причем указанная композиция предназначена необязательно для системного или местного применения. В одном варианте осуществления эта композиция предназначена для лечения заболевания, причем это заболевание выбрано из группы, содержащей опухолевые заболевания. В дополнительном аспекте проблема, лежащая в основе данного изобретения, решается с использованием способа профилактики и/или лечения пациента, нуждающегося в таком предупреждении и/или лечении, предусматривающего введение нуклеиновой кислоты в соответствии с данным изобретением,и/или вектора в соответствии с данным изобретением, и/или композиции в соответствии с данным изобретением. В дополнительном варианте осуществления нуклеиновую кислоту в соответствии с данным изобретением и/или вектор в соответствии с данным изобретением используют для приготовления лекарственного средства. Это лекарственное средство может быть предназначено для профилактики и/или лечения заболевания, причем такое заболевание выбрано из группы, содержащей опухолевые заболевания. Это опухолевое заболевание может быть выбрано из группы, содержащей солидные опухоли, метастатические опухоли, в том числе PTEN-отрицательные опухоли, опухоли, которые являются устойчивыми к лекарственным средствам, и опухоли, в которых ингибирование RTP801 может быть использовано для сенсибилизации. Кроме того, этим опухолевым заболеванием может быть опухолевое заболевание последней стадии или это опухолевое заболевание может включать клетки, которые являются нечувствительными к опухолевому супрессору; указанным опухолевым супрессором может быть PTEN. Дополнительный аспект данного изобретения решается способом конструирования нуклеиновой кислоты или скрининга на нуклеиновую кислоту, которая пригодна для отрицательной регуляцииa) конструирование или скрининг нуклеиновой кислоты, которая пригодна для отрицательной регуляции RTP801;b) оценку дефекта нуклеиновой кислоты в соответствии с любым из вышеуказанных аспектов данного изобретения;c) сравнение действия нуклеиновой кислоты стадии а) с действием нуклеиновой кислоты стадии b).- 29012799 В одном варианте осуществления этим действием является отрицательная регуляция RTP801. Дополнительным аспектом данного изобретения является применение нуклеиновой кислоты по данному изобретению в качестве сенсибилизатора, в частности, в качестве сенсибилизатора в лечении заболевания, причем такое заболевание выбрано из группы, содержащей опухоль и, более конкретно,опухолей, которые являются резистентными к лечению с использованием химиотерапевтических и/или радиотерапевтических средств. Дополнительные заболевания, для которых нуклеиновая кислота данного изобретения может служить в качестве сенсибилизатора, описаны здесь. Данная заявка описывает, что нуклеиновая кислота, содержащая двухцепочечную структуру, которая является специфической в отношении RTP801, является подходящим средством ингибирования ангиогенеза/роста сосудистой сети и подтекания сосудов (как из существующей кровеносной сети, так и из растущей сосудистой сети). Кроме того, эта заявка описывает (без связывания теорией), что RTP801, являясь индуцируемым стрессом белком (индуцируемым гипоксией, окислительным стрессом, тепловым стрессом, ER-стрессом), является фактором, действующим в тонкой настройке реакции клетки на нарушение баланса энергии. Таким образом, ингибирование RTP801 такой двухцепочечной нуклеиновой кислотой является пригодным для лечения любого заболевания, в котором клетки должны быть спасены от апоптоза вследствие стрессовых условий (например, заболеваний, сопровождающихся гибелью нормальных клеток) или в котором клетки, адаптированные к стрессовым состояниям вследствие изменений в экспрессии RTP801, должны убиваться (например, опухолевые клетки). В последнем случае после ингибирования RTP801 такой двухцепочечной нуклеиновой кислотой фактор выживания с антиапоптотической функцией в гипоксических клетках, более конкретно в гипоксических раковых клетках, становится неэффективным, позволяя, следовательно, клеткам, лишенным RTP801-опосредованной защиты, переходить в апоптоз. Это может встречаться также, когда присутствуют другие стимулирующие апоптоз факторы. Такие другие стимулирующие апоптоз факторы включают, среди прочих, химиотерапию и лучевую терапию. Другими словами, двухцепочечная нуклеиновая кислота в соответствии с данным изобретением может быть эффективной в лечении рака (в качестве монотерапии), а также в качестве дополнительной терапии. Такая двухцепочечная структура содержит первую цепь и вторую цепь, причем первая цепь содержит первый сегмент смежных нуклеотидов, а вторая цепь содержит второй сегмент смежных нуклеотидов, причем этот первый сегмент является либо комплементарным, либо идентичным последовательности нуклеиновой кислоты, кодирующей ген RTP801, причем второй сегмент является либо идентичным,либо комплементарным последовательности нуклеиновой кислоты, кодирующей RTP801. Таким образом, с использованием, в частности, RTP801 в качестве мишени для такого типа двухцепочечной нуклеиновой кислоты можно также непосредственно действовать на мишень в каскаде, участвующем в росте и развитии сосудистой сети и ангиогенезе соответственно, и, следовательно, отличающимся путем в сравнении с путем, используемым ингибиторами VEGF, такими как антитела к VEGF. Не желая связывать себя теорией, авторы данного изобретения предполагают, что нуклеиновая кислота в соответствии с данным изобретением может проявлять свою функцию в клетках, которые обеспечивают фон, который участвует или наблюдается в связи с любым заболеванием, при котором имеет место нежелательный, в частности, индуцированный гипоксией ангиогенез и/или рост или развитие сосудистой сети. Это понимание подтверждается обнаружением того, что мыши с нокаутом RTP801 не проявляют никакого фенотипа, отличающегося от фенотипа мышей дикого типа, при негипоксических состояниях. Только после индукции гипоксии, как наблюдалось в патологическом состоянии, таком как, например, опухолевый рост, нокаут RTP801 приводит к патологии, сходной с патологией, наблюдаемой у людей, страдающих от этого типа заболевания. Должно быть понятно, что нуклеиновая кислота в соответствии с данным изобретением является предпочтительно функциональной нуклеиновой кислотой. В данном контексте термин функциональная нуклеиновая кислота предпочтительно обозначает нуклеиновую кислоту, функция которой отличается от функции быть активной в клетке в качестве матрицы для транскрипции любой гетерогенной ядерной РНК (гяРНК), мРНК или другого продукта транскрипции, причем либо указанная гяРНК, мРНК или любой другой продукт транскрипции соответственно, либо нуклеиновая кислота в соответствии с данным изобретением подвергается процессу трансляции, предпочтительно клеточному процессу трансляции,приводящему к биологически активному белку RTP801. Должно быть понятно, что функциональная кислота, как предпочтительно используемая здесь, способна уменьшать экспрессию нуклеиновой кислотымишени. Более конкретно, такое уменьшение основано на посттранскрипционном процессе сайленсинга гена нуклеиновой кислоты-мишени. Еще более предпочтительно, такое уменьшение основано на интерференции РНК. Наиболее предпочтительной формой функциональной нуклеиновой кислоты является молекула siRNA или любая другая молекула, имеющая то же самое действие, что и молекула siRNA. Такая дополнительная молекула выбрана из группы, содержащей siRNA, синтетические siRNA, shRNA и синтетические shRNA. В данном контексте, siRNA могут дополнительно содержать полученные из экспрессирующего вектора siRNA, причем этим экспрессирующим вектором является в предпочтительном варианте осуществления вирус, такой как аденовирус, аденоассоциированные вирусы, герпесвирус и лентивирусы. В данном контексте, shRNA предпочтительно обозначают шпилечные РНК (образующие
МПК / Метки
МПК: A61P 25/02, A61K 48/00
Метки: rtp801, терапевтические, ингибиторов, применения
Код ссылки
<a href="https://eas.patents.su/30-12799-terapevticheskie-primeneniya-ingibitorov-rtp801.html" rel="bookmark" title="База патентов Евразийского Союза">Терапевтические применения ингибиторов rtp801</a>
Предыдущий патент: Фармацевтический состав, содержащий карбонат лантана (варианты)
Следующий патент: Применение белков в качестве деэмульгаторов
Случайный патент: 3-(4-гетероарилциклогексиламино) циклопентанкарбоксамиды в качестве модуляторов хемокиновых рецепторов


































