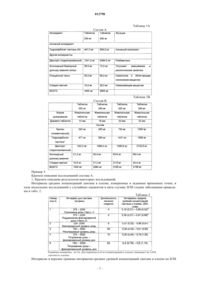
Фармацевтический состав, содержащий карбонат лантана (варианты)
Номер патента: 12798
Опубликовано: 30.12.2009
Авторы: Треспиди Лаура Анна, Хаслам Роберт Пол, Фердинандо Жозефин Кристин
Формула / Реферат
1. Жевательный состав в виде таблетки или порошка, содержащий карбонат лантана и по меньшей один фармацевтически приемлемый жевательный наполнитель, при этом указанный состав содержит карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана.
2. Жевательный состав по п.1, отличающийся тем, что указанный карбонат лантана представляет собой карбонат лантана общей формулы La2(СО3)3xH2O, где x принимает значения от 3 до 8, например от 3 до 7, от 3 до 6, от 3 до 5, от 4 до 5.
3. Жевательный состав по п.1, отличающийся тем, что наполнитель выбран из группы, включающей разбавители, компоненты смеси, повышающие текучесть, и смазочные вещества.
4. Жевательный состав по п.3, отличающийся тем, что включает по меньшей мере один разбавитель, выбранный из группы: декстраты, кукурузный сироп, олигосахарид, изомальтоолигосахарид, глюкоза, ликазин, ксилитол, лактитол, эритритол, маннитол, изомальтоза, полидекстроза, декстрин, крахмал, фруктоза, ксилитол, мальтодекстрин, мальтитол, изомальт, лактоза, сорбитол, микрокристаллическая целлюлоза, разбавители и связующие вещества на основе сахарозы, сахарная глазурь, дигидросульфат кальция, тригидрат лактата кальция, гидролизованный крахмал, декстроза, инозитол, гидролизованный сухой зерновой остаток, амилоза и глицин.
5. Жевательный состав по п.3, отличающийся тем, что включает по меньшей мере один разбавитель, выбранный из группы: декстраты, крахмал, лактоза, маннитол, сорбитол, микрокристаллическая целлюлоза, разбавители и связующие вещества на основе сахарозы, сахарная глазурь, дигидросульфат кальция, тригидрат лактата кальция, гидролизованный крахмал, декстроза, инозитол, гидролизованный сухой зерновой остаток, амилоза и глицин.
6. Жевательный состав по п.3, отличающийся тем, что включает по меньшей мере один разбавитель, выбранный из группы: декстраты, крахмал, лактоза, маннитол, сорбитол, микрокристаллическая целлюлоза, разбавители и связующие вещества на основе сахарозы, дигидросульфат кальция, тригидрат лактата кальция, гидролизованные крахмалы, декстроза, инозитол и амилоза.
7. Жевательный состав по п.3, отличающийся тем, что включает по меньшей мере один разбавитель, выбранный из группы: декстраты, фруктоза, ксилитол, эритритол, мальтодекстрин, декстроза, мальтитол, изомальт и глюкоза.
8. Жевательный состав по любому из пп.1-7, в котором разбавителем является декстрат в количестве от примерно 10 до примерно 90 вес.% от общего веса всех ингредиентов, предпочтительно от 40 до примерно 80 вес.% от общего веса всех ингредиентов, более предпочтительно примерно от 30 до примерно 60 вес.% от общего веса всех ингредиентов.
9. Жевательный состав по п.3, включающий компоненты смеси, повышающие текучесть, и смазочные вещества, выбранные из группы: стеарат магния, тальк, полиэтиленгликоль, диоксид кремния, коллоидный безводный диоксид кремния, гидрогенизированные растительные масла, глицерил бегенат и глицерил моностеарат.
10. Фармацевтический состав в виде таблетки или порошка, содержащий карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, приготовленный согласно способу, включающему следующие этапы:
a) смешивание в порошкообразной форме карбоната лантана и по меньшей мере одного фармацевтически приемлемого наполнителя в смесителе с получением смеси или
b) смешивание в порошкообразной форме карбоната лантана и наполнителя, прессование полученной смеси с образованием агрегированного материала или уплотнение образовавшейся смеси в валках с получением спрессованного материала в виде ленты и измельчение приготовленного материала в свободнотекучую смесь и
с) таблетирование смеси или наполнение образовавшейся смесью соответствующего контейнера.
11. Фармацевтический состав в виде таблетки или порошка, содержащий карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, приготовленный согласно способу, включающему этапы прессования карбоната лантана с получением агрегированного материала или уплотнения в валках с получением спрессованного материала в виде ленты и измельчения приготовленного материала в свободно текучую смесь; смешивания с наполнителями; при этом образовавшуюся смесь таблетируют или наполняют образовавшейся смесью соответствующий контейнер.
12. Способ лечения гиперфосфатемии, включающий введение в организм пациента, нуждающегося в лечении, терапевтически эффективного количества состава по любому из пп.1-11.
13. Применение терапевтически эффективного количества состава по любому из пп.1-11 для лечения гиперфосфатемии у пациента, нуждающегося в лечении.
14. Способ приготовления состава, содержащего карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, для таблетирования, включающий этапы:
a) смешивание порошковых форм карбоната лантана и по меньшей мере одного фармацевтически приемлемого наполнителя в смесителе с получением смеси и
b) таблетирование смеси.
15. Фармацевтический состав на основе карбоната лантана в форме жевательной таблетки, содержащий карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана и фармацевтически приемлемый наполнитель, полученный согласно способу, включающему этапы:
a) смешивание карбоната лантана и фармацевтически приемлемого наполнителя с получением смеси или
b) смешивание карбоната лантана и фармацевтически приемлемого наполнителя, прессование полученной смеси с образованием агрегированного материала или уплотнение образовавшейся смеси в валках в виде ленты и измельчение приготовленного материала в свободнотекучую смесь и
c) таблетирование смеси, полученной на этапе а) или b),
при этом способ осуществляют в отсутствие влажного гранулирования или сушки.
16. Фармацевтический состав на основе карбоната лантана в форме жевательной таблетки, содержащий карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана и фармацевтически приемлемый наполнитель, полученный согласно способу, включающему этапы:
a) прессования карбоната лантана с образованием агрегированного материала или уплотнение карбоната лантана в валках в виде ленты,
b) измельчения агрегированного материала или ленты в свободнотекучий материал,
c) смешивания свободно текучего материала с фармацевтически приемлемым наполнителем с получением смеси и
d) таблетирование смеси,
при этом способ осуществляют в отсутствие влажного гранулирования или сушки.
17. Состав по п.15, отличающийся тем, что карбонат лантана представляет собой карбонат лантана формулы
La2(CO3)3xH2O,
где x принимает значения от 3 до 8.
18. Состав по п.17, отличающийся тем, что х принимает значения от 4 до 5.
19. Состав по п.15, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 40 примерно до 80 вес.% от общего веса состава.
20. Состав по п.19, отличающийся тем, что разбавитель представляет собой декстраты или сорбитол.
21. Состав по п.15, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой агент, повышающий текучесть.
22. Состав по п.21, отличающийся тем, что агент, повышающий текучесть, представляет собой коллоидный безводный диоксид кремния в количестве примерно 2 вес.% от общего веса состава.
23. Жевательная фармацевтическая таблетка, содержащая карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, для лечения хронической почечной недостаточности, полученная путем прямого прессования в отсутствие влажного гранулирования с последующей сушкой, содержащая следующие ингредиенты:
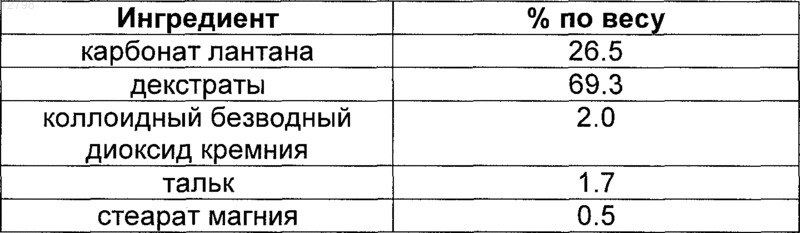
при этом карбонат лантана гидратирован и содержит примерно 4 моль воды.
24. Жевательная фармацевтическая таблетка, содержащая карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, для лечеэшя хронической почечной недостаточности, полученная путем прямого прессования в отсутствие влажного гранулирования с последующей сушкой, содержащая следующие ингредиенты:


при этом карбонат лантана гидратирован и содержит примерно 4 моль воды.
25. Фармацевтический состав, содержащий карбонат лантана, в виде порошка, включающий карбонат лантана в количестве примерно от 10 до примерно 40 вес.% элементарного лантана и фармацевтически приемлемый наполнитель, причем указанный состав получен согласно способу, включающему этапы:
a) смешивания карбоната лантана и фармацевтически приемлемого наполнителя,
b) прессования полученной смеси с образованием агрегированного материала или уплотнения образовавшейся смеси в валках в виде ленты и
c) измельчения приготовленного материала в свободнотекучую порошкообразную смесь; и
при этом процесс осуществляют в отсутствие влажного гранулирования или сушки.
26. Фармацевтический состав, содержащий карбонат лантана, в виде порошка, включающий карбонат лантана в количестве примерно от 10 до примерно 40 вес.% элементарного лантана и фармацевтически приемлемый наполнитель, причем указанный состав получен согласно способу, включающему этапы:
a) прессования карбоната лантана с образованием агрегированного материала или уплотнения карбоната лантана в валках в виде ленты,
b) измельчения агрегированного материала или ленты с получением свободнотекучего материала,
c) смешивания свободнотекучего материала с фармацевтически приемлемым наполнителем с получением смеси, и
при этом процесс осуществляют в отсутствие влажного гранулирования или сушки.
27. Состав по п.15, отличающийся тем, что получен согласно способу, включающему этапы:
a) смешивания карбоната лантана и фармацевтически приемлемого наполнителя с получением смеси и
b) таблетирования смеси.
28. Фармацевтический состав, содержащий карбонат лантана, по п.15, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой компоненты смеси, повышающие текучесть, и смазочные вещества в количестве примерно от 0,1 примерно до 5,0 вес.%.
29. Фармацевтический состав, содержащий карбонат лантана, по п.15, отличающийся тем, что количество карбоната лантана составляет примерно от 20 примерно до 30 вес.% элементарного лантана.
30. Фармацевтический состав, содержащий карбонат лантана, по п.29, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 30 примерно до 60 вес.%.
31. Фармацевтический состав, содержащий карбонат лантана, по п.29, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 30 примерно до 50 вес.%.
32. Фармацевтический состав, содержащий карбонат лантана, по п.29, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 40 примерно до 60 вес.%.
33. Фармацевтический состав, содержащий карбонат лантана, по п.15, отличающийся тем, что количество карбоната лантана составляет примерно от 10 примерно до 30 вес.% элементарного лантана.
34. Фармацевтический состав, содержащий карбонат лантана, по п.33, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 24 примерно до 60 вес.%.
35. Фармацевтический состав, содержащий карбонат лантана, по п.15, отличающийся тем, что количество карбоната лантана составляет примерно от 10 примерно до 30 вес.% элементарного лантана.
36. Фармацевтический состав, содержащий карбонат лантана, по п.35, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 42 примерно до 58 вес.%.
Текст
012798 Область техники Гиперфосфатемия является одной из проблем, с которой сталкиваются пациенты с хронической почечной недостаточностью, получающие лечение гемодиализом, и приблизительно 70% пациентов в терминальной стадии почечной недостаточности (ESRD). Данное состояние может привести к возникновению серьезных заболеваний костей и метастатическому кальцинозу основных органов; с ним связывают значительную заболеваемость и смертность. При помощи обычного диализа снизить уровень фосфата в крови не удается, со временем уровень повышается. При повышении уровня фосфатов применяют комбинированную терапию, включающую ограничения в диете и прием веществ, связывающих фосфаты. Другой проблемой пациентов с хронической почечной недостаточностью является вторичный гиперпаратиреоз. Для пациентов с хронической почечной недостаточностью важно избежать возникновения вторичного гиперпаратиреоза или получить соответствующее лечение. Известно применение при лечении гиперфосфатемии у пациентов с почечной недостаточностью некоторых форм карбоната лантана (см., например, JP1876384). В патенте США 5968976 описаны способы приготовления и применения в фармацевтических составах некоторых гидратов карбоната лантана для лечения гиперфосфатемии. Краткое описание изобретения Вследствие нарушений работы почек пациенты в терминальной стадии почечной недостаточности или с хроническими заболеваниями почек вынуждены ограничивать объем принимаемой жидкости. Поэтому имеется необходимость в составе, содержащем соединения лантана, который можно принимать без воды или вместе с ограниченным количеством воды. Кроме того, существует потребность в составе для жевания (жевательном составе). Необходимо, чтобы состав был приятен на вкус, особенно при приеме его в максимально обезвоженной форме. Необходимо также, чтобы состав можно было спрессовать в форме таблетки. Таким образом, настоящее изобретение относится к жевательному составу, содержащему лантан,включающему а) фармацевтически эффективное количество соединения лантана и b) по меньшей мере один фармацевтически приемлемый жевательный наполнитель. Далее, изобретение относится к приятному на вкус составу, содержащему лантан, включающему а) фармацевтически эффективное количество соединения лантана и b) по меньшей мере один фармацевтически приемлемый наполнитель; состав приятен на вкус для млекопитающих, например для человека, а также для котов, собак и т.д. Настоящее изобретение относится также к составу для распыления, содержащему лантан, включающему а) фармацевтически эффективное количество соединения лантана и b) по меньшей мере один фармацевтически приемлемый наполнитель. Настоящее изобретение относится к способу контроля гиперфосфатемии у пациента, включающему введение в организм терапевтически эффективного количества соединения лантана в форме состава,приятного на вкус. Настоящее изобретение относится к способу контроля гиперфосфатемии у пациента, включающему введение в организм терапевтически эффективного количества соединения лантана в форме жевательного состава. Настоящее изобретение относится к способу контроля гиперфосфатемии у пациента, включающему введение в организм терапевтически эффективного количества соединения лантана в форме состава для распыления. Настоящее изобретение относится к фармацевтическому составу в форме таблетки или порошка,включающего терапевтически эффективное количество соединения лантана, приготовленного по способу, включающему следующие этапы:a) смешивание порошковых форм соединения лантана и по меньшей мере одного фармацевтически приемлемого наполнителя в смесителе с получением смеси;b) таблетирование смеси или наполнение полученной смесью подходящего контейнера. Настоящее изобретение относится к фармацевтическому составу в форме таблетки или порошка,включающему фармацевтически эффективное количество соединения лантана и приготовленному согласно способу, включающему следующие этапы:a) смешивание в порошкообразной форме соединения лантана и по меньшей мере одного фармацевтически приемлемого наполнителя в смесителе с получением смеси; илиb) смешивание в порошкообразной форме соединения лантана и наполнителей, прессование полученной смеси в виде кусков материала неправильной формы или валковое уплотнение в виде ленты и измельчение полученного материала для превращения его в свободно текущий материал,c) таблетирование полученной смеси или наполнение полученной смесью подходящего контейнера. Настоящее изобретение относится к фармацевтическому составу в форме таблетки или порошка,включающему фармацевтически эффективное количество соединения лантана, приготовленному согласно процессу, включающему этапы прессования соединения лантана в виде кусков материала неправильной формы либо валкового уплотнения в виде ленты; измельчения полученного материала с получением свободно текущего (сыпучего) материала, затем смешивания его с наполнителями и таблетирования по-1 012798 лученной смеси или наполнения полученной смесью соответствующего контейнера. Согласно предпочтительному примеру реализации подобный состав представляет собой жевательную форму и/или форму для распыления и/или форму, приятную на вкус, а карбонат лантана находится в желательной степени гидратации. Настоящее изобретение относится к фармацевтическому составу в форме жевательной таблетки,включающей терапевтически эффективное количество соединения лантана, приготовленного согласно процессу, включающему следующие этапы: а) смешивание в порошкообразной форме соединения лантана и по меньшей мере одного фармацевтически приемлемого наполнителя в смесителе с получением смеси и b) таблетирование смеси. Настоящее изобретение относится к способу приготовления состава, содержащего соединение лантана, включающему следующий этап: а) смешивание в порошкообразной форме соединения лантана и по меньшей мере одного фармацевтически приемлемого наполнителя в смесителе с получением смеси. Настоящее изобретение относится к способу приготовления состава, содержащего соединение лантана, в форме таблетки, включающему следующие этапы: а) смешивание в порошкообразной форме соединения лантана и по меньшей мере одного фармацевтически приемлемого наполнителя в смесителе для получения смеси и b) таблетирование смеси. Согласно одному аспекту настоящее изобретение направлено на способ получения состава согласно настоящему изобретению. Следует отметить, что степень гидратации соединения лантана, входящего в состав по настоящему изобретению, существенно влияет на биологические свойства продукта. Поэтому желательно поддерживать стабильное гидратационное состояние соединения лантана. Например, в случае, когда исходным соединением лантана является описанный здесь карбонат лантана, желательно поддерживать степень гидратации постоянной в течение всего процесса приготовления состава. Это является еще одной проблемой, возникающей при создании приемлемой для пациента лекарственной формы,таблетки или порошка. Следует отметить, что некоторые соединения лантана, такие как карбонат лантана, обладают низкой текучестью (сыпучестью). Вследствие низкой текучести порошка возникает еще одна проблема при приготовлении составов с высоким содержанием лекарства, как в случае с карбонатом лантана, которая заключается в трудности поддержания размера дозы, приемлемой и приятной на вкус для пациента. Для препаратов с некоторой степенью гидратации не всегда допустимо гранулирование с водой или растворителем и последующее высушивание, поскольку этот процесс может повлиять на степень гидратации препарата. Иногда для улучшения текучести применяют такие способы, как валковое уплотнение (roller compaction)/агрегирование/измельчение/прессование. Если такие способы, как уплотнение в валках/агрегирование/измельчение/уплотнение, не применимы, таблетки изготовляют способом прямого прессования. Опять же, если препарат обладает низкими реологическими характеристиками и доза его высока, прямое прессование затруднено из-за низкой текучести. Если доза препарата не высока(например, менее 100 мг/табл или менее), то для улучшения реологических характеристик можно взять большее количество наполнителя; однако для гидрокарбоната лантана, содержащегося в препарате в высокой дозе, количество добавленных наполнителей необходимо ограничить для обеспечения приемлемого размера таблетки. Поэтому возникает необходимость разработки процесса приготовления состава, в ходе которого возможно поддержание степени гидратации соединения лантана в желаемых пределах. Согласно следующему примеру реализации в процессе исключен этап влажного гранулирования. Согласно следующему примеру реализации в процессе приготовления состава по настоящему изобретению исключен этап сушки. Согласно одному из примеров реализации изобретение относится к способу лечения гиперфосфатемии у пациентов с почечной недостаточностью, включая без ограничения пациентов, получающих лечение диализом, и пациентов с почечной недостаточностью (ESRD) в терминальной стадии, включающему введение в организм пациента терапевтически эффективного количества соединения лантана. Согласно одному из примеров реализации изобретение относится к способу лечения пациентов с хроническими почечными заболеваниями, включающему введение в организм пациента терапевтически эффективного количества соединения лантана. Согласно другому примеру реализации изобретение относится к способу контроля гиперпаратиреоза у пациентов с хронической почечной недостаточностью, включающему введение в организм пациента терапевтически эффективного количества соединения лантана, предпочтительно карбоната лантана. Согласно еще одному примеру реализации изобретение относится к способу лечения гиперпаратиреоза у пациентов с хронической почечной недостаточностью, включающему введение в организм пациента терапевтически эффективного количества соединения лантана, предпочтительно карбоната лантана. Согласно еще одному примеру реализации соединение лантана вводят в виде состава, который обеспечивает низкий уровень лантана в плазме, например такой уровень, который возникает при введении состава, у которого согласно фармакокинетической кривой Cmax, Tmax и AUC предпочтительно составляют менее 1,5 нг/мл, около 12 ч и менее 50 нгч./мл соответственно, для дозы 3 г в день (например, по 1 г три раза в день), как при предыдущем уровне технике. Согласно более предпочтительному-2 012798 примеру реализации Cmax и AUC составляют менее 1,1 нг/мл и менее 32 нгч./мл; а согласно наиболее предпочтительному примеру реализации Cmax and AUC составляют менее 0,5 нг/мл и менее 20 нгч./мл при таком же уровне дозирования. На величину Tmax уровень дозы существенно не влияет, а величины Cmax и AUC линейно зависят от дозы. Все эти параметры используются в их общепринятых значениях. Согласно другому примеру реализации изобретение относится к способу лечения гиперфофатемии,включающему введение в организм пациента, нуждающегося в лечении, состава, содержащего карбонат лантана. Предпочтительные соединения лантана включают карбонаты лантана. Карбонаты лантана относятся ко всем формам карбонатов лантана. Согласно предпочтительному примеру реализации изобретение относится к карбонату лантана общей формулы La2(CO3)3xH2O, где х принимает значения от 3 до 8, от 3 до 7, от 3 до 6, предпочтительно от 3 до 5, более предпочтительно от 3 до 4, более предпочтительно от 3 до 4,5, предпочтительно от 4 до 5, наиболее предпочтительно 3,4, наиболее предпочтительно среднее значение х, равное 4; о приготовлении препарата для лечения гиперфосфатемии введением в организм через желудочно-кишечный тракт см., например, патент США 5968976, полное описание которого включено в настоящую заявку по ссылке. Степень гидратации соединения лантана можно измерить способами, хорошо известными специалистам в данной области, например термическим анализом (TGA). Согласно одному аспекту наполнители, применяемые для приготовления состава согласно настоящему изобретению, пригодны для введения в организм пациентов с почечной недостаточностью. Согласно следующему аспекту вспомогательные вещества включают разбавители, связующие вещества,смазочные и облегчающие скольжение вещества. Следует понимать, что состав может содержать прочие добавки, такие как агенты, вызывающие дезинтеграцию, подкрашивающие агенты, ароматы и подсластители. Разбавители выбирают из группы: декстраты, кукурузный сироп, олигосахариды, изомальтоолигосахарид, глюкоза, ликазин, ксилитол, лактитол, эритритол, маннитол, изомальтоза, полидекстроза, декстрин, крахмал, фруктоза, ксилитол, мальтодекстрин, мальтитол, изомальт, лактоза, сорбитол, микрокристаллическая целлюлоза (такая как Avicel), разбавители и связующие вещества на основе сахарозы (такие как Nutab, Di-Pac или Sugartab), сахарная глазурь, дигидросульфат кальция, тригидролактат кальция,гидролизованный крахмал (такой как Emdex или Celutab), декстроза (такая как Cerelose), инозитол, гидролизованные сухие зерновые остатки (hydrolyzed cereal solids) (такие как Maltrons или Mor-Rex), амилоза или глицин. Разбавители выбирают из следующей группы: декстраты, крахмал, лактоза, маннитол, сорбитол,микрокристаллическая целлюлоза (такая как Avicel), разбавители и связующие вещества на основе сахарозы (такие как Nutab, Di-Pac или Sugartab), сахарная глазурь, дигидросульфат кальция, тригидролактат кальция, гидролизованный крахмал (такой как Emdex или Celutab), декстроза (такая как Cerelose), инозитол, гидролизованные сухие зерновые остатки (hydrolyzed cereal solids) (такие как Maltrons или Mor-Rex),амилоза или глицин. Согласно следующему примеру реализации разбавители выбирают из группы, включающей декстраты, крахмал, лактозу, маннитол, сорбитол, микрокристаллическую целлюлозу (например, Avicel), разбавители и связующие вещества на основе сахарозы (такие как Nutab, Di-Pac или Sugartab), сахарная глазурь, дигидросульфат кальция, тригидролактат кальция, гидролизованный крахмал (такой как Emdex илиCelutab), декстрозу (такая как Cerelose), инозитол, гидролизованные сухие зерновые остатки (hydrolyzedcereal solids) (такие как Maltrons или Mor-Rex), амилозу или глицин. Согласно следующему примеру реализации разбавители выбирают из группы: декстраты, фруктоза,ксилитол, эритритол, мальтодекстрин, декстроза, мальтитол, изомальт или глюкоза. Согласно следующему примеру реализации разбавитель представляет собой декстрат. Согласно следующему примеру реализации смазочные и облегчающие скольжение агенты, компоненты смеси, улучшающие реологические свойства, выбирают, например, из группы: стеарат магния,тальк, полиэтиленгликоль, диоксид кремния (silica), коллоидный безводный диоксид кремния (colloidalanhydrous silica), гидрогенизированное растительное масло, глицерил бегенат или глицерил моностеарат. Согласно следующему примеру реализации смазочные и облегчающие скольжение агенты, компоненты смеси, улучшающие реологические свойства, выбирают, например, из группы: стеарат магния,тальк, полиэтиленгликоль, диоксид кремния, коллоидный безводный диоксид кремния.-3 012798 Согласно одному аспекту изобретения предложен состав для жевания, содержащий Согласно следующему аспекту изобретения предложен состав для жевания, содержащий Согласно следующему аспекту изобретения предложен состав для жевания, содержащий Согласно следующему аспекту изобретения предложен состав для жевания, содержащий Согласно следующему аспекту изобретения предложен состав для жевания, содержащий Согласно следующему аспекту изобретения предложен состав для жевания, содержащий-4 012798 Согласно следующему аспекту изобретения предложен состав для жевания, содержащий Данные составы пригодны также для приема в измельченном виде, если они изготовлены в традиционной форме, обеспечивающей возможность дозирования, например в виде горошинок, измельчаемых таблеток, порошков, калиброванных гранул - все они должны быть приятными на вкус. Пациенты, у которых затруднен процесс жевания, могут принимать измельченный состав с ложки или при необходимости посыпать им пищу. На таблетки можно нанести оболочку способами, хорошо известными специалистам в данной области. В составы согласно настоящему изобретению целесообразно вводить антиоксидант, например аскорбиновую кислоту, бутилированный гидроксианизол или гидрохинон для увеличения их срока годности при хранении. Альтернативно, введение в организм состава можно проводить в непрерывном режиме, возможно в долговременном режиме, например в постоянном режиме. Согласно одному аспекту изобретения предложен фармацевтический состав в форме таблетки, содержащей элементарный лантан в количестве, выбранном из 250, 500, 750 и 1000 мг, приготовленной согласно способу, включающему следующие этапы: а) сухое смешивание соединения лантана и вспомогательных веществ в смесителе для образования смеси и b) таблетирование смеси прессованием с применением однопуансонного (single punch) пресса или ротационного таблетирочного пресса. Обычная доза для взрослого человека составляет, например, 750-3000 мг ежедневно. Дозу можно разделить и вводить в организм вместе с каждым приемом пищи, например, по 250-1000 мг, например,три раза в день. Контроль уровня сыворотки в плазме осуществляют еженедельно до достижения оптимального уровня фосфатов в сыворотке согласно общепринятым нормам. Лантан представляет собой редкоземельный элемент с атомным номером 57. Свойства лантана позволяют предположить, что лантан является агентом, эффективно связывающим фосфор. Он обладает высоким сродством при связывании фосфора, а в форме соли - карбоната, имеет низкую растворимость,что ограничивает всасывание в желудочно-кишечном тракте. Кроме того, связывание фосфата не зависит от рН; соединение обладает низкой токсичностью - на основе данных по LD50, приятно на вкус, доступно и ограниченно влияет на концентрации электролитов в сыворотке (Hutchison, A.J. et al. (1998) Perit. Dial.Int. 18 (Suppl 2): S.38. Следует понимать, что дозирование состава и длительность приема препарата согласно изобретению варьируют в зависимости от конкретного субъекта. Точный режим дозирования определяет врач или хирург-ветеринар, который должен учесть, среди прочих, такие факторы, как вес тела, возраст и симптомы (если таковые имеются). По желанию составы включают один или несколько активных ингредиентов. Согласно следующему примеру реализации настоящее изобретение относится к применению соединения лантана в ветеринарии для лечения животных, например домашнего животного, страдающего от гиперфорсатемии, которое включает этап введения в организм такого животного, например домашнего животного, нуждающегося в таком лечении, фармацевтически приемлемого количества соединения лантана. Пероральное введение препаратов в организм животного обычно затруднено из-за нежелания животного глотать таблетки, пилюли или пищу, в которой присутствует препарат, особенно если лекарство имеет неприятный вкус или аромат. Животное отказывается принимать препарат, вводимый перорально,например в форме таблеток, даже при смешивании их с привычной пищей; в этом случае лечение невозможно или же препарат приходится вводить насильно, в данном случае прием препарата ограничен и обычно происходит в недостаточной или неполной дозе. Возможность перорального введения препаратов в организм домашнего животного ограничена. Например, в патенте США 5824336 описана необходимость противоглистного состава для домашних животных, в частности состава в виде таблетки для жевания, содержащей фторбендазол, приятной на вкус для собак. В частности, ветеринарные руководства для владельцев кошек обычно предостерегают против измельчения таблеток в порошки. Например, в Ветеринарном домашнем руководстве для владельцев кошек Cat Owner's Home Veterinary Handbook by Carlson D.G. et al. (1983, First Edition, Howell Book HouseInc.) подчеркивается, что порошки делают неприятным вкус пищи, и кошки ее плохо переносят. Более-5 012798 того, в руководстве рекомендуют маскировать вкус препаратов, вводимых в рацион кошек, добавлением пивных дрожжей, сыра или рыбьего жира. В этом справочнике также подробно описаны способы введения таблеток или жидких препаратов в организм кошки; в частности описано, как держать кошку, открывать ей рот, класть в рот дозированную форму для обеспечения заглатывания. Признается также, что контроль рациона домашнего животного осложнен, поэтому контроль поступления в организм фосфатов относительно труден по сравнению с подобным контролем у человека. Общеизвестно также, что обоняние (напрямую связанное с ощущением вкуса) у домашних животных особенно остро по сравнению с обонянием человека. Соответственно, возникает необходимость в агенте, приятном на вкус, который легко использовать для лечения гиперфосфатемии и регулирования связанной с ней гиперкальциемии, особенно у домашних животных, включая, например, кошек и собак. Поскольку почечные заболевания зачастую диагностируют у старых кошек, существует насущная необходимость в разработке усовершенствованных препаратов для лечения подобных состояний у этих особей. Согласно изобретению обнаружено, что соединения лантана можно вводить в организм животных,в том числе домашних животных, в приятном на вкус виде, в количестве, эффективном для уменьшения гиперфосфатемии. Далее, обнаружено, что степень, в которой соединения лантана создают приятные вкусовые ощущения у таких животных, позволяет вводить указанные препараты в дозированных формах, для которых не требуется использование специальных оболочек, маскирующих вкус компонентов,или же специальных процедур, стимулирующих (облегчающих) заглатывание, в частности, при добавлении препарата в пищевой рацион животного. Например, обнаружено, что соединения лантана в виде макрочастиц для смешивания с пищей можно скармливать кошкам в количестве, эффективном для уменьшения гиперфорсфатемии. Следовательно, согласно одному аспекту изобретение относится к способу лечения гиперфосфатемии у домашних животных, включающему этап введения фармацевтически приемлемого количества соединения лантана в организм домашнего животного, нуждающегося в подобном лечении. При определении режима дозирования можно назначать введение препарата однократно или по несколько раз в день, например один, два, три или четыре раза в день. Если не указано иное, все применяемые здесь научные и технические термины имеют такое же значение, как и общепринято у специалистов в области, к которой принадлежит данное изобретение. Все публикации, патентные заявки, патенты, упомянутые в заявке, включены во всей полноте через ссылки в описание настоящей заявки. В случае возникновения противоречий, определяющим является описание настоящей заявки, включая определения. Кроме того, все материалы, способы и примеры представляют собой иллюстративный материал и не ограничивают настоящего изобретения. Предполагается, что опытный специалист в данной области с помощью вышеприведенного описания сможет применить настоящее изобретение во всей его полноте. Следующие предпочтительные примеры реализации следует считать иллюстративными, ни в коей мере не ограничивающими настоящего изобретения. Краткое описание чертежей На фиг. 1 показаны средние концентрации лантана в сыворотке (лантан вводится в максимально переносимой дозе в течение 72 ч). На фиг. 2 показаны средние концентрации неорганического фосфора в моче. Примеры Пример 1. Приготовление таблеток для жевания, содержащих гидрокарбонат лантана (250, 500, 750 и 1000 мг). Процесс производства включает просеивание и смешивание активного ингредиента с вспомогательными веществами с последующим прямым прессованием. В частности, приготовление состава А в форме таблеток 250 и 500 мг включает следующие этапы: а) пропускание карбоната лантана, декстрата и коллоидного диоксида кремния через сито с размером отверстий по меньшей мере 16 меш в соответствующий блендер и измельчение в течение приблизительно 20 мин;b) просеивание талька (возможно) и стеарата магния через сито с размером отверстий 30 меш, добавление смеси в блендер и измельчение в течение приблизительно 5 мин;c) прессование смеси с применением стандартной техники до достижения желаемого веса спрессованной смеси. Следующие таблетки изготавливают по описанию по следующему примеру: Пример 3. Краткое описание исследований состава А. 1. Краткое описание результатов некоторых исследований. Интервалы средних концентраций лантана в плазме, измеренные в заданные временные точки, в ходе нескольких исследований у случайных пациентов в пяти случаях II/III стадии заболевания приведены в табл. 2. Таблица 2 Единицы измерения - нг/гм. Для перевода в нг/мл концентрации в плазме умножают на 1,054,плотность плазмы. Интервалы и верхние границы интервалов средних уровней концентраций лантана в плазме на II/III-7 012798 фазах исследования сходны при максимальном среднем уровне 1 нг/мл. Значения интервалов низки,аналогично значениям концентраций Cmax, определенным в ходе предыдущих экспериментов. 2. Задачей эксперимента являлась оценка фармакологических свойств и безопасности карбоната лантана (LC), применяемого при традиционном безкальциевом лечении гиперфосфатемии. Методика. Эффективность связывания фосфата карбонатом лантана (LC) in vitro оценивают в условиях рН, характерных для желудочно-кишечного тракта, т.е. 3,5 и 7. Для сравнения использовали гидроксид алюминия (АН) и соли кальция. В экспериментах in vivo связывание фосфата, содержащегося в рационе, сравнивают по АН, карбонату кальция (CC) и севеламера гидрохлорид (SH) (1000 мг связующего вещества/кг/в день) у крыс после удаления 5/6 ткани почек, получавших дозу препарата ежедневно в течение недель; для первичной оценки конечных результатов эксперимента использовали данные по выведению фосфата с мочой. Возможность возникновения нежелательных фармакологических воздействий LC на ЦНС, кардиоваскулярную, респираторную и желодочно-кишечную систему оценивали в экспериментах над мышами, крысами и собаками при дозировании до 2000 мг/кг/в день. Результаты. В экспериментах in vitro эффективность связывания фосфата карбонатом лантана LC равна эффективности связывания гидратом алюминия АН и значительно превышает эффективность связывания карбонатом кальция или ацетатом кальция. LC наиболее эффективен (97,5% связывания фосфата) при рН 3,проявляет хорошую эффективность при рН 5 и 7. У крыс после удаления 5/6 почечной ткани эффективность LC равна эффективности АН и значительно превышает эффективность CC или SH, определенную по экскреции фосфата с мочой, являющейся чувствительным маркером связывания фосфата, присутствующего в пищевом рационе, по данной модели. При дозировании до 2000 мг/кг LC не оказывает прямого воздействия на содержание кальция в сыворотке, уровни витамина D или PTH, а также не оказывает вредного фармакологического влияния на кардиоваскулярную, респираторную или желудочнокишечную систему у мышей, крыс и собак, в тестах по Irwin и нейротоксичности у мышей и собак острого или отсроченного воздействия препарата на ЦНС не отмечалось. LC не обладает проконвульсивными или антиконвульсивными свойствами и не влияет на локомоторную активность у мышей. Данный эксперимент доказывает, что LC является селективным и мощным агентом, связывающим фосфат, причем эффективность связывания LC аналогична эффективности связывания гидроксидом алюминия; при этом фармакологические свойства LC позволяют уменьшить вероятность возникновения неблагоприятных побочных эффектов. 3. Задачей данного доклинического испытания являлось исследование долгосрочной токсичности обычного карбоната лантана (LC). Методика. Исследование токсического воздействия LC на мышей, крыс и собак при однократном, многократном пероральном и внутривенном введении препарата проводили с дозами до 2000 мг/кг/в день (перорально) (17 дозы для человека, составляющей 1000 мг t.i.d.) и 1 мг/кг/в день (внутривенно). Уровни концентрации LC в плазме превышали уровни концентраций у пациентов, находящихся на диализе, в 20000 раз. Длительность испытаний составила до одного года у собак и двух лет (введение препарата в течение жизни) у грызунов. Эксперименты над крысами с удаленной на 5/6 почечной тканью не выявили влияния почечной недостаточности на интоксикацию. В ходе эксперимента проводили клинические исследования, ЭКГ, офтальмоскопию, гематологические анализы, анализы мочи, химического состава сыворотки,изучали воздействие LC на плазму и ткани; кроме того, проводили гистопатологическое исследование более чем 40 тканей. Эксперимент включал полные программы для оценки генетической и репродуктивной токсичности, а также канцерогенных свойств препарата. Результаты. В ходе экспериментов, проводившихся в течение всей жизни животного, выявили, что LC очень хорошо переносим, не влияет на внешний вид, рост или жизнеспособность. Наблюдались только адаптивные изменения в желудках грызунов (не наблюдались у собак) при пероральном введении больших доз. Ткани крыс с нарушенной функцией почек подверглись воздействию в степени, сравнимой со степенью воздействия на ткани нормальных крыс; особи с нарушенной функцией почек также хорошо переносилиLC. Гистоморфометрия не выявила прямого токсического воздействия на костную систему. Некоторое косвенное влияние на минерализацию связано с выведением фосфата, вызванным избыточным связыванием фосфата, поступающего с пищей, при приеме больших доз. Лантан не проявляет генотоксических или канцерогенных свойств и не оказывает неблагоприятного воздействия на различные этапы репродукции. 4. Задачей данного этапа эксперимента заключалась в сравнении LC терапии с другими видами терапии (соли кальция или алюминия, или севеламера гидрохлорид). Методика. Данный 2-годичный многоцентровый, рандомизированный, открытый эксперимент с участием параллельных групп состоит из этапа вымывания, длящегося от 1 до 3 недель, затем 6-недельной фазы титрования и длительной фазы поддержания. Пациенты, получающие лечение гемодиализом, с концентра-8 012798 цией фосфора в сыворотке 5,9 мг/дл ( 1,9 ммоль/л) получали либо LC (375-3000 мг/в день элементарного лантана), либо вещество, связывающее фосфат - то же, что и до начала эксперимента. Основная цель эксперимента - выявление переносимости и безопасности в течение 2 лет. В основном, эффективность оценивали по конечному результату - контролируемому содержанию фосфора в сыворотке на уровне 5,9 мг/дл. Результаты. Карбонат лантана получали 647 пациента; 642 пациента получали стандартное лечение (кальцийсодержащие агенты: 78%; севеламер - 16%). Длительность стандартного лечения в среднем больше, чем длительность лечения LC (422,2258,5 vs. 304,1253,8 дней). Неблагоприятные явления, связанные с лечением, с большей частотой возникали в группе, получавшей стандартное лечение, чем в группе, получавшей LC: гиперкальциемия (10,4 vs. 3,4%), диарея(27,4 vs. 19,8%), боли в области живота (20,9 vs. 14,1%), диспепсия (14,8 vs. 8,2%). Серьезные неблагоприятные явления также возникали с большей частотой в группе, получавшей стандартное лечение (65,4vs. 51,0%). Однако данная картина, возможно, усложнена за счет разницы в длительности лечения, получаемого в двух группах. Уровень лантана в плазме остается очень низким в течение всего периода лечения (средний уровень: 0,5-0,6 нг/мл). Подобные соотношения наблюдаются для пациентов, у которых осуществляют контроль содержания фосфора в организме в ходе поддерживающей терапии (46,3% vs. 41,3%; стандартное лечение vs. LC в течение 2-х лет). Переносимость LC в течение длительного периода по меньшей мере не хуже, чем переносимость других применяемых в настоящее время фосфатосвязующих веществ; показано, что эффективность LC при поддерживающей терапии для обеспечения контроля содержания фосфата в сыворотке не меньше,чем эффективность других фосфатосвязующих веществ в течение 2-летнего периода. 5. В данном исследовании проводили сравнение эффективности, безопасности и переносимости обычного карбоната лантана (LC) и карбоната лантана (CC) в рандомизированном, открытом, многоцентровом эксперименте. Методика. По окончании периода вымывания, длящегося 1-3 недели, пациентов с гиперфосфатемией, получающих лечение гемодиализом (содержание фосфора в сыворотке 1,80 ммоль/л [5,6 мг/дл]), случайно разделили на группу получающих LC (375-3000 мг/день лантана; n = 533) или CC (1500-9000 мг/день кальция; n = 267). Затем проводили титрование для определения дозы препарата, обеспечивающей поддержание оптимального уровня фосфата (фосфор в сыворотке 1,80 ммоль/л) в течение 5 недель. Пациенты, получавшие лечение LC, и пациенты, получавшие лечение CC, с контролируемым уровнем фосфатов в сыворотке после титрования получали поддерживающее лечение еще в течение 20 недель. Результаты. Контроль концентраций фосфата в сыворотке достигается в равных пропорциях среди пациентов,получавших лечение LC, и получавших CC (неделя 9: 67,9% vs. 65,8%; неделя 25: 65,8% vs. 63,9%). С LC связывают значительно более быстрое уменьшение уровня кальцияфосфоросодержащего продукта, по сравнению с CC на 9-й неделе (-1,80 vs. -1,35 ммоль 2/л 2; P = 0,009) и несколько более быстрое уменьшение на 25-й неделе (-1,59 vs. -1,26 ммоль 2/л 2). Уровни содержания лантана в плазме оставались очень низкими на протяжении всего периода лечения LC: 0,49 нг/мл при максимальной вводимой дозе лантана на 25-й неделе. Неблагоприятные явления, в основном, в слабой или умеренной степени отмечались у 77,7% пациентов, получавших LC, и у 79,8% пациентов, получавших CC. Гиперкальциемия отмечалась значительно чаще у пациентов, получавших CC (20,2%), по сравнению с пациентами, получавшими LC (0,4%). Показано, что эффективность LC при поддерживающей терапии для обеспечения контроля содержания фосфата в сыворотке у пациентов в терминальной стадии почечной недостаточности эквивалентна эффективности CC. LC хорошо переносится, риск возникновения гиперкальциемии меньше, чем при приеме CC. 6. В данном исследовании изложены результаты шестимесячного открытого продолжения предыдущего шестимесячного рандомизированного клинического эксперимента, в котором сравнивали воздействие обычного LC с воздействием карбоната кальция (CC). Методика. В течение следующих 6 месяцев рандомизированного лечения по начальной стадии эксперимента пациенты, получавшие CC в течение 6 месяцев, переходят к 5-недельной стадии титрования LC (LC/CC группа) для контроля содержания фосфора в сыворотке на уровне 1,8 ммоль/л (5,6 мг/дл). Пациенты,получавшие LC в ходе рандомизированного эксперимента, продолжали получать LC в установленной для них поддерживающей дозе (LC/LC группа; продолжительность всего периода лечения - 49 недель). Результаты. В продолжении эксперимента принимали участие 518 пациентов. 185 - CC/LC группа и 333 - LC/LC группа. Всего до завершения эксперимента в нем принимали участие 375 пациентов (72,4%); 113 (61,1%) в CC/LC группе и 262 (78,7%) в LC/LC группе. Содержание фосфора в сыворотке поддерживали прибли-9 012798 зительно на уровне 1,8 ммоль/л (5,6 мг/дл) в обеих группах в течение 24 недель: средние значения в концевых точках составили 1,76 ммоль/л в LC/LC группе, 1,83 ммоль/л в CC/LC группе. В конце периода продления эксперимента у 63,3% пациентов в LC/LC группе удалось отрегулировать уровень фосфора в сыворотке по сравнению с 58,3% в CC/LC группе. Чаще всего возникавшие неблагоприятные явления,связанные с лечением, были связаны с желудочно-кишечным трактом; предполагают, что данные явления связаны с лечением по настоящему эксперименту у 17% пациентов LC/LC группы и 31% пациентовCC/LC группы. У 0,3% пациентов LC/LC группы и у 2,7% пациентов CC/LC группы регистрировали гиперкальциемические явления.LC хорошо переносим и эффективен, по меньшей мере, в течение одного года. Снижение частоты возникновения гиперкальциемии, наблюдаемое при применении LC в краткосрочном эксперименте, сохранялось в течение одного года. 7. В ходе масштабного, рандомизированного одногодичного эксперимента по пролонгированному лечению обычным карбонатом лантана LC или карбонатом кальция CC оценивали безопасность и эффективность воздействия на параметры костной системы. Методика. Пациенты с хронической почечной недостаточностью, находящиеся на гемодиализе или постоянном амбулаторном перитонеальном диализе, были рандомизированы (1:1) и получали либо LC (до 3750 мг/день лантана; n = 49) или CC (до 9000 мг/день кальция; n = 49) в течение 50 недель. При оценке безопасности рассматривали неблагоприятные явления, основные показатели состояния организма и содержание лантана в плазме. При оценке эффективности принимали во внимание содержание в сыворотке фосфора и паратиреоидного гормона (PTH). Результаты. Все 98 пациентов были включены в исследование для оценки эффективности и безопасности предлагаемой к использованию методики. Количество неблагоприятных явлений для LC и CC сходно, однако явления гиперкальциемии (содержание кальция в сыворотке 2,65 ммоль/л) наблюдались намного реже при применении LC (6%) по сравнению с CC (35%). При LC и CC терапии клинически значимых отклонений жизненно важных показателей организма, связанных с лечением, не наблюдали. Содержание лантана в плазме у пациентов, получавших лечение LC и CC, на исходном уровне приблизительно совпадали (интервал 0,31-0,11 нг/мл) и были выше у пациентов, получавших лечение LC ( 0,03-1,95 нг/мл) по сравнению с пациентами, получавшими лечение CC (все 0,03 нг/мл) в конечной точке. Уровень лантана в плазме в ходе эксперимента быстро стабилизировался у пациентов, получавших лечение LC, и оставался на данном уровне в период между 8-й и 52-й неделями. LC и CC одинаково обеспечивают регулирование уровня фосфора в сыворотке. Средние величины на исходном уровне (SD) составили 1,720,39 и 1,870,52 ммоль/л, в конечных точках 1,790,47 и 1,650,54 ммоль/л для LC и CC соответственно. Содержание PTH в сыворотке для LC оставалось стабильным в течение одного года и уменьшалось для CC. Выяснилось, что LC так же хорошо переносим и столь же эффективен, как CC, но при примененииLC сильно снижается риск возникновения кальциемии в течение одного года лечения. Как и в других продолжительных экспериментах, при LC терапии не происходит аккумулирования лантана в плазме. 8. В данном эксперименте оценивали эффективность и безопасность обычного карбоната лантана(LC) в группе пациентов, состоящей из этнических китайцев. Оценивали воздействие таблеток, содержащих LC, обеспечивающих введение в организм 500 мг лантана. Эти усиленные таблетки помогают снизить общую лекарственную нагрузку - важный момент, влияющий на согласие пациентов. Методика. Эксперимент состоял из трех этапов: фаза скрининга и вымывания - от 1 до 3-х недель, фаза титрования дозы LC - 4-недельная фаза открытого эксперимента, 4-недельная фаза поддержания - двойное слепое испытание, в ходе которого пациенты были рандомизированы (1:1), одни стали получать LC, другие - плацебо. LC вводили в организм в виде таблеток для жевания, содержащих 250 или 500 мг лантана. В эксперимент включались пациенты, находящиеся на гемодиализе, мужчины и женщины, с содержанием фосфора в сыворотке на уровне 5,6 мг/дл (1,8 ммоль/л) после вымывания фосфатосвязующего вещества, которое они получали ранее. В эксперименте участвовали 103 пациента. Основной конечной точкой при оценке эффективности стало содержание фосфора в плазме, достигнутое на последней неделе двойного слепого эксперимента. Регулирование содержание фосфора в плазме на уровне 5,6 мг/дл(1,8 ммоль/л) стало второй конечной контрольной точкой. Прочие вторичные измерения эффективности включали построение кривых содержания фосфора в сыворотке в течение фазы титрования, содержание паратиреоидного гормона в сыворотке, уровень кальция и кальцияфосфоросодержащего вещества. Параметры безопасности и переносимости LC оценивали, проводя мониторинг неблагоприятных явлений и основных показателей организма при каждом осмотре в рамках эксперимента. Проводили также полный биохимический и гематологический скрининг; в течение всего эксперимента проводили измерения содержания лантана в плазме.- 10012798 9. Нефрогенная остеодистрофия является серьезным осложнением гиперфосфатемии, с чем связывают значительный уровень смертности пациента. Токсическое воздействие на костную систему ассоциируют с воздействием фосфатосвязующих веществ на основе алюминия, что осложняет течение нефрогенной остеодистрофии. Целью данного эксперимент стала демонстрация меньшей токсичности обычного карбоната лантана (LC) и его долгосрочного воздействия на костную систему по сравнению с карбонатом кальция CC. Методика. Всего 98 пациентов были рандомизированы для лечения либо LC (n = 49), либо CC (n = 49) в течение одного года. Биопсию кости, помеченной тетрациклином (Tetracycline-labeled), брали на исходном уровне и через год лечения в открытом эксперименте проводили полный гистоморфометрический анализ. Измеряли также активность щелочной фосфатазы в костных тканях, содержание паратиреоидного гормона (PTH) и кальцитриола в сыворотке. Результаты. Биопсии костной ткани на исходном уровне и через год после начала лечения взяли у 33 пациентов,получавших LC, и 30 пациентов, получавших CC. Ни в одной группе не наблюдали токсического воздействия на костную систему, подобного воздействию агентов, содержащих алюминий. Через год было отмечено, что у 5/7 пациентов с остеомаляцией и адинамической костной болезнью (adynamic bone) на исходном уровне, получавших LC, и у 3/7 пациентов, получавших CC, и у 4/5 пациентов с нефрогенной остеодистрофией на исходном уровне, получавших LC, и у 3/6 пациентов, получавших CC, произошло обратное развитие течения нефрогенной остеодистрофии. Только у одного из пациентов группы LC произошло развитие заболевания, приведшее к адинамической костной болезни, по сравнению с шестью пациентами группы CC. Различия между активностью щелочной фосфатазы и уровнем кальцитриола в сыворотке в различных группах, а также на исходном уровне в сравнении с конечной точкой эксперимента не наблюдалось. В LC группе содержание паратиреоидного гормона (PTH) в сыворотке у пациентов оставалось стабильным, а в CC группе отмечено снижение содержания с разбросом данных в большом интервале. В течение года у пациентов, получавших лечение LC, наблюдали более быстрое обратное развитие течения нефрогенной остеодистрофии, чем у пациентов, получавших CC. Другие параметры состояния костей у пациентов, получавших лечение LC, существенно не изменились. Таким образом, LC обладает преимуществом при лечении нефрогенной остеодистрофии по сравнению с другими традиционными фосфатосвязующими веществами. Предыдущие примеры можно также с успехом воспроизвести, если заменить рабочие условия и реагенты, описанные в предыдущих примерах, на общеупотребительные или конкретные реагенты и рабочие условия согласно описанию данного изобретения. На основе предыдущего описания специалисту в данной области будут понятны основные характеристики данного изобретения и, оставаясь в рамках настоящего изобретения, он сможет внести изменения и модифицировать изобретение для адаптации его к различным способам и условиям применения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Жевательный состав в виде таблетки или порошка, содержащий карбонат лантана и по меньшей один фармацевтически приемлемый жевательный наполнитель, при этом указанный состав содержит карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана. 2. Жевательный состав по п.1, отличающийся тем, что указанный карбонат лантана представляет собой карбонат лантана общей формулы La2(СО 3)3xH2O, где x принимает значения от 3 до 8, например от 3 до 7, от 3 до 6, от 3 до 5, от 4 до 5. 3. Жевательный состав по п.1, отличающийся тем, что наполнитель выбран из группы, включающей разбавители, компоненты смеси, повышающие текучесть, и смазочные вещества. 4. Жевательный состав по п.3, отличающийся тем, что включает по меньшей мере один разбавитель, выбранный из группы: декстраты, кукурузный сироп, олигосахарид, изомальтоолигосахарид, глюкоза, ликазин, ксилитол, лактитол, эритритол, маннитол, изомальтоза, полидекстроза, декстрин, крахмал,фруктоза, ксилитол, мальтодекстрин, мальтитол, изомальт, лактоза, сорбитол, микрокристаллическая целлюлоза, разбавители и связующие вещества на основе сахарозы, сахарная глазурь, дигидросульфат кальция, тригидрат лактата кальция, гидролизованный крахмал, декстроза, инозитол, гидролизованный сухой зерновой остаток, амилоза и глицин. 5. Жевательный состав по п.3, отличающийся тем, что включает по меньшей мере один разбавитель, выбранный из группы: декстраты, крахмал, лактоза, маннитол, сорбитол, микрокристаллическая целлюлоза, разбавители и связующие вещества на основе сахарозы, сахарная глазурь, дигидросульфат кальция, тригидрат лактата кальция, гидролизованный крахмал, декстроза, инозитол, гидролизованный сухой зерновой остаток, амилоза и глицин. 6. Жевательный состав по п.3, отличающийся тем, что включает по меньшей мере один разбавитель, выбранный из группы: декстраты, крахмал, лактоза, маннитол, сорбитол, микрокристаллическая- 11012798 целлюлоза, разбавители и связующие вещества на основе сахарозы, дигидросульфат кальция, тригидрат лактата кальция, гидролизованные крахмалы, декстроза, инозитол и амилоза. 7. Жевательный состав по п.3, отличающийся тем, что включает по меньшей мере один разбавитель, выбранный из группы: декстраты, фруктоза, ксилитол, эритритол, мальтодекстрин, декстроза,мальтитол, изомальт и глюкоза. 8. Жевательный состав по любому из пп.1-7, в котором разбавителем является декстрат в количестве от примерно 10 до примерно 90 вес.% от общего веса всех ингредиентов, предпочтительно от 40 до примерно 80 вес.% от общего веса всех ингредиентов, более предпочтительно примерно от 30 до примерно 60 вес.% от общего веса всех ингредиентов. 9. Жевательный состав по п.3, включающий компоненты смеси, повышающие текучесть, и смазочные вещества, выбранные из группы: стеарат магния, тальк, полиэтиленгликоль, диоксид кремния, коллоидный безводный диоксид кремния, гидрогенизированные растительные масла, глицерил бегенат и глицерил моностеарат. 10. Фармацевтический состав в виде таблетки или порошка, содержащий карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, приготовленный согласно способу,включающему следующие этапы:a) смешивание в порошкообразной форме карбоната лантана и по меньшей мере одного фармацевтически приемлемого наполнителя в смесителе с получением смеси илиb) смешивание в порошкообразной форме карбоната лантана и наполнителя, прессование полученной смеси с образованием агрегированного материала или уплотнение образовавшейся смеси в валках с получением спрессованного материала в виде ленты и измельчение приготовленного материала в свободнотекучую смесь и с) таблетирование смеси или наполнение образовавшейся смесью соответствующего контейнера. 11. Фармацевтический состав в виде таблетки или порошка, содержащий карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, приготовленный согласно способу,включающему этапы прессования карбоната лантана с получением агрегированного материала или уплотнения в валках с получением спрессованного материала в виде ленты и измельчения приготовленного материала в свободно текучую смесь; смешивания с наполнителями; при этом образовавшуюся смесь таблетируют или наполняют образовавшейся смесью соответствующий контейнер. 12. Способ лечения гиперфосфатемии, включающий введение в организм пациента, нуждающегося в лечении, терапевтически эффективного количества состава по любому из пп.1-11. 13. Применение терапевтически эффективного количества состава по любому из пп.1-11 для лечения гиперфосфатемии у пациента, нуждающегося в лечении. 14. Способ приготовления состава, содержащего карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, для таблетирования, включающий этапы:a) смешивание порошковых форм карбоната лантана и по меньшей мере одного фармацевтически приемлемого наполнителя в смесителе с получением смеси иb) таблетирование смеси. 15. Фармацевтический состав на основе карбоната лантана в форме жевательной таблетки, содержащий карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана и фармацевтически приемлемый наполнитель, полученный согласно способу, включающему этапы:a) смешивание карбоната лантана и фармацевтически приемлемого наполнителя с получением смеси илиb) смешивание карбоната лантана и фармацевтически приемлемого наполнителя, прессование полученной смеси с образованием агрегированного материала или уплотнение образовавшейся смеси в валках в виде ленты и измельчение приготовленного материала в свободнотекучую смесь иc) таблетирование смеси, полученной на этапе а) или b),при этом способ осуществляют в отсутствие влажного гранулирования или сушки. 16. Фармацевтический состав на основе карбоната лантана в форме жевательной таблетки, содержащий карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана и фармацевтически приемлемый наполнитель, полученный согласно способу, включающему этапы:a) прессования карбоната лантана с образованием агрегированного материала или уплотнение карбоната лантана в валках в виде ленты,b) измельчения агрегированного материала или ленты в свободнотекучий материал,c) смешивания свободно текучего материала с фармацевтически приемлемым наполнителем с получением смеси иd) таблетирование смеси,при этом способ осуществляют в отсутствие влажного гранулирования или сушки. 17. Состав по п.15, отличающийся тем, что карбонат лантана представляет собой карбонат лантана формулыLa2(CO3)3xH2O,где x принимает значения от 3 до 8.- 12012798 18. Состав по п.17, отличающийся тем, что х принимает значения от 4 до 5. 19. Состав по п.15, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 40 примерно до 80 вес.% от общего веса состава. 20. Состав по п.19, отличающийся тем, что разбавитель представляет собой декстраты или сорбитол. 21. Состав по п.15, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой агент, повышающий текучесть. 22. Состав по п.21, отличающийся тем, что агент, повышающий текучесть, представляет собой коллоидный безводный диоксид кремния в количестве примерно 2 вес.% от общего веса состава. 23. Жевательная фармацевтическая таблетка, содержащая карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, для лечения хронической почечной недостаточности,полученная путем прямого прессования в отсутствие влажного гранулирования с последующей сушкой,содержащая следующие ингредиенты: при этом карбонат лантана гидратирован и содержит примерно 4 моль воды. 24. Жевательная фармацевтическая таблетка, содержащая карбонат лантана в количестве примерно от 10 примерно до 40 вес.% элементарного лантана, для лечения хронической почечной недостаточности,полученная путем прямого прессования в отсутствие влажного гранулирования с последующей сушкой,содержащая следующие ингредиенты: при этом карбонат лантана гидратирован и содержит примерно 4 моль воды. 25. Фармацевтический состав, содержащий карбонат лантана, в виде порошка, включающий карбонат лантана в количестве примерно от 10 до примерно 40 вес.% элементарного лантана и фармацевтически приемлемый наполнитель, причем указанный состав получен согласно способу, включающему этапы:a) смешивания карбоната лантана и фармацевтически приемлемого наполнителя,b) прессования полученной смеси с образованием агрегированного материала или уплотнения образовавшейся смеси в валках в виде ленты иc) измельчения приготовленного материала в свободнотекучую порошкообразную смесь; и при этом процесс осуществляют в отсутствие влажного гранулирования или сушки. 26. Фармацевтический состав, содержащий карбонат лантана, в виде порошка, включающий карбонат лантана в количестве примерно от 10 до примерно 40 вес.% элементарного лантана и фармацевтически приемлемый наполнитель, причем указанный состав получен согласно способу, включающему этапы:a) прессования карбоната лантана с образованием агрегированного материала или уплотнения карбоната лантана в валках в виде ленты,b) измельчения агрегированного материала или ленты с получением свободнотекучего материала,c) смешивания свободнотекучего материала с фармацевтически приемлемым наполнителем с получением смеси, и при этом процесс осуществляют в отсутствие влажного гранулирования или сушки. 27. Состав по п.15, отличающийся тем, что получен согласно способу, включающему этапы:a) смешивания карбоната лантана и фармацевтически приемлемого наполнителя с получением смеси иb) таблетирования смеси. 28. Фармацевтический состав, содержащий карбонат лантана, по п.15, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой компоненты смеси, повышающие текучесть,и смазочные вещества в количестве примерно от 0,1 примерно до 5,0 вес.%. 29. Фармацевтический состав, содержащий карбонат лантана, по п.15, отличающийся тем, что количество карбоната лантана составляет примерно от 20 примерно до 30 вес.% элементарного лантана. 30. Фармацевтический состав, содержащий карбонат лантана, по п.29, отличающийся тем, что фар- 13012798 мацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 30 примерно до 60 вес.%. 31. Фармацевтический состав, содержащий карбонат лантана, по п.29, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 30 примерно до 50 вес.%. 32. Фармацевтический состав, содержащий карбонат лантана, по п.29, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 40 примерно до 60 вес.%. 33. Фармацевтический состав, содержащий карбонат лантана, по п.15, отличающийся тем, что количество карбоната лантана составляет примерно от 10 примерно до 30 вес.% элементарного лантана. 34. Фармацевтический состав, содержащий карбонат лантана, по п.33, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 24 примерно до 60 вес.%. 35. Фармацевтический состав, содержащий карбонат лантана, по п.15, отличающийся тем, что количество карбоната лантана составляет примерно от 10 примерно до 30 вес.% элементарного лантана. 36. Фармацевтический состав, содержащий карбонат лантана, по п.35, отличающийся тем, что фармацевтически приемлемый наполнитель представляет собой разбавитель в количестве примерно от 42 примерно до 58 вес.%.
МПК / Метки
МПК: A61K 33/24, A61J 3/10, A61K 47/36, A61K 47/26, A61K 33/00, A61K 9/68, A61K 9/20, A61P 13/12
Метки: содержащий, варианты, лантана, фармацевтический, карбонат, состав
Код ссылки
<a href="https://eas.patents.su/15-12798-farmacevticheskijj-sostav-soderzhashhijj-karbonat-lantana-varianty.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтический состав, содержащий карбонат лантана (варианты)</a>
Предыдущий патент: Лампа
Следующий патент: Терапевтические применения ингибиторов rtp801
Случайный патент: Вакцина