Ингибиторы взаимодействия между mdm2 и р53
Номер патента: 12452
Опубликовано: 30.10.2009
Авторы: Вермют Камилль Жорж, Схунтьес Брюно, Линьи Янник Эме Эдди, Ксока Имр Кристиан Франсис, Житлен Брюно, Лакрамп Жан Фернан Арман, Мейер Кристоф, Жубер Мюриель, Ван Хейфте Люк, Артс Янине, Контрера Жан -Мари
Формула / Реферат
1. Соединение формулы (I)

его N-оксидная форма, аддитивная соль или стереохимически изомерная форма,
где m представляет 0, 1 или 2, и когда m равно 0, тогда имеется прямая связь;
n представляет 0, 1, 2 или 3, и когда n равно 0, тогда имеется прямая связь;
р представляет 0 или 1, и когда р равно 0, тогда имеется прямая связь;
s представляет 0 или 1, и когда s равно 0, тогда имеется прямая связь;
t представляет 0 или 1, и когда t равно 0, тогда имеется прямая связь;
X обозначает С(=O) или CHR8;
где R8 обозначает водород, -С(=O)-NR17R18, арил-C1-6-алкилоксикарбонил, пиперазинилкарбонил, пиперидинилкарбонил, C1-6-алкил, замещенный гидрокси; пиперазинилкарбонил, замещенный гидрокси-C1-6-алкилом или гидрокси-C1-6-алкилокси-C1-6-алкилом; или пиперидинилкарбонил, замещенный одним или двумя заместителями, выбранными из гидрокси, C1-6-алкила, гидрокси-C1-6-алкила, C1-6-алкилокси-C1-6-алкила, C1-6-алкил(дигидрокси)С1-6-алкила или C1-6-алкилокси(гидрокси)C1-6-алкила;
R17 и R18, каждый независимо, выбраны из водорода, C1-6-алкила, ди(C1-6-алкил)амино-C1-6-алкила, арил-C1-6-алкила, С1-6-алкилокси-C1-6-алкила, гидрокси-C1-6-алкила;
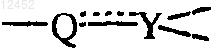 обозначает -CR9=C< и пунктир обозначает связь или -CHR9-CH<; где каждый R9 обозначает независимо водород или C1-6-алкил;
обозначает -CR9=C< и пунктир обозначает связь или -CHR9-CH<; где каждый R9 обозначает независимо водород или C1-6-алкил;
R1 обозначает водород, гетероарил, C1-6-алкилоксикарбонил, C1-12-алкил или C1-12-алкил, замещенный одним гетероарилом;
R2 обозначает водород, галоген, C1-6-алкил, C1-6-алкилокси, арил-C1-6-алкилокси или фенилтио;
R3 обозначает водород, C1-6-алкил или гетероарил;
R4 и R5 обозначают, каждый независимо, водород, галоген, C1-6-алкил, циано или C1-6-алкилокси;
R6 обозначает водород, C1-6-алкилоксикарбонил или C1-6-алкил;
когда р равно 1, тогда R7 обозначает водород, арил-C1-6-алкил или гидрокси;
Z обозначает радикал, выбранный из
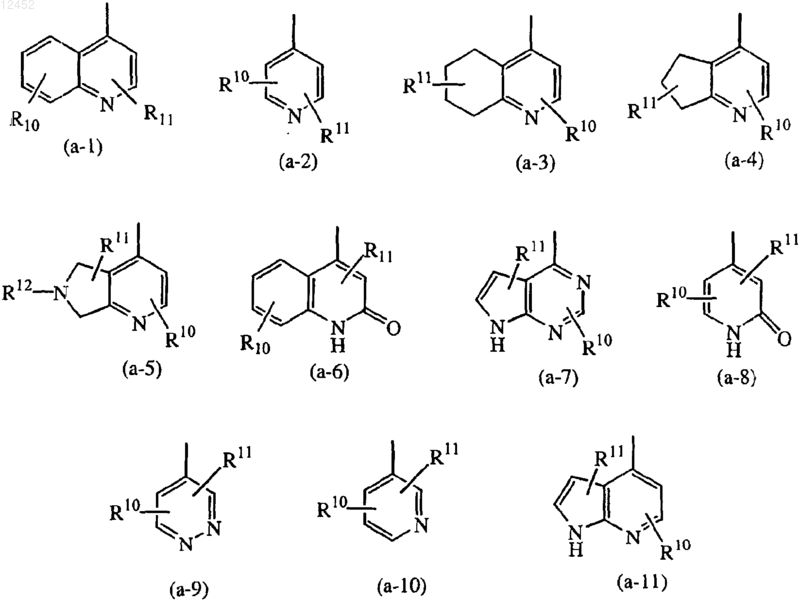
где каждый R10 или R11 независимо выбирают из водорода, галогена, гидрокси, C1-6-алкила, нитро, полигалоген-C1-6-алкила, циано, арила, гетероарила, арил-C1-6-алкила, гетероарил-C1-6-алкила, арил(гидрокси)C1-6-алкила, арилкарбонила, C1-6-алкилкарбонила, C1-6-алкилокси, C3-7-циклоалкилкарбонила, C3-7-циклоалкил(гидрокси)C1-6-алкила, арил-C1-6-алкилокси-C1-6-алкила, C1-6-алкилокси-C1-6-алкилокси-C1-6-алкила, C1-6-алкилкарбонилокси-C1-6-алкила, C1-6-алкилоксикарбонил-C1-6-алкилокси-C1-6-алкила, гидрокси-C1-6-алкилокси-C1-6-алкила, C1-6-алкилоксикарбонил-C2-6-алкенил-C1-6-алкилокси-C1-6-алкила, C1-6-алкилоксикарбонила, гидрокси-C1-6-алкила, гидроксикарбонила, гидроксикарбонил-С1-6-алкила и -(СН2)v-(С(=O)r)-(CHR19)u-NR13R14;
где v представляет 0, 1, 2, 3, 4, 5 или 6, и когда v равно 0, тогда имеется прямая связь;
r представляет 0 или 1, и когда r равно 0, тогда имеется прямая связь;
u представляет 0, 1, 2, 3, 4, 5 или 6, и когда u равно 0, тогда имеется прямая связь;
R19 обозначает водород или C1-6-алкил;
R12 обозначает водород, C1-6-алкил, C3-7-циклоалкил, C1-6-алкил, замещенный заместителем, выбранным из гидрокси, амино, C1-6-алкилокси и арила; или C3-7-циклоалкил, замещенный заместителем, выбранным из гидрокси, амино, арила и C1-6-алкилокси;
R13 и R14, каждый независимо, выбирают из водорода, C1-12-алкила, C1-6-алкилкарбонила, C1-6-алкилсульфонила, арил-C1-6-алкилкарбонила, С3-7-циклоалкилкарбонила, -(СН2)k-NR15R16, C1-12-алкила, замещенного заместителем, выбранным из гидрокси, гидроксикарбонила, циано, C1-6-алкилоксикарбонила или арила; или
R13 и R14 вместе с атомом азота, с которым они связаны, могут необязательно образовывать морфолинил, пиперидинил, пирролидинил, пиперазинил или пиперазинил, замещенный заместителем, выбранным из C1-6-алкила или арил-C1-6-алкилоксикарбонила;
где k представляет 0, 1, 2, 3, 4, 5 или 6, и когда k равно 0, тогда имеется прямая связь;
R15 и R16, каждый независимо, выбирают из водорода, C1-6-алкила или арил-C1-6-алкилоксикарбонила; или R15 и R16 вместе с атомом азота, с которым они связаны, могут необязательно образовывать морфолинил, пиперазинил или пиперазинил, замещенный C1-6-алкилоксикарбонилом;
арил представляет собой фенил;
каждый фенил может необязательно быть замещен одним, двумя или тремя заместителями, выбранными, каждый независимо, из галогена, гидрокси, C1-6-алкила, амино, полигалоген-C1-6-алкила и C1-6-алкилокси; и
гетероарил представляет собой пиридинил, индолил, хинолинил, имидазолил, фуранил, тиенил, оксадиазолил, тетразолил, бензофуранил или тетрагидрофуранил;
каждый пиридинил, индолил, хинолинил, имидазолил, фуранил, тиенил, оксадиазолил, тетразолил, бензофуранил или тетрагидрофуранил может необязательно быть замещен одним, двумя или тремя заместителями, выбранными, каждый независимо, из галогена, гидрокси, C1-6-алкила, амино, полигалоген-C1-6-алкила, арила, арил-C1-6-алкила или C1-6-алкилокси; и
при условии, что
когда m равно 1, заместители на фенильном кольце кроме R2 находятся в мета-положении;
s равно 0 и t равно 0;
тогда Z обозначает радикал, выбранный из (а-1), (а-3), (а-4), (а-5), (a-6), (а-7), (а-8) или (а-9).
2. Соединение по п.1, в котором
R8 обозначает водород, -С(=O)-NR17R18, арил-C1-6-алкилоксикарбонил, C1-6-алкил, замещенный гидрокси, пиперазинилкарбонил, замещенный гидрокси-C1-6-алкилом или гидрокси-C1-6-алкилокси-C1-6-алкилом, пиперидинилкарбонил, замещенный одним или двумя заместителями, выбранными из гидрокси, C1-6-алкила, гидрокси-C1-6-алкила, C1-6-алкилокси-C1-6-алкила, C1-6-алкил(дигидрокси)C1-6-алкила или C1-6-алкилокси(гидрокси)C1-6-алкила;
когда р равно 1, тогда R7 обозначает арил-C1-6-алкил или гидрокси;
Z обозначает радикал, выбранный из (а-1), (а-2), (а-3), (а-4), (а-5), (a-6), (а-8), (а-9), (а-10) и (а-11); R10 или R11, каждый независимо, выбраны из водорода, галогена, гидрокси, C1-6-алкила, нитро, полигалоген-C1-6-алкила, циано, арила, гетероарила, гетероарил-C1-6-алкила, арил(гидрокси)C1-6-алкила, арилкарбонила, C1-6-алкилкарбонила, С3-7-циклоалкилкарбонила, C3-7-циклоалкил(гидрокси)C1-6-алкила, арил-C1-6-алкилокси-C1-6-алкила, C1-6-алкилокси-C1-6-алкилокси-C1-6-алкиыр, C1-6-алкилкарбонилокси-C1-6-алкила, C1-6-алкилоксикарбонил-C1-6-алкилокси-C1-6-алкила, гидрокси-C1-6-алкилокси-C1-6-алкила, C1-6-алкилоксикарбонил-С2-6-алкенила, C1-6-алкилокси-C1-6-алкила, C1-6-алкилоксикарбонила, гидрокси-C1-6-алкила, гидроксикарбонила, гидроксикарбонил-C1-6-алкила и -(СН2)v-(С(=O)r)-(CHR19)u-NR13R14;
v равно 0 или 1;
u равно 0 или 1;
R12 обозначает водород или C1-6-алкил;
R13 и R14, каждый независимо, выбраны из водорода, C1-12-алкила, C1-6-алкилкарбонила, C1-6-алкилсульфонила, арил-C1-6-алкилкарбонила, С3-7-циклоалкилкарбонила, -(СН2)k-NRl5R16, C1-12-алкила, замещенного заместителем, выбранным из гидрокси, гидроксикарбонила, циано, C1-6-алкилоксикарбонила или арила;
R13 и R14 вместе с атомом азота, с которым они связаны, могут необязательно образовывать морфолинил, пирролидинил, пиперазинил или пиперазинил, замещенный заместителем, выбранным из C1-6-алкила или арил-C1-6-алкилоксикарбонила;
k равно 2;
арил представляет собой фенил или фенил, замещенный галогеном;
гетероарил представляет собой пиридинил, индолил, оксадиазолил или тетразолил;
и каждый пиридинил, индолил, оксадиазолил или тетразолил может необязательно быть замещенный заместителем, выбранным из C1-6-алкила, арила или арил-C1-6-алкила.
3. Соединение по любому из предшествующих пунктов, где m равно 0; n равно 1; р равно 0; s равно 0; t равно 0.
4. Соединение по любому из предшествующих пунктов, где X обозначает CHR8; R8 обозначает водород.
5. Соединение по любому из предшествующих пунктов, где 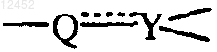 обозначает -CR=С<; каждый R9 обозначает водород.
обозначает -CR=С<; каждый R9 обозначает водород.
6. Соединение по любому из предшествующих пунктов, где R1 обозначает водород; R3 обозначает водород; R6 обозначает водород.
7. Соединение по любому из предшествующих пунктов, где R4 и R5 обозначают, каждый независимо, водород, C1-6-алкил или C1-6-алкилокси.
8. Соединение по любому из предшествующих пунктов, где Z обозначает радикал, выбранный из (а-1), (а-2), (а-3) или (а-4).
9. Соединение по любому из предшествующих пунктов, где R10 или R11, каждый независимо, выбраны из водорода, гидрокси или гидрокси-C1-6-алкила.
10. Соединение по любому из предшествующих пунктов, где R2 обозначает водород или C1-6-алкилокси.
11. Соединение по п.1 или 2, в котором m равно 0; n равно 1; р равно 0; s равно 0; t равно 0; X обозначает CHR8; R8 обозначает водород; ![]() обозначает -CR9=C<; каждый R9 обозначает водород; R1 обозначает водород; R2 обозначает водород или C1-6-алкилокси; R3 обозначает водород; R4 и R5 обозначают, каждый независимо, водород, C1-6-алкил или C1-6-алкилокси; R6 обозначает водород; Z обозначает радикал, выбранный из (а-1), (а-2), (а-3) или (а-4); и R10 или R11, каждый независимо, выбраны из водорода, гидрокси или гидрокси-С1-6-алкила.
обозначает -CR9=C<; каждый R9 обозначает водород; R1 обозначает водород; R2 обозначает водород или C1-6-алкилокси; R3 обозначает водород; R4 и R5 обозначают, каждый независимо, водород, C1-6-алкил или C1-6-алкилокси; R6 обозначает водород; Z обозначает радикал, выбранный из (а-1), (а-2), (а-3) или (а-4); и R10 или R11, каждый независимо, выбраны из водорода, гидрокси или гидрокси-С1-6-алкила.
12. Соединение по пп.1, 2 или 3, где соединение представляет собой соединение ь 1, соединение ь 21, соединение ь 4, соединение ь 5, соединение ь 36, соединение ь 69, соединение ь 110, соединение ь 111, соединение ь 112, соединение ь 229 и соединение ь 37,
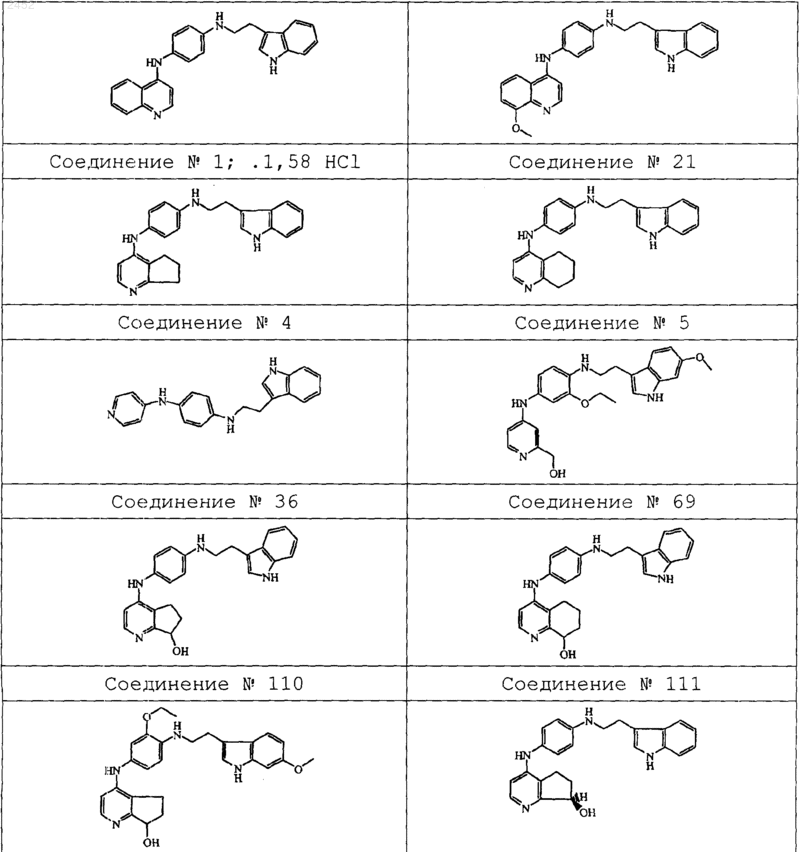

его N-оксид, фармацевтически приемлемую кислотно-аддитивную или основно-аддитивную соль или стереохимически изомерную форму.
13. Соединение по любому из предшествующих пунктов, где соединение представлет собой
его N-оксидную форму или аддитивную соль.
14. Соединение по п.13, где соединение представлет собой
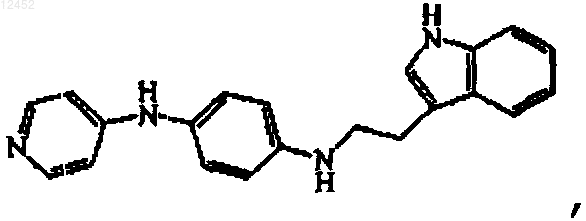
или его фармацевтически приемлемую кислотно-аддитивную соль.
15. Соединение по п.14, где соединение представлет собой
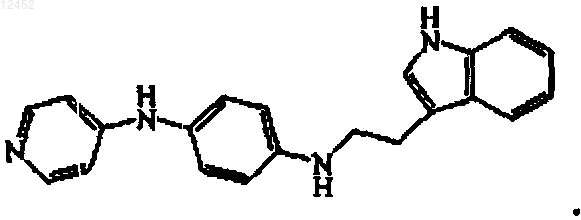
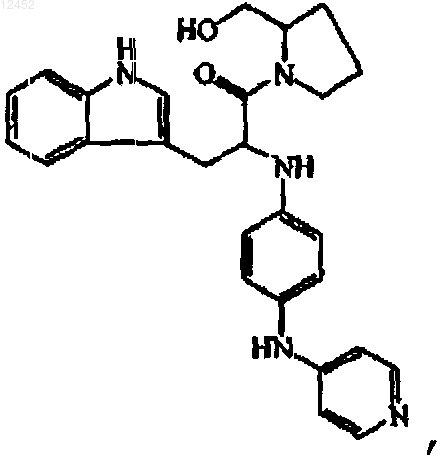
16. Соединение, имеющее следующую формулу:
его N-оксид, аддитивную соль или стереохимически изомерную форму.
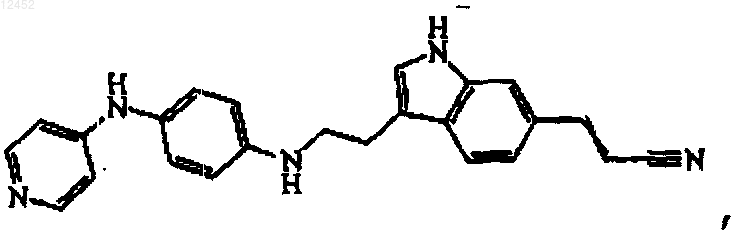
17. Соединение, имеющее следующую формулу:
его N-оксид, аддитивную соль или стереохимически изомерную форму.
18. Применение соединения по любому из пп.1-17 в качестве лекарственного средства.
19. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-17.
20. Способ получения фармацевтической композиции по п.19, в котором фармацевтически приемлемые носители и соединение по любому из пп.1-17 тщательно смешивают.
21. Применение соединения по любому из пп.1-17 для получения лекарственного средства для лечения нарушения, опосредуемого взаимодействием p53-MDM2.
22. Применение соединения по любому из пп.1-17 для получения лекарственного средства для лечения рака.
23. Применение по п.22, где рак выбирают из рака легкого (например, аденокарцинома, и включая немелкоклеточный рак легкого), рака поджелудочной железы (например, карцинома поджелудочной железы, такая как, например, экзокринный рак поджелудочной железы), рака толстой кишки (например, колоректальные раки, такие как, например, аденокарцинома толстой кишки и аденома толстой кишки), рака глотки, сквамозного рака полости рта, рака языка, рака желудка, рака носоглотки, гематопоэтических опухолей лимфоидного происхождения (например, острый лимфоцитарный лейкоз, лимфома В-клеток, лимфома Беркитта), лейкозов спинного мозга (например, острый миелогенный лейкоз (AML)), фолликулярного рака щитовидной железы, миелодиспластического синдрома (MDS), опухоли мезенхимального происхождения (например, фибросаркомы и рабдомиосаркомы), меланомы, тератокарциномы, нейробластомы, опухоли головного мозга, глиомы, доброкачественной опухоли кожи (например, кератоакантомы), рака молочной железы (например, запущенный рак молочной железы), рака почек, рака яичника, рака шейки матки, рака эндометрия, рака мочевого пузыря, рака предстательной железы, включая запущенное заболевание, рака яичек, остеосаркомы, рака головы и шеи и эпидермальной карциномы.
24. Применение по п.22, где рак выбирают из рака легкого, включая аденокарциному и немелкоклеточный рак легкого, рака молочной железы, рака толстой кишки, например колоректальные раки, острого миелогенного лейкоза, рака яичника, рака мочевого пузыря, гематопоэтических опухолей лимфоидного происхождения.
25. Комбинация противоракового средства и соединения по любому из пп.1-17.
26. Комбинация по п.25, где противораковое средство выбирают из платиновых координационных соединений, например цисплатины, карбоплатины или оксалиплатины; таксановых соединений, например паклитаксела или доцетаксела; ингибиторов топоизомеразы I, таких как камптотециновые соединения, например иринотекан или топотекан; ингибиторов топоизомеразы, таких как противоопухолевые подофиллотоксиновые производные, например этопозид или тенипозид; противоопухолевых алкалоидов барвинка, например винбластина, винкристина или винорелбина; противоопухолевых производэых нуклеозидов, например 5-фтороурацила, гемцитабина или капецитабина; алкилирующих агентов, таких как азотная горчица или нитрозомочезина, например циклофосфамид, хлорамбуцил, кармустин или ломустин; противоопухолевых производных антрациклина, например даунорубицина, доксорубицина, идарубицина или митоксантрона; антитела HER2, например трастузумаба; антагонистов рецептора эстрогена или селективных модуляторов рецептора эстрогена, например тамоксифена, торемифена, дролоксифена, фаслодекса или ралоксифена; ингибиторов ароматазы, таких как эксеместан, анастрозол, летразол и ворозол; дифференцирующих агентов, таких как ретиноиды, витамин D и блокирующие агенты метаболизма ретиноевой кислоты (RAMBA), например аккутан; ингибиторов ДНК метилтрансферазы, например азацитидина; ингибиторов киназы, например флавоперидола, иматиниб мезилата или гефитиниба; ингибиторов фарнезилтрансферазы; ингибиторов HDAC; ингибиторов пути убиквитин-протеасома, например Velcade или Yondelis.
27. Продукт, содержащий в качестве первого активного ингредиента ингибитор p53-MDM2 по любому из пп.1-17, а в качестве второго активного ингредиента противораковое средство, в форме комбинированного препарата для одновременного, раздельного или последовательного использования при лечении пациентов, страдающих раком.
28. Способ получения соединения по п.1, отличающийся тем, что промежуточное соединение формулы (II) взаимодействует с промежуточным соединением формулы (III), в котором W обозначает подходящую удаляемую группу, например галоген
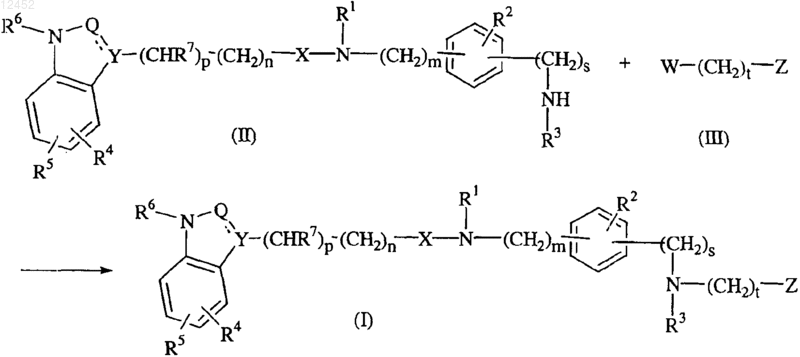
где все значения являются таковыми, как определено в п.1.
29. Способ получения соединения по п.1, отличающийся тем, что соединение формулы (I), в которой X обозначает С(=O), указанное соединением формулы (I-b), преобразуют в соединение формулы (I), в которой X обозначает CH2, указанное соединением формулы (I-а), в присутствии алюмогидрида лития в подходящем растворителе
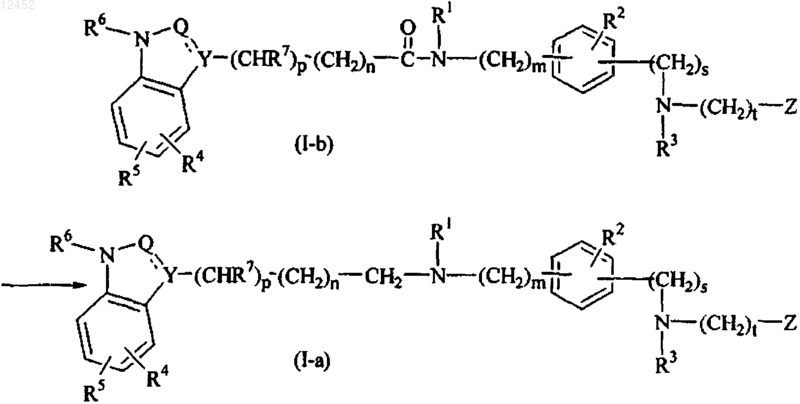
где все значения являются таковыми, как определено в п.1.
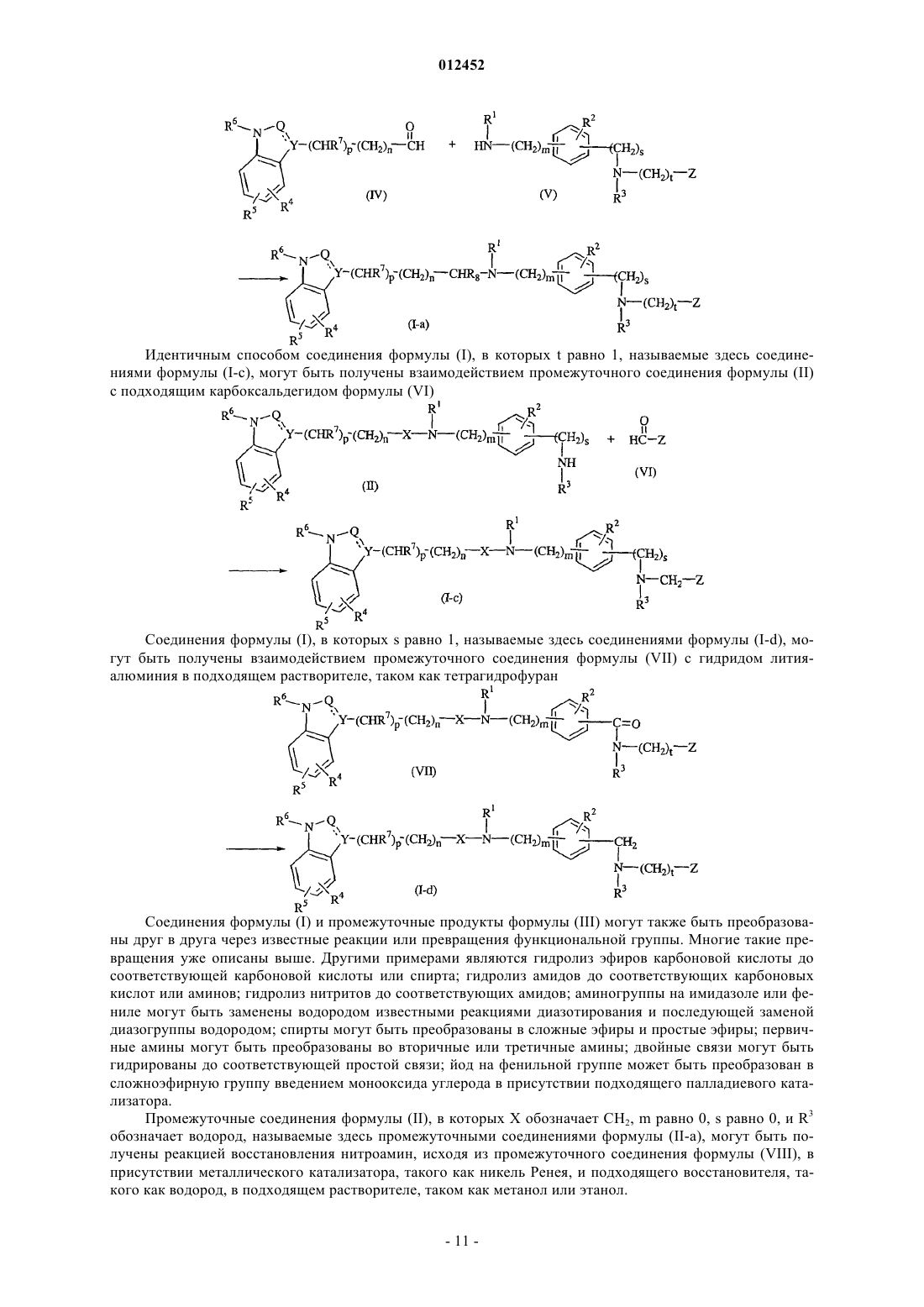
30. Способ получения соединения по п.1, отличающийся тем, что подходящий карбоксальдегид формулы (IV) взаимодействует с промежуточным соединением формулы (V) в присутствии подходящего восстанавливающего агента в подходящем растворителе с получением соединения формулы (I), указанного соединением формулы (I-а)
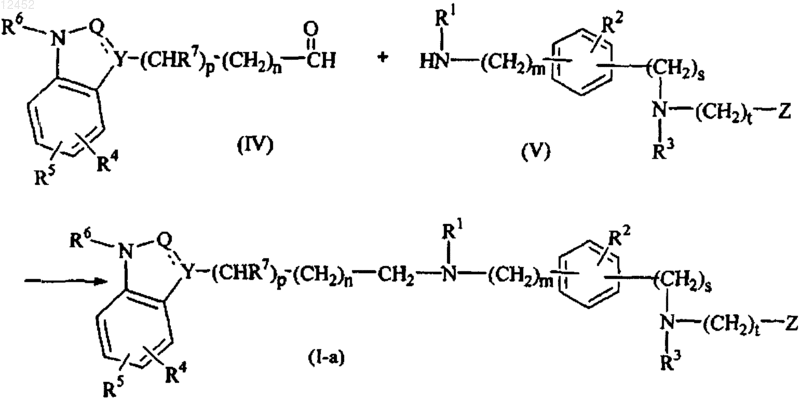
где все значения являются таковыми, как определено в п.1.
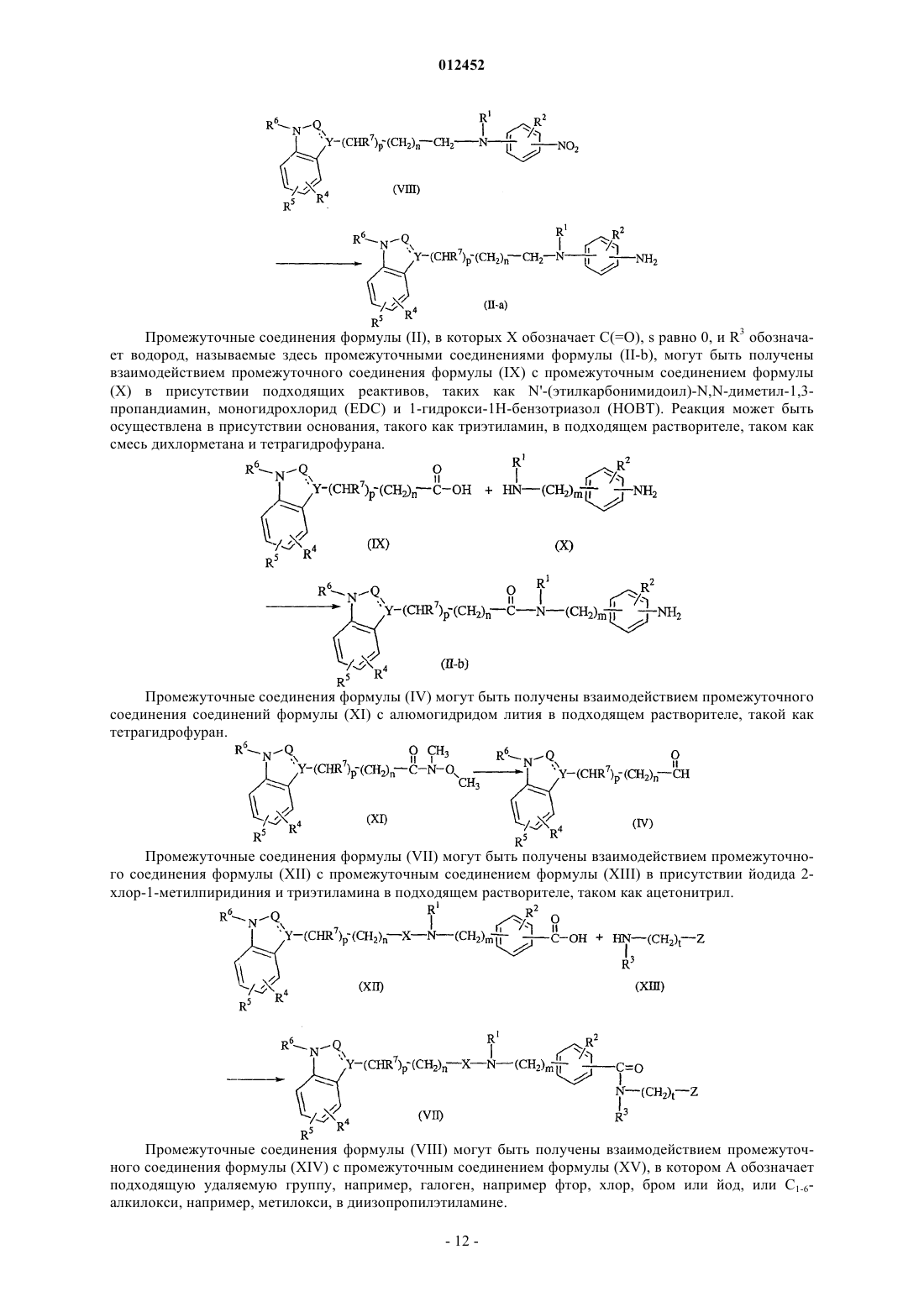
31. Способ получения соединения по п.1, отличающийся тем, что промежуточное соединение формулы (II) взаимодействует с подходящим карбоксальдегидом формулы (VI) и подходящим восстанавливающим агентом с получением соединения формулы (I), в которой t равно 1, указанного соединением формулы (I-c)
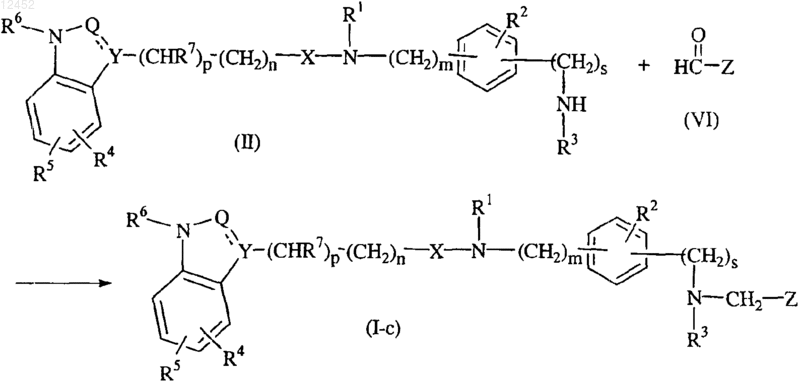
где все значения являются таковыми, как определено в п.1.
32. Способ получения соединения по п.1, отличающийся тем, что промежуточное соединение формулы (VII) взаимодействует с алюмогидридом лития в подходящем растворителе с получением соединения формулы (I), в которой s равно 1, называемого соединением формулы (I-d)
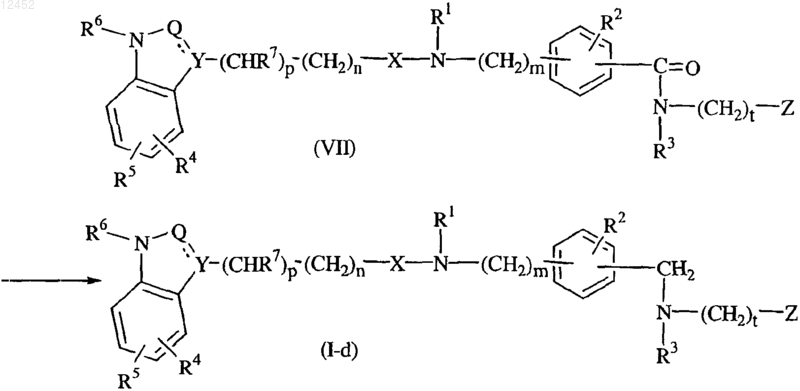
где все значения являются таковыми, как определено в п.1.
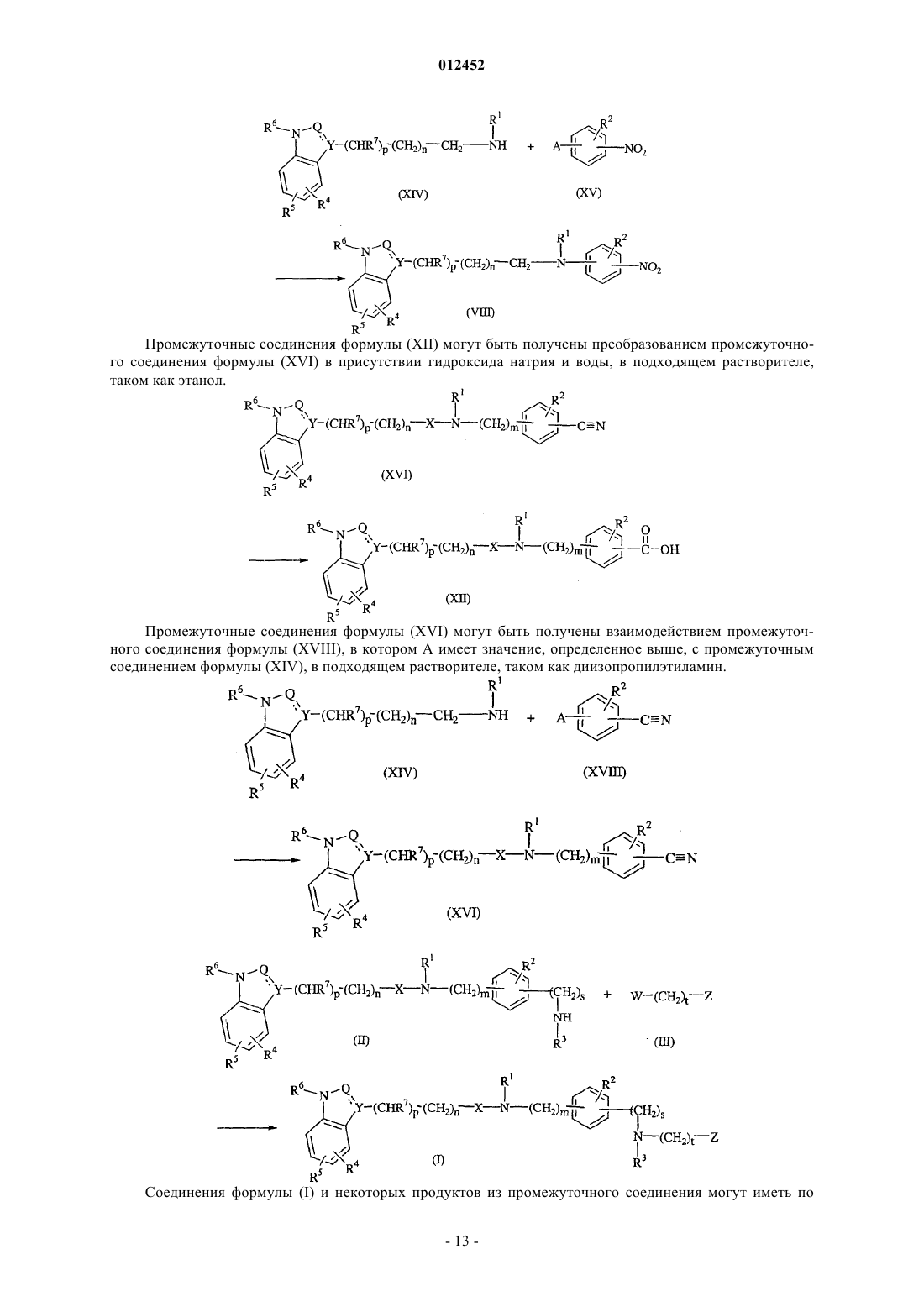
Текст
012452 Область изобретения Настоящее изобретение относится к соединениям и композициями, содержащим указанные соединения, действующие как ингибиторы взаимодействия между MDM2 и р 53. Кроме того, настоящее изобретение относится к способам получения раскрытых ингибиторов, композициям, включающим их, и способы их применения, например, в качестве лекарственных средств. р 53 представляет собой белок-супрессор опухоли, который играет стержневую роль в регулировании баланса между пролиферацией клеток и остановкой/апоптозом роста клеток. В нормальных условиях полупериод р 53 очень короток, и, следовательно, уровень р 53 в клетках низок. Однако, в ответ на повреждение клеточной ДНК или стресс клеток (например, активация онкогена, эрозия теломеры, гипоксия), уровни р 53 увеличиваются. Это увеличение уровней р 53 приводят к активации транскрипции множества генов, которая приводит или к прекращению роста клеток, или к процессам апоптоза. Таким образом, важная функция р 53 заключается в предотвращении нерегулируемой пролиферации поврежденных клеток и, таким образом, в защите организма от развития рака.MDM2 представляет собой ключевой отрицательный регулятор функции р 53. Он формирует отрицательную авторегулирующую петлю, связываясь с аминоконцевым доменом трансактивации р 53 и, таким образом, MDM2 одновременно ингибирует способность р 53 активировать транскрипцию и нацеливает р 53 для протеолитического разложения. В нормальных условиях эта регулирующая петля ответственна за поддержание низких уровней р 53. Однако в опухолях с диким типом р 53 равновесные концентрации активного р 53 могут быть увеличены за счет противодействия взаимодействию между MDM2 и р 53. Это приведет к восстановлению р 53-опосредованных проапоптотических и антипролиферативных эффектов в таких опухолевых клетках.MDM2 представляет собой клеточный протоонкоген. Суперэкспрессия MDM2 наблюдалась в различных видах рака. MDM2 суперэкспрессируется в различных видах опухолей вследствие амплификации или увеличенной транскрипции или трансляции гена. Механизм, за счет которого амплификация MDM2 приводит к туморогенезу, по крайней мере, частично связан с его взаимодействием с р 53. В клетках, суперэкспрессирующих MDM2, блокирована защитная функция р 53, и, таким образом, клетки неспособны ответить на повреждение ДНК или клеточный стресс увеличением уровня р 53, что приводит к остановке роста клеток и/или апоптозу. Таким образом после повреждения ДНК и/или клеточного стресса, клетки, суперэкспрессирующие MDM2, свободно продолжают пролиферировать и принимают онкогенный фенотип. В этих условиях разрушение взаимодействия р 53 и MDM2 привело бы к высвобождению р 53 и, таким образом, обеспечивало бы нормальное функционирование сигналов остановки роста и/или апоптоза.MDM2 может также иметь другие функции в дополнение к ингибированию р 53. Например, показано, что MDM2 взаимодействует непосредственно с pRb-регулируемым фактором транскрипцииE2F1/DP1. Это взаимодействие может быть критическим для р 53-независимых опухолеродных активностей MDM2. Домен E2F1 демонстрирует потрясающее сходство с MDM2-связывающим доменом р 53. Так как взаимодействия MDM2 как с р 53, так и с E2F1, имеют место в одном и том же связывающем сайте на MDM2, можно ожидать, что антагонисты MDM2/p53 будут не только активировать клеточный р 53,но также и модулировать активности E2F1, которые обычно дерегулированы в опухолевых клетках. Также терапевтическая эффективность ДНК-повреждающих средств, используемых в настоящее время (химиотерапия и лучевая терапия), может быть ограничена за счет отрицательной регуляции р 53,осуществляемой MDM2. Таким образом, если ингибирование р 53 по принципу обратной связи, осуществляемое MDM2, будет прервано, то увеличение уровней функциональных р 53 увеличит терапевтическую эффективность таких средств, восстанавливая функцию р 53 дикого типа, которая приводит к апоптозу и/или реверсированию р 53-связанной лекарственной резистентности. Было показано, что комбинация видов лечения с ингибированием MDM2 и повреждением ДНК in vivo приводила к синергическим эффектам в отношении противоопухолевого действия (Vousden K.H., Cell, Vol. 103, 691-694, 2000). Таким образом, разрушение взаимодействия MDM2 и р 53 предлагает подход для терапевтического вмешательства в опухоли с диким типом р 53, даже может продемонстрировать антипролиферативные эффекты в опухолевых клетках, которые лишены функционального р 53 и, кроме того, может сенсибилизировать онкогенные клетки к химиотерапии и лучевой терапии. Предпосылки создания изобретения В JP 11130750, опубликованном 18 мая 1999, описаны, среди прочих, замещенные производные фениламинокарбонилиндолила в качеств антагонистов рецептора 5-НТ. В ЕР 1129074, опубликованном 18 мая 2000, описаны амиды антраниловой кислоты как ингибиторы рецепторов фактора роста эндотелия сосудов (VEGFR), пригодные для лечения ангиогенных нарушений. В ЕР 1317443, опубликованном 21 марта 2002, раскрыты трициклические производные третичного амина, пригодные как модуляторы рецептора хемокина CXCR4 или CCR5 для лечения вируса иммунодефицита человека и кошачьего вируса иммунодефицита. В ЕР 1379239, опубликованном 10 октября 2002, раскрыты N-(2-арилэтил)бензиламины как антагонисты рецептора 5-HT6. В частности, описаны 6-хлор-N-3-(4-пиридиниламино)фенил]метил]-1 Н-индол 3-этанамин В WO00/15357, опубликованной 23 марта 2000, описаны производные пиперазин-4-фенила как ингибиторы взаимодействия между MDM2 и р 53. В ЕР 1137418, опубликованном 8 июня 2000, описаны трициклические соединения для восстановления конформационной устойчивости белков семейства р 53. В WO03/041715, опубликованной 22 мая 2003, описаны замещенные 1,4-бензодиазепины и их применения в качестве ингибиторов взаимодействий MDM2-p53. В WO03/51359, опубликованной 26 июня 2003, описаны цис-2,4,5-трифенилмидазолоны, ингибирующие взаимодействие белка MDM2 с р 53-подобными пептидами и имеющие антипролиферативную активность. В WO04/05278, опубликованной 15 января 2004, раскрыты соединения бисарилсульфонамида, связывающиеся с MDM2 и которые могут использоваться в терапии рака. Сохраняется потребность в эффективных и мощных малых молекулах, которые ингибируют взаимодействия между MDM2 и р 53. Соединения согласно настоящему изобретению отличаются от предшествующего уровня техники по структуре, по их фармакологической активности и/или по фармакологическому потенциалу. Описание изобретения Настоящее изобретение относится к соединениям, композициям и способам для ингибирования взаимодействия между MDM2 и р 53 для лечения рака. Кроме того, соединения и композиции согласно изобретению полезны в усиливании эффективности химиотерапии и лучевой терапии. Это изобретение касается соединений формулы (I) их N-оксидной формы, аддитивной соли или стереохимически изомерной формы, гдеm представляет 0, 1 или 2, и когда m равно 0, тогда имеется прямая связь;n представляет 0, 1, 2 или 3, и когда n равно 0, тогда имеется прямая связь; р представляет 0 или 1, и когда р равно 0, тогда имеется прямая связь;s представляет 0 или 1, и когда s равно 0, тогда имеется прямая связь;t представляет 0 или 1, и когда t равно 0, тогда имеется прямая связь;NR R , гидроксикарбонил, арил-C1-6-алкилоксикарбонил, гетероарил, гетероарилкарбонил, гетероарил-C1-6 алкилоксикарбонил, пиперазинилкарбонил, пирролидинил, пиперидинилкарбонил, С 1-6-алкилоксикарбонил,C1-6-алкил, замещенный заместителем, выбранным из гидрокси, амино, арила и гетероарила; C3-7-циклоалкил,замещенный заместителем, выбранным из гидрокси, амино, арила и гетероарила; пиперазинилкарбонил, замещенный гидрокси, гидрокси-C1-6-алкилом, гидрокси-C1-6-алкилокси-C1-6-алкилом; пирролидинил, замещенный гидрокси-C1-6-алкилом; или пиперидинилкарбонил, замещенный одним или двумя заместителями, выбранными из гидрокси, C1-6-алкила, гидрокси-C1-6-алкила, C1-6-алкилокси-C1-6-алкила, C1-6-алкил(дигидрокси)R17 и R18, каждый независимо, выбраны из водорода, C1-6-алкила, ди(C1-6-алкил)амино-C1-6-алкила,арил-C1-6-алкила, C1-6-алкилокси-C1-6-алкила, гидрокси-C1-6-алкила, гидрокси-C1-6-алкил(C1-6-алкила) или гидрокси-C1-6-алкил (арил-C1-6-алкила); обозначает -CR9=C, и пунктир обозначает связь, -C(=O)-CH, -C(=O)-N, -CHR9-CH 9 или -CHR -N; причем каждый R9 обозначает независимо водород или C1-6-алкил;R1 обозначает водород, арил, гетероарил, C1-6-алкилоксикарбонил, C1-12-алкил или C1-12-алкил, замещенный одним или двумя заместителями, независимо выбранными из гидрокси, арила, гетероарила,амино, C1-6-алкилокси, моно- или ди(C1-6-алкил)амино, морфолинила, пиперидинила, пирролидинила,пиперазинила,C1-6-алкилпиперазинила,арил-C1-6-алкилпиперазинила,гетероарил-C1-6-алкилпиперазинила, C3-7-циклоалкилпиперазинила и C3-7-циклоалкил-C1-6-алкилпиперазинила;R4 и R5 вместе могут в случае необходимости образовывать двухвалентный радикал, выбранный из метилендиокси или этилендиокси;v представляет 0, 1, 2, 3, 4, 5 или 6, и когда v равно 0, тогда имеется прямая связь;r представляет 0 или 1, и когда r равно 0, тогда имеется прямая связь;u представляет 0, 1, 2, 3, 4, 5 или 6, и когда u равно 0, тогда имеется прямая связь;R19 обозначает водород или C1-6-алкил;R13 и R14 вместе с атомом азота, с которым они связаны, могут в случае необходимости образовывать морфолинил, пиперидинил, пирролидинил, пиперазинил или пиперазинил, замещенный заместителем, выбранным из C1-6-алкила, арил-C1-6-алкила, арил-C1-6-алкилоксикарбонила, гетероарил-C1-6-алкила,C3-7-циклоалкила и C3-7-циклоалкилC1-6-алкила; причемk представляет 0, 1, 2, 3, 4, 5 или 6, и когда k равно 0, тогда имеется прямая связь;R15 и R16 вместе с атомом азота, с которым они связаны, могут в случае необходимости образовывать морфолинил, пиперазинил или пиперазинил, замещенный C1-6-алкилоксикарбонилом; арил представляет собой фенил или нафталинил; каждый фенил или нафталинил могут в случае необходимости быть замещены одним, двумя или тремя заместителями, выбранными, каждый независимо, из галогена, гидрокси, C1-6-алкила, амино, полигалоген-C1-6-алкила и C1-6-алкилокси; и каждый фенил или нафталинил могут в случае необходимости быть замещены двухвалентным радикалом, выбранным из метилендиокси и этилендиокси; гетероарил представляет собой пиридинил, индолил, хинолинил имидазолил, фуранил, тиенил, оксадиазолил, тетразолил, бензофуранил или тетрагидрофуранил; каждый пиридинил, индолил, хинолинил, имидазолил, фуранил, тиенил, оксадиазолил, тетразолил,бензофуранил или тетрагидрофуранил может в случае необходимости быть замещен одним, двумя или тремя заместителями, выбранными, каждый независимо, из галогена, гидрокси, C1-6-алкила, амино, полигалоген-C1-6-алкила, арила, арил-C1-6-алкила или C1-6-алкилокси; и каждый пиридинил, индолил, хинолинил, имидазолил, фуранил, тиенил, бензофуранил или тетрагидрофуранил может в случае необходимости быть замещен двухвалентным радикалом, выбранным из метилендиокси или этилендиокси; при условии, что когда m равно 1; заместители на фенильном кольце кроме R2 находятся в мета-положении;t равно 0; тогда Z обозначает радикал, выбранный из (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8) или (а-9). Соединения формулы (I) могут также существовать в их таутомерных формах. Такие формы, хотя явно не обозначены в приведенной выше формуле, входят в рамки настоящего изобретения. Множество терминов, используемых в предшествующих определениях, в дальнейшем объясняются ниже. Эти термины иногда используются как таковые или в составе сложных терминов. В предшествующих определениях и в дальнейшем описании, галоген является родовым понятием для фтора, хлора, брома и йода; C1-6-алкил обозначает насыщенный углеводородный радикал с прямой и разветвленной цепью, имеющей от 1 до 6 атомов углерода, такой как, например, метил, этил, пропил,бутил, пентил, гексил, 1-метилэтил, 2-метилпропил, 2-метилбутил, 2-метилпентил и т.п.; C1-6-алкандиил обозначает двухвалентный насыщенный углеводородный радикал с прямой и разветвленной цепью,имеющий от 1 до 6 атомов углерода, такой как, например, метилен, 1,2-этандиил, 1,3-пропандиил 1,4 бутандиил, 1,5-пентандиил, 1,6-гександиил и их разветвленные изомеры, такие как 2-метилпентандиил,3-метилпентандиил, 2,2-диметилбутандиил, 2,3-диметилбутандиил и т.п.; C1-12-алкил включает C1-6-алкил и его высшие гомологи, имеющие 7-12 атомов углерода, такие как, например, гептил, октил, нонил, децил, ундецил и додецил; гидрокси-C1-6-алкил обозначает гидроксизаместитель на прямой и разветвленной цепи насыщенного углеводородного радикала, имеющего от 1 до 6 атомов углерода; тригалогенметил обозначает метил, содержащий три одинаковых или разных галогеновых заместителя, например,трифторметил; C2-6-алкенил обозначает углеводородный радикал с прямой и разветвленной цепью, содержащий одну двойную связь и имеющий от 2 до 6 атомов углерода, такой как, например, винил, 2 пропенил, 3-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил и т.п.; С 3-7-алкинил обозначает углеводородный радикал с прямой и разветвленной цепью, содержащий одну тройную связь и имеющий от 3 до 6 атомов углерода, такой как, например, 2-пропинил, 3-бутинил, 2-бутинил, 2-пентинил, 3-пентинил, 3 гексинил и т.п.; С 3-7-циклоалкил включает циклическую углеводородную группу, содержащую от 3 до 10 атомов углерода, такую как циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил и т.п. Термин "аддитивная соль" включает соли, которые могут образовывать соединения формулы (I) с органическими или неорганическими основаниями, такими как амины, основания щелочного металла и основания щелочно-земельного металла, или четвертичные аммониевые основания, или с органическими или неорганическими кислотами, такими как минеральные кислотами, сульфокислоты, карбоновые кислоты или фосфорсодержащие кислоты.-4 012452 Термин "аддитивная соль" также включает фармацевтически приемлемые соли, комплексные соединения металла и сольваты и их соли, которые могут образовывать соединения формулы (I). Термин "фармацевтически приемлемые соли" означает аддитивные соли фармацевтически приемлемой кислоты или основания. Аддитивные соли фармацевтически приемлемой кислоты или основания,как упомянуто выше, включают терапевтически активные аддитивные соли с нетоксичной кислотой и нетоксичным основанием, которые могут образовывать соединения формулы (I). Соединения формулы(I), которые имеют основные свойства, могут быть преобразованы в их фармацевтически приемлемые аддитивные соли с кислотой путем обработки указанной основной формы подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты,например хлористо-водородная или бромисто-водородная кислота; серная; азотная; ортофосфорная и т.п. кислоты; или органические кислоты, такие как, например, уксусная, пропионовая, гидроксиуксусная,молочная, пировиноградная, щавелевая, малоновая, янтарная (то есть, бутандиоевая кислота), малеиновая, фумаровая, оксиянтарная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, пара-аминосалициловая, памовая и т.п. кислоты. Соединения формулы (I), которые имеют кислые свойства, могут быть преобразованы в их фармацевтически приемлемые аддитивные соли с основанием путем обработки указанной кислотной формы подходящим органическим или неорганическим основанием. Подходящие формы соли с основанием включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например, соли лития,натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например, соли бензатина, Nметил-D-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Термин аддитивная соль с кислотой или основанием также включает гидраты и формы добавления растворителя, которые могут образовывать соединения формулы (I). Примерами таких форм являются,например, гидраты, алкоголяты и т.п. Термин "комплексные соединения металла" означает комплексное соединение, которое образуется между соединением формулы (I) и одной или более органических или неорганических солей металла или солей. Примеры указанных органических или неорганических солей включают галогениды, нитраты,сульфаты, фосфаты, ацетаты, трифторацетаты, трихлорацетаты, пропионаты, тартраты, сульфонаты, например метилсульфонаты, 4-метилфенилсульфонаты, салицилаты, бензоаты и т.п., металлы второй главной группы Периодической Системы, например, магния или кальция, третьей или четвертой главной группы, например, алюминия, олова, свинца, а также с первой по восьмую переходную группу периодической системы, таких как, например, хрома, марганца, железа, кобальта, никеля, меди, цинка и т.п. Термин "стереохимически изомерные формы соединений формулы (I)", как он используется выше,определяет все возможные соединения, составленные из тех же самых атомов, связанных той же самой последовательностью связей, но имеющие различные пространственные строения, которые не взаимозаменяемы, которыми могут обладать соединения формулы (I). Если иначе не упомянуто или обозначено,химическое обозначение соединения охватывает смеси всех возможных стереохимически изомерных форм, которыми могут обладать указанные соединения. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений формулы (I) как в чистой форме, так и в смеси друг с другом находятся в рамках настоящего изобретения.N-оксидные формы соединений формулы (I) включают соединения формулы (I), в которых один или несколько атомов азота окислены до так называемых N-оксидов, в частности, N-оксидов, в которых один или более атомов азота пиперидина, пиперазина или пиридазинила являются N-окисленными. Всякий раз, когда он используется в дальнейшем описании, термин "соединения формулы (I)" включает также N-оксидные формы, фармацевтически приемлемой кислотно-аддитивной или основноаддитивной соли. Первая группа представляющих интерес соединений состоит из соединений формулы (I), к которым применимо одно или более следующих ограничений:b) R1 обозначает водород, арил, гетероарил, C1-12-алкил или C1-12-алкил, замещенный одним или двумя заместителями, независимо выбранными из гидрокси, арила, гетероарила, амино, C1-6-алкилокси,моно- или ди(C1-6-алкил)амино, морфолинила, пиперидинила, пирролидинила, пиперазинила, C1-6 алкилпиперазинила,арил-С 1-6-алкилпиперазинила,гетероарил-C1-6-алкилпиперазинила,C3-7 циклоалкилпиперазинила и C3-7-циклоалкил-C1-6-алкилпиперазинила;e) R4 и R5 вместе могут в случае необходимости образовывать двухвалентный радикал, выбранный из метилендиокси или этилендиокси;f) R6 обозначает водород или C1-6-алкил;i) каждый R10 или R11 независимо выбран из водорода, гидрокси, амино, C1-6-алкила, нитро, полигалоген-C1-6-алкила, циано, циано-C1-6-алкила, тетразоло-C1-6-алкила, арила, гетероарила, арил-C1-6-алкила,гетероарил-C1-6-алкила, арил(гидрокси)C1-6-алкила, гетероарил(гидрокси)C1-6-алкила, арилкарбокила, гетероарилкарбонила, арил-C1-6-алкилкарбонила, гетероарил-C1-6-алкилкарбонила, C1-6-алкилокси, C1-6-алкилокси-C1-6 алкила, C1-6-алкилоксикарбонила, C1-6-алкилкарбонилокси, аминокарбонила, гидрокси-C1-6-алкила, амино-C1-6 алкила, гидроксикарбонила, гидроксикарбонил-C1-6-алкила и -(CH2)v-(C(=O)r)-(CH2)u-NR13R14;k) R13 и R14 вместе с атомом азота, с которым они связаны, могут в случае необходимости образовывать морфолинил, пиперидинил, пирролидинил, пиперазинил или пиперазинил, замещенный заместителем, выбранным из C1-6-алкила, арил-C1-6-алкила, гетероарил-C1-6-алкила, C3-7-циклоалкила и С 3-7 циклоалкил-C1-6-алкила;m) гетероарил представляет собой пиридинил, индолил, хинолинил, имидазолил, фуранил, тиенил,бензофуранил или тетрагидрофуранил; и каждый пиридинил, индолил, хинолинил, имидазолил, фуранил, тиенил, бензофуранил или тетрагидрофуранил может в случае необходимости быть замещен одним,двумя или тремя заместителями, независимо выбранными из галогена, гидрокси, C1-6-алкила, амино, полигалоген-C1-6-алкила и C1-6-алкилокси; иn) каждый пиридинил, индолил, хинолинил, имидазолил, фуранил, тиенил, бензофуранил или тетрагидрофуранил может в случае необходимости быть замещен двухвалентным радикалом, выбранным из метилендиокси или этилендиокси. Вторая группа представляющих интерес соединений состоит из соединений формулы (I), к которым применимо одно или более следующих ограничений:g) R3 обозначает водород или C1-6-алкил;j) каждый R10 или R11 независимо выбраны из водорода, гидрокси, амино, C1-6-алкила, нитро, полигалоген-C1-6-алкила, циано, арила, арил-C1-6-алкила, арил(гидрокси)C1-6-алкила, арилкарбонила, C1-6 алкилокси, C1-6-алкилокси-C1-6-алкила, C1-6-алкилоксикарбонила, аминокарбонила, гидрокси-C1-6-алкила,амино-C1-6-алкила, гидроксикарбонила и -(СН 2)v-(С(=O)r)-(СН 2)u-NR13R14;r) арил представляет собой фенил или фенил, замещенный галогеном; иs) гетероарил представляет собой пиридинил или индолил. Третья группа представляющих интерес соединений состоит из тех соединений формулы (I), к ко-6 012452 торым применимо одно или более следующих ограничений:h) R обозначает арил, гетероарил, C1-6-алкилоксикарбонил, C1-12-алкил или C1-12-алкил, замещенный одним или двумя заместителями, независимо выбранными из гидрокси, арила, гетероарила, амино, C1-6 алкилокси, моно- или ди(C1-6 алкил)амино, морфолинила, пиперидинила, пирролидинила, пиперазинила,C1-6-алкилпиперазинила,арил-C1-6-алкилпиперазинила,гетероарил-C1-6-алкилпиперазинила,C3-7 циклоалкилпиперазинила и С 3-7-циклоалкил-C1-6-алкилпиперазинила;l) R4 и R5 вместе могут в случае необходимости образовывать двухвалентный радикал, выбранный из метилендиокси или этилендиокси;n) R7 обозначает водород, арил-C1-6-алкил, гидрокси или гетероарил-С 1-6-алкил; и о) Z обозначает радикал, выбранный из (а-1), (а-3), (а-4), (а-5), (а-6), (а-7), (а-8) или (а-9). Четвертая группа представляющих интерес соединений состоит из тех соединений формулы (I), к которым применимо одно или более следующих ограничений:a) R8 обозначает водород, -С(=O)-NR17R18, арил-C1-6-алкилоксикарбонил, C1-6-алкил, замещенный гидрокси, пиперазинилкарбонил, замещенный гидрокси, гидрокси-C1-6-алкилом, гидрокси-C1-6 алкилокси-C1-6-алкилом, пирролидинил, замещенный гидрокси-C1-6-алкилом, или пиперидинилкарбонил,замещенный одним или двумя заместителями, выбранными из гидрокси, C1-6-алкила, гидрокси-C1-6 алкила, C1-6-алкилокси-C1-6-алкила, C1-6-алкил(дигидрокси)C1-6-алкила или C1-6 алкилокси(гидрокси)C1-6 алкила;m) R12 обозначает водород или C1-6-алкил;-7 012452 о) R13 и R14 вместе с атомом азота, с которым они связаны, могут в случае необходимости образовывать морфолинил, пирролидинил, пиперазинил или пиперазинил, замещенный заместителем, выбранным из C1-6-алкила или арил-C1-6-алкилоксикарбонила; р) k равно 2;r) R15 и R16 вместе с атомом азота, с которым они связаны, могут в случае необходимости образовывать морфолинил, пиперазинил или пиперазинил, замещенный C1-6-алкилоксикарбонилом;s) арил представляет собой фенил или фенил, замещенный галогеном;t) гетероарил представляет собой пиридинил, индолил, оксадиазолил или тетразолил; иu) каждый пиридинил, индолил, оксадиазолил или тетразолил может в случае необходимости быть замещен заместителями, выбранными из C1-6-алкила, арила или арил-C1-6-алкила. Пятая группа представляющих интерес соединений состоит из тех соединений формулы (I), к которым применимо одно или более следующих ограничений:k) R2 обозначает водород или C1-6-алкилокси;n) R6 обозначает водород; о) Z обозначает радикал, выбранный из (а-1), (а-2), (а-3) или (а-4); р) R10 или R11, каждый независимо, выбраны из водорода, гидрокси или гидрокси-C1-6-алкила. Группа предпочтительных соединений состоит из соединений формулы (I) или любой подгруппы этих соединений, в которыхR8 обозначает водород, -С(=O)-NR17R18, арил-C1-6-алкилоксикарбонил, C1-6-алкил, замещенный гидрокси, пиперазинилкарбонил, замещенный гидрокси, гидрокси-C1-6-алкил, гидрокси-C1-6-алкилокси-C1-6 алкил, пирролидинил, замещенный гидрокси-C1-6-алкилом, или пиперидинилкарбонил, замещенный одним или двумя заместителями, выбранными из гидрокси, C1-6-алкила, гидрокси-C1-6-алкила, C1-6 алкилокси-C1-6-алкила, C1-6-алкил(дигидрокси)C1-6-алкила или C1-6-алкилокси (гидрокси)C1-6-алкила;R12 обозначает водород или C1-6-алкил;R13 и R14 вместе с атомом азота, с которым они связаны, могут в случае необходимости образовывать морфолинил, пирролидинил, пиперазинил или пиперазинил, замещенный заместителем, выбранным из C1-6-алкила или арил-C1-6-алкилоксикарбонила;k равно 2; R15 и R16, каждый независимо, выбраны из водорода, C1-6-алкила или арил-C1-6 алкилоксикарбонила; R15 и R16 вместе с атомом азота, с которым они связаны, могут в случае необходимости образовывать морфолинил или пиперазинил, или пиперазинил, замещенный C1-6 алкилоксикарбонилом; арил представляет собой фенил или фенил, замещенный галогеном; гетероарил представляет собой пиридинил, индолил, оксадиазолил или тетразолил; и каждый пиридинил, индолил,оксадиазолил или тетразолил может в случае необходимости быть замещен одним заместителем, выбранным из C1-6-алкила, арила или арил-C1-6-алкила. Группа более предпочтительных соединений состоит из соединений формулы (I) или любой подгруппы этих соединений, в которых m равно 0; n равно 1; р равно 0; s равно 0; t равно 0;R2 обозначает водород или C1-6-алкилокси;R10 или R11, каждый независимо, выбраны из водорода, гидрокси или гидрокси-C1-6-алкила. Наиболее предпочтительными соединениями являются соединение 1, соединение 21, соединение 4, соединение 5, соединение 36, соединение 69, соединение 110, соединение 111,соединение 112, соединение 229 и соединение 37. 9-9 012452 Соединения формулы (I), их фармацевтически приемлемые соли и N-оксиды и их стереохимически изомерные формы могут быть получены обычным образом. Исходные материалы и некоторые из продуктов промежуточного соединения являются известными соединениями и коммерчески доступны или могут быть получены согласно обычным реакционным процедурам, общеизвестным в данной области. Многие такие способы получения будут описано в дальнейшем более подробно. Другие способы получения конечных соединений формулы (I) описаны в примерах. Соединения формулы (I) могут быть получены взаимодействием промежуточного соединения формулы (II) с промежуточным соединением формулы (III), в котором W обозначает подходящую удаляемую группу, такую как, например, галоген, например, фтор, хлор, бром или йод, или сульфонилоксирадикал, такой как метилсульфонилокси, 4-метилфенилсульфонилокси и т.п. Реакция может быть осуществлена в инертном растворителе, таком как, например, спирт, например метанол, этанол, 2 метоксиэтанол, пропанол, бутанол и т.п.; простой эфир, например, 4,4-диоксан, 1,1'-оксибиспропан и т.п.; кетон, например 4-метил-2-пентанон; или N,N-диметилформамид, нитробензол, ацетонитрил, уксусная кислота и т.п. Добавление подходящего основания, такого как, например, карбонат или гидрокарбонат щелочного или щелочно-земельного металла, например, триэтиламина или карбоната натрия, может использоваться для сбора кислоты, которая высвобождается в ходе реакции. Малое количество подходящего йодида металла, например, йодида натрия или калия, может быть добавлено для промотирования реакции. Перемешивание может увеличить скорость протекания реакции. Реакция может быть осуществлена при температуре между комнатной температурой и температурой кипения реакционной смеси и, если желательно, реакция может быть выполнена при повышенном давлении. Соединения формулы (I), в которых X обозначает СН 2, называемые здесь соединениями формулы(I-а), могут быть получены превращением соединений формулы (I), в которых X обозначает С(=O), называемых здесь соединениями формулы (I-b), путем введения в реакцию соединения формулы (I-b) с алюмогидридом лития в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы (I-а) могут также быть получены путем введения в реакцию подходящего карбоксальдегида формулы (IV) с промежуточным соединением формулы (V), в присутствии подходящего реактива, такого как боргидрид натрия, например тетрагидробората натрия или цианотригидробората на полимерном носителе, в подходящем растворителе, таком как спирт, например метанол. Идентичным способом соединения формулы (I), в которых t равно 1, называемые здесь соединениями формулы (I-c), могут быть получены взаимодействием промежуточного соединения формулы (II) с подходящим карбоксальдегидом формулы (VI) Соединения формулы (I), в которых s равно 1, называемые здесь соединениями формулы (I-d), могут быть получены взаимодействием промежуточного соединения формулы (VII) с гидридом литияалюминия в подходящем растворителе, таком как тетрагидрофуран Соединения формулы (I) и промежуточные продукты формулы (III) могут также быть преобразованы друг в друга через известные реакции или превращения функциональной группы. Многие такие превращения уже описаны выше. Другими примерами являются гидролиз эфиров карбоновой кислоты до соответствующей карбоновой кислоты или спирта; гидролиз амидов до соответствующих карбоновых кислот или аминов; гидролиз нитритов до соответствующих амидов; аминогруппы на имидазоле или фениле могут быть заменены водородом известными реакциями диазотирования и последующей заменой диазогруппы водородом; спирты могут быть преобразованы в сложные эфиры и простые эфиры; первичные амины могут быть преобразованы во вторичные или третичные амины; двойные связи могут быть гидрированы до соответствующей простой связи; йод на фенильной группе может быть преобразован в сложноэфирную группу введением монооксида углерода в присутствии подходящего палладиевого катализатора. Промежуточные соединения формулы (II), в которых X обозначает СН 2, m равно 0, s равно 0, и R3 обозначает водород, называемые здесь промежуточными соединениями формулы (II-а), могут быть получены реакцией восстановления нитроамин, исходя из промежуточного соединения формулы (VIII), в присутствии металлического катализатора, такого как никель Ренея, и подходящего восстановителя, такого как водород, в подходящем растворителе, таком как метанол или этанол. Промежуточные соединения формулы (II), в которых X обозначает С(=O), s равно 0, и R3 обозначает водород, называемые здесь промежуточными соединениями формулы (II-b), могут быть получены взаимодействием промежуточного соединения формулы (IX) с промежуточным соединением формулы(X) в присутствии подходящих реактивов, таких как N'-(этилкарбонимидоил)-N,N-диметил-1,3 пропандиамин, моногидрохлорид (EDC) и 1-гидрокси-1 Н-бензотриазол (НОВТ). Реакция может быть осуществлена в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как смесь дихлорметана и тетрагидрофурана. Промежуточные соединения формулы (IV) могут быть получены взаимодействием промежуточного соединения соединений формулы (XI) с алюмогидридом лития в подходящем растворителе, такой как тетрагидрофуран. Промежуточные соединения формулы (VII) могут быть получены взаимодействием промежуточного соединения формулы (XII) с промежуточным соединением формулы (XIII) в присутствии йодида 2 хлор-1-метилпиридиния и триэтиламина в подходящем растворителе, таком как ацетонитрил. Промежуточные соединения формулы (VIII) могут быть получены взаимодействием промежуточного соединения формулы (XIV) с промежуточным соединением формулы (XV), в котором А обозначает подходящую удаляемую группу, например, галоген, например фтор, хлор, бром или йод, или C1-6 алкилокси, например, метилокси, в диизопропилэтиламине. Промежуточные соединения формулы (XII) могут быть получены преобразованием промежуточного соединения формулы (XVI) в присутствии гидроксида натрия и воды, в подходящем растворителе,таком как этанол. Промежуточные соединения формулы (XVI) могут быть получены взаимодействием промежуточного соединения формулы (XVIII), в котором А имеет значение, определенное выше, с промежуточным соединением формулы (XIV), в подходящем растворителе, таком как диизопропилэтиламин. Соединения формулы (I) и некоторых продуктов из промежуточного соединения могут иметь по- 13012452 крайней мере один стереогенный центр в своей структуре. Такой стереогенный центр может присутствовать в R или S конфигурации. Соединения формулы (I), полученные вышеописанными способами, обычно представляют собой рацемические смеси энантиомеров, которые могут быть разделены известными способами разделения. Рацемические соединения формулы (I) могут быть преобразованы в формы соответствующей диастереомерной соли реакцией с подходящей хиральной кислотой. Указанные формы диастереомерной соли впоследствии отделяют, например, селективной или фракционной кристаллизацией, и энантиомеры высвобождают с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут также быть получены из соответствующих чистых стереохимически изомерных форм подходящих исходных материалов, при условии, что реакция происходит стереоспецифически. Предпочтительно, если желателен определенный стереоизомер, указанное соединение синтезируют стереоспецифическими способами получения. В этих способах предпочтительно используют энантиомерно чистые исходные материалы. Соединения формулы (I), их фармацевтически приемлемые кислотно-аддитивные соли и их стереоизомерные формы имеют ценные фармакологические свойства, заключающиеся в том, что они ингибируют взаимодействие между р 53 и MDM2. Термин "MDM2" означает белок, полученный в результате экспрессии гена mdm2. В пределах значения этого термина MDM2 охватывают все белки, кодируемые mdm2, их мутанты, продукты альтернативного сплайсинга этого белка и фосфорилированные белки. Дополнительно в рамках настоящего описания термин "MDM2" включает аналоги MDM2, например, MDMX, также известный как MDM4, и гомологи и аналоги MDM2 других животных, например, человеческий гомолог HDM2 или человеческий аналог HDMX. Термин "ингибирование взаимодействия" или "ингибитор взаимодействия" означает предотвращение или уменьшение прямой или косвенной ассоциации одной или более молекул, пептидов, белков,ферментов или рецепторов; или предотвращение или ослабление нормальной активности одной или более молекул, пептидов, белков, ферментов или рецепторов. Термин "ингибитор взаимодействия р 53 с MDM2" или "p53-MDM2 ингибитор" используется здесь для описания средства, которое увеличивает экспрессию р 53 в тесте, описанном в С.1. Это увеличение может быть вызвано, но не ограничено ими, одним или более из следующих механизмов действия: ингибирование взаимодействия между р 53 и MDM2,прямая ассоциация с белком MDM2 или р 53,взаимодействия с мишенями выше или ниже, например, киназами, или ферментативными активностями, участвующими в убиквитинировании или модификации SUMO,захват или транспортировка MDM2 и р 53 в различные клеточные компартменты,модуляция белков, связывающихся с MDM2, например, (но не ограничиваясь им), р 73, E2F-1, Rb,p21waf1 или cip1,даунрегуляция или интерференция с экспрессией MDM2 и/или активностью MDM2, например (но не ограничиваясь этим), влияющая на его клеточную локализацию, посттрансляционная модификация,ядерный экспорт или убиквитин-лигазная активность,прямая или косвенная стабилизация белка р 53, например, путем сохранения его в его функциональной структурной форме, или предотвращения неправильного скручивания,усиление экспрессии р 53 или экспрессии членов семейства р 53, например р 63 и р 73,увеличение активности р 53, например (но не ограничиваясь этим) путем усиления его транскрипционной активности и/или усиление экспрессии генов и белков р 53-сигнального пути, например (но не ограничиваясь ими)p21waf1 cip1, MIC-1 (GDF-15), PIG-3 и ATF-3. Следовательно, настоящее изобретение относится к соединениям формулы (I) для использования в качестве лекарственного средства. Кроме того, изобретение также относится к применению соединения для получения лекарственного средства для лечения нарушения, опосредуемого взаимодействием p53-MDM2, причем указанное соединение представляет собой соединение формулы (I). Термин "лечение" в рамках настоящего описания относится к любому лечению заболевания и/или состояния у животного, особенно человека, и включает: (i) профилактику заболевания и/или состояния у пациента, который может быть предрасположен к этому заболеванию и/или состоянию, но у которого оно еще не было диагностировано; (ii) подавление заболевания и/или состояния, то есть, остановку его развития; (iii) устранение заболевания и/или состояния, то есть, регрессию заболевания и/или состояния. Под термином "нарушение, опосредуемое взаимодействием р 53-MDM2" имеется в виду любое нежелательное или вредное состояние, которое приводит или к ингибированию взаимодействия между белком MDM2 и р 53 или другими клеточными белками, которые вызывают апоптоз, клеточную смерть или регулируют клеточный цикл. Это изобретение также относится к способу лечения нарушения, опосредуемого взаимодействиемp53-MDM2, путем введения эффективного количества соединения согласно настоящему изобретению,пациенту, например млекопитающему (и более конкретно, человеку). Соединения по изобретению могут иметь антипролиферативные эффекты в опухолевых клетках,даже если такие клетки лишены функционального р 53. В частности, соединения по изобретению могут иметь антипролиферативные эффекты в опухолях с диким типом р 53 и/или в опухолях, суперэкспрессирующих MDM2. Таким образом, это изобретение также относится к способу замедления роста опухоли путем введения эффективного количества соединения согласно настоящему изобретению, пациенту, например млекопитающему (и более конкретно, человеку). Примерами опухолей, которые могут ингибироваться, но не ограничиваясь ими, являются рак легкого (например, аденокарцинома и включая немелкоклеточный рак легкого), рак поджелудочной железы(например, карцинома поджелудочной железы, такая как, например, экзокринный рак поджелудочной железы), рак толстой кишки (например, колоректальные раки, такие как, например, аденокарцинома толстой кишки и аденома толстой кишки), рак глотки, сквамозный рак полости рта, рак языка, рак желудка,рак носоглотки, гематопоэтические опухоли лимфоидного происхождения (например, острый лимфоцитарный лейкоз, лимфома В-клеток, лимфома Беркитта), лейкозы спинного мозга (например, острый миелогенный лейкоз (AML, фолликулярный рак щитовидной железы, миелодиспластический синдром(MDS), опухоли мезенхимального происхождения (например, фибросаркомы и рабдомиосаркомы), меланомы, тератокарциномы, нейробластомы, опухоли головного мозга, глиомы, доброкачественная опухоль кожи (например, кератоакантомы), рак молочной железы (например, запущенный рак молочной железы), рак почек, рак яичника, рак шейки матки, рак эндометрия, рак мочевого пузыря, рак предстательной железы, включая запущенное заболевание, рак яичек, остеосаркома, рак головы и шеи, и эпидермальная карцинома. Соединения согласно настоящему изобретению могут также использоваться для лечения и профилактики воспалительных состояний. Таким образом, это изобретение также относится к способу для лечения и профилактики воспалительных состояний путем введения эффективного количества соединения согласно настоящему изобретению пациенту, например, млекопитающему (и более конкретно, человеку). Соединения согласно настоящему изобретению могут также использоваться для лечения аутоиммунных заболеваний и состояний. Под термином "аутоиммунные заболевания" имеется в виду любое заболевание, в котором иммунная система животного патологически реагирует на аутоантиген. Под термином "аутоантиген" имеется в виду любой антиген, который обычно находится в организме животного. Примеры аутоиммунных заболеваний включают, но не ограничены ими: тиреоидит Хашимото, болезнь Грэйва, рассеянный склероз, пернициозную анемию, Аддисонову болезнь, инсулинозависимый сахарный диабет, ревматоидный артрит, системную красную волчанку (SLE или волчанка), дерматомиозит, Болезнь Крона, гранулематоз Вегенера, антигломерулярное заболевание базальной мембраны, антифосфолипидный синдром, герпетиформный дерматит, аллергический энцефаломиелит, гломерулонефрит, мембранный гломерулонефрит, синдром Гудпасчера, Ламберт-Итон, миастенический синдром, миастения Гравис, буллезный пемфигоид, полиэндокринопатии, болезнь Рейтера и синдром Стиффмана. Таким образом, это изобретение также относится к способу лечения аутоиммунных заболеваний и состояний и лечения заболеваний, связанных с конформационно нестабильными или неправильно скрученными белками, путем введения эффективного количества соединения согласно настоящему изобретению, пациенту, например, млекопитающему (и более конкретно, человеку). Соединения согласно настоящему изобретению могут также быть полезными для лечения заболеваний, связанных с конформационно нестабильными или неправильно скрученными белками. Примеры заболеваний, связанных с конформационно нестабильными или неправильно скрученными белками включают, но не ограничены ими: муковисцидоз (CFTR), синдром Марфана (фибриллин), боковой амиотрофический склероз (супероксиддисмутаза), цинга (коллаген), болезнь мочи с запахом кленового сиропа (альфа-кетокислота-дегидрогеназный комплекс), несовершенный остеогенез (тип 1 проколлаген проальфа), болезнь Кройцфельда-Якоба (прион), Болезнь Альцгеймера (бета-амилоид), семейный амилоидоз(лизоцим), катаракты (кристаллины), семейную гиперхолестеринемию (рецептор ЛПНП), I - антитрипсиновая недостаточность, болезнь Тей-Закса (бета-гексозаминидаза), ретинит пигментоза (родопсин), и лепречаунизм (инсулиновый рецептор). Таким образом, это изобретение также относится к способу лечения заболеваний, связанных с конформационно нестабильными или неправильно скрученными белками, путем введения эффективного количества соединения согласно настоящему изобретению, пациенту, например, млекопитающему (и более конкретно, человеку). Ввиду их полезных фармакологических свойств, соединения по изобретению могут быть составлены в различные фармацевтические формы для введения. Для получения фармацевтических композиций по изобретению, эффективное количество определенного соединения, в форме кислотно-аддитивной или основно-аддитивной соли, в качестве активного ингредиента комбинируют в тесной смеси с фармацевтически приемлемым носителем, который может- 15012452 иметь разнообразные формы в зависимости от желательной для введения формы препарата. Эти фармацевтические композиции находятся по желанию в подходящей лекарственной форме, предпочтительно,для введения перорально, ректально, чрескожно или парентеральной инъекцией. Например, для получения композиций в пероральной лекарственной форме может использоваться любая обычная фармацевтическая среда, такая как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахар, каолин, лубриканты, связующие агенты, дезинтеграторы и т.п., в случае порошков, пилюль,капсул и таблеток. В силу их легкости введения, таблетки и капсулы представляют собой наиболее предпочтительную пероральную лекарственную форму, в которой, очевидно, используются твердые фармацевтические носители. Для парентеральных композиций носитель будет обычно включать стерилизованную воду, по крайней мере в значительной степени, хотя могут быть включены другие ингредиенты, например, для повышения растворимости. Например, могут быть получены инъецируемые растворы, в которых носитель включает физиологический раствор, раствор глюкозы или смесь раствора глюкозы и физиологического раствора. Могут также быть получены инъецируемые суспензии, в которых могут использоваться подходящие жидкие носители, суспендирующие агенты и т.п. В композициях, подходящих для чрескожного введения, носитель в случае необходимости включает средство, усиливающее проникновение и/или подходящее смачивающее вещество, в случае необходимости объединенное с подходящими добавками любой природы в незначительных количествах, причем эти добавки не оказывают существенного вредного эффекта на кожу. Указанные добавки могут облегчить нанесение на кожу и/или могут быть полезными для получения желаемых композиций. Эти композиции могут вводиться различными способами,например, как трансдермальный пластырь, как spot-on, как мазь. Особенно предпочтительно составлять указанные фармацевтические композиции в разовые лекарственные формы для простоты введения и однородности дозировки. Разовая лекарственная форма в рамках описания и формулы изобретения относится к физически отдельным единицам, подходящим в качестве разовых доз, причем каждая единица содержит предопределенное количество активного ингредиента, вычисленное так, чтобы произвести желаемый терапевтический эффект, в комбинации с необходимым фармацевтическим носителем. Примерами таких разовых лекарственных форм являются таблетки (включая надпиленные или таблетки, покрытые оболочкой), капсулы, пилюли, пакетики с порошком, пластинки, инъецируемые растворы или суспензии, чайные ложки, столовые ложки и т.п., и упаковки множества этих форм. Особенно предпочтительно составлять указанные фармацевтические композиции в разовые лекарственные форме для простоты введения и однородности дозировки. Разовая лекарственная форма в рамках описания и формулы изобретения относится к физически отдельным единицам, подходящим в качестве разовых доз, причем каждая единица содержит предопределенное количество активного ингредиента, вычисленное так, чтобы произвести желаемый терапевтический эффект, в комбинации с необходимым фармацевтическим носителем. Примерами таких разовых лекарственных форм являются таблетки(включая надпиленные или таблетки, покрытые оболочкой), капсулы, пилюли, пакетики с порошком,пластинки, инъецируемые растворы или суспензии, чайные ложки, столовые ложки и т.п., и упаковки множества этих форм. Соединение по изобретению применяется в количестве, достаточном, чтобы ингибировать взаимодействие между MDM2 и р 53 или другими клеточными белками, которые вызывают апоптоз, вызывают гибель клетки или регулируют клеточный цикл. Онкогенный потенциал MDM2 определяется не только его способностью к подавлению р 53, но также и его способностью регулировать другие белки-супрессоры опухоли, например, белок ретинобластомы pRb и близко связанный фактор транскрипции E2F1. Таким образом, соединение по изобретению применяется в количестве, достаточном для модулирования взаимодействия между MDM2 и факторами транскрипции E2F. Специалист может легко определить эффективное количество на основании результатов тестов,представленных далее. В целом считается, что терапевтически эффективное количество составляет от 0,005 до 100 мг/кг массы тела, и в особенности от 0,005 до 10 мг/кг массы тела. Может быть необходимость во введении необходимой дозы в виде единственной, двух, трех, четырех или более субдоз через подходящие интервалы в течение дня. Указанные субдозы могут быть составлены как разовые лекарственные формы, например, содержащие от 0,5 до 500 мг, и, в частности, от 10 до 500 мг активного ингредиента на разовую лекарственную форму. Другой аспект настоящего изобретения относится к комбинации ингибитора p53-MDM2 с другим противораковым средством для использования в качестве лекарственного средства, в частности, для лечения рака или связанных с ним заболеваний. Для лечения указанных состояний соединения по изобретению могут быть предпочтительно использованы в комбинации с одним или более другими лекарственными средствами, более конкретно, с другими противораковыми средствами. Примерами противораковых средств являются платиновые координационные соединения, например цисплатин, карбоплатин или оксалиплатин; таксановые соединения, например паклитаксел или доцетаксел;- 16012452 ингибиторы топоизомеразы I, такие как камптотециновые соединения, например иринотекан или топотекан; ингибиторы топоизомеразы, такие как противоопухолевые подофиллотоксиновые производные, например этопозид или тенилозид; противоопухолевые алкалоиды барвинка, например винбластин, винкристин или винорелбин; противоопухолевые производные нуклеозидов, например 5-фтороурацил, гемцитабин или капецитабин; алкилирующие агенты, такие как азотная горчица или нитрозомочевина, например циклофосфамид,хлорамбуцил, кармустин или ломустин; противоопухолевые производные антрациклина, например даунорубицин, доксорубицин, идарубицин или митоксантрон; антитела HER2, например трастузумаб; антагонисты рецептора эстрогена или селективные модуляторы рецептора эстрогена, например тамоксифен, торемифен, дролоксифен, фаслодекс или ралоксифен; ингибиторы ароматазы, такие как эксеместан, анастрозол, летразол и ворозол; дифференцирующие агенты, такие как ретиноиды, витамин D и блокирующие агенты метаболизма ретиноевой кислоты (RAMBA), например аккутан; ингибиторы ДНК метилтрансферазы, например азацитидин; ингибиторы киназы, например флавоперидол, иматиниб мезилат или гефитиниб; ингибиторы фарнезилтрансферазы; ингибиторы HDAC; другие ингибиторы пути убиквитин-протеасома, например Velcade или Yondelis. Термин "платиновое координационное соединение" обозначает любое платиновое координационное соединение, ингибирующее рост опухолевых клеток, которое содержит платину в форме иона. Термин "таксановые соединения" указывает класс соединений, имеющих таксановую кольцевую систему и относящихся к или полученных из экстрактов определенных разновидностей деревьев тиса(Taxus). Термин "ингибиторы топоизомеразы" указывает ферменты, которые способны изменять топологию ДНК в эукариотических клетках. Они являются критическими для важных клеточных функций и пролиферации клеток. Существуют два класса топоизомераз в эукариотических клетках, а именно, тип I и типII. Топоизомераза I представляет собой мономерный фермент с молекулярной массой приблизительно 100000. Фермент связывается с ДНК и вводит переходный одноцепочечный разрыв, разматывает двойную спираль (или позволяет ей разматываться), и затем вновь запечатывает разрыв перед тем как диссоциироваться от цепи ДНК. Топизомераза II имеет подобный механизм действия, который включает индукцию разрыва цепи ДНК или формирование свободных радикалов. Термин "камптотециновые соединения" указывает соединения, которые относятся к или получены из материнского соединения камптотецина, которое является нерастворимым в воде алкалоидом, полученным из китайского дерева Camptothecin acuminata и индийского дерева Nothapodytes foetida. Термин "подофиллотоксиновые соединения" указывает соединения, которые относятся к или получены из материнского подофиллотоксина, который экстрагируют из растения корневища мандрагоры. Термин "противоопухолевые алкалоиды барвинка" указывает соединения, которые относятся к или получены из экстрактов растения барвинка (Vinca rosea). Термин "алкилирующие агенты" охватывает разнообразную группу химических соединений, общей особенностью которых является то, что они способны вводить, в физиологических условиях, алкильные группы в биологически витальные макромолекулы, такие как ДНК. В случае большинства наиболее важных агентов, таких как азотные горчицы и нитрозомочевины, активные алкилирующие группы генерируются in vivo в результате реакций деградации комплекса, некоторые из которых являются ферментативными. Самые важные фармакологические действия алкилирующих агентов - те, которые нарушают фундаментальные механизмы, относящиеся к пролиферации клеток, в частности, синтез ДНК и деление клетки. Способность алкилирующих агентов нарушать функционирование ДНК и целостность быстро пролиферирующих тканей обеспечивает основание для их терапевтического применения и для многих из их токсических свойств. Термин "противоопухолевые производные антрациклина" включает антибиотики, полученные отStrep, peuticus var. caesius, и их производные, характеризующиеся наличием кольцевых структур тетрациклина с необычным сахаром, даунозамином, присоединенным с помощью гликозидной связи. Показано, что амплификация человеческого белка рецептора 2 эпидермального фактора роста(HER2) в первичном раке молочной железы коррелирует с неблагоприятным клиническим прогнозом для некоторых пациентов. Трастузумаб представляет собой высокоочищенное рекомбинантное ДНКпроизводное гуманизированное моноклональное антитело каппа IgG1, которое связывается с высоким сродством и специфичностью с внеклеточным доменом рецептора HER2. Многие разновидности рака молочной железы имеют рецепторы эстрогена, и рост этих опухолей может стимулироваться эстрогеном. Термины "антагонисты рецептора эстрогена" и "селективные моду- 17012452 ляторы рецептора эстрогена" используются для указания конкурентных ингибиторов эстрадиола, связывающихся с рецептором эстрогена (ER). Селективные модуляторы рецептора эстрогена, будучи связаны с ER, вызывают изменение в трехмерной форме рецептора, модулируя его связывание с эстрогенчувствительным элементом (ERE) на ДНК. У женщин в период после менопаузы основным источником циркулирующего эстрогена является превращение надпочечных и овариальных андрогенов (андростендиона и тестостерона) в эстрогены (эстрон и эстрадиол) с помощью фермента ароматазы в периферических тканях. Депривация эстрогена через ингибирование или инактивацию ароматазы представляет собой эффективное и селективное лечение для некоторых пациентов в период после менопаузы с гормонозависимым раком молочной железы. Термин "антиэстрогенное средство" в рамках изобретения включает не только антагонисты рецептора эстрогена и селективные модуляторы рецептора эстрогена, но также и ингибиторы ароматазы, как обсуждено выше. Термин "дифференцирующие агенты" охватывает соединения, которые, различными способами,могут замедлять пролиферацию клеток и вызывать дифференцировку. Известно, что витамин D и ретиноиды играют главную роль в регуляции роста и дифференцировки широкой разновидности нормальных и злокачественных типов клеток. Агенты, блокирующие метаболизм ретиноевой кислоты (RAMBA), увеличивают уровни эндогенных ретиноевых кислот, ингибируя цитохром Р 450-опосредованный катаболизм ретиноевых кислот. Изменения метилирования ДНК числятся среди самых общих проявлений патологического функционирования в неоплазии у человека. Гиперметилирование в промоторах определенных генов обычно связывается с инактивацией включаемых генов. Термин "ингибиторы ДНК-метилтрансферазы" используется для указания соединений, которые действуют через фармакологическое ингибирозание ДНКметилтрансферазы и реактивацию экспрессии гена-супрессора опухоли. Термин "ингибиторы киназы" включает мощные ингибиторы киназ, которые участвуют в развитии клеточного цикла и запрограммированной гибели клеток (апоптоз). Термин "ингибиторы фарнезилтрансферазы" указывает соединения, которые были разработаны,чтобы предотвратить фарнезилирование Ras и других внутриклеточных белков. Показано, что они имеют эффект на пролиферацию и выживание злокачественных клеток. Термин "ингибитор гистондеацетилазы" идентифицирует соединение, которое является способным к взаимодействию с гистон-деацетилазой и ингибированию ее активности, точнее, ее ферментативной активности. Ингибирование ферментативной активности гистондеацетилазы означает уменьшение способности гистондеацетилазы удалять ацетильную группу из гистона. Термин "другие ингибиторы пути убиквитина-протеасомы" используется в отношении соединений,которые ингибируют нацеленное разрушение клеточных белков в протеасоме, включая белки, регулирующие клеточный цикл. Как указано выше, соединения согласно настоящему изобретению также имеют терапевтические применения в сенсибилизации опухолевых клеток для химиотерапии и лучевой терапии. Следовательно, соединения согласно настоящему изобретению могут использоваться как "радиосенсибилизаторы" и/или "химиосенсибилизаторы" или могут использоваться в комбинации с другим "радиосенсибилизатором" и/или "химиосенсибилизатором". Термин "радиосенсибилизатор" в рамках изобретения определен, как молекула, предпочтительно низкомолекулярная молекула, вводимая животным в терапевтически эффективном количестве, чтобы увеличить чувствительность клеток к ионизирующей радиации и/или промотировать лечение заболеваний, которые поддаются лечению с ионизирующей радиацией. Термин "химиосенсибилизатор" в рамках изобретения определен как молекула, предпочтительно низкомолекулярная молекула, вводимая животным в терапевтически эффективном количестве, чтобы увеличить чувствительность клеток к химиотерапии и/или промотировать лечение заболеваний, которые поддаются лечению химиотерапевтическими средствами. Несколько механизмов действия радиосенсибилизаторов было предложено в литературе, включая радиосенсибилизаторы гипоксической клетки (например, соединения 2-нитроимидазола и соединения бензотриазиндиоксида), кислород-имитирующие или альтернативно ведущие себя как биовосстановительные средства в состоянии гипоксии; радиосенсибилизаторы негипоксической клетки (например, галоидированные пиримидины) могут быть аналогичны основаниям ДНК и предпочтительно могут встраиваться в ДНК раковых клеток и, таким образом, промотировать вызываемое облучением разрушение молекул ДНК и/или препятствовать нормальным механизмам репарации ДНК; и были гипотетически предположены различные другие потенциальные механизмы действия для радиосенсибилизаторов в лечении заболевания. Много протоколов лечения рака в настоящее время используют радиосенсибилизаторы в комбинации с облучением рентгеновскими лучами. Примеры рентген-активируемых радиосенсибилизаторов включают, но не ограничены ими, следующее: метронидазол, мизонидазол, десметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин С, RSU 1069, SR 4233, ЕO9, RB 6145, никотинамид, 5 бромдезоксиуридин (BUdR), 5-йоддезоксиуридин (IUdR), бромдезоксицитидин, фтордезоксиуридин(FudR), гидроксимочевина, цисплатин и их терапевтически эффективные аналоги и производные. Фотодинамическая терапия (PDT) рака использует видимый свет как лучевой активатор сенсибилизатора. Примеры фотодинамических радиосенсибилизаторов включают следующее, но не ограничены этим: производные гематопорфирина, фотофрин, производные бензопорфирина, этиопорфирин олова,феоборбид-а, бактериохлорофилл-а, нафталоцианины, фталоцианины, цинковый фталоцианин и их терапевтически эффективные аналоги и производные. Радиосенсибилизаторы могут применяться в сочетании с терапевтически эффективным количеством одного или более других соединений, включая, но не ограничиваясь ими: соединения, которые промотируют включение радиосенсибилизаторов в клетки-мишени; соединения, которые контролируют подачу терапевтических средств, питательных веществ и/или кислорода к клеткам-мишеням; химиотерапевтические средства, которые действуют на опухоли с использованием или без дополнительного облучения; или другие терапевтически эффективные соединения для лечения рака или другого заболевания. Химиосенсибилизаторы могут применяться в сочетании с терапевтически эффективным количеством одного или более других соединений, включая, но не ограничиваясь ими: соединения, которые промотируют включение химиосенсибилизаторов в клетки-мишени; соединения, которые контролируют подачу терапевтических средств, питательных веществ и/или кислорода к клеткам-мишеням; химиотерапевтические средства, который действуют на опухоли, или другие терапевтически эффективные соединения для лечения рака или другого заболевания. Ввиду их полезных фармакологических свойств, компоненты комбинаций согласно изобретению,то есть другое лекарственное средство и ингибитор p53-MDM, могут быть составлены в различные фармацевтические формы для введения. Эти компоненты могут быть составлены отдельно в индивидуальных фармацевтических композициях или в единой фармацевтической композиции, содержащей оба компонента. Настоящее изобретение поэтому также относится к фармацевтической композиции, включающей другое лекарственное средство и ингибитор p53-MDM вместе с одним или более фармацевтическими носителями. Настоящее изобретение далее относится к применению комбинации согласно изобретению в производстве фармацевтической композиции для ингибирования роста опухолевых клеток. Настоящее изобретение далее относится к продукту, содержащему в качестве первого активного ингредиента ингибитор p53-MDM2 согласно изобретению, а в качестве второго активного ингредиента противораковое средство, в форме комбинированного препарата для одновременного, раздельного или последовательного использования при лечении пациентов, страдающих раком. Другое лекарственное средство и ингибитор p53-MDM2 могут вводиться одновременно (например,в отдельных или единых композициях) или последовательно в любом порядке. В последнем случае, два соединения вводят в пределах периода и в количестве и способом, которые являются достаточными, чтобы гарантировать достижение выгодного или синергического эффекта. Следует понимать, что предпочтительный способ и порядок введения, и соответствующие количества дозировки и режимы для каждого компонента комбинации будут зависеть от конкретного другого лекарственного средства и вводимого ингибитора p53-MDM2, их пути введения, конкретной излечиваемой опухоли и конкретного пациента. Оптимальный способ и порядок введения, и количества дозировки и режим могут быть легко определены специалистом с использованием обычных способов и ввиду информации, изложенной здесь. Координационное соединение платины предпочтительно вводят в дозе от 1 до 500 мг на квадратный метр (мг/м 2) площади поверхности тела, например, от 50 до 400 мг/м 2, в частности, в случае цисплатина - в дозировке приблизительно 75 мг/м 2, и в случае карбоплатина - приблизительно 300 мг/м 2 за курс лечения. Соединение таксана предпочтительно вводят в дозировке от 50 до 400 мг на квадратный метр(мг/м 2) площади поверхности тела, например, от 75 до 250 мг/м 2, в частности, в случае паклитаксела - в дозировке приблизительно от 175 до 250 мг/м 2, и в случае доцетаксела - приблизительно от 75 до 150 мг/м 2 за курс лечения. Соединение камптотецина предпочтительно вводят в дозировке от 0,1 до 400 мг на квадратный метр (мг/м 2) площади поверхности тела, например, от 1 до 300 мг/м 2, в частности, в случае иринотекана в дозировке приблизительно от 100 до 350 мг/м 2, и в случае топотекана - приблизительно 1-2 мг/м 2 за курс лечения. Противоопухолевые производные подофиллотоксина предпочтительно вводят в дозировке от 30 до 300 мг на квадратный метр (мг/м 2) площади поверхности тела, например, от 50 до 250 мг/м 2, в частности,в случае этопозида - в дозировке приблизительно от 35 до 100 мг/м 2, и в случае тенипозида приблизительно от 50 до 250 мг/м 2 за курс лечения. Противоопухолевый алкалоид барвинка предпочтительно вводят в дозировке от 2 до 30 мг на квадратный метр (мг/м 2) площади поверхности тела, в частности, в случае винбластина - в дозировке приблизительно от 3 до 12 мг/м 2, для винкристина - в дозировке приблизительно 1-2 мг/м 2, и для винорелбина в дозировке приблизительно от 10 до 30 мг/м 2 за курс лечения. Противоопухолевое производное нуклеозида предпочтительно вводят в дозировке от 200 до 2500- 19012452 мг на квадратный метр (мг/м 2) площади поверхности тела, например, от 700 до 1500 мг/м 2, в частности, в случае 5-FU - в дозировке от 200 до 500 мг/м 2, для гемцитабина - в дозировке приблизительно от 800 до 1200 мг/м 2, и для капецитабина - приблизительно от 1000 до 2500 мг/м 2 за курс лечения. Алкилирующие агенты, такие как азотная горчица или нитрозомочевина, предпочтительно вводят в дозировке от 100 до 500 мг на квадратный метр (мг/м 2) площади поверхности тела, например, от 120 до 200 мг/м 2, в частности, в случае циклофосфамида - в дозировке приблизительно от 100 до 500 мг/м 2, в случае хлорамбуцила - в дозировке приблизительно от 0,1 до 0,2 мг/м 2, в случае кармустина - в дозировке приблизительно от 150 до 200 мг/м 2, и в случае ломустина в дозировке приблизительно от 100 до 150 мг/м 2 за курс лечения. Противоопухолевое производное антрациклина предпочтительно вводят в дозировке от 10 до 75 мг на квадратный метр (мг/м 2) площади поверхности тела, например, от 15 до 60 мг/м 2, в частности, в случае доксорубицина - в дозировке приблизительно от 40 до 75 мг/м 2, в случае даунорубицина - в дозировке приблизительно от 25 до 45 мг/м 2, и в случае идарубицинав дозировке приблизительно от 10 до 15 мг/м 2 за курс лечения. Трастузумаб предпочтительно вводят в дозировке от 1 до 5 мг в квадратный метр (мг/м 2) площади поверхности тела, особенно от 2 до 4 мг/м 2 за курс лечения. Антиэстрогенное средство предпочтительно вводят в дозировке приблизительно от 1 к 100 мг ежедневно в зависимости от конкретного средства и излечиваемого состояния. Тамоксифен предпочтительно вводят перорально в дозировке от 5 до 50 мг, предпочтительно от 10 до 20 мг два раза в день, продолжая терапию в течение времени, достаточного для достижения и поддержания терапевтического эффекта. Торемифен предпочтительно вводят перорально в дозировке приблизительно 60 мг один раз в день,продолжая терапию в течение времени, достаточного для достижения и поддержания терапевтического эффекта. Анастрозол предпочтительно вводят перорально в дозировке приблизительно 1 мг один раз в день. Дролоксифен предпочтительно вводят перорально в дозировке приблизительно 20-100 мг один раз в день. Ралоксифен предпочтительно вводят перорально в дозировке приблизительно 60 мг один раз в день. Эксеместан предпочтительно вводят перорально в дозировке приблизительно 25 мг один раз в день. Эти дозировки могут вводиться, например, один, два или более раз в течение курса лечения, причем введение может быть повторено, например, каждые 7, 14, 21 или 28 дней. Соединения формулы (I), их аддитивные соли с фармацевтически приемлемой кислотой и их стереоизомерные формы могут иметь ценные диагностические свойства в том отношении, что они могут использоваться для детекции или идентификации взаимодействия p53-MDM2 в биологической пробе,включая детекцию или измерение формирования комплекса между меченым соединением и/или р 53,и/или MDM2, и или другими молекулами, пептидами, белками, ферментами или рецепторами. В способах детекции или идентификации могут использоваться соединения, которые мечены агентами мечения, такими как радиоизотопы, ферменты, флуоресцентные вещества, люминесцентные вещества и т.д. Примеры радиоизотопов включают 125I, 131I, 3 Н и 14 С. Ферменты обычно становятся поддающимися детекции за счет конъюгации с подходящим субстратом, который, в свою очередь, катализирует детектируемую реакцию. Примеры этого включают, например, бета-галактозидазу, бета-глюкозидазу,щелочную фосфатазу, пероксидазу и малат-дегидрогеназу, предпочтительно пероксидазу хрена. Люминесцентные вещества включают, например, люминол, производные люминола, люциферин, экворин и люциферазу. Биологические пробы могут быть определены как ткань или жидкость организма. Примеры жидкостей организма, цереброспинальная жидкость, кровь, плазма, сыворотка, моча, мокрота, слюна и т.п. Следующие примеры иллюстрируют настоящее изобретение. Экспериментальная часть В дальнейшем, "DMF" определяют как N,N-диметилформамид, "DCM" определяют как дихлорметан, "DIPE" определяют как простой диизопропиловый эфир, "EtOAc" определяют как этилацетат,"EtOH" определяют как этанол, "EDC" определяют как N'-(этилкарбонимидоил)-N,N-этан-1,3 пропандиамин, моногидрохлорид, "МеОН" определяют как метанол, "ТГФ" определяют как тетрагидрофуран, "НОВТ" определяют как 1-гидроксибензотриазол.A. Получение промежуточных соединений Пример А 1. а) Получение промежуточного соединения 1 Смесь 1-фтор-4-нитробензола (0,0142 моль), 1 Н-индол-3-этанамина (0,0129 моль) и N-этил-N-(1 метилэтил)-2-пропанамина (0,032 моль) перемешивали при 210 С в течение 18 ч, затем доводили до комнатной температуры и декантировали. Остаток забирали смесью ацетонитрил/вода. Осадок фильтро- 20012452 вали, промывали простым диэтиловым эфиром и высушивали, получая 2,3 г (64%) промежуточного соединения 1.b) Получение промежуточного соединения 2 Смесь промежуточного соединения 1 (0,0078 моль) и никеля Ренея (2,2 г) в EtOH (50 мл) гидрировали при комнатной температуре в течение 3 ч под давлением 3 бара, затем фильтровали через целит. Целит промывали DCM/MeOH. Фильтрат упаривали. Остаток забирали DCM, высушивали (MgSO4),фильтровали и растворитель выпаривали, получая 1,88 г (95%) промежуточного соединения 2. Пример А 2. а) Получение промежуточного соединения 3 Смесь 2-этокси-1-метокси-4-нитробензола (0,009 моль), 1 Н-индол-3-этанамина (0,009 моль) и Nэтил-N-(1-метилэтил)-2-пропанамина (0,0228 моль) перемешивали при 210 С в течение 24 ч, затем доводили до комнатной температуры, забирали смесью DCM/MeOH и высушивали. Остаток забирали в DCM(небольшое количество) и очищали колоночной хроматографией на силикагеле (35-70 мкм) (элюент: циклогексан/DCM 30/70). Чистые фракции собирали и растворитель выпаривали, получая 0,6 г (20%) промежуточного соединения 3.b) Получение промежуточного соединения 4 Смесь промежуточного соединения 3 (0,002 моль) и H2/Никель Ренея (0,6 г) в МеОН (100 мл) гидрировали при комнатной температуре в течение 1 ч и 30 мин под давлением 3 бара, затем фильтровали через целит. Целит промывали DCM/MeOH. Фильтрат упаривали. Остаток забирали в DCM/MeOH (небольшое количество), высушивали(MgSO4), фильтровали и растворитель выпаривали, получая 0,45 г (83%) промежуточного соединения 4. Пример A3. а) Получение промежуточного соединения 5(0,0038 моль) и карбоната калия (0,076 моль) в ксилоле (60 мл) перемешивали и нагревали с обратным холодильником в течение 18 ч, затем доводили до комнатной температуры. Добавляли воду. Смесь фильтровали через целит. Целит промывали DCM. Фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (35-70 мкм) (элюент: DCM/MeOH/NH4OH 97/3/0,1). Чистые фракции собирали и растворитель выпаривали, получая 6,4 г (65%) промежуточного соединения 5.b) Получение промежуточного соединения 6 Гидроксид натрия (концентрированный) (10 мл) добавляли к смеси промежуточного соединения 5(0,025 моль) в EtOH (80 мл). Смесь перемешивали и нагревали с обратным холодильником в течение 2 ч,затем доводили до комнатной температуры. Добавляли воду. Смесь перемешивали в течение 15 мин,затем фильтровали. Остаток очищали колоночной хроматографией на силикагеле (70-200 мкм) (элюент:DCM/MeOH от 100/0 до 95/5). Чистые фракции собирали и растворитель выпаривали, получая 1,5 г- 21012452 с) Получение промежуточного соединения 7 Смесь промежуточного соединения 6 (0,007 моль) и никеля Ренея (1,5 г) в МеОН (30 мл) и ТГФ (10 мл) гидрировали при комнатной температуре в течение 1 ч под давлением 3 бара, затем фильтровали через целит. Целит промывали DCM/MeOH. Фильтрат упаривали. Остаток забирали в DCM. Органический слой отделяли, высушивали (MgSO4), фильтровали и растворитель выпаривали, получая 1,2 г (92%) промежуточного соединения 7. Пример А 4. Получение промежуточного соединения 8N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин, моногидрохлорид (=EDCI) (0,0344 моль) добавляли к смеси 1,4-бензолдиамина (0,137 моль) в ТГФ (200 мл) и DCM (200 мл) под током N2. Смесь перемешивали при комнатной температуре в течение 24 ч, выливали в воду и экстрагировали DCM. Органический слой отделяли, высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (20-45 мкм) (элюент: DCM/MeOH/NH4OH 97/3/0,5). Чистые фракции собирали и растворитель выпаривали, получая 1,75 г (24%) промежуточного соединения 8. Пример А 5. а) Получение промежуточного соединения 9 Смесь 1-фтор-4-нитробензола (0,0025 моль), 1-метил-1 Н-индол-3-этанамина (0,0023 моль) и Nэтил-N-(1-метилэтил)-2-пропанамина (0,0057 моль) перемешивали при 200 С в течение 2 ч, затем доводили до комнатной температуры. Добавляли воду и DCM. Органический слой отделяли, высушивали(MgSO4), фильтровали и растворитель выпаривали. Остаток (0,8 г) очищали колоночной хроматографией на силикагеле (35-70 мкм) (элюент: DCM 100). Чистые фракции собирали и растворитель выпаривали. Остаток (0,45 г) забирали в DTPE. Осадок фильтровали и высушивали, получая 0,33 г (66%) промежуточного соединения 9.b) Получение промежуточного соединения 10 Смесь промежуточного соединения 9 (0,0011 моль) и никеля Ренея (0,4 г) в МеОН (20 мл) гидрировали при комнатной температуре в течение 1 ч под давлением 3 бара, затем фильтровали через целит. Целит промывали DCM/MeOH. Фильтрат упаривали. Остаток забирали в DCM. Органический слой отделяли, высушивали (MgSO4), фильтровали и растворитель выпаривали, получая 0,305 г (97%) промежуточного соединения 10. Пример А 6. а) Получение промежуточного соединения 11 Смесь 4-фтор-бензонитрила (0,071 моль), 1 Н-индол-3-этанамина (0,071 моль) и N-этил-N-(1 метилэтил)-2-пропанамина (0,1775 моль) перемешивали при 210 С в течение 16 ч, затем доводили до комнатной температуры и забирали в DCM/MeOH. Органический слой промывали 3 н. HCl, высушивали(MgSO4), фильтровали и растворитель выпаривали. Остаток забирали смесью простой диэтиловыйb) Получение промежуточного соединения 12 Смесь промежуточного соединения 11 (0,0115 моль) и гидроксида натрия (0,17 моль) в EtOH (50 мл) и воде (50 мл) перемешивали и нагревали с обратным холодильником в течение 18 ч, затем доводили до комнатной температуры. Растворитель выпаривали. Остаток забирали в 3 н. гидроксид натрия. Водный слой промывали с DCM и подкисляли до рН 5. Осадок фильтровали и высушивали, получая 1,06 г (35%) промежуточного соединения 12, температура плавления 225 С. с) Получение промежуточного соединения 13 Смесь промежуточного соединения 12 (0,0037 моль), 4-пиридинамина (0,0037 моль), йодида 2 хлор-1-метилпиридиния (0,0113 моль) и триэтиламина (0,015 моль) в ацетонитриле (100 мл) перемешивали и нагревали с обратным холодильником в течение 90 мин, затем доводили до комнатной температуры. Растворитель выпаривали. Остаток забирали в DCM/MeOH. Органический слой промывали карбонатом калия (10%), высушивали (MgSO4), фильтровали и растворитель выпаривали до степени высушивания. Остаток очищали колонкой для флэш-хроматографии на силикагеле (35-70 мкм) (элюент: DCM/MeOH/NH4OH 95/5/0,1). Две фракции собирали и растворитель выпаривали, получая 0,06 г F1 и 0,08 г F2. F1 перекристаллизовывали из смеси простой диэтиловый эфир/ацетонитрил. Осадок фильтровали и высушивали, приводя к первой порции 0,032 г (2,4%) промежуточного соединения 13. F2 и маточный слой объединяли и перекристаллизовывали из смеси простой диэтиловый эфир/ацетонитрил. Осадок фильтровали и высушивали, приводя к второй порции 0,105 г(10%) промежуточного соединения 13, температура плавления 200 С. Пример А 7. Получение промежуточного соединения 14 Осуществляли процедуру как в способе 6 (см. пример А 13), исходя из 1-(4-хлор-2-пиридинил)этанона (227 мг, 0,0015 моль) и с добавлением триэтиламина (0,22 мл). После обработки остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент: EtOAc). Чистые фракции собирали и растворитель выпаривали, приводя к 256 мг (52%) промежуточного соединения 14 в форме светложелтого масла. Пример А 8. Получение промежуточного соединения 15 Осуществляли процедуру как в способе 4 (см. пример А 22/22), исходя из бензил 1 пиперазинкарбоксилата (1,3 мл, 0,0069 моль) и 4-хлор-2-пиридинметанола (500 мг, 0,0034 моль). После обработки остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент:DCM/MeOH 95/5). Чистые фракции собирали и растворитель выпаривали, приводя к 840 мг (70%) промежуточного соединения 15 в форме оранжевого масла. Пример А 9. Получение промежуточного соединения 16 Осуществляли процедуру как в способе 4 (см. пример А 22/22), исходя из 4-амино-бутан-1-ола (310- 23012452 мг, 0,0021 моль) и 4-хлор-2-пиридинметанола (300 мг, 0,0021 моль). После обработки остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент: DCM/MeOH 85/15). Чистые фракции собирали и растворитель выпаривали, приводя к 55 мг (17%) промежуточного соединения 16 в форме желтого масла. Пример А 10. Получение промежуточного соединения 17 Осуществляли процедуру как в способе 5 (см. пример А 22/34), исходя из трет-бутилового эфира 4(2-аминоэтил)пиперазин-1-карбоновой кислоты(579 мг,0,0025 моль) и 4-хлор-2 пиридинкарбоксальдегида (325 мг, 0,0023 моль). После обработки остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент: DCM/MeOH 90/10). Чистые фракции собирали и растворитель выпаривали, получая 425 мг (53%) промежуточного соединения 17 в форме желтого масла. Пример A11. Получение промежуточного соединения 18 Осуществляли процедуру как в способе 5 (см. пример А 22/34), исходя из гидрохлорида метилового эфира 3-аминопропионовой кислоты (351 мг, 0,0025 моль) и 4-хлор-2-пиридинкарбоксальдегида (325 мг,0,0023 моль) и с добавлением триэтиламина (0,35 мл, 0,0025 моль). После обработки остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент: DCM/MeOH 95/5). Чистые фракции собирали и растворитель выпаривали, приводя к 160 мг (30%) промежуточного соединения 18 в форме желтого масла. Пример А 12. Получение промежуточного соединения 19 Осуществляли процедуру как в способе 3 (см. пример А 22/20), исходя из метилового эфира бромуксусной кислоты (0,26 мл, 0,0021 моль) и 4-хлор-2-пиридинметанола (300 мг, 0,0021 моль). После обработки остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент:AcOEt/циклогексан 60/40). Чистые фракции собирали и растворитель выпаривали, приводя к 170 мг(38%) промежуточного соединения 19 в форме желтого масла. Пример А 13. Получение промежуточного соединения 20 Способ 6. 4-Амино-1-бутанол (0,13 мл, 0,0014 моль) добавляли при комнатной температуре к смеси 1-(4-хлор 2-пиридинил)этанона (200 мг, 0,0013 моль), паратолуолсульфокислоты (123 мг, 0,00065 моль), и 3 молекулярных сит в МеОН (4 мл). Смесь перемешивали 6 ч при комнатной температуре, охлаждали до 0 С и медленно добавляли боргидрид натрия (93 мг, 0,0026 моль). Смесь перемешивали при комнатной температуре в течение 18 ч. Молекулярные сита отфильтровывали и смесь выливали в воду и растворитель выпаривали. Водный слой подщелачивали насыщенным раствором бикарбоната натрия и экстрагировали 3 раза с DCM. Органический слой отделяли, промывали солевым раствором, высушивали (MgSO4),фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле(40-63 мкм) (элюент: DCM/MeOH 95/5). Чистые фракции собирали и растворитель выпаривали, приводя к 269 мг (91%) промежуточного соединения 20 в форме желтого масла.- 24012452 Пример А 14. Получение промежуточного соединения 21 Смесь -(фенилметил)-1 Н-индол-3-уксусной кислоты (94 мг, 0,00035 моль) и 1,1 карбонилдиимидазола (59 мг, 0,00036 моль, добавленных порциями) в DCM (1 мл), перемешивали 3 ч при комнатной температуре в атмосфере аргона. Добавляли N,О-диметилгидроксиламин гидрохлорид(36 мг, 0,00037 моль) и смесь перемешивали еще 3 ч при комнатной температуре, охлаждали до 0 С, затем выливали в воду. Устанавливали рН 10 с помощью 4 н. раствора гидроксида натрия, и водный слой экстрагировали EtOAc. Органический слой отделяли, промывали с 3 н. раствором соляной кислоты, высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент: EtOAc/циклогексан 50/50). Чистые фракции собирали и растворитель выпаривали, приводя к 52 мг (47%) промежуточного соединения 21. Пример А 15. а) Получение промежуточного соединения 22 К раствору промежуточного соединения 1 (3,0 г, 0,011 моль) в DCM (130 мл), добавляли 4 диметиламинопиридин (261 мг, 0,0021 моль) и ди-трет-бутилдикарбонат (14,0 г, 0,064 моль). Смесь перемешивали при комнатной температуре в течение 5 ч. Реакцию останавливали добавлением воды и экстрагировали дважды с DCM. Органический слой промывали последовательно насыщенным раствором бикарбоната натрия и солевым раствором, высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент:EtOAc/циклогексан от 10/90 до 20/80). Чистые фракции собирали и растворитель выпаривали, приводя к 4,65 г (90%) промежуточного соединения 22 в форме твердого вещества желтого цвета.b) Получение промежуточного соединения 22 Никель Ренея (3 г) добавляли к раствору промежуточного соединения 22 (4,7 г, 0,0097 моль) в этиловом спирте (15 мл) и ТГФ (15 мл). Реакционную смесь перемешивали под 1 атмосферой водорода в течение 16 ч. Чтобы закончить реакцию добавляли никель Ренея (1 г), и смесь перемешивали под 1 атмосферой водорода в течение еще 4 ч. Смесь фильтровали через целит и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент:EtOAc/циклогексан от 10/90 до 20/80). Чистые фракции собирали и растворитель выпаривали, приводя к 4,0 г (92%) промежуточного соединения 23 в форме пены желтого цвета. Пример А 16. а) Получение промежуточного соединения 24 Бром (0,0104 моль), затем раствор нитрита натрия (0,0362 моль) в воде (3 мл) добавляли по каплям при -10 С к смеси 6,7-дигидро-5 Н-1-пиридин-4-амина (0,0112 моль) в водном бромоводороде (48%) (5 мл). Смесь доводили до 20 С. Добавляли лед. Смесь подщелачивали концентрированным гидроксидом натрия и экстрагировали EtOAc. Органический слой отделяли, высушивали (MgSO4), фильтровали и рас- 25012452 творитель выпаривали, получая 2 г (90%) промежуточного соединения 24.b) Получение промежуточного соединения 25 Мета-хлорпербензойную кислоту (0,012 моль) добавляли к смеси промежуточного соединения 24(0,01 моль) в DCM (15 мл). Смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли гидроксид натрия 3 н. и воду. Смесь экстрагировали три раза DCM. Органический слой промывали водой,высушивали (MgSO4), фильтровали и растворитель выпаривали, получая 1,85 г (86%) промежуточного соединения 25. с) Получение промежуточного соединения 26 Смесь промежуточного соединения 25 (0,008 6 моль) в уксусном ангидриде (18 мл) перемешивали при 100 С в течение 30 мин, затем охлаждали до комнатной температуры и упаривали. Остаток забирали в NaHCO3 и EtOAc и фильтровали через целит. Целит промывали EtOAc. Органический слой отделяли,высушивали (MgSO4), фильтровали и растворитель выпаривали, получая 1,63 г (73%) промежуточного соединения 26.d) Получение промежуточного соединения 27 Смесь промежуточного соединения 26 (0,0074 моль) в МеОН (10 мл) и 3 н. гидроксиде натрия (80 мл) перемешивали при комнатной температуре в течение 30 мин, затем перемешивали при 80 С в течение 10 мин, затем охлаждали до комнатной температуры. МеОН упаривали. Смесь экстрагировали дважды с DCM, затем промывали с насыщенным NaCl. Органический слой отделяли, высушивали (MgSO4),фильтровали и растворитель выпаривали, получая 1,02 г (64%) промежуточного соединения 27. Пример А 17. а) Получение промежуточного соединения 28 Бром (1,3 мл), затем раствор нитрита натрия (3,3 г) в воде (4 мл) добавляли по каплям при -10 С к раствору 5,6,7,8-тетрагидро-4-хинолинамина (0,0135 моль) в водном бромоводороде (48%) (6,7 мл). Смесь доводили до 20 С, выливали на лед, подщелачивали концентрированным гидроксидом натрия и экстрагировали EtOAc. Органический слой отделяли, высушивали (MgSO4), фильтровали и растворитель выпаривали, получая 2,2 г (77%) промежуточного соединения 28.b) Получение промежуточного соединения 29 Мета-хлорпербензойную кислоту (0,0125 моль) добавляли к смеси промежуточного соединения 28(0,0104 моль) в DCM (20 мл). Смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли 3 н. гидроксид натрия и лед. Смесь экстрагировали дважды с DCM. Органический слой высушивали- 26012452 с) Получение промежуточного соединения 30 Смесь промежуточного соединения 29 (0,0086 моль) в уксусном ангидриде (22 мл) перемешивали при 100 С в течение 30 мин, затем охлаждали до комнатной температуры и упаривали. Остаток забирали в насыщенный NaHCO3 и EtOAc. Смесь перемешивали в течение 30 мин. Органический слой отделяли,высушивали (MgSO4), фильтровали и растворитель выпаривали, получая 3,4 г (100%) промежуточного соединения 30.d) Получение промежуточного соединения 31 Смесь промежуточного соединения 30 (0,0104 моль) в МеОН (18 мл) и 3 н. гидроксида натрия (150 мл) перемешивали при комнатной температуре в течение 30 мин, затем перемешивали при 80 С в течение 10 мин. МеОН упаривали. Смесь экстрагировали дважды с DCM. Органический слой промывали с насыщенным NaCl, высушивали (MgSO4), фильтровали и растворитель выпаривали, получая 1,84 г (77%) промежуточного соединения 31. Пример А 18. а) Получение промежуточного соединения 32 Смесь 2-этокси-4-нитроанизола (0,0107 моль), 6-метокситриптамина (0,0107 моль) и диизопропилэтиламина (0,0268 моль) перемешивали при 210 С в течение 5 ч, затем выливали на лед и экстрагировали с DCM. Органический слой отделяли, высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (15-40 мкм) (элюент: DCM 100%). Чистые фракции собирали и растворитель выпаривали, получая 0,85 г (22%) промежуточного соединения 32.b) Получение промежуточного соединения 33 Смесь промежуточного соединения 32 (0,0023 моль) и никеля Ренея (0,85 г) в МеОН (42 мл) и ТГФ(42 мл) гидрировали при комнатной температуре в течение 2 ч под давлением 3 бара, затем фильтровали через целит. Фильтрат упаривали, получая 0,74 г (95%) промежуточного соединения 33. Пример А 19. а) Получение промежуточного соединения 34 Хлорангидрид щавелевой кислоты (0,012 моль) добавляли по каплям при 0 С к раствору 5 цианоиндола (0,007 моль) в простом диэтиловом эфире (21 мл). Смесь перемешивали при 0 С в течение 5 ч, затем перемешивали при комнатной температуре в течение ночи. Осадок фильтровали, промывали простым диэтиловым эфиром и высушивали, получая 1,454 г (73%) промежуточного соединения 34.b) Получение промежуточного соединения 35 Раствор промежуточного соединения 34 (0,0027 моль) в DCM (12 мл) добавляли по каплям при 5 С к раствору N-пиридин-4-ил-бензол-1,4-диамина (0,022 моль) и N,N-диизопропилэтиламина (0,0034 моль) в DCM (4 мл). Смесь перемешивали и нагревали с обратным холодильником в течение уикэнда, затем охлаждали до комнатной температуры. Осадок фильтровали и высушивали. Остаток перекристаллизовывали из iPrOH. Осадок фильтровали и высушивали, получая 0,756 г сырого продукта. Эту фракцию очищали колоночной хроматографией с kromasil (5 мкм) (элюент: DCM/MeOH/NH4OH от 97/3/0,3 до 87/13/1,3). Чистые фракции собирали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (15-40 мкм) (элюент: DCM/MeOH/NH4OH от 90/10/0,1 до 87/13/0,1). Чистые фракции собирали и растворитель выпаривали, получая 0,098 г (20%) промежуточного соединения 35,температура плавления 264 С. Пример А 20. а) Получение промежуточного соединения 36 Смесь 1 Н-бензимидазол-1-этанамина (0,011 моль) 1-фтор-4-нитробензола (0,011 моль) и диизопропилэтиламина (0,034 моль) перемешивали при 210 С в течение 30 мин. Диизопропилэтиламин упаривали. Осадок растворяли в DCM/MeOH. Органический слой промывали карбонатом калия (10%), высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток (3,2 г) очищали колоночной хроматографией на силикагеле (15-40 мкм) (элюент: DCM/MeOH/NH4OH 98/2/0,5). Чистые фракции собирали и растворитель выпаривали. Остаток (2,1 г, 77%) перекристаллизовывали из ацетонитрила. Осадок фильтровали и высушивали, получая 1,3 г (47%) промежуточного соединения 36, температура плавления 144 С.b) Получение промежуточного соединения 37 Смесь промежуточного соединения 36 (0,006 моль) и никеля Ренея (2 г) в МеОН (20 мл) гидрировали при комнатной температуре под давлением 3 бара, затем фильтровали через целит. Целит промывали с DCM/MeOH. Фильтрат упаривали, получая 1,7 г (100%) промежуточного соединения 37. Пример А 21. а) Получение промежуточного соединения 38 Смесь D,L-Триптофана, сложного метилового эфира (0,0078 моль), 1-фтор-4-нитробензола (0,0078 моль) и диизопропилэтиламина (0,0353 моль) перемешивали при 210 С в течение 4 ч и затем забирали вDCM/MeOH. Добавляли 3 н. HCl. Смесь перемешивали в течение 15 мин. Органический слой промывали насыщенным NaHCO3, высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (35-70 мкм) (элюент: DCM 100%, затем DCM/MeOH 99/1). Чистые фракции собирали и растворитель выпаривали, получая 0,75 г (28%) промежуточного соединения 38.b) Получение промежуточного соединения 39 Смесь промежуточного соединения 38 (0,0022 моль) и никеля Ренея (0,75 г) в МеОН (100 мл) гидрировали при комнатной температуре в течение 1 ч под давлением 3 бара, затем фильтровали через це- 28012452 лит. Фильтрат упаривали, получая 0,65 г (96%) промежуточного соединения 39. с) Получение промежуточного соединения 40 Смесь промежуточного соединения 39 (0,139 моль) и 4-бромпиридин гидрохлорида (0,139 моль) в уксусной кислоте (450 мл) перемешивали при 120 С в течение 3 ч, выливали на лед, подщелачивали концентрированным гидроксидом натрия и экстрагировали DCM/MeOH (небольшое количество). Органический слой отделяли,высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток (62,7 г) очищали колоночной хроматографией с kromasil (20-45 мкм) (элюент: DCM/MeOH/NH4OH 93/7/0,5). Чистые фракции собирали и растворитель выпаривали, получая 22 г (41%) промежуточного соединения 40.d) Получение промежуточного соединения 41 Гидроксид лития, моногидрат (0,112 моль) добавляли порциями при 0 С к раствору промежуточного соединения 40 (0,056 моль) в МеОН (86 мл) и воде (34,4 мл) под током N2. Смесь перемешивали при комнатной температуре в течение ночи, затем упаривали до степени высушивания, выход: 22 г (количественный выход) промежуточного соединения 41. Пример А 22. 1) Получение промежуточного соединения 42-78 С. Диэтилкарбонат (1,0 мл, 0,0096 моль) добавляли по каплям и смесь перемешивали еще 1 ч при -78 С,затем нагревали до комнатной температуры и перемешивали в течение 2,5 ч. Реакцию останавливали медленным добавлением воды и экстрагировали дважды с EtOAc. Органический слой отделяли, промывали солевым раствором, высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент: EtOAc/MeOH 100/0, затем 90/10). Чистые фракции собирали и растворитель выпаривали, получая 74 мг (9%) промежуточного соединения 42. 2) Получение промежуточного соединения 43 Триэтилфосфоноацетат (0,075 мл, 0,00038 моль) добавляли по каплям к смеси гидрида натрия (10,6 мг, 0,00044 моль) в ТГФ (5 мл) при комнатной температуре в атмосфере аргона. Смесь перемешивали при комнатной температуре в течение 20 мин, затем добавляли по каплям раствор 4-хлор-3 пиридинкарбоксальдегида (50 мг, 0,00035 моль) в ТГФ (3 мл). Смесь перемешивали при комнатной температуре в течение 16 ч, затем выливали в воду и экстрагировали дважды с EtOAc. Органический слой отделяли, промывали солевым раствором, высушивали (MgSO4), фильтровали и растворитель выпаривали, получая 77 мг (88%) промежуточного соединения 43. 3) Получение промежуточного соединения 44-78 С, затем добавляли по каплям раствор 4-хлорпиридина (219 мг, 0,0019 моль) в ТГФ (1 мл). Смесь перемешивали 1,25 ч при -78 С, затем добавляли по каплям пропионовый альдегид (0,14 мл, 0,0019 моль). Смесь перемешивали 30 мин при -78 С, и, наконец, 4 ч при комнатной температуре, выливали в воду и экстрагировали с EtOAc. Органический слой отделяли, промывали солевым раствором, высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией- 29012452 на силикагеле (40-63 мкм) (элюент: EtOAc/циклогексан 90/10). Чистые фракции собирали и растворитель выпаривали, получая 147 мг (44%) промежуточного соединения 44. 4) Получение промежуточного соединения 45 Способ 2. 3M раствор этилмагнийбромида в диэтиловом эфире (1,1 мл, 0,0032 моль) добавляли к раствору метилового эфира 4-хлор-2-пиридинкарбоновой кислоты (200 мг, 0,0012 моль) в ТГФ (4 мл) при -30 С в атмосфере аргона. Смесь нагревали при 75 С в течение 2 ч 30 мин, охлаждали до 0 С и реакцию останавливали водой. Полученную смесь подщелачивали насыщенным раствором бикарбоната натрия и экстрагировали дважды с EtOAc. Органический слой промывали солевым раствором, высушивали (MgSO4),фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле(40-63 мкм) (элюент:EtOAc/циклогексан 10/90). Чистые фракции собирали и растворитель выпаривали,получая 54 мг (23%) промежуточного соединения 45 в форме коричневого масла. 5) Получение промежуточного соединения 46 Метансульфонилхлорид (98 мкл, 0,0013 моль) добавляли по каплям к раствору 4-хлор-2 пиридинметанамина (150 мг, 0,0011 моль) и триэтиламина (177 мкл, 0,0013 моль) в DCM (4 мл) при 0 С в атмосфере аргона. Смесь перемешивали при комнатной температуре в течение 30 мин. Реакцию останавливали насыщенным раствором бикарбоната натрия и экстрагировали дважды с DCM. Органическую фазу высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент: EtOAc). Чистые фракции собирали и растворитель выпаривали, получая 82 мг (35%) промежуточного соединения 46 в форме оранжевого масла. 6) Получение промежуточного соединения 47 Способ 7. Циклопропанкарбонилхлорид (115 мкл, 0,0013 моль) добавляли по каплям к раствору 4-хлор-2 пиридинметанамина (150 мг, 0,0011 моль) и триэтиламина (177 мкл, 0,0013 моль) в DCM (4 мл) при 0 С в атмосфере аргона. Смесь перемешивали при комнатной температуре в течение 15 мин. Реакцию останавливали насыщенным раствором бикарбоната натрия и экстрагировали дважды с DCM. Органическую фазу высушивали (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент: EtOAc). Чистые фракции собирали и растворитель выпаривали, получая 85 мг (38%) промежуточного соединения 47 в форме твердого вещества белого цвета. 7) Получение промежуточного соединения 48 Осуществляли процедуру, как в способе 7 (см. пример А 22/6), исходя из 4-хлор-2 пиридинметанамина (150 мг, 0,0011 моль) и гидроциннамоилхлорида (187 мкл, 0,0013 моль). После обработки остаток очищали колоночной хроматографией на силикагеле (40-63 мкм) (элюент: EtOAc). Чистые фракции собирали и растворитель выпаривали, получая 191 мг (66%) промежуточного соединения 48 в форме твердого вещества желтого цвета.
МПК / Метки
МПК: A61K 31/501, A61K 31/4709, C07D 403/12, C07D 487/04, C07D 413/14, C07D 401/14, A61K 31/519, A61K 31/4439, C07D 401/12, A61P 35/00
Метки: взаимодействия, ингибиторы, между
Код ссылки
<a href="https://eas.patents.su/30-12452-ingibitory-vzaimodejjstviya-mezhdu-mdm2-i-r53.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы взаимодействия между mdm2 и р53</a>
Предыдущий патент: Новые амидозамещённые гидрокси-6-фенилфенантридины
Следующий патент: Реверсивные (обратные) мицеллы на основе фитостеролов и ацилглицеролов и их терапевтическое использование
Случайный патент: Способы и композиции для стимуляции роста невритов, использующие соединения с афинностью к fkbp12 в комбинации с нейротрофическими факторами