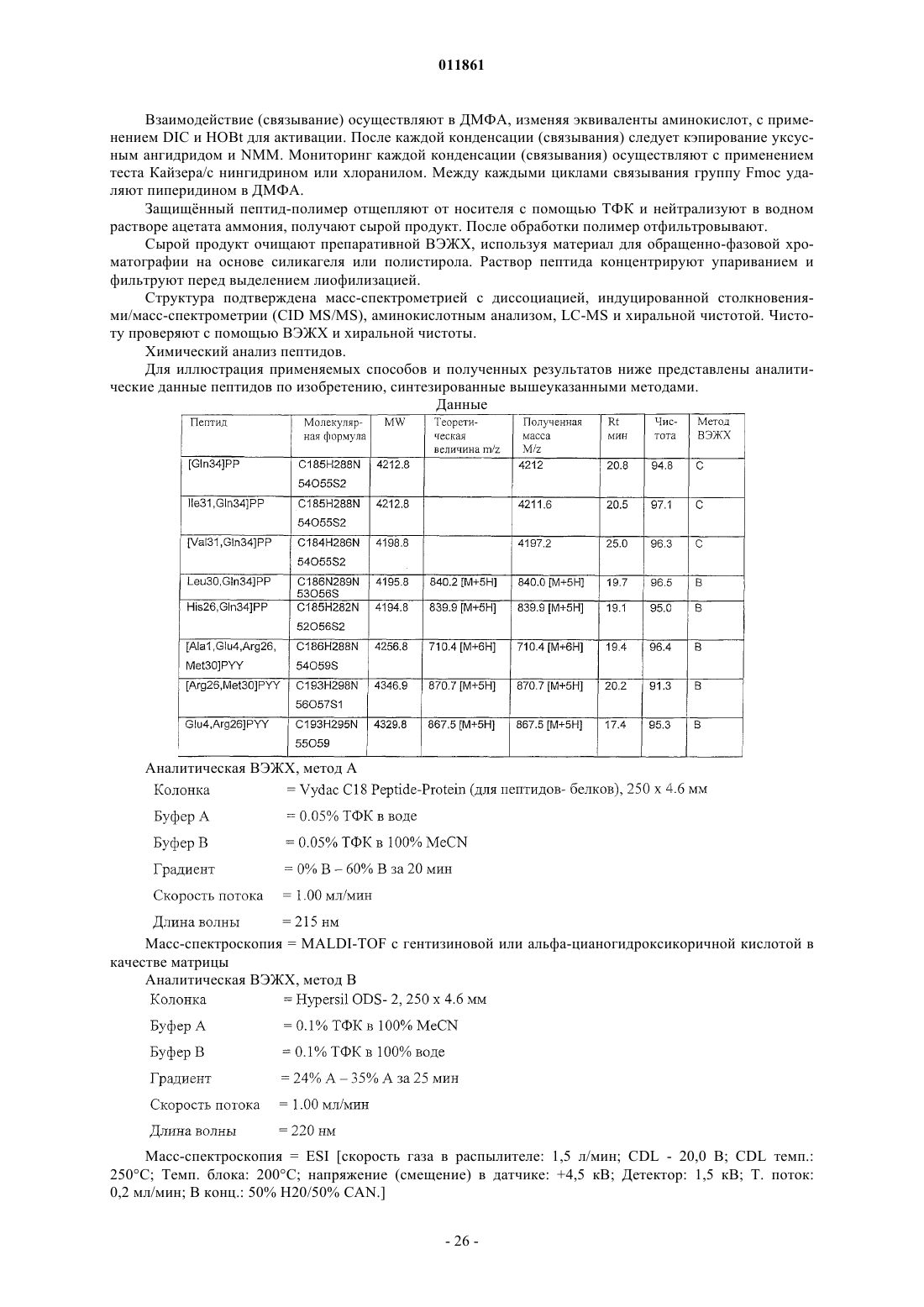
Селективные агонисты рецепторов y2/y4 для терапевтического воздействия
Формула / Реферат
1. Применение Y-рецепторного агониста, селективного в отношении Y2 и Y4 рецепторов по сравнению с Y1 рецептором, для получения композиции для лечения состояний, восприимчивых к активации Y2 и/или Y4 рецепторов, причём:
(а) указанный агонист является РР-складчатым пептидом или РР-складчатым пептидом-миметиком, который содержит:
(i) С-концевую аминокислотную последовательность Y-рецепторного распознавания, представленную как X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2, где R1 и R2, независимо, обозначают водород или
C1-C6 алкил, X обозначает Val, Ile, Leu или Ala, a X3 обозначает Gln или Asn, или её консервативно замещённый вариант, в котором Thr замещён на His или Asn, и/или Tyr замещён на Trp или Phe, и/или Arg замещён на Lys, и
(ii) N-концевую аминокислотную последовательность Y-рецепторного распознавания, представленную как H2N-X1-Pro-X2-(Glu или Asp)-, где X1 отсутствует или обозначает любой аминокислотный остаток, а X2 обозначает Leu или Ser или консервативные замены Leu или Ser, или
(б) указанный агонист содержит:
С-концевую аминокислотную последовательность Y-рецепторного распознавания по определению, данному в (i),
указанную последовательность Y-рецепторного распознавания, связанную с амфифильным доменом аминокислотной последовательности, содержащим по меньшей мере один альфа-спиральный поворот, прилегающий к N-концу указанной гексапептидной последовательности, причём указанный поворот заключён в спиральной конфигурации за счёт ковалентной внутримолекулярной связи, и, необязательно,
N-концевую последовательность, которая начинается с аминокислотной последовательности
Y-рецепторного распознавания по определению, данному в (ii).
2. Применение по п.1, отличающееся тем, что в С-концевой аминокислотной последовательности Y-рецепторного распознавания агониста каждый из R1 и R2 обозначает водород.
3. Применение по п.1 или 2, отличающееся тем, что в С-концевой аминокислотной последовательности Y-рецепторного распознавания агониста остаток X обозначает Val или Ile.
4. Применение по п.1, отличающееся тем, что агонист содержит С-концевую последовательность
Y-рецепторного распознавания, представленную как -XA-X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2, где остаток ХА является некислым и неосновным, a последовательность -X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2 имеет значение по определению в любом из пп.1-3.
5. Применение по п.4, отличающееся тем, что в С-концевой последовательности Y-рецепторного распознавания агониста указанный некислый и неосновной аминокислотный остаток представляет собой Leu, Met, Ile, Val или Ala.
6. Применение по п.1, отличающееся тем, что агонист содержит С-концевой ундекапептид,
представленный как -XC-Tyr-XB-Asn-ХА-X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2, где последовательность
-ХА-X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2 имеет значение по определению в п.4 или 5, XC обозначает Arg или Lys, а XB обозначает Ile, Leu или Val.
7. Применение по п.1, отличающееся тем, что агонист содержит С-концевую ундекапептидную последовательность, представленную как -XC-Tyr-XB-Asn-XA-X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2, где последовательность -ХА-X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2 имеет значение по определению в п.4 или 5, XC обозначает His, Asn или Gln, а XB обозначает Ile, Leu или Val.
8. Применение по любому из пп.1-7, отличающееся тем, что в С-концевой аминокислотной последовательности Y-рецепторного распознавания X3 обозначает Gln.
9. Применение по п.1, отличающееся тем, что агонист содержит С-концевую ундекапептидную последовательность -Arg-Tyr-Leu-Asn-(Leu или Met)-Val-Thr-Arg-Gln-Arg-Tyr-C(=O)NH2.
10. Применение по п.1, отличающееся тем, что агонист содержит С-концевую ундекапептидную последовательность -His-Tyr-(Ile или Leu)-Asn-Met-Leu-Thr-Arg-Gln-Arg-Tyr-C(=O)NH2.
11. Применение по любому из пп.1-10, отличающееся тем, что в N-концевой аминокислотной последовательности Y-рецепторного распознавания остаток X1, в случае его присутствия, обозначает Ala или он отсутствует.
12. Применение по любому из пп.1-11, отличающееся тем, что в N-концевой аминокислотной последовательности Y-рецепторного распознавания остаток X2, в случае его присутствия, обозначает Leu, Ile или Ser.
13. Применение по любому из пп.1-10, отличающееся тем, что N-концевая последовательность представляет собой H2N-Ala-Pro-Leu-Glu- или H2N-Pro-Leu-Glu-.
14. Применение по любому из пп.1-13, отличающееся тем, что агонист является агонистом типа (b) с N-концевой последовательностью Y-рецепторного распознавания и имеет РР-складчатую структуру, в которой ограничивающая спиральный поворот внутримолекулярная связь тянется от аминокислотного остатка в амфифильном домене до точки связывания на N-концевом участке агониста, соответствующем домену полипролина РР-складчатого пептида, который тянется антипараллельно амфифильному домену.
15. Применение по п.14, отличающееся тем, что в агонисте ограничивающая спиральный поворот внутримолекулярная связь представляет собой дисульфидную или лактамную связь.
16. Применение по п.15, отличающееся тем, что ковалентная внутримолекулярная связь в агонисте является дисульфидной связью, образующейся между остатком L- или D-Cys в альфа-спирали и остатком Cys, расположенным в N-концевой части агониста, соответствующей домену полипролина
PP-складчатого пептида, который тянется антипараллельно амфифильному домену.
17. Применение по любому из пп.1-12, отличающееся тем, что агонист является агонистом типа (b), и в агонисте ограничивающая спиральный поворот внутримолекулярная связь представляет собой лактамную связь, образованную между остатками Lys и Glu в указанном спиральном повороте или между остатком Lys или Glu в указанном спиральном повороте и остатком Glu или Lys в С-концевой последовательности Y-рецепторного распознавания.
18. Применение по любому из пп.1-17, отличающееся тем, что агонист содержит как С-концевую, так и N-концевую последовательность Y-рецепторного распознавания, причём С-концевая последовательность по своему N-концу связана с аминокислотной последовательностью амфифильного домена, содержащего по меньшей мере один поворот альфа-спирали, прилегающий к N-концу указанного эпитопа, причём указанные С- и N-концевые аминокислотные последовательности связаны пептидными связями, соответственно, с карбоксильными и аминогруппами аминокислоты формулы NH2(CH2)nCO2H, где n обозначает целое число от 2 до 12.
19. Применение по п.18, отличающееся тем, что n обозначает 6, 7, 8, 9 или 10.
20. Применение по п.1, отличающееся тем, что агонист выбирают из


и их консервативно замещённых аналогов.
21. Применение по п.1, отличающееся тем, что агонист представляет собой [Gln34]PP (SEQ ID
No: 4), или [Ala1,Glu4,Arg26,(Met30 или Nle30)]PYY (SEQ ID No: 12), или их аналог с консервативной заменой.
22. Применение по любому из пп.1-21, отличающееся тем, что агонист ацилирован по своему
N-концу с целью придать резистентность к аминопептидазной активности.
23. Применение по п.22, отличающееся тем, что агонист ацилирован по своему N-концу, причём углеродная цепь ацилирующей группы содержит 2-24 углеродных атома.
24. Применение по п.22, отличающееся тем, что агонист ацилирован по своему N-концу.
25. Применение по любому из пп.1-24, отличающееся тем, что агонист содержит мотив связывания с сывороточэыь альбумином, или мотив связывания с гликозаминогликаном (GAG), или мотив, индуцирующий спираль, или является ПЭГилированным.
26. Применение по п.25, отличающееся тем, что в агонисте мотив связывания с сывороточным альбумином представляет собой липофильную группу.
27. Применение по п.26, отличающееся тем, что в агонисте липофильная группа содержит необязательно замещённую, насыщенную или ненасыщенную, линейную или разветвлённую углеводородную группу, включающую 10-24 углеродных атома.
28. Применение по п.25 или 26, отличающееся тем, что в агонисте липофильная группа представляет собой боковую цепь или часть боковой цепи каркаса агониста.
29. Применение по п.28, отличающееся тем, что в агонисте боковая цепь, содержащая липофильную группу, связана с остатком в каркасе молекулы простой эфирной, тиоэфирной, амино, сложноэфирной или амидной связью.
30. Применение по п.29, отличающееся тем, что в агонисте боковую цепь, содержащую липофильную группу, выбирают из группы, состоящей из
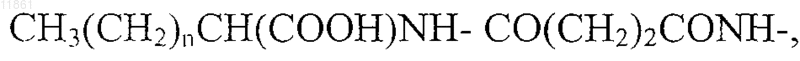
где n обозначает целое число от 9 до 15,

где r обозначает целое число от 9 до 15,

где s обозначает целое число от 9 до 15,
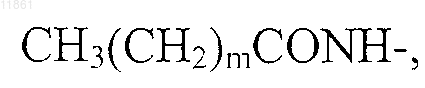
где m обозначает целое число от 8 до 18,
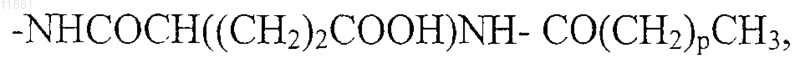
где p обозначает целое число от 10 до 16,
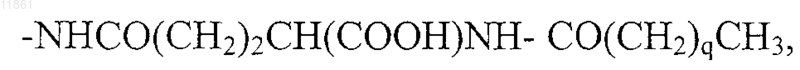
где q обозначает целое число от 10 до 16,
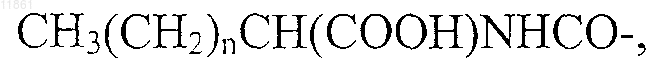
где n обозначает целое число от 9 до 15,
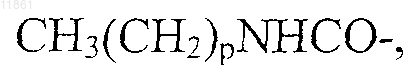
где p обозначает целое число от 10 до 18,
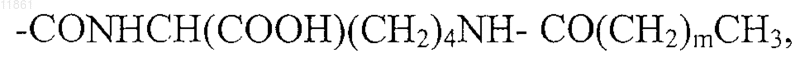
где m обозначает целое число от 8 до 18,
![]()
где p обозначает целое число от 10 до 16,
![]()
где q обозначает целое число от 10 до 16, и
частично или полностью гидрированнового циклопентанофенантренового скелета.
31. Применение по п.28, отличающееся тем, что в агонисте боковая цепь, содержащая липофильную группу, представляет собой С12, C14, С16 или C18 ацильную группу, ацилирующую аминогруппу в боковой цепи каркасного остатка агониста.
32. Применение по п.28, отличающееся тем, что в агонисте боковая цепь, содержащая липофильную группу, представляет собой тетрадеканоильную группу, ацилирующую аминогруппу в боковой цепи каркасного остатка агониста.
33. Применение по п.1, отличающееся тем, что агонист представляет собой Lys11-тетрадеканоил - [Lys11,Gln34]PP, [N-(N'-гексадеканоил)-гамма-глутамоил-Lys13,Gln34]PP (SEQ ID No: 34), [Ala1,Glu4,N-(N'-гексадеканоил)-гамма-глутамоил-Lys13,Arg26Nle30]PYY (SEQ ID No: 37) или [Cys2,N-(8-(8-гамма-глутамоиламинооктаноиламино)октаноил)-Lys13,D-Cys27,Gln34]PP (SEQ ID No: 31) или его консервативно замещённый аналог.
34. Применение по п.25, отличающееся тем, что в агонисте GAG-связывающий мотив представляет собой аминокислотную последовательность, которая является боковой цепью или частью боковой цепи каркаса агониста.
35. Применение по п.34, отличающееся тем, что в агонисте GAG-связывающий мотив содержит аминокислотную последовательность XBBXBX и/или XBBBXXBX, где В обозначает основной аминокислотный остаток, a X обозначает любой аминокислотный остаток.
36. Применение по п.34 или 35, отличающееся тем, что в агонисте GAG-связывающий мотив является конкатамерным или дендримерным.
37. Применение по любому из пп.34-36, отличающееся тем, что GAG-связывающий мотив представляет собой Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala, связанный амидной связью, образованной между С-концом конкатамерного мотива GAG-связывания и эпсилон-аминогруппой остатка Lys18 в [Lys18,Gln34]PP (SEQ ID No: 24) или Lys11 в агонисте [Ala1,Glu4,Lys11,Arg26,(Met30 или Nle30)]PYY (SEQ ID No: 25).
38. Применение по пп.34-36, отличающееся тем, что GAG-связывающий мотив представляет собой Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala, связанный амидной связью, образованной между С-концом конкатамерного мотива GAG-связывания и эпсилон-аминогруппой остатка Lys18 в [Lys18,Gln34]PP (SEQ ID No: 24) или Lys11 в агонисте [Ala1,Glu4,Lys11,Arg26,(Met30 или Nle30)]PYY (SEQ ID No: 25).
39. Применение по п.25, отличающееся тем, что в агонисте GAG-связывающий мотив ковалентно связан с С- или N-концом агониста либо непосредственно, либо через линкерный радикал.
40. Применение по п.39, отличающееся тем, что в агонисте GAG-связывающий мотив ковалентно связан либо непосредственно, либо через линкерный радикал с N-концом агониста.
41. Применение по п.39 или 40, отличающееся тем, что в агонисте GAG-связывающий мотив содержит аминокислотную последовательность XBBXBX и/или XBBBXXBX, где В обозначает основной аминокислотный остаток, a X обозначает любой аминокислотный остаток.
42. Применение по п.39 или 40, отличающееся тем, что в агонисте GAG-связывающий мотив содержит аминокислотную последовательность [XBBBXXBX]n, где n обозначает число от 1 до 5, В обозначает основной аминокислотный остаток, a X обозначает любой аминокислотный остаток.
43. Применение по п.39, отличающееся тем, что пептид представляет собой Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-[Gln34]PP (SEQ ID
No: 26), [Ala1,Glu4,N-(Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala)3-Lys13,Arg26,Nle30]PYY (SEQ ID No: 38) или [Cys2,N-{(Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala)3}-Lys13,D-Cys27,Gln34]PP (SEQ ID No: 32).
44. Применение по п.25, отличающееся тем, что в агонисте ПЭГ (PEG) обозначает полиэтиленгликоль или полиэтиленоксид с молекулярной массой не более 20 кДа.
45. Применение по п.25, отличающееся тем, что агонист представляет собой [Lys11,Gln34]PP, ПЭГилированный по остатку Lys11, или [Ala1,Glu4,Lys18,Arg26,(Met30 или Nle30)]PYY, ПЭГилированный по остатку Lys18, или [Ala1,Glu4,N-PEG5000-Lys13,Arg26,Nle30]PYY (SEQ ID No: 39), или [Cys2,N-{N'-(21-амино-4,7,10,13,16,19-гексаоксагенэйкозаноил)}-гамма-глутамоил-Lys13,D-Cys27,Gln34]PP (SEQ ID No: 33).
46. Применение по п.25, отличающееся тем, что в агонисте пептид, индуцирующий спираль, ковалентно связан либо непосредственно, либо через линкерный радикал с С- или N-концом агониста.
47. Применение по п.25, отличающееся тем, что в агонисте пептид, индуцирующий спираль, ковалентно связан либо непосредственно, либо через линкерный радикал с N-концом агониста.
48. Применение по п.46 или 47, отличающееся тем, что пептид, индуцирующий спираль, содержит 4-20 аминокислотных остатков, выбранных из группы, состоящей из Ala, Leu, Ser, Thr, Tyr, Asn, Gln, Asp, Glu, Lys, Arg, His, Met, Orn, и аминокислотных остатков формулы -NH-C(R1)(R2)-CO-, где R1 обозначает необязательно замещённый C1-C6алкил, фенил или фенилметил или R1 и R2 вместе с атомом С, с которым они связаны, образуют циклопентильное, циклогексильное или циклогептильное кольцо.
49. Применение по п.46 или 47, отличающееся тем, что пептид, индуцирующий спираль, содержит 4, 5 или 6 остатков Lys.
50. Применение по п.46 или 47, отличающееся тем, что агонист представляет собой Lys-Lys-Lys-Lys-Lys-Lys-Lys-[Gln34]-PP.
51. Применение по любому из пп.26-35, 42 или 43, отличающееся тем, что в агонисте мотив связывания сывороточного альбумина, или GAG-связывающий мотив, или ПЭГ радикал является боковой цепью или образует часть боковой цепи каркасного углерода, соответствующего любому из нижеприведёнэых положений PYY или PP: 1, 3, 6, 7, 10, 11, 12, 13, 15, 16, 17, 18, 19, 21, 22, 23, 25, 26, 28, 29, 30 и 32 или соответствующего любому из нижеприведённых положений NPY: 1, 3, 6, 7, 10, 11, 12, 14, 15, 16, 17, 18, 19, 21, 22, 23, 25, 26, 28, 29, 30 и 32.
52. Применение по п.51, отличающееся тем, что агонист является агонистом типа (с), а мотив связывания сывороточного альбумина, или GAG-связывающий мотив, или ПЭГ радикал является боковой цепью или образует часть боковой цепи каркасного углеродного атома, соответствующего любому из приведённых ниже положений PYY, NPY или PP: 2, 5, 8, 9, 13, 14, 20 и 24.
53. Применение по п.51, отличающееся тем, что агонист имеет значение по определению в п.12, а мотив связывания сывороточного альбумина, или GAG-связывающий мотив, или ПЭГ радикал является боковой цепью или образует часть боковой цепи каркасного линкерного радикала -(CH2)n-.
54. Y-рецепторный агонист, селективный к Y2 и Y4 рецепторам по сравнению с Y1 рецептором, выбранный из


и их консервативно замещённых аналогов.
55. Y-рецепторный агонист, селективный к Y2 и Y4 рецепторам по сравнению с Y1 рецептором, представляющий собой [Ala1,Glu4,Arg26,(Met30 или Nle30)]PYY или его аналог с консервативной заменой.
56. Способ лечения состояний, восприимчивых к активации Y2 и/или Y4 рецепторов, заключающийся во введении нуждающемуся в этом пациенту эффективного количества Y2 и Y4 селективного рецепторного агониста по любому из пп.54 или 55.
57. Применение по любому из пп.1-53, отличающееся тем, что состояние, лечение которого проводится, является состоянием, для которого показаны регуляция потребления энергии или энергетического метаболизма, контроль интестинальной секреции, снижение моторики желудочно-кишечного тракта или индукция ангиогенеза.
58. Применение по п.57, отличающееся тем, что состояние, лечение которого проводится, является состоянием, для которого показана индукция ангиогенеза, и тем, что Y2 и Y4 селективный рецепторный агонист содержит GAG-связывающий мотив.
59. Применение по п.57, отличающееся тем, что состояние, лечение которого проводится, является состоянием, для которого показана индукция ангиогенеза, и тем, что Y2 и Y4 селективный рецепторный агонист содержит мотив связывания с сывороткой.
60. Применение по п.57, отличающееся тем, что состояние, лечение которого проводится, является состоянием, для которого показана индукция ангиогенеза, и тем, что Y2 селективный рецепторный агонист является ПЭГилированным.
61. Применение по любому из пп.57-60, отличающееся тем, что лечение проводят с целью замедления опорожнения желудка.
62. Применение по п.57, отличающееся тем, что состояние, лечение которого проводится, представляет собой ожирение или избыточный вес, состояние, при котором ожирение или избыточный вес рассматривается как способствующий фактор.
63. Применение по п.62, отличающееся тем, что состояние, лечение которого проводится, представляет собой булимию, нейрогенную булимию, синдром X (метаболический синдром), диабет, сахарный диабет типа 2 или инсулиннезависимый сахарный диабет (NIDDM), гипергликемию, устойчивость к инсулину, нарушенную толерантность к глюкозе, сердечно-сосудистое заболевание, гипертензию, атеросклероз, заболевание коронарных артерий, инфаркт миокарда, заболевание периферических сосудов, удар, тромбоэмболическое заболевание, гиперхолистеринемию, гиперлипидемию, болезнь желчного пузыря, остеоартрит, остановку дыхания во сне, репродуктивные нарушения, такие как синдром поликистоза яичников, или рак молочной железы, простаты или толстой кишки.
64. Применение по п.62 или 63, отличающееся тем, что агонист вводят пациенту натощак.
65. Применение по п.57, отличающееся тем, что состояние, лечение которого проводится, представляет собой диарею или кишечную гиперсекрецию.
66. Применение по любому из пп.56-65, отличающееся тем, что агонист вводят пациенту парентерально, включая подкожное, внутримышечное, внутривенное, назальное, трансдермальное или трансбуккальное введение.
67. Фармацевтическая композиция, содержащая один или более Y2 и Y4 селективных рецепторных агонистов по определению в любом из пп.54 или 55 вместе с фармацевтически приемлемым эксципиентом.
68. Косметическая композиция, содержащая один или более Y2 и Y4 селективных агонистов по п.54 или 55 вместе с косметически приемлемым эксципиентом.
Текст
011861 Данное изобретение относится к пептидам или пептидным соединениям, которые ведут себя как селективные агонисты Y2 и Y4 относительно Y1 рецепторов, и их применению при лечении состояний,чувствительных к активации Y2 и/или Y4 рецепторов, например при лечении ожирения и избыточного веса, и состояний, при которых они рассматриваются как содействующие факторы, и для регуляции/понижения секреции ЖКТ. Предпосылки создания изобретения Семейство пептидов с РР-складкой.NPY (нейропептид Y) (человеческая последовательность SEQ ID No: 1), PYY (пептид YY) (человеческая последовательность SEQ ID No: 2) и PP (панкреатический пептид) являются секретируемыми в природе гомологичными, содержащими последовательность из 36 аминокислот, амидированными по С-концу пептидами, которые характеризуются общей трхмерной структурой (РР-складкой), поразительно устойчивой даже в разбавленном водном растворе и являющейся важной для рецепторного распознавания. Первоначально с помощью рентгеновского кристаллографического анализа (PCA) более подробно была охарактеризована рентгеновская структура птичьего PP с разрешением до 0,98 , и уникальная структура получила сво название от этого пептида (Blundell et al., 1981, Proc. Natl. Acad. Sci. USA, 78: 4175-79; Glover et al., 1984, Eur. J. Biochem. 142: 379-85). Затем РР-складчатая структура других членов семейства была проанализирована, главным образом, с помощью ЯМР-спектроскопии. Как PCA, так и ЯМР-спектроскопии осуществляют, несомненно, в концентрированном или тврдом состоянии; однако точный анализ методом кругового дихроизма подтверждает, что NPY и PP даже в водном растворе принимают РР-складчатую структуру, необычную для такого малого пептида (Fuhlendorff et al., 1990, J. Biol.Chem. 265:11706-12). Важно отметить, что анализ протеолитической устойчивости пептидов и их фрагментов и аналогов чтко показывает, что, например, полноразмерный PP1-36 в разбавленном водном растворе сохраняет складчатую конфигурацию, которая защищает его от разрушения под действием некоторых ферментов, которые быстро и легко разрушают аналоги, не способные принять РР-складчатую структуру вследствие минорных замен (Schwartz et al., 1990, Annals NY Acad. Sci. 611: 35-47). РР-складчатая структура, общая для NPY, PYY и PP, состоит из: 1) N-концевой полипролиноподобной спирали (соответствующей остаткам 1-8 с Pro2, Pro5 и Pro8), за которой следует 2) участок бетаповорота типа I (соответствующий остаткам с 9 по 12), далее следуют 3) амфифильная альфа-спираль(остатки 13-30), которая расположена антипараллельно полипролиновой спирали с углом около 152 между осями спиралей, и 4) С-концевой гексапептид (остатки 31-36). Складчатая структура стабилизирована за счт взаимодействий между боковыми цепями амфифильной альфа-спирали, которые тесно переплетаются с тремя гидрофобными остатками пролина (Schwartz et al., 1990). Помимо ключевых остатков в рецепторе, распознающем C-концевой гексапептид, именно ядерные гидрофобные остатки, которые являются консервативными в целом семействе РР-складчатых пептидов, стабилизируют PP-складчатую структуру. На фиг. 1A изображена последовательность NPY с остатками, консервативными в ряду NPY,PYY и PP, показанными белыми буквами на тмном фоне. На фиг. 1A также показаны элементы РР-складчатой структуры, описанные выше. Полагают, что С-концевой гексапептид, важный для рецепторного узнавания, является неструктурированным, но РР-складка обеспечивает устойчивый каркас, который презентирует С-концевой гексапептид рецепторам (иллюстрируется на фиг. 1B), которые до некоторой степени зависят или не зависят также от участков N-конца пептида. Анализ методом ЯМР-спектроскопии также показал, что дальние С- и N-концевые участки, например NPY, являются скорее подвижными, это означает, что РР-складке постоянно угрожает опасность "расстегнуть молнию" на свободном конце.NPY является весьма распространнным нейропептидом, обладающим разнообразным действием в различных частях как центральной, так и периферической нервной системы, действующий с помощью различных субтипов рецептора в организме людей: Y1, Y2, Y4 и Y5. Основными NPY рецепторами являются Y1 рецептор, который обычно является постсинаптическим рецептором, передающим "действие"NPY нейронов, и Y2 рецептор, который обычно является пресинаптическим, ингибирующим рецептором. Это действительно имеет место в гипоталамусе, где NPY нейроны, которые также экспрессируют антагонист/обратный агонист рецептора мелакортина AgRP (агути-родственный пептид), ведут себя как первичные "сенсорные" нейроны в стимулирующей ветвь дугообразного (аркуатного) ядра. Поэтому в этом "сенсорном ядре" для регуляции аппетита и потребления энергии NPY/AgRP нейроны, вместе с ингибирующими POMC/CART нейронами, контролируют гормональный и питательный статус организма,так как эти нейроны являются мишенью как действующих продолжительно регуляторов, таких как лептин и инсулин, так и кратковременных регуляторов, таких как грелин и PYY (см. ниже). Стимулирующие NPY/AgRP нейроны распространяются, например, на паравентрикулярное ядро - также гипоталамуса - где, как полагают, их постсинаптическими нацеленными рецепторами являются Y1 и Y5 рецепторы.NPY является наиболее эффективным из известных соединений, способствующих повышению потребления пищи, так грызуны после интрацеребровентрикулярной (ICV) инъекции NPY едят до тех пор, пока они в буквальном смысле не лопнут. AgRP, полученный при использовании NPY/AgRP нейронов, ведт себя как антагонист, главным образом, в отношении рецепторов меланокортинов типа 4 (MC-4) и блоки-1 011861 рует действие пептидов из POMC, в основном aMSH, на этот рецептор. Так как МС 4 рецепторный сигнал действует как ингибитор потребления пищи, действие AgRP точно так же, как действие NPY, является стимулирующим сигналом для потребления пищи (т.е. ингибирование ингибирования, угнетение угнетения). На NPY/AgRP нейронах обнаружены ингибирующие пресинаптические Y2 рецепторы, которые являются мишенью как локально высвобождающегося NPY, так и кишечного гормона PYY - другого РР-складчатого пептида.PYY выделяется в процессе еды пропорционально калорийности пищи энтероэндокринными клетками в дистальной части тонкого кишечника и ободочной кишки, действуя как на периферии на функцию ЖКТ, так и в центральной области как сигнал насыщения. Полагают, что периферически PYY действует как ингибитор ("удар под дых"), например, двигательной функции верхнего ЖКТ, секреции желудочной кислоты и секреции экзокринных клеток поджелудочной железы. Полагают, что "центрально"PYY действует, главным образом, на пресинаптические ингибирующие Y2 рецепторы на NPY/AgRP нейронах в дугообразном (аркуатном) ядре, к которому он поступает из крови (Batterham et al., 2002,Nature, 418: 650-4). Пептид выделяется в виде PYY1-36, но часть (около 50%) циркулирует в кровотоке в виде PYY3-36, который является продуктом разложения дипептидилпептидазы-IV, фермента, который удаляет дипептид с N-конца пептида при условии, что Pro или Ala находятся в положении два, как во всех трх РР-складчатых пептидах PP, PYY и NPY (Eberlein et al., 1989, Peptides, 10: 797-803). Таким образом, PYY в кровотоке представляет собой смесь PYY1-36, который действует как на Y1, так и на Y2 рецепторы (так же как Y4 и Y5 с различной аффинностью), и PYY3-36, который обладает более низкой аффинностью в отношении рецепторов Y1, Y4 и Y5 рецепторов, чем в отношении Y2 рецептора.PP представляет собой гормон, который выделяется эндокринными клетками в панкреатических островках, хотя регулируется исключительно вагусно холинергическими влияниями, выявляемыми,главным образом, при потреблении пищи (Schwartz, 1983, Gastroenterology 85: 1411-25). PP оказывает различное действие на желудочно-кишечный тракт, но оно обычно не наблюдается в изолированных клетках и органах и, очевидно, зависит от отсутствия нарушения вагусной иннервации (Schwartz, 1983,Gastroenterology 85: 1411-25). В соответствии с этим PP рецепторы, называемые Y4 рецепторами, расположены, главным образом, в области пострема в стволе мозга с сильной экспрессией в моторных вагусных нейронах, активация которых вызывает периферические эффекты PP, и в ядрах одиночного пучка(NTS), активация которых вызывает действие PP как гормона насыщения (Whitecomb et al., 1990, Am. J.PP в крови имеет доступ к этой области мозга, так как гематоэнцефалический барьер "пропускает" в этой области, где обнаруживаются различные гормоны с периферии. Недавно были приведены доводы, что влияние PP на потребление пищи частично опосредуется действием на нейроны - в особенности POMC/CART нейроны в дугообразном ядре (Batterham et al.,2004, Abstract 3.3 International NPY Symposium in Coimbra, Portugal). PP действует через Y4 рецепторы, к которым он обладает аффинностью в субнаномолярных концентрациях, в отличие от PYY и NPY, которые проявляют аффинность к этому рецептору в наномолярных концентрациях (Michel et al., 1998, Pharmacol. Rev. 50:143-150). PP также проявляет заметную аффинность к рецептору Y5, но она, по-видимому,не имеет физиологического значения для циркуляции PP вследствие как отсутствия доступа к клеткам в ЦНС, где этот рецептор главным образом экспрессируется, и вследствие относительно низкой аффинности к PP. Рецепторы PP-складчатых пептидов Существует четыре точно установленных типа рецепторов РР-складчатых пептидов у человека: Y1,Y2, Y4 и Y5, которые распознают NPY1-36 и PYY1-36 с аналогичной аффинностью. Было высказано предположение о типе рецептора Y3, который мог иметь предпочтение в отношении NPY по сравнению с PYY, но в настоящее время его не принимают как реальный подтип рецепторов (Michel et al., 1998,Pharmacol. Rev. 50:143-150). Был клонирован подтип рецепторов Y6, который в организме человека экспрессируется в усечнной форме, не содержащей TM-VII, а также в виде хвоста рецептора, и, следовательно, по меньшей мере, сам по себе, по-видимому, не может образовывать функциональную рецепторную молекулу.Y1 receptors. Исследования по аффинности наводят на мысль, что Y1 одинаково хорошо связывается как с NPY,так и с PYY, но, в принципе, не с PP. Аффинность к Y1 зависит от идентичности обеих концевых последовательностей РР-складчатой молекулы (NPY/PYY), например являются важными остатки Tyr1 и Pro2,и зависит от того, чтобы пептидные концы были представлены "правильным образом". На С-конце, где важными являются боковые цепи некоторых остатков, Y1 рецептор подобно Y5 и Y4 рецептору, но неY2 рецептору, допускает некоторые замены в положении 34 (обычно Gln), такие как Pro (Fuhlendorff etal., 1990, J. Biol. Chem. 265: 11706-12; Schwartz et al. 1990, Annals NY Acad. Sci. 61: 35-47). Сообщалось о некоторых исследованиях зависимости структура-функция, касающихся требований Y1 и Y2 рецепторовY2 рецепторы. Исследования аффинности наводят на мысль, что Y2 одинаково хорошо связывается как с NPY, так и с PYY, но, в принципе, не с PP. Для рецептора нужен, главным образом, С-конец PP-складчатого пептида (NPY/PYY). Таким образом, длинные С-концевые фрагменты, например вплоть до NPY13-36 (целая альфа-спираль плюс С-концевой гексапептид), распознаются с относительно высокой аффинностью, т.е. в пределах десятикратной величины аффинности полноразмерного пептида (Sheikh et al., 1989, FEBSLett. 245: 209-14, Sheikh et al., 1989, J. Biol. Chem. 264: 6648-54). Следовательно, различные N-концевые делеции, которые приводят к утрате связывания с Y1 рецептором, позволяют вс ещ до некоторой степени сохранять связывание с Y2 рецептором. Однако аффинность С-концевых фрагментов снижается,примерно, в 10 раз по сравнению с NPY/PYY даже для сравнительно длинных фрагментов. Остаток Gln в положении 34 NPY и PYY является в высшей степени важным для распознавания лиганда Y2 рецептором (Schwartz et al., 1990, Annals NY Acad. Sci. 611: 35-47).("субнаномолярная аффинность"), соответствующих концентрациям, обнаруживаемым в плазме, тогда как NPY и PYY распознаются со значительно более низкой аффинностью. Такие исследования наводят на мысль, что Y4 рецептор в высшей степени зависим от С-конца PP-складчатых пептидов и что относительно короткие N-концевые делеции уменьшают аффинность лигандов. Сообщалось о некоторых исследованиях структура-активность, относящихся к Y4 рецептору (Gehlert et al., 1996, Mol. Pharmacol. 50: 112-18; Walker et al., 1997, Peptides 18: 609-12).Y5 рецепторы. Исследования аффинности показывают, что Y5 одинаково хорошо связывается с NPY и PYY, но также связывается с PP с более низкой аффинностью, которая, однако, ниже обычных уровней этого гормона в кровотоке. PYY3-36 также хорошо распознатся рецептором Y5, однако этот рецептор по большей степени экспрессируется в ЦНС, где такой пептид не может легко получить доступ к рецептору при введении на периферии.PP-складчатые пептиды и их аналоги были предложены для применения при лечении ожирения и связанных с этим заболеваний, включая, например, синдром Прадера-Вилли, на основании действия этих пептидов, продемонстрированного на животных моделях и на человеке, и на основании того факта, что у людей с избыточным весом (ожирением) наблюдаются низкие базальные уровни PYY и PP, а также более слабые реакции этих пептидов на пищу (Hoist J.J. et al., 1983, Int. J. Obes. 7: 529-38; Batterham et al.,1990, Nature). Первоначально было показано, что вливание PP больным с синдромом Прадера-Вилли PP снижает потребление пищи (Berntson et al., 1993, Peptides, 14: 497-503), и этот эффект был подтверждн вливанием PP здоровым людям (Batterham et al., 2003, Clin. Endocrinol. Metab. 88: 3989-92). РР-складчатые пептиды также были предложены для применения при аналогичном терапевтическом ангиогенезе (Zukowska et al., 2003, Trends Cardiovasc. Med. 13: 86-92) и при воспалительном заболевании кишечника (см., например, Международную заявку WO 03/105763). Однако нативные РР-складчатые пептиды не являются оптимальными для применения в качестве биофармацевтических веществ. Например, полноразмерные пептиды PYY1-36 и NPY1-36 реагируют слишком неизбирательно со всеми типами рецепторов Y и, следовательно, будут вызывать побочные эффекты в сердечно-сосудистой системе и, например, рвоту, кроме того, природные пептиды не оптимизированы по устойчивости белка, так как их готовят таким образом, чтобы они действовали в течение сравнительно короткого времени в качестве нейропептида или гормона. Природный, более селективный в отношении Y2 пептид, PYY3-36, имеет, например, искажнную тыльную сторону, так что его РР-складчатая структура ухудшена вследствие элиминирования важного остатка Pro2 полипролиновой спирали, который в полноразмерном пептиде взаимодействует с Tyr27 в амфифильной спиральной области молекулы. Для лечения состояний, откликающихся на Y-рецепторную модуляцию, желательно, следовательно,использовать Y-рецепторные РР-складчатые пептиды или РР-складчатые пептиды-миметики, специфические в отношении выбранного Y рецептора, предполагаемого в качестве мишени, и которые устойчиво сохраняют элементы PP-складчатой структуры, важные для рецепторного связывания. В частности, было бы в высшей степени желательно использовать такие агенты, которые селективны в отношении Y2 и Y4 рецепторов по сравнению с Y1 рецептором. При некоторых состояниях, таких как ожирение и секреторная диарея, применение агониста как Y2, так и Y4 является благотворным. Поэтому одно соединение,обладающее обоими этими свойствами - агонизм Y2 и Y4 - было бы в высшей степени выгодным. Однако для клинических показателей важно, чтобы такое соединение было не только заметным агонистом рецептора Y1, так как стимуляция Y1 рецептора ведт к нежелательным побочным эффектам, таким как вредное воздействие на сердечно-сосудистую систему (например, повышение артериального давления) и на почки (например, натрийурез). Существуют природные соединения, которые являются селективными агонистами Y2 рецептора в противоположность Y2 рецептору, такие как PYY3-36, и которые предлагаются, например, для лечения ожирения. Имеются также соединения, которые являются селективными агонистами Y4 рецептора по сравнению с Y1 рецептором, такие как природный пептид PP, которые так-3 011861 же предлагаются для лечения ожирения. Имеются также соединения, которые, например, являются комбинированными агонистами Y1 и Y2 рецепторов, такие как природные пептиды PYY и NPY. Однако не сообщалось ни об одном известном соединении, которое было бы эффективным агонистом как Y2, так иY4 рецептора. Более того, ранее не предлагалось использовать комбинированный Y2 и Y4 агонист с селективностью к Y1 рецептору для терапевтического применения. Некоторые общие термины, применяемые в описании Аффинность: Аффинность пептида к специфическому рецептору выражается, например, величинойIC50, или величиной K1, или Kd, которая в конкретном неограничивающем примере определяется анализом, например, таким как анализ конкурентного связывания. Значение IC50 соответствует концентрации пептида, который замещает (релевантный для данного рецептора) радиоактивный лиганд, применяемый в количестве, значительно меньшем, чем Kd для этого радиоактивного лиганда, на 50%. Аппетит: Естественная потребность в еде или сильное желание еды. Повышенный аппетит обычно приводит к повышенному пищевому поведению. Супрессоры аппетита: Соединения, понижающие потребность в еде. Связывание: Специфическое взаимодействие между двумя молекулами такое, что две молекулы взаимодействуют. Связывание с рецептором может быть специфическим и селективным, так что преимущественно связывается одна молекула по сравнению с другой молекулой. Специфическое связывание можно определять константой диссоциации Kd. Эта величина зависит от селективности испытуемого соединения. Например, соединение с Kd ниже 10 нМ обычно считается прекрасным возможным лекарством. Однако соединение с низкой аффинностью, но селективное в отношении конкретного рецептора,также может быть хорошим возможным лекарством. Индекс массы тела (ИМТ, BMI): Математическая формула для измерения массы тела, иногда также называемая индексом Кветеля. BMI рассчитывают как частное от деления массы (кг) на рост (м). Современными стандартами как для мужчин, так и для женщин, принятыми за "нормальные", являются BMI около 20 кг/м 2. В одном варианте изобретения для определения страдающего ожирением субъекта можно применять BMI выше 25 кг/м 2. Первая степень ожирения соответствует BMI 25 кг/м 2. Вторая степень ожирения соответствует BMI 30-40 кг/м 2 и третья степень ожирения соответствует BMI выше 40 кг/м 2(Jequier, 1987, Ain. J. Clin. Nutr. 45: 1035-47). Идеальный вес тела различен у разных видов и индивидуумов и зависит от роста, строения тела, строения костей и пола. Потребление калорий, потребление в калориях: Число калорий (энергия), потребляемых индивидуумом. В контексте настоящего изобретения этот термин идентичен термину "потребление энергии". Косметическое лечение: Предполагается, что этот термин обозначает лечение не с медицинской целью, но для улучшения качества жизни субъекта, например внешнего вида субъекта. Этот термин включает лечение субъекта, желающего снизить свой вес, не будучи человеком, страдающим избыточным весом или ожирением. Потребление пищи: Количество пищи, потребляемой индивидуумом. Потребление пищи можно измерять объмом или весом. Это выражение включает: i) потребление пищи как общее количество поглощнной индивидуумом пищи; и ii) потребление пищи как количество белков, жиров, углеводов, холестерина, витаминов, минералов или любых других пищевых компонентов, поглощнных индивидуумом. Соответственно, выражение "потребление пищи" в контексте настоящего изобретения аналогично выражению "потребление энергии". Нормальная дневная диета: Среднее потребление пищи индивидуумом данного вида. Нормальную дневную диету можно выражать терминами "потребление калорий", "потребление белков", "потребление углеводов" и/или "потребление жиров". Нормальная дневная диета человека обычно содержит следующее: от около 2000, около 2400 или около 2800 до значительно большего числа калорий. Кроме того,нормальная дневная диета человека обычно включает примерно 12-45 г белка, около 120-610 г углеводов и около 11-90 г жиров. Низкокалорийная диета составляет, примерно, не более 85% и предпочтительно не более 70% нормального потребления в калориях человека. У животных потребности в калориях или в пище меняются в зависимости от вида и размера животного. Например, у кошек общее потребление калорий на кг, а также распределение белков, жиров и углеводов в процентах меняется с изменением возраста кошки и репродуктивного состояния. Ожирение: Состояние, при котором избыточный вес тела может стать причиной повышенного риска для здоровья человека (см. Barlow and Dietz, Pediatrics 102:E29, 1998; National Institutes of Health, National Heart, Lung and Blood Institute (NHLBI), Obes. Res. (suppl. 2): 51 S209S, 1998). Избыточный телесный жир является результатом дисбаланса между потреблением и расходом энергии. В одном варианте изобретения для оценки ожирения применяют индекс массы тела (BMI). В одном варианте изобретенияBMI примерно от 22 кг/м 2 (т.е. примерно на 10% выше нормального значения) и примерно до 30 кг/м 2 рассматривается как избыточный вес, особенно примерно от 25 до 30 кг/м 2, тогда как BMI 30 кг/м 2 или выше рассматривается как ожирение. Избыточный вес: Вес индивидуума (человека), который выше идеального веса его тела. Человек с избыточным весом может страдать ожирением, но необязательно ожирением. В одном варианте изобретения человеком, страдающим избыточным весом, является любой индивидуум, желающий снизить свой-4 011861 вес. В другом варианте изобретения человек с BMI примерно от 22 кг/м 2 (т.е. примерно на 10% выше нормального значения) и примерно до 30 кг/м 2 рассматривается как человек, страдающий избыточным весом, особенно примерно от 25 до 30 кг/м 2. Следует отметить, что субъекты, имеющие BMI немногим выше нормального значения (например, около 22-25 кг/м 2), очень часто желают снизить вес, хотя только в косметических целях. Эффективность (активность): In vitro эффективность соединения определяется величиной EC50, т.е. концентрацией, которая дат 50% максимально достижимого эффекта, определяемого релевантным для данного рецептора анализом передачи сигнала. Субъект: Субъект может быть любым субъектом, включая как человека, так и млекопитающих, следовательно, субъект может быть человеческим или нечеловеческим приматом, сельскохозяйственным животным, таким как свиньи, крупный рогатый скот, овцы и птицы, спортивным или домашним животным, таким как собаки, кошки, лошади, хомяки, и грызунами. Терапевтически эффективное количество: Доза, достаточная для предупреждения, лечения или уменьшения интенсивности состояния или заболевания и/или для ослабления специфических признаков или симптомов конкретного состояния или заболевания. Термин (выражение) включает дозу, достаточную для предупреждения прогрессирования или для того, чтобы вызвать регрессию нарушения, или дозу, способную облегчить признак или симптом нарушения, или дозу, которая позволяет достичь нужного результата. В вариантах изобретения, относящихся к косметическому лечению или к лечению избыточного веса или ожирения, терапевтический эффект рецепторного агониста определяется количеством,достаточным для ингибирования или прекращения увеличения веса тела, или количеством, достаточным для снижения аппетита, или количеством, достаточным для уменьшения потребления энергии или пищи или для повышения расхода энергии. Предполагается, что выражение (термин) "косметически эффективное количество" обозначает дозу, достаточную для достижения нужного эффекта при лечении субъекта. Подробное описание изобретения В свом самом широком аспекте настоящее изобретение охватывает применение Y-рецепторного агониста, селективного в отношении Y2 и Y4 рецепторов по сравнению с Y1 рецептором, для получения композиции для лечения состояний, откликающихся на активацию Y2 и/или Y4 рецепторов, причм:(а) указанный агонист является РР-складчатым пептидом или РР-складчатым пептидом-миметиком,который содержит:(i) С-концевую аминокислотную последовательность Y-рецепторного распознавания, представленную как X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2, где R1 и R2, независимо, обозначают водород или C1-C6 алкил, X обозначает Val, Ile, Leu или Ala, a X3 обозначает Gln или Asn, или е консервативно замещнный вариант, в котором Thr замещн на His или Asn, и/или Tyr замещн на Trp или Phe; и/или Arg замещн на(ii) N-концевую аминокислотную последовательность Y-рецепторного распознавания, представленную как H2N-X1-Pro-X2-(Glu или Asp)-, где X1 отсутствует или обозначает любой аминокислотный остаток, а X2 обозначает Leu или Ser, или консервативные замены Leu или Ser, или(б) указанный агонист содержит: С-концевую аминокислотную последовательность Y-рецепторного распознавания по определению в (i), см. выше,указанную последовательность Y-рецепторного распознавания, слитую с амфифильным доменом аминокислотной последовательности, содержащим по меньшей мере один альфа-спиральный поворот,прилегающий к N-концу указанной гексапептидной последовательности,указанный поворот заключн в спиральной конфигурации с помощью ковалентной внутримолекулярной связи, и, необязательно,N-концевую последовательность, которая начинается с аминокислотной последовательности Yрецепторного распознавания по определению в (ii), см. выше. Специфическая терминология, относящаяся к изобретению Агонисты, к которым относится настоящее изобретение, являются селективными в отношении Y2 иY4 рецепторов по сравнению с Y1 рецептором. В контексте настоящего изобретения это условие выполняется, если величина IC50 агониста по меньшей мере в 10 раз ниже в отношении Y2 и Y4 рецепторов,чем в отношении Y1 рецептора, при определении методами анализа аффинности по данному описанию. В целом, что касается эффективности (активности), величина EC50 агонистов по данному изобретению также по меньшей мере в 10 раз ниже для Y2 и Y4 рецепторов, чем в отношении Y1 рецептора, как определено анализом активности по данному описанию. Некоторые из предпочтительных агонистов по данному изобретению имеют величины аффинности и эффективности по меньшей мере в 100 раз выше в отношении Y2 и Y4 рецепторов, чем в отношении Y1 рецептора. Для целей данного описания РР-складчатый пептид представляет собой молекулу, имеющую 3-D структуру, которая, будучи картирована в оригинальной 3-D структуре птичьего PP, определнной методом PCA (Blundell et al., 1981, Proc. Natl. Acad. Sci. USA 78: 4175-79; Glover et al., 1984, Eur. J. Biochem. 142: 379-85), имеет домены, соответствующие доменам N-концевой полипролиноподобной спирали, области бета-поворота типа I, амфифильной альфа-спирали и С-концевого гексапептида указанного NPY,-5 011861PYY и/или PP и практически выравниваемые в них (фиг. 1). Таким образом, описание различных доменов РР-складчатых пептидов, применяемых в данном изобретении, относится к оригинальной рентгеновской структуре птичьего PP (Blundell et al., 1981, Proc. Natl. Acad. Sci. USA 78: 4175-79; Glover et al.,1984, Eur. J. Biochem. 142: 379- 85; Schwartz et al., 1990). РР-складчатый пептид-миметик по настоящему описанию обозначает молекулу, имеющую 3-D структуру, которая, при картировании на оригинальной 3-D структуре птичьего PP, по меньшей мере,имеет домены, соответствующие доменам последнего поворота амфифильной альфа-спирали и С-концевого гексапептида PP и практически выравниваемые в них. РР-складчатые пептид-миметики могут также, при вышеуказанном картировании, иметь домены, соответствующие одному или более остальных поворотов амфифильной альфа-спирали, N-концевой полипролиноподобной спирали и области бета-поворота типа I. Пептид-миметик необязательно состоит исключительно из последовательности альфа-аминокислот, связанных классическими пептидными связями. Одна или более связей в такой последовательности может быть замещена пептидомиметическими связями, такими как обратная амидная и восстановленная пептидная связи, так что пептид-миметик можно рассматривать как псевдопептидную последовательность. Такие замены связей могут придать устойчивость к расщеплению эндопептидазой и улучшить фармакодинамические свойства молекулы. Такие сравнения 3-D структуры, как упомянутые в выше приведнных определениях"РР-складчатого пептида" и "РР-складчатого пептида-миметика", можно делать, конструируя модели молекул сравнения на основании координат их атомов, определяемых, например, методом PCA, или с помощью одной или более компьютерных программ, выпускаемых для визуализации прогнозируемой на основании структурной формулы 3-D структуры молекулы, например "Maestro Modeling Environment" отSchrodinger Inc, 1500 S. W. First Avenue, Suite 1180 Portland, OR 97201; "Insight II Modeling Environment",версия 4.0, от Accelrys Inc. San Diego и "SYBYL 7.0" от Tripos Inc., 1699 South Hanley Rd., St. Louis,Missouri, 63144, USA. Следует отметить, что 3-D структура РР-складчатого пептида или РР-складчатого пептида-миметика по настоящему изобретению необязательно должна точно соответствовать, и обычно не соответствует точно, 3-D структуре природного NPY, PPY или PP. Наблюдаемая 3-D структура РР-складчатого пептида или РР-складчатого пептида-миметика в значительной степени зависит от применяемых экспериментальных условий, и в особенности малые пептиды могут казаться более или менее скрученными в определнных условиях. Однако достаточно, чтобы РР-складчатый пептид или РР-складчатый пептид-миметик имел домены, соответствующие РР-складчатым доменам, описанным выше, и чтобы он имел структурные элементы для того, чтобы принять общую определнную форму,аналогичную форме нативного пептида, в котором С-концевая и, при наличии, N-концевая последовательности были нормально ориентированы. Агонисты, к которым относится данное изобретение, имеют С-концевую последовательностьY-рецепторного распознавания (распознавания Y рецептором). Эта последовательность, обычно содержащая около 5-7 остатков и, в особенности, гексапептидную последовательность, расположена на С-конце агониста, которая, в случае е присутствия в РР-складчатом пептиде или РР-складчатом пептиде-миметике, связывается с Y рецептором и активирует рецептор за счт только лишь этого связывающего взаимодействия, или в результате такого связывающего действия и связывания с Y рецепторомY-рецепторного распознавания (распознавания Y рецептором) представляет собой последовательность,обычно содержащая около 3-5 остатков, главным образом, 4 остатка, расположенную на N-конце агониста, которая, в случае е присутствия в РР-складчатом пептиде или РР-складчатом пептиде-миметике,связывается с Y рецептором и активирует рецептор за счт комбинации такого связывающего действия и связывания с Y рецептором С-концевой Y-рецепторной последовательности, имеющейся в агонисте. Классические С- и N-концевые последовательности Y-рецепторного распознавания представляют собой последовательности, обнаруживаемые в природных PP, NPY и PPY пептидах, но как станет очевидно из данного описания, эти классические последовательности можно модифицировать для того, чтобы распознавать Y2 и Y4, но уменьшить распознавание Y1. В данном описании выражение, такое как "остаток,соответствующий положению N NPY", является ссылкой на аминокислотный остаток агониста, который,при картировании 3-D структуры агониста на NPY, отображается (картируется) наиболее близко к остатку N NPY. Действительная нумерация конкретного остатка в специфическом пептиде может отличаться от N, например, вследствие делеций в специфическом пептиде относительно природных пептидов. В целом, РР-складчатые агонисты или РР-складчатые агонисты-миметики, которые рассматриваются в настоящем изобретении, обычно имеют пептидный каркас или частично пептидный каркас, по меньшей мере, имеют С-концевую аминокислотную последовательность и, обычно, N-концевую аминокислотную последовательность, хотя остальная часть каркаса может представлять собой непептидный линкерный радикал, например линейную или разветвлнную алкиленовую цепь. Аминокислоты, присутствующие на пептидном(ых) участке(ах) агонистов, обычно являются природными, особенно в С- иN-концевых последовательностях, которые взаимодействуют с Y2 и Y4 рецепторах, но также могут присутствовать неприродные альфа-аминокислоты, которые поддерживают РР-складку, но не предупреждают Y2- и Y4-рецепторное связывание.-6 011861 Если агонист по настоящему изобретению содержит С- и N-концевые аминокислотные последовательности, то С-концы могут быть амидированы и/или N-концы могут быть ацилированы с целью придать резистентность карбокси- и/или аминопептидазам. На самом деле С-конец нативных NPY, PYY и PP пептидов амидирован, так что С-концевая аминокислота агониста по изобретению также амидирована. В данном описании ссылки на аминокислоты даются в виде их обычных названий или в виде сокращений, например валин (Val), лейцин (Leu), изолейцин (Ile), метионин (Met), фенилаланин (Phe), аспарагин (Asn), глутаминовая кислота (Glu), глутамин (Gln), гистидин (His), лизин (Lys), аргинин (Arg),аспарагиновая кислота (Asp), глицин (Gly), аланин (Ala), серин (Ser), треонин (Thr), тирозин (Tyr), триптофан (Trp), цистеин (Cys) и пролин (Pro). Когда называется обычное название или аббревиатура без указания стереоизомерной формы, следует понимать, что речь идт об L-форме рассматриваемой кислоты. Когда подразумевается D-форма, она специально указывается в названии аминокислоты. Иногда, когда этого требует контекст, L-форма скорее описывается, нежели подразумевается. Термин "консервативная замена" по данному описанию обозначает, что одна или более аминокислот замещены на другой, биологически сходный остаток. Примеры включают замену на аминокислотные остатки со сходными характеристиками, например малые аминокислоты, кислые аминокислоты, полярные аминокислоты, основные аминокислоты, гидрофобные аминокислоты и ароматические аминокислоты. Неограничивающие примеры консервативных аминокислотных замен, пригодных для применения в настоящем изобретении, включают консервативные аминокислотные замены, представленные в приведнной ниже таблице, и аналогичные замены исходного остатка неприродными альфа-аминокислотами с аналогичными характеристиками. Например, в предпочтительном варианте изобретения остатки Met замещаются на норлейцин (Nle), биоизостер Met, который, в отличие от Met, трудно окисляется. Другим примером консервативной замены на остаток, обычно не присутствующий в эндогенных пептидах и белках млекопитающих, является консервативная замена Arg или Lys, например, на орнитин, канаванин,аминоэтилцистеин, или другая основная аминокислота. Более подробные сведения о фенотипически молчащих заменах в пептидах и белках даны, например, в Bowie et al. Science, 247, 1306-1310, 1990. Если не указано иначе в контексте, в котором он встречается, термин "замещнный" в применении к любому фрагменту по данному описанию означает имеющий до четырх совместимых заместителей,каждый из которых, независимо, может представлять собой, например, (C1-C6)алкил, (C1-C6)алкокси,гидрокси, гидрокси(C1-C6)алкил, меркапто, меркапто(C1-C6)алкил, (C1-C6)алкилтио, галоген (включая фтор, бром и хлор), трифторметил, трифторметокси, нитро, нитрил (-CN), оксо, фенил, -COOH, -COORA,-CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2, -NHRA, -NRARB,-OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA, -NRBSO2OH, -NHCONH2,-NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB, независимо,обозначают (C1-C6)алкильную группу. "Возможный (необязательный) заместитель" может представлять собой одну из приведнных выше замещающих групп. Если контекст не диктует иначе, ссылки по данному описанию на NPY, PYY и PP пептиды и их последовательности относятся к человеческим формам этих пептидов и их последовательностям. Однако часто NPY, PYY и PP пептиды других млекопитающих составляют РР-складчатые пептиды-миметики человеческих NPY, PYY и PP или консервативно замещнных человеческих NPY, PYY и PP, когда эти термины применяются в данном описании. Агонисты типа (а) для применения по данному изобретению Обычно агонисты типа (а) являются РР-складчатыми аналогами NPY, PYY и PP или РРскладчатыми миметиками NPY, PYY и PP, имеющими модификации для того, чтобы гарантировать различие (разделение) аффинности и активности в отношении Y2 и Y4 рецепторов по сравнению с Y1 рецетором. Такие РР-складчатые аналоги и миметики включают пептиды, имеющие полный комплемент ха-7 011861 рактеристик РР-складчатых пептидов (N-концевую полипролиноподобную спираль, бета-поворот, амфифильную альфа-спираль и С-концевой гексапептид), пептидные аналоги, в которых часть каркаса (например, остатки бета-поворота и прилегающие остатки) замещена на непептидную спейсерную цепь, и усечнные (процессированные) пептиды, содержащие С-концевой гексапептид и последний поворот амфифильной альфа-спирали, но не содержащие целую полипролиноподобную спираль или е часть и/или весь бета-поворот или его часть. В С-концевой аминокислотной последовательности Y-рецепторного распознавания агонистом по данному изобретению R1 и R2, каждый независимо, предпочтительно обозначают водород. Предпочтительно также остаток X обозначает Val или Ile. В тех случаях, когда агонист по изобретению является PP последовательностью с модификациями по изобретению на С-конце, остаток X может представлять собой, например, Leu, Val или Ile. В тех случаях, когда агонист по изобретению представляет собой PYY или NPY последовательность с С-концевыми модификациями по данному изобретению, остаток X может являться, например, Val или Ile. В одном варианте изобретения агонисты, которые рассматривает данное изобретение, содержат Сконцевую последовательность Y-рецепторного распознавания, представленную как -ХА-X-Thr-Arg-X3Arg-Tyr-C(=O)NR1R2, где остаток ХА не является основным или кислым, а последовательность -X-ThrArg-X3-Arg-Tyr-C(=O)NR1R2 определяется выше. В этом случае не основный и не кислый аминокислотный остаток XA может представлять собой, например, Leu, Met или Nle, Ile, Val или Ala. В другом варианте изобретения агонист содержит С-концевой ундекапептид, представленный как-XC-Tyr-XB-Asn-XA-X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2, где последовательность -XA-X-Thr-Arg-X3-ArgTyr-C(=O)NR1R2 определяется выше, XC обозначает Arg или Lys, а XB обозначает Ile, Leu или Val. В агонисте такого класса C-концевая ундекапептидная последовательность представляет собой -Arg-Tyr-LeuAsn-(Leu или Met)-Val-Thr-Arg-Gln-Arg-Tyr-C(=O)NH2. В другом варианте изобретения агонист содержит С-концевую ундекапептидную последовательность, представленную как -XC-Tyr-XB-Asn-ХА-X-Thr-Arg-X3-Arg-Tyr-C(=O)NR1R2, где определение последовательности -XA-X-Thr-Arg-Gln-Arg-Tyr-C(=O)NR1R2 дано выше, XC обозначает His, Asn или Gin, аXB обозначает Ile, Leu или Val. В агонисте такого класса С-концевая ундекапептидная последовательность представляет собой -His-Tyr-(Ile или Leu)-Asn-Met-Leu-Thr-Arg-Gln-Arg-Tyr-C(=O)NH2. В С-концевой аминокислотной последовательности Y-рецепторного распознавания агонистов типа(а), которые рассматриваются в настоящем изобретении, остаток X1 предпочтительно обозначает Ala,или может отсутствовать, а остаток X2 предпочтительно обозначает Leu, Ile или Ser. Следовательно, одной предпочтительной N-концевой последовательностью является H2N-Ala-Pro-Leu-Glu-. Другой предпочтительной N-концевой последовательностью является последовательность H2N-Pro-Leu-Glu-. Агонисты типа (b) для применения по данному изобретению Обычно агонисты типа (b) можно рассматривать как типа (а) аналоги PP-складчатых пептидов или РР-складчатые миметики, минимальные структурные признаки которых (С-концевая последовательностьY-рецепторного распознавания и последний поворот альфа-спирали) стабилизированы с помощью определнной внутримолекулярной ковалентной связи. Типа (b) агонисты, рассматриваемые в настоящем изобретении, могут являться PP-складчатыми миметиками, которые содержат N-концевую последовательность Y-рецепторного распознавания, обсуждавшуюся выше в связи с агонистами типа (а), или они могут быть усечнными по N-концу РР-складчатыми миметиками, которые не содержат N-концевой последовательности Y-рецепторного распознавания типа, описанного для агонистов типа (а) (хотя они могут иметь другие N-концевые аминокислотные последовательности). Следовательно, N-концевая последовательность распознавания рецептором по определению для агонистов типа (а) не обязательна для класса агониста типа (b). Агонисты этого типа характеризуются внутримолекулярной связью, которая либо не имеет эквивалента в нативных NPY, PYY или PP пептидах, либо соответствует нековалентному взаимодействию, или замещает нековалентное взаимодействие с ковалентной связью, например, ковалентный дисульфидный мостик между Cys2 и D-Cys27 в [Cys2,D-Cys27,Gln34]PP (SEQ ID No: 22). Установлено, что такая связь может служить для стабилизации обязательных элементов РР-складчатой структуры, в частности подвижной С-концевой последовательности Y2-распознавания и последнего поворота альфа-спирали, и/или презентации N-конца. В полноразмерных или близких к полноразмерным пептидах такая связь может стабилизировать нативную РР-складчатую структуру как таковую. Это выгодно по двум причинам: вопервых, она стабилизирует С-концевую аминокислотную последовательность Y-рецепторного распознавания, оптимально повышая активность в отношении Y рецептора; во-вторых, за счт стабилизации целой РР-складки как таковой пептид становится менее чувствительным к протеолитическому расщеплению, так как для таких ферментов часто требуется, чтобы такие целевые последовательности находились в относительно нескрученной форме (Schwartz et al., 1990). Внутримолекулярная связь может также способствовать Y2/Y4-селективным агонистам, которые трудно модифицируются сравнительно со структурой нативных пептидов, например агонистам, у которых отсутствует один или более доменов, или участков доменов, имеющихся в нативных пептидах.-8 011861 Одна группа такого типа (b) имеет РР-складчатую структуру, в которой ограничивающая спиральный поворот внутримолекулярная связь тянется от аминокислотного остатка в амфифильном домене до точки связывания с N-концевым участком агониста, в соответствии с доменом полипролина РР-складчатого пептида, который тянется антипараллельно амфифильному домену. Сдерживающая спиральный поворот внутримолекулярная связь, например дисульфидная или лактамная связь, в вышеприведнных случаях может простираться от аминокислотного остатка в амфифильном домене до одного из остатков в полипролиноподобном домене. Если агонист является РР-складчатым миметиком, первые четыре аминокислотных остатка которого картируются на соответствующие N-концевые положения PP,NPY или PYY, сдерживающая спиральный поворот внутримолекулярная связь, например дисульфидная или лактамная связь, в вышеприведнных случаях может тянуться от аминокислотного остатка в амфифильном домене до одного из этих четырх N-концевых остатков, как, например, в[Cys2,D-Cys27,Gln34]PP (SEQ ID No: 22). В другой группе агонистов типа (b) сдерживающая спиральный поворот внутримолекулярная связь соединяет остатки в последнем спиральном повороте домена альфа-спирали, например лактамная связь между остатками Lys и Glu в спиральном повороте, или остаток в С-концевой аминокислотной последовательности Y2-распознавания и остаток в последнем спиральном повороте домена альфа-спирали, например лактамный мостик между Lys28 и Glu32 [Lys28,Glu32]PP25-36 (SEQ ID No: 28). Агонисты типа (а) и (b) В одной группе РР-складчатых агонистов-миметиков, рассматриваемых в данном изобретении, типа (а) и (b), в которых агонист содержит как С-концевую, так и N-концевую последовательностьY-рецепторного распознавания, С-концевая последовательность может быть слита по своему N-концу с доменом амфифильной аминокислотной последовательности, содержащим по меньшей мере один альфаспиральный поворот, прилегающий к N-концу С-концевой гексапептидной последовательности, причм указанные С- и N-концевые аминокислотные последовательности соединены линкерным радикалом, который может представлять собой линейный или разветвлнный алкиленовый радикал, необязательно содержащий одну или более двойных или тройных связей. Например, С- и N-концевые аминокислотные последовательности могут соединяться пептидными связями, соответственно, с карбоксильной или аминогруппами аминокислоты формулы NH2(CH2)nCO2H, где n имеет значение от 2 до 12, главным образом 6, 7, 8, 9 или 10. Так, агонист может являться РР-складчатым миметиком NPY, PPY или PP, который содержит вышеуказанные С-концевую и N-концевую последовательности Y-рецепторного распознавания с описанным мостиком Cys-Cys, но при этом его аминокислотные остатки, соответствующие 5-24 нативного пептида, замещены на аминокарбоновую кислоту с углеродной цепью, содержащей 6-10 атомов углерода, выбранную их группы, состоящей из 6-аминогексановой кислоты (ипсилон-аминокапроновой кислоты), 7-аминогептановой кислоты, 8-аминооктановой кислоты, 9-аминононановой кислоты и аминодекановой кислоты. В конкретных вариантах изобретения предпочтительны 8-аминооктановые кислоты(в данном описании иногда сокращнно называемые "Аос"). Примером такого агониста является[Cys2,Aoc5-24,D-Cys27,Gln34]PP (SEQ ID No: 23). Некоторые агонисты тех типов, к которым относится настоящее изобретение, можно рассматривать либо 1) как аналоги NPY или PYY пептидов, в которых остатки, имеющиеся в некоторых важных положениях в PP, но не в соответствующих положениях NPY или PYY, замещены на остатки, соответствующие PP остаткам, или на природные или неприродные остатки, сходные по структуре (консервативная замена) остаткам, соответствующим PP остаткам, или 2) как аналоги PP, в котором остатки в некоторых важных положениях NPY или PYY, но не в соответствующих положениях PP, замещены на остатки, соответствующие NPY или PYY остаткам, или на природные или неприродные остатки, сходные по структуре остаткам, соответствующим NPY или PYY остаткам. Как описано выше и как показано на фиг. 1, Y рецепторы распознают остатки, локализованные на общих С- и N-концах пептидов, представленных РР-складчатыми пептидами или РР-складчатыми миметиками. Обычно PP пептиды не распознаются Y2 рецептором вследствие присутствия остатков, главным образом, на С-конце PP, несовместимых с высокоаффинным связыванием и активностью пептида на Y2 рецепторе. Однако заменой одного или более остатков в молекуле PP или PP-складчатого миметика PP на соответствующий остаток NPY или PYY можно повысить аффинность пептида на Y2 рецепторе без потери аффинности и активности на Y4 рецепторе, или только в сравнительно малой степени уменьшив аффинность и активность на Y4 рецепторе. В представленной ниже таблице показаны остатки, отличающиеся в N- и C-концевых последовательностях PP, NPY и PYY, т.е. остатки в положениях 1, 3, 4, 26, 28, 30, 31 и 34. Заданную общую Y2 иY4 высокую аффинность можно получить с помощью вышеописанной гомологичной замены в одном или более этих положений. Однако предпочтительной заменой в PP для достижения высокой аффинности и активности на Y2 рецепторе при сохранении аффинности и активности на Y2 рецепторе является замена Pro34 на Gln или на неприродный остаток с аналогичными физико-химическими свойствами. Поэтому [Gln34]PP является в высшей степени предпочтительным пептидом, так же как PP аналоги или миметики, в которых Gln34 совмещается с заменой одного или более не-NPY/He-PYY остатка в PP на соответствующий остаток, или остаток с аналогичными физико-химическими свойствами, или неприродную аминокислоту с аналогичными свойствами.-9 011861 Следует, однако, отметить, что разрешнные гомологичные замены по настоящему изобретению представляют собой такие замены, которые приводят к агонистам по данному описанию, так как не все возможные замены, предлагаемые в таблице, обеспечивают заданные свойства пептида. Например, введение Pro в положение 34 в PYY или NPY уменьшает аффинность пептидов в отношении Y2 рецептора слишком заметно для того, чтобы этот аналог применялся в настоящем изобретении, хотя эта замена обеспечивает высокую аффинность в отношении Y4 рецептора. Специфические агонисты для применения по данному изобретению Ниже представлены конкретные примеры агонистов для применения по данному изобретению- 10011861 и их аналоги с консервативными заменами. Особенно предпочтительными Y2/Y4-селективным агонистами для применения по настоящему изобретению являются [Gln34]PP (SEQ ID No: 4) и [Ala1,Glu4,Arg26,(Met30 или Nle30)]PYY(SEQ ID No: 12) или их аналоги с консервативными заменами. Агонисты, пригодные для применения по данному изобретению До настоящего времени основные Y2/Y4-селективные агонисты для применения по настоящему изобретению были описаны в целом и приводились конкретные примеры таких агонистов. Однако такие агонисты, включая специфически идентифицированные агонисты, можно подвергнуть различным модификациям с целью улучшения их фармакокинетических, фармакодинамических и метаболических свойств. Такие модификации могут включать связывание агониста с функциональными группами (также известными как мотивы), известными сами по себе в технике пептидных или белковых фармацевтических веществ. Три конкретные модификации, дающие конкретное преимущество в случае агонистов,которые рассматривает настоящее изобретение, вне зависимости от типа (а) или (b), представляют собой элемент с мотивами связывания с сывороточным альбумином, или мотив связывания гликозаминогликана (GAG), или ПЭГилирование. Мотивы связывания сывороточного альбумина Мотивы связывания сывороточного альбумина (мотивы, связывающие сывороточный альбумин) обычно являются липофильными группами, вводимыми для того, чтобы способствовать продолжительному пребыванию в организме после введения, или по другим причинам, которые могут связываться различными известными способами с пептидными или белковыми молекулами, например, i) ковалентной связью, например, с помощью функциональной группы в боковой цепи аминокислотного остатка, ii) за счт функциональной группы, встроенной в пептид или подходящим образом дериватизированный пептид, iii) в виде единого участка пептида. Например, в Международной заявке WO 96/29344 (Novo NordiskChem. 43: 1664-69, описан ряд липофильных модификаций, которые можно использовать для агонистов,которые рассматриваются в данном изобретении. Подходящие липофильные группы включают необязательно замещнные, насыщенные или ненасыщенные, линейные или разветвлнные углеводородные группы, содержащие 10-24 углеводных атома. Такие группы могут образовывать целую боковую цепь или часть боковой цепи в каркасе агониста, например, за счт простой эфирной, тиоэфирной, сложноэфирной или амидной связи с боковой цепью аминокислотного остатка скелета, или с углеродным атомом скелета или боковой цепи каркаса (скелета) непептидного линкерного радикала в скелете РР-складчатого миметика-агониста. Химический способ присоединения липофильной группы не важен, но приведнные боковые цепи, включая липофильные группы, являются примерами групп, которые могут связываться со скелетным углеродом агониста или его подходящего ответвления и состоят из где n обозначает целое число от 9 до 15,где r обозначает целое число от 9 до 15,где s обозначает целое число от 9 до 15,где m обозначает целое число от 8 до 18,где p обозначает целое число от 10 до 16,где q обозначает целое число от 10 до 16,где n обозначает целое число от 9 до 15,где p обозначает целое число от 10 до 18,где m обозначает целое число от 8 до 18,где p обозначает целое число от 10 до 16,где q обозначает целое число от 10 до 16, и частично или полностью гидрированного циклопентанофенантренового скелета.- 11011861 В одном методе химического синтеза боковая цепь, содержащая липофильную группу, представляет собой C12, C14, C16 или C18 ацильную группу, ацилирующую аминогруппу в боковой цепи остатка каркаса агониста. Как указывалось, модификация агонистов для применения с целью улучшить характеристики связывания с сывороточным белком является методом, который можно применять в целом и,в частности, в случае специфических агонистов, перечисленных выше. Так, например, [Lys11,Gln34]PP и его аналоги с консервативными заменами могут быть модифицированы вышеописанным способом, например тетрадеканоилацетилированием Lys11, или [Lys13,Gln34]PP может модифицироваться с образованием [N-(N'-гексадеканоил)-гамма-глутамоил-Lys13,Gln34]РР, а [Ala1,Glu4,Lys13,Arg26,Nle30]PYY может модифицироваться с образованиемGAG-связывание Как и в случае мотивов липофильного связывания с сывороткой, обсуждавшегося выше, агонисты,рассматриваемые в данном изобретении, можно модифицировать, вводя мотив GAG связывания в качестве боковой цепи, или участка боковой цепи скелета агониста. Известные GAG-связывающие мотивы для введения таким способом включают аминокислотные последовательности XBBXBX и/илиXBBBXXBX, где B обозначает остаток основной аминокислоты, a X обозначает любую аминокислоту. Несколько, например три, таких последовательностей можно ввести с образованием конкатамерныхGAG-связывания и аминогруппой в боковой цепи аминокислоты в каркасе агониста, такой как ипсилонаминогруппа Lys18 в агонисте [Lys18,Gln34]PP (SEQ ID No: 24), с образованием [N-(Ala-Arg-Arg-ArgAla-Ala-Arg-Ala)3-Lys18,Gln34]PP, или Lys13 в агонисте [Ala1,Glu4,Lys13,Arg26,Nle30]PYY с образованием [Ala1,Glu4,N-(Ala-Axg-Arg-Arg-Ala-Ala-Arg-Ala)3-Lys13,Arg26,Nle30]PYY. Вместо того, чтобы присоединяться к агонисту в виде боковой цепи, или части боковой цепи каркасного остатка, GAG мотив может ковалентно связываться с С- или (предпочтительно) с N-концом агониста либо непосредственно, либо через линкерный радикал. В этом случае GAG-связывающий мотив может также содержать аминокислотную последовательность XBBXBX и/или XBBBXXBX, где В обозначает основной аминокислотный остаток, a X обозначает любой аминокислотный остаток, например последовательность [XBBBXXBX]n, где n обозначает число от 1 до 5, В обозначает основной аминокислотный остаток, a X обозначает любой аминокислотный остаток, в частности Ala-Arg-Arg-Arg-Ala-AlaArg-Ala-Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-[Gln34]PP (SEQ ID No: 26).Y2/Y4 селективные агонисты, к которым относится настоящее изобретение, применимы, среди прочего, для терапевтического ангиогенеза. В частности, для такого применения агонисты предпочтительно содержат мотив, связывающий гликозаминогликан (GAG), обсуждавшийся выше. Такие мотивы гарантируют, что агонисты связываются с GAG во внеклеточной матрице, и тем самым обеспечивают пролонгированную локальную экспозицию Y рецепторов в этой ткани. Факторы роста, хемокины и т.д. связываются с GAG за счт участков основных аминокислот, которые взаимодействуют с кислыми сахарами GAG. Эти положительно заряженные эпитопы на факторах роста обычно состоят из боковых цепей основных остатков, которые в последовательности необязательно расположены последовательно, но часто находятся в непосредственной близости за счт элемента вторичной структуры, такого как альфаспираль или поворот, или за счт общей трхмерной структуры белка. Описаны некоторые GAGсвязывающие линейные последовательности, обсуждавшиеся выше, например XBBXBX и XBBBXXBX,где В представляет собой основной остаток (Hileman et al. Bioassays, 1998, 20: 156-67). Методом кругового дихроизма было показано, что эти сегменты при связывании с GAG образуют альфа-спирали. Если такие последовательности помещены, например, в конкатамерную или дендримерную конструкцию, где присутствуют три таких последовательности, например каждая в виде ARRRAARA последовательности,результирующий 24-мерный пептид, например ARRRAARA-ARRRAARA-ARRRAARA, гарантирует сохранение во внеклеточной матрице, аналогичной высокомолекулярному полилизину, т.е. он не вымывается в течение 4-часового вливания (Sakharov et al. FEBS Lett., 2003, 27: 6-10). Таким образом, факторы роста и хемокины естественно создаются с двумя типами связывающих мотивов: один мотив связывания рецептора, с помощью которого осуществляется сигнальная трансдукция, и один мотив связывания с GAG, с помощью которого достигается присоединение и пролонгированная локальная активность. Пептиды, такие как NPY и PP, являются нейропептидами и гормонами,которые достаточно быстро вымываются из ткани, а не оптимизируются для пролонгированной активности. Присоединяя GAG-связывающий мотив к Y2/Y4 селективному агонисту по настоящему изобретению создают бифункциональную молекулу, аналогичную факторам роста и хемокинам, содержащую как эпитоп, ответственный за связывание с рецептором на РР-складчатом пептидном участке, так и GAGсвязывающий мотив. Кроме того, за счт включения GAG-связывающего мотива модифицированный пептид имеет свойство дольше оставаться в ткани при инъекции, например, подкожно или внутримы- 12011861 шечно или трансдермально, или аналогичным образом доставляться в ткань как таковой. Поэтому GAGмодифицированный пептид также входит в состав препарата пролонгированного действия, который может быть в высшей степени предпочтительным для медленного высвобождения в кровоток и пролонгированного способа действия. Другим подходящим положением для введения GAG-связывающего мотива, такого как конкатамерная или дендримерная конструкция, РР-складчатых пептидов является положение 14 для NPY пептидов и их аналогов, и положение 13 для PYY и PP пептидов. Как для пептидов типа NPY, PYY, так и для пептидов типа PP другими предпочтительными положениями являются положения 11 и 18. Однако, как обсуждалось выше, остаток, содержащий GAG-связывающий мотив, можно ввести в любое положение в агонистах при условии, что это введение согласуется с сохранением РР-складчатой структуры, требуемой в агонистах типа (а), (b) и (с), рассматриваемых в данном изобретении, и нужной С-концевой последовательностью Y2-распознавания. Так, GAG-связывающий мотив можно в качестве части спейсерной конструкции поместить в аналоги, в которых часть РР-складки замещена на непептидный спейсер. ПЭГилирование При ПЭГилировании полиалкиленоксидный радикал или радикалы ковалентно связан/связаны с пептидными или белковыми лекарствами с целью увеличения эффективного периода полужизни в организме после введения. Термин происходит от названия предпочтительного полиалкиленоксида, применяемого в таких процессах, а именно образованного из этиленгликоля полиэтиленгликоля, или "ПЭГ"("PEG"). Подходящий радикал ПЭГ может присоединяться к агонисту любым подходящим химическим методом, например, за счт каркасного аминокислотного остатка агониста. Например, в случае молекулы,подобной ПЭГ, в качестве присоединяющей группы часто применяется ипсилон - аминогруппа лизина или N-концевая аминогруппа. Другие присоединяющие (встраивающие) группы включают свободную карбоксильную группу (например, свободная карбоксильная группа С-концевого аминокислотного остатка или остатка аспарагиновой или глутаминовой кислоты), подходящим образом активированные карбонильные группы, меркаптогруппы (например, меркаптогруппы цистеинового остатка), остатки ароматических кислот (например, Phe, Tyr, Trp), гидроксигруппы (например, гидроксигруппы в Ser, Thr или OH-Lys), гуанидин (например, Arg), имидазол (например, His) и частицы окисленных углеводов. Если агонист является ПЭГилированным, он обычно содержит 1-5 молекул полиэтиленгликоля(ПЭГ), например 1, 2 или 3 молекулы ПЭГ. Каждая молекула ПЭГ имеет молекулярную массу примерно от 5 до примерно 100 кДа, например молекулярная масса составляет около 10-40 кДа, около 12 кДа или предпочтительно не более 20 кДа. Подходящие молекулы ПЭГ выпускаются фирмами Shearwater Polymers, Inc. и Enzon, Inc. и их можно выбрать из SS-PEG, NPC-PEG, альдегид-ПЭГ, mPEG-SPA, mPEG-SCM, mPEG-BTC, SC-PEG, трезилированный mPEG (патент США 5880255), или оксикарбонил-окси-N-дикарбоксиимид-ПЭГ (патент США 5122614). В особом варианте изобретения вышеупомянутый агонист [Lys13,Gln34]PP можно ПЭГилировать по Lys13 с образованием [N-PEG5000-Lys13,Gln34]PP (SEQ ID No: 40) или [Ala1,Glu4,Lys18,Arg26,(Met30 или Nle30)]PYY (SEQ ID No: 25) можно ПЭГилировать по Lys18. Сывороточный альбумин, GAG и ПЭГ Вне зависимости от того, осуществляется ли модификация агониста за счт присоединения групп для того, чтобы способствовать связыванию сывороточного альбумина, GAG-связыванию или повысить устойчивость с помощью ПЭГилирования, мотив связывания сывороточного альбумина, или мотивGAG-связывания, или ПЭГ радикал может являться боковой цепью или образовывать часть боковой цепи при каркасном углероде агониста, соответствующем любому из следующих положений PYY или PP: 1, 3, 6, 7, 10, 11, 12, 13, 15, 16, 17, 18, 19, 21, 22, 23, 25, 26, 28, 29, 30 и 32, соответствующем любому из следующих положений NPY: 1, 3, 6, 7, 10, 11, 12, 14, 15, 16, 17, 18, 19, 21, 22, 23, 25, 26, 28, 29, 30 и 32. Конъюгация с биомолекулами большего размера Как описывается выше, можно присоединять некоторые мотивы в различных положениях в РР-складчатом пептиде или РР-складчатом пептиде-миметике, не ослабляя их высокую Y-рецепторную аффинность (см. примеры). Аналогичным образом комбинированные селективные в отношении Y2-Y4 рецепторов агонисты можно использовать в качестве химерных (гибридных, слитых) белков, в которых они связаны, например, с альбумином или молекулой другого белка или носителя, что обеспечивает благоприятную фармакокинетику или другие свойства, например пониженное выведение почками. Как известно в технике, существует множество химических модификаций и линкеров, которые можно использовать для такого ковалентного соединения, так же как можно использовать множество белков или носителей. Особенно предпочтительно ковалентное присоединение селективного Y2-Y4 пептидного агониста к альбумину и в одном из положений РР-складчатой структуры, которое указано в другом месте данного описания в связи с модификациями с помощью различных мотивов. Такие гибридные белки можно получать различными полусинтетическими методами, когда пептид можно получать пептидным синтезом по данному описанию, а биомолекулу - методом рекомбинантной ДНК. Гибридный белок можно также получать целиком как рекомбинантную молекулу, экспрессированную, например, в виде молекулы- 13011861 предшественника, удлиннную за счт последовательности Gly-Lys-Arg, которая, будучи экспрессирована в виде секреторного белка в эукариотических клетках, отщепляется биосинтетическими ферментами,и Gly превращается в карбоксамид на С-концевом остатке Tyr С-концевой последовательностиY2-рецепторного распознавания. Стабилизация Как указывается в разных местах в данном описании, многие из селективных Y2-Y4 агонистов по настоящему изобретению стабилизируются различными способами, например N-концевым ацилированием или замещением каркасных участков агониста на непептидный линкер, или внутренней циклизацией за счт мостиковых связей для стабилизации РР-складчатой структуры. Эта стабилизация в большинстве случаев служит двум целям, причм одной целью является презентировать эпитопы рецепторного распознавания оптимальным образом в отношении Y2 и Y4 рецепторов за счт сохранения РР-складки; а второй целью является стабилизация пептида против расщепления, т.е. главным образом против протеолитического расщепления. Это особенно важно, когда селективные Y2-Y4 агонисты также модифицированы для того, чтобы продлить период полужизни, достичь пролонгированного высвобождения и/или продолжительной экспозиции с тканями, за счт присоединения различных мотивов, обсуждавшихся выше. Обычно пептидные агонисты очень быстро выводятся, главным образом, через почки, и устойчивость белка как таковая может быть неважна; однако, когда присутствие пептида в различных жидкостях организма продлевается одним или более способами на несколько часов, особенно важно, чтобы биологическая активность пептида также оставалась интактной, т.е. чтобы пептид стабилизировался в форме,устойчивой к протеолитическому воздействию, описанному как вообще, так и в отношении специфических примеров селективных Y2-Y4 пептидов-агонистов, например PP-складчатых стабилизированных,циклических [Cys2,D-Cys27]PP и их различных аналогов. Так, в предпочтительных вариантах изобретения объединенные Y2-Y4 селективные агонисты как стабилизированы структурно, с помощью структурных изменений, некоторые из них конкретно указаны в представленных ниже примерах, так и "декорированы" различными мотивами и/или слиты с биомолекулами и/или приготовлены фармацевтическими методами, которыми добиваются продолжительного высвобождения и т.д., для пролонгированной экспозиции с рецептором. Пептиды, индуцирующие спираль Ацилирование по N-концу агонистов, которые рассматривает данное изобретение, упоминалось как способ стабилизации агониста против действия аминопептидаз. Другая стабилизирующая модификация включает ковалентное присоединение стабилизирующей пептидной последовательности из 4-20 аминокислотных остатков ковалентно на N- и/или С-конце, предпочтительно на N-конце. Аминокислотные остатки в таком пептиде выбирают из группы, состоящей из Ala, Leu, Ser, Thr, Tyr, Asn, Gln, Asp, Glu,Lys, Arg, His, Met и т.д. В интересном варианте изобретения присоединяемый N-концевой пептид содержит 4, 5 или 6 остатков Lys, например Lys-Lys-Lys-Lys-Lys-Lys-[Gln34PP] (SEQ ID No: 29). Они могут присоединяться на N-конце PP-складчатого пептидного агониста или они могут быть помещены наN-конце усечнного по N-концу PP-складчатого агониста-миметика, или укороченного на N-конце РР-складчатого агониста-миметика, если спейсерный пептид вводится между новым N-концом стабилизирующего пептида. Общее описание таких удлинений (расширений) стабилизирующего пептида дано в Международной заявке WO 99/46283 (Zealand Pharmaceuticals), которая вводится в данное описание в качестве ссылки. Рецепторные агонисты, которые рассматриваются в настоящем изобретении, можно получать общеизвестными методами, например синтетическими, полусинтетическими и/или методами рекомбинантной ДНК. Способы включают стандартные методы получения пептидов, такие, например, как синтез в растворе и твердофазный синтез. Руководствуясь учебником и общими знаниями в данной области техники, специалист в этой области поймт, как получать агонисты и их производные и модификации. Далее описаны конкретные агонисты по изобретению наряду с их молекулярными фармакологическими свойствами, а также химическими свойствами и описанием устойчивости пептидов.[Ile31,Gln34]PP (SEQ ID No: 5) Этот пептид является аналогом PP, созданным с целью достижения высокой аффинности к Y2 рецептору путм введения Ile в положение 31 и Gln в положение 34, соответствующих остаткам, обнаруженным в этих положениях в NPY (Fuhlendorff et al. JBC 1990, 265: 11706-12). Профиль рецепторного распознавания.[Ile31,Gln34]PP имеет выражаемую однозначным числом наномолярную активность к человеческому Y4 рецептору (IC50=1,2 нМ), сходную с аффинностью PP (IC50=0,5 нМ), а аффинность [Ile31,Gln34]PP к Y2 рецептору 54 нМ, a IC50 в отношении Y1 рецептора составляет более 1000 нМ и, соответственно,[Не 31,Gln34]PP является селективным Y2-Y4 агонистом по сравнению с Y1 рецептором (табл. 1). Величины аффинности к Y рецепторам сообщались ранее, в то время был доступен только Y4 рецептор крысы, где было показано, что аффинность [Ile31,Gln34]PP равна около 50 нМ к Y4 рецептору крысы, что примерно в 100 раз ниже аффинности PP (Fuhlendorff et al. JBC 1990, 265: 11706-12, Schwartz et al.Y4 рецептора 0,91 нМ (величина EC50), в отношении Y2 рецептора EC50 6,5 нМ и в отношении Y1 рецептора величина EC50 составляет 48 нМ (табл. 2). Таким образом, по сравнению с ранее опубликованными данными по аффинности (Fuhlendorff et al. JBC 1990, 265: 11706-12, Schwartz et al. NYAC, 1990, 611: 3547) удивительным является то, что [Ile31,Gln34]PP на самом деле является агонистом с активностью, выражаемой однозначным числом, как против Y2, так и против Y4 рецептора, в отличие от выражаемой двузначным числом активности в отношении Y1 рецептора. Устойчивость белка аналогична устойчивости PP1-36.[Val31,Gln34]PP (SEQ ID No: 6) Так же как и [Ile31,Gln34]PP (SEQ ID No: 5), этот пептид является PP аналогом, созданным с целью достижения высокой аффинности к Y2 рецептору, но при сохранении высокой аффинности к Y4 рецептору, однако в данном случае путм введения Val в положение 31, соответствующего остатку, находящемуся в PYY в этом положении, и, опять же, Gln в положение 34, соответствующего остатку, обнаруженному в этом положении в NPY и PYY. Это новое соединение. Профиль рецепторного распознавания. Аффинность [Val31,Gln34]PP к Y4 рецептору составляет 0,93 нМ, а к Y2 рецептору - 69 нМ, тогда как аффинность к Y1 рецептору не удатся измерить даже при концентрациях 1000 нМ (табл. 1). Таким образом, [Val31,Gln34]PP является Y2-Y4 селективным лигандом. Что касается in vitro активности,[Val31,Gln34]PP имеет величину EC50 1,0 нМ в отношении Y4 рецептора и 9,9 нМ в отношении Y2 рецептора, тогда как его активность в отношении Y1 рецептора составляет 99 нМ (табл. 2). Устойчивость белка аналогична устойчивости PP1-36.[Gln34]PP (SEQ ID No: 4) Так же как [Ile31,Gln34]PP (SEQ ID No: 5) и [Val31,Gln34]PP (SEQ ID No: 6), этот пептид являетсяPP аналогом, созданным с целью достижения высокой аффинности к Y2 рецептору, однако в данном случае, за счт введения одного лишь Gln в положение 34, соответствующего остатку, обнаруженному в этом положении как в NPY, так и в PYY. Вследствие того, что положение 34 не является важным для распознавания PP Y4 рецептором, пептид проявляет двойственную высокую аффинность к Y2 и к Y4 рецепторам. В бычьем PP Gln вводят в положение 34, и обнаружено, что его аффинность к Y4 рецептору очень сходна с аффинностью самого бычьего PP, но этот пептид не испытывался в отношении Y2 рецептора (Gehlert et al., 1996, Mol Pharmacol. 1996 50: 112-8). В настоящем изобретении сделана замена Pro наGln в человеческом PP1-36 и показано, что [Gln34]PP неожиданно имеет высокую аффинность к Y2 рецептору, сходную с аффинностью NPY и PYY, и что он не связывается с Y1 рецептором. Таким образом,[Gln34]PP (т.е. [Gln34]человеческий PP1-36) является новым соединением, селективным к Y2 и Y4 рецептору в отличие от Y рецептора. Профиль рецепторного распознавания. Аффинность связывания [Gln34]PP с Y4 рецептором равна 1,2 нМ, а с Y2 рецептором - 9,0 нМ, тогда как аффинность к Y1 рецептору не удатся измерить даже при концентрациях 1000 нМ (табл. 1). Что касается in vitro активности, [Gln34]PP имеет величину EC50 1,1 нМ в отношении Y4 рецептора и 3,0 нМ в отношении Y2 рецептора, тогда как его активность в отношении Y1 рецептора составляет 388 нМ (табл. 2). Устойчивость белка аналогична устойчивости PP1-36.In vivo селективность рецептора. В исследовании с эскалацией дозы [Gln34]PP вводили внутривенным вливанием анестезированным собакам с последующей 30-минутной инфузией в дозах 0,3, 1, 3, 10, 30 и 100 мкг/кг. Уровни [Gln34]PP в плазме измеряют радиоиммунным анализом, который показывает линейную зависимость от дозы. При наивысших дозах уровни в плазме 100 нМ получают у собак. Тем не менее, никакого зависящего от дозы действия ни на кровяное давление, ни на частоту сердечных сокращений не наблюдают. Хорошо известно, что NPY и PYY, которые являются агонистами как к Y1, так и к Y2 рецепторам, при значительно более низких уровнях в плазме повышают кровяное давление. Таким образом, эти эксперименты показывают, что [Gln34]PP также in vivo является высокоселективным пептидом в отсутствие измеримойIn vivo действие на срочный прим пищи у мышей - PYY3-36, [Gln34]PP или физиологический солевой раствор вводят в виде подкожных инъекций группам из 8 мышей в дозах 3 или 30 мкг (PYY3-36) или 1 и 10 мкг ([Gln34]PP) каждому животному после 16 ч в отсутствие пищи. На фиг. 2 показано аккумулированное потребление пищи у мышей. PYY3-36 в дозе 30 мкг ингибирует потребление пище в течение первых двух часов, но действие постепенно ослабевает в последующие 2-6 ч. [Gln34]PP проявляет более выраженный и продолжительный ингибирующий эффект в отношении потребления пищи у мышей, чем PYY3-36. Так, даже в дозе 1 мкг наблюдается более эффективное ингибирование потребления пищи и этот эффект длится более 8 ч (фиг. 2). Таким образом, [Gln34]PP, который в 10 раз менее активен в отношении Y2 рецептора, как определено in vitro анализами (значения EC50 3,0 по сравнению с 0,24 дляPYY3-36, табл. 2), тем не менее, очевидно, более активен и оказывает более продолжительное действие на срочный прим пищи у мышей, предположительно, благодаря его действию также в качестве Y4 агониста.[Gln34]PP может по аналогии с другими представленными в данном описании примерами пептидов модифицироваться далее для различных фармакокинетических или других целей, при этом сохраняя общую Y2-Y4 селективность по сравнению с Y1. Например, остатки Met в положении 17 и/или 30 можно заместить, например, на Leu или Nle, один или более Lys или других предрасположенных к присоединению остатков можно ввести в различные положения для введения различных мотивов и т.д. При этом можно получить группу селективных Y2-Y4 пептидных агонистов, из которых можно выбрать соединения в качестве лекарств для лечения ожирения и т.д., представленные в другом месте данного описания.[Leu30,Gln34]PP (SEQ ID No: 7), [Nle30,Gln34]PP (SEQ ID No: 8),[Leu28,Gln34]PP (SEQ ID No: 9), [His26,Gln34]PP (SEQ ID No: 10) Так же как [He31,Gln34]PP (SEQ ID No: 5) и [Val31,Gln34]PP (SEQ ID No: 6), эти пептиды являются аналогами PP, созданными с целью высокой аффинности к Y2 рецептору, однако в этих случаях заменаHis (как в NPY и PYY). Например, замена Met30 на Leu или Nle имеет то преимущество, что она исключает возможность окисления природного остатка Met. [Leu30,Gln34]PP, [Nle30,Gln34]PP,[Leu28,Gln34]PP и [His26,Gln34]PP представляют собой новые соединения.[Ile3,Gln34]PP представляет собой пептиды, модифицированные как на С, так и на N-конце каркасаPP с целью получить объединнную (общую) Y2-Y4 селективность относительно Y1. Так же как, например, [Ile31,Gln34]PP и [Val31,Gln34]PP, этот пептид является аналогом PP, созданным с целью получения высокой аффинности к Y2 рецептору, однако в этом случае замена Pro34 на Gln совмещается с заменой других не-NPY/не-PYY остатков в N-концевой последовательности PP: Leu3 на Ile (как в PYY - в NPY это Ser). [Ile3,Gln34]PP является новым соединением.[Ala1,Glu4,Arg26,Met30]PYY (SEQ ID No: 12) Этот пептид представляет в данном описании группу аналогов PYY и NPY, в которых один или более не-PP остатков на N- и/или С-конце (концах) заменяе(ю)тся остатком(ами), имеющимися в PP, с целью получения заданной общей Y2-Y4 селективности относительно Y1. [Ala1,Glu4,Arg26,Met30]PYY создан с целью получения высокой аффинности к Y4 рецептору за счт введения в целом четырхPP-подобных остатков в С- и N-концевые последовательности. Остаток Pro не вводится в положение 34,так как это оказывает большое влияние на аффинность пептидов к Y2 рецептору, хотя и повышает аффинность пептидов к Y4 рецептору. [Ala1,Glu4,Arg26,Met30]PYY является новым соединением. Профиль рецепторного распознавания.[Ala1,Glu4,Arg26,Met30]PYY проявляет высокую активность в отношении стимулирования человеческого Y2 рецептора (EC50=1,0 нМ) и человеческого Y4 рецептора (EC50=1,4 нМ), тогда как его активность в отношении человеческого Y1 составляет лишь 87 нМ (табл. 2). Устойчивость белка аналогична устойчивости PYY1-36.[Ala1,Glu4,Arg26,Met30]PYY можно по аналогии с другими представленными в данном описании примерами пептидов модифицировать далее для различных фармакокинетических или других целей, при этом сохраняя общую Y2-Y4 селективность по сравнению с Y1. Например, остатки Met в положении 17 и/или 30 можно заместить, например, на Leu или Nle, один или более Lys или других, предрасположенных к присоединению, остатков можно ввести в различные положения для введения различных мотивов и т.д. При этом можно получить группу селективных Y2-Y4 пептидных агонистов, из которых можно выбрать соединения в качестве лекарств для лечения ожирения и т.д., представленные в другом месте данного описания.[Ala1,Glu4]PYY (SEQ ID No: 14), [Arg26,Met30]PYY (SEQ ID No: 16),[Glu4,Met30]PYY (SEQ ID No: 18), [Glu4,Arg26]PYY (SEQ ID No: 20) Эти новые пептиды, наряду с [Ala1,Glu4,Arg26,Met30]PYY, представляют собой группу пептидных агонистов на основе PYY или NPY, в которых на С- и/или на N-концах заменены остатки, чтобы получить селективность к Y2 плюс Y4 рецепторам в отличие от Y1 рецептора. Тем самым, и вместе с другими пептидами на основе PP, получены многообразные пептиды, из которых можно выбрать пептиды с оптимальным сочетанием высокой активности в отношении Y2 и Y4 с меняющейся активностью в отношении Y1 c целью использования в качестве лекарств против ожирения и т.д. Профили рецепторного распознавания. В качестве примеров в табл. 1 показано, что аффинность [Arg26,Met30]PYY к Y2 и Y4 рецепторам составляет 0,13 и 2,3 нМ, соответственно, в отличие от аффинности к Y1 рецептору, равной 65 нМ. Другой пример, аффинность PYY к Y1 рецептору снижается с 16 до 367 нМ при замене Glu вместо Lys в положении 4 и Arg вместо His в положении 26 в [Glu4,Arg26]PYY, в то же время за счт этих замен повышается аффинность к Y4 с 30 нМ (для PYY) до 3,3 нМ для [Glu4,Arg26]PYY, таким образом создатся "окно селективности" более чем в 100 раз (табл. 1).[Cys2,D-Cys27,Gln34]PP (SEQ ID No: 22) Здесь данный аналог PP представляет группу Y2-Y4 селективных агонистов, в которых повышенная устойчивость белка [Cys2,D-Cys27]PP пептида сочетается с двойной селективностью в отношенииY2 и Y4 в сравнении с Y1-рецепторной селективностью пептида [Gln34]PP. Это новое соединение. На основании рассмотрения вышеприведнных пептидов ясно, что этот пептид можно модифицировать далее для различных фармакокинетических или других целей, при этом сохраняя общую Y2-Y4 селективность по сравнению с Y1. Например, остатки Met в положении 17 и/или 30 можно заместить, например,на Leu или Nle, один или более Lys или других, предрасположенных к присоединению, остатков можно ввести в различные положения для введения различных мотивов и т.д. При этом можно получить группу селективных Y2-Y4 пептидных агонистов, из которых можно выбрать соединения в качестве лекарств для лечения ожирения и т.д., представленные в другом месте данного описания.[Cys2,Aoc-24,D-Cys27,Gln34]PP (SEQ ID No: 23) В данном PP аналоге двойная рецепторная специфичность [Gln34]PP встроена в малый подходящий аналог PP типа [Cys2,Aoc-24,D-Cys27]PP. Это новое соединение. Клинические показанияY2/Y4-специфические агонисты, которые рассматриваются в настоящем изобретении, важны для лечения состояний, откликающихся на активацию Y2 и/или Y4 рецепторов. Такие состояния включают состояния, для которых показаны регуляция потребления энергии или энергетический метаболизм, контроль интестинальной секреции или индукция ангиогенеза. Для применения в каждом таком случае агонист может включать модификацию или мотив, которые придают устойчивость к пептидазам, свойства связывания с сывороточным белком, или ПЭГилирование для того, чтобы продлить период полужизни в сыворотке и/или в ткани. Главным образом, для индукции ангиогенеза агонист может содержать GAGсвязывающий мотив для продления периода полужизни в тканях и экспозиции с Y рецептором. Заболевания или состояния, при которых показана регуляция потребления энергии или энергетический метаболизм, включают ожирение и избыточный вес и состояния, при которых ожирение и избыточный вес рассматриваются как способствующие факторы, такие как булимия, нейрогенная булимия, Синдром X (метаболический синдром), диабет, сахарный диабет типа 2 или инсулиннезависимый сахарный диабет (NIDDM), гипергликемия, устойчивость к инсулину, нарушенная толерантность к глюкозе, сердечно-сосудистое заболевание, гипертензия, атеросклероз, заболевание коронарных артерий, инфаркт миокарда, заболевание периферических сосудов, удар, тромбоэмболическое заболевание, гиперхолистеринемия, гиперлипидемия, болезни желчного пузыря, остеоартрит, остановка дыхания во сне, репродуктивные нарушения, такие как синдром поликистоза яичников, или рак молочной железы, простаты или толстой кишки. Заболевания или состояния, при которых показана регуляция интестинальной секреции, включают различные формы диареи или кишечную гиперсекрецию. Заболевания или состояния, при которых показана индукция ангиогенеза, включают заболевание периферических сосудов, заболевание коронарных сосудов, инфаркт миокарда, удар, состояния, при которых вс вышеперечисленное рассматривается как способствующий фактор, заживление ран и восстановление тканей. 1. Ожирение и избыточный вес. Было показано, что PYY3-36 снижает аппетит, потребление пищи и вес тела у различных у различных грызунов при периферическом введении (Batterham et al. Nature 2002, 418: 595-7; Chaflis et al. BBRCNov. 2003, 311: 915-9), а также для снижения аппетита у человека также при периферическом введении(Batterham et al., 2002). Данные на животных, включая исследования нокаутированных по рецептору животных, чтко показывает, что это действие PYY3-36 опосредуется с помощью Y2 рецепторов иPYY, так как инфузия PYY3-36 в течение 90 мин снижает потребление пищи у субъектов, страдающих ожирением, аналогичным образом в течение длительного времени (Batterham et al., 2003, NEJM 349: 94148). Накопленные в последних исследованиях на животных многочисленные данные показывают, чтоPP является мощным и эффективным анорексигенным пептидом при периферическом введении peripherally (Asakawa et al. Peptides 1999, 20; 1445-8; Katsuura et al. Peptides 2002, 23: 323-9; Asakawa et al. Gastroenterology 2003,124: 1325-36). Так как PP не оказывает влияния на аппетит, потребление пищи и т.д. у нокаутированных по Y4 животных, весьма вероятно, что PP действует с помощью Y4 рецептора, снижая аппетит и потребление пищи (Batterham et al., 2004, тезисы S3.3 from International NPY symposium inCoimbra Portugal). PP также оказывает влияние на потребление пищи у животных, чь ожирение вызвано диетой. PP рецепторы обнаружены в основном в стволе мозга в двигательных нейронах блуждающего нерва и в ядрах одиночного пучка (NTS), каждый из которых является поверхностью, где гематоэнцефалический барьер неэффективен и где гормоны кровотока, такие как PP, могут получить доступ к нейронам. Весьма вероятно, что Y4 рецепторы в NTS в стволе мозга являются основной мишенью, через кото- 17011861 рую действует PP, подавляя аппетит и потребление пищи. Однако последние результаты также указывают на возможность того, что PP могут действовать с помощью Y рецептора в дугообразном ядре, возможно, на POMC, а, возможно, также на NPY/AgRP нейронах (Batterham et al. Coimbra NPY meeting abstract S3.3). Низкие уровни PP обнаружены у субъектов, страдающих ожирением, особенно у субъектов с синдромом Прадера-Вилли (Zipf et al. J.C.E.M. 1981, 52: 1264-6, Hoist et al., 1983, Int. J. Obes. 7: 529-38;Glaser et al. Horm. Metab. 1988, 20: 288-92), а высокие уровни PP обнаружены у пациентов с нейрогенной анорексией. Важно отметить, что инфузия PP человеку понижает аппетит и потребление пищи в течение до 24 ч (Batterham et al. JCEM 2003, 88: 3989-92). Таким образом, действие PP на потребление пищи наблюдают после того, как уровни PP в кровотоке вернулись к нормальным значениям. Такое продолжительное действие на аппетит и т.д. хорошо известно также после инъекции ICV, особенно AgRP. Важно отметить, что также показано, что инфузия PP снижает потребление пищи у больных с синдромом Прадера-Вилли, страдающих вызванным болезнью ожирением (Berntson et al., 1993, Peptides 14: 497-503). Вследствие того, что действие PYY с помощью Y2 рецепторов - ингибирование стимулирующихsymposium, Coimbra abstract S3.3), общий эффект Y2 агониста и Y4 агониста является аддитивным или даже синергическим эффектом, т.е. более эффективное действие достигается при совместном лечении,чем при лечении каждым из них по отдельности. Известно, что сам по себе PYY при периферическом введении является сильным рвотным средством, на самом деле, PYY был открыт - "во второй раз" - в 1989 г. как биологически активный компонент в хроматографической фракции интестинального экстракта, вызывающий рвоту у собак (Harding andMcDonald, 1989, Peptides 10: 21-24). Был сделан вывод, что PYY является наиболее мощным идентифицированным пептидом в кровотоке, вызывающим рвоту, и что этот эффект опосредуется с помощью области пострема, известной тем,что она имеет "негерметичный" гематоэнцефалический барьер. Также сообщалось, что PYY3-36 может вызывать тошноту при периферическом введении людям (Nastech press release 29th of June 2004). С физиологической точки зрения кажется логичным, что PYY, и биологически активные продукты его превращения, который обычно сначала секретируется в больших количествах в процессе прима большого количества пищи, или когда происходит демпинг (сбрасывание) пищи в нижние отделы кишечника в результате различных хирургических вмешательств, способен вызывать рвоту, чтобы избавить субъекта от ситуации явного переедания. Интересно, что в статье было отмечено, что PP в сходных дозах не вызывает рвоты у этих собак (Harding and McDonald, 1989). PP действует с помощью Y4 рецепторов, также расположенных в области пострема ствола мозга, но не вызывает рвоту. Большие дозы комбинированных Y2-Y4 пептидных агонистов, таких как [Gln34]PP, можно вводить животным, таким как обезьяны циномолгус (cyno), достигая уровня в плазме 12-13 нМ, не наблюдая никакой рвоты у животных и никаких побочных эффектов со стороны ЖКТ. Это является неожиданным, так как [Gln34]PP имеет относительно высокую активность в отношении Y2 рецептора, к которому PYY3-36 является полностью селективным. Так, неожиданно, комбинированный Y2-Y4 селективный агонист не вызывает рвоты в той же степени, в какой селективный Y2 агонист - соединение PYY3-36 - вызывает. Очевидно, Y4-рецепторная активация, предположительно, в области пострема, предупреждает рвотное действие Y2 активации того же соединения. Это свойство комбинированного Y2-Y4 селективного агониста является очень благоприятным для лечения ожирения и связанных с ним состояний. Следовательно, Y2/Y4 селективные агонисты, которые рассматриваются в настоящем изобретении,пригодны для применения для субъекта, такого как млекопитающее, включая человека, чтобы регулировать потребление энергии. Соответственно, изобретение относится к способам изменения потребления энергии, потребления пищи, аппетита и расхода энергии. В данном описании раскрывается способ уменьшения потребления энергии или пищи путм введения субъекту косметически или терапевтически эффективного количества такого агониста. В одном варианте изобретения введение рецепторного агониста приводит к снижению количества, или общего веса, или общего объма, или калорийности (содержания калорий) пищи. В другом варианте изобретения это может вызывать снижение потребление компонента пищи, например снижение прима липидов, углеводов, холестерина или белков. В некоторых других способах по данному описанию могут вводиться предпочтительные соединения, которые подробно обсуждаются в данном описании. В дополнительном варианте изобретения раскрывается способ снижения аппетита путм введения терапевтически эффективного количества такого агониста. Аппетит можно измерять (определять) любыми способами, известными специалисту в данной области техники. Например, пониженный аппетит можно определять с помощью физиологической оценки. В таком варианте изобретения введение рецепторного агониста приводит к изменению чувства голода, насыщения и/или сытости. Голод можно оценивать любыми способами, известными специалисту в данной области техники. В одном варианте изобретения голод оценивают с помощью физиологических анализов,таких как оценка чувства голода и сенсорного восприятия, используя, например, анкету.- 18011861 В другом варианте изобретения раскрывается способ снижения моторики верхних отделов ЖКТ,например замедление опорожнения желудка. Способ включает введение терапевтически эффективного количества такого агониста субъекту, тем самым снижается моторика ЖКТ. Общеизвестно, что соединения, которые замедляют опорожнение желудка, также оказывают благотворное действие при снижении потребления пищи, так как субъект чувствует насыщение или сытость. Известно, что как PYY3-36, прототип Y2 агониста, так и PP, прототип Y4 агонистов, замедляют опорожнение желудка. Комбинированный Y2-Y4 агонист оказывает аддитивное или даже синергическое действие при ингибировании моторики верхних отделов ЖКТ. В другом варианте изобретения раскрывается способ по данному описанию изменения энергетического метаболизма у субъекта. Способ включает введение субъекту терапевтически эффективного количества такого агониста, тем самым изменяется расход энергии. Энергия сжигается в физиологических процессах. Организм может непосредственно изменять расход энергии, модулируя эффективность этих процессов или изменяя количество или природу протекающих процессов. Например, в процессе пищеварения повышается энергия в организме при прохождении через пищеварительный тракт и усвоении пищи, и в клетках, при этом эффективность клеточного метаболизма может меняться, выделяя больше или меньше тепла. В другом варианте изобретения раскрывается способ по данному описанию любых и всех манипуляциях дугообразной цепи, описанных в данной заявке, которые согласованно изменяют потребление пищи и соответственно изменяют расход энергии. Расход энергии является результатом клеточного метаболизма, белкового синтеза, интенсивности обмена веществ и усвоения калорий. Таким образом,периферическое введение приводит к повышенному расходу энергии и пониженной эффективности усвоения калорий. В одном варианте изобретения терапевтически эффективное количество рецепторного агониста по изобретению вводят субъекту, тем самым повышая расход энергии. В некоторых вариантах изобретения как при терапевтическом, так и при косметическом применении Y2/Y4 селективный агонист можно использовать для контроля веса и лечения, снижения или предупреждения ожирения, в частности для достижения одного или более из нижеприведнных результатов: предупреждение и снижение увеличения массы тела; индукция и промотирование потери веса; уменьшение ожирения, определяемого с помощью индекса массы тела. Как указано выше, изобретение также относится к применению Y2/Y4 селективного агониста для регуляции одного или более чувств: аппетита, сытости или голода, в частности одного или более из нижеперечисленного: индукции, увеличения,повышения и промотирования сытости и ощущения насыщения; уменьшения, ингибирования и подавления голода и ощущения голода. Это раскрытие относится далее к применению Y2/Y4 селективного агониста для поддержания одного или более из нижеперечисленного: заданного веса тела, заданного индекса массы тела, желаемого внешнего вида и хорошего здоровья. В другом, или альтернативном, аспекте данное изобретение относится к способу лечения и/или предупреждения пониженного энергетического метаболизма, нарушений питания, нарушения аппетита,избыточного веса, ожирения, булимии, нейрогенной булимии, Синдрома X (метаболического синдрома),или связанных с этим осложнений или рисков, включая диабет, сахарный диабет типа 2 или инсулиннезависимый сахарный диабет (NIDDM), гипергликемию, устойчивость к инсулину, нарушенную толерантность к глюкозе, сердечно-сосудистое заболевание, гипертензию, атеросклероз, застойную сердечную недостаточность, удар, инфаркт миокарда, тромбоэмболические заболевания, гиперхолистеринемию, гиперлипидемию, болезни желчного пузыря, остеоартрит, остановка дыхания во сне, репродуктивные нарушения, такие как синдром поликистоза яичников, или рак молочной железы, простаты или толстой кишки, причм способ заключается во введении субъекту, такому как млекопитающее, включая человека, эффективной дозы одного или более Y2/Y4 селективных агонистов по данному описанию. 2. Кишечная гиперсекреция. Известно, что как NPY, так и PYY оказывают антисекреторное действие как на тонкий, так и на толстый кишечник. С помощью исследований, проведнных на выделенных тканях человеческой толстой кишки, было продемонстрировано, что это действие опосредуется как Y1, так и Y2 рецепторами, а с помощью TTX было показано, что основная часть Y2 компонента опосредуется с помощью нейронного компонента (СохTough 2001 Br. J. Pharmacol. 135: 1505-12). PP также оказывает сильное антисекреторное действие, и оно, очевидно, опосредуется Y4 рецепторами, расположенными на эпителиальных клетках, а не по нейронным механизмам (СохTough 2001). Таким образом, вследствие аналогичного эффекта, но опосредуемого другими механизмами, комбинированный Y2-Y4 агонист оказывает аддитивное или даже синергическое антисекреторное действие на ЖКТ. Было показано in vivo, что периферическое введение PYY может вызвать продолжительную реакцию на кишечную секрецию, индуцированную вазоактивным кишечным полипептидом у людей с илеостомией (Playford et al., 1990, Lancet, 335: 1555-57). Был сделан вывод, что PYY пептид может быть терапевтическим агентом против диареи, однако, например, натрийуретический и гипертензивный эффекты комбинированного Y1 и Y2 агониста препятствуют этому. Комбинированные селективные Y2-Y4 агонисты по настоящему изобретению особенно применимы для лечения или защиты против гиперсекреции ЖКТ, включая различные формы диареи,вне зависимости от того, вызваны они непосредственно гиперсекрецией или нет. Одно особенно интересное показание представляет собой гиперсекрецию у пациентов с илеостомией, которые часто теряют- 19011861 большие количества жидкости. 2.1. Терапевтический ангиогенез. Ряд in vitro исследований влияния на рост клеток сосудов гладких мышц, гипертрофию вентрикулярных кардиомиоцитов, а также на пролиферацию и миграцию эндотелиальных клеток наводят на мысль, что NPY может действовать как ангиогенный фактор (Zukowska-Grojek et al., 1998, Circ. Res. 83: 187-95). Важно отметить, что исследования in vivo как на мышиной модели корнеальных микрокарманов, так и анализ хорион-аллантоисной мембраны (САМ) цыплят подтвердили, что NPY является мощным ангиогенным фактором, который приводит к возникновению васкулярных структур, подобных сосудистому дереву, с проявляющейся вазодилатацией, как наблюдалось в ином случае только для фактора роста фибробластов-2 (FGF-2), а не на примере ангиогенных структур сосудистого эндотелиального фактора роста (СЭФР, VEGF) (Ekstrand et al., 2003, PNAS, 100: 6033-38). При развитии эмбрионов цыплятNPY индуцировал прорастание сосудов из ранее имевшихся кровеносных сосудов. Действие NPY не наблюдается у животных, нокаутированных по Y2 рецептору, это указывает, что Y2 рецептор отвечает за ангиогенный эффект NPY (Ekstrand et al., 2003). Это замечание подтверждается также наблюдениями,показывающими, что Y2 рецептор является высокоактивированным в ишемических сосудах, и фермент,который генерирует эндогенный, селективный Y2 лиганд PYY3-36, дипептидилпептидазу-IV, также является высокоактивированным. Пептиды по настоящему изобретению, все, представляют собой Y2 агонисты, имеющие, по меньшей мере, дополнительное свойство - являться также Y4 агонистами и быть селективными, в то же время они являются слабыми агонистами Y1. Таким образом, свойство этих пептидов быть Y2 агонистами делает их пригодными в качестве терапевтических ангиогенных агентов, a Y4 агонизм оказывает благотворное действие на снижение или избавление от нежелательной стимуляции тошноты или рвоты, как известно, ассоциируемых с высокими уровнями Y2 агонистов в плазме. При различных сердечно-сосудистых заболеваниях, например, таких как атеросклероз, считается,что в периферических сосудах, а также в коронарных сосудах индукция ангиогенеза является благотворной. Также считают, что индукция благотворна для обеспечения реперфузии после инфаркта микарда. Полагают, что FGF-2 является эффективным агентом для индукции ангиогенеза у пациентов с сердечнососудистыми заболеваниями. Однако, подобно большинству ангиогенных факторов, FGF-2 является фактором роста и может также стимулировать рост опухолей, вызывая ангиогенез. Как представлено выше,NPY, действующий через Y2 рецепторы, индуцирует неоваскуляризацию типа, аналогичного неоваскуляризации, индуцируемой FGF-2, однако NPY является нейропептидом, а не классическим фактором роста и не вызывает осложнений в виде индукции роста опухоли, таким образом, Y2 агонист является агентом, пригодным для терапевтического ангиогенеза. Однако особенно важно для такого применения то, что агонист не проявляет Y1-рецепторного агонизма, так как это оказывало бы нежелательное действие на сердечно-сосудистую систему. Это означает, что пептиды, которые рассматриваются в данном изобретении, являющиеся Y2 селективными рецепторными агонистами, являются особенно подходящими терапевтическими агентами с учтом того, что они вызывают ангиогенез. Они особенно применимы после модификации с присоединением GAG-связывающего мотива, обсуждавшегося выше. Дальнейшее уточнение: действие FGF-2, как действие большинства классических факторов, частично опосредуется или регулируется с помощью их связывания с гликозаминогликаном (GAG) во внеклеточной матрице. Это связывание с GAG гарантирует, что ангиогенный фактор действует в соответствующем пространстве и времени и что он не скоро вымывается из ткани. Для применения в терапевтическом ангиогенезе малых пептидов и пептидов-миметиков, таких как описанные в настоящем изобретении, это особенно важно. Поэтому в предпочтительном варианте изобретения пептиды включают один или более GAG-связывающих мотивов, которые гарантируют, что они присоединятся к GAG во внеклеточной матрице, с целью индуцировать оптимальный ангиогенез после введения. Это можно осуществлять, например, внутривенным или внутриартериальным введением, или, например, можно вводить непосредственно в коронарные артерии, чтобы индуцировать ангиогенез в сердце при болезни коронарной артерии и/или после острого инфаркта миокарда. Аналогично, такое соединение можно вводить внутриартериальной инъекцией в бедренную артерию для лечения болезни периферических сосудов. Его можно также, например, применять для топического, местного введения в кожные поражения, чтобы стимулировать более быстрое заживление ран. Продолжительной экспозиции с Y рецептором, эффективной для индукции ангиогенеза, можно также добиться, используя пептид по настоящему изобретению, модифицированный мотивом, связывающим сывороточный альбумин. Таким образом, в предпочтительном варианте изобретения Y2/Y4 селективные агонисты содержатGAG-связывающий мотив, который вводят в положение, где он не снижает устойчивости пептида или не снижает активности и селективности пептида. Соответственно, в одном варианте данное изобретение относится к применению модифицирующих изменений Y2/Y4-рецепторного агониста в системе ангиогенеза, особенно, для индукции ангиогенеза, такого как ангиогенез, ассоциированный заболеваниями или состояниями, например, такими как сердечно-сосудистые заболевания, включая болезнь периферических сосудов и инфаркт миокарда; процессы репарации тканей, включая заживление ран на коже, воспалительные состояния, включая воспалительные состояния в желудочно-кишечном тракте, такие, например,как язвы, колит, воспалительное заболевание кишечника, болезнь Крона и т.д.- 20011861 Специфический вариант изобретения включает применение рецепторного агониста для индукции ангиогенеза в сердце или в кровеносных сосудах, или в тканях, таких как ткань слизистой оболочки,включая слизистую оболочку желудочно-кишечного тракта и кожу. 3. Заживление ран. Сообщалось, что у животных, у которых Y2 рецептор селективно выделяется (элиминирует) за счт делеции его гена, заживление ран замедляется, и что ухудшается ассоциированная с этим неоваскуляризация (Ekstrand et al., 2003, PNAS, 100: 6033-38). Поэтому селективные Y2-Y4 агонисты по настоящему изобретению применимы для улучшения заживления ран за счт их свойства - быть агонистами Y2. Для этого пептиды можно вводить различными способами, включая парентеральное введение. Однако предпочтительным способом применения является топическое введение, например, в виде раствора, дисперсии, порошков, плиток, крема, мази, лосьона,геля, гидрогеля, трансдермальной системы доставки, включая пластыри и т.д. Для топического применения их можно использовать в обычной форме. Однако в предпочтительном варианте изобретения пептиды модифицируют с помощью одного или более GAG-связывающих мотивов по данному описанию для того, чтобы гарантировать продолжительное местное действие пептида с помощью связывания GAG в ткани. 4. Воспалительное заболевание кишечника. Ранее было описано применение PYY для предупреждения и/или лечения воспалительного заболевания кишечника; см. международную заявку 03/105763, принадлежащую Amylin Pharmaceuticals, Inc.,вводимую в данное описание в качестве ссылки. Следовательно, агонисты по данному изобретению являются также эффективными для лечения или предупреждения воспалительного заболевания кишечника. Соответственно, настоящее изобретение также относится к применению агонистов по данному описанию для такой медицинской цели. В представляющем интерес варианте изобретения пептиды содержат один или более GAG-связывающих мотивов, см. выше. Дополнительные комментарии относительно применения Y2/Y4 агонистов для лечения или предупреждения ожирения и родственных заболеваний В процессе еды широкий спектр желудочно-кишечных гормонов и нейромедиаторных систем активируется тщательно согласованно, последовательно или с наложением. Кроме того, компоненты пищи влияют не только на секрецию ЖК гормонов и активность различных путей афферентных нейронов, но эти компоненты пищи, после всасывания, также непосредственно влияют на различные гормоны и центры в ЦНС. Поэтому регуляция потребления пищи и расхода энергии представляет собой в высшей степени сложный и многоаспектный процесс. С этой точки зрения удивительным является, что некоторые гормоны, такие как агонисты Y2, могут на самом деле заметно влиять на систему при введении таким образом, который приводит, например, только к 3-4-кратным уровням в плазме, которые достигаются в процессе еды. Частью проблемы является то, что применение таких соединений - комбинированных Y2-Y4 агонистов - вызывает оптимальный эффект, если соединения дают натощак в описанных эффективных дозах. Если Y2-Y4 агонисты дают в ситуации, когда различные гормональные и нейронные системы активны вследствие присутствия компонентов пищи в ЖКТ или ожидания пищи, эффекта не наблюдается или наблюдаемый эффект значительно меньше. Поэтому в предпочтительном варианте изобретения комбинированный Y2-Y4 агонист вводят натощак в эффективной дозе либо подкожно, назально, либо другими способами, указанными в другом месте данного описания. В данном контексте термин "натощак" означает, что субъект не принимал никакой пищи или питья в течение, по меньшей мере, последних 2 ч перед введением комбинированного Y2-Y4-рецепторного агониста, например, по меньшей мере, в течение последних 3 ч, по меньшей мере, в течение последних 4 ч, по меньшей мере, в течение последних 5 ч, по меньшей мере, в течение последних 6 ч, по меньшей мере, в течение последних 7 ч, по меньшей мере, в течение последних 8 ч, по меньшей мере, в течение последних 9 ч, по меньшей мере, в течение последних 10 ч, по меньшей мере, в течение последних 11 ч, по меньшей мере, в течение последних 12 ч перед введением дозы. В подгруппе популяции комбинированный Y2-Y4 агонисты могут не оказывать предполагаемого действия вследствие генетических изменений, таких как полиморфизм в гене Y4 рецептора. Утрата функциональных мутаций в этих рецепторах связана, по-видимому, с ожирением. Поэтому в предпочтительном варианте изобретения осуществляют анализ Y4-рецепторного гена субъекта, которого нужно лечить, чтобы проверить эти гены на полиморфизм/мутации и идентифицировать такой полиморфизм. На основании такого анализа можно проводить оптимальное лечение субъектов. Например, только субъекты с нормальным генотипом или с полиморфизмом, который не влияет на функцию Y4 агонистов,включая комбинированные Y2-Y4 агонисты, можно лечить с применением таких агонистов. Другая возможность - повысить дозу комбинированного Y2-Y4 агониста, вводимую субъектам с ослабленным рецептором, чтобы гарантировать оптимальное действие лекарства. В случае, когда ожирение субъекта вызвано недостаточностью функции Y4 рецептора, можно утверждать, что лечение, например большими дозами, комбинированного Y2-Y4 агониста является формой заместительной терапии при условии, что релевантная рецепторная функция вс ещ сохраняется, например, у гетерозиготных пациентов. В ситуа- 21011861 ции, когда невозможно или по финансовым причинам не удатся провести такой генетический анализ,применение селективного комбинированного Y2-Y4 агониста особенно подходит, так как он вследствие его двойного действия на две различные мишени будет эффективен даже в тех случаях, когда одна из мишеней не функциональна или имеет пониженную функциональность из-за генетического полиморфизма. Перед началом постоянного лечения, чтобы быть уверенными, что лечение проходят только чувствительные к нему субъекты, можно провести тщательный тест для того, чтобы гарантировать, что эти соединения оказывают предполагаемое действие на субъекта, которого нужно лечить. Селективные Y2-Y4 агонисты по изобретению можно комбинировать при лечении ожирения, диабета и родственных заболеваний с различными другими лекарствами, имеющими целью аппетит и расход энергии, эти лекарства включают, но без ограничения, лекарства, такие как ингибиторы липаз ЖКТ,ингибиторы обратного захвата нейромедиаторов, антагонисты каннабиноидных рецепторов и обратные агонисты, а также другие типы нейромедиатора, включая, но без ограничения, 5 Н рецепторы, и/или гормона, включая, но без ограничения, агонисты или антагонисты GLP-1, МС 4, МС 3-рецепторов. Так как селективные Y2-Y4 агонисты направлены на гомеостатический регуляторный механизм для связи между ЖКТ и ЦНС, т.е. на Y2 и Y4 рецепторы обычно нацелен опосредующий насыщение гормон PYY из кишечника и PP из поджелудочной железы, особенно полезно совмещать лечение комбинированными Y2Y4 селективными агонистами с лечением лекарством, направленным на важнейший гедонический механизм аппетита и расхода энергии, таким как CB1 рецепторы, например, являющиеся частью системы поощрения. Поэтому применение селективных Y2-Y4 агонистов при лечении ожирения и родственных заболеваний в комбинации с CB1 антагонистом является предпочтительным вариантом настоящего изобретения. Дозировки Терапевтически эффективное количество Y2/Y4-рецепторного агониста по данному изобретению зависит от конкретного применяемого агониста, возраста, веса и состояния субъекта, проходящего лечение, тяжести и типа состояния или заболевания, которое нужно лечить, способа введения и эффективности применяемой композиции. Например, терапевтически эффективное количество Y2/Y4-рецепторного агониста может меняться, примерно, от 0,1 мкг на кг массы тела, примерно, до 1 г на кг массы тела, например от около 5 мкг до около 1 мг на кг массы тела. В другом варианте изобретения рецепторный агонист вводят субъекту в количестве 0,5-135 пикомолей (пмоль) на кг массы тела или 72 пмоля на кг массы тела. В одном конкретном неограничивающем примере приблизительно 5-50 нмоль вводят в виде подкожной инъекции, например, около 2-20 нмоль или около 1,0 нмоль. Точную дозу специалист в данной области техники легко определит, исходя из активности конкретного применяемого соединения (такого как агонист рецептора), возраста, веса, пола и физиологического состояния субъекта. Доза агониста может быть молярным эквивалентом терапевтически эффективной дозы PYY3-36. Это количество можно разделить на одну или несколько доз для применения ежедневно, через день, еженедельно, через каждые две недели, ежемесячно или с любой другой подходящей частотой. Обычно прим осуществляют один или два раза в день. Способы применения Агонист можно вводить любым способом, включая энтеральный (например, оральное введение) или парентеральный способ. В конкретном варианте изобретения предпочтительным является парентеральный способ, он включает внутривенную, внутрисуставную, интраперитонеальную (внутрибрюшинную), подкожную, внутримышечную, надчревную инъекцию и инфузию, а также сублингвальный (подъязычный), трансдермальный (чрескожный), топический, трансмукозный, включая назальный, способ,или ингаляция, например лгочная ингаляция. В конкретных вариантах изобретения предпочтительным является подкожный и/или назальный способ применения. Агонисты рецепторов можно вводить как таковые в подходящем носителе, или их можно вводить в виде подходящей фармацевтической или косметической композиции. Такие композиции также входят в объм настоящего изобретения. Ниже описаны подходящие фармацевтические композиции. Специалист в данной области техники знает, что такая композиция может быть также пригодна для косметического применения, или он знает, как скорректировать композицию, чтобы сделать ее косметической, используя подходящие косметически приемлемые эксципиенты. Фармацевтические композиции Агонисты рецепторов (рецепторные агонисты, также называемые "соединения") по данному изобретению для применения в медицине или косметике обычно бывают в виде фармацевтической композиции, содержащей конкретное соединение или его производное совместно с одним или более физиологически или фармацевтически приемлемых эксципиентов. Соединения можно вводить животному, включая млекопитающих, таких как, например, человек,любым подходящим способом введения, например, таким как оральный, трансбуккальный, назальный,окулярный, лгочный, топический, трансдермальный, вагинальный, ректальный, парентеральный (включая, наряду с другими, подкожный, внутримышечный и внутривенный, см. выше) способ, в дозе, которая эффективна для индивидуальных целей. Специалист в данной области техники знает, как выбрать под- 22011861 ходящий способ введения. Как указывалось выше, предпочтительным является парентеральное введение. В конкретном варианте изобретения рецепторный агонист вводят подкожно и/или назально. Общеизвестно в уровне техники, что подкожные инъекции может делать себе сам пациент. Композицию, пригодную для конкретного способа применения, индивидуально для каждого пациента легко определит практикующий врач. Различные фармацевтически приемлемые носители и их состав описаны в обычных монографиях о препаратах, например в Remington's Pharmaceutical Sciences byE.W. Martin. Фармацевтическая композиция, содержащая соединение по изобретению, может быть в виде тврдой, полутврдой или жидкой композиции. Для парентерального применения композиция обычно находится в жидком виде или в виде полутврдом или тврдом виде для имплантации. Жидкие композиции, которые представляют собой стерильные растворы или дисперсии, могут применяться, например, для внутривенной, внутримышечной, внутриоболочечной, эпидуральной, интраперитонеальной или подкожной инъекции или инфузии. Соединения можно также приготовить в виде стерильной тврдой композиции, которую можно растворять или диспергировать до или во время введения, например, в стерильной воде, физиологическом растворе или другой подходящей стерильной среде для инъекций. Композиции в жидком виде может представлять собой раствор, эмульсию, включая наноэмульсии,суспензию, дисперсию, липосомную композицию, смесь, спрей или аэрозоль (два последних типа являются особенно релевантными для назального применения). Подходящие среды для растворов или дисперсий обычно бывают на водной основе или на основе фармацевтически приемлемых растворителей, например, таких как масло (например, кунжутное или арахисовое масло) или органический растворитель, например, такой как пропанол или изопропанол. Кроме того, композиция по изобретению содержит фармацевтически приемлемые эксципиенты, например, такие как агенты, корректирующие pH, осмотически активные агенты, например, для того, чтобы довести изотоничность композиции до физиологически приемлемых уровней, агенты коррекции вязкости, суспендирующие агенты, эмульгаторы, стабилизаторы, консерванты, антиоксиданты и т.д. Предпочтительной средой является вода. Композиции для назального применения могут также содержать нераздражающие носители, например, такие как полиэтиленгликоли, гликофурол, и т.д., а также энхансеры всасывания, хорошо известные специалисту в данной области техники (например, со ссылкой на Remington's PharmaceuticalScience). Для парентерального применения в одном варианте изобретения агонист рецептора можно вообще готовить смешением агониста рецептора заданной степени чистоты в виде стандартной лекарственной формы для инъекций (в виде раствора, суспензии или эмульсии) с фармацевтически приемлемым эксципиентом или носителем, т.е. таким, который не является токсическим для реципиентов в применяемых дозах и концентрациях и который совместим с другими ингредиентами композиции. Обычно препараты готовят с помощью однородного и тщательного смешения (контактирования) рецепторного агониста с жидкими носителями, или с тонкоизмельчнными тврдыми носителями, или с теми и другими. Затем, при необходимости, продукту придают форму нужного препарата. Предпочтительно носитель представляет собой парентеральный носитель, более предпочтительно раствор, изотонический с кровью реципиента. Примеры таких носителей включают воду, физиологический солевой раствор, раствор Рингера и раствор декстрозы. Также применимы по данному описанию неводные носители, такие как нелетучие масла и этилолеат, а также липосомы. Благодаря амфифильной природе пептидов по данному описанию подходящие формы также включают мицеллярные препараты, липосомы и другие типы препаратов, содержащие один или более соответствующих липидов, таких, например, как фосфолипиды и т.п. Предпочтительно они суспендируются в водном носителе, например в изотоническом буферном растворе при pH около 3,0-8,0, предпочтительно при pH около 3,5-7,4, 3,5-6,0 или около 3,5-5. Применимые буферные вещества включают ацетатный, цитратный, фосфатный, боратный, карбонатный буферы,например, такие как цитрат натрия-лимонная кислота или фосфат натрия-фосфорная кислота и ацетат натрия-уксусная кислота. Композиции также могут быть предназначены для контролируемой или пролонгированной доставки рецепторного агониста после введения, чтобы создать схему с менее частым введением. Обычно подходящей считается схема прима лекарственного вещества 1-2 раза в сутки, но в объм настоящего изобретения также входят другие схемы применения, такие, например, как более частое и более редкое введение. Для осуществления пролонгированной доставки рецепторного агониста можно применять подходящий носитель, включающий, например, липиды или масла, чтобы образовать депо в месте введения, из которого рецепторный агонист медленно высвобождается в систему кровообращения, или можно использовать имплантат. Подходящие с этой точки зрения композиции включают липосомы и биоразрушаемые частицы, в которые включн рецепторный агонист.- 23011861 В таких ситуациях, когда нужны тврдые композиции, эти композиции могут быть в виде таблеток,таких как обычные таблетки, шипучие таблетки, таблетки, покрытые оболочкой, формованные таблетки,в виде пеллет, порошков, гранул, гранулятов, материала в виде макрочастиц, тврдых дисперсий или тврдых растворов. Полутврдая форма композиции может представлять собой жевательную резинку, мазь, крем, линимент, пасту, гель или гидрогель. Другие подходящие лекарственные формы фармацевтических композиций по изобретению могут представлять собой вагитории, суппозитории, пластыри, накладки, таблетки, капсулы, саше, пастилки,устройства и т.д. Лекарственная форма может быть предназначена для неограниченного (свободного) или контролируемого высвобождения, например, за счт того, что таблетки могут иметь соответствующие покрытия. Фармацевтическая композиция может содержать терапевтически эффективное количество соединения по изобретению. Содержание соединения по изобретению в фармацевтической композиции по изобретению составляет, например, около 0,1-100% вес./вес. фармацевтической композиции. Фармацевтические композиции можно готовить любым способом, хорошо известным специалисту в области приготовления фармацевтических препаратов. В фармацевтических композициях соединения обычно объединяются с фармацевтическим эксципиентом, т.е. терапевтически инертным веществом или носителем. Носитель может иметь весьма разнообразные формы в зависимости от заданной лекарственной формы и способа применения. Фармацевтически приемлемые эксципиенты могут представлять собой, например, наполнители,связующие, вещества, способствующие расщеплению, разбавители, вещества, способствующие проглатыванию, растворители, эмульгаторы, суспендирующие агенты, стабилизаторы, энхансеры, вещества,придающие вкус и запах, агенты коррекции pH, замедлители, увлажняющие средства, поверхностноактивные агенты, консерванты, антиоксиданты и т.д. Подробности можно найти в фармацевтических справочниках, например, таких как Remington's Pharmaceutical Science или Pharmaceutical ExcipientHandbook. Синтез Пептидные агонисты по данному изобретению можно синтезировать твердофазным пептидным синтезом, применяя либо автоматический синтезатор пептидов, либо обычный лабораторный синтез. Тврдым носителем может являться, например, полимер хлортритила (C1) или Ванга (Wang), каждый из которых можно легко приобрести. Активные группы этих полимеров легко реагируют с карбоксильной группой N-Fmoc аминокислоты, при этом связывая е с полимером ковалентной связью. Связанный с полимером амин можно депротекционировать экспозицией с пиперидином. Затем вторуюN-аминокислоту можно присоединить к элементу полимер-аминокислота. Эти стадии повторяют до тех пор, пока не получат нужную последовательность. По окончании синтеза связанный с полимером защищенный пептид можно депротекционировать и отщепить от смолы под действием трифторуксусной кислоты (ТФК, TFA). Ниже даны примеры реагентов, облегчающих присоединение новых аминокислот к связанной с полимером аминокислотной цепи: тетраметилурония гексафторфосфат (HATU),О-(1H-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HBTU), O-(1H-бензотриазол-1 ил)-N,N,N',N'-тетраметилурония гексафторборат (TBTU), 1H-гидроксибензотриазол (HOBt). Также предпочтительнее бывает пептидный синтез в растворе, нежели твердофазный пептидный синтез. Модификация боковых амино- и карбоксильных групп аминокислоты пептидной цепи, например,введением GAG-связывающего или другого мотива, описанного выше, является простым способом введения и снятия (депротекции) защиты других реакционноспособных групп боковых цепей, не участвующих в реакции.- 24011861 Пример. Для иллюстрации способов, применяемых в синтезе агонистов по изобретению, описано получение последовательности [Gln34]PP. Схема синтеза Химические реактивы. Используют следующие исходные материалы и растворители. Исходные материалы Нужный продукт собирают с помощью Fmoc-SPPS на полимере Fmoc-Rink-TentaGel-resin. Аминокислоты с защитными группами в боковой цепи суть следующие: Arg(Pbf), Asn(Trt), Asp(OtBu), Gln(Trt),Glu(OtBu), Thr(tBu) и Tyr(tBu).- 25011861 Взаимодействие (связывание) осуществляют в ДМФА, изменяя эквиваленты аминокислот, с применением DIC и HOBt для активации. После каждой конденсации (связывания) следует кэпирование уксусным ангидридом и NMM. Мониторинг каждой конденсации (связывания) осуществляют с применением теста Кайзера/с нингидрином или хлоранилом. Между каждыми циклами связывания группу Fmoc удаляют пиперидином в ДМФА. Защищнный пептид-полимер отщепляют от носителя с помощью ТФК и нейтрализуют в водном растворе ацетата аммония, получают сырой продукт. После обработки полимер отфильтровывают. Сырой продукт очищают препаративной ВЭЖХ, используя материал для обращенно-фазовой хроматографии на основе силикагеля или полистирола. Раствор пептида концентрируют упариванием и фильтруют перед выделением лиофилизацией. Структура подтверждена масс-спектрометрией с диссоциацией, индуцированной столкновениями/масс-спектрометрии (CID MS/MS), аминокислотным анализом, LC-MS и хиральной чистотой. Чистоту проверяют с помощью ВЭЖХ и хиральной чистоты. Химический анализ пептидов. Для иллюстрация применяемых способов и полученных результатов ниже представлены аналитические данные пептидов по изобретению, синтезированные вышеуказанными методами. Данные Масс-спектроскопия = MALDI-TOF с гентизиновой или альфа-цианогидроксикоричной кислотой в качестве матрицы Аналитическая ВЭЖХ, метод В Для дальнейшей иллюстрации синтетических методов, которые можно применять для полученияY2/Y4 селективных агонистов, которые рассматриваются в настоящем изобретении, только в качестве примера, представлены нижеприведнные протоколы: Синтез [Cys2,Lys13,D-Cys27,Gln34]PP (SEQ ID No: 30) и его аналогов. Ниже описывается синтез циклического Y2 селективного пептида [Cys2,Lys13,D-Cys27,Gln34]PP(SEQ ID No: 30) и синтез его аналогов с GAG-связывающим мотивом, мотивом, связывающим сывороточный белок или фрагментом полиэтиленгликоля, присоединнными к ипсилон-аминогруппе Lys13. Как правило, защитной группой в боковой цепи является Fmoc, за исключением: В случае [Cys2,Lys13,D-Cys27,Gln34]PP для того, чтобы добиться селективной депротекции, используют следующие защитные группы: Пептид синтезируют твердофазным синтезом на полимере PAL Peg-PS (полимер, который при отщеплении образует биологически важную карбоксиамидную группу) с применением Fmoc защиты с 5-кратным молярным избытком реагента. Конденсацию осуществляют с помощью HCTU в ДМФА в качестве реагента. Снятие Fmoc после каждой стадии конъюгации осуществляют 20% раствором пиперидина в ДМФА в течение 10-15 мин. Присоединение проверяют на каждой стадии количественным анализом с нингидрином. В некоторых случаях можно осуществлять двойное связывание (присоединение). После синтеза полноразмерных пептидов защитную группу в ипсилон-аминогруппе Lys 13 селективно снимают обработкой 2% раствором гидразина в ДМФА в течение 15-20 мин, в то же время пептид ещ остатся связанным с полимером. Затем полимер делят на три различных части для получения недериватизированного пептида, а также пептидов, модифицированных тремя различными мотивами: 1. [Cys2,Lys13,D-Cys27,Gln34]PP (SEQ ID No: 30)."Материнский пептид" отщепляют от полимера и депротекционируют обработкой смесью 95% трифторуксусной кислоты, 2,5% воды, 2,5% трипропилсилана в течение 2-3 ч. Внутримолекулярный стабилизирующий дисульфидный мостик между Cys2 и D-Cys27 получают окислением на воздухе, растворяя пептид с концентрацией 1 мг/мл в ацетате аммония pH 8,5-9 при перемешивании в течение 24-28 ч до тех пор, пока не исчезнут свободные тиолы, определяемые реактивом Эллмана. Пептид очищают обращенно-фазовой ВЭЖХ: колонка Vydac 300 , 250 мм 10 мм, элюент (буфер А=0,05% ТФК в воде; буфер В=60% MeCN: 40% воды: 0,05% ТФК) в градиенте 30-80% буфера В в течение 20 мин, 2 мл/мин. Определяют OD при 215 нм и элюент, содержащий конкретный пептид, собирают и лиофилизируют. Структуру пептида подтверждают масс-спектрометрией, аминокислотным анализом и, при необходимости, также анализом аминокислотной последовательности. 2.(SEQ ID No: 31). Для того чтобы присоединить мотив связывания сывороточного альбумина, 8-(8-гаммаглутамоиламинооктаноиламино)октаноильную группу связывают со свободной ипсилон-аминогруппой остатка Lys 13 после удаления защитной Dde группы, пептидным синтезом, с помощью защищнной аминооктановой кислоты, а затем дважды с помощью защищнной гамма-глутаминовой кислоты, в то время как пептид вс ещ остатся связанным со смолой.- 27011861 Пептид, модифицированный с применением мотива, депротекционируют, циклизуют и очищают,как описано выше для "материнского пептида". 3. Флуоресцеин-[Cys2,N-(Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala)3-Lys13,D-Cys27,Gln34]PP(SEQ ID No: 32). Для того чтобы присоединить GAG-связывающий мотив, мотив строят постадийно пептидным синтезом, используя свободную ипсилон-аминогруппу Lys13, после удаления Dde группы, на пептиде[Cys2,Lys13,D-Cys27,Gln34]PP, вс ещ связанном с полимером, используя стандартный метод с Fmoc,как в целом описано выше: GAG-связывающая последовательность, полученная таким образом, представляет собой Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-Ala-Arg-Arg-Arg-Ala-Ala-Arg-Ala-Ala-Arg-Arg-Arg-AlaAla-Arg-Ala. Флуоресцеиновую метку присоединяют для in vitro и in vivo для аналитических целей в виде его 5,6 изомера - NHS эфира, 10 избыток в течение 72 ч - к N-концу окончательнойGAG-связывающей последовательности. Пептид, модифицированный с помощью GAG-связывающего мотива, отщепляют от полимера, депротекционируют, циклизуют и очищают, как описано выше для "материнского пептида". 4.[Cys2,N-N'-(21-амино-4,7,10,13,16,19-гексаоксагенэйкозаноил)-гамма-глутамоил-Lys13,DCys27,Gln34]PP (SEQ ID No: 33). Для того чтобы присоединить фрагмент полиэтиленгликоля к Y2-Y4 селективному пептиду, защищнную 21-амино-4,7,10,13,16,19-гексаоксагенэйкозановую кислоту связывают пептидным синтезом,используя свободную ипсилон-аминогруппу Lys13, после удаления Dde группы, на пептиде[Cys2,Lys13,D-Cys27,Gln34]PP, вс ещ связанном с полимером, а затем присоединяют защищнную гамма-глутаминовую кислоту. ПЭГилированный пептид отщепляют от полимера, депротекционируют, циклизуют и очищают, как описано выше для "материнского пептида". Используя описанные выше методы, синтезируют следующие агонисты по изобретению, приведнные в качестве примеров:I. In vitro анализы для определения аффинности и активности пептидов. Анализ аффинности к человеческому Y2 рецептору. Аффинность тестируемых соединений к человеческому Y2 рецептору определяют анализом конкурентного связывания, используя 125I-PYY связывание в клетках COS-7, транзиторно трансфецированных человеческим Y2 рецептором трансфекцией с фосфатом кальция. Трансфецированные COS-7 клетки переносят в культуральные планшеты через день после трансфекции при плотности 40103 клеток на лунку, добиваясь 5-8% связывания радиоактивного лиганда. Через два дня после трансфекции проводят эксперименты по конкурентному связыванию в течение 3 ч при 4C, используя 25 пМ 125I-PYY (Amersham, Little Chalfont, UK). Анализы связывания проводят в 0,5 мл 50 мМ буфера Hepes, pH 7,4, дополненного 1 мМ CaCl2, 5 мМ MgCl2 и 0,1% (вес./об.) бычьего сывороточного альбумина и 100 мкг/мл бацитрацина. Неспецифическое связывание определяют как связывание в присутствии 1 мкМ немеченого PYY. Клетки дважды отмывают в 0,5 мл охлажднного льдом буфера и добавляют 0,5-1 мл буфера для лизиса (8 M мочевина, 2% NP40 в 3 M уксусной кислоте) и гаммасчтчиком считают связанную радиоактивность. Определения делают в двойном повторе. Связывания в стационарном (равновесном) состоянии достигают в этих условиях. Величины EC50 рассчитывают, используя программу работы со стандартными фармакологическими данными, Prism 3.0 (graphPad Sofware,San Diego, USA). Анализ аффинности к человеческому Y4 рецептору. Используется такой же протокол, как для анализа аффинности к Y2, за исключением того, что применяют человеческие трансформированные с помощью Y4 клетки COS-7, в конкурентном анализе используют 125I-PP, и для определения неспецифического связывания используют PP. Анализ аффинности к человеческому Y1 рецептору. Используется такой же протокол, как для анализа аффинности к Y2, за исключением того, что применяют человеческие трансформированные с помощью Y1 клетки COS-7 и переносят в культуральные планшеты при плотности 1,5106 клеток на лунку, в конкурентном анализе используют 125I-NPY и для определения неспецифического связывания используют NPY. Результаты тестирования NPY, PYY, PYY3-36, PP и [Gln45]PP, [Ile31,Gln34]PP, [Val31,Gln34]PP,[Arg26,Met30]PYY, [Glu4,Arg26]PYY агонистов по изобретению в вышеуказанных анализах аффинности даны в табл. 1. Таблица 1 Анализ активности к человеческому Y2 рецептору. Активность тестируемых соединений к человеческому Y2 рецептору измеряют (определяют) в экспериментах доза-эффект в клетках COS-7, транзиторно трансфецированных человеческим Y2 рецептором, а также смешанным G белком, Gqi5, который гарантирует, что Y2 рецептор связывается через Gq путь, ведущий к повышению метаболизма инозитолфосфатов. Метаболизм фосфатидилинозитола. Через день после трансфекции клетки COS-7 инкубируют в течение 24 ч, используя 5 мкКи [3H]миоинозитола (Amersham, РТ 6-271) в 1 мл среды, дополненной 10% фетальной бычьей сыворотки, 2 мМ глутамина и 0,01 мг/мл гентамицина на лунку. Клетки дважды отмывают в буфере, 20 мМ HEPES, pH 7,4, дополненном 140 мМ NaCl, 5 мМ KCl, 1 мМ MgSO4, 1 мМCaCl2, 10 мМ глюкозы, 0,05% (вес./об.) бычьей сыворотки; и инкубируют в 0,5 мл буфера, дополненного 10 мМ LiCl при 37C в течение 30 мин. После стимуляции при различных концентрациях пептида в течение 45 мин при 37C клетки экстрагируют 10% ледяной перхлорной кислотой с последующей инкубацией на льду в течение 30 мин. Полученные супернатанты нейтрализуют KOH в буфере HEPES и полученный [3H]инозитолфосфат очищают на анионообменной смоле Bio-Rad AG1-Х 8 и считают бетасчтчиком. Определения делают в двойном повторе. Величины EC50 рассчитывают, используя программу для работы со стандартными фармакологическими данными. Prism 3.0 (graphPad Sofware, San Diego,USA).- 29011861 Анализ активности к человеческому Y4 рецептору. Используется такой же протокол, как для анализа активности к Y2, за исключением того, что применяют человеческие трансформированные с помощью Y4 клетки COS-7. Анализ активности к человеческому Y1 рецептору. Используется такой же протокол, как для анализа активности к Y2, за исключением того, что применяют человеческие трансформированные с помощью Y1 клетки COS-7. Результаты тестирования NPY, PYY, PYY3-36, PP и [Gln45]PP, [Ile31,Gln34]PP, [Val31,Gln34]PP(SEQ ED No: 10) агонистов по изобретению в вышеуказанных анализах активности даны в табл. 2. Таблица 2II. In vitro анализы для определения устойчивости белков. Важным показателем для многих пептидов по изобретению является устойчивость белков, в особенности устойчивость, например, к расщеплению ферментами, так как эти пептиды создаются так, чтобы иметь повышенную устойчивость по сравнению, например, с PYY3-36, или даже повышенную устойчивость по сравнению с полноразмерными PYY и PP. Устойчивость РР-складки определяют как устойчивость пептидов к расщеплению эндопептидазами, которые расщепляют, например, в области петли, которая является относительно гибкой (как описано в О'Hare, M.Schwartz, T.W. 1990. In Degradation of Bioactive Substances: Physiology and Pathophysiology. J. Henriksen, ed. CRC Press, Boca Raton, Fl). В качестве модельного фермента используют эндопротеиназу Asp-N (Pierce). Этот фермент расщепляет на N-концевой стороне остатков Asp, например между остатками 9 и 10 (Asp) PP. Пептиды инкубируют с эффективной дозой эндопептидазы Asp-N, как указано производителем в 0,01 M Tris/HCl буфере, pH 7,5 при комнатной температуре и образцы извлекают через 24 ч. Образцы анализируют методом ВЭЖХ и затем проводят последовательную деградацию (отщепление) во времени. Пептиды сравнивают по стабильности с PYY, PYY3-36 и PP. Устойчивость к аминопептидазам определяют, как описано выше для эндопептидаз, но вместо них используют аминопептидазу N и дипептидилпептидазу IV. Некоторые из пептидов специально предназначены для того, чтобы быть устойчивыми к этим аминопептидазам, например PYY2-36, ацилированные по N-концу, пептидные производные и пептидные дериваты, алкилированные фрагментом, связывающим альбумин, на N-конце. Пептиды сравнивают по стабильности (устойчивости) с PYY, PYY3-36 иIII. In vitro анализы для определения связывания с гликозаминогликанами (GAGS). Способность тестируемых соединений связываться с GAGS проверяют in vitro анализом с применением иммобилизованного гепарина, т.е. гепарин-агарозы, в качестве аффинной матрицы. Применяют либо колонку HiTrap с гепарин-сефарозой (Amersham Pharmacia Biotech, Uppsala, Sweden), либо колонки с гепарином для ВЭЖХ, элюируют в 50-мин. линейном градиенте 0-0,5 M NaCl в 50 мМ растворе фосфата натрия (pH 7,3), содержащем 2 мМ DTT и 1 мМ MgEDTA при скорости потока 1 мл/мин. Для регенерации колонку промывают 1 M NaCl в буфере А в течение 51-55 мин.IV. In vivo исследование действия пептидов на аппетит, потребление пищи и массу тела. Действие селективных к Y2/Y4, по сравнению с Y1, агонистов, на быстрое потребление пищи у мышей. Берут мышей линии ddy весом 34-37 г в возрасте 8-9 недель (Japan SLC, Shizuuoka, Japan). Мышей индивидуально помещают в регулируемую среду (22C, влажность 55%) с 12-часовым световым циклом"день-ночь" с включением света в 7 часов утра. Пищу и воду дают неограниченно, за исключением времени непосредственно перед экспериментами (см. ниже). Мыши привыкают к подкожным инъекциям в течение недели перед началом экспериментов. Мышей в экспериментах используют по одному разу. Непосредственно перед применением пептиды разводят в физиологическом солевом растворе и вводят в виде подкожной инъекции в объме 100 мкл. Результаты представлены как среднее +/-SE. Для оценки разницы между группами применяют дисперсионный анализ, а затем тест Бонферрони. Мышей отлучают от пищи, но оставляют свободный доступ к воде за 16 ч до данного теста и эксперименты начинают в 10 часов утра на следующий день. Используют стандартную диету (CLEA Japan,- 30
МПК / Метки
МПК: A61P 3/04, A61K 8/00, C07K 14/705, A61K 38/17
Метки: терапевтического, рецепторов, агонисты, воздействия, селективные
Код ссылки
<a href="https://eas.patents.su/30-11861-selektivnye-agonisty-receptorov-y2-y4-dlya-terapevticheskogo-vozdejjstviya.html" rel="bookmark" title="База патентов Евразийского Союза">Селективные агонисты рецепторов y2/y4 для терапевтического воздействия</a>
Предыдущий патент: Селективные агонисты рецептора y2 для терапевтического воздействия
Следующий патент: Композиции рамиприла
Случайный патент: Клапанный блок