Антагонисты рецептора pgd2 для лечения воспалительных заболеваний
Номер патента: 11385
Опубликовано: 27.02.2009
Авторы: Карсон Кеннет Дж., Гош Шомир, Элдер Эйми М., Харрисон Шон, Спротт Кевин
Формула / Реферат
1. Способ ингибирования CRTH2 у субъекта, нуждающегося в ингибировании CRTH2, включающий введение субъекту эффективного количества соединения, представленного следующей структурной формулой:
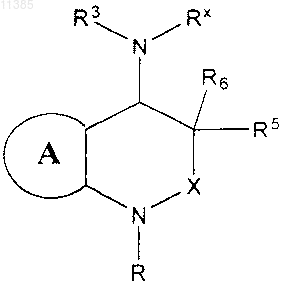
или его фармацевтически приемлемой соли, в которой
кольцо А означает необязательно замещенное фенильное кольцо;
R представляет собой -X1-R1;
Rx означает -C(O)R4 и R3 представляет собой необязательно замещенную фенильную, пиридильную или циклогексильную группу;
X означает -С(О)- или -C(R2)2-;
X1 и Х2, каждый независимо, представляет собой связь, S(O), S(O)2, C(O) или C(O)NH;
R1 означает Н или необязательно замещенную, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;
при условии, что когда X1 представляет собой связь, SO или SO2, тогда R1 не означает Н;
каждый R2 независимо представляет собой -Н, -X4-R8 или необязательно замещенную, алифатическую группу, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;
R4 означает -Н, -Х6-R10 или необязательно замещенную, алифатическую группу, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;
при условии, что когда Х2 представляет собой связь, SO или SO2, тогда R4 не является атомом водорода;
Х4 и Х6, каждый независимо, представляет собой неразветвленную или разветвленную углеводородную группу, необязательно замещенную одной или несколькими группами, выбранными из группы, состоящей из галоида, -ОН, =О, С1-С3алкокси, нитро и циано;
R5 и R6, каждый независимо, представляет собой Н; и
R8 и R10, каждый независимо, означает Н, -C(O)OR' или необязательно замещенную, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;
где необязательные заместители в алифатической группе, циклоалифатической группе или неароматической гетероциклической группе представляют собой от одной до трех групп, каждая из которых независимо выбрана из группы, состоящей из галоида, R11, =O, =S, =NNHR*, =NN(R*)2, =NNHC(O)R*, =NNHCO2(алкил), =NNHSO2(алкил) и =NR*;
необязательные заместители при ненасыщенных атомах углерода ароматической группы представляют собой от одного до четырех независимых возможных радикалов R11;
необязательные заместители при атоме азота ароматической группы или атом азота неароматической азотсодержащей гетероциклической группы означают от одной до трех групп, причем каждая независимо выбрана из группы, состоящей из R+, -N(R+)2, -C(O)R+, -CO2R+, -C(O)C(O)R+, -C(O)CH2C(O)R+,
-SO2R+, -SO2, -N(R+)2, -C(=S)N(R+)2, -C(=NH)-N(R+)2 и -NR+SO2R+;
каждый R11 независимо выбран из группы, состоящей из галоида, Ro, -ОН, -ORo, -SH, -SRo, 1,2-метилендиокси, 1,2-этилендиокси, защищенного гидроксила (-ОН), фенила, [R12]фенила, -О(фенила), -O([R12]фенила), -СН2(фенила), -CH2([R12]фенила), -СН2СН2(фенила), -СН2СН2(R12]фенила), -NO2, -CN, -N(R')2, -NR'CO2Ro, -NR'C(O)Ro, -NR'NR'C(O)Ro, -N(R')C(O)N(R')2, -NR'NR'C(O)N(R')2, -NR'NR'CO2Ro, -C(O)C(O)Ro, -C(O)CH2C(O)R', -CO2R', -C(O)Ro, -C(O)N(R')2, -OC(O)N(R')2, -S(O)2Ro, -SO2N(R')2, -S(O)R', -NR'SO2N(R')2, -NR'SO2Ro, -C(=S)N(R')2, -(CH2)yN(R')2, -C(=NH)-N(R')2, -(CH2)yC(O)N(R')2, -(CH2)yNHC(O)R' или -(CH2)yNHC(O)CH(V-R')(R'); R' представляет собой H, Ro, -CO2Ro, -SO2Ro или -C(O)Ro; у означает 0-6; V означает С1-С6алкилен;
каждый R* независимо представляет собой Н, алифатическую группу или алифатическую группу, замещенную радикалом R12;
R+ означает Н, фенил, [R12]фенил, -О(фенил), -О([R12]фенил), -СН2(фенил), -CH2([R12]фенил), гетероарильную группу, неароматическую гетероциклическую группу, алифатическую группу или алифатическую группу, замещенную R12;
Rш означает алифатическую группу, циклоалифатическую группу, ароматическую группу, аралкильную группу или неароматическую гетероциклическую группу, причем каждая группа необязательно замещена радикалом R12;
R12 представляет собой от одного до четырех заместителей, причем каждый независимо выбирают из группы, состоящей из галоида, C1-С6алкила, (галоид)r алкила С1-С6, циклоалкила C3-C8, (галоид)r циклоалкила С3-C8, -CN, -CF3, -CHF2, -CH2F, -OCF3, -OCHF2, -OCH2F, -OR', -OR13C(O)R', -C(O)OR', -C(O)N(R16)2, -N(RI6)2, -NO2, -NR16C(O)R', -NR16C(O)OR', -NR16C(O)N(R16)2, -NR16SO2R17, -S(O)qR17, -R13NR16C(O)R', -R13C(O)R', -R13NR16C(O)OR', тетразолил, имидазолил или оксадиазолил;
R13 означает С1-С6алкил или С3-С8циклоалкил;
R16, каждый независимо, представляет собой R' или бензил;
R17 представляет собой R13 или -CF3;
q означает 0-2; и
r означает 1-3.
2. Способ по п.1, в котором
кольцо А представляет собой фенил или [R11]фенил;
X означает -CHR2-;
R1 представляет собой необязательно замещенную, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;
R2 означает Н или необязательно замещенную, С1-С4алкильную группу, С1-С4алкилалкоксиметиленовую группу или С3-С6циклоалкильную группу; и
R4 представляет собой необязательно замещенную, алифатическую группу, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу.
3. Способ по п.2, в котором R3 является необязательно замещенной фенильной группой.
4. Способ по п.3, в котором соединение представлено следующей структурной формулой:

5. Способ по п.4, в котором
R1 является необязательно замещенной, циклоалкильной группой, ароматической группой или неароматической гетероциклической группой;
R3 означает фенил или [R11]фенил;
R4 означает Н, -CH2C(O)R14, -CH2R15, -CH2OR14 или необязательно замещенную С1-С3алкильную группу, циклоалкильную группу, ароматическую группу или неароматическую гетероциклическую группу;
R14 является Н или необязательно замещенной алкильной группой, ароматической группой, циклоалкильной группой или неароматической гетероциклической группой; и
R15 является необязательно замещенной, ароматической группой, циклоалкильной группой или неароматической гетероциклической группой;
где каждый R11 и необязательные заместители независимо определены в п.1.
6. Соединение, представленное следующей структурной формулой:
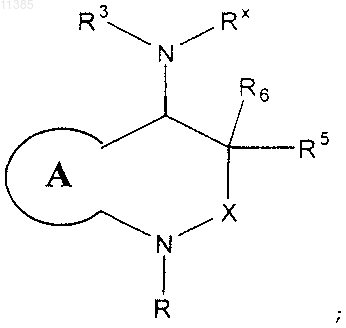
или его фармацевтически приемлемая соль, где
кольцо А представляет собой необязательно замещенное фенильное кольцо;
R означает -X1-R1;
Rx представляет собой -C(O)R4, и R3 означает необязательно замещенную фенильную группу;
X означает -С(О)- или -C(R2)2-;
Х1 и Х2, каждый независимо, представляет собой связь, S(O), S(O)2, C(O) или C(O)NH;
R1 означает Н или необязательно замещенную, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;
при условии, что когда X1 означает связь, SO или SO2, тогда R1 не является атомом водорода Н;
каждый R2 независимо представляет собой Н, -X4-R8 или необязательно замещенную, алифатическую группу, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;
R4 означает Н, -Х6-R10 или необязательно замещенную, алифатическую группу, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;
при условии, что когда Х2 означает связь, SO или SO2, тогда R4 не является атомом водорода;
Х4 и Х6, каждый независимо, представляет собой неразветвленную или разветвленную углеводородную группу, необязательно замещенную одной или несколькими группами, выбранными из групп, состоящих из галоида, -ОН, =O, C1-С3алкокси, нитро и циано;
R5 и R6, каждый независимо, представляет собой Н; и
R8 и R10, каждый независимо, представляет собой Н, -C(O)OR' или необязательно замещенную, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;
где необязательные заместители в алифатической группе, циклоалифатической группе или неароматической гетероциклической группе означают от одной до трех групп, причем каждая независимо выбрана из группы,состоящей из галоида, R11, =O, =S, =NNHR*, =NN(R*)2, =NNHC(O)R*, =NNНСО2(алкил), =NNHSO2(алкил) и =NR*;
необязательные заместители при ненасыщенных атомах углерода ароматической группы представляют собой от одного до четырех независимых возможных радикалов R11;
необязательные заместители при атоме азота ароматической группы или атоме азота неароматической азотсодержащей гетероциклической группы представляют собой от одной до трех групп, причем каждая независимо выбрана из группы, состоящей из R+, -N(R+)2, -C(O)R+, -CO2R+, -C(O)C(O)R+, -C(O)CH2C(O)R+, -SO2R+, -SO2N(R+)2, -C(=S)N(R+)2, -C(=NH)-N(R+)2 и -NR+SO2R+;
каждый R11 независимо выбран из группы, состоящей из галоида, Ro, -ОН, -ORo, -SH, -SRo, 1,2-метилендиокси, 1,2-этилендиокси, защищенного гидроксила, фенила, [R12]фенила, -О(фенила), -О(R12]фенила), -СН2(фенила), -СН2([R12]фенила), -СН2СН2(фенила), -СН2СН2(R12]фенила), -NO2, -CN, -N(R')2, -NR'CO2Ro, -NR'C(O)Ro, -NR'NR'C(O)Rш, -N(R')C(O)N(R')2, -NR'NR'C(O)N(R')2, -NR'NR'CO2Ro, -C(O)C(O)Ro, -C(O)CH2C(O)R', -CO2R', -C(O)Ro, -C(O)N(R')2, -OC(O)N(R')2, -S(O)2Ro, -SO2N(R')2, -S(O)R', -NR'SO2N(R')2, -NR'SO2Ro, -C(=S)N(R')2, -(CH2)yN(R')2, -C(=NH)-N(R')2, -(CH2)yC(O)N(R')2, -(CH2)yNHC(O)R' или -(CH2)yNHC(O)CH(V-R')(R');
R' представляет собой Н, Ro, -CO2Ro, -SO2Ro или -C(O)Ro; у означает 0-6; V означает C1-С6алкилен;
каждый R* независимо представляет собой Н, алифатическую группу или алифатическую группу, замещенную радикалом R12;
R+ означает Н, фенил, [R12]фенил, -О(фенил), -O([R12]фенил), -СН2(фенил), -CH2([R12]фенил), гетероарильную группу, неароматическую гетероциклическую группу, алифатическую группу или алифатическую группу, замещенную радикалом R12;
Ro означает алифатическую группу, циклоалифатическую группу, ароматическую группу, аралкильную группу или неароматическую гетероциклическую группу, причем каждая группа необязательно замещена R12;
R12 представляет собой от одного до четырех заместителей, причем каждый независимо выбран из группы, состоящей из галоида, С1-С6алкила, (галоид)rалкилаC1-С6, циклоалкилаС3-С8, (галоид)rциклоалкилаС3-С8, -CN, -CF3, -CHF2, -CH2F, -OCF3, -OCHF2, -OCH2F, -OR', -OR13C(O)R', -C(O)OR', -C(O)N(R16)2, -N(R16)2, -NO2, -NR16C(O)R', -NR16C(O)OR', -NR16C(O)N(R16)2, -NR16SO2R17, -S(O)qR17, -R13NR16C(O)R', -R13C(O)R', -R13NR16C(O)OR', тетразолила, имидазолила или оксадиазолила;
R13 означает C1-С6алкил или С3-С8циклоалкил;
каждый R16 представляет собой независимо R' или бензил;
R17 означает R13 или -CF3;
q представляет собой 0-2; и
r означает 1-3;
при условии, что соединение не означает 2-метил-N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(2-метил-1-оксобутил)-4-хинолинил]бутамид; N-(1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилгептамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(1-оксо-3-фенилпропил)-4-хинолинил]бензолепропанамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(3-нитробензоил)-4-хинолинил]гексанамид; N-[1,1'-бифенил]-3-ил-N-[1,2,3,4-тетрагидро-1-(4-метоксибензоил)-2-метил-4-хинолинил]ацетамид; N-(1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-(4-нитрофенил)гептанамид; N-(1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-(4-метоксифенил)-2-метилпропанамид; N-[1-(4-фторбензоил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилбутанамид; N-фенил-N-[1,2,3,4-тетрагидро-1-(3-метоксибензоил)-2-метил-4-хинолинил]пентанамид; 2-этил-N-[1-(2-этил-1-оксобутил)-1,2,3,4-тетрагидро-2,8-диметил-4-хинолинил]-N-(2-метилфенил)бутанамид; N-[1-[(4-фторфенил)ацетил]-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилпропанамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(4-нитробензоил)-4-хинолинил]октанамид; N-циклогексил-4-[(циклогексиламино)карбонил]фениламино]-3,4-дигидро-2-метил-1(2Н)-хинолинкарбоксамид; N-[1-(4-этилбензоил)-1,2,3,4-тетрагидрю-2,8-диметил-4-хинолинил]-N-(2-метилфенил)-3-(4-нитрофенил)-2-пропенамид; 3-(4-метоксифенил)-N-фенил-N-[1,2,3,4-тетрагидро-1-[3-(4-метоксифенил)-1-оксо-2-пропенил]-2-метил-4-хинолинил]-2-пропенамид; 4-[(этоксиоксоацетил)фениламино]-3,4-дигидро-2-метил-g-оксоэтиловый эфир 1-(2Н)-хинолинуксусной кислоты; N-[1-(3-циклогексил-1-оксопропил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилциклогексанпропанамид; 4-(ацетилфениламино)-3,4-дигидро-2-метил-g-оксо-1-(2Н)-хинолинпентановую кислоту; N-(1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-2,2-диметил-N-фенилпропанамид; N-(1-бензоил-6-бром-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилпентанамид; N-[1-(2-фуранилкарбонил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилацетамид; 2-метил-N-фенил-N-[1,2,3,4-тетрагидро-1-(3-метоксибензоил)-2-метил-4-хинолинил]пропанамид; N-[1-[(1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил)ацетил]-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилацетамид; 2,2,2-трифтор-N-фенил-N-[1,2,3,4-тетрагидро-1-(3-метоксибензоил)-2-метил-4-хинолинил]ацетамид; 2-этил-N-[1-(2-этил-1-оксобутил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилбутанамид; N-(1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-(3-метоксифенил)ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(1-оксогексил)-4-хинолинил]ацетамид; N-(1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенил-2-тиофенкарбоксамид; N-[1-(2-фторбензоил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилгексанамид; N-фенил-N-[1,2,3,4-тетрагидро-1-(4-метоксибензоил)-2-метил-4-хинолинил]гексанамид; N-фенил-N-[1,2,3,4-тетрагидро-1-(4-метоксибензоил)-2-метил-4-хинолинил]гексанамид; N-[1-(циклопропилкарбонил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилциклопропанекарбоксамид; N-(1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-(4-метилфенил)ацетамид; 2-метил-N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(2-метил-1-оксопропил)-4-хинолинил]пропанамид; -N-фенил-N-[1,2,3,4-тетрагидро-1-(4-метоксибензоил)-2-метил-4-хинолинил]-2-тиофенкарбоксамид; 1-(3,5-динитробензоил)-N-формил-1,2,3,4-тетрагидро-2-метил-N-фенил-4-хинолинамин; N-[1-(4-хлор-3-нитробензоил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилацетамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(3-нитробензоил)-4-хинолинил]ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-1-(3-метоксибензоил)-2-метил-4-хинолинил]гексанамид; N-[1-(2-фуранилкарбонил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенил-2-фуранкарбоксамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(1-оксопропил)-4-хинолинил]ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-1-[3-(4-метоксифенил)-1-оксо-2-пропенил]-2-метил-4-хинолинил]ацетамид; 3-(2-фуранил)-N-[1-[3-(2-фуранил)-1-оксо-2-пропенил]-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенил-2-пропенамид; N-[1-[2-(1,3-дигидро-1,3-диоксо-2Н-изоиндол-2-ил)-1-оксо-3-фенилпропил]-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилоктанамид; N-[1-(3-хлорбензоил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилацетамид; относительная стереохимия N-фенил-N-[(2R,4S)-1,2,3,4-тетрагидро-2-метил-1-(1-оксопропил)-4-хинолинил]ацетамида; относительная стереохимия N-[(2R,4S)-1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-2-метил-N-фенилпропанамида; относительная стереохимия N-[(2R,4S)-1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилгексанамида; относительная стереохимия N-[(2R,4S)-1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилпропанамида; относительная стереохимия N-[(2R,4S)-1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилгептанамида; относительная стереохимия N-[(2R,4S)-1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-2,2-диметил-N-фенилпропанамида; N-[1-(3-фторбензоил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилацетамид; N-[1-[4-(1,1-диметилэтил)бензоил]-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилацетамид; N-(1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-2-метил-N-фенилпропанамид; 2,2,2-трифтор-N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(трифторацетил)-4-хинолинил]ацетамид; относительная стереохимия N-[(2R,4S)-1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-2,2-диметил-N-фенилпропанамида; относительная стереохимия N-[(2R,4S)-1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилбутанамида; относительная стереохимия N-[(2R,4S)-1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилацетамида; относительная стереохимия N-фенил-N-[(2R,4S)-1,2,3,4-тетрагидро-2-метил-1-(1-оксогептил)-4-хинолинил]ацетамида; относительная стереохимия N-фенил-N-[(2R,4S)-1,2,3,4-тетрагидро-2-метил-1-(1-оксогексил)-4-хинолинил]ацетамида; относительная стереохимия N-[(2R,4S)-1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилпентанамида; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(1-оксо-3-фенил-2-пропенил)-4-хинолинил]ацетамид; относительная стереохимия N-[(2R,4S)-1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилгептанамида; относительная стереохимия N-[(2R,4S)-1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилацетамида; относительная стереохимия N-[(2R,4S)-1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилпентанамида; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(трицикло[3.3.1.13.7]дец-1-илкарбонил)-4-хинолинил]ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(1-оксопропил)-4-хинолинил]пропанамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(2-тиенилкарбонил)-4-хинолинил]ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-1-(4-метоксибензоил)-2-метил-4-хинолинил]-2-фуранкарбоксамид; N-фенил-N-[1,2,3,4-тетрагидро-1-(4-метоксибензоил)-2-метил-4-хинолинил]ацетамид; N-[1-(3,5-динитробензоил)-1,2,3,4-тетрагидро-2-метил-4-хинолинил]-N-фенилацетамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(4-нитробензоил)-4-хинолинил]ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-1-(2-иодобензоил)-2-метил-4-хинолинил]ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(2-метил-1-оксопропил)-4-хинолинил]ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-[(4-метилфенил)сульфонил]-4-хинолинил]ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-[(4-нитрофенил)метил]-4-хинолинил]ацетамид; N-фенил-N-[1,2,3,4-тетрагидро-1-(3-метоксибензоил)-2-метил-4-хинолинил]ацетамид; N-(1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилбутанамид; N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(1-оксобутил)-4-хинолинил]ацетамид; N-(1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилгексанамид; N-(1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилпентанамид; N-(1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилпропанамид; 1-бензоил-1,2,3,4-тетрагидро-4-(N-фенилацетамидо)хинальдин; N-(1-ацетил-6-бром-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилацетамид; N-(1-ацетил-1,2,3,4-тетрагидро-2-метил-6-нитро-4-хинолил)ацетанилид; N-(1-ацетил-6-хлор-1,2,3,4-тетрагидро-2-метил-4-хинолил)ацетанилид; N-(1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилацетамид; N-(1-бензоил-6-бром-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилацетамид; N-(1-бензоил-6-хлор-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилацетамид; N-(1-бензоил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилбутанамид; N-фенил-N-[1,2,3,4-тетрагидро-1-(3-фторбензоил)-2-метил-4-хинолинил]гексанамид; N-[1-(3-хлорбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид; N-[1-(4-фторбензоил)-2-метил-6-нитро-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид; (1-бензоил-6-бром-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)фениламид пентановой кислоты; N-(1-бензоил-6-хлор-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)-N-фенилацетамид; N-[6-хлор-1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид; N-[6-бром-1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид; N-(1-бензоил-6-нитро-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)-N-фенилацетамид; N-(1-бензоил-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)-N-фенилбутирамид; N-[1-(3-метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-2,2-диметил-N-фенилпропионамид.
7. Соединение по п.6, в котором X представляет собой -CHR2-; R2 означает Н, метил или этил;
R3 представляет собой необязательно замещенную фенильную группу; и R5 и R6 каждый означает Н.
8. Соединение по п.7, в котором соединение представлено следующей структурной формулой:

9. Соединение по п.8, в котором
R1 представляет собой Н или необязательно замещенную, циклоалкильную группу, ароматическую группу или неароматическую гетероциклическую группу;
R3 означает фенил или [R11]фенил;
R4 представляет собой Н, -CH2C(O)R14, -CH2R15, -CH2OR14 или необязательно замещенную, С1-С3 алкильную группу, циклоалкильную группу, ароматическую группу или неароматическую гетероциклическую группу;
R14 представляет собой Н или необязательно замещенную алкильную группу, ароматическую группу, циклоалкильную группу или неароматическую гетероциклическую группу; и
R15 означает необязательно замещенную, ароматическую группу, циклоалкильную группу или неароматическую гетероциклическую группу.
10. Соединение по п.8, в котором
кольцо А представляет собой фенил или [R11]фенил, где R11 находится в пятом, шестом, седьмом и/или восьмом положении;
R1 означает R18; и
R4 представляет собой R18, С1-С4алкил, -СН2ОН, -СН2ОСН3, -СН2ОСН2СН3, -СН2СН2ОСН3 или
-СН2СН2ОСН2СН3; и
R18 представляет собой необязательно замещенный фенил, пиридил, фуранил, тиофенил, изоксазолил, имидазолил, пиразолил, пирролил, бензофуранил, тетразолил, тиазолил, бензил, бензотиазолил, бензоимидазолил, бензотриазолил, бензоморфолинил, бензопиразолил, индолил, -СН2-(N-пиридил), -СН2-фуранил, -СН2-тиофенил, -СН2-изоксазолил, -СН2-имидазолил, -СН2-пиразолил, -СН2-пирролил, -СН2-бензофуранил, -СН2-тетразолил, -СН2-тиазолил, -СН2-тетразолил, -СН2-бензотиазолил, -СН2-бензимидазолил, -СН2-О-фенил, -СН2С(О)-фенил, нафталимидил, тетрагидрофуранил, циклогексил, циклопентил или циклопропильную группу.
11. Соединение по п.10, в котором
кольцо А представляет собой фенил или [R11]фенил, где R11 находится в шестом и/или седьмом положении;
R1 означает фенил, тиофенил, фуранил, пиридил, пиримидинил, оксазолил, изоксазолил, бензотриазолил или бензоморфолинил, причем каждая группа необязательно замещена группой R11;
R3 представляет собой [R11]фенил; и
R4 означает метил, этил, пропил, изопропил, н-бутил, втор-бутил, трет-бутил, -СН2ОСН3 или -СН2ОСН2СН3.
12. Соединение по п.10, в котором
R1 представляет собой тиофенил, [R11]тиофенил, изоксазолил, [R11]изоксазолил, пиридинил, [R11]пиридинил, бензотриазолил, [R11]бензотриазолил, бензоморфолинил или [R11]бензоморфолинил, или R1 означает фенил или [R11]фенил, где R11 представляет собой галоид, -ORo, -N(R')2, оксазолил или
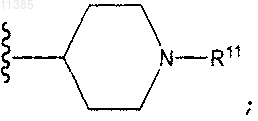
R3 означает [R11]фенил, где R11 представляет собой Br, Cl, -СН3, -N(R')2, -NHC(O)OR', - S(O)2CH3, -S(O)2N(R')2 или -(CH2)yC(O)N(R')2; и
R4 представляет собой метил, этил или -СН2ОСН3.
13. Соединение по п.12, в котором R3 представляет собой [R11]фенил, где R11 означает один заместитель в пара-положении.
14. Соединение по п.6, в котором
X представляет собой -CHR2 и
R2 и NRXR3 находятся в цис-конфигурации относительно друг друга.
15. Соединение по п.14, в котором цис-конфигурация представляет собой 2S,4R или 2R,4S
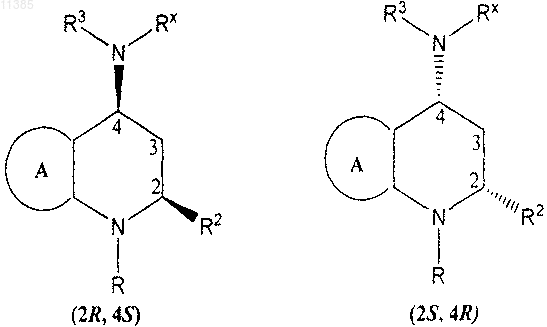
16. Соединение по п.6, в котором
X представляет собой -CHR2;
R2 и NRXR3 находятся в цис-конфигурации относительно друг друга
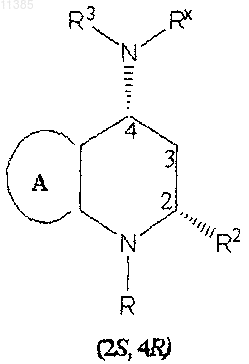
17. Соединение по п.16, в котором
R представляет собой -C(O)R1, где R1 означает необязательно замещенный фенил;
R2 означает Н, метил или этил;
R3 представляет собой [R11]фенил;
Rx представляет собой -С(О)R4, где R4 означает метил, этил, пропил, изопропил, н-бутил, втор-бутил, трет-бутил, -СН2ОСН3 или -СН2ОСН2СН3 и
кольцо А представляет собой фенил или [R11]фенил, где R11 находится в шестом и/или седьмом положении.
18. Соединение по п.17, в котором
R3 означает [R11]фенил, где R11 представляет собой Br, Cl, -CH3, -N(R')2, -NHC(O)OR', - S(O)2CH3, -S(O)2N(R')2 или -(CH2)yC(O)N(R')2; a
R4 представляет собой метил, этил или -СН2ОСН3.
19. Соединение по п.6, имеющее формулу
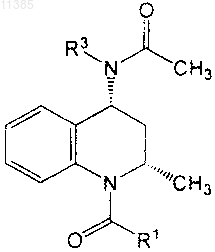
где R1 означает необязательно замещенный фенил,
R3 означает [R11]фенил и
R11 представляет собой Br, Cl, -CH3, -N(R')2, -NHC(O)OR', -S(O)2CH3, -S(O)2N(R')2 или
-(CH2)yC(O)N(R')2.
20. Соединение по п.19, в котором R11 означает один заместитель в пара-положении.
21. Соединение по п.6, которое представлено структурной формулой, выбранной из группы, состоящей из
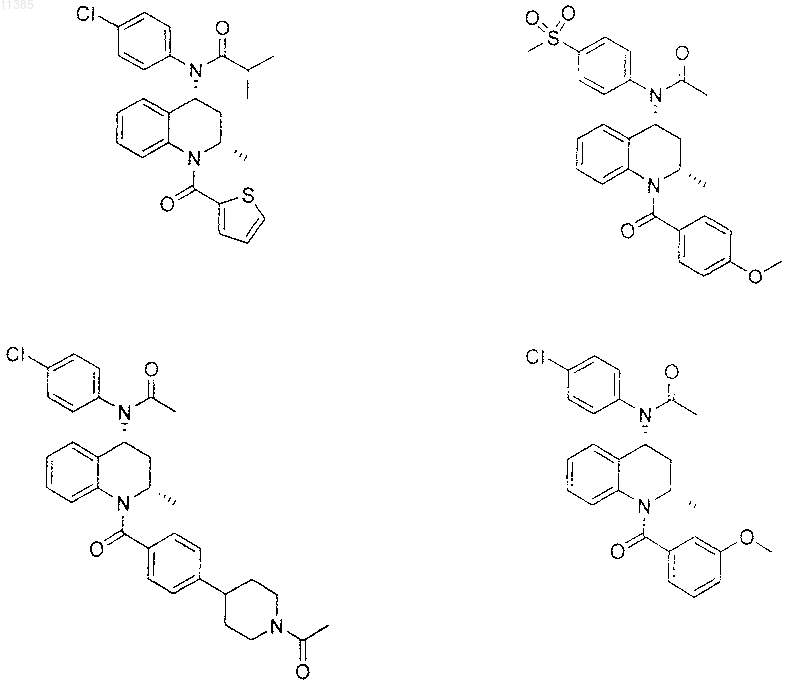
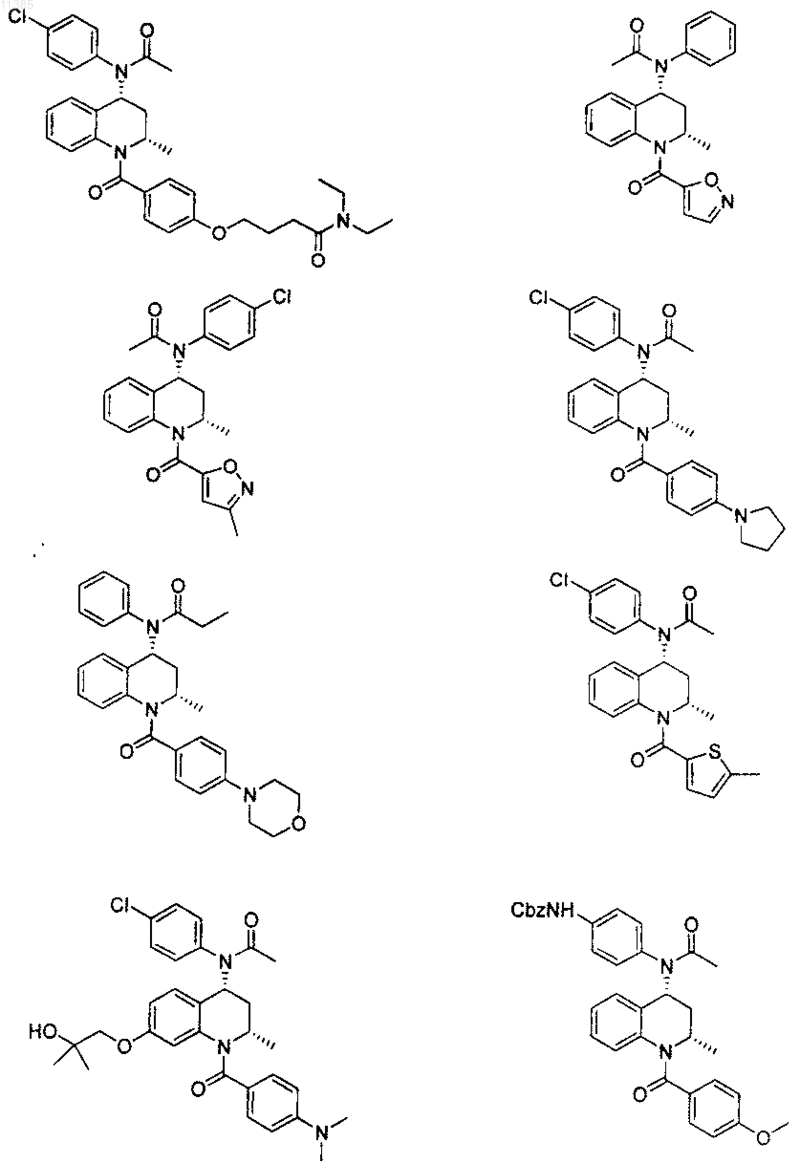
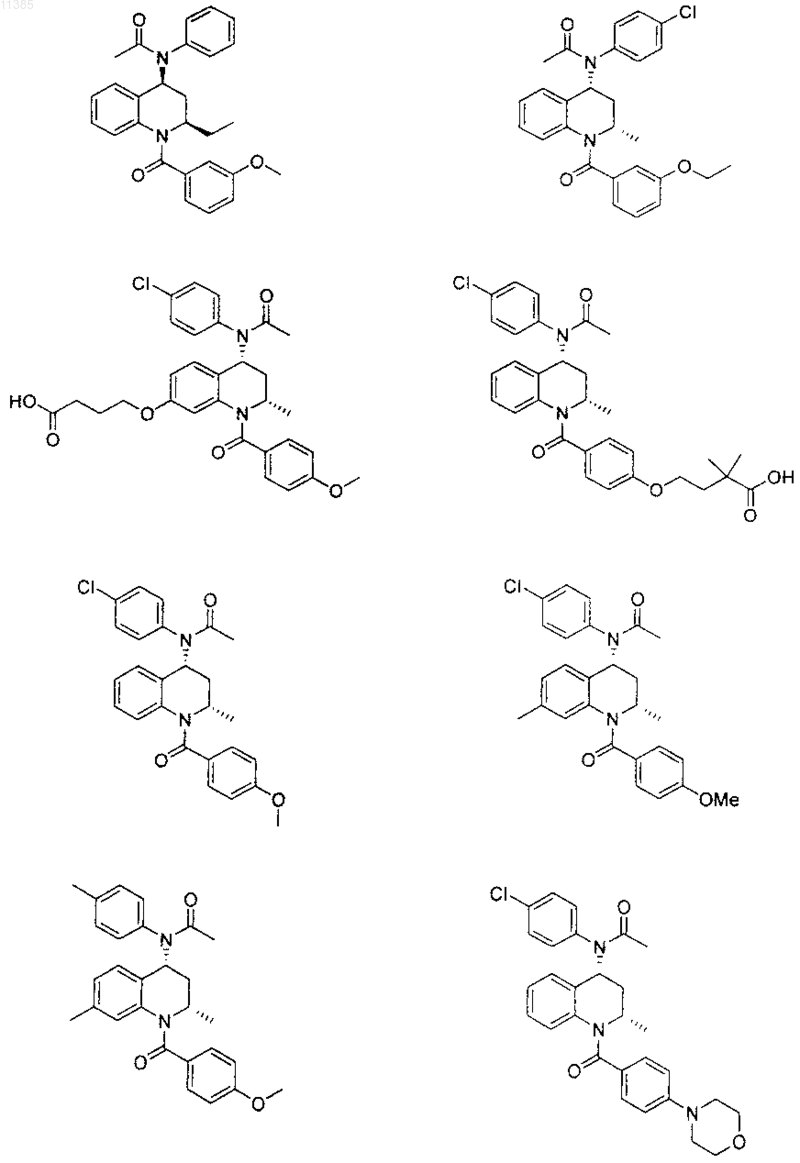
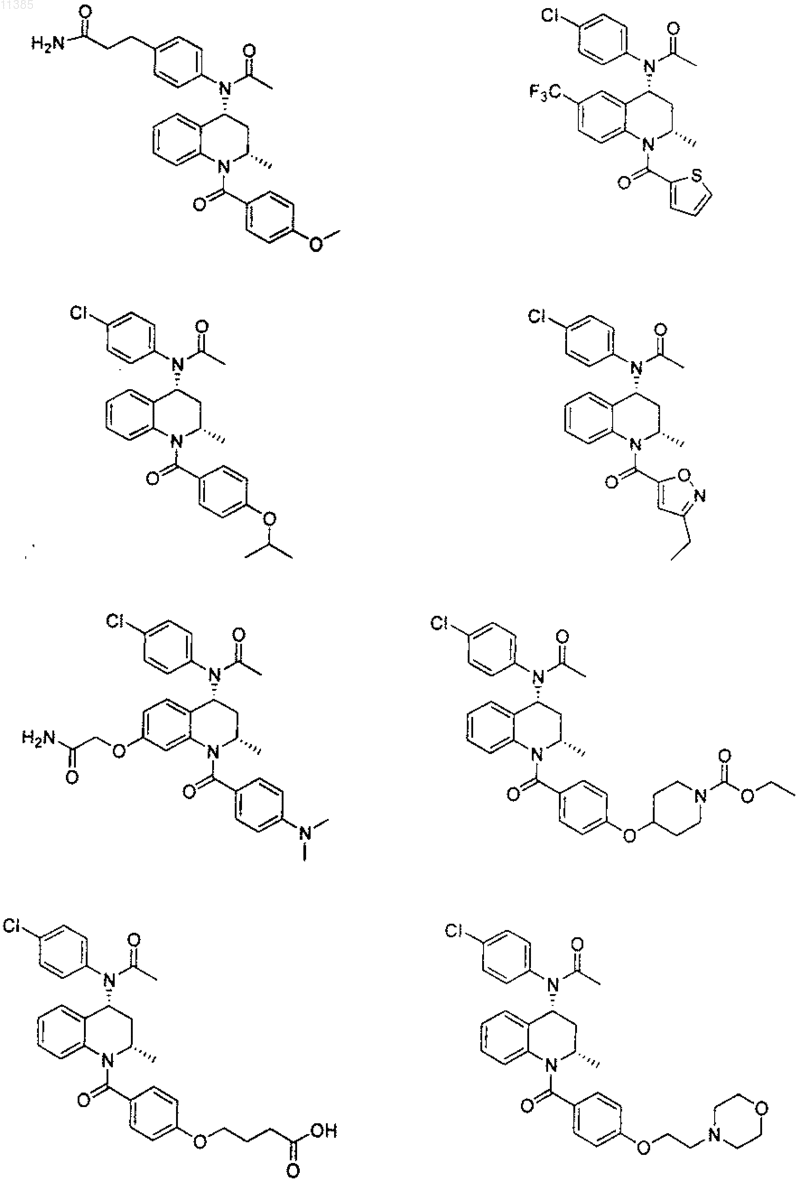
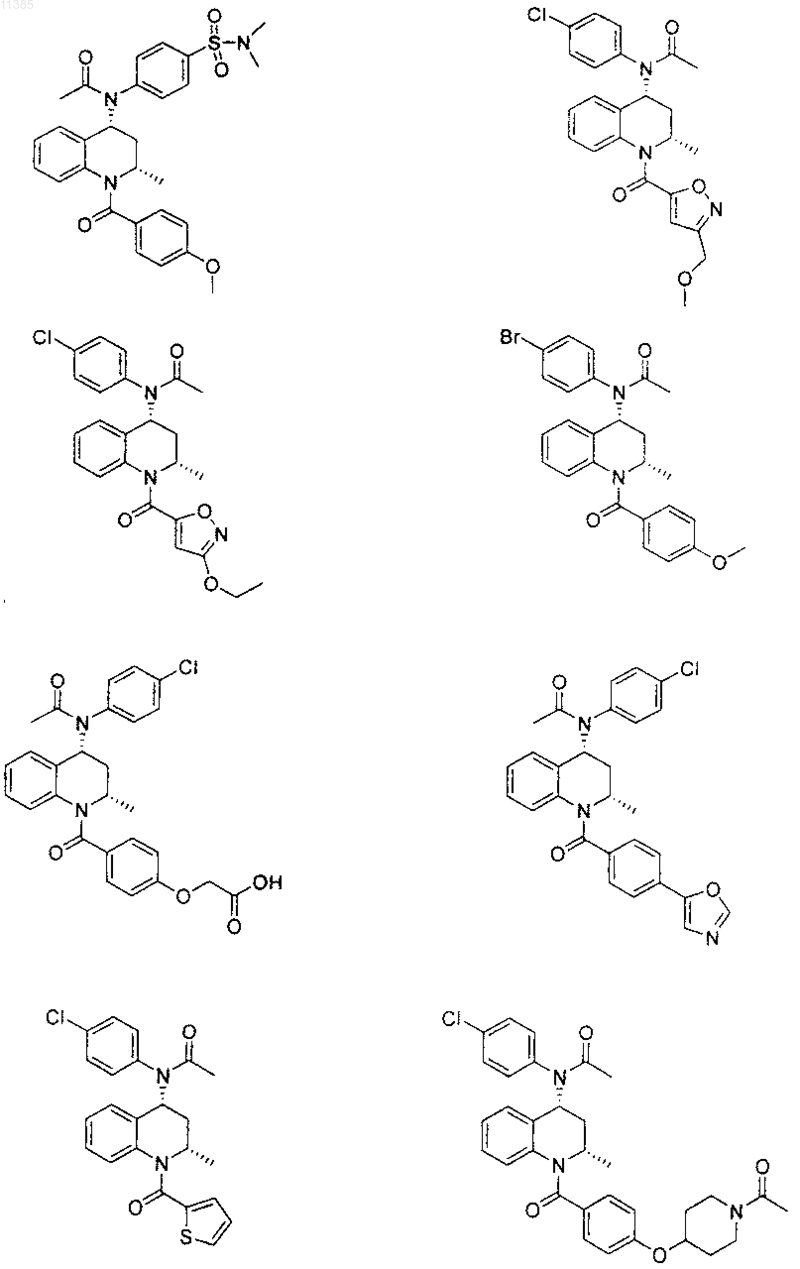
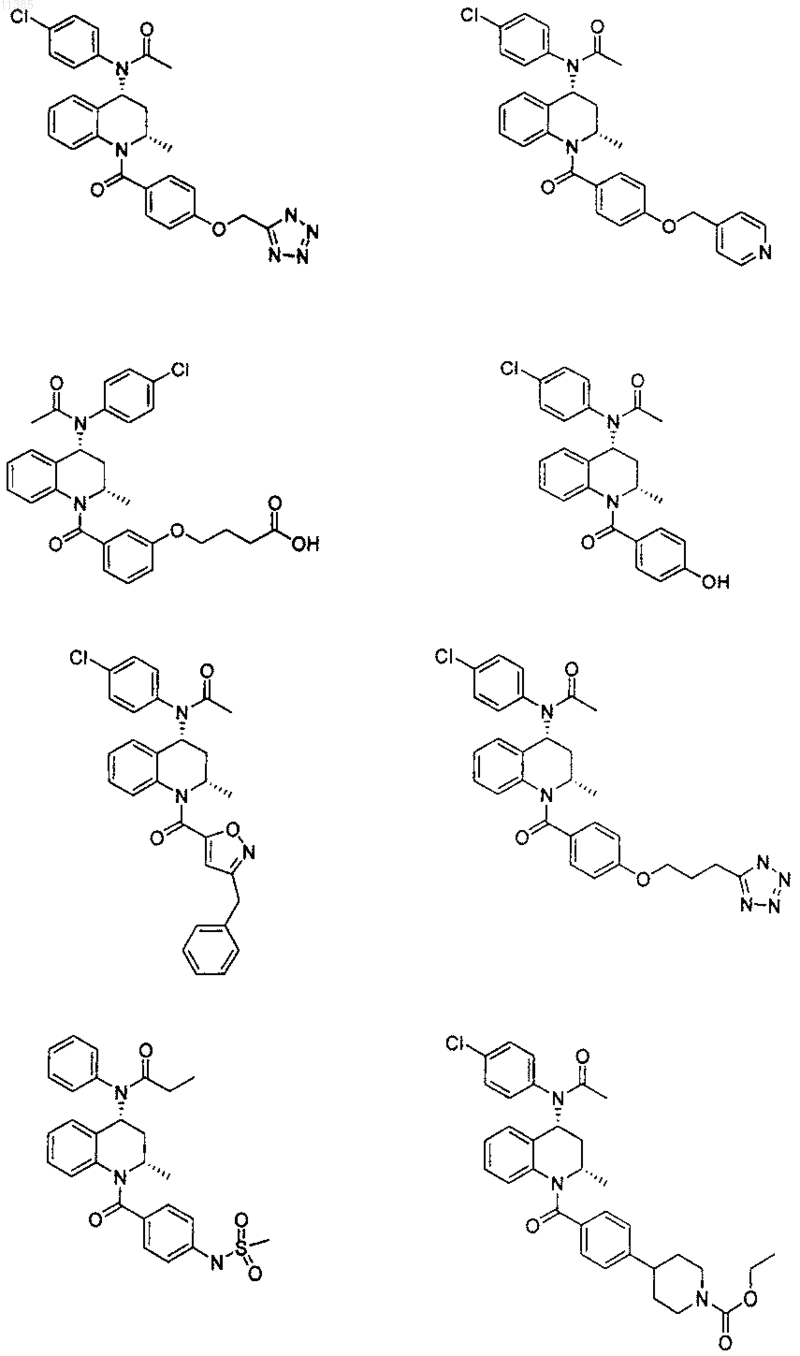
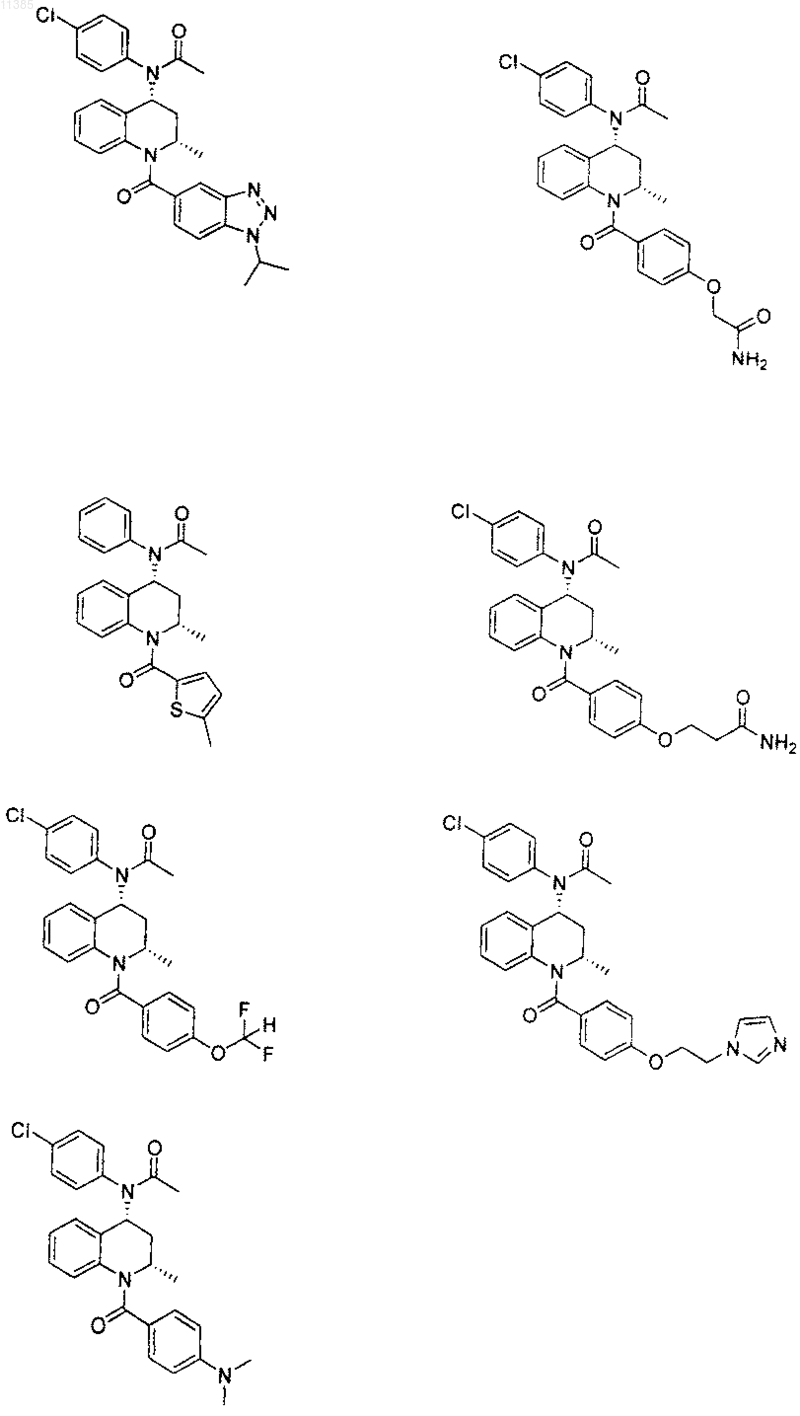
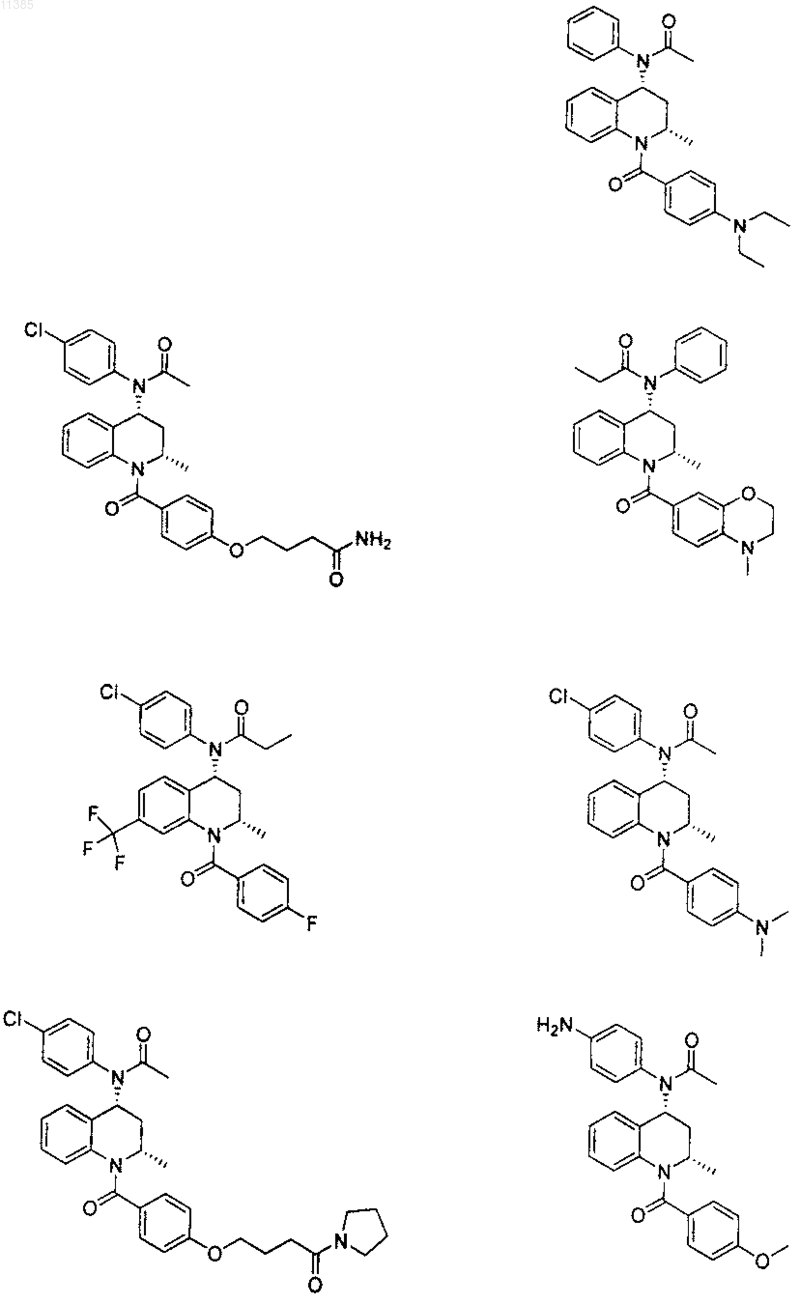
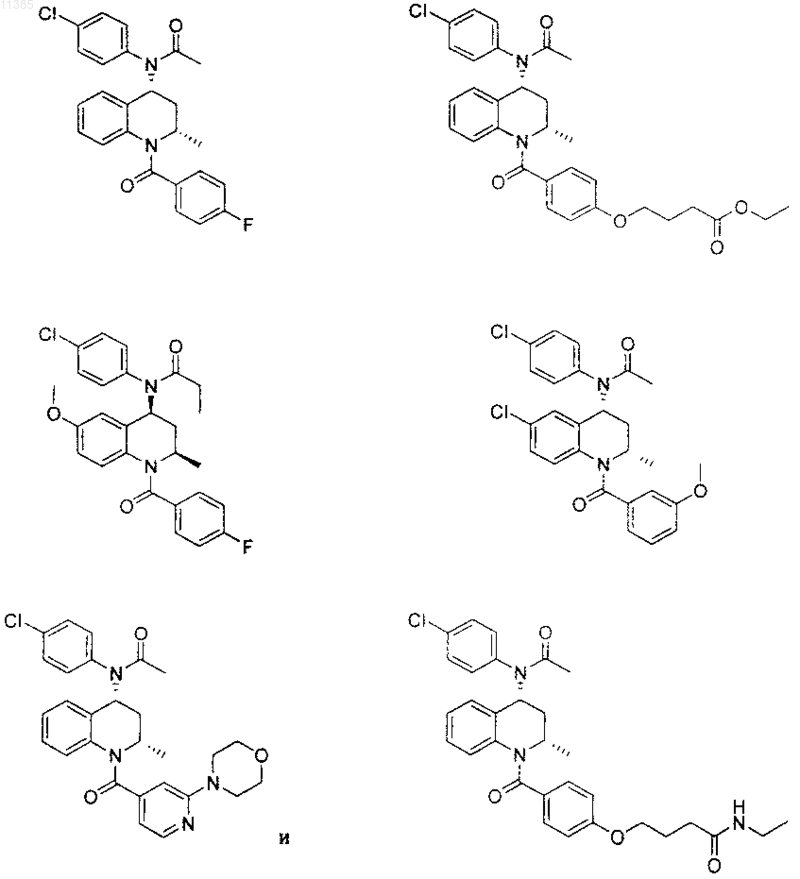
или его фармацевтически приемлемая соль.
22. Фармацевтическая композиция, которая включает в себя соединение по п.6 и фармацевтически приемлемый разбавитель, наполнитель или носитель.
23. Способ по п.1, включающий введение субъекту эффективного количества соединения или фармацевтически приемлемой соли по п.8.
24. Способ ингибирования DP у субъекта, который нуждается в DP ингибировании, включающий введение субъекту эффективного количества соединения или фармацевтически приемлемой соли по п.6.
25. Способ лечения воспалительного заболевания, нарушения или симптома у субъекта, который нуждается в лечении, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п.6.
26. Способ по п.25, в котором воспалительное заболевание, нарушение или симптом представляет собой аллергический ринит, аллергическую астму, атопический дерматит, хроническое обструкционное легочное нарушение, ревматический артрит, остеоартрит, воспалительное заболевание кишечника или кожное нарушение.
27. Способ по п.26, в котором воспалительное заболевание, нарушение или симптом представляет собой аллергический ринит шыш аллергическую астму.
Текст
011385 Соединение PGD2 относится к классу простагландинов, произведенных из арахидоновой кислоты. Оно представляет собой преобладающий простаноид, продуцируемый активированными тучными клетками, и участвует в патогенезе аллергических заболеваний, таких как астма, ринит и атопический дерматит (см. Lewis и др., J. Immunol. 129:1627 (1982), Hardy и др., N. Eng. J. Med. 311: 209 (1984), Murray и др., N. Eng. J. Med. 315: 800 (1986), Barry и др., Br. J. Pharmacol. 94:773 (1988). PGD2 представляет собой лиганд DP рецептора, и первоначально предполагали, что все биологические эффекты PGD2 проявляются через этот рецептор. Роль DP рецептора в аллергической астме была продемонстрирована на мышах с дефицитом DP (см. Matsuoka и др., Science 287: 2013 (2000. Сравнительно недавно PGD2 был идентифицирован как лиганд для рецептора, спаренного с G-протеином и названного "хемоатрактантный рецептор-гомологичная молекула, выраженная на Th2", или просто "CRTH2" (см. Tanaka и др., J. Immunol. 164:2277 (2000), и опубликованную заявку на патентUS2002/0022218). Молекула CRTh2 экспрессируется на базофилах, эозинофилах и иммунных клетках-хелперах типа Th2. Было продемонстрировано, что клетки Th2 вовлечены в гармоничное сочетание аллергической реакции (см. Wills-Karp, Annual Review ofImmunology, 17: 255 (1999. Было показано, что PGD2 индуцирует хемотаксис в клетках Th2 и эозинофилах через CRTH2 рецептор; это позволяет предположить, что CRTh2 может играть провоспалительную роль в аллергических заболеваниях (см. Hirai и др. J. Exp. Med. 193: 255 (2001). Кроме того, было показано, что у пациентов с атопическим дерматитом, наблюдается рост циркулирующих Тклеток, экспрессирующих CRTh2, который коррелирован с тяжестью заболевания (см. Cosmi и др. Eur. J.Immunol. 30: 2972(2000), Iwazaki и др. J. Investigative Dermatology, 119: 609 (2002). Таким образом, PGD2 принимает участие в различных аспектах воспаления через свои рецепторы DP и CRTh2. Поэтому предполагается, что антагонисты CRTH2 и DP могут быть эффективными при лечении нарушений, опосредованных PGD2. К сожалению, известны лишь немногие (если они имеются) ингибиторы CRTH2. В результате практикующие врачи не могут использовать эти открытия, пока не будут разработаны новые ингибиторы CRTH2. Сущность изобретения Заявители обнаружили, что определенные 1,2,3,4-тетрагидрохинолин-4-иламины представляют собой сильные ингибиторы CRTH2. Например, многие соединения эффективно ингибируют связываниеPGD2 с клетками НЕК-293, которые стабильно экспрессируют CRTH2 со значением Ki меньше, чем 1,0 микромоль/л. В этой заявке раскрыты ингибиторы CRTH2, фармацевтические композиции, содержащие эти ингибиторы, и способы ингибирования активности CRTH2 у субъекта, нуждающегося в таком лечении, полученные на основе этого открытия. Один объект настоящего изобретения представляет собой соединение, представленное следующей структурной формулой: или его фармацевтически приемлемой соли,в которой кольцо А означает необязательно замещенное фенильное кольцо;Rx означает -C(O)R4 и R3 представляет собой необязательно замещенную фенильную, пиридильную или циклогексильную группу;X1 и Х 2 каждый независимо представляет собой связь, S(O), S(O)2, C(O) или C(O)NH;R1 означает Н или необязательно замещенную, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу; при условии, что, когда X1 представляет собой связь, SO или SO2, тогда R1 не означает Н; каждый R2 независимо представляет собой -Н, -X4-R8 или необязательно замещенную, алифатическую группу, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу;R4 означает -Н, -Х 6-R10 или необязательно замещенную, алифатическую группу, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу; при условии, что, когда Х 2 представляет собой связь, SO или SO2, тогда R4 не является атомом водорода; Х 4 и Х 6 каждый независимо представляет собой неразветвленную или разветвленную углеводородную группу, необязательно замещенную одной или несколькими группами, выбранными из группы, со-1 011385 стоящей из галоида, -ОН, =O, C1-С 3 алкокси, нитро и циано;R5 и R6 каждый независимо представляет собой Н; иR8 и R10 каждый независимо означает Н, -C(O)OR' или необязательно замещенную, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу; где необязательные заместители в алифатической группе, циклоалифатической группе или неароматической гетероциклической группе представляют собой от одной до трех групп, каждая из которых независимо выбрана из группы состоящей из галоида, R11, =O, =S, =NNHR, =NN(R)2, =NNHC(O)R,=NNHCO2(алкил), =NNHSO2(алкил) и =NR; необязательные заместители при ненасыщенных атомах углерода ароматической группы представляют собой от одного до четырех независимых возможных радикалов R11; необязательные заместители при атоме азота ароматической группе или атом азота неароматической азотсодержащей гетероциклической группе означают от одной до трех групп, причем каждая независимо выбрана из группы, состоящей из R+, -N(R+)2, -C(O)R+, -CO2R+, -C(O)C(O)R+, -C(O)CH2C(O)R+,-SO2R+, -SO2, -N(R+)2, -C(=S)N(R+)2, -C(=NH)-N(R+)2 и -NR+ SO2R+; каждый R11 независимо выбран из группы, состоящей из галоида, Ro, -ОН, -ORo, -SH, -SRo, 1,2 метилендиокси, 1,2-этилендиокси, защищенного гидроксила (-ОН), фенила, [R12-фенила, -О(фенила), О(R12]фенила), -СН 2(фенила), -СН 2([R12]фенила), -СН 2 СН 2(фенила), -СН 2 СН 2([R12]фенила), -NO2, -CN, N(R')2, -NR'CO2Ro, -NR'C(O)Ro, -NR'NR'C(O)Ro, -N(R')C(O)N(R')2, -NR'NR'C(O)N(R')2, -NR'NR'CO2R,-C(O)C(O)R, -C(O)CH2C(O)R', -CO2R', -C(O)Ro, -C(O)N(R')2, -OC(O)N(R')2, -S(O)2Ro, -SO2N(R')2, -S(O)R',-NR'SO2N(R')2, -NR'SO2Ro, -C(=S)N(R')2, -(CH2)yN(R')2, -C(=NH)-N(R')2, -(CH2)yC(O)N(R')2,-(CH2)yNHC(O)R' или -(CH2)yNHC(O)CH(V-R')(R');V означает C1-С 6 алкилен; каждый R независимо представляет собой Н, алифатическую группу или алифатическую группу,замещенную радикалом R12;R+ означает Н, фенил, [R12]фенил, -О(фенил), -О([R12]фенил), -СН 2(фенил), -CH2([R12]фенил), гетероарильную группу, неароматическую гетероциклическую группу, алифатическую группу или алифатическую группу, замещенную R12;Ro означает алифатическую группу, циклоалифатическую группу, ароматическую группу, аралкильную группу или неароматическую гетероциклическую группу, причем каждая группа необязательно замещена радикалом R12;R12 представляет собой от одного до четырех заместителей, причем каждый независимо выбирают из группы, состоящей из галоида, C1-С 6 алкила, (галоид)rалкила C1-С 6, циклоалкила C3-С 8, (галоид)rциклоалкила C3-С 8, -CN, -CF3, -CHF2, -CH2F, -OCF3, -OCHF2, -OCH2F, -OR', -OR13C(O)R', -C(O)OR', C(O)N(R16)2, -N(R16)2, -NO2, -NR16C(O)R', -NR16C(O)OR', -NR16C(O)N(R16)2, -NR16SO2R17, - S(O)qR17, R13NR16C(O)R', -R13C(O)R', -R13NR16C(O)OR', тетразолил, имидазолил или оксадиазолил;R16 каждый независимо представляет собой R' или бензил;r означает 1-3. Другой объект настоящего изобретения представляет собой способ ингибирования CRTH2 у субъекта, нуждающегося в ингибировании CRTH2. Этот способ включает стадию введения субъекту эффективного количества соединения, представленного указанной структурной формулой. Еще один объект настоящего изобретения представляет собой фармацевтическую композицию. Эта фармацевтическая композиция содержит фармацевтически приемлемый носитель или разбавитель и соединение, представленное указанной структурной формулой. Эти фармацевтические композиции могут быть использованы в терапии, например, для ингибирования активности CRTH2 у субъекта, нуждающегося в таком лечении. Также объектом настоящего изобретения является применение соединения, представленного указанной структурной формулой, с целью получения лекарственного препарата для ингибирования активности CRTH2 у субъекта, нуждающегося в таком лечении. Этот лекарственный препарат содержит эффективное количество соединения. Описанные соединения представляют собой эффективные ингибиторы активности CRTH2, причем можно ожидать, что они будут пригодны для лечения и предупреждения заболеваний, опосредованных активностью CRTH2, в том числе (но без ограничения) воспалительных заболеваний, таких как (аллергическая) астма, атопический дерматит, аллергический ринит, системная анафилаксия или гиперчувствительные реакции, лекарственная аллергия (например, на пенициллин, цефалоспорины), аллергия на укус насекомого, хроническое обструкционное легочное нарушение (COPD) и воспалительные кожные болезни, такие как дерматит, экзема, аллергический контектный дерматит и крапивная лихорадка, атероскле-2 011385 роз, рестеноз, миозит (в том числе полимиозит, дерматомиозит) и другие заболевания с воспалительной составляющей, такие как ревматический артрит, остеоартрит и воспалительное заболевание кишечника(IBD). Подробное описание изобретения Настоящее изобретение относится к ингибиторам хемоатрактантного рецептора-гомологичной молекулы, выраженной на клетках Th2, также названного здесь как "CRTH2". Простагландин PGD2 представляет собой естественный лиганд для CRTH2, где он связывает и индуцирует, по меньшей мере, немного своей про-воспалительной активности. Таким образом, описанные соединения могут быть использованы, для того чтобы ингибировать активность CRTH2; ингибировать активность PGD2 и ингибировать или обрабатывать (терапевтически или профилактически) воспалительные нарушения и аллергические состояния, опосредованные с использованием CRTH2 и/или PGD2. Клетки иммунной системы, которые экспрессируют CRTH2, включают в себя клетки Th2, эозинофилы и базофилы. Таким образом,описанные соединения могут быть преимущественно использованы для ингибирования воспалительных нарушений и аллергических состояний, опосредованных этими клетками. В первом предпочтительном варианте осуществления настоящего изобретения, X означает -CHR2-,2R представляет собой -Н, метил или этил; R3 означает замещенную или незамещенную ароматическую группу; R5 и R6 означают -Н; а остальные переменные в структурной формуле (I) такие же, как указано выше. Более предпочтительно, соединение представлено структурной формулой, выбранной из структурных формул (II)-(VIII) Переменные в структурных формулах (II)-(VIII) такие же, как указано выше для структурной формулы (I). Предпочтительные значения для этих переменных приведены ниже. Фенильное кольцо А представляет собой замещенную или незамещенную фенильную группу. Подходящие заместители для фенильного кольца А указаны ниже, в разделе, описывающем подходящие заместители в арильном кольце.R1 в структурных формулах (II)-(IV) и (VI)-(VIII) представляет собой -Н, необязательно замещенную, циклоалифатическую группу, ароматическую группу или неароматическую гетероциклическую группу, при условии, что R1 в структурных формулах (III) не является -Н; и R1 в структурной формулеR3 в структурных формулах (II)-(VIII) представляет собой необязательно замещенную фенильную группу.R4 в структурных формулах (II)-(VI) и (VIII) означает -Н, -CH2C(O)R14, -CH2R15, -CH2OR14, или необязательно замещенную С 1-С 3-алкильную группу, или необязательно замещенную циклоалкильную группу, ароматическую группу или неароматическую гетероциклическую группу, при условии, что R4 в структурной формуле (VI) не является -Н; и R4 в структурной формуле (VII) означает -(CH2)H-R13.R13 представляет собой -Н, -CH2C(O)R14, -CH2R15, -CH2OR14, или необязательно замещенную С 1-С 3 алкильную группу или необязательно замещенную циклоалкильную группу, ароматическую группу или неароматическую гетероциклическую группу. Каждый R14 независимо представляет собой -Н, или необязательно замещенную алкильную группу,ароматическую группу, циклоалкильную группу, или неароматическую гетероциклическую группу. Каждый R15 независимо представляет собой необязательно ароматическую группу, циклоалкильную группу или неароматическую гетероциклическую группу.n равно 0, 1, 2 или 3. Более предпочтительные значения для R1, R4 и R13 в структурных формулах (II)-(VIII) представляют собой R1 и R13 необязательно замещенные группы: фенил, пиридил, фуранил, тиофенил, изоксазолил,имидазолил, пиразолил, пирролил, бензофуранил, тетразолил, тиазолил, бензил, бензотиазолил, бензоимидазолил, бензотриазолил, бензоморфолинил, бензопиразолил, индолил, -СН 2-(N-пиридил), -СН 2 фуранил, -СН 2-тиофенил, -СН 2-изоксазолил, -СН 2-имидазолил, -СН 2-пиразолил, -СН 2-пирролил, -СН 2 бензофуранил, -СН 2-тетразолил, -СН 2-тиазолил, -СН 2-тетразолил, -СН 2-бензотиазолил, -СН 2 бензимидазолил, -СН 2-О-фенил, -СН 2 С(О)-фенил, нафталимидил, тетрагидрофуранил, циклогексил, циклопентил или циклопропил; и R4 представляет собой группы: С 1-С 4 алкил, -СН 2 ОН, -CH2OCH3, CH2OCH2CH3, -СН 2 СН 2 ОСН 3, -CH2CH2OCH2CH3 или необязательно замещенный фенил, пиридил, фуранил, тиофенил, изоксазолил, имидазолил, пиразолил, пирролил, бензофуранил, тетразолил, бензил, бензотиазолил, бензоимидазолил, бензотриазолил, бензоморфолинил, бензопиразолил, индолил, -СН 2-(Nпиридил), -СН 2-фуранил, -СН 2-тиофенил, -СН 2-изоксазолил, -СН 2-имидазолил, -СН 2-пиразолил, -СН 2 пирролил, -СН 2-бензофуранил, -СН 2-тетразолил, -СН 2-тиазолил, -СН 2-тетразолил, -СН 2-бензотиазолил,-СН 2-бензимидазолил, -СН 2-О-фенил, -СН 2 С(О)-фенил, нафталимидил, тетрагидрофуранил, циклогексил,циклопентил или циклопропил, где R1, R4 и R13 выбираются независимо; и кольцо А является необязательно замещенным в пятом, шестом, седьмом и/или восьмом положении. Еще более предпочтительно,соединения в структурных формулах (II)-(VIII) имеют один из следующих признаков и предпочтительно,все следующие признаки: фенильное кольцо А является необязательно замещенным радикалом R11 в пятом, шестом, седьмом и/или восьмом положении; R1 представляет собой фенил, тиофенил, фуранил, пиридил, оксазолил, бензотриазол, пиримидинил, изоксазолил или бензоморфолинил, причем каждая группа необязательно замещена радикалом R11; R3 означает [R11]-фенил; и R4 представляет собой метил, этил,пропил, изо-пропил, н-бутил, втор-бутил, трет-бутил, -СН 2 ОСН 3 или -СН 2 ОСН 2 СН 3. Особенно предпочтительными являются соединения, представленные структурными формулами (II)-(VIII), в которых фенильное кольцо А необязательно замещено радикалом R11 в шестом и/или седьмом положении; R1 представляет собой тиофенил, [R11]-тиофенил, оксазолил, [R11]оксазолил, пиридинил, [R11]пиридинил, бензотриазолил, [R11]-бензотриазолил, бензоморфолинил, [R11]-бензоморфолинил, фенил или фенил, замещенный одной - четырьмя группами, выбранными из группы, состоящей из галоида, -ORo и -N(R11)2,-4 011385R3 представляет собой фенил, замещенный одним - четырьмя атомами или группами, выбранными из группы, состоящей из Br, Cl, -CH3, -N(R16)2, -NHC(O)OR", -S(O)2CH3, -S(O)2N(R16)2 и -R13C(O)N(R16)2. В третьем предпочтительном варианте кольцо А в структурной формуле (I) представляет собой моноциклическую гетероарильную группу, такую как тиофен, фуран, пиридин, пиразол, пиррол,[2,3]пиримидин, [3,4]пиримидин, [4,5]пиримидин, [5,6]пиримидин, оксазол, изоксазол или 1,2,3-триазол,причем каждая группа необязательно замещена радикалом R11. Когда кольцо А имеет указанные значения, это соединение предпочтительно имеет по меньшей мере один и предпочтительно все следующие признаки: X означает -CHR2-, R2 означает -Н, метил или этил; R5 и R6 представляют собой атомы водорода; и R представляет собой замещенную или незамещенную фенильную группу. Когда соединение имеет по меньшей мере один или все эти признаки, тогда предпочтительно R1 и R4 независимо представляет собой -Н, -CH2C(O)R14, -CH2R15 или -CH2OR14, или необязательно замещенную алкильную группу, циклоалкильную группу, ароматическую группу или неароматическую гетероциклическую группу; и R14 иR15 такие же, как указано выше для структурной формулы (II). Когда кольцо А в структурной формуле (I) представляет собой моноциклическое гетероарильное кольцо, как описано в предшествующем абзаце, для X1 и Х 2 обычно выбирают следующие значения: оба(II)-(VIII) заменяют одной из моноциклических ароматических групп, которые описаны в предшествующем абзаце, а остальные переменные такие же, как указано выше. В четвертом предпочтительном варианте R2 в структурных формулах (I)-(VIII) представляет собой-Н, С 1-С 4-алкил, галоидированный С 1-С 6-алкил, С 3-С 8-циклоалкил, замещенный С 3-С 8-циклоалкил, фенил, замещенный фенил, -C(O)OR16, бензил, замещенный бензил или -(CH2)nO(CH2)m; R16 представляет собой С 1-С 6-алкил; n и m обозначают такие положительные целые числа, чтобы n+m = 6; а остальные переменные такие же, как указано выше. Конкретные примеры соединения настоящего изобретения показаны в табл. 1-6. Кроме того, в данном изобретении описано соединение, представленное структурной формулой (II),и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R1 имеет значение, соответствующее любому соединению из табл. 1-6, а радикалы R3 и R4 имеют такие же значения, что указаны выше для структурной формулы (II). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (II), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R3 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R4 такие же, как указано выше для структурной формулы (II). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (II), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R4 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R3 такие же, как указано выше для структурной формулы (II). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (III), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R3 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R4 такие же, как указано выше для структурной формулы (III). Также, в этом изобретении описано соединение, представленное структурной формулой (III), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R4 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R3 такие же, как указано выше для структурной формулы (III). Также, в этом изобретении описано соединение, представленное структурной формулой (III), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R1 имеет значение, соответствующее любому соединению из табл. 1-6, a R3 и R4 такие же, как указано выше для структурной формулы (III). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (IV), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R3 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R такие же, как указано выше для структурной формулы (IV). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (IV), и-5 011385 способы его применения для ингибирования CRTH2, в котором R4 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R3 такие же, как указано выше для структурной формулы (IV). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (IV), и способы его применения для ингибирования CRTH2, в котором R1 имеет значение, соответствующее любому соединению из табл. 1-6, a R3 и R4 такие же, как указано выше для структурной формулы (IV). Также, в этом изобретении описано соединение, представленное структурной формулой (V), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R3 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R4 такие же, как указано выше для структурной формулы (V). Также, в этом изобретении описано соединение, представленное структурной формулой (V), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R4 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R3 такие же, как указано выше для структурной формулы (V). Также, в этом изобретении описано соединение, представленное структурной формулой (V), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R1 имеет значение, соответствующее любому соединению из табл. 1-6, a R3 и R4 такие же, как указано выше для структурной формулы (V). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (VI), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R3 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R4 такие же, как указано выше для структурной формулы (VI). Кроме того, в этом изобретении описано соединение представленное структурной формулой (VI), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R4 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R3 такие же, как указано выше для структурной формулы (VI). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (VI), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R1 имеет значение, соответствующее любому соединению из табл. 1-6, a R3 и R4 такие же, как указано выше для структурной формулы (VI). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (VII),и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R3 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R4 такие же, как указано выше для структурной формулы (VII). Также в этом изобретении описано соединение, представленное структурной формулой (VII), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R4 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R3 такие же, как указано выше для структурной формулы (VII). Также в этом изобретении описано соединение, представленное структурной формулой (VII), и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R1 имеет значение, соответствующее любому соединению из табл. 1-6, a R3 и R4 такие же, как указано выше для структурной формулы (VII). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (VIII),и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R3 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R4 такие же, как указано выше для структурной формулы (VIII). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (VIII),и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R4 имеет значение, соответствующее любому соединению из табл. 1-6, a R1 и R3 такие же, как указано выше для структурной формулы (VIII). Кроме того, в этом изобретении описано соединение, представленное структурной формулой (VIII),и способы его применения для ингибирования CRTH2 у субъекта, нуждающегося в таком лечении, и фармацевтические композиции, содержащие это соединение, в котором R1 имеет значение, соответствующее любому соединению из табл. 1-6, a R3 и R4 такие же, как указано выше для структурной формулы (VIII). В определенных аспектах, из настоящего изобретения исключаются следующие соединения: 2-метил-N-фенил-N-[1,2,3,4-тетрагидро-2-метил-1-(2-метил-1-оксобутил)-4-хинолинил]бутамид; N(1-ацетил-1,2,3,4-тетрагидро-2-метил-4-хинолинил)-N-фенилгептамид; N-фенил-N-[1,2,3,4-тетрагидро-2 метил-1-(1-оксо-3-фенилпропил)-4-хинолинил]бензолпропанамид;N-[1-(3-метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-2,2-диметил-N-фенилпропионамид. Многие из описанных ингибиторов CRTH2 содержат один или несколько хиральных центров. Наличие хиральных центров в молекуле приводит к стереизомерам. Например, для каждого хирального центра в молекуле существует пара оптических изомеров, называемых "энантиомеры" и для каждого хирального центра в соединении, имеющем два или более хиральных центров существует пара диастереомеров. Даже если структурные формулы (I)-(VIII) не отображают подробную стереохимию, следует понимать, что эти формулы включают в себя энантиомеры, не содержащие соответствующих оптических изомеров, рацемические смеси, смеси, обогащенные одним энантиомером, относительно его соответствующего оптического изомера, диастереомер, не содержащий других диастереомеров, пару диастереомеров не содержащих других диастереомерных пар, смеси диастереомеров, смеси диастереомерных пар,смеси диастереомеров, в которых один диастереомер обогащен относительно другого диастереомера(диастереомеров), и смеси диастереомерных пар, в которых одна диастереомерная пара обогащена относительно другой диастереомерной пары (пар). Предпочтительной диастереомерной парой является пара, в которой группы R2 и NRXR3 в структурных формулах (I)-(VIII) имеют цис-ориентацию относительно друг друга. В качестве примера, цисдиастереомерная пара для соединения, представленного структурной формулой (II), показана ниже в структурных формулах (IX) и (X) Предпочтительная конфигурация для R2 и NRXR3 (изображено как N(R3)(COR4) в структурных формулах (IX) и (X представляет собой (2R, 4S), как показано в структурной формуле (IX). Таким образом, структурная формула (IX) представляет собой предпочтительный оптический изомер для соединения, представленного структурной формулой (II). Аналогично, также конкретно описан соответствующий (2R,4S) оптический изомер для соединения, представленного структурными формулами (I) и (III)(VIII) и табл. 1-6. Более предпочтительная конфигурация для R2 и NRXR3 (изображено как N(R3)(COR4 в-8 011385 структурных формулах (IX) и (X) представляет собой (2S, 4R), как показано в структурной формуле (X). Таким образом, структурная формула (X) представляет собой более предпочтительный оптический изомер для соединения, представленного структурными формулами (I) и (III)-(VIII) и в табл. 1-6. Подразумевается, что используемая в этом изобретении структура, изображающая один оптический изомер, или ссылка на один оптический изомер включает энантиомерные смеси, которые обогащены энантиомером,который изображен или на который сделана ссылка, относительно его оптических изомеров, например,избыток энантиомера составляет по меньшей мере 50, 75, 90, 95, 99 или 99,5%. Подразумевается, что используемая в этом изобретении структура, изображающая диастереомерную пару, или ссылка на диастереомерную пару включает смеси, которые обогащены диастереомерной парой, которая изображена или на которую сделана ссылка, относительно других диастереомеров или диастереомерных пар этого соединения, например молярный избыток составляет по меньшей мере 50, 75, 90, 95, 99 или 99,5%. Энантиомеры настоящего изобретения могут быть разделены с использованием методов, которые известны специалистам в этой области техники, например путем образования диастереизомерных солей,которые могут быть разделены, например, путем кристаллизации; образования диастереизомерных производных или комплексов, которые могут быть разделены, например, путем кристаллизации, газожидкостной или жидкостной хроматографии; селективного взаимодействия одного энантиомера с энантиомерно-специфичным реагентом, например путем ферментативной этерификации; или газожидкостной или жидкостной хроматографии в хиральной окружающей среде, например на хиральном носителе, например диоксиде кремния со связанным хиральным лигандом или в присутствии хирального растворителя. Когда желательный энантиомер превращается в другое химическое соединение с помощью одной из методик разделения, описанных выше, для выделения желательной энантиомерной формы требуется дополнительная стадия. Альтернативно, могут быть синтезированы специфичные энантиомеры посредством асимметричного синтеза с использованием оптически активных реагентов, субстратов, катализаторов или растворителей, или путем превращения одного энантиомера в другой за счет асимметричного преобразования. Диастереизомерная пара может быть разделена с использованием методов, которые известны специалистам в этой области техники, например путем хроматографии или кристаллизации, причем индивидуальные энантиомеры в пределах каждой пары могут быть разделены, как описано выше. Конкретные методики хроматографического разделения диастереомерных пар предшественников, применяемых для получения соединений, раскрытых в этом изобретении, приведены в схемах 1 и 2. В некоторых случаях соединения настоящего изобретения в выделенном виде могут быть ассоциированы с растворителем или водой, например, как "сольват" или "гидрат". Подразумевается, что ссылки на описанные соединения или структурные формулы, представляющие описанные соединения, включают такие сольваты и гидраты. Используемый в этом изобретении термин "алифатический" означает углеводороды с неразветвленной или разветвленной цепочкой, которые являются полностью насыщенными или которые содержат одно или несколько звеньев ненасыщенности, но которые не являются ароматическими звеньями. Обычно алифатическая группа представляет собой C1-8, более типично C1-6. Например, подходящие алифатические группы включают замещенные или незамещенные линейные или разветвленные алкильные, алкенильные, алкинильные группы и их гибриды. Термины "алкил", "алкокси", "гидроксиалкил", "алкоксиалкилен", и "алкоксикарбонил", используемые как таковые или как часть более крупной функциональной группы, включают как неразветвленные, так и разветвленные насыщенные цепочки, содержащие от одного до восьми атомов углерода. Термины "алкенил" и алкинил", используемые как таковые или как часть более крупной функциональной группы, должны включать как неразветвленные, так и разветвленные насыщенные цепочки, содержащие от одного до восьми атомов углерода и одну или несколько двойных и/или тройных связей, соответственно. Термин "циклоалифатический", используемый как таковой или как часть более крупной функциональной группы, должен включать циклические С 3-С 10 углеводороды, которые являются полностью насыщенными или которые содержат одно или несколько звеньев ненасыщенности, но которые не являются ароматическми. Обычно циклоалифатические группы представляют собой С 3-10, более типично С 3-7."Циклоалкил" представляет собой циклическую алифатическую группу, которая является полностью насыщенной. Термин "алкокси" означает (алкил)-О-; "алкоксиалкилен" означает (алкил)-О-(алкилен), такой как метоксиметилен (СН 3 ОСН 2); "гидроксиалкил" означает гидроксизамещенную алкильную группу; "алкоксикарбонил означает карбонил, замещенный алкоксилом, как в группе (алкил)-О-С(О)-; и "аралкил" означает алкил, замещенный ароматической группой. Например, "С 1-С 4-аралкильная группа" представляет собой С 1-С 4-алкильную группу, замещенную ароматической группой. Термин "гетероатом" означает азот, кислород, или серу и включает любую окисленную форму азота и серы, и кватернизированную форму любого основного атома азота. Кроме того, термин "азот" включает способный к замещению атом азота гетероциклического кольца. Например, в насыщенном или частично ненасыщенном кольце, имеющем 0-3 гетероатома, выбранных из кислорода, серы или азота; азот может представлять собой N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или NR+ (как-9 011385 в N-замещенном пирролидиниле). Термин "ароматическая группа", используемый как таковой или как часть более крупной функциональной группы, как например, в группах: "аралкил", "аралкокси", или "арилоксиалкил", включает карбоциклические ароматические кольцевые группы и гетероарильные кольцевые группы. Термин "ароматическая группа" может быть использован попеременно с терминами "арил", "арильное кольцо" или"ароматическое кольцо". Карбоциклические ароматические кольцевые группы имеют только кольцевые атомы углерода и включают моноциклические ароматические кольца, такие как фенил и конденсированные полициклические ароматические кольцевые системы, в которых два или больше карбоциклических ароматических колец конденсированы друг с другом. Примеры включают 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. Кроме того, объем термина "карбоциклически ароматическое кольцо", который используется в этом изобретении, включает группу, в которой ароматическое кольцо конденсировано с одним или несколькими неароматическими кольцами (алифатическими или гетероциклическими), такими как в группах: инданил, фталимидил, нафтимидил, фенантренидинил, или тетрагидронафтил, где радикал или место его присоединения находятся в ароматическом кольце. Термин "гетероарильный" или "гетероароматический", используемый как таковой или как часть более крупной функциональной группы, как в группах: "гетероаралкил" или "гетероарилалкокси", относится к гетероароматическим кольцевым группам, имеющим от пяти до четырнадцати атомов, в том числе моноциклические гетероароматические кольца и полициклические ароматические кольца, в которых моноциклическое ароматическое кольцо конденсировано с одним или несколькими другими карбоциклическими или гетероароматическими ароматическими кольцами. Примеры гетероарильных колец включают 2-фуранил, 3-фуранил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4 изоксазолил, 5-изоксазолил, 2-оксадиазолил, 5-оксадиазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 1 пирролил, 2-пирролил, 3-пирролил, пиразолил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4 пиримидил, 5-пиримидил, 3-пиридазинил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-триазолил, 5-триазолил,тетразолил, 2-тиенил, 3-тиенил, карбазолил, бензимидазолил, бензотиенил, бензофуранил, индолил, хинолинил, бензотриазолил, бензотиазолил, бензооксазолил, бензимидазолил, изохинолинил, индолил,изоиндолил, акридинил, или бензоизазолил. Кроме того, объем термина "гетероарильный", который используется в этом изобретении, включает группу, в которой гетероарильное кольцо конденсировано с одной или несколькими циклоалифатическими или неароматическими гетероциклическими группами, в которых радикал или место его присоединения находится в гетероароматическом кольце. Примеры включают тетрагидрохинолинил, тетрагидроизохинолинил, и пиридо[3, 4-d] пиримидинил. Термин "гетероарильный" может быть использован попеременно с термином "гетероарильное кольцо" или с термином "гетероароматическое кольцо". Термин "неароматическое гетероциклическое кольцо", используемый как таковой или как часть более крупной функциональной группы, как в "гетероциклическом алкиле", относится к неароматическим кольцевым системам, обычно содержащим от пяти до четырнадцати атомов, предпочтительно от пяти до десяти, в которых один или несколько атомов углерода кольца, предпочтительно, от одного до четырех,каждый замещен гетероатомом, таким как N, О, или S. Примеры неароматических гетероциклических колец включают 3-1 Н-бензимидазол-2-он,3-тетрагидрофуранил,2-тетрагидропиранил,3 тетрагидропиранил, 4-тетрагидропиранил, [1,3]-диоксаланил, [1,3]-дитиоланил, [1,3]-диоксанил, 2 тетрагидротиофенил, 3-тетрагидротиофенил, 2-морфолинил, 3-морфолинил, 4-морфолинил, 2 тиоморфолинил, 3-тиоморфолинил, 4-тиоморфолинил, 1-пирролидинил, 2-пирролидинил, 3 пирролидинил, 1-пиперазинил, 2-пиперазинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4 пиперидинил, 4-тиазолидинил, диазолонил, N-замещенный диазолонил, 1-фталимидинил, бензоксанил,бензопирролидинил, бензопиперидинил, бензоксоланил, бензотиоланил и бензотианил. "Углеводородная группа" представляет собой полиметиленовую группу, то есть -(СН 2)n-, в которой n является целым положительным числом. Предпочтительно, n является целым числом от 1 до 6, более предпочтительно от 2 до 4 и наиболее предпочтительно от 2 до 3. "Замещенная углеводородная группа" представляет собой углеводородную группу, в которой один или несколько метиленовых атомов водорода замещены заместителями. Подходящие заместители представляет собой такие, что описаны ниже для замещенной алифатической группы. Предпочтительными заместителями для углеводородных групп, представленных Х 3 Х 6, являются галоид, -ОН, =O, C1-С 3 алкил, C1-С 3 алкокси, нитро и циано. Углеводородная группа может быть необязательно прервана одной или несколькими функциональными группами. Углеводородная группа прерывается функциональной группой, когда одна из внутренних метиленовых групп замещается функциональной группой. Примеры подходящих "прерывающих функциональных групп" включают -O-, -S-, -N(Ra)-, -S(O)-, -SO2, -С(O)-, -OC(O)-, -N(Ra)C(O)-,-C(O)N(Ra), -SO2N(Ra)- и -N(Ra)SO2-. Радикал Ra представляет собой -Н или С 1-С 3 алкильную группу. Ароматическая группа (в том числе кольцо А, карбоциклическая ароматическая, гетероарильная,аралкильная, аралкокси, арилоксиалкильная и гетероаралкильная и подобные группы) может содержать один или несколько заместителей. Примеры подходящих заместителей при ненасыщенном атоме углерода ароматической группы включают атом галогена, -Ro, -ORo, -SRo, 1,2-метилендиокси, 1,2- 10011385 этилендиокси, защищенная ОН-группа (такая как ацилокси), фенил (Ph), замещенный Ph, -O(Ph), замещенный -O(Ph), -CH2(Ph), замещенный -CH2(Ph), -CH2CH2(Ph), замещенный -CH2CH2(Ph), -NO2, -CN, N(R')2, -NR'CO2R, -NR'C(O)R, -NR'NR'C(O)R, -N(R')C(O)N(R')2, -NR'NR'C(O)N(R')2, -NR'NR'CO2R, C(O)C(O)R, -C(O)CH2C(O)R, -CO2R, -C(O)R, -C(O)N(R)2, -OC(O)N(R)2, -S(O)2R, -SO2N(R')2, S(O)R, -NR'SO2N(R')2, -NR'SO2R, -C(=S)N(R')2, -(CH2)yN(R')2, -C(=NH)-N(R')2, -(CH2)yNHC(O)R, (CH2)yNHC(O)CH(V-R)(R). Радикал R' означает R, -CO2R, -SO2R или -C(O)R и предпочтительно представляет собой водород, C1-6 алифатическую группу, CO2R, SO2Ro или C(O)R. Радикал Ro означает водород или замещенную или незамещенную алифатическую, циклоалифатическую, ароматическую,аралкильную или неароматическую гетероциклическую группу, и предпочтительно водород, С 1-6-алкил,фенил (Ph), -CH2(Ph), аралкил, неароматическую гетероциклическую группу или гетероарильную группу; у означает 0-6; и V представляет собой С 1-С 6 алкиленовую группу. Примеры заместителей в алифатической группе или в фенильном кольце Ro включают амино, алкиламино, диалкиламино, аминокарбонил, галоген, алкил, аминоалкил, алкиламинокарбонил, диалкиламинокарбонил, алкиламинокарбонилокси, диалкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкоксикарбонил, алкилкарбонил, гидрокси, галоидалкокси, или галоидалкил. Алифатическая группа или неароматический гетероцикл может содержать один или несколько заместителей. Примеры подходящих заместителей при насыщенном атоме углерода алифатической группы неароматического гетероцикла включают те заместители, которые перечислены выше для ненасыщенного атома углерода ароматической группы, и следующие: =O, =S, =NNHR, =NN(R)2, =NNHC(O)R,=NNHCO2(алкил), =NNHSO2(алкил) или =NR. Каждый радикал R независимо выбирают из водорода,незамещенной алифатической группы или замещенной алифатической группы. Примеры заместителей в алифатической группе, представленные как R, включают амино, алкиламино, диалкиламино, аминокарбонил, галоген, алкил, алкиламинокарбонил, диалкиламинокарбонил, алкиламинокарбонилокси, диалкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкоксикарбонил, алкилкарбонил, гидрокси, галоидалкокси или галоидалкил. Подходящие заместители при замещаемом атоме азота гетероарильной или неароматической гетероциклической группе включают -R+, -N(R+)2, -C(O)R+, -CO2R+, -C(O)C(O)R+, -C(O)CH2 C(O)R+, -SO2 R+,-SO2 N(R+)2, -C(=S)N(R+)2, -C(=NH)-N(R+)2, и -NR+SO2R+; где R+ представляет собой водород, алифатическую группу, замещенную алифатическую группу, фенил (Ph), замещенный Ph, -O(Ph), замещенный-O(Ph), -CH2(Ph) или незамещенное гетероарильное или неароматическое гетероциклическое кольцо. Примеры заместителей в алифатической группе или в фенильном кольце, представленные как R+, включают амино, алкиламино, диалкиламино, аминокарбонил, галоген, алкил, алкиламинокарбонил, диалкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкоксикарбонил, алкилкарбонил, гидрокси, галоидалкокси или галоидалкил. Кроме того, в настоящее изобретение также включены фармацевтически приемлемые соли описанных здесь соединений, и они могут быть использованы в композициях и способах, описанных в этом изобретении. Например, кислотная соль соединения, содержащего аминную или другую основную группу, может быть получена путем взаимодействия этого соединения с подходящей органической или неорганической кислотой, такой как хлористый водород, бромистый водород, уксусная кислота, перхлорная кислота и т.п. Соединения с группой четвертичного аммония, кроме того, содержат противоион, такой как хлорид, бромид, иодид, ацетат, перхлорат и т.п. Другие примеры таких солей включают гидрохлориды, гидробромиды, сульфаты, метансульфонаты, нитраты, малеаты, ацетаты, цитраты, фумараты, тартраты [например, (+)-тартраты, (-)-тартраты или их смеси, в том числе рацемические смеси], сукцинаты,бензоаты и соли с аминокислотами, такими как глутаминовая кислота. Соли соединения, содержащего карбоновую кислоту или другую кислотную функциональную группу, могут быть получены путем взаимодействия с подходящим основанием. Такие фармацевтически приемлемые соли могут быть получены с основанием, которое предоставляет фармацевтически приемлемый катион, который включает соли щелочного металла (особенно натрия и калия), соли щелочноземельных металлов (особенно кальция и магния), соли алюминия и соли аммония, а также соли, полученные из физиологически приемлемых органических оснований, таких как триметиламин, триэтиламин,морфолин, пиридин, пиперидин, пиколин, дициклогексиламин, N,N'-дибензилэтилендиамин, 2 гидроксиэтиламин, бис-(2-гидроксиэтил)амин, три-(2-гидроксиэтил)амин, прокаин, дибензилпиперидин,дегидроабиетиламин, N,N'-бис-дегидроабиетиламин, глюкамин, N-метилглюкамин, коллидин, хинин,хинолин и основной аминокислотой, такой как лизин и аргинин. Описанные соединения, фармацевтические композиции и способы могут быть использованы для ингибирования активности CRTH2; для ингибирования активности PGD2, в том числе активности DP и для ингибирования или лечения (терапевтического или профилактического) нарушений с воспалительным компонентом и аллергическими состояниями, опосредованными путем CRTH2, и/или PGD2, и/илиDP. Кроме того, они могут быть использованы для ингибирования воспалительных нарушений и аллергических состояний, опосредованных клетками Th2, эозинофилами и базофилами. Примеры аллергических состояний, для которых предполагается, что описанные соединения, фар- 11011385 мацевтические композиции и способы являются особенно эффективными, включают аллергическую астму, атопический дерматит, аллергический ринит и хроническое обструкционное легочное нарушение(COPD). Другие аллергические состояния включают системную анафилаксию или гиперчувствительные реакции, лекарственную аллергию (например, к пенициллину, цефалоспоринам), аллергию на укус насекомых и кожные болезни, такие как дерматит, экзема, атопический дерматит, аллергический контактный дерматит и крапивная лихорадка. Примеры заболеваний с воспалительным компонентом, для которых предполагается, что описанные соединения, фармацевтические композиции и способы являются особенно эффективными, включают ревматический артрит, остеоартрит, воспалительное заболевание кишечника (например, такое как язвенный колит, болезнь Крона, илеит, брюшные заболевания, нетропические афты, воспаление тонких кишок, энтеропатия, связанная с серонегативными заболеваниями суставов, микроскопический или коллагеновый колит, эозинофильный гастроэнтерит, или резервуарный илеит, проистекающий от проктоколэктомии, и илеоанальный анастомоз) и кожные нарушения (например, псориаз, эритема, зуд и воспаление сальной железы). Многие аутоиммунные заболевания также имеют воспалительный компонент. Примеры таких заболеваний: рассеянный склероз, системная красная волчанка, астенический бульбарный паралич, юношеский начальный диабет, гломерулонефрит и другие нефриты, аутоиммунный тиреоидит, болезнь Бехчета и отторжение трансплантата (в том числе отторжение аллотрансплантата или реакция трансплантат против хозяина). Полагают, что воспалительный компонент этих нарушений, по меньшей мере частично, опосредован рецептором CRTH2. Заболевания, характеризующиеся реперфузией, имеют воспалительный компонент, который, как полагают, по меньшей мере частично, опосредован рецептором CRTH2. Примеры включают инсульт,кардиальную ишемию, и т.п. Описанные соединения и композиции также могут быть использованы для лечения этих нарушений. Другие заболевания и состояния с воспалительным компонентом, которые предположительно опосредованы рецептором CRTH2, включают мастит (грудная железа), вагинит, холецистит, воспаление желчных путей или перихолангит (желчный проток и окружающая ткань печени), хронический бронхит,хронический синусит, хроническое воспалительное заболевание легких, которое приводит к внутритканевому фиброзу, такие как внутритканевые заболевания легких (ILD) (например, идиопатический фиброз легких, или ILD связанные с ревматическим артритом, или другими аутоиммунными состояниями), гиперчувствительный пневмонит, коллагеновые заболевания и саркоидоз. Другие заболевания или состояния с воспалительными компонентами, которые поддаются лечению в соответствии со способами, описанными в этом изобретении, включают васкулит (например, некротизирующий, кожный и гиперчувствительный васкулит), спондилоартропатию, склеродерму, атеросклероз, рестеноз и миозит в том числе полимиозит, дерматомиозит), панкреатит и инсулинозависимый диабетический меллит. Считается, что субъект с одним из вышеупомянутых заболеваний или состояний "нуждается в ингибировании CRTH2". Субъекта с заболеванием или состоянием такого типа "лечат", когда в целом или частично по меньшей мере один из симптомов, связанных с заболеванием или состоянием, облегчается"Субъект" означает млекопитающее, предпочтительно человек, но также может быть животным,которое нуждается в ветеринарном лечении, например домашние животные (например, собаки, кошки и т.п.), сельскохозяйственные животные (например, крупный рогатый скот, овцы, свиньи, лошади и т.п.) и лабораторные животные (например, крысы, мыши, морские свинки, и т.п.). Как указано выше, "субъект нуждающийся в ингибировании CRTH2" представляет собой субъект, для которого может быть достигнут целесообразный терапевтический или профилактический эффект или эффект путем ингибирования функции или активности CRTH2."Эффективное количество" описанных ингибиторов CRTH2 представляет собой количество, которое ингибирует активность CRTH2 у субъекта, нуждающегося в таком ингибировании, или которое, когда введено субъекту, имеющему состояние или заболевание, которое может быть профилактически или терапевтически вылечено путем ингибирования активности CRTH2, улучшает симптомы заболевания,задерживает появление симптомов и/или увеличивает долгожительство. Точное количество ингибитораCRTH2, назначаемого субъекту будет зависеть от типа и тяжести заболевания или состояния и от таких индивидуальных особенностей субъекта, таких как общее состояние, возраст, пол, масса тела и толерантность к лекарственным препаратам. Кроме того, дозировка может изменяться в соответствии со способом введения, который включает оральный, аэрозольный, ректальный, трансдермальный, подкожный,внутривенный, внутримышечный, внутрибрюшинный и внутриносовой. Квалифицированный специалист в этой области техники сможет определить подходящие дозировки, зависящие от этих и других факторов. Обычно "эффективное количество"изменяется приблизительно от 0,01 до 100 мг/кг/сутки,предпочтительно приблизительно от 0,5 до 50 мг/кг/сутки. Описанные в даном изобретении ингибиторы CRTH2 и их фармацевтически приемлемые соли могут быть использованы в фармацевтических препаратах, в сочетании с фармацевтически приемлемым носителем или разбавителем. Подходящие фармацевтически приемлемые носители включают инертные- 12011385 твердые наполнители или разбавители и стерильные водные или органические растворы. ИнгибиторCRTH2 может присутствовать в таких фармацевтических композициях в количествах, которые достаточны, для того чтобы обеспечить желаемое дозируемое количество в указанном здесь диапазоне. Методики для подбора состава и введения соединения настоящего изобретения можно найти в ремингтоновском справочнике, 19 е издание - Remington: the Science и Practice of Pharmacy, 19th edition, Mack Publishing Co.,Easton, PA (1995). Для орального назначения ингибитор CRTH2 или его соли могут быть объединены с подходящим твердым или жидким носителем или разбавителем, с получением капсул, таблеток, пилюль, порошков,сиропов, растворов, суспензий и т.п. Таблетки, пилюли, капсулы, и т.п. содержат приблизительно от 1 до 99 мас.% активного ингредиента и связующего, такого как смола трагаканта, акации, кукурузный крахмал или желатин; наполнители,такие как дикальцийфосфат; распадающийся агент, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота, смазочный материал, такой как стеарат магния; и подслащивающее вещество,такое как сахароза, лактоза или сахарин. Когда форма единичной дозировки представляет собой капсулу,она может содержать, кроме материалов указанного выше типа, жидкий носитель, такой как нелетучее масло. Могут использоваться различные другие материалы в качестве покрытий или для того, чтобы модифицировать физическую форму единичной дозировки. Например, таблетки могут быть покрыты шеллаком, сахаром или тем и другим. Сироп или эликсир может содержать, в дополнение к активному ингредиенту, сахарозу в качестве подслащивающего вещества, метил и пропилпарабены в качестве предохраняющих средств, краситель и ароматизирующее вещество, такое как вишневый или апельсиновый аромат. Для парентерального назначения описанный ингибитор CRTH2 или его соли могут быть объединены со стерильными водными или органическими средами, для того чтобы получить растворы или суспензии для инъекции. Например, могут быть использованы растворы в кунжутном или арахисовом масле, в водном пропиленгликоле и т.п., а также водные растворы водорастворимых фармацевтически приемлемых солей этого соединения. Кроме того, могут быть получены дисперсии в глицерине, жидком полиэтиленглколе и в их смесях с маслами. При обычных условиях хранения и использования эти препараты содержат предохраняющее средство для предотвращения роста микроорганизмов. В дополнение к описанным ранее составам, эти соединения также могут быть включены в состав складского препарата. Такие составы длительного действия могут быть введены путем имплантации,например, подкожно или внутримышечно или путем внутримышечной инъекции, так, например, в виде эмульсии в подходящем масле, или как ионообменные смолы, или как труднорастворимые производные,например, как труднорастворимые соли. Настоящее изобретение иллюстрируется следующими примерами, которые никоим образом не предназначены для ограничения объема изобретения. Экспериментальный раздел Общие положения. Все реакции с участием чувствительных к воздуху реагентов проводятся в атмосфере азота. Реагенты используются в том виде, как получены от промышленных поставщиков, если не указано другое. Данные 1 Н-ЯМР зарегистрированы с использованием прибора Bruker UltraShield 300 МГц/54 мм, оборудованного автоматическим пробоотборником (Bruker B-ACS60 Auto Sampler) или прибором Varian 300 МГц. Промежуточные и конечные соединения были очищены методом флэш-хроматографии с использованием одного из следующих приборов: 1. Biotage 4-channel Quad UV Flash - Collector, оборудованный модулем Quad 1 Pump Module и Quad 12/25 Cartridge module. 2. Biotage 12-channel Quad UV FlashCollector, оборудованный модулем Quad 3 Pump Module и Quad 3 Cartridge module. 3. Комбинированный флэш-хроматограф ISCO. Спектры жидкостной хроматографии/масс-спектрометрии (ЖХ/МС) записывали с использованием прибора MicroMass Platform ЖХ(с колонкой Phenomenex C18, 5 мкм, 504,6 мм) оборудованного ручным дозатором жидкости Gilson 215 Liquid Handler. Ниже указаны стандартные условия ЖХ/МС: Стандартные условия - муравьиная кислота: Данные ЖХ/МС были получены с использованием стандартного метода с муравьиной кислотой, ес- 13011385 ли не указано другое. Схема 1-Цис- и -транс-(2-этил-1,2,3,4-тетрагидрохинолин-4-ил)-фениламин (1) и (2) В колбу емкостью 250 мл в атмосфере азота загружают анилин (1,00 г, 10,7 ммоль, 1,00 эквмвалента), ацетальдегид (0,599 мл, 10,7 ммоль), бензотриазол (0,255 г, 2,01 ммоль, 0,2 экв.) и высушенный толуол (100 мл) (Осторожно: наблюдается экзотермическая реакция). Сразу происходит образование осадка аддукта бензотриазол/альдегид. Этот раствор оставляют перемешиваться при комнатной температуре в течение 12 ч. Осадок, который образовался после перемешивания в течение ночи, отфильтровывают и промывают минимальным объемом диэтилового эфира, для того чтобы получить исключительно цисизомер. транс-Изомер может быть получен путем концентрирования фильтрата. Остаток очищают с помощью флэш-системы Biotage методом хроматографии (95% гексана/5% диэтилового эфира) с образованием цис- и транс-изомеров в виде смеси. Затем образовавшийся маслянистый остаток растирают с гексаном, для того чтобы выделить цис-изомер в виде белого твердого вещества, и фильтрат концентрируют, получая транс-изомер. Цис 1-(2-метил-4-фениламино-3,4-дигидро-2H-хинолин-1-ил)этанон В колбу емкостью 30 мл в атмосфере азота загружают -цис-2-(2-метил-1,2,3,4-тетрагидрохинолин-4-ил)фениламин (0,520 г, 2,02 ммоль, 1,00 экв.), уксусный ангидрид (0,209 мл, 2,02 ммоль, 1,00 экв.) и осушенный толуол (31 мл). Раствор нагревают при 50C в течение 15 ч. Реакционную смесь выпаривают в вакууме. Остаток очищают с помощью флэш-системы Biotage (70% гексана/30% этилацетата), получая 2-ацетил цис-изомеры с выходом 67%. 1(1-Ацетил-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)фениламид транс-фуран-2-карбоновой кислоты (6) В круглодонную колбу в атмосфере азота загружают -транс-1-(2-метил-4-фениламино-3,4 дигидро-2 Н-хинолин-1-ил)этанон (0,110 г, 0,39 ммоль, 1,00 экв.) и 2-фуроилхлорид (0,193 мл, 1,09 ммоль, 5,0 экв.), пиридин (1,00 экв.) и осущенный толуол (5 мл). Этот раствор нагревают при 50 С в течение 5 ч. Реакционную смесь выпаривают в вакууме. Остаток очищают с помощью флэш-системы Biotage (смеси от 30% гексана/70 % этилацетата до 50% гексана/50% этилацетата), для того чтобы получить транс-изомер с выходом 34%. 1 Н-ЯМР (CDCl3) : 1,011(д, 3 Н), 1,076 (с, 3 Н), 2,007 (дд, 1 Н), 2,037 (м, 1 Н), 5,00 (м, 1 Н), 5,48 (д, 1 Н),6,14 (дд, 1 Н), 6,29 (т, 1 Н), 6,90 (м, 1 Н), 6,99 (м, 1 Н), 7,22-7,32 (м, 6 Н), 7,34 (д, 1 Н),7,54(дд, 1 Н).-Цис-N-(1-ацетил-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)-4-фтор-N-фенилбензамид (7) В колбу емкостью 30 мл в атмосфере азота загружают -цис-(2-метил-1,2,3,4-тетрагидрохинолин 4-ил)фениламин (0,520 г, 2,02 ммоль, 1,00 экв.) и уксусный ангидрид (0,209 мл, 2,02 ммоль, 1,00 экв.), и осущенный толуол (31 мл). Этот раствор нагревают при 50 С в течение 15 ч. Реакционную смесь выпаривают в вакууме. Остаток очищают с помощью флэш-системы Biotage (70% гексана/30% этилацетата),чтобы получить 2-ацетил цис-изомеры с выходом 67%.(дд, 1 Н), 4,96 (м, 1 Н), 6,65 (д, 2 Н), 6,75 (т, 1 Н), 7,12-7,33 (м, 6 Н). В круглодонную колбу в атмосфере азота загружают -цис-1-(2-метил-4-фениламино-3,4-дигидро 2 Н-хинолин-1-ил)этанон (1,00 экв.) и 2-фторбензоилхлорид (5,0 экв.), пиридин (1,00 экв.) и осущенный толуол (3 мл). Этот раствор нагревают при 90 С в течение 15 ч. Реакционную смесь выпаривают в вакууме. Остаток очищают с помощью флэш-системы Biotage (50% гексана/50% этилацетата), чтобы получить цис-изомер с выходом 40%. 1 Н-ЯМР (CDCl3) : 1,01 (3 Н, д), 1,02 (1 Н, м), 2,01 (3 Н, с), 2,01 (1 Н, м), 4,8 (1 Н, м), 5,4 (1 Н, м), 6,8-транс-N-(1-Ацетил-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)-4-фтор-N-фенилбензамид (8) В колбу емкостью 30 мл в атмосфере азота загружают -транс-(2-метил-1,2,3,4 тетрагидрохинолин-4-ил)фениламин (0,260 г, 1,01 ммоль, 1,00 экв.) и ацетилхлорид (0,075 мл, 1,00 ммоль, 0,95 экв.) в пиридине (5 мл). Этот раствор оставляют перемешиваться при комнатной температуре в течение 6 ч. Реакционную смесь выпаривают в вакууме. Остаток очищают с помощью флэшсистемы Biotage (от 70% гексана/30% этилацетата до 60% гексана/40% этилацетата и до 50% гексана/50% этилацетата), чтобы получить 2-ацетил транс-изомеры с выходом 35 %. 1H-ЯМР (CDCl3):1,019 (д, 3H), 1,076 (м, 1 Н), 2,017(с,3 Н), 2,052 (дд, 1 Н), 4,60(т, 1 Н), 4,93 (м, 1 Н),6,67 (д, 2 Н), 6,71 (т, 1 Н), 7,13-7,36 (м ,6 Н), 7,41 (д, 1 Н). В круглодонную колбу в атмосфере азота загружают -транс-1-(2-метил-4-фениламино-3,4 дигидро-2 Н-хинолин-1-ил)этанон (1,00 экв.) и 4-фторбензоилхлорид (5,0 экв.), пиридин (1,00 экв.) и осушенный толуол (5 мл). Этот раствор нагревают при 50 С в течение 5 ч. Реакционную смесь выпаривают в вакууме. Остаток очищают с помощью флэш-системы Biotage (от 30% гексана/70 % этилацетата до 50% гексана/50% этилацетата), чтобы получить транс-изомер с выходом 34%. 1 Н-ЯМР (CDCl3) : 1,02 (3 Н, д), 1,09 (3 Н, с), 2,00 (1 Н, м), 2,03 (1H, м), 5,0 (1H, м), 6,2 (1 Н, м), 6,6-6,8-Цис-N-[1-(фуран-2-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид (А-1) К раствору -цис-(2-метил-1,2,3,4-тетрагидрохинолин-4-ил)фениламина (430 мг, 1,083 ммоль) в дихлорметане (18 мл) при комнатной температуре добавляют диизопропилэтиламин (318 мкл, 1,083 ммоль) и затем 2-фуроилхлорид. Раствор оставляют перемешиваться при комнатной температуре в течение 12 ч. Смесь выливают в воду и экстрагируют дихлорметаном. Экстракты промывают 1 М (водным) раствором NaOH и рассолом, сушат над сульфатом магния, фильтруют и концентрируют. Сырой остаток очищают хроматографически на силикагеле (80% гексана/20% этилацетата), для того чтобы получить амид (500 мг, 83%). К раствору -цис-фуран-2-ил-(2-метил-4-фениламино-3,4-дигидро-2 Н-хинолин-1-ил)метанона(360 мг, 1,00 ммоль) в метиленхлориде (5 мл) добавляют диизопропилэтиламин (1,09 мл, 10 ммоль) и затем ацетилхлорид (388 мкл, 5 ммоль). Эту смесь перемешивают при комнатной температуре в течение ночи. Смесь выливают в воду и экстрагируют дихлорметаном. Экстракты промывают 1 М (водным) раствором NaOH и рассолом, сушат над сульфатом магния, фильтруют и концентрируют. Сырой остаток очищают хроматографически на силикагеле (50% гексана/50% этилацетата), чтобы получить амид (230 мг, 57%). 1 Н-ЯМР (CDCl3) : 1,012 (д, 3 Н), 1,025 (т, 1 Н), 2,001 (с, 3 Н), 2,032 (м, 1 Н), 4,12 (секстет, 1 Н), 5,49-Цис-2-метокси-N-[1-(3-метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3-метоксибензоилхлорид и ацетилхлорид на метоксиацетилхлорид. 1 Н-ЯМР (CDCl3) : 1,014 (д, 3 Н), 1,025 (т, 1 Н), 2,033 (м, 1 Н), 3,39 (с, 3 Н), 3,60(с, 3 Н), 3,85(д, 1 Н),- 15011385 3,98 (д, 1 Н), 4,79 (секстет, 1 Н), 5,62 (шир, с, 1 Н), 6,53 (д, 1 Н), 6,72 (с, 1 Н), 6,81 (д, 1 Н), 6,92 (т, 1 Н), 7,08-Цис-4-хлор-N-[1-(3-метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилбензамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 3-метоксибензоилхлорид и ацетил хлорид на 4-хлорбензоилхлорид. 1 Н-ЯМР (CDCl3) : 1,024 (д, 3 Н), 1,026 (м, 1 Н), 2,029 (м, 1 Н), 3,60 (с, 3 Н), 4,84 (секстет, 1 Н), 5,92-Цис-N-[1-(3-метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилизобутирамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на на 3-метоксибензоилхлорид и ацетилхлорид на изобутирилхлорид. 1 Н-ЯМР (CDCl3) : 1,014 (д, 9 Н), 1,023 (т, 1 Н), 2,028 (м, 1 Н), 2,065 (секстет, 1 Н), 3,65 (с, 3 Н), 4,77-Цис-N-[2-метил-1-(тиофен-2-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 2-тиофенкарбонилхлорид.-Цис-N-[2-метил-1-(тиофен-2-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид разделяют методом хиральной ЖХВД с использованием хиральной колонки cel OD, при изократическом элюировании системой 90% гексана/10% этанола, чтобы получить (2R,4S)- и (2S,4R)-N-[2-метил-1(тиофен-2-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид (А-11 и А-10, соответственно). 1 Н-ЯМР (CDCl3) : 1,015 (д, 3 Н), 1,025 (м, 1 Н), 2,002 (с, 3 Н), 2,031 (м, 1 Н), 4,73 (секстет, 1 Н), 5,53-Цис-N-[1-(4-трет-бутилбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-трет-бутилбензоилхлорид.-Цис-N-[1-(4-трет-бутилбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид разделяют методом хиральной ЖХВД с использованием хиральной колонки cel OD при изократическом элюировании системой 90% гексана/10% этанола, чтобы получить (2R,4S)- и (2S,4R)-цис-N-[1-(4-третбутилбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид (А-8 и А-9, соответственно). 1 Н-ЯМР (CDCl3) : 1,014 (д, 3 Н), 1,016 (м, 1 Н), 1,023 (с, 9 Н), 2,004 (с, 3 Н), 2,033 (м, 1 Н), 4,78 (секстет, 1 Н), 5,62 (шир, с, 1 Н), 6,53 (д, 1 Н), 6,91 (т, 1 Н), 7,15-7,40 (м, 11 Н).-Цис-N-[1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 4-фторбензоилхлорид.-Цис-N-[1-(4-фторбензоил)-2-метил-1,2,3)4-тетрагидрохинолин-4-ил]-N-фенилацетамид разделяют методом хиральной ЖХВД с использованием хиральной колонки cel OD при изократическом элюировании системой 90% гексана/10% этанола, чтобы получить (2R,4S)- и (2S,4R)-цис-N-[1-(4 фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид (А-52 и А-44, соответственно). 1 Н-ЯМР (CDCl3) : 1,013 (д, 3 Н), 1,025 (м, 1 Н), 2,003 (с, 3 Н), 2,032 (м, 1 Н), 4,78 (секстет, 1 Н), 5,62-Цис-N-[2-метил-1-(5-метилтиофен-2-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 5-метил-2 тиофенкарбонилхлорид.-Цис-N-[2-метил-1-(5-метилтиофен-2-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид разделяют методом хиральной ЖХВД с использованием хиральной колонки cel OD при изократическом элюировании системой 90% гексана/10% этанола, чтобы получить (2R,4S)- и (2S,4R)-цис-N-[2- 16011385 метил-1-(5-метилтиофен-2-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид (А-59 и А-60,соответственно). 1 Н-ЯМР (CDCl3) : 1,007 (м, 1 Н), 1,012 (д, 3 Н), 2,001 (с, 3 Н), 2,031 (м, 1 Н), 2,039 (с, 3 Н), 4,69 (секстет, 1 Н), 5,50 (шир, с, 1 Н), 6,44 (с, 1 Н), 6,51 (д, 1 Н), 6,94 (д, 1 Н), 7,09 (т, 1 Н), 7,21-7,30 (м, 3 Н), 7,39-7,41-Цис-N-[2-этил-1-(4-метил-2-пиразин-2-илтиазол-5-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]N-фенилацетамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 4-метил-2-(2 пиразинил)-1,3-тиазол-5-карбонилхлорид. 1 Н-ЯМР (CDCl3) : 1,018 (д, 3 Н), 1,077 (шир. с, 1 Н), 2,003 (с, 3 Н), 2,010 (с, 3 Н), 2,032 (м, 1 Н), 4,79-Цис-N-[2-метил-1-(3-метилтиофен-2-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3-метил-2 тиофенкарбонилхлорид. 1 Н-ЯМР (CDCl3) : 1,013 (д, 3 Н), 1,016 (м, 1 Н), 1,080 (с, 3 Н), 2,000 (с, 3 Н), 2,029 (м, 1 Н), 4,73 (секстет, 1 Н), 5,49 (шир, с, 1 Н), 6,56 (д, 1 Н), 6,66 (д, 1 Н), 6,97 (т, 1 Н), 7,16 (д, 2 Н), 7,25 (д, 2 Н), 7,32 (д, 1 Н),7,38 (шир. с, 3 Н). МС m/z: 405 (М+1).-Цис-N-[2-метил-1-(5-фенилтиофен-2-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А, заменяя 2-фуроилхлорид на 5-фенил-2 тиофенкарбонилхлорид. 1 Н-ЯМР (CDCl3) : 1,015 (д, 3 Н), 1,017 (м, 1 Н), 2,003 (с, 3 Н), 2,031 (м, 1 Н), 4,73 (секстет, 1 Н), 5,55-Цис-N-[2-метил-1-(4-метил-2-фенилтиазол-5-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-метил-2-фенил-1,3 тиазол-5-карбонилхлорид. 1 Н-ЯМР (CDCl3) : 1,016 (д, 3 Н), 1,018 (м, 1 Н), 2,003 (с, 3 Н), 2,014 (с, 3 Н), 2,032 (м, 1 Н), 4,74 (секстет, 1 Н), 5,53 (шир, с, 1 Н), 6,77 (д, 2 Н), 7,04 (т, 1 Н), 7,24-7,28 (м, 3 Н), 7,38-7,40 (м, 7 Н), 7,83 (д, 2 Н). МС m/z: 482 (М+1).-Цис-N-[2-метил-1-(4-метил-[1,2,3]тиадиазол-5-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилацетамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 4-метил[1,2,3]тиадиазол-5-карбонилхлорид. 1 Н-ЯМР (CDCl3) : 1,017 (д, 3 Н), 1,021 (м, 1 Н), 2,001 (с, 3 Н), 2,036 (с, 3 Н), 2,024 (м, 1 Н), 4,81 (секстет, 1 Н), 5,48 (шир, с, 1 Н), 6,52 (д, 1 Н), 6,98 (т, 1 Н), 7,22-7,26 (м, 3 Н), 7,37-7,42 (м, 4 Н).-Цис-N-[1-(5-изопропилтиофен-2-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилацетамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 5 изопропилтиофенкарбонилхлорид. 1 Н-ЯМР (CDCl3) : 1,011 (д, 3 Н), 1,015 (м, 1 Н), 1,019-1,025 (м, 6 Н), 2,001 (с, 3 Н), 2,030 (м, 1 Н), 2,070-Цис-N-[2-метил-1-(3,4,5-трифторбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 3,4,5-трифторбензоилхлорид.-Цис-N-[1-(4-фтор-3-метилбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-фтор-3-метилбензоилхлорид. 1 Н-ЯМР (CDCl3) : 1,012 (д, 3 Н), 1,022 (м, 1 Н), 2,004 (с, 3 Н), 2,015 (с, 3 Н), 2,029 (м, 1 Н), 4,75 (секстет, 1 Н), 5,60 (шир, с, 1 Н), 6,50 (д, 1 Н), 6,73 (т, 1 Н), 6,86 (с, 1 Н), 6,93 (т, 1 Н), 7,15-7,39 (м,8 Н).-Цис-N-[1-(4-фтор-3-трифторметилбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-фтор-3(трифторметил)бензоилхлорид. 1 Н-ЯМР (CDCl3) : 1,015 (д, 3 Н), 1,024 (м, 1 Н), 2,004 (с, 3 Н), 2,033 (м, 1 Н), 4,75 (секстет, 1 Н), 5,58-Цис-N-[1-(3-хлор-4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 3-хлор-4-фторбензоилхлорид. 1 Н-ЯМР (CDCl3) : 1,013 (д, 3 Н), 1,024 (м, 1 Н), 2,004 (с, 3 Н), 2,031 (м, 1 Н), 4,76 (секстет, 1 Н), 5,59-Цис-N-[2-метил-1-(2,4,6-трифторбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 2,4,6-трифторбензоилхлорид. 1 Н-ЯМР (CDCl3) : 1,013 (д, 3 Н), 1,021 (м, 1 Н), 2,005 (с, 3 Н), 2,029 (м, 1 Н), 4,86 (секстет, 1 Н), 5,45-Цис-N-[1-(4-хлорбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 4-хлорбензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,009 (т, 3 Н), 1,012 (д, 3 Н), 1,022 (м, 1 Н), 2,023 (м, 3 Н), 4,73 (секстет, 1 Н), 5,58-Цис-N-[2-метил-1-(3-фенилизоксазол-5-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3-фенил-5 изоксазолкарбонилхлорид и ацетилхлорид на пропионилхлорид.-Цис-N-2-метил-1-[4-(5-метилтетразол-1-ил)-бензоил]-1,2,3,4-тетрагидрохинолин-4-ил-Nфенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-(5-метил-1 Нтетразол-1-ил)-бензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,016 (т, 3 Н), 1,017 (д, 3 Н), 1,024 (м, 1 Н), 2,026 (м, 3 Н), 2,055 (с, 3 Н), 4,82 (секстет, 1 Н), 5,64 (шир, с, 1 Н), 6,50 (д, 1 Н), 6,94 (т, 1 Н), 7,21-7,41 (м, 11 Н).-Цис-N-1-[3-(4-хлорфенил)изоксазол-5-карбонил]-2-метил-1,2,3,4-тетрагидрохинолин-4-ил-Nфенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3-(4-хлорфенил)5-изоксазолкарбонилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР(CDCl3) : 1,021 (м,6 Н), 1,024 (м, 1 Н), 2,023 (м,3 Н), 4,76 (секстет, 1 Н), 5,48 (шир. с, 1 Н), 6,28-N-[1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-2-гидрокси-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-фторбензоилхлорид и ацетилхлорид на ацетоксиацетилхлорид. 1 Н-ЯМР (CDCl3) : 1,013 (д, 3 Н), 1,022 (м, 1 Н), 2,039 (м, 1 Н), 3,42 (с, 1 Н), 3,85 (д, 1 Н), 4,04 (д, 1 Н),4,77 (секстет, 1 Н), 5,54 (шир, с, 1 Н), 6,49 (д, 1 Н), 6,85 (т, 2 Н), 6,94 (т, 1 Н), 7,18-7,27 (м, 5 Н), 7,33 (д, 1 Н),7,43 (с, 3 Н).-Цис-N-[1-(1 Н-индол-2-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на индол-2-карбонилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,025 (т, 3 Н), 1,026 (д, 3 Н), 1,027 (м, 1 Н), 2,036 (м, 3 Н), 4,86 (секстет, 1 Н), 5,62-Цис-N-[2-метил-1-(4-пиразол-1-илбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-(1 Н-пиразол-1 ил)бензоилхлорид и ацетил хлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,003 (т, 3 Н), 1,011 (д, 3 Н), 1,020 (м, 1 Н), 2,019 (м, 3 Н), 4,73 (секстет, 1 Н), 5,62-Цис-N-[1-(бензофуран-2-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Н-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 2-бензофуранкарбонилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,004 (т, 3 Н), 1,007 (д, 3 Н), 1,018 (м, 1 Н), 2,019 (м, 3 Н), 4,69 (секстет, 1 Н), 5,54-Цис-N-[1-(3-хлорбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3-хлорбензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,009 (т, 3 Н), 1,012 (д, 3 Н), 1,022 (м, 1 Н), 2,023 (м, 3 Н), 4,73 (секстет, 1 Н), 5,58-цис-4-[2-метил-4-(фенилпропиониламино)-3,4-дигидро-2 Н-хинолин-1 карбонил]феноксиуксусной кислоты получают из -N-[1-(4-гидроксибензоил)-2-метил-1,2,3,4 тетрагидрохинолин-4-ил]-Н-фенилпропионамида. -N-[1-(4-Метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид (0,147 г) растворяют в диметилформамиде (ДМФ) (5 мл) при комнатной температуре. Добавляют гидрид натрия (60% в масле, 0,021 г) и смесь оставляют перемешиваться в течение 30 мин. Добавляют этиловый эфир 4-бромуксусной кислоты (0,065 г) и реакционную смесь оставляют перемешиваться в течение ночи. Добавляют этанол и реакционную смесь концентрируют в вакууме. Сырой остаток очищают хроматографически на силикагеле (градиент от 80/20 гексан/этилацетат до 50/50 гексан/этилацетат), чтобы получить продукт (130 мг, 73%). 1-Цис-N-[1-(4 метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид (0,548 г, 0,001 моль) растворяют в дихлорметане и добавляют раствор BBr3 (1,00 М в дихлорметане, 10 мл); реакционную смесь оставляют перемешиваться при комнатной температуре в течение 4 ч или пока не израсходуется исходный материал. Реакционную смесь тщательно промывают насыщенным раствором NaHCO3 и рассолом. Органические слои сушат над MgSCO4, фильтруют и концентрируют при пониженном давлении. Фенол концентрируют и остаток очищают методом флэш-хроматографии Biotage с использованием 100% этилацетата, чтобы получить белое твердое вещество, с выходом 68%. 1 Н-ЯМР (CDCl3)1,009 (д, 3 Н), 1,011 (т, 3 Н), 1,019 (м, 1 Н), 2,026 (м, 3 Н), 4,74 (секстет, 1 Н), 5,54-Цис-N-[1-(4-метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А, заменяя 2-фуроилхлорид на 4-метоксибензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,012 (д, 3 Н), 1,015 (т, 3 Н), 1,017 (м, 1 Н), 2,023 (м, 3 Н), 3,74 (с, 3 Н), 4,74 (секстет, 1 Н), 5,61 (шир, с, 1 Н), 6,52 (д, 1 Н), 6,67 (д, 2 Н), 6,92 (д, 1 Н), 7,17 (д, 2 Н), 7,25-7,34 (м, 4 Н), 7,39-Цис-4-[2-метил-4-(фенилпропиониламино)-3,4-дигидро-2 Н-хинолин-1-карбонил]феноксиуксусную кислоту получают из этилового эфира -цис-4-[2-метил-4-(фенилпропиониламино)-3,4 дигидро-2 Н-хинолин-1-карбонил]феноксиуксусной кислоты. Этиловый эфир-цис-4-[2-метил-4(фенилпропиониламино)-3,4-дигидро-2 Н-хинолин-1-карбонил]феноксиуксусной кислоты растворяют в этаноле (5 мл) и добавляют при комнатной температуре 0,5 мл 1 н. раствора NaOH. Реакционную смесь оставляют перемешиваться в течение 4 ч. Этанол удаляют в вакууме и водный раствор подкисляют 1 н. раствором HCl, чтобы получить белый осадок, который отфильтровывают, чтобы получить желаемый продукт с выходом 88%. 1 Н-ЯМР (CDCl3) : 1,012 (д, 3 Н), 1,016 (т, 3 Н), 1,015 (м, 1 Н), 2,028 (м, 3 Н), 4,52 (с, 2 Н), 4,74 (секстет, 1 Н), 5,63 (шир, с, 1 Н), 6,50 (д, 1 Н), 6,68 (д, 2 Н), 6,91 (т, 1 Н), 7,16 (т, 1 Н), 7,18 (д, 2 Н), 7,26-7,32 (м,4 Н), 7,40 (шир. с, 2 Н).-Цис-N-[1-(4-метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4 ил]-N-фенилпропионамид растворяют в ДМФ (5 мл) при комнатной температуре. Добавляют гидрид натрия (60% в масле, 0,061 г) и смесь оставляют перемешиваться на 30 мин. Добавляют гидрохлорид 4-(2 хлорэтил)морфолина (0,143 г) и реакционную смесь оставляют перемешиваться в течение ночи. Добав- 20011385 ляют этанол и реакционную смесь концентрируют в вакууме. Остаток распределяют между этилацетатом и водой, затем экстрагируют 3 раза этилацетатом, сушат над MgSO4, фильтруют и концентрируют. Сырой остаток очищают хроматографически на силикагеле (с градиентом от 2/98 метанол/дихлорметан до 5/95 метанол/дихлорметан), чтобы получить продукт (200 мг). 1 Н-ЯМР (CDCl3) : 1,009 (д, 3 Н), 1,012 (м, 4 Н), 1,022 (с, 4 Н), 2,023 (м, 3 Н), 2,050 (с, 4 Н), 2,070 (м,2 Н), 4,01 (т, 2 Н), 4,70 (секстет, 1 Н), 5,59 (шир, с, 1 Н), 6,49 (д, 1 Н), 6,64 (д, 2 Н), 6,89 (т, 1 Н), 7,13 (д, 2 Н),7,23-7,36 (м, 7 Н).-Цис-N-[1-(4-карбамоилметоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилпропионамид получают из -цис-N-[1-(4-гидроксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин 4-ил]-N-фенилпропионамида. -Цис-N-[1-(4-гидроксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4 ил]-N-фенилпропионамид (0,120 г) растворяют в ДМФ (5 мл) при комнатной температуре. Добавляют гидрид натрия (60% в масле, 0,70 г) и смесь оставляют перемешиваться 30 мин. Добавляют 2 бромацетамид (0,320 г) и реакционную смесь оставляют перемешиваться в течение ночи. Добавляют этанол и реакционную смесь концентрируют в вакууме. Остаток распределяют между этилацетатом и водой, затем экстрагируют 3 раза этилацетатом, сушат над MgSO4, фильтруют и концентрируют. Сырой остаток очищают хроматографически на силикагеле (с градиентом от 2/98 метанол/дихлорметан до 10/90 метанол/дихлорметан), чтобы получить продукт (20 мг, 15%). 1 Н-ЯМР (CDCl3) : 1,012 (д, 3 Н), 1,014 (т, 3 Н), 1,024 (т, 1 Н), 2,025 (м, 3 Н), 4,42 (с, 2 Н), 4,73 (секстет,1 Н), 5,61 (шир, с, 1 Н), 5,79 (с, 1 Н), 6,49 (д, 2 Н), 6,70 (д, 2 Н), 6,92 (т, 1 Н), 7,14-7,39 (м, 8 Н).-Цис-N-1-[4-(2-гидрокси-2-метилпропокси)бензоил]-2-метил-1,2,3,4-тетрагидрохинолин-4-илN-фенилпропионамид получают из этилового эфира -цис-4-[2-метил-4-(фенилпропиониламино)-3,4 дигидро-2 Н-хинолин-1-карбонил]феноксиуксусной кислоты. Этиловый эфир -цис-4-[2-метил-4(фенилпропиониламино)-3,4-дигидро-2 Н-хинолин-1-карбонил]феноксиуксусной кислоты (0,170 г) растворяют в тетрагидрофуране (ТГФ) и охлаждают до 0 С. Добавляют 0,5 мл метилмагнийбромида (3,0 М раствор в диэтиловом эфире) и реакционную смесь оставляют перемешиваться при 0 С в течение 30 мин. Реакцию прерывают, добавляя насыщенный раствор хлорида аммония и смесь разбавляют этилацетатом. Органический слой выделяют и промывают рассолом, сушат над MgSO4, фильтруют и концентрируют. Сырой остаток очищают хроматографически на силикагеле (с градиентом от 50/50 гексан/этилацетат до 75/25 гексан/этилацетат), чтобы получить продукт (132 мг, 80%). 1 Н-ЯМР (CDCl3) : 1,010 (д, 3 Н), 1,014 (т, 3 Н), 1,023 (т, 1 Н), 1,029 (с, 6 Н), 2,024 (м, 3 Н), 3,70 (с, 2 Н),4,74 (секстет, 1 Н), 5,61 (шир, с, 1 Н), 6,50 (д, 1 Н), 6,66 (д, 2 Н), 6,91 (т, 1 Н), 7,13 (т, 1 Н), 7,14 (д, 2 Н), 7,25(0,063 г), EDCI (0,071 г) и 0,162 мл диметиламина (2,0 М раствор в ТГФ), а также 2 капли ДМФ и смесь перемешивают при комнатной температуре в течение 11 ч. Реакционную смесь разбавляют этилацетатом, промывают 1 н. раствором NaOH, 1 н. раствором HCl и рассолом. Органический слой сушат надMgSO4, фильтруют и концентрируют. Сырой остаток очищают хроматографически на силикагеле (100% этилацетат), чтобы получить продукт (84 мг, 54%). 1 Н-ЯМР (CDCl3) : 1,010 (д, 3 Н), 1,013 (т, 3 Н), 1,022 (т, 1 Н), 2,023 (м, 3 Н), 2,094 (с, 3 Н), 3,00 (с, 3 Н),4,60 (с, 2H), 4,71 (секстет, 1 Н), 5,58 (шир, с, 1 Н), 6,49 (д, 1 Н), 6,70 (д, 2 Н), 6,89 (т, 1 Н), 7,13 (д, 1 Н), 7,24-Цис-N-[1-(3-диметиламинобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3 диметиламинобензоилхлорид и ацетилхлорид на пропионилхлорид.-Цис-[2-этил-1-(пиридин-3-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 3-пиридинилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (300 МГц, CDCl3) : 1,008-1,032 (м, 7 Н), 2,016-2,044 (м, 3 Н), 4,84 (ддд, 1 Н), 5,62 (шир. с,1 Н), 6,53 (д, 1 Н), 6,97 (дд, 1 Н), 7,11 (дд, 1 Н), 7,20-7,51 (м, 8 Н), 8,55 (дд, 1 Н), 8,68 (шир. с, 1 Н).-Цис-N-[1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-4-метокси-N-фенилбутирамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 4-фторбензоилхлорид и ацетилхлорид на 4-метоксибутирилхлорид. 1 Н-ЯМР (300 МГц, CDCl3) : 1,008-1,020 (м, 4 Н), 1,086-2,002 (м, 2 Н), 2,021-2,041 (м, 3 Н), 3,26 (м,3 Н), 3,28-3,44 (м, 2 Н), 4,76 (ддд, 1 Н), 5,64 (шир. с, 1 Н), 6,43 (д, 1 Н), 6,83-6,96 (м, 3 Н), 7,17-7,34 (м, 5 Н),7,36-7,51 (м, 4 Н). МС m/z: 461 (М+1).-Цис-2-(ацетилметиламино)-N-[1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-фторбензоилхлорид и ацетилхлорид на (ацетилметиламино)ацетилхлорид. 1 Н-ЯМР (300 МГц, CDCl3) : 1,010-1,018 (м, 4 Н), 2,013 (с, 3 Н), 2,027-2,043 (м, 1 Н), 3,14 (м, 3 Н), 3,77-[1-(3-Метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]фениламид цис-циклогексанкарбоновой кислоты получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3 метоксибензоилхлорид и ацетилхлорид на циклогексанкарбонилхлорид. 1 Н-ЯМР (CDCl3) : 0,8 (8 Н, м), 1,05-1,08 (5 Н, м), 2,00-2,04 (3 Н, м), 3,7 (3 Н, д), 4,8 (1 Н, м), 5,6 (1 Н,д), 6,2-6,6 (2 Н, м), 6,6-7,5 (11 Н, м). МС m/z: 483 (М+1).-[1-(3-Метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]фениламид цис-изоксазол-5 карбоновой кислоты получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3 метоксибензоилхлорид и ацетилхлорид на изоксазол-5-карбонилхлорид. 1 Н-ЯМР (CDCl3) : 1,02 (3 Н, д),1,02 (1 Н, м), 2,04 (1 Н, м), 3,6 (3 Н, с), 4,9 (1 Н, м), 5,8 (1 Н, м), 6,4 (1 Н,д), 6,7-7,7 (12 Н, м), 8,2 (1 Н, с), 8,4 (1 Н, м).-Цис-N-[1-(фуран-3-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 3-фуроилхлорид. 1 Н-ЯМР (CDCl3) : 1,01 (3 Н, д),1,02 (1 Н, м), 2,00 (3 Н, с), 2,02 (1 Н, м), 4,7 (1 Н, м), 5,5 (1 Н, м), 5,9-Цис-N-[1-(3-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А, заменяя 2-фуроилхлорид на 3-фторбензоилхлорид. 1 Н-ЯМР (CDCl3) : 1,01 (3 Н, д), 1,01 (1 Н, м), 2,00 (3 Н, с), 2,03 (1 Н, м), 4,7 (1 Н, м), 5,6 (1 Н, м), 6,4-Цис-N-[1-(3,4-дифторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3,4-дифторбензоилхлорид. 1 Н-ЯМР (CDCl3) : 1,01 (3 Н, д), 1,01 (1 Н, м), 2,00 (3 Н, с), 2,03 (1 Н, м), 4,7 (1 Н, м), 5,6 (1 Н, м), 6,5-Цис-N-[1-(бензо[b]тиофен-3-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на бензо[b]тиофен-3 карбонилхлорид. 1 Н-ЯМР (CDCl3) : 1,02 (3 Н, д), 1,03 (1 Н, м), 2,00 (3 Н, с), 2,03 (1 Н, м), 4,9 (1 Н, м), 5,7 (1 Н, м), 6,5-Цис-N-[1-(3,5-диметиофен-2-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3,5-диметилтиофен-2 карбонилхлорид. 1 Н-ЯМР (CDCl3) : 1,01 (3 Н, д), 1,01 (1 Н, м), 1,07 (3 Н, с), 2,00 (3 Н, д), 2,00 (1 Н, м), 2,03 (3 Н, с), 4,7-Цис-N-[1-(3-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилизобутирамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 3-фторбензоилхлорид и ацетилхлорид на изопропилхлорид. 1 Н-ЯМР (CDCl3) : 1,00-1,02 (10 Н, м), 2,03 (1 Н, м), 2,07 (1 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, м), 6,5 (1 Н, м),6,8-7,6 (12 Н, м).-Цис-N-[1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилизобутирамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-фторбензоилхлорид и ацетилхлорид на изопропилхлорид. 1 Н-ЯМР (CDCl3) : 1,00-1,02 (10 Н, м), 2,03 (1 Н, м), 2,06 (1 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, м), 6,5 (1 Н, д),6,8-7,0 (3 Н, м), 7,1-7,4 (9 Н, м).-Цис-N-[1-(2,4-диметилтиазол-5-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 2,4-диметилтиазол-5 карбонилхлорид . 1 Н-ЯМР (CDCl3) : 1,02 (3 Н, д), 1,02 (1 Н, м), 2,00 (3 Н, с), 2,02 (3 Н, с), 2,03 (1 Н, м), 2,06 (3 Н, с), 4,7-Цис-N-[1-(фуран-2-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,00-1,02 (7 Н, м), 2,02-2,04 (3 Н, м), 4,7 (1 Н, м), 5,4 (1 Н, м), 6,2 (2 Н, м), 6,8 (1 Н,д), 7,0-7,4 (9 Н, м).-Цис-N-[1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилбутирамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-фторбензоилхлорид и ацетилхлорид на бутирилхлорид. 1 Н-ЯМР (CDCl3) : 0,8 (3 Н, т), 1,02 (3 Н, д), 1,02 (1 Н, м), 1,05 (2 Н, м), 2,00 (3 Н, м), 4,7 (1 Н, м), 5,4-Цис-N-[1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-2-фенокси-N-фенилацетамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-фторбензоилхлорид и ацетилхлорид на 1-хлор-3-феноксипропан-2-он. 1 Н-ЯМР (CDCl3) : 1,01 (3 Н, д), 1,01 (1 Н, м), 2,03 (1 Н, м), 4,5 (2 Н, с), 4,7 (1 Н, м), 5,7 (1 Н, м), 6,4 (1 Н,д), 6,7-6,9 (7H, м), 7,1-7,4 (9 Н, м), 10,0 (1 Н, м). МС m/z: 496 (М+2).-Цис-N-[1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-3,N-дифенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-фторбензоилхлорид и ацетилхлорид на 3-фенилпропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,02 (3 Н, д), 1,02 (1 Н, м), 2,02 (1 Н, м), 2,07 (2 Н, т), 3,1 (2 Н, т), 4,7 (1 Н, м), 5,7-Цис-N-[1-(бензо[b]тиофен-2-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на бензо[b]тиофен 2-карбонилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01-1,02 (7 Н, м), 2,01-2,03 (3 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, м), 6,9 (1 Н, д), 7,0 (2 Н,м), 7,2-7,5 (9 Н, м), 7,6 (1 Н, д), 7,8 (1 Н, д). МС m/z: 456 (М+2).-Цис-N-[1-(4-цианобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-цианобензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01-1,03 (7 Н, м), 2,02-2,04 (3 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, м), 6,4 (1 Н, д), 6,9 (1 Н, т),7,2-7,6 (11 Н,м). МС M/Z: 424 (М+1).-Цис-N-[1-(3-фтор-4-метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3-фтор-4 метоксибензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01-1,02 (7 Н, м), 2,01-2,03 (3 Н, м), 3,8 (3 Н, с), 4,8 (1 Н, м), 5,6 (1 Н, м), 6,5 (1 Н, д),6,7 (1 Н, т), 6,8 (1 Н, д), 6,9 (1 Н, т), 7,2-7,5 (8 Н, м). МС m/z: 447 (М+1).-Цис-N-[1-(4-метокси-3-метилбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3-метил-4 метоксибензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 0,9-1,01 (7 Н, м), 1,08-2,02 (6 Н, м), 3,8 (3 Н, с), 4,8 (1 Н, м), 5,6 (1 Н, м), 6,5 (2 Н, м),6,7-7,8 (10H, м).-Цис-N-[1-(4-этоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-этоксибензоилхлорид и анетилхло- 24011385 рид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01-1,03 (7 Н, м), 1,04 (3 Н, т), 2,02-2,04 (3 Н, м), 4,0 (2 Н, кв), 4,8 (1 Н, м), 5,6 (1 Н,м), 6,5 (1 Н, д), 6,9 (2 Н, д), 6,9 (1 Н, т), 7,2-7,6 (9 Н, м).-Цис-N-[2-метил-1(4-трифторметилбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4 трифторметилбензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01-1,03 (7 Н, м), 2,02-2,04 (3 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, м), 6,4 (1 Н, д), 6,9 (1 Н, т),7,2-7,6 (11 Н, м).-Цис-N-[1-(4-бензилморфолин-2-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-бензилморфолин-2 карбонилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01-1,02 (7 Н, м), 2,01-2,03 (4 Н. м), 2,06 (3 Н, м), 3,5 (2 Н, м), 3,9 (1 Н, м), 4,2 (1 Н,м), 4,7 (1 Н, м), 5,2 (1 Н, м), 7,1-7,5 (14 Н, м).-Цис-N-[1-(4-этилморфолин-2-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-этилморфолин-2 карбонилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01-1,02 (10 Н, м). 2,01-2,04 (6H, м), 2,06 (2 Н, м), 3,6 (1 Н, т), 3,9 (1 Н, м), 4,2 (1 Н,м), 4,7 (1 Н, м), 5,2 (1 Н, м), 7,2-7,5 (14 Н, м). МС m/z: 436 (М+1).-Цис-N-[2-метил-1-(4-феноксибензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 4-феноксибензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,00-1,02 (7 Н, м), 2,02-2,04 (3 Н, м), 4,7 (1 Н, м), 5,6 (1 Н, м), 6,5 (1 Н, д), 6,5 (1 Н,д), 6,8 (2 Н, д), 7,0-7,4 (15 Н, м). МС m/z: 491 (М+1).-Цис-N-[1-(4-фтор-3-метоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-фтор-3 метоксибензоилхлорид и ацетилхлорид на пропионилхлорид 1 Н-ЯМР (CDCl3) : 1,00-1,02 (7 Н, м), 2,02-2,04 (3 Н, м), 3,6 (3 Н, с), 4,7 (1 Н, м), 5,6 (1 Н, м), 6,4 (1 Н, д),6,7-6,9 (4 Н, м), 7,1-7,4 (7 Н, м). МС m/z: 447 (М+1).-Цис-N-[1-(4-метокси-3-трифторметилбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-метокси-3 трифторметилбензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,00-1,02 (7 Н, м), 2,02-2,04 (3 Н, м), 3,8 (3 Н, с), 4,7 (1 Н, м), 5,6 (1 Н, м), 6,5 (1 Н, д),6,7 (1 Н, д), 7,0 (2 Н, м), 7,2-7,4 (7 Н, м), 7,8 (1 Н, с). МС m/z: 497 (М+1).-Цис-N-[1-(2,3-дигидробензофуран-5-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 2,3 дигидробензофуран-5-карбонилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01-1,02 (7 Н, м), 2,01-2,03 (3 Н, м), 4,5 (2 Н, т), 4,8 (1 Н, м), 5,6 (1 Н, м), 6,5 (2 Н,м), 6,9 (2 Н, м), 7,1-7,4 (7 Н, м).-цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилацетамида. -Цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-нитробензоилхлорид и ацетилхлорид на пропионилхлорид. Образовавшийся нитроаналог восстанавливают под давлением водорода 35 psi (244 кПа), используя катализатор - Pd/C (10%) в этаноле и качалку Parr. -Цис-N-[1-(4 аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид (150 мг, 0,376 ммоль) растворяют в 10 мл толуола и добавляют 64 мг метилизоцианата (1,013 ммоль). Образовавшуюся реакционную смесь перемешивают при комнатной температуре в течение 2 ч, затем нагревают при 50 С в течение ночи. Смесь концентрируют в вакууме. Остаток очищают хроматографически на силикагеле, при элюировании системой метанол/дихлорметан (1:19), чтобы получить указанное в заголовке соединение (87 мг,51%). 1-цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамида. -Цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид растворяют в метиленхлориде и добавляют этилиодид (1,05 экв.) и после этого K2CO3. Реакционную смесь оставляют перемешиваться при комнатной температуре в течение 12 ч. Реакционную смесь отфильтровывают и концентрируют в вакууме. Остаток очищают хроматографически на силикагеле, при элюировании системой метанол/дихлорметан (1:19), чтобы получить указанное в заголовке соединение. 1 Н-ЯМР (CDCl3) : 1,00-1,02 (10 Н, м), 2,00 (3 Н, с), 2,04 (1 Н, м), 3,3 (4 Н, кв), 4,7 (1 Н, м), 5,6 (1 Н, м),6,4 (2H, д), 6,6 (1 Н, д), 6,9 (1 Н, т), 7,0-7,4 (9 Н, м). МС м/z: 456 (M+1).-Цис-4-[4-(ацетилфениламино)-2-метил-3,4-дигидро-2 Н-хинолин-1-карбонил]фениламиноуксусную кислоту получают из -цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилацетамид. -Цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид растворяют в диметилформамиде и добавляют этиловый эфир бромуксусной кислоты и после этого K2CO3. Реакционную смесь нагревают при 90 С в течение 12 ч. Реакционную смесь отфильтровывают и концентрируют в вакууме. Остаток очищают хроматографически на силикагеле, при элюировании системой метанол/дихлорметан (2:18), чтобы получить сложный эфир. Этот эфир гидролизуют с использованием раствора NaOH (водный) в метаноле и воде, чтобы получить указанное в заголовке соединение. 1 Н-ЯМР (CDCl3) : 1,01 (3 Н, д), 1,01 (1 Н, м), 2,00 (3 Н, с), 2,03 (1 Н, м), 3,6 (1 Н, с), 4,7 (3 Н, b), 5,6-цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид (50 мг, 0,12 ммоль) растворяют в 5 мл ДМФ и добавляют ангидрид метансульфоновой кислоты(21 мг, 0,12 ммоль). Образовавшуюся реакционную смесь нагревают при 45 С и перемешивают в течение 1 ч. Смесь концентрируют в вакууме. Остаток очищают хроматографически на силикагеле, при элюировании системой метанол/дихлорметан (1:9), чтобы получить указанное в заголовке соединение (15 мг,25%). 1 Н-ЯМР (CDCl3) : 1,01-1,02 (7 Н, м), 2,01-2,03 (3 Н, м), 3,0 (3 Н, с), 4,7 (1 Н, м), 5,6 (1 Н, м), 6,5 (1 Н,д), 6,7 (2 Н, д), 6,9 (1 Н, т), 7,1 (2 Н, м), 7,2-7,4 (7 Н, м). МС m/z: 491 (М).-Цис-N-[6-фтор-1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-(4-фторфенил)пропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4 фторбензоилхлорид, -цис-N-(6-фтор-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)фениламин на -цис- 26011385(2-метил-1,2,3,4-тетрагидрохинолин-4-ил)-(4-фторфенил)амин и ацетилхлорид на пропионилхлорид. Цис-N-(6-фтор-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)-(4-фторфенил)амин синтезируют, используя реакции, подробно приведенные на схеме 1, заменяя анилин на 4-фторанилин. 1 Н-ЯМР (CDCl3) : 1,01-1,02 (6 Н,м), 2,02-2,04 (4 Н, м), 4,8 (1 Н, дд), 5,4-5,6 (1 Н, шир. сигнал), 6,4-Цис-N-[6-бром-1-(4-фторбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-(4-бромфенил)пропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4 фторбензоилхлорид, -цис-(2-метил-1,2,3,4-тетрагидрохинолин-4-ил)фениламин на -цис-(6-бром-2 метил-1,2,3,4-тетрагидрохинолин-4-ил)-(4-бромфенил)амин и ацетилхлорид на пропионилхлорид. цис-(6-Бром-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)-(4-бромфенил)амин синтезируют, используя реакции, подробно приведенные на схеме 1, заменяя анилин на 4-броманилин. 1 Н-ЯМР (CDCl3) : 1,01-1,02 (6 Н,м), 1,06 (1 Н, м), 2,02-2,04 (3 Н, м), 4,8 (1H, м), 5,4-5,6 (1 Н, шир. сигнал), 6,4 (1 Н, д), 6,8 (2 Н, м), 7,0-7,4 (6 Н, М), 7,8-7,9 (2 Н, м).-Цис-N-[1-(3-этоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилацетамид получают, следуя общей методике А, заменяя 3-этоксибензоилхлорид на 2-фуроилхлорид. 1 Н-ЯМР (CDCl3) : 1,02 (3 Н, м), 1,04 (4 Н, м), 2,01 (3 Н, с), 2,04 (1 Н, м), 4,0 (2 Н, м), 4,9 (1 Н, м), 5,6-Цис-N-[1-(4-изопропоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-изопропоксибензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 0,9-1,02 (12 Н, м), 1,04 (1 Н, м), 2,00 (3 Н, м), 4,3 (1H, м), 4,5 (1H, м), 5,4 (1 Н, шир. сигнал), 6,3 (1 Н, д), 6,4 (2 Н, д), 6,7 (1 Н, м), 6,9-7,2 (9 Н, м). МС m/z: 457 (М+1).-Цис-N-[1-(1-изопропил-1-Н-бензотриазол-5-карбонил)-2-метил-1,2,3,4-тетрагидрохинолин-4 ил]-N-фенилпропионамид получают, следуя общей методике А, и заменяя 2-фуроилхлорид на 1 изопропил-1 Н-бензотриазол-5-карбонилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,03 (7 Н, м), 1,08 (6 Н, м), 2,04 (3 Н, м), 5,0 (1 Н, м), 5,1 (1H, м), 5,7 (1 Н, шир. сигнал), 6,6 (1 Н, д), 7,0 (1 Н, м), 7,2-7,5 (9 Н, м), 8,3 (1H, с). МС m/z: 482 (М+1).-Цис-N-[1-(3-этоксибензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 3-этоксибензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,02 (6 Н,м), 1,05 (4 Н, м), 2,04 (3 Н, м), 4,0 (2 Н, м), 4,9 (1 Н, м), 5,7 (1 Н, шир. сигнал), 6,6 (1H, д), 6,8 (1H, д), 6,9 (1H, м), 7,1 (2 Н, м), 7,2 (1 Н, м), 7,3-7,6 (7 Н, м). МС m/z: 443 (М+1). Этиловый эфир-цис-4-4-[2-метил-4-(фенилпропиониламино)-3,4-дигидро-2 Н-хинолин-1 карбонил]фенилпиперидин-1-карбоновой кислоты получают, следуя общей методике А и заменяя 2 фуроилхлорид на этиловый эфир 4-(4-хлоркарбонилфенил)пиперидин-1-карбоновой кислоты и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01-1,03 (10 Н, м), 1,05 (2 Н, м), 1,07 (2 Н, м), 2,03 (3 Н, м), 2,06 (1 Н, м), 2,08 (2 Н,т), 4,1 (2 Н, м), 4,2 (2 Н, м), 4,8 (1H, м), 5,6 (1 Н, шир. сигнал), 6,5 (1 Н, д), 6,9 (1 Н, м), 7,2 (2 Н, м), 7,3-7,4-Цис-N-[2-метил-1-(4-пиперидин-4-илбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропи- 27011385 онамид получают из этилового эфира -цис-4-4-[2-метил-4-(фенилпропиониламино)-3,4-дигидро-2 Нхинолин-1-карбонил]фенилпиперидин-1-карбоновой кислоты. Этиловый эфир -цис-4-4-[2-метил-4(фенилпропиониламино)-3,4-дигидро-2 Н-хинолин-1-карбонил]фенилпиперидин-1-карбоновой кислоты(96 мг, 0,17 ммоль) растворяют в ацетонитриле (2 мл). Добавляют триметилиодосилан (74 мкл, 0,51 ммоль) и реакционную смесь оставляют перемешиваться при комнатной температуре в течение ночи. Избыток реагента гасят путем добавления метанола (1 мл) и смесь концентрируют при пониженном давлении. Сырой остаток распределяют между этилацетатом и насыщенным водным раствором бикарбоната натрия. Экстракты промывают 1 М раствором гидроксида натрия, насыщенным водным раствором тиосульфата натрия и рассолом, сушат над сульфатом натрия, фильтруют, концентрируют и очищают путем хроматографии на силикагеле (3:1 метиленхлорид/метанол) (77 мг, 94%). 1 Н-ЯМР (CDCl3) : 1,01 (6 Н, м), 1,03 (1H, т), 1,06 (2 Н, м), 1,07 (2 Н, д), 2,03 (3 Н, м), 2,06 (1H, м), 2,07-Цис-N-[1-(4-бромбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-бромбензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,02 (6 Н, м), 1,025 (1 Н, м), 2,03 (3 Н, м), 4,8 (1 Н,м), 5,6 (1 Н, шир. сигнал), 6,4 (1 Н,д), 6,9 (1 Н, м), 7,1 (2 Н, д), 7,2 (1H, м), 7,3-7,4 (8 Н, м).-Цис-N-1-[4-(1-ацетилпиперидин-4-ил)бензоил]-2-метил-1,2,3,4-тетрагидрохинолин-4-ил-Nфенилпропионамид (А-100). К раствору -цис-(2-метил-1,2,3,4-тетрагидрохинолин-4-ил)фениламина (636 мг, 2,070 ммоль) в дихлорметане (10 мл) при комнатной температуре добавляют 1,004 г диизопропилэтиламина (1,044 мл,2,098 ммоль) и затем добавляют свежеприготовленный трет-бутиловый эфир 4-(4 хлоркарбонилфенил)пиперидин-1-карбоновой кислоты (2,098 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, выливают в воду и экстрагируют дихлорметаном. Экстракты промывают 1 М водным раствором NaOH и рассолом, сушат над сульфатом магния, фильтруют, сушат и концентрируют. Сырой остаток очищают хроматографически на силикагеле (градиент от 100% гексана до смеси 70/30 гексан/этилацетат), чтобы получить чистый амид (827 мг, 58%). Полученный таким образом трет-бутиловый эфир -цис-4-[4-(2-метил-4-фениламино-3,4-дигидро 2 Н-хинолин-1-карбонил)фенил]пиперидин-1-карбоновой кислоты (827 мг, 1,057 ммоль) растворяют в метиленхлориде (50 мл). Добавляют трифторуксусную кислоту (3 мл) и смесь перемешивают 70 мин при комнатной температуре. Растворитель и избыток кислоты удаляют при пониженном давлении. Сырой остаток растворяют в этилацетате и нейтрализуют 1 М раствором гидроксида натрия (до значения рН = 10,5). Водную фазу экстрагируют 2 раза дополнительным количеством этилацетата. Экстракты объединяют и промывают рассолом, сушат над сульфатом натрия, фильтруют и концентрируют, чтобы получить сырой диамин (676 мг, 100%) в виде масла. К полученному выше раствору пиперидинамина (676 мг, 1,059 ммоль) в метиленхлориде (25 мл) добавляют диизопропилэтиламин (616 мг, 849 мкл, 4,77 ммоль), и затем 162 мг ацетилхлорида (156 мкл,2,006 ммоль). Смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют дополнительным количеством метиленхлорида. Экстракты объединяют, промывают рассолом, сушат над сульфатом натрия,фильтруют, сушат и концентрируют, чтобы получить пиперидинацетамид (844 мг,100%). Сырой пиперидинацетамид, полученный выше, (844 мг) растворяют в метиленхлориде (25 мл) и в этот раствор затем добавляют 205 мг диизопропилэтиламина (283 мкл, 1,059 ммоль) и после этого 4,42 г пропионилхлорида (4,2 мл, 47,7 ммоль). Образовавшуюся реакционную смесь перемешивают при комнатной температуре в течение 96 ч и концентрируют. Образовавшийся остаток распределяют между этилацетатом и насыщенным водным раствором бикарбоната натрия. Экстракты промывают рассолом и сушат над сульфатом натрия, фильтруют, сушат и концентрируют. Сырой остаток очищают хроматографически на силикагеле (с градиентом от 50/50 этилацетат/гексан до 100% этилацетата), чтобы получить продукт (437 мг, 52%).-Цис-N-1-[4-(1-ацетилпиперидин-4-ил)бензоил]-2-метил-1,2,3,4-тетрагидрохинолин-4-ил-Nфенилпропионамид разделяют методом хиральной ЖХВД с использованием хиральной колонки cel OD при изократическом элюировании системой 90%гексана/10% этанола, чтобы получить (2R,4S)- и(18 мкл, 0,33 ммоль) добавляют одной порцией. Смесь перемешивают при комнатной температуре 30 мин, и затем медленно добавляют раствор триацетоксиборгидрида натрия (35 мг, 0,165 ммоль) в дихлорметане (1 мл) и после этого добавляют 1 каплю уксусной кислоты. Реакционную смесь оставляют перемешиваться при комнатной температуре в течение ночи и реакцию прерывают, добавляя водный раствор бикарбоната натрия. Двухфазную смесь экстрагируют три раза метиленхлоридом (20 мл); объединенные экстракты промывают рассолом, сушат над сульфатом магния, фильтруют, концентрируют и очищают методом ЖХВД, чтобы получить продукт (35 мг, 62%). 1 Н-ЯМР (CDCl3) : 1,00-1,02 (9 Н, м), 1,03 (1 Н, м), 1,08 (4 Н, шир. сигнал), 2,00 (2 Н, м), 2,03 (3 Н, м),2,05 (2 Н, м), 3,1 (3 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, шир. сигнал), 6,5 (1 Н, д), 6,9 (1 Н, м), 7,0 (2 Н, д), 7,1-7,4 (9 Н,м).-Цис-N-[2-метил-1-(4-нитробензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-нитробензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,02 (7 Н,м), 2,03 (3 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, шир. сигнал), 6,4 (1 Н, д), 6,9 (1 Н,м), 7,2-7,4(9 Н, м), 8,0 (2 Н, д).-Цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают из -цис-N-[2-метилметил-1-(4-нитробензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамида. -Цис-N-[2-метил-1-(4-нитробензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид (200 мг, 0,45 ммоль) растворяют в этаноле (20 мл). Осторожно добавляют катализатор - палладий на угле (10%), и образовавшуюся суспензию встряхивают под давлением водорода (40 psi, 280 кПа) в течение ночи. Суспензию отфильтровывают через слой Celite, чтобы удалить твердые вещества, и лепешку фильтра промывают три раза этанолом. При концентрировании раствора получают чистый продукт (160 мг, 86 %). 1 Н-ЯМР (CDCl3) : 1,02 (7 Н, м), 2,03 (3 Н, м), 3,9 (2 Н, шир. сигнал), 4,7 (1 Н, м), 5,6 (1 Н, шир. сигнал), 6,4 (2 Н, д), 6,6 (1 Н, д), 6,9 (1 Н, м), 7,0 (2 Н, д), 7,1 (1 Н, м), 7,2-7,4 (6 Н, м).-Цис-N-[2-метил-1-(4-пиррол-1-илбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-пиррол-1-илбензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,02 (6 Н, м), 1,03 (1 Н, м), 2,03 (3 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, шир. сигнал), 6,3 (2 Н,с), 6,6 (1 Н, д), 6,9 (1 Н, м), 7,1 (2 Н, с), 7,2-7,4 (11 Н, м). МС m/z: 464 (М+1).-цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилпропионамида. К раствору -цис-N-[1-(4-аминобензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4 ил]-N-фенилпропионамида (100 мг, 0,24 ммоль) в 2,05 мл тетрагидрофурана добавляют ацетилхлорид (44 мкл, 0,63 ммоль) и после этого триэтиламин (88 мкл, 0,63 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Эту смесь концентрируют при пониженном давлении. Остаток очищают хроматографически на силикагеле, при элюировании системой гексан/этилацетат (3:1),чтобы получить указанное в заголовке соединение (51 мг, 46%). 1 Н-ЯМР (CDCl3) :1,01 (7 Н, м), 2,02 (3 Н, с), 2,03 (3 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, шир. сигнал), 6,5 (1 Н,д), 6,9 (1 Н, м), 7,1 (2 Н, д), 7,2 (1 Н, д), 7,3-7,4 (8 Н, м), 8,4 (1 Н, шир. сигнал).-цис-4-[2-метил-4-(фенилпропиониламино)-3,4-дигидро-2 Н-хинолин-1 карбонил]фенилкарбаминовой кислоты получают из -цис-N-[1-(4-аминоаминобензоил)-2-метил 1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамида, следуя способу, описанному выше для синтеза-Цис-N-[1-(4-бромбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилпропионамид (100 мг, 0,22 ммоль) объединяют с карбонатом цезия (355 мг, 1,009 ммоль), рацемическим реагентом BINAP (25 мг, 0,04 ммоль), Pd2(dba)3 (dba означает дибензилиденацетон) (36 ммоль,0,04 ммоль) и 1-метилпиперазином и растворяют в толуоле (10 мл). Реакционную смесь нагревают при 100 С в атмосфере аргона в течение ночи. Реакционную смесь охлаждают до комнатной температуры,фильтруют и твердое вещество промывают эфиром. Фильтрат промывают водой и рассолом, сушат над сульфатом магния, фильтруют и концентрируют. Сырой продукт очищают методом ЖХВД. 1-Цис-N-[2-метил-1-(4-пиримидин-2-илбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-пиримидин-2 илбензоилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,02 (7 Н, м), 2,03 (3 Н, м), 4,8 (1 Н, м), 5,6 (1 Н, шир. сигнал), 6,5 (1 Н, д), 6,9 (1 Н,м), 7,2-7,4 (10 Н, м), 8,3 (2 Н, д), 8,8 (2 Н, д). МС m/z: 478 (М+2).-Цис-N-[2-метил-1-(4-метил-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-карбонил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид получают, следуя общей методике А и заменяя 2-фуроилхлорид на 4-метил-3,4-дигидро-2 Н-бензо[1,4]оксазин-7-карбонилхлорид и ацетилхлорид на пропионилхлорид. 1 Н-ЯМР (CDCl3) : 1,01 (6 Н, м), 1,03 (1H, т), 2,03 (3 Н, м), 2,08 (3 Н, с), 3,3 (2 Н, т), 4,2 (2 Н, т), 4,7 (1 Н,м), 5,6 (1 Н, шир. сигнал), 6,3 (1 Н, д), 6,5 (1 Н, д), 6,6 (1 Н, д), 6,9 (1H, с), 7,0 (1 Н, м), 7,1 (1 Н, м), 7,3-7,4-Цис-N-[2-метил-1-(4-морфолин-4-илбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-Nфенилпропионамид получают из -цис-N-[1-(4-бромбензоил)-2-метил-1,2,3,4-тетрагидрохинолин-4-ил]N-фенилпропионамида, следуя методике, применяемой для получения -цис-N-2-метил-1-[4-(4 метилпиперазин-1-ил)-бензоил]-1,2,3,4-тетрагидрохинолин-4-ил-N-фенилпропионамида, заменяя 1 метилпиперазин на морфолин.-Цис-N-[2-метил-1-(4-морфолин-4-илбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид разделяют методом хиральной ЖХВД с использованием хиральной колонки cel OD при изократическом элюировании системой 90% гексана/10% этанола, чтобы получить (2R,4S)- и (2S,4R)-цис-N-[2 метил-1-(4-морфолин-4-илбензоил)-1,2,3,4-тетрагидрохинолин-4-ил]-N-фенилпропионамид (А-120 и А 119, соответственно). 1 Н-ЯМР (CDCl3) : 1,01 (7 Н, м), 2,03 (3 Н, м), 3,1 (4 Н, т), 3,8 (4 Н, т), 4,7 (1 Н, м), 5,6 (1 Н, шир. сигнал), 6,6 (1 Н, д), 6,7 (2 Н, д), 6,9 (1 Н, м), 7,2-7,4 (9 Н, м). МС m/z: 485 (М+2).
МПК / Метки
МПК: A61K 31/47
Метки: лечения, воспалительных, рецептора, антагонисты, заболеваний
Код ссылки
<a href="https://eas.patents.su/30-11385-antagonisty-receptora-pgd2-dlya-lecheniya-vospalitelnyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты рецептора pgd2 для лечения воспалительных заболеваний</a>
Предыдущий патент: Способ лечения воспалительного заболевания
Следующий патент: Биологически активная пищевая добавка для людей и животных
Случайный патент: Антагонисты активина-actriia и применение для стимуляции роста кости у больных раком


































