Тканевые протективные цитокины для защиты, восстановления и стимуляции реактивных клеток, тканей и органов
Формула / Реферат
1. Фармацевтическая композиция, содержащая:
(i) терапевтически эффективное количество тканевого протективного цитокина; и
(ii) терапевтически эффективное количество по меньшей мере одного противовоспалительного средства и/или по меньшей мере одного иммуномодуляторного компонента и
(iii) фармацевтически приемлемый носитель,
где терапевтически эффективное количество достаточно для профилактики, лечения или снижения воспаления и/или иммунного ответа.
2. Фармацевтическая композиция по п.1, где у указанного тканевого протективного цитокина отсутствует по меньшей мере один из эффектов, которые природный эритропоэтин оказывает на костный мозг.
3. Фармацевтическая композиция, состоящая из:
(i) терапевтически эффективного количества тканевого протективного цитокина; и
(ii) терапевтически эффективного количества по меньшей мере одного противовоспалительного средства и/или по меньшей мере одного иммуномодуляторного компонента; и
(iii) фармацевтически приемлемого носителя,
где терапевтически эффективное количество достаточно для профилактики, лечения или снижения воспаления и/или иммунного ответа.
4. Фармацевтическая композиция по любому из пп.1, 2 или 3, где противовоспалительное средство выбрано из группы, состоящей из кортикостероидов, глюкокортикоидов, стероидов, нестероидных противовоспалительных средств, бета-агонистов, антихолинергических средств, метилксантинов, инъекционных препаратов на основе золота, сульфасалазина, пеницилламина, противоангиогенных средств, дапсона, псораленов, антималярийных средств, противовирусных средств и антибиотиков.
5. Фармацевтическая композиция по любому из пп.1, 2 или 3, где противовоспалительное средство выбрано из группы, состоящей из метотрексата, лефлуномида, циклофосфамида, цитоксана, иммурана, циклоспорина А, миноциклина, азатиоприна, антибиотиков, метилпреднизолона, кортикостероидов, стероидов, микофенолата мофетила, рапамицина, мизорибина, дезоксиспергуалина, бреквинара, малононитриламидов, модуляторов рецепторов Т-клеток и модуляторов рецепторов цитокинов.
6. Фармацевтическая композиция по любому из пп.1, 2 или 3, где указанный тканевой протективный цитокин обладает по меньшей мере одной из следующих модификаций по сравнению с природным эритропоэтином:
i) имеет 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 групп сиаловой кислоты;
ii) имеет пониженное количество или не имеет N-связанных углеводов;
iii) обладает пониженным содержанием углеводов;
iv) имеет один или несколько окисленных углеводов;
v) имеет один или несколько окисленных углеводов, и где тканевой протективный цитокин химически восстановлен;
vi) имеет один или несколько модифицированных остатков аргинина;
vii) имеет один или несколько модифицированных остатков лизина или имеет модификацию N-концевой аминогруппы;
viii) имеет один или несколько модифицированных остатков тирозина;
ix) имеет один или несколько модифицированных остатков аспарагиновой кислоты или глутаминовой кислоты;
х) имеет один или несколько модифицированных остатков триптофана;
xi) удалена одна или несколько аминогрупп;
xii) имеет разрыв по меньшей мере одной цистиновой связи;
xiii) является укороченным и
xiv) имеет пониженное количество или не имеет O-связанных углеводов.
7. Фармацевтическая композиция по любому из пп.1, 2 или 3, где указанный тканевой протективный цитокин является эритропоэтином по меньшей мере с одним карбамилированным остатком лизина.
8. Фармацевтическая композиция по п.7, где все остатки лизина указанного эритропоэтина карбамилированы.
9. Фармацевтическая композиция по любому из пп.1, 2 или 3, где указанный тканевой протективный цитокин является алкилированным эритропоэтином.
10. Фармацевтическая композиция по любому из пп.1, 2 или 3, где указанный тканевой протективный цитокин представляет собой альфа-N-карбамоил, N-эпсилон-карбамоилэритропоэтин.
11. Фармацевтическая композиция по любому из пп.1, 2 или 3, где указанный тканевой протективный цитокин является асиалоэритропоэтином.
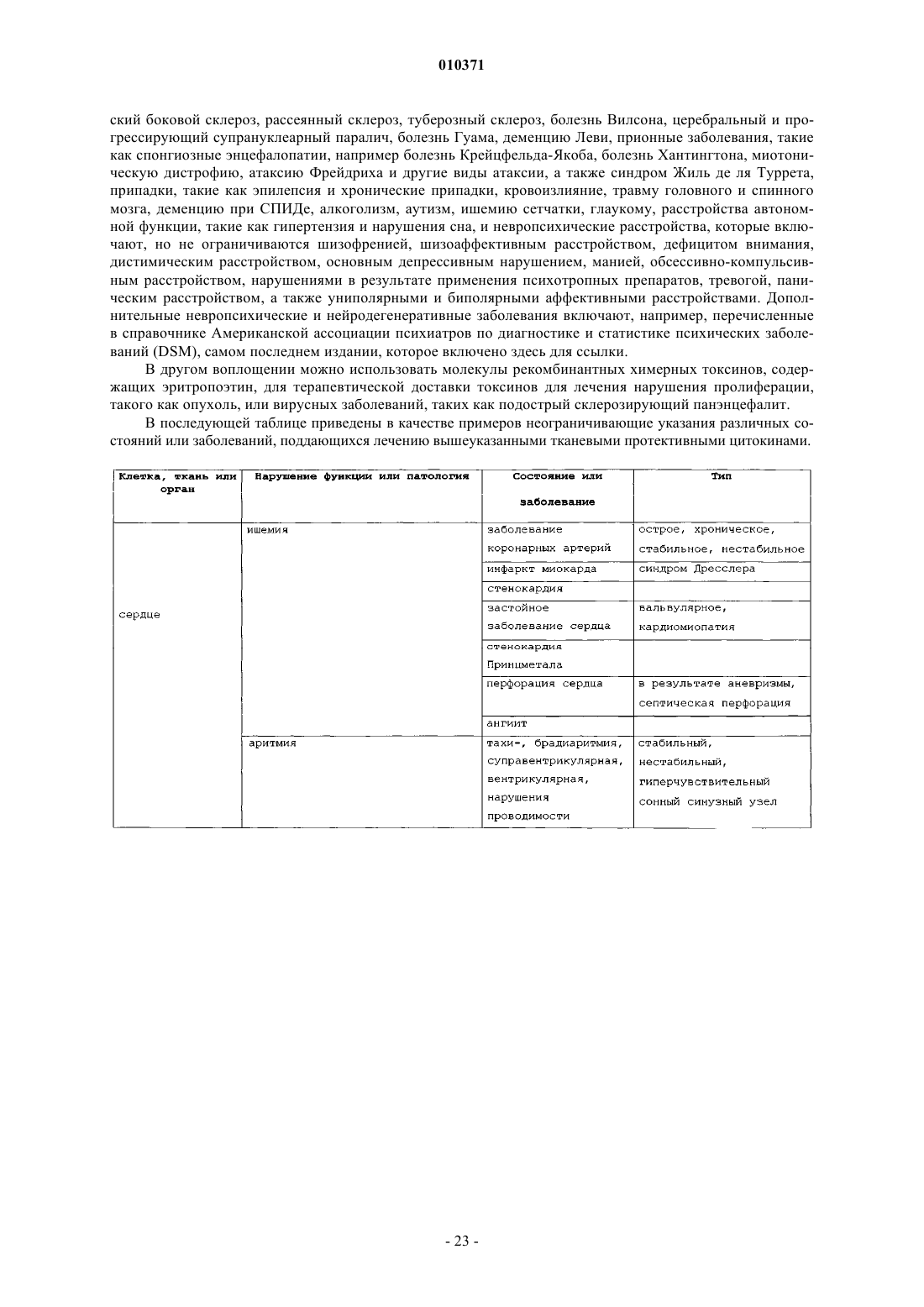
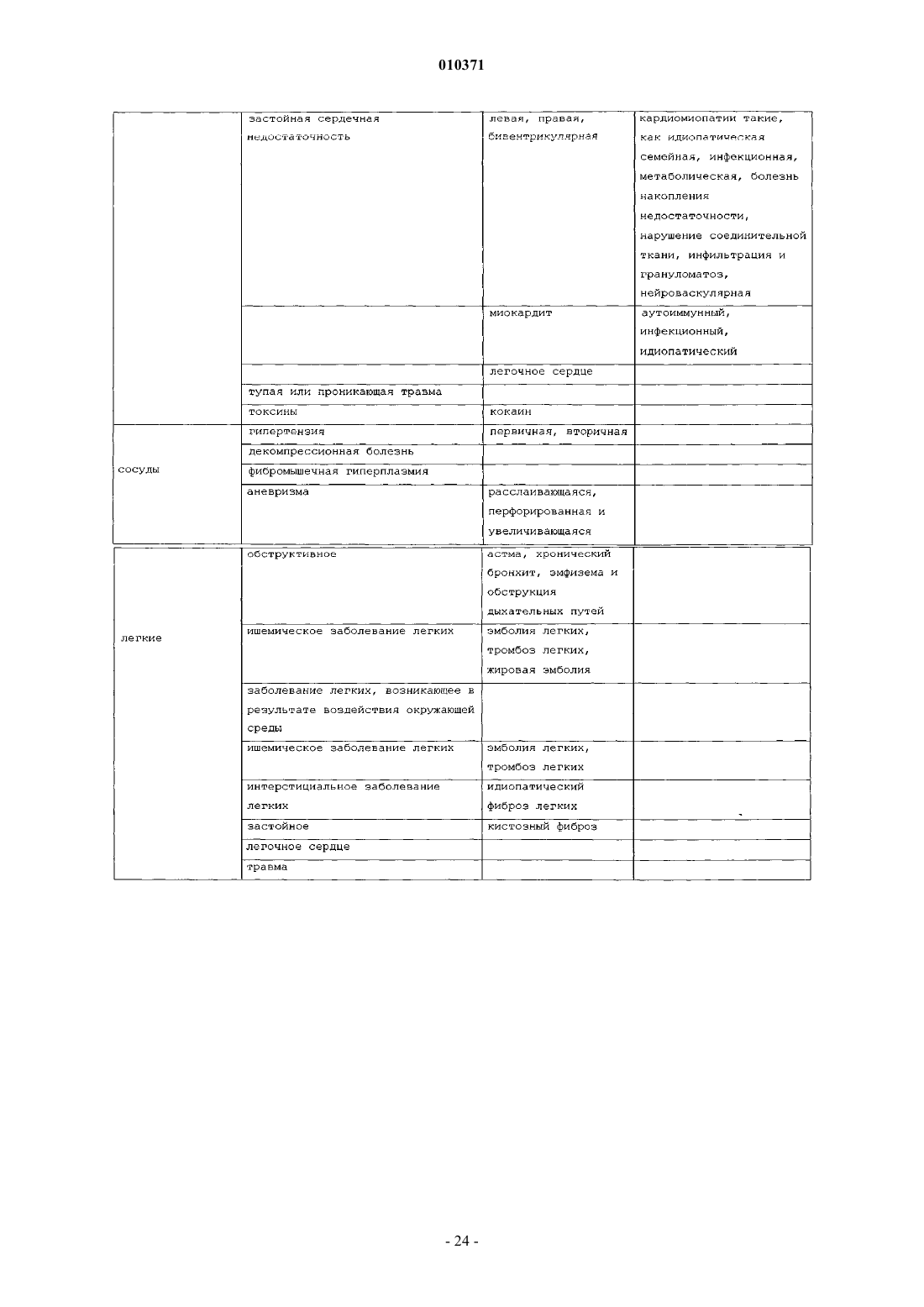
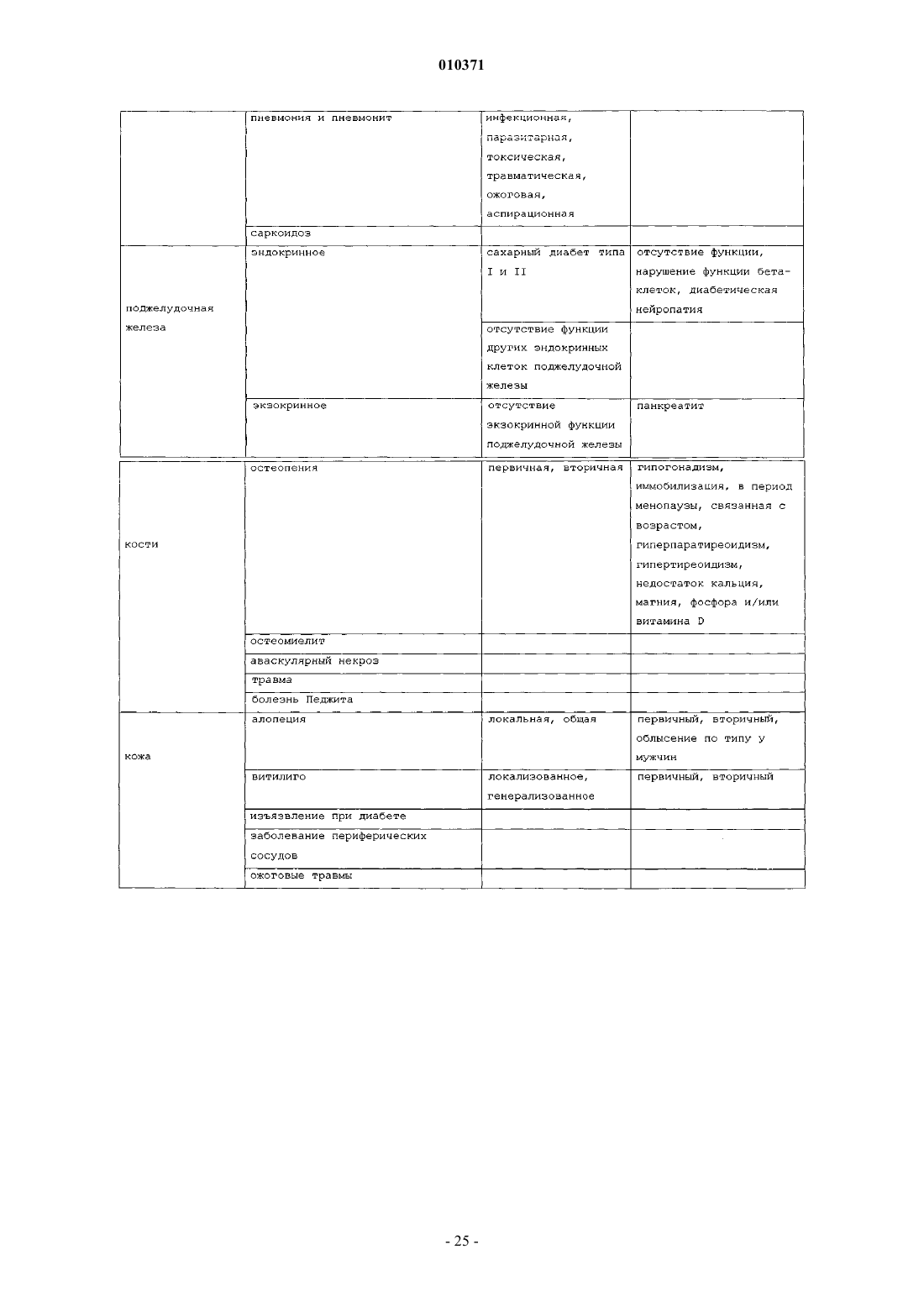
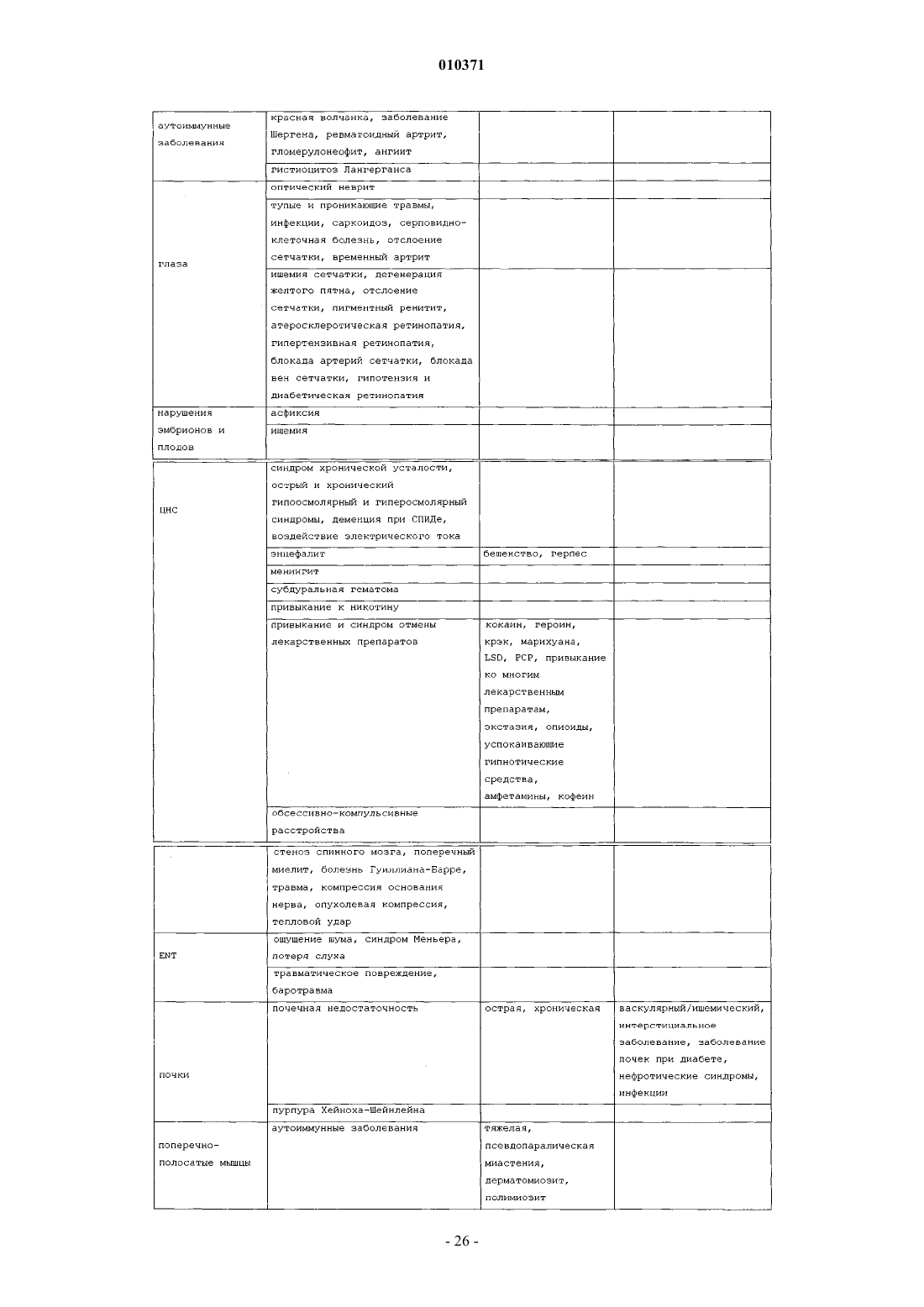
12. Способ лечения воспаления легких, печени, почек, тонкого кишечника, коры надпочечников, мозгового вещества надпочечников, клеток капилляров, эндотелиальных клеток, яичек, яичников, клеток эндометрия или стволовых клеток у млекопитающего, где указанный способ включает введение терапевтически эффективного количества тканевого протективного цитокина и фармацевтически приемлемого носителя млекопитающему при необходимости лечения воспаления легких, печени, почек, тонкого кишечника, коры надпочечников, мозгового вещества надпочечников, клеток капилляров, эндотелиальных клеток, яичек, яичников, клеток эндометрия или стволовых клеток.
13. Способ лечения ангиита, хронического бронхита, панкреатита, остеомиелита, гломерулонефрита, неврита зрительного нерва, височного артериита, поперечного миелита, дерматомиозита, полимиозита, некротизирующего фасцита, гепатита и некротизирующего энтероколита у млекопитающего или воспаления в результате судорожных нарушений, инсульта, гипотензии, остановки сердца, ишемии, инфаркта миокарда, возрастного снижения когнитивных функций, повреждения при облучении, церебрального паралича, нейродегенеративного заболевания, болезни Альцгеймера, болезни Паркинсона, болезни Лейга, деменции при СПИДе, потери памяти, амиотрофического бокового склероза, алкоголизма, расстройства настроения, тревожного расстройства, дефицита внимания, аутизма, болезни Крейтцфельда-Якоба, травмы головного мозга, травмы спинного мозга, ишемии мозга, ишемии спинного мозга, сердечно-легочного анастомоза, хронической сердечной недостаточности, дегенерации желтого пятна, диабетической невропатии, диабетической ретинопатии, глаукомы, ишемии сетчатки или травмы сетчатки у млекопитающего, где указанный способ включает введение фармацевтической композиции, содержащей терапевтически эффективное количество тканевого протективного цитокина и фармацевтически приемлемый носитель, млекопитающему при необходимости лечения.
14. Способ лечения атаксии Фрейдриха, рассеянного склероза или синдрома Жиль де ля Туррета у млекопитающего, где указанный способ включает введение фармацевтической композиции, содержащей терапевтически эффективное количество тканевого протективного цитокина и фармацевтически приемлемый носитель, млекопитающему при необходимости лечения.
15. Способ по пп.12, 13 или 14, где у тканевого протективного цитокина отсутствует по меньшей мере одна активность, выбранная из группы, состоящей из повышенного гематокрита, сужения сосудов, гиперактивации тромбоцитов, прокоагулянтной активности и повышенной продукции тромбоцитов.
16. Способ лечения ревматоидного артрита у млекопитающего, где указанный способ включает введение фармацевтической композиции, содержащей: (i) терапевтически эффективное количество тканевого протективного цитокина, у которого отсутствует по меньшей мере одна активность, выбранная из группы, состоящей из повышенного гематокрита, сужения сосудов, гиперактивации тромбоцитов, прокоагулянтной активности и повышенной продукции тромбоцитов, и (ii) фармацевтически приемлемый носитель, млекопитающему для лечения ревматоидного артрита.
17. Способ лечения воспаления реактивных клеток или связанных клеток, тканей или органов у млекопитающего, где указанный способ включает введение указанному млекопитающему при необходимости такого лечения:
(i) фармацевтической композиции, содержащей профилактически или терапевтически эффективное количество тканевого протективного цитокина и фармацевтически приемлемый носитель,
(ii) введение млекопитающему профилактически или терапевтически эффективного количества одного или нескольких противовоспалительных или иммуномодулирующих средств.
18. Способ по п.17, где у указанного тканевого протективного цитокина отсутствует по меньшей мере одна активность, выбранная из группы, состоящей из повышенного гематокрита, сужения сосудов, гиперактивации тромбоцитов, прокоагулянтной активности и повышенной продукции тромбоцитов.
19. Способ по п.17 или 18, уфх противовоспалительное средство выбрано из группы, состоящей из кортикостероида, глюкокортикоида, стероида, нестероидного противовоспалительного препарата, бета-агониста, антихолинергического препарата, метилксантина, инъекционного препарата на основе золота, сульфасалазина, пеницилламина, противоангиогенного средства, дапсона, псоралена, антималярийного средства, противовирусного средства и антибиотика.
20. Способ по п.17 или 18, где иммуномодулирующее средство выбрано из группы, состоящей из белкового средства, пептидного миметика, антитела, молекулы нуклеиновой кислоты, малой молекулы, органического соединения, неорганического соединения, метотрексата, лефлуномида, циклофосфамида, цитоксана, иммурана, циклоспорина А, миноциклина, азатиоприна, антибиотика, метилпреднизолона (МР), кортикостероида, стероида, микофенолата мофетила, рапамицина, мизорибина, дезоксиспергуалина, бреквинара, малононитрилоамида, модулятора рецепторов Т-клеток и модулятора рецепторов цитокинов.
21. Способ по п.17 или 18, где реактивные клетки выбраны из группы, состоящей из нейронов, мышечных клеток, клеток сердца, миокардиальных клеток, легких, печени, почек, тонкого кишечника, коры надпочечников, мозгового вещества надпочечников, капиллярных клеток, эндотелиальных клеток, клеток семенников, яичников, эндометриальных и стволовых клеток.
22. Способ по п.17 или 18, где воспаление выбрано из группы, состоящей из ангиита, хронического бронхита, панкреатита, остеомиелита, ревматоидного артрита, гломерулонефрита, неврита зрительного нерва, височного артериита, энцефалита, менингита, поперечного миелита, дерматомиозита, полимиозита, некротизирующего фасцита и некротизирующего энтероколита.
23. Способ по п.18, где воспалением, при котором эффективно применение указанного тканевого протективного цитокина, является гепатит.
24. Способ лечения воспаления реактивных клеток или связанных клеток, тканей или органов у млекопитающих, где указанный способ включает введение терапевтически эффективного количества тканевого протективного цитокина и фармацевтически приемлемого носителя, где указанный тканевой протективный цитокин имеет по меньшей мере одну из следующих модификаций по сравнению с природной молекулой эритропоэтина:
i) имеет 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 групп сиаловой кислоты;
ii) имеет пониженное количество или не имеет N-связанных углеводов;
iii) обладает пониженным содержанием углеводов;
iv) имеет один или несколько окисленных углеводов;
v) имеет один или несколько окисленных углеводов, и где тканевой протективный цитокин химически восстановлен;
vi) имеет один или несколько модифицированных остатков аргинина;
vii) имеет один или несколько модифицированных остатков лизина или имеет модификацию N-концевой аминогруппы;
viii) имеет один или несколько модифицированных остатков тирозина;
ix) имеет один или несколько модифицированных остатков аспарагиновой кислоты или глутаминовой кислоты;
х) имеет один или несколько модифицированных остатков триптофана;
xi) удалена одна или несколько аминогрупп;
xii) имеет разрыв по меньшей мере одной цистиновой связи;
xiii) является укороченным и
xiv) имеет пониженное количество или не имеет О-связанных углеводов.
25. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где реактивные клетки включают клетки, выбранные из группы, состоящей из клеток фоторецептора, ганглиональных клеток, биполярных клеток, горизонтальных клеток, амакриновых клеток, клеток Мюллера, клеток водителя ритма, клеток синоатриального узла, клеток синусного узла, клеток атриовентрикулярного узла, клеток пучка Гиса, гепатоцитов, звездчатых клеток, купферовых клеток, мезангиальных клеток, бокаловидных клеток, железистных клеток кишечника, энтеральных эндокринных клеток, клеток клубочковой зоны, клеток пучков, ретикулярных клеток, хромаффинных клеток, перицитов, клеток Лейдига, клеток Сертоли, сперматозоидов, фолликулярных клеток Граффиана, клеток примордиальных фолликулов, стромальных клеток эндометрия и эндометриальных клеток.
26. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин имеет по меньшей мере один остаток карбамилированного лизина.
27. Способ по п.26, где все остатки лизина указанного тканевого протективного цитокина являются карбамилированными.
28. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин является эритропоэтином, выбранным из группы, состоящей из альфа-N-карбамоилэритропоэтина; N-эпсилон-карбамоилэритропоэтина; альфа-N-карбамоил, N-эпсилон-карбамоилэритропоэтина; альфа-N-карбамоиласиалоэритропоэтина; N-эпсилон-карбамоиласиалоэритропоэтина; альфа-N-карбамоил, N-эпсилон-карбамоиласиалоэритропоэтина; альфа-N-карбамоилгипосиалоэритропоэтина; N-эпсилон-карбамоилгипосиалоэритропоэтина и альфа-N-карбамоил, N-эпсилон-карбамоилгипосиалоэритропоэтина.
29. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин представляет собой альфа-N-карбамоил, N-эпсилон-карбамоилэритропоэтин.
30. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин является асиалоэритропоэтином.
31. Способ по п.30, где указанный асиалоэритропоэтин является асиалоэритропоэтином человека.
32. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин представляет собой алкилированный эритропоэтин.
33. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин является эритропоэтином с уменьшенным числом или без N-связанных углеводов.
34. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин является эритропоэтином с уменьшенным числом или без О-связанных углеводов.
35. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин является эритропоэтином, обработанным по меньшей мере одной гликозидазой.
36. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин биотинилирован.
37. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где указанный тканевой протективный цитокин ингибирует воспаление, возникшее в результате продукции цитокинов глиальными клетками.
38. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где воспаление запускается апоптозом.
39. Способ по любому из пп.12, 13, 14, 16, 17 или 24, где тканевой протективный цитокин способен проходить через эндотелиальный клеточный барьер.
40. Способ по п.39, где эндотелиальный клеточный барьер выбран из группы, состоящей из гематоэнцефалического барьера, гематоглазного барьера, гематосеменникового барьера, гематояичникового барьера и гематоматочного барьера.
41. Способ по п.24, где указанный тканевой протективный цитокин имеет дополнительную модификацию, выбранную из группы, состоящей из:
i) периодатного окисления;
ii) R-глиоксальной молекулы на одном или нескольких остатках аргинина, где R представляет собой арильную или алкильную молекулу;
iii) по меньшей мере одного остатка аргинина, модифицированного реакцией с вицинальным дикетоном, выбранным из группы, состоящей из 2,3-бутандиона и циклогександиона;
iv) по меньшей мере одного остатка аргинина, провзаимодействовавшего с 3-деоксигликозоном;
v) по меньшей мере одного биотинилированного лизина или биотинилированной N-концевой аминогруппы;
vi) по меньшей мере одного глюцитолиллизина или фруктозиллизина;
vii) по меньшей мере одного ацилированного остатка лизина;
viii) по меньшей мере одного сукцинилированного остатка лизина;
ix) по меньшей мере одного остатка лизина, модифицированного солью 2,4,6-тринитробензолсульфоновой кислоты;
х) по меньшей мере одного нитрированного и/или йодинированного остатка тирозина и
xi) по меньшей мере одного остатка аспарагиновой кислоты и/или глутаминовой кислоты, провзаимодействовавшего с карбодиимидом с последующей реакций с амином.
42. Способ по п.41, где указанэыщ окисленный периодатом эритропоэтин химически восстановлен цианоборгидридом натрия.
43. Способ по п.41, где указанный тканевой протективный цитокин является фенилглиоксальэритропоэтином.
44. Способ по п.41, где по меньшей мере один ацилированный остаток лизина ацетилирован.
45. Способ по п.44, где указанный ацетилированный эритропоэтин выбран из группы, состоящей из альфа-N-ацетилэритропоэтина; N-эпсилон-ацетилэритропоэтина; альфа-N-ацетил, N-эпсилон-ацетилэритропоэтина; альфа-N-ацетиласиалоэритропоэтина; N-эпсилон-ацетиласиалоэритропоэтина; альфа-N-ацетил, N-эпсилон-ацетиласиалоэритропоэтина; альфа-N-ацетилгипосиалоэритропоэтина; N-эпсилон-ацетилгипосиалоэритропоэтина и альфа-N-ацетил, N-эпсилон-ацетилгипосиалоэритропоэтина.
46. Способ по п.41, где указанный суцинилированный эритропоэтин выбран из группы, состоящей из альфа-N-сукцинилэритропоэтина; N-эпсилон-сукцинилэритропоэтина; альфа-N-сукцинил, N-эпсилон-сукцинилэритропоэтина; альфа-N-сукциниласиалоэритропоэтина; N-эпсилон-сукциниласиалоэритропоэтина; альфа-N-сукцинил, N-эпсилон-сукциниласиалоэритропоэтина; альфа-N-сукцинилгипосиалоэритропоэтина; N-эпсилон-сукцинилгипосиалоэритропоэтина и альфа-N-сукцинил, N-эпсилон-сукцинилгипосиалоэритропоэтина.
47. Способ по п.41, где соль 2,4,6-тринитробензолсульфоновой кислоты представляет собой 2,4,6-тринитробензолсульфонат натрия.
48. Способ по п.41, где указанный амин является глицинамидом.
49. Способ по любому из пп.15, 16 или 18, где указанный тканевой протективный цитокин не является эритропоэтическим.
Текст
010371 Перекрестная ссылка на родственные заявки Заявка на данное изобретение заявляет преимущество над заявкой на выдачу патента США 10/188905, поданной 3 июля 2002 г., которая полностью включена здесь для ссылки. Уровень техники В течение многих лет единственной очевидной физиологической ролью эритропоэтина была его регуляция продукции эритроцитов. Недавно были получены доказательства того, что эритропоэтин, как член суперсемейства цитокинов, осуществляет другие важные физиологические функции, которые опосредуются через взаимодействие с рецепторами эритропоэтина (эритропоэтин-R). Данные функции включают митогенез, модуляцию притока ионов кальция в клетки гладкой мускулатуры и нейроны, продукцию эритроцитов, гиперактивацию тромбоцитов, продукцию тромбоцитов и влияние на промежуточный обмен. Полагается, что эритропоэтин обеспечивает компенсаторные ответные реакции, которые служат для улучшения микросреды клеток с гипоксией, а также модулируют запрограммированную смерть, вызванную метаболическим стрессом. Несмотря на установление того факта, что эритропоэтин,введенный интракраниально, защищает нейроны от повреждения в результате гипоксии, интракраниальное введение является непригодным для практики и неприемлемым путем для терапевтического использования, в частности, для нормальных индивидуумов. Кроме того, в ранее проведенных исследованиях на пациентах с анемией, которым вводили эритропоэтин, было установлено, что введенный периферически эритропоэтин не проникает в мозг (Marti et al., 1997, Kidney Int. 51: 416-8; Juul et al., 1999, Pediatr.Res. 46: 543-547; Buemi et al., 2000, Nephrol. Dial. Transplant. 15: 422-433). Описаны различные модифицированные формы эритропоэтина с улучшенной эритропоэтической активностью молекулы, например с измененными аминокислотами по концевой карбоксильной группе,описанные в патенте США 5457089 и в патенте США 4835260; изоформы эритропоэтина с различным числом остатков сиаловых кислот на молекулу, например, описанные в патенте США 5856298; полипептиды, описанные в патенте США 4703008; агонисты, описанные в патенте США 5767078; пептиды, которые связываются с рецептором эритропоэтина, описанные в патентах США 5773569 и 5830851, и небольшие молекулы миметиков, описанные в патенте США 5835382. Настоящее изобретение относится к тканевым протективным цитокинам, полученным химической модификацией эритропоэтина, и их применениям для защиты, поддержания, стимуляции или восстановления реактивных на эритропоэтин клеток и связанных клеток, тканей и органов in situ, а также в условияхex vivo и для доставки тканевого протективного цитокина через эндотелиальный клеточный барьер в целях защиты и стимуляции реактивных на эритропоэтин клеток и связанных клеток, тканей и органов, отделенных от сосудистой сети, или для переноса связанных молекул через эндотелиальный клеточный барьер. Сущность изобретения В одном аспекте настоящее изобретение относится к применению тканевых протективных цитокинов,химически модифицированных эритропоэтинов, у которых отсутствует один или более аспектов воздействия эритропоэтинов на костный мозг, для получения фармацевтических композиций для защиты, поддержания, стимуляции или восстановления функции или жизнеспособности реактивных клеток млекопитающих и связанных с ними клеток, тканей или органов. В одном конкретном аспекте реактивные клетки млекопитающих и связанные с ними клетки, ткани или органы отделены от сосудистой сети посредством плотного эндотелиального клеточного барьера. В другом конкретном аспекте клетки, ткани или органы или другие части организма выделены из организма млекопитающего, такие, как предназначенные для трансплантации или реплантации. В качестве неограничивающих примеров реактивной клеткой или тканью могут быть клетки или ткань органов нервной системы, сетчатки, мышц, сердца, легких, почек, тонкого кишечника, коры надпочечников, мозгового вещества надпочечников, эндотелия капилляров, семенников, яичников, поджелудочной железы, кости, кожи или эндометрия. Кроме того, неограничивающие примеры реактивных клеток включают клетки фоторецепторов (палочек и конусов), клетки ганглия,биполярные, горизонтальные, амакриновые клетки, клетки Мюллера, миокарда, водителя ритма, синусно-предсердного узла, синусного узла, соединительной ткани, атриовентрикулярного узла, пучка Гиса,гепатоциты, звездчатые клетки, купферовы клетки, мезангиальные клетки, клетки почечного эпителия,интерстициальные клетки почечных канальцев, бокаловидные клетки, клетки кишечных желез (крипт),энтеральные, эндокринные, клетки клубочковой зоны, пучков, ретикулярные клетки, хромаффинные клетки, перициты, клетки Лейдига, Сертоли, сперматозоиды, фолликулярные клетки Граффиана, клетки примордиальных фолликулов, клетки островков Лангерганса, -клетки, -клетки, -клетки, F-клетки,преостесбласты, остеокласты, остеобласты, клетки стромы эндометрия, эндометриальные клетки, стволовые и эндотелиальные клетки. Данные примеры реактивных клеток являются только иллюстративными. В одном аспекте реактивные клетки или связанные с ними клетки, ткани или органы не являются возбудимыми клетками, тканями или органами или, в основном, не включают возбудимые клетки или ткани. В конкретном воплощении клеткой, тканью или органом, для которых применяются вышеуказанные тканевые протективные цитокины, являются таковые, которые размножаются или будут размножаться по меньшей мере при одном условии, неблагоприятно влияющем на жизнеспособность клетки,ткани или органа. Подобные условия включают гипоксию или метаболическое нарушение функций insitu в результате травмы, индуцированную хирургической операцией гипоксию или метаболическое на-1 010371 рушение функции in situ или воздействие in situ токсина; последнее может быть связано с химиотерапией или лучевой терапией. В одном воплощении неблагоприятные условия являются результатом проведения экстракорпорального кровообращения (сердечно-легочный аппарат), которое применяется при некоторых хирургических вмешательствах. Тканевые протективные цитокины пригодны для терапевтического или профилактического лечения заболеваний центральной или периферической нервной системы у человека, которые, в основном, проявляются в виде неврологических или психических симптомов, а также заболеваний глаз, сердечно-сосудистых заболеваний, кардиопульмональных заболеваний, респираторных заболеваний, заболеваний почек, органов мочеполовой системы, желудочно-кишечных заболеваний, эндокринных метаболических нарушений и воспаления. Изобретение также относится к фармацевтическим композициям, содержащим конкретные тканевые протективные цитокины для введения млекопитающему, предпочтительно человеку. Подобные фармацевтические композиции можно получить для перорального, интраназального или парентерального введения или в виде перфузионного раствора для поддержания жизнеспособности клеток, тканей или органов в условиях ex vivo. Тканевые протективные цитокины, пригодные для вышеуказанных целей, и фармацевтические композиции включают эритропоэтины, измененные по меньшей мере одной модификацией по сравнению с природным эритропоэтином и предпочтительно по сравнению с природным человеческим эритропоэтином. По меньшей мере одна модификация может представлять собой модификацию по меньшей мере одной аминокислоты в молекуле эритропоэтина или модификацию по меньшей мере одного углевода в молекуле эритропоэтина. Конечно, молекулы тканевых протективных цитокинов могут включать множество модификаций по сравнению с природной молекулой, например множественные модификации аминокислотной части молекулы, множественные модификации углеводной части молекулы или по меньшей мере одну модификацию аминокислотной части молекулы и по меньшей мере одну модификацию углеводной части молекулы. Молекула тканевого протективного цитокина сохраняет ее способность к защите, поддержанию, стимуляции или восстановлению функции или жизнеспособности реактивных клеток млекопитающих, хотя бы одно или более свойств молекулы эритропоэтина, не относящихся к вышеуказанному, желаемое свойство может отсутствовать по сравнению с природной молекулой. В предпочтительном воплощении тканевой протективный цитокин не обладает способностью оказывать влияние на костный мозг, т.е. повышать гематокрит (эритропоэз), сужать сосуды (высокое кровяное давление), повышать кровяное давление, гиперактивировать тромбоциты, способствовать свертываемости крови и повышать продукцию тромбоцитов. Более предпочтительно, когда у тканевого протективного цитокина отсутствует способность оказывать влияние на эритропоэз; наиболее предпочтительно, когда у тканевых протективных цитокинов отсутствует способность ко всем эффектам эритропоэтинов на костный мозг. В качестве примера тканевой протективный цитокин по изобретению может представлять собой асиалоэритропоэтин. В другом примере тканевой протективный цитокин по изобретению может представлять эритропоэтин или асиалоэритропоэтин после взаимодействия с одним или более реагентом, который модифицирует одну или более аминогруппу аминокислотных остатков природного эритропоэтина или асиалоэритропоэтина. В предпочтительном воплощении тканевой протективный цитокин по изобретению не оказывает влияния на эритропоэз. В одном воплощении тканевой протективный цитокин представляет собой эритропоэтин, в котором отсутствуют остатки сиаловой кислоты. В предпочтительном воплощении тканевой протективный цитокин представляет собой асиалоэритропоэтин и наиболее предпочтительно человеческий асиалоэритропоэтин. В другом воплощении тканевой протективный цитокин содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 остатков сиаловой кислоты. Подобные частично десиалилтированные эритропоэтины относятся здесь к гипосиалоэритропоэтинам. Их можно получить химической или ферментативной модификацией природного эритропоэтина, или их можно получить экспрессией в системе, которая либо совсем не сиалилтирует молекулу, либо только частично сиалилтирует эритропоэтин. Асиалоэритропоэтин и гипосиалоэритропоэтин входят в объем изобретения независимо от способов, с помощью которых получены молекулы. В другом предпочтительном воплощении тканевой протективный цитокин содержит по меньшей мере один или более модифицированный остаток лизина или модификацию N-концевой аминогруппы в молекуле эритропоэтина, подобные модификации получены в результате взаимодействия эпсилонаминогруппы лизина или N-концевой аминогруппы с модифицирующим аминогруппу агентом или агентами. Модифицированный остаток лизина или модифицированную N-концевую аминогруппу можно дополнительно химическим способом восстановить. В одном предпочтительном воплощении эритропоэтин биотинилируют, карбамилируют, сукцинилируют или ацетилируют по одному и более остатков лизина или в N-конце. В другом предпочтительном воплощении лизин подвергают взаимодействию с альдегидом или восстанавливающим сахаром с образованием имина, который затем необязательно стабилизируют химическим восстановлением, например, с использованием цианоборгидрида натрия с получением остатка N-алкилированного лизина, такого как глюцитолиллизин, или в случае восстанавливающих сахаров их можно стабилизировать посредством перегруппировки Амадори или Хейнса с полу-2 010371 чением альфа-дезокси-альфа-аминосахара, такого как альфа-дезокси-альфа-фруктозиллизин. В другом предпочтительном воплощении лизин или N-концевую аминогруппу карбамилируют (карбамоилируют),например, посредством взаимодействия с ионом цианата, алкилкарбамилируют, арилкарбамилируют или арилтиокарбамилируют, соответственно, с помощью алкилизоцианата, арилизоцианата или арилизотиоцианата, или их можно ацилировать с помощью реакционноспособного производного алкилкарбоновой или арилкарбоновой кислоты, например взаимодействием с уксусным ангидридом, янтарным ангидридом или фталевым ангидридом. По меньшей мере одну группу лизина или N-концевую аминогруппу также можно тринитрофенилировать взаимодействием с тринитробензолсульфоновой кислотой или предпочтительно с одной из ее солей. В другом воплощении остатки лизина можно модифицировать взаимодействием с глиоксалем, например взаимодействием с глиоксалем, метилглиоксалем или 3-дезоксиглюкозоном, с получением соответствующих альфа-карбоксиалкилпроизводных. В другом воплощении тканевой протективный цитокин можно получить модификацией по меньшей мере одного остатка тирозина в молекуле эритропоэтина с использованием электрофильного реагента,например, включая, но не ограничиваясь модификацией нитрованием или йодированием, для модификации положения в ароматическом кольце. Как уже отмечалось выше, тканевой протективный цитокин для данных целей может содержать по меньшей мере одну из вышеуказанных модификаций, но может включать более чем одну из вышеуказанных модификаций. В качестве примера тканевых протективных цитокинов с одной модификацией аминокислотной части молекулы и необязательной модификацией углеводной части молекулы тканевой протективный цитокин представляет собой карбамилэритропоэтин, карбамиласиалоэритропоэтин, карбамилгипосиалоэритропоэтин, ацетилэритропоэтин, ацетиласиалоэритропоэтин, ацетилгипосиалоэритропоэтин, сукцинилэритропоэтин, сукциниласиалоэритропоэтин, сукцинилгипосиалоэритропоэтин, биотинилэритропоэтин, биотиниласиалоэритропоэтин, биотинилгипосиалоэритропоэтин, йодэритропоэтин,йодасиалоэритропоэтин, йодгипосиалоэритропоэтин, N-эпсилон-карбоксиметилэритропоэтин, N-эпсилон-карбоксиметиласиалоэритропоэтин, N-эпсилон-карбоксиметилгипосиалоэритропоэтин и глюцитолилэритропоэтин, глюцитолиласиалоэритропоэтин, глюцитолиласиалогипоэритропоэтин. Данные соединения представляют только примеры модифицированных эритропоэтинов по изобретению. Вышеупомянутые тривиальные названия представляют только модификации молекулы природных эритропоэтинов и описанных здесь выше, модификация аминогруппы может быть по одной или более эпсилонаминогруппе остатков лизина или N-концевой аминогруппе или, например, в случае нитро- или йодмодифицированных эритропоэтинов в одном или более остатке тирозина. Любая комбинация вышепредставленного находится в объеме изобретения. Настоящее изобретение также включает композиции, в том числе фармацевтические композиции, содержащие один или более из вышеуказанных тканевых протективных цитокинов. Любая из данных композиций может также включать природный эритропоэтин. В другом аспекте изобретения обеспечивается способ защиты, поддержания, стимуляции или восстановления функции или жизнеспособности реактивных клеток млекопитающих и связанных с ними клеток, тканей и органов введением эффективного количества одного или более вышеуказанных тканевых протективных цитокинов. В одном конкретном аспекте способа реактивные клетки млекопитающих и связанные с ними клетки, органы и ткани отделены от сосудистой сети посредством плотного эндотелиального клеточного барьера. В другом конкретном аспекте клетки, ткани или органы или другие части организма выделены из организма млекопитающего, например предназначенные для трансплантации или ретрансплантации. В качестве неограничивающих примеров реактивная клетка или ткань может представлять собой клетки или ткань органов нервной системы, сетчатки, мышц, сердца, легких, печени, почек, тонкого кишечника, коры надпочечников, мозгового вещества надпочечников, эндотелия капилляров, семенников, яичников, поджелудочной железы, кожи, костей или эндометрия. Данные примеры реактивных клеток являются только иллюстративными. В конкретном воплощении реактивные клетки или связанные с ними клетки, ткани или органы не являются возбудимыми клетками, тканями или органами или, в основном, не включают возбудимые клетки или ткани. В другом конкретном воплощении клетка,ткань или орган млекопитающего, для которых возможно применение вышеуказанного тканевого протективного цитокина, представляют таковые, которые размножаются или будут размножаться в течение периода времени по меньшей мере при одном условии, оказывающем неблагоприятное действие на жизнеспособность клетки, ткани или органа. Подобные условия включают гипоксию или метаболическое нарушение функции in situ в результате травмы, индуцированную хирургической операцией гипоксию или метаболическое нарушение функции in situ или воздействие in situ токсина; последнее может быть связано с химиотерапией или лучевой терапией. В одном воплощении изобретение защищает от неблагоприятных условий, явившихся результатом проведения экстракорпорального кровообращения. Еще в одном аспекте изобретения любой из вышеуказанных тканевых протективных цитокинов можно использовать для получения фармацевтической композиции для обработки клеток, тканей или органов в условиях ex vivo в целях защиты, поддержания, стимуляции или восстановления функции или жизнеспособности реактивных клеток млекопитающих и связанных с ними клеток, тканей и органов. Подобная обработка в условиях ex vivo пригодна, например, для консервации клеток, тканей или органов, предназначенных для трансплантации, независимо от того, является ли она аутотрансплантацией-3 010371 или ксенотрансплантацией. Клетки, ткань или орган можно поместить в баню с раствором, содержащим тканевые протективные цитокины, или перфузировать его в орган через сосудистую сеть, или применить иначе для поддержания функционирования клеток в периоде, когда клетки, ткань или орган отделены от сосудистой сети донора или реципиента. Введение перфузата можно проводить донору до извлечения органа, а также в извлеченный орган или реципиенту. Кроме того, вышеуказанное применение любого тканевого протективного цитокина пригодно в тех случаях, когда клетка, ткань или орган изолированы от сосудистой системы индивидуума и, таким образом, находятся в условиях ex vivo в течение периода времени, где термин изолированы относится к отключению или пережатию сосудистой сети от или к клетке, ткани или органу или другим частям организма, например при проведении операции, включая, в частности, операцию с экстракорпоральным кровообращением; шунтирование сосудистой сети клетки,ткани, органа или другой части организма; удаление клетки, ткани, органа или другой части из организма млекопитающего, что, например, проводят при ксенотрансплантации или перед или во время аутотрансплантации; или ампутацию в результате травмы клетки, ткани, органа или другой части организма. Таким образом, данный аспект изобретения относится к перфузии тканевого протективного цитокина в условиях in situ и ex vivo. В условиях ex vivo эритропоэтин может быть обеспечен в виде раствора для консервации клеток, ткани или органа. В другом аспекте воздействие может быть в виде постоянной перфузии, прерывистой перфузии, инфузии, бани, инъекции или катетеризации. Еще в одном аспекте изобретение относится к способу защиты, поддержания, стимуляции или восстановления жизнеспособности клеток, тканей и органов или других частей организма у млекопитающего, которые включают реактивную клетку или ткань, где клетка, ткань, орган или их часть выделены из организма млекопитающего. Данный способ включает, по меньшей мере, воздействие на изолированную клетку, ткань, орган млекопитающего или их часть количества тканевого протективного цитокина, указанного выше, в течение периода времени, который эффективен для защиты, поддержания, стимуляции или восстановления вышеуказанной жизнеспособности. В неограничивающих примерах термин изолированы относится к отключению или пережатию сосудистой сети от или к клетке, ткани или органу или их части, например, при проведении операции, включая, в частности, операцию с экстракорпоральным кровообращением; шунтирование сосудистой сети клетки, ткани, органа или другой части организма; удаление клетки, ткани, органа или другой части из организма млекопитающего, что, например, проводят при ксенотрансплантации или перед или во время аутотрансплантации; или ампутацию в результате травмы клетки, ткани, органа или их части. Таким образом, данный аспект изобретения относится к перфузии с тканевым защитным цитокином как in situ, так и в условиях ex vivo. В условиях ex vivo тканевой протективный цитокин может быть обеспечен в виде раствора для консервации клеток, ткани или органа. В другом аспекте воздействие может быть в виде постоянной перфузии, прерывистой перфузии, инфузии, бани, инъекции или катетеризации. В качестве неограничивающих примеров реактивная клетка или ткань в условиях ex vivo может представлять собой клетки или ткань органов нервной системы, сетчатки, мышц, сердца, легких, печени,почек, тонкого кишечника, коры надпочечников, мозгового вещества надпочечников, эндотелия капилляров, семенников, яичников, поджелудочной железы, кожи, костей, костного мозга, пупочного канатика или эндометрия. Данные примеры реактивных клеток являются только иллюстративными. Все вышеуказанные способы и применения предпочтительно применимы для людей, но также применимы для любого млекопитающего, включая, но не ограничиваясь собаками и кошками, домашними животными, сельскохозяйственными животными и зоопарковыми животными. Пути введения вышеуказанных фармацевтических композиций включают пероральный, внутривенный, интраназальный, местный, внутриполостной, ингаляционный или парентеральный путь введения, последний включает внутривенное, внутриартериальное, подкожное, внутримышечное, внутрибрюшинное, под слизистую или внутрикожное введение. Для условий ex vivo предпочтительным является перфузат или раствор для бани. Это включает перфузирование изолированного участка сосудистой сети в условиях in situ. Еще в одном аспекте изобретения любой из вышеуказанных тканевых протективных цитокинов пригоден для получения фармацевтической композиции для восстановления нарушенной функции клетки, ткани или органа при введении после начала развития заболевания или патологического состояния,ответственного за нарушение функции. В качестве неограничивающего примера введение фармацевтической композиции, содержащей тканевые протективные цитокины, приводит к восстановлению познавательной функции у животных, имевших ранее травму мозга, даже при введении спустя длительный период времени (например, спустя 3 суток, 5 суток, неделю, месяц или более) после получения травмы. Еще в одном воплощении изобретение обеспечивает способы применения вышеуказанного тканевого протективного цитокина для восстановления нарушенной функции клетки, ткани или органа при введении после начала развития заболевания или патологического состояния, ответственного за нарушение функции. В качестве неограничивающего примера способы введения фармацевтической композиции, содержащей тканевые протективные цитокины, приводят к восстановлению познавательной функции у животных, имевших ранее травму мозга, даже при введении спустя длительный период времени(например, спустя 3 суток, 5 суток, неделю, месяц или более) после получения травмы. Тканевые протективные цитокины, пригодные для данных способов, включают любой из конкретных вышеуказанных-4 010371 модифицированных эритропоэтинов. Еще в одном дополнительном аспекте настоящего изобретения обеспечиваются способы облегчения прохождения молекулы через эндотелиальный клеточный барьер у млекопитающего введением композиции молекулы в связи с тканевым защитным цитокином, описанным выше. Связь между молекулой,предназначенной для переноса, и тканевым протективным цитокином может представлять собой, например, лабильную ковалентную связь, стабильную ковалентную связь или нековалентную связь со связывающим сайтом молекулы. Эндотелиальные клеточные барьеры могут представлять собой гематоэнцефалический барьер, гематоглазной барьер, гематосеменниковый барьер, гематояичниковый барьер и гематоплацентарный барьер. Подходящие молекулы для транспорта способами по настоящему изобретению включают гормоны, такие как гормон роста, фактор роста нервов (NGF), нейротрофический фактор из мозга (BDNF), цилиарный нейротрофический фактор (CNTF), основной фактор роста фибробластов(bFGF), трансформирующий фактор роста 1 (TGF1), трансформирующий фактор роста 2 (TGF2),трансформирующий фактор роста 3 (TGF3), интерлейкин 1, интерлейкин 2, интерлейкин 3 и интерлейкин 6, AZT, антитела против фактора некроза опухоли, противовирусные средства и иммуносупрессоры, такие как циклоспорин. Кроме того, к эритропоэтину или одному из тканевых протективных цитокинов по настоящему изобретению можно присоединить красители или маркеры для визуализации клеток, тканей или органов в мозге и других органах, имеющих барьер, для диагностических целей. Еще один аспект настоящего изобретения обеспечивает композицию для облегчения прохождения молекулы через эндотелиальный клеточный барьер у млекопитающего, композицию, содержащую молекулу в связи с тканевым защитным цитокином, описанным выше. Связь между молекулой, предназначенной для транспорта, и тканевым протективным цитокином может представлять собой, например, лабильную ковалентную связь, стабильную ковалентную связь или нековалентную связь со связывающим сайтом молекулы. Эндотелиальные клеточные барьеры могут представлять собой гематоэнцефалический барьер, гематоглазной барьер, гематосеменниковый барьер, гематояичниковый барьер и гематоплацентарный барьер. Подходящие молекулы для транспорта способами по настоящему изобретению включают гормоны, такие как гормон роста, фактор роста нервов (NGF), нейротрофический фактор из мозга(BDNF), цилиарный нейротрофический фактор (CNTF), основной фактор роста фибробластов (bFGF),трансформирующий фактор роста 1 (TGF1), трансформирующий фактор роста 2 (TGF2), трансформирующий фактор роста 3 (TGF3), интерлейкин 1, интерлейкин 2, интерлейкин 3 и интерлейкин 6,AZT, антитела против фактора некроза опухоли, противовирусные средства и иммуносупрессоры, такие как циклоспорин. Кроме того, к эритропоэтину или одному из тканевых протективных цитокинов по настоящему изобретению можно присоединить красители или маркеры для визуализации клеток, тканей или органов в мозге и других органах, имеющих барьер, для диагностических целей. Еще в одном аспекте настоящего изобретения любой из вышеуказанных тканевых протективных цитокинов пригоден для получения фармацевтической композиции для облегчения прохождения молекулы через эндотелиальный клеточный барьер у млекопитающего. Связь может быть, например, лабильной ковалентной связью, стабильной ковалентной связью или нековалентной связью со связывающим сайтом молекулы. Эндотелиальные клеточные барьеры могут представлять собой гематоэнцефалический барьер, гематоглазной барьер, гематосеменниковый барьер, гематояичниковый барьер и гематоплацентарный барьер. Подходящие молекулы для транспорта способом по настоящему изобретению включают гормоны, такие как гормон роста, антибиотики, противовирусные препараты, краски, маркеры и противоопухолевые средства, в качестве некоторых неограничивающих примеров. В одном воплощении фармацевтическая композиция по изобретению содержит терапевтически эффективное количество тканевого протективного цитокина, по меньшей мере одно противовоспалительное средство и фармацевтически приемлемый носитель. В близком воплощении противовоспалительное средство выбрано из группы, состоящей из кортикостероидов, глюкокортикоидов, стероидов, нестероидных противовоспалительных препаратов, бета-агонистов, антихолинергических средств, метилксантинов, инъекционных препаратов на основе золота, сульфасалазина, пеницилламина, противоангиогенных средств, дапзона, псораленов, противомалярийных препаратов, противовирусных средств и антибиотиков. В одном воплощении изобретение обеспечивает фармацевтическую композицию по изобретению,содержащую терапевтически эффективное количество тканевого протективного цитокина, по меньшей мере одно противовоспалительное средство и/или по меньшей мере одно иммуномодулирующее средство и фармацевтически приемлемый носитель, при условии, что противовоспалительное средство или иммуномодулирующее средство не являются MSH или анти-TNF. В близком воплощении противовоспалительное средство или иммуномодулирующее средство не являются антителом. В одном воплощении изобретение обеспечивает фармацевтическую композицию по изобретению,состоящую, в основном, из терапевтически эффективного количества тканевого протективного цитокина и содержащую по меньшей мере одно противовоспалительное средство и/или по меньшей мере одно иммуномодулирующее средство и фармацевтически приемлемый носитель. Изобретение обеспечивает фармацевтическую композицию, которая содержит терапевтически эффективное количество тканевого протективного цитокина, по меньшей мере одно иммуномодулирующее-5 010371 средство и фармацевтически приемлемый носитель. В близком воплощении противовоспалительное средство выбрано из группы, состоящей из метотрексата, лефлуномида, циклофосфамида, цитоксана,иммурана, циклоспорина А, миноциклина, азатиоприна, антибиотиков, метилпреднизолона, кортикостероидов, стероидов, микофенолата мофетила, рапамицина, мизорибина, дезоксиспергуалина, бреквинара,малононитриламидов, модуляторов рецепторов Т-клеток и модуляторов рецепторов цитокинов. Изобретение также обеспечивает фармацевтическую композицию, описанную выше, где указанный тканевой протективный цитокин выбран из группы, состоящей из: i) эритропоэтина, в котором отсутствуют остатки сиаловой кислоты; ii) эритропоэтина, в котором отсутствуют N-связанные или О-связанные углеводы; iii) эритропоэтина, имеющего пониженное содержание углеводов, в результате обработки природного эритропоэтина по меньшей мере одной гликозидазой; iv) эритропоэтина, имеющего по меньшей мере один или более окисленных углеводов; v) эритропоэтина, содержащего по меньшей мере один или более окисленных углеводов, которые восстановлены химическим способом; vi) эритропоэтина, содержащего по меньшей мере один или более модифицированных остатков аргинина; vii) эритропоэтина, содержащего по меньшей мере один или более модифицированных остатков лизина или модификацию N-концевой аминогруппы в молекуле эритропоэтина; viii) эритропоэтина, содержащего по меньшей мере модифицированный остаток тирозина; ix) эритропоэтина, содержащего модифицированный остаток аспарагиновой кислоты или глутаминовой кислоты; х) эритропоэтина, содержащего, по меньшей мере, модифицированный остаток триптофана; xi) эритропоэтина, имеющего по меньшей мере одну удаленную аминогруппу; xii) эритропоэтина, содержащего, по меньшей мере, разрыв по меньшей мере одной цистиновой связи в молекуле эритропоэтина; и xiii) усеченного эритропоэтина. В одном воплощении способ лечения воспаления у млекопитающего, имеющего реактивные клетки, ткани и/или органы, включает введение млекопитающему фармацевтической композиции, содержащей терапевтически эффективное количество тканевого протективного цитокина и фармацевтически приемлемый носитель. В близком воплощении у тканевого протективного цитокина отсутствует по меньшей мере одна активность, выбранная из группы, состоящей из повышения гематокрита, сужения сосудов, гиперактивации тромбоцитов, способствования коагулянтной активности крови и повышения продукции тромбоцитов. Еще в одном воплощении способ лечения воспаления у млекопитающего, имеющего реактивные клетки, ткани и/или органы, включает введение млекопитающему, нуждающемуся в этом, фармацевтической композиции, содержащей профилактически или терапевтически эффективное количество тканевого протективного цитокина и фармацевтически приемлемый носитель, и введение млекопитающему профилактически или терапевтически эффективного количества одного или более противовоспалительных или иммуномодулирующих средств. В одном воплощении противовоспалительное средство выбрано из группы, состоящей из кортикостероида, глюкокортикоида, стероида, нестероидного противовоспалительного препарата, бета-агониста, антихолинергического средства, метилксантина, инъекционного препарата на основе золота, сульфасалазина, пеницилламина, противоангиогенного средства, дапзона,псоралена, противомалярийного препарата, противовирусного средства и антибиотика. В одном воплощении изобретение обеспечивает способ лечения воспаления у млекопитающего,имеющего реактивные клетки, ткани и/или органы, включающий введение млекопитающему, нуждающемуся в этом, фармацевтической композиции, содержащей профилактически или терапевтически эффективное количество тканевого протективного цитокина и фармацевтически приемлемый носитель, и введение млекопитающему профилактически или терапевтически эффективного количества одного или более противовоспалительных или иммуномодулирующих средств, при условии, что противовоспалительное средство или иммуномодулирующее средство не является MSH или анти-THF. В близком воплощении противовоспалительное средство или иммуномодулирующее средство не является антителом. Еще в одном воплощении иммуномодулирующее средство выбрано из группы, состоящей из белкового соединения, пептидного миметика, антитела, молекулы нуклеиновой кислоты, малой молекулы,органического соединения, неорганического соединения, метотрексата, лефлуномида, циклофосфамида,цитоксана, иммурана, циклоспорина А, миноциклина, азатиоприна, антибиотика, метилпреднизолона(МР), кортикостероида, стероида, микофенолата мофетила, рапамицина, мизорибина, дезоксиспергуалина,бреквинара, малононитрилоамида, модулятора рецепторов Т-клеток и модулятора рецепторов цитокинов. Изобретение обеспечивает способ, описанный выше, где указанный тканевой защитный цитокин является: i) эритропоэтином, в котором отсутствуют остатки сиаловой кислоты; ii) эритропоэтином, в котором отсутствуют N-связанные или О-связанные углеводы; iii) эритропоэтином, имеющим пониженное содержание углеводов, в результате обработки природного эритропоэтина по меньшей мере одной гликозидазой; iv) эритропоэтином, имеющим по меньшей мере один или более окисленных углеводов; v) эритропоэтином, содержащим по меньшей мере один или более окисленных углеводов, которые восстановлены химическим способом; vi) эритропоэтином, содержащим по меньшей мере один или более модифицированных остатков аргинина; vii) эритропоэтином, содержащим по меньшей мере один или более модифицированных остатков лизина или модификацию N-концевой аминогруппы в молекуле эритропоэтина;viii) эритропоэтином, содержащим, по меньшей мере, модифицированный остаток тирозина; ix) эритропоэтином, содержащим модифицированный остаток аспарагиновой кислоты или глутаминовой кислоты;-6 010371 х) эритропоэтином, содержащим, по меньшей мере, модифицированный остаток триптофана; xi) эритропоэтином, имеющим по меньшей мере одну удаленную аминогруппу; xii) эритропоэтином, содержащим,по меньшей мере, разрыв по меньшей мере одной цистиновой связи в молекуле эритропоэтина; и xiii) усеченным эритропоэтином. В одном воплощении тканевой протективный цитокин в композициях и способах, описанных выше,представляет собой асиалоэритропоэтин или фенилглоксальэритропоэтин. В другом воплощении тканевой протективный цитокин способен проходить через эндотелиальный клеточный барьер. Эндотелиальный клеточный барьер выбран из группы, состоящей из гематоэнцефалического барьера, гематоглазного барьера, гематосеменникового барьера, гематояичникового барьера и гематоматочного барьера. В одном воплощении реактивные клетки, ткани и/или органы у млекопитающего, которые являются мишенями для фармацевтических композиций и способов по изобретению, выбраны из группы, состоящей из нейронов, клеток сетчатки, мышц, сердца, легких, печени, почек, тонкого кишечника, коры надпочечников, мозгового вещества надпочечников, клеток капилляров, эндотеллальных клеток, клеток семенников, яичников, эндометрия и стволовых клеток. В другом воплощении реактивные клетки млекопитающих дополнительно включают клетки, выбранные из группы, состоящей из клеток фоторецептора,клеток ганглия, биполярных клеток, горизонтальных клеток, амакриновых клеток, клеток Мюллера, клеток миокарда, клеток водителя ритма, клеток синусно-предсердного узла, клеток синусного узла, клеток атриовентрикулярного узла, клеток пучка Гиса, гепатоцитов, звездчатых клеток, купферовых клеток,мезангиальных клеток, бокаловидных клеток, клеток кишечных желез, энтеральных эндокринных клеток, клеток клубочковой зоны, клеток пучков, ретикулярных клеток, хромаффинных клеток, перицитов,клеток Лейдига, клеток Сертоли, сперматозоидов, фолликулярных клеток Граффиана, клеток примордиальных фолликулов, клеток стромы эндометрия и клеток эндометрия. Изобретение также обеспечивает фармацевтическую композицию и способы лечения воспаления у млекопитающего, описанные выше, где указанный тканевой протективный цитокин представляет собой асиалоэритропоэтин. В предпочтительных воплощениях асиалоэритропоэтин является человеческим асиалоэритропоэтином. Тканевой протективный цитокин предпочтительно представляет собой эритропоэтин без О-связанных углеводов. В одном воплощении тканевой протективный цитокин является эритропоэтином, обработанным по меньшей мере одной гликозидазой. В другом воплощении тканевой протективный цитокин представляет собой окисленный периодатом эритропоэтин. Предпочтительно окисленный периодатом эритропоэтин восстановлен химически с использованием цианоборгидрида натрия. В одном воплощении тканевой протективный цитокин является эритропоэтином, содержащим R-глиоксальную группу в одном или более остатках аргинина, где R представляет арил или алкил. Предпочтительно эритропоэтин представляет собой фенилглиоксальэритропоэтин. В другом воплощении тканевой протективный цитокин является эритропоэтином, в котором по меньшей мере один остаток аргинина модифицирован взаимодействием со смежным дикетоном, выбранным из группы, состоящей из 2,3-бутандиона и циклогександиона. Еще в одном воплощении тканевой протективный цитокин по изобретению представляет собой эритропоэтин, в котором по меньшей мере один остаток аргинина взаимодействует с 3-дезоксиглюкозоном. Еще в одном воплощении тканевой протективный цитокин является молекулой эритропоэтина, содержащей по меньшей мере один биотинилированный лизин или N-концевую аминогруппу. Молекула эритропоэтина может быть биотинилированным эритропоэтином. Изобретение также обеспечивает фармацевтическую композицию и способы лечения воспаления у млекопитающего, включающие тканевой протективный цитокин, который является глюцитолиллизинэритропоэтином или фруктозиллизинэритропоэтином. В одном воплощении тканевой протективный цитокин в фармацевтических композициях и способах по изобретению представляет собой эритропоэтин, содержащий по меньшей мере один остаток карбамилированного лизина. В другом воплощении карбамилированный эритропоэтин выбран из группы,состоящей из альфа-N-карбамоилэритропоэтина; N-эпсилон-карбамоилэритропоэтина; альфа-N-карбамоил, N-эпсилон-карбамоилэритропоэтина; альфа-N-карбамоиласиалоэритропоэтина; N-эпсилон-карбамоиласиалоэритропоэтина; альфа-N-карбамоил, N-эпсилон-карбамоиласиалоэритропоэтина; альфа-N-карбамоилгипосиалоэритропоэтина; N-эпсилон-карбамоилгипосиалоэритропоэтина и альфа-N-карбамоил,N-элсилон-карбамоилгипосиалоэритропоэтина. В одном воплощении тканевой протективный цитокин в фармацевтических композициях и способах по изобретению представляет эритропоэтин, в котором по меньшей мере один остаток лизина ацилирован. В другом воплощении остаток лизина указанного эритропоэтина ацетилирован. Еще в одном воплощении ацетилированный эритропоэтин выбран из группы, состоящей из альфа-N-ацетилэритропоэтина; N-эпсилон-ацетилэритропоэтина; альфа-N-ацетил, N-эпсилон-ацетилэритропоэтина; альфа-N-ацетиласиалоэритропоэтина; N-эпсилон-ацетиласиалоэритропоэтина; альфа-N-ацетил, N-эпсилон-ацетиласиалоэритропоэтина; альфа-N-ацетилгипосиалоэритропоэтина; N-эпсилон-ацетилгипосиалоэритропоэтина и альфа-N-ацетил, N-эпсилон-ацетилгипосиалоэритропоэтина. В одном воплощении тканевой протективный цитокин в фармацевтических композициях и способах по изобретению представляет собой эритропоэтин, содержащий сукцинилированный остаток лизина. В одном воплощении эритропоэтин выбран из группы, состоящей из альфа-N-сукцинилэритропоэтина;N-эпсилон-сукцинилэритропоэтина; альфа-N-сукцинил, N-эпсилон-сукцинилэритропоэтина; альфа-N-сукциниласиалоэритропоэтина; N-эпсилон-сукциниласиалоэритропоэтина; альфа-N-сукцинил, N-эпсилонсукциниласиалоэритропоэтина; альфа-N-сукцинилгипосиалоэритропоэтина; N-эпсилон-сукцинилгипосиалоэритропоэтина и альфа-N-сукцинил, N-эпсилон-сукцинилгипосиалоэритропоэтина. В одном воплощении тканевой протективный цитокин в фармацевтических композициях и способах по изобретению представляет собой эритропоэтин по меньшей мере с одним остатком лизина, модифицированным с помощью соли 2,4,6-тринитробензолсульфоновой кислоты. В одном аспекте соль представляет 2,4,6-тринитробензолсульфонат натрия. Еще в одном воплощении тканевой протективный цитокин в фармацевтических композициях и способах по изобретению представляет эритропоэтин, в котором по меньшей мере один остаток тирозина нитрирован и/или йодирован. Еще в одном воплощении тканевой протективный цитокин в фармацевтических композициях и способах по изобретению представляет эритропоэтин, в котором остаток аспарагиновой кислоты и/или глутаминовой кислоты взаимодействует с карбодиимидом с последующим взаимодействием с амином. В одном аспекте изобретения амин представляет собой глицинамид. В одном воплощении тканевой протективный цитокин в фармацевтических композициях и способах по изобретению, описанных выше, используется для лечения воспаления, развившегося в результате болезненного состояния или травмы. В одном воплощении травма выбрана из группы, состоящей из ангиита, хронического бронхита, панкреатита, остеомиелита, ревматоидного артрита, гломерулонефрита,неврита оптического нерва, временного артрита, энцефалита, менингита, поперечного миелита, дерматомиозита, полимиозита, некротизирующего фасцита, гепатита и некротизирующего энтероколита. В одном воплощении тканевой протективный цитокин в фармацевтических композициях и способах по изобретению подавляет воспаление, возникшее в результате цитокинов, продуцированных глиальными клетками. Еще в одном воплощении воспаление запускается апоптозом. По одному аспекту изобретения тканевой протективный цитокин можно использовать для получения фармацевтической композиции для лечения воспаления у млекопитающего, имеющего реактивные клетки,ткани и/или органы. По некоторым аспектам у тканевого протективного цитокина отсутствует по меньшей мере одна активность, выбранная из группы, состоящей из повышения гематокрита, сужения сосудов,гиперактивации тромбоцитов, способствования коагулянтной активности и повышения продукции тромбоцитов. В одном воплощении воспаление возникает в результате болезненного состояния или травмы. Еще в одном воплощении травма вызвана припадком, рассеянным склерозом, кровоизлиянием, гипотензией, остановкой сердца, ишемией, инфарктом миокарда, возрастным снижением познавательной функции, повреждениями в результате облучения, церебральным параличом, нейродегенеративным заболеванием, болезнью Альцгеймера, болезнью Паркинсона, болезнью Лейдига, деменцией при СПИДе,потерей памяти, амиотрофическим боковым склерозом, алкоголизмом, эмоциональным расстройством,тревогой, дефицитом внимания, аутизмом, болезнью Крейтцфельда-Якоба, травмой головного мозга,травмой спинного мозга, ишемией мозга, ишемией спинного мозга, сердечно-легочным анастомозом,хронической сердечной недостаточностью, дегенерацией желтого пятна, диабетической невропатией,диабетической ретинопатией, глаукомой, ишемией сетчатки или травмой сетчатки. Изобретение обеспечивает применение тканевого протективного цитокина для получения фармацевтической композиции для лечения воспаления у млекопитающего, имеющего реактивные клетки,ткани и/или органы, где фармацевтическая композиция содержит терапевтически эффективное количество тканевого протективного цитокина, по меньшей мере одно противовоспалительное средство или иммуномодулирующее средство и фармацевтически приемлемый носитель. В одном воплощении тканевой протективный цитокин представляет собой: i) эритропоэтин, в котором отсутствуют остатки сиаловой кислоты; ii) эритропоэтин, в котором отсутствуют N-связанные или О-связанные углеводы; iii) эритропоэтин, имеющий пониженное содержание углеводов, в результате обработки природного эритропоэтина по меньшей мере одной гликозидазой; iv) эритропоэтин, имеющий по меньшей мере один или более окисленных углеводов; v) эритропоэтин, содержащий по меньшей мере один или более окисленных углеводов, которые восстановлены химическим способом; vi) эритропоэтин, содержащий по меньшей мере один или более модифицированных остатков аргинина; vii) эритропоэтин, содержащий по меньшей мере один или более модифицированных остатков лизина или модификацию N-концевой аминогруппы в молекуле эритропоэтина; viii) эритропоэтин, содержащий, по меньшей мере, модифицированный остаток тирозина; ix) эритропоэтин, содержащий модифицированный остаток аспарагиновой кислоты или глутаминовой кислоты; х) эритропоэтин, содержащий, по меньшей мере, модифицированный остаток триптофана; xi) эритропоэтин, имеющий по меньшей мере одну удаленную аминогруппу; xii) эритропоэтин,содержащий, по меньшей мере, разрыв по меньшей мере одной цистиновой связи в молекуле эритропоэтина; и xiii) усеченный эритропоэтин. Данные и другие аспекты настоящего изобретения станут более понятными при обращении к последующим фигурам и подробному описанию.-8 010371 Краткое описание фигур На фиг. 1 представлено распределение рецепторов эритропоэтина в мозге здорового человека, в тонких срезах, окрашенных антителами против эритропоэтина. Фиг. 2 представляет сильное увеличение снимка на фиг. 1. На фиг. 3 показано ультраструктурное распределение рецепторов эритропоэтина с использованием меченных золотом вторичных антител. На фиг. 4, полученной аналогично фиг. 3, показана высокая плотность рецепторов эритропоэтина в просвете и с противоположной просвету поверхностях капилляров мозга человека. На фиг. 5 проводится сравнение эффективности эритропоэтина и асиалоэритропоэтина в отношении жизнеспособности клеток Р 19 при истощении сыворотки крови. На фиг. 6 представлены данные другого опыта, в котором сравнивается эффективность эритропоэтина и асиалоэритропоэтина в условиях in vitro на жизнеспособность клеток Р 19 при истощении сыворотки крови. На фиг. 7 показано защитное действие эритропоэтина и асиалоэритропоэтина на модели очаговой ишемии мозга на крысах. На фиг. 8 показано сравнение зависимости доза-ответная реакция по эффективности человеческого эритропоэтина и человеческого асиалоэритропоэтина при окклюзии средней церебральной артерии на модели ишемического инсульта. На фиг. 9 показана активность йодированного эритропоэтина в тесте на клетках Р 19. На фиг. 10 показана активность биотинилированного эритропоэтин и асиалоэритропоэтина в тесте на клетках Р 19. На фиг. 11 представлено сравнение эффективности эритропоэтина и фенилглиоксальмодифицированного эритропоэтина на жизнеспособность клеток Р 19 при истощении сыворотки крови. На фиг. 12 показано влияние тканевых протективных цитокинов в тесте интоксикации водой. На фиг. 13 представлено проникновение парентерально введенного эритропоэтина в спинно-мозговую жидкость. На фиг. 14 показано поддержание функции сердца, приготовленного для трансплантации, под действием эритропоэтина. На фиг. 15 представлено защитное действие эритропоэтина на миокард от ишемического повреждения после временной окклюзии сосудов. На фиг. 16 представлено влияние обработки эритропоэтином на модели глаукомы на крысах. На фиг. 17 показана степень сохранения функции сетчатки под действием эритропоэтина на модели глаукомы на крысах. На фиг. 18 показано восстановление познавательной функции после травмы мозга введением эритропоэтина, начиная через 5 суток после травмы. На фиг. 19 показано восстановление познавательной функции после травмы мозга введением эритропоэтина, начиная через 30 суток после травмы. На фиг. 20 показана эффективность человеческого асиалоэритропоэтина на модели церебральной токсичности с каинатом. На фиг. 21 показана эффективность тканевых протективных цитокинов на модели повреждения спинного мозга на крысах. На фиг. 22 показана эффективность тканевых протективных цитокинов на модели повреждения спинного мозга на кроликах. На фиг. 23 представлен венечный срез кортикального слоя мозга, окрашенный гематоксилинэозином. На фиг. 24 представлены венечные срезы лобной коры, смежной с областью инфаркта, окрашенные антителами GFAP. На фиг. 25 представлены венечные срезы кортикального слоя мозга, окрашенные антителами ОХ-42. На фиг. 26 представлены венечные срезы кортикального слоя мозга, смежного области инфаркта,окрашенные антителами ОХ-42. На фиг. 27 показана эффективность эритропоэтина против воспаления на модели ЕАЕ. На фиг. 28 приводится сравнение действия дексаметазона и эритропоэтина при воспалении на модели ЕАЕ. На фиг. 29 показано, что эритропоэтин подавляет воспаление, связанное с гибелью нейронов. Подробное описание изобретения Способы по изобретению обеспечивают местное или системное защитное действие или стимуляцию клеток, тканей или органов в организме млекопитающего в самых различных нормальных и неблагоприятных условиях или защитное действие для таковых, предназначенных для трансплантации в организм другого млекопитающего. Кроме того, также обеспечивается восстановление или регенерация нарушенной функции. Как уже отмечалось выше, способность эритропоэтина проходить через плотный эндотелиальный клеточный барьер и оказывать его положительное действие на реактивные клетки (а также другие типы клеток), отделенные от сосудистой сети, представляет потенциальную возможность для профилактики, а также лечения самых разнообразных патологических состояний и заболеваний, кото-9 010371 рые, в противном случае, являются причиной значительного повреждения клеток и тканей у животного,включая человека, и, кроме того, позволяет успешно проводить представленные выше трудновыполнимые хирургические вмешательства, при которых традиционно риск превышает положительный эффект. Эритропоэтин представляет гликопротеидный гормон, который у людей имеет молекулярную массу, равную 34 кДа. Зрелый белок содержит 165 аминокислот, и гликозильные остатки составляют примерно 40% от массы молекулы. Имеется промышленно доступный эритропоэтин, например, под торговыми названиями PROCRIT производства Ortho Biotech Inc., Raritan, NJ и EPOGEN производства Amgen,Inc., Thousand Oaks, CA. Кроме того, можно использовать разнообразные системы хозяев для экспрессии и продукции рекомбинантного эритропоэтина, включая, но не ограничиваясь клеточными системами бактерий, дрожжей, насекомых, растений и млекопитающих, включая человека. Например, рекомбинантный эритропоэтин, продуцированный бактериями, которые не гликозилируют или сиалилтируют продукт, можно использовать для получения негликозилированных форм эритропоэтина. Альтернативно рекомбинантный эритропоэтин можно получить в других системах, которые осуществляют гликозилирование, например, с использованием растений, включая человеческие клетки. Формы эритропоэтина,пригодные для практики настоящего изобретения, включают химические модификации и/или модификации с опосредуемым экспрессирующими системами гликозилированием природных, синтетических и рекомбинантных форм человеческого эритропоэтина и других млекопитающих. Реактивные клетки относятся к клеткам млекопитающих, функционирование или жизнеспособность которых может поддерживаться, усиливаться, стимулироваться, регенерироваться или положительно изменяться иначе, под действием эритропоэтина. Неограничивающие примеры подобных клеток включают нейроны, клетки сетчатки, мышц, сердца, легких, почек, тонкого кишечника, коры надпочечников, мозгового вещества надпочечников, эндотелия капилляров, семенников, яичников, поджелудочной железы, кости, кожи или эндометрия. В частности, реактивные клетки включают, без ограничения,нейроны; клетки сетчатки: фоторецептора (палочек и конусов), клетки ганглия, биполярные, горизонтальные, амакриновые клетки и клетки Мюллера; мышечные клетки; сердечные клетки: миокарда, водителя ритма, синусно-предсердного узла, синусного узла и соединительной ткани (атриовентрикулярного узла и пучка Гиса); легочные клетки; клетки печени: гепатоциты, звездчатые клетки, купферовы клетки; почечные клетки: мезангиальные клетки, клетки почечного эпителия, интерстициальные клетки почечных канальцев; клетки тонкого кишечника: бокаловидные клетки, клетки кишечных желез (крипт) и энтеральные, эндокринные клетки; клетки коры надпочечников: клетки клубочковой зоны, пучков и ретикулярные клетки; клетки мозгового вещества надпочечников: хромаффинные клетки; капиллярные клетки: перициты; клетки семенников: клетки Лейдига, Сертоли и сперматозоиды и их предшественники; клетки яичника: фолликулярные клетки Граффиана, клетки примордиальных фолликулов; эндометриальные клетки: клетки стромы эндометрия и эндометрия; клетки поджелудочной железы: островков Лангерганса, -клетки, -клетки, -клетки, F-клетки; клетки кожи; костные клетки: преостеобласты, остеокласты, остеобласты; а также стволовые и эндотелиальные клетки, имеющиеся в вышеуказанных органах. Кроме того, такие реактивные клетки и положительные эффекты, обеспеченные для них эритропоэтином, можно распространить, с обеспечением протективного действия или стимуляции, опосредованно на другие клетки, которые сами не являются реактивными, или ткани, или органы, содержащие такие нереактивные клетки. Данные другие клетки, или ткани, или органы, для которых обеспечивается опосредованное положительное действие в результате стимуляции реактивных клеток, находятся в виде части клеток, ткани или органа в виде связанных клеток, тканей или органов. Таким образом, положительное действие эритропоэтина, описанное здесь, можно обеспечить в результате наличия небольшого количества реактивных клеток в ткани или органе, например возбудимая или нервная ткань присутствует в такой ткани, или клетки Лейдига в семенниках, которые продуцируют тестостерон. В одном аспекте реактивные клетки или связанные с ними клетки, ткани или органы не являются возбудимыми клетками,тканями или органами или преимущественно не включают возбудимые клетки или ткани. Продолжительность или степень целенаправленных неблагоприятных условий, индуцированных для получения конечного положительного действия, таких как химиотерапия в высоких дозах, лучевая терапия, пролонгированное поддержание трансплантата в условиях ex vivo и длительные периоды индуцированной хирургическим вмешательством ишемии, можно проводить с использованием преимуществ настоящего изобретения. Однако изобретение не ограничивается таким образом и включает в одном аспекте способы или композиции, где реактивные клетки-мишени отделены от сосудистой сети посредством эндотелиального клеточного барьера или эндотелиальных плотных соединений. В основном, изобретение относится к любым реактивным клеткам и связанным с ними клеткам, тканям и органам, для которых обеспечивается преимущество в результате воздействия эритропоэтина. Кроме того, нарушение функции клетки, ткани или органа можно восстановить или регенерировать после короткого неблагоприятного события (например, травмы) воздействием эритропоэтина. Изобретение, в основном, относится к применению эритропоэтина для получения фармацевтических композиций, предназначенных для вышеуказанных целей, где функция клетки поддерживается,усиливается, стимулируется, регенерируется или любым другим путем улучшается. Изобретение также относится к способам поддержания, стимуляции, усиления или регенерации функции клеток введением- 10010371 млекопитающему эффективного количества эритропоэтина, описанного здесь. Изобретение дополнительно относится к способам поддержания, усиления, стимуляции или регенерации функции клеток в условиях ex vivo воздействием на клетки, ткань или орган эритропоэтином. Изобретение также относится к перфузату, содержащему эритропоэтин, для применения при консервации органа или ткани. В различных способах по изобретению применяется фармацевтическая композиция, которая содержит, по меньшей мере, эритропоэтин в эффективном количестве для конкретного пути и продолжительности воздействия для проявления положительных эффектов или преимущественного действия на реактивные клетки, находящиеся в или удаленные из организма млекопитающего. В тех случаях, когда для мишеневых клеток, тканей или органов, предназначенных для лечения, требуется, чтобы эритропоэтин проходил через эндотелиальный клеточный барьер, то фармацевтическая композиция содержит эритропоэтин в концентрации, которая способна, после прохождения через барьер из эндотелиальных клеток,оказывать желательное действие на реактивные клетки. Молекулы, способные взаимодействовать с рецептором эритропоэтина или модулировать активность рецептора, относящиеся здесь к модуляторам активности эритропоэтина или рецептора эритропоэтина, являются пригодными в контексте настоящего изобретения. Такие молекулы могут представлять собой, например, природные, синтетические или рекомбинантные формы молекул эритропоэтина, описанные выше, или другие молекулы, которые необязательно каким-то образом схожи с эритропоэтином, за исключением модуляции активности эритропоэтина в отношении реактивных клеток, описанных здесь. В дополнении к вышеуказанным тканевым протективным свойствам, эритропоэтин чаще ассоциируется с его воздействием на костный мозг, например со способностью повышать гематокрит (эритропоэз), сужать сосуды (высокое кровяное давление), гиперактивировать тромбоциты, способствовать коагулянтной активности и повышать продукцию тромбоцитов. Однако данные эффекты на костный мозг могут представлять определенный риск при длительном или кратковременном введении эритропоэтина для лечения нарушенных функций клеток, ткани или органа, обсужденных выше. Следовательно, изобретение, в основном, относится к применению тканевых протективных цитокинов, которые представляют химически модифицированный эритропоэтин, у которого предпочтительно отсутствует один или более эффектов эритропоэтина на костный мозг. Более предпочтительно, когда тканевые протективные цитокины не влияют на эритропоэз; наиболее предпочтительно, если у тканевых протективных цитокинов отсутствуют все эффекты эритропоэтина в отношении костного мозга. В других воплощениях у тканевого протективного цитокина отсутствуют два из вышеуказанных эффектов или любые три из вышеуказанных эффектов. Кроме того, тканевые протективные цитокины, желательные для применений, описанных здесь,можно получить гуанидированием, амидированием, карбамилированием (карбамоилированием), тринитрофенилированием, ацетилированием, сукцинилированием, нитрованием или модификацией остатков аргинина, лизина, тирозина, триптофана или цистеина или карбоксильных групп, среди прочих методов,таких как ограниченный протеолиз, удаление аминогрупп и/или замена в результате мутации остатков аргинина, лизина, тирозина, триптофана или цистеина в молекуле эритропоэтина с использованием методов молекулярной биологии. Предпочтительно, если данные химические модификации затрагивают четыре известных рецепторных области - VLQRY (SEQ ID NO: 1), TKVNFYAW (SEQ ID NO: 2),SGIRSLTTL (SEQ ID NO: 3) или SNFLRG (SEQ ID NO: 4). Более предпочтительно, если данные рецепторные области, которые являются основными по своей природе, модифицируют с помощью химической модификации основных аминокислот, аргинина и лизина, в данных областях. Кроме того, можно также химически модифицировать участки молекулы, окружающие данные рецепторные области, для изменения кинетики или связывающих свойств рецептора молекулы. В результате этого можно получить тканевые протективные цитокины, которые сохраняют адекватный уровень активности в отношении конкретных органов и тканей, но не для других, например эритроцитов (например, Satake et al., 1990, Biochim.Biophys. Acta 1038: 125-9; полностью включено здесь для ссылки). Одним неограничивающим примером,описанным ниже, является модификация остатков аргинина в молекуле эритропоэтина взаимодействием с глиоксалем, таким как фенилглиоксаль (по способу Takahashi, 1977, J. Biochem. 81: 395-402). Как станет очевидным ниже, такая молекула тканевого протективного цитокина полностью сохраняет ее нейротрофическое действие. Такие молекулы тканевых протективных цитокинов полностью включаются для различных применений и композиций, описанных здесь. Традиционно активность (в единицах) эритропоэтина или эритропоэтинподобных молекул определяется на основе их эффективности стимулировать продукцию эритроцитов на моделях на грызунах (и она выражается в международных стандартах эритропоэтина). Одна единица (Е) обычного эритропоэтина (молекулярная масса 34000) равняется приблизительно 8 нг белка (1 мг белка соответствует примерно 125000 Е). Однако поскольку воздействие на эритропоэз является побочным по отношению к желаемым здесь активностям и необязательно является детектируемым свойством некоторых тканевых протективных цитокинов по изобретению, то определение активности определенных тканевых протективных цитокинов по изобретению на основе эритропоэтической активности является неподходящим. Таким образом, в том смысле, в котором она здесь используется, единица активности эритропоэтина или тканевых протективных цитокинов определяется как количество белка, необходимое для проявления- 11010371 аналогичной активности на нейронах или других реактивных клеточных системах, какая проявляется международным стандартом эритропоэтина ВОЗ в той же системе. Специалисты в данной области легко определят единицы не влияющего на эритропоэз эритропоэтина или молекулы близкого тканевого протективного цитокина, следуя представленным здесь указаниям. В дополнении к вышеуказанным тканевым протективным цитокинам, последующее обсуждение касается различных тканевых протективных цитокинов по изобретению. Тканевой протективный цитокин по изобретению может включать эритропоэтин, не содержащий,по меньшей мере, остатков сиаловой кислоты, относящийся к асиалоэритропоэтину. Предпочтительно тканевой протективный цитокин по изобретению представляет собой человеческий асиалоэритропоэтин. Его можно получить десиалилтированием эритропоэтина с использованием сиалидазы, такой как описана на упаковке производителя для сиалидазы А производства ProZyme Inc., San Leandro, Калифорния. Как правило, PROZYME GLYCOPRO сиалидаза А для секвенирования (N-ацетилнейраминат гликогидролазы, ЕС 3.2.1.18) используется для отщепления всех невосстанавливающих концевых остатков сиаловой кислоты от комплекса углеводов и гликопротеинов, такого как эритропоэтин. Она также будет отщеплять разветвленные сиаловые кислоты (связанные с внутренним остатком). Сиалидазу А выделяют из клона Arthrobacter ureafaciens. В неограничивающем примере вышепредставленного способа эритропоэтин можно подвергнуть десиалилтированию под действием сиалидазы (0,025 Е/мг ЕРО) при 37 С в течение 3 ч, после чего эритропоэтин можно обессолить и сконцентрировать. После пропускания через ионообменную колонку с использованием системы AKTAPRIME (Amersham Pharmacia Biotech) и элюирования выбранными буферами отбирают фракции, включающие только две верхние полосы, идентифицированные иммуноэлектрофорезом (мигрирующие при pI 8,5 и 7,9 на геле IEF). Не должно детектироваться значительного количества сиаловой кислоты в данном препарате тканевого протективного цитокина. В альтернативных воплощениях тканевой протективный цитокин по изобретению может представлять эритропоэтин, содержащий по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 13 остатков сиаловой кислоты, полученный частичным десиалилтированием вышеуказанным способом. Данные тканевые протективные цитокины, полученные в результате частичного десиалилтирования эритропоэтина, также можно отнести к гипосиалоэритропоэтинам, и они могут представлять собой гомогенную композицию,например, только с 2 остатками сиаловой кислоты на молекулу эритропоэтина, или они могут быть гетерогенной смесью эритропоэтинов с самой различной степенью сиалилтирования, или, например, они могут иметь низкое количество, например, в среднем, примерно от 1 до примерно 4 молекул сиаловой кислоты на эритропоэтин или в другом примере большее количество, например, в среднем, примерно от 10 до примерно 13 остатков сиаловой кислоты на молекулу эритропоэтина. Такие смеси могут включать асиалоэритропоэтин или эритропоэтин. Эритропоэтин, предназначенный для вышеуказанных применений, содержит по меньшей мере один или более остатков модифицированного аргинина. Например, модифицированный эритропоэтин может содержать R-глиоксальную группу в одном или более остатков аргинина, где R может быть арилом, гетероарилом, низшим алкилом, низшим алкокси, или циклоалкилом, или альфа-дезоксиглицитолилом. В том смысле, в котором он здесь используется, термин низший алкил означает нормальную или разветвленную насыщенную алифатическую углеводородную группу, предпочтительно содержащую 1-6 атомов углерода. Представителями таких групп являются метил, этил, изопропил, изобутил, бутил, пентил, гексил и т.п. Термин алкокси означает низший алкил, имеющий значения, определенные выше,соединенный с остальной частью молекулы через кислород. Примеры алкокси включают метокси, этокси, пропокси, изопропокси и т.п. Термин циклоалкил относится к циклическому алкилу, содержащему от 3 до примерно 8 атомов углерода, включая, например, циклопропил, циклобутил, циклогексил и т.п. Термин арил относится к фенилу и нафтилу. Термин гетероарил относится к гетероциклическим группам, содержащим 4-10 членов в кольце и 1-3 гетероатомов, выбранных из группы, состоящей из атома кислорода, азота и серы. Примеры включают, но не ограничиваются изоксазолилом, фенилизоксазолилом, фурилом, пиримидинилом, хинолилом, тетрагидрохинолилом, пиридилом, имидазолилом, пирролидинилом, 1,2,4-триазолилом, тиазолилом, тиенилом и т.п. Группа R может быть замещена, как, например, 2,3,4-тригидроксибутил в 3-дезоксиглюкозоне. Типичными примерами R-глиоксальных соединений являются глиоксаль, метилглиоксаль, 3-дезоксиглюкозон и фенилглиоксаль. ПредпочтительнымиR-глиоксальными соединениями являются метилглиоксаль или фенилглиоксаль. Примерный способ такой модификации можно найти у Werber et al., 1975, Isr. J. Med. Sci. 11 (11): 1169-70 с использованием фенилглиоксаля. В дополнительном примере по меньшей мере один остаток аргинина можно модифицировать взаимодействием со смежным дикетоном, таким как 2,3-бутандион или циклогександион, предпочтительно примерно в 50 мМ боратном буфере при рН 8-9. Методику последней модификации с использованием 2,3-бутандиона можно провести согласно методу Riordan, 1973, Biochemistry 12 (20): 3915-3923 и с циклогексаноном по методу Patthy et al., 1975, J. Biol. Chem. 250 (2): 565-9. Тканевой протективный цитокин по изобретению может содержать по меньшей мере один или более- 12010371 остатков модифицированного лизина или модификацию N-концевой аминогруппы в молекуле эритропоэтина, такие модификации получают взаимодействием остатка лизина с модифицирующим аминогруппу агентом. Например, эритропоэтин или вышеуказанные асиалоэритропоэтин или гипосиалоэритропоэтин можно модифицировать ацетилированием, карбаминилированием, сукцинилированием, окислением или последующим карбоксиметиллизинированием, среди прочих способов, для модификации аминогрупп. В неограничивающем примере тканевой протективный цитокин можно получить карбамилированием эритропоэтина или десиалилтированного эритропоэтина, такого как асиалоэритропоэтин, с помощью перекристаллизованного цианата калия в боратном буфере, после чего проводят тщательный диализ. Аналогичным образом вышеуказанный эритропоэтин можно сукцинилировать взаимодействием с янтарным ангидридом с последующим диализом с получением тканевого протективного цитокина по настоящему изобретению. Еще в одном воплощении тканевой протективный цитокин можно получить взаимодействием эритропоэтина с уксусным ангидридом в фосфатном буфере с ацетилированием эритропоэтина. Данную реакцию можно остановить диализом против воды. Способ описан Satake et al. (1990). Chemical modification oferythropoietin: an increase in in-vitro activity by guanidination. Biochimica et Biophysica Acta. 1038: 125-129. В другом воплощении тканевые протективные цитокины представляют собой аддукты N-(карбоксиметил)лизина (CML) из эритропоэтина или асиалоэритропоэтина, полученные взаимодействием с глиоксиловой кислотой и NaBH3CN в натриевом фосфатном буфере с последующим диализом. Akhtar et al.,(1999). Conformational study of N-(carboxymethyl)lysine adducts of recombinant a-crystallins. Current EyeResearch, 18: 270-276. Еще в одном воплощении тканевой протективный цитокин получают модификацией остатков лизина эритропоэтина взаимодействием с производными глиоксаля, например взаимодействием с глиоксалем, метилглиоксалем и 3-дезоксиглюкозоном с образованием альфа-карбоксиалкильных производных. Примеры включают взаимодействие с глиоксалем с образованием остатка карбоксиметиллизина, как описано Glomb and Monnier, 1995, J. Biol. Chem. 270 (17): 10017-26, или с метилглиоксалем с образованием остатка (1-карбоксиэтил)лизина, как описано Degenhardt et al., 1998, Cell. Mol. Biol. (Noisy-le-grand) 44 (7): 1139-45. Остаток модифицированного лизина можно дополнительно химическим способом восстановить. Например, эритропоэтин можно биотинилировать по лизину, например, как описано в способе в примере 2, в котором N-гидроксисукцинимидовый эфир D-биотиноиламинокапроновой кислоты подвергали взаимодействию с эритропоэтином с последующим удалением непрореагировавшего биотина гель-фильтрацией на колонке с Centricon 10, как описано Wojchowski and Caslake, 1989, Blood 74 (3): 952-8. В данной работе авторы применяют три различных способа биотинилирования эритропоэтина,любой из которых можно использовать для получения тканевых протективных цитокинов для применений по изобретению. Биотин можно добавить к: (1) остаткам сиаловой кислоты, (2) карбоксилатным группам или (3) аминогруппам. В другом предпочтительном воплощении лизин можно подвергнуть взаимодействию с альдегидом или восстанавливающим сахаром с образованием имина, который можно стабилизировать восстановлением цианоборгидридом натрия с получением остатка N-алкилированного лизина, такого как глуцитолиллизин, или в случае применения восстанавливающих сахаров их можно стабилизировать перегруппировкой Амадори или Хейнса с получением альфа-дезокси-альфа-аминосахара, такого как остаток альфадезокси-альфа-фруктозиллизина в молекуле эритропоэтина. В качестве примера получение фруктозиллизинмодифицированного белка при инкубации с 0,5 М раствором глюкозы в натриевом фосфатном буфере при рН 7,4 в течение 60 суток описано Makita et al., 1992, J. Biol. Chem. 267: 5133-5138. В другом примере группу лизина можно карбамилировать, например, взаимодействием с ионом цианата, или алкил- или арилкарбамилировать, или тиокарбамилировать взаимодействием с алкил- или арилизоцианатом, или ее можно ацилировать с помощью реакционноспособного производного алкил- или арилкарбоновой кислоты, например взаимодействием с уксусным ангидридом, или янтарным ангидридом, или фталевым ангидридом. Примером является модификация групп лизина 4-сульфофенилизотиоцианатом или уксусным ангидридом, как в обоих случаях описано Gao et al., 1994, Proc. Natl. Acad. Sci. USA 91 (25): 12027-30. Группы лизина можно также тринитрофенилировать взаимодействием с тринитробензолсульфоновой кислотой или предпочтительно с ее солями. Такие способы описаны ниже в примере 2. По меньшей мере, остаток тирозина в молекуле эритропоэтина может быть модифицирован в положении ароматического кольца электрофильным реагентом, например, нитрованием или йодированием с получением тканевого протективного цитокина. В качестве неограничивающего примера эритропоэтин можно подвергнуть взаимодействию с тетранитрометаном (Nestler et al., 1985, J. Biol. Chem. 260 (12): 7316-21) или йодировать, как описано в примере 3. Например, йодирование с использованием NaI и предварительно покрытой пробирки для йодирования IODO-GEN (Pierce, 28601) можно провести с эритропоэтином или асиалоэритропоэтином в натриевом фосфатном буфере. Можно модифицировать, по меньшей мере, остаток аспарагиновой кислоты или глутаминовой кислоты, например, взаимодействием с карбодиимидом с последующим взаимодействием с амином, таким как, но не ограничиваясь глицинамидом.- 13010371 В другом примере остаток триптофана эритропоэтина можно модифицировать, например, взаимодействием с н-бромсукцинимидом или н-хлорсукцинимидом, следуя способам, таким как описаны Josseet al., Chem. Biol. Interact., 1999, May 14; 119-120. Еще в одном примере тканевой протективный цитокин можно получить удалением по меньшей мере одной аминогруппы природного эритропоэтина, например, взаимодействием с нингидрином с последующим восстановлением полученной карбонильной группы боргидридом. Еще в одном примере тканевой протективный цитокин обеспечивается таким образом, что он имеет, по меньшей мере, разрыв по меньшей мере одной из цистиновых связей в молекуле эритропоэтина взаимодействием с восстанавливающим агентом, таким как дитиотреитол, с последующим взаимодействием полученных сульфгидрилов с йодацетамидом, йодуксусной кислотой или другим электрофилом для предупреждения преобразования дисульфидных связей. Как уже указывалось выше, альтернативно или в комбинации дисульфидные связи можно удалить при изменении молекулы цистеина, которая принимает участие в образовании реальной поперечной связи или по меньшей мере одного другого остатка аминокислоты, что приводит к неспособности эритропоэтина образовывать по меньшей мере одну из дисульфидных связей, находящихся в природной молекуле. Тканевой протективный цитокин можно получить, подвергнув эритропоэтин ограниченному химическому протеолизу, который направлен на определенные остатки-мишени, например, с последующим отщеплением остатков триптофана. Такие полученные фрагменты эритропоэтина включаются в объем изобретения. Как уже указывалось выше, тканевой протективный цитокин, пригодный для настоящих целей, может включать по меньшей мере одну из вышеуказанных модификаций, но может иметь более чем одну из вышеуказанных модификаций. В качестве примера тканевого протективного цитокина с одной модификацией в углеводной части молекулы и с одной модификацией в аминокислотной части тканевой протективный цитокин может представлять собой асиалоэритропоэтин и иметь биотинилированные или карбамилированные остатки лизина. Кроме того, химически модифицированный эритропоэтин можно дополнительно модифицировать мутацией по меньшей мере одной аминокислоты эритропоэтина. Подобные мутации могут включать замены, делеции, включая внутренние делеции, добавления, включая добавления, дающие гибридные белки, или консервативные замены аминокислотных остатков в и/или смежной аминокислотной последовательности, но результатом которых является молчащая замена, в результате чего получается функционально эквивалентный эритропоэтин. Консервативные аминокислотные замены можно провести, основываясь на аналогии в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфотерной природы участвующих в этом остатков. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Альтернативно неконсервативные аминокислотные замены и более крупные вставки и делеции можно использовать для получения функционально измененного эритропоэтина. Такие мутанты можно использовать для изменения свойств эритропоэтина желаемыми путями. Например, в одном воплощении эритропоэтин, пригодный для практики изобретения, может быть изменен по одной или более аминокислот в четырех функциональных доменах эритропоэтина, что оказывает влияние на связывание с рецепторами: VLQRY (SEQ ID NO: 1), и/или TKVNFYAW (SEQ ID NO: 2), и/или SGLRSLTTL (SEQ ID NO: 3),и/или SNFLRG (SEQ ID NO: 4). В другом воплощении можно использовать эритропоэтины, включающие мутации в окружающих участках молекулы, которые оказывают влияние на кинетику и свойства связывания с рецептором молекулы. Данные дополнительные модификации можно использовать для повышения тканевого протективного действия, подавления воздействия на костный мозг или изменения физических свойств, таких как заряд, тканевого протективного цитокина. Вышепредставленные в качестве примеров способы получения тканевых протективных цитокинов по изобретению являются только иллюстративными и неограничивающими, и для получения соединений по изобретению можно использовать данные или другие способы. Вышеуказанные названия, в которые включен способ получения, например ацетилированный или биотинилированный, приводятся здесь только в качестве указания того, каким образом получено соединение, поскольку настоящее изобретение относится к соединениям, которые представляют собой продукты вышеуказанных реакций. Специалисты в данной области, очевидно, понимают, что выше приводятся соединения, которые являются продуктами вышеуказанных реакций. Кроме того, соединения по изобретению имеют информационные и тривиальные названия для определения объема модификаций по изобретению и того факта, что они могут иметь место в одном или более мест в молекуле эритропоэтина или модифицированного эритропоэтина. В качестве неограничивающих примеров последующие соединения представляют собой члены групп соединений, включенных в объем изобретения.- 14010371 1. Карбамилированные эритропоэтины. Последующие соединения представляют карбамоильные группы в N-концевой аминокислоте в молекуле эритропоэтина (альфа-N-карбамоил-) или в одной (или более) эпсилон-аминогруппе остатков лизила эритропоэтина (N-эпсилон-карбамоил-). Конечно, могут иметь место множественные N-эпсилон-модификации с или без альфа-N-модификации.ix. альфа-N-карбамоил, N-эпсилон-карбамоилгипосиалоэритропоэтин. 2. Сукцинилированные эритропоэтины. Последующие соединения представляют сукцинильные группы в N-концевой аминокислоте в молекуле эритропоэтина (альфа-N-сукцинил-) или в одной (или более) эпсилон-аминогруппе остатков лизила в эритропоэтине (N-эпсилон-сукцинил-). Конечно, могут иметь место множественные N-эпсилонмодификации с или без альфа-N-модификации.ix. альфа-N-сукцинил, N-эпсилон-сукцинилгипосиалоэритропоэтин. 3. Ацетилированные эритропоэтины. Последующие соединения содержат ацетильные группы в N-концевой аминокислоте в молекуле эритропоэтина (альфа-N-ацетил-) или в одной (или более) эпсилон-аминогруппе остатков лизила в эритропоэтине (N-эпсилон-ацетил-). Конечно, могут иметь место множественные N-эпсилон-модификации с или без альфа-N-модификации.ix. альфа-N-ацетил, N-эпсилон-ацетилгипосиалоэритропоэтин. 4. Биотинилированные эритропоэтины. Последующие соединения содержат биотинильные группы в N-концевой аминокислоте в молекуле эритропоэтина (альфа-N-биотинил-) или в одной (или более) эпсилон-аминогруппе остатков лизила в эритропоэтине (N-эпсилон-биотинил-). Конечно, могут иметь место множественные N-эпсилон-модификации с или без альфа-N-модификации.ix. альфа-N-биотинил, N-эпсилон-биотинилгипосиалоэритропоэтин. 5. Йодированные эритропоэтины. Специалистам в данной области, очевидно, понятно, что несколько различных остатков тирозина, а также комбинации остатков тирозина могут быть йодированы и последующие соединения приводятся только в целях иллюстрации.iii. йодгипосиалоэритропоэтин. 6. Карбоксиметиллизилэритропоэтины. Последующие соединения содержат карбоксиметильные группы в одной (или более) эпсилон-аминогруппе остатков лизила в эритропоэтине (N-эпсилон-карбоксиметил-). Конечно, могут иметь место множественные N-эпсилон-модификации.iii. N-эпсилон-карбоксиметилгипосиалоэритропоэтин. Для получения эритропоэтинов и близких к эритропоэтинам молекул по изобретению можно использовать самые различные системы экспрессирующих векторных хозяев. Такие системы экспрессирующих хозяев представляют собой носители, с помощью которых можно получить и затем выделить интересующие эритропоэтины, но также они представляют клетки, которые могут при трансформации или трансфекции соответствующими нуклеотидными кодирующими последовательностями продуцировать модифицированный продукт гена эритропоэтина in situ. Они включают, но не ограничиваются системами хозяев в ряду бактерий, насекомых, растений, млекопитающих, включая человека, но не ограничиваются клеточными системами насекомых, инфицированных рекомбинантными экспрессирующими вирусными векторами (например, бакуловирусом), включающими кодирующие последовательности модифицированных эритропоэтинов; растительными клеточными системами, инфицированными рекомбинантными экспрессирующими вирусными векторами (например, вирусом мозаики цветной капусты,CaMV; вирусом табачной мозаики, TMV) или трансформированными рекомбинантными плазмидными экспрессирующими векторами (например, Ti-плазмидой), содержащими кодирующие последовательности близких к эритропоэтинам молекул; или системами клеток млекопитающих, включая системы человеческих клеток (например, НТ 1080, COS, СНО, BHK, 293, 3 Т 3), включающих рекомбинантные экспрессирующие конструкции, содержащие промоторы, полученные из генома клеток млекопитающих (например, промотор металлотионеина) или из вирусов млекопитающих (например, поздний промотор аденовирусов; промотор вакцинного вируса 7.5 К). В дополнение, можно выбрать штамм клеток-хозяев, который модулирует экспрессию вставленных последовательностей, или модифицирует, или процессирует продукт гена желаемым определенным образом. Подобные модификации (например, гликозилирование) и процессинг (например, отщепление) белковых продуктов могут иметь значение для функционирования белка. Различные клетки-хозяева обладают характерными и специфическими механизмами посттрансляционного процессинга и модификации белков и продуктов гена. Можно выбрать подходящие клеточные линии или системы хозяев для обеспечения правильной модификации и процессинга чужеродных экспрессируемых белков. Наконец,можно использовать эукариотные клетки-хозяева, которые обладают клеточным механизмом правильного процессинга первичного транскрипта, гликозилирования и фосфорилирования генного продукта. Такие клетки-хозяева млекопитающих, в том числе человеческие клетки-хозяева, включают, но не ограничиваются НТ 1080, СНО, VERO, BHK, HeLa, COS, MDCK, 293, 3 Т 3 и WI38. Для обеспечения длительной с высоким выходом продукции рекомбинантных белков предпочтительной является стабильная экспрессия. Например, можно получить генно-инженерные клеточные линии, которые стабильно экспрессируют продукт гена близких к эритропоэтину молекул. В большей степени, чем с использованием экспрессирующих векторов, которые включают вирусные репликаторы,клетки-хозяева можно трансформировать с ДНК, контролируемой подходящими регулирующими экспрессию элементами (например, промотором, энхансером, последовательностями, терминаторами транскрипции, сайтами полиаденилирования и т.д.), и использовать селективный маркер. После вставки чужеродной ДНК сконструированные клетки культивируют в течение 1-2 суток в обогащенных средах и затем переносят на селективные среды. Селективный маркер в рекомбинантной плазмиде придает устойчивость к селекции и позволяет клеткам стабильно интегрировать плазмиду в их хромосомы и размножаться с образованием очага, который, в свою очередь, можно клонировать и превратить в клеточные линии. Данный способ можно преимущественно использовать для создания клеточных линий, экспрессирующих продукт гена близких к эритропоэтину молекул. Такие генно-инженерные клеточные линии могут быть особенно пригодными для скрининга и оценки соединений, влияющих на эндогенную активность продукта гена близких к эритропоэтину молекул. Альтернативно экспрессирующие свойства гена эндогенного эритропоэтина в клеточной линии или микроорганизме можно модифицировать вставкой гетерологичного регуляторного элемента ДНК в геном стабильной клеточной линии или клонированного микроорганизма так, чтобы в результате вставленный регуляторный элемент был оперативно связан с геном эндогенного эритропоэтина. Например,ген эндогенного эритропоэтина, который в норме является транскрипционно молчащим, т.е. в норме ген эритропоэтина не экспрессируется или экспрессируется на очень низком уровне в клеточной линии,можно активировать вставкой регуляторного элемента, который способен повышать экспрессию в норме экспрессируемого гена продукта в такой клеточной линии или микроорганизме. Альтернативно, транскрипционно молчащий ген эндогенного эритропоэтина можно активировать вставкой произвольного регуляторного элемента, который работает во всех типах клеток.- 16010371 Гетерологичный регуляторный элемент можно вставить в стабильную клеточную линию или клонированный микроорганизм таким образом, чтобы он был оперативно связан с геном эндогенного эритропоэтина с использованием методов, таких как направленная гомологичная рекомбинация, которые хорошо известны специалистам в данной области и описаны в патенте Франции 2646438, институт Пастера, патенте США 4215051, Chappel; патенте США 5578461, Sherwin et al.; международной заявкеPCT/US92/09627 (WO93/09222), Selden et al. и международной заявкеPCT/US90/06436(WO91/06667) Skoultchi et al., которые все полностью включены здесь для ссылки. В одном воплощении изобретения тканевой протективный цитокин представляет собой молекулу химически модифицированного эритропоэтина с недостатком остатков сиаловой кислоты или полным отсутствием остатков сиаловой кислоты, и ее можно получить в клетках млекопитающих, включая человеческие клетки. Такие клетки можно сконструировать с недостатком или отсутствием ферментов, которые принимают участие в добавлении сиаловых кислот, т.е. -галактозидаза 2,3-сиалилтрансфераза(А 2,3-сиалилтрансфераза) и -галактозидаза 2,6-сиалилтрансфераза (А 2,6-сиалилтрансфераза). В одном воплощении используют клетки млекопитающих, в которых делецированы один или оба гена 2,3-сиалилтрансферазы и/или ген 2,6-сиалилтрансферазы. Такие делеции можно сконструировать с использованием методов вышибания генов, известных в данной области. В другом воплощении используют клетки яичников китайского хомячка (СНО) с недостатком дигидрофолатредуктазы (DHFR) в качестве клетки-хозяина для получения молекул близких рекомбинантных эритропоэтинов. Клетки СНО не экспрессируют фермент 2,6-сиалилтрансферазу, и, следовательно, в них не происходит добавления сиаловой кислоты по 2,6-связи к N-связанным олигосахаридам гликопротеинов, продуцированных в данных клетках. В результате в рекомбинантных белках, продуцированных клетками СНО, отсутствует сиаловая кислота по 2,6-связи с галактозой (Sasaki et al. (1987); Takeuchi et al., выше; Mutsaers et al., Eur.J. Biochem. 156, 651 (1986); Takeuchi et al., J. Chromotgr. 400, 207 (1987. В одном воплощении для получения клетки-хозяина в целях продукции асиалоэритропоэтина подвергается делеции ген, кодирующий 2,3-сиалилтрансферазу в клетках СНО. У подобных клеток СНО после вышибания гена 2,3-сиалилтрансферазы полностью отсутствует активность сиалилтрансферазы, и в результате они пригодны для рекомбинантной экспрессии и продукции тканевого протективного цитокина, представляющего собой асиалоэритропоэтин. В другом воплощении асиалогликопротеины можно получить, нарушив транспорт сиаловой кислоты в аппарат Гольджи, например, см. Eckhardt et al., 1998, J. Biol. Chem. 273: 20189-95. С использованием хорошо известных специалистам в данной области методов (например, Oelmann et al., 2001, J. Biol. Chem. 276: 26291-300) можно провести мутагенез нуклеотидного сахарного транспортера СМР-сиаловой кислоты с получением мутантов клеток яичников китайского хомячка. В данных клетках не происходит добавления остатков сиаловой кислоты к гликопротеинам, таким как эритропоэтин, и продуцируется только асиалоэритропоэтин. Трансфектированные клетки млекопитающих, синтезирующие эритропоэтин, также продуцируют цитозольную сиалидазу, которая при высвобождении в культуральную среду очень эффективно разрушает сиалоэритропоэтин (например, Gramer et al., 1995, Biotechnology 13: 692-698). С использованием методов, хорошо известных специалистам в данной области (например, информации, представленнойFerrari et al., 1994, Glycobiology 4: 367-373), клеточные линии можно трансфектировать, мутировать или вызвать иначе конститутивную продукцию сиалидазы. Таким образом, можно получить асиалоэритропоэтин во время продукции асиалоэритропоэтина. Тканевой протективный цитокин по изобретению имеет по меньшей мере одну модификацию аминокислотного остатка в эритропоэтине, независимо от состояния гликозилирования молекул. Как уже указывалось выше, химическая модификация может представлять собой модификацию по меньшей мере одной аминогруппы по меньшей мере одной аминокислоты, например остатка лизина, или N-концевой аминогруппы или йодирование по меньшей мере одного остатка тирозина. После получения рекомбинантных тканевых протективных цитокинов и химически модифицированных рекомбинантных тканевых протективных цитокинов по настоящему изобретению специалист в данной области может подтвердить наличие тканевых протективных цитокинов и отсутствие влияния на костный мозг с использованием известных методов. Например, отсутствие эритропоэтического действия рекомбинантного тканевого протективного цитокина можно подтвердить при использовании теста на клетках TF-1. В данном тесте клетки TF-1 культивируют в полной среде RPMI с добавлением GM-CSF в концентрации 5 нг/мл и 10% FCS в течение суток при 37 С в СО 2-инкубаторе. Затем клетки отмывают и суспендируют с титром 106 клеток/мл в течение 16 ч в минимальной среде (5% FCS без GM-CSF). 96-луночный планшет готовят: 1) добавлением 100 мкл стерильной воды во внешние лунки для поддержания влаги; 2) добавлением только среды (10%FCS без клеток или GM-CSF) в 5 лунок и 3) посевом 25000 клеток/лунку в среде, содержащей 10% FCS и рекомбинантные тканевые протективные цитокины, в оставшиеся лунки (5 лунок на каждый тестируемый цитокин). Если клетки размножаются, то рекомбинантный тканевой протективный цитокин может обладать гематопоэтическим действием. Затем следует оценить действие соединения в условиях in vivo в- 17010371 тесте in vivo по определению повышения гематокрита в результате воздействия рекомбинантного тканевого протективного цитокина. Отрицательный результат означает отсутствие пролиферации клеток TF-1 в условиях in vitro, и отсутствие повышения гематокрита в тесте in vivo означает, что рекомбинантный тканевой протективный цитокин не обладает эритропоэтическим действием. Тканевые протективные свойства рекомбинантного тканевого протективного цитокина можно подтвердить при использовании теста на клетках Р 19 или в тесте интоксикации водой in vivo на крысах, которые оба подробно описаны ниже. Вышеуказанные тесты приводятся только в качестве примеров, и предполагается использование в настоящем изобретении других подходящих тестов для определения воздействия цитокинов на костный мозг и защитного действия для тканей, известных специалистам в данной области. В практике одного аспекта настоящего изобретения фармацевтическую композицию, описанную выше, содержащую тканевой протективный цитокин, можно вводить млекопитающему любым путем,который обеспечивает достаточную концентрацию тканевого протективного цитокина в сосудистой сети при прохождении через эндотелиальный клеточный барьер и проявления положительного действия на реактивные клетки. При ее использовании для перфузии ткани или органа желательно получение аналогичных результатов. Например, в случаях, когда тканевой протективный цитокин применяется для перфузии в условиях ex vivo, тканевой протективный цитокин может представлять любой из вышеуказанных химически модифицированных эритропоэтинов. В случаях, когда клетки или ткань не имеют сосудистой сети, и/или при применении инкубации на бане клеток или ткани с композицией по изобретению фармацевтическая композиция обеспечивает эффективное в отношении проявления положительного действия на реактивные клетки количество тканевого протективного цитокина. Эндотелиальные клеточные барьеры, через которые может пройти тканевой протективный цитокин, включают плотные соединения, перфорированные соединения, фенестрированные соединения и любые другие типы эндотелиальных барьеров, имеющихся у млекопитающих. Предпочтительным барьером является плотное соединение из эндотелиальных клеток, но изобретение не ограничивается этим. Вышеуказанные тканевые протективные цитокины, в основном, пригодны для терапевтического или профилактического лечения у человека заболеваний центральной нервной системы или периферической нервной системы, которые, в основном, проявляются в виде неврологических или психических симптомов, глазных болезней, сердечно-сосудистых заболеваний, кардиопульмональных заболеваний, респираторных заболеваний, заболеваний почек, органов мочевой и половой системы, заболеваний костей,заболеваний кожи, желудочно-кишечных заболеваний и эндокринных и метаболических нарушений. В частности, данные состояния и заболевания включают гипоксию, которая отрицательно влияет на возбудимые ткани, такие как возбудимые ткани в центральной нервной системе, ткани периферической нервной системы или сердечной ткани или ткани сетчатки, например в мозге, сердце или сетчатке/глазе. Следовательно, изобретение можно использовать для лечения и профилактики повреждения возбудимой ткани, возникающего в результате гипоксии в различных условиях и обстоятельствах. Неограничивающие примеры таких условий и обстоятельств приведены в таблице ниже. В примере протективного действия при патологиях нервной ткани, поддающихся лечению по настоящему изобретению, такие патологии включают таковые, возникающие в результате пониженной оксигенации нервных тканей. Любое состояние, снижающее доступность кислорода для нервной ткани,приводящее к стрессу, повреждению и в конечном итоге к гибели нервных клеток, можно лечить способами по настоящему изобретению. В основном, относящиеся к гипоксии и/или ишемии данные состояния возникают или включают, но не ограничиваются кровоизлиянием, окклюзией сосудов, недостатком кислорода в пренатальном или постнатальном периоде развития, удушением, удушьем, низким погружением, отравлением окисью углерода, вдыханием табачного дыма, травмой, включая операцию и лучевую терапию, асфиксией, эпилепсией, гипогликемией, хроническим обструктивным заболеванием легких,эмфиземой, дистресс-синдромом дыхания у взрослых, гипотензивным шоком, септическим шоком, анафилактическим шоком, инсулиновым шоком, кризисом у больных с серповидно-клеточной анемией, остановкой сердца, нарушением ритма, азотным наркозом и неврологическими расстройствами в результате применения экстракорпорального кровообращения. В одном воплощении, например, определенные композиции на основе тканевых протективных цитокинов можно вводить для профилактики травмирования или повреждения ткани при наличии риска травмирования или повреждения ткани во время проведения хирургических вмешательств, таких как,например, резекция опухоли или восстановление аневризмы. Другие патологии, вызываемые или возникающие в результате гипогликемии, которые поддаются лечению способами, описанными здесь, включают передозировку инсулина, также относящуюся к ятрогенной гиперинсулинемии, инсулиному, недостаток гормона роста, гипокортицизм, передозировку лекарственных препаратов и некоторые опухоли. Другие патологии, возникающие в результате повреждения нервной ткани, включают приступообразные расстройства, такие как эпилепсия, судороги или хронические припадки. Другие поддающиеся лечению состояния или заболевания включают такие заболевания, как кровоизлияние, рассеянный склероз, гипотензия, остановка сердца, болезнь Альцгеймера, болезнь Паркинсона, церебральный паралич,травма головного или спинного мозга, деменция при СПИДе, возрастная потеря познавательной функ- 18010371 ции, потеря памяти, амиотрофический боковой склероз, припадки, алкоголизм, ишемия сетчатки, повреждение зрительного нерва в результате развития глаукомы и потери нервных клеток. Определенную композицию и способы по настоящему изобретению можно использовать для лечения воспаления, возникающего в результате болезненных состояний или различных травм, таких как физически или химически индуцированное воспаление. Такие заболевания могут включать ангиит, хронический бронхит, панкреатит, остеомиелит, ревматоидный артрит, гломерулонефрит, оптический неврит, височный артериит, энцефалит, менингит, поперечный миелит, дерматомиозит, полимиозит, некротизирующий фасцит, гепатит и некротизирующий энтероколит. Имеются доказательства того, что активированные астроциты могут играть цитотоксическую роль в отношении нейронов, продуцируя нейротоксины. Окись азота, реактивные формы кислорода и цитокины высвобождаются из глиальных клеток в ответ на церебральную ишемию (см. Becker K.J., 2001. TargetingRes. 301: 173-187). Позднее в результате проведенных исследований было показано на моделях нейродегенерации, что активирование глии и последующая продукция цитокинов воспаления зависит от первичного повреждения нейронов (см. Viviani В., Corsini E., Galli C.L., Padovani A., Ciusani E. and Marinovich M.,2000. Dying neural cells activate glia through the release of a protease product. Glia 32: 84-90 and Rabuffettithrough apoptosis reduction and decrease of proinflammatory cytokines. J. Neurosci. 20: 4398-4404). Воспаление и активирование глии являются общими признаками различных форм нейродегенеративных нарушений, включая церебральную ишемию, травму мозга и экспериментальный аллергический энцефаломиелит, нарушения, при которых эритропоэтин проявляет защитное действие в отношении нервной ткани. Подавление продукции цитокинов под действием эритропоэтина может, по меньшей мере, частично опосредовать его защитное действие. Однако оказалось, что, в отличие от классических противовоспалительных цитокинов, таких как IL-10 и IL-13, которые непосредственно подавляют продукцию фактора некроза опухолей, эритропоэтин активен только при наличии гибели нейронов. Не желая связываться какой-либо теорией, выяснили, что данную противовоспалительную активность гипотетически можно объяснить несколькими неограничивающими теоретическими предположениями. Первое, поскольку эритропоэтин предупреждает апоптоз, то будут предупреждаться воспалительные события, индуцируемые апоптозом. Кроме того, эритропоэтин может предупреждать высвобождение сигнальных молекул из погибающих нейронов, которые стимулируют глиальные клетки и могут непосредственно воздействовать на глиальные клетки, снижая их реакцию на данные продукты. Другой возможностью является то, что действие эритропоэтина направлено на более удаленные члены каскада развития воспаления (например, каспазу 1, реактивный кислород или азотсодержащие промежуточные соединения), которые индуцируют как апоптоз, так и воспаление. Кроме того, оказалось, что эритропоэтин обеспечивает защиту от воспаления, не оказывая побочного действия, обычно характерного для других противовоспалительных средств, таких как дексаметазон. Вновь повторяясь, не желая связываться какой-либо конкретной теорией, выяснили, что это может быть в результате влияния эритропоэтина на многоцелевые нейротоксины, такие как окись азота (NO). Несмотря на то, что активированные астроциты и микроглия продуцируют нейротоксические количестваNO в ответ на различные травмы, NO играет многоцелевую роль в организме, включая модуляцию основных физиологических функций. Таким образом, несмотря на то, что применение противовоспалительного средства может ослабить воспаление посредством подавления продукции NO и других нейротоксинов, если противовоспалительное действие является слишком длительным, то оно будет мешать процессу восстановления тканей в результате травмы, вызывающей воспаление. Гипотетически можно предположить, что тканевые протективные цитокины по настоящему изобретению способны ослаблять воспаление, не нарушая восстановительную функцию нейротоксинов, таких как NO. Настоящее изобретение обеспечивает композиции, содержащие один или более тканевых протективных цитокинов и одно или более профилактических или терапевтических средств (т.е. активных средств), иных, чем тканевые протективные цитокины, и способы профилактики, лечения или ослабления одного или более симптомов, характерных для воспаления реактивных клеток млекопитающих и связанных с ними клеток, тканей и органов, у млекопитающего, включающих введение указанному млекопитающему одной или более указанных композиций. Настоящее изобретение также обеспечивает композиции, содержащие один или более тканевых протективных цитокинов, и способы профилактики, лечения или ослабления одного или более симптомов, связанных с воспалением реактивных клеток млекопитающих и связанных с ними клеток, тканей и органов у млекопитающего, включающие введение указанному млекопитающему одной или более указанных композиций, где композиции вводят в комбинации с одним или более профилактическим или терапевтическим средством, иным, чем тканевые протективные цитокины. Воспаление может быть вызвано травмой или заболеванием, таким, но не ограничиваясь этим, как астма, энцефалит, воспалительное заболевание кишечника, хроническое обструктивное заболевание легких (COPD), артрит или аллергическое расстройство. Терапевтические или профилакти- 19010371 ческие средства включают, но не ограничиваются пептидами, полипептидами, гибридными белками,молекулами нуклеиновых кислот, небольшими молекулами, миметическими средствами, синтетическими лекарственными препаратами, неорганическими молекулами и органическими молекулами. Любое средство, о котором известно, что оно является полезным, или которое использовалось или используется в настоящее время для профилактики, лечения или ослабления одного или более симптомов, связанных с воспалением, можно использовать в комбинации с тканевым защитным цитокином по изобретению, описанным здесь. Примеры таких средств включают, но не ограничиваются дерматологическими средствами для лечения высыпаний и отеков (например, фототерапией (т.е. ультрафиолетовое облучение В), фотохимиотерапией (например, PUVA) и средствами для местного применения, такими как смягчающие вещества, салициловая кислота, каменно-угольная смола, стероиды для местного применения, кортикостероиды для местного применения, аналоги витамина D3 для местного применения (например, кальципотриен), тазаротен и ретиноиды для местного применения), противовоспалительными средствами, например кортикостероидами (например, преднизоном и гидрокортизоном), глюкокортикоидами, стероидами,нестероидными противовоспалительными средствами (например, аспирином, ибупрофеном, диклофенаком и ингибиторами СОХ-2), бета-агонистами, антихолинергическими препаратами и метилксантинами,иммуномодулирующими средствами (например, небольшими органическими молекулами, модуляторами рецепторов Т-клеток, модуляторами рецепторов цитокинов, элиминирующими Т-клетки средствами,антагонистами цитокинов, антагонистами монокинов, ингибиторами лимфоцитов или противоопухолевыми средствами), инъекционными препаратами на основе золота, сульфазалазином, пеницилламином,противоангиогенными средствами (например, ангиостатином, антагонистами TNF- (например, антителами против TNF-) и эндостатином), дапсоном, псораленами (например, метоксиленом и триоксаленом), антималярийными средствами (например, гидроксихлорквином), противовирусными средствами и антибиотиками (например, эритромицином и пенициллином). В способах и композициях по изобретению можно использовать любое иммуномодулирующее средство, хорошо известное специалистам в данной области. Иммуномодулирующее средство может оказывать воздействие на один или более или все аспекты иммунного ответа у субъекта. Аспекты иммунного ответа включают, но не ограничиваются воспалительной ответной реакцией. В предпочтительном воплощении изобретения введение иммуномодулирующего средства субъекту приводит к подавлению или снижению одного или более аспектов способности субъекта к иммунному ответу. В конкретном воплощении изобретения иммуномодулирующее средство ингибирует или подавляет воспалительную ответную реакцию у субъекта. В одном воплощении тканевой протективный цитокин по изобретению вводят в комбинации с одним или более иммуномодулирующих средств для лечения, т.е. ослабления симптомов, или для профилактики воспаления. Примеры иммуномодулирующих средств включают, но не ограничиваются белковыми средствами,такими как цитокины, пептидные миметики и антителами (например, человеческими, гуманизированными,химерными, моноклональными, поликлональными, фрагментами Fvs, ScFvs, Fab или F(ab)2 или фрагментами связывающих эпитопов), молекулами нуклеиновых кислот (например, молекулами антисмысловой нуклеиновой кислоты и тройными спиралями), малыми молекулами, органическими соединениями и неорганическими соединениями. В частности, иммуномодулирующие средства включают, но не ограничиваются метотрексатом, лефлуномидом, циклофосфамидом, цитоксаном, иммураном, циклоспорином А,миноциклином, азатиоприном, антибиотиками (например, FK506 (такролимусом, метилпреднизолоном(МР), кортикостероидами, стероидами, микофенолатом мофетилом, рапамицином (сиролимусом), мизорибином, дезоксиспергуалином, бреквинаром, малононитрилоамидами (например, лефлунамидом), модуляторами рецепторов Т-клеток и модуляторами рецепторов цитокинов. Примеры модуляторов рецепторов Т-клеток включают, но не ограничиваются антителами против рецепторов Т-клеток (например, антиCD4-антителами (например, сМ-Т 412 (Boeringer), IDEC-CE9.1 (IDEC и SKB), mAB4162W94, Orthoclone и OKTcdr4a (Janssen-Cilag, анти-CD3-антителами, анти-CD5-антителами (например, связанный с рицином иммуноконъюгат против CD5), анти-CD7-антителами (например, СНН-380 (Novartis, анти-CD8 антителами, моноклональными антителами против лиганда CD40, анти-CD52-антителами (например,CAMPATH 1H (Ilex, анти-CD2-моноклональными антителами) и CTLA4-иммуноглобулином. Примеры модуляторов рецепторов цитокинов включают, но не ограничиваются растворимыми рецепторами цитокинов (например, внеклеточным доменом TNFрецепторов или его фрагментами, внеклеточным доменом IL-1-рецепторов или его фрагментами и внеклеточным доменом IL-6-рецепторов или его фрагментами), цитокинами или их фрагментами (например, интерлейкином (IL)-2, IL-3, IL-4, IL5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-15, TNF-, TNF-, интерфероном, (IFN)-, IFN-, IFN- иGM-CSF), антителами против рецепторов цитокинов (например, антителами против рецептора IL-2, антителами против рецептора IL-4, антителами против рецептора IL-6, антителами против рецептора IL-10,антителами против рецептора IL-12), антителами против цитокинов (например, антителами против рецептора IFN, анти-TNFантителами, анти-IL-1-антителами, анти-IL-6-антителами и анти-IL-12-антителами). В конкретном воплощении модулятор рецепторов цитокинов представляет IL-4, IL-10 или их фрагменты. В другом воплощении модулятор рецепторов цитокинов представляет анти-IL-1-антитело,- 20010371 анти-IL-6-антитело, антитело против рецептора IL-12, анти-TNF-антитело. В другом воплощении модулятор рецепторов цитокинов представляет внеклеточный домен рецептора TNF- или его фрагмент. В некоторых воплощениях модулятор рецепторов цитокинов не является антагонистом TNF-. В предпочтительном воплощении белки, полипептиды или пептиды (включая антитела), которые применяются в качестве иммуномодулирующих средств, получены от того же вида, к какому относится реципиент белков, полипептидов или пептидов для снижения вероятности проявления иммунного ответа на данные белки, полипептиды или пептиды. В другом предпочтительном воплощении в тех случаях,когда субъект является человеком, то белки, полипептиды или пептиды, которые используются в качестве иммуномодулирующих средств, являются человеческими или гуманизированными. По изобретению одно или более иммуномодулирующих средств вводят субъекту с воспалением до,после или одновременно с терапевтическими и/или профилактическими средствами по изобретению. Предпочтительно один или более иммуномодулирующих средств вводят субъекту с воспалением для снижения или подавления одного или более аспектов иммунного ответа, если это необходимо. Можно использовать любую методику, хорошо известную специалистам в данной области, для определения одного или более аспектов иммунного ответа у конкретного субъекта и при этом установить, когда необходимо вводить иммуномодулирующее средство указанному субъекту. В предпочтительном воплощении одно или более иммуномодулирующих средств вводят субъекту с воспалением таким образом, чтобы временно уменьшить или подавить один или более аспектов иммунного ответа. Такое временное подавление или уменьшение одного или более аспектов иммунной системы может продлиться в течение часов, суток, недель или месяцев. Предпочтительно, чтобы временное подавление или уменьшение иммунного ответа продолжалось в течение нескольких часов (например, 2,4, 6, 8, 12, 14, 16, 18, 24, 36 или 48 ч), нескольких суток (например, 3, 4, 5, 6, 7 или 14 суток) или нескольких недель (например, 3, 4, 5, 6 недель). Временное снижение или подавление одного или более аспектов иммунного ответа повышает профилактическую и/или терапевтическую эффективность тканевого протективного цитокина. В одном воплощении изобретения иммуномодулирующее средство, которое уменьшает или истощает количество Т-клеток, предпочтительно Т-клеток памяти, вводят субъекту с воспалением согласно способам по изобретению. См., например, патент США 4658019. В другом воплощении иммуномодулирующее средство, которое инактивирует CD8+ Т-клетки, вводят субъекту с воспалением согласно способам по изобретению. В конкретном воплощении анти-CD8-антитела используют для снижения или истощения количества CD8+ Т-клеток. Взаимодействие CD40 лиганда (CD40L)-CD40 является желательной точкой для блокирования иммунного ответа за счет его широкого спектра активности для активации и функционирования хелперных Т-клеток, а также отсутствия избыточности в его сигнальном пути. Таким образом, в конкретном воплощении изобретения взаимодействие CD40L с CD40 временно блокируется во время введения одного или более иммуномодулирующих средств. Это можно осуществить обработкой средством, которое блокирует лиганд CD40 на клетках ТН и нарушает нормальное связывание лиганда CD40 на хелперных Т-клетках с антигеном CD40 на В-клетках. Антитело против лиганда CD40 (анти-CD40L) (производства Bristol-MyersSquibb Co.; см., например, заявку на европейский патент 555880, опубликованную 18 августа 1993 года) или молекулу растворимого CD40 можно выбрать и использовать в качестве иммуномодулирующего средства в способах по изобретению. Другие примеры иммуномодулирующих средств, которые можно использовать по изобретению включают, но не ограничиваются кортикостероидами, азатиоприном, микофенолатом мофетилом, циклоспорином А, гидрокортизоном, FK506, метотрексатом, лефлуномидом и циклофосфамидом. Было показано, что короткий курс циклофосфамида приводит к эффективному прерыванию активирования CD4+ и CD8+ Т-клеток на аденовирусный капсидный белок (Jooss et al., 1996, Hum. Gene Ther. 7: 1555-1566). Обработка гидрокортизоном или циклоспорином А успешно применяется для снижения индукции цитокинов, некоторые из которых могут участвовать в элиминации бактериальных инфекций и воспаления. Молекулы нуклеиновых кислот, кодирующих белки, полипептиды или пептиды с иммуномодулирующей активностью, или белки, полипептиды или пептиды с иммуномодулирующей активностью можно вводить субъекту с воспалением по способам по настоящему изобретению. Кроме того, молекулы нуклеиновых кислот, кодирующих производные, аналоги, фрагменты или варианты белков, полипептидов или пептидов с иммуномодулирующей активностью, или производные, аналоги, фрагменты или варианты белков, полипептидов или пептидов с иммуномодулирующей активностью можно вводить субъекту с воспалением по способам по изобретению. Предпочтительно такие производные, аналоги, фрагменты или варианты сохраняют иммуномодулирующую активность полноразмерного белка, полипептида или пептида дикого типа. Белки, полипептиды или пептиды, которые можно использовать в качестве иммуномодулирующего средства, можно получить любой методикой, хорошо известной в данной области или описанной здесь. См., например, Chapter 16 Ausubel et al. (eds.), 1999, Short Protocols in Molecular Biology, Fourth Edition,John WileySons, NY, где описаны способы получения белков, полипептидов или пептидов и которая- 21010371 полностью включена здесь для ссылки. Антитела, которые могут быть использованы в качестве иммуномодулирующего средства, можно получить, например, с использованием способов, описанных в патенте США 6245527 и в Harlow and Lane Antibodies: A Laboratory Manual, Cold Spring Harbor LaboratoryPress, Cold Spring Harbor, NY, 1988, которые включены здесь полностью для ссылки. Предпочтительно в композициях и способах по изобретению используют промышленно доступные и известные в качестве иммуномодулирующих средства. Иммуномодулирующую активность средства можно определить в условиях in vitro и/или in vivo при использовании любой методики, хорошо известной в данной области,включая, например, тесты CTL, анализ пролиферации и иммуноанализ (например, ELISA), для экспрессии конкретных белков, таких как состимулирующие молекулы или цитокины. Определенные композиции и способы по изобретению можно использовать для лечения состояний и повреждений ткани сетчатки. Такие нарушения включают, но не ограничиваются ишемией сетчатки,дегенерацией желтого пятна, отслоением сетчатки, пигментным ретинитом, атеросклеротической ретинопатией, гипертензивной ретинопатией, блокадой артерий сетчатки, блокадой вен сетчатки, гипотензией и диабетической ретинопатией. В другом воплощении способы и принципы по изобретению можно использовать для защиты от или лечения повреждения, возникшего в результате облучения возбудимой ткани. Дополнительной применимостью способов по настоящему изобретению является лечение отравления нейротоксинами, такими как домоковая кислота из ракообразных, нейролатиризм и болезнь Гуама, амиотрофического бокового склероза и болезни Паркинсона. Как уже указывалось выше, настоящее изобретение также относится к способу стимуляции функциональной активности возбудимой ткани у млекопитающего периферическим введением тканевого протективного цитокина, описанного выше. Различные заболевания и состояния поддаются лечению с использованием данного способа, и дополнительно данный способ пригоден для повышения познавательной функции при отсутствии какого-либо состояния или заболевания. Данные применения настоящего изобретения описаны подробно ниже и включают стимуляцию усвоения и обучаемости как у человека, так и не относящихся к человеку млекопитающих. Состояния и заболевания, поддающиеся лечению способами по данному аспекту настоящего изобретения, относящиеся к центральной нервной системе, включают, но не ограничиваются эмоциональными расстройствами, тревогой, депрессией, аутизмом, дефицитом внимания, гиперактивными расстройствами и нарушениями познавательной функции. На данные состояния положительное действие оказывает стимуляция функциональной активности нейронов. Другие состояния, поддающиеся лечению согласно принципам настоящего изобретения, включают нарушение сна, например апноэ во сне и связанные с поездками расстройства; субарахноидальные и связанные с аневризмами кровотечения, гипотензивный шок, сотрясение мозга, септический шок, анафилактический шок и осложнения после различных видов энцефалита и менингита, например церебрит, связанный с заболеваниями соединительной ткани, например волчанка. Другие применения включают профилактику или защиту от отравления нейротоксинами,такого как отравление домоковой кислотой из ракообразных и болезнь Гуана, амиотрофического бокового склероза; болезни Паркинсона; послеоперационного лечения эмболических или ишемических повреждений; полного облучения мозга; кризиса у больных с серповидно-клеточной анемией и эклампсии. Дополнительная группа состояний, поддающихся лечению способами по настоящему изобретению,включает нарушение функций митохондрий, наследственной или приобретенной природы, что является причиной различных неврологических заболеваний, для которых характерны повреждение и гибель нейронов. Например, заболевание Лейдига (подострая некротизирующая энцефалопатия) характеризуется прогрессирующей потерей зрения и энцефалопатией за счет снижения количества нейронов и миопатией. В таких случаях нарушенный метаболизм митохондрий не способен поставлять высокоэнергетические субстраты в качестве источников энергии для метаболизма возбудимых клеток. Модулятор активности рецепторов эритропоэтина оптимизирует нарушенную функциональную активность при различных заболеваниях, опосредуемых митохондриями. Как уже указывалось выше, гипоксия оказывает отрицательное влияние на возбудимые ткани. Возбудимые ткани включают, но не ограничиваются тканью центральной нервной системы, тканью периферической нервной системы и тканью сердца. В дополнение к состояниям, описанным выше, способы по настоящему изобретению пригодны для лечения ингаляционных отравлений, таких как отравление окисью углерода и табачным дымом, тяжелая астма, дыхательный дистресс-синдром у взрослых, удушье и глубокое погружение. Дополнительные состояния, которые приводят к развитию гипоксии или иначе индуцируют повреждение возбудимых тканей, включают гипогликемию, которая может иметь место при несоответствующем дозировании инсулина или при развитии продуцирующих инсулин новообразований (инсулиномы). Полагается, что различные невропсихические расстройства, возникающие в результате повреждения возбудимых тканей, поддаются лечению настоящими способами. Хронические нарушения, при которых имеется повреждение нейронов и для которых обеспечивается лечение по настоящему изобретению, включают расстройства, относящиеся к центральной нервной системе и/или периферической нервной системе, в том числе возрастное снижение познавательной функции и старческую деменцию, хронические припадки, болезнь Альцгеймера, болезнь Паркинсона, деменцию, потерю памяти, амиотрофиче- 22010371 ский боковой склероз, рассеянный склероз, туберозный склероз, болезнь Вилсона, церебральный и прогрессирующий супрануклеарный паралич, болезнь Гуама, деменцию Леви, прионные заболевания, такие как спонгиозные энцефалопатии, например болезнь Крейцфельда-Якоба, болезнь Хантингтона, миотоническую дистрофию, атаксию Фрейдриха и другие виды атаксии, а также синдром Жиль де ля Туррета,припадки, такие как эпилепсия и хронические припадки, кровоизлияние, травму головного и спинного мозга, деменцию при СПИДе, алкоголизм, аутизм, ишемию сетчатки, глаукому, расстройства автономной функции, такие как гипертензия и нарушения сна, и невропсихические расстройства, которые включают, но не ограничиваются шизофренией, шизоаффективным расстройством, дефицитом внимания,дистимическим расстройством, основным депрессивным нарушением, манией, обсессивно-компульсивным расстройством, нарушениями в результате применения психотропных препаратов, тревогой, паническим расстройством, а также униполярными и биполярными аффективными расстройствами. Дополнительные невропсихические и нейродегенеративные заболевания включают, например, перечисленные в справочнике Американской ассоциации психиатров по диагностике и статистике психических заболеваний (DSM), самом последнем издании, которое включено здесь для ссылки. В другом воплощении можно использовать молекулы рекомбинантных химерных токсинов, содержащих эритропоэтин, для терапевтической доставки токсинов для лечения нарушения пролиферации,такого как опухоль, или вирусных заболеваний, таких как подострый склерозирующий панэнцефалит. В последующей таблице приведены в качестве примеров неограничивающие указания различных состояний или заболеваний, поддающихся лечению вышеуказанными тканевыми протективными цитокинами. Как уже указывалось выше, данные заболевания, расстройства и состояния являются только иллюстративными для демонстрации пределов полезного действия, оказываемого тканевыми протективными цитокинами по изобретению. Следовательно, в общем, данное изобретение обеспечивает терапевтическое или профилактическое лечение последствий механической травмы или заболеваний человека. Терапевтическое или профилактическое лечение заболеваний, расстройств или состояний ЦНС и/или периферической нервной системы является предпочтительным. Обеспечивается терапевтическое или профилактическое лечение заболеваний, расстройств или состояний, которые имеют психический компонент. Обеспечивается терапевтическое или профилактическое лечение заболеваний, расстройств или состояний, включая, но не ограничиваясь таковыми, имеющими офтальмологический, сердечно-сосудистый,кардиопульмональный, респираторный, почечный, мочевой, репродуктивный, желудочно-кишечный,эндокринный или обменный компонент. Специалисты в данной области, очевидно, понимают, что фармацевтическую композицию по настоящему изобретению можно получить из смеси тканевых протективных цитокинов по настоящему изобретению, а также эритропоэтина. В одном воплощении такую фармацевтическую композицию эритропоэтина или тканевого протективного цитокина можно вводить системно для защиты или стимуляции мишеневых клеток, ткани или органа. Такое введение может быть парентеральным, ингаляционным или через слизистую, например пероральным, интраназальным, ректальным, интравагинальным, сублингвальным, под слизистую и трансдермальным. Предпочтительным путем введения является парентеральный, например посредством внутривенной или внутрибрюшинной инъекции, и также включая, но не ограничиваясь внутриартериальным, внутримышечным или подкожным введением. Для других путей введения, например при применении перфузата, инъекции в орган или при дру- 27010371 гом местном применении, можно обеспечить фармацевтическую композицию, которая будет обеспечивать аналогичные концентрации тканевого протективного цитокина, описанного выше. Предпочтительной является концентрация примерно 15 пМ-30 нМ. Фармацевтические композиции по изобретению могут содержать терапевтически эффективное количество соединения и фармацевтически приемлемый носитель. В конкретном воплощении термин фармацевтически приемлемый означает разрешенный официальным государственным управлением или правительством штата или имеющийся в Фармакопее США или других общепринятых иностранных фармакопеях для применения на животных, и конкретнее на людях. Термин носитель относится к разбавителю, адъюванту, наполнителю или растворителю, с которыми можно вводить лекарственное средство. Также фармацевтические носители могут представлять собой стерильные жидкости, такие как солевые растворы на воде и маслах, включая вазелин, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. Физиологический раствор является предпочтительным носителем, когда фармацевтическую композицию вводят внутривенно. Солевые растворы и водные растворы декстрозы и глицерина также можно использовать в качестве жидких носителей, в частности, для инъекционных растворов. Подходящие фармацевтические наполнители включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел,силикагель, стеарат натрия, глицерилмоностеарат, тальк, хлорид натрия, сухое обезжиренное молоко,глицерин, пропиленгликоль, воду, этанол и т.п. Композиция, если желательно, может содержать небольшие количества смачивающих веществ, или эмульгаторов, или буферных веществ, регулирующих рН. Данные композиции могут быть в виде растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, композиций для длительного введения и т.п. Композицию можно получить в виде суппозитория с традиционно применяемыми связующими веществами и наполнителями, такими как триглицериды. Соединения по изобретению можно формулировать в виде нейтральных веществ или солей. Фармацевтически приемлемые соли включают таковые, образованные свободными аминогруппами, производные соляной, фосфорной, уксусной, щавелевой, винной кислот и т.д. и таковые, образованные свободными карбоксильными группами, производные натрия, калия, аммония, кальция, гидроокиси железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.д. Примеры подходящих фармацевтических носителей описаны в Remington's Pharmaceutical Sciences, E.W. Martin. Такие композиции будут содержать терапевтически эффективное количество соединения, предпочтительно в очищенной форме, вместе с соответствующим количеством носителя для обеспечения формы для правильного введения пациенту. Композиция должна соответствовать способу введения. Фармацевтические композиции, адаптированные для перорального введения, могут быть обеспечены в виде капсул, или таблеток, или порошков, или гранул; в виде растворов, сиропов и суспензий (в водных и неводных жидкостях); в виде пищевых пенок, или взбитых продуктов, или эмульсий. Таблетки или твердые желатиновые капсулы могут содержать лактозу, крахмал или их производные, стеарат магния, сахарин натрия, целлюлозу, карбонат магния, стеариновую кислоту или ее соли. Мягкие желатиновые капсулы могут содержать растительные масла, воска, жиры, полутвердые или жидкие полиолы и т.д. Растворы и сиропы могут включать воду, полиолы и сахара. Активный ингредиент, предназначенный для перорального введения, можно покрыть или смешать с веществом, которое замедляет распадаемость и/или всасывание активного вещества в желудочно-кишечном тракте (например, можно использовать глицерилмоностеарат или глицерилдистеарат). Так, можно достичь длительного высвобождения активного вещества в течение многих часов, и, если необходимо,активное вещество можно защитить от разложения в желудке. Фармацевтические композиции для перорального введения можно формулировать для облегчения высвобождения активного вещества в определенном участке желудочно-кишечного тракта за счет определенного значения рН или ферментативных условий. Фармацевтические композиции, адаптированные для трансдермального введения, могут быть обеспечены в виде отдельных пластырей, предназначенных для тесного контакта с эпидермисом реципиента в течение длительного периода времени. Фармацевтические композиции, адаптированные для местного применения, могут быть обеспечены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для местного применения на кожу, ротовую полость, глаза или другие наружные ткани предпочтительно использовать мазь или крем для местного применения. При получении мази активный ингредиент можно использовать с парафиновой или смешивающейся с водой основой для мази. Альтернативно активный ингредиент можно формулировать в виде крема с основой масло-в-воде или вода-в-масле. Фармацевтические композиции, адаптированные для местного применения в глаза, включают глазные капли. В данных композициях активный ингредиент можно растворить или суспендировать в подходящем носителе, например водном растворителе. Фармацевтические композиции, адаптированные для местного применения в ротовой полости, включают лозенджис, пастилки и жидкости для полоскания ротовой полости. Фармацевтические композиции, адаптированные для интраназального и пульмонального введения,могут включать твердые носители, такие как порошки (предпочтительно с размером частиц в пределах от 20 до 500 мкм). Порошки можно вводить таким же образом, как принимают порошок для вдыхания,- 28010371 т.е. быстрым вдыханием через нос из контейнера с порошком, держа его близко к носу. Альтернативно,композиции, предназначенные для интраназального введения, могут содержать жидкие носители, например они могут находиться в виде назальных спреев или капель для носа. Альтернативно, можно проводить ингаляцию соединений непосредственно в легкие при глубоком вдыхании или вдувании через ротовое отверстие в ротоглотку. Данные композиции могут представлять собой водные или масляные растворы активного ингредиента. Композиции для введения ингаляцией могут поставляться в специально адаптированных устройствах, включая, но не ограничиваясь аэрозолями под давлением, распылителями или инсуффляторами, которые можно сконструировать таким образом, что они обеспечивают заранее определенные дозы активного ингредиента. В предпочтительном воплощении фармацевтические композиции по изобретению вводят в носовую полость непосредственно или в легкие через носовую полость или ротоглотку. Фармацевтические композиции, адаптированные для ректального введения, можно обеспечить в виде суппозиториев или клизм. Фармацевтические композиции, адаптированные для интравагинального введения, можно обеспечить в виде вагинальных суппозиториев, тампонов, кремов, гелей, паст, пен или спреев. Фармацевтические композиции, адаптированные для парентерального введения, включают водные и неводные стерильные инъекционные растворы или суспензии, которые могут содержать антиоксиданты, буферы, бактериостатики и растворенные вещества, которые делают композиции, в основном, изотоническими по отношению к крови предполагаемого реципиента. Другие компоненты, которые могут находиться в таких композициях, включают, например, воду, спирты, полиолы, глицерин и растительные масла. Композиции, адаптированные для парентерального введения, могут находиться в контейнерах с одной или многими дозами, например в запаянных ампулах или флаконах, и они могут храниться в высушенном замораживанием (лиофилизованном) состоянии, для которых требуется только добавление стерильного жидкого носителя, например стерильного физиологического раствора для инъекций, непосредственно перед применением. Приготовленные экстемпоро инъекционные растворы и суспензии можно приготовить из стерильных порошков, гранул и таблеток. В одном воплощении автоматический инъектор, включающий инъекционный раствор эритропоэтина, можно обеспечить для неотложного введения в амбулаторных условиях, отделениях неотложной помощи и в военных условиях и даже для самостоятельного введения в домашних условиях, особенно в тех случаях, когда имеется вероятность ампутации в результате травмы, например при неосторожном обращении с газонокосилкой. Вероятность того, что клетки и ткани пострадавшей ступни или пальцев ноги приживутся после ретрансплантации,можно повысить введением эритропоэтина или тканевого протективного цитокина в несколько мест пострадавшего органа, как только возможно быстро, даже до появления медицинского персонала на месте или доставки пострадавшего с поврежденным пальцем ноги в отделение неотложной помощи. В предпочтительном воплощении композицию получают с использованием обычных методов в виде фармацевтической композиции, адаптированной для внутривенного введения людям. Как правило,композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. Там, где это требуется, композиция может включать солюбилизирующее вещество и местный анестетик, такой как лидокаин, для облегчения боли в месте инъекции. Обычно ингредиенты вводят либо по отдельности, либо их смешивают в разовой лекарственной форме, например в виде сухого лиофилизованного порошка или не содержащего воду концентрата в герметично закрытом контейнере,таком как ампула или саше, с указанием количества активного ингредиента. В случаях, когда композицию вводят инфузией, ее можно разлить в бутыли для инфузий, содержащих стерильную воду или физиологический раствор для фармацевтического применения. Если композицию вводят инъекционно, то ампулу со стерильным раствором можно обеспечить таким образом, чтобы ингредиенты можно было смешать перед введением. Суппозитории, как правило, содержат активный ингредиент в пределах от 0,5 до 10 мас.%; композиции для перорального введения содержат от 10 до 95% активного ингредиента. Можно обеспечить перфузат для применения в банях для органов, при перфузии in situ или для введения в сосудистую сеть донора органа до извлечения органа. Такие фармацевтические композиции могут содержать количества эритропоэтина, тканевых протективных цитокинов или форму эритропоэтина или тканевых протективных цитокинов, не подходящих для кратковременного или длительного, местного или системного введения индивидууму, но они должны отвечать функциям, предназначенным в данном случае для трупа, для бани для органов, для перфузата для органов или перфузата in situ перед удалением или при снижении количества эритропоэтина, содержащегося там, перед или после возвращения обрабатываемого органа или ткани к постоянному кровотоку. Эритропоэтин для данного аспекта изобретения может представлять собой любой эритропоэтин, например природный, например человеческий эритропоэтин, или любой из тканевых протективных цитокинов, описанных выше, например асиалоэритропоэтин и фенилглиоксальэритропоэтин, в качестве неограничивающих примеров. Настоящее изобретение обеспечивает фармацевтические композиции для лечения, профилактики и ослабления одного или более симптомов, связанных с воспалением. В конкретном воплощении композиция содержит один или более тканевых протективных цитокинов. В другом воплощении композиция- 29010371 содержит один или более тканевых протективных цитокинов и одно или более профилактических или терапевтических средств, иных, чем тканевые протективные цитокины, где известно, что указанные профилактические или терапевтические средства пригодны, или использовались ранее, или используются в настоящее время для профилактики, лечения или ослабления одного или более симптомов, связанных с воспалением. В предпочтительном воплощении композиция по изобретению представляет собой фармацевтическую композицию. Такие композиции содержат профилактически или терапевтически эффективное количество одного или более профилактических или терапевтических средств (например, тканевого протективного цитокина или другого профилактического или терапевтического средства) и фармацевтически приемлемый носитель. В одном воплощении терапевтически эффективное количество означает количество средства, которое необязательно является эффективным, когда средство вводят самостоятельно, но оно становится эффективным, когда его вводят совместно с другим средством. Изобретение также обеспечивает фармацевтическую упаковку или набор, содержащий один или более контейнеров, заполненных одним или более ингредиентами, входящими в состав фармацевтических композиций по изобретению. Необязательно связанным с контейнером(ами) может быть указание с информацией в форме, предписанной государственным управлением, регулирующим производство,применение или продажу фармацевтических препаратов или биологических продуктов, где указание отражает разрешение агентства на производство, применение и продажу для введения человеку. В частности, изобретение обеспечивает, что одно или более профилактических или терапевтических средств или фармацевтические композиции по изобретению упакованы в герметично закрытом контейнере, таком как ампула или саше, с указанием количества средства. В одном воплощении одно или более профилактических или терапевтических средств или фармацевтические композиции по изобретению поставляются в виде сухого, стерильного, лиофилизованного порошка или не содержащего воду концентрата в герметично закрытом контейнере, и они могут быть восстановлены, например, с помощью воды или физиологического раствора до соответствующей концентрации для введения субъекту. Предпочтительно одно или более профилактических или терапевтических средств или фармацевтические композиции по изобретению поставляются в виде сухого, стерильного, лиофилизованного порошка в герметично закрытом контейнере с разовой лекарственной формой в количестве по меньшей мере 5 мг,более предпочтительно по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 25 мг, по меньшей мере 35 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 75 мг или по меньшей мере 100 мг. Лиофилизованные профилактические или терапевтические средства или фармацевтические композиции по изобретению следует хранить при температуре в пределах 2-8 С в исходном контейнере, и профилактические или терапевтические средства или фармацевтические композиции по изобретению следует вводить в течение 1 недели, предпочтительно 5 суток, в течение 72 ч, в течение 48 ч, в течение 24 ч, в течение 12 ч, в течение 6 ч, в течение 5 ч, в течение 3 ч или в течение 1 ч после восстановления. В альтернативном воплощении одно или более профилактических или терапевтических средств или фармацевтические композиции по изобретению поставляются в жидкой форме в герметично закрытом контейнере с указанием количества и концентрации средства. Предпочтительно жидкую форму композиции для введения поставляют в герметично закрытом контейнере в концентрации по меньшей мере 0,25 мг/мл, более предпочтительно по меньшей мере 0,5 мг/мл, по меньшей мере 1 мг/мл, по меньшей мере 2,5 мг/мл, по меньшей мере 5 мг/мл, по меньшей мере 8 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 15 мг/мл, по меньшей мере 25 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 75 мг/мл или по меньшей мере 100 мг/мл. Жидкую форму следует хранить при температуре в пределах 2-8 С в ее исходном контейнере. Композиция может, если желательно, находиться в упаковке или распределительном устройстве,которое может содержать одну или более разовых лекарственных форм, включающих активный ингредиент. Упаковка может быть, например, из металлической или пластиковой фольги, такой как блистер. К упаковке или распределительному устройству могут прилагаться инструкции для применения. В основном, ингредиенты композиции по изобретению получают от субъекта тогоже вида или видовой реактивности, что и реципиент таких композиций. Так, в предпочтительном воплощении человеческие или гуманизированные антитела вводят человеку для лечения или профилактики. В другом воплощении, например, тканевой протективный цитокин можно вводить в системе с контролируемым высвобождением. Например, полипептид можно вводить с использованием внутривенной инфузии, имплантируемого осмотического насоса, трансдермального пластыря, липосом или других способов введения. В одном воплощении можно использовать насос (см. Langer, выше; Sefton, 1987, CRCCrit. Ref. Biomed. Eng. 14: 201; Buchwald et al., 1980, Surgery 88: 507; Saudek et al., 1989, N. Engl. J. Med. 321: 574). В другом воплощении соединение можно вводить в везикуле, в частности липосоме (см.Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp.353-365 (1989); заявку WO91/04014; патент США 4704355; Lopez-Berestein, там же, pp.317-327; см., в основном, там же). В другом воплощении можно использовать полимерные материалы (см. Medical Applications of Controlled Release, Langer and
МПК / Метки
МПК: A61K 45/00, A61K 38/19
Метки: реактивных, восстановления, тканей, защиты, клеток, тканевые, органов, протективные, цитокины, стимуляции
Код ссылки
<a href="https://eas.patents.su/30-10371-tkanevye-protektivnye-citokiny-dlya-zashhity-vosstanovleniya-i-stimulyacii-reaktivnyh-kletok-tkanejj-i-organov.html" rel="bookmark" title="База патентов Евразийского Союза">Тканевые протективные цитокины для защиты, восстановления и стимуляции реактивных клеток, тканей и органов</a>
Предыдущий патент: Производные пиримидин-2,4-диона в качестве антагонистов рецептора гонадотропин-высвобождающего гормона
Следующий патент: Диспергируемая во рту фармацевтическая композиция антитромботического соединения
Случайный патент: Катехоламиновые производные, полезные для лечения болезни паркинсона