Композиции на основе производных липопептидных антибиотиков и способы их применения
Номер патента: 10294
Опубликовано: 29.08.2008
Авторы: Вакович-Сгарби Ширли А., Чен Юхен, Курран Вильям В., Сгарби Паоло В.М., Нодвелл Мэтью, Лиз Ричард А., Джиа Кьюи, Камерон Дэйл Р., Дугорд Доминик, Бордерс Дональд Б., Бойд Винсент А.
Формула / Реферат
1. Противомикробное соединение и его фармацевтически приемлемые соли структурной формулы (II)
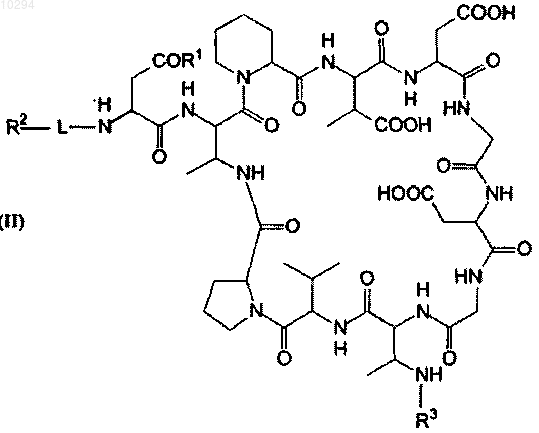
где
R1 представляет собой ОН или NH2;
L выбран из по меньшей мере одной аминокислоты, по меньшей мере одной замещенной аминокислоты, -R'C(=O)-, -R'OC(=O)(NR')- и -O-PhC(=O)-;
R2 выбран из -C(=O)R5, -C(=O)OR5, -C(=O)NHR4, -C(=O)NR4R4, -C(=S)NHR4, -C(=S)NR4R4,
-C(=NR4)NHR4 и -C(=NR4)NR4R4;
R3 выбран из группы: -OR5, -SR5, NR5R5, -CN, -NO2, -N3, -C(=O)R5, -C(=O)OR5, -C(=O)NR5R5,
-C(=S)NR5R5, -C(=NR5)NR5R5, -C(=O)H, -R5C(=O), -SO2R5, -S(=O)R5, -P(=O)(OR5)2, -P(=O)(OR5), -CO2H,
-SO3H, -PO3H, галоген, тригалометил, (C1-C25)алкил, замещенный (C1-C25)алкил, (C1-C25)гетероалкил, замещенный (C1-C25)гетероалкил, (С5-C10)арил, замещенный (С5-C10)арил, (С5-С15)ариларил, замещенный (C5-C15)ариларил, (С5-С15)биарил, замещенный (С5-С15)биарил, (5-10)-членный гетероарил, замещенный (5-10)-членный гетероарил, (C6-C26)арилалкил, замещенный (С6-С26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота;
R4 независимо выбран из группы (С7-C10)алкил, (С17-С26)арилалкил и (17-26)-членный гетероарилалкил с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидроксиалифатических составляющих с цепью, образуемой 7-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота;
R5 независимо выбран из группы: водород, (С1-C10)алкил, (C5-C10)арил, (5-10)-членный гетероарил, (С6-С26)арилалкил и (6-26)-членный гетероарилалкил, с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидроксиалифатических компонентов с цепью, образуемой 5-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота, или любая их комбинация;
R' независимо представляет собой один или несколько одинаковых или различных заместителей, определенных для R3 или R5.
2. Соединение по п.1, где R3 представляет собой по меньшей мере одну аминокислоту, выбранную из группы: глицин, b-аланин, саркозин, лизин; или любую их комбинацию, например, такую как две аминокислоты, выбранные из пар глицин-лизин или саркозин-лизин.
3. Соединение по п.1, где указанное соединение представляет собой соединение 91 из табл. 6D или соединение 331 или 332 из табл. 16, или соединение 86 из табл. 6D или соединение 87 или 280 из табл. 7, или соединение 89 из табл. 8.
4. Соединение по любому из пп.1-3, где L представляет собой по меньшей мере одну аминокислоту или по меньшей мере одну замещенную аминокислоту, выбранную из группы: п-аминофенилацетил, (п-аминофенилпропаноил)n, где n равняется 1 или 2, м-аминофенилацетил, (м-аминофенилпропаноил)n, где n равняется 1 или 2, о-аминофенилацетил, (о-аминофенилпропаноил)n, где n равняется 1 или 2, ГАМК (GABA), п-аминобензойная кислота (РАВА), м-аминобензойная кислота, о-аминобензойная кислота, п-гидразинобензойная кислота, м-гидразинобензойная кислота, о-гидразинобензойная кислота, п-амино-транс-циннамил, м-амино-транс-циннамил, о-амино-транс-циннамил, (S)-3-бензо[b]тиофен-3-ил-аминопропионовая кислота (L-BBTA); или любую их комбинацию.
5. Соединение по п.4, где R5 представляет собой алифатическую или гидроксиалифатическую составляющую с неразветвленной цепью, образованной 10-15 атомами углерода.
6. Соединение по любому из пп.1-5, где R3 представляет собой по меньшей мере одну аминокислоту, выбранную из группы: глицин (Gly), b-аланин, ГАМК (GABA), 5-аминопентановая кислота, 6-аминогексановая кислота, лизин (Lys), 2,4-диаминомаслянная кислота (gDab), саркозин (Sar), орнитин (Orn), диаминопропионовая кислота (Dap), гомолизин (hLys); или любую их комбинацию.
7. Соединение по любому из пп.1-6, где указанный R3 включает по меньшей мере одну защитную группу.
8. Противомикробное соединение и его фармацевтически приемлемые соли структурной формулы (IV)
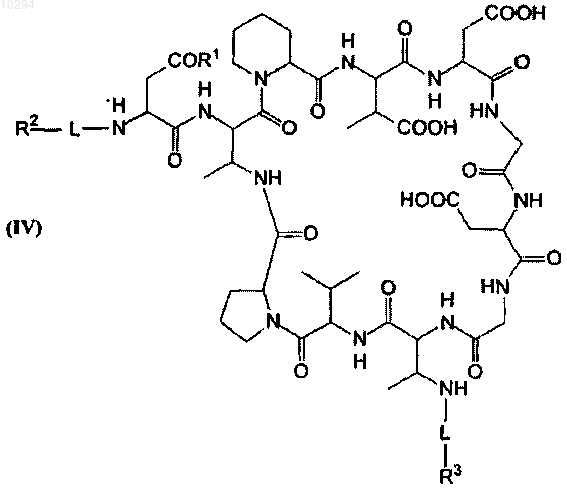
где R1 представляет собой ОН или NH2;
L независимо выбран из группы: по меньшей мере одна аминокислота, по меньшей мере одна замещенная аминокислота, -С(=O)-, -R'C(=O)-, -SO2-, -C(=S)-, -Р(=O)-, -ОР(=O)-, -ОС(=O)-,
-R'OC(=O)(NR')-, -NHC(=O)-, -O-PhC(=O)- и -NR'C (=O)-, при условии что L в Dab9 представляет собой
-С(=O)-;
R2 выбран из группы: -OR4, -SR4, NR4R4, -CN, -NO2, -N3, -C(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S) NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O), -SO2R4, -S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H, -PO3H, галоген, тригалометил, (С1-С25) алкил, замещенный (С1-С25)алкил, (С1-С25)гетероалкил, замещенный (С1-С25)гетероалкил, (С5-C10)арил, замещенный (С5-С10)арил, (С5-С15)ариларил, замещенный (С5-С15) ариларил, (С5-С15)биарил, замещенный (С5-С15)биарил, (5-10)-членный гетероарил, замещенный (5-10)-членный гетероарил, (С6-С26)арилалкил, замещенный (С6-С26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота;
R3 выбран из группы -C(=O)OR4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O),
-CO2H, замещенный (С1-С25)алкил, замещенный (С1-С25)гетероалкил, замещенный (С5-C10)арил, замещенный (C5-С15)ариларил, замещенный (С5-С15)биарил, замещенный (5-10)-членный гетероарил, замещенный (C6-C26)арилалкил, замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота, при условии что R3 содержит по меньшей мере один из -С(=O)-, -C(=S)- или -C(=NR4)-;
R4 независимо выбран из группы: водород, (С1-C10)алкил, (С5-C10)арил, (5-10)-членный гетероарил, (С6-С26)арилалкил и (6-26)-членный гетероарилалкил, с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидроксиалифатических компонентов с цепью, образуеьющ 5-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота, или любая их комбинация;
R' независимо представляет собой один или несколько одинаковых или различных заместителей, определенных для R2, R3 или R4.
9. Соединение по п.8, где указанное соединение представляет собой соединение 210, 373, 223, 237, 235, или 81 табл. 12.
10. Соединение по п.8 или 9, где R3 представляет собой по меньшей мере одну аминокислоту или замещенную аминокислоту, выбранную из группы: глицин (Gly), b-аланин, ГАМК (GABA), 5-аминопентановая кислота, 6-аминогексановая кислота, лизин (Lys), 2,4-диаминомаслянная кислота (gDab), саркозин (Sar), орнитин (Orn), диаминопропионовая кислота (Dap) и гомолизин (hLys).
11. Соединение по любому из пп.8-10, где по меньшей мере одна из групп L и R3 включает по меньшей мере одну защитную группу.
12. Противомикробное соединение и его фармацевтически приемлемые соли, где соединение представляет собой соединение 3 из табл. 1, или соединение 4 из табл. 10, или соединение 60 из табл. 13, или соединение 128 из табл. 16, или соединение 147 из табл. 1, или соединение 199 из табл. 10, или соединение 253 из табл. 4, или соединение 278 из табл. 4.
13. Фармацевтический состав, включающий противомикробное соединение по любому из пп.1-7 или 8-12 и фармацевтически приемлемый носитель, наполнитель или разбавитель.
14. Способ лечения микробной инфекции, включающий введение в организм субъекта, нуждающегося в лечении, соединения по любому из пп.1-7 или 8-12 или фармацевтической композиции по п.13.
15. Способ по п.14, где микробная инфекция вызвана грамположительными микроорганизмами, например, такими как Streptococcus, предпочтительно Streptococcus pyogenes, Streptococcus pneumoniae или Viridans Streptococcus; Staphylococcus, предпочтительно Staphylococcus aureus, Staphylococcus epidermidis или коагуляза-отрицательные Staphylococcus; Enterococcus, предпочтительно Enterococcus faecalis или Enterococcus faecium, Bacillus, Corynebacterium, дифтероидные микроорганизмы и Listeria.
16. Способ по п.14, где грамположительные микроорганизмы устойчивы к действию лекарственных препаратов.
17. Способ по п.16, где микроорганизмы, устойчивые к действию лекарственных препаратов, представляют собой устойчивые к пенициллину Streptococcus pneumoniae, имеющие умеренную устойчивость к пенициллину Streptococcus pneumoniae, или устойчивые к различным лекарственным препаратам Streptococcus, или устойчивые к метициллину Staphylococcus aureus, устойчивые к метициллину Staphylococcus epidermidis, имеющие умеренную устойчивость к ванкомицину Staphylococcus aureus, или устойчивые к различным лекарственным препаратам Staphylococcus, или устойчивые к ванкомицину Enterococcus или устойчивые к различным лекарственным препаратам Enterococcus.
18. Способ по любому из пп.14-17, где микробная инфекция выбрана из осложненой или неосложненной кожной инфекции, такой как импетиго; фолликулит; фурункулез, эктима; рожистое воспаление; воспаление рыхлой клетчатки; острая паронихия; панариций; некротизирующий фасцит; стафилококковый ожоговая кожная инфекция; воспаление лимфатических узлов; пресептальное воспаление рыхлой клетчатки или периорбитальное воспаление рыхлой клетчатки; инфекция хирургической раны; внутрибрюшная инфекция; инфекции мочеполового тракта; пиелонефрита; госпитальной инфекции, госпитальной пневмонии; инфекции, приобретенной в общественных местах; пневмонии, приобретенной в общественных местах, и инфекционного эндокардита.
Текст
010294 Область техники Настоящее изобретение относится, в основном, к лечению инфекционных заболеваний, в частности,к способам и соединениям для приготовления композиций на основе производных липопептидных антибиотиков, содержащих производные липопептидных антибиотиков, и их терапевтическому применению. Уровень техники В дополнение к иммунному ответу здорового индивида, терапевтические режимы, включающие применение антибиотиков, в настоящее время представляют собой основной курс лечения большинства инфекционных заболеваний в развитых странах. Липопептидные антибиотики являются важным классом антибиотиков, проявляющих противомикробную активность в отношении грамположительных бактерий. В основном, липопептидные антибиотики содержат либо циклическое пептидное ядро или циклическое депсипептидное ядро, ацилированное липофильным фрагментом. Длина липофильного фрагмента (например, ненасыщенной жирной кислоты) может варьировать, что влияет на активность данного липопептида. Однако из-за широкого применения антибиотиков устойчивость к данным и другим антибиотикам становится все более общей проблемой при лечении некоторых ранее излечимых инфекционных заболеваний во всем мире. Например, получают все более широкое распространение инфекции, вызываемые грамположительными, лекарственно-устойчивыми организмами, такими как ванкомицин-устойчивые энтерококки (Enterococci, VRE) и метициллин-устойчивые Staphylococcus aureus (MRSA). Более того, в большинстве случаев внутрибольничные инфекции вызываются грамположительными кокками и бактериями, обладающими устойчивостью по отношению ко многим антибиотикам, и количество таких случаев растет. Количество штаммов микроорганизмов, устойчивых к традиционным видам терапии с применением антибиотиков, непрерывно растет, вследствие чего возникает необходимость разработки новых антибиотиков и антибиотиков с новыми механизмами воздействия. Настоящее изобретение отвечает данной потребности, кроме того, обладает другими преимуществами. Краткое описание изобретения Настоящее изобретение предлагает производные липопептидов, в частности производные амфомицина или аспартоцина и композиции подобных липопептидов для применения в лечении или профилактике, например, в очаге первичной инфекции, при вторичной инфекции, возникшей на фоне первичного заболевания, или при инфекциях, связанных с попаданием инородных тел. Согласно одному аспекту настоящего изобретения предложены липопептидные антибиотики на основе амфомицина или аспартоцина, в которых антибиотик состоит из циклического пептидного ядра и липофильного заместителя. Циклическое пептидное ядро содержит одну или более аминокислот с боковой цепью, содержащей аминогруппу, и ее производные, обычно в положении 9 ядра макроциклического пептида. По одному примеру реализации аминокислота в положении 9 ядра макроциклического пептида представляет собой Dab9. Ядро макроциклического пептида включает также по меньшей мере одну экзоциклическую аминокислоту с концевой аминогруппой, причем обычно кислота представляет собой Asp или Asn. По другому примеру реализации экзоциклическая аминокислота с концевой аминогруппой занимает позицию между циклической частью ядра пептида и липофильным заместителем. Согласно другому аспекту настоящего изобретения, предложены противомикробное соединение и его фармацевтически приемлемые соли со структурой (IIa) R2-L-R-R3, где R представляет собой циклическое пептидное ядро амфомицина или аспартоцина; R' представляет собой ОН или группу NH2 аминокислоты ядра циклического пептида R в положении 1; L выбран из по меньшей мере одной аминокислоты, по меньшей мере одной замещенной аминокислоты, -R'C(=O)-, -R'OC(=O)(NR')- и -O-PhC(=O)-; R2 выбран из -С(=O)R5, -C(=O)OR5, -C(=O)NHR4, -C(=O)NR4R4, -C(=S)NHR4, -C(=S)NR4R4, -C(=NR4)NHR4 и-C(=NR4)NR4R4; R3 выбран из группы, включающей -OR5, -SR5, NR5R5, -CN, -NO2, -N3, -C(=O)R5,-C(=O)OR5, -C(=O)NR5R5, -C(=S)NR5R5, -C(=NR5)NR5R5, -C(=O)H, -R5C(=O), -SO2R5, -S(=O)R5,-P(=O)(OR5)2, -P(=O)(OR5), -CO2H, -SO3H, -PO3H, галоген, тригалометил, (С 1-С 25)алкил, замещенный (С 1 С 25)алкил, (С 1-С 25)гетероалкил, замещенный (С 1-С 25)гетероалкил, (C5-С 10)арил, замещенный (C5-C10) арил, (С 5-С 15) ариларил, (С 5-С 15)биарил, замещенный (С 5-С 15)биарил, (5-10)-членный гетероарил, замещенный (5-10)-членный гетероарил, (C6-C26)арилалкил, замещенный (C6-C26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота, и по меньшей мере одна замещенная аминокислота; R4 независимо выбран из группы: (С 7-C10)алкил, (С 17 С 26)арилалкил и (17-26)-членный гетероарилалкил, с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидроксиалифатических составляющих с цепью, образуемой 7-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота; R5 независимо выбран из группы: водород, (C1-C10)алкил, (С 5-C10)арил, (5-10)-членный гетероарил, (C6-C26)арилалкил и (6-26)-членный гетероарилалкил, с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидроксиалифатических составляющих с цепью, образуемой 5-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота в любой комбинации; a R' независимо представляет собой один или-1 010294 несколько одинаковых или различных заместителей, определенных для R3 или R5. Согласно настоящему изобретению, в некоторых примерах реализации предложены различные соединения, которые могут быть любыми из вышеупомянутых соединений, где R' представляет собой ОН или R' представляет собойNH2. Далее, в других примерах реализации, в любом из вышеупомянутых соединений R2 представляет собой -C(=O)OR5 или -C(=O)R5, или -C(=O)NHR4, -C(=S)NHR4, или -C(=NR4)NHR4. В других примерах реализации предложены любые из вышеупомянутых соединений, где R3 представляет собой по меньшей мере одну аминокислоту, выбранную из группы: глицин, Р-аланин, саркозин, лизин - в любой комбинации или по меньшей мере одну аминокислоту, выбранную из группы: Gly, (3-аланин, GABA, 5 аминопентановая кислота, 6-аминогексановая кислота, Lys, gDab, Sar, Orn, Dap, hLys - в любой комбинации. В соответствующих примерах реализации аминокислота группы R3 представляет собой две аминокислоты, выбранные из группы глицин-лизин или саркозин-лизин. Согласно некоторым примерам реализации предложены различные соединения из вышеупомянутых соединений, где R3 дополнительно содержит по меньшей мере одну защитную группу. В некоторых примерах реализации предложены любые из вышеупомянутых соединений, где L представляет собой по меньшей мере одну замещенную аминокислоту, выбранную из группы: п-аминофенилацетил, (п-аминофенилпропаноил)n, где n равняется 1 или 2, м-аминофенилацетил, (м-аминофенилацетил)n, где n равняется 1 или 2, о-аминофенилацетил, (оаминофенилпропаноил)n, где n равняется 1 или 2, GABA, п-аминобензойная кислота (РАВА), маминобензойная кислота,о-аминобензойная кислота,п-гидразинобензойная кислота,мгидразинобензойная кислота, о-гидразинобензойная кислота, л-амино-транс-циннамил, м-амино-трансциннамил, о-амино-транс-циннамил, L-BBTA - в любой комбинации. В некоторых примерах реализацииR2 и R3 возможно содержат насыщенный алифатический или гидрокси-алифатический заместитель с прямой цепью, содержащей от 10 до 15 атомов углерода. В некоторых примерах реализации, предложены конкретные соединения, такие как соединение 91 табл. 6D, соединение 331 или 332 табл. 16, соединение 86 табл. 6D, соединение 87 или 280 табл. 7, иди соединение 89 табл. 8. Согласно следующему аспекту изобретения, предложены противомикробное соединение и его фармацевтически приемлемые соли структуры (IIa) R2-L-R-R3, где R представляет собой циклическое пептидное ядро амфомицина или аспартоцина; R1 представляет собой ОН или группу NH2 аминокислоты ядра циклического пептида R в положении 1; L выбран из по меньшей мере одной аминокислоты, по меньшей мере одной замещенной аминокислоты, -R'C(=O)- и -R'OC(=O)(NR')-; R2 выбран из группы,включающей OR5, -SR5, NR5R5, -C(=O)OR5, -C(=O)R5, -C(=O)NHR4, -C(=O)NR4R4, -C(=S)NHR4,-C(=S)NR4R4, -C(=NR4)NHR4, -C(=NR4)NR4R4, -RSC(=O), -SO2R5, -S(=O)R5, -P(=O)(OR5)2) -P(=O)(OR5),-CO2H, -SO3H, -PO3H, галоген и тригалометил; R3 представляет собой водород; R4 независимо выбран из группы: (С 7-С 10)алкил, (С 17-С 26)арилалкил и (17-26)-членный гетероарилалкил, с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидрокси-алифатических составляющих с цепью, образуемой 7-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота;R5 независимо выбран из группы: водород, (C1-C10)алкил, (C5-С 10)арил, (5-10)-членный гетероарил, (C6C26)арилалкил, (6-26)-членный гетероарилалкил, прямой или разветвленный, насыщенный или содержащий одну или несколько ненасыщенных связей алифатический или гидрокси-алифатический компонент с углеродной цепью, образованной 5-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота или любая их комбинация; aR' независимо представляет собой один или несколько одинаковых или различных заместителей, определенных для R3 или R5. Согласно некоторым примерам реализации настоящего изобретения предложены различные соединения из вышеупомянутых соединений, где R' представляет собой ОН или R' представляет собой NH2. Далее, в любом из вышеупомянутых соединений R2 представляет собой -C(=O)R5, -C(=O)NHR4,-C(=S)NHR4 или -C(=NR4)NHR4. В других примерах реализации предложены любые из вышеупомянутых соединений, в которых R5 представляет собой (10-20)-членный гетероарилалкил или алифатическую или гидрокси-алифатическую составляющую с цепью, образуемой 5-17 атомами углерода; или R4 представляет собой алифатическую или гидроксиалифатическую ненасыщенную составляющую с прямой цепью,образуемой 8-16 атомами углерода. В некоторых примерах реализации L представляет собой по меньшей мере одну аминокислоту или по меньшей мере одну замещенную аминокислоту, такую как глицин, саркозин, фенилглицин, фенилаланин, О-метиласпарагиновая кислота, О-трет-бутиласпарагиновая кислота,п-аминобензойная кислота (РАВА), м-аминобензойная кислота, п-гидразино-бензойная кислота, паминофенилпропионовая кислота, (п-амино-фенилпропионовая кислота)n, где n равняется 1 или 2, LBBTA, м-аминофенилуксусная кислота, л-аминофенилуксусная кислота (Ара), п-амино-транс-коричная кислота, о-аминобензойная кислота, о,о-диаминобензойная кислота, о,м-диаминобензойная кислота, о,пдиаминобензойная кислота, м,п-диаминобензойная кислота, м,м-диаминобензойная кислота, оаминофенилуксусная кислота, м-аминофенилуксусная кислота, л-амино-фенилуксусная кислота (Ара),аминотиазолуксусная кислота - в любой комбинации. В иных примерах реализации предложены любые из вышеупомянутых соединений, где R3 представляет собой по меньшей мере одну аминокислоту, выбранную из группы: Gly, -аланин, GABA, 5-аминопентановая кислота, 6-аминогексановая кислота, Lys,-2 010294gDab, Sar, Orn, Dap, или hLys. Далее, в иных примерах реализации, R3 содержит по меньшей мере одну защитную группу. Далее, в следующих примерах реализации любое из вышеупомянутых соединений включает соединение 103, 105, 106, 107, 112, 115, 116, 118, 311, 313, 314, 315, 316, 317, 344, 345, 346, 358,359, или 360 табл. 3; соединение 104,108, 109, 1 10, 111, 113, 122, 119, 281, 293, 294, 296, 297, 300, 301,303, 310, 312 или 361 табл. 6D; соединение 117 табл. 6 С; соединение 21, 85, 282, 283, 284, 285 или 123 табл. 7; соединение 120 табл. 8; соединение 305, 320, 319, 337, 374, 337, 305, 320 или 319 табл. 14; соединение 286, 321, 304, 254, 307, 295 или 291 табл. 4; или соединение 288, 306, 290, 362, 289, 292, 287 или 302 табл. 6 А. Согласно еще одному аспекту настоящего изобретения предложены противомикробные соединения и их фармацевтически приемлемые соли структуры (IVa) R2-L-R-L-R3, где R1 представляет собой циклическое пептидное ядро амфомицина или аспартоцина; R1 представляет собой ОН или группу NH2 аминокислоты ядра циклического пептида R в положении 1; L независимо выбран из по меньшей мере одной аминокислоты, по меньшей мере одной замещенной аминокислоты, -С(=O)-, -R'C(=O)-, -SO2, -C(=S)-, P(=O)-, -OP(=O)-, -ОС(=O)-, -R'OC(=O)(NR1)-, -NHC(=O)-, -O-PhC(=O)- и -NR'C(=O)-, если L в Dab9 представляет собой -С(=O)-; R2 независимо выбран из группы -OR4, -SR4, NR4R4, -CN, -NO2, -N3, -C(=O)OR4, C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O), -SO2R4, -S(=O)R4, P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H, -PO3H, галоген, тригалометил, (C1-C25)алкил, замещенный (C1C25)алкил, (C1-C25)гетероалкил, замещенный (C1-C25)гетероалкил, (С 5-C10)арил, замещенный (C5-C10) арил, (С 5-С 15)ариларил, замещенный (C5-C15)ариларил, (С 5-С 15)биарил, замещенный (C5-C15)биарил, (510)-членный гетероарил, замещенный (5-10)-членный гетероарил, (С 6-С 26)арилалкил, замещенный (С 6 С 26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота; R3 выбран из группы C(=O)OR4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O), -CO2H, замещенный (C1C25)алкил, замещенный (C1-C25)гетероалкил, замещенный (С 5-C10)арил, замещенный (С 5-С 15)ариларил,замещенный (C5-С 15)биарил, замещенный (5-10)-членный гетероарил, замещенный (С 6-С 26)арилалкил,замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота, при условии, что R3 содержит по меньшей мере одну из следующих групп: -С(=O)-, -C(=S)- или -C(=NR4)-; R4 независимо выбран из группы: водород, (C1-C10)алкил, (С 5C10)арил, (5-10)-членный гетероарил, (C6-C26)арилалкил и (6-26)-членный гетероарилалкил, с разветвленной или прямой углеродной цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидроксиалифатических составляющих с цепью, образуемой 5-25 атомами углерода,первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота и любая их комбинация; a R' независимо представляет собой один или несколько одинаковых или различных заместителей, определенных для R2, R3 или R4. В некоторых примерах реализации настоящего изобретения предложены различные соединения,которые могут быть любыми из вышеупомянутых соединений, где R' представляет собой ОН или R' представляет собой NH2. В следующих примерах реализации в любом из вышеупомянутых соединенийR3 представляет собой -С(=O)- или -C(=S)-. В прочих примерах реализации любое из вышеупомянутых соединений включает соединение 210, 373, 223, 237, 235 или 81 табл. 12. В некоторых примерах реализации R3 представляет собой по меньшей мере одну аминокислоту, выбранную из группы Gly, -аланин,GABA, 5-аминопентановая кислота, 6-аминогексановая кислота, Lys, gDab, Sar, Orn, Dap и hLys. Далее, в прочих примерах реализации, R3 дополнительно содержит по меньшей мере одну защитную группу. Согласно еще одному аспекту изобретения предложено противомикробное соединение и его фармацевтически приемлемые соли, такое как соединение 3 табл. 1; соединение 4 табл. 10; соединение 60 табл. 13; соединение 128 табл. 16; соединение 147 табл. 1; соединение 199 табл. 10; соединение 253 табл. 4; или соединение 278 табл. 4. Согласно еще одному аспекту, каждое из вышеупомянутых соединений может быть структурно чистым, либо существовать в виде композиции, включающей смесь одного или более соединений различной структуры. В некоторых примерах реализации соединения согласно настоящему изобретению могут существовать в виде свободной кислоты или основания, либо в виде соли, например фармацевтически приемлемой соли. Далее, в других примерах реализации ядро циклического пептида представляет собой -изомер, ангидроизомер или диангидроизомер. Согласно следующему аспекту настоящего изобретения предложены фармацевтические составы,включающие любые из вышеупомянутых соединений. В некоторых примерах реализации составы включают одно или несколько соединений согласно изобретению и фармацевтически или физиологически приемлемый носитель, наполнитель или разбавитель. Конкретно природа носителя, наполнителя или разбавителя зависит от предполагаемого применения состава, и может варьировать; состав может оказаться пригодным или приемлемым для промышленного применения или применения в области экологии; пригодным или приемлемым для применения в ветеринарии; пригодным или приемлемым для человека (т.е. фармацевтически приемлемым). Согласно еще одному аспекту настоящего изобретения предложены способы синтеза соединений-3 010294 согласно настоящему изобретению. В одном примере реализации изобретения соединения по изобретению можно приготовить из исходных липопептидных антибиотиков на основе амфомицина или аспартоцина, изолированных из культуры, посредством взаимодействия исходного антибиотика и соответствующим образом защищенного реагента, такого как соответствующим образом защищенная аминокислота, при условиях, в которых возможно присоединение реагента к концевой аминогруппе амина экзоциклической аминокислоты или -азоту макроциклического остатка Dab9. В некоторых примерах реализации защитные группы могут быть удалены с целью получения соединений по изобретению с определенным концевым аминозаместителем, со связующим звеном (линкером) или без связующего звена, определенным заместителем Dab9 со связующим звеном или без связующего звена, или любой их комбинации. В некоторых примерах реализации подобные исходные антибиотики представляют собой смесь соединений с различными структурами макроциклических пептидных ядер или различнымии липофильными заместителями. В некоторых примерах реализации конечный продукт - производное по концевой аминогруппе или Dab9 согласно настоящему изобретению получают в виде смеси соединений, структуры и относительное количественное содержание которых зависят от структур и относительных количеств соединений, образующих смесь исходных антибиотиков. В некоторых других примерах реализации различные соединения - компоненты, образующие смесь исходных антибиотиков разделяют и выделяют до начала синтеза производных по аминоконцевой аминокислоте или макроциклическому остатку Dab9. Альтернативно, разделять и выделять компоненты можно из конечного продукта реакции образования производных по аминоконцевой аминокислоте или Dab9, либо до, либо после удаления любых защитных групп, для того, чтобы получить структурно чистые производные по аминоконцевой аминокислоте или производные Dab9 согласно настоящему изобретению, или любую их комбинацию. Согласно другому аспекту настоящего изобретения, связанному с предыдущим, структура остатка жирной кислоты, присоединенного по концевой аминогруппе исходного антибиотика, неизвестна. В некоторых примерах реализации липофильный остаток жирной кислоты удаляют и замещают его липофильным заместителем, аминокислотным заместителем и их комбинацией, возможно присоединенным через связывающую группу L определенной структуры, с целью получения аминокислотной производной по аминоконцу или Dab9 производного согласно настоящему изобретению со строго определенными заместителями со связующим звеном или без связующего звена. В одном примере реализации в исходной смеси антибиотиков защищают -аминогруппу макроциклического остатка Dab9 и удаляют остатки липидов; в результате образуется промежуточный продукт не содержащий остатков липидов; далее, указанный промежуточный продукт вступает во взаимодействие с желательным липофильным заместителем в условиях ацилирования с образованием синтетического антибиотика со строго определенным липофильным компонентом. В другом примере реализации возможно получение производных этого синтетического антибиотика вышеописанным способом для получения Dab9 производных согласно настоящему изобретению. Вышеописанные пути синтеза позволяют получить защищенные соединения-полупродукты (промежуточные соединения) и эти полупродукты составляют другой аспект настоящего изобретения (как сказано выше и здесь, полупродукты содержат защитные группы). Согласно другим аспектам настоящее изобретение предлагает способы ингибирования роста микроорганизмов, таких как грамположительные бактерии. В целом, способ включает воздействие на микроорганизм одного или нескольких соединений по настоящему изобретению (или их приемлемых солей) в количестве, эффективном для ингибирования роста указанного микроорганизма. Применяя данный способ, можно добиться либо бактериостатического эффекта - замедления размножения микробов, либо бактерицидного эффекта - уничтожения микробов. Согласно аспекту, связанному с предыдущим, настоящее изобретение предлагает способы лечения или профилактики микробных инфекций, таких как инфекции, вызываемые грамположительными бактериями у человека, растения или животного. В некоторых примерах реализации, указанные способы заключаются во введении в организм субъекта одного или нескольких соединений или композиций по настоящему изобретению в количестве, эффективном для лечения или профилактикиинфекционного заболевания. Соединения или композиции можно вводить системно, или применять локально, в зависимости от природы инфекции. В некоторых примерах реализации настоящего изобретения соединения и композиции по изобретению применяют для лечения или профилактики инфекций кожи или кожной структуры(включая осложненные инфекции), или пневмонии. Краткое описание чертежей На фиг. 1 представлены примеры -изомеров соединений - производных липопептидных антибиотиков согласно настоящему изобретению; на фиг. 2 - примеры ангидро- или диангидроизомеров соединений - производных липопептидных антибиотиков согласно настоящему изобретению; фиг. 3 иллюстрирует (cхема I) два основных подхода к получению соединений - производных липопептидных антибиотиков согласно настоящему изобретению; на фиг. 4A-4I представлены кривые доза-эффект (kill curves), иллюстрирующие бактерицидную ак-4 010294 тивность различных липопептидных производных в отношении в Enterococcus faecalis; на фиг. 5 А-5K представлены кривые доза-эффект (kill curves), иллюстрирующие бактерицидную активность различных липопептидных производных против Staphylococcus aureus. Подробное описание изобретения Как указано выше, согласно настоящему изобретению предложены композиции и способы их применения и получения производных противомикробных липопептидов для лечения и профилактики инфекционных заболеваний. Таким образом, настоящее изобретение, в основном, связано с тем, неожиданным открытием, заключающемся в том, что определенные липопептидные антибиотики можно химически модифицировать для максимального усиления их противомикробной активности in vivo и in vitro. В частности, липопептидные антибиотики применимы для лечения или профилактики инфекций, вызываемых грамположительными бактериями, такими как Enterococci, Streptococci и Staphylococci, возникающими в при различных средах условиях (напр., внутрибольничные инфекции, акне, инфекции, связанные с внутрисосудистой нарушением целостности сосудов пенетрацией - напр., при введении подкожно игл,катетеров и других медицинских инструментов). Ниже более подробно обсуждаются производные липопептидов, применимые в рамках настоящего изобретения, а также репрезентативные композиции и их терапевтическое применение. Перед тем, как приступить к подробному изложению изобретения, для облегчения понимания будет полезно дать определения некоторым терминам, которые используются в дальнейшем. Термин аминокислоты здесь относится к природным (т.е. существующим в природе) аминокислотам, замещенным природным аминокислотам, неприродным аминокислотам, замещенным неприродным аминокислотам, а также к любым их комбинациям. Для обозначения природных аминокислот здесь используются либо однобуквенные, либо трехбуквенные коды. Природные полярные аминокислоты включают аспарагин (Asp или N) и глютамин глутамин (Gln или Q), наряду с основными аминокислотами, такими как аргинин (Arg или R), лизин (Lys или K), гистидин (His или Н) и их производные; и кислые аминокислоты, такие как аспаргиновая кислота (Asp или D) и глутаминовая кислота (Glu или Е) и их производные. Природные гидрофобные аминокислоты включают триптофан (Trp или W), фенилаланин(Phe или F), изолейцин (IIe или I), лейцин (Leu или L), метионин (Met или М), валин (Val или V) и их производные, а также прочие неполярные аминокислоты, такие как глицин (Gly или G), аланин (Ala или А), пролин (Pro или Р) и их производные. Природные аминокислоты средней полярности включают серии (Ser или S), треонин (Thr или Т), тирозин (Tyr или Y), цистеин (Cys или С) и их производные. Любая описанная здесь аминокислота может обладать как D-, так и L-конфигурацией, если не указано иное. Заглавная буква обозначает L-энантиомерную форму аминокислоты; маленькая буква указывает на Dэнантиомерную форму кислоты. Среди других типичных аминокислот коричные (В-фенилакриловые) кислоты (такие как аминокоричные кислоты, амино-транс-коричные кислоты, амино-цис-коричные кислоты, о-аминокоричные кислоты, м-аминокоричные кислоты, п-аминокоричные кислоты, о-амино-транс-коричные кислоты, мамино-транс-коричные кислоты, п-амино-транс-коричная кислота, о-амино-цис-коричная кислота, мамино-цис-коричная кислота, п-амино-цис-коричная кислота), фенилглицин (Phg), 2,3-диаминомасляная кислота (Dab), 2,4-диаминомасляная кислота (gDab), 2,3-диаминопропионовая кислота (Dap), метиласпартат (MeAsp), циклогексилаланин (-Cha), норлейцин (NIe), норвалин (NvI), изонипекотиновая кислота (Ina), пипеколиновая кислота (гомопролин) (Pip или hPro), фенилуксусные кислоты (такие как аминофенилуксусные кислоты, диаминофенилуксусные кислоты, триаминофенилуксусные кислоты, оамино-фенилуксусная кислота, м-аминофенилуксусная кислота, п-амино-фенилуксусная кислота (Ара),о,о-диаминофенилуксусная кислота, о,м-диаминофенилуксусная кислота, о,п-диаминофенилуксусная кислота,м,м-диаминофенилуксусная кислота,м,п-диаминофенилуксусная кислота,о,о,мтриаминофенилуксусная кислота, о,о,п-триаминофенилуксусная кислота, о,м,п-триаминофенилуксусная кислота, м,м,п-триаминофенилуксусная кислота, о,м,м-триаминофенилуксусная кислота, о,о,мтриаминофенилуксусная кислота), фенилпропионовые кислоты (такие как аминофенилпропионовые кислоты,диаминофенилпропионовые кислоты,триаминофенилпропионовые кислоты,оаминофенилпропионовая кислота, м-аминофенилпропионовая кислота, п-аминофенилпропионовая кислота, о,о-диаминофенилпропионовая кислота, о,м-диаминофенилпропионовая кислота, о,пдиаминофенилпропионовая кислота,м,м-диаминофенилпропионовая кислота,м,пдиаминофенилпропионовая кислота,о,о,м-триаминофенилпропионовая кислота,о,о,птриаминофенилпропионовая кислота,о,м,п-триаминофенилпропионовая кислота,м,м,птриаминофенилпропионовая кислота,о,м,м-триаминофенилпропионовая кислота,о,о,мтриаминофенилпропионовая кислота), 2-аминомасляная кислота (Abu), саркозин (Sar или N-метил глицин), 6-аминогексановая кислота (Ahx), п-фторфенилаланин (p-F-Phe), -аминомасляная кислота(GABA), бензойные кислоты (такие как аминобензойные кислоты, диаминобензойные кислоты, триаминобензойные кислоты, о-аминобензойная кислота, м-аминобензойная кислота, п-аминобензойная кислота (РАВА), о,о-диаминобензойная кислота, о,м-диаминобензойная кислота, о,п-диаминобензойная кислота, м,м-диаминобензойная кислота, м,п-диаминобензойная кислота, о,о,м-триаминобензойная кисло-5 010294 та, о,о,п-триамино-бензойная кислота, о,м,п-триаминобензойная кислота, м,м,п-триаминобензойная кислота, о,м,м-триаминобензойная кислота, о,о,м-триаминобензойная кислота), гидразинобензойные кислоты (такие как дигидразинобензойные кислоты, тригидразинобензойные кислоты, огидразинобензойная кислота, м-гидразинобензойная кислота, п-гидразинобензойная кислота, о,одигидразинобензойная кислота, о,м-дигидразинобензойная кислота, о,п-дигидразинобензойная кислота,м,м-дигидразинобензойная кислота, м,п-дигидразинобензойная кислота, о,о,м-тригидразинобензойная кислота, о,о,п-тригидразинобензойная кислота, о,м,п-тригидразинобензойная кислота, м,м,птригидразинобензойная кислота, о,м,м-тригидразинобензойная кислота, о,о,м-тригидразинобензойная кислота), гомофенилаланин (homoPhe или hPhe), -цианоАланин (-циано-Ala), метил- или этилариловые эфиры тирозина (Tyr (Me) или Tyr (Et), соответственно), аминоизомасляная кислота (Aib, известная также как, ,-диметилглицин), S-метилцистеин (MeCys), N'N'-диметиларгинин Ме)2Arg), гидроксипролин (Hyp), цитруллин (Cit), N,N,N-триметиллизин или N,N,N-(CH3)3-лизин или -триметиллизинMe)3Lys), гомолизин (homoLys или hLys), 5-аминопентановая кислота или аминовалериановая кислота(pGlu), аминотиазолуксусные кислоты, 2-аминотиазол-4-илуксусная кислота, аминогептановые кислоты,аминооктановые кислоты, аминононановые кислоты, аминодекановые кислоты, аминоундекановые кислоты, аминододекановые кислоты, 7-аминогептановая кислота, 8-аминооктановая кислота, 9 аминононановая кислота, 10-аминодекановая кислота, 11-аминоундекановая кислота, 12 аминододекановая кислота, производные 3- или 4-меркаптолина, N5-ацетил-N5-гидрокси-L-омитин, -Nгидроксаминокислоты и тому подобные. Противомикробный липопептидный аналог или его производное могут включать любую из упомянутых выше аминокислот или их комбинацию, либо одну из упомянутых выше аминокислот, возможно замещенных, или их комбинацию. Встречающееся здесь сокращение "АТСС" обозначает American Type Culture Collection - Американская коллекция типовых культур, Manassas, VA 20108 (см. также www. atcc. org), a "NRRL" - обозначаетAgriculture Research Service Culture Collection - Коллекция культур службы исследований в области сельского хозяйства, Microbial Genomics and Bioprocessing Research Unit - Отдел исследований геномов микроорганизмов и биотехнологий, National Center for Agriculture Utilization Research - Национальный центр прикладных сельскохозяйственных исследований, Peoria, IL 61604 (см. также nrrl. ncaur. usda. gov). В данном описании указанные интервалы концентраций, процентные интервалы, интервалы соотношений включают любые значения в пределах указанного интервала - целое число с его дробной частью (напр., десятые или сотые доли числа), если не указано иное. Слова приблизительно или состоит в основном из здесь обозначают 15%. Предложение альтернативы (напр., союз или) следует понимать как одно, или другое; и то, и другое; или любая комбинация альтернативных вариантов. Кроме того,следует понимать, что отдельные соединения или группы соединений, производных от различных комбинаций описанных здесь структур и заместителей, включены в настоящую заявку, точно так же, как если бы каждое соединение или группа соединений было описано индивидуально. Таким образом, выбор определенной структуры или определенного заместителя происходит в рамках настоящего изобретения. Используемый здесь термин алкил относится к насыщенным или ненасыщенным, разветвленным,прямым или циклическим моновалентным углеводородным группам, образующимся путем удаления одного из атомов водорода от одиночного атома углерода или исходного алкана, алкена или алкина. Типичные алкильные группы - включают метил; этилы, такие как этанил, этенил, этинил; пропилы, такие как пропан-1-ил, пропан-2-ил, циклопропан-1-ил, проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил, проп-1-ин-1-ил, проп-2-ин-1-ил, и т.д; бутилы, такие как бутан-1-ил, бутан-2-ил, 2-метил-пропан-1-ил, 2-метил-пропан-2-ил, циклобутан-1-ил, бут-1-ен-1-ил,бут-1-ен-2-ил, 2-метил-проп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2 ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил, бут-1-ин-1-ил, бут-1-ин-3-ил, бут 3-ин-1-ил, и т.д.; и тому подобные. Термином алкил, в частности, обозначают прямые или разветвленные углеводороды, содержащие от 1 до 25 атомов углерода, предпочтительно от 5 до 20, наиболее предпочтительно от 10 до 18. Алкилы могут обладать разной степенью или уровнем насыщения, т.е., группы с исключительно простыми углерод-углеродными связями; группы с одной или несколькими двойными углерод-углеродными связями; группы с одной или несколькими тройными углерод-углеродными связями и группы, содержащие вместе простые, двойные и тройные углерод-углеродные связи. Там, где подразумевается определенный уровень насыщения связей, используются термины алканил, алкенил и алкинил. Термин низший алкил относится к алкильным группам, включающим от 1 до 8 атомов углерода. Алкильная группа может быть замещенной или незамещенной. Термин алканил относится к насыщенной алкильной группе с разветвленной или прямой углеродной цепью, либо к циклической алкильной группе. Типичные алканильные группы включают метанил; этанил; пропанилы -такие как пропан-1-ил, пропан-2-ил (изопропил), циклопропан-1-ил, и т.д.; бутанилы - такие как бутан-1-ил, бутан-2-ил (втор-бутил), 2-метил-пропан-1-ил (изобутил), 2-метилпропан-2-ил (трет-бутил), циклобутан-1-ил, и т.д.; и тому подобные.-6 010294 Термин алкенил относится к ненасыщенной алкильной группе с разветвленной или прямой углеродной цепью, либо к циклической алкильной группе или их комбинации с по меньшей мере одной двойной углерод-углеродной связью, образующейся вследствие удаления одного из атомов водорода от углеродного атома исходного алкена. Группа может либо в цис-, либо в транс-конфигурации относительно двойной связи (или связей). Типичные алкенильные группы включают этенил; пропенилы - такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен-2-ил, циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метил-проп-1-ен-1-ил, бут-2-ен-1-ил,бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен 3-ил, циклобута-1,3-диен-1-ил и т.д.; и тому подобные. Алкенильная группа может быть как замещенной,так и не замещенной. Термин алкинил относится к ненасыщенной алкильной группе с разветвленной или прямой углеродной цепью, либо к циклической алкильной группе с по меньшей мере одной тройной углеродуглеродной связью, образующейся вследствие удаления одного из атомов водорода от углеродного атома исходного алкина. Типичные алкинильные группы включают этинил; пропинилы - такие как проп-1-ин 1-ил, проп-2-ин-1-ил, и т.д.; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил, и т.д.; и тому подобные. Термин алкилдиил относится к двухвалентной углеводородной группе, насыщенной или ненасыщенной, с разветвленной или прямой углеродной цепью, либо циклической, образующейся вследствие удаления одного атома водорода от каждого из двух различных атомов углерода исходного алкана, алкена или алкина; или удалением двух атомов водорода от одного атома углерода исходного алкана, алкена или алкина. Два одновалентных радикальных центра или каждая валентность двухвалентного радикального центра могут образовывать связи с одинаковыми или различными атомами. Типичные алкидиильные группы включают метандиил; этилдиилы, такие как этан-1,1-диил, этан-1,2-диил, этен-1,1-диил,этен-1,2-диил; пропилдиилы, такие как пропан-1,1-диил, пропан-1,2-диил, пропан-2,2-диил, пропан-1,3 диил, циклопропан-1,1-диил, циклопропан-1,2-диил, проп-1-ен-1,1-диил, проп-1-ен-1,2-диил, проп-2-ен 1,2-диил, проп-1-ен-1,3-диил, циклопроп-1-ен-1,2-диил, циклопроп-2-ен-1,2-диил, циклопроп-2-ен-1,1 диил, проп-1-ин-1,3-диил, и т.д.; бутилдиилы, такие как бутан-1,1-диил, бутан-1,2-диил, бутан-1,3-диил,бутан-1,4-диил, бутан-2,2-диил, 2-метил-пропан-1,1-диил, 2-метил-пропан-1,2-диил, циклобутан-1,1 диил; циклобутан-1,2-диил, циклобутан-1,3-диил, бут-1-ен-1,1-диил, бут-1-ен-1,2-диил, бут-1-ен-1,3 диил, бут-1-ен-1,4-диил, 2-метил-проп-1-ен-1,1-диил, 2-метанилиден-пропан-1,1-диил, бута-1,3-диен-1,1 диил, бута-1,3-диен-1,2-диил, бута-1,3-диен-1,3-диил, бута-1,3-диен-1,4-диил, циклобут-1-ен-1,2-диил,циклобут-1-ен-1,3-диил, циклобут-2-ен-1,2-диил, циклобута-1,3-диен-1,2-диил, циклобута-1,3-диен-1,3 диил, бут-1-ин-1,3-диил, бут-1-ин-1,4-диил, бута-1,3-дин-1,4-диил, и т.д.; и тому подобные. Там, где подразумевается определенный уровень насыщения связей, используется номенклатура алканилдиил, алкенилдиил или алкинилдиил. По предпочтительным примерам реализации алкилдиильная группа представляет собой (C1-C4)алкилдиил. Также предпочтительны насыщенные ациклические алканилдиильные группы, в которых радикальные центры расположены при концевых атомах углерода, напр.: метандиил(называемые также алкиленами, определено ниже). Термин алкилено относится к алкилдиильной группе с прямой углеродной цепью, обладающей двумя концевыми одновалентными радикальными центрами, образованной удалением одного атома водорода от каждого из концевых углеродных атомов исходного алкана, алкена или алкина с прямой углеродной цепью. Типичные алкилено-группы включают метано; этилено - такие как этано, этено, этино; пропилено - такие как пропано, проп[1] ено, проп[1,2]диено, проп[1]ино, и т.д.; бутилено - такие как бутано, бут[1]ено, бут[2]ено, бута[1,3]диено, бут[1]ино, бут[2]ино, бут[1,3]диино, и т.д.; и тому подобные. Там, где подразумевается определенный уровень насыщения связей, используется номенклатура алкано,алкено или алкино. По предпочтительным примерам реализации алкиленогруппа представляет собой (C1 С 6) или (С 1-С 4)алкилено. Также предпочтительны насыщенные алканогруппы с прямой углеродной цепью, напр., метано, этано, пропано, бутано и тому подобные. Термины гетероалкил, гетероалканил, гетероалкенил, гетероалканил, гетероалкилдиил и гетероалкилено относится к алкильным, алканильным, алкенильным, алкинильным, алкилдиильным и алкилено группам соответственно, в которых один или несколько атомов углерода (и любой из связанных атомов водорода) - каждый независимо замещен одинаковыми или различными гетероатомами или гетероатомными группами. Типичные гетероатомы или гетероатомные группы, которые, возможно, входят в эти группы, включают: -О-, -S-, -Se-, -О-О-, -S-S-, -O-S-, -O-S-O-, -O-NR'-, -NR'-,-NR'-NR'-, =N-N=, -N=N-, N=N-NR'-, -PH-, -P(=O)2-, -O-P(=O)2-, -SH2-, -S(=O)2-, -SnH2- и тому подобные, и их комбинации, включая-NR'-S(=O)2-, где каждый R' независимо выбран из группы: водород, алкил, алканил, алкенил, алкинил,арил, арилалкил, гетероарил и гетероарилалкил, согласно данному здесь определению. Термин арил относится к одновалентной ароматической углеводородной группе, образованной удалением одного атома водорода от углеродного атома исходной системы, содержащей ароматическое кольцо. Типичные арильные группы включают группы, производные ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гекса-7 010294 фена, гексалена, ас-индацена, с-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена, рубицена, трифенилена, тринафталена, и тому подобных. По предпочтительным примерам реализации арильная группа представляет собой (C5-C14)арил, (С 5-C10) наиболее предпочтительны. Особо предпочтительными арилами являются циклопентадиенил, фенил и нафтил. Арильная группа может быть как замещенной, так и незамещенной. Термин арилалкил относится к ациклической алкильной группе, в которой один из атомов водорода связанный с атомом углерода, обычно концевым или sp3 атомом углерода, замещен арильной группой. Типичные арилалкильные группы включают бензил, 2-фенилэтан-1-ил, 2-фенилэтен-1-ил, нафтилметил, 2-нафтилэтан-1-ил, 2-нафтилэтен-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и тому подобные. Там, где подразумеваются определенные алкильные компоненты, используется номенклатура арилалканил, арилалкенил или арилалкинил. По предпочтительным примерам реализации арилалкильная группа представляет собой (С 6-С 20)арилакил, например алканил, алкенил или алкинил, входящий в состав арилалкильной группы представляет собой (C1-С 6), а арил -(C5-С 14). По особо предпочтительным примерам реализации арилакильная группа представляет собой (C6-С 13), например алканил, алкенил или алкинил,входящий в состав арилалкильной группы представляет собой (C1-С 3), а арил -(С 5-C10). Термин гетероарил относится к одновалентной гетероароматической группе, образуемой вследствие удаления одного атома водорода от одного из атомов исходной гетероароматической кольцевой системы, возможно, моноциклической системы или системы с конденсированными кольцами (т.е. кольцами, обладающими сопряженной парой атомов). Типичные гетероарильные группы включают группы,производные от акридина, арсиндола, карбазола, Р-карболина, хромана, хромена, циннолина, фурана,имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, перимидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина,пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадизола, тиазола, тиофена, триазола, ксантена и тому подобных. По предпочтительным примерам реализации гетероарильная группа представляет собой (5-10)-членный гетероарил, особенно предпочтителен (5-10)-членный гетероарил. Наиболее предпочтительны гетероарильные группы, производные от тиофена, пиррола, бензотиофена, бензофурана, индола, пиридина, хинолина, имидазола, оксазола и пиразина. Гетероарильная группа может быть как замещенной, так и незамещенной. Термин гетероарилалкил относится к ациклической алкильной группе, в которой один из атомов водорода, связанных с атомом углерода, - обычно с концевым или sp3 атомом углерода, замещен гетероарильной группой. Там, где подразумеваются определенные алкильные компоненты, используется номенклатура гетероарилалканил, гетероарилалкенил или гетероарилалкинил. По предпочтительным примерам реализации гетероарилалкильная группа представляет собой (6-20)-членный гетероарилалкил,напр., алканил, алкенил или алкинил, входящий в состав гетероарилалкильной группы, содержит от 1 до 6 членов, а гетероарильный компонент содержит от 5 до 14 членов. В наиболее предпочтительных примерах реализации гетероарильный компонент содержит от 6 до 13 членов, например алканил, алкенил или алкинил, входящий в состав гетероарилалкильной группы, содержит от 1 до 3 членов, а гетероарильный компонент содержит от 5 до 10 членов. Термин ацил относится к группе C(=O)-R", где R" выбран предпочтительно из группы: водород,гидрокси, алкил, галоалкил, циклоалкил, арил, возможно замещенный одной или несколькими алкильными, галоалкильными, алкокси, гало или замещенными аминогруппами; гетероарил (присоединенный через углеродный атом, входящий в кольцо), возможно замещенный одной или несколькими алкильными, галоалкильными, алкокси, гало или замещенными аминогруппами; и гетероалициклическая группа(присоединенная через углеродный атом, входящий в кольцо), возможно замещенная одной или несколькими алкильными, галоалкильными, алкокси, гало или замещенными аминогруппами. Ацильные группы включают альдегиды, кетоны, кислоты, хлорангидриды, сложные эфиры и амиды. Предпочтительными ацильными группами являются карбоксильные группы, напр., в кислотах и сложных эфирах. Сложные эфиры включают сложные эфиры аминокислот. Ацильная группа может быть присоединена к углеродному скелету с любого конца ацильной группы, т.е. через С или R". Если ацильная группа присоединена через R", то у С будет другой заместитель, такой как водород, алкил или тому подобные. Термин замещенный, -ая относится к группе, в которой один или несколько атомов водорода каждый независимо замещен (-ы) одинаковыми или различными заместителями (заместителем). Типичные заместители включают -X, -R13,-O-, =O, -OR, -SR13, -S-, =S, -NR13R13, =NR13, CX3, -CF3, -CN, -OCN, -SCN,-NO, NO2, =N2, -N3, -S (=O)2O-, -S (=O)2OH, -S(=O)2R13, -OS(=O)2O-, -OS(=O)2OH, -OS(=O)2R13, -P(=O)(O)2, -P(=O)(OH)(O-), -OP(=O)2(O-), -C(=O)R13, -C(=S)R13, -C(=O)OR13, -C(=O)O-, -C(=S)OR13, -NR13-C(=O)N(R13)2, -NR-C(=S)-N(Rl3)2, и -C(=NR13)NR13R13, где каждый X независимо представляет собой галоген; каждый R13 независимо представляет собой водород, галоген, алкил, арил, арилалкил, ариларил, арилгетероалкил, гетероарил, гетероарилалкил NR14R14, -C(=O)R14, и -S(=O)2R14; и каждый R14 независимо представляет собой водород, алкил, алканил, алкинил, арил, арилалкил, арилгетероалкил, ариларил, гетероарил или гетероарилалкил. Арилсодержащие заместители, содержащие или не содержащие один или-8 010294 несколько заместителей, могут находиться в пара- (п-), мета- (м-) или орто- (о-) положении, или в любой их комбинации. Термин фармацевтически приемлемые соли относится к солям соединений по изобретению, фармацевтически приемлемым, обладающим желательной фармацевтической активностью исходного соединения. Подобные соли включают: (1) кислые соли, образованные неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота, и тому подобные; либо соли, образованные органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, циклопентанпропионовая кислота, гликолевая кислота,пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота,малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4 гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота,этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4 толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, три мети луксусная кислота, третбутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота, и тому подобные; или (2) соли, в которых кислый протон исходного соединения либо замещен ионом металла, напр., ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; либо сопряжен с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и тому подобные. Согласно другому аспекту любое из вышеупомянутых соединений может содержать пептидное ядро, которое является производным аспартоцина. Нативный аспартоцин отличается от нативного амфомицина лишь в области ацильного заместителя хвоста. В общем, соединения по настоящему изобретению могут обладать нативным ацильным хвостом, или же другой (не-нативный) ацильный хвост можно присоединить к пептидному ядру амфомицина или аспартоцина. Производные липопептидные соединения по настоящему изобретению, обладающие пептидным ядром аспартоциновыам пептидным ядром синтезируют теми же (или идентичными) способами, что и производные, обладающие пептидным ядром амфомициновыма пептидным ядром; при этом различаются только источники исходного материала, получаемого от различных разновидностей Streptomyces (напр.,Streptomyces canus продуцируют амфомицин, a Streptomyces griseus - аспартоцин). Здесь, в любом общем описании синтеза липопептидных производных по изобретению фразу на основе амфомицина возможно заменить на фразу на основе аспартоцина, оставаясь в области охвата изобретения, если не указано иное. Следующие заместители обозначены здесь следующими аббревиатурами, они включают: циклогексил (сНех или cHexyl), пиколиновая кислота (Pla), 2-пиразинкарбоновая кислота (Рса), ацетил (Ас), янтарная кислота (Suc). В наименованиях соединений, перечисляемых в примерах, заместитель, обозначенный перед названием амфомицин (или аспартоцин) указывает на заместитель, такой как ацильный хвост или аминокислоту, присоединенный к концевому концевой амину аминогруппе пептидного ядра; в то время как заместитель, обозначенный после амфомицин-9- указывает на заместитель, присоединенный в положении Dab9 пептидного ядра. Кроме того, сокращенная форма записи Cn (напр., С 10, С 12,С 15) относится к соединению, включающему линейную углеродную цепь, такую как ацильный хвост,где количество атомов углерода равняется n. В примере с ацильным хвостом обозначение Cn может объективно описывать ацильный хвост при помощи следующей структурной формулы: Cn = СН 3(СН 2)i-С(=O)-, где i = n-2. Как указано выше строчные, выделенные курсивом буквы "о","м"или "п" в названии соединения указывают на положение заместителей: орто, мета и пара, соответственно. Применяемое здесь обозначение Ph относится к фенильному кольцу, a -OSu относится к соединению, активированному суккцинимидом, такому как аминокислота (напр., Ala-OSu), которое может быть получено по реакции, описанной здесь (см., например, пример 1) или приобретено в коммерческих компаниях (таких как Bachem California Inc., Torrance, CA). Липопептидные антибиотики и их производные Как отмечено выше, настоящее изобретение предлагает производные липопептидных антибиотиков, их фармацевтически приемлемые соли и способы их применения. Производные липопептидных антибиотиков по настоящему изобретению включают циклическое пептидное ядро (называемое здесь также макроциклическим пептидным ядром) и аминоконцевой липофильный заместитель. Термин циклическое пептидное ядро относится к циклической пептидной части или циклическому депсипептиду липофильного антибиотика, остающегося после удаления аминоконцевого липофильного заместителя, возможно включающего одну или несколько экзоциклических аминокислот. Производные липопептидных антибиотиков по настоящему изобретению, возможно, имеют липофильный заместитель,присоединенный к циклическому пептидному ядру: (1) непосредственно (напр., в случае амидо- или аминолипофильного заместителя), (2) через одну или более экзоциклических аминокислот, или (3) через связующую группу (линкер) - (L), присоединенную либо непосредственно к циклическому пептидно-9 010294 му ядру, или либо через посредством вставки одной или более экзоциклических аминокислот, как описано здесь. В предпочтительном примере реализации циклическое пептидное ядро образовано от А 1437,аспартоцина или амфомицина, наиболее предпочтительно от аспартоцина или амфомицина. Традиционные липопептидные антибиотики амфомицинового ряда включают амфомицин (глумамицин) (Heinemann et al., 1953, Antibiot. Chemother. 3: 1239-1242; Fujino et al, 1965, Bull. Chem. Soc. Jap. 38: 515; Bodanszky et al, 1973, J. Am. Chem. Soc. 95: 2352; Shibata et al., U. S. Patent No. 3,160, 561); аспартоцин (Shay et al., U. S. Patent No. 3,057, 779; Shay et al., 1960, Antibiotics Ann. 194; Hausman et al., 1964,Antimicrob. Ag. Chemother. 352; Hausman et al., 1969, J. Antibiotics 22: 207; Martin et al., 1960, J. Am.et al., EP 0 629 636 BI ; Hammann et al., U. S. Patent No. 6,194, 383; Lattrell et al., U. S. Patent No. 5,629,288); фриулимицин (Vertesy et al., 2000, J. Antibiotics 53: 816); сушимицин (tsushimycin) (Shoji et al., 1968,J. Antibiotics 21: 439; Nishimura et al., U. S. Patent No. 3,781, 420); и заомицин (Hinurna, 1954, J.Antibiotics 7 (4): 134-136; Kuroya, 1960, Antibiotics Ann. 194; Kuroya, JP 8150). Липопептидные антибиотики амфомицинового ряда проявляют антибиотическую активность по отношению к грамположительным бактериям, таким как, например, стрептококки, стафилококки и энтерококки; они состоят из макроциклического пептидного ядра, ацилированного по концевой аминогруппе липофильной жирной кислотой. Примеры других липопептидных антибиотиков, применяемых в комбинации с соединениями по изобретению, либо применяемых в качестве исходных соединений для синтеза производных способами по настоящему изобретению, включают ласпартомицин (Umezawa et al., United States Patent No. 3,639,582; Naganawa et al., 1968, J. Antibiot, 21,55; Naganawa et al., 1970, J. Antibiot, 23, 423), бревистин (Shoji etPatent No. 5,039, 789; Boeck et al., 1990, J. Antibiotics, 43,587), и антибиотик А-21978 С (Debono et al., 1988,J. Antibiotics, 41,1093). Термины амфомициновый липопептидный антибиотик, липопептидный антибиотик на основе амфомицина или аспартоциновый липопептидный антибиотик, липопептидный антибиотик на основе аспартоцина, здесь относятся к антибиотику, содержащему макроциклическое пептидное ядро,включающее аминокислоту с боковой цепью с первичной аминогруппой, например остаток Dab и липофильный заместитель, такой как жирнокислотный компонент. Макроциклическое пептидное ядро аспартоцина или амфомицина включает по меньшей мере одну экзоциклическую аминокислоту, обычно Asn или Asp. Экзоциклическая аминокислота (или кислоты) может (могут) размещаться между циклическим пептидом и липофильным заместителем, или между циклическим пептидом и связующей группой (линкером), к которой присоединен липофильный заместитель. По некоторым аспектам изобретения R относится к циклическому пептидному ядру амфомицина или аспартоцина, что иллюстрирует следующая структурная формула: В вышеописанной группировке, которая представляет собой циклическое пептидное ядро, пунктирная линия, отходящая от экзоциклической аминокислоты, указывает точку присоединения, например,линкера L, одной или нескольких дополнительных экзоциклических аминокислот, липофильного заместителя или любой их комбинации. Пунктирная линия, отходящая от остатка Dab9, указывает на точку присоединения, например, линкера L, одной или нескольких дополнительных экзоциклических аминокислот, липофильного заместителя или любой их комбинации, как описано здесь. Альтернативно, вышеописанный компонент - циклическое пептидное ядро объективно эквивалентно и равноценно иллюстрирует следующая структурная формула (где концевой амин циклического пептидного ядра теперь расположен на иллюстрации с правой стороны): Согласно некоторым примерам реализации R циклического пептидного ядра представляет собой-ОН (т.е., экзоциклическая аминокислота представляет собой Asp), такое соединение может быть названо по номенклатуре ИЮПАК (IUPAC) (CRC Handbook of Chemistry and Physics, CRC Press, Inc., Boca Raton,FL, Weast, R. C, (ed.) и включенные в него ссылки) следующим образом: 3-амино-N-[16-(1-аминоэтил)31-(1-карбоксиэтил)-22,28-бис-(карбоксиметил)-13-изопропил-4-метил-2,6,12,15,18,21,24,27,30,33-декакиоксо-1,5,11,14,17,20,23,26,29,32-декаазатрицикло[32.4.0.0'.07,11]октатриаконт-3-ил]сукцинаминовая слота. Трициклическое макроциклическое ядро данного пептида носит название"2,6,12,15,18,21,24,27,30,33-декаоксо-1,5,11,14,17,20,23,26,29,32-декаазатрицикло-[32.4.0.07,11]октатриаконтан", здесь Pro11 представляет собой одно кольцо, Pip3 представляет другое кольцо, циклическое лактамовое ядро циклического пептида представляет третье, 31-членное кольцо. Каждый атом азота в трициклическом ядре находится в положении 1, 5, 11, 14,17, 20, 23, 26, 29 и 32. Каждая карбонильная группа в трициклическом ядре находится в положении 2, 6, 12, 15, 18, 21, 24, 27, 30 и 33. Атомы азота и карбонильные группы, вместе взятые, представляют амидные связи циклического пептидного ядра. Атомы углерода в положениях 3, 7, 13,16, 19, 22, 25, 28, 31 и 34 представляют собой -атомы углерода аминокислот, образующих циклическое пептидное ядро. Атом углерода в положении 4 представляет собой-углерод боковой цепи Dab2, образующей циклический лактам через образование цикла с концевым карбоксилом липопептида.-метильная боковая цепь Dab2 находится в положении 4 и к ней также относится наименование 4 метил. К -атому азота Dab2 относится также наименование 3-амино заместитель в положении 3. Фрагмент "N-[" "]сукцинаминовая кислота" представляет Asp1 аминокислоту (т.е., в случае, когда R1 представляет собой -ОН), которая может быть возможной точкой замещения, например, ацильных хвостов (т.е., при Asp'). Боковая цепь -Asp4 также носит наименование 1-карбоксиэтил в положении 31 трициклического ядра. К боковым цепям Asp5 и Asp7 относятся также наименования бискарбоксиметил в положении 28 и 22 трициклического ядра, соответственно. К боковой цепи Val10 относится также наименование изопропил в положении 13 трициклического ядра. Наконец, к боковой цепиDab9 относится наименование 1-аминоэтил в положении 16 трициклического ядра, возможной точке присоединения заместителей Dab9. Следует понимать, что наименование будет идентичным для циклического липопептидного ядра, где R1 представляет собой NH2 (т.е., там, где экзоциклическая аминокислота представляет собой Asn), за исключением того, что "сукцинаминовая кислота" следует заменить на"сукцинамид". В качестве примера: соединение С-15-амфомицин-9-(-Ala), будет иметь наименование "3(пентадеканоил)амино-N-[16-[1-(3-аминопропиониламино)-этил]-31-(1-карбоксиэтил)-22,28-бис-(карбоксиметил)-13-изопропил-4-метил-2,6,12,15,18,21,24,27,30,33-декаоксо-1,5,11,14,17,20,23,26,29,32-декаазатрицикло[32.4.0.07,11]октатриаконт-3-ил]сукцинаминовая кислота", где в двух заместителях, ацильный хвост - группа С 15 (к которому относится наименование "пентадеканоил") и группа Dab9 -Ala (к которому относится наименование ["1-(3-аминопропиониламино)-этил]"), выделены жирным шрифтом для наглядности. Согласно одному примеру реализации липопептидный антибиотик на основе амфомицина обладает структурой I где R1 представляет собой ОН или NH2; и каждый из R2 и R3 независимо выбран из группы водород, -OR4, -SR4, NR4R4, -CN, -NO2, -N3)(С 5-C10) арил, (С 5-С 15)ариларил, замещенный (C5-C15)ариларил, (С 5-С 15)биарил, замещенный (С 5 С 15)биарил, (5-10)-членный гетероарил, замещенный (5-10)-членный гетероарил, (C6-C26) арилалкил, замещенный (C6-C26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)членный гетероарилалкил, одна аминокислота и одна замещенная аминокислота. В некоторых примерах независимо выбранные заместители включают -OR4, -SR4, NR4R4, -CN, -NO2, -N3, -C(=O)OR4, -C(=O)R4, -C(=O)NR4R4,-C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O), -SO2R4, -S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4),-CO2H, -SO3H, -PO3H, галоген, тригалометил; где каждый R4 независимо выбран из группы (С 1-С 10)алкил,(С 5-C10)арил, (5-10)-членный гетероарил, (С 6-С 16)арилалкил и (6-16)-членный гетероарилалкил, с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидрокси-алифатических составляющих с цепью, образуемой 6-25 атомами углерода,первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота; или любая их комбинация; при условии, что R2 и R3 одновременно не являются атомами водорода. Согласно некоторым примерам реализации, изобретение предлагает полупродукты (промежуточные продукты) структуры (I), где R' представляет собой ОН или NH2; R2 представляет собой водород; aR3 обладает защитной группой, например, в случае защищенных аминокислот Gly, Sar, -аланин, Gly-Lys или Sar-Lys. Согласно другому примеру реализации липопептидный антибиотик на основе амфомицина обладает структурой II где R1 представляет собой ОН или NH2;L независимо выбран из группы: по меньшей мере одна аминокислота, по меньшей мере одна,замещенная аминокислота, -С(=O)-, -R'C(=O)-, -SO2, -C(=S)-, -Р(=O)-, -ОР(=O)-, -ОС(=O)-, R'OC(=O)(NR')-, -NHC(=O)-, -O-PhC(=O)- или -NR'C(=O)-; и каждый из R2 и R3 независимо выбран из- 12010294 группы: водород, -OR4, -SR4, NR4R4, -CN, -NO2, -N3, -C(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, C(=NR4)NR4R4, -C(=O)H, -R4C(=O). -SO2R4, -S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H, -PO3H,галоген, тригалометил, (С 1-С 25)алкил, замещенный (С 1-С 25)алкил, (С 1-С 25)гетероалкил, замещенный (С 1 С 25)гетероалкил, (С 5-C10)арил, замещенный (С 5-C10)арил, (С 5-С 15)ариларил, замещенный (C5C15)ариларил, (C5-C15)биарил, замещенный (С 5-С 15)биарил, (5-10)-членный гетероарил, замещенный (510)-членный гетероарил, (С 6-С 26)арилалкил, замещенный (C6-C26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, одна аминокислота и одна замещенная аминокислота. В некоторых примерах независимо выбранные заместители включают -OR4, -SR4, NR4R4, -CN, NO2, -N3, -С(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O), SO2R4, -S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H,-PO3H, галоген, тригалометил; где каждый R4 независимо выбран из группы (C1-C10)алкил, (С 5-С 10)арил, (5-10)-членный гетероарил, (С 5-С 16)арилалкил и (6-16)-членный гетероарилалкил, с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидроксиалифатических составляющих с цепью,образуемой 6-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота; или любая их комбинация; R' и R" независимо представляют собой одинаковые или различные заместители, определенные для R2, R3 или R4; при условии, что R2 и R3 одновременно не являются атомами водорода. Согласно предпочтительному примеру реализации предложена структура (II), гдеR1 представляет собой ОН или NH2;L выбран из группы: по меньшей мере одна аминокислота, по меньшей мере одна замещенная аминокислота, -R'C(=O)-, R'OC(=O)(NR')-, и -O-PhC(=O)-, где R' независимо представляет собой один или несколько одинаковых или различных заместителей, определенных здесь для R3 или R5;R2 независимо выбран из группы: -C(=O)R5, -C(=O)OR5, -C(=O)NHR4, -C(=O)NR4R4, -C(=S)NHR4, C(=S)NR4R4, -C(=NR4)NHR4, и -C(=NR4)NR4R4;R3 независимо выбран из группы: -OR5, -SR5, NR5R5, -C(=O)OR5, -C(=O)R5, C(=O)NHR4, C(=O)NR4R4, -C(=S)NHR4, -C(=S)NR4R4, -C(=NR4)NHR4, -C(=NR4)NR4R4, -RSC(=O), -SO2R5, -S(=O)R5, P(=O)(OR5)2, -P(=O)(OR5), -CO2H, -SO3H, -PO3H, галоген, тригалометил, (С 1-С 25) алкил, замещенный (С 1 С 25) алкил, (С 1-С 25)гетероалкил, замещенный (С 1-С 25)гетероалкил, (C5-C10)арил, замещенный (С 5-С 10) арил, (C5-C15)ариларил, замещенный (С 5-С 15)ариларил, (C5-C15)биарил, замещенный (С 5-С 15)биарил, (C6C26)-членный гетероарил, замещенный (5-10)-членный гетероарил, (C6-C26)арилалкил, замещенный (С 6 С 26)арилалкил, (6- 26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота; и каждый R4 независимо выбран из группы: (С 7-С 10) алкил, (C17-C26)арилалкил и (17-26)-членный гетероарилалкил, с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидрокси-алифатических составляющих с цепью, образуемой 7-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота; и R5 независимо выбран из группы: водород, (C1-C10)алкил, (C5 С 10)арил, (5-10)-членный гетероарил, (C6-C26)арилалкил, (6-26)-членный гетероарилалкил, прямой или разветвленный, насыщенный или содержащий одну или несколько ненасыщенных связей алифатический или гидроксиалифатический компонент с углеродной цепью, образованной 5-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота или любая их комбинация. Согласно некоторым примерам реализации R2 представляет собой -C(=O)OR5 или -C(=O)R5, или-C(=O)NHR4, -C(=S)NHR4, или -C(=NR4)NHR4. По другим примерам реализации R3 представляет собой по меньшей мере одну аминокислоту, выбранную из группы глицин, Р-аланин, саркозин, лизин, или любую их комбинацию, или представляет собой по меньшей мере одну аминокислоту, выбранную из группы: глицин, -аланин, GABA, 5-аминопентановая кислота, 6-аминогексановая кислота, Lys, gDab, Sar,Orn, Dap, hLys и любую их комбинацию. По связанным с предыдущим примерам реализации аминокислота R3 включает две аминокислоты, такие как глицин-лизин или саркозин-лизин. Предпочтительно R3 представляет собой аминокислоту глицин или -аланин. По некоторым примерам реализации R2 и R3 возможно замещены насыщенным алифатическим или гидроксиалифатическим компонентом с прямой углеродной цепью, образованной 10-15 атомами углерода. По особым примерам реализации, в которых предпочтительны полупродукты структуры (II), предложены любые из вышеупомянутых соединений,где R3 дополнительно содержит по меньшей мере одну защитную группу, согласно данному здесь описанию. Согласно некоторым примерам реализации в структуре (II) L представляет собой по меньшей мере одну аминокислоту или по меньшей мере одну замещенную аминокислоту. Например, аминокислоты или замещенные аминокислоты могут представлять собой п-аминофенилацетил,(паминофенилпропаноил)n, где n равняется 1 или 2, м-аминофенилацетил, (м-аминофенилацетил)n, где n равняется 1 или 2, о-аминофенилацетил, (о-аминофенилпропаноил)n, где n равняется 1 или 2, GABA, паминобензойная кислота (РАВА), м-аминобензойная кислота, о-аминобензойная кислота, л- 13010294 гидразинобензойная кислота, м-гидразинобензойная кислота, о-гидразинобензойная кислота, п-аминотранс-циннамил, м-амино-транс-циннамил, о-амино-транс-циннамил, L-BBTA; или любую их комбинацию. Предпочтительно L представляет собой п-аминофенилацетил, РАВА, м-аминобензойную кислоту,о-аминобензойную кислоту, п-амино-транс-циннамил, м-амино-транс-циннамил, о-амино-трансциннамил или любую их комбинацию. Согласно некоторым предпочтительным примерам реализации настоящего изобретения предложены определенные антимикробные липопептидные соединения, пригодные, например, для лечения и профилактики микробных инфекций. Примеры соединений, производных структуры (II), включают соединения 91, 331, 332, 86, 87, 280 или 89. По предпочтительному примеру реализации изобретение предлагает соединение 280. Согласно еще одному примеру реализации липопептидный антибиотик на основе амфомицина обладает структурой IIR1 представляет собой ОН или NH2;L независимо выбран из группы: по меньшей мере одна аминокислота, по меньшей мере одна замещенная аминокислота, -R'C(=O)- и -R'OC (=O)(NR')-, где R' независимо представляет собой один или несколько одинаковых или различных заместителей, определенных для R2 или R5;R3 представляет собой водород; где каждый R4 независимо выбран из группы: (С 7-C10)алкил, (С 17-С 26)арилалкил и (17-26)-членный гетероарилалкил, с разветвленной или прямой цепью, насыщенный или содержащий один или несколько ненасыщенных алифатических или гидроксиалифатических составляющих с цепью, образуемой 7-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота; и R5 независимо выбран из группы: водород, (C1-C10)алкил, (C5C10)арил, (5-10)-членный гетероарил, (С 6-С 26)арилалкил, (6-26)-членный гетероарилалкил, прямой или разветвленный, насыщенный или содержащий одну или несколько ненасыщенных связей алифатический или гидрокси-алифатический компонент с углеродной цепью, образованной 5-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота или любая их комбинация; Согласно некоторым примерам реализации R2 представляет собой -C(=O)R5, -C(=O)NHR4,-C(=S)NHR4, или -C(=NR4)NHR4. Согласно другим примерам реализации R5 представляет собой 10-20 членный гетероарилалкил, или насыщенный алифатический или гидроксиалифатический компонент с прямой углеродной цепью, образованной 5-17 атомами углерода. Согласно некоторым примерам реализации L представляет собой по меньшей мере одну аминокислоту или замещенную аминокислоту, такую как глицин, саркозин, фенилглицин, фенилаланин, О-метиласпарагиновая кислота, O-трет-бутиласпарагиновая кислота, п-аминобензойная кислота (РАВА), м-аминобензойная кислота, лгидразинбензойная кислота, п-аминофенилпропионовая кислота, (п-аминофенилпропионовая кислота)n,где n равняется 1 или 2, L-BBTA, м-аминофенилуксусная кислота, п-аминофенилуксусная кислота (Ара),п-амино-транс-коричная кислота, о-аминобензойная кислота, о,о-диаминобензойная кислота, о,мдиаминобензойная кислота, о,п-диаминобензойная кислота, м,п-диаминобензойная кислота, м,мдиаминобензойная кислота, о-амино-фенилуксусная кислота, м-аминофенилуксусная кислота, п-аминофенилуксусная кислота (Ара), аминотиазолуксусная кислота или любую их комбинацию. Предпочти- 14010294 тельно L представляет собой м-аминобензойную кислоту, о-аминобензойную кислоту, м,мдиаминобензойную кислоту, аминотиазолуксусную кислоту или РАВА, наиболее предпочтительно L представляет собой РАВА. Согласно другим примерам реализации R3 представляет собой по меньшей мере одну аминокислоту, выбранную из группы: Gly, -аланин, GABA, 5-аминопентановая кислота, 6-аминогексановая кислота, Lys, gDab, Sar, Orn, Dap, hLys. Альтернативно, там, где предлагаются полупродукты, производные от структуры II, R3 включаетдополнительно содержит по меньшей мере одну защитную группу. В предпочтительных примерах реализации противомикробные соединения по настоящему изобретению способны лечить или предотвращать микробные инфекции, вызванные, например, грамположительными бактериями. Примеры соединений включают соединения 21, 85, 103, 104, 105, 106, 107,108,109, 110, 111, 112, 113, 115, 116, 117, 118, 119, 120, 122, 123, 254, 281, 282, 283, 284, 285, 286, 287, 288,289, 290, 291, 292, 293, 294, 295, 296, 297, 300, 301, 302, 303, 304, 305, 306, 307, 310, 311, 312, 313, 314,315, 316, 317, 319, 320, 321, 337, 344, 345, 346, 358, 359, 360, 361, 362 и 374. По некоторым предпочтительным примерам реализации липопептидные производные по настоящему изобретению включают соединения 85 или 108 или 119. В другом примере реализации липопептидный антибиотик на основе амфомицина характеризуется структурой IIIR1 представляет собой ОН или NH2;L выбран из по меньшей мере одной аминокислоты или замещенной аминокислоты, -С(=O)-,-R'C(=O)-, -SO2, -C(=S)-, -Р(=O)-, -ОР(=O)-, -ОС(=O)-, -R'OC(=O)(NR'R")-, -NHC(=O)-, -O-PhC(=O)- или-NR'C(=O)-; и каждый из R2 и R3 независимо выбран из группы: водород, -OR4, -SR4, NR4R4, -CN,-NO2, -N3, -C(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O),-SO2R4, -S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H, -PO3H, галоген, тригалометил, (С 1-С 25)алкил,замещенный (C1-С 25)алкил, (С 1-С 25)гетероалкил, замещенный (С 1-С 25)гетероалкил, (С 5-C10)арил, замещенный (C5-C10)арил, (С 5-С 15)ариларил, замещенный (С 5-С 15)ариларил, (С 5-С 15)биарил, замещенный (C5C15)биарил, (5-10)-членный гетероарил, замещенный (5-10)-членный гетероарил, (C6-C26)арилалкил, замещенный (C6-C26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, природные аминокислоты, неприродные аминокислоты, замещенные природные и неприродные аминокислоты. Примеры независимо выбранных заместителей включают -OR4, -SR4, NR4R4, -CN, -NO2,-N3, -C(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O), -SO2R4,-S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H, -PO3H, галоген, тригалометил; где каждый R4 независимо выбран из группы: водород, (C1-C10)алкил, (C5-C10)арил, (5-10)-членный гетероарил, (C6C16)арилалкил, (6-16)-членный гетероарилалкил, прямой или разветвленный, насыщенный или содержащий одну или несколько ненасыщенных связей алифатический или гидроксиалифатический компонент с углеродной цепью, образованной 6-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота или любая их комбинация; а каждый R' и R" независимо представляет собой один или несколько одинаковых или различных заместителей, определенных для R2, R3 или R4; при условии, что R2 и R3 не могут одновременно представлять собой водород. Согласно некоторым примерам реализации предложены полупродукты структуры III, в которых R1 представляет собой ОН или NH2; L представляет собой аминокислоту выбранную из пары Gly и Sar; R2 представляет собой водород, a R3- аминокислоту с защитной группой, такую как Lys.- 15010294 Согласно другому примеру реализации липопептидный антибиотик на основе амфомицина обладает структурой IVR1 представляет собой ОН или NH2;L выбран из по меньшей мере одной аминокислоты или замещенной аминокислоты, -С(=O)-,-R'C(=O)-, -OC(=O)-, C(=O)R'-, SO2, -C(=S)-, -P(=O)-, -ОР(=O)-, -R'OC(=O)(NR'R") -, -NHC(=O)-, -OPhC(=O)- или -NR'C(=O)-; и каждый из R2 и R3 независимо выбран из группы: водород, -OR4, -SR4, NR4R4, -CN, -NO2, -N3,-C(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O), -SO2R4,-S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H, -РО 3 Н, галоген, тригалометил, (С 1-С 25)алкил, замещенный (C1-С 25)алкил, (С 1-С 25)гетероалкил, замещенный (С 1-С 25)гетероалкил, (С 5-C10)арил, замещенный(С 5-C10) арил, (C5-C15)ариларил, замещенный (С 5-С 15)ариларил, (С 5-С 15)биарил, замещенный (С 5 С 15)биарил, (5-10)-членный гетероарил, замещенный (5-10)-членный гетероарил, (С 6-С 26)арилалкил, замещенный (С 6-С 26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота или замещенная аминокислота. Примеры независимо выбранных заместителей включают -OR4, -SR4, NR4R4, -CN, -NO2, -N3, -С(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O), -SO2R4, -S(=O)R4,-P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H,-PO3H, галоген, тригалометил; где каждый R4 независимо выбран из группы: водород, (C1-C10)алкил, (С 5-C10)арил, (5-10)-членный гетероарил, (C6-С 16)арилалкил, (616)-членный гетероарилалкил, прямой или разветвленный, насыщенный или содержащий одну или несколько ненасыщенных связей алифатический или гидроксиалифатический компонент с углеродной цепью, образованной 6-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота или любая их комбинация; а каждый R' иR" независимо представляет собой один или несколько одинаковых или различных заместителей, определенных для R2, R3 или R4; при условии, что R2 и R3 не могут одновременно представлять собой водород. Согласно предпочтительным примерам реализации липопептидные антибиотики на основе амфомицина или аспартоцина имеют структуру (IV), где R1 представляет собой ОН или NH2;L независимо выбран из группы: по меньшей мере одна аминокислота, по меньшей мере одна замещенная аминокислота, -С(=O)-, -R'C(=O)-, -SO2, -C(=S)-, -Р (=O)-, -OP(=O)-, -OC(=O)-,-R'OC(=O)NR'R")-, -NHC(=O)-, -O-PhC(=O)- и -NR'C(=O)-. При условии, что L при Dab9 представляет собой -С(=O), где R' независимо представляет собой один или несколько одинаковых или различных заместителей, определенных для R2, R3 или R4;(5-10)-членный гетероарил, (С 6-С 26)арилалкил, замещенный (С 6-С 26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота.R3 выбран из группы: -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O),-CO2H, замещенный (C1-C25)алкил, замещенный (C1-C25)гетероалкил, замещенный (С 5-C10)арил, замещенный (C5-С 15)ариларил, замещенный (С 5-С 15)биарил, замещенный (5-10)-членный гетероарил, заме- 16010294 щенный (С 6-С 26)арилалкил, замещенный (6-26)-членный гетероарилалкил, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота, при условии, что R3 по меньшей мере одну из групп -С(=O)-, -C(=S)- или -C(=NR4)-; где каждый R4 независимо выбран из группы: водород, (C1-C10)алкил, (С 5-С 10)арил, (5-10)-членный гетероарил, (С 6-С 16)арилалкил, (6-16)-членный гетероарилалкил, прямой или разветвленный, насыщенный или содержащий одну или несколько ненасыщенных связей алифатический или гидроксиалифатический компонент с углеродной цепью, образованной 5-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота и по меньшей мере одна замещенная аминокислота или любая их комбинация. Согласно некоторым примерам реализации настоящее изобретение предлагает липопептидные производные - соединения структуры (IV), где R1 представляет собой ОН или NH2. По другим примерам реализации R3 представляет собой -С(=O) или -C(=S)-. По другим предпочтительным примерам реализации предложены соединения, обладающие противомикробной активностью. Примеры соединений включают 81, 210, 223, 235, 237 или 373. По некоторым примерам реализации R3 представляет собой по меньшей мере одну аминокислоту или замещенную аминокислоту, выбранную из группы: Gly, -аланин,GABA, 5-аминопентановая кислота, 6-аминогексановая кислота, Lys, gDab, Sar, Orn, Dap, hLys. По отдельным примерам реализации, где предпочтительны полупродукты структуры (IV), предложены любые из вышеупомянутых соединений, где, по меньшей мере, один из L или R3 дополнительно содержит по меньшей мере одну защитную группу, описанную здесь. Согласно другим примерам реализации изобретение предлагает липопептидные производные соединения и их фармацевтически приемлемые соли, такие как соединения 3, 4, 60, 128, 147, 199, 253 или 278. Любые из данных производных или другие, здесь описанные, могут входить в фармацевтические составы вместе с фармацевтически приемлемым носителем, наполнителем или разбавителем. Согласно некоторым примерам реализации липопептидные производные соединения по настоящему изобретению могут быть структурно чистыми, или же существовать в виде композиции, включающей смесь одного, или нескольких соединений, различающихся по структуре. По некоторым примерам реализации соединения по согласно настоящему изобретению существуют в виде свободной кислоты или основания, или в виде фармацевтически приемлемой соли. По другим примерам реализации циклическое пептидное ядро представляет собой -изомер, ангидроизомер или диангидроизомер. Для удобства для обозначения производных циклических пептидов амфомицинового ядра применяются следующие сокращения:(IVa) R2-L-R-L-R3 где R представляет собой амфомициновое циклическое пептидное ядро амфомицина (включающее экзоциклическую аминокислоту в положении 1, где присоединен R1),R2 и R3 представляют собой любой из описанных заместителей, включая, например: водород, (С 1 С 25)алкил, замещенный (С 1-С 25)алкил, (С 1-С 25)гетероалкил, замещенный (С 1-С 25)гетероалкил, (C5C10)арил, замещенный (С 5-C10)арил, (С 5-С 15)ариларил, замещенный (С 5-С 15)ариларил, (С 5-С 15)биарил,замещенный (C5-C15)биарил, (5-10)-членный гетероарил, замещенный (5-10)-членный гетероарил, (С 6 С 26)арилалкил, замещенный (C6-C26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)членный гетероарилалкил, аминокислоты, замещенные аминокислоты или тому подобные, при условии,что R2 и R3 одновременно не представляют собой водород. R2 и R3 возможно связаны с циклическим пептидным ядром через описанное здесь связующее звено - линкер L, содержащий любую химическую функциональную группу, способную к образованию ковалентной связи с азотом, известную специалистам в данной области. Например, связующее звено - линкер L возможно включает амид, имид, сульфонамид, сульфонимид, амидин, карбонат, карбамат, тиомочевину, мочевину и тому подобное. По некоторым примерам реализации L выбран из одной или нескольких аминокислот, одной или нескольких замещенных аминокислот, -С(=O)-, -SO2, -C(=S)-, -Р(=O)-, -ОР(=O)-, -ОС(=O)-, -R'OC(=O)(NR'R")-,-NHC(=O)-, -O-PhC(=O)- и -NR'C(=O)-; каждый R' независимо представляет собой один или несколько одинаковых или различных заместители, определенных здесь для R2, R3 или R4. Как известно специалистам в данной области, липопептидные антибиотики (например, амфомицин,аспартоцин), изолированные из культуры обычно состоят из смеси соединений, различающихся структурами макроциклических ядер (определено ниже) или липофильными заместителями (например, жирнокислотными компонентами). Различные соединения, образующие смесь, можно выделить и изолировать либо в виде суб-смесей или в виде соединений, описанных здесь, как структурно чистые. Термин липопептидный антибиотик здесь включает, среди прочего, смеси естественно вырабатываемые продуцирующим штаммом, так же, как и любые суб-смеси или структурно чистые соединения, которые выделяют и синтезируют их производные. Далее, пептидное циклическое ядро может содержать модификации, включая -изомеры, ангидрои- 17010294 зомеры и диангидроизомеры. Например, пара Asp-Gly (в положениях 5, 6 и 7,8 соответственно) циклического пептида амфомицинового или аспартоцинового ядра может изменить модификацию - связывание на -связывание. В измененной модификации протяженная пептидная основа вместо кислоты аспартатного остатка содержит -кислоту. Образовавшиеся -изомеры могут содержать одну или несколько вероятных структурных модификаций, выбранных из следующих трех, без учета возможных стереохимических изменений: (а) 5,6- и 7,8-, (b) 5,6- и 7,8-, или (с) 5, 6- и 7,8-. Каждый из изомеров циклических пептидов амфомицинового или аспартоцинового ядра амфомицина или аспартоцина имеет тот же молекулярный вес, что и циклический пептид ядра -амфомициновогоа ядра. Аналогично, пару Asp-Gly (в положениях 5, 6 и 7,8 соответственно) циклического пептида амфомицинового ядра амфомицина можно модифицировать, убрав молекулу воды, и получить ангидроизомер или диангидроизомер. Два возможных моно-ангидроизомера образуются при удалении одной молекулы воды. Если модификации происходят в обоих положениях, диангидроизомер образуется при удалении двух молекул воды. Следует понимать, что возможны комбинации -изомеров и ангидроизомеров; также как и стереохимические модификации индивидуальных аспартатных остатков. Отсюда следует, что: термин липопептидный антибиотик включает любые модифицированные структуры, а также их комбинации. Структуры -изомеров циклического пептида амфомицинового ядра показаны на фиг. 1. Структуры ангидро- и диангидроизомеров циклического пептида амфомицинового ядра показаны на фиг. 2. Термин структурно чистый относится к композиции соединений, в которых процент вещества,состоящего из молекул, определенного вида, образующих композицию, содержащих одинаковое количество атомов одного типа, соединенных друг с другом в одинаковом порядке связями одинаковой природы, количественно составляет от 95 до 100%, предпочтительно 95, 96, 97, 98, 99% и более. Термин структурно чистый здесь не предназначен для различения геометрических или оптических изомеров. Например, описанная здесь смесь цис- и транс-бут-2,3-енов считается структурно чистой, так как представляет собой рацемическую смесь. Когда композиция должна включать значительное процентное количество определенного геометрического или оптического изомера, используется номенклатура геометрически чистый или оптически или энантиометрически чистый соответственно. Термин структурно чистый здесь не предназначен ни для описания различных таутомерных форм или степеней ионизации молекулы, ни прочих молекулярных форм, образующихся по причине равновесных явлений или других обратимых превращений. Таким образом, композиция, например, органической кислоты является структурно чистой, несмотря на то, что у некоторых карбоксильных групп возможно присоединен протон (-СООН), а у других протон отсутствует (-СОО-). Аналогично, композиция, состоящая из смеси кето или енольных таутомеров, если не указано другое, считается структурно чистой. Согласно некоторым примерам реализации соединения по изобретению представляют собой липопептидные производные исходных липопептидных антибиотиков амфомицинового ряда, продуцированных культурами. Примеры исходных липопептидных антибиотиков амфомицинового ряда включают амфомицин (глумамицин), аспартоцин, кристалломицин, фриулимицин (friulimycin), сушимицин (tsushimicin) и заомицин (zaomicin). Специалист в данной области понимает, что по этим примерам реализации структуры экзоциклических аминокислот и липофильный заместитель R2 в структурных формулах(I)-(IV) в основном определяется определяются природой продуцирующего штамма и условиями, в которых находится культура. Специалист в данной области понимает также, что по этим примерам реализации исходные липопептидные антибиотики амфомицинового ряда возможно содержат смеси соединений с различными структурами экзоциклических аминокислот или липофильных заместителей R2. Далее, в связи с описанием синтеза соединений по настоящему изобретению, подробно обсуждается возможность получения желательных соединений при соответствующем выборе исходных липопептидных антибиотиков амфомицинового ряда в качестве исходного материала. Например, в состав препаратов амфомицина, аспартоцина, заомицина и сушимицина, изолированных из культур, входят смеси соединений, однако все они обладают общим (одинаковым) макроциклическим ядром одного и того же амфомицинового ряда: в макроциклическом пептидном ядре R, где заместитель R' представляет собой -ОН. Аналогично,все компоненты смеси, входящие в состав препаратов фриулимицина, обладают одинаковыми макроциклическими ядрами одного и того же, амфомицинового ряда: в макроциклическом пептидном ядре R, где заместитель R' представляет собой -NH2. Таким образом, считается, что соединения, входящие в состав этих анитибиотических смесей, отличаются друг от друга только структурами липофильного заместителя (т.е. жирнокислотного компонента). Альтернативно, в состав антибиотика А 1437 входит смесь соединений, которые, как полагают, отличаются друг от друга структурами макроциклических ядер амфомицинового ряда и жирнокислотных компонентов (см., напр., патент США No. 6,194,383). Все названные исходные липопептидные антибиотики амфомицинового ряда можно использовать в качестве исходного материала для получения липопептидных антибиотиков по изобретению (напр., обладающих определенным липофильным заместителем или замещающим компонентом Dab9). Структурно чистые липопептидные производные по изобретению можно получить путем разделения и выделения соединений, входящих в состав исходного материала для получения исходного липопептидного антибиотика, перед синтезом производных макроциклического пептида ядра; или же, в качестве альтернати- 18010294 вы, путем разделения соединений - компонентов смеси, образовавшейся после синтеза производных,ниже это будет описано подробнее. Кроме того, во многих случаях, точные структуры жирнокислотных компонентов исходных липопептидных антибиотиков амфомицинового ряда не установлены. Соединения по изобретению, обладающие жирнокислотными компонентами определенной структуры, можно синтезировать путем удаления липидного компонента исходного материала для получения исходного липопептидного антибиотика и взаимодействием данного делипидированного полупродукта с жирной кислотой или другим заместителем (напр., липофильным заместителем) определенной структуры. От полученного продукта можно образовать производные, например, по компоненту (остатку) Dab9, в результате образуется производное соединение Dab9 по изобретению, обладающее определенным липофильным заместителем при концевой аминогруппе. В качестве альтернативы, Dab9 производное соединение согласно настоящему изобретению, синтезированное путем образования производного исходного липопептидного антибиотика амфомицинового ряда, можно удалить липидный компонент, и производный делипидированный Dab9 полупродукт Dab9 производного привести во взаимодействие с жирной кислотой или другим заместителем определенной структуры. Специалистам в данной области хорошо известны жирные кислоты, образующие соответствующие жирнокислотные компоненты; либо способные присоединять соответствующие жирнокислотные компоненты к макроциклическому пептиду ядра (см., напр., Rmpp Chemie Lexicon, Prof. Falbe and Prof. Regitz,gth Edition, Georg Thieme Verlag Stuttgart, New York; and Hawley, 3rd Edition, Van Nostrand Reinhold Company, New York, каждая из которых включена в настоящее описание посредством ссылки). По одному примеру реализации, выбирают жирную кислоту, образующую соединение по изобретению, обладающее жирнокислотным компонентом, идентичным жирнокислотному компоненту определенного липопептидного антибиотика амфомицинового ряда. Такие жирные кислоты хорошо известны специалистам в данной области. Иллюстративные примеры приведены, например, в патенте США No. 6,194,383, (см., в частности, Cols. 5-8), включенном посредством ссылки. Жирная кислота, однако, не обязательно соответствует жирной кислоте известного липопептидного антибиотика амфомицинового ряда. Подходящие жирные кислоты возможно включают неразветвленные и насыщенные кислоты (такие как, напр., капроновая, энантовая, каприловая, пеларгоновая, каприновая,ундекановая, лауриновая, тридекановая, муристиновая, пентадекановая, пальмитиновая, маргариновая(pentacosenoic), и тому подобные); разветвленные и насыщенные (напр., изомасляная, изовалериановая,изопальмитиновая и тому подобные, и соответствующие кислоты в анте-изо конфигурации, возможно содержащие метокси или гидрокси заместители); моноенойные (напр., обтузиловая (obtusilic), капролеиновая (caproleic), додециновая, линдеровая (linderic), миристоловая (myristoleic), фистеровая (physeteric),цузуивая (tsuzuic), палмитоловая (palmitoleic), петроселиновая (petroselinic), олеиновая, ваксценовая (vaccenic), гадолеиновая, гондоловая (gondoic), цетоловая (cetoleic), эруковая, нервоновая (nervonic), и тому подобные кислоты); полиенойные (напр., линолевая, -линолевая, арахидоновая, stearidonic, и тому подобные кислоты, а также полиеновые кислоты (линоловая, гамма-линоловая, арахидоновая, стеаридоновая и подобные кислоты), прерванные метиленовыми или полиметиленовыми группами (вставками), сопряженные жирные кислоты, галогенированные жирные кислоты). См. также патент США No. 6,194,383,включенный посредством ссылки. Согласно некоторым предпочтительным примерам реализации жирная кислота представляет собой жирнокислотный компонент или гидроксижирнокислотный компонент с углеродной цепью, образованной 6-25 атомами углерода и более предпочтительно 10-20 атомами углерода. Жирная кислота или гидрокси-жирная кислота возможно является разветвленной линейной, насыщенной или содержащей одну или несколько ненасыщенных связей и их комбинации. По одному примеру реализации жирная кислота представляет собой насыщенную или содержащую одну ненасыщенную связь жирную кислоту с углеродной цепью, образованной 10-18 атомами углерода, линейной или имеющей одно ответвление, предпочтительно изо или анте-изо конфигурации. По другому примеру реализации жирная кислота представляет собой насыщенную или содержащую одну ненасыщенную связь жирную кислоту с углеродной цепью, образованной 10-18 атомами углерода, линейной или имеющей одно ответвление, предпочтительно изо- или анте-изоконфигурации. По определенным примерам реализации гидроксижирные кислоты имеют гидроксильную группу в положении 2, 3 или в конце цепи. Согласно некоторым аспектам, как показано на примере соединений структур (I-III), R2 (напр., липофильный заместитель) может быть присоединен непосредственно к аминоконцевой аминогруппе Asp или Asn, а заместитель R3 может быть присоединен непосредственно к -аминогруппе Dab9, где R2 и R3 независимо выбраны из группы: водород, (С 1-С 25)алкил, замещенный (С 1-С 25)алкил, (С 1-С 25)гетероалкил,замещенный (С 1-С 25)гетероалкил, (C5-C10)арил, замещенный (С 5-C10)арил, (С 5-С 15)ариларил, замещенный(5-10)-членный гетероарил, (С 6-С 26)арилалкил, замещенный (С 6-С 26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, природные аминокислоты, неприродные ами- 19010294 нокислоты, замещенные природные и неприродные аминокислоты; где R2 и R3 одновременно не представляют собой водород. Примеры независимо выбранных заместителей включают -OR4, -SR4, NR4R4,-CN, -NO2, -N3, -C(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H, -R4C(=O),-SO2R4, -S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H, -PO3H, галоген и тригалометил; где каждыйR4 независимо выбран из группы: водород, (C1-С 10)алкил, (C5-C10)арил, (5-10)-членный гетероарил, (C6 С 16)арилалкил и (6-16)-членный гетероарилалкил с разветвленной или прямой углеродной цепью, насыщенный или включающий алифатический или гидрокси алифатический компонент, содержащий одну или несколько ненасыщенных связей, с углеродной цепью, образованной 6-25 атомами углерода, первичный или вторичный амин, по меньшей мере одна аминокислота, по меньшей мере одна замещенная аминокислота и любая их комбинация. В соединениях структур (I)-(IV) R4 возможно представляет собой -ОН или -NH2; это означает, что аминоконцевая экзоциклическая аминокислота представляет собой остаток Asp, остаток или остаток Asn остаток, соответственно. Будет ли аминоконцевая экзоциклическая аминокислота представлять собойAsp или Asn, зависит от выбора исходного липопептидного антибиотика на основе ряда амфомицина для использования в качестве исходного материала для синтеза липопептидных производных по изобретению, или производных соединений по изобретению с определенными липофильными заместителями и/или Dab9 заместителями, что очевидно для специалистов в данной области. Например, липопептидные антибиотики, в которых аминоконцевая экзоциклическая аминокислота, представляет собой Asp, можно приготовить из амфомицина, аспартоцина, сушимицина (tsushimicin), или Asp-фракции антибиотика А 1437. Липопептидные производные по изобретению, в которых аминоконцевая экзоциклическая аминокислота, представляет собой Asn, можно приготовить из фриулимицина или Asn-фракции антибиотика А 1437. Asn и Asp фракции антибиотика А 1437 можно изолировать из препарата культивированного антибиотика 1437 способами, описанными, например, в Патенте США 6194383, включенном в настоящую заявку посредством ссылки. Согласно некоторым другим аспектам производные антимикробные соединения структурных формул с (I) по (III) возможно содержат заместитель R3, выбранный из группы, включающей водород, -OR4,-SR4, NR4R4, -CN, -NO2, -N3, -C(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H,-R4C(=O), -SO2R4, -S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H, -PO3H, галоген, тригалометил, (С 1 С 25)алкил, замещенный (С 1-С 25)алкил, (С 1-С 25)гетероалкил, замещенный (С 1-С 25)гетероалкил, (C5-C10) арил, замещенный (C5-C10)арил, (С 5-С 15)ариларил, замещенный (С 5-С 15)ариларил, (С 5-С 15)биарил, замещенный (С 5-С 15)биарил, (5-10)-членный гетероарил, замещенный (5-10)-членный гетероарил, (С 6-С 26) арилалкил, замещенный (С 6-С 26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)членный гетероарилалкил, природные аминокислоты, неприродные аминокислоты, замещенные природные и неприродные аминокислоты. Примеры независимо выбранных заместителей включают -OR4, -SR4,NR4R4, -CN, -NO2, -N3, -C(=O)OR4, -C(=O)R4, -C(=O)NR4R4, -C(=S)NR4R4, -C(=NR4)NR4R4, -C(=O)H,-R4C(=O), -SO2R4, -S(=O)R4, -P(=O)(OR4)2, -P(=O)(OR4), -CO2H, -SO3H, -PO3H, галоген и тригалометил; где каждый R4 независимо выбран из группы: водород, (C1-C10)алкил, (С 5-C10)арил, (5-10)-членный гетероарил, (С 6-С 16)арилалкил и (6-16)-членный гетероарилалкил с разветвленной или прямой углеродной цепью, насыщенный или включающий алифатический или гидроксиалифатический компонент, содержащий одну или несколько ненасыщенных связей, с углеродной цепью, образованной 6-25 атомами углерода, первичный или вторичный амин, по меньшей мере одну аминокислоту, по меньшей мере одну замещенную аминокислоту и любую их комбинацию, первичную аминогруппу, вторичную аминогруппу,одну или несколько аминокислот, одну или несколько замещенных аминокислот. По одному предпочтительному примеру реализации (3-аминогруппа Dab9 непосредственно связана с заместителем R3, образуя при этом первичный или вторичный амин формулы -NHR3, где R3 представляет собой водород, (С 1-С 25) алкил, замещенный (С 1-С 25)алкил, (С 1-С 25)гетероалкил, замещенный (С 1-С 25)гетероалкил, (C5-C10)арил,замещенный (С 5-C10)арил, (С 5-С 15)ариларил, замещенный (С 5-С 15)ариларил, (С 5-С 15)биарил, замещенный(С 5-С 15)биарил, (5-10)-членный гетероарил, замещенный (5-10)-членный гетероарил, (С 6-С 26)арилалкил,замещенный (C6-C26)арилалкил, (6-26)-членный гетероарилалкил, замещенный (6-26)-членный гетероарилалкил, природные аминокислоты, неприродные аминокислоты, замещенные природные и неприродные аминокислоты и любые их комбинации. По другому предпочтительному примеру реализации первичная или вторичная аминогруппа может быть отделена пространственно от макроцикпического остатка Dab9 связующим компонентом (линкером), что представлено здесь, и в описании показано в структуре соединений (III) и (IV). Частично, настоящее изобретение основано на удивительном неожиданном открытии: производные липопептидных антибиотиков на основе амфомицина, содержащие заместители у аминоконцевой экзоциклической аминокислоты, у макроциклического остатка Dab9 или в обоих положениях, в основном, сохраняют антимикробные свойства исходных липопептидных антибиотиков амфомицинового ряда, производными которых они являются; однако растворимость их, возможно, изменяется. Например, таким образом можно получить производные липопептидных антибиотиков на основе амфомицина с улучшенными терапевтическими свойствами или спектром воздействия по сравнению с исходными липопептидными антибиотиками амфомицинового ряда, производными которых они являются. Без ограничения рамками какой-либо теории, возможно присутствующую связующую группу (лин- 20010294 кер), через которую к макроциклическому пептидному ядру присоединены R2 и R3 вместе или по отдельности, предпочтительно вводят, чтобы таким образом обеспечить достаточное количество атомов для,отделения вводимого заместителя от пептида макроциклического ядра на расстояние, составляющее,приблизительно от 1 до 10. Обычно связующая группа (линкер) представляет собой компонент, который вместе с атомом азота аминогруппы аминоконцевой экзоциклической аминокислоты или с -атомом азота, входящим в состав Dab9, с которым связана связующая группа, образует связующее звено, стабильное при физиологических условиях, в которых применяются соединения по настоящему изобретению. Примеры связующих групп включают: амид, имид, сульфонамид, сульфонимид, амидин, карбонат,карбамат, тиомочевину, мочевину и тому подобные. Таким образом, примеры подходящих связующих групп включают одну или несколько аминокислот, одну или несколько замещенных аминокислот, комбинацию одной или нескольких аминокислот с одной или несколькими замещенными аминокислотами, С(=O), -S(O)2-, -C(=NH)-, -NHC(=O)-,-NHC(=S)-, -NHC(=O)NH-, -NHC(=S)NH- и -С(=O)O-группы. Специалисту в данной области ясно, что точное число атомов, необходимое для обеспечения желательного пространственного разделения заместителей R2 и R3 и циклического пептида ядра зависит, среди прочего, от природы атомов (например, N, О, S, С, и т.д.) и связей (например, простая, двойная, тройная, и т.д.), входящих в состав связующего компонента; таким образом, можно подобрать дополнительные заместители при необходимости обеспечить оптимальное пространственное разделение. Например,возможно присутствующие или отсутствующие заместители, обеспечивающие дополнительное пространственное разделение, включают практически любую комбинацию атомов углерода или гетероатомов, пригодных для пространственного разделения. По некоторым примерам реализации, в состав связующего звена L возможно входят гидрофильные или гидрофобные, длинные или короткие, жесткие,полужесткие или подвижные пространственные компоненты. Примеры групп, в состав которых, возможно,входит разделительная группа, включают -CH2-, -СН=СН-, -С=С-, -О-, -S-, -NH-, -NH-NH-, -N=N-, -C(=O)-,-S(=O)2-, -S(=O)2-O-, -C(=NH)- и тому подобные. Специалистам в данной области известны и другие разделительные группы, среди них алкил, гетероалкил, ациклические гетероатомные мостики, арил, ариларил, арилалкил, гетероарил, гетероарил-гетероарил, замещенный гетероарил-гетероарил, гетероарилалкил, гетероарил-гетероалкил и тому подобные. Таким образом, в разделительной группе возможно присутствуют простые, двойные, тройные или ароматические углерод-углеродные связи, связи азот-азот, углерод-азот, углерод-кислород или углерод-сера, и следовательно, функциональные группы, такие как карбонилы, эфиры,тиоэфиры, карбоксамиды, сульфонамиды, мочевины, уретаны, гидразины и тому подобные. Для специалиста в данной области очевидно, что из этих и других группы можно составить множество комбинаций, создать подходящие разделительные группы или комбинированные линкерыразделители. Кроме того, разделительные группы могут содержать заместители - один или несколько,одинаковые или различные, как описано здесь. Специалист в данной области может выбрать подходящее связующее звено или разделяющий компонент. Например, там, где необходимо жесткое связующее звено (линкер), можно использовать полиненасыщенный алкил или арил, биарил, гетероарил и т.п. Там, где необходимо подвижное связующее звено, можно использовать подвижный гибкий пептид, такой как GlyGly-Gly, или подвижный гибкий насыщенный алканил или гетероалканил. Гидрофильные связующие или разделительные группы могут представлять собой, например, полиспирты или полиэфиры, такие как полиэтиленгликоли. Гидрофобные связующие или разделительные группы могут представлять собой,например, алкилы или арилы. Согласно некоторым предпочтительным примерам реализации в производных соединениях структурных формул (I)-(IV) заместитель R2 или R3 может представлять собой одну или более аминокислот(или несколько аминокислот), связанную связанных через концевую карбоксильную группу с аминогруппой аминоконцевой экзоциклической аминокислоты или с -аминогруппой макроциклического остатка Dab9, соответственно, образуя с образованием амидной связи. Такими аминокислотами могут быть-, - и -аминокислоты. Аминокислоты могут содержать боковые цепи, такие как боковые цепи одной из двадцати генетические кодируемых аминокислот, или их аналоги. По некоторым предпочтительным примерам реализации заместитель представляет собой аминокислоту, выбранную из группы: глицин,пролин, пипеколиновая кислота, саркозин, фенилаланин, фенилглицин, аспарагин, тирозин, триптофан,лейцин, аланин, изолейцин, валин, глутамин, треонин, (3-аланин, 2,4-диаминомасляная кислота, 2,3 диаминопропионовая кислота, п-метиласпартат, циклогексилаланин, изонипекотиновая кислота, орнитин, и 6-аминогексановая кислота. По другим предпочтительным примерам реализации, присоединяют более одного заместителя, представляющего собой аминокислоту: глицин-лейцин, глицин-лизин, лизинглицин, глицин-лейцин, пролин-глицин, (P-аланин)-(6-аминогексановая кислота), 3-аланин)-орнитин,(-аланин)-лизин, глицин-аланин, (6-аминогексановая кислота)-глицин, глицин-(6-аминогексановая кислота), глицин-глицин-глицин, глицин-лизин-глицин, глицин-глицин-лизин, глицин-лизин-лизин, лизинлизин-лизин, лизин-лизин, глицин-валин, пролин-лизин, глицин-орнитин, глицин-(2,3-диаминомасляная кислота, глицин-(2,3-диаминопропионовая кислота), глицин-гомолизин, саркозин-(6-аминогексановая кислота), саркозин-лизин. Все хиральные центры аминокислот могут обладать либо R-, либо Sконфигурацией. Примеры подходящих аминокислот включают двадцать генетически кодируемых ами- 21010294 нокислот; различные аминокислоты, перечисленные в Практическом руководстве по биохимии и молекулярной биологии Fasman, CRC Practical Handbook at Biochemistry and Molecular Biology, 1989, CRCPress, Inc., Boca Raton, FL на страницах 4-60, и -, -ненасыщенные аминокислоты, перечисленные в Руководстве Fasman, 1989, названном выше, на странице 69. Другие аминокислоты, подходящие в качестве заместителей, известны специалистам в данной области. Способы синтеза Соединения по настоящему изобретению можно синтезировать различными путями с применением коммерчески доступных для приобретения исходных материалов или исходных материалов, которые можно приготовить традиционными синтетическими и биосинтетическими способами. Два общих подхода к синтезу показаны на фиг. 3. По схеме (I) R и R1 являются заместителями, определенными для структурных формул (I)-(III). Согласно схеме (I) исходный липопептидный антибиотик амфомицинового ряда (или смесь антибиотиков) 10 связывают с соответствующим образом защищенным реагентом 12, который в особо отдельном проиллюстрированном примере представляет собой F-moc-защищенный глицин, в результате образуется защищенный Dab9 полупродукт (или смесь полупродуктов) 14. Защищенный реагент может представлять собой любой из описанных здесь заместителей, включая липофильные заместители, другие органические заместители, одну или несколько аминокислот (природных, неприродных, замещенных и т.д.), и тому подобные. Реакционные условия связывания первичных аминов, например, реакции антибиотика (или смеси антибиотиков) 10 с карбоновыми кислотами, например реагентом 12, с образованием амидных связей известны специалистам в данной области и содержатся в любом руководстве по стандартным методам синтеза или в литературе, посвященной синтезу пептидов и протеинов. См., напр., March, J., Advanced Organic Chemistry; Reactions, Mechanisms and Structure, 4Ih ed., 1992; Larock, Comprehensive Organic Transformations, VCH, New York, 1999; Bodanzsky, Principles of Peptide Synthesis, Springer Verlag,1984; Bodanzsky, Practice of Peptide Synthesis, Springer Verlag, 1984; Lloyd-Williams et al., Chemical Approaches to the Synthesis of Peptides and Proteins, CRC Press, 1997 (see especially pp. 105-114); and AthertonSheppard, Solid Phase Peptide Synthesis: A Practical Approach, IRL Press, 1989). Возможно использование альтернативных реакционных групп, таких как изоцианат (в результате образуется мочевина), и другие,описанные здесь в примерах, и известные специалистам в данной области. Затем с защищенного полупродукта 14 снимают защиту, в результате образуется производное соединение Dab9 (или смесь производных) 16. Способ проиллюстрирован при помощи примера с F-mocзащитной группой, однако для любого специалиста в данной области очевидно, что можно использовать и другие защитные группы. Более того, реагент 12 может содержать и другие или дополнительные функциональные группы, которым возможно может быть нужна защита. Группы, пригодные в качестве защитных для различных функциональных групп, так же, как и условия снятия защиты, хорошо известны специалистам в данной области. Специальные указания по селективной защите различных функциональных групп содержатся, например, в руководстве GreeneWuts, Protective Groups in Organic Synthesis, 3dedition, 1999 ("GreeneWuts"). Предпочтительны защитные группы, которые легко удалить. Предпочтительные защитные группы для первичных аминов: трет-бутилоксикарбонил ("t-Boc"), 9-фтор-илметоксикарбонил ("Fmoc") и бензилоксикарбонил ("Z"). Специалистам в данной области понятно, что если исходный липопептидный антибиотик амфомицинового ряда 10 представляет собой смесь отдельных компонентов, то в результате реакции образуется смесь производных соединений 16, из которой каждое отдельное соединение можно частично или полностью выделить или очистить, получив отдельные производные соединения 16 с различными R1 группами, описанными здесь. Репрезентативные производные соединения 16, приготовленные по данному способу, показаны в табл. 16 и в примерах 367,378, 369, 370, 371 и 372. Исходный липопептидный антибиотик амфомицинового ряда 10 можно получить путем изоляции его выделения из культуры микроорганизмов, способных продуцировать данный антибиотик. Микроорганизмы, продуцирующие липопептидные антибиотики амфомицинового ряда, хорошо известны, так же,как и условия выделения, возможной дальнейшей очистки образовавшегося в результате антибиотика. Например, штаммы, продуцирующие амфомицин (глумамицин) включают: Streptomyces canus (АТСС 12237; см. также Heinemann et al., 1953, Antibiot.Chemother. 3: 1239-1242) и Streptomyces zaomyceticus- 22010294 Условия культивирования и выделения различных липопептидных антибиотиков содержатся в данном описании, и цитируемых выше патентах и ссылках, равно как и в предыдущих ссылках, упоминаемых в связи с перечислением различных антибиотиков. Далее следует пример: описание способа приготовления липопептидных соединений на основе амфомицина путем ферментации в биореакторе. Липопептид на основе амфомицина можно приготовить путем ферментации в 700-литровом биореакторе из нержавеющей стали. Биохимический синтез амфомицина осуществляют следующим образом: в среду, состоящую из 0,1% декстрозы, 0,5% мелассы, 1,0%Bacto Peptone и 0,1% СаСО 3 в 100 мл воды из-под крана, вносят затравку - соскоб спор и мицелия с культуры Streptomyces griseus ssp. spiralis (NRRL B-3290; BSP-M707) на косом агаре. Среду с внесенной затравкой инкубировали инкубируют при температуре около 28 С на вращающемся встряхивателе на скорости около 180 поворотов в минуту (RPM) в течение приблизительно 48 ч, что обеспечивает при этих условиях значительный и равномерный вегетативный рост культуры. Эту затравочную культуру переносят в 400 мл той же среды в 2-литровую колбу, которую инкубируют при тех же условиях, затем добавляют к 9,6 л той же среды в 16-литровый ферментер; через 48 ч при скорости перемешивания 200 RPM,скорости воздушного потока 5 л/мин образуется затравка 3-й стадии. Эта конечная затравка используется для инокуляции 500 л среды, содержащей 1 г/л CaCO3, 10 г/л Grandma's Molasses (десульфурированной), 10 г/л Difco Bacto Peptone от Difco, и 20 г/л декстрозы - Baker Dextrose, перед стерилизацией устанавливают рН 7,1. Ферментацию проводят при скорости перемешивания 200 RPM, воздушного потока 125 л/мин, температуре 28 С с добавлением пеногасителя, Mazu DF204, если требуется. Ферментационный бульон вызревает через 114 ч. После ферментации для получения неочищенного препарата липопептида на основе амфомицина можно использовать следующий стандартный способ. Клетки и другие твердые частицы, содержащиеся в ферментационном бульоне отделяют центрифугированием; доводят рН надосадочной жидкости до 3,3 при помощи HCl и выстаивают при 14 С в течение 2 ч. Образовавшийся осадок отделяют центрифугированием и отбрасывают. Доводят рН декантированной жидкости до 7,0 и добавляют сульфат аммония для осаждения неочищенного комплекса антибиотика. Осадок отделяют центрифугированием, растворяют в воде, доводят рН до 7,0, затем высушивают лиофильным способом, в результате образуется 2058 г твердого вещества, содержащего 5-7% липопептидного комплекса на основе амфомицина. Для дальнейшей очистки липопептида на основе амфомицина можно воспользоваться способом,основанном на образовании хелатного соединения. Неочищенное вещество темного цвета (68,3 г), содержащее 5-7% липопептидного комплекса на основе амфомицина растворяют в 500 мл дистиллированной воды и перемешивают, доводя рН до 7,0, для максимального увеличения растворимости в воде. Возможно образование нерастворимого вещества, отделяемого центрифугированием, затем рН оставшейся декантационной жидкости доводят до 3,3. Липопептидный комплекс на основе амфомицина экстрагируют последовательно двумя порциями 1-бутанола (500 мл, 300 мл), к объединенным бутанольным фазам добавляют 600 мл воды. Образовавшуюся двухфазную систему перемешивают, при помощи 1N NaOH доводят рН до 8,0, чтобы получить липопептидный комплекс на основе амфомицина в виде натриевой соли в водной фазе. К отделенной водной фазе добавили добавляюти хлорид кальция (2,642 г) и экстрагируют липопептид на основе амфомицина в виде хелата в 1-бутанол двумя последовательными экстракциями (500 мл, 250 мл). Для удаления кальция объединяют 1-бутанольные фазы, смешивают с 900 мл воды, довели доводят рН до 3,0, отделили отделяют от водной фазы и промыли промывают 150 мл воды. К 1-бутанольной фазе, содержащей липопептидный комплекс на основе амфомицина, добавляют 500 мл воды, доводят рН до 7,0. Для удаления остатка пигментов, рН водной фазы, содержащей комплекс антибиотика, доводят до 3,0 и смешивают с 500 мл 1-бутанола. 1-бутанольную фазу отделяют, промывают 150 мл воды (рН 2-3), добавляют 500 мл воды, затем рН смеси доводят до 7,0. Водную фазу, содержащую липопептидный комплекс на основе амфомицина, в виде неполной натриевой соли выпаривают под вакуумом для удаления остаточного 1-бутанола и высушили лиофильным способом; в результате получили 3,6 г белого порошка. Анализ очищенного комплекса способом ВЭЖХ проводили для определения степени чистоты липопептида на основе амфомицина % площадь при длине волны 215 нм, пики комплеса 9,4 и 10,6 мин (предпочтительно приблизительно от 85 до 95% чистоты, более предпочтительно приблизительно от 90 до 95% чистоты). Возможно применение ВЭЖХ системы Prodigy 511 ODS (2) колонка,элюирование в течение 8 мин, градиент с 10 до 75% ацетонитрила при рН 7,2 с 0,05 М фосфатным буфером. Как обсуждалось выше, в большинстве случаев липопептидные антибиотики амфомицинового ряда или смесь антибиотиков 10, изолированных из культур представляют собой соединения с различными структурами R1 или циклического пептидного ядра R. Например, амфомицин является смесью соединений 10, в которых R1 является смесью изо и анте-изо С 12 и С 13 жирных кислот. Сушимицин (tsushimicin) является смесью соединений 10, в которых R1 является смесью изо- и анте-изо С 13 и С 14 жирных кислот. В амфомицине, аспартоцине и сушимицине циклический пептид ядра связан с R1 через экзоциклическую аминокислоту, которая представляет собой аспартат (экзоциклическую аспарагиновую аминокислоту). Фриулимицин является смесью соединений 10, в которых R1 является смесью изо- и анте-изо C13 и C15 жирных кислот. В фриулимицине циклический пептид ядра связан с R1 через экзоциклическую амино- 23010294 кислоту, которая представляет собой аспарагин (экзоциклическую аминокислоту). Антибиотик А 1437 является сложной смесью из 11 соединений, где R1 является смесью изо- и анте-изо С 13, C14 и С 15 жирных кислот и экзоциклическая аминокислота представляет собой либо аспарагиновую кислотут, либо аспарагин. Во многих случаях, культуральные условия, способствующие получению одного или нескольких соединений смеси с большими или меньшими выходами, известны (см., напр., J. Biotechnology 7: 283292, 1988). Подобные способы можно применять в сочетании с подходами по настоящему изобретению для получения смесей производных Dab9 производных, обладающих жирнокислотными компонентами с определенными молярными отношениями. Липопептидный антибиотик амфомицинового ряда (или смесь антибиотиков) 10, изолированный из культур, можно непосредственно использовать в синтезе по схеме (I) без предварительного разделения и выделения различных компонентов смесей; возможно также предварительное разделение, либо по жирным кислотам, либо (как в случае антибиотика А 1437) по экзоциклической аминокислоте (напр., аспарагиновая кислота или аспарагин), на структурно чистые соединения, или суб-фракции, или суб-смеси. Способы разделения отдельных компонентов или суб-смесей препаратов антибиотиков хорошо известны специалистам в данной области. В частности, пригодные способы предложены в патенте США No. 6,194,383 (см. в частности Cols. 10-12), и в разделе примеры, см. ниже. В некоторых случаях структуры жирнокислотных компонентов липопетидного антибиотика (или смеси антибиотиков) 10 на основе амфомицина, возможно, могут быть не известны. В некоторых случаях может быть желательно желательным получение производных соединений по изобретению с особыми заместителями у по концевого концевому амина, например, жирнокислотные жирнокислотным компонентыкомпонентом, или в положении у макроциклической Dab9. В других случаях может быть желательным получение производных, являющихся структурно чистыми, геометрически или оптически чистыми, например, в отношении липофильного заместителя. Соответственно, замещение компонента природной жирной кислоты культурированного антибиотика (или смеси антибиотиков) 10, выделенных из культуры 10 определенным заместителем, возможно представляющим собой особый жирнокислотный компонент или другой компонент, способный к образованию ковалентной связи с N-концевым атомом N(по данному описанию), может оказаться более удобным удобной или предпочтительным предпочтительной по сравнению с выделением отдельных компонентов из культурированного препарата антибиотика. Как показано на схеме (I), этого можно достичь при помощи нескольких стратегий синтеза. По первой стратегической схеме липопептидный антибиотик (или смесь антибиотиков) 10 амфомицинового ряда, во-первых, защищают у -аминогруппы макроциклического остатка Dab9 для того, чтобы получить защищенный полупродукт (или смесь полупродуктов) 18. Хотя для иллюстрации используется пример, где защитной группой является группа Fmoc; специалисту в данной области очевидно, что можно использовать другие общеизвестные аминные защитные группы. Далее защищенный полупродукт(или смесь полупродуктов) 18 делипидируют или деацилируют (удаляют липидные заместители и ацильные группы), в результате образуется защищенное макроциклическое ядро амфомицинового ряда 20. Защищенное ядро 20 далее связывают с реакционной группой 22 (в примере это карбоновая кислота) стандартными химическими способами; в результате образуется защищенный дипопептидный антибиотик амфомицинового ряда 24. Специалисты в данной области признают, что можно использовать любые реакционные группы, способные к реакции с концевым N-атомом, получая в результате другие липопептидные антибиотики 24, описываемые здесь. По примеру с карбоновой кислотой 22 Rx вместе с карбонильной группой -С(=O) может представлять собой либо R2 структуры (I) или (III), или R2-L структуры (II) или (IV). Данную карбоновую кислоту можно активировать и очистить по стандартной методике, представленной ниже (см. ниже пример 1). Карбоновую кислоту можно растворить в безводном диметилформамиде (ДМФ) в инертной атмосфере с последующим добавлением сукцинимида и охлаждением на ледяной бане. Далее, двумя равными порциями с интервалом в 10 мин к реакционной смеси добавляют дициклогексилкарбодиимид, после чего смесь перемешивают некоторое время, не снимая со льда, выдерживают до нагревания до комнатной температуры, затем перемешивают не менее 2 ч. Образовавшийся продукт, содержащий примеси, затем можно сконцентрировать под вакуумом и очистить рекристаллизацией из изопропанола или гексана, это обеспечивает хороший выход и относительно чистый активированный сложный эфир. Добавление активированной карбоновой кислоты к защищенному макроциклическому пептиду ядра можно завершить осуществить по следующей стандартной методике (см. также раздел примеры). Защищенное пептидное ядро на основе амфомицина 20 (например, амфомицин-9-Fmoc) растворяют в воде,затем разбавляют диметилформамидом. Медленно добавляют раствор бикарбоната натрия, затем охлаждают смесь на ледяной бане. Предварительно приготовленный раствор сложного эфира 22, активированного ацилом, в ДМФ добавляют к реакционной смеси, не снимая ее со льда, выдерживают до нагревания до комнатной температуры, затем перемешивают не менее 6 ч при комнатной температуре. Добавляют пиперидин и перемешивают реакционную смесь дополнительно в течение 1 ч. Смесь фильтруют, нерастворимые частицы промывают дополнительной порцией диметилформамида, фильтрат концентрируют,высушивают под вакуумом. Методом флэш-хроматографии с использованием градиентной системы метанол в хлороформе (или метанол в этилацетате) получают желаемое соединение: ациловый хвост, со- 24010294 пряженный с амфомицином, с хорошим общим выходом и достаточной чистоты. С защищенного антибиотика 24 можно затем снять защиту, при этом образуется соединение 26, которое вступая в реакцию с реагентом 12, образует защищенное Dab9 производное - соединение 28, которое после снятия защиты образует Dab9 производное - соединение 30. Присоединение заместителя к макроциклическому Dab9 остатку можно завершить осуществить по следующей стандартной методике (см. также раздел Примеры). Готовят суспензию ацилсопряженного амфомицина в диметилформамиде, добавляют бикарбонат натрия, затем охлаждают на водяной бане. Карбоновую кислоту, активированную сукцинимидом, предварительно растворенную в диметилформамиде, добавляют к реакционной смеси, не снимая ее со льда, затем перемешивают не менее 6 ч при комнатной температуре. Образовавшийся продукт, содержащий примеси, затем можно сконцентрировать под вакуумом, далее поместить в стандартные условия для снятия защиты, если потребуется. Окончательная очистка на колонке С 18 Prepack BJSolid Phase Column с применением градиентной системы ацетонитрил в воде приводит к образованию очищенного продукта с хорошим выходом и достаточной степени чистоты. Когда исходный липопептидный антибиотик (или смесь антибиотиков) амфомицинового ряда 10 представляет собой смесь соединений, обладающих одинаковыми макроциклическими ядрами амфомицинового типа, таких как амфомицин, аспартоцин, фриулимицин, сушимицин, или заомицин (tsushimicin или, zaomicin), данным способом можно синтезировать производные Dab9 производные по согласно настоящему изобретению, являющиеся структурно чистыми; здесь не требуется разделения различных жирнокислотных фракций исходного липопептидного антибиотика амфомицинового ряда 10. Делипидирование (или деацилирование) - отщепление липидных компнентов или ацильных групп - позволяет получить смесь соединений, содержащую различные жирные кислоты и однотипные защищенные макроциклические ядра амфомицинового типа 19. Защищенное макроциклическое ядро 19 можно легко изолировать из смеси с высокой степенью чистоты способами, известными специалистам в данной области,например, жидкостной хроматографией высокого разрешения, противоточной экстракцией, центрифугированием, фильтрацией, осаждением, ионообменной хроматографией, гель-электрофорезом, аффинной хроматографией и т.д. Особые методики, которые можно применить непосредственно или адаптировать под конкретную задачу: изоляцию определенного защищенного макроциклического ядра описаны в статье Debono et. al., 1988, J. Antibiotics 41: 1093 и патенте США U.S. 5039789 (см., напр., Cols. 30-34), которые включены в данное описание посредством ссылки. Дополнительные химические процедуры и методики, которые можно использовать непосредственно для делипидирования/деацилирования и реацилирования исходного липопептидного антибиотика амфомицинового ряда 10, описаны в Патенте США 5629288 на открытие, включенное в данное описание посредством ссылки, выданный Lattrell et al. По предпочтительному пути синтеза защищенное производное соединение Dab9 производное 14 делипидируют/деацилируют; в результате образуется защищенное макроциклическое ядро амфомицинового типа 19, представляющее собой основной полупродукт. Полупродукт 19 возможно обладает множеством различных описываемых здесь Dab9 заместителей. Полупродукт 19 далее приводят во взаимодействие с реакционной группой 22, в результате реакции образуется защищенное производное соединениеDab9 производное - соединение 28, из которого после снятия защиты образуется Dab9 производное - соединение 30. Данный предпочтительный путь синтеза обладает преимуществом, так как он не требует отдельной защиты -аминогруппы макроциклической Dab9 и позволяет получить производные Dab9 3 производные 30 меньшим количеством этапов. Как правило, жирнокислотный компонент защищенного липопептидного антибиотика (или смеси антибиотиков) амфомицинового ряда 18 или защищенного производного Dab9 производного (или смеси производных) 14 можно отщепить при помощи фермента. Фермент может представлять собой, например,деградирующий фермент, такой как пептидаза, эстераза или тиолаза; специалистам в данной области известно множество подобных ферментов. Предпочтительным ферментом является деацилаза. По типичному примеру реализации этап расщепления включает культивирование микроорганизмов, продуцирующих деацилазу в соответствующей культуральной среде и содержащих защищенные производные Dab9 производные (или смесь производных) 14, или защищенный антибиотик (или смесь антибиотиков) 18 с культуральной средой, содержащей деацилазу. Микроорганизмы, продуцирующие деацилазы, хорошо известны любому специалисту в данной области. По предпочтительному примеру реализации микроорганизмы Actinoplanes utahensis (NRRL num; 12052) продуцируют подходящую деацилазу. Способы выращивания затравки, затравочные среды, культуральные среды и условия культивирования подобных ферментов также хорошо известны специалистам в данной области, стандартные методики для Actinoplanes utahensis (NRRL 12052) описаны в статьях и патентах Boeck et al., 1988, J.Antibiot. 41: 1085; Debono et al., 1988, J. Antibiotics 41: 1093; патент США 4524135 (см., напр., Cols. 2223) и патент США 5039789 (см., напр., Col. 29, строки 9-63). По одному примеру реализации соединения 14 и 18 делипидируют путем приведения их в контакт с культуральной средой, содержащей Actinoplanes utahensis (NRRL 12052) приблизительно на 4-16 ч при температуре около 29 С. Мониторинг реакции можно осуществлять хроматографией или другими традиционными способами, таким образом, периоды инкубации могут быть длиннее или короче, если это- 25010294 необходимо. Дополнительные способы делипидации соединений 14 или 18 описаны в Debono et al., 1988,J. Antibiotics 41: 1093; патент США 5039789 см., например, Cols. 29-34) и патент США 5629288. Схема (I) иллюстрирует синтез определенных Dab9 производных по изобретению, в которых заместитель R6 связывают с макроцикпическим остатком Dab9 через амидный линкер; однако для специалистов в данной области очевидно, что производные Dab9 производные, содержащие другие связующие группы, можно синтезировать, используя рутинные модификации проиллюстрированных схем. Более того, в некоторых случаях заместитель R3 может содержать дополнительные функциональные группы,требующие защиты. Для специалистов в данной области очевидно, что природа защитной группы зависит, среди прочего, от природы функциональной группы, требующей защиты, и других защитных групп,содержащихся в молекуле. Руководящие указания можно найти выше, в руководстве GreeneWuts,описанном выше. Схема (I) иллюстрирует синтез определенных Dab9 производных по изобретению, в которых заместители R2 и R2-L связывают с концевым атомом N через амидный линкер; однако для специалистов в данной области очевидно, что производные, содержащие другие связующие группы, можно синтезировать, используя рутинные модификации проиллюстрированных схем. Более того, в некоторых случаях заместители R2 и R2-L могут содержать дополнительные функциональные группы, требующие защиты. Для специалистов в данной области очевидно, что природа защитной группы зависит, среди прочего, от природы функциональной группы, требующей защиты, и других защитных групп, содержащихся в молекуле. Руководящие указания можно найти выше, в руководстве GreeneWuts, описанном выше. Производные соединения по изобретению можно выделить и очистить стандартными способами,например жидкостной хроматографией высокого разрешения, противоточной экстракцией, центрифугированием, фильтрацией, осаждением, ионообменной хроматографией, гель-электрофорезом, аффинной хроматографией, флэш-хроматографией и т.д. Особые способы выделения соединений описаны ниже, в разделе Примеры. Любые исходные антибиотики, циклические соединения ядра, соединенияполупродукты или соединения, производные антибиотиков по изобретению, можно изолировать и очистить способами экстрактивной очистки, описанными в WO 02/055537, включенном в данную заявку посредством ссылок. Например, очистку способом ВЭЖХ можно произвести на оборудовании для перфузионной хроматографии BioCAD Sprint Perfusion Chromatography system с колонкой WatersSymmetry- Prep C18 или С 8 (7pm, 19150 мм), этот способ очистки используется в большинстве способов синтеза производных липопептидных антибиотиков согласно настоящему изобретению. Кроме того,анализ чистоты соединения можно провести на колонке Spherisorb S3 (ODS2,2.0100 мм) системы разделения Waters 2695 Separations system с фотодиодным детектором 996 (Waters, Milord, MA). Например, можно провести линейное градиентное элюирование с 40-80% ацетонитрила в воде Milli-Q со скоростью 0,25 мл/мин (каждый элюент содержит 0,1% трифторуксусной кислоты) за 15 мин; температура колонки -40 С; полученные данные можно обрабатывать с применением программного обеспечения Millennium32TM Chromatography Manager V4 software (Waters, Milford, MA). Для любого специалиста в данной области очевидно, что многие производные соединения по изобретению, так же, как и прочие описываемые соединения, возможно имеют различные таутомерные,конформационные, геометрические или оптические изомерные формы. На чертежах структурных формул, приведенных в тексте заявки и в формуле изобретения, показана только одна из возможных таутомерных, конформационных, геометрических или оптических изомерных форм, однако следует понимать,что изобретение охватывает все таутомерные, конформационные, геометрические или оптические изомерные формы соединений, обладающих одной или несколькими описанными возможностями, а также смеси различных изомеров. Более того, несмотря на то, что конкретные оптические конфигурации хиральных центров для различных макроциклических ядер амфомицинового типа не определены, следует понимать, что структурные иллюстрации несовершенным образом описывают данные ядра и не ограничивают данного изобретения. Следует понимать, что макроциклические ядра липопептидных антибиотиков амфомицинового ряда обладают конкретными оптическими конфигурациями - известны они, или не известны. Кроме того, предполагают, что структурные формулы пептидных макроциклов, входящих в состав исходных липопептидных антибиотиков амфомицинового ряда, от которых образованы производные соединения, корректно отображают их структуры; однако в некоторых случаях данные, полученные позднее, могут указать на ошибки в структурных формулах. Предполагают, что структурные формулы являются несовершенным отображением структур различных соединений по изобретению и не ограничивают его. Следует понимать, что в производных соединениях по изобретению структуры пептидных макроциклов соответствуют структурам исходных липопептидных антибиотиков амфомицинового ряда,от которых образованы конкретные производные. Особенности липопептидных производных Липопептидные производные по изобретению обычно проявляют противомикробную активность по отношению к грамположительным бактериям, аналогичную активности, проявляемой традиционными липопептидными антибиотиками амфомицинового ряда, как показывают исследования in vitro и in vivo.- 26010294 Более того, многие липопептидные производные по изобретению неожиданным образом проявляют улучшенное терапевтическое воздействие (например, пониженную токсичность, расширенный спектр воздействия, улучшенные фармакокинетические/фармакодинамические характеристики) по сравнению с традиционными липопептидными антибиотиками амфомицинового ряда, что указывает на особую пригодность аминоконцевых или Dab9 производных по изобретению для терапевтического применения(напр., при системном применении), или благоприятного режима дозирования при борьбе с инфекциями,вызванными, например, грамположительными бактериями (например, Staphylococcus spp., Streptococcusspp., Enterococcus spp.). Противомикробные липопептидные соединения по изобретению определяют как активные по результатам, например, скрининговых исследований in vitro, хорошо известным специалистам в данной области, таких как стандартные тестовые системы на ингибирование бактерий (NCCLS bacterial inhibitionassays), или тесты по определению минимальной ингибирующей концентрации (minimum inhibitory concentration (MIC) tests). См., напр., документ Национального комитета по стандартам для клинических лабораторий Нормы проведения исследований чувствительности к противомикробным препаратам,(National Committee on Clinical Laboratory Standards "Performance Standards for Antimicrobial SusceptibilityTesting, "NCCLS Document M100-S5 Vol. 14, No. 16, December 1994) Способы исследования чувствительности к противомикробным препаратам аэробных бактерий - методики разведения; ("Methods forM7-A3, National Committee for Clinical Standards, Villanova, PA ("Approved Standard M7-A3". Противомикробные соединения определяются как активные, если MIC не превышает приблизительно 64 мкг/мл. По некоторым предпочтительным примерам реализации, величина MIC для некоторых соединений составляет менее 64, менее 32, менее 16, менее 4 мкг/мл для микроорганизмов, например бактерий (в частности, грамположительных бактерий). По некоторым примерам реализации противомикробные липопептидные соединения, проявляющие низкую токсичность или существенную противомикробную активность (напр., менее 4 мкг/мл или менее 16 мкг/мл) возможно являются предпочтительными для лечения или профилактики системных инфекций, в том числе вызываемых микроорганизмами, резистентными к антибиотикам. По другим примерам реализации противомикробные липопептидные производные по изобретению возможно предпочтительны для лечения или профилактики местных (например, кожных) инфекций. Специальные исследования противомикробной активности, относящиеся к конкретным путям введения в организм, проводимые in vitro и in vivo, описаны в примерах. Одним из фармакокинетических параметров, характеризующим свойства липопептидных производных соединений по изобретению, является постантибиотический эффект (РАЕ) липопептидного производного. Например, бактериальную культуру, с первоначальным содержанием микроорганизмов в колониеобразующей единице от 106 до 107 колониеобразующих единиц на мл (CFU/мл), в течение определенного времени подвергали воздействию липопептидного производного определенной концентрации,при этом параллельная (контрольная) культура не подвергалась воздействию. По окончании обработки липопептидным производным, данное соединение удалили из культуры (например, путем разбавления 1:1000 в свежеприготовленной среде, не содержащей липопептидного производного), при этом культуру,не подвергавшуюся воздействию данного соединения, обработали таким же образом. Далее, культуры инкубировали и периодически осуществляли мониторинг роста бактериальной культуры. Следовательно,величину РАЕ можно определить в единицах времени (минутах или часах), за которое в культуре, обработанной липопептидным производным, количество CFU (колониеобразующих единиц) увеличивается на величину 1log10 по сравнению с необработанной контрольной группой. Исходя из теоретических соображений, можно предположить, что липопептидное производное соединение, обладающее измеримым пост-антибиотическим эффектом (РАЕ), позволит иммунной системе организма-хозяина получить дополнительное время, необходимое для удаления бактерий, оставшихся после лечения антибиотиками и размножившимся после разложения, удаления или вывода антибиотика из циркуляторной системы путем фильтрования. Более длительный период РАЕ может повлиять на клинический эффект противомикробной терапии (т.е., возможно снижение дозы липопептидного производного для лечения инфекции, или уменьшение частоты введения дозы). Другим способом измерения противомикробных характеристик липопептидных производных соединений по настоящему изобретению является построение "kill curves" - кривых, иллюстрирующих бактерицидную активность различных липопептидных производных против различных микроорганизмов. При проведении исследований с построением кривых "kill curves" микроорганизмы обычно подвергают воздействию тестируемого соединения в различных концентрациях (например, множеству кратных MIC(минимальных ингибирующих концентраций) для данного соединения). Микроорганизмы могут присутствовать в культуре, находящейся в фазе логарифмического роста, или в конкретной ткани (например, в легком) организма-хозяина в течение 24 ч до воздействия тестируемого соединения. В определенные моменты времени образцы каждой культуры или ткани анализируют, определяя величину титра микроорганизмов, который обычно калибруемого калибруют по относительно времени, необходимому необходимого для замедления роста или уничтожения бактерий соединением. Специалистам в области микробиологии известно, что соединение явялется бактерицидным, если соединение уничтожает 99,9% бак- 27010294 териальных клеток в течение 24 ч (см. напр., указания NCCLS guideline M26-A,Vol. 19 N18). Для оценки противомикробных характеристик липопептидных производных соединений по данному изобретению применяют различные модели исследований in vivo. Например, можно исследовать эффективность противомикробных соединений по настоящему изобретению путем измерения способности данного соединения защитить мышь от микробной инфекции, вызванной грамположительными бактериями или родственными микроорганизмами, включая Staphylococcus aureus, Streptococcus pneumoniae, иEnterococcus faecalis. Мышей индивидуально инфицируют (напр., внутрибрюшинно (i.p. из бактериального посева дозой, как правило, превышающей однократную LD50 (50% летальной дозы, например, 2-3 дозы LD50 ). LD50 - это бактериальная доза, убивающая 50% инфицированной популяции, например, мышей). В течение некоторого времени после инфицирования мыши получали индивидуальное лечение,состоящее во введении в организм (например, внутривенно) липопептидных производных соединений по настоящему изобретению. Затем в течение определенного времени (например, от нескольких дней до нескольких недель) проводили мониторинг, оценивая способность тестируемых липопептидных производных предотвратить развитие у мышей фатальной системной инфекции, или же способность предотвратить проявление других симптомов инфекции. Для оценки эффективности противомикробных липопептидов по настоящему изобретению возможно применение других моделей исследования инфекций in vivo, включая следующие: (А) модель легочной инфекции (пневмонии) у мышей (или крыс), вызываемой бактериями, вводимыми интраназально (i.n.); (В) модель инфекции бедренной мышцы у мышей (или крыс), вызываемой бактериями, вводимыми внутримышечно (i.m.) у нормальных или нейтропенических (иммунокомпромиссных) мышей; и(С) комбинированная модель инфекции бедренной мышцы у мышей (i.m. инфицирование)/легочной (i.n.) инфекции. Как правило, определяют величину ED50 (50% эффективная доза) для каждого липопептидного производного по изобретению. Термин ED50 здесь обозначает величину эффективной дозы, (а) защищающей 50% инфицированных животных (напр., по моделям легочной инфекции и при внутрибрюшинном введении (i.p., или (b) обеспечивающей снижение логарифмического максимума через 24 ч после начала лечения (напр., по моделям для инфицированной бедренной мышцы и легочной ткани). По некоторым примерам реализации величины ED50 варьируют в приблизительных интервалах от 0,1 до 50 мг/кг, или от 0,15 до 30 мг/кг, или от 0,2 до 15 мг/кг, или от 0,25 до 10 мг/кг. Кроме того, для определения фармакокинетических и фармакодинамических параметров противомикробных соединений по настоящему изобретению возможно применение других стандартных моделейin vivo. Среди параметров, подлежащих измерению: период полувыведения соединений in vivo, скорость элиминации и клиренс, объем распределения и биодоступность. Например, соединения вводят однократной внутривенной i.v. или пероральной р.о. дозой мышам или крысам. В различных временных точках(от 1 мин до 72 ч) забирают кровь подопытных животных и методом жидкостной хроматографии с массспектрометрическим детектором (LC/MS), например, количественно определяют концентрацию липопептидных производных в плазме ex vivo. После количественного определения, по способам, известным специалистам в данной области, таким как одночастная модель моно-экспоненциального распада при равномерном распределении вещества (one compartment model of mono-exponential decay) и линейный регрессивный анализ, высчитывают фармакокинетические параметры (см., например, Fantin et al., Antimicrob.Agents Chemotherap. 35 : 1413.1991). Составы и композиции Фармацевтические композиции, содержащие производные липопептидных антибиотиков по изобретению, можно производить путем традиционного смешивания, растворения, гранулирования, дражирования, растирания, эмульгирования, капсулирования; через процессы захвата и лиофилизации. Фармацевтические композиции составляют традиционными способами, применяя один или несколько физиологически приемлемых носителей, разбавителей, наполнителей или вспомогательных веществ, способствующих введению активных противомикробных липопептидных производных соединений в составы,которые можно использовать в фармацевтике. Единичное противомикробное липопептидное производное, несколько противомикробных липопептидных производных, или противомикробные липопептидные производные в комбинации с одним или несколькими промышленными или биологически активными агентами может входить в фармацевтический состав вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем, образуя промышленные и аптечные фармацевтические композиции, соответственно, по настоящему изобретению. Фармацевтически приемлемые носители, разбавители или наполнители для терапевтического применения хорошо известны специалистам в области фармацевтики, они описаны здесьи, например в Remington's Pharmaceutical Sciences, Mack Publishing Co. (A. R.Gennaro, ed., 18"Edition, 1990) и в CRC Handbook of Food, Drug, and Cosmetic Excipients, CRC Press LLC (S. С. Smolinski, ed., 1992). По некоторым примерам реализации противомикробные липопептидные производные могут входить в состав вместе с фармацевтически или физиологически приемлемым носителем, разбавителем или наполнителем, растворимым в воде, который является водным/жидким, таким как вода или раствор маннитола (напр., приблизительно от 1 до приблизительно 20%), а также гидрофобным (например, масло или липид), или их комбинацией (например, водомасляные эмульсии). По некоторым примерам реализации любые упомянутые- 28010294 фармацевтические составы могут быть стерильными. Составы по настоящему изобретению, содержащие противомикробные липопептиды в количестве,достаточном для лечения или профилактики инфекции, в частности, например, пригодны для местного применения (напр., в виде кремов, мазей, кожных пластырей, глазных капель, ушных капель, шампуней) или введения в организм. Другие пути введения в организм включают без ограничения способы оральный, парентеральный, сублингвальный, вагинальный, ректальный, энтеральный, назальный, ингаляционный; состав могут содержать жидкости для промывания мочевого пузыря, суппозитории. Термин парентеральный здесь включает следующие инъекционные и инфузионные способы: подкожный, внутривенный, внутримышечный, внутриартериальный, интраабдоминальный, внутрибрюшинный, внутрисуставной, внутриглазной или ретробульбарный, внутриушной, интратекальный, внутриполостной, итрацелиальный, интраспинальный, внутрилегочный или транспульмонарный, интрасиновиальный и интрауретральный. Фармацевтические композиции по настоящему изобретению составляют так, чтобы содержащиеся в них противомикробные липопептиды при введении композиции в организм субъекта, обладали биодоступностью. Уровень концентрации липопептида в сыворотке и других тканях после введения в организм можно отслеживать различными способами - анализом бактериальным, тестовые системы с использованием хроматографическим хроматографии или анализом антител (например, ELISA). По некоторым примерам реализации описанные здесь противомикробные липопептидные производные входят в фармацевтические составы для местного применения на участке локализации мишени воздействия у субъекта, нуждающегося в лечении человека или животного. По другим примерам реализации противомикробные липопептидные производные входят в фармацевтические составы для парентерального введения в организм субъекта, нуждающегося в лечении (например, от инфекции, вызванной грамположительными бактериями) - человека или животного. Как известно специалистам в данной области, выбор оптимального состава зависит от предполагаемого пути введения в организм. Например, по типичным примерам реализации противомикробные липопептидные производные по изобретению могут входить в состав растворов, гелей, мазей, кремов,суспензий, паст и т.д. для местного применения. По другому примеру реализации составы для системной терапии включают составы, вводимые в организм путем инъекции, например, подкожно, внутривенно,внутримышечно, интратекально или интраперитонеально, а также предназначенные для трансдермального, трансмукозального, орального, интраназального или пульмонарного введения. По одному примеру реализации состав для системного введения является стерильным. По еще одному примеру реализации противомикробные липопептидные производные по настоящему изобретению входят в составы для инъекций в виде водных растворов, предпочтительно в виде физиологически совместимых или буферных растворов, таких как раствор Хэнкса, раствор Рингера, растворы маннитола или физиологический соляной буфер. По некоторым примерам реализации описанные здесь композиции могут содержать составообразующие агенты, например, суспендирующие, стабилизирующие или диспергирующие агенты. Альтернативно, противомикробные липопептидные антибиотики могут входить в составы в твердом виде(напр, в виде порошка), их объединяют с приемлемым носителем (напр., стерильной бидистиллированной водой) перед употреблением. По примерам реализации, где предусмотрено трансмукозальное введение, в состав могут входить пенетранты, солюбизаторы или смягчающие вещества, способные проникать через соответствующие барьеры. Например, 1-додецилгексагидро-2 Н-азепин-2-он (Azone), олеиновая кислота, пропиленгликоль, ментол, диэтиленгликоль этоксигликоль моноэтиловый эфир (Transcutol),полисорбат полиэтиленсорбитан монолаурат (Tween-20) и препарат 7-хлор-1-метил-5-фенил-3H-1,4 бензодиазепин-2-он (Diazepam), изопропил миристат, и другие подобные пенетранты, солюбизаторы и смягчающие компоненты, хорошо известны специалистам в данной области, они могут входить в любые фармацевтические составы по настоящему изобретению. По другим примерам реализации противомикробные липопептидные производные возможно входят в состав вместе с фармацевтически приемлемыми носителями в форме таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, эмульсий, суспензий и т.п., для перорального введения в организм пациента или субъекта, получающего лечение. По некоторым примерам реализации, изобретение предлагает твердые фармацевтические составы для перорального введения, такие как порошки, капсулы или таблетки, приемлемые наполнители, включая сахара (например, лактоза, сахароза, маннитол, сорбитол); составы, содержащие целлюлозу, такие как кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза,натриевая карбоксиметилцеллюлоза, или поливинилпирролидон (PVP); гранулирующие агенты; или связующие агенты. Возможно добавление разлагающихся агентов, таких как поливинилпирролидон с поперечными связями, агар, или альгиновая кислота (или ее соль, например, альгинат натрия). По желанию,твердые дозированные формы могут иметь сахарное или энтеральное покрытие, наносимое стандартными способами. По некоторым примерам реализации, изобретение предлагает жидкие препараты для перорального введения, такие как суспензии, эликсиры или растворы, приемлемые носители, наполнители или разбавители, включая воду, гликоли, масла, спирты, или их комбинации. Кроме того, в состав можно- 29010294 добавлять ароматизаторы, консерванты, агенты, повышающие вязкость, гигроскопические вещества,подкрашивающие агенты и т.п. По некоторым примерам реализации, изобретение предлагает составы для буккального введения в форме, например, таблеток или леденцов, изготовленных традиционными способами, описанными здесь и известными специалистам в данной области. По некоторым примерам реализации, изобретение предлагает вводить соединения по настоящему изобретению в составы для ингаляционного введения, изготовленные в удобных формах, таких как капли для интраназального введения, или аэрозольные спреи в упаковках под давлением, или составы, вводимые при помощи распылителей, содержащие приемлемый газ-вытеснитель (например, дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, двуокись углерода или другой приемлемый газ). По некоторым примерам реализации капли или аэрозольные составы являются стерильными. В случае аэрозоля, упакованного под давлением, дозирующее устройство может содержать кран, обеспечивающий введение точного количества препарата. Капсулы и контейнеры, изготовленные, например, из желатина,для применения в ингаляторе или инсуффляторе, возможно состоят из порошкообразной смеси соединения и приемлемой порошкообразной основы, например, лактозы или крахмала. По другим примерам реализации противомикробные липопетидные производные входят в составы,вводимые ректально или вагинально, например, в виде суппозиториев или задерживающих(ся) клизм,содержащих, например, традиционные основы для изготовления суппозиториев, такие как масло какао или другие глицериды. Кроме описанных выше фармацевтических составов противомикробные липопептидные производные могут также содержать препараты, изготовленные в виде депо. Например, противомикробные липопептидные производные по настоящему изобретению изготавливают в виде препаратов, медленно поступающих в организм, что обеспечивает длительное воздействие. Подобные препараты длительного действия вводят в организм путем имплантации (например, подкожно или внутримышечно) или внутримышечной инъекцией. По некоторым примерам реализации соединения входят в состав препарата вместе с приемлемым полимером (включая (поли)лактиды, (поли)гликолиды, поли(капролактоны), и их смеси), гидрофобным материалом, (включая физиологически приемлемое масло, возможно в виде эмульсии), ионообменной смолой или в виде труднорастворимых производных (напр., в виде труднорастворимой соли). В качестве альтернативы возможно применение других фармацевтических систем доставки препарата. По некоторым примерам реализации соединения входят в состав препаратов, где в качестве носителей применяют липосомы или эмульсии. Возможно применение некоторых органических растворителей,таких как DMSO (диметилсульфоксид), Кроме того, доставку противомикробных липопептидных производных осуществляют при помощи систем с замедленным высвобождением, таких как полупроницаемые матрицы из твердых или полутвердых полимеров (например, из термопаст), содержащих терапевтический агент. Капсулы, содержащие препараты замедленного высвобождения, в зависимости от химической природы могут высвобождать соединения в течение нескольких дней, недель или периода продолжительностью до 100 дней. Поскольку некоторые карбоксильные группы противомикробных липопептидных производных по изобретению являются кислотными группами, а также заместители R2, R3, R4 и связующие группы - L могут включать кислотные или основные заместители, противомикробные липопептидные производные возможно входят в составы вышеописанных препаратов в виде свободных кислот или свободных оснований. Или в виде фармацевтически приемлемых солей. Фармацевтически приемлемыми считают соли, в значительной степени сохраняющие противомикробную активность свободной кислоты или свободного основания, приготовленные взаимодействием с основанием или кислотой, соответственно. Подходящие для этих задач кислоты и основания хорошо известны специалистам в данной области. Для фармацевтических солей характерна более высокая растворимость в воде и других протонных растворителях, чем для соответствующей свободной основной или кислотной формы. Возможно введение липопептидных производных в организм субъекта в виде отдельной единичной дозы (напр., в виде таблетки, капсулы, инъекции или геля), или же возможно введение препарата в виде множественных единиц дозирования (напр., в аэрозольной форме или в виде состава для инъекций). Например, противомикробные липопептидные препараты стерилизуют и упаковывают в одноразовые, пластиковые ламинированные пакеты или пластиковые тубы, размеры которых подобраны для удобного ежедневного дозированного расходования. По одному примеру контейнер возможно обладает объемом,пригодным для расходования противомикробного липопептидного препарата (например, капля, гель или форма для инъекций) в количестве 0,5 мл на субъекта, или на ограниченную целевую поверхность на(или в) теле субъекта, для лечения или профилактики инфекции. Область применения препарата, например, может находиться непосредственно в очаге кожной инфекции (например, при некротизирующем фасците или другой осложненной кожной инфекции), причем площадь области применения зависит от площади поражения инфекцией. Предложены различные формы противомикробных липопептидных составов; формы зависят от веса и объема, а также количества различных фармацевтически приемлемых наполнителей в препарате. Например, препараты, в состав которых входят липопептидные композиции, предложены в различных
МПК / Метки
МПК: C07K 7/56, A61K 38/12, A61P 31/04
Метки: способы, производных, композиции, антибиотиков, липопептидных, основе, применения
Код ссылки
<a href="https://eas.patents.su/30-10294-kompozicii-na-osnove-proizvodnyh-lipopeptidnyh-antibiotikov-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции на основе производных липопептидных антибиотиков и способы их применения</a>
Предыдущий патент: Частицеобразующие композиции, содержащие конденсированные пирролокарбазолы
Следующий патент: Соединения амфетамина с пониженной способностью вызывать злоупотребление ими












