Соединения инданилпиперазина, способ их получения и содержащие их фармацевтические композиции
Номер патента: 10051
Опубликовано: 30.06.2008
Авторы: Гобер Ален, Ортюн Жан-Клод, Глоанек Филипп, Портевен Бернар, Маннури-Ла-Кур Клотильда, Де-Нантёй Гийом, Миллан Марк
Формула / Реферат
1. Соединение формулы
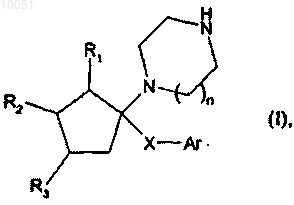
в которой R3 представляет собой атом водорода и R1 и R2 вместе с атомами углерода, которые их несут, образуют кольцевую структуру бензола, нафталина или хинолина, предпочтительно бензольное кольцо, при этом каждая из этих кольцевых структур является необязательно замещенной одним или более идентичными или различными заместителями, выбранными из водорода, галогена и линейного или разветвленного C1-C6алкила, необязательно замещенного одним или более атомами галогена, или R1 представляет собой атом водорода, a R2 и R3 вместе с атомами углерода, которые их несут, образуют кольцевую структуру бензола, нафталина или хинолина, предпочтительно бензольное кольцо, при этом каждая из этих кольцевых структур является необязательно замещенной одним или более идентичными или
различными заместителями, выбранными из водорода, галогена и линейного или разветвленного
C1-C6алкила, необязательно замещенного одним или более атомами галогена;
n равно 1 или 2;
-Х- представляет собой группу, выбранную из-(CH2)m-O-Ak-, -(CH2)m-NR4-Ak-, -(CO)-NR4-Ak- и
-(CH2)m-NR4-(CO)-;
m представляет собой целое число от 1 до 6 включительно;
Ak представляет собой линейную или разветвленную цепь C1-C6алкилена, необязательно замещенную группой гидрокси;
R4 представляет собой атом водорода или линейную или разветвленную группу C1-C6алкила;
Ar представляет собой группу арила или гетероарила,
его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,
при этом
оптические изомеры означают энантиомеры и диастереоизомеры;
арильная группа означает фенил, бифенилил или нафтил, каждая из этих групп является необязательно замещенной одной или более идентичными или различными группами, выбранными из галогена, линейного или разветвленного C1-C6алкила, линейного или разветвленного C1-C6алкокси, гидрокси, циано и линейного или разветвленного C1-C6тригалоалкила;
гетероарильная группа означает ароматическую моно- или бициклическую 5-12-членную группу, содержащую один, два или три гетероатома, выбранных из кислорода, азота и серы, при этом гетероарильная группа может быть необязательно замещенной одной или более идентичными или различными группами, выбранными из галогена, линейного или разветвленного C1-C6алкила, линейного или разветвленного C1-C6алкокси, гидрокси и линейного или разветвленного C1-C6тригалоалкила.
2. Соединение формулы (I) в соответствии с п.1, в котором R1 и R2 вместе с атомами углерода, которые их несут, образуют необязательно замещенное бензольное кольцо, a R3 представляет собой атом водорода, или R2 и R3 вместе с атомами углерода, которые их несут, образуют необязательно замещенное бензольное кольцо, a R1 представляет собой атом водорода.
3. Соединение формулы (I) в соответствии с п.1 или 2, в котором n равно 1.
4. Соединение формулы (I) в соответствии с любым из пп.1-3, в котором m равно 1.
5. Соединение формулы (I) в соответствии с любым из пп.1-4, в котором Ar представляет собой арильную группу.
6. Соединение формулы (I) в соответствии с п.1, выбранное из
1-[(1RS)-1-(3,5-дибромбензилоксиметил)индан-1-ил]пиперазина, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
1-[(1RS)-1-(3,5-диметилбензилоксиметил)индан-1-ил]пиперазина, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
1-[2-(3,5-диметилбензилоксиметил)индан-2-ил]пиперазина, а также его солей присоединения фармацевтически приемлемой кислоты;
N-[(3,5-бис-(трифторметил)бензил]-2-(1-пиперазинил)-2-инданкарбоксамида, а также его солей присоединения фармацевтически приемлемой кислоты;
(1RS)-N-бензил-N-метил-1-(1-пиперазинил)-1-инданкарбоксамида, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
(1RS)-N-[3,5-бис-(трифторметил)бензил]-N-метил-1-(1-пиперазинил)-1-инданкарбоксамида, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
(1RS)-N-(3,5-диметилбензил)-1-(1-пиперазинил)-1-инданкарбоксамида, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
N-(3,5-дифторбензил)-2-(1-пиперазинил)-2-инданкарбоксамида, а также его солей присоединения фармацевтически приемлемой кислоты;
N-(3,5-дихлорбензил)-N-метил-2-(1-пиперазинил)-2-инданкарбоксамида, а также его солей присоединения фармацевтически приемлемой кислоты,
(1RS)-N-(3,5-дифторбензил)-N-метил-1-(1-пиперазинил)-1-инданкарбоксамида, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
(1RS)-N-[3-фтор-5-(трифторметил)бензил]-N-метил-1-(1-пиперазинил)-1-инданкарбоксамида, его оптических изомеров, а также его солей присоединения фармацевтически приемлемой кислоты;
(1RS)-1-[1-(3,5-дифторбензилоксиметил)индан-1-ил]пиперазина, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
N-(3-хлор-5-фторбензил)-N-метил-2-(1-пиперазинил)-2-инданкарбоксамида, а также его солей присоединения фармацевтически приемлемой кислоты;
1-[(1RS)-1-(3,5-дифторбензилоксиметил)индан-1-ил]пиперазина, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
(1RS)-N-(3,5-дифторбензил)-N-метил-1-(1-пиперазинил)-1-инданкарбоксамида, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
1-[(1RS)-1-(3,5-дифторбензилоксиметил)-5,6-дифториндан-1-ил]пиперазина, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты;
1-[(1RS)-1-(3-бром-5-фторбензилоксиметил)индан-1-ил]пиперазина, его оптических изомеров, а также солей присоединения фармацевтически приемлемой кислоты.
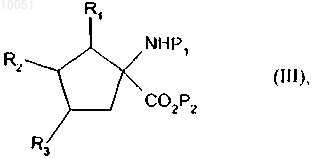
7. Способ получения соединений формулы (I) в соответствии с п.1 при использовании в качестве исходного соединения формулы
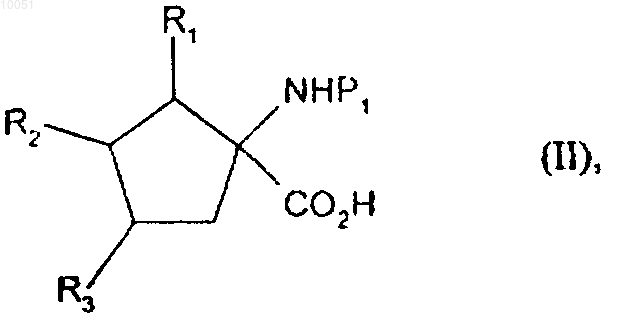
в которой R1, R2 и R3 являются такими, как определено для формулы (I);
P1 представляет собой защитную группу для амина,
кислотная группа которого защищается с образованием соединения формулы
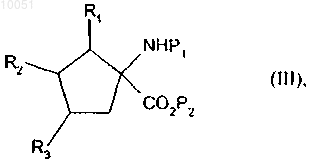
в которой R1, R2, R3 и P1 являются такими, как определено в данном изобретении выше;
Р2 представляет собой защитную группу для кислотной группы, которая является отличной от P1,
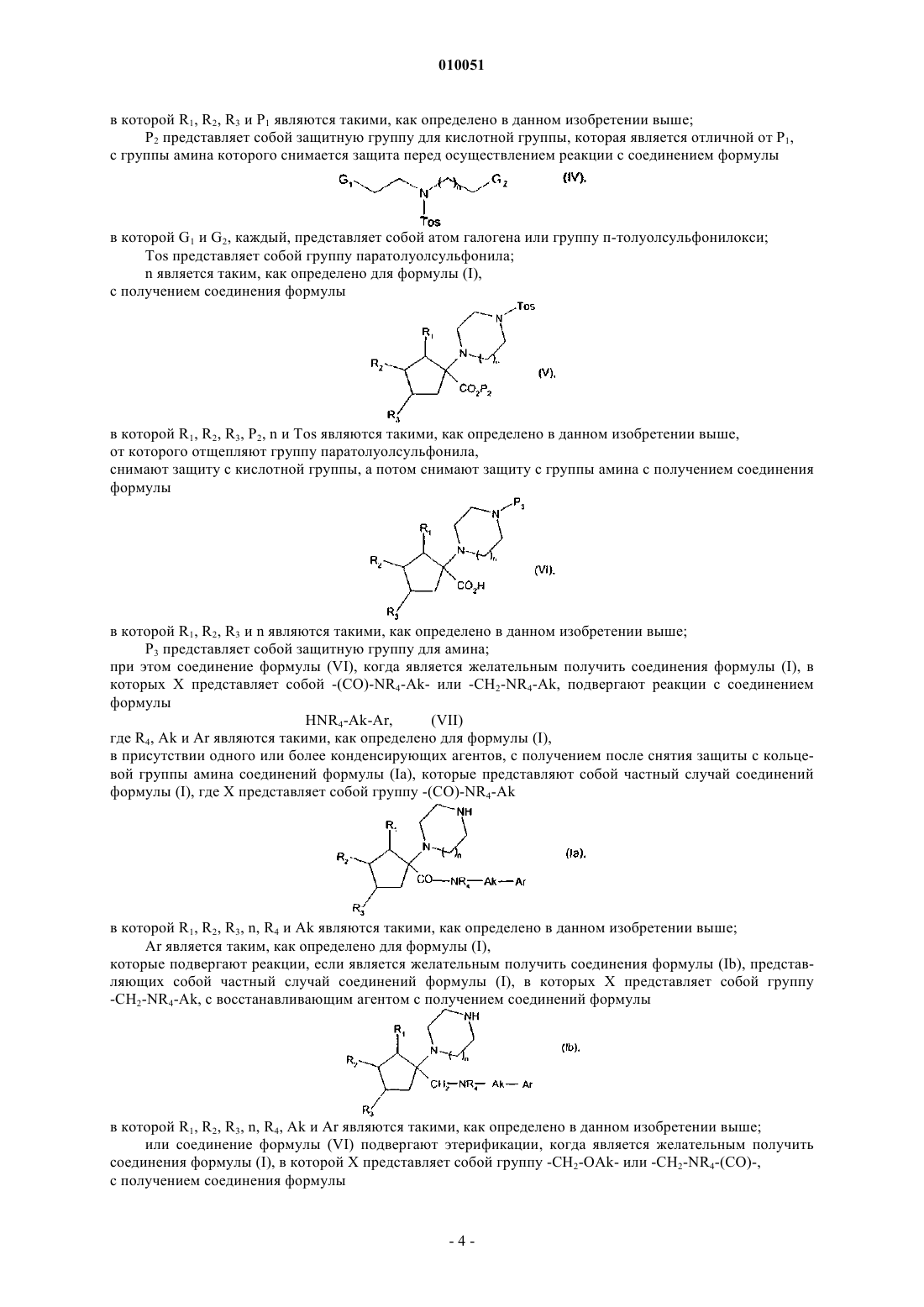
с группы амина которого снимается защита перед осуществлением реакции с соединением формулы
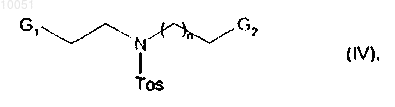
в которой G1 и G2, каждый, представляют собой атом галогена или группу п-толуолсульфонилокси;
Tos представляет собой группу паратолуолсульфонила;
n является таким, как определено для формулы (I),
с получением соединения формулы

в которой R1, R2, R3, Р2, n и Tos являются такими, как определено в данном изобретении выше,
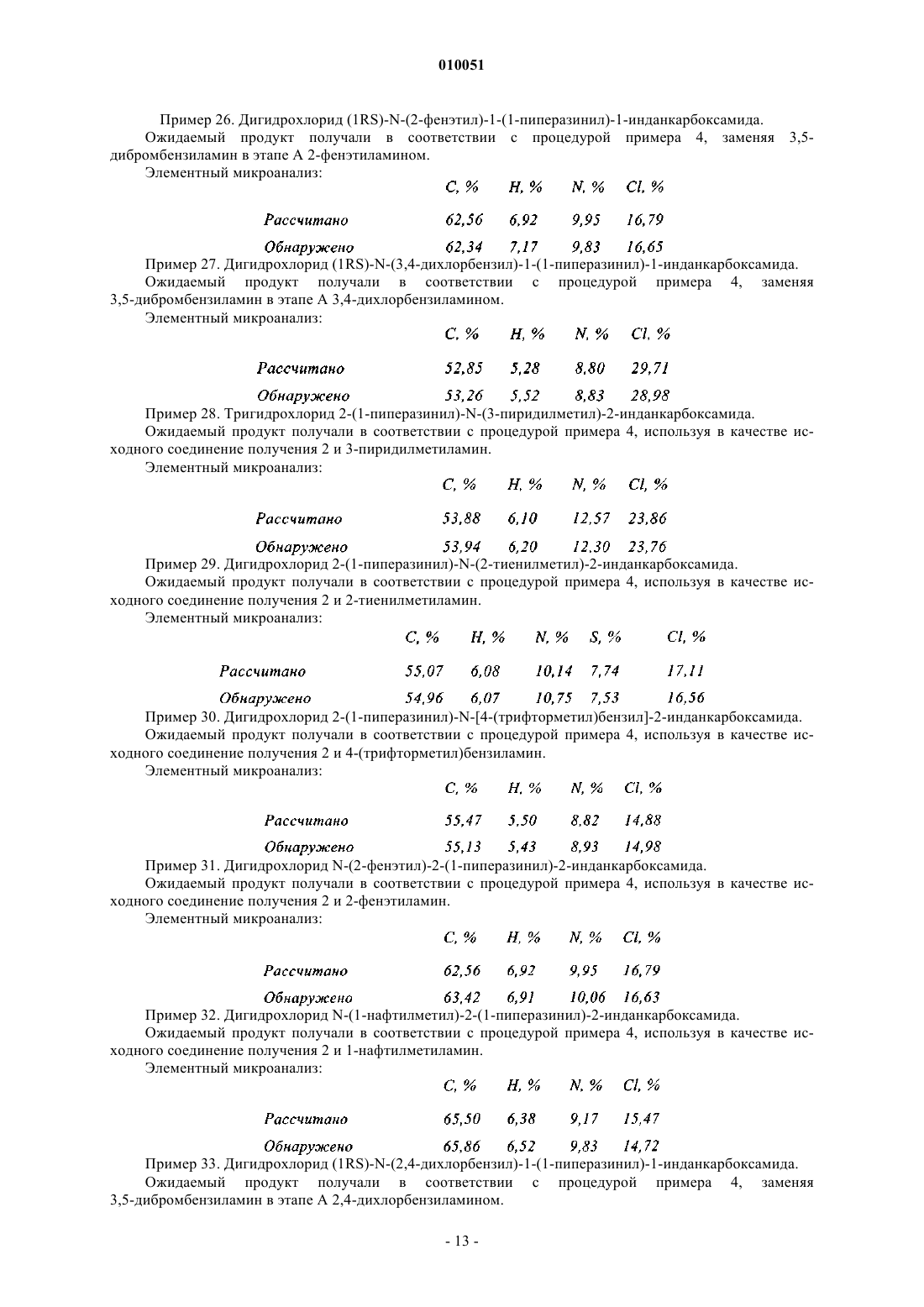
от которого отщепляют группу паратолуолсульфонила, снимают защиту с кислотной группы, после чего снимают защиту с группы амина с получением соединения формулы
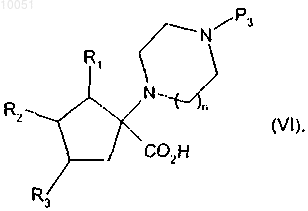
в которой R1, R2, R3 и n являются такими, ъръ определено в данном изобретении выше;
Р3 представляет собой защитную группу для амина,
при этом соединение формулы (VI), когда является желательным получить соединения формулы (I), в которых X представляет собой -(CO)-NR4-Ak- или CH2-NR4-Ak, подвергают реакции с соединением формулы
| HNR4-Ak-Ar, | (VII) |
где R4, Ak и Ar являются такими, как определено для формулы (I), в присутствии одного или более конденсирующих агентов,
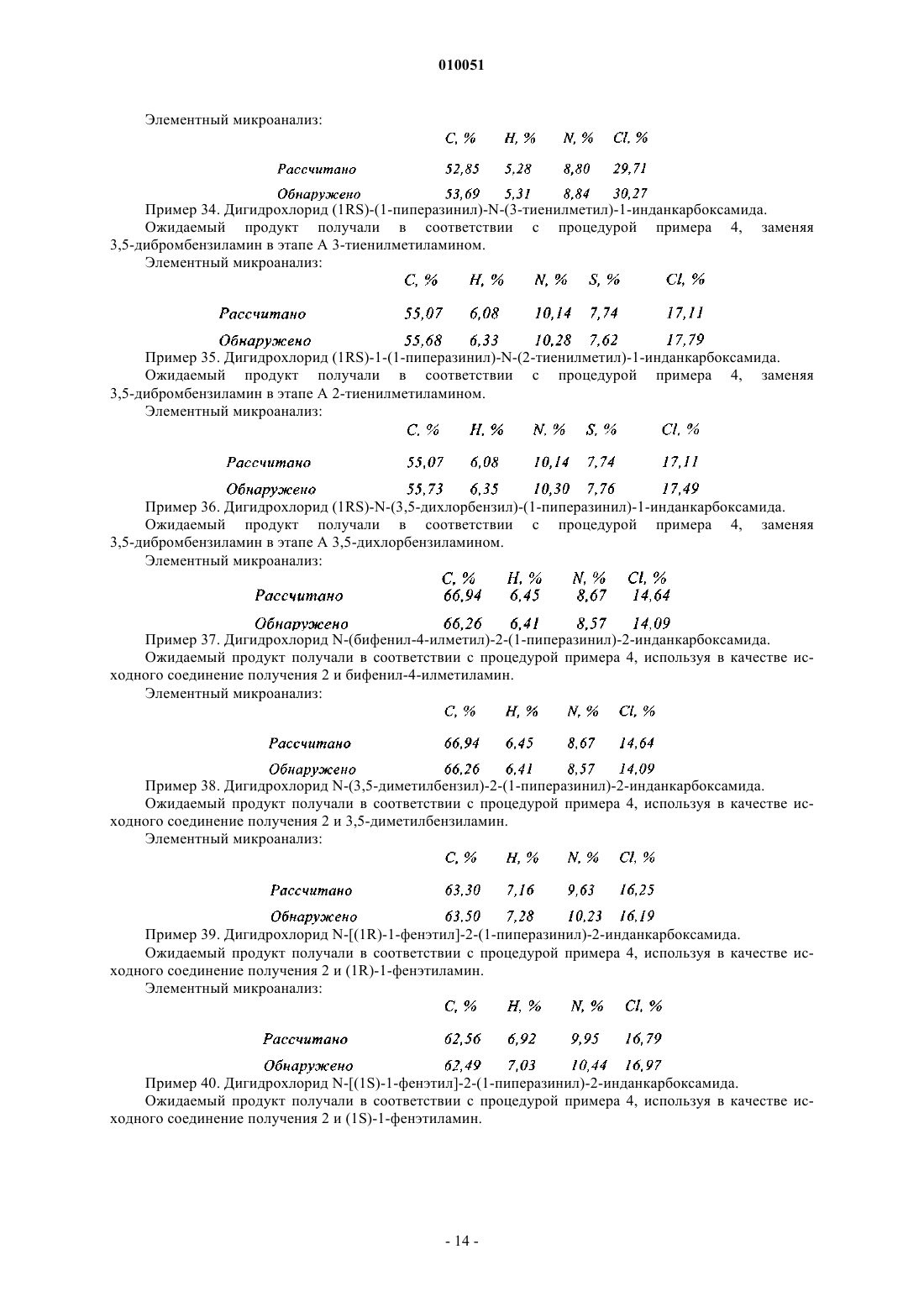
с получением после снятия защиты с кольцевой группы амина соединений формулы (Ia), которые представляют собой частный случай соединений формулы (I), где X представляет собой группу -(CO)-NR4-Ak
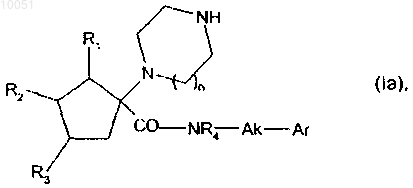
в которой R1, R2, R3, n, R4 и Ak являются такими, как определено в данном изобретении выше;
Ar является таким, как определено для формулы (I),
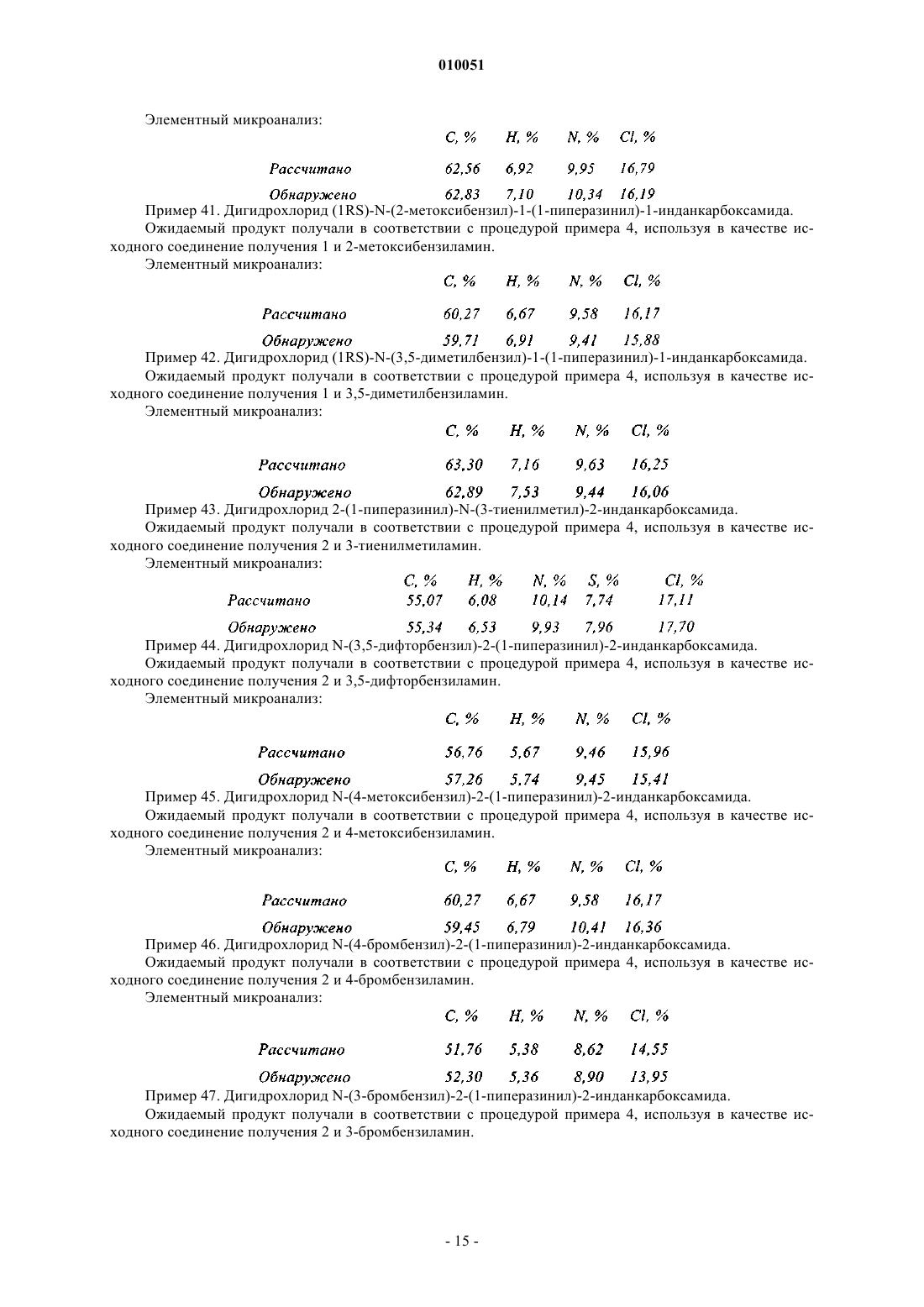
которое подвергают реакции, если является желательным получить соединения формулы (Ib), представляющие собой частный случай соединений формулы (I), где X представляет собой группу -CH2-NR4-Ak, с восстанавливающим агентом с получением соединения формулы
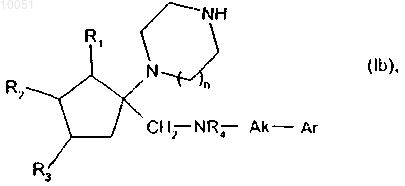
в которой R1, R2, R3, n, R4, Ak и Ar являются такими, как определено в данном изобретении выше,
при этом соединения формул (Ia) и (Ib) очищают в соответствии с традиционным способом очистки, разделяют, если это является желательным, на их оптические изомеры и превращают, если это является желательным, в соли присоединения фармацевтически приемлемой кислоты.
8. Способ получения соединений формулы (I) в соответствии с п.1 при использовании в качестве исходного соединения формулы

в которой R1, R2 и R3 являются такими, как определено для формулы (I);
P1 представляет собой защитную группу для амина,
кислотная группа которого защищается с образованием соединения формулы
в которой R1, R2, R3 и P1 являются такими, как определено в данном изобретении выше;
P2 представляет собой защитную группу для кислотной группы, которая является отличной от P1,
с группы амина которого снимается защита перед осуществлением реакции с соединением формулы
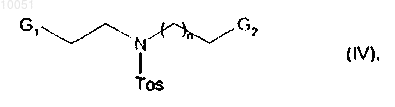
в которой G1 и G2, каждый, представляют собой атом галогена или группу п-толуолсульфонилокси;
Tos представляет собой группу паратолуолсульфонила;
n является таким, как определено для формулы (I),
с получением соединения формулы
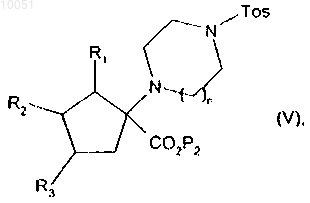
в которой R1, R2, R3, P2, n и Tos являются такими, как определено в данном изобретении выше,
от которого отщепляют группу паратолуолсульфонила, снимают защиту с кислотной группы, после чего снимают защиту с группы амина с получением соединения формулы
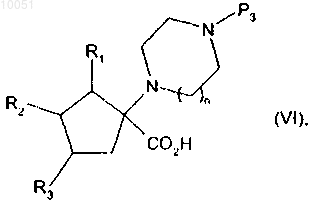
в которой R1, R2, R3 и n являются такими, как определено в данном изобретении выше;
P3 представляет собой защитную группу для амина,
соединение формулы (VI) подвергают этерификации, когда является желательным получить соединения формулы (I), где X представляет собой группу -CH2-OAk-, с получением соединения формулы
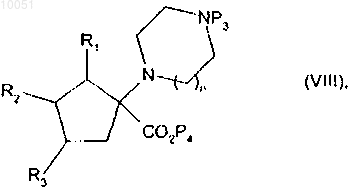
в которой R1, R2, R3, n и Р3 являются такими, как определено в данном изобретении выше;
Р4 представляет собой бензил или линейную или разветвленную группу C1-C6алкила,
которое помещают вместе с восстанавливающим агентом с получением спирта формулы
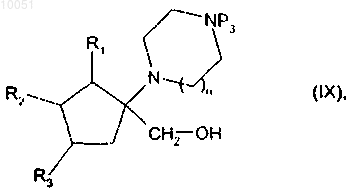
в которой R1, R2, R3, n и Р3 являются такими, как определено в данном изобретении выше,
спирт формулы (IX) подвергают реакции с соединением формулы
| Hal-Ak-Ar, | (X) |
где Ak и Ar являются такими, как определено для формулы (I);
Hal представляет собой атом галогена, с получением после снятия защиты с кольцевой группы амина, соединений формулы
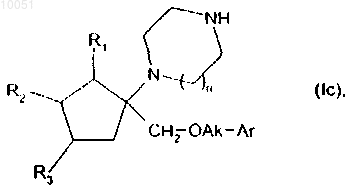
в которой R1, R2, R3, n, Ak и Ar являются такими, как определено в данном изобретении выше,
при этом соединение формулы (Ic) очищают в соответствии с традиционным способом очистки, разделяют, если это является желательным, на их оптические изомеры и превращают, если это является желательным, в соли присоединения фармацевтически приемлемой кислоты.
9. Способ получения соединений формулы (I) в соответствии с п.1 при использовании в качестве исходного соединения такового формулы

в которой R1, R2 и R3 являются такими, как определено для формулы (I);
P1 представляет собой защитную группу для амина,
кислотная группа которого защищается с образованием соединения формулы
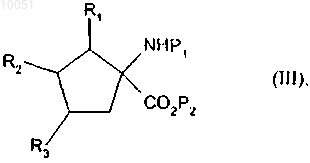
в которой R1, R2, R3 и P1 являются такими, как определено в данном изобретении выше;
Р2 представляет собой защитную группу для кислотной группы, которая является отличной от P1,
с группы амина которого снимается защита перед осуществлением реакции с соединением формулы
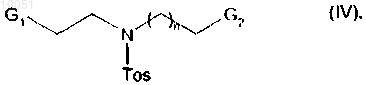
в которой G1 и G2 каждый представляет собой атом галогена или группу п-толуолсульфонилокси;
Tos представляет собойгруппу паратолуолсульфонила, а n является таким, как определено для формулы (I),
с получением соединения формулы
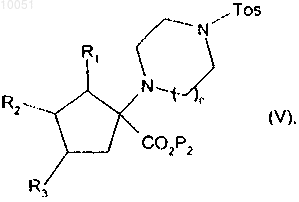
в которой R1, R2, R3, Р3, n и Tos являются такими, как определено в данном изобретении выше,
от которого отщепляют группу паратолуолсульфонила, снимают защиту с кислотной группы, после чего снимают защиту с группы амина с получением соединения формулы
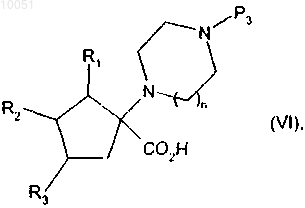
в которой R1, R2, R3 и n являются такими, как определено в данном изобретении выше;
Р3 представляет собой защитную группу для амина,
соединение формулы (VI) подвергают этерификации, когда является желательным получить соединения формулы (I), где X представляет собой группу CH2-NR4-(CO)-, с получением соединения формулы
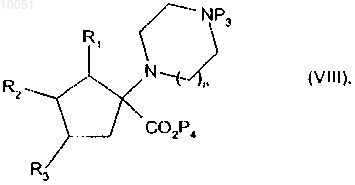
в которой R1, R2, R3, n и Р3 являются такими, как определено в данном изобретении выше;
Р4 представляет собой бензил или линейную или разветвленную группу C1-C6алкила,
которое помещают вместе с восстанавливающим агентом с получением спирта формуыы (IX)
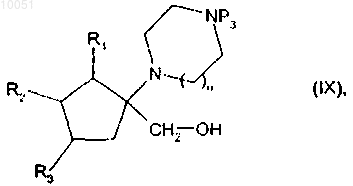
в которой R1, R2, R3, n и Р3 являются такими, как определено в данном изобретении выше,
превращение с помощью традиционных реакций органической химии спирта формулы (IX) в амин формулы
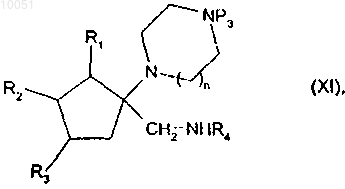
в которой R1, R2, R3, n, R4 и Р3 являются такими, как определено в данном изобретении выше,
который подвергают реакции с соединением формулы

в которой Ar является таким, как определено для формулы (I),
с получением после снятия защиты с кольцевой группы амина соединений формулы (Id)
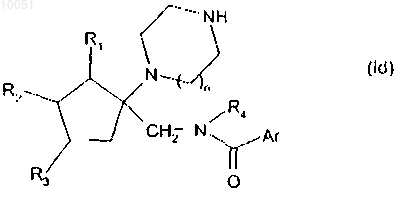
в которой R1, R2, R3, n, R4 и Ar являются такими, как определено в данном изобретении выше,
при этом соединение формулы (Id) очищают в соответствии с традиционным способом очистки, разделяют, если это является желательным, на их оптические изомеры и превращают, если это является желательным, в соли присоединения фармацевтически приемлемой кислоты.
10. Фармацевтическая композиция, включающая в качестве активного ингредиента соединение в соответствии с любым из пп.1-6 в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксическими носителями.
11. Применение соединений формулы (I) в соответствии с любым из пп.1-6 при производстве лекарственных средств для использования в качестве ингибиторов обратного поглощения серотонина и антагонистов NK1.
12. Применение соединений формулы (I) в соответствии с любым из пп.1-6 при производстве лекарственных средств для лечения депрессивных состояний, состояний беспокойства, импульсивных расстройств, агрессивного поведения, злоупотребления лекарственными средствами, ожирения и расстройств аппетита, боли и воспаления, деменции, психотических состояний, расстройств хронобиологических ритмов, рвоты или желудочно-кишечных расстройств.
Текст
010051 Настоящее изобретение относится к соединениям инданилпиперазина, к способу их получения и к содержащим их фармацевтическим композициям, а также к их применению в качестве ингибиторов обратного поглощения серотонина и антагонистов NK1. Соединения в соответствии с настоящим изобретением действуют в качестве ингибиторов обратного поглощения серотонина. На основании этого факта они являются полезными для лечения депрессивных состояний (Goodnick и Goldstein, J. Psychopharmacol 1998, 12 (Suppl В): S. 55-87; Cheer и Goa, Drugs 2001, 61: 81-110; MacQueen и др., CNS Drug Rev 2001, 7: 1-24; Wagstaff и др., Drugs 2002, 62: 655-703),состояний беспокойства, таких как генерализованный страх, приступы паники и фобии (Feighner,J. Clin Psychiatry 1999, 60 (Suppl 22): 18-22; Bakker и др., Int Clin Psychopharmacol 2000, 15 (Suppl 2): S. 25-30; Davidson, Int Clin Psychopharmacol 2000, 15 (Suppl 1): S. 13-17; Schneier, J. Clin Psychiatry 2001,62 (Suppl 1): 43-48), пагубного эффекта стресса, либо физиологического (Marona-Lewicka и Nichols,Stress 1997, 2: 91-100; Mar и др., Pharmacol Biochem Behav 2002, 73: 703-712; Will и др., Mol Psychiatry 2003, 8: 925-932; Ballenger, J. Clin Psychiatry 2004, 65: 1696-1707), либо нейротоксического (Malberg и(Suppl 2) S7-S13), агрессивных состояний (Knutson и др., Am J. Psychiatry 1998, 155: 373-379; Lanctot и др., Neuropsychopharmacology 2002, 27: 646-654; New и др., Psychopharmacology 2004, 176: 451-458),ожирения и расстройств аппетита, таких как булимия (Proietto и др., Expert Opin Investig Drugs 2000, 9: 1317-1326; Ljung и др., J. Intern Med 2001, 250: 219-224; Appolinario и др., CNS Drugs 2004, 18: 629-651;Appolinario и McElroy, Curr Drug Targets 2004, 5: 301-307), болевых состояний (Aragona и др., Eur J. Pain 2005, 9: 33-38; Millan и др., Neuropharmacology 2002, 42: 677-684; Duman и др., J. Pharmacol Sci 2004, 94: 161-165; Otsuka и др., J. Anesth 2004, 15: 154-158); и в отношении тех объектов, расстройств поведения и нейронной дегенерации, которые ассоциированы с деменцией и другими расстройствами, связанными со старением (Lyketos и др., Am J. Psychiatry 2000, 157: 1686-1689; Lanctot и др., J. Neuropsyhiatry Clin Neurosci 2001, 13: 5-21; Lanctot и др., Neuropsychopharmacology 2002, 27: 646-654; Pollock и др., Am J. Psychiatry 2002,159: 460-465). Кроме того, соединения в соответствии с настоящим изобретением также являются активными в качестве антагонистов нейрокинина NK1. На основании этого факта они также являются полезными для лечения депрессивных состоянийKramer и др., Neuropsychopharmacology 2004, 29: 385-392; Dableh и др., Eur J. Pharmacol 2005, 507: 99105), состояний беспокойства, таких как генерализованный страх, приступы паники и фобии (Rupniak и др., Behav Pharmacol 2001, 12: 497-508; Santarelli и др., Proc Natl Acad Sci USA 2001, 98: 1912-1927; Varty и др., Neuropsychopharmacology 2002, 27: 371-379; Rupniak и Kramer, Neuropsychopharmacology 2002, 13: 169-177), пагубного эффекта стресса, либо физиологического (Ballard и др., Eur J. Pharmacol 2001, 412: 255-264; Rupniak и Kramer, Neuropsychopharmacology 2002, 13: 169-177; Spooren и др., Eur J. Pharmacol 2002, 435: 161-170; Steinberg и др., J. Pharmacol Exp Ther 2002, 303:1180-1188), либо нейротоксического(Siegel и Schubert, Rev Neurosci 1995, 6: 47-61; De Felipe и др., Nature 1998, 392: 394-397; Rupniak и др.,Behav Pharmacol 2001, 12: 497-508), а также злоупотребления лекарственными средствами (Murtra и др.,Nature 2000, 405: 180-183; Ripley и др., Neuropharmacology 2002, 43: 1258-1268; Gadd и др., J. Neurosci 2003, 23: 8271-8280), психотических состояний (Zachrisson и др., Eur Neuropsychopharmacol 2000, 10: 355-363) и экстрапирамидальных моторных эффектов, вызванных антипсихотическими средствами(Anderson и др., J. Pharmacol Exp Ther 1995, 274: 928-936, Steinberg и др., J. Pharmacol Exp Ther 2002, 303: 1180-1188), сексуальных дисфункций (Priest и др., Brain Res Mol Brain Res 1995, 28: 61-71; Daniels и др.,Neurosci Lett 2003, 338: 111-114; Kramer и др., Science 1998, 281: 1640-1644; Kramer и др., Neuropsychopharmacology 2004, 29: 385-392), нарушений хронобиологических ритмов, таких как циркадные ритмыJoos и Pauwels, Curr Opin Pharmacol 2001, 1: 235-241; Sanger, Br J. Pharmacol 2004, 141: 1303-1312), тошноты и других расстройств желудочно-кишечного тракта (McAllister и Pratt Eur J. Pharmacol 1998, 351: 141-148; Gardner и др., Regulatory Peptides 1996, 65: 45-53; Patel и Lindley, Expert Opin. Pharmacother 2003,4: 2279-2296; Sanger, Br J. Pharmacol 2004, 141: 1303-1312); и в отношении тех объектов, расстройств по-1 010051 ведения и нейронной дегенерации, которые ассоциированы с деменцией и другими расстройствами, связанными со старением (Raffa, Neurosci Biobehav Rev 1998, 22:789-813). Поскольку указанные соединения являются активными как на рецепторах NK1, так и на сайтах обратного поглощения серотонина (5-НТ), они должны обладать комплементарными и синергетическими механизмами для контроля импульсивного, агрессивного, болевого и, прежде всего, депрессивного состояний. Более того, было показано, что блокирование рецепторов NK1 усиливает влияние 5-НТ ингибиторов обратного поглощения серотонина на серотонинергическую трансмиссию: вследствие этого факта такие соединения могли бы оказывать более быстрые и более сильные антидепрессантные эффекты(Guiard и др., J. Neurochem 2004, 89: 54-63; Froger и др., J. Neurosci 2001, 21: 8188-8197). Быстрые анксиолитические эффекты антагонистов NK1, кроме того, могут быть комплементарными к анксиолитическим эффектам ингибиторов обратного поглощения 5-НТ, которые экспрессируются после длительного лечения. В отношении анксиогенных эффектов, вызываемых 5-НТ в начале лечения (Bagdy и др., Int J.Neuropsychopharmacol 2001, 4: 399-408), то они предотвращались бы антагонистическими свойствамиNK1 (Ballard и др., Eur J. Pharmacol 2001, 412: 255-264; Rupniak и др., Neuropharmacology 2003, 44: 516523). Поскольку другие нежелательные эффекты, ассоциированные с блокированием обратного поглощения 5-НТ, связаны с такими эффектами, как рвотные эффекты (Goldstein и Goodnick, J. Psychopharmacol 1998, 12 (Suppl В): S55-S87; Edwards и Anderson, Drugs 1999, 57: 507-533; Waugh и Goa, CNS Drugs 2003, 17: 343-362) и сексуальные дисфункции (Goldstein и Goodnick, J. Psychopharmacol 1998, 12 (Suppl(Suppl 18): 20-24), то антагонисты NK1 также могли бы противодействовать таким эффектам. Таким образом, соединения, которые представляют собой как антагонисты NK1, так и ингибиторы обратного поглощения серотонина, будут иметь терапевтические преимущества по сравнению с соединениями, которые взаимодействуют только с одной или другой из этих двух мишеней. В частности, настоящее изобретение относится к соединениям формулы в которой R3 представляет собой атом водорода;R1 и R2 вместе с атомами углерода, которые их несут, образуют кольцевую структуру бензола, нафталина или хинолина, предпочтительно бензольное кольцо, при этом каждая из этих кольцевых структур является необязательно замещенной одним или более идентичными или различными заместителями, выбранными из водорода, галогена и линейного или разветвленного C1-C6 алкила, необязательно замещенного одним или более атомами галогена, или R1 представляет собой атом водорода, a R2 и R3 вместе с атомами углерода, которые их несут, образуют кольцевую структуру бензола, нафталина или хинолина,предпочтительно бензольное кольцо, при этом каждая из этих кольцевых структур является необязательно замещенной одним или более идентичными или различными заместителями, выбранными из водорода, галогена и линейного или разветвленного C1-C6 алкила, необязательно замещенного одним или более атомами галогена;m представляет собой целое число от 1 до 6 включительно;Ak представляет собой линейную или разветвленную цепь C1-C6 алкилена, необязательно замещенную группой гидрокси;R4 представляет собой атом водорода, линейную или разветвленную C1-C6 алкильную группу;Ar представляет собой группу арила или гетероарила,и их оптическим изомерам, а также к адитивным солям с фармацевтически приемлемой кислотой. Под оптическими изомерами понимают энантиомеры и диастереоизомеры. Среди фармацевтически приемлемых кислот следующие могут быть упомянуты без намерения какого-либо ограничения: хлористо-водородная, бромисто-водородная, серная, фосфоновая, уксусная,трифторуксусная, молочная, пировиноградная, малоновая, янтарная, глутаровая, фумаровая, винная, малеиновая, лимонная, аскорбиновая, щавелевая, метансульфоновая, бензолсульфоновая, камфарная кислоты. Под арильной группой понимают фенил, бифенилил или нафтил, каждая из этих групп является необязательно замещенной одной или более идентичными или различными группами, выбранными из галогена, линейного или разветвленного C1-C6 алкила, линейного или разветвленного C1-C6 алкокси, гидрокси, циано и линейного или разветвленного C1-C6 тригалоалкила.-2 010051 Под гетероарильной группой понимают ароматическую моно- или бициклическую 5-12-членную группу, содержащую один, два или три гетероатома, выбранных из кислорода, азота и серы, при этом понятно, что гетероарильная группа может быть необязательно замещенной одной или более идентичными или различными группами, выбранными из галогена, линейного или разветвленногоC1-C6 алкила, линейного или разветвленного C1-C6 алкокси, гидрокси и линейного или разветвленногоC1-C6 тригалоалкила. Среди гетероарильных групп могут быть упомянуты без намерения какого-либо ограничения группы тиенила и пиридила.n предпочтительно представляет собой 1.m предпочтительно представляет собой 1.Ar предпочтительно представляет собой арильную группу. Предпочтительные соединения в соответствии с изобретением представляют собой 1-[(1RS)-1-(3,5-дибромбензилоксиметил)индан-1-ил]пиперазин, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,1-[(1RS)-1-(3,5-диметилбензилоксиметил)индан-1-ил]пиперазин, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,1-[2-(3,5-диметилбензилоксиметил)индан-2-ил]пиперазин, а также его соли присоединения фармацевтически приемлемой кислоты,N-[(3,5-бис-(трифторметил)бензил]-2-(1-пиперазинил)-2-инданкарбоксамид, а также его соли присоединения фармацевтически приемлемой кислоты,(1RS)-N-бензил-N-метил-1-(1-пиперазинил)-1-инданкарбоксамид, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,(1RS)-N-[3,5-бис-(трифторметил)бензил]-N-метил-1-(1-пиперазинил)-1-инданкарбоксамид, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,(1RS)-N-(3,5-диметилбензил)-1-(1-пиперазинил)-1-инданкарбоксамид, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,N-(3,5-дифторбензил)-2-(1-пиперазинил)-2-инданкарбоксамид, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,N-(3,5-дихлорбензил)-N-метил-2-(1-пиперазинил)-2-инданкарбоксамид, а также его соли присоединения фармацевтически приемлемой кислоты,(1RS)-N-(3,5-дифторбензил)-N-метил-1-(1-пиперазинил)-1-инданкарбоксамид, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,(1RS)-N-[3-фтор-5-(трифторметил)бензил]-N-метил-1-(1-пиперазинил)-1-инданкарбоксамид,его оптические изомеры, а также его соли присоединения фармацевтически приемлемой кислоты,(1RS)-1-[1-(3,5-дифторбензилоксиметил)индан-1-ил]пиперазин, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,N-(3-хлор-5-фторбензил)-N-метил-2-(1-пиперазинил)-2-инданкарбоксамид, а также его соли присоединения фармацевтически приемлемой кислоты,1-[(1RS)-1-(3,5-дифторбензилоксиметил)индан-1-ил]пиперазин, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,(1RS)-N-(3,5-дифторбензил)-N-метил-1-(1-пиперазинил)-1-инданкарбоксамид, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты,1-[(1RS)-1-(3,5-дифторбензилоксиметил)-5,6-дифториндан-1-ил]пиперазин, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты, и 1-[(1RS)-1-(3-бром-5-фторбензилоксиметил)индан-1-ил]пиперазин, его оптические изомеры, а также соли присоединения фармацевтически приемлемой кислоты. Изобретение также относится к способу получения соединений формулы (I) при использовании в качестве исходного соединения формулы в которой R1, R2 и R3 являются такими, как определено для формулы (I);P1 представляет собой защитную группу для амина,кислотную группу которого защищают с образованием соединения формулы-3 010051 в которой R1, R2, R3 и P1 являются такими, как определено в данном изобретении выше; Р 2 представляет собой защитную группу для кислотной группы, которая является отличной от P1,с группы амина которого снимается защита перед осуществлением реакции с соединением формулы в которой G1 и G2, каждый, представляет собой атом галогена или группу п-толуолсульфонилокси;Tos представляет собой группу паратолуолсульфонила;n является таким, как определено для формулы (I),с получением соединения формулы в которой R1, R2, R3, Р 2, n и Tos являются такими, как определено в данном изобретении выше,от которого отщепляют группу паратолуолсульфонила,снимают защиту с кислотной группы, а потом снимают защиту с группы амина с получением соединения формулы в которой R1, R2, R3 и n являются такими, как определено в данном изобретении выше; Р 3 представляет собой защитную группу для амина; при этом соединение формулы (VI), когда является желательным получить соединения формулы (I), в которых X представляет собой -(CO)-NR4-Ak- или -CH2-NR4-Ak, подвергают реакции с соединением формулыHNR4-Ak-Ar,(VII) где R4, Ak и Ar являются такими, как определено для формулы (I),в присутствии одного или более конденсирующих агентов, с получением после снятия защиты с кольцевой группы амина соединений формулы (Ia), которые представляют собой частный случай соединений формулы (I), где X представляет собой группу -(CO)-NR4-AkAr является таким, как определено для формулы (I),которые подвергают реакции, если является желательным получить соединения формулы (Ib), представляющих собой частный случай соединений формулы (I), в которых X представляет собой группу в которой R1, R2, R3, n, R4, Ak и Ar являются такими, как определено в данном изобретении выше; или соединение формулы (VI) подвергают этерификации, когда является желательным получить соединения формулы (I), в которой X представляет собой группу -CH2-OAk- или -CH2-NR4-(CO)-,с получением соединения формулы в которой R1, R2, R3, n и Р 3 являются такими, как определено в данном изобретении выше; Р 4 представляет собой бензил, линейную или разветвленную группу C1-C6 алкила,которое помещают вместе с восстанавливающим агентом с получением спирта формулы в которой R1, R2, R3, n и Р 3 являются такими, как определено в данном изобретении выше,спирт формулы (IX) подвергают реакции, если является желательным получить соединения формулы(Ic), представляющие собой частный случай соединений формулы (I), где X представляет собой группуHal-Ak-Ar,(X) где Ak и Ar являются такими, как определено для формулы (I), a Hal представляет собой атом галогена,с получением после снятия защиты с кольцевой группы амина соединений формулы в которой R1, R2, R3, n, Ak и Ar являются такими, как определено в данном изобретении выше,или спирт формулы (IX) превращают с помощью традиционных реакций органической химии в амин формулы где Ar является таким, как определено для формулы (I),с получением после снятия защиты с кольцевой группы амина соединений формулы (Id), которые представляют собой частный случай соединений формулы (I), где X представляет собой группу-CH2-NR4-(CO) в которой R1, R2, R3, n, R4 и Ar являются такими, как определено в данном изобретении выше,при этом соединения формул (Ia), (Ib), (Ic) и (Id) очищают в соответствии с традиционным способом очистки, разделяют, если это является желательным, на их оптические изомеры и превращают, если это является желательным, в соли присоединения фармацевтически приемлемой кислоты. Соединения в соответствии с формулой (Ie), которые представляет собой частный случай соединений формулы (I), где X представляет собой группу формулы -СН 2 О-СН(СН 3) в которой R1, R2, R3, n и Ar являются такими, как определено в данном изобретении выше,могут также быть получены путем конденсации соединения формулы (IX) с соединением формулы где R1, R2, R3, n, Ar и P3 являются такими, как определено в данном изобретении выше,которое подвергают гидрогенизации с получением соединения формулы (XVI) в которой R1, R2, R3, n, Ar и P3 являются такими, как определено в данном изобретении выше,с аминогруппы которого снимают защиту с получением соединения формулы (Ie),которое разделяют, если это является желательным, на оптические изомеры и превращают, если это является желательным, в соли присоединения фармацевтически приемлемой кислоты. Соединения в соответствии с настоящим изобретением представляют собой ингибиторы обратного поглощения серотонина и антагонисты NK1. Они являются полезными при лечении депрессивных состояний, состояний беспокойства, импульсивных расстройств, агрессивного поведения, злоупотребления лекарственными средствами, ожирения и расстройства аппетита, боли и воспаления, деменции, психотических состояний, нарушений хронобиологического ритма, тошноты и желудочно-кишечных расстройств. Настоящее изобретение также относится к фармацевтическим композициям, которые включают в качестве активного ингредиента соединение формулы (I) или его соли присоединения фармацевтически приемлемой кислоты в комбинации с одним или более фармацевтически приемлемыми, инертными, нетоксическими наполнителями или носителями. Среди фармацевтических композиций в соответствии с изобретением, в частности, могут быть упомянуты те, которые являются приемлемыми для перорального, парентерального (внутривенного, внутримышечного или подкожного введения), чрескожного, назального, ректального, чрезъязычного, окулярного введения или введения через респираторный тракт, и, в частности, таблетки, драже, подъязычные таблетки, желатиновые капсулы, капсулы, суппозитории, кремы, мази, дермальные гели, препараты,вводимые путем инъекции, препараты, которые вводятся с питьем, аэрозоли, глазные или носовые капли. Приемлемые дозировки варьируют в зависимости от возраста, веса пациента, пути введения,природы и тяжести расстройства, а также проведения какого-либо ассоциированного лечения от 0,5 до 500 мг в день однократно или в виде большего количества введений. Примеры, которые следуют далее, иллюстрируют изобретение. Используемый исходный материал представляет собой известные продукты или может быть получен в соответствии с известными способа-6 010051 ми. Различные получения обеспечивают синтез промежуточных соединений, которые используются при получении соединений в соответствии с изобретением. Структуры соединений, описанных в примерах, определены в соответствии с традиционными спектрометрическими способами (инфракрасный, ядерного магнитного резонанса, масс-спектрометрии). Под соединением конфигурации (1) понимают соединение, выбранное из соединений абсолютных конфигураций (1R) и (1S), при этом понятно, что когда соединение (1) представляет собой соединение конфигурации (1R), соединение (1) представляет собой другой энантиомер. Под соединением конфигурации (1') понимают соединение, выбранное из соединений абсолютных конфигураций (1R) и (1S), при этом понятно, что когда соединение (1') представляет собой соединение конфигурации (1R), соединение (1') представляет собой другой энантиомер. Под соединением конфигурации (1RS) понимают рацемическую смесь двух энантиомеров абсолютных конфигураций (1R) и (1S). Получение 1. (1RS)-1-[4-(трет-Бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоновая кислота. Этап А. Бензил (1RS)-1-[(трет-бутилоксикарбонил)амино]-1-инданкарбоксилат. К 0,140 моль 1-[(трет-бутилоксикарбонил)амино]-1-инданкарбоновой кислоты прибавляли 750 мл диметилформамида, а потом 0,147 моль карбоната цезия. Перемешивание осуществляли в течение 2 ч 30 мин при комнатной температуре и потом по каплям выливали в течение 1/2 ч в 0,145 моль бензилбромида, растворенного в 150 мл диметилформамида, перемешивание осуществляли в течение 20 ч при комнатной температуре. После этого отфильтровывали минеральные соли и выпаривали растворитель. Остаток повторно растворяли в этилацетате и промывали водой. Органическую фазу высушивали, а потом выпаривали с получением ожидаемого продукта. Этап В. Бензил (1RS)-1-амино-1-инданкарбоксилат гидрохлорид. 0,471 моль соединения, полученного на этапе, описанном выше, прибавляли к 2 л этилацетата. Пропускали струю газа хлористого водорода в течение 1 ч 15 мин при перемешивании, а потом перемешивание продолжали в течение 20 ч при комнатной температуре. Ожидаемый продукт получали путем выпаривания этилацетата. Этап С. Бензил (1RS)-1-[4-(паратолуолсульфонил)-1-пиперазинил]-1-инданкарбоксилат. К 0,235 моль соединения, полученного на этапе, описанном выше, прибавляли 750 мл диметилформамида, 750 мл диизопропилэтиламина и 0,235 моль N,N-бис-(2-хлорэтил)паратолуолсульфонамида. Кипячение осуществляли в течение 48 ч, а потом выпаривали растворители. Остаток растворяли в этилацетате и промывали водой. Органическую фазу высушивали и выпаривали. Остаток очищали с помощью хроматографии на силикагеле при использовании смеси 98/2 метиленхлорид/этилацетат в качестве элюента с получением ожидаемого продукта. Этап D. (1RS)-1-[4-(Паратолуолсульфонил)-1-пиперазинил]-1-инданкарбоновая кислота. К 0,181 моль соединения, полученного на этапе, описанном выше, прибавляли 620 мл диоксана, а потом 620 мл 1N раствора гидроокиси натрия и 360 мл воды. Кипячение осуществляли в течение 20 ч, а потом выпаривали диоксан. Нейтрализацию осуществляли путем прибавления 620 мл 1N хлористоводородной кислоты, после чего проводили экстракцию с метиленхлоридом. Органическую фазу высушивали и выпаривали. Остаток выкристаллизовывали из этилового эстера, а потом отфильтровывали с получением ожидаемого продукта. Этап Е. Дигидробромид (1RS)-1-(1-пиперазинил)-1-инданкарбоновой кислоты. К 100 мл 30% раствора бромисто-водородной кислоты в уксусной кислоте прибавляли 40 мл уксусной кислоты, 12,5 ммоль нафталина и 12,5 ммоль соединения, полученного на предыдущем этапе. Кипячение осуществляли в течение 1 ч, после чего осуществляли концентрирование. Остаток переносили в воду и водную фазу промывали с помощью этилацетата, а потом выпаривали. Твердый остаток промывали с помощью ацетонитрила, а потом высушивали с получением ожидаемого продукта. Этап F. (1RS)-1-[4-(трет-Бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоновая кислота. К 9,26 ммоль соединения, полученного на этапе, описанном выше, прибавляли 40 мл диоксана и 37 мл 1N раствора гидроокиси натрия. К полученному раствору прибавляли по каплям при комнатной температуре раствор 10,2 ммоль ди-трет-бутилдикарбоната в 100 мл диоксана. Перемешивание осуществляли в течение 5 ч, а потом диоксан выпаривали. Значение рН доводили до 4-5 при использовании 1N хлористо-водородной кислоты и осуществляли насыщение с помощью хлорида натрия и экстракцию при использовании этилацетата. Органическую фазу высушивали и выпаривали с получением ожидаемого продукта. Получение 2. 2-[4-(трет-Бутилоксикарбонил)-1-пиперазинил]-2-инданкарбоновая кислота. Ожидаемый продукт получали в соответствии с процедурой, описанной в получении 1, заменяя на этапе А 1-[(трет-бутилоксикарбонил)амино]-1-инданкарбоновую кислота 2-[(трет-бутилоксикарбонил)амино]-2-инданкарбоновой кислотой и бензилбромид 1-бромэтаном. Пример 1. Дигидрохлорид 1-[(1RS)-1-(3,5-дибромбензилоксиметил)индан-1-ил]пиперазина. Этап А. Бензил (1RS)-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоксилат. К 63,5 ммоль соединения получения 1 прибавляли 550 мл диметилформамида и 66 ммоль карбоната цезия; перемешивание осуществляли в течение 2 ч при комнатной температуре, после чего прибавляли по каплям в течение 1/2 ч раствор 65,7 ммоль бензилбромида в 50 мл диметилформамида. Перемешивание осуществляли в течение 20 ч при комнатной температуре, а потом растворитель выпаривали. Остаток переносили в этилацетат, органическую фазу промывали водой, высушивали и выпаривали с получением ожидаемого продукта в виде бесцветного масла. Этап B. (1RS)-1-[4-(трет-Бутилоксикарбонил)-1-пиперазинил]-1-гидроксиметилиндан. К 250 мл тетрагидрофурана и 63,2 ммоль гидрида лития-алюминия прибавляли в течение 1 ч 15 мин при поддержании температуры реакционной смеси ниже 20 С раствор 57,5 ммоль соединения, полученного на этапе, описанном выше, в 550 мл тетрагидрофурана. После прибавления перемешивание осуществляли в течение 1/2 ч при температуре 20 С; потом осуществляли гидролиз при использовании 50 мл изопропанола, а потом 50 мл насыщенного раствора хлорида натрия. Осуществляли фильтрацию, фильтрат выпаривали; а остаток повторно растворяли в этилацетате и промывали водой. Высушенная и выпаренная органическая фаза обеспечивала получение ожидаемого продукта. Этап C. 4-(трет-Бутилоксикарбонил)-1-[(1RS)-1-(3,5-дибромбензилоксиметил)индан-1-ил]пиперазин. К 30 мл диметилформамида и 5,4 ммоль гидрида натрия 95% прибавляли в течение 10 мин раствор 3,6 ммоль соединения, полученного на этапе, описанном выше, в 50 мл диметилформамида. Осуществляли нагревание при температуре 50-60 С в течение 1/2 ч, после чего оставляли для охлаждения до комнатной температуры. Прибавляли 0,36 ммоль иодида тетрабутиламмония, а потом в течение 10 мин раствор 5,4 ммоль 3,5-дибромбензилбромида в 30 мл диметилформамида. Перемешивание осуществляли в течение 20 ч при комнатной температуре. Выпаривали растворитель, а остаток повторно растворяли в этилацетате. Осуществляли промывание водой и раствором хлорида натрия. Органическую фазу высушивали и выпаривали. Продукт очищали с помощью хроматографии на силикагеле (элюент: CH2Cl2/AcOet 90/10) с получением ожидаемого продукта. Этап D. Дигидрохлорид 1-[(1RS)-1-(3,5-дибромбензилоксиметил)индан-1-ил]пиперазина. К 2,75 ммоль соединения, полученного на этапе, описанном выше, растворенного в 30 мл этилацетата, прибавляли 15 мл 1N раствора хлористо-водородной кислоты в диоксане. После перемешивания в течение 20 ч при комнатной температуре отфильтровывали полученный преципитат, промывали с помощью этилацетата, а потом повторно растворяли в воде. После выпаривания и высушивания получали ожидаемый продукт. Элементный микроанализ: Пример 2. Дигидрохлорид 1-[(1RS)-1-(3,5-диметилбензилоксиметил)индан-1-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой, описанной в примере 1, заменяя 3,5-дибромбензилбромид на этапе С 3,5-диметилбензилбромидом. Пример 3. Дигидрохлорид 1-[2-(3,5-диметилбензилоксиметил)индан-2-ил]пиперазина. Этап A. 2-[4-(трет-Бутилоксикарбонил)-1-пиперазинил]-2-гидроксиметилиндан. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапах А и В примера 1,заменяя соединение получения 1 этапа А соединением получения 2. Этап В. Дигидрохлорид 1-[2-(3,5-диметилбензилоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапах С и D примера 1,используя в качестве исходного соединение, полученное на этапе А, описанном выше, и 3,5-диметилбензилбромид. Элементный микроанализ:(1RS)-N-(3,5-Дибромбензил)-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоксамид. К 2 ммоль соединения получения 1 прибавляли 50 мл диметилформамида, 2 ммоль 3,5-дибромбензиламина, 2 ммоль 1-гидроксибензотриазола и 2 ммоль дициклогексилкарбодиимида. Перемешивали в течение 20 ч при комнатной температуре, а потом осуществляли выпаривание. Остаток переносили в этилацетат. Образовавшуюся дициклогексилмочевину удаляли с помощью фильтрования; после этого органическую фазу промывали с помощью насыщенного раствора бикарбоната натрия, а потом насыщенным раствором хлорида натрия. После высушивания, выпаривания и очистки с помощью хроматографии на силикагеле Этап В. Дигидрохлорид (1RS)-N-(3,5-дибромбензил)-1-(1-пиперазинил)-1-инданкарбоксамида. К 1,6 ммоль соединения, полученного на этапе, описанном выше, растворенного в 30 мл этилацетата, прибавляли 15 мл 4N раствора хлористо-водородной кислоты в диоксане, потом реакционную смесь перемешивали в течение 20 ч при комнатной температуре. Полученный преципитат отфильтровывали, а потом повторно растворяли в 5 мл воды. После выпаривания воды и высушивания получали ожидаемый продукт. Элементный микроанализ:N-[3,5-бис-(трифторметил)бензил]-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3,5-бис-(трифторметил)бензиламин. Элементный микроанализ: Пример 6. Тригидрохлорид [3,5-бис-(трифторметил)фенил]-N-[2-(1-пиперазинилиндан)-2-ил]метилметанамина. К 3 ммоль соединения примера 5, растворенного в 80 мл тетрагидрофурана, прибавляли в атмосфере азота в течение 20 мин 30 ммоль 2N раствора борандиметилсульфида в тетрагидрофуране. Потом реакционную смесь подвергали кипячению в течение 18 ч и постепенно охлаждали до комнатной температуры. После этого прибавляли по каплям 50 мл 4N хлористо-водородной кислоты и перед выпариванием растворителей снова последовательно осуществляли нагревание при температуре кипения в течение 20 ч,подщелачивая раствор с помощью раствора гидроокиси натрия и экстрагируя реакционную смесь при-9 010051 использовании этилацетата. Органическую фазу промывали с помощью насыщенного раствора хлорида натрия, высушивали, а потом выпаривали. После очистки с помощью хроматографии, превращения в соль при использовании хлористо-водородной кислоты и выпаривания получали ожидаемый продукт после высушивания. Элементный микроанализ: Пример 7. Дигидрохлорид N-бензил-N-метил-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-бензил-N-метиламин. Элементный микроанализ: Пример 8. Дигидрохлорид 1-[(1)-1-(3,5-диметилбензилоксиметил)индан-1-ил]пиперазина. Ожидаемый продукт получали путем разделения соединения примера 2 на хиральной колонке для жидкостной хроматографии высокого разрешения. Пример 9. Дигидрохлорид 1-[(1)-1-(3,5-диметилбензилоксиметил)индан-1-ил]пиперазина. Ожидаемый продукт представляет собой второй энантиомер, полученный в результате разделения соединения Примера 2 колонке хиральной колонке для жидкостной хроматографии высокого разрешения. Пример 10. Дигидрохлорид(1RS)-N-[3,5-бис-(трифторметил)бензил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, заменяя 3,5-дибромбензиламин этапа А 3,5-бис-(трифторметил)бензиламином. Элементный микроанализ: Пример 11. Дигидрохлорид (1RS)-N-Бензил-N-метил-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и N-метилбензиламин. Элементный микроанализ: Пример 12. Дигидрохлорид 1-[2-(бифенил-4-илметоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и бифенил-4-илметилбромид. Элементный микроанализ: Пример 13. Дигидрохлорид 1-[2-(3,5-диметоксибензилоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и 3,5-диметоксибензилбромид. Элементный микроанализ:- 10010051 Пример 14. Дигидрохлорид 1-[2-(3,5-дихлорбензилоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и 3,5-дихлорбензилбромид. Элементный микроанализ: Пример 15. Дигидрохлорид 1-[2-(3,4-дихлорбензилоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и 3,4-дихлорбензилбромид. Элементный микроанализ: Пример 16. Дигидрохлорид 1-[2-(3,5-дибромбензилоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и 3,5-дибромбензилбромид. Элементный микроанализ: Пример 17. Дигидрохлорид 1-[2-[3,5-бис-(трифторметил)бензилоксиметил]индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и 3,5-бис-(трифторметил)бензилбромид. Элементный микроанализ: Пример 18. Дигидрохлорид (1RS)-N-бензил-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4,3,5-дибромбензиламин этапа А бензиламином. Элементный микроанализ: Пример 19. Дигидрохлорид 1-[2-(нафт-2-илметоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и нафт-2-илметилбромид. Элементный микроанализ: Пример 20. Дигидрохлорид (1RS)-N-[3,5-бис-(трифторметил)бензил]-N-метил-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и N-метил-3,5-бис-(трифторметил)бензиламин. Элементный микроанализ:- 11010051 Пример 21. Дигидрохлорид N-(3,5-дихлорбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3,5-дихлорбензиламин. Элементный микроанализ: Пример 22. Дигидрохлорид (1)-N-[(1S)-1-фенэтил]-1-(1-пиперазинил)-1-инданкарбоксамида. Этап А. (1RS)-N-[(1S)-1-фенэтил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил-1-инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, используя в качестве исходного соединение получения 1 и (1S)-1-фенэтиламин. Этап В. (1)-N-[(1S)-1-фенэтил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил-1-инданкарбоксамид. Ожидаемый продукт получали путем разделения с помощью хроматографии на кремнеземе смеси диастереоизомеров, полученной на этапе А. Этап С. Дигидрохлорид (1)-N-[(1S)-1-фенэтил]-1-(1-пиперазинил)-1-инданкарбоксамида. Используя в качестве исходного соединение, полученное на этапе В, ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4. Элементный микроанализ: Пример 23. Дигидрохлорид (1)-N-[(1S)-1-фенэтил]-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизомеров, разделение которых осуществляли на этапе В примера 22. Элементный микроанализ:(1RS)-N-[(1R)-1-фенэтил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, используя в качестве исходного соединение получения 1 и (1R)-1-фенэтиламин. Этап В.(1)-N-[(1R)-1-фенэтил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоксамид. Ожидаемый продукт получали путем разделения с помощью хроматографии на кремнеземе смеси диастереоизомеров, полученной на этапе А. Этап С. Дигидрохлорид (1)-N-[(1R)-1-фенэтил]-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе В. Элементный микроанализ: Пример 25. Дигидрохлорид (1)-N-[(1R)-1-фенэтил]-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизомеров, разделение которых осуществляли на этапе В примера 24. Элементный микроанализ:- 12010051 Пример 26. Дигидрохлорид (1RS)-N-(2-фенэтил)-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, заменяя 3,5 дибромбензиламин в этапе А 2-фенэтиламином. Элементный микроанализ: Пример 27. Дигидрохлорид (1RS)-N-(3,4-дихлорбензил)-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, заменяя 3,5-дибромбензиламин в этапе А 3,4-дихлорбензиламином. Элементный микроанализ: Пример 28. Тригидрохлорид 2-(1-пиперазинил)-N-(3-пиридилметил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3-пиридилметиламин. Элементный микроанализ: Пример 29. Дигидрохлорид 2-(1-пиперазинил)-N-(2-тиенилметил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 2-тиенилметиламин. Элементный микроанализ: Пример 30. Дигидрохлорид 2-(1-пиперазинил)-N-[4-(трифторметил)бензил]-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 4-(трифторметил)бензиламин. Элементный микроанализ: Пример 31. Дигидрохлорид N-(2-фенэтил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 2-фенэтиламин. Элементный микроанализ: Пример 32. Дигидрохлорид N-(1-нафтилметил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 1-нафтилметиламин. Элементный микроанализ: Пример 33. Дигидрохлорид (1RS)-N-(2,4-дихлорбензил)-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, заменяя 3,5-дибромбензиламин в этапе А 2,4-дихлорбензиламином. Пример 34. Дигидрохлорид (1RS)-(1-пиперазинил)-N-(3-тиенилметил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, заменяя 3,5-дибромбензиламин в этапе А 3-тиенилметиламином. Элементный микроанализ: Пример 35. Дигидрохлорид (1RS)-1-(1-пиперазинил)-N-(2-тиенилметил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, заменяя 3,5-дибромбензиламин в этапе А 2-тиенилметиламином. Элементный микроанализ: Пример 36. Дигидрохлорид (1RS)-N-(3,5-дихлорбензил)-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, заменяя 3,5-дибромбензиламин в этапе А 3,5-дихлорбензиламином. Элементный микроанализ: Пример 37. Дигидрохлорид N-(бифенил-4-илметил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и бифенил-4-илметиламин. Элементный микроанализ: Пример 38. Дигидрохлорид N-(3,5-диметилбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3,5-диметилбензиламин. Элементный микроанализ: Пример 39. Дигидрохлорид N-[(1R)-1-фенэтил]-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и (1R)-1-фенэтиламин. Элементный микроанализ: Пример 40. Дигидрохлорид N-[(1S)-1-фенэтил]-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и (1S)-1-фенэтиламин. Пример 41. Дигидрохлорид (1RS)-N-(2-метоксибензил)-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и 2-метоксибензиламин. Элементный микроанализ: Пример 42. Дигидрохлорид (1RS)-N-(3,5-диметилбензил)-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и 3,5-диметилбензиламин. Элементный микроанализ: Пример 43. Дигидрохлорид 2-(1-пиперазинил)-N-(3-тиенилметил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3-тиенилметиламин. Элементный микроанализ: Пример 44. Дигидрохлорид N-(3,5-дифторбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и3,5-дифторбензиламин. Элементный микроанализ: Пример 45. Дигидрохлорид N-(4-метоксибензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 4-метоксибензиламин. Элементный микроанализ: Пример 46. Дигидрохлорид N-(4-бромбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 4-бромбензиламин. Элементный микроанализ: Пример 47. Дигидрохлорид N-(3-бромбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3-бромбензиламин. Пример 48. Дигидрохлорид N-(4-хлорбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 4-хлорбензиламин. Элементный микроанализ: Пример 49. Дигидрохлорид N-бензил-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и бензиламин. Элементный микроанализ: Пример 50. Дигидрохлорид (1RS)-N-(3,5-дибромбензил)-N-метил-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и N-метил-3,5-дибромбензиламин. Элементный микроанализ:(1RS)-1-[1-(3,5-бис-(трифторметил)бензилоксиметил)индан-1 ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 1 и 3,5-бис-(трифторметил)бензилбромид. Элементный микроанализ: Пример 52. Дигидрохлорид 1-[(1RS)-1-(3,5-дихлорбензилоксиметил)индан-1-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 1 и 3,5-дихлорбензилбромид. Элементный микроанализ: Пример 53. Дигидрохлорид 1-[(1RS)-1-(3-(трифторметил)бензилоксиметил)индан-1-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 1 и 3-(трифторметил)бензилбромид. Элементный микроанализ: Пример 54. Тригидрохлорид 2-(1-пиперазинил)-N-(2-пиридилметил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 2-пиридилметиламин. Пример 55. Тригидрохлорид 2-(1-пиперазинил)-N-(3-пиридилметил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3-пиридилметиламин. Элементный микроанализ: Пример 56. Дигидрохлорид N-(2-бромбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 2-бромбензиламин. Элементный микроанализ: Пример 57. Дигидрохлорид N-(4-фторбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 4-фторбензиламин. Элементный микроанализ: Пример 58. Дигидрохлорид N-(4-метилбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 4-метилбензиламин. Элементный микроанализ: Пример 59. Дигидрохлорид N-(3,5-дибромбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3,5-дибромбензиламин. Элементный микроанализ: Пример 60. Дигидрохлорид N-[3,5-бис-(трифторметил)бензил]-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-метил-3,5-бис-(трифторметил)бензиламин. Элементный микроанализ: Пример 61. Дигидрохлорид 2-(1-пиперазинил)-N-[4-(трифторметил)бензил]-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 4-(трифторметил)бензиламин. Пример 62. Дигидрохлорид N-(2-нафтилметил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 2-нафтилметиламин. Элементный микроанализ: Пример 63. Дигидрохлорид N-(3,5-дифторбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3,5-дифторбензиламин. Элементный микроанализ: Пример 64. Дигидрохлорид (1RS)-1-[1-(3-фтор-5-(трифторметил)бензилоксиметил)индан-1 ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 1 и 3-фтор-5-(трифторметил)бензилбромид. Элементный микроанализ:(1RS)-1-(1-пиперазинил)-N-[3-(трифторметил)бензил]-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и 3-(трифторметил)бензиламин. Элементный микроанализ: Пример 66. Дигидрохлорид (1RS)-1-(1-пиперазинил)-N-метил-N-[3-(трифторметил)бензил]-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и N-метил-3-(трифторметил)бензиламин. Элементный микроанализ:N-(3,5-дихлорбензил)-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-метил-3,5-дихлорбензиламин. Элементный микроанализ:(1RS)-N-(3,5-дифторбензил)-N-метил-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и N-метил-3,5-дифторбензиламин. Элементный микроанализ: Пример 69. Дигидрохлорид (1RS)-N-[3-фтор-5-(трифторметил)бензил]-N-метил-1-(1-пиперазинил)1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и N-метил-3-фтор-5-(трифторметил)бензиламин. Элементный микроанализ: Пример 70. Дигидрохлорид (1RS)-1-[1-(3,5-дифторбензилоксиметил)индан-1-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 1 и 3,5-дифторбензилбромид. Элементный микроанализ:N-(3,5-дибромбензил)-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-метил-3,5-дибромбензиламин. Масс-спектрометрия: ESI: [M+H]+ m/z 506,0. Пример 72. ДигидрохлоридN-[3-(трифторметил)бензил]-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-метил-3-(трифторметил)бензиламина. Масс-спектрометрия: ESI: [M+H]+ m/z 418,2. Пример 73. ДигидрохлоридN-(3,5-дифторбензил)-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-метил-3,5-дифторбензиламин. Масс-спектрометрия: ESI: [M+H]+ m/z 386,2. Пример 74. ДигидрохлоридN-(3,5-диметилбензил)-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-метил-3,5-диметилбензиламин. Масс-спектрометрия: ESI: [M+H]+ m/z 378,3. Пример 75. Тригидрохлорид N-бензил-N-метил-[2-(1-пиперазинил)индан-2-ил]метанамина. Ожидаемый продукт получали в соответствии с процедурой примера 6, используя в качестве исходного соединение примера 7. Масс-спектрометрия: ESI: [M+H]+ m/z 336,2. Пример 76. ДигидрохлоридN-[3-фтор-5-(трифторметил)бензил]-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3-фтор-5-(трифторметил)бензиламин. Элементный микроанализ:N-(3,5-дифторбензил)-N-метил-[2-(1-пиперазинил)индан-2 ил]метанамина. Ожидаемый продукт получали в соответствии с процедурой примера 6, используя в качестве исходного соединение примера 73. Элементный микроанализ:N-3,5-(диметилбензил)-N-метил-[2-(1-пиперазинил)индан-2 ил]метанамина. Ожидаемый продукт получали в соответствии с процедурой примера 6, используя в качестве исходного соединение примера 74. Масс-спектрометрия: ESI: [M+H]+ m/z 364,3. Пример 79. ТригидрохлоридN-(3,5-дихлорбензил)-N-метил-[2-(1-пиперазинил)индан-2 ил]метанамина. Ожидаемый продукт получали в соответствии с процедурой примера 6, используя в качестве исходного соединение примера 67. Масс-спектрометрия: ESI: [M+H]+ m/z 404,2. Пример 80. Дигидрохлорид N-[3-фтор-5-(трифторметил)бензил]-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-метил-3-фтор-5-(трифторметил)бензиламин. Масс-спектрометрия: ESI: [M+H]+ m/z 436,2. Пример 81. Дигидрохлорид N-[3-фтор-5-(трифторметил)бензил]-N-метил-[2-(1-пиперазинил)индан-2-ил]метанамина Ожидаемый продукт получали в соответствии с процедурой примера 6, используя в качестве исходного соединение примера 80. Элементный микроанализ: Пример 82. Дигидрохлорид N-[3-(трифторметил)бензил]-N-метил-[2-(1-пиперазинил)-индан-2 ил]метанамина. Ожидаемый продукт получали в соответствии с процедурой примера 6, используя в качестве исходного соединение примера 72. Элементный микроанализ: Пример 83. Дигидрохлорид N-[3,5-бис-(трифторметил)бензил]-N-метил-(2-(1-пиперазинил)-индан 2-ил]метанамина. Ожидаемый продукт получали в соответствии с процедурой примера 6, используя в качестве исходного соединение примера 60. Элементный микроанализ:(1RS)-N-(3,5-дибромбензил)-N-этил-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и N-этил-3,5-дибромбензиламин.(1RS)-N-(3,5-дихлорбензил)-N-метил-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и N-метил-3,5-дихлорбензиламин. Элементный микроанализ: Пример 86. Дигидрохлорид (1)-N-(3,5-диметилбензил)-1-(1-пиперазинил)-1-инданкарбоксамида. Этап А. Бензил (1)-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоксилат. Ожидаемый продукт представлял собой первый из энантиомеров, полученных путем разделения с помощью хиральной колонки жидкостной хроматографии высокого разрешения соединения, полученного на этапе А примера 1. Этап В. (1)-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоновая кислота. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе F получения 1, используя в качестве исходного соединение этапа А, описанного выше. Этап С. Дигидрохлорид (1)-N-(3,5-диметилбензил)-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение этапа В, описанного выше, и 3,5-диметилбензиламин. Элементный микроанализ: Пример 87. Дигидрохлорид (1)-N-(3,5-диметилбензил)-1-(1-пиперазинил)-1-инданкарбоксамида. Этап А. (1)-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоновая кислота. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе F получения 1, используя в качестве исходного соединения второй из энантиомеров, полученных в результате разделения на этапе А примера 86. Этап В. Дигидрохлорид (1)-N-(3,5-диметилбензил)-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение этапа А, описанного выше, и 3,5-диметилбензиламин. Элементный микроанализ:N-(3,5-дибромбензил)-N-метил-[2-(1-пиперазинил)индан-2 ил]метанамина. Ожидаемый продукт получали в соответствии с процедурой примера 6, используя в качестве исходного соединение примера 71. Масс-спектрометрия: ESI: [M+H]+ m/z 492,1. Пример 89. Дигидрохлорид(1)-N-[(1')-1-(3,5-диметилфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Этап А. (1)-N-[(1RS)-1-(3,5-диметилфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]1-инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, используя в качестве исходного соединение, полученное на этапе В примера 86, и(RS)-1-(3,5-диметилфенил)этиламин. Этап B. (1)-N-[(1')-1-(3,5-диметилфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали путем хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) смеси диастереоизомеров, полученной на этапе А.(1)-N-[(1')-1-(3,5-диметилфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе В, описанном выше. Элементный микроанализ:(1)-N-[(1')-(3,5-диметилфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизомеров, полученных в результате разделения на этапе В примера 89. Элементный микроанализ:(1)-N-1')-1-(3,5-диметилфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Этап А. (1)-N-[(1RS)-1-(3,5-диметилфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, используя в качестве исходного соединение, полученное на этапе А примера 87, и(RS)-1-(3,5-диметилфенил)этиламин. Этап B. (1)-N-[(1')-1-(3,5-Диметилфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали путем хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) смеси диастереоизомеров, полученной на этапе А. Этап С. Дигидрохлорид(1)-N-[(1')-1-(3,5-диметилфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе В, описанном выше. Элементный микроанализ:(1)-N-[(1')-1-(3,5-диметилфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизомеров, полученных в результате разделения на этапе В примера 91. Элементный микроанализ:(1RS)-N-(3,5-диметилбензил)-N-метил-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 1 и N-метил-3,5-диметилбензиламин. Элементный микроанализ:(1)-N-[(1S)-2-гидрокси-1-фенилэтил]-1-(1-пиперазинил)-1 инданкарбоксамида. Этап А. (1RS)-N-[(1S)-2-гидрокси-1-фенилэтил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, используя в качестве исходного соединение получения 1 и (S)-2-фенилглицинол. Этап В. (1)-N-[(1S)-2-Гидрокси-1-фенилэтил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали путем разделения с помощью хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) смеси диастереоизомеров, полученной на этапе А. Этап С. Дигидрохлорид(1)-N-[(1S)-2-гидрокси-1-фенилэтил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе В, описанном выше. Элементный микроанализ:(1)-N-[(1S)-2-гидрокси-1-фенилэтил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизомеров, полученных в результате разделения на этапе В примера 94. Элементный микроанализ:N-[(1R)-1-(3,5-диметилфенил)этил]-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и (R)-1-(3,5-диметилфенил)этиламин. Элементный микроанализ:N-[2-(1-пиперазинил)индан-2-ил]метил-3,5-бис(трифторметил)бензамида. Этап А. 2-Азидометил-2-[4-(трет-бутоксикарбонил)-1-пиперазинил]-2-индан. Ожидаемый продукт получали путем реакции соединения, полученного на этапе А примера 3, с дифенилфосфорилазидом (DPPA) и 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU) в соответствии с процедурой, описанной в J. Org Chem. 1993, 58, 5886-5888, и последующей очистки с помощью хроматографии на кремнеземе (элюент: дихлорметан/этилацетат 98/2). Этап В. 2-Аминометил-2-[4-(трет-бутоксикарбонил)-1-пиперазинил]-2-индан. 2,35 ммоль соединения, полученного на этапе А, описанном выше, растворяли в 80 мл тетрагидрофурана, потом прибавляли 2,59 ммоль трифенилфосфина и перемешивание осуществляли в течение 1/4 ч. После этого прибавляли 10 мл воды и перемешивание проводили в течение 24 ч. После выпаривания растворителей продукт очищали с помощью хроматографии на кремнеземе (элюент: дихлорметан/метанол/аммиак 85/15/1) с получением ожидаемого продукта. Этап С.N-[2-[4-(трет-Бутилоксикарбонил)-1-пиперазинил]индан-2-ил]метил-3,5-бис(трифторметил)бензамид. 2 ммоль амина, полученного на этапе В, описанном выше, растворяли в 15 мл тетрагидрофурана,потом охлаждали до 0 С и по каплям прибавляли раствор 2 ммоль 3,5-бис-(трифторметил)бензоилхлорида в 5 мл тетрагидрофурана. Перемешивание осуществляли в течение 1 ч, выпаривали растворитель, остаток повторно растворяли в метиленхлориде и последовательно промывали раствором бикарбоната натрия, раствором 10% лимонной кислоты, а потом водой. После выпаривания и хроматографии на кремнеземе (элюент: дихлорметан/этилацетат 98/2) восстанавливали ожидаемый продукт.N-[2-(1-пиперазинил)индан-2-ил]метил-3,5-бис-(трифторметил)бензамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе D примера 1, используя в качестве исходного соединение, полученное на этапе С, описанном выше. Элементный микроанализ:N-[(1)-1-(3,5-дибромфенил)этил]-2-(1-пиперазинил)-2 инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и (1)-1-(3,5-дибромфенил)этиламин. Точка плавления: 178-180 С. Пример 99. ДигидрохлоридN-[(1S)-1-(3,5-диметилфенил)этил]-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и (S)-1-(3,5-диметилфенил)этиламина Точка плавления: 175 С. Пример 100. ДигидрохлоридN-[(1)-1-(3,5-дибромфенил)этил]-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и (1)-1-(3,5-дибромфенил)этиламин. Точка плавления: 192-194 С. Пример 101. Дигидрохлорид(1RS)-1-[3,5-бис-(трифторметил)фенил]этиламин превращали в соль при использовании (L)-винной кислоты, полученную таким образом смесь диастереоизомеров разделяли, а потом осуществляли повторное превращение в основание каждого из двух диастереоизомеров. Ожидаемый продукт представлял собой первый из энантиомеров, полученных таким образом. Этап(1RS)-N-[(1')-1-(3,5-бис-(трифторметил)фенил)этил]-1-[4-(третбутилоксикарбонил)-1-пиперазинил]-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, начиная от получения 1 и соединения, полученного на этапе А, описанном выше. Этап С. Дигидрохлорид (1)-N-[(1')-1-(3,5-бис-(трифторметил)фенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1-инданкарбоксамида. Ожидаемый продукт получали путем разделения с помощью хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) смеси диастереоизомеров, полученной на этапе В. Этап D. Дигидрохлорид (1)-N-[(1')-1-(3,5-бис-(трифторметил)фенил)этил]-1-(1-пиперазинил)инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе С, описанном выше. Элементный микроанализ:(1)-N-[(1')-1-(3,5-бис-(трифторметил)фенил)этил]-1-(1 пиперазинил)инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизомеров, полученных в результате разделения на этапе С примера 101. Элементный микроанализ:(1)-N-[(1')-1-(3,5-бис-(трифторметил)фенил)этил]-1-(1 пиперазинил)инданкарбоксамида. Этап A. (1')-1-[3,5-бис-(трифторметил)фенил]этиламин. Ожидаемый продукт представлял собой второй из энантиомеров, полученных на этапе А примера 101. Этап(1RS)-N-[(1')-1-(3,5-бис-(трифторметил)фенил)этил]-1-[4-(третбутилоксикарбонил)-1-пиперазинил]-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, используя в качестве исходного соединение получения 1 и соединение, полученного на этапе А, описанном выше. Этап(1)-N-[(1')-1-(3,5-бис-(трифторметил)фенил)этил]-1-[4-(третбутилоксикарбонил)-1-пиперазинил]-1-инданкарбоксамида. Ожидаемый продукт получали путем разделения с помощью хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) диастереоизомерной смеси, полученной на этапе В. Этап(1)-N-[(1')-1-(3,5-бис-(трифторметил)фенил)этил]-1-(1 пиперазинил)инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе С, описанном выше. Элементный микроанализ:(1)-N-[(1')-1-(3,5-бис-(трифторметил)фенил)этил]-1-(1 пиперазинил)инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизомеров, полученных в результате разделения на этапе С примера 103. Элементный микроанализ: Пример 105. Дигидрохлорид 1-[(1RS)-1-(3-бром-5-фторбензилоксиметил)индан-1-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 1 и 3-бром-5-фторбензилбромид. Элементный микроанализ: Пример 106. Дигидрохлорид 1-[(1RS)-1-(3-хлор-5-фторбензилоксиметил)индан-1-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 1 и 3-хлор-5-фторбензилбромид. Масс-спектрометрия: ESI (H2O/CH3CN): [M+H]+ m/z 375,2 Th. Пример 107. Дигидрохлорид 1-[2-(3,5-дифторбензилоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и 3,5-дифторбензилбромид. Элементный микроанализ: Пример 108. Дигидрохлорид N-[(1S)-1-(3,5-диметилфенил)этил]-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-[(1S)-1-(3,5-диметилфенил)этил]-N-метиламин. Пример 109. Дигидрохлорид N-[(1R)-1-(3,5-диметилфенил)этил]-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-[(1R)-1-(3,5-диметилфенил)этил]-N-метиламин. Элементный микроанализ: Пример 110. Дигидрохлорид 1-[2-(3-бром-5-фторбензилоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и 3-бром-5-фторбензилбромида. Элементный микроанализ:N-[(1R)-1-(3,5-дихлорфенил)этил]-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и (1R)-1-(3,5-дихлорфенил)этиламин. Элементный микроанализ: Пример 112. Дигидрохлорид 1-[2-(3-фтор-5-(трифторметил)бензилоксиметил)индан-2 ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и 3-фтор-5-(трифторметил)бензилбромид. Элементный микроанализ: Пример 113. Дигидрохлорид N-[(1S)-1-(3,5-бис-(трифторметил)фенил)этил]-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и (1S)-1-[3,5-бис-(трифторметил)фенил]этиламин. Элементный микроанализ: Пример 114. Дигидрохлорид 1-[2-(3-хлор-5-фторбензилоксиметил)индан-2-ил]пиперазина. Ожидаемый продукт получали в соответствии с процедурой примера 1, используя в качестве исходного соединение получения 2 и 3-хлор-5-фторбензилбромид. Элементный микроанализ:(1RS)-1-[3,5-дибромфенил]этиламин превращали в соль при использовании (L)-винной кислоты,полученную таким образом смесь диастереоизомеров разделяли, а потом повторно осуществляли превращение до основания каждого из двух диастереоизомеров. Ожидаемый продукт представлял собой первый из полученных таким образом энантиомеров. Этап В. Дигидрохлорид (1RS)-N-[(1')-1-(3,5-дибромфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1 пиперазинил]-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, начиная с получения 1 и соединения, полученного на этапе А, описанном выше. Этап С. Дигидрохлорид (1)-N-[(1')-1-(3,5-дибромфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1 пиперазинил]-1-инданкарбоксамида. Ожидаемый продукт получали путем разделения с помощью хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) смеси диастереоизомеров, полученных на этапе В. Этап(1)-N-[(1')-1-(3,5-дибромфенил)этил]-1-(1-пиперазинил)инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе С, описанном выше. Элементный микроанализ: Пример 116. Дигидрохлорид (1)-N-[(1')-1-(3,5-дибромфенил)этил]-1-(1-пиперазинил)инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизомеров, полученных в результате разделения на этапе С примера 115. Элементный микроанализ:(1)-N-[(1')-1-(3,5-дибромфенил)этил]-1-(1-пиперазинил)инданкарбоксамида. Этап A. (1')-1-[3,5-дибромфенил]этиламин. Ожидаемый продукт представлял собой второй из энантиомеров, полученных на этапе А примера 115. Этап В. Дигидрохлорид (1RS)-N-[(1')-1-(3,5-дибромфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1 пиперазинил]-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, используя в качестве исходного соединение получения 1 и соединение, полученное на этапе А, описанном выше. Этап С. Дигидрохлорид (1)-N-[(1')-1-(3,5-дибромфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1 пиперазинил]-1-инданкарбоксамида. Ожидаемый продукт получали путем разделения с помощью хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) смеси диастереоизомеров, полученной на этапе В. Этап(1)-N-[(1')-1-(3,5-дибромфенил)этил]-1-(1-пиперазинил)инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе С, описанном выше. Элементный микроанализ:(1)-N-[(1')-(3,5-дибромфенил)этил]-1-(1-пиперазинил)инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизомеров, полученных в результате разде- 27010051 ления на этапе С примера 117. Элементный микроанализ: Пример 119. Дигидрохлорид N-[(1)-1-(3,5-дихлорфенил)этил]-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Этап А. N-[(1RS)-1-(3,5-дихлорфенил)этил]-N-метил-2-(1-пиперазинил)-2-инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и N-метил-1-(3,5-дихлорфенил)этиламин. Этап В. N-[(1)-1-(3,5-дихлорфенил)этил]-N-метил-2-(1-пиперазинил)-2-инданкарбоксамид. Соединение, полученное на этапе, описанном выше, разделяли с помощью жидкостной хроматографии высокого разрешения, на хиральной фазе, рацемического соединения, полученного на этапе, описанном выше. Ожидаемый продукт представлял собой первый из энантиомеров, разделенных таким образом. Этап С. ДигидрохлоридN-[(1)-1-(3,5-дхлорфенил)этил]-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали путем превращения соединения, полученного на этапе, описанном выше, в соль при использовании хлористо-водородной кислоты. Элементный микроанализ: Пример 120. Дигидрохлорид N-[(1)-1-(3,5-дихлорфенил)этил]-N-метил-2-(1-пиперазинил)-2 инданкарбоксамида. Второй из энантиомеров, разделенных на этапе В примера 119, превращали в соль при использовании хлористо-водородной кислоты, при этом получали ожидаемый продукт. Элементный микроанализ:N-[(1)-1-(3,5-дифторфенил)этил]-2-(1-пиперазинил)-2 инданкарбоксамида. Этап А. N-[(1RS)-1-(3,5-дифторфенил)этил]-2-(1-пиперазинил)-2-инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 1-(3,5-дифторфенил)этиламин. Этап В. N-[(1)-1-(3,5-дифторфенил)этил]-2-(1-пиперазинил)-2-инданкарбоксамид. Соединение, полученное на этапе, описанном выше, разделяли с помощью жидкостной хроматографии высокого разрешения, на хиральной фазе, рацемического соединения, полученного на этапе, описанном выше. Ожидаемый продукт представлял собой первый из энантиомеров, разделенных таким образом. Этап С. ДигидрохлоридN-[(1)-1-(3,5-дифторфенил)этил]-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали путем превращения соединения, полученного на этапе, описанном выше, в соль при использовании хлористо-водородной кислоты. Элементный микроанализ:N-[(1)-1-(3,5-дифторфенил)этил]-2-(1-пиперазинил)-2 инданкарбоксамида. Второй из энантиомеров, разделенных на этапе В примера 121, превращали в соль при использовании хлористо-водородной кислоты, получая при этом ожидаемый продукт. Пример 123. Дигидрохлорид (1)-N-(1RS)-1-[3,5-бис-(трифторметил)фенил]этил-N-метил-1-(1 пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение,полученное на этапе В примера 86,и Пример 124. Дигидрохлорид (1)-N-(1RS)-1-[3,5-бис-(трифторметил)фенил]этил-N-метил-1-(1 пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение,полученное на этапе А примера 87,и(1)-N-[(1')-1-(3,5-дифторфенил)этил-1-(1-пиперазинил)-1 инданкарбоксамида. Этап А. (1)-N-[(1RS)-1-(3,5-Дифторфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4, используя в качестве исходного соединение, полученное на этапе В примера 86, и (RS)-1-(3,5 дифторфенил)этиламин. Этап В. (1)-N-[(1')-1-(3,5-дифторфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали путем хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) смеси диастереоизомеров, полученной на этапе А. Этап С. Дигидрохлорид (1)-N-[(1')-1-(3,5-дифторфенил)этил]-1-(1-пиперазинил)-1-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе В, описанном выше. Элементный микроанализ:(1)-N-[(1')-1-(3,5-дифторфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из дистереоизомеров, полученных в результате разделения на этапе В примера 125. Элементный микроанализ:- 29010051 Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4,используя в качестве исходного соединение, полученное на этапе А примера 87, и(RS)-1-(3,5-дифторфенил)этиламин. Этап В. (1)-N-[(1')-1-(3,5-дифторфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали путем хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) смеси диастереоизомеров, полученной на этапе А. Этап С. Дигидрохлорид(1)-N-[(1')-1-(3,5-дифторфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе В, описанном выше. Элементный микроанализ:(1)-N-[(1')-1-(3,5-дифторфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединения второй из диастереоизмеров, полученных в результате разделения на этапе В примера 127. Элементный микроанализ: Пример 129. Дигидрохлорид N-(3-хлор-5-фторбензил)-2-(1-пиперазинил)-2-инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и 3-хлор-5-фторбензиламин. Элементный микроанализ:N-[(1S)-1-(3,5-дихлорфенил)этил]-2-(1-пиперазинил)-2 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой примера 4, используя в качестве исходного соединение получения 2 и (1S)-1-[3,5-дихлорфенил]этиламин. Элементный микроанализ:(1)-N-[(1')-1-(3,5-дихлорфенил)этил]-1-(1 пиперазинил)инданкарбоксамида. Этап А. (1)-N-[(1RS)-1-(3,5-Дихлорфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе А примера 4,используя в качестве исходного соединение, полученное на этапе В примера 86, и(RS)-1-(3,5-дихлорфенил)этиламин. Этап В. (1)-N-[(1)-1-(3,5-Дихлорфенил)этил]-1-[4-(трет-бутилоксикарбонил)-1-пиперазинил]-1 инданкарбоксамид. Ожидаемый продукт получали путем хроматографии на кремнеземе (элюент: дихлорметан/этилацетат) смеси диастереоизомеров, полученной на этапе А. Этап С. Дигидрохлорид(1)-N-[(1')-1-(3,5-дихлорфенил)этил]-1-(1-пиперазинил)-1 инданкарбоксамида. Ожидаемый продукт получали в соответствии с процедурой, описанной в этапе В примера 4, используя в качестве исходного соединение, полученное на этапе В, описанном выше.
МПК / Метки
МПК: C07D 295/033, C07D 213/56, A61K 31/495, C07D 333/38, A61P 25/00, A61K 31/496
Метки: получения, фармацевтические, способ, содержащие, соединения, композиции, инданилпиперазина
Код ссылки
<a href="https://eas.patents.su/30-10051-soedineniya-indanilpiperazina-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения инданилпиперазина, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Способ изготовления гнутых металлических профилей и профиль, изготавливаемый данным способом
Следующий патент: Не содержащая желатин мягкая карамель и способ ее получения
Случайный патент: Защитный колпачок шприца