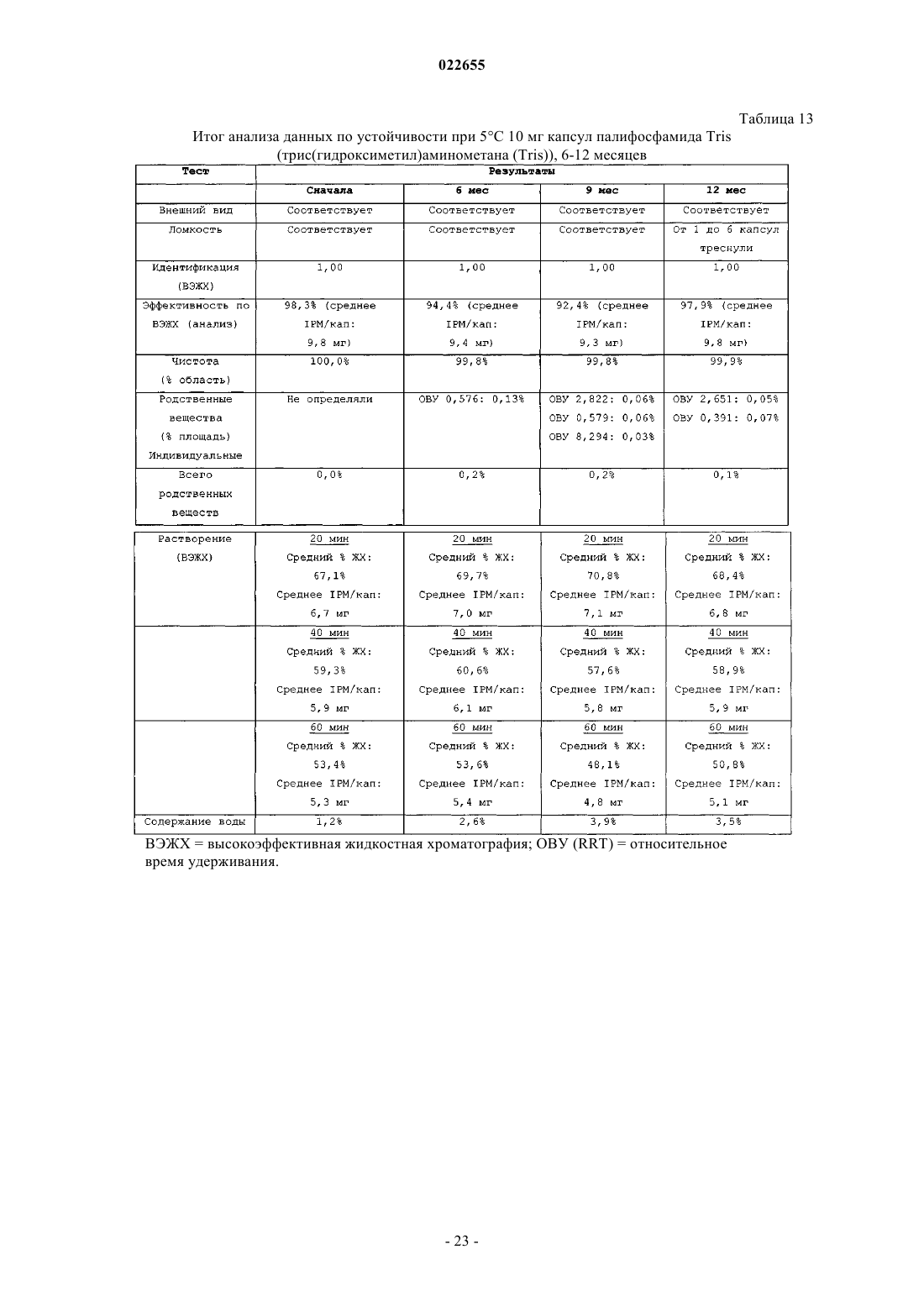
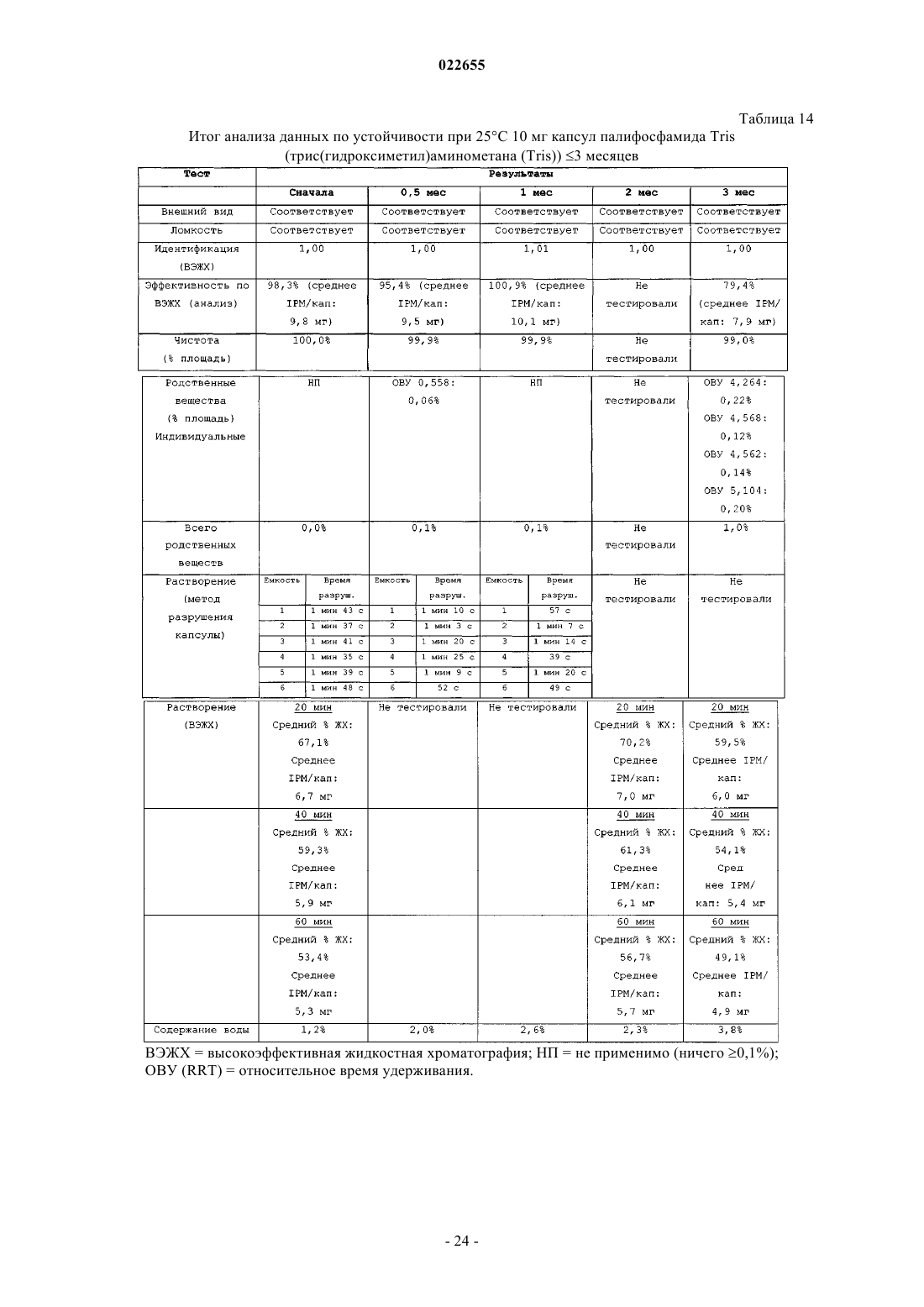
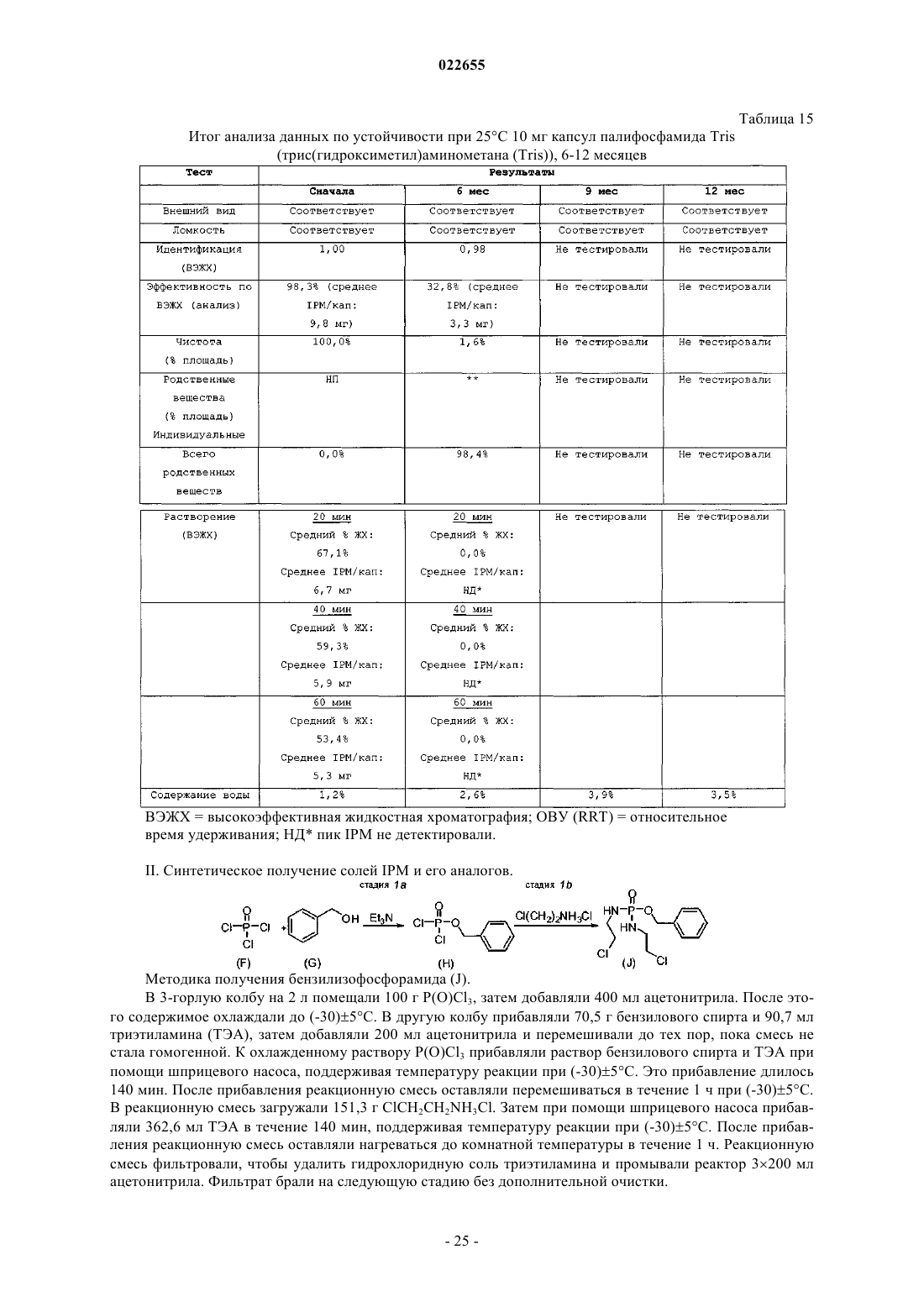
Синтез и составы на основе солей изофосфорамидного иприта и его аналогов
Формула / Реферат
1. Пероральный состав соединения формулы (Е) для лечения состояния, характеризуемого аномальным ростом клеток и/или дифференциацией
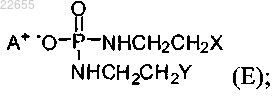
где указанный состав содержит от массы состава
одно или более смазывающих веществ, выбранных из группы, состоящей из 1-5% талька, 0,1-0,5% пирогенной двуокиси кремния, 1-10% крахмала, 0,5-2% силиката кальция, 1-3% карбоната магния (тяжелый), 1-3% оксида магния (тяжелый), 0,2-2% лаурилсульфата магния, 0,2-2% лаурилсульфата натрия, 0,5-4% стеарата кальция, 0,5-2% стеарилфумарата натрия, 2-10% полиэтиленгликоля 4000 и 6000, 2-5% бензоата натрия, 1-3% легкого минерального масла, 1-5% гидрированных растительных масел, 0,25-2% стеариновой кислоты, 0,5-4% глицерилбегената и от 0,25 до около 2% стеарата магния, 5-98% микрокристаллической целлюлозы, 10-90% маннита, вплоть до 98% лактозы и 10-80% гидроксидиоксидооксофосфорана кальция;
один или более разбавитель, выбранный из группы, состоящей из 5-98% микрокристаллической целлюлозы, 10-90% маннита, вплоть до 98% декстрозы, вплоть до 98% глюкозы, вплоть до 98% крахмала и производных, вплоть до 98% карбоната кальция, вплоть до 98% дикальций фосфата, вплоть до 98% карбоната магния, вплоть до 98% лактозы и 10-80% гидроксидиодиоксидооксофосфорана кальция;
одно или более дезинтегрирующее вещество, выбранное из группы, состоящей из 5-90% микрокристаллической целлюлозы, 3-25% крахмала, 2-8% гликолята крахмала натрия, вплоть до 15% карбоксиметилцеллюлозы натрия, менее 5% камеди, 4-6% альгиновой кислоты или альгината натрия и 1-5% кросповидона; и
соединение, в котором
X и Y независимо представляют собой уходящие группы, выбранные из группы, состоящей из галогена и сульфоната; а
А+ представляет собой аммониевый катион,
два или более из смазывающего вещества, разбавителя и дезинтегрирующего вещества могут представлять собой единый компонент; и
соединение формулы (Е) в указанном составе подвергается разложению менее чем на 30% после трех месяцев при 25°С.
2. Пероральный состав по п.1, где соединение формулы (Е) представлено формулой
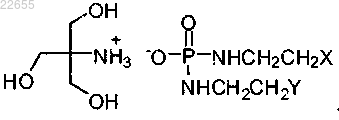
3. Пероральный состав по любому из предшествующих пунктов, где состав содержит по меньшей мере один из следующих разбавителей в указанном количестве (от массы состава): микрокристаллическая целлюлоза - 5-98%, маннит - 10-90%, лактоза - до 98% и гидроксидиоксидооксофосфоран кальция - 10-80%.
4. Пероральный состав по любому из предшествующих пунктов, где состав содержит 80-98% микрокристаллической целлюлозы.
5. Пероральный состав по п.1, где состав содержит 0,25-1% стеарата магния и около 91% микрокристаллической целлюлозы.
6. Пероральный состав по любому из предшествующих пунктов, где состав содержит по меньшей мере один из следующих дезинтегрирующих веществ в указанном количестве (от массы состава): микрокристаллическая целлюлоза - 5-90%, крахмал - 3-25%, гликолят крахмала натрия - 2-8% и карбоксиметилцеллюлоза натрия - до 15%.
7. Пероральный состав по любому из предшествующих пунктов, где состав содержит до 15% карбоксиметилцеллюлозы натрия.
8. Пероральный состав по п.3, где состав содержит в указанном количестве (от массы состава): стеарат магния - 0,25-1%, микрокристаллическая целлюлоза - около 91% и карбоксиметилцеллюлоза натрия - 0,5-2%.
9. Пероральный состав по любому из предшествующих пунктов для использования при лечении состояния, характеризуемого аномальным ростом клеток и/или дифференциацией.
10. Применение соединения формулы (Е)
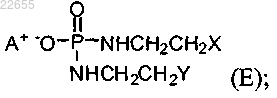
где X и Y независимо представляют собой уходящие группы, выбранные из группы, состоящей из галогена и сульфоната; и А+ представляет собой аммониевый катион,
при получении лекарственного средства для перорального введения для лечения состояния, характеризуемого аномальным ростом клеток и/или дифференциацией, при этом лекарственное средство включает (по весу лекарственного средства)
одно или более смазывающих веществ, выбранных из группы, состоящей из 1-5% талька, 0,1-0,5% пирогенной двуокиси кремния, 1-10% крахмала, 0,5-2% силиката кальция, 1-3% карбоната магния (тяжелый), 1-3% оксида магния (тяжелый), 0,2-2% лаурилсульфата магния, 0,2-2% лаурилсульфата натрия, 0,5-4% стеарата кальция, 0,5-2% стеарилфумарата натрия, 2-10% полиэтиленгликоля 4000 и 6000, 2-5% бензоата натрия, 1-3% легкого минерального масла, 1-5% гидрированных растительных масел, 0,25-2% стеариновой кислоты, 0,5-4% глицерилбегената, от 0,25 до около 2% стеарата магния, 5-98% микрокристаллической целлюлозы, 10-90% маннита, вплоть до 98% лактозы и 10-80% гидроксидиоксидооксофосфорана кальция;
один или более разбавитель, выбранный из группы, состоящей из 5-98% микрокристаллической целлюлозы, 10-90% маннита, вплоть до 98% декстрозы, вплоть до 98% глюкозы, вплоть до 98% крахмала и производных, вплоть до 98% карбоната кальция, вплоть до 98% дикальций фосфата, вплоть до 98% карбоната магния, вплоть до 98% лактозы и 10-80% гидроксидиоксидооксофосфорана кальция;
одно или более дезинтегрирующее вещество, выбранное из группы, состоящей из 5-90% микрокристаллической целлюлозы, 3-25% крахмала, 2-8% гликолята крахмала натрия, вплоть до 15% карбоксиметилцеллюлозы натрия, менее 5% камеди, 4-6% альгиновой кислоты или альгината натрия и 1-5% кросповидона; и
соединение, где соединение формулы (Е) в указанном составе подвергается разложению менее чем на 10% после трех месяцев при 25°С и два или более из смазывающего вещества, разбавителя и дезинтегрирующего вещества могут представлять собой единый компонент.
11. Пероральный состав по п.4, где состав содержит около 91% микрокристаллической целлюлозы.
12. Пероральный состав по п.7, где состав содержит от 0,5-2% карбоксиметилцеллюлозы натрия.
13. Пероральный состав по п.1, где разбавитель и дезинтегрирующее вещество представляют собой микрокристаллическую целлюлозу.
Текст
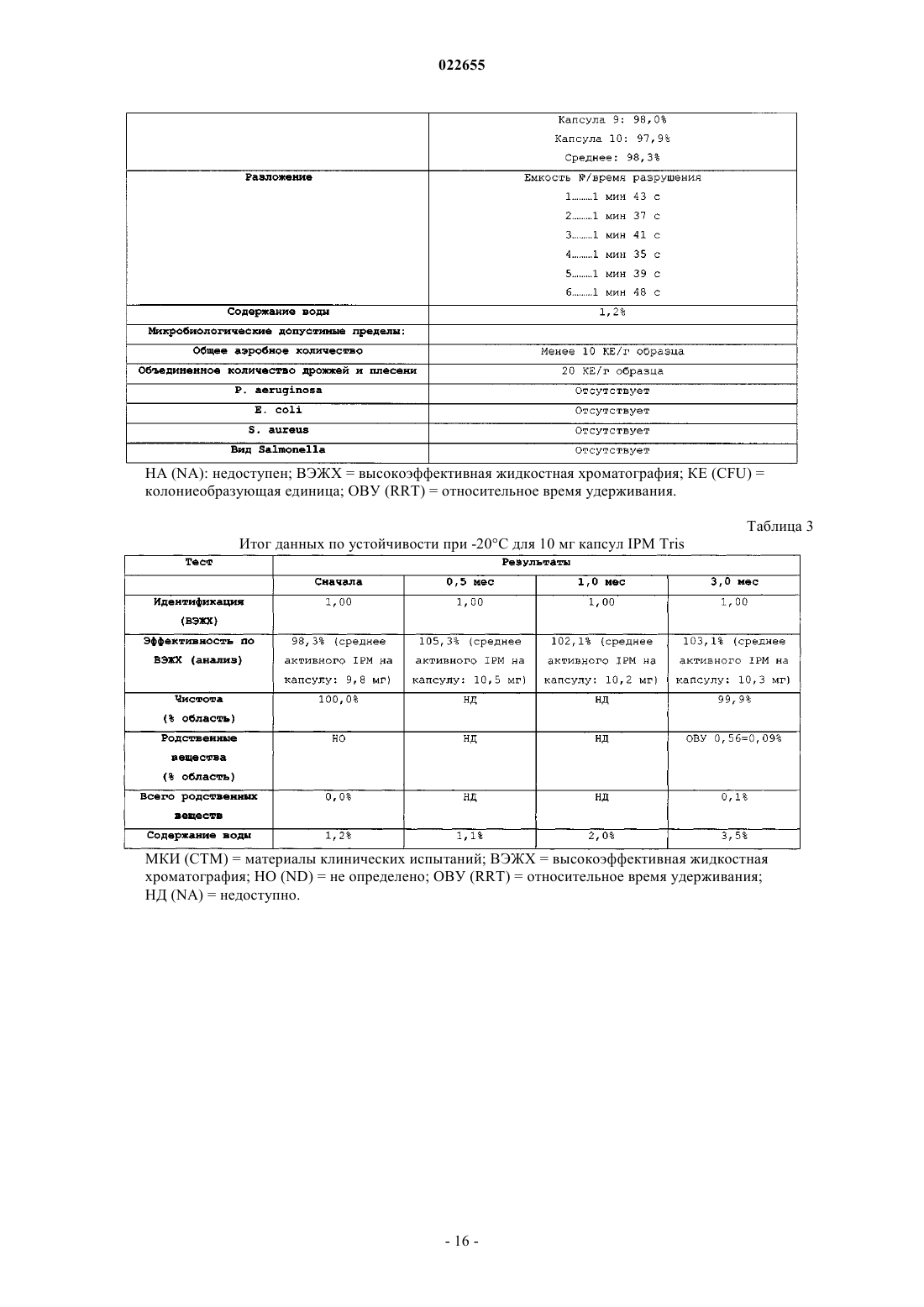
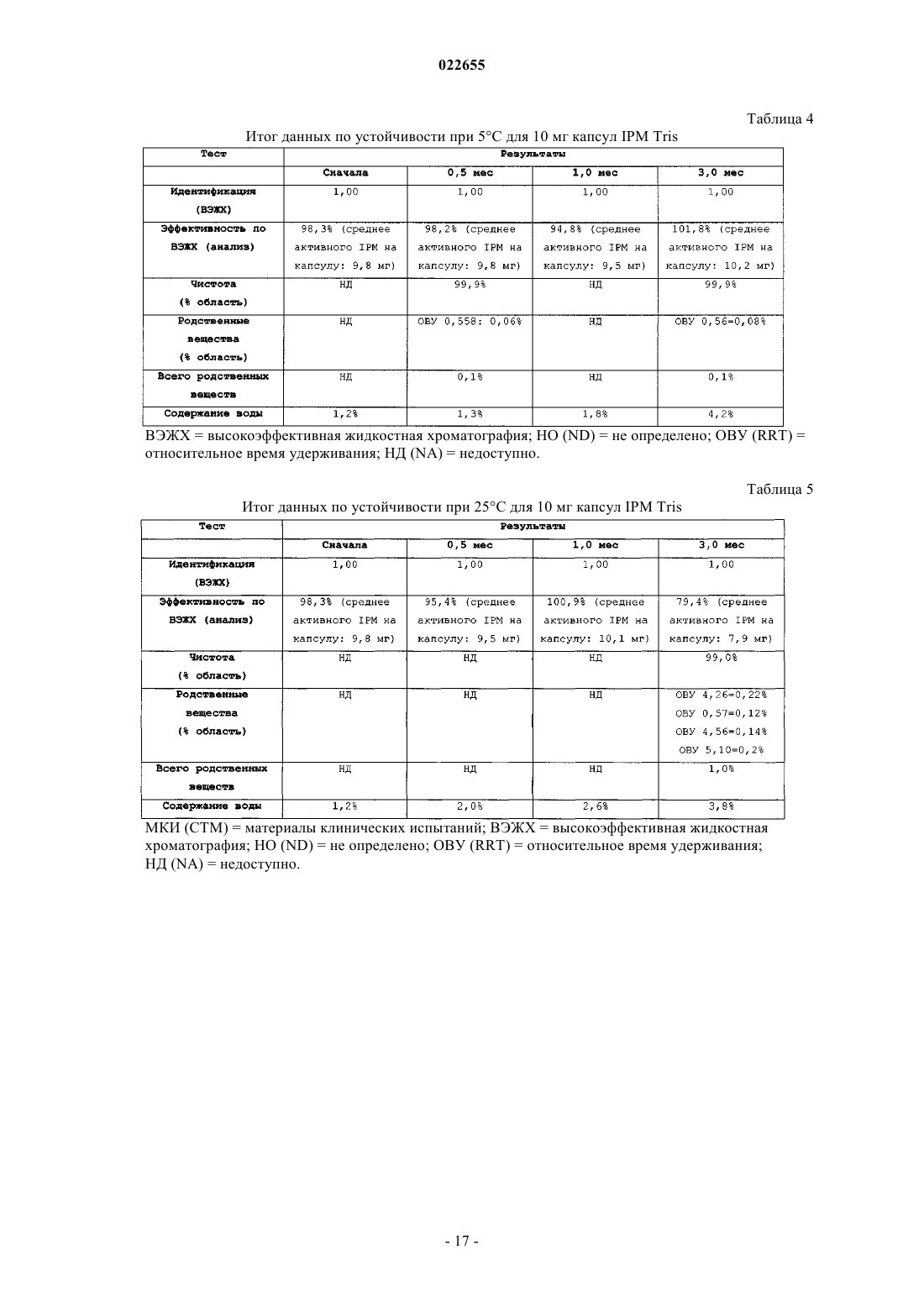
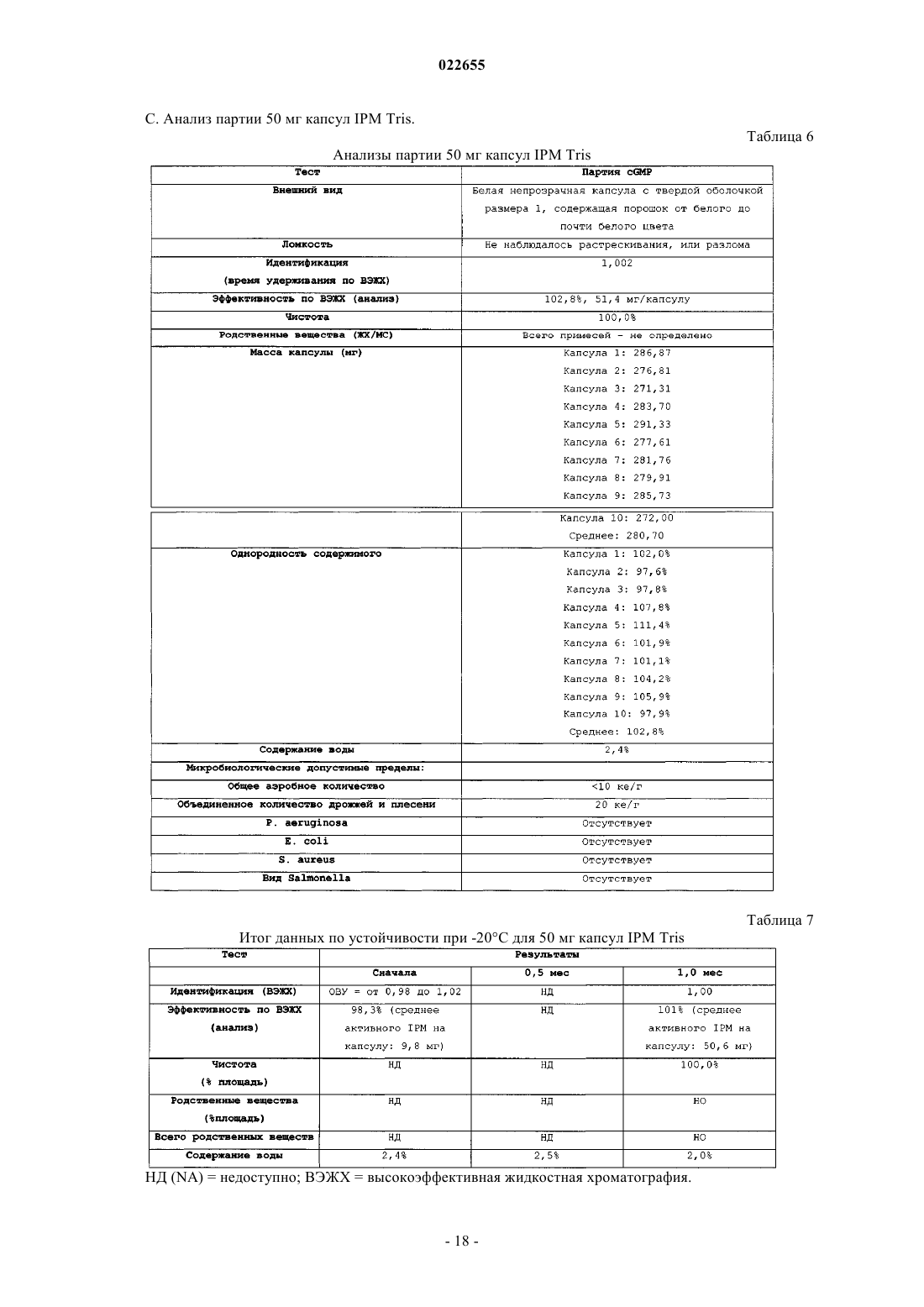
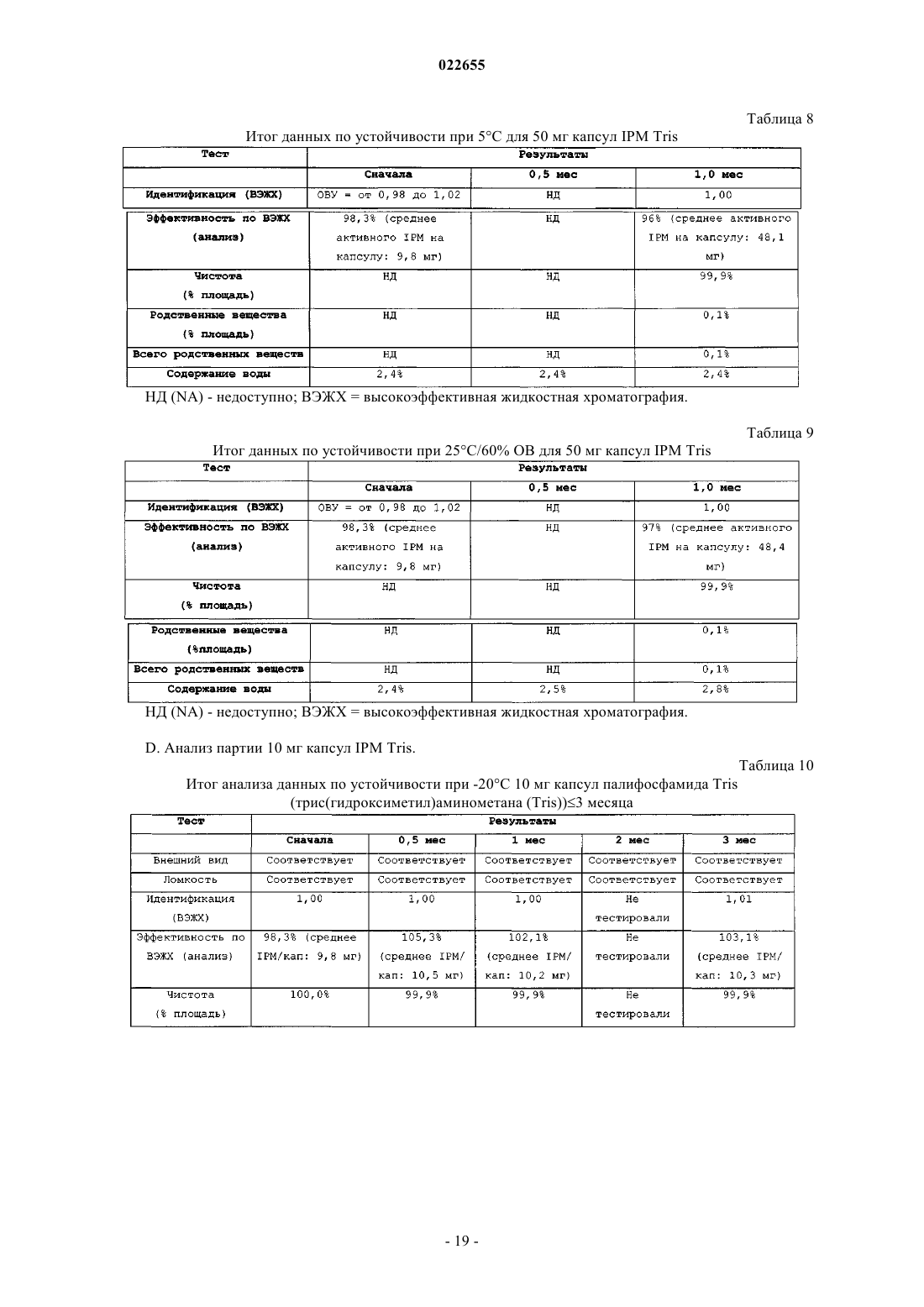
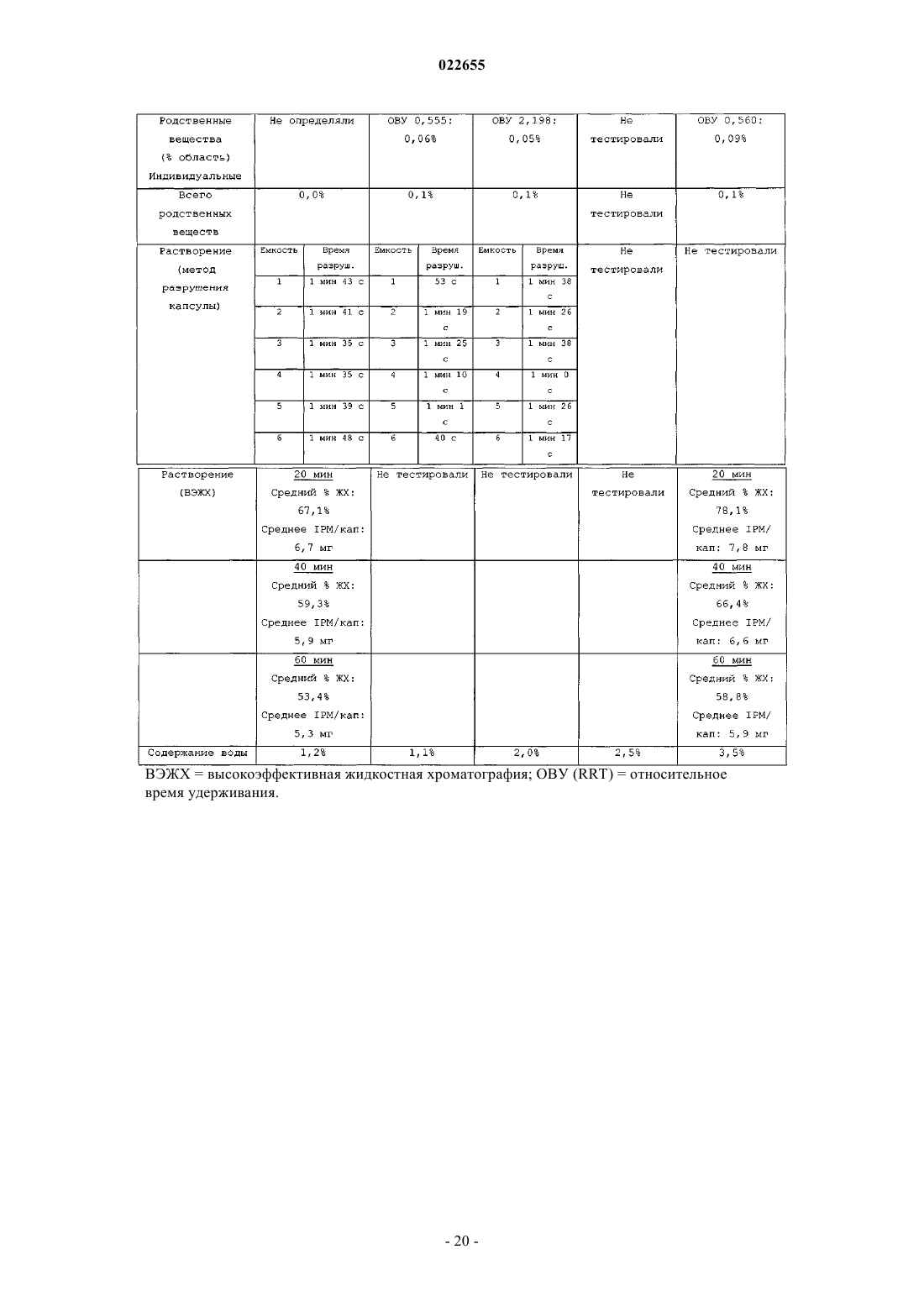
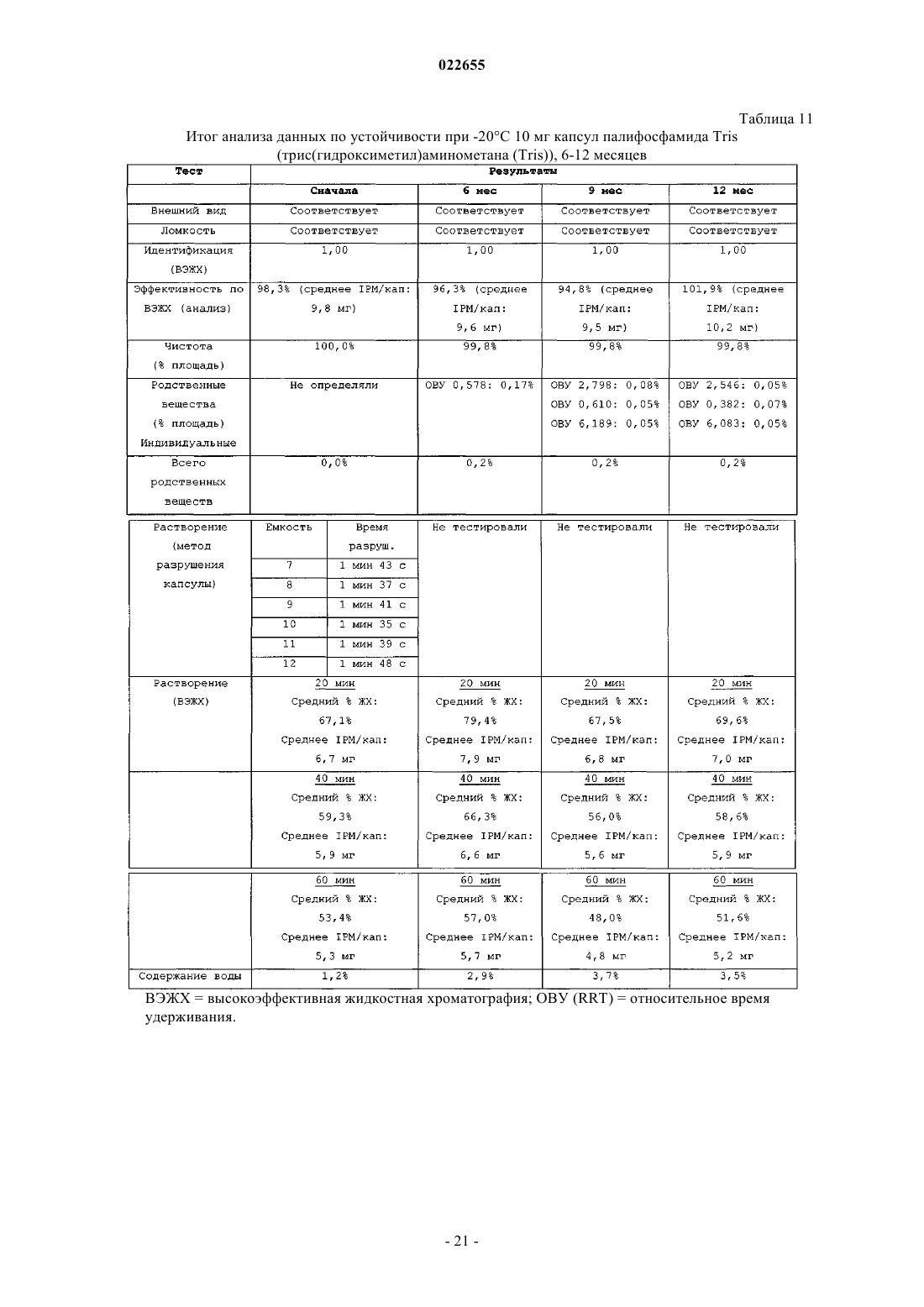
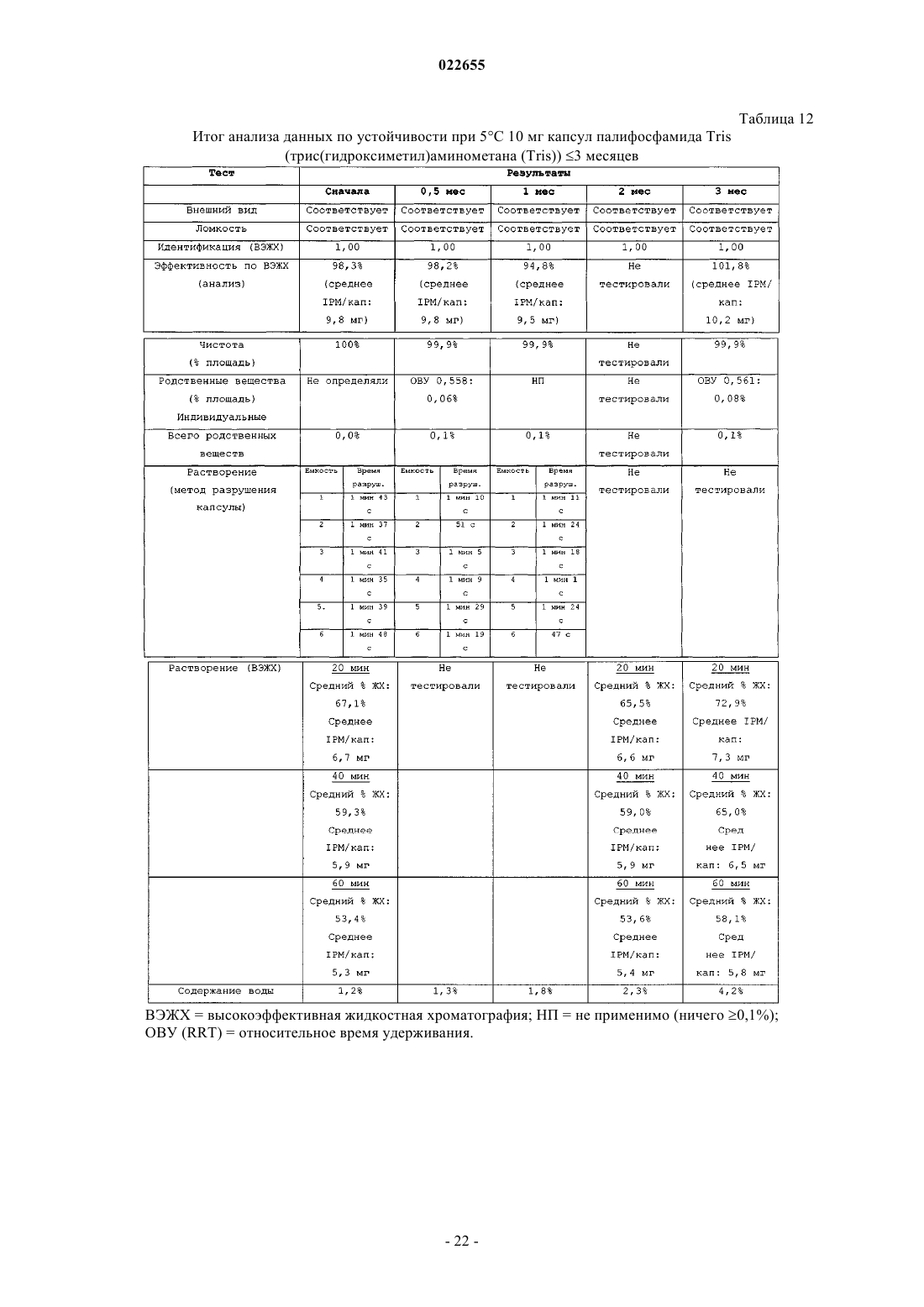
СИНТЕЗ И СОСТАВЫ НА ОСНОВЕ СОЛЕЙ ИЗОФОСФОРАМИДНОГО ИПРИТА И ЕГО АНАЛОГОВ В настоящем описании раскрыт пероральный состав соединения формулы (Е) для лечения состояния, характеризуемого аномальным ростом клеток и/или дифференциацией в котором X и Y независимо представляют собой уходящие группы, выбранные из группы,состоящей из галогена и сульфоната; а А+ представляет собой аммониевый катион; где состав дополнительно включает один или более смазывающих веществ, один или более разбавителей и один или более дезинтегрирующих веществ. Изобретение также относится к применению соединения формулы (Е) при получении лекарственного средства для перорального введения для лечения состояния, характеризуемого аномальным ростом клеток и/или дифференциацией. Перекрестная ссылка на родственные заявки В данной заявке заявлен приоритет предварительной заявки США под серийным номером 61/137538, поданной 31 июля 2008 г., которая включена в настоящий документ посредством ссылки во всей своей полноте. Уровень техники Аутопсия солдат, погибших от иприта во время Первой мировой войны, свидетельствует о том, что сернистый иприт оказывает диспропорционирующее влияние на быстро делящиеся клетки и позволяет предположить, что соединения сернистого иприта могли бы обладать противоопухолевым действием. Действительно, ранние исследователи пытались лечить рак прямой инъекцией сернистого иприта в опухоли. Это исследование было ограничено чрезвычайной токсичностью соединений сернистого иприта, и в качестве менее токсичной альтернативы были исследованы азотистые аналоги иприта, такие как мехлорэтамин. Вследствие недостаточной селективности большинства аналогов мехлорэтамина были исследованы пролекарства, такие как фосфорамидные соединения, которые можно активировать за счет высокой концентрации фосфорамидаз, присутствующих в неопластических клетках. Два фосфорамидных алкилирующих агента, циклофосфамид (СРА) и изомерное соединение ифосфамид (IFOS), показали эффективность при лечении широкого ряда солидных опухолей и гематологических видов рака (Zhang et al., Current Drug Therapy 1:55-84 (2006. СРА и IFOS использовали и как отдельные агенты, и в сочетании с другими противораковыми агентами для получения синергетического противоопухолевого действия. Помимо его применения в случае рака, СРА можно также использовать в качестве иммуносуппрессанта для лечения аутоиммунных заболеваний, таких как ревматоидный артрит и системная красная волчанка(2006. СРА и IFOS представляют собой пролекарства, которые активируются внутриклеточно путем 4 гидроксилирования цитохром (CYP) P450 оксидаз, главным образом CYP3A4, CYP2C9 и CYP2B6 в печени, с образованием цитотоксических азотистых ипритов, способных взаимодействовать с ДНК. Побочным продуктом данной реакции является акролеин. Метаболизм СРА и IFOS in vivo включает также дезактивацию за счет N-дехлорэтилирования под действием CYP3A4/5 и CYP2B6 перед их превращением в азотистые иприты, что приводит к образованию дехлорэтилированных метаболитов и побочного продукта хлорацетальдегида (САА). Акролеин и САА вносят вклад в токсичность СРА и IFOS, не связанную с цитотоксическим механизмом действия молекул азотистого иприта (Zhang et al., Current DrugTherapy 1:55-84 (2006. Акролеин вызывает уротоксичность, геморрагический цистит и поражение печени, а САА вызывает нейротоксичность и также влечет за собой почечную токсичность. Совместное введение сульфгидрильных соединений, месны и амифостина, которые специфически взаимодействуют с акролеином в мочевых путях, может снизить уротоксичность акролеина, но не устранит других видов токсичности (Zaki et al., Toxicol. In Vitro 17: 397-402 (2003. Азотистые иприты СРА и IFOS, фосфорамидный иприт и изофосфорамидный иприт представляют собой бифункциональные алкилирующие агенты, ковалентно связывающиеся с нуклеофильными группами нуклеиновых кислот. При рН 7 иприты дехлорируются, образуя карбониевые ионы, которые ковалентно связываются с N7 гуаниновыми остатками. Данную реакцию называют алкилированием ДНК. И меж-, и внутрицепочечные перекрестные связи возникают вследствие способности каждой молекулы иприта взаимодействовать с двумя гуаниновыми остатками (Zhang et al., Current Drug Therapy 1:55-84(2006. Поскольку межцепочечные перекрестные связи предотвращают разделение цепочек, необходимое для репликации ДНК, алкилирование ДНК считается основным механизмом, ответственным за ингибирование деления клеток под действием СРА и IFOS. Помимо антипролиферативного (цитостатического) влияния, повреждение ДНК также вызывает апоптоз, то есть запрограммированную гибель клетки(О'Conner et al., Cancer Res. 1: 6550-6557; (1991); Bahtia et al., Clin. Cancer Res. 1: 873-880 (1995. Цитотоксическое/цитостатическое действие азотистых ипритов, в основном, ответственно за противоопухолевую активность СРА и IFOS и за счет предотвращения пролиферативного распространения лимфоцитов также за иммуносуппрессантную активность СРП при аутоиммунном заболевании. Однако перекрестное связывание ДНК азотистыми ипритами в нормальных тканях также вызывает цитотоксическое, основан-1 022655 ное на механизме сопутствующее поражение, в частности миелосуппрессию, приводящую к лейкоцитопении, которая является основной доза-лимитирующей гематологической токсичностью (Zhang et al.,Current Drug Therapy 1:55-84 (2006. Несмотря на то, что фосфорамидный иприт и изофосфорамид химически похожи, изофосфорамидный иприт взаимодействует с ДНК с большим сродством, чем фосфорамидный иприт (Boal et al., J. Med.Chem. 32: 1768-1773; 1989). По-видимому, структурные различия, включающие внутримолекулярные расстояния между хлорэтильными группами и их ориентацию, ответственны за различное сродство двух ипритов (Springer et al., J. Org. Chem. 63: 7218-7222 (1998. При введении цитотоксических азотистых ипритов непосредственно раковым пациентам можно снизить внецелевую токсичность и резистентность к лекарственному средству, связанную с лекарственным средством. Синтезировали IPM и провели предварительную биологическую оценку данного соединения, но, к сожалению, сам IPM неустойчив и сложен для непосредственного применения для лечения людей. Стабилизированные составы IPM могли бы дополнительно снизить токсичность и дать возможность регулярно вводить дозы, достаточные как для непосредственной цитотоксичности в отношении опухоли, так и антиангиогенной активности. Необходимы улучшенные способы для составления составов и получения IPM и аналогов и их солей. Сущность изобретения В данном изобретении описаны фармацевтические составы на основе солей изофосфорамидного иприта (IPM) и их аналогов, а также способы синтеза IPM и их солей и аналогов. Соли и аналоги IPM согласно данному изобретению включают соединения формулы (Е) в которой X и Y независимо представляют собой уходящие группы, а А+ представляет собой аммониевый катион. В некоторых вариантах осуществления изобретение относится к фармацевтическим составам,включающим соединение формулы (Е) и один или более фармацевтически приемлемых носителей. Кроме того, описаны способы получения подобных соединений и составов. Подробное описание Описание относится к фармацевтическим составам на основе солей изофосфорамидного иприта(IPM) и его аналогов, а также способам синтеза IPM и его солей и аналогов. Соли и аналоги IPM согласно данному изобретению включают соединения формулы (Е) в которой X и Y независимо представляют собой уходящие группы, такие как Cl, Br, I, или сульфонат,например толуолсульфонат, метансульфонат, 2,4,6-триизопропилбензолсульфонат или 2,4,6-триметилбензолсульфонат, а А+ представляет собой аммониевый катион. Соединения, описанные в заявке США 11/257766, поданной 25 октября 2005 г., применимы в композициях и способах изобретения и включены здесь ссылкой. Составы по изобретению включают соли и аналоги IPM наряду со смазывающим веществом, разбавителем и дезинтегрирующим веществом. Кроме того, составы изобретения могут содержать дополнительные эксципиенты, такие как связывающее вещество и наполнитель сжатия. Раскрытие относится также к синтетическому получению солей и аналогов IPM.I. Соли IPM и аналоги IPM. Описанные здесь составы включают IPM и аналоги IPM, составленные с одним или более эквивалентами основания. В некоторых вариантах осуществления описанные соединения представляют собой соли изофосфорамидного иприта или аналогов изофосфорамидного иприта, содержащие один или более катионов. В одном из вариантов осуществления катионы могут представлять собой сопряженную кислоту основания амина или могут являться четвертичным аммониевым катионом. Подходящие противоионы для изофосфорамида и его аналогов включают сопряженные кислоты (как использовано здесь, термины,относящиеся к аминам, следует понимать как включающие их сопряженные кислоты, если в контексте не указано, что подразумевается свободный амин) оснований, включающих основные аминокислоты,алифатические амины, гетероциклические амины, ароматические амины, пиридины, гуанидины и амидины. В некоторых вариантах осуществления группу А формулы (Е) выбирают из первичного, вторичного или третичного амина. Например, в некоторых вариантах осуществления группа А формулы (Е) представляет собой по меньшей мере один первичный амин, такой как лизин, аргинин, аланин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин,глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, серин, треонин, триптофан, тирозин, валин, 2-аминоэтанол или три(гидроксиметил)аминометан. В некоторых вариантах осуществления А формулы (Е) представляет собой по меньшей мере один вторичный амин, такой как диэтиламин, 2(метиламино)этанол, азиридин, азетидин, пирролидин и пиперидин. В некоторых вариантах осуществления А формулы (Е) представляет собой по меньшей мере один третичный амин, такой как триэтиламин,триметиламин, N,N-диизопропилэтиламин и 2-(диметиламино)этанол. Использованные здесь первичные, вторичные и третичные амины относятся к количеству непосредственных одинарных связей между атомом(атомами) азота и углерода, при этом остаток от трех валентностей нейтрального амина заполнен атомами водорода. У первичного амина есть лишь одна непосредственная связь между атомом азота и углерода, тогда как вторичный амин связан одинарной связью точно с двумя атомами углерода, третичный амин связан одинарной связью точно с тремя атомами углерода. У четвертичных аммониевых катионов имеется четыре одинарных связи с атомами углерода, при этом четвертая связь включает неподеленную электронную пару атома азота, а также три валентности,обычно присутствующие в первичных, вторичных и третичных аминах. Соответственно, как подразумевает название, подобные частицы несут на себе положительный заряд. Чтобы классифицировать молекулу в рамках конкретного типа амина, например первичного, вторичного или третичного амина, молекула должна содержать по меньшей мере один атом азота с указанным образцом связывания с атомом(атомами) углерода. Например, первичный амин включает по меньшей мере один атом азота, который связан одинарной связью точно с одним атомом углерода. Однако молекула может включать более одного типа амина, например 2-аминопиперидин включает и первичную, и вторичную аминную функциональную группу. В некоторых вариантах осуществления амин представляет собой алифатический амин, такой как ациклический алифатический амин. В некоторых вариантах осуществления амин представляет собой ациклический алифатический амин, например амин, имеющий 2-3 алкильных заместителя с разветвленной или линейной цепью. В некоторых вариантах осуществления каждый алкильный заместитель с разветвленной или линейной цепью представляет собой С 3-С 10 алкиламин, такой как С 3-С 5 алкиламин. В некоторых вариантах осуществления один или более из алкильных заместителей с разветвленной или линейной цепью необязательно замещены, например, одним или более гидроксильными заместителями,например 1, 2, 3 или 4 гидроксильными заместителями. Примеры аминов (и соответствующих им аммониевых ионов) для использования в составах и способах включают пиридин, N,N-диметиламинопиридин, диазабициклононан, диазабициклоундецен, Nметил-N-этиламин, диэтиламин, триэтиламин, N,N-диизопропилэтиламин, моно-, бис- или трис-(2 гидроксиэтил)амин, 2-гидрокситретбутиламин, трис(гидроксиметил)метиламин, N,N-диметил-N-(2 гидроксиэтил)амин, три-(2-гидроксиэтил)амин и N-метил-D-глюкамин. В следующем аспекте соли, описанные выше в формуле (Е), могут включать вторичную аминную или аммониевую группу. В некоторых вариантах осуществления описанные здесь соединения включают более одного эквивалента амина для каждого эквивалента изофосфорамидного иприта или аналога изофосфорамидного иприта. Подобные варианты осуществления включают варианты, имеющие не целые соотношения амина и изофосфорамидного иприта, или аналогов изофосфорамидного иприта. В некоторых вариантах осуществления соединения имеют соотношение амина и изофосфорамидного иприта или аналога изофосфорамидного иприта, составляющее два к одному или три к одному. В рабочих вариантах осуществления получали соли, содержащие 2 экв. основания амина на 1 экв. изофосфорамидного иприта. В некоторых вариантах осуществления, основание амина, используемое для получения солей изофосфорамидного иприта и аналога изофосфорамидного иприта, включает более одной аминогруппы; подобные основания можно назвать "полиосновными". Более конкретно, некоторые примеры полиосновных оснований, которые можно использовать, содержат две аминогруппы; подобные соединения можно назвать"двухосновными". Например, одна подходящая двухосновная молекула представляет собой N,Nдиметиламинопиридин, содержащий две основных аминогруппы. В конкретном варианте осуществления описанного здесь соединения соединение включает изофосфорамидный иприт или аналог изофосфорамидного иприта и 1 экв. двухосновного амина. В одном из вариантов осуществления описанные соединения включают одно или более цвиттерионных оснований. Примеры подобных оснований включают основные аминокислоты, которые являются цвиттер-ионными при физиологическом значении рН. Как использовано в настоящем описании, "алифатический амин" относится к соединению формулыNR1R2R3, в котором по меньшей мере один из R1, R2 или R3 представляет собой алифатическую группу. Термин "ациклический алифатический амин" относится к описанному выше алифатическому амину, в котором по меньшей мере одна, а предпочтительно все алифатические группы являются ациклическими. Термин "гетероциклический амин" относится к соединению формулы NR1R2R3, в котором по меньшей мере один из R1, R2 или R3 представляет собой гетероциклическую группу, или R1, R2 и/или R3 вместе с общим для них атомом азота образуют цикл. Термин "уходящая группа" относится к группе, которая может быть замещена нуклеофилом. Обращаясь к описанным здесь соединениям, уходящая группа относится к группе, которая может быть замещена с образованием азиридиниевого промежуточного соединения, или может быть непосредственно замещена биомолекулярным нуклеофилом, таким как нуклеофил нуклеиновой кислоты, с образованием,например, 7-алкилированной гуанидиниевой частицы. Примеры подходящих уходящих групп включают галогены и сульфонаты (-SO2R). В некоторых вариантах осуществления для описанных здесь солей изофосфорамидных аналогов соединение представляет собой соединение со "смешанной" уходящей группой, включая два различных типа уходящих групп, например галоген и сульфонат, или два разных галогена, таких как бромид и хлорид. В патенте США 6197760, выданном Struck, обучают способам получения подобных соединений со смешанными уходящими группами.II. Составы на основе солей IPM и их аналогов. Один из аспектов описания включает фармацевтические составы, такие как пероральная дозированная форма, приготовленная для введения субъекту, которая включает терапевтически эффективное количество одной или более солей IPM и его аналогов, описанных здесь или где-либо еще. Указанный состав может иметь форму пилюли, таблетки или капсулы, предназначенной для перорального введения. В некоторых вариантах осуществления состав имеет форму капсулы для перорального введения. В некоторых вариантах осуществления состав содержит смазывающее вещество, разбавитель и дезинтегрирующее вещество, в дополнение, например, в виде смеси с солью IPM, или его аналогом. Состав может включать, например, 0,25-5% смазывающего вещества, до 98% разбавителя, например от 80 до 98%, например от 85 до 95%, например около 90% разбавителя, и до 90% дезинтегрирующего вещества,например от 0,5 до 10%, например от 0,5 до 5%, например около 1% дезинтегрирующего вещества от массы состава. Кроме того, состав может включать один или более разбавителей, дезинтегрирующих агентов или смазывающих веществ и дополнительных носителей. В некоторых вариантах осуществления пероральная дозированная форма содержит от 1 до 250 мг соединения формулы (Е), например от около 1 до около 100 мг или от около 10 до около 50 мг. В некоторых вариантах осуществления состав содержит 5-25 мг соединения формулы (Е), например около 5,около 7,5, около 10, около 12, около 15, около 20 и около 25 мг. В некоторых вариантах осуществления соединение формулы (Е) представляет собой соль трис(гидроксиметил)аминометана (Tris) в которой X и Y независимо выбирают из уходящих групп, таких как Cl, Br или I, или сульфоната, например толуолсульфоната, метансульфоната, 2,4,6-триизопропилбензолсульфоната или 2,4,6-триметилбензолсульфоната. В некоторых вариантах осуществления смазывающее вещество состава можно выбрать из одного или более из талька, пирогенной двуокиси кремния, такой как Aerosil, Cab-O-Sil или Syloid; крахмала; силиката кальция; карбоната магния (тяжелого); оксида магния (тяжелого); лаурилсульфата магния, лаурилсульфата натрия, стеарата кальция, стеарилфумарата натрия, полиэтиленгликоля 4000 и 6000, бензоата натрия, легкого минерального масла, гидрированных растительных масел, стеариновой кислоты или глицерилбегената. В некоторых вариантах осуществления смазывающее вещество состава включает соль жирной кислоты, такой как соль длинноцепочечной, например, С 10-С 24 насыщенной или ненасыщенной жирной кислоты. В некоторых вариантах осуществления соль жирной кислоты представляет собой соль металла, такую как магниевая соль жирной кислоты, например стеарат магния. В некоторых вариантах осуществления смазывающее вещество состава включает эфир длинноцепочечной жирной кислоты, такой как стеарилфумарат натрия. В других вариантах осуществления смазывающее вещество состава включает смесь глицеридов жирных кислот, таких как глицерилбегенат. Состав может включать по меньшей мере одно из следующих смазывающих веществ в указанном количестве (от массы состава): В некоторых вариантах осуществления состав содержит стеарат магния в количестве (от массы состава), выбранном из интервала от 0,25 до 2%, или от 0,25 до 1%, или около 0,5%. Капсульный состав может включать разбавитель, выбранный из любого одного или более из лактозы, микрокристаллической целлюлозы, маннита, гидроксидиоксидооксофосфорана кальция, декстрозы,глюкозы, сахарозы, крахмала и производных, карбоната кальция, дикальций фосфата и карбоната магния. В некоторых вариантах осуществления разбавитель выбирают из микрокристаллической целлюлозы, маннита, лактозы и гидроксидиодиоксидооксофосфорана кальция. В некоторых вариантах осуществления разбавитель представляет собой микрокристаллическую целлюлозу. В некоторых вариантах осуществления разбавитель включает углевод, такой как сахар или сахарные спирты (например, лактоза, моногидрат -лактозы, сахароза, маннит или сорбит), или полимер целлюлозы, такой как микрокристаллическая целлюлоза, силикатированная микрокристаллическая целлюлоза или порошкообразная целлюлоза. Состав может содержать по меньшей мере один разбавитель в количестве до 98% от массы состава,например около 50-85% или около 50-75%. В некоторых примерах вариантов осуществления состав содержит один или более и числа следующих разбавителей в указанном количестве от массы состава: В некоторых вариантах осуществления состав содержит 85-95% микрокристаллической целлюлозы. Состав может содержать 88-92% микрокристаллической целлюлозы, например около 91% микрокристаллической целлюлозы. В примерах вариантов осуществления состав содержит 0,25-1% стеарата магния и около 91% микрокристаллической целлюлозы. В некоторых конкретных вариантах осуществления состав содержит около 91% микрокристаллической целлюлозы и около 0,5% стеарата магния. Состав может содержать по меньшей мере одно дезинтегрирующее вещество, например водорастворимый полимер, предпочтительно анионный водорастворимый полимер, такой как целлюлоза, или ее производное, или ее соль. В различных вариантах осуществления дезинтегрирующее вещество можно выбрать из любого одного или более из крахмала, микрокристаллической целлюлозы, нерастворимых ионообменных смол, гликолята крахмала натрия, карбоксиметилцеллюлозы натрия, камедей, таких как агар-агар, гуар и ксантан, альгиновой кислоты, альгината натрия и повидона. В некоторых вариантах осуществления дезинтегрирующее вещество включает соль целлюлозы или ее производное. Производные целлюлозы включают молекулы, в которых одна или более гидроксильных функциональных групп целлюлозы связаны с атомами, или группами атомов, отличающимися от водорода. Например, дезинтегрирующее вещество может включать карбоксиметилцеллюлозу (CMC) (например, производное целлюлозы с карбоксиметильными группами (-СН 2-СООН), связанными с некоторыми из гидроксильных групп глюкопиранозных мономеров, составляющих структуру целлюлозы), или ее анионную форму. В некоторых вариантах осуществления дезинтегрирующее вещество представляет собой или включает карбоксиметилцеллюлозу натрия, которая необязательно может быть сшитой. Предпочтительно дезинтегрирующее вещество выбирают таким образом, чтобы состав распадался в желудке менее чем за 30 мин, например менее чем за 15 мин или даже менее чем за 10 мин. Состав может содержать по меньшей мере одно дезинтегрирующее вещество в количестве до 90% от массы состава. В некоторых примерах вариантов осуществления состав содержит одно из следующих дезинтегрирующих веществ в указанном количестве от массы состава: В некоторых вариантах осуществления дезинтегрирующее вещество представляет собой карбоксиметилцеллюлозу натрия. Состав может содержать 0,5-2% карбоксиметилцеллюлозы натрия. В некоторых вариантах осуществления состав содержит около 1% карбоксиметилцеллюлозы натрия. В некоторых вариантах осуществления состав содержит 0,5-2,0% карбоксиметилцеллюлозы натрия, 0,25-1% стеарата магния, по меньшей мере около 90% микрокристаллической целлюлозы и 5-9% соединения формулы (Е). В примерах вариантов осуществления состав содержит около 1% карбоксиметилцеллюлозы натрия, около 91% микрокристаллической целлюлозы, около 0,5% стеарата магния и около 15 мг соединения формулы (Е) в которой X и Y представляют собой уходящие группы, такие как Br, Cl или I. В примере варианта осуществления соединение формулы (Е) представляет собой Состав может дополнительно включать один или более дополнительных носителей, таких как связывающее вещество, в количестве 3-90% и наполнитель сжатия в количестве до 98%. Кроме того, состав может содержать носитель, выбранный из второго разбавителя, второго дезинтегрирующего вещества и второго смазывающего вещества. Другие фармацевтически приемлемые носители, приемлемые для данных составов, являются стандартными. В Remington's Pharmaceutical Sciences, E.W. Martin, Mack Publishing Co., Easton, PA, 19th Edition (1995) описаны составы, подходящие для фармацевтической доставки описанных здесь соединений. В некоторых вариантах осуществления состав содержит компонент, осуществляющий функцию двух или более из смазывающего вещества, разбавителя и дезинтегрирующего вещества, например, действующего в качестве как смазывающего вещества, так и дезинтегрирующего вещества. Например, состав может содержать микрокристаллическую целлюлозу в качестве и разбавителя, и дезинтегрирующего вещества. В некоторых из таких вариантов осуществления в составе может быть, а может не быть один или более дополнительных разбавителей и/или дезинтегрирующих веществ, и/или многофункциональный компонент присутствует в количестве, равном количествам всех компонентов, функции которых он выполняет. В некоторых вариантах осуществления один компонент состава может выступать в качестве всех трех из разбавителя, смазывающего вещества и дезинтегрирующего вещества. В некоторых вариантах осуществления каждый из смазывающего вещества, разбавителя и дезинтегрирующего вещества представляет собой соединения, отличающиеся друг от друга. Фармацевтические составы могут также включать один или более дополнительных активных ингредиентов, таких как антимикробные средства, противовоспалительные средства, анестетики и так далее. В одном из аспектов на основе некоторых вариантов осуществления фармацевтических составов получены разовые дозированные формы. Например, подобные разовые дозированные формы могут содержать от около 1 до около 250 мг, например от около 5 до около 100 мг, например от около 5 до около 50 мг, например около 5, около 10, около 15, около 20, около 25, около 30, около 35, около 40, около 45 или около 50 мг описанной соли изофосфорамидного иприта или его аналога на разовую дозу. В некоторых вариантах осуществления описанные здесь составы солей IPM или его аналогов устойчивы при комнатной температуре по меньшей мере в течение двух недель, по меньшей мере в течение одного месяца, по меньшей мере в течение двух месяцев при 5 С, по меньшей мере в течение трех месяцев при 5 С, по меньшей мере в течение шести месяцев при 5 С, по меньшей мере в течение 9 месяцев при 5 С, по меньшей мере в течение 12 месяцев при 5 С, по меньшей мере в течение 18 месяцев при 5 С или даже по меньшей мере в течение 24 месяцев при 5 С. В некоторых вариантах осуществления активный ингредиент подобных устойчивых составов подвергается разложению менее чем на 10%,предпочтительно менее чем на 5, 2 или даже менее чем разложению на 1%, например, определенного при помощи анализа на наличие подобных продуктов разложения, таких как фосфорная кислота и ее соли, и замещенных этиламинов, например, при помощи ВЭЖХ или ГХ по меньшей мере в течение двух недель,по меньшей мере в течение одного месяца, по меньшей мере в течение двух месяцев, в течение трех месяцев или даже по меньшей мере в течение шести месяцев. В других вариантах осуществления устойчивые составы сохраняют эффективность 90%, 95% или даже 98% при комнатной температуре по меньшей мере в течение двух недель, по меньшей мере в течение одного месяца, по меньшей мере в течение двух месяцев при 5 С, по меньшей мере в течение трех месяцев при 5 С, по меньшей мере в течение шести месяцев при 5 С, по меньшей мере в течение 9 месяцев при 5 С, по меньшей мере в течение 12 месяцев при 5 С, по меньшей мере в течение 18 месяцев при 5 С или даже по меньшей мере в течение 24 месяцев при 5 С, определенную при помощи анализа методом ВЭЖХ. Использованный здесь термин "устойчивый" означает, что чистота соли IPM или его аналога после некоторого промежутка времени (например, одного месяца, двух месяцев, трех месяцев, шести месяцев,одного года и так далее) составляет по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или даже по меньшей мере 99% от первоначальной чистоты, которую можно определить, например, методом ВЭЖХ с использованием испарительных детекторов светорассеяния (ELSD). Подобный анализ можно осуществить, например, при использовании колонки С 18 и изократической системы с подвижной фазой, содержащей 0,005 М гептафтормасляной кислоты и 0,1% трифторуксусной кислоты в воде. Фармацевтические составы, которые можно использовать перорально, включают забивные капсулы, изготовленные из желатина ("gelcaps"), а также мягкие, герметичные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит. Набивные капсулы могут содержать активные ингредиенты в смеси с носителями. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, вазелиновое масло или жидкие полиэтиленгликоли (ПЭГ). Кроме того, можно добавить стабилизаторы. В настоящем описании раскрыты способы лечения состояний, характеризуемых аномальной или патологической пролиферативной активностью или неоплазией, при помощи введения субъекту одного или более описанных соединений или составов. "Неоплазия" относится к процессу аномального и неконтролируемого роста клеток. Неоплазия представляет собой один из примеров пролиферативного нарушения. Продуктом неоплазии является неоплазм (опухоль), являющийся аномальным ростом ткани, который происходит в результате избыточного деления клеток. Опухоль, не дающую метастаз, называют"доброкачественной". Опухоль, проникающую в окружающую ткань и/или способную давать метастазы,называют "злокачественной". Состояния, которые можно лечить согласно описанному способу, включают состояния, характеризуемые аномальным ростом клеток и/или дифференциацией, такие как различные виды рака и другие неопластические состояния. Типичные примеры пролиферативных нарушений, которые можно лечить при использовании описанных соединений и составов, перечислены далее. Примеры гематологических опухолей, которые можно лечить при использовании описанных соединений и составов, включают лейкозы, включая острые лейкозы (такие как острый лимфолейкоз), острый миелоцитарный лейкоз, острый миелогенный лейкоз и миелобластический, промиелоцитарный, миеломоноцитарный, моноцитарный и эритролейкоз), хронические лейкозы (такие как хронический миелоцитарный (гранулоцитарный) лейкоз, хронический миелогенный лейкоз и хронический лимфоцитарный лейкоз), истинную полицитемию, лимфому, болезнь Ходжкина, неходжкинскую лимфому (вялотекущую и острую формы), множественную миелому, болезнь Вальденстрема, болезнь тяжелой цепи, миелодиспластический синдром, лейкемию волосковой клетки и миелодисплазию. Дополнительные примеры состояний, которые можно лечить при помощи описанных соединений и составов, включают солидные опухоли, такие как саркомы и карциномы, включают фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому и другие саркомы, синовиому, мезотелиому, опухоль Эвинга, лейомиосаркому, рабдомиосаркому, карциному кишечника, злокачественные лимфомы, рак поджелудочной железы, рак груди, рак легких, рак яичника, рак предстательной железы,печеночно-клеточный рак, карциному сквамозных клеток, базально-клеточный рак, аденокарциному,карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярную аденокарциному, медуллярную карциному, бронхогенную карциному, почечно-клеточную карциному, гепатому,карциному желчных протоков, хориокарциному, опухоль Вильмса, рак шейки матки, опухоль яичка,карциному мочевого пузыря и опухоли CNS (такие как глиома, астроцитома, медуллобластома, краниофариогиома, эпендимома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, менангиома, меланома, нейробластома и ретинобластома). В некоторых вариантах осуществления описанные здесь способы включают лечение субъекта со СРА-резистентным неопластическим состоянием солью изофосфорамидного иприта или его аналогом,описанными здесь. В одном из вариантов осуществления данного способа субъекту вводят от около 0,2 до около 20 мг/кг/день описанной соли изофосфорамидного иприта или его аналога. Например, субъекту можно вводить от около 0,5 до около 10 мг/кг/день, например от около 1 до около 7,5 мг/кг/день описанного соединения. В другом варианте осуществления данного способа субъекту вводят от около 10 до около 700 мг/м 2/день, например от около 20 до около 400 мг/м 2/день или от около 100 до около 500 мг/м 2/день. Например, от около 30 до около 100 мг/м 2/день, например от около 40 до около 90 мг/м 2/день описанного соединения. В одном из вариантов осуществления способа лечения описанных здесь гиперпролиферативных нарушений, описанное соединение вводят субъекту в режиме многократной дневной дозировки. В таких вариантах осуществления соединение вводят по меньшей мере в течение двух дней и в течение пяти разных дней. В одном из аспектов режимов многократной дневной дозировки соединение вводят субъекту в течение последовательных дней, например от двух до пяти последовательных дней. В одном из вариантов осуществления способа помимо описанных в настоящем описании соединений и составов субъекту вводят один или более дополнительных терапевтических агентов. Например,дополнительные терапевтические агенты, которые можно использовать, включают микротрубочные связывающие вещества, интеркаляторы или кросс-линкеры ДНК, ингибиторы синтеза ДНК, ингибиторы транскрипции ДНК и/или РНК, антитела, ферменты, ингибиторы ферментов, регуляторы генов и/или ингибиторы ангиогенеза."Микротрубочное связывающее вещество" относится к веществу, которое взаимодействует с тубулином, стабилизируя или дестабилизируя образование микротрубок, ингибируя, таким образом, деление клеток. Примеры микротрубочных связывающих веществ, которые можно использовать в связи с описанными здесь солями изофосфорамидного иприта и его аналогами, включают, без ограничения, паклитаксел, доцетаксел, винбластин, виндезин, винорельбин (навельбин), эпотилоны, колхицин, доластатин 15, нокодазол, подофиллотоксин и ризоксин. Можно также использовать аналоги и производные подобных соединений, и они известны специалисту в данной области. Например, подходящие эпотилоны и аналоги эпотилонов для включения в настоящие соединения описаны в международной публикацииWO 2004/018478, которая включена здесь ссылкой. В настоящее время полагают, что таксоиды, такие как паклитаксел и доцетаксел, особенно полезны в качестве терапевтических агентов в описанных здесь соединениях. Примерами дополнительных применимых таксоидов, включая аналоги паклитаксела, обучают в патентах США 6610860, выданном Holton, 5530020, выданном Gurram et al., и 5912264, выданном Wittman et al. Каждый из этих патентов включен здесь ссылкой. Подходящие регулятор транскрипции ДНК и/или РНК, включая, без ограничения, актиномицин D,даунорубицин, доксорубицин и их производные и аналоги, также применимы для использования в сочетании с описанными в настоящем изобретении соединениями. Интеркаляторы ДНК и сшивающие агенты, которые можно включить в описанные соединения,включают, без ограничения, цисплатин, карбоплатин, оксалиплатин, митомицины, такие как митомицин С, блеомицин, хлорамбуцил, циклофосфамид и их производные и аналоги. Ингибиторы синтеза ДНК, применимые для использования в качестве терапевтических агентов,включают, без ограничения, метотрексат, 5-фтор-5'-дезоксиуридин, 5-фторурацил и их аналоги. Примеры подходящих ингибиторов ферментов, подходящих для использования в сочетании с описанными в настоящем изобретении соединениями, включают, без ограничения, камптотецин, этопозид,форместан, трихостатин и их производные и аналоги. Подходящие терапевтические средства для использования с описанными в настоящем изобретении соединениями, воздействующими на регуляцию генов, включают агенты, которые приводят к повышенной или пониженной экспрессии одного или более генов, такие как, без ограничения, ралоксифен, 5 азацитидин, 5-аза-2'-дезоксицитидин, тамоксифен, 4-гидрокситамоксифен, мифепристон и их производные и аналоги. Использованный здесь термин "ингибитор ангиогенеза" означает молекулу, включающую, но без ограничения, биомолекулы, такие как пептиды, белки, ферменты, полисахариды, олигонуклеотиды,ДНК, РНК, рекомбинантные векторы и малые молекулы, которые функционируют, ингибируя рост кровеносных сосудов. Ангиогенез вовлечен в некоторые патологические процессы, такие как процессы,принимающие участие в таких нарушениях, как диабетическая ретинопатия, хронические воспалительные заболевания, ревматоидный артрит, дерматит, псориаз, язва желудка и большинство типов человеческих солидных опухолей. Ингибиторы ангиогенеза известны в данной области, и примеры подходящих ингибиторов ангиогенеза включают, без ограничения, ангиостатин K1-3, стауроспорин, генистеин, фумагиллин, медроксипрогестерон, сурамин, интерферон-, ингибиторы металлопротеиназы, тромбоцитарный фактор 4, соматостатин, тромбоспондин, эндостатин, талидомид и их производные и аналоги. Другие терапевтические средства, в частности противоопухолевые агенты, которые могут попадать или могут не попадать под одну или более из приведенных выше классификаций, также применимы в сочетании с описанными в настоящем изобретении соединениями. В качестве примера подобные агенты включают адриамицин, апигенин, рапамицин, зебуларин, циметидин и их производные и аналоги.III. Получение солей IPM и его аналогов. В одном из аспектов используются способы для получения соединений формулы (Е) или любой их соли, пролекарства, таутомера или изомера,в которойX и Y независимо представляют собой уходящие группы; а А+ представляет собой аммониевый катион. В некоторых вариантах осуществления в настоящем описании предоставлены способы получения соединений формулы (Е) по пути схемы 1. Схема 1 Получение IPM и его солей и аналогов Согласно схеме 1 фосфиноксид (А) обрабатывают спиртом R1OH, получая моноэфир (В). Моноэфир (В) обрабатывают одним или более аминами, например XCH2CH2NH2 и YCH2CH2NH2, или их солями, вместе или последовательно, в условиях конденсации, получая диамидофосфат (С). Диамидофосфат (С) превращают в условиях гидрогенолиза в диамидофосфорную кислоту (D). Затем диамидофосфорную кислоту (D) переводят в соль обработкой основанием. В некоторых вариантах осуществления в настоящем изобретении предоставлен способ получения соединения формулы (В) включающий обработку соединения формулы (А) спиртом R1-OH в условиях конденсации, где, как позволяет валентность и устойчивость,X1, независимо для каждого появления, выбирают из Cl, I и Br,R1 представляет собой бензил, необязательно замещенный одним или более заместителями, например, выбранными из галогена, -R2, -OR2 и -NR22, где R2 независимо выбирают для каждого появления из Н и низшего алкила. В некоторых вариантах осуществления R1 представляет собой бензил, необязательно замещенный одним или более заместителями. В некоторых вариантах осуществления R1 представляет собой незамещенный бензил. В некоторых вариантах осуществления X1 при каждом появлении независимо выбирают из любого из -Cl, -Br и -I. В некоторых вариантах осуществления соединение формулы (А) представляет собой P(O)Cl3, и/или R1OH представляет собой PhCH2OH. В некоторых аспектах условия конденсации включают основание амина. В некоторых из подобных вариантов осуществления основание амина выбирают из любого из N-метилморфолина, триэтиламина,пиридина или диизопропилэтиламина, например триэтиламина. В некоторых вариантах осуществления условия конденсации могут включать апротонный органический растворитель, например ацетон, 2-бутанон, бутилацетат, этилацетат, ацетонитрил, толуол, ТГФ,диоксан, N,N-ДМФА, ДМСО, 1,2-дихлорэтан или хлористый метилен. В некоторых вариантах осуществления апротонный органический растворитель включает ацетонитрил, где ацетонитрил может составлять, например, примерно более 10, 20, 30, 50, 70 или 90% от системы растворителя, или, по существу,всю систему растворителя, например около 95% или более от системы растворителя. В некоторых вариантах осуществления фосфиноксид А и R1OH соединяют в условиях конденсации,например, в соотношении в интервале от 2:1 до 1:1,2 соединения формулы (А) к R1OH, например в соотношении в интервале от 1,2:1 до 1:1,2, предпочтительно приблизительно в эквимолярных количествах соединения формулы (А) и спирта R1OH. В некоторых вариантах осуществления условия конденсации включают поддержание пониженной температуры, например, в интервале от около -50 до около -10 С, такой как от около -35 до около -25 С,например около -30 С. В некоторых вариантах осуществления в настоящем изобретении предоставлен способ получения соединения формулы (С) включающий обработку соединения формулы (В) аминами XCH2CH2NH2 и YCH2CH2NH2 или их солями в условиях конденсации, где, насколько позволяет валентность и устойчивость,X и Y независимо представляют собой уходящие группы, которые могут быть одинаковыми или различными; аR1 представляет собой бензил, необязательно замещенный одним или более заместителями, например, выбранными из галогена, -R2, -OR2 и -NR22, где R2 независимо выбирают для каждого появления из Н и низшего алкила. В некоторых вариантах осуществления R1 представляет собой бензил, необязательно замещенный одним или более заместителями. В некоторых вариантах осуществления R1 представляет собой незамещенный бензил. В некоторых вариантах осуществления X1 при каждом появлении независимо выбирают из любого из Cl, Br и I. В некоторых вариантах осуществления R1 представляет собой бензил и/или X1 при каждом появлении выбирают из Cl или Br.X и Y аминов XCH2CH2NH2 и YCH2CH2NH2 можно независимо выбрать из галогена, например Cl,Br или I, или сульфоната, например толуолсульфоната, метансульфоната, 2,4,6-триизопропилбензолсульфоната или 2,4,6-триметилбензолсульфоната. В некоторых вариантах осуществления X и Y независимо выбирают из Cl, Br или I. В некоторых вариантах осуществления X и Y идентичны, например, и X и Y являются Cl. В любом варианте осуществления настоящего изобретения XCH2CH2NH2 иYCH2CH2NH2 можно использовать в форме солей, таких как соль HCl. Амин или амины можно включать в соединение формулы (В) в виде разовой дозы, в виде порций с течением времени или в виде многократных меньших доз. В некоторых вариантах осуществления амин постоянно прибавляют к соединению формулы (В) в течение промежутка времени, например в виде непрерывной подачи, при помощи насоса-пипетки или капельной воронки. В вариантах осуществления, в которых X и Y аминов XCH2CH2NH2 и YCH2CH2NH2 отличаются друг от друга, например X является Cl, a Y является Br или X является Br, a Y является I, данные амины,например ClCH2CH2NH2 и BrCH2CH2NH2, можно вводить в соединение формулы (В) вместе или предпочтительно последовательно. В примере последовательного прибавления амин ClCH2CH2NH2 вводят в соединение формулы (В) в виде одной дозы и, например, после исчерпывающего взаимодействия, добавляют амин BrCH2CH2NH2. В некоторых вариантах осуществления сумма молярных эквивалентов аминов XCH2CH2NH2 иYCH2CH2NH2 относительно соединения формулы (В) представляет собой соотношение в интервале от 2,5:1 до 1,8:1. В некоторых вариантах осуществления, в которых X и Y представляют собой уходящие группы, имеющие одну и ту же молекулярную формулу, так что XCH2CH2NH2 и YCH2CH2NH2 являются соединениями одной и той же формулы, соотношение компонентов аминов к соединению формулы (B) составляет приблизительно 2:1. В некоторых вариантах осуществления, в которых X и Y не являются идентичными заместителями, амины XCH2CH2NH2 и YCH2CH2NH2 приблизительно эквимолярны по отношению друг к другу и добавляются вместе в соотношении примерно 2:1 по отношению к соединению формулы (В). Условия конденсации могут включать основание амина, такое как N-метилморфолин, триэтиламин,пиридин или диизопропилэтиламин. В некоторых вариантах осуществления основание амина присутствует в соотношении от 5:1 до 3:1 по отношению к соединению формулы (В). В некоторых вариантах осуществления основание амина присутствует в соотношении приблизительно 4:1 по отношению к соединению формулы (В). Основание амина может представлять собой триэтиламин в соотношении 4:1 по отношению к соединению формулы (В). Специалисты в данной области признают, что большее количество основания амина будет предпочтительным в том случае, когда амины XCH2CH2NH2 и YCH2CH2NH2 прибавляют в форме их соли, чем когда их прибавляют в форме их свободного основания. Конкретно,реакции конденсации будет способствовать добавление двух или более эквивалентов основания амина,когда XCH2CH2NH2 и YCH2CH2NH2 используют в форме их свободных оснований, тогда как в том случае, когда XCH2CH2NH2 и YCH2CH2NH2 прибавляют в виде солей аминов, предпочтительно четыре или более эквивалентов основания амина. В некоторых вариантах осуществления в настоящем изобретении предоставлен способ получения соединения формулы включающий: а) обработку соединения формулы (А) спиртом R1-OH в реакционной смеси в условиях конденсации с образованием соединения формулы (В)b) прибавление к реакционной смеси аминов XCH2CH2NH2 и YCH2CH2NH2 или их соли, или солей в условиях конденсации, где, независимо для каждого появления и насколько позволяет валентность и устойчивость,X и Y независимо представляют собой уходящие группы;X1, независимо для каждого появления, выбирают из Cl, I и Br,R1 представляет собой бензил, необязательно замещенный одним или более заместителями, например, выбранными из галогена, -R2, -OR2 и -NR22, где R2 независимо выбирают для каждого появления из Н и низшего алкила. В некоторых вариантах осуществления R1 представляет собой бензил, необязательно замещенный одним или более заместителями. В некоторых вариантах осуществления R1 представляет собой незамещенный бензил. В некоторых вариантах осуществления X1 при каждом появлении независимо выбирают из любого из Cl, Br и I. В некоторых вариантах осуществления R1 представляет собой незамещенный бензил и/или X1 при каждом появлении выбирают из Cl или Br, например, соединение формулы (А) может представлять собой Р(О)Cl3. В некоторых аспектах условия конденсации включают основание амина. В некоторых из подобных вариантов осуществления основание амина выбирают из любого из N-метилморфолина, триэтиламина,пиридина или диизопропилэтиламина, например триэтиламина. Условия конденсации могут включать апротонный органический растворитель, например, один или более из ацетона, 2-бутанона, бутилацетата, этилацетата, ацетонитрила, толуола, ТГФ, диоксана, N,NДМФА, ДМСО, 1,2-дихлорэтана или хлористого метилена. В некоторых вариантах осуществления апротонный растворитель включает ацетонитрил, где ацетонитрил может составлять, например, примерно более чем 10, 20, 30, 50, 70 или 90% от системы растворителя или, по существу, всю систему растворителя, например около 95% или более от системы растворителя. В некоторых вариантах осуществления фосфиноксид (А) и R1OH соединяют в условиях конденсации, например, в соотношении в интервале от 2:1 до 1:1,2 соединения формулы (А) к R1OH, например в соотношении в интервале от 1,2:1 до 1:1,2, например, приблизительно в эквимолярных количествах соединения формулы (А) и замещающего реагента R1OH. В некоторых вариантах осуществления условия конденсации включают поддержание пониженной температуры, например, в интервале от около -50 до около -10 С, такой как от около -35 до около -25 С,например около -30 С.X и Y аминов XCH2CH2NH2 и YCH2CH2NH2 можно независимо выбрать из галогена, например Cl,Br или I, или сульфоната, например толуолсульфоната, метансульфоната, 2,4,6-триизопропилбензолсульфоната или 2,4,6-триметилбензолсульфоната. В некоторых вариантах осуществления X и Y независимо выбирают из Cl, Br или I. В некоторых вариантах осуществления X и Y идентичны, например оба являются Cl. В любом варианте осуществления настоящего изобретения XCH2CH2NH2 иYCH2CH2NH2 можно использовать в форме солей, таких как соль HCl. Амин можно вводить в реакционную смесь в виде единовременной дозы, в виде порций с течением времени или в виде многократных меньших доз. В некоторых вариантах осуществления амин постоянно прибавляют к соединению формулы (В) в течение промежутка времени, например, при помощи насосапипетки, капельной воронки или непрерывной подачи. В вариантах осуществления, в которых X и Y аминов XCH2CH2NH2 и YCH2CH2NH2 отличаются друг от друга, например X является Cl, a Y является Br, или X является Br, a Y является I, амины, например ClCH2CH2NH2 и BrCH2CH2NH2, можно вводить в реакционную смесь вместе или предпочтительно последовательно. В примере последовательного прибавления амин ClCH2CH2NH2 вводят в реакционную смесь в виде одной дозы и, например, после исчерпывающего взаимодействия, добавляют аминBrCH2CH2NH2. В некоторых вариантах осуществления сумма молярных эквивалентов аминов XCH2CH2NH2 иYCH2CH2NH2 относительно соединения формулы (А) представляет собой соотношение в интервале от 2,5:1 до 1,8:1. В некоторых вариантах осуществления, в которых X и Y представляют собой уходящие группы, имеющие одну и ту же молекулярную формулу, так что XCH2CH2NH2 и YCH2CH2NH2 являются соединениями одной и той же формулы, соотношение компонентов аминов к соединению формулы (А) составляет приблизительно 2:1. В некоторых вариантах осуществления, в которых X и Y не являются идентичными заместителями, амины XCH2CH2NH2 и YCH2CH2NH2 приблизительно эквимолярны по отношению друг к другу и добавляются вместе в соотношении примерно 2:1 по отношению к соединению формулы (А). Условия конденсации могут включать основание амина, такое как N-метилморфолин, триэтиламин,пиридин или диизопропилэтиламин. В некоторых вариантах осуществления основание амина присутствует в соотношении от 5:1 до 3:1 по отношению к соединению формулы (А). В некоторых вариантах осуществления основание амина присутствует в соотношении приблизительно 4:1 по отношению к соединению формулы (А). Основание амина может представлять собой триэтиламин в соотношении 4:1 по отношению к соединению формулы (А). Специалисты в данной области признают, что большее количество основания амина будет предпочтительным в том случае, когда амины XCH2CH2NH2 и YCH2CH2NH2 прибавляют в форме их соли, чем когда их прибавляют в форме их свободного основания. Конкретно,реакции конденсации будет способствовать добавление двух или более эквивалентов основания амина,когда XCH2CH2NH2 и YCH2CH2NH2 используют в форме их свободных оснований, тогда как в том случае, если XCH2CH2NH2 и YCH2CH2NH2 прибавляют в виде солей аминов, предпочтительны четыре или более эквивалентов основания амина (помимо любого основания амина, используемого при конденсации со спиртом R1OH, например обычно по меньшей мере один дополнительный эквивалент). В некоторых вариантах осуществления реакционную смесь, содержащую продукт реакции соединения формулы (В) для получения соединения формулы (С), используют в реакции гидрогенолиза, например, без первоначальной очистки или частичного или полного удаления растворителей из реакционной смеси. Например, реакционную смесь можно профильтровать, чтобы удалить твердые вещества, например, солевые побочные продукты условий конденсации, перед подверганием данного раствора условиям гидрогенолиза с получением соединения формулы (D). Реакционную смесь можно профильтровать любым способом, известным в данной области для удаления твердых веществ из растворителя реакционной смеси. В некоторых вариантах осуществления реакционную смесь фильтруют и, по существу, непосредственно подвергают условиям гидрогенолиза, например соединение формулы (C) дополнительно не очищают или не выделяют из реакционной смеси (например, не осуществляют экстракций, хроматографии или гашений). В некоторых вариантах осуществления в настоящем изобретении предоставлен способ получения соединения формулы (D) включающий обработку соединения формулы (С) восстановителем в условиях гидрогенолиза, где, насколько это позволяет валентность и устойчивость,X и Y независимо представляют собой уходящие группы; аR1 представляет собой бензил, необязательно замещенный одним или более заместителями, например, выбранными из галогена, -R2, -OR2 и -NR22, где R2 независимо выбирают для каждого появления из Н и низшего алкила. В некоторых вариантах осуществления R1 представляет собой бензил, необязательно замещенный одним или более заместителями. В некоторых вариантах осуществления R1 представляет собой незамещенный бензил. В некоторых вариантах осуществления X и Y при каждом появлении независимо выбирают из галогенов, таких как Cl, Br и I. В некоторых вариантах осуществления R1 представляет собой незамещенный бензил и/или X и Y оба являются Cl. В некоторых вариантах осуществления реакционную смесь, содержащую продукт реакции соединения формулы (В) с получением соединения формулы (С), используют в реакции гидрогенолиза, например, без первоначальной очистки или частичного или полного удаления растворителей из реакционной смеси. Например, реакционную смесь можно профильтровать, чтобы удалить твердые вещества, например солевые побочные продукты условий конденсации, перед подверганием данного раствора условиям гидрогенолиза с получением соединения формулы (D). Реакционную смесь можно профильтровать любым способом, известным в данной области, для удаления твердых веществ из растворителя реакционной смеси. В некоторых вариантах осуществления реакционную смесь фильтруют и, по существу, непосредственно подвергают условиям гидрогенолиза, например соединение формулы (С) дополнительно не очищают или не выделяют из реакционной смеси (например, не осуществляют экстракций, хроматографии или гашений). Условия гидрогенолиза могут включать обработку соединения формулы (С) газообразным водородом в присутствии катализатора. Катализатор можно выбрать из любого подходящего катализатора гидрогенолиза, такого как Pd/уголь, Pd чернь, PdEnCat (полимер с инкапсулированным катализатором из активного металла), никель Ренея, Rh/уголь, Ru/углерод, Re/уголь, оксид палладия, PtO2, или RuO2. В некоторых вариантах осуществления катализатор гидрогенолиза включает палладий, напримерPd/углерод. В некоторых вариантах осуществления условия гидрогенолиза включают парциальное давление водорода, превышающее 1 атм. В некоторых вариантах осуществления парциальное давление водорода меньше или равно 100, 75 или 50 фунт/кв.дюйм. В некоторых вариантах осуществления парциальное давление водорода выбирают из интервала от 10 до 50 фунт/кв.дюйм. Парциальное давление водорода может составлять 20-50 фунт/кв.дюйм, например 40-50 фунт/кв.дюйм. Альтернативным образом, парциальное давление водорода во время гилрогенолиза может составлять примерно 50 фунт/кв.дюйм или даже от 50 до 75 фунт/кв.дюйм. В некоторых вариантах осуществления условия гидрогенолиза могут включать апротонный органический растворитель, например толуол, ксилол, бензол, фуран, ацетонитрил, диоксан, тетрагидрофуран,хлороформ или их смесь. В некоторых вариантах осуществления апротонный растворитель включает ацетонитрил, где ацетонитрил может составлять, например, примерно более 10, 20, 30, 50, 70 или 90% от системы растворителя или, по существу, всю систему растворителя, например около 95% или более от системы растворителя. В некоторых вариантах осуществления отделение продукта от оставшегося катализатора достигается за счет получения основной соли в водных условиях, например, при использовании гидроксида натрия или другого основания в воде, которое можно осуществить in situ. Полученную соль можно растворить в подходящем растворителе, а оставшийся катализатор можно отфильтровать, чтобы удалить твердые вещества из растворителя реакционной смеси. В некоторых вариантах осуществления отделение продукта от оставшегося катализатора достигается за счет получения основной соли в неводных условиях, например, при использовании триэтиламина или другого основания, например основания амина, предпочтительно стерически затрудненного основания, такого как диизопропилэтиламин или протонная губка. Последующую соль можно растворить в реакционном растворителе, а оставшийся катализатор можно отфильтровать, чтобы удалить твердые вещества из растворителя реакционной смеси. В некоторых вариантах осуществления в настоящем изобретении предоставлен способ получения соединения формулы (Е) включающий обработку соединения формулы (D) основанием в условиях солеобразования, где, насколько это позволяет валентность и устойчивость,X и Y независимо представляют собой уходящие группы; а А+ представляет собой аммониевый катион. В некоторых вариантах осуществления X и Y при каждом появлении независимо выбирают из галогенов, таких как -Cl, -Br и -I. В некоторых вариантах осуществления X и Y оба являются Cl. В некоторых вариантах осуществления А+ представляет собой ВН+, а В представляет собой амин,выбранный из основных аминокислот, пиридина, N,N-диметиламинопиридина, диазабициклононана,диазабициклоундецена, N-метил-N-этиламина, диэтиламина, триэтиламина, диизопропилэтиламина, моно-, бис- или трис(2-гидроксиэтил)амина, 2-гидрокситретбутиламина, трис (гидроксиметил)метиламина,N,N-диметил-N-(2-гидроксиэтил)амина, три-(2-гидроксиэтил)амина и N-метил-D-глюкамина. В некоторых вариантах осуществления В представляет собой трис(гидроксиметил)метиламин. В некоторых вариантах осуществления условия солеобразования включают соединение приблизительно эквимолярных количеств основания амина и соединения формулы (D). В некоторых вариантах осуществления соединение формулы (D) и основание амина соединяют в молярном соотношении, находящемся в интервале от 1:1 до 1:10. В некоторых вариантах осуществления условия солеобразования включают соединение приблизительно эквимолярных количеств трис(гидроксиметил)аминометана и соединения формулы (D). В некоторых вариантах осуществления условия солеобразования включают полярный апротонный растворитель, такой как N,N-ДМФА, ацетон, ДМСО, ТТФ, 2-бутанон, бутилацетат, этилацетат, ацето- 13022655 нитрил и их сочетания. В некоторых вариантах осуществления апротонный растворитель включает N,NДМФА, где N,N-ДМФА может составлять, например, примерно более 10, 20, 30, 50, 70 или 90% от системы растворителя или, по существу, всю систему растворителя, например около 95% или более от системы растворителя. В некоторых вариантах осуществления данное изобретение относится к соединению, включающему кристаллическую соль IPM или его аналог, где IPM или его аналог и противоион предпочтительно трис(гидроксиметил)аминометан (tris), присутствуют в соотношении от 2:1 до 1:2, предпочтительно 1:1. В некоторых вариантах осуществления кристаллический состав содержит более одной полиморфной формы кристаллов, например две, три, четыре или даже пять полиморфных форм кристаллов. В некотором варианте подобных вариантов осуществления кристаллический состав содержит одну полиморфную форму кристаллов. В некоторых вариантах осуществления подобные соли более устойчивы, чем IPM и его аналоги в виде свободных кислот. В некоторых из подобных вариантов осуществления соединение представляет собой кристаллическую соль в соотношении IPM и tris 1:1. В некоторых из подобных вариантов осуществления температура плавления кристаллического вещества находится в интервале от около 100 до около 110 С, от около 102 до около 108 С, от около 103 до около 106 С или даже от около 105 до около 106 С. В некоторых вариантах осуществления соединение, например кристаллическая соль, в соотношении IPM и tris 1:1 имеет по меньшей мере примерно 80% чистоту, по меньшей мере примерно 85% чистоту, по меньшей мере примерно 90% чистоту, по меньшей мере примерно 95% чистоту, по меньшей мере примерно 97% чистоту, по меньшей мере примерно 98% чистоту или даже по меньшей мере примерно 99% чистоту. В некоторых из подобных вариантов осуществления ни одна из примесей не превосходит 1 мас.%. В некоторых вариантах осуществления чистоту определяют относительно всех остальных компонентов состава, тогда как в других вариантах осуществления (например, в которых данное соединение является частью фармацевтического состава или смесью лиофилизатов) чистоту можно определить относительно продуктов разложения данного соединения (например, фосфорсодержащих продуктов разложения соединения), или побочных продуктов получения соединения (например, фосфорсодержащих продуктов разложения соединения), исключая, таким образом, другие компоненты, целенаправленно добавленные в состав. Иллюстративные примеры Предшествующее описание объяснено далее при помощи следующих неограничивающих примеров. Иллюстративные составы. 1. Разработка состава. Лекарственный состав IPM tris включает смесь соли IPM tris, микрокристаллическую целлюлозу(Avicel PH112), кроскармеллозу натрия (Ac-Di-Sol) и стеарат магния (растительный источник). А. Состав партии капсул Tris IPM прочности 10 мг. Таблица 1 Количественный состав капсульного лекарственного продукта IPM Tris - прочности 10 мг 154 г соли IPM tris (молекулярная масса=342,16) доставят 100,0 г активного фармацевтического ингредиента IPM (молекулярная масса=221,0); АФИ (API) = активный фармацевтический ингредиент; НД (NA) = недоступно; НФ (NF) = национальный формуляр. В. Анализ партии 10 мг капсул IPM Tris. Продукт: капсулы IPM Tris (табл. 1). Расположение партии: устойчивость, МКИ. Условия устойчивого хранения: -20 С, 5 С или 20 С/60% ОВ. Таблица 2 Анализы партии лекарственного продукта IPM TrisHA (NA): недоступен; ВЭЖХ = высокоэффективная жидкостная хроматография; КЕ (CFU) = колониеобразующая единица; ОВУ (RRT) = относительное время удерживания. Таблица 3 Итог данных по устойчивости при -20 С для 10 мг капсул IPM Tris Таблица 4 Итог данных по устойчивости при 5 С для 10 мг капсул IPM Tris ВЭЖХ = высокоэффективная жидкостная хроматография; НО (ND) = не определено; ОВУ (RRT) = относительное время удерживания; НД (NA) = недоступно. Таблица 5 Итог данных по устойчивости при 25 С для 10 мг капсул IPM Tris Таблица 7 Итог данных по устойчивости при -20 С для 50 мг капсул IPM Tris Таблица 8 Итог данных по устойчивости при 5 С для 50 мг капсул IPM Tris НД (NA) - недоступно; ВЭЖХ = высокоэффективная жидкостная хроматография. Таблица 9 Итог данных по устойчивости при 25 С/60% ОВ для 50 мг капсул IPM TrisD. Анализ партии 10 мг капсул IPM Tris. Таблица 10 Итог анализа данных по устойчивости при -20 С 10 мг капсул палифосфамида Tris Таблица 11 Итог анализа данных по устойчивости при -20 С 10 мг капсул палифосфамида Tris Таблица 12 Итог анализа данных по устойчивости при 5 С 10 мг капсул палифосфамида Tris Таблица 13 Итог анализа данных по устойчивости при 5 С 10 мг капсул палифосфамида Tris Таблица 14 Итог анализа данных по устойчивости при 25 С 10 мг капсул палифосфамида Tris Таблица 15 Итог анализа данных по устойчивости при 25 С 10 мг капсул палифосфамида TrisII. Синтетическое получение солей IPM и его аналогов. Методика получения бензилизофосфорамида (J). В 3-горлую колбу на 2 л помещали 100 г P(О)Cl3, затем добавляли 400 мл ацетонитрила. После этого содержимое охлаждали до (-30)5 С. В другую колбу прибавляли 70,5 г бензилового спирта и 90,7 мл триэтиламина (ТЭА), затем добавляли 200 мл ацетонитрила и перемешивали до тех пор, пока смесь не стала гомогенной. К охлажденному раствору Р(О)Cl3 прибавляли раствор бензилового спирта и ТЭА при помощи шприцевого насоса, поддерживая температуру реакции при (-30)5 С. Это прибавление длилось 140 мин. После прибавления реакционную смесь оставляли перемешиваться в течение 1 ч при (-30)5 С. В реакционную смесь загружали 151,3 г ClCH2CH2NH3Cl. Затем при помощи шприцевого насоса прибавляли 362,6 мл ТЭА в течение 140 мин, поддерживая температуру реакции при (-30)5 С. После прибавления реакционную смесь оставляли нагреваться до комнатной температуры в течение 1 ч. Реакционную смесь фильтровали, чтобы удалить гидрохлоридную соль триэтиламина и промывали реактор 3200 мл ацетонитрила. Фильтрат брали на следующую стадию без дополнительной очистки. Методика получения бензилизофосфорамида (K). Фильтрат, полученный на описанной выше стадии 1b, переносили в реактор гидрирования и загружали 3,4 г Pd/C. Гидрогенолиз проводили при 50 фунтах/кв.дюйм водорода. Спустя 15 ч реакция завершалась, и Bz-IPM не наблюдалось (примечание: рН реакционной смеси составлял 3-4). Для обработки и выделения продукта реакционную смесь переносили в колбу и охлаждали содержимое до 0 С-10 С. К охлажденной реакционной смеси прибавляли 100 мл (719,4 ммоль, 1,1 экв.) ТЭА для повышения рН до 9,5-10 (примечание: это прибавление занимало менее 5 мин). Полученную смесь фильтровали, чтобы удалить катализатор и промывали 2100 мл ацетонитрила. Фильтрат охлаждали до 0-10 С и прибавляли к нему 76 мл (924,5 ммоль, 1,4 экв.) 37%-ной HCl, чтобы понизить рН до 1-2 (примечание: это прибавление занимало 15 мин). Полученную суспензию фильтровали, а сырой остаток переводили в суспензию при помощи двух порций 400 мл 5% воды в ацетонитриле и перемешивали в течение 5 мин каждую. Затем сырой остаток промывали 3200 мл ацетонитрила, получая 105,8871 г (73,5%) продукта. А. Методика получения соли IPM (L). В 3-горлую колбу на 250 мл помещали 26,5791 г трис(гидроксиметил)аминометана, затем добавляли 78,0 мл N,N-ДМФА. После этого смесь нагревали до 100 С для растворения основания. После получения прозрачного раствора загрузку охлаждали до 20-25 С (затем образовывалась суспензия). В описанную выше суспензию загружали 49,1322 г (чистота 98,7% по данным ЯМР, 0,2194 моль) аналога IPM(K) (1766-026-11) и промывали 48 мл N,N-ДМФА. Смесь перемешивали в течение 1 ч до получения прозрачного раствора. Осуществляли полировочное фильтрование полученного раствора через фильтровальную бумагу Whatman 1. Фильтрат переносили в колбу на 2 л и добавляли в нее 144 мл ацетонитрила в течение 5 мин. В данную загрузку вводили 852 мл метилтретбутилового эфира (МТБЭ), получая мутный раствор (твердые кристаллы-затравки получали, потирая стекло шпателем). Загрузку перемешивали в течение 1 ч. Продукт выделяли фильтрованием с последующим промыванием 242 мл МТБЭ с выходом 72,3868 г (96,4%) в виде твердого вещества белого цвета. Остаточное содержание палладия составляло 10 ч./млн по данным анализа ICP. В. Методика получения соли IPM (L). В 3-горлую колбу на 500 мл помещали 54,1043 г трис(гидроксиметил)аминометана, затем добавляли 158 мл N,N-ДМФА. После этого смесь нагревали до 100 С для растворения основания. После получения прозрачного раствора загрузку охлаждали до 20-25 С (затем образовывалась суспензия). В описанную выше суспензию загружали 100,0135 г (чистота 98,7% по данным ЯМР, 0,4466 моль) IPM (1766-02811) и промывали 99 мл N,N-ДМФА. Смесь перемешивали в течение 140 мин до получения прозрачного раствора. Осуществляли полировочное фильтрование полученного раствора через фильтровальную бумагу Whatman 1. Фильтрат переносили в колбу на 5 л и добавляли в нее 293 мл ацетонитрила в течение 5 мин. К данной загрузке прибавляли смесь суспензии 0,3 г соли L в 4,8 мл ДМФА и 5,7 мл ацетонитрила. В загрузку вводили 1734 мл МТБЭ. Загрузку перемешивали в течение 1 ч. Продукт выделяли фильтрованием с последующим промыванием 494 мл МТБЭ с выходом 146,7 г (96,0%) в виде твердого вещества белого цвета. Эквиваленты Специалисты в данной области признают или смогут убедиться в использовании не более чем обычных экспериментальных работ, многочисленных эквивалентов соединений и способов их использования, описанных здесь. Считается, что подобные эквиваленты входят в рамки данного изобретения и охватываются следующей формулой изобретения. Все цитированные выше ссылки и публикации включены в настоящее описание ссылкой. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пероральный состав соединения формулы (Е) для лечения состояния, характеризуемого аномальным ростом клеток и/или дифференциацией где указанный состав содержит от массы состава одно или более смазывающих веществ, выбранных из группы, состоящей из 1-5% талька, 0,1-0,5% пирогенной двуокиси кремния, 1-10% крахмала, 0,5-2% силиката кальция, 1-3% карбоната магния (тяжелый), 1-3% оксида магния (тяжелый), 0,2-2% лаурилсульфата магния, 0,2-2% лаурилсульфата натрия, 0,54% стеарата кальция, 0,5-2% стеарилфумарата натрия, 2-10% полиэтиленгликоля 4000 и 6000, 2-5% бензоата натрия, 1-3% легкого минерального масла, 1-5% гидрированных растительных масел, 0,25-2% стеариновой кислоты, 0,5-4% глицерилбегената и от 0,25 до около 2% стеарата магния, 5-98% микрокристаллической целлюлозы, 10-90% маннита, вплоть до 98% лактозы и 10-80% гидроксидиоксидооксофосфорана кальция; один или более разбавитель, выбранный из группы, состоящей из 5-98% микрокристаллической целлюлозы, 10-90% маннита, вплоть до 98% декстрозы, вплоть до 98% глюкозы, вплоть до 98% крахмала и производных, вплоть до 98% карбоната кальция, вплоть до 98% дикальций фосфата, вплоть до 98% карбоната магния, вплоть до 98% лактозы и 10-80% гидроксидиодиоксидооксофосфорана кальция; одно или более дезинтегрирующее вещество, выбранное из группы, состоящей из 5-90% микрокристаллической целлюлозы, 3-25% крахмала, 2-8% гликолята крахмала натрия, вплоть до 15% карбоксиметилцеллюлозы натрия, менее 5% камеди, 4-6% альгиновой кислоты или альгината натрия и 1-5% кросповидона; и соединение, в которомX и Y независимо представляют собой уходящие группы, выбранные из группы, состоящей из галогена и сульфоната; а А+ представляет собой аммониевый катион,два или более из смазывающего вещества, разбавителя и дезинтегрирующего вещества могут представлять собой единый компонент; и соединение формулы (Е) в указанном составе подвергается разложению менее чем на 30% после трех месяцев при 25 С. 2. Пероральный состав по п.1, где соединение формулы (Е) представлено формулой 3. Пероральный состав по любому из предшествующих пунктов, где состав содержит по меньшей мере один из следующих разбавителей в указанном количестве (от массы состава): микрокристаллическая целлюлоза - 5-98%, маннит - 10-90%, лактоза - до 98% и гидроксидиоксидооксофосфоран кальция 10-80%. 4. Пероральный состав по любому из предшествующих пунктов, где состав содержит 80-98% микрокристаллической целлюлозы. 5. Пероральный состав по п.1, где состав содержит 0,25-1% стеарата магния и около 91% микрокристаллической целлюлозы. 6. Пероральный состав по любому из предшествующих пунктов, где состав содержит по меньшей мере один из следующих дезинтегрирующих веществ в указанном количестве (от массы состава): микрокристаллическая целлюлоза - 5-90%, крахмал - 3-25%, гликолят крахмала натрия - 2-8% и карбоксиметилцеллюлоза натрия - до 15%. 7. Пероральный состав по любому из предшествующих пунктов, где состав содержит до 15% карбоксиметилцеллюлозы натрия. 8. Пероральный состав по п.3, где состав содержит в указанном количестве (от массы состава): стеарат магния - 0,25-1%, микрокристаллическая целлюлоза около - 91% и карбоксиметилцеллюлоза натрия- 0,5-2%. 9. Пероральный состав по любому из предшествующих пунктов для использования при лечении состояния, характеризуемого аномальным ростом клеток и/или дифференциацией. 10. Применение соединения формулы (Е) где X и Y независимо представляют собой уходящие группы, выбранные из группы, состоящей из галогена и сульфоната; и А+ представляет собой аммониевый катион,при получении лекарственного средства для перорального введения для лечения состояния, характеризуемого аномальным ростом клеток и/или дифференциацией, при этом лекарственное средство включает (по весу лекарственного средства) одно или более смазывающих веществ, выбранных из группы, состоящей из 1-5% талька, 0,1-0,5% пирогенной двуокиси кремния, 1-10% крахмала, 0,5-2% силиката кальция, 1-3% карбоната магния (тяжелый), 1-3% оксида магния (тяжелый), 0,2-2% лаурилсульфата магния, 0,2-2% лаурилсульфата натрия, 0,5- 27022655 4% стеарата кальция, 0,5-2% стеарилфумарата натрия, 2-10% полиэтиленгликоля 4000 и 6000, 2-5% бензоата натрия, 1-3% легкого минерального масла, 1-5% гидрированных растительных масел, 0,25-2% стеариновой кислоты, 0,5-4% глицерилбегената, от 0,25 до около 2% стеарата магния, 5-98% микрокристаллической целлюлозы, 10-90% маннита, вплоть до 98% лактозы и 10-80% гидроксидиоксидооксофосфорана кальция; один или более разбавитель, выбранный из группы, состоящей из 5-98% микрокристаллической целлюлозы, 10-90% маннита, вплоть до 98% декстрозы, вплоть до 98% глюкозы, вплоть до 98% крахмала и производных, вплоть до 98% карбоната кальция, вплоть до 98% дикальций фосфата, вплоть до 98% карбоната магния, вплоть до 98% лактозы и 10-80% гидроксидиоксидооксофосфорана кальция; одно или более дезинтегрирующее вещество, выбранное из группы, состоящей из 5-90% микрокристаллической целлюлозы, 3-25% крахмала, 2-8% гликолята крахмала натрия, вплоть до 15% карбоксиметилцеллюлозы натрия, менее 5% камеди, 4-6% альгиновой кислоты или альгината натрия и 1-5% кросповидона; и соединение, где соединение формулы (Е) в указанном составе подвергается разложению менее чем на 10% после трех месяцев при 25 С и два или более из смазывающего вещества, разбавителя и дезинтегрирующего вещества могут представлять собой единый компонент. 11. Пероральный состав по п.4, где состав содержит около 91% микрокристаллической целлюлозы. 12. Пероральный состав по п.7, где состав содержит от 0,5-2% карбоксиметилцеллюлозы натрия. 13. Пероральный состав по п.1, где разбавитель и дезинтегрирующее вещество представляют собой микрокристаллическую целлюлозу.
МПК / Метки
МПК: C07F 9/22, A61K 31/675, A61K 31/66, A61P 35/00
Метки: основе, составы, изофосфорамидного, солей, синтез, иприта, аналогов
Код ссылки
<a href="https://eas.patents.su/29-22655-sintez-i-sostavy-na-osnove-solejj-izofosforamidnogo-iprita-i-ego-analogov.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез и составы на основе солей изофосфорамидного иприта и его аналогов</a>
Предыдущий патент: Способ обработки растворов, содержащих органические вещества
Следующий патент: Способ очистки сингаза
Случайный патент: Способ получения замещенных адамантиларилмагний галогенидов