Синтез и применение антиинвертированных фосфоротиоатных аналогов кэп-структуры матричной phk
Номер патента: 17740
Опубликовано: 28.02.2013
Авторы: Ковальска Йоанна, Емелити Яцек, Грудзен-Ногальска Ева М., Дажинкевич Эдвард, Роудс Роберт Е.
Формула / Реферат
1. Соединение, имеющее общую структуру

где каждый Y выбирают из группы, состоящей из О и S;
разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;
R1 выбирают из группы, состоящей из Н, ОН, ОСН3 и ОСН2СН3;
R2 выбирают из группы, состоящей из Н, ОН, ОСН3 и ОСН2СН3;
n равно 3 или 4 и,
если R1 представляет собой ОН, то R2 не является ОН;
В выбирают из группы, состоящей из гуанина, аденина, уридина, цитозина;
X выбирают из группы, состоящей из метила, этила, пропила, бутила, бензила, замещенного бензила, нафтилметила, замещенного нафтилметила и других замещенных или незамещенных С1-С10 алифатических или ароматических групп,
при этом указанное соединение характеризуется следующими свойствами:
если указанное соединение включено в молекулу РНК на 5'-конце, причем молекула РНК содержит открытую рамку считывания, и если молекула РНК введена в клетки в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, то получаемая экспрессия белка in vivo выше, чем экспрессия белка in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы.
2. Соединение, имеющее общую структуру
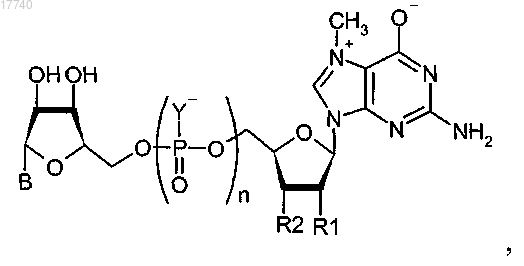
где каждый Y выбирают из группы, состоящей из О и S;
разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;
R1 выбирают из группы, состоящей из Н, ОН, ОСН3 и ОСН2СН3;
R2 выбирают из группы, состоящей из Н, ОН, ОСН3 и ОСН2СН3;
n равно 3 или 4 и,
если R1 представляет собой ОН, то R2 не является ОН;
В выбирают из группы, состоящей из
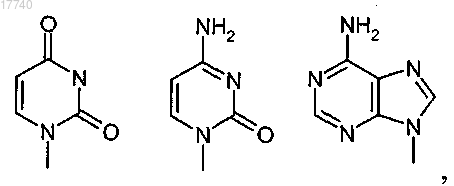
при этом указанное соединение характеризуется следующими свойствами:
если указанное соединение включено в молекулу РНК на 5'-конце, причем молекула РНК содержит открытую рамку считывания, и если молекула РНК введена в клетки в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, то получаемая экспрессия белка in vivo выше, чем экспрессия белка in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы.
3. Соединение, имеющее общую структуру
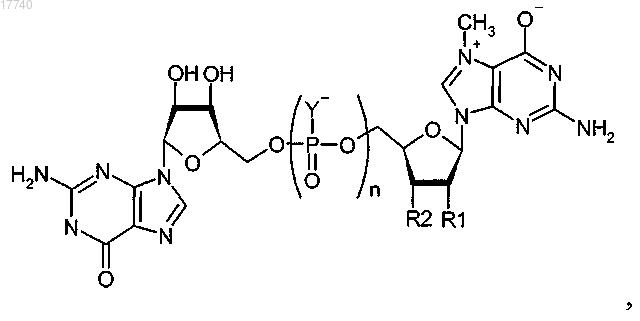
где каждый Y выбирают из группы, состоящей из О и S;
разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;
R1 выбирают из группы, состоящей из Н, ОН, ОСН3 и ОСН2СН3;
R2 выбирают из группы, состоящей из Н, ОН, ОСН3 и ОСН2СН3;
n равно 3 или 4 и,
если R1 представляет собой ОН, то R2 не является ОН.
4. Соединение, имеющее общую структуру

где каждый Y выбирают из группы, состоящей из О и S;
разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;
n равно 3 или 4 и
В выбирают из группы, состоящей из гуанина, аденина, уридина, цитозина;
X выбирают из группы, состоящей из метила, этила, пропила, бутила, бензила, замещенного бензила, нафтилметила, замещенного нафтилметила и других замещенных или незамещенных С1-С10 алифатических или ароматических групп,
при этом указанное соединение характеризуется следующими свойствами:
если указанное соединение включено в молекулу РНК на 5'-конце, причем молекула РНК содержит открытую рамку считывания, и если молекула РНК введена в клетки в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, то получаемая экспрессия белка in vivo выше, чем экспрессия белка in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы.
5. Соединение, имеющее общую структуру
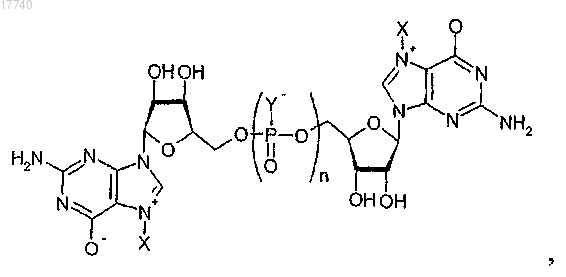
где каждый Y выбирают из группы, состоящей из О и S;
разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;
n равно 3 или 4;
X выбирают из группы, состоящей из метила, этила, пропила, бутила, бензила, замещенного бензила, нафтилметила, замещенного нафтилметила и других замещенных или незамещенных С1-С10 алифатических или ароматических групп, где разные X могут быть одинаковыми или различающимися,
при этом указанное соединение характеризуется следующими свойствами:
если указанное соединение включено в молекулу РНК на 5'-конце, причем молекула РНК содержит открытую рамку считывания, и если молекула РНК введена в клетки в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, то получаемая экспрессия белка in vivo выше, чем экспрессия белка in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы.
6. Соединение, имеющее общую структуру
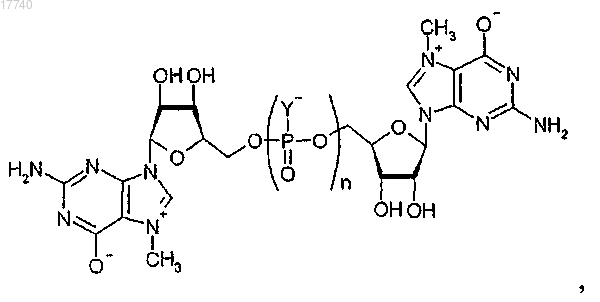
где каждый Y выбирают из группы, состоящей из О и S;
разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;
n равно 3 или 4.
7. Соединение, выбранное из группы, состоящей из m27,2'-oGppspG; m27,3'-oGppspG; m27,2'-oGpppspG; m27,3'-oGpppspG; m27,2'-oGppsppG; m27,3'-oGppsppG; m27,2'-oGpspspG; m27,3'-oGpspspG; m27,2'-oGppspsG; m27,3'-oGppspsG; bn7m2'-oGppspG; bn7m3'-oGppspG; bn7m2'-oGpppspG; bn7m3'-oGpppspG; bn7m2'-oGppsppG; bn7m3'-oGppsppG; bn7m2'-oGpspspG;
bn7m3'-oGpspspG; bn7m2'-oGppspsG и bn7m3'-oGppspsG.
8. Соединение по любому из предшествующих пунктов, где указанное соединение представляет собой, по существу, один стереоизомер.
9. Соединение по любому из пп.1-7, где указанное соединение представляет собой смесь по меньшей мере двух диастереомеров, первого диастереомера и второго диастереомера, причем указанные первый и второй диастереомеры являются идентичными за исключением того, что указанные первый и второй диастереомеры имеют разные стереохимические конфигурации у хирального атома фосфора, при этом указанный хиральный атом фосфора представляет собой атом фосфора, который связан с атомом серы.
10. Молекула РНК, 5'-конец которой включает соединение по любому из пп.1-7.
11. Способ синтеза in vitro молекулы РНК по п.10, где указанный способ включает проведение реакции между АТФ, ЦТФ, УТФ, ГТФ, указанным соединением и полинуклеотидной матрицей в присутствии РНК-полимеразы, в условиях, способствующих транскрипции с помощью указанной РНК-полимеразы полинуклеотидной матрицы в РНК-копию, посредством чего некоторые копии РНК могут включать указанное соединение для получения указанной молекулы РНК.
12. Способ синтеза in vitro белка или пептида, где указанный способ включает трансляцию молекулы РНК, определенной в п.10, в бесклеточной системе синтеза белка, причем молекула РНК содержит открытую рамку считывания, в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания.
13. Способ синтеза in vivo белка или пептида, где указанный способ включает введение в клетки молекулы РНК по п.10, где молекула РНК содержит открытую рамку считывания, в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания.
14. Соединение по любому из пп.1-7, где n равно 3 и указанное соединение содержит β-фосфоротиоатную группу или где n равно 4 и указанное соединение содержит γ-фосфоротиоатную группу, и где указанное соединение не гидролизуется с помощью Dcp2 в физиологических условиях.
15. Соединение по любому из пп.1-7, где n равно 3 и указанное соединение содержит γ-фосфоротиоатную группу или где n равно 4 и указанное соединение содержит 5-фосфоротиоатную группу, и где указанное соединение не гидролизуется с помощью Dcp2 в физиологических условиях и указанное соединение ингибирует кэп-зависимую трансляцию.
16. Способ синтеза in vivo белка или пептида, где указанный способ включает введение в клетки молекулы РНК, 5'-конец которой включает соединение по п.14, причем молекула РНК содержит открытую рамку считывания, в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, где скорость трансляции in vivo по меньшей мере в два раза выше скорости трансляции in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы.
Текст
СИНТЕЗ И ПРИМЕНЕНИЕ АНТИИНВЕРТИРОВАННЫХ ФОСФОРОТИОАТНЫХ АНАЛОГОВ КЭП-СТРУКТУРЫ МАТРИЧНОЙ PHK Раскрыты новые аналоги кэп-структуры РНК, содержащие одну или несколько фосфоротиоатных групп. Аналоги также содержат модификации во 2'-О положении 7-метилгуанозина, которые препятствуют их встраиванию в обратной ориентации во время синтеза in vitro мРНК и которые в настоящем описании названы "антиинвертированными аналогами кэп-структуры" (ARCA). Модификации ARCA гарантируют, что расположение атома S будет точно в активных участках кэп-связывающих белков как в трансляционном, так и декэпирующем комплексах. Новые аналоги S-ARCA являются устойчивыми к in vivo декэпирующим ферментам. Некоторые из S-ARCA имеют более высокую аффинность к eIF4E, чем соответствующие аналоги, не содержащие фосфоротиоатную группу. При введении мРНК, содержащих различные S-ARCA, в культивируемые клетки некоторые из них транслируются в пять раз более эффективно, чем мРНК,синтезированные с обычными аналогами m7GpppG.(71)(73) Заявитель и патентовладелец: БОРД ОФ СЬЮПЕРВАЙЗОРЗ ОФ ЛУИЗИАНА СТЭЙТ ЮНИВЕРСИТИ ЭНД ЭГРИКАЛЧУРАЛ ЭНД МЕКЭНИКАЛ КОЛЛЕДЖ (US); ЮНИВЕРСИТИ ОФ ВАРШАВА (PL) 017740 Приоритет по дате подачи предварительной заявки на патент США 60/944842, поданной 19 июня 2007 г., заявлен согласно статье 119(е) 35 U.S.C. США и согласно принятым соглашениям и договорам во всех странах. Разработка настоящего изобретения частично финансировалась грантомR01GM20818 правительства Соединенных Штатов, выданным Национальному Институту Общих Медицинских Исследований (National Institute of General Medical Sciences). Правительство Соединенных Штатов обладает определенными правами на данное изобретение. Разработка настоящего изобретения частично финансировалось грантом 2 Р 04 А 00628 правительства Польши, выданным Министерству Науки и Высшего образования Польши (Polish Ministry of Scienceand Higher Education). Область техники, к которой относится изобретение Синтезированы новые анти-инвертированные фосфоротиоатные аналоги кэп-структуры матричной РНК и показана их польза в трансляции мРНК. Область техники 5'-Концы большинства матричных РНК (мРНК) эукариот заблокированы, или "кэпированы". Кроме того, существуют и некоторые другие формы РНК, которые также кэпированы, например малые ядерные РНК (мяРНК). Кэп-структура содержит 5'-5' трифосфатную связь между двумя остатками нуклеозида и 7-метильную группу на дистальном гуаниновом кольце. Кэпирование мРНК и мяРНК способствует их нормальному функционированию в клетках. Способность синтезировать копированные молекулы РНК in vitro полезна, поскольку она позволяет получать молекулы РНК, которые при использовании их во множестве биологических применений функционируют должным образом. Такие применения включают как исследования, так и коммерческое производство полипептидов, например, продуцирование в бесклеточной системе трансляции полипептидов,содержащих на определенном участке "неприродную" аминокислоту, или продуцирование в культивируемых клетках полипептидов, которым для восстановления активности или стабильности необходима пост-трансляционная модификация. В последних системах синтез протекает в течение значительно более длительного времени и, следовательно, производится больше белка. Наиболее часто используемый для получения копированных РНК in vitro способ представляет собой транскрипцию матрицы ДНК с помощью либо бактериальной РНК-полимеразы, либо РНКполимеразы бактериофага, в присутствии всех четырех рибонуклеозид трифосфатов и динуклеотида кэпструктуры, такого как m7G(5')ррр(5')G (далее в описании m7GpppG). Полимераза инициирует транскрипцию путем нуклеофильной атаки -фосфата следующего включенного в матрицу нуклеозидного трифосфата, используя 3'-ОН остатка Guo в m7GpppG, приводя к образованию исходного продуктаm7GpppGpN. В качестве альтернативы ГТФ-инициированный продукт pppGpN подавляют путем создания в реакционной смеси для транскрипции соотношения m7GpppG к ГТФ, находящегося в пределах от 5 до 10. Синтетические РНК могут быть синтезированы путем бесклеточной транскрипции ДНК-матриц. См. R. Contreras et al., "Simple, efficient in vitro synthesis of capped RNA useful for direct expression ofRNA hybridization probes from plasmids containing a bacteriophage SP6 promoter", Nucl. Acids Res., vol.12,pp.7035-7056 (1984). Полученные таким образом копированные РНК являются активными в реакциях сплайсинга, выполняемых in vitro. См. М. Konarska et al., "Recognition of cap structure in splicing in vitro of mRNA precursors", Cell, vol. 38, pp.731-736 (1984); and I. Edery et al., "Cap-dependent, RNA splicing in a HeLa nuclearextract", Proc. Natl. Acad. Sci. USA, vol.82, pp.7590-7594 (1985). По сравнению с некэпированными мРНК копированные мРНК транслируются в бесклеточных системах трансляции более эффективно. См. S. Muthukrishnan et al., "5'-Terminal 7-methylguanosine in eukaryotic mRNA is required for translation", Nature, vol. 255, pp. 33-37 (1975); L. Chu et al., "Paradoxical observations on the 5' terminus of ovalbumin messenger ribonucleic acid", J. Biol Chem., vol. 253, pp. 5228-5231affect analogue activity", Biochem., vol. 28, pp.4771-4778 (1989). С точки зрения трансляции 5'-неметилированные мРНК являются менее активными по сравнению с 5'-метилированными мРНК. См. G. Both et al., "Methylation-dependent translation of viral messenger RNAsin vitro", Proc. Natl. Acad. Sci. USA, vol. 72, pp. 1189-1193 (1975). Копированные мРНК, введенные в культивируемые клетки млекопитающих с помощью электропорации, транслируются более эффективно, чем некэпированные мРНК. См. Е. Grudzien et al., "Differential inhibition of mRNA degradation pathways by novel cap analogs", J. Biol. Chem. vol. 281, pp. 1857-1867 (2006).-1 017740 В статье A. Pasquinelli et al., "Reverse 5' caps in RNAs made in vitro by phage RNA polymerases", RNA,vol. 1, pp. 957-967 (1995), сообщается о том, что для инициации транскрипции полимеразы бактериофагов используется 3'-ОН группа остатка 7-метилгуанозина в m7GpppG, что является свидетельством того,что обычно примерно одна треть - половина продуктов РНК, полученных с помощью этих аналогов кэпструктуры, содержит кэп-структуру, имеющую обратную ориентацию, т.е. Gpppm7GpN. Такие инвертированно-кэпированные молекулы РНК ведут себя аномально. Те же самые авторы сообщают о том, что при введении инвертированно-кэпированных транскриптов pre-U1 мяРНК в ядра Xenopus laevis они экспортировались более медленно по сравнению с природными транскриптами. Аналогично цитоплазматические инвертированно-кэпированные U1 мяРНК в цитоплазме не были импортированы в ядро должным образом. Наличие кэп-структуры в мРНК сильно стимулирует трансляцию транскрипта мРНК в белок. В работе Е. Grudzien et al, "Novel cap analogs for in vitro synthesis of mRNAs with high translational efficiency",RNA vol. 10, pp.1479-1487 (2004) показано, что мРНК, содержащие кэп-структуры, встроенные исключительно в обратной ориентации, транслировались в бесклеточной системе только с 4%-ой эффективностью по сравнению с РНК, содержащими кэп-структуры, встроенные исключительно в нормальной ориентации. Статья J. Stepinski et al., "Synthesis and properties of mRNAs containing the novel 'anti-reverse' cap analogues 7-methyl(3'-O-methyl)GpppG and 7-methyl(3'-deoxy)GpppG", RNA, vol. 7, pp. 1486-1495 (2001) посвящена синтезу и использованию двух новых аналогов кэп-структуры, m73'dGpppG и m27,3'-oGpppG, которые не способны встраиваться в обратной ориентации. мРНК, кэпированные такими "антиинвертированными аналогами кэп-структуры" (ARCA), транслируются в системе in vitro более эффективно, чем мРНК, кэпированные обычным аналогом, m7GpppG. См. также патент США 7074596 и заявку на патент США 2003/0194759. В работе Z. Peng et al., "Synthesis and application of a chain-terminating dinucleotide mRNA cap analog", Org. Lett., vol.4, pp. 161-164 (2002), описан синтез m27,3'-oGpppG и его использование в транскрипцииin vitro гомогенно кэпированной РНК. В статье J. Jemielity et al., "Novel 'anti-reverse' cap analogues with superior translational properties",RNA, vol. 9, pp. 1108-1122 (2003) указано, что замещение во 2'-положении на -OCH3 или -Н для получения m27,2' -oGpppG или m72'dGpppG, соответственно, дает ARCA, обладающие свойствами, эквивалентными или немного более предпочтительными свойствам ARCA, замещенным в 3'-положении, как было измерено с использованием критериев связывания с трансляционным кэп-связывающим белком eIF4E,правильного встраивания в мРНК во время транскрипции in vitro и трансляционной эффективности полученных мРНК в бесклеточной системе. Количество белка, продуцированного из синтетических мРНК, введенных в культивируемые клетки млекопитающих, ограничено деградацией мРНК, происходящей в результате естественных процессов метаболизма. Основной путь деградации мРНК in vivo инициируется удалением кэп-структуры из неповрежденной мРНК специфической фосфатазой, Dcp1/Dcp2, которая расщепляет связи междуифосфатами. Е. Grudzien et al. , "Differential inhibition of mRNA degradation pathways by novel cap analogs", J.Biol. Chem., vol. 281, pp. 1857-1867 (2006) разработали и синтезировали аналог кэп-структуры, в которой атом О междуифосфатными группами замещен группой метилена, m27,3' -oGppCH2PG, причем мРНК,кэпированные этим аналогом, были устойчивы к гидролизу рекомбинантным человеческим Dcp2 in vitro. При введении в культивируемые клетки мРНК кэпированные m27,3' -o GppCH2PG были более стабильными по сравнению с мРНК, кэпированными m27,3' -oGpppG. Существуют два известных декэпирующих фермента: Dcp1/Dcp2, который воздействует на неповрежденную мРНК, инициируя 5'3' деградацию; и DcpS, который воздействует на короткие кэпированные олигонуклеотиды, приводя к 3'5' деградации. Поскольку Dcp1/Dcp2 или только Dcp2 высвобождает m7GDP из кэпированной мРНК, то, вероятно, расщепление происходит междуифосфатами. См. Z. Wang et al., "The hDcp2 protein is a mammalian mRNA decapping enzyme", Proc. Natl. Acad. Sci.erythrocyte adenylate cyclase and blocking of the catecholamine-stimulated GTPase by guanosine 5'-(gammathio) triphosphate", Biochem Biophys Res Commun, vol. 77, pp. 868-873 (1977). Кроме того было обнаружено, что полинуклеотиды, содержащие внутринуклеотидные фосфоротиоатные связи, расщеплялись более медленно по сравнению с их природными вариантами. См. Н. Matzura et al., "A polyribonucleotide containing alternation P=O and P=S linkages", Eur. J. Biochem., vol. 3, pp. 448-452 (1968). Интересно отметить, что диастереомеры фосфоротиоатов могут проявлять различную чувствительность к нуклеазам. Р 1 нуклеаза гидролизует диастереомер Sp быстрее, чем Rp. См. В. Potter et al., "Synthesis and configurational analysis of-2 017740 предпочтительнее расщепляют диастереомер Rp, чем Sp. См. F. Eckstein et al., "Stereochemistry of theAcad. Sci. U.S.A., vol. 75, pp. 4798-4800 (1978). Хотя мРНК, копированная m27,3' -oGppCH2pG, более стабильна в культивируемых клетках, она обладает более низкой трансляционной эффективностью, по-видимому, в связи с тем, что m27,3' -oGppCH2PG по сравнению с m27,3' -oGpppG связывается с eIF4E in vitro со значительно более низкой аффинностью. Таким образом, даже хотя в культивируемых клетках она является более стабильной, это преимущество обесценивается более низкой трансляционной эффективностью. В работе J. Kowalska et al. "Synthesis and properties of mRNA cap analogs containing phosphorothioatemoiety in 5',5'-triphosphate chain", Nucleos. Nucleot. Nucl. Acids, vol. 24, pp. 595-600 (2005), описан синтез трех аналогов кэп-структуры, у которых атом S заменен атомом О либо в - и -, либо в -фосфатных группах, например, m7GpsppG, m7GpppsG и m7Gpps-CH3pG. Эти синтезированные фосфоротиоатные аналоги кэп-структуры были более стабильными ингибиторами кэп-зависимой трансляции и были устойчивыми по отношению к декэпирующему ферменту DcpS. Однако по сравнению с обычными ARCA эти соединения не смогли бы показать более высокую трансляционную эффективность ни in vitro, ни in vivo,поскольку они встраивались бы в большой степени в обратной ориентации. Существует потребность в "модификации, при которой достигалась бы как более высокая трансляционная эффективность, так и повышенная устойчивость к деградации как in vivo, так и in vitro. Уникальные соединения, раскрытые в настоящем документе, обладают и тем и другим. Раскрытие изобретения Было обнаружено, что S-замещение в одном или нескольких фосфатах вместе с 2'-О метилзамещением дает новые аналоги, названные S-ARCA, обладающие неожиданными свойствами. Новая модификация ARCA гарантирует, что , , ифосфоротиоатные группы находятся точно в активных участках кэп-связывающих белков как в трансляционном, так и в декэпирующем комплексах. По меньшей мере, некоторые из этих аналогов являются устойчивыми к Dcp1/Dcp2. Некоторые из S-ARCA обладают намного более высокой аффинностью к eIF4E по сравнению с соответствующими аналогами, у которых отсутствует фосфоротиоатная группа. При введении в культивируемые клетки мРНК, содержащие различные S-ARCA, некоторые из них транслировались в пять раз более эффективно, чем мРНК, синтезированные с обычным аналогом, m7GpppG. Кроме того, время полужизни мРНК, кэпированных некоторыми S-ARCA, было в три раза длиннее времени полужизни мРНК, синтезированных немодифицированными кэп-структурами. Комбинация более эффективно транслируемой мРНК и более стабильной мРНК привела к более высокому уровню продуцирования белков-репортеров в трансфицированных клетках, чем в случае обычных синтетических мРНК или мРНК, кэпированных прежними ARCA. Возросла стабильность S-ARCA in vivo, и к удивлению увеличилась эффективность трансляции, обусловленная более высокой аффинностью к eIF4E, а также устойчивостью по отношению к Dcp1/Dcp2. Устойчивость к катализируемому Dcp2 гидролизу в физиологических условиях неожиданным образом коррелировала с -фосфоротиоатной группой в трифосфатах, и также предполагалась корреляция с фосфоротиоатом в тетрафосфатах. Другим преимуществом по сравнению с обычными ARCA является наличие Р-диастереоизомеризации благодаря фосфоротиоатным группам. В каждом случае, когда фосфоротиоатная группа находится точно в -, - или -положениях, все еще существуют две возможности размещения атома серы (proR и proS), которые дают два различных диастереомера с потенциально различной биологической активностью. Например, имелись существенные различия в аффинностях связывания с eIF4E между диастереомерами, представленными вариантами D1 и D2, а также мРНК, кэпированной m27,2' -oGppspG (D1), к тому же указанный D1 был намного более восприимчивым к Dcp2, чем его вариант D2. Следовательно, S-ARCA, чистые с точки зрения наличия диастереомеров, могут использоваться в качестве Р-хиральных зондов, полезных для изучения с точки зрения стереохимии протекания ферментативных процессов, в которых используется кэп-структура. Краткое описание фигур На фиг. 1 изображен синтезS-ARCA, m27,2' -oGpppsG (D1 и D2).Ha фиг. 2 изображен синтезS-ARCA, m27,2' -oGpsppG (D1 и D2). На фиг. 3 изображен синтезS-ARCA, m27,2' -oGppspG (D1 и D2). На фиг. 4 изображен синтез тетрафосфата у S-ARCA, m27,2' -o GppsppG (D1 и D2). На фиг. 5 изображен синтез S-ARCA с двумя фосфоротиоатными группами виположениях в трифосфатном мостике, m27,2' -o GppspsG (D1, D2, D3 и D4). На фиг. 6 А-6 Н представлены результаты анализа с помощью анионообменной ВЭЖХ синтезированных in vitro олигонуклеотидов, гидрализованных с помощью hDcp2. На фиг. 7 представлен распад копированной S-ARCA мРНК люциферазы в клетках HC11. На фиг. 8 представлена трансляционная эффективность кэпированных S-ARCA мРНК в клетках-3 017740 На фиг. 9 А-9 Е показано распределение кэпированной S-ARCA мРНК люциферазы между полисомами в клетках HC11 в виде седиментации в градиентах сахарозы, наблюдаемой при поглощении при 260 нм (А), и с помощью ПЦР в реальном времени, чтобы показать распределение мРНК люциферазы (В,С и D) и мРНК GAPDH (Е) . На фиг. 10 показана временная зависимость экспрессии люциферазы после нуклеопорации клетокHC11, содержащих S-ARCA-кэпированные мРНК. Варианты осуществления изобретения Материалы и способы Пример 1. Общие химические процедуры Промежуточные нуклеотиды разделяли в виде солей триэтиламмония с помощью ионообменной хроматографии на колонке, заполненной DEAD-сефадексом А-25 (НСО 3- форма), используя линейный градиент бикарбонат триэтиламмония (ТЕАВ) в деионизированной воде, с последующим выпариванием при пониженном давлении с добавлением этанола. Конечные продукты (аналоги кэп-структуры) разделяли либо с помощью аналитической, либо полупрепаративной ВЭЖХ с обращенными фазами (RPHPLC) и, после повторной сублимации, выделяли в виде солей аммония. Аналитическую ВЭЖХ выполняли на аппарате Spectra-Physics SP8800, оборудованном колонкой с обращенной фазой Supelcosil LC-18T (4,6250 мм, скорость потока 1,3 мл/мин) с линейным градиентом 0-25% метанола в 0,05 М аммоний ацетатном буфере, рН 5,9, используя УФ-детектирование при 260 нм. Полупрепаративную ВЭЖХ выполняли в системе Waters 600E Multisolvent Delivery System, оборудованной колонкой с обращенной фазой Waters HR-C-18 (19 300 мм, скорость потока 5,0 м/мин) с линейным градиентом метанола в 0,05 М аммоний ацетатном буфере, рН 5,9, используя УФ-детектирование при 260 нм.GMP и GDP были приобретены у компании Sigma-Aldrich и преобразованы в соли триэтиламмония с использованием ионообменной смолы Dowex 50 WX 8. Другие нуклеотиды, т.е. m7GMP, m27,2' -oGMP,m7GDP, m27,2' -oGDP были приготовлены, как сообщалось ранее в работе J. Jemielity et al. "Novel 'antireverse' cap analogues with superior translational properties", RNA, vol. 9, pp. 1108-1122 (2003). Соль, тиофосфат триэтиламмония, получали из Na3PSO3 путем превращения на ионообменной смоле Dowex 50WX 8 (после выпаривания до сухого состояния) и повторного выпаривания, используя 99,8% этанол, и хранили при -20 С. См. J. Kowalska et al. "A simple and rapid synthesis of nucleotide analogues containing aphosphorothioate moiety at the terminal position of the phosphate chain", Tetrahedron Lett., vol. 48, pp. 54755479 (2007). 7-метилгуанозин получали описанным ранее способом за исключением того, что вместо ДМА использовали ДМФА (см.; J. Jones et al., "Purine Nucleosides. 111. Methylation 'Studies of CertainNaturally Occurring Purine Nucleosides", J. Am. Chem. Soc, vol. 85, pp. 193-201 (1963. 7,2'-Oдиметилгуанозин синтезировали из 2'-O-метилгуанозина, используя аналогичную процедуру. 2'-Oметилгуанозин получали согласно J. Kusmierek et al., "A new route to 2'(3')-O-alkyl purine nucleosides",Nucleic Acids Res. vol. 1, pp.73-77, Special Publication4 (1978). Структуру и однородность конечных соединений подтверждали с помощью повторной хроматографии, используя ВЭЖХ с обращенными фазами, масс-спектрометрии, используя отрицательную электроспрей-ионизацию (MC ESI-), и 1 Н ЯМР и 31 Р ЯМР спектроскопии. (Результаты приведены в табл. 1). Запись спектров 1H ЯМР и 31 Р ЯМР производили при 25 С на спектрометре UNITY-plus при 399,94 МГц и 161,90 МГц, соответственно. 1H ЯМР химические сдвиги для 3-триметилсилил-[2,2,3,3-D4]-пропионата(TSP) в D2O были записаны в качестве внутреннего стандарта. 31 Р ЯМР химические сдвиги для 20%-ой фосфорной кислоты в D2O были записаны в качестве внешнего стандарта. Массовые спектры регистрировали спектрометром Micromass QToF 1 MS, используя отрицательную электроспрей ионизацию (ESI-). Пример 2. Общая процедура для производных имидазолидов нуклеотидов (GMP-Im, m27,2' -oGMP-Im, GDP-Im и 7,2' -oPreparation of active phosphorylating reagents", M. Bull. Chem. Soc. Jpn, vol. 44, 2284 (1971). Соответствующий нуклеотид (1 экв. соли TEA), имидазол (8 экв. ) и 2,2'-дитиодипиридин (3 экв.) смешивали в ДМФА (примерно 2,5 мл/100 мг нуклеотида). Добавляли триэтиламин (2 экв.) и трифенилфосфин (3 экв.), и смесь перемешивали в течение 6-8 ч. Продукт осаждали из реакционной смеси безводным перхлоратом натрия (1 экв. на один отрицательный заряд), растворяли в сухом ацетоне (примерно 8 мл/1 мл ДМФА). После охлаждения до 4 С преципитат фильтровали, повторно промывали холодным сухим ацетоном и сушили в вакууме над Р 4 О 10. Выход составлял 80-100%. В случае m7GMP, из-за более низкой растворимости в ДМФА, использовали реактивы в количестве, превышающем двукратный избыток, и время реакции увеличивали до 24 ч. Пример 3. Общая процедура для нуклеозид 5'-О-фосфоротиоатов (9-11) Суспензию соответствующих нуклеозидов (1 экв., которую сушили в течение ночи в вакууме над Р 4 О 10) в триметилфосфате (1,5 мл/100 мг нуклеозидов) охлаждали до 0 С в бане со смесью льда и воды. Добавляли 2,6-диметилпиридин (3 экв.) и PSCl3 (1/5 экв.). Реакционную смесь оставляли на ночь при температуре 0 С, затем реакцию останавливали с помощью 0,35 М ТЕАВ и перемешивали в течение 1 ч при комнатной температуре. Продукт разделяли хроматографией с DEAE-сефадексом, используя линей-4 017740 ный градиент 0-0,7M ТЕАВ. Выходы: (9) 380 мг (0,67 ммоль), начиная с 257 мг (0,91 ммоль) гуанозина(74%); (10) 57 мг (0,10 ммоль), начиная с 120 мг (0,42 ммоль) 7-метилгуанозина (24%); (11) 75 мг (0,13 ммоль), начиная с 7 0 мг (0,23 ммоль) 7,2'-О-диметилгуанозина (53%). Пример 4. Синтез нуклеозид 5'-(2-О-тиодифосфатов) 7,2'-О-диметилгуанозин 5 '-О-(2-тиодифосфат) (17). К суспензии 14 (100 мг, 0,21 ммоль) и соли триэтиламмония тиофосфата (220 мг) в 5 мл ДМФА добавляли безводный ZnCl2 (190 мг, 1,40 ммоль). Полученный раствор перемешивали в течение 20 мин при комнатной температуре. Реакцию останавливали добавлением раствора ЭДТА (520 мг, 1,40 ммоль) в 50 мл воды и нейтрализовали твердым NaHCO3. Продукт выделяли на сефадексе DEAE, используя 0-1,0 М градиент ТЕАВ. Выход: 106 мг (0,15 ммоль)(17) в виде соли TEA (71%). 7-метилгуанозин 5'-О-(2-тиодифосфат) (16). Это соединение синтезировали описанным выше для(17) способом, начиная с (13) (40 мг, 0,089 ммоль) и соли, триэтиламмония тиофосфат, (100 мг). Выход: 31 мг (0,046 ммоль) (16) в виде соли TEA (52%). Пример 5. Синтез кэп-структуры S-ARCA Ниже приведено описание синтеза различных кэп-структур S-ARCA. Пути синтеза изображены на фиг. 1, 2 и 3. Ссылочные позиции (номера) для соединений указаны согласно нумерации, приведенной на фиг. 1, 2 и 3.m7GpppsG D1 и D2 (1a, 1b). К суспензии (9) (10 мг, 0,018 ммоль) и 7 (15 мг, 0,027 ммоль) в ДМФА (0,8 мл) добавляли безводный ZnCl2 (30 мг, 0,22 ммоль). Реакционную смесь оставляли на 2 дня при комнатной температуре. Реакцию останавливали добавлением 90 мг ЭДТА в 10 мл воды и нейтрализовали твердым NaHCO3. Диастереомеры (1 а) и (1b) разделяли с помощью аналитической ВЭЖХ с обращенными фазами. Выход: 0,8 мг(1 а) и 1,0 мг (1b) в виде NH4+ солей. Схематически синтез показан на фиг. 1.m7GppspG D1 и D2 (2a, 2b). Это соединение синтезировали вышеописанным для 1 способом, начиная с 16 (20 мг, 0,030 ммоль),15 (23 мг, 0,053 ммоль), ZnCl2 (60 мг, 0,44 ммоль) в 2 мл ДМФА. Выход: 2,2 мг (2 а) и 1,8 мг (2b) в видеNH4+ солей. Схематически синтез показан на фиг. 3.m7GpsppG D1 и D2 (3 а, 3b). Это соединение синтезировали вышеописанным для 1 способом, начиная с (10) (58 мг, 0,090 ммоль), (12) (120 мг, 0,22 ммоль),. ZnCl2 (24 9 мг, 1,8 ммоль) в 3,5 мл ДМФА. Выход: 14,7 мг (3 а) и 10,1 мг (3b) в виде NH4+ солей. Схематически синтез показан на фиг. 2.m27,2' -oGpppsG D1 и D2 (4 а, 4b). Соединения (9) (48 мг, 0,084 ммоль) и (8) (57 мг, 0,10 ммоль) суспендировали в 2 мл ДМФА. Затем добавляли безводный ZnCl2 (115 мг, 0,84 ммоль). Полученный раствор оставляли на 2 дня при комнатной температуре. Реакцию останавливали добавлением 350 мг ЭДТА в 30 мл воды и нейтрализовали твердым бикарбонатом натрия. Продукты разделяли с помощью полупрепаративной ВЭЖХ с обращенными фазами, используя линейный градиент метанола в 0,05 М ацетате аммония, рН 5,9, из 0-50% в пределах 45 мин. Выход: 5,2 мг (4 а) и 7,4 мг (4b) в виде NH4+ солей. Схематически синтез показан на фиг. 1.m27,2' -oGppspG D1 и D2 (5 а, 5b). Это соединение синтезировали вышеописанным для (4) способом, начиная с (17) (106 мг, 0,16 ммоль), (15) (103 мг, 0,24 ммоль) и ZnCl2 (260 мг, 1,9 ммоль) в 5 мл ДМФА. Реакцию останавливали добавлением 800 мг ЭДТА в 100 мл воды и нейтрализовали твердым бикарбонатом натрия. Продукты разделяли полупрепаративной ВЭЖХ с обращенными фазами, используя изократический 0,05 М ацетат аммония, рН=5,9. Выход: 10,0 мг (5 а) и 12,1 мг (5b) в виде NH4+ солей. Схематически синтез показан на фиг. 3.m27,2'-oGpsppG D1 и D2 (6 а, 6b). Это соединение синтезировали вышеописанным для (4) способом, начиная с (11) (70 мг, 0,15 ммоль), (12) (107 мг, 0,20 ммоль) и безводного ZnCl2 (220 мг, 1,6 ммоль) в 3 мл ДМФА. Реакцию останавливали 650 мг ЭДТА в 70 мл воды. Продукты разделяли, полупрепаративной ВЭЖХ с обращенными фазами, используя линейный ингредиент метанола в 0,05 М ацетате аммония, рН=5,9, из 0-50% в пределах 45 мин. Выход: 15 мг (6 а) и 20 мг (6b) в виде NH4+ солей. Схематически синтез показан на фиг. 2. Структуру и однородность вышеуказанных конечных соединений подтверждали с помощью повторной хроматографии, используя ВЭЖХ с обращенными фазами, масс-спектрометрии, используя отрицательную электроспрей-ионизацию (MS ESI-), и 1H ЯМР и 31 Р ЯМР спектроскопии. Результаты приведены ниже в табл. 1.-5 017740 Таблица 1. 1 Н ЯМР химические сдвиги в частях на миллион (0,01) против внутреннего 3 триметилсилил-[2,2,3,3-2 Н 4]-пропионата натрия и 31 Р ЯМР химические сдвиги в частях на миллион Пример 6. Синтез тетрафосфатного S-ARCA Применимость разработанной стратегии синтеза S-ARCA, содержащего 5',5'-тетрафосфатный мостик, показана на примере синтеза m27,2'-oGppsppG (фиг. 4). Синтез трех других тетрафосфатных S-ARCA(30 мг, 0,05 6 ммоль) суспендировали в 2 мл ДМФА. Затем добавляли безводный ZnCl2 (61 мг, 0,45 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 3 дней. Реакцию останавливали добавлением ЭДТА (166 мг, 0,4 5 ммоль) в 20 мл воды и нейтрализовали твердым бикарбонатом натрия. Продукты разделяли с помощью ионообменой хроматографии на DEAE-сефадексе, используя 0-1,2 М градиент TEAB. Фракции, содержащие диастереомерную смесь из m27,2'-o GppsppG, собирали, сливали вместе и выпаривали при пониженном давлении с повторным добавлением этанола. Заключительную очистку проводили с помощью полупрепаративной ВЭЖХ с обращенными фазами, используя линейный градиент метанола в 0,05 М ацетате аммония, рН=5,9, от 0-25% в пределах 60 мин. Выход: 7 мг m27,2' -oGppsppG (диастереомерная смесь) в виде NH4+ соли.-6 017740 Пример 7. Синтез S-ARCA с двумя фосфоротиоатными группами Разработанная стратегия также предлагает способ синтеза соединений, содержащих множество фосфоротиоатных групп в 5',5'-полифосфатном мостике, которые могут быть получены по схеме синтеза,предложенной на фиг. 5 на примере соединения m27,2'-o GppspsG. Производное имидазолида гуанозин 5'-Отиофосфата получали аналогично согласно процедуре, описанной выше для производного имидазолида аденозин 5'-О-тиофосфата [М. Shimazu et al. "Regio- and stereocontrolled synthesis of 2'-5'-linked phosphorothioate oligoadenylates by uranyl ion catalyst in aqueous solution", J. Chem. Soc, Perkin Trans. 1, 2002,1778-1785], и очищали на колонке, заполненной DEAE-сефадексом А-25, с линейным градиентом бикарбоната триэтиламмония (0-0,5 М ТЕАВ в деионизированной воде). Схема синтеза приведена на фиг. 5. Гуанозин 5 '-О-(1,2-дитиодифосфат). Производное имидазолида гуанозин 5'-О-монотиофосфата (соль триэтиламмония, 53 мг, 0,1 ммоль) смешивали с солью, триэтиламмония фосфоротиоат, (320 мг, примерно 1,2 ммоль) и полученную смесь суспендировали в 3,5 мл ДМФА. Затем добавляли безводный хлорид цинка (55 мг, 0,4 ммоль) и хлорид марганца (50 мг, 0,4 ммоль). Реакцию останавливали добавлением раствора ЭДТА (270 мг, 0,8 ммоль в 35 мл воды) и, используя бикарбонат натрия, доводили рН до 7. Хроматографическое выделение выполняли на колонке, заполненной DEAE-сефадексом А-25, с линейным градиентом бикарбоната триэтиламмония (0-0,9 М ТЕАВ в деионизированной воде). Фракции,содержащие гуанозин 5'-О-(1,2-дитиодифосфат), собирали и выпаривали при пониженном давлении с добавлением этанола, и полученное твердое вещество сушили в вакууме над Р 4 О 10.m27,2' -oGppspsG. Производное имидазолида 7,2'-О-диметилгуанозин 5'-O-монофосфата (натриевая соль, 23 мг, 0,05 ммоль) смешивали с гуанозин 5'-О-(1,2-дитиодифосфатом) (триэтиламмониевая соль, 39 мг, 0,05 ммоль),и полученную смесь суспендировали в 1,5 мл ДМФА. Затем добавляли безводный хлорид цинка (55 мг,0,4 ммоль). Реакцию останавливали добавлением раствора ЭДТА (135 мг, 0,4 ммоль в 20 мл воды) и, используя бикарбонат натрия, доводили рН до 7. Хроматографическое выделение и разделение диастереомеров m27,2' -oGppspsG (D1, D2, D3, D4) выполняли с помощью полупрепаративной ВЭЖХ с обращенными фазами. Пример 8. Клеточная культура Эпителиальные клетки молочной железы HC11 получали путем клонирования мышиных клеток молочной железы линии COMMA-1D. См. K. Danielson et al. "Epithelial mouse mammary cell line exhibiting normal morphogenesis in vivo and functional differentiation in vitro", Proc. Natl. Acad. Sci. U.S.A., vol.81,pp.3756-3760 (1984). Клетки выращивали в среде RPMI 1640, содержащей 10%-ую фетальную телячью сыворотку (HyClone), 5 мкг/мл бычьего инсулина (Sigma) и 10 нг/мл рекомбинантного EGF (BD Biosciences). Пример 9. Синтез мРНК in vitro Копированные РНК синтезировали транскрипцией in vitro с помощью полимеразы Т 7 в присутствии кодирующей люциферазу плазмиды (pluc-А 60) при наличии всех четырех нуклеозид трифосфатов и различных динуклеотидов кэп-структуры. См. J. Jemielity et al. "Novel 'anti-reverse' cap analogues with superior translational properties," RNA, vol. 9, pp. 1108-1122 (2003). Обычная реакционная смесь для транскрипции содержала 40 мМ Трис-HCl, рН 7,9, 6 мМ MgCl2, 2 мМ спермидина, 10 мМ ДТТ, 0,1 мг/мл BSA,1 ед/мкл RNasin (Promega), 0,5 мМ АТФ, 0,5 мМ ЦТФ, 0,5 мМ УТФ, 0,1 мМ ГТФ, 1 мМ аналог кэпструктуры, 15 мкг/мл ДНК и 1 ед/мкл полимеразы Т 7 (Promega). Содержащий полную последовательность, кодирующую люциферазу светлячка, pluc-А 60 в pGEM4 (Promega) и 3'-терминальный 60-nt поли(А) участок (см. Е. Grudzien et al., "Differential inhibition of mRNA degradation pathways by novel capanalogs", J. Biol. Chem., vol. 281, pp. 1857-1867 (2006 расщепляли с помощью HpaI для синтеза мРНК люциферазы и с помощью NcoI для синтеза копированных олигонуклеотидов. Короткие РНК (копированные олигонуклеотиды, состоящие примерно из 48 нуклеотидов) синтезировали в присутствии 10 мкКи/мкл [ -32 Р]ГТФ(ICN) в 50-мкл реакционных смесей, инкубированных в течение 45 мин при 37 С. Реакционные смеси экстрагировали фенолом и хлороформом, и затем отделяли РНК от невстроившихся нуклеотидов, используя спин-колонки (Ambion) согласно протоколу изготовителя. Концентрации мРНК определяли с помощью счетчика Черенкова (Cerenkov), в котором удельную радиоактивность [-32 Р]ГТФ в конечной реакционной смеси для транскрипции использовали для преобразования счета распадов в пмоль. мРНК синтезировали в 200 мкл реакционных смесей, инкубированных в течение 45 мин при 37 С. После инкубации 200 мкл реакционных смесей обрабатывали 3 единицами ДНКазы RQ1 (Promega) в течение 20 мин при 37 С, и РНК очищали с помощью мини-набора РНКаз (Qiagen), используя протокол изготовителя. Концентрацию РНК определяли спектрофотометрически. Пример 10. Анализ in vitro декапирования РНК Активность Dcp2 измеряли, используя в качестве субстратов копированные 48-nt олигонуклеотиды,укороченная форма мРНК люциферазы (48 нуклеотидов). GST-hDcp2 экспрессировали в Escherichia coli и очищали способом, описанным у Z. Wang et al., "The hDcp2 protein is a mammalian mRNA decappingenzyme", Proc. Natl. Acad. Sci. U.SA., vol. 99, pp. 12663-12668 (2002). Копированные олигонуклеотиды сначала подвергали катализированному GST-hDcp2 расщеплению при 37 С в течение 2 ч в буфере для декэпирования (10 мМ Трис-HCl, рН 7,5, 100 мМ ацетат калия, 2 мМ ацетат магния, 0,5 мМ MnCl2, 2 мМ дитиотриэтол и 0,1 мМ спермин). См. С. Piccirillo et al., "Functional characterization of the mammalianmRNA decapping enzyme hDcp2", RNA, vol. 9, pp. 1138-1147 (2003). Затем реакционную смесь экстрагировали один раз равным объемом фенола и два раза хлороформом и осаждали РНК этанолом. Затем продукты реакции декэпирования расщепляли коктейлем рибонуклеаз (RiboShredder; Epicentre) при 37 С в течение 1 ч. Продукты разделяли анионообменной ВЭЖХ на 4,6250 мм колонке Partisil 10SAX/25(Whatman). Градиент состоял из воды в течение 1 мин, линейного градиента 112 мМ KH2PO4, рН 4,5, в течение 20 мин, линейного градиента 112-450 мМ KH2PO4 в течение 15 мин, линейного градиента 450 мМ-1,5 М KH2PO4 в течение 15 мин и изократической элюции в 1,5 М KH2PO4 в течение 9 мин, все проводили при скорости потока 1 мл/мин. Пример 11. Измерение трансляционной эффективности и разрушения мРНК в клетках НС 11 Для доставки РНК в клетки использовали два способа, электропорацию и нуклеопорацию. В случае электропорации 5 мкг РНК вводили в 107 клеток НС 11 в среде RPMI 1640 с уменьшенным количеством сыворотки, общий объем среды составлял 400 мкл, в кювете Gene Pulser (4-мм щель) на Bio-RadGenepulser, установив 0,22 кВ и 960 мкФ. После разрядки клетки промывали два раза PBS, центрифугировали в течение 2 мин при 300g при комнатной температуре, ресуспендировали в предварительно нагретой полной среде и выдерживали при 37 С. Нуклеопорацию выполняли, используя Amaxa Nucleofector II (Amaxa Biosystems) согласно рекомендациям изготовителя. Один микрограмм РНК вводили в 106 клеток HC11, используя Nucleofector Solution V и установки согласно рекомендуемым режимам(программа Т-024). Для измерения трансляционной эффективности клетки разделяли в несколько пробирок Eppendorf,помещали в водяную баню при 37 С и встряхивали. Для измерения стабильности мРНК клетки распределяли в 35-мм чашки для клеточных культур и выдерживали при 37 С в увлажненной атмосфере 5% СО 2. Клетки отбирали в различные моменты времени и дважды промывали PBS. Для экстракции цитоплазматической РНК 2 105 клеток лизировали в 175 мкл лизирующего буфера(50 мм Трис-HCl, рН 8,0, 140 мМ NaCl, 1,5 мМ MgCl2, 0,5% (об/об) Igepal (Sigma) и 1 мМ дитиотриэтол). Затем РНК очищали, используя мининабор РНКаз. Для экстракции белка 2105 клеток лизировали в 200 мкл реагента для лизиса Luciferase Cell Culture Lysis Reagent (Promega). Активность люциферазы клеточных экстрактов измеряли согласно протоколу изготовителя (Promega). Пример 12. Приготовление полисом Для разделения рибосомальных субъединиц и комплексов инициации 4106 НС 11 клеток обрабатывали в течение 2 мин ледяным PBS, содержащим 0,1 мг/мл циклогексимида, дважды промывали той же самой средой и лизировали в 600 мкл буфера, содержащего: 0,3M NaCl, 15 мМ Трис-HCl (рН 7,6), 15 мМMgCl2, 1% Тритон Х-100, 1 мг/мл гепарина и 0/1 мг/мл циклогексимида. После центрифугирования при 14000g в течение 10 мин супернатант наслаивали на 15-45% градиент сахарозы в том же самом буфере,но без Тритона Х-100, и центрифугировали в роторе Beckman SW41 Ti при 38000 об/мин при 4 С в течение 2 ч. Градиенты фракционировали, непрерывно отслеживая поглощение при 260 нм. РНК из каждой фракции (1 мл) выделяли и анализировали с помощью ПЦР в реальном времени. Пример 13. ПЦР в реальном времени Для измерения стабильности мРНК примерно 2 мкг каждого образца общей РНК, выделенной из клеток НС 11 и очищенной с помощью мини-набора РНКаз (Qiagen), обрабатывали 3 ед. ДНКазы RQ1(Promega) в течение 20 мин при 37 С. Обратную транскрипцию выполняли с 400 нг РНК в 20 мкл реакционных смесей, содержащих 5,5 мМ MgCl2, 500 мкМ каждого dNTP, 2,5 мкМ случайных гексамеров,0,2 ед. ингибитора РНКазы и 0,8 ед. обратной транскриптазы MultiScribe (Applied Biosystems). Реакционные смеси инкубировали при 25 С в течение 10 мин, при 48 С в течение 30 мин и при 95 С в течение 5 мин. Количественную ПЦР в реальном времени выполняли, используя специфические праймеры, разработанные для каждой мРНК с помощью Beacon Designer (Bio-Rad). Для детектирования последовательностей на 5'-конце мРНК люциферазы праймеры представляли собой 5'-CGTTCGGTTGGCAGAAGCTA3' (SEQ ID NO:1) и 5'-ACTGTTGAGCAATTCACGTTCATT-3' (SEQ ID NO:2). мРНК люциферазы из кэпструктуры в начале 3'-терминального гомополимерного участка состояла из 1714 нуклеотидов. Эти праймеры амплифицировали нуклеотиды 226-398. Уровни мышиных мРНК GAPDH измеряли тем же самым способом и в тех же самых образцах РНК,используя праймеры 5'CAATGTGTCCGTCGTGGATCT-3' (SEQ ID NO:3) и 5'-GAAGAGTGGGAGTTGCTGTTGA-3' (SEQ IDNO:4). Амплификацию и детектирование выполняли с помощью системы детектирования методом ПЦР в реальном времени iCycler IQ в 25 мкл реакционных смесей, содержащих 5 мкл реакционной смеси для транскрипции (50 нг кДНК), 12,5 мкл IQ SYBRgreen Supermix и 0,3 мМ праймеров (Bio-Rad). Условия инкубации были следующими: 3 мин при 95 С для активации полимеразы и 40 циклов по 15 с при 95 С и-8 017740 1 мин при 60 С. Уровни мРНК люциферазы вычисляли, используя метод абсолютной стандартной кривой, как описано в бюллетене для пользователей 2 (User Bulletin2) для системы детектирования последовательностей ABI Prism 7700. После вычисления количества мРНК люциферазы на основе стандартной кривой,полученную величину нормализовали на количество мышиной мРНК GAPDH в каждом образце. Количество мРНК люциферазы для каждой временной точки преобразовывали в процент от РНК, присутствовавшей в нулевой момент времени, и для определения времени полужизни результаты отображали на графике зависимости log10([РНК]) от времени. Для анализа РНК из полисомных градиентов к каждой фракции перед выделением РНК в качестве внутреннего стандарта добавляли синтезированную in vitro мРНК GFP для контроля за изменением выхода РНК. Уровень мРНК GFP использовали для нормализации уровней люциферазы и мРНК GAPDH. Пример 14. Аффинность связывания с eIF4E Аффинность связывания аналогов S с мышиными eIF4E определяли подавлением флуоресценции. Титрометрическое измерение флуоресценции выполняли на спектрофлуорометре LS-50B (Perkin ElmerCo.) в реакционной смеси, содержащей: 50 мМ HEPES/KOH (рН 7,2), 100 мМ KCl, 0,5 мМ ЭДТА, 1 мМ ДТТ, при 20,00,2 С. Аликвоты объемом 1 мкл с увеличивающейся концентрацией растворов аналогов кэп-структуры добавляли к 1,4 мл 0,1 растворов белка. Интенсивность флуоресценции (возбуждение при 280 нм с 2,5-нм полосой пропускания и детектирование при 337 нм с 4-нм полосой пропускания и 290-нм фильтром с ограниченной полосой пропускания) корректировали, учитывая растворение образца и эффект внутренней фильтрации. Равновесную константу ассоциации (KAS) определяли путем подгонки теоретической зависимости интенсивности флуоресценции от общей концентрации аналогов кэп-структуры к точкам полученных экспериментальных данных, согласно ранее описанному уравнению (см. A. Niedzwiecka et al., "Biophysical studies of eIF4E cap-binding protein: recognition of mRNA 5' cap structure and synthetic fragments of eIF4G and 4E-BP1 proteins", J. Mol. Biol, vol. 319, pp. 615-635 (2002. Концентрацию белка подбирали в виде свободного параметра равновесного уравнения, показывающего количество "активного" белка. Конечную KAS вычисляли в виде взвешенного среднего для трех-десяти независимых титрований с весами, взятыми в виде обратных величин стандартных квадратичных отклонений, полученных численным методом. Численный нелинейный регрессионный анализ методом наименьших квадратов выполняли, используя программу ORGIN 6.0 (Microcal Software Inc, USA). Свободную энергию связывания Гиббса вычисляли из величины KhS согласно стандартному уравнению G = -RTlnKAS. Пример 15. Ферментативный гидролиз с помощью человеческого DcpS и DcpS С. elegans Человеческий DcpS и DcpS нематоды экспрессировали в Escherichia coli согласно процедурам, описанным ранее (L.S. Cohen et al., "Nematode m7GpppG and m3(2,2,7)GpppG decapping: activities in Ascarisembryos and characterization of С elegans scavenger DcpS", RNA, vol. 10, pp. 1609-1624 (2004. Оба белка хранили при -80 С в 20 мМ Трис-буфере, рН 7,5, содержащем 50 мМ KCl, 0,2 мМ ЭДТА, 1 мМ ДТТ, 0,5 мМ PMSF и 20% глицерин. Соответствующий аналог кэп-структуры с концентрацией 1 мМ обрабатывали 5,0 или 7,0 мкл DcpS (человека или С. elegans, соответственно) в 500 мкл 50 мМ ТРИС-буфера,рН=7,9, содержащего 20 мМ MgCl2 и 60 мМ (NH4)2SO4, при 37 С в течение 60-90 мин. Каждые 15-20 мин из реакционной смеси отбирали по 100 мкл образца и дезактивировали инкубацией при 90 С в течение 3 мин. Собранные образцы анализировали без дополнительной обработки с помощью аналитической ВЭЖХ с обращенными фазами, используя линейный градиент метанола в 0,1 М KH2PO4, рН=6,0, от 050% в пределах 15 мин, и УФ-детектированием при 260 нм. Пример 16. Подавление кэп-зависимой трансляции Для трансляции in vitro использовали лизат ретикулоцитов кролика, обработанный нуклеазой микрококка (A. Cai et al., "Quantitative assessment of mRNA cap analogues as inhibitors of in vitro translation",Biochemistry, vol.38, pp.8538-8547 (1999. Оптимальную кэп-зависимую трансляцию получали в 100 мМ ацетате калия и 1,4 мМ хлориде магния. Для определения подавления трансляции различными аналогами кэп-структуры природную мРНК глобина кролика добавляли к лизату при концентрации 5 мкг/мл, и синтез белка измеряли встраиванием [3H]Leu. Нормализацию данных KI проводили ранее описанным способом (Cai et al., 1999). Концентрацию растворов динуклеотидных аналогов кэп-структуры измеряли УФпоглощением при рН 7,0, используя =255 нм и M=22,610-3 М. Результаты Пример 17. Синтез аналогов кэп-структуры Способы синтеза, дающие аналоги, содержащие фосфоротиоатную группу в , иположениях трифосфатной цепи, изображены на фиг. 1, 2 и 3, соответственно. Синтезировали серию из шести аналогов кэп-структуры, несущих одну фосфоротиоатную группу либо в , , либо вположении 5',5'-трифосфатной цепи (см. ниже). В виду наличия стереогенного Рцентра каждый S-аналог получали в виде смеси двух диастереомеров, обозначенных, как D1 и D2 согласно порядку их элюции при проведении ВЭЖХ с, обращенными фазами. Каждый S-аналог успешно разделяли с помощью ВЭЖХ с обращенными фазами, получив двенадцать соединений, которые затем были охарактеризованы биофизическими и биохимическими параметрами. Шесть из S-аналогов содер-9 017740 жали модификацию ARCA, 2'-О-метильную группу в остатке m7Guo, и названия в настоящем описанииS-ARCA. Введение фосфоротиоатной группы в -положение привело к устойчивости по отношению кDcp2, увеличило время полужизни и улучшило трансляционную эффективность. Химический синтез S-ARCA представлял собой модификацию синтеза, первоначально разработанного для аналогов кэп-структуры с немодифицированными 5',5'-полифосфатными мостиками. См. M.(2003). В ДМФ соединены два вида мононуклеотидов, один из которых быстрее превращается в реактивное производное имидазолида. Протекание реакции облегчали 8-кратным избытком ZnCl2, который значительно улучшает растворимость реагентов в органических средах, препятствует гидролизу производных имидазолида и ускоряет реакцию. Важной стадией в синтезе является присоединение соответствующего производного имидазолида к нуклеозид 5'-фосфоротиоату или 5'-(2-тиодифосфату) в ДМФА в присутствии ZnCl2. Промежуточные нуклеозид 5'-(2-тиодифосфаты) эффективно получали с помощью аналогичной, недавно разработанной реакции, в которой в качестве нуклеофила используется анион тиофосфата (PSO33-). См. J. Kowalska et al., "A simple and rapid synthesis of nucleotide analogues containinga phosphorothioate moiety at the terminal position of the phosphate chain", Tetrahedron Lett vol. 48, 2007,5475-5479. Стратегия разработанной авторами изобретения реакции позволяет вводить фосфоротиоатную группу в выбранные положения полифосфатной цепи, а также получать промежуточные нуклеозид 5'-(2-тиодифосфаты). Как показано выше и как используется в формуле изобретения, фосфатная группа, которая называется , представляет собой фосфатную группу, наиболее удаленную от 7-метилгуанозинового остатка. Положение, называемое , представляет собой следующий фосфат в направлении к 7 метилгуанозиновому остатку, и положение, называемое , представляет собой следующий фосфат в направлении к 7-метилгуанозиновому остатку. В трифосфате ARCA, как показано выше, представляет собой наиболее близко расположенный к 7-метилгуанозиновому остатку фосфат. В тетрафосфатеARCA отделен от 7-метилгуанозинового остатка фосфатом. (Очевидно, что в отношении ARCA без 7-метилгуанозинового остатка вышеприведенное определение должно быть модифицировано, чтобы ссылка соответствовала остатку с тем положением, который является аналогичным положению 7 метилгуанозинового остатка в приведенных здесь примерах). Способ синтеза, дающий аналоги 1 и 4, модифицированные в -положении 5',5'-трифосфатного мостика (т.е. m7GpppsG и m27,2'-o GpppsG), изображен на фиг. 1. В обеих заключительных реакциях присоединения использовали 1,5-2-кратный избыток фосфороимидазолида с тем, чтобы гарантировать полный расход нуклеозид 5'-тиофосфата. Присоединение протекало устойчиво, приводя почти к полному расходу субстрата за 1-2 дня. Синтез аналогов 3 и 6, модифицированных вположении (т.е. m7GpsppG иm27,2'-oGpsppG), который изображен на фиг. 2, аналогичен вышеописанному синтезу. В каждом случае- 10017740 образование двух диастереомеров определяли с помощью ВЭЖХ с обращенными фазами, как показано на фиг. 2. Промежуточные нуклеозид 5'-тиофосфаты 9, 10 и 11 синтезировали через тиофосфорилирование соответствующих нуклеозидов, используя PSCl3 в триметилфосфате в присутствии 2,6 диметилпиридина, при 0 С, аналогично ранее описанным процедурам (J.R. Moran et al., "A practical enzymatic synthesis of (S[P])-adenosine 5'-O-(1-thiotriphosphate) S[P])-ATP-a-S)", J. Org. Chem., vol. 49, pp. 704-706 (1984. В случае соединений 10 и 11 метилирование в N7 положении необходимо выполнять на стадии нуклеозида до стадии тиофосфорилирования, поскольку, в ином случае, метилйодид предпочтительно будет алкилировать атом серы (неопубликованные результаты). Превращение нуклеозид 5'дифосфатов в производные имидазолида (7, 8 и 12-15) легко протекает через реакцию с имидазолом, в которой используется система активации 2,2'-дитиодипиридин/трифенилфосфин (Т. Mukaiyama et al.,"Phosphorylation by oxidation-reduction condensation. Preparation of active phosphorylating reagents", Bull.m27,2'-oGppspG (5), синтезировали согласно изображенной на фиг. 3 схеме. Анализ ВЭЖХ заключительного присоединения выявил образование двух Р-диастереоизомеров. Однако их времена задержки были очень схожими. Для получения промежуточных нуклеозид 5'-О-(2-тиодифосфатов) 16 и 17 была использована недавно разработанная реакция присоединения к нуклеозид 5'-монофосфат имидазолиду соли,триэтиламмония тиофосфат (PSO33-), в виде нуклеофила (J. Kowalska et al., "A simple and rapid synthesis ofnucleotide analogues containing a phosphorothioate moiety at the terminal position of the phosphate chain", Tetrahedron Lett, vol. 48, 2007, 5475-5479). Во всех реакциях, дающих аналоги 1-6 кэп-структуры, анализ ВЭЖХ выявил, что желаемые соединения были образованы в виде главных продуктов только с умеренным количеством побочных продуктов. Тем не менее, препаративный выход был значительно ниже выхода, указываемого ВЭЖХ, и в целом составлял 10-20%. Вероятно, это происходит из-за больших потерь материала во время длительного разделения диастереомеров методом ВЭЖХ с обращенными фазами, который во многих случаях для получения чистых с точки зрения диастереоизомеров образцов выполняли неоднократно. Пример 18. Реакция декапирования in vitro Проводили тестирование олигонуклеотидов, копированных любым S-ARCA, на гидролиз рекомбинантным hDcp2, с целью проверки, будет ли мРНК, кэпированная различными диастереомерами m27,2'-oGpppsG иm27,2'-oGppspG, отличаться по чувствительности к расщеплению Dcp1/Dcp2. См., в основном, Z. Wang et al.,"The hDcp2 protein is a mammalian mRNA decapping enzyme," Proc. Natl. Acad. Sci. U.S.A., vol. 99, pp. 1266312668 (2002), и Z. Wang et al., "An mRNA Stability Complex Functions with Poly(A)-Binding Protein To Stabilize mRNA in vitro", Mol. Cell. Biol., vol. 19, pp. 4552-4560 (1999). Использованные аналоги кэпструктуры сначала были немаркированными, поэтому с тем, чтобы отслеживать продукты реакции расщепления, синтезировали кэпированные олигонуклеотиды в присутствии [-32 Р]ГТФ и матрицы ДНК, в которой Г был первым рибонуклеотидом, определенным после промотора. Олигонуклеотиды, кэпированные любым S-ARCA, расщепляли с помощью Dcp2 in vitro, после чего продукты дополнительно расщепляли с помощью коктейля рибонуклеаз (RiboShredder от Epicenter). Любой нуклеотид приобретал на 5'-конце остатка Г 32 Р-меченную 3'-фосфатную группу после расщепления рибонуклеазами путем переноса ближайшего соседа. Затем использовали анионообменную хроматографию для отделения меченых 3'-нуклеозид монофосфатов (3'-NMP), имеющих внутренние положения в РНК, от меченых 5'терминальных продуктов (фиг. 6). Последние, соответственно, содержат p3Gp, полученные из некэпированных транскриптов и m27,2'-oGp3Gp (если использовали m27,2'-oGp3G), или pGp, получающийся из кэпированной РНК, устойчивой или неустойчивой к ферментативному расщеплению. Все использованные аналоги кэп-структуры представляли собой ARCA, что гарантировало их встраивание в РНК исключительно в правильной ориентации. Это также гарантировало обнаружение после обработки рибонуклеазами только 5'-терминального продукта (m27,2'-oGp3Gp). Некэпированная РНК не является субстратом для Dcp2, что объясняет обнаружение продукта p3Gp после расщепления с помощью Dcp2. Для определения того, какие аналоги кэп-структуры защищают мРНК от расщепления с помощьюhDcp2, кэпированную 32 Р-меченную короткую РНК расщепляли с помощью рекомбинантной hDcp2 в условиях, при которых (i) олигонуклеотид, копированный m27,2'-o Gp3G был полностью расщеплен с помощью hDcp2 (фиг. 6 А), и (ii) олигонуклеотид, копированный m27,3'-oGppCH2pG, был устойчивым (фиг. 6 В). Ранее было показано, что m27,3'-oGppCH2pG защищает мРНК от деградации hDcp2. См. Е. Grudzien etal., "Differential inhibition of mRNA degradation pathways by novel cap analogs", J. Biol. Chem., vol. 281, pp. 1857-1867 (2006). Авторами изобретения было обнаружено, что только изомер D2 m27,2' -oGppspG стабилизировал РНК от гидролиза hDcp2 (фиг. 6F). Олигонуклеотиды, копированные изомерами m27,2'-oGpppsG и m27,2'-o GpsppG, не показывали увеличения стабильности по отношению к hDcp2 (фиг. 6 С, 6D, 6G и 6 Н). Пример 19. 5'-Деградация мРНК, кэпированных фосфоротиоатными аналогами кэп-структуры Поскольку короткие РНК, копированные m27,2'-oGppspG (D2), были устойчивыми к гидролизуhDcp2, авторами изобретения была предсказана возможность влияния присутствия этого аналога кэпструктуры в клетках на стабильность мРНК. Для введения синтетической мРНК люциферазы в эпителиальные клетки молочной железы мыши HC11 была использована либо нуклеопорация, либо электропо- 11017740 рация. Эти способы позволяют измерять уровень синтеза люциферазы и уровни мРНК люциферазы в клетках практически сразу после разрядки. Электропорацию проводили в оптимизированных ранее условиях. См. Е. Grudzien et al., "Differential inhibition of mRNA degradation pathways by novel cap analogs",J. Biol. Chem., vol.281, pp.1857-1867 (2006). Нуклеопорацию проводили в условиях, рекомендованныхAmaxa Biosystems (см. раздел "Материалы и способы"). Поскольку протокол Amaxa давал самую высокую эффективность трансфекции, а также самую высокую жизнеспособность клеток, его использовали в большинстве раскрытых в настоящем описании экспериментов. Синтезировали in vitro мРНК люциферазы, содержащую различные 5'-терминальные кэп-структуры и 3'терминальный 60-nt поли(А) участок (Luc-А 60). После нуклеопорации клетки отбирали либо с интервалами до 90 мин для измерения трансляционной эффективности, используя скорость увеличения активности люциферазы; либо до 8 ч для измерения стабильности мРНК люциферазы с помощью ПЦР в реальном времени. Определение трансляционной эффективности и стабильности мРНК могло бы быть ошибочным, если бы мРНК были получены из клеток, содержащих как транслируемые, так и нетранслируемые мРНК. Для решения этой проблемы была определена скорость деградации общей цитоплазматической мРНК относительно полисомной мРНК. мРНК люциферазы, кэпированную m27,2'-oGp3G, подвергали нуклеопорации в клетках HC11,которые затем лизировали через различные промежутки времени и наслаивали на градиент сахарозы для отделения полисом от комплексов инициации. Полисомные фракции объединяли и РНК очищали. Для последующей цитоплазматической деградации мРНК использовали мРНК, выделенную из общих клеточных экстрактов. В обоих случаях количественное определение мРНК люциферазы проводили с помощью ПЦР в реальном времени с использованием пары праймеров, направленных противоположно 5'концу мРНК люциферазы. Транскрипты, ассоциированные с полисомами, разрушались примерно с той же скоростью, что и общая цитоплазматическая мРНК (данные не показаны). Это предполагает, что, даже при наличии в любой момент времени как транслируемых, так и нетранслируемых пулов мРНК люциферазы, между ними происходит свободный обмен мРНК. Это наблюдение подтверждает измерения трансляционной эффективности и скорость деградации. После нуклеопорации в клетках HC11 определяли стабильность Luc-А 60, кэпированного различными S-ARCA. Остававшуюся мРНК определяли с помощью ПЦР в реальном времени через различные промежутки времени. Luc-А 60, кэпированный m27,2'-oGppspG (D2), был более стабильным (t1/2=257 мин) по сравнению с мРНК, кэпированной любой природной кэп-структурой, m7Gp3G (t1/2=86 мин), или родительского соединения, m27,2'-oGp3G (t1/2=155 мин) (фиг. 7 и табл. 2). Это предполагает, что увеличение стабильности мРНК является результатом устойчивости к гидролизу Dcp1/Dcp2. Ни m27,2' -oGpppsG (D1)(t1/2=169 мин), ни m27,2'-oGppspG (D1) (t1/2=185 мин) не придавала значительно большей стабильности, чемm27,2' -oGp3G (t1/2= 155 мин) (табл. 2). Примечательно то, что аффинность к eIF4E, как у m27,2'-oGpppsG (Dl),так и у m27,2'-oGppspG (Dl), была в 3 раза выше, чем у m27,2' -oGp3G. Если бы гипотеза о конкуренции междуDcp1/Dcp2 за eIF4E была бы верной, то можно было бы ожидать, что мРНК, копированная этими аналогами, была бы более стабильной. См. Е. Grudzien et al., "Differential inhibition of mRNA degradation pathways by novel cap analogs", J. Biol. Chem., vol. 281, pp.1857-1867 (2006). У мРНК, копированной этими аналогами, не наблюдалось увеличения ни стабильности, ни трансляционной эффективности (см. ниже). Это может указывать на то, что, хотя m27,2'-oGpppsG (D1) и m27,2'-oGppspG (D1) связываются с eIF4E более сильно, существует верхний предел, после которого высокая аффинность к eIF4E не ускоряет трансляцию в целом. Согласно этой интерпретации, когда скорость связывания кэп-структуры становится достаточно высокой, какая-то другая стадия в инициации синтеза белка становится ограничивающей скорость. Пример 20. Трансляционная эффективность кэпированной S-ARCA мРНК люциферазы в клетках НС 11 Для кэпированной с S-ARCA мРНК люциферазы также определяли трансляционную эффективность в культивируемых клетках. Такое определение включало два измерения, которые проводились через различные промежутки времени после нуклеопорации - активность люциферазы измеряли с помощью люминометрии в очищенных клеточных лизатах, а уровни Luc-А 60 измеряли с помощью ПЦР в реальном времени. Активность люциферазы нормализовали с помощью количества мРНК люциферазы,которая была доставлена в клетки. Для определения количества находящейся в клетках РНК сразу после нуклеопорации, т.е. до того как произойдет какое-либо разрушение, клетки отбирали через различные промежутки времени в пределах от 2 до 8 ч после нуклеопорации и экстрагировали цитоплазматическую РНК. Количество мРНК люциферазы измеряли с помощью ПЦР в реальном времени, используя праймеры, которые амплифицировали последовательности около 5'-конца. Для определения, t1/2 мРНК люциферазы количество ее, определенное для каждой временной точки, отображали на графике зависимостиlog10([РНК]) от времени. Кривую экстраполировали к 0 ч и вычисляли количество доставленной в клетки РНК. Определяли условия, при которых накопление люциферазы находилось в линейной зависимости от времени, после начального 30-минутного периода задержки поступления мРНК к рибосомам, заканчивавшим первую полипептидную цепь, и выхода люциферазы в цитозоль. мРНК Luc-A60, кэпированная m27,2'-oGppspG (D1) и m27,2'-oGppspG (D2), транслировалась в 2,8- и 5,1- 12017740 раз, соответственно, более эффективно, чем m7Gp3G-кэпированная мРНК (фиг. 8 и табл. 2). Что касается бесклеточной трансляции в системе лизата ретикулоцитов кролика, мРНК Luc-A60, копированные m27,2-oGppspG(D1) и m27,2'-oGpppsG (D2) транслировались только в 2,3-раза более эффективно, чем мРНК Luc-A60, кэпированная m7Gp3G (данные не показаны). Такое различие предполагает, что увеличение трансляционной эффективности в культивируемых клетках связано с более высокой стабильностью мРНК (что не является фактором для систем бесклеточной трансляции), поскольку только мРНК, кэпированная устойчивыми к hDcp2 аналогами, транслировалась более эффективно. Таблица 2. Трансляционная эффективность и стабильность мРНК люциферазы с фосфоротиоатными аналогами кэп-структуры в клетках НС 11 Равновесные константы ассоциации для взаимодействия мышиной eIF4E (аминокислоты 28-217) с различными аналогами кэп-структуры при 20 С. Мышиную eIF4E (остатки 28-217) экспрессировали в Е.coli, и титрование синхронизированной по времени флуоресценции выполняли, как описано в J. Zuberekb Данные, приведенные на фиг. 4, использовали для оценки восприимчивости олигонуклеотидов,кэпированных различными аналогами, к гидролизу с помощью hDcp2. Радиоактивности в пиках элюции через 44 мин (нерасщепленная кэп-структура) и 38 мин (pGp) корректировали относительно фоновой радиоактивности и суммировали для получения полной радиоактивности в кэп-структуре. Восприимчивость к Dcp2 получена из радиоактивности в pGp, выраженной в процентах от общего значения. (ND) Не определено. с Деградацию 5'-терминальных последовательностей в мРНК Luc-А 60, кэпированных указанными аналогами, определяли с помощью ПЦР в реальном времени, используя праймеры, направленные противоположно 5'-концу мРНК люциферазы.d Показана трансляционная эффективность мРНК Luc-A60, кэпированных указанными аналогами кэп-структуры, в клетках HC11. Активность люциферазы нормализована количеством РНК люциферазы в клетках. Относительную трансляционную эффективность вычисляли, как описано у J. Jemielity et al.,"Novel 'antireverse' cap analogues with superior translational properties" RNA, vol. 9, pp. 1108-1122 (2003). Указано время полужизни, которое значимо отличается (р 0,05) от времени полужизни мРНК, кэпированной m27,2'-oGp3G. Пример 21. Кэпированная S-ARCA мРНК люциферазы более эффективно поступала в полисомы в клетках НС 11. Для доказательства наблюдения того, что m27,2'-oGppspG-кэпированные мРНК транслируются более эффективно, был использован независимый способ, а именно их полисомное распределение (фиг. 9 А 9 Е). Увеличение скорости инициации относительно элонгации или терминации приводит к перемещению мРНК от более легких к более тяжелым полисомам. См. Н. Lodish, "Model for the regulation of mRNAtranslation applied to haemoglobin synthesis", Nature, vol. 251, pp. 385-388 (1974). He ожидалось, что тип структуры кэпа повлияет на скорость удлинения. Таким образом, перемещение к более тяжелым полисо- 13017740 мам указывает на более быструю инициацию. мРНК Luc-A60, кэпированная m27Gp3G, m27,2'-oGp3G или m27,2'-o GppspG (D2), была подвергнута электропорации в клетки HC11. Эти клетки лизировали через 4 ч после электропорации и очищенные супернатанты наслаивали на градиент сахарозы для отделения полисом от комплексов инициации. мРНК люциферазы преобладала в полисомах (фиг. 9 А и 9 В, фракция 6-11), хотя некоторое количество находилось также и в области комплексов инициации (фракция 3-5). Небольшое количество мРНК люциферазы присутствовало в пуле комплексов нетранслируемых матричных рибонуклеопротеинов (мРНП) (фиг. 9A и 9 В, фракция 1-2). мРНК, кэпированная стандартным ARCA, m27,2'-oGp3G, переместилась к более тяжелым полисомам (фиг. 9 С). Однако мРНК, кэпированная m27,2'-o GppspG (D2), переместилась к еще более тяжелым полисомам и одновременно с этим пропала из области мРНП (фиг. 9 В). В таких же экспериментальных условиях эндогенная мРНК GAPDH транслировалась эффективно (фиг. 9E), хотя некоторое количество также осело в области комплексов инициации. В целом, согласно данным результатам можно предположить, что наличие m27,2'-oGppspG (D2) на 5'-конце транскриптов люциферазы увеличивает их скорость инициации, что подтверждает результаты, основанные на накоплении активности люциферазы. Пример 22. Комбинация более высокой стабильности и более высокой трансляционной эффективности S-ARCA-кэпированной мРНК люциферазы обеспечивает более полную экспрессию белка в клетках НС 11 Также определяли общее накопление люциферазы по измерению по ферментативной активности в виде функции от времени для мРНК, кэпированной m27,2'-oGp3G, m27,2'-oGppspG (D1) и m27,2'-oGppspG (D2). КлеткиHC11 подвергли нуклеопорации и затем лизировали в различные моменты времени вплоть до 10 ч. Измеренную в супернатанте активность люциферазы нормализовали на количество Luc-A60, доставленной в клетки. Как показано на фиг. 10, активность люциферазы в клетках НС 11 достигла максимального уровня через 3 ч, а затем в целом за 10 ч уменьшилась в 10. Кинетики экспрессии согласуются с временем полужизни белка люциферазы, которое составляет примерно 180 мин (см. J. Thompson et al., "Modulation of firefly luciferase stabilityand impact on studies of gene regulation", Gene, vol. 103, pp. 171-177 (1991, и временем полужизни различных мРНК люциферазы, которое составляет 155, 185 и 257 мин, соответственно. Максимальное накопление люциферазы наблюдали для Luc-A60, кэпированной m27,2'-oGppspG (D2), которая обладала как самой высокой трансляционной эффективностью, так и самой высокой стабильностью. Теоретически ожидается, что увеличение в общей экспрессии белка от мРНК, кэпированной этим аналогом, будет еще большим для белков,имеющих более длительное время полужизни. Пример 23. Аффинность связывания с eIF4E Значения KAS и свободной энергии связывания ( G) для S-аналогов приведены в табл. 3 вместе с аналогичными данными для их немодифицированных родительских соединений. Необычным является то, что наличие фосфоротиоатной группы не только не снижает аффинность связывания с eIF4E, но в некоторых случаях аффинность значительно увеличивается. Значения KAS находятся в сильной зависимости как от положения фосфоротиоатной модификации, так и от абсолютной конфигурации вокруг асимметричного Р-центра. Интересен тот факт, что в каждой паре диастереомеров элемент D1 связывается сeIF4E с аффинностью, которая в 2,3-4,5 раз выше аффинности элемента D2 или родительского аналога. Например, в случае m27,2'-oGpsppG, KAS для изомера D1 в 3 раза выше, чем для D2 или m27,2'-oGpppG. Аналогично,в случае m27,2'-oGppspG, KAS для изомера D1 в 2 раза выше, чем для D2, и в 4,5 раза выше, чем для m27,2'-oGpppG. Самые большие различия в аффинностях связывания между диастереомерами D1/D2 наблюдали для модифицированных аналогов. С другой стороны, самые большие различия между модифицированными и немодифицированными парами наблюдали для -замещенных аналогов.- 14017740 Таблица 3. Равновесная константа ассоциации (KAS) и свободная энергия связывания ( G) для связывания мышиного elF4E (28-217) с фосфоротиоатными аналогами кэп-структуры, как определено путем подавления флуоресценции Определено для смеси диастереомеров. Пример 24. Восприимчивость к ферментативному гидролизу, проводимому с помощью DcpS человека и C. elegans Новые виды S-аналогов были подвергнуты ферментативному гидролизу in vitro, катализируемомуDcpS как человека, так и нематоды С. elegans. Во всех экспериментах соответствующий немодифицированный аналог кэп-структуры использовали в качестве положительного контроля, т.е. m7GpppG для неARCA S-аналогов и m27,2' -oGpppG для S-ARCA. Количество фермента DcpS оптимизировали для обеспечения полной деградации контрольного субстрата в течение 40-90 мин. Образцы, отобранные из реакционных смесей через различные промежутки времени, анализировали с помощью ВЭЖХ с обращенными фазами (как описано в разделе "Материалы и способы"). В табл. 4 аналоги кэп-структуры с концентрацией 4 мкМ были подвергнуты ферментативному расщеплению, катализируемому DcpS, в условиях, приводящих к полной деградации немодифицированного родительского соединения (т.е. m7GpppG для не-ARCA S-аналогов и m27,2'-oGpppG для ARCA) в течение 40-90 мин. Образцы, отобранные из реакционных смесей в различные моменты времени, анализировали с помощью ВЭЖХ с обращенными фазами с использованием УФ-детектирования при 260 нм, как описано в разделе "Материалы и способы". В табл. 4 аналоги, обозначенные как устойчивые, в применявшихся условиях оставались полностью нерасщепленными, тогда как аналоги, обозначенные как гидролизованные, были гидролизованы DcpS с эффективностью, сравнимой с соответствующим немодифицированным родительским соединением. Было обнаружено, что S-аналоги, модифицированные в -положении,были устойчивыми к гидролизу независимо от абсолютной конфигурации Р-центра (табл. 4). Результат не изменился даже при увеличении времени реакции до 24 ч, при этом использовали различное количество фермента и модифицировали состав реакционного буфера. Все другие S-аналоги были гидролизованы hDcpS с эффективностью, сравнимой с эффективностью немодифицированного родительского аналога. Что касается гидролиза S-аналогов, катализируемого DcpS человека и нематоды С elegans, никаких существенных отличий не наблюдалось. Анализ продуктов катализируемой DcpS деградации модифицированных в -положении аналогов позволил определить их абсолютную конфигурацию в области асимметричных Р-центров. Было обнаружено,что катализируемый DcpS гидролиз либо m7GpppsG (D1), либо m7GpppsG (D2) приводит к m7GMP и либо D1,либо D2 изомеру гуанозин 5'-О-(1-тиодифосфату) (GDPaS), тогда как гидролиз либо m27,2'-oGpppsG (D1), либо Пример 25. Аналоги кэп-структуры как ингибиторы кэп-зависимой трансляции Способность новых S-аналогов ингибировать кэп-зависимую трансляцию оценивали в системе лизата. ретикулоцитов кролика, настроенной на природную мРНК глобина кролика. Из 12-ти S-аналогов выбрали два, модифицированные в -положении, m7GpsppG (D1) и m7GpsppG (D2), поскольку было обнаружено, что они являются устойчивыми к DcpS и более стабильными in vivo. Данные по ингибированию трансляции фитировали теоретической кривой, которая описывает кап-зависимую трансляцию в виде функции зависимости связывания мРНК от ингибитора (Cai et al. 1999). Это позволило определятьKI, концентрацию аналога кэп-структуры, при которой кэп-зависимая трансляция подавляется на 50%m7GpppG, что является дополнительным свидетельством того, что фосфоротиоатная группа в целом стабилизирует взаимодействие кэп-eIF4E. Кроме того, m7GpsppG (D1) оказался значительно более сильным ингибитором, чем его вариант D2 (KI=4,1 0,2 мкМ против KI=12,l 3,2 мкМ), что соответствует его более высокой аффинности связывания с eIF4E (KAS=30,8 0,5 против KAS=10,0 0,2). Таблица 5. Константа ингибирования (KI) для ингибирования кэп-зависимой трансляции с помощью модифицированных S-аналогов в системе трансляции в лизате ретикулоцитов кролика Пример 26. Копированные S-ARCA фрагменты мРНК в качестве in vivo ингибиторов кэпзависимой трансляции В будущем S-ARCA, особенно трифосфаты, у которых фосфоротиоатная модификация происходит в -положении, такие как соединения 6 а и 6b в примере 17, могли бы использоваться в качестве ингибиторов кэп-зависимой трансляции. Документально подтверждено, что кэп-зависимая трансляция активирована в раковых клетках и подавление eIF4E приводит к реверсии злокачественного фенотипа. Фрагменты, получающиеся в результате 3'5' деградации кэпированных мРНК, вероятно, теряют кэпструктуру при достижении длины менее 25 нуклеотидов до того, как произойдет их полная деградация до нуклеотидов. Предполагается, что такие фрагменты, копированные трифосфатными S-ARCA, содержащими фосфоротиоатную модификацию в -положении, являются устойчивыми к DcpS, аналогично тому, что было показано для самих динуклеотидов кэп-структуры (см. табл. 4 выше). Таким образом, предполагается, что они накапливаются в клетке и конкурируют с нормальными мРНК за участие в механизме трансляции. Авторами изобретения предлагается ввести в культивируемые клетки мРНК или фрагменты мРНК, кэпированные трифосфатными. S-ARCA, замещенными в -положении (соединения 6 а и 6b в примере 17). Затем предлагается сравнить кэп-зависимую трансляцию с кэп-независимой трансляцией,используя репортерные конструкции. В результате ожидается, что предпочтительно ингибируемым бу- 16017740 дет первый тип трансляции. Необходимо отметить, что необходима модификация ARCA для правильной ориентации этих S-ARCA при встраивании в мРНК, поскольку в ином случае фосфоротиоатная группа не будет находиться в правильном положении, требуемом для придания фрагменту мРНК устойчивости к DcpS. Аналогичным образом предлагается проанализировать тетрафосфатные S-ARCA, в качестве потенциальных ингибиторов кэп-зависимой трансляции. Предполагается, что тетрафосфатные S-ARCA, в особенности содержащие -фосфоротиоатную группу, не будут подвергаться катализируемому DcpS гидролизу в физиологических условиях и будут ингибировать кэп-зависимую трансляцию. Пример 27. В формуле изобретения определены все комбинации фосфоротиоатной модификации динуклеотидов трифосфатных и тетрафосфатных аналогов кэп-структуры, аналогичных перечисленным ниже. Модификация остатка рибозы у m7Guo представляет собой 2'-дезокси, 3'-дезокси, арабинозу, 2'-O-этил и 3'О-этил. Модификация 7-заместителей Г представляет собой метил, этил, пропил, бутил, бензил, замещенный бензил, нафтилметил, замещенный нафтилметил и другие замещенные или незамещенные С 1 С 10 алифатические или ароматические группы. Модификация остатка гуанина заключается в использовании аденина, уридина, цитозина или m7G. Эти различные модификации могут быть синтезированы, как раскрыто в настоящей заявке, и заимствованы из способов, известных в данной области техники, например публикации заявки на патент США 2003/0194759. Все процитированные в настоящем описании документы полностью включены в него посредством ссылок. Также посредством ссылки полностью включены приведенные ниже публикации работ самих авторов изобретения, которые не являются предшествующим уровнем техники по отношению к настоящей заявке: J. Kowalska et al., "Synthesis and characterization, of mRNA cap analogs containing phosphorothioate substitutions that bind tightly to eIF4E and are resistant to the decapping pyrophosphatase DcpS",RNA, vol. 14, pp. 1119-1131 (2008); E. Grudzien-Nogalska et al., "Phosphorothioate cap analogs stabilizetranslation", реферат и постер, представленные на RNA Meeting, Seattle, Washington, June 20-25, 2006. Однако в случае возникновения любого конфликта и противоречий следует руководствоваться настоящим описанием. где каждый Y выбирают из группы, состоящей из О и S; разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;X выбирают из группы, состоящей из метила, этила, пропила, бутила, бензила, замещенного бензила, нафтилметила, замещенного нафтилметила и других замещенных или незамещенных С 1-С 10 алифатических или ароматических групп,при этом указанное соединение характеризуется следующими свойствами: если указанное соединение включено в молекулу РНК на 5'-конце, причем молекула РНК содержит открытую рамку считывания, и если молекула РНК введена в клетки в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, то получаемая экспрессия белка in vivo выше, чем экспрессия белка in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы. 2. Соединение, имеющее общую структуру где каждый Y выбирают из группы, состоящей из О и S; разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S; при этом указанное соединение характеризуется следующими свойствами: если указанное соединение включено в молекулу РНК на 5'-конце, причем молекула РНК содержит открытую рамку считывания, и если молекула РНК введена в клетки в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, то получаемая экспрессия белка in vivo выше, чем экспрессия белка in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы. 3. Соединение, имеющее общую структуру где каждый Y выбирают из группы, состоящей из О и S; разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S; где каждый Y выбирают из группы, состоящей из О и S; разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;X выбирают из группы, состоящей из метила, этила, пропила, бутила, бензила, замещенного бензила, нафтилметила, замещенного нафтилметила и других замещенных или незамещенных С 1-С 10 алифатических или ароматических групп,при этом указанное соединение характеризуется следующими свойствами: если указанное соединение включено в молекулу РНК на 5'-конце, причем молекула РНК содержит открытую рамку считывания, и если молекула РНК введена в клетки в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, то получаемая экспрессия белка in vivo выше, чем экспрессия белка in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы. 5. Соединение, имеющее общую структуру где каждый Y выбирают из группы, состоящей из О и S; разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;X выбирают из группы, состоящей из метила, этила, пропила, бутила, бензила, замещенного бензила, нафтилметила, замещенного нафтилметила и других замещенных или незамещенных С 1-С 10 алифатических или ароматических групп, где разные X могут быть одинаковыми или различающимися,при этом указанное соединение характеризуется следующими свойствами: если указанное соединение включено в молекулу РНК на 5'-конце, причем молекула РНК содержит открытую рамку считывания, и если молекула РНК введена в клетки в условиях, способствующих транс- 19017740 ляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, то получаемая экспрессия белка in vivo выше, чем экспрессия белка in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы. 6. Соединение, имеющее общую структуру где каждый Y выбирают из группы, состоящей из О и S; разные Y могут быть одинаковыми или различающимися и по меньшей мере один Y представляет собой S;bn7m2'-oGpspspG; bn7m3'-oGpspspG; bn7m2'-oGppspsG и bn7m3'-oGppspsG. 8. Соединение по любому из предшествующих пунктов, где указанное соединение представляет собой, по существу, один стереоизомер. 9. Соединение по любому из пп.1-7, где указанное соединение представляет собой смесь по меньшей мере двух диастереомеров, первого диастереомера и второго диастереомера, причем указанные первый и второй диастереомеры являются идентичными за исключением того, что указанные первый и второй диастереомеры имеют разные стереохимические конфигурации у хирального атома фосфора, при этом указанный хиральный атом фосфора представляет собой атом фосфора, который связан с атомом серы. 10. Молекула РНК, 5'-конец которой включает соединение по любому из пп.1-7. 11. Способ синтеза in vitro молекулы РНК по п.10, где указанный способ включает проведение реакции между АТФ, ЦТФ, УТФ, ГТФ, указанным соединением и полинуклеотидной матрицей в присутствии РНК-полимеразы, в условиях, способствующих транскрипции с помощью указанной РНКполимеразы полинуклеотидной матрицы в РНК-копию, посредством чего некоторые копии РНК могут включать указанное соединение для получения указанной молекулы РНК. 12. Способ синтеза in vitro белка или пептида, где указанный способ включает трансляцию молекулы РНК, определенной в п.10, в бесклеточной системе синтеза белка, причем молекула РНК содержит открытую рамку считывания, в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания. 13. Способ синтеза in vivo белка или пептида, где указанный способ включает введение в клетки молекулы РНК по п.10, где молекула РНК содержит открытую рамку считывания, в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания. 14. Соединение по любому из пп.1-7, где n равно 3 и указанное соединение содержит фосфоротиоатную группу или где n равно 4 и указанное соединение содержит -фосфоротиоатную группу, и где указанное соединение не гидролизуется с помощью Dcp2 в физиологических условиях. 15. Соединение по любому из пп.1-7, где n равно 3 и указанное соединение содержит фосфоротиоатную группу или где n равно 4 и указанное соединение содержит 5-фосфоротиоатную группу, и где указанное соединение не гидролизуется с помощью Dcp2 в физиологических условиях и указанное соединение ингибирует кэп-зависимую трансляцию. 16. Способ синтеза in vivo белка или пептида, где указанный способ включает введение в клетки молекулы РНК, 5'-конец которой включает соединение по п.14, причем молекула РНК содержит открытую рамку считывания, в условиях, способствующих трансляции открытой рамки считывания молекулы РНК в белок или пептид, кодируемый открытой рамкой считывания, где скорость трансляции in vivo по меньшей мере в два раза выше скорости трансляции in vivo, которую можно было бы получить любым другим аналогичным способом, в котором каждый Y представляет собой атом кислорода и в котором ни один из Y не является атомом серы.
МПК / Метки
МПК: C07H 19/207
Метки: применение, антиинвертированных, фосфоротиоатных, матричной, синтез, кэп-структуры, аналогов
Код ссылки
<a href="https://eas.patents.su/27-17740-sintez-i-primenenie-antiinvertirovannyh-fosforotioatnyh-analogov-kep-struktury-matrichnojj-phk.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез и применение антиинвертированных фосфоротиоатных аналогов кэп-структуры матричной phk</a>
Предыдущий патент: Двухстадийный газификатор с высокотемпературным предварительно нагретым паром
Следующий патент: Сталь для получения деталей машин путем объемной деформации
Случайный патент: Связывающие белки, включающие антитела, производные антител и фрагменты антител, которые специфически связываются с cd154, и их применения












