Стирилпиридиновые производные и их применение для связывания и визуализации амилоидных бляшек
Формула / Реферат
1. Соединение формулы I
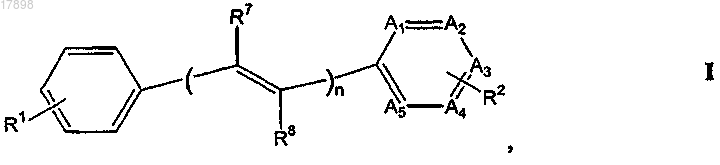
или его фармацевтически приемлемая соль, где
n равен 1;
A1, А2, А3 и А5, каждый независимо, представляют собой -СН или -CR2, по необходимости;
А4 представляет собой N;
R1 представляет собой
-(CH2)pNRaRb, где Ra и Rb представляют собой, независимо, водород или С1-4-алкил и р равен 0;
гидрокси;
-OCO(C1-4)алкил;
R2 представляет собой:
i)
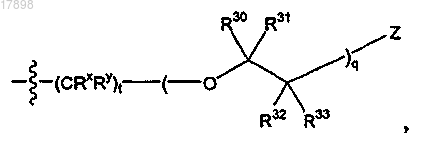
где q равен целому числу от 1 до 5;
t равен 0;
Z представляет собой гидрокси или галоген и
R30, R31, R32 и R33 в каждом случае представляют собой, независимо, водород; или
ii)
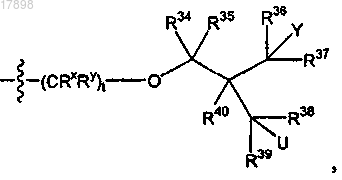
где t равен 0;
Y представляет собой галоген;
U представляет собой водород, гидрокси или галоген и
R34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой, независимо, водород и
R7 и R8 в каждом случае представляют собой, независимо, водород.
2. Соединение по п.1, содержащее по меньшей мере один радиоактивный изотоп галогена.
3. Соединение по п.1, содержащее по меньшей мере один галоген, который представляет собой I, 123I, 125I, 131I, Br, 76Br, 77Br, F или 18F.
4. Соединение по п.1, где R2 представляет собой
i)
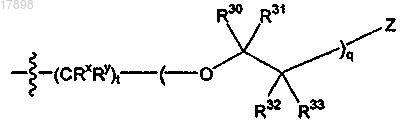
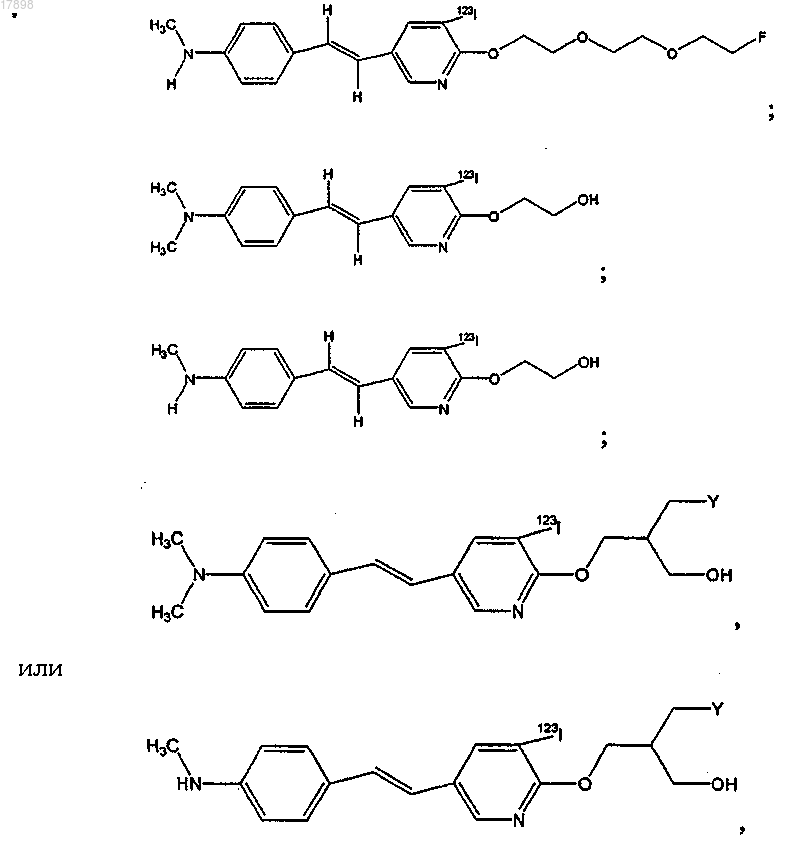
5. Соединение по п.1, имеющее формулу
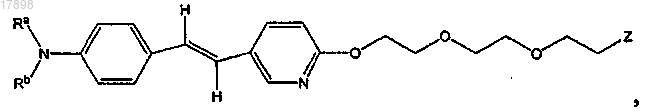
где Ra и Rb представляют собой, независимо, водород или C1-4-алкил и
Z представляет собой I, 123I, 125I, 131I, Br, 76Br, 77Br, F или 18F.
6. Соединение по п.1, имеющее формулу
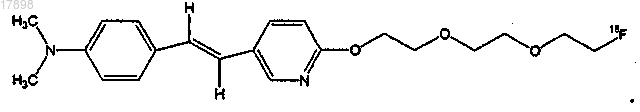
7. Соединение по п.1, имеющее формулу

8. Соединение по п.1, имеющее формулу
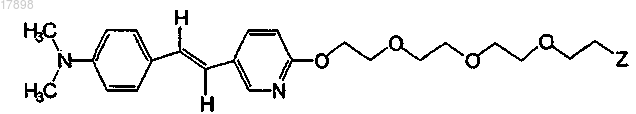
где Z представляет собой I, 123I, 125I, 131I, Br, 76Br, 77Br, F или 18F.
9. Соединение по п.1, имеющее формулу
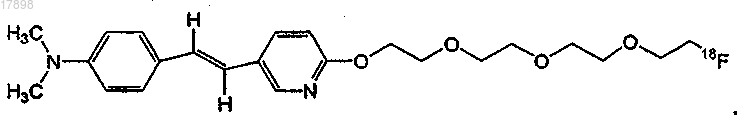
10. Соединение по п.1, где R2 представляет собой
i)
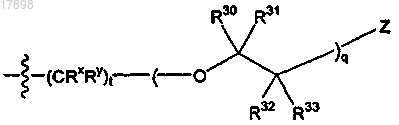
где Z представляет собой гидрокси.
11. Соединение по п.1, где q равен 1, 2 или 3.
12. Соединение по п.1, где R2 представляет собой
ii)
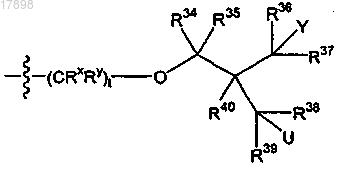
где U представляет собой гидрокси.
13. Соединение по п.12, имеющее формулу
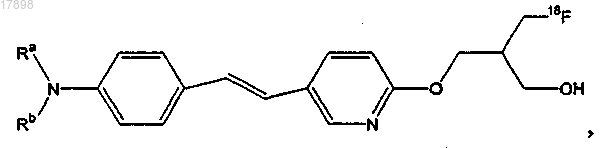
где Ra и Rb представляют собой, независимо, водород или С1-4-алкил.
14. Соединение по п.12, имеющее формулу
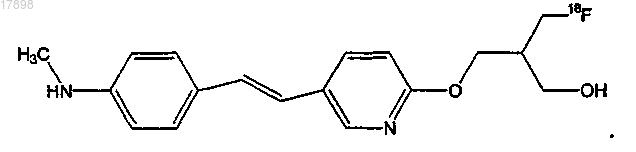
15. Композиция, содержащая эффективное количество соединения по п.1 и фармацевтически приемлемый носитель или разбавитель, где указанное соединение содержит изотоп 11C, указанный изотоп присутствует в количестве, превышающим распространенность в природе, и указанное соединение, содержащее указанный изотоп 11C, имеет удельную радиоактивность, превышающую уровень фона.
16. Соединение формулы III
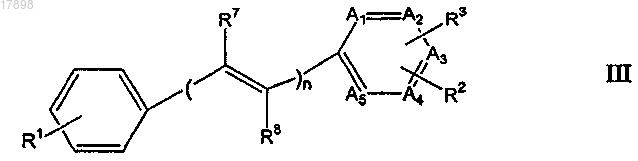
или его фармацевтически приемлемая соль, где
А1, А2, А3 и А5, каждый независимо, представляют собой -СН, -CR2 или -CR3, по необходимости;
А4 представляет собой N;
n равен 1;
R1 представляет собой
-(CH2)pNRaRb, где Ra и Rb представляют собой, независимо, водород или C1-4-алкил и р равен 0;
гидрокси или
-OCO(C1-4)алкил;
R3 представляет собой радиоизотоп галогена или -Sn((C1-4-алкил)3; и
R2 представляет собой
i)
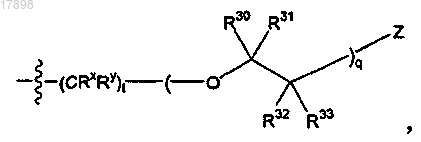
где q равен целому числу от 1 до 5;
t равен 0;
Z представляет собой гидрокси или галоген и
R30, R31, R32 и R33 в каждом случае представляют собой, независимо, водород; или
ii)
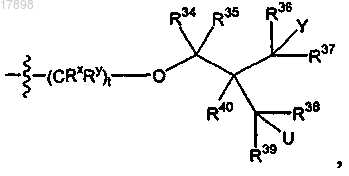
где t равен 0;
Y представляет собой галоген;
U представляет собой водород, гидрокси или галоген и
R34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой, независимо, водород; и
R7 и R8 в каждом случае представляют собой, независимо, водород.
17. Соединение по п.16, где R3 представляет собой 125I, 123I, 131I, 18F, 18F(С1-4-алкил), 76Br, 77Br и Sn(C1-4-алкил)3.
18. Соединение по п.16, где R1 представляет собой гидрокси или -(СН2)pNR'R'', где R' и R'' представляют собой, независимо, водород или C1-4-алкил и р равен 0.
19. Соединение по п.16, где R2 представляет собой
i)
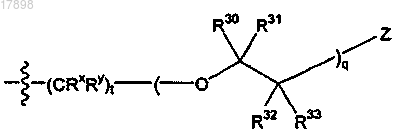
где q равен целому числу от 1 до 4.
20. Соединение по п.16, где Z представляет собой фтор.
21. Соединение по п.16, где R2 представляет собой
ii)
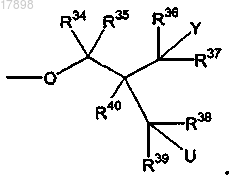
22. Соединение по п.21, где U представляет собой гидрокси.
23. Соединение по п.16, представляющее собой
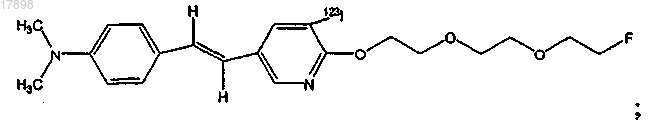
где Y представляет собой фтор.
24. Фармацевтическая композиция, содержащая эффективное количество соединения по п.1 или 16 и фармацевтически приемлемый носитель или разбавитель.
25. Диагностическая композиция для визуализации амилоидных отложений, содержащая эффективное количество меченного радиоактивным изотопом соединения по п.1 или 16 и фармацевтически приемлемый носитель или разбавитель.
26. Способ визуализации амилоидных отложений, включающий:
a) введение млекопитающему детектируемого количества диагностической композиции по п.25;
b) предоставление достаточного времени для ассоциации меченого соединения с амилоидными отложениями и
c) детекцию меченого соединения, ассоциированного с одним или несколькими амилоидными отложениями.
27. Способ ингибирования агрегации амилоидных бляшек у млекопитающего, включающий введение композиции по п.24 в количестве, эффективном для ингибирования агрегации амилоидных бляшек.
28. Соединение по п.1, представляющее собой
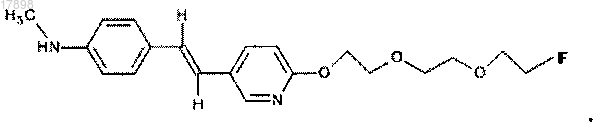
29. Фармацевтическая композиция, содержащая эффективное количество соединения по п.7 или 28 и фармацевтически приемлемый носитель или разбавитель.
30. Соединение по п.1, имеющее формулу
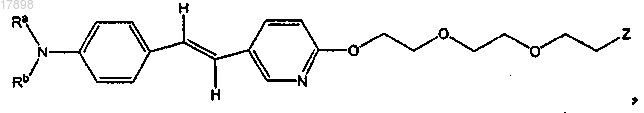
где Ra и Rb представляют собой, независимо, водород или метил и Z представляет собой F или 18F.
Текст
СТИРИЛПИРИДИНОВЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ ДЛЯ СВЯЗЫВАНИЯ И ВИЗУАЛИЗАЦИИ АМИЛОИДНЫХ БЛЯШЕК Изобретение относится к способу визуализации амилоидных отложений и к стирилпиридинам и способам получения стирилпиридинов, меченных радиоактивными изотопами, применимых при визуализации амилоидных отложений. Данное изобретение также относится к соединениям и способам получения соединений для ингибирования агрегации амилоидных белков, при которой образуются амилоидные отложения, и к способу доставки лечебного средства к амилоидным отложениям.(71)(73) Заявитель и патентовладелец: ДЗЕ ТРАСТИЗ ОФ ДЗЕ ЮНИВЕРСИТИ ОФ ПЕНСИЛЬВАНИЯ (US) Предпосылки создания изобретения Область техники, к которой относится изобретение Данное изобретение относится к новым стирилпиридинам, их применению при диагностической визуализации и ингибировании агрегации амилоида- и способам получения указанных соединений. Уровень техники Болезнь Альцгеймера (AD) представляет собой прогрессирующее нейродегенеративное расстройство, характеризующееся снижением познавательных способностей, необратимой потерей памяти, дезориентацией и ухудшением речи. Посмертное исследование срезов головного мозга с AD показывает обильные старческие бляшки (SP), состоящие из амилоидных- (А) пептидов, и многочисленные нейрофибриллярные сплетения (NFT), образованные филаментами высокофосфорилированных тау-белковet al., "Cell Biology of Tau and Cytoskeletal Pathology in Alzheimer's Disease", Alzheimer's Disease, Lippincot,WilliamsWilkins, Philadelphia, PA (1999), pp. 359-372). Амилоидоз является состоянием, характеризующимся накоплением различных нерастворимых фибриллярных белков в тканях пациента. Амилоидное отложение образуется путем агрегации амилоидных белков с последующим дополнительным объединением агрегатов и/или амилоидных белков. Образование и накопление агрегатов амилоидных- (А) пептидов в головном мозгу являются критическими факторами в развитии и прогрессировании AD. Кроме роли амилоидных отложений при болезни Альцгеймера показано наличие амилоидных отложений при таких заболеваниях, как средиземноморская лихорадка, синдром Muckle-Wells, идеопатическая миелома, амилоидная полиневропатия, амилоидная кардиомиопатия, системный сенильный амилоидоз, наследственное внутримозговое кровотечение с амилоидозом, синдром Дауна, почесуха, болезнь Крейтцфельда-Якоба, куру, синдром Gerstamnn-Straussler-Scheinker, медуллярная карцинома щитовидной железы, Isolated atrial amyloid, 2-амилоид микроглобулина у пациентов при диализе, миозит телец включения, отложение 2-амилоида при мышечной атрофии и инсулинома островков Лангерганса при диабете типа II. Фибриллярные агрегаты амилоидных пептидов A1-40 и А 1-42 являются основными метаболическими пептидами, образованными амилоидным белком-предшественником, обнаруженными в старческих бляшках и амилоидных отложениях сосудов головного мозга у больных AD (Xia W. et al., J. Proc. Natl.Acad. Sci. USA., 97: 9299-9304 (2000. Предупреждение и прекращение образования бляшек А(3 намечены как способ лечения такого заболевания (Selkoe D.J., JAMA, 283: 1615-1617 (2000); Wolfe M.S. et al., J.Med. Chem., 41: 6-9 (1998); Skovronsky D.M. and Lee V.M., Trends Pharmacol. Sci., 21: 161-163 (2000. Семейная AD (FAD) вызвана несколькими мутациями в белке-предшественнике А (АРР), генах пресенилина 1 (PS1) и пресенилина 2 (PS2) (Ginsberg S.D. et al., "Molecular Pathology of Alzheimer's Disease and Related Disorders", в Cerebral Соктех: Neurodegenerative and Age-related Changes in Structure andFAD, исследованные до сих пор, повышают продуцирование более амилоидогенной формы пептида А длиной в 42-43 аминокислоты. Таким образом, по меньшей мере, при FAD, представляется, что разрегулирование продуцирования А является достаточным для индуцирования каскада событий, ведущих к нейродегенерации. Действительно, гипотеза амилоидного каскада преполагает, что образование агрегатов внеклеточного фибриллярного A в головном мозгу может являться центральным событием в патогенезе AD (Selkoe D.J, "Biology -amyloid Precursor Protein and the Mechanism of Alzheimer's Disease", Alzheimer's Disease, Lippincot, WilliamsWilkins, Philadelphia, PA (1999), pp. 293-310; Selkoe D.J, J. Am.et al., Biochimica et Biophysica Acta, 1502: 172-187 (2000. В настоящее время различные подходы в попытке ингибировать образование и снизить накопление фибриллярного A в головном мозгу оцениваются как возможные методы лечения AD (Skovronsky D.M.Wolfe M.S. et al., J. Med. Chem., 41: 6-9 (1998); Moore C.L. et al., J. Med. Chem., 43: 3434-3442 (2000); Findies M.A., Biochimica et Biophysica Acta, 1502: 76-84 (2000); Kunner P., Bohrmann et al., J. Biol. Chem., 273: 1673-1678 (2000. Поэтому существует заинтересованность в разработке лигандов, которые специфически связывают агрегаты фибриллярного A. Так как внеклеточные SP являются доступными мишенями,такие новые лиганды можно было бы использовать в качестве диагностических инструментов in vivo и зондов для визуализации прогрессирующего отложения A в исследованиях амилоидогенеза АД в организме пациентов. В связи с этим сообщается о некоторых подходах для разработки специфических лигандов к агрега-1 017898al., Proc. XIIth Intl. Symp. Radiopharm. Chem., Uppsala, Sweden: 94-95 (1997); Lorenzo A. and Yankner B.A.,Proc. Natl. Acad. Aci. U.S.A., 91: 12243-12247 (1994); Zhen W. et al., J. Med. Chem., 42:2805-2815 (1999. Наиболее привлекательный подход основан на высококонъюгированном хризамине-G (CG) и конго красном (CR), и последний используют для флуоресцентного окрашивания SP и NFT в посмертных срезах головного мозга с AD (Ashburn Т.Т. et al., Chem. Biol., 3: 351-358 (1996); Klunk W.E. et al., J. Histochem. Cytochem., 37: 1273-1281 (1989. Константы ингибирования (Ki) в случае связывания с агрегатами фибриллярного A CR, CG и 3'-бром- и 3'-иодпроизводных CG составляют 2800, 370, 300 и 250 нМ, соответственно (Mathis С.А. et al., Proc. XIIth Intl. Symp. Radiopharm. Chem., Uppsala, Sweden: 94-95 (1997. Показано, что такие соединения селективно связываются с агрегатами пептида A (1-40) in vitro, а также с отложениями фибриллярного A в срезах головного мозга с AD (Mathis С.A. et al., Proc. XIIth Intl.Symp. Radiopharm. Chem., Uppsala, Sweden: 94-95 (1997. Существует несколько возможностей визуализации агрегатов A в головном мозгу. Метод визуализации будет улучшать диагностику путем идентификации потенциальных больных с избыточными бляшками A в головном мозгу; следовательно, у них возможно развитие болезни Альцгеймера. Он также будет применим для контроля за развитием болезни. Когда лечение лекарственными средствами против бляшек станет доступным, визуализация бляшек A в головном мозгу сможет обеспечить важный инструмент для контроля за лечением. Таким образом, идет напряженный поиск простого неинвазивного способа детекции и количественного определения амилоидных отложений у пациента. В настоящее время детекция амилоидных отложений включает гистологический анализ материалов биопсии или аутопсии. Оба способа имеют недостатки. Например, аутопсию можно использовать только для посмертного диагноза. Непосредственная визуализация амилоидных отложений in vivo затруднена, так как отложения могут иметь многие физические свойства (например, плотность и содержание воды) такие же, как у здоровых тканей. Попытки визуализации амилоидных отложений с использованием ядерного магнитного резонанса (MRI) и вспомогательной компьютерной томографии (CAT) не оправдали надежд и позволяли обнаруживать амилоидные отложения только при некоторых благоприятных условиях. Кроме того, усилия в отношении мечения амилоидных отложений антителами, сывороточным амилоидным Р-белком или другими молекулами-зондами обеспечивали некоторую селективность на периферии тканей, но давали плохую визуализацию внутренних областей тканей. Потенциальные лиганды для детекции агрегатов A в живом головном мозгу должны преодолевать интактный гематоэнцефалический барьер. Таким образом, поглощение в головном мозгу можно улучшить, используя лиганды с молекулами относительно небольшого размера (в сравнении с конго красным) и повышенной липофильностью. Обычно в качестве красителей для окрашивания агрегатов A в головном мозгу используют высококонъюгированные тиофлавины (S и Т) (Elhaddaoui A. et al., Biospectroscopy, 1: 351-356 (1995. Имеется сообщение о высоколипофильном радиоактивном индикаторе [18F]FDDNP для связывания как со сплетениями (состоящими, главным образом, из гиперфосфорилированного тау-белка), так и с бляшками (содержащими агрегаты белка A) (Shoghi-Jadid K. et al., Am. J. Geriatr. Psychiatry, 2002, 10: 24-35). Сообщается, что, с использованием позитронной эмиссионной томографии (PET), таким радиоактивным индикатором специфически метили отложения бляшек и сплетений у девяти больных AD и семи субъектов для сравнения (Nordberg A., Lancet Neurol., 2004, 3: 519-27). С использованием названной новой процедуры фармакокинетического анализа показаны различия в относительном времени пребывания в участке головного мозга, представляющего интерес, против моста у больных AD и субъектов для сравнения. Относительное время пребывания существенно выше у больных AD. Это дополнительно осложняется вызывающим интерес результатом, что FDDNP конкурирует с NSAID за связывание с фибриллами A in vitro и бляшками A ex vivo (Agdeppa E.D. et al., 2001; Agdeppa E.D. et al., Neuroscience, 2003,117: 723-30). Недавно появились сообщения о визуализации -амилоида в головном мозгу больных AD с использованием производного бензотиазоланилина [11 С]6-ОН-ВТА-1 (также называемого [11C]PIB) (Mathis С.A.et al., Curr. Pharm. Des., 2004, 10: 1469-92; Mathis C.A. et al., Arch. Neurol., 2005, 62: 196-200). В противоположность тому, что наблюдали в случае [18F]FDDNP, [11 С] 6-ОН-ВТА-1 связывается специфически с фибриллярным А in vivo. Больные с диагнозом слабой AD показали заметное удерживание [11 С]6-ОНВТА-1 в коре головного мозга, которая, как известно, при AD содержит большое количество амилоидных отложений. В группе больных AD удерживание [11 С] 6-ОН-ВТА-1 повышено, главным образом, в лобной части коры головного мозга. Большое возрастание также наблюдали в теменной, височной и затылочной частях коры головного мозга и в полосатом теле. Удерживание [11 С] 6-ОН-ВТА-1 эквивалентно у больных AD и субъектов для сравнения в участках, которые, как известно, относительно не подвергаются отложению амилоида (таких как подкорковое белое вещество, мост и мозжечок). Недавно иссле-2 017898 дован другой зонд, метящий 11 С бляшки A - производное стильбена [11C]SB-13. Связывание in vitro с использованием [11C]SB-13 предполагает, что соединение показывает превосходную аффиность связывания, и связывание можно четко измерить в сером веществе коры головного мозга в случаях AD, но не в белом веществе (Kung M.-P. et al. , Brain Res., 2004, 1025: 89-105). Специфическое связывание в гомогенатах кортикальных тканей контрольного головного мозга было очень низким. Величины Kd [3H]SB-13 в кортикальных гомогенатах AD составляли 2,40,2 нМ. Наблюдали высокую связывающую способность и сравнимые значения (14-45 пмоль/мг белка) (там же). Как ожидалось, у больных AD [11C]SB-13 отображал высокое накопление в лобной части коры головного мозга (возможно, в области, содержащей бляшки А высокой плотности) у больных со слабой и умеренной AD, но не у контрольных субъектов соответствующего возраста (Verhoeff N.P. et al., Am. J. Geriar. Psychiatry, 2004, 12: 584-95). Было бы полезно иметь неинвазивный метод визуализации и количественного определения амилоидных отложений у пациента. Кроме того, было бы полезно иметь соединения, которые ингибируют агрегацию амилоидных белков с образованием амилоидных осаждений и способ определения способности соединения ингибировать агрегацию амилоидных белков. Сущность изобретения Настоящее изобретение относится к соединениям формул I и III. Настоящее изобретение также относится к диагностическим композициям, содержащим меченное изотопом соединение формулы I и III и фармацевтически приемлемый носитель или разбавитель. Изобретение также относится к способу визуализации амилоидных отложений, включающему введение пациенту детектируемого количества меченного изотопом соединения формулы I и III или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу ингибирования агрегации амилоидных белков,включающему введение млекопитающему ингибирующего амилоид количества соединения формулы I иIII или его фармацевтически приемлемой соли. Другой аспект данного изобретения относится к способам и промежуточным соединениям, применимым для синтеза ингибирующих и визуализирующих амилоид соединений формул I и III, описанных в данном описании. Описание фигур Фиг. 1 отображает пленку с результатами визуализации соединением по настоящему изобретению. Фиг. 2 изображает поглощение головным мозгом и костной тканью стирилпиридина 2 в сравнении со стильбеновым аналогом. Фиг. 3 отображает ауторадиографию на пленке, где стирилпиридин 2 сравнивается со стильбеновым аналогом. Фиг. 4 изображает кривую насыщения стирилпиридина 2 в гомогенатах головного мозга с AD. Фиг. 5 показывает некоторые соединения по настоящему изобретению и соответствующие им данные по связыванию. Фиг. 6 отображает ауторадиографию in vitro ряда срезов головного мозга. Фиг. 7 отображает устойчивость in vitro меченных F-18 индикаторов к смешанным микросомным фракциям печени человека. Индикаторы в PBS без микросомных фракций служат в качестве контроля. Величины (% неизменившегося исходного соединения) являются средними из двух повторений. Фиг. 8 отображает специфическое связывание [18F]2 со смешанными гомогенатами тканей головного мозга с AD и контроля. Серое и белое вещества иссечены из кортикальных участков. Высокоспецифическое связывание обнаружено только в сером веществе. Приведенные величины являются среднимиSEM из шести измерений. Относительно слабое связывание наблюдают в гомогенатах белого вещества. Напротив, гомогенаты контрольного головного мозга, и серого и белого вещества, показывают существенно более низкое специфическое связывание [18F]2. Фиг. 9 отображает (в верхней части) профиль ВЭЖХ соединения [18F]2 и (в нижней части) УФзапись нерадиоактивного стандартного соединения 2 (350 нм). Условия ВЭЖХ: серия 1100 Agilent; колонка С-18 Phenomenex Gemini, 5 мкм, 2504,6 мм, буфер CH3CN/формиат аммония (1 мМ), 8/2, об./об.,1 мл/мин. Кт 6,34 мин (радиоактивного), 6,05 мин (УФ). Интервал во времени удерживания имеет место из-за конфигурации детектора. Подробное описание изобретения Изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, где n равен 1;A1, А 2, А 3 и А 5 каждый независимо представляет собой -СН - или -CR2, по необходимости; А 4 представляет собой N; где q равен целому числу от 1 до 5;Z представляет собой гидрокси или галоген; иR30, R31, R32 и R33 в каждом случае представляют собой независимо водород; илиR34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой, независимо, водород; иR7 и R8 в каждом случае представляют собой независимо водород. Предпочтительные соединения включают соединения, в которых галоген при одном или нескольких появлениях в структуре представляет собой радиоизотоп галогена. Также предпочтительными являются соединения, в которых галоген выбирают из группы, состоящей из I, 123I, 125I, 131I, Br, 76Br, 77Br, F или 18F. Особенно предпочтительными являются соединения, которые содержат 18F. Соединения, содержащие 123I, также являются особенно предпочтительными. Применимые значения R1 перечислены выше. Предпочтительными значениями являются гидрокси или -(СН 2)pNRaRb, где р равен 0, и Ra и Rb представляют собой независимо водород или C1-4-алкил. Применимые значения р включают целые числа от 0 до 5. В предпочтительных воплощениях R1 находится или в мета- или в пара-положении относительно соответствующего мостика. Предпочтительным значением R1 является NRaRb, где Ra и Rb представляют собой, независимо, водород или C1-4-алкил. В таком воплощении предпочтительно, чтобы C1-4-алкил представлял собой метил. Предпочтительно, один из Ra и Rb представляет собой водород, а другой представляет собой C1-4-алкил,такой как метил. Наиболее предпочтительно, когда как Ra, так и Rb представляет собой метил. Другим предпочтительным значением R1 является гидрокси. Также предпочтительными являются любые пролекарственные группы, которые после введения дают предпочтительное значение R1. Такие пролекарственные группы хорошо известны в технике. Предпочтительные соединения формулы I включают такие соединения, в которых А 4 представляет собой N, имеющие формулу где Ra и Rb выбирают, независимо, из водорода или C1-4-алкила,Z имеет значения, указанные выше, иq равен целому числу от 1 до 5. Примеры предпочтительных соединений включают где q равен целому числу от 1 до 4; такие как-4 017898 Другие предпочтительные соединения формулы I, где R2 представляет собой ii, включают В другом воплощении соединения по настоящему изобретению представляют собой соединения формулы III, имеющие структуру или их фармацевтически приемлемые соли, гдеA1, А 2, А 3 и А 5 каждый независимо представляет собой -СН, -CR2 или -CR3, по необходимости; А 4 представляет собой N;R3 представляет собой радиоизотоп галогена или -SnC1-4-алкил)3; и где q равен целому числу от 1 до 5;Z представляет собой гидрокси или галоген, иR30, R31, R32 и R33 в каждом случае представляют собой, независимо, водород; илиR34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой, независимо, водород; иR7 и R8 в каждом случае представляют собой, независимо, водород. Предпочтительные соединения включают соединения, в которых галоген при одном или нескольких появлениях в структуре представляет собой радиоизотоп галогена. Также предпочтительными являются соединения, в которых галоген выбирают из группы, состоящей из I, 123I, 125I, 131I, Br, 76Br, 77Br, F или 18F. Особенно предпочтительными являются соединения, которые содержат 18F. Соединения, содержащие 123I, также являются особенно предпочтительными. Применимые значения R1 перечислены выше. Предпочтительными значениями являются гидрокси или -(СН 2)pNRaRb, где р равен 0, так что R1 представляет собой NRaRb. В предпочтительных воплощенияхR1 находится или в мета- или в пара-положении относительно соответствующего мостика. Предпочтительным значением R1 является NRaRb, где Ra и Rb представляют собой, независимо, водород или C1-4 алкил. В таком воплощении предпочтительно, чтобы С 1-4-алкил представлял собой метил. Предпочтительно один из Ra и Rb представляет собой водород, а другой представляет собой C1-4-алкил, такой как-5 017898 метил. Наиболее предпочтительно, когда как Ra, так и Rb представляет собой метил. Другим предпочтительным значением R1 является гидрокси. Примеры наиболее предпочтительных соединений формулы III включают Другие предпочтительные соединения формулы III, в которых R2 представляет собой ii, включают где R1 и R2 имеют значения, указанные в случае формулы III. Соединения по настоящему изобретению также могут содержать радиоактивный изотоп углерода в качестве радиоизотопа. Это относится к соединениям, которые содержат один или несколько радиоактивных атомов углерода, предпочтительно 11 С, с удельной радиоактивностью, превышающей активность фонового уровня для такого атома. Хорошо известно, в этом отношении, что встречающиеся в природе элементы присутствуют в форме различных изотопов, из которых некоторые являются радиоактивными изотопами. Радиоактивность встречающихся в природе элементов является результатом естественного распределения или распространенности таких изотопов и обычно называется фоновым уровнем. Соединения по настоящему изобретению с радиоизотопом углерода имеют удельную радиоактивность, которая более высокая, чем распространенная в природе, и поэтому выше фонового уровня. Композиция, заявленная в данной заявке, включающая соединение(я) по настоящему изобретению с радиоизотопом(ами) углерода, будет включать такое количество соединения, чтобы композицию можно было использовать для индикации, визуализации, радиотерапии и подобного применения. В некоторых воплощениях соединений, раскрытых в данном описании, галоген, предпочтительно F,или хелатирующии агент соединяются со стирилпиридиновой основой через цепь ПЭГ с различным числом этоксигрупп. Фторированный стирилпиридин 2 показывает высокую аффинность связывания (Ki = 2,50,4 нМ) . Аналог с диметиламиногруппой показывает самую высокую аффинность. Это противоположно аналогам стильбена, имеющим склонность проявлять более высокую аффинность в случае замещения монометиламино. Как видно на схемах 1-3 в данном описании, введение радиоактивных изотопов осуществляется успешно с образованием соединений-мишеней. Синтез соединения 2 по схеме 5 приводит ко времени получения примерно 60 мин; радиохимический выход 35% (скорректирован на распад); радиохимическая чистота 98%; и удельная радиоактивность от примерно 1000 до примерно 1500 Ки/ммоль. Биораспределение in vivo 18F-пегилированного стиролпиридина у здоровых мышей показывает исключительное проникновение в головной мозг после iv инъекции и быстрое вымывание. Ауторадиография с 2 посмертных срезов головного мозга с AD подтверждает специфическое связывание, связанное с наличием бляшек A. Соединения формул I и III также могут быть сольватированы, в особенности, гидратированы. Гидратация может происходить во время получения соединений или композиций, содержащих соединения,или гидратация может происходить со временем из-за гигроскопичного характера соединений. Кроме того, соединения по настоящему изобретению могут существовать в несольватированной, а также в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобные растворители. Вообще, для целей настоящего изобретения сольватированные формы считаются эквивалентыми несольватированным формам. Когда любая переменная встречается более одного раза в любом элементе или в формуле I или III,ее определение при каждом появлении не зависит от ее определения при любом другом появлении. Также сочетания заместителей и/или переменных допустимы только в том случае, если такие сочетания приводят к устойчивым соединениям. Термин алкил, используемый в данном описании сам по себе или как часть другой группы, относится как к линейным, так и к разветвленным радикалам с числом атомов углерода до 4 атомов углерода,таким как метил, этил, пропил, изопропил, бутил, трет-бутил и изобутил. Термин гало или галоген, используемый в данном описании сам по себе или как часть другой группы, относится к атомам хлора, брома, фтора или иода и их изотопам. Термин радиогалоген относится конкретно к радиоактивным изотопам галогена. Другой аспект данного изобретения относится к способам получения соединений формул I и III. Синтез диметиламинозамещенного производного стирилпиридина 1 и его фторпегелированного варианта 2 показан на схеме 1. Соединение 1 получают реакцией Виттига между диэтил-4(диметиламино)бензилфосфонатом и 6-хлорникотинальдегидом в присутствии трет-бутоксида калия в ДМФА (выход 62%). Прямым аликилированием соединения 1 2-(2-(2-фторэтокси)этокси)этанолом 2 с использованием гидрида натрия в ТГФ получают фторпегелированное соединение 2 (выход 33%), которое можно использовать в качестве холодного стандарта для введения радиоактивных изотопов. Получение монометиламинозамещенного производного 6 осуществляют способом, показанным на схеме 2. Реакция Виттига между 4-нитробензилфосфонатом и 6-хлорникотинальдегидом в присутствии метоксида натрия в метаноле при кипячении с обратным холодильником дает соединение 3 с высоким выходом(88%). Соединение 3 после реакции можно легко извлечь фильтрацией и использовать непосредственно на следующей стадии; дополнительной очистки не требуется. Алкилированием 3 2-(2-(2 фторэтокси)этокси)этанолом с использованием гидрида натрия в ТГФ получают соединение 4 (выход 30%). Нитрогруппу соединения 4 можно восстановить с использованием хлорида олова(2) в этаноле и получить соединение 5 (выход 58%). Монометилирования 5 достигают с использованием параформальдегида, метоксида натрия и борогидрида натрия, и получают соединение 6 с относительно высоким выходом (73%). Для того, чтобы получить нужное меченное F-18 диметиламинозамещенное производное стирилпиридина [18F]2, используют в качестве предшественника тозилат 10 (схема 3). Получение 10 начинают с алкилирования 3 триэтиленгликолем в ДМФА, которому способствует микроволновое излучение, и получают соединение 7 (выход 77%). Затем нитрогруппу 7 восстанавливают до аминогрупы с использованием хлорида олова(2) и получают соединение 8 (выход 76%), а затем следует диметилирование с использованием параформальдегида и цианоборогидрида натрия в уксусной кислоте с образованием соединения 9 с высоким выходом (95%). Сначала пытались мезилировать 9, однако мезилат 9 оказался очень неустойчивым и разлагался во время получения. Успешно осуществляют тозилирование 9 с использованием тозилхлорида в пиридине, и получают нужный тозилат 10 (выход 41%) как предшественник для получения меченного радиоактивным изотопом [18F]2. Схемы 5-7 отображают способ синтеза соединений формулы III. Схема 5 отображает синтез некоторых промежуточных соединений, применимых для получения соединений по изобретению. Схемы 6 и 7 отображают синтез меченных радиоактивными изотопами и немеченных соединений по изобретению. В соединениях 17-110 "I" в названии соединения означает промежуточное соединение. Схема 5 Комплексы Тс-99m можно получить следующим образом. Небольшое количество несодержащего радиоактивные изотопы соединения (1-2 мг) растворяют в 100 мкл EtOH и смешивают с 200 мкл HCl (1 н) и 1 мл раствора Sn-глюкогептоната (содержащего 8-32 мкг SnCl2 и 80-320 мкг Na-глюкогептоната, рН 6,67) и 50 мкл раствора ЭДТК (0,1 н). Затем добавляют раствор [99mTc]пертехнетата в физиологическом растворе (100-200 мкл; колебание в пределах 2-20 мКи). Реакционную смесь греют в течение 30 мин при 100 С и затем охлаждают до комнатной температуры. Реакционную смесь анализируют ТСХ (EtOH: конц. NH3, 9:1) на образование продукта реакции и для контроля за чистотой. Смесь можно нейтрализовать фосфатным буфером до рН 5,0. Настоящее изобретение также относится к способу получения комплекса технеция-99m по настоящему изобретению взаимодействием технеция-99m в форме пертехнетата в присутствии восстановителя и, необязательно, подходящего хелатообразователя с соответствующим Ch-содержащим соединением. Восстановитель служит для восстановления пертехнетата Тс-99m, который элюируют из генератора молибдена-технеция в физиологическом растворе. Подходящими восстановителями являются, например,дитионит, формамидинсульфиновая кислота, диаминоэтандисульфинат или подходящие восстанавливающие ионы металлов, такие как Sn(II), Fe(II), Cu(I), Ti(III) или Sb(III). Установлено, что Sn(II) является особенно подходящим. В случае вышеуказанной реакции образования комплекса технеций-99m вводят во взаимодействие с соответствующим соединением по изобретению в виде соли или в форме технеция, связанного с относительно слабым хелатообразователем. В последнем случае нужный комплекс технеция-99m формируется за счет лигандного обмена. Примерами подходящих хелатообразователей для радионуклеида являются дикарбоновые кислоты, такие как щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, ортофталевая кислота, яблочная кислота, молочная кислота, винная кислота, лимонная кислота, аскорбиновая кислота, салициловая кислота, или производные таких кислот; соединения фосфора,такие как пирофосфаты; или еноляты. Лимонная кислота, винная кислота, аскорбиновая кислота, глюкогептоновая кислота или их производные являются особенно подходящими хелатообразователями для такой цели, поскольку хелат технеция-99m с одним из указанных хелатообразователей претерпевает нужный лигандный обмен особенно легко. Самая используемая процедура получения комплексов [TcvO]+3N2S2 основана на восстановлении хлоридом олова (II) [99mTc] пертехнетата - обычного исходного вещества. Процедура введения радиоактивного изотопа обычно имеет в основе реакцию обмена лигандами Тс-99m между (Sn)глюкогептонатом Тс-99m и лигандом N2S2. Получение хлорида олова (II) и сохранение его в соответствующей форме олова(II) критически важно для успеха реакции введения радиоактивного изотопа. Для того, чтобы стабилизировать чувствительный к воздуху ион олова, обычной практикой в медицинской радиологии является применение лиофилизованного набора, в котором ион олова находится в веществе в форме лиофилизованного порошка, смешанного с избыточным количеством глюкогептаноата, в атмосфере инертного газа, такого как азот или аргон. Получение наборов лиофилизованный хлорид олова/глюкогептаноат натрия обеспечивает воспроизводимость и предсказуемость реакции введения радиоактивного изотопа. Лиганды N2S2, как правило, чувствительны к воздушной атмосфере (тиолы легко окисляются воздухом), и существуют последующие реакции, которые ведут к разложению лигандов. Наиболее распространенным и предсказуемым способом сохранения лигандов является получение лиофилизованных наборов, содержащих по 100-500 мкг лигандов в атмосфере аргона или азота. Когда соединения по данному изобретению должны использоваться в качестве средств визуализации, в них следует ввести подходящие радиоактивные изотопы галогена. Хотя изотопы 125I применимы для лабораторного тестирования, они, как правило, неприменимы для целей фактического диагноза из-за относительно длительного периода полураспада (60 дней) и низкого гамма-излучения (30-60 кэВ) 125I. Изотоп 123I имеет период полураспада тринадцать часов и энергию гамма-излучения 159 кэВ, и поэтому ожидается, что возможно мечение таким изотопом лигандов, используемых для диагностических целей. Другие изотопы, которые можно использовать, включают 131I (период полураспада 2 часа). Подходящие изотопы брома включают 77Br и 76Br. Соединения по данному изобретению, содержащие радиоактивные изотопы галогенов, допускают простое получение из материалов, которые могут получить пользователи в наборах. Наборы для получения средств для визуализации, могут содержать, например, флакон, содержащий физиологически подходящий раствор промежуточного соединения формулы I или III, в концентрации и при рН, подходящих для оптимальных условий комплексообразования. Пользователю следует добавить во флакон соответствующее количество вещества, содержащего радиоизотоп, например Na123I, и окислителя, такого как пероксид водорода. Полученный содержащий радиоактивный изотоп лиганд затем можно вводить внутривенно пациенту и визуализировать рецепторы в головном мозгу посредством измерения их гаммаизлучения или фотоэмиссии. Так как радиоактивную фармацевтическую композицию по настоящему изобретению можно получить легко и просто, получение может легко осуществить пользователь. Поэтому настоящее изобретение также относится к набору, включающему:(1) несодержащее радиоактивные изотопы соединение по настоящему изобретению, находящееся,необязательно, в сухом состоянии; и также необязательно содержащее инертный фармацевтически приемлемый носитель и/или вспомогательные вещества, добавляемые к нему; и(2) восстановитель и, необязательно, хелатообразователь; где ингредиенты (1) и (2) могут быть, необязательно, объединены; и где также, необязательно, могут быть включены инструкции по применению с предписанием по осуществлению вышеуказанного способа путем введения во взаимодействие реагентов (1) и (2) с технецием-99m в форме раствора пертехнетата. Примеры подходящих восстановителей и хелатообразователей для вышеуказанного набора приводятся выше. Раствор пертехнетата пользователь может получить из генератора молибдена-технеция. Такие генераторы доступны от ряда институтов, которые осуществляют радиодиагностические процедуры. Как отмечалось выше, ингредиенты (1) и (2) могут быть объединены, при условии, что они совместимы. Такой однокомпонентный набор, в котором объединенные ингредиенты предпочтительно лиофилизованы, исключительно подходит для осуществления пользователем взаимодействия с раствором пертехнетата простым способом. При желании радиоактивное диагностическое средство может содержать любую добавку, такую как вещества, регулирующие рН (например, кислоты, основания, буферы), стабилизаторы (например, аскорбиновую кислоту) или вещества, придающие изотоничность (например, хлорид натрия). Термин фармацевтически приемлемая соль, используемый в данном описании, относится к солям карбоновых кислот или солям присоединения кислот соединений по настоящему изобретению, которые,в рамках здравого смысла в медицине, подходят для применения в контакте с тканями пациентов без нежелательных токсичности, раздражения, аллергической реакции и т.п., соизмеримо с разумным соотношением благоприятное воздействие/риск и эффективны для их предполагаемого применения, а также к цвиттерионным формам соединений по изобретению, когда они возможны. Термин соли относится к относительно нетоксичным солям присоединения неорганических и органических кислот соединений по настоящему изобретению. Он также включает соли, полученные с нетоксичными органическими кислотами, такими как алифатические моно- и дикарбоновые кислоты, например, уксусная кислота, фенилзамещенные алкановые кислоты, гидроксиалкановые и алкандиовые кислоты, ароматические кислоты и алифатические и ароматические сульфоновые кислоты. Такие соли можно получить in situ во время конечной стадии извлечения и очистки соединений или отдельно взаимодействием очищенного соединения в его форме свободного основания с подходящей органической или неорганической кислотой и выделением полученной таким образом соли. Другие характерные соли включают гидробромиды, гидрохлориды, сульфаты, бисульфаты, нитраты, ацетаты, оксалаты, валераты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, фосфаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты,нафтилаты, мезилаты, глюкогептонаты, лактобионаты и лаурилсульфонаты, пропионаты, пивалаты, цикламаты, изэтионаты и подобные соли. Они могут включать катионы на основе щелочных и щелочноземельных металлов, таких как натрий, литий, калий, кальций, магний, и т.п., а также нетоксичные катионы аммония, четвертичного аммония и аминов, в том числе, но без ограничения, аммония, тетраметиламмония, тетраэтиламмония, метиламина, диметиламина, триметиламина, триэтиламина, этиламина и т.п. (см., например, работу Berge S.M. et al., Pharmaceutical Salts, J. Pharm. Sci., 66: 1-19 (1977), включенную в данное описание в качестве ссылки). На первой стадии способа визуализации по настоящему изобретению меченное соединение формулы I или III вводят в ткань или пациенту в детектируемом количестве. Соединение, типично, является частью фармацевтической композиции и вводится в ткань или пациенту способами, хорошо известными специалистам в данной области техники. Введение меченного соединения пациенту может быть способом общего или локального введения. Например, соединение можно ввести или перорально, или ректально, парентерально (внутривенно, внутримышечно или подкожно), внутриполостно, интравагинально, интраперитонеально, интравезикулярно,локально (порошки, мази или капли), или в виде внутриротового или назального спрея. Меченое соединение можно вводить пациенту таким образом, что оно доставляется в определенный орган или ткань,представляющие интерес. Например, желательно обнаружить местоположение и количество амилоидных отложений в головном мозгу с целью диагностики или отслеживания развития болезни Альцгеймера у пациента. Одним из наиболее желательных свойств средства визуализации in vivo головного мозга является способность проходить через интактный гематоэнцефалический барьер после инъекции iv ударной дозы. В предпочтительном воплощении изобретения меченое соединение вводят пациенту в детектируемом количестве, и после того, как пройдет достаточное время для того, чтобы соединение ассоциировалось с амилоидными отложениями, меченое соединение детектируют неинвазивно в организме пациента. В другом воплощении изобретения меченное радиоактивными изотопами соединение формулы I или III вводят пациенту, оставляют достаточное время для того, чтобы соединение ассоциировалось с амилоидными отложениями, затем берут у пациента образец ткани и детектируют в ткани меченое соединение вне организма пациента. В третьем воплощении изобретения берут у пациента образец ткани и вводят в образец меченное радиоактивными изотопами соединение формулы I или III. Спустя достаточное время для того, чтобы соединение связалось с амилоидными отложениями, соединение детектируют. Термин ткань обозначает часть тела пациента. Примеры тканей включают головной мозг, сердце,печень, кровеносные сосуды и артерии. Детектируемое количество представляет собой количество меченого соединения, необходимое для обнаружения выбранным способом детекции. Количество меченого соединения, которое вводят пациенту для того, чтобы обеспечить детекцию, могут легко определить специалисты в данной области техники. Например, пациенту можно давать возрастающие количества меченого соединения до тех пор, пока соединение не будет обнаруживаться выбранным способом детекции. В соединения вводят метку для обеспечения детекции соединений. Термин пациент обозначает людей и других млекопитающих. Специалисты в данной области техники также хорошо знакомы с определением промежутка времени, достаточного для того, чтобы соединение ассоциировалось с амилоидными отложениями. Необходимое количество времени можно легко определить путем введения пациенту детектируемого количества соединения формулы I или III и последующей детекции меченого соединения в различные моменты времени после введения. Термин ассоциированный обозначает химическое взаимодействие между меченым соединением и амилоидным отложением. Примеры ассоциаций включают ковалентные связи, ионные связи, гидрофильные-гидрофобные взаимодействия, гидрофобные-гидрофильные взаимодействия и комплексообразование. Специалисты в данной области техники хорошо знакомы с различными способами детекции меченых соединений. Например, ядерный магнитный резонанс (MRI), позитронную эмиссионную томографию (PET) или эмиссионную компьютерную томографию отдельных фотонов (SPECT) можно использовать для детекции соединений, меченных радиоактивными изотопами. Радиоизотоп, который вводят в соединение, будет зависеть от желательного способа детекции. Например, если в качестве способа детекции выбирают PET, соединение должно обладать атомом, испускающим позитроны, таким как 11 С- 11017898 или 18F. Радиоактивное диагностическое средство должно иметь достаточную радиоактивность и концентрацию радиоактивного фактора, которая может обеспечить достоверный диагноз. Например, в случае,когда радиоактивным металлом является технеций-99m, его можно включать, как правило, в количестве 0,1-50 мКи в примерно 0,5-5,0 мл во время введения. Количество соединения формулы I или III может быть таким, какого достаточно для образования устойчивого хелатного соединения с радиоактивным металлом. Полученное таким образом хелатное соединение как радиоактивное диагностическое средство является достаточно устойчивым и поэтому его можно сразу же вводить как таковое или хранить до его применения. При необходимости радиоактивное диагностическое средство может содержать любую добавку, такую как вещества, регулирующие рН (например, кислоты, основания, буферы), стабилизаторы(например, аскорбиновую кислоту) или вещества, придающие изотоничность (например, хлорид натрия). Визуализацию амилоидных отложений также можно осуществить количественно, так что можно определить количество амилоидных отложений. Предпочтительные соединения для визуализации включают радиоизотопы, такие как 11C, 123I, 125I,131 18I, F, 76Br или 77Br. Другим аспектом изобретения является способ ингибирования агрегации амилоидных бляшек. Настоящее изобретение также относится к способу ингибирования агрегации амилоидных белков с образованием амилоидных отложений путем введения пациенту амилоидингибирующего количества соединения указанной выше формулы I, Ia, II или III. Специалисты в данной области техники могут легко определить амилоидингибирующее количество путем простого введения пациенту соединения формулы I или III в возрастающих количествах до тех пор, пока рост амилоидных отложений на уменьшится или не прекратится. Скорость роста можно оценить с использованием визуализации, как описано выше, или путем взятия образца ткани у пациента и наблюдения в нем амилоидных отложений. Соединения по настоящему изобретению можно вводить пациенту при уровнях дозировки в интервале от примерно 0,1 до примерно 1000 мг в сутки. Для обычного взрослого человека с массой тела примерно 70 кг достаточной является дозировка в интервале от примерно 0,01 до примерно 100 мг на килограмм массы тела в сутки. Однако конкретная используемая дозировка может изменяться. Например, дозировка может зависеть от ряда факторов, включая потребности пациента, тяжесть состояния, от которого лечат, и фармакологическую активность используемого соединения. Определение оптимальных дозировок хорошо известно специалистам в данной области техники. Приведенные далее примеры являются иллюстративными, но не ограничительными, для способа и композиций по настоящему изобретению. Другие подходящие модификации и адаптации к различным условиям и параметрам, которые обычно встречаются и очевидны для специалистов в данной области техники, находятся в сфере сущности и объема изобретения. Все реагенты, используемые в синтезах, являются коммерческими продуктами, используются без дополнительной очистки, если не указано иное. Спектры 1 Н ЯМР получают на спектрометре BruckerDPX (200 МГц) в CDCl3. Химические сдвиги приводятся в величинах(миллионные доли) относительно внутреннего стандарта ТМС. Константы взаимодействия приводятся в герцах. Мультиплетность определена с (синглет), д (дублет), т (триплет), уш (уширенный), м (мультиплет). Элементный анализ осуществляет Atlantic Microlab INC. В случае каждой процедуры стандартная обработка относится к следующим стадиям: добавление указанного органического растворителя, промывка органического слоя водой и затем солевым раствором, отделение органического слоя от водного слоя, сушка объединенных органических слоев безводным сульфатом натрия, отфильтровывание сульфата натрия и удаление органического растворителя при пониженном давлении. Примеры Пример 1. Синтез соединения 2(Е)-2-Хлор-5-(4-диметиламиностирил)пиридин (1) К раствору диэтил-(4-диметиламинобензил)фосфоната (80 мг, 0,30 ммоль) в безводном ДМФА (5,0 мл) при 0 С добавляют трет-бутоксид калия (99 мг, 0,89 ммоль). Затем добавляют 2-хлор-5 пиридилальдегид (42 мг, 0,30 ммоль). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 4 ч. Добавляют воду и смесь экстрагируют MeOH/DCM (1:9, об./об.). Органический слой отделяют, промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают. Остаток очищают ПТСХ (PTLC) (в качестве проявляющего растворителя 20% гексана в DCM) и получают продукт 1 (48 мг, выход 62%). 1(Е)-2-(2-(2-(2-Фторэтокси)этокси)этокси)-5-(4-диметиламиностирил)пиридин (2) К раствору 2-(2-(2-фторэтокси)этокси)этанола (39 мг, 0,26 ммоль) в безводном ДМФА (5,0 мл) добавляют гидрид натрия (95%, 10 мг, 0,39 ммоль). После перемешивания при комнатной температуре в течение 20 мин добавляют соединение 5 (35 мг, 0,13 ммоль) и реакционную смесь греют при 100 С в течение 2 ч. После охлаждения до комнатной температуры добавляют воду и реакционную смесь экстрагируют этилацетатом. Органический слой отделяют, промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают. Остаток очищают ПТСХ (в качестве проявляющего растворителя 4% МеОН в DCM), и получают продукт 2 (16 мг, выход 32,9%). 1 Н ЯМР (200 МГц, CDCl3):8,14 (1H, д, J=2,4 Гц), 7,76 (1H, д, д, J1=8,6 Гц, J2=2,4 Гц), 7,39 (2H, д,J=8,8 Гц), 6,87 (2 Н, м) , 6,76 (3 Н, м) , 4,53 (2 Н, д, т, J1=47,6 Гц, J2=4,2 Гц), 4,50 (2H, т, J=4,8 Гц), 3,85 (3 Н,м), 3,70 (5 Н, м), 2,99 (6 Н, с). МСВР (EI) m/z вычислено для [C21H28N2O4]+ 372, 2049. Пример 2. Синтез соединения 6(Е)-2-Хлор-5-(4-нитростирил)пиридин (3) В раствор диэтил-(4-нитробензил)фосфоната (546 мг, 2,0 ммоль) и 2-хлор-5-пиридилальдегида (283 мг, 2,0 ммоль) в метаноле (5,0 мл) постепенно добавляют метоксид натрия (1 М раствор в метаноле, 5,0 мл). Затем реакционную смесь кипятят с обратным холодильником в течение 1 ч. После охлаждения до 0 С выпавшее в осадок желтое вещество отфильтровывают и промывают холодным метанолом, и получают продукт 3 (458 мг, выход 88%), который используют непосредственно на следующей стадии без дополнительной очистки. 1 Н ЯМР (200 МГц, CDCl3):8,53 (1 Н, д, ,J=2,4 Гц), 8,25 (2 Н, д, J=8,8 Гц), 7,85 (1 Н, д, д, J1=8,4 Гц,J2=2,4 Гц), 7,65 (2 Н, д, J=8,8 Гц), 7,36 (1 Н, д, J=8,4 Гц), 7,19 (2 Н, с), МСВР (EI) m/z вычислено для(Е)-2-(2-(2-(2-Фторэтокси)этокси)этокси)-5-(4-нитростирил)пиридин (4) В защитной атмосфере азота при 0 С 2-(2-(2-фторэтокси)этокси)этанол (60 мг, 0,39 ммоль) добавляют в смесь гидрида натрия (26,4 мг, 60% дисперсия в минеральном масле, 0,66 ммоль) и безводного ДМФА (5 мл). Смесь перемешивают при комнатной температуре в течение получаса, и добавляют соединение 3 (85,7 мг, 0,33 ммоль). Затем реакционную смесь греют при 100 С в течение 2 ч и охлаждают. Добавляют этилацетат и воду, органический слой отделяют, промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают. Остаток очищают ПТСХ (в качестве проявляющего растворителя 2% MeOH в DCM), и получают продукт 4 (37 мг, выход 30%). 1 Н ЯМР (200 МГц, CDCl3):8,22 (3 Н, д, J=8,8 Гц), 7,84 (1 Н, д, д, J1=8,6 Гц, J2=2,4 Гц), 7,61 (2 Н, д,J=8,8 Гц), 7,20 (1 Н, д, J=16,4 Гц), 7,02 (1 Н, д, J=16,4 Гц), 6,84 (1 Н, д, J=8,6 Гц), 4,53 (2 Н, д, т, J1=47,6 Гц,J2=4,2 Гц), 4,52 (2 Н, т, J=4,8 Гц), 3,85 (3 Н, м), 3,70 (5 Н, м); MCBP (EI) m/z вычислено для [C19H21FN2O5]+ 376,1435.(Е)-2-(2-(2-(2-Фторэтокси)этокси)этокси)-5-(4-аминостирил)пиридин (5) Соединение 4 (34 мг, 0,09 ммоль) растворяют в этаноле (5 мл), и затем добавляют хлорид олова(II)(51,4 мг, 0,27 ммоль) и концентрированную HCl (0,25 мл). Реакционную смесь кипятят с обратным холодильником в течение 2 ч и охлаждают. Используют 2 н раствор NaOH для доведения рН до 10. Добавляют дихлорметан, и органический слой отделяют, промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают. Остаток очищают ПТСХ (в качестве проявляющего растворителя 3% МеОН в DCM) , и получают продукт 5 (18 мг, выход 58%). 1 Н ЯМР (200 МГц, CDCl3):8,14 (1 Н, д, J=2,2 Гц), 7,76 (1 Н, д, д, J1=8,6 Гц, J2=2,4 Гц), 7,32 (2 Н, д,J=8,4 Гц), 6,80 (5 Н, м), 4,53 (2 Н, д, т, J1=47,6 Гц, J2=4,2 Гц), 4,49 (2 Н, т, J=4,8 Гц), 3,85 (3 Н, м), 3,70 (5 Н,м), 1,8-3,0 (2 Н, ушир.); MCBP (EI) m/z вычислено для [C19H23FN2O3]+ 376,1693.(Е)-2-(2-(2-(2-Фторэтокси)этокси)этокси)-5-(4-метиламиностирил)пиридин (6) К раствору соединения 5 (15,8 мг, 0,046 ммоль) в метаноле (5 мл) добавляют метоксид натрия (1 М раствор в метаноле, 0,23 мл), а затем добавляют параформальдегид (6,6 мг, 0,23 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 1,5 ч и затем охлаждают до 0 С на ледяной бане. Осторожно добавляют борогидрид натрия (10,4 мг, 0,27 ммоль). Смесь снова кипятят с обратным холодильником в течение 1 ч и охлаждают. Добавляют дихлорметан и воду. Органический слой отделяют,промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают. Остаток очищают ПТСХ (в качестве проявляющего растворителя 3% МеОН в DCM) и получают продукт 6 (12 мг, выход 73%). 1(Е)-2-(2-(2-(2-Гидроксиэтокси)этокси)этокси)-5-(4-нитростирил)пиридин (7) Смесь карбоната калия (158,7 мг, 1,15 ммоль), соединения 3 (100 мг, 0,38 ммоль) и триэтиленгликоля (576 мг, 3,8 ммоль) в безводном ДМФА (5,0 мл) запаивают в ампуле для микроволновой электропечи(от Biotage) и подвергают облучению микроволнами (система Biotage Initiator) при 180 С в течение 25 мин. После охлаждения до комнатной температуры добавляют воду и реакционную смесь экстрагируют этилацетатом. Органический слой отделяют, промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают. Остаток очищают ПТСХ (в качестве проявляющего растворителя 4% МеОН в DCM) и получают продукт 7 (110 мг, выход 77%). 1(Е)-2-(2-(2-(2-Гидроксиэтокси)этокси)этокси)-5-(4-аминостирил)пиридин (8) К раствору соединения 7 (100 мг, 0,27 ммоль) в этаноле (10 мл) добавляют хлорид олова(II) (202,8 мг, 1,07 ммоль), а затем добавляют концентрированную HCl (0,5 мл). Реакционную смесь кипятят с обратным холодильником в течение 1,5 ч и затем охлаждают до 0 С. Выпавшее в осадок желтое вещество собирают фильтрацией и затем суспендируют в этилацетате. Добавляют насыщенный раствор NaHCO3 для доведения рН до 9. Органический слой отделяют, промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают. Остаток очищают ПТСХ (в качестве проявляющего растворителя 5% МеОН в DCM), и получают продукт 8 (710 мг, выход 76%). 1(Е)-2-(2-(2-(2-Гидроксиэтокси)этокси)этокси)-5-(4-диметиламиностирил)пиридин (9) К раствору соединения 8 (65 мг, 0,19 ммоль) и параформальдегида (57 мг, 1,9 ммоль) в уксусной кислоте (10 мл) добавляют цианоборогидрид натрия (36 мг, 0,57 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и выливают на лед. Используют бикарбонат натрия для доведения рН до 9. Реакционную смесь экстрагируют этилацетатом. Органический слой отделяют, промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают. Остаток очищают ПТСХ (в качестве проявляющего растворителя 5% МеОН в DCM) и получают продукт 9 (67 мг, выход 95%). 1 Н ЯМР (200 МГц, CDCl3):8,14 (1 Н, д, J=2,4 Гц), 7,76 (1 Н, д, д, J1=8,6 Гц, J2=2,4 Гц), 7,39 (2 Н, д,J=8,8 Гц), 6,87 (2 Н, м), 6,76 (3 Н, м), 4,50 (2 Н, т, J=4,8 Гц), 3,87 (2 Н, т, J=4,8 Гц), 3,70 (6 Н, м), 3,61 (2 Н, м),2,98 (6 Н, с), 2,49 (1 Н, ушир.), МСВР (EI) m/z вычислено для [C21H28N2O4]+ 372,2049(52 мг, 0,27 ммоль). Реакционную смесь перемешивают при 0 С в течение 1 ч и затем нагревают до комнатной температуры и перемешивают в течение 3 ч. Добавляют воду и реакционную смесь экстрагируют этилацетатом. Органический слой отделяют, промывают солевым раствором, сушат над безводным сульфатом натрия и упаривают. Остаток очищают ПТСХ (в качестве проявляющего растворителя 4% МеОН в DCM) и получают продукт 10 (25 мг, выход 41%). 1 Н ЯМР (200 МГц, CDCl3):8,14 (1 Н, д, J=2,0 Гц), 7,76 (3 Н, м), 7,39 (2 Н, д, J=8,8 Гц), 7,32 (2 Н, д,J=8,0 Гц), 6,87 (2 Н, м), 6,75 (3 Н, м), 4,46 (2 Н, т, J=4,6 Гц), 4,16 (2 Н, т, J=4,8 Гц), 3,81(2 Н, т, J=4,8 Гц), 3,66(6 Н, м), 2,99 (6 Н, с), 2,43 (3 Н, с), МСВР (EI) m/z вычислено для [C28H34N2O6S]+ 526,2138. Пример 4. Синтез соединения 11 а А) Синтез промежуточных соединений 18 и 19 2-Гидрокси-3-бром-5-иодпиридин (18) Следуя ранее разработанному способу (Meana A. et al., Synlett., 2003, 1678-1682) получают соединение 18 из N-иодсукцинимида (2,48 г, 11,0 ммоль) и 3-бром-2-гидроксипиридина 17 (1,74 г, 10,0 ммоль) в виде бледно-коричневого твердого вещества (2,55 г, 85%). 1(0,511 г, 1,95 ммоль) в 10 мл ТГФ при перемешивании при -10 С добавляют по каплям раствор диизопропилазодикарбоксилата (DIAD, 0,394 г, 1,95 ммоль) в 5 мл ТГФ. Ледяную баню с солью удаляют, и реакционную смесь выдерживают при комнатной температуре (r.t.) в течение 2 ч. Реакционный раствор концентрируют и остаток очищают ФХ (FC) (МеОН/CHCl3, 1/99), и получают I9 - бесцветную вязкую жидкость (0,423 г, 75%). 1 Н ЯМР 8,21 (д, 1 Н, J=2,0 Гц), 8,02 (д, 1 Н, J=2,0 Гц), 4,66 (т, 1 Н, J=4,1 Гц), 4,50-4,39 (м, 3 Н), 3,893,64 (м, 8 Н). 13 С ЯМР 159,4, 151,2, 148,5, 108,5, 84,9, 81,6, 81,5, 71,1, 71,0, 70,8, 70,4, 69,3, 66,9. МСВР вычислено для C11H14BrFINO3 (M+), 432,9186; найдено, 432,9173. 0,025 ммоль) в 2 мл ДМФА особождают от кислорода, продувая азотом в течение 15 мин, и затем греют при 65 С в течение 2 ч. Реакционную смесь охлаждают до r.t. и подвергают стандартной обработке с этилацетатом (EtOAc). Сырой продукт реакции очищают ФХ (EtOAc/гексан, 30/70) и получают 11 а в виде светло-желтого твердого вещества (0,178 г, 79%). 1 Н ЯМР 8,08 (д, 1 Н, J=2,l Гц), 8,00 (д, 1 Н, J=2,1 Гц), 7,39 (д, 2 Н, J=8,8 Гц), 6,92 (д, 1 Н, J=16,3 Гц),6,74 (д, 1 Н, J=16,3 Гц), 6,72 (д, 2 Н, J=8,1 Гц), 4,69 (т, 1 Н, J=4,2 Гц), 4,55 (т, 2 Н, J=4,8 Гц), 4,45 (т, 1 Н,J=4,2 Гц), 3,94-3,68 (м, 8 Н), 3,00 (с, 6 Н). 13 С ЯМР 158,3, 150,4, 143,5, 138,0, 129,6, 129,5, 127,7, 125,2, 118,8, 112,5, 107,5, 85,0, 81,6, 71,2,71,0, 70,8, 70,4, 69,6, 66,7, 40,5. МСВР вычислено для C21H26BrFN2O3 (М+), 452,1111; найдено, 452,1099. Пример 5. Синтез соединения 11b(11b) Соединение 11b получают из 4-метиламиностирола (0,073 г, 0,55 ммоль) и I9 (0,217 г, 0,50 ммоль) в виде светло-желтой вязкой жидкости (0,113 г, выход 52%). 1 Н ЯМР 8,07 (д, 1H, J=2,l Гц), 8,00 (д, 1 Н, J=2,1 Гц), 7,35 (д, 2 Н, J=8,6 Гц), 6,91 (д, 1H, J=16,3 Гц),6,74 (д, 1 Н, J=16,3 Гц), 6,60 (д, 2 Н, J=8,6 Гц), 4,69 (т, 1 Н, J=4,2 Гц), 4,55 (т, 2 Н, J=4,8 Гц), 4,45 (т, 1H,J=4,2 Гц), 3,94-3,68 (м, 8 Н) , 2,88 (с, 3 Н). 13 С ЯМР 158,4, 149,5, 143,6, 138,0, 129,8, 129,5, 127,9, 126,1, 118,9, 112,6, 107,5, 85,0, 81,7, 71,2,71,1, 70,8, 70,4, 69,6, 66,8, 30,7. МСВР вычислено для C20H24BrFN2O3 (M+) , 438,0954; найдено, 438,0967. Пример 6. Синтез соединения 11 е(Е)-(5-Бром-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-[4-N-метил-4-N-(трет-бутилоксикарбонил)аминофенил]этилен (11c) Соединение 11 с получают из 4-N-метил-4-N-(трет-бутилоксикарбонил) аминостирола (0,219 г, 0,94 ммоль) и I9 (0,273 г, 0,63 ммоль) в виде белой вязкой жидкости (0,319 г, выход 94%). 1H ЯМР 8,12 (д, 1 Н, J=2,1 Гц), 8,03 (д, 1 Н, J=2,1 Гц), 7,44 (д, 2 Н, J=8,6 Гц), 7,25 (д, 2 Н, J=9,0 Гц),6,94 (д, 2 Н, J=2,1 Гц), 4,69 (т, 1 Н, J=4,2 Гц), 4,56 (т, 2 Н, J=4,9 Гц), 4,45 (т, 1 Н, J=4,2 Гц), 3,94-3,68 (м, 8 Н),3,28 (с, 3 Н), 1,48 (с, 9 Н). 13 С ЯМР 158,8, 154,5, 144,0, 143,5, 138,2, 133,6, 128,5, 128,4, 126,8, 126,6, 125,4, 122,9, 107,4, 84,8,81,4, 80,4, 71,0, 70,9, 70,6, 70,2, 69,4, 66,7, 53,5, 37,1, 28,4. МСВР вычислено для C25H32BrFN2O5 (M+),538,1479; найдено, 538,1476.(Е)-(5-Бром-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-(4-ацетоксифенил)этилен (11d) Соединение 11d получают из 4-ацетоксистирола (0,122 г, 0,75 ммоль) и I9 (0,217 г, 0,5 ммоль) в виде белой вязкой жидкости (0,181 г, выход 77%). 1 Н ЯМР 8,12 (д, 1 Н, J=2,1 Гц), 8,03 (д, 1H, J=2,1 Гц), 7,50 (д, 2H, J=8,6 Гц), 7,10 (д, 2H, J=8,6 Гц),6,94 (д, 2H, J=3,3 Гц), 4,69 (т, 1H, J=4,2 Гц), 4,56 (т, 2 Н, J=4,9 Гц), 4,45 (т, 1H, J=4,2 Гц), 3,94-3,68 (м, 8 Н),2,32 (с, 3 Н), 1,48 (с, 9 Н). 13 С ЯМР 169,3, 158,9, 150,3, 144,1, 138,2, 134,5, 128,24, 128,16, 127,4, 123,4, 121,9, 107,5, 84,8, 81,5,71,0, 70,9, 70,6, 70,3, 69,4, 66,7, 21,1. МСВР вычислено для C21H23BrFNO5 (M+), 467,0744; найдено,467,0731.(Е)-(5-Бром-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-(4-гидроксифенил) этилен (11 е) Ацетат 11d (0,145 г, 0,31 ммоль) и K2CO3 (0,064 г, 0,465 ммоль) помещают в смесь EtOH/ТГФ (5 мл/5 мл), и реакционную смесь перемешивают при r.t. в течение 2 ч. После стандартной обработки сEtOAc сырой продукт реакции очищают ПТСХ и получают 11 е в виде белого твердого вещества (0,128 г,97%). 1 Н ЯМР 8,07 (д, 1 Н, J=2,1 Гц), 7,99 (д, 1H, J=2,l Гц), 7,35 (д, 2 Н, J=8,6 Гц), 6,96-6,74 (м, 4 Н), 5,22(ушир.с, 1 Н), 4,69 (т, 1 Н, J=4,2 Гц), 4,54 (т, 2H, J=4,8 Гц), 4,45 (т, 1H, J=4,2 Гц), 3,94-3,68 (м, 8H). 13 С ЯМР 158,5, 156,4, 143,6, 138,2, 129,2, 129,0, 127,9, 120,7, 116,0, 107,6, 84,9, 81,6, 71,1, 71,0,70,8, 70,4, 69,6, 66,8. МСВР вычислено для C19H21BrFNO4 (M+), 425,0638; найдено, 425,0651. Пример 7. Синтез соединения 12b(Е)-(5-три-Бутилстаннил-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-(4-метиламинофенил)этилен (12b) Соединение 12b получают из 11b (0,069 г, 0,156 ммоль) в виде светло-желтого масла (0,068 г, выход 68%). 1 Н ЯМР 8,10 (д, 1H, J=2,5 Гц), 7,80 (д, 1H, J=2,5 Гц), 7,36 (д, 2H, J=8,6 Гц), 6,92 (д, 1 Н, J=16,3 Гц),6,80 (д, 1H, J=16,3 Гц), 6,61 (д, 2H, J=8,6 Гц), 4,69 (т, 1 Н, J=4,2 Гц), 4,45 (т, 3 Н, J=5,1 Гц), 3,83 (т, 3 Н,J=4,4 Гц), 3,71-3,66 (м, 5H), 2,88 (с, 3 Н), 1,68-1,48 (м, 6 Н), 1,43-1,25 (м, 6 Н), 1,15-1,02 (м, 6 Н), 0,91 (т, 9 Н,J=7,1 Гц). 13 С ЯМР 166,8, 149,1, 145,4, 143,6, 127,8, 127,7, 127,0, 123,8, 121,2, 112,6, 85,0, 81,6, 71,1, 70,9,70,8, 70,5, 70,1, 65,0, 30,8, 29,5, 29,3, 29,1, 28,1, 27,5, 26,9, 13,9, 13,4, 13,3, 9,9, 6,6, 6,4. МСВР вычислено для C32H51FN2O3Sn (М+), 650,2906; найдено, 650,2894.(Е)-(5-три-Бутилстаннил-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-(4-гидроксифенил)этилен (12 е) Соединение 12 е получают из 11 е (0,032 г, 0,075 ммоль) в виде белой вязкой жидкости (0,04 0 г, выход 84%). 1 Н ЯМР 8,11 (д, 1 Н, J=2,5 Гц), 7,82 (д, 1 Н, J=2,5 Гц), 7,39 (д, 2 Н, J=8,6 Гц), 6,98-6,74 (м, 4 Н), 5,19(ушир.с, 1 Н), 4,71-4,66 (м, 1 Н), 4,48-4,43 (м, 3 Н), 3,90-3,62 (м, 8 Н), 1,70-1,02 (м, 18 Н), 0,91 (т, 9 Н, J=7,1 Гц). 13 С ЯМР 166,9, 156,0, 145,4, 144,0, 130,1, 127,9, 127,6, 127,4, 124,3, 123,0, 115,9, 85,0, 81,6, 71,0,70,9, 70,7, 70,5, 70,0, 65,2, 29,5, 29,3, 29,1, 28,0, 27,5, 26,9, 13,9, 13,4, 13,3, 9,9, 6,6, 6,4. МСВР вычислено для C31H48FNO4Sn (M+), 637,2589; найдено, 637,2573. Пример 9. Синтез соединения 13 а(Pd(PPh3)4 (0,013 г, 10 мол.%) в толуоле греют при 110 С в течение 18 ч. Реакционный раствор охлаждают до к.т. и обрабатывают 5 мл 10% KF. После энергичного перемешивания еще в течение 0,5 ч стандартная обработка с EtOAc и последующая ФХH ЯМР 8,11 (д, 1H, J=2,5 Гц), 7,81 (д, 1H, J=2,5 Гц), 7,41 (д, 2H, J=8,8 Гц), 6,93 (д, 1 Н, J=16,5 Гц),6,81 (д, 1H, J=16,5 Гц), 6,72 (д, 2H, J=8,7 Гц), 4,69 (т, 1H, J=4,2 Гц), 4,46 (т, 3 Н, J=4,9 Гц), 3,83 (т, 3 Н,J=4,8 Гц), 3,71-3,66 (м, 5 Н) , 3,00 (с, 6 Н), 1,68-1,48 (м, 6 Н), 1,43-1,21 (м, 6 Н), 1,15-1,02 (м, 6 Н), 0,91 (т, 9 Н,J=7,1 Гц). 13 С ЯМР 166,7, 150,2, 145,4, 143,6, 127,8, 127,7, 127,5, 126,0, 123,7, 121,2, 112,6, 85,0, 81,6, 71,0,70,8, 70,7, 70,4, 70,0, 65,0, 40,6, 29,5, 29,3, 29,1, 28,1, 27,5, 26,9, 13,9, 13,4, 13,3, 9,9, 6,6, 6,4. МСВР вычислено для C33H53FN2O3Sn (M+), 664,3062; найдено, 664,3037.(13 а) К раствору 12 а (0,114 г, 0,172 ммоль) в ТГФ (3 мл) при охлаждении на ледяной бане добавляют по каплям раствор иода (I2, 0,063 г, 0,024 ммоль) в ТГФ (2 мл). По окончании добавления реакционную смесь перемешивают при 0 С в течение 1 ч. После стандартной обработки с CH2Cl2 сырой продукт реакции очищают ФХ (EtOAc/гексан, 25/75), и получают светло-желтое твердое вещество 13 а (0,037 г, 48%). 1 Н ЯМР 8,22 (д, 1 Н, J=2,1 Гц), 8,10 (д, 1 Н, J=2,1 Гц), 7,38 (д, 2 Н, J=8,8 Гц), 6,92 (д, 1 Н, J=16,3 Гц),6,72 (д, 1 Н, J=16,3 Гц), 6,71 (д, 2 Н, J=8,8 Гц), 4,72-4,67 (м, 1H), 4,54-4,44 (м, 3 Н), 3,93-3,69 (м, 8 Н), 3,00 (с,6 Н). 13 С ЯМР 160,4, 150,5, 144,6, 144,55, 129,8, 129,5, 127,8, 125,3, 118,8, 112,6, 85,1, 81,7, 80,6, 71,3,71,1, 70,8, 70,5, 69,6, 67,1, 40,6. МСВР вычислено для C21H26FIN2O3 (M+), 500,0972; найдено, 500,0959. Пример 10. Синтез соединения 13b(Е)-(5-три-Бутилстаннил-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-[4-N-метил-4-N(трет-бутилоксикарбонил)аминофенил]этилен (12 с) Соединение 12 с получают из 11 с (0,072 г, 0,133 ммоль) в виде белой вязкой жидкости (0,07 7 г, выход 77%). 1 Н ЯМР 8,14 (д, 1H, J=2,5 Гц), 7,83 (д, 1H, J=2,5 Гц), 7,46 (д, 2H, J=8,6 Гц), 7,23 (д, 2H, J=8,5 Гц),6,96 (с, 2H), 4,70-4,66 (м, 1H), 4,49-4,42 (м, 3 Н), 3,86-3,66 (м, 8H), 3,28 (с, 3 Н), 1,80-1,02 (м, 27 Н), 0,90 (т,9 Н, J=7,1 Гц). 13 С ЯМР 167,3, 146,1, 143,8, 143,2, 134,6, 127,0, 126,8, 126,6, 125,7, 125,4, 124,1, 85,0, 81,6, 80,6,71,1, 70,9, 70,8, 70,5, 70,0, 65,1, 37,4, 29,5, 29,3, 29,1, 28,1, 27,5, 26,9, 13,9, 13,4, 9,9, 6,4. МСВР вычислено для C37H59FN2O5Sn (M+) , 750,343; найдено, 750,3425.(Е)-(5-Иод-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-[4-N-метил-4-N-(третбутилоксикарбонил)аминофенил]этилен (13 с) Соединение 13 с получают из 12 с (0,024 г, 0,032 ммоль) в виде белой вязкой жидкости (0,018 г,98%). 1 Н ЯМР 8,25 (д, 1 Н, J=1,6 Гц), 8,13 (д, 1 Н, J=1,6 Гц), 7,44 (д, 2 Н, J=8,4 Гц), 7,24 (д, 2 Н, J=8,4 Гц),6,97 (д, 1 Н, J=16,4 Гц), 6,86 (д, 1 Н, J=16,4 Гц), 4,69 (т, 1 Н, J=4,1 Гц), 4,53 (т, 2 Н, J=4,8 Гц), 4,45 (т, 1 Н,J=4,1 Гц), 3,94-3,69 (м, 8 Н), 3,28 (с, 3 Н), 1,47 (с, 9 Н). 13 С ЯМР 161,0, 154,8, 145,3, 144,9, 143,7, 133,9, 128,9, 128,6, 126,8, 125,7, 123,1, 85,1, 81,7, 80,7,77,4, 71,3, 71,1, 70,9, 70,5, 69,6, 67,2, 37,4, 28,6. МСВР вычислено для C21H26FIN2O3 (M+), 500,0972; найдено, 500,0959.(Е)-(5-Иод-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-(4-метиламинофенил)этилен (13b) К раствору 13 е (0,014 г, 0,024 ммоль) и 2,6-лутидина (28 мкл, 0,24 ммоль) в 2 мл CH2Cl2 при перемешивании при 0 С добавляют триметилсилилфталат (34 мкл, 0,19 ммоль). Через 15 мин реакционный раствор подвергают стандартной обработке с CH2Cl2. Сырой продукт реакции очищают ПТСХ и получают светло-желтую вязкую жидкость 13b (0,010 г, 88%). 1 Н ЯМР 8,22 (д, 1 Н, J=2,1 Гц), 8,10 (д, 1 Н, J=2,1 Гц), 7,34 (д, 2 Н, J=8,6 Гц), 6,91 (д, 1 Н, J=16,3 Гц),6,70 (д, 1 Н, J=16,3 Гц), 6,60 (д, 2 Н, J=8,6 Гц), 4,71-4,67 (м, 1 Н) , 4,54-4,43 (м, 3 Н), 3,94-3,69 (м, 9 Н), 2,88(с, 3 Н). 13 С ЯМР 160,5, 149,5, 144,6, 129,8, 129,7, 128,0, 126,3, 118,9, 112,6, 85,1, 81,7, 80,6, 77,4, 71,3, 71,2,70,9, 70,5, 69,7, 67,2, 30,8. МСВР вычислено для C20H24FIN2O3 (М+), 486,0816; найдено, 486,0818. Пример 11. Синтез соединения 13 е(Е)-(5-три-Бутилстаннил-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-(4-гидроксифенил)этилен (12 е) Соединение 12 е получают из 11 е (0,032 г, 0,075 ммоль) в виде белой вязкой жидкости (0,040 г, выход 84%). 1 Н ЯМР ввв 8,11 (д, 1 Н, J=2,5 Гц), 7,82 (д, 1 Н, J=2,5 Гц), 7,39 (д, 2 Н, J=8,6 Гц), 6,98-6,74 (м, 4 Н) ,5,19 (ушир.с, 1 Н), 4,71-4,66 (м, 1 Н), 4,48-4,43 (м, 3 Н), 3,90-3,62 (м, 8 Н), 1,70-1,02 (м, 18 Н), 0,91 (т, 9 Н,J=7,1 Гц). 13 С ЯМР 166,9, 156,0, 145,4, 144,0, 130,1, 127,9, 127,6, 127,4, 124,3, 123,0, 115,9, 85,0, 81,6,71,0, 70,9, 70,7, 70,5, 70,0, 65,2, 29,5, 29,3, 29,1, 28,0, 27,5, 26,9, 13,9, 13,4, 13,3, 9,9, 6,6, 6,4. МСВР вычислено для C31H48FNO4Sn (M+), 637,2589; найдено, 637,2573.(Е)-(5-Иод-6-2-[2-(2-фторэтокси)этокси]этоксипиридин-3-ил)-2-(4-гидроксифенил)этилен (13 е) Соединение 13 е получают из 12 е (0,012 г, 0,019 ммоль) в виде белого твердого вещества (0,008 г,90%). 1 Н ЯМР 8,21 (д, 1 Н, J=2,1 Гц), 8,08 (д, 1 Н, J=2,1 Гц), 7,33 (д, 2 Н, J=8,6 Гц), 6,94-6,69 (м, 4H), 4,714,67 (м, 1 Н), 4,53-4,43 (м, 3 Н), 3,94-3,69 (м, 8 Н). МСВР вычислено для C19H21FINO4 (M+), 473,0499; найдено, 473,0498. Пример 12. Синтез соединения 14 а 2-Гидрокси-3-бром-5-иодпиридин (9b) К суспензии I8 (см. пример 4 выше) (0,906 г, 3,0 ммоль), 2-(трет-бутилдиметилсиланилокси)этанола(0,554 г, 3,15 ммоль) и PPh3 (0,944 г, 3,6 ммоль) в 20 мл ТГФ при перемешивании при -10 С добавляют по каплям раствор диизопропилазодикарбоксилата (DIAD) (0,728 г, 3,6 ммоль) в 10 мл ТГФ. Ледяную баню с солью удаляют, и реакционную смесь выдерживают при r.t. в течение 2 ч. Реакционный раствор концентрируют и остаток очищают ФХ (EtOAc/гексан, 5/95), и получают 2-(третбутилдиметилсиланилокси)этокси-3-бром-5-иодпиридин - бесцветную вязкую жидкость (0,995 г, 72%). 1 Н ЯМР 8,23 (д, 1 Н, J=2,0 Гц), 8,05 (д, 1 Н, J=2,0 Гц), 4,42 (т, 2 Н, J=4,9 Гц), 3,98 (т, 2H, J=4,9 Гц),0,90 (с, 9H), 0,10 (с, 6 Н). МСВР вычислено для C12H18BrINO2Si (M-CH3+), 441,9335; найдено, 441,9312.(Е)-[5-Бром-6-(2-гидроксиэтокси)пиридин-3-ил]-2-(4-диметиламинофенил)этилен (14 а) Соединение 14 а получают из 4-диметиламиностирола (0,031 г, 0,212 ммоль) и 110 (0,073 г, 0,212 ммоль) в виде светло-желтого твердого вещества (0,022 г, выход 29%). 1 Н ЯМР 8,07 (д, 1H, J=2,1 Гц), 8,03 (д, 1H, J=2,1 Гц), 7,39 (д, 2 Н, J=8,8 Гц), 6,94 (д, 1H, J=16,3 Гц),6,78-6,69 (м, 3 Н), 4,57-4,52 (м, 2 Н), 3,99 (т, 2 Н, J=4,3 Гц), 3,21 (ушир.с, 1 Н), 3,00 (с, 6 Н). 13 С ЯМР 158,3, 150,4, 143,0, 138,2, 129,9, 129,8, 127,6, 124,9, 118,3, 112,3, 107,5, 69,6, 62,1, 40,3. МСВР вычислено для C17H19BrN2O2 (М+). 362,063; найдено, 362,0629. Пример 13. Синтез соединения 14b(с, 3 Н). 13 С ЯМР 149,6, 143,3, 138,5, 130,1, 130,0, 128,0, 126,0, 118,6, 112,6, 107,7, 69,8, 62,2, 30,7. МСВР вычислено для C17H19BrN2O2 (M+), 348,0473; найдено, 348,0468. Пример 14. Синтез соединения 14d(Е)-[5-Бром-6-(2-гидроксиэтокси)пиридин-3-ил]-2-(4-ацетоксифенил)этилен (14d) Соединение 14d получают из 4-ацетоксистирола (0,130 г, 0,80 ммоль) и 10 (0,244 г, 0,7 ммоль) в виде белой вязкой жидкости (0,031 г, выход 12%). 1(Е)-[5-Бром-6-(2-гидроксиэтокси)пиридин-3-ил]-2-(4-гидроксифенил)этилен (14 е) Процедурой, подобной процедуре, описанной при получении 11 е, из ацетата 14d (0,031 г, 0,082 ммоль) получают соединение 14 е в виде белого твердого вещества (0,020 г, 73%). 1 Н ЯМР (ДМСО-d6)9,60 (ушир.с, 1H), 8,31 (с, 1 Н), 8,23 (с, 1 Н), 7,39 (д, 2 Н, J=8,3 Гц), 7,19 (д, 1 Н,J=16,8 Гц), 6,94 (д, 1 Н, J=16,6 Гц), 6,77 (д, 2H, J=8,3 Гц), 4,35 (т, 2 Н, J=5,1 Гц), 3,73 (т, 2H, J=5,1 Гц). С ЯМР (ДМСО-d6)157,9, 157,4, 143,7, 138,1, 129,2, 129,0, 127,8, 119,8, 115,6, 106,7, 68,4, 59,2. МСВР вычислено для C15H14BrNO3 (M+) , 335,0157; найдено, 335,0165. Пример 16. Синтез соединения 15 е(Е)-[5-три-Бутилстаннил-6-(2-гидроксиэтокси)пиридин-3-ил]-2-(4-гидроксифенил)этилен (15 е) Соединение 15 е получают из 14 е (0,031 г, 0,092 ммоль) в виде белой вязкой жидкости (0,012 г, выход 24%). 1(ушир.с, 1 Н), 5,01 (ушир.с, 1 Н), 4,50-4,46 (м, 2 Н), 3,98-3,94 (м, 2 Н), 1,69-1,01 (м, 18 Н), 0,91 (т, 9 Н, J=7,1 Гц). 13 С ЯМР 167,2, 156,0, 144,9, 144,7, 144,5, 130,1, 128,0, 127,96, 124,7, 122,8, 116,0, 69,9, 63,4, 29,9,29,5, 29,3, 29,1, 28,1, 27,5, 26,9, 13,9, 13,6, 13,5, 10,1, 6,7, 6,6. МСВР вычислено для C27H41NO3Sn (M+),547,2108; найдено, 547,2112. Пример 17. Синтез соединения 16 а(Е)-[5-три-Бутилстаннил-6-(2-гидроксиэтокси)пиридин-3-ил]-2-(4-диметиламинофенил)этилен (15 а) Соединение 15 а получают из 14 а (0,100 г, 0,275 ммоль) в виде светло-желтого масла (0,105 г, выход 66%). 1 Н ЯМР 8,10 (д, 1 Н, J=2,5 Гц), 7,85 (д, 1H, J=2,4 Гц), 7,41 (д, 2 Н, J=8,7 Гц), 6,95 (д, 1H, J=16,3 Гц),6,81 (д, 1H, J=16,6 Гц), 6,73 (д, 2 Н, J=8,8 Гц), 4,48-4,44 (м, 2 Н), 3,96-3,92 (м, 2H), 2,99 (с, 6 Н), 1,68-1,01 (м,18 Н), 0,92 (т, 9 Н, J=7,2 Гц). 13 С ЯМР 166,6, 150,1, 144,5, 144,1, 128,2, 128,1, 127,4, 125,6, 124,0, 120,5, 112,4, 69,4, 63,0, 40,4,29,0, 27,2, 13,6, 9,8. МСВР вычислено для C29H46N2O2Sn (М+), 574,2581; найдено, 574,2584.(0,004 г, 50%). 1 Н ЯМР 8,25 (с, 1 Н), 8,10 (с, 1 Н), 7,39 (д, 2 Н, J=8,6 Гц), 6,94 (д, 1 Н, J=16,3 Гц), 6,76-6,70 (м, 3 Н),4,51 (т, 2 Н, J=4,2 Гц), 4,02-3,95 (м, 2 Н), 3,19 (с, 1 Н), 3,00 (с, 6 Н). МСВР вычислено для C17H19IN2O2 (M+) ,410,0491; найдено, 410,0489. Пример 18. Синтез соединения 16b(Е)-[5-три-Бутилстаннил-6-(2-гидроксиэтокси)пиридин-3-ил]-2-(4-метиламинофенил)этилен (15b) Соединение 15b получают из 14b (0,052 г, 0,15 ммоль) в виде светло-желтого масла (0,059 г, выход 64%). 1 Н ЯМР 8,08 (д, 1 Н, J=2,5 Гц), 7,84 (д, 1 Н, J=2,4 Гц), 7,37 (д, 2 Н, J=8,6 Гц), 6,93 (д, 1 Н, J=16,3 Гц),6,80 (д, 1 Н, J=16,4 Гц), 6,61 (д, 2 Н, J=8,6 Гц), 4,48-4,43 (м, 2 Н), 3,95-3,91 (м, 2 Н), 2,88 (с, 3 Н), 1,69-1,01 (м,18 Н), 0,91 (т, 9 Н, J=7,1 Гц). 13 С ЯМР 166,9, 149,2, 144,7, 144,3, 128,4, 128,3, 127,8, 126,7, 124,2, 120,7, 112,6, 69,6, 63,2, 30,8,29,5, 29,3, 29,1, 28,0, 27,5, 26,9, 13,9, 13,5, 13,4, 10,0, 6,6, 6,5. МСВР вычислено для C28H44N2O2Sn (M+),560,2425; найдено, 560,2419.C16H17IN2O2 (M+), 396,0335; найдено, 396,0335. Пример 19. Иодирование радиоактивными изотопами Иодированные радиоактивным изотопом иода [125I] соединения 13 а, 13b, 16a, 16b и 16 е получают реакций иоддестаннилирования из соответствующих предшественников соединений трибутилолова согласно способу, описанному ранее (ссылка). К смеси 50 мкл предшественника соединения трибутилолова(4 мкг/мкл EtOH), 50 мкл 1 н HCl и [125I]NaI (1-5 мКи, закупают у Perkin Elmer) добавляют пероксид водорода (50 мкл, 3%, мас./об.) в запаяной ампуле. Реакции дают возможность протекать в течение 5-10 мин при комнатной температуре и прекращают, добавляя 100 мкл насыщ. раствора NaHSO3. Реакционную смесь экстрагируют этилацетатом (31 мл), и экстракты нейтрализуют 1,5 мл насыщенного раствора бикарбоната натрия. Объединенные экстракты упаривают досуха. Остаток растворяют в 100 мкл EtOH и очищают ВЭЖХ с использованием колонки с обращенной фазой (аналитическая колонка PhenomenexGemini C18, 4,6250 мм, 5 мкм, буфер CH3CN/формиат аммония (1 мМ), 8/2 или 7/3; скорость потока 0,5-1,0 мл/мин). Продукты реакции без добавления носителя упаривают досуха и снова растворяют в 100% EtOH (1 мкКи/мкл), и хранят при -20 С до 6 недель для исследований на животных и аутографических исследований. Пример 20. Исследования связывания[125I] IMPY с удельной активностью 2200 Ки/ммоль и радиохимической чистотой более 95% получают с использованием стандартной реакции иоддестаннилирования и очищают с помощью упрощенной миниколонки с С-4, как описано ранее в Kung M.-P., Hou С, Zhuang Z.-P., Cross A.J., Maier D.L., Kungmice", Eur. J. Nucl. Med. Mol. Imaging, 2004, 31, 1136-1145. Анализы конкурентного связывания осуществляют в пробирках из боросиликатного стекла 1275 мм. Реакционная смесь содержит 50 мкл объединенных гомогенатов головного мозга с AD (20-50 мкг), 50 мкл [125I] IMPY (0,04-0,06 нМ, разведенного вPBS) и 50 мкл ингибиторов (10-5-10-10 М, серийно разведенных в PBS, содержащем 0,1% бычьего сывороточного альбумина) в конечном объеме 1 мл. Неспецифическое связывание определяют в присутствии 600 нМ IMPY в таких же аналитических пробирках. Смесь инкубируют при 37 С в течение 2 ч и связанную и свободную радиоактивность разделяют фильтрацией под вакуумом через фильтры Whatman GF/B с использованием клеточного харвестера Brandel M-24R с последующими промывками 23 мл PBS при комнатной температуре. Фильтры, содержащие лиганд со связанным 1-125, обсчитывают в счетчике гамма-квантов (Packard 5000) с эффективностью подсчета 70%. В условиях анализа специфически связанная фракция составляет менее 15% от общей радиоактивности. Результаты экспериментов по ингибированию подвергают нелинейному регрессионному анализу с использованием анализа данных по равновесному связыванию, из которых вычисляют величины Ki. Фиг. 1 и 6 показывают величины Ki для выбранных соединений по настоящему изобретению. Пример 21. Пленочная ауторадиография Индикаторы с [18F]. Срезы головного мозга больных AD получают, замораживая головной мозг на измельченном сухом льду и нарезая на срезы толщиной 20 мкм. Срезы инкубируют с индикаторами с [18F] (200000-250000 чим/200 мкл) в течение 1 ч при комнатной температуре. Затем срезы погружают в насыщенный растворLi2CO3 в 40% EtOH (две промывки по две минуты) и промывают 40% EtOH (одна двухминутная промывка), а затем ополаскивают водой в течение 30 с. После сушки срезы, меченные 18F, экспонируют на пленку Kodak MR в течение ночи. Результаты, полученные на пленке, отображены на фиг. 2. Индикаторы с [125I]. Для того, чтобы сравнить различные зонды с использованием схожих срезов ткани головного мозга человека, собирают макросрезы головного мозга от 6 субъектов с подтвержденной AD и одного контрольного субъекта. Наличие и локализацию бляшек на срезах подтверждают иммуногистохимическим окрашиванием моноклональными антителами против A 4G8 (Sigma). Срезы инкубируют с индикаторами с [125I] (200000-250000 чим/200 мкл) в течение 1 ч при комнатной температуре. Затем срезы погружают в насыщенный раствор Li2CO3 в 40% EtOH (две промывки по две минуты) и промывают 40% EtOH(одна двухминутная промывка), а затем ополаскивают водой в течение 30 с. После сушки срезы, меченные 125I, экспонируют на пленку Kodak Biomax MR в течение ночи. Пример 22. Распределение в органах у мышей В это время под анестезией изофураном 0,15 мл 0,1% раствора бычьего сывороточного альбумина,содержащего индикаторы с [125I] (5-10 мкКи, инъецируют непосредственно в хвостовую вену мышам ICR(самцы, 22-25 г). Мышей (n = 3 для каждого момента времени) умерщвляют цервикальной дислокацией в установленные моменты времени после инъекции. Органы, представляющие интерес, извлекают и взвешивают, и подсчитывают радиоактивность автоматическим счетчиком гамма-квантов. Дозу, в процентах,на орган вычисляют, сравнивая число импульсов ткани с подходящим образом разведенными аликвотами инъецируемого вещества. Общую активность крови вычисляют при предположении, что она составляет 7% от общей массы тела. Вычисляют % дозы/г образцов, сравнивая число импульсов для образцов с числом импульсов разведенной исходной дозы. Таблица 1. Биораспределение у мышей ICR после iv инъекции [18F]10 в 5% EtOH в физиологическом растворе (% дозы/г, средн. для 3 мышейср.-кв. откл.) Специалистам в данной области техники следует иметь в виду, что то же самое можно осуществить в широком и равнозначном интервале условий, композиций и других параметров без отхода от объема изобретения или любых его воплощений. Все патенты, заявки на патенты и публикации, цитированные в данном описании, входят в него в качестве ссылок. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I или его фармацевтически приемлемая соль, где где q равен целому числу от 1 до 5;Z представляет собой гидрокси или галоген иR30, R31, R32 и R33 в каждом случае представляют собой, независимо, водород; илиU представляет собой водород, гидрокси или галоген иR34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой, независимо, водород иR7 и R8 в каждом случае представляют собой, независимо, водород. 2. Соединение по п.1, содержащее по меньшей мере один радиоактивный изотоп галогена. 3. Соединение по п.1, содержащее по меньшей мере один галоген, который представляет собой I,123 125 131 15. Композиция, содержащая эффективное количество соединения по п.1 и фармацевтически приемлемый носитель или разбавитель, где указанное соединение содержит изотоп 11C, указанный изотоп присутствует в количестве, превышающим распространенность в природе, и указанное соединение, со- 22017898 держащее указанный изотоп 11C, имеет удельную радиоактивность, превышающую уровень фона. 16. Соединение формулы III или его фармацевтически приемлемая соль, где А 1, А 2, А 3 и А 5, каждый независимо, представляют собой -СН, -CR2 или -CR3, по необходимости; А 4 представляет собой N;R3 представляет собой радиоизотоп галогена или -SnC1-4-алкил)3; и где q равен целому числу от 1 до 5;Z представляет собой гидрокси или галоген иR30, R31, R32 и R33 в каждом случае представляют собой, независимо, водород илиU представляет собой водород, гидрокси или галоген иR34, R35, R36, R37, R38, R39 и R40 в каждом случае представляют собой, независимо, водород; иR7 и R8 в каждом случае представляют собой, независимо, водород. 17. Соединение по п.16, где R3 представляет собой 125I, 123I, 131I, 18F, 18F(С 1-4-алкил), 76Br, 77Br иSn(C1-4-алкил)3. 18. Соединение по п.16, где R1 представляет собой гидрокси или -(СН 2)pNR'R, где R' и R представляют собой, независимо, водород или C1-4-алкил и р равен 0. 19. Соединение по п.16, где R2 представляет собой где q равен целому числу от 1 до 4. 20. Соединение по п.16, где Z представляет собой фтор. 21. Соединение по п.16, где R2 представляет собой: где Y представляет собой фтор. 24. Фармацевтическая композиция, содержащая эффективное количество соединения по п.1 или 16 и фармацевтически приемлемый носитель или разбавитель. 25. Диагностическая композиция для визуализации амилоидных отложений, содержащая эффективное количество меченного радиоактивным изотопом соединения по п.1 или 16 и фармацевтически приемлемый носитель или разбавитель. 26. Способ визуализации амилоидных отложений, включающий:a) введение млекопитающему детектируемого количества диагностической композиции по п.25;b) предоставление достаточного времени для ассоциации меченого соединения с амилоидными отложениями иc) детекцию меченого соединения, ассоциированного с одним или несколькими амилоидными отложениями. 27. Способ ингибирования агрегации амилоидных бляшек у млекопитающего, включающий введение композиции по п.24 в количестве, эффективном для ингибирования агрегации амилоидных бляшек. 28. Соединение по п.1, представляющее собой 29. Фармацевтическая композиция, содержащая эффективное количество соединения по п.7 или 28 и фармацевтически приемлемый носитель или разбавитель. 30. Соединение по п.1, имеющее формулу где Ra и Rb представляют собой, независимо, водород или метил и
МПК / Метки
МПК: A61K 51/04, C07D 213/16, A61P 7/02
Метки: связывания, амилоидных, применение, визуализации, производные, стирилпиридиновые, бляшек
Код ссылки
<a href="https://eas.patents.su/29-17898-stirilpiridinovye-proizvodnye-i-ih-primenenie-dlya-svyazyvaniya-i-vizualizacii-amiloidnyh-blyashek.html" rel="bookmark" title="База патентов Евразийского Союза">Стирилпиридиновые производные и их применение для связывания и визуализации амилоидных бляшек</a>












