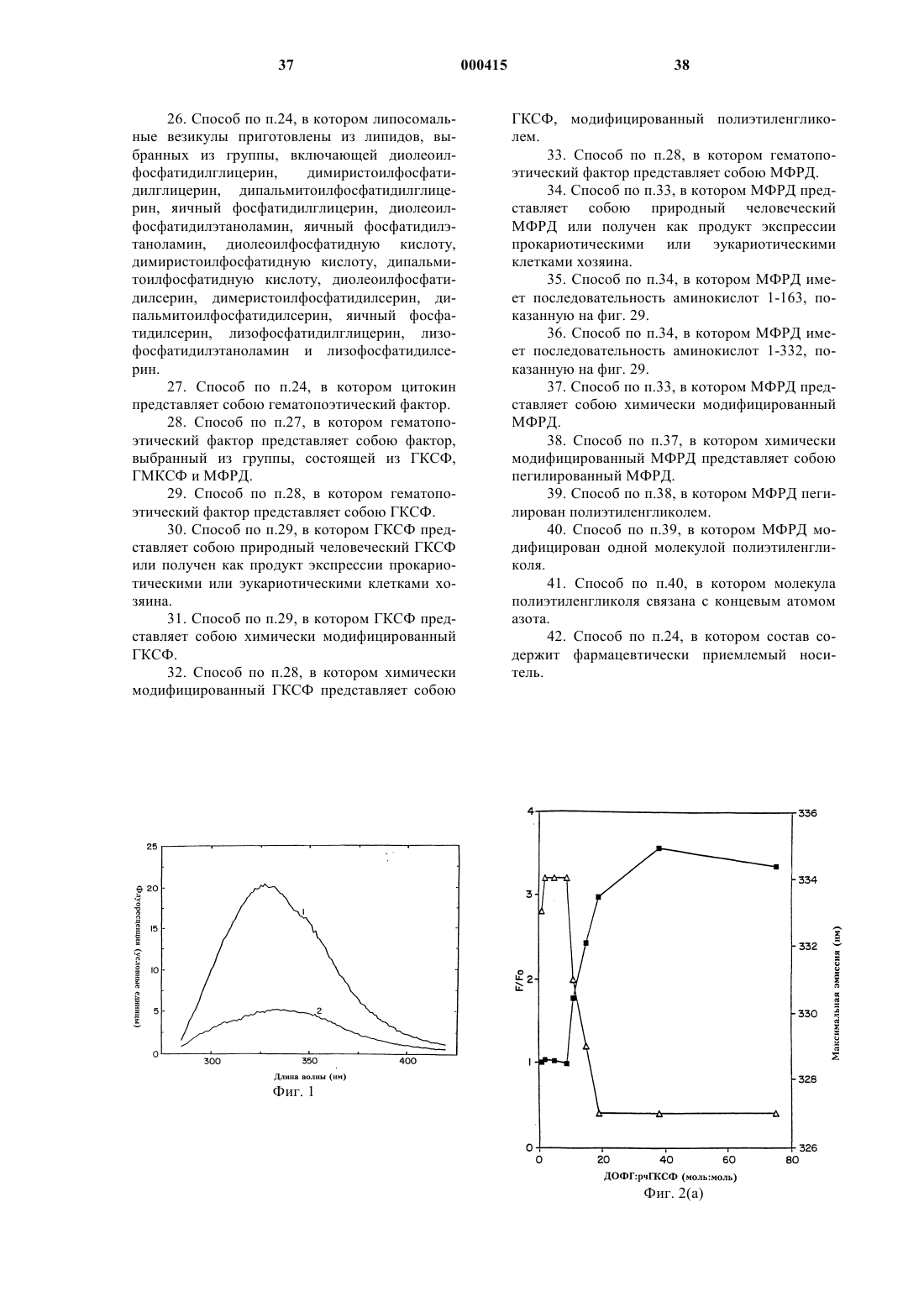
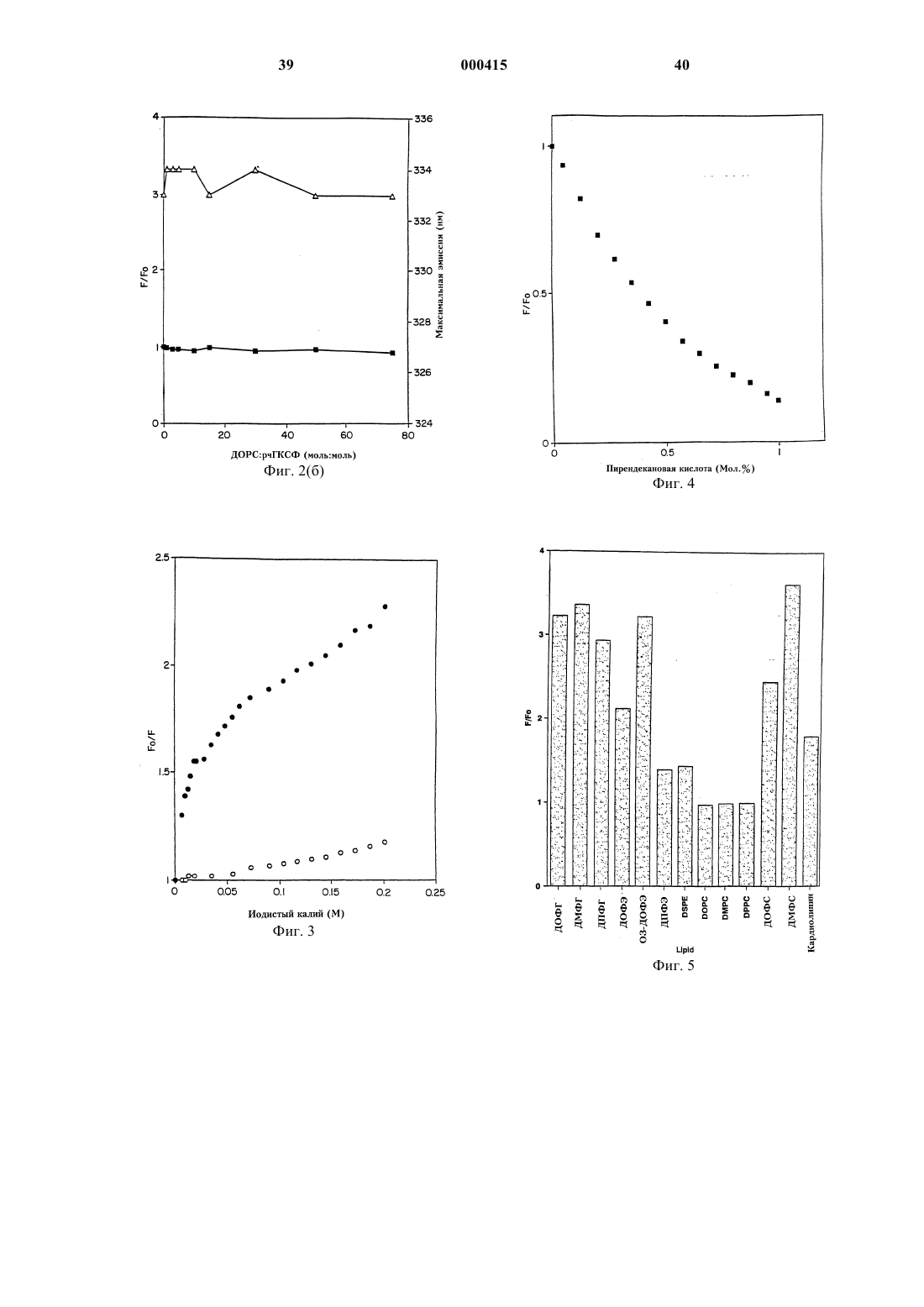
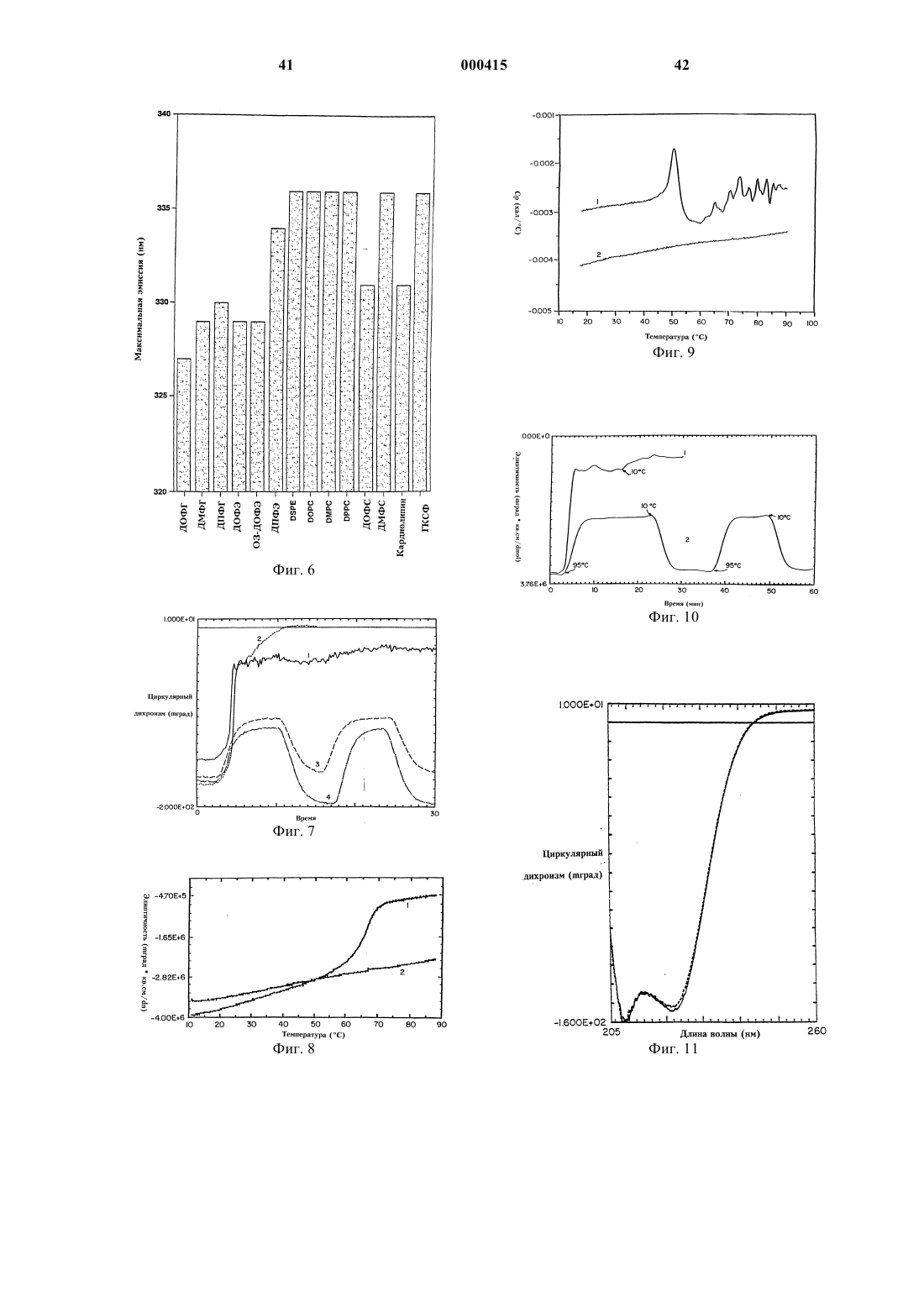
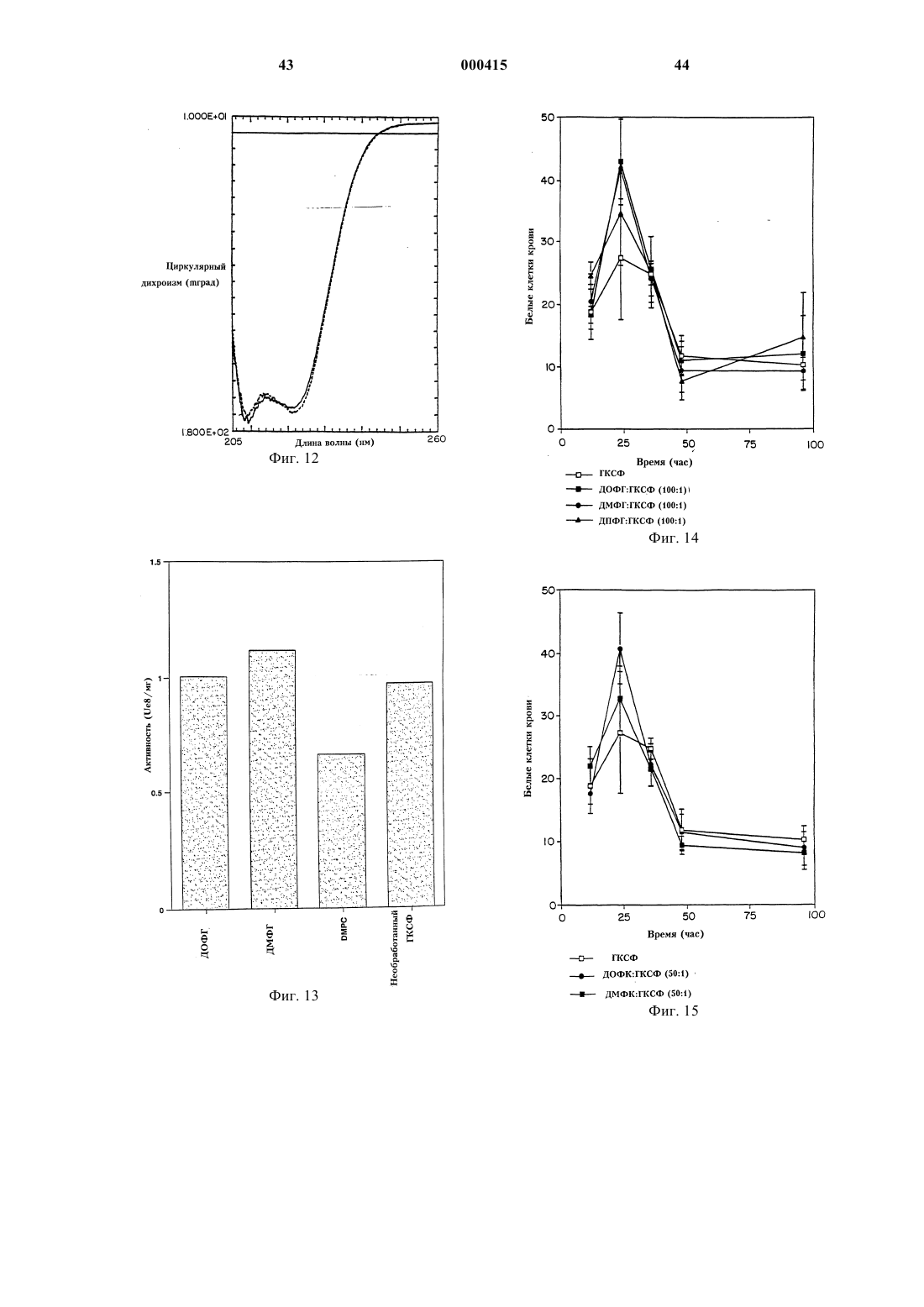
Стабильные белково-фосфолипидные составы и способы их получения
Формула / Реферат
1. Состав, включающий цитокин, смешанный с интактными фосфолипидными липосомальными везикулами, состоящими из отрицательно заряженных фосфолипидов, до образования липосомально-цитокинного комплекса, причем лишь часть белка цитокина включена в липидную часть липосомальных везикул, а липосомально-цитокинный комплекс непосредственно стабилизирован против развертывания спирали вторичной структуры цитокина.
2. Состав по п.1, в котором рН состава равняется 3,0-7,5 и отношение липид:цитокин составляет, по крайней мере, 10:1.
3. Состав по п.1, в котором липосомальные везикулы выбраны из группы, состоящей из диолеоилфосфатидилглицерина, димиристоилфосфатидилглицерина, дипальмитоилфосфатидилглицерина, яичного фосфатидилглицерина, диолеоилфосфатидилэтаноламина, яичного фосфатидилэтаноламина, диолеоилфосфатидной кислоты, димиристоилфосфатидной кислоты, дипальмитоилфосфатидной кислоты, диолеоилфосфатидилсерина, димеристоилфосфатидилсерина, дипальмитоилфосфатидилсерина, яичного фосфатидилсерина, лизофосфатидилглицерина, лизофосфатидилэтаноламина и лизофосфатидилсерина.
4. Состав по п.1, в котором цитокин представляет собою гематопоэтический фактор.
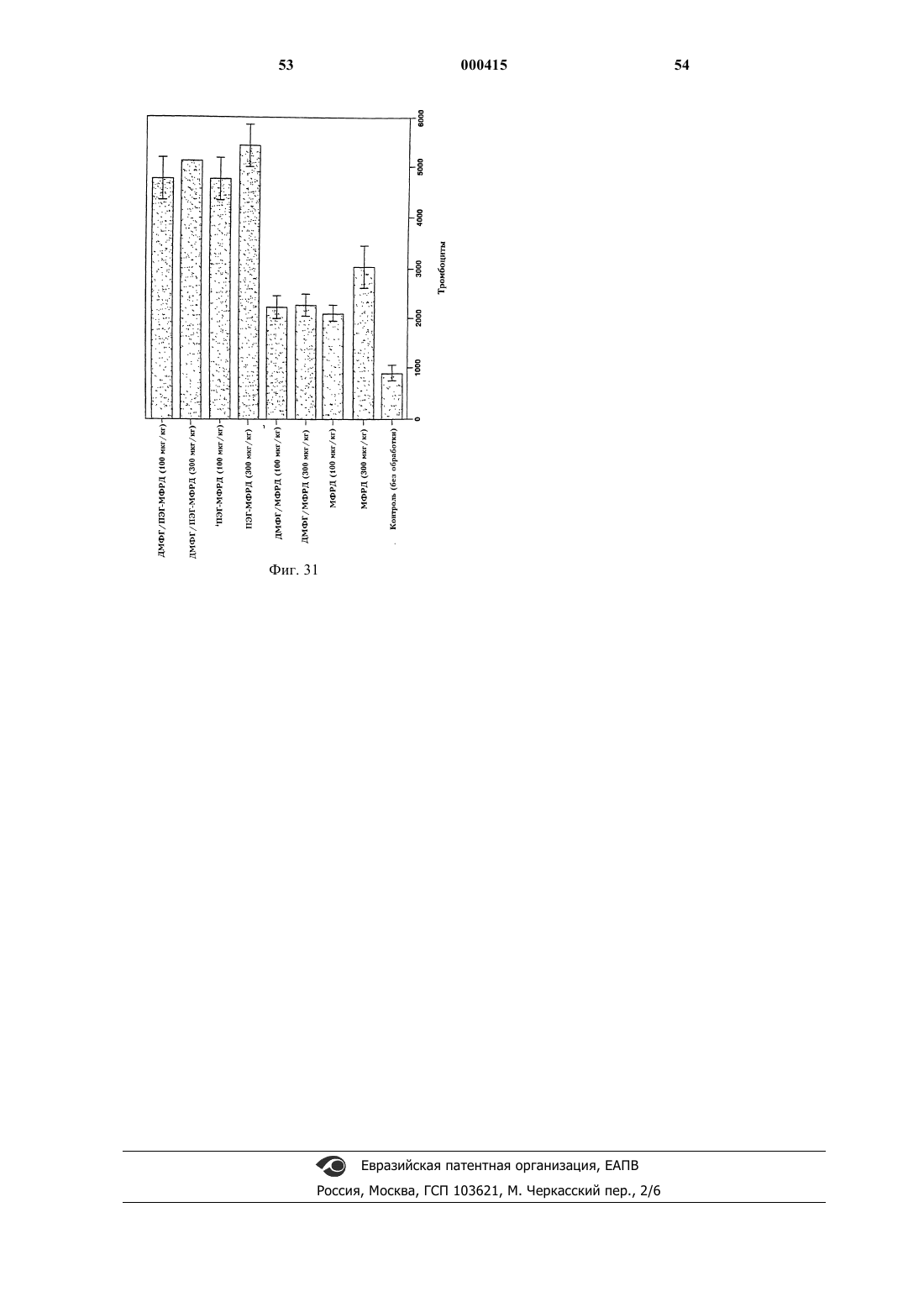
5. Состав по п.4, в котором гематопоэтический фактор представляет собою фактор, выбранный из группы, состоящей из ГКСФ, ГМКСФ и МФРД.
6. Состав по п.5, в котором гематопоэтический фактор представляет собою ГКСФ.
7. Состав по п.6, в котором ГКСФ представляет собою природный человеческий ГКСФ или получен как продукт экспрессии прокариотическими или эукариотическими клетками хозяина.
8. Состав по п.6, в котором ГКСФ представляет собою химически модифицированный ГКСФ.
9. Состав по п.8, в котором химически модифицированный ГКСФ представляет собою ГКСФ, модифицированный полиэтиленгликолем.
10. Состав по п.5, в котором гематопоэтический фактор представляет собою МФРД.
11. Состав по п.10, в котором МФРД представляет собою природный человеческий МФРД или получен как продукт экспрессии прокариотическими или эукариотическими клетками хозяина.
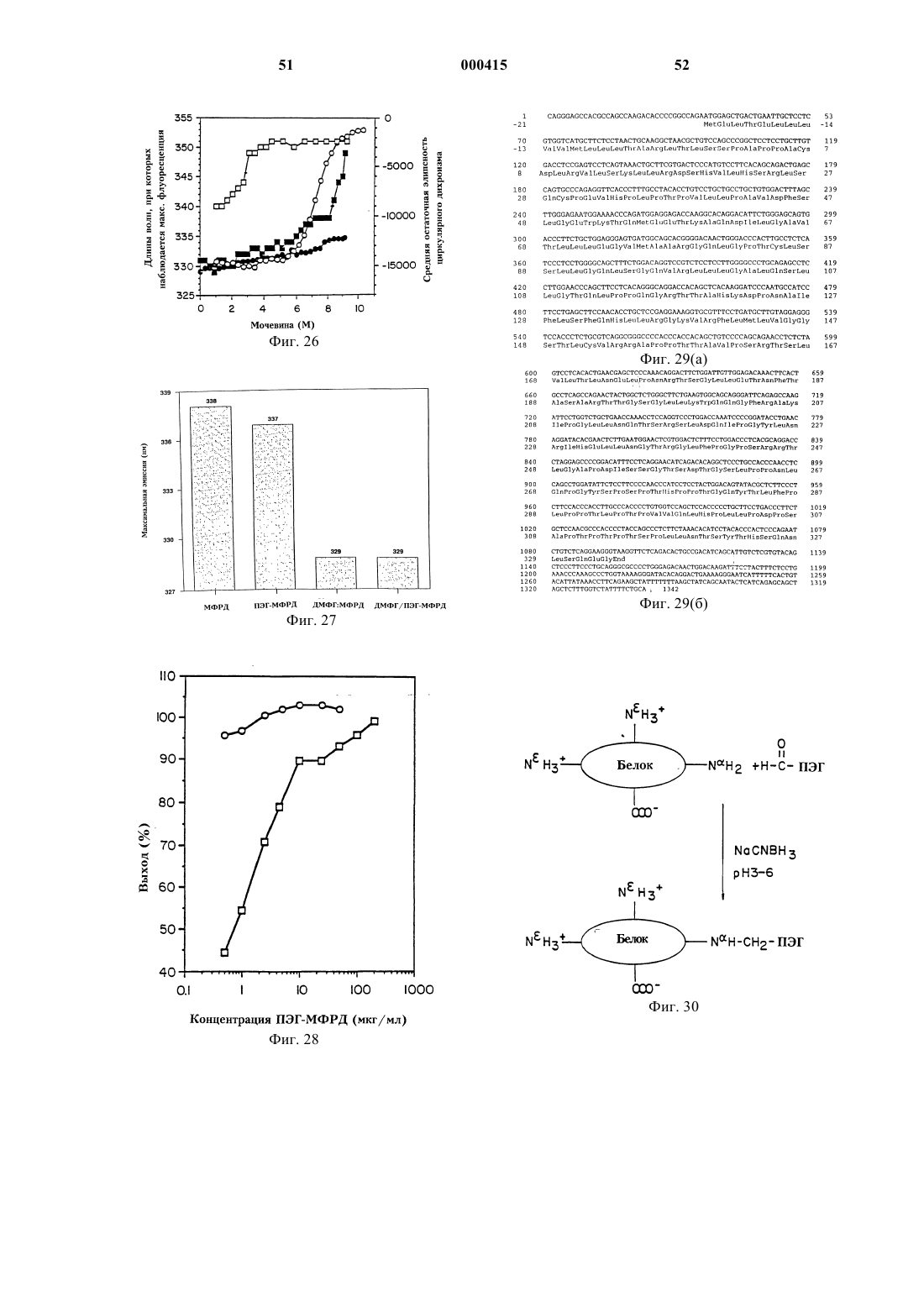
12. Состав по п.11, в котором МФРД имеет последовательность аминокислот 1-163, показанную на фиг. 29.
13. Состав по п.11, в котором МФРД имеет последовательность аминокислот 1-332, показанную на фиг. 29.
14. Состав по п.10, в котором МФРД представляет собою химически модифицированный МФРД.
15. Состав по п.14, в котором химически модифицированный МФРД представляет собою пегилированный МФРД.
16. Состав по п.15, в котором МФРД пегилирован полиэтиленгликолем.
17. Состав по п.16, в котором пегилированный МФРД содержит одну молекулу присоединенного полиэтиленгликоля.
18. Состав по п.17, в котором молекула полиэтиленгликоля связана с концевым атомом азота.
19. Состав по п.1, который содержит фармацевтически приемлемый носитель.
20. Состав по п.1, в котором белок представляет собою образованный с помощью клеток Е.соli рчГКСФ, липосомальные везикулы представляют собою ДОФГ, отношение ДОФГ:рчГКСФ равняется 50:1 и состав имеет значение рН 4,5 и содержит 10 мМ ацетата натрия.
21. Состав по п.1, в котором белок представляет собою образованный с помощью клеток E.coli МФРД с последовательностью аминокислот 1-163, липосомальные везикулы представляют собою ДМФГ, отношение ДМФГ:МФРД равняется 100:1 и состав имеет значение рН 5,0 и содержит 10 мМ ацетата натрия и 5% сорбита.
22. Состав по п.1, в котором белок представляет собою образованный с помощью клеток E.coli МФРД, модифицированный одной молекулой полиэтиленгликоля (моноПЭГ-МФРД), липосомальные везикулы представляют собою ДМФГ, отношение ДМФГ:моноПЭГ-МФРД равняется 100:1 и состав имеет значение рН 5,0 и содержит 10 мМ ацетата натрия и 5% сорбита.
23. Состав по п.1, в котором белок представляет собою образованный овариальными клетками китайского хомячка МФРД с последовательностью аминокислот 1-332, липосомальные везикулы представляют собою ДМФГ, отношение ДМФГ: МФРД равняется 100:1, состав имеет значение рН 5,0 и содержит 10 мМ ацетата натрия и 5% сорбита.
24. Способ получения липосомально-цитокинного состава, включающий смешивание цитокина с интактными фосфолипидными липосомальными везикулами, причем указанные липосомальные везикулы отрицательно заряжены таким образом, что лишь часть цитокина встраивается в липидную часть липосомальных везикул, а получаемый липосомально-цитокинный состав непосредственно стабилизирован против развертывания спирали вторичной структуры цитокина.
25. Способ по п.24, в котором состав имеет значение рН 3,0-7,5 и отношение липид:цитокин, по крайней мере, равное 10:1.
26. Способ по п.24, в котором липосомальные везикулы приготовлены из липидов, выбранных из группы, включающей диолеоилфосфатидилглицерин, димиристоилфосфатидилглицерин, дипальмитоилфосфатидилглицерин, яичный фосфатидилглицерин, диолеоилфосфатидилэтаноламин, яичный фосфатидилэтаноламин, диолеоилфосфатидную кислоту, димиристоилфосфатидную кислоту, дипальмитоилфосфатидную кислоту, диолеоилфосфатидилсерин, димеристоилфосфатидилсерин, дипальмитоилфосфатидилсерин, яичный фосфатидилсерин, лизофосфатидилглицерин, лизофосфатидилэтаноламин и лизофосфатидилсерин.
27. Способ по п.24, в котором цитокин представляет собою гематопоэтический фактор.
28. Способ по п.27, в котором гематопоэтический фактор представляет собою фактор, выбранный из группы, состоящей из ГКСФ, ГМКСФ и МФРД.
29. Способ по п.28, в котором гематопоэтический фактор представляет собою ГКСФ.
30. Способ по п.29, в котором ГКСФ представляет собою природный человеческий ГКСФ или получен как продукт экспрессии прокариотическими или эукариотическими клетками хозяина.
31. Способ по п.29, в котором ГКСФ представляет собою химически модифицированный ГКСФ.
32. Способ по п.28, в котором химически модифицированный ГКСФ представляет собою ГКСФ, модифицированный полиэтиленгликолем.
33. Способ по п.28, в котором гематопоэтический фактор представляет собою МФРД.
34. Способ по п.33, в котором МФРД представляет собою природный человеческий МФРД или получен как продукт экспрессии прокариотическими или эукариотическими клетками хозяина.
35. Способ по п.34, в котором МФРД имеет последовательность аминокислот 1-163, показанную на фиг. 29.
36. Способ по п.34, в котором МФРД имеет последовательность аминокислот 1-332, показанную на фиг. 29.
37. Способ по п.33, в котором МФРД представляет собою химически модифицированный МФРД.
38. Способ по п.37, в котором химически модифицированный МФРД представляет собою пегилированный МФРД.
39. Способ по п.38, в котором МФРД пегилирован полиэтиленгликолем.
40. Способ по п.39, в котором МФРД модифицирован одной молекулой полиэтиленгликоля.
41. Способ по п.40, в котором молекула полиэтиленгликоля связана с концевым атомом азота.
42. Способ по п.24, в котором состав содержит фармацевтически приемлемый носитель.
Текст
1 Настоящее изобретение касается белковофосфолипидных составов, которые могут стабилизировать вторичную и третичную структуры белков, способных переходить в расплавленное глобулярное состояние. Более конкретно это изобретение связано со следующими составами: гранулоцитарный колониестимулирующий фактор : фосфолипид (ГКСФ:фосфолипид) и мегакариоцитарный фактор роста и дифференциации: фосфолипид (МФРД : фосфолипид),обладающими повышенной стабильностью,имеющими увеличенный срок хранения и способными использоваться в условиях высоких температурных нагрузок и в качестве новых переносчиков лекарств. Отдельные белки проявляют способность переходить в расплавленное глобулярное состояние (PГC)[Van der Goot, F.G., Nature, 354,408-410 (1991)]. Белки в расплавленном глобулярном состоянии обладают вторичной структурой, которая сравнима со вторичной структурой нативных белков. Однако они имеют недостаточно жесткую третичную структуру [Pitsyn etal., FEBS Letters, 262.0:1, 20-24 (1990)].В некоторых случаях превращение в это состояние сопровождается предварительным удалением у белков гидрофобных участков. При таком удалении гиброфобных остатков, РГС может являться промежуточным в процессе агрегировании и осаждения белков. Переход в это состояние (РГС) может быть определен при сравнении циркулярного дихроизма в дальней УФ области со спектром ароматической боковой цепи(ближняя УФ область и флуоресценция). В расплавленном глобулярном состоянии проявляются изменения спектров ароматических групп при отсутствии изменений циркулярного дихроизма в дальней УФ области [Bychkova et al.,FEBS Letters 238.:231-234 (1988)] и РГС может обусловить проникновение некоторых белков в структуру мембран [Bychkova et al, FEBS Letters 238.:231-234 (1988); Van der Goot, F.G.Nature 354, 408-410 (1991)]. Гранулоцитарный колониестимулирующий фактор (ГКСФ) - единственный известный белок, переходящий в РГС до агрегации. Человеческий рекомбинантный ГКСФ селективно стимулирует нейтрофилы, тип белых клеток крови, используемые для борьбы с инфекцией. В настоящее время Филграстин - рекомбинантный ГКСФ стал доступен для терапевтического использования. Структура ГКСФ при различных условиях была широко изучена [Lu et al., J.Biol. Chem., Vol. 267, 8770-8777 (1992)]. По причине его гидрофобных свойств, ГКСФ было трудно охарактеризовать по длительности хранения Препараты некоторых гидрофобных белков теряют активность за счет образования димеров и агрегатов более высокого порядка (область макросоединений) в процессе длительного хранения. Другие химические изменения, такие как дезаминирование и окисление, также могли 2 наблюдаться при хранении. Заявленный ГКСФ должен защищать белки против денатурации и,в частности, показывал сохранение стабильности вторичной и третичной структуры белка Человеческий гранулоцитарномакрофагальный колониестимулирующий фактор(ГМКСФ) это гликопротеин размером 22 кДа,постоянно необходимый для пролиферации invitro макрофагов и клеток предшественников гранулоцитов. Он также контролирует необратимый переход этих предшественников в форму гранулоцитов и макрофагов. Кроме того, его биологическая активность позволяет регулировать функциональную активность созревающих клеток [Gough et al., Nature, 309., 763-767(1984)], и усиливать хемотаксис против узнаваемых химических раздражителей [Williams etal., Hematology, 4th ed. (1990)]. ГМКСФ также стимулирует образование моноцитов и таким образом может быть использован для лечения заболеваний, связанных с нарушениями образования моноцитов, таких как моноцитопения. Человеческий ГМКСФ может быть получен в очищенном виде из разных источников. Технология получения рекомбинантного человеческого ГМКСФ ранее была описана Burgesset al [Blood, 69.: 1,43-51 (1987)]. Сведения из патента США 5 047 504 (Вооnе) вместе с вышеприведенным источником информации позволяют производить в коммерческих масштабах ГМКСФ в негликозилированной форме как продукт экспрессии прокариотическими клетками. Мегакариоцитарный фактор роста и дифференциации (МФРД) представляет собою недавно клонированный цитокин, который является основным регулятором уровня циркулирующих тромбоцитов [см. Bartley Т. D. et al., Cell 77: 1117-1124 (1994); Lok S et al, Nature 369 565568 (1994), de Sauvage F J et al, Nature 369 533538 (1994), Miyazake H et aI, Exp Hematol 22 838(1994), Kuter D J et al, PNAS USA 91.: 1110411108 (1994)]. МФРД имеет отношение к тромбопоэтину, mpl-ligand и к мегапоэтину. Зрелый человеческий МФРД - белок, состоящий из 332 аминокислот. Последовательность аминокислот в этом белке и оснований в соответствующей сДНК показаны на фиг. 29. Как было показано, рекомбинантный МФРД, образуемый с помощью овариальных клеток китайского хомячка и Е. coli, обладает биологической активностью, выражающейся в специфическом стимулировании или увеличении уровня мегакариоцитов и/или тромбоцитовin vivo у мышей, крыс и обезьян [см., например,Hunt Р. et al., Blood 84. (10): 390 А (1994)]. Молекулы человеческого МФРД, которые были усечены таким образом, что содержали, по крайней мере, 151 аминокислоту, начиная от положения 1, показанного на фиг. 29, сохраняли свою биологическую активность in vivo. Можно удалить также первые шесть аминокислот с N 3 конца последовательности аминокислот человеческого МФРД и сохранить биологическую активность. Следовательно, биологическая активность сохраняется при наличии аминокислотной цепи с 7 по 151 (включительно) аминокислоту из полной аминокислотной последовательности человеческого МФРД, показанной на фиг. 29. Природный МФРД - гликозилированная молекула. Гликозилирование природного МФРД связано с двумя ключевыми доменами,которые были установлены у МФРД Последовательность первых приблизительно 151 аминокислот человеческого МФРД, соответствующая активной части молекулы, наводит на мысль о заметном его подобии эритропоэтину - цитокину, способному стимулировать образование эритроцитов, и может рассматриваться как"эритропоэтинподобная" область человеческого МФРД. Оставшиеся аминокислоты полного белка составляют так называемую "Nсвязывающую углеводы" область, которая включает большинство, если не все, сайты, ответственные за N-связанное гликозилирование. В человеческом МФРД имеется шесть сайтов,ответственных за N-гликозилирование, которые все содержатся в области N-связанного гликозилирования. Обе области содержат Oсвязанные сайты гликозилирования. В молекуле насчитывается 12-14 таких O-связанных цепей гликозилирования. Экспериментами с ДНК,ответственной за экспрессию рекомбинантного человеческого МФРД в овариальных клетках китайского хомячка (ОККХ) показано, что эритропоэтино подобная область, по крайней мере,в двух O-связанных сайтах гликозилирована - в положении 1 (сер) и в положении 37 (тре). В то время как такие белки как ГКСФ и МФРД могут быть стабильными при некоторых определенных условиях, до сих пор существует необходимость увеличить продолжительность хранения этих и других белков путем стабилизации их вторичной и третичной структуры. Один путь, который был испытан ранее в работах с такими белками, это использование липосом. Липиосомы, полностью закрытые двуслойной липидной мембраной, образуются водонерастворимыми полярными липидами, в частности, фосфолипидами. Липосомные частицы могут иметь единственную двухслойную мембрану (моноламелярные) или множество двухслойных мембран (мультиламелярные). Двойной слой состоит из двух липидных монослоев,имеющих гидрофильную (полярную) "головную" область и гидрофобную (неполярную)"хвостовую" область, при этом гидрофобные хвосты ориентированы в направлении к центру двойного слоя, а гидрофильные головы ориентированы в направлении водной фазы. Стабильность, устойчивость и проницаемость липосом могут меняться при изменении состава фосфолипидной композиции, при изменении температуры, при включении стеролов или заряженных 4 амфифилов. Базовая структура липосом может быть получена различными методами, известными в этой области. В процессе образования липосомы могут захватывать водные растворы в водные каналы и освобождать их с различной скоростью. На основе того открытия, что липосомы могут доставлять в клетки ферменты и изменять клеточный метаболизм [Gregoriadis, New Engl.J.Med. 295., 704-710, 765-770 (1976)], липосомы были провозглашены ответом на вопрос, как доставить лекарство к цели. В результате в области фармацевтики были проведены значительные поисковые исследования, включая использование липосом как средства постепенного освобождения лекарств, витаминов и белков, заключенных в гидрофобных слоях или в гидрофобном ядре липосом. Успешное использование липосом как носителя лекарств было ограничено, поскольку исследовательские попытки такого использования ставили несколько проблем. Например, известно, что липосомы действуют как сильные иммунологические адъюванты связанных с ними антигенов и должны быть соблюдены предосторожности, когда ферменты или другие белки ксеногенного происхождения включаются в липосомы. К тому же скорость диффузии лекарства трудно контролировать. Скорость диффузии зависит от неустойчивости липосом и от присутствия некоторых компонентов крови,которые усиливают диффузию ряда лекарств. Кроме того, исходя из их природы, некоторые вещества плохо включаются в липосомы и по этой причине быстро попадают в кровяное русло. Наконец, существует проблема доставки лекарства в определенные клетки и органы,иные чем печень и селезенка. Прекрасный обзор по липосомам, веществам, которые могут быть включены в липосомы, и по проблемам, связанным с использованием липосом как носителей лекарств, сделан Gregory Gregoriaidis в книгеand Medicine. Academic Press., N.Y.,1979]. В то время как имеется много сообщений,посвященных попыткам использования липосом как носителя лекарств, было мало работ, посвященных использованию липосом с целью увеличения сроков хранения лекарственных пептидов и белков путем стабилизации пептидов и/или белков. В международной заявке PCT/US 90/05163, названной "Лекарственные пептиды и белки", Hostetler et al. заявляют использование свободных липосом как фармацевтически приемлемого разжижителя для солюбилизации полипептидов и/или белков для предотвращения накопления полипептидов и/или белков на поверхности раздела воздух/вода и для предотвращения адсорбции полипептидов и/или белков на твердой поверхности. Hostetler et al. обнаружили, что отрицательно заряженный фос 5 фолипид может быть добавлен до концентрации приблизительно 50 мол.% и что фосфатидилхолин, нейтральный фосфолипид, предпочтителен для образования липосом. Hostetler et al. не раскрыли того, что разжижитель стабилизирует структуру полипептидов и белков. В международной заявкеPCT/US 91/07694, озаглавленной "Препарат и способ приготовления липосомальной формы фактора некроза опухоли" Hung et al описывают модифицированную липофилизированную молекулу фактора некроза опухоли (ФНО), ассоциированную с поверхностью или включенную внутрь липосом. Сообщается, что липосомальные липофилизированные молекулы ФНО имеют in vivo повышенную стабильность Стабильность объясняется уменьшением или тенденцией к уменьшению освобождения ФНО из включающих его липосом в организме in vivo. Предпочтительны липосомы на основе нейтральных липидов Hung et al не раскрывают состав ФНО,в котором связующие обеспечивают стабилизирующий эффект в отношении структуры белка Из литературы не было получено никакой информации, посвященной взаимодействию белков, например ГКСФ или МФРД, с отрицательно заряженными липидными везикулами,которое непосредственно стабилизирует белки в отношении термически индуцируемой агрегации, денатурации, потери активности и развертывания вторичной структуры. Существует потребность в таких композициях, при использовании которых обеспечивается полезный результат при осуществлении процедур, требующих высоких температурных нагрузок (например, включение ГКСФ и/или МФРД в полимеры), и которые могут быть использованы как новые носители лекарства (например, оральное назначение модифицированного полиэтиленгликолем ГКСФ). Настоящее изобретение обеспечивает возможность получения таких составов. Настоящее изобретение предусматривает добавление гидрофобных связующих, например, лизофосфолипидов или других липосом к белкам в расплавленном глобулярном состоянии, что непосредственно стабилизирует вторичную и третичную структуру белков, что, в свою очередь, защищает белки от термически индуцированной агрегации, денатурации и потери активности. В особенности, изобретение направлено на получение стабильных составов ГКСФ : фосфолипид и МФРД : фосфолипид. Неожиданно оказалось, что особенно ГКСФ: фосфолипидные и МФРД: фосфолипидные составы могли некоторое время находиться при температуре 10-95 С с полным возвратом вторичной белковой структуры при охлаждении. Составы были полезны при осуществлении процессов, требующих высоких температурных нагрузок, равно как и в качестве новых носителей - средств доставки лекарств. Кроме того, 000415 6 составы имеют больший срок хранения по сравнению с соответствующими белками как таковыми, а взаимодействие белка с фосфолипидной везикулой предотвращает адсорбцию белка на стекле. В предпочтительном варианте белковофосфолипидные комплексы включают отрицательно заряженные липосомы, которые изготовлены из диолеоилфосфатидилглицерина(ДПФС), яичного фосфатидилсерина, лизофосфатидилглицерина, лизофосфатидилэтаноламина, лизофосфатидилсерина. ДОФГ, отрицательно заряженный ненасыщенный фосфолипид,особо предпочтителен. Осуществление изобретения также предусматривает поддержание значения рН в пределах 3,0-7,5 и отношения липид: белок, равного, по крайней мере, 10:1. Дополнительные элементы, которые обеспечивают предпочтительный вариант воплощения изобретения, включают использование химически модифицированных белков в составе белково-фосфолипидного комплекса, так же как и использование одного или нескольких следующих агентов: агента для создания изотоничности; буферирующего агента; агента для доведения значения рН до требуемого. Изобретение охватывает стабильные составы белок : фосфолипид, имеющие различные комбинации этих дополнительных компонентов, которые должны быть известны специалистам в этой области. На фиг. 1 представлен спектр флуоресцентной эмиссии рчГКСФ в присутствии (кривая 1) и в отсутствие (кривая 2) везикул ДОФГ. Концентрация рчГКСФ равнялась 0,2 мг/мл. Молярное отношение ДОФГ рчГКСФ (кривая 1) равнялось 100:1. На фиг. 2 показано влияние увеличения отношения липид: белок на флуоресценцию рчГКСФ. Fo - начальная флуоресценция (без липидов) и F - флуоресценция после добавления липидов до достижения указанного молярного отношения липид : рчГКСФ. Фиг. 2(а) показывает отношение F/Foи длины волн, при которых наблюдается максимум испусканиядля смесей ДОФР : рчГКСФ. Фиг. 2(б) показывает отношение F/Foи длины волн, при которых наблюдается максимум испусканиядля смесей ВОРС : рчГКСФ. На фиг. 3 показан график Штерн-Вольмера(Stem-Volmer) гашения флуоресценции рчГКСФ йодистым калием в отсутствиеи в присутствии (О) везикул ДОФГ. Эксперименты по гаше 7 нию были выполнены при добавлении аликвот йодистого калия к рчГКСФ (0,2 мг/мл) и к ДОФГ : рчГКСФ (молярное отношение 100:1). На фиг. 4 показано гашение флуоресценции триптофана в рчГКСФ при добавлении пирендекановой кислоты. Эмиссия определялась при длине волны 327 нм. Молярное отношение ДОФГ : рчГКСФ составляло 100:1. На фиг. 5 графически показано сравнение интенсивности изменений F для рчГКСФ в отсутствие и в присутствии различных липидов. В каждом случае молярное отношение липид : белок равнялось 100:1. На фиг. 6 графически показано сравнение сдвигов максимума испускания рчГКСФ в отсутствие и в присутствии различных липидов. В каждом случае молярное отношение липид : белок равнялось 100:1. На фиг. 7 показано влияние DMPC (кривая 2), ДМФГ (кривая 3) и DМФК (кривая 4) на циркулярный дихроизм рчГКСФ (кривая 1). В каждом случае молярное отношение липид : белок 50:1 в воде при рН 6,0 равнялось 50:1. На фиг. 8 показан эффект увеличения температуры на циркулярный дихроизм рчГКСФ(кривая 1) или ДОФГ : рчГКСФ (молярное отношение 140:1) (кривая 2). Концентрация рчГКСФ в воде при рН 6,0 равнялась 80 мкг/мл. Температура сканировалась в диапазоне 1090 С при скорости 100 С/ч. На фиг. 9 показаны термограммы дифференциального калориметрического сканирования рчГКСФ (кривая 1) и ДОФГ : рчГКСФ (молярное отношение 45:1) (кривая 2). Концентрация рчГКСФ в образце равнялась 1 мг/мл (вода,рН 7,0). Скорость сканирования составляла 90 С/ч. На фиг. 10 показан эффект температурного цикла воздействия на циркулярный дихроизм рчГКСФ (кривая 1) и ДОФГ : рчГКСФ (молярное отношение 140:1) (кривая 2). Образцы были быстро нагреты до 95 С и охлаждены до 10 С как указано стрелками. Концентрация рчГКСФ в образце составляла 80 мкг/мл при значении рН 6,0. На фиг. 11 показан эффект температурного цикла воздействия на циркулярный дихроизм рчГКСФ (кривая 1) и ДМФГ : рчГКСФ (молярное отношение 150:1) (кривая 2). Образцы были нагреты до 95 С и охлаждены до 10 С. Концентрация рчГКСФ в образце составляла 80 мкг/мл при значении рН 6,0. На фиг. 12 показан эффект температурного цикла воздействия на циркулярный дихроизм рчГКСФ (кривая 1) и ДПФГ : рчГКСФ (молярное отношение 150:1) (кривая 2). Образцы были нагреты до 95 С и охлаждены до 10 С. Концентрация рчГКСФ в образце составляла 80 мкг/мл при значении рН 6,0. На фиг. 13 графически показана способность различных липидов стабилизировать рчГКСФ в процессе лиофильного высушивания. 8 Отношение липид : белок в каждом случае равнялось 100:1. Стабильность определялась по сохранению in vitro активности в испытании на клетках костного мозга. Только рчГКСФ не выдерживал процесса лиофильного высушивания так же как и использованный контроль - необработанный рчГКСФ в отсутствие липидов. На фиг. 14 показано влияние различных липидов на активность in vivo рчГКСФ. Активность (количество белых клеток крови) измерялась после подкожной инъекции хомячкам. Доза рчГКСФ составляла 100 мкг/кг при отношении липид : белок, равном 100:1. На фиг. 15 показано влияние различных липидов на активность in vivo рчГКСФ. Активность (количество белых клеток крови) измерялась после подкожной инъекции хомячкам. Доза рчГКСФ составляла 100 мкг/кг при отношении липид : белок, равном 50:1. На фиг. 16 графически показано сравнение интенсивности изменений F для ОККХ-ГКСФ в отсутствие и в присутствии ДОФГ при различных значениях рН. В каждом случае молярное отношение липид : белок равнялось 100:1. На фиг. 17 графически показано сравнение сдвигов максимумов эмиссии для ОККХ-ГКСФ в отсутствие и в присутствии ДОФГ при различных значениях рН. В каждом случае молярное отношение липид : белок равнялось 100:1. На фиг. 18 показан эффект температурного цикла воздействия на циркулярный дихроизм ПЭГ-ГКСФ (прямая линия) и ДПФГ : ПЭГГКСФ (молярное отношение 17:1) (пунктирная линия). Образцы были нагреты до 95 С и охлаждены до 10 С. На фиг. 19 показан: а) эффект температурного цикла воздействия на циркулярный дихроизм ГМКСФ в фосфатном буфере рН 7,0. ГМКСФ при 10 С (прямая линия) был сравнен с ГМКСФ, который был нагрет до 90 С и охлажден до 10 С (пунктирная линия); б) эффект температурного цикла воздействия на циркулярный дихроизм ДПФГ : ПЭГ-ГКСФ (молярное отношение 17:1). ДПФГ : ГМКСФ при 10 С (прямая линия) был сравнен с ДПФГ: ГМКСФ, который был нагрет до 90 С и охлажден до 10 С (пунктирная линия). На фиг. 20 показано: а) результаты общего ответа (количество белых клеток крови) на интрадуоденальную инфузию рчГКСФ в отсутствие и в присутствии ДОФГ. Доза рчГКСФ составляла 750 мкг/кг и отношение липид:белок равнялось 100:1; б) результаты общего ответа(количество белых клеток крови) на интрадуоденальную инфузию ПЭГ-ГКСФ в отсутствие и в присутствии ДОФГ. Доза ПЭГ-ГКСФ составляла 750 мкг/кг и отношение липид : белок равнялось 100:1. На фиг. 21 показано влияние ДОФГ на уровень содержания в сыворотке крови ПЭГГКСФ после интрадуоденальной струйной ин 9 фузии. Доза ПЭГ-ГКСФ составляла 750 мкг/кг и отношение липид : белок равнялось 100:1. На фиг. 22 показан флуоресцентный спектр эмиссии МФРД в присутствии и в отсутствие везикул ДМФГ. Концентрация МФРД составляла 0,1 мг/мл. МФРД представлял собою продукт, полученный с помощью E.coli и содержащий последовательность аминокислот 1163. Молярное отношение ДМФГ : МФРД составляло 100:1. На фиг. 23 показан эффект увеличения отношения липид : белок на флуоресценцию МФРД. МФРД представлял собою продукт, полученный с помощью E.coli и содержащий последовательность аминокислот 1-163. Показана длина волны, при которой наблюдается максимум эмиссии для смеси ДМФГ : МФРД при рН 5,0 (О) и при рН 7,0 . На фиг. 24 показан график ШтернВольмера гашения флуоресценции МФРД йодистым калием в отсутствие (О) и в присутствии везикул ДМФГ. МФРД представлял собою продукт, полученный с помощью E.coli и содержащий последовательность аминокислот 1163. Эксперименты по гашению были выполнены при добавлении аликвот йодистого калия к МФРД (0,1 мг/мл) и к ДМФГ: МФРД (молярное отношение 100:1). На фиг. 25 показано влияние температурного цикла воздействия на циркулярный дихроизм МФРД (О) и ДМФГ : МФРД (молярное отношение 100:1) . МФРД представлял собою продукт, полученный с помощью E.coli и содержащий последовательность аминокислот 1163. Процент сохранившейся спиральности вычислялся на основе величин циркулярного дихроизма, определяемых при 10 С после каждого цикла (за один цикл образец быстро нагревают до 95 С и охлаждают до 10 С). На фиг. 26 показана степень денатурации МФРД и МФРД : ДМФГ в присутствии различных концентраций мочевины. Показана средняя остаточная элиптичность циркулярного дихроизма МФРД (О) и ДМФГ : МФРД , а также положение максимума флуоресцентной эмиссии МФРДи ДМФГ : МФРД . МФРД представлял собою продукт, полученный с помощьюE.coli и содержащий последовательность аминокислот 1-163. Молярное отношение ДМФГ : МФРД равнялось 100:1. На фиг. 27 в графической форме представлены данные о максимальной флуоресцентной эмиссии МФРД и ПЭГ-МФРД как таковых и в присутствии ДМФГ. МФРД представлял собою продукт, полученный с помощью E.coli и содержащий последовательность аминокислот 1163, а ПЭГ-МФРД представлял собою МФРД,полученный с помощью Е.соli и содержащий последовательность аминокислот 1-163, который модифицирован одной молекулой полиэтиленгликоля. Молярное отношение ДМФГ : МФРД равнялось 100:1. 10 На фиг. 28 показана степень адсорбции ПЭГ-МФРД как такового и в присутствии ДМФГ к стеклу при разных концентрациях ПЭГ-МФРД. МФРД представлял собою продукт, полученный с помощью E.coli и содержащий последовательность аминокислот 1-163, а ПЭГ-МФРД представлял собою МФРД, полученный с помощью E.coli и содержащий последовательность аминокислот 1-163, который модифицирован одной молекулой полиэтиленгликоля. Выход (в %) ПЭГ-МФРД и ДМФГ : ПЭГМФРД (,соответственно) был оценен при количественном определении меченого МФРД,возвращаемого из стеклянных ампул после 18 ч инкубации при комнатной температуре. На фиг. 29 показана структура ДНК и последовательность аминокислот человеческого МФРД, включая сигнальный пептид (аминокислоты от -21 до -1) и основную последовательность (1-332). На фиг. 30 приведен пример сайтспецифического восстановительного алкилирования N-концевой альфа-аминогруппы МФРД при использовании альдегида моно-метоксиполиэтиленгликоля для получения продукта реакции, включающего одну молекулу полиэтиленгликоля,На фиг. 31 показана активность in vivo ДМФГ : МФРД и ДМФР : ПЭГ-МФРД в отношении нормальных мышей, выраженная количеством тромбоцитов. МФРД представлял собою продукт, полученный с помощью E.coli и содержащий последовательность аминокислот 1-163, а ПЭГ-МФРД представлял собою МФРД,полученный с помощью E.coli и содержащий последовательность аминокислот 1-163, который модифицирован одной молекулой полиэтиленгликоля. Дозы ДМФГ : МФРД и ДМФГ : ПЭГ-МФРД составляли 100 мкг/кг и 300 мкг/кг,соответственно, а отношение липид : белок было равно 100:1. Составы по настоящему изобретению описаны более детально в последующем обсуждении и иллюстрируются примерами, приводимыми ниже. Примеры раскрывают различные аспекты изобретения и включают результаты по стабильности и биологической активности, определенные для разных составов белок : фосфолипид. Неожиданно оказалось, что взаимодействие белков с липидными везикулами прямо стабилизирует белковую структуру протеинов,что оказывает стабилизирующий эффект на белок даже при условиях, которые ведут к денатурации белка в отсутствие липидов. Далее также описываются результаты орального назначения состава, включающего химически модифицированный ГКСФ и фосфолипид, причем при этом использовался ГКСФ(как обозначено выше), к которому были присоединены молекулы полиэтиленгликоля. Предпочтительными для использования в рамках настоящего изобретения являлись раз 11 личные белки, способные переходить в расплавленное глобулярное состояние. Образцовыми белками предполагались цитокины, включая различные гематопоэтические факторы, такие как вышеупомянутые ГКСФ, ГМКСФ,МФРД, моноцитарный колониестимулирующий фактор (МКСФ), интерфероны (альфа, бета и гамма), интерлейкины (1-11), эритропоэтин,фибробластный фактор роста, фактор стволовых клеток, фактор роста нервных клеток, BDNF,NT3, тромбоцитопроизводимый фактор роста и фактор роста опухолей (альфа, бета). Другие белки могут быть оценены по способности переходить в РГС. Чтобы выяснить, способен ли конкретный белок переходить в РГС, этот белок может быть подвергнут контакту с отрицательно заряженными липосомальными везикулами и оценен стабилизирующий эффект. Вообще, ГКСФ, используемый при осуществлении настоящего изобретения, может быть в нативной без примесей форме извлечен из организма млекопитающих, или может быть продуктом химического синтеза или продуктом экспрессии в прокариотических или эукариотических клетках хозяина экзогенной последовательности ДНК, полученной клонированием геномной или сДНК или синтезом гена. Желательные прокариотические хозяева включают различные бактериальные (например, E.coli) клетки. Желательные эукариотические хозяева включают дрожжи (например, S.cerevisiae) и клетки млекопитающих (например, овариальные клетки китайского хомячка, клетки обезьян). В зависимости от использованного хозяина экспрессированный ГКСФ может быть гликозилирован углеводами млекопитающих или других эукариотов, или он может быть негликозилирован. Настоящее изобретение предполагает использование как одной, так и другой форм ГКСФ, хотя рекомбинантный ГКСФ, особенно экспрессированный в клетках E.coli, предпочтителен как наиболее коммерчески доступный. ГКСФ может быть химически модифицирован для использования в рамках настоящего изобретения и может быть или природным человеческим или продуктом экспрессии рекомбинантных нуклеиновых кислот в прокариотических или эукариотических клетках хозяина. В основном, химическая модификация предполагает присоединение химической структуры к молекуле ГКСФ. Имеется обзорная статья Francis по модификациям белков и фузии белковMediscript, Mountniew Court, Friem Barnet Lane,London N20 OLD, UK]. Например, см. Европейский патент 0.401.384, озаглавленный "Химически модифицированный гранулоцитарный колониестимулирующий фактор", в котором описываются материалы и методы для получения ГКСФ, к которому присоединены молекулы полиэтиленгликоля. Присоединение может осуществляться за счет связывания полиэти 000415 12 ленгликоля непосредственно с белком или со структурой, которая действует как промежуточный мостик между модифицирующим и модифицируемым агентами. Ковалентное связывание предпочтительно как обеспечивающее наиболее стабильное присоединение. Химическая модификация может способствовать контролируемости длительности или продолжительности эффекта ГКСФ. В частности, может контролирования время циркуляции использованного химически модифицированного ГКСФ. Примером химических модификаторов может служить полиэтиленгликоль, включая его производные. Предполагаемыми для использования в рамках настоящего изобретения являются те химически модифицированные препараты ГКСФ, которые проявляют эффективность при применении. Эффективность может быть определена известными методами, признаваемыми профессионалами в этой области. ГКСФ, модифицированный полиэтиленгликолем, особенно экспрессированный E.coli модифицированный полиэтиленгликолем ГКСФ, и в особенности экспрессированный E.coli и модифицированный тремя-четырьмя молекулами полиэтиленгликоля ГКСФ, наиболее предпочтительны. Описанный ГКСФ наиболее стабилен в кислых условиях, несмотря на тот факт, что в области рН 2,5-5,0 наблюдаются конформационные изменения, которые включают ослабление третичной структуры и увеличение числа альфа-спиралей. [Narhi et al., J.Protein Chem. 10.,359-367, (1991)]. Эти конформационные изменения являются характеристикой расплавленного глобулярного состояния (РГС). Таким образом, как и в случае с предложенными препаратами других белков, способных переходить в РГС, препараты ГКСФ могут защищать против термически индуцированного развертывания вторичной и третичной структур белков, что предотвращает их агрегацию и денатурацию,ГМКСФ, используемый в настоящем изобретении, может находиться в нативной форме и быть выделенным в чистом виде из организма млекопитающих или являться продуктом экспрессии в прокариотических или эукариотичсских клетках хозяина экзогенной последовательности ДНК, полученной клонированием геномной или сДНК или синтезом гена. Желательные прокариотические хозяева включают различные бактериальные (например, E.coli) клетки. Желательные эукариотические хозяева включают дрожжи (например, S.cerevisiae) и клетки млекопитающих (например, овариальные клетки китайского хомячка, клетки обезьян). В зависимости от использованного хозяина экспрессированный ГМКСФ может быть гликозилирован углеводами млекопитающих или других эукариотов, или он может быть негликозилирован. Настоящее изобретение предполагает использование как одной, так и другой форм 13 ГМКСФ, хотя рекомбинантный ГМКСФ, особенно экспрессированный в клетках E.coli,предпочтителен как наиболее коммерчески доступный. Понятие "МФРД", как использовано в данном описании, включает природный МФРД,усеченный природный МФРД, так же как и неприродные полипептиды, имеющие аминокислотную последовательность и глюкозильную группу достаточно точно воспроизводящие природный МФРД, чтобы они обладали биологической активностью специфически стимулировать рост, развитие и/или образование мегакариоцитов и/или тромбоцитов. В предпочтительном варианте осуществления изобретения МФРД является продуктом экспрессии экзогенной последовательности ДНК, которая была трансфецирована в прокариотические или эукариотические хозяйские клетки; т.е. в предпочтительном варианте осуществления изобретения МФРД является "рекомбинантным МФРД". Предпочтительным эукариотическим хозяином являются клетки млекопитающих, особенно предпочтительным ОККХ и предпочтительным прокариотическим хозяином являются бактерии, особо предпочтительным - E.coli. Рекомбинантный МФРД хорошо образуется в соответствии с процессом,описанным в настоящем описании и в цитированных публикациях, касающихся клонирования и экспрессии МФРД. Некоторые другие приемлемые молекулы МФРД имели следующие аминокислотные последовательности, приводимые на фиг. 29: МФРД 1-332 МФРД 1-191 МФРД 1-183 МФРД 1-174 МФРД 1-163 МФРД 1-153 МФРД 1-152 МФРД 1-151 МФРД 7-332 МФРД 7-191 МФРД 7-183 МФРД 7-174 МФРД 7-163 МФРД 7-153 МФРД 7-152 МФРД 7-151 Аминокислоты 1-332 как показано на фиг.29 Аминокислоты 1-191 как показано на фиг.29 Аминокислоты 1-183 как показано на фиг.29 Аминокислоты 1-174 как показано на фиг.29 Аминокислоты 1-163 как показано на фиг. 29 Аминокислоты 1-153 как показано на фиг.29 Аминокислоты 1-152 как показано на фиг.29 Аминокислоты 1-151 как показано на фиг.29 Аминокислоты 7-332 как показано на фиг.29 Аминокислоты 7-191 как показано на фиг.29 Аминокислоты 7-183 как показано на фиг.29 Аминокислоты 7-174 как показано на фиг.29 Аминокислоты 7-163 как показано на фиг.29 Аминокислоты 7-153 как показано на фиг.29 Аминокислоты 7-152 как показано на фиг.29 Аминокислоты 7-151 как показано на фиг.29 Кроме того, в каждом вышеприведенном случае в N-терминальную область может быть включен Мет-Лиз. К тому же, для использования в рамках настоящего изобретения предполагаются различные аналоги МФРД. Упомянутое понятие "аналоги МФРД" относится к МФРД с одним или несколькими изменениями в аминокислотной последовательности NGDF, которые приводят к изменению типа (N- или O-связывание), числа или локализации сайтов, с которым связывается углевод. Аналоги МФРД сохраняют, по крайней мере, равную биологическую активность по 14 сравнению с активностью природной последовательности МФРД (например, с человеческимNGDF) и могут обладать существенно более высокой активностью, как показали измерения биологической активности. Такие аналоги могут иметь меньше или больше (предпочтительно больше) углеводных цепей, чем природный/рекомбинантный МФРД. Среди аналогов по настоящему изобретению имеются такие, которые имеют одну или более дополнительных аминокислот, расположенных перед концевой карбоксильной группы МФРД и удлиннение концевого карбоксила обеспечивает, по крайней мере, один дополнительный углеводный сайт. Концевой карбоксил МФРД может меняться в зависимости от конкретной формы использованного МФРД (например, МФРД с последовательностью аминокислот 1-332 или МФРД с последовательностью аминокислот 1-163 8). Дополнительный углеводный сайт может быть создан у концевого карбоксила образцов МФРД за счет присоединения к концевому карбоксилу аминокислот,содержащих один или более N- или Oсвязывающих сайтов гликозилирования. Настоящее изобретение также включает широкий круг химически модифицированных составов МФРД. В основном под химически модифицированными составами имеются в виду молекулы МФРД, в которых к белку присоединена, по крайней мере, одна молекула полиэтиленгликоля. Присоединение полиэтиленгликоля может быть осуществлено одним из известных методов его присоединения [см., например, Focus on Growth Factors 3.(2) : 4-10, 1992; Европейский патент 0 154 316; Европейский патент 0 401 384] и другие цитированные публикации по присоединению полиэтиленгиколя. Предпочтительно присоединение полиэтиленгликоля выполняют путем реакции ацилирования или алкилирования с реакционно способной молекулой полиэтиленгликоля (или аналогичного реакционно способного водораствормого полимера). Присоединение полиэтиленгликоля ацилированием в основном предусматривает взаимодействие активного эфирного производного полиэтиленгликоля с белком МФРД. Любые известные и в дальнейшем открытые реакционно способные молекулы ПЭГ могут быть использованы для присоединения к МФРД. В предпочтительном случае активированным эфиром ПЭГ является ПЭГ,эстерифицированный"ацилирование" подразумевает использование без ограничений следующих типов связывания МФРД и водорастворимого полимера, такого как ПЭГ: амидного, карбаматного, уретанового и подобных [cм.Bioconjugate Chem.5.:133-140,1994]. Условия взаимодействия могут быть выбраны, исходя из известных знаний о процессе присоединения ПЭГ или из полученных впо 15 следствии, но следует избегать при модификации условий, таких как температура, растворитель, рН, которые могут инактивировать МФРД. Присоединение ПЭГ ацилированием обычно приводит к получению продукта, содержащего несколько молекул присоединенного ПЭГ, когда эпсилон-аминогруппа лизина связана с молекулой ПЭГ ацильной связующей группой. Предпочтителен амидный связующий мостик. Предпочтительно также, чтобы целевой продукт содержал одну, две или три молекулы ПЭГ (в каждом случае их содержание могло составлять, например, 95 % и более). Однако,некоторые соединения, содержащие большее количество молекул ПЭГ (до максимального числа молекул, присоединенных к эпсилонаминогруппам лизина плюс одна, присоединенная к концевой альфа-аминогруппе МФРД) могут нормально образовываться в количествах,зависящих от использованных специфических условий реакции. Если желательно, более чистые образцы продукта присоединения ПЭГ могли быть отделены от смеси, особенно от непрореагировавших веществ, стандартными методами очистки, включающими среди других диализ, обессоливание, ультрафильтрацию, ионообменную хроматографию, гельфильтрацию,хроматографию и электрофорез. Присоединение молекул ПЭГ методом алкилирования обычно предполагает взаимодействие концевой альдегидной группы производного ПЭГ с белком, таким как МФРД, в присутствии восстанавливающего агента. Присоединение молекул ПЭГ методом алкилирования приводит к присоединению нескольких молекул ПЭГ. Можно изменять условия взаимодействия,как указано выше, для создания наиболее благоприятных условий для присоединения молекул ПЭГ в основном лишь к N-концевой альфааминогруппе образцов МФРД (т.е. осуществлять присоединение лишь одной молекулы ПЭГ). Образцовая реакция восстановительного алкилирования с МФРД приводит к получению продукта присоединения лишь одной молекулы ПЭГ, как показано на фиг. 30. В других случаях присоединения одной или нескольких молекул ПЭГ, молекулы ПЭГ предпочтительно присоединяются к белку через -CH2-NH- группы. Что касается -СН 2- группы, этот тип связи в данном случае относится к алкильной связи. Метод получения подобных производных путем восстановительного алкилирования для получения продуктов присоединения одной молекулы ПЭГ использует разные способности различных типов имеющихся первичных аминогрупп (лизиновые против N-терминальных) для получения производных МФРД. Проведение реакции осуществляют при значениях рН(см.ниже), которое позволяют воспользоваться различиями рКа между эпсилон-аминогруппы лизина и альфа-аминогруппы концевых остатков белка. Такими селективными методами по 000415 16 лучения производных контролируется связывание водорастворимых полимеров, которые содержат такие реакционноспособные группы, как альдегидные, с белками: наблюдаемая конъюгация с полимером имеет место преимущественно у N-конца белка и не происходит значительной модификации других реакционноспособных групп, таких как аминогруппы лизина в боковой цепи. Таким образом, в предпочтительном виде настоящее изобретение направлено на связывание МФРД с молекулами ПЭГ, когда как группы ПЭГ присоединяются через ацильные или алкильные группы. Как выше обсуждалось, такие продукты могут содержать одну или несколько молекул ПЭГ (например, 2-6, предпочтительно 2-5 молекул ПЭГ). Молекулы ПЭГ обычно связываются с белком через альфа или эпсилон аминогруппы аминокислот, однако,допускается, что молекулы ПЭГ могут присоединяться и к другими аминогруппам белков,которые достаточно реакционноспособны, чтобы осуществилась связь с молекулами ПЭГ при желаемых условиях реакции. Полимерные молекулы, подходящие для использования в реакциях ацилирования и алкилирования, могут быть выбраны из водорастворимых полимеров или их смесей. Выбранные полимеры должны быть водорастворимы настолько, чтобы белок, к которому они присоединяются, не осаждался в водной среде, такой как физиологическая среда. Полимеры, выбранные для модификации, должны иметь единственную реакционноспособную группу,такую как активная эфирная для ацилирования или альдегидная для алкилирования, предпочтительно, таким образом, чтобы степень полимеризации могла быть контролируема, как предусматривается в описанных методах. Предпочтительный ПЭГ с альдегидной активной группой полиэтиленгликольпропиональдегид, который стабилен в воде, или моно С 1-С 10 алкокси или арилокси его производные [см. патент США 5.252.714]. Полимеры могут быть разветвленными или неразветвленными. Для терапевтического использования конечного продукта желательно, чтобы полимер был фармацевтически приемлем. Водорастворимые полимеры могут быть выбраны из группы, состоящей, например,из полиэтиленгликоля, монометоксиполиэтиленгликоля, декстрана, поли-(N-винилпирролидон)-полиэтиленгликоля, гомополимеров пропиленгликоля, сополимера полипропиленоксида и полиэтиленоксида, полиоксиэтилированных полиолов (например, глицерин) и поливинилового спирта. Для реакции ацилирования выбранные полимеры должны иметь единственную реакционно способную эфирную группу. Для восстановительного алкилирования выбранный полимер должен иметь только реакционноспособную альдегидную группу. Обычно водорастворимые полимеры не выбираются из 17 природных гликозильных соединений, т.к. они могут быть более традиционно получены экспрессией в рекомбинантных системах. Полимер может иметь любой молекулярный вес и быть разветвленным или неразветвленным. Особенно предпочтительным для использования водорастворимым полимером является ПЭГ. Как указывалось выше, ПЭГ предназначен для получения разных форм, которые используются для получения производных разных белков, таких как моно-(С 1-С 10)-алкокси или арилокси-ПЭГ. Способы получения МФРД, связанного с молекулами ПЭГ, обычно включают этапы а) взаимодействия полипептида МФРД с ПЭГ (таким как производные ПЭГ с реакционноспособными эфирными или альдегидными группами) при условиях, когда МФРД оказывается связанным с одной или несколькими молекулами ПЭГ, и б) выделение продукта реакции. Обычно, оптимальные условия для реакции ацилирования определяются каждый раз особо на основе известных параметров и желаемого результата. Например, увеличение отношения ПЭГ:белок приводит к повышению выхода продукта с присоединением большего числа молекул ПЭГ. Важное значение имеет молекулярный вес полимера. Обычно при более высоком молекулярном весе полимера уменьшается число полимерных молекул, которые могут связаться с белком. Аналогично, разветвленный полимер должен быть взят в количествах, которые оптимальны для данного случая. Обычно, это наиболее высокий молекулярный вес (или большая разветвленность), более высокое соотношение полимер : белок. Обычно, для реакции присоединения ПЭГ предпочтительный молекулярный вес составляет приблизительно от 2 до 1000 кДа(термин "приблизительно" имеет в виду 1 кДа). Более предпочтительный молекулярный вес составляет приблизительно от 5 до 50 кДа,особенно предпочтительный молекулярный вес- приблизительно от 12 до 25 кДа, а наиболее предпочтительный 20 кДа. Отношение водорастворимого полимера к белку МФРД составляет от 1:1 до 100:1, предпочтительно (для связывания с несколькими молекулами ПЭГ) от 1:1 до 20:1 и (для связывания с одной молекулой ПЭГ) от 1:1 до 5:1. При использовании условий, указанных выше, восстановительное алкилирование будет обеспечивать селективное присоединение полимера к белку какого-либо МФРД, имеющего концевую альфа-аминогруппу, и обеспечивать получение однородного белкового конъюгата монополимер/МФРД. Понятие"белковый конъюгат монополимер/МФРД" используется в настоящем описании для обозначения состава,включающего единственную полимерную молекулу, связанную с молекулой белка МФРД. Белковый конъюгат монополимер/МФРД будет предпочтительно иметь полимерную молекулу, 000415 18 локализованную при концевом N, но не на аминогруппе лизина. Препарат будет предпочтительно содержать более 90% белкового конъюгата монополимер/МФРД и предпочтительнее более 95% конъюгата с остатком непрореагировавших молекул (т.е. белка, лишенного полимерной части). Дале приводимые примеры обеспечивают приготовление препаратов, в которых содержится, по крайней мере, приблизительно 90% конъюгата монополимер/МФРД и приблизительно 10% непрореагировавшего белка. Конъюгат монополимер/МФРД обладал биологической активностью. Липидные везикулы, используемые в составах по настоящему изобретению, представляют собою отрицательно заряженные липосомы, способные к взаимодействию с белком в ранее упоминаемом смысле. В частности, липосомы, предполагаемые для использования,включают диолеоилфосфатидилглицерин, димиристоилфосфатидилглицерин,дипальмитоилфосфатидилглицерин, яичного фосфатидилглицерин, диолеоилфосфатидилэтаноламин, яичного фосфатидилэтаноламин, диолеоилфосфатидная кислота, димиристоилфосфатидная кислота, дипальмитоилфосфатидная кислота, диолеоилфосфатидилсерин, димеристоилфосфатидилсерин, дипальмитоилфосфатидилсерин, яичный фосфатидилсерин, лизофосфатидилглицерин, лизофосфатидилэтаноламин, лизофосфатидилсерин. В зависимости от особенностей конкретных использованных липосом их количества могут меняться. Белок : фосфолипидные составы предпочтительно включают буферирующий агент для поддержания значения рН раствора в желаемых пределах. Предпочтительные агенты включают ацетат натрия, фосфат натрия и цитрат натрия. Смеси этих буферирующих агентов также могут быть использованы. Количество буферирующего агента, используемого в составе, в значительной степени зависит от использованного агента и требуемого значения рН раствора. Например, ацетат более эффективный буферирующий агент при рН 5, чем при рН 6 и, таким образом, меньше ацетата используется в растворе с рН 5, чем в растворе с рН 6. Предпочтительная область значений рН для составов по настоящему изобретению лежит в пределах 3,07,5. Составы по настоящему изобретению могут включать агент, создающий изотоничность,чтобы сделать раствор изотоничным и более приемлемым для инъекций. Наиболее предпочтительный агент - хлористый натрий в концентрации 0-150 мМ. Изобретение также охватывает формацевтические составы, включающие эффективные количества полипептидных продуктов по настоящему изобретению совместно с фармацевтически приемлемыми разбавителями, консервантами, солюбилизаторами, эмульгаторами, 19 адъювантами и/или носителями. Такие составы оказывают влияние на физическое состояние,стабильность и биологическую пригодность белка [см.например, Remingtons PharmaceuticalSciences. 18th Edition, 1435-1712 (Mack Publishing Co.,Easton,PA.,1990), которая включена в цитированные ссылки]. Что касается эффективного количества белка, в частных случаях оно зависит от различных факторов, которые известны профессионалам и будут приняты во внимание, включая желаемый терапевтический эффект, тяжесть состояния или заболевание,подлежащее лечению, физическое состояние пациента и т.д. Предпочтительный вариант осуществления изобретения включает использование состава, содержащего рчГКСФ, получаемого с помощью E.coli, липосомные везикулы из ДМФГ с отношением ДОФГ : ГКСФ, равным 50:1, имеющего рН 4,5 и содержащего 10 мМ ацетата натрия. Другой предпочтительный вариант осуществления изобретения включает использование состава, содержащего рчГМКСФ, образуемого с помощью E.coli; липосомальные везикулы из ДМФГ при отношении ДМФГ : ГМКСФ, равном 17:1, имеющего рН 7,0 в фосфатном буфере. Другой предпочтительный вариант осуществления изобретения включает использование состава, содержащего рчГКСФ, образуемого с помощью E.coli, химически модифицированного присоединением молекул полиэтиленгликоля до получения рчГКСФ, связанного с 3-4 молекулами полиэтиленгликоля; липосомальные везикулы из ДМФГ при отношении ДМФГ : ПЭГ-ГКСФ, равном 17:1, имеющего рН 4,5. Другой предпочтительный вариант осуществления изобретения включает использование состава, содержащего МФРД, полученный с помощью E.coli и имеющий последовательность аминокислот 1-163; липосомальные везикулы из ДМФГ при соотношении ДМФГ:МФРД, равном 100:1, имеющего рН 5,0 в 10 мМ растворе ацетата натрия, содержащего 5% сорбита. Еще один предпочтительный вариант осуществления изобретения включает использование состава, содержащего МФРД, полученный с помощью E.coli и имеющий последовательность аминокислот 1-163, химически модифицированный присоединением молекул полиэтиленгликоля до получения МФРД, связанного с одной молекулой полиэтиленгликоля (2 кДа) путем восстановительного алкилирования; липосомальные везикулы из ДМФГ при отношенииDМРG:МФРД, равном 100:1, имеющего рН 5,0 в 10 мМ растворе ацетата натрия, содержащего 5% сорбита. Другой предпочтительный вариант осуществления изобретения включает использование состава, содержащего МФРД, полученный с помощью овариальных клеток китайского хо 000415 20 мячка и имеющий последовательность аминокислот 1-332; липосомальные везикулы из ДМФГ при отношении ДМФГ : МФРД, равном 100:1, имеющего рН 5,0 в 10 мМ растворе ацетата натрия, содержащего 5% сорбита. Хотя изобретение было описано и проиллюстрировано с точки зрения специфических составов белок : липид и способов их получения, для любого специалиста ясно, что различные сходные составы и методы могут быть использованы в рамках настоящего изобретения. Следующие примеры более подробно иллюстрируют различные аспекты настоящего изобретения. Пример 1. Предварительные эксперименты были выполнены для изучения возможности включения рекомбинантного человеческого ГКСФ (рчГКСФ) в липидные везикулы. рчГКСФ был получен, используя технологию рекомбинантной ДНК, в которой клетки E.coli были трансфецированы последовательностью ДНК, кодирующей человеческий ГКСФ, как описано в патенте США 4.810.643 Sauza. ГКСФ был приготовлен в виде раствора ГКСФ с концентрацией 4 мг/мл в разбавленной соляной кислоте рН 4,0. Все липиды были получены от фирмы Avanti Polar Lipids (Alabaster, Ala) и хранились при температуре -20 С в атмосфере азота при конечной концентрации 100 мг/мл в хлороформе. Приготовление комплексов ГКСФ : фосфолипид Для приготовления липидных везикул,предназначенных для сочетания с ГКСФ, 30 микромолей соответствующего липида было распределено по поверхности стеклянной трубки и высушено до образоования тонкой пленки,используя ток газообразного азота. Липидная пленка высушивалась, по крайней мере, 2 ч под вакуумом до полного удаления следов хлороформа. Липидная пленка была гидратирована в 1 мл или дистиллированной деионизированной воды, или солевого фосфатного буфера с рН 7,2 или в 150 мМ растворе хлористого натрия. Образцы были подвергнуты обработке ультразвуком в соответствующем аппарате (LaboratorySupplies, Hicksville, N.Y.). Обработка ультразвуком продолжалась до достижения оптической прозрачности образца (обычно в пределах 10-15 мин). Образцы до использования хранились при температуре 4 С в атмосфере азота. Конечная концентрация липидов составляла 30 мМ. Альтернативно липидные везикулы могли быть приготовлены из 300 микромолей липида, высушены под током азот и высушены, как описано выше. Высушенная пленка липида могла быть гидратирована 10 мл соответствующего водного раствора как описано выше. Образцы могли быть затем псевдоожижены в батарейном эмульсификаторе (Microfluidies Model 110S,Microfluidies,Inc. Cambridge, MA), действующем при давлении 10000 psi. Образцы могли быть пропущены через аппарат в течение 10 циклов. 21 Псевдоожиженные образцы затем могли храниться при температуре 4 С как описано выше. Комплексы ГКСФ : липид были приготовлены путем смешения ГКСФ (как он описан выше) с соответствующим липидом (как он описан выше). Смешивание выполнялось турбулизацией, перемешиванием или мягким встряхиванием. Были приготовлены образцы с разным молярным отношением липид : ТКСФ,чтобы оценить включение белка в мембрану и его стабилизацию. Например, для приготовления 3 мл образца (в воде), который содержит 0,2 мг/мл ГКСФ при молярном отношении липид : ТКСФ, равном 40:1, 150 мкл исходного ГКСФ соединяют с 44 мкл липида (исходное содержание 30 мМ, приготовлен обработкой ультразвуком в воде) и добавляют воду до конечного объема образца 3 мл. Рекомендуется выдержать образец в течение 5 мин (это, однако, не необходимо) перед использованием или исследованием. ГКСФ мог быть также подвергнут взаимодействию с гидратированным липидом до микропсевдоожижения. Последующее микропсевдоожижение смеси, как описано выше, ведет к включению ГКСФ в липидную мембрану. Анализ комплексов ГКСФ : фосфолипид 1. Спектр испускания триптофана. В рчГКСФ имеются два остатка триптофана, которые вполне чувствительны к условиям внешней среды. Поэтому анализ был выполнен на основе определения флуоресценции триптофана в составе рчГКСФ, когда рчГКСФ взаимодействует с липосомами. Смещение в синюю сторону максимума флуоресцентного спектра испускания дает основания предполагать, что остатки триптофанов находятся в более гидрофобных условиях и, следовательно, рчГКСФ внедряется в липидную мембрану. Прекрасный обзор по флуоресцентному анализу триптофана,сделанный J.Lakonicz имеется в Principles ofFluorescence Microscopy, Chap 11 (Plenum Press,New York, 1983). Флуоресценция триптофана в комплексе ГКСФ : липид (как он описан выше) была исследована после возбуждения образца при 280 нм, путем последующего сканирования испускания при длинах волн от 285 нм до 420 нм при шаге 1 нм и при скорости 1 нм/с. Образцы имели объем 3 мл и конечная концентрация ГКСФ равнялась 0,2 мг/мл для всех образцов. Отношения липид:ГКСФ изменялись. Все флуоресцентные измерения были выполнены, используяPTI сканирующий флуорометр (South Brunswick,NJ). Все измерения были выполнены при температуре 25 С и эта температура поддерживалась в результате использования кюветы с водяной рубашкой, связанной циркуляцией воды с водяной баней. Спектр испускания был снят и проанализирован, используя программное обеспечение прибора. 22 Спектр флуоресценции рчГКСФ в присутствии и в отсутствие мелких униламелярных везикул, состоящих из ДОФГ, показан на фиг. 1. Максимум испускания рчГКСФ находился при 334 нм в отсутствие везикул ДОФГ. В присутствии ДОФГ при отношении липид:белок, равном 100:1, спектр флуоресценции триптофана в рчГКСФ показал смещение в синюю область максимуме флуоресценции до 327 нм и резкое увеличение интенсивности флуоресценции. Низкая длина волны флуоресцентной эмиссии в присутствии ДОФГ наводит на предположение,что триптофан находится в более гидрофобном окружении, чем в нативном белке. Как показано на фиг. 2, сдвиг флуоресценции зависит от молярного отношения ДОФГ: ГКСФ и включение в мембрану определяется только при отношении ДОФГ : ГКСФ, равном 10:1. 2. Эксперименты по иодидному гашению. Иодид является эффективным конкурентным гасителем флуоресценции триптофана, но не включается в липидную мембрану. Поэтому эффективное гашение иодидом флуоресценции триптофана указывает на наличие его остатков в водном растворе, в то время как защита от гашения иодидом наблюдается, когда триптофан в структуре белка изолирован от водной фазы. В этих экспериментах были использованы ГКСФ и комплекс ДОФГ:ГКСФ (отношение липид:белок равно 100:1). После того, как начальные показания прибора (Fo) в исходных образцах были сняты и зарегистрированы, была измерена интенсивность флуоресценции после добавления увеличивающихся количеств иодида калия (исходная концентрация 5 М). И образец,и растворы йодистого калия были доведены до содержания в них 1 мМ сульфита натрия (конечная концентрация) как ранее описано [Lee etLe Doan et al., Biochem. Biophys.Acta 858.:1-5,1986]. Добавление сульфита натрия предотвращает образование свободного иода, который может разрушать неполярные области белков и мембран. Данные были обработаны по уравнению Штерн-Вольмера (Fo/F = 1 + Ккi [KI]) , гдеFo и F означают интенсивность флуоресценции образцов в отсутствии и в присутствии, соответственно, йодистого калия в концентрации[KI]. Ккi означает константу Штерн-Вольмера гашения йодистым калием флуоресценции триптофана в ГКСФ [Lehrer S., Biochemistry 10.:3254-3263 (1979)]. Графики Штерн-Вольмера показаны на фиг. 3. В отсутствие везикул ДОФГ, флуоресценция рчГКСФ эффективно гасится йодистым калием. В присутствии ДОФГ график ШтернВольмера линеен, указывая, что иодид имеет плохой доступ к обоим остаткам триптофанов. Результаты показывают, что остатки триптофана, которые иодиду доступны в отсутствие ДОФГ, становятся недоступными для иодида в присутствии ДОФГ. Следовательно, часть 23 рчГКСФ, содержащая эти остатки триптофана,должна быть внедрена в биполярный слой ДОФГ. 3. Измерение переноса энергии. Как показано ранее, перенос энергии может наблюдаться между триптофаном как донором и растворимыми в липидах флуоресцентыми акцепторами, такими как пирендекановая кислота, так как спектр возбуждения этой пробы значительно перекрывает спектр испускания триптофана [Friere et al., Biochemisrty 22.: 16751680, 1983]. Если белок включается в липидные мембраны, перенос энергии от триптофана к пирену приводит к гашению флуоресценции триптофана. В этом эксперименте интенсивность флуоресценции триптофана в различных комплексах липид : ГКСФ была зарегистрирована до (Fo) и после (F) добавления разных количеств пирендекановой кислоты (исходный раствор в тетрагидрофуране имел концентрацию 30 мкг/мл). Образцы непрерывно перемешивали во время приливания пирендекановой кислоты, чтобы способствовать смешению пирендекановой кислоты с образцом. ОтношениеFo/F пропорционально переносу энергии, наблюдающемуся между триптофаном в составе ГКСФ и пирендекановой кислотой как гидрофобным акцептором энергии. Фиг. 4 показывает профиль гашения флуоресценции между рчГКСФ в присутствии ДОФГ(отношение липид : белок равно 100:1) в зависимости от количества добавленной пирендекановой кислоты. Гашение наблюдается при очень низкой концентрации пирендекановой кислоты( 1 мол.%), так что воздействие флуоресцентного зонда на структуру и поведение мембраны было минимальным. Поскольку можно было ожидать, что пирендекановая кислота быстро разрушит двойной липидный слой, настоящие данные указывают, что рчГКСФ внедрен в мембрану ДОФГ достаточно глубоко, чтобы позволить эффективно осуществить перенос энергии от триптофана к пирену как акцептору. Перенос энергии подтверждался изучением спектра возбуждения комплекса пирендекановая кислота меченые везикулы ДОФГ в присутствии и в отсутствие рчГКСФ. Проведенный выше анализ показал, что рчГКСФ может тесно взаимодействовать с ненасыщенными фосфолипидами, сходными с ДОФГ. В присутствии везикул ДОФГ триптофан в составе рчГКСФ защищен от водорастворимых гасителей флуоресценции, но он чувствителен к гашению при переносе энергии к гидрофобным флуоресцентным зондам. Рассмотренные совместно, эти результаты показывают,что рчГКСФ может включаться в мембраны,выполненные из ДОФГ. Включение в мембраны определимо лишь при отношении липид : ГКСФ, равном 10:1, и это число может представлять число молекул липидов, которые окружают включенную в мембрану порцию белка. 24 Пример 2. В этом примере способность рчГКСФ взаимодействовать с другими фосфолипидами была определена путем сравнения величин F/Fo и максимумов эмиссии, как описано выше. В каждом случае молярное отношение липид : рчГКСФ было равно 100:1. Фиг. 5 показывает значения F/Fo для рчГКСФ в отсутствие и в присутствии разных липидов. Фиг. 6 показывает значения максимумов эмиссии тех же составов. Данные фиг. 5 и фиг. 6 показывают, что кроме ДОФГ, рчГКСФ может включаться в ДМФГ, DPPG и менее эффективно в фосфатидилэтаноламины и в фосфатидилсерины. Кроме того, было найдено, что ОЗ-ДОФЭ (образец ДОФЭ, в котором головная группа фосфатидилэтаноламина была сделана более отрицательно заряженной), обеспечивает улучшенное включение рчГКСФ, чем ДОФЭ.DOPC, DMPC и DPPC - нейтральные липиды и их везикулы менее, если не полностью,неэффективны по влиянию на положение максимума эмиссии или на интенсивность флуоресценции рчГКСФ, указывая, что взаимодействия ГКСФ с этими фосфолипидами не имеет места (см., фиг. 5, 6 и фиг. 7, кривая 2). Полученные данные демонстрируют, что белок, способный переходить в расплавленное глобулярное состояние, может включаться в различные липидные везикулы. Однако взаимодействие рчГКСФ с липидом наблюдается лишь тогда, когда используют отрицательно заряженную липидную везикулу. Среди отрицательно заряженных липидных везикул, везикулы с более высоким отрицательным зарядом проявляют более сильное взаимодействие с рчГКСФ. Пример 3. В этом примере был определен эффект взаимодействия ДОФГ с рчГКСФ в отношении стабильности белка. Измерение циркулярного дихроизма проводилось на прибореJasco J-720, оборудованном термостатированным штативом типа Peltier с магнитной мешалкой для клеток. Циркулярный дихроизм при 222 нм был измерен при использовании конечной концентрации рчГКСФ 80 мкг/мл при значении рН 6,0. Дифференциальные сканирующие калориметрические измерения были осуществлены при использовании калориметра Microcal MC-2. Образцы рчГКСФ (1 мг/мл, вода) или ДОФГ : рчГКСФ (молярное отношение 45 : 1, вода) были сканированы при скорости 90 С/ч. Данные были сохранены и проанализированы, используя программное обеспечение прибора. Индуцированные температурой изменения в альфа-спиральности ГКСФ могли быть выявлены из измерения циркулярного дихроизма(222 нм) как функции увеличения температуры. Термически индуцированное развертывание спирали рчГКСФ при рН 6,0 показано на фиг. 8. Кривая указывает, что достаточно резкие изменения, которые ведут к потере альфаспиральности, наблюдаются при 60-70 С. После этих изменений рчГКСФ необратимо осаждает 25 ся из раствора. Область температуры развертывания спирали сходна с температурой плавления рчГКСФ при рН 7,0, как было определено дифференциальной сканирующей калориметрией, как показано на фиг. 9. Напротив, образцы ДОФГ : рчГКСФ показали постепенную потерю альфа-спиральности с увеличением температуры, не похожую на наблюдающуюся у рчГКСФ. Индуцированные температурой изменения спиральности ДОФГ : рчГКСФ не представляются согласованными с изменениями, происходящими при плавлении(см.фиг. 8). Это заключение также доказывается отсутствием перехода плавления, как показано дифференциальной сканирующей калориметрией (фиг. 9). Удивительно, но образцы ДОФГ : рчГКСФ могли вернуть альфа-спиральность после нагревания до 95 С и могли повторно нагреваться между 95 и 10 С с полным возвратом спиральности после охлаждения (см. фиг. 10), Один рчГКСФ как таковой при этих условиях необратимо развертывает спиральную структуру и осаждается из раствора. Также изучалось влияние ДМФГ и ДПФГ на циркулярный дихроизм ГКСФ. При отношении липид : рчГКСФ, равном 150:1, как и в случае с ДОФГ, ДМФГ и ДПФГ также обеспечивали стабилизацию вторичной структуры рчГКСФ(фиг. 11-13). Эти данные показывают, что взаимодействие рчГКСФ с ДОФГ, ДМФГ и ДПФГ увеличивает стабильность белка при условиях, в которых один рчГКСФ как таковой нестабилен. Такое взаимодействие непосредственно стабилизирует вторичную и третичную структуру рчГКСФ. Пример 4. В этом примере определялось влияние взаимодействия рчГКСФ с ДОФГ на биологическую активность рчГКСФ. Активность рчГКСФ in vitro определялась при использовании зависимого от рчГКСФ включения[3H]-тимидина в клетки костного мозга, как описано Zcebo et al. [Jmmunology 172.: 175-184,1986]. Все опыты по определению биологической активности выполнялись в трехкратной повторности. Активность in vivo была определена при подкожном введении препарата китайским хомячкам (доза рчГКСФ 100 мкг/кг) и измерением количества белых клеток крови. 1. Активность in vitro. А. Удельная активность рчГКСФ была определена в отсутствие и в присутствии ДОФГ. Были также испытаны образцы рчГКСФ и ДОФГ:рчГКСФ, подвергнутые тепловой обработке. Результаты суммированы в таблице 1. Образцы рчГКСФ рчГКСФ (прогретый) ДОФГ : рчГКСФ ДОФГ : рчГКСФ (прогретый)- образцы были инкубированы 10 мин при температуре 85 С в водяной бане до осуществления опыта;- комплекс ДОФГ : рчГКСФ имел молярное отношение, равное 50:1. Как показано в таблице 1, включение в двойной слой ДОФГ не оказывает неблагоприятного действия на биологическую активность рчГКСФ. После прогревания в течение 10 мин при температуре 85 С, рчГКСФ не проявляет биологической активности и белок осаждается. После аналогичной обработки ДОФГ : рчГКСФ сохраняет приблизительно 85 % активности непрогретого рчГКСФ и полностью возвращает вторичную структуру после охлаждения. В. Была изучена также способность разных липидов стабилизировать рчГКСФ в процессе лиофильного высушивания. Образцы рчГКСФ в комбинации с различными липидами были лиофильно высушены и испытаны (как описано выше) на биологическую активность. Комбинирование ДОФГ, ДМФГ и ДПФГ с рчГКСФ позволило почти полностью сохранить биологическую активность рчГКСФ после лиофильного высушивания (фиг. 14). Как таковой рчГКСФ не выдерживал процесса лиофильного высушивания. 2. Активность in vivo. Была изучена активность (по количеству белых клеток крови) рчГКСФ в отсутствие и в присутствии липидов. Активность определялась после подкожного введения рчГКСФ в дозе 100 мкг/кг в тот же день. Пять различных комплексов липид : рчГКСФ испытывалось и в каждом случае комплекс липид : рчГКСФ сохранял биологическую активность in vivo (фиг. 15 и 16). Проведенные опыты продемонстрировали,что включение в отрицательно заряженный двойной липидный слой не оказывает неблагоприятного влияния на биологическую активность рчГКСФ. Кроме того, оказывается, что липиды защищают рчГКСФ в процессе лиофильного высушивания. Пример 5. В этом примере химически модифицированный ГКСФ (связанный с ПЭГ)(ПЭГ-ГКСФ) и рчГКСФ, полученный как продукт экспрессии эукариотическими клетками хозяина (овариальными клетками китайского хомячка) (ОККХ-рчГКСФ) был исследован на способность взаимодействовать с отрицательно заряженными липидными везикулами. Для ОККХ-ГКСФ определение было проведено путем сравнения величины F/Fo и максимумов эмиссии (как описано выше в примере 1). В каждом случае молярное отношение липид:белок равнялось 100:1. Для ПЭГ-ГКСФ определение было основано на анализе циркулярного дихроизма. Используемый ОККХ-ГКСФ был получен,используя рекомбинантную технологию, в которой овариальные клетки китайского хомячка(ОККХ) были трансфецированы последователь 27 ностью ДНК, кодирующей человеческий рчГКСФ, как описано в патенте США 4.810.643Souza. ОККХ-ГКСФ был приготовлен в виде раствора в концентрации 6 мг/мл в фосфатном солевом буфере рН 7,0. Было показано, что ОККХ-ГКСФ взаимодействует с ДОФГ аналогично рчГКСФ; в каждом образце было показано увеличение интенсивности флуоресценции в присутствии ДОФГ, так же как и сдвиг в синюю область максимума эмиссии в присутствии ДОФГ (фиг. 17 и 18). Следовательно, взаимодействие с ДОФГ не объясняется одними особенностями рекомбинантной формы ГКСФ. ПЭГ-ГКСФ, используемый в этих экспериментах, являлся производным ГКСФ, полученным с помощью E.coli и содержащим 3-4 молекулы ПЭГ (использовался ПЭГ с мол.весом 6000). Образцы ДМФГ:ПЭГ-ГКСФ (молярное отношение равно 17:1) были приготовлены, используя методику, описанную выше. ОбразцыDРМG:ПЭГ-ГКСФ полностью обнаруживали восстановление вторичной структуры после прогревания (фиг. 19). Несмотря на присутствие молекул ПЭГ, производные белков были способны взаимодействовать с липидами тем же путем, что и нативные белки. Полученные результаты показывают, что стабилизирующий эффект, связанный с взаимодействием ГКСФ с отрицательно заряженными липидными везикулами, не является лишь присущим рчГКСФ, полученному как продукт экспрессии прокариотическими клетками хозяина. Химически модифицированные белки, способные переходить в расплавленное глобулярное состояние и контактировать с липосомальными везикулами - в данном случае ПЭГ-ГКСФ : ДМФГ - также показывают повышенную стабильность. Пример 6. В этом примере изучалось влияние ДМФГ и ДПФГ на ГМКСФ. ГМКСФ является рекомбинантным человеческим ГМКСФ,который описан в патенте США 5.047.504 Вооnе, и был приготовлен в виде раствора в фосфатном буфере рН 7,0 в концентрации 1 мг/мл. Образец с отношением липид : ГМКСФ,равным 17:1, был использован для определения его термической стабильности,что осуществлялось анализом циркулярного дихроизма, как было описано выше. ДМФГ и ДПФГ способствовали повышению термической устойчивости ГМКСФ, т.е. к возврату вторичной структуры после нагревания (фиг. 20 а и 206). Эти результаты представляют другой пример белка, способного переходить в расплавленное глобулярное состояние, взаимодействующего с отрицательно заряженными липидными везикулами, что повышает термическую устойчивость белка. Пример 7. В этом примере комплекс ДОФГ : ПЭГ-ГКСФ использовался для оценки возможности увеличения терапевтической эффективности ГКСФ после энтерального назна 000415 28 чения. Для этого эксперимента ДОФГ был приготовлен, как описано в примере 1, а ПЭГГКСФ был приготовлен, как описано в примере 5. 100 микромолей липида (797 мкл) были высушены под вакуумом и затем 1 мл воды был добавлен, чтобы получить 100 мМ раствор липида. Этот раствор был обработан ультразвуком в течение 5 мин в облучаемой водяной бане(модель G 112SPIT Lab. Supply Inc., Hicksville,N.Y) или до того момента, когда липидный раствор станет прозрачным. 9 микромолей ДОФГ(90 мкл раствора) были добавлены к 90 нмолям нативного рчГКСФ или ПЭГ-ГКСФ в 1 мМ соляной кислоты. Раствор был турбулизован и доведен до конечного объема 2 мл с помощью 1 мМ соляной кислоты. Для интрадуоденального назначения крысам материал был помещен в осмотический насос, который был имплантирован животному. Освобождение материала наблюдалось до 24 ч. Результаты анализа общего числа белых клеток крови у животных, получавших рчГКСФ и ПЭГ-ГКСФ с добавлением и без добавления липидов, показаны на фиг. 21. На фиг. 21 а показано, что инфузия нативного ГКСФ оказалась не в состоянии стимулировать терапевтический ответ по сравнению с контролем. Прибавление липидов оказало малое воздействие на терапевтическую реакцию животных на введение рчГКСФ. Реакция крыс на введение ГКСФ, связанного с ПЭГ, продемонстрирована на фиг. 21 б. Можно видеть, что только ПЭГ-ГКСФ стимулировал ответную реакцию. Подъем числа белых клеток крови поддерживается 48 ч до последующего возвращения к исходному уровню. Рецептура ПЭГ с ДОФГ также стимулирует терапевтический ответ и этот ответ почти в 2 раза выше, чем при использовании только ПЭГГКСФ. Эти результаты подтверждаются измерением уровня ПЭГ-ГКСФ в сыворотке крови после инфузии (фиг. 22). Эти результаты показывают, что включение анионогенных липидов, таких как ДОФГ, в рецептуру ПЭГ-ГКСФ, предназначенную для орального применения, приводит к усилению терапевтического ответа. Механизм действия в настоящее время не установлен. Пример 8. В этом примере было изучено влияние ДМФГ на МФРД. МФРД представлял собою продукт, полученный с помощью рекомбинантной культурой E.coli и содержащий последовательность аминокислот 1-163, приготовленный в виде раствора с концентрацией 1 мг/мл, содержащего 10 мМ ацетата натрия и 5 % сорбита и имеющего с рН 5,0. Комплексы ДМФГ : МФРД были приготовлены, как описано в примере 1. Анализ комплексов ДМФГ: МФРД 1. Спектр эмиссии триптофана. В МФРД (положение 51) имеется один остаток триптофана, который используется как 29 индикатор взаимодействия МФРД с везикулами ДМФГ. Флуоресценция триптофана в комплексах ДМФГ:МФРД была проанализирована, как описано в примере 1, используя концентрацию МФРД 0,1 мг/мл. Спектр флуоресценции МФРД в присутствии и в отсутствие мелких униламелярных везикул ДМФГ показан на фиг. 22. МФРД имел максимум эмиссии при 336 нм в отсутствие везикул ДМФГ. В присутствии ДМФГ, при отношении липид : белок, равном 100:1, флуоресценция триптофана в МФРД проявляла сдвиг максимума флуоресценции в синюю область до 328 нм. Малая длина волны флуоресцентной эмиссии в присутствии ДМФГ предполагает, что триптофан находится в окружении более гидрофобном, чем в природном белке. Как показано на фиг. 23, сдвиг флуоресценции зависит от молярного отношения ДМФГ: МФРД и включение в мембрану определяется лишь при отношении ДМФГ:МФРД, равном 830:1. Изменения флуоресценции максимальны при молярных отношениях 100:1, и МФРД проявляет заметно более высокое сродство к ДМФГ при снижении значений рН от 7,0 до 5,0. Это предполагает, что титрование (нейтрализация) некоторых аминокислот (например, гистидина) может быть использована для увеличения или ослабления взаимодействия. 2. Эксперименты по иодидному гашению. В этих экспериментах МФРД и комплекс ДМФГ:МФРД (отношение ДМФГ:МФРД равно 100:1) были использованы в опытах по иодидному гашению, как описано в примере 1. Диаграммы Штерн-Вольмера показаны на фиг. 24. В отсутствие везикул ДМФГ флуоресценция МФРД значительно гасится йодистым калием. Напротив, в присутствии ДМФГ триптофан не чувствителен к иодиду, что указывает на то, что часть МФРД, содержащая триптофан, должна быть внедрена в двойной слой ДМФГ. Предварительный анализ показал, что как и в случаях с ГКСФ и с ГМКСФ, МФРД может активно взаимодействовать с ненасыщенными фосфолипидами, сходными с ДМФГ. В присутствии везикул ДМФГ триптофан в МФРД защищен от водорастворимых гасителей флуоресценции. Рассмотренные совместно, результаты показывают, что МФРД может включаться в мембраны, состоящие из ДМФГ. Включение в мембрану определяется лишь при отношении ДМФГ : МФРД, равном 8:1 и это число может представлять число молекул липидов, которые окружают включенную часть белка. Пример 9. В этом эксперименте определялось влияние взаимодействия ДМФГ с МФРД на стабильность белка. Оценивались термическая стабильность, стабильность в присутствии мочевины и стабильность в процессе хранения МФРД как такового или в присутствии ДМФГ оценивались. В каждом из этих опытов молярное отношение ДМФГ:МФРД составляло 100:1. 1. Термическая стабильность. 30 Циркулярный дихроизм при 222 нм МФРД как такового или включенного в везикулы ДМФГ изучался в зависимости от циклов термической обработки между 95 и 10 С, как описано в примере 3, на фиг. 10. Определялось значение показателя циркулярного дихроизма по отношению к исходной величине показателя(при 10 С) после каждого цикла нагревания(один цикл включал нагревание по схеме 10 С 95 С - 10 С), выраженное в процентах, по сравнению с величиной циркулярного дихроизма необработанного образца упомянутого соединения. В то время как МФРД терял более чем 70% спиральности после трех циклов тепловой обработки, комплекс ДМФГ:МФРД полностью сохранял исходную альфа-спиральность при тех же условиях (см. фиг. 25). 2. Стабильность в присутствии мочевины. Мочевина как разобщающий агент может развертывать спиральную структуру и денатурировать белки. Равновесная денатурация МФРД в присутствии или в отсутствие ДМФГ изучалась методом флуоресценции, т.е. анализом третичной структуры, и методом циркулярного дихроизма, т.е. анализом вторичной структуры. Как изображено на фиг. 26, в то время как третичная структура белка утрачивается, остатки триптофана более проявляются в водной фазе и длины волн эмиссии сдвигаются в область более длинных волн; в то время как вторичная структура утрачивается, средняя остаточная элептичность становится менее отрицательной,в то время как альфа-спиральность утрачивается. В отсутствие ДМФГ наблюдается 50%-ная потеря вторичной структуры в присутствии 3 М мочевины, в то время, как требуется 8 М мочевины для достижения 50%-ной утраты структуры в присутствии ДМФГ. Аналогичным образом, для 50%-ной потери МФРД средней остаточной элиптичности требуется 7 М мочевины в отсутствии ДМФГ, по сравнению с 9 М мочевины в присутствии ДМФГ. 3. Стабильность в процессе хранения. МФРД, полученный с помощью E.coli и содержащий последовательность аминокислот 1-163, хранился в присутствии и в отсутствие ДМФГ в условиях, указанных в нижеприводимой таблице 2. Исследование проводилось методом вытеснительной хроматографмм (МВХ),используя колонку Toso-Haas G3000SWXL с подвижной фазой, содержащей 100 мМ фосфатного буфера, 10% этанола, 0,2% Твина-20,имеющей значение рН, равное 6,9. Образцы были разведены этанолом и Твином-20 до той же концентрации, что и в подвижной фазе, и 10-20 мкг образца были поданы на разделение. Температура на колонке поддерживалась на уровне 40 С. Агрегированный МФРД, который элюировался раньше, чем не агрегированный белок,был количественно измерен по площади пика агрегата и по площади мономерного пика. При 31 веденные данные указывают процентное содержание МФРД в суммарном пике агрегата.%агрегации, измеренный МВХ Температура 5 недель 11 недель Как показано в таблице 2, ДМФГ эффективно снижает образование агрегатов при хранении. ДМФГ может таким образом быть использован для увеличения срока хранения МФРД. Эти данные показывают, что взаимодействие МФРД с везикулами ДМФГ увеличивает стабильность белка при условиях, в которых МФРД нестабилен. Такое взаимодействие прямо стабилизирует вторичную и третичную структуру МФРД в присутствии денатурантов типа мочевины и значительно увеличивает срок хранения МФРД при различных температурах. Пример 10. В этом эксперименте химически модифицированный МФРД с последовательностью аминокислот 1-163 и с одной присоединенной молекулой ПЭГ (использовался ПЭГ 20 кДа) (ПЭГ-МФРД) был изучен относительно его способности взаимодействовать с отрицательно заряженными липидными везикулами. Для ПЭГ-МФРД определения были выполнены, используя сравнение величин F/Fo и максимумов эмиссии (как описано в примерах 1 и 8). В каждом случае молярное отношение липид : белок равнялось 100:1. ПЭТ : МФРД, используемый в этом эксперименте, представлял собою МФРД, полученный с помощью E.coli и содержащий последовательность аминокислот 1-163, который был модифицирован альдегидом моно-метоксиполиэтиленгликоля (мол. вес 20 кДа) МФРД путем восстановительного алкилирования. Гомогенность конъюгата ПЭГ-МФРД была определена электрофорезом в натрий додецилсульфат полиакриламидном геле, используя 4-20%ный градиентный гель заводского производства(NOVEX). Была обнаружена одна главная полоса, соответствующая положению белка с мол. весом 46,9 кДа. Затем были приготовлены образцы ДМФГ: ПЭГ-МФРД (молярное отношение 100:1), используя процессы, описанные ранее. Было найдено, что образцы ДМФГ : ПЭГ-МФРД полностью возвращают вторичную структуру после нагревания (фиг. 27). Несмотря на присутствие молекул ПЭГ, производные белков были спо 000415 32 собны взаимодействовать с липидами тем же путем, что и нативные белки. Эти данные показывают, что сдвиг максимума эмиссии, связанный с взаимодействием МФРД с отрицательно заряженными везикулами, присущ не единственно МФРД, полученному как продукт экспрессии прокариотическими клетками хозяина. Как было показано с химически модифицированным рчГКСФ, ДМФГ : ПЭГ-МФРД также проявляет сдвиг эмиссии и результаты показывают, что химически модифицированный МФРД может включаться в мембраны, состоящие из ДМФГ. Пример 11. В этом эксперименте было изучено влияние взаимодействия ДМФГ с ПЭГМФРД на адсорбцию МФРД стеклянными поверхностями. При концентрации 11 рг/мл[512501]-ПЭГ-МФРД комбинировался с различными концентрациями немеченого ПЭГ-МФРД,чтобы обеспечить указанную конечную концентрацию ПЭГ-МФРД (см. фиг. 28). Как ранее было указано, ДМФГ был включен в раствор(см. также фиг. 27). 1 мл препарата был помещен в стеклянные сосуды объемом 3 куб.см.(Kimble). Выход ПЭГ-МФРД в процентах был определен расчетом количества радиоактивного МФРД, возвращенного из сосудов после 18 ч инкубации при комнатной температуре. Как показано на фиг. 28, ПЭГ-МФРД легко адсорбируется на стеклянной поверхности, так как концентрация белка снижается и адсорбция особенно высока в пределах концентраций 0,1-50 мкг/мл. Напротив, образцы ДМФГ : ПЭГ-МФРД показали почти полное отсутствие адсорбции к стеклу в районе концентраций ПЭГ-МФРД 1-50 мкг/мл. Пример 12. В этом примере была изучена биологическая активность ДМФГ: МФРД с последовательностью аминокислот 1-163 и ДМФГ: ПЭГ-МФРД с последовательностью аминокислот 1-163 по сравнению с биологической активностью МФРД с последовательностью аминокислот 1-163 и ПЭГ-МФРД с последовательностью аминокислот 1-163. МФРД с последовательностью аминокислот 1-163 был получен с помощью E.coli и отношение липид : белок составляло 100:1. Количество тромбоцитов у мышей, обработанных 100 мкг/кг и 300 мкг/кг МФРД, ПЭГ-МФРД, ДМФГ: МФРД или ДМФГ: ПЭГ-МФРД было измерено и результаты представлены на фиг. 31. Указанные концентрации каждого образца назначались подкожно нормальным самкам мышей линии Balb/c один раз в день в течение 8 дней. Кровь из хвостовой вены была собрана через 24 ч после последней инъекции. Анализ клеток крови был выполнен с помощью электронного анализатора клеток крови (Baxter Diagnostics, Inc. Irvine, CA). Результаты представлены как среднее из определений на четырех животных с учетом средней стандартной ошибки. Другие параметры клеток крови, такие как общее количество белых кле 33 ток крови или красных клеток крови не изменялись при такой обработке (данные не показаны). Результаты указывают, что обработка полиэтиленгликолем МФРД с последовательностью аминокислот 1-163, полученного с помощьюE.coli, увеличивает in vivo активность молекулы МФРД. Более важно, что изучение показало, что включение в отрицательно заряженный липидный двойной слой не оказывает неблагоприятного воздействия на биологическую активность различных форм МФРД. Список последовательностей(2) Информация по идентификации последовательности N 1:(2) Информация по идентификации последовательности N 2: 35 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Состав, включающий цитокин, смешанный с интактными фосфолипидными липосомальными везикулами, состоящими из отрицательно заряженных фосфолипидов, до образования липосомально-цитокинного комплекса,причем лишь часть белка цитокина включена в липидную часть липосомальных везикул, а липосомально-цитокинный комплекс непосредственно стабилизирован против развертывания спирали вторичной структуры цитокина. 2. Состав по п.1, в котором рН состава равняется 3,0-7,5 и отношение липид:цитокин составляет, по крайней мере, 10:1. 3. Состав по п.1, в котором липосомальные везикулы выбраны из группы, состоящей из диолеоилфосфатидилглицерина, димиристоилфосфатидилглицерина, дипальмитоилфосфатидилглицерина, яичного фосфатидилглицерина,диолеоилфосфатидилэтаноламина,яичного фосфатидилэтаноламина,диолеоилфосфатидной кислоты, димиристоилфосфатидной кислоты, дипальмитоилфосфатидной кислоты, диолеоилфосфатидилсерина, димеристоилфосфатидилсерина,дипальмитоилфосфатидилсерина,яичного фосфатидилсерина, лизофосфатидилглицерина, лизофосфатидилэтаноламина и лизофосфатидилсерина. 4. Состав по п.1, в котором цитокин представляет собою гематопоэтический фактор. 5. Состав по п.4, в котором гематопоэтический фактор представляет собою фактор, выбранный из группы, состоящей из ГКСФ,ГМКСФ и МФРД. 6. Состав по п.5, в котором гематопоэтический фактор представляет собою ГКСФ. 7. Состав по п.6, в котором ГКСФ представляет собою природный человеческий ГКСФ или получен как продукт экспрессии прокариотическими или эукариотическими клетками хозяина. 8. Состав по п.6, в котором ГКСФ представляет собою химически модифицированный ГКСФ. 9. Состав по п.8, в котором химически модифицированный ГКСФ представляет собою ГКСФ, модифицированный полиэтиленгликолем. 10. Состав по п.5, в котором гематопоэтический фактор представляет собою МФРД. 11. Состав по п.10, в котором МФРД представляет собою природный человеческий МФРД или получен как продукт экспрессии прокариотическими или эукариотическими клетками хозяина. 12. Состав по п.11, в котором МФРД имеет последовательность аминокислот 1-163, показанную на фиг. 29. 13. Состав по п.11, в котором МФРД имеет последовательность аминокислот 1-332, показанную на фиг. 29. 36 14. Состав по п.10, в котором МФРД представляет собою химически модифицированный МФРД. 15. Состав по п.14, в котором химически модифицированный МФРД представляет собою пегилированный МФРД. 16. Состав по п.15, в котором МФРД пегилирован полиэтиленгликолем. 17. Состав по п.16, в котором пегилированный МФРД содержит одну молекулу присоединенного полиэтиленгликоля. 18. Состав по п.17, в котором молекула полиэтиленгликоля связана с концевым атомом азота. 19. Состав по п.1, который содержит фармацевтически приемлемый носитель. 20. Состав по п.1, в котором белок представляет собою образованный с помощью клеток Е.соli рчГКСФ, липосомальные везикулы представляют собою ДОФГ,отношение ДОФГ:рчГКСФ равняется 50:1 и состав имеет значение рН 4,5 и содержит 10 мМ ацетата натрия. 21. Состав по п.1, в котором белок представляет собою образованный с помощью клеток E.coli МФРД с последовательностью аминокислот 1-163, липосомальные везикулы представляют собою ДМФГ,отношение ДМФГ:МФРД равняется 100:1 и состав имеет значение рН 5,0 и содержит 10 мМ ацетата натрия и 5% сорбита. 22. Состав по п.1, в котором белок представляет собою образованный с помощью клеток E.coli МФРД, модифицированный одной молекулой полиэтиленгликоля(моноПЭГМФРД), липосомальные везикулы представляют собою ДМФГ, отношение ДМФГ:моноПЭГМФРД равняется 100:1 и состав имеет значение рН 5,0 и содержит 10 мМ ацетата натрия и 5% сорбита. 23. Состав по п.1, в котором белок представляет собою образованный овариальными клетками китайского хомячка МФРД с последовательностью аминокислот 1-332, липосомальные везикулы представляют собою ДМФГ, отношение ДМФГ: МФРД равняется 100:1, состав имеет значение рН 5,0 и содержит 10 мМ ацетата натрия и 5% сорбита. 24. Способ получения липосомальноцитокинного состава, включающий смешивание цитокина с интактными фосфолипидными липосомальными везикулами, причем указанные липосомальные везикулы отрицательно заряжены таким образом, что лишь часть цитокина встраивается в липидную часть липосомальных везикул,а получаемый липосомальноцитокинный состав непосредственно стабилизирован против развертывания спирали вторичной структуры цитокина. 25. Способ по п.24, в котором состав имеет значение рН 3,0-7,5 и отношение липид:цитокин, по крайней мере, равное 10:1. 37 26. Способ по п.24, в котором липосомальные везикулы приготовлены из липидов, выбранных из группы, включающей диолеоилфосфатидилглицерин,димиристоилфосфатидилглицерин, дипальмитоилфосфатидилглицерин, яичный фосфатидилглицерин, диолеоилфосфатидилэтаноламин, яичный фосфатидилэтаноламин, диолеоилфосфатидную кислоту,димиристоилфосфатидную кислоту, дипальмитоилфосфатидную кислоту, диолеоилфосфатидилсерин, димеристоилфосфатидилсерин, дипальмитоилфосфатидилсерин, яичный фосфатидилсерин, лизофосфатидилглицерин, лизофосфатидилэтаноламин и лизофосфатидилсерин. 27. Способ по п.24, в котором цитокин представляет собою гематопоэтический фактор. 28. Способ по п.27, в котором гематопоэтический фактор представляет собою фактор,выбранный из группы, состоящей из ГКСФ,ГМКСФ и МФРД. 29. Способ по п.28, в котором гематопоэтический фактор представляет собою ГКСФ. 30. Способ по п.29, в котором ГКСФ представляет собою природный человеческий ГКСФ или получен как продукт экспрессии прокариотическими или эукариотическими клетками хозяина. 31. Способ по п.29, в котором ГКСФ представляет собою химически модифицированный ГКСФ. 32. Способ по п.28, в котором химически модифицированный ГКСФ представляет собою 38 ГКСФ, модифицированный полиэтиленгликолем. 33. Способ по п.28, в котором гематопоэтический фактор представляет собою МФРД. 34. Способ по п.33, в котором МФРД представляет собою природный человеческий МФРД или получен как продукт экспрессии прокариотическими или эукариотическими клетками хозяина. 35. Способ по п.34, в котором МФРД имеет последовательность аминокислот 1-163, показанную на фиг. 29. 36. Способ по п.34, в котором МФРД имеет последовательность аминокислот 1-332, показанную на фиг. 29. 37. Способ по п.33, в котором МФРД представляет собою химически модифицированный МФРД. 38. Способ по п.37, в котором химически модифицированный МФРД представляет собою пегилированный МФРД. 39. Способ по п.38, в котором МФРД пегилирован полиэтиленгликолем. 40. Способ по п.39, в котором МФРД модифицирован одной молекулой полиэтиленгликоля. 41. Способ по п.40, в котором молекула полиэтиленгликоля связана с концевым атомом азота. 42. Способ по п.24, в котором состав содержит фармацевтически приемлемый носитель.
МПК / Метки
МПК: A61K 9/127
Метки: получения, способы, составы, стабильные, белково-фосфолипидные
Код ссылки
<a href="https://eas.patents.su/28-415-stabilnye-belkovo-fosfolipidnye-sostavy-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Стабильные белково-фосфолипидные составы и способы их получения</a>
Предыдущий патент: Система связи низкой стоимости и большого радиуса действия для обмена данными с удаленными или мобильными полевыми модулями и способ работы такой системы связи
Следующий патент: Устройство для обеззараживания воздуха
Случайный патент: Фунгицидные водные композиции для протравливания семян