Способы лечения злокачественных опухолей in vivo при помощи генотерапии с использованием генов, кодирующих &beta-интерферон
Формула / Реферат
1. Способ лечения злокачественных опухолей с помощью генотерапии in vivo, включающий стадию введения субъекту терапевтически эффективного количества вирусного вектора, отличающийся тем, что указанный вектор содержит ген, кодирующий b-интерферон, и где указанный вектор выбран из группы, состоящей из аденовирусного вектора, лентивирусного вектора, вектора, полученного на основе вируса Эпштейна-Барр, бакуловирусного вектора и вектора, полученного на основе вируса простого герпеса.
2. Способ по п.1, отличающийся тем, что вектор выбран из группы, состоящей из аденовирусного вектора, бакуловирусного вектора и лентивирусного вектора.
3. Способ по п.1, отличающийся тем, что вектор представляет собой аденовирусный вектор.
4. Способ по п.3, отличающийся тем, что аденовирусный вектор содержит делецию в гене E3.
5. Способ по п.3 или 4, где аденовирусный вектор содержит делецию в гене E1.
6. Способ по п.1, отличающийся тем, что вектор вводят путем, выбранным из группы, состоящей из прямой инъекции в опухоль, местного введения, внутриглазного введения, парентерального введения, интраназального введения, интратрахеального введения, интрабронхиального введения и подкожного введения.
7. Способ по п.6, отличающийся тем, что указанный путь представляет собой парентеральное введение, выбранное из группы, состоящей из внутривенного введения, внутримышечного введения и внутрибрюшинного введения.
8. Способ по п.6, отличающийся тем, что вектор вводят прямой инъекцией в опухоль.
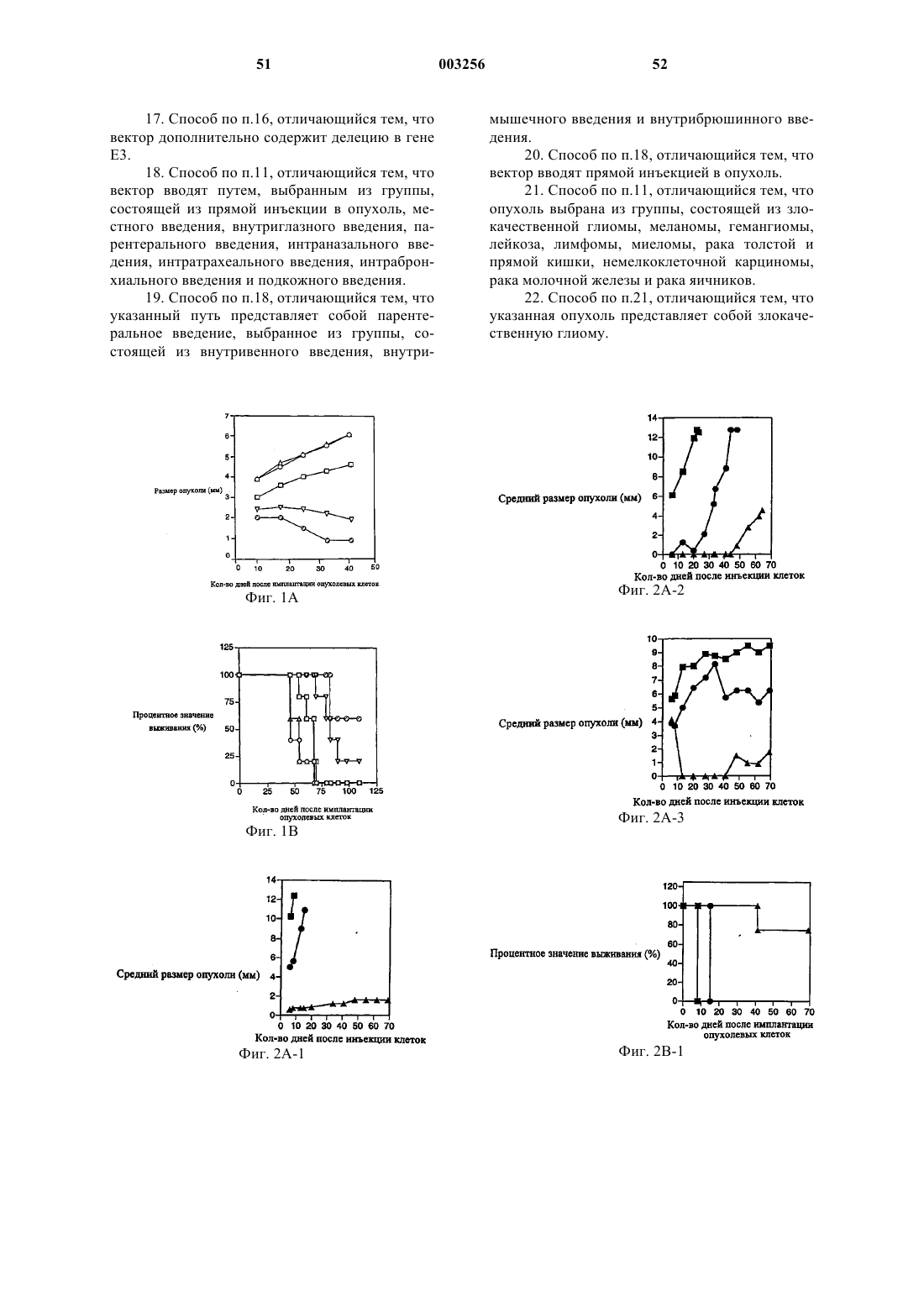
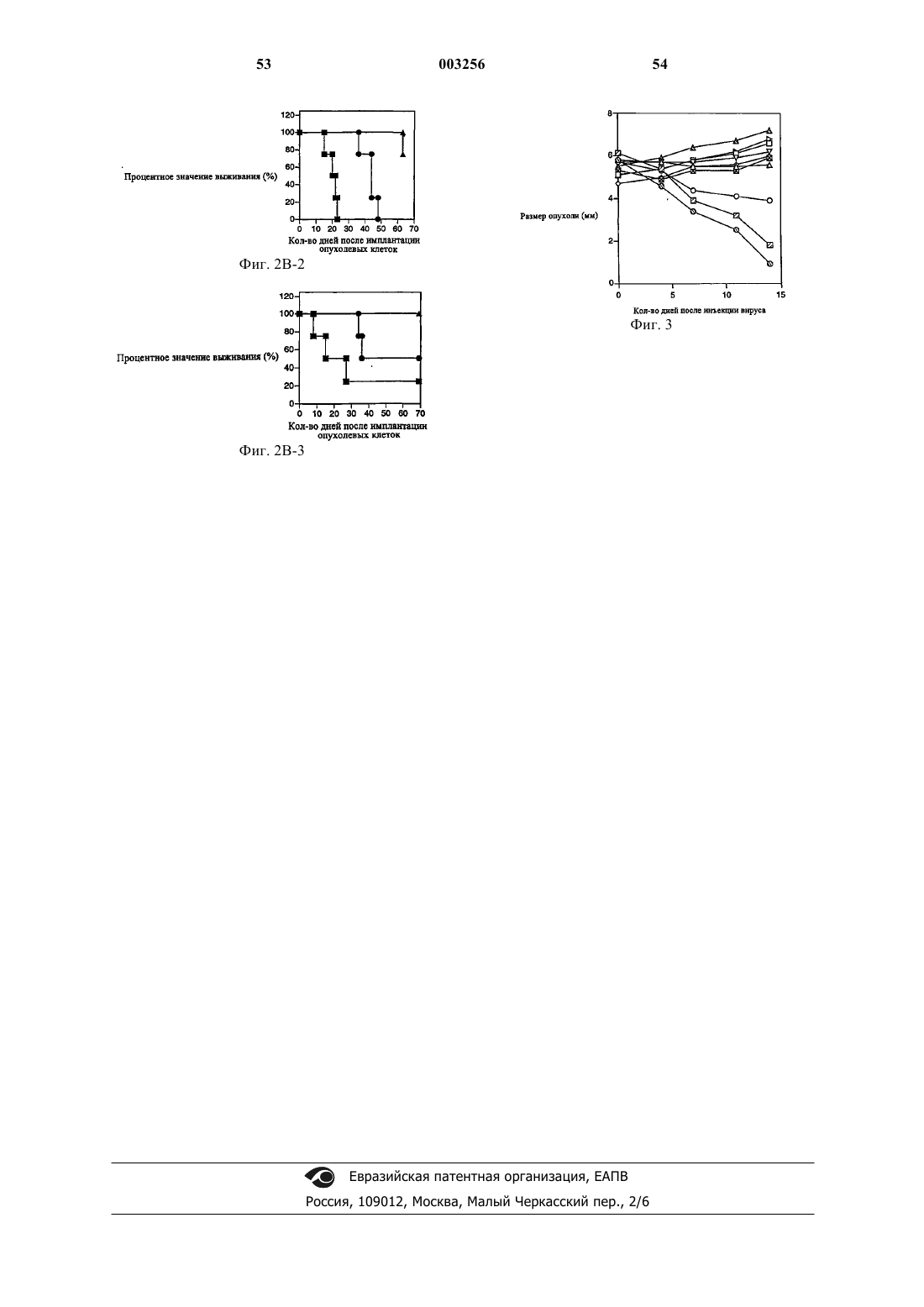
9. Способ по п.1, отличающийся тем, что опухоль выбрана из группы, состоящей из злокачественной глиомы, меланомы, гемангиомы, лейкоза, лимфомы, миеломы, рака толстой и прямой кишки, немелкоклеточной карциномы, рака молочной железы и рака яичников.
10. Способ по п.9, отличающийся тем, что опухоль представляет собой злокачественную глиому.
11. Способ лечения злокачественных опухолей с помощью генотерапии in vivo, включающий стадию введения субъекту терапевтически эффективного количества дефектного по репликации вектора, отличающийся тем, что указанный вектор содержит ген, кодирующий b-интерферон, и где указанный вектор выбран из группы, состоящей из аденовирусного вектора, лентивирусного вектора, бакуловирусного вектора, вектора, полученного на основе вируса Эпштейна-Барр, и вектора, полученного на основе вируса простого герпеса.
12. Способ по п.11, отличающийся тем, что вектор выбран из группы, состоящей из аденовирусного вектора, бакуловирусного вектора и лентивирусного вектора.
13. Способ по п.12, отличающийся тем, что вектор представляет собой аденовирусный вектор.
14. Способ по п.13, отличающийся тем, что вектор делетирован по одной или нескольким геномным областям, выбранным из группы, состоящей из областей E1, E2A и E4 аденовирусного генома.
15. Способ по п.13 или 14, отличающийся тем, что вектор содержит делецию в гене E3.
16. Способ по п.14, отличающийся тем, что вектор не содержит ген E1.
17. Способ по п.16, отличающийся тем, что вектор дополнительно содержит делецию в гене E3.
18. Способ по п.11, отличающийся тем, что вектор вводят путем, выбранным из группы, состоящей из прямой инъекции в опухоль, местного введения, внутриглазного введения, парентерального введения, интраназального введения, интратрахеального введения, интрабронхиального введения и подкожного введения.
19. Способ по п.18, отличающийся тем, что указанный путь представляет собой парентеральное введение, выбранное из группы, состоящей из внутривенного введения, внутримышечного введения и внутрибрюшинного введения.
20. Способ по п.18, отличающийся тем, что вектор вводят прямой инъекцией в опухоль.
21. Способ по п.11, отличающийся тем, что опухоль выбрана из группы, состоящей из злокачественной глиомы, меланомы, гемангиомы, лейкоза, лимфомы, миеломы, рака толстой и прямой кишки, немелкоклеточной карциномы, рака молочной железы и рака яичников.
22. Способ по п.21, отличающийся тем, что указанная опухоль представляет собой злокачественную глиому.
Текст
1 Область техники Это изобретение относится к генотерапии. В частности, настоящее изобретение относится к введению ДНК, кодирующей секретируемые белки, такие как интерфероны, человеку и животным. Предпосылки изобретения Интерфероны (именуемые также "IFN") являются белками, обладающими различной биологической активностью, в частности антивирусной, иммуномодулирующей и антипролиферативной. Интерфероны являются относительно мелкими, видоспецифическими, одноцепочечными полипептидами, продуцируемыми клетками млекопитающих в ответ на воздействие разных индукторов, таких как вирусы, полипептиды, митогены и тому подобные. Интерфероны защищают ткани и клетки животных от проникновения вирусов и представляют собой важный механизм защиты хозяина. В большинстве случаев интерфероны обеспечивают лучшую защиту тканей и клеток того типа, в котором они были продуцированы, по сравнению с другими типами тканей и клеток, из чего следует, что интерферон человека позволяет гораздо эффективнее лечить болезни человека чем интерфероны, продуцированные животными других видов. Существует несколько разных типов интерферонов человека, которые можно классифицировать как лейкоцитарный ([] альфаинтерферон),фибробластный([] бетаинтерферон), иммунный интерферон ([] гаммаинтерферон) и большое количество их разновидностей. С общим описанием интерферонов можно ознакомиться в разных научных статьях и монографиях, в том числе: The Interferon System (W.E. Stewart, II, Springer-Verlag, N.Y. 1979); и Interferon Therapy (World Health Organization Technical Reports Series 676, World HealthOrganization, Geneva 1982), которые включены в это описание изобретения в качестве ссылки. Интерфероны весьма перспективны для лечения целого ряда злокачественных опухолей человека, поскольку данные молекулы проявляют противораковую активность на многих уровнях. Во-первых, интерфероны могут непосредственно подавлять пролиферацию опухолевых клеток человека. Причем их антипролиферативная активность синергична с действием различных проверенных химиотерапевтических средств, таких как цис-платин, 5FU и таксол. Во-вторых, иммуномодулирующее действие интерферонов может индуцировать противоопухолевую иммунную реакцию. Эта реакция активирует NK-клетки, стимулирует действие макрофагов и индуцирует поверхностную экспрессию МНС класса I, вызывающую активность противоопухолевых цитотоксических Тлимфоцитов. Кроме того, в некоторых исследованиях установлено, что белок -IFN обладает 2 антиангиогенной активностью. Ангиогенез, то есть развитие новых кровеносных сосудов, имеет важное значение для роста солидных опухолей. Имеющиеся данные показывают, что -IFN может ингибировать ангиогенез, подавляя экспрессию проангиогенных факторов, таких какbFGF и VEGF. И наконец, интерфероны могут ингибировать инвазивность опухоли, воздействуя на экспрессию таких ферментов, как коллагеназа и эластаза, которые имеют важное значение для перестраивания тканей. Интерфероны обладают также антивирусным действием, в основе которого лежат два разных механизма. Например, интерфероны типа I ( и ) могут подавлять репликацию вируса гепатита В человека ("HBV") и вируса гепатита С ("HCV"), при этом они способны стимулировать иммунную реакцию в отношении клеток, инфицированных этими вирусами. Несмотря на многообещающее терапевтическое значение интерфероны находят весьма ограниченное применение в клинической практике для лечения вирусного гепатита и солидных опухолей. Белок -IFN сертифицирован для применения при лечении HBV и HCV; однако коэффициент выздоровления в обоих случаях равен примерно 20%. Хотя интерфероны сертифицированы также для лечения некоторых видов злокачественных опухолей, таких как лимфома, лейкоз, меланома и злокачественная опухоль почки, в большинстве клинических испытаний, в которых интерфероны использовались отдельно или в сочетании с обычными химиотерапевтическими средствами для лечения солидных опухолей, не было получено положительных результатов. Способ введения интерферона является важным фактором в клиническом применении этого важного лекарственного средства. Наиболее часто производится системное введение интерферона в виде внутривенных, внутримышечных или подкожных инъекций, при этом достигается определенный успех при лечении таких заболеваний, как злокачественный ретикулоэндотелиоз, синдром приобретенного иммунодефицита человека (СПИД) и саркома Капоши. Однако известно, что белки в очищенном виде особенно подвержены разрушению. В частности, первичным механизмом разрушения бетаинтерферона в растворе является агрегация и деамидирование. До настоящего времени применение интерферонов было весьма ограниченным из-за плохой устойчивости в растворах и других продуктах. Кроме того, в случае парентерального введения интерферона (внутримышечно, подкожно или внутривенно) происходит очень быстрое выведение белка интерферона из организма. Поэтому парентеральное введение этого белка не обеспечивает доставку достаточного количества интерферона к очагу заболевания (солидная опухоль или печень в случае ге 3 патита). Количество интерферона, которое можно ввести пациентам парентерально, ограничено из-за побочных эффектов, возникающих при введении больших доз интерферона. Из вышеизложенного следует, что существует потребность в более эффективной терапии. Сущность изобретения Эта заявка на патент ставит своей целью устранение проблем, связанных с доставкой к очагу заболевания секретируемого белка, такого как интерферон, используемого в качестве лекарственного средства. Настоящее изобретение относится к способу лечения интерфероном, в соответствии с которым производится доставка гена, кодирующего секретируемый белок, а не самого белка. Таким образом, целью настоящего изобретения является способ генотерапии на основе использования генетически сконструированных клеток и его применение для доставки секретируемого белка, такого как интерферон, к очагу заболевания у млекопитающего-реципиента. Настоящее изобретение обеспечивает достижение этих и других целей путем разработки способов формирования клеточной экспрессирующей системы и использования полученной экспрессирующей системы и фармацевтических композиций, содержащих указанную систему. Клеточная экспрессирующая система экспрессирует ген, кодирующий один или несколько секретируемых белков, и является полезным носителем для доставки in situ генного продукта к активному участку млекопитающегореципиента. В соответствии с предпочтительным вариантом осуществления изобретения млекопитающее-реципиент является человеком. Одним вариантом осуществления изобретения является клеточная экспрессирующая система, предназначенная для экспрессии invivo в клетке млекопитающего-реципиента интерферона для лечения определенного заболевания. Экспрессирующая система включает клетку, относящуюся к тому же виду, что и млекопитающее-реципиент, и введенный в нее экспрессирующий вектор, служащий для экспрессии интерферона. Млекопитающее-реципиент предпочтительно является человеком, а экспрессирующий вектор представляет собой вирусный вектор. В соответствии с еще одним вариантом осуществления изобретения экспрессирующая система включает множество клеток, относящихся к тому же виду, что и млекопитающеереципиент, и введенный в них экспрессирующий вектор, служащий для экспрессии секретируемого белка. Экспрессирующий вектор находится лишь в части клеток. Его предпочтительно содержат, по крайней мере, 0,3% всех клеток. Предпочтительным секретируемым белком является интерферон и наболее предпочтительными интерферонами являются альфа-, бета-,гамма- и консенсусный интерфероны, причем 4 самым предпочтительным считается бетаинтерферон. В соответствии с другими вариантами осуществления изобретения клеточная экспрессирующая система включает множество злокачественных клеток, и, по крайней мере, часть злокачественных клеток содержит аденовирусный вектор с выделенным полинуклеотидом,кодирующим интерферон в процессе экспрессии. Используемые в этой клеточной экспрессирующей системе аденовирусные векторы выбирают из группы, включающей: (а) аденовирусный вектор с делецией и/или мутацией в гене El;(b) аденовирусный вектор с делецией и/или мутацией в гене Е 2 а, причем указанный вектор экспрессирует бета-интерферон человека; (с) аденовирусный вектор с делецией и/или мутацией в генах Е 1 и Е 4; и (d) аденовирусный вектор с делецией всех генов, причем указанный вектор экспрессирует бета-интерферон человека. Способ, предназначенный для генотерапииin vivo, включает стадию введения аденовирусного вектора, содержащего выделенный полинуклеотид, кодирующийбета-интерферон человека, непосредственно в клетку субъекта без предварительного удаления указанной клетки. В соответствии со способами in vivo и exvivo лекарственное средство можно использовать для местного, внутриглазного, парентерального, назального, внутритрахеального,внутрибронхиального, внутримышечного, подкожного, внутривенного и внутрибрюшинного введения. Настоящее изобретение обладает несколькими преимуществами. Генотерапия интерфероном позволяет создавать очень высокие локальные концентрации интерферона при низких системных уровнях. Это обеспечивает более высокую эффективность при менее выраженных побочных эффектах. Кроме того, интерфероны,доставляемые к очагу заболевания методом генотерапии, сохраняются на достаточно постоянном уровне в отличие от других методов лечения интерфероном, при которых очень высокие "всплески" или пики концентрации интерферона (которые могут вызвать токсичность),имеющие место после инъекции белка, сменяются очень низкими уровнями, когда концентрация интерферона является, по-видимому,слишком низкой, чтобы оказывать эффективное действие. Удобство субъекта также имеет важное значение. Этот способ позволяет заменить частые инъекции интерферона всего одним или несколькими редкими введениями вектора, экспрессирующего ген интерферона, который обеспечивает долговременное устойчивое продуцирование белка. Генотерапия позволяет контролировать доставку интерферонов к конкретному органу-мишени или опухоли. Можно создать аутокринную систему, в которой одни и те 5 же клетки экспрессируют, секретируют и поглощают интерферон. Так могут достигаться очень высокие локальные дозы. Такие высокие дозы нельзя получить путем парентерального введения белка из-за проблем, связанных с токсичностью. Поскольку клетки секретируют белки интерферонов, необязательно трансдуцировать геном интерферона все клетки опухоли или пораженной гепатитом печени. Клетки, которые не поглощают указанный ген, будут находиться под действием соседних клеток (так называемый "эффект подражания"), которые имеют этот ген и секретируют интерферон. Это важное открытие, по-видимому, должно оказать сильное влияние на схемы лечения, так как теперь необязательно, чтобы все клетки в опухолевом образовании или в пораженном органе содержали экспрессирующий вектор. И, наконец, установлено, что парентеральное введение интерферона вызывает образование антител против интерферона. Вполне возможно, что этот гуморальный иммунный ответ,потенциально нейтрализирующий действие лекарственного средства, можно уменьшить благодаря введению гена интерферона в конкретный локальный участок. Помимо локальной экспрессии экспрессированный интерферон может быть продуцирован эндогенными клетками человека, поэтому он будет более естественным по своей структуре и гликозилированию и, возможно, менее иммуногенным, чем интерферон, продуцированный бактериями, дрожжами или клетками яичника китайского хомячка, а затем очищен и введен в виде парентеральной инъекции. Эти и другие цели настоящего изобретения, а также его преимущества и способы применения очевидны из подробного описания предпочтительных вариантов осуществления и прилагаемых чертежей. Краткое описание чертежей Фиг. 1. (А) Неинфицированные клеткиMDA-MB-468 (-O-) или указанные клетки, инфицированные клетками H5.110hIFN в количестве 0,01% , 0,03% (-%-), 0,1% или 0,3% (- -), инъецированы подкожно в бок мышам "nude", и после имплантации опухолевых клеток построен график изменения среднего размера опухоли в зависимости от времени; (В) график Каплана-Мейра, показывающий процентное значение выживания мышей на протяжении всего периода наблюдения, равного 109 дням. Неинфицированные клетки (-O-); клетки, инфицированные H5.110hIFN в количестве 0,01% ,0,03% (-%-), 0,1% или 0,3% (- -). Фиг. 2. (А) Генотерапия бета-интерфероном ex vivo с использованием (1) клетокKM12L4A; (2) клеток Huh7 и (3) клеток МЕ 180. График изменения среднего размера опухоли в зависимости от времени построен после им 003256 6 плантации опухолевых клеток. Мышам были имплантированы неинфицированные клеткиили клетки, инфицированные H5.110hIFN в количестве 1% или 10% . В тех группах, где некоторые мыши были умерщвлены,размер опухоли представлен в виде среднего значения, причем первым указано последнее значение, полученное для умерщвленных животных. Прерывание графиков соответствует гибели или умерщвлению всех животных в группе. (В) Процентное значение выживания мышей на протяжении всего периода наблюдения, равного 70 дням. В блоках 1, 2 и 3 приведены данные, полученные для мышей, которым были соответственно имплантированы клеткиKM12L4A, клетки Huh7 и клетки МЕ 180. Нижеследующие символы обозначают мышей, которым имплантированы неинфицированные клетки ; клетки, инфицированные H5.110hIFN в количестве 1% или 10% . Фиг. 3. Непосредственное лечение in vivo опухолей MDA-МВ-468. В опухоли инъецировали H5.110hIFN в количестве соответственно 3 х 109 БОЕ (бляшкообразующих единиц) (- -),1 х 109 БОЕ (- -), 3 х 108 БОЕ (-O-), 1 х 108 БОЕ (-) и 3 х 107 БОЕ ; физиологический раствор с фосфатным буфером (PBS) (- -) илиH5.110lacZ в количестве соответственно 3 х 109 БОЕ , 1 х 109 БОЕ , 3 х 108 БОЕ (-Х-) и 1 х 108 БОЕ (- -). Размеры опухолей измеряли в течение 14 дней после инъекций. Описание предпочтительных вариантов осуществления изобретения Настоящее изобретение частично основано на разработке способа генотерапии ех vivo, при осуществлении которого используется клетка,которая (1) может быть легко удалена из организма пациента; (2) может быть модифицирована in vitro путем введения генетического материала; (3) может быть имплантирована реципиенту; (4) не является тромбогенной и (5) может быть имплантирована реципиенту в большом количестве. В рассматриваемом способе генотерапии in vivo используется клетка, которая (1) находится в организме реципиента и (2) может быть модифицирована in situ для экспрессии выделенного генетического материала. Генетически модифицированная клетка включает регуляторные элементы, позволяющие контролировать количество экспрессированного генетического материала. Генетически модифицированные клетки должны сохранять жизнеспособность и продолжать продуцировать экспрессированный материал in situ в течение периода времени, необходимого для того, чтобы экспрессированный материал мог оказать благоприятное (то есть лечебное) действие, не препятствуя при этом нормальному функционированию ткани, в которой находятся эти клетки. 7 Экспрессированный материал предпочтительно является секретируемым белком (определяемым ниже). Секретируемый белок наиболее предпочтительно является интерфероном. Хотя интерфероны являются наиболее предпочтительным лечебным средством, выявлен общий принцип, который применим к генотерапии любым секретируемым белком. Мы обнаружили, что, поскольку секретируемые белки, такие как интерфероны, выделяются из клеток, в которых они были экспрессированы, необязательно трансдуцировать "секретируемый белок" во все клетки опухолевого образования или, например, пораженной гепатитом печени. Клетки,которые не поглощают этот ген, будут находиться под действием соседних клеток, которые имеют такой ген и секретируют белок (то есть так называемый "эффект подражания"). Хотя данные способы генотерапии описаны для выделенных полинуклеотидов, которые кодируют интерфероны в процессе экспрессии, в способах и композициях по настоящему изобретению может быть использован любой секретируемый белок (определяемый ниже). Все справочные материалы, приведенные в этой заявке, включены в это описание изобретения в качестве ссылки."Генотерапия" означает методику, которая позволяет корректировать фенотип заболевания путем введения генетической информации в пораженный организм."Генотерапия ex vivo" означает методику,в соответствии с которой у субъекта удаляют клетки и культивирования их in vitro. В эти клетки in vitro вводят полинуклеотид, такой как функциональный ген, после чего модифицированные клетки размножают в культуре и вновь имплантируют данному субъекту."Генотерапия in vivo" означает методику, в соответствии с которой у субъекта не удаляют клетки-мишени. Вместо этого выделенный полинуклеотид (например, ген, кодирующий интерферон в процессе экспрессии) вводят в клетки реципиента in situ, то есть в клетки, находящиеся в организме реципиента. Генотерапия invivo исследована на нескольких животных моделях, и в последних публикациях сообщается о возможности прямого переноса гена in situ в органы и ткани."Состояния, поддающиеся лечению генотерапией" означают состояния, такие как генетические заболевания (то есть заболевание, обусловленное дефектами одного или нескольких генов), приобретенные патологии (то есть патологии, которые не обусловлены врожденным дефектом), злокачественные заболевания и профилактические процедуры (то есть профилактика заболевания или нежелательного медицинского состояния)."Приобретенная патология" означает заболевание или синдром, проявляющийся в не со 003256 8 ответствующем норме физиологическом, биохимическом, клеточном, структурном или молекулярном биологическом состоянии."Полинуклеотид" означает полимер, состоящий из мономерных звеньев нуклеиновой кислоты, причем указанные мономерные звенья могут быть рибонуклеиновыми кислотами(ДНК) или их комбинациями. Четырьмя основаниями ДНК являются аденин (А), гуанин (G),цитозин (С) и тимин (Т). Четырьмя основаниями РНК являются А, G, С и урацил (U)."Выделенный" применительно к полинуклеотидным последовательностям генов, кодирующих интерферон, означает полинуклеотид РНК или ДНК, часть геномного полинуклеотида, кДНК или синтетический полинуклеотид,который благодаря своему происхождению или манипуляции: (i) не ассоциируется со всем полинуклеотидом, с которым он ассоциируется в природе (например, присутствует в клеткехозяине в виде части экспрессирующего вектора); (ii) связан с нуклеиновой кислотой или другой химической частью, которая отличается от той части, с которой он связан в природе; или(iii) не встречается в природе. Термин "выделенный" далее означает полинуклеотидную последовательность, которая: (i) амплифицированаin vitro, например, полимеразной реакцией синтеза цепи (PCR); (ii) синтезирована химическим методом; (iii) продуцирована рекомбинантным методом путем клонирования; или (iv) очищена путем расщепления и разделения в геле. Таким образом, "выделенный" полинуклеотид интерферона включает, например, неприродную нуклеиновую кислоту, которая может быть транскрибирована в антисмысловой РНК, а также ген, кодирующий интерферон,который не экспрессируется или экспрессируется на биологически незначимых уровнях в естественной клетке. Для иллюстрации вышеизложенного можно отметить, что синтетический или естественный ген, кодирующий бетаинтерферон 1 а человека, следует считать "выделенным" в отношении клеток головного мозга человека, так как эти клетки не экспрессируют бета-интерферон 1 а в естественных условиях. Еще одним примером "выделенного полинуклеотида" является введение лишь части гена интерферона для создания рекомбинантного гена, в частности объединение индуцируемого промотора с последовательностью, кодирующей эндогенный интерферон, путем гомологичной рекомбинации.(то есть линейную матрицу нуклеотидов, соединенных друг с другом 3'-5'-концевыми пентозафосфодиэфирными связями), которая кодирует с помощью мРНК аминокислотную последовательность специфического белка."Транскрипция" означает процесс синтеза мРНК из гена."Трансляция" означает процесс синтеза белка из мРНК."Экспрессия" означает процесс, претерпеваемый последовательностью ДНК или гена для синтеза белка, сочетающий транскрипцию и трансляцию."Подавление роста", в используемом здесь значении, этот термин относится как к подавлению роста клетки-мишени (то есть опухоли), так и к ингибированию трансформированного фенотипа (измеряемому, например, изменениями морфологии)."Аминокислота" означает мономерное звено пептида, полипептида или белка. Существует двадцать L-изомеров аминокислот. Этот термин включает также аналоги аминокислот и Dизомеры аминокислот белка и их аналоги."Белок" означает любой полимер, состоящий практически из любых 20 аминокислот белка независимо от его размера. Хотя термин"полипептид" часто используется для определения относительно крупных полипептидов и термин "пептид" часто используется для определения небольших полипептидов, эти термины являются взаимозаменяемыми. Термин "белок" в используемом здесь значении относится к пептидам, белкам и полипептидам за исключением особо оговоренных случаев."Секретируемый белок" означает белок,транспортируемый из клетки наружу; среди секретируемых белков имеется большое количество факторов роста и белков-иммуномодуляторов, в частности разных интерферонов"Генетическое слияние" означает колинеарное, ковалентное связывание двух или более белков через их пептидные остовы путем генетической экспрессии полинуклеотидной молекулы, кодирующей эти белки."Мутант" означает любое качественное или структурное изменение генетического материала организма, в частности любое изменение (то есть, делецию, замену, добавление или модификацию) в гене интерферона дикого типа или любое изменение в белке интерферона дикого типа."Дикий тип" означает природную полинуклеотидную или аминокислотную последовательность гена или белка интерферона в том виде, как она существует in vivo."Стандартные условия гибридизации" означают условия получения соли и температурный режим, которые обычно составляют для гибридизации и промывки от 0,5 Х SSC до примерно 5xSSC и 65 С. Термин "стандартные условия гибридизации" в используемом здесь значении является рабочим определением и охватывает весь диапазон условий гибридизации. Более строгие условия могут, например, включать гибридизацию с использованием буфера 10 для скрининга бляшек (0,2% поливинилпирролидона, 0,2% Ficoll 400, 0,2% бычьего сывороточного альбумина, 50 мМ трис-HCl (рН 7,5),1 М NaCl, 0,1% пирофосфата натрия, 1% SDS); 10% сульфата декстрана и 100 мкг/мл денатурированной, обработанной ультразвуком ДНК спермы лосося, при температуре 65 С в течение 12-20 ч и промывку 75 мМ NaCl/7,5 мМ цитрата натрия (0,5 хSSC)/1% SDS при температуре 65 С. Менее строгие условия могут, например,включать гибридизацию с использованием буфера для скрининга бляшек, 10% сульфата декстрана и 110 мкг/мл денатурированной, обработанной ультразвуком ДНК спермы лосося при температуре 55 С в течение 12-20 ч и промывку 300 мМ NaCl/30 мМ цитрата натрия"Контролирующая экспрессию последовательность" означает последовательность нуклеотидов, которая контролирует и регулирует экспрессию генов при оперативном связывании с этими генами."Оперативно связанный" означает полинуклеотидную последовательность (ДНК, РНК),которая оперативно связана с контролирующей экспрессию последовательностью, когда указанная последовательность контролирует и регулирует транскрипцию и трансляцию данной полинуклеотидной последовательности. Термин"оперативно связанный" включает наличие соответствующего инициирующего сигнала (например, ATG) перед экспрессируемой полинуклеотидной последовательностью и сохранение правильной рамки считывания для экспрессии полинуклеотидной последовательности под контролем контролирующей экспрессию последовательности и продуцирование требуемого интерферона, закодированного выделенной полинуклеотидной последовательностью."Экспрессирующий вектор" означает полинуклеотид, обычно плазмиду ДНК (которая включает также вирус), которая обеспечивает экспрессию, по крайней мере, одного гена при введении экспрессирующего вектора в клеткухозяина. Этот вектор может быть способен или не способен реплицироваться в клетке."Опухоль" означает любую нежелательную пролиферацию клеток. Такой рост клеток включает злокачественные и доброкачественные, солидные или жидкие опухоли, карциномы, миеломы, саркомы, лейкозы, лимфомы и другие злокачественные, опухолевые или онкогенные заболевания.(именуемая также "клеточная экспрессирующая система") включает клетку и экспрессирующий вектор, служащие для экспрессии интерферона. В случае применения еx vivo генетически модифицированные клетки должны быть пригодны для введения млекопитающему-реципиенту,где они заменяют или сосуществуют с эндогенными клетками реципиента. В случае примене 11 ния in vivo такие клетки продуцируются в организме реципиента. Настоящее изобретение относится также к разным способам получения и применения вышеописанных генетически модифицированных клеток. В частности, это изобретение относится к способу генетической модификации клетки(клеток) млекопитающего-реципиента ех vivo и введения генетически модифицированных клеток млекопитающему-реципиенту. В соответствии с предпочтительным вариантом осуществления изобретения для генотерапии ех vivo указанные клетки являются аутогенными клетками,то есть клетками, удаляемыми у млекопитающего-реципиента. В используемом здесь значении термин "удаленный" означает клетку или множество клеток, которые были удалены с участка их естественного нахождения in vivo. Способы удаления клеток у пациента и способы сохранения выделенных клеток в культуре хорошо известны специалистам в этой области (Stylianou,E., et al., Kidney Intl. 37:1563-1570 (1992); Hjelle,J.H., et al., Peritoneal Dialysis Intl. 9: 341-347(1992); Di Paolo, N et al., Int. J. Art. Org., 12: 485-501 (1989); Di Paolo, N., et al., Clinical Nephrol., 34: 179-1848 (1990); Di Paolo, N., et al.,Nephron., 57: 323-331 (1991. Все патенты, заявки на патент и публикации, приведенные выше и ниже в разделе "Подробное описание изобретения" включены в это описание изобретения в качестве ссылки."Интерферон" (именуемый также "IFN") является относительно мелким, видоспецифическим, одноцепочечным полипептидом, продуцируемым клетками млекопитающих в ответ на воздействие разных индукторов, таких как вирусы, полипептиды, митогены и тому подобные. Наиболее предпочтительные интерфероны находятся в рекомбинантной форме и способы получения белков на основе рекомбинантной ДНК, включая разные интерфероны, хорошо известны и не ограничивают объем данного изобретения. См., например, патенты США 4399216, 5149636, 5179017 (Axel et al.) и 4470461 (Kaufman). Получены рекомбинантные формы альфа-, бета-, гамма- и консенсусного интерферона. Разные формы интерферона могут быть экспрессированы в клетках, содержащих полинуклеотидные последовательности, кодирующие такие варианты, как мутанты с элиминированным цистеином (например, для бетаинтерферона) или мутанты с элиминированным метионином. Другие модификации могут быть получены с помощью систем посттрансляционного процессинга клетки-хозяина. Поэтому точная химическая структура конкретного интерферона будет зависеть от нескольких факторов и не ограничивает объем этого изобретения. Все интерфероны, входящие в состав описанных 12 здесь композиций, сохраняют свою биологическую активность в приемлемых окружающих условиях. Предпочтительные полинуклеотиды, которые можно использовать при осуществлении способов по настоящему изобретению, выделяют из последовательностей гена интерферона дикого типа разных позвоночных животных,предпочтительно млекопитающих, и получают методами, хорошо известными специалистам в этой области. См., например, патент США 5641656 (выдан 24 июня 1997 г.; ДНК, кодирующая птичий пробелок интерферона типа I и зрелый птичий интерферон типа I), патент США 5605688 (25 февраля 1997 г.; рекомбинантные интерфероны типа I собаки и лошади); патент США 5554513 (10 сентября 1996 г.; последовательность ДНК, кодирующая бета-интерферон 2 А человека); патент США 5541312 (30 июля 1996 г.; ДНК, кодирующая полипептид бета-2 интерферона фибробластов человека); патент США 5231176 (27 июля 1993 г.; молекула ДНК, кодирующая лейкоцитарный интерферон человека); патент США 5071761 (10 декабря 1991 г.; последовательность ДНК, кодирующая субпоследовательности лимфобластоидных интерферонов LуIFN-альфа-2 и LyIFN-альфа-3 человека); патент США 4970161 (13 ноября 1990 г.; последовательность ДНК, кодирующая гамма-интерферон человека); патент США 4738931 (19 апреля 1988 г.; ДНК, содержащая ген бета-интерферона человека); патент США 4695543 (22 сентября 1987 г.; ген Gх-1 альфаинтерферона человека) и патент США 4456748 (26 июня 1984 г.; ДНК, кодирующая субпоследовательности разных природных лейкоцитарных интерферонов). В соответствии с настоящим изобретением можно использовать мутанты генов семейства интерферонов. Мутации полинуклеотидной последовательности интерферона дикого типа получают с помощью обычных методов направленного мутагенеза, которые хорошо известны специалистам в этой области. Термин "мутант" означает также генетические слияния, поэтому все нижеследующие последовательности интерферона, включенные в это описание изобретения в качестве ссылки, следует считать "мутантными" последовательностями: Патент США 5273889 (28 декабря 1993 г.; конструкция ДНК, содержащая ген гаммаинтерферона, связанный с последовательностью,кодирующей иммуногенный лейкотоксин); патент США 4959314 (25 сентября 1990 г., ген с последовательностью ДНК,кодирующей синтетический мутеин биологически активного нативного белка); патент США 4929554 (29 мая 1990 г.; ДНК, кодирующая рекомбинантный иммунный интерферон des-CYSTYR-CTS человека); патент США 4914033 (3 апреля 1990 г., молекула ДНК, кодирующая модифицированный бета-интерферон, включаю 13 щая бета-интерферон) и патент США 4569908 (11 февраля 1986 г.; ДНК, имеющая нуклеотидную последовательность, которая кодирует полипептид многофункционального гибридного интерферона). Кроме того, выделенные полинуклеотиды,описанные в этих патентах, можно перестроить,чтобы получить функционально эквивалентные полинуклеотиды. Полинуклеотид является"функционально эквивалентным" по сравнению с полинуклеотидами вышеуказанных последовательностей, если он удовлетворяет по крайней мере одному из нижеследующих условий:(a) "функциональный эквивалент" является полинуклеотидом, который гибридизуется с любой из вышеуказанных последовательностей в стандартных условиях гибридизации, и/или является вырожденным в отношении любых вышеуказанных последовательностей. Предпочтительнее всего он кодирует мутантный интерферон, обладающий лечебным действием интерферона дикого типа;(b) "функциональный эквивалент" является полинуклеотидом, который кодирует в процессе экспрессии аминокислотную последовательность, закодированную любыми полинуклеотидами вышеуказанных последовательностей интерферона. Коротко говоря, термин "интерферон" включает, но не ограничивается ими, все вышеуказанные вещества, а также их функциональные эквиваленты. В используемом здесь значении термин "функциональный эквивалент" означает белок интерферона или полинуклеотид,кодирующий белок интерферона, который оказывает такое же или лучшее действие на млекопитающего-реципиента, что и интерферон,функциональным эквивалентом которой он является. Как это хорошо известно любому специалисту в этой области, функционально эквивалентный белок можно получить рекомбинантными методами, например путем экспрессии "функционально эквивалентной ДНК". Поэтому в объем настоящего изобретения входят интерфероны, закодированные природными ДНК, а также неприродными ДНК, которые кодируют тот же белок, что и закодированный природной ДНК. Вследствие вырожденности нуклеотида, кодирующего последовательности,для кодирования интерферонов можно использовать другие полинуклеотиды. К ним относятся все или части вышеуказанных последовательностей, которые изменены путем замены разных кодонов, кодирующих тот же аминокислотный остаток в последовательности, в результате чего получают молчащую мутацию. Например,Phe(F) закодирован двумя кодонами, ТТС или ТТТ, Туr (Y) закодирован ТАС или ТАТ, и His(H) закодирован САС или CAT. С другой стороны, Trp (W) закодирован одним кодоном, TGG. Поэтому очевидно, что для данной последовательности ДНК, кодирующей конкретный ин 003256 14 терферон, существует много вырожденных последовательностей ДНК, способных кодировать этот интерферон. Все эти вырожденные последовательности ДНК входят в объем настоящего изобретения. Консенсусный интерферон также входит в это определение. В используемом здесь значении термин "консенсусный интерферон" означает неприродный полипептид, который, в основном, включает такие аминокислотные остатки, которые являются общими для последовательностей всех подтипов природного интерферона человека и содержат в одном или нескольких положениях, где отсутствует аминокислота,общая для всех подтипов, аминокислоту, которая встречается, главным образом, в этом положении, и ни в коем случае не содержат любой аминокислотный остаток, который не встречается в этом положении по крайней мере у одного природного подтипа. Последовательности консенсусного интерферона включают консенсусные последовательности любых вышеуказанных интерферонов при условии, что они имеют последовательности подтипов. Типичные консенсусные интерфероны описываются в патентах США 4695623 и 4897471 (Amgen). Последовательности ДНК, кодирующие консенсусный интерферон, могут быть синтезированы так, как это описано в этих патентах, или другими стандартными методами. Полипептиды консенсусного интерферона предпочтительно являются продуктами экспрессии сконструированных последовательностей ДНК, трансформированных или трансфицированных в хозяева,как указано в этом описании изобретения. То есть консенсусный интерферон предпочтительно получают рекомбинантным методом. Такие материалы могут быть очищены методами, хорошо известными в этой области. Вышеописанные интерфероны и условия,пригодные для терапии путем замены гена приведены в иллюстративных целях и не ограничивают объем настоящего изобретения. Приемлемый интерферон для лечения известного заболевания может быть выбран специалистом в этой области без излишнего экспериментирования.III. Способы введения полинуклеотидных последовательностей секретируемых белков в клетки. Термин "трансформация" или "трансформировать" означает любую генетическую модификацию клеток и включает как "трансфекцию",так и "трансдукцию". В используемом здесь значении термин"трансфекция клеток" означает приобретение клеткой нового генетического материала путем введения добавленной ДНК. Таким образом,трансфекция относится к введению нуклеиновой кислоты (например, ДНК) в клетку с использованием физических или химических методов. Специалистам в этой области известны(см. выше); катионную трансфекцию, опосредованную липосомами (см. выше); и бомбардировку микрочастицами, стимулируемую частицами вольфрама (Johnston, S.A., Nature, 346: 776-777 (1990; и копреципитацию ДНК и фосфата стронция (Brash D.E. et al., Molec. Cell.Biol., 7: 2031-2034 (1987). Все эти методы хорошо известны в этой области. В отличие от этого термин "трансдукция клеток" означает методику переноса нуклеиновой кислоты в клетку с использованием вирусов, содержащих ДНК или РНК. В хромосому трансдуцированной клетки можно включить одну или несколько выделенных полинуклеотидных последовательностей, кодирующих один или несколько белков интерферона, содержащихся в вирусе. Альтернативно клетку трансдуцируют вирусом, но эта клетка не должна иметь выделенного полинуклеотида в своих хромосомах, при этом она должна быть способна экспрессировать интерферон в клетке вне хромосом. В соответствии с одним вариантом осуществления изобретения клетки трансформируют(то есть генетически модифицируют) ех vivo. Клетки выделяют из организма млекопитающего (предпочтительно человека) и трансформируют (то есть трансдуцируют или трансфицируют in vitro) вектором, содержащим выделенный полинуклеотид, в частности рекомбинантный ген, оперативно связанный с одной или несколькими контролирующими экспрессию последовательностями, для экспрессии рекомбинантного секретируемого белка (например,интерферона). Затем эти клетки вводят млекопитающему-реципиенту для доставки белка insitu. Млекопитающее-реципиент предпочтительно является человеком и модифицируемые клетки являются аутогенными клетками, то есть клетками, выделенными у млекопитающегореципиента. Методы выделения и культивирования клеток in vitro всесторонне описаны в научной литературе. В соответствии с другим вариантом осуществления изобретения клетки трансформируют или каким-либо другим образом генетически модифицируют in vivo. Клетки млекопитающего-реципиента (предпочтительно человека) трансформируют (то есть трансдуцируют или трансфицируют) in vivo вектором, содержащим выделенный полинуклеотид, в частности рекомбинантный ген, оперативно связанный с одной или несколькими контролирующими экспрессию последовательностями, для экспрессии секретируемого белка (то есть рекомбинантного 16 интерферона) с последующей доставкой этого белка in situ. Выделенные полинуклеотиды, кодирующие сектерируемый белок (например, кДНК,кодирующая один или несколько белков лечебного интерферона), вводят в клетку ех vivo илиin vivo методами генетического переноса, такими как трансфекция или трансдукция, с целью получения генетически модифицированной клетки. Специалистам в этой области известны разные экспрессирующие векторы (то есть векторы, облегчающие доставку выделенного полинуклеотида в клетку-мишень). Введенный генетический материал обычно включает выделенный полинуклеотид, такой как ген интерферона (обычно в форме кДНК,включающей экзоны, кодирующие интерферон),вместе с промотором, контролирующим транскрипцию нового гена. Указанный промотор обычно имеет специфическую нуклеотидную последовательность, необходимую для инициации транскрипции. Генетический материал может необязательно включать интроны, которые необходимо удалить из зрелого транскрипта сплайсингом РНК. Сигнал полиаденилирования должен присутствовать в 3'-концевой части экспрессируемого гена. Введенный генетический материал может также включать соответствующую "сигнальную" последовательность секреции для секреции лекарственного генного продукта (то есть интерферона) из клетки во внеклеточную среду. Необязательно выделенный генетический материал может включать дополнительные последовательности (то есть энхансеры), необходимые для достижения требуемой активности транскрипции гена. В соответствии с поставленными целями "энхансер" является любой нетранслированной последовательностью ДНК,которая связана с кодирующей последовательностью (в цис-положении), с изменением исходного уровня транскрипции, определяемого промотором. Выделенный генетический материал предпочтительно вводят в геном клетки непосредственно ниже промотора, так что промотор и кодирующая последовательность оказываются оперативно связанными, в результате чего достигается транскрипция кодирующей последовательности. Предпочтительные вирусные экспрессирующие векторы включают экзогенный промотор, контролирующий транскрипцию вставленного гена интерферона. Такие экзогенные промоторы включают как конститутивные,так и индуцибельные промоторы. Природные конститутивные промоторы контролируют экспрессию белков, регулирующих основные функции клеток. В результате этого ген, контролируемый конститутивным промотором, экспрессируется во всех условиях роста клетки. Типичными конститутивными промоторами являются промоторы для следую 17 щих генов, кодирующих определенные конститутивные или "внутренние" функции: гипоксантин-фосфорибозилтрансфераза (HPRT), дигидрофолат-редуктаза (DHFR) (Scharfmann et al.,Proc. Natl. Acad. Sci. USA, 88: 4626-4630 (1991,аденозиндезаминаза,фосфоглицеролкиназаSci. USA, 86: 10006-10010 (1989 и другие структурные промоторы, известные специалистам в этой области. Кроме того, многие вирусные промоторы выполняют конститутивную функцию в эукариотических клетках. Эти промоторы включают: ранние и поздние промоторы SV40 (см. Bernoist and Chambon, Nature, 290:304 (1981; длинные концевые повторы (LTR) вируса лейкоза Молонея и других ретровирусов (см. WeissLaboratory, Cold Spring Harbor, NY (1985; промотор тимидинкиназы вируса простого герпесаUSA, 78: 1441 (1981; самый ранний промотор цитомегаловируса (IE1) (см. Karasuyama et al., J.Exp. Med., 169: 13 (1989); промотор вируса саркомы Рауса (RSV) (Yamamoto et al., Cell, 22:787(1980; главный поздний промотор аденовируса(Yamada et al., Proc. Nat. Acad. Sci. USA, 82: 3567 (1985 и многие другие. Поэтому любые вышеуказанные конститутивные промоторы можно использовать для контроля транскрипции генной вставки. (См. также раздел В). Если ген интерферона должен быть доставлен к конкретным тканям, весьма желательно произвести целенаправленную экспрессию этого гена. Например, в научной литературе описано много промоторов, которые экспрессируются только в определенных тканях. Примерами таких промоторов являются печень-специфические промоторы вируса гепатита В (Sandig etal., Gene Therapy, 3: 1002-1009 (1996 и ген альбумина (Pinkert et al., Genes and Development, 1: 268-276 (1987; см. также Guo et al., Gene Therapy, 3: 802-810 (1996) для ознакомления с еще одним печень-специфическим промотором. Кроме того, в научной литературе описано много промоторов, которые экспрессируются только в специфических опухолях. Примерами таких промоторов являются промотор PSA (рак предстательной железы), промотор карциноэмбрионального антигена (рак толстой кишки и легкого), промотор -казеина (рак молочной железы), промотор тирозиназы (меланома),промотор кальцинеурина A (глиома, нейробластома), c-sis промотор (остеосаркома) и промотор -фетопротеина (гепатома). Гены, контролируемые индуцируемыми промоторами, экспрессируются только или главным образом в присутствии индуцирующего агента (например, транскрипция под контролем промотора металлотионеина значительно 18 усиливается в присутствии определенных ионов металла). См. также глюкокортикоид-индуцируемый промотор, присутствующий в длинном концевом повторе вируса опухоли молочной железы мышей (MMTV LTR) (Klessig et al., Mol.Cell. Biol., 4: 1354 (1984. Индуцируемые промоторы включают реактивные элементы (RE),которые стимулируют транскрипцию тогда, когда связаны их индуцибельные факторы. Например, существуют реактивные элементы для сывороточных факторов, стероидных гормонов,ретиноевой кислоты и циклического АМФ. Можно выбрать промоторы, содержащие определенный реактивный элемент, чтобы получить индуцибельную реакцию, и в некоторых случаях можно сам реактивный элемент присоединить к другому промотору, что позволяет сообщить индуцибельность рекомбинантному гену. Таким образом, выбирая соответствующий промотор (конститутивный или индуцибельный; сильный или слабый), можно контролировать как наличие, так и уровень экспрессии интерферона в генетически модифицированной клетке. Если ген, кодирующий интерферон, контролируется индуцибельным промотором, доставка интерферона in situ запускается тогда, когда генетически модифицированная клетка in situ оказывается в условиях, делающих возможной транскрипцию интерферона, например путем инъецирования специфических индукторов индуцибельных промоторов, которые контролируют транскрипцию данного агента. Например,экспрессия in situ генетически модифицированными клетками белка интерферона, закодированного геном интерферона, под контролем промотора металлотионеина усиливается в результате контактирования in situ генетически модифицированных клеток с раствором, содержащим соответствующие (то есть индуцибельные) ионы металла. Недавно были разработаны очень сложные системы, которые позволяют точно регулировать экспрессию гена экзогенно введенными мелкими молекулами. К этим системам относятся FК 506/рапамициновая система (Rivera etet al., Proc. Nat. Acad. Sci. USA, 93: 3346-3351,1996) и прогестероновая система (Wang et al.,Nature Biotechnology, 15: 239-243, 1997). Таким образом, количество интерферона,доставляемое in situ, регулируется путем контролирования таких факторов, как(1) тип промотора, используемого для прямой транскрипции введенного гена (то есть является ли промотор конститутивным или индуцибельным, сильным или слабым, либо тканеспецифическим);(2) количество копий экзогенного гена,введенного в клетку; (3) количество трансдуцированных/трансфицированных клеток, введен 19 ных (например, имплантированных) пациенту;(4) размер имплантата (например, имплантат или инкапсулированная экспрессирующая система) при осуществлении методов ex vivo; (5) количество имплантатов при осуществлении методов ex vivo; (6) количество трансдуцированных/трансфицированных клеток при введении in vivo; (7) продолжительность нахождения трансдуцированных/трансфицированных клеток или имплантатов в организме при осуществлении методов ех vivo и in vivo; и (8) скорость продуцирования интерферона генетически модифицированной клеткой. Специалисты в этой области могут выбрать и оптимизировать эти факторы для доставки терапевтически эффективной дозы конкретного интерферона без излишнего экспериментирования, приняв во внимание вышеуказанные факторы и клиническую карту пациента. Так как белок, экспрессированный в соответствии с нашими методами гемотерапии, является секретируемым белком, окружающие клетки, не содержащие вектор для генотерапии,все же подвергаются воздействию (см. примеры). Исходя из этого, способы по настоящему изобретению обычно не требуют использования селективного гена. Тем не менее, помимо, по крайней мере, одного промотора и, по крайней мере, одного выделенного полинуклеотида, кодирующего интерферон, экспрессирующий вектор может необязательно включать селективный ген, например ген устойчивости к неомицину,для облегчения выбора клеток, которые были трансфицированы или трансдуцированы экспрессирующим вектором. Альтернативно, клетки трансфицируют двумя или более экспрессирующими векторами, из которых, по крайней мере, один вектор содержит ген(ы), кодирующий интерферон(ы), а другой вектор содержит селективный ген. Специалист в этой области может легко выбрать требуемый промотор, энхансер, селективный ген и/или сигнальную последовательность (описанные ниже) без излишнего экспериментирования.IV. Способы получения специфических векторов для генотерапии. Можно использовать любые известные в этой области методы вставки полинуклеотидных последовательностей в вектор. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory,Cold Spring Harbor, NY (1989) и Ausubel et al.,Current Protocols in Molecular Biology, J. WileySons, NY (1992). Типичные векторы включают приемлемые сигналы, контролирующие транскрипцию/трансляцию, которые оперативно связаны с полинуклеотидной последовательностью конкретного интерферона. Для контроля экспрессии интерферонов можно также использовать промоторы/энхансеры. (См. раздел III). Экспрессирующие векторы, совместимые с клетками-хозяевами млекопитающего и предна 003256 20 значенные для генотерапии опухолевых клеток,включают, например, плазмиды; ретровирусные векторы птиц, мышей и человека; аденовирусные векторы; векторы на основе вируса герпеса; парвовирусы и нерепликативные поксвирусы. В частности, рекомбинантные вирусы с дефектом репликации можно получить в линиях упаковочных клеток, которые продуцируют только вирусы с дефектом репликации. См. Current(Ausubel et al., eds.). Green Publishing Associates,1989. Специфические вирусные векторы, предназначенные для использования в системах переноса гена хорошо известны. См., например:(1984) (ретровирус); Miller et al., Nature, 357: 455-450 (1992) (ретровирус); Anderson, Science,256: 808-813 (1992) (ретровирус). Предпочтительные векторы являются ДНК-содержащими вирусами, которые включают аденовирусы (предпочтительно векторы на основе Ad-2 или Ad-5), вирусы герпеса (предпочтительно векторы на основе вируса простого герпеса) и парвовирусы (предпочтительно векторы на основе "дефектного" или неавтономного парвовируса, более предпочтительно векторы на основе аденоассоциированного вируса и наиболее предпочтительно векторы на основе AAV2). См., например, Ali et al., Gene Therapy, 1: 367-384, 1994; патенты США 4797368 и 5399346 и нижеследующие описания. Выбор конкретной векторной системы, например для переноса последовательности интерферона, зависит от ряда факторов. Одним важным фактором является тип популяции клеток-мишеней. Хотя ретровирусные векторы всесторонне исследованы и использованы в ряде генотерапевтических применений, они обычно не подходят для инфицирования клеток, которые не делятся, но могут быть полезны при лечении злокачественной опухоли, так как они интегрируют и экспрессируют свои гены только в реплицирующихся клетках. Они применимы в методах ex vivo и привлекательны в этом отношении благодаря устойчивой интеграции в геном клетки-мишени. Аденовирусы являются эукариотическими ДНК- содержащими вирусами, которые могут быть модифицированы для эффективной доставки лекарственного или репортерного транс 21 гена в разные типы клеток. В настоящее время разрабатываются методы использования обычных аденовирусов типов 2 и 5 (соответственноAd2 и Ad5), вызывающих респираторное заболевание человека, для генотерапии псевдогипертрофической миопатии Дюшенна (DMD) и муковисцидоза (CF). Ad2 и Ad5 относятся к подклассу аденовирусов, которые не ассоциированы со злокачественными опухолями человека. Аденовирусные векторы способны обеспечивать исключительно высокие степени доставки трансгена фактически во все типы клеток независимо от митотического состояния. Высокие титры (1011 бляшкообразующих единиц/мл) рекомбинантного вируса можно легко получить в клетках 293 (линия трансформированных аденовирусом, комплементарных эмбриональных клеток почки человека: АТСС CRL1573), при этом их можно хранить в криостате в течение длительных периодов времени без существенных потерь. Эффективность этой системы в отношении доставки лечебного трансгена in vivo,уравновешивающего генетический дисбаланс,продемонстрирована на животных моделях разных заболеваний. См. Y. Watanabe, Atherosclerosis, 36: 261-268 (1986); K. Tanzawa et al., FEBS(1994). Рекомбинантный аденовирус с дефектом репликации, кодирующий кДНК для трансмембранного регулятора муковисцидоза (CFTR) действительно был использован в нескольких клинических испытаниях с участием больных муковисцидозом. См., например, J. Wilson, Nature, 365: 691-692 (21 октября 1993 г.). Дальнейшим подтверждением безопасности рекомбинантных аденовирусов для генотерапии должно стать широкомасштабное опробование живых вакцин из аденовируса для вакцинации населения. Аденовирусы человека включают геном с линейной двухцепочечной ДНК длиной 36 т.п.н., который разделен на 100 единиц генетической карты, длина каждой из которых равна 360 п.н. ДНК содержит короткие инвертированные концевые повторы (ITR) с каждого конца генома, которые необходимы для репликации вирусной ДНК. Генные продукты расположены в ранних (с E1 no E4) и поздних (с L1 no L5) областях на основании экспрессии до или после инициации синтеза вирусной ДНК. См., например, Horwitz, Virology, 2d edit., ed. В.N. Fields,Raven Press Ltd., New York (1990). Геном аденовируса выполняет строго отрегулированную программу в течение всего своего нормального жизненного цикла. См. Y.Yang et al., Proc. Natl. Acad. Sci. USA, 91: 44074411 (1994). Вирионы интернализируются клетками и проникают в эндосому, оттуда вирус проникает в цитоплазму и начинает терять свою 22 белковую оболочку. ДНК вириона мигрирует к ядру, где она сохраняет свою внехромосомную линейную структуру, а не интегрируется в хромосому. Самые ранние гены, Е 1 а и E1b, экспрессируются в ядре. Эти ранние генные продукты регулируют транскрипцию аденовируса,поэтому они необходимы для репликации вируса и экспрессии целого ряда генов хозяев (которые служат затравкой, заставляющей клетку продуцировать вирус) и занимают центральное место в каскадной активации отсроченных ранних генов (например, Е 2, Е 3 и E4), за которыми следуют поздние гены (например, L1-L5). Рекомбинантные аденовирусы с дефектом репликации первого поколения, сконструированные для генотерапии, имеют делеции всей Е 1 а и части E1b областей. Этот вирус с дефектом репликации выращивают в клетках 293,которые содержат функциональную область Е 1 аденовируса, обеспечивающую получение белков транс-E1, что делает возможной репликацию аденовируса с делецией Е 1. Полученный вирус способен инфицировать многие типы клеток и может экспрессировать введенный ген(при условии, что он несет промотор), но не может реплицироваться в клетке, которая не несет ДНК области Е 1. Преимуществом рекомбинантных аденовирусов является то, что они имеют много разных хозяев, могут инфицировать покоящиеся или дифференцированные в конечной области клетки, такие как нейроны, и практически не являются онкогенными. Аденовирусы, по-видимому, не интегрируются в геном хозяина. Поскольку они существуют вне хромосомы, риск инсерционного мутагенеза значительно уменьшается. Рекомбинантные аденовирусы продуцируют очень высокие титры, при этом вирусные частицы являются умеренно устойчивыми, достигаются высокие уровни экспрессии и таким образом можно инфицировать большое количество клеток. Аденоассоциированные вирусы (AAV) также были использованы в качестве векторов для соматической генотерапии. AAV является мелким вирусом, содержащим одноцепочечную ДНК, с простой геномной организацией (4,7 т.п.н.), что делает его идеальным субстратом для технологии получения рекомбинантных ДНК. Две открытые рамки считывания кодируют ряд rep- и сар-полипептидов. Repполипептиды (rер 78, rер 68, rер 62 и rер 40) участвуют в репликации, сохранении и интеграции генома AAV. Сар-белки (VP1, VP2 и VP3) образуют капсид вириона. Открытые рамки считывания rер- и сар-полипептидов в 5'- и 3'концевых областях фланкированы инвертированными концевыми повторами длиной 145 п.н.(ITR), из которых первые 125 п.н. способны образовывать Y- или Т-образные дуплексные структуры. Важное значение для конструирования векторов AAV имеет то, что все rep- и capдомены можно вырезать и заменить лекарствен 23 ным или репортерным трансгеном. См. В.J.Carter, in Handbook of Parvoviruses, ed., P. Tijsser, CRC Press, pp. 155-168 (1990). Установлено, что инвертированные концевые повторы представляют собой минимальную последовательность, необходимую для репликации, сохранения, упаковки и интеграции генома AAV.AAV имеет двухфазный жизненный цикл,состоящий из латентных и литических эпизодов. Во время латентного инфицирования вирионыAAV проникают в клетку в виде инкапсидированной одноцепочечной ДНК и вскоре после этого переносятся в ядро, где ДНК AAV устойчиво интегрируется в хромосому хозяина, не требуя деления клетки-хозяина. При отсутствии вируса-помощника интегрированный геномAAV остается латентным, но он может быть активирован и сохранен. Литическая фаза жизненного цикла начинается тогда, когда клетка,несущая провирус AAV, повторно инфицируется вирусом герпеса или аденовирусом, кодирующим функции вируса-помощника, которые необходимы AAV для его вырезания из хроматина хозяина (В.J. Carter, см. выше). Инфицирование родительской одноцепочечной ДНК распространяется на ДНК дуплексной репликативной формы (RF) rep-зависимым образом. Сохраненные геномы AAV упаковываются в предварительно образованные белковые капсиды(двадцатигранная симметрия с диаметром примерно 20 нм) и выделяются в виде инфекционных вирионов, которые содержат упакованные + или -геномы одноцепочечной ДНК после лизиса клеток. Использование AAV связано с большими перспективами в генотерапии. Вирусные частицы являются очень устойчивыми и рекомбинантные AAV (rAAV) обладают хорошими "лекарствоподобными" характеристиками, выражающимися в том, что rAAV можно очищать путем осаждения центрифугированием или расслоения градиентом CsCl. Они являются термостойкими, могут быть лиофилизованы с образованием порошка и регидратированы с сохранением активности в полном объеме. Их ДНК устойчиво интегрируется в хромосомы хозяина,поэтому экспрессия является долговременной. Они имеют широкий диапазон хозяев, при этомAAV не вызывает известных заболеваний, так что рекомбинантные векторы не являются токсичными. Установлено, что высокая экспрессия гена из AAV у мышей происходит в течение по крайней мере 1,5 лет. См. Xiao, Li and Samulski,(1996) Journal of Virology, 70, 8089-8108. Так как нет данных, свидетельствующих о вирусной токсичности или иммунной реакции клеткихозяина, можно сделать вывод о том, что в настоящее время преодолены эти ограничения,относящиеся к вирусной генотерапии. 24 148-153, описали продолжительную (до 4 месяцев) экспрессию тирозингидроксилазы в головном мозгу крыс после прямой внутричерепной инъекции с использованием вектора AAV. Это метод может быть весьма перспективным для лечения болезни Паркинсона у людей. Экспрессия была очень эффективной и вирус был безопасным и устойчивым.Fisher et al., (Nature Medicine, (1997) 3, 306312) сообщили об устойчивой экспрессии гена у мышей после внутримышечной инъекции AAV. В этом случае вирус также был безопасным. Никакой клеточной или гуморальной иммунной реакции не было обнаружено против этого вируса или чужеродного генного продукта.Kessler et al., (Proc. Natl. Acad. Sci. USA,(1996) 93, 14082-14087) сообщили о высокой экспрессии гена эритропоэтина (Еро) после внутримышечной инъекции AAV мышам. Было установлено, что белок Еро присутствует в кровотоке, при этом было отмечено увеличение эритроцитов, что свидетельствует о лечебном потенциале этого метода. В другом исследовании, выполненном тем же коллективом исследователей, был использован AAV, экспрессирующий ген tk HSV, для лечения злокачественных опухолей. Была обнаружена высокая экспрессия гена в солидных опухолях. Недавно было продемонстрировано, что рекомбинантный бакуловирус, выделенный из бакуловируса Autographa californica, который является вирусом множественного ядерного полиэдроза (AcMNPV), способен трансдуцировать клетки млекопитающих in vitro. (См. Hofmann, С., Sandig, V., Jennings, G., Rudolph, M.,Schlag, P. and Strauss, M. (1995), "Efficient gene"Baculovirus-mediated gene transfer into mammalian cells", Proc. Natl. Acad. Sci. USA, 93,2348-2352). Рекомбинантный бакуловирус обладает несколькими важными преимуществами для генотерапии. Такими преимуществами являются возможность вставки очень большой ДНК, отсутствие предшествующей иммунной реакции у человека, отсутствие репликации у млекопитающих, отсутствие токсичности у млекопитающих, отсутствие экспрессии вирусных генов в клетках млекопитающих из-за специфичности к насекомым транскрипционных промоторов бакуловируса и, вероятно, отсутствие цитотоксической реакции Т-лимфоцитов, направленной против этих вирусных белков.V. Испытание на эффективность и идентификация интерферонов. Полинуклеотиды интерферона вводят в клетку при помощи экспрессирующего вектора. Обычно эффективность данного вектора для генотерапии при определенном состоянии клетки и метаболизм испытывают, анализируя: (i) 25 изменения морфологии клетки; (ii) подавление пролиферации клеток и (iii) антивирусное действие. Чтобы выбрать и оптимизировать определенный экспрессирующий вектор, предназначенный для экспрессии специфического генного продукта интерферона в выделенной клетке,получают ген интерферона, предпочтительно имеющий одну или несколько приемлемых контролирующих областей (например, промотор); создают векторную конструкцию, содержащую вектор со вставкой гена интерферона; трансфицируют или трансдуцируют культивируемые клетки in vitro этой векторной конструкцией; и определяют наличие продукта интерферона в культивируемых клетках. Результат трансфекции полинуклеотидами,кодирующими интерфероны, можно проверитьin vitro, используя любую имеющуюся линию опухолевых клеток человека. К таким клеткам относятся линии клеток злокачественной опухоли мочевого пузыря человека, 5637 (АТСС НТВ 9), линии клеток злокачественной опухоли молочной железы человека, MDA-MB-468(АТСС НТВ 132); линия клеток злокачественной опухоли предстательной железы человека, DU 145 (АТСС НТВ 81); линия клеток остеосаркомы человека, SAOS2 (АТСС НТВ 85); линия клеток фибросаркомы с метастазами, переходящими в злокачественную опухоль легкого человека,Hs913T (ATCC HTB152); линия клеток злокачественной опухоли шейки матки человека, HeLa(ATCC ECL2). Все эти линии клеток могут быть трансфицированы соответствующими полинуклеотидами, кодирующими интерферон, и результат трансфекции на рост и морфологию клеток можно испытать с помощью методов,известных в этой области, таких как метод исключения трипана голубого для измерения жизнеспособности клеток, подсчет клеток для измерения их размножения с течением времени и включения меченого тритием тимидина для измерения репликации ДНК. Влияние секретируемого белка на окружающие клетки, которые не содержат вирусного вектора с соответствующими полинуклеотидами, кодирующими белок, можно легко испытать при помощи методов, описанных в примере 3. После введения в клетку-мишень последовательности интерферона можно идентифицировать обычными методами, такими как гибридизация нуклеиновой кислоты с использованием зондов, содержащих последовательности, которые являются гомологичными/комплементарными вставленным последовательностям мутантного интерферона. Транскрипцию интерферона можно измерить с помощью полимеразной цепной реакции с применением обратной транскриптазы. Альтернативно, белок интерферона измеряют в кондиционированной клетками среде при помощи обычного антивирусного анализа или твердофазного иммуноферментного ана 003256 26 лиза (ELISA). В соответствии с другим подходом одну или несколько последовательностей можно идентифицировать по наличию или отсутствию функции "маркерного" гена (например, активность тимидинкиназы, устойчивость к антибиотику и тому подобные), вызываемой введением экспрессирующего вектора в клеткумишень. Например, если полинуклеотид, кодирующий бета-интерферон 1 а, вставлен в вектор,имеющий доминантный селективный маркерный ген, такой как ген неомицинфосфотрансферазы, отдельно контролируемый ранним промотором SV40, последовательность можно идентифицировать по наличию функции маркерного гена (устойчивость к генетицину). Другие методы обнаружения соответствующего вектора также хорошо известны специалистам в этой области.VI. Полезность. А. Интерфероны и инфекционные заболевания. Интерфероны используют для лечения бактериальных, грибковых и вирусных инфекций. Вирусы гриппа и везикулярного стоматита(VSV) особенно чувствительны к подавлению интерферонами и часто используются в анализах для определения активности интерферона и в исследованиях, выполняемых на основе механизма антивирусной активности интерферона. Другие вирусы, которые являются патогенами человека и, по-видимому, чувствительны к интерферонам, включают вирус гепатита В (HBV),вирус гепатита С (HCV), вирус гепатита D, вирус папилломы человека, вирус простого герпеса, вирус опоясывающего герпеса, цитомегаловирус (CMV), вирус ринита и вирус энцефаломиокардита. Гепатит является одним из наиболее перспективных заболеваний для генотерапии. Вирусный гепатит, то есть заболевание печени,вызываемое многими вирусами, является главной проблемой здравоохранения во всем мире. В настоящее время выделены и клонированы пять разных вирусов гепатита человека. Это вирусы гепатита А, В, С, D и Е. Некоторые случаи острого и хронического вирусного гепатита,по-видимому, ассоциированы с еще малоизученными вирусами гепатита, такими как недавно открытый вирус гепатита G. Наиболее широко распространены вирусы А, В и С. Помимо острого и хронического поражения и воспаления печени инфекционные заболевания, вызванные вирусами HBV и HCV, могут привести к возникновению злокачественной гепатомы. Интерфероны продемонстрировали достаточно эффективное действие in vivo против HBV иHCV, а также против гепатита D и гепатита А в культуре клеток. Вирусный гепатит можно лечить введением гена интерферона. Предпочтительными клетками для введения этого гена являются гепатоциты в печени. Хотя в этом случае можно 27 использовать метод генотерапии ex vivo (например, путем эксплантации клеток печени,введения полинуклеотида, экспрессирующего интерферон, и последующей трансплантации этих клеток пациенту), более предпочтительным методом является доставка гена in vivo. Ген инъецируют в воротную вену печени при помощи хирургической операции или вводят через катетер в печеночную артерию. Широко применяется менее инвазивный метод, такой как внутривенная инъекция. Ген интерферона контролируется транскрипционным промотором в приемлемом экспрессирующем векторе. Транскрипционный промотор по своей природе может быть клеточным или вирусным (CMV, SV40, RSV и т.д.). Для достижения специфической экспрессии гена в печени предпочтительно используют гепатоцитспецифический клеточный промотор, такой как энхансер/промотор альбумина, промотор 1-антитрипсина или энхансер/промоторHBV. В научной литературе описано много печень-специфических промоторов (см. выше). Кроме того, можно сконструировать вектор, в котором ген интерферона экспрессируется только в клетках, инфицированных гепатитом. Например, экспрессия гена интерферона может быть индуцирована фактором транскрипции НВх HBV, который присутствует только в HBV-инфицированных гепатоцитах. Помимо этого, можно использовать системуноситель. Система доставки может иметь невирусное происхождение; с этой целью можно использовать катионные липосомы или конъюгаты белка:ДНК (конъюгаты ДНК с азиалогликопротеинами можно доставить в печень путем связывания с рецептором азиалогликопротеина на гепатоцитах). Однако в настоящее время наиболее эффективные системы доставки гена имеют вирусное происхождение. Рекомбинантные ретровирусы используются для доставки генов в гепатоциты человека ех vivo. Животные модели показывают, что рекомбинантные аденовирусы могут очень эффективно локализоваться в печени после внутривенного введения in vivo. Примерно 98% аденовирусов, введенных внутривенно, локализуются в печени. Очевидно, что рекомбинантный аденоассоциированный вирус (rAAV) может также инфицировать печень после введения in vivo. Можно использовать и другие типы вирусов,такие как альфа-вирусы, лентивирусы или другие вирусы млекопитающих. Недавно было обнаружено, что вирус немлекопитающего, в частности бакуловирус, специфический для насекомых, способен эффективно доставлять и экспрессировать гены в гепатоцитах (Hofman et al.,1995; Boyce and Bucher, 1996, см. выше). Например, рекомбинантные аденовирусы можно использовать для доставки гена интерферона in vivo. Аденовирусы с дефектом репли 003256 28 кации были сконструированы несколькими коллективами исследователей. Первое поколение таких вирусов является дефектным из-за делеции области E1. Этот дефект комплементируется в линии клеток 293, которая экспрессирует область Е 1 аденовируса. Желательно использовать рекомбинантный аденовирус, который в большей степени поврежден делецией генов Е 1,Е 2 а и/или Е 4. Все эти удаленные функции могут быть экспрессированы в линии упаковочных клеток. Ген интерферона вводят внизу от любого большого количества промоторов (например,самый ранний промотор CMV, длинный концевой повтор RSV, промотор клеточного актина,энхансер/промотор альбумина и другой печеньспецифический промотор). Этот генный кластер вводят в вектор на основе рекомбинантного аденовируса вместо одного из удаленных генов,таких как Е 1, с целью создания вектора переноса аденовируса. Рекомбинантные аденовирусы, имеющие ген интерферона, получают прямым лигированием или гомологичной рекомбинацией после трансфекции упаковочных клеток стандартными методами. Штамм рекомбинантного вируса,имеющего ген интерферона, несколько раз подвергают гемолитической очистке и затем продуцируют в большом объеме в упаковочных клетках. Вирус можно очищать путем расслоения CsC1, хроматографией на колонках или другими методами и затем титровать на упаковочных клетках. В научной литературе подробно описаны методы получения аденовирусов с дефектом в Е 1 и Е 2 а (Engelhardt et al., Proc. Nat.Acad. Sci. USA, 91: 6196-6200, 1994) и аденовирусов с дефектом в Е 1 и Е 4 (Gao et al., J. Virology,70: 8934-8943, 1996). Методы получения аденовирусов с дефектом в Е 1 представлены в работеGraham, F.L. and L. Prevec, "Methods for Construction of Adenovirus Vectors", Mol. Biotech., 3: 207-220 (1995. Следует произвести испытание разных доз вирусов. Доза вируса, по-видимому, составляет от 107 бляшкообразующих единиц (БОЕ) до 1012 БОЕ. При необходимости вирус можно вводить повторно (например, один раз в месяц в течение 1-6 месяцев). Гуморальная иммунная реакция,возникающая в результате повторного введения вируса, может ограничить эффективность повторного введения. В этом случае вместе с вирусом можно ввести иммуносупрессор, такой как циклоспорин или антитело, против лигандаCD40. Эффект генотерапии интерфероном против вирусного гепатита можно испытать на животных моделях (см. раздел С). Например, существует много животных моделей, используемых для испытания вируса гепатита В. Такими животными являются сурки, утки, тупайи, крысы и мыши. В качестве животных моделей HBV можно использовать мышей, которые имеют трансген для HBV и устойчиво реплицируют 29 ДНК HBV в печени, что ведет к постоянному продуцированию вируса HBV в кровотоке. При исследовании HCV в качестве животной модели можно использовать шимпанзе. Аденовирус,имеющий ген интерферона, можно вводить прямо в печень или в виде внутривенной инъекции. Чтобы определить эффективность лечения,осуществляют контроль за репликацией вирусной ДНК вирусными частицами в кровотоке,ферментами печени (ALT), патологией и воспалением печени. В. Злокачественные опухоли. Установлено, что белки интерферона обладают антионкогенным действием в случае многих злокачественных опухолей. Для ознакомления с исследованиями в этой области см.Wadler and Schwartz, Cancer Research, 50: 34733486, 1990; Martin-Odegard, DNP, 4: 116-117,1991; и Spiegel, Seminars in Oncology, 15(5): 4145, 1988. Лечение альфа-интерфероном и бетаинтерфероном оказалось эффективным в случае нескольких видов злокачественных опухолей. Генотерапию можно проводить отдельно или в сочетании с обычными методами, такими как хирургическое вмешательство, лучевая терапия или химиотерапия. Нижеследующий список злокачественных опухолей, подлежащих лечению генотерапией, является весьма неполным, и вполне вероятно, что генотерапия интерфероном может дать положительные результаты в целом ряде злокачественных опухолей, не вошедших в этот список. Злокачественные глиомы составляют 6080% всех первичных опухолей головного мозга у взрослых. Клетки глиомы человека можно имплантировать интрацеребрально мышам nude с иммунодефицитом для получения модели глиомы. Установлено, что лечение белком бетаинтерферона повышает выживаемость этих мышей. В испытаниях по лечению глиомы бетаинтерфероном возникает проблема высокой токсичности, вызываемой парентеральным введением (внутривенным или внутримышечным) бета-интерферона. Локализованная доставка гена бета-интерферона в головной мозг, например, во время хирургической операции может обеспечить долговременное продуцирование бета-интерферона в головном мозгу без возникновения побочных эффектов, имеющих место после системного введения белка. Меланома является очень перспективным заболеванием для генотерапии интерфероном. Прогноз метастатической злокачественной меланомы является неблагоприятным. Заболеваемость меланомой постоянно возрастает и ее лечение обычными методами химиотерапии оказывается неэффективным. Меланома, повидимому, является опухолью иммуногенного типа, поэтому реакция пациента может зависеть от иммунной реакции хозяина. В этом случае эффективный результат может дать как антипролиферативное, так и иммуномодулирующее 30 действие бета-интерферона. Мы убедились в том, что белок бета-интерферона оказывает прямое антипролиферативное действие на культивируемые клетки злокачественной меланомы. Гемангиома - это пролиферация капиллярного эндотелия, ведущая к отложению тучных клеток, фибробластов и макрофагов и в конечном счете вызывающая поражение ткани. Хотя гемангиомы обычно являются безвредными, они могут поражать жизненно важные органы и быть причиной летального исхода. Установлено, что белок альфа-интерферона вызывает обратное развитие устойчивых к стероидам гемангиом на ранней стадии развития у детей младшего возраста (Martin-Odegard, см. выше). Белки интерферона, как известно, позволяют эффективно лечить лейкозы, лимфомы и миеломы. Подобный результат противоречит общему мнению о том, что, несмотря на высокую эффективность белков интерферона для лечения злокачественной опухоли in vitro, они гораздо менее эффективны при лечении in vivo. И все же, как показали клинические испытания с участием человека, альфа-интерферон позволяет эффективно лечить злокачественный ретикулоэндотелиоз, хронический миелолейкоз, Тклеточные лимфомы кожи, лимфому Ходжкина и множественную миелому. Белок бетаинтерферона подавляет рост клеток злокачественной опухоли почки в культуре. IFN- уже сертифицирован для применения при лечении злокачественной опухоли почки. Злокачественная опухоль толстой и прямой кишки является главной причиной смертности онкологических больных в США. БелкиIFN-, IFN- и IFN- оказывают сильное антипролиферативное действие на культивируемые клетки злокачественной опухоли толстой кишки человека. Злокачественная опухоль толстой кишки часто дает метастазы в печень с опасными для жизни последствиями. Для доставки гена интерферона в печень с целью воздействия на эти метастазы можно использовать аденовирус или другие печень-специфические системы доставки. Лечение злокачественной гепатомы может быть весьма успешным благодаря высокой эффективности доставки в печень, обеспечиваемой аденовирусом. Установлено, что белокIFN- существенно подавляет пролиферацию клеток гепатомы человека в культуре. Белки интерферона позволяют эффективно лечить неоперабельную немелкоклеточую злокачественную опухоль легкого в одних клинических испытаниях и не дают такого результата в других испытаниях. Установлено, что две линии клеток злокачественной опухоли легкого человека чувствительны к подавлению роста белком бета-интерферона (бета-интерферон оказался более эффективным, чем альфаинтерферон). В одном клиническом испытании после внутривенного введения интерферона 31 наблюдалась значительная обусловленная интерфероном токсичность. Локальная доставка гена бета-интерферона в легкое (например, аэрозольное введение вектора рекомбинантного аденовируса) может дать хорошие результаты,не вызывая токсичности, наблюдаемой в случае системной доставки этого белка. При выполнении исследований in vitro белок бетаинтерферона подавлял пролиферацию клеток мелкоклеточной злокачественной опухоли легкого. Белок альфа-интерферона подавляет рост ксенотрансплантатов злокачественной опухоли молочной железы у мышей nude. Бетаинтерферон может дать эффективные результаты при лечении злокачественной опухоли молочной железы не только благодаря своему антипролиферативному действию, но и вследствие индукции рецепторов эстрогена и прогестеронаin vivo, в результате чего достигается сенсибилизация злокачественной опухоли молочной железы к тамоксифену антиэстрогена. Ниже приведены данные экспериментов по применению генотерапии IFN- для лечения злокачественной опухоли молочной железы человека у мышей, использованных в качестве животной модели (см. примеры 3 и 4). Злокачественную опухоль яичника также можно лечить этим методом. Белок бетаинтерферона, по-видимому, является менее активным, чем альфа-интерферон, в отношении подавления пролиферации культивируемых клеток злокачественной опухоли яичника. В этом случае вектор, используемый в генотерапии, вводят в брюшину, так как опухоль этого типа стремится заполнить брюшную полость. Коротко говоря, белки интерферона демонстрируют антионкогенные свойства при целом ряде заболеваний, хотя результаты клинических испытаний с использованием белка интерферона не являются повсеместно положительными. Белки IFN- и IFN- испытывали в сочетании с обычными методами химиотерапии,причем оказалось, что во многих случаях их действие синергично с этими лекарственными средствами, включая клетки злокачественной опухоли шейки матки, злокачественной опухоли гортани, лейкоза, злокачественной опухоли почки, аденокарциномы толстой кишки и миеломы. Кроме того, считается, что интерфероны обладают активностью против ангиогенеза. Существует обратная корреляция между локальными уровнями IFN- и ангиогенной способностью. Некоторые данные показывают, что для подавления ангиогенеза необходимо поддерживать концентрацию IFN- на высоком уровне. В этом случае генотерапия интерфероном должна быть более предпочтительна, чем такое лечение белком, при котором высокое содержание интерферона может внезапно падать или вообще не обнаруживаться. 32 С. Животные модели для генотерапии. Специалистам в этой области должны быть известны многие животные модели, используемые для испытания методов генотерапии ex vivo и in vivo. Наиболее распространенной животной моделью злокачественной опухоли являются грызуны, в частности голые мыши (nu/nu) с ксенотрансплантатом опухоли человека. Клетки злокачественной опухоли человека размножают в культуре, после чего их трансфицируют или инфицируют геном, кодирующим интерферон,оперативно связанным с соответствующими контролирующими экспрессию последовательностями. Затем эти клетки инъецируют голым мышам. Опухолевые клетки обычно вводят подкожно в спину мыши, что ведет к образованию солидной опухоли (см. пример 1). Альтернативно, опухолевые клетки можно инъецировать ортотопически в тот орган, где они обычно развиваются (клетки злокачественной опухоли легкого инъецируют в легкое; клетки злокачественной опухоли толстой кишки вводят в толстую кишку и т.д.). Рост опухоли контролируют, измеряя диаметр опухолевого образования в течение определенного периода времени (см. пример 2).Okada et al., (1996), Gene Therapy, 3, 957964, получили экспериментальные глиомы у мышей путем прямой внутричерепной стереотактической инъекции клеток глиомы человека в головной мозг. После образования обнаруживаемых опухолей в тот же участок в виде прямой инъекции вводили вектор AAV, экспрессирующий ген тимидинкиназы вируса простого герпеса (tk HSV). Фермент tk HSV превращает ганцикловир (GCV) нетоксичного аналога нуклеозида в токсичный метаболит. После генотерапии внутрибрюшинно вводили GCV. У мышей, которым вводили AAV-tk и GCV, а не контрольный AAV или AAV-tk без GCV, наблюдалось сильное уменьшение размера опухоли. Этот метод лечения является безопасным и эффективным. Рекомбинантные аденовирусы (AdV) также использовали для лечения солидных опухолей в животных моделях и в начальных клинических испытаниях с участием людей. Во многих этих исследованиях использовали аналогичные модели ксенотрансплантатов голых мышей/человека. Ниже приведены некоторые примеры этих моделирующих экспериментов,Clayman et al., (1995), Cancer Research, 55, 1-6,создали модель плоскоклеточной злокачественной опухоли кожи головы и шеи мышей nude. Они установили, что аденовирус, экспрессирующий р 53 дикого типа, препятствует образованию этих опухолей.Therapy, 6, 1055-1063, ввели мышам nude клетки злокачественной опухоли толстой кишки человека. После образования опухолей они инъецировали непосредственно в эти опухоли аденови 33 рус, экспрессирующий ген цитозиндеаминазы(CD) E.coli, а затем системно вводили 5-фторцитозин (5FC) (CD и 5FC представляют собой комбинацию фермента/пролекарства, которая подобна tk и GCV). Эти исследователи наблюдали 4-5-кратное уменьшение размера опухоли.USA, 93 4513-4518, получили у мышей nude опухоли молочной железы человека. Непосредственно в эти опухоли инъецировали аденовирус, экспрессирующий альфа-интерферон. Эти исследователи наблюдали 100% уменьшение опухоли у этих животных. Ко et al., (1996), Human Gene Therapy, 1,1683-1691, получили у мышей nude опухоли предстательной железы человека и обнаружили,что прямое внутриопухолевое инъецирование аденовируса, экспрессирующего р 53 дикого типа, подавляет рост опухоли. У всех инъецированных мышей опухоль отсутствовала в течение, по крайней мере, 12 недель после окончания лечения.Bischoff et al., (1996), Science, 274, 373-376,получили у мышей nude опухоли шейки матки и глиобластомы. Они вводили этим мышам аденовирус с делецией гена Е 1 В. При отсутствии Е 1 В аденовирус избирательно уничтожает клетки опухоли с р 53-дефицитом. При инъецировании непосредственно в опухоли этот аденовирус вызывал уменьшение опухоли у 60% животных.Ohwada et al., (1996), Human Gene Therapy,7, 1567-1576, инъецировали клетки злокачественной опухоли толстой кишки человека в печень мышам nude, чтобы имитировать метастазы злокачественной опухоли толстой кишки в печени. Затем этим мышам инъецировали в печень рядом с опухолью аденовирус, экспрессирующий CD. Системное введение 5FC подавляло рост опухоли у этих животных. Модели злокачественных опухолей могут быть также созданы у иммунокомпетентных мышей и крыс. Эти опухоли можно получить из опухолевых клеток сингенных грызунов, инъецированных мышам. Альтернативно, эти опухоли можно получить из эндогенных клеток. В этих случаях эндогенные опухоли могут возникать в результате введения животному канцерогена или альтернативно могут образовываться спонтанно вследствие генетической среды мыши (например, в связи с дефицитом р 53).Elshami et al., (1996), Human Gene Therapy,7, 141-148, обрабатывали эндогенную мезотелиому у иммунокомпетентных крыс аденовирусом, экспрессирующим ген tk. Этот вирус инъецировали в плевральную полость, после чего системно вводили GCV. Эти исследователи наблюдали значительное уменьшение массы опухоли и увеличение времени выживания.Eastham et al., (1996), Human Gene Therapy,7, 515-523, имплантировали линии клеток опухоли предстательной железы сингенной мыши подкожно иммунокомпетентным мышам. Затем 34 они инъецировали аденовирус-tk непосредственно в опухоль и системно вводили GCV. Авторы сообщили об уменьшении размера опухоли и увеличении продолжительности жизни мышей.Bramson et al., (1996), Human Gene Therapy,7, 1995-2002, инъецировали аденовирус, экспрессирующий цитокин IL-12 непосредственно в опухоли молочной железы эндогенным мышам. Они обнаружили, что у 75% мышей опухоли уменьшались и у остальных 33% мышей опухоли полностью отсутствовали в течение продолжительного периода времени.Riley et al., (1996), Nature Medicine, 2, 13361341, инъецировали аденовирус, экспрессирующий ген ретинобластомы, непосредственно в меланотрофические опухоли гипофиза, которые возникли спонтанно у мышей Rb+/-. Эти исследователи обнаружили уменьшение пролиферации опухолевых клеток, сокращение роста опухоли и увеличение продолжительности жизни у экспериментальных животных. В клинических исследованиях генотерапии с участием человека первыми были использованы ретровирусные векторы. Отчет Roth et al.,(1996), Nature Medicine, 2, 985-991, имеет непосредственно отношение к настоящей заявке на патент. В этом отчете описывается рекомбинантный ретровирус, экспрессирующий ген р 53 дикого типа. Этот вирус был введен девяти пациентам, страдающим немелкоклеточной злокачественной опухолью легкого, в виде прямой внутриопухолевой инъекции при помощи иглы,вставленной в бронхоскоп. Из девяти пациентов у трех наблюдалось обратное развитие опухоли и еще у трех пациентов была отмечена стабилизация роста опухоли.D. Другие варианты осуществления изобретения. Генетически модифицированные клетки вводят, например, в виде внутрибрюшинной инъекции или имплантируют клетки, трансплантат или содержащую клетки капсулу в совместимый с этими клетками участок организма реципиента. В используемом здесь значении термин "совместимый с клетками участок" означает структуру, полость или жидкость реципиента, в которые можно имплантировать генетически модифицированную клетку (клетки),клеточный трансплантат или инкапсулированную клеточную экспрессирующую систему без каких-либо вредных физиологических последствий. Типичными совместимыми с клетками участками являются, например, брюшинная,плевральная и перикардиальная полости, а также солидная опухоль, из которой были выделены эти клетки, или орган, из которого была удалена опухоль. Эти генетически модифицированные клетки имплантируют в совместимый с клетками участок отдельно или вместе с другими генетически модифицированными клетками. Таким 35 образом, в объем настоящего изобретения входит способ модификации системы реципиента с использованием смеси генетически модифицированных клеток, так что первая модифицированная клетка экспрессирует первый интерферон и вторая модифицированная клетка экспрессирует второй интерферон или другой секретированный белок. Генетически модифицированные клетки других типов (например, гепатоциты, клетки гладких мышц, фибробласты, глиальные клетки, эндотелиальные клетки или кератиноциты) можно ввести вместе с генетически измененными клетками, чтобы продуцировать экспрессию комплексного набора введенных генов. Кроме того, в каждую генетически модифицированную клетку можно ввести несколько рекомбинантных генов на одном или разных векторах, в результате чего достигается экспрессия нескольких интерферонов в одной клетке. Настоящее изобретение далее относится к клеточному трансплантату. Этот трансплантат включает несколько вышеописанных генетически модифицированных клеток, присоединенных к носителю, пригодному для имплантации в организм млекопитающего-реципиента. Носитель может быть получен из природного или синтетического материала. В соответствии с еще одним вариантом осуществления изобретения такой трансплантат содержит кусочек брюшины. В соответствии с этим вариантом осуществления изобретения носитель является природной матрицей, удерживающей вместе множество генетически модифицированных клеток. Альтернативно, этот трансплантат содержит множество вышеописанных клеток, прикрепленных к заменителю природной матрицы (например, гель-пена (Upjohn, Каlamazoo, Mich.),Дакрон, Кортекс). Еще одним объектом этого изобретения является инкапсулированная клеточная экспрессирующая система. Инкапсулированная система включает капсулу, пригодную для имплантации в организм млекопитающего-реципиента, и множество находящихся в ней вышеописанных генетически модифицированных мезотелиальных клеток. Эта капсула может быть изготовлена из синтетического или природного материала. Методы изготовления таких капсул хорошо известны специалистам в этой области. В отличие от клеток, которые имплантируют непосредственно в организм млекопитающегореципиента (то есть имплантируют таким образом, что генетически модифицированные клетки находятся в прямом физическом контакте с совместимым с клетками участком), инкапсулированные клетки остаются изолированными (то есть не находятся в прямом физическом контакте с очагом заболевания) после имплантации. Таким образом, инкапсулированная система не ограничивается капсулой, содержащей генетически модифицированные неиммортализован 003256 36 ные клетки, она может включать и генетически модифицированные иммортализованные клетки.VII. Лекарственные препараты. В соответствии с предпочтительным вариантом осуществления изобретения препарат генетически модифицированных клеток содержит количество клеток, достаточное для доставки терапевтически эффективной дозы интерферона реципиенту in situ. Специалист в этой области может определить терапевтически эффективную дозу конкретного интерферона для данного заболевания без ненужного экспериментирования. Так, чтобы определить эффективную дозу, специалист в этой области должен принять во внимание состояние пациента, серьезность заболевания, а также результаты клинических исследований конкретного интерферона, предназначенного для введения. Если ген или генетически модифицированные клетки не были предварительно введены в фармацевтически приемлемом носителе, их помещают в такой носитель непосредственно перед введением реципиенту. Такие фармацевтически приемлемые носители включают, например, изотонический физиологический раствор и другие буферы, которые подходят для введения пациенту и для данного метода лечения. Термин "фармацевтически приемлемый носитель" означает один или несколько ингредиентов, природных или синтетических, с которыми смешивают выделенный полинуклеотид,кодирующий интерферон, чтобы облегчить его введение нуждающемуся субъекту. Приемлемым носителем является стерильный физиологический раствор, хотя специалистам в этом области должны быть известны другие водные и неводные изотонические стерильные растворы и суспензии. В этом отношении термин "носитель"означает любые плазмидные и экспрессирующие вирусные векторы. Термин "эффективное количество" означает количество, которое позволяет уменьшить интенсивность или приостановить развитие болезни, дегенеративного состояния или поражения. Эффективное количество можно определить на индивидуальной основе, принимая во внимание имеющиеся симптомы и ожидаемые результаты. Специалист в этой области может определить эффективное количество с учетом вышеуказанных факторов в пределах обычного эксперментирования. В соответствии с предпочтительными методами генотерапии эффективное количество полинуклеотидной последовательности интерферона, находящейся в сопутствующем векторе(то есть "носителе"), можно ввести непосредственно в клетку-мишень или опухолевую ткань в виде прямой инъекции при помощи иглы или катетера или другой трубки, которую помещают в опухоль или в кровеносный сосуд, питающий эту опухоль. Величина дозы зависит, прежде всего, от таких факторов, как характер болезни, 37 выбранный интерферон, возраст, масса тела и состояние здоровья нуждающегося субъекта, и поэтому может быть различной для разных субъектов. При использовании вектора для генотерапии предполагается, что эффективное количество для человека находится в пределах от около 0,1 до около 10 мл физиологического раствора, содержащего от около 1 х 107 до около 1 х 1012 бляшкообразующих единиц (БОЕ)/мл экспрессирующих вирусных векторов, включающих интерферон. Как описывалось выше, ген IFN можно ввести путем прямой инъекции в солидные опухоли. Альтернативно, можно произвести вливание в кровеносный сосуд, питающий эту опухоль. Кроме того, возможно парентеральное введение этого вектора. Для введения полинуклеотидов, кодирующих интерферон, можно использовать местный, внутриглазной, парентеральный, назальный, внутритрахеальный, внутрибронхиальный, внутримышечный, подкожный и другие способы введения. Парентеральное введение включает внутривенное, внутримышечное, внутрибрюшинное и подкожное введение. Более сложным подходом может быть парентеральное введение вируса или химического конъюгата, который локализуется в опухоли определенного типа, благодаря природному тропизму или наличию поверхностной молекулы, которая связывается с рецептором, присутствующим только в определенных типах опухоли. Как описывалось выше, настоящее изобретение относится к способам получения клеточной экспрессирующей системы, предназначенной для экспрессии генного продукта (например,интерферона) у млекопитающегореципиента, к полученной таким образом экспрессирующей системе и фармацевтическим композициям, содержащим указанную экспрессирующую систему. Нижеследующие примеры показывают осуществимость клеточной генотерапии в системе животных моделей. Пример 1. Типичная животная модель. Полинуклеотиды, способные экспрессировать интерферон, обычно испытывают in vivo на животной модели. У мышей nude вызывают образование опухолей, инъецируя им линии опухолевых клеток человека. Голые мыши (линияnu/nu) являются иммунодефицитными и не отвергают чужеродные опухолевые клетки. Опухоли образуются в течение 1-2 недель после инъекции опухолевых клеток, хотя точный период времени зависит от количества инъецированных клеток и онкогенных свойств линий клеток. Полинуклеотиды, экспрессирующие интерферон, вводят в опухолевые клетки обычными методами трансфекции в культуре до их инъецирования мышам. Альтернативно, соответствующий полинуклеотид можно ввести в опухоль путем трансфекции или вирусной 38 трансдукции in vivo после образования опухолей у мышей. В качестве примера можно привести исследование, в котором использованы клетки,относящиеся к линии клеток злокачественной опухоли мочевого пузыря НТВ 9 (Huang et al.,см. выше) или к линии клеток ретинобластомыUSA, 88: 5257-5261, 1991). Для доставки находящегося в культуре выделенного полинуклеотида, кодирующего интерферон, опухолевые клетки трансфицируют (используя обычные методы, такие как осаждение фосфатом кальция, электропорация или трансфекция липофектамином) или непосредствено инфицируют (используя ретровирус, аденовирус, бакуловирус или аденоассоциированный вирус). В случае эффективного инфицирования вирусом, при котором 100% клеток успешно приобретают соответствующий полинуклеотид, не нужно производить селекцию клеток. Кроме того, установлено (пример 3), что лишь небольшое количество клеток в процентном выражении должно экспрессировать ген интерферона, поэтому селекция лекарственного средства обычно не требуется. При выполнении селекции в случае трансфекции, которая является не такой эффективной, как инфицирование вирусом, клетки трансфицируют экспрессирующим вектором,кодирующим лекарственноустойчивый ген (такой как неоген, который кодирует устойчивость к G418), и полинуклеотидом, таким как ген интерферона. Контрольную трансфекцию производят только вектором, кодирующим лекарственноустойчивый ген. Примерно через 2-3 недели селекции в среде, содержащей лекарственное средство, колонии клеток собирают и вводят в виде подкожной инъекции в бок самкам (nude) мышей nu/nu при концентрации клеток около 106 в объеме около 100 мкл. Инфицированные вирусом клетки инъецируют без выполнения стадии селекции. За мышами наблюдают в течение, по крайней мере, 2 месяцев и еженедельно измеряют штангенциркулем размер опухоли. Альтернативно, в бок мышам в виде подкожной инъекции вводят нетрансфицированные или неинфицированные опухолевые клетки. После образования опухоли непосредственно в опухоль инъецируют ДНК или вирус, содержащий полинуклеотид, кодирующий интерферон. Для этого метода подходят многие вирусы, хотя рекомбинантные аденовирусы являются наиболее эффективными, и преимуществом рекомбинантных ретровирусов является то, что они устойчиво интегрируются в геном опухолевой клетки. ДНК можно ввести в клетки в виде инъекции смеси ДНК с катионными липосомами. ДНК или вирусы, не содержащие ген интерферона, инъецируют в опухоли других мышей,которые служат в качестве контрольных живот 39 ных. Развитие или уменьшение опухоли контролируют при помощи штангенциркуля. Пример 2. Типичная модель злокачественной опухоли легкого. Ниже в качестве примера рассмотрен способ лечения мелкоклеточной злокачественной опухоли легкого человека инкапсулированным в липосомы выделенным полинуклеотидом, кодирующим интерферон, в соответствии с которым полинуклеотид, кодирующий интерферон,вводят in vivo в клетки, требующие такого лечения, с использованием липосом, например в виде мелкораспыленных липосомных аэрозолей. Вводимый в виде аэрозолей полинуклеотид, кодирующий интерферон, равномерно осаждается на поверхности носоглотки, трахеобронхиального дерева и в легочной области. См.Dis., 7: 721-731 (1988) для ознакомления с липосомными аэрозолями. Для лечения злокачественных опухолей легкого подобным образом полинуклеотид, кодирующий интерферон, очищают любым известным методом. Полинуклеотид, кодирующий интерферон, смешивают с липосомами и вводят в них с высокой степенью эффективности. Поскольку доставка аэрозоля не вызывает раздражения и хорошо переносится добровольцами и пациентами, полинуклеотид,кодирующий интерферонсодержащие липосомы, вводят пациентам, страдающим злокачественной опухолью легкого на любой стадии. Липосомы вводят при помощи назальной ингаляции или интубационной трубки, присоединенной к распылителю, в дозе, достаточной для подавления роста опухоли. Аэрозоль вводят ежедневно в течение двух недель, после чего при необходимости курс лечения повторяют. Исследования in vivo по лечению ортотопической мелкоклеточной злокачественной опухоли легкого можно выполнить с использованием опухоли, которую инъецируют в правый главный бронх бестимусным голым (nu/nu) мышам (примерно 1,5 х 106 клеток/мышь). Через 3 дня начинают курс лечения мышей (ежедневно в течение 3 последующих дней), которым эндобронхиально вводят ген инкапсулированного в липосомы интерферона и проверяют наличие последовательностей гена интерферона. Образование опухоли и ее размер контролируют, для чего опухоль измеряют штангенциркулем и оценивают выживание мышей. Пример 3. Генотерапия eх vivo геном бетаинтерферона 1 а. В этом примере использована линия клеток злокачественной опухоли молочной железы человека MBA-MD-468 (получена из Американской коллекции типовых культур). Клетки не инфицируют или инфицируют аденовирусом,экспрессирующим ген бета-интерферона 1 а человека. В этом случае у аденовируса удалены гены Е 1 и имеется температурозависимая мутация в гене Е 2 а. Методы получения этого адено 003256 40 вируса описаны в работе Engelhardt et al., (1994),Gene Therapy, 5:1217-1229 (более подробное описание см. также ниже). Кратко существо этих методов можно изложить следующим образом: ген бета-интерферона 1 а предварительно клонируют в векторе аденовируса pAdCMVlink1 так, чтобы транскрипцию гена стимулировал промотор CMV IE1, в результате чего получают плазмиду переноса аденовируса. Ген вставляют в этот вектор вместо удаленного гена E1. Рекомбинантный аденовирус с этим геном интерферона получают путем рекомбинации плазмиды переноса и генома аденовируса в клетках 293. Вирус подвергают гемолитической очистке и титруют в соответствии с анализами бляшкообразования обычными методами. Материалы и методы Культура клеток. Злокачественные клетки человека MDA-MB-468, Huh7, KM12LA4,МЕ 180, HeLa, U87 и 293 помещают в виде адгезионных культур в модифицированную по способу Дульбекко среду Игла, содержащую 10% бычью сыворотку, 2 мМ глутамина, пенициллин и стрептомицин, заменимые аминокислоты и витамины. Продуцирование очищенных аденовирусов. Вектор переноса аденовируса, кодирующий ген IFN человека, стимулируемый ранним промотором цитомегаловируса,pAdCMVhuIFN, конструируют путем лигирования кДНК-вставки, кодирующей IFN- 1 а человека,в плазмиду pAdCMVlink1 (см. Engelhardt et al.,1994, см. выше). Плазмиду pAdCMV-huIFN котрансгенно переносят в клетки 293 с геномной ДНК, очищенной от температурозависимого аденовируса H5ts125. Рекомбинантные аденовирусы, выделенные из отдельных бляшек,используют для инфицирования клеток 293 при 39 С, после чего тестируют супернатанты на экспрессию гена IFN- твердофазным иммуноферментным анализом (ELISA). Аденовирусы,несущие кДНК IFN- (H5.11hlIFN), идентифицируют и затем амплифицируют. Аналогично получают контролирующий Е 2 А температурозависимый аденовирус,кодирующий галактозидазу колориметрического маркера(H5.110lacZ). Вирусные препараты продуцируют в клетках 293 и очищают градиентами CsCl после двух циклов отделения бляшек. В этих препаратах не было обнаружено наличия аденовируса дикого типа. Субконфлюэнтные клетки инфицируютH5.110hlIFN в соответствии с множественностью заражения (MOI), равной 100, в 3 мл среды, содержащей 2% бычью сыворотку. Через 15-18 ч супернатанты собирают и производят количественное определение концентрации IFN анализом ELISA. Анализ ELISA. 96-Луночные планшеты покрывают на ночь при 4 С антителом противIFN человека, В 02 (Summit Pharmaceuticals Co., 41 Япония). Антитело используют в количестве 10 мкг/мл в буфере для сенсибилизации поверхностей,содержащем 50 мМ бикарбоната/карбоната натрия, 0,2 мМ MgCl2 и 0,2 мМCaCl2 (pH 9,6). Затем планшеты блокируют 1% казеином в физиологическом растворе с фосфатным буфером (PBS) в течение 1 ч при комнатной температуре и добавляют образцы эталонов белка IFN- (Avonex, Biogen), разведенные 1% казеином и 0,05% твином-20. Планшеты затем последовательно инкубируют при комнатной температуре в течение 1 ч с сывороткой кролика против IFN- (разведение 1:2000), в течение 1 ч с антителом осла против кролика, конъюгированным с пероксидазой из хрена (HRP) (Jackson Immuno Research, разделение 1:5000), и раствором субстрата (4,2 мМ ТМВ и 0,1 М ацетата натрия и лимонной кислоты, pH 4,9). Реакцию прекращают 2 н. растворомH2SO4 и измеряют оптическую плотность при 450 нм. Эксперименты с использованием мышей. Самки мышей nu/nu Balb/c в возрасте 4-6 недель были предоставлены фирмой Taconic farms(Бостон, шт.Массачусетс). Всех мышей содержали в стерильном боксе для животных Biogen в течение, по крайней мере, 2 недель до начала каждого эксперимента. Для экспериментов ехvivo инфицированные и неинфицированные клетки собирают при помощи раствора трипсина/EDTA и дважды промывают PBS. Эти клетки смешивают непосредственно перед инъецированием мышам в нижеследующих отношениях. Мышам в правый бок подкожно имплантируют в общей сложности 2 х 106 клеток в 100 мкл PBS. При помощи штангенциркуля измеряют длину и ширину опухоли и выражают в виде среднего диаметра опухоли (мм). Для экспериментов по прямому инъецированию in vivo (пример 4) мышам nude сначала подкожно имплантируют 2 х 106 опухолевых клеток в 100 мкл PBS. Когда размер опухоли достигает 5-6 мм в диаметре, в виде одной инъекции в центр опухоли вводят 100 мкл PBS, содержащего разные дозы рекомбинантных аденовирусов. При помощи штангенциркуля измеряют длину и ширину опухоли. Размер опухоли высчитывают путем усреднения длины и ширины. Смерть животных констатируют в момент умерщвления мышей, у которых появились признаки кровотечения или размер опухоли достиг 10% от общей массы тела. Апоптоз исследуют с помощью набора для обнаружения апоптоза insitu, предоставленного фирмой Оnсоr, Inc. (номер по каталогу S7110-KIT). Результаты Сначала определяли эффективность трансдукции и экспрессию трансгена аденовирусными векторами. Клетки злокачественной опухоли молочной железы человека MDA-MB-468 инфицировали H5.110lacZ с возрастающей множе 003256 42 ственностью заражения (MOI). После окрашивания Х-gаl было установлено, что при MOI,равной 100, эффективность трансдукции гена достигает в этих клетках примерно 100% (данные не приведены). Таким образом, клетки злокачественной опухоли молочной железы инфицированы в культуре в отношении 100 бляшкообразующих единиц (БОЕ) на клетку, так как наш опыт работы с этими злокачественными клетками показывает, что это является наименьшим отношением вирус : клетка, которое ведет к экспрессии гена в каждой клетке популяции. Во время первого эксперимента через 18 ч после инфицирования мышам nude подкожно инъецировали в спину 2 х 106 клеток. Пяти мышам была сделана инъекция неинфицированных клеток и пяти мышам были инъецированы клетки, инфицированные аденовирусом-IFN. У всех мышей, которым были инъецированы контрольные неинфицированные клетки, образовались опухоли значительного размера. Опухоли отсутствовали у всех мышей, которым инъецировали клетки, обработанные аденовирусом,экспрессирующим IFN- (Н 5.110hIFN: табл. 1). Чтобы исключить вероятность того, что воздействие на опухолевые клетки in vitro белком IFN- может привести к утрате онкогенности in vivo, клетки MDA-MB-468 были обработаны белком IFN- при концентрации, обнаруженной через 18 ч после инфицирования вирусом. После тщательной промывки клеток мышам nude инъецировали равное количество обработанных клеток, необработанных клеток или смеси, содержащей 10% обработанных клеток. Опухоли развивались во всех трех группах мышей (данные не приведены), свидетельствуя о том, что важным значением для подавления образования опухоли является доставка гена IFNex vivo, а не обработка белком in vitro. Для определения того, могут ли злокачественные клетки, экспрессирующие ген IFN-,вызывать разрушение нетрансдуцированных клеток, был выполнен следующий эксперимент. Одни и те же злокачественные клетки не инфицировали, инфицировали аденовирусом, экспрессирующим ген IFN- (H5.110hIFN), или инфицировали тем же типом аденовируса, но эксперссирующим ген lacZ (H5.110lacZ), который кодирует репортерный белок галактозидазы, не оказывающий противозлокачественного действия и поэтому используемый для контроля любых эффектов, вызываемых самим аденовирусом. Клетки инфицировали аденовирусом в отношении БОЕ : клетка, равном 100. Опухолевые клетки MDA-MB-468 были отдельно инфицированы H5.110hIFN илиH5.110lacZ с MOI, равной 100. Через 18 ч после инфицирования инфицированные клетки собирали и часть этих клеток смешивали с неинфи 43 ции, трансдуцированной H5.110lacZ, может происходить вследствие каких-то общих токсических действий или каких-то противоопухолевых действий этого поколения аденовируса, но при этом необходимо отметить, что трансдуцированные клетки обладают способностью реплицироваться in vitro (неопубликованные данные). Чтобы определить количество интерферонсодержащего вируса, необходимого для подавления онкогенности, опухолевые клетки,инфицированные H5.110hIFN и H5.110lacZ,отдельно смешивали с неинфицированными клетками в разных отношениях при условии,что во всех случаях имел место избыток неинфицированных клеток. Смешение производили таким образом, что разные образцы содержали только 10, 3, 1, 0,3% клеток, инфицированных аденовирусом, при этом остальные клетки не были инфицированы. Сразу же после смешения эти клетки инъецировали мышам nude. Результаты приведены в табл. 1. Диаметры опухолей измеряли в двух направлениях в разное время после инъецирования клеток. Все величины,приведенные в табл. 1, представляют собой среднее значениестандартное отклонение измерений диаметра в поперечном и продольном направлениях у 4 мышей. Измерения производили на 12, 19, 26 и 33 день после инъецирования опухолевых клеток. Таблица 1Cpeдний диаметр опухоли (с мм) 19-ый день 26-ой день 33-ий день 4,90,8 5,90,5 6,30,6 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 0,0 2,90,3 3,00,6 1,82,0 0,0 0,0 0,0 5,20,6 6,20,5 6,50,5 4,60, 6 5,80,8 6,51,0 4,60,4 5,00,5 6,30,9 4,70,6 Данных нет Данных нет Развитие опухоли было полностью блокировано у мышей, которым вводили только 1% клеток, трансдуцированных H5.110hIFN (табл. 1). В течение первой недели после инъецирования клеток очень маленькие опухоли (они пальпировались, но были недостаточно большими,чтобы их можно было измерить) были обнаружены у мышей, которым инъецировали 10, 3 и 1% клеток с H5.110hIFN. Однако все эти маленькие опухоли полностью исчезли к 9-му дню. На основании этого можно предположить,что некоторые клетки сохраняли жизнеспособность в течение короткого периода времени и экспрессировали ген IFN- на протяжении этого периода, что вызывало гибель всей опухоли. В нескольких экспериментах, выполненных при введении этой линии клеток мышам nude, опухоль вообще не появлялась, когда 1% клеток трансдуцировали H5.110hIFN, при этом имело место 100% выживание животных (данные не приведены). У мышей, которым вводили 0,3% клеток, трансдуцированных H5.110hIFN, происходило образование опухолей, однако, размер этих опухолей был значительно меньше, чем у контрольных мышей, и у 2 из 5 мышей, входящих в 0,3% группу, опухоли полностью исчезли на 33-ий день (табл. 1). В отличие от этого, у мышей, которым вводили от 10 до 0,3% клеток, обработанныхH5.110.lacZ, образовались опухоли такого же цированными клетками до инъецирования мышам. Мышам nude Balb/c имплантировали подкожно одинаковое количество инфицированных клеток, неинфицированных клеток или смеси,содержащей 10% инфицированных клеток и 90% клеток, не обработанных вирусом. Рост опухоли контролировали через двадцать дней. У всех мышей, которым были имплантированы неинфицированные клетки, образовались опухоли, а у мышей, которым вводили 100% клеток,инфицированныхH5.110lacZ, опухоли отсутствовали, свидетельствуя о том, что инфицирование любым вирусом может подавлять онкогенность (табл. 1). Однако у всех мышей, которым вводили 10% клеток, инфицированных H5.110lacZ, образовались опухоли, в то время как у всех мышей, которым вводили 10% клеток, инфицированных Н 5.110hIFN, опухоли отсутствовали. На основании этого можно сделать вывод о том, что,хотя инфицирование H5.110lacZ подавляет образование опухоли инфицированных клеток,этот препарат не способен блокировать онкогенность коинъецированных "наивных" или неинфицированных клеток. В отличие от этого,трансдукция H5.110hIFN 10% клеток была достаточна, чтобы подавить онкогенность клеток, трансдуцированных вирусом, а также тех клеток, которые не были трансдуцированы. Подавление образования опухоли в 100% популяОбразец 100% неинфицированных клеток 100% AdV-IFN 10% AdV-IFN 3% AdV-IFN 1% AdV-IFN 0,3% AdV-IFN 100% AdV-lacZ 10% AdV-lacZ 3% AdV-lacZ 1% AdV-lacZ 0,3% AdV-lacZ 45 размера, что и в неинфицированной группе,причем ни в одной из этих контрольных групп не наблюдалось обратное развитие опухоли(табл. 1). Очевидно, что экспрессия бета-интерферона человека (hIFN-) даже в очень небольшом проценте клеток блокирует онкогенность у мышей nude. Затем было выполнено исследование по определению наименьшего отношения клеток, инфицированных Н 5.110hIFN, необходимого для воздействия на опухоль, которое необязательно выражается в ее блокировании, и увеличения выживания мышей. Мышам nude имплантировали одинаковые количества клетокMDA-MB-468, содержащих 0,3, 0,1, 0,33, 0,01 и 0% клеток, инфицированных H5.110hIFN, и контролировали рост опухоли. У мышей, которым было введено 0,3 или 0,1% инфицированных клеток, образовались гораздо меньшие опухоли по сравнению с мышами, которым были введены только неинфицированные клетки (фиг. 1 А). Из опухолей, которые образовались при 0,3 и 0,1% трансдукции, соответственно 3 из 5 опухолей и 1 из 5 опухолей полностью исчезли. Значительно более продолжительное выживание мышей наблюдалось в группах с 0,3 и 0,1% трансдукцией. Все животные, которым было имплантировано 0, 0,01 или 0,03% инфицированных клеток, погибли в течение 75 дней, в то время как в 0,1 и 0,3% группах соответственно 1 из 5 и 3 из 5 животных были живы и не имели опухолей на 109-ый день, когда этот эксперимент был закончен (фиг. 1 В). Вероятно, необходимо трансфицировать или инфицировать лишь небольшую часть (более 0,3%, предпочтительно более 1,0%) всех опухолевых клеток, чтобы получить эффективный результат. Этот вывод отличается от таких подходов к противоопухолевой генотерапии,как доставка супрессоров опухоли дикого типа(например, р 53), при которой все клетки в опухоли должны иметь ген супрессора опухоли. Таким образом, ген интерферона демонстрирует сильное антипролиферативное действиеin vivo после инфицирования in vitro. Контрольные эксперименты показывают, что это происходит благодаря интерферону, а не аденовирусу. Генотерапия -интерфероном ех vivo других ксенотрансплантируемых опухолей человека Эффект трансдукции H5.110hIFN был исследован в отношении других типов опухолевых клеток в модели ксенотрансплантата человека ех vivo. Клетки злокачественной опухоли толстой кишки человека KM12L4A, клетки злокачественной опухоли печени человека Huh7 или клетки злокачественной опухоли шейки матки человека МЕ 180 трансдуцировалиH5.110hIFN. Одинаковое количество клеток,содержащих 10, 1 или 0% трансдуцированных клеток, испытывали в отношении их способности образовывать опухоли у мышей nude. Инъе 003256 46 цирование неинфицированных клеток всех трех типов вызывало образование быстро растущих опухолей у всех мышей. В отличие от этого,введение ех vivo 10% клеток, инфицированныхH5.110hIFN, вызывало или полное подавление развития опухоли или более позднее появление медленно растущих опухолей у всех исследованных животных (фиг. 2 А). В отличие от результатов, полученных при использовании клеток MDA-MB-468, в которых 1% трансдукцияH5.110hIFN полностью предотвращала образование опухоли, 1% трансдукция этих трех типов клеток вызывала образование опухолей, хотя они имели меньший размер, чем у неинфицированных контрольных животных в каждый период измерения опухоли. Мыши, которым вводили 10 и 1% трансдуцированных клеток, характеризовались более продолжительным временем выживания по сравнению с мышами, которым вводили неинфицированные клетки (фиг. 2 В). Таким образом, опосредованная аденовирусом доставка ех vivo гена IFN- в множество разных опухолевых клеток вызывает эффективное подавление онкогенеза и ведет к увеличению времени выживания животных. Пример 4. Генотерапия in vitro геном бетаинтерферона 1 а. Вместо ex vivo можно проводить генотерапию in vivo. В случае генотерапии in vivo ген вводят непосредственно пациенту. В этом примере аденовирус с геном IFN- человека(Н 5.110hIFN) инъецировали непосредственно в солидную опухоль. То есть клетки злокачественной опухоли молочной железы человекаMBA-MD-468 в количестве 2 х 106 инъецировали подкожно в спину 50 мышам nude. Подкожные опухоли диаметром около 5-6 мм образовались у мышей nude через 24 дня после подкожной инъекции клеток MDA-MB-468. В этот период времени опухоли обрабатывали PBS или векторами H5.110hIFN и H5.110lacZ при разных дозах вируса от 1 х 107 до 3 х 109 БОЕ/мышь в виде одной внутриопухолевой инъекции. Данные, приведенные на фиг. 3, показывают, что в течение 14 дней введение одной дозы H5.110hIFN в концентрации 3 х 109, 1 х 109 или 3 х 108 общих БОЕ вызывает уменьшение опухоли. Полное обратное развитие опухоли происходит у 4 из 5 мышей в группе, получившей 3 х 109 БОЕ, и у 3 из 5 животных в группе,получившей 1 х 109 БОЕ. В опухолях, в которые было инъецировано 1 х 109 БОЕ H5.110hIFN,можно обнаружить высокую локальную концентрацию IFN-, равную примерно 1500 МЕ/мл, в то время как в сыворотке концентрация IFN- составляет только 37 МЕ/мл. Более низкие дозы H5.110hIFN, равные 1 х 108, 3 х 107 и 1 х 107 БОЕ, оказывают незначительное воздействие или вообще не имеют никакого эффекта(фиг. 3 и данные не приведены), указывая на то,что противоопухолевая реакция зависит от до 47 зы. Инъекции PBS или H5.110lacZ в эквивалентных дозах не вызывают обратного развития опухоли (фиг. 3). При наблюдении за опухолями в течение более продолжительного периода времени можно обнаружить замедление роста и обратное развитие некоторых отдельных опухолей, в которые инъецировали H5.110lacZ в концентрации 3 х 109 БОЕ, что позволяет предположить, что контрольный вирус в этой дозе может в незначительной степени подавлять рост опухоли. Обработка H5.110hIFN с концентрацией 3 х 109, 1 х 109 или 3 х 108 БОЕ значительно увеличивает выживание мышей по сравнению с мышами, которым вводили PBS или H5.110lacZ(данные не приведены). Кроме того, была исследована схема лечения, состоящая из нескольких инъекций, в частности из 5 инъекцийH5.110hIFN в дозе 1 х 108 БОЕ, которые делали через каждые три дня в опухоли MDA-MB-468 иHeLa, в результате чего происходило замедление роста и обратное развитие опухолей обоих типов (неопубликованные данные). Аналогичный эксперимент in vivo был выполнен с использованием линии клеток глиомы человекаU87. Эти клетки были очень чувствительны кIFN-, так как полное обратное развитие опухоли наблюдалось у 4 из 4 мышей, которым вводили H5.110hIFN в дозе 1 х 109 БОЕ, и у 2 из 4 мышей, которым вводили 1 х 108 БОЕ (данные не приведены). Эти результаты свидетельствуют о том, что прямая и локальная доставка in vivo аденовируса, содержащего ген IFN-, может вызывать значительное противоопухолевое действие. Через 4 дня после инъекции 1 х 109 БОЕ вируса опухоли MDA-MB-468 брали для гистологического исследования. В этот период времени у опухолей, в которые был инъецированH5.110hIFN, наблюдались признаки обратного развития. Гистологический анализ опухолейMDA-MB-468 выполняли путем окрашивания гематоксилинэозином. Большее количество апоптонических клеток обнаружено в опухоли,в которую инъецировали H5.110hIFN, чем в опухоли, в которую инъецировали H5.110lacZ. Наличие апоптоза было подтверждено прямым флуоресцентным детектированием меченой по концам фрагментированной геномной ДНК. Очень мало инфильтрующих мононуклеарных клеток обнаружено в опухолях, в которые инъецировали H5.110hIFN или H5.110lacZ, что свидетельствует о том, что клеточная иммунная реакция не имеет важного значения для обратного развития опухоли под действиемH5.110hIFN в этой модели. В описанных выше экспериментах ex vivo и in vivo было исследовано только прямое антипролиферативное действие интерферона. Поскольку в исследованиях были использованы мыши с иммунодефицитом, должна отсутствовать любая иммуностимулирующая активность, 003256 48 которой обладает интерферон и которая может стимулировать разрушение опухоли. Кроме того, поскольку интерфероны не предназначены для межвидового скрещивания человека с мышью, IFN- человека, использованный для подавления клеток злокачественных опухолей человека у этих мышей, по-видимому, не может ингибировать ангиогенез, так как IFN- человека не действует на эндотелиальные клетки сосудов. Поэтому вполне возможно, что при введении человеку аденовируса с IFN- человека будет иметь место еще более выраженное противоопухолевое действие. Это действие может быть смоделировано на иммунокомпетентных приматах кроме человека. Альтернативно, можно ввести аденовирус с геном IFN- мышей иммунокомпетентным мышам с опухолями мышиного происхождения. Существует много моделей опухолей сингенных мышей. Приведенные здесь данные демонстрируют замечательную способность генотерапии интерфероном блокировать образование опухолей de novo, а также вызывать обратное развитие имеющихся опухолей. Эксперименты по трансдукции ех vivo подтверждают, что введение сильнодействующего секретируемого белка всего в 0,3-1,0% трансдуцированных клеток блокирует образование опухолей MDA-MB-468. Был испытан целый ряд других линий опухолевых клеток и, хотя наблюдались различия в действии IFN-, все опухоли можно было подавить 1-10% клеток, трансдуцированных IFN-. С учетом того, что для подавления роста опухоли необходимо относительно небольшое процентное количество клеток, секретирующих IFN-,было произведено прямое внутриопухолевое инъецирование аденовируса в ранее образовавшиеся опухоли. В этом случае ген IFN- также оказывал сильное действие, причем в результате отдельных инъекций вируса наблюдалось частичное или полное обратное развитие опухолей. В этих исследованиях значительное обратное развитие опухолей, по-видимому, прежде всего явилось результатом прямого антипролиферативного или цитотоксического действияIFN-. Этот вывод подтверждается тем, что генIFN-, использованный в этом исследовании,имеет человеческое происхождение, и IFNчеловека не участвует в перекрестной реакции с клетками-хозяевами мыши. Кроме того, у использованных мышей nude с иммунодефицитом отсутствуют Т-лимфоциты, главная эффекторная клетка в индуцированной интерфероном иммуностимуляции типа 1 (Tough, D.F. et al.,(1996), Science, 272: 1947-1950 и Rogge, L. et al.,(1997) J. Exp. Med., 185: 825-831). Кроме того, в быстро обратно развивающихся клетках после введения гена IFN- не наблюдается явного увеличения инфильтрации мононуклеарных клеток. Эти результаты подтверждают мнение о том, что антипролиферативное действие, опо 49 средованное -интерфероном, само по себе может быть достаточным для стимуляции обратного развития опухоли. Полученные нами данные совместимы с клинической корреляцией,которая ранее была выявлена между чувствительностью злокачественных клеток in vitro кCytokine Res., 16: 275-281). Коротко говоря, было обнаружено, что опосредованная аденовирусом генотерапия интерфероном может оказывать эффективное противоопухолевое действие на мышей, используемых в качестве животной модели. Введение ех vivo гена IFN- в очень небольшом процентном количестве клеток достаточно для подавления образования опухоли, и прямое внутриопухолевое инъецирование однократной дозы генаIFN- ведет к обратному развитию опухолей. Не связывая себя какой-либо теорией, можно сделать вывод о том, что сильное противоопухолевое действие может быть результатом аутокринного и паракринного действия -интерферона. Это противоопухолевое действие может иметь важное значение для дальнейших генотерапевтических исследований злокачественных опухолей, в которых степень доставки гена, повидимому, является ограничивающим фактором и необходимо достижение большого эффекта подражания. Поэтому локальная генотерапия интерфероном представляет собой многообещающую стратегию лечения опухолей у человека. Модификации Очевидно, что выше приведено только подробное описание конкретных предпочтительных вариантов осуществления изобретения. Поэтому специалистам в этой области должно быть ясно, что в объем этого изобретения входят разные модификации и варианты. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения злокачественных опухолей с помощью генотерапии in vivo, включающий стадию введения субъекту терапевтически эффективного количества вирусного вектора, отличающийся тем, что указанный вектор содержит ген, кодирующий -интерферон, и где указанный вектор выбран из группы, состоящей из аденовирусного вектора, лентивирусного вектора, вектора, полученного на основе вируса Эпштейна-Барр, бакуловирусного вектора и вектора, полученного на основе вируса простого герпеса. 2. Способ по п.1, отличающийся тем, что вектор выбран из группы, состоящей из аденовирусного вектора, бакуловирусного вектора и лентивирусного вектора. 50 3. Способ по п.1, отличающийся тем, что вектор представляет собой аденовирусный вектор. 4. Способ по п.3, отличающийся тем, что аденовирусный вектор содержит делецию в гене Е 3. 5. Способ по п.3 или 4, где аденовирусный вектор содержит делецию в гене Е 1. 6. Способ по п.1, отличающийся тем, что вектор вводят путем, выбранным из группы,состоящей из прямой инъекции в опухоль, местного введения, внутриглазного введения, парентерального введения, интраназального введения, интратрахеального введения, интрабронхиального введения и подкожного введения. 7. Способ по п.6, отличающийся тем, что указанный путь представляет собой парентеральное введение, выбранное из группы, состоящей из внутривенного введения, внутримышечного введения и внутрибрюшинного введения. 8. Способ по п.6, отличающийся тем, что вектор вводят прямой инъекцией в опухоль. 9. Способ по п.1, отличающийся тем, что опухоль выбрана из группы, состоящей из злокачественной глиомы, меланомы, гемангиомы,лейкоза, лимфомы, миеломы, рака толстой и прямой кишки, немелкоклеточной карциномы,рака молочной железы и рака яичников. 10. Способ по п.9, отличающийся тем, что опухоль представляет собой злокачественную глиому. 11. Способ лечения злокачественных опухолей с помощью генотерапии in vivo, включающий стадию введения субъекту терапевтически эффективного количества дефектного по репликации вектора, отличающийся тем, что указанный вектор содержит ген, кодирующий интерферон, и где указанный вектор выбран из группы, состоящей из аденовирусного вектора,лентивирусного вектора, бакуловирусного вектора, вектора, полученного на основе вируса Эпштейна-Барр, и вектора, полученного на основе вируса простого герпеса. 12. Способ по п.11, отличающийся тем, что вектор выбран из группы, состоящей из аденовирусного вектора, бакуловирусного вектора и лентивирусного вектора. 13. Способ по п.12, отличающийся тем, что вектор представляет собой аденовирусный вектор. 14. Способ по п.13, отличающийся тем, что вектор делетирован по одной или нескольким геномным областям, выбранным из группы, состоящей из областей E1, E2A и Е 4 аденовирусного генома. 15. Способ по п.13 или 14, отличающийся тем, что вектор содержит делецию в гене Е 3. 16. Способ по п.14, отличающийся тем, что вектор не содержит ген Е 1. 17. Способ по п.16, отличающийся тем, что вектор дополнительно содержит делецию в гене Е 3. 18. Способ по п.11, отличающийся тем, что вектор вводят путем, выбранным из группы,состоящей из прямой инъекции в опухоль, местного введения, внутриглазного введения, парентерального введения, интраназального введения, интратрахеального введения, интрабронхиального введения и подкожного введения. 19. Способ по п.18, отличающийся тем, что указанный путь представляет собой парентеральное введение, выбранное из группы, состоящей из внутривенного введения, внутри мышечного введения и внутрибрюшинного введения. 20. Способ по п.18, отличающийся тем, что вектор вводят прямой инъекцией в опухоль. 21. Способ по п.11, отличающийся тем, что опухоль выбрана из группы, состоящей из злокачественной глиомы, меланомы, гемангиомы,лейкоза, лимфомы, миеломы, рака толстой и прямой кишки, немелкоклеточной карциномы,рака молочной железы и рака яичников. 22. Способ по п.21, отличающийся тем, что указанная опухоль представляет собой злокачественную глиому.
МПК / Метки
МПК: C12N 15/86, A61P 35/00, A61K 48/00
Метки: генотерапии, опухолей, способы, кодирующих, лечения, генов, злокачественных, помощи, beta-интерферон, использованием
Код ссылки
<a href="https://eas.patents.su/28-3256-sposoby-lecheniya-zlokachestvennyh-opuholejj-in-vivo-pri-pomoshhi-genoterapii-s-ispolzovaniem-genov-kodiruyushhih-beta-interferon.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения злокачественных опухолей in vivo при помощи генотерапии с использованием генов, кодирующих &beta-интерферон</a>
Предыдущий патент: Комбинация производных тетрагидропиридинов и ингибиторов ацетилхолинэстеразы для лечения старческой деменции по типу альцгеймера
Следующий патент: Способ получения 5-цианофталида
Случайный патент: Электромагнитный привод вакуумного выключателя