Мутантный хемокин rantes человека и применение мутантных хемокинов для лечения рассеянного склероза
Номер патента: 6137
Опубликовано: 27.10.2005
Авторы: Коско-Вильбуа Мари, Праудфут Аманда, Уэллс Тимоти Н.К.
Формула / Реферат
1. Применение мутантного CC-хемокина, который содержит, по меньшей мере, две мутации в катионном сайте петли 40-ых положений аминокислот, как показано на фиг. 1, и который по сравнению с молекулой дикого типа обладает пониженной GAG-связывающей активностью, для получения фармацевтической композиции для лечения рассеянного склероза и/или других демиелинизирующих заболеваний, в котором хемокин выбран из RANTES, MIP-1альфа, MIP-1бета, MIP-3, HCCl, I309, I35612 и MCP-2.
2. Применение по п.1, в котором мутантный хемокин представляет собой мутантный RANTES.
3. Применение по п.2, в котором мутантный CC-хемокин представляет собой тройной мутантный RANTES, в котором три основные аминокислоты в катионном сайте петли 40-ых положений аминокислот замещены другими аминокислотами.
4. Применение по п.3, в котором три основные аминокислоты в катионном сайте петли 40-ых положений аминокислот замещены аланином, серином, треонином, пролином или глицином.
5. Применение по п.4, в котором мутантный CC-хемокин представляет собой мутантный RANTES с аминокислотной последовательностью SEQ ID No: 2.
6. Применение по п.4, в котором мутантный CC-хемокин представляет собой усеченный и мутантный RANTES с аминокислотной последовательностью SEQ ID No: 3.
7. Применение по п.1, в котором мутантный CC-хемокин представляет собой мутантный MIP-1-альфа с аминокислотной последовательностью SEQ ID No: 4.
8. Применение по п.1, в котором мутантный CC-хемокин представляет собой мутантный MIP-1-бета с аминокислотной последовательностью SEQ ID No 5.
9. Фармацевтическая композиция для лечения рассеянного склероза и/или других демиелинизирующих заболеваний, включающая в качестве активного ингредиента мутантный хемокин, определенный в п.п.1-8, вместе с фармацевтически приемлемым наполнителем.
10. Усеченный и мутантный хемокин RANTES человека, имеющий аминокислотную последовательность SEQ ID No: 3.
11. Молекула ДНК, включающая последовательность ДНК, кодирующую усеченный и мутантный RANTES по п.10.
12. Экспрессирующий вектор, который включает молекулу ДНК по п.11.
13. Клетка-хозяин, включающая экспрессирующий вектор по п.12.
14. Рекомбинантный способ получения хемокина RANTES по п.10, включающий культивирование в соответствующей питательной среде клеток по п.13, и выделение хемокина.
Текст
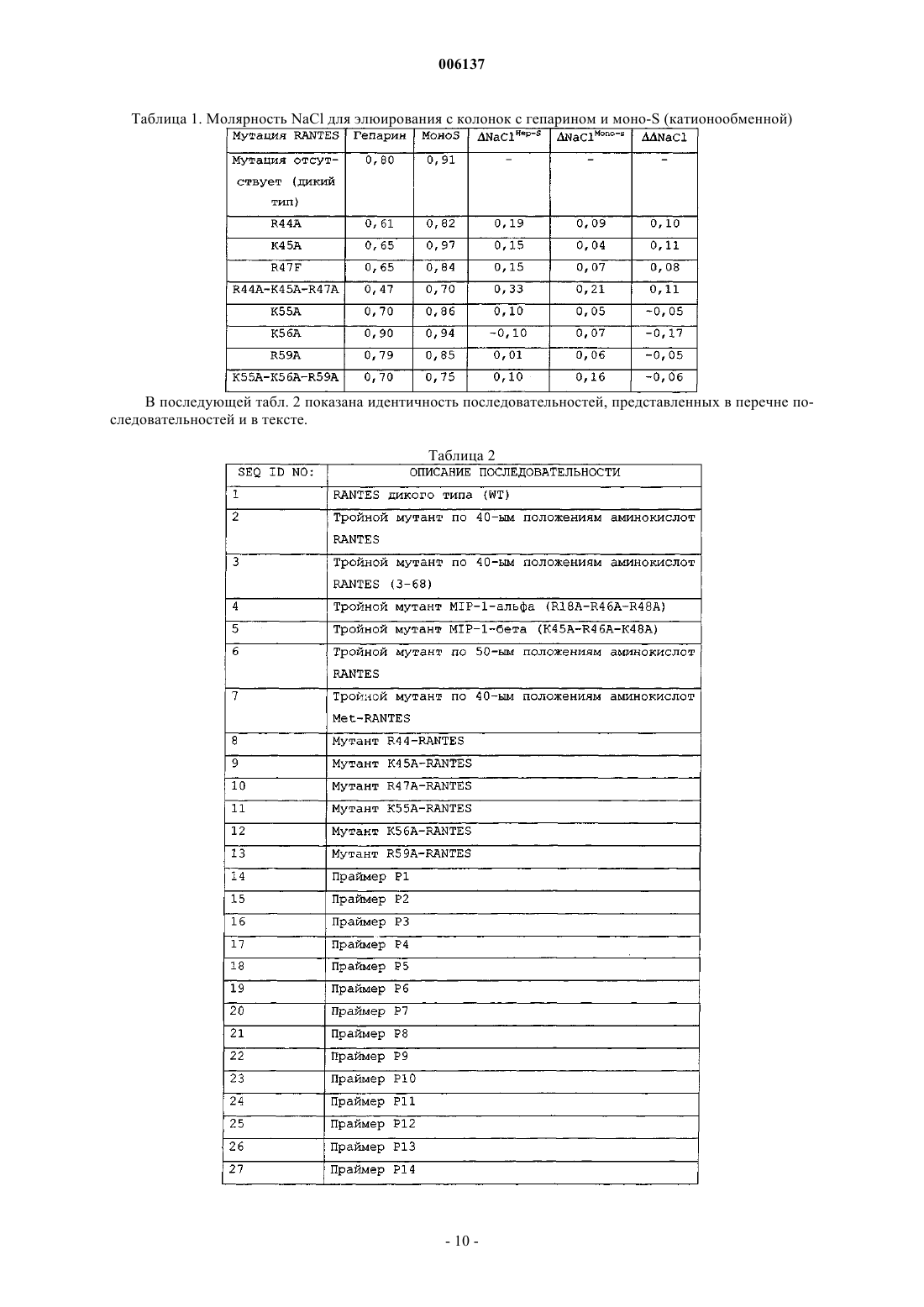
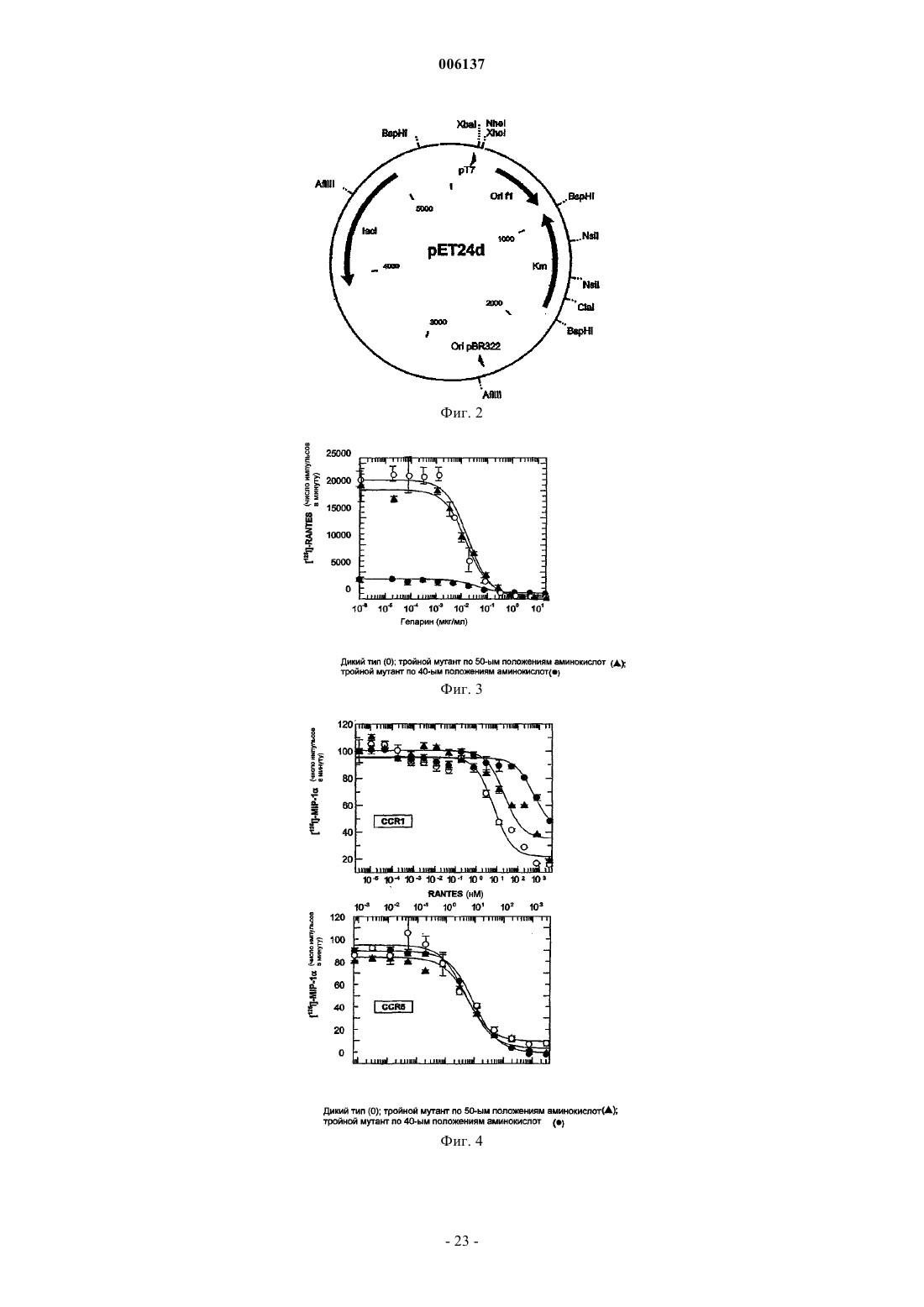
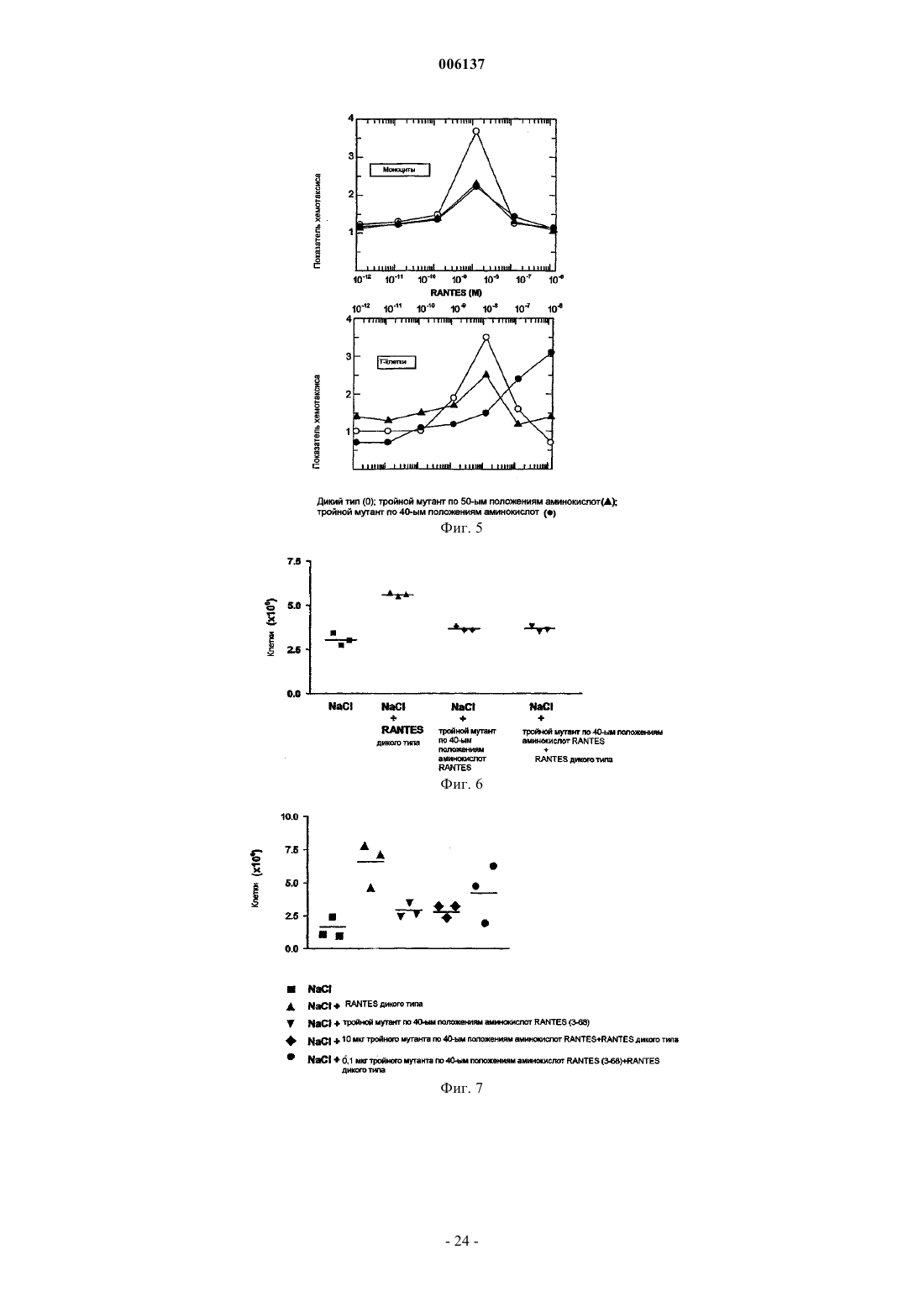
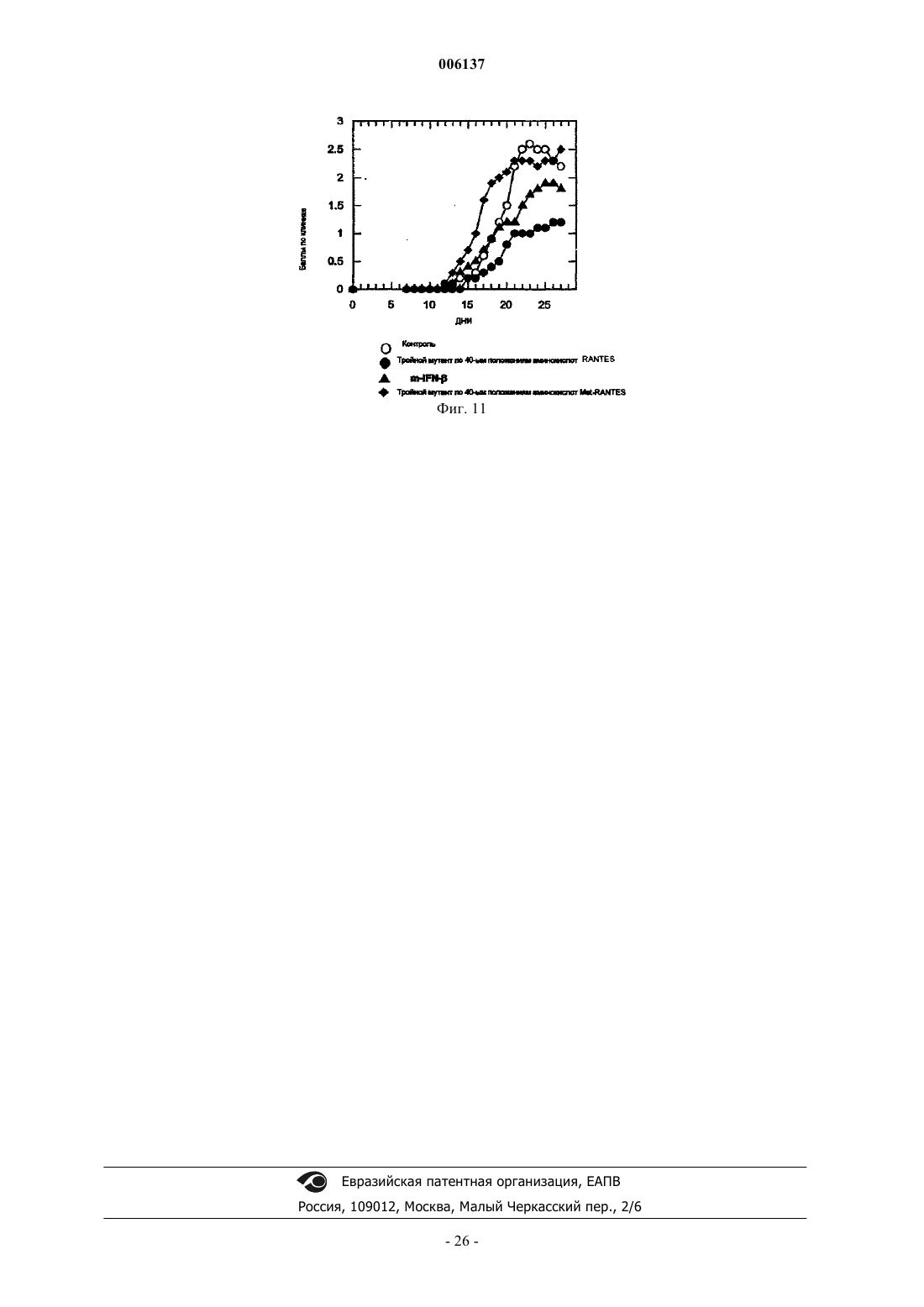
006137 Область изобретения Настоящее изобретение относится к мутантным СС-хемокинам, которые включают по меньшей мере две мутации в петле 40-ых положений аминокислот и которые по сравнению с молекулой дикого типа обладают пониженной GAG-связывающей активностью: было установлено, что такие мутантные хемокины эффективны при лечении рассеянного склероза и/или других демиелинизирующих заболеваний. Предпосылки изобретения Хемокины составляют семейство небольших цитокинов провоспаления с хемотаксическими и активирующими для лейкоцитов свойствами. В зависимости от положения первых консервативных цистеинов семейство хемокинов подразделяется на С-С-, С-Х-С- и С-Х 3-С-хемокины (Baggiolini M. et al., Adv.Immunol. 1994, 55:97-179; Baggiolini M. et al., Annu. Rev. Immunol. 1997, 15:675-705; Taub D. et al. , Cytokine Growth Factor Rev. 1996, 7(4):355-76). Многие С-Х-С-хемокины, такие как интерлейкин-8 (IL-8), являются хемотаксическими для нейрофилов, в то время как СС-хемокины активны в отношении различных лейкоцитов, включая моноциты,лимфоциты, эозинофилы, базофилы, NK-клетки (естественные киллеры) и дендритные клетки.NН 2-концевой домен хемокинов участвует в связывании с рецептором, и NН 2-концевой процессинг может либо активировать хемокины, либо превращать хемокины в полностью неактивные.N-концевые варианты синтетических С-С-хемокинов тестировали на их активность в качестве ингибиторов или антагонистов естественных форм. МСР-1, МСР-3 и RANTES, потерявшие 8-9 NН 2 концевых аминокислот, являются неактивными на моноцитах и пригодны в качестве антагонистов рецепторов (Gong J.H. et al., J. Exp. Med. 1995, 181 (2): 631-40 и Gong J.H. et al., J. Biol. Chem., 1996, 271(18):10521-7). Увеличение RANTES на один метионин приводит к почти полной инактивации молекулы, и MetRANTES ведет себя, как антагонист в отношении аутентичного RANTES (Proudfoot A.E. et al., J. Biol.WO 99/16877 относится к усеченному с аминоконца RANTES, у которого отсутствуют NH2 концевые аминокислоты, соответствующие аминокислотным остаткам 1, 1-2, 1-3 или 1-4 естественногоRANTES, и обладающему хемокин-антагонистической активностью, а также к последовательностям ДНК, кодирующим их, их применению для терапии и/или диагностики заболеваний, при которых необходима антагонистическая активность для действия хемокинов. RANTES (3-68) представляет предпочтительный усеченный антагонист хемокинов. Несмотря на то, что в целом хемоаттрактантная активность RANTES и СС-хемокинов изучалась в основном в связи со специфическими мембранными рецепторами клеток, RANTES может также взаимодействовать с гликозаминогликанами (GAG), широко различающимися, разветвленными группами сахаров, добавляемыми к некоторым белкам после трансляции, обычно называемых протеогликанами (PG). Такие белки находятся на клеточных мембранных, во внеклеточном матриксе и кровотоке, где могут также присутствовать свободные GAG. Взаимодействие с GAG является свойством, присущим многим передающим сигнал клетке растворимым молекулам (интерлейкинам, факторам роста). PG или свободные GAG могут образовать комплекс с растворимыми молекулами, возможно с целью защитить данную молекулу от протеолиза во внеклеточной среде. Было высказано также предположение, что GAG могут помочь в правильной презентации молекул, передающих сигнал клетке, их специфическому рецептору и, в определенных случаях, также модулировать активацию клеток-мишеней. В случае хемокинов концентрирование в постоянных градиентах в месте воспаления и, следовательно, взаимодействие с рецепторами клеток и их активация, вероятно, модулируется различными формами GAG (Hoogewerf A.J. et al., Biochemistry 1997, 36(44):13570-8). Следовательно, было высказано предположение, что модуляция таких взаимодействий может представлять терапевтический подход при воспалительных заболеваниях (Schwarz M.K. and Wells T.N., Curr. Opin. Chem. Biol., 1999 3(4):407-17) и ВИЧ-инфекции (Burns J.M. et al., Proc. Natl. Acad. Sci. USA, 1999, 96 (25) : 14499-504). Структурные требования и функциональные эффекты взаимодействия GAG-RANTES изучали на различных моделях. RANTES связывается с GAG на человеческих эндотелиальных клетках пупочной вены (HUVECs) в микромолярных концентрациях с аффинностью и специфичностью выше, чем другие хемокины, такие, как МСР-1, IL-8 или МIР-1 альфа. По-видимому, такое взаимодействие является не просто электростатическим, но также зависит от других параметров, таких, как длина и N- и Oсульфатирование GAG (Kuschert G.S. et al., Biochemistry, 1999 38(39): 12959-68). Клеточные линии с дефицитом GAG также могут связываться с хемокинами, но присутствие поверхностных GAG на клетке значительно усиливает их активность по отношению к рецепторам, когда они находятся в низких концентрациях (Ali S. et al., J. Biol. Chem., 2000, 275 (16) :11721-7). В других опытах было показано, чтоGAG, в частности, гепаринсульфат, cпособствуют взаимодействию RANTES с клеточной поверхностью макрофагов и последующему подавлению ВИЧ-инфекции, результат, согласующийся с хорошо известной резистентностью этих клеток со слабой экспрессией гепаринсульфата, к противовирусному действию RANTES (Oravecz Т. et al., J. Immunol., 1997, 159 (9) :4587-92). Растворимые GAG конкурируют с клеточными мембранными GAG и могут действовать в качестве-1 006137 специфических ингибиторов индуцированной RANTES активации поверхности (Аррау V. et al., Int. Immunol., 2000, 12 (8):1173-82) или в качестве супрессора ВИЧ-инфекции (Burns J.M. et al., Proc. Natl. Acad.Sci. USA, 1999, 96(25):14499-504). В некоторых опытах по изучению зависимости структуры-функции была предпринята попытка идентифицировать домен RANTES, ответственный за взаимодействие с GAG, поскольку традиционная консенсусная последовательность (ВВХВ, где В представляет основный остаток, и X может быть любым остатком) является слишком общей. Провели картирование эпитопа с использованием моноклонального антитела, полученного против рекомбинантного человеческого RANTES, способного блокировать как противовирусное действие, так мобилизацию внеклеточного кальция, опосредуемые RANTES (BurnsJ.M. et al., J. Exp. Med., 1998, 188 (10) :1917-27). Данный подход позволил определить остатки 55-66, в качестве необходимых как для проявления подобной активности, так и для взаимодействия с GAG, доказывая, что взаимодействие с GAG может иметь дополнительную или отличную функцию от таковой,опосредуемой соответствующими рецепторами, как было также предположено при исследовании вариантов RANTES, обладающих измененными агрегационными свойствами (Аррау V. et al., J. Biol. Chem.,1999, 274 (39) :27505-12). Область 55-66, которая представляет С-концевой альфа-спиральный сегмент, является гомологичной к GAG-связывающему домену других хемокинов таких, как IL-8 (Witt D.P. and Lander A.D., Curr.Biol., 1994, 4 (5):394-400), и содержит катионный сайт, содержащий лизин и аргинин (KKWVR). Такая связывающая область отличается от связывающего сайта для клеточных рецепторов, находящегося в Nконце (Pakianathan D.R. et al., Biochemistry, 1997, 36 (32):9642-8) и включает некоторые остатки, участвующие в агрегации мономеров RANTES, даже несмотря на то, что дезагрегирующие мутации, повидимому, не оказывают влияния на взаимодействие с GAG (Czaplewski L.G. et al., J. Biol. Chem., 1999,274 (23) :16077-84; WO 98/13495).RANTES включает другой катионный сайт (RKNR) в положениях остатков 44-47, который сохраняется в GAG-связывающем сайте других хемокинов, таких, как MIP-l (Koopmann W. and Krangel M.S., J.Biol. Chem., 1997, 272(15):10103-9) и MIP-1 (Koopmann W. et al., J. Immunol., 1999, 163 (4):2120-7). Варианты человеческого RANTES, содержащие единичные мутации в данных катионных сайтах,раскрыты в качестве антагонистов RANTES, обладающих потенциальными терапевтическими применениями при лечении ВИЧ-инфекции и воспалительных или аллергических заболеваний (WO 99/33989). Было также раскрыто, что только тройной мутант RANTES, в котором три остатка в положениях 44,45 и 47 замещены аланином, потерял способность связываться с GAG (A. Proudfoot et al., Chemokine Cordon Conference, Session I, July 24th, 2000, персональное сообщение). Описание изобретения В настоящее время установлено, что СС-хемокины, содержащие по меньшей мере две мутации в катионном сайте, так называемой петли 40-ых положений аминокислот, являются эффективными при лечении рассеянного склероза и/или других демиелинизирующих заболеваний. Данный сайт представляет консервативный GAG-связывающий мотив в СС-хемокинах (таких, как RANTES, МIР-1 альфа и МIР 1 бета, MIP-3, HCC1, I309, МСР-2). Все эти мутантные хемокины обладают пониженной способностью связываться с GAG по сравнению с соответствующими молекулами дикого типа. Область, в которой должны присутствовать по меньшей мере две мутации по данному изобретению, так называемая петля 40-ых положений аминокислот, указана для ряда СС-хемокинов на фиг. 1. В частности, было установлено, что тройной мутантный RANTES, в котором три основных остатка в положениях 44, 45 и 47 замещены аланином, активны на моделях животных для лечения рассеянного склероза. Было показано, что данный тройной мутантный RANTES имеет дозозависимый эффект на мышиной модели ЕАЕ и сравнимую эффективность со стандартным лечением рекомбинантным IFN-бета. Аналогичные результаты были получены с усеченным тройным мутантным RANTES, в котором три остатка в положениях 44, 45 и 47 замещены аланином и в которых отсутствуют 2N-концевые аминокислоты. Данный усеченный мутантный RANTES (обладающий аминокислотной последовательностью SEQID No: 3) является новым и представляет другой объект настоящего изобретения. Аналогичные экспериментальные доказательства были также получены в отношении тройных мутантных МIР-1 альфа и МIР-1 бета, которые уже известны и которые здесь названы, как тройной мутантный MIP-l, R18A-R46A-R48A (Koopmann W. and Krangel M.S., J. Biol. Chem., 1997, 272 (15) : 10103-9) и тройной мутантный по 40-м положениям аминокислот MIP- K45A-R46A-K48A (Laurence J.S., Biochemistry, 2001, 40:4990-4999). Выражение пониженная GAG-связывающая активность означает, что мутанты по изобретению обладают низкой способностью связываться с GAG, т.е. низкий процент каждого из данных мутантов связывается с GAG (такими, как гепаринсульфат) по сравнению с соответствующей молекулой дикого типа. Более предпочтительными являются мутантные RANTES человека, в котором три основные аминокислоты в положениях 44, 45 и 47 молекулы дикого типа замещены другими аминокислотами. Такие остатки могут быть замещены небольшими алифатическими неполярными или слегка полярными остатка-2 006137 ми, такими как Ala, Ser, Thr, Pro и Gly. Алании является предпочтительным. Было установлено, что мутантными RANTES, особенно эффективными при лечении MS, являются таковые, имеющие аминокислотные последовательности, представленные соответственно SEQ ID No: 2 и SEQ ID No: 3. Другим объектом настоящего изобретения является применение мутантных хемокинов, определенных выше, для получения фармацевтической композиции для лечения рассеянного склероза и/или других демиелинизирующих заболеваний. Рассеянный склероз (MS) представляет медленно прогрессирующее заболевание ЦНС, характеризующееся рассеянными бляшками демиелинизации в головном мозге и спинном мозге, приводящее к множественным и различным неврологическим симптомам и признакам, обычно с ремиссиями и обострением (см. Merck Manual, 16-е издание). Причина заболевания неизвестна, но в качестве таковой предполагается иммунологическое нарушение при наличии в настоящее время некоторой информации, указывающей на специфический механизм. Высказываемые причины включают заражение медленно развивающимся или латентным вирусом,и миелинолиз под действием ферментов. Уровень IgG обычно повышен в СМЖ, и увеличенные титры связывали с различными вирусами, включая корь. Значение данных фактов и сообщений о взаимосвязи сHLA-аллотипами и измененным количеством Т-клеток неясно, поскольку доказательства являются до некоторой степени противоречащими. Повышенная частота заболевания в семьях предполагает наличие генетической предрасположенности: женщины чаще заболевают, чем мужчины. По-видимому, имеются факторы окружающей среды. Несмотря на то, что начало заболевания обычно приходится на возраст между 20-40 годами, MS связан с географической областью, где пациент проводит первые 15 лет жизни. Перемещение после 15-летнего возраста не изменяет риск возникновения заболевания. Бляшки или островки демиелинизации с разрушением олигодендроглии и околососудистым воспалением рассеяны по ЦНС, в основном в белом веществе с предрасположением к латеральным и задним столбам (особенно в шейной и дорсальной областях), зрительных нервах и перивентрикулярных областях. Поражаются также пути в среднем мозге, мосте и мозжечке, может быть также поражено серое вещество, как в мозжечке, так и спинном мозге. Обычно сохраняются тела клеток и аксоны, особенно на ранних стадиях поражения. Позднее, аксоны могут разрушаться, особенно на длинных путях, и фиброзный глиоз придает путям их склеротический вид. Одновременно можно обнаружить участки поражения на ранних и поздних стадиях. Были показаны химические изменения в липидных и белковых составляющих миелина в бляшках и вокруг них. Заболевание характеризуется различными жалобами и признаками дисфункции ЦНС с ремиссиями и постоянно возникающими обострениями. Ядерно-магнитный резонанс (MRI) является наиболее чувствительным методом диагностики; он может показать много бляшек. Участки поражения также могут быть видимыми при контрастной компьютерной томографии. Достижения в лечении рассеянного склероза (MS) появляются медленно, частично в результате неполного понимания патогенеза заболевания. Для эмпирического лечения основные препятствия для развития включают в сильной степени разнящееся течение MS, длительную природу наиболее важных результативных мероприятий и отсутствие объективных маркеров эффекта лечения, особенно в короткий срок. Несмотря на то, что патогенез MS остается неопределенным, естественная история продолжает изучаться. Были разработаны объективные результативные мероприятия, основанные на данных ядерномагнитного резонанса, и в настоящее время известны многие ошибки при клинических испытаниях, которые привели к улучшенным методам испытаний и лучшей интерпретации результатов. Другим объектом настоящего изобретения является, следовательно, способ лечения MS введением эффективного количества мутантного хемокина по изобретению вместе с фармацевтически приемлемым наполнителем. Эффективное количество относится к количеству активных ингредиентов, которое достаточно для воздействия на течение и тяжесть заболевания, приводящее к уменьшению или ремиссии такой патологии. Эффективное количество будет зависеть от пути введения и состояния пациента. Дополнительным объектом настоящего изобретения являются фармацевтические композиции,включающие мутантные хемокины по изобретению, в присутствии одного или более фармацевтически приемлемых наполнителей, для лечения MS и/или других демиелинизирующих заболеваний. Фармацевтически приемлемый означает включение любого носителя, который не снижает эффективность биологической активности активного ингредиента и который не является токсичным для хозяина, которому его вводят. Например, для парентерального введения вышеуказанные активные ингредиенты можно включить в разовую лекарственную форму для инъекций в растворителях, таких как физиологический раствор, раствор декстрозы, сывороточный альбумин и раствор Рингера. Помимо фармацевтически приемлемого носителя, композиции по изобретению могут также включать небольшие количества добавок, таких как стабилизаторы, наполнители, буферы и консерванты.-3 006137 Введение такого активного ингредиента может быть внутривенным, внутримышечным или подкожным путем. В настоящее изобретение входят другие пути введения, при которых могут быть получены желаемые концентрации соответствующих ингредиентов в крови. Оптимальная доза активного ингредиента может быть соответственно выбрана, исходя из пути введения, состояния и характеристик пациента (пола, возраста, массы тела, состояния здоровья, массы), степени выраженности симптомов, другого одновременного лечения, частоты лечения и желаемого эффекта. Корректировка и манипуляции с установленными дозами находятся в компетенции специалистов в данной области. Обычно суточная доза активного ингредиента может составлять примерно от 0,01 до 100 мг на кг массы тела. Обычно 1-40 мг на кг в день, введенные в раздельных дозах или в форме пролонгированного высвобождения, эффективны для достижения желаемых результатов. Второе или последующие введения можно проводить в дозе, которая является такой же, меньше или выше, чем первоначальная или предшествующая доза, вводимая индивидууму. Настоящее изобретение описано при обращении к конкретным воплощениям, но содержание описания включает все модификации и замены, которые может проводить специалист в данной области, не отступая от смысла и цели формулы изобретения. Сейчас изобретение будет описано с помощью следующих примеров, которые никоим образом не следует рассматривать в качестве ограничивающих настоящее изобретение. В примерах будут ссылки на фигуры, представленные здесь ниже. Описание чертежей Фиг. 1: представлено выравнивание некоторых примерных СС-хемокинов, выравненных на уровне петли 40-х положений аминокислот. Данный сегмент белка и катионный сайт, который соответствуетGAG-связывающему мотиву, помещены в рамки. Фиг. 2 - карта плазмиды, использованной для клонирования RANTES дикого типа и его мутантов согласно примерам. Фиг. 3 - результаты анализа конкурентного связывания [125I]-RANTES и мутантов гепарином в анализе с гранулами, нагруженными гепарином. Фиг. 4 - данные анализов конкурентного равновесного связывания RANTES и тройного мутанта по 40-м положениям аминокислот RANTES. Фиг. 5 - индукция хемотаксиса моноцитов и Т-клеток под воздействием RANTES и тройных мутантов по 40-м и 50-м положениям аминокислот RANTES. Фиг. 6 - ингибирование рекрутмента перитонеальных клеток под воздействием мутанта по 40-м положениям аминокислот RANTES. Фиг. 7: показано ингибирование индуцированного RANTES рекрутмента перитонеальных клеток под воздействием усеченного тройного мутанта по 40-м положениям аминокислот RANTES (3-68), полученного в Pichia pastoris. Фиг. 8 - ингибирование индуцированного MIP-1 рекрутмента перитонеальных клеток под воздействием тройного мутанта по 40-м положениям аминокислот MIP-1 (K45AR46AK48A). Фиг. 9 - ингибирование индуцированного МIР-1 рекрутмента перитонеальных клеток под воздействием тройного мутанта по 40-м положениям аминокислот MIP-l (R18A-R46A-R48A). Фиг. 10 - ингибирование индуцированного тиогликолятом рекрутмента клеток под воздействием тройного мутанта по 40-ым положениям аминокислот RANTES. Фиг. 11 - подавление начала развития экспериментального аутоиммунного энцефаломиелита под воздействием всех тройных мутантов по 40-ым положениям аминокислот RANTES по изобретению. Примеры 1. Материалы и методы а) Получение несвязывающих гепарин мутантов RANTES Мутагенез RANTES достигали обратной полимеразной цепной реакцией. Точечные мутации вводили в один из двух праймеров, использованных для гибридизации с человеческой кодирующей последовательностью RANTES (GenBank номер доступа NM-002985) в обратной ориентации. Для того чтобы повысить эффективность отжига праймеров (особенно, когда в праймеры вводили многочисленные мутации), ДНК денатурировали щелочью. Денатурированную ДНК разбавляли до концентрации примерно 10 пг/реакцию для избежания включения немутантной ДНК в реакцию трансформации. Нумерация аминокислот, представленная в примерах и описании, касается зрелого белка, т.е. начиная с Ser, который является аминокислотой в положении 24 в соответствии со списком последовательностей. Следовательно, для того, чтобы иметь правильное соответствие между числом аминокислот в списке последовательностей и таковым в примерах, 23 следует добавить к числам в примерах или описании. Последовательности использованных мутагенных праймеров являются следующими, и мутантные основания подчеркнуты: Амплификацию проводили в термоблоке для ДНК (Perkin-Elmer-Cetus 480) в течение 35 циклов с использованием ДНК-полимеразы pfuturbo. ДНК лигировали и трансформировали в Тор 10 F' компетентные клетки E.coli (Invitrogen). Последовательность мутантов проверяли секвенированием ДНК.b) Экспрессия и очистка RANTES дикого типа и мутантов RANTES в E.coli Полученные с помощью ПЦР фрагменты ДНК, как пояснено выше, клонировали в плазмидуpET24d (фиг. 2) с получением ряда векторов. Кодирующую последовательность RANTES дикого типа или мутантного RANTES клонировали в 3'-положении от промотора рТ 7 между XbaI- и NheI/XhoIсайтами. Плазмида содержит два маркерных гена (Km и lacI) и активное начало репликации (Ori fl) . Полученные векторы использовали для повторной трансформации штамма E.coli BL21(DE3), в котором достигается высокая экспрессия белка с использованием системы pT7/LacI. Экспрессию белка индуцировали добавлением к культуре 1 мМ изопропилD-тиогалактопиранозида (IPTG). Клетки собирали и ресуспендировали в буфере для лизиса (50 мМ Трис-HCl, рН 8, 10 мМ МgСl2, 5 мМ бензамидина/НСl, 1 мМ DTT, 0,1 мМ фенилметилсульфонилфторида (PMSF), DNaзы 20 мг/л). Клетки разрушали тремя пропусканиями через французский аппарат для продавливания клеток под давлением. Затем суспензию центрифугировали при 10000 x g в течение 30 мин при 4 С. Осадок тел включения, содержащий RANTES дикого типа или один из мутантов RANTES, солюбилизировали в 0,1 М Трис/HCl,рН 8,0, содержащем 6 М гуанидина/HCl и 1 мМ DTT, и перемешивали в течение 30 мин при 60 С. Раствор диализовали против 3 смен 1% уксусной кислоты. Нерастворимые вещества удаляли центрифугированием при 10000 x g в течение 30 мин. Супернатант, содержащий RANTES дикого типа или один из мутантов RANTES, лиофилизовали. Лиофилизованный порошок растворяли в 0,1 М Трис/HCl, рН 8,0, содержащем 6 М гуанидина/HCl и 1 мМ DTT, для получения концентрации, равной примерно 1 мг/мл. Белки ренатурировали добавлением по каплям в 10 х объеме раствора гуанидина раствора 20 мМ Трис/HCl, рН 8,0, содержащего 0,01 мМ окисленного глутатиона и 0,1 мМ восстановленного глутатиона. Раствор перемешивали в течение ночи при 4 С. Нерастворимые вещества удаляли центрифугированием при 10000 x g в течение 30 мин. Значение рН доводили до 4,5 уксусной кислотой и электропроводность доводили до 20 мS разбавлением водой. Раствор наносили на колонку HiLoad S 26/10, предварительно уравновешенную 20 мМ ацетатом натрия, рН 4,5 и белок элюировали линейным градиентом 0-2 М NaCl в том же буфере. Фракции, содержащие RANTES дикого типа или один из мутантных белков RANTES, собирали, диализовали против 3-5 006137 смен уксусной кислоты и лиофилизовали. Лиофилизованные белки растворяли в 50 мМ Трис/HCl буфере, рН 8,0. Лидерную последовательность MKKKWPR, полученную в результате клонирования, отщепляли от RANTES дикого типа или одного из мутантных белков RANTES инкубированием с эндопротеиназой Arg-C (фермент: субстрат 1:600,маc./маc.) в течение ночи при 37 С. Отщепленные белки отделяли от неотщепленного белка катионообменной хроматографией на колонке HiLoad S 26/10, предварительно уравновешенной 20 мМ ацетатом натрия, рН 4,5, содержащем 6 М мочевины, и белки элюировали линейным градиентом 0-2 М NaCl в том же буфере. Собирали отщепленные фракции и диализировали против двух смен 1% уксусной кислоты и,наконец, против 0,1% трифторуксусной кислоты и затем лиофилизовали (Edgerton M.D. et al., pg. 33-40and Proudfoot A.E. et al., pg. 75-87, in "Chemokine Protocols", Methods in Molecular Biology, 2000, vol. 138,Humana Press). Аутентичность белков дикого типа и мутантного RANTES проверяли масс-спектрометрией. С использованием аналогичной методики получали другой мутант, который содержал Met в качестве удлинения NН 2-конца, а также единичный или тройной мутанты по 40-ым положениям аминокислот RANTES и единичный или тройной мутанты по 50-ым положениям аминокислот. с) Экспрессия и очистка RANTES дикого типа и мутантов RANTES в Pichia pastoris Получали зрелый тройной мутант по 40-ым положениям аминокислот RANTES (R44A-K45A-R47A) с использованием мегапраймера на основе ПЦР-мутагенеза (Datta А.K., Nucleic Acid. Research, 1995,23(21):4530-31). Его клонировали в экспрессирующий вектор Pichia pastoris, pPIC9K, в рамке считывания с пре-про-сигнальным пептидом Mat альфа S. cerevisiae. После подтверждения последовательности плазмиду переносили в штамм-хозяин Pichia pastorisGS115(his4) электропорацией. His+-клоны подвергали скринингу на экспрессию мутанта RANTES. Проводили опыты по экспрессии в небольшом объеме с использованием стандартных методов, как описано в наборе для экспрессии в Pichia от Invitrogen (Life Technologies). Кратко, культуру размножали в обогащенной среде, содержащей глицерин в качестве источника углерода, после чего ее осаждали и ресуспендировали в среде, содержащей метанол для индукции экспрессии мутантного белка RANTES. Секрецию мутантного RANTES в среде детектировали при окрашивании Кумаси синим после проведения электрофореза в SDS-ПААГ. Клон, секретирующий мутантный RANTES в высокой концентрации (примерно 500-750 мг/л), использовали для размножения в больших встряхиваемых колбах. Бульон после ферментации центрифугировали при 5000 об/мин и супернатант использовали для выделения. Белок выделяли из супернатанта хроматографией в одну стадию на колонке с гепарин-сефарозой,уравновешенной 0,1 М Трис/HCl, и элюировали линейным градиентом 0-2 М NaCl в том же буфере с использованием 20 объемов колонки. Аутентичность белка проверяли масс-спектрометрией, и было установлено, что продуцированный в такой системе мутант RANTES (R44A-K45A-R47A), также является усеченным в N-конце по сравнению с молекулой дикого типа, т.е. он теряет 2 первых аминокислоты. Следовательно, полученный таким образом мутант идентифицировали как тройной мутант по 40-ым положениям аминокислот RANTES (3-68)(R44A, К 45 А, R47A), и его аминокислотной последовательностью является SEQ ID No: 3.d) Анализ связывания гепарина Проводили хроматографию на гепарин-сефарозе с использованием 50 мкг белков дикого типа или мутантного RANTES, которые нагружали на колонку с гепарином-сефарозой, уравновешенную 25 мМ Трис/HCl, рН 8,0 и 50 мМ NaCl, и элюировали линейным градиентом 0-2 М NaCl в 25 мМ Трис/HCl, рН 8,0. Хроматографию на гепарин-сефарозе проводили с использованием 50 мкг белков дикого типа или мутантного RANTES, которые наносили на катионообменную колонку MonoS, уравновешенную 50 мМ ацетатом натрия, рН 4,5. Белок элюировали градиентом 0-2 М NaCl. Анализ конкурентного связывания проводили с использованием RANTES дикого типа, тройного мутанта по 50-ым положениям аминокислот RANTES и тройного мутанта по 40-ым положениям аминокислот RANTES (последовательность SEQ ID No: 2 - также обозначенный здесь, как R44A-K45AR47ARANTES), которые были помечены 125I (Amersham) с удельной активностью 2200 мкюри/моль. 96-луночные планшеты с фильтром пропитывали буфером для связывания (50 мМ HEPES, рН 7,2,содержащем 1 мМ СаСl2, 5 мМ МgСl2, 0,15 М NaCl и 0,5% BSA). Проводили серийные разведения гепарина в буфере для связывания в пределах концентраций 20 мг/мл-1 мкг/мл. Анализ проводили в общем объеме 100 мкл с добавлением в каждую лунку 25 мкл разведений гепарина, 25 мкл 0,4 нМ [125I]хемокина, 25 мкл гранул, нагруженных гепарином (0,2 мкг/мл в воде) и 25 мкл буфера для связывания. Анализы проводили в трех параллелях. Планшеты инкубировали при комнатной температуре при встряхивании в течение 4 ч. Планшеты с фильтром промывали 3 раза 200 мкл буфера для промывания с использованием вакуумного насоса для удаления несвязанного-меченого хемокина. Затем в каждую лунку добавляли 50 мкл сцинтилляционной жидкости и определяли радиоактивность (1 мин/лунку). Данные анализировали с использованием программы GraFit Software.-6 006137 е) Aнализы равновесного конкурентного связывания с рецептором Анализы проводили на мембранах от трансфектантов СНО, экспрессирующих CCR1 или CCR5, с использованием сцинтилляционного анализа пространственной близости (SPA), применяя в качестве индикатора [125I]-МIР-1. Конкуренты готовили серийным разведением немеченых хемокинов в буфере для связывания в пределах концентраций 10-6-10-12 М. Использованным буфером для связывания был 50 мМ HEPES, рН 7,2, содержащий 1 мМ СаСl2, 5 мМ МgСl2, 0,15 М NaCl и 0,5% BSA. Гранулы WheatgermSPA (Amersham) солюбилизировали в PBS до концентрации 50 мг/мл и разбавляли в буфере для связывания до концентрации 10 мг/мл, и конечная концентрация при анализе составляла 0,25 мг/лунку. Мембраны, полученные из клеток СНО, экспрессирующих CCR1 или CCR5, хранили при -80 С и разбавляли в буфере для связывания до концентрации 80 мкг/мл. Перед постановкой анализа для уменьшения фона смешивали равные объемы исходных растворов мембран и гранул. Конечная концентрация мембран составляла 2 мкг/мл, и концентрация для [125I]-МIР-1 равнялась 0,1 нМ. Планшеты инкубировали при комнатной температуре при встряхивании в течение 4 ч. Определяли радиоактивность и данные анализировали, как описано для анализа связывания гепарина.f) Анализы хемотаксиса Хемотаксис моноцитов проводили с помощью анализа с использованием камеры микро-Boyden. Моноциты выделяли из светлого слоя кровяного сгустка с использованием следующей методики выделения: 100 мл раствора светлого слоя кровяного сгустка разбавляли 100 мл PBS, помещали на Фиколл и центрифугировали при 600 x g в течение 20 мин при комнатной температуре. Клетки, образующие поверхность раздела, собирали, дважды промывали PBS и ресуспендировали при концентрации 40-100 x 106/мл в среде RPMI 1640, содержащей 5% инактивированной фетальной телячьей сыворотки (FCS), 2 мМ глутамина и 25 мМ HEPES, рН 7,2. Затем их выделяли из фракции лимфоцитов добавлением 106 овечьих эритроцитов/мл, проводили реакцию розеткообразования в течение ночи при 4 С и отделяли вторым центрифугированием в градиенте Фиколла при 900 х g в течение 20 мин при комнатной температуре. Моноциты обнаруживали на поверхности раздела между Фиколлом и буфером, а Т-клетки находились в осадке. Моноциты промывали PBS и ресуспендировали при концентрации 2,5 x 106/мл в средеRPMI 1640. Чистоту определяли прямым и боковым рассеянием возбужденной флуоресценции сортированных клеток, и она была установлена на уровне 40-80% в зависимости от донора. Хемокины разбавляли до конечного объема 30 мкл, в пределах концентраций 10-6-10-12 М в среде RPMI вносили в нижние лунки. Над нижними лунками помещали фильтр с размером пор 5 мкм (Neuroprobe) для моноцитов и 8 мкм для Т-клеток для гарантии отсутствия пузырьков воздуха и систему скрепляли. 50 мкл клеточной суспензии (2,5 x 106 клеток/мл) в среде RPMI помещали в верхние лунки. Камеру инкубировали в течение 30 мин для моноцитов и 1,5 ч - для Т-клеток при 37 С в атмосфере О 2. Затем клетки удаляли, верхнюю поверхность мембраны очищали от клеток и затем мембрану промывали PBS. Мембрану фиксировали погружением в МеОН на 1 мин, высушивали воздухом и окрашивали растворами Fields А и В. Подсчитывали число мигрировавших клеток при произвольном выборе полей зрения для каждой лунки с объективом 20 на обычном микроскопе, снабженным программой IBAS. Данные обрабатывали программой GraFit.g) Анализы по рекрутменту перитонеальных клеток В первом анализе рекрутмент клеток индуцировали внутрибрюшинным введением 10 мкг хемокина, разведенного в 0,2 мл стерильного физиологического раствора (NaCl, не содержащий LPS), мышам самкам BALB/c в возрасте 8-12 недель. Мутанты хемокинов (10 мкг хемокина, разбавленного в 0,2 мл стерильного физиологического раствора) вводили за 30 мин до введения агониста. Через 16 ч мышей убивали СO2 в аэрозоле. Лаваж брюшной полости проводили 3 промываниями по 5 мл PBS и промывные фракции собирали. Клетки центрифугировали при 600 x g в течение 10 мин, ресуспендировали в конечном объеме 1 мл и с помощью гемоцитометра подсчитывали общее число извлеченных лейкоцитов. Во втором анализе рекрутмент клеток индуцировали внутрибрюшинным введением 200 мкл 3% раствора тиогликолята в дистиллированной воде мышам самкам BALB/c в возрасте 8-12 недель (день 1). Мутант хемокина (10 мкг хемокина, разведенного в 0,2 мл стерильного физиологического раствора) вводили за 30 мин до введения тиогликолята. Мутант хемокина затем вводили ежедневно в течение 3 дней(день 2, 3 и 4). На день 5 мышей убивали СО 2 в аэрозоле. Лаваж брюшной полости проводили 3 промываниями по 5 мл PBS и промывные фракции собирали. Клетки центрифугировали при 600 x g в течение 10 мин, ресуспендировали в конечном объеме 1 мл и с помощью гемоцитометра подсчитывали общее число извлеченных лейкоцитов.h) Экспериментальный аутоиммунный энцефаломиелит (ЕАЕ) Процедура иммунизации Мышей самок С 57 BL/6NCrlBR в возрасте 8 недель с массой тела 18-22 иммунизировали (день=0) подкожным введением в заднюю область шеи 0,1 мл эмульсии, содержащей 200 мкг пептида MOG35-55(Neosystem, Strasbourg, Франция) в полном адъюванте Фрейнда (CFA с Mycobacterium butyricum, Difco,Detroit, США), содержащем 0,25 мг Mycobacterium tuberculosis. Перед подкожным введением они получали 200 мкл внутривенно 300 нг коклюшного токсина (List Biological Lab., Campbell, CA, США), рас-7 006137 творенного в PBS в хвостовую вену. На день 2 животным делали вторую в/б инъекцию 300 нг коклюшного токсина. В результате данной процедуры, начиная примерно с дня 8-10, появлялся прогрессирующий паралич, начиная от хвоста, и прогрессивно восходящий к передним конечностям. Схема опыта В опыт входили группы по 10 животных в каждой. Все группы иммунизировали пептидом MOG35-55 в CFA и коклюшным токсином по протоколу иммунизации: Группа 1: положительная контрольная группа с введением одного растворителя (PBS) в/б. Группа 2: положительная контрольная группа с введением одного растворителя (PBS) п/к. Группа 3: с введением тройного мутанта по 40-ым положениям аминокислот RANTES в дозе 10 мкг/мышь в/б. Группа 4: с введением тройного мутанта по 40-ым положениям аминокислот RANTES в дозе 1 мкг/мышь в/б. Группа 5: с введением тройного мутанта по 40-ым положениям аминокислот Met-RANTES в дозе 10 мкг/мышь в/б. Группа 6: с введением тройного мутанта по 40-ым положениям аминокислот Met-RANTES в дозе 1 мкг/мышь в/б. Группа 7: с введением мышиного рекомбинантного интерферона бета (m-IFN-) в дозе 10000 Е/мышь п/к. Группа 8: с введением m-IFN- в дозе 20000 Е/мышь п/к. РастворительPBS использовали для разведения тройного мутанта по 40-ым положениям аминокислот RANTES,тройного мутанта по 40-ым положениям аминокислот Met-RANTES и m-IFN- до соответствующей концентрации. Путь введения Тройной мутант по 40-ым положениям аминокислот RANTES, тройной мутант по 40-ым положениям аминокислот Met-RANTES и m-IFN- вводили ежедневно в/б в объеме 200 мкл/мышь. Группам 1, 2 в/б вводили PBS из расчета 200 мкл/мышь. Продолжительность лечения Лечение каждого животного начинали со дня 4 опыта (примерно за 3-5 дней до обычного проявления заболевания) и затем продолжали в течение 14 последующих дней (животных убивали на день 18 опыта). Клинические наблюдения Начиная со дня 5, животных индивидуально обследовали на наличие паралича в баллах по клинике следующим образом: 0 = отсутствие признаков заболевания 0,5 = частичный паралич хвоста 1 = паралич хвоста 1,5 = паралич хвоста + частичный односторонний паралич задних конечностей 2 = паралич хвоста + слабость задних конечностей или частичный паралич задних конечностей 2,5 = паралич хвоста + частичный паралич задних конечностей (опущенный таз) 3 = паралич хвоста + полный паралич задних конечностей 3,5 = паралич хвоста + полный паралич задних конечностей + недержание мочи 4 = паралич хвоста + паралич задних конечностей + слабость или частичный паралич передних конечностей 5 = агония или смерть 2. Результаты а) Анализы связывания с гепарином Очищенные белки RANTES, мутантные по одному или трем положениям, анализировали хроматографией с гепарином и концентрацию NaCl, необходимую для их элюирования, сравнивали с профилем элюирования RANTES дикого типа. Поскольку взаимодействие с гепарином является электростатическим, мутанты также подвергали катионообменной хроматографии на колонке MonoS. Это приводило к снижению концентрации NaCl, необходимой для их элюирования, поскольку в результате мутагенеза удаляются основные остатки. Разницу в концентрации NaCl, полученную при проведении катионообменной хроматографии, вычитали из таковой, полученной при проведении хроматографии с гепарином. Если это значение является положительным, то это указывает на специфическое взаимодействие с гепарином (табл. 1). Прямое определение связывания с гепарином проводили с тройными мутантами по 40-ым и 50-ым положениям аминокоислот RANTES в анализе конкурентного связывания. RANTES дикого типа и мутанты йодировали (Amersham), и все они имели одинаковую удельную радиоактивность, равную 2200 мкюри/моль. Однако только примерно 20% тройного мутанта по 40-ым положениям аминокислот связывалось с гранулами, нагруженными гепарином, с максимальным числом импульсов в минуту, равным-8 006137 4000, по сравнению с 22000 импульсами в минуту для RANTES дикого типа и мутантом по 50-ым положениям аминокислот (фиг. 3). Это показывает, что данные остатки в петле 40-ых положений аминокислот, которые подвергали мутагенезу, в значительной степени определяют способность RANTES связываться с гепарином. С другой стороны, это также показывает, что предполагаемый GAG-связывающий мотив в петле 50-х положений аминокислот не является действительным сайтом GAG-связывания.b) Анализы равновесного конкурентного связывания с рецептором Оценивали способность тройных мутантов по 40-ым и 50-ым положениям аминокислот RANTES конкурировать с [125I]-МIР-1 за связывание с рекомбинантными CCR1 и CCR5 в мембранах, полученных из стабильных трансфектантов СНО. Достоверное различие отсутствовало при любой из единичных мутаций на обоих рецепторах (результаты не представлены). Ни один из тройных мутантов не показывал различия в связывании с CCR5 по сравнению с белком RANTES дикого типа. Однако на CCR1 тройной мутант по 40-ым положениям аминокислот имел 100-кратное снижение аффинности, в то время как тройной мутант по 50-ым положениям аминокислот показывал только небольшую (3-кратную) потерю аффинности (фиг. 4).c) Анализы хемотаксиса Все тройные мутанты по 40-ым и 50-ым положениям аминокислот были способны индуцировать хемотаксис моноцитов с активностями, сравнимыми с RANTES дикого типа, за исключением тройного мутанта по 40-ым положениям аминокислот, который был способен индуцировать существенный хемотаксис только в концентрации 1 мкМ. Однако тройные мутанты по 40-ым и 50-ым положениям аминокислот были равны по их способности индуцировать хемотаксис Т-клеток (фиг. 5). Результаты, полученные в анализах хемотаксиса моноцитов, хорошо совпадают с полученными в анализах связывания с рецептором. Потеря активности тройного мутанта по 40-ым положениям аминокислот RANTES в отношении хемотаксиса моноцитов соответствуют потере аффинности для CCR1.d) Анализы рекрутмента перитонеальных клеток Тройной мутант по 40-ым положениям аминокислот RANTES не был способен индуцировать рекрутмент клеток в брюшную полость в дозе (10 мкг/мышь), в то время как RANTES вызывает существенный рекрутмент (фиг. 6). Более того, если мутант в дозе 10 мкг вводили за 30 мин до введения RANTES, рекрутмент клеток,индуцируемый RANTES, подавлялся. Следовательно, потеря GAG-связывания давала ингибитор индуцированного хемокинами рекрутмента клеток in vivo. Аналогичные результаты представлены на фиг. 7 с усеченным (3-68) тройным мутантом по 40-ым положениям аминокислот RANTES (полученным в Pichia pastoris), на фиг. 8 с тройным мутантом по 40 ым положениям аминокислот MIP-1- (K45A-R46A-K48A) и на фиг. 9 с тройным мутантом по 40-ым положениям аминокислот MIP-l (R18A-R46A-R48A). Рекрутмент клеток, стимулированный тиогликолятом, также ингибировался тройным мутантом по 40-ым положениям аминокислот RANTES, как представлено на фиг. 10. е) Экспериментальный аутоиммунный энцефаломиелит (ЕАЕ) Тройной мутант по 40-ым положениям аминокислот RANTES показывал дозозависимый эффект на модели мышиного ЕАЕ. Было показано, что белок в дозах 1 мкг/мышь и 10 мкг/мышь, вводимый ежедневно в/б, начиная с 10-го дня после первичной иммунизации MOG, проявлял сравнимую эффективность со стандартным лечением рекомбинантным m-IFN- (фиг. 11). Начало заболевания существенно замедлялось, и тяжесть заболевания (что оценивали по площади под кривой) также значительно снижалась. Кроме того, среднее значение максимального количества баллов по клинике, полученное во время опыта, также снижалось. Другой мутант (тройной мутант по 40-ым положениям аминокислот MetRANTES) был не способен проявить положительное воздействие в том же опыте. Результаты заявителей показывают четкое положительное воздействие при лечении всеми тройными мутантами по 40-ым положениям аминокислот RANTES, которые уменьшают выраженность клинических признаков хронического ЕАЕ у мышей после иммунизации MOG. Следовательно, тройной мутант по 40-ым положениям аминокислот RANTES имеет положительный терапевтический эффект, и может применяться в качестве лечения при хронических демиелинизирующих заболеваниях, таких как MS. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение мутантного СС-хемокина, который содержит по меньшей мере две мутации в катионном сайте петли 40-ых положений аминокислот, как показано на фиг. 1, и который по сравнению с молекулой дикого типа обладает пониженной GAG-связывающей активностью, для получения фармацевтической композиции для лечения рассеянного склероза и/или других демиелинизирующих заболеваний, в котором хемокин выбран изRANTES, МIР-1 альфа, МIР-1 бета, MIP-3, HCCl, I309, I35612 и МСР-2. 2. Применение по п.1, в котором мутантный хемокин представляет собой мутантный RANTES. 3. Применение по п.2, в котором мутантный СС-хемокин представляет собой тройной мутантныйRANTES, в котором три основные аминокислоты в катионном сайте петли 40-ых положений аминокислот замещены другими аминокислотами. 4. Применение по п.3, в котором три основные аминокислоты в катионном сайте петли 40-ых положений аминокислот замещены аланином, серином, треонином, пролином или глицином. 5. Применение по п.4, в котором мутантный СС-хемокин представляет собой мутантный RANTES с аминокислотной последовательностью SEQ ID No: 2. 6. Применение по п.4, в котором мутантный СС-хемокин представляет собой усеченный и мутантный RANTES с аминокислотной последовательностью SEQ ID No: 3. 7. Применение по п.1, в котором мутантный СС-хемокин представляет собой мутантный MIP-1 альфа с аминокислотной последовательностью SEQ ID No: 4. 8. Применение по п.1, в котором мутантный СС-хемокин представляет собой мутантный MIP-1-бета с аминокислотной последовательностью SEQ ID No 5. 9. Фармацевтическая композиция для лечения рассеянного склероза и/или других демиелинизирующих заболеваний, включающая в качестве активного ингредиента мутантный хемокин, определенный в п.п.1-8, вместе с фармацевтически приемлемым наполнителем. 10. Усеченный и мутантный хемокин RANTES человека, имеющий аминокислотную последовательность SEQ ID No: 3. 11. Молекула ДНК, включающая последовательность ДНК, кодирующую усеченный и мутантныйRANTES по п.10. 12. Экспрессирующий вектор, который включает молекулу ДНК по п.11. 13. Клетка-хозяин, включающая экспрессирующий вектор по п.12. 14. Рекомбинантный способ получения хемокина RANTES по п.10, включающий культивирование в соответствующей питательной среде клеток по п.13, и выделение хемокина.
МПК / Метки
МПК: A61P 25/00, C12N 15/19, A61K 38/19, C07K 14/52
Метки: мутантный, мутантных, человека, склероза, лечения, хемокинов, хемокин, применение, рассеянного, rantes
Код ссылки
<a href="https://eas.patents.su/27-6137-mutantnyjj-hemokin-rantes-cheloveka-i-primenenie-mutantnyh-hemokinov-dlya-lecheniya-rasseyannogo-skleroza.html" rel="bookmark" title="База патентов Евразийского Союза">Мутантный хемокин rantes человека и применение мутантных хемокинов для лечения рассеянного склероза</a>
Предыдущий патент: Способ получения вируса или вирусного белка для получения вакцины
Следующий патент: Текучая композиция для жарения и способ ее получения
Случайный патент: Композиция для профилактики и лечения дизентерии свиней