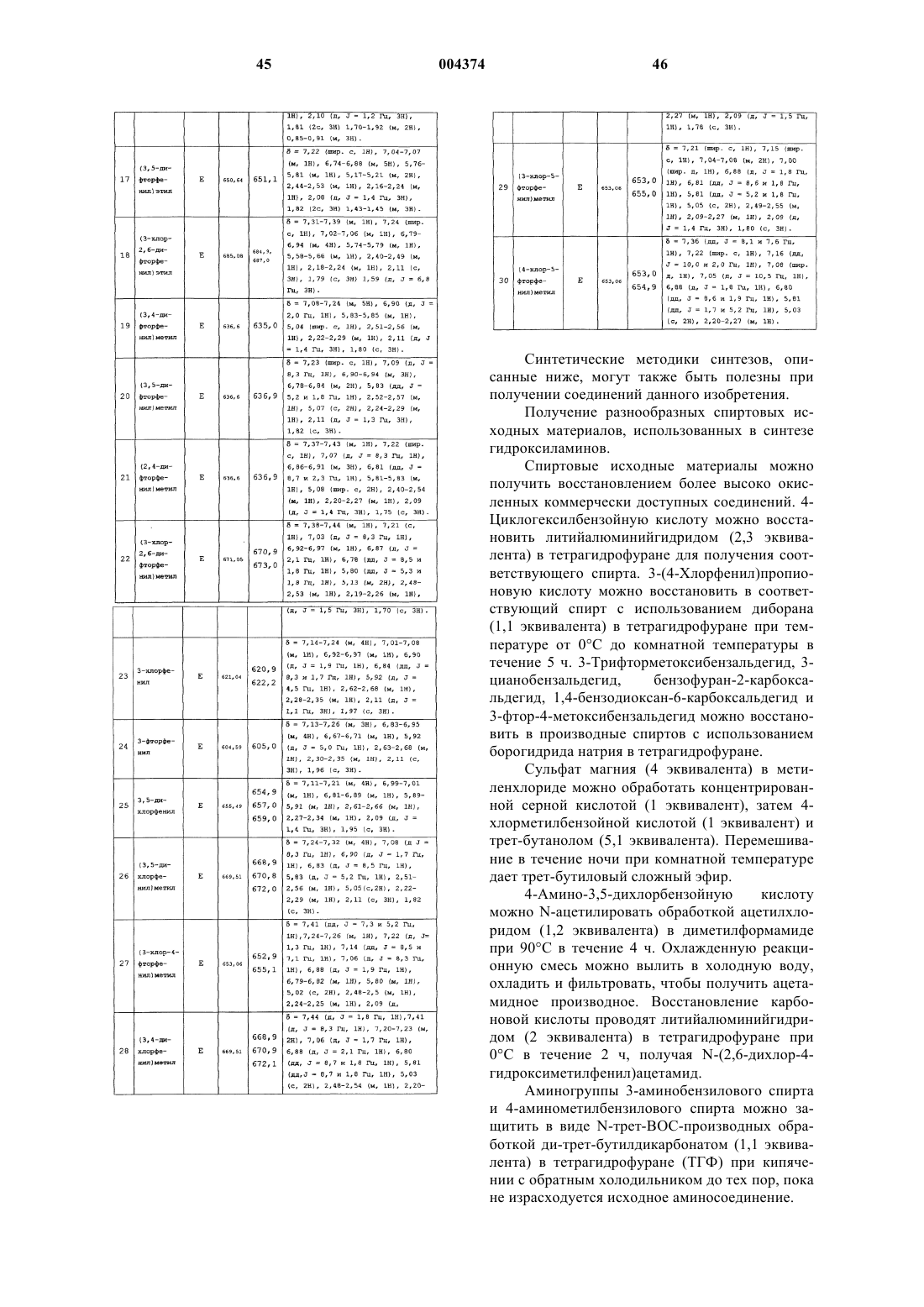
Производные 2″-деоксигигромицина
Формула / Реферат
1. Соединение формулы

или его фармацевтически приемлемые соли, пролекарства или сольваты,
где R1 и R2, взятые вместе, образуют =N-OR3, =CR4R3;
каждый R3 независимо выбирают из C1-C10-алкила, -(CH2)t(C3-C10-циклоалкила), -(CH2)t(C6-C10-арила) и -(CH2)t(4-10-членного гетероциклила), где t равно целому числу от 0 до 5 и где указанная алкильная группа необязательно содержит 1 или 2 гетерофрагмента -O-, при условии, что два атома O не соединяются непосредственно друг с другом, а указанные арильные и гетероциклические группы R3 необязательно конденсированы с кольцом бензола, C5-C8-насыщенной циклической группой или 4-10-членной гетероциклической группой, содержащей атомы C и O; и вышеуказанные группы R3, включая любые, необязательно конденсированные кольца, указанные выше, необязательно замещены 1-5 группами R5;
каждый R5 независимо выбирают из C1-C10-алкила, галогена, -OR6, -NR6R7, -(CH2)m(C6-C10-арила) и -(CH2)m(4-10-членного гетероциклила), где m равно целому числу от 0 до 4;
арильные группы R5 необязательно замещены 1-5 заместителями, независимо выбранными из галогена;
каждый R6 независимо выбирают из C1-C10-алкила.
2. Соединение по п.1, где R1 и R2 взяты вместе с образованием =N-OR3 и R3 представляет собой C1-C4-алкил, - (CH2)t(C6-C10-арил) или -(CH2)t(4-10-членный гетероциклил), где t равно целому числу от 0 до 3, гетероциклическая группа необязательно конденсирована с кольцом бензола, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой, и вышеупомянутые группы R3, в том числе указанные, необязательно конденсированные фрагменты необязательно замещены 1-5 заместителями, независимо выбранными из галогена, C1-C3-алкокси, пиперидинила, морфолино.
3. Соединение по п.1, где R1 и R2 взяты вместе с образованием =N-OR3 и R3 представляет -(CH2)t(C6-C10-арил) или -(CH2)t(4-10-членный гетероциклил), где t равно целому числу от 0 до 3, гетероциклическая группа необязательно конденсирована с кольцом бензола, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой и вышеупомянутые группы R3, в том числе указанные, необязательно конденсированные части необязательно замещены 1-5 заместителями, независимо выбранными из галогена, C1-C3-алкокси, пиперидинила, морфолино.
4. Соединение по п.1, где указанное соединение выбирают из группы, включающей
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-фторфенил)метил]оксим (4);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(бензофуран-2-ил)метил]оксим (6);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(бензофуран-2-ил)метил]оксим (6);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-фенилметилоксим (2);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-фенилметилоксим (2);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3,4-дихлорфенил)метил]оксим (28);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3,4-дифторфенил)метил]оксим (19);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(1,3-бензодиоксол-5-ил)метил]оксим (3);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(1,3-бензодиоксол-5-ил)метил]оксим (3);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлорфенил)метил]оксим (1);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(бензофуран-5-ил)метил]оксим (6);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритро-гексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[(бензофуран-5-ил)метил]оксим (6);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-фтор-4-метоксифенил)метил]оксим (7);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-нео-инозит, (E)-O-[(3,4-дигидро-2H-1-бензопиран-4-ил)метил]оксим (5);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлор-4-фторфенил)метил]оксим (27);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлор-5-фторфенил)метил]оксим (29);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3,5-дифторфенил)метил]оксим (20);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[1-(2,4-дифторфенил)пропил]оксим (16);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[1-(3,4-дифторфенил)этил]оксим (15);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O-[1-(2,4-дифторфенил)этил]оксим (14);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[1-(3,5-дифторфенил)этил]оксим (17);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[1-(3-хлор-2,6-дифторфенил)этил]оксим (18);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлор-2,6-дифторфенил)метил]оксим (22);
5-деокси-5-[[3-[4-[(2,6-дидеокси-b-D-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(2,4-дифторфенил)метил]оксим (21);
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-хлорфенил)]оксим (23);
5-деокси-5-[[3-[4-[(6-деокси-b-D-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-O-[(3-фторфенил)]оксим (24)
и фармацевтически приемлемые соли, пролекарства и сольваты указанных соединений.
5. Фармацевтическая композиция для лечения бактериальной инфекции, протозойной инфекции или нарушения, связанного с бактериальной или протозойной инфекцией, у млекопитающих, рыб или птиц, которая включает терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
6. Способ лечения бактериальной инфекции, протозойной инфекции или нарушения, связанного с бактериальной или протозойной инфекцией, у млекопитающих, рыб или птиц, который включает введение указанным млекопитающим, рыбам или птицам терапевтически эффективного количества соединения по п.1.
7. Способ получения соединения по п.1, где R1 и R2, взятые вместе, образуют =N-OR3, который включает обработку соединения формулы 4
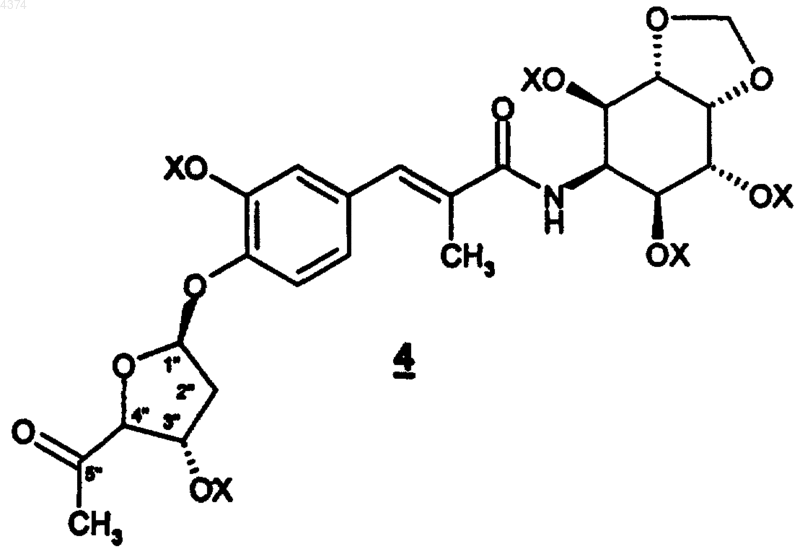
где X представляет собой защитную группу, гидроксиламином формулы H2N-OR3 или солью указанного гидроксиламина, где R3 такой, как определено выше, в инертном растворителе, необязательно с добавлением основания, если используют соль гидроксиламина, при температуре, составляющей от около 0 до 65шC, и последующее снятие защиты с использованием источника фторид-иона.
8. Способ по п.7, где указанным инертным растворителем является метанол, этанол или пиридин или смесь вышеуказанных растворителей, причем необязательными указанными основаниями являются Na2CO3 или K2CO3, указанный интервал температур составляет от 50 до 60шC и указанным источником фторид-иона является фторид тетрабутиламмония или комплекс фтористый водород-пиридин.
Текст
1 Данное изобретение относится к новым производным 2"-дезоксигигромицина А, которые могут быть полезны в качестве антибактериальных и антипротозойных агентов для млекопитающих, в том числе людей, а также рыб и птиц. Это изобретение относится также к фармацевтическим композициям, содержащим эти новые соединения, и способам лечения бактериальных и протозойных инфекционных болезней млекопитающих, рыб и птиц путем введения этих новых соединений млекопитающим, рыбам и птицам, для которых требуется такое лечение. Соединения данного изобретения можно получить из гигромицина А. Гигромицин А является полученным ферментацией природным продуктом, впервые выделенным из Streptomyces hygroscopicus в 1953. В качестве антибиотика гигромицин А обладает активностью против патогенов человека и, как сообщается, обладаетin vitro сильной активностью против Serpulina(Treponema) hyodydenteriae, который вызывает дизентерию у свиней. Несколько ссылок относится к полусинтетическим модификациям гигромицина А, включая: превращение 5"-кетона гигромицина А в 2,4-динитрофенилгидразон приводится в К. Isono et al., J. Antibiotics 1957, 10, 21, и R.L. Mann and D.O. Woolf, J.Hecker et al., Bioorg. Med. Chem. Lett., 1992, 2,533 и S.J. Hecker et al., Bioorg. Med. Chem. Lett.,1933, 3, 295; аналоги фуранозы приводятся в В.Н. Jaynes et al., Bioorg. Med. Chem. Lett., 1993,3, 1531, и В.Н. Jaynes et al., J. Antibiot. 1992, 45,1705; аналоги с ароматическим кольцом приведены в S.J. Hecker et al., Bioorg. Med. Chem.Med. Chem. Lett., 1997, 7, 1747; енамидные аналоги приведены в S.J. Hecker et al., Bioorg. Med.Chem. Lett., 1992, 2, 533; аналоги аминоциклических спиртов приведены в S.J. Hecker et al.,Bioorg. Med. Chem. Lett., 1992, 2, 1015, и S.J.Heckrt et al. , Bioorg. Med. Chem. Lett., 1992, 2,1043. Производные гигромицина данного изобретения обладают активностью как против грамположительных, так и против грамотрицательных бактерий и простейших. Предварительная заявка на патент Соединенных Штатов 60/084058, выданная 4 мая 1998 и озаглавленная HygromycinDerivatives (номер дела поверенного PC 10057),с названными авторами изобретения К.Е.Brighty, R.G. Linde II, M.R. Jefson, E.L. McCormick and S.S. Guhan, также относится к аналогам гигромицина А и включается здесь в качестве ссылки во всей ее полноте. Краткое изложение сущности изобретения Данное изобретение относится к соединениям формулы и их фармацевтически приемлемым солям, пролекарствам и сольватам, в которойOR3 или =CR4C (О) NR3R4; каждый R3 независимо выбирают из Н, С 1 С 10-алкила, С 2-С 10-алкенила, -(CH2)t(С 3-С 10 циклоалкила), -(СН 2)t(С 6-С 10-арил), и -(СН 2)t(410-членный гетероциклил (гетероциклической группы, где t равно целому числу, от 0 до 5,причем указанная алкильная группа, необязательно, содержит 1 или 2 гетерофрагмента, выбранных из О, -S(O)j, где j равно целому числу,от 0 до 2, и -N(R7)-, при условии, что два атома О, два атома S или атом О и атом S не соединяются непосредственно друг с другом, причем указанные циклоалкильные, арильные и гетероциклические группы R3 необязательно конденсированы с кольцом бензола, С 5-С 8-насыщенной циклической группой или 4-10-членной гетероциклической группой; фрагменты -(CH2)t- выше указанных групп R3, необязательно, включают в себя углерод-углеродную двойную или тройную связь, где t равно целому числу, от 2 до 5; и выше указанные группы R3, за исключением Н, но включая любые, необязательно, конденсированные кольца, указанные выше, необязательно,замещены 1-5-ю группами R5; каждый R4 независимо представляет собой Н или C1-С 10-алкил; каждый R5 независимо выбирают из C1 С 10-алкила, С 3-С 10-циклоалкила, галогена, циано, нитро, трифторметила, дифторметокси,трифторметокси,азидо,-OR6,-C(O)R6,6 7 9 6(С 6-С 10-арил) и -(СН 2)m(4-10-членный гетероциклил), где m равно целому числу, от 0 до 4; причем указанная алкильная группа, необязательно, содержит 1 или 2 гетерофрагменты, выбранных из О, -S(O)j-, где j равно целому числу,от 0 до 2, и -N(R7)-, при условии, что два атома О, два атома S или атом О и атом S не соединяются непосредственно друг с другом; причем указанные циклоалкильные, арильные и гетероциклические группы R5, необязательно, конденсированы с С 6-С 10-арильной группой, С 5-С 8 насыщенной циклической группой или 4-10 членной гетероциклической группой; и указанные алкильные, циклоалкильные, арильные и 3 гетероциклические группы R5, необязательно,замещены 1-5-ю заместителями, независимо выбранными из галогена, циано, нитро, дифторметокси, трифторметила, трифторметокси,азидо,-NR7SO2R9,-SO2NR6R7,-C(O)R6,6 6 7 9-С(О)OR , -OC(O)R , -NR C(O)OR , -NR7C(O)R6,-C(O)-NR6R7, -NR6R7, -OR6, C1-С 10-алкила,-(СН 2)m(С 6-С 10-арила) и -(CH2)m(4-10-членного гетероциклила), где m равно целому числу, от 0 до 4; каждый R6 независимо выбирают из Н, C1 С 10-алкила, С 3-С 10-циклоалкила, -(СН 2)m(С 6-С 10 арила) и -(СН 2)m(4-10-членного гетероциклила),где m равно целому числу, от 0 до 4, причем указанная алкильная группа, необязательно,включает в себя 1 или 2 гетерофрагменты, выбранных из О, -S(O)j, где j равно целому числу,варьирующемуся от 0 до 2, и -N(R7)-, при условии, что два атома О, два атома S или атом О и атом S не соединяются непосредственно друг с другом, указанные циклоалкильные, арильные и гетероциклические группы R6 необязательно конденсированы с С 6-С 10-арильной группой, С 5 С 8-насыщенной циклической группой или 4-10 членной гетероциклической группой; и вышеуказанные заместители R6, за исключением Н,необязательно, замещены 1-5-ю заместителями,независимо, выбранными из галогена, циано,нитро, дифторметокси, трифторметила, трифторметокси,азидо,-C(O)R7,-С(О)OR7,7 7 8 7 8-OC(O)R , -NR C(O)R , -C(O)NR R , -NR7R8,гидрокси, С 1-С 6-алкила и С 1-С 6-алкокси; каждый из R7 и R8 независимо представляет собой Н или C1-C6-алкил иR9 выбирают из заместителей, приведенных в определении R6, за исключением Н. Предпочтительные соединения формулы 1 включают в себя соединения, где R1 и R2, взятые вместе, образуют =N-OR3, где R3 представляет собой С 1-С 4-алкил, С 2-С 4-алкенил, -(СН 2)t(C6C10-арил) или -(СН 2)t(4-10-членный гетероциклил), где t равно целому числу, от 0 до 3, гетероциклическая группа, необязательно, конденсирована с кольцом бензола, арильная группа,необязательно, конденсирована с 5- или 6 членной гетероциклической группой, и вышеупомянутые группы R3, в том числе указанные,необязательно, конденсированные фрагменты,необязательно, замещены 1-5-ю заместителями,независимо, выбранными из нитро, галогена, C1 С 3-алкокси, С 1-С 4-алкила, трифторметила, ацетамидо, трет-бутоксикарбониламино, третбутоксикарбониламинометила,трет-бутоксикарбонила, NR6R7, фенила, циклогексила, карбокси, аминометила, дифторметокси, трифторметокси, циано, пиперидинила, морфолино, фенокси и фенилтио. Другие предпочтительные соединения формулы 1 включают в себя соединения, где R1 и R2, взятые вместе, образуют =N-OR3 и R3 представляет -(СН 2)t(С 6-С 10-арил) или -(СН 2)t(410-членный гетероциклил), где t равно целому 4 числу, от 0 до 3, гетероциклическая группа, необязательно, конденсирована с кольцом бензола, арильная группа, необязательно, конденсирована с 5- или 6-членной гетероциклической группой, и вышеупомянутые группы R3, в том числе указанные, необязательно, конденсированные части, необязательно, замещены 1-5-ю заместителями, независимо, выбранными из нитро, галогена, C1-С 3-алкокси, С 1-С 4-алкила,дифторметокси, трифторметила, ацетамидо,трет-бутоксикарбонила, трет-бутоксикарбониламино, -NR6R7, фенила, циклогексила, карбокси,трет-бутоксикарбониламинометила, аминометила, трифторметокси, циано, пиперидинила,морфолино, фенокси и фенилтио. Другие предпочтительные соединения формулы 1 включают в себя соединения, где R1 представляет собой Н, R2 представляет собой-(СН 2)t(4-10-членный гетероциклил), где t равно целому числу, от 0 до 2, группа R3 необязательно замещена 1-5-ю заместителями, независимо выбранными из галогена, C1-С 3-алкокси, С 1-С 4 алкила и трифторметила. Другие предпочтительные соединения формулы 1 включают в себя соединения, где R1 представляет собой Н, R2 представляет собой-NR4C(O)R3, R4 представляет собой Н и R3 представляет С 3-С 6-циклоалкил, -(СН 2)t(С 6-С 10-арил) или -(СН 2)t(4-10-членный гетероциклил), где t равно целому числу, от 0 до 2, арильная группа,необязательно, конденсирована с 5- или 6 членной гетероциклической группой, гетероциклическая группа, необязательно, конденсирована с кольцом бензола и вышеупомянутые группы R3, в том числе указанные, необязательно, конденсированные части, необязательно,замещены 1-5-ю заместителями, независимо,выбранными из галогена, C1-С 3-алкокси, С 1-С 4 алкила и трифторметила. Другие предпочтительные соединения формулы 1 включают в себя соединения, где R1 и R2 взяты вместе с образованием =CR4C(O)OR3 или =CR4C(O)NR3R4, R4 представляет собой Н иR3 представляет собой Н, C1-С 6-алкил, С 3-С 6 циклоалкил, -(CH2)t(4-10-членный гетероциклил) или -(СН 2)t(С 6-С 10-арил), где t равно целому числу, от 0 до 2, арильная группа, необязательно конденсирована с 5- или 6-членной гетероциклической группой, гетероциклическая группа, необязательно, конденсирована с кольцом бензола и вышеупомянутые группы R3, за исключением Н, но включая указанные необязательно, конденсированные фрагменты, необязательно, замещены 1-5-ю заместителями, независимо, выбранными из галогена, C1-С 4-алкокси,С 1-С 4-алкила, -NR6R7 и трифторметила. Другие предпочтительные соединения формулы 1 включают в себя соединения, где R1 представляет собой Н, R2 представляет собой-(СН 2)t(С 6-С 10-арил), где t равно целому числу,от 1 до 2, арильная группа, необязательно конденсирована с 5- или 6-членной гетероциклической группой, гетероциклическая группа, необязательно, конденсирована с кольцом бензола и вышеупомянутые группы R3, включая указанные, необязательно, конденсированные фрагменты, необязательно, замещены 1-5-ю заместителями, независимо выбранными из галогена,C1-C3-алкокси, С 1-С 4-алкила, циклогексила,циано, трифторметила, бензилокси и трифторметила. Другие предпочтительные соединения формулы 1 включают в себя соединения, где R1 представляет собой Н, R2 представляет собой-OC(O)NR3R4, R4 представляет собой Н и R3 представляет -(СН 2)t(C6-C10-арил), где t равно целому числу, от 0 до 2, и группа R3, необязательно замещена 1-5-ю заместителями, независимо, выбранными из галогена, С 1-С 3-алкокси,С 1-С 4-алкила и трифторметила. Конкретные предпочтительные соединения формулы 1 включают в себя соединения,выбранные из группы, включающей 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-О[(3-фторфенил)метил]оксим; 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-O[(3-фторфенил)метил]оксим; 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-O[(бензофуран-2-ил)метил]оксим; 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-О[(бензофуран-2-ил)метил]оксим; 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-Офенилметилоксим; 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)О-фенилметилоксим; 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O[(4-хлорфенил)метил]оксим; 5-деокси-5-3-[4-[(2,6-дидеоксиD 004374 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит,(Z)-О-[(2,3,5,6 тетрафторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит, (Е)-О-[(2,3-дифторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(2,3-дифторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(4-фенилфуран 3-ил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(4-фенилфуран 3-ил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-O-[(4-фенилфуран 2-ил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(4-фенилфуран 2-ил) метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2 О-метилен-D-неоинозит, (Е)-O-[(2,3-дифтор-6 метоксифенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(2,3-дифтор-6 метоксифенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(3-хлортиофен 2-ил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3-хлортиофен 2-ил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(5-хлортиофен 2-ил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритро 17 гексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(5-хлортиофен 2-ил)метил]оксим; и фармацевтически приемлемые соли,пролекарства и сольваты указанных соединений. В более конкретном варианте данное изобретение включает в себя следующие соединения: 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-O-[(1,3-бензодиоксол-5-ил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-O-[(3-хлорфенил) метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3-хлорфенил) метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-O-[(3-фторфенил) метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит, (Z)-О-[(3-фторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит,(Z)-О-[(бензофуран-2-ил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-O-[(3,5-дихлорфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3,5-дифторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит,(Е)-O-[(3,5-дифторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит,(Z)-O-[(3-хлор-2 фторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритро 004374 18 гексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-O-[(3-хлор-2-фторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит, (Z)-O-[(3-хлор-4 фторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-O-[(3-хлор-4-фторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-O-[(4-хлор-3-фторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит, (Е)-O-[(4-хлор-3 фторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(4-фторфенил) метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(4-фторфенил) метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-O-[(4-хлорфенил) метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(4-хлорфенил) метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(4-фенилфуран 2-ил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-O-[(3-хлор-5-фторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(3,4-дифторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифе 19 нил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(3,4-дифторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-O-[(2,3-дифторфенил)метил]оксим; 5-деокси-5-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(2,3,5,6-тетрафторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-(3-хлор-4-фторфенил)оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-(3-хлор-4-фторфенил)оксим; 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Z)-О-[(5-хлортиофен 2-ил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит,(Е)-О-[(3-хлор-2,6 дифторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2 О-метилен-D-неоинозит,(Z)-O-[(4-хлор-2,6 дифторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2O-метилен-D-неоинозит, (Е)-О-[(2,4-дифторфенил)метил]оксим; 5-деокси-5-3-[4-[(6-деоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит, (Z)-О-[(2,4-дифторфенил)метил]оксим; и фармацевтически приемлемые соли,пролекарства и сольваты указанных соединений. Данное изобретение относится также к фармацевтической композиции для лечения нарушений, из числа: бактериальной и протозойной инфекций, и нарушений, связанных с бактериальными инфекциями или протозойным инфекциями, у млекопитающих, рыб или птиц,которая включает в себя терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. 20 Изобретение относится также к способу лечения нарушения, выбранного из бактериальной и протозойной инфекций, а также нарушений, связанных с бактериальными инфекциями или протозойными инфекциями, у млекопитающих, рыб или птиц, который включает введение указанному млекопитающему, рыбе или птице терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Используемый здесь термин лечение,если не оговорено особо, означает развитие в противоположном направлении, облегчение,ингибирование развития или профилактику нарушения или состояния, для которого такой термин используют, или одного или нескольких симптомов такого нарушения или состояния. Термин treatment, используемый здесь, относится к лечебному действию, где лечение определено непосредственно. Если не оговорено особо, используемые здесь термины или фразы бактериальная инфекция(и), протозойная инфекция(и) и нарушения, связанные с бактериальными инфекциями или протозойными инфекциями, включают в себя следующее: пневмонию, воспаление среднего уха, синусит, бронхит, тонзиллит и мастоидит, связанные с инфекцией Streptococcusfaecalis, E. faecium, E. casselflavus, S. epidermidis,S. haemolyticus или Peptostreptococcus spp.; фарингит, ревматическую атаку и гломерулонефрит, связанные с инфекцией Streptococcus pyogenes, стрептококками групп С и G, Corynebacterium diptheriae или Actinobacillus haemolyticum; инфекционные заболевания дыхательных путей, связанные с инфекцией MycoplasmaChlamydia pneumoniae; инфекционные заболевания крови и тканей, в том числе эндокардит и остеомиелит, вызванные S. aureus, S. haemolyticus, E. faecalis, E. faecium, E. durans, в том числе штаммами, устойчивыми к известным антибактериальным средствам, таким как, но не ограничиваясь ими, бета-лактамы, ванкомицин, аминогликозиды, хинолоны, хлорамфеникол, тетрациклины и макролиды; неосложненные инфекционные заболевания кожи и абсцессы и послеродовой сепсис, связанные с инфекциейBartonella henselae; неосложненные острые инфекционные заболевания мочевых путей, связанные с инфекцией Staphylococcus aureus, коагулаза-отрицательными стафилококковыми ви 21 дами или Enterococcus spp.; уретрит и цервицит; передающиеся половым путем заболевания,связанные с инфекцией Chlamydia trachomatis,Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorreae; заболевания, вызванные токсинами связанные с инфекцией S. aureus (пищевое отравление и синдром токсического шока) или стрептококками групп А, В и С; язвы, связанные с инфекциейMycobacterium intracel-lulare; инфекционные заболевания, вызванные Mycobacterium tuberculosis, M. Leprae, M. Paratuberculosis, M. kansasii или М. chelonei; гастроэнтерит, связанный с инфекцией Campylobacter jejuni; кишечные простейшие, связанные с инфекцией Cryptosporidium spp.; одонтогенные инфекции, связанные с инфекцией зеленящими стрептококками; хронический кашель, связанный с инфекцией Bordetella pertussis; газовая гангрена, связанная с инфекцией Clostridium perfringenes или Bacteriodes spp.; и атеросклероз или сердечнососудистое заболевание, связанное с инфекциейHelicobacter pylori или Chlamydia pneumoniae. Бактериальные и протозойные инфекции и нарушения, связанные с такими инфекциями, которые можно лечить или предупредить у животных, включают в себя следующие: респираторные заболевания коров, связанную с инфекцией P. haemolytica, P. multocida, Mycoplasma(т.е. neosporium); инфекционные болезни кожи и мягких тканей у собак и кошек, связанные с инфекцией S. epidermidis, S. intermedius, коагулазаотрицательным Staphylococcus или P. multocida, и инфек 004374 22 ционные болезни зубов и полости рта у собак и кошек, связанные с инфекцией Alcaligenes spp.,Bacteroides spp., Clostridium spp., Enterobacterspp., Eubacterium, Peptostretococcus, Porphyromonas или Prevotella. Другие бактериальные инфекционные заболевания и протозойные инфекционные заболевания и нарушения, связанные с такими инфекциями, которые можно лечить или предупредить способом данного изобретения, указываются в J.P. Sanford et al. , TheSanford Guide To Antimicrobal Therapy, 26th Edition (Antimicrobial Therapy, Inc., 1996). Используемый здесь термин галоген, если не оговорено особо, включает в себя фтор,хлор, бром или иод. Предпочтительными галогеновыми группами являются фтор, хлор и бром. Используемый здесь термин алкил, если не оговорено особо, включает в себя насыщенные одновалентные углеводородные радикалы,имеющие неразветвленные или разветвленные части. Указанная алкильная группа может включать в себя одну или две двойные или тройные связи. Должно быть понятно, что для включения в указанную алкильную группу углерод-углеродной двойной или тройной связи необходимо наличие в ней по меньшей мере двух атомов углерода. Используемый здесь термин арил, если не оговорено особо, включает в себя органический радикал, образованный из ароматического углеводорода путем удаления одного водорода,такой как фенил или нафтил. Используемый здесь термин 4-10 членный гетероцикл если не оговорено особо,включает в себя ароматические и неароматические углеводородные группы, содержащие один или несколько гетероатомов, каждый из которых выбирают из О, S и N, где каждая гетероциклическая группа имеет 4-10 атомов в своей циклической системе. Неароматические гетероциклические группы включают в себя группы,имеющие только 4 атома в свой циклической системе, но ароматические гетероциклические группы должны иметь по меньшей мере 5 атомов в своей циклической системе. Эти гетероциклические группы включают бензоконденсированные циклические системы и циклические системы, замещенные одной или несколькими оксогруппами. Примером 4-членной гетероциклической группы является азетидинил (образован из азетидина). Примером 5-членной гетероциклической группы является тиазолил и примером 10-членной гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил,тетрагидрофуранил,тетрагидротиенил, тетрагидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино,тиоксанил, пиперазинил, азетидинил, оксетанил,тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепинил, тиазепинил, 23 1,2,3,6-тетрагидропиридинил, 2-пирролинил, 3 пирролинил, индолинил, 2 Н-пиранил, 4 Нпиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил,дигидротиенил, дигидрофуранил, пиразолидинил, имидазолидинил, имидазолинил, 3 азабицикло[3.1.0]гексанил, 3-азабицикло[4.1,0] гептанил, 3H-индолил и хинолизинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксазолил, изотиазолил, пирролил, хинолинил,изохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксодиазолил,тиадиазолил, фуразанил, бензофуразанил, бензотиофенил, бензотиазолил, бензоксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинилу. Упомянутые группы, образуемые из перечисленных выше соединений, могут быть С- или N-присоединенными, когда такое возможно. Например, группа, образованная из пиррола, может быть пиррол-1-илом (Nприсоединенная) или пиррол-3-илом (Сприсоединенная). Используемая здесь фраза фармацевтически приемлемая соль(и) если не оговорено особо, включает в себя соли кислотных или основных групп, которые могут присутствовать в соединениях данного изобретения. Соединения данного изобретения, которые имеют природу основания, способны образовать большое число солей с различными неорганическими и органическими кислотами. Кислотами, которые можно использовать для получения фармацевтически приемлемых аддитивных солей таких основных соединений, являются кислоты, которые образуют нетоксичные кислотно-аддитивные соли,т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат,ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат,сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат,глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)]. Соединения данного изобретения, которые включают в себя основную группу, такую как аминогруппа, могут образовать фармацевтически приемлемые соли с различными аминокислотами, в дополнение к указанным выше кислотам. Те соединения данного изобретения, которые имеют природу кислоты, способны образовывать соли с основаниями с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочно-земельных металлов и, 004374 24 особенно, кальциевые, магниевые, натриевые и калиевые соли соединений данного изобретения. Соединения данного изобретения имеют асимметричные центры и, следовательно, существуют в разных энантиомерных и диастереомерных формах. Это изобретение относится к использованию всех оптических изомеров и диастереоизомеров соединений данного изобретения и их смесей и всех фармацевтических композиций и способов лечения, которые могут использовать или содержать их. В этом отношении, изобретение включает как Е-, так и Zконфигурации группы -OR3, соединенной с азотом, где R1 и R2 вместе образуют оксимную группу формулы -N=OR3. Соединения формулы 1 могут существовать также как таутомеры. Это изобретение относится к использованию таких таутомеров и их смесей. Предмет изобретения включает в себя также меченые изотопами соединения и их фармацевтически приемлемые соли, которые идентичны соединениям, указанным в формуле 1, за исключением того, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа атома,обычно обнаруживаемого в природе. Примеры изотопов, которые можно вводить в соединения изобретения, включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, фтор и хлора, такие как 2 Н, 3 Н, 13 С, 14 С, 15N, 18O, 17O,35S, 18F и 36 Сl, соответственно. Соединения данного изобретения, пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, находятся в пределах объема этого изобретения. Некоторые меченые изотопом соединения данного изобретения, например, соединения, в которые введены радиоактивные изотопы, такие как 3 Н и 14 С, можно использовать в анализах распределения лекарственного средства и/или субстрата в тканях. Изотопы тритий, т.е. 3 Н, и углерод-14, т.е. 14 С, особенно предпочтительны из-за легкости их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может обеспечить некоторые терапевтические преимущества, являющиеся результатом более высокой метаболической стабильности, например, может повысить период полувыведения in vivo или снизить дозовые потребности и, отсюда, могут быть предпочтительны в некоторых случаях. Меченые изотопами соединения формулы 1 этого изобретения и их пролекарства обычно можно получить проведением по методикам, описанным в приведенных ниже схемах и/или в примерах или получениях, путем замены не меченого изотопом реагента на легко доступный, меченый изотопом реагент. 25 Это изобретение включает в себя также фармацевтические композиции, содержащие пролекарства соединений формулы 1, и способы лечения бактериальных инфекций путем введения пролекарств соединений формулы 1. Соединения формулы 1, имеющие свободные амино, амидо, гидрокси или карбоксильные группы,можно превратить в пролекарства. Пролекарства включают в себя соединения, где аминокислотный остаток или полипептидная цепь из двух или более (например, двух, трех или четырех) аминокислотных остатков ковалентно соединяется через амидную или сложноэфирную связь со свободной амино, гидрокси или карбоксигруппой соединений формулы 1. Аминокислотные остатки включают в себя, но не ограничиваются ими, 20 природных аминокислот,обычно обозначаемых символами из трех букв,и включают также 4-гидроксипролин, гидроксилизин, демозин, изодемозин, 2-метилгистидин, норвалин, бета-аланин, гамма-аминомасляную кислоту, цитруллин, гомоцистеин, гомосерин, орнитин и метионинсульфон. В изобретение включаются также дополнительные типы пролекарств. Например, свободные карбоксильные группы могут быть превращены в производные, амиды или алкиловые сложные эфиры. Такие амидные и сложноэфирные группы могут включать в себя группы,включающие, но не ограничивающиеся ими,функциональные группы простого эфира, амина и карбоновой кислоты. Свободные гидроксигруппы могут быть превращены в производные с использованием групп, включающих, но не ограничивающихся ими, полусукцинаты, фосфатные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, как описывается в D. Fleisher, R. Bong, B.H. Stewart, AdvancedDrug Delivery Reviews (1996) 19, 115. Включаются также карбаматные пролекарства гидрокси- и амидогрупп, так же как карбонатные пролекарства и сульфатные эфиры гидроксигрупп. Сюда входит также превращение гидроксигрупп в производные, как например, (ацилокси)метиловые и (ацилокси)этиловые простые эфиры, где ацильная группа может быть алкиловым сложным эфиром, необязательно, замещенным группами, включающими в себя, но не ограничивающимися ими, функциональные группы простого эфира, амина и карбоновой кислоты, или где ацильная группа является эфиром аминокислоты, как описано выше. Пролекарства этого типа описываются в R.P. Robinsonet al., J. Medicinal Chemistry (1996) 39, 10. Селективное введение боковых цепей пролекарства можно проводить на гидроксигруппах молекулы - ядра гигромицина А. Например, исчерпывающее силилирование шести гидроксигрупп гигромицина А можно проводить, например, трет-бутилдиметилсилилхлоридом. При воздействии на гексасилилпроизводное карбонатом калия в метаноле при комнатной темпе 004374 26 ратуре происходит селективное удаление фенольной силильной группы, что дает возможность проводить дальнейшую селективную модификацию в этом положении. Подробное описание изобретения Получение соединений данного изобретения иллюстрируется в следующих схемах. Схема 1 Соединения данного изобретения легко получаются. Что касается схемы, приведенной выше, исходным соединением формулы 2 является гигромицин А, который можно получить по методикам, известным специалисту в данной области, таким как ферментация Streptomyceshygroscopicus NRRL 2388. Метилкетон на фура 27 нозном сахаре молекулы гигромицина А может существовать в S-конфигурации (гигромицин А) или R-конфигурации (эпигигромицин) на фуранозном сахаре. Когда в качестве модели для ферментации и выделения гигромицина А (патент США 3100176; Antibiotic Chemotherapy(1953)3:, 1268-1278, 1279-1282) используют опубликованные протоколы, гигромициновый продукт является смесью приблизительно 3:1 гигромицина A (4"-(S)-эпимер) с бета-ориентированным метилкетоном на фуранозном сахаре,как изображено на рисунке, и эпигигромицина. В литературе (Journal of Antibiotic 33(7), 695704, 1980) известно, что чистый гигромицин А превращается в эпигигромицин в щелочных растворах. Путем осторожного регулирования рН ниже 6,9 во время ферментации и рН, температуры и воздействия растворителя во время процесса очистки отношение гигромицин А: эпигигромицин конечного выделенного продукта можно улучшить до соотношения 14:1. С использованием этого материала можно получить,по существу, отдельные изомеры, образованные из 4"-(S)-гигромицина, для использования в качестве эталонов для дальнейших синтетических модификаций. Гигромицин А, обогащенный 4"-(S)эпимером, получают ферментацией Streptomyces hygroscopicus NRRL 2388 или его мутантов в среде со значением рН, регулируемой до менее чем 6,9, предпочтительно от 6,2 до 6,7, на протяжении всего процесса. Как известно специалистам в данной области, среда содержит ассимилируемые источники углерода, азота и микроэлементов. Ферментацию проводят при температуре около 25-35 С, предпочтительно около 29 С. Ферментацию контролируют хроматографией, например, высокоэффективной жидкостной хроматографией. Инкубацию продолжают до тех пор, пока выход соединения не достигнет максимального, обычно, в течение периода приблизительно от 3 до 10 дней, предпочтительно приблизительно от 4 до 6 дней. Образование эпигигромицина минимизируют во время процесса очистки путем использования водного буфера (вместо воды без буфера) и регулирования рН активных потоков приблизительно до 6,0. Образование эпигигромицина также минимизируют путем минимизации времени, в течение которого выделенный материал подвергается действию высоких температур. Так, когда необходимо снизить концентрации растворителей, предпочтительно разбавление активных потоков водным буфером, что позволяет избежать использования роторного испарения при повышенных температурах. Кроме того, в качестве средства, позволяющего избежать более высоких температур для концентрирования активного раствора до конечной стадии очистки с целью снижения объема раствора (для чего требуется кипячение), можно использовать колонку со смолой. Конечной ста 004374 28 дией очистки в этом процессе является концентрирование активных фракций для получения твердого вещества с использованием вакуума и температуры бани около 35-50 С. Период, в течение которого раствор подвергают повышенным температурам, можно минимизировать постадийным кипячением. Соединения формулы 1 можно получить из соединения формулы 4. В этом способе соединение формулы 3 (где X представляет защитную группу, как описано ниже) получают путем защиты всех гидроксигрупп гигромицина А, за исключением гидрокси группы у 2"-углерода(С-2"), в виде их силильных эфиров с использованием подходящего реагента, такого как триэтилсилилхлорид (TESCl), триметилсилилхлорид(TMSCl) или трет-бутилдиметилсилилхлорид (TBDMSCl). Предпочтительным способом является использование 10 экв.TBDMS1 и имидазола в N,N-диметилформамиде (ДМФ) при температуре 25-40 С в течение 12-36 ч. Соединение формулы 4 затем получают удалением гидроксигруппы с использованием способа Barton et al., J. Chem. Soc, Perkin Trans. I 1975, 1574. Предпочтительным способом в этом случае является способ Genu-Dellac et al., Carbohydrate Res. 1991, 216, 249. Соединения формулы 1, где R1 и R2 взяты вместе с образованием =NOR3, где R3 такой, как определено выше, можно получить обработкой соединения формулы 4 гидроксиламином формулы R3ONH2 с использованием свободного основания или соли гидроксиламина, предпочтительно, свободного основания гидроксиламина. Реакцию проводят в инертном растворителе, таком как метанол, с добавлением основания, такого как К 2 СО 3, если используют соль,например соль гидроксиламина с НСl, при температуре, составляющей от около 0 до 65 С,предпочтительно, от 0 до 25 С. Защитные группы затем удаляют кислотой, такой как уксусная кислота, фтористо-водородная, комплекс фтористый водород-пиридин, или источником фторида-иона, таким как фторид тетрабутиламмония (TBAF). Гидроксиламин формулы R3ONH2 можно получить с использованием одной или нескольких методик, описанных в Bioconjugate(1967)15, 345. Соединения формулы 1, где R1 и R2 взяты вместе с образованием кетона формулы =O,можно получить обработкой соединения формулы 4 кислотой, такой как уксусная кислота,фтористо-водородная, комплекс фтористый водород-пиридин, или источником фторид-иона,таким как фторид тетрабутиламмония (TBAF),предпочтительно, комплексом фтористый водород-пиридин. Соединения формулы 1, где R1 представляет Н и R2 представляет -NR3R4, где R3 и R4 такие, как определено выше, можно синтезиро 29 вать восстановительным аминированием в положении С-5"-кетона соединения формулы 4. Смешивание R4NH2 и соединения формулы 4 в инертном растворителе и обработка восстанавливающим агентом, таким как NaBH4,NaBH(OAc)3 (Ac представляет ацетил) илиNaCNBH3, дает продукт с R3 = Н. Для превращения R3 в группу, отличную от Н, можно провести второе восстановительное аминирование с подходящим альдегидом (или кетоном) формулы R3C(O)H. Для введения метильной группы в качестве заместителя R3 можно применять реакцию Eschweiler-Clark. Для образования амидной группы, такой как группа, где R1 представляет Н и R2 представляет -NR4C(O)R3, амин формулы NHR4 можно ввести, как описано выше, и затем ацильную часть формулы -C(O)R3 можно ввести обработкой промежуточного продукта активированной формой карбоновой кислоты, такой как R3COCl или R3C(O)ОС(О)R3, или с использованием амидного сочетающего агента, такого как 2-этокси-1-этоксикарбонил-1,2 дигидрохинолин(EEDQ),1,1'-карбонилдиимидазол (CDI) или карбодиимида, такого как 1,3-дициклогексилкарбодиимид (DCC). Во всех вышеупомянутых способах защитные группы удаляют кислотой, такой как уксусная кислота,фтористоводородная, комплекс фтористого водорода-пиридина, или источником фторида,таким как TBAF, в качестве последней стадии. Соединения формулы 1, где R1 представляет Н и R2 представляет -NR4C(O)R3, где R4 представляет Н и R3 такой, как определено выше, можно получить использованием первичного амина, полученного восстановительным аминированием соединения формулы 4 эквивалентом аммония, например, использованием ацетата аммония, и цианоборгидрида натрия или триацетоксиборгидрида натрия. Альтернативно,этот первичный амин можно получить через соответствующий азид: (1) С-5"-кетон соединения формулы 4 восстанавливают, например,борогидридом натрия; 2) получаемый спирт превращают в мезилат, например, посредством воздействия метансульфонилхлорида и триэтиламина; 3) мезилат замещают азидом, например,с использованием азида натрия в ДМФ, и 4) азид восстанавливают в первичный амин с использованием, например, трифенилфосфина, с последующим водным гидролизом. Реакция первичного амина с активированной формой R3C(O)OH, например, R3C(O)Cl илиR3C(О)ОС(О)R3, дает соответствующий амид. В альтернативном случае амидные агенты сочетания можно использовать с R3C(O)OH, таким как 1-(3-диметиламинопропил)-3-этилкарбодиимид(EDS), диэтилфосфорилцианид (DEPC), DCC,CDI или EEDQ. Наконец, любые защитные группы удаляют с использованием кислоты,такой как уксусная кислота, фтористо-водородная, комплекс фтористого водородапиридина, или фторид-иона, такого как TBAF. 30 Для введения группы R4, другой, чем Н,амид, указанный выше, можно алкилировать после защиты любой свободной гидроксигруппы, например, в виде силильных простых эфиров. Алкилирование можно проводить с основанием и алкилирующим агентом, такими как гидрид натрия и подходящий бромид формулы R4Br. Снятие защиты у гидроксигрупп затем проводят кислотой, такой как уксусная кислота, фтористоводородная, комплекс фтористый водород-пиридин, или фторид-ионом, таким как TBAF. В альтернативном случае, восстановительное аминирование можно проводить на соединении формулы 4 при помощи R4NH2, медлированного триацетоксиборгидридом натрия или цианоборогидридом натрия. Получаемый вторичный амин можно ацилировать, как описано выше, активированной формой R3C(O)OH или подвергнуть реакции с R3C(O)OH с использованием амидного сочетающего реагента. Снятие зашиты у гидроксигрупп затем проводят,как описано выше. Что касается схемы 2, соединения формулы 1, где R1 представляет Н и R2 представляет-OR3, где R3 представляет алкильную группу или замещенную алкильную группу, можно получить алкилированием соответствующего спирта формулы 5 (где X представляет защитную группу, как описано выше), где R1 представляет гидроксил и R2 представляет водород. По этому способу С-5"-кетоновую группу соединения формулы 4 восстанавливают с использованием подходящего восстанавливающего агента, такого как боргидрид натрия. Получаемый С-5"-спирт можно затем алкилировать при помощи R3-Z, где Z представляет уходящую группу, такую как Сl, Вr, I или метансульфонат,в присутствии основания, такого как гидрид натрия или трет-бутоксид калия. Защитные группы затем удаляют кислотой, такой как уксусная кислота, фторид водорода, комплекс фторид водорода-пиридин, или фторид-ионом,таким как TBAF. Соединения формулы 1, где R1 представляет Н и R2 представляет -OR3, где R3 представляет ароматическую или гетероциклическую группу, можно получить посредством реакции Мицунобу. С-5"-спирт, полученный, как описано выше, подвергают реакции Мицунобу сR3OH, опосредованной трифенилфосфином и диэтилазодикарбоксилатом. Получаемый простой эфир затем освобождают от защитной группы, как описано выше. В альтернативном случае, когда R1 представляет Н и R2 представляет -OR3, где R3 представляет ароматическую или гетероароматическую группу, С-5"-спирт, полученный из соединения формулы, можно превратить в уходящую группу, например, бромидное или мезилатное производное. Уходящую группу можно затем заменить на R3OH с использованием ос 31 нования, такого как гидрид натрия, третбутоксид калия или карбонат калия. Соединения формулы 1, где R1 представляет Н и R2 представляет -OC(O)NR3R4, можно получить взаимодействием С-5"-спирта, полученного из соединения формулы 5, как описано выше, с изоцианатом R3NCO в толуоле при температурах от 40 до 110 С, предпочтительно, 5080 С. Может быть выгодно добавление к реакционной смеси диметиламинопиридина и триэтиламина. Продукт этой реакции, который имеет R4, представляющий Н, можно алкилировать, чтобы получить R4, представляющий С 1 С 10-алкил, используя основание, такое как гидрид натрия, и алкилирующего агента, такого как бромид формулы R4-Br. Снятие защиты у гидроксигрупп можно затем проводить с использованием фторид-иона, такого как TBAF. Соединения формулы 1, где R1 и R2 взяты вместе с образованием =CR4C(O)R3, =CR4C(O)OR3 или =CR4C(O)NR3R4, где R3 и R4 такие, как определено выше, можно получить посредством соответствующих промежуточных ,-ненасыщенных сложных эфиров, полученных олефинированием по реакции Виттига ХорнерЭммонс-Виттига С-5"-кетона соединения формулы 4. Например, (карбэтоксиметилен) трифенилфосфоран или (карбэтоксиэтилиден)трифенилфосфоран можно подвернуть реакции с соединением формулы 4, чтобы получить ненасыщенный этиловый сложный эфир. Гидролиз этого эфира, например, гидроксидом натрия,дает соответствующую карбоновую кислоту(соединение формулы 5, где R1 и R2 взяты вместе с образованием =СНС(О)ОН). На этом этапе, гидроксигруппы, которые были превращены в свободную форму в предыдущей стадии, можно защитить, например, в виде их простых эфиров TES или TBDMS. Для получения сложных эфиров, описанных выше, карбоновую кислоту можно этерифицировать R3OH, например, посредством воздействия DCC или 4-диметиламинопиридина (DMAP) или CDI и каталитического основания, такого как этоксид натрия. Снятие защиты у гидроксильных групп затем проводят кислотой, такой как уксусная кислота,фтористоводородная, комплекс фтористый водород-пиридин, или фторид-ионом, таким какTBAF. Соединения формулы 1, где R1 и R2 взяты вместе с образованием =CR4C(O)NR3R4, можно получить обработкой вышеуказанной промежуточной карбоновой кислоты (соединение формулы 5, где R1 и R2 взяты вместе с образованием=СНС(О)ОН) с амином формулы R3NH2 с использованием амидного агента сочетания, такого как DCC, CDI, EEDQ, DEPS или EDS. В защищенное производное R4 можно ввести через алкилирование, например, с использованием основания, такого как гидрид натрия или третбутоксид калия, и алкилирующего агента, такого как R4-X, где X представляет Вr, Сl или ме 004374 32 тансульфонат. Снятие защиты у гидроксильных групп затем проводят так, как описано выше. Кетон формулы 1 (R1 и R2 взяты вместе с образованием =CR4C(O)R3) можно получить либо непосредственной реакций Виттига или Хорнер-Эммонса соединения формулы 4, например с соответствующим реагентом R3C(O)R1 и R2 взяты вместе с образованием =СНС(О) ОН, можно превратить в амид Weinreb, например, посредством обработки CDI и N,Одиметилгидроксиламина. Этот амид затем подвергают реакции с R3-M, где М представляет ион металла, такого как Li или MgBr, для получения кетона. Альдегид (структура кетона, гдеR3 представляет Н) можно получить реакцией амида Weinreb с гидридным источником, таким как диизобутилалюминийгидрид (DIBAL) илиLiAlH4. Соединения формулы 1, где R1 и R2 взяты вместе с образованием =CR4R3, где R3 и R4 такие, как определено выше, можно получить реакцией Виттига или Хорнер-Эммонса илида R4CH(PPh3)-R3 или R4-CH(P=O(OEt)2)-R3 с соединением формулы 4. Защитные группы можно затем удалить, как описано выше. В альтернативном случае, либо кетон, либо альдегид формулы 5, где R1 и R2 взяты вместе с образованием =CR4C(O)R3 и =CR4C(O)H, соответственно, можно использовать в качестве промежуточного продукта. Эти соединения могут быть доступны посредством реакции Виттига или Хорнер-Эммонса с окисленной солью трифенилфосфония или фосфораном, таким какPh3P-C(R3)ОМе (Me представляет метил). Получаемый простой эфир енола можно гидролизовать слабой кислотой, такой как уксусная кислота, или разбавленной НС 1, получая альдегид или кетон. Альдегид или кетон можно затем подвергнуть реакции с металлорганическим производным R4-M, где М представляет, например, Li или MgBr, чтобы получить соответствующий спирт, который можно дегидратировать при воздействии метансульфонилхлорида для получения соответствующего олефина. Снятие защиты, как описано выше, затем дает соединение формулы 1, где R1 и R2 взяты вместе с образованием =CR4R3. Соединение формулы 1, где R1 и R2 взяты вместе с образованием =CR4R3 и R4 представляет арил или гетероарил и R3 не представляет водород, можно получить с использованием катализируемого палладием способа. Превращение соединения формулы 5, где R3 представляет -CH(COR3), в активированный простой эфир енола, например, трифлат енола, дает промежуточный продукт, который можно сочетать способом Сузуки или Stille способом катализируемого палладием с арил- или гетероарилбороновыми кислотами R4B(OH)2 или с соединения 33 ми арилолова, например, R4SnMe3 или R4SnBu3(Bu представляет бутил) для получения ненасыщенных арилпроизводных. Снятие защиты,как описано выше, затем дает конечное соединение. Соединения данного изобретения имеют асимметричные атомы углерода. Такие диастереомерные смеси можно разделить на индивидуальные диастереомеры на основе различий их физических и химических свойств способами,известными специалистам в данной области,например, хроматографией или фракционной кристаллизацией. Все такие изомеры, в том числе смеси диастереомеров, являются частью данного изобретения. Соединения данного изобретения, которые являются основаниями по природе, способны образовывать большое разнообразие различных солей с разными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемы для введения животным, часто необходимо на практике сначала выделить соединения данного изобретения из реакционной смеси в виде фармацевтически неприемлемой соли и затем просто превратить последнюю обратно в соединение в виде его свободного основания обработкой щелочным реагентом и затем превратить это свободное основание в фармацевтически приемлемую кислотно-аддитивную соль. Кислотно-аддитивные соли основных соединений этого изобретения легко получают обработкой основного соединения по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или подходящего органического растворителя, такого как метанол или этанол. При осторожном выпаривании растворителя легко получают целевую твердую соль. Целевую соль с кислотой можно также осадить из раствора свободного основания в органическом растворителе добавлением раствора подходящей минеральной или органической кислоты. Те соединения данного изобретения, которые имеют кислотную природу, способны образовывать соли оснований с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных или щелочно-земельных металлов и, особенно, соли натрия и калия. Все эти соли получают общепринятыми методиками. Химические основания, которые используют в качестве реагентов для получения фармацевтически приемлемых солей с основаниями этого изобретения, являются основаниями, которые образуют нетоксичные соли оснований с кислотными соединениями данного изобретения. Такие нетоксичные соли с основаниями включают в себя соли, полученные из таких фармакологически приемлемых катионов, как например, катионы натрия,калия, кальция и магния и т.д. Эти соли можно легко получить обработкой соответствующих 34 кислотных соединений водным раствором, содержащим нужный алкоксид щелочного металла или гидроксид металла и затем упариванием получаемого раствора досуха, предпочтительно,при пониженном давлении. В альтернативном случае, их можно также получить смешиванием вместе низших спиртовых растворов кислотных соединений и нужного алкоксида щелочного металла или гидроксида металла и затем упариванием получаемого раствора досуха таким же образом, как указано ранее. В любом случае предпочтительно, используют стехиометрические количества реагентов, для обеспечения полноты реакции и максимальных выходов целевого конечного продукта. Антибактериальную активность соединений данного изобретения против бактериальных патогенов демонстрируют посредством способности этих соединений ингибировать рост определенных штаммов патогенов. Тестирование Испытание, описанное ниже, использует общепринятую методологию и критерии интерпретации, оно предназначается для направления химических модификаций, т.о, чтобы привести к получению соединений с антибактериальной активностью против восприимчивых и устойчивых к лекарственным средствам организмов,включающих, но не ограничивающихся ими,организмы, устойчивые к бета-лактамам, макролидам и ванкомицину. В этом испытании собирали панель бактериальных штаммов для включения различных целевых патогенных видов, в том числе представителей устойчивых к антибиотикам бактерий. Использование этой панели делает возможным установление связи химическая структура-активность в отношении эффективности и спектра активности. Испытание проводят в титрационных микропланшетах и интерпретируют в соответствии с PerformanceLaboratory Standards (NCCLS) guidelines; для сравнения штаммов используют минимальную ингибирующую концентрацию (MIC). Соединения сначала растворяют в диметилсульфоксиде(ДМСО) и используют как исходные растворы. Активность соединений данного изобретения можно также испытывать в соответствии с репликаторной методикой Steers, которая является стандартным методом бактериального испытания in vitro, описанного Steers et al., Antibiotics and Chemotherapy 1959, 9, 307. Активность соединений данного изобретения in vivo можно определить путем общепринятых тестов защиты животных, хорошо известных специалистам в данной области, обычно проводимых на грызунах. В соответствии с одной моделью in vivo соединения оценивают по эффективности в моделях острой бактериальной инфекции на мы 35 шах. Пример одной такой системы in vivo обеспечивают следующим образом. Мышей (мышиCF1 смешанного пола, 18-20 г) распределяют по клеткам по их прибытию и оставляют для акклиматизации на 1-2 дня до исследования. Острую инфекцию продуцируют внутрибрюшинной инокуляцией бактерий (штамм 01 А 1095Staphylococcus aureus), суспендированных в 5% стерильном слизистом желудочном секрете свиньи. Инокулят получают: выращиванием этой культуры в течение ночи при 37 С на кровяном агаре, сбором получаемой поверхностной культуры стерильным бульоном с сердечномозговым экстрактом и доводят эту суспензию до помутнения, чтобы при разбавлении 1:10 в 5% стерильном слизистом желудочном секрете свиньи могла обеспечиваться 100% летальность. Мышей (10 на группу) обрабатывают подкожно через 0,5 и 4 ч после заражения. В каждое исследование включают соответствующие необработанные (инфицированные, но не леченые) и позитивные (ванкомицин или миноциклин и т.д.) контроли. Процент выживания регистрируют после 4 дневного периода наблюдения; PD50 (вычисленные дозы в мг/кг для защиты 50% инфицированных животных) определяют пробит-методом. Соединения данного изобретения и их фармацевтически приемлемые соли (в дальнейшем активные соединения) можно вводить пероральным, парентеральным, местным или ректальным путем при лечении бактериальных и протозойных инфекционных заболеваний. В общем, эти соединения весьма желательно вводить в дозах, составляющих от около 0,2 мг на кг массы тела в день (мг/кг/день) до около 200 мг/кг/день в одной или разделенных дозах (например, от 1 до 4 доз в день), хотя неизбежно будут иметь место варианты в зависимости от вида, массы и состояния субъекта, которого лечат, и определенного выбранного пути введения. Однако весьма желательным является использование уровня доз, который находится в диапазоне от около 3 мг/кг/день до около 60 мг/кг/день. Варианты, тем не менее, могут иметь место в зависимости от вида млекопитающего,рыбы или птицы, который лечат, и его индивидуальной реакции на указанное лекарственное средство, а также от типа выбранной фармацевтической готовой препаративной формы и периода времени и интервалов между введениями. В некоторых случаях уровни доз, ниже нижнего предела вышеуказанного диапазона, могут быть более чем адекватными, тогда как в других случаях еще более высокие дозы можно использовать без вызывания любого вредного побочного действия, при условии, что такие более высокие дозы сначала делят на несколько маленьких доз для введения на всем протяжении дня. Активные соединения можно вводить сами по себе или в комбинации с фармацевтически приемлемыми носителями или разбавителями 36 ранее указанными путями, и такое введение можно проводить в виде одной или нескольких доз. Более конкретно, активные соединения можно вводить в виде большого числа разных лекарственных форм, т.е. их можно комбинировать с разными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, твердых конфет, порошков, спреев, кремов, мазей, суппозиториев,желе, гелей, паст, лосьонов, мазей, водных суспензий, инъекционных растворов, эликсиров,сиропов и тому подобное. Такие носители включают в себя твердые разбавители или наполнители, стерильную водную среду и различные нетоксичные органические растворители и т.д. Кроме того, пероральные фармацевтические композиции можно подходящим образом подсластить или ароматизировать. В общем, активные соединения присутствуют в таких лекарственных формах при уровнях концентрации, составляющих от около 5,0% до около 70% по массе. Для перорального введения можно использовать таблетки, содержащие различные наполнители, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальций-фосфат и глицин, вместе с различными дезинтеграторами, такими как крахмал (предпочтительно, кукурузный, картофельный крахмал или крахмал тапиоки), альгиновая кислота и некоторые комплексные силикаты, вместе со связующими для грануляции, подобными поливинилпирролидону, сахарозе, желатине и аравийской камеди. Кроме того, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк часто очень полезны для целей таблетирования. Твердые композиции подобного типа можно также использовать в качестве наполнителей для желатиновых капсул; предпочтительные в этом отношении материалы включают также лактозу или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой. Когда для перорального введения необходимы водные суспензии и/или эликсиры, активное соединение можно комбинировать также с различными подслащивающими агентами или корригентами, красящим веществом или красителями и, если необходимо,эмульгирующими и/или суспендирующими агентами, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и различные подобные их комбинации. Для парентерального введения можно использовать растворы активного соединения либо в кунжутном, либо в арахисовом масле, в водном этаноле или пропиленгликоле. Может быть также удобно использование производного циклодекстрина, такого как натриевая соль сульфобутилового эфира -циклодекстрина (см. патент Соединенных Штатов 5134127). Если это необходимо, водные растворы должны быть подходящим образом забуферены, а жидкие 37 растворители сначала делают изотоническими. Эти водные растворы пригодны для целей внутривенной инъекции. Масляные растворы пригодны для целей внутрисуставной, внутримышечной и подкожной инъекции. Получение всех этих растворов в стерильных условиях легко выполняется по стандартным фармацевтическим методикам, известным специалистам в данной области. Кроме того, возможно также введение активных соединений данного изобретения местно, и это можно сделать посредством применения кремов, желе, гелей, паст, пластырей, мазей и тому подобное, в соответствии со стандартной фармацевтической практикой. Для введения животным, таким как крупный рогатый скот или домашние животные, активные соединения можно ввести в кормах животным или перорально в виде композиции для вливания лекарства в ротовую полость животного. Активные соединения можно также ввести в форме липосомных систем для доставки, таких как небольшие однослойные везикулы,большие однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из различных фосфолипидов, таких как холестерин, стеарил амин или фосфатидилхолины. Активные соединения можно также сочетать с растворимыми полимерами, применяемыми в качестве носителей, доставляющих к цели лекарственное средство. Такие полимеры могут включать в себя поливинилпирролидон,сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный пальмитоильными остатками. Кроме того, активные соединения можно сочетать с классом биодеградируемых полимеров, пригодных для достижения регулируемого высвобождения лекарственного средства, например, полиакриловой кислотой, полигликолевой кислоты, сополимерами полимолочной кислоты и полигликолевой кислоты, полиэпсилонкапролактоном, полигидроксимасляной кислотой,полиортоэфирами, полиацеталями, полигидропиранами, полицианоакрилатами и сшитыми или амфипатическими блок-сополимерами или гидрогелями. Данное изобретение далее описывается и иллюстрируются в описанных ниже получениях и примерах. В получениях и примерах к.т. означает комнатную температуру или температуру окружающей среды, которая является температурой около 20-25 С. Получение 1. Пять (5) мл замороженной партии (хранили при -80 С в смеси 20% глицерина/80% среды для инокулята) культурыStreptomyces hygroscopicus NRRL 2388 использовали для инокуляции 1 л гигромициновой среды для засевания (13 г/л церелозы Corn Products Corp., 7 г/л крахмала Hubinger, 3 г/л размо 004374 38 ченных измельченных початков кукурузы Roquette, 7 г/л амина YTT Sheffield Brand ProductsNZ, 0,002 г/л СоСl26 Н 2O Baker, 0,7 г/л КН 2 РО 4,1,3 г/л MgSO47H2O, 0,7 г/л сульфата аммония, 1 капля/ колбу противовспенивателя Dow Chemical P2000, 2 капли/колбу соевого масла Colfax,pH 7,0 до автоклавирования) в колбе Fernbach на 2,8 л. Культуру выращивали в течение 3 дней при 29 С с перемешиванием со скоростью 200 об./мин в шюттель-аппарате с амплитудой в 5,08 см (2 дюйма). Эту выращенную культуру использовали для инокуляции 8 л стерильной среды для ферментации гигромицина (1 г/л карбоната кальция Albaglos, 5 г/л амина YTT Sheffield Brand Products NZ, 20 г/л крахмалаBrunswick, New Jersey) , снабженном двумя лопастями размером 12,06 см (4,75 дюйма) Rushton и с расстоянием лопастей друг от друга 9,52 см (3,75 дюйма). Бульон инкубировали при 29 С со скоростью аэрации 8 л/мин и с перемешиванием при 800 об./мин. Чтобы свести к минимуму образование эпигигромицина, рН поддерживали между 6,5 и 6,9 в течение 12 6 ч, затем от 6,2 до 6,6 при помощи H2SO4 (15%) в течение остального времени процесса. Продукт ферментации собирали через 143 ч общей инкубации. К этому времени отношение гигромицина А к эпигигромицину было 31:1. Шесть литров бульона вышеуказанной ферментации центрифугировали при 8000 об./мин в течение приблизительно 15 мин. После центрифугирования осадок выгружали и супернатант (при рН 6,4, анализ ВЭЖХ показывал, что он содержал приблизительно 4,12 г активного гигромицина А) вводили в колонку, заполненную 500 г смолы XAD-16 (Rohmand Haas (Philadelphia, Pennsylvania. Смолу предварительно уравновешивали двумя объемами (слоя смолы) 25 мМ динатрийфосфата, рН 6,0 (буфер). После загрузки колонку промывали 2 объемами (слоя смолы) буфера и 2 объемами смеси 80/20 буфер/метанол и активный продукт элюировали 5 объемами (слоя) смеси 50/50 буфер/метанол. Фракции анализировали ВЭЖХ и объединяли фракции, содержащие основное количество активного продукта (2,730 г гигромицина А). Часть элюата XAD-16 (приблизительно 800 мг гигромицина А) разбавляли до 10% метанола добавлением 1,8 л буфера и вводили в колонку с 100 мл CG-161 (TosoHaas (Montgomeryville, Pennsylvania, которая была уравновешена 4 объемами (слоя) смеси 90/10 буфер/метанол. Продукт элюировали 6 объемами (слоя) смеси 50/50 буфер/метанол. Фракции анализи 39 ровали ВЭЖХ и активные фракции объединяли. Объединенную фракцию упаривали досуха,анализ показывал, что чистота твердого вещества составляет приблизительно 65% по массе. Небольшую часть этого твердого вещества направляли на испытание. Около 500 мг твердого вещества смешивали с 500 мл воды и 500 мл этилацетата и перемешивали в течение 20 мин. Происходило разделение на два слоя, и часть водного слоя сушили для получения твердого вещества, анализ которого показывал, что он имеет чистоту приблизительно 52% по массе. Оба этих твердых вещества (34945-280-1 и 281-1) анализировали ЯМР и ТСХ, и было обнаружено, что они содержат активный гигромицин А. Кроме того,ЯМР показал, что отношение гигромицин А/эпигигромицин составляет приблизительно 15:1. Получение 2. Пять (5) мл замороженной партии (хранили при -80 С в смеси 20% глицерина/80% среды для инокулята) культурыStreptomyces hygroscopicus NRRL 2388 использовали для инокуляции 1 л гигромициновой среды для инокулята (13 г/л церелозы СРС International Inc., 7 г/л крахмала Hubinger, 3 г/л размоченных измельченных початков кукурузыP2000, 2 капли/колбу соевого масла Colfax, pH 7,0 до автоклавирования) в колбе Fernbach на 2,8 л. Культуру выращивали в течение 2-3 дней при 29 С с перемешиванием со скоростью 200 об./мин в шюттель-аппарате с амплитудой в 5,08 см (2 дюйма). В два ферментера из нержавеющей стали на 1893,5 л (пятьсот галлонов) загружали 1438-1516 л (380-400 галлонов) среды для ферментации гигромицина (1 г/л карбоната кальция Mineral Technologies, 5 г/л аминаChemical, 0,002 г/л СоСl26 Н 2O Baker, 2 г/л соевого масла Colfax, 10 г/л церелозы, Cargill Inc.,5 г/л NaCl Cargill Inc.). Эту среду стерилизовали в ферментерах водяным паром при давлении 1,406 кг/см 2 (20 фунт/дюйм 2) в течение 60 мин. После охлаждения среды с использованием охлаждающих змеевиков в ферментерах рН доводили до 6,5-6,7. Условия ферментеров устанавливали такие, чтобы скорость потока воздуха была 0,566 м 3 (20 стандартных кубических футов) в минуту, температура была 28 С, давление выпускного отверстия было 0,352 кг/см 2 (5 фунт/дюйм 2), и значение рН поддерживали между 6,5 и 6,7 25% гидроксидом натрия и 98% серной кислотой. Скорость перемешивания в двух ферментерах изменяли так, чтобы поддерживать уровень растворенного кислорода выше, 004374 40 чем 20% от уровня насыщения, измеряемого в бульоне непосредственно перед инокуляцией. После установления контрольных условий ферментера пять колб Fernbach инокулята были объединены в стерильных условиях в аспирационном сосуде на 8 л. Этот инокулят затем использовали для инокуляции одного, номинального ферментера на 1893,5 л (пятьсот галлонов),как описано выше. Эту процедуру повторяли с использованием 4 л инокулята так, чтобы в один ферментер ввели четыре литра инокулята, а в другой ферментер - пять литров инокулята. Каждый ферментер действовал в течение приблизительно 114 ч, после чего ферментацию останавливали. Значение рН бульона доводили до 6,3 с использованием 98% серной кислоты и бульон удаляли из ферментеров для извлечения. Реакционные смеси двух ферментеров,указанных выше (рН = 6,3, отношение гигромицина А к эпигигромицину составляет приблизительно 51:1), фильтровали на керамической системе для фильтрования. Фильтрат (1450 г А,1915,2 л (506 галлонов загружали в колонку со смолой XAD-16 на 264,9 л (70 галлонов). Эту колонку предварительно 4 объемами (слоя смолы) раствора тринатрийфосфатного буфера при рН 6,0 (буфер). После загрузки колонку промывали 2 объемами (слоя) буфера и 2 объемами(слоя) смеси 80/20 буфер/метанол. Активный продукт затем элюировали из колонки 10 частями (приблизительно 189,2 л (50 галлонов) каждая) раствора смеси 50/50 буфер/метанол. Активные фракции (приблизительно 1240 г А) объединяли и разбавляли до конечной концентрации 10% метанола добавлением 4542 л (1200 галлонов) буфера. Использование разбавления(а не роторного испарения) для снижения концентрации метанола позволяло использовать более низкие температуры, чтобы минимизировать количества эпигигромицина, поскольку имеется тенденция к его увеличению при более высоких температурах. Половину этого раствора загружали в колонку на 40 л CG-161 (предварительно уравновешенного 4 объемами (слоя смолы) раствора 90/10 буфер/метанол). После загрузки колонку промывали 4 объемами (слоя) смеси 80/20 буфер/метанол и элюировали 5,5 объема (слоя) смеси 50/50 буфер/метанол. После регенерации и повторного уравновешивания колонки, в колонку загружали вторую половину активного продукта и элюировали, как описано выше. Объединенные фракции из обоих разделений (120 л, приблизительно 1051 г А) разбавляли до 10% метанола добавлением буфера. Эту смесь снова загружали в колонку с регенерированной и снова уравновешенной смолой CG161. После того, как активный продукт адсорбировался на колонке, его элюировали 4 объемами(слоя) метанола. Эта стадия позволяла как снизить содержание солей, так и повысить концентрацию образца до конечного упаривания. Объединенные фракции из заключительной колонкиCG-161 упаривали досуха, получая всего приблизительно 1 кг гигромицина А. Отношение гигромицина А к эпи-гигромицину в конечном твердом продукте было около 14,5:1. Экспериментальные методики для примеров Получение соединения формулы 3. Раствор гигромицина А (1 экв.) в диметилформамиде (ДМФ, 0,1 М) обрабатывают имидазолом (10 экв.) и трет-бутилдиметилсилилхлоридом (10 экв.) при 35 С в течение 1416 ч. Реакционную смесь выливают в воду и экстрагируют этилацетатом (EtOAc). Объединенные экстракты сушат над MgSO4 и концентрируют. Продукт получают после хроматографии (5-15% EtOAc/ гексаны). Получение соединения формулы 5. Раствор соединения формулы 3 (1 экв.) в дихлорэтане обрабатывают фенилтионохлорформиатом (3 экв.), пиридином (5 экв.) и диметиламинопиридином (0,05 экв.) при комнатной температуре в течение 2-3 дней. В конце этого времени реакционную смесь разбавляют метиленхлоридом, промывают 0,5 н. НСl, насыщенным бикарбонатом натрия и затем насыщенным раствором соли. Органические слои сушат надMgSO4 и концентрируют. Целевой 2-тионокарбонат получают после хроматографии (510% EtOAc/гексаны). Раствор вышеуказанного 2-тионокарбоната (1 экв.) в толуоле (0,1 М) обрабатывают,'-азобис (изобутиронитрилом) (1 экв.) и трин-бутилоловогидридом (3 экв.) при 90 С в течение 2 ч. Реакционную смесь концентрируют и хроматографируют (5-10% EtOAc/гексаны), с получением целевого 2-дезоксисоединения формулы 5. Получение простых эфиров оксимов, примеры 1-30. Раствор соединения формулы 4 (1 экв.) в метаноле (0,1 М) обрабатывают соответствующим гидроксиламином при 60 С в течение 30 мин - 1 ч. Реакционную смесь концентрируют и целевые оксимы получают после хроматографии (обычно 5-15% EtOAc/(толуол или гексаны. Удаление силильных групп выполняют обработкой вышеуказанного оксима фторидом тетрабутиламмония (10 экв.) в тетрагидрофуране при комнатной температуре в течение 12-24 ч. Концентрированную реакционную смесь пропускают через слой ионообменной смолы(35 г смолы Dowex 400 на г исходного материала) и затем целевой оксим получают в виде смеси изомеров Е и Z после хроматографии (обычно 5-15% метанол/хлороформ). В альтернативном случае удаление силильных групп выполняют добавлением раствора тетрагидрофурана, пиридина, комплекса HFпиридин (65 мл, 16,5 мл 8,25 мл, соответственно) к находящемуся при комнатной температуре раствору вышеуказанного оксима (6 ммолей) в тетрагидрофуране (98 мл). Реакцию продолжа 004374 42 ют в течение 24-96 ч и гасят добавлением твердого бикарбоната натрия. Целевой оксим получают с преобладанием Е-изомера после хроматографии (обычно 5-15% метанол/хлороформ). В случае примера 10 соединение формулы 4 снимают защитную группу вышеуказанным способом смесью HF-пиридин. Получение гидроксиламинов для синтеза простых эфиров оксимов, примеры 1-30. Основная часть используемых гидроксиламинов была либо коммерчески доступна(обычно в виде соли с кислотой), либо была получена из соответствующего спирта или галогенида посредством указанных ниже способов. 1) Получение фталимидозащищенных гидроксиламинов. Из спирта: для сочетания N-гидроксифталимида и исходного спирта используют реакцию Мицунобу с диэтилазодикарбоксилатом и трифенилфосфином по методике Е. Grochowski and J.Jurczak, Synthesis (1976), 682. Из бромида или хлорида: реакцию N-гидроксифталимида (1 эквивалент) с галогенидом в качестве исходного материала (1,2-2 экв.), проводят в растворе диметилсульфоксида (ДМСО) с использованием карбоната калия (0,6-2 эквивалента) в качестве основания. Эти реакции проводят при комнатной температуре, обычно, при перемешивании в течение ночи. При выливании реакционной смеси в холодную воду образуется осадок, который фильтруют, получая фталимидо-защищенный гидроксиламин. Во многих случаях у этого материала сразу снимают защиту; можно также использовать хроматографию на силикагеле с использованием смесей этилацетат-гексан для очистки фталимидозащищенного гидроксиламина. 2) Удаление фталимидной защитной группы для получения указанного гидроксиламина. Снятие защиты у фталимидозащищенного гидроксиламина можно осуществить реакцией с гидразин-гидратом (1-2 эквивалента) в растворе этанола при температуре от комнатной до температуры кипячения с обратным холодильником в течение периода, составляющего от 30 мин до ночи. Реакционную смесь фильтруют и фильтрат концентрируют. Этот сырой продукт либо берут для следующей стадии как таковой, либо далее очищают. Смешивание сырого продукта с хлороформом, удаление твердых веществ фильтрованием и удаление растворителя из фильтрата удаляет дополнительный фталгидразид. В альтернативном случае, сырой продукт растворяют в 1 н. хлористо-вородной кислоте и промывают простым эфиром или этилацетатом. Водный слой подщелачивают насыщенным раствором карбоната калия и экстрагируют простым эфиром или этилацетатом. Сушка конечных органических слоев и удаление растворителя дает указанный продукт гидроксиламин.Shiba, Bull. Chem. Soc. Jpn., 1985, 58, 352. Этот альдегид восстанавливают в соответствующий спирт с использованием борогидрида натрия в этаноле. Соответствующий хлорметилтиазол можно получить обработкой этого спирта тионилхлоридом (4 эквивалента) в метиленхлориде при комнатной температуре в течение 2-5 ч. 4) Получение -замещенных бензиловых спиртов.(1-3-Хлор-2,6-дифторфенил)этанол и другие производные фенилэтанола (примеры 11, 14,15, 17, 18) получают обработкой соответствующего фенилкарбоксальдегида метилмагнийбромидом (1 эквивалент) в ТГФ при комнатной температуре. Их затем превращают в соответствующие бензилбромиды обработкой 48% НВr в течение 1-4 ч. 1-(3-Хлор-2,6-дифторфенил)карбоксальдегид получают из 3-хлор-2,6-дифторбензола и диизопропиламида лития и N,N-диметилформамида способом, аналогичным способу A.S.Cantrell, et al., J. Vedicinal Chemistry 1996, 21,4261. 2,4-Дифторпропиофенон (пример 16) восстанавливают в соответствующий спирт с использованием борогидрида натрия в этаноле. 5) Получение О-арилгидроксиламинов. Замещенные фенолы превращают в соответствующие О-арилгидроксиламины посредством использования мезитиленсульфонилгидроксиламина, как описано Y. Endo, К. Shudo and T.Okamoto, Synthesis 1980, 461. Конкретные соединения, полученные по вышеописанным способам, иллюстрируются в приведенной ниже таблице. Пр. означает пример, стерео означает стереохимию оксима,мол. масса означает молекулярную массу и масс-сп. означает масс-спектрометрию. Таблица Синтетические методики синтезов, описанные ниже, могут также быть полезны при получении соединений данного изобретения. Получение разнообразных спиртовых исходных материалов, использованных в синтезе гидроксиламинов. Спиртовые исходные материалы можно получить восстановлением более высоко окисленных коммерчески доступных соединений. 4 Циклогексилбензойную кислоту можно восстановить литийалюминийгидридом (2,3 эквивалента) в тетрагидрофуране для получения соответствующего спирта. 3-(4-Хлорфенил)пропионовую кислоту можно восстановить в соответствующий спирт с использованием диборана(1,1 эквивалента) в тетрагидрофуране при температуре от 0 С до комнатной температуры в течение 5 ч. 3-Трифторметоксибензальдегид, 3 цианобензальдегид,бензофуран-2-карбоксальдегид, 1,4-бензодиоксан-6-карбоксальдегид и 3-фтор-4-метоксибензальдегид можно восстановить в производные спиртов с использованием борогидрида натрия в тетрагидрофуране. Сульфат магния (4 эквивалента) в метиленхлориде можно обработать концентрированной серной кислотой (1 эквивалент), затем 4 хлорметилбензойной кислотой (1 эквивалент) и трет-бутанолом (5,1 эквивалента). Перемешивание в течение ночи при комнатной температуре дает трет-бутиловый сложный эфир. 4-Амино-3,5-дихлорбензойную кислоту можно N-ацетилировать обработкой ацетилхлоридом (1,2 эквивалента) в диметилформамиде при 90 С в течение 4 ч. Охлажденную реакционную смесь можно вылить в холодную воду,охладить и фильтровать, чтобы получить ацетамидное производное. Восстановление карбоновой кислоты проводят литийалюминийгидридом (2 эквивалента) в тетрагидрофуране при 0 С в течение 2 ч, получая N-(2,6-дихлор-4 гидроксиметилфенил)ацетамид. Аминогруппы 3-аминобензилового спирта и 4-аминометилбензилового спирта можно защитить в виде N-трет-ВОС-производных обработкой ди-трет-бутилдикарбонатом (1,1 эквивалента) в тетрагидрофуране (ТГФ) при кипячении с обратным холодильником до тех пор, пока не израсходуется исходное аминосоединение. 47 Реакцию этил-4-фторбензоата с пиперидином (3 эквивалента) в ацетонитриле можно проводить при кипячении с обратным холодильником в течение 4 дней. Разбавление охлажденной реакционной смеси несколькими объемами воды дает осадок, который можно отфильтровать для получения этил-4-(пиперидин-1-ил)бензоата. Восстановление этого эфира литийалюминийгидридом (2 эквивалента) в тетрагидрофуране дает соответствующий спирт. 5-Гидроксиметилбензофуран можно получить по методике К. Hiroja, К. Hashimura and К.Ogasawara, Heterocycles (1994), 38, 2463. 2-Фенилпиримидин-5-карбоксальдегид можно получить по методике J.T. Gupton, J.E.Gall, S.W. Riesinger et al., J. Heteroceclic Chemistry (1991), 28, 1281. Этот альдегид можно восстановить в соответствующий спирт с использованием борогидрида натрия в метаноле. Другие методы, которые можно использовать для получения различных соединений данного изобретения, описываются в предварительной заявке на патент Соединенных Штатов,озаглавленный Hegromycin A Derivatives (номер реестра поверенного PC 10057), указанной выше. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемые соли,пролекарства или сольваты,где R1 и R2, взятые вместе, образуют =N3OR , =CR4R3; каждый R3 независимо выбирают из C1 С 10-алкила, -(СН 2)t(С 3-С 10-циклоалкила), -(СН 2)t(С 6-С 10-арила) и -(СН 2)t(4-10-членного гетероциклила), где t равно целому числу от 0 до 5 и где указанная алкильная группа необязательно содержит 1 или 2 гетерофрагмента -O-, при условии, что два атома О не соединяются непосредственно друг с другом, а указанные арильные и гетероциклические группы R3 необязательно конденсированы с кольцом бензола, С 5 С 8-насыщенной циклической группой или 4-10 членной гетероциклической группой, содержащей атомы С и О; и вышеуказанные группы R3,включая любые, необязательно конденсированные кольца, указанные выше, необязательно замещены 1-5 группами R5; каждый R5 независимо выбирают из C1 С 10-алкила, галогена, -OR6, -NR6R7, -(СН 2)m(С 6 С 10-арила) и -(СН 2)m(4-10-членного гетероциклила), где m равно целому числу от 0 до 4; арильные группы R5 необязательно заме 004374 48 щены 1-5 заместителями, независимо выбранными из галогена; каждый R6 независимо выбирают из C1 С 10-алкила. 2. Соединение по п.1, где R1 и R2 взяты вместе с образованием =N-OR3 и R3 представляет собой С 1-С 4-алкил, -(CH2)t(С 6-С 10-арил) или-(СН 2)t(4-10-членный гетероциклил), где t равно целому числу от 0 до 3, гетероциклическая группа необязательно конденсирована с кольцом бензола, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой, и вышеупомянутые группыR3, в том числе указанные, необязательно конденсированные фрагменты необязательно замещены 1-5 заместителями, независимо выбранными из галогена, C1-С 3-алкокси, пиперидинила, морфолино. 3. Соединение по п.1, где R1 и R2 взяты вместе с образованием =N-OR3 и R3 представляет -(СН 2)t(С 6-С 10-арил) или -(СН 2)t(4-10-членный гетероциклил), где t равно целому числу от 0 до 3, гетероциклическая группа необязательно конденсирована с кольцом бензола, арильная группа необязательно конденсирована с 5- или 6-членной гетероциклической группой и вышеупомянутые группы R3, в том числе указанные,необязательно конденсированные части необязательно замещены 1-5 заместителями, независимо выбранными из галогена, C1-С 3-алкокси,пиперидинила, морфолино. 4. Соединение по п.1, где указанное соединение выбирают из группы, включающей 5-деокси-5-3-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-O-[(3-фторфенил)метил]оксим (4); 5-деокси-5-3-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит, (Е)-O-[(бензофуран-2-ил)метил]оксим (6); 5-деокси-5-3-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит, (Z)-O-[(бензофуран-2-ил)метил]оксим (6); 5-деокси-5-3-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит,(Z)-O-фенилметилоксим (2); 5-деокси-5-3-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил] амино]-1,2-O-метилен-D-неоинозит, (Е)-O-фенилметилоксим (2); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е) 49 пропенил]амино]-1,2-O-метилен-D-неоинозит,(Е)-O-[(3,4-дихлорфенил)метил]оксим (28); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)O-[(3,4-дифторфенил)метил]оксим (19); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)O-[(1,3-бензодиоксол-5-ил)метил]оксим (3); 5-деокси-5-3-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит,(Е)-O-[(1,3 бензодиоксол-5-ил)метил]оксим (3); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)пропенил]амино]-1,2-O-метилен-D-неоинозит,(Е)-O-[(3-хлорфенил)метил]оксим (1); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(E)пропенил]амино]-1,2-O-метилен-D-неоинозит,(Е)-О-[(бензофуран-5-ил)метил]оксим (6); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(E)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-O[(бензофуран-5-ил)метил]оксим (6); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (E)-О[(3-фтор-4-метоксифенил)метил]оксим (7); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-O[(3,4-дигидро-2 Н-1-бензопиран-4-ил)метил]оксим (5); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)О-[(3-хлор-4-фторфенил)метил]оксим (27); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-O[(3-хлор-5-фторфенил)метил]оксим (29); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-O[(3,5-дифторфенил)метил]оксим (20); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропе 004374 50 нил]амино]-1,2-O-метилен-D-неоинозит, (Е)-О[1-(2,4-дифторфенил)пропил]оксим (16); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-О-[1-(3,4 дифторфенил)этил]оксим (15); 5-деокси-5-3-[4-[(2,6-дидеоксиD-эритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Z)-О-[1-(2,4 дифторфенил)этил]оксим (14); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3 гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-О[1-(3,5-дифторфенил)этил]оксим (17); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит,(Е)-О-[1-(3 хлор-2,6-дифторфенил)этил]оксим (18); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит, (Е)-О-[(3-хлор 2,6-дифторфенил)метил]оксим (22); 5-деокси-5-3-[4-[(2,6-дидеоксиDэритрогексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]-1,2-O-метилен-D-неоинозит,(E)-О-[(2,4 дифторфенил)метил]оксим (21); 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-О-метилен-D-неоинозит, (Е)-O-[(3-хлорфенил)]оксим (23); 5-деокси-5-3-[4-[(6-деоксиD-арабиногексофураноз-5-улоз-1-ил)окси]-3-гидроксифенил]-2-метил-1-оксо-2-(Е)-пропенил]амино]1,2-O-метилен-D-неоинозит, (Е)-O-[(3-фторфенил)]оксим (24) и фармацевтически приемлемые соли,пролекарства и сольваты указанных соединений. 5. Фармацевтическая композиция для лечения бактериальной инфекции, протозойной инфекции или нарушения, связанного с бактериальной или протозойной инфекцией, у млекопитающих, рыб или птиц, которая включает терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. 6. Способ лечения бактериальной инфекции, протозойной инфекции или нарушения,связанного с бактериальной или протозойной инфекцией, у млекопитающих, рыб или птиц,который включает введение указанным млекопитающим, рыбам или птицам терапевтически эффективного количества соединения по п.1. 7. Способ получения соединения по п.1, 51 где R1 и R2, взятые вместе, образуют =N-OR3,который включает обработку соединения формулы 4 где X представляет собой защитную группу,гидроксиламином формулы H2N-OR3 или солью указанного гидроксиламина, где R3 такой, как определено выше, в инертном растворителе, 52 необязательно с добавлением основания, если используют соль гидроксиламина, при температуре, составляющей от около 0 до 65 С, и последующее снятие защиты с использованием источника фторид-иона. 8. Способ по п.7, где указанным инертным растворителем является метанол, этанол или пиридин или смесь вышеуказанных растворителей, причем необязательными указанными основаниями являются Nа 2 СО 3 или K2 СО 3, указанный интервал температур составляет от 50 до 60 С и указанным источником фторид-иона является фторид тетрабутиламмония или комплекс фтористый водород-пиридин.
МПК / Метки
МПК: A61K 31/70, A61P 31/00, C07H 15/26
Метки: производные, 2"-деоксигигромицина
Код ссылки
<a href="https://eas.patents.su/27-4374-proizvodnye-2-deoksigigromicina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2″-деоксигигромицина</a>