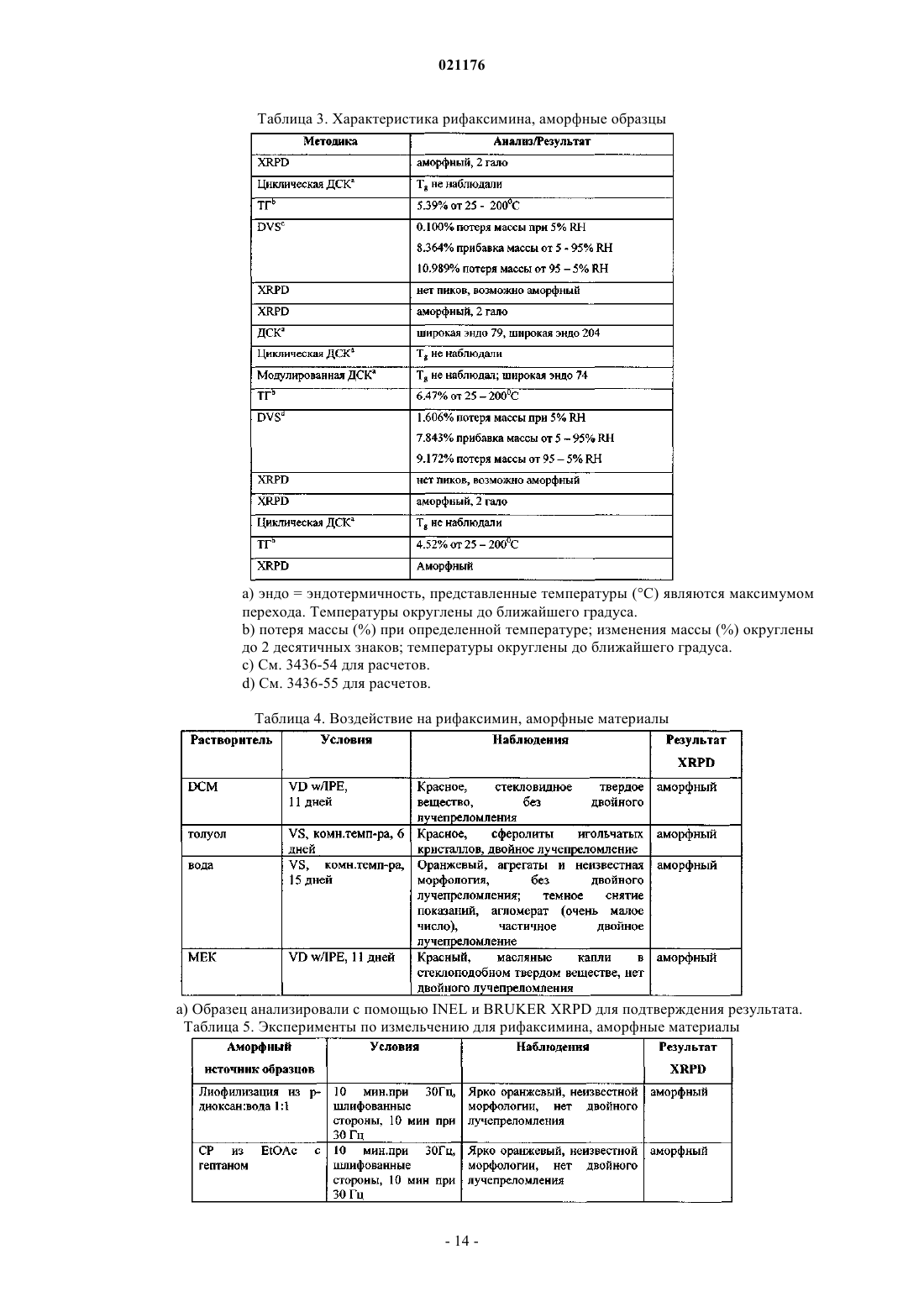
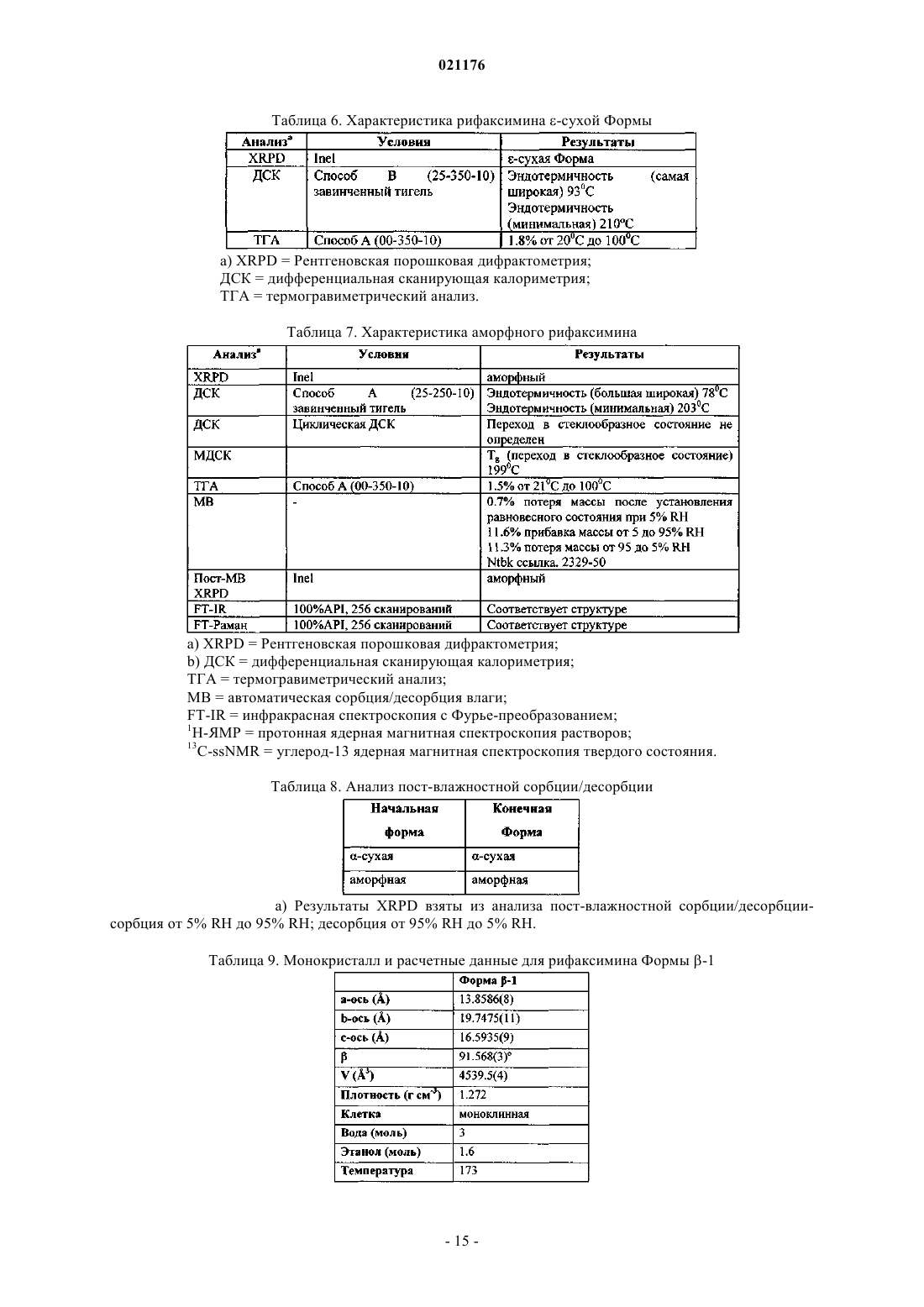
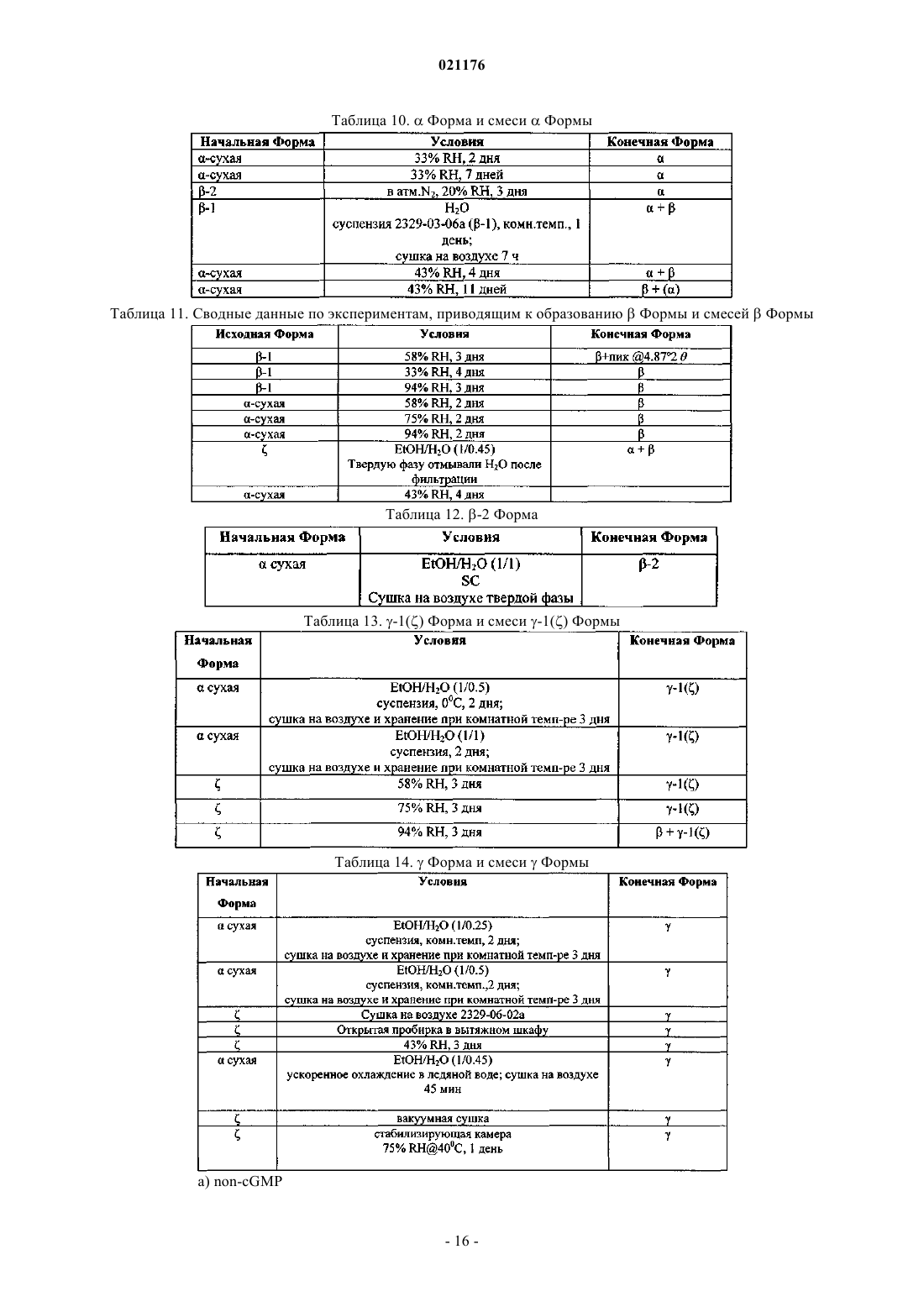
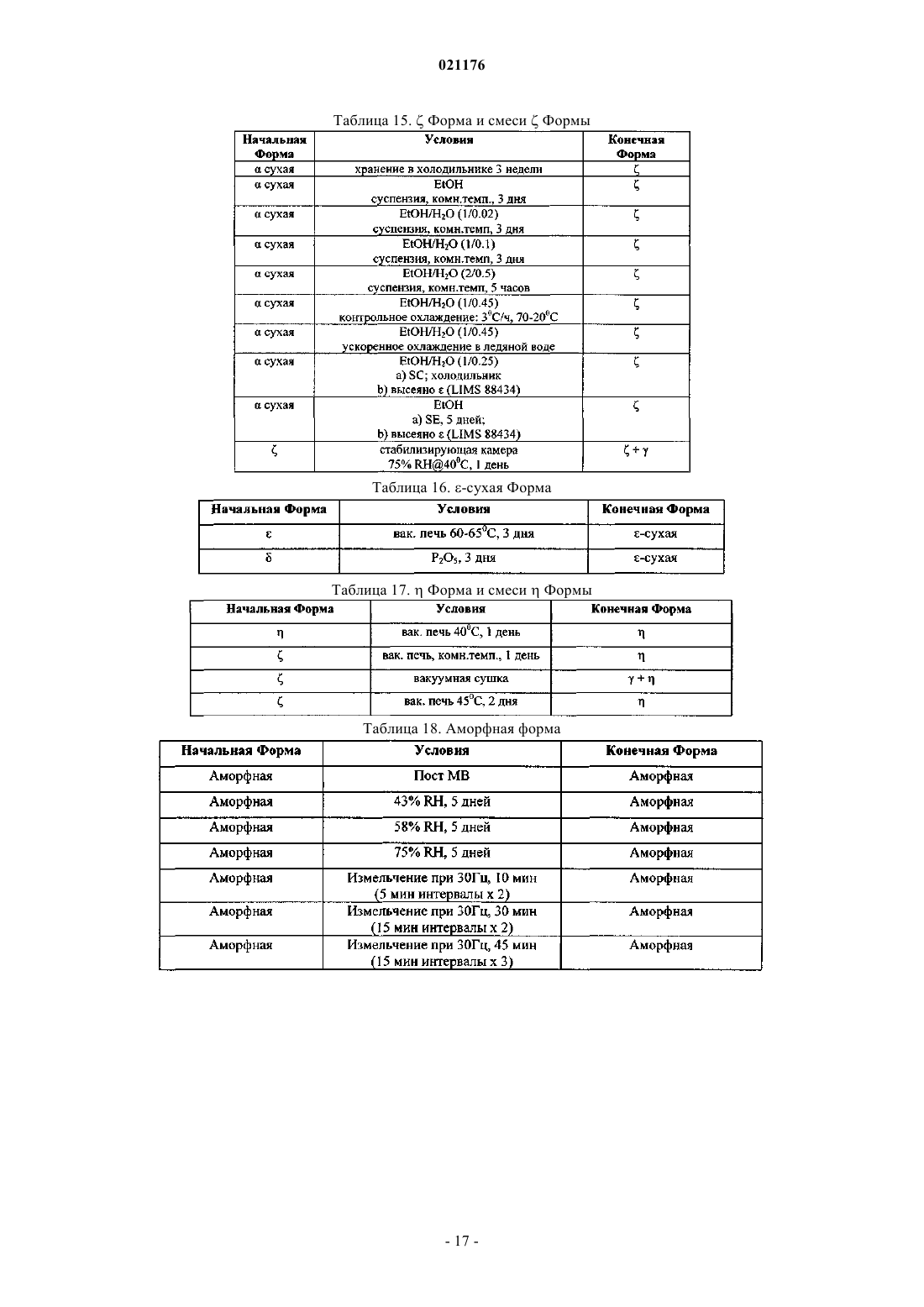
Полиморфная форма рифаксимина и ее применение
Номер патента: 21176
Опубликовано: 30.04.2015
Авторы: Ро Мелани, Влахова Петинка, Хьюстон Трэвис Л., Шультхайсс Натан, Сталтс Джеффри С., Гасхёрст Карен С., Ян Донлай
Формула / Реферат
1. Полиморфная z Форма рифаксимина, которая проявляет порошковую рентгенограмму, содержащую характеристические пики, выраженные в градусах угла 2θ (+/- 0,20° угла θ) при
4.7, 7.6 и 9.5; или
8.2, 8.6 и 9.5; или
4.7, 7.3 и 8.2; или
7.3, 7.6, 8.2 и 8.6.
2. Полиморфная z Форма рифаксимина по п.1, которая содержит менее чем 5 мас.% общего содержания примесей.
3. Полиморфная z Форма рифаксимина по п.1, которая имеет чистоту по меньшей мере 50%.
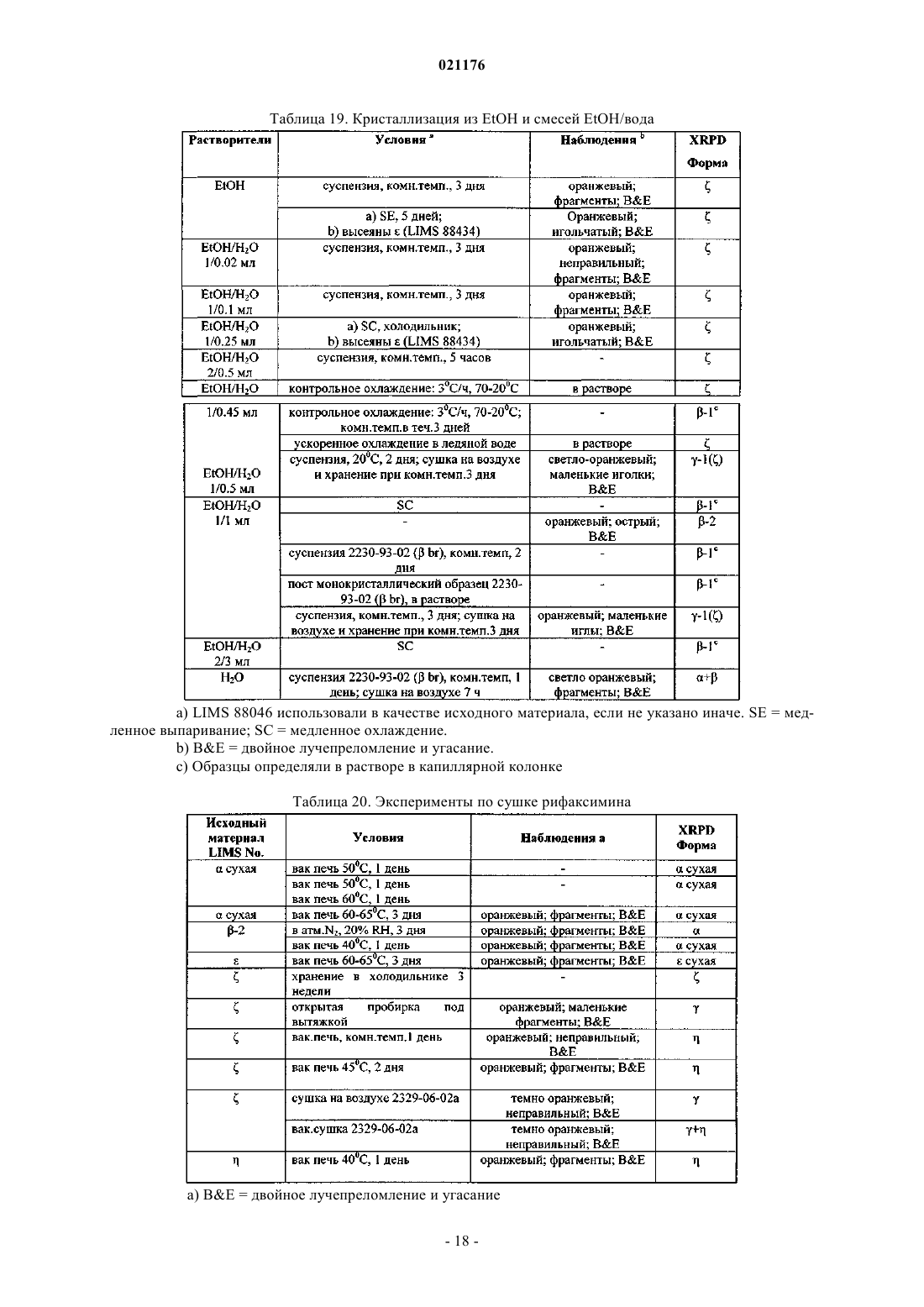
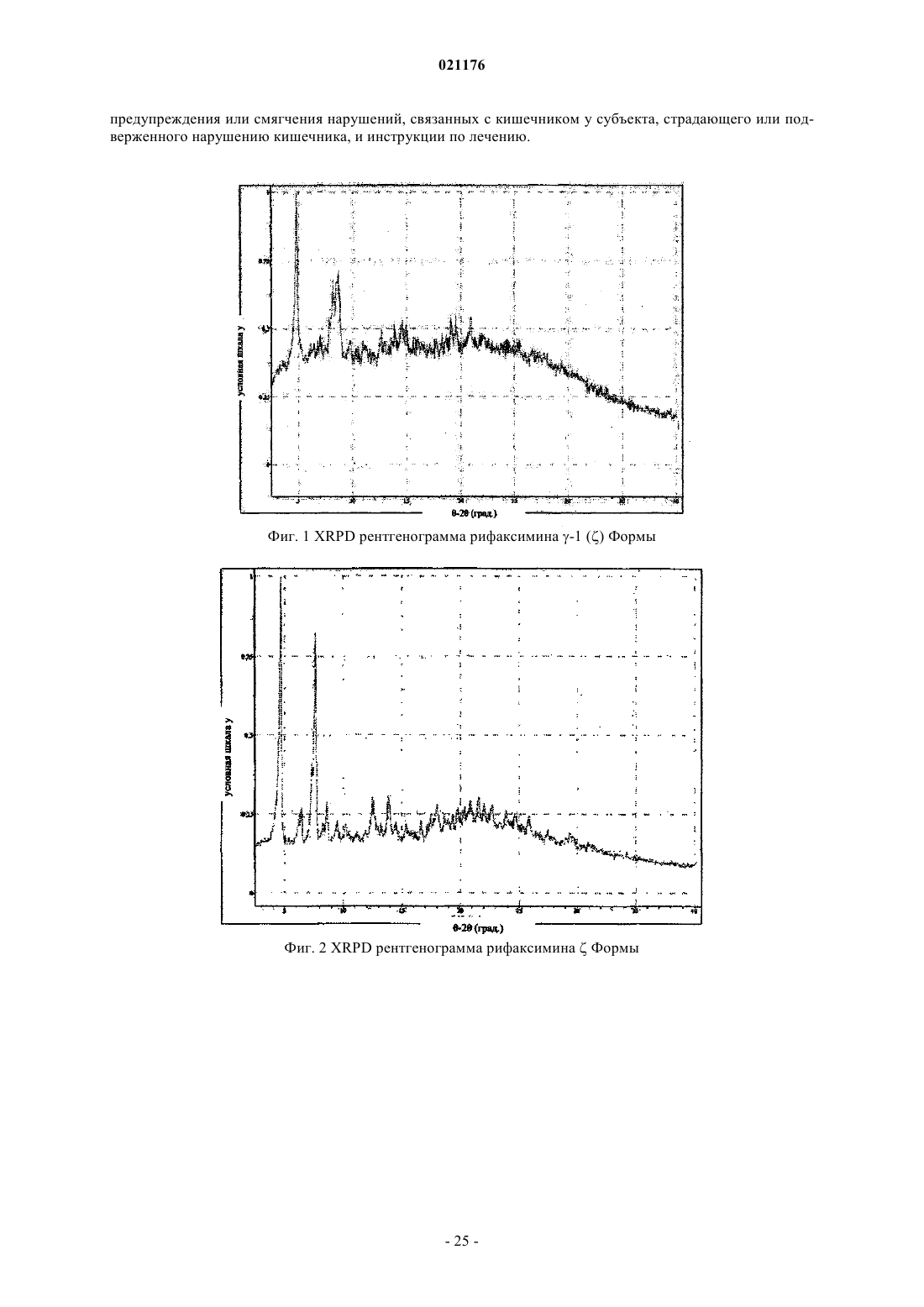
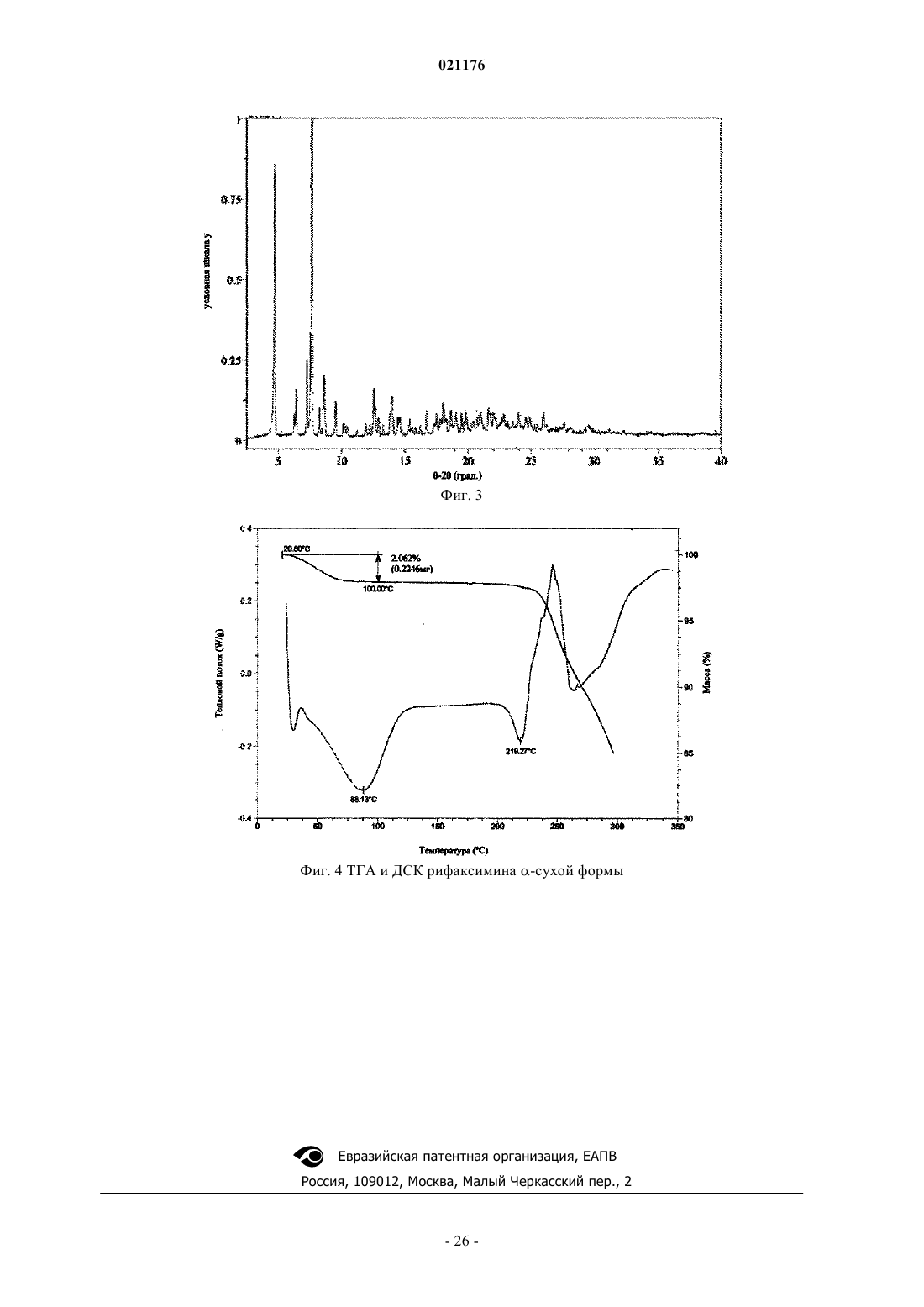
4. Полиморфная z Форма рифаксимина по п.1, включающая XRPD рентгенограмму, по существу, аналогичную фиг. 2.
5. Полиморфная z Форма рифаксимина по п.1, которая имеет чистоту по меньшей мере 75%.
6. Полиморфная z Форма рифаксимина по п.1, которая имеет чистоту по меньшей мере 80%.
7. Полиморфная z Форма рифаксимина по п.1, которая имеет чистоту по меньшей мере 90%.
8. Полиморфная z Форма рифаксимина по п.1, которая имеет чистоту по меньшей мере 95%.
9. Полиморфная z Форма рифаксимина по п.1, которая имеет чистоту по меньшей мере 98%.
10. Фармацевтическая композиция, включающая полиморфную z Форму рифаксимина по п.1 и один или более фармацевтически приемлемых вспомогательных веществ для применения для лечения, предупреждения или смягчения нарушений, связанных с кишечником.
11. Фармацевтическая композиция по п.10, в которой вспомогательные вещества включают один или более из разбавителя, связующего, лубриканта, улучшающего распадаемость вещества, красителя, ароматизатора или подсластителя.
12. Фармацевтическая композиция по п.10, изготовленная в виде покрытых или не покрытых оболочкой таблеток, жестких или мягких желатиновых капсул, покрытых сахаром пилюль, таблеток для рассасывания, пластин в облатке, гранул, кремов, лосьонов или порошков в герметичной упаковке.
13. Способ лечения, предупреждения или смягчения нарушения, связанного с кишечником, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества полиморфной z Формы рифаксимина по п.1.
14. Способ по п.13, в котором субъект страдает по меньшей мере от одного связанного с кишечником нарушения, выбранного из группы, состоящей из синдрома раздраженного кишечника, диареи, диареи, связанной с микробами, диареи, связанной с Clostridium difficile, диареи путешественника, чрезмерного бактериального роста в тонкой кишке, заболевания Крона, хронического панкреатита, недостаточности поджелудочной железы, энтерита, колита, гепатической энцефалопатии или паучита.
15. Способ по п.13, в котором субъект имеет риск развития инфекционного заболевания кишечника.
16. Способ по п.15, в котором риск у субъекта связан с тем, что субъект, страдает от угнетения иммунной системы или находился в контакте с субъектом с бактериальной инфекцией, врачом, медперсоналом, или путешествует в отдаленные регионы, известные скоплением бактерий, вызывающих инфекционное заболевание кишечника.
17. Способ получения z Формы рифаксимина, включающий формирование EtOH суспензии начальной α-сухой Формы рифаксимина при комнатной температуре и кристаллизацию рифаксимина из суспензии.
18. Упакованная композиция, включающая терапевтически эффективное количество полиморфной z Формы рифаксимина по п.1 и фармацевтически приемлемый носитель или разбавитель, для лечения, предупреждения или смягчения нарушений, связанных с кишечником у субъекта, страдающего или подверженного нарушению кишечника, и инструкции по лечению.
Текст
ПОЛИМОРФНАЯ ФОРМА РИФАКСИМИНА И Е ПРИМЕНЕНИЕ Настоящее изобретение относится кформе рифаксимина, фармацевтической композиции,включающей полиморфнуюформу рифаксимина, которая используется для лечения,предупреждения или смягчения нарушений и заболеваний, связанных с кишечником, и к способам лечения с их применением. Предпосылки создания изобретения Рифаксимин (INN; смотри The Merck Index, XII Ed., 8304) является антибиотиком, принадлежащим к антибиотикам рифамицинового ряда, например, пиридоимидазорифамицину. Рифаксимин проявляет антибактериальную активность широкого спектра, например, в желудочно-кишечном тракте в отношении локализованной желудочно-кишечной бактерии, которая вызывает инфекционную диарею, синдром раздраженного кишечника, чрезмерное развитие микрофлоры тонкого кишечника, болезнь Крона и/или недостаточность поджелудочной железы. Сообщалось, что рифаксимин характеризуется незначительной системной абсорбцией благодаря его химическим и физическим характеристикам (Descombe J.J. et al.(2), 51-56, (1994. Описание рифаксимина представлено в патенте Италии IT 1154655 и ЕР 0161534, оба из которых включены здесь полностью в виде ссылки. Патент ЕР 0161534 раскрывает процесс получения рифаксимина с помощью рифамицина О в качестве исходного материала (The Merck Index, XII Ed., 8301). Патент США 7045620 В 1 и РСТ публикация WO 2006/094662 A1 раскрывают полиморфные формы рифаксимина. Рифаксимин утвержден для лечения патологий, вызванных неинвазивными штаммами Escherichiacoli, микроорганизмом, который не способен проникать в слизистую оболочку ЖКТ и, следовательно,остается в контакте с жидкими средами желудочно-кишечного тракта. Сущность изобретения Настоящее изобретение относится кФорме рифаксимина. Полиморф вформе проявляет порошковую дифракционную рентгенограмму, имеющую характеристические пики, выраженные в градусах угла 2 (+/- 0.20 угла ) при 4.7 (дублет), 7.6 (дублет) и 9.5 угла 2-; или 4.7 (дублет), 7.3, и 8.2 угла 2; или 8.2, 8.6, и 9.5 угла 2-; или 7.3, 7.6 (дублет), 8.2, 8.6 угла 2-. Полиморф вформе проявляет порошковую дифракционную рентгенограмму, имеющую характеристические пики, выраженные в градусах угла 2 (+/- 0.20 угла ) при 4.7 (дублет), 7.6 (дублет) и 9.5 2-; или 4.7 (дублет), 7.3, и 8.2 угла 2-. Полиморф вформе проявляет порошковую дифракционную рентгенограмму, имеющую характеристические пики, выраженные в градусах угла 2 (+/- 0.20 угла ) при 8.2, 8.6, и 9.5 угла 2-. Полиморф вформе проявляет порошковую дифракционную рентгенограмму, имеющую характеристические пики, выраженные в градусах угла 2 (+/- 0.20 угла ) при 7.3, 7.6 (дублет), 8.2, и 8.6 угла 2-. В одном из вариантов изобретенияФорма рифаксимина содержит менее 5 мас.% общего содержания примесей. В другом вариантеФорма рифаксимина имеет чистоту по меньшей мере 50%, или по меньшей мере 75%, или по меньшей мере 80%, или по меньшей мере 90%, или по меньшей мере 95%, или по меньшей мере 98%. Согласно одному варианту фармацевтическая композиция включаетФорму рифаксимина и фармацевтически приемлемый носитель. Композиция, кроме того, содержит одно или более фармацевтически приемлемых вспомогательных веществ. Вспомогательными веществами могут являться один или более из разбавителя, связующего,лубриканта, улучшающего распадаемость вещества, красителя, ароматизатора или подсластителя. Согласно одному варианту, фармацевтическая композиция может быть составлена в виде покрытых или не покрытых оболочкой таблеток, твердых или мягких желатиновых капсул, покрытых сахаром пилюль, таблеток для рассасывания, пластин в облатке, гранул или порошков в герметичной упаковке. В родственном варианте, фармацевтическая композиция может быть также составлена для местого применения. Согласно другому аспекту изобретения предлагаются способы лечения, предупреждения или смягчения нарушения, связанного с кишечником, включающие введение пациенту, нуждающемуся в таком лечении, эффективного количестваФормы рифаксимина. В одном варианте пациент страдает, по меньшей мере, от одного нарушения, связанного с кишечником, выбранного из группы, включающей синдром раздраженного кишечника, диарею путешественников, чрезмерный бактериальный рост в тонкой кишке, болезнь Крона, хронический панкреатит, недостаточность поджелудочной железы, энтерит и колит. В ещ одном аспекте здесь обеспечены способы полученияФормы рифаксимина, включающие образование суспензии в EtOH начальной -сухой формы рифаксимина при комнатной температуре и кристаллизацию рифаксимина из суспензии. В одном варианте, способ кроме того включает ускоренное охлаждение суспензии перед кристаллизацией. В другом варианте, суспензия в EtOH включает суспензию в смеси EtOH/Н 2 О в соотношении от 1 до 0,02-0,45. Рассмотрены способы получения смеси полиморфови , включающие увлажненнуюформу. Согласно одному варианту раскрыты способы полученияи смесейипутем осаждения начальных форм рифаксимина способом, представленным далее в табл. 15. Способы получения смесейформы, включающих, но не ограничивающихся этим,форму и смесиформы, а такжеформу и смесиформы, при этом способ включает осаждение начальных форм способом, представлены далее в табл. 14. Способы получения смесей -1 формы, включающих, но не ограничивающихся этим, -1 форму и смесиформы, включающие осаждение начальных форм способом, представлены далее в табл. 13. Способы получения рифаксимина ,форм и смесей рифаксиминаи , включающие осаждение начальных форм способом, представлены далее в табл. 10 и 11. Способы получения -сухой формы рифаксимина, включающие осаждение начальных форм рифаксимина способом, представлены в табл. 16. Способы получения рифаксиминаформы и смесей рифаксиминаиформ, включающие осаждение начальных форм рифаксимина способом, представлены в табл. 17. Способы получения аморфного рифаксимина, включающие осаждение начальных форм рифаксимина способом, представлены в табл. 18. Согласно одному варианту раскрыты способы полученияформы рифаксимина, включающие осаждение начальных форм рифаксимина способом, представленным далее в табл. 19. Способы получения -сухой формы, и других форм рифаксимина, включающие осаждение начальных форм способом, представленным далее в табл. 20-22. Способ получения формы мезилата рифаксимина, включающий условия, представлен далее в табл. 26. Способы полученияформы, включающие условия, представлены далее в табл. 27. Согласно одному варианту раскрыты упакованные композиции, включающие терапевтически эффективное количествоформы рифаксимина, а также фармацевтически приемлемый носитель или разбавитель, при этом композиция составлена для лечения субъекта, страдающего или подверженного нарушению кишечника, и упакована с инструкциями по лечению субъекта, страдающего или подверженного нарушению кишечника. В одном аспекте изобретения представлена фармацевтическая композиция, которая содержитформу рифаксимина, а также фармацевтически приемлемый носитель. В одном варианте фармацевтическая композиция, кроме того, содержит вспомогательные вещества. Вспомогательными веществами являются один или более из разбавителя, связующего, лубриканта,улучшающего распадаемость вещества, красителя, ароматизатора или подсластителя. В другом варианте композиция составлена для выбранных покрытых и не покрытых оболочками таблеток, твердых и мягких желатиновых капсул, покрытых сахаром пилюль, таблеток для рассасывания,пластин в облатке, гранул и порошков в герметичной упаковке. В одном варианте композиция составлена для местного применения. Согласно ещ одному аспекту изобретения здесь представлены способы лечения, предупреждения или смягчения нарушений, связанных с кишечником, включающие введение субъекту, нуждающемуся в таком лечении, инфицированной вирусом клетки с эффективным количествомформы рифаксимина. Нарушение кишечника представляет собой одно или более из синдрома раздраженного кишечника,диареи путешественника, чрезмерного бактериального роста в тонкой кишке, болезни Крона, хронического панкреатита, недостаточноти поджелудочной железы или колита. Согласно другому аспекту здесь также представлены упакованные композиции, включающие терапевтически эффективное количествоформы рифаксимина, и фармацевтически приемлемый носитель или разбавители, при этом композиция составлена для лечения субъекта, страдающего или подверженного нарушению кишечника, и упакована с инструкциями по лечению субъекта, страдающего или подверженного нарушению кишечника. Предложено также применениеформы рифаксимина в качестве лекарственного препарата. Согласно другому аспекту здесь представлены способы полученияформы рифаксимина. Представлена -1 форма, содержащая XRPD рентгенограмму, по существу, аналогичную фиг. 1. Представленаформа рифаксимина, содержащая XRPD рентгенограмму, по существу, аналогичную фиг. 2. Представленаформа рифаксимина, содержащая XRPD рентгенограмму, по существу, аналогичную фиг. 3. Представлена -сухая форма, содержащая ТГА и/или ДСК, по существу, аналогичные фиг. 4. Краткое описание чертежей Фиг. 1 является примером XRPD рентгенограммы -1 формы рифаксимина. Фиг. 2 является примером XRPD рентгенограммыформы рифаксимина. Фиг. 3 иллюстрирует пример XRPD рентгенограммыформы рифаксимина. Фиг. 4 иллюстрирует пример результатов ТГА и ДСК рифаксимина -сухой формы. Подробное описание Изобретение относится к обнаружению новых полиморфных форм рифаксимина и применению этих форм в качестве антибиотиков. В одном варианте рассматривается применениеформы (фиг. 1, 2 и 3) антибиотика, известного как Рифаксимин (INN), в производстве медицинских препаратов для орального или местного применения. Варианты изобретения также относятся к введению данных медицинских препаратов субъекту, нуждающемуся в лечении антибиотиками. Рифаксимин представляет собой соединение рифамицинового ряда антибиотиков. Рифаксимин представляет собой соединение, которое имеет структуру формулы 1 Таблица 1. Сводная таблица некоторых форм рифаксиминаa) Гидрат определяли с помощью данных монокристалла или примерно оценивали по данным ТГА потери массы конкретного анализируемого образца (в скобках). Так как структура монокристалла указывает на присутствие воды в слоях, разные количества воды могут присутствовать в одинаковой кристаллической форме. Мезофазу определяли с помощью XRPD рентгенограммы.b) Моль воды на моль рифаксимина, определяли по данным монокристалла или оценивали с помощью ТГА потери массы.c) Изменение твердой формы после воздействия на образцы определенных RH условий, ам = аморфныйd) Данный образец изучали при 20% RH.e) Данный образец подвергали воздействию 75% RH при 40C в течение одного дня. Использующийся здесь термин "рифаксиминФормы", " Форма рифаксимина", "полиморфный " и " рифаксимин" используются взаимозаменяемо для обозначения полиморфной формы рифаксимина,как описано здесь далее с помощью, например, одного или более пиков рентгеновской дифрактограммы,данных дифференциальной сканирующей калориметрии (фиг. 1 и 2).Форма содержит положения пика порошковых рентгенограмм примерно в градусах угла 2 (+/- 0.20 угла ) при 4.7 (дублет), 7.6 (дублет) и 9.5 угла 2-; или 4.7 (дублет), 7.3, и 8.2 угла 2-; или 8.2, 8.6 и 9.5 угла 2-; или 7.3, 7.6 (дублет), 8.2,8.6 угла 2-.Форма может быть идентифицирована и охарактеризована одним или более из этих параметров и/или одним или более из пиков или точек в областях. Использующийся здесь термин полиморф иногда применяется как общий термин в отношении форм рифаксимина и включает в рамках контекста соль, гидрат, полиморф и аморфные формы рифаксимина, раскрытые здесь. Данное применение зависит от контекста и будет очевидным опытному специалисту в данной области. Использующийся здесь термин "примерно" при использовании в отношении положений пиков на порошковой рентгенограмме относится к внутренней изменчивости пиков в зависимости, например, от градуировки прибора, способов получения полиморфа, возраста кристаллизованного материала и т.п., в зависимости от используемого контрольно-измерительного оборудования. В данном случае величина изменчивости прибора составила 0.2 угла 2-. Опытному специалисту в данной области будет понятно использование термина "примерно" в данном контексте. Термин "примерно" в отношении других определенных параметров, например содержания воды, Смакс., t макс., AUC, внутренней скорости растворения,температуры и времени, указывает на собственную изменчивость, например, в измерении параметра или достижении параметра. Опытному специалисту в данной области с помощью данного раскрытия сущности изобретения будет понятна изменчивость параметра в том смысле, в котором предполагается использование этого слова. Полиморфизм, как используется здесь, относится к возникновению разных кристаллических форм одного соединения в разном гидратном состоянии, например, свойству некоторых соединений и комплексов. Таким образом, полиморфы являются разными твердыми веществам, имеющими одинаковую молекулярную формулу, при этом каждый полиморф может обладать разными физическими свойствами. Следовательно, одно соединение может давать начало разным полиморфным формам, где каждая форма имеет разные и отличные физические свойства, такие как профили растворимости, температуры точек плавления, гигроскопичность, форму частицы, плотность, текучесть, уплотняемость и/или пики рентгеновской дифракции. Растворимость каждого полиморфа может отличаться, следовательно, обнаружение существования фармацевтических полиморфов является важным для обеспечения фармацевтических препаратов, обладающих предсказуемыми профилями растворимости. Желательно провести исследование всех форм лекарственных препаратов в твердом состоянии, включающих все полиморфные формы, и определить стабильность, растворимость и профили текучести каждой полиморфной формы. Полиморфные формы соединения можно определить в лаборатории с помощью рентгеновской дифракционной спектроскопии, а также другими способами, такими как инфракрасная спектрометрия. Для общего обзора полиморфов и фармацевтического применения полиморфов смотри G. M. Wall, Pharm Manuf. 3, 33(1986); J. K. Haleblian and W. McCrone, J Pharm. Sci., 58, 911 (1969) и J. K. Haleblian, J. Pharm. Sci., 64,1269 (1975), все из которых включены здесь в виде ссылки. Использующийся здесь термин "субъект" включает организмы, которые могут страдать от нарушения кишечника или другого нарушения, поддающегося лечению рифаксимином, или которые могут получать какой-либо другой положительный эффект от введения рифаксимина, как описано здесь, такие как человек и не относящееся к человеку животное. Предпочтительно, чтобы животным являлся человек. Термин изобретения "не относящееся к человеку животное" включает всех позвоночных, например млекопитающих, грызунов, мышей, и не млекопитающих, таких как приматы, например, овцы, собаки, коровы, цыплята, земноводные, рептилии и т.п. Подверженные нарушению кишечника означает включение субъектов, имеющих риск развития инфекционного заболевания кишечника, т.е. субъектов, страдающих от угнетения иммунной системы, а также субъектов, которые находились в контакте с другими субъектами с бактериальной инфекцией, врачей, медперсонал, субъектов, путешествующих в отдаленные регионы, известные скоплением бактерии, вызывающей диарею путешественника, и т.д. Выражение "профилактически эффективное количество" соединения относится к количеству соединения изобретения формулы (I) или иначе описанному здесь, которое является эффективным после введения однократной или многократной дозы субъекту для предупреждения или лечения бактериальной инфекции. Выражение "терапевтически эффективное количество" соединения изобретения относится к количеству препарата, которое является эффективным после введения однократной или многократной дозы субъекту для обеспечения положительного эффекта субъекту. В одном варианте терапевтическим эффектом является ингибирование вируса или продление жизнеспособности субъекта с такой вирусной инфекцией. В другом варианте, терапевтическим эффектом является ингибирование бактериальной инфекции или продление выживаемости субъекта с такой бактериальной инфекцией, которая бесспорно ожидается при отсутствии такого лечения. Рифаксимин проявляет широкую антибактериальную активность в желудочно-кишечном тракте в отношении локальных желудочно-кишечных бактерий, которые вызывают инфекционную диарею,включая анаэробные штаммы. Сообщалось, что рифаксимин характеризуется незначительной системной абсорбцией благодаря его химическим и физическим характеристикам (Descombe J.J. et al. Pharmacokinetic study of rifaximin after oral administration in healthy volunteers. Int J Clin Pharmacol Res, 14 (2), 51-56,(1994. В отношении возможных неблагоприятных побочных явлений, связанных с терапевтическим применением рифаксимина, индуцирование бактериальной устойчивости к антибиотикам является особенно актуальным. С этой точки зрения, любые различия, обнаруженные в системной абсорбции ,или аморфных форм рифаксимина, могут быть значимыми, поскольку при субингибирующей концентрации рифакси-4 021176 мина, такой как в диапазоне от 0,1 до 1 мкг/мл, была доказана возможность выбора устойчивых мутантовthe rate of selection of spontaneously resistant mutants against representative anaerobic and aerobic bacteria,including ammonia-producing species. Chemotherapy, 46(4), 253-266, (2000. Было обнаружено, что полиморфы рифаксимина имеют отличающиеся in vivo параметры биодоступности. Таким образом, раскрытые здесь полиморфы будут полезными в приготовлении фармацевтических препаратов, обладающих разными характеристиками для лечения инфекций. Это позволит получить составы рифаксимина, которые обладают совершенно разными уровнями адсорбции с величинами Смакс примерно от 0.0 нг/мл до 5.0 мкг/мл. Таким образом, возможно приготовление композиций рифаксимина, обладающих разной степенью адсорбции, от незначительной до значительной, субъектами, подвергающимися лечению. Один вариант изобретения заключается в модулировании терапевтического действия рифаксимина с помощью выбора соответствующей полиморфной формы или смеси форм для лечения пациента. Например, в случае инвазивной бактерии может быть выбрана самая биодоступная полиморфная форма из раскрытых здесь форм, в то время как в случае неинвазивных патогенных микроорганизмов могут быть выбраны менее адсорбируемые формы рифаксимина, поскольку они могут быть безопаснее для субъекта, подвергающегося лечению. Вышеупомянутаяформа может успешно применяться в качестве чистых и гомогенных продуктов в производстве медицинских препаратов, содержащих рифаксимин. Некоторые свойства полиморфа вформе включают, например:Форму наблюдали с использованием метода XRPD твердой фазы в растворе (фиг. 1 и 2). Данные твердые фазы удаляли и подвергали воздействию разным условиям относительной влажности (RH). Через три дня XRPD анализ показал переход вформу при относительной влажности до 43% RH; -1 форму при 58 и 75% RH, и + -1 форму при 94% RH, несмотря на то, что переход формы, повидимому, был инициирован после удаления твердой фазы из растворов. В отношении XRPD анализа, точность и разрешение при количественных измерениях, проводимых на независимо приготовленных образцах с использованием других контрольно-измерительных приборов,могут привести к изменчивости более 0.1 2. В отношении перечня d-межплоскостных расстояний, для расчета d-межплоскостных расстояний использовали длину волны 1.541874 , средневзвешенное значение Cu-K1 и Cu-K2 длин волн. Изменчивость, относящуюся к оценочным показателям dмежплоскостных расстояний, рассчитывали на основании рекомендаций USP при каждом d-расстоянии,и представили в соответствующих таблицах данных и перечне пиков. Способы лечения Здесь описаны способы лечения, предупреждения или смягчения нарушений, связанных с кишечником, включающие введение субъекту, нуждающемуся в таком лечении, эффективного количестваформы рифаксимина. Нарушения, связанные с кишечником, включают одно или более из синдрома раздраженного кишечника, диареи, связанной с микробами диареи, связанной с Clostridium difficile диареи,диареи путешественника, чрезмерного бактериального роста в тонкой кишке, заболевания Крона, хронического панкреатита, недостаточности поджелудочной железы, энтерита, колита, гепатической энцефалопатии или паучита. Длительность лечения конкретного нарушения кишечника частично зависит от вида заболевания. Например, для диареи путешественника может потребоваться лечение только в течение от 12 до 72 ч, в то время как для лечения болезни Крона может потребоваться от 2 дней до 3 месяцев. Дозы рифаксимина будут также различаться в зависимости от стадии заболеваний. Соответствующие диапазоны доз представлены здесь далее. Здесь обеспечены способы лечения или предупреждения патологии у субъекта, который предположительно подвергался воздействию биологического боевого отравляющего вещества. Идентификация тех субъектов, которым требуется профилактическое лечение нарушения кишечника, также находится в рамках квалификации и знаний опытных в данной области специалистов. Некоторые из методов идентификации субъектов, имеющих риск развития нарушения кишечника, которое можно лечить способом изобретения, являются признанными в области медицины, такие как история семьи, история путешествий и предполагаемые планы путешествий, наличие факторов риска, связанных с развитием данной стадии заболевания у субъекта. Практикующий врач, опытный в данной области,легко идентифицирует таких возможных субъектов с помощью, например, клинических тестов, физического обследования и истории болезни/семьи/путешествий. Способ оценки эффективности лечения у субъекта включает определение перед началом лечения уровня чрезмерного бактериального роста в кишечнике способами, хорошо известными в данной области (например, тестирование вдыханием водорода, биопсия, пробы бактерий кишечника и др.), и последующее введение терапевтически эффективного количества полиморфа рифаксимина пациенту. Через соответствующий период времени (например, после начального периода лечения) после введения соединения, например, 2, 4, 8, 12 или 72 ч, снова определяется уровень чрезмерного роста бактерий. Модуляция бактериального уровня указывает на эффективность лечения. Уровень чрезмерного бактериального роста можно определять периодически в течение лечения. Например, чрезмерный бактериальный рост можно проверять каждые несколько часов, дней или недель для оценки дальнейшей эффективности лечения. Уменьшение чрезмерного бактериального роста указывает на то, что лечение является эффективным. Описанный способ можно использовать для скрининга или отбора субъектов, которые могут иметь положительный эффект от лечения полиморфом рифаксимина. В еще другом аспекте, способ лечения субъекта, страдающего или подверженного нарушению кишечника, включает введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества описанного здесь полиморфа рифаксимина. После идентификации субъекта, страдающего и подверженного нарушению кишечника, например синдрому раздраженного кишечника, вводится один или более полиморфов рифаксимина. В одном аспекте способы оценки эффективности лечения полиморфом рифаксимина у субъекта включают определение уровня чрезмерного бактериального роста перед началом лечения, введение терапевтически эффективного количества полиморфа рифаксимина субъекту, и определение чрезмерного бактериального роста после начального периода лечения полиморфом рифаксимина, при этом модуляция чрезмерного бактериального роста указывает на эффективность антибактериалььного лечения. Эффективность лечения можно определить, например, снижением уровня чрезмерного бактериального роста. Эффективность также можно определить по уменьшению или смягчению симптомов, связанных с нарушением кишечника, например снижением тошноты, метеоризма, диареи и т.п. В одном аспекте способы наблюдения за улучшением состояния субъекта, лечение которого производится полиморфом рифаксимина, включают определение уровня чрезмерного бактериального роста перед началом лечения, введение терапевтически эффективного количества полиморфа рифаксимина субъекту и определение уровня чрезмерного бактериального роста после начального периода лечения полиморфом рифаксимина, при этом модуляция уровня чрезмерного бактериального роста указывает на эффективность антибактериального лечения. Фармацевтические составы Варианты также обеспечивают фармацевтические композиции, включающие эффективное количествоформы, а также фармацевтически приемлемый носитель. В других вариантах, эффективное количество является эффективным для лечения бактериальной инфекции, например, чрезмерного бактериального роста в тонком кишечнике, заболевании Крона, гепатической энцефалопатии, колита, связанного с применением антибиотиков, и/или дивертикулеза. Примеры применения рифаксимина для лечения диареи путешественника смотри в Infante RM, Ericsson CD, Zhi-Dong J, Ke S., Steffen R, Riopel L., Sack DA, DuPont, HL. Enteroaggregative Escherichia coliWith Rifaximin on Various Continents. The American Journal of Gastroenterology. May 2003, Volume 98,Number 5, все из которых включены здесь полностью в виде ссылки. Варианты также обеспечивают фармацевтические композиции, включающиеформу рифаксимина,а также фармацевтически приемлемый носитель. То есть составы могут содержать только один полиморф или могут содержать смесь более одного полиморфа. Смеси могут быть выбраны, например, на основании требуемых величин системной абсорбции, профиля растворимости, требуемой локализации в пищеварительном тракте, подлежащей лечению, и т.п. Варианты фармацевтической композиции, кроме того, содержат вспомогательные вещества, например, один или более из разбавителя, связующего, лубриканта, улучшающего распадаемость вещества, красителя, ароматизатора и подсластителя. Одна композиция может быть составлена для выбранных покрытых и не покрытых оболочкой таблеток, твердых или мягких желатиновых капсул, покрытых сахаром пилюль, таблеток для рассасывания, пластин в облатке,гранул и порошков в герметичной упаковке. Например, композиции могут быть составлены для местного применения, например, мази, помады, кремы, гели и лосьоны. В одном варианте, полиморф рифаксимина вводится субъекту с использованием фармацевтически приемлемых составов, например, фармацевтически-приемлемых составов, которые обеспечивают непрерывную доставку полиморфа рифаксимина пациенту в течение по меньшей мере 12, 24, 36, 48 ч, одной недели, двух недель, трех недель или четырех недель после введения фармацевтически приемлемого состава субъекту. В определенных вариантах, эти фармацевтические композиции являются пригодными для местного или орального введения субъекту. В другом варианте, как подробно описано ниже, фармацевтические композиции настоящего изобретения могут быть специально составлены для введения в твердой или жидкой форме, включая такие, которые приспособлены для следующих способов введения: (1) оральное введение, например, вливания (водные или неводные растворы или суспензии), таблетки, шарики, порошки, гранулы, пасты; (2) парентеральное введение, например, подкожная, внутримышечная или внутривенная инъекция, например стерильного раствора или суспензии; (3) местное применение, например в виде крема, мази или спрея, наносимого на кожу; (4) интравагинальное или интраректальное, например,-6 021176 в виде маточного кольца, крема или пены; или (5) аэрозольное, например в виде водного аэрозоля, липосомального состава или твердых частиц, содержащих соединение. Фраза "фармацевтически приемлемый" относится к таким полиморфам рифаксимина настоящего изобретения, композициям, содержащим такие соединения, и/или лекарственным формам, которые в рамках медицинских процедур являются пригодными для использования при контакте с тканями человека и животных, не вызывая избыточной токсичности, раздражения, аллергической реакции или других нарушений или осложнений, соизмеримых с разумным соотношением польза/риск. Фраза "фармацевтически приемлемый носитель" включает фармацевтически приемлемый материал,композицию или растворитель, такой как жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или капсулированный материал, вовлеченный в перенос или транспортировку химического препарата из одного органа или части тела в другой орган или часть тела. Каждый носитель является предпочтительно "приемлемым" в отношении его сочетания с другими компонентами состава и ненанесения вреда пациенту. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза;(2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлоза и ее производные,такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; (4) порошковая адрагантовая камедь; (5) солод; (6) желатин; (7) тальк; (8) вспомогательные вещества, такие как масло какао и суппозиторные воски; (9) масла, такие как арахисовое масло, хлопковое масло, подсолнечное масло,кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиоли, такие как глицерин, сорбитол, маннитол и полиэтиленгликоль; (12) эфиры,такие как этилолеат и этиллаурат; (13) агар; (14) буферные агенты, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы и (21) другие нетоксичные совместимые вещества, применяющиеся в фармацевтических составах. Также, в композициях могут присутствовать смачивающие агенты, эмульгаторы и лубриканты, такие как лаурилсульфат натрия и стеарат магния, а также красители, высвобождающие агенты, покрывающие агенты, подсластители, ароматизаторы и парфюмерные добавки, консерванты и антиоксиданты. Примеры фармацевтически приемлемых антиоксидантов включают: (1) растворимые в воде антиоксиданты, такие как аскорбиновая кислота, цистеина гидрохлорид, бисульфат натрия, метабисульфит натрия, сульфит натрия и т.п.; (2) растворимые в масле антиоксиданты, такие как аскорбил пальмитат,бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, альфа-токоферол и т.п. и (3) хелатирующие агенты, такие как лимонная кислота, этилендиамин тетрауксусная кислота (EDTA), сорбитол, винная кислота, фосфорная кислота и т.п. Композиции, содержащие раскрытые здесь формы рифаксимина, включают такие, которые являются пригодными для орального, назального (включая буккальное и сублингвальное), ректального, вагинального, аэрозольного и/или парентерального введения. Обычно композиции могут быть представлены в виде лекарственной формы и могут быть приготовлены способами, хорошо известными в области фармацевтики. Количество активного компонента, которое можно объединить с материалом носителя для получения однократной лекарственной формы, будет различаться в зависимости от организма "хозяина",который подвергается лечению, конкретного режима введения. Количество активного компонента, которое можно объединить с материалом носителя для получения однократной лекарственной формы, в целом будет таким количеством соединения, которое вызывает терапевтический эффект. В целом, из 100%,это количество будет находиться в диапазоне примерно от 1 до 99% активного компонента, предпочтительно примерно от 5 до 70% и более предпочтительно примерно от 10 до 30%. Способы приготовления этих композиций включают приведение в контакт полиморфа(ов) рифаксимина с носителем и, факультативно, с одним или более дополнительными компонентами. В целом,составы готовят путем равномерного и тщательного приведения в контакт полиморфа рифаксимина с жидкими носителями или тонкодиспергированными твердыми носителями, или обоими, и затем придания формы продукту при необходимости. Композиции, пригодные для орального введения, могут быть в форме желатиновых капсул, крахмальных капсул, пилюль, таблеток, таблеток для рассасывания (с использованием ароматизированной основы, обычно сахарозы и камеди или траганта), порошков, гранул, а также в виде растворов или суспензий в водных или неводных жидкостях, а также в виде жидких эмульсий масло-в-воде или вода-вмасле, а также в виде эликсира или сиропа, или в виде пастилок (с использованием инертной базы, такой как желатин и глицерин, или сахарозы и камеди), и/или в виде полоскания для полости рта и т.п., каждые из которых содержат заранее установленное количество полиморфа(ов) рифаксимина в качестве активного компонента. Также, соединение можно вводить в виде шариков, электуария или пасты.Форма может успешно применяться в производстве медицинских препаратов, обладающих активностью антибиотика, содержащих рифаксимин, как для орального, так и для местного применения. Медицинские составы для орального применения будут содержать рифаксиминформы совместно с традиционными вспомогательными веществами, например, разбавителями, такими как маннитол, лактоза и сорбитол; связующими, такими как крахмалы, желатины, сахара, производные целлюлозы, натуральные смолы и поливинилпирролидон; лубрикантами, такими как тальк, стеараты, гидрогенизированные растительные масла, полиэтиленгликоль и коллоидный диоксид кремния; деинтегрирующими агентами, такими как крахмалы, целлюлозы, альгинаты, смолы и ретикулярные полимеры; красителями, ароматизаторами и подсластителями. Варианты изобретения включают твердые составы, вводимые оральным способом, например покрытые и непокрытые оболочкой таблетки в мягких или твердых желатиновых капсулах, покрытые сахаром пилюли, пастилки, таблетки для рассасывания, пластинки в облатке, гранулы и порошки в герметичной упаковке или других контейнерах. Медицинские составы для местного применения могут содержать рифаксиминформы совместно с традиционными вспомогательными веществами, такими как белый вазелин, белый воск, ланолин и его производные, стеариловый спирт, пропиленгликоль, натрия лаурилсульфат, эфиры жирных полиэтиленгликолей, эфиры жирных полиоксиэтиленовых кислот, сорбитанмоностеарат, глицерилмоностеарат,пропиленгликольмоностеарат, полиэтиленгликоли, метилцеллюлоза, гидроксиметилпропилцеллюлоза,натрия карбоксиметилцеллюлоза, коллоидный раствор алюминия и силикат магния, альгинат натрия. Варианты изобретения относятся ко всем составам для местного применения, например, мазям, помадам, кремам, гелям и лосьонам. В твердых лекарственных формах рифаксимина для орального введения (капсулы, таблетки, пилюли, драже, порошки, гранулы и т.п.) активный компонент обычно смешан с одним или более фармацевтически приемлемыми носителями, такими как цитрат натрия или дикальция фосфат, и/или любым из следующих вспомогательных веществ: (1) наполнители или расширители, такие как крахмалы, лактоза,сахароза, глюкоза, маннитол и/или кремниевая кислота; (2) связующие, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь; (3) увлажнители,такие как глицерол; (4) дезинтегрирующие агенты, такие как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия; (5) замедлители схватывания раствора, такие как парафин; (6) ускорители абсорбции, такие как четвертичные аммониевые соединения; (7) смачивающие агенты, такие как, например, ацетиловый спирт и глицерол моностеарат; (8) абсорбенты, такие как каолин и бентонитовая глина; (9) лубриканты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, твердый лаурилсульфат и их смеси; и (10) красители. В случае капсул, таблеток и пилюль, фармацевтические композиции могут также содержать буферные вещества. Твердые композиции аналогичного типа могут также применяться в качестве наполнителей в мягких или твердых наполненных желатиновых капсулах с помощью вспомогательных вещества,таких как лактоза или молочный сахар, а также полиэтиленгликоли с высоким молекулярным весом и т.п. Таблетки могут быть изготовлены прессованием или формованием, факультативно с одним или более дополнительными компонентами. Прессованные таблетки могут быть приготовлены с помощью связующего (например, желатина или гидроксипропилцеллюлозы), лубриканта, инертного разбавителя,консерванта, дезинтегратора (например, натрия гликолят крахмала или поперечно-связанной натрия карбоксиметилцеллюлозы), поверхностно-активного или диспергирующего агента. Формованные таблетки могут быть изготовлены формованием на пригодном оборудовании смеси порошковых активных компонентов, увлажненных инертным жидким разбавителем. Таблетки и другие твердые лекарственные формы описанных здесь фармацевтических композиций,такие как драже, капсулы, пилюли и гранулы, дополнительно могут содержать риску или быть приготовленными с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия,хорошо известные в области фармакологии и составления рецептур. Они также могут быть составлены таким образом, чтобы обеспечить медленное или контролируемое высвобождение активного компонента с помощью, например, гидроксипропилметилцеллюлозы в разных пропорциях для обеспечения требуемого профиля высвобождения, других полимерных матриц, липосом и/или микросфер. Они могут быть стерилизованы, например, фильтрацией через удерживающий бактерии фильтр или путем включения стерилизующих агентов в виде стерильных твердых композиций, которые могут растворяться в стерильной воде или некоторых других стерильных средах для вливаний непосредственно перед применением. Эти композиции могут также факультативно содержать замутняющие агенты и являться такой композицией, которая высвобождает активный компонент(ы) только, или преимущественно, в определенных участках желудочно-кишечного тракта, факультативно, замедленным способом. Примеры заливочных композиций, которые могут использоваться, включают полимерную основу и воски. Также, при необходимости, активный компонент может быть заключен в микрокапсулу с одним или более из описанных выше вспомогательных веществ. Жидкие лекарственные формы для орального введения полиморфа(ов) рифаксимина включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и элексиры. Дополнительно к активным компонентам, жидкие лекарственные формы могут содержать инертные разбавители, широко используемые в данной области, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат,-8 021176 бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности хлопковое масло, арахисовое масло, кукурузное масло, масло зародышей пшеницы, касторовое масло и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и эфиры сорбита и жирной кислоты и их смеси. Дополнительно к инертным разбавителям, оральные композиции могут включать вспомогательные вещества, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подстастители, ароматизаторы, красители, парфюмерные добавки и консерванты. Суспензии, дополнительно к активному полиморфу(ам) рифаксимина, могут содержать суспендирующие агенты, например, этоксилированные изостеариловые спирты, полиоксиэтиленовый сорбит и сорбитовые эфиры, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагант, а также их смеси. Фармацевтические композиции для ректального или вагинального введения могут быть представлены в виде суппозитория, который можно приготовить путем смешивания одного или более полиморфов рифаксимина с одним или более пригодными нераздражающими вспомогательными веществами или носителями, включающими, например, кокосовое масло, полиэтиленгликоль, восковый или салицилатный суппозиторий, и который, находясь в твердом состоянии, при комнатной температуре становится жидким при температуре тела и таким образом расплавляется в ректальной или вагинальной полости,высвобождая активный агент. Композиции, которые являются пригодными для вагинального введения, также включают вагинальные суппозитории, тампоны, кремы, гели, пасты, пены или составы спреев, содержащие такие носители, которые признаны пригодными в данной области. Лекарственные формы для местного или подкожного введения полиморфа(ов) включают порошки,спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляционные формы. Активный полиморф(ы) рифаксимина может быть смешан в стерильных условиях с фармацевтически приемлемым носителем и любыми консервантами, буферами или сжатыми жидкостями, которые могут потребоваться. Мази, пасты, кремы и гели могут содержать, дополнительно к полиморфу(ам) рифаксимина, вспомогательные вещества, такие как жиры животного и растительного происхождения, масла, воски, парафины, крахмал, трагант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка или их смеси. Порошки и спреи могут содержать, дополнительно к полиморфу(ам) рифаксимина, вспомогательные вещества, такие как лактоза, тальк, кремниевую кислоту, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси этих веществ. Спреи могут дополнительно содержать обычные сжатые жидкости, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Полиморф(ы) рифаксимина могут альтернативно вводиться в виде аэрозоля. Это выполняется приготовлением водного аэрозоля, липосомального состава или твердых частиц, содержащих соединение. Может применяться безводная суспензия (например, сжатый фторуглерод). Предпочтительными являются ультразвуковые распылители, потому что они минимизируют воздействие агента на сдвиг, который может привести к разложению соединения. Водный аэрозоль изготовлен, например, путем составления водного раствора или суспензии агента вместе с обычными фармацевтически приемлемыми носителями и стабилизаторами. Носители и стабилизаторы различаются в зависимости от требований конкретного соединения, но обычно включают неионные поверхностно-активные вещества (Твины, Плюронилы или полиэтиленгликоль), нетоксичные белки, подобные сывороточному альбумину, эфиры сорбита, олеиновую кислоту, лецитин, аминокислоты, такие как глицин, буферы, соли, сахара или сахарные спирты. Аэрозоли обычно готовят из изотонических растворов. Трансдермальные пластыри обладают дополнительным преимуществом, которое состоит в обеспечении контролируемой доставки полиморфа(ов) рифаксимина телу субъекта. Такие лекарственные формы могут быть изготовлены путем растворения или диспергирования агента в соответствующей среде. Также, для увеличения растекания активного компонента по коже можно использовать усилители абсорбции. Скорость такого растекания можно контролировать с помощью контролирующей скорость мембраны или диспергирования активного компонента в полимерной матрице или геле. Офтальмологические составы, глазные мази, порошки, растворы и т.п. также рассматриваются в рамках изобретения. Пригодные для парентерального введения фармацевтические композиции могут содержать один или более полиморфов рифаксимина в комбинации с одним или более фармацевтически приемлемыми стерильными изотоническими водными или не водными растворами, дисперсиями, суспензиями или эмульсиями, или стерильными порошками, которые можно перевести в стерильные растворы или дисперсии для вливаний непосредственно перед применением, и которые могут содержать антиоксиданты,буферы, бактериостаты, растворы, делающие составы изотоническими с кровью предполагаемого реципиента, или суспендирующие агенты, или загустители. Примеры пригодных водных или неводных носителей, которые можно использовать в фармацевти-9 021176 ческих композициях, включают воду, этанол, полиолы (такие как глицерол, пропиленгликоль, полиэтиленгликоль и подобные), и их пригодные смеси, масла животного происхождения, такие как оливковое масло и впрыскиваемые органические эфиры, такие как этилолеат. Требуемую текучесть можно поддерживать, например, с помощью использования покрывающих материалов, таких как лецитин, сохранением требуемого размера частиц в случае дисперсий и с помощью использования поверхностно-активных вещетв. Данные композиции могут также содержать вспомогательные вещества, такие как консерванты,смачивающие агенты, эмульгаторы и диспергаторы. Предотвращение действия микроорганизмов может быть обеспечено включением разных антибактериальных и антифугицидных агентов, например, парабена, хлорбутанола, фенол сорбиновой кислоты и подобных. Возможно, будет желательно включить в композиции изотонические агенты, такие как сахара, хлорид натрия и т.п. Дополнительно, продленную абсорбцию впрыскиваемой фармацевтической формы можно вызвать включением агентов, задерживающих абсорбцию, таких как моностеарат алюминия и желатин. В некоторых случаях для продления действия лекарства желательно изменить абсорбцию лекарственного препарата. Это может быть достигнуто использованием жидкой суспензии кристаллического,ораморфного материала на основе соли, который имеет низкую растворимость в воде. Таким образом,скорость абсорбции лекарственного препарата может зависеть от его скорости растворения, которая, в свою очередь, зависит от размера кристалла и кристаллической формы. Или же, замедленная абсорбция лекарственной формы может быть достигнута растворением или суспендированием лекарственного препарата в масляном наполнителе. Формы для инъекций с замедленным всасыванием изготовлены путем формирования микроинкапсулированных матриксов полиморфа(ов) рифаксимина в биоразлагаемых полимерах, таких как полилактид-полигликолид. Скорость высвобождения лекарственного препарата можно контролировать в зависимости от соотношения лекарственного препарата к полимеру и природы конкретного использующегося полимера. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Составы для инъекций с замедленным всасыванием также готовятся путем включения лекарственного препарата в липосомы или микроэмульсии, которые являются совместимыми с тканями тела. Введение полиморфа(ов) рифаксимина в виде лекарственных препаратов человеку и животным может производиться непосредственно в чистом виде или в виде фармацевтической композиции, содержащей, например, от 0,1 до 99,5% (более предпочтительно от 0,5 до 90%) активного компонента в комбинации с фармацевтически приемлемым носителем. Независимо от выбранного курса введения, полиморф(ы) рифаксимина, который может применяться в пригодной гидратированной форме, и/или фармацевтические композиции настоящего изобретения составлены в виде фармацевтически приемлемых лекарственных форм с помощью способов, известных опытным в данной области специалистам. Фактические уровни доз и продолжительность курса введения активных компонентов в фармацевтических композициях могут изменяться таким образом, чтобы получить количество активного компонента, которое является эффективным для достижения желаемого терапевтического ответа для конкретного субъекта, такую композицию и режим введения, которые не оказывают токсического действия на субъекта. Примерный диапазон доз составляет от 25 до 3000 мг в день. Предпочтительной дозой полиморфа рифаксимина настоящего изобретения является максимальная доза, которую пациент может перенести без развития серьезных побочных эффектов. Предпочтительно,чтобы полиморф рифаксимина настоящего изобретения вводился при концентрации примерно от 1 мг до 200 мг на килограмм веса тела, примерно от 10 до 100 мг/кг или примерно от 40 до 80 мг/кг веса тела. Также, предполагаются использование промежуточных диапазонов вышеуказанных значений. При комбинированном терапевтическом лечении оба соединения данного изобретения и другие лекарственные агенты вводятся млекопитающим (например, человеку мужского или женского пола) традиционными способами. Агенты можно вводить в виде однократной лекарственной формы или в виде отдельных лекарственных форм. Эффективные количества других терапевтических агентов хорошо известны опытным в данной области специалистам. Также, в пределах компетентности опытных специалистов находится определение оптимального диапазона эффективного количества другого терапевтического агента. В одном варианте, в котором животному вводится другой терапевтический агент, эффективное количество соединения данного изобретения меньше, чем его эффективное количество в случае, если другой терапевтический агент не вводится. В другом варианте, эффективное количество традиционного агента является меньше, чем его эффективное количество в случае, если соединение данного изобретения не вводится. В этом случае, нежелательные побочные эффекты, связанные с высокими дозами каждого агента, могут быть сведены к минимуму. Другие важные преимущества (включая без ограничения утвержденные режимы дозирования и/или сниженную стоимость препарата) будут очевидны опытным специалистам в данной области. В разных вариантах, терапии (например, профилактические или терапевтические агенты) назначаются с интервалом менее 5 мин, менее 30 мин, 1 ч, примерно с интервалом в 1 ч, примерно с интервалом от 1 до 2 ч, примерно с интервалом от 2 до 3 ч, примерно с интервалом от 3 до 4 ч, примерно с интервалом от 4 до 5 ч, примерно с интервалом от 5 до 6 ч, примерно с интервалом от 6 до 7 ч, примерно с интервалом от 7 до 8 ч, примерно с интервалом от 8 до 9 ч, примерно с интервалом от 9 до 10 ч, примерно с интервалом от 10 до 11 ч, примерно с интервалом от 11 до 12 ч, примерно с интервалом от 12 до 18 ч, с интервалом от 18 до 24 ч, с интервалом от 24 до 36 ч, с интервалом от 36 до 48 ч, с интервалом от 48 до 52 ч, с интервалом от 52 до 60 ч, с интервалом от 60 до 72 ч, с интервалом от 72 до 84 ч, с интервалом от 84 до 96 ч, с интервалом от 96 до 120 ч. В предпочтительных вариантах две или более терапий вводятся за один визит пациента. В определенных вариантах одно или более соединений и одна или более терапий (например, профилактические или терапевтические агенты) вводятся циклически. Циклическая терапия включает введение первой терапии (например, первого профилактического или терапевтического агента) в течение периода времени, с последующим введением второй терапии (например, второго профилактического или терапевтического агента) в течение периода времени, дополнительно, с последующим введением третьей терапии (например, профилактического или терапевтического агента) в течение периода времени и так далее, и повторении последовательности введения, т.е. цикла для снижения развития устойчивости к одной из терапий, для предотвращения или уменьшения побочных эффектов одной из терапий, и/или повышения эффективности терапий. В определенных вариантах введение одного и того же соединения можно повторять и введения могут отстоять друг от друга по меньшей мере на 1, 2, 3, 5, 10, 15, 30, 45 дней, 2 месяца, 75 дней, 3 месяца или по меньшей мере 6 месяцев. В другом варианте введение одной и той же терапии (например, профилактического или терапевтического агента), отличной от полиморфа рифаксимина, можно повторять, и введения могут отстоять друг от друга по меньшей мере на 1, 2, 3, 5, 10, 15, 30, 45 дней, 2 месяца, 75 дней, 3 месяца или по меньшей мере 6 месяцев. Определенные показатели могут потребовать более длительного курса лечения. Например, лечение диареи путешественника может продлиться только примерно от 12 до 72 ч, в то время как лечение болезни Крона может составить примерно от 1 дня до 3 месяцев. Лечение гепатической энцефалопатии может продлиться, например, до конца жизни пациента. Лечение синдрома раздраженного кишечника может быть прервано на несколько недель или месяцев на некоторое время или продлиться до конца жизни пациента. Готовые изделия Другой вариант включает готовые изделия, которые включают, например, контейнер, содержащий фармацевтическую композицию, пригодную для орального или местного введения рифаксимина в комбинации с отпечатанными этикетками с инструкциями, содержащими комментарии по приему конкретной лекарственной формы с пищей и на пустой желудок. Примеры лекарственных форм и протоколов введения представлены далее. Композиции могут содержаться в любом пригодном контейнере, способном удерживать и распределять лекарственную форму, и который не будет значительно взаимодействовать с композицией, и при этом будет находиться в физическом сродстве с соответствующей этикеткой. Этикетки с инструкциями согласуются со способами лечения, как описано здесь выше. Этикетки могут быть связаны с контейнером любыми средствами, сохраняющими с ними физическое сродство, например, содержаться в упаковке, такой как коробка или пластиковая термоусадочная оболочка, или могут быть приклеены на контейнер, например, с помощью клея, который не замутняет инструкции на этикетке, или с помощью других присоединяющих или удерживающих средств. Другим аспектом является готовое изделие, которое включает контейнер, содержащий фармацевтическую композицию рифаксимина, при этом контейнер содержит предпочтительно композицию рифаксимина в виде однократной лекарственной формы и связан с отпечатанными инструкциями, содержащими рекомендации по различающейся абсорбции при введении фармацевтической композиции во время и до приема пищи. Также обеспечены упакованные композиции, которые могут содержать терапевтически эффективное количество рифаксимина. Рифаксимин и фармацевтически приемлемый носитель или разбавитель,при этом композиция составлена для лечения пациента, страдающего или подверженного нарушению кишечника, и упакована с инструкциями для лечения пациента, страдающего или подверженного нарушению кишечника. Также здесь обеспечены наборы, например наборы для лечения нарушения кишечника у пациента. Наборы могут содержать, например, одну или более изформы,формы, -сухой формы,формы, -1 формы, -2 формы, -сухой формы, формы мезилата или аморфных форм рифаксимина и инструкции по применению. Инструкции по применению могут содержать запрещающую информацию, информацию по дозировке, хранению и т.п. Также обеспечены упакованные композиции, которые могут содержать терапевтически эффективное количество одного или более из полиморфа рифаксимина и фармацевтически приемлемый носитель или разбавитель, при этом композиция составлена для лечения пациента, страдающего или подвержденного нарушению кишечника, и упакована с инструкциями по лечению пациента, страдающего или под- 11021176 верженного нарушению кишечника. Примеры Материалы Рифаксимин хранили в дессикаторе при комнатной температуре. Характеристика форм Некоторые из гидратированных, солевых и аморфных форм рифаксимина были охарактеризованы с помощью одного или более из метода рентгеновской порошковой дифрактометрии (XRPD), термического анализа, метода инфракрасной спектроскопии с Фурье-преобразованием (FT-IR), метода рамановской спекстроскопии с Фурье-преобразованием (FT-Raman), метода 13 С-ЯМР спектроскопии. Высушенные материалы, полученные с помощью вакуумной сушки или нагревания гидратов, были помечены как "сухие". Эти материалы проявили XRPD рентгенограммы, которые были смещены или содержали один или два дополнительных маленьких пика при сравнении с невысушенным материалом.ФормаФорма является гигроскопичной кристаллической мезофазой. По данным ТГА данная форма демонстрирует потерю массы 1,2-3,8% и плавится приблизительно при 203C (табл. 4).Форму рифаксимина получали из раствора в водно-этанольных смесях. Твердую фазу получали ускоренным охлаждением этанол/вода (1/0,45) раствора в ледяной ванне и сушкой на воздухе в течение 45 мин, а также из суспензииФормы в смеси этанол/вода (1/0,5). Термогравиметрический анализ (ТГ) показал потерю массы от 1,2 до 3,8%, соответствующую широкой эндотермичности при 89C на кривой ДСК. Наблюдаемая в обоих образцах незначительная эндотермичность при 203C приписывается плавлению. Влажностный баланс сорбции/десорбции показал потерю массы 2,4% при установлении равновесия при относительной влажности 5% RH. Материал является гигроскопичным, набирающим 10,8% по массе при относительной влажности 95% RH. Эта масса (11,7%) была потеряна во время десорбции до 5% RH. Продолжительное исследование относительной влажностиФормы показали отсутствие перехода формы при воздействии разных величин относительной влажности от 11 до 94% в течение двух дней. Форма оставалась без изменений по данным XRPD анализа после сушки в вакууме при комнатной температуре в течение одного дня. Другие способы раскрыты далее, например, в последующих таблицах.-1 Форма является кристаллической мезофазой (фиг. 1). Материал получали путем суспендирования -сухой Формы в смеси этанол/вода (1/0,45 при 0C и 1/1 при комнатной температуре) в течение двух дней (0 и 0). Выделенную твердую фазу высушивали на воздухе и хранили при комнатной температуре в течение трех дней. Образование -1 Формы также происходило при выдерживанииФормы при относительной влажности 58 и 75% RH в течение трех дней. Другие способы раскрыты далее, например, в последующих таблицах.ФормаФорму наблюдали с использованием XRPD анализа твердых фаз в растворе (фиг. 2). Данные твердые фазы удаляли и подвергали воздействию различных условий относительной влажности RH. Через три дня анализ XRPD показал переход вФорму при относительной влажности 43% RH; -1 Форму при относительной влажности 58 и 75% RH, и + -1 Форму при относительной влажности 94% RH, хотя начало перехода формы, вероятно, было инициировано удалением твердой фазы из раствора. Другие способы раскрыты далее, например, в последующих таблицах.ФормаФорму получали сушкойФормы (фиг. 3) под вакуумом в течение одного дня. Материал оставался без изменений во время сушки под вакуумом при 40C в течение одного дня. Другие способы раскрыты далее, например, в последующих таблицах.Форма Пространственную группу определили как P212121 (No.19). Упаковочный мотивФормы рифаксимина отличается от слоистой структуры, наблюдаемой в предыдущих двух структурах. Кристаллическая структура содержала дополнительную остаточную электронную плотность, обычно приписываемую высоко разупорядоченным молекулам растворителя в решетке. Аморфный материал Аморфный рифаксимин готовили путем помолаФормы или + Форм при комнатной температуре. Аморфный рифаксимин был физически стабильным в разных условиях относительной влажности и показал высокую начальную температуру стеклования 199C. Термогравиметрический анализ (ТГ) аморфного рифаксимина продемонстрировал потерю 1,5 мас.% до 100C, сопровождаемую широкой эндотермичностью при 78C на кривой ДСК, указывая на содержание в материале остаточного растворителя. Минимальную эндотермичность при 203C также наблюдали на кривой ДСК. Циклическую ДСК выполняли для сушки образца и определения Tg, однако температура стеклования не была очевидна на основании полученных данных. Модулированная дифференциальная сканирующая калориметрия показала начальную температуру стеклования (Tg), равную приблизительно 199C. Аморфный рифаксимин был гигроскопичным, набирающим 11,6 мас.% под воздействием 95% RH. Приращенная масса была потеряна во время цикла десорбции. По данным XRPD анализа материал сохранялся аморфным. Также было исследовано поведение аморфного рифаксимина в разных условиях относительной влажности. Аморфный материал хранили при относительной влажности 43% RH в течение 5 дней, 58%RH в течение 8 дней и 75% RH в течение 2 дней. Материал сохранялся аморфным по данным XRPD анализа. Кристаллизацию рифаксимина проводили с помощью воды и изменения соотношений этанол/вода с использованием разных методик, раскрытых здесь. Дополнительно проводили изучение сушки, а также подвергали воздействию разных условий относительной влажности. Аморфный рифаксимин был охарактеризован методами циклической ДСК и ТГ: ускоренным осаждением из этилацетата гептаном, лиофилизацией в смеси р-диоксан:вода 1:1 и быстрым выпариванием из ацетона. Термограммы циклической ДСК не показали наличия стеклования. Стандартный ДСК тест на аморфном образце, который был получен ускоренным осаждением из этилацетата гептаном, показал две широких эндотермичности приблизительно при 79 и 204C, что указывало на вероятную десольватацию с последующим распадом. Этот образец анализировали с использованием метода модулированной ДСК. По данным ТГ все аморфные образцы показали потерю по массе в диапазоне примерно от 5 до 6% от 25 до 200C, что указывало на содержание остаточного растворителя во всех трех составах. Два аморфных состава Рифаксимина (один в результате лиофилизации из смеси р-диоксан:вода 1:1,другой в результате ускоренного осаждения в этилацетате гептаном, известный как лиофилизированный аморфный рифаксимин и осажденный аморфный рифаксимин, соответственно), были охарактеризованы с использованием метода анализа динамической испарительной сорбции/десорбции (DVS). Оба образца были умеренно гигроскопичными со стабильным поглощением воды (приблизительно 8% прибавки по массе для обоих образцов) от 5 до 95% относительной влажности. DVS кривые для обоих образцов показали гистерезис, поскольку оба потеряли больше массы/воды на десорбции, чем прибавили на адсорбции. Кристаллизацию не наблюдали ни на одном образце после анализа DVS. На основании полученных данных рекомендуется провести изучение воздействия относительной влажности на два аморфных материала при 40C/75% RH. Экспериментальные испытания по воздействию пара проводили на аморфном материале, полученном двумя способами: лиофилизацией из смеси р-диоксан:вода 1:1 и ускоренным осаждением из этилацетата гептаном. Через 6 дней один образец (воздействие толуолом) показал двулучепреломление при микроскопии, что являлось признаком кристаллизации, но не показал пиков при анализе методом XRPD. Большинство подвергнутых воздействию образцов через 6 дней представляли собой прозрачные красные растворы. Эти растворы помещали в пробирки с антирастворителем для диффузии пара. Экспериментальные испытания сухого и влажного помола проводили на аморфных материалах, полученных двумя способами, упомянутыми выше. Аморфные материалы получали в результате испытаний по сухому помолу. Анализ методом модулированной ДСК рентгеноаморфного рифаксимина, полученного ускоренным осаждением в этилацетате гептаном, не обнаружил признаков температуры стеклования. Второй анализ методом модулированной ДСК на образце рентгеноаморфного рифаксимина, полученного в результате воздействия паров воды, рассматривается далее. Возможно, что присутствие воды в образце сможет понизить температуру стеклования, что теоретически может позволить ее детектировать методом модулированной ДСК. Кристаллизацию аморфного рифаксимина вФорму наблюдали в экспериментах по диффузии паров в метаноле и тетрагидрофуране с использованием воды в качестве антирастворителя. Таблица 2. Аморфный рифаксиминa) эндо = эндотермичность, представленные температуры (C) являются максимумом перехода. Температуры округлены до ближайшего градуса.b) потеря массы (%) при определенной температуре; изменения массы (%) округлены до 2 десятичных знаков; температуры округлены до ближайшего градуса.a) Образец анализировали с помощью INEL и BRUKER XRPD для подтверждения результата. Таблица 5. Эксперименты по измельчению для рифаксимина, аморфные материалыFT-IR = инфракрасная спектроскопия с Фурье-преобразованием; 1 Н-ЯМР = протонная ядерная магнитная спектроскопия растворов; 13C-ssNMR = углерод-13 ядерная магнитная спектроскопия твердого состояния. Таблица 8. Анализ пост-влажностной сорбции/десорбцииa) Результаты XRPD взяты из анализа пост-влажностной сорбции/десорбциисорбция от 5% RH до 95% RH; десорбция от 95% RH до 5% RH. Таблица 9. Монокристалл и расчетные данные для рифаксимина Формы -1 Таблица 11. Сводные данные по экспериментам, приводящим к образованиюФормы и смесейФормыa) LIMS 88046 использовали в качестве исходного материала, если не указано иначе. SE = медленное выпаривание; SC = медленное охлаждение.c) Образцы определяли в растворе в капиллярной колонке Таблица 20. Эксперименты по сушке рифаксиминаa) В = двойное лучепреломление; Е = затухание Таблица 22. Нагрузка разными относительными влажностямиa) Все образцы хранили при комнатной температуре, если не указано иначе;b) В = двойное лучепреломление; Е = затухание Материалы Образцы хранили в дессикаторе. Растворители и другие реагенты приобретали у коммерческих поставщиков и использовали после получения. Растворители имели степень чистоты HPLC или ACS. Медленное выпаривание Растворитель добавляли в навески рифаксимина в пробирках. Смеси диспергировали с помощью ультразвука для достижения полного растворения твердой фазы. Растворы затем фильтровали в чистые пробирки. Растворители медленно выпаривали при комнатной температуре. Ускоренное охлаждение Образец рифаксимина готовили в смеси этанол/вода 1/0.45 и пропускали через 0,2 мкм нейлоновый фильтр в чистую пробирку. Затем содержащую раствор пробирку быстро охлаждали погружением в ледяную ванну на несколько секунд. Осажденную твердую фазу собирали фильтрацией и высушивали. Испытания суспензии Тестируемые растворители добавляли в пробирки с рифаксимином таким образом, чтобы в раство- 19021176 рах присутствовало избыточное количество нерастворенной твердой фазы. Смеси затем суспендировали на встряхивателе или роторном смесителе при температуре ниже комнатной или при комнатной температуре. Воздействие разных условий относительной влажности (RH) Пробирку, содержащую рифаксимин, помещали открытой внутрь сосуда, содержащего пентоксид фосфора (Р 2 О 5) или насыщенный раствор соли в воде. Сосуд взвешивали и хранили при комнатной температуре или в печи при повышенной температуре. Медленное охлаждение Насыщенные растворы рифаксимина готовили суспендированием избыточного количества твердой фазы в тестируемом растворителе при повышенной температуре. Насыщенный раствор фильтровали,пока он был теплым, в чистую пробирку. Образец оставляли охлаждаться до комнатной температуры и затем дополнительно охлаждали до температуры ниже комнатной с помощью холодильника и затем морозильной камеры. Помол Твердый образец рифаксимина загружали в шаровую мельницу. Образцы перемалывали с интервалами от 5 до 15 мин (25 мин, 215 мин и 315 мин) при 30 Гц с помощью вибрационной мельницы ММ 200 компании Retsch. Твердую фазу собирали со стенок колбы после каждого интервала. Инструментальные методики Рентгеновская порошковая дифрактометрия (XRPD)Shimadzu Анализ методом порошковой рентгенографии (XRPD) проводили с использованием дифрактометраShimadzu XRD-6000 с Cu K излучением. Прибор снабжен рентгеновской трубкой с тонкой фокусировкой. Напряжение и силу тока трубки устанавливали 40 кВ и 40 мА соответственно. Устанавливали значения для щелей расхождения и рассеивания 1 и для щели приемника 0,15 мм. Лучи после дифрации регистрировали NaI сцинтилляционным детектором. Использовали непрерывное сканирование в режиме-2 при 3/мин (шаг 0,4 с/0,02) от 2,5 до 40 2. Для проверки точности установки прибора анализировали кремниевый эталон. Данные регистрировали и анализировали с использованием XRD-6100/7000v.5.0. Образцы готовили для анализа путем помещения их в держатель образца. Анализ методом порошковой рентгенографии (XRPD) проводили с использованием дифрактометраInel XRG-3000, снабженного CPS (изогнутым позиционно чувствительным) детектором с интервалом 2 120. Данные в реальном времени регистрировали с использованием Cu K излучения, начиная приблизительно при 42 при разрешении 0,032. Напряжение и силу тока трубки устанавливали 40 кВ и 30 мА соответственно. Щель монохроматора устанавливали при 5 мм на 160 мкм. Получена рентгенограмма в интервале углов 2 от 2,5-40. Образцы готовили для анализа путем упаковки в тонкостенные стеклянные капилляры. Каждый капилляр монтировали на гониометрической головке, моторизованной для вращения капилляра во время регистрации данных. Образцы анализировали в течение 300 с. Калибровку прибора выполняли с помощью кремниевого эталона.XRPD (VT-XRPD) с переменной температурой Анализ методом XRPD (VT-XRPD) с переменной температурой проводили с использованием порошкового рентгеновского дифрактометра Shimadzu XRD-6000, снабженного высокотемпературной камерой Anton Paar НТК 1200. Образец упаковывали в керамический держатель и анализировали в интервале углов 2 от 2,5 до 40 при 3/мин (шаг 0,4 с/0,02 о). Скорость нагрева составляла 10C/мин. Для проверки точности установки прибора анализировали кремниевый эталон. Калибровку температуры выполняли с помощью ваниллинового и сульфапиридинового эталонов. Данные регистрировали и анализировали с использованием XRD-6000 v. 4.1.XRPD (VRH-XRPD) с переменной относительной влажностью Анализ методом VRH-XRPD проводили с использованием порошкового рентгеновского дифрактометра Shimadzu XRD-6000, снабженного источником относительной влажности RH-200. Этот анализ является non-cGMP. Образец помещали в керамический держатель и анализировали в интервале углов 2 от 2,5-40 при 3/мин (шаг 0,4 с/0,02) приблизительно при 32C. Профиль RH для камеры указан в таблицах. XRPD рентгенограммы регистрировали в заданном интервале времени каждые 15 мин в течение 2 ч. Регистратор данных (SN 05012010) использовали для измерения относительной влажности в камере(смотри раздел ДАННЫЕ, страницы 57-60). Для проверки точности установки прибора XRPD анализировали кремниевый эталон. XRPD данные регистрировали и анализировали с помощью XRD-6100/7000v.5.0. Эталонные XRPD рентгенограммы Эталонные XRPD рентгенограммы были получены из Американских или Европейских патентов или Патентных заявок и переведены в электронные файлы с помощью UN-SCAN-IT версии 6.0 (антиcGMP). Оптическая микроскопия Оптическую микроскопию проводили с использованием стереомикроскопа Leica MZ12.5. Для на- 20021176 блюдения образцов в перекрестно-поляризованном свете использовали разные объективы, обычно в диапазоне 0,8-4 х. Образцы наблюдали in situ. Термический анализ Дифференциальная сканирующая калориметрия (ДСК) Дифференциальную сканирующую калориметрию (ДСК) проводили с использованием дифференциального сканирующего калориметра 2920 компании ТА Instruments. Образец помещали в алюминиевый тигель для ДСК и точно регистрировали массу. Тигель накрывали крышкой и затем завинчивали или оставляли незавинченным. Ячейку с образцом приводили в равновесие при 25C и нагревали в потоке азота со скоростью 10C/мин до конечной температуры 250 или 350C. Металлический индий использовали в качестве калибровочного эталона. Отмеченные температуры относятся к максимуму перехода. Способ А: 25-250-10: предварительное приведение в равновесие при 25C, нагревание до 250C со скоростью 10C/мин Способ В: 25-350-10: предварительное приведение в равновесие при 25C, нагревание до 350C со скоростью 10C/мин Циклическая дифференциальная сканирующая калориметрия Циклическую ДСК проводили с использованием дифференциального сканирующего калориметра 2920 компании ТА Instruments. Образец помещали в герметично закрытый тигель для ДСК и точно регистрировали массу. Тигель накрывали крышкой, содержащей лазерное отверстие. Способ состоял в следующем: 1. Приведение в равновесное состояние при -50C 2. Увеличение температуры до 80C со скоростью 20C/мин 3. Изотермический режим при 80C в течение 1 мин 4. Приведение в равновесное состояние при -50C. 5. Увеличение температуры до 220C со скоростью 20C/мин Металл индий использовали в качестве калибровочного эталона. Отмеченная температура соответствует максимуму перехода. Модулированная дифференциальная сканирующая калориметрия (МДСК) Данные модулированной дифференциальной сканирующей калориметрии (МДСК) регистрировали на дифференциальном сканирующем калориметре 2920 компании ТА Instruments, снабженном холодильной охлаждающей системой (RCS). Образцы помещали в алюминивый тигель для ДСК и точно регистрировали массу. Тигель накрывали крышкой с лазерным отверстием для высвобожения давления и затем герметично закрывали. МДСК данные получали с использованием амплитуды модулирования +/0,8C и периода в 60 с при базовой скорости нагревания 1C/мин от 25 до 225C. Температуру и мощность нагревания калибровали с использованием металла индия и сапфира в качестве калибровочных эталонов соответственно. Отмеченные температуры стеклования получали из середины изгиба скачкообразного изменения на кривой зависимости обратимого потока тепла от температуры. Термогравиметрический анализ (ТГ) Термогравиметрический анализ (ТГ) проводили с использованием термогравиметрического анализатора 2950 компании ТА Instruments. Каждый образец помещали в алюминиевый тигель для образцов и устанавливали в печь для ТГ. Сначала печь приводили в равновесное состояние при 25C или начинали непосредственно от комнатной температуры, после чего нагревали в потоке азота при скорости 10C/мин до конечной температуры 350C. Никель и Alumel использовали в качестве калибровочных эталонов. Способы для определенных образцов представлены ниже. Способ А: 00-350-10: без предварительного приведения в равновесное состояние; анализ начинали непосредственно от комнатной температуры, образец нагревали до 350C со скоростью 10C/мин Способ В: 25-350-10: предварительное приведение в равновесное состояние при 25C, образец нагревали до 350C со скоростью 10C/мин Способ С: 00-300-10: без предварительного приведения в равновесное состояние; анализ начинали непосредственно от комнатной температуры, образец нагревали до 300C со скоростью 10C/мин Спектроскопия Фурье ИК-спектроскопия Инфракрасные спектры регистрировали на ИК-спектрофотометре с преобразованием Фурье MagnaIR 860 (фирмы Thermo Nicolet), снабженном средним/дальним ИК-источником Ever-Glo, светоделителем с расширенной областью из бромида калия (KBr) и детектором из дейтерированного триглицинсульфата (DTGS). При исследовании образцов использовали приставку нарушенного полного внутреннего отражения (ATR) (Thunderdome, ThermoSpectra-Tech) с кристаллом германия (Ge). Спектр представляет собой 256 добавленных вместе сканов, регистрируемых при спектральной чувствительности 4 см-1. Набор исходных данных получали с помощью чистого кристалла Ge. Log 1/R (R=отражение) спектра получали путем взятия отношения этих двух наборов данных относительно друг друга. Градуировку по длинам волн осуществляли по полистиролу. Раман-спектроскопия с Фурье преобразованием Рамановские спектры получали на дополнительном Раман-модуле, соединенном с ИКспектрофотометром с преобразованием Фурье Magna 860 (Thermo Nicolet). Этот модуль использует длину волны возбуждения 1064 нм и детектор на арсениде индия-галлия (InGaAs). Для облучения образца использовали приблизительную мощность 0,6-2,0 W лазера Nd:YVO4. Образцы готовили для анализа помещением материала в стеклянную трубку и помещением трубки в покрытый золотом держатель трубки. Всего регистрировали 256 или 1024 сканов образцов из 98-3600 см-1 при спектральном разрешении 4 см-1 с использованием Happ-Genzel аподизирования. Калибровку длины волны выполняли с использованием серы и циклогексана. Автоматическая сорбция/десорбция влаги Данные по сорбции и десорбции влаги регистрировали на анализаторе сорбции паров компанииVTI модели SGA-100. Данные по сорбции и десорбции регистрировали в диапазоне от 5 до 95% относительной влажности (RH) с интервалами 10% RH в потоке азота. Образцы не высушивали перед анализом. Критерии равновесия, которые использовали для анализа, составили менее чем 0,0100% изменения массы в течение 5 мин при максимальном времени приведения в равновесное состояние 3 ч в случае не соответствия критерия по массе. Данные не корректировали на начальное содержание влаги в образцах.NaCl и PVP использовали в качестве калибровочных эталонов. 13 С ядерный магнитный резонанс (ЯМР) твердого состояния Образцы готовили для ЯМР спектроскопии твердого состояния с помощью их упаковки в 4 мм циркониевые роторы PENCIL типа. Определенные параметры приведены на графике первого полного спектра каждого образца в разделе данных. XRPD данные для Форм рифаксимина. Данные XRPD с высоким разрешением регистрировали наиформах рифаксимина для идентификации положений пиков, а также облегчения индицирования рентгенограмм.Форму успешно индицировали с использованием этих данных. Благодаря разупорядочению, присущемуФорме, попытки индицировать XRPD рентгенограмму оказались безуспешными. Перечень XRPD пиков для рифаксиминаФормы получали с использованием результатов индицированной рентгенограммы. Перечни XRPD пиков дляФормы и рентгеноаморфной формы рифаксимина были получены с использованием PatternMatch, программного обеспечения SSCI. Дифрактограммы сравнивали с пиками, полученными с помощью программного обеспечения, для подтверждения того, что выбранные пики являются настоящими. Пики с широкой и/или низкой интенсивностью, а также пики за пределами угла 2 20 не были включены в таблицы положений пиков. Способы приготовления для отбора форм рифаксимина Рифаксимин(зета) Формы Рифаксимин (404,5 мг) суспендировали в смеси этанол/вода (2 мл/0,5 мл) при комнатной температуре в течение примерно 5 ч. Растворитель удаляли декантацией, и сырую твердую фазу хранили в холодильнике в течение менее одного дня перед проведением анализа методом XRPD. Твердая фаза была сырой до и после анализа методом XRPD. (фиг. 3) Рентгеновская порошковая рентгенография (XRPD) Диффрактометр Inel XRG-3000 Анализ методом порошковой рентгенографии (XRPD) проводили с использованием дифрактометраInel XRG-3000, снабженного CPS (изогнутым позиционно-чувствительным) детектором с интервалом 2 120. Данные в реальном времени регистрировали с использованием Cu-K излучения. Напряжение и силу тока трубки устанавливали 40 кВ и 30 мА соответственно. Щель монохроматора устанавливали при 1-5 мм на 160 мкм. Получали рентгенограммы в интервале углов 2 от 2,5 до 40. Образцы готовили для анализа упаковкой их в тонкостенные стеклянные капилляры. Каждый капилляр монтировали на гониометрической головке, моторизированной для вращения капилляра во время регистрации данных. Образцы анализировали в течение 300 с. Калибровку прибора выполняли с помощью кремниевого эталона. Дифрактометр X'pert Pro компании PANanalytical Образцы также анализировали с использованием дифрактометра X'pert Pro компании PANanalytical. Образец анализировали с использованием Cu излучения с использованием рентгеновской трубки с тонкой фокусировкой Optix. Эллептическое многослойное зеркало использовали для фокусировки рентгеновского Cu-K излучения сквозь образец и на детектор. Образец помещали между пленками толщиной 3-микрона, анализировали в режиме геометрии пропускания и вращали для оптимизации данных по ориентации. Ловушки прямого пучка и продувку гелием использовали для минимизации фона, созданного рассеянием в воздухе. Щели Соллера использовали для падающих и отраженных лучей для минимизации осевого отклонения. Дифракционные рентгенограммы регистрировали с использованием сканирущего позиционно-чувствительного детектора (X'Celerator), расположенного на расстоянии 240 мм от образца. Параметры регистрации данных каждой дифракционной рентгенограммы расположены над изображением каждой рентгенограммы в разделе данных приложения. Перед анализом кремниевый образец (NIST эталонный материал 640 с) анализировали для определения положения пика кремния 111. Таблица 23. XRPD положения пиков рифаксиминаФормыa) I/Io = относительная интенсивность Таблица 24. Положения пиков XRPD рифаксиминаФормы а) I/Io = относительная интенсивность Таблица 25. XRPD диапазон аморфного гало рифаксимина рентгеноаморфной формы Таблица 26. Мезилатная форма Способы приготовления мезилатной формы рифаксимина Включение в виде ссылок Содержание всех ссылок, патентов, утвержденных патентных заявок и опубликованных патентов,размещенное в данной заявке, включено здесь в виде ссылки. Эквиваленты Опытный в данной области специалист распознает или сможет установить при помощи простых экспериментов много эквивалентов описанным здесь определенным вариантам изобретения. Предполагается, что такие эквиваленты являются охваченными следующей формулой. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. ПолиморфнаяФорма рифаксимина, которая проявляет порошковую рентгенограмму, содержащую характеристические пики, выраженные в градусах угла 2 (+/- 0,20 угла ) при 4.7, 7.6 и 9.5; или 8.2, 8.6 и 9.5; или 4.7, 7.3 и 8.2; или 7.3, 7.6, 8.2 и 8.6. 2. ПолиморфнаяФорма рифаксимина по п.1, которая содержит менее чем 5 мас.% общего содержания примесей. 3. ПолиморфнаяФорма рифаксимина по п.1, которая имеет чистоту по меньшей мере 50%. 4. ПолиморфнаяФорма рифаксимина по п.1, включающая XRPD рентгенограмму, по существу,аналогичную фиг. 2. 5. ПолиморфнаяФорма рифаксимина по п.1, которая имеет чистоту по меньшей мере 75%. 6. ПолиморфнаяФорма рифаксимина по п.1, которая имеет чистоту по меньшей мере 80%. 7. ПолиморфнаяФорма рифаксимина по п.1, которая имеет чистоту по меньшей мере 90%. 8. ПолиморфнаяФорма рифаксимина по п.1, которая имеет чистоту по меньшей мере 95%. 9. ПолиморфнаяФорма рифаксимина по п.1, которая имеет чистоту по меньшей мере 98%. 10. Фармацевтическая композиция, включающая полиморфнуюФорму рифаксимина по п.1 и один или более фармацевтически приемлемых вспомогательных веществ для применения для лечения,предупреждения или смягчения нарушений, связанных с кишечником. 11. Фармацевтическая композиция по п.10, в которой вспомогательные вещества включают один или более из разбавителя, связующего, лубриканта, улучшающего распадаемость вещества, красителя,ароматизатора или подсластителя. 12. Фармацевтическая композиция по п.10, изготовленная в виде покрытых или не покрытых оболочкой таблеток, жестких или мягких желатиновых капсул, покрытых сахаром пилюль, таблеток для рассасывания, пластин в облатке, гранул, кремов, лосьонов или порошков в герметичной упаковке. 13. Способ лечения, предупреждения или смягчения нарушения, связанного с кишечником, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества полиморфнойФормы рифаксимина по п.1. 14. Способ по п.13, в котором субъект страдает по меньшей мере от одного связанного с кишечником нарушения, выбранного из группы, состоящей из синдрома раздраженного кишечника, диареи, диареи, связанной с микробами, диареи, связанной с Clostridium difficile, диареи путешественника, чрезмерного бактериального роста в тонкой кишке, заболевания Крона, хронического панкреатита, недостаточности поджелудочной железы, энтерита, колита, гепатической энцефалопатии или паучита. 15. Способ по п.13, в котором субъект имеет риск развития инфекционного заболевания кишечника. 16. Способ по п.15, в котором риск у субъекта связан с тем, что субъект, страдает от угнетения иммунной системы или находился в контакте с субъектом с бактериальной инфекцией, врачом, медперсоналом, или путешествует в отдаленные регионы, известные скоплением бактерий, вызывающих инфекционное заболевание кишечника. 17. Способ полученияФормы рифаксимина, включающий формирование EtOH суспензии начальной -сухой Формы рифаксимина при комнатной температуре и кристаллизацию рифаксимина из суспензии. 18. Упакованная композиция, включающая терапевтически эффективное количество полиморфнойФормы рифаксимина по п.1 и фармацевтически приемлемый носитель или разбавитель, для лечения,- 24021176 предупреждения или смягчения нарушений, связанных с кишечником у субъекта, страдающего или подверженного нарушению кишечника, и инструкции по лечению.
МПК / Метки
МПК: C07D 498/00
Метки: форма, применение, рифаксимина, полиморфная
Код ссылки
<a href="https://eas.patents.su/27-21176-polimorfnaya-forma-rifaksimina-i-ee-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфная форма рифаксимина и ее применение</a>
Предыдущий патент: Способ получения жидкого продукта из легкого газа (варианты) и система переработки легкого газа
Следующий патент: Полиненасыщенные жирные кислоты для лечения заболеваний, связанных с сердечно-сосудистыми, метаболическими и воспалительными заболеваниями
Случайный патент: Импульсный модулятор