Цитотоксические агенты, содержащие новые таксаны
Номер патента: 12625
Опубликовано: 30.10.2009
Авторы: Балоглу Эркан, Чари Рави В Дж., Коммерсон Ален, Миллер Майкл Л.
Формула / Реферат
1. Таксаны, имеющие следующую формулу (I):
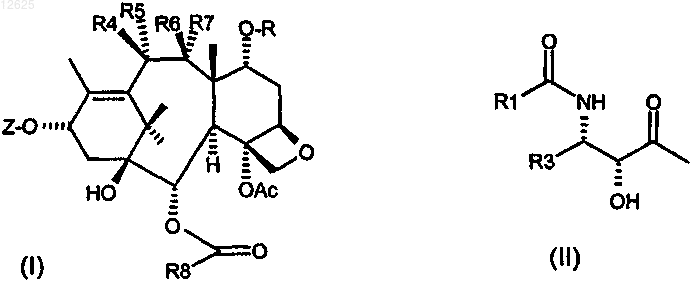
где Z означает радикал формулы II;
R1 представляет собой трет-бутоксигруппу;
R3 представляет собой изобутенил или фурил;
R4 представляет собой связующую группу, выбранную из дисульфидной группы и тиоэфирной группы, гидроксигруппу, ацетоксигруппу, (С2-С4)алкилоксикарбонилоксигруппу, (С1-С2)диалкилкарбамоилоксигруппу, причем ацетоксигруппа, (С2-С4)алкилоксикарбонилоксигруппа и (С1-С2)диалкилкарбамоилоксигруппа могут содержать терминальную дисульфидную или тиоэфирную группу;
R5 или R7 представляет собой Н;
R6 представляет собой Н;
R7 или R5 и R образуют связь (циклический простой эфир);
R8 представляет собой фенил, 3-метоксифенил, 3-хлорфенил, 2,5-диметоксифенил, фурил, пироллил, тиенил, тиазолил, имидазолил, пиридил, оксазолил, индолил, бензофуранил или бензотиенил.
2. Соединение по п.1, в котором связующая группа представляет собой дисульфидную группу.
3. Соединение по п.2, в котором связующая группа представляет собой дисульфидную группу, в которой боковая цепь, несущая дисульфидную группу, может быть линейной или разветвленной.
4. Соединение по п.3, в котором связующую группу при R4 выбирают из нижеследующих заместителей: -OCO(CR13R14)m(CR15R16)n(ОСН2СН2)ySZ' или -OCONR12(CR13R14)m(CR15R16)n(OCH2CH2)ySZ',
где Z' представляет собой Н, тиолзащищающую группу или SR';
R' и R12 являются одинаковыми или различными и представляют собой линейный алкил, разветвленный алкил или циклический алкил, имеющие 1-10 атомов углерода, и R12, кроме того, может представлять собой Н;
R13, R14, R15 и R16 являются одинаковыми или различными и представляют собой Н или линейный или разветвленный алкил, имеющий 1-4 атомов углерода;
n равно целому числу от 1 до 10;
m равно целому числу от 1 до 10 и также может быть равным 0;
y равно целому числу от 1 до 20 и также может быть равным 0.
5. Соединение по п.1, в котором R8 представляет собой 3-метоксифенил, 3-хлорфенил, 2,5-диметоксифенил, фурил, пироллил, тиенил, тиазолил, имидазолил, пиридил, оксазолил, индолил, бензофуранил или бензотиенил.
6. Соединение по п.1, в котором R5 представляет собой Н и R и R7 образуют связь.
7. Цитотоксический агент, содержащий один или несколько таксанов, ковалентно связанных с клеточным связующим агентом посредством связующей группы, в котором по меньшей мере один из указанных таксанов представляет собой соединение, представленное формулой (III)
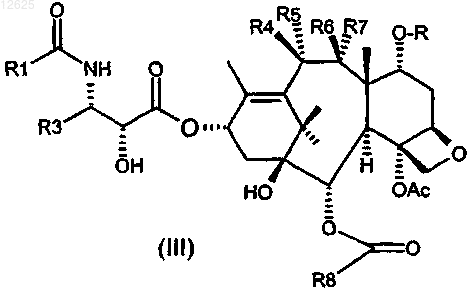
где R1 представляет собой трет-бутоксигруппу;
R3 представляет собой изобутенил или фурил;
R4 представляет собой связующую группу, выбранную из дисульфидной группы или тиоэфирной группы;
R5 или R7 представляет собой Н;
R6 представляет собой Н;
R7 или R5 и R образуют связь (циклический простой эфир);
R8 представляет собой фенил, 3-метоксифенил, 3-хлорфенил, 2,5-диметоксифенил, фурил, пироллил, тиенил, тиазолил, имидазолил, пиридил, оксазолил, индолил, бензофуранил или бензотиенил.
8. Терапевтическая композиция, включающая:
(А) терапевтически эффективное количество цитотоксического агента по п.7 и
(В) фармацевтически приемлемый носитель.
9. Цитотоксический агент по п.7, в котором клеточный связующий агент выбирают из группы, состоящей из антител, фрагмента антитела, интерферонов, лимфокинов, гормонов, витаминов, факторов роста, колонийстимулирующих факторов и трансферрина.
10. Цитотоксический агент по п.7, в котором клеточный связующий агент представляет собой антитело.
11. Цитотоксический агент по п.7, в котором клеточный связующий агент представляет собой моноклональное антитело.
12. Цитотоксический агент по п.7, в котором клеточный связующий агент представляет собой фрагмент антигенспецифического антитела.
13. Цитотоксический агент по п.7, в котором фрагмент антитела представляет собой sFV, Fab, Fab' или F(ab')2.
14. Цитотоксический агент по п.7, в котором клеточный связующий агент представляет собой фактор роста или колонийстимулирующий фактор.
15. Способ уничтожения выбранных клеточных популяций, включающий приведение в контакт целевых клеток или тканей, содержащих целевые клетки, с эффективным количеством цитотоксического агента по п.7.
Текст
012625 Область техники, к которой относится изобретение Настоящее изобретение относится к новым цитотоксическим агентам и их терапевтическому применению. Более конкретно изобретение относится к новым цитотоксическим агентам, содержащим таксаны, и их терапевтическому применению. Эти новые цитотоксические агенты имеют терапевтическое применение благодаря доставке таксанов в специфическую клеточную популяцию путем нацеливания посредством химического связывания таксана с клеточным связующим агентом. Уровень техники Опубликовано множество сообщений, в которых описана попытка специфического нацеливания конъюгатов моноклональное антитело-лекарственное вещество на раковые клетки (Sela et al., in Immunoconjugates 189-216 (С. Vogel, ed. 1987); Ghose et al., in Targeted Drugs 1-22 (E. Goldberg, ed. 1983); DienerRodwell, ed. 1988). Все ссылки и патенты включены в настоящее описание во всей своей полноте в качестве ссылки. Цитотоксические лекарственные средства, такие как метотрексат, даунорубицин, доксорубицин,винкристин, винбластин, мелфалан, митомицин С и хлорамбуцил использовали в конъюгатах с множеством различных мышиных моноклональных антител. В некоторых случаях молекулы лекарственных веществ связывали с молекулами антител, используя промежуточную молекулу-носитель, такую как сывороточный альбумин (Garnett et al., 46 Cancer Res. 2407-2412 (1986); Ohkawa et al., 23 Cancer Immunol. Immunother. 81-86 (1986); Endo et al., 47 Cancer Res. 1076-1080 (1980, декстран (Hurwitz et al., 2 Appl. Biochem. 25-35 (1980); Manabi et al., 34 Biochem. Pharmacol. 289-291 (1985); Dillman et al., 46 Cancer Res. 4886-4891 (1986); Shoval et al., 85 Proc. Natl. Acad. Sci. 8276-8280 (1988, или полиглутаминовая кислотаet al., 52 Br. J. Cancer 111-116 (1985. Для получения таких иммуноконъюгатов использовался широкий набор способов с использованием связующих групп, и были исследованы как расщепляемые, так и нерасщепляемые связующие группы. Однако в большинстве случаев можно было наблюдать полную цитотоксическую активность лекарственных веществ, только если молекулы лекарственных веществ могли высвобождаться из конъюгатов в немодифицированном виде в целевом участке. Одна из расщепляемых связующих групп, которая использовалась для получения конъюгатов антитело-лекарственное средство, представляет собой неустойчивую в кислой среде связующию группу на основе цис-аконитовой кислоты, которую предпочтительно использовать в кислой среде различных внутриклеточных компартментов, таких как эндосомы, которые образуются во время рецепторопосредованного эндоцитоза, и лизосомы. Shen и Ryser внедрили этот способ для получения конъюгатов даунорубицина с макромолекулярными носителями (102 Biochem. Biophys. Res. Commun. 1048-1054(1981. Yang и Reisfeld использовали такой же способ для получения конъюгатов даунорубицина с антителом против меланомы (80 J. Natl. Cane. Inst. 1154-1159 (1988. Dillman и др. также использовали связующую группу, неустойчивую в кислой среде, таким же способом для получения конъюгатов даунорубицина с анти Т-клеточным антителом (48 Cancer Res. 6097-6102 (1988. Альтернативный подход, описанный у Trouet и др., включал связывание даунорубицина с антителом посредством пептидной "ножки" (79 Proc. Natl. Acad. Sci. 626-629 (1982. Это было сделано, исходя из предположения, что свободное лекарственное вещество может быть высвобождено из такого конъюгата под воздействием лизосомальных пептидаз. Однако цитотоксические тесты in vitro выявили, что конъюгаты антитело-лекарственное вещество редко достигают такой же цитотоксической активности, какой обладают свободные неконъюгированные лекарственные вещества. Это подтверждает, что механизмы, при помощи которых молекулы лекарственных веществ высвобождаются из антител, являются очень неэффективными. В области иммунотоксинов показано, что конъюгаты, образованные при помощи дисульфидных мостиков между моноклональными антителами и каталитически активными белковыми токсинами, являются более цитотоксическими по сравнению с конъюгатами, содержащими другие связующие группы. См. Lambert и др., 260 J.Biol. Chem. 12035-12041 (1985); Lambert et al., in Immunotoxins 175-209 (A. Frankel, ed. 1988); Ghetie и др.,48 Cancer Res. 2610-2617 (1988). Это объясняли наличием высокой внутриклеточной концентрации глутатиона, способствующего эффективному расщеплению дисульфидной связи между молекулой антитела и токсином. Несмотря на это, имеется только несколько опубликованных примеров использования дисульфидных мостиков для получения конъюгатов между лекарственными веществами и макромолекулами. Shen и др. (260 J. Biol. Chem. 10905-10908 (1985 описали превращение метатрексата в производное меркаптоэтиламида с последующей конъюгацией с поли-D-лизином посредством дисульфидной связи. В другой работе описано получение конъюгата трисульфида, содержащего токсическое лекарственное вещество калихеамицин, с антителом (Hinman et al., 53 Cancer Res. 3336-3342 (1993. Одна из причин отсутствия конъюгатов антитело-лекарственное вещество с дисульфидными связями заключается в том, что цитотоксические лекарственные вещества с фрагментом, содержащим атом серы, которые можно с легкостью использовать, не способны связывать лекарственное вещество с анти-1 012625 телом через дисульфидный мостик. Более того, трудно осуществлять химическую модификацию существующих лекарственных веществ, не снижая при этом их цитотоксическую активность. Другой важный недостаток существующих конъюгатов антитело-лекарственное вещество заключается в их неспособности поставлять достаточную концентрацию лекарственного вещества к целевому участку из-за ограниченного количества целевых антигенов и относительно умеренной цитотоксичности канцеростатических лекарственных веществ, таких как метотрексат, даунорубицин и винкристин. Для получения значимой цитотоксичности большое количество молекул лекарственных веществ необходимо связывать либо непосредственно с антителом, либо при помощи молекулы полимерного носителя. Однако такие сильно модифицированные антитела часто показывают слабое связывание с целевым антигеном и быстрое выведение из кровотока in vivo. Несмотря на вышеописанные трудности, были опубликованы сообщения о полезных цитотоксических агентах, содержащих клеточные связующие фрагменты и группы цитотоксических лекарственных веществ, известных как майтанзиноиды (USP 5208020, USP 5416064, and R. V. J. Chari, 31 Advanced DrugDelivery Reviews 89-104 (1998. Аналогично, также было опубликовано сообщение о полезных цитотоксических агентах, содержащих клеточные связующие фрагменты, аналоги и производные потенциального противоопухолевого антибиотика СС-1065 (USP 5475092 и USP 5585499). Паклитаксель (таксол), природный цитотоксический продукт, и доцетаксель (таксотер), полусинтетическое производное, широко используются при лечении рака. Эти соединения принадлежат к семейству соединений, которые называются таксанами. Таксаны представляют собой яд для митотического веретена, который ингибирует деполимеризацию тубулина, приводя к увеличению скорости сборки микротрубочек и гибели клетки. Несмотря на то, что доцетаксель и паклитаксель являются полезными агентами в раковой терапии, их противоопухолевая активность ограничена из-за их неспецифической токсичности в отношении аномальных клеток. Более того, соединения, подобные паклитакселю и доцетакселю, сами по себе не являются эффективными в достаточной степени для использования их в конъюгатах клеточных связующих агентов. Недавно было описано несколько новых аналогов доцетакселя, которые являются более эффективными по сравнению с доцетакселем или паклитакселем (Ojima et al., 39, J. Med. Chem. 3889-3896 (1996. Однако у этих соединений отсутствует подходящая функциональная группа, которая предоставляет возможность для связывания с клеточными связующими агентами посредством расщепляемой связи. Следовательно, способ лечения заболеваний с использованием таксанов, у которых снижены побочные эффекты без ослабления их цитотоксичности, является чрезвычайно востребованным. В патентах США 6436931; 6372738 и US 6340701 описаны таксаны, связанные с моноклональным антителом при помощи дисульфидного мостика. По-видимому, эти таксаны не являются в достаточной степени эффективными для использования. Сущность изобретения Как раскрыто в первом варианте осуществления целью настоящего изобретения является предоставление таксанов, которые являются высокотоксичными и которые все еще могут эффективно использоваться для лечения многих заболеваний. Другой целью настоящего изобретения является предоставление новых таксанов. Эти и другие цели достигнуты предоставлением цитотоксического агента, содержащего один или несколько таксанов, связанных с клеточным связующим агентом. Во втором варианте осуществления настоящее изобретение предоставляет терапевтическую композицию, содержащую:(A) эффективное количество одного или нескольких таксанов, связанных с клеточным связующим агентом, и(B) фармацевтически приемлемый носитель, разбавитель или наполнитель. В третьем варианте осуществления настоящее изобретение предоставляет способ уничтожения выбранной клеточной популяции, содержащий приведение в контакт целевых клеток или ткани, содержащей целевые клетки, с цитотоксическим количеством цитотоксического агента, содержащего один или несколько таксанов, связанных с клеточным связующим агентом. Подробное описание изобретения Настоящее изобретение основано на синтезе новых таксанов, которые сохраняют высокую цитотоксичность и могут эффективно связываться с клеточными связующими агентами. Ранее было показано,что связывание высокотоксичных лекарственных веществ с антителами, используя расщепляемую связь,такую как дисульфидная связь, гарантирует высвобождение внутри клетки полностью активных лекарственных веществ, и такие конъюгаты являются цитотоксическими благодаря антиген-специфичности (US 6340701; US 6372738; US 6436931). Однако из уровня техники известно, что достаточно сложно модифицировать существующие лекарственные вещества без ослабления их цитотоксической активности. В настоящем изобретении эта задача решена путем модификации таксанов при помощи химических фрагментов. В результате описанные новые таксаны сохраняют, а в некоторых случаях даже увеличивают цитотоксическую активность известных таксанов. Применение комплексов клеточный связующий агенттаксан позволяет в полной мере использовать цитотоксическое действие таксанов путем нацеливания-2 012625 только против нежелательных клеток, избегая, таким образом, побочных эффектов вследствие повреждения нецелевых здоровых клеток. Таким образом, настоящее изобретение предлагает полезные агенты для элиминации больных или аномальных клеток, которые должны быть уничтожены или лизированы,таких как клетки опухоли (в частности, клетки солидных опухолей). Цитотоксический агент согласно настоящему изобретению содержит один или несколько таксанов,связанных с клеточным связующим агентом посредством связующей группы. Связующая группа представляет собой часть химического фрагмента, который ковалентно связан с таксаном при помощи обычных способов. В предпочтительном варианте осуществления химический фрагмент может быть ковалентно связан с таксаном при помощи сложно-эфирной связи. Таксаны, используемые в настоящем изобретении, имеют нижеприведенную формулу (I):Z=H или радикал формулы II,R1 представляет собой связующую группу или необязательно замещенный арил или гетероциклический радикал, алкил, имеющий 1-10 атомов углерода, алкенил или алкинил, имеющие 2-10 атомов углерода, циклоалкил или циклоалкенил, имеющие 3-10 атомов углерода, -OR2 или карбамат, образованный из любого из указанных алкила, имеющих 1-10 атомов углерода, алкенила или алкинила, имеющих 2-10 атомов углерода, циклоалкила или циклоалкенила, имеющих 3-10 атомов углерода, или необязательно замещенного арила или гетероциклического радикала. Предпочтительно R1 представляет собой -OR2 или необязательно замещенный арил или гетероциклический радикал.R2 представляет собой алкильный радикал, имеющий 1-10 атомов углерода, алкенил или алкинил,имеющие 2-10 атомов углерода, циклоалкил или циклоалкенил, имеющие 3-10 атомов углерода, необязательно замещенный арил или гетероциклический радикал. Предпочтительно R2 представляет собой алкильную группу и более предпочтительно замещенную алкильную группу, такую как тербутильная группа.R3 представляет собой связующую группу или необязательно замещенный арил или гетероциклический радикал, алкил, имеющий 1-10 атомов углерода, алкенил или алкинил, имеющие 2-10 атомов углерода, циклоалкил или циклоалкенил, имеющие 3-10 атомов углерода.R4 представляет собой связующую группу, Н, гидроксирадикал, алкокси, алкенилокси, необязательно замещенный алканоилокси, ароилокси, алкеноилокси, алкиноилокси, циклоалканоилокси, алкоксиацетил, алкилтиоацетил, алкилоксикарбонилокси, циклоалкилокси, циклоалкенилокси, карбамоилокси,алкилкарбамоилокси или диалкилкарбамоилокси, гетероциклический или арильный простой эфир, сложный эфир или карбамат, или линейный, разветвленный или циклический алкиловый или алкениловый сложный эфир или простой эфир, имеющий 1-10 атомов углерода, или карбамат формулы -ОСОХ, где X представляет собой азотсодержащий гетероцикл, такой как незамещенный или замещенный пиперидино,морфолино, пиперазино, N-метилпиперазино, или карбамат формулы -OCONR9R10, где R9 и R10 являются одинаковыми или различными и представляют собой Н, линейный, разветвленный или циклический алкил, имеющий 1-10 атомов углерода, или простой или замещенный арил, имеющий 1-10 атомов углерода. Предпочтительно R4 представляет собой связующую группу или алканоилоксирадикал.R8 = необязательно замещенный арил или гетероциклический радикал. Ниже настоящее изобретение описано более полно при помощи 3 основных вариантов осуществления. Вариант осуществления 1: R4 представляет собой связующую группу Z=H или радикал формулы II.R1 представляет собой необязательно замещенный арил или гетероциклический радикал, алкил,имеющие 1-10 атомов углерода, алкенил или алкинил, имеющие 2-10 атомов углерода, циклоалкил или циклоалкенил, имеющие 3-10 атомов углерода, -OR2 или карбамат, образованный из любого из указанных алкила, имеющего 1-10 атомов углерода, алкенила или алкинила, имеющих 2-10 атомов углерода,циклоалкила или циклоалкенила, имеющих 3-10 атомов углерода, или необязательно замещенного арила или гетероциклического радикала.R2 представляет собой алкильный радикал, имеющий 1-10 атомов углерода, алкенил или алкинил,имеющие 2-10 атомов углерода, циклоалкил или циклоалкенил, имеющие 3-10 атомов углерода, необязательно замещенный арил или гетероциклический радикал.R3 представляет собой необязательно замещенный арил или гетероциклический радикал, алкил,имеющий 1-10 атомов углерода, алкенил или алкинил, имеющие 2-10 атомов углерода, циклоалкил или циклоалкенил, имеющие 3-10 атомов углерода. Предпочтительно R.3 представляет собой кротил, диметилакрилил, пропенил, изобутенил, гексенил,циклопентенил, циклогексенил, фурил, пироллил, тиенил, тиазолил, пиридил, оксазолил, индолил, бензофуранил или бензотиенил. Более предпочтительно R3 представляет собой изобутенил, кротил, диметилакрилил, тиенил, тиазолил, пиридил, трет-бутил или фурил.R4 представляет собой связующую группу. Подходящие связующие группы хорошо известны в данной области техники и включают дисульфидные группы, тиоэфирные группы, группы, не устойчивые в кислой среде, светонеустойчивые группы,группы, не устойчивые к воздействию пептидаз, и группы, не устойчивые к воздействию эстераз. Предпочтительными являются дисульфидные группы и тиоэфирные группы. Если связующая группа представляет собой тиол- или дисульфидсодержащую группу, то боковая цепь, несущая тиольную или дисульфидную группу, может быть линейной или разветвленной, ароматической или гетероциклической. Специалист в данной области техники может легко идентифицировать подходящие боковые цепи. Специфические примеры тиол- или дисульфидсодержащих заместителей включает-О(CR13R14)m(CR15R16)n(OCH2CH2)ySZ', -ОСО(CR13R14)m(CR15R16)n(ОСН 2 СН 2)ySZ',-O(CR13R14)m(CR17=CR18)(CR15R16)m(OCH2CH2)ySZ',-OCO-(CR13R14)m(CR17=CR18)(CR15R16)m(OCH2CH2)ySZ',-OCONR12(CR13R14)m(CR15R16)n(OCH2CH2)ySZ', -ОСО-фенил-Х'SZ', -OCO-фурил-X'SZ', -ОСО-оксазолилX'SZ', -ОСО-тиазолил-Х'SZ', -OCO-тиенил-X'SZ', -ОСО-имидазолил-Х'SZ', -ОСО-морфолино-Х'SZ',-ОСО-пиперазино-Х'SZ', -ОСО-пиперидино-Х'SZ' и -OCO-N-метилпиперазино-Х'SZ' или -OCO-Nметилпиперазино-Х'SZ',где Z' представляет собой Н, тиолзащищающую группу или SR',где X' представляет собой непосредственно связь или линейный алкил или разветвленный алкил, имеющий 1-10 атомов углерода, или полиэтиленгликолевый-спейсер с 2-20 повторяющимися этиленоксифрагментами;R' и R12 являются одинаковыми или различными и представляют собой линейный алкил, разветвленный алкил или циклический алкил, имеющий 1-10 атомов углерода, или простой или замещенный арил или гетероциклический радикал, и R12, кроме того, может представлять собой Н,R13, R14, R15 и R16 являются одинаковыми или различными и представляют собой Н или линейный или разветвленный алкил, имеющий 1-4 атома углерода,R17 и R18 представляют собой Н или алкил,n равно целому числу от 1 до 10,m равно целому числу от 1 до 10 и также может быть равным 0,у равно целому числу от 1 до 20 и также может быть равным 0,R5 или R7 представляет собой Н,R6 представляет собой Н,R7 или R5 и R образуют связь (циклический простой эфир),R8 представляет собой необязательно замещенный арил или гетероциклический радикал. Предпочтительно R8 представляет собой 3-метоксифенил, 3-хлорфенил, 2,5-диметоксифенил, фурил, пироллил, тиенил, тиазолил, имидазол, пиридил, индолил, оксазолил, бензофуранил или бензотиенил. Вариант осуществления 2.R1 представляет собой связующую группу,Z представляет собой радикал формулы II,R1 представляет собой связующую группу. Подходящие связующие группы хорошо известны в данной области техники и включают дисульфидные группы, тиоэфирные группы, группы, неустойчивые в кислой среде, светонеустойчивые группы,группы, неустойчивые к воздействию пептидазы, и группы, неустойчивые к воздействию эстеразы. Предпочтительными являются дисульфидные группы и тиоэфирные группы. Если связующая группа представляет собой тиол- или дисульфидсодержащую группу, то боковая цепь, несущая тиольную или дисульфидную группу, может быть линейной или разветвленной, ароматической или гетероциклической. Специалист в данной области техники может легко идентифицировать подходящие боковые цепи.-4 012625 Специфические примеры тиол- или дисульфидсодержащих заместителей включаютZ' представляет собой Н, тиолзащищающую группу или SR',X' представляет собой непосредственно связь, или линейный алкил, или разветвленный алкил,имеющий 1-10 атомов углерода, или полиэтиленгликолевый спейсер с 2-20 повторяющимися этиленоксифрагментами;R' и R12 являются одинаковыми или различными и представляют собой линейный алкил, разветвленный алкил или циклический алкил, имеющий 1-10 атомов углерода, или простой или замещенный арил, или гетероциклический радикал, и R12, кроме того, может представлять собой Н,R13, R14, R15 и R16 являются одинаковыми или различными и представляют собой Н или линейный или разветвленный алкил, имеющий 1-4 атома углерода,R17 и R18 представляют собой Н или алкил,n равно целому числу от 1 до 10,m равно целому числу от 1 до 10 и также может быть равным 0,y равно целому числу от 1 до 20 и также может быть равным 0.R3 представляет собой необязательно замещенный арил или гетероциклический радикал, алкил,имеющий 1-10 атомов углерода, алкенил или алкинил, имеющие 2-10 атомов углерода, циклоалкил или циклоалкенил, имеющие 3-10 атомов углерода. Предпочтительно R3 представляет собой кротил, диметилакрилил, пропенил, изобутенил, гексенил,циклопентенил, циклогексенил, фурил, пироллил, тиенил, тиазолил, имидазолил, пиридил, оксазолил,индолил, бензофуранил или бензотиенил. Более предпочтительно R3 представляет собой изобутенил, кротил, диметилакрилил, тиенил, тиазолил, пиридил, трет-бутил или фурил.R4 представляет собой Н, гидроксирадикал, алкокси, алкенилокси, необязательно замещенный алканоилокси, ароилокси, алкеноилокси, алкиноилокси, циклоалканоилокси, алкоксиацетил, алкилтиоацетил, алкилоксикарбонилокси, циклоалкилокси, циклоалкенилокси, карбамоилокси, алкилкарбамоилокси или диалкилкарбамоилокси, гетероциклический или арильный простой эфир, сложный эфир или карбамат, или, линейный, разветвленный или циклический алкиловый или алкениловый сложный эфир или простой эфир, имеющий 1-10 атомов углерода, или карбамат формулы -ОСОХ, где X представляет собой азотсодержащий гетероцикл, такой как незамещенный или замещенный пиперидино, морфолино, пиперазино, N-метилпиперазино, или карбамат формулы -OCONR9R10, где R9 и R10 являются одинаковыми или различными и представляют собой Н, линейный, разветвленный или циклический алкил, имеющий 1-10 атомов, или простой или замещенный арил, имеющий 5-10 атомов углерода;R5 или R7 представляют собой Н,R6 представляет собой Н,R7 или R5 и R образуют связь (циклический простой эфир),R8 представляет собой необязательно замещенный арил или гетероциклический радикал. Предпочтительно R8 представляет собой 3-метоксифенил, 3-хлорфенил, 2,5-диметоксифенил, фурил, пироллил, тиенил, тиазолил, оксазолил, имидазол, пиридил, индолил, бензофуранил или бензотиенил. Вариант осуществления 3.R3 представляет собой связующую группу,Z представляет собой радикал формулы II,R1 представляет собой необязательно замещенный арил или гетероциклический радикал, алкил,имеющий 1-10 атомов углерода, алкенил или алкинил, имеющие 2-10 атомов углерода, циклоалкил или циклоалкенил, имеющие 3-10 атомов углерода, -OR2 или карбамат, образованный из любого из указанных алкила, имеющего 1-10 атомов углерода, алкенила или алкинила, имеющих 2-10 атомов углерода,циклоалкила или циклоалкенила, имеющих 3-10 атомов углерода, или необязательно замещенного арила или гетероциклического радикала.R2 представляет собой алкильный радикал, имеющий 1-10 атомов углерода, алкенил или алкинил,имеющие 2-10 атомов углерода, циклоалкил или циклоалкенил, имеющие 3-10 атомов углерода, необязательно замещенный арил или гетероциклический радикал. Предпочтительно R1 представляет собой трет-бутокси, кротил, диметилакрилил, изобутенил, гексенил, циклопентенил, циклогексенил, фурил, пироллил, тиенил, тиазолил, имидазолил, пиридил, морфолино, пиперидино, пиперазино, оксазолил, индолил, бензофуранил или бензотиенил. Более предпочтительно R1 представляет собой трет-бутокси, изобутенил, кротил, диметилакрилил,тиенил, тиазолил или фурил.R3 представляет собой связующую группу. Подходящие связующие группы хорошо известны в данной области техники и включают дисульфидные группы, тиоэфирные группы, группы, неустойчивые в кислой среде, светонеустойчивые группы,группы, не устойчивые к воздействию пептидаз, и группы, не устойчивые к воздействию эстераз. Предпочтительными являются дисульфидные группы и тиоэфирные группы. Если связующая группа представляет собой тиол- или дисульфидсодержащую группу, то боковая цепь, несущая тиольную или дисульфидную группу, может быть линейной или разветвленной, ароматической или гетероциклической. Специалист в данной области техники может легко идентифицировать подходящие боковые цепи. Специфические примеры тиол- или дисульфидсодержащих заместителей включаютZ' представляет собой Н, тиолзащищающую группу или SR',X' представляет собой непосредственно связь или линейный алкил или разветвленный алкил,имеющий 1-10 атомов углерода, или полиэтиленгликолевый спейсер с 2-20 повторяющимися этиленоксифрагментами;R' представляет собой линейный алкил, разветвленный алкил или циклический алкил, имеющие 110 атомов углерода, или простой или замещенный арил, или гетероциклический радикал,R13, R14, R15 и R16 являются одинаковыми или различными и представляют собой Н или линейный или разветвленный алкил, имеющий 1-4 атома углерода,R17 и R18 представляют собой Н или алкил,n равно целому числу от 1 до 10,m равно целому числу от 1 до 10 и также может быть равным 0,у равно целому числу от 1 до 20 и также может быть равным 0.R4 представляет собой Н, гидроксирадикал, алкокси, алкенилокси, необязательно замещенный алканоилокси, ароилокси, алкеноилокси, алкиноилокси, циклоалканоилокси, алкоксиацетил, алкилтиоацетил, алкилоксикарбонилокси, циклоалкилокси, циклоалкенилокси, карбамоилокси, алкилкарбамоилокси или диалкилкарбамоилокси, гетероциклический или арильный простой эфир, сложный эфир или карбамат, или линейный, разветвленный или циклический алкиловый или алкениловый сложный эфир, или простой эфир, имеющий 1-10 атомов углерода, или карбамат формулы -ОСОХ, где X представляет собой азотсодержащий гетероцикл, такой как незамещенный или замещенный пиперидино, морфолино, пиперазино, N-метилпиперазино, или карбамат формулы -OCONR9R10, где R9 и R10 являются одинаковыми или различными и представляют собой Н, линейный, разветвленный или циклический алкил, имеющий 1-10 атомов, или простой или замещенный арил, имеющий 5-10 атомов углерода;R5 или R7 представляют собой Н,R6 представляет собой Н,R7 или R5 и R образуют связь (циклический простой эфир),R8 представляет собой необязательно замещенный арил или гетероциклический радикал. Предпочтительно R8 представляет собой 3-метоксифенил, 3-хлорфенил, 2,5-диметоксифенил, фурил, пироллил, тиенил, тиазолил, имидазолил, пиридил, оксазолил, индолил, бензофуранил или бензотиенил. Были синтезированы нижеприведенные соединения изобретения-7 012625 К раствору 10-ацетокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2(2,5-диметоксибензоил)доцетакселя (1,30 г, 1,25 ммоль) в этаноле (25 мл) добавляли моногидрат гидразина (10,5 мл) при помешивании. Через 15 мин реакционную смесь разбавляли этилацетатом (50 мл) и органический слой экстрагировали хлоридом аммония (50 мл), водой (50 мл) и солевым раствором (50 мл). Затем органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на колонке с силикагелем, используя 40% этилацетат в гексане в качестве элюента. Фракции, содержащие желаемый продукт, собирали и концентрировали для получения 1,1 г 2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя в виде твердого вещества белого цвета. 1 7-(Трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2 дебензоил-2-(2,5-диметоксибензоил)доцетаксель. Раствор 2'-(триизопропилсилилокси)-3'-дефенил-3'(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя (1,1 г, 1,1 ммолъ) в метиленхлориде (7 мл) и пиридин (0,44 мл, 5,5 ммоль) охлаждали до -30 С в бане с сухим льдом и ацетоном. Раствор, содержащий ангидрид трифторметансульфокислоты (0,37 мл, 2,2 ммоль), растворенный в метиленхлориде(0,3 мл), добавляли по каплям. Полученную смесь оставили постепенно нагреваться до комнатной температуры при помешивании. Спустя час реакционную смесь разбавляли этилацетатом (25 мл) и органический слой экстрагировали хлоридом аммония (25 мл), водой (25 мл) и солевым раствором (25 мл). Затем органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на колонке с силикагелем, используя 20% этилацетат в гексане в качестве элюента. Фракции, содержащие желаемый продукт, собирали и концентрировали для получения 565 мг 7-(трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2(2,5-диметоксибензоил)доцетакселя в виде твердого вещества. 1 Н ЯМР (CDCl3)1,10 (м, 24 Н), 1,26 (с, 3 Н), 1,38 (с, 9 Н), 1,68 (с, 3 Н), 1,72 (с, 3 Н), 1,92 (с, 3 Н), 1,95(117 мг, 1,00 ммоль) с последующим добавлением перрутената тетрапропиламмония (ТРАР) (10 мг, 0,03 ммоль). Полученную смесь оставили перемешиваться под наблюдением при комнатной температуре. Спустя 8 ч реакционную смесь фильтровали через целит и слой целита промывали метиленхлоридом. Объединенный супернатант концентрировали под вакуумом и полученный остаток очищали на колонке с силикагелем, используя 25% этилацетат в гексане. Фракции, содержащие продукт, собирали и концен-8 012625 трировали для получения 325 мг 7-(трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'дефенил-3'-(изобутенил)-10-оксо-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя в виде твердого вещества. 1 7,9-Эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетакаель. К хорошо перемешанному раствору 7-(трифторметансульфонилокси)-2'-(триизопропилсилилокси)3'-дефенил-3'-(изобутенил)-10-оксо-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя (323 мг, 0,286 ммоль) в этаноле (3,5 мл) добавляли боргидрид натрия (58 мг, 1,5 ммоль). После 10 мин реакционную смесь разбавляли этилацетатом (15 мл) и дважды экстрагировали солевым раствором (15 мл). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на силикагеле тонкослойной хроматографией (PTLC), используя 50% этилацетат в гексане в качестве проявляющего растворителя, для получения желаемого продукта, 7,9-эпокси-2'(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя 7,10-Эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. Раствор, содержащий 7,10-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2 дебензоил-2-(2,5-диметоксибензоил)доцетаксель (20 мг, 0,02 ммоль), растворенный в 1:1 смеси ацетонитрил:пиридин (2 мл), охлаждали до 0 С в ледяной бане. К нему добавляли фтороводородпиридин (0,2 мл) и раствор оставляли медленно нагреваться до комнатной температуры. Спустя 16 ч реакционную-9 012625 смесь разбавляли этилацетатом (15 мл) и гасили реакцию насыщенным раствором бикарбоната натрия(15 мл). Органический слой промывали один раз солевым раствором (20 мл) и затем сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле тонкослойной хроматографией, используя 70% этилацетат в гексане в качестве проявляющего растворителя. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 12 мг 7,10 эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя в виде твердого вещества белого цвета. 1 Н ЯМР (CDCl3)1,19 (с, 3 Н), 1,32 (с, 3 Н), 1,41 (с, 9 Н), 1,73 (с, 6 Н), 1,85 (с, 3 Н), 1,89 (с, 3 Н), 2,03 (с,3 Н), 2,28-2,42 (м, 4 Н), 3,69 (дд, J=2,0, 7,2 Гц, 1 Н), 3,81 (с, 3 Н), 3,89 (с, 3 Н), 4,25 (дд, J=2,4, 4,4 Гц, 1 Н),4,34 (д, J=6,0 Гц, 1 Н), 4,36 (д, J=6,0 Гц, 1 Н), 4,53 (д, J=7,6 Гц, 1 Н), 4,82 (м, 2 Н), 5,00 (д, J=9,2 Гц, 1 Н), 5,08(0,25 мл) и раствор оставляли медленно нагреваться до комнатной температуры. Спустя 16 ч реакционную смесь разбавляли этилацетатом (15 мл) и гасили реакцию насыщенным раствором бикарбоната натрия (15 мл). Органический слой промывали один раз солевым раствором (20 мл) и затем сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле тонкослойной хроматографией, используя 70% этилацетат в гексане в качестве проявляющего растворителя. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 12 мг из 7,9-эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя в виде твердого вещества белого цвета. 1(0,025 мл, 0,26 ммоль). Реакционную смесь перемешивали при комнатной температуре и спустя 4 ч разбавляли этилацетатом (20 мл) и промывали один раз солевым раствором (25 мл). Органический слой отделяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на силикагеле тонкослойной хроматографией, используя 50% этилацетат в гексане в каче- 10012625 стве проявляющего растворителя. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 75 мг 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-ацетоксидоцетакселя в виде твердого вещества белого цвета. 1 Н ЯМР (CDCl3)1,10 (м, 21 Н), 1,22 (с, 6 Н), 1,38 (с, 9 Н), 1,67 (с, 3 Н), 1,70 (с, 3 Н), 1,73 (с, 3 Н), 1,94 7,9-Эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-ацетоксидоцетаксель. Раствор, содержащий 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2 дебензоил-2-(2,5-диметоксибензоил)-10-ацетоксидоцетаксель (75 мг, 0,073 ммоль), растворенный в 1:1 смеси ацетонитрил:пиридин (3 мл), охлаждали до 0 С в ледяной бане. К нему добавляли фтороводородпиридин (0,5 мл) и раствор оставляли медленно нагреваться до комнатной температуры. Спустя 16 ч реакционную смесь разбавляли этилацетатом (25 мл) и гасили реакцию насыщенным раствором бикарбоната натрия (25 мл). Органический слой промывали один раз солевым раствором (30 мл) и затем сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле тонкослойной хроматографией, используя 70% этилацетат в гексане в качестве проявляющего растворителя. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 52 мг 7,9-эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-ацетоксидоцетакселя. 1 Н ЯМР (CDCl3)1,26 (с, 3 Н), 1,28 (с, 3 Н), 1,41 (с, 9 Н), 1,74 (с, 6 Н), 1,76 (с, 3 Н), 1,99 (с, 3 Н), 2,09 (с,3 Н), 2,11 (с, 3 Н), 2,18 (м, 1 Н), 2,27 (м, 1 Н), 2,36 (м, 1 Н), 2,49 (м, 1 Н), 3,81 (с, 3 Н), 3,91 (с, 1 Н), 3,94 (с, 3 Н),4,02 (д, J=6,0 Гц, 1H), 4,28 (м, 2H), 4,33 (д, J=7,2 Гц, 1 Н), 4,80 (м, 2 Н), 4,86 (д, J=6,4 Гц, 1 Н), 4,91 (с, 1 Н),5,00 (д, J=9,2 Гц, 1 Н), 5,29 (д, J=8,4 Гц, 1 Н), 5,67 (д, J=6,4 Гц, 1 Н), 5,71 (д, J=6,4 Гц, 1 Н), 6,01 (т, J=8,8 Гц,1 Н), 6,96 (д, J=9,2 Гц, 1 Н), 7,07 (дд, J=3,2 9,2 Гц, 1 Н), 7,28 (д, J=3,2 Гц, 1 Н). 7,9-Эпокси-2'-(триизопропилсилилокси:)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-метоксикарбонилоксидоцетаксель. Раствор 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5 диметоксибензоил)доцетакселя (28 мг, 0,029 ммоль), растворенный в безводном тетрагидрофуране (0,65 мл) в атмосфере азота, охлаждали до -40 С в бане с сухим льдом и ацетоном. В этот раствор добавляли 1,0 М LiHMDS (0,04 мл, 0,039 ммоль) и оставляли перемешиваться в течение 15 мин. К нему добавляли метилхлорформат (0,003 мл, 0,036 ммоль) и проводили реакцию под наблюдением при температуре-40 С. Через 1 ч реакционную смесь разбавляли этилацетатом (15 мл) и экстрагировали водой (15 мл) с последующим промыванием органического слоя солевым раствором (15 мл). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на селикагеле тонкослойной хроматографией, используя 5% метанол в метиленхлориде в качестве проявляющего растворителя. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре- 11012625 этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 9 мг 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-метоксикарбонилоксидоцетакселя в виде твердого вещества белого цвета. 1 7,9-Эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-метоксикарбонилоксидоцетаксель. Раствор, содержащий 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2 дебензоил-2-(2,5-диметоксибензоил)-10-метоксикарбонилоксидоцетаксель (9 мг, 0,008 ммоль), растворенный в 1:1 смеси ацетонитрил:пиридин (1,2 мл), охлаждали до 0 С на ледяной бане. К нему добавляли фтороводородпиридин (0,15 мл) и оставляли раствор медленно нагреваться до комнатной температуры. Спустя 16 ч реакционную смесь разбавляли этилацетатом (15 мл) и гасили реакцию насыщенным раствором бикарбоната натрия (15 мл). Органический слой промывали один раз солевым раствором (15 мл) и затем сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле тонкослойной хроматографией, используя 60% этилацетат в гексане в качестве проявляющего растворителя. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 4 мг 7,9-эпокси-3'дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-метоксикарбонилоксидоцетакселя. 1 7,9-Эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-димеатоксибензоил)-10-диметиламинокарбонилоксидоцетаксель. Раствор 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5 диметоксибензоил)доцетаксель (28 мг, 0,029 ммоль), растворенный в безводном тетрагидрофуране (0,65 мл) в атмосфере азота, охлаждали до -40 С в бане с сухим льдом и ацетоном. В этот раствор добавляли 1,0 М LiHMDS (0,04 мл, 0,039 ммоль) и оставляли перемешиваться в течение 15 мин. К нему добавляли диметилкарбамилхлорид (0,003 мл, 0,031 ммоль) и проводили реакцию под наблюдением при температуре -40 С. Через 1 ч реакционную смесь разбавляли этилацетатом (15 мл) и экстрагировали водой (15 мл) с последующим промыванием органического слоя солевым раствором (15 мл). Органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на селикагеле тонкослойной хроматографией, используя 5% метанол в метиленхлориде в качестве проявляющего растворителя. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре- 12012625 этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 20 мг 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-диметиламинокарбонилоксидоцетакселя в виде твердого вещества белого цвета. 1 Н ЯМР (CDCl3)1,10 (м, 21 Н), 1,23 (с, 6 Н), 1,39 (с, 9 Н), 1,68 (с, 3 Н), 1,71 (с, 3 Н), 1,73 (с, 3 Н), 1,98 7,9-Эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-диметиламинокарбонилоксидоцетаксель. Раствор, содержащий 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2 дебензоил-2-(2,5-диметоксибензоил)-10-диметиламинокарбонилоксидоцетаксель (20 мг, 0,016 ммоль),растворенный в 1:1 смеси ацетонитрил:пиридин (1,2 мл), охлаждали до 0 С на ледяной бане. К нему добавляли фтороводородпиридин (0,25 мл) и оставляли раствор медленно нагреваться до комнатной температуры. Спустя 16 ч реакционную смесь разбавляли этилацетатом (15 мл) и гасили реакцию насыщенным раствором бикарбоната натрия (15 мл). Органический слой промывали один раз солевым раствором(15 мл) и затем сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле тонкослойной хроматографией, используя 70% этилацетат в гексане в качестве проявляющего растворителя. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 12 мг 7,9-эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-диметиламинокарбонилоксидоцетакселя. 1 Н ЯМР (CDCl3)1,24 (с, 3 Н), 1,26 (с, 3 Н), 1,40 (с, 9 Н), 1,73 (с, 6 Н), 1,74 (с, 3 Н), 2,00 (с, 3 Н), 2,07 (с,3 Н), 2,17 (м, 1 Н), 2,25 (м, 1 Н), 2,36 (м, 1 Н), 2,48 (м, 1 Н), 2,93 (с, 3 Н), 2,94 (с, 3 Н), 3,79 (с, 3 Н), 3,86 (с, 1 Н),3,92 (с, 3 Н), 4,02 (д, J=6,0 Гц, 1 Н), 4,28 (м, 2 Н), 4,31 (д, J=7,6 Гц, 1 Н), 4,80 (м, 2 Н), 4,89 (д, J=6,0 Гц, 1 Н),4,90 (с, 1 Н), 4,97 (д, J=9,6 Гц, 1 Н), 5,28 (д, J=8,4 Гц, 1 Н), 5,67 (д, J=6,0 Гц, 1 Н), 5,70 (д, J=6,0 Гц, 1 Н), 6,02 10-Ацетокси-7-(триэтилсилил)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2(2,5-диметоксибензоил)доцетаксель. Смесь (3R,4S)-1-трет-бутоксикарбонил-3-триизопропилсилилокси-4-(2-фурил)азетидин-2-он (1,27 г,3,11 ммоль) и 7-(триэтилсилил)-2-дебензоил-2-(2,5-диметоксибензоил)баккатин III (1,9 г, 2,5 ммоль) растворяли в безводном ТГФ (20 мл). Смесь охлаждали до -40 С и по каплям добавляли 1,0 М LiHMDS (3,5 мл, 3,5 ммоль). Реакционную смесь оставляли перемешиваться при температуре от -40 до -20 С в течение 1 ч, после чего реакцию завершали. Реакцию гасили насыщенным водным раствором хлорида аммония и проводили экстракцию этилацетатом (100 мл 2). Объединенные органические слои промывали водой (30 мл 1), сушили над сульфатом магния и концентрировали под вакуумом. Неочищенный остаток очищали на колонке с силикагелем, используя в качестве элюента 30% этилацетат в гексане, получая 10-ацетокси-7-(триэтилсилил)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5 диметоксибензоил)доцетаксель в виде твердого вещества белого цвета (2,88 г, 98%). 1 Н ЯМР (CDCl3)0,53 (м, 6 Н), 0,89 (м, 30 Н), 1,18 (с, 6 Н), 1,36 (с, 9 Н), 1,69 (с, 3 Н), 1,85 (м, 1 Н), 1,96 10-Ацетокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 10-Ацетокси-7-(триэтилсилил)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2(2,5-диметоксибензоил)доцетаксель (670 мг, 0,57 ммоль) растворяли в этаноле (2,5 мл). Раствор 5% соляной кислоты в этаноле (5,0 мл) добавляли по каплям. Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 5 ч, затем реакцию завершали. Реакцию гасили насыщенным водным раствором бикарбоната натрия, а продукт экстрагировали этилацетатом (75 мл 2). Объединенные слои этилацетата промывали водой (25 мл 1) и солевым раствором (25 мл 1), сушили над сульфатом магния и концентрировали под вакуумом. Неочищенный 10-ацетокси-2'-(триизопропилсилилокси)-3'-дефенил-3'(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель использовали без очистки. 1 Н ЯМР (CDCl3)0,92 (м, 21 Н), 1,12 (с, 3 Н), 1,25 (с, 3 Н), 1,39 (с, 9 Н), 1,70 (с, 3 Н), 1,85 (м, 4 Н), 2,19- 14012625 мл) добавляли по каплям в течение 5 мин, затем реакцию завершали. Реакционную смесь разбавляли этилацетатом и гасили реакцию насыщенным водным раствором хлорида аммония. Продукт экстрагировали этилацетатом (75 мл 2), промывали водой (25 мл 1) и солевым раствором (25 мл 1), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный остаток очищали на колонке с силикагелем, используя 40% этилацетат в гексане в качестве элюента, получая 2'(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель в виде твердого вещества белого цвета (507,6 мг, 87%, два этапа). 1 7-(Трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 2'-(Триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель (1,7 г, 1,68 ммоль) разбавляли в метиленхлориде (10,0 мл) и охлаждали до -30 С. Добавляли пиридин (0,68 мл, 8,4 ммоль) с последующим добавлением ангидрида трифторметансульфокислоты (0,57 мл, 3,4 ммоль) в метиленхлориде (0,5 мл) при этом реакционный раствор принимал желтую окраску. Реакционную смесь оставляли медленно нагреваться до 0 С в течение 1 ч, после чего реакцию завершали. Продукт экстрагировали этилацетатом (150 мл 1), промывали водой (50 мл 1) и солевым раствором (50 мл 1), сушили над сульфатом магния и концентрировали под вакуумом. Неочищенный остаток очищали на колонке с силикагелем, используя 25% этилацетат в гексане в качестве элюента, получая 7(трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5 диметоксибензоил)доцетаксель в виде твердого вещества белого цвета (1,44 г, 75%). 1 Н ЯМР (CDCl3)0,94 (м, 21 Н), 1,09 (с, 3 Н), 1,22 (с, 3 Н), 1,39 (с, 9 Н) 1,92 (м, 6 Н), 2,30 (м, 5 Н), 2,40 7-(Трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-10-оксо-2 дебензоил-2-(2,5-диметоксибензоил)доцетаксель. В перемешанный раствор 7-(трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя (1,44 г, 1,26 ммоль) в метиленхлориде (30 мл) добавляли 4-метилморфолин-N-оксид (NMO) (590 мг, 5 ммоль) с последующим добавлением перрутената тетрапропиламмония (ТРАР) (62 мг, 0,18 ммоль). Полученную смесь оставляли перемешиваться под наблюдением при комнатной температуре. Спустя 8 ч реакционную смесь фильтровали через целит и слой целита промывали метиленхлоридом. Объединенный супернатант концентрировали под вакуумом и полученный остаток очищали на колонке с силикагелем, используя 10% этилацетат в гексане. Фракции, содержащие продукт, собирали и концентрировали для получения 619 мг 7(трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-10-оксо-2-дебензо- 15012625 ил-2-(2,5-диметоксибензоил)доцетакселя в виде твердого вещества. 1 Н ЯМР (CDCl3)0,91 (м, 21 Н), 1,15 (с, 3 Н), 1,25 (с, 3 Н), 1,37 (с, 9 Н), 1,89 (с, 6 Н), 2,14 (м, 1 Н), 2,27 7,9-Эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель и 7,10-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил 2-(2,5-диметоксибензоил)доцетаксель. Боргидрид натрия (102 мг, 2,7 ммоль) добавляли в 7-(трифторметансульфонилокси)-2'(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-10-оксо-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя (618 мг, 0,54 ммоль), растворенный в этаноле (7,0 мл). После 5 мин реакцию завершали, а реакционную смесь разбавляли этилацетатом. Продукт экстрагировали этилацетатом (100 мл 1), промывали насыщенным водным раствором хлоридом натрия (50 мл 1), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный остаток очищали на колонке с силикагелем, используя 50% этилацетат в гексане в качестве элюента, получая 7,9-эпокси-2'-(триизопропилсилилокси)-3'дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель (258 мг, 48%) и 7,10-эпокси 2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель 7,10-Эпокси-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 7,10-Эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель (49,1 мг, 0,049 ммоль) растворяли в смеси пиридин-ацетонитрил (1/1, 2,0 мл) и охлаждали до 0 С. Добавляли HF/пиридин (70:30, 0,5 мл) и реакционную смесь оставляли медленно нагреваться до комнатной температуры в течение ночи. Реакцию гасили насыщенным водным раствором- 16012625 бикарбоната натрия и разбавляли этилацетатом. Слой этилацетата промывали дополнительным насыщенным водным раствором бикарбоната натрия (15 мл 2) и затем промывали объединенные водные слои этилацетатом (40 мл 2). Объединенные слои этилацетата промывали водой (15 мл 2), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле, используя 50% этилацетат в гексане в качестве элюента, получая 7,10-эпокси-3'-дефенил-3'(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель (33,5 мг, 81%). 1 7,9-Эпокси-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель растворяли в смеси пиридин-ацетонитрил (1/1, 1,5 мл) и охлаждали до 0 С. Добавляли HF/пиридин (70:30, 0,2 мл) и реакционную смесь оставляли медленно нагреваться до комнатной температуры в течение ночи. Реакцию гасили насыщенным водным раствором бикарбоната натрия и разбавляли этилацетатом. Слой этилацетата промывали дополнительным насыщенным водным раствором бикарбоната натрия (10 мл 2). Объединенные водные слои промывали этилацетатом (20 мл 2). Затем объединенные слои этилацетата промывали водой (10 мл 2), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле, используя 75% этилацетат в гексане в качестве элюента, получая 7,9-эпокси-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5 диметоксибензоил)доцетаксель в виде твердого вещества белого цвета (10,26 мг, 70%). 1 Н ЯМР (CDCl3)1,09 (с, 3 Н), 1,23 (с, 3 Н), 1,40 (с, 9 Н), 1,77 (с, 3 Н), 1,95 (с, 3 Н), 2,07 (с, 3 Н), 2,21 7,9-Эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-ацетоксидоцетаксель. Уксусный ангидрид (8,1 мкл, 0,858 ммоль) и DMAP (5 мг, 0,043 ммоль) добавляли в раствор 7,9 эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель (28,5 мг, 0,0286 ммоль) в пиридине (0,5 мл). Реакцию завершали после перемешивания при комнатной температуре в течение 3 ч. Продукт экстрагировали этилацетатом (30 мл 1), промывали водой(15 мл 1) и солевым раствором (15 мл 1), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле, используя 50% этилацетат в гексане в качестве элюента, получая 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил 2-(2,5-диметоксибензоил)-10-ацетоксидоцетаксель в виде твердого вещества белого цвета (25 мг, 85%). 1 Н ЯМР (CDCl3)0,95 (м, 21 Н), 1,26 (м, 6 Н), 1,44 (с, 9 Н), 1,76 (с, 3 Н), 1,99 (с, 3 Н), 2,13 (с, 3 Н), 2,18 7,9-Эпокси-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-димеаюксибензоил)-10-ацетоксидоцетаксель. 7,9-Эпокси-2'-(триизопропилсилилокси)-3-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-ацетоксидоцетаксель (25 мг, 0,025 ммоль) растворяли в смеси пиридин-ацетонитрил (1/1, 1,5 мл) и охлаждали до 0 С. Добавляли HF/пиридин (70:30, 0,25 мл) и оставляли реакционную смесь медленно нагреваться до комнатной температуры в течение ночи. Реакцию гасили насыщенным водным раствором бикарбоната натрия и растворяли этилацетатом. Слой этилацетата промывали дополнительным насыщенным водным раствором бикарбоната натрия (10 мл 2). Объединенные водные слои промывали этилацетатом (25 мл 2). Объединенные слои этилацетата затем промывали водой (10 мл 2), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле, используя 80% этилацетата в гексане в качестве элюента, получая конечный продукт, 7,9 эпокси-3-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-ацетоксидоцетаксель (17,2 мг,78%). 1 Н ЯМР (CDCl3)1,24 (с, 6 Н), 1,41 (с, 9 Н), 1,74 (с, 3 Н), 1,94 (с, 3 Н), 2,10 (с, 6 Н), 2,27 (м, 2 Н), 2,33 Нижеприведенные промежуточные вещества описаны выше. 2'-(Триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 7-(Трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2 дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 7-(Трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-10-оксо 2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 7,9-Эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 7,9-Эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-(4-метилдитиобутаноил)доцетаксель. В раствор 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2-дебензоил-2(2,5-диметоксибензоил)доцетаксель (28 мг, 0,029 ммоль), растворенный в метиленхлориде (1,5 мл) в атмосфере азота, добавляли DMAP (3,5 мг, 0,028 ммоль) и 4-метилдитиобутановую кислоту (50 мг, 0,28 ммоль). В эту смесь добавляли диизопропилкарбодиимид (0,045 мл, 0,28 ммоль) и полученную смесь оставляли перемешиваться при комнатной температуре в течение ночи. Затем реакцию гасили хлоридом аммония (15 мл) и проводили экстракцию метиленхлоридом (20 мл). Затем органический слой промывали солевым раствором (15 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали на силикагеле тонкослойной хроматографией, используя 40% этилацетат в гексане в качестве проявляющего раствора. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 23 мг 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2 дебензоил-2-(2,5-диметоксибензоил)-10-(4-метилдитиобутаноил)доцетакселя в виде твердого вещества белого цвета. 1 7,9-Эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-(4-метилдитиобутаноил)доцетаксель. Раствор, содержащий 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(изобутенил)-2 дебензоил-2-(2,5-диметоксибензоил)-10-(4-метилдитиобутаноил)доцетаксель (23 мг, 0,02 ммоль), растворенный в 1:1 смеси ацетонитрил:пиридин (1,6 мл), охлаждали до 0 С на ледяной бане. К нему добавляли фтороводородпиридин (0,25 мл) и оставляли раствор медленно нагреваться до комнатной температуры. Спустя 16 ч реакционную смесь разбавляли этилацетатом (15 мл) и гасили реакцию насыщенным раствором бикарбоната натрия (15 мл). Органический слой промывали один раз солевым раствором (15 мл) и затем сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле тонкослойной хроматографией, используя 65% этилацетат в гексане в качестве проявляющего растворителя. Полоску, содержащую желаемый продукт, соскребали и промывали на фильтре этилацетатом. Органические слои объединяли и концентрировали под вакуумом для получения 16 мг 7,9-эпокси-3'-дефенил-3'-(изобутенил)-2-дебензоил-2-(2,5-диметоксибензоил)-10(4-метилдитиобутаноил)доцетакселя. 1 Н ЯМР (CDCl3)1,25 (с, 3 Н), 1,29 (с, 3 Н), 1,40 (с, 9 Н), 1,73 (с, 6 Н), 1,74 (с, 3 Н), 1,97 (с, 3 Н), 2,04 Нижеприведенные промежуточные вещества описаны выше. 2'-(Триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 7-(Трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 7-(Трифторметансульфонилокси)-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-10-оксо-2 дебензоил-2-(2,5-диметоксибензоил)доцетаксель. 7,9-Эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетаксель.DMAP (4,6 мг, 0,037 4 ммоль), 4-метилдитиобутановую кислоту (62 мг, 0,374 ммоль) и DIC (58,5 мкл, 0,0374 ммоль) добавляли в раствор 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2 фурил)-2-дебензоил-2-(2,5-диметоксибензоил)доцетакселя (37,3 мг, 0,0374 ммоль) в метиленхлориде (0,5 мл). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение ночи, затем реакцию завершали и гасили насыщенным водным раствором хлорида аммония. Продукты экстрагировали этилацетатом (25 мл 2), промывали водой (15 мл 1), сушили над сульфатом магния и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле, используя 50% этилацетат в гексане в качестве элюента,получая 7,9-эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2 дебензоил-2-(2,5-диметоксибензоил)-10-(4-метилдитиобутаноил)доцетаксель (48,2 мг, 100+%). 1 Н ЯМР (CDCl3)0,92 (м, 21 Н), 1,24 (м, 6 Н), 1,41 (с, 9 Н), 1,73 (с, 3 Н), 1,95 (с, 3 Н), 2,05 (м, 2 Н), 2,15 7,9-Эпокси-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-(4-метилдитио- 20012625 бутаноил)доцетаксель. 7,9-Эпокси-2'-(триизопропилсилилокси)-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-(4-метилдитиобутаноил)доцетаксель (42,8 мг, 0,0374 ммоль) растворяли в смеси пиридинацетонитрил (1/1, 3,0 мл) и охлаждали до 0 С. Добавляли HF/пиридин (70:30, 0,5 мл) и реакционную смесь оставляли медленно нагреваться до комнатной температуры в течение ночи. Реакцию гасили насыщенным водным раствором бикарбоната натрия и разбавляли этилацетатом. Слой этилацетата промывали дополнительным насыщенным водным раствором бикарбоната натрия (15 мл 2) и затем объединенные водные слои промывали этилацетатом (40 мл 2). Объединенные слои этилацетата промывали водой (15 мл 2), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Неочищенный остаток очищали на силикагеле, используя 50% этилацетат в гексане в качестве элюента, получая 7,9-эпокси-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-(4-метилдитиобутаноил)доцетаксель (22,9 мг, 62%, 2 этапа). 1 Н ЯМР (CDCl3)1,24 (м, 6 Н), 1,41 (с, 9 Н), 1,74 (с, 3 Н), 1,93 (с, 3 Н), 2,04 (м, 2 Н), 2,09 (с, 3 Н), 2,24m/z ЖХ/МС для C48H63NO17S2Na+: вычислено: 1012,3; найдено: 1012,3. Активность соединений настоящего изобретения определяли, следуя процедуре, описанной у Riou,Naudin and Lavelle in Biochemical and Biophysical Research Communications; vol.187,1, 1992, pp. 164170. Конъюгаты таксанов изобретения и клеточного связующего агента могут быть образованы при помощи любого из способов, которые известны в настоящее время или будут разработаны в будущем. Многочисленные способы конъюгации раскрыты в патентах США 5416064 и 5475092. Сложный эфир таксана может быть модифицирован для получения свободной аминогруппы и затем связан с антителом или другим клеточным связующим агентом при помощи связующей группы, не устойчивой в кислой среде, или светонеустойчивой связующей группы. Эфир таксана может быть конденсирован с пептидом и затем связан с клеточным связующим агентом для получения связующей группы, не устойчивой к действию пептидаз. Гидроксильная группа в эфире таксана может быть сукцинилирована и связана с клеточным связующим агентом для получения конъюгата, который может быть расщеплен внутриклеточными эстеразами для высвобождения свободного лекарственного вещества. Наиболее предпочтительно эфиры, эстеры или карбаматы таксанов обрабатывают для получения свободной или защищенной тиольной группы и затем дисульфид- или тиолсодержащие таксаны связывают с клеточным связующим агентом при помощи дисульфидных связей. Характерные конъюгаты изобретения представляют собой антитело-таксан, фрагмент антителатаксан, эпидермальный фактор роста (EGF)-таксан, меланоцитстимулирующий гормон (MSH)-таксан,тироидстимулирующий гормон (TSH)-таксан, эстроген-таксан, аналог эстрогена-таксан, андрогентаксан, аналог андрогена-таксан и фолат-таксан. Конъюгаты таксанов с антителами, фрагментами антител, белками или пептидными гормонами,белками или пептидными факторами роста и другими белками синтезируют таким же образом при помощи известных способов. Например, пептиды и антитела могут быть модифицированы известными способами при помощи реагентов для образования поперечных связей, такими как N-сукцинимидил 3-(2 пиридилдитио)пропионат, N-сукцинимидил 4-(2-пиоидилдитио)пентаноат (SPP), 4-сукцинимидилоксикарбонилметил(2-пиридилдитио)толуол (SMPT), N-сукцинимидил-3-(2-пиридилдитио)бутиратBiophys. 605 (1962); и Liu и др., 18 Biochem. 690 (1979), Blakey and Thorpe, 1 Antibody, ImmunoconjugatesRadiopharmaceuticals, 1-16 (1988), Worrell и др. 1 Anti-Cancer Drug Design 179-184 (1986). Полученный таким образом клеточный связующий агент, содержащий свободную или защищенную тиольную группу,затем подвергают реакции с дисульфид- или тиолсодержащим таксаном для получения конъюгатов. Конъюгаты могут быть очищены при помощи ВЭЖХ или гель-фильтрации. Предпочтительно конъюгаты моноклональное антитело- или клеточный связующий агент-таксан представляют собой конъюгаты, которые соединены при помощи дисульфидной связи, как обсуждалось выше, которые способны доставлять молекулы таксанов. Такие клеточные связующие конъюгаты получают известными способами, такими как модификация моноклональных антител сукцинимидилпиридилдитиопропионатом (SPDP) (Carlsson et al., 173 Biochem. J. 723-737 (1978. Полученную тиопиридильную группу затем замещают обработкой тиолсодержащими таксанами для получения конъюгатов,имеющих дисульфидные связи. В качестве альтернативы, в случае арилдитио-таксанов образование клеточного связующего конъюгата осуществляется прямым замещением арилтиола таксана сульфгидрильными группами ранее введенными в молекулы антител. Конъюгаты, содержащие 1-10 таксановых лекарственных веществ, связанных дисульфидным мостиком, легко образуются любым способом. Более конкретно раствор дитио-нитропиридил-модифицированного антитела с концентрацией 2,5 мг/мл в 0,05 М калий-фосфатном буфере, рН 7,5, содержащем 2 мМ ЭДТА, обрабатывают тиолсодержащим таксаном (1,3 мол.экв./дитиопиридильная группа). Высвобождение тионитропиридина из модифицированного антитела, которое завершается примерно за 16 ч, контролируют при помощи спек- 22012625 трофотометрии при 325 нм. Конъюгат антитело-таксан очищают и от них отделяют непрореагировавшее лекарственное вещество и другое низкомолекулярное вещество при помощи гель-фильтрации, используя колонку с сефадексом G-25 или с сефакрилом S300. Количество связанных фрагментов таксана на молекулу антитела можно определить путем измерения отношения поглощения при 230 и 275 нм. Этим способом посредством дисульфидных связей может быть связано в среднем 1-10 таксановых молекул/молекула антитела. Влияние конъюгации на аффинность связывания в отношении антиген-экспрессирующих клеток может быть определено при помощи способов, описанных ранее у Liu и др., 93 Proc. Natl. Acad. Sci 86188623 (1996). Цитотоксичность таксанов и их конъюгатов с антителами в неадгезивных клеточных линиях, таких как Namalwa и HL-60, может быть измерена при помощи обратной экстраполяции кривых клеточной пролиферации, как описано у Goldmacher и др., 135 J. Immunol. 3648-3651 (1985). Цитотоксичность этих соединений к адгезивным клеточным линиям, таким как COLO 205 и А-375, может быть определена при помощи клоногенного анализа, как описано у Goldmacher и др., 102 J Cell Biol. 1312-1319 7,9-Эпокси-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5-диметоксибензоил)-10-(N-2,2-диметил-2 сульфгидрилэтилкарбамоил)доцетаксель (IGT-15-075-SH). В небольшой пробирке растворяли 7,9-эпокси-3'-дефенил-3'-(2-фурил)-2-дебензоил-2-(2,5 диметоксибензоил)-10-(N-2,2-диметил-2-метилдитиоэтилкарбамоил)доцетаксель (36 мг, 0,0353 ммоль) в смеси метанола (1,0 мл) и этилацетата (0,73 мл). В отдельной пробирке растворяли DTT (55 мг, 0,343 ммоль) в 50 ммоль калий-фосфатного буфера (0,73 мл), рН 7,5, который затем добавляли в раствор таксоида. Реакцию контролировали при помощи тонкослойной хроматографии до тех пор, пока не обнаружили, что она завершилась (-19 ч). Реакцию гасили 50 мМ калий-фосфатного буфера (6 мл), рН 6,5 и проводили экстракцию этилацетатом (320 мл). Объединенные органические слои промывали водой,сушили над безводным сульфатом натрия и концентрировали. Остаток очищали тонкослойной хроматографией, используя диоловую колонку для получения желаемого продукта (27 мг, 79%), который сразу аликвотировали и хранили для использования в конъюгации, m/z ЖХ/МС для C48H64N2O17SNa+: вычислено: 995,4; найдено: 995,5. Конъюгация таксоидов с моноклональными антителами.HuC242 антитело, которое связывается с CanAg антигеном предпочтительно экспрессировали на поверхности клеток рака толстой кишки человека и на других солидных опухолях, было выбрано для конъюгации с таксоидами. На первом этапе проводили реакцию антитела с модифицирующим агентом Nсульфосукцинимидил 5-нитро-2-пиридилдитиобутаноатом (SSNPB) для введения групп нитропиридилдитио. Раствор huC242 антитела (525 мг, 0,0036 ммоль) с концентрацией 8 мг/мл в водном буфере (65,6 мл), рН 6,5, содержащем 0,05 М фосфата калия, 0,05 М хлорида натрия и 2 мМ этилендиаминтетрауксусной кислоты (ЭДТА), обрабатывали раствором SSNPB (0,0288 ммоль, 13,62 мг) в диметилацетамиде(DMA) (3,28 мл), взятым в 8-кратном молярном избытке. Реакционную смесь перемешивали при комнатной температуре в течение 90 мин и затем загружали в колонку с сефадексом G25 для гель-фильтрации(50 мм 35,5 мм, объем колонки = 700 мл), которую предварительно уравновешивали водным буфером,содержащим 0,05 М фосфата калия, 0,05 М хлорида натрия и 2 мМ ЭДТА, рН 7,5 (65,6 мл). Модифицированные фракции, содержащие антитело, собирали и объединяли для получения 502,4 мг (95,7%) продукта. Небольшую аликвоту модифицированного антитела обрабатывали дитиотриэтолом для расщепления нитропиридилдисульфида и освобожденный нитропиридин-2-тион анализировали спектрофотометрически (325 нм=10964 М-1 см-1 и 280 нм=3344 М-1 см-1 для нитропиридин-2-тиона, и 280 нм=217560 М-1 см-1 для антитела). В среднем было связано 4,53 нитропиридилдисульфидных молекул с одной молекулой антитела. Модифицированное антитело (502,0 мг, 0,0034 ммоль) разбавляли в 2,5 мг/мл вышеуказанного буфера, рН 7,5 и затем обрабатывали раствором таксоида IGT-15-075-SH (0,020 ммоль, 19,5 мг) в DMA так,чтобы конечная концентрация DMA в буфере составила 20%. Смесь для конъюгации перемешивали при- 23012625 комнатной температуре в течение 16 ч. Реакционную смесь очищали, пропуская через колонку с сефакрилом S300 для гель-фильтрации (50 мм 42 см, объем колонки = 825 мл), которую перед этим уравновешивали физраствором, забуференным фосфатами, PBS буфером, рН 6,5. Фракции, содержащие мономерные конъюгаты антитело-таксоид, объединяли и диализовали против PBS буфера. Конечный конъюгат (251 мг) анализировали спектрофотометрически, используя нижеприведенные коэффициенты экстинкции: (323 нм=4299 М-1 см-1, 280 нм=565 М-1 см-1 для таксоида и 280 нм=217560 М-1 см-1 с для антитела). В среднем конъюгаты содержали 4,16 таксоида. Анализ связывания. Относительную аффинность связывания huC24 2 антитела и конъюгата таксоида с антигенэкспрессирующими клетками рака толстой кишки человека НТ-29 определяли, используя флуоресцентный анализ. Конъюгат антитело-таксоид и голое антитело с начальной концентрацией 1 на 10-7 М добавляли в 96-луночные круглодонные планшеты и титровали, используя 3-кратное серийное разведение,дублируя каждую концентрацию. В каждую лунку, содержащую различные концентрации антитела или конъюгата, а также в контрольные лунки добавляли НТ-29 клетки по 50000 клеток на лунку. Планшеты инкубировали на льду в течение 3 ч. После инкубации клетки в планшете промывали и добавляли флуоресцентно меченные вторичные антитела, которые связываются с гуманизированными IgG, такими какhuC242, и планшеты инкубировали в течение 1 ч на льду. После инкубации планшеты снова промывали и клетки фиксировали 1% раствором формальдегид/PBS. Считывали флуоресценцию в каждой лунке планшеты, используя флуоресцентный анализатор Becton Dickinson FACSCalibur. Данные представляли в виде графиков как процент от максимальной флуоресценции, которая получена при самой большой концентрации антитела или конъюгата (фиг. 1). Результаты показывают, что конъюгация таксоидов с антителами не изменяет аффинность связывания с клетками-мишенями. Активность in vitro и специфичность конъюгата huC242-таксоид. Образцы свободных таксоидных конъюгатов orhuC242-таксоид добавляли в 96-луночную плоскодонную планшету для тканевых культур и титровали, используя серийные разведения в диапазоне от 110-12 до 310-7 М. Клетки рака толстой кишки человека, COLO 205, или клетки человеческой меланомы, А-375, добавляли в лунки так, чтобы для каждой концентрации лекарственного вещества для каждой линии клеток было по три повтора. Планшеты инкубировали при 37 С в атмосфере 5% СО 2 в течение 4 дней. В конце периода инкубации 20 мкл реагента татразолия WST-8, (2-(2-метоксинитрофенил)-3-(4 нитрофенил)-5-(2,4-дисульфофенил)-2-тетразолия, мононатриевая соль), добавляли в каждую лунку, и планшеты продолжали инкубировать в течение 2 ч. Затем в каждой лунке планшеты измеряли поглощение, используя устройство для считывания планшет Molecular Devices при 450 нм. Выжившие фракции клеток для каждой концентрации таксоида или конъюгата представлены графически на фиг. 2 а, b. Результаты показывают, что конъюгация с антителами демонстрирует высокую специфичность мишеней к таксоидам. Таким образом, huC242-таксоид является очень эффективным при уничтожении целевых клеток рака толстой кишки человека, COLO 205, со значением IC50, равным 810-11 M. Напротив, антигеннегативные клетки являются примерно в 150 раз менее чувствительными, со значением IC50,равным 1,210-8 М, демонстрируя антигенную специфичность цитотоксического эффекта (фиг. 2a). С другой стороны, свободный таксоид имеет одинаковую эффективность в отношении обеих клеточных линий (IC50110-10 М) (фиг. 2b). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Таксаны, имеющие следующую формулу (I): где Z означает радикал формулы II;R3 представляет собой изобутенил или фурил;R4 представляет собой связующую группу, выбранную из дисульфидной группы и тиоэфирной группы, гидроксигруппу, ацетоксигруппу, (С 2-С 4)алкилоксикарбонилоксигруппу, (С 1-С 2)диалкилкарбамоилоксигруппу, причем ацетоксигруппа, (С 2-С 4)алкилоксикарбонилоксигруппа и (С 1-С 2)диалкилкарбамоилоксигруппа могут содержать терминальную дисульфидную или тиоэфирную группу;R8 представляет собой фенил, 3-метоксифенил, 3-хлорфенил, 2,5-диметоксифенил, фурил, пироллил, тиенил, тиазолил, имидазолил, пиридил, оксазолил, индолил, бензофуранил или бензотиенил. 2. Соединение по п.1, в котором связующая группа представляет собой дисульфидную группу. 3. Соединение по п.2, в котором связующая группа представляет собой дисульфидную группу, в которой боковая цепь, несущая дисульфидную группу, может быть линейной или разветвленной. 4. Соединение по п.3, в котором связующую группу при R4 выбирают из нижеследующих заместителей: -OCO(CR13R14)m(CR15R16)n(ОСН 2 СН 2)ySZ' или -OCONR12(CR13R14)m(CR15R16)n(OCH2CH2)ySZ',где Z' представляет собой Н, тиолзащищающую группу или SR';R' и R12 являются одинаковыми или различными и представляют собой линейный алкил, разветвленный алкил или циклический алкил, имеющие 1-10 атомов углерода, и R12, кроме того, может представлять собой Н;R13, R14, R15 и R16 являются одинаковыми или различными и представляют собой Н или линейный или разветвленный алкил, имеющий 1-4 атомов углерода;n равно целому числу от 1 до 10;m равно целому числу от 1 до 10 и также может быть равным 0;y равно целому числу от 1 до 20 и также может быть равным 0. 5. Соединение по п.1, в котором R8 представляет собой 3-метоксифенил, 3-хлорфенил, 2,5 диметоксифенил, фурил, пироллил, тиенил, тиазолил, имидазолил, пиридил, оксазолил, индолил, бензофуранил или бензотиенил. 6. Соединение по п.1, в котором R5 представляет собой Н и R и R7 образуют связь. 7. Цитотоксический агент, содержащий один или несколько таксанов, ковалентно связанных с клеточным связующим агентом посредством связующей группы, в котором по меньшей мере один из указанных таксанов представляет собой соединение, представленное формулой (III)R3 представляет собой изобутенил или фурил;R4 представляет собой связующую группу, выбранную из дисульфидной группы или тиоэфирной группы;(А) терапевтически эффективное количество цитотоксического агента по п.7 и(В) фармацевтически приемлемый носитель. 9. Цитотоксический агент по п.7, в котором клеточный связующий агент выбирают из группы, состоящей из антител, фрагмента антитела, интерферонов, лимфокинов, гормонов, витаминов, факторов роста, колонийстимулирующих факторов и трансферрина. 10. Цитотоксический агент по п.7, в котором клеточный связующий агент представляет собой антитело. 11. Цитотоксический агент по п.7, в котором клеточный связующий агент представляет собой моноклональное антитело. 12. Цитотоксический агент по п.7, в котором клеточный связующий агент представляет собой фрагмент антигенспецифического антитела. 13. Цитотоксический агент по п.7, в котором фрагмент антитела представляет собой sFV, Fab, Fab' или F(ab')2. 14. Цитотоксический агент по п.7, в котором клеточный связующий агент представляет собой фактор роста или колонийстимулирующий фактор. 15. Способ уничтожения выбранных клеточных популяций, включающий приведение в контакт целевых клеток или тканей, содержащих целевые клетки, с эффективным количеством цитотоксического агента по п.7.
МПК / Метки
МПК: C07K 16/30, C07D 493/06, A61P 35/00, A61K 39/395
Метки: агенты, цитотоксические, таксаны, новые, содержащие
Код ссылки
<a href="https://eas.patents.su/27-12625-citotoksicheskie-agenty-soderzhashhie-novye-taksany.html" rel="bookmark" title="База патентов Евразийского Союза">Цитотоксические агенты, содержащие новые таксаны</a>
Предыдущий патент: Способ получения аннелированных производных пиперазин-2-она и соответствующие промежуточные продукты
Следующий патент: Способ получения органосилилполисульфанов
Случайный патент: Замещенные хинолины и их применение в качестве лекарственных средств