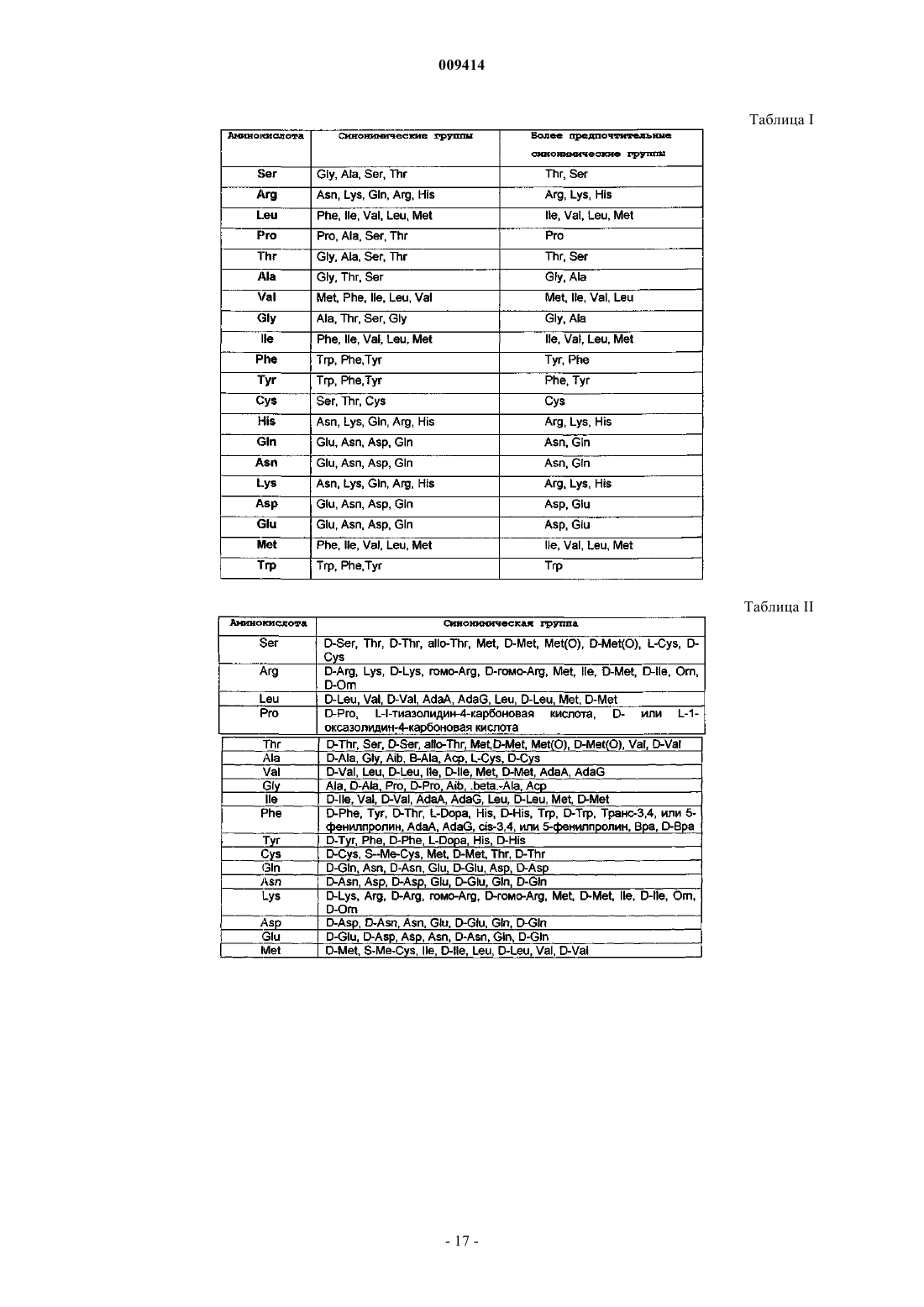
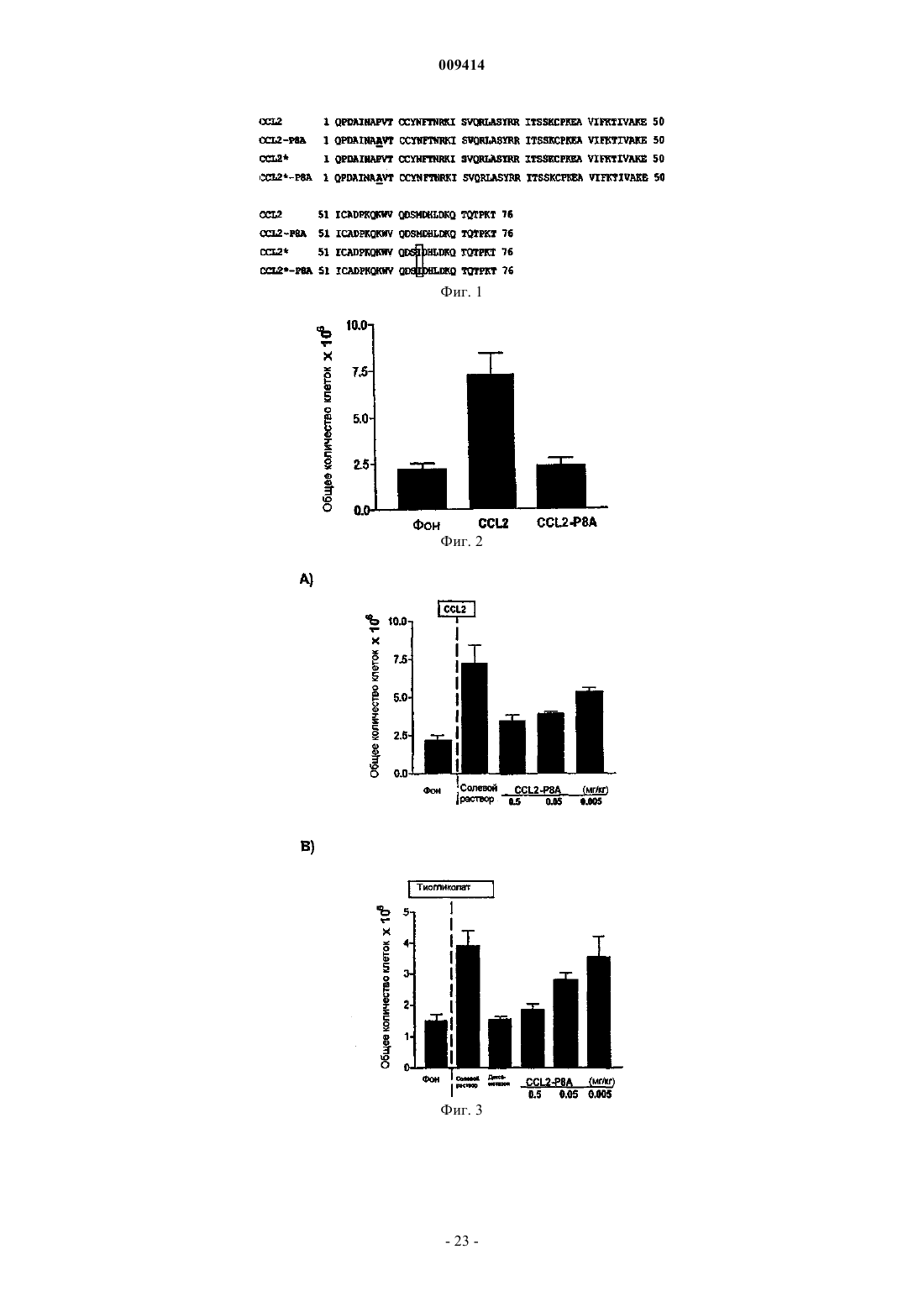
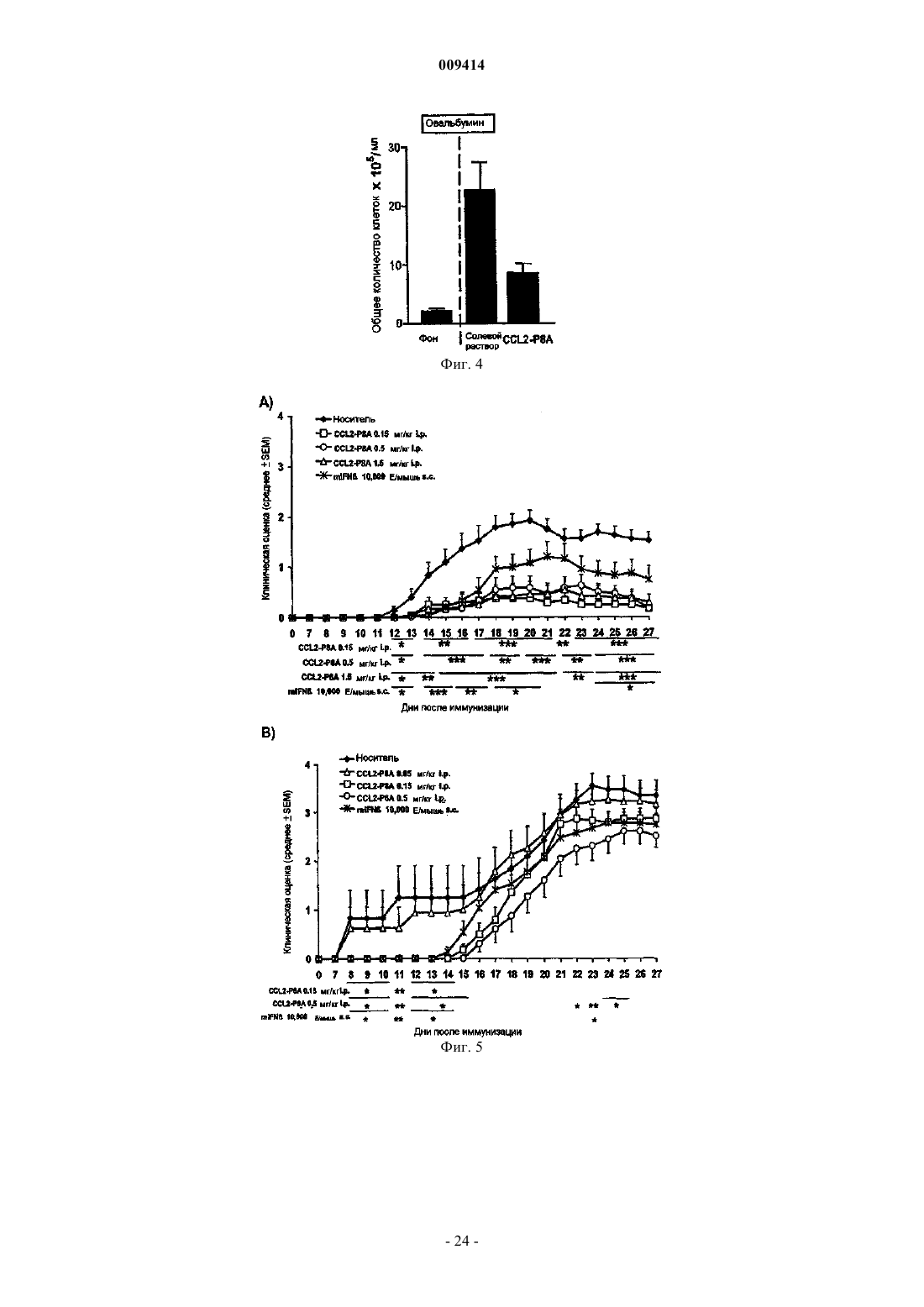
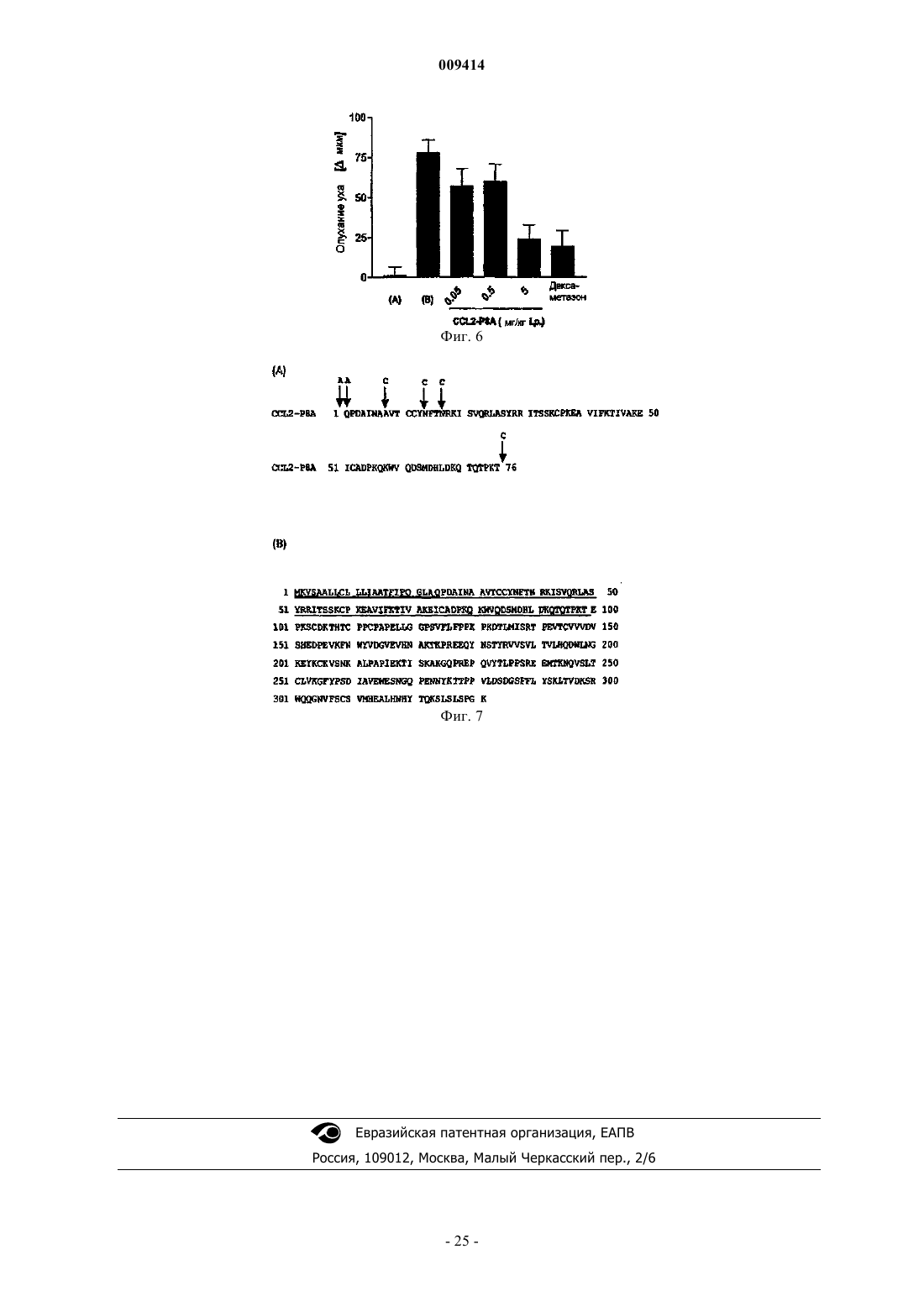
Терапевтические применения вариантов хемокинов
Формула / Реферат
1. Применение полипептида, содержащего SEQ ID NO:2, для изготовления лекарственного средства для лечения аутоиммунных, воспалительных или инфекционных заболеваний.
2. Применение по п.1, где этот полипептид дополнительно содержит изолейцин в положении 64 SEQ ID NO:2 и таким образом содержит SEQ ID NO:4.
3. Применение по п.1 или 2, дополнительно отличающееся тем, что указанный полипептид не содержит мутацию в положении 9, 10 или 13 в соответствующей последовательности SEQ ID NO:2 и SEQ ID NO:4.
4. Применение по п.1 или 2, дополнительно отличающееся тем, что указанный полипептид содержит в соответствующей последовательности SEQ ID NO:2 и SEQ ID NO:4:
a) цистеин в положении 8, 14, 17 или 77 или
b) аланин или глицин в положении 1.
5. Применение по любому из пп.1-4, где указанный полипептид содержит константную область тяжелой цепи иммуноглобулина человека.
6. Применение по п.1 или 2, где указанное заболевание выбрано из группы, состоящей из артрита, ревматоидного артрита (RA), псориатического артрита, остеоартрита, системной красной волчанки (SLE), системного склероза, склеродермии, полимиозита, гломерулонефрита, фиброза, аллергических заболеваний или заболеваний, связанных с повышенной чувствительностью, дерматита, астмы, хронической обструктивной болезни легких (COPD), воспалительного заболевания пищеварительного тракта (IBD), болезней Крона, язвенного колита, рассеянного склероза, рака, септического шока, вирусных или ВИЧ-инфекций, трансплантации, воспаления дыхательных путей, реакции трансплантат против хозяина (GVHD) и атеросклероза.
7. Применение по п.6, где заболеванием является рассеянный склероз.
8. Слитый полипептид, образованный аминокислотной последовательностью SEQ ID NO:2 и константной областью тяжелой цепи иммуноглобулина человека, причем слитый полипептид имеет последовательность, идентифицированную как SEQ ID NO:5.
9. Последовательность нуклеиновой кислоты, кодирующая слитый полипептид SEQ ID NO:5.
10. Способ получения слитого полипептида по п.8, включающий:
a) клонирование последовательности нуклеиновой кислоты, кодирующей зрелый CCL2-P8A, в экспрессирующий вектор, слитый с последовательностью нуклеиновой кислоты, кодирующей сигнальную последовательность CCL2 человека, на его 5'-конце и последовательностью нуклеиновой кислоты, кодирующей константную область (сегмент 243-474) тяжелой цепи иммуноглобулина лямбда человека IgG1, на его 3'-конце;
b) трансформацию клеточной линии СНО или HEK293 полученным вектором;
c) отбор клонов, стабильно экспрессирующих и секретирующих рекомбинантный слитый белок, имеющий CCL2-P8A на N-конце и последовательность IgG1 на С-конце;
d) очистку этого слитого белка из культуральной среды.
11. Способы скрининга на облигатные мономерные варианты-антагонисты хемокинов, предусматривающие:
a) получение моносайтовых мутаций в CCL2, которые блокируют его способность димеризоваться;
b) идентификацию указанных вариантов, которые связываются с рецептором и обнаруживают агонистические свойства in vitro;
c) идентификацию указанных вариантов из группы, идентифицированной в (b) выше, которые дополнительно характеризуются как ингибирующие рекрутинг перитонеальных клеток.
Текст
009414 Область техники, к которой относится изобретение Данное изобретение относится к новым терапевтическим применениям вариантов хемокинов и, в частности, вариантов CCL2 человека. Уровень техники Хемокины являются небольшими, секретируемыми провоспалительными белками, которые опосредуют направленную миграцию лейкоцитов из крови к месту повреждения. В зависимости от положения консервативных цистеинов, характеризующих это семейство белков, семейство хемокинов может быть подразделено структурно на С, С-С, С-Х-С и С-Х 3-С-хемокины, которые связываются с рядом мембранных рецепторов (Baggiolini M. et al., 1997; Fernandes E.J. and Lolis E., 2002). Эти мембранные рецепторы, все являющиеся гептаспиральными G-белок-связанными рецепторами,позволяют хемокинам проявлять их биологическую активность на клетках-мишенях, которые могут представлять специфические комбинации рецепторов в соответствии с их состоянием и/или типом. Физиологические эффекты хемокинов происходят из комплексной и интегрированной системы одновременных взаимодействий: эти рецепторы часто имеют перекрывающуюся лигандную специфичность, так что единственный рецептор может связывать различные хемокины, а также единственный хемокин может связываться с различными рецепторами. Обычно хемокины продуцируются в месте повреждения и вызывают миграцию и активацию лейкоцитов, играя фундаментальную роль в воспалительных, иммунных, гомеостатических, гемопоэтических и ангиогенных процессах. Даже при наличии потенциальных недостатков в использовании хемокинов в качестве терапевтических агентов (тенденции агрегироваться и разнородного связывания, в частности) эти молекулы считаются хорошими кандидатами-мишенями для терапевтического вмешательства в заболевания, ассоциированные с такими процессами, посредством ингибирования специфических хемокинов и их рецепторов с целью предотвращения избыточного рекрутинга и избыточной активации лейкоцитов (Baggiolini М., 2001; Loetscher Р. and Clark-Lewis I., 2001; Godessart N. and Kunkel S.L., 2001). Исследование взаимосвязи структура-активность указывает на то, что хемокины имеют два главных сайта взаимодействия с их рецепторами, гибкий аминоконцевой район и конформационно жесткую петлю, которая следует за вторым цистеином. Считается, что хемокины стыкуются на рецепторах посредством района петли, и считается, что этот контакт облегчает связывание аминоконцевого района, которое приводит к активации рецептора. Эта важность аминоконцевого района была продемонстрирована также испытанием природных и синтетических хемокинов, в которых этот домен является модифицированным или укороченным. Этот процессинг после протеолитического расщепления, мутагенеза или химической модификации аминокислот, может либо активировать, либо делать эти молекулы неактивными с образованием соединений с агонистической и/или антагонистической активностью. Таким образом, хемокины со специфическими модификациями в аминоконцевом районе имеют терапевтический потенциал в отношении воспалительных и аутоиммунных заболеваний (Schwarz and Wells, 1999).CCL2, также известный как моноцитарный хемоаттрактантный белок 1 (MCP-1) или моноцитарный хемотаксический и активирующий фактор (MCAF), был идентифицирован как имеющий центральную роль в воспалении, будучи способным стимулировать рекрутинг моноцитов и лимфоцитов в ответ на сигналы повреждения и инфекции в различных воспалительных заболеваниях, различных типах опухолей, аллотрансплантате сердца, СПИДе и туберкулезе (Yoshimura T. et al., 1989; Gu L. et al., 1999). Физиологические активности, ассоциированные с CCL2, интенсивно исследовались с использованием трансгенных животных, что позволило продемонстрировать, что этот хемокин контролирует не только рекрутинг моноцитов в моделях воспаления, но также экспрессию цитокинов, связанных с Тхелперными реакциями и инициацией атеросклероза (Gu L. et al., 2000; Gosling J. et al., 1999; Lu В. et al.,1998). Структурно CCL2 состоит из N-концевой петли и -складки, на которую наложена -спираль на Сконцевой стороне, и образует гомодимеры, даже хотя он детектируется в виде мономера в специфических экспериментальных условиях (Handel T. et al., 1996; Kim K.S. et al., 1996; Lubkowski J. et al., 1997). Что касается многих других хемокинов, литература обеспечивает много примеров исследований структура-активность, в которых были созданы мутанты CCL2 экспрессией N-терминально укороченных или замещенных в единственном сайте вариантов для оценки роли делетированных или замененных аминокислот в CCL2-ассоциированных активностях связывания и других свойствах (Gong J. and Clark-Lewus I.,1995; Zhang Y. et al., 1996; Steitz S.A. et al., 1998; Gu L. et al., 1999; Hemmerich S. et al., 1999; Seet В.Т. etal., 2001). В частности, изучалась роль димеризации в связывании и активации рецептора CCL2, и было показано, что различные мутации в концевом районе, препятствующие димеризации, могут изменять некоторые активности CCL2, такие как аффинность связывания рецептора, стимуляция хемотаксиса, ингибирование аденилатциклазы и стимуляцию вхождения кальция (Paavola С. et al., 1998). Хотя один мутант,описанный Paavola, называемый здесь Р 8 А, не димеризуется, но сохраняет исходную силу и эффективность, было показано, что другой облигатный мутант, описанный Paavola, называемый здесь Y13A,имеет в 100 раз более слабую аффинность связывания in vitro, чтобы быть гораздо менее сильным ингибитором аденилатциклазы и стимулятором вхождения кальция in vitro, и не способным стимулировать-1 009414 хемотаксис в культуре клеток. Подобно Y13A, мутант [1+9-76]МСР-1 (мутант CCL2, лишенный остатков 2-8) является антагонистом активностей CCL2 in vitro. Связывающие свойства мутанта CCL2, содержащего замену Р 8 А, также были исследованы в экспериментальной модели, основанной на узнавании вирусного хемокинсвязывающего белка М 3, с демонстрацией эффективного связывания этого вирусного белка с данным мутантом CCL2 (Alexander J.M. et al.,2002). Кроме того, было показано, что мономерные варианты хемокинов, такие как CCL2-P8A, лишены активности in vivo, хотя являются полностью активными и неотличимыми от димерной формы in vitro(Proudfoot A. et al., 2003). Примеры мутантов CCL2, включающих в себя остатки, не влияющие на профиль димеризации полученного белка, уже были описаны в литературе как приводящие к молекулам, имеющим антагонистические свойства в отношении CCL2 (US 5739103, WO 03/84993). Однако в предыдущем уровне техники нет указания на то, что конкретный мутант хемокина и, в частности мутант CCL2, являющийся облигатным мономером вследствие замены единственного сайта (например, включающего в себя пролин), может действовать в качестве антагониста хемокина. Сущность изобретения Неожиданно было обнаружено, что варианты гомодимеробразующих хемокинов, таких как CCL2,имеющие единственную замену аминокислоты в границе димеризации, которая изменяет картину водородных связей таким образом, что образуется облигатный мономер, который связывается с рецептором и имеет агонистические свойства in vitro, может быть антагонистом природных хемокинов и иметь противовоспалительную активность in vivo. Описанные здесь варианты применимы в качестве лекарственного средства. Полипептиды, содержащие SEQ ID NO:2, и полипептиды, содержащие SEQ ID NO:2 с дополнительной мутацией в изолейцин в положении 64 SEQ ID NO:2 (SEQ ID NO:4), применимы в качестве лекарственных средств. Описанные здесь варианты применимы в качестве лекарственных средств для лечения аутоиммунных, воспалительных или инфекционных заболеваний. Полипептиды, содержащие SEQ ID NO:2, и полипептиды, содержащие SEQ ID NO:2 с дополнительной мутацией в изолейцин в положении 64 SEQ IDNO:2 (SEQ ID NO:4), применимы в качестве лекарственных средств для лечения аутоиммунных, воспалительных и инфекционных заболеваний. В одном примере полипептиды, содержащие SEQ ID NO:2, и полипептиды, содержащие SEQ ID NO:2 с дополнительной мутацией в изолейцин в положении 64 SEQID NO:2 (SEQ ID NO:4), применимы в качестве лекарственных средств для лечения рассеянного склероза. Описанные здесь варианты дополнительно применимы для лечения аутоиммунных, воспалительных и инфекционных заболеваний. Такие способы предусматривают введение эффективного количества мономерного варианта данного изобретения, где указанный вариант происходит из по меньшей мере одной аминокислотной замены, которая изменяет картину водородных связей в границе димеризации указанного хемокина. Примерами таких мономерных вариантов, которые могут быть использованы в таких способах, являются: а) полипептид, содержащий SEQ ID NO:2; b) полипептид, содержащий SEQ IDNO:4; с) активный мутант а) или b); d) полипептид, содержащий а), b) или с) и аминокислотную последовательность, принадлежащую белку, другому, чем указанный хемокин; а также соответствующие молекулы в форме их активных фракций, предшественников, солей, производных, комплексов или конъюгатов. Далее, данное изобретение включает в себя фармацевтические композиции, содержащие полипептид, содержащий облигатные мономерные антагонистические варианты хемокина данного изобретения. Далее, данное изобретение включает в себя слитые белки, содержащие облигатный мономерный антагонистический вариант хемокина, описанный здесь, слитый с последовательностью белканехемокина, например, аминокислотную последовательность SEQ ID NO:2, слитую с константной областью тяжелой цепи иммуноглобулина человека (SEQ ID NO:5). Далее, данное изобретение включает в себя способы получения этих слитых белков. Далее, данное изобретение включает в себя способы скрининга на облигатные мономерные антагонистические варианты хемокина, описанные здесь, предусматривающий:a) получение моносайтовых мутаций в CCL2, которые блокируют способность димеризоваться;b) идентификацию указанных вариантов, которые связываются с рецептором и обнаруживают агонистические свойства in vitro; с) идентификацию указанных вариантов из группы, идентифицированной в (b) выше, которые дополнительно характеризуются как ингибирующие рекрутинг перитонеальных клеток. Другие признаки и преимущества данного изобретения будут очевидными из следующего подробного описания. Описание фигур Фиг. 1 - аминокислотные последовательности зрелого CCL2 человека (остатки 24-99 SWISSRROTCCL2-P8A; релевантная мутация Р 8 А напечатана жирным шрифтом и подчеркнута.-2 009414 Фиг. 2 - диаграмма, сравнивающая активность рекрутинга клеток рекомбинантных CCL2 и CCL2P8A человека с базовой линией (фоном) в анализе рекрутинга перитонеальных клеток. Фиг. 3 - диаграмма, показывающая ингибирующую активность доза-ответ CCL2-P8A в анализах рекрутинга перитонеальных клеток с использованием двух различных индукторов: CCL2 (А) или тиогликолата (В); эти результаты сравниваются с базовым уровнем, отрицательным контролем (только носителем, солевым раствором) и положительным контролем, дексаметазоном (Dex; только в В). Фиг. 4 - диаграмма, показывающая ингибирующую активность CCL2-P8A в анализе индуцированного овальбумином воспаления легких; этот результат сравнивается с базовым уровнем и отрицательным контролем (солевым раствором). Фиг. 5 - график, показывающий эффективность CCL2-P8A в уменьшении клинических оценок в модели рассеянного склероза животного, называемой EAE (экспериментальным аутоиммунным энцефаломиелитом), при обнаружении животными либо легкого заболевания с низкой клинической оценкой (не более чем 2; А), либо тяжелого заболевания с высокой клинической оценкой (по меньшей мере 3; В); эти данные сравниваются с данными, наблюдаемыми с использованием только носителя (отрицательным контролем), или с данными положительного контроля для модели ЕАЕ (мышиного интерферона ; количество звездочек на нижней части каждого графика указывает уровень статистической значимости действия, наблюдаемого в сравнении с отрицательным контролем в каждой временной точке ( обозначает р 0,05,обозначает р 0,01 иобозначает р 0,001, как рассчитано однофакторным ANOVA с использованием критерия Фишера). Фиг. 6 - диаграмма, показывающая ингибирующую активность CCL2-P8A при введении в различных дозах в модели воспаления кожи животного (DNFB-индуцированного воспаления на ухе сенсибилизированных мышей); действие CCL2-P8A на объем опухания уха после обработки, и его сравнивают со следующими контролями: животными, не сенсибилизированными, но получавшими обработку в день 5DNFB (А), животным, сенсибилизированным и получавшим DNFB, но обработанным только носителем(В), и животными, обработанными дексаметазоном (Dex; вводимым таким же образом, что и CCL2-P8A). Эти величины измеряли в день 6 (день после обработки и введения DNFB). Фиг. 7 - альтернативные формы CCL2-P8A, которые могут быть генерированы добавлением и/или заменой одной аминокислоты/множественных аминокислот (А) или слиянием с остатками 243-474 тяжелой цепи иммуноглобулиначеловека IgGl (В; сигнальная последовательность CCL2 подчеркнута двойной линией, зрелый CCL2-P8A подчеркнут). Подробное описание изобретения В связи с вышеупомянутыми данными в предыдущем уровне техники, не было указания на то, что вариант CCL2, происходящий из по меньшей мере единственной аминокислотной замены в границе димеризации, которая изменяет картину водородных связей таким образом, что приводит к связыванию облигатного мономера с рецептором и наличию агонистических свойств in vitro, может быть антагонистом CCL2 in vivo и обычно может ингибировать рекрутинг клеток и/или воспалительные реакции. Единственная замена аминокислоты находится предпочтительно в положении 8 в зрелом CCL2 человека и, в частности, она состоит в замене пролина в положении 8 аланином. Эти варианты не содержат дополнительной мутации в положении, соответствующем положениям 9, 10 или 13 зрелого CCL2 человека. Примером вышеописанных замен является мономерный вариант зрелой формы CCL2, называемыйCCL2-P8A, который может быть экспрессирован либо в виде включающего единственную замену пролина в положении 8 аланином (SEQ ID NO:2), либо в виде включающего дополнительную замену (улучшающую экспрессию этого белка) метионина 64 на изолейцин (SEQ ID NO:4). Замена пролина 8 на аланин (аминокислоту, имеющую отличающуюся ориентацию химической группы, возможно, образующей водородные связи) генерирует вариант CCL2, действующий в качестве облигатного мономера. CCL2P8A и CCL2-P8A могут рассматриваться как молекулы, имеющие эквивалентную активность. Фармацевтические применения, способы и композиции, которые могут затем ожидаться для этих специфических облигатных мономерных вариантов CCL2, называемых CCL2-P8A и CCL2-P8A, могут ожидаться также для любого другого облигатного мономерного варианта CCL2 или других хемокинов,которые являются природно активными в качестве димеров, которые генерируют таким же образом. Эти мутанты должны предоставлять антагонистические и ингибиторные свойства, сходные со свойствамиCCL2-P8A и CCL2-P8A, против природного хемокина, и, следовательно, они должны иметь применимость в медицине. Одним аспектом данного изобретения является применение облигатного мономерного варианта гомодимеробразующего хемокина, например, CCL2, который, как известно, является терапевтической мишенью для различных заболеваний, таких как аутоиммунные, воспалительные или инфекционные заболевания. Такие варианты происходят по меньшей мере из одной аминокислотной замены, которая изменяет картину водородных связей на границе димеризации указанного хемокина таким образом, что приводит к облигатному мономеру, который связывается с рецептором и имеет агонистические свойства invitro и антагонистические свойства in vivo, в качестве активного ингредиента в фармацевтической ком-3 009414 позиции, в частности, для лечения или предупреждения аутоиммунных, воспалительных или инфекционных заболеваний. Эти антагонистические свойства in vivo могут становиться очевидными в анализах,позволяющих оценивать такие свойства, такие как рекрутинг эффекторных клеток в брюшной полости после индукции воспалительной молекулой (хемокином, таким как сам CCL2, тиогликолатом или овальбумином). Этот облигатный мономерный вариант может происходить из единственной аминокислотной замены в границе димеризации, которая изменяет картину водородных связей. Более конкретно, поскольку хорошо известно, что пролин является аминокислотой, которая является особенно важной для установления стереоспецифических водородных связей, участвующих в образовании белковых комплексов, таких как гомодимеры, эта единственная аминокислотная замена должна быть заменой пролина аминокислотой, не являющейся пролином. Альтернативно, единственная аминокислотная замена должна быть заменой аминокислоты, не являющейся пролином, пролином, так что стереоспецифичность водородных связей становится измененной. Альтернативные формы мономерных вариантов гомодимеробразующих хемокинов, определенные выше, которые могут быть использованы в качестве активных ингредиентов в фармацевтических композициях, включают в себя:b) полипептид, содержащий указанный вариант или указанный активный мутант, и аминокислотную последовательность, принадлежащую последовательности белка, другого, чем указанный хемокин. Термин активный означает, что такие альтернативные соединения должны сохранять функциональные признаки мутантов CCL2 данного изобретения, т.е. должны быть антагонистами CCL2 in vivo и ингибировать рекрутинг клеток и/или воспалительные реакции. Облигатные мономерные антагонисты хемокина, определенные здесь, в качестве активного соединения в соответствии с данным изобретением, могут быть в форме их активных фракций, предшественников, солей, производных, комплексов или конъюгатов. Эти альтернативные соединения должны рассматриваться как молекулы с изменениями относительно последовательности мономерных вариантов гомодимеробразующих хемокинов, которые не влияют на основные описанные здесь характеристики. Например, был генерирован CCL2-P8A на основе мутанта CCL2 (CCL2-M64I или CCL2), который сохраняет нормальные активности CCL2, но имеет улучшенные свойства в отношении рекомбинантной экспрессии. Антагонистические свойства мономерных вариантов гомодимеробразующих хемокинов, определенных выше, и приведенных здесь в качестве примеров, с использованием CCL2-P8A в качестве антагониста CCL2, могут быть сохранены или даже усилены в этих активных мутантах. Эта категория молекул включает в себя природные или синтетические аналоги указанной последовательности, где один или несколько аминокислотных остатков были добавлены, делетированы или заменены, при условии, что они проявляют ту же самую биологическую активность, охарактеризованную в данном изобретении, в сравнимых или более высоких уровнях, как определено способами, известными в данной области и описанными в примерах ниже. Предполагается, что природные аналоги являются соответствующими последовательностями белков-хемокинов человека, идентифицированных в других организмах, подобных мышиному CCL2(SWISSPROT Acc.Р 10148). Предполагается, что искусственные аналоги мономерных вариантов гомодимеробразующих хемокинов являются полипептидами, полученными известным химическим синтезом и/или способами сайт-направленного мутагенеза, комбинаторными технологиями на уровне кодирующей последовательности ДНК (такими как перетасовка ДНК, фаговый дисплей/отбор), исследованиями конструирования с использованием компьютера или любым другим известным подходящим способом, которые обеспечивают имеющий предел набор по существу соответствующих мутированных или укороченных пептидов или полипептидов, которые могут быть получены рутинным образом и тестированы специалистом с обычной квалификацией в данной области с использованием описаний, представленных в предыдущем уровне техники и в примерах ниже. Например, конкретные искусственные мутанты могут иметь одну или несколько аминокислот, замененных в других положениях CCL2, в отношении которых обнаружено, что они являются релевантными для генерирования антагонистов CCL2 (WO 03/84993). В соответствии с данным изобретением предпочтительными изменениями в активных мутантах являются замены, обычно называемые "консервативными" или "безопасными" заменами, и они включают в себя неосновные остатки. Консервативными аминокислотными заменами являются замены аминокислотами, имеющими достаточно сходные химические свойства, для сохранения структуры и биологической функции данной молекулы. Ясно, что инсерции и делеции аминокислот могут быть также произведены в определенных выше последовательностях без изменения их функции, в частности, если эти инсерции или делеции включают в себя небольшое количество аминокислот, например, менее десяти и предпочтительно менее трех, и не удаляют или не заменяют аминокислот, которые являются решающими для функциональной конформации белка или пептида. В литературе обеспечены многие модели, на которых отбор консервативных аминокислотных замен-4 009414 может выполняться на основе статистических и физико-химических исследований на последовательности и/или структуре природного белка (Rogov S.I. and Nekrasov A.N., 2001). Эксперименты по конструированию белков показали, что использование специфических субпопуляций аминокислот может давать способные к укладке и активные белки, способствуя классификации аминокислотных синонимических замен, которые могут более легко вмещаться в структуру белка и которые могут быть использованы для детектирования функциональных и структурных гомологов и паралогов (Murphy L.R. et al., 2000). Синонимические аминокислотные группы и более предпочтительные синонимические группы определены в табл. I. Например, замена метионина 64 изолейцином, общая для CD и CCL2-P8A, была выбрана с использованием сходных критериев. Дополнительной группой активных мутантов мономерных вариантов гомодимеробразующих хемокинов, определенных выше, являются пептидные миметики (также называемые пептидомиметиками), в которых природа пептида или полипептида была химически модифицирована на уровне боковых цепей аминокислот, хиральности аминокислот и/или пептидного скелета молекулы. Эти изменения предназначены для обеспечения мономерных вариантов гомодимеробразующих хемокинов, имеющих сходные или улучшенные свойства в отношении получения, эффективности и/или фармакокинетических признаков. Например, когда пептид является чувствительным к расщеплению пептидазами, после инъекции в субъекта это является проблемой, и замена особенно чувствительной пептидной связи нерасщепляемым пептидным миметиком может обеспечивать пептид, более стабильный и, следовательно, более применимый в качестве терапевтического средства. Подобным образом, замена L-аминокислотного остатка является стандартным путем превращения этого пептида в пептид, менее чувствительный к протеолизу, и,наконец, более сходный с органическими соединениями, иными, чем пептиды. Применимы также аминоконцевые блокирующие группы, такие как трет-бутоксикарбонил, ацетил, теил, сукцинил, метоксисукцинил, суберил, адипил, азелаил, дансил, бензилоксикарбонил, флуоренилметоксикарбонил, метоксиазелаил, метоксиадипил, метоксисуберил и 2,4-динитрофенил. Многие другие модификации, обеспечивающие увеличенную эффективность, пролонгированную активность, легкость очистки и/или увеличенный полупериод существования в организме, известны в данной области (WO 02/10195; Villian M. et al.,2001). Предпочтительными альтернативными синонимическими группами для аминокислот, включенных в пептидные миметики, являются группы, представленные в табл. II. Неисчерпывающий перечень аминокислотных производных включает в себя также аминоизомасляную кислоту (Aib), гидроксипролин(Hyp), 1,2,3,4-тетрагидроизохинолин-3-COOH, индолин-2-карбоновую кислоту, 4-дифторпролин, Lтиазолидин-4-карбоновую кислоту, L-гомопролин, 3,4-дегидропролин, 3,4-дигидроксифенилаланин,циклогексилглицин и фенилглицин. Под аминокислотным производным имеют в виду аминокислоту или подобную аминокислоте химическую частицу, другую, чем одна из 20 генетически кодируемых природно встречающихся аминокислот. В частности, аминокислотное производное может содержать замещенные или незамещенные алкильные части, которые могут быть линейными, разветвленными или циклическими и могут включать в себя один или несколько гетероатомов. Амиинокислотные производные могут быть получены de novo или получены из коммерческих источников (Calbiochem-Novabiochem AG, Switzerland; Bachem, USA). Способы синтеза и развития пептидных миметиков, а также непептидных миметиков хорошо известны в данной области (Hruby V.J. and Balse P.M., 2000; Golebiowsky A. et al., 2001). Разнообразные методологии для включения неприродных аминокислот в белки с использованием систем трансляции какin vitro, так и in vivo, для зондирования и/или улучшения структуры и функции белков также описаны в литературе (Dougherty DA, 2000). Данное изобретение описывает применение мономерных вариантов гомодимеробразующих хемокинов и их активных мутантов в качестве активных ингредиентов в фармацевтических композициях, а также белков, содержащих их аминокислотную последовательность и аминокислотную последовательность, принадлежащую последовательности белка, другого, чем указанный хемокин. Эта гетерологичная последняя последовательность должна обеспечивать дополнительные свойства без ухудшения фармацевтической применимости. Примерами таких дополнительных свойств являются более легкая процедура очистки, более длительный полупериод существования в жидкостях тела или внеклеточная локализация. Этот последний признак является особенно важным для определения конкретной группы слияния или химерных белков, включенных в приведенное выше определение, так как он позволяет этим мономерным вариантам быть локализованными в пространстве, где не только облегчается выделение и очистка этих пептидов, но также где CCL2 природным образом взаимодействует с другими молекулами. Конструирование этих частей молекул, лигандов и линкеров, а также способы и стратегии для конструирования, очистки, детектирования и применения слитых белков широко обсуждаются в литературе(Nilsson J. et al., 1997; "Application of chimeric genes and hybrid proteins" Methods Enzymol. Vol. 326-328,Academic Press, 2000; WO 01/77137). Дополнительными белковыми последовательностями, которые могут быть использованы для генерирования альтернативных форм этих облигатных мономерных вариантов гомодимеробразующих хемокинов, определенных выше, являются последовательности внеклеточных доменов мембраносвязанного белка, константная область (Fc-район) иммуноглобулина, домены-5 009414 мультимеризации, внеклеточные белки, содержащие сигнальный пептид белки, содержащие сигнал экспорта белки. Выбор одной или нескольких из этих последовательностей, которые должны быть слиты с мономерным вариантом, является функциональным для конкретного применения указанного агента. Когда дополнительная белковая последовательность, как в случае последовательности внеклеточных содержащих сигнал экспорта или сигнальный пептид белков, позволяет мономерному варианту секретироваться во внеклеточное пространство, этот агент может быть более легко выбран и очищен от культивируемых клеток в связи с дополнительным процессингом, или, альтернативно, эти клетки могут быть непосредственно использованы или введены. Облигатные мономерные варианты гомодимеробразующих хемокинов, определенных выше, могут быть также использованы в других предпочтительных формах, например в виде активных фракций,предшественников, солей, производных, конъюгатов или комплексов. Термин "фракция" относится к любому фрагменту полипептидной цепи самого соединения, отдельно или в комбинации с родственными молекулами или остатками, присоединенными к нему, например остатками сахаров или фосфатов, или агрегатам исходного полипептида или пептида. Такие молекулы могут происходить также из других модификаций, которые обычно не изменяют первичную последовательность, например, из in vivo или in vitro химической дериватизации пептидов (ацетилирования или карбоксилирования), пептидов, полученных модификацией распределения фосфорилирования (введения остатков фосфотирозина, фосфосерина или фосфотреонина) или гликозилирования (подверганием этого пептида действию ферментов, которые выполняют гликозилирование, например ферментов гликозилирования или дегликозилирования млекопитающих) пептидов во время их синтеза и процессинга или в дополнительных стадиях процессинга."Предшественниками" являются соединения, которые могут быть превращены в соединения данного изобретения метаболическим и ферментативным процессингом до или после введения в клетки или в тело. Термин "соли" относится здесь как к солям карбоксильных групп, так и к кислотно-аддитивным солям аминогрупп пептидов, полипептидов или их аналогов данного изобретения. Соли карбоксильной группы могут быть образованы способами, известными в данной области, и включают в себя неорганические соли, например, соли натрия, кальция, аммония, железа (III) или цинка и т.п., и соли с органическими основаниями, такие как образуемые, например, с аминами, такими как триэтаноламин, аргинин или лизин, пиперидин, прокаин и т.п. Кислотно-аддитивные соли включают в себя, например, соли с минеральными кислотами, такими как, например, хлористо-водородная кислота или серная: кислота, и соли с органическими кислотами, такими как, например, уксусная кислота или щавелевая кислота. Любая из таких солей должна иметь, по существу, сходную активность с активностью пептидов и полипептидов данного изобретения или их аналогов. Термин "производные" относится в данном контексте к производным, которые могут быть получены из функциональных групп, присутствующих на боковых цепях аминокислотных частей молекул или на N- или С-концевых группах, в соответствии с известными способами. Такие производные включают в себя, например, сложные эфиры или алифатические амиды карбоксильных групп и N-ацилпроизводные свободных аминогрупп или O-ацилпроизводные свободных гидроксильных групп и образованы с ацильными группами, такими как, например, алканоильные или ароильные группы. Применимые конъюгаты или комплексы облигатных мономерных вариантов гомодимеробразующих хемокинов, определенных выше, могут быть получены с использованием молекул и способов, известных в области взаимодействия рецептора или других белков (радиоактивных или флуоресцентных меток, биотина), терапевтической эффективности (цитотоксических агентов), или улучшения этих агентов в отношении эффективности доставки лекарственных средств, таких как полиэтиленгликоль или другие природные или синтетические полимеры (Harris J.M. and Chess R.B., 2003; Greenwald R.B. et al.,2003; Pillai O. and Panchagnula R., 2001). Остатки могут быть использованы для присоединения, при условии, что они имеют боковую цепь, подходящую для присоединения полимера (т.е. боковую цепь аминокислоты, несущую функциональную группу, например, лизина, аспарагиновой кислоты, глутаминовой кислоты, цистеина, гистидина и т.д.). Альтернативно, остаток в таких сайтах может быть заменен другой аминокислотой, имеющей боковую цепь, подходящую для присоединения полимера. Боковые цепи генетически кодируемых аминокислот могут быть также химически модифицированы для присоединения полимера или может быть использована неприродная аминокислота с подходящими функциональными группами боковой цепи. Присоединение полимера может иметь место не только к боковой цепи аминокислоты, природно встречающейся в конкретном положении этого антагониста, или к боковой цепи природной или неприродной аминокислоты, которая заменяет аминокислоту, природно встречающуюся в конкретном положении этого антагониста, но также к углеводу или другой части молекулы, которая присоединена к этой боковой цепи аминокислоты в положении-мишени. Полимеры, подходящие для этих целей, являются биосовместимыми, а именно, они являются нетоксичными в отношении биологических систем, и многие такие полимеры являются известными. Такие полимеры могут быть гидрофобными или гидрофильными по их природе, биодеградируемыми, небиодеградируемыми или их комбинацией. Эти полимеры включают в себя природные полимеры (такие как-6 009414 коллаген, желатин, целлюлоза, гиалуроновая кислота), а также синтетическими полимерами (такими как полиэфиры, полиортоэфиры, полиангидриды). Примеры гидрофобных недеградируемых полимеров включают в себя полидиметилсилоксаны, полиуретаны, политетрафторэтилены, полиэтилены, поливинилхлориды и полиметилметакрилаты. Примеры гидрофильных недеградируемых полимеров включают в себя поли(2-гидроксиэтилметакрилат), поливиниловый спирт, поли(N-винилпирролидон), полиалкилены, полиакриламид и их сополимеры. Предпочтительные полимеры содержат в виде последовательного повторяющегося элементарного звена этиленоксид, например полиэтиленгликоль (ПЭГ). Предпочтительный способ присоединения использует комбинацию пептидного синтеза и химического лигирования. Предпочтительно присоединение водорастворимого полимера будет происходить через биодеградируемый линкер, особенно в амино-концевом районе белка. Такая модификация действует, обеспечивая этот белок в форме предшественника (или "пролекарства"), которая после деградации этого линкера высвобождает белок без модификации полимером. В качестве обычной процедуры облигатные мономерные варианты гомодимеробразующих хемокинов, определенных выше, могут быть получены любой процедурой, известной в данной области, в том числе технологиями, связанными с рекомбинантной ДНК, и технологиями химического синтеза. Многие книги и обзоры обеспечивают описания, каким образом можно клонировать и получать рекомбинантные белки с использованием векторов и прокариотических (например, Е. coli) или эукариотических клеток-хозяев (см., например, некоторые названия в серии "A Practical Approach" published by Oxford University Press ("DNA Cloning 2: Expression Systems", 1995; "DNA Cloning 4: Mammaliaf Systems",1996; "Protein Expression", 1999; "Protein Purification Techniques", 2001). Другим вариантом осуществления в соответствии с данным изобретением является последовательность нуклеиновой кислоты, кодирующая облигатный мономерный вариант-антагонист хемокина, описанный здесь. ДНК-последовательность, кодирующая облигатные мономерные варианты гомодимеробразующих хемокинов, может быть выделена и лигирована в подходящие эписомные или неэписомные/гомологично интегрирующиеся векторы, которые могут быть введены в подходящие клетки-хозяева любым подходящим способом (трансформацией, трансфекцией, конъюгацией, слиянием протопластов, электропорацией, преципитацией фосфатом кальция, прямой микроинъекцией и т.д.) для их трансформации. Важные факторы в выборе конкретных плазмиды или вирусного вектора включают в себя: легкость, с которой реципиентные клетки, которые содержат этот вектор, могут быть распознаны и отобраны из реципиентных клеток, которые не содержат этого вектора; количество копий вектора, которые являются желательными в конкретном хозяине; и решение, является ли желательным, чтобы этот вектор был "челночным" вектором между клетками-хозяевами разных видов. Векторы должны делать возможной экспрессию выделенного или слитого белка, в том числе антагониста данного изобретения, в прокариотической или эукариотической клетке-хозяине под контролем регуляторных последовательностей инициации/терминации транскрипции, которые выбраны таким образом, чтобы они были конститутивно активными или индуцируемыми в указанной клетке. Затем клеточная линия, существенно обогащенная такими клетками, может быть выделена с получением стабильной клеточной линии. Для эукариотических хозяев (например, дрожжей, клеток насекомых или млекопитающих) могут быть использованы различные регуляторные последовательности транскрипции и трансляции. Они могут быть получены из вирусных источников, таких как аденовирус, бычий папилломавирус, вирус обезьян или т.п., где эти регуляторные сигналы ассоциированы с конкретным геном, который имеет высокий уровень экспрессии. Примерами являются промотор ТК герпесвируса, ранний промотор SV40, промотор гена ga14 дрожжей и т.д. Могут быть выбраны регуляторные сигналы транскрипции, которые делают возможными репрессию и активацию, так что экспрессия генов может модулироваться. Клетки, которые были стабильно трансформированы введенной ДНК, могут быть отобраны также введением одного или нескольких маркеров, которые делают возможным отбор клеток-хозяев, которые содержат этот экспрессирующий вектор. Этот маркер может также обеспечивать фототрофию ауксотрофному хозяину, устойчивость к биоцидам, например, антибиотикам, или тяжелым металлам, таким как медь, или т.п. Ген селектируемого маркера может быть либо непосредственно связан с последовательностями ДНК гена, который должен быть экспрессирован, либо введен в ту же самую клетку котрансфекцией. Для оптимального синтеза этих белков могут быть также необходимы дополнительные элементы. Клетки-хозяева могут быть прокариотическими или эукариотическими. Предпочтительными являются эукариотические хозяева, например клетки млекопитающих, такие как клетки человека, обезьяны,мыши и яичника китайского хомячка (CHO), так как они обеспечивают посттрансляционную модификацию белковых молекул, включающую в себя правильный фолдинг или гликозилирование в правильных сайтах. Дрожжевые клетки также могут проводить посттрансляционные модификации пептидов, в том числе гликозилирование. Существует ряд стратегий рекомбинантных ДНК, которые используют сильные промоторные последовательности и высокое число копий плазмид, которые могут быть использованы для получения желаемых белков в дрожжах. Дрожжи узнают лидерные последовательности в клонированных продуктах генов млекопитающих и секретируют пептиды, несущие лидерные последовательно-7 009414 сти (т.е. препептиды). Для долгосрочного высокопроизводительного получения рекомбинантного полипептида предпочтительной является стабильная экспрессия. Например, клеточные линии, которые стабильно экспрессируют представляющий интерес полипептид, могут быть трансформированы с использованием экспрессирующих векторов, которые могут содержать вирусные сайты инициации репликации и/или эндогенные элементы экспрессии и ген селектируемого маркера на одном и том же или на отдельном векторе. После введения этого вектора клеткам можно позволить расти в течение 1-2 дней в обогащенной среде перед переключением их на селективную среду. Целью селектируемого маркера является придание устойчивости к отбору, и его присутствие делает возможным рост и извлечение клеток, которые успешно экспрессируют введенные последовательности. Резистентные клоны стабильно трансформированных клеток могут быть пролиферированы с использованием способов культуры ткани, подходящих для данного типа клеток. Затем может быть выделена клеточная линия, существенно обогащенная такими клетками, для получения стабильной клеточной линии. Клетки млекопитающих, доступные в качестве хозяев для экспрессии, известны в данной области и включают в себя многие иммортализованные клеточные линии, доступные из Американской Коллекции Типовых Культур (АТСС), в том числе, но не только, клетки яичника китайского хомячка (CHO), HeLa,почки детеныша хомячка (ВНК), клетки обезьяны (COS), C127, 3 Т 3, ВНК, НЕК 293, меланомы Bowes и печеночно-клеточного рака человека (например, Hep G2) и ряд других клеточных линий. В бакуловирусной системе материалы для систем экспрессии бакуловирус/клетки насекомых являются коммерчески доступными в форме набора из inter alia, "МахВас" (Invitrogen). Примерами технологий химического синтеза являются твердофазный синтез и жидкофазный синтез. В качестве твердофазного синтеза, например, аминокислоту, соответствующую С-концу пептида,который должен быть синтезирован, связывают с носителем, который является нерастворимым в органических растворителях, и посредством чередующегося повторения реакций, одной реакции, в которой аминокислоты с их аминогруппами и функциональными группами боковых цепей, защищенными подходящими защитными группами, конденсируют одну за другой от С-конца к N-концу, и одной реакции, в которой аминокислоты, связанные с этой смолой, или защитную группу аминогрупп этих пептидов высвобождают, пептидную цепь, следовательно, удлиняют таким образом. Способы твердофазного синтеза классифицируют в значительной степени по tBoc-способу и Fmoc-способу в зависимости от типа используемых защитных групп. Обычно используемые защитные группы включают в себя tBoc (третбутоксикарбонил), Cl-Z (2-хлорбензилоксикарбонил), Br-Z (2-бромбензилоксикарбонил), Bzl (бензил),Fmoc (9-флуоренилметоксикарбонил), Mbh (4,4'-диметоксидибензилгидрил), Mtr (4-метокси-2,3,6 триметилбензолсульфонил), Trt (тритил), Tos (тозил), Z (бензилоксикарбонил) и C12-Bzl (2,6 дихлорбензил) для аминогрупп; NO2 (нитро) и Pmc (2,2,5,7,8-пентаметилхроман-6-сульфонил) для гуанидиногрупп); и tBu (трет-бутил) для гидроксильных групп). После синтеза желаемого пептида его подвергают реакции удаления защитных групп и отрезают от твердого носителя. Такая реакция отрезания пептида может проводиться фторидом водорода или трифторметансульфоновой кислотой для Восспособа и ТФУ для Fmoc-способа. Полностью синтетические белки CCL2 описаны в литературе (BrownA. et al., 1996). Очистку синтетических или рекомбинантных мономерных вариантов гомодимеробразующих хемокинов, определенных выше, проводят любым из способов, известных для этой цели, т.е. любой общепринятой процедурой, включающей в себя экстракцию, осаждение, хроматографию, электрофорез или т.п. Дополнительной процедурой очистки, которая может быть использована предпочтительно для очистки белка данного изобретения, является аффинная хроматография с использованием моноклональных антител или аффинных групп, которые связывают белок-мишень и продуцируются и иммобилизуются на гелевом матриксе, содержащемся в колонке. Неочищенные препараты, содержащие эти белки, пропускают через эту колонку. Белок будет связываться с колонкой посредством гепарина или специфическим антителом, тогда как примеси будут проходить через колонку. После промывки этот белок элюируют из геля изменением pH или ионной силы. Альтернативно, может быть использована ВЖХ (высокоэффективная жидкостная хроматография). Элюция может проводиться с использованием растворителя на основе воды-ацетонитрила, обычно используемого для очистки белков. Мономерный вариант гомодимеробразующего хемокина может быть использован в фармацевтической композиции для лечения или предупреждения аутоиммунных, воспалительных или инфекционных заболеваний. В частности, результаты, обеспеченные в примерах, рассматривающих модель рассеянного склероза животного, показывают, что эти мономерные варианты могут быть использованы в фармацевтической композиции для лечения или предупреждения рассеянного склероза. Другим аспектом данного изобретения является мономерный вариант гомодимеробразующего хемокина, где указанный вариант происходит по меньшей мере из одной аминокислотной замены, которая изменяет картину водородных связей в границе димеризации указанного хемокина, используемый в качестве лекарственного средства. Примеры таких вариантов описаны здесь в виде CCL2-P8A и CCL2P8A. Однако описание данного изобретения делает возможными идентификацию, получение и испыта-8 009414 ние сходных молекул на основе этой последовательности и активностей других хемокинов. В частности, эти мономерные варианты могут быть выбраны изd) полипептида, содержащего (а), (b) или (с) и аминокислотную последовательность, принадлежащую последовательности белка, иного, чем указанный хемокин; а также соответствующих мономерных вариантов в форме их активных фракций, предшественников, солей, производных, комплексов или конъюгатов. Другим аспектом данного изобретения является фармацевтическая композиция, содержащая мономерный вариант гомодимеробразующего хемокина в качестве активного ингредиента, где указанный вариант происходит по меньшей мере из одной аминокислотной замены, которая изменяет картину водородных связей в границе димеризации указанного хемокина, такого как CCL2-P8A или CCL2-Р 8 А,необязательно в формах, определенных выше (таких как активные мутанты, содержащие их полипептиды или конъюгаты), а также кодирующую их ДНК или экспрессирующие их клетки. Фармацевтические композиции данного изобретения могут содержать подходящие фармацевтически приемлемые носители, биологически совместимые носители и добавки, которые пригодны для введения животному (например, физиологический солевой раствор), и необязательно содержащие вспомогательные вещества (такие как эксципиенты, стабилизаторы или разбавители), которые облегчают процессинг активных соединений в препаратах, которые могут быть использованы фармацевтически. Эти фармацевтические композиции могут быть приготовлены любым приемлемым способом, соответствующим требованиям способа введения. Например, применение биоматериалов и других полимеров для доставки лекарственных средств, а также различные способы и модели для валидизации конкретного способа введения описаны в литературе (Luo D. and Prestwich G.D., 2001; Cleland J.L. et al., 2001). Термин эффективное количество относится к количеству активных ингредиентов, которое является достаточным для влияния на ход и тяжесть заболевания, приводящего к уменьшению или ремиссии такой патологии. Эффективное количество будет зависеть от способа введения и состояния пациента."Фармацевтически приемлемый" обозначает любой носитель, который не уменьшает эффективность биологической активности активного ингредиента и который не является токсичным для хозяина,которому его вводят. Например, для парентерального введения описанные выше активные ингредиенты могут быть приготовлены в унифицированной дозированной форме для инъекции в носителях, таких как солевой раствор, раствор декстрозы, раствор сывороточного альбумина и раствор Рингера. Носители могут быть выбраны также из крахмала, целлюлозы, талька, глюкозы, лактозы, сахарозы, желатина, солода, риса, муки, мела, силикагеля, стеарата магния, стеарата натрия, моностеарата глицерина, хлорида натрия, сухого обезжиренного молока, глицерина, пропиленгликоля, воды, этанола и различных масел, в том числе масел, происходящих из нефти, растений, или масел синтетического происхождения (арахисового масла, соевого масла, минерального масла, кунжутного масла). Любой приемлемый способ введения может быть использован и определен специалистами с квалификацией в данной области для установления желаемых уровней активных ингредиентов в крови. Например, введение может выполняться различными парентеральными способами, такими как подкожный, внутривенный, интрадермальный, внутримышечный, интраназальный, трансдермальный, пероральный или буквальный способы. Парентеральное введение может быть болюсной инъекцией, постепенной перфузией на протяжении времени или дозированными формами регулируемого высвобождения,в том числе депо-инъекциями, осмотическими насосами и т.п., для пролонгированного введения полипептида при заданной скорости, предпочтительно в унифицированных дозированных формах, подходящих для отдельного введения точных доз. Препараты для парентерального введения включают в себя стерильные водные или неводные растворы, суспензии и эмульсии, которые могут содержать вспомогательные агенты или эксципиенты, известные в данной области, и могут быть приготовлены в соответствии с рутинными способами. Кроме того, может вводиться суспензия активных соединений, в случае необходимости, масляные инъекционные суспензии. Подходящие липофильные растворители или носители включают в себя жирные масла, например, кунжутное масло, или синтетические эфиры жирных кислот, например, этилолеат или триглицериды. Водные инъекционные суспензии, которые могут содержать вещества, увеличивающие вязкость суспензии, включают в себя, например, натрийкарбоксиметилцеллюлозу, сорбит и/или декстран. Необязательно, эта суспензия может также содержать стабилизаторы. Фармацевтические композиции включают в себя подходящие растворы для введения посредством инъекции и содержат приблизительно 0,01-99%, предпочтительно приблизительно 20-75% активного соединения вместе с эксципиентом. Композиции, которые могут вводиться ректально, включают в себя суппозитории. Понятно, что вводимая доза будет зависеть от возраста, пола, здоровья и массы реципиента, типа одновременной терапии, если она имеется, частоты обработки и характера желаемого эффекта. Эту дозу подбирают для индивидуального субъекта, как это понятно и может быть определено специалистом с квалификацией в данной области. Общая доза, необходимая для каждой обработки, может вводиться в-9 009414 виде разделенных доз или в виде единственной дозы. Фармацевтическая композиция данного изобретения может быть введена отдельно или вместе с другими терапевтическими веществами, направленными на это состояние или направленными на другие симптомы данного состояния. Обычно суточная доза активного ингредиента содержит 0,01-100 мг на килограмм массы тела. Обычно 1-40 мг на килограмм в день, предоставляемые в разделенных дозах или в форме задержанного высвобождения, являются эффективными для получения желаемых результатов. Второе или последующие введения могут выполняться в дозе, которая является такой же, меньшей или большей, чем начальная или предыдущая доза,вводимая данному индивидууму. Другой целью данного изобретения является способ лечения или предупреждения аутоиммунных или воспалительных (таких как рассеянный склероз) или инфекционных заболеваний, предусматривающий введение эффективного количества мономерных вариантов гомодимеробразующих хемокинов, где указанный вариант происходит по меньшей мере из одной аминокислотной замены, которая изменяет картину водородных связей в границе димеризации указанного хемокина. Примерами таких мономерных вариантов, которые могут быть использованы в подобных способах, являются:d) полипептид, содержащий (а), (b) или (с) и аминокислотную последовательность, принадлежащую последовательностии белка, иного, чем указанный хемокин; а также соответствующих мономерных вариантов в форме их активных фракций, предшественников, солей, производных, комплексов или конъюгатов. Неограничительный перечень примеров аутоиммунных, воспалительных или инфекционных заболеваний, упомянутых выше в отношении применений, вариантов и способов данного изобретения, является следующим: артрит, ревматоидный артрит (RA), псориатический артрит, остеоартрит, системная красная волчанка (SLE), системный склероз, склеродермия, полимиозит, гломерулонефрит, фиброз, аллергические заболевания или заболевания, связанные с повышенной чувствительностью, дерматит, астма, хроническая обструктуивная болезнь легких (COPD), воспалительное заболевание пищеварительного тракта (IBD), болезни Крона, язвенный колит, рассеянный склероз, рак, септический шок, вирусные или ВИЧ-инфекции, трансплантации, воспаление дыхательных путей, реакция трансплантат против хозяина(GVHD) и атеросклероз. Терапевтические применения полипептидов данного изобретения и родственных реагентов могут оцениваться (на основе безопасности, фармакокинетики и эффективности) с использованием анализов invivo или in vitro с применением клетки, ткани и моделей животных (Coleman R.A. et al., 2001; Li А.Р.,2001; Methods Mol. Biol. vol. 138, "Chemokines Protocols", edited by Proudfoot A. et al., Humana Press Inc.,2000; Methods Enzymol vol. 287 b 288, Academic Press, 1997). Другим аспектом данного изобретения являются способы скрининга на облигатные антагонистические варианты хемокинов, описанные здесь, предусматривающие:a) получение моносайтовых мутаций в CCL2, которые блокируют его способность димеризоваться;b) идентификацию указанных вариантов, которые связываются с рецептором и обнаруживают агонистические свойства in vitro;c) идентификацию указанных вариантов из группы, идентифицированной в (b) выше, которые дополнительно характеризуются как ингибирующие рекрутинг перитонеальных клетов. Эта оценка этих свойств может выполняться с использованием способов, известных в данной области и показанных в примерах, с применением молекулы, о которой известно, что она индуцирует воспаление и рекрутинг перитонеальных клеток, например, хемокина, такого как сам CCL2, тиогликолат или овальбумин. Данное изобретение было описано со ссылкой на конкретные варианты осуществления, но содержание этого описания содержит все модификации и замены, которые могут быть осуществлены лицом с квалификацией в данной области без отклонения от идеи и цели приведенной формулы изобретения. Теперь данное изобретение будет описано посредством следующих примеров, которые не должны рассматриваться как ограничивающие каким-либо образом данное изобретение. Примеры Пример 1. Клонирование, экспрессия и очистка рекомбинантных белков. Зрелый белок CCL2 (фиг. 1; SEQ ID NO:1) и мутантный белок CCL2-P8A (фиг. 1; SEQ ID NO:2),зрелый белок CCL2 (фиг. 1; SEQ ID NO:3) и мутантный белок CCL2-P8A (фиг. 1; SEQ ID NO:4) генерировали и экспрессивали в виде рекомбинантных белков в Е. coli, как описано в литературе (PaavolaS.D. et al., 1998) на основе последовательности зрелой формы CCL2/MCP-1 человека, соответствующей сегменту 24-99 молекулы-предшественника. Для CCL2 и CCL2-P8A замена метионина изолейцином в положении 64 улучшает чистоту и гомогенность мутантов элиминацией образования разновидности,содержащей сульфоксид метионина в положении 64. Вкратце, гены для CCL2 и для CCL2 конструировали стандартными способами синтеза генов с оптимальным использованием кодонов для экспрессии в Е. coli и кодона для метионина, добавленного на- 10009414 5'-конце последовательности, кодирующей зрелый CCL2 или CCL2 человека. Мутантные конструкции,включающие в себя аланин в положении 8, получали мутагенезом с использованием полимеразной цепной реакции матрицы CCL2 или CCL2 и клонировали в вектор рЕТ 3 а (Novagen) между сайтами XhoI иNdeI. Плазмиды, кодирующие белки на основе CCL2, использовали для трансформации клеток ТАР 302,которые являются клетками BL21 pLys S, сконструированными нокаутом тиоредоксинредуктазы, чтобы сделать внутриклеточный окислительно-восстановительный потенциал более проводимым для образования дисульфидной связи. С использованием этого штамма дисульфидные связи, по-видимому, образуются в этой клетке, устраняя необходимость стадии рефолдинга. Все конструкции получали и контролировали стандартными способами молекулярной биологии(ПЦР-мутагенезом и амплификацией, секвенированием ДНК, расщеплением рестриктазами). Один из клонов, содержащий правильную последовательность МСР-1 (Р 8 А), использовали затем для получения этого белка в Е. coli. Эти плазмиды использовали также для трансформации BL21 Star (DE3) (InvitrogenCCL2, CCL2 и CCL2-P8A экспрессировали и очищали, как описано в оригинальной статье, с использованием стадии обработки ультразвуком, стадии лизиса и хроматографической стадии (колонка SPSepharose; элюция градиентом NaCl в 10 мМ K2PO4, рН 7,5). Фракции пиков объединяли и дополнительно очищали обращенно-фазовой ВЖХ (колонка С 18 с размером частиц 5 мкм и размерами пор 100 ). Белки элюировали с использованием градиента увеличения ацетонитрила, содержащего 0,1% трифторуксусную кислоту; обычно белки элюировались при 345% ацетонитрила. Затем их лиофилизировали, растворяли при 1 мг/мл в 35 мМ Трис, pH 8, давали им реагировать с 15 мкг аминопептидазы (Peprotech,Rock Hill, NJ)/1 мг белка в течение 36 ч при комнатной температуре и повторно очищали обращеннофазовой ВЖХ. Обработка аминопептидазой удаляет только N-концевой метионин, образуя либо Nконцевой глутамин, либо N-концевую пироглутаминовую кислоту (нет влияния на биологическую активность вследствие этого различия), как наблюдали секвенированием N-конца этого рекомбинантного белка. Затем этот белок лиофилизировали, повторно растворяли в воде при 1-5 мг/мл и хранили в виде небольших аликвот при 80 С. Более высокие количества рекомбинантных белков и, в частности, CCL2-P8A, получали также с использованием альтернативного протокола, предназначенного для очистки, начинающейся от осадка клеток, полученного из больших ферментационных культур штаммов Е. coli, продуцирующих эти белки. Обычно ферментер на 5 л продуцирует приблизительно 200 г сырой массы осадка клеток, а ферментер на 50 л продуцирует 1,8 кг сырой массы осадка клеток. Процедура очистки, описанная здесь, обрабатывает 200 г сырой массы осадка клеток. Этот осадок клеток оттаивали и добавляли 3 мл буфера для разрушения на грамм сырой массы (50 мМ Трис/HCl-буфер, pH 8,0 (Cat. 20092391, Biosolve), содержащего 10 мМ MgCl2 (Cat. 63065, Fluka), 5 мМ бензамидин/HCl (Cat. 12073, Fluka), 1 мМ 1,4 дл дитиотреитол (ДТТ) (Cat. 43819, Fluka) 1 мМ фенилметилсульфонилфторид (ФМСФ) (Cat. 78830, Fluka), 20 мг/л ДНКазы (Fluka) (Cat. DN-25, Sigma). Эту суспензию гомогенизировали с использованием политрона для получения хорошего гомогената, лишенного фрагментов или слипаний. Все манипуляции проводили при 4 С. Эту гомогенизированую бактериальную суспензию переносили в механический разрушитель клеток French Press (дифференциальное давление). Количество пассажей было обычно 2-4 при 1500 бар. Разрушение клеток подвергали мониторингу при помощи электрофореза в ДСН-ПААГ с окрашиванием Кумасси синим. Лизат помещали в центрифужные пробирки GSA и центрифугировали при 10000 об./мин с использованием центрифуги Sorval RC5C (16300 x g) в течение 90 мин при 4 С. После центрифугирования супернатант выбрасывали после подтверждения анализом при помощи электрофореза в ДСН-ПААГ, что представляющий интерес растворимый белок не мог детектироваться в этом супернатанте. Осадок извлекали шпателем из центрифужной пробирки и переносили в предварительно взвешенный химический стакан для взвешивания осадка. Этот осадок промывали деионизованной водой добавлением 5 мл воды на грамм осадка в химическом стакане и перемешивали в течение 30 мин при 4 С с использованием магнитной мешалки. Суспензию центрифугировали в центрифужных пробирках GSA при 10000 об./мин с использованием центрифуги Sorval RC5C (16300 х g) в течение 60 мин при 4 С. Стадию промывки повторяли 3 раза. После каждого центрифугирования супернатант выбрасывали после подтверждения анализом при помощи электрофореза в ДСН-ПААГ, что представляющий интерес растворимый белок не мог детектироваться в этом супернатанте. Осадок солюбилизировали в свежеприготовленном буфере для экстракции телец включения (100 мМ Трис/HCl-буфер, рН 8,0 (Cat. 20092391, Biosolve), содержащем 1 мМ 1,4 дл дитиотреитол (ДТТ) (Cat. 43819, Fluka) и 6 М гуанидиний/HCl (Cat. 50950, Fluka в соотношении 100 мл буфера на 25 г осадка клеток с использованием Polytron. Этот раствор нагревали в течение 30 мин при 60 С и перемешивали для гарантии мономеризации, затем охлаждали до комнатной температуры. Гомогенат помещали в центрифужные пробирки Ti45 и ультрацентрифугировали при 35000 об./мин с использованием ультрацентрифуги Beckman L-60 (100000 х g). Супернатант фильтровали с использованием фильтра 0,8-0,2 мм (Spi- 11009414ralCap (Cat. 12069, PALL), анализировали электрофорезом в ДСН-ПААГ и количественно определяли с использованием реагента для анализа белка Кумасси (Pierce) в соответствии с протоколом, поставляемым с этим набором. Представляющий интерес рекомбинантный белок улавливали на колонке FineLine 35 Pilot, содержащей смолу Source 30 RPC, упакованную в соответствии с инструкциями поставщика (Amersham Pharmacia). После использования эту колонку регенерировали в соответствии с процедурой очистки, поставляемой изготовителем Amersham Pharmacia). Для 100 г клеточного осадка упаковывали колонку 3,5 см диаметр 23 см высота, дающую в целом 220 мл (эквивалентных 1 колоночному объему) Source 30 RPC. Эту колонку инсталлировали на AKTA FPLC (Amersham Pharmacia). Скорость тока была 10 мл/мин и максимальное давление 1 мПа. Перед нанесением пробы колонку промывали деионизованной водой для 2 колоночных объемов (440 мл). После промывки колонку уравновешивали 5 КО (колоночными объемами) буфера для уравновешивания (100 мМ Трис/HCl-буфер, (Cat. 20092391, Biosolve), доведенного до pH 7,5 дымящей 37% HCl (Cat. 84426, Fluka). Растворенные IB (тельца включения) в гуанидиний/HCl наносили на эту колонку при скорости тока 5 мл/мин. Затем колонку промывали 5 колоночными объемами буфера для уравновешивания и затем 5 колоночными объемами (КО) буфера А (0,1% ТФУ (трифторуксусная кислота) (Cat. 28904, Pierce) и 99,9% дистиллированной воды). Белок элюируют с использованием линейного градиента от 0 до 100% буфера В (0,1% ТФУ (трифторуксусная кислота) (Cat. 28904, Pierce), 9,9% дистиллированной воды, 90% ацетонитрила (UN1648, Baker) более чем 10 КО (колоночных объемов) со скоростью тока 10 мл/мин и пределом давления 1 МРа. Собирали фракции 10 мл. Все обнаруженные пики анализировали электрофорезом в ДСН-ПААГ, ВЖХ и количественной УФ-спектроскопией. Фракции, содержащие представляющий интерес белок, объединяли и количество измеряли УФ-спектроскопией. Этот белок ренатурировали 10-кратным разведением в буфер для ренатурации (100 мМ Трис/HClбуфер, pH 8,0 (Cat. 20092391, Biocolve, содержащий 0,1 М восстановленный глутатион (Cat. G-4251,Sigma) и 0,01 мМ окисленный глутатион (Cat. 120 000 250, Acros Organic), с получением конечной концентрации приблизительно 0,1 мг/мл. Этот пул Source 30 RPC добавляли по каплям в буфер для ренатурации. Если объем является большим, эту процедуру можно проводить с использованием перистальтического насоса. Раствор перемешивали в течение ночи при 4 С. Раствор часто кажется мутным вследствие осаждения белка, который не ренатурировался. Конечные концентрации в диапазоне от 0,1 до 0,4 мг/мл в буфере для ренатурации давали эквивалентные количества ренатурированного белка (40-50%). Этот pH и ацетонитрил в исходном материале не влияли на стадию ренатурации. За ренатурацией может следовать ВЖХ для прослеживания рефолдинга. Раствор ренатурации фильтровали с использованием перистальтического насоса High Flow с двойным фильтром, состоящим из предварительного фильтра 0,8 мм с последующим фильтром 0,22 мм. Затем осветленный раствор концентрировали катионным обменом на Hiload SP Sepharose HP после количественного определения посредством УФ-спектра. Размер этой ионообменной колонки зависит от количества белка. Для 500 мг использовали колонку 16/10 (1 колоночный объем = 20 мл); для 500-1000 мг колонку 26/10 (1 колоночный объем = 50 мл) и для 1-2 г колонку 50/5 (1 колоночный объем = 100 мл). Колонку упаковывали в соответствии с инструкциями поставщика (Amersham Pharmacia). Эту колонку промывали 2 КО деионизованной воды и затем уравновешивали 4 КО катионообменного буфера А(50 мМ уксусная кислота (Fluka, доведенного до pH 4,5 NaOH (Cat. 71690 Fluka). Этот раствор доводили до pH 4,5 уксусной кислотой и проводимость доводили до 10 мС. После нанесения раствора белка при скорости тока, рекомендуемой поставщиком для выбранной колонки, эту колонку промывали 5 КО буфера А. Белок элюировали линейным градиентом от 0 до 100% буфера В (буфер А, содержащий 2 МNaCl (Cat. 71380, Fluka) более чем 20 колоночными объемами (КО). Размер фракций определялся размером колонки. Все обнаруженные пики анализировали электрофорезом в ДСН-ПААГ, ВЖХ и определяли количественно УФ-спектроскопией. После анализа фракции, содержащие AS900652, объединяли, количественно определяли посредством УФ-спектра и анализировали при помощи ВЖХ. Удаление N-концевого метионина выполняли ферментативно с использованием метионинаминопептидазы (MAP) с последующей стадией очистки. Вкратце, пробу сначала диализовали с использованием мембранной трубки с пределом отсечения 3,5 кД в буфер для расщепления (35 мМ Трис/НС 1-буфер,pH 7,5 (Cat. 20092391, Biosolve. Буфер для диализа заменяли три раза на протяжении 24 ч. Метионинаминопептидазу (MAP) добавляли к раствору белка в соотношении 1:10000 (мм, фермент:белок). Расщепление выполняли при комнатной температуре в течение 48 ч. Затем расщепленный белок очищали катионным обменом, проводимым, как описано выше. Белок имел чистоту 98%, как было оценено электрофорезом в ДСН-ПААГ. Систему очистки AKTA (Pharmacia) использовали для дополнительной очистки желаемого белка. Эту систему очищали в течение 1 ч 1 М NaOH, промывали стерильной водой и уравновешивали в буфере,отфильтрованном с использованием фильтра 0,22 мм (0,1% ТФУ (трифторуксусная кислота) (Cat. 28904,Pierce), 99,9% дистиллированная вода). Белок обессоливали с использованием колонки G-25 fine Sepharose ХK50/30. Эту колонку промывали 1 колоночным объемом (1 КО) 1 М NaOH и затем 4 колоночными- 12009414 объемами стерильной воды и затем уравновешивали 5 колоночными объемами 0,1% ТФУ. Для оптимальных условий обессоливания пробы 50-100 мл обессоливают на 450 мл G-25 fine Sepharose. Для объемов, больших чем 100 мл, стадию обессоливания повторяют. Эту пробу фильтровали с использованием фильтра 0,22 мм перед нанесением. Колонку элюируют 1,5 КО 0,1% ТФУ со скоростью тока 10 мл/мин и при максимальном давлении 1 МПа. Фракции 10 мл собирают в стерильные пробирки. После анализа фракции, содержащие этот белок, объединяют, определяют количественно при помощи УФ-спектра в стерильных условиях и анализируют при помощи ВЖХ, электрофореза в ДМН-ПААГ и массспектрометрии. Оставшиеся загрязнители удаляют с использованием препаративной обращенно-фазовой хроматографии (RPC) на DeltaPrep HPLC (Waters). Пробу подкисляли до 0,1% ТФУ и наносили на колонку Vydac(Cat. 28904, Pierce) и 99,9% дистиллированная вода). Белок элюировали с использованием линейного градиента от 0 до 100% буфера В (0,1% ТФУ (трифторуксусная кислота) (Cat. 28904, Pierce), 99% ацетонитрил (UN1648, Baker), более 10 КО со скоростью тока 25 мл/мин и пределом давления 700 бар. Все обнаруженные пики анализировали электрофорезом в ДСН-ПААГ, ВЖХ и определяли количественно УФ-спектроскопией. После анализа фракции, содержащие AS900652, объединяли, количественно определяли посредством УФ-спектра, делили на аликвоты, как это необходимо, и лиофилизировали. Белок хранили при -20 или при -80 С. Рекомбинантный белок определяли количественно УФ-спектроскопией с использованием спектрофотометра UV-VTS (Uvikon system, KONTRON). Кварцевую кювету (QS 1.000, HELLMA) использовали для эталона-буфера, а другая кювета содержит пробу. Измеряли отрезок длин волн 350-240 нм и поглощения при 280 нм использовали для определения количества в соответствии с коэффициентом экстинкции, полученным из композиции аминокислот с использованием ProtParam, Expasy. Используемая величина была 1,1 для раствора 1 мг/мл для окисленного белка, содержащего дисульфидные связи. Анализы электрофореза в ДСН-ПААГ проводили с использованием 10% геля NuPAGE (Cat.NP0301, Invitrogen). Эту пробу разбавляли в 2 раза в буфере для проб (Cat. LC2 676, Invitrogen) и нагревали в течение 5 мин при 95 С. В качестве стандартов молекулярных масс использовали лэддер (лестницу) белков Benchmark. 10 мкл раствора стандартов молекулярных масс и 20 мкл пробы белка наносили в соответствующие лунки. Рабочим буфером электрофореза был MES (Cat. NP0002, Invitrogen). Миграцию проводили в соответствии с инструкциями поставщика при 200 В, 12 мА и 25 Вт в течение 35 мин(PowerEase500, Invitrogen). Гели NuPAGE окрашивали 0,1% R250 Кумасси синим в 10% уксусной кислоте, 30% метаноле в дистиллированной воде при медленном качании, пока фоновый уровень не терял окрашивание. Затем гель промывали несколько раз в воде перед погружением в осушающий раствор (Invitrogen), помещенный в виде сэндвича между двумя листами целофановой бумаги (Invitrogen), на 10 мин и затем помещали в миниатюрный пресс, позволяющий гелю храниться в виде тонкого листа. Альтернативно, этот гель окрашивали по протоколу красителя SimplyBlue Safe (Cat. LC6065, Invitrogen). Систему Alliance HPLC, поставляемую Waters, использовали с аналитической колонкой С 8 Aquapore RP-300 7m (0,2 см диаметр х 22 см), уравновешенной в 0,1 ТФУ. Инъецировали 10-50 мг белка,предварительно подкисленного 0,1% конечной ТФУ. Белки элюировали градиентом 25-50% ацетонитрила, более чем 20 колоночными объемами. Идентичность рекомбинантного белка подтверждали масс-спектральными анализами и анализом Nконцевой последовательности. Для очищенного материала получали правильную N-концевую последовательность QPDAINAAVT. Масса 8655 Да была получена для основной разновидности, что соответствовало теоретической массе белковой цепи с 2 дисульфидными связями. Также наблюдали вторую разновидность с массой,меньшей чем 17 Да, соответствующую модификации N-концевого остатка глутамина в пироглутаминовую кислоту. Присутствие этой модификации не влияло на активность этого белка. Пример 2. Анализы на основе клеток. Материалы и способы. Анализы для индуцированного хемокином рекрутинга перитонеальных клеток. Самок мышей Balb/c (Janvier, France) в возрасте 8-12 недель содержали при нормальных условиях содержания животных со стандартным циклом 12 ч свет/темнота и со свободным доступом к корму и воде. Группы, состоявшие из 3-6 мышей, инъецировали внутрибрюшинно 200 мкл солевого раствора(стерильного, не содержащего LPS 9% NaCl (м/о), или этого раствора, содержащего CCL2 или CCL2-P8A в концентрации 10 мкг на одну инъекцию). Для исследований, изучающих ингибиторные действияCCL2-P8A на индуцированный CCL2 рекрутинг перитонеальных клеток, эти молекулы вводили внутрибрюшинно за 30 мин перед внутрибрюшинной инъекцией CCL2. Все эти молекулы вводили при указанной концентрации и в указанном выше буфере (солевом растворе). Мышей умерщвляли при 4 ч после последней инъекции CCL2 или CCL2-P8A. Анализ на индуцированный тиогликолатом рекрутинг перитонеальных клеток был опубликован(Mishell В. 1980). Вкратце, тиогликолатную среду готовили суспендированием 30 г тиогликолатной среды (Becton Dickinson) в 1 л холодной дистиллированной воды, затем нагревали до кипения для полного растворения порошка. Затем среду делили на аликвоты в склянки на 100 мл и автоклавировали. После охлаждения среду хранили в темноте при комнатной температуре в течение по меньшей мере одного месяца. Клеточный рекрутинг индуцировали внутрибрюшинной инъекцией мышей в группах из 3 мышей 200 мкл 3% раствора тиогликолата в день 1, спустя 30 мин после введения CCL2-Р 8 А. CCL2 вводили один раз в день после этого в течение 3 дней (дни 2, 3 и 4). Дексаметазон (Sigma) использовали в качестве положительного контроля и вводили при 10 мг/кг внутрибрюшинно. Мышей умерщвляли в день 5. Перитонеальные лаважи для оценки рекрутинга клеток в предыдущих анализах выполняли следующим образом. Мышей умерщвляли асфиксией повышающимися концентрациями СО 2 в боксе из плексигласа. Кожу очищали 70% этанолом. Наружный слой кожи удаляли, обнажая перитонеальную мембрану. Перитонеальную полость промывали 3 раза 5 мл охлажденного на льду ЗФР (забуференного фосфатом солевого раствора) и жидкость объединяли в полистироловой пробирке Falcon (Becton Dickinson) на 15 мл на льду. Каждый лаваж сопровождался легким массажем перитонеальной полости. Жидкость лаважа центрифугировали при 425g, супернатант выбрасывали и полученный осадок клеток ресуспендировали осторожным множественным пипетированием в 1 мл ЗФР. 10 мкл суспензии клеток окрашивали 90 мкл трипанового синего и общее количество клеток считали с использованием гемоцитометра Neubauer подсчетом 4 зон, по 1 мм 2 каждая. Брали среднее из 4 подсчетов, умножали на фактор разведения 10 и снова умножали на 10 с получением количества клеток на мкл, в соответствии с инструкциями для применения, прилагаемыми к гемоцитометру. Наконец, общую величину умножали на 1000 (для расчета на 1 мл) для получения общего количества извлеченных клеток. Результаты. Рекомбинантный зрелый белок CCL2/MCP-1 человека и мутанты, названные CCL2, и соответствующие облигатные мономерные мутанты, названные CCL2-P8A и CCL2-P8A (фиг. 1), зкспрессировали в Е. coli. Литературные данные ясно показывают, что мутация Р 8 А в CCL2 блокирует образование димеровCCL2 без влияния на связывание с клетками, экспрессирующими рецептор, или с вирусным рецепторподобным белком, но также без обнаружения активностей известного антагониста CCL2 в релевантных анализах (см. (1+9-76)МСР-1 в табл. I Paavola C.D. et al., 1998; Alexander J.M. et al., 2002). Облигатная мономерная форма CCL2 предоставляет специфические и неожиданные свойства в анализах, выполняемых в тестах на основе клеток. В анализе рекрутинга перитонеальных клетов: CCL2P8A и CCL2-P8A были не способны рекрутировать клетки в сравнении с природным CCL2 (фиг. 2). Кроме того, эти молекулы способны, зависимым от дозы образом, ингибировать индуцированный CCL2(фиг. 3 А) и индуцированный тиогликолатом рекрутинг макрофагов (фиг. 3 В). В последнем анализеCCL2-P8A является, по-видимому, таким же эффективным, что и положительный контроль (дексаметазон, известное противовоспалительное соединение). Пример 3. Свойства CCL2-P8A в моделях заболеваний животных. Материалы и способы. Модель индуцированного овальбумином воспаления легких. Модель индуцированного овальбумином воспаления легких получают, как опубликовано (Blyth D.I.et al., 1996). Группы из 6 мышей сенсибилизировали внутрибрюшинной инъекцией 10 мкг альбумина куриного яйца в 2 мг 2% гидроксида алюминия (Serva) в общем объеме 200 мкл, который готовили смешиванием 25 мкл овальбумина (2 мг/мл), 250 мкг гидроксида алюминия в 725 мкл не содержащего LPS 0,9% NaCl (солевого раствора) и осаждали 3-4 ч при 4 С. Спустя 15 дней после сенсибилизации мышей обрабатывали и провоцировали в группах из 6 мышей интраназальным введением 15 мкг овальбумина в 50 мкл солевого раствора, под анестезией ингаляцией изофлурана один раз в день со дня 15 до дня 19.CCL2-P8A (200 мкл, 10 мкг на одну внутрибрюшинную инъекцию) вводили за 30 мин перед каждой ингаляторной провокацией. Перитонеальные лаважи для оценки рекрутинга клеток и счета клеток выполняли, как описано выше в примере 2. Модель ЕАЕ (экспериментального аутоиммунного энцефаломиелита). Мышей C57BI/6 из Charles River Italy (выбранный штамм имеет документированную восприимчивость к ЕАЕ; Sahrbacher U.C. et al., 1988) иммунизировали (день 0) инъекцией s.c. в левый бок 0,2 мл эмульсии, состоящей из 200 мкг пептида MOG35-55 (Neosystem, Strasburg, France) в полном адъюванте Фрейнда (CFA, Difco, Detroit, U.S.A.), содержащем 0,5 мг Mycobacterium tuberculosis. Сразу же после этого они получали i.p. инъекцию 500 нг коклюшного токсина (List Biological Lab., Campbell, CA,U.S.A.), растворенного в 400 мкл буфера (0,5 М NaCl, 0,017% Тритон Х-100, 0,015 М Трис, pH 7,5). В день 2 животным давали вторую i.p. инъекцию 500 нг коклюшного токсина. В день 7 мыши получали вторую дозу 200 мкг пептида MOG35-55 в CFA инъекцией s.c. в правый бок. Начиная приблизительно со дня 8-10,эта процедура приводит к постепенно прогрессирующему параличу, возникающему от хвоста и простирающемуся до передних конечностей. Со дня 7 животных индивидуально обследуют на присутствие паралича с использованием клинической оценки следующим образом:- 14009414 0 = нет признака заболевания 0,5 = частичный паралич хвоста 1 = паралич хвоста 1,5 = паралич хвоста + частичный односторонний паралич задней конечности 2 = паралич хвоста + слабость задних конечностей или частичный паралич задних конечностей 2,5 = паралич хвоста + частичный паралич задних конечностей (пониженный таз) 3 = паралич хвоста + полный паралич задних конечностей 3,5 = паралич хвоста + полный паралич задних конечностей + недержание 4 = паралич хвоста + паралич задних конечностей + слабость или частичный паралич передних конечностей 5 = агонизирующие или мертвые Обработка соединениями или носителем начинается для каждого животного в день 7 после иммунизации и продолжается в течение 21 последовательного дня (10-12 животных на одну группу обработки). Интерферони CCL2-P8A вводили s.c. или i.p., соответственно, один раз в день, солюбилизированные в 10 мл/кг ЗФР, в дозах, указанных на фигуре. Модель контактной аллергической реакции замедленного типа. Мышиный тест опухания ушей для измерения контактной аллергической реакции выполняли, как описано ранее (Garrigue J.L. et al., 1994). Вкратце, мышей предварительно сенсибилизировали местно нанесением 25 мкл 0,5% раствора 2,4-динитрофторбензола (DNFB; Sigma Chemicals Co.) в ацетоне/оливковом масле (4:1) на выбритый живот. Спустя пять дней 20 мкл 0,2% DNFB в том же самом носителе наносили на правые уши, а один носитель на левые уши. Мышей (n=6 на группу) обрабатывали один раз в день в день 5 внутрибрюшинным введением 0,05, 0,5 или 5 мг/кг (1, 10 или 100 мг на мышь соответственно) CCL2-P8A, дексаметазона (1 мг/кг) или только ЗФР в контрольной группе. Эту обработку производили за 30 мин перед введением DNFB. Толщину ушей измеряли измерителем с циферблатом толщины (Mitutoyo Corp.). Опухание ушей оценивали вычитанием величины перед провокацией из величины после провокации и дополнительным вычитанием любого опухания, детектируемого в провоцированном носителем контралатеральном ухе. Результаты. Потенциальные терапевтические активности CCL2-P8A в качестве антагониста хемокинов испытывали в моделях воспалительных и аутоиммунных заболеваний животных.CCL2-P8A испытывали в модели заболевания, индуцированного овальбумином воспаления легких. В этой классической модели для аллергического воспаления легких мышей сенсибилизировали овальбумином с использованием гидроксида алюминия в качестве адъюванта во время фазы сенсибилизации для бустинга иммунной реакции и затем провоцировали интраназальным введением овальбумина на протяжении периода 5 последовательных дней, причем CCL2-P8A вводили внутрибрюшинно на протяжении этой фазы. Также и в этом случае CCL2-P8A был способен ингибировать рекрутинг клеток(фиг. 4). Во второй модели CCL2-P8A испытывали в модели ЕАЕ (экспериментального аутоиммунного энцефаломиелита), хорошо известной модели для рассеянного склероза, которую использовали для валидизации антагонистов хемокинов (в том числе CCL2) для лечения этого аутоиммунного, воспалительного демиелинизирующего заболевания центральной нервной системы человека (Mahad D.J. and RansohoffR.M., 2003; Izikson L. et al., 2002). CCL2-P8A испытывали в животных, обнаруживающих либо легкий,либо тяжелый уровень этого заболевания, оцениваемый клинической оценкой, после обработки ЕАЕиндуцирующими соединениями. Каждую из двух групп животных делили на пять подгрупп: три из них обрабатывали различными количествами CCL2-P8A, а две другие использовали в качестве либо отрицательного контроля (обрабатываемого только носителем), либо положительного контроля (обрабатывамого интерфероном-, обычным терапевтическим продуктом для лечения рассеянного склероза). Развитие состояния животных сравнивали на основе клинической оценки, измеряемой во время периода обработки (21 день). В обеих моделях заболеваний введение CCL2-P8A (в дозе, снижающейся до 0,15 мг/кг) улучшает состояние животных статистически значимым образом. Наблюдаемое уменьшение клинической оценки с использованием CCL2-P8A является по меньшей мере сравнимым с уменьшением, наблюдаемым при использовании интерферона- в качестве обработки (фиг. 5). Модель другого заболевания, модель контактной аллергической реакции, использовали для оценки потенциальной терапевтической эффективности CCL2-P8A на воспалении кожи, опосредованном Тклетками. Контактная аллергическая реакция (CHS) является зависимой от клеток Лангерганса (LC),опосредуемой Т-клетками кожной иммунной реакцией, отражающей кульминацию активностей LC invivo (поглощения надкожных антигенов, миграции в лимфатические узлы и презентации антигенов необученным Т-клеткам). Эта модель хорошо установлена для характеристики соединения в отношении дерматологических показаний, таких как псориаз и аллергический контактный дерматит (Xu H. et al.,1996). Она включает в себя фазу сенсибилизации и последующую стимуляцию (провокацию) антигеном,приводящую к воспалению кожи с образованием отека и клеточных инфильтратов в коже. Этот отек мо- 15009414 жет быть измерен штангенциркулем (инструментом для определения толщины) в месте введения антигена (ухе мышей). Было продемонстрировано участие хемокинов и, в частности, CCL2, в развитии заболевания с избыточной реакцией (Mitsui G. et al., 2003; Mizumoto N. et al., 2001). Внутрибрюшинное введение CCL2-P8A за 30 мин перед стимуляцией антигеном (DNFB в данном случае) приводит к уменьшению опухания в сравнении с уменьшением, наблюдаемым с использованием известного противовоспалительного соединения (дексаметазона), спустя один день после этой обработки. Контрольных мышей получали стимуляцией их антигеном, но с предыдущей сенсибилизацией или без предыдущей сенсибилизации, так чтобы зависимое от Т-клеток воспаление образовывалось или не образовывалось (фиг. 6). Таким образом, мономерный вариант гомодимеробразующего СС-хемокина, где указанный вариант происходит по меньшей мере из одной аминокислотной замены, которая изменяет картину водородных связей в границе димеризации, является ингибитором опосредованного хемокинами рекрутинга клеток в анализах рекрутинга клеток in vivo, а также в моделях-животных заболеваний человека, что предполагает, что именно эта новая стратегия для генерирования вариантов хемокинов может быть использована для приготовления фармацевтических композиций и в терапевтических способах. Пример 4. Альтернативные формы CCL2-P8A. Альтернативные формы вариантов хемокинов, описанных выше, могут быть получены введением мутаций, известных в данной области, в качестве улучшения конкретных признаков. Одна или более отдельных аминокислотных замен и/или одно или более добавлений отдельных аминокислот могут вводиться в другом положении CCL2-P8A (фиг. 7 А). CCL2-P8A может экспрессироваться в виде зрелого белка, лишенного природного N-концевого остатка глутамина, или с добавлением дополнительного небольшого остатка (такого как аланин или глицин) на N-конце перед глутамином, так что этот остаток глутамина не остается открытым и не превращается самопроизвольно в формупироглутамата (Gong J. and Clark-Lewis I., 1995). CCL2-P8A может быть также мутирован таким образом,что пятый цистеин является доступным для прохождения специфических реакций ПЭГилирования. Эти сайты ПЭГилирования могут быть интегрированы на уровне либо внутренней аминокислоты (например,в положении аспарагина 14 или 17 и даже в положении 8, так что единственная модификация может сделать возможными как мономеризацию, так и ПЭГилирование), либо на С-конце (прямым добавлением цистеина после природного С-концевого треонина). Дополнительный вариант CCL2-P8A может быть получен слиянием этой последовательности с константной областью домена иммуноглобулина, белкового домена, который, как известно, улучшает стабильность и эффективность рекомбинантных белков в кровотоке. Полученный слитый белок может быть экспрессирован непосредственно клетками млекопитающих (такими как клетки CHO или HEK293) с использованием соответствующих экспрессирующих векторов, так что этот слитый белок секретируется в культуральную среду. В предпочтительном варианте осуществления последовательность нуклеиновой кислоты, кодирующая зрелый CCL2-Р 8 А, может быть клонирована в экспрессирующий вектор, слитый с последовательностью нуклеиновой кислоты, кодирующей сигнальную последовательность CCL2 человека, на его 5'-конце, и последовательностью нуклеиновой кислоты, кодирующей константную область (сегмент 246-467) тяжелой цепи иммуноглобулина лямбда человека IgGl (NCBI Acc. No.CAA75302), на его 3'-конце. Полученный вектор может быть использован для трансформации клеточной линии CHO или HEK293 и могут быть отобраны клоны, стабильно экспрессирующие и секретирующие рекомбинантный слитый белок, имеющий CCL2-P8A на N-конце и последовательность IgGl на С-кокце(фиг. 7 В). Затем этот клон может быть использован для увеличения масштаба получения и для очистки этого рекомбинантного слитого белка из культуральной среды. Альтернативно, положение нуклеиновой кислоты, кодирующей константную область (сегмент 243-474) тяжелой цепи иммуноглобулинаIgGl человека и CCL2-P8A, может быть обращено, и полученный белок может экспрессироваться и секретироваться с использованием все еще сигнальной последовательности CCL2 человека или любой другой сигнальной последовательности.Zhang Y. et al., Methods, 10: 93-103, 1996. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение полипептида, содержащего SEQ ID NO:2, для изготовления лекарственного средства для лечения аутоиммунных, воспалительных или инфекционных заболеваний. 2. Применение по п.1, где этот полипептид дополнительно содержит изолейцин в положении 64SEQ ID NO:2 и таким образом содержит SEQ ID NO:4. 3. Применение по п.1 или 2, дополнительно отличающееся тем, что указанный полипептид не содержит мутацию в положении 9, 10 или 13 в соответствующей последовательности SEQ ID NO:2 и SEQID NO:4. 4. Применение по п.1 или 2, дополнительно отличающееся тем, что указанный полипептид содержит в соответствующей последовательности SEQ ID NO:2 и SEQ ID NO:4:b) аланин или глицин в положении 1. 5. Применение по любому из пп.1-4, где указанный полипептид содержит константную область тя- 18009414 желой цепи иммуноглобулина человека. 6. Применение по п.1 или 2, где указанное заболевание выбрано из группы, состоящей из артрита,ревматоидного артрита (RA), псориатического артрита, остеоартрита, системной красной волчанки(SLE), системного склероза, склеродермии, полимиозита, гломерулонефрита, фиброза, аллергических заболеваний или заболеваний, связанных с повышенной чувствительностью, дерматита, астмы, хронической обструктивной болезни легких (COPD), воспалительного заболевания пищеварительного тракта(IBD), болезней Крона, язвенного колита, рассеянного склероза, рака, септического шока, вирусных или ВИЧ-инфекций, трансплантации, воспаления дыхательных путей, реакции трансплантат против хозяина(GVHD) и атеросклероза. 7. Применение по п.6, где заболеванием является рассеянный склероз. 8. Слитый полипептид, образованный аминокислотной последовательностью SEQ ID NO:2 и константной областью тяжелой цепи иммуноглобулина человека, причем слитый полипептид имеет последовательность, идентифицированную как SEQ ID NO:5. 9. Последовательность нуклеиновой кислоты, кодирующая слитый полипептид SEQ ID NO:5. 10. Способ получения слитого полипептида по п.8, включающий:a) клонирование последовательности нуклеиновой кислоты, кодирующей зрелый CCL2-P8A, в экспрессирующий вектор, слитый с последовательностью нуклеиновой кислоты, кодирующей сигнальную последовательность CCL2 человека, на его 5'-конце и последовательностью нуклеиновой кислоты, кодирующей константную область (сегмент 243-474) тяжелой цепи иммуноглобулина лямбда человека IgG1,на его 3'-конце;b) трансформацию клеточной линии СНО или HEK293 полученным вектором;c) отбор клонов, стабильно экспрессирующих и секретирующих рекомбинантный слитый белок,имеющий CCL2-P8A на N-конце и последовательность IgG1 на С-конце;d) очистку этого слитого белка из культуральной среды. 11. Способы скрининга на облигатные мономерные варианты-антагонисты хемокинов, предусматривающие:a) получение моносайтовых мутаций в CCL2, которые блокируют его способность димеризоваться;b) идентификацию указанных вариантов, которые связываются с рецептором и обнаруживают агонистические свойства in vitro;c) идентификацию указанных вариантов из группы, идентифицированной в (b) выше, которые дополнительно характеризуются как ингибирующие рекрутинг перитонеальных клеток.
МПК / Метки
МПК: A61P 29/00, A61P 37/00, A61K 38/19, A61P 31/00
Метки: вариантов, хемокинов, применения, терапевтические
Код ссылки
<a href="https://eas.patents.su/26-9414-terapevticheskie-primeneniya-variantov-hemokinov.html" rel="bookmark" title="База патентов Евразийского Союза">Терапевтические применения вариантов хемокинов</a>
Предыдущий патент: Полиморфные формы габоксадола, агониста gabaa
Следующий патент: Способ частичного и селективного гидрирования полимеров, полученных из конъюгированных диенов
Случайный патент: Разлагаемый заменитель смолы для жевательной резинки