Производные 4-фенилпиридина, их применение, лекарственное средство
Номер патента: 3673
Опубликовано: 28.08.2003
Авторы: Штадлер Хайнц, Галлей Гуидо, Хункелер Вальтер, Бёс Михаэль, Шнидер Патрик, Бранка Кирико, Хоффманн Торстен, Годель Тирри
Формула / Реферат
1. Соединения общей формулы I
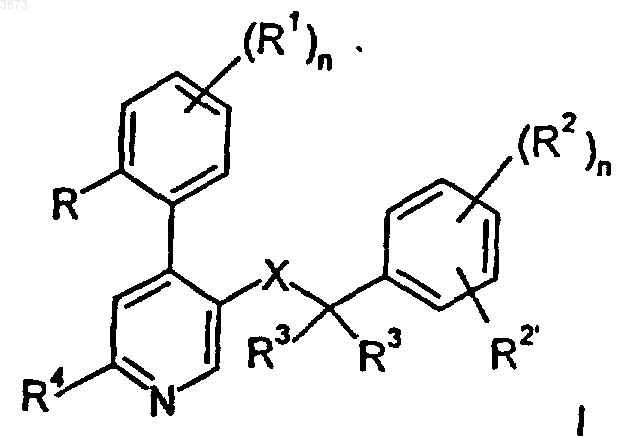
в которой R обозначает водород, (низш.)алкил, (низш.)алкокси, галоген или трифторметил,
R1 обозначает водород или галоген либо
R и R1 совместно могут образовывать группу -CH=CH-CH=CH-,
R2 и R2', каждый независимо друг от друга, обозначает водород, галоген, трифторметил, (низш.)алкокси или цианогруппу либо R2 и R2' совместно могут образовывать группу -CH=CH-CH=CH-, необязательно замещенную одним или двумя заместителями, выбранными из (низш.)алкила и (низш.)алкокси,
R3 обозначает водород, (низш.)алкил или образует C3-C6циклоалкил;
R4 обозначает водород, -N(R5)2, -N(R5)(CH2)n-OH, -N(R5)S(O)2-(низш.)алкил, -N(R5)S(O)2-фенил, -N=CHN(R5)2, -N(R5)C(O)R5 или циклический третичный амин, необязательно связанный посредством группы -(CH2)nN(R5)- и представляющий собой пиррол-1-ил, имидазол-1-ил, пиперидин-1-ил, пиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, 1-оксотиоморфолин-4-ил или 1,1-диоксотиоморфолин-4-ил;
R5 в каждом случае независимо обозначает водород, C3-C6циклоалкил, бензил или (низш.)алкил,
R6 обозначает водород, гидроксил, (низш.)алкил, -(CH2)nCOO-(низш.)алкил, -N(R5)CO-(низш.)алкил, гидрокси-(низш.)алкил, цианогруппу, -(CH2)nO(CH2)nOH, -CHO или гетероциклическую группу, необязательно связанную посредством алкиленовой группы и представляющую собой пиридинил, пиримидинил, оксадиазолил, триазолил, тетразолил, тиазолил, тиенил, фурил, пиранил, пирролил, имидазолил, пиразолил, изотиазолил, пиперазинил или пиперидил;
X обозначает -C(O)N(R5)-, -(CH2)mO-, -(CH2)mN(R5)-, -N(R5)C(O)- или -N(R5)(CH2)m-,
n обозначает 0-4 и m обозначает 1 или 2,
причем (низш.)алкил обозначает прямую или разветвленную C1-C7алкильную группу, а (низш.)алкокси означает апкоксигруппу, содержащую прямой или разветвленный C1-C7алкильный остаток,
и их фармацевтически приемлемые кислотно-аддитивные соли.
2. Соединение по п.1, у которого X обозначает -C(O)N(R5)-, a R5 обозначает метил, этил или циклопропил.
3. Соединение по п.2, которое представляет собой
N-(3,5-бистрифторметилбензил)-N-метил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-4-(2-хлорфенил)никотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-4-(2-трифторметилфенил)никотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-4-(2-фторфенил)никотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-4-(2-метоксифенил)никотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-4-фенилникотинамид,
N-(3,5-бистрифторметилбензил)-N-этил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-N-циклопропил-4-o-толилникотинамид,
N-[1-(3,5-бистрифторметилфенил)этил]-N-метил-4-o-толилникотинамид,
N-(3,5-дифторбензил)-N-метил-4-o-толилникотинамид,
N-(3,5-дихлорбензил)-N-метил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-6-(4-метилпиперазин-1-ил)-4-o-толилникотинамид,
(3,5-бистрифторметилбензил)метиламид 2'-метил-5-(4-метилпиперазин-1-ил)дифенил-2-карбоновой кислоты,
N-(3,5-бистрифторметилбензил)-N-метил-6-(4-метилпиперазин-1-ил)-4-нафталин-1-илникотинамид,
этиловый эфир {4-[5-[(3,5-бистрифторметилбензил)метилкарбамоил]-4-o-толилпиридин-2-ил]пиперазин-1-ил}уксусной кислоты,
этиловый эфир 5'-[(3,5-бистрифторметилбензил)метилкарбамоил]-4'-o-толил-3,4,5,6-тетрагидро-2H-[1,2']-бипиридинил-4-карбоновой кислоты,
N-(3,5-бистрифторметилбензил)-N-метил-6-(4-пропилпиперазин-1-ил)-4-o-толилникотинамид,
(RS)-6-[3-(ацетилметиламино)пирролидин-1-ил]-N-(3,5-бистрифторметилбензил)-N-метил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-6-[метил-(2-морфолин-4-илэтил)амино]-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-6-морфолин-4-ил-4-o-толилникотинамид ,
N-(3,5-бистрифторметилбензил)-N-метил-6-тиоморфолин-4-ил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-6-(1-оксо-1l4тиоморфолин-4-ил)-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-6-(1,1-диоксо-1l4-тиоморфолин-4-ил)-N-метил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-6-пиперазин-1-ил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-6-[4-(2-гидроксиэтил)пиперазин-1-ил]-N-метил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-6-(4-цианометилпиперазин-1-ил)-N-метил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-6-{4-[2-(2-гидроксиэтокси)этил]пиперазин-1-ил}-N-метил-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-6-(4-[1,2,4]оксадиазол-3-илметилпиперазин-1-ил)-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-N-метил-6-[4-(5-оксо-4,5-дигидро-1H-[1,2,4]триазол-3-илметил)пиперазин-1-ил]-4-o-толилникотинамид,
N-(3,5-бистрифторметилбензил)-6-(4-формилпиперазин-1-ил)-N-метил-4-o-толилникотинамид или
N-метил-N-(2-метилнафталин-1-илметил)-6-морфолин-4-ил-4-o-толилникотинамид.
4. Соединение по п.1, у которого X обозначает -N(R5)C(O)-, a R5 обозначает водород или метил.
5. Соединение по п.4, которое представляет собой
2-(3,5-бистрифторметилфенил)-N-метил-N-[6-(4-метилпиперазин-1-ил)-4-o-толилпиридин-3-ил]изобутирамид,
2-(3,5-бистрифторметилфенил)-N-[4-(2-хлорфенил)-6-(4-метилпиперазин-1-ил)пиридин-3-ил]-N-метилизобутирамид,
2-(3,5-бистрифторметилфенил)-N-[4-(4-фтор-2-метилфенил)-6-(4-метилпиперазин-1-ил)пиридин-3-ил]-N-метилизобутирамид,
2-(3,5-бистрифторметилфенил)-N-[4-(2-хлорфенил)пиридин-3-ил]-N-метилизобутирамид,
2-(3,5-бистрифторметилфенил)-N-метил-N-(4-o-толилпиридин-3-ил)изобутирамид,
2-(3,5-бистрифторметилфенил)-N-(4-o-толилпиридин-3-ил)изобутирамид,
2-(3,5-бистрифторметилфенил)-N-метил-N-(4-o-толилпиридин-3-ил)ацетамид,
2-(3,5-бистрифторметилфенил)-N-метил-N-(4-o-толилпиридин-3-ил)пропионамид,
2-(3,5-бистрифторметилфенил)-N-метил-N-(6-морфолин-4-ил-4-o-толилпиридин-3-ил)изобутирамид,
2-(3,5-бистрифторметилфенил)-N-[4-(2-хлорфенил)-6-морфолин-4-илпиридин-3-ил]-N-метилизобутирамид,
2-(3,5-бистрифторметилфенил)-N-метил-N-{6-[метил-(2-морфолин-4-илэтил)амино]-4-o-толилпиридин-3-ил}изобутирамид,
2-(3,5-бистрифторметилфенил)-N-метил-N-[6-(4-пиримидин-2-илпиперазин-1-ил)-4-o-толилпиридин-3-ил]изобутирамид,
2-(3,5-бистрифторметилфенил)-N-(6-морфолин-4-ил-4-o-толилпиридин-3-ил)изобутирамид,
2-(3,5-бистрифторметилфенил)-N-[4-(2-хлорфенил)-6-диметиламинопиридин-3-ил]изобутирамид,
2-(3,5-бистрифторметилфенил)-N-метил-N-(6-пиперазин-1-ил-4-о-толилпиридин-3-ил)изобутирамид,
2-(3,5-бистрифторметилфенил)-N-(4-гидрокси-4'-o-толил-3,4,5,6-тетрагидро-2H-[1,2']бипиридинил-5'-ил)-N-метилизобутирамид,
2-(3,5-бистрифторметилфенил)-N-{6-[(2-гидроксиэтил)метиламино]-4-o-толилпиридин-3-ил}-N-метилизобутирамид,
(R)-2-(3,5-бистрифторметилфенил)-N-[6-(3-гидроксипирролидин-1-ил)-4-o-толилпиридин-3-ил]-N-метилизобутирамид,
2-(3,5-бистрифторметилфенил)-N-метил-N-(6-морфолин-4-ил-4-o-толилпиридин-3-ил)ацетамид или
[2-(3,5-бистрифторметилфенил)-2-метилпропил]-[4-(4-фтор-2-метилфенил)-6-(4-метилпиперазин-1-ил)пиридин-3-ил]метиламин.
6. Лекарственное средство, включающее одно или несколько соединений по любому из пп.1-5 и фармацевтически приемлемые наполнители.
7. Лекарственное средство по п.6 для лечения заболеваний, связанных с антагонистрьш рецептора NK-1.
8. Применение соединения по любому из пп.1-5 для лечения заболеваний, связанных с антагонистами рецептора NK-1.
9. Применение соединения по любому из пп.1-5 при приготовлении лекарственных средств, включающих одно или несколько соединений формулы I, для лечения заболеваний, связанных с антагонистами рецептора NK-1.
Текст
1 Настоящее изобретение относится к соединениям общей формулыR обозначает водород, низший алкил, соответственно (низш.) алкил, (низш.) алкокси, галоген или трифторметил,R1 обозначает водород или галоген либоR и R1 совместно могут образовывать группу -СН=СН-СН=СН-, R2 и R2' каждый независимо друг от друга обозначает водород, галоген, трифторметил, (низш.) алкокси или цианогруппу либоR2 и R2' совместно могут образовывать группу -СН=СН-СН=СН-, необязательно замещенную одним или двумя заместителями, выбранными из (низш.)алкила и (низш.)алкокси,R3 обозначает водород, (низш.)алкил или образует циклоалкильную группу, R4 обозначает водород,-N(R5)2,-N(R5)(СН 2)n-ОН,5-N(R )S(O)2-(низш.)алкил, -N(R5)S(O)2-фенил,-N=CHN(R5)2, -N(R5)C(O)R5 или циклический третичный амиловый радикал одной из следующих группR5 в каждом случае независимо обозначает водород, С 3-С 6 циклоалкил, бензил или (низш.) алкил,R6 обозначает водород,гидроксил,(низш.)алкил, -(СН 2)nСОО-(низш.)алкил,-N(R5)CO-(низш.)aлкил, гидрокси(низш.) алкил, цианогруппу, -(СН 2)nO(СН 2)nОН, -СНО или 5- или 6-членную гетероциклическую группу, необязательно связанную посредством алкиленовой группы, Х обозначает -C(O)N(R5)-, (СH2)mO-, -(СН 2)mN(R5)-, -N(R5)С(O)- или N(R5)(СН 2)m-,n обозначает 0-4 и m обозначает 1 или 2, и к их фармацевтически приемлемым кислотноаддитивным солям. Соединения формулы I и их соли характеризуются ценными терапевтическими свойствами. Было установлено, что соединения, предлагаемые по настоящему изобретению, являются антагонистами рецептора нейрокинина-1 (NK-1,вещество Р). Вещество Р представляет собой встречающийся в природе ундекапептид, принадлежащий к пептидам тахикининового семейства, причем эти последние получили такое название из-за их быстрого контрактильного воздействия на экстраваскулярную ткань гладкой мускулатуры. Рецептор для вещества Р является членом суперсемейства рецепторов, связанных сG-белком. Нейропептидный рецептор для вещества Р(NK-1) довольно широко распределен в нервной 2 системе млекопитающих (прежде всего в головном мозге и спинальных ганглиях), в сердечнососудистой и лимфатической системе в целом, в периферических тканях (прежде всего в двенадцатиперстной кишке и в тощей кишке) и участвует в регулировании ряда разнообразных биологических процессов. Центральное и периферическое действие вещества Р семейства тахикинина млекопитающих связано как с различными воспалительными состояниями, включая такие болезни, как мигрень, ревматоидный артрит, астму и воспаление кишечника, так и с опосредованием рвотного рефлекса и модуляцией расстройств центральной нервной системы (ЦНС), таких как болезнь Паркинсона (Neurosci. Res., 1996, 7,187-214), боязнь (Can. J. Phys., 1997, 75, 612621) и депрессия (Science, 1998, 281, 1640-1645). Эффективность применения антагонистов рецептора тахикинина в случае боли, головной боли, прежде всего мигрени, болезни Альцгеймера, рассеянного склероза, ослабление боли при отмене морфина, сердечно-сосудистых изменений, отека, такого как отек, вызванный термическим ожогом, хронических воспалительных болезней таких, как ревматоидный артрит, астма/бронхиальная гиперреактивность бронхов и другие респираторные заболевания,включая аллергические рениты, воспалительные заболевания кишок, в том числе неспецифический язвенный колит и болезнь Крона, повреждений глаз и воспалительных заболеваний глаз подтверждена в обзоре "Tachykinin Receptor andTachikinin Receptor Antagonists", J. Auton. Pharmacol., 13, 23-93, 1993. Более того, ведутся работы над созданием антагонистов рецептора нейрокинина-1 для лечения ряда физиологических расстройств, связанных с избытком или с дисбалансом тахикинина, в частности вещества Р. Примеры состояний, в которых участвует вещество Р, включают расстройства центральной нервной системы,такие как страх, депрессия и психоз (WO 95/16679, WO 95/18124 и WO 95/23798). Кроме того, антагонисты рецептора нейрокинина-1 показаны и при лечении от укачивания и вызванной этим тошноты. В дополнение к этому в The New EnglandJournal of Medicine, т. 340,3, 190-195, 1999,было описано ослабление рвотного рефлекса,индуцированного цисплатином, воздействием селективного антагониста рецептора нейрокинина-1. Более того, в патенте US 5972938 описан метод лечения психоиммунологических или психосоматических расстройств введением антагонистов рецептора тахикинина, такого как антагонист рецептора NK-1. Объектами настоящего изобретения являются соединения формулы I и их фармацевтически приемлемые соли, способы получения вышеупомянутых соединений, включающие их 3 лекарственные средства и их приготовление, а также применение вышеупомянутых соединений при лечении или профилактике заболеваний, прежде всего заболеваний и расстройств такого типа, как указанные выше, или при приготовлении соответствующих лекарственных средств. Наиболее предпочтительными показаниями в соответствии с настоящим изобретением являются те, которые включают заболевания центральной нервной системы, например лечение или профилактика некоторых депрессивных расстройств или рвоты введением антагониста рецептора NK-1. Главный депрессивный период определяется как период, состоящий по крайней мере из двух недель, в течение которых в большинстве дней или почти каждый день наблюдается либо депрессивное настроение, либо потеря интереса или неудовлетворенность при любом или практически любом виде деятельности. Приведенные ниже определения общих понятий, использованных в настоящем описании, применимы независимо от того, встречаются ли рассматриваемые понятия индивидуально или в сочетании. Использованное в настоящем описании понятие "(низш.)алкил" обозначает прямоцепочечную или разветвленную алкильную группу, содержащую 1-7 углеродных атомов, например метил, этил, пропил, изопропил, н-бутил, изобутил, трет-бутил и т.п. Предпочтительными (низш.)алкильными группами являются группы, содержащие 1-4 атома углерода. Термин "(низш.)алкокси" обозначает группу, представляющую собой описанный выше алкильный остаток, который присоединен через атом кислорода. Термин "галоген" обозначает атом хлора,иода, фтора или брома. Термин "циклоалкил" обозначает насыщенную карбоциклическую группу, содержащую 3-6 атомов углерода. Термин "циклический третичный амин" обозначает, например, пиррол-1-ил, имидазол-1 ил, пиперидин-1-ил, пиперазин-1-ил, морфолин 4-ил, тиоморфолин-4-ил, 1-оксотиоморфолин-4 ил или 1,1-диоксотиоморфолин-4-ил. Понятием "5- или 6-членная гетероциклическая группа" обозначают, например, пиридинил, пиримидинил, оксадиазолил, триазолил,тетразолил, тиазолил, тиенил, фурил, пиранил,пирролил, имидазолил, пиразолил, изотиазолил,пиперазинил или пиперидил. Под понятием "фармацевтически приемлемые кислотно-аддитивные соли" подразумеваются соли неорганических и органических кислот, таких как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота,янтарная кислота, винная кислота, метансуль 003673N-метил-N-(2-метилнафталин-1-илметил)6-морфолин-4-ил-4-о-толилникотинамид. Более предпочтительны соединения, у которых Х обозначает -N(R5)-C(O)-, a R5 обозначает водород или метил. Примерами таких соединений являются следующие: 2-(3,5-бистрифторметилфенил)-N-метилN-[6-(4-метилпиперазин-1-ил)-4-о-толилпиридин-3-ил]изобутирамид,2-(3,5-бистрифторметилфенил)-N-[4-(2 хлорфенил)-6-(4-мeтилпипepaзин-1-ил)пиpидин-3-ил]-N-мeтилизoбyтиpaмид,2-(3,5-бистрифторметилфенил)-N-[4-(4 фтор-2-метилфенил)-6-(4-метилпиперазин-1 ил)пиридин-3-ил]-N-метилизобутирамид,2-(3,5-бистрифторметилфенил)-N-[4-(2 хлорфенил)пиридин-3-ил]-N-метилизобутирамид,2-(3,5-бистрифторметилфенил)-N-метилN-(4-о-толилпиридин-3-ил)изобутирамид,2-(3,5-бистрифторметилфенил)-N-(4-отолилпиридин-3-ил)изобутирамид,2-(3,5-бистрифторметилфенил)-N-метилN-(4-о-толилпиридин-3-ил)ацетамид,2-(3,5-бистрифторметилфенил)-N-метилN-(4-о-толилпиридин-3-ил)пропионамид,2-(3,5-бистрифторметилфенил)-N-метилN-(6-морфолин-4-ил-4-о-толилпиридин-3-ил) изобутирамид,2-(3,5-бистрифторметилфенил)-N-[4-(2 хлорфенил)-6-морфолин-4-илпиридин-3-ил]-Nметилизобутирамид,2-(3,5-бистрифторметилфенил)-N-метилN-6-[метил(2-морфолин-4-илэтил)амино]-4-отолилпиридин-3-илизобутирамид, 003673[2-(3,5-бистрифторметилфенил)-2-метилпропил]-[4-(4-фтор-2-метилфенил)-6-(4-метилпиперазин-1-ил)пиридин-3-ил]метиламин. Предлагаемые соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области техники, например описанным ниже способом, который включает: а) взаимодействие соединения формулы-ОS(O)2 С 6H4 СН 3, а другие заместители имеют указанные выше значения, или е) восстановление соединения формулы в которой R1-R5, R и n имеют значения, указанные выше, или в) восстановление соединения формулы до соединения формулы в которой заместители имеют указанные выше значения, или г) взаимодействие соединения формулы-ОS(O)2C6H4 СН 3, а другие заместители имеют указанные выше значения, или д) взаимодействие соединения формулы в которой заместители имеют указанные выше значения, или ж) модификацию одного или нескольких заместителей R1-R6 или R в рамках вышеприведенных значений и при необходимости превращение полученного соединения в фармацевтически приемлемую кислотно-аддитивную соль. В соответствии с вариантом а) способа в смесь соединения формулы II, например метил[6-(4-метилпиперазин-1-ил)-4-о-толилпиридин-3-ил]амина, и соединения формулы III, например,2-(3,5-бистрифторметилфенил)-2-метилпропилхлорида, в дихлорметане вводят Nэтилдиизопропиламин (ЭДИПА) и полученную смесь перемешивают при температуре в пределах 35-40 С. После очистки с высоким выходом получают целевое соединение формулы I-1. При осуществлении варианта б) способа предусмотрено взаимодействие соединения формулы IV с соединением формулы V с получением соединения формулы I-2. Эту реакцию проводят обычным путем, например в растворителе, таком как смесь толуола с триэтиламином. Смесь кипятят с обратным холодильником в течение примерно 1 ч. В соответствии с вариантом в) способа соединение формулы I-2 восстанавливают до соединения формулы I-4. Эту реакцию проводят с использованием восстановителя, такого какLiAlH4 или ВН 3 ТГФ, обычным путем. В варианте г) способа предусмотрено взаимодействие соединения формулы VI с соединением формулы VII с получением соединения формулы I-2. Эту реакцию проводят депротонированием соединения формулы VI с использованием гексаметилдисилазида калия(ГМДСК) и последующим добавлением соединения формулы VII. Приемлемым растворителем является тетрагидрофуран. Реакцию проводят при комнатной температуре. 9 В соответствии с вариантом д) способа получают соединение формулы I-5. Эту реакцию проводят депротонированием соединения формулы VIII с помощью NaH и последующим добавлением соединения формулы VII. Реакцию ведут обычным путем. Еще один путь получения соединения формулы I представлен в описании варианта е) способа. Соединение формулы I-1 восстанавливают до соединения формулы I-3 по обычному методу, например с использованием LiAlH4 или ВН 3 ТГФ. Процесс солеобразования проводят при комнатной температуре в соответствии с методами, которые известны специалистам в данной области техники. При этом имеются в виду не только соли минеральных кислот, но также соли органических кислот. Примерами таких солей являются гидрохлориды, гидробромиды, сульфаты, нитраты, цитраты, ацетаты, малеаты, сукцинаты, метансульфонаты, п-толуолсульфонаты и т.п. Способы получения соединений формулыI более подробно проиллюстрированы на следующих схемах 1-8. Исходные продукты формул V, IX, XII, XV, XVI, XXII, XXV, XXVIII,IXXX и XXX представляют собой соединения,которые известны или могут быть получены по методам, которые известны в данной области техники. На этих схемах использованы следующие аббревиатуры: ПивСl - пивалоилхлорид; ТГФ - тетрагидрофуран; ТМЭДА - N,N,N',N'-тетраметилэтилендиамин; ЭДИПА - N-этилдиизопропиламин; ГМДСК - гексаметилдисилазид калия. Схема 1 Значения заместителей указаны выше. Схема 3Z обозначает Cl, Br, I или ОS(O)2C6H4 СН 3,а значения других заместителей указаны выше. Схема 4 Значения заместителей указаны выше. Значения заместителей указаны выше.Z обозначает Cl, Br, I или -OS(O)2 С 6 Н 4 СH3,а значения других заместителей указаны выше. Схема 6Z обозначает Cl, Br, I или -OS(O)2 С 6 Н 4 СН 3,а значения других заместителей указаны выше. Схема 7 Значения заместителей указаны выше. Схема 8 Значения заместителей указаны выше. Как сказано выше, соединения формулы I и их фармацевтически приемлемые аддитивные соли обладают ценными фармакологическими свойствами. Было установлено, что соединения,предлагаемые по настоящему изобретению, являются антагонистами рецептора нейрокинина-1(NK-1, вещество Р). Эти соединения исследовали в соответствии с приведенными ниже тестами. 12 Сродство тестируемых соединений к рецептору NK-1 оценивали на рецепторах NK-1 человека в клетках СНО, инфицированных рецептором NK-1 человека (используя систему экспрессии вируса Semliki) и меченного посредством 3 Н вещества Р (конечная концентрация 0,6 нМ). Опыты по связыванию проводили в буфере HEPES (N-2-гидроксиэтилпиперазин-N'2-гидроксипропансульфоновая кислота) (50 мМ, рН 7,4), содержащем бычий сывороточный альбумин (0,04%), лейпептин (8 мкг/мл), MnCl2 (3 мМ) и фосфорамидон (2 мкМ). Проба в опытах по связыванию состояла из 250 мкл суспензии мембраны (1,25 х 105 клеток/пробирка), 0,125 мкл буфера, содержащего замещающий агент, и 0,125 мкл буфера, содержащего вещество Р, меченное посредством 3 Н. Кривые замещения определяли по крайней мере при семи концентрациях тестируемого соединения. Пробирки инкубировали при комнатной температуре в течение 60 мин, после чего содержимое пробирки быстро фильтровали под вакуумом через фильтрыGF/C, предварительно пропитанные ПЭИ (полиэтиленимин, 0,3%) и промытые 2 раза по 2 мл буфером HEPES (50 мМ, рН 7,4). Остаточную радиоактивность на фильтре измеряли с помощью сцинцилляционного счетчика. Все испытания повторяли три раза по крайней мере в двух отдельных экспериментах. Для предпочтительных соединений значения pKi, выражающие сродство к рецепторуNK-1, составляют от 8,00 до 9,80. Ниже приведены примеры таких соединений. Соединения формулы I, равно как и их фармацевтически приемлемые кислотно-аддитивные соли могут быть использованы в качестве лекарственных средств, например в форме фармацевтических препаратов. Эти фармацевтические препараты можно вводить в организм перорально, например в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий и суспензий. Однако введение можно также осуществлять ректальным путем, например в форме суппозиториев, или парентерально, например в форме растворов для инъекций. Соединения формулы I и их фармацевтически приемлемые кислотно-аддитивные соли можно перерабатывать совместно с фармацев 13 тически инертными неорганическими или органическими наполнителями при изготовлении таблеток, таблеток с покрытиями, драже и твердых желатиновых капсул. В качестве таких наполнителей, например, при изготовлении таблеток, драже и твердых желатиновых капсул,можно использовать лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.д. Приемлемыми наполнителями для изготовления мягких желатиновых капсул являются,например, растительные масла, воски, твердые жиры, полутвердые и жидкие полиолы и т.д. Приемлемыми наполнителями для приготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар,глюкоза и т.д. При приготовлении растворов для инъекций приемлемыми наполнителями являются,например, вода, спирты, полиолы, глицерин,растительные масла и т.д. Для изготовления суппозиториев в качестве носителей могут быть использованы, например, натуральные и отвержденные масла, воски,твердые жиры, полужидкие и жидкие полиолы и т.д. Более того, фармацевтические препараты могут включать консерванты, солюбилизаторы,стабилизаторы, смачивающие вещества, эмульгаторы, подслащивающие вещества, красители,корригенты, соли для варьирования осмотического давления, буферы, маскирующие добавки и антиоксиданты. Они могут также включать другие терапевтически ценные вещества. Дозу можно варьировать в широком диапазоне, однако, обычно в каждом конкретном случае ее подбирают в соответствии с индивидуальными потребностями. В случае перорального введения приемлемой ежедневной дозой соединения общей формулы I следует считать от примерно 10 до 1000 мг/пациента, хотя, когда в этом есть необходимость, приведенный верхний предел может быть и превышен. Ниже изобретение проиллюстрировано на примерах, не ограничивающих его объем. Во всех случаях температура указана в градусах Цельсия. Пример 1. N-(3,5-Бистрифторметилбензил)-N-метил-4-о-толилникотинамид. а) Метил-4-о-толилникотинат. Смесь 1,2 г (6,9 ммоля) метил-4-хлорникотината, 20 мл диметоксиэтана, 6,4 мл 2 н. раствора карбоната натрия, 0,4 г (0,34 ммоля) тетракис(трифенилфосфин) палладия (0) и 1,4 г(10,3 ммоля) о-толилбороновой кислоты выдерживали в аргоне при 80 С в течение 18 ч. После охлаждения до комнатной температуры водную фазу отделяли и дважды промывали этилацетатом. Объединенные органические слои промывали 50 мл рассола, сушили (над сульфатом натрия), упаривали и сушили под вакуумом. Продукт в виде сырого масла подвергали хромато 003673 14 графической обработке в колонке с получением 1,5 г (выход 97%) указанного в заголовке соединения в виде масла, которое при стоянии при 0 С кристаллизовалось.MC, m/e (%):227 (M+, 15). б) 4-о-Толилникотиновая кислота. Раствор 1,13 г (5,0 ммоля) метил-4-отолилникотината в 15 мл этанола и 12 мл 2 н. раствора гидроксида натрия в течение 1 ч кипятили с обратным холодильником. Значение рН доводили до 5 и смесь дважды экстрагировали этилацетатом. Объединенные органические слои сушили (над сульфатом натрия) и упаривали с получением в виде не совсем белых кристаллов 1 г (выход 94%) указанного в заголовке соединения.N-(3,5-Бистрифторметилбензил)-Nметил-4-о-толилникотинамид 1 г (4,6 ммоля) 4 о-толилникотиновой кислоты в 10 мл дихлорметана и 2 капли N,N-диметилформамида при комнатной температуре в течение 2 ч перемешивали совместно с 1 мл (14 ммолей) тионилхлорида. Растворитель удаляли и остаток растворяли в 10 мл толуола и 2 мл триэтиламина. После добавления 1,3 г (5,1 ммоля) 3,5 бистрифторбензилметиламина смесь кипятили с обратным холодильником в течение 1 ч, дважды экстрагировали этилацетатом и промывали бикарбонатом натрия. Объединенные органические слои сушили (над сульфатом натрия) и упаривали. Продукт в виде сырого масла подвергали хроматографической обработке в колонке с получением в виде масла 1,4 г (выход 67%) указанного в заголовке соединения. МС, m/е (%):452 (М+,5). Пример 2. N-(3,5-бистрифторметилбензил)-N-метил-4-(2-хлорфенил)никотинамид. Аналогично примеру 1 указанное в заголовке соединение получали с сопоставимым выходом в виде масла с использованием на стадии а) о-хлорфенилбороновой кислоты вместо о-толилбороновой кислоты.MC, m/e (%):471 (М+,3). Пример 3. N-(3,5-бистрифторметилбензил)-N-метил-4-(2-трифторметилфенил)никотинамид. Аналогично примеру 1 указанное в заголовке соединение получали с сопоставимым выходом в виде масла с использованием на стадии а) о-трифторметилфенилбороновой кислоты вместо о-толилбороновой кислоты. МС, m/е (%): 506 (М+, 15). Пример 4. N-(3,5-Бистрифторметилбензил)-N-метил-4-(2-фторфенил)никотинамид. Аналогично примеру 1 указанное в заголовке соединение получали с сопоставимым выходом в виде масла с использованием на стадии а) о-фторфенилбороновой кислоты вместо о-толилбороновой кислоты. МС, m/е (%): 456 (М+, 30). 15 Пример 5. N-(3,5-бистрифторметилбензил)-N-метил-4-(2-метоксифенил)никотинамид. Аналогично примеру 1 указанное в заголовке соединение получали с сопоставимым выходом в виде масла с использованием на стадии а) о-метоксифенилбороновой кислоты вместо о-толилбороновой кислоты. МС, m/е (%): 469 (М+Н+, 100). Пример 6. N-(3,5-бистрифторметилбензил)-N-метил-4-фенилникотинамид. Аналогично примеру 1 указанное в заголовке соединение получали с сопоставимым выходом в виде масла с использованием на стадии а) фенилбороновой кислоты вместо отолилбороновой кислоты. МС, m/е (%): 438 (М+, 60). Пример 7. N-(3,5-Бистрифторметилбензил)-N-этил-4-о-толилникотинамид. Аналогично примеру 1 указанное в заголовке соединение получали с сопоставимым выходом в виде масла с использованием на стадии в) 3,5-бистрифторбензилэтиламина вместо 3,5-бистрифторбензилметиламина. МС, m/е (%): 465 (М-Н-, 3). Пример 8. Гидрохлорид N-(3,5-бистрифторметилбензил)-N-циклопропил-4-о-толилникотинамида (0,8:1). а)N-(3,5-бистрифторметилбензил)-Nциклопропил-4-о-толилникотинамид. Раствор 106 мг (0,5 ммоля) 4-отолилникотиновой кислоты в 5 мл дихлорметана и 2 капли N,N-диметилформамида при комнатной температуре в течение 1,5 ч перемешивали совместно с 0,1 мл (1,4 ммоля) тионилхлорда. Растворитель удаляли и остаток растворяли в 5 мл дихлорметана и 0,3 мл триэтиламина. После добавления 155 мг (0,55 ммоля) 3,5 бистрифторметилбензилциклопропиламина при комнатной температуре смесь перемешивали в течение 1 ч и дважды промывали водой. Органический слой сушили (над сульфатом магния) и упаривали. Продукт в виде сырого масла подвергали хроматографической обработке в колонке с получением в виде масла 140 мг (выход 58%) указанного в заголовке соединения. МС, m/е (%): 479 (М+, 100). б) Гидрохлорид N-(3,5-бистрифторметилбензил)-N-циклопропил-4-о-толилникотинамида (0,8:1). В раствор 140 мг N-(3,5-бистрифторметилбензил)-N-циклопропил-4-о-толилникотинамида в 1 мл диэтилового эфира вводили 3 капли 3 н. раствора соляной кислоты в метаноле. После перемешивания в течение 15 мин при 0 С смесь упаривали досуха с получением в виде белых кристаллов 100 мг (выход 41%) указанного в заголовке соединения. tпл: 174-178 С. МС, m/е (%): 479 (М+, 100). Пример 9. N-[1-(3,5-Бистрифторметилфенил)этил]-N-метил-4-о-толилникотинамид. Аналогично примеру 1 указанное в заголовке соединение получали с сопоставимым 16 выходом в виде масла с использованием на стадии в) 2-(3,5-бистрифторфенил)этилметиламина вместо 3,5-бистрифторбензилметиламина. МС, m/е (%): 467 (М+Н+, 100). Пример 10.N-(3,5-Дифторбензил)-Nметил-4-о-толилникотинамид. Аналогично примеру 1 указанное в заголовке соединение получали с сопоставимым выходом в виде твердого вещества с использованием на стадии в) 3,5-дифторбензилметиламина вместо 3,5-бистрифторбензилметиламина. МС, m/е (%): 353 (М+Н+, 100). Пример 11.N-(3,5-Дихлорбензил)-Nметил-4-о-толилникотинамид. Аналогично примеру 1 указанное в заголовке соединение получали с сопоставимым выходом в виде масла с использованием на стадии в) 3,5-дихлорбензилметиламина вместо 3,5 бистрифторбензилметиламина. МС, m/е (%): 385 (М+Н+, 100), 387 (М+Н+,70). Пример 12. Гидрохлорид N-(3,5-бистрифторметилбензил)-N-метил-6-(4-метилпиперазин-1-ил)-4-о-толилникотинамида (2:1). а) 6-Хлор-N-метилникотинамид. В 50 г (317 ммолей) 2-хлорникотиновой кислоты при 0 С вводили 230 мл (3,16 моля) тионилхлорида. После кипячения смеси с обратным холодильником в течение 2 ч отгонкой удаляли избыток тионилхлорида. Маслянистый коричневый остаток растворяли в 250 мл дихлорметана. Раствор при 0 С обрабатывали газообразным метиламином до тех пор, пока по данным наблюдений не прекращалась экзотермическая реакция. Образовавшуюся суспензию разбавляли 1000 мл смеси дихлорметан/вода. Слои разделяли и водный слой экстрагировали дихлорметана тремя порциями по 300 мл. В результате сушки органического слоя над сульфатом натрия и концентрирования получали 53,2 г(выход 98%) указанного в заголовке соединения в виде светло-желтого твердого желтого вещества. МС, m/е (%): 171 (М+Н+, 15). б) N-Метил-6-(4-метилпиперазин-1-ил) никотинамид. Смесь 52,0 г (30,5 ммоля) 6-хлор-Nметилникотинамида и 176 мл (1,58 моля) 1 метилпиперазина при 100 С выдерживали в автоклаве в течение 1,5 ч. После охлаждения до комнатной температуры отгонкой удаляли избыток 1-метилпиперазина. Остаток распределяли в 1000 мл смеси дихлорметан/1 н. водный раствор гидроксида натрия. Слои разделяли и водный слой экстрагировали тремя 500 миллилитровыми порциями дихлорметана. В результате концентрирования и хроматографии в короткой колонке получали 72,3 г (выход 97%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. МС, m/е (%): 235 (М+Н+, 100). 17 в) 4-Иод-N-метил-6-(4-метилпиперазин-1 ил)никотинамид. В раствор 936 мг (3,99 ммоля) N-метил-6(4-метилпиперазин-1-ил)никотинамида и 2,46 мл (16,4 ммоля) N,N,N',N'-тетраметилэтилендиамина в 20 мл сухого тетрагидрофурана при-78 С по каплям вводили 10 мл (16 ммолей) 1,6 М раствора н-бутиллития в гексане. По истечении 0,5 ч смесь подогревали до -35 С. При этой температуре перемешивание продолжали в течение 3 ч. После охлаждения до -78 С добавляли раствор 1,52 г (6,00 ммоля) иода в 2,5 мл тетрагидрофурана. Реакционную смесь в течение ночи нагревали до комнатной температуры. Далее реакцию в реакционной смеси прекращали добавлением 30 мл 20%-ного водного раствора бисульфита натрия при 0 С. В результате экстракции тремя 30-миллилитровыми порциями этилацетата, сушки над сульфатом натрия и концентрирования в виде коричневого масла получали 1,2 г продукта. Хроматографией в колонке получали 618 мг (выход 43%) указанного в заголовке соединения.MC, m/e (%): 360 (М+, 15). г) N-Метил-6-(4-метилпиперазин-1-ил)-4 о-толилникотинамид. Суспензию 4,00 г (11,1 ммоля) 4-иод-Nметил-6-(4-метилпиперазин-1-ил)никотинамида и 642 мг (0,555 ммоля) тетракис (трифенилфосфин) палладия (0) в 60 мл толуола диоксигенировали в течение 30 мин в токе аргона. После добавления 11 мл 2 н. водного раствора карбоната натрия и 1,66 г (12,2 ммоля) о-толилбороновой кислоты смесь в течение ночи кипятили с обратным холодильником. После охлаждения до комнатной температуры смесь разбавляли водой и экстрагировали тремя 50 миллилитровыми порциями этилацетата. Водный слой насыщали хлоридом натрия и экстрагировали тремя 50-миллилитровыми порциями дихлорметана. Объединенные органические слои сушили над сульфатом натрия и концентрировали. В результате хроматографии в колонке получали 2,26 г (выход 63%) указанного в заголовке соединения. MC, m/e (%):324 (М+, 5). д) Гидрохлорид N-(3,5-бистрифторметилбензил)-N-метил-6-(4-метилпиперазин-1-ил)-4 о-толилникотинамида (2:1). В раствор 750 мг (2,32 ммоля) N-метил-6(4-метилпиперазин-1-ил)-4-о-толилникотинамида в 16 мл тетрагидрофурана при комнатной температуре вводили 3 мл 1 М раствора (3 ммоля) гексаметилдисилазида калия в тетрагидрофуране. По прошествии 1 ч в образовавшуюся суспензию по каплям добавляли 0,43 мл (2,3 ммоля) 3,5-бис(трифторметил)бензилбромида. По истечении 1 ч реакцию прекращали добавлением воды и смесь экстрагировали тремя 20 миллилитровыми порциями этилацетата. Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия, сушили над сульфатом натрия и концен 003673 18 трировали. В результате хроматографии в колонке получали 950 мг (выход 74%) N-(3,5 бистрифторметилбензил)-N-метил-6-(4-метилпиперазин-1-ил)-4-о-толилникотинамида. Этот последний в виде белой пены растворяли в небольшом количестве диэтилового эфира и обрабатывали 2 мл 3 н. раствора соляной кислоты в диэтиловом эфире. Путем концентрирования получали 1,02 г (выход 74%) указанного в заголовке соединения в виде белого твердого вещества.MC, m/e (%): 551 (М+Н+, 100). Пример 13. Гидрохлорид N-(3,5-бистрифторметилбензил)-4-(2-хлорфенил)-N-метил-6(4-метилпиперазин-1-ил)никотинамида (2:1). Указанное в заголовке соединение получали аналогично примеру 12 с использованием на стадии г) 2-хлорфенилбороновой кислоты вместо о-толилбороновой кислоты. МС, m/е (%): 571 (М+Н+, 100). Пример 14. Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-метил-N-[6-(4-метилпиперазин-1-ил)-4-о-толилпиридин-3-ил]изобутирамида (2:1) а) 1-Метил-4-(5-нитропиридин-2-ил)пиперазин. В раствор 20 г (126 ммолей) 2-хлор-5 нитропиридина в 200 мл тетрагидрофурана в течение 10 мин по каплям вводили 35 мл (315 ммолей) 1-метилпиперазина. В течение последующих 1,5 ч реакционную смесь кипятили с обратным холодильником. После охлаждения до комнатной температуры под вакуумом удаляли растворитель и остаток вновь растворяли в 200 мл этилацетата. Органическую фазу промывали 200 мл 1 н. раствора бикарбоната натрия,сушили (над сульфатом магния) и упаривали с получением 27,9 г (количественный выход) указанного в заголовке соединения в виде желтого твердого вещества. МС, m/е (%): 223 (М+Н+, 100). б) 2,2-Диметил-N-[6-(4-метилпиперазин-1 ил)пиридин-3-ил]пропионамид. В раствор 27,9 г (125,5 ммоля) 1-метил-4(5-нитропиридин-2-ил)пиперазина в 400 мл метанола вводили 2,6 г 10%-ного палладия на активированном древесном угле. При температуре в интервале от комнатной до примерно 45 С и под давлением 1 бар реакционную смесь гидрогенизовали до тех пор, пока теоретическое количество водорода не оказывалось поглощенным (в течение примерно 2 ч). Катализатор отфильтровывали и дважды промывали 100 миллилитровыми порциями метанола. Фильтрат упаривали под вакуумом с получением 28 г продукта в виде пурпурного масла, которое в соответствии с данным ТСХ-анализа (тонкослойная хроматография) примерно на 90% состояло из целевого анилинового производного. Этот сырой продукт растворяли в смеси 400 мл тетрагидрофурана и 100 мл диэтилового эфира. После охлаждения до 0 С в виде одной 19 порции вводили 30 мл (215 ммолей) триэтиламина. Перемешивание продолжали, добавляя одновременно по каплям в течение 10 мин 26 г(215 ммолей) пивалоилхлорида. Ледяную баню удаляли и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Далее под вакуумом удаляли растворитель и остаток суспендировали в 200 мл 1 н. раствора бикарбоната натрия. Продукт три раза экстрагировали 200-миллилитровыми порциями дихлорметана,сушили (над сульфатом натрия) и очищали экспресс-хроматографией с получением 30 г (выход 86%) указанного в заголовке соединения в виде розовых кристаллов. МС, m/е (%): 277 (М+Н+, 100). в)N-[4-Иод-6-(4-метилпиперазин-1-ил) пиридин-3-ил]-2,2-диметилпропионамид. Раствор 30 г (108 ммолей) 2,2-диметил-N[6-(4-метилпиперазин-1-ил)пиридин-3-ил]пропионамида и 58 мл (380 ммолей) N,N,N',N'тетраметилэтилендиамина в атмосфере аргона в 650 мл тетрагидрофурана на бане с сухим льдом охлаждали до -78 С. По каплям в течение 1 ч вводили 239 мл (380 ммолей) 1,6 н. раствора нбутиллития в гексане. Реакционную смесь в течение ночи нагревали до -30 С. После повторного охлаждения до -78 С по каплям в течение 15 мин добавляли 43,6 г (170 ммолей) иода, растворенного в 60 мл тетрагидрофурана. Баню с сухим льдом заменяли ледяной баней и в течение 10 мин, когда температура реакционной смеси достигла 0 С, добавляли 90 г (363 ммоля) пентагидрата тиосульфата натрия в 250 мл воды. Далее добавляли 1000 мл диэтилового эфира и отделяли органический слой. Водный слой дважды экстрагировали 500 мл дихлорметана и объединенные органические слои сушили (над сульфатом магния) и упаривали. Экспрессхроматографией получали 18,5 г (выход 42%) указанного в заголовке соединения в виде светло-коричневого масла, которое при стоянии при комнатной температуре кристаллизовалось. МС, m/е (%): 403 (M+Н+, 100). г) 2,2-Диметил-N-[6-(4-метилпиперазин-1 ил)-4-о-толилпиридин-3-ил]пропионамид. Смесь 54 г (134 ммолей) N-[4-иод-6-(4 метилпиперазин-1-ил)пиридин-3-ил]-2,2 диметилпропионамида, 420 мл толуола, 150 мл 2 н. раствора карбоната натрия, 4,63 г (3,9 ммоля) тетракис(трифенилфосфин) палладия (0) и 20,16 г (147 ммолей) о-толилбороновой кислоты выдерживали в аргоне при 80 С в течение 12 ч. После охлаждения до комнатной температуры водную фазу отделяли и дважды промывали толуолом. Объединенные органические слои промывали 50 мл рассола, сушили (над сульфатом натрия), упаривали и сушили под вакуумом с получением в виде коричневого масла 49 г 20 д) 6-(4-Метилпиперазин-1-ил)-4-о-толилпиридин-3-иламин. Суспензию 56 г (152 ммоля) 2,2-диметилN-[6-(4-метилпиперазин-1-ил)-4-о-толилпиридин-3-ил]пропионамида в 1300 мл 3 н. раствора соляной кислоты в течение ночи выдерживали при 90-95 С. Реакционную смесь охлаждали до комнатной температуры, промывали тремя 500 миллилитровыми порциями диэтилового эфира и фильтровали через броунмиллерит. Фильтрат разбавляли 500 мл воды и добавлением 28%ного раствора гидроксида натрия с одновременным охлаждением льдом значение рН доводили до 7-8. Продукт экстрагировали четырьмя 1000 миллилитровыми порциями дихлорметана. Объединенные органические слои промывали 500 мл рассола, сушили (над сульфатом магния) и упаривали с получением в виде светлокоричневого масла 35 г (выход 82%) указанного в заголовке соединения. МС, m/e (%): 283 (М+Н+, 100). е) Метил-[6-(4-метилпиперазин-1-ил)-4-отолилпиридин-3-ил]амин. Раствор 35 г (124 ммолей) 6-(4 метилпиперазин-1-ил)-4-толилпиридин-3-иламина в 270 мл триметилортоформиата и 8 капель трифторуксусной кислоты в течение 3 ч выдерживали при 130 С. Реакционную смесь упаривали и в течение 30 мин сушили под вакуумом. Остаток в виде масла растворяли в 100 мл тетрагидрофурана и при охлаждении льдом по каплям добавляли к 9,4 г (248 ммолей) литийалюминийгидрида в 300 мл тетрагидрофурана. Реакционную смесь в течение 1 ч перемешивали при комнатной температуре, вновь охлаждали до 0 С и добавлением 28%-ного раствора соляной кислоты подкисляли до значения рН 12. После перемешивания в течение 5 мин 28%ный раствор гидроксида натрия добавляли до достижения рН 10. Раствор фильтровали через броунмиллерит, упаривали и очищали экспрессхроматографией с получением в виде светлокоричневого масла 23,6 г (выход 64%) указанного в заголовке соединения. МС, m/e (%): 297 (М+Н+, 100). ж) 2-(3,5-Бистрифторметилфенил)-N-метил-N-[6-(4-метилпиперазин-1-ил)-4-о-толилпиридин-3-ил]изобутирамид. Раствор 20 г (67,5 ммоля) метил-[6-(4 метилпиперазин-1-ил)-4-о-толилпиридин-3-ил] амина и 17,5 мл (101 ммоль) N-этилдиизопропиламина в 200 мл дихлорметана охлаждали на ледяной бане и по каплям вводили раствор 24 г (75 ммолей) 2-(3,5-бистрифторметилфенил)-2-метилпропионилхлорида в 50 мл дихлорметана. Реакционную смесь в течение 3 ч выдерживали при 35-40 С, вновь охлаждали до комнатной температуры и перемешивали с 250 мл насыщенного раствора бикарбоната натрия. Органический слой отделяли и водную фазу экстрагировали дихлорметаном. Объединенные органические слои сушили (над сульфатом маг 21 ния) и упаривали. Остаток очищали экспрессхроматографией с получением в виде белых кристаллов 31,6 г (выход 81%) указанного в заголовке соединения, tпл 155-157 С. МС, m/e (%): 579 (М+Н+, 100). з) Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-метил-N-[6-(4-метилпиперазин-1-ил)4-о-толилпиридин-3-ил]изобутирамида (2:1). В раствор 31,6 г (54,6 ммоля) 2-(3,5 бистрифторметилфенил)-N-метил-N-[6-(4 метилпиперазин-1-ил)-4-о-толилпиридин-3-ил] изобутирамида в 250 мл диэтилового эфира при охлаждении льдом вводили 60 мл 3 н. раствора соляной кислоты в диэтиловом эфире. После перемешивания в течение 15 мин при 0 С суспензию упаривали досуха, повторно суспендировали в 100 мл диэтилового эфира, фильтровали и сушили под вакуумом с получением в виде белых кристаллов 34,8 г (выход 98%) указанного в заголовке соединения.MC, m/e (%): 579 (М+Н+, 100). Пример 15. Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-[4-(2-хлорфенил)-6-(4-метилпиперазин-1-ил)пиридин-3-ил]-N-метилизобутирамида (2:1). Аналогично примеру 14 указанное в заголовке соединение получали с сопоставимым выходом в виде белых кристаллов с использованием на стадии г) о-хлорфенилбороновой кислоты вместо о-толилбороновой кислоты.MC, m/e (%): 599 (М+Н+, 100), 601 (М+Н+,43). Пример 16. Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-[4-(4-фтор-2-метилфенил)6-(4-метилпиперазин-1-ил)пиридин-3-ил]-Nметилизобутирамида (2:1). Аналогично примеру 14 указанное в заголовке соединение получали с сопоставимым выходом в виде белых кристаллов с использованием на стадии г) 4-фтор-2-метилфенилбороновой кислоты вместо о-толилбороновой кислоты.N,N,N',N'-тетраметилэтилендиамина в 2000 мл тетрагидрофурана на бане с сухим льдом охлаждали в токе аргона до -78 С. По каплям в течение 1 ч вводили 153 мл (1,53 ммоля) 10 н. раствора н-бутиллития в гексане. В течение последующих 2 ч реакционную смесь перемешивали при 0 С. После повторного охлаждения до(1,5 моля) иода, растворенного в 300 мл тетрагидрофурана. Баню с сухим льдом удаляли и реакционную смесь нагревали до комнатной 22 температуры в течение ночи. Перемешивание продолжали и добавляли 1000 мл воды и 1000 мл насыщенного раствора пентагидрата тиосульфата натрия. Водный слой отделяли и дважды экстрагировали 800 мл этилацетата. Объединенные органические слои сушили (над сульфатом магния) и упаривали. Хроматографической обработкой получали 75 г (выход 48%) указанного в заголовке соединения в виде коричневых кристаллов. МС, m/e (%): 305 (M+H+, 100). 6) N-[4-(2-Хлорфенил)пиридин-3-ил]-2,2 диметилпропионамид. Смесь 35 г (115 молей) 2,2-диметил-N-(4 иодпиридин-3-ил)ацетамида, 400 мл толуола,120 мл 2 н. раствора карбоната натрия, 4,0 г (3,5 ммоля) тетракис(трифенилфосфин)палладия (0) и 20,0 г (128 ммолей) о-хлорфенилбороновой кислоты выдерживали в аргоне при 80 С в течение 12 ч. После охлаждения до комнатной температуры водную фазу отделяли и дважды промывали толуолом. Объединенные органические слои промывали 50 мл рассола, сушили (над сульфатом магния) и упаривали. Остаток очищали экспресс-хроматографией с получением в виде белых кристаллов 21,6 г (выход 65%) указанного в заголовке соединения. МС, m/e (%): 289 (М+Н+, 100), 291 (М+Н+,40). в) 4-(2-Хлорфенил)пиридин-3-иламин. Суспензию 22,2 г (77 ммолей) N-[4-(2 хлорфенил)пиридин-3-ил]-2,2-диметилпропионамида в 730 мл 3 н. раствора соляной кислоты в течение ночи выдерживали при 90-95 С. Реакционную смесь охлаждали до комнатной температуры, промывали тремя 130-миллилитровыми порциями диэтилового эфира и добавляли 500 мл этилацетата. Добавлением 28%-ного раствора гидроксида натрия с одновременным охлаждением льдом значение рН водной фазы доводили до 7-8. Органическую фазу отделяли и продукт экстрагировали тремя 200-миллилитровыми порциями этилацетата. Объединенные органические слои сушили (над сульфатом магния) и упаривали с получением в виде белых кристаллов 14,9 г (выход 95%) указанного в заголовке соединения. МС, m/e (%): 205 (М+Н+, 100), 207 (М+Н+,39). г) [4-(2-Хлорфенил)пиридин-3-ил]метиламин. Раствор 14,9 г (72,8 ммоля) 4-(2-хлорфенил)пиридин-3-иламина в 80 мл триметилортоформиата и 5 капель трифторуксусной кислоты в течение 2,5 ч выдерживали при 130 С. Реакционную смесь упаривали и в течение 30 мин сушили под вакуумом. Остаток в виде масла растворяли в 130 мл тетрагидрофурана и с охлаждением льдом по каплям добавляли 220 мл(220 ммолей) 1 М борантетрагидрофуранового комплекса. После перемешивания реакционной смеси в течение ночи при комнатной темпера 23 туре ее упаривали, охлаждали до 0 С и осторожно добавляли 130 мл 5 н. раствора соляной кислоты в этаноле. Раствор кипятили с обратным холодильником в течение 1 ч, охлаждали до комнатной температуры и вновь добавляли дробленый лед. Водную фазу промывали тремя 100-миллилитровыми порциями диэтилового эфира и органические слои экстрагировали 100 мл 1 н. раствора соляной кислоты. Добавлением концентрированного раствора гидроксида натрия значение рН объединенных органических слоев доводили до 8-9 и их экстрагировали тремя 500-миллилитровыми порциями этилацетата. Объединенные органические экстракты сушили(над сульфатом магния), упаривали и твердый остаток перекристаллизовывали из смеси гексан/этилацетат с получением в виде белых кристаллов 12,3 г (выход 77%) указанного в заголовке соединения. МС, m/e (%): 219 (М+Н+, 100), 221 (М+Н+,42). д) 2-(3,5-Бистрифторметилфенил)-N-[4-(2 хлорфенил)пиридин-3-ил]-N-метилизобутирамид. Раствор 12,2 г (55,8 ммоля) [4-(2-хлорфенил)пиридин-3-ил]метиламина и 15,3 мл (89 ммолей) N-этилдиизопропиламина в 130 мл дихлорметана охлаждали на ледяной бане и по каплям вводили раствор 19 г (59,6 ммоля) 2(3,5-бистрифторметилфенил)-2-метилпропионилхлорида в 30 мл дихлорметана. Реакционную смесь в течение 20 ч выдерживали при 3540 С, вновь охлаждали до комнатной температуры и перемешивали с 250 мл насыщенного раствора бикарбоната натрия. Органический слой отделяли и водную фазу экстрагировали дихлорметаном. Объединенные органические слои сушили (над сульфатом магния) и упаривали. Остаток очищали экспресс-хроматографией с получением в виде белых кристаллов 24,7 г (выход 88%) указанного в заголовке соединения. МС, m/e (%): 501 (М+Н+, 100), 503 (М+Н+,36). г) Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-[4-(2-хлорфенил)пиридин-3-ил]-Nметилизобутирамида (1:1). В раствор 24,7 г (54,6 ммоля) 2-(3,5 бистрифторметилфенил)-N-[4-(2-хлорфенил) пиридин-3-ил]-N-метилизобутирамида в 100 мл диэтилового эфира при охлаждении льдом вводили 60 мл 3 н. раствора соляной кислоты в диэтиловом эфире. После перемешивания в течение 20 мин при 0 С суспензию упаривали досуха, повторно суспендировали в 100 мл диэтилового эфира, фильтровали и сушили под вакуумом с получением в виде белых кристаллов 26,3 г (выход 99%) указанного в заголовке соединения. tпл: 186-188 С. МС, m/е (%): 501 (M+H+, 100), 503 (М+Н+,36). 24 Пример 18. Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-метил-N-(4-о-толилпиридин-3-ил)изобутирамида (1:1). Аналогично примеру 17 указанное в заголовке соединение получали с сопоставимым выходом в виде белых кристаллов с использованием на стадии б) о-толилбороновой кислоты вместо о-хлорфенилбороновой кислоты. МС, m/e (%): 480 (М+, 5), 255 (25), 225(100). Пример 19. 2-(3,5-Бистрифторметилфенил)-N-(4-о-толилпиридин-3-ил)изобутирамид. Аналогично примеру 17 указанное в заголовке соединение получали с сопоставимым выходом в виде коричневого масла с использованием на стадии б) о-толилбороновой кислоты вместо о-хлорфенилбороновой кислоты. Стадию г) не проводили и гидрохлоридную соль не получали. МС, m/e (%): 467 (М+Н+, 100). Пример 20. Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-метил-N-(4-o-толилпиридин-3-ил)ацетамида (1:1). Аналогично примеру 17 указанное в заголовке соединение получали с сопоставимым выходом с использованием на стадии б) отолилбороновой кислоты вместо о-хлорфенилбороновой кислоты. Стадию д) осуществляли следующим образом. В раствор 511 мг (1,88 ммоля) 3,5 бис(трифторметил)фенилуксусной кислоты в 8 мл тетрагидрофурана при 0 С в виде одной порции вводили 305 мг (1,88 ммоля) 1,1'карбонилдиимидазола. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и добавляли 310 мг (1,56 ммоля) метил(4-о-толилпиридин-3-ил)амина. При 55 С перемешивание продолжали в течение ночи. Реакционную смесь упаривали и остаток очищали экспресс-хроматографией. Процесс получения гидрохлоридной соли проводили аналогично стадии е), в результате чего в виде желтых кристаллов получали 290 мг (выход 38%) указанного в заголовке соединения. МС, m/e (%): 453 (М+Н+, 100). Пример 21. Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-метил-R-(4-о-толилпиридин-3-ил)пропионамида (1:1). Аналогично примеру 17 указанное в заголовке соединение получали с сопоставимым выходом в виде белых кристаллов с использованием на стадии б) о-толилбороновой кислоты вместо о-хлорфенилбороновой кислоты и с использованием на стадии д) 2-(3,5-бистрифторметилфенил)пропионилхлорида вместо 2(3,5-бистрифторметилфенил)-2-метилпропионилхлорида. МС, m/e (%): 466 (М+, 5), 241 (12), 225(0,6 ммоля) N-этилдиизопропиламина в 4 мл дихлорметана вводили раствор 174 мг (0,3 ммоля) хлорангидрида 1-(3,5-бистрифторметилфенил)циклопропанкарбоновой кислоты в 1 мл дихлорметана. После кипячения с обратным холодильником в течение 72 ч реакционную смесь дважды промывали водой, сушили (над сульфатом магния) и упаривали. В результате хроматографии остатка (на силикагеле, этилацетат/гексан в соотношении 7:3) в виде желтого масла получали 132 мг (выход 66%) указанного в заголовке соединения. МС, m/e (%): 499 (М+Н, 100). б) Гидрохлорид [4-(2-хлорфенил)пиридин 3-ил]метиламида 1-(3,5-бистрифторметилфенил)циклопропанкарбоновой кислоты. В 125 мг [4-(2-хлорфенил)пиридин-3-ил] метиламида 1-(3,5-бистрифторметилфенил) циклопропанкарбоновой кислоты вводили 1,5 мл 3 н. соляной кислоты в метаноле. После упаривания раствора добавляли 3 мл диэтилового эфира и при 0 С суспензию перемешивали в течение 1 ч. В результате фильтрования в виде белых кристаллов получали 100 мг (выход 75%) указанного в заголовке соединения, tпл 194196 С. Пример 23. Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-метил-N-(6-морфолин-4 ил-4-о-толилпиридин-3-ил)изобутирамида(1,45:1). а) 4-(5-Нитро-2-пиридил)морфолин. В раствор 20 г (126 ммолей) 2-хлор-5 нитропиридина в 150 мл тетрагидрофурана в течение 10 мин по каплям вводили 27 мл (315 ммолей) морфолина. В течение последующих 2 ч реакционную смесь кипятили с обратным холодильником. После охлаждения до комнатной температуры под вакуумом удаляли растворитель и остаток вновь растворяли в 200 мл этилацетата. Органическую фазу промывали 200 мл 1 н. раствора бикарбоната натрия, сушили (над сульфатом магния) и упаривали с получением в виде желтого твердого вещества 27,3 г (количественный выход) указанного в заголовке соединения, tпл 142-143 С. б) 2,2-Диметил-N-(6-морфолин-4-илпиридин-3-ил)пропионамид. В раствор 27,3 г (126 ммолей) 4-(5-нитро 2-пиридил)морфолина в 600 мл метанола вводили 2,5 г 10%-него палладия на активированном древесном угле. При температуре в интервале от комнатной до примерно 45 С и под давлением 1 бар реакционную смесь гидрогенизовали до тех пор, пока не было поглощено теоретическое количество водорода (в течение примерно 3 ч). Катализатор отфильтровывали и дважды промывали 100-миллилитровыми порциями мета 003673 26 нола. Фильтрат упаривали под вакуумом с получением 22,6 г продукта в виде пурпурного масла, которое в соответствии с данными ТСХанализа примерно на 95% состояло из целевого анилинового производного. Этот сырой продукт растворяли в смеси 240 мл тетрагидрофурана и 60 мл диэтилового эфира. После охлаждения до 0 С в виде одной порции вводили 26 мл (189 ммолей) триэтиламина. Перемешивание продолжали, добавляя одновременно по каплям в течение 10 мин 23 г(189 ммолей) пивалоилхлорида. Ледяную баню удаляли и реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Далее под вакуумом удаляли растворитель и остаток суспендировали в 200 мл 1 н. раствора бикарбоната натрия. Продукт три раза экстрагировали 200-миллилитровыми порциями дихлорметана,сушили (над сульфатом натрия) и упаривали. В результате перекристаллизации твердого остатка из смеси этилацетат/гексан в соотношении 1:8 в виде белых кристаллов получали 28,6 г(выход 86%) указанного в заголовке соединения. МС, m/e (%): 264 (M+H+, 100). в) N-(4-Иод-6-морфолин-4-илпиридин-3 ил)-2,2-диметилпропионамид. Раствор 28,4 г (108 ммолей) 2,2-диметилN-(6-морфолин-4-илпиридин-3-ил)пропионамида и 49 мл (324 ммоля) N,N,N',N'-тетраметилэтилендиамина в атмосфере аргона в 600 мл тетрагидрофурана на бане с сухим льдом охлаждали до -78 С. По каплям в течение 1 ч вводили 202 мл (324 ммолей) 1,6 н. раствора нбутиллития в гексане. Реакционную смесь в течение ночи нагревали до -35 С. После повторного охлаждения до -78 С по каплям в течение 15 мин добавляли 37 г (146 ммолей) иода, растворенного в 60 мл тетрагидрофурана. Баню с сухим льдом заменяли ледяной баней и в течение 10 мин, когда температура реакционной смеси достигла 0 С, добавляли 90 г (363 ммоля) пентагидрата тиосульфата натрия в 250 мл воды. Далее добавляли 1000 мл диэтилового эфира и отделяли органический слой. Водный слой дважды экстрагировали 500 мл дихлорметана и объединенные органические слои сушили (над сульфатом магния) и упаривали. Экспрессхроматографией получали 15,6 г (выход 37%) указанного в заголовке соединения в виде светло-коричневого масла, которое при стоянии при комнатной температуре кристаллизовалось. МС, m/e (%): 389 (М+, 71), 358 (25), 304(43), 57 (100). г) 2,2-Диметил-N-(6-морфолин-4-ил-4-отолилпиридин-3-ил)пропионамид. Смесь 3,50 г (9,0 ммоля) N-(4-иод-6 морфолин-4-илпиридин-3-ил)-2,2-диметилпропионамида, 35 мл толуола, 18 мл 2 н. раствора карбоната натрия, 312 мг (0,27 ммоля) тетракис(трифенилфосфин) палладия(0) и 1,34 г (9,9 ммоля) о-толилбороновой кислоты выдержива 27 ли в аргоне при 80 С в течение 12 ч. После охлаждения до комнатной температуры водную фазу отделяли и дважды промывали этилацетатом. Объединенные органические слои промывали 50 мл рассола, сушили (над сульфатом натрия) и упаривали. В результате очистки экспресс-хроматографией в виде белой пены получали 3,23 г (количественный выход) указанного в заголовке соединения. МС, m/e (%): 354 (М+Н+, 100). д) 6-Морфолин-4-ил-4-о-толилпиридин-3 иламин. Суспензию 2,93 г (8,28 ммоля) 2,2-диметил-N-(6-морфолин-4-ил-4-о-толилпиридин-3 ил)пропионамида в 80 мл 3 н. раствора соляной кислоты и 5 мл 1-пропанола в течение ночи выдерживали при 90-95 С. Реакционную смесь охлаждали до комнатной температуры, промывали тремя 20-миллилитровыми порциями диэтилового эфира и фильтровали через броунмиллерит. Фильтрат разбавляли 20 мл воды и добавлением 28%-ного раствора гидроксида натрия с одновременным охлаждением льдом значение рН доводили до 7-8. Продукт экстрагировали четырьмя 100-миллилитровыми порциями дихлорметана. Объединенные органические слои промывали 50 мл рассола, сушили (над сульфатом магния) и упаривали с получением в виде белой пены 2,31 г (количественный выход) указанного в заголовке соединения. МС, m/е (%): 269 (М+, 100). е) Метил-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)амин. Раствор 2,24 г (8,3 ммоля) 6-морфолин-4 ил-4-о-толилпиридин-3-иламина в 17 мл триметилортоформиата и 3 каплях трифторуксусной кислоты в течение 2 ч выдерживали при 130 С. Реакционную смесь упаривали и в течение 30 мин сушили под вакуумом. Остаток в виде масла растворяли в 5 мл тетрагидрофурана и с охлаждением льдом по каплям добавляли к 630 мг(16,6 ммоля) алюмогидрида лития в 20 мл тетрагидрофурана. Реакционную смесь в течение 1 ч перемешивали при комнатной температуре,вновь охлаждали до 0 С и добавлением 28%ного раствора соляной кислоты подкисляли до значения рН 1-2. После перемешивания в течение 5 мин 28%-ный раствор гидроксида натрия добавляли до достижения рН 10. Раствор фильтровали через броунмиллерит, упаривали и очищали экспресс-хроматографией с получением в виде белой пены 1,56 г (выход 66%) указанного в заголовке соединения. МС, m/е (%): 283 (М+, 100). ж) 2-(3,5-Бистрифторметилфенил)-Nметил-N-(6-морфолин-4-ил-4-о-толилпиридин 3-ил)изобутирамид. Раствор 1,46 г (5,15 ммоля) метил-(6 морфолин-4-ил-4-о-толилпиридин-3-ил)амина и 1,32 мл (7,73 ммоля) N-этилдиизопропиламина в 15 мл дихлорметана охлаждали на ледяной бане 28 и по каплям вводили раствор 1,8 г (5,67 ммоля) 2-(3,5-бистрифторметилфенил)-2-метилпропионилхлорида. Реакционную смесь в течение 3 ч выдерживали при 35-40 С, вновь охлаждали до комнатной температуры и перемешивали с 25 мл насыщенного раствора бикарбоната натрия. Органический слой отделяли и водную фазу экстрагировали дихлорметаном. Объединенные органические слои сушили (над сульфатом магния) и упаривали. Остаток очищали экспрессхроматографией с получением в виде белых кристаллов 2,9 г (количественный выход) указанного в заголовке соединения, tпл 131-132 С. з) Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-метил-N-(6-морфолин-4-ил-4-отолилпиридин-3-ил)изобутирамида (1,45:1). В раствор 2,9 г (5,13 ммоля) 2-(3,5 бистрифторметилфенил)-N-метил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)изобутирамида в 50 мл диэтилового эфира при охлаждении льдом вводили 2,8 мл 3 н. раствора соляной кислоты в диэтиловом эфире. После перемешивания в течение 15 мин при 0 С суспензию упаривали досуха, повторно суспендировали в 100 мл диэтилового эфира, фильтровали и сушили под вакуумом с получением в виде белых кристаллов 2,82 г (выход 89%) указанного в заголовке соединения. МС, m/e (%): 566 (М+Н+, 100), 588 (М+Na+,11). Пример 24. Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-[4-(2-хлорфенил)-6-морфолин-4-илпиридин-3-ил]-N-метилизобутирамида(1:1). Аналогично примеру 23 указанное в заголовке соединение получали с сопоставимым выходом в виде белых кристаллов с использованием на стадии г) 2-хлорфенилбороновой кислоты вместо о-толилбороновой кислоты. МС, m/e (%): 586 (М+Н+, 100). Пример 25. 2-(3,5-Бистрифторметилфенил)-N-метил-N-6-[метил-(2-морфолин-4 илэтил)амино]-4-о-толилпиридин-3-илизобутирамид. Аналогично примеру 23 указанное в заголовке соединение получали с сопоставимым выходом в виде светло-коричневого масла с использованием на стадии а) 4-[2-(метиламино)] этилморфолина вместо морфолина. Гидрохлоридную соль не получали. МС, m/e (%): 623 (М+Н+, 100). Пример 26. 2-(3,5-Бистрифторметилфенил)-N-метил-N-[6-(4-пиримидин-2-илпиперазин-1-ил)-4-о-толилпиридин-3-ил]изобутирамид. Аналогично примеру 23 указанное в заголовке соединение получали с сопоставимым выходом в виде бесцветного масла с использованием на стадии а) 2-(1-пиперазинил)пиримидина вместо морфолина. Гидрохлоридную соль не получали. 29 Пример 27. 2-(3,5-Бистрифторметилфенил)-N-(6-морфолин-4-ил-4-о-толилпиридин-3 ил)изобутирамид. Алалогично примеру 23, но с исключением стадии е) и без получения гидрохлоридной соли,с сопоставимым выходом в виде белого порошка получали указанное в заголовке соединение.MC, m/e (%): 552 (М+Н+, 100). Пример 28. Гидрохлорид 2-(3,5-бистрифторметилфенил)-N-[4'-(2-хлорфенил)-3,4,5,6 тетрагидро-2 Н-[1,2']бипиридинил-5'-ил]-Nметилизобутирамида (1:1). Аналогично примеру 23 указанное в заголовке соединение получали с сопоставимым выходом в виде белого порошка с использованием на стадии а) пиперидина вместо морфолина и с использованием на стадии г) 2-хлорфенилбороновой кислоты вместо о-толилбороновой кислоты.(100). Пример 29. 2-(3,5-Бистрифторметилфенил)-N-(6-диметиламино-4-о-толилпиридин-3 ил)-N-метилизобутирамид. Аналогично примеру 23 указанное в заголовке соединение получали с сопоставимым выходом в виде белого твердого вещества с использованием на стадии а) диметиламингидрохлорида вместо морфолина. Гидрохлоридную соль не получали.MC, m/e (%): 524 (М+Н+, 100). Пример 30. 2-(3,5-Бистрифторметилфенил)-N-[4-(2-хлорфенил)-6-диметиламинопиридин-3-ил]изобутирамид. Аналогично примеру 23 указанное в заголовке соединение получали с сопоставимым выходом в виде белого твердого вещества с использованием на стадии а) диметиламингидрохлорида вместо морфолина и с использованием на стадии г) 2-хлорфенилбороновой кислоты вместо о-толилбороновой кислоты.MC, m/e (%): 544 (М+Н+, 100). Пример 31. 2-(3,5-Бистрифторметилфенил)-N-метил-N-(6-пиперазин-1-ил-4-о-толилпиридин-3-ил)изобутирамид. В раствор 100 мг (0,173 ммоля) 2-(3,5 бистрифторметилфенил)-N-метил-N-[6-(4-метилпиперазин-1-ил)-4-о-толилпиридин-3-ил] изобутирамида [пример 14 ж)] и 7 мг (0,035 ммоля) 1,8-бис(диметиламино)нафталина в 1 мл 1,2-дихлорэтана при 0 С вводили 26 мг (0,181 ммоля) 1-хлорэтилхлорформиата. После выдержки реакционной смеси в течение 1 ч при 80 С под вакуумом удаляли растворитель и полученный промежуточный продукт очищали экспресс-хроматографией, вновь растворяли в 1 мл метанола и в течение 3 ч кипятили с обратным холодильником. В результате экспрессхроматографии в виде белой пены получали 56MC, m/e (%): 565 (М+Н+, 100). Пример 32. 2-(3,5-Биcтpифтopмeтилфeнил)-N-(4-гидpoкcи-4-o-тoлил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-5'-ил)-N-метилизобутирамид. Аналогично примеру 23 указанное в заголовке соединение получали с сопоставимым выходом в виде белой пены с использованием на стадии а) 4-гидроксипиперидина вместо морфолина. Гидрохлоридную соль не получали.MC, m/e (%): 580 (М+Н+, 100). Пример 33. 2-(3,5-Бистрифторметилфенил)-N-6-[(2-гидроксиэтил)метиламино]-4-отолилпиридин-3-ил-N-метилизобутирамид Аналогично примеру 23 указанное в заголовке соединение получали с сопоставимым выходом в виде белой пены с использованием на стадии а) N-метилэтаноламина вместо морфолина. Гидрохлоридную соль не получали.MC, m/e (%): 554 (М+Н+, 100). Пример 34. (R)-2-(3,5-Бистрифторметилфенил)-N-[6-(3-гидроксипирролидин-1-ил)-4-отолилпиридин-3-ил]-N-метилизобутирамид. Аналогично примеру 23 указанное в заголовке соединение получали с сопоставимым выходом в виде белой пены с использованием на стадии а) (R)-3-гидроксипирролидина вместо морфолина. Гидрохлоридную соль не получали. МС, m/e (%): 566 (М+Н+, 100). Пример 35. 2-(3,5-Бистрифторметилфенил)-N-метил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)ацетамид. В раствор 300 мг (1,1 ммоля) 3,5 бис(трифторметил)фенилуксусной кислоты в 7 мл N,N-диметилформамида вводили 185 мг(1,14 ммоля) 1,1'-карбонилдиимидазола и раствор при комнатной температуре перемешивали в течение 30 мин. После добавления 283 мг (1 ммоля) метил(6-морфолин-4-ил-4-толилпиридин-3-ил)амина [как указано в описании стадии е) примера 23] реакционную смесь выдерживали в течение ночи при 90 С. После охлаждения до комнатной температуры под вакуумом удаляли растворитель и остаток вновь растворяли в 30 мл этилацетата. Органическую фазу промывали 2 порциями по 30 мл воды и рассолом, сушили (над сульфатом магния) и упаривали. В результате экспресс-хроматографии в виде коричневой пены получали 506 мг (выход 94%) указанного в заголовке соединения. МС, m/e (%): 538 (М+Н+, 100). Пример 36. 2-(3,5-Диметоксифенил)-Nметил-N-(6-морфолин-4-ил-4-о-толилпиридин 3-ил)ацетамид. В раствор 226 мг (1,15 ммоля) 3,5 диметоксифенилуксусной кислоты в 7 мл N,Nдиметилформамида вводили 244 мг (1,5 ммоля) 1,1'-карбонилдиимидазола и раствор при комнатной температуре перемешивали в течение 30 мин. После добавления 283 мг (1 ммоля) ме 31 тил(6-морфолин-4-ил-4-толилпиридин-3-ил) амина [как указано в описании стадии е) примера 23] реакционную смесь выдерживали в течение 7 ч при 70 С. После охлаждения до комнатной температуры под вакуумом удаляли растворитель и остаток вновь растворяли в 30 мл этилацетата. Органическую фазу промывали 2 порциями по 30 мл воды и рассолом, сушили(над сульфатом магния) и упаривали. В результате экспресс-хроматографии в виде белой пены получали 347 мг (выход 75%) указанного в заголовке соединения. МС, m/e (%): 462 (М+Н+, 100). Пример 37. 2-(3-Фтор-5-трифторметилфенил)-N-метил-N-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)ацетамид. В раствор 266 мг (1,2 ммоля) 3-фтор-5 трифторметилфенилуксусной кислоты в 7 млN,N-диметилформамида вводили 195 мг (1,2 ммоля) 1,1'-карбонилдиимидазола и раствор при комнатной температуре перемешивали в течение 30 мин. После добавления 283 мг (1 ммоля) метил(6-морфолин-4-ил-4-толилпиридин-3-ил) амина [как указано в описании стадии е) примера 23] реакционную смесь выдерживали в течение 6 ч при 90 С. После охлаждения до комнатной температуры под вакуумом удаляли растворитель и остаток вновь растворяли в 30 мл этилацетата. Органическую фазу промывали 2 порциями по 30 мл воды и рассолом, сушили (над сульфатом магния) и упаривали. В результате экспресс-хроматографии в виде светло-желтой пены получали 432 мг (выход 88%) указанного в заголовке соединения. МС, m/e (%): 488 (М+Н+, 100). Пример 38. Гидрохлорид [2-(3,5-бистрифторметилфенил)-2-метилпропил]-[4-(4-фтор-2 метилфенил)-6-(4-метилпиперазин-1-ил)пиридин-3-ил]метиламина (3:1). В смесь 400 мг (0,60 ммоля) гидрохлорида 2-(3,5-бистрифторметилфенил)-N-[4-(4-фтор-2 метилфенил)-6-(4-метилпиперазин-1-ил)пиридин-3-ил]-N-метилизобутирамида (2:1) (пример 16) и 50 мл дихлорметана вводили 20 мл 1 н. раствора гидроксида натрия. После встряхивания в течение 1 мин органическую фазу отделяли и упаривали досуха. Остаток вновь растворяли в 5 мл тетрагидрофурана и добавляли 4 мл 1 М раствора борантетрагидрофуранового комплекса. После выдержки при 60 С в течение 3 дней добавляли 10 мл 3 н. раствора соляной кислоты в диэтиловом эфире и реакционную смесь кипятили с обратным холодильником в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры, промывали 10 мл 1 н. раствора гидроксида натрия, сушили (над сульфатом натрия) и очищали экспресс-хроматографией, получая в виде бледно-желтого масла 279 мг продукта, который переводили в гидрохлоридную соль аналогично тому, как это указано в описании стадии з) примера 23, с получением в виде 32 бледно-желтых кристаллов 153 мг (выход 37%) указанного в заголовке соединения. МС, m/e (%): 583 (М+Н+, 100). Пример 39. (3,5-Бистрифторметилбензил) метил(4-о-толилпиридин-3-илметил)амин. 107 мг (2,82 ммоля, 3 экв.) алюмогидрида лития при 0 С в атмосфере аргона суспендировали в 7 мл тетрагидрофурана. При 5 С медленно вводили 1,425 мг (0,94 ммоля) N-(3,5 бистрифторметилбензил)-N-метил-4-о-толилникотинамида (пример 1), растворенного в 4 мл тетрагидрофурана. При комнатной температуре смесь перемешивали в течение 5 мин и в течение 1 ч кипятили с обратным холодильником. Добавляли 1 мл этилацетата, затем смесь охлаждали до комнатной температуры и по каплям добавляли насыщенный водный раствор сульфата натрия. Смесь сушили (над сульфатом натрия), фильтровали, концентрировали и очищали экспресс-хроматографией с получением в виде бесцветного масла 93 мг (выход 23%) указанного в заголовке соединения. МС, m/e (%): 439 (М+Н+, 100). Пример 40. 3-(3,5-Бистрифторметилбензилоксиметил)-4-о-толилпиридин. а) (4-о-Толилпиридин-3-ил)метанол. 439 мг (11,6 ммоля, 1 экв.) алюмогидрида лития при 0 С в атмосфере аргона суспендировали в 23 мл тетрагидрофурана. При -5 С медленно вводили 2,63 г (11,6 ммоля) метилового эфира 4-о-толилникотиновой кислоты, растворенного в 12 мл тетрагидрофурана. При комнатной температуре смесь перемешивали в течение 5 мин и в течение 1 ч кипятили с обратным холодильником. Добавляли 1 мл этилацетата, затем смесь охлаждали до комнатной температуры и по каплям добавляли насыщенный водный раствор сульфата натрия. Смесь сушили (над сульфатом натрия), фильтровали, концентрировали и очищали экспресс-хроматографией с получением в виде бледно-желтой жидкости 0,77 г (выход 33%) указанного в заголовке соединения. Таким путем выделяли 1,60 г (61%) исходного материала. МС, m/e (%): 199 (М+, 3), 180 (100). б) 3-(3,5-Бистрифторметилбензилоксиметил)-4-о-толилпиридин. 89,1 мг (2,04 ммоля, 1,1 экв.) гидрида натрия в атмосфере аргона дважды промывали нгексаном и суспендировали в 1 мл диметилформамида. По каплям вводили 370 мг (1,86 ммоля)(4-о-толилпиридин-3-ил)метанола, растворенного в 4 мл диметилформамида, и смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли 627 мг (2,04 ммоля, 1 экв.) 3,5 бис(трифторметил)бензилбромида, растворенного в 2 мл диметилформамида, и при комнатной температуре смесь перемешивали в течение 2,5 ч. Смесь концентрировали и остаток разделяли между водой и дихлорметаном. Органиче 33 ский экстракт промывали рассолом, сушили(над сульфатом натрия), фильтровали, концентрировали и очищали экспресс-хроматографией с получением в виде желтого масла 196 мг (выход 25%) указанного в заголовке соединения. Таким путем выделяли 0,24 г (65%) исходного материала. МС, m/е (%): 426 (М+Н+, 100). Пример 41. Гидрохлорид N-(3,5-бистрифторметилбензил)-N-метил-6-(4-метилпиперазин-1-ил)-4-нафталин-1-илникотинамида (2:1). Аналогично методике, описанной выше для получения N-(3,5-бистрифторметилбензил)N-метил-6-(4-метилпиперазин-1-ил)-4-о-толилникотинамида (пример 12), указанное в заголовке соединение получали с сопоставимым выходом в виде белого твердого вещества с использованием на стадии г) 1-нафтилбороновой кислоты вместо о-толилбороновой кислоты и с использованием на стадии д) N-метил-6-(4 метилпиперазин-1-ил)-4-нафталин-1-илникотинамида вместо N-метил-6-(4-метилпиперазин 1-ил)-4-о-толилникотинамида.(пример 13) в 6,3 мл сухого тетрагидрофурана вводили 2,73 мл (2,73 ммоля) 1 М боранового раствора в тетрагидрофуране. Смесь кипятили с обратным холодильником в течение 16 ч. После охлаждения до комнатной температуры добавляли 12,6 мл 3 н. раствора хлорида водорода в диэтиловом эфире и смесь кипятили с обратным холодильником в течение 40 мин. После охлаждения до комнатной температуры добавляли 1 н. водного раствора гидроксида натрия. В результате экстракции этилацетатом, сушки сульфатом натрия и концентрирования и последующей экспресс-хроматографии в виде бесцветного масла получали 165 мг продукта. В раствор этого последнего в 2 мл диэтилового эфира добавляли 3 мл 3 н. раствора хлорида водорода в диэтиловом эфире. После перемешивания смеси в течение 45 мин образовывался осадок, который собирали фильтрованием. Сушкой под вакуумом в виде белого твердого вещества получали 144 мг (выход 47,5%) указанного в заголовке соединения.MC, m/e (%): 557 (М+Н+, 100). Пример 43. трет-Бутиловый эфир 4-5[(3,5-бистрифторметилбензил)метилкарбамоил]-4-о-толилпиридин-2-илпиперазин-1 карбоновой кислоты. а) 6-Хлор-N-метил-4-о-толилникотинамид. В раствор 3,41 г (20,0 ммоля) 6-хлор-Nметилникотинамида [см. стадию а) примера 12] в 80 мл тетрагидрофурана при 0 С по каплям 34 вводили 50 мл (50 ммоля) 1 М раствора отолилмагнийхлорида в тетрагидрофуране. По завершении добавления реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1,5 ч. Смесь вновь охлаждали до 0 С с последующим добавлением по каплям 5,7 мл (100 ммолей) уксусной кислоты и раствора 5,1 г (22 ммоля) 2,3-дихлор-5,6 дициано-1,4-бензохинона в 18 мл тетрагидрофурана. После завершения операции добавления реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 15 мин. Добавляли 30 мл 2 н. водного раствора гидроксида натрия, а затем разбавляли 1 л этилацетата и 200 мл воды. Слои разделяли и органический слой промывали 4 порциями по 250 мл 2 н. водного раствора гидроксида натрия. Объединенные водные слои экстрагировали 3 порциями по 500 мл этилацетата. Объединенные органические экстракты промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом натрия. В результате концентрирования получали 5,44 г продукта в виде коричнево-красного масла. Экспрессхроматографией в виде светло-желтого твердого вещества получали 2,15 г (выход 41,3%) указанного в заголовке соединения. МС, m/e (%): 260(М+, 11), tпл: 91-93 С. б) трет-Бутиловый эфир 4-(5-метилкарбамоил-4-о-толилпиридин-2-ил)пиперазин-1 карбоновой кислоты. Смесь 8,31 г (31,9 ммоля) 6-хлор-N-метил 4-о-толилникотинамида, 6,53 г (35,0 ммоля) 1 трет-бутоксикарбонилпиперазина, 16,7 мл (95,6 ммоля) N-этилдиизопропиламина и каталитически эффективного количества 4-(N,N-диметиламино) пиридина в течение ночи кипятили с обратным холодильником. После охлаждения до комнатной температуры смесь растворяли в дихлорметане и промывали двумя порциями 0,1 н. водного раствора соляной кислоты. Сушкой над сульфатом натрия и концентрированием получали 10,7 г сырого продукта. В результате экспресс-хроматографии в виде не совсем белого твердого вещества получали 6,28 г (выход 48,0%) указанного в заголовке соединения. МС, m/e (%): 411 (М+Н+, 100). в) трет-Бутиловый эфир 4-5-[(3,5 бистрифторметилбензил)метилкарбамоил]-4-отолилпиридин-2-илпиперазин-1-карбоновой кислоты. В соответствии с методикой, описанной выше для получения N-(3,5-бис-трифторметилбензил)-N-метил-6-(4-метилпиперазин-1-ил)4-о-толилникотинамида [см. стадия д) примера 12], указанное в заголовке соединение получали с сопоставимым выходом в виде белого твердого вещества с использованием трет-бутилового эфира 4-(5-метилкарбамоил-4-о-толилпиридин 2-ил)пиперазин-1-карбоновой кислоты вместоMC, m/e (%): 637 (М+Н+, 100). Пример 44. Этиловый эфир 4-[5-[(3,5 бистрифторметилбензил)метилкарбамоил]-4-отолилпиридин-2-ил]пиперазин-1-илуксусной кислоты. Указанное в заголовке соединение получали в виде желтого твердого вещества с сопоставимым выходом для стадии б) и 3%-ным выходом продукта для стадии в) в соответствии с методами, описанными выше для получения трет-бутилового эфира 4-5-[(3,5-бистрифторметилбензил)метилкарбамоил]-4-о-толилпиридин-2-илпиперазин-1-карбоновой кислоты(пример 43), с использованием на стадии б) 1(этоксикарбонилметил)пиперазина вместо 1 трет-бутоксикарбонилпиперазина и с использованием на стадии в) этилового эфира [4-(5 метилкарбамоил-4-о-толилпиридин-2-ил)пиперазин-1-ил]уксусной кислоты вместо третбутилового эфира 4-(5-метилкарбамоил-4-отолилпиридин-2-ил)пиперазин-1-карбоновой кислоты.MC, m/e (%): 623 (М+Н+, 100). Пример 45. Этиловый эфир 5'-[(3,5 бистрифторметилбензил)метилкарбамоил]-4'-отолил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил 4-карбоновой кислоты. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения трет-бутилового эфира 4-5-[(3,5-бистрифторметилбензил)метилкарбамоил]-4-о-толилпиридин-2-илпиперазин-1-карбоновой кислоты(пример 43), с сопоставимым выходом с использованием на стадии б) этилизонипекотата вместо 1-трет-бутоксикарбонилпиперазина и на стадии в) этилового эфира 5'-метилкарбамоил 4'-о-толил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-карбоновой кислоты вместо третбутилового эфира 4-(5-метилкарбамоил-4-отолилпиридин-2-ил)пиперазин-1-карбоновой кислоты.N-(3,5-бистрифторметилбензил)-N-метил-6-(4-пропилпиперазин-1-ил)-4 о-толилникотинамид. Указанное в заголовке соединение получали в виде светло-желтого твердого вещества в соответствии с методикой, описанной выше для получения трет-бутилового эфира 4-5-[(3,5 бистрифторметилбензил)метилкарбамоил]-4-отолилпиридин-2-илпиперазин-1-карбоновой кислоты (пример 43), с сопоставимым выходом с использованием на стадии б) 1-пропилпиперазина вместо 1-третбутоксикарбонилпиперазина и на стадии в) N-метил-6-(4-пропилпиперазин-1-ил)-4-о-толилникотинамида вместо трет-бутилового эфира 4-(5-метилкарбамоил-4 о-толилпиридин-2-ил)пиперазин-1-карбоновой кислоты. МС, m/e (%): 579 (M+H+, 100). 36 Пример 47. (RS)-6-[3-(ацетилметиламино) пирролидин-1-ил]-N-(3,5-бис-трифторметилбензил)-N-метил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде светло-желтого твердого вещества в соответствии с методикой, описанной выше для получения трет-бутилового эфира 4-5-[(3,5 бистрифторметилбензил)метилкарбамоил]-4-отолилпиридин-2-илпиперазин-1-карбоновой кислоты (пример 43), с сопоставимым выходом с использованием на стадии б) (RS)-3-(ацетил метиламино)пирролидина вместо 1-третбутоксикарбонилпиперазина и с использованием на стадии в) (RS)-6-[3-(ацетилметиламино) пирролидин-1-ил]-N-метил-4-о-толилникотинамида вместо трет-бутилового эфира 4-(5-метилкарбамоил-4-о-толилпиридин-2-ил)пиперазин-1 карбоновой кислоты. МС, m/e (%): 593 (М+Н+, 100). Пример 48.N-(3,5-бистрифторметилбензил)-N-метил-6-[метил-(2-морфолин-4-илэтил)амино]-4-o-толилникотинамид. Указанное в заголовке соединение получали в виде светло-желтого твердого вещества в соответствии с методикой, описанной выше для получения трет-бутилового эфира 4-5-[(3,5 бистрифторметилбензил)метилкарбамоил]-4-отолилпиридин-2-илпиперазин-1-карбоновой кислоты (пример 43), с сопоставимым выходом с использованием на стадии б) метил-(2 морфолин-4-илэтил)амина вместо 1-третбутоксикарбонилпиперазина и с использованием на стадии в) N-метил-6-[метил-(2-морфолин 4-илэтил)амино]-4-о-толилникотинамида вместо трет-бутилового эфира 4-(5-метилкарбамоил-4 о-толилпиридин-2-ил)пиперазин-1-карбоновой кислоты. МС, m/e (%): 295 (M+H+, 100). Пример 49. N-(3,5-бистрифторметилбензил)-N-метил-6-морфолин-4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения трет-бутилового эфира 4-5-[(3,5-бистрифторметилбензил)метилкарбамоил]-4-о-толилпиридин-2-илпиперазин-1-карбоновой кислоты(пример 43), с сопоставимым выходом с использованием на стадии б) морфолина вместо 1-третбутоксикарбонилпиперазина и с использованием на стадии в) N-метил-6-морфолин-4-ил-4-отолилникотинамида вместо трет-бутилового эфира 4-(5-метилкарбамоил-4-о-толилпиридин 2-ил)пиперазин-1-карбоновой кислоты. МС, m/e (%): 538 (М+Н+, 100). Пример 50. N-(3,5-бистрифторметилбензил)-N-метил-6-тиоморфолин-4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения трет-бутилового эфира 4-[5-(3,5-бистри 37 фторметилбензил)метилкарбамоил]-4-о-толилпиридин-2-илпиперазин-1-карбоновой кислоты(пример 43), с сопоставимым выходом с использованием на стадии б) тиоморфолина вместо 1 трет-бутоксикарбонилпиперазина и с использованием на стадии в) N-метил-6-тиоморфолин-4 ил-4-о-толилникотинамида вместо трет-бутилового эфира 4-(5-метилкарбамоил-4-о-толилпиридин-2-ил)пиперазин-1-карбоновой кислоты. МС, m/e (%): 554 (М+Н+, 100). Пример 51. N-(3,5-бистрифторметилбензил)-N-метил-6-(1-оксо-14-тиоморфолин-4-ил)4-о-толилникотинамид. В раствор 1,24 г (2,24 ммоля) N-(3,5 бистрифторметилбензил)-N-метил-6-тиоморфолин-4-ил-4-о-толилникотинамида (пример 50) в 25 мл метанола при 0 С вводили 689 мг (1,12 ммоля) продукта Охоnе. По завершении операции введения реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1,5 ч. После прекращения реакции добавлением 5 мл 40%-ного водного раствора бисульфита натрия добавляли 6 мл 1 н. раствора гидроксида натрия для доведения значения рН до 7-8. Смесь разбавляли 50 мл воды и экстрагировали 3 порциями по 150 мл дихлорметана. Объединенные экстракты сушили над сульфатом натрия и концентрировали с получением 1,20 г сырого продукта. В результате экспресс-хроматографии в виде белого твердого вещества получали 1,02 г (выход 79,9%) указанного в заголовке соединения. МС, m/e (%): 570 (М+Н+, 100). Пример 52.N-(3,5-бистрифторметилбензил)-6-(1,1-диоксо-16-тиоморфолин-4-ил)N-метил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения N-(3,5-бистрифторметилбензил)-N-метил-6(1-оксо-14-тиоморфолин-4-ил)-4-о-толилникотинамида (пример 51), с сопоставимым выходом с использованием N-(3,5-бистрифторметилбензил)-N-метил-6-(1-оксо-14-тиоморфолин-4 ил)-4-о-толилникотинамида вместоN-(3,5 бистрифторметилбензил)-N-метил-6-тиоморфолин-4-ил)-4-о-толилникотинамида. МС, m/e (%): 586 (М+Н+, 100). Пример 53. N-(3,5-бистрифторметилбензил)-N-метил-6-пиперазин-1-ил-4-о-толилникотинамид. В раствор 6,60 г (104 ммоля) третбутилового эфира 4-5[(3,5-бистрифторметилбензил)метилкарбамоил]-4-о-толилпиридин 2-илпиперазин-1-карбоновой кислоты (пример 43) и 8,40 мл (207 ммолей) метанола в 50 мл этилацетата при 0 С по каплям вводили 14,7 мл(207 ммолей) ацетилхлорида. По прошествии 4 ч реакционную смесь разбавляли этилацетатом и обрабатывали 1 н. раствором гидроксида натрия. Слои разделяли и водный слой экстраги 003673 38 ровали дихлорметаном. Объединенные органические слои сушили над сульфатом натрия и концентрировали с получением 5,36 г сырого продукта. В результате экспресс-хроматографии в колонке получали 4,86 г (выход 87,4%) указанного в заголовке соединения в виде светлокоричневого твердого вещества. МС, m/е (%): 537 (М+Н+, 100). Пример 54.N-(3,5-бистрифторметилбензил)-6-[4-(2-гидроксиэтил)пиперазин-1-ил]N-метил-4-о-толилникотинамид. Смесь 100 мг (0,186 ммоля) N-(3,5 бистрифторметилбензил)-N-метил-6-пиперазин 1-ил-4-о-толилникотинамида (пример 53), 0,030 мл (0,42 ммоля) 2-бромэтанола и 46 мг (0,33 ммоля) карбоната калия в 2 мл ацетонитрила при 45 С перемешивали в течение 70 ч. После охлаждения до комнатной температуры добавляли 10 мл 1 н. раствора гидроксида натрия. Экстракцией 3 порциями по 15 мл этилацетата,сушкой над сульфатом натрия и концентрированном получали 138 мг сырого продукта. В результате экспресс-хроматографии в колонке получали 85 мг (выход 78,6%) указанного в заголовке соединения в виде белого твердого вещества. МС, m/e (%): 581 (М+Н+, 100). Пример 55. N-(3,5-Бистрифторметилбензил)-6-(4-цианометилпиперазин-1-ил)-N-метил 4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для полученияN-(3,5-бистрифторметилбензил)-6-[4-(2 гидроксиэтил)пиперазин-1-ил]-N-метил-4-отолилникотинамида (пример 54), с сопоставимым выходом с использованием хлорацетонитрила вместо 2-бромэтанола. МС, m/e (%): 576 (М+Н+, 100). Пример 56.N-(3,5-бистрифторметилбензил)-6-4-[2-(2-гидроксиэтокси)этил]пиперазин-1-ил-N-метил-4-о-толилникотинамид. Смесь 400 мг (0,746 ммоля) N-(3,5 бистрифторметилбензил)-N-метил-6-пиперазин 1-ил-4-о-толилникотинамида (пример 53), 0,18 мл (1,7 ммоля) 2-(2-хлорэтокси)этанола и 0,189 г (1,35 ммоля) карбоната калия в 8 мл ацетонитрила при 85 С перемешивали в течение 48 ч. После охлаждения до комнатной температуры добавляли 40 мл 1 н. раствора гидроксида натрия. Экстракцией 3 порциями по 60 мл дихлорметана, сушкой над сульфатом натрия и концентрированием получали 528 мг сырого продукта. В результате экспресс-хроматографии в колонке получали 300 мг (выход 64,4%) указанного в заголовке соединения в виде светлокоричневого твердого вещества. МС, m/e (%): 625 (М+Н+, 100). Пример 57. N-(3,5-бистрифторметилбензил)-N-метил-6-(4-[1,2,4]оксадиазол-3-илметилпиперазин-1-ил)-4-о-толилникотинамид.(0,56 ммоля) 3-(хлорметил)-1,2,4-оксадиазола и 62 мг (0,45 ммоля) карбоната калия в 4 мл ацетонитрила перемешивали в течение 1 ч при 45 С и при комнатной температуре в течение ночи. Реакционную смесь разбавляли 10 мл воды и экстрагировали 3 порциями по 30 мл дихлорметана. Сушкой над сульфатом натрия и концентрированием получали 244 мг сырого продукта. В результате экспресс-хроматографии в колонке получали 80 мг (выход 34,7%) указанного в заголовке соединения в виде красно-коричневого твердого вещества. МС, m/e (%): 619 (М+Н+, 100). Пример 58.N-(3,5-бистрифторметилбензил)-N-метил-6-[4-(5-оксо-4,5-дигидро-1 Н[1,2,4]триазол-3-илметил)пиперазин-1-ил]-4-отолилникотинамид. Смесь 800 мг (1,49 ммоля) N-(3,5 бистрифторметилбензил)-N-метил-6-пиперазин 1-ил-4-о-толилникотинамида (пример 53), 296 мг (1,79 ммоля) N-карбометокси-2-хлорацетамидразона и 0,52 мл (3,0 ммоля) N-этилдиизопропиламина в 14 мл ацетонитрила перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли 20 мл воды и экстрагировали 3 порциями по 50 мл дихлорметана. Объединенные экстракты сушили над сульфатом натрия и концентрировали. Остаток растворяли в 14 мл ДМФ и добавляли 0,29 мл(1,6 ммоля) N-этилдиизопропиламина. Реакционную смесь при 140 С перемешивали в течение ночи. Концентрированием и сушкой под высоким вакуумом получали 1,09 г сырого продукта. В результате экспресс-хроматографии в колонке получали 820 мг (выход 86,8%) указанного в заголовке соединения в виде светлокоричневого твердого вещества. МС, m/e (%): 634 (М+Н+, 100). Пример 59. N-(3,5-бистрифторметилбензил)-6-(4-формилпиперазин-1-ил)-N-метил-4-отолилникотинамид. В смесь 0,089 мл (1,1 ммоля) N,Nдиметилформамида и 38 мг (0,56 ммоля) имидазола при комнатной температуре по каплям вводили 0,071 мл (0,56 ммоля) триметилхлорсилана. Реакционную смесь охлаждали до 0 С и добавляли 0,10 г (0,19 ммоля) N-(3,5 бистрифторметилбензил)-N-метил-6-пиперазин 1-ил-4-о-толилникотинамида (пример 53). Баню из воды со льдом удаляли и смесь перемешивали в течение ночи. Реакцию прекращали добавлением смеси 2 мл 1 н. водного раствора соляной кислоты и 4 мл воды и смесь экстрагировали этилацетатом. Объединенные экстракты сушили над сульфатом натрия и концентрировали. В результате экспресс-хроматографии в колонке получали 81 мг (выход 82%) указанного в заголовке соединения в виде белого твердого вещества. 40 МС, m/e (%): 565 (М+Н+, 100). Пример 60. N-Метил-N-(2-метилнафталин 1-илметил)-6-морфолин-4-ил-4-о-толилникотинамид. а) N-Метил-6-морфолин-4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде не совсем белого твердого вещества в соответствии с методикой, описанной выше для получения трет-бутилового эфира 4-5-[(3,5 бистрифторметилбензил)метилкарбамоил]-4-отолилпиридин-2-илпиперазин-1-карбоновой кислоты [см. стадию б) примера 43], с сопоставимым выходом с использованием морфолина вместо 1-трет-бутоксикарбонилпиперазина. МС, m/e (%): 311 (M+, 63). 6) N-Метил-N-(2-метилнафталин-1-илметил)-6-морфолин-4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения N-(3,5-бистрифторметилбензил)-N-метил-6 морфолин-4-ил-4-о-толилникотинамида[см. стадию д) примера 12], с сопоставимым выходом с использованием 1-хлорметил-2-метилнафталина вместо 3,5-бистрифторметилбензилбромида. МС, m/e (%): 466 (М+Н+, 100). Пример 61. N-метил-6-морфолин-4-ил-Nнафталин-1-илметил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде бесцветного вязкого масла в соответствии с методикой, описанной выше для получения(пример 60), с сопоставимым выходом с использованием на стадии б) 1-хлорметилнафталина вместо 1-хлорметил-2-метилнафталина. МС, m/e (%): 452 (М+Н+, 100). Пример 62. N-(2-Метоксинафталин-1 илметил)-N-метил-6-морфолин-4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде бесцветного вязкого масла в соответствии с методикой, описанной выше для получения(пример 60), с сопоставимым выходом с использованием на стадии б) 2-метоксинафталин-1 илметилового эфира толуол-4-сульфоновой кислоты вместо 1-хлорметил-2-метилнафталина. МС, m/e (%): 482 (М+Н+, 100). Пример 63. N-(2-Метоксибензил)-N-метил 6-морфолин-4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде бесцветного вязкого масла в соответствии с методикой, описанной выше для получения(пример 60), с сопоставимым выходом с использованием на стадии б) 2-метоксибензилхлорида вместо 1-хлорметил-2-метилнафталина. 41 МС, m/e (%): 432 (М+Н+, 100). Пример 64. N-(5-Хлор-2-метоксибензил)N-метил-6-морфолин-4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения N-метил-N-(2-метилнафталин-1-илметил)-6 морфолин-4-ил-4-о-толилникотинамида (пример 60), с сопоставимым выходом с использованием на стадии б) 5-хлор-2-метоксибензилхлорида вместо 1-хлорметил-2-метилнафталина. МС, m/е (%): 466 (М+Н+, 100). Пример 65. N-(2-Хлор-5-метоксибензил)N-метил-6-морфолин-4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения N-метил-N-(2-метилнафталин-1-илметил)-6 морфолин-4-ил-4-о-толилникотинамида (пример 60), с сопоставимым выходом с использованием на стадии б) 2-хлор-5-метоксибензилбромида вместо 1-хлорметил-2-метилнафталина. МС, m/e (%): 466 (М+Н+, 100). Пример 66. N-Метил-6-морфолин-4-ил-Nпентафторфенилметил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения N-метил-N-(2-метилнафталин-1-илметил)-6 морфолин-4-ил-4-о-толилникотинамида (пример 60), с сопоставимым выходом с использованием на стадии б) 2,3,4,5,6-пентафторбензилбромида вместо 1-хлорметил-2-метилнафталина. МС, m/e (%): 492 (М+Н+, 100). Пример 67. N-Метил-6-морфолин-4-ил-Nнафталин-2-илметил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения N-метил-N-(2-метилнафталин-1-илметил)-6 морфолин-4-ил-4-о-толилникотинамида (пример 60), с сопоставимым выходом с использованием на стадии б) 2-хлорметилнафталина вместо 1 хлорметил-2-метилнафталина. МС, m/е (%): 452 (M+H+, 100). Пример 68. N-[2-Метокси-5-(5-трифторметилтетразол-1-ил)бензил]-N-метил-6-морфолин 4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде белого твердого вещества в соответствии с методикой, описанной выше для получения N-метил-N-(2-метилнафталин-1-илметил)-6 морфолин-4-ил-4-о-толилникотинамида (пример 60), с сопоставимым выходом с использованием на стадии б) 42 МС, m/e (%): 568 (M+H+, 100). Пример 69. N-(1,4-Диметоксинафталин-2 илметил)-N-метил-6-морфолин-4-ил-4-о-толилникотинамид. Указанное в заголовке соединение получали в виде бесцветного вязкого масла в соответствии с методикой, описанной выше для получения(пример 60), с сопоставимым выходом с использованием на стадии б) 2-хлорметил-1,4-диметоксинафталина вместо 1-хлорметил-2-метилнафталина. МС, m/e (%): 512 (М+Н+, 100). Пример 70. 5'-[(3,5-Бистрифторметилбензил)метилкарбамоил]-4'-о-толил-3,4,5,6-тетрагидро-2 Н-[1,2']бипиридинил-4-карбоновая кислота. Смесь 200 мг (0,33 ммоля) этилового эфира 5'-[(3,5-бистрифторметилбензил)метилкарбамоил]-4'-о-толил-3,4,5,6-тетрагидро-2 Н[1,2']бипиридинил-4-карбоновой кислоты (пример 45), 10 мл 1 н. водного раствора гидроксида натрия и 10 мл метанола при комнатной температуре перемешивали в течение ночи. После промывки 2 порциями этилацетата добавлением 1 н. водного раствора соляной кислоты водный слой подкисляли до рН 4. В результате экстракции дихлорметаном, сушки над сульфатом натрия и экспресс-хроматографии в колонке получали 81 мг (выход 42%) указанного в заголовке соединения в виде белого твердого вещества. МС, m/e (%): 580 (М+Н+, 100). Пример 71. N-(3,5-Бистрифторметилбензил)-N-метил-6-[4-(1 Н-тетразол-5-илметил)пиперазин-1-ил]-4-о-толилникотинамид. Смесь 0,10 г (0,17 ммоля) N-(3,5 бистрифторметилбензил)-6-(4-цианометилпиперазин-1-ил)-N-метил-4-о-толилникотинамида(пример 55), 34 мг (0,52 ммоля) азида натрия и 36 мг (0,26 ммоля) триэтиламмонийхлорида в 1 мл 1-метил-2-пирролидона в течение 2 ч кипятили с обратным холодильником. После охлаждения до комнатной температуры добавляли 6 мл воды со льдом. Добавлением 1 н. раствора соляной кислоты смесь подкисляли до рН 1-2 и экстрагировали дихлорметаном. В результате сушки объединенных экстрактов над сульфатом натрия,концентрирования и экспрессхроматографии в колонке получали 95 мг (выход 88%) указанного в заголовке соединения в виде светло-коричневого твердого вещества. МС, m/e (%): 619 (М+Н+, 100). Пример 72. N-(6-Бензиламино-4-о-толилпиридин-3-ил)-2-(3,5-бистрифторметилфенил)N-метилизобутирамид. а) 2-Бензил-N-5-метил-4-о-толилпиридин 2,5-диамин. Указанное в заголовке соединение получали аналогично методике, описанной выше для синтеза метил-(6-морфолин-4-ил-4-о-толилпиридин-3-ил)амина [см. стадию е) примера 23].N-этилдиизопропиламина при 0 С по каплям вводили раствор 2,1 мл (14,09 ммоля) бензилформиата в 50 мл дихлорметана. После перемешивания при комнатной температуре в течение 2 ч реакционную смесь промывали 2 порциями по 50 мл воды, 50 мл рассола, сушили (над сульфатом магния) и упаривали. В результате хроматографии в виде светло-коричневых кристаллов получали 2,36 г (выход 80%) указанного в заголовке соединения, tпл 110-112 С. МС, m/e (%): 438 (М+Н+, 100). в) Бензиловый эфир бензил-5-2-(3,5 бистрифторметилфенил)-2-метилпропионил]метиламино]-4-о-толилпиридин-2-илкарбаминовой кислоты. В раствор 1,075 г (2,5 ммоля) бензилового эфира бензил(5-метиламино-4-о-толилпиридин 2-ил)карбаминовой кислоты в 10 мл дихлорметана и 1 мл N-этилдиизопропиламина при 0 С по каплям вводили раствор 1,15 г (3,5 ммоля) хлорангидрида 2-(3,5-бистрифторметилфенил)2-метилпропионовой кислоты в 2 мл дихлорметана и смесь перемешивали при комнатной температуре в течение 3 ч. Раствор промывали 20 мл воды, 20 мл насыщенного водного раствора бикарбоната натрия и 20 мл рассола, сушили(над сульфатом магния) и упаривали. В результате хроматографии в виде желтого масла получали 1,15 г (выход 62%) указанного в заголовке соединения. МС, m/e (%): 720 (М+Н+, 100). г) N-(6-Бензиламино-4-о-толилпиридин-3 ил)-2-(3,5-бистрифторметилфенил)-N-метилизобутирамид. В раствор 973 мг (1,35 ммоля) бензилового эфира бензил-52-(3,5-бис-трифторметилфенил)-2-метилпропионил]метиламино]-4-отолилпиридин-2-илкарбаминовой кислоты в 13 мл метанола и 1 мл N,N-диметилформамида вводили 40 мг 10%-ного палладия на активированном древесном угле и при комнатной температуре и под давлением 1 бар смесь гидрогенизовали в течение 1 ч. В результате отфильтровывания катализатора и упаривания фильтрата в виде желтого масла получали 795 мг (количественный выход) указанного в заголовке соединения. МС, m/e (%): 586 (М+Н+, 100). Пример 73. N-(6-Амино-4-о-толилпиридин-3-ил)-2-(3,5-бистрифторметилфенил)-Nметилизобутирамид. Раствор 750 мг (1,28 ммоля) N-(6 бензиламино-4-о-толилпиридин-3-ил)-2-(3,5 бистрифторметилфенил)-N-метилизобутирамида [см. стадию г) примера 73] в 25 мл 5 н. рас 003673 44 твора соляной кислоты в этаноле упаривали досуха, а остаток растворяли в 30 мл метанола и при комнатной температуре и под давлением 10 бар гидрогенизовали в присутствии 60 мг 10%ного палладия на древесном угле в течение 20 ч. После отфильтровывания катализатора и упаривания растворителя остаток растворяли в 30 мл этилацетата, дважды промывали насыщенным водным раствором бикарбоната натрия и сушили (над сульфатом магния). В результате упаривания раствора в виде светло-коричневых кристаллов получали 514 мг (выход 81%) указанного в заголовке соединения. МС, m/e (%): 496 (М+Н+, 100). Пример 74. 2-(3,5-Бистрифторметилфенил)-N-[6-(диметиламинометиленамино)-4-отолилпиридин-3-ил]-N-метилизобутирамид. В раствор 100 мг (0,2 ммоля) N-(6-амино 4-о-толилпиридин-3-ил)-2-(3,5-бистрифторметилфенил)-N-метилизобутирамида (пример 73) в 4 мл N,N-диметилформамида при 0 С вводили в виде 60%-ной дисперсии в масле 11 мг (0,252 ммоля) гидрида натрия и смесь без охлаждения перемешивали в течение 30 мин. Далее при 0 С добавляли 28 мкл (0,218 ммоля) бензолсульфонилхлорида и при комнатной температуре раствор перемешивали в течение ночи. Реакционную смесь вводили в воду и экстрагировали 3 порциями по 10 мл этилацетата. Объединенные экстракты промывали 3 порциями по 20 мл воды, 20 мл рассола, сушили (над сульфатом магния) и упаривали. В результате хроматографии остатка в виде белой пены получали 51 мг (выход 46%) указанного в заголовке соединения. МС, m/e (%): 551 (М+Н+, 100). Пример 75. 2-(3,5-Бистрифторметилфенил)-N-(6-метансульфониламино-4-о-толилпиридин-3-ил)-N-метилизобутирамид. В раствор 100 мг (0,2 ммоля) N-(6-амино 4-о-толилпиридин-3-ил)-2-(3,5-бистрифторметилфенил)-N-метилизобутирамида (пример 73) в 2 мл пиридина вводили 27 мкл (0,35 ммоля) метансульфонилхлорида и при комнатной температуре смесь перемешивали в течение ночи. После выпаривания растворителя остаток растворяли в этилацетате, дважды промывали насыщенным водным раствором бикарбоната натрия и рассолом и сушили (над сульфатом магния). В результате хроматографии остатка получали 24 мг (выход 42%) указанного в заголовке соединения в виде белой пены. МС, m/е (%): 574 (М+Н+, 100). Пример 76. N-(6-Бензолсульфониламино 4-о-толилпиридин-3-ил)-2-(3,5-бис-трифторметилфенил)-N-метилизобутирамид. В раствор 100 мг (0,2 ммоля) N-(6-амино 4-о-толилпиридин-3-ил)-2-(3,5-бистрифторметилфенил)-N-метилизобутирамида в 4 мл дихлорметана и 85 мкл N-этилдиизопропиламина вводили 56 мкл (0,436 ммоля) бензолсульфонилхлорида и при комнатной температуре смесь перемешивали в течение ночи. Реакци 45 онную смесь дважды промывали насыщенным водным раствором бикарбоната натрия и сушили (над сульфатом магния). В результате хроматографии остатка получали 26 мг (выход 28%) указанного в заголовке соединения в виде белой пены. МС, m/e (%): 634 (М+Н+, 100). Пример А. По обычной технологии изготавливают таблетки следующего состава: мг/ таблетку Действующее вещество 5 Лактоза 45 Кукурузный крахмал 15 Микрокристаллическая целлюлоза 34 Стеарат магния 1 Масса таблетки 100 Пример Б. Изготавливают капсулы с содержимым следующего состава: мг/ капсулу Действующее вещество 10 Лактоза 155 Кукурузный крахмал 30 Тальк 5 Масса наполненной капсулы 200 Действующее вещество, лактозу и кукурузный крахмал вначале смешивают в смесителе, а затем в измельчительной установке. Смесь возвращают в смеситель, добавляют в нее тальк и тщательно перемешивают. Готовой смесью наполняют твердые желатиновые капсулы. Пример В. Изготавливают суппозитории следующего состава: мг/ суппозиторий Действующее вещество 15 Основа для суппозитория 1285 Общая масса 1300 Основу для суппозитория плавят в стеклянном или стальном сосуде, тщательно перемешивают и охлаждают до 45 С. На этом этапе в нее добавляют тонкодисперсное порошкообразное действующее вещество и перемешивают до его полного диспергирования. Смесь выливают в формы для суппозиториев приемлемого размера, оставляют остывать, а затем суппозитории извлекают из форм и индивидуально упаковывают в вощеную бумагу или металлическую фольгу. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы I, в которойR обозначает водород, (низш.)алкил,(низш.)алкокси, галоген или трифторметил,R1 обозначает водород или галоген либоR и R1 совместно могут образовывать группу -СН=СН-СН=СН-,R2 и R2', каждый независимо друг от друга,обозначает водород, галоген, трифторметил,(низш.)алкокси или цианогруппу либо R2 и R2' совместно могут образовывать группу -СН=СНСН=СН-, необязательно замещенную одним или двумя заместителями,выбранными из-N(R )(СН 2)n-ОН,-N(R )S(O)2-(низш.)алкил,-N(R5)S(O)2-фенил, -N=CHN(R5)2, -N(R5)С(O)R5 или циклический третичный амин, необязательно связанный посредством группы -(CH2)nN(R5)и представляющий собой пиррол-1-ил, имидазол-1-ил, пиперидин-1-ил, пиперазин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, 1-оксотиоморфолин-4-ил или 1,1-диоксотиоморфолин-4 ил;R5 в каждом случае независимо обозначает водород,С 3-С 6 циклоалкил,бензил или(низш.)алкил,R6 обозначает водород,гидроксил,(низш.)алкил, -(СН 2)nСОО-(низш.)алкил, -N(R5) СО-(низш.)алкил, гидрокси-(низш.)алкил, цианогруппу, -(СН 2)nО(СH2)nОH, -СНО или гетероциклическую группу, необязательно связанную посредством алкиленовой группы и представляющую собой пиридинил, пиримидинил, оксадиазолил, триазолил, тетразолил, тиазолил, тиенил, фурил, пиранил, пирролил, имидазолил,пиразолил, изотиазолил, пиперазинил или пиперидил; Х обозначает -C(O)N(R5)-, -(СН 2)mО-,-(СН 2)mN(R5)-, -N(R5)C(O)- или -N(R5)(СН 2)m-,n обозначает 0-4 и m обозначает 1 или 2,причем (низш.)алкил обозначает прямую или разветвленную С 1-С 7 алкильную группу, а(низш.)алкокси означает алкоксигруппу, содержащую прямой или разветвленный С 1 С 7 алкильный остаток,и их фармацевтически приемлемые кислотно-аддитивные соли. 2. Соединение по п.1, у которого Х обозначает -C(O)N(R5)-, a R5 обозначает метил, этил или циклопропил. 3. Соединение по п.2, которое представляет собойN-метил-N-(2-метилнафталин-1-илметил)6-морфолин-4-ил-4-о-толилникотинамид. 4. Соединение по п.1, у которого Х обозначает -N(R5)C(O)-, a R5 обозначает водород или метил. 5. Соединение по п.4, которое представляет собой 2-(3,5-бистрифторметилфенил)-N-метилN-[6-(4-метилпиперазин-1-ил)-4-о-толилпиридин-3-ил]изобутирамид,2-(3,5-бистрифторметилфенил)-N-[4-(2 хлорфенил)-6-(4-метилпиперазин-1-ил)пиридин-3-ил]-N-метилизобутирамид,2-(3,5-бистрифторметилфенил)-N-[4-(4 фтор-2-метилфенил)-6-(4-метилпиперазин-1 ил)пиридин-3-ил]-N-метилизобутирамид,2-(3,5-бистрифторметилфенил)-N-[4-(2 хлорфенил)пиридин-3-ил]-N-метилизобутирамид,2-(3,5-бистрифторметилфенил)-N-метилN-(4-о-толилпиридин-3-ил)изобутирамид,2-(3,5-бистрифторметилфенил)-N-(4-отолилпиридин-3-ил)изобутирамид,2-(3,5-бистрифторметилфенил)-N-метилN-(4-о-толилпиридин-3-ил)ацетамид,2-(3,5-бистрифторметилфенил)-N-метилN-(4-о-толилпиридин-3-ил)пропионамид,2-(3,5-бистрифторметилфенил)-N-метилN-(6-морфолин-4-ил-4-о-толилпиридин-3 ил)изобутирамид,2-(3,5-бистрифторметилфенил)-N-[4-(2 хлорфенил)-6-морфолин-4-илпиридин-3-ил]-Nметилизобутирамид,2-(3,5-бистрифторметилфенил)-N-метилN-6-[метил-(2-морфолин-4-илэтил)амино]-4-отолилпиридин-3-илизобутирамид,2-(3,5-бистрифторметилфенил)-N-метилN-[6-(4-пиримидин-2-илпиперазин-1-ил)-4-отолилпиридин-3-ил]изобутирамид,2-(3,5-бистрифторметилфенил)-N-(6 морфолин-4-ил-4-о-толилпиридин-3-ил)изобутирамид,2-(3,5-бистрифторметилфенил)-N-[4-(2 хлорфенил)-6-диметиламинопиридин-3-ил]изобутирамид,2-(3,5-бистрифторметилфенил)-N-метилN-(6-пиперазин-1-ил-4-о-толилпиридин-3-ил) изобутирамид,2-(3,5-бистрифторметилфенил)-N-(4-гидрокси-4'-о-толил-3,4,5,6-тетрагидро-2 Н-[1,2'] бипиридинил-5'-ил)-N-метилизобутирамид, 49[2-(3,5-бистрифторметилфенил)-2-метилпропил]-[4-(4-фтор-2-метилфенил)-6-(4-метилпиперазин-1-ил)пиридин-3-ил]метиламин. 6. Лекарственное средство, включающее одно или несколько соединений по любому из 50 пп.1-5 и фармацевтически приемлемые наполнители. 7. Лекарственное средство по п.6 для лечения заболеваний, связанных с антагонистами рецептора NK-1. 8. Применение соединения по любому из пп.1-5 для лечения заболеваний, связанных с антагонистами рецептора NK-1. 9. Применение соединения по любому из пп.1-5 при приготовлении лекарственных средств, включающих одно или несколько соединений формулы I, для лечения заболеваний,связанных с антагонистами рецептора NK-1.
МПК / Метки
МПК: A61K 31/44, C07D 213/30, A61P 11/06
Метки: лекарственное, производные, средство, 4-фенилпиридина, применение
Код ссылки
<a href="https://eas.patents.su/26-3673-proizvodnye-4-fenilpiridina-ih-primenenie-lekarstvennoe-sredstvo.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 4-фенилпиридина, их применение, лекарственное средство</a>
Предыдущий патент: Препарат в виде порошка для введения через слизистую оболочку, содержащий лекарственное средство с высокой молекулярной массой
Следующий патент: Биспиперидины в качестве противотромботических агентов, их применение, способ их получения (варианты), промежуточные продукты и терапевтическая композиция
Случайный патент: Производные 3-циклоалкиламинопирролидина в качестве модуляторов рецепторов хемокинов












