Производные аминоциклоалкилпирролидона и антибактериальное лекарственное средство на их основе
Номер патента: 3321
Опубликовано: 24.04.2003
Авторы: Мияути Сатору, Оки Хитоси, Кимура Кенити, Кимура Юити, Такемура Макото, Такахаси Хисаси
Формула / Реферат
1. Соединение, представленное формулой (I)
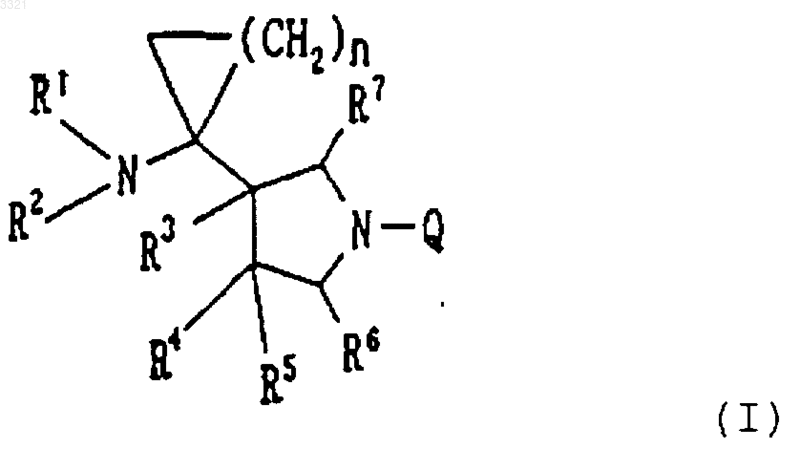
где заместитель R1 представляет собой атом водорода;
заместитель R2 представляет собой атом водорода;
заместитель R3 представляет собой атом водорода;
каждый из заместителей R4 и R5 независимо друг от друга представляет собой атом водорода, атом галогена, алкильную группу, содержащую от 1 до 6 атомов углерода, или алкоксигруппу, содержащую от 1 до 6 атомов углерода, которая может быть замещена гидроксильной группой;
n принимает целые значения от 1 до 3; и Q представляет собой неполную структуру формулы (II)
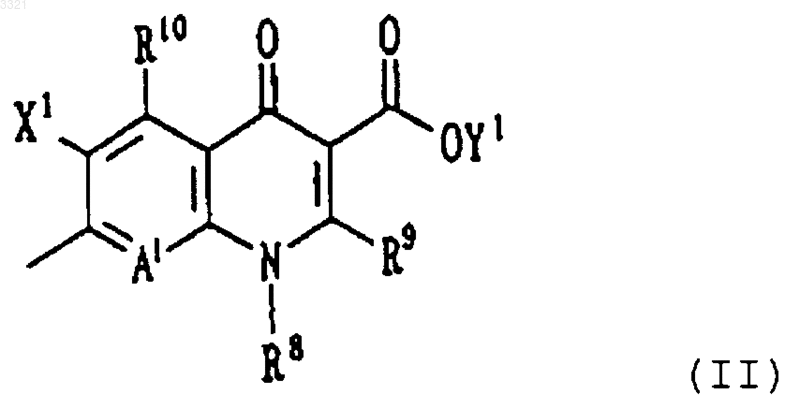
где заместитель R8 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, галогеналкильную группу, содержащую от 1 до 6 атомов углерода, или циклическую алкильную группу, содержащую от 3 до 6 атомов углерода, которая может иметь заместитель(и);
заместитель R9 представляет собой атом водорода;
заместитель X1 представляет собой атом галогена или атом водорода;
заместитель R10 представляет собой атом водорода или аминогруппу;
A1 представляет собой атом азота или неполную структуру, представленную формулой (III)

где X2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода, или алкоксильную группу, содержащую от 1 до 6 атомов углерода; и
заместители X2 и R8 могут быть объединены с образованием циклической структуры, включающей часть основного ядра, и кольцо может содержать атом кислорода в качестве атома, образующего кольцо, и может дополнительно иметь в качестве заместителя алкильную группу, содержащую от 1 до 6 атомов углерода; и
заместитель Y1 представляет собой атом водорода или неполную структуру, представленную формулой (IV)
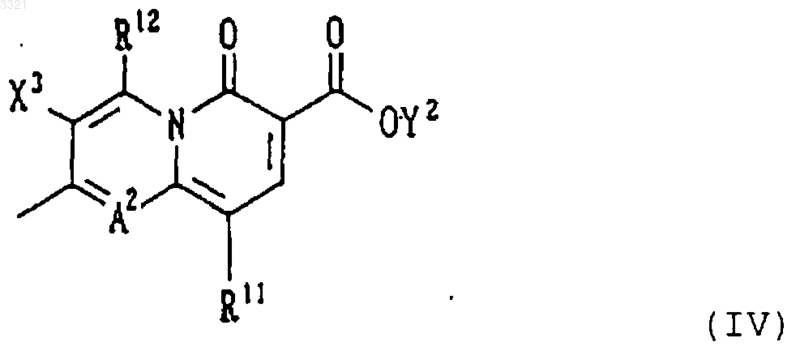
где заместитель R11 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, галогеналкильную группу, содержащую от 1 до 6 атомов углерода, или циклическую алкильную группу, содержащую от 3 до 6 атомов углерода, которая может иметь заместитель(и);
заместитель R12 представляет собой атом водорода или аминогруппу;
заместитель X3 представляет собой атом галогена или атом водорода;
A2 представляет собой атом азота или неполную структуру, представленную формулой (V)

где X4 представляет собой атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода, или алкоксильную группу, содержащую от 1 до 6 атомов углерода, и
заместитель Y2 представляет собой атом водорода;
и его соли и гидраты.
2. Соединение, его соли и гидраты по п.1, где Q в формуле (I) представляет собой структуру формулы (III).
3. Соединение, его соли и гидраты по п.2, где заместитель R8 представляет собой галогенциклопропильную группу.
4. Соединение, его соли и гидраты по п.1, где галогенциклопропильная группа в формуле (I) представляет собой 1,2-цис-2-галогенциклопропильную группу.
5. Соединение, его соли и гидраты по пп.2, 3 или 4, где галогенциклопропильная группа в формуле (I) представляет собой стереохимически чистый заместитель.
6. Соединение, его соли и гидраты по п.5, где галогенциклопропильная группа в формуле (I) представляет собой (1R,2S)-2-галогенциклопропильную группу.
7. Соединение, его соли и гидраты по п.6, где атом галогена в галогенциклопропильной группе в формуле (I) представляет собой атом фтора.
8. Соединение, его соли и гидраты по п.7, где соединение формулы (I) представляет собой стереохимически чистое соединение.
9. Соединение, его соли и гидраты по п.1, имеющее структурную формулу
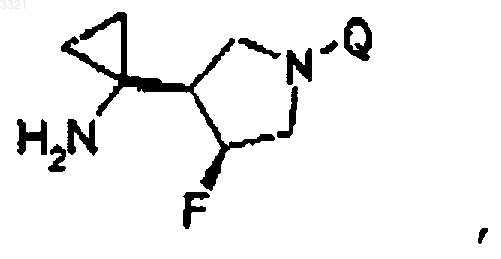
где Q выбран из частичной структуры, выбранной из
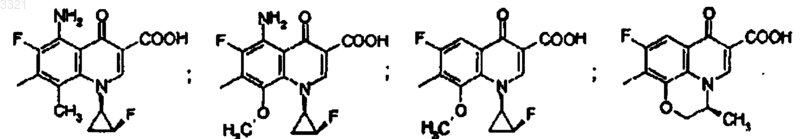
10. Соединение, его соли и гидраты по п.1, имеющее структурную формулу
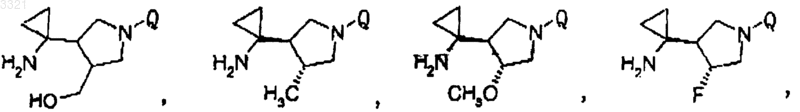
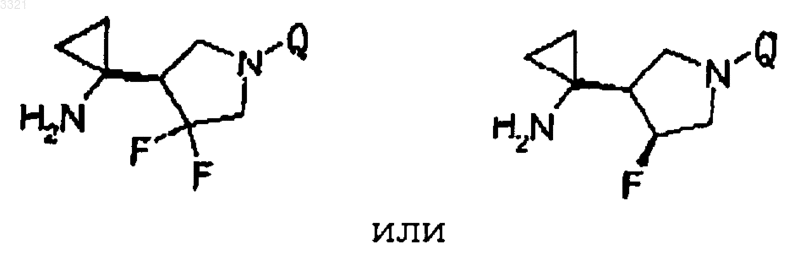
где Q представляет собой частичную структуру
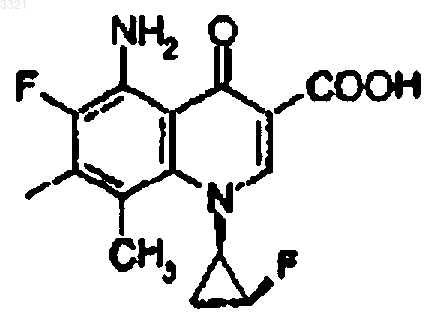
11. Фармацевтический препарат, включающий соединение, его соли или гидрат по п.1 в качестве активного ингредиента.
12. Антибактериальное лекарственное средство, которое в качестве активного ингредиента содержит соединение, его соль или гидрат, по п.1.
Текст
1 Настоящее изобретение относится к антибактериальному соединению для применения в фармацевтических препаратах, лекарственных средствах для животных, лекарственных средствах для использования в рыбоводстве и антибактериальным консервантам, а также к антибактериальным лекарственным средствам и антибактериальным препаратам, которые содержат это соединение. После открытия норфлоксацина антибактериальная активность и распределение после введения хинолоновых антибактериальных агентов была улучшена и много соединений используется в настоящее время в клинической практике как химиотерапевтические агенты,которые эффективны при лечении системных инфекционных заболеваний. Однако в последние годы в клинической области растет число бактерий, имеющих низкую чувствительность к этим лекарственным средствам. Также как, например, в случаеStaphylococcus aureus (MRSA), который нечувствителен к -лактамовым антибиотикам, число бактерий, имеющих низкую чувствительность к хинолоновым антибактериальным агентам, значительно увеличивается среди бактерий, которые устойчивы к другим лекарственным средствам, отличным от хинолоновых антибактериальных агентов. Следовательно, разработка лекарственных средств, обладающих высокой эффективностью, вызвана клинической необходимостью. Кроме того, так как обнаружено побочное действие при сопутствующем применении нестероидного противовоспалительного лекарства, которое проявляется в сильных судорогах, а также другие побочные эффекты, такие как фототоксичность и т.д., также было уделено большое внимание к разработке хинолоновых соединений, обладающих большей безопасностью. Задачей настоящего изобретения является создание соединения, которое может удовлетворять названным выше требованиям. Установлено, что замещенное аминометилпирролидиновое производное, представленное ниже формулой (I), и его соли, обладают широким спектром антибактериальной активности, проявляют сильную антибактериальную активность против бактерий, устойчивых к хинолону,включая грамм-положительные бактерии, в частности MRSA, а также обладают прекрасным распределением и безвредностью. Настоящее изобретение выполнено на основе этого открытия. Таким образом, настоящее изобретение относится к соединению, представленному формулой (I) 2 где заместитель R1 представляет собой атом водорода; заместитель R2 представляет собой атом водорода; заместитель R3 представляет собой атом водорода, атом галогена, алкильную группу,содержащую от 1 до 6 атомов углерода, алкоксигруппу, содержащую от 1 до 6 атомов углерода, или алкилтиогруппу, содержащую от 1 до 6 атомов углерода, которая может иметь один заместитель, гидроксильную группу; каждый из заместителей R6 и R7 независимо друг от друга представляет собой атом водорода или алкильную группу, содержащую от 1 до 6 атомов углерода;n принимает целые значения от 1 до 3; иQ представляет собой структуру формулы где заместитель R8 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, галогеналкильную группу, содержащую от 1 до 6 атомов углерода или циклическую алкильную группу, содержащую от 3 до 6 атомов углерода, которая может иметь заместитель(и),арильную группу, которая может иметь заместитель(и); заместитель R9 представляет собой атом водорода; заместитель Х 1 представляет собой атом галогена или атом водорода; заместитель R10 представляет собой атом водорода или аминогруппу,А 1 представляет собой атом азота или неполную структуру, представленную формулой(III) где X2 представляет собой атом водорода или алкильную группу, содержащую от 1 до 6 атомов углерода или алкоксигруппу, содержащую от 1 до 6 атомов углерода,заместители X2 и R8 могут быть объединены с образованием циклической структуры,включающей часть основного ядра, и кольцо может содержать атом кислорода в качестве атома, образующего кольцо, и может дополнительно иметь в качестве заместителя алкильную группу, содержащую от 1 до 6 атомов углерода) и заместитель Y1 представляет собой атом водорода или неполную структуру, представленную формулой (IV) 3 где заместитель R11 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, галогеналкильную группу, содержащую от 1 до 6 атомов углерода или циклическую алкильную группу, содержащую от 3 до 6 атомов углерода, которая может иметь заместитель(и); заместитель R12 представляет собой атом водорода или аминогруппу,заместитель X3 представляет собой атом галогена или атом водорода;A2 представляет собой атом азота или неполную структуру, представленную формулой(V) где X4 представляет собой атом водорода или алкоксильную группу, содержащую от 1 до 6 атомов углерода,заместитель Y2 представляет собой атом водорода и его соли и гидраты. Настоящее изобретение также относится к названному выше соединению, его солям и гидратам, где Q в формуле (I) имеет структуру,представленную формулой (III); названному выше соединению, его солям и гидратам, где заместитель R8 представляет собой галогенциклопропильную группу; названному выше соединению, его солям и гидратам, где галогенциклопропильная группа в формуле (I) представляет собой 1,2-цис-2 галогенциклопропильную группу; названному выше соединению, его солям и гидратам, где галогенциклопропильная группа в формуле (I) представляет собой стереохимически чистый заместитель; названному выше соединению, его солям и гидратам, где галогенциклопропильная группа в формуле (I) представляет собой (1R,2S)-2 галогенциклопропильную группу; названному выше соединению, его солям и гидратам, где атом галогена в галогенциклопропильной группе в формуле (I) представляет собой атом фтора; названному выше соединению, его солям и гидратам, где соединение формулы (I) представляет собой стереохимически чистое соединение. Соединение, его соли и гидраты, имеющее структурную формулу где Q представляет собой частичную структуру также включены в объем настоящего изобретения. Фармацевтическому препарату, который в качестве активного ингредиента содержит соединение формулы (I) или его соль или гидрат; и антибактериальному лекарственному средству или антибактериальному препарату, который в качестве активного ингредиента содержит соединение формулы (I) или его соль или гидрат. Другие объекты и преимущества настоящего изобретения станут понятны из приведенного ниже описания. Заместители соединения настоящего изобретения, представленные формулой (I), описываются следующим образом. Заместитель R1 представляет собой атом водорода. Заместитель R2 представляет собой атом водорода. Заместитель R3 представляет собой атом водорода. Каждый из заместителей R4 и R5 независимо друг от друга представляет собой атом водорода, атом галогена, алкильную группу, содержащую от 1 до 6 атомов углерода или алкоксильную группу, содержащую от 1 до 6 атомов углерода и алкильный остаток этих групп может иметь заместитель, выбираемый из гидроксильной группы. Величина n представляет собой целое число от 1 до 3 и соответствующее кольцо может быть циклопропановым или циклобутановым кольцом. Соединение настоящего изобретения отличается тем, что этот остаток представляет собой циклическую структуру. Предпочтительным значением n является 1.Q представляет собой неполную структуру конденсированной гетероциклической системы,представленную формулами (II) или (IV). где Q выбран из частичной структуры, выбранной из Каждый из заместителей R8 и R11 независимо друг от друга представляет собой алкиль 5 ную группу, содержащую от 1 до 6 атомов углерода, галогеналкильную группу, содержащую от 1 до 6 атомов углерода или циклическую алкильную группу, содержащую от 3 до 6 атомов углерода, которая может иметь заместитель(и). В качестве алкильной группы, содержащей от 1 до 6 атомов углерода, особенно предпочтительна этильная группа. В качестве галогеналкильной группы, содержащей от 1 до 6 атомов углерода, предпочтительна 2-фторэтильная группа. В качестве циклической алкильной группы, содержащей от 3 до 6 атомов углерода,которая может иметь заместитель(и), предпочтительны циклопропильная и 2-галогенциклопропильная группа, и в такой 2-галогенциклопропильной группе атом фтора особенно предпочтителен в качестве атома галогена. Заместитель R9 представляет собой атом водорода. Каждый из заместителей X1 и X3 независимо друг от друга представляет собой атом галогена или атом водорода, и в случае атома галогена предпочтительным является атом фтора. Из них предпочтительными заместителями являются атомы фтора и водорода. Каждый из заместителей R10 и R12 независимо друг от друга представляет собой атом водорода, аминогруппу. Когда заместитель R10 или R12 представляет собой аминогруппу, то эта группа может быть защищена с помощью обычно используемых защитных групп. Иллюстративными примерами таких защитных групп являются алкоксикарбонильные группы, такие как трет-бутоксикарбонильная,2,2,2-трихлорэтоксикарбонильная группа и им подобные группы, аралкилоксикарбонильные группы, такие как бензилоксикарбонильная, пметоксибензилоксикарбонильная, п-нитробензилоксикарбонильная и подобные им группы,ацильные группы, такие как ацетильная, метоксиацетильная, трифторацетильная, хлорацетильная, пивалоильная, формильная, бензоильная и им подобные группы, алкильные или аралкильные группы, такие как трет-бутильная,бензильная, п-нитробензильная, п-метоксибензильная, трифенилметильная и им подобные группы, эфирные группы, такие как метоксиметильная, трет-бутоксиметильная, тетрагидропиранильная, 2,2,2-трихлорэтоксиметильная группы и им подобные, а также силильные группы,такие как триметилсилильная, изопропилдиметилсилильная,трет-бутилдиметилсилильная,трибензилсилильная,трет-бутилдифенилсилильная группы и им подобные. Соединения,содержащие заместители, которые защищены с помощью этих защитных групп, особенно предпочтительны в качестве промежуточных соединений. Когда А 1 представляет собой неполную структуру формулы (III) Х 2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода или алкоксильную группу, содержащую от 1 до 6 атомов углерода. Алкильная группа может иметь или линейную, или разветвленную цепь, содержащую от 1 до 6 атомов углерода, и предпочтительно представляет собой метильную или этильную группу. Алкоксильная группа может содержать от 1 до 6 атомов углерода, при этом предпочтительной является метоксигруппа. Из этих заместителей предпочтительными являются алкильная группа или алкоксильная группа. Наиболее предпочтительна метильная или метоксигруппа. Кроме того, заместители Х 2 и R8 могут быть объединены с образованием циклической структуры (кольцо может представлять собой четырех-семичленное кольцо и это кольцо может быть насыщено, частично насыщено или ненасыщено), с включением части основного ядра (то есть, включая атом азота, к которому присоединен заместитель R8, и атом углерода, к которому присоединен заместитель Х 2). Образованное таким образом кольцо может содержать атом кислорода, в качестве образующего кольцо атома и могут дополнительно содержать в качестве заместителя алкильную группу, содержащую от 1 до 6 атомов углерода. Когда А 2 представляет собой неполную структуру формулы (V): заместитель X4 представляет собой атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода или алкоксильную группу, содержащую от 1 до 6 атомов углерода. Алкильная группа может иметь или линейную, или разветвленную цепь, содержащую от 1 до 6 атомов углерода, и предпочтительно представляет собой метильную или этильную группу. Когда А 1 представляет собой неполную структуру формулы (III) то предпочтительным сочетанием заместителейR10 и X2 является сочетание, в котором заместитель R10 представляет собой аминогруппу, атом водорода. В более предпочтительном сочетании заместитель R10 представляет собой аминогруппу,атом водорода, а заместитель X2 представляет собой метильную группу, метоксигруппу или атом водорода. В наиболее предпочтительном сочетании заместитель R10 представляет собой аминогруппу, атом водорода, гидроксильную группу или метильную группу, а заместитель X2 представ 7 ляет собой метильную группу или метоксигруппу. Для этих заместителей R10 и X2, заместитель Х 1 предпочтительно представляет собой атом фтора. Когда заместитель А 2 представляет собой неполную структуру формулы (V) то предпочтительным сочетанием заместителейR12 и X4 является сочетание, в котором заместитель R12 представляет собой аминогруппу или атом водорода, а заместитель X4 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, алкоксильную группу, содержащую от 1 до 6 атомов углерода или атом водорода. В более предпочтительном сочетании заместитель R12 представляет собой амино-группу,атом водорода, а заместитель X4 представляет собой метильную группу, метоксигруппу или атом водорода. В наиболее предпочтительном сочетании заместитель R12 представляет собой аминогруппу, атом водорода, а заместитель X4 представляет собой метильную группу или метоксигруппу. Кроме того, в качестве заместителя R8 предпочтительна галогенциклопропильная группа. В качестве примеров атома галогена могут быть названы атом фтора и атом хлора, из которых атом фтора является особенно предпочтительным. Что касается стереохимического окружения этого остатка, то особенно предпочтительно, чтобы атом галогена и остаток пиридонкарбоновой кислоты принимали цис-конфигурацию по отношению к циклопропановому кольцу. Энантиомерные изомеры могут существовать только благодаря присутствию этого цис-2 галогенциклопропильного остатка R8, а сильная антибактериальная активность и высокая безвредность характерны для обоих этих изомеров. Когда соединение формулы (I) настоящего изобретения имеет структуру, для которой характерно существование диастереомеров, желательно вводить заявляемое соединение человеку и животным в виде соединения, состоящего из одного диастереомера. Понятие "соединение,состоящее из одного диастереомера", используемое в данном случае, означает не только вариант, когда другой диастереомер полностью отсутствует, но также вариант, при котором соединение находится в химически чистой форме. Иными словами, другой диастереомер может присутствовать в таком количестве, что он не оказывает влияния на физические константы и физиологическую активность. 8 Кроме того, понятие "стереохимически чистое" означает, что когда соединение существует в виде множества изомерных форм из-за наличия асимметричного атома углерода, соединение содержит только из одну из этих форм. Под определением "чистое" в этом случае подразумевается то же, что и в описанном выше случае. Производное пиридонкарбоновой кислоты настоящего изобретения может быть использовано в его свободной форме или в виде кислотноаддитивной соли или соли по карбоксильной группе. Примерами таких кислотноаддитивных солей являются соли неорганических кислот, такие как гидрохлорид, сульфат,нитрат, гидробромид, гидройодид, фосфат и др.,и соли органических кислот, такие как ацетат,метансульфонат, бензолсульфонат, толуолсульфонат, цитрат, малеат, фумарат, лактат и им подобные соли. Соли по карбоксильной группе могут быть или неорганическими или органическими солями, которые включают соли лития, соли натрия,соли калия и соли других щелочных металлов,соли магния, соли кальция и соли других щелочноземельных металлов, аммонийную соль,триэтиламинную соль, N-метилглюкаминовую соль,трис-(гидроксиметил)аминометановую соль и др. Так же, эти свободные формы, кислотноаддитивные соли и соли по карбоксильной группе производного пиридонкарбоновой кислоты могут существовать в виде гидратов. С другой стороны, производное хинолона,в котором остаток карбоновой кислоты представляет собой сложноэфирную группу, может быть использовано как промежуточное соединение при синтезе или в качестве пролекарства. Например, в качестве промежуточных соединений могут быть полезны алкиловые сложные эфиры, бензиловые сложные эфиры, алкоксиалкиловые сложные эфиры, фенилалкиловые сложные эфиры и фениловые сложные эфиры. Сложные эфиры, которые могут быть использованы в качестве пролекарства, представляют собой сложные эфиры, которые легко расщепляются в организме с образованием свободной карбоновой кислоты, и иллюстративными примерами таких соединений являются ацетоксиметиловый сложный эфир, пивалоилоксиметиловый сложный эфир, этоксикарбонильный эфир, сложный эфир на основе холина, диметиламиноэтиловый сложный эфир, 5-инданиловый сложный эфир, оксоалкиловый сложный эфир,такие как фталидиниловый сложный эфир, 5 алкил-2-оксо-1,3-диоксол-4-ил-метиловый эфир,3-ацетокси-2-оксобутиловый сложный эфир и им подобные соединения. Соединения настоящего изобретения,представленные формулой (I), могут быть получены различными способами, например, с по 9 мощью предпочтительного способа, в котором соединение, представленное формулой (VI) где заместитель X5 представляет собой заместитель, который выполняет функцию уходящей группы, такой как, например, атом фтора, атом хлора, атом брома, замещенная или незамещенная фенилсульфонильная группа или замещенная или незамещенная алкилсульфонильная группа, содержащая от 1 до 3 атомов углерода; заместитель Y3 представляет собой заместитель Y1, который определен для формулы (II),или группу, представленную формулой (VII) где каждый из заместителей Y31 и Y32 представляет собой атом фтора или алкилкарбонилоксигруппу, содержащую от 2 до 5 атомов углерода,а заместители R13, R14, R15, А 3 и X6 представляют собой группы, соответствующие заместителям R8, R9, R10, А 1 и X1, которые определены для формулы (II) или соединение, представленное формулой (VIII) где заместитель X7 представляет собой заместитель, выполняющий функцию уходящей группы, например, атом фтора, атом хлора, атом брома, замещенную или незамещенную фенилсульфонильную группу или замещенную или незамещенную алкилсульфонильную группу,содержащую от 1 до 3 атомов углерода, а заместители R16, R17, А 4, X8 и Y4 представляют собой группы, соответствующие заместителям R11,R12, А 2, X3 и Y2, которые определены для формулы (IV) реагирует с соединением, представленным формулой (IX) где заместитель R111 представляет собой заместитель R1, определенный для формулы (I), или защитную группу для аминогруппы, а заместители R2, R3, R4, R5, R6, R7 и n принимают значения, определенные для формулы (I) или с его кислотно-аддитивной солью. Реакция может быть проведена без растворителя или в растворителе. Примерами растворителей, которые могут быть использованы в этой реакции, являются растворители, которые инертны в условиях проведения реакции, такие как диметилсульфоксид, пиридин, ацетонитрил,этанол, хлороформ, диметилформамид, диме 003321 10 тилацетамид, N-метилпирролидон, тетрагидрофуран, вода, 3-метоксибутанол и их смеси. Предпочтительно проводить реакцию в присутствии неорганического основания, органического основания или аналогичного акцептора кислоты, такого как карбонат или бикарбонат щелочного или щелочноземельного металла,или триэтиламин, пиридин, 1,8-диазабициклоундецен и др. Температура реакции обычно находится в интервале от комнатной температуры до 200 С,но предпочтительно - в интервале приблизительно от 25 до 150 С. Время реакции может составлять от 15 мин до 48 ч, и обычно реакция заканчивается в течение от 30 мин до 2 ч. Иллюстративными примерами защитных групп для аминогруппы являются такие группы,которые обычно используются в данном случае и к которым относятся алкоксикарбонильные группы, такие как трет-бутоксикарбонильная,2,2,2-трихлорэтоксикарбонильная и им подобные группы, аралкилоксикарбонильные группы,такие как бензилоксикарбонильная, п-метоксибензилоксикарбонильная, п-нитробензилоксикарбонильная группы и им подобные, ацильные группы, такие как ацетильная, метоксиацетильная, трифторацетильная, хлорацетильная, пивалоильная, формильная, бензоильная и им подобные группы, алкильные или аралкильные группы, такие как трет-бутильная, бензильная,п-нитробензильная, п-метоксибензильная, трифенилметильная и им подобные группы, эфиры,такие как метоксиметиловый, трет-бутоксиметиловый, тетрагидропираниловый, 2,2,2 трихлорэтоксиметиловый и др., а также силильные группы, такие как триметилсилильная, изопропилдиметилсилильная, трет-бутилдиметилсилильная,трибензилсилильная,трет-бутилдифенилсилильная группы и им подобные группы. Когда каждый из заместителей Y3 и Y4 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, алкоксиметильную группу, содержащую от 2 до 7 атомов углерода, или фенилалкильную группу, которая состоит из алкиленовой группы, содержащей от 1 до 6 атомов углерода, и фенильной группы,превращение в соответствующую карбоновую кислоту может быть осуществлено путем обработки в кислых или основных условиях обычно с использованием для гидролиза эфиров карбоновой кислоты. Когда заместитель Y3 имеет структуру,представленную формулой (VII) превращение в соответствующую карбоновую кислоту может быть осуществлено при взаимодействии соединения формулы (VI) с соединением (IX) с последующей обработкой в кислых или основных условиях. 11 Кроме того, когда необходимо снять защитную группу, желаемое соединение формулы(I) может быть получено путем удаления защитной группы в соответствии с подходящей методикой, известной в данной области для снятия используемой защитной группы. Так как соединение настоящего изобретения обладает высокой антибактериальной активностью, оно находит различное применение в таких областях, как изготовление фармацевтических препаратов для человека, животных и рыб, или в качестве агрохимикатов и пищевых консервантов. Когда соединение настоящего изобретения используется в фармацевтическом препарате,предназначенном для человека, его доза может составлять от 50 мг до 1 г, предпочтительно от 100 мг до 300 мг в день из расчета на взрослого человека. В случае использования при лечении животных доза соединения меняется в зависимости от объекта применения (например, лечение или профилактика), вида и размеров каждого животного, которое необходимо лечить, вида инфекционных патогенных бактерий и степени зараженности, но его ежедневная доза может находиться в интервале обычно от 1 до 200 мг,предпочтительно от 5 до 100 мг из расчета на 1 кг веса тела. Ежедневная доза может быть введена один раз в день или ее делят на 2-4 дозы. Если необходимо, то ежедневная доза может быть увеличена и может выходить за пределы указанного интервала. Так как соединение настоящего изобретения обладает активностью в отношении широкого спектра микроорганизмов, которые вызывают различные инфекционные заболевания,оно эффективно при лечении, профилактике или ослаблении заболеваний, вызванных этими патогенами. Примерами бактерий или бактериаподобных микроорганизмов, которые могут быть обработаны соединением настоящего изобретения,являются род Staphylococcus, Streptococcus pyogenes, гемолитический стрептококк, энтерококк, пневмококк, род Peptostreptococcus, Neisseria gonorrhoeae, Escherichia coli, род Citrobacter, род Shigella, Klebsiella pneumoniae, род Enterobacter, род Serratia, род Proteus, Pseudomonasaeruginosa, Haemophilus influenzae, род Acinetobacter, род Campylobacter, Chlamydia trachomatis и др. Примерами заболеваний, вызываемых этими патогенами, являются фолликулит, фурункул, карбункул, рожистое воспаление, флегмона, лимфангинит (лимфаденит), гнойное воспаление подушечки пальца, подкожный абсцесс,гидраденит, шаровидные угри, инфекционная атерома, периректальный абсцесс, мастит, поверхностные вторичные инфекции, такие как травма, ожог, хирургическая рана и др., фарин 003321 12 гит, ларингит, острый бронхит, тонзилит, хронический бронхит, бронхоэктаз, диффузный бронхиолит, вторичное инфекционное хроническое респираторное заболевание, пневмония,пиелонефрит, цистит, простатит, эпидимит, гонококковый уретрит, неспецифический уретрит,холецистит, холангит, bacillary dystentery, энтерит, маточный аднексит, внутриматочная инфекция, бартолинит, блефарит, ячмень, дакриоцистит, тарзаденит, корнеальная язва, воспаление среднего уха, синусит, периодонтит, перикоронит, воспаление челюсти, перитонит, эндокардит, сепсис, менингит, кожная инфекция и др. Соединение настоящего изобретения также эффективно против различных микроорганизмов, которые вызывают инфекционные заболевания у животных, такие как, например, родEscherichia, Salmonella, Pasteurella, Haemophilus,Bordetella, Staphylococcus, Mycoplasma и др. Иллюстративными примерами таких болезней являются колибактериоз, pullorum, птичий брюшной тиф, птичья холера, инфекционный острый ринит, стафилококковая инфекция, инфекция Mycoplasma и другие подобные заболевания у птиц, колибактериоз, сальмонеллез,пастереллез,инфекцияHaemophilus,атрофический ринит, экссудативный эпидермит инфекция Mycoplasma и другие подобные заболевания у свиней, колибактериоз, сальмонеллез,геморрагический сепсис, инфекция Mycoplasma,бычья плевропневмония, мастит и другие подобные заболевания у крупного рогатого скота,колисепсис, инфекция Salmonella, геморрагический сепсис, маточная эмпиема, цистит и другие подобные заболевания у собак, и экссудативный плеврит, цистит, хронический ринит, инфекцияHaemophilus, диарея у котят, инфекция Mycoplasma и другие подобные заболевания у кошек. Антибактериальный препарат, который содержит соединение настоящего изобретения,может быть получен путем выбора подходящей лекарственной формы, соответствующей каждому способу введения, и при использовании различных обычно используемых методик получения медицинских препаратов. Примерами лекарственной формы антибактериального препарата, который содержит соединение настоящего изобретения в качестве активного агента,являются пероральные препараты, такие как таблетки, порошки, гранулы, капсулы, растворы, сиропы, эликсиры, масляные и водные суспензии и др. Препараты, используемые путем инъекций, могут содержать стабилизирующие агенты,антисептики, солюбилизирующие агенты, и растворы, которые содержат эти вспомогательные вещества, могут быть помещены в упаковку для лекарственного средства и могут быть лиофилизированы для получения твердого препарата,который перед применением снова растворяют. Кроме того, в одну упаковку может быть поме 13 щена одна доза или в одну и ту же упаковку может быть помещено несколько доз для многократного приема. В качестве препаратов для наружного применения могут быть использованы растворы, суспензии, эмульсии, мази, гели, кремы,лосьоны, спреи и др. Твердые препараты могут быть получены при смешении активного соединения с фармацевтически приемлемым вспомогательным агентом, необязательно выбираемым из числа наполнителей и сухих разбавителей, связующих веществ, диспергирующих агентов, солюбилизирующих агентов, увлажняющих агентов, смазывающих агентов и др. Примерами жидких препаратов являются растворы, суспензии, эмульсии и им подобные препараты, которые могут содержать суспендирующие агенты, эмульгирующие агенты и другие аналогичные добавки. Соединение настоящего изобретения может быть введено животным способом, при котором соединение вводится напрямую или после его смешения с пищей, способом, при котором соединение готовится в виде раствора и этот раствор вводится перорально напрямую или путем добавления раствора в питьевую воду или в пищу, или способом, при котором соединение вводится путем инъекции. Что касается фармацевтических препаратов соединения настоящего изобретения предназначенных для введения животным, то соединение может быть необязательно получено в виде порошков, растворимых порошков, сиропов, растворов и растворов для инъекций с использованием технологий, обычных для этой области. Приведенные ниже рецептурные примеры иллюстрируют фармацевтические препараты. Рецептурный пример 1 (капсулы): Заявляемое соединение, пример 3 Кукурузный крахмал Кальцийкарбоксиметилцеллюлоза Гидроксиметилцеллюлоза Стеарат магния Всего Рецептурный пример 2 (растворы): Заявляемое соединение, пример 5 Уксусная кислота или гидроксид натрия Этиловый эфир п-оксибензойной кислоты Очищенная вода Всего Рецептурный пример 3 (порошки для добавления в пищу): Заявляемое соединение, пример 7 Кукурузный крахмал Мягкий кремниевый ангидрид Всего Ниже приведены примеры настоящего изобретения, которые поясняют изобретение, но не ограничивают его. В этой связи антибактериальная активность каждого рассматриваемого 14 соединения измерена в соответствии со стандартным способом, описанным в Japan Societyof Chemotherapy. Полученные результаты представлены в таблицах 1-3 как минимальная ингибирующая концентрация (МИК, мкг/мл). Справочный пример 1-1. Этиловый эфир(27,6 г, 75,2 ммоля) в дихлорметане (300 мл) и кипятят с обратным холодильником в течение 4 ч. После упаривания растворителя полученный остаток наносят на хроматографическую колонку с силикагелем и элюируют смесью нгексан:этилацетат, 9:1. Получают 9,23 г (выход 61 %) названного соединения. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 6,48 (д, J=15,62 Гц, 1 Н), 5,84 (д, J=15,62 Гц, 1 Н),5,00 (уш.с, 1 Н), 4,18 (кв, J=7,33 Гц, 2 Н), 1,45 (с,9 Н), 1,28 (т, J=7,33 Гц, 3H), 1,28 (уш.с, 2 Н), 1,16(2,91 г, 11,38 ммоля) и N-бензил-N-(н-бутоксиметил)триметилсилилметиламина (7,43 г, 26,59 ммоля) растворяют в дихлорметане (40 мл), в атмосфере азота раствор смешивают с 1 М раствором трифторуксусной кислоты (2,66 мл, 2,66 ммоля) в дихлорметане и перемешивают при комнатной температуре в течение 3 ч. По окончании реакции реакционный раствор промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлористого натрия в названной последовательности и сушат безводным сульфатом натрия. После упаривания растворителя полученный остаток наносят на хроматографическую колонку с силикагелем и элюируют смесью н-гексан: этилацетат, 2:1. Получают 3,06 г (выход 69 %) названного соединения в виде белых иглоподобных кристаллов. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 7,34-7,21 (м, 5 Н), 5,14 (уш.с, 1 Н), 4,13 (д, J=7,33 Гц, 2 Н) , 3,60 и 3,56 (АВ-д, J=13,19 Гц, 2 Н),3,21-3,11 (м, 1 Н), 2,87-2,76 (м, 1 Н), 2,75-2,64 (м,1 Н), 2,55-2,45 (м, 1 Н), 2,43-2,33 (м, 1 Н), 1,43 (с,9 Н), 1,25 (т, J=7,33 Гц, 2 Н), 0,98-0,88 (м, 1 Н),0,86-0,73 (м, 2 Н), 0,72-0,63 (м, 1 Н). В атмосфере азота суспендируют литийалюминийгидрид (381 мг, 9,54 ммоля) в безводном тетрагидрофуране (30 мл) и к полученной суспензии при охлаждении на ледяной бане в течение 15 мин добавляют по каплям раствор этилового эфира транс-1-бензил-4-(1-трет-бутоксикарбониламиноциклопропил)пирролидин-3 карбоновой кислоты (1,24 г, 3,18 ммоля). После перемешивания при той же температуре в течение 4 ч к реакционной смеси постепенно добавляют охлажденную льдом воду. Суспензию фильтруют на целитах (с промывкой хлороформом) для отделения органического слоя. Водный слой экстрагируют хлороформом (50 мл х 2), органические слои объединяют и сушат безводным сульфатом натрия. После упаривания растворителя получают 1,12 г (выход 99 %) названного соединения. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 7,34-7,23 (м, 5 Н), 5,01 (уш.с, 1 Н), 3,61 (уш.с,2 Н), 3,59 (с, 2 Н), 2,95-2,87 (м, 1 Н), 2,63-2,49 (м,2 Н), 2,37-2,27 (м, 1 Н), 1,98-1,88 (м, 1 Н), 1,43 (с,9 Н), 1,25 (т, J=7,33 Гц, 2 Н), 0,94-0,84 (м, 1 Н),0,84-0,70 (м, 2 Н), 0,70-0,62 (м, 1 Н). Заявляемый пример 1. 5-Амино-7-[транс-4(1-аминоциклопропил)-3-гидроксиметил-1 пирролидинил]-1-циклопропил-6-фтор-1,4 дигидро-8-метил-4-оксохинолин-3-карбоновая кислота. Транс-1-бензил-4-(1-трет-бутоксикарбониламиноциклопропил)-3-гидроксиметилпирролидин (1,10 г, 3,18 ммолей) растворяют в этаноле (50 мл), полученный раствор смешивают с гидроксидом палладия (500 мг) и перемешивают в течение 1,5 ч при комнатной температуре и в атмосфере водорода. Реакционную суспензию фильтруют на целитах (с промывкой этанолом) и растворитель упаривают. Полученный остаток и 5-амино-1-циклопропил-6,7-дифтор-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновую кислоту (471 мг, 1,60 ммоля) растворяют в диметилсульфоксиде (20 мл), полученный раствор в атмосфере азота смешивают с триэтиламином (5 мл) и перемешивают при 150 С в течение 19 ч. Полученный после упаривания растворителя остаток смешивают с 10 %-ным водным раствором лимонной кислоты (50 мл) и экстрагируют хлороформом (50 мл х 2) и экстракт сушат безводным сульфатом натрия. После упаривания растворителя полученный остаток смешивают 16 концентрированной соляной кислотой (5 мл) и перемешивают в течение часа. Полученную смесь смешивают с водой (50 мл) и промывают хлороформом (50 мл х 2). Доводят рН водного слоя до 12,00 с помощью водного раствора гидроксида натрия и промывают хлороформом (50 мл х 2). Затем рН водного слоя доводят до 7,4 с помощью 1 н. соляной кислоты и экстрагируют хлороформом (300 мл х 5). Экстракт сушат безводным сульфатом натрия, растворитель упаривают и затем полученный остаток перекристаллизовывают из этанола, получают 165 мг (выход 38%) названного соединения. Температура плавления: 179-182 С. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 8,40 (с, 1 Н), 4,06-3,97 (м, 1 Н), 3,85-3,79 (м, 1 Н),3,68-3,48 (м, 4 Н), 3,47-3,39 (м, 1 Н), 2,50-2,40 (м,1 Н), 2,42 (с, 3H), 1,79-1,70 (м, 1 Н), 1,17-1,03 (м,2 Н), 0,82-0,67 (м, 2 Н), 0,67-0,46 (м, 4 Н). Элементный анализ: C22H27FN4O4. Вычислено: С 61,38; Н 6,32; N 13,01. Найдено: С 61,15; Н 6,31; N 12,78. Справочный пример 2-1. Этиловый эфир 3-(1-трет.-бутоксикарбониламиноциклопропил)пропиоловой кислоты. В атмосфере азота в безводном тетрагидрофуране (30 мл) суспендируют хлорметилтриметилфосфонийхлорид (5,156 г, 14,85 ммоля) и к полученной суспензии после охлаждения до 55 С добавляют по каплям в течение 5 мин 1,68 М раствор н-бутиллития в гексане (8,87 мл,14,90 ммоля). Реакционную суспензию перемешивают в течение 30 мин при охлаждении на ледяной бане и в течение 3 ч при комнатной температуре, а затем охлаждают до -55 С. Затем к суспензии по каплям в течение 10 мин добавляют раствор 1-трет-бутоксикарбониламиноциклопропанкарбальдегида (2,498 г, 13,50 ммоля) в безводном тетрагидрофуране (10 мл) и перемешивают в течение 1 ч при -50 С, а затем в течении 30 мин при охлаждении на ледяной бане. Суспензию охлаждают до -78 С, добавляют по каплям в течение 10 мин 1,68 М раствор нбутиллития (17,68 мл, 29,70 ммолей) в н-гексане и полученную смесь перемешивают при -78 С в течение 20 мин. Затем к суспензии по каплям добавляют этилхлорформиат (1,61 мл, 16,88 молей) и перемешивают в течение 1,5 ч при-78 С, а затем в течение 1 ч при охлаждении на ледяной бане. При охлаждении на ледяной бане реакционную суспензию смешивают с насыщенным рассолом (30 мл), органический слой отделяют и водный слой экстрагируют диэтиловым эфиром (30 мл х 2). Органические слои объединяют, промывают насыщенным рассолом(30 мл) и сушат безводным сульфатом магния. Полученный после фильтрования фильтрат упаривают при пониженном давлении, полученный остаток наносят на хроматографическую колон 17 ку с силикагелем для быстрого хроматографирования и элюируют смесь н-гексан : этилацетат, 5:1. Получают 2,178 г (выход 63,9 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 5,04 (уш. с, 1 Н), 4,27 (кв, J=7,16 Гц, 2 Н), 1,44 (с,9 Н), 1,28 (т, J=7,16 Гц, 3H), 1,15 (м, 2 Н), 1,06 (м,2 Н). Справочный пример 2-2. Этиловый эфир 1 бензил-4-(1-трет-бутоксикарбониламиноциклопропил)-3-пирролин-3-карбоновой кислоты.N-Бензил-N-(н-бутоксиметил)триметилсилилметиламин (2,006 г, 7,176 ммоля) и этиловый эфир 3-(1-трет-бутоксикарбониламиноциклопропил)пропиоловой кислоты (1,136 г, 4,485 ммоля) растворяют в сухом дихлорметане (9 мл) и при перемешивании при комнатной температуре полученный раствор смешивают с 1,0 М раствором трифторуксусной кислоты (0,72 мл,0,72 ммоля) в дихлорметане. После перемешивания в течение 3 ч раствор смешивают с насыщенным водным раствором бикарбоната натрия(20 мл) и экстрагируют дихлорметаном (20 мл х 3). Органические соли объединяют, промывают насыщенным рассолом (30 мл) и сушат безводным сульфатом магния. Фильтруют, фильтрат концентрируют при пониженном давлении, полученный остаток наносят на хроматографическую колонку с силикагелем для быстрого хроматографирования и элюируют хлороформом. Получают 1,449 г (выход 83,6%) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 7,40-7,11 (м, 5 Н), 5,17 (уш.с, 1 Н), 4,12 (кв,J=6,83 Гц, 2 Н), 3,85 (м, 2 Н), 3,72 (м, 2 Н), 3,67 (с,2 Н), 1,44 (с, 9 Н), 1,24 (т, J=6,83 Гц, 3H), 1,14 (м,2 Н), 1,01 (м, 2 Н). Справочный пример 2-3. Этиловый эфир цис-1-бензил-4-(1-трет-бутоксикарбониламиноциклопропил)пирролидин-3-карбоновой кислоты Перхлорат бис(бицикло[2.2.1]гепта-2,5-диен)родия (I) (54,5 мг, 0,14 ммоля) и 1,2-бис(дифенилфосфино)этан (67,4 мг, 0,17 ммоля) растворяют при токе азота в сухом и дегазированном метаноле (25 мл) и перемешивают при комнатной температуре в течение 10 мин. Полученный таким образом раствор катализатора смешивают с раствором этилового эфира 1-бензил 4-(трет-бутоксикарбониламиноциклопропил)-3 003321 18 пирролин-3-карбоновой кислоты (1,090 г, 2,820 ммоля) в сухом и дегазированном метаноле (15 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2,5 ч в атмосфере водорода (1 кг/см 2). Реакционную массу смешивают с активированным углем (1 г) и смесь перемешивают при комнатной температуре в течение 30 мин, затем фильтруют через целиты (с промывкой метанолом). Полученный после концентрирования фильтрата при пониженном давлении остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан:этилацетат,5:1, получают 1,071 г (выход 97,8 %) названного соединения в виде бесцветных кристаллов. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 7,40-7,19 (м, 5 Н), 5,07 (уш.с, 1 Н), 4,13 (кв,J=7,33 Гц, 2 Н), 3,63 (с, 2 Н), 2,87 (м, 1 Н), 2,67 (м,1 Н), 2,54 (м, 1 Н), 2,35 (м, 1 Н), 2,15 (м, 1 Н), 1,79 В атмосфере азота суспендируют литийалюминийгидрид (195,6 мг, 5,153 ммоля) в безводном тетрагидрофуране (40 мл) и к полученной суспензии при перемешивании при -15 С по каплям в течение 15 мин добавляют раствор этилового эфира цис-1-бензил-4-(1-трет-бутоксикарбониламиноциклопропил)пирролидин-3 карбоновой кислоты (1,001 г, 2,577 ммоля) в безводном тетрагидрофуране (10 мл). Суспензию перемешивают в течение 3,5 ч при охлаждении на ледяной бане, постепенно смешивают с холодной водой (5 мл), и затем дополнительно перемешивают в течение 15 мин при комнатной температуре. Суспензию фильтруют через целиты (с промывкой диэтиловым эфиром) и полученный фильтрат концентрируют при пониженном давлении и сушат, получают 833,9 мг (выход 93,4%) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 7,39-7,00 (м, 5 Н), 5,10 (уш.с, 1 Н), 3,69 (м, 2 Н),3,58 (с, 2 Н), 2,99 (м, 1 Н), 2,61 (м, 1 Н), 2,51 (м,1 Н), 2,27 (м, 1 Н), 2,00 (м, 1 Н), 1,94 (уш.с, 1 Н),1,74 (м, 1 Н), 1,42 (с, 9 Н), 0,90 (м, 1 Н), 0,74-0,61 Цис-1-бензил-4-(1-трет-бутоксикарбониламиноциклопропил)-3-гидроксиметилпирролидин (820,1 мг, 2,376 ммоля) растворяют в метаноле (50 мл), полученный раствор смешивают с 5%-ным палладием-на-угле (катализатор, содержание воды 55,6 %, 750 мг) и перемешивают в течение одного дня в атмосфере водорода (4,5 кг/см 2). После удаления катализатора путем фильтрования на целитах (с промывкой метанолом) полученный фильтрат концентрируют при пониженном давлении, получают 578,8 мг (выход 91 %) названного соединения в виде белого аморфного вещества. Спектр 1H-ЯМР (400 МГц, СDCl3,м.д.): 5,05 (уш.с, 1 Н), 3,72 (м, 2 Н), 3,15 (м, 2 Н), 2,82(550,1 мг, 2,146 ммоля) растворяют в диметилсульфоксиде (15 мл), полученный раствор смешивают с триэтиламином (3,5 мл) и 5-амино-1 циклопропил-6,8-дифтор-1,4-дигидро-8-метил 4-оксохинолин-3-карбоновой кислотой (300,2 мг, 1,020 ммоля) и перемешивают в атмосфере азота в течение 22 ч при нагревании на масляной бане (150 С). После охлаждения диметилсульфоксид упаривают при пониженном давлении, полученный остаток растворяют в хлороформе (100 мл) и промывают 10%-ным водным раствором лимонной кислоты (100 мл) и насыщенным рассолом (50 мл) в указанном порядке. Затем органический слой сушат безводным сульфатом магния. Полученный после фильтрования фильтрат концентрируют при пониженном давлении, к полученному остатку, который охлаждают на ледяной бане, по каплям добавляют концентрированную соляную кислоту (10 мл) и затем смесь перемешивают в течение 1 часа. Водный реакционный раствор промывают дихлорметаном (20 мл х 4), рН водного слоя доводят до 12 с помощью 15%-ного водного раствора гидроксида натрия и промывают дихлорметаном (20 мл х 2). Доводят рН водного раствора до 7,2 с помощью 1 н. соляной кислоты и экстрагируют хлороформом (100 мл х 4). Органические слои объединяют, сушат безводным 20 сульфатом магния и фильтруют, полученный фильтрат концентрируют при пониженном давлении. Полученный таким образом сырой продукт очищают перекристаллизацией из смеси 2 пропанол:диизопропиловый эфир и выделенные кристаллы сушат при 70 С в течение 18 ч при пониженном давлении. Получают 112,4 мг (выход 25,6 %) названного соединения в виде желтых кристаллов. Температура плавления: 158,8-159,9 С Описанную ниже реакцию проводят в атмосфере азота. К раствору диизопропилэтиламина (1,37 мл, 9,75 ммоля) в тетрагидрофуране(40 мл) при -78 С по каплям добавляют нбутиллитий (5,39 мл, 1,68 н. раствор в н-гексане,9,06 ммоля), полученную смесь нагревают до 0 С и перемешивают в течение 30 мин. Затем к реакционной смеси при -78 С добавляют по каплям раствор (4S)-4-(1-этоксикарбонилциклопропил)-1-[(S)-1-фенилэтил]-2-пирролидона(2,10 г, 6,97 ммоля) в тетрагидрофуране (20 мл). После перемешивания в течение еще 15 мин к реакционной смеси по каплям добавляют метилйодид (2,17 мл, 34,8 ммоля) и перемешивают в течение 30 мин, повышая температуру до 0 С. По окончании реакции реакционную смесь охлаждают на ледяной бане и смешивают с насыщенным водным раствором хлористого аммония (150 мл), а затем упаривают тетрагидрофуран. Полученный остаток экстрагируют хлороформом (150 мл х 3), органический слой сушат безводным сульфатом натрия. После упаривания растворителя полученный остаток очищают хроматографированием на колонке с силикагелем (силикагель, 160 мл, элюент этилацетат:гексан, 2:3), получают 1,90 г (выход 87 %) названного соединения. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 0,67-0,75 (м, 2 Н), 1,06 (т, J=7,33 Гц, 3H), 1,141,19 (м, 2 Н), 1,24 (д, J=7,33 Гц, 3H), 1,52 (д,J=7,33 Гц, 3H), 1,98 (кв, J=9,03 Гц, 1 Н), 2,40(3R,4S)-(1-Этоксикарбонилциклопропил)3-метил-1-[(S)-1-фенилэтил]-2-пирролидон (1,85 г, 5,87 ммоля) растворяют в бензоле (100 мл),полученный раствор смешивают с реагентом Лавессона (Lawesson) (1,31 г, 3,24 ммоля) и кипятят с обратным холодильником в течение 20 мин. По окончании реакции растворитель упаривают и полученный остаток очищают хроматографированием на колонке с силикагелем (силикагель, 160 мл, элюент этилацетат:гексан,1:4), получают 1,80 г (выход 92 %) названного соединения. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,63-0,69 (м, 2 Н), 1,11 (т, J=7,08 Гц, 3H), 1,151,18 (м, 2 Н), 1,41 (д, J=7,32 Гц, 3H), 1,58 (д,J=6,84 Гц, 3H), 2,02-2,08 (м, 1 Н), 2,73-2,80 (м,1 Н), 3,11 (дд, J=7,81, 11,23 Гц, 1 Н), 3,65 (дд,J=8,79, 11,23 Гц, 1 Н), 3,95-4,06 (м, 2 Н), 6,44 (кв,J=6,84 Гц, 1 Н), 7,28-7,39 (м, 5 Н). Справочный пример 3-3. (3S,4R)-3-(1-Этоксикарбонилциклопропил)-4-метил-1-[(S)-1 фенилэтил]пирролидин.(40 мл) и к полученному раствору затем по каплям добавляют бензилхлорформиат (0,766 мл,5,37 ммоля). По окончании добавления реакционную смесь кипятят с обратным холодильником в течение 1,5 ч. По окончании реакции растворитель упаривают и полученный остаток очищают хроматографированием на колонке с силикагелем (силикагель, 100 мл, элюент этилацетат:гексан, 1:4), получают 1,17 г (выход 88%) названного соединения. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 0,69-0,77 (м, 2 Н), 1,04 (дд, J=6,83, 7,81 Гц, 3H),1,20-1,26 (м, 5 Н), 1,75-1,87 (м, 1 Н), 2,27-2,37 (м,1 Н), 2,91 (дт, J=2,93, 10,25 Гц, 1 Н), 3,32 (дд,J=10,74, 21,49 Гц, 1 Н), 3,59-3,75 (м, 2 Н), 4,074,13 (м, 2 Н), 5,12 (с, 2 Н), 7,21-7,33 (м, 5 Н). Справочный пример 3-5. 1-[(3S,4R)-1 Бензилоксикарбонил-4-метил-3-пирролидинил]циклопропанкарбоновая кислота.(3S,4R)-3-(1-Этоксикарбонилциклопропил)-4-метил-1-[(S)-1-фенилэтил]-2-пирролидинтион (1,80 г, 5,43 ммоля) растворяют в этаноле (100 мл), полученный раствор смешивают с никелем Ренея (10 мл) и кипятят с обратным холодильником в течение 1,5 ч. По окончании реакции реакционную массу фильтруют через целиты и фильтрат концентрируют при пониженном давлении. Полученный остаток растворяют в хлороформе (100 мл), промывают 10%ной аммиачной водой (100 мл), водой (100 мл) и насыщенным рассолом (100 мл) в указанном порядке, а затем сушат безводным сульфатом натрия. Полученный после упаривания растворителя остаток очищают хроматографированием на колонке с силикагелем (силикагель, 160 мл, элюент этилацетат:гексан, 1:1), получают 558 мг (выход 34 %) названного соединения. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 0,75-0,83 (м, 2 Н), 1,02 (д, J=6,84 Гц, 3H), 1,111,14 (м, 2 Н), 1,21 (т, J=7,08 Гц, 3H), 1,30 (д,J=6,59 Гц, 3H), 1,70-1,78 (м, 1 н), 2,04-2,15 (м,1 Н), 2,19 (дд, J=6,35, 9,03 Гц, 1 Н), 2,42 (дд,J=9,03, 6,83 Гц, 1 Н), 2,58 (т, J=8,55 Гц, 1 Н), 2,67(1,17 г, 3,66 ммоля) растворяют в этаноле (100 мл), полученный раствор смешивают с 1 н. водным раствором гидроксида натрия (11 мл) и кипятят с обратным холодильником в течение 8 ч. По окончании реакции растворитель упаривают и полученный остаток смешивают с 0,5 н. водным раствором соляной кислоты (30 мл). Смесь экстрагируют этилацетатом (50 мл х 3),органический слой промывают водой (50 мл) и насыщенным водным раствором хлорида натрия(50 мл) в указанном порядке, сушат безводным сульфатом натрия и затем упаривают растворитель. Получают 1,20 г названного соединения 23 1-[(3S,4R)-1-Бензилоксикарбонил-4-метил 3-пирролидинил]циклопропанкарбоновую кислоту (1,20 г, 3,66 ммоля) растворяют в третбутиловом спирте (50 мл), полученный раствор смешивают с дифенилфосфорилазидом (0,946 мл, 4,39 ммоля) и триэтиламином (1,02 мл, 7,32 ммоля) и кипятят с обратным холодильником в течение 19 ч. По окончании реакции растворитель упаривают и полученный остаток очищают хроматографированием на колонке с силикагелем (силикагель, 120 мл, элюент этилацетат:гексан, 1:2), получают 0,793 г (выход 58%) названного соединения. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,52-0,60 (м, 1 Н), 0,70-0,82 (м, 2 Н), 0,90-1,01 (м,1 Н), 1,15 (д, J=5,37 Гц, 3H), 1,41 (с, 9 Н), 1,41 (с,9 Н), 1,43-1,50 (м, 1 Н), 2,08-2,17 (м, 1 Н), 2,91 (дт,J=5,86, 10,26 Гц, 1 Н), 3,28 (т, J=10,26 Гц, 1 Н),3,57-3,73 (м, 2 Н), 4,80 (д, J=7,82 Гц, 1 Н), 5,12 (с,2 Н), 7,29-7,37 (м, 5 Н). Заявляемый пример 3. 5-Амино-7-[(3R,4R)3-(1-аминоциклопропил)-4-метил-1-пирролидинил]-6-фтор-1-[(1R,2S)-2-фторциклопропил]1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота.(3R,4R)-1-Бензилоксикарбонил-3-(1-третбутоксикарбониламиноциклопропил)-4-метилпирролидин (793 мг, 2,12 ммоля) растворяют в этаноле (50 мл) и полученный раствор смешивают с 5%-ным палладием-на-угле (790 мг) и проводят гидрирование при давлении 5 атмосфер. По окончании реакции 5%-ный палладийна-угле отфильтровывают и упаривают этанол. Полученный таким образом остаток растворяют в диметилсульфоксиде (8 мл), полученный раствор смешивают с триэтиламином (2 мл) и 5 амино-6,7-дифтор-1-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-8-метил-4-оксохинолин-3 карбоновой кислотой (330 мг, 1,06 ммоля) и перемешивают при 150 С в течение 18 ч. По окончании реакции упаривают диметилсульфоксид, полученный таким образом остаток смешивают с хлороформом (100 мл) и промывают 10%-ной лимонной кислотой (100 мл) и насыщенным рассолом (100 мл) в указанном порядке. Органический слой сушат безводным сульфатом натрия и затем упаривают растворитель. К полученному в результате остатку, который охлаждают на ледяной бане, добавляют по каплям концентрированную соляную кислоту(10 мл), а затем в течение часа перемешивают при комнатной температуре. По окончании реакции реакционную смесь промывают дихлорметаном (20 мл). Доводят рН водного слоя до 12 с помощью водного раствора гидроксида натрия и затем до рН 7,4 с помощью соляной кислоты,после чего проводят экстракцию хлороформом(100 мл х 4). Органические слои объединяют,сушат безводным сульфатом натрия и затем упаривают растворитель. Полученный таким образом остаток наносят на тонкий слой силикагеля для хроматографирования и проявляют с помощью нижнего слоя смеси растворителей хлороформ:метанол, 3:1, а затем соскребают и экстрагируют той же системой растворителей. Растворитель упаривают, полученный таким образом остаток растворяют в 1 н. водном растворе соляной кислоты (6 мл) и перемешивают при комнатной температуре в течение 10 мин. После упаривания растворителя полученный сырой продукт перекристаллизовывают из изопропилового спирта, получают 20,1 мг (выход 4%) названного соединения. Температура плавления: 203-205 С (разложение) []D24 = -162,93 (с = 0,205, 0,1 н. водный раствор гидроксида натрия). Спектр 1H-ЯМР (400 МГц, 0,1 н. NaOD,м.д.): 0,35-0,41 (м, 1 Н), 0,48-0,60 (м, 3H), 1,101,15 (м, 1 Н), 1,12 (д, J=6,35 Гц, 3H), 1,40-1,55 (м,2 Н), 2,26 (с, 3H), 2,18-2,24 (м, 1 Н), 3,30 (т,J=8,55 Гц, 1 Н), 3,29-3,51 (м, 2 Н), 3,76-3,78 (м,1 Н), 3,89-3,94 (м, 1 Н), 4,96 (дм, J=65,91 Гц, 1 Н),8,25 (д, J=2,93 Гц, 1 Н). Элементный анализ: C22H26F2N4O3HCl1,25 Н 2 О. Вычислено: С 53,77; Н 6,05; N 11,40. Найдено: С 53,68; Н 6,05; N 11,12. Справочный пример 4-1. 4-(S)-(1-Этоксикарбонилциклопропил)-3-(R)-гидрокси-1-[1-(S)фенилэтил]-2-пирролидон. В атмосфере азота в безводном тетрагидрофуране (200 мл) растворяют диизопропиламин (3,93 мл, 28,0 ммоля) и к раствору при температуре -78 С добавляют по каплям в течение 10 мин раствор 1,69 М раствор н-бутиллития в нгексане (15,9 мл, 26,9 ммоля). Через 20 мин перемешивания при 0 С и последующего охлаждения до -78 С к полученной реакционной массе добавляют по каплям в течение 15 мин раствор 4-(S)-(1-этоксикарбонилциклопропил)-1-[1(S)-фенилэтил]-2-пирролидона (6,74 г, 22,4 ммоля) в безводном тетрагидрофуране (40 мл). Реакционную массу перемешивают при -78 С в течение 10 мин и затем при той же температуре в реакционный сосуд подают высушенный кислород. Реакционную смесь перемешивают при-78 С в течение 20 мин, затем смешивают с насыщенным водным раствором хлористого аммония (200 мл), нагревают до комнатной температуры и отделяют органический слой. Водный слой экстрагируют диэтиловым эфиром (200 мл х 2), органические слои объединяют и сушат безводным сульфатом магния. Полученный после фильтрации фильтрат концентрируют при пониженном давлении, остаток наносят на ко 25 лонку с силикагелем для быстрой хроматографии и элюируют смесью н-гексан:этилацетат,2:1, получают 5,21 г (выход 73%) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,86-0,96 (м, 2 Н), 1,13 (т, J=7,08 Гц, 3H), 1,181,30 (м, 2 Н), 1,56 (д, J=6,92 Гц, 3H), 2,38 (дд,J=18,06, 9,28 Гц, 1 Н), 2,81 (т, J=9,28 Гц, 1 Н),3,50 (т, J=9,28 Гц, 2 Н), 3,99-4,07 (м, 2 Н), 4,11 (д,J=9,28 Гц, 1 Н), 5,48 (кв, J=6,92 Гц, 1 Н), 7,26-7,36(7,26 г, 22,87 ммоля) растворяют в безводном диметилформамиде (75 мл), полученный раствор смешивают с имидазолом (3,90 г, 57,3 ммоля) и перемешивают при комнатной температуре в течение 10 мин, полученную смесь затем смешивают с трет-бутилхлордиметилсиланом (4,32 г, 28,7 ммоля) и перемешивают в течение 4 ч. После концентрирования смеси при пониженном давлении получают остаток, который растворяют в этилацетате (300 мл), промывают водой (150 мл), насыщенным водным раствором бикарбоната натрия (150 мл х 5) и насыщенным рассолом (150 мл) в указанном порядке и затем сушат безводным сульфатом натрия. Фильтрат, полученный после фильтрования, концентрируют при пониженном давлении,полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесь н-гексан:этилацетат, 6:1. Получают 8,74 г (выход 88 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,043 (с, 3H), 0,122 (с, 3H), 0,54-0,63 (м, 1 Н),0,79 (с, 9 Н), 0,95 (т, J=7,08 Гц, 3H), 1,03-1,15 (м,3H), 1,38 (д, J=6,98 Гц, 3H), 1,61-1,90 (м, 1 Н),2,83 (т, J=9,28 Гц, 1 Н), 3,13 (т, J=9,28 Гц, 1 Н),3,81-3,90 (м, 2 Н), 4,48 (д, J=9,28 Гц, 1 Н), 5,36 3-(R)-трет-Бутилдиметилсилилокси-4-(S)(1-этоксикарбонилциклопропил)-1-[1-(S)-1 фенилэтил]-2-пирролидон растворяют в сухом бензоле (200 мл), полученный раствор смешивают с реактивом Лавессона (4,49 г, 11,1 ммоля) и кипятят с обратным холодильником в течение 26 3 ч. После охлаждения бензол упаривают, полученный остаток наносят на хроматографическую колонку с силикагелем для быстрого хроматографирования и элюируют смесью нгексан:этилацетат, 4:1, получают 7,96 г (выход 88%) названного соединения в виде светло-желтого масла. Спектр 1 Н-ЯМР (400 МГц, CDCl3,м.д.): 0,176 (с, 3H), 0,327 (с, 3H), 0,63-0,68 (м, 1 Н),0,92-0,95 (м, 1 Н), 0,95 (с, 9 Н), 1,11 (т, J=7,08 Гц,3H), 1,15-1,20 (м, 1 Н), 1,29-1,34 (м, 1 Н), 1,58 (д,J=6,84 Гц, 3H), 1,68-1,79 (м, 1 Н), 3,27 (т, J=10,74 Гц, 1 Н), 3,44 (дд, J=10,74, 8,79 Гц, 1 Н), 3,99-4,01 3-(R)-трет-Бутилдиметилсилилокси-4-(S)(1-этоксикарбонилциклопропил)-1-[1-(S)-1 фенилэтил]-2-пирролидинтион (7,96 г, 17,74 ммоля) растворяют в безводном этаноле (490 мл), полученный раствор смешивают с никелем Ренея (25 мл) и кипятят с обратным холодильником в течение 40 мин. После удаления катализатора путем фильтрования через целиты (с промывкой этанолом) полученный фильтрат концентрируют при пониженном давлении. Полученный в результате остаток растворяют в хлороформе (400 мл), промывают 10%-ной аммиачной водой (300 мл), водой (300 мл) и насыщенным рассолом (300 мл) в указанном порядке и затем сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют при пониженном давлении,полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан:этилацетат, 6:1, получают 5,48 г (выход 74 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,023 (с, 3H), 0,038 (с, 3H), 0,61-0,64 (м, 1 Н),0,83-0,85 (м, 1 Н), 0,84 (с, 9 Н), 1,11-1,13 (м, 2 Н),1,17 (т, J=7,33 Гц, 3H), 1,29 (д, J=6,83 Гц, 3H),1,74-1,79 (м, 1 Н), 2,35 (т, J=9,27 Гц, 1 Н), 2,622,67 (м, 1 Н), 2,74-2,77 (м, 1H), 3,16 (кв, J=6,51 Гц, 1 Н), 4,00-4,06 (м, 2 Н), 4,33-4,37 (м, 1 Н),7,23-7,30 (м, 5 Н). Справочный пример 4-5. 1-Бензилоксикарбонил-3-(S)-трет-бутилдиметилсилилокси-4-(R)(1-этоксикарбонилциклопропил)пирролидин. 27 3-(S)-трет-Бутилдиметилсилилокси-4-(R)(1-этоксикарбонилциклопропил)-1-[1-(S)-1-фенилэтил]пирролидин (5,48 г, 13,15 ммоля) растворяют в сухом дихлорметане (120 мл), полученный раствор охлаждают на ледяной бане и добавляют по каплям бензилхлорформиат (3,76 мл, 26,3 ммоля). Реакционную массу кипятят с обратным холодильником в течение 2 ч, дихлорметан упаривают при пониженном давлении. Затем полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования, элюируют смесью н-гексан : этилацетат, 5:1. Получают 4,52 г (выход 77%) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,049 (с, 6 Н), 0,66-0,71 (м, 1 Н), 0,87 (с, 9 Н), 0,930,97 (м, 1 Н), 1,04-1,08 (м, 1 Н), 1,22 (т, J=3,42 Гц,3H), 1,36-1,39 (м, 1 Н), 1,77-1,87 (м, 1 Н), 3,08 (т,J=8,29 Гц, 1 Н), 3,43 (кв, J=10,42 Гц, 1 Н), 3,603,82 (м, 2 Н), 4,08-4,16 (м, 2 Н), 4,54-4,63 (м, 1 Н),5,10-5,18 (м, 2 Н), 7,29-7,35 (м, 5 Н). Справочный пример 4-6. 1-Бензилоксикарбонил-3-(S)-гидрокси-4-(R)-(1-этоксикарбонилциклопропил)пирролидин. 1-Бензилоксикарбонил-3-(S)-трет-бутилдиметилсилилокси-4-(R)-(1-этоксикарбонилциклопропил)пирролидин (1,79 г, 4,00 ммоля) растворяют в тетрагидрофуране (40 мл), полученный раствор охлаждают на ледяной бане и затем по каплям добавляют 1,0 М раствор тетрабутиламмонийфторида в тетрагидрофуране (5,33 мл,5,33 ммоля). Реакционную массу перемешивают при комнатной температуре в течение 30 мин и затем при пониженном давлении упаривают тетрагидрофуран. Затем полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования, элюируют смесью н-гексан:этилацетат, 1:1. Получают 1,04 г (выход 76%) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 0,80-0,89 (м, 2 Н), 1,21-1,28 (м, 5 Н), 2,57-2,73 (м,1 Н), 2,85-2,98 (м, 1 Н), 3,23-3,33 (м, 2 Н), 3,623,67 (м, 1 Н), 3,82-3,99 (м, 1 Н), 4,10-4,25 (м, 3H),5,12 (с, 2 Н), 7,28-7,39 (м, 5 Н). Справочный пример 4-7. 1-[1-Бензилоксикарбонил-4-(R)-метокси-3-(S)-пирролидинил]циклопропанкарбоновая кислота В атмосфере азота в безводном тетрагидрофуране (20 мл) суспендируют 60%-ный гидрид натрия (0,149 г, 3,73 ммоля), к суспензии после охлаждения до 0 С по каплям в течение 5 28 мин добавляют раствор 1-бензилоксикарбонил 3-(S)-гидрокси-4-(R)-(1-этоксикарбонилциклопропил)пирролидина (0,98 г, 2,92 ммоля) в сухом тетрагидрофуране (20 мл). После 15 мин перемешивания при охлаждении на ледяной бане к реакционной смеси по каплям добавляют диметилсульфат (0,441 мл, 4,66 ммоля), охлаждая раствор на ледяной бане. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч и затем смешивают с водой (0,5 мл), а затем при пониженном давлении упаривают тетрагидрофуран. Полученный таким образом остаток растворяют в этаноле (40 мл) и к полученному раствору при комнатной температуре по каплям добавляют 1 М водный раствор гидроксида натрия (8,76 мл). Реакционный раствор кипятят с обратным холодильником в течение 2 ч и затем при пониженном давлении упаривают этанол. Полученный остаток охлаждают на ледяной бане, подкисляют путем добавления по каплям 1 М водного раствора соляной кислоты (15 мл) и затем экстрагируют этилацетатом (50 мл х 3). Все органические слои объединяют, промывают 1 н. водным раствором соляной кислоты (50 мл) и насыщенным рассолом (50 мл), а затем сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют в вакууме при пониженном давлении, получают 0,935 г (выход количественный) названного соединения в виде бесцветного аморфного вещества. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 0,84-0,89 (м, 1 Н), 0,89-1,01 (м, 1 Н), 1,25-1,35 (м,2 Н), 2,33-2,40 (м, 1 Н), 3,22-3,30 (м, 2 Н), 3,35 (с,3H), 3,74-3,91 (м, 3H), 5,12 (с, 2 Н), 7,32-7,38 (м,5 Н). Справочный пример 4-8. 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3-(R)-метоксипирролидин. 1-[1-Бензилоксикарбонил-4-(R)-метокси-3(S)-пирролидинил]циклопропанкарбоновую кислоту (713 мг, 2,22 ммоля) растворяют в третбутиловом спирте (20 мл), полученный раствор смешивают с дифенилфосфорилазидом (623 мкл, 2,89 ммоля) и триэтиламином (775 мкл,5,56 ммоля), перемешивают при комнатной температуре в течение 20 мин и затем кипятят с обратным холодильником в течение 19 ч. Реакционный раствор охлаждают и затем концентрируют при пониженном давлении. Полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан:этилацетат, 3:2, получают названное соединение (431 мг, выход 50 %) в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, СDCl3,м.д.): 0,65-0,97 (м, 4 Н), 1,39, 1,41 (каждый с, всего 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3-(R)-метоксипирролидин (550 мг, 1,41 ммоля) растворяют в этаноле (40 мл), полученный раствор смешивают с 5%-ным палладием-на-угле (катализатор,содержание воды 55,6%, 550 мг) и перемешивают в течение 4 ч в атмосфере водорода (4,5 кг/см 2). Катализатор отфильтровывают через целиты (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток растворяют в диметилсульфоксиде (5 мл), полученный раствор смешивают с 5-амино-6,7-дифтор-1-[2-(S)фтор-1-(R)-циклопропил]-1,4-дигидро-8-метил 4-оксохинолин-3-карбоновой кислотой (249,8 мг, 0,80 ммоля) и триэтиламином (3 мл) и перемешивают в течение двух дней в атмосфере азота и при нагревании на масляной бане (120 С). После охлаждения диметилсульфоксид упаривают при пониженном давлении, полученный таким образом остаток растворяют в хлороформе (100 мл), промывают 10%-ным водным раствором лимонной кислоты (50 мл х 2) и насыщенным рассолом (100 мл) в указанном порядке и затем органический слой сушат безводным сульфатом магния. Полученный после фильтрования фильтрат концентрируют при пониженном давлении. К полученному таким образом остатку, который охлаждают на ледяной бане,по каплям добавляют концентрированную соляную кислоту (10 мл) и затем перемешивают при комнатной температуре в течение 1 ч. После добавления к реакционному раствору воды (20 мл) водный раствор промывают дихлорметаном(50 мл х 3), доводят рН до 11 с помощью водного раствора гидроксида натрия и затем промывают дихлорметаном (50 мл х 2). Доводят рН полученной смеси до 7,4 с помощью концентрированной соляной кислоты и экстрагируют хлороформом (150 мл х 3). Органические слои объединяют, сушат безводным сульфатом натрия и затем фильтруют. Фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают с помощью препаративной тонкослойной хроматографии на силикагеле (проявление с помощью нижнего слоя смеси хлороформ:метанол:вода, 7:3:1), полученный сырой продукт очищают перекристаллизацией из смеси этанол: диизопропиловый эфир и затем сушат при пониженном дав 003321(3,99 мл, 30,4 ммоля) и к раствору при температуре -78 С добавляют по каплям в течение 10 мин 1,68 М раствор н-бутиллития в н-гексане(18,1 мл, 30,4 ммоля). Через 20 мин перемешивания при -10 С и последующего охлаждения до-78 С к полученной реакционной смеси добавляют по каплям в течение 15 мин раствор 4-(S)(1-этоксикарбонилциклопропил)-1-[1-(S)-фенилэтил]-2-пирролидона (7,052 г, 23,40 ммоля) в безводном тетрагидрофуране (30 мл). Реакционную массу перемешивают при -78 С в течение 1 ч и затем при той же температуре в течение 25 мин добавляют раствор N-фторбензолдисульфонимида (11,81 г, 37,44 ммоля) в безводном тетрагидрофуране (60 мл). Реакционную смесь перемешивают при -78 С в течение 2 ч и затем при комнатной температуре в течение 20 мин. Реакционную смесь охлаждают на ледяной бане и смешивают с насыщенным водным раствором хлористого аммония (200 мл) и отделяют органический слой. Водный слой экстрагируют диэтиловым эфиром (200 мл х 2),органические слои объединяют, промывают водой (200 мл х 3) и сушат безводным сульфатом магния. Полученный после фильтрации фильтрат концентрируют при пониженном давлении, остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан: этилацетат, 3:1,получают 5,276 г (выход 70,6 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,76-0,81 (м, 1 Н), 0,89-0,93 (м, 1 Н), 1,09 (т,J=6,84 Гц, 3H), 1,24-1,34 (м, 2 Н), 1,58 (д, J=7,33 Гц, 3H), 2,23 (д.кв, J=28,32, 8,30 Гц, 1 Н), 2,882,93 (м, 1 Н), 3,48 (т, J=9,28 Гц, 1 Н), 3,92-4,08 (м, 31 2 Н), 5,14 (дд, J=53,71, 7,81 Гц, 1 Н), 5,54 (кв,J=7,33 Гц, 1 Н), 7,27-7,34 (м, 5 Н) Справочный пример 5-2. 4-(S)-(1-Этоксикарбонилциклопропил)-3-(R)-фтор-1-[1-(S)-1 фенилэтил]-2-пирролидинтион.(4,825 г, 15,11 ммоля) растворяют в сухом бензоле (150 мл), полученный раствор смешивают с реактивом Лавессона (3,085 г, 7,625 ммоля) и кипятят с обратным холодильником в течение 30 мин. После охлаждения бензол упаривают при пониженном давлении, полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью нгексан:этилацетат, 5:1. Получают 4,494 г (выход 88,7%) названного соединения в виде светложелтого масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,75-0,82 (м, 1 Н), 0,88-0,93 (м, 1 Н), 1,11 (т,J=7,33 Гц, 3H), 1,25-1,34 (м, 2 Н), 1,64 (д, J=7,33 Гц, 3H), 2,28 (д.кв, J=26,86, 8,30 Гц, 1 Н), 3,123,18 (м, 1 Н), 3,72 (дд, J=11,23, 9,28 Гц, 1 Н), 3,924,08 (м, 2 Н), 5,22 (дд, J=53,22, 7,81 Гц, 1 Н), 6,33(4,401 г, 13,12 ммоля) растворяют в сухом этаноле (150 мл), полученный раствор смешивают с никелем Ренея (13 мл) и перемешивают при комнатной температуре в течение 1 ч. После удаления катализатора путем фильтрования через целиты (с промывкой этанолом) полученный фильтрат концентрируют при пониженном давлении. Полученный в результате остаток растворяют в диэтиловом эфире (250 мл), промывают 10%-ной аммиачной водой (100 мл х 5) и насыщенным рассолом (100 мл) в указанном порядке и затем сушат безводным сульфатом магния. Полученный после фильтрования фильтрат концентрируют при пониженном давлении, полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан : этилацетат, 4:1, получают 3,794 г (выход 94,7 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,66-0,71 (м, 1 Н), 0,83-0,88 (м, 1 Н), 1,19 (т,J=7,33 Гц, 3H), 1,28-1,44 (м, 2 Н), 1,37 (д, J=6,84(3,786 г, 12,40 ммоля) растворяют в сухом дихлорметане (120 мл), полученный раствор охлаждают на ледяной бане и добавляют по каплям бензилхлорформиат (3,37 мл, 25 ммолей). После перемешивания реакционной смеси в течение 25 ч при комнатной температуре, дихлорметан упаривают при пониженном давлении. Затем полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования, элюируют смесью н-гексан : этилацетат, 4:1. Получают 3,718 г (выход 89,4%) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,71-0,78 (м, 1 Н), 0,90-0,95 (м, 1 Н), 1,23 (т,J=6,83 Гц, 3H), 1,19-1,25 (м, 1 Н), 1,28-1,32 (м,1 Н), 2,48 (дм, J=28,32 Гц, 1 Н), 3,27 (т, J=10,25 Гц, 1 Н), 3,67 (дд, J=23,93, 13,19 Гц, 1 Н), 3,803,92 (м, 2 Н), 4,11 (кв, J=6,83 Гц, 2 Н), 5,14 (с,2 Н), 5,17 (уш.д, J=55,17 Гц, 1 Н), 7,29-7,35 (м,5 Н). Справочный пример 5-5. 1-[1-Бензилоксикарбонил-4-(R)-фтор-3-(S)-пирролидинил] циклопропанкарбоновая кислота.(3,715 г, 11,08 ммоля) растворяют в этаноле (110 мл) и к полученному раствору при охлаждении на ледяной бане по каплям добавляют 10 н. водный раствор гидроксида натрия (11 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и затем при пониженном давлении упаривают этанол. Полученный остаток смешивают с водой (50 мл) и промывают дихлорметаном (50 мл х 2). Отделенный водный слой охлаждают на ледяной бане,подкисляют путем добавления по каплям концентрированной соляной кислоты, экстрагируют диэтиловым эфиром (100 мл х 5) и затем сушат безводным сульфатом магния. Полученный 33 после фильтрования фильтрат концентрируют при пониженном давлении, остаток растворяют в бензоле (100 мл) и снова концентрируют при пониженном давлении. Стадию азеотропной сушки с бензолом повторяют 3 раза, получают 3,346 г (выход 98,3 %) названного соединения в виде бесцветного аморфного вещества. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,84-0,89 (м, 1 Н), 0,99-1,07 (м, 1 Н), 1,32-1,42 (м,2 Н), 2,37-2,56 (м, 1 Н), 3,26-3,31 (м, 1 Н), 3,583,67 (м, 1 Н), 3,82-3,88 (м, 2 Н), 5,13 (с, 1 Н), 5,20 1-[1-Бензилоксикарбонил-4-(R)-фтор-3-(S)пирролидинил]циклопропанкарбоновую кислоту (3,342 г, 10,87 ммоля) растворяют в третбутиловом спирте (100 мл), полученный раствор смешивают с дифенилфосфорилазидом (2,398 мкл, 11,11 ммоля) и триэтиламином (2,273 мкл,16,31 ммоля), перемешивают при комнатной температуре в течение 2 ч и затем кипятят с обратным холодильником в течение 14 ч. Реакционный раствор охлаждают и затем концентрируют при пониженном давлении. Полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан:этилацетат, 3:1, получают названное соединение (2,682 г, выход 65,2 %) в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 0,64-0,70 (м, 1 Н), 0,79-0,83 (м, 1 Н), 0,86-1,09 (м,2 Н), 1,39, (с, 9 Н), 2,21 (дм, J=21,48 Гц, 1 Н), 3,44 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3-(R)-фторпирролидин (757,8 мг, 2,002 ммоля) растворяют в метаноле (80 мл), полученный раствор смешивают с 5%-ным палладием-на-угле (катализатор,содержание воды 55,6%, 800 мг) и перемешивают в течение 7 ч в атмосфере водорода (4,5 кг/см 2). Катализатор удаляют путем фильтрования на целитах (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток рас 003321 34 творяют в диметилсульфоксиде (8 мл), полученный раствор смешивают с 5-амино-6,7 дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4 дигидро-8-метил-4-оксохинолин-3-карбоновой кислотой (404,7 мг, 1,296 ммоля) и триэтиламином (3 мл) и перемешивают в течение 4 дней в атмосфере азота и при нагревании на масляной бане (120 С). После охлаждения диметилсульфоксид упаривают при пониженном давлении,полученный таким образом остаток растворяют в хлороформе (150 мл) и промывают 10%-ным водным раствором лимонной кислоты (100 мл х 2) и насыщенным рассолом (100 мл) в указанном порядке и затем органический слой сушат безводным сульфатом магния. Полученный после фильтрования фильтрат концентрируют при пониженном давлении. К полученному таким образом остатку, который охлаждают на ледяной бане, по каплям добавляют концентрированную соляную кислоту (10 мл) и затем перемешивают при комнатной температуре в течение 15 минут. После добавления к реакционному раствору воды (10 мл) водный раствор промывают дихлорметаном (30 мл х 4), доводят рН до 7,4 с помощью водного раствора гидроксида натрия и затем экстрагируют хлороформом (100 мл х 4). Органические слои объединяют, сушат сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток подвергают препаративной тонкослойной хроматографии на силикагеле (проявление с помощью нижнего слоя смеси хлороформ:метанол:вода, 7:3:1), полученный сырой продукт растворяют в этаноле(20 мл). К раствору при охлаждении на ледяной бане добавляют по каплям 1 н. соляную кислоту(1,5 мл) и полученный раствор перемешивают в течение 5 мин при той же температуре, а затем концентрируют при пониженном давлении (3 кратная азеотропная отгонка с этанолом). Затем полученный остаток очищают перекристаллизацией из смеси этанол: диизопропиловый эфир и сушат при пониженном давлении. Получают 141,8 мг (выход 22,3%) названного соединения в виде желтого порошка. Температура плавления: 220,2-224,9 С (разложение). Спектр 1H-ЯМР (400 МГц, 0,1 н. NaOD,м.д.): 0,58-0,68 (м, 4 Н), 1,11-1,25 (м, 1 Н), 1,521,59 (м, 1 Н), 2,41 (с, 3H), 2,39-2,49 (м, 1 Н), 3,39 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3-(S)-фторпирролидин (759,9 мг, 2,008 ммоля) растворяют в метаноле (80 мл), полученный раствор смешивают с 5%-ным палладием-на-угле (катализатор,содержание воды 55,6%, 800 мг) и перемешивают в течение 7 ч при давлении водорода 4,5 кг/см 2. Катализатор отфильтровывают через целиты (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный в результате остаток растворяют в диметилсульфоксиде (8 мл), раствор смешивают с хелатом 9,10-дифтор-2,3-дигидро-3-(S)-метил 7-оксо-7 Н-пиридо-[1.2.3-de][1.4]бензоксазин-6 карбоновая кислота/BF2 (440,9 мг, 1,340 ммоля) и триэтиламином (374 мкл, 2,68 ммоля) и перемешивают при комнатной температуре в течение 20 ч. После концентрирования реакционного раствора при пониженном давлении полученный остаток смешивают с водой и выпадающие в осадок желтые кристаллы отфильтровывают и промывают водой. Полученные кристаллы суспендируют в растворе метанол:вода,9:1 (20 мл), суспензию смешивают с триэтиламином (1 мл) и кипятят с обратным холодильником в течение 4 ч. После охлаждения реакционную массу концентрируют при пониженном давлении и полученный остаток растворяют в хлороформе (100 мл), промывают 10%-ным водным раствором лимонной кислоты (100 мл х 2) и насыщенным рассолом (100 мл) в указанном порядке и затем органический слой сушат безводным сульфатом магния. Полученный после фильтрования фильтрат концентрируют при пониженном давлении. К полученному остатку,который охлаждают на ледяной бане, добавляют по каплям концентрированную соляную кислоту (10 мл), а затем перемешивают в течение 15 мин при комнатной температуре. После добавления к реакционному раствору воды (10 мл) водный слой промывают дихлорметаном (30 мл х 2 ), доводят рН до 7,2 с помощью водного раствора гидроксида натрия и экстрагируют хлороформом (100 мл х 4). Органические слои объединяют, сушат безводным сульфатом магния и затем фильтруют и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают перекристаллизацией из смеси этанола и 28%-ной аммиачной воды и сушат при пониженном давлении. Получают 370,8 мг(2,49 мл, 19,0 ммоля) и к раствору при температуре -78 С добавляют по каплям в течение 10 мин 1,68 М раствор н-бутиллития в н-гексане(11,2 мл, 18,8 ммоля). Через 20 мин перемешивания при -10 С и последующего охлаждения до-78 С к полученной реакционной смеси добавляют по каплям в течение 15 мин раствор 4(S)(1-этоксикарбонилциклопропил)-3-(R)-фтор-1[1-(S)-фенилэтил]-2-пирролидона (5,011 г, 15,69 ммоля) в безводном тетрагидрофуране (15 мл). Реакционную массу перемешивают при -78 С в течение 30 мин и затем при той же температуре в течение 20 мин добавляют по каплям растворN-фторбензолдисульфонимида (7,421 г, 23,54 ммоля) в безводном тетрагидрофуране (35 мл). Реакционную смесь перемешивают при -78 С в течение 2 ч и затем при комнатной температуре в течение 1 ч. Реакционную смесь охлаждают на ледяной бане и смешивают с насыщенным водным раствором хлористого аммония (100 мл) и отделяют органический слой. Водный слой экстрагируют диэтиловым эфиром (100 мл х 3),органические слои объединяют, промывают водой (100 мл х 2) и сушат безводным сульфатом магния. Полученный после фильтрации фильтрат концентрируют при пониженном давлении, остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан:этилацетат, 4:1, получают 3,637 г (выход 68,7 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, СDСl3,м.д.): 0,76-0,82 (м, 1 Н), 0,87-0,94 (м, 1 Н), 1,09 (т,J=6,83 Гц, 3H), 1,23-1,36 (м, 2 Н), 1,58 (д, J=7,33 Гц, 3H), 2,56-2,69 (м, 1 Н), 2,92-2,98 (м, 1 Н), 3,53(3,621 г, 10,73 ммоля) растворяют в сухом бензоле (100 мл), полученный раствор смешивают с реактивом Лавессона (2,192 г, 5,420 ммоля) и кипятят с обратным холодильником в течение 1 ч. После охлаждения бензол упаривают при пониженном давлении, полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью нгексан:этилацетат, 5:1. Получают 2,886 г (выход 76,1 %) названного соединения в виде светложелтого масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,85-0,95 (м, 2 Н), 1,10 (т, J=6,84 Гц, 3H), 1,241,32 (м, 2 Н), 1,64 (д, J=7,33 Гц, 3H), 2,69-2,81 (м,1 Н), 3,20 (ддд, J=11,72, 6,84, 2,93 Гц, 1 Н), 3,73(2,883 г, 8,157 ммоля) растворяют в безводном этаноле (80 мл), полученный раствор смешивают с никелем Ренея (8 мл) и перемешивают при комнатной температуре в течение 30 мин. После удаления катализатора путем фильтрования через целиты (с промывкой этанолом) полученный фильтрат концентрируют при пониженном давлении. Полученный в результате остаток растворяют в диэтиловом эфире (150 мл), промывают 10%-ной аммиачной водой (100 мл х 4) и насыщенным рассолом (100 мл) в указанном порядке и затем сушат безводным сульфатом магния. Полученный после фильтрования фильтрат концентрируют при пониженном давлении, а полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан: этилацетат, 4:1, получают 2,540 г (выход 96,3 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, СDCl3,м.д.): 0,67-0,89 (м, 2 Н), 1,19 (т, J=7,33 Гц, 3H), 1,271,46 (м, 2 Н), 1,38 (д, J=7,33 Гц, 3H), 2,34-2,62 (м,2 Н), 2,68-2,96 (м, 2 Н), 3,20 (кв, J=7,33 Гц, 1 Н),3,52-3,48 (м, 1 Н), 3,94-4,09 (м, 2 Н), 7,28-7,34 (м,5 Н). Справочный пример 6-4. 1-Бензилоксикарбонил-4-(R)-(1-этоксикарбонилциклопропил)-3,3-дифторпирролидин.(2,536 г, 7,842 ммоля) растворяют в сухом дихлорметане (80 мл), полученный раствор охлаждают на ледяной бане и добавляют к нему по каплям бензилхлорформиат (2,80 мл, 19,6 ммоля). Реакционную смесь перемешивают при комнатной температуре в течение 44 ч, дихлорметан упаривают при пониженном давлении. Затем полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан:этилацетат,4:1. Получают 2,294 г (выход 82,8 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,97-1,05 (м, 1 Н), 1,07-1,16 (м, 1 Н), 1,22 (т,J=7,33 Гц, 3H), 1,20-1,30 (м, 1 Н), 1,32-1,42 (м,1 Н), 2,93-3,07 (м, 1 Н), 3,36-3,44 (м, 1 Н), 3,773,84 (м, 2 Н), 3,93 (т, J=10,74 Гц, 1 Н), 4,12 (д.кв,J=7,33, 1,47 Гц, 2 Н), 5,14 (с, 2 Н), 7,28-7,35 (м,5 Н). Справочный пример 6-5. 1-[1-Бензилоксикарбонил-4,4-дифтор-3-(S)-пирролидинил] циклопропанкарбоновая кислота.(2,287 г, 6,472 ммоля) растворяют в этаноле (65 мл) и к полученному раствору при охлаждении на ледяной бане по каплям добавляют 10 н. водный раствор гидроксида натрия (6,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч и затем при пониженном давлении упаривают этанол. Полученный остаток смешивают с водой (50 мл) и промывают дихлорметаном (50 мл х 2). Отделенный водный слой охлаждают на ледяной бане,подкисляют путем добавления по каплям концентрированной соляной кислоты, экстрагируют диэтиловым эфиром (100 мл х 5 ) и затем экстракт сушат безводным сульфатом магния. Полученный после фильтрования фильтрат концентрируют при пониженном давлении, остаток растворяют в бензоле (100 мл) и снова концентрируют при пониженном давлении. Стадию азеотропной сушки с бензолом повторяют 3 раза, получают 1,956 г (выход 92,9 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 1,08-1,14 (м, 1 Н), 1,19-1,28 (м, 1 Н), 1,37-1,42 (м,1 Н), 1,44-1,49 (м, 1 Н), 2,93-3,09 (м, 1 Н), 3,373,46 (м, 1 Н), 3,76-3,85 (м, 2 Н), 3,92-4,00 (м, 1 Н),5,14 (с, 2 Н), 7,29-7,34 (м, 5 Н). Справочный пример 6-6. 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3,3-дифторпирролидин. 1-[1-Бензилоксикарбонил-4,4-дифтор-3(S)-пирролидинил]циклопропанкарбоновую кислоту (1,953 г, 6,004 ммоля) растворяют в трет-бутиловом спирте (50 мл), полученный раствор смешивают с дифенилфосфорилазидом(1,381 мкл, 9,906 ммоля), перемешивают при комнатной температуре в течение 2 ч и затем кипятят с обратным холодильником в течение 16 ч. Реакционный раствор охлаждают и затем концентрируют при пониженном давлении. Полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан:этилацетат, 4:1, получают 1,430 г (выход 60,1%.) названного соединения в виде бесцветного масла. Спектр 1H-ЯMP (400 МГц, CDCl3,м.д.): 0,83-0,92 (м, 2 Н), 1,40 (с, 9 Н), 1,34-1,55 (м, 2 Н),2,38-2,51 (м, 1 Н), 3,47 (т, J=9,28 Гц, 1 Н), 3,673,84 (м, 2 Н), 4,99 (уш.с, 1 Н), 5,13 (с, 2 Н), 7,297,35 (м, 5 Н). Заявляемый пример 7. 5-Амино-7-[4-(R)(1-аминоциклопропил)-3,3-дифтор-1-пирролидинил]-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-8-метил-4-оксохинолин-3 карбоновой кислоты гидрохлорид. 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3,3-дифторпирролидин (792,4 мг, 1,999 ммоля) растворяют в метаноле (80 мл), полученный раствор смешивают с 5%-ным палладием-на-угле (катализатор,содержание воды 55,6%, 800 мг) и перемешивают в течение 6 ч в атмосфере водорода (давление 4,5 кг/см 2). Катализатор удаляют путем фильтрования на целитах (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток растворяют в диметилсульфоксиде (8 мл),полученный раствор смешивают с 5-амино-6,7 дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4 дигидро-8-метил-4-оксохинолин-3-карбоновой кислотой (416,2 мг, 1,333 ммоля) и триэтиламином (3 мл) и перемешивают в течение 5 дней в атмосфере азота и при нагревании на масляной бане (120 С). После охлаждения диметилсульфоксид упаривают при пониженном давлении, полученный таким образом остаток растворяют в хлороформе (150 мл), промывают 10%-ным водным раствором лимонной кислоты(100 мл х 2) и насыщенным рассолом (100 мл) в указанном порядке и затем органический слой сушат безводным сульфатом магния. Получен 003321 40 ный после фильтрования фильтрат концентрируют при пониженном давлении. К полученному таким образом остатку, который охлаждают на ледяной бане, по каплям добавляют концентрированную соляную кислоту (10 мл) и затем перемешивают при комнатной температуре в течение 15 мин. После добавления к реакционному раствору воды (10 мл) водный раствор промывают дихлорметаном (30 мл х 5), доводят рН до 7,4 с помощью водного раствора гидроксида натрия и затем экстрагируют хлороформом (100 мл х 4). Органические слои объединяют, сушат сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток подвергают препаративной тонкослойной хроматографии на силикагеле (проявление с помощью нижнего слоя смеси хлороформ:метанол:вода,7:3:1), полученный сырой продукт растворяют в этаноле (20 мл). К раствору при охлаждении на ледяной бане добавляют по каплям 1 н. соляную кислоту (1,5 мл) и полученный раствор перемешивают в течение 5 мин при той же температуре, а затем концентрируют при пониженном давлении (3-кратная азеотропная отгонка с этанолом). Затем полученный остаток очищают перекристаллизацией из смеси этанол : диизопропиловый эфир и сушат при пониженном давлении. Получают 137,4 мг (выход 19,9 %) названного соединения в виде желтого порошка. Температура плавления: 211,2-215,4 С 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3,3-дифторпирролидин (628,8 мг, 1,586 ммоля) растворяют в метаноле (60 мл), полученный раствор смешивают с 5%-ным палладием-на-угле (катализатор,содержание воды 55,6%, 650 мг) и перемешивают в течение 7 ч при давлении водорода 4,5 кг/см 2. Катализатор отфильтровывают через целиты (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный в результате остаток растворяют в диметилсульфоксиде (8 мл), раствор смешивают с хелатом 9,10-дифтор-2,3-дигидро-3-(S)-метил 41 7-оксо-7 Н-пиридо-[1.2.3-de][1.4]бензоксазин-6 карбоновая кислота/ВF2 (347,9 мг, 1,057 ммоля) и триэтиламином (294 мкл, 2,11 ммоля) и перемешивают при комнатной температуре в течение 41 ч. После концентрирования реакционного раствора при пониженном давлении, полученный остаток смешивают с водой и выпадающие в осадок желтые кристаллы отфильтровывают и промывают водой. Полученные кристаллы суспендируют в растворе метанол:вода,9:1 (20 мл), суспензию смешивают с триэтиламином (1 мл) и кипятят с обратным холодильником в течение 5 ч. После охлаждения реакционную массу концентрируют при пониженном давлении и полученный остаток растворяют в хлороформе (100 мл), промывают 10%-ным водным раствором лимонной кислоты (100 мл х 2) и насыщенным рассолом (100 мл) в указанном порядке и затем органический слой сушат безводным сульфатом магния. Полученный после фильтрования фильтрат концентрируют при пониженном давлении. К полученному остатку,который охлаждают на ледяной бане, добавляют по каплям концентрированную соляную кислоту (10 мл), а затем перемешивают в течение 15 мин при комнатной температуре. После добавления воды (10 мл) водный слой промывают дихлорметаном (30 мл х 3), доводят рН до 7,2 с помощью водного раствора гидроксида натрия и экстрагируют хлороформом (100 мл х 4). Органические слои объединяют, сушат безводным сульфатом магния, затем фильтруют и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают перекристаллизацией из смеси этанола и 28%-ной аммиачной воды и сушат при пониженном давлении. Получают 183,8 мг (41,1%) названного соединения в виде светло-желтых кристаллов. Температура плавления: 246,7-248,0 С В атмосфере азота в безводном тетрагидрофуране (100 мл) растворяют диизопропиламин (7,22 мл, 51,52 ммоля) и к полученному раствору при температуре -78 С добавляют по каплям в течение 15 мин 1,68 М раствор н 003321 42 бутиллития в н-гексане (28,1 мл, 47,21 ммоля). Через 10 мин перемешивания при 0 С и последующего охлаждения до -78 С к полученной реакционной смеси по каплям в течение 20 мин добавляют раствор 4-(S)-(1-этоксикарбонилциклопропил)-3-(R)-фтор-1-[1-(S)-фенилэтил]-2 пирролидона (13,72 г, 42,96 ммоля) в безводном тетрагидрофуране (40 мл). Реакционную массу перемешивают при -78 С в течение еще 20 мин и затем в течение 20 мин добавляют по каплям раствор 2,6-ди-трет-бутилфенола (10,63 г, 51,52 ммоля) в безводном тетрагидрофуране (40 мл). Реакционную смесь перемешивают при -78 С в течение 10 мин и нагревают до комнатной температуры. При охлаждении на ледяной бане полученный раствор смешивают с насыщенным водным раствором хлористого аммония (200 мл) и отделяют органический слой. Водный слой экстрагируют диэтиловым эфиром (200 мл х 2),органические слои объединяют, промывают водой (400 мл х 2) и сушат безводным сульфатом магния. Полученный после фильтрации фильтрат концентрируют при пониженном давлении, остаток наносят на колонку с силикагелем для быстрой хроматографии и элюируют смесью н-гексан:этилацетат, 3:1, получают 10,19 г (выход 74,2 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, СDCl3,м.д.): 0,57-0,63 (м, 1 Н), 0,78-0,84 (м, 1 Н), 1,07-1,13 (м,1 Н), 1,26 (т, J=7,09 Гц, 3H), 1,23-1,29 (м, 1 Н),1,54 (д, J=7,32 Гц, 3H), 2,59 (т, J=9,77 Гц, 1 Н),3,05 (д.кв, J=28,81, 8,30 Гц, 1 Н), 3,25 (т, J=9,77 Гц, 1 Н), 4,00-4,16 (м, 2 Н), 5,15 (дд, J=52,73, 6,35 Гц, 1 Н), 5,53 (кв, J=7,32 Гц, 1 Н), 7,27-7,38 (м,5 Н). Справочный пример 7-2. 4-(S)-(1-Этоксикарбонилциклопропил)-3-(S)-фтор-1-[1-(S)-1 фенилэтил]-2-пирролидинтион.(6,86 г, 21,48 ммоля) растворяют в сухом толуоле (100 мл), полученный раствор смешивают с реактивом Лавессона (5,21 г, 12,89 ммоля) и нагревают при 60 С в течение 30 мин. После охлаждения толуол упаривают при пониженном давлении, полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан : этилацетат, 4:1. Получают 6,49 г (выход 90,1%) названного соединения в виде светло-желтого масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,59-0,66 (м, 1 Н), 0,86-0,92 (м, 1 Н), 1,08-1,15 (м,1 Н), 1,20 (т, J=7,33 Гц, 3H), 1,24-1,31 (м, 1 Н),1,60 (д, J=7,32 Гц, 3H), 2,85 (дд, J=11,23, 9,28 Гц,1 Н), 3,16 (д.кв, J=30,27, 8,30 Гц, 1 Н), 3,50 (дд, 43 4-(S)-(1-Этоксикарбонилциклопропил)-3(S)-фтор-1-[1-(S)-фе-илэтил]-2-пирролидинтион (6,49 г, 19,35 ммоля) растворяют в безводном тетрагидрофуране (150 мл), полученный раствор смешивают с никелем Ренея (15 мл) и перемешивают при комнатной температуре в течение 30 мин. После удаления катализатора путем фильтрования через целиты (с промывкой тетрагидрофураном) полученный фильтрат концентрируют при пониженном давлении. Полученный в результате остаток растворяют в диэтиловом эфире (200 мл), промывают 10%-ной аммиачной водой (200 мл х 2) и насыщенным рассолом (150 мл) в указанном порядке и затем сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют при пониженном давлении, получают 5,08 г (выход 86,0 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,54-0,60 (м, 1 Н), 0,95-1,08 (м, 2 Н), 1,22 (т,J=7,33 Гц, 3H), 1,25-1,32 (м, 1 Н), 1,35 (д, J=6,35 Гц, 3H), 1,99 (т, J=9,28 Гц, 1 Н), 2,42 (т, J=8,30 Гц, 1 Н), 2,63 (ддд, J=33,21, 11,72, 1,95 Гц, 1 Н),2,99 (д.м, J=28,32 Гц, 1H), 3,25-3,37 (м, 2 Н),4,03-4,16 (м, 2 Н), 5,33 (дм, J=55,67 Гц, 1H), 7,217,36 (м, 5 Н). Справочный пример 7-4. 1-Бензилоксикарбонил-4-(S)-(1-этоксикарбонилциклопропил)-3(S)-фторпирролидин. 4-(S)-(1-Этоксикарбонилциклопропил)-3(S)-фтор-1-[1-(S)-1-фенилэтил]пирролидин (5,08 г, 16,63 ммоля) растворяют в сухом дихлорметане (50 мл), полученный раствор охлаждают на ледяной бане и добавляют к нему по каплям бензилхлорформиат (3,56 мл, 25,0 ммолей). После кипячения с обратным холодильником реакционного раствора в течение 1 ч дихлорметан упаривают при пониженном давлении. Затем полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования, элюируют смесью н-гексан : этилацетат, 3:1. Получают 4,67 г (выход 83,7 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,71-0,78 (м, 1 Н), 1,11-1,23 (м, 2 Н), 1,24 (т, 003321 1-Бензилоксикарбонил-4-(S)-(1-этоксикарбонилциклопропил)-3-(S)-фторпирролидин (4,67 г, 13,92 ммоля) растворяют в этаноле (50 мл) и к полученному раствору по каплям добавляют 1 н. водный раствор гидроксида натрия (50 мл). Реакционную смесь перемешивают при 40 С в течение 1,5 ч и затем при пониженном давлении упаривают этанол. Полученный остаток смешивают с водой (50 мл) и промывают хлороформом (100 мл). Отделенный водный слой подкисляют путем добавления по каплям 1 н. соляной кислоты, экстрагируют хлороформом (200 мл х 2 ) и затем диэтиловым эфиром (100 мл). Органические слои объединяют и сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют при пониженном давлении, получают 3,94 г (выход 92,1 %) названного соединения в виде бесцветного аморфного вещества. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,79-0,89 (м, 1 Н), 1,18-1,35 (м, 2 Н), 1,37-1,47 (м,1 Н), 2,90-3,18 (м, 2 Н), 3,50-3,84 (м, 3H), 5,13 (с,2 Н), 5,31 (ддм, J=53,22, 15,13 Гц, 1 Н), 7,26-7,42 1-[1-Бензилоксикарбонил-4-(S)-дифтор-3(S)-пирролидинил]-циклопропанкарбоновую кислоту (3,22 г, 10,48 ммоля) растворяют в безводном ацетонитриле (80 мл), полученный раствор смешивают с N,N'-карбонилдиимидазолом(2,55 г, 15,73 ммоля) и перемешивают при комнатной температуре в течение 30 мин. При этой же температуре в течение 30 мин через реакционный раствор барботируют аммиак. Реакционный раствор концентрируют при пониженном давлении. Полученный остаток смешивают с водой (80 мл) и экстрагируют хлороформом (80 х 2), органические слои объединяют и сушат безводным сульфатом натрия. Полученный остаток растворяют в трет-бутиловом спирте (100 мл) и раствор смешивают с тетраацетатом свинца (7,93 г, 15,70 ммоля) и кипятят с обратным 45 холодильником в течение 30 мин. Раствор охлаждают, смешивают с диэтиловым эфиром (50 мл) и бикарбонатом натрия (10 г) и затем перемешивают при комнатной температуре в течение 10 мин. Фильтрат, полученный после фильтрования, концентрируют при пониженном давлении. Полученный в результате остаток смешивают с этилацетатом (150 мл), промывают насыщенным водным раствором бикарбоната натрия и сушат безводным сульфатом натрия. Фильтруют, фильтрат упаривают при пониженном давлении, полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью н-гексан: этилацетат, 3:2. Получают 3,216 г (81,2 %) названного соединения в виде бесцветного масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 0,65-0,74 (м, 1 Н), 0,77-0,84 (м, 1 Н), 0,85-1,00 (м,2 Н), 1,42 (с, 9 Н), 2,21 (ддм, J=80,57, 36,14 Гц,1 Н), 3,08-3,24 (м, 2 Н), 3,48-3,84 (м, 3H), 5,02 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3-(S)-фторпирролидин (1,43 г, 3,78 ммоля) растворяют в этаноле (60 мл), полученный раствор смешивают с 5 %-ным палладием-на-угле (катализатор,содержание воды 55,6%, 1,5 г) и перемешивают в течение 3 ч в атмосфере водорода. Катализатор удаляют путем фильтрования на целитах (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток растворяют в диметилсульфоксиде (12 мл), полученный раствор смешивают с 5-амино-6,7-дифтор-1-[2-(S)-фтор-1(R)-циклопропил]-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновой кислотой (1,18 г, 3,78 ммоля) и триэтиламином (3 мл) и перемешивают в течение 3 дней в атмосфере азота при 130 С. После охлаждения диметилсульфоксид упаривают при пониженном давлении, полученный таким образом остаток растворяют в хлороформе (80 мл) и промывают 10%-ным водным раствором лимонной кислоты (80 мл) и насыщенным рассолом (100 мл) в указанном порядке и затем органический слой сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют при пониженном давлении. Полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью хлороформ:метанол, 9:1, элюат концентрируют при пониженном давлении. К полученному таким 46 образом остатку, который охлаждают на ледяной бане, по каплям добавляют концентрированную соляную кислоту (10 мл) и затем перемешивают при комнатной температуре в течение 50 минут. После добавления к реакционному раствору 1 н. соляной кислоты (30 мл) водный раствор промывают хлороформом (50 мл х 2), доводят рН до 12 с помощью водного раствора гидроксида натрия. Водный раствор промывают хлороформом (100 мл), доводят рН до 7,4 с помощью 1 н. соляной кислоты и экстрагируют хлороформом (150 мл х 3). Органические слои объединяют, сушат сульфатом натрия и фильтруют. Фильтрат концентрируют при пониженном давлении. К полученному таким образом остатку, который охлаждают на ледяной бане, добавляют по каплям 1 н. соляную кислоту(2,0 мл), затем перемешивают 5 мин при той же температуре и реакционную массу концентрируют при пониженном давлении (3-кратная азеотропная отгонка с этанолом). Затем полученный остаток очищают перекристаллизацией из этанола и сушат при пониженном давлении. Получают 230 мг (выход 12,1 %) названного соединения в виде желтого порошка. Спектр 1H-ЯМР (400 МГц, 0,1 н. NaOD,м.д.): 0,55-0,71 (м, 4 Н), 1,10-1,21 (м, 1 Н), 1,461,58 (м, 1 Н), 2,30 (с, 3H), 2,21-2,35 (м, 1 Н), 3,32 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3-(S)-фторпирролидин (400 мг, 1,06 ммоля) растворяют в этаноле (20 мл), полученный раствор смешивают с 5%-ным палладием-на-угле (катализатор,содержание воды 55,6%, 500 мг) и перемешивают в течение 18 ч в атмосфере водорода. Катализатор удаляют путем фильтрования на целитах (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток растворяют в диметилсульфоксиде (8 мл), полученный раствор смешивают с 5-амино-6,7-дифтор-1-[2-(S)фтор-1-(R)-циклопропил]-1,4-дигидро-8-метокси-4-оксохинолин-3-карбоновой кислотой (289 мг, 0,88 ммоля) и триэтиламином (2 мл) и перемешивают в течение 26 ч в атмосфере азота при температуре 110 С. После охлаждения диметил 47 сульфоксид упаривают при пониженном давлении, полученный таким образом остаток растворяют в хлороформе (80 мл) и промывают 10%-ным водным раствором лимонной кислоты(80 мл) и затем органический слой сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют при пониженном давлении. Полученный остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью хлороформ:метанол, 9:1, элюат концентрируют при пониженном давлении. К полученному таким образом остатку, который охлаждают на ледяной бане, по каплям добавляют концентрированную соляную кислоту (5 мл) и затем перемешивают при комнатной температуре в течение 20 мин. После добавления к реакционному раствору 1 н. соляной кислоты (30 мл) водный раствор промывают хлороформом (50 мл х 2) и доводят рН до 12 с помощью водного раствора гидроксида натрия. Водный раствор промывают хлороформом (100 мл х 2), доводят рН до 7,4 с помощью 1 н. соляной кислоты и затем экстрагируют хлороформом (200 мл х 3). Органические слои объединяют, сушат сульфатом натрия и фильтруют. Фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают перекристаллизацией из этанола и сушат при пониженном давлении. Получают 170 мг (выход 42,6 %) названного соединения в виде желтого порошка. Спектр 1H-ЯМР (400 МГц, 0,1 н. NaOD,м.д.): 0,57-0,74 (м, 4 Н), 1,12-1,27 (м, 1 Н), 1,361,48 (м, 1 Н), 2,24 (дм, J=37,60 Гц, 1 Н), 3,46 (с,3H), 3,53 (т, J=8,79 Гц, 1 Н), 3,69 (дд, J=25,40,12,21 Гц, 1 Н), 3,86-3,94 (м, 2 Н), 4,10 (ддм,J=42,48, 12,70 Гц, 1 Н), 5,00 (дм, J=63,97 Гц, 1 Н),5,49 (уш.д, J=54,69 Гц, 1 Н), 8,19 (д, J=3,91 Гц,1 Н). Элементный анализ: С 21 Н 23F3N4O4. Вычислено: С 55,75; Н 5,12; N 12,38. Найдено: С 55,78; Н 5,20; N 12,28. Заявляемый пример 11. 10-[4-(R)-(1-Аминоциклопропил)-3-(S)фтор-1-пирролидинил]-9-фтор-2,3-дигидро-3(S)-метил-7-оксо-7 Н-пиридо[1.2.3-de][1.4]бензоксазин-6-карбоновая кислота. 1-Бензилоксикарбонил-4-(R)-(1-трет.-бутоксикарбониламиноциклопропил)-3-(S)-фторпирролидин (913 мг, 2,41 ммоля) растворяют в метаноле (50 мл), полученный раствор смешивают с 5%-ным палладием-на-угле (катализатор,содержание воды 55,6 %, 1,0 мг) и перемешивают в течение 3 ч в атмосфере водорода. Катализатор отфильтровывают через целиты (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный в результате остаток растворяют в диметилсульфок 003321 48 сиде (15 мл), раствор смешивают с хелатом 9,10-дифтор-2,3-дигидро-3-(S)-метил-7-оксо-7 Нпиридо-[1.2.3.-de][1.4]бензоксазин-6-карбоновая кислота/ВF2 (661 мг, 2,01 ммоля) и триэтиламином (336 мкл, 2,41 ммоля) и перемешивают при комнатной температуре в течение 3 дней. Раствор концентрируют при пониженном давлении,полученный остаток смешивают с водой и выпадающие в осадок желтые кристаллы отфильтровывают и промывают водой. Полученные кристаллы суспендируют в растворе метанол: вода, 1:1 (200 мл), суспензию смешивают с триэтиламином (4 мл) и кипятят с обратным холодильником в течение 4 ч. После охлаждения реакционную массу концентрируют при пониженном давлении и полученный остаток растворяют в хлороформе (200 мл), промывают 10%ным водным раствором лимонной кислоты (200 мл) и затем органический слой сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют при пониженном давлении. К полученному остатку,который охлаждают на ледяной бане, добавляют по каплям концентрированную соляную кислоту (10 мл), а затем перемешивают в течение 10 мин при комнатной температуре. После добавления к реакционному раствору 1 н. соляной кислоты водный слой промывают хлороформом(50 мл х 2 ), доводят рН до 12 с помощью водного раствора гидроксида натрия, затем до 7,4 с помощью 1 н. соляной кислоты и экстрагируют хлороформом (500 мл х 3). Органические слои объединяют, сушат безводным сульфатом натрия, затем фильтруют и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают перекристаллизацией из этанола и сушат при пониженном давлении. Получают 459 мг (56,4 %) названного соединения в виде светло-желтых кристаллов. Спектр 1H-ЯМР (400 МГц, 0,1 н. NaOD,м.д.): 0,55-0,75 (м, 4 Н), 1,52 (д, J=6,84 Гц, 3H),2,25 (дм, J=36,62 Гц, 1 Н), 3,49 (т, J=8,79 Гц, 1 Н),3,70 (дд, J=26,37, 11,72 Гц, 1 Н), 3,88 (т, J=8,79 Гц, 1 Н), 4,10 (дд, J=40,53, 12,70 Гц, 1 Н), 4,30 (д,J=9,27, 1H), 4,50 (д, J=9,28 Гц, 1H), 4,55-4,65 (м,1H), 5,47 (дт, J=55,17, 3,42 Гц, 1H), 7,53 (д,J=14,16 Гц, 1H), 8,33 (с, 1H). Заявляемый пример 12. 7-[4-(R)-(1-Аминоциклопропил)-3-(S)-фтор-1-пирролидинил]-6 фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4 дигидро-8-метокси-4-оксохинолин-3-карбоновая кислота. 1-Бензилоксикарбонил-4-(R)-(1-трет-бутоксикарбониламиноциклопропил)-3-(S)-фторпирролидин (1,07 г, 2,84 ммоля) растворяют в этаноле (50 мл), полученный раствор смешивают с 10%-ным палладием-на-угле (катализатор, содержание воды 50,5%, 1,0 мг) и перемешивают в 49 течение 16 ч в атмосфере водорода. Катализатор отфильтровывают через целиты (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный в результате остаток растворяют в диметилсульфоксиде (10 мл), раствор смешивают с хелатом 6,7-дифтор 1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро 8-метокси-4-оксохинолин-3-карбоновая кислота/ВF2 (853 мг, 2,36 ммоля) и триэтиламином(395 мкл, 2,83 ммоля) и перемешивают при комнатной температуре в течение 24 ч. Раствор концентрируют при пониженном давлении, полученный остаток смешивают с водой и выпадающий в осадок твердый продукт отфильтровывают и промывают водой. Полученный твердый продукт суспендируют в растворе метанол:вода, 9:1 (100 мл), суспензию смешивают с триэтиламином (5 мл) и кипятят с обратным холодильником в течение 3 ч. После охлаждения реакционную массу концентрируют при пониженном давлении, полученный остаток растворяют в хлороформе (300 мл), промывают 10%-ным водным раствором лимонной кислоты(300 мл) и затем органический слой сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют при пониженном давлении. К полученному остатку,который охлаждают на ледяной бане, добавляют по каплям концентрированную соляную кислоту (10 мл), а затем перемешивают в течение 5 минут при комнатной температуре. После добавления к реакционному раствору 1 н. соляной кислоты (30 мл) водный слой промывают хлороформом (50 мл х 2), доводят рН до 12 с помощью водного раствора гидроксида натрия. Водный раствор промывают хлороформом (50 мл х 2), доводят рН до 7,4 с помощью 1 н. соляной кислоты и экстрагируют хлороформом (500 мл х 3). Органические слои объединяют, сушат безводным сульфатом натрия, затем фильтруют и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают перекристаллизацией из этанола и сушат при пониженном давлении. Получают 715 мг (69,3%) названного соединения в виде светло-желтых кристаллов. Температура плавления: 218,5-219,8 С Моноэтиловый эфир циклобутан-1,1-дикарбоновой кислоты (64,43 г, 374 ммоля) растворяют в метиленхлориде (500 мл) и к полученному раствору при охлаждении на ледяной бане последовательно в указанном порядке добавляют оксалилхлорид (65,29 мл, 748 ммолей) и каталитическое количество N,N-диметилформамида. После перемешивания при комнатной температуре в течение 1,5 ч растворитель упаривают и полученный остаток дважды подвергают азеотропной обработке с толуолом, получают хлорангидрид кислоты. Отдельно в токе азота в 1 л тетрагидрофурана суспендируют йодид меди (I) (85,52 г, 449 ммолей) и к суспензии при -20 С по каплям добавляют 1,4 М раствор метиллития в диэтиловом эфире (294 мл), а затем перемешивают при той же температуре в течение 1 ч, после чего по каплям при той же температуре добавляют раствор (300 мл) полученного хлорангидрида кислоты и перемешивают в течение 1,5 ч. По окончании реакции реакционный раствор нагревают до комнатной температуры и смешивают с 10%-ным водным раствором лимонной кислоты (500 мл). Тетрагидрофуран упаривают, полученный остаток смешивают с этилацетатом (1 л), отфильтровывают нерастворимый материал, промывают в указанном порядке 5%-ным водным раствором тиосульфата натрия (300 мл) и насыщенным рассолом (300 мл) и сушат безводным сульфатом натрия. После упаривания растворителя полученный остаток наносят на хроматографическую колонку с силикагелем и элюируют смесью н-гексан: этилацетат, 4:1, получают 56,70 г Этиловый эфир 1-ацетилциклобутанкарбоновой кислоты (13,79 г, 81 ммоль) растворяют в тетрагидрофуране (50 мл), полученный раствор смешивают с порошком цинка (10,59 г) и каталитическим количеством йода. Затем при кипячении с обратным холодильником добавляют раствор этилбромацетата (13,48 мл, 121 ммоль) в тетрагидрофуране (100 мл). Реакционный раствор кипятят с обратным холодильником еще в течение 1 ч, охлаждают и смешивают с 1 н. соляной кислотой (100 мл). После упаривания растворителя полученный остаток смешивают с этилацетатом (500 мл), отфильтровывают нерастворимые продукты, промывают на 51 сыщенным рассолом (300 мл) и затем сушат безводным сульфатом натрия. После упаривания растворителя получают названное соединение в виде масла с количественным выходом. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 1,24-1,32 (м, 9 Н), 1,73-1,87 (м, 2 Н), 2,21-2,34 (м,2 Н), 2,41-2,57 (м, 5 Н), 4,16-4,21 (м, 4 Н). Справочный пример 8-3. Этиловый эфир (Е)-3-(1-этоксикарбонилциклобутил)-2-бутеновой кислоты.(22,27 г, 86 ммолей) растворяют в пиридине (42 мл), к полученному раствору, который охлаждают до -10 С, по каплям добавляют тионилхлорид (8,18 мл, 112 ммолей). По окончании реакции раствор выливают в ледяную воду (250 мл) и экстрагируют этилацетатом (100 мл х 3). Органические слои объединяют, промывают 1 н. соляной кислотой (100 мл) и насыщенным рассолом (100 мл) в указанном порядке и затем сушат безводным сульфатом натрия. Растворитель упаривают и полученный остаток растворяют в метиленхлориде (250 мл). К приготовленному раствору при 0 С по каплям добавляют 1,8-диазабицикло[5.4.0]-7-ундецен (12,89 мл) и затем перемешивают при комнатной температуре в течение 18 ч. По окончании реакции растворитель упаривают, полученный остаток смешивают с ледяной водой (100 мл) и экстрагируют этилацетатом (200 мл х 3). Органические слои объединяют, промывают 1 н. соляной кислотой (100 мл) и насыщенным рассолом (100 мл) и сушат безводным сульфатом натрия. После упаривания растворителя полученный остаток наносят на хроматографическую колонку с силикагелем и элюируют смесью н-гексан: этилацетат, 4:1. Получают 16,91 г (выход 82%) названного соединения в виде масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 1,24 (т, J=6,83 Гц, 3H), 1,29 (т, J=7,32 Гц, 3H),1,74-1,80 (м, 2 Н), 1,94-2,04 (м, 1 Н), 2,07 (д,J=1,47 Гц, 3H), 2,12-2,30 (м, 2 Н), 2,12-2,30 (м,2 Н), 2,50-2,57 (м, 2 Н), 4,13-4,20 (м, 4 Н). Справочный пример 8-4. 4-(1-Этоксикарбонилциклобутил)-1-[(S)-1-фенилэтил]-3-пирролин-2-он. Этиловый эфир (Е)-3-(1-этоксикарбонилциклобутил)-2-бутеновой кислоты (16,91 г, 70 ммолей) растворяют в хлороформе (180 мл),полученный раствор смешивают с N-бромсукцинимидом (12,53 г, 70 ммолей) и каталитическим количеством азобисизобутиронитрилом и кипятят с обратным холодильником в течение 18 ч. По окончании реакции растворитель упа 003321 52 ривают, полученный в результате остаток смешивают с четыреххлористым углеродом (100 мл), отфильтровывают нерастворимые примеси и полученный фильтрат концентрируют. Остаток растворяют в этаноле (100 мл) и смешивают с бикарбонатом натрия (11,82 г, 140 ммолей). При комнатной температуре к полученной смеси по каплям добавляют (S)-фенилэтиламин(9,87 мл, 77 ммолей). По окончании добавления смесь кипятят с обратным холодильником в течение 3 ч. По окончании реакции растворитель упаривают и полученный остаток смешивают с метиленхлоридом (300 мл). Нерастворимые вещества отфильтровывают, растворитель упаривают, полученный остаток наносят на хроматографическую колонку с силикагелем и элюируют смесью н-гексан : этилацетат, 1:1. Получают 19,57 г (выход 43%) названного соединения в виде масла. Спектр 1H-ЯMP (400 МГц, СDCl3,м.д.): 1,17 (т, J=7,33 Гц, 3H), 1,74-1,80 (м, 2 Н), 1,59 (д,J=6,84 Гц, 3H), 1,84-2,01 (м, 2 Н), 2,15-2,28 (м,2 Н), 2,60-2,69 (м, 2 Н), 3,56 (д, J=9,04 Гц, 2 Н),3,88 (д, J=9,04 Гц, 2 Н), 4,13 (кв, J=7,32 Гц, 2 Н),5,50-5,59 (м, 1 Н), 6,03 (с, 1 Н), 7,26-7,35 (м, 5 Н). Справочный пример 8-5. 4-(1-Этоксикарбонилциклобутил)-1-[(S)-1-фенилэтил]-2-пирролидон. 4-(1-Этоксикарбонилциклобутил)-1-[(S)-1 фенилэтил]-3-пирролин-2-он (9,57 г, 31 ммоль) растворяют в этаноле (150 мл), полученный раствор смешивают с оксидом платины (230 мг) и перемешивают в течение 18 ч в атмосфере водорода. По окончании реакции реакционную массу фильтруют и концентрируют, полученный остаток наносят три раза на хроматографическую колонку с силикагелем и элюируют смесью н-гексан : этилацетат, 1:1. Получают оптический изомер А (2,3 г, выход 24%) и оптический изомер В (7,1 г, выход 74%) названного соединения, каждый изомер в виде масла. Оптический изомер А. Спектр 1H-ЯМР (400 МГц, СDCl3,м.д.): 1,26 (т, J=6,83 Гц, 3H), 1,49 (д, J=7,32, 2 Н), 1,831,95 (м, 4 Н), 2,38-2,54 (м, 4 Н), 2,66-2,74 (м, 1 Н),3,01 (т, J=8,30 Гц, 1 Н), 3,14 (д, J=5,86, 9,77 Гц,1 Н), 4,09-4,18 (м, 2 Н), 5,48 (дд, J=7,32 14,16 Гц,1 Н), 7,27-7,35 (м, 5 Н). Оптический изомер В. Спектр 1H-ЯМР (400 МГц, СDCl3,м.д.): 1,17 (т, J=7,32 Гц, 3H), 1,52 (д, J=7,33, 2 Н), 1,681,92 (м, 4 Н), 2,23-2,43 (м, 3H), 2,50-2,57 (м, 1 Н),2,73-2,86 (м, 2 Н), 3,37 (т, J=8,30 Гц, 1 Н), 4,05 В атмосфере азота в безводном тетрагидрофуране (120 мл) растворяют диизопропиламин (2,55 мл, 18,2 ммоля) и к полученному раствору при температуре -78 С добавляют по каплям в течение 10 минут 1,63 М раствор нбутиллития в н-гексане (11,2 мл, 18,2 ммоля). После перемешивания в течение 15 мин при 0 С раствор охлаждают до -78 С и по каплям в течение 15 мин добавляют раствор 4-(1-этоксикарбонилциклопропил)-1-[1-(S)-фенилэтил]-2 пирролидона (оптический изомер В, 4,42 г,14,01 ммоля) в безводном тетрагидрофуране (30 мл). Реакционную массу перемешивают при-78 С в течение 1 ч и в течение 5 мин добавляют по каплям раствор N-фторбензолдисульфонимида (7,07 г, 22,42 ммоля) в безводном тетрагидрофуране (25 мл). Реакционную смесь перемешивают при -78 С в течение 30 мин и затем при комнатной температуре в течение 20 мин. При охлаждении на ледяной бане к полученному раствору добавляют насыщенный водный раствор хлористого аммония (200 мл) и упаривают тетрагидрофуран. Водный слой экстрагируют этилацетатом (200 мл х 2), органические слои объединяют, промывают водой (200 мл х 3) и сушат безводным сульфатом натрия. Полученный после фильтрации фильтрат концентрируют при пониженном давлении, остаток наносят на хроматографическую колонку с силикагелем и элюируют смесью н-гексан:этилацетат,1:1, получают 3,88 г (выход 83%) названного соединения в виде масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 1,14 (т, J=6,83 Гц, 3H), 1,57 (д, J=6,83 Гц, 2 Н),1,88-2,08 (м, 4 Н), 2,33-2,58 (м, 3H), 2,81-2,92 (м,1 Н), 3,42 (т, J=9,77 Гц, 1 Н), 3,93-4,07 (м, 2 Н),5,18 (дд, J=6,83, 53,22 Гц, 1 Н), 5,51 (дд, J=7,32,14,16 Гц, 1 Н), 7,25-7,34 (м, 5 Н). Справочный пример 8-7. цис-4-(1-Этоксикарбонилциклобутил)-3-фтор-1-[1-(S)-фенилэтил]-2-пирролидон (оптический изомер В).(2,97 мл, 21,19 ммоля) и к полученному раствору при температуре -78 С добавляют по каплям в течение 5 минут 1,63 М раствор н-бутиллития в н-гексане (10,8 мл, 17,60 ммоля). После перемешивания в течение 15 мин при 0 С раствор охлаждают до -78 С и по каплям в течение 5 мин добавляют раствор транс-4-(1-этоксикар 003321 54 бонилциклопропил)-3-фтор-1-[1-(S)-фенилэтил]2-пирролидона (оптический изомер В, 4,71 г,14,13 ммоля) в безводном тетрагидрофуране (30 мл). Реакционную массу перемешивают при-78 С в течение 3 мин и в течение 5 мин добавляют по каплям раствор 2,6-ди-трет-бутилфенола (4,37 г, 21,18 ммоля) в безводном тетрагидрофуране (40 мл). Реакционную смесь перемешивают при -78 С в течение 10 мин, смешивают с насыщенным водным раствором хлористого аммония (200 мл) и нагревают до комнатной температуры. Органический слой отделяют и водный слой экстрагируют хлороформом (100 мл х 2). Органические слои объединяют, промывают водой (100 мл х 2) и сушат безводным сульфатом натрия. Полученный после фильтрации фильтрат концентрируют при пониженном давлении, остаток наносят на хроматографическую колонку с силикагелем и элюируют смесью н-гексан:этилацетат, 2:1, выделяют 1,96 г(выход 42%) исходного материала, а после элюирования смесью н-гексан : этилацетат, 3:2 получают 1,79 г (выход 38%) названного соединения в виде масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 1,22 (т, J=6,83 Гц, 3H), 1,56-1,58 (д, J=6,83 Гц,3H), 1,84-2,42 (м, 6 Н), 2,83-2,97 (м, 1 Н), 3,153,24 (м, 1 Н), 3,36-3,43 (м, 1 Н), 4,11-4,17 (м, 2 Н),5,07 (дд, J=6,83, 52,24 Гц, 1 Н), 5,56 (кв, J=7,33 Гц, 1 Н), 7,26-7,36 (м, 5 Н). Справочный пример 8-8. цис-4-(1-Карбоксициклобутил)-3-фтор-1[1-(S)-фенилэтил]-2-пирролидон цис-4-(1-Этоксикарбонилциклобутил)-3 фтор-1-[1-(S)-фенилэтил]-2-пирролидон (оптический изомер В; 1,79 г, 5,37 ммоля) растворяют в метаноле (10 мл) и к полученному раствору добавляют по каплям 1 н. водный раствор гидроксида натрия (10 мл). Реакционный раствор перемешивают при 40 С в течение 18 ч и затем упаривают метанол при пониженном давлении. Полученный в результате остаток смешивают с водой (50 мл) и промывают хлороформом (100 мл). Отделенный водный слой подкисляют путем добавления по каплям 1 н. соляной кислоты и экстрагируют хлороформом (100 мл х 2). Органические слои объединяют и сушат безводным сульфатом натрия. Полученный после фильтрации фильтрат концентрируют при пониженном давлении, получают названное соединение с количественным выходом в виде сырого продукта. Справочный пример 8-9. цис-4-(1-третБутоксикарбониламиноциклобутил)-3-фтор-1[1-(S)-фенилэтил]-2-пирролидон(оптический изомер В; 1,92 г, 6,29 ммоля) растворяют в безводном ацетонитриле (30 мл), полученный раствор смешивают с N,N'-карбонилдиимидазолом(1,33 г, 8,20 ммолей) и перемешивают при температуре 60 С в течение 1 ч. В реакционный раствор при комнатной температуре в течение 10 минут барботируют аммиак и затем концентрируют при пониженном давлении. Полученный остаток смешивают с водой (100 мл) и экстрагируют хлороформом (100 мл х 2), органические слои объединяют и сушат безводным сульфатом натрия. Полученный после фильтрации фильтрат упаривают при пониженном давлении, остаток растворяют в трет-бутиловом спирте (50 мл), смешивают с тетраацетатом свинца (6,32 г, 14,25 ммоля) и затем кипятят с обратным холодильником в течение 1 ч. После охлаждения реакционный раствор смешивают с диэтиловым эфиром и бикарбонатом натрия (6 г) и перемешивают при комнатной температуре в течение 10 мин. Фильтруют и фильтрат концентрируют при пониженном давлении. Полученный в результате остаток смешивают со 100 мл этилацетата, промывают насыщенным водным раствором бикарбоната натрия, затем сушат безводным сульфатом натрия и фильтруют. Фильтрат концентрируют при пониженном давлении, получают 1,74 г (выход 65%) названного соединения в виде масла. Спектр 1H-ЯМР (400 МГц, СDCl3,м.д.): 1,40 (с, 9 Н), 1,92-2,21 (м, 6 Н), 3,04-3,12 (м, 1 Н),3,31-3,38 (м, 1 Н), 4,87 (уш.с, 1 Н), 5,01 (дд,J=5,86, 52,73 Гц, 1 Н), 5,52 (дд, J=7,32, 14,16 Гц,1 Н), 7,30-7,38 (м, 5 Н). Справочный пример 8-10. Цис-1-[1-(S)фенилэтил]-4-(1-трет-бутоксикарбониламиноциклобутил)-3-фторпирролидон цис-4-(1-трет-Бутоксикарбониламиноциклобутил)-3-фтор-1-[1-(S)-фенилэтил]-2 пирролидон (оптический изомер В; 1,74 г, 4,62 ммоля) растворяют в тетрагидрофуране (30 мл),полученный раствор смешивают с 1 М комплексом борантетрагидрофуран (13,86 мл) при 0 С и затем перемешивают при комнатной температуре в течение 2 дней. По окончании реакции растворитель упаривают, полученный остаток смешивают с водой (50 мл) и экстрагируют хлороформом (100 мл х 2). Органические слои объединяют и сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют при пониженном давлении и остаток растворяют в 80%-ном водном растворе(10 мл) и затем кипятят с обратным холодильником в течение 2 ч. Затем растворитель упаривают, полученный остаток наносят на хроматографическую колонку с силикагелем и элюируют смесью н-гексан : этилацетат, 2:1. Получают 1,13 г (выход 67%) названного соединения в виде масла. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 1,37 (д, J=6,35 Гц, 3H), 1,44 (с, 9 Н), 1,65-2,58 (м,7 Н), 2,70-2,92 (м, 4 Н), 3,27-3,32 (м, 1 Н), 5,14 Цис-1-[1-(S)-фенилэтил]-4-(1-трет-бутоксикарбониламиноциклобутил)-3-фторпирролидин (оптический изомер В; 1,13 г, 3,12 ммоля) растворяют в этаноле (20 мл), полученный раствор смешивают с 10%-ным палладием-на-угле(катализатор, содержание воды 55,6%, 1 г) и перемешивают при 50 С в течение 18 ч в атмосфере водорода. Катализатор удаляют путем фильтрования на целитах (с промывкой метанолом) и фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток растворяют в диметилсульфоксиде (10 мл),полученный раствор смешивают с 5-амино-6,7 дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4 дигидро-8-метил-4-оксохинолин-3-карбоновой кислотой (1,18 г, 3,78 ммоля) и триэтиламином(5 мл) и перемешивают в течение 4 дней в атмосфере азота при температуре 140 С. После охлаждения диметилсульфоксид упаривают при пониженном давлении, полученный таким образом остаток растворяют в хлороформе (50 мл),промывают 10%-ным водным раствором лимонной кислоты (50 мл) и насыщенным рассолом (100 мл) в указанном порядке и затем органический слой сушат безводным сульфатом натрия. Полученный после фильтрования фильтрат концентрируют при пониженном давлении. Остаток наносят на колонку с силикагелем для быстрого хроматографирования и элюируют смесью хлороформ:метанол, 9:1. Элюат концентрируют при пониженном давлении. К полученному таким образом остатку, который охлаждают на ледяной бане, по каплям добавляют концентрированную соляную кислоту (5 мл) и затем перемешивают при комнатной температуре в течение 30 мин. После добавления к реакционному раствору 1 н. соляной кислоты (30 мл) водный раствор промывают хлороформом (50 мл х 2) и доводят рН до 12 с помощью водного раствора гидроксида натрия. Водный раствор промывают хлороформом (100 мл), доводят рН до 7,4 с помощью 1 н. соляной кислоты и затем экстрагируют хлороформом (150 мл х 3). Органические слои объединяют, сушат безводным сульфатом натрия и фильтруют. Фильтрат концентрируют при пониженном давлении. Полученный таким образом остаток очищают с помощью препаративной ТСХ (проявление с помощью нижнего слоя смеси хлороформ: метанол : вода, 7:3:1). Получают сырое названное соединение, которое перекристаллизовывают из смеси этанол и эфир. Получают 157 мг (выход 17%) названного соединения. Температура плавления: 177-184 С. Спектр 1H-ЯМР (400 МГц, CDCl3,м.д.): 1,16-2,34 (м, 13 Н), 2,47-2,60 (м, 1 Н), 3,35 (т,J=8,79 Гц, 1 Н), 3,53 (кв, J=12,21 Гц, 1 Н), 3,783,83 (м, 1 Н), 4,09-4,21 (м, 2 Н), 4,76-4,95 (м, 1 Н),5,42 (дт, J=3,41, 55,18 Гц, 1 Н), 6,53 (уш.с, 2 Н),8,60 (д, J=3,41 Гц, 1 Н). Элементный анализ: С 22H25F3N4O30,5 Н 2O. Вычислено: С 57,51; Н 5,70; N 12,19. Найдено: С 57,59; Н 5,52; N 11,89. Линия/Соединение Е.соli, NIHJ Промышленное применение Таким образом, очевидно, что соединение настоящего изобретение обладает прекрасной антибактериальной активностью и высокой безопасностью и может быть использовано как фармацевтическое лекарственное средство. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой (I) где заместитель R1 представляет собой атом водорода; заместитель R2 представляет собой атом водорода; заместитель R3 представляет собой атом водорода; каждый из заместителей R4 и R5 независимо друг от друга представляет собой атом водорода, атом галогена, алкильную группу, содержащую от 1 до 6 атомов углерода, или алкоксигруппу, содержащую от 1 до 6 атомов углерода,которая может быть замещена гидроксильной группой;n принимает целые значения от 1 до 3; иQ представляет собой неполную структуру формулы (II) где заместитель R8 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, галогеналкильную группу, содержащую от 1 до 6 атомов углерода, или циклическую алкильную группу, содержащую от 3 до 6 атомов углерода, которая может иметь заместитель(и); заместитель R9 представляет собой атом водорода; заместитель X1 представляет собой атом галогена или атом водорода; заместитель R10 представляет собой атом водорода или аминогруппу; А 1 представляет собой атом азота или неполную структуру, представленную формулой где X2 представляет собой атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода, или алкоксильную группу, содержащую от 1 до 6 атомов углерода; и заместители X2 и R8 могут быть объединены с образованием циклической структуры,включающей часть основного ядра, и кольцо может содержать атом кислорода в качестве атома, образующего кольцо, и может дополнительно иметь в качестве заместителя алкильную группу, содержащую от 1 до 6 атомов углерода; и заместитель Y1 представляет собой атом водорода или неполную структуру, представленную формулой (IV) где заместитель R11 представляет собой алкильную группу, содержащую от 1 до 6 атомов углерода, галогеналкильную группу, содержащую от 1 до 6 атомов углерода, или циклическую алкильную группу, содержащую от 3 до 6 атомов углерода, которая может иметь заместитель(и); заместитель R12 представляет собой атом водорода или аминогруппу; заместитель X3 представляет собой атом галогена или атом водорода; А 2 представляет собой атом азота или неполную структуру, представленную формулой где X4 представляет собой атом водорода, алкильную группу, содержащую от 1 до 6 атомов углерода, или алкоксильную группу, содержащую от 1 до 6 атомов углерода, и заместитель Y2 представляет собой атом водорода; и его соли и гидраты. 2. Соединение, его соли и гидраты по п.1,где Q в формуле (I) представляет собой структуру формулы (III). 3. Соединение, его соли и гидраты по п.2,где заместитель R8 представляет собой галогенциклопропильную группу. 4. Соединение, его соли и гидраты по п.1,где галогенциклопропильная группа в формуле(I) представляет собой 1,2-цис-2-галогенциклопропильную группу. 5. Соединение, его соли и гидраты по пп.2,3 или 4, где галогенциклопропильная группа в формуле (I) представляет собой стереохимически чистый заместитель. 6. Соединение, его соли и гидраты по п.5,где галогенциклопропильная группа в формуле(I) представляет собой (1R,2S)-2-галогенциклопропильную группу. 7. Соединение, его соли и гидраты по п.6,где атом галогена в галогенциклопропильной группе в формуле (I) представляет собой атом фтора. 8. Соединение, его соли и гидраты по п.7,где соединение формулы (I) представляет собой стереохимически чистое соединение. 9. Соединение, его соли и гидраты по п.1,имеющее структурную формулу где Q выбран из частичной структуры, выбранной из где Q представляет собой частичную структуру 11. Фармацевтический препарат, включающий соединение, его соли или гидрат по п.1 в качестве активного ингредиента. 12. Антибактериальное лекарственное средство, которое в качестве активного ингредиента содержит соединение, его соль или гидрат, по п.1.
МПК / Метки
МПК: C07D 401/04, A61P 31/04, A61K 31/473
Метки: лекарственное, средство, аминоциклоалкилпирролидона, производные, антибактериальное, основе
Код ссылки
<a href="https://eas.patents.su/30-3321-proizvodnye-aminocikloalkilpirrolidona-i-antibakterialnoe-lekarstvennoe-sredstvo-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">Производные аминоциклоалкилпирролидона и антибактериальное лекарственное средство на их основе</a>
Предыдущий патент: Ингибиторы клеточной адгезии.
Следующий патент: Применение кетолидов для профилактики тромботических артериальных осложнений, связанных с атеросклерозом
Случайный патент: Способ получения состава, содержащего аморфный гидрат окиси железа












