Способы получения соединений, являющихся пролекарствами ингибиторов присоединения вируса вич, и их интермедиатов
Номер патента: 21726
Опубликовано: 31.08.2015
Авторы: Шультц Митчелл Дж., Фокс Ричард Дж., Фанфэйр Дейн Дастан, Муругесан Сараванабабу, Айви Сабрина Е., Даблдей Уендел У., Пайак Джосеф Франсис, Чен Чун-Пин Х., Трипп Джонатан Клайв
Формула / Реферат
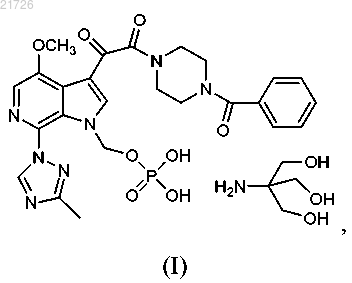
1. Способ получения соединения формулы (I)
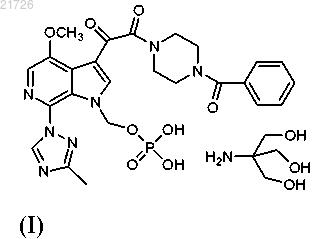
который включает:
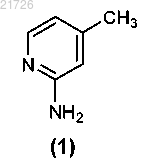
(А) бромирование соединения
с получением соединения
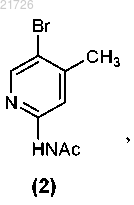
(Б) нитрование соединения (2) с получением соединения
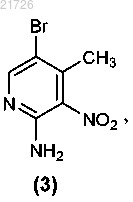
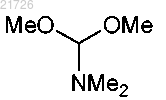
(В) превращение аминогруппы соединения (3) в метоксигруппу с получением соединения
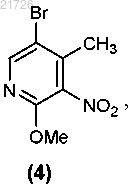
(Г) последующее превращение соединения (4) в соединение
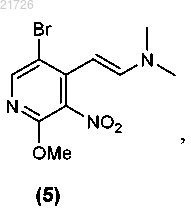
(Д) превращение соединения (5) в соединение
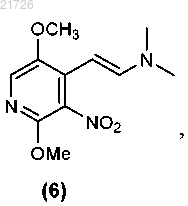
(Е) формирование бициклической структуры из соединения (6) с получением
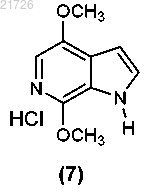
(Ж) последующее хлорирование соединения (7) с получением
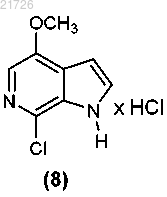
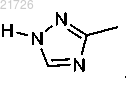
(З) последующее добавление триазолильного фрагмента к соединению (8) с получением
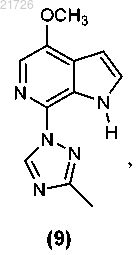
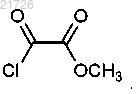
(И) превращение соединения (9) в структуру
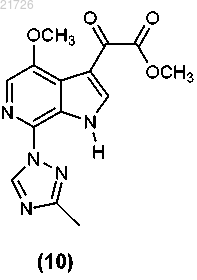
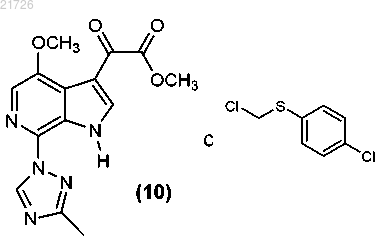
(К) модификацию соединения (10) с получением соединения
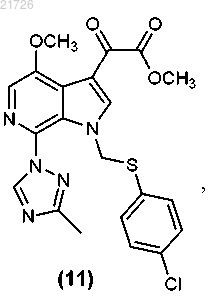
(Л) реакцию соединения (11) с получением соединения

(М) последующее превращение соединения (12) в соединение

(Н) последующее превращение соединения (13) с получением соединения
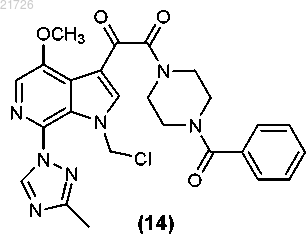
(О) последующее превращение соединения (14) с получением соединения
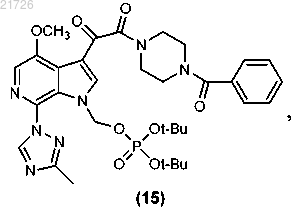
(П) последующее превращение соединения (15) в соединение формулы (I).
2. Способ получения соединения формулы (I)
который включает:
(i) взаимодействие соединения
в присутствии TMG, NMP и NaI или K2CO3, MeCN и TBAI с получением соединения
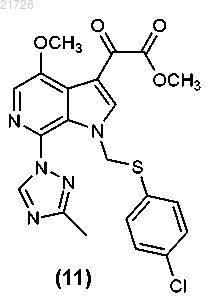
(ii) взаимодействие соединения (11) с
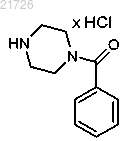
с получением соединения
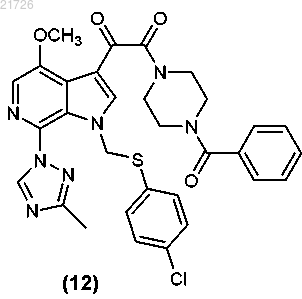
(iii) последующее превращение соединения (12) в соединение
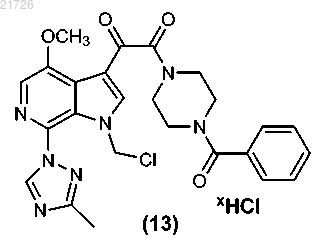
(iv) с последующим превращением соединения (13) для получения соединения
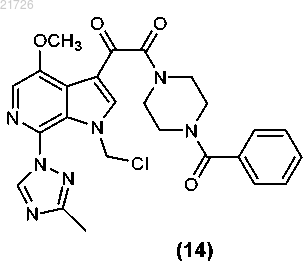
(v) с последующим превращением соединения (14) для получения соединения

(vi) с последующим превращением соединения (15) в соединение формулы (I).
3. Способ по п.1, в котором стадию (А) проводят с использованием Ac2O.
4. Способ по п.1, в котором стадию (Б) осуществляют в кислых условиях.
5. Способ по п.4, в котором стадию (Б) осуществляют с использованием азотной кислоты.
6. Способ по п.5, в котором стадию (Б) осуществляют с использованием азотной и серной кислот.
7. Способ по п.1, в котором стадию (В) проводят с использованием NaNO2 и TMS-Cl в спирте.
8. Способ по п.7, в котором указанный спирт представляет собой метанол.
9. Способ по п.1, в котором стадию (Г) проводят с использованием
10. Способ по п.1, в котором стадию (З) проводят с использованием
11. Способ по п.1, в котором стадию (И) проводят с использованием
12. Способ по п.1, в котором стадию (К) проводят с использованием
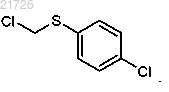
13. Способ по п.2, в котором стадию (ii) проводят с использованием
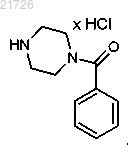
14. Способ по п.2, в котором стадию (iv) проводят с использованием дихлорметана.
15. Способ по п.2, в котором стадию (v) проводят с использованием
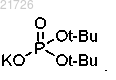
16. Способ по п.2, в котором стадию (vi) проводят с использованием ацетона в воде и трометамина.
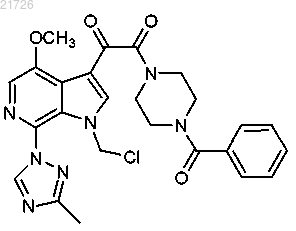
17. Способ получения соединения формулы (14)
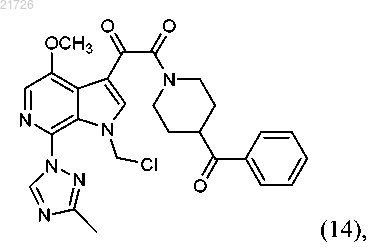
который включает:
(i) взаимодействие соединения
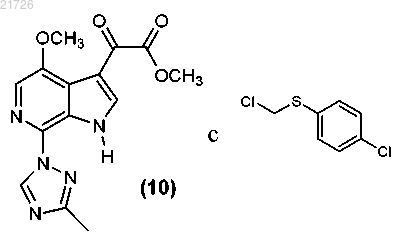
с получением соединения

(ii) реакцию соединения (11) с
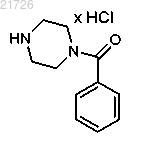
с получением соединения
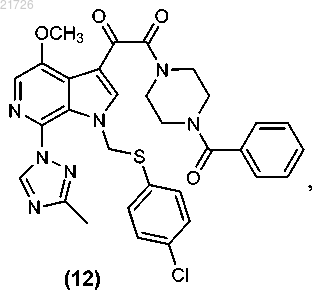
(iii) последующее превращение соединения (12) в соединение
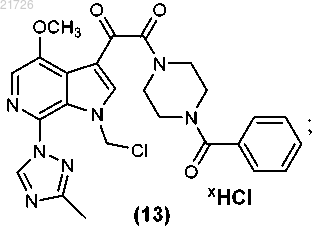
с использованием газообразного хлора;
(iv) последующее превращение соединения (13) в соединение
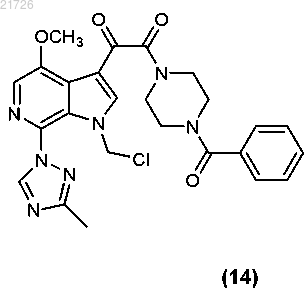
с помощью обработки дихлорметаном.
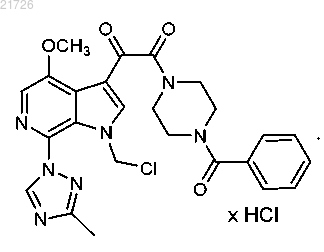
18. Соединение, имеющее следующую формулу:
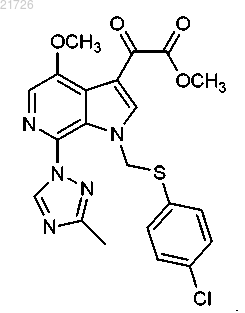
19. Соединение, имеющее следующую формулу:
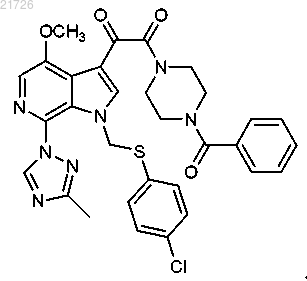
20. Соединение, имеющее следующую формулу:
21. Соединение, имеющее следующую формулу:
Текст
СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ, ЯВЛЯЮЩИХСЯ ПРОЛЕКАРСТВАМИ ИНГИБИТОРОВ ПРИСОЕДИНЕНИЯ ВИРУСА ВИЧ, И ИХ ИНТЕРМЕДИАТОВ Рассмотрен способ получения соединения формулы (I) Область техники Изобретение относится к способам получения соединений пролекарств, полезных против ВИЧ, и, в частности, к способам получения пролекарства 1-бензоил-4-[2-[4-метокси-7-(3-метил-1H-1,2,4-триазол-1 ил)-1-[(фосфоноокси)метил]-1H-пирроло[2,3-с]пиридин-3-ил]-1,2-диоксоэтил]пиперазина, а также их определенным промежуточным соединениям (интермедиатам), с использованием новых стратегий алкилирования, амидирования, хлорирования и введения фосфатной группы. Изобретение также относится к соединениям, полученным с помощью описанных здесь способов. Уровень техники Соединение, являющееся пролекарством ингибитора присоединения вируса ВИЧ, представляющее собой 1-бензоил-4-[2-[4-метокси-7-(3-метил-1H-1,2,4-триазол-1-ил)-1-[(фосфоноокси)метил]-1Hпирроло[2,3-с]пиридин-3-ил]-1,2-диоксоэтил]пиперазин и имеющее структурную формулу было раскрыто и описано в патенте США 7745625, который включен в настоящий документ посредством ссылки в полном объеме. Это соединение является содержащим фосфатную группу пролекарством основного соединения, имеющего структурную формулу которое было раскрыто и описано в патенте США 7354924, также включенном в настоящий документ посредством ссылки в полном объеме. И указанное соединение, и указанное выше пролекарство продемонстрировали отличный эффект против ВИЧ. При масштабировании процедуры получения содержащего фосфатную группу пролекарства в процессе алкилирования были использованы два соединения: бис(1,1-диметилэтиловый) сложный эфир Р-(хлорметил)фосфоновой кислоты и 1-(4-бензоилпиперазин-1 ил)-2-(4-метокси-7-(3-метил-1 Н-1,2,4-триазол-1-ил)-1 Н-пирроло[2,3-с]пиридин-3-ил)этан-1,2-дион. Однако данные соединения оказалось трудно использовать в синтезе, они оказались нестабильными и сложно синтезируемыми в большом количестве. Кроме того, выход реакции алкилирования с использованием этих соединений уменьшался в ходе масштабирования реакции. Таким образом, возникла необходимость разработки новых способов получения пролекарства против ВИЧ 1-бензоил-4-[2-[4-метокси 7-(3-метил-1H-1,2,4-триазол-1-ил)-1-[(фосфоноокси)метил]-1H-пирроло[2,3-с]пиридин-3-ил]-1,2 диоксоэтил]пиперазина, а также его интермедиатов. Указанные новые способы должны основываться на новых способах алкилирования, амидирования, хлорирования и введения фосфатной группы. Необходимы также новые соединения и интермедиаты, которые образуются в результате применения новых способов. Сущность изобретения В первом варианте осуществления настоящее изобретение относится к способу получения соединения формулы (I)(В) превращение аминогруппы соединения (3) в метоксигруппу с получением соединения(Г) последующее превращение соединения (4) в соединение(Е) формирование бициклической структуры из соединения (6) с получением(Ж) последующее хлорирование соединения (7) с получением(З) последующее добавление триазолильного фрагмента к соединению (8) с получением(М) последующее превращение соединения (12) в соединение(Н) последующее превращение соединения (13) с получением соединения(О) последующее превращение соединения (14) с получением соединения(П) с последующим превращением соединения (15) в соединение формулы (I). В еще одном варианте осуществления настоящего изобретения предложен способ получения соединения формулы (I)(iii) последующее превращение соединения (12) в соединение(iv) с последующим превращением соединения (13) для получения соединения(v) с последующим превращением соединения (14) для получения соединения с последующим превращением соединения (15) в соединение формулы (I). Также в настоящем изобретении предусмотрен способ получения соединения формулы (14)(iii) последующее превращение соединения (12) в соединение(iv) и последующее превращением соединения (13) в соединение Изобретение также относится к более общему химическому превращению тиоэфира в соответствующий хлорид с использованием хлорирующего агента. где R может представлять собой алкил, циклоалкил, фенил, замещенный и полизамещенный фенил,гетероароматические кольца, замещенные и полизамещенные гетероароматические кольца, но не ограничиваться ими. Хлорирующий агент, используемый в данном превращении, может представлять собой газообразный хлор,сульфурилхлорид,гексахлорэтан,дихлортрифенилфосфоран,N,N-дихлор-4 метилбензолсульфонамид, трихлоризоциануровую кислоту, N-хлорсукцинимид, 2-хлоризоиндолин-1,3 дион или N-хлорсахарин, но не ограничивается ими. Изобретение также относится к новым соединениям Изобретение направлено на эти и другие важные объекты и описано ниже. Подробное описание изобретения Изобретение относится к способам получения соединения формулы (I) и некоторым его интермедиатам. Общая схема реакции может быть суммирована и представлена следующим образом: Таким образом, в первом варианте осуществления изобретения соединение используют в качестве исходного материала. Это соединение подвергают взаимодействию с уксусным ангидридом (Ac2O), а затем бромируют с получением Затем данное соединение подвергают реакции с азотной кислотой и серной кислотой с получением Затем это соединение подвергают взаимодействию с нитритом натрия (NaNO2) и триметилсилил хлоридом (TMS-Cl) в метаноле (МеОН) с получением Затем это соединение подвергают взаимодействию с который затем подвергают взаимодействию со смесью NaOMe/MeOH, CuI и NH4Cl и метилпропионатом в тетрагидрофуране (ТГФ) с получением Это соединение затем подвергают взаимодействию с 1% Pd/C в атмосфере водорода (Н 2) в этилацетате (EtOAc), получая который далее взаимодействует с POCl3 с получением Это соединение затем подвергали взаимодействию с Затем это соединение подвергали взаимодействию с Это соединение затем вводили в реакцию с Затем это соединение хлорировали с использованием газообразного хлора (Cl2), получая Затем это соединение подвергали взаимодействию с дихлорметаном (DCM) в воде с образованием Это соединение затем вводили в реакцию с В еще одном варианте осуществления изобретения соединение формулы (I), описанное выше, получали с использованием в качестве исходного материала. Это соединение может быть синтезировано в соответствии с процедурами, изложенными выше, или может быть получено согласно способам, раскрытым и описанным в заявке США 20060293304, поданной 28 декабря 2006 г., которая включена в настоящее описание посредством ссылки во всей своей полноте. В этом варианте осуществления изобретения соединение сначала подвергают взаимодействию с Затем это соединение подвергают взаимодействию с Это соединение затем превращают в соединение с использованием газообразного хлора (Cl2). Затем это соединение превращают в с использованием дихлорметана в воде. Это соединение затем превращают в соединение и, наконец, это соединение превращают в соединение формулы (I) с помощью обработки ацетоном в воде, а затем трометамином. В еще одном варианте осуществления изобретения соединение формулы (14) получают с использованием соединения формулы (10) в качестве исходного материала. Этот процесс включает взаимодействие соединения с последующим превращением соединения (11) с получением соединения Соединения (11), (12), (13) и (14), таким образом, представляют дополнительные варианты осуществления изобретения. Следующий пример приведен для описания предпочтительного способа по изобретению, но не должен быть истолкован как ограничение его объема. Пример. В данном примере в качестве исходного материала использовали соединение(для описания получения соединения (10) см. заявку США 20060293304 от 28 декабря 2006 г.). Ниже приводится краткое описание процедуры, используемой для превращения соединения (10) в соединение Реакционные сосуды объемом 20 и 10 л продували инертным газом. Все стадии проводили в защитной атмосфере инертного газа. В 20-л реакционный сосуд загружали 1,80 л этилацетата при комнатной температуре. К этой смеси добавляли 0,48 кг соединения К этому раствору добавляли 0,34 кг йодида натрия. Всю стеклянную химическую посуду, использованную для добавления реагентов, затем промывали 0,45 л этилацетата, который также добавляли в 20-л реакционный сосуд. Реакционную смесь нагревали до внутренней температуры 65C и перемешивали при этой температуре в течение 3 ч. Образец реакционной смеси анализировали с помощью 1H-ЯМР для определения степени превращения Если степень превращения не превышала 90%, то нагревание продолжали. После завершения реакции раствор оставляли охлаждаться до комнатной температуры. В 10-л реакционный сосуд добавляли 1,58 л Nметилпирролидинона (NMP), а затем 0,18 кг N,N,N',N'-тетраметилгуанидина (TMG). К полученному раствору добавляли 0,45 кг соединения (10). Всю стеклянную химическую посуду, использованную для добавления реагентов, затем промывали 0,50 л NMP. Смесь перемешивали при комнатной температуре в течение 2 ч. Затем раствор в NMP из 10 л реактора добавляли к раствору в EtOAc в течение 1 ч. Затем колбу промывали 0,18 л NMP, который также добавляли к раствору в течение 2 мин. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Образец реакционной смеси отбирали для исследования методом высокоэффективной жидкостной хроматографии (ВЭЖХ). К реакционной смеси в течение 2 ч добавляли в общей сложности 0,099 кг TMG 10 равными порциями, после чего полученную смесь перемешивали при комнатной температуре в течение 14 ч. Образец реакционной смеси отбирали для исследования методом ВЭЖХ. К реакционной смеси добавляли 6,75 л EtOAc, а затем 4,50 л 0,5 н. водного раствора соляной кислоты (HCl). Смесь энергично перемешивали в течение 30 мин, затем фазам давали возможность разделиться и нижнюю фазу отбрасывали. К оставшейся верхней фазе добавляли 2,50 л этилацетата с последующим медленным добавлением 4,50 л 0,5 н. HCl. Двухфазную смесь энергично перемешивали в течение 15 мин, после чего фазам давали возможность разделиться и нижнюю фазу отбрасывали. К оставшейся верхней фазе добавляли 0,50 л этилацетата с последующим медленным добавлением 4,50 л 0,5 н. HCl. Двухфазную смесь энергично перемешивали в течение 15 мин, после чего фазам давали возможность разделиться и нижнюю фазу отбрасывали. К оставшейся верхней фазе добавляли 1,10 л EtOAc, а затем 4,50 л дистиллированной воды. Двухфазную смесь энергично перемешивали в течение 15 мин, после чего фазам давали возможность разделиться и нижнюю фазу отбрасывали. К оставшемуся верхней фазе добавляют 0,5 л этилацетата последующим 4,50 л дистиллированной воды. Двухфазную смесь энергично перемешивали в течение 15 мин,после чего фазам давали возможность осесть, а нижнюю фазу отбрасывали. Полученную органическую фазу переносили в 10-л реакционный сосуд порциями по 4,00 л, затем 20 л реакционный сосуд промывали 1,00 л EtOAc и между каждым добавлением органической фазы объем уменьшали до 3,60 л путем отгонки растворителя. Затем смесь растворителей, состоящую в основном из этилацетата, заменяли на смесь, состоящую в основном из изопропилового спирта (IPA), с использованием метода перегонки с добавлением растворителя порциями с общим количеством IPA 9,00 л, при этом общий объем реакционной смеси не уменьшали до значения ниже 3,60 л. Конечный раствор выдерживали в течение 8 ч. Полученную суспензию фильтровали для выделения продукта. Затем продукт дважды промывали 1,12 л IPA. Выделенный продукт высушивали при максимальной температуре 50C до постоянного веса. Выход составил 0,43 кг (63,23%) соединения (11) в виде бежевых кристаллов. Аналитические данные: температура плавления 127,0-128,8C. 1HRMS: рассчитано для C21H19O4N5ClS [М+1]+ 472,0841, измерено 472,0841, элементный анализ: С: 53,44, Н: 3,84, N: 14,84, S: 6,79, Cl: 7,51; измерено: С: 53,53, Н: 3,55, N: 14,63, S: 6,98, Cl: 7,73. Затем для превращения соединения (11) в соединение (12), как показано ниже, процесс продолжали следующим образом: Реакционный сосуд продували инертным газом. Все стадии проводили в защитной атмосфере инертного газа. Затем в сосуд загружали 8,0 л MeTHF при температуре 20-25C. Далее добавляли 800 г соединения Получали белую суспензию. К суспензии добавляли 488 мл воды и 388 мл 1 н. NaOH. Выделения тепла не наблюдали. Смесь перемешивали в течение 1 ч, после чего слоям давали отстояться. Нижний водный слой удаляли. Оставшийся органический слой нагревали с обратным холодильником и отгоняли приблизительно 3 л MeTHF. После этого перегонку осуществляли при постоянном объеме. При достижении KF500 частей на миллион смеси давали остыть до комнатной температуры. Органический слой фильтровали и измеряли концентрацию пиперазин бензоила. Отдельный сосуд продували инертным газом. В сосуд загружали 5,2 л указанного выше раствора соединения После этого добавляли 1 кг соединения (11) и получали белую суспензию. И, наконец, добавляли 260 мл Ti(OnBu)4 и 800 мл MeTHF. Смесь нагревали с обратным холодильником. Через 3 ч в смесь вносили 2 г соединения формулы(11). Реакционную смесь оставляли для продолжения реакции при кипячении с обратным холодильником. После завершения реакции суспензию охлаждали до 10C и продолжали перемешивать в течение 2 ч. Продукт отфильтровывали, промывали 2 л MeTHF и затем 3,15 л этанола. Продукт сушили при 50C в вакуумном сушильном шкафу до достижения постоянного веса. Выход составлял 1,07 кг (80,4%) грязнобелых кристаллов соединения формулы (12). Аналитические данные: температура плавления 162C. 1HRMS; рассчитано для C31H29ClN7O4S [M+1]+: 630,1685; измерено: 630,1688, элементный анализ: С: 59,09, Н: 4,47, N: 15,56, S: 5,08, Cl: 5,62; измерено: С: 59,05, Н: 4,28, N: 15,57, S: 5,07, Cl: 5,66. Затем для превращения соединения (12) в соединение (14), как показано ниже, процесс продолжали следующим образом: Реакционный сосуд продували инертным газом. Все стадии проводили в защитной атмосфере инертного газа. Затем в сосуд загружали 5 л дихлорметана при температуре 20-25C. Затем в сосуд добавляли 1,00 кг соединения формулы (12) с получением бесцветного раствора. Затем раствор охлаждали до 0C (от -3 до +3C), после чего через раствор пропускали 113 г хлора. Был получен оранжевый раствор, реакция протекала экзотермически. Температуру поддерживали около 0C (от -3 до +3C). Образец реакционной смеси отбирали для исследования методом высокоэффективной жидкостной хроматографии (ВЭЖХ), в случае необходимости, через раствор дополнительно пропускали хлор. После завершения реакции раствор нагревали до 15C. Готовили раствор изопропанола (1,0 экв.) и 10 л ацетона. В сосуд в течение примерно 30 мин добавляли данный раствор в количестве 5% по объему, получая тонкую желтую суспензию. Смесь выдерживали в течение 30 мин, после чего в течение 2 ч добавляли остальные 95% по объему раствора изопропанол/ацетон с получением белой суспензии. Описываемый процесс добавления носил слабо экзотермический характер, поэтому было необходимо некоторое охлаждение (Tmax=25C). Суспензию выдерживают при 20C, и для мониторинга прогресса кристаллизации использовали ВЭЖХ. Продукт (13) затем отфильтровывали и промывали 5 л 2:1 (по объему) смеси ацетон:дихлорметан, затем 2,5 л ацетона. Продукт (13) может быть либо высушен при максимальной температуре 50C до достижения постоянного веса, либо влажный осадок может быть превращен в продукт 3. После выделения (13) выход составил 0,78 кг (88%), вещество было получено в виде белых кристаллов. Для выделения (14) второй реакционный сосуд продували инертным газом. Затем в сосуд загружали 5 л дихлорметана при температуре 20-25C. Затем в сосуд добавляли около 1,10 кг влажного осадка соединения формулы (13 а) с получением белой суспензии, после чего добавляли 5 л воды. Получали двухфазный раствор, температуру поддерживали около 22C (от 20 до 25C). Проводили разделение фаз и к нижнему обогащенному продуктом органическому слою затем добавляли 1,5 л этилацетата при перегонке при постоянном объеме (давление = 400 мбар). В полученный раствор затем вносили затравку 13b и выдерживали в течение 30 мин. Затем при перегонке при постоянном объеме дополнительно добавляли 9-12 л этилацетата (давление понижали до 100 мбар). Суспензию выдерживали при 20C и для мониторинга прогресса кристаллизации использовали ВЭЖХ. Затем продукт (14) отфильтровывали и промывали 4 л этилацетата. Затем продукт (14) высушивали при максимальной температуре 50C до достижения постоянного веса. После выделения (14) выход составил 0,70 кг (85%), вещество было получено в виде белых кристаллов. Аналитические данные для вещества (13): температура плавления 121C. 1 Н-ЯМР (d7-DMF) (, ppm): 11,17 (br s, 1H), 9,18 (s, 1H), 8,88 (s, 1H), 8,19 (s, 1H), 7,52-7,54 (m, 5H),6,44 (s, 2H), 4,19 (s, 3H), 3,67-3,84 (m, 8H), 2,55 (s, 3H); 13 С-ЯМР (d7-DMF) (, ppm): 185,4, 169,9, 166,2, 161,3, 151,1, 146,6, 142,3, 136,1, 129,9, 129,5, 128,6,127,3, 127,2, 124,7, 123,4, 116,1, 57,7, 56,9, 45,9, 41,7, 13,1;HRMS рассчитано для C25H25ClH7O4 [M-Cl]+: 522,1578 измерено 522,1648, элементный анализ: С: 53,77, Н: 4,51, N: 17,55, Cl: 12,69, измерено: С: 53,05, Н: 4,68, N: 17,20, Cl: 12,56. Аналитические данные для вещества 14: температура плавления 211C; 1HRMS: рассчитано для C25H25ClH7O4 [M+H]+: 522,1578, измерено 522,1653, элементный анализ: С: 57,52, Н: 4,64, N: 18,78, Cl: 6,79, измерено С: 57,26, Н: 4,60, N: 18,44, Cl: 7,14. Затем для превращения соединения (14) в соединение (15), как показано ниже, процесс продолжали следующим образом: Реакционный сосуд продували инертным газом. Все стадии проводили в защитной атмосфере инертного газа. Затем в сосуд загружали 3 л дихлорметана при температуре 20-25C. Затем в сосуд добавляли 1,00 кг соединения формулы (14), 0,20 кг тетраэтиламмонийбромида (0,50 экв.) и 0,5 л дихлорметана, получая бесцветный раствор. Затем раствор нагревали до 35C (от 33 до 37C) и к нему добавляли 0,57 кг дитрет-бутилфосфата калия (1,2 экв.) 4 порциями по 0,3 экв. в течение 1 ч, а затем добавляли 0,5 л дихлорметана. Получали желтую суспензию и реакционную смесь нагревали до 40C (от 38 до 42C). Образец реакционной смеси отбирали для мониторинга методом высокоэффективной жидкостной хроматографии(ВЭЖХ), и, если необходимо, дополнительно добавляли ди-трет-бутилфосфат калия. После завершения реакции суспензию охлаждали до 20C. Затем в сосуд добавляли 5 л воды и полученный в результате двухфазный раствор выдерживали при около 20C (от 18 до 22C). Проводили разделение фаз и к нижнему обогащенному продуктом органическому слою затем добавляли 5 л 20:1 (по объему) смеси трет-бутилметиловый эфир:изопропанол. Затем в раствор вносили затравку соединения 15 и смесь выдерживали в течение 30 мин. В течение 3 ч к смеси дополнительно добавляли 11 л 20:1 (по объему) смеси трет-бутилметиловый эфир:изопропанол. Суспензию выдерживали при 20C и для мониторинга процесса кристаллизации использовали ВЭЖХ. Соединение (15) затем отфильтровывали, промывали 5 л 4:1 (по объему) смеси [20:1 (по объему) смесь трет-бутилметиловый эфир:изопропанол]:дихлорметан и затем 5 л трет-бутилметилового эфира. Соединение (15) затем высушивали при максимальной температуре 50C до достижения постоянного веса. После выделения соединения (15) выход составил 1,13 кг (85%), соединение было получено в виде белых кристаллов. Аналитические данные для соединения (2): температура плавления 198C. 1 Н-ЯМР (CDCl3) (, ppm): 8,51 (s, 3H), 8,17 (s, 3H), 7,88 (s, 3H), 7,39 (m, 5H), 5,92 (d, J= 14 Гц, 2H),4,03 (s, 3H), 3,30-3,80 (m, 8H), 2,47 (s, 3H), 1,25 (s, 18H); 13 С-ЯМР (CDCl3) (, ppm): 184,6, 170,5, 166,8, 161,4, 150,7, 145,3, 141,8, 134,9, 130,1, 129,5, 128,5,127,5, 127,0, 124,6, 122,6, 115,1, 83,7 (d, J=7,4 Гц), 73,55 (d, J=6,6 Гц), 56,8, 45,9, 41,6, 29,5 (d, J=4,4 Гц),13,8. 31 Р-ЯМР (CDCl3) (, ppm): -10,0; Описанный выше процесс может быть затем продолжен, как здесь раскрыто в описании, с получением соединения формулы (I). Полученное соединение формулы (I) может быть использовано в композициях для лечения ВИЧинфекции, как раскрыто и описано, например, в патентах США 7745625, 7354924 и 7776863, но не ограничиваясь этим. Приведенное выше описание приведено в иллюстративных целях и его не следует понимать в качестве ограничения каким-либо образом объема и основополагающих принципов изобретения. Из приведенных примеров и предшествующего описания специалистам в данной области техники в дополнение к показанным и описанным здесь воплощениям станут очевидными различные модификации изобретения. Такие модификации также входят в объем прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I)(В) превращение аминогруппы соединения (3) в метоксигруппу с получением соединения(Г) последующее превращение соединения (4) в соединение(Е) формирование бициклической структуры из соединения (6) с получением(Ж) последующее хлорирование соединения (7) с получением(З) последующее добавление триазолильного фрагмента к соединению (8) с получением(М) последующее превращение соединения (12) в соединение(Н) последующее превращение соединения (13) с получением соединения(О) последующее превращение соединения (14) с получением соединения(П) последующее превращение соединения (15) в соединение формулы (I). 2. Способ получения соединения формулы (I)(iii) последующее превращение соединения (12) в соединение(iv) с последующим превращением соединения (13) для получения соединения(v) с последующим превращением соединения (14) для получения соединения(vi) с последующим превращением соединения (15) в соединение формулы (I). 3. Способ по п.1, в котором стадию (А) проводят с использованием Ac2O. 4. Способ по п.1, в котором стадию (Б) осуществляют в кислых условиях. 5. Способ по п.4, в котором стадию (Б) осуществляют с использованием азотной кислоты. 6. Способ по п.5, в котором стадию (Б) осуществляют с использованием азотной и серной кислот. 7. Способ по п.1, в котором стадию (В) проводят с использованием NaNO2 и TMS-Cl в спирте. 8. Способ по п.7, в котором указанный спирт представляет собой метанол. 9. Способ по п.1, в котором стадию (Г) проводят с использованием 16. Способ по п.2, в котором стадию (vi) проводят с использованием ацетона в воде и трометамина. 17. Способ получения соединения формулы (14)(iii) последующее превращение соединения (12) в соединение(iv) последующее превращение соединения (13) в соединение
МПК / Метки
МПК: C07F 9/6524, A61K 31/675, C07F 9/6561, C07D 471/04, C07F 9/572, A61K 31/496, C07F 9/09
Метки: вируса, присоединения, ингибиторов, интермедиатов, являющихся, вич, получения, способы, соединений, пролекарствами
Код ссылки
<a href="https://eas.patents.su/26-21726-sposoby-polucheniya-soedinenijj-yavlyayushhihsya-prolekarstvami-ingibitorov-prisoedineniya-virusa-vich-i-ih-intermediatov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения соединений, являющихся пролекарствами ингибиторов присоединения вируса вич, и их интермедиатов</a>
Предыдущий патент: Новый способ бурения подземных полостей
Следующий патент: Способ использования характеристик давления для прогнозирования аномалий нагнетательных скважин
Случайный патент: Способ хранения продукта












