Способы получения арил-&beta-дикетонов и интермедиатов для получения соединений для защиты посевов.
Номер патента: 2129
Опубликовано: 24.12.2001
Авторы: Чин Хсиао-Линг Мао, Ли Дэвид Луис, Феликс Рэймонд Энтони, Вулард Фрэнк Ксавьер
Формула / Реферат
1. Способ получения арил-b-дикетона формулы
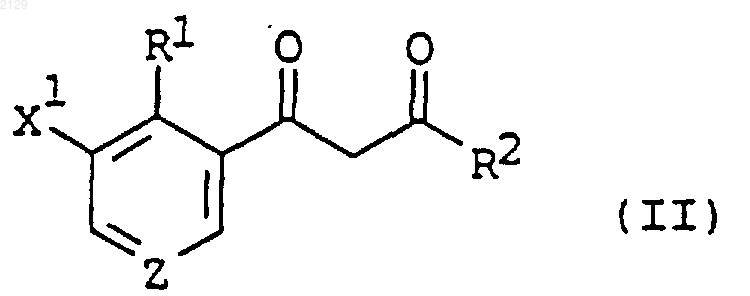
в которой R1 является водородом, C1-C6 алкилом, C1-C6 галогеналкилом, галогеном, нитрогруппой или C2-C4 алкенилом;
R2 является C1-C6 алкилом, C3-C6 циклоалкилом или C1-C6 алкоксилом;
X1 является водородом, галогеном, C1-C6 алкилом или C1-C6 галогеналкилом; a
Z является СН или N,
включающий взаимодействие соединения формулы
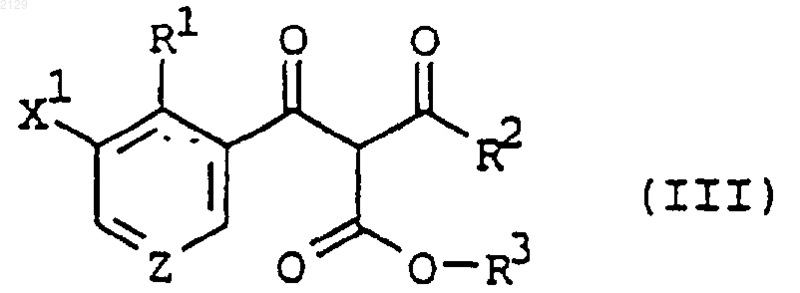
в которой R1 является водородом, C1-C6 алкилом, C1-C6 галогеналкилом, галогеном, нитрогруппой или C2-C4 алкенилом;
R2 является C1-C6 алкилом, C3-C6 циклоалкилом или C1-C6 алкоксилом;
X1 является водородом, галогеном, C1-C6 алкилом или C1-C6 галогеналкилом;
R3 является аллилом или замещенным аллилом; а
Z является СН или N,
с восстанавливающим агентом в присутствии палладиевого катализатора.
2. Способ по п.1, в котором восстанавливающий агент выбирают из группы, состоящей из газообразного водорода, гидрида трибутилолова, боргидрида натрия и растворимых солей муравьиной кислоты.
3. Способ по п.1, в котором R1 является C1-C6 галогеналкилом; R2 является метилом, изопропилом или циклопропилом; R3 является аллилом или замещенным аллилом; a Z является СН.
4. Соединение формулы
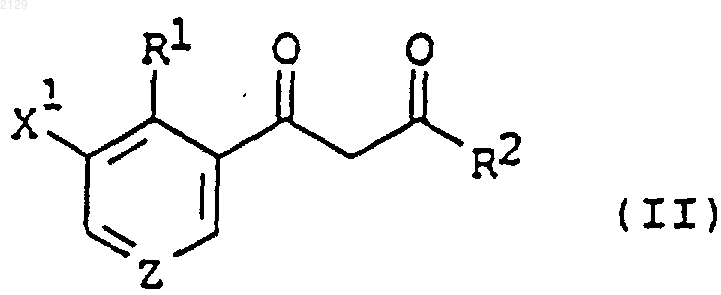
в которой R1 является C1-C6 галогеналкилом, a R2 является циклопропилом; X1 является водородом, галогеном, C1-C6 алкилом или C1-C6 галогеналкилом; a Z является СН или N, при условии, что если Z является СН, R1 не может быть трифторметилом.
5. Соединение формулы
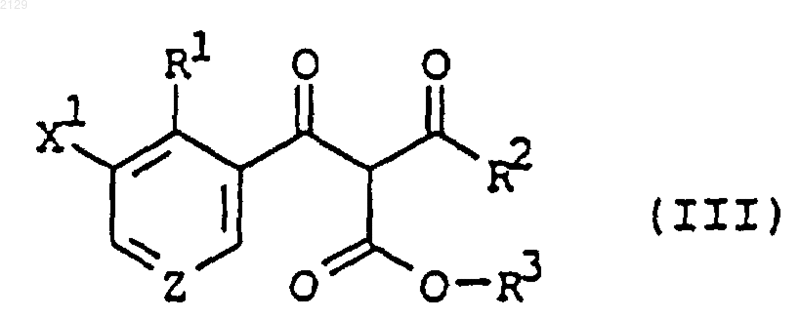
в которой R1 является водородом, C1-C6 алкилом, C1-C6 галогеналкилом, галогеном, нитрогруппой или C2-C4 алкенилом;
R2 является C1-C6 алкилом, C3-C6 циклоалкилом или C1-C6 алкоксилом;
X1 является водородом, галогеном, C1-C6 алкилом или C1-C6 галогеналкилом;
R3 является аллилом или замещенным аллилом; a
Z является СH или N.
6. Соединение по п.5, в котором R1 является C1-C6 галогеналкилом, R2 является метилом, изопропилом или циклопропилом, R3 является аллилом или замещенным аллилом; a Z является СН.
Текст
Настоящее изобретение относится к способам получения арилдикетонов и арилпиримидинкетонов. Кроме этого, настоящее изобретение относится к получению арил-трикетонов и диметил аминометилен-дикетонов, пригодных в качестве интермедиатов для получения соединений для защиты посевов. Предпосылки к созданию изобретения Некоторые замещенные гетероарил гербициды описаны в РСТ публикацияхWO 95/29898 и 95/29893, которые включены здесь в качестве ссылок. Одним из предпочтительных классов этих гербицидов является группа замещенных пиримидинов, имеющих следующую структуру: зультате чего образуется гидроксибензил пиримидиновое соединение. При использовании описанной выше методики реакция декарбоксилирования, по которой получают интермедиат -дикетона, приводит к образованию нежелательного побочного продукта, а именно, арилметилкетона. Неожиданно,авторы изобретения обнаружили, что в случае,если -кетоэфир содержит аллильную группу,или замещенную аллильную группу, реакция декарбоксилирования, по которой получают арилдикетон, протекает без образования арилметилкетона. Тот факт, что арилметилкетон не образуется, значительно снижает стоимость производства. Краткое описание изобретения Настоящее изобретение предлагает способ получения арилдикетона формулы II в которой R1 является водородом, C1-C6 алкилом, C1-C6 галогеналкилом, галогеном, нитрогруппой, или C2-C4 алкенилом; R2 является C1C6 алкилом, C3-C6 циклоалкилом, или C1-C6 алкоксилом; X1 является водородом, галогеном,C1-C6 алкилом, или C1-C6 галогеналкилом; a Z является СН или N, включающий взаимодействие соединения формулы III в которой R6 является C1-C6 алкилом, или выражается формулой N(R7)(R8), в которой R7 и R8 независимо являются водородом, C1-C6 галогеналкилом, C1-C6 алкилом, C2-C6 алкенилом, или совместно R7 и R8 образуют пирролидиновое кольцо,Y является галогеном, C2-C6 алкенилом,C2-C6 алкинилом, C1-C6 алкилом, C1-C6 галогеналкилом, C1-C6 алкоксилом, C1-C6 галогеналкоксилом, нитро-, циано-, C1-C6 алкилкарбамилтио-, меркапто-, гидрокси-, тиоцианогруппами,(C1-C6)-алкокси-(C1-C6)-алкилом, -S(O)k-R10 илиm независимо друг от друга равны 0 или 1, а р равно 0, 1, 2, или 3. Как обсуждается в РСТ публикации WO 95/29898, соединения формулы I можно получить с использованием следующей общей методики. Сначала бензоилхлорид взаимодействует с магниевым енолятом соответствующего кетоэфира с образованием трикетоинтермедиата с последующим гидролизом и декарбоксилированием в -дикетоннный интермедиат. Этот дикетон превращают затем с помощью стандартных методов в алкоксиметилен или диалкиламинометилен -дикетон. Окончательное замыкание кольца в пиримидин достигается при нагревании с ацетатом формамидина в спиртовом растворителе, с последующим восстановлением полученного бензоил пиримидина, в ре в которой R1 является водородом, C1-C6 алкилом, C1-C6 галогеналкилом, галогеном, нитрогруппой, или С 2-С 4 алкенилом; R2 является C1C6 алкилом, C3-C6 циклоалкилом, или C1-C6 алкоксилом; X1 является водородом, галогеном,C1-C6 алкилом, или C1-C6 галогеналкилом; R3 является аллилом, или замещенным аллилом; аZ является СН или N, с восстанавливающим агентом и металлическим катализатором. Другой аспект настоящего изобретения относится к соединению формулы IIN. Следующий аспект настоящего изобретения относится к соединению формулы III 4 мидинкетона в соответствии с приведенной ниже схемой III в которой R1 является водородом, C1-C6 алкилом, C1-C6 галогеналкилом, галогеном, нитрогруппой или С 2-С 4 алкенилом; R2 является C1-C6 алкилом, C3-C6 циклоалкилом или C1-C6 алкоксилом; X1 является водородом, галогеном, C1-C6 алкилом или C1-C6 галогеналкилом; R3 является аллилом или замещенным аллилом; a Z является СН или N. Соединения формул II, III используются в качестве интермедиатов для получения гербицидов. Типичные гербицидные соединения, полученные из упомянутых интермедиатов, описаны в примерах 8 и 9. Подробное описание изобретения Один аспект настоящего изобретения относится к способу получения арилдикетонов,а также к самим новым арилдикетонам. Способ изобретения можно схематично изобразить,как показано на приведенной ниже схеме IR3 является аллилом или замещенным аллилом; а Z является СН или N. Особенно предпочтительными продуктами этого способа являются такие, в которых R1 является трифторметилом, R2 является С 3 алкилом или циклоалкилом, R3 является аллилом или замещенным аллилом, X1 является водородом, a Z является СН или N. Другой аспект настоящего изобретения относится к новым арилтрикетонам формулыIII. Эти соединения можно синтезировать по реакции, представленной следующей схемой:C2-С 4 алкенилом; R2 является C1-С 6 алкилом, C3 С 6 циклоалкилом или C1-С 6 алкоксилом; X1 является водородом, галогеном, C1-С 6 алкилом или C1-С 6 галогеналкилом; R3 является аллилом или замещенным аллилом; а Z является СН илиN. Следующий аспект настоящего изобретения относится к способу получения арилпири Схема III в которой R1 является водородом, C1-С 6 алкилом, C1-С 6 галогеналкилом, галогеном, нитрогруппой или С 2-С 4 алкенилом; R2 является C3-С 6 циклоалкилом или C1-С 6 алкоксилом; X1 является водородом, галогеном, C1-С 6 алкилом или C1 С 6 галогеналкилом; R3 является аллилом или замещенным аллилом; R4 является C3-С 6 циклоалкилом или гидроксилом; a Z является СН илиN. А. Получение арилтрикетонов. Арилтрикетоны настоящего изобретения можно получить при взаимодействии хлорангидрида арилкарбоновой кислоты с дикетоном в присутствии этилата магния, в результате чего образуется арилтрикетон, как показано на схеме II и в примере 1. В общем виде получение ацилхлоридов и -дикетонов описано у J. March, Advanced Organic Chemistry,четвертое издание, J. WileySons, New York(1992), страницы 437-438 и 490-494, соответственно. Обычно кетоэфир и Мg(ОЕt)2 смешивают в подходящем растворителе, таком, как тетрагидрофуран, толуол, диоксан, или диметилформамид, или т.п., а затем нагревают в течение нескольких часов. После этого растворитель упаривают для того, чтобы удалить этанол. Производят замену подходящим растворителем,прибавляют хлорангидрид кислоты и нагревают реакционную смесь до завершения реакции. Как обсуждалось выше, R3 представляет собой аллил, или замещенный аллил. Аллильная группа может быть моно-, ди- и полизамещена галогеном, цианогруппой, C1-С 3 алкилом, C1-С 3 галогеналкилом, C1-С 3 алкоксилом и фенильной группами. Термин галоген означает хлор, фтор, бром и йод. Термин галогеналкил означает алкильную группу, в которой, по меньшей мере, один из атомов водорода замещен атомом галогена. Б. Получение арилдикетонов. Арилдикетоны можно получить путем декарбоксилирования арилтрикетонов, полученных в части А. Как правило, в подходящем реакционном сосуде, таком как круглодонная колба, арилтрикетон взаимодействует с восстанавливающим агентом и палладиевым катализатором с образованием арилдикетонов. Подходящие восстанавливающие агенты включают газообразный водород, гидрид трибутилолова и NaBH4. Предпочтительные восстанавливающие агенты включают растворимые соли муравьиной кислоты, такие как смесь муравьи 5 ной кислоты и триэтиламина (формиат триэтиламмония). При использовании смеси муравьиной кислоты и триэтиламина, предпочтительно используют стехиометрическое количество триэтиламина и молярный избыток муравьиной кислоты. Наиболее предпочтителен трехкратный молярный избыток муравьиной кислоты. Предпочтительным палладиевым катализатором является ацетат палладия. По отношению к ацетату палладия используют 20-кратный молярный избыток арилтрикетона. Достаточно эффективны также катализаторы на основе нуль-валентного палладия, позволяющие использовать меньшие количества катализатора,при условии, что восстанавливающий агент находится в избытке и доступен. Если восстанавливающий агент слаборастворим и поэтому не является легкодоступным, происходит аллильный перенос, как в примере 5 части Б. Частично это происходит вследствие нерастворимости формиата аммония в тетрагидрофуране. Добавляют подходящий растворитель, такой как тетрагидрофуран, и реакционную смесь нагревают, при необходимости, до температуры дефрагментации. Хотя температура дефрагментации определяется применяемым растворителем, при использовании тетрагидрофурана его температура кипения составляет около 66 С. Несмотря на то, что тетрагидрофуран является предпочтительным растворителем, другие подходящие растворители включают толуол, диоксан и диметилформамид. Устанавливают температуру и при необходимости реакционную смесь кипятят от одного до трех часов. Затем растворитель реакции удаляют в вакууме. После этого реакционную смесь экстрагируют диэтиловым эфиром, а потом промывают водой. Органический слой высушивают над MgSO4 и упаривают досуха, получая арилдикетон с хорошим выходом. В. Получение арилпиримидинкетона. Арилпиримидинкетоны можно получить прежде всего при взаимодействии арил-дикетонов, полученных в описанной выше части Б, с диметилацеталем диметилформамида с образованием диалкиламинометилен -дикетонных соединений формулы V. Аналогичным образом, вместо диметилацеталя диметилформамида для получения этоксиметилендикетона можно использовать триэтилортоформиат. Последующее замыкание кольца в пиримидин достигается при нагревании интермедиата метилен-дикетона с солью формамидина и основанием в спиртовом растворителе. В подходящем реакционном сосуде арил-дикетон, полученный в описанной выше части Б, вводится во взаимодействие с диметилацеталем диметилформамида в стехиометрическом соотношении. Раствор перемешивают и оставляют для протекания реакции в течение от око 002129 6 ло 5 до около 10 ч для получения интермедиата диалкиламинометилендикетона. Этот интермедиат диалкиламинометилен-дикетона прибавляют к стехиометрическим количествам соли формамидина, такой как ацетат формамидина, и основания, такого как метилат натрия, в C1-6 спирте. Смесь перемешивают и нагревают около 1 ч. Подходящие спиртовые растворители включают в себя, но не ограничены метанолом и этанолом. После этого реакционную смесь экстрагируют хлористым метиленом и затем промывают водой. Органический слой сушат над МgSО 4 и упаривают досуха, получая при этом арилпиримидинкетон. Г. Восстановление арилпиримидинкетона. Соединение формулы IV, полученное в части В, можно восстановить с помощью подходящего восстанавливающего агента, такого как боргидрид натрия, с получением гидроксибензил пиримидинового соединения, или гидроксиникотинил пиримидинового соединения. При применении боргидрида натрия используется 2-4-кратный молярный избыток соединения формулы IV по сравнению с боргидридом натрия. Гербицидные производные этих гидроксибензил пиримидинового, или гидроксиникотинил пиримидинового соединений получают по общим методикам, приведенным далее. Восстановленный продукт формулы (IV) в подходящем растворителе (таком как тетрагидрофуран,метиленхлорид или т.п.) обычно можно прибавить к соответствующему основанию (такому как гидрид натрия, или триэтиламин), взятому в количестве от около 1 до около 4 эквивалентов,при температуре около 0 С. После этого прибавляют от около 1 до около 3 эквивалентов функционализирующего агента (такого как карбамоил галогенид, алкил галогенид, сульфонил галогенид или галогенид фосфора, или галогенангидрид алкил- или арилкарбоновой кислоты,или триалкилсилилгалогенид) и перемешивают смесь до завершения реакции. Реакцию можно остановить прибавлением водного раствора, а продукты выделить обычными методами, такими как экстракция, фильтрование и т.п. Выделенный таким образом продукт затем можно очистить обычными методами, такими как флэш-хроматография и т.п. По другому способу восстановленный продукт формулы (IV) в подходящем растворителе (таком как тетрагидрофуран, метиленхлорид или т.п.) можно прибавить к соответствующему изоцианату, такому как алкил- или арилизоцианат, взятому в количестве от около 2 до около 3 эквивалентов. Можно добавить от около 1 до около 100 мольных процентов соответствующих катализаторов, например, триэтиламина или дилаурата дибутилолова, и перемешивать реакционную смесь при температуре от около 0 до около 100 С в течение соответст 7 вующего промежутка времени (например, от 2 до 24 ч). Продукт можно выделить обычными методами, такими как экстракция, фильтрование и т.п. и очистить обычными методами, такими как флэш-хроматография и т.п. Следующие неограничивающие примеры иллюстрируют настоящее изобретение. Пример 1. Получение арилтрикетона.(А) Получение -кетоэфира. В круглодонную колбу, снабженную капельной воронкой и обратным холодильником, поместили 21,3 г(0,15 моль) диаллилкарбоната и 50 мл тетрагидрофурана, смесь перемешали. Затем порциями прибавили 8,4 г (0,21 моль) гидрида натрия. Из капельной воронки к реакционной смеси прибавили 12,6 г (0,15 моль) циклопропилметилкетона (растворенного в 25 мл тетрагидрофурана). Смесь довели до кипения и нагревали еще в течение 1 ч. После этого смесь оставили охлаждаться и удалили растворитель. Затем прибавили холодной воды (50 мл) и 1N соляной кислоты(50 мл). Реакционную смесь перенесли в делительную воронку и прибавили диэтилового эфира. Органический слой высушили над MgSO4 и упарили в вакууме, получив при этом кетоэфир, карбоаллилоксиметилциклопропилкетон.(Б) Получение арилтрикетона. В круглодонную колбу поместили 23,6 г (0,14 моль) кетоэфира, 16 г (0,14 моль) этилата магния и 100 мл тетрагидрофурана. Затем реакционную смесь кипятили с обратным холодильником течение 2 ч и удалили растворитель, чтобы убедиться в полном удалении этанольного побочного продукта. После этого в колбу вновь прибавили 100 мл тетрагидрофурана и 29,3 г (0,14 моль) ацилхлоридарила. Раствор кипятили с обратным холодильником несколько часов, после чего смесь упарили в вакууме, экстрагировали диэтиловым эфиром и промыли водой. Строение 46,4 г продукта-трикетона,трифторметилбензоилкарбоаллилоксиметилциклопропилкетона было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и масс-спектрометрии В круглодонную колбу поместили 120 г трикетона (0,27 моль) (полученного в примере 1), 450 мл тетрагидрофурана, 23,3 г муравьиной кислоты (0,62 моль), 39,2 мл триэтиламина (0,28 8 моль) и 3 г ацетата палладия (0,014 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником 2 ч. Затем дополнительно прибавили 10 мл муравьиной кислоты и кипятили с обратным холодильником еще в течение часа. После этого прибавили 1 г ацетата палладия и еще 10 мл муравьиной кислоты. После еще часа кипячения с обратным холодильником смесь упарили в вакууме, экстрагировали диэтиловым эфиром и промыли водой. Органический слой высушили над MgSO4 и упарили досуха, получив при этом 68,1 г дикетона, трифторметилбензоилметилциклопропилкетона. Строение продукта было подтверждено данными инфракрасной спектроскопии(ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и масс-спектрометрии (МС). Пример 3. Получение трифторметилникотиноилметилэтилкетона.(А) Получение арилтрикетона. В круглодонную колбу поместили 14,9 г (0,105 моль)-кетоэфира (полученного при переэтерификации этилпропионоил ацетата), 11,3 г (0,1 моль) этилата магния и 150 мл тетрагидрофурана. Затем этот раствор кипятили с обратным холодильником в течение 2 ч и упарили растворитель, чтобы убедиться в полном удалении этанольного побочного продукта. После этого в колбу вновь прибавили 100 мл тетрагидрофурана и 0,095 моль ацилхлорида (полученного из 20 г 4-трифторметилникотиновой кислоты и оксалилхлорида). Полученный раствор повторно кипятили с обратным холодильником несколько часов, после чего реакционную смесь упарили и обработали разбавленной кислотой и эфиром. Строение продукта арилтрикетона,трифторметилникотиноилкарбоаллилоксиметилэтилкетона (22,7 г) было подтверждено данными ИК, ЯМР и МС.(Б) Получение трифторметилникотиноилметилэтилкетона. В круглодонную колбу поместили 21,1 г -трикетона (0,064 моль), 110 мл тетрагидрофурана, 10 мл муравьиной кислоты(0,28 моль), 9,2 мл триэтиламина (0,066 моль) и 1 г ацетата палладия (0,0046 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение одного часа. После этого смесь упарили в вакууме, экстрагировали диэтиловым эфиром и промыли водой. Органический слой высушили надMgSO4 и упарили досуха, получив при этом 14,7 г -дикетона, трифторметилникотиноилметилэтилкетона. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и масс-спектрометрии (МС). Пиридилтрикетон в примере 4 получали с использованием условий реакции, аналогичных описанным в примере 3, исходя из трифторметилникотиноил хлорида и соответствующего -кетоэфира. В круглодонную колбу поместили 34,8 г трикетона (0,10 моль), 175 мл тетрагидрофурана, 8,7 мл муравьиной кислоты (0,23 моль), 14,6 мл триэтиламина (0,10 моль) и 1,1 г ацетата палладия (0,005 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение одного часа. Добавили один эквивалент муравьиной кислоты и смесь кипятили с обратным холодильником дополнительно в течение одного часа. Смесь упарили в вакууме, экстрагировали диэтиловым эфиром и промыли водой. Органический слой высушили над МgSO4 и упарили досуха, получив при этом 25 г -дикетона. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и масс-спектрометрии (МС). Пример 5. Часть А. Восстанавливающий агент, растворимый в используемом растворителе. Получение трифторметилбензоилметилэтилкетона с использованием катализатора на основе нуль-валентного палладия. В круглодонную колбу поместили 44 г трикетона (0,134 моль), 200 мл тетрагидрофурана, 15,2 мл муравьиной кислоты (0,402 моль),19,1 г триэтиламина (0,137 моль) и 0,77 г тетракис(трифенилфосфин)палладия (0,00067 моль). Реакционную смесь перемешивали при комнатной температуре в течение около 72 ч. Смесь упарили в вакууме, экстрагировали диэтиловым эфиром и промыли водой. Органический слой высушили над MgSO4 и упарили досуха, получив при этом 32,2 г -дикетона. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и масс-спектрометрии (МС). Часть Б. Восстанавливающий агент, не растворимый в используемом растворителе. Получение трифторметилбензоилбутиленциклопропилкетона. В круглодонную колбу поместили 5,0 г(0,0147 моль) арилтрикетона в смеси с 50 мл тетрагидрофурана, 1,85 г (0,029 моль) формиата аммония и 0,17 (0,000147 моль) тетракис(трифенилфосфин) палладия и нагревали реакционную смесь до кипения с обратным холодильником в течение получаса. После этого реакционную смесь охладили до комнатной температуры и перемешивали в течение ночи. На следующий день смесь нагревали до кипения с обратным холодильником еще в течение часа и охладили до комнатной температуры. Затем смесь упарили в вакууме, экстрагировали диэтиловым эфиром и промыли водой. Органический слой высушили над MgSO4 и упарили досуха, получив при этом 3,8 г продукта. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и массспектрометрии (МС). Пример 6. Получение 4-циклопропил-5[(2-трифторметил)бензоил]-пиримидина.(А) 68,1 г (0,266 моль) трифторметилбензоилметилциклопропилкетона осторожно смешали с 39,5 г (0,297 моль) диметилацеталя N,Nдиметилформамида. Полученный раствор перемешивали 45 мин и упарили, получив 82,9 г трифторметилбензоилметил-[(диметиламино) метилен]циклопропилкетона. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса(Б) К раствору, кипящему с дифлегмацией,56,9 г (0,547 моль) ацетата формамидина, 700 мл этанола и 125 мл (0,547 мол) 25% раствора метилата натрия в метаноле прибавили по каплям 82,9 г (0,267 моль) продукта стадии А. После этого реакционную смесь кипятили с обратным холодильником 4 ч и оставили перемешиваться на выходные дни. Затем реакционную смесь упарили при пониженном давлении и экстрагировали 20 мл дихлорметана. Упаренный продукт хроматографировали на колонке в 4 дюйма(10,16 см) высотой и 3 дюйма (7,62 см) в диаметре на силикагеле, фракциями по 75 мл этилацетата, смешанного с гексаном. Собрали два 11 дцать две фракции, содержащих 20% этилацетата, затем собрали шестнадцать фракций, содержащих 50% этилацетата. Фракции с 8 по 13 объединили, получив в результате 40,5 г продукта,4-циклопропил-5-[(2-трифторметил)-бензоил]пиримидина. Пример 7. Получение 4-циклопропил-5[2,3-дихлорбензоил]-пиримидина.(А) Получение -кетоэфира. В круглодонную колбу, снабженную капельной воронкой и обратным холодильником, поместили 21,3 г(0,15 моль) диаллилкарбоната и 50 мл тетрагидрофурана, смесь перемешали. Затем порциями прибавили 8,4 г (0,21 моль) гидрида натрия. Из капельной воронки к реакционной смеси прибавили 12,6 г (0,15 моль) циклопропилметилкетона (растворенного в 25 мл тетрагидрофурана). Смесь довели до кипения с обратным холодильником и нагревали еще в течение 1 ч. После этого смесь оставили охлаждаться и удалили растворитель. Затем прибавили холодной воды (50 мл) и 1N соляной кислоты (50 мл). Реакционную смесь перенесли в делительную воронку и прибавили диэтилового эфира. Органический слой высушили над MgSO4 и упарили в вакууме, получив при этом -кетоэфир, карбоаллилоксиметилциклопропилкетон.(Б) Получение арилтрикетона. В круглодонную колбу поместили 16,8 г (0,1 моль) кетоэфира, 11,4 г этилата магния и 100 мл тетрагидрофурана. Затем реакционную смесь кипятили с обратным холодильником в течение 2 ч и удалили растворитель, чтобы убедиться в полном удалении этанольного побочного продукта. После этого в колбу вновь прибавили 100 мл тетрагидрофурана и 20,85 г (0,1 моль) 2,3 дихлорбензоилхлорида. Раствор кипятили с обратным холодильником два часа, после чего смесь упарили в вакууме, экстрагировали диэтиловым эфиром и высушили над сульфатом магния. Строение 30 г продукта, 2,3 дихлорбензоилкарбоаллилоксиметилциклопропилкетона, было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и массспектрометрии (МС).(В) Получение 2,3-дихлорбензоилметилциклопропилкетона. В круглодонную колбу поместили 34,1 г -трикетона (часть Б) (0,1 моль), 450 мл тетрагидрофурана, 14,55 г муравьиной кислоты (0,39 моль), 21 мл триэтиламина (0,15 моль) и 0,5 г ацетата палладия (0,002 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение шести часов. Затем прибавили еще 50%-ное количество муравьиной кислоты и ацетата палла 002129 12 дия и перемешивали, смесь кипятили с обратным холодильником дополнительно четыре(4) ч. Смесь упарили в вакууме, экстрагировали диэтиловым эфиром и 1N соляной кислотой. Затем смесь промыли водой. Органический слой высушили над MgSО 4 и упарили досуха, получив -дикетон. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и масс-спектрометрии (МС).(0,169 моль) диметилацеталя N,N-диметилформамида. Полученный раствор перемешивали 48 ч и упарили, получив 42 г 2,3 дихлорбензоилметил[(диметиламино)метилен] циклопропилкетона.(0,169 моль) ацетата формамидина, 200 мл этанола и 55,2 г (0,207 мол) 25% раствора метилата натрия в метаноле прибавили по каплям 42,3 г(0,137 моль) диметиламинометилендикетона. После этого реакционную смесь кипятили с обратным холодильником 1,5 ч и оставили перемешиваться на ночь. Затем реакционную смесь упарили при пониженном давлении и экстрагировали 20 мл дихлорметана. Упаренный продукт хроматографировали, используя этилацетат, смешанный с гексаном. Фракции объединили, получив 39,7 г продукта, 4-циклопропил-5[(2,3-дихлорбензоил)]-пиримидина. Пример 8. Получение 4-циклопропил-5-(1 бензилокси-2'-трифторметилбензил)-пиримидина.(А) К раствору 4-циклопропил-5-[(2 трифторметил)бензоил)]-пиримидина (44,6 г,0,153 моль) (пример 6, часть Б) в 250 мл этанола при комнатной температуре прибавили 2,37 г(0,0622) боргидрида натрия. Храматография показала, что реакция завершается через 15 мин после прибавления. Смесь упарили при пониженном давлении, экстрагировали дихлорметаном, промыли водой, высушили над сульфатом магния и упарили при пониженном давлении,получив в результате 42,2 г продукта, 4-циклопропил-5-(1-гидрокси-2'-трифторметилбензил)пиримидина.(Б) 1,2 г (0,00408 моль) 4-циклопропил-5(1-гидрокси-2'-трифторметилбензил)-пиримидина смешали с 0,59 мл (0,0051 моль) бензилхло 13 рида в 12 мл ДМФА. Порциями прибавили 0,11 г (0,0047 моль) гидрида натрия. Реакция завершилась в течение 1 ч; реакционную смесь вылили на лед, экстрагировали дихлорметаном,высушили над MgSO4, отфильтровали и упарили досуха при пониженном давлении, получив при этом 4-циклопропил-5-(1-бензилокси-2'трифторметилбензил)-пиримидин. Продукт хроматографировали на колонке с диаметром 1 дюйм (2,54 см) и высотой 4 дюйма (10,16 см) на силикагеле при элюировании смесью 50% этилацетат/гексан, при отборе фракций объемом 20 мл. Фракции 4 и 8 объединили и упарили, получив 0,75 г продукта. Пример 9. Получение 4-циклопропил-5-(1 бензилокси-2'-трифторметилникотинил)-пиримидина.(А) 25 г (0,097 моль) трифторметилникотиноилметилциклопропилкетона (пример 4) осторожно смешали с 14,5 мл (0,109 моль) диметилацеталя N,N-диметилформамида. Раствор перемешивали 45 мин и упарили, получив 27,9 г трифторметилникотиноилметил[(диметиламино)метилен]циклопропилкетона. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и массспектрометрии (МС).(Б) К раствору, кипящему с обратным холодильником, 19,1 г (0,184 моль) ацетата формамидина, 230 мл этанола и 42 мл (0,184 моль) 25% раствора метилата натрия в метаноле прибавили по каплям 27,9 г (0,089 моль) продукта стадии А. После этого реакционную смесь кипятили с обратным холодильником 4 ч и оставили перемешиваться на выходные дни. Затем реакционную смесь упарили при пониженном давлении и экстрагировали 20 мл дихлорметана. Упаренный продукт хроматографировали на колонке 2 дюймов (5,08 см) высоты и 4 дюймов(10,16 см) в диаметре с силикагелем, фракциями по 50 мл этилацетата, смешанного с гексаном. Содержащие продукт фракции объединили, получив при этом 8,4 г продукта, 4-циклопропил 5-[(2-трифторметил)никотиноил]пиримидина. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и масс-спектрометрии (МС).(В) К раствору 4-циклопропил-5-[(трифторметил)никотиноил]-пиримидина (8,4 г,0,0285 моль), растворенного в 85 мл этанола,при комнатной температуре прибавили 0,44 г(0,0119 моль) боргидрида натрия. Хроматография показала, что реакция завершается за 15 мин после прибавления. Смесь упарили при пониженном давлении, экстрагировали дихлорметаном, промыли водой, высушили над сульфатом магния и упарили при пониженном давлении, получив 7,3 г продукта, 4-циклопропил-5[1-гидрокси-1-(4'-трифторметилпиридин-3-ил)] метилпиримидина. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и масс-спектрометрии(Г) 1,5 г (0,0051 моль) 4-циклопропил-5-(1 гидрокси-1-(4'-трифторметилпиридин-3-ил)] метилпмримидина смешали с 0,73 мл (0,00635 моль) бензилхлорида в 15 мл ДМФА. Порциями прибавили 0,14 г (0,00577 моль) гидрида натрия. Реакция завершилась в течение 1 ч; реакционную смесь вылили на лед, экстрагировали дихлорметаном, высушили над MgSO4, отфильтровали и упарили досуха при пониженном давлении, получив при этом 4-циклопропил-5-(1 бензилокси-1-(4'-трифторметилпиридин-3-ил)] метилпиримидин. Продукт хроматографировали на колонке с диаметром 2 дюйма (5,08 см) и высотой 4 дюйма (10,16 см) на силикагеле при элюировании смесью 50% этилацетат/гексан,при отборе фракций 50 мл. Содержащие продукт фракции объединили и упарили, получив при этом 0,3 г продукта. Строение продукта было подтверждено данными инфракрасной спектроскопии (ИК), спектроскопии ядерного магнитного резонанса (ЯМР) и масс-спектрометрии(МС). Несмотря на то, что настоящее изобретение описано со ссылкой на его предпочтительные варианты воплощения и примеры, рамки настоящего изобретения не ограничены только описанными вариантами воплощения. Для специалистов в данной области будет очевидно, что можно осуществить изменения и приложения к вышеописанному изобретению, не изменяя при этом духу и рамкам этого изобретения, которые определены и ограничены прилагаемой формулой. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ формулыR3 является аллилом или замещенным аллилом; aZ является СН или N,включающий взаимодействие соединения формулыR3 является аллилом или замещенным аллилом; аZ является СН или N,с восстанавливающим агентом в присутствии палладиевого катализатора. 2. Способ по п.1, в котором восстанавливающий агент выбирают из группы, состоящей из газообразного водорода, гидрида трибутилолова, боргидрида натрия и растворимых солей муравьиной кислоты. 3. Способ по п.1, в котором R1 является C1C6 галогеналкилом;Z является СН или N,при условии, что если Z является СН, R1 не может быть трифторметилом. 5. Соединение формулыR3 является аллилом или замещенным аллилом; aZ является СH или N. 6. Соединение по п.5, в котором R1 является C1-C6 галогеналкилом,R2 является метилом, изопропилом или циклопропилом,R3 является аллилом или замещенным аллилом; a
МПК / Метки
МПК: C07C 45/67, C07D 401/06
Метки: арил-&beta-дикетонов, соединений, защиты, интермедиатов, способы, посевов, получения
Код ссылки
<a href="https://eas.patents.su/9-2129-sposoby-polucheniya-aril-beta-diketonov-i-intermediatov-dlya-polucheniya-soedinenijj-dlya-zashhity-posevov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения арил-&beta-дикетонов и интермедиатов для получения соединений для защиты посевов.</a>
Предыдущий патент: Способ олигомеризации низших олефинов
Следующий патент: Инсектицидные и акарицидные композиции
Случайный патент: Новый стабильный кристалл производного тиазолидиндиона и способ его получения












