Способы получения ингибиторов jak киназ и родственных промежуточных соединений
Номер патента: 20643
Опубликовано: 30.12.2014
Авторы: Юэ Тай-Юйэнь, Роджерс Джеймс Д., Ксиа Майкл, Лю Пинли, Чжоу Цзячэн, Мелони Дэвид, Пань Юнчунь, Меткаф Брайан В., Ли Мей, Ван Хайшэн, Лин Циянь
Формула / Реферат
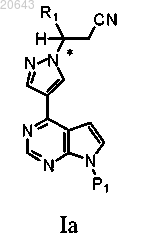
1. Способ получения композиции, содержащей рацемат соединения формулы Ia
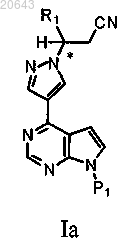
который включает:
(а) обработку композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Ia, соединением формулы D-1
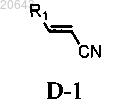
в присутствии первого основания в условиях, достаточных для получения соединения формулы IV
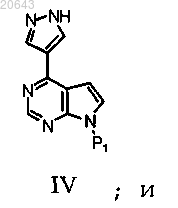
(b) реакцию соединения формулы IV с соединением формулы D-1 в присутствии второго основания, где * указывает на хиральный углерод; P1 является защитной группой и R1 выбирают из С3-7 циклоалкила, С1-6 алкила и С1-6 фторалкила.
2. Способ по п.1, где указанное первое основание представляет собой карбонат цезия.
3. Способ по п.1 или 2, где указанное второе основание представляет собой 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU).
4. Способ получения композиции, содержащей рацемат соединения формулы Ia
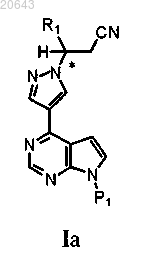
который включает обработку композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Ia, соединением формулы D-1
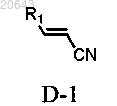
в присутствии основания в условиях, достаточных для получения указанного рацемата указанного соединения формулы Ia, где * указывает на хиральный углерод; P1 является защитной группой и R1 выбирают из С3-7 циклоалкила, С1-6 алкила и С1-6 фторалкила.
5. Способ по п.4, где указанное основание представляет собой трет-бутоксид калия.
6. Способ по любому из пп.1-5, дополнительно включающий получение композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Ia
включающий пропускание композиции, содержащей рацемат соединения формулы Ia, через хиральную хроматографическую ячейку с использованием подвижной фазы и сбор композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Ia, где * указывает на хиральный углерод; R1 выбирают из С3-7 циклоалкила, С1-6 алкила и C1-6 фторалкила и P1 является защитной группой.
7. Способ по п.6, где подвижная фаза содержит изопропанол и гексаны, где указанный изопропанол присутствует в количестве от приблизительно 25 до приблизительно 10 об.%.
8. Способ по п.6 или 7, где указанная хроматографическая ячейка представляет собой ячейку для хроматографии с псевдодвижущимся слоем (SMB), снабженную набором из восьми колонок или ячейкой хиральной колонки, где каждая колонка заполнена хиральной стационарной фазой.
9. Способ по любому из пп.1-8, где P1 является СН2ОС(=О)С(СН3)3 или -CH2OCH2CH2Si(CH3)3.
10. Способ по любому из пп.1-9, где R1 является циклопентилом.
11. Способ по любому из пп.6-8, дополнительно включающий реакцию указанного соединения формулы Ia в условиях снятия защитной группы с получением соединения формулы III
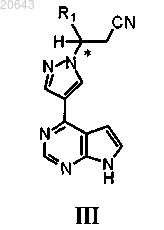
где * указывает на хиральный углерод;
R1 выбирают из С3-7 циклоалкила, С1-6 алкила и C1-6 фторалкила и
P1 является защитной группой.
12. Способ по п.11, где Р1 является -СН2ОС(=O)С(СН3)3 или -CH2OCH2CH2Si(CH3)3.
13. Способ по п.11 или 12, где R1 является циклопентилом.
14. Способ по п.11 или 12, где указанное соединение формулы III является (3R)-3-циклопентил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрилом.
15. Способ по любому из пп.11-14, дополнительно включающий реакцию соединения формулы III с фосфорной кислотой с образованием фосфатной соли указанного соединения формулы III.
16. Композиция, содержащая энантиомерный избыток (R)- или (S)-энантиомера соединения формулы I
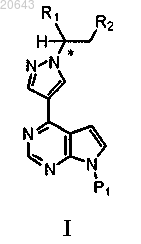
где * указывает на хиральный углерод;
R1 выбирают из С3-7 циклоалкила, С1-6 алкила и С1-6 фторалкила;
R2 выбирают из -C(=O)-NH2, -C(=O)O-R3, -C(=O)OH и -С(=О)Н;
R3 выбирают из С1-4 алкила или С1-4 фторалкила и
Р1 является защитной группой.
17. Композиция по п.16, где Р1 является -СН2ОС(=O)С(СН3)3 или -CH2OCH2CH2Si(СН3)3.
18. Композиция по п.16 или 17, где R1 является циклопентилом.
19. Способ получения композиции, содержащей энантиомерный избыток, равный или превышающий 90% (R)-энантиомера соединения формулы III'
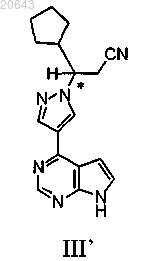
который включает:
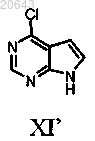
(а) обработку соединения формулы XI'
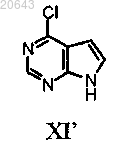
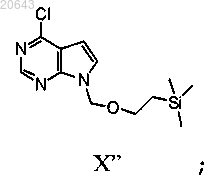
гидридом натрия и N-пивалоилоксиметилхлоридом с получением соединения формулы X'
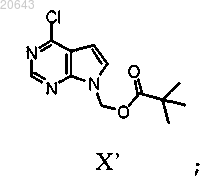
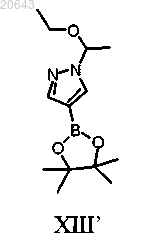
(b) обработку соединения формулы X' соединением формулы XIII'
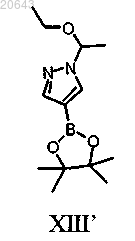
в присутствии Pd(трифенилфосфин)4, карбоната калия и растворителя с получением соединения формулы XII'

(с) реакцию указанного соединения формулы XII' в условиях снятия защитной группы с получением соединения формулы IV'
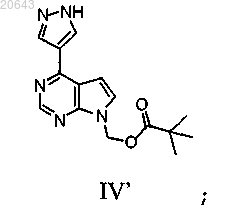
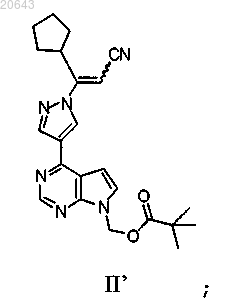
(d) реакцию соединения формулы IV' с соединением формулы XIV'

в присутствии 1,8-диазабицикло[5.4.0]ундец-7-ена с получением соединения формулы II'
(е) реакцию указанного соединения формулы II' с газообразным водородом в присутствии [Rh(COD)2] CF3SO3 и хирального фосфинового лиганда, который выбирают из
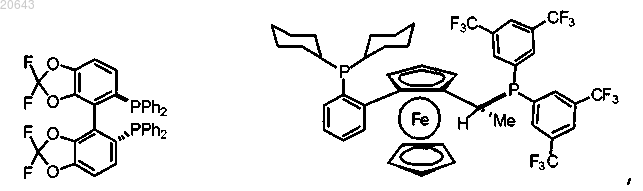
с получением соединения формулы I'
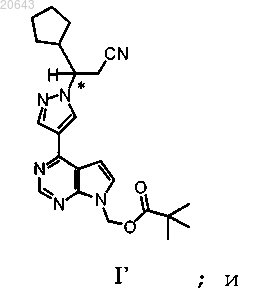
(f) реакцию указанного соединения формулы I' в условиях снятия защитной группы с получением указанного соединения формулы III';
где* указывает на хиральный углерод.
20. Способ по п.19, дополнительно включающий получение указанного соединения формулы XI'
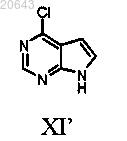
который включает:
(i) реакцию соединения F-4

с приблизительно 3-5 экв. POCl3 в присутствии от приблизительно 1 до приблизительно 2 экв. диметилформамида с получением соединения формулы F-3
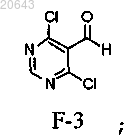
(ii) реакцию указанного соединения F-3 с приблизительно 2 экв. аммиака в метаноле с получением соединения формулы F-2
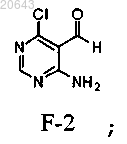
(iii) реакцию указанного соединения формулы F-2 с приблизительно 1-1,5 экв. реагента типа реагента Виттига формулы [Ph3P+(СН2ОСН3)]Cl-, где Ph является фенилом, в присутствии приблизительно 1-1,5 экв. трет-бутоксида калия с получением соединения формулы F-1
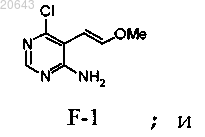
(iv) обработку указанного соединения формулы F-1 водной концентрированной хлористо-водородной кислотой в тетрагидрофуране при кипении с получением соединения формулы XI'.
21. Способ получения композиции, содержащей энантиомерный избыток (R)-энантиомера соединения формулы III'
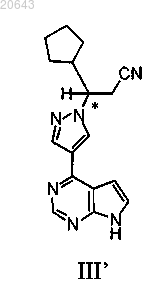
который включает:
(а) обработку соединения формулы XI'
гидридом натрия и 2-(триметилсилил)этоксиметилом с получением соединения формулы X"
(b) обработку указанного соединения формулы X" соединением формулы XIII'
в присутствии Pd(трифенилфосфин)4, карбоната калия и растворителя с получением соединения формулы XII"
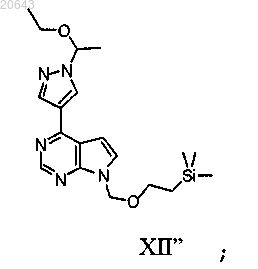
(с) реакцию указанного соединения формулы XII" в условиях снятия защитной группы с получением соединения формулы IV"
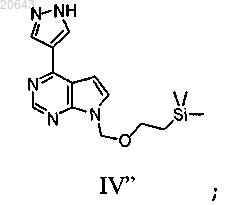
(d) реакцию указанного соединения формулы IV" с соединением формулы D-1'
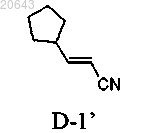
в условиях, достаточных для получения композиции, содержащей рацемат соединения формулы I"
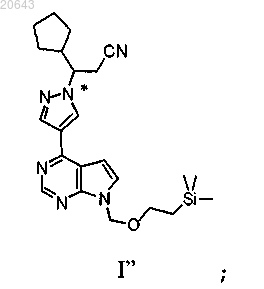
(e) пропускание указанной композиции, содержащей указанный рацемат указанного соединения формулы I", через хиральную хроматографическую ячейку с использованием подвижной фазы и сбор композиции, содержащей энантиомерный избыток (R)-энантиомера указанного соединения формулы I"; и
(f) реакцию указанного соединения формулы I" с тетрафторборатом лития, затем с водным гидроксидом аммония с получением композиции, содержащей энантиомерный избыток (R)-энантиомера указанного соединения формулы III', где * указывает на хиральный углерод.
22. Способ получения композиции, содержащей энантиомерный избыток (R)-энантиомера соединения формулы III'
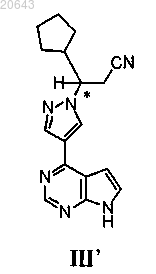
который включает:
(а) обработку композиции, содержащей энантиомерный избыток (S)-энантиомера соединения формулы I"

соединением формулы D-1'
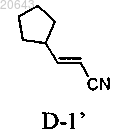
в присутствии карбоната цезия в ацетонитриле в условиях, достаточных для получения рацемата соединения формулы I";
(b) пропускание указанной композиции, содержащей указанный рацемат указанного соединения формулы I", через хиральную хроматографическую ячейку с использованием подвижной фазы и сбор композиции, содержащей энантиомерный избыток (R)-энантиомера указанного соединения формулы I"; и
(c) реакцию указанного соединения формулы I" с тетрафторборатом лития, затем с водным гидроксидом аммония с получением композиции, содержащей энантиомерный избыток (R)-энантиомера указанного соединения формулы III', где * указывает на хиральный углерод.
23. Способ получения композиции, содержащей энантиомерный избыток (R)-энантиомера соединения формулы III'
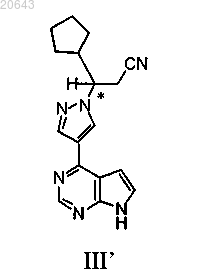
который включает:
(а) обработку соединения формулы XI'

гидридом натрия и 2-(триметилсилил)этоксиметилом с получением соединения формулы X"
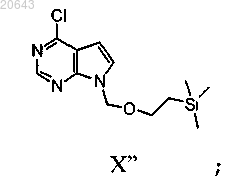
(b) обработку указанного соединения формулы X" соединением формулы XIII'
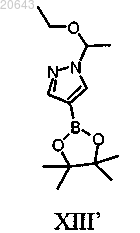
в присутствии Pd(трифенилфосфин)4, карбоната калия и растворителя с получением соединения формулы XII"
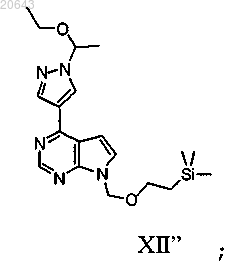
(с) реакцию указанного соединения формулы XII" в условиях снятия защитной группы с получением соединения формулы IV"
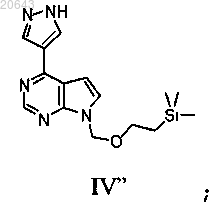
(d) реакцию указанного соединения формулы IV" с соединением формулы D-1'
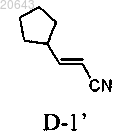
в условиях, достаточных для получения композиции, содержащей рацемат соединения формулы I"
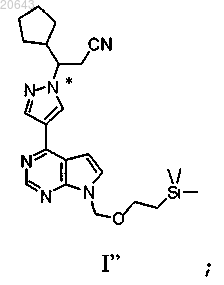
(e) пропускание указанной композиции, содержащей указанный рацемат указанного соединения формулы I", через хиральную хроматографическую ячейку с использованием подвижной фазы, и сбор композиции, содержащей энантиомерный избыток (R)-энантиомера указанного соединения формулы I"; и
(f) реакцию указанного соединения формулы I" с диэтилэфиратом трифторида бора затем с водным гидроксидом аммония с получением композиции, содержащей энантиомерный избыток (R)-энантиомера указанного соединения формулы III', где * указывает на хиральный углерод.
24. Способ получения композиции, содержащей энантиомерный избыток (R)-энантиомера соединения формулы III'
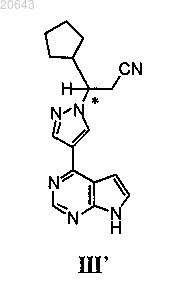
который включает:
(а) обработку композиции, содержащей энантиомерный избыток (S)-энантиомера соединения формулы I"
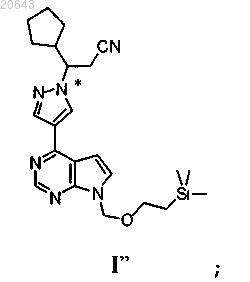
соединением формулы D-1'

в присутствии карбоната цезия в ацетонитриле в условиях, достаточных для получения рацемата соединения формулы I";
(b) пропускание указанной композиции, содержащей указанный рацемат указанного соединения формулы I", через хиральную хроматографическую ячейку с использованием подвижной фазы и сбор композиции, содержащей энантиомерный избыток (R)-энантиомера указанного соединения формулы I"; и
(c) реакцию указанного соединения формулы I" с диэтилэтератом трифторида бора, затем с водным гидроксидом аммония с получением композиции, содержащей энантиомерный избыток (R)-энантиомера указанного соединения формулы III', где * указывает на хиральный углерод.
25. Способ получения композиции, содержащей энантиомерный избыток (R)-энантиомера соединения формулы III'
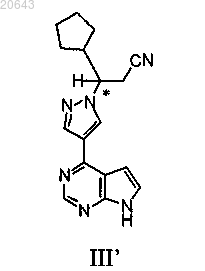
который включает реакцию указанного соединения формулы I"
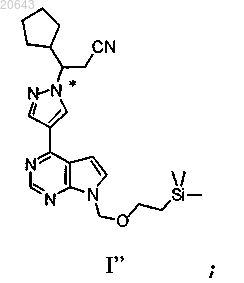
с диэтилэтератом трифторида бора, затем с водным гидроксидом аммония с получением композиции, содержащей энантиомерный избыток (R)-энантиомера указанного соединения формулы III', где * указывает на хиральный углерод.
26. Способ получения фосфатной соли (3R)-циклопентил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)пиразол-1-ил]пропионитрила, который включает реакцию (3R)-циклопентил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)пиразол-1-ил]пропионитрила с фосфорной кислотой в присутствии 2-пропанола и дихлорметана.
27. Способ очистки фосфатной соли (3R)-циклопентил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)пиразол-1-ил]пропионитрила, который включает перекристаллизацию фосфатной соли (3R)-циклопентил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)пиразол-1-ил]пропионитрила из смеси растворителей, содержащей метанол, 2-пропанол и н-гептан.
28. Способ по п.26, где указанные 2-пропанол и н-гептан добавляют к смеси фосфатной соли (3R)-циклопентил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)пиразол-1-ил]пропионитрила в метаноле.
Текст
LETTERS 8 NOV 2007, vol. 9, no. 23, 8 November 2007 (2007 Настоящее изобретение касается способов получения хиральных замещенных пиразолилпирроло[2,3-d]пиримидинов формулыIII и родственных синтетических промежуточных соединений. Хиральные замещенные пиразолилпирроло[2,3-d]пиримидины полезны как ингибиторы Янус киназ семейства протеинтирозинкиназ (JAK) для лечения воспалительных заболеваний, миелопролиферативных нарушений и других заболеваний. Область техники Изобретение касается способов получения хиральных замещенных пиразолилпирроло[2,3-d]пиримидинов и родственных синтетических промежуточных соединений. Хиральные замещенные пиразолилпирроло[2,3-d]пиримидины полезны как ингибиторы янус киназ семейства протеинтирозин-киназ(JAK) для лечения воспалительных заболеваний, миелопролиферативных нарушений и других заболеваний. Предшествующий уровень техники Протеинкиназы (ПК) представляют собой группу ферментов, которые регулируют разнообразные важные биологические процессы, включая среди прочего рост клеток, выживание и дифференцировку,формирование органов и морфогенез, неоваскуляризацию, восстановление тканей и регенерацию. Протеинкиназы проявляют свои физиологические функции, катализируя фосфорилирование протеинов (или субстратов) и модулируя тем самым клеточные активности субстратов в различных биологических контекстах. Помимо функций в нормальных тканях/органах, многие протеинкиназы также играют более специализированные роли во множестве болезней человека, включая рак. Подмножество протеинкиназ(на которые также ссылаются как на онкогенные протеинкиназы), при нарушении, может вызвать образование опухолей и их рост, и дополнительно способствовать сохранению опухоли и ее развитию(Blume-Jensen P. et al., Nature 2001, 411(6835): 355-365). Поэтому онкогенные протеинкиназы представляют одну из наибольших и наиболее привлекательных групп белковых мишеней для вмешательства в рак и разработки лекарственных средств. Протеинкиназы могут быть классифицированы как протеинкиназы рецепторного типа и нерецепторного типа. Рецепторные тирозин-киназы (РТК) имеют внеклеточную часть, трансмембранный домен и внутриклеточную часть, тогда как нерецепторные тирозин-киназы являются целиком внутриклеточными. Янус киназ семейство протеинтирозин-киназ (JAK) принадлежит к нерецепторному типу тирозинкиназ и включает члены семейства: JAK1 (известная также как Янус киназа-1), JAK2 (известная также как Янус киназа-2), JAK3 (известная также как Янус киназа, лейкоцит; JAKL; L-JAK и Янус киназа-3) иTYK2 (известная также как протеинтирозин-киназа 2). Путь, включающий JAK и STAT (Переносчики Сигнала и Активаторы Транскрипции), задействован в передаче сигналов широкой области цитокинов. Цитокины представляют собой низкомолекулярные полипептиды или гликопротеины, которые стимулируют биологические реакции в фактически всех типах клеток. В общем, цитокиновые рецепторы не обладают внутренней тирозин-киназной активностью, и поэтому требуются рецептор-ассоциированные киназы для распространения фосфорилирующего каскада. JAK выполняют эту функцию. Цитокины связываются с их рецепторами, обусловливая димеризацию рецепторов, и это дает возможность JAK фосфорилировать друг друга, также как и специфические тирозиновые мотивы внутри цитокиновых рецепторов. STAT, которые узнают эти фосфотирозиновые мотивы, привлекаются к данному рецептору, и затем сами активируются JAK-зависимым тирозинфосфорилирующим событием. После активации, STAT диссоциируют от данных рецепторов, димеризуются и перемещаются к данному ядру, связываясь со специфическими ДНК сайтами, и изменяют транскрипцию (Scott, M. J., С. J. Godshall, et al. (2002). "Jaks, STATs, Cytokines, and Sepsis." Clin Diagn Lab Immunol 9(6): 1153-9).JAK семейство играет роль в цитокинзависимой регуляции пролиферации и функции клеток, включенных в иммунную реакцию. JAK/STAT путь, и, в частности, все четыре члена семейства JAK как предполагается играют роль в патогенезе астматической реакции, хроническом обструктивном пульмонарном заболевании, бронхите и других родственных воспалительных заболеваниях нижних дыхательных путей. Кроме того, множественные цитокины, которые передают сигнал через JAK киназы, связаны с воспалительными заболеваниями или состояниями верхних дыхательных путей, такими как те, что поражают нос и синусы (например, ринит, синусит), независимо от того, являются ли они классическими аллергическими реакциями или нет. JAK/STAT путь также, как подразумевается, играет роль в воспалительных заболеваниях/состояниях глаза, включая, но не ограничиваясь этим, ирит, увеит, склерит, конъюнктивит, также как и хронические аллергические реакции. Таким образом, ингибирование JAK киназ может играть полезную роль в терапевтическом лечении этих болезней. Блокирование сигнальной трансдукции на уровне JAK киназ перспективно в плане разработки методов лечения рака у человека. Ингибирование JAK киназ, как также предусматривается, имеет терапевтические преимущества для пациентов, страдающих от иммунных нарушений кожи, таких как псориаз и сенсибилизация кожи. Соответственно, проводится широкий поиск ингибиторов янус киназ или родственных киназ, и в ряде публикаций сообщается об эффективных классах соединений. Например, о некоторых JAK ингибиторах, включая (R)-3-(4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил)-3 циклопентилпропаннитрил, сообщается в публикации патента США 2007/0135461, которая включена здесь путем отсылки. Ввиду растущего спроса на соединения для лечения расстройств, связанных с ингибированием киназ, таких как янус киназы, требуются новые и более эффективные пути для получения ингибиторов,таких как хиральные замещенные пиразолилпирроло [2,3-d]пиримидины, и родственных им промежу-1 020643 точных соединений. Описанные здесь способы и соединения помогают удовлетворить эти и другие потребности. Сущность изобретения Изобретение представляет, inter alia, способы получения композиции, содержащей соединение формулы I которые включают реакцию соединения формулы II с газообразным водородом в присутствии катализатора гидрирования; гдеуказывает на хиральный углерод;P1 является защитной группой. Настоящее изобретение также представляет способы получения композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы I включающие реакцию соединения формулы II с газообразным водородом в присутствии рутениевого или родиевого катализатора, имеющего L1 где L1 является хиральным фосфиновым лигандом; гдеуказывает на хиральный углерод;P1 является защитной группой. Настоящее изобретение также представляет способы превращения соединения формулы I в соединение формулы Ic, включающие реакцию соединения формулы I:-2 020643 с металлическим гидроксидом с образованием соединения формулы Ic гдеуказывает на хиральный углерод;P1 является защитной группой. Настоящее изобретение также представляет способ превращения соединения формулы Ic в соединение формулы Ib, включающий реакцию соединения формулы Ic с аммиаком или гидроксидом аммония в присутствии связывающего реагента с образованием соединения формулы Ib: гдеуказывает на хиральный углерод;P1 является защитной группой. Настоящее изобретение также представляет способы превращения соединения формулы Ib в соединение формулы Ia, включающие реакцию соединения формулы Ib в условиях дегидратации с образованием соединения формулы Ia гдеуказывает на хиральный углерод;P1 является защитной группой. Настоящее изобретение также представляет способы получения композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Id которые включают реакцию соединения формулы IV в присутствии хирального амина и органической кислоты; гдеуказывает на хиральный углерод;P1 является защитной группой. Настоящее изобретение также представляет способы получения композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы VI которые включают реакцию соединения формулы V в присутствии хирального амина и органической кислоты; гдеуказывает на хиральный углерод;X1 является галогеном. Настоящее изобретение также представляет способ превращения соединения формулы VI в соединение формулы III, включающий обработку соединения формулы VI аммиаком или гидроксидом аммония и йодом с образованием соединения формулы VIII гдеуказывает на хиральный углерод;X1 является галогеном. Настоящее изобретение также представляет способ превращения соединения формулы VIII в соединение формулы IX, включающий реакцию соединения формулы VIII с образованием соединения формулы IX гдеуказывает на хиральный углерод;Rc и Rd каждый выбирают независимо из Н и C1-6 алкила; илиRc и Rd совместно с кислородными атомами, к которым они присоединены, и атомом бора, к которому присоединены данные атомы кислорода, образуют 5- или 6-членное гетероциклическое кольцо,которое необязательно замещено 1, 2, 3 или 4 C1-4 алкильными группами. Настоящее изобретение также представляет способы превращения соединения формулы IX в соединение формулы Ia, включающие реакцию соединения формулы IX в присутствии палладиевого катализатора и основания, с образованием соединения формулы Ia гдеуказывает на хиральный углерод;Rc и Rd каждый выбирают независимо из Н и С 1-6 алкила; илиRc и Rd совместно с кислородными атомами, к которым они присоединены, и атомом бора, к кото-5 020643 рому присоединены данные кислородные атомы, образуют 5- или 6-членное гетероциклическое кольцо,которое необязательно замещено 1, 2, 3 или 4 C1-4 алкильными группами. В некоторых вариантах настоящее изобретение представляет композиции, содержащие энантиомерный избыток (R)- или (S)-энантиомера соединения формулы IX гдеуказывает на хиральный углерод;Rc и Rd каждый представляет собой независимо C1-6 алкил; илиRc и Rd совместно с кислородными атомами, к которым они присоединены, и атомом бора, к которому присоединены данные атомы кислорода, образуют 5- или 6-членное гетероциклическое кольцо,которое необязательно замещено 1, 2, 3 или 4 C1-4 алкильными группами. Настоящее изобретение также представляет способы получения композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы IX которые включают пропускание композиции, содержащей рацемат соединения формулы IX, через хиральную хроматографическую ячейку, с использованием подвижной фазы, и сбор композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы IX; гдеуказывает на хиральный углерод;Rc и Rd каждый представляет собой независимо C1-6 алкил; илиRc и Rd совместно с кислородными атомами, к которым они присоединены, и атомом бора, к которому присоединены данные атомы кислорода, образуют 5- или 6-членное гетероциклическое кольцо,которое необязательно замещено 1, 2, 3 или 4 С 1-4 алкильными группами. Настоящее изобретение представляет способы получения композиции, содержащей рацемат соединения формулы Ia включающие: а) обработку композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Ia, соединением формулы D-1 в присутствии первого основания в условиях, достаточных для образования соединения формулы(b) реакцию соединения формулы IV с соединением формулы D-1 в присутствии второго основания; гдеотвечает хиральному углероду;P1 является защитной группой иR1 выбирают из С 3-7 циклоалкила, C1-6 алкила и C1-6 фторалкила. Настоящее изобретение также представляет способы получения композиции, содержащей рацемат соединения формулы Ia включающие обработку композиции, содержащей энантиомерный избыток (R)- или (S)энантиомера соединения формулы Ia, соединением формулы D-1: в присутствии основания в условиях, достаточных для образования рацемата соединения формулыP1 является защитной группой иR1 выбирают из C3-7 циклоалкила, C1-6 алкила и C1-6 фторалкила. Настоящее изобретение также представляет способы получения композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Ia которые включают пропускание композиции, содержащей рацемат соединения формулы Ia, через хиральную хроматографическую ячейку с использованием подвижной фазы, и сбор композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Ia; гдеотвечает хиральному углероду;P1 является защитной группой. Настоящее изобретение представляет способы получения композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Ia:(a) реакцию композиции, содержащей рацемат соединения формулы Ia, с хиральной кислотой в присутствии растворителя с образованием соли соединения формулы Ia;(b) разделение композиции, содержащей энантиомерный избыток хиральной соли (R)- или (S)энантиомера соединения формулы Ia; и(c) обработку данной хиральной соли основанием с образованием композиции, содержащей энантиомерный избыток (R)- или (S)-энантиомера соединения формулы Ia; где отвечает хиральному углероду;P1 является защитной группой. Настоящее изобретение также представляет способы превращения соединения формулы Ia в соединение формулы III, включающие реакцию соединения формулы Ia: в условиях депротектирования (снятия защиты) с образованием соединения формулы III:P1 является защитной группой. Настоящее изобретение также представляет способ получения соединения формулы XII включающий реакцию соединения формулы X в присутствии палладиевого катализатора, основания и растворителя, с получением соединения формулы XII,гдеотвечает хиральному углероду;Rc и Rd каждый представляет собой независимо Н или C1-6 алкил; илиRc и Rd совместно с кислородными атомами, к которым они присоединены, и атомом бора, к которому присоединены данные атомы кислорода, образуют 5- или 6-членное гетероциклическое кольцо,которое является необязательно замещенным 1, 2, 3 или 4 C1-4 алкильными группами; иP1 и Р 2 каждый представляет собой независимо защитную группу. Настоящее изобретение также представляет способы получения соединения формулы XVI(а) реакцию соединения формулы XVIII с приблизительно 1 или несколькими эквивалентами C1-6 алкильного реактива Гриньяра или C1-6 ал-8 020643 кильного литиевого реактива с последующей обработкой приблизительно 1 или несколькими эквивалентами соединения формулы XVII и (b) необязательно повторную защиту продукта стадии (а) с получением соединения формулыm является целым числом, которое выбирают из 1 и 2. Настоящее изобретение также представляет способ получения соединения формулы XIa который включает обработку соединения формулы F-1 кислотой в условиях, достаточных для получения соединения формулы XIa. Настоящее изобретение также представляет композиции, содержащие энантиомерный избыток (R)или (S)-энантиомера соединения формулы IR2 выбирают из -C(=O)-NH2, -C(=O)O-R3, -C(=O)OH и -С(=O)Н; R3 выбирают из C1-4 алкила или C1-4 фторалкила; и P1 является защитной группой. Настоящее изобретение также представляет соединения формулы IIP1 является защитной группой. Подробности одного или нескольких вариантов данного изобретения изложены в сопроводительных рисунках и приведенном ниже описании. Другие особенности, предметы и преимущества данного изобретения станут очевидными из описания и рисунков, а также из формулы изобретения. Подробное описание изобретения В различных местах данной спецификации заместители соединений данного изобретения представлены в виде групп или в виде некоторого диапазона. В частности, предполагается, что данное изобретение включает каждую индивидуальную субкомбинацию членов таких групп и диапазонов. Например,термин "C1-6 алкил", как предполагается, представляет, индивидуально, метил, этил, С 3 алкил, С 4 алкил,С 5 алкил и С 6 алкил. Кроме того, предполагается, что некоторые особенности данного изобретения, которые, для ясности, описаны в контексте отдельных вариантов, могут также быть представлены в виде комбинации в одном варианте. И обратно, различные особенности данного изобретения, которые, для краткости, опи-9 020643 саны в контексте одного варианта, могут быть также представлены по отдельности или в виде любой подходящей субкомбинации. Термин "n-членный", где n является целым числом, описывает, обычно, число кольцеобразующих атомов в составляющей, где число кольцеобразующих атомов равно n. Например, пиперидинил служит примером 6-членного гетероциклоалкильного кольца и 1,2,3,4-тетрагидронафталин является примером 10-членной циклоалкильной группы. Для соединений данного изобретения, в которых переменная появляется более одного раза, каждая переменная может представлять другую составляющую, которую выбирают, независимо, из группы, определяющей данную переменную. Например, там, где описана структура, которая имеет две группы R,присутствующие одновременно на том же самом соединении, эти две группы R могут представлять разные составляющие, которые выбирают, независимо, из группы, определенной для R. В другом примере,когда составной, необязательно, заместитель имеет обозначение: то предполагается, что заместитель R может встречаться р раз на кольце, и R в каждом случае может представлять другую составляющую. Понятно, что каждая группа R может заменять любой атом водорода, присоединенный к кольцевому атому, включая один или оба из (СН 2)n водородных атомов. Кроме того, в вышеприведенном примере, если переменная Q включает, по определению, водороды, такие как когда Q является СН 2, NH и т.д., любой плавающий заместитель, такой как R в вышеприведенном примере, может заменять водород данной переменной Q, так же как и водород в любой другой непеременной компоненте данного кольца. Для соединений данного изобретения, в которых переменная появляется более одного раза, каждая переменная может представлять другую составляющую, которую выбирают независимо из группы, определяющей данную переменную. Например, там, где описана структура, имеющая две группы R, которые одновременно присутствуют на том же самом соединении, данные две группы R могут представлять различные составляющие, которые выбирают независимо из группы, определенной для R. Как здесь используется, фраза "замещенный, необязательно" означает незамещенный или замещенный. Как здесь используется, термин "замещенный" означает, что атом водорода удален и заменен заместителем. Как здесь используется, фраза "замещенный оксо" означает, что два водородных атома удалены от атома углерода и заменены кислородом, связанным двойной связью с данным атомом углерода. Понятно, что замещение на данном атоме ограничивается валентностью. Как здесь используется, термин "алкил", примененный отдельно или в комбинации с другими терминами, касается насыщенной углеводородной группы, которая может быть с прямой или разветвленной цепью. В некоторых вариантах данная алкильная группа содержит 1-12, 1-8 или 1-6 углеродных атомов. Примеры алкильных составляющих включают, но не ограничиваясь этим, химические группы, такие как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил; высшие гомологи, такие как 2-метил-1-бутил, н-пентил, 3-пентил, н-гексил, 1,2,2-триметилпропил, н-гептил, н-октил и тому подобное. В некоторых вариантах данная алкильная составляющая представляет собой метил, этил, нпропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил или 2,4,4 триметилпентил. В некоторых вариантах данная алкильная составляющая представляет собой метил. Как здесь используется, термин "алкилкарбоксамид" или "алкиламинокарбонил" касается группы формулы -С(О)-NH(алкил). В некоторых вариантах каждая алкильная группа имеет от 1 до 6 углеродных атомов. Как здесь используется, "алкенил", примененный отдельно или в комбинации с другими терминами, касается алкильной группы, имеющей одну или несколько двойных связей углерод-углерод. В некоторых вариантах, алкенильная составляющая содержит 2-10 или 2-6 углеродных атомов. Пример алкенильных групп включает, но не ограничиваясь этим, этенил, н-пропенил, изопропенил, н-бутенил, вторбутенил и тому подобное. Как здесь используется, "алкинил", примененный отдельно или в комбинации с другими терминами, касается алкильной группы, имеющей одну или несколько тройных связей углерод-углерод. Примеры алкинильных групп включают, но не ограничиваясь этим, этинил, пропин-1-ил, пропин-2-ил и тому подобное. В некоторых вариантах алкинильная составляющая содержит 2-10 или 2-6 углеродных атомов. Как здесь используется, термин "алкокси", примененный отдельно или в комбинации с другими терминами, касается группы формулы -О-алкил. Пример алкоксигрупп включает метокси, этокси, пропокси (например, н-пропокси и изопропокси), трет-бутокси и тому подобное. В некоторых вариантах каждая алкильная группа имеет от 1 до 6 углеродных атомов. Как здесь используется, термин "алкоксикарбонил" касается группы формулы -С(О)О-алкил. В некоторых вариантах каждая алкильная группа имеет от 1 до 6 углеродных атомов. Как здесь используется, термин "три-Cn-m алкилсилил" касается группы формулы -Si(алкил)3, где каждая алкильная группа имеет от n до m углеродных атомов. В некоторых вариантах каждая алкильная группа имеет от 1 до 6 углеродных атомов.- 10020643 Как здесь используется, термин "три-Cn-m алкилсилилокси" касается группы формулы -OSi(алкил)3,где каждая алкильная группа имеет от n до m углеродных атомов. В некоторых вариантах каждая алкильная группа имеет от 1 до 6 углеродных атомов. Как здесь используется, термин "арил", примененный отдельно или в комбинации с другими терминами, касается моноциклической или полициклической (например, имеющей 2, 3 или 4 слитых кольца) ароматической углеводородной составляющей, такой как, но не ограничиваясь этим, фенил, 1 нафтил, 2-нафтил, антраценил, фенантренил и тому подобное. В некоторых вариантах данная арильная составляющая может быть дополнительно слита с циклоалкильным кольцом. В некоторых вариантах,арильные группы имеют от 6 до 20 углеродных атомов, от приблизительно 6 до 10 углеродных атомов или от приблизительно 6 до 8 углеродных атомов. Как здесь используется, термин "ариламино" касается группы формулы -NH(арил). Как здесь используется, термин "карбокси" касается группы формулы -С(О)ОН. Как здесь используется, термин "циклоалкил", примененный отдельно или в комбинации с другими терминами, касается неароматической циклической углеводородной составляющей, которая может содержать, необязательно, одну или несколько алкениленовых или алкиниленовых групп как часть данной кольцевой структуры. Циклоалкильные группы могут включать моно-или полициклическую (например,имеющую 2, 3 или 4 слитых или ковалентно связанных колец) кольцевую системы. Один или несколько кольцеобразующих углеродных атомов циклоалкильной группы могут быть окислены с образованием карбонильных связей. Примеры циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентинил, циклогексенил, циклогексадиенил, циклогептатриенил,норборнил, норпинил, норкарнил, адамантил и тому подобное. В некоторых вариантах циклоалкильная группа является циклопентилом. Как здесь используется, термин "галогеналкил", примененный отдельно или в комбинации с другими терминами, касается алкильной группы, имеющей от одного атома галогена до 2n+1 галогеновых атомов, которые могут быть одинаковыми или различными, где "n" равно числу углеродных атомов в данной алкильной группе. Как здесь используется, термин "фторированный алкил", примененный отдельно или в комбинации с другими терминами, касается алкильной группы, имеющей от одного атома фтора до 2n+1 атомов фтора, которые могут быть одинаковыми или различными, где "n" равно числу углеродных атомов в данной алкильной группе. В некоторых вариантах данной фторированной алкильной группой является трифторметил. Как здесь используется, термины "гало" и "галоген", примененные отдельно или в комбинации с другими терминами, касаются фтора, хлора, брома и йода. Как здесь используется, термин "гетероарил", "гетероарильное кольцо" или "гетероарильная группа", примененный отдельно или в комбинации с другими терминами, касается моноциклической или полициклической (например, имеющей 2, 3 или 4 слитых кольца) ароматической углеводородной составляющей, которая имеет один или несколько гетероатомных кольцевых членов, выбранных из азота, серы и кислорода. В некоторых вариантах данное гетероарильное кольцо или группа имеет 1, 2, 3 или 4 гетероатома, выбранных из N, О или S. В некоторых вариантах данное гетероарильное кольцо или группа имеет 1 или 2 кольца. Когда данная гетероарильная группа содержит более одного гетероатомного кольцевого члена, данные гетероатомы могут быть одинаковыми или различными. В некоторых вариантах данная гетероарильная составляющая может быть дополнительно слита с циклоалкильным или гетероциклоалкильным кольцом. Примеры гетероарильных групп включают, без ограничений, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, фурил, хинолил, изохинолил, тиенил, имидазолил, тиазолил, индолил, пиррил, оксазолил, бензофурил, бензотиенил, бензтиазолил, изоксазолил, пиразолил, триазолил, тетразолил, индазолил, 1,2,4-тиадиазолил, изотиазолил, бензотиенил, пуринил, карбазолил, бензимидазолил, индолинил и тому подобное. В некоторых вариантах данная гетероарильная группа имеет от 1 до приблизительно 20 углеродных атомов, и в дополнительных вариантах от приблизительно 3 до приблизительно 20 углеродных атомов. В некоторых вариантах гетероарильная группа содержит от приблизительно 3 до приблизительно 14, от приблизительно 4 до приблизительно 14, от приблизительно 3 до приблизительно 7 или от 5 до 6 кольцеобразующих атомов. В некоторых вариантах данная гетероарильная группа имеет от приблизительно 1 до приблизительно 4, от приблизительно 1 до приблизительно 3 или от приблизительно 1 до приблизительно 2 гетероатомов. На связывающую гетероарильную группу здесь ссылаются как на "гетероарилен." Как здесь используется, термин "гетероариламино" касается группы формулы -NH(гетероарил). Как здесь используется, термин "гетероциклоалкил" касается неароматических гетероциклов,включая циклизированный алкил, алкенил и алкинильную группы, где один или несколько кольцеобразующих углеродных атомов заменен гетероатомом, таким как атом О, N или S. Гетероциклоалкильные группы включают моноциклическую и полициклическую (например, имеющую 2, 3 или 4 слитых кольца) системы, также как и спироциклы. Примеры "гетероциклоалкильных" групп включают морфолино,тиоморфолино, пиперазинил, тетрагидрофуранил, тетрагидротиенил, 2,3-дигидробензофурил, 1,3 бензодиоксол, бензо-1,4-диоксан, пиперидинил, пирролидинил, изоксазолидинил, изотиазолидинил, пи- 11020643 разолидинил, оксазолидинил, тиазолидинил, имидазолидинил и тому подобное. Кольцеобразующие углеродные атомы и гетероатомы гетероциклоалкильной группы могут быть замещены, необязательно,оксо или сульфидо. В определение гетероциклоалкила также включены составляющие, которые имеют одно или несколько ароматических колец, слитых (т.е. имеющих общую связь) с неароматическим гетероциклическим кольцом, например, фталимидилом, нафталимидилом и бензо производными гетероциклов. Данная гетероциклоалкильная группа может быть присоединена через кольцеобразующий углеродный атом или кольцеобразующий гетероатом. Гетероциклоалкильная группа, содержащая слитое ароматическое кольцо, может быть присоединена через любой кольцеобразующий атом, включая кольцеобразующий атом данного слитого ароматического кольца. В некоторых вариантах данная гетероциклоалкильная группа имеет от приблизительно 1 до приблизительно 20 углеродных атомов, и в дополнительных вариантах - от приблизительно 3 до приблизительно 20 углеродных атомов. В некоторых вариантах гетероциклоалкильная группа содержит от приблизительно 3 до приблизительно 14, от приблизительно 4 до приблизительно 14, от приблизительно 3 до приблизительно 7 или от 5 до 6 кольцеобразующих атомов. В некоторых вариантах данная гетероциклоалкильная группа имеет от приблизительно 1 до приблизительно 4, от приблизительно 1 до приблизительно 3 или от приблизительно 1 до приблизительно 2 гетероатомов. В некоторых вариантах данная гетероциклоалкильная группа содержит от 0 до 3 двойных или тройных связей. В некоторых вариантах данная гетероциклоалкильная группа содержит от 0 до 2 двойных или тройных связей. На связывающую гетероциклоалкильную группу здесь ссылаются как на"гетероциклоалкилен". Как здесь используется, термин "оксо" касается группы формулы =O. Как здесь используется, термин "трифлатная группа" касается трифторметилсульфонилокси группы. Как здесь используется, термин "тозилатная группа" касается n-толилсульфонилокси группы. Описанные здесь процессы могут подвергаться мониторингу в соответствии с любым подходящим методом, известным в данной области. Например, образование продукта может контролироваться спектроскопическими методами, такими как спектроскопия ядерного магнитного резонанса (например, 1 Н или 13 С), инфракрасная спектроскопия, или спектрофотометрическими методами (например, УФвидимой); или хроматографическими методами, такими как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография (ТСХ), или с использованием других подобных способов. Как здесь используется, термин "реакция" применяется, как это известно в данной области, и обычно касается сведения вместе химических реагентов таким образом, чтобы обеспечить их взаимодействие на молекулярном уровне с осуществлением химического или физического превращения. В некоторых вариантах данная реакция включает два реагента, где один или несколько эквивалентов второго реагента используются с учетом первого реагента. Реакционные стадии описанных здесь процессов могут проводиться в течение такого времени и при таких условиях, которые подходят для получения идентифицированного продукта. Как здесь используется, термин "хиральная хроматография", или "хиральная хроматографическая колонка", или "хиральная колонка" касается хроматографического устройства или метода для разделения смесей энантиомеров или диастереомеров, которые растворены в подвижной фазе. Когда в сочетании с любым из вышеупомянутых терминов используется термин "препаративный", это означает, что данное устройство или метод имеют достаточный масштаб для выделения соответствующих количеств требуемого энантиомера или диастереомера. Иллюстративные методы разделения, подходящие для хиральной хроматографии, включают высокоэффективную жидкостную хроматографию (ВЭЖХ), сверхкритическую жидкостную хроматографию (СЖХ), обе в режиме пакетной обработки и непрерывной обработки,например, ХПС (хроматография с псевдодвижущимся слоем), и родственные методы. В способе настоящего изобретения могут использоваться любые хроматографические методы для разделения рацемических соединений с получением оптически чистого требуемого энантиомера. Такие методы включают, но не ограничиваясь этим, традиционную одноколоночную пакетную хроматографию, непрерывную хроматографию, или стационарный, последовательный инъекционный способ (как описано, например, в патенте США 5630943 и РСТ публикацииWO 98/51391). Непрерывные хроматографические методы включают, но не ограничиваясь этим, мультиколоночные непрерывные хроматографические методы,включая такие противоточные хроматографические процессы, как ХПС (как описано, например, в патентах США 2985589, 4402832 и 4498991), или нестационарные непрерывные хроматографические методы, известные как "Varicol" метод (как описано, например, в патентах США 6136198, 6375839,6413419 и 6712973). При разделении энантиомеров эти методы включают использование хиральной стационарной фазы. Ахиральная стационарная фаза может быть использована для разделения диастереомеров. Термин "стационарная фаза" касается подходящего инертного материала-носителя, на который нанесен или иммобилизован взаимодействующий агент. Как здесь используется, термин "хиральная стационарная фаза" относится к стационарным фазам, в которых данным взаимодействующим агентом является энантиомерно обогащенный расщепляющий- 12020643 агент, например, иммобилизованный путем покрытия, путем химического связывания или путем инсолюбилизации посредством сшивания на инертном материале-носителе. Подходящий инертный материалноситель является, преимущественно, макропористым, например, структурированный полистирол, полиакриламид, полиакрилат, окись алюминия, кизельгур (диатомовый), кварц, каолин, оксид магния или диоксид титана. В некоторых вариантах данный инертный материал-носитель содержит силикагель. Средний диаметр частиц набивочного материала варьирует в зависимости от объемной скорости потока растворителя, текущего в данной хроматографической системе. В некоторых вариантах он составляет от 1 до 300 мкм, от 2 до 100 мкм, от 5 до 75 мкм или от 10 до 30 мкм. Соответствующий выбор среднего диаметра частиц набивочного материала поможет отрегулировать падение давления в данном хроматографическом процессе и эффективность набивочного материала. Примерами стационарных фаз, содержащих энантиомерно обогащенный расщепляющий материал, являются, например, фазы, основанные либо на синтетических либо на природных хиральных полимерах, макроциклические фазы, лигандобменные фазы и фазы типа пиркловских. Такие хиральные стационарные фазы известны и имеются в продаже. В некоторых вариантах данная хиральная стационарная фаза дериватизирована с, по меньшей мере, одним производным сахара, и, в частности, является дериватизированным полисахаридом, который выбирают из амилозного, целлюлозного, хитозанового, ксиланового, курдланового, декстранового и инуланового класса полисахаридов. В некоторых вариантах данная хиральная стационарная фаза является членом амилозного или целлюлозного класса полисахаридов. В частности, подходят эфиры и карбаматы этих материалов. В дополнительных вариантах хиральную стационарную фазу выбирают из целлюлоза фенилкарбаматных производных, таких как целлюлоза трис(3,5-диметилфенил)карбамат (имеется на фирме Daicel Chemical Industries, Ltd. (Daicel), в виде "Chiralcel OD" или "Chiralpak IB", где данное карбаматное производное связано с целлюлозным остовом); целлюлоза трибензоатные производные,такие как целлюлоза три 4-метилбензоат (имеется на фирме Daicel в виде "Chiralcel OJ"); целлюлоза трициннамат (имеется на фирме Daicel в виде "Chiralcel OK"); амилаза фенил- и бензилкарбаматных производных, таких как амилоза трис[(S)метилбензилкарбамат] (имеется на фирме Daicel в виде "Chiralpak AS"); амилоза трис(3,5-диметилфенил)карбамат (имеется на фирме Daicel в виде "ChiralpakAD" или "Chiralpak IA", где данное карбаматное производное связано с амилозным остовом); амилоза 3,4-замещенный фенилкарбамат или амилоза 4-замещенный фенилкарбамат; и амилоза трициннамат. В некоторых вариантах данная хиральная фаза является членом семейства фаз Пиркла (Pirkle); предпочтение отдается (S,S) Whelk-Ol и (R,R) Whelk-Ol (имеются на фирме Regis technologies Inc.). Как здесь используется, термин "подвижная фаза" относится к растворителю или смеси растворителей, в которой растворена смесь энантиомеров, которые предстоит разделить. Подходящими растворителями для использования в препаративных хроматографических процессах согласно данного изобретения являются растворители, которые, как известно, применяются в аналитической хроматографии. В жидкостной хроматографии обычно используются неполярные, полярные протонные или апротонные растворители, или их смеси. В сверхкритической хроматографии предпочитают использовать смеси диоксида углерода и полярных протонных растворителей. Подходящими неполярными растворителями служат,например, углеводороды, такие как, например, н-пентан, н-гексан, гексаны, н-гептан, гептаны, циклогексан и метилциклогексан. Подходящими протонными или апротонными растворителями являются, например, спирты, в частности, метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол, 2-бутанол, изобутанол, трет-бутанол, простые эфиры, например, метил-трет-бутиловый эфир, сложные эфиры, например,этилацетат, галогенированные углеводороды и ацетонитрил. Добавление воды, кислоты (например, муравьиной кислоты, уксусной кислоты, трифторуксусной кислоты) или основания (например, органических оснований, например, триэтиламин) в количестве, например, меньшем 1% (объем/объем), в растворитель может оказывать положительные эффекты. В жидкостной хроматографии могут использоваться C1-C3 спирты или смеси этих спиртов с углеводородами, например, н-гексаном или н-гептаном. В сверхкритической хроматографии могут использоваться смеси диоксида углерода и полярных протонных растворителей, например, метанола. Оптимальный растворитель (комбинация) может быть отобран с использованием известных в данной отрасли методов. При использовании другой стационарной фазы может быть найден иной оптимальный растворитель (комбинация). Соединения настоящего изобретения также включают фармацевтически приемлемые соли раскрытых здесь соединений. Как здесь используется, термин "фармацевтически приемлемая соль" касается соли, полученной путем добавления фармацевтически приемлемой кислоты или основания к раскрытому здесь соединению. Как здесь используется, фраза "фармацевтически приемлемый" касается вещества,которое приемлемо для использования в фармацевтических приложениях с токсикологической точки зрения и не взаимодействует неблагоприятно с данным активным ингредиентом. Фармацевтически приемлемые соли, включая моно- и би-соли, включают, но не ограничиваясь этим, полученные из органических и неорганических кислот, таких как, но не ограничиваясь этим, уксусная, молочная, лимонная, коричная, виннокаменная, янтарная, фумаровая, малеиновая, малоновая, миндальная, яблочная, щавелевая,пропионовая, хлористо-водородная, бромисто-водородная, фосфорная, азотная, серная, гликолевая, пи- 13020643 ровиноградная, метансульфоновая, этансульфоновая, толуолсульфоновая, салициловая, бензойная, и в такой же мере известные приемлемые кислоты. Перечень подходящих солей можно найти в работах Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, p. 1418 и Journal ofPharmaceutical Science, 66, 2 (1977), которые включены здесь во всей полноте путем отсылки. Получение соединений может включать защиту и снятие защиты (депротектирование) с различных химических групп. Необходимость в защите и депротектировании, и выбор подходящих защитных групп могут быть легко определены специалистом в данной области. С химией защитных групп можно ознакомиться, например, в работе Greene, et al., Protective Groups in Organic Synthesis, 4d. Ed., WileySons,2007, которая включена здесь во всей полноте путем отсылки. Корректировки к защитным группам и методам образования и расщепления, описанным здесь, могут быть сделаны как необходимые в свете различных заместителей. Реакции описанных здесь процессов могут быть осуществлены в подходящих растворителях, которые могут быть легко выбраны специалистом в области органического синтеза. Подходящие растворители могут быть в значительной мере нереакционными в отношении исходных материалов (реактивов),промежуточных соединений или продуктов при температурах, при которых проводятся данные реакции,например, температурах, которые могут варьировать от температуры замерзания данного растворителя до температуры его кипения. Данная реакция может быть проведена в одном растворителе или смеси нескольких растворителей. В зависимости от конкретной реакционной стадии, могут быть выбраны подходящие растворители для конкретной реакционной стадии. В некоторых вариантах, реакции могут проводиться при отсутствии растворителя, таких как когда, по меньшей мере, один из реагентов является жидкостью или газом. Подходящие растворители могут включать галогенированные растворители, такие как четыреххлористый углерод, бромдихлорметан, дибромхлорметан, бромоформ, хлороформ, бромхлорметан, дибромметан, бутил хлорид, дихлорметан, тетрахлорэтилен, трихлорэтилен, 1,1,1-трихлорэтан, 1,1,2 трихлорэтан, 1,1-дихлорэтан, 2-хлорпропан, -трифтортолуол, 1,2-дихлорэтан, 1,2-дибромэтан, гексафторбензол, 1,2,4-трихлорбензол, 1,2-дихлорбензол, хлорбензол, фторбензол, их смеси и тому подобное. Подходящие эфирные растворители включают: диметоксиметан, тетрагидрофуран, 1,3-диоксан, 1,4 диоксан, фуран, диэтиловый эфир, этиленгликоль диметиловый эфир, этиленгликоль диэтиловый эфир,диэтиленгликоль диметиловый эфир, диэтиленгликоль диэтиловый эфир, триэтиленгликоль диметиловый эфир, анизол, трет-бутил метиловый эфир, их смеси и тому подобное. Подходящие протонные растворители могут включать, в качестве примера и без ограничений, воду,метанол, этанол, 2-нитроэтанол, 2-фторэтанол, 2,2,2-трифторэтанол, этиленгликоль, 1-пропанол, 2 пропанол, 2-метоксиэтанол, 1-бутанол, 2-бутанол, i-бутиловый спирт, трет-бутиловый спирт, 2 этоксиэтанол, диэтиленгликоль, 1-, 2- или 3-пентанол, неопентиловый спирт, трет-пентиловый спирт,диэтиленгликоль монометиловый эфир, диэтиленгликоль моноэтиловый эфир, циклогексанол, бензиловый спирт, фенол или глицерин. Подходящие апротонные растворители могут включать, в качестве примера и без ограничений, тетрагидрофуран (ТГФ), N,N-диметилформамид (ДМФА), N,N-диметилацетамид (ДМА), 1,3-диметил 3,4,5,6-тетрагидро-2(1 Н)-пиримидинон(ДМИ),Nметилпирролидинон (NMП), формамид, N-метилацетамид, N-метилформамид, ацетонитрил, диметилсульфоксид, пропионитрил, этилформиат, метилацетат, гексахлорацетон, ацетон, этилметилкетон, этилацетат, сульфолан, N,N-диметилпропионамид, тетраметилмочевина, нитрометан, нитробензол или гексаметилфосфорамид. Подходящие углеводородные растворители включают бензол, циклогексан, пентан, гексан, толуол,циклогептан, метилциклогексан, гептан, этилбензол, м-, о- или п-ксилен, октан, индан, нонан или нафталин. В качестве растворителей могут также использоваться сверхкритический диоксид углерода и ионные жидкости. Реакции описанных здесь процессов могут быть осуществлены при соответствующих температурах, которые могут быть легко определены специалистом в данной области. Температуры реакции будут зависеть от, например, точек плавления и кипения данных реагентов и растворителя, если таковой присутствует; термодинамики данной реакции (например, сильно экзотермические реакции необходимо проводить при сниженных температурах); и кинетики данной реакции (например, высокий активационный энергетический барьер может потребовать повышенных температур). "Повышенная температура" относится к температурам выше комнатной (около 22 С). Реакции описанных здесь процессов могут осуществляться на воздухе или под инертной атмосферой. Типично реакции, содержащие реагенты или продукты, которые являются в значительной степени реакционными в отношении воздуха, могут проводиться с использованием чувствительных к воздуху синтетических методов, которые хорошо известны специалисту в данной области. В некоторых вариантах получение соединений может включать добавление кислот или оснований для влияния, например, на катализ желательной реакции или образование солевых форм, таких как кис- 14020643 лые соли присоединения. Иллюстративными кислотами могут быть неорганические или органические кислоты. Неорганические кислоты включают хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту,фосфорную кислоту и азотную кислоту. Органические кислоты включают муравьиную кислоту, уксусную кислоту, пропионовую кислоту, масляную (бутановую) кислоту, бензойную кислоту, 4 нитробензойную кислоту, метансульфоновую кислоту, п-толуолсульфоновую кислоту, бензолсульфоновую кислоту, виннокаменную кислоту, трифторуксусную кислоту, пропионовую кислоту, масляную кислоту, 2-масляную кислоту, винилуксусную кислоту, пентановую кислоту, гексановую кислоту, гептановую кислоту, октановую кислоту, нонановую кислоту и деценовую кислоту. Иллюстративные основания включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия и карбонат калия. Некоторые иллюстративные сильные основания включают, но не ограничиваясь этим, гидроксид, алкоксиды, металлические амиды, металлические гидриды,металлические диалкиламиды и ариламины, где алкоксиды включают литиевые, натриевые и калиевые соли метила, этила и трет-бутил оксиды; металлические амиды включают амид натрия, амид калия и амид лития; металлические гидриды включают гидрид натрия, гидрид калия и гидрид лития; и металлические диалкиламиды включают натриевые и калиевые соли метила, этила, н-пропила, изопропила, нбутила, трет-бутила, триметилсилила и циклогексил замещенные амиды. Настоящее изобретение также включает солевые формы описанных здесь соединений. Примеры солей (или солевых форм) включают, но не ограничиваясь этим, соли минеральных или органических кислот основных остатков, таких как амины, щелочи, или органические соли кислотных остатков, таких как карбоновые кислоты, и тому подобное. В общем солевые формы могут быть получены путем реакции свободного основания или кислоты со стехиометрическими количествами или с избытком необходимой солеобразующей неорганической или органической кислоты или основания в подходящем растворителе или различных комбинациях растворителей. Перечни подходящих солей можно найти в работе Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, c. 1418, которая включена здесь в своей полноте путем отсылки. После получения соединений в соответствии с описанными здесь способами, могут быть использованы обычные операции выделения и очистки, такие как концентрирование, фильтрация, экстракция,твердофазная экстракция, рекристаллизация, хроматография и тому подобное, для выделения необходимых продуктов. В некоторых вариантах, соединения данного изобретения и их соли в значительной степени выделены. Под фразой "в значительной степени выделены", имеется в виду, что данное соединение, по меньшей мере, частично или в значительной степени отделено от окружающей среды, в которой оно было образовано или обнаружено. Частичное выделение может включать, например, композицию, обогащенную соединением данного изобретения. Значительное выделение может включать композиции, содержащие по меньшей мере около 50%, по меньшей мере около 60%, по меньшей мере около 70%, по меньшей мере около 80%, по меньшей мере около 90%, по меньшей мере около 95%, по меньшей мере около 97% или по меньшей мере около 99% по весу соединения данного изобретения или его соли. Способы выделения соединений и их солей являются рутинными в данной области.Cпособы и промежуточные соединения Настоящее изобретение представляет, inter alia, способы синтеза нитрильных соединений формулыIII и их промежуточных соединений, которые полезны как ингибиторы JAK киназ. В одном аспекте данный способ представляет собой метод гидрирования. В некоторых вариантах данный способ представляет собой метод асимметричного гидрирования, который дает энантиомерный избыток (R)- или (S)энантиомера JAK ингибитора или его промежуточного соединения. В другом аспекте, данный способ представляет собой метод асимметричного присоединения аза-Михаэла (aza-Michael), который дает энантиомерный избыток (R)- или (S)-энантиомера JAK ингибитора или его промежуточного соедиения. В еще одном аспекте настоящее изобретение представляет способ обогащения энантиомерного избытка соединений формулы III с помощью методов хирального разделения или хирального расщепления солей. В некоторых вариантах эти способы включают хиральное разделение (такое как хиральная препаративная хроматография) или хиральное расщепление солей промежуточных соединений, а затем последующую реакцию с образованием соединений формулы III. В некоторых вариантах данное изобретение также представляет способ рацемизации нежелательных энантиомеров промежуточных соединений для получения соединений формулы III, которые затем могут быть расщеплены с получением энантиомерного избытка необходимого энантиомера с помощью описанных ранее методов. В еще одном аспекте настоящее изобретение представляет способы получения промежуточных со- 15020643 единений, полезных для получения соединений формулы III. В другом аспекте настоящее изобретение представляет промежуточные соединения из любых описанных здесь промежуточных соединений. В еще одном аспекте настоящее изобретение представляет энантиомерно обогащенные композиции из любых описанных здесь промежуточных соединений, при условии, что данные промежуточные соединения имеют, по меньшей мере, один хиральный центр. Описанные здесь способы включают методы получения соединений и промежуточных соединений и их композиций, где R1 выбирают из циклопентила, метила и трифторметила. В некоторых вариантах R1 является циклопентилом или циклопропилом. В некоторых вариантах R1 является циклопентилом. В некоторых вариантах R1 является метилом. В некоторых вариантах R1 является трифторметилом. Эти варианты применимы к любым промежуточным соединениям или соединениям, описанным здесь, в любом из соответствующих методов. В некоторых вариантах данный способ может использоваться для получения соединения формулыIII, которое является 3-циклопентил-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]пропаннитрилом или его фармацевтически приемлемой солью. В некоторых вариантах данный способ может быть использован для получения соединения формулы III, которое является (3R)-3-циклопентил-3[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]пропаннитрилом или его фармацевтически приемлемой солью. Понятно, что описанные здесь способы включают методы получения этих соединений, в частности,(3R)-3-циклопентил-3-[4-(7 Н-пирроло[2,3-d]пиримидин-4-ил)-1 Н-пиразол-1-ил]пропаннитрила. Способы получения некоторых промежуточных соединений можно найти в патентной публикации СШАUS 20070135461, опубликованной 14 июня 2007 года (Appl. Ser.11/637545, от 12 декабря 2006 года); и патентной заявке США 12/138082, от 12 июня 2008 года, которые включены здесь во всей полноте путем отсылки.I. Способы каталитического гидрирования (включая методы асимметрического гидрирования). Соединения формулы III могут быть получены путем каталитического гидрирования соединения формулы II с получением соединения формулы I, которое затем может быть превращено в соединение формулы III посредством стадий трансформирования и/или депротектирования функциональной группы. В некоторых вариантах данные способы приводят к образованию соединения формулы I как рацемата,тогда как в более предпочтительных вариантах данные способы дают энантиомерный избыток (S)- или(R)-энантиомера соединения формулы I. Одна стадия данного способа включает гидрирование ,ненасыщенных соединений формулы II, как показано ниже. Соответственно, в одном аспекте настоящее изобретение представляет способ получения композиции, содержащей соединение формулы I который включает реакцию соединения формулы II с газообразным водородом в присутствии катализатора гидрирования; гдеуказывает на хиральный углерод;P1 является защитной группой. В некоторых вариантах R1 выбирают из циклопентила, метила и трифторметила. В некоторых вариантах R1 является циклопентилом или циклопропилом. В некоторых вариантах R1 является циклопентилом. В некоторых вариантах R1 является метилом. В некоторых вариантах R1 является трифторметилом. В некоторых вариантах R2 является -C(=O)O-R3. В некоторых вариантах R2 является -С(=О)ОСН 3. В некоторых вариантах R2 является циано. В некоторых вариантах R3 выбирают из C1-4 алкила. В некоторых вариантах R3 выбирают из метила. Фигурный символ для связи, соединенной с R2, указывает, что данное соединение может быть в (Е)- 16020643 или (Z)-конформации. В некоторых вариантах, когда R2 является циано или -C(=O)-NH2, данное соединение формулы II является (Z)-изомером, и когда R2 является -C(=O)O-R3, данное соединение формулы II является (Е)-изомером. В некоторых вариантах данное соединение формулы II является (Z)-изомером. В некоторых вариантах соединение формулы II является (Е)-изомером. В некоторых вариантах P1 является -СН 2 ОС(=O)С(СН 3)3. В некоторых вариантах P1 выбирают из CH2OCH2CH2Si(CH3)3. Соответствующие P1 защитные группы включают, но не ограничиваясь этим, защитные группы для аминов, описанные в работе Wuts and Greene, Protective Groups in Organic Synthesis,4th ed., John WileySons: New Jersey, c. 696-887 (и, в частности, с. 872-887) (2007), которая включена здесь во всей полноте путем отсылки. В некоторых вариантах защитная группа для данной группы Р 1 представляет собой такую группу, которая является стабильной в условиях для удаления защитной группы Р 2 на других стадиях способа, описанного ниже. В некоторых вариантах P1 является группой, которая резистентна к кислотным условиям при комнатной температуре. В некоторых вариантах P1 является группой, которая не удаляется в среде хлористо-водородной кислоты с нормальностью от приблизительно 1 до приблизительно 5 н. при комнатной температуре, при температуре от приблизительно 10 до приблизительно 40 С, при температуре от приблизительно 15 до приблизительно 40 С или при температуре от приблизительно 15 до приблизительно 30 С. В некоторых вариантах P1 представляет собой бензилоксикарбонил (Cbz), 2,2,2-трихлорэтоксикарбонил (Troc), 2-(триметилсилил)этоксикарбонил (Теос), 2-(4 трифторметилфенилсульфонил)этоксикарбонил(ВОМ), или 2-тетрагидропиранил (ТНР). В некоторых вариантах P1 представляет собой три(С 1-4 алкил)силил (например, три(изопропил)силил). В некоторых вариантах P1 является 1,1-диэтоксиметилом. В некоторых вариантах P1 является 2-(триметилсилил)этоксиметилом (SEM). В некоторых вариантах P1 является N-пивалоилоксиметилом (РОМ). В некоторых вариантах данный способ дает композицию, содержащую рацемат соединения формулы II. Там, где требуется рацемат, может быть использован любой катализатор гидрирования, известный в данной области. В некоторых вариантах катализатором гидрирования является палладий на углероде. В других вариантах данный способ дает композицию, содержащую энантиомерный избыток (R)или (S)-энантиомера соединения формулы I. В общем, когда требуется энантиомерный избыток соединения формулы I, используется катализатор асимметричного гидрирования. В некоторых вариантах катализатором гидрирования является рутениевый или родиевый катализатор, имеющий L1; где L1 является хиральным лигандом. В данной области известно множество подходящих катализаторов. В некоторых вариантах используются хиральные фосфиновые лиганды. Активные катализаторные системы (металлические, лигандные и аддитивные) могут быть сгенерированы in situ в процессе реакции или сгенерированы до данной реакции. В некоторых вариантах катализатор может быть сначала отобран путем проведения экспериментов по каталитическому асимметрическому гидрированию с использованием относительно высокой каталитической загрузки. Когда каталитические системы выбраны, экспериментальные условия, включая загрузку катализатора, давление водорода, реакционный растворитель или систему растворителей, температуру реакции и время реакции, могут быть дополнительно оптимизированы для улучшения химического превращения и энантиоселективности. В некоторых вариантах каталитическая загрузка составляет от приблизительно 0,005 до приблизительно 0,1 мол.%, исходя из соединения формулы II. В некоторых вариантах заранее известно, какой энантиомер соединения формулы I будет получен с помощью конкретного хирального лиганда. В некоторых вариантах хиральный лиганд в катализаторе асимметричного гидрирования может быть отобран для определения того, какой энантиомер соединения формулы I получается в результате данного процесса. Требуемый хиральный лиганд затем может быть отобран, чтобы обеспечить получение необходимого энантиомера соединения формулы I. Например, в некоторых вариантах данный способ дополнительно включает, до реакции, стадии:(i) реакции соединения формулы II с газообразным водородом в присутствии рутениевого или родиевого катализатора, имеющего L2; и анализа полученной композиции для определения того, является ли избыточным (R)- или (S)-энантиомер; где L2 является хиральным лигандом;(ii) реакции соединения формулы II с газообразным водородом в присутствии рутениевого или родиевого катализатора, имеющего L3; и анализа полученной композиции для определения того, является ли избыточным (R)- или (S)-энантиомер; где L3 является тем же самым хиральным лигандом, что и L2,имеющим противоположную стереохимию; и(iii) выбора L2 или L3 для использования как L1, исходя из необходимой стереохимии для энантиомерного избытка данной композиции. В некоторых вариантах катализатор гидрирования выбирают из [Ru(п-цимена) (L1)Cl]Cl, Rh(COD)(L1) (BF4), Rh (COD)2 (L1) (CF3SO3) и Ru(L1) (CF3CO2)2. В некоторых вариантах катализатор гидрирования выбирают из [Ru(L4)(L1)Cl]Cl, Rh(L4)(L1)(BF4), Rh(L4)2(L1)(CF3SO3) и Ru(L1)(CF3CO2)2. В некоторых- 17020643 вариантах L4 является цименом или COD. В некоторых вариантах X' является галогеном. В некоторых вариантах X' является хлором. В некоторых вариантах катализатором гидрирования является смесь[Rh(COD)2]CF3SO3 и хирального фосфинового лиганда. В некоторых вариантах растворителем является 2,2,2-трифторэтанол (TFE). В некоторых вариантах загрузка катализатора гидрирования составляет от приблизительно 0,005 до приблизительно 0,01 мол.%; и отношение соединения формулы II к катализатору гидрирования составляет от приблизительно 20000/1 до приблизительно 10000/1. В некоторых вариантах концентрация реакционной смеси составляет от приблизительно 5 до приблизительно 6 мл TFE/г,давление водорода от приблизительно 7 до приблизительно 60 бар, данная реакция проводится при температуре от приблизительно равной комнатной до приблизительно 75 С. В некоторых вариантах реакция осуществляется до тех пор, пока превращение соединения формулы II в соединение формулы I составляет или превышает приблизительно 99,5%. В некоторых вариантах реакция протекает от приблизительно 10 до приблизительно 25 ч. В некоторых вариантах энантиомерный избыток равняется или превышает приблизительно 94%. В некоторых вариантах: катализатор гидрирования представляет собой смесь [Rh(COD)2]CF3SO3 и хирального фосфинового лиганда, который выбирают из: растворителем является 2,2,2-трифторэтанол (TFE); загрузка катализатора гидрирования составляет от приблизительно 0,005 до приблизительно 0,01 мол.%; отношение соединения формулы II к катализатору гидрирования составляет от приблизительно 20000/1 до приблизительно 10000/1; давление водорода составляет от приблизительно 7 до приблизительно 60 бар; реакция осуществляется при температуре от приблизительно равной комнатной до приблизительно 75 С; реакция проводится до тех пор, пока превращение соединения формулы II в соединение формулы I приблизительно равняется или превышает 99,5%; реакция протекает от приблизительно 10 до приблизительно 25 ч; и энантиомерный избыток равняется или превышает приблизительно 94%. В некоторых вариантах хиральный лиганд представляет собой хиральный фосфиновый лиганд. В некоторых вариантах данный хиральный лиганд выбирают из одного из следующих: В дополнительных вариантах данная композиция включает энантиомерный избыток (S)энантиомера соединения формулы I. В некоторых вариантах L1 выбирают из одного из следующих лигандов: В других вариантах композиция содержит энантиомерный избыток (R)-энантиомера соединения формулы I. В некоторых вариантах L1 выбирают из одного из следующих лигандов: В некоторых вариантах хиральный катализатор выбирают из катализаторов гидрирования, приведенных в работе Sigma Aldrich, "Asymmetric Catalysis: Privileged Ligands and Complexes", ChemFiles, vol. 8,2, c. 1-88, которая включена здесь во всей полноте путем отсылки. В некоторых вариантах энантиомерный избыток равняется или превышает приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%, приблизительно 96%, приблизительно 97%,приблизительно 98%, приблизительно 99%, приблизительно 99,1%, приблизительно 99,2%, приблизительно 99,3%, приблизительно 99,4%, приблизительно 99,5%, приблизительно 99,6%, приблизительно 99,7%, приблизительно 99,8%, приблизительно 99,9% или приблизительно 99,99%. В дополнительных вариантах данный способ дополнительно включает реакцию соединения формулы Ic в условиях снятия защитной группы с образованием соединения формулы III гдеуказывает на хиральный углерод;P1 является защитной группой. В некоторых вариантах данный способ дополнительно включает соединение формулы III с фосфорной кислотой с образованием фосфатной соли соединения формулы III. Обработка соединения формулы Ic для удаления P1 группы может проводиться с помощью методов,известных в данной области, для удаления конкретных защитных групп для аминов, таких как в работе(и, в частности, с. 872-887) (2007), которая включена здесь во всей полноте путем отсылки. Например, в некоторых вариантах группу P1 удаляют путем обработки фторид ионом (например, обработка тетрабутиламмоний фторидом), хлористо-водородной кислотой, пиридиний п-толуолсульфоновой кислотой(PPTS) или кислотой Льюиса (Lewis) (например, литий тетрафторборатом. В некоторых вариантах данная обработка включает обработку литий тетрафторборатом с последующей обработкой гидроксидом аммония (например, когда P1 является 2-(триметилсилил)этоксиметилом). В некоторых вариантах обработка включает обработку основанием (например, P1 является N-пивалоилоксиметилом). В некоторых вариантах данным основанием является гидроксид щелочного металла. В некоторых вариантах данным основанием является гидроксид натрия. В некоторых вариантах данная обработка включает обработку гидроксидом натрия или аммония в растворителе, таком как метанол или вода. В некоторых вариантах для депротектирования SEM-защитной группы применяется нестрогий двухстадийный протокол. SEM-защищенный субстрат формулы Ic обрабатывается литий тетрафторборатом (LiBF4) в водном ацетонитриле при повышенной температуре, такой как 80 С, в течение от десяти до двадцати часов. Затем полученное соответствующее гидроксиметильное промежуточное соединение обрабатывается водным гидроксидом аммония (NH4OH) при комнатной температуре с получением соединения формулы III. В некоторых вариантах для РОМ-депротектирования используется водный раствор гидроксида натрия (NaOH). Так, суспензию РОМ-защищенного соединения формулы Ic обрабатывают 1 н. водным раствором гидроксида натрия при комнатной температуре в течение от двух до трех часов. Необходимый продукт формулы III может быть получен после обычной кислотно-основной обработки. В некоторых вариантах условия депротектирования включают обработку литий тетрафторборатом, с последующей обработкой водным гидроксидом аммония. В некоторых вариантах данный способ дополнительно включает реакцию соединения формулы III с фосфорной кислотой с получением фосфатной соли соединения формулы III. Способы превращения амида формулы I в нитрил формулы III Настоящее изобретение представляет также способ превращения амида формулы I в нитрильное соединение формулы I. Способы превращения амида формулы I включают дегидратацию даного амида с получением нитрила. Затем защитная группа может быть удалена, и полученный амин может быть протонирован с получением фармацевтически приемлемой соли. Соответственно, в некоторых вариантах настоящее изобретение представляет способ, включающий реакцию соединения формулы I в условиях дегидратации с образованием соединения формулы Ia гдеуказывает на хиральный углерод;P1 является защитной группой. В некоторых вариантах условия дегидратации включают трихлорацетилхлорид в присутствии триэтиламина. В некоторых вариантах условия дегидратации включают любой осушитель для дегидратации амидов, включая, но не ограничиваясь этим, хлорангидрид (например, трихлорацетилхлорид), Р 2 О 5;ZnCl2 этилдихлорфосфат/DBU; и PdCl2. В некоторых вариантах условия дегидратации отвечают описанным в работах Kuo, C-W.; Zhu, J.-L.; Wu, J.; et al. Chem. Commun. 2007, 301; Manjula, K.; Pasha, M. A. Syn.Aghapour, G. Syn. Commun. 2002, 32, 2535, каждая из которых включена здесь во всей полноте путем отсылки. В некоторых вариантах данный способ также включает реакцию соединения формулы Ic в условиях снятия защитной группы с образованием соединения формулы III гдеуказывает на хиральный углерод;P1 является защитной группой. Соответствующие группы P1 и методы депротектирования включают, но не ограничиваясь этим,описанные выше. В некоторых вариантах данный способ также включает реакцию соединения формулы III с фосфорной кислотой с получением фосфатной соли соединения формулы III. Способы превращения эфира формулы I в нитрил формулы III Настоящее изобретение также представляет способ превращения эфира формулы I в нитрильное соединение формулы I. Способы превращения эфира формулы I включают омыление данного эфира с получением кислоты, селективный аммонолиз и дегидратацию данного амида. Защитная группа затем может быть удалена, и полученный амин может быть протонирован с получением фармацевтически приемлемой соли. Соответственно, настоящее изобретение представляет способ, включающий реакцию соединения формулы I с металлическим гидроксидом с образованием соединения формулы Ic гдеуказывает на хиральный углерод;P1 является защитной группой. В некоторых вариантах данным металлическим гидроксидом является гидроксид щелочного металла или гидроксид щелочноземельного металла. В некоторых вариантах металлическим гидроксидом является гидроксид лития. В дополнительных вариантах данный способ также включает реакцию соединения формулы Ic с аммиаком или гидроксидом аммония в присутствии связывающего реагента с получением соединения формулы Ib гдеуказывает на хиральный углерод;P1 является защитной группой. В некоторых вариантах данным связывающим агентом является N,N-карбонилдиимидазол. В некоторых вариантах связывающий агент выбирают из 1,2-бензизоксазол-3-ил дифенил фосфата; ClCO2-i-Bu и Et3N; карбодиимида; SOCl2 и Cl-C(O)-C(O)-Cl; тозил хлорида и DMAP; и ClCO2-i-Bu и триэтиламина. В некоторых вариантах связывающий агент выбирают из описанных в работах: Ueda, М.; Oikawa, H. J. Org.J. Am. Chem. Soc, 1992, 114, 7969. (ClCO2-i-Bu, Et3N). В других вариантах данный способ также включает реакцию соединения формулы Ib в условиях дегидратации с получением соединения формулы Ia: гдеуказывает на хиральный углерод;P1 является защитной группой. В некоторых вариантах условия дегидратации включают трихлорацетил хлорид в присутствии триэтиламина. В некоторых вариантах условия дегидратации включают любой осушитель для дегидратации амидов, включая, но не ограничиваясь этим, хлорангидрид (например, трихлорацетилхлорид), Р 2 О 5;N-хлорсукцинимид; этилдихлорфосфат/DBU; и PdCl2. В некоторых вариантах условия дегидратации отвечают описанным в работах Kuo, C-W.; Zhu, J.-L.; Wu, J.; et al. Chem. Commun. 2007, 301; Manjula, K.; Pasha, M. A. Syn.Aghapour, G. Syn. Commun. 2002, 32, 2535, каждая из которых включена здесь во всей полноте путем отсылки.- 21020643 В дополнительных вариантах данный способ также представляет реакцию соединения формулы Ic в условиях снятия защитной группы с получением соединения формулы III: гдеуказывает на хиральный углерод;P1 является защитной группой. Соответствующие группы P1 и методы депротектирования включают, но не ограничиваясь этим,описанные выше. В некоторых вариантах данный способ также включает реакцию соединения формулы III с фосфорной кислотой с получением фосфатной соли соединения формулы III. Исходные материалы для способов гидрирования (соединения формулы II) Соединения формулы II, используемые в способах асимметричного гидрирования (выше), могут быть получены таким образом, как показано на схеме 1, где P1 и Р 2, каждый независимо, является защитными группами, R1 выбирают из С 3-7 циклоалкила, C1-6 алкила и C1-6 фторалкила, и R2 является циано или алкил эфиром. Режимы получения соединений формулы IV описаны ниже. Схема 1 Данный способ включает реакцию присоединения аза-Михаэла (aza-Michael) между соответственно замещенным ацетиленом формулы XIV и защищенным 4-(1 Н-пиразол-4-ил)-7 Н-пирроло[2,3-d]пиримидиновым соединением формулы IV (получение соединений формулы IV и XIV описано ниже). Эта реакция может быть проведена под влиянием каталитического количества твердого карбоната калия в ДМФА при комнатной температуре с получением соответствующего соединения формулы I. Соединения формулы II, где R1 является -C(=O)NH2, могут быть сформированы таким образом, как показано на схеме 2, путем обработки соединения формулы IIa кислотой с получением соединения формулы IIb. Схема 2 Соответственно, настоящее изобретение представляет способ получения соединения формулы II который включает реакцию соединения формулы IV в присутствии основания; гдеуказывает на хиральный углерод;P1 является защитной группой. Соответствующие защитные группы P1 включают, но не ограничиваясь этим, перечисленные выше. В некоторых вариантах присоединение аза-Михаэла проводится в органическом растворителе при комнатной температуре в присутствии каталитического количества основания. Данное основание может представлять собой подходящий растворитель или основание для реакций аза-Михаэла. В некоторых вариантах данный растворитель является ацетонитрилом или диметилформамидом (ДМФА). В некоторых вариантах данное основание представляет собой тетраалкиламмоний галогенид, тетраалкиламмоний гидроксид, гуанидин, амидин, гидроксид, алкоксид, силикат, фосфат щелочного металла, оксид, третичный амин, карбонат щелочного металла, бикарбонат щелочного металла, кислый фосфат щелочного металла, фосфин или соль щелочного металла карбоновой кислоты. В некоторых вариантах данное основание представляет собой тетраметил гуанидин, 1,8-диазабицикло(5.4.0)ундец-7-ен, 1,5-диазабицикло(4.3.0)нон-5-ен, 1,4-диазабицикло(2.2.2)октан, трет-бутил аммоний гидроксид, гидроксид натрия, гидроксид калия, метоксид натрия, этоксид натрия, трикалийфосфат, силикат натрия, оксид кальция, триэтиламин, карбонат натрия, карбонат калия, бикарбонат натрия, бикарбонат калия, кислый фосфат калия,трифенил фосфин, триэтил фосфин, ацетат калия или акрилат калия. В некоторых вариантах данное основание представляет собой 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU) или карбонат калия. В некоторых вариантах данное основание является DBU. В некоторых вариантах данное основание присутствует в каталитическом количестве. В некоторых вариантах количество основания составляет от приблизительно 0,1 до приблизительно 5 эквивалентов или от приблизительно 0,5 до приблизительно 3 эквивалентов, или от приблизительно 0,1 до приблизительно 0,5 эквивалентов. В некоторых вариантах данная реакция завершается в течение приблизительно 1-3 ч. В некоторых вариантах R1 выбирают из циклопентила, метила и трифторметила. В некоторых вариантах R1 является циклопентилом или циклопропилом. В некоторых вариантах R1 является циклопентилом. В некоторых вариантах R1 является метилом. В некоторых вариантах R1 является трифторметилом. В некоторых вариантах данное основание представляет собой карбонат щелочного металла или карбонат щелочно-земельного металла. В некоторых вариантах данное основание является карбонатом калия. В некоторых вариантах настоящее изобретение представляет соединение формулы IIP1 является защитной группой. В некоторых вариантах P1 является -СН 2 ОС(=O)С(СН 3)3 или -CH2OCH2CH2Si(CH3)3. В некоторых вариантах R1 является циклопентилом. Соединения формулы IIb, где R1 является -C(=O)NH2, могут быть получены путем обработки соединения формулы IIa- 23020643 кислотой с образованием рацемической формы соединения IIbP1 является защитной группой. В некоторых вариантах данная кислота представляет собой трифторуксусную кислоту, серную кислоту или их комбинацию. В некоторых вариантах обработка включает обработку трифторуксусной кислотой (TFA) и серной кислотой (H2SO4) при комнатной температуре. В некоторых вариантах отношениеTFA к H2SO4 составляет около 10:1 по объему. В некоторых вариантах данная реакция завершается в течение приблизительно одного часа. Соединения формулы XIV, используемые в процессе, который описан на схеме 1, могут быть получены с помощью способов, показанных ниже на схеме 3. Соответственно, соединение формулы XIVa(где R2 формулы XIV является циано) получают путем обработки литиевой соли соединения формулы С 1 цианобензолом (С-2), который генерируется in situ из фенола и цианбромида, в органическом растворителе, таком как безводный ТГФ, при температуре в интервале от приблизительно -78 С до приблизительно комнатной темпеартуры с получением соответствующего 3-замещенного пропиолонитрила формулы XIVa. Подобно этому, литиевая соль соединения формулы С-1, обработанная хлорформиатом формулы С-3, дает 3-замещенное пропиолатное соединение формулы XIVb (где R2 формулы XIV является C(=O)OR3). Схема 3II. Способы асимметричного присоединения аза-Михаэла для получения альдегидного промежуточного соединения формулы Id или VI. В другом аспекте настоящее изобретение представляет, inter alia, способ получения энантиомерного избытка (R)- или (S)-энантиомера соединения формулы Id который включает реакцию соединения формулы IV в присутствии хирального амина и органической кислоты; гдеуказывает на хиральный углерод;P1 является защитной группой. В еще одном аспекте настоящее изобретение представляет способ получения энантиомерного избытка (R)- или (S)-энантиомера соединения формулы VI который включает реакцию соединения формулы V в присутствии хирального амина и органической кислоты; гдеуказывает на хиральный углерод;X1 является галогеном. Без привязки к какой-либо конкретной теории понятно, что механизм этого катализируемого хиральным амином сопряженного присоединения аза-Михаэла гетероциклических соединений к ,ненасыщенным альдегидам включает следующие пути. Во-первых, ,-ненасыщенный альдегид формулы V взаимодействует с протонированным катализатором, сформированным из комбинации данного хирального амина и органической кислоты, и образует иминиевый ион с потерей воды. Благодаря хиральности данного катализатора, могут быть получены два разных иминиевых иона, которые имеют Е- и Zконфигурации. Как предполагается, соответствующая Е конфигурация является основным присутствующим промежуточным соединением, в котором Si поверхность экранируется данной хиральной группой в катализаторе, оставляя Re поверхность доступной для подхода N-гетероциклических соединений. Во-вторых, присоединение замещенного пиразола к иминиевому иону дает енаминовое промежуточное соединение, которое несет положительный заряд на протонированном пиразольном кольце. Затем этот протон переносится от данного атома азота в пиразольное кольцо к енаминовому углеродному атому с образованием иминиевого промежуточного соединения. В-третьих, гидролиз данного иминиевого иона приводит к регенерации данного катализатора и продукта. Основываясь на понимании механизма реакции, были определены условия реакции для этой органокатализируемой реакции аза-Михаэла. В некоторых вариантах соединение формулы V присутствует в избыточных количествах (например,от приблизительно 1,5 до приблизительно 5 эквивалентов). В некоторых вариантах хиральный амин присутствует в количестве от приблизительно 0,02 до приблизительно 0,15 эквивалентов или от приблизительно 0,05 до приблизительно 0,10 эквивалентов. В некоторых вариантах любого из способов асимметричного присоединения аза-Михаэла, органической кислотой является п-толуолсульфоновая кислота, бензойная кислота или 4-нитробензойная кислота. В некоторых вариантах органическая кислота представляет собой бензойную кислоту. В некоторых вариантах органическая кислота присутствует в количестве от приблизительно 0,05 до приблизительно 0,10 эквивалентов. В некоторых вариантах данная реакция проводится в органическом растворителе, который выбирают из хлороформа (CHCl3) или толуола. В некоторых вариантах реакция проводится при температуре,отвечающей приблизительно комнатной температуре, или при температуре от приблизительно 0 до приблизительно 5 С. В некоторых вариантах данная реакция завершается в течение от приблизительно 10 до приблизительно 24 ч. В некоторых вариантах степень превращения данной реакции достигает более 95% при отдельном выходе от приблизительно 80 до приблизительно 90%. Для определения хиральной чистоты каждого из аддуктов аза-Михаэла или его производного были разработаны методы хиральной высокоэффективной жидкостной хроматографии. В некоторых вариантах любого из способов асимметричного присоединения аза-Михаэла, хиральным амином является (R)- или (S)-энантиомер соединения формулы А-1Q1 и Q2 каждый выбирают независимо из Н, C1-6 алкила, C1-6 галогеналкила, карбокси, C1-6 алкилкарбоксамида, C1-6 алкоксикарбонила и фенила; где C1-6 алкил, C1-6 галогеналкил, C1-6 алкилкарбоксамид,C1-6 алкоксикарбонил и фенил, каждый, замещены необязательно 1, 2 или 3 группами, которые выбирают независимо из гидроксила, карбокси, три-C1-6 алкилсилила, три-C1-6 алкилсилилокси, С 6-10 арила, С 6-10 ариламино, C1-9 гетероарила и C1-9 гетероариламино; где данные С 6-10 арил, С 6-10 ариламино, C1-9 гетероарил и C1-9 гетероариламино, каждый, замещены, необязательно, 1, 2, 3 или 4 группами, которые выбирают, независимо, из галогена, C1-6 алкила и C1-6 галогеналкила; иY1, Y2, Y3, Y4, Y5, Y6 каждый выбирают независимо из Н, гидроксила, карбокси, C1-6 алкила, C1-6 галогеналкила, C1-6 алкоксикарбонила и фенила; илиQ1 и Y5 совместно с углеродными атомами, к которым они присоединены, образуют 5- или 6 членное циклоалкильное кольцо. В некоторых вариантах соединений формулы А-1:Q2 выбирают из Н, метила, изопропила, бутила, карбокси, С 1-5 алкиламинокарбонила, метоксикарбонила и фенила; где метил и C1-5 алкиламинокарбонил, каждый, замещены, необязательно, 1, 2 или 3 группами, которые выбирают, независимо, из гидроксила, карбокси, три-С 1-6 алкилсилила, три-С 1-4 алкилсилилокси, фенила, фениламино и индол-3-ила; где данные фенил и индол-3-ил, каждый, замещены,необязательно, 1 или 2 группами, которые выбирают, независимо, из метила и трифторметила;Y3, Y4, Y5 и Y6 каждый выбирают независимо из Н, гидроксила, метила и фенила;Q1 и Y5 совместно с углеродными атомами, к которым они присоединены, образуют 6-членное циклоалкильное кольцо. В некоторых вариантах любого из способов асимметричного присоединения аза-Михаэла, хиральным амином является (R)- или (S)-энантиомер соединения формулы А-2:Ar1 и Ar2 каждый являются независимо С 6-10 арилом, который замещен, необязательно, 1, 2, 3 или 4 группами, которые выбирают независимо из C1-6 алкила и C1-6 галогеналкила; каждый Ra выбирают независимо из C1-6 алкила; иRb выбирают из Н, C1-6 алкила и C1-6 галогеналкила. В некоторых вариантах Ar1 и Ar2 каждый представляет собой независимо фенил, который замещен необязательно 1, 2, 3 или 4 группами, которые выбирают независимо из метила и трифторметила; каждый Ra выбирают независимо из метила, этила или трет-бутила; и Rb является Н. В некоторых вариантах любого из способов асимметричного присоединения аза-Михаэла, хиральным амином является (R)- или (S)-энантиомер соединения, которое выбирают из пролина, пролинамида,пролил-L-лейцина, пролил-L-аланина, пролилглицина, пролил-L-фенилаланина, дифенилпирролидина,дибензилпирролидина, N-(1-метилэтил)пирролидинкарбоксамида, 2-(анилинометил)пирролидина, 2[бис(3,5-диметилфенил)метил]пирролидина,дифенил(пирролидин-2-ил)метанола,пролинола,4 тиазолидинкарбоновой кислоты, транс-3-гидроксипролина, транс-4-гидроксипролина, 4-бензил-1-метилимидазолидин-2-карбоновой кислоты, 1-метил-4-фенил-имидазолидин-2-карбоновой кислоты, 4,5 октагидро-бензимидазол-2-карбоновой кислоты, 4,5-дифенил-имидазолидин-2-карбоновой кислоты, N1 метил-3-фенилпропан-1,2-диамина, 1,2-дифенилэтандиамина, 1-метил-4-(1-метил-1 Н-индол-3-илметил)имидазолидин-2-карбоновой кислоты, 4-бензил-1-метил-имидазолидин-2-карбоновой кислоты, 1,2- 26020643 циклогександиамина, 2-фенилтиазолидин-4-карбоновой кислоты, трет-лейцин метилового эфира, 5 бензил-2,2,3-триметилимидазолин-4-она, метилпролината, 4,5-дифенилимидазолидина, 2-циклогексил 4,5-дифенилимидазолидина,2-бис-[3,5-бис(трифторметил)фенил]триметилсиланилоксиметилпирролидина, 2-бис-[3,5-диметилфенил]триметилсиланилоксиметилпирролидина, 2-дифенилтриметилсиланилоксиметилпирролидина, 2-бис[нафт-2-ил]триметилсиланилоксиметилпирролидина, 2-третбутилдиметилсилилоксидифенилметилпирролидина,2-бис-[3,5-бис(трифторметил)фенил]триэтилсиланилоксиметилпирролидина и 2-бис-[3,5-бис(трифторметил)фенил]этилдиметилсилилоксиметил пирролидина; где (R)- или (S)-конфигурация определяется по атому углерода, соседнему с группой NH в данном соединении. В некоторых предыдущих вариантах хиральным амином является (R)-энантиомер. В некоторых вариантах любого из способов асимметричного присоединения аза-Михаэла, хиральный амин выбирают из одного из следующих соединений: В некоторых вариантах энантиомерный избыток составляет от приблизительно 85% до приблизительно 95%. В некоторых вариантах энантиомерный избыток равняется или превышает приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95%,приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, приблизительно 99,1%, приблизительно 99,2%, приблизительно 99,3%, приблизительно 99,4%, приблизительно 99,5%,приблизительно 99,6%, приблизительно 99,7%, приблизительно 99,8%, приблизительно 99,9% или приблизительно 99,99%. В некоторых вариантах настоящее изобретение представляет композицию, содержащую энантиомерный избыток (R)- или (S)-энантиомера соединения формулы I гдеуказывает на хиральный углерод;P1 является защитной группой. В некоторых вариантах P1 является -СН 2 ОС(=O)С(СН 3)3 или -CH2OCH2CH2Si (CH3)3. В некоторых вариантах R1 является циклопентилом. В других вариантах настоящее изобретение представляет композицию, содержащую энантиомерный избыток (R)- или (S)-энантиомера соединения формулы IX гдеуказывает на хиральный углерод;Rc и Rd каждый независимо является C1-6 алкилом; илиRc и Rd совместно с кислородными атомами, к которым они присоединены, и атомом бора, к которому присоединены данные атомы кислорода, образуют 5- или 6-членное гетероциклическое кольцо,которое необязательно замещено 1, 2, 3 или 4 С 1-4 алкильными группами. В некоторых вариантах R1 является циклопентилом. Способы превращения альдегидных промежуточных соединений формулы I или VI в нитрильное соединение. В другом аспекте настоящее изобретение представляет способ получения нитрильного соединения из соединения формулы Id. Соответственно, в некоторых вариантах настоящее изобретение представляет- 27020643 способ, включающий обработку соединения формулы Id аммиаком или гидроксидом аммония и йодом с получением соединения формулы Ia гдеуказывает на хиральный углерод;P1 является защитной группой. В некоторых вариантах данная обработка включает обработку хирального альдегида формулы I избыточным количеством водного гидроксида аммония (NH4OH) и стехиометрическим количеством йода(I2) в органическом растворителе, таком как тетрагидрофуран (ТГФ), при комнатной температуре. В некоторых вариантах данная реакция завершается в течение приблизительно 1-2 ч при комнатной температуре. При таких условиях реакции хиральность данных хиральных альдегидов остается нетронутой. Хиральность данных хиральных нитрилов может контролироваться с помощью анализа, осуществляемого методом хиральной высокоэффективной жидкостной хроматографии. В некоторых вариантах данный способ также включает реакцию соединения формулы Ic в условиях снятия защитной группы с получением соединения формулы III гдеуказывает на хиральный углерод;P1 является защитной группой. Соответствующие группы P1 включают, но не ограничиваясь этим, описанные выше. В некоторых вариантах данный способ также включает реакцию соединения формулы III с фосфорной кислотой с получением фосфатной соли соединения формулы III. В еще одном аспекте настоящее изобретение представляет способ получения нитрильного соединения из соединения формулы VI. Соответственно, в некоторых вариантах настоящее изобретение представляет способ, включающий обработку соединения формулы VI аммиаком или гидроксидом аммония и йодом с получением соединения формулы VIII гдеуказывает на хиральный углерод;X1 является галогеном. В некоторых вариантах данный способ также включает реакцию соединения формулы VIII с соединением формулы В-1 с получением соединения формулы IX гдеуказывает на хиральный углерод;Rc и Rd каждый выбирают независимо из Н и C1-6 алкила; илиRc и Rd совместно с атомами кислорода, к которым они присоединены, и атомом бора, к которому присоединены данные атомы кислорода, образуют 5- или 6-членное гетероциклическое кольцо, которое необязательно замещено 1, 2, 3 или 4 C1-4 алкильными группами. В некоторых вариантах соединение формулы В-1 представляет собой 4,4,5,5,4',4',5',5'-октаметил[2,2']бис[1,3,2-диоксабороланил]. В дополнительных вариантах данный способ включает также реакцию соединения формулы IX с соединением формулы X в присутствии палладиевого катализатора и основания с получением соединения формулы Ic гдеуказывает на хиральный углерод;Rc и Rd каждый выбирают независимо из Н и C1-6 алкила; илиRc и Rd совместно с атомами кислорода, к которым они присоединены, и атомом бора, к которому присоединены данные атомы кислорода, образуют 5- или 6-членное гетероциклическое кольцо, которое необязательно замещено 1, 2, 3 или 4 C1-4 алкильными группами;P1 является защитной группой. В дополнительных вариантах данный способ также включает реакцию соединения формулы IX с соединением формулы XI: в присутствии палладиевого катализатора, основания и растворителя с получением соединения формулы III: гдеуказывает на хиральный углерод;
МПК / Метки
МПК: C07F 7/08, C07D 487/04, C07D 231/16, C07F 5/04
Метки: родственных, промежуточных, киназ, соединений, способы, получения, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-20643-sposoby-polucheniya-ingibitorov-jak-kinaz-i-rodstvennyh-promezhutochnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения ингибиторов jak киназ и родственных промежуточных соединений</a>
Предыдущий патент: Огнестойкая полимерная композиция с улучшенными механическими свойствами
Следующий патент: Полиметаллический катализатор для гидропереработки и способ его получения
Случайный патент: Предшественник напитка, содержащий черный листовой чай, и способ его приготовления












