Быстро диссоциирующие антагонисты рецептора 2 дофамина
Номер патента: 17508
Опубликовано: 30.01.2013
Авторы: Макдональд Грегор Джеймс, Ван Гол Михиль Люк Мария, Бартоломе-Небреда Хосе Мануэль, Ланглуа Ксавье Жан Мишель
Формула / Реферат
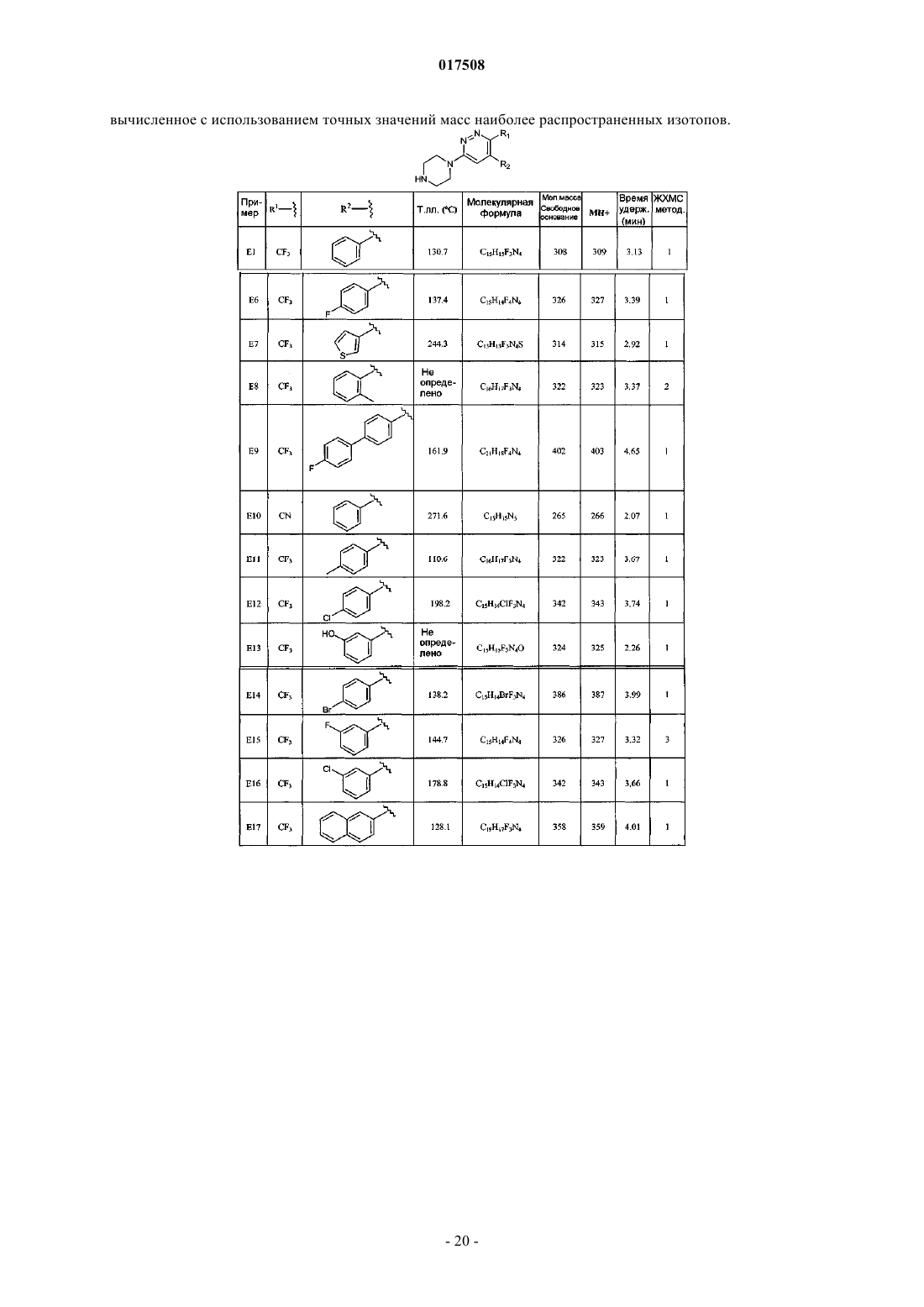
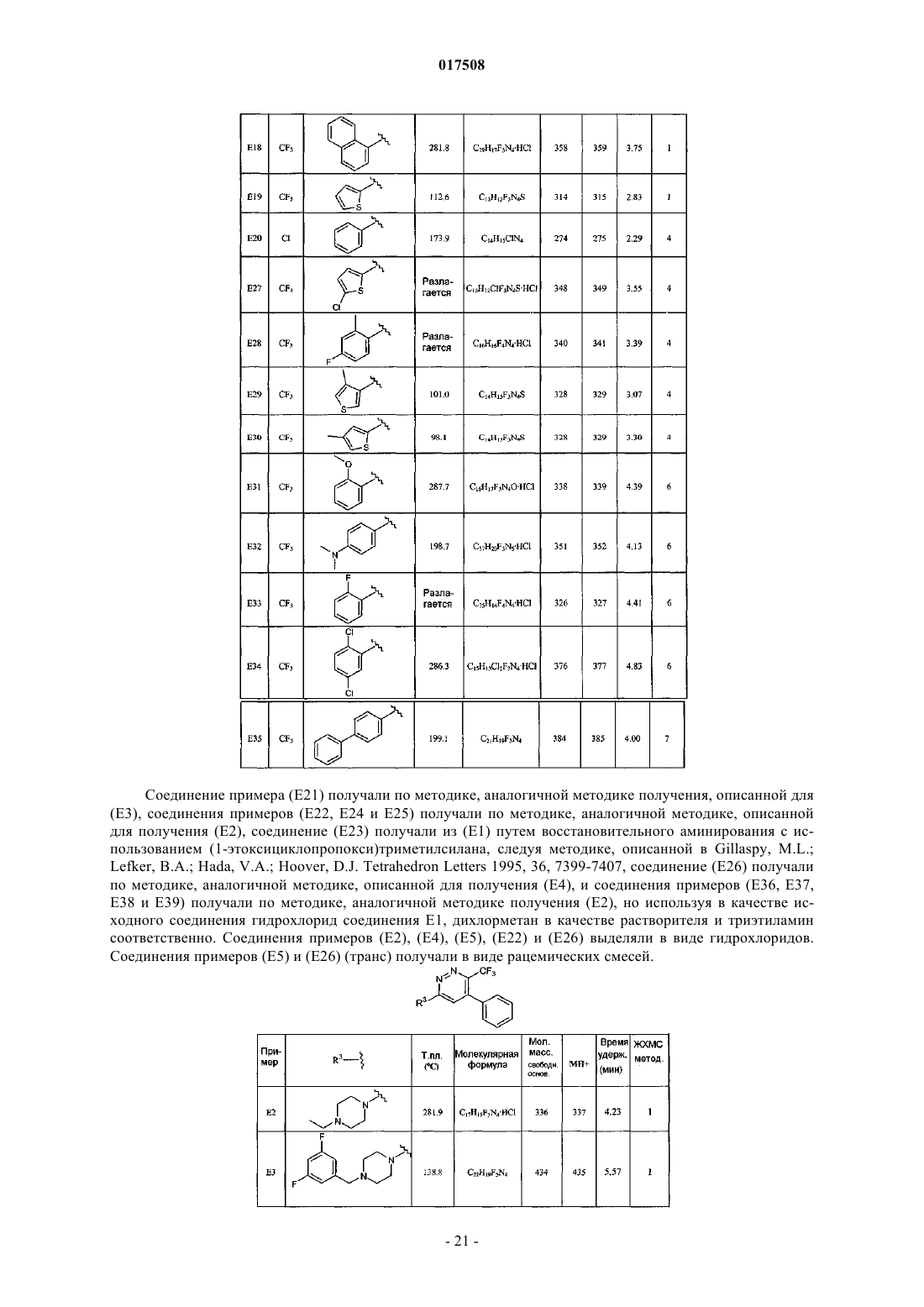
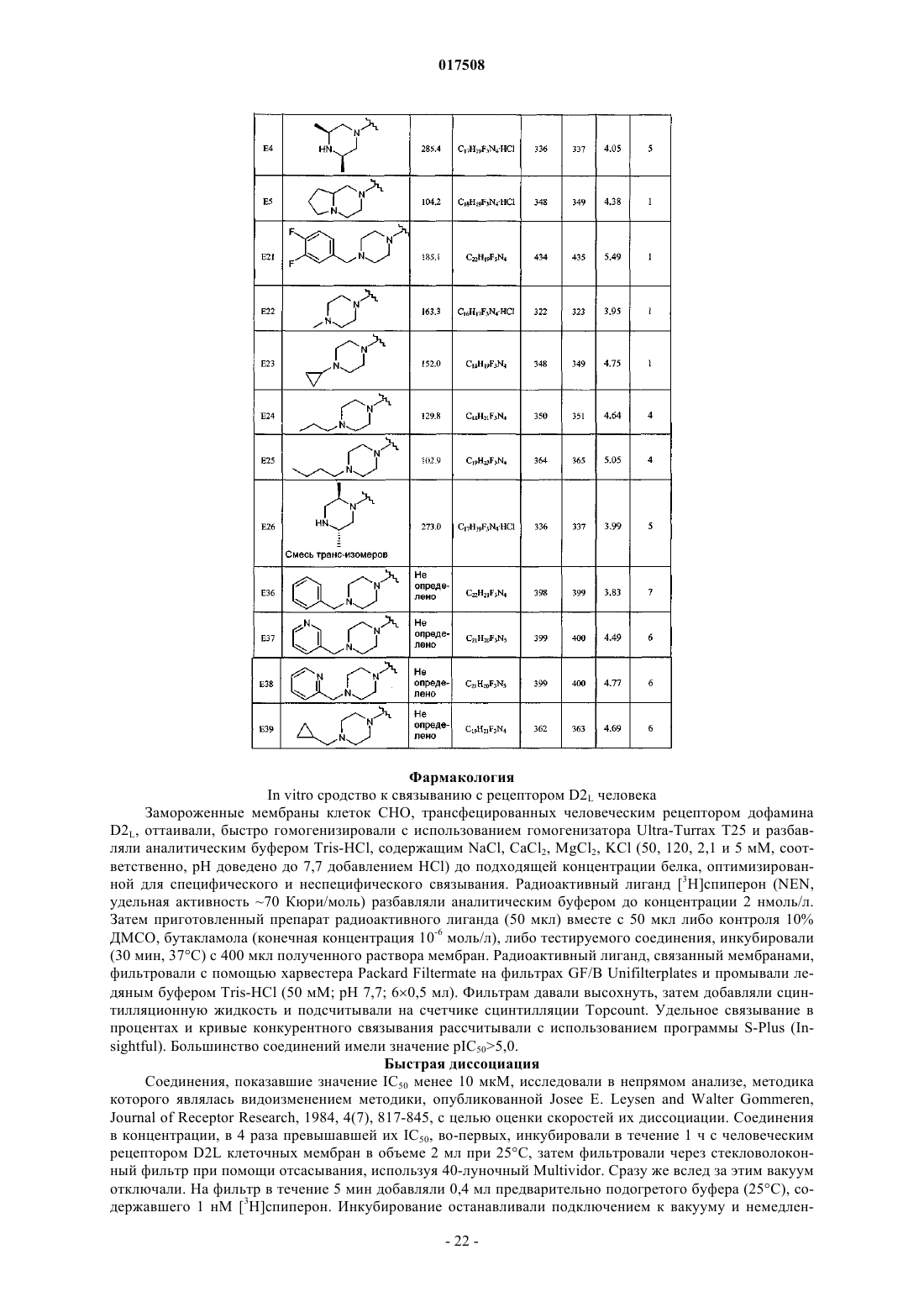
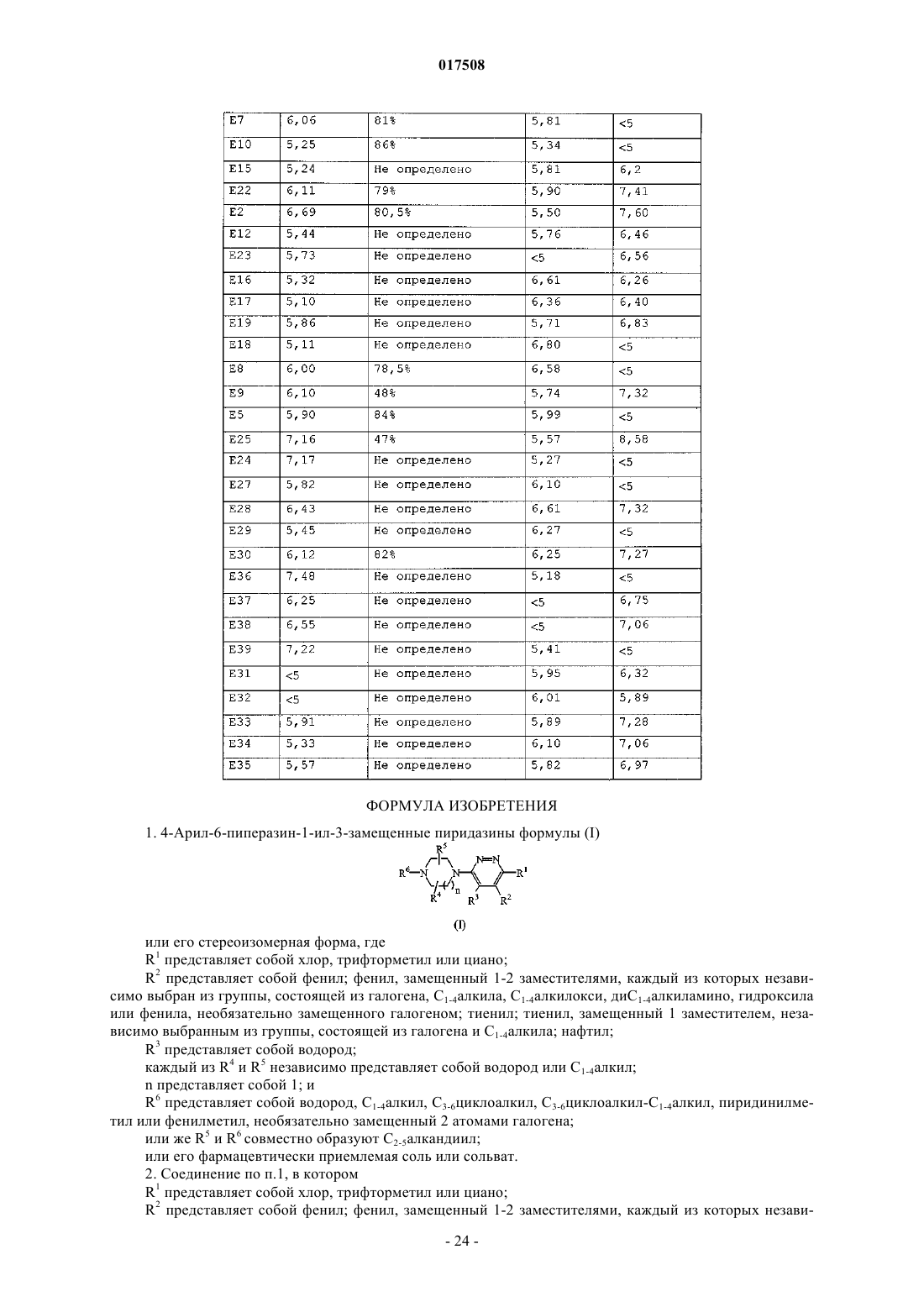
1. 4-Арил-6-пиперазин-1-ил-3-замещенные пиридазины формулы (I)

или его стереоизомерная форма, где
R1 представляет собой хлор, трифторметил или циано;
R2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4алкила, C1-4алкилокси, диС1-4алкиламино, гидроксила или фенила, необязательно замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, независимо выбранным из группы, состоящей из галогена и C1-4алкила; нафтил;
R3 представляет собой водород;
каждый из R4 и R5 независимо представляет собой водород или C1-4алкил;
n представляет собой 1; и
R6 представляет собой водород, C1-4алкил, C3-6циклоалкил, С3-6циклоалкил-C1-4алкил, пиридинилметил или фенилметил, необязательно замещенный 2 атомами галогена;
или же R5 и R6 совместно образуют С2-5алкандиил;
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, в котором
R1 представляет собой хлор, трифторметил или циано;
R2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4алкила, C1-4алкилокси, диС1-4алкиламино, гидроксила или фенила, замещенного галогеном, тиенил; тиенил, замещенный 1 заместителем, независимо выбранным из галогена и C1-4алкила; нафтил;
R3 представляет собой водород;
каждый из R4 и R5 независимо представляет собой водород или C1-4алкил;
n представляет собой 1; и
R6 представляет собой водород, C1-4алкил, C3-6циклоалкил, С3-6циклоалкил-C1-4алкил или фенилметил, замещенный 2 атомами галогена;
или же R5 и R6 совместно образуют С2-5 алкандиил;
или его фармацевтически приемлемая соль или сольват.
3. Соединение по п.1, в котором
R1 представляет собой трифторметил или циано;
R2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4алкила, C1-4алкилокси, диС1-4алкиламино, гидроксила и фенила, замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, независимо выбранным из галогена и C1-4алкила; нафтил;
R3 представляет собой водород;
каждый из R4 и R5 независимо представляет собой водород или C1-4алкил;
n представляет собой 1;
R6 представляет собой водород, метил, этил, циклопропил или фенилметил, замещенный 2 атомами галогена;
или же R5 и R6 совместно образуют С2-5алкандиил;
или его фармацевтически приемлемая соль или сольват.
4. Соединение по п.1, в котором
R1 представляет собой трифторметил;
R2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4алкила, C1-4алкилокси, диС1-4алкиламино, гидроксила и фенила, замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, выбранным из галогена и
C1-4алкила; нафтил;
R3 представляет собой водород;
каждый из заместителей R4 и R5 независимо представляет собой водород или метил;
n представляет собой 1;
R6 представляет собой водород, этил или (3,5-дифторфенил)метил; или
R5 и R6 совместно образуют 1,3-пропандиил;
или его фармацевтически приемлемая соль или сольват.
5. Соединение по п.1, где соединение представляет собой 4-фенил-6-пиперазин-1-ил-3-трифторметилпиридазин.
6. Соединение по п.1, где соединение представляет собой моногидрохлорид 4-фенил-6-пиперазин-1-ил-3-трифторметилпиридазина.
Текст
БЫСТРО ДИССОЦИИРУЮЩИЕ АНТАГОНИСТЫ РЕЦЕПТОРА 2 ДОФАМИНА Изобретение относится к 4-арил-6-пиперазин-1-ил-3-замещенным пиридазинам, которые являются быстро диссоциирующими антагонистами рецептора 2 дофамина. Описываемые соединения находят применение в качестве лекарственных средств, предназначенных для лечения или предотвращения расстройств центральной нервной системы, например шизофрении, благодаря тому, что они проявляют антипсихотическое действие без побочных моторных эффектов. Макдональд Грегор Джеймс, Ланглуа Ксавье Жан Мишель (BE), БартоломеНебреда Хосе Мануэль, Ван Гол Михиль Люк Мария (ES) Медведев В.Н. (RU) 017508 Область техники, к которой относится изобретение Настоящее изобретение относится к 4-арил-6-пиперазин-1-ил-3-замещенным пиридазинам, которые являются быстро диссоциирующими антагонистами рецептора 2 дофамина, способу получения этих соединений, фармацевтическим композициям, включающим эти соединения в качестве действующего ингредиента. Эти соединения находят применение в качестве лекарственных средств, предназначенных для лечения или предотвращения расстройств центральной нервной системы, например шизофрении, благодаря тому, что они проявляют антипсихотическое действие без побочных моторных эффектов. Описание изобретения Шизофрения представляет собой тяжелое и хроническое умственное расстройство, которым поражен примерно 1% населения. Клинические симптомы проявляются в относительно раннем возрасте, возникая в основном в подростковом периоде или в начале зрелого возраста. Симптомы шизофрении, как правило, делят на симптомы, называемые позитивными, включая галлюцинации, бредовые идеи и дезорганизованные мысли, и симптомы, называемые негативными, в число которых входят социальная самоизоляция, сниженная эмоциональная реакция, скудость речи и неспособность испытывать удовольствие. Кроме того, пациенты с шизофренией, страдают от когнитивных расстройств, например нарушения внимания и памяти. Этиология заболевания до сих пор неизвестна, но была выдвинута гипотеза, согласно которой в основе симптомов шизофрении лежит нарушение действия нейромедиаторов. Одной из наиболее часто используемых является дофаминовая гипотеза; согласно этой гипотезе предполагается, что за большинство позитивных симптомов, наблюдаемых у пациентов, несет ответственность гиперактивность передачи сигналов через дофамин. Эта гипотеза основана на наблюдении, что лекарственные средства,усиливающие действие дофамина, например амфетамин или кокаин, могут вызывать психозы, и на корреляции, которая существует между клиническими дозировками антипсихотических средств и их эффективностью в блокировании рецепторов дофамина D2. Все выпущенные в продажу антипсихотические средства опосредуют свою терапевтическую эффективность против позитивных симптомов путем блокирования рецепторов дофамина D2. Наряду с клинической эффективностью, считается, что большинство побочных действий антипсихотических средств, например экстрапирамидальные симптомы (EPS) и поздняя дискинезия, также связаны с действием антагонистов дофамина. Эти истощающие побочные действия чаще всего проявляются при применении типичных антипсихотических средств или антипсихотических средств первого поколения (например, галоперидола). Они менее выражены при применении атипичных антипсихотических средств или антипсихотических средств второго поколения (например,рисперидона, оланзапина) и даже практически отсутствуют при применении клозапина, который считается прототипом атипичных антипсихотических средств. Среди различных теорий, предложенных для объяснения более редкого возникновения EPS, наблюдаемого при применении атипичных антипсихотических средств, значительное внимание на протяжении последних пятнадцати лет привлекла к себе мультирецепторная гипотеза. Она появилась после исследований по связыванию рецепторов, показавших, что многие атипичные антипсихотические препараты взаимодействуют с рецепторами многих других нейромедиаторов, помимо рецепторов дофамина D2, в частности с рецепторами 5-НТ 2 серотонина, в то время как типичные антипсихотические средства, такие как галоперидол, более селективно связываются с рецепторами D2. Эта теория в последние годы была подвергнута сомнению, в связи с тем, что все основные атипичные антипсихотические средства полностью связывают рецепторы 5-НТ 2 серотонина при клинически эффективных дозировках, но все-таки различаются с точки зрения вызываемых ими побочных двигательных эффектов. В качестве альтернативы мультирецепторной гипотезе Kapur и Seeman("Does fast dissociation from dopamine D2 receptor explain the action of atypical antipsychotics: A new hypothesis" Am. J. Psychiatry 2001, 158: 3 p.360-369) предположили, что атипичные антипсихотические средства могут отличаться от типичных психотических средств скоростями, с которыми они выделяются из комплекса с рецептором дофамина D2. Быстрая диссоциация комплекса с рецептором D2 могла бы сделать антипсихотическое средство более легко приспосабливающимся к физиологической передаче сигнала дофамином, допускающим возможность антипсихотического действия без побочных моторных эффектов. Эта гипотеза является отчасти убедительной, если рассмотреть клозапин и кветиапин. Два этих препарата обладают наибольшей скоростью диссоциации комплекса с рецептором D2 дофамина, и они характеризуются наименьшей опасностью появления EPS у людей. Напротив, типичные антипсихотические средства, с которыми связана значительная частота появления EPS, являются антагонистами рецептора D2, обладающими наименьшими скоростями диссоциации. Следовательно, обнаружение новых лекарственных препаратов, исходя из скорости диссоциации их комплексов с рецепторами D2, повидимому, является обоснованной стратегией для разработки новых атипичных антипсихотических средств. Как было указано ранее, современные атипичные антипсихотические средства взаимодействуют со многими рецепторами различных нейромедиаторов. Некоторые из этих взаимодействий (например, блокирование рецепторов серотонина 5-НТ 6 и дофамина D3) могут оказаться полезными, если речь идет о когнитивных нарушениях и негативных симптомах. Действительно, многочисленные данные доклинических исследований показали, что антагонизм в отношении рецептора 5-НТ 6 обладает положительным воздействием на когнитивный процесс у грызунов (Mithell and Neumaier (2005) 5-НТ 6 receptors: a noveltarget for cognitive enhancement. PharmacologyTherapeutics 108: 320-333). Антагонизм в отношении рецептора 5-НТ 6 также оказался связанным с аппетитом и подавлением приема пищи. Далее, антагонизм в отношении рецептора D3 улучшает социальное взаимодействие у крыс, что предполагает возможное благоприятное влияние на негативные симптомы пациентов с шизофренией (Joyce and Millan (2005) Dopamine D3 receptor antagonist as therapeutic agents. Drug Discovery Today 10: 917-925). С другой стороны,другие взаимодействия (например, с адренергическим рецептором 1, рецепторами гистамина H1 и серотонина 5-НТ 2 С) принимают участие в опосредовании побочных эффектов, включая гипотензию, седативное действие, метаболические расстройства и набор веса. Следовательно, дополнительная цель заключается в том, чтобы соединить свойства быстрой диссоциации комплекса с рецептором D2 с ингибированием рецепторов серотонина 5-НТ 6 и дофамина D3, при отсутствии взаимодействий с адренергическим рецептором 1, рецепторами гистамина H1 и серотонина 5-НТ 2 С. Такой профиль активности, как ожидается, даст возможность получить новые соединения, которые эффективны против позитивных симптомов, негативных симптомов и когнитивных расстройств, при отсутствии или незначительном проявлении основных побочных эффектов, связанных с известными в настоящее время антипсихотическими средствами. Цель настоящего изобретения заключается в разработке новых соединений, которые являются антагонистами рецептора 2 дофамина, образуя с ним быстро диссоциирующий комплекс, а также антагонистами рецептора серотонина 5-НТ 6 и дофамина D3, которые обладают благоприятным фармакологическим профилем в указанном выше смысле, в частности пониженными моторными побочными действиями, а также умеренными или очень малыми взаимодействиями с другими рецепторами, что приводит к снижению риска развития метаболических расстройств. Этой цели удалось добиться с помощью новых соединений, структура которых соответствует формуле (I) или его стереоизомерной формы, гдеR2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4 алкила, C1-4 алкилокси, диС 1-4 алкиламино, гидроксила или фенила, необязательно замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, независимо выбранным из группы, состоящей из галогена и C1-4 алкила; нафтил;R3 представляет собой водород; каждый из R4 и R5 независимо представляет собой водород или C1-4 алкил;R6 представляет собой водород, C1-4 алкил, С 3-6 циклоалкил, С 3-6 циклоалкил-C1-4 алкил, пиридинилметил или фенилметил, необязательно замещенный 2 атомами галогена; или же R5 и R6 совместно образуют С 2-5 алкандиил; или его фармацевтически приемлемой соли или сольвата. Соединения по настоящему изобретению являются быстро диссоциирующими антагонистами рецептора D2. Кроме того, соединения по настоящему изобретению имеют примерно такое же сродство к рецепторам дофамина D3 и серотонина 5-НТ 6, как и к рецепторам дофамина D2. Насколько показали проведенные испытания, описываемые соединения являются антагонистами этих трех подтипов рецепторов. Это свойство делает соединения по настоящему изобретению особенно подходящими для применения в качестве лекарственных средств при лечении или предотвращении шизофрении, шизофрениформного расстройства, шизоаффективного расстройства, бредового расстройства, кратковременного психотического расстройства, разделенного психотического расстройства, психотического расстройства,вызванного общим состоянием здоровья, психотического расстройства, вызванного тем или иным веществом, психотического расстройства, не относящегося к перечисленным выше; психоза, связанного с деменцией; большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, депрессивного расстройства, не относящегося к перечисленным выше,биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, биполярного расстройства, не относящегося к перечисленным выше, аффективного расстройства, вызванного общим состоянием здоровья, аффективного расстройства, вызванного тем или иным веществом, аффективного расстройства, не относящегося к перечисленным выше; генерализованного тревожного расстройства,обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства,посттравматического стрессового расстройства; задержки умственного развития; общего расстройства психического развития; расстройств дефицита внимания, расстройства дефицит внимания/гиперактивность, расстройства дезорганизации поведения; расстройства личности параноидального типа, расстрой-2 017508 ства личности шизоидного типа, расстройства личности шизотипического типа; тикового расстройства,синдрома Туретта; зависимости от веществ; неправильного употребления веществ; воздержания от употребления тех или иных веществ; трихотилломании; а также состояний, при которых нарушена познавательная способность; болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, деменции с тельцами Леви, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни КрейтцфельдтаЯкоба; амнестических расстройств; умеренного когнитивного расстройства; возрастного снижения познавательной способности; и расстройств, связанных с питанием, таких как анорексия и булимия; а также ожирения. Специалист в данной области может осуществить выбор соединений на основе экспериментальных данных, приведенных в экспериментальной части далее по тексту заявки. Любой выбор соединений входит в объем настоящего изобретения. Настоящее изобретение относится к соединениям формулы (I) и их стереоизомерным формам, в которыхR2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4 алкила, C1-4 алкилокси, диС 1-4 алкиламино, гидроксила или фенила, необязательно замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, независимо выбранным из группы, состоящей из галогена и C1-4 алкила; нафтил;R3 представляет собой водород; каждый из R4 и R5 независимо представляет собой водород или C1-4 алкил;R6 представляет собой водород, C1-4 алкил, C3-6 циклоалкил, С 3-6 циклоалкил-C1-4 алкил, пиридинилметил или фенилметил, необязательно замещенный 2 атомами галогена; или же R5 и R6 совместно образуют С 2-5 алкандиил; а также их фармацевтически приемлемым солям или сольватам. Например, изобретение относится к соединениям формулы (I) и их стереоизомерным формам, в которыхR1 представляет собой трифторметил или циано;R2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4 алкила, C1-4 алкилокси, диС 1-4 алкиламино, гидроксила и фенила, замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, независимо выбранным из группы, состоящей из галогена и C1-4 алкила; нафтил;R3 представляет собой водород; каждый из R4 и R5 независимо представляет собой водород или C1-4 алкил;R6 представляет собой водород, метил, этил, циклопропил или фенилметил, замещенный по фенильному ядру 2 атомами галогена; или же R5 и R6 совместно образуют С 2-5 алкандиил; а также их фармацевтически приемлемым солям или сольватам. Особый интерес представляют соединения формулы (I) и их стереоизомерные формы, в которыхR2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4 алкила, C1-4 алкилокси, диС 1-4 алкиламино, гидроксила и фенила, замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, выбранным из галогена и C1-4 алкила; нафтил;R3 представляет собой водород; каждый из заместителей R4 и R5 независимо представляет собой водород или метил;R5 и R6 совместно образуют 1,3-пропандиил; а также их фармацевтически приемлемые соли или сольваты. Среди соединений формулы (I) и их стереоизомерных форм наиболее интересным является, например, 4-фенил-6-пиперазин-1-ил-3-трифторметилпиридазин (Е 1), а также его моногидрохлорид. В тексте настоящей заявки термин "C1-4 алкил", используемый сам по себе или в качестве составной части комбинированных терминов, таких как "C1-4 алкилокси", "диС 1-4 алкиламино", включает, например,метил, этил, пропил, бутил, 1-метилпропил, 1,1-диметилэтил; С 3-8 циклоалкил включает циклопропил,циклобутил, циклопентил, циклогексил, циклогептил и циклооктил; С 5-7 циклоалкенил включает циклопентенил, циклогексенил и циклогептенил. Термин "галоген" включает фтор, хлор, бром и йод. В число фармацевтически приемлемых солей, согласно определению, входят терапевтически активные, нетоксичные кислотно-аддитивные солевые формы, которые могут образовывать соединения формулы (I). Указанные соли можно получить обработкой основных форм соединений формулы (I) подходящими кислотами, например неорганическими кислотами, такими как галогеноводородные кислоты,в частности хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота-3 017508 и фосфорная кислота; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропановой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, миндальной кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, цикламовой кислотой,салициловой кислотой, п-аминосалициловой кислотой, памовой кислотой и миндальной кислотой. С другой стороны, указанные солевые формы могут быть превращены в свободные формы обработкой подходящим основанием. Термин "сольваты" относится к гидратам и алкоголятам, которые могут образовывать соединения формулы (I). Термин "стереохимически изомерные формы" в настоящей заявке определяет все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не указано или не упомянуто иное,химические наименования соединений означают смесь всех возможных стереохимических изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители у двухвалентных циклических (частично) насыщенных радикалов могут иметь либо цис- либо трансконфигурацию. Соединения, включающие двойные связи, могут иметь Е- или Z-конфигурацию при упомянутой двойной связи. Стереохимические изомерные формы соединений формулы (I) входят в объем настоящего изобретения. Соединения формулы (I), полученные по описанному ниже способу, могут быть синтезированы в форме рацемических смесей или энантиомеров, которые могут быть разделены друг с другом с использованием известных в технике методик разделения. Рацемические соединения формулы (I) могут быть превращены в соответствующие диастереомерные солевые формы взаимодействием с подходящей хиральной кислотой. После этого разделяют указанные диастереомерные солевые формы, например, селективной или дробной кристаллизацией и высвобождают из полученных солей диастереомеры действием щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы могут быть также получены из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ, при условии, что реакция проходит стереоспецифично. Если желательно получить конкретный стереоизомер, указанное соединение предпочтительно могло бы быть синтезировано с помощью стереоспецифических способов синтеза. В этих способах преимущественно применяются энантиомерно чистые исходные соединения. Фармакология Для обнаружения антипсихотических соединений, которые активны против позитивных и негативных симптомов и когнитивных расстройств и имеют улучшенный профиль безопасности (низкая частота появления EPS и отсутствие метаболических расстройств), авторы провели скрининг соединений, селективно взаимодействующих с рецептором дофамина D2 и образующих быстро диссоциирующий комплекс с этим рецептором и, кроме этого, обладающих сродством к рецептору дофамина D3, а также рецептору серотонина 5-НТ-6. В первую очередь исследовали соединения на сродство к рецептору D2 в анализе связывания с использованием [3 Н]спиперона и человеческого рецептора клеточных мембранD2L. Соединения, показавшие IC50 менее 10 мкМ, с целью оценки скорости диссоциации тестировали в непрямом анализе, проводившемся по адаптированной методике, опубликованной Josee Е. Leysen andWalter Gommeren, Journal of Receptor Research, 1984, 4(7), 817-845. Затем соединения отбирали с помощью панели, состоявшей из более чем 50 обычных рецепторов,сопряженных с G-белком (CEREP), и выявляли соединения, имеющие чистый профиль, т.е. низкое сродство к исследованным рецепторам, за исключением рецептора дофамина D3 и рецептора серотонина 5 НТ 6. Некоторые из соединений дополнительно испытывали в моделях in vivo, например "Противодействие возбуждению, вызванному апоморфином, у крыс" и обнаружили, что они активны и биодоступны при пероральном приеме. Было дополнительно обнаружено, что соединение Е 1 проявляет активность в тесте "Инверсия субхронического сдвига внимания у крыс, вызванного РСР" (J.C. Rodefer et al., Neuropsychopharmacology(2007), 1-10). Принимая во внимание описанную выше фармакологию соединений формулы (I), можно сделать вывод, что они подходят для применения в качестве лекарственных средств, в частности в качестве антипсихотических средств. Более конкретно, эти соединения подходят для применения в качестве лекарственных средств для лечения или предотвращения шизофрении, шизофрениформного расстройства,шизоаффективного расстройства, бредового расстройства, кратковременного психотического расстройства, разделенного психотического расстройства, психотического расстройства, вызванного общим состоянием здоровья, психотического расстройства, вызванного тем или иным веществом, психотического расстройства, не относящегося к перечисленным выше; психоза, связанного с деменцией; большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического рас-4 017508 стройства, депрессивного расстройства, не относящегося к перечисленным выше, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, биполярного расстройства, не относящегося к перечисленным выше, аффективного расстройства, вызванного общим состоянием здоровья, аффективного расстройства, вызванного тем или иным веществом, аффективного расстройства, не относящегося к перечисленным выше; генерализованного тревожного расстройства, обсессивнокомпульсивного расстройства, панического расстройства, острого стрессового расстройства, посттравматического стрессового расстройства; задержки умственного развития; общего расстройства психического развития; расстройств дефицита внимания, расстройства дефицит внимания/гиперактивность, расстройства дезорганизации поведения; расстройства личности параноидального типа, расстройства личности шизоидного типа, расстройства личности шизотипического типа; тикового расстройства, синдрома Туретта; зависимости от веществ; неправильного употребления веществ; воздержания от употребления тех или иных веществ; трихотилломании. Вследствие антагонистической активности в отношении рецептора 5-НТ 6, соединения по настоящему изобретению могут дополнительно применяться для лечения или профилактики состояний, при которых нарушена познавательная способность; болезни Альцгеймера,болезни Паркинсона, болезни Хантингтона, деменции с тельцами Леви, деменции вследствие ВИЧзаболевания, деменции вследствие болезни Крейтцфельдта-Якоба; амнестических расстройств; умеренного когнитивного расстройства; а также возрастного снижения познавательной способности. Для оптимизации лечения пациентов, страдающих одним из расстройств, упомянутых в предыдущем параграфе, соединения формулы (I) могут вводиться совместно с другими психотропными соединениями. Так, в случае шизофрении, целью лечения могут быть негативные и когнитивные симптомы. Кроме того, в настоящем изобретении разработан способ лечения теплокровных животных, страдающих указанными расстройствами, причем упомянутый способ включает системное введение терапевтического количества соединения формулы (I), эффективного для лечения описанных выше расстройств. Помимо этого настоящее изобретение относится к применению соединений формулы (I), соответствующих данным выше определениям, с целью производства лекарственных средств, в частности антипсихотических лекарственных средств, более конкретно лекарственных средств, предназначенных для лечения или предотвращения шизофрении, шизофрениформного расстройства, шизоаффективного расстройства, бредового расстройства, кратковременного психотического расстройства, разделенного психотического расстройства, психотического расстройства, вызванного общим состоянием здоровья, психотического расстройства, вызванного тем или иным веществом, психотического расстройства, не относящегося к перечисленным выше; психоза, связанного с деменцией; большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, депрессивного расстройства, не относящегося к перечисленным выше, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, биполярного расстройства, не относящегося к перечисленным выше, аффективного расстройства, вызванного общим состоянием здоровья, аффективного расстройства, вызванного тем или иным веществом, аффективного расстройства, не относящегося к перечисленным выше; генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства, посттравматического стрессового расстройства; задержки умственного развития; общего расстройства психического развития; расстройств дефицита внимания, расстройства дефицит внимания/гиперактивность, расстройства дезорганизации поведения; расстройства личности параноидального типа, расстройства личности шизоидного типа, расстройства личности шизотипического типа; тикового расстройства, синдрома Туретта; зависимости от веществ; неправильного употребления веществ; воздержания от употребления тех или иных веществ; трихотилломании; а также состояний, при которых нарушена познавательная способность; болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, деменции с тельцами Леви, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Крейтцфельдта-Якоба; амнестических расстройств; умеренного когнитивного расстройства; и возрастного снижения познавательной способности. Специалист в лечении перечисленных расстройств мог бы определить терапевтически эффективное дневное количество препаратов на основании результатов тестов, приведенных ниже по тексту заявки. Терапевтически эффективное дневное количество могло бы составлять от примерно 0,01 до примерно 10 мг/кг массы тела, более предпочтительно от примерно 0,05 до примерно 1 мг/кг массы тела. Настоящее изобретение относится также к фармацевтической композиции, включающей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I) в качестве действующего ингредиента. Для более легкого введения описываемые соединения можно включать в состав различных лекарственных форм. Соединения по настоящему изобретению, в частности соединения формулы (I), их фармацевтически приемлемые кислотно- и основно-аддитивные соли, их стереохимически изомерные формы,их N-оксидные формы и их пролекарства, или любые подгруппы и комбинации перечисленных веществ,с целью введения могут быть включены в различные лекарственные формы. В качестве подходящих композиций могут быть упомянуты все композиции, обычно применяемые для системного введения лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению эф-5 017508 фективное количество конкретного соединения, необязательно в форме аддитивной соли, являющегося действующим соединением, тщательно смешивают с фармацевтически приемлемым носителем, причем этот носитель может иметь самые разнообразные формы, в зависимости от формы препарата, которую желательно ввести. Желательно, чтобы эти фармацевтические композиции представляли собой стандартные лекарственные формы, в частности, подходящие для перорального, ректального, чрескожного введения, введения с помощью парентеральной инъекции или ингаляции. Например, при получении композиций в виде пероральных стандартных форм может применяться любая из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и т.п. в случае жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазывающие средства, связующие средства, дезинтегрирующие средства и т.п. в случае порошков, пилюль, капсул и таблеток. Благодаря легкости введения таблетки и капсулы представляют собой наиболее предпочтительные пероральные стандартные лекарственные формы, и в этом случае, очевидно, применяются твердые фармацевтические носители. Для парентеральных композиций носитель обычно будет включать стерильную воду, по меньшей мере в качестве основного компонента, хотя в состав могут входить и другие ингредиенты, например средства, способствующие растворимости. Например, могут быть получены растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы или смесь растворов соли и глюкозы. Растворы для инъекций, содержащие соединения формулы (I), могут быть получены с применением масла, для достижения пролонгированного действия. Подходящими для этой цели маслами являются, например, арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические эфиры глицерина и жирных кислот с длинными цепями, а также смеси этих и других масел. Кроме того, могут быть получены пригодные для инъекций суспензии, и в этом случае могут применяться подходящие жидкие носители и суспендирующие средства. Кроме того, в объем изобретения входят твердые препараты, которые предназначены для превращения, незадолго перед применением, в жидкие препараты. В композициях, подходящих для чрескожного введения, носитель необязательно включает средства, усиливающие способность к прониканию и/или подходящие смачивающие средства, необязательно в сочетании с подходящими добавками любой природы в незначительном количестве, которые не оказывают значительного неблагоприятного воздействия на кожу. Указанные добавки могут облегчать введение в кожу и/или могут оказывать содействие в получении желаемых композиций. Эти композиции могут вводиться различными путями, например, в форме трансдермального пластыря, чрескожного состава или мази. Кислотно- или основно-аддитивные соли соединений формулы (I) благодаря их повышенной растворимости в воде по сравнению с соответствующими основными или кислотными формами, больше подходят для получения водных композиций. Особенно предпочтительно получать описанные выше фармацевтические композиции в виде стандартных лекарственных форм для более легкого введения и постоянства дозирования. Термин стандартная лекарственная форма в настоящей заявке относится к физически дискретным единицам, подходящим в качестве однократной дозы, причем каждая единица лекарственной формы содержит заранее определенное количество действующего ингредиента, рассчитанное на достижение желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с насечкой или таблетки с покрытием), капсулы, пилюли, пакеты с порошками, облатки, суппозитории, растворы или суспензии для инъекций и т.п. и упаковки с большим количеством отдельных единиц этих стандартных лекарственных форм. Поскольку соединения по настоящему изобретению являются соединениями, потенциально пригодными для перорального введения, особенно выгодными являются фармацевтические композиции,предназначенные для перорального введения и включающие указанные соединения. С целью улучшения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях, может быть целесообразно применение -, - или -циклодекстринов или их производных, в частности гидроксиалкилзамещенных циклодекстринов, например 2-гидроксипропил-циклодекстрина. Помимо этого растворимость и/или стабильность соединений по настоящему изобретению в фармацевтических композициях может быть улучшена за счет применения сорастворителей, например спиртов. Получение Соединения формулы (I), в которых R1 представляет собой хлор или трифторметил и R2, R3, R4, R5,R6 и n соответствуют данным выше определениям, могут быть получены взаимодействием соединения формулы (II) в котором R1 представляет собой хлор или трифторметил и R2 и R3 соответствуют данным выше определениям, с соединением формулы (III) в котором R4, R5, R6 и n соответствуют данным выше определениям, в присутствии подходящего основания, например диизопропилэтиламина, в подходящем растворителе, например ацетонитриле, и в подходящих условиях, например при подходящей температуре или при соответствующем нагревании или микроволновом излучении, в течение времени, гарантирующего завершение реакции. Соединения формулы (II), в которых R1 представляет собой хлор и R2 и R3 соответствуют данным выше определениям, могут быть получены по методике, аналогичной описанной в WO-2005/013907. Соединения формулы (II), в которых R1 представляет собой трифторметил и R2 и R3 соответствуют данным выше определениям, могут быть получены взаимодействием соединения формулы (IV) в котором R1 представляет собой трифторметил и R2 и R3 соответствуют данным выше определениям, с оксихлоридом фосфора, в подходящем растворителе, например ацетонитриле, в подходящих условиях, например при подходящей температуре или при соответствующем нагревании или микроволновом излучении, в течение времени, гарантирующего завершение реакции. Соединения формулы (IV), в которых R1 представляет собой трифторметил и R2 и R3 соответствуют данным выше определениям, могут быть получены взаимодействием соединения формулы (V) в котором R1 представляет собой трифторметил и R2 и R3 соответствуют данным выше определениям, с гидразингидратом в присутствии подходящего катализатора, например уксусной кислоты, в подходящем растворителе, например ацетонитриле, в подходящих условиях, например при подходящих температурах, либо при соответствующем нагревании или микроволновом излучении, в течение времени,которое гарантирует завершение реакции. Соединения формулы (V) , в которых R1 представляет собой трифторметил и R2 и R3 соответствуют данным выше определениям, могут быть получены взаимодействием соединения формулы (VI) в котором R2 и R3 соответствуют данным выше определениям, с CF3SiMe3 (VII) в присутствии подходящего катализатора, например фторида цезия, в подходящем растворителе, таком как ацетонитрил, в подходящих условиях, например, при низких температурах, как правило в диапазоне от -78 до 0 С. Соединения формулы (VI), в которых R2 и R3 соответствуют данным выше определениям, могут быть приобретены на коммерческой основе или получены по методике, аналогичной описанной в Dean,W.D.; Bum, D.M. J. Org. Chem. 1993, 58, 7916-7917. Соединения формулы (I-a) в которых R6' представляет собой R6, согласно данному выше определению, но за исключением водорода, R1 представляет собой хлор или трифторметил и R2, R3, R4, R5 и n соответствуют данному выше определению, также могут быть получены взаимодействием соединений формулы (I-b) в которых R1 представляет собой хлор или трифторметил и R2, R3, R4, R5 и n соответствуют данному выше определению, с реагентом формулы R6'-W, в которых R6' представляет собой R6, согласно данному-7 017508 выше определению, но за исключением водорода, и W представляет собой уходящую группу, такую как галоген, например хлор, бром или йод, или сульфонилоксигруппу, например метилсульфонилокси, трифторметилсульфонилокси или метилфенилсульфонилокси в присутствии основания, например, диизопропилэтиламина, в подходящем растворителе, таком как ацетонитрил, и в подходящих условиях, например при подходящей температуре, либо при соответствующем нагревании или при микроволновом излучении в течение времени, которое гарантирует завершение реакции. В качестве альтернативы, соединения формулы (I-а), в которых R6' представляет собой R6, согласно данному выше определению, но за исключением водорода, R1 представляет собой хлор или трифторметил и R2, R3, R4, R5 и n соответствуют данному выше определению, также могут быть из соединений формулы (I-b), в которых R1 представляет собой хлор или трифторметил и R2, R3, R4, R5 и n соответствуют данному выше определению, с помощью реакции восстановительного N-алкилирования с подходящим кетоном или альдегидом в присутствии подходящего восстанавливающего реагента, например триацетоксиборгидрида натрия в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы (I-b), в которых R1 представляет собой хлор или трифторметил и R2, R3, R4, R5 и n соответствуют данному выше определению, могут быть получены удалением защитной группы из промежуточного соединения формулы (VIII) в котором L представляет собой подходящую защитную группу, например трет-бутоксикарбонил,R1 представляет собой хлор или трифторметил и R2, R3, R4, R5 и n соответствуют данному выше определению, в подходящих условиях, например, в присутствии трифторуксусной кислоты в дихлорметане или в присутствии кислотной формы ионообменной смолы Amberlyst 15 в метаноле, где L представляет собой трет-бутоксикарбонильную группу. Соединения формулы (VIII), в которых R1 представляет собой хлор или трифторметил и R2, R3, R4,5R и n соответствуют данному выше определению, могут быть получены взаимодействием соединения формулы (II), в котором R1 представляет собой хлор или трифторметил и R2 и R3 соответствуют данному выше определению, с соединением формулы (IX) в котором L представляет собой подходящую защитную группу, например трет-бутоксикарбонил иR4, R5 и n соответствуют данному выше определению, в присутствии подходящего основания, например диизопропилэтиламина, в подходящем растворителе, например ацетонитриле, и в подходящих условиях,например при подходящей температуре, либо при соответствующем нагревании или микроволновом облучении в течение времени, которое гарантирует завершение реакции. Соединения формулы (VIII), в которых R1 представляет собой трифторметил, и R2, R3, R4, R5 и n соответствуют данному выше определению, и L представляет собой подходящую защитную группу, например трет-бутоксикарбонил, также могут быть получены взаимодействием соединения формулы (X) в котором R1 представляет собой трифторметил, и R3, R4, R5 и n соответствуют данному выше определению, и L представляет собой подходящую защитную группу, например трет-бутоксикарбонил, с соответствующей арилбороновой кислотой R2-B(ОН)2 в присутствии подходящего катализатора, например дихлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II), дихлорметана в присутствии подходящего лиганда, например 1,1'-бис(дифенилфосфино)ферроцена и основания, такого как фосфат калия, в подходящем инертном растворителе, например диоксане, при повышенной температуре. Соединения формулы (X) , в которых R1 представляет собой трифторметил, R3, R4, R5 и n соответствуют данному выше определению и L представляет собой подходящую защитную группу, например трет-бутоксикарбонил, могут быть получены взаимодействием соединения формулы (XI) в котором R1 представляет собой трифторметил, R3, R4, R5 и n соответствуют данному выше определению и L представляет собой подходящую защитную группу, например, трет-бутоксикарбонил, с йодом в присутствии подходящего основания, например, смеси бутиллития и 2,2,6,6-тетраметилпиперидина в подходящем инертном растворителе, таком как тетрагидрофуран, при низких температурах, как правило в диапазоне от -78 до 0 С. Соединения формулы (XI), в которых R1 представляет собой трифторметил, R3, R4, R5 и n соответствуют данному выше определению и L представляет собой подходящую защитную группу, например трет-бутоксикарбонил, могут быть получены взаимодействием 6-хлор-3-трифторметилпиридазина (полученного по методике, описанной в Goodman, A.J.; Stanforth, S.P; Tarbit В. Tetrahedron 1999, 55, 1506715070) с трет-бутил 1-пиперазинкарбоксилатом в присутствии подходящего основания, такого как диизопропилзтиламин в подходящем растворителе, таком как ацетонитрил, при подходящей температуре,либо при соответствующем нагревании или при микроволновом облучении в течение времени, которое гарантирует завершение реакции. Соединения формулы (I-c), в которых R6' представляет собой R6 в соответствии с данным выше определением, но за исключением водорода, R1 представляет собой трифторметил, R3, R4, R5, R7 и n соответствуют данным выше определениям, могут быть получены взаимодействием соединения формулы (I-d) в котором R1 представляет собой трифторметил, R3, R4, R5, R7 и n соответствуют данным выше определениям, с реагентом формулы R6'-W, в котором R6' представляет собой R6, согласно данному выше определению, но за исключением водорода, и W представляет собой уходящую группу, такую как галоген, например хлор, бром или йод, или сульфонилоксигруппу, например метилсульфонилокси, трифторметилсульфонилокси или метилфенилсульфонилокси, в присутствии основания, например диизопропилэтиламина, в подходящем растворителе, например ацетонитриле, и в подходящих условиях, например,при необходимой температуре или при соответствующем нагревании или при действии микроволнового излучения, в течение времени, которое гарантирует завершение взаимодействия. В качестве альтернативы, соединения формулы (I-c), в которых R6' представляет собой R6, согласно данному выше определению, но за исключением водорода, R1 представляет собой трифторметил, R3, R4,R5, R7 и n соответствуют данным выше определениям, могут быть получены из соединений формулы (Id), в которых R1 представляет собой трифторметил, R3, R4, R5, R7 и n соответствуют данным выше определениям, путем восстановительного N-алкилирования с использованием подходящего кетона или альдегида, в присутствии подходящего восстанавливающего средства, например триацетоксиборгидрида натрия, в подходящем растворителе, например тетрагидрофуране. Соединения формулы (I-d), в которых R1 представляет собой трифторметил, R3, R4, R5, R7 и n соответствуют данным выше определениям, могут быть получены путем удаления защитной группы из промежуточного соединения формулы (XII) в котором R1 представляет собой трифторметил, R3, R4, R5, R7 и n соответствуют данным выше определениям и L представляет собой подходящуюзащитную группу, например трет-бутоксикарбонил, в подходящих условиях, например в присутствии трифторуксусной кислоты в дихлорметане или кислотной формы ионообменной смолы Amberlyst 15 в метаноле, где L представляет собой трет-9 017508 бутоксикарбонильную группу. Соединения формулы (XII), в которых R1 представляет собой трифторметил, R3, R4, R5, R7 и n соответствуют данным выше определениям и L представляет собой подходящую защитную группу, например трет-бутоксикарбонил, могут быть получены взаимодействием соединения формулы (XIII) в котором R1 представляет собой трифторметил, R3, R4, R5 и n соответствуют данным выше определениям и L представляет собой подходящую защитную группу, например, трет-бутоксикарбонил, с соответствующей арилбороновой кислотой в присутствии подходящего катализатора, например, трансPd(ОАс)2(Cy2NH)2 (полученного по методике, описанной в Тао, В.; Boykin, D.W. Tetrahedron Lett. 2003,44, 7993-7996), в присутствии подходящего основания, например фосфата калия, в подходящем инертном растворителе, например диоксане, в подходящих условиях реакции, например, при необходимой температуре, либо при соответствующем нагревании или при действии микроволнового излучения, в течение времени, которое гарантирует завершение взаимодействия. Соединения формулы (I), в которых R1 представляет собой циано, R6 соответствует данному выше определению, но за исключением водорода, R2, R3, R4, R5 и n соответствуют данным выше определениям,могут быть получены взаимодействием соединения формулы (I-е) в котором R2, R3, R4, R5 и n соответствуют данным выше определениям, с реагентом формулы R6'W, в котором R6' представляет собой R6, согласно данному выше определению, но за исключением водорода, и W представляет собой уходящую группу, такую как галоген, например хлор, бром или йод, или сульфонилоксигруппу, например метилсульфонилокси, трифторметилсульфонилокси или метилфенилсульфонилокси, в присутствии основания, например диизопропилэтиламина, в подходящем растворителе, например ацетонитриле, и в подходящих условиях, например при необходимой температуре или при соответствующем нагревании или при действии микроволнового излучения, в течение времени, которое гарантирует завершение взаимодействия. В качестве альтернативы, соединения формулы (I), в которых R1 представляет собой циано, R6' представляет собой R6, но за исключением водорода, и R2, R3, R4, R5 и n соответствуют данным выше определениям, могут быть получены из соединения формулы (I-е), в котором R1 представляет собой циано, R6' представляет собой водород и R2, R3, R4, R5 и n соответствуют данным выше определениям, путем восстановительного N-алкилирования с использованием подходящего кетона или альдегида в присутствии подходящего восстанавливающего средства в подходящем растворителе. Соединения формулы (I), в которых R1 представляет собой циано, R6 соответствует данному выше определению и R2, R3, R4, R5 и n соответствуют данным выше определениям, могут быть получены удалением защитной группы из промежуточного соединения формулы (XIV) в котором R2, R3, R4, R5 и n соответствуют данным выше определениям и L представляет собой подходящую защитную группу, например трет-бутоксикарбонил, в подходящих условиях, например в присутствии трифторуксусной кислоты в дихлорметане или кислотной формы ионообменной смолы Amberlyst 15 в метаноле, где L представляет собой трет-бутоксикарбонильную группу. Соединения формулы (XIV), в которых R2, R3, R4, R5 и n соответствуют данным выше определениям и L представляет собой подходящую защитную группу, например, трет-бутоксикарбонил, получали взаимодействием соединения формулы (VIII), в котором R1 представляет собой хлор, и R2, R3, R4, R5 и n соответствуют данным выше определениям, и L представляет собой подходящую защитную группу, например трет-бутоксикарбонил, с цианидом цинка в присутствии подходящего катализатора, например,тетракис(трифенилфосфин)палладия(0) в подходящем растворителе, например N,N-диметилформамиде в подходящих условиях, например при необходимой температуре или при соответствующем нагревании,или при действии микроволнового излучения, в течение времени, которое гарантирует завершение взаи- 10017508 модействия. Экспериментальная часть Химические методики Реакции, проходящие при содействии микроволнового излучения, проводили в однорежимном реакторе: Emrys Optimizer microwave reactor (Personal Chemistry А.В., в настоящее время Biotage). Окончательную очистку продуктов в примерах (Е 1-Е 39) выполняли либо колоночной хроматографией на силикагеле с применением указанного элюента, либо препаративной ВЭЖХ на обращенной фазе на колонке Hyperprep RP 18 BDS (Shandon) (8 мкм, 200мм, 250 г). Для реализации градиентной методики использовали три подвижные фазы (подвижная фаза А: 90% 0,5% ацетата аммония +10% ацетонитрила; подвижная фаза В: метанол; подвижная фаза С: ацетонитрил), начиная с 75% А и 25% В при скорости потока 40 мл/мин сохраняли эти параметры в течение 0,5 мин и затем увеличивали скорость потока до 80 мл/мин в течение 0,01 мин, доводя до соотношения компонентов 50% В и 50% С в течение 41 мин и до 100% С в течение 20 мин и сохраняли эти условия в течение 4 мин. Спектры 1 Н регистрировали на спектрометрах Bruker DPX 360, DPX 400 или Bruker AV-500. Химические сдвиги выражены в миллионных долях относительно тетраметилсилана. Определение температур плавления осуществляли на приборе FP62. ЖХМС Общая методика ЖХМС, методика А. Измерения ЖХМС проводили с использованием прибора HP 1100 фирмы Agilent Technologies,включавшего насос для четырехкомпонентных смесей с дегазатором, устройство для автоматической загрузки образцов, печь для колонки (установленную на 40 С, за исключением методики 4, в которой температура была установлена на 60 С), детектор на диодной матрице (DAD) и колонку, указанную ниже в описании соответствующей методики. Часть потока из колонки поступала на МС-детектор. МСдетектор был сконфигурирован для работы с источником ионизации электрораспылением. В качестве распыляющего газа применяли азот. Температуру источника поддерживали равной 140 С. Регистрацию данных производили с использованием программы MassLynx-Openlynx. Общая методика ЖХМС, методика В. Измерения ЖХМС осуществляли с использованием модуля Agilent 1100, включавшего насос, детектор на диодной матрице (DAD) (использовалась длина волны 220 нм), подогреватель колонки и колонку, указанную ниже в описании соответствующей методики. Часть потока из колонки поступала наAgilent MSD Series G1946C и G1956A. МС-детектор был сконфигурирован для работы с API-ES (ионизация электрораспылением при атмосферном давлении). Масс-спектры регистрировали путем сканирования от 100 до 1000. Напряжение на капиллярной игле составляло 2500 В для режима ионизации положительным напряжением и 3000 В для режима ионизации отрицательным напряжением. Напряжение фрагментации составляло 50 В. Температуру осушающего газа поддерживали на уровне 350 С при скорости потока 10 л/мин. Методика 1. ЖХМС. В дополнение к общей методике А ЖХМС: осуществляли ВЭЖХ на обращенной фазе на колонке АСЕ-С 18 (3,0 мкм, 4,630 мм) фирмы Advanced Chromatography Technologies, при скорости потока 1,5 мл/мин. Условия градиентного элюирования: 80% А (раствор ацетата аммония 0,5 г/л), 10% В (ацетонитрил), 10% С (метанол) до 50% В и 50% С в течение 6,5 мин, до 100% В на 7 мин и возвращение к исходным условиям на 7,5 мин до 9,0 мин. Объем впрыска 5 мкл. Масс-спектры высокого разрешения (время пролета, TOF) регистрировали только в режиме ионизации положительным зарядом, путем сканирования от 100 до 750 в течение 0,5 с с использованием времени задержки 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима ионизации положительным зарядом и напряжение на конусе составляло 20 В. Стандартным веществом, используемым для калибровки масс-спектра, являлся лейцин-энкефалин. Методика 2 ЖХМС. В дополнение к общей методике А ЖХМС: осуществляли ВЭЖХ на обращенной фазе на колонке АСЕ-С 18 (3,0 мкм, 4,630 мм) фирмы Advanced Chromatography Technologies, при скорости потока 1,5 мл/мин. Условия градиентного злюирования: 80% А (раствор ацетата аммония 0,5 г/л), 10% В (ацетонитрил), 10% С (метанол) до 50% В и 50% С в течение 6,5 мин, до 100% В на 7 мин, и возвращение к исходным условиям на 7,5 мин до 9,0 мин. Объем впрыска 5 мкл. Масс-спектры высокого разрешения (время пролета, TOF) регистрировали путем сканирования от 100 до 750 в течение 0,5 с с использованием времени задержки 0,3 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима ионизации положительным зарядом и 2,9 кВ для режима ионизации отрицательным зарядом. Напряжение на конусе составляло 20 В для обоих режимов ионизации положительным и отрицательным зарядом. Стандартным веществом, используемым для калибровки масс-спектра, являлся лейцин-энкефалин. Методика 3 ЖХМС. То же, что и в методике 1, с использованием объема впрыска 10 мкл. Методика 4 ЖХМС. В дополнение к общей методике А ЖХМС: осуществляли ВЭЖХ на обращенной фазе с использо- 11017508 ванием картриджа XDB-C18 (1,8 мкм, 2,130 мм) фирмы Agilent, при скорости потока 1 мл/мин. Условия градиентного элюирования: 90% А (раствор ацетата аммония 0,5 г/л), 5% В (ацетонитрил), 5% С (метанол) до 50% В и 50% С в течение 6,5 мин, до 100% В на 7 мин, и возвращение к исходным условиям на 7,5 минуте до 9,0 мин. Объем впрыска 2 мкл. Масс-спектры высокого разрешения (время пролета, TOF) регистрировали только в режиме ионизации положительным зарядом, путем сканирования от 100 до 750 в течение 0,5 с с использованием времени задержки 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима ионизации положительным зарядом, и напряжение на конусе составляло 20 В. Стандартным веществом, используемым для калибровки масс-спектра, являлся лейцин-энкефалин. Методика 5 ЖХМС. В дополнение к общей методике А ЖХМС: осуществляли ВЭЖХ на обращенной фазе на колонке АСЕ-С 18 (3,0 мкм, 4,630 мм) фирмы Advanced Chromatography Technologies, при скорости потока 1,5 мл/мин. Условия градиентного элюирования: 80% А (раствор бикарбоната аммония 1 г/л), 10% В (ацетонитрил), 10% С (метанол) до 50% В и 50% С в течение 6,5 мин, до 100% В на 7 мин, и возвращение к исходным условиям на 7,5 мин до 9,0 мин. Объем впрыска 5 мкл. Масс-спектры высокого разрешения(время пролета, TOF) регистрировали только в режиме ионизации положительным зарядом, путем сканирования от 100 до 750 в течение 0,5 с с использованием времени задержки 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима ионизации положительным зарядом, и напряжение на конусе составляло 20 В. Стандартным веществом, используемым для калибровки масс-спектра, являлся лейцин-энкефалин. Методика 6 ЖХМС. В дополнение к общей методике В ЖХМС: осуществляли ВЭЖХ на обращенной фазе на колонкеYMC-Pack ODS-AQ, 502,0 мм, 5 мкм, при скорости потока 0,8 мл/мин. Использовали две подвижные фазы (подвижная фаза А: вода с 0,1% ТФУ; подвижная фаза В: ацетонитрил с 0,05% ТФУ). На первом этапе осуществляли элюирование 100% А в течение 1 мин. Затем постепенно доводили состав элюента до 40% А и 60% В в течение 4 мин и выдерживали 2,5 мин. Использовали типовой объем впрыска 2 мкл. Температура печи составляла 50 С. (Полярность МС: положительная). Методика 7 ЖХМС. В дополнение к общей методике В ЖХМС: осуществляли ВЭЖХ на обращенной фазе на колонкеYMC-Pack ODS-AQ, 502,0 мм, 5 мкм, при скорости потока 0,8 мл/мин. Использовали две подвижные фазы (подвижная фаза А: вода с 0,1% ТФУ; подвижная фаза В: ацетонитрил с 0,05% ТФУ). На первом этапе осуществляли элюирование 90% А и 10% В в течение 0,8 мин. Затем постепенно доводили состав элюента до 20% А и 80% В в течение 3,7 мин и выдерживали 3 мин. Использовали типовой объем впрыска 2 мкл. Температура печи составляла 50 С. (Полярность МС: положительная). Описание синтеза 1. 5,5,5-Трифтор-4-оксо-3-фенилпент-2-еновая кислота (D1) К перемешиваемому раствору фенилмалеинового ангидрида (18,7 г, 0,107 моль) в ацетонитрилеCsF (18,6 г, 0,127 моль) и затем по каплям добавляли CF3SiMe3 (18,58 мл, 0,127 моль). Реакционную смесь перемешивали в течение 1 ч, затем разбавляли диэтиловым эфиром и экстрагировали 2 М гидроксидом натрия (200 мл). Отделенный водный слой подкисляли до рН 1 добавлением концентрированной хлористо-водородной кислоты. Эту смесь экстрагировали дихлорметаном. Отделенный органический слой высушивали (Na2SO4) и выпаривали растворитель в вакууме, получая соединение D1 (22,6 г, 86%) в виде смеси изомеров (соотношение 80/11 по данным ЖХМС). Вычисленная масса для C11H7F3O3 составляет 244; найдено 243 (M-Н). Описание синтеза 2. 5-Фенил-6-трифторметил-2H-пиридазин-3-он (D2) К перемешиваемому раствору 5,5,5-трифтор-4-оксо-3-фенилпент-2-еновой кислоты (D1) (22,6 г,0,084 моль) в смеси ацетонитрила (150 мл) и уксусной кислоты (15 мл) добавляли гидразингидрат (7,75 мл, 0,148 моль). Реакционную смесь нагревали до кипения с обратным холодильником в течение 16 ч,охлаждали до комнатной температуры, разбавляли дихлорметаном и затем экстрагировали 0,5 М хлористоводородной кислотой (150 мл). Органический слой отделяли, высушивали (Na2SO4) и выпаривали растворитель в вакууме, получая соединение D2 (20,7 г, 100%) в виде смеси изомеров (в соотношении 75/5 по данным ЖХМС). Вычисленная масса для C11H7F3N2O составляет 240; найдено 239 (М-Н-). Описание синтеза 3. 6-Хлор-4-фенил-3-трифторметилпиридазин (D3). К перемешиваемому раствору 5-фенил-6-трифторметил-2H-пиридазин-3-она (D2) (20,66 г, 0,086 моль) в ацетонитриле (150 мл) добавляли оксихлорид фосфора (20 мл, 0,215 ммоль) и реакционную смесь нагревали до кипения с обратным холодильником в течение 1 ч. После этого реакционную смесь выливали в смесь насыщенного раствора гидрокарбоната натрия, льда и дихлорметана. После этого добавляли дополнительное количество твердого гидрокарбоната натрия до прекращения выделения газа. Затем отделяли органический слой, высушивали (Na2SO4) и выпаривали растворитель в вакууме. Затем неочищенный остаток фильтровали через силикагель, промывая дихлорметаном для удаления минорного изомера. После выпаривания растворителя неочищенный продукт повторно очищали колоночной хроматографией (диоксид кремния; 0-25% этилацетат/гептан), получая D3 (7,1 г, 32%). Вычисленная масса для К перемешиваемому раствору 6-хлор-4-фенил-3-трифторметилпиридазина (D3) (7,1 г, 0,0274 моль) и N-Вос-пиперазина (5,62 г, 0,0302 моль) в ацетонитриле (150 мл) добавляли диизопропилэтиламин (5,1 мл, 0,0302 моль) и нагревали смесь до 150 С в течение 20 мин при действии микроволнового излучения. По истечении этого времени реакционную смесь разбавляли дихлорметаном и экстрагировали водой. Органический слой отделяли, высушивали (MgSO4) и выпаривали растворители в вакууме. Неочищенный продукт очищали колоночной хроматографией (оксид кремния; 20% этилацетат в гептане, затем 10% этилацетат в дихлорметане). После выпаривания растворителя полученный продукт перекристаллизовывали из гептана, получая соединение D4 (10,4 г, 93%). Вычисленная масса для C20H23F3N4O2 составляет 408; найдено 409 (МН+). Описание синтеза 5. 5,5,5-Трифтор-3-(4-фторфенил)-4-оксопент-2-еновая кислота (D5) К перемешиваемому раствору 4-фторфенилмалеинового ангидрида (1,42 г, 7,39 ммоль) (полученного по методике, аналогичной описанной в Dean, W.D.; Bum, D.M. J. Org. Chem. 1993, 58, 7916-7917) в ацетонитриле (15 мл) при 0 С (баня лед/вода/хлорид натрия, температура бани -10 С) в атмосфере азота добавляли CsF (1,1 г, 7,39 ммоль) и затем по каплям добавляли CF3SiMe3 (1 мл, 7,39 ммоль). Реакционную смесь перемешивали в течение 1 ч и затем разбавляли диэтиловым эфиром и экстрагировали 2 М гидроксидом натрия (200 мл). Органический слой удаляли и водный слой подкисляли до рН 1 добавлением концентрированной хлористоводородной кислоты. Полученную смесь экстрагировали дихлорметаном, отделяли органический слой, высушивали (Na2SO4) и удаляли растворитель в вакууме, получая соединение D5 (1,4 г, 72%) в виде смеси изомеров. Вычисленная масса для C11H6F4O3 составляет 262; найдено 261 (М-H-). Описание синтеза 6. 5-(4-Фторфенил)-6-трифторметил-2H-пиридазин-3-он (D6).(1,4 г, 5,3 ммоль) в смеси этанола (10 мл) и уксусной кислоты (1 мл) добавляли гидразингидрат (0,49 мл,9,33 ммоль). Реакционную смесь нагревали до кипения с обратным холодильником в течение 16 ч, охлаждали до комнатной температуры, разбавляли дихлорметаном и затем экстрагировали 0,5M хлористоводородной кислотой (150 мл). Органический слой отделяли, высушивали (Na2SO4) и выпаривали растворитель в вакууме, получая соединение D6 (0,96 г, 70%) в виде смеси изомеров. Вычисленная масса для C11H6F4N2O составляет 258; найдено 25 9 (MH+). Описание синтеза 7. 6-Хлор-4-(4-фторфенил)-3-трифторметилпиридазин (D7). К перемешиваемому раствору 5-(4-фторфенил)-6-трифторметил-2H-пиридазин-3-она (D6) (0,96 г,3,7 ммоль) в ацетонитриле (10 мл) добавляли оксихлорид фосфора (0,866 мл, 9,3 ммоль) и реакционную смесь перемешивали при 180 С в течение 30 мин при микроволновом облучении. По истечении этого времени реакционную смесь выливали в смесь насыщенного раствора гидрокарбоната натрия, льда и дихлорметана. Затем добавляли дополнительное количество твердого гидрокарбоната натрия до прекращения выделения газа. Затем органический слой отделяли, высушивали (Na2SO4) и выпаривали растворитель в вакууме, получая соединение D7 (0,81 г, 79%). После обработки были обнаружены лишь следовые количества нежелательного изомера. Вычисленная масса для C11H5ClF4N2 составляет 276; найдено 277 (МН+). Описание синтеза 8. трет-Бутиловый эфир 4-[5-(4-фторфенил)-6-трифторметилпиридазин-3 ил]пиперазин-1-карбоновой кислоты (D8) К перемешиваемому раствору 6-хлор-4-(4-фторфенил)-3-трифторметилпиридазина (D7) (0,81 г, 2,93 ммоль) и N-Boc-пиперазина (0,818 г, 4,39 ммоль) в ацетонитриле (10 мл) добавляли диизопропилэтиламин (1 мл, 5,9 ммоль) и смесь перемешивали при 80C в течение 30 мин при микроволновом облучении. По завершении этого времени реакционную смесь разбавляли дихлорметаном и экстрагировали водой. Органический слой отделяли, высушивали (MgSO4) и выпаривали растворители в вакууме, получая соединение D8 (1,27 г, 62%). Вычисленная масса для C20H22F4N4O2 составляет 426; найдено 427 (MH+). Описание синтеза 9. трет-Бутиловый эфир 4-(6-трифторметилпиридазин-3-ил)пиперазин-1 карбоновой кислоты (D9) Смесь 6-хлор-3-трифторметилпиридазина (0,666 г, 5,09 ммоль) (полученного по методике, описанной в Goodman, A.J.; Stanforth, S.P; Tarbit B. Tetrahedron 1999, 55, 15067-15070), N-Boc-пиперазина (1,138 г, 6,11 ммоль) и диизопропилэтиламина (1,95 мл, 1,12 ммоль) в ацетонитриле (10 мл) перемешивали при 180 С в течение 30 мин при микроволновом облучении. Растворитель выпаривали в вакууме и остаток очищали колоночной хроматографией (силикагель; гексан/этилацетат), получая соединение D9 (1,67 г,99%) в виде светло-желтого твердого вещества. Вычисленная масса для C14H19F3N4O2 составляет 332; найдено 333 (МН+). Описание синтеза 10. трет-Бутиловый эфир 4-(5-йод-6-трифторметилпиридазин-3-ил)пиперазин-1 карбоновой кислоты (D10) К смеси бутиллития (2,5M в гексанах) (6,31 мл, 15,79 ммоль) и тетрагидрофурана (125 мл) при 0 С добавляли 2,2,6,6-тетраметилпиперидин (3,808 мл, 22,56 ммоль). Полученную реакционную смесь затем перемешивали при комнатной температуре в течение 1 ч. Смесь охлаждали до -78 С и затем добавляли раствор трет-бутилового эфира 4-(6-трифторметилпиридазин-3-ил)пиперазин-1-карбоновой кислоты (D9)(2,5 г, 7,52 ммоль) в тетрагидрофуране (20 мл). Смесь перемешивали в течение 1 ч при -78 С и затем добавляли раствор йода (2,29 г, 9,024 ммоль) в тетрагидрофуране (10 мл). Эту смесь перемещивали при-78 С в течение 1 ч и затем разбавляли 10% раствором уксусной кислоты в тетрагидрофуране. Затем температуре смеси давали подняться до комнатной и после этого выпаривали растворитель в вакууме. Остаток разбавляли дихлорметаном и экстрагировали водой. Органический слой отделяли, высушивали(MgSO4), фильтровали и выпаривали растворитель в вакууме. Остаток осаждали из диэтилового эфира,получая соединение D10 (2,81 г, 82%) в виде светло-желтого твердого вещества. Вычисленная масса для Смесь трет-бутилового эфира 4-(5-йод-6-трифторметилпиридазин-3-ил)пиперазин-1-карбоновой кислоты (D10) (0,20 г, 0,436 ммоль), о-толилбороновой кислоты (0,071 г, 0,523 ммоль), дихлорида 1,1'бис(дифенилфосфино)ферроценпалладия(II), дихлорметана (0,022 г, 0,026 ммоль), 1,1'-бис(дифенилфосфино)ферроцена (0,015 г, 0,026 ммоль) и фосфата калия (0,138 г, 0,654 ммоль) в диоксане (8,5 мл) перемешивали при 80 С в течение 16 ч и затем при 110 С в течение 2 дней. Затем смесь фильтровали через слой диатомовой земли и выпаривали растворитель в вакууме. Остаток очищали колоночной хроматографией (силикагель; дихлорметан/метанол 70/30), получая D11 (0,089 г, 48%) в виде твердого вещества желтого цвета. Вычисленная масса для C21H25F3N4O2 составляет 422; найдено 423 (MH+). Описание синтеза 12. трет-Бутиловый эфир 4-[5-(4'-фторбифенил-4-ил)-6-трифторметилпиридазин 3-ил]пиперазин-1-карбоновой кислоты (D12) Смесь трет-бутилового эфира 4-[5-(4-бромфенил)-6-трифторметилпиридазин-3-ил]пиперазин-1 карбоновой кислоты (0,2 г, 0,41 ммоль) (полученного по методике, аналогичной описанной методике получения D8), 4-фторбензолбороновой кислоты (0,069 г, 0,49 ммоль), транс-Pd(OAc)2(Cy2NH)2 (0,015 г,0,026 ммоль) (полученного по методике, описанной в Тао, В.; Boykin, D.W. Tetrahedron Lett. 2003, 44,7993-7996) и фосфата калия (0,261 г, 1,23 ммоль) в диоксане (3 мл) перемешивали при 80 С в течение ночи. Затем реакционную смесь разбавляли дихлорметаном и экстрагировали насыщенным раствором карбоната натрия. Органические слои отделяли, высушивали (Na2SO4), фильтровали и выпаривали растворитель в вакууме. После этого остаток очищали колоночной хроматографией (силикагель; дихлорметан/гептан 3:7-10:0). Желаемые фракции собирали и упаривали в вакууме, получая соединение D12(0,115 г, 56%). Вычисленная масса для C26H26F4N4O2 составляет 502; найдено 503 (MH+). Описание синтеза 13. трет-Бутиловый эфир 4-(6-хлор-5-фенилпиридазин-3-ил)пиперазин-1 карбоновой кислоты (D13)WO-2005/013907, N-Boc-пиперазина (0,509 г, 2,37 ммоль) и диизопропилэтиламина (0,634 мл, 3,64) в ацетонитриле (7,5 мл) перемешивали при 180 С в течение 40 мин при микроволновом облучении, и затем еще в течение 30 мин. По завершении этого времени добавляли дополнительные количества диизопропилэтиламина (0,1 мл, 0,57 ммоль) и N-Boc-пиперазина (0,1 г, 0,54 ммоль) и полученную смесь перемешивали при 180 С в течение 40 мин. Растворитель выпаривали в вакууме и затем добавляли дихлорметан и насыщенный раствор хлорида аммония. Органический слой отделяли, высушивали (Na2SO4), фильтровали и выпаривали растворитель в вакууме. После этого очищали остаток колоночной хроматографией(силикагель; дихлорметан и гептан/этилацетат 8:2-7:3). Желаемые фракции собирали и упаривали в вакууме, получая D13 (0,137 г, 20%) в виде белого твердого вещества. Вычисленная масса для К смеси цианида цинка (0,077 г, 0,66 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,1 г, 0,09 ммоль) добавляли раствор трет-бутилового эфира 4-(6-хлор-5-фенилпиридазин-3-ил)пиперазин-1 карбоновой кислоты (D13) (0,137 г, 0,36 ммоль) в N,N-диметилформамиде (3,5 мл). Полученную смесь перемешивали при 160 С в течение 30 мин при микроволновом облучении. Растворитель выпаривали в вакууме, получая соединение D14 (0,133 г, количественный выход). Вычисленная масса для C20H23N5O2 Смесь трет-бутилового эфира 4-(5-йод-6-трифторметилпиридазин-3-ил)пиперазин-1-карбоновой кислоты (D10) (0,20 г, 0,436 ммоль), 5-хлортиофен-2-бороновой кислоты (0,082 г, 0,51 ммоль), тетракис(трифенилфосфин)палладия(0) (0,024 г, 0,021 ммоль) и карбоната натрия (0,103 г, 0,96 ммоль) в дихлорметане (3 мл) и воде (0,75 мл) перемешивали в запаянной трубке при 110 С в течение 16 ч. Затем смесь фильтровали через слой диатомовой земли и выпаривали растворитель в вакууме. Остаток очищали колоночной хроматографией (силикагель; дихлорметан/10% аммиак в метаноле (7M) в дихлорметане 97/3), получая соединение D15 (0,152 г, 67%) в виде желтого сиропа. Вычисленная масса для К раствору трет-бутилового эфира 4-(5-фенил-6-трифторметилпиридазин-3-ил)пиперазин-1 карбоновой кислоты (D4) (1,8 г, 0,0044 моль) в метаноле (125 мл) добавляли кислотную форму ионообменной смолы Amberlyst 15 (4,1 ммоль/г) (5,3 г, 0,022 моль) и реакционную смесь встряхивали при комнатной температуре в течение 18 ч. По завершении этого времени смесь фильтровали и затем добавляли насыщенный раствор аммиака в метаноле. Смесь встряхивали в течение 1 ч, фильтровали и фильтрат упаривали в вакууме. Неочищенный продукт кристаллизовали из смеси эфир/гептан, получая соединение Е 1 (1,3 г, 96%). Вычисленная масса для C15H15F3N4 составляет 308; найдено 309 (МН+). Температура плавления (эфир/гептан): 130,7 С. 1 Н ЯМР (500 МГц, хлороформ-d)м.д.: 1,71 (ушир.с, 1 Н), 3,01 (т, J=5,20 Гц, 4 Н), 3,77 (т, J=5,20 Гц,4 Н), 6,71 (с, 1 Н), 7,29-7,37 (м, 2 Н), 7,42-7,49 (м, 3 Н). 13 С ЯМР (126 МГц, хлороформ-d)м.д.: 45,72 (с,2 СН 2), 45,76 (с, 2 СН 2), 112,73 (с, СН), 122,48 (кв., J=581 Гц, С), 128,19 (с, СН), 128,36 (с, 2 СН), 129,01 (с,СН), 135,66 (с, С), 140,55 (с, С), 141,03 (с, С), 160,22 (с, С). Пример 2. 6-(4-Этилпиперазин-1-ил)-4-фенил-3-трифторметилпиридазин (E2). К смеси 4-фенил-6-пиперазин-1-ил-3-трифторметилпиридазин (E1) (0,15 г, 0,49 ммоль) в тетрагидрофуране (5 мл) добавляли ацетальдегид (55 мл, 0,97 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин и затем добавляли триацетоксиборгидрид натрия (0,154 г, 0,73 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем добавляли дополнительное количество ацетальдегида (55 мл, 0,97 ммоль) и триацетоксиборгидрида натрия (0,154 г,0,73 ммоль) и смесь перемешивали при комнатной температуре в течение 4 ч. Затем добавляли дихлорметан и смесь экстрагировали насыщенным раствором хлорида аммония. Органическую фазу отделяли,высушивали (Na2SO4), фильтровали и выпаривали растворитель в вакууме. Остаток очищали колоночной хроматографией (силикагель; этилацетат/10% аммиак в метаноле (7 М) в дихлорметане 10:0 - 8:2). Собирали желаемые фракции, растворитель выпаривали в вакууме, остаток растворяли в ацетонитриле и превращали в соль хлористо-водородной кислоты добавлением насыщенного раствора хлористо-водородной кислоты в диэтиловом эфире. Полученное белое твердое вещество фильтровали и высушивали, получая Е 2 (0,039 г, 21%). C17H19F3N4HCl, вычисленная масса свободного основания составляет 336; найдено 337 Смесь 4-фенил-6-пиперазин-1-ил-3-трифторметилпиридазина (Е 1) (0,050 г, 0,16 ммоль), 3,5 дифторбензилбромида (0,031 мл, 0,24 ммоль) и диизопропилэтиламина (0,056 мл, 0,32 ммоль) в ацетонитриле (2 мл) перемешивали при 100 С в течение 10 мин при действии микроволнового излучения. Растворитель выпаривали в вакууме и затем добавляли дихлорметан и хлорид аммония (10% водный раствор). Смесь фильтровали через картридж с диатомовой землей. Затем растворитель выпаривали в вакууме и остаток очищали с помощью CC-TLC (центробежной круговой тонкослойной хроматографии) на хроматотроне (препаративный радиальный тонкослойный хроматограф с центробежным ускорением). Полученный неочищенный продукт кристаллизовали из смеси эфир/гептан, получая соединение Е 3(0,037 г, 52%) в виде твердого вещества. Вычисленная масса для C22H19F5N4 составляет 434; найдено 435 (МН+). Температура плавления: 138,8 С. 1H ЯМР (400 МГц, хлороформ-d)м.д.: 2,56-2,62 (м, 4 Н), 3,54 (с,2 Н), 3,78-3,85 (м, 4 Н), 6,72 (тт, J=8,91, 2,28 Гц, 1 Н), 6,71 (с, 1 Н), 6,86-6,95 (м, 2 Н), 7,28-7,35 (м, 2 Н), 7,417,51 (м, 3 Н). Пример 4. цис-6-(3,5-Диметилпиперазин-1-ил)-4-фенил-3-трифторметилпиридазин (E4). Смесь 6-хлор-4-фенил-3-трифторметилпиридазина (D3) (0,15 г, 0,58 ммоль), 2,6-цисдиметилпиперазина (0,097 г, 0,87 ммоль) и диизопропилэтиламина (0,2 02 мл, 1,16 ммоль) в ацетонитриле (3 мл) перемешивали при 180 С в течение 30 мин при действии микроволнового излучения. Растворитель выпаривали в вакууме и затем добавляли дихлорметан и насыщенный раствор хлорида аммония. Смесь фильтровали и растворитель выпаривали в вакууме. Остаток очищали колоночной хроматографией (силикагель; 1-3% аммиак в метаноле (7 М)/дихлорметан). Желаемые фракции собирали и упаривали в вакууме. Полученный таким образом продукт обрабатывали раствором хлористоводородной кислоты в диэтиловом эфире (2 М), получая соответствующую соль соединения Е 4 (0,058 г, 27%; ЦИС) в виде бледно-коричневого твердого вещества. C17H19F3N4HCl, вычисленная масса свободного основания составляет 336; найдено 337 (МН+). Температура плавления (эфир): 285,4 С. 1H ЯМР (400 МГц, ДМСО-d6)м.д.: 1,32 (д, J=6,63 Гц,6 Н), 3,08 (дд, J=13,99, 11,51 Гц, 2 Н), 3,30-3,41 (м, 2 Н), 4,76 (д, J=13,27 Гц, 2 Н), 7,36-7,43 (м, 3 Н), 7,49-7,55 Смесь 6-хлор-4-фенил-3-трифторметилпиридазина (D3) (0,10 г, 0,39 ммоль), октагидропирроло(1,2 а)пиразина в виде рацемической смеси (0,053 г, 0,42 ммоль) и диизопропилэтиламина (0,103 мл, 0,585 ммоль) в ацетонитриле (3 мл) перемешивали при 150 С в течение 30 мин при действии микроволнового излучения. Затем реакционную смесь разбавляли дихлорметаном (25 мл) и экстрагировали насыщенным раствором карбоната натрия (12 мл). Органический слой отделяли, высушивали (Na2SO4), фильтровали и выпаривали растворитель в вакууме. После этого остаток очищали колоночной хроматографией (силикагель; 0-2,5% аммиак в метаноле (7 М)/дихлорметан). Желаемые фракции собирали и упаривали в вакууме. Остаток осаждали из смеси ацетонитрил/гептан. Полученный продукт обрабатывали раствором хлористоводородной кислоты в диэтиловом эфире (2 М), получая соответствующую соль соединения Е 5(0,081 г, 54%) в виде белого твердого вещества.C18H19F3N4HCl, вычисленная масса свободного основания составляет 348; найдено 349 (MH+). Температура плавления: 104,2 С. 1 Н ЯМР (500 МГц, ДМСО-d6)м.д.: 1,71-2,25 (м, 3,5 Н), 2,88-3,01 К раствору трет-бутилового эфира 4-[5-(4-фторфенил)-6-трифторметилпиридазин-3-ил]пиперазин 1-карбоновой кислоты (D8) (1,25 г, 2,93 ммоль) в метаноле (50 мл) добавляли кислотную форму ионообменной смолы Amberlyst 15 (4,1 ммоль/г) (3,6 г, 14,64 ммоль) и реакционную смесь встряхивали при комнатной температуре в течение 18 ч. По окончании этого времени смесь фильтровали и затем добавляли насыщенный раствор аммиака в метаноле. Эту смесь встряхивали в течение 1 ч, фильтровали и фильтрат упаривали в вакууме. Неочищенный продукт очищали ВЭЖХ. Желаемые фракции собирали и упаривали в вакууме, получая соединение Е 6 (0,507 г, 53%). Вычисленная масса C15H14F4N4 составляет 326; найдено 327 (МН+). Температура плавления: 137,4 С. 1D8, в метаноле (5 мл) добавляли кислотную форму ионообменной смолы Amberlyst 15 (4,1 ммоль/г)(0,218 г, 0,89 ммоль) и реакционную смесь встряхивали при комнатной температуре в течение 18 ч. По окончании этого времени смесь фильтровали и затем добавляли насыщенный раствор аммиака в метаноле. Эту смесь встряхивали в течение 1 ч, фильтровали и фильтрат упаривали в вакууме. Неочищенный продукт кристаллизовали из смеси эфир/гептан, получая соединение Е 7 (0,049 г, 87%). Вычисленная масса C13H13F3N4S составляет 314; найдено 315 (МН+). Температура плавления (эфир/гептан): 244,3 С. 1 К раствору трет-бутилового эфира 4-[5-(2-толил)-6-трифторметилпиридазин-3-ил]пиперазин-1 карбоновой кислоты (D11) (0,089 г, 0,21 ммоль) в метаноле (7 мл) добавляли кислотную форму ионообменной смолы Amberlyst 15 (4,1 ммоль/г) (0,257 г, 1,05 ммоль) и реакционную смесь встряхивали при комнатной температуре в течение 18 ч. По окончании этого времени смесь фильтровали и затем добавляли насыщенный раствор аммиака в метаноле. Эту смесь встряхивали в течение 1 ч, фильтровали и фильтрат упаривали в вакууме. Остаток очищали ВЭЖХ и собирали желаемые фракции, получая соединение Е 8 (0,026 г, 50%) в виде твердого вещества. Вычисленная масса C16H17F3N4 составляет 322; найдено 323 (MH+). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д.: 2,05 (с, 3 Н), 2,74-2,83 (м, 4 Н), 3,37 (ушир.с, 1 Н), 3,62-3,72 (м,4 Н), 7,15 (т, J=3,63 Гц, 2 Н), 7,26 (тд, J=7,26, 1,66 Гц, 1 Н), 7,31-7,38 (м, 2H). Пример 9. 4-(4'-фторбифенил-4-ил)-6-пиперазин-1-ил-3-трифторметилпиридазин (Е 9)(8 мл) перемешивали при комнатной температуре в течение 2 ч. Растворитель выпаривали в вакууме и затем добавляли дихлорметан и насыщенный раствор карбоната натрия. Органические слои отделяли,высушивали (Na2SO4), фильтровали и выпаривали растворитель в вакууме. После этого очищали остаток колоночной хроматографией (силикагель; 1-3% аммиак в метаноле (7 М)/дихлорметан). Желаемые фрак- 18017508 ции собирали и упаривали в вакууме, получая соединение Е 9 (0,084 г, 91%). Вычисленная масса C21H18F4N4 составляет 402; найдено 403 (MH+). Температура плавления: 161,9 С. 1 Н ЯМР (400 МГц, хлороформ-d)м.д.: 1,72 (ушир.с, 1 Н), 2,993,05 (м, 4 Н), 3,75-3,82 (м, 4 Н), 6,74 (с, 1 Н), 7,13-7,20 (м, 2 Н), 7,40 (д, J=8,29 Гц, 2 Н), 7,57-7,64 (м, 4 Н). Пример 10. 4-Фенил-6-пиперазин-1-илпиридазин-3-карбонитрил (Е 10). К раствору трет-бутилового эфира 4-(6-циано-5-фенилпиридазин-3-ил)пиперазин-1-карбоновой кислоты (D14) (0,133 г, 0,37 ммоль) в метаноле (10 мл) добавляли кислотную форму ионообменной смолыAmberlyst 15 (4,1 ммоль/г) (1,3 г, 5,3 ммоль) и реакционную смесь встряхивали при комнатной температуре в течение 18 ч. По окончании этого времени смесь фильтровали и затем добавляли насыщенный раствор аммиака в метаноле. Эту смесь встряхивали в течение 1 ч, фильтровали и фильтрат упаривали в вакууме. Остаток очищали ВЭЖХ. Собирали желаемые фракции и упаривали в вакууме, получая соединение Е 10 (0,06989 г, 72%) в виде твердого вещества белого цвета. Вычисленная масса C15H15N5 составляет 265; найдено 266 (МН+). Температура плавления: 271,6 С. 1H ЯМР (400 МГц, ДМСО-d6)м.д.: 2,77-2,84 (м, 4 Н), 3,34 К раствору трет-бутилового эфира 4-[5-(5-хлортиофен-2-ил)-6-трифторметилпиридазин-3-ил]пиперазин-1-карбоновой кислоты (D15) (0,114 г, 0,25 ммоль) в метаноле (10 мл) добавляли кислотную форму ионообменной смолы Amberlyst 15 (4,1 ммоль/г) (0,305 г, 1,25 ммоль) и реакционную смесь встряхивали при комнатной температуре в течение 18 ч. По окончании этого времени смесь фильтровали и затем добавляли насыщенный раствор аммиака в метаноле. Эту смесь встряхивали в течение 1 ч, фильтровали и фильтрат упаривали в вакууме. После этого очищали остаток колоночной хроматографией (силикагель; 3% раствора аммиака в метаноле (7 М)/дихлорметан). Желаемые фракции собирали и упаривали в вакууме. Полученный продукт растворяли в 2 М растворе хлористоводородной кислоты в диэтиловом эфире и смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель выпаривали в вакууме. Полученное твердое вещество растирали с диэтиловым эфиром, получая соединение Е 27 (0,062 г, 87%). Вычисленная масса C13H12ClF3N4S составляет 348; найдено 349 (МН+). Температура плавления: разлагается. 1 Н ЯМР (500 МГц, ДМСО-d6)м.д.: 3,24 (ушир.с, 4 Н), 4,07 (д, J=5,2 Гц, 4H), 7,23 (д, J=3,8 Гц, 1 Н),7,26 (д, J=3,8 Гц, 1H), 7,41 (с, 1H), 9,45 (ушир.с, 2 Н). Пример 40. 4-Фенил-6-пиперазин-1-ил-3-трифторметилпиридазина моногидрохлорид (Е 40). К раствору Е 1 (16 г, 51,90 ммоль) в 2-бутаноне (400 мл), нагретому до 50 С, по каплям добавляли раствор хлористо-водородной кислоты в 2-пропаноле (6 н, 51,90 ммоль). Смесь нагревали до кипения с обратным холодильником в течение 90 мин и затем перемешивали в течение 2 ч при 50C и после этого в течение ночи при комнатной температуре. Выпавшие в осадок кристаллы отделяли фильтрованием и высушивали в вакууме при 45 С, получая Е 40 (10,4 г, 58%). Температура плавления: 185 С (с разложением). Соединения примеров (Е 11-Е 19) получали по методикам, аналогичным описанным в примере (Е 6). Соединение примера (Е 20) получали снятием защиты с соединения, полученного в описании синтеза (D13) по методике, аналогичной описанной для примера(Е 1). Соединение примера (Е 28) получали по аналогии с (Е 27), но с применением карбоната калия в качестве основания и 1,4-диоксана в качестве растворителя. Соединения примеров (Е 29)(1,4-диоксан/H2O), (Е 34) (1,4-диоксан/H2O) и (Е 35) (1,4-диоксан/H2O) получали по методикам, аналогичным методике, описанной для соединения примера (Е 27), но с использованием растворителей, указанных для каждого случая соответственно. Соединения примеров (Е 18, Е 27, Е 28, Е 31, Е 32, Е 33 и Е 34) выделяли в виде солей хлористо-водородной кислоты. Значения в столбце Мол. масса свободное основание представляет собой точное значение массы,- 19017508 вычисленное с использованием точных значений масс наиболее распространенных изотопов.(Е 3), соединения примеров (Е 22, Е 24 и Е 25) получали по методике, аналогичной методике, описанной для получения (Е 2), соединение (Е 23) получали из (Е 1) путем восстановительного аминирования с использованием (1-этоксициклопропокси)триметилсилана, следуя методике, описанной в Gillaspy, M.L.;Lefker, В.A.; Hada, V.A.; Hoover, D.J. Tetrahedron Letters 1995, 36, 7399-7407, соединение (Е 26) получали по методике, аналогичной методике, описанной для получения (Е 4), и соединения примеров (Е 36, Е 37,Е 38 и Е 39) получали по методике, аналогичной методике получения (Е 2), но используя в качестве исходного соединения гидрохлорид соединения Е 1, дихлорметан в качестве растворителя и триэтиламин соответственно. Соединения примеров (Е 2), (Е 4), (Е 5), (Е 22) и (Е 26) выделяли в виде гидрохлоридов. Соединения примеров (Е 5) и (Е 26) (транс) получали в виде рацемических смесей.In vitro сродство к связыванию с рецептором D2L человека Замороженные мембраны клеток СНО, трансфецированных человеческим рецептором дофаминаD2L, оттаивали, быстро гомогенизировали с использованием гомогенизатора Ultra-Turrax Т 25 и разбавляли аналитическим буфером Tris-HCl, содержащим NaCl, CaCl2, MgCl2, KCl (50, 120, 2,1 и 5 мМ, соответственно, рН доведено до 7,7 добавлением HCl) до подходящей концентрации белка, оптимизированной для специфического и неспецифического связывания. Радиоактивный лиганд [3 Н]спиперон (NEN,удельная активность 70 Кюри/моль) разбавляли аналитическим буфером до концентрации 2 нмоль/л. Затем приготовленный препарат радиоактивного лиганда (50 мкл) вместе с 50 мкл либо контроля 10% ДМСО, бутакламола (конечная концентрация 10-6 моль/л), либо тестируемого соединения, инкубировали(30 мин, 37 С) с 400 мкл полученного раствора мембран. Радиоактивный лиганд, связанный мембранами,фильтровали с помощью харвестера Packard Filtermate на фильтрах GF/B Unifilterplates и промывали ледяным буфером Tris-HCl (50 мМ; рН 7,7; 60,5 мл). Фильтрам давали высохнуть, затем добавляли сцинтилляционную жидкость и подсчитывали на счетчике сцинтилляции Topcount. Удельное связывание в процентах и кривые конкурентного связывания рассчитывали с использованием программы S-Plus (Insightful). Большинство соединений имели значение pIC505,0. Быстрая диссоциация Соединения, показавшие значение IC50 менее 10 мкМ, исследовали в непрямом анализе, методика которого являлась видоизменением методики, опубликованной Josee E. Leysen and Walter Gommeren,Journal of Receptor Research, 1984, 4(7), 817-845, с целью оценки скоростей их диссоциации. Соединения в концентрации, в 4 раза превышавшей их IC50, во-первых, инкубировали в течение 1 ч с человеческим рецептором D2L клеточных мембран в объеме 2 мл при 25 С, затем фильтровали через стекловолоконный фильтр при помощи отсасывания, используя 40-луночный Multividor. Сразу же вслед за этим вакуум отключали. На фильтр в течение 5 мин добавляли 0,4 мл предварительно подогретого буфера (25 С), содержавшего 1 нМ [3 Н]спиперон. Инкубирование останавливали подключением к вакууму и немедлен- 22017508 ным промыванием 25 мл ледяного буфера. Связанную на фильтре радиоактивность измеряли с помощью жидкостного сцинтилляционного спектрометра. Идея данного анализа основана на предположении,что чем быстрее происходит диссоциация комплекса соединения с рецептором D2, тем быстрее с рецептором D2 связывается [3 Н]спиперон. Например, если рецепторы D2 инкубируют с клозапином в концентрации 1850 нм (4IC50), связывание [3 Н]спиперона эквивалентно 60-70% общего возможного связывания (измеренного в отсутствие клозапина) после 5 мин инкубирования на фильтре. При инкубировании с другими антипсихотическими средствами связывание [3 Н]спиперона меняется в пределах 20-50%. Поскольку клозапин включали в каждое фильтрование, тестируемые соединения считались быстро диссоциирующими антагонистами D2, если они диссоциировали так же быстро, как клозапин, или быстрее. Большинство тестируемых соединений имели большую скорость диссоциации, чем у клозапина, т.е. 50%.D3 человека Замороженные мембраны клеток СНО, трансфецированных человеческим рецептором дофамина D3, оттаивали, быстро гомогенизировали с использованием гомогенизатора Ultra-Turrax Т 25 и разбавляли 50 мМ буфером Tris-HCl, содержащим 120 мМ NaCl, 2 мМ CaCl2, 1 мМ MgCl2, 5 мМ KCl и 0,1% BSA (значение рН доведено до 7,4 добавлением HCl) до подходящей концентрации белка, оптимизированной для специфического и неспецифического связывания. Радиоактивный [125I]Iodosulpide (Amersham, удельная активность 2000 Кюри/моль) разбавляли аналитическим буфером до концентрации 2 нМ. Затем приготовленный препарат радиоактивного лиганда (20 мкл) вместе с 40 мкл либо контроля 10% ДМСО, Рисперидона (конечная концентрация 10-6 М), либо тестируемого соединения, инкубировали с 70 мкл полученного раствора мембран и 70 мкл гранул PVT, покрытых WGA (конечная концентрация 0,25 мг/лунка). После встряхивания в течение 24 ч при комнатной температуре планшеты подсчитывали на сцинтилляционном счетчике Topcount. Удельное связывание в процентах и кривые конкурентного связывания рассчитывали с использованием программы S-Plus (Insightful).In vitro сродство к связыванию с рецептором 5 НТ 6 человека Замороженные мембраны клеток НЕК, трансфецированных человеческим рецептором серотонина 5 НТ 6, оттаивали, быстро гомогенизировали с использованием гомогенизатора Ultra-Turrax Т 25 и разбавляли 50 мМ буфером Tris-HCl, содержащим 10 мМ MgCl2, 1 мМ ЭДТУ и 10 мкМ Паргилин (значение рН доведено до 7,4 добавлением HCl) до подходящей концентрации белка, оптимизированной для специфического и неспецифического связывания. Радиоактивный лиганд [3 Н]диэтиламид лизергиновой кислоты(Perkin Elmer, удельная активность 80 Кюри/ммоль) разбавляли аналитическим буфером до концентрации 20 нМ. Затем препарат радиоактивного лиганда (20 мкл) вместе с 40 мкл либо контроля 10% ДМСО,Метиотепина (конечная концентрация 10-5 M), либо тестируемого соединения, инкубировали с 70 мкл полученного раствора мембран и 70 мкл гранул PVT, покрытых WGA (конечная концентрация 0,25 мг/лунка). После встряхивания в течение 24 ч при комнатной температуре планшеты подсчитывали на сцинтилляционном счетчике Topcount. Удельное связывание в процентах и кривые конкурентного связывания рассчитывали с использованием программы S-Plus (Insightful). или его стереоизомерная форма, гдеR2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4 алкила, C1-4 алкилокси, диС 1-4 алкиламино, гидроксила или фенила, необязательно замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, независимо выбранным из группы, состоящей из галогена и C1-4 алкила; нафтил;R3 представляет собой водород; каждый из R4 и R5 независимо представляет собой водород или C1-4 алкил;R6 представляет собой водород, C1-4 алкил, C3-6 циклоалкил, С 3-6 циклоалкил-C1-4 алкил, пиридинилметил или фенилметил, необязательно замещенный 2 атомами галогена; или же R5 и R6 совместно образуют С 2-5 алкандиил; или его фармацевтически приемлемая соль или сольват. 2. Соединение по п.1, в которомR2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых незави- 24017508 симо выбран из группы, состоящей из галогена, C1-4 алкила, C1-4 алкилокси, диС 1-4 алкиламино, гидроксила или фенила, замещенного галогеном, тиенил; тиенил, замещенный 1 заместителем, независимо выбранным из галогена и C1-4 алкила; нафтил;R3 представляет собой водород; каждый из R4 и R5 независимо представляет собой водород или C1-4 алкил;R6 представляет собой водород, C1-4 алкил, C3-6 циклоалкил, С 3-6 циклоалкил-C1-4 алкил или фенилметил, замещенный 2 атомами галогена; или же R5 и R6 совместно образуют С 2-5 алкандиил; или его фармацевтически приемлемая соль или сольват. 3. Соединение по п.1, в которомR1 представляет собой трифторметил или циано;R2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4 алкила, C1-4 алкилокси, диС 1-4 алкиламино, гидроксила и фенила, замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, независимо выбранным из галогена и C1-4 алкила; нафтил;R3 представляет собой водород; каждый из R4 и R5 независимо представляет собой водород или C1-4 алкил;R6 представляет собой водород, метил, этил, циклопропил или фенилметил, замещенный 2 атомами галогена; или же R5 и R6 совместно образуют С 2-5 алкандиил; или его фармацевтически приемлемая соль или сольват. 4. Соединение по п.1, в которомR2 представляет собой фенил; фенил, замещенный 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, C1-4 алкила, C1-4 алкилокси, диС 1-4 алкиламино, гидроксила и фенила, замещенного галогеном; тиенил; тиенил, замещенный 1 заместителем, выбранным из галогена и C1-4 алкила; нафтил;R3 представляет собой водород; каждый из заместителей R4 и R5 независимо представляет собой водород или метил;R5 и R6 совместно образуют 1,3-пропандиил; или его фармацевтически приемлемая соль или сольват. 5. Соединение по п.1, где соединение представляет собой 4-фенил-6-пиперазин-1-ил-3 трифторметилпиридазин. 6. Соединение по п.1, где соединение представляет собой моногидрохлорид 4-фенил-6-пиперазин-1 ил-3-трифторметилпиридазина.
МПК / Метки
МПК: A61K 31/495, C07D 409/04, C07D 487/04, C07D 237/20, C07D 237/24
Метки: дофамина, диссоциирующие, антагонисты, быстро, рецептора
Код ссылки
<a href="https://eas.patents.su/26-17508-bystro-dissociiruyushhie-antagonisty-receptora-2-dofamina.html" rel="bookmark" title="База патентов Евразийского Союза">Быстро диссоциирующие антагонисты рецептора 2 дофамина</a>
Предыдущий патент: Пестицидная композиция, содержащая синтетическое соединение, полезное в качестве средства для образования клубней у бобовых растений, и инсектицидное соединение
Следующий патент: Защитное укрытие
Случайный патент: Двигатель внутреннего сгорания