Фенилацетамидотиазольные производные, способ их получения и их использования в качестве противоопухолевых средств
Номер патента: 7392
Опубликовано: 27.10.2006
Авторы: Нези Марчелла, Браска Мария Габриелла, Амичи Раффаэлла, Певарелло Паоло, Вилла Мануэла, Варази Марио, Вульпетти Анна, Салом Барбара, Тракуанди Габриэлла
Формула / Реферат
1. Способ лечения нарушений клеточной пролиферации, связанной с измененной, зависимой от клеточного цикла киназной активностью, путем введения млекопитающему, нуждающемуся в этом, эффективного количества фенилацетамидотиазольного производного, представленного формулой (I)

где R представляет собой атом водорода или С1-С4-алкильную группу с прямой или разветвленной цепью;
R1 представляет собой группу формулы (IIа-е)
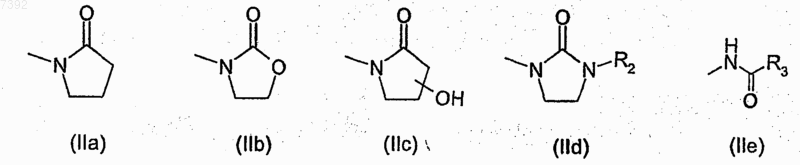
где R2 представляет собой атом водорода или C1-С6-алкильную группу с прямой или разветвленной цепью, и гидроксигруппа на кольце (IIс) находится в любом из свободных положений;
R3 выбран из группы, включающей амино, аминометил (-СН2-NH2), гидроксиметил (-СН2ОН), C1-C4-алкил с прямой или разветвленной цепью, или R3 представляет собой 5- или 6-членный гетероцикл с 1 гетероатомом или 2 гетероатомами, выбранными из азота, кислорода и серы;
при условии, что когда R представляет собой водород, то R3 не является метилом или пиридил-3-илом;
или его фармацевтически приемлемой соли.
2. Способ по п.1, где нарушение клеточной пролиферации выбрано из группы, включающей рак, болезнь Альцгеймера, вирусные инфекции, аутоиммунные заболевания и нейродегенеративные заболевания.
3. Способ по п.2, где рак выбран из группы, включающей карциному, плоскоклеточную карциному, опухоль кроветворной ткани миелоидного или лимфоидного направления, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, ксеродерму пигментозум, кератоакантому, фолликулярный рак щитовидной железы и саркому Капоши.
4. Способ по п.1, где нарушение клеточной пролиферации выбрано из группы, включающей доброкачественную гиперплазию простаты, наследственный аденоматозный полипоз, нейрофиброматоз, псориаз, пролиферацию клеток гладких мышц сосудов, связанную с атеросклерозом, фиброз легких, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз.
5. Способ по п.1, который обеспечивает подавление ангиогенеза и метастазов опухолей.
6. Способ по п.1, который обеспечивает лечение или профилактику вызываемой лучевой терапией или химиотерапией алопеции.
7. Способ по п.1, дополнительно включающий проведение млекопитающему, нуждающемуся в этом, курса лучевой терапии или химиотерапии в сочетании по меньшей мере с одним цитостатическим или цитотоксическим средством.
8. Способ по п.1, где млекопитающее, нуждающееся в этом, является человеком.
9. Способ подавления циклинозависимой киназной активности, который включает контактирование указанной киназы с эффективным количеством соединения, которому дано определение в п.1.
10. Способ по п.1, который включает введение эффективного количества соединения формулы (I), выбранного из группы, включающей
N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]ацетамид,
(2S)-2-[4-(ацетиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид,
N-(4-{(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)никотинамид и
N-(4-{(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)изоникотинамид.
11. Фенилацетамидотиазольное производное, представляемое формулой (I)
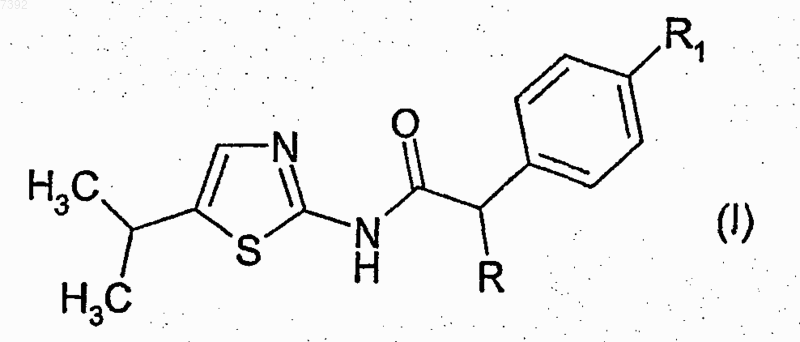
где R представляет собой атом водорода или C1-С4-алкильную группу с прямой или разветвленной цепью;
R1 представляет собой группу формулы (IIа-е)
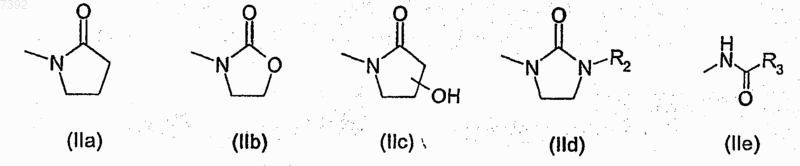
где R2 представляет собой атом водорода или С1-С6-алкильную группу с прямой или разветвленной цепью, и гидроксигруппа на кольце (IIс) находится в любом из свободных положений;
R3 выбран из группы, включающей амино, аминометил (-СН2-NH2), гидроксиметил (-СН2ОН), C1-C4-алкил с прямой или разветвленной цепью, или R3 представляет собой 5- или 6-членный гетероцикл с 1 гетероатомом или 2 гетероатомами, выбранными из азота, кислорода и серы;
при условии, что когда R представляет собой водород, то R3 не является метилом или пиридил-3-илом;
или его фармацевтически приемлемая соль.
12. Фенилацетамидотиазольное производное формулы (I) по п.11, где R является метилом.
13. Фенилацетамидотиазольное производное формулы (I) по п.11, где R1 является группой формулы (IIа) или (IIb).
14. Фенилацетамидотиазольное производное формулы (I) по п.11, где R1 является группой формулы (IIc), а его гидроксигруппа находится в положении 3 пирролидинового кольца.
15. Фенилацетамидотиазольное производное формулы (I) по п.11, где R1 является группой формулы (IIе), где R3 выбран из группы, включающей метил, пиридил-4-ил или пиридил-3-ил.
16. Фенилацетамидотиазольное производное формулы (I) по п.11, где R является атомом водорода.
17. Фенилацетамидотиазольное производное формулы (I) по п.11, где R является атомом водорода, a R1 является группой формулы (IIа), которое представляет собой N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]ацетамид.
18. Фенилацетамидотиазольное производное формулы (I) по п.11, которое выбрано из группы, включающей
(2S)-2-[4-(ацетиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид,
N-(4-{(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)никотинамид и
N-(4-{(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)изоникотинамид.
19. Фенилацетамидотиазольное производное формулы (I), которому дано определение в п.11, необязательно в форме фармацевтически приемлемой соли, выбрано из группы, включающей:
1) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]ацетамид;
2) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]пропанамид;
3) (2R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]пропанамид;
4) (2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]пропанамид;
5) 2-[4-(3-гидрокси-2-оксо-1-пирролидинил)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
6) 2-{4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
7) 2-{4-[(3R)-3-гидрокси-2-оксо-1-пирролидинил]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
8) 2-[4-(3-гидрокси-2-оксо-1-пирролидинил)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
9) 2-{4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
10) 2-{4-[(3R)-гидрокси-2-оксо-1-пирролидинил]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
11) 2(R)-2-{4-[(3S)-3-гидрокси-2-оксo-1-пирролидинил]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
12) 2(S)-2-{4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
13) 2(R)-2-{4-[(3R)-3-гидрокси-2-оксо-1-пирролидинил]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
14) 2(S)-2-{4-[(3R)-3-гидрокси-2-оксо-l-пирролидинил]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
15) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]ацетамид;
16) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид;
17) (2R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид;
18) (2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид;
19) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]ацетамид;
20) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропанамид;
21) (2R)-N-(5-изопропиы-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропанамид;
22) (2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропанамид;
23) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]ацетамид;
24) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]пропанамид;
25) (2R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]пропанамид;
26) (2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]пропанамид;
27) (2S)-2-[4-(ацетиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
28) (2R)-2-[4-(ацетиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
29) 2-[4-(ацетиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
30) (2S)-2-{4-[(аминокарбонил)амино]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
31) (2R)-2-{4-[(аминокарбонил)амино]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
32) 2-{4-[(аминокарбонил)амино]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
33) 2-{4-[(аминокарбонил)амино]фенил}-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
34) (2S)-2-[4-(глициламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
35) (2R)-2-[4-(глициламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
36) 2-[4-(глициламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;
37) N-1-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}фенил)глицинамид;
38) N-(4-{(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)никотинамид;
39) N-(4-{(1R)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)никотинамид;
40) N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)никотинамид;
41) N-(4-{(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)пиридин-2-карбоксамид;
42) N-(4-{(1R)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)пиридин-2-карбоксамид;
43) N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)пиридин-2-карбоксамид;
44) N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}фенил)пиридин-2-карбоксамид;
45) N-(4-{(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)изоникотинамид;
46) N-(4-{(1R)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)изоникотинамид;
47) N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил}фенил)изоникотинамид;
48) N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}фенил)изоникотинамид.
20. Способ получения соединений формулы (I) или их фармацевтически приемлемых солей, охарактеризованных в п.11, который включает взаимодействие 2-амино-5-изопропил-1,3-тиазола с соединением формулы (III)
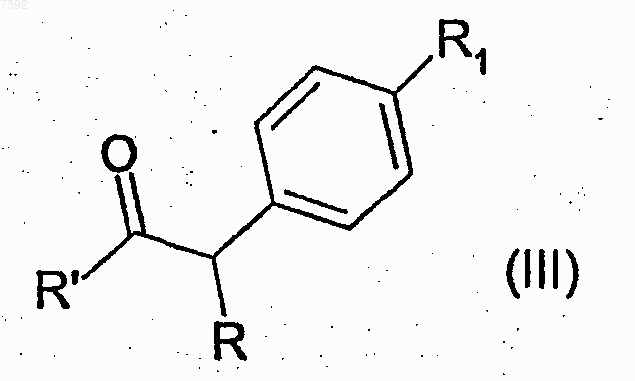
где R и R1 определены в п.11, и R' представляет собой гидроксил или подходящую удаляемую группу и, необязательно, преобразование их в фармацевтически приемлемые соли.
21. Способ по п.20, где R' представляет собой гидроксил или атом галогена.
22. Способ по п.21, причем R' представляет собой гидроксил или атом хлора.
23. Фармацевтическая композиция, содержащая терапевтически эффективное количество фенилацетамидотиазольного производного формулы (I), охарактеризованное в п.11, и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, один носитель и/или разбавитель.
24. Фармацевтическая композиция по п.23, дополнительно содержащая одно или несколько химиотерапевтических средств.
25. Продукт или набор, включающий соединение формулы (I), охарактеризованное в п.11, или его фармацевтическую композицию, охарактеризованную в п.23, и одно или несколько химиотерапевтических средств, в виде комбинированного препарата для одновременного, раздельного или последовательного использования при противораковой терапии.
26. Соединение формулы (I), охарактеризованное в п.11, для использования в качестве лекарственного средства.
27. Применение соединения формулы (I), охарактеризованного в п.11, при получении лекарственного средства, обладающего активностью, ингибирующей зависимую от клеточного цикла киназу.
28. Применение соединения формулы (I), охарактеризованного в п.11, при получении лекарственного средства, обладающего противоопухолевой активностью.
Текст
007392 Предпосылки создания изобретения Область изобретения Данное изобретение относится к фенилацетамидотиазольным производным, к способу их получения, к содержащим их фармацевтическим композициям и их использованию в качестве терапевтических средств, в частности для лечения рака и нарушений клеточной пролиферации. Обсуждение предпосылок изобретения Некоторые цитотоксичные лекарственные средства, такие как, например, фторурацил (5-ФУ), доксорубицин и камптотецины, повреждают ДНК или действуют на метаболические пути клеток и, таким образом, во многих случаях вызывают непрямую блокаду клеточного цикла. Поэтому путем осуществления необратимого повреждения как нормальных, так и опухолевых клеток, эти средства дают в результате значительную токсичность и побочные действия. В связи с этим, желательны соединения, способные функционировать как сравнительно эффективные высокоспецифические противоопухолевые средства путем селективной направленности на остановку роста и апоптоз опухолевых клеток, но обладающие пониженной токсичностью по сравнению с доступными в настоящее время лекарственными средствами. Хорошо известно, что последовательность событий на протяжении клеточного цикла регулируется серией промежуточных регуляторов, иначе называемыми точками (областями) ограничения, которые регулируются семейством ферментов, известных как циклинозависимые киназы (cdk). В свою очередь сами cdk регулируются на многих уровнях, таких как, например, связывание циклинами. Координированная активация и инактивация различных циклин/cdk комплексов необходима для нормальной последовательности событий в течение клеточного цикла. Как критические G1-S так и G2-M переходы регулируются активацией действия различных циклинов/cdk. В G1 как сdk4/циклин D, так и сdk2/циклин Е, как полагают, опосредуют начало S-фазы. Развитие в течение S-фазы требует активностиcdk2/циклина А, тогда как активация cdc2 (cdk1)/циклина А и cdc2/циклинa В необходима для начала митоза. В отношении основных сведений по циклинам и циклинозависимым киназам см., например,Kevin R. Webster et al., in Exp. Opin. Invest. Drugs, 1998, Vol. 7(6), 865-887. Промежуточные регуляторы являются дефектными в опухолевых клетках, частично, из-за нарушения регуляции активности cdk. Например, измененная экспрессия циклина Е и cdk наблюдалась у опухолевых клеток, и делеция гена р 27KIP ингибитора cdk у мышей, как было показано, приводит к высокой частоте случаев рака. Все увеличивающееся число данных подтверждает мысль о том, что cdk являются ограничивающими скорость ферментами при развитии клеточного цикла, и как таковые, представляют молекулярные мишени для терапевтического вмешательства. В частности, прямое подавление активностиcdk/циклинкиназы должно быть полезно для ограничения нерегулируемой пролиферации опухолевых клеток. Краткое изложение изобретения Объектом данного изобретения является получение соединений, которые пригодны для лечения нарушений клеточной пролиферации, связанных с измененной зависимой от клеточного цикла киназной активностью. Другим объектом является получение соединений, которые обладают активностью, подавляющей киназы комплексов cdk/циклин. В настоящее время открыто, что некоторые фенилацетамидотиазолы наделены активностью, подавляющей киназы комплексов cdk/циклин и, таким образом, могут использоваться в терапии в качестве противоопухолевых средств, и у них отсутствуют вышеназванные недостатки, такие как токсичность и побочные эффекты, имеющиеся у доступных в настоящее время противоопухолевых средств. Более конкретно, фенилацетамидотиазолы по данному изобретению могут использоваться для лечения ряда раковых заболеваний, включая, но не ограничиваясь этим, карциному, такую как карцинома мочевого пузыря, молочных желез, толстого кишечника, почек, печени, легких, включая мелкоклеточный рак легких, пищевода, желчного пузыря, яичников, поджелудочной железы, желудка, шейки матки,щитовидной железы, простаты и кожи, включая плоскоклеточную карциному, опухоли кроветворной ткани лимфоидного направления, включая лейкемию, острую лимфоцитную лейкемию, острую лимфобластную лейкемию, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, лимфому не Ходжкина, волосковоклеточную лимфому и лимфому Буркета; опухоли кроветворной ткани миелоидного направления, включая острую и хроническую миелогенные лейкемии, миелодиспластический синдром и промиелоцитную лейкемию; опухоли мезенхимального происхождения, включая фибросаркому,и рабдомиосаркому; опухоли центральной и периферической нервных систем, включая астроцитому,нейробластому, глиому и шванномы; другие опухоли, включая меланому, семиному, тератокарциному,остеосаркому, ксеродерму пигментозум, кератоакантому, фолликулярный рак щитофидной железы и саркому Капоши. Из-за ключевой роли cdk в регуляции клеточной пролиферации эти фенилацетамидотиазольные производные пригодны также для лечения ряда нарушений клеточной пролиферации, таких как, например, доброкачественной гиперплазии простаты, наследственный аденоматозный полипоз, нейрофиброматоз, псориаз, пролиферация клеток гладких мышц сосудов, связанная с атеросклерозом, фиброз легких, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз.-1 007392 Соединения по данному изобретению могут использоваться при лечении болезни Альцгеймера, что можно предположить, исходя из того факта, что cdk5 участвует в фосфорилировании тау-протеина (J.Biochem. 117, 741-749, 1995). Соединения по данному изобретению могут быть также использованы в качестве модуляторов апоптоза для лечения рака, вирусных инфекций, предотвращения развития СПИДа у инфицированных ВИЧ индивидуумов, аутоиммунных заболеваний и нейродегенеративных заболеваний. Соединения по данному изобретению могут быть использованы для подавления ангиогенеза и метастазов при опухолях. Соединения по данному изобретению могут также действовать как ингибиторы других протеинкиназ, например протеинкиназы С в разных изоформах, Met, PAK-4, PAK-5, ZC-1, STLK-2, DDR-2, Aurora 1, Aurora 2, Bub-1, PLK, Chk1, Chk2, HER2, raf1, MEK1, МАРK, EGF-R, PDGF-R, FGF-R, IGF-R, PI3K,киназа верши, Scr, Alb, Akt, МАРK, ILK, MK-2, IKK-2, Cdc7, Nek и таким образом, быть эффективными при лечении заболеваний, связанных с другими протеинкиназами. Соединения по данному изобретению также пригодны для лечения и профилактики алопеции, вызванной лучевой терапией или химиотерапией. Соответственно, данное изобретение относится к способу лечения нарушений клеточной пролиферации, связанных с измененной, зависящей от клеточного цикла, киназной активностью, путем введения млекопитающему, нуждающемуся в этом, эффективного количества фенилацетамидтиазольного производного, представленного формулой (I) где R является атомом водорода или С 1-С 4-алкильной группой с прямой или разветвленной цепью;R1 представляет собой группу формулы (IIа-е) где R2 является атомом водорода или C1-С 6-алкильной группой с прямой или разветвленной цепью, и гидроксильная группа на кольце (IIс) находится в любом одном из свободных положений;R3 выбран из группы, состоящей из амино, аминометила (-СН 2-NH2), гидроксиметила (-СН 2 ОН), С 1 С 4-алкила с прямой или разветвленной цепью, или R3 представляет собой 5- или 6-членный гетероцикл с 1 гетероатомом или 2 гетероатомами, выбранными из азота, кислорода и серы; при условии, что, когда R является водородом, то R3 не является метилом или пиридил-3-илом; или его фармацевтически приемлемой соли. В предпочтительном осуществлении данного способа, описанного выше, нарушение клеточной пролиферации выбрано из группы, включающей рак, болезнь Альцгеймера, вирусные инфекции, аутоиммунные заболевания и нейродегенеративные заболевания. Конкретные виды рака, которые можно лечить, включают карциному, плоскоклеточную карциному, опухоли кроветворения миелоидного или лимфоидного направления, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, ксеродерму пигментозум, кератоакантому, фолликулярный рак щитовидной железы и саркому Капоши. В другом предпочтительном осуществлении способа, описанного выше, нарушение клеточной пролиферации выбрано из группы, включающей доброкачественную гиперплазию простаты, наследственный аденоматозный полипоз, нейрофиброматоз, псориаз, пролиферацию клеток гладких мышц сосудов,связанную с атеросклерозом, фиброз легких, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. Кроме того, способ по данному изобретению обеспечивает подавление ангиогенеза и метастазов опухолей. Способ по данному изобретению может также обеспечивать ингибирование клеточного цикла или cdk/циклинзависимое ингибирование. В дополнение к вышеизложенному способ по данному изобретению обеспечивает лечение и профилактику алопеции, вызванной лучевой терапией или химиотерапией. Данное изобретение относится также к фенилацетамидотиазольному производному, представленному формулой (I) где R представляет собой атом водорода или метильную группу;R1 представляет собой группу формулы (IIа-е) где R2 представляет собой водород или C1-С 6-алкильную группу с прямой или разветвленной цепью, и гидроксигруппа на кольце (IIс) находится в любом одном из свободных положений;R3 выбран из группы, состоящей из амино, аминометила (-СН 2-NH2), гидроксиметила (-СН 2 ОН), C1C4-алкила с прямой или разветвленной цепью, или R3 представляет собой 5- или 6-членный гетероцикл с 1 гетероатомом или 2 гетероатомами, выбранными из азота, кислорода и серы; при условии, что когда R является водородом, то R3 не является метилом или пиридил-3-илом; или его фармацевтически приемлемую соль. Данное изобретение включает также способы синтеза фенилацетамидотиазольных производных,представленных формулой (I). Фармацевтическая композиция, содержащая фенилацетамидотиазольные производные, представленные формулой (I), также включена в данное изобретение. Более полное понимание по данному изобретению и многие сопутствующие ему преимущества станут более понятны из последующего подробного описания изобретения. Некоторые аминотиазолы известны специалистам, например, в качестве гербицидов, промежуточных соединений для синтеза или даже в качестве терапевтических средств. Среди них можно указать,например, 2-бензамидо-1,3-тиазолы в качестве антиаллергических средств (ЕР-А-261503, Valeas S.p.A.); 5-алкил-2-фенилалкилкарбониламино-1,3-тиазолы как ингибиторы протеинкиназы С (WO 98/04536,Otsuka Pharmaceutical Co.); 5-арилтио-2-ациламино-1,3-тиазолы как противоопухолевые средства (ЕР-А 412404, Fujisawa Pharm. Co.); 4-амино-2-карбониламино-1,3-тиазолы как ингибиторы циклинзависимых киназ (WO 99/21845, Agouron Pharmaceutical Inc.); аминотиазолы, среди которых присутствуют 5 алкенил-2-ациламинотиазолы в качестве ингибиторов циклинзависимых киназ (WO 99/65884, BrystolMyers Squibb Co.); фенилацетамидотиазолы, замещенные циклоалкилалкильными группами, как активаторы глюкокиназ, пригодные для лечения диабета II типа (WO 01/85707, Hoffmann-La Roche AG). Кроме того, в двух международных патентных заявках WO 00/26202 и WO 01/14353 (US 6114365),обе от PharmaciaUpjohn S.p.A., включенные здесь в виде ссылок, описаны широкие группы амидотиазольных производных, обладающих ингибиторной активностью в отношении зависимых от клетки киназ. Соединения - объект по данному изобретению подпадают под объем общей формулы WO 00/26202 и WO 01/14353, но там не приведены их конкретные примеры. Соединения формулы (I) могут иметь асимметричные атомы углерода и поэтому могут существовать или в виде рацемических смесей, или в виде отдельных оптических изомеров, которые все подпадают под объем по данному изобретению. Например, когда R не является водородом, атом углерода, с которым соединен сам R, является асимметричным атомом углерода и, следовательно, как (R), так и (S) оптические изомеры соединений формулы (I), а также рацемическая смесь (R,S) или любая другая смесь, содержащая большей частью один из двух оптических (R) или (S) изомеров, включены в объем по данному изооретению. Подобным же образом использование в качестве противоопухолевого средства всех подобных изомеров и их смесей, и как метаболитов, так и фармацевтически приемлемых биопредшественников (иначе называемых пролекарствами) соединений формулы (I) также включены в объем по данному изобретению. В данном описании, как ясно для специалиста в данной области, атом азота, являющийся частью групп R1 формулы (IIа), (IIb), (IIc), (IId) и (IIe), непосредственно связан в формуле (I) с фениленовой группой. Кроме того, если не указано иначе, когда упоминаются соединения формулы (I), где R1 является группой (IIc), группа 2-оксопирролидин-1-ил является дополнительно замещенной в положениях 3, 4 и 5 кольца гидроксильными группами так, что получаются группы 3-гидрокси-, 4-гидрокси- или 5-гидрокси 2-оксопирролидин-1-ил. В данном описании, если не указано иначе, под термином C1-С 4-алкил с прямой или разветвленной цепью подразумевается любая из групп: метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил-3 007392 и вторичный бутил. Под термином 5- или 6-членный гетероцикл с 1 гетероатомом или 2 гетероатомами, выбранными из азота, кислорода или серы, подразумевается такая группа, как, например, фуран, пиррол, имидазол, пиразол, тиофен, тиазол, изотиазол, оксазол, изооксазол, пиридин, пиразин, пиримидин, пиридазин, пирролидин, пирролин, имидазолидин, имидазолин, пиразолидин, пиразолин, пиперидин, пиперазин, морфолин и тому подобное. Фармацевтически приемлемые соли соединений формулы (I) включают соли присоединения кислот и оснований с неорганическими или органическими кислотами или основаниями. Примеры вышеуказанных кислот включают, например, азотную, хлористо-водородную, бромисто-водородную, серную, перхлорную, фосфорную, уксусную, трифторуксусную, пропионовую, гликолевую, молочную, щавелевую,малоновую, яблочную, малеиновую, виннокаменную, лимонную, бензойную, коричную, миндальную,метансульфоновую, изотионовую и салициловую кислоту. Далее, подходящими основаниями являются, например, гидроксиды щелочных или щелочноземельных металлов, а также органические амины, например алифатические амины, пиперидин и тому подобное. Группой предпочтительных соединений формулы (I) по данному изобретению являются такие, гдеR представляет собой метил. В этом классе предпочтительных соединений формулы (I) наиболее предпочтительными являются такие, где R1 является группой формулы (IIа), (IIb) или (IIc), причем гидроксильный заместитель находится в положении 3 пирролидинового кольца, или R1 является группой формулы (IId), где R2 представляет собой водород или метил, или R1 является группой формулы (IIе), где R3 представляет собой метил или пиридил, следовательно, включая пиридил-4-ил, пиридил-3-ил или пирил-2-ил. Еще более предпочтительными в этой группе являются соединения формулы (I), где R1 представляет собой группу формулы (IIа) или (IIе). Также предпочтительными являются соединения формулы (I), где R является атомом водорода. Еще более предпочтительными являются соединения, где вышеуказанные признаки соединяются вместе так, что получается соединение формулы (I), где R является водородом, R1 представляет собой группу формулы (IIа), т.е. представляет собой соединение N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо 1-пирролидинил)фенил]ацетамид, или соединение формулы (I), где R является метилом, a R3 представляет собой метил, пиридил-3-ил или пиридил-4-ил, в (S) конфигурации, а именно, (2S)-2-[4(ацетиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид,N(4-(1S)-2-[(5-изопропил-1,3 тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)никотинамид и N-(4-(1S)-2-[(5-изопропил-1,3-тиазол-2 ил)амино]-1-метил-2-оксоэтилфенил)изоникотинамид. Примерами соединений формулы (I) по данному изобретению, необязательно, в виде фармацевтически приемлемых солей, являются 1. N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]ацетамид; 2. N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]пропанамид; 3. (2R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]пропанамид; 4. (2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]пропанамид; 5. 2-[4-(3-гидрокси-2-оксо-1-пирролидинил)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 6. 2-4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 7 2-4-[(3R)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 8. 2-[4-(3-гидрокси-2-оксо-1-пирролидинил)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид; 9. 2-4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид; 10. 2-4-[(3R)-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид; 11. 2(R)-2-4-[(3S)-3-гидрокси-2-оксо-l-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил) пропанамид; 12. 2(S)-2-4-[(3S)-3-гидрокси-2-оксо-l-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил) пропанамид; 13. 2(R)-2-4-[(3R)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил) пропанамид; 14. 2(S)-2-4-[(3R)-3-гидрокси-2-оксo-l-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил) пропанамид; 15. N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]ацетамид; 16. N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид; 17. (2R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид; 18. (2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид; 19. N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]ацетамид; 20. N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропанамид; 21. (2R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропанамид;N-(4-(lR)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)пиридин-2 карбоксамид; 43. N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)пиридин-2-карбоксамид; 44. N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилфенил)пиридин-2-карбоксамид; 45. N-(4-(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)изоникотинамид; 46. N-(4-(1R)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)изоникотинамид; 47. N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)изоникотинамид; 48. N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилфенил)изоникотинамид. Соединения формулы (I) по данному изобретению могут быть получены способом, включающим взаимодействие 2-амино-5-изопропил-1,3-тиазола с соединением формулы (III) где R и R1 имеют значения, указанные выше, и R' представляет собой гидроксил или подходящую удаляемую группу, и, необязательно, преобразование их в фармацевтически приемлемые соли. Альтернативно, соединения формулы (I), где R1 является группой формулы (IIе), могут быть получены способом, включающим: а') когда R3 не является амино, взаимодействие соединения формулы (IV)(V),R3-COX где R и R3 имеют значения, указанные выше, и X представляет собой гидроксил или подходящую удаляемую группу; а) когда R3 является амино, взаимодействие соединения формулы (IV) с цианатом калия; и, необязательно, преобразование соединений формулы (I), полученных таким образом на любой одной из стадий а') или а) в их фармацевтически приемлемые соли. Вышеуказанный способ является аналогией способа, который может быть осуществлен в соответствии с методами, хорошо известными специалистам. Взаимодействие 2-амино-5-изопропил-1,3-тиазола с соединением формулы (III), где R' является-5 007392 гидроксилом, может быть осуществлено в присутствии агента сочетания, такого, например, как карбодиимид, т.е. 1,3-дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид, 1-(3-диметиламинопропил)3-этилкарбодиимид, N-циклогексилкарбодиимид или N'-метилполистирол, необязательно, в присутствии третичного основания, такого как триэтиламин, N-метилморфолин, N,N-диизопропилэтиламин, пиридин или диэтиламинометилполистирол. Данная реакция осуществляется в подходящем растворителе, таком как, например, этилацетат, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, ацетонитрил, толуол или N,Nдиметилформамид, при температуре, находящейся в интервале от примерно -10 С до температуры дефлегмации, предпочтительно от 0 С до комнатной температуры, и в течение подходящего времени, т.е. в течение от примерно 30 мин до примерно 8 суток. Альтернативно, ту же самую реакцию можно осуществить смешанным ангидридным методом, т.е. путем использования алкилхлорформиата, такого как этил-, изобутил, или изопропилхлорформиат, в присутствии третичного основания, такого как триэтиламин, N,N-диизопропилэтиламин или пиридин. Также это взаимодействие проводят в подходящем растворителе, таком как, например, толуол, дихлорметан, хлороформ, тетрагидрофуран, ацетонитрил, диэтиловый эфир, 1,4-диоксан или N,Nдиметилформамид, при температуре, находящейся в интервале от примерно -30 С до комнатной температуры. Взаимодействие 2-амино-5-изопропил-1,3-тиазола с соединением формулы (III), где R' является подходящей удаляемой группой, например, атомом галогена, может быть осуществлено в присутствии третичного основания, такого как триэтиламин, N,N-диизопропилэтиламин или пиридин, в подходящем растворителе, таком как этилацетат, толуол, дихлорметан, хлороформ, диэтиловый эфир, тетрагидрофуран, ацетонитрил или N,N-диметилформамид, при температуре, находящейся в интервале от примерно-10 С до температуры дефлегмации. В соответствии с предпочтительным осуществлением по данному изобретению способ получения соединений формулы (I) осуществляют путем использования соединений формулы (III), где R' является гидроксилом или атомом галогена, предпочтительно хлора. Специалисту в данной области ясно, что реакция амидирования в соответствии со стадией а') данного способа осуществляется аналогичным образом между аминопроизводным формулы (IV) и производным карбоновой кислоты формулы (V), по существу, как представлено выше. Например, получение соединения формулы (I), где R3 является метилом, в соответствии со стадией а') выполняется путем взаимодействия производного формулы (IV) с ацетилхлоридом (V) или, возможно, с аналогичными ему ацилирующими средствами, например, уксусным ангидридом. Реакция происходит в присутствии подходящего основания, такого как триэтиламин, N-метилморфолин, N,N-диизопропилэтиламин, пиридин или диэтиламинополистирол, в подходящем растворителе, таком как этилацетат, дихлорметан, тетрагидрофуран или ацетонитрил, при температуре в интервале от 0 С до комнатной температуры. В соединениях формулы (V) X является гидроксилом или подходящей удаляемой группой, такой как, например, атом галогена. Предпочтительно X является гидроксилом или атомом хлора. Согласно стадии а) данного способа промежуточное соединение формулы (IV) подвергают взаимодействию с цианатом калия по обычным методикам получения уреидопроизводных [соединения формулы (I) с R3 в виде амино] в подходящем растворителе, например ацетонитриле, и в присутствии трифторуксусной кислоты. Необязательное получение соли соединения формулы (I), или альтернативно, преобразование его соли в свободное соединение - все могут быть осуществлены обычными методами. Исходный 2-амино-5-изопропил-1,3-тиазол является известным соединением, которое может быть легко получено известными методами, например, как изложено в рабочих примерах. Подобным же образом соединения формулы (III), где R' является гидроксилом или подходящей удаляемой группой, известны или могут быть получены обычными методами. Например, соединения формулы (III), где R' является гидроксилом, R представляет собой описанное выше и R1 является группой формулы (IIа), может быть получено путем взаимодействия соединений формулы (VI) где R, как описано выше, с 6,6-диметил-5,7-диоксаспиро(2,5)октан-4,8-дионом в подходящем растворителе, таком как толуол, ксилол или N,N-диметилформамид, при температуре дефлегмации и в течение периода времени в интервале от примерно 2 до примерно 6 ч. Альтернативно, те же самые соединения могут быть получены путем взаимодействия вышеуказанных соединений формулы (VI) с бутиролактоном в подходящем растворителе, таком как ледяная уксусная кислота или хлористоводородная кислота, при температуре в интервале от 150 до 200 С. По другому альтернативному способу эти соединения могут быть получены путем взаимодействия-6 007392 соединений формулы (VI) с 4-хлорбутирилхлоридом в подходящем растворителе, таком как хлороформ,дихлорметан, N,N-диметилацетамид, при комнатной температуре, а затем путем взаимодействия с неорганическим основанием, таким как гидроксид натрия или калия, при комнатной температуре. Соединения формулы (III), где R1 является группой формулы (IIе), могут быть получены путем взаимодействия соединений формулы (VI), где значения R указаны выше, с подходящим производным карбоновой кислоты формулы (V) с получением любого производное формулы (III), где R3 не является амино, или альтернативно, с цианатом калия с получением производного формулы (III), где R3 является амино. Рабочие условия, использованные здесь, являются обычными и соответствуют описанным для реакций амидирования ранее, или при описании получения уреидогрупп, соответственно. Соединения формулы (III), где R' является гидроксилом, R, как описано выше, и R1 является группой (IIb), могут быть получены способом, включающим: а) взаимодействие соединений формулы (VI) с 2-хлорэтилхлорформиатом в подходящем растворителе, таком как хлороформ или дихлорметан, при температуре в интервале от 0 С до комнатной температуры, и затем обработку фосфатом натрия с получением таким образом соединений формулы (VII), где значения R такие, как указаны вышеb) и циклизацию соединений формулы (VII) в присутствии подходящего неорганического основания, такого как карбонат калия или натрия, в N,N-диметилформамиде или в присутствии органического основания, такого как 1,5-диазабицикло[4,3,0]нон-5-ен или 1,8-диазабицикло[5,4,0]ундец-7-ен, при комнатной температуре. Соединения формулы (III), где R' является гидроксилом, значения R указаны выше, R1 является группой (IId), и R2 является водородом, могут быть получены способом, включающим: а) преобразование соединений формулы (VI), где значения R описаны выше, в соответствующие производные метиловые эфиры (VIII), где значения R такие, как описаны выше, следующими общепринятыми методамиb) взаимодействие соединений формулы (VIII), где значения R указаны выше, с хлорэтилизоцианатом в подходящем растворителе, таком как хлороформ, дихлорметан, тетрагидрофуран, 1,4-диоксан, при температуре в интервале от примерно 0 С до комнатной температуры с получением таким образом соединений формулы (IX), где значения R указаны выше с) циклизацией соединений формулы (IX) в присутствии подходящего неорганического основания,такого как карбонат калия или натрия в N,N-диметилформамиде, или в присутствии органического основания, такого как 1,5-диазабицикло[4,3,0]нон-5-ен или 1,8-диазабицикло[5,4,0]ундец-7-ен, при комнатной температуре, получая таким образом соединения формулы (X), где значения R указаны вышеd) и гидролизом соединений формулы (X) с помощью основания, такого как карбонат калия или натрия, или гидроксид калия или натрия или лития, в подходящем растворителе, таком как смеси водаметанол или вода-тетрагидрофуран, при комнатной температуре. Соединения формулы (III), где R' является гидроксилом, значения R указаны выше, R1 является-7 007392 группой формулы (IId), и R2 является алкильной группой, могут быть получены способом, включающим: а) взаимодействие соединений формулы (X) с соединениями формулы (XI), где R2 является алкилом и X является галогеном(XI) в присутствии основания, такого как трет-бутоксид калия или гидрид натрия, в подходящем растворителе, таком как тетрагидрофуран, ацетонитрил, 1,4-диоксан или N,N-диметилформамид, при температуре в интервале от примерно 0 С до комнатной температуры, с получением, таким образом, соединений формулы (XII), где значения R и R2 - такие, как указано вышеb) гидролиз соединений формулы (XII) с помощью основания, такого как карбонат калия или натрия, или гидроксид калия или натрия или лития, в подходящем растворителе, таком как смеси водаметанол или вода-тетрагидрофуран, при комнатной температуре. Соединения формулы (I), где значения R такие, как указано выше, и R1 является группой (IIс), могут быть получены взаимодействием соединений формулы (IV), где значения R такие, как указано выше,с 2,2-диметил-4-оксо-1,3-диоксолан-5-ацетальдегидом, например, полученным как описано в TetrahedronLett., 39, (1998), 5313-5316, в присутствии натрийцианоборогидрида или (полистирилметил) триметиламмония цианоборогидрида в подходящем растворителе, таком как ледяная уксусная кислота или трифторэтанол, при комнатной температуре. Соединения формулы (IV), где значения R такие, как указано выше, могут быть получены способом, включающим: а) взаимодействие соединений формулы (XIII), где значения R такие, как указано выше, с 5-изопропил-2-амино-1,3-тиазолом, полученным обычными методами, в присутствии подходящего агента сочетания, подобного карбодиимиду, такого как дициклогексилкарбодиимид, диизопропилкарбодиимид, 1-(3-диметиламинопропил)-3-этилкарбодиимид, с получением соединений формулы (XIV), где значения R такие, как указано вышеb) и гидролиз соединений формулы (XIV) в кислой среде, например, в присутствии хлористоводородной кислоты или серной кислоты в этаноле, или с помощью муравьиной кислоты или трифторуксусной кислоты в дихлорметане при комнатной температуре в течение времени в интервале от примерно 2 ч до примерно 12 ч. Реакция по вышеуказанной стадии а) осуществляется в подходящем растворителе, таком как, например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, ацетонитрил, толуол или N,N-диметилформамид при температуре в интервале от -10 С до комнатной температуры. Альтернативно, соединения формулы (XIV) могут быть получены путем преобразования соединений формулы(XIII) в соответствующие ацилхлоридные производные с помощью тионилхлорида или оксалилхлорида в подходящем растворителе, таком как толуол, дихлорметан, тетрагидрофуран, этилацетат, при температуре в интервале от примерно 0 С до комнатной температуры, и затем приводя их во взаимодействие с 5 изопропил-2-амино-1,3-тиазолом в присутствии подходящего основания, такого как триэтиламин, Nметилморфолин, N,N-диизопропилэтиламин или пиридин, в подходящем растворителе, таком как этилацетат, дихлорметан, тетрагидрофуран, ацетонитрил, N,N-диметилформамид, при температуре в интервале от 0 С до комнатной температуры. Соединения формулы (XIII), где R - как описано выше, могут быть получены взаимодействием соединений формулы (VI) с трет-бутоксикарбонилангидридом в подходящем растворителе, таком как смеси воды/1,4-диоксана в присутствии основания, такого как карбонат натрия, при комнатной температуре в течение времени, находящегося в интервале от примерно 4 до примерно 12 ч. Соединения формулы (III), где R' является удаляемой группой, удобно получать известными мето-8 007392 дами, исходя из соответствующих производных карбоновых кислот формулы (III), где R' является гидроксилом. В качестве примера, соединения, где R' является атомом галогена, например хлора, получают путем взаимодействия производных формулы (III), где R' является гидроксилом, с оксалилом или тионилхлоридом в соответствии с обычными методиками получения ацилгалогенидов. Эта реакция обычно осуществляется в присутствии каталитических количеств N,N-диметилформамида и в присутствии подходящего растворителя, например дихлорметана, тетрагидрофурана, этилацетата или толуола, при температуре в интервале от 0 С до температуры дефлегмации. Также соединения формулы (IV) могут быть получены путем амидирования, как изложено выше,при взаимодействии 2-амино-5-изопропил-1,3-тиазола с соединением формулы (VIII). В свою очередь, соединения формулы (VIII) и (V), если они сами коммерчески не доступны, известны или их легко получить известными методами. Из всего вышеизложенного квалифицированному специалисту должно быть ясно, что при получении соединений формулы (I) по любому из вышеуказанных вариантов способа необходимо, чтобы необязательные функциональные группы в исходных веществах или промежуточных для него соединениях и те, которые могли бы давать нежелательные побочные реакции, были соответственно защищены в соответствии с общепринятыми методами. Подобным же образом, преобразование этих последних в свободные незащищенные соединения может быть проведено по обычным методикам. Только в качестве примера аминогруппы могут быть, соответственно, защищенными в виде(ВОС=БОК) трет-бутоксикарбониламиногрупп путем взаимодействия с ди-трет-бутилдикарбонатом в подходящем растворителе, таком как смеси воды/1,4-диоксана, и в присутствии основания, например карбоната натрия, при осуществлении операций при комнатной температуре и в течение времени, изменяющегося в интервале от примерно 4 до примерно 12 ч. Любое последующее удаление защиты, таким образом, может быть осуществлено гидролизом в кислой среде, например, в присутствии хлористо-водородной или серной кислоты в этаноле или с помощью муравьиной или трифторуксусной кислоты в дихлорметане, при осуществлении операций при комнатной температуре и в течение времени, меняющегося в интервале от примерно 2 до примерно 12 ч. Как должно быть легко понятно, если соединения формулы (I), полученные способом, описанным выше, получаются в виде смеси изомеров, их разделение на отдельные изомеры формулы (I) в соответствии с обычными методами, включено в объем по данному изобретению. Обычные методики разделения рацемата включают, например, раздельную кристаллизацию производных диастереомерных солей или препаративную хиральную ВЭЖХ. Фармакология Соединения формулы (I) активны в качестве cdk/циклинингибиторов, и их можно использовать при лечении различных опухолей, таких как, например, карциномы, например карциномы молочных желез,карцинома легких, карцинома мочевого пузыря, карцинома толстого кишечника, опухоли яичников и эндометрия, саркомы, например саркомы мягких тканей и костей, и гематологических злокачественных опухолей, таких как, например, лейкемии. Кроме того, соединения формулы (I) могут использоваться также для лечения других нарушений клеточной пролиферации, таких как псориаз, пролиферация клеток гладких мышц сосудов, связанная с атеросклерозом, и послеоперационным стенозом и рестенозом, и для лечения болезни Альцгеймера. Ингибирующую активность предполагаемых cdk/циклинингибиторов определяли сначала методом,основанным на использовании 96-ячеечной планшеты MultiScreen-PH (Millipore), при котором фосфоцеллюлозную фильтровальную бумагу помещали на дно каждой ячейки, давая возможность связывания положительно заряженного субстрата после стадии промывания/фильтрования. Когда радиоактивно меченная фосфатная группа переносилась с помощью ser/threo киназы на связанный с фильтром гистон,излучаемый свет оценивали с помощью сцинтилляционного счетчика по следующей методике. Киназная реакция: 1,5 мкМ субстрата гистона H1, 25 мкМ АТФ (0,5 мкКи Р 33 гамма АТФ), 100 нг комплекса циклин A/cdk2, 10 мкМ ингибитора в конечном объеме, равном 100 мкл буфера (ТРИСНСl 10 мМ, рН 7,5, МgСl2 10 мМ, 7,5 мМ ДТТ) добавляли в каждую ячейку планшеты из 96 ячеек с U-образным дном. Через 10 мин инкубации при 37 С реакцию останавливали 20 мкл ЭДТУ, 120 мМ. Связывание: 100 мкл переносили из каждой ячейки планшеты Multiscreen, чтобы дать возможность связывания субстрата с фосфоцеллюлозным фильтром. Затем планшеты 3 раза промывали 150 мкл/ячейку ФБР (PBS), лишенного Са/Мg и фильтровали с помощью системы для фильтрации Multiscreen. Регистрация: фильтрам давали высохнуть при 37 С, затем добавляли 100 мкл/ячейку сцинтиллирующего раствора и меченный 33 Р гистон H1 регистрировали по подсчету радиоактивности на прибореTop-Count. Результаты: данные анализировали и выражали в виде % ингибирования по отношению к общей активности фермента (=100%). Когда число соединений, которые нужно испытать, стало сообразным, возникала необходимость-9 007392 быстрого и однородного исследования по отбору. Так, был представлен способ исследования, основанный на использовании методики SPA (Amersham Pharmacia Biotech). Данное исследование состоит в переносе радиоактивно меченной фосфатной группы с помощью киназы на биотинилированный субстрат. Полученному меченному 33 Р биотинилированному продукту давали связаться с покрытыми стрептавидином SPA гранулами (связывающая способность биотина 130 пмоль/мг), и излучение света регистрировали на сцинтилляционном счетчике. Определение ингибирования активности cdk2/циклина А Киназная реакция: в каждую ячейку планшеты из 96 ячеек с U-образным дном добавляли 4 мкМ субстрата биотинилированного на месте гистона H1 (SigmaН-5505), 10 мкМ АТФ (0,1 мкКи 33 Р-гаммаАТФ), 4,2 нг комплекса cdk2/циклина А, ингибитора в конечном объеме, равном 30 мкл буфера(ТРИСНСl 10 мМ, рН 7,5, МgСl2 10 мМ, ДТТ 7,5 мМ+0,2 мг/мл БСА). Через 30 мин инкубации при комнатной температуре реакцию останавливали 100 мкл ФБР (PBS)+32 мМ ЭДТУ+0,1% Тритон Х-100+500 мкМ АТФ, содержащими 1 мг гранул SPA. Затем объем, равный 110 мкл, переносили на Optiplate. После 20 мин инкубации для связывания субстрата добавляли 100 мкл 5 М CsCl, чтобы дать возможность образования слоя гранул поверх планшеты и оставляют стоять на 4 ч перед измерением радиоактивности на приборе Top-Count. Определение IC50: ингибиторы испытывали при разных концентрациях, находящихся в интервале от 0,0015 до 10 мкМ. Данные экспериментов анализировали с помощью компьютерной программыGraphPad Prizm, используя логистическое уравнение по четырем параметрам у = низ + (верх-низ)/(1+10logIC50-x)коэффиц. наклона,где х является логарифмом концентрации ингибитора,у является реакцией; у начинается снизу и идет к вершине по кривой сигмоидальной формы.Ki на сdk2/циклине А. Метод эксперимента: реакцию осуществляли в буфере (10 мМ Трис, рН 7,5, 10 мМ МgСl2, 0,2 мг/мл БСА, 7,5 мМ ДТТ) содержащем 3,7 нМ фермента, гистона и АТФ (постоянное соотношение нерадиоактивного/меченного АТФ 1/3000). Реакцию останавливали с помощью ЭДТУ и субстрат связывали на фосфомембране (96-ячеечные планшеты Multiscreen от Millipore). После интенсивного промывания планшеты Multiscreen считывают на счетчике с верхним подсчетом. Измеряли контроль (время ноль) для каждой концентрации АТФ и гистона. План эксперимента: скорость реакции определяли при разных четырех концентрациях АТФ, субстрата (гистона) и ингибитора. В области соответствующих значений Km АТФ и субстрата и значенийIC50). Предварительный ход эксперимента во времени в отсутствие ингибитора и при разных концентрациях АТФ и субстрата давал возможность выбора единственного времени окончания (10 мин) в линейном интервале реакции для эксперимента определения Ki. Оценки кинетического параметра: кинетические параметры оценивали с помощью синхронной нелинейной регрессии методом наименьших квадратов, применяя [рав.1] (конкурентный ингибитор по отношению к АТФ, случайный механизм) с использованием полного набора данных (80 точек): где А=[АТФ], В=[субстрат], I=[ингибитор], Vm=максимальная скорость, Kа, Kb, Ki - константы диссоциации АТФ, субстрата и ингибитора, соответственно, - и -фактор кооперативности между связыванием субстрата и АТФ и связыванием субстрата и ингибитора соответственно. Кроме того, выбранные соединения были охарактеризованы на наборе ser/threo-киназ непосредственно связанных с клеточным циклом (cdk2/циклинЕ, cdk1/циклинВ 1, cdk5/p25, cdk4/циклинD1). Исследование подавления активности cdk2/циклинЕ Киназная реакция: в каждую ячейку из 96 с U-образным дном добавляли 10 мкМ субстрата биотинилированного на месте гистона H1 (SigmaН-5505), 30 мкМ АТФ (0,2 мкКи 33 Р-гамма-АТФ), 4 нг комплекса GST-циклинЕ/cdk2, ингибитор в конечном объеме, равном 30 мкл, буфера (Трис НСl 10 мМ, рН 7,5, МgСl2 10 мМ, ДТТ 7,5 мМ+0,2 мг/мл БСА). Через 60 мин инкубации при к.т. реакцию останавливали 100 мкл ФБР+32 мМ ЭДТУ+0,1% Тритона Х-100+500 мкМ АТФ, содержащих 1 мг гранул SPA. Затем объем, равный 110 мкл, переносили в Optiplate. Через 20 мин инкубации для связывания субстрата добавляли 100 мкл 5 М CsCl, чтобы дать возможность наслоения гранул поверх планшеты и оставляли стоять на 4 ч перед подсчетом радиоактивности на приборе Top-Count. Определение IС 50: см. выше. Исследование подавления активности cdk1/циклин В 1 Киназная реакция: в каждую ячейку из 96 с U-образным дном добавляли 4 мкМ субстрата биотинилированного на месте гистона H1 (SigmaН-5505), 20 мкМ АТФ (0,2 мкКи 33 Р-гамма-АТФ), 3 нг ком- 10007392 плекса cdkl/циклин В, ингибитор в конечном объеме, равном 30 мкл, буфера (Трис НСl 10 мМ, рН 7,5,МgСl2 10 мМ, ДТТ 7,5 мМ+0,2 мг/мл БСА). Через 20 мин инкубации при к.т. реакцию останавливали 100 мкл ФБР+32 мМ ЭДТУ+0,1% Тритона Х-100+500 мкМ АТФ, содержащих 1 мг гранул SPA. Затем объем,равный 110 мкл, переносили в Optiplate. Через 20 мин инкубации для связывания субстрата добавляли 100 мкл 5 М CsCl, чтобы дать возможность наслоения гранул поверх планшеты и оставляли стоять на 4 ч перед подсчетом радиоактивности на приборе Top-Count. Определение IС 50: см. выше. Исследование подавления активности cdk5/p25 Исследование подавления активности cdk5/p25 выполняли в соответствии со следующей методикой. Киназная реакция: в каждую ячейку из 96 с U-образным дном добавляли 10 мкМ субстрата биотинилированного гистона H1 (SigmaН-5505), 30 мкМ АТФ (0,2 мкКи Р 33-гамма-АТФ) , 15 нг комплексаCDK5/p25, ингибитор в конечном объеме, равном 30 мкл, буфера (Трис НСl 10 мМ, рН 7,5, МgСl2 10 мМ,ДТТ 7,5 мМ + 0,2 мг/мл БСА). Через 30 мин инкубации при к.т. реакцию останавливали 100 мкл ФБР + 32 мМ ЭДТУ + 0,1% Тритона Х-100 + 500 мкМ АТФ, содержащих 1 мг гранул SPA. Затем объем, равный 110 мкл, переносили в Optiplate. Через 20 мин инкубации для связывания субстрата добавляли 100 мкл 5 М CsCl, чтобы дать возможность наслоения гранул поверх Optiplate и оставляли стоять на 4 ч перед подсчетом радиоактивности на приборе Top-Count. Определение IC50: см. выше. Исследование подавления активности cdk4/циклина D1 Киназная реакция: в каждую ячейку из 96 ячеек с U-образным дном добавляли 0,4 мкМ субстрата мышиного GST-Rb (769-921) ( sc-4112 от Santa Cruz), 10 мкМ АТФ (0,5 мкКи Р 33-гамма-АТФ), 100 нг экспрессируемого бакуловирусом GST-cdk4/GST-циклинD1, соответствующие концентрации ингибитора в конечном объеме, равном 50 мкл, буфера (Трис НСl 10 мМ, рН 7,5, МgСl2 10 мМ, 7,5 мМ ДТТ + 0,2 мг/мл БСА). Через 40 мин инкубации при 37 С реакцию останавливали 20 мкл ЭДТУ 120 мМ. Связывание: 60 мкл переносили из каждой ячейки в планшету Multiscreen, чтобы дать субстрату связаться с фосфоцеллюлозным фильтром. Затем планшеты промывали 3 раза 150 мкл/ячейку ФБР, не содержащим Са/Мg, и фильтровали с помощью системы для фильтрования Multiscreen. Обнаружение: фильтрам давали высохнуть при 37 С, затем добавляли 100 мкл/ячейку сцинтиллирующего раствора и меченный 33 Р фрагмент Rb обнаруживали по подсчету радиоактивности на прибореTop-Count. Определение IC50: см. выше. По данным представленных выше исследований ингибирования соединения формулы (I) по данному изобретению, как показывают полученные данные, обладают высокой подавляющей cdk активностью. Например, при испытании в отношении cdk2/циклинa А типичное соединение по данному изобретению - (2S)-2-[4-(ацетиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид проявляет ингибирующую активность, выражаемую IС 50, равной 11 нМ. Неожиданно, что указанная полученная ингибирующая активность заметно превосходила, активность очень близкого прототипного соединения, используемого для сравнимых целей. Фактически, при испытании в отношении cdk/циклина А, как сообщено ранее, соединение N-(5-изопропил-1,3-тиазол-2 ил)-2-[4-(ацетиламино)фенил]ацетамид из WO 01/14353 (см. пример 4, с переходом раздела на страницах 32, 33, там же) показало значение IC50, равное 110 нМ. Другое типичное соединение по данному изобретению, а именно N-(5-изопропил-1,3-тиазол-2-ил)2-[4-2-оксо-1-пирролидинил)фенил]ацетамид, при испытании в отношении cdk2/циклина А продемонстрировало подобную превосходную активность. Итак, новые соединения по данному изобретению неожиданно обладают ингибирующей cdk активностью значительно более высокой, чем активность ближайших прототипных соединений из WO 01/14353, и, таким образом, являются особенно благотворными для терапии при нарушениях пролиферации, связанных с измененной киназной активностью, зависимой от клеточного цикла. Благодаря ограничению нерегулируемой пролиферации опухолевых клеток, соединения формулы(I), следовательно, могут использоваться для лечения различных опухолей, таких как, например, карциномы, например карцинома молочных желез, карцинома мочевого пузыря, карцинома толстого кишечника, опухоли яичников, эндометрия, саркомы, например саркома мягких тканей и костей, и гематологические злокачественные опухоли, такие как, например, лейкемии. Кроме того, соединения формулы (I) могут использоваться также при лечении других нарушений клеточной пролиферации, таких как псориаз, пролиферация клеток гладких мышц сосудов, связанная с атеросклерозом и послеоперационным стенозом и рестенозом, и при лечении болезни Альцгеймера. Соединения по данному изобретению можно вводить либо сами по себе, либо альтернативно в сочетании с известными примерами противораковой терапии, такими как курс лучевой терапии или химио- 11007392 терапии в комбинации с цитостатическими или цитотоксическими средствами, средствами типа антибиотиков, алкилирующими средствами, гормональными средствами, иммунологическими средствами,средствами типа интерферона, ингибиторами циклооксигеназы (например, ингибиторами СОХ-2), ингибиторами матриксметаллопротеазы, ингибиторами теломеразы, ингибиторами тирозинкиназы, средствами против рецепторов фактора роста, средствами против HER, средствами против EGFR, средствами против ангиогенеза (например, ингибиторы ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами путей трансдукции сигнала ras-raf, ингибиторами клеточного цикла, другими ингибиторами cdk,связывающими тубулин средствами, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II и тому подобного. В качестве примера соединения по данному изобретению можно вводить в сочетании с одним химиотерапевтическим средством или несколькими, таким как, например, экземестан, форместан, анастрозол, летрозол, фадрозол, таксан и такие производные, как паклитаксел или досетаксел, инкапсулированные таксаны, СРТ-11, производные каптотецина, антрациклиновые гликозиды, например, доксорубицин,идарубицин, эпирубицин, этопозид, навелбин, винбластин, карбоплатин, цисплатин, эстрамустина фосфат, целекоксиб, тамоксифен, ралоксифен, суген SU-5416, суген SU-6668, герцептин и тому подобное,необязательно, в их липосомных препаратах. Если изготовлен препарат с фиксированной дозой, в таких комбинированных продуктах соединения по данному изобретению используются в интервале дозировки, описанном ниже, а другое фармацевтически активное средство - в принятом интервале дозировки. Соединения формулы (I) могут использоваться последовательно с известными противораковыми средствами, когда невозможен комбинированный препарат. Соединения формулы (I) по данному изобретению, пригодные к применению для млекопитающих,например людей, можно вводить обычными путями, и уровень дозирования зависит от возраста, веса,состояния здоровья пациента и пути введения. Например, подходящая дозировка, адаптированная для перорального введения, соединения формулы (I) может находиться в интервале от примерно 10 до примерно 500 мг на дозу от 1 до 5 раз в сутки. Соединения по данному изобретению можно вводить в разных дозированных формах, например, перорально в виде таблеток, капсул, таблеток с сахарным или пленочным покрытием, жидких растворов или суспензий; ректально в виде суппозиториев; парентерально, например, внутримышечно или путем внутривенных и/или интратекальных и/или интраспинальных инъекций или вливаний. Данное изобретение включает также фармацевтические композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым вспомогательным веществом, которое может быть носителем или разбавителем. Фармацевтические композиции, содержащие соединения по данному изобретению, обычно изготавливают, следуя обычным методам, и применяют в подходящей лекарственной форме. Например, твердые пероральные формы могут содержать, вместе с активным соединением, разбавители, например лактозу, декстрозу, тростниковый сахар, сахарозу, целлюлозу, кукурузный или картофельный крахмал; вещества, улучшающие скольжение, например двуокись кремния, тальк, стеариновую кислоту, стеарат магния, стеарат кальция, и/или полиэтиленгликоли; связывающие вещества, например крахмалы, аравийскую камедь, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; дезинтеграторы, например крахмал, альгиновую кислоту, альгинаты или натрийкрахмалгликолят; шипучие смеси; красители; подсластители; улучшающие смачивание вещества, такие как лецитин,полисорбаты, лаурилсульфаты; и, в общем, нетоксичные и фармакологически неактивные вещества, используемые в фармацевтических препаратах. Эти фармацевтические препараты можно изготавливать известным образом, например, посредством процессов смешивания, грануляции, таблетирования, покрытия сахаром и покрытия пленкой. Жидкие дисперсии для перорального введения могут быть, например, сиропами, эмульсиями и суспензиями. Например, сиропы могут содержать в качестве носителя сахарозу или сахарозу с глицерином и/или маннитом и сорбитом. Суспензии и эмульсии могут содержать, как примеры носителей, природный агар, альгинат натрия,пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензия или растворы для внутримышечных инъекций могут содержать, вместе с активным соединением, фармацевтически приемлемый носитель, например стерильную воду, оливковое масло, этилолеат, гликоли, например пропиленгликоль, и, если желательно, подходящее количество лидокаина гидрохлорида. Растворы для внутривенных инъекций или вливаний могут содержать в качестве носителя стерильную воду или предпочтительно они могут быть в виде стерильных водных изотонических солевых растворов, или они могут содержать пропиленгликоль в качестве носителя. Суппозитории могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например масло какао, полиэтиленгликоль, поверхностно-активное вещество - сложный эфир полиоксиэтиленсорбитана и жирных кислот или лецитин.- 12007392 С целью лучшей иллюстрации по данному изобретению без представления ими каких-либо ограничений далее даны следующие примеры. Пример 1. Получение 2-амино-5-изопропил-1,3-тиазола. 3-Метилбутиральдегид (2 мл; 18,6 ммоль) растворяли в 15 мл 1,4-диоксана. В раствор по каплям добавляли 40,4 мл (18,6 ммоль) раствора 2 об.% брома в 1,4-диоксане при 0 С. Смесь выдерживали при комнатной температуре при перемешивании в течение 2 ч, затем добавляли 2,83 г (37,2 ммоль) тиомочевины и 5 мл этанола. После 6 ч при комнатной температуре раствор выпаривали досуха, остаток растворяли в СН 2 Сl2 и продукт экстрагировали 1 М хлористо-водородной кислотой; водный слой делали щелочным, применяя 30% раствор гидрата аммония и снова экстрагировали СН 2 Сl2. Органическую фазу сушили над сульфатом натрия и выпаривали в вакууме. Остаток подвергали хроматографии на колонке с силикагелем,элюируя циклогексаном-этилацетатом с получением 1,1 г (42% выход) соединения, указанного в заголовке. 1H ЯМР (DMSO-d6)м.д.: 6,6 (с, 2H, NH2); 6,58 (с, 1 Н, тиазол СН); 2,9 (м, 1 Н, СНМе 2); 1,18 (с, 3 Н,МеСНМе); 1,17 (с, 3 Н, МеСНМе). Пример 2. 2-(4-Аминофенил)пропановая кислота. 10 г (0,05 моль) 2-(4-нитрофенил)пропановой кислоты растворяли в смеси 5 мл воды и 100 мл метанола и добавляли 0,65 г Pd/C 5%. Смесь подвергали гидрированию при 60 фунт/дюйм 2 в течение 2 ч при комнатной температуре. После отделения катализатора фильтрованием на кселите метанол выпаривали в вакууме и соединение, указанное в заголовке, кристаллизовали из воды при охлаждении (7 г; 85% выход).ESI(+)MS: m/z 166 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6)м.д.: 7,08-6,71 (2 д, 4 Н, СН-фенил, J=7,1 Гц), 3,76 (кв., 1 Н, СН-Ме,J=7,6 Гц), 1,53 (д, 3 Н, СН 3, 7,6 Гц). Пример 3. (2S)-2-(4-Аминофенил)пропановая кислота и (2R)-2-(4-аминофенил)пропионовая кислота. К 4,34 г 2-(4-аминофенил)пропановой кислоты добавляли 26 мл воды и 3,94 г L-(+)-винной кислоты. Смесь нагревали до 80 С при перемешивании до полного растворения. Нагревание затем прекращали и раствор оставляли охлаждаться. Через 24 ч 3,8 г левовращающего тартрата фильтровали и сушили. Раствор, содержащий правовращающий тартрат, концентрировали в вакууме при 40 С, чтобы испарить примерно 10 мл воды. Затем раствор охлаждали до 30 С и добавляли 1,047 г гидрата натрия.(+)-(2S)-2-(4-Аминофенил)пропановую кислоту собирали фильтрованием и сушили с получением 1,36 г (D20=+73,0; С=0,1% в метаноле). Обрабатывая левовращающий тартрат гидроксидом натрия, получали (-)-(2S)-2-(4-аминофенил)пропановую кислоту. Пример 4. [4-(2-Оксо-1-пирролидинил)фенил]уксусная кислота. 8,8 г (0,058 моль) 4-аминофенилуксусной кислоты растворяли в 350 мл N,N-диметилформамида и добавляли 10 г (0,058 моль) 6,6-диметил-5,7-диоксаспиро(2,5)октан-4,8-диона, и смесь перемешивали при нагревании с обратным холодильником в течение 8 ч. Растворитель затем выпаривали в вакууме и продукт-сырец очищали хроматографией на колонке с силикагелем с использованием смеси гексана/этилацетата 7/3 в качестве элюента, получая, таким образом, 6,53 г (51% выход) соединения, указанного в заголовке.(м, 2 Н, CH2N), 2,57 (м, 2 Н, СН 2 СО), 2,10 (м, 2 Н, СН 2). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - карбоновых кислот: 2-[4-(2-оксо-1-пирролидинил)фенил]пропановую кислоту;(2S)-2-[4-(2-оксо-1-пирролидинил)фенил]пропановую кислоту. Пример 5. N-(5-Изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]ацетамид. 2,5 г (11,4 ммоль) [4-(2-оксо-1-пирролидинил)фенил]уксусной кислоты растворяли в 150 мл дихлорметана и последовательно добавляли 1,54 г (11,4 ммоль) N-гидроксибензотриазола и 2,18 г (11,4 ммоль) 1-(3-диметиламинопропил)-3-этилкарбодиимида при 0 С. Через 30 мин при той же температуре по каплям добавляли 1,35 г (5,7 ммоль) 5-изопропил-2-амино-1,3-тиазола, растворенного в 40 мл дихлорметана. Через 6 ч при комнатной температуре смесь промывали насыщенным раствором гидрокарбоната натрия. Органический слой отделяли, сушили над сульфатом натрия и концентрировали при пониженном давлении. Продукт-сырец очищали хроматографией на колонке с силикагелем (гексанэтилацетат 7/3) с получением 1,17 г (60% выход) соединения, указанного в заголовке.H ЯМР (400 МГц, DMSO-d6)м.д.: 7,48-7,51 (м, 4 Н, СН-фенил), 3,68 (с, 2 Н, CH2Ph), 7,51 (с, 1 Н,СН-тиазол), 3,91 (м, 1 Н, СН-изопропил), 1,39 (д, 6 Н, СН 3, J=7,1 Гц) 3,83 (м, 2 Н, CH2N), 2,60 (м, 2 Н,СН 2 СО), 2,15 (м, 2 Н, СН 2). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - карбоновых кислот:(2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропанамид. Пример 6. (2S)-2-4-[(трет-Бутоксикарбонил)амино]фенилпропановая кислота. 12 г (73 ммоль) (2S)-2-(4-аминофенил)пропановой кислоты, суспендированной в 140 мл 1,4 диоксана и 140 мл воды, обрабатывали 7,6 г (73 ммоль) карбоната натрия, растворенного в 70 мл воды. Полученный раствор, охлажденный до 4 С, подвергали взаимодействию с 17,2 г (79 ммоль) третбутоксикарбонилангидрида и перемешивали в течение ночи, давая температуре подняться до комнатной. Растворитель выпаривали, водную фазу промывали 150 мл этилацетата, разбавляли 200 мл того же растворителя, при перемешивании обрабатывали 130 мл 1 М водного раствора гидросульфата калия. Органический слой отделяли и водную фазу экстрагировали превосходящим объемом этилацетата. Объединенные органические экстракты, промытые насыщенным раствором соли и высушенные над сульфатом натрия, выпаривали и получали соединение 18,8 г (94% выход), указанное в заголовке, после растирания в гексане и фильтрования.ESI(+)MS: m/z 266 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6)м.д.: 7,47-7,52 (м, 4 Н, СН-фенил), 3,76 (кв., 1 Н, СНМе, J=7,6 Гц),1,53 (д, 3 Н, СН 3, J=7,6), 1,51 (с, 9 Н, трет-бутил). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - карбоновых кислот:(с, 9 Н, трет-бутил). Пример 7. (2S)-2-(4-Аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид. 265 мг (1 ммоль) (2S)-2-4-[(трет-бутоксикарбонил)амино]фенилпропановой кислоты обрабатывали при 4 С 0,146 мл (2 ммоль) тионилхлорида. Реакционную смесь перемешивали в течение 2,5 ч, и температура реакционной смеси постепенно повышалась до комнатной температуры. Смесь выпаривали досуха, собирали тетрагидрофураном и тщательно выпаривали. Этот неочищенный продукт использовали на следующей стадии без дополнительной очистки. Его растворяли в 3 мл безводного тетрагидрофурана и по каплям добавляли к раствору 113 мг (0,8 ммоль) 5-изопропил-2-амино-1,3-тиазола и 0,14 мл (1 ммоль) триэтиламина в 5 мл тетрагидрофурана при комнатной температуре. Через 3 ч растворитель выпаривали, неочищенный продукт снова растворяли в 5 мл дихлорметана и добавляли 1 мл трифторуксусной кислоты. Смесь перемешивали при комнатной температуре в течение 4 ч. Выпаривание растворителя давало масло, которое обрабатывали насыщенным раствором гидрокарбоната натрия и экстрагировали несколько раз дихлорметаном. Объединенные органические экстракты сушили над сульфатом натрия и выпаривали с получением 115 мг (в целом выход 50%) соединения, указанного в заголовке. Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - карбоновых кислот:(4-аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид. Пример 8. 2-(4-[(2-Хлорэтокси)карбонил]аминофенил)пропановая кислота. 1 г (6 ммоль) 2-(4-аминофенил)пропановой кислоты растворяли в 30 мл дихлорметана. Смесь охлаждали до 0 С и добавляли 1,24 мл (12 ммоль) 2-хлорэтилхлорформиата. Через 30 мин порциями добавляли 2,27 г (12 ммоль) додекагидрата фосфата натрия и реакционную смесь выдерживали при перемешивании в течение 3 ч. Затем добавляли 0,5 н. хлористо-водородную кислоту до получения кислой рН, и продукт экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия и выпаривали с получением масла, которое давало после кристаллизации из диизопропилового эфира 1,3 г (93% выход) соединения, указанного в заголовке. 1H ЯМР (400 МГц, DMSO-d6)м.д.: 7,47-7,58 (2 д, 4 Н, СН-фенил, J=9,0 Гц), 3,75 (кв., 1 Н, СН-Ме,J=7,6 Гц), 4,31 (м, 2 Н, СН 2 Сl), 3,62 (м, 2 Н, СН 2 О), 1,53 (д, 3 Н, СН 3, 7,6 Гц). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - карбоновых кислот:(м, 2 Н, СН 2 Сl), 3,63 (м, 2 Н, СН 2 О). Пример 9. 2-[4-(2-Оксо-1,3-оксазолидин-3-ил)фенил]пропановая кислота. 500 мг (1,85 ммоль) 2-(4-[(2-хлорэтокси)карбонил]аминофенил)пропановой кислоты растворяли в 10 мл N,N-диметилформамида и добавляли 0,55 мл (3,7 ммоль) 1,8-диазабицикло[5,4,0]ундец-7-ена при комнатной температуре. Через 2 ч при перемешивании смеси выливали в 150 мл воды, подкисленной 1 н. хлористо-водородной кислотой, и тщательно экстрагировали этилацетатом. Органические экстракты сушили над сульфатом натрия и выпаривали досуха, получая 350 мг (80% выход) соединения, указанного в заголовке, перекристаллизованного из смеси этилацетата-диизопропилового эфира.H ЯМР (400 МГц, DMSO-d6) м.д.: 7,08-7,35 (2 д, 4 Н, СН-фенил, J=8,6 Гц), 3,76 (кв., 1 Н, СН-Ме,J=7,6 Гц), 3,80 (м, 2 Н, CH2N), 4,45 (м, 2 Н, СН 2 О), 1,53 (д, 3 Н, СН 3, 7,6 Гц). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих хлорпроизводных:(м, 2 Н, CH2N), 4,45 (м, 2 Н, СН 2 О). Пример 10. N-(4-Изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид. 460 мг (1,96 ммоль) 2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропановую кислоту суспендировали в 15 мл дихлорметана и добавляли 0,22 мл (2,5 ммоль) оксалилхлорида и одну каплю N,Nдиметилформамида при 0 С. Через 2 ч перемешивания растворитель удаляли, неочищенный продукт снова растворяли в 15 мл тетрагидрофурана и по каплям добавляли в раствор 250 мг (1,764 ммоль) 5 изопропил-2-амино-1,3-тиазола и 2,2 мл (11,76 ммоль) N,N-диизопропилэтиламина в 11 мл того же растворителя при 0 С. Температура реакции постепенно повышалась до комнатной температуры, и через 5 ч растворитель выпаривали в вакууме, неочищенный продукт снова растворяли в дихлорметане и промывали водой. Органический слой окончательно сушили над сульфатом натрия, выпаривали и остаток подвергали хроматографии на колонке с силикагелем, получая 450 мг (в целом 71%) соединения, указанного в заголовке.H ЯМР (400 МГц, DMSО-d6) м.д.: 6,88 (с, 4 Н, СН-фенил), 3,85 (кв., 1 Н, СНМе, J=6,8 Гц), 1,25 (д,3 Н, СН 3, J=6,8 Гц), 7,55 (с, 1 Н, СН-тиазол), 3,90 (м, 1 Н, СН-изопропил), 1,38 (д, 6 Н, СН 3-изопропил, J=7,0 Гц), 3,80 (м, 2 Н, CH2N), 4,40 (м, 2 Н, СН 2 О). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - карбоновых кислот:(2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]пропанамид. Пример 11. Метил-2-(4-аминофенил)пропаноат. 10 г (0,06 моль) 4-аминофенилпропановую кислоту суспендировали в 100 мл метанола. Реакционную, смесь охлаждали до 0 С и по каплям добавляли 10 мл 96% серной кислоты. Полученный раствор выдерживали при комнатной температуре в течение ночи и затем выливали в ледяную воду, подщелачивали 30% гидратом аммония и несколько раз экстрагировали дихлорметаном. Органическую фазу сушили над сульфатом натрия с получением 10 г (93% выход) соединения, указанного в заголовке, в виде масла.ESI(+)MS: m/z 180 (100, МН+); Н ЯМР (400 МГц, DMSO-d6) м.д.: 6,50-6,94 (2 д, 4 Н, СН-фенил, J=8,6 Гц), 3,70 (кв., 1 Н, СНМе,J=7,2 Гц), 1,48 (д, 3 Н, С 10, J=7,2 Гц), 3,50 (с, 3 Н, СH3 О). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - карбоновых кислот: метил(2R)-2-(4-аминофенил)пропаноат; метил(2S)-2-(4-аминофенил)пропаноат; метил-2-(4-аминофенил)ацетат;(с, 3 Н, СH3 О). Пример 12. Метил-2-[4-([(2-хлорэтил)амино]карбониламино)фенил]пропаноат. 700 мг (3,9 ммоль) метил-2-(4-аминофенил)пропаноата растворяли в 10 мл дихлорметана и добавляли 0,4 мл (4,68 ммоль) 2-хлорэтилизоцианата при комнатной температуре. Через 2 ч образовавшийся осадок собирали фильтрованием и сушили в вакууме, получая 1 г (90% выход) соединения, указанного в заголовке. 1 Н ЯМР (400 МГц, DMSO-d6) м.д.: 7,28-7,53 (2 д, 4 Н, СН-фенил, J=9,0 Гц), 3,69 (кв., 1 Н, СНМе,J=7,1 Гц), 1,44 (д, 3 Н, СН 3, J=7,1 Гц), 3,48 (с, 3 Н, СH3 О), 3,50 (м, 2 Н, СН 2 Сl), 3,31 (м, 2 Н, CH2N). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих аминопроизводных: метил(2R)-2-[4-([(2-хлорэтил)амино]карбониламино)фенил]пропаноат; метил(2S)-2-[4-([(2-хлорэтил)амино]карбониламино)фенил]пропаноат; метил-2-[4-([(2-хлорэтил)амино]карбониламино)фенил]ацетат; Пример 13. Метил-2-[4-(2-оксо-1-имидазолидинил)фенил]пропаноат. 950 мг (3,3 ммоль) метил-2-[4-([(2-хлорэтил)амино]карбониламино)фенил]пропаноата растворяли в 20 мл N,N-диметилформамида и добавляли 2 мл 1,8-диазабицикло[5,4,0]ундец-7-ена. Реакционную смесь выдерживали при комнатной температуре в течение 6 ч. Добавляли 500 мл смеси 1/1 гексана/этилацетата и органическую фазу промывали 1 н. хлористо-водородной кислотой, насыщенным раствором соли, сушили над сульфатом натрия и выпаривали досуха, получая 760 мг (92% выход) соединения, указанного в заголовке.ESI(+)MS: m/z 249 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6) м.д.: 7,19-6,82 (2 д, 4 Н, СН-фенил, J=8,6 Гц), 3,69 (кв., 1 Н, СНМе,J=7,2 Гц), 1,48 (д, 3 Н, СН 3, J=7,2 Гц), 3,50 (с, 3 Н, СH3 О), 3,85 (м, 2 Н, CH2N), 3,48 (м, 2 Н, CH2NH). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих хлорпроизводных: метил(2R)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропаноат; метил(2S)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропаноат; метил-2-[4-(2-оксо-1-имидазолидинил)фенил]ацетат. Пример 14. 2-[4-(2-Оксо-1-имидазолидинил)фенил]пропановая кислота. 850 мг (3,42 ммоль) метил-2-[4-(2-оксо-1-имидазолидинил)фенил]пропаноата растворяли в 30 мл метанола и добавляли 10 мл насыщенного раствора карбоната натрия. После ночи при комнатной температуре метанол выпаривали и водную фазу экстрагировали этилацетатом, подкисляли 1 н. хлористоводородной кислотой и снова экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия и выпаривали с получением 400 мг (50% выход) соединения, указанного в заголовке.ESI(+)MS: m/z 235 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6) м.д.: 7,03-7,33 (2 д, 4 Н, СН-фенил, J=8,6 Гц), 3,76 (кв., 1 Н, СНМе,J=7,6 Гц), 1,53 (д, 3 Н, СН 3, J=7,6 Гц), 3,84 (м, 2 Н, CH2N), 3,48 (м, 2 Н, CH2NH). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - сложных эфиров:ESI(+)MS: m/z 249 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6) м.д.: 7,14-7,35 (2 д, 4 Н, СН-фенил, J=8,5 Гц), 3,76 (кв., 1 Н, СНМе,J=7,6 Гц), 1,52 (д, 3 Н, СН 3, J=7,6 Гц), 3,20 (м, 2 Н, CH2NMe), 3,70 (м, 2 Н, CH2NPh), 2,75 (с, 3 Н, CH3N); 2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]уксусную кислоту. Пример 15. Метил-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]пропаноат. 248 мг (1 ммоль) 2-[4-(2-оксо-1-имидазолидинил)фенил]пропаноата в N,N-диметилформамиде в атмосфере аргона обрабатывали 120 мг (3 ммоль) 60% гидрида натрия. Через 20 мин добавляли 0,068 мл 1(1,1 ммоль) метилйодида. Через 2 ч реакционную смесь выливали в ледяную воду, разбавляли 10 мл гексана/этилацетата 1/1 и дважды промывали 2 н. хлористо-водородной кислотой. Органическую фазу сушили над сульфатом натрия, выпаривали, очищали хроматографией (гексан/этилацетат 6/4) с получением 105 мг (40% выход) соединения, указанного в заголовке.H ЯМР (400 МГц, DMSO-d6) м.д.: 6,93-7,19 (2 д, 4 Н, СН-фенил, J=8,4 Гц), 3,69 (кв., 1 Н, СНМе,J=7,2 Гц), 1,48 (д, 3 Н, СН 3, J=7,2 Гц), 3,35 (м, 2 Н, CH2NMe), 3,70 (м, 2 Н, CH2NPh), 2,74 (с, 3 Н, CH3N),3,44 (с, 3 Н, СH3 О). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - сложных эфиров: метил(2R)-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]пропаноат; метил(2S)-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]пропаноат; метил-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]ацетат. Пример 16. (2S)-2-4-[(3S)-3-Гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол 2-ил)пропанамид. 158 мг (1 ммоль) [(4S)-2,2-диметил-5-оксо-1,3-диоксолан-4-ил]ацетальдегида и 290 мг (1 ммоль)(2S)-2-(4-аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамида растворяли в 10 мл трифторэтанола, обрабатывали цианоборогидридом (полистирилметил)триметиламмония (Novabiochem, загрузка: 3,04,5 ммоль/г) и перемешивали в течение ночи при комнатной температуре. В этих условиях вторичный амин, получаемый при восстановительном аминировании, спонтанно образует -лактам. Смолу отфильтровывали и промывали метанолом. Выпаривание фильтрата с последующей флэш-хроматографией неочищенного продукта давали 269 мг (72% выход) соединения, указанного в заголовке. Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих аминопроизводных и подходящего (2,2-диметил-5-оксо-1,3-диоксолан-4-ил)ацетальдегида: 2-[4-(3-гидрокси-2-оксо-1-пирролидинил)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 2-4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 2-4-[(3R)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 2-[4-(3-гидрокси-2-оксо-1-пирролидинил)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид; 2-4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид; 2-4-[(3R)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид;(2S)-2-4-[(трет-Бутоксикарбонил)амино]фенилпропановую кислоту (4,2 г, 15,85 ммоль) растворяли в безводном тетрагидрофуране (48 мл), добавляли N,N-диметилформамид и по каплям добавляли чистый оксалилхлорид (1,49 мл, 17,43 ммоль) при +4C в атмосфере аргона. Реакционную смесь перемешивали в течение 2 ч, и температура реакции постепенно повышалась до комнатной температуры. Смесь выпаривали досуха; не совсем белое твердое вещество собирали циклогексаном, фильтровали, тщательно промывали циклогексаном и сушили в вакууме. Получали ацилхлорид при 84% выходе и использовали без дополнительной очистки на следующей стадии. Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих производных - кислот: трет-бутил-4-[(1R)-2-хлор-1-метил-2-оксоэтил]фенилкарбамат; трет-бутил-4-(2-хлор-1-метил-2-оксоэтил)фенилкарбамат; трет-бутил-4-(2-хлор-2-оксоэтил)фенилкарбамат. Пример 18. трет-Бутил-4-(lS)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенилкарбамат. К 2-амино-5-изопропил-1,3-тиазолу (1,63 г, 11,48 ммоль), растворенному в безводном тетрагидрофуране (50 мл) добавляли диэтиламинометилполистирол (Fluka, нагрузка: 3,2 ммоль/г, 3,98 г). Реакционную смесь осторожно перемешивали и подвергали взаимодействию, добавляя по каплям в атмосфере аргона, с трет-бутил-4-[(1S)-2-хлор-1-метил-2-оксоэтил]фенилкарбаматом (3,61 г, 12,756 ммоль), растворенным в тетрагидрофуране (40 мл). Через 1 ч при +4 С и еще через 2 ч при комнатной температуре добавляли трис-(2-аминоэтил)аминополистирол (Novabiochem, нагрузка: 3,2 ммоль/г, 2,3 г), чтобы связать любое непрореагировавшее количество ацилхлорида и его соответствующую кислоту. После перемешивания в течение одного часа смолы отфильтровывали и промывали несколько раз дихлорметаном и ме- 17007392 танолом. После выпаривания летучих веществ оставалось светло-желтое твердое вещество, которое подвергали следующей стадии без какой-либо дополнительной очистки.ESI(+)MS: m/z 390 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6)м.д.: 11,98 (с, 1 Н), 9,24 (с, 1 Н), 7,35 (д, 2 Н, J=8,7 Гц), 7,2 (д, 2 Н, J=8,7 Гц), 7,10 (с, 1 Н), 3,85 (кв., 1 Н, J=7,0 Гц), 3,1 (м, 1 Н, J=6,8 Гц), 1,44 (с, 9 Н), 1,36, (д, 3 Н, J=7,0 Гц), 1,22 (д,6 Н, J=6,8 Гц). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих ацилхлоридных производных: трет-бутил-4-(1R)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенилкарбамат; трет-бутил-4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенилкарбамат; трет-бутил-4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилфенилкарбамат; т.пл. 179-180 С; 1 Н ЯМР (400 МГц, DMSO-d6)м.д.: 12,1 (с, 1 Н), 9,22 (с, 1 Н), 7,35 (д, 2 Н), 7,19 (с, 1 Н), 7,15 (д, 2 Н),3,6 (с, 2 Н), 1,43 (с, 9 Н), 1,11 (д, 6 Н). Пример 19. (2S)-2-(4-Аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид. Неочищенный трет-бутил-4-(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтил фенилкарбамат обрабатывали смесью 8:2 дихлорметана и трифторуксусной кислоты (130 мл) при перемешивании при комнатной температуре. Через 2,5 ч летучие вещества выпаривали, неочищенное вещество растворяли в минимальном количестве метанола (15 мл) и по каплям добавляли в насыщенный водный раствор бикарбоната натрия (200 мл) при перемешивании. Осаждалось белое твердое вещество,которое отфильтровывали и несколько раз промывали водой. После сушки при 40 С в вакууме получали 2,96 г не совсем белого кристаллического вещества (ТСХ: дихлорметан/метанол 95:5) при 89% выходеESI(+)MS: m/z 290 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6)м.д.: 11,86 (с, 1 Н), 7,10 (с, 1 Н), 6,97 (д, 2 Н, J=2,0 Гц), 6,47 (д, 2 Н,J=2,0 Гц), 4,92 (с, 2 Н), 3,85 (кв., 1 Н, J=7,0 Гц), 3,1 (м, 1 Н, J=6,8 Гц), 1,31 (д, ЗН, 7,0 Гц), 1,22 (д, 6 Н, J=6,8 Гц); Вычислено для: C15H19N3OS: С 62,25; Н 6,62; N 14,52; S 11,08. Найдено: С 57,93; Н 6,16; N 13,07; S 9,53. Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующего трет-бутилкарбамата:(2S)-2-(4-Аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид (1,6 г, 5,54 ммоль) растворяли в пиридине (18 мл) и обрабатывали, добавляя по каплям в атмосфере аргона при +4 С, чистым уксусным ангидридом (627 мкл, 6,648 ммоль). Через 1,5 ч температура повышалась до комнатной температуры и еще через 1,5 ч реакционную смесь медленно добавляли к 300 мл ледяной воды при перемешивании. Происходило осаждение липкого твердого вещества. Экстрагирование водной фазы дихлорметаном (300 мл, 100 мл х 2) с последующим промыванием органической фазы сначала 2 н. НСl (200 мл), затем насыщенным водным раствором бикарбоната натрия (100 мл) и, наконец, небольшим количеством насыщенного раствора соли до нейтральной реакции, сушка над сульфатом натрия и выпаривание летучих веществ давали 1,62 г неочищенного продукта. При дополнительной очистке колоночной хроматографией(дихлорметан, метанол 95:5) получали 1,58 г чистого соединения в виде не совсем белого аморфного твердого вещества (86% выход).(д, 6 Н, J=6,8 Гц); Вычислено для: C17H21N3O2S: С 61,61; Н 6,39; N 12,68; S 9,67. Найдено: С 61,11; Н 6,45; N 12,48; S 9,31. Преобладание энантиомера: 99,5% (хиральная ВЭЖХ). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующих аминопроизводных:(2S)-2-(4-Аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)-пропанамид (289 мг, 1 ммоль) растворяли в ацетонитриле, обрабатывали трифторуксусной кислотой (153 мкл, 2 ммоль) и цианатом калия (162 мг,2 ммоль) при комнатной температуре, перемешивали до гомогенности и оставляли стоять на ночь. Растворитель выпаривали и остаток собирали этилацетатом. Органическую фазу сначала промывали насыщенным водным раствором бикарбоната натрия, а затем насыщенным раствором соли, сушили над сульфатом натрия и выпаривали. Полученное желтое масло очищали колоночной хроматографией (дихлорметан, метанол 96:4) с получением 205 мг соединения, указанного в заголовке, в виде белого твердого вещества (выход: 62%).ESI(+)MS: m/z 333 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6) : 11,95 (с, 1 Н), 8,6 (с, 1 Н), 7,30 (д, 2 Н, J=8,7 Гц), 7,17 (д, 2 Н, J=8,7 Гц), 7,10 (с, 1 Н), 5,75 (с, 2 Н), 3,83 (кв., 1 Н, J=6, 9 Гц), 3,07 (м, 1 Н, J=6,8 Гц), 1,36 (д, 3 Н, J=6,9 Гц), 1,22 (д,6 Н, J=6,8 Гц); Вычислено для: C16H20N4O2S: С 57,81; Н 6,06; N 16,85; S 9,65. Найдено: С 56,73; Н 6,06; N 16,28; S 7,54. Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующего аминопроизводного:(2S)-2-(4-Аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид (289 мг, 1 ммоль) и Boc-glyOH (210 мг, 1,2 ммоль), растворенные в дихлорметане (10 мл) подвергали воздействию Nциклогексилкарбодиимида, N'-метилполистирола (Novabiochem, нагрузка: 1,93 ммоль/г, 1,04 г). Смесь осторожно перемешивали в течение одного часа, затем оставляли стоять при +4 С в течение ночи. Смолу отфильтровывали и тщательно промывали дихлорметаном. После упаривания растворителя осталось желтое масло (чистота после ВЭЖХ: 93%, по определению при 254 нм), которое подвергали следующему преобразованию без дополнительной очистки.(с, 9 Н), 1,37 (д, 3 Н, J=7,1 Гц), 1,21 (д, 6 Н, J=6,8 Гц). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующего аминопроизводного: трет-бутиловый эфир(4-[(5-изопропилтиазол-2-илкарбамоил)метил]фенилкарбамоилметил) карбаминовой кислоты. Пример 23. (2S)-2-[4-(Глициламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид. трет-Бутиловый эфир (4-[(S)-1-(5-изопропилтиазол-2-илкарбамоил)этил]фенилкарбамоилметил) карбаминовой кислоты обрабатывали смесью 9:1 дихлорметана и трифторуксусной кислоты (10 мл) при комнатной температуре, перемешивали в течение 1,5 ч, затем выпаривали. Остающееся масло растворяли в минимальном количестве абсолютного этанола (5 мл) и по каплям добавляли в насыщенный водный раствор бикарбоната натрия (50 мл) при перемешивании. Водную фазу экстрагировали дихлорметаном, промывали насыщенным раствором соли, сушили над сульфатом натрия и выпаривали. Очистка продукта-сырца колоночной хроматографией (дихлорметан, метанол 9:1 + 1% ТЭА) давала 217 мг чистого соединения (общий выход: 63%).H ЯМР (400 МГц, DMSO-d6) : 7,54 (д, 2 Н, J=8,7 Гц), 7,26 (д, 2 Н, J=8,7 Гц), 7,11 (с, 1 Н), 1,21 (д, 6 Н,J=6,8 Гц), 3,88 (кв., 1 Н, J=7,1 Гц), 3,05 (м, 1 Н, J=6,8 Гц), 1,37 (д, 3 Н, J=7,1 Гц); Вычислено для: C17H22N4O2S: С 58,94; Н 6,40; N 16,17; S 9,25. Найдено: С 56,88; Н 6,56; N 15,07; S 7,69. Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующего трет-бутилового эфира карбаминовой кислоты:- 19007392 Пример 24. N-(4-(1S)-2-[(5-Изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)никотинамид. Гидрохлорид никотиноилхлорида (762 мг, 4,15 ммоль) в пиридине (30 мл) при +4 С в инертной атмосфере подвергали воздействию при перемешивании (2S)-2-(4-аминофенил)-N-(5-изопропил-1,3 тиазол-2-ил)пропанамида (800 мг, 2,77 ммоль), растворяли в пиридине (19 мл). Через 2 ч реакционной смеси давали достичь комнатной температуры и оставляли стоять в течение ночи. На следующий день реакцию проводили до завершения путем дополнительного добавления гидрохлорида никотиноилхлорида (254 мг). Реакционную смесь по каплям добавляли в крошеный лед и воду (600 мл) при перемешивании, но образовавшийся осадок был довольно липким. Водную фазу экстрагировали этилацетатом (300 мл, 100 мл х 2). Объединенные органические экстракты сушили над сульфатом натрия и летучие вещества выпаривали, получая 1,56 г желтого масла. Дополнительная очистка хроматографией (дихлорметан,метанол 95:5) давала 967 мг соединения, указанного в заголовке (выход: 89%).ESI(+)MS: m/z 395 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6) : 12,05 (с, 1 Н), 10,40 (с, 1 Н), 9,04-9,09 (м, 1 Н), 8,70-8,76 (м, 1 Н), 8,228,28 (м, 1 Н), 7,69 (д, 2 Н, J=8,5 Гц), 7,50-7,57 (м, 1 Н), 7,33 (д, 2 Н, J=8,5 Гц), 7,12 (с, 1 Н), 3,92 (кв., 1 Н,J=7,1 Гц), 3,07 (м, 1 Н, J=6,8 Гц), 1,40 (д, 3 Н, J=7,1 Гц), 1,22 (д, 6 Н, J=6,8 Гц); Вычислено для: C21H22N4O2S: С 63,94; Н 5,62; N 14,20; S 8,13. Найдено: С 63,49; Н 5,65; N 14,10; S 8,10. Преобладание энантиомера: 99,5% (хиральная ВЭЖХ). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующего аминопроизводного:(2S)-2-(4-аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид (289 мг, 1 ммоль) растворяли в дихлорметане (10 мл) и обрабатывали сначала пиколиновой кислотой (148 мг, 1,2 ммоль), растворенной в минимальном количестве ДМФ, затем N-циклогексилкарбодиимид-N'-метилполистиролом (Novabiochem, нагрузка: 1,93 ммоль/г, 1,04 г) и перемешивали на орбитальном шейкере в течение уик-энда. Так как исходное аминосоединение все еще присутствовало, порциями добавляли еще пиколиновой кислоты(148 мг х 3) вместе с дополнительным количеством N-циклогексилкарбодиимид-N'-метилполистирола (1 г). На следующий день растворители выпаривали и продукт-сырец очищали хроматографией (дихлорметан, этилацетат 8:2), что давало 231 мг чистого соединения в виде не совсем белого аморфного твердого вещества (выход: 59%).ESI(+)MS: m/z 395 (100, МН+); 1 Н ЯМР (400 МГц, DMSO-d6) : 12,04 (с, 1 Н), 10,57 (с, 1 Н), 8,70 (м, 1 Н), 8,12 (м, 1 Н), 8,04 (м, 1 Н),7,80 (д, 2 Н, J=8,5 Гц), 7,66 (м, 1 Н), 7,33 (д, 2 Н, J=8,5 Гц), 7,11 (с, 1 Н), 3,91 (кв., 1 Н, J=7,1 Гц), 3,07 (м, 1 Н,J=6,8 Гц), 1,41 (д, 3 Н, J=7,1 Гц), 1,22 (д, 6 Н, J=6,8 Гц); Вычислено для: C21H22N4O2S: С 63,94; Н 5,62; N 14,20; S 8,13. Найдено: С 61,91; Н 5,71; N 13,92; S 7,31. Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующего аминопроизводного:(2S)-2-(4-Аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид (289 мг, 1 ммоль) растворяли в дихлорметане (10 мл) и обрабатывали сначала изоникотиновой кислотой (148 мг, 1,2 ммоль), растворенной в минимальном количестве ДМФ, затем N-циклогексилкарбодиимид-N'-метилполистиролом (Novabiochem, нагрузка: 1,93 ммоль/г, 1,04 г) и перемешивали на орбитальном шейкере в течение уик-энда. Так как исходное аминосоединение, (2S)-2-(4-аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид,все еще присутствовало, порциями добавляли еще изоникотиновой кислоты (148 мг х 3) вместе с дополнительным количеством N-циклогексилкарбодиимид-N'-метилполистирола (1 г, 0,5 г). Через два дня растворители выпаривали и продукт-сырец очищали хроматографией (дихлорметан, метанол 9:1), что давало 231 мг чистого соединения в виде не совсем белого аморфного твердого вещества (выход: 59%). Преобладание энантиомера: 99,5% (хиральная ВЭЖХ). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующего аминопроизводного:(2S)-2-(4-Аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид (3,6 г, 12,46 ммоль) растворяли в дихлорметане (60 мл), обрабатывали сначала N,N-диизопропилэтиламином (2,6 мл, 14,95 ммоль), а затем при 4 С в атмосфере аргона ацетоксиацетилхлоридом (1,61 мл, 14,95 ммоль) в дихлорметане (40 мл). Через 1 ч реакционную смесь разбавляли дихлорметаном, промывали 1 н. НСl, затем насыщенным водным раствором бикарбоната натрия, и наконец, небольшим количеством насыщенного раствора соли до нейтральной реакции. Сушка над сульфатом натрия и выпаривание летучих веществ давали количественный выход в чистом виде желаемого соединения в виде желтого аморфного вещества.H ЯМР (400 МГц, DMSO-d6) : 10,01 (с, 1 Н), 7,49 (д, 2 Н, J=8,8 Гц), 7,28 (д, 2 Н, J=8,8 Гц), 7,11 (с,1 Н), 4,60 (с, 2 Н), 3,88 (кв., 1 Н, J=6,9 Гц), 3,06 (м, 1 Н, J=6,8 Гц), 2,09 (с, 3 Н), 1,38 (д, 3 Н, J=6,9 Гц), 1,22 (д,6 Н, J=6,8 Гц). Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующего аминопроизводного: 2-[(4-(lR)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)амино]-2-оксоэтилацетат; 2-[(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)амино]-2-оксоэтилацетат; 2-[(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилфенил)амино]-2-оксоэтилацетат. Пример 28. (2S)-2-[4-(Гликолоиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид. 2-[(4-(1S)-2-[(5-Изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)амино]-2-оксоэтилацетат (5 г, 12,85 ммоль) в тетрагидрофуране (80 мл) обрабатывали моногидратом гидроксида лития(1,08 г, 25,27 ммоль) в воде (80 мл) при комнатной температуре. Через 1 ч реакционную смесь частично выпаривали, водную фазу нейтрализовали 1 М водным раствором гидрофосфата калия и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над сульфатом натрия и выпаривали. Очистка продукта-сырца флэш-хроматографией (дихлорметан/ацетон 9:1) давала 3,82 г соединения, указанного в заголовке, в виде белого твердого вещества (выход: 86%).[]D+207 (с=1, СН 3OН) Вычислено для: C17H21N3O3S: С 58,77; Н 6,09; N 12,09; S 9,23. Найдено: С 58,58; Н 6,25; N 11,65; S 9,12. Действуя аналогичным образом, можно получить следующие соединения, исходя из соответствующего аминопроизводного:(2R)-2-[4-(гликолоиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид; 2-[4-(гликолоиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид; 2-[4-(гликолоиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения нарушений клеточной пролиферации, связанной с измененной, зависимой от клеточного цикла киназной активностью, путем введения млекопитающему, нуждающемуся в этом, эффективного количества фенилацетамидотиазольного производного, представленного формулой (I) где R представляет собой атом водорода или С 1-С 4-алкильную группу с прямой или разветвленной це- 21007392 пью;R1 представляет собой группу формулы (IIа-е) где R2 представляет собой атом водорода или C1-С 6-алкильную группу с прямой или разветвленной цепью, и гидроксигруппа на кольце (IIс) находится в любом из свободных положений;R3 выбран из группы, включающей амино, аминометил (-СН 2-NH2), гидроксиметил (-СН 2 ОН), C1C4-алкил с прямой или разветвленной цепью, или R3 представляет собой 5- или 6-членный гетероцикл с 1 гетероатомом или 2 гетероатомами, выбранными из азота, кислорода и серы; при условии, что когда R представляет собой водород, то R3 не является метилом или пиридил-3 илом; или его фармацевтически приемлемой соли. 2. Способ по п.1, где нарушение клеточной пролиферации выбрано из группы, включающей рак,болезнь Альцгеймера, вирусные инфекции, аутоиммунные заболевания и нейродегенеративные заболевания. 3. Способ по п.2, где рак выбран из группы, включающей карциному, плоскоклеточную карциному,опухоль кроветворной ткани миелоидного или лимфоидного направления, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, ксеродерму пигментозум, кератоакантому, фолликулярный рак щитовидной железы и саркому Капоши. 4. Способ по п.1, где нарушение клеточной пролиферации выбрано из группы, включающей доброкачественную гиперплазию простаты, наследственный аденоматозный полипоз, нейрофиброматоз, псориаз, пролиферацию клеток гладких мышц сосудов, связанную с атеросклерозом, фиброз легких, артрит,гломерулонефрит и послеоперационный стеноз и рестеноз. 5. Способ по п.1, который обеспечивает подавление ангиогенеза и метастазов опухолей. 6. Способ по п.1, который обеспечивает лечение или профилактику вызываемой лучевой терапией или химиотерапией алопеции. 7. Способ по п.1, дополнительно включающий проведение млекопитающему, нуждающемуся в этом, курса лучевой терапии или химиотерапии в сочетании по меньшей мере с одним цитостатическим или цитотоксическим средством. 8. Способ по п.1, где млекопитающее, нуждающееся в этом, является человеком. 9. Способ подавления циклинозависимой киназной активности, который включает контактирование указанной киназы с эффективным количеством соединения, которому дано определение в п.1. 10. Способ по п.1, который включает введение эффективного количества соединения формулы (I),выбранного из группы, включающей где R представляет собой атом водорода или C1-С 4-алкильную группу с прямой или разветвленной цепью;R1 представляет собой группу формулы (IIа-е) где R2 представляет собой атом водорода или С 1-С 6-алкильную группу с прямой или разветвленной цепью, и гидроксигруппа на кольце (IIс) находится в любом из свободных положений;C4-алкил с прямой или разветвленной цепью, или R3 представляет собой 5- или 6-членный гетероцикл с 1 гетероатомом или 2 гетероатомами, выбранными из азота, кислорода и серы; при условии, что когда R представляет собой водород, то R3 не является метилом или пиридил-3 илом; или его фармацевтически приемлемая соль. 12. Фенилацетамидотиазольное производное формулы (I) по п.11, где R является метилом. 13. Фенилацетамидотиазольное производное формулы (I) по п.11, где R1 является группой формулы(IIа) или (IIb). 14. Фенилацетамидотиазольное производное формулы (I) по п.11, где R1 является группой формулы(IIc), а его гидроксигруппа находится в положении 3 пирролидинового кольца. 15. Фенилацетамидотиазольное производное формулы (I) по п.11, где R1 является группой формулы(IIе), где R3 выбран из группы, включающей метил, пиридил-4-ил или пиридил-3-ил. 16. Фенилацетамидотиазольное производное формулы (I) по п.11, где R является атомом водорода. 17. Фенилацетамидотиазольное производное формулы (I) по п.11, где R является атомом водорода,a R1 является группой формулы (IIа), которое представляет собой N-(5-изопропил-1,3-тиазол-2-ил)-2-[4(2-оксо-1-пирролидинил)фенил]ацетамид. 18. Фенилацетамидотиазольное производное формулы (I) по п.11, которое выбрано из группы,включающейN-(4-(1S)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)изоникотинамид. 19. Фенилацетамидотиазольное производное формулы (I), которому дано определение в п.11, необязательно в форме фармацевтически приемлемой соли, выбрано из группы, включающей: 1) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]ацетамид; 2) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]пропанамид; 3) (2R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]пропанамид; 4) (2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-пирролидинил)фенил]пропанамид; 5) 2-[4-(3-гидрокси-2-оксо-1-пирролидинил)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 6) 2-4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 7) 2-4-[(3R)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 8) 2-[4-(3-гидрокси-2-оксо-1-пирролидинил)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)пропанамид; 9) 2-4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2 ил)пропанамид; 10) 2-4-[(3R)-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2 ил)пропанамид; 11) 2(R)-2-4-[(3S)-3-гидрокси-2-оксo-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил) пропанамид; 12) 2(S)-2-4-[(3S)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил) пропанамид; 13) 2(R)-2-4-[(3R)-3-гидрокси-2-оксо-1-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил) пропанамид; 14) 2(S)-2-4-[(3R)-3-гидрокси-2-оксо-l-пирролидинил]фенил-N-(5-изопропил-1,3-тиазол-2-ил) пропанамид; 15) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]ацетамид; 16) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид; 17) (2R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид; 18) (2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1,3-оксазолидин-3-ил)фенил]пропанамид; 19) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]ацетамид; 20) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропанамид; 21) (2R)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропанамид; 22) (2S)-N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(2-оксо-1-имидазолидинил)фенил]пропанамид; 23) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]ацетамид; 24) N-(5-изопропил-1,3-тиазол-2-ил)-2-[4-(3-метил-2-оксо-1-имидазолидинил)фенил]пропанамид; 25)N-(4-(1R)-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2 оксоэтилфенил)изоникотинамид; 47) N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-1-метил-2-оксоэтилфенил)изоникотинамид; 48) N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилфенил)изоникотинамид. 20. Способ получения соединений формулы (I) или их фармацевтически приемлемых солей, охарактеризованных в п.11, который включает взаимодействие 2-амино-5-изопропил-1,3-тиазола с соединением формулы (III) где R и R1 определены в п.11, и R' представляет собой гидроксил или подходящую удаляемую группу и,необязательно, преобразование их в фармацевтически приемлемые соли. 21. Способ по п.20, где R' представляет собой гидроксил или атом галогена. 22. Способ по п.21, причем R' представляет собой гидроксил или атом хлора. 23. Фармацевтическая композиция, содержащая терапевтически эффективное количество фенилацетамидотиазольного производного формулы (I), охарактеризованное в п.11, и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, один носитель и/или разбавитель. 24. Фармацевтическая композиция по п.23, дополнительно содержащая одно или несколько химиотерапевтических средств. 25. Продукт или набор, включающий соединение формулы (I), охарактеризованное в п.11, или его фармацевтическую композицию, охарактеризованную в п.23, и одно или несколько химиотерапевтических средств, в виде комбинированного препарата для одновременного, раздельного или последовательного использования при противораковой терапии. 26. Соединение формулы (I), охарактеризованное в п.11, для использования в качестве лекарственного средства. 27. Применение соединения формулы (I), охарактеризованного в п.11, при получении лекарственного средства, обладающего активностью, ингибирующей зависимую от клеточного цикла киназу. 28. Применение соединения формулы (I), охарактеризованного в п.11, при получении лекарственного средства, обладающего противоопухолевой активностью.
МПК / Метки
МПК: C07D 233/00, A61K 31/425, A61P 35/00, C07D 207/00, C07D 417/12, C07D 277/46, C07D 263/00
Метки: получения, производные, способ, противоопухолевых, фенилацетамидотиазольные, средств, качестве, использования
Код ссылки
<a href="https://eas.patents.su/25-7392-fenilacetamidotiazolnye-proizvodnye-sposob-ih-polucheniya-i-ih-ispolzovaniya-v-kachestve-protivoopuholevyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Фенилацетамидотиазольные производные, способ их получения и их использования в качестве противоопухолевых средств</a>
Предыдущий патент: Способ диагностики или выявления конформационного заболевания или его маркера и набор для использования в способе
Следующий патент: Способ получения карведилола
Случайный патент: Установка и способ изготовления стержней из высокочистого кремния с использованием смешанного сердечникового средства





























