Новые арилоксиалкилдиалкиламины
Номер патента: 3937
Опубликовано: 30.10.2003
Авторы: Потоски Джон Ричард, Зелдис Джозеф, Вид Галина, Рен Дзианксин, Равиндранат Панолил
Формула / Реферат
1. Соединения формулы (I)
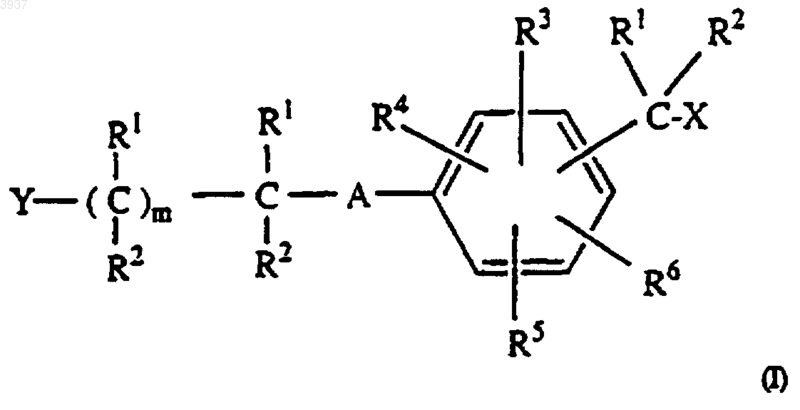
где R1 и R2 независимо представляют H;
X выбирают из галогена;
A представляет -O-;
m представляет 1;
R3, R4, R5 и R6 независимо представляют H; и
Y выбирают из
a) остатка
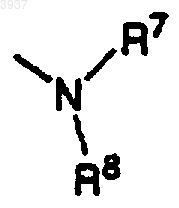
где R7 и R8 независимо представляют C1-C6алкил;
b) шестичленного насыщенного или частично ненасыщенного гетероцикла, включающего вплоть до двух гетероатомов азота;
c) семичленного насыщенного или частично ненасыщенного гетероцикла, включающего вплоть до двух гетероатомов азота, и их фармацевтически приемлемые соли.
2. Соединение по п.1, представляющее собой хлоргидрат (4-хлорметилфенокси)этилпиперидин-1-ила.
3. Соединение по п.1, представляющее собой хлоргидрат (4-хлорметилфенокси)этилгексаметиленимин-1-ила.
4. Соединение по п.1, представляющее собой (4-хлорметилфенокси)этилдиметиламинхлоргидрат.
5. Способ получения соединения формулы (I) по любому из пп.1-4 или его фармацевтически приемлемой соли реакцией спирта формулы
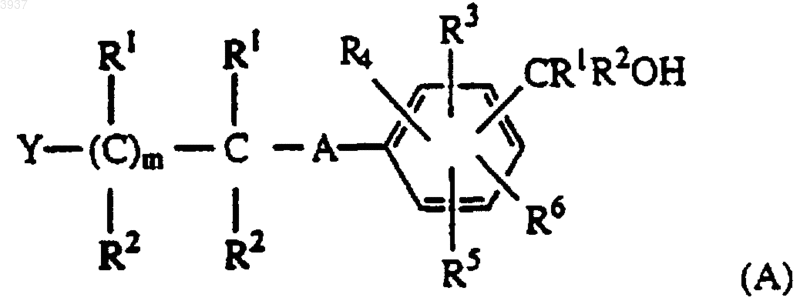
где m, A, Y и R1-6 являются такими, как определено в п.1, с таким агентом, как галогенирующий, сульфонилирующий или ацилирующий, содержащим отщепляемую группу X, определенную в п.1, с получением соответствующего соединения формулы (I), в котором X представляет отщепляемую группу, определенную в п.1, и, при необходимости, окисляют полученное соединение формулы I, в случае, если A представляет S, до соответствующего соединения формулы I, в котором A представляет -SO- или -SO2-; и
необязательно превращают любое полученное соединение формулы (I) в его фармацевтически приемлемую соль.
6. Способ получения соединения по п.1, где A представляет -O-, включающий стадии:
a) алкилирования гидроксибензальдегида формулы

где R3-6 являются такими, как определено в п.1, алкилгалогенидом формулы
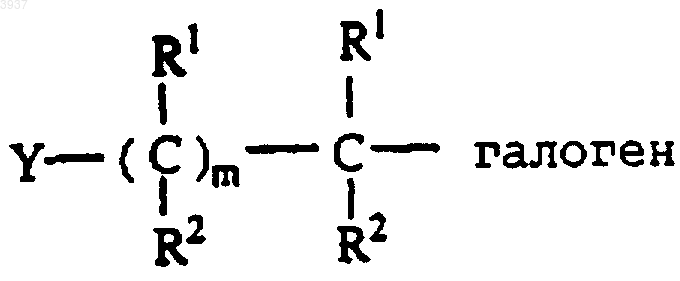
где R1 и R2 являются такими, как определено в п.1, m представляет 1, и галоген выбирают из Cl, F, Br или I, с получением альдегида формулы
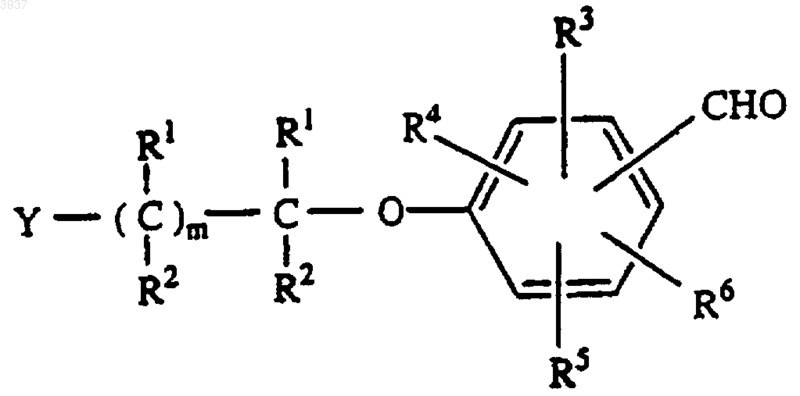
b) восстановления альдегида, полученного на стадии a) с получением спирта формулы
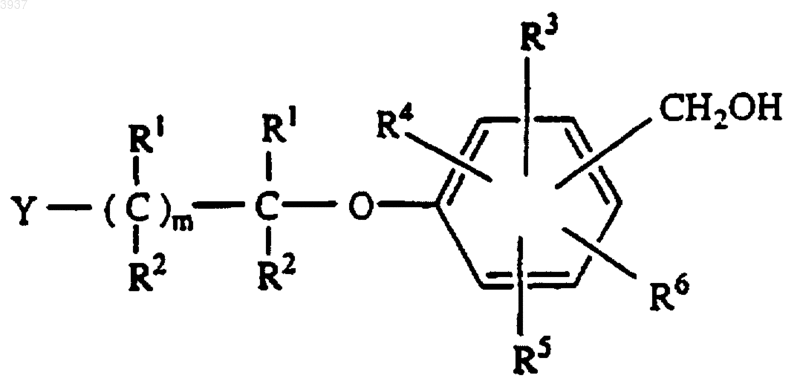
c) превращения спирта со стадии b) в его хлоргидратную соль, и
d) превращения спирта в соединении из стадии c) в отщепляемую группу.
7. Способ получения соединения по п.1, где A представляет S, осуществлением следующих стадий:
a) алкилирования соединения следующей формулы
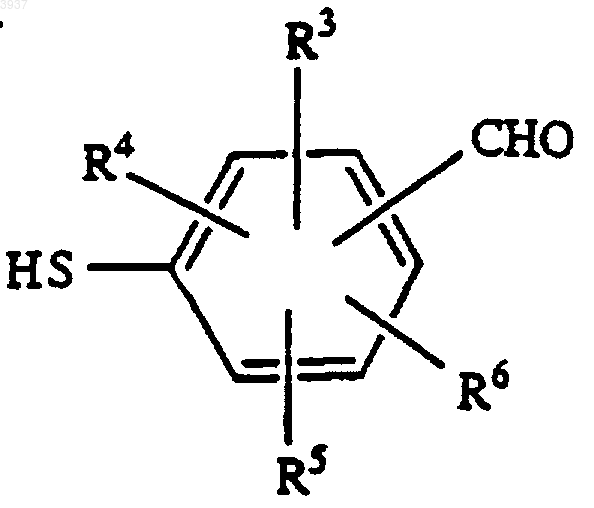
где R3-6 являются такими, как определено в п.1, алкилирующим агентом формулы
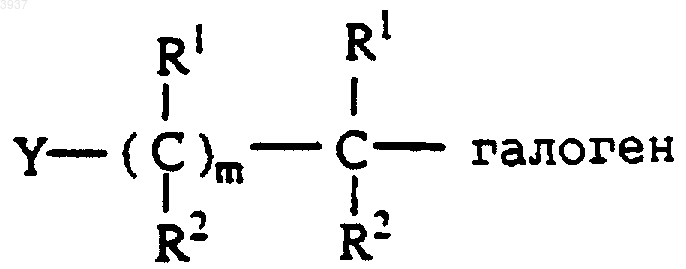
где Y, R1 и R2 и m являются такими, как определено в п.1, галоген может быть Cl, F, Br или I, с получением альдегида формулы
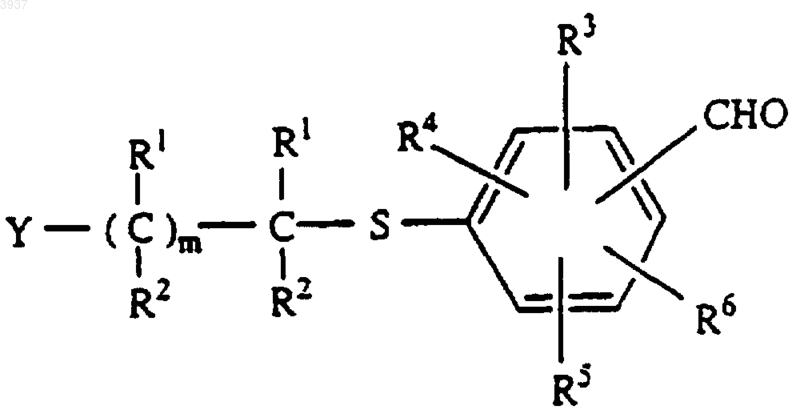
b) восстановления альдегида, например, боргидридом натрия, в спирт формулы
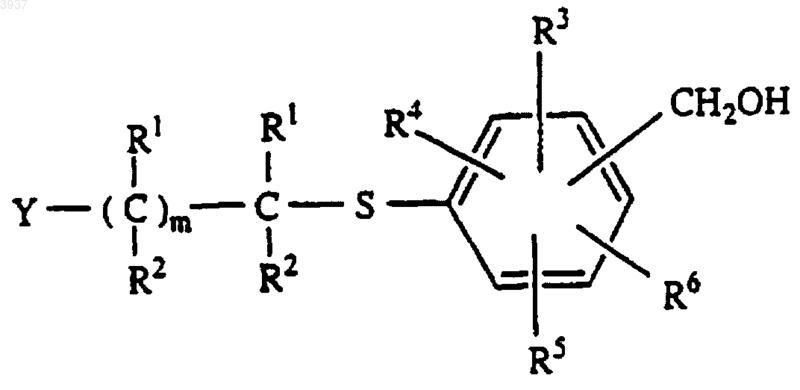
c) обработки спирта со стадии b) газообразным HCl с получением его хлоргидрата; и
d) превращения хлоргидрата спирта, полученного на стадии c), в отщепляемую группу.
8. Способ по п.7, дополнительно включающий стадию контролируемого окисления серы в хлоргидрате спирта со стадии d) до сульфоксида или до сульфона.
9. Способ по любому из пп.5-8, где спирт превращают в отщепляемую группу обработкой метансульфонилхлоридом, толуолсульфонилхлоридом или трифторуксусным ангидридом в присутствии пиридина или триэтиламина.
10. Способ по любому из пп.5-9, где галоген является Cl, и m равно 1.
11. Способ получения соединений формулы
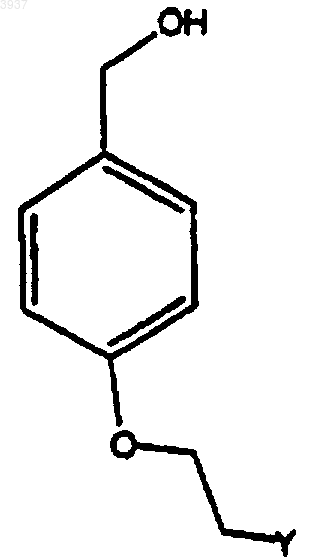
где Y представляет собой:
a) остаток
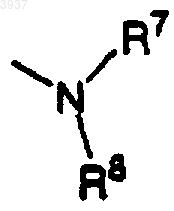
где R7 и R8 независимо представляют H; или b) шести- или семичленное ненасыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее один или два атома азота, причем гетероциклическое кольцо, связано с этоксимостиком у атома азота кольца, и необязательно замещено от 1 до 3 группами, выбранными из C1-C6алкила, C1-C6алкокси, C1-C6тиоалкила, -CF3 или -NO2,
включающий взаимодействие в щелочной среде 4-гидроксибензилового спирта с солью соединения формулы
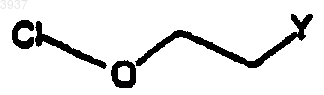
где Y является таким, как определено выше.
12. Способ по п.11, где щелочную среду поддерживают при pH равном 9 или более.
13. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как описано в любом из пп.1-4, и фармацевтически приемлемый носитель.
Текст
1 Настоящее изобретение предусматривает новые соединения, полезные в производстве биологически активных соединений, а также способы для их получения. Более конкретно настоящее изобретение предусматривает новые арилоксиалкилдиалкиламины, которые могут быть использованы при получении фармацевтических продуктов. Предпосылки изобретения Матричные металлопротеиназы (ММП) представляют собой группу ферментов, которые принимают участие в патологическом разрушении соединительной ткани и базальных мембранTop. Microbiol. и Immunol. 1996, 213, 1]. Эти цинксодержащие эндопептидазы включают несколько подгрупп ферментов, включая коллагеназы, стромелизины и желатиназы. Среди этих классов желатиназы, как показано, являются ММП, наиболее тесно участвующие в росте и распространении опухолей, в то время как коллагеназы связывают с патогенезом остеоартритаVol. 2, pp. 1723; Dean. D.D. Sem. Arthritis Rheum. 1991, 20, 2; Crawford. H.C; Matrisian, L.M. Invasion Metast. 1994-95, 14, 234; Ray, J.M.; StetlerStevenson, W.G. Exp. Opin. Invest. Drugs. 1996, 5,323]. Использование гормонзамещающей терапии для предупреждения потери костной ткани у женщин в период после менопаузы хорошо известно. Нормальный протокол лечения включает введение эстрогенов с использованием таких препаратов, включающих эстрон, эстриол,этинилэстрадиол, или конъюгированные эстрогены, выделенные из природных источников(например, конъюгированные эстрогены Premarin от Wyeth-Ayerst). Для некоторых пациентов терапия может быть противопоказана из-за пролиферативных воздействий свободных эстрогенов (эстрогенов, присутствующих вне сочетания с прогестинами) на ткань матки. Эта пролиферация связывается с повышенным риском эндометрита и/или рака слизистой оболочки матки. Воздействия свободных эстрогенов на ткани груди являются менее изученными, но представляют собой предмет некоторого беспокойства. Необходимость в эстрогенах, которые могут поддерживать щадящее воздействие в отношении костной ткани, при этом минимизируя все пролиферативные воздействия на матку и грудь, является очевидной. Определенные нестероидные антиэстрогены, поддерживают массу костей, как показано на моделях крыс с удаленными яичниками, а также при клиниче 003937 2 ских испытаниях на людях. Tamoxifen (торговая марка Novadex цитрат тамоксифена от ZenecaPharmaceuticals, Wilmington, Delaware), например, является полезным паллиативом при лечении рака груди и, как продемонстрировано,проявляет воздействие, подобное агонисту эстрогена, на костную ткань у людей. Однако он также является частичным агонистом в матке, и это дает причину для некоторого беспокойства.Raloxifene, антиэстроген на основе бензотиофена, как показано, стимулирует рост матки у крыс с удаленными яичниками в меньшей степени, чем Tamoxifen, при этом сохраняя способность сохранять костную ткань. Соответствующий обзор по ткань-селективным эстрогенам можно увидеть в статье "Tissue-Selective ActionsOf Estrogen Analogs", Bone Vol. 17, No. 4, October 1995. 181S-190S. Настоящее изобретение предусматривает новые промежуточные соединения, которые могут быть использованы при получении фармацевтических соединений для антиэстрогенных и ММП-ингибирующих применений. Использование 4-карбамоилметоксиметоксибензилхлоридных соединений формул раскрыто в NL 6402393: 1964; и Chem. Abstr. 1965, 62. 7698. Использование 4-(2-диалкиламиноэтокси) бензоилхлоридных соединений структуры раскрыто Huang, F-C. et.al. J. Med. Chem. 1990,33, 1194. Краткое описание изобретения Настоящее изобретение предусматривает новые соединения, а также способы их получения, которые могут быть использованы при получении фармацевтически активных соединений. Соединения по настоящему изобретению могут, в частности, быть использованы в качестве промежуточных соединений при получении фармацевтических соединений, таких как низкомолекулярные, не содержащие пептидов ингибиторы матричных металлопротеиназ (например, желатиназ, стромелизинов и коллагеназ), и ФНО-преобразующий фермент (ТАСЕ,преобразующий фермент фактора некроза опухоли), которые являются полезными для использования при лечении заболеваний, в которых эти ферменты задействованы, таких как артрит, метастазы опухолей, изъязвление тканей, патологическое заживление ран, заболева 3 ние периодонтальной ткани, заболевание костной ткани, протеинурия, заболевание аневризмы аорты, дегенеративные потери хрящевой ткани после травматического повреждения суставов,заболевания нервной системы, связанные с процессом демиелинизации, и ВИЧ-инфекция. Кроме того, соединения по настоящему изобретению могут быть использованы для получения соединений, которые ведут себя подобно агонистам эстрогенов путем понижения уровня холестерина и предотвращения потерь костной ткани. Следовательно, указанные соединения полезны для лечения многих заболеваний, связанных с недостаточностью, включая остеопороз,гипертрофию простаты, бесплодие, рак груди,внутриматочную гиперплазию и рак, сердечнососудистые заболевания, контрацепцию, болезнь Альцгеймера и меланому. Настоящее изобретение включает новые соединения формулы (I)R1 и R2 независимо выбирают из Н; C1-C12 алкила, предпочтительно C1-С 6 алкила; или C1C6 перфторированного алкила, предпочтительноm является целым числом от 0 до 3, предпочтительно 1;R3, R4, R5 и R6 независимо выбирают из Н,галогена, -NO2, алкила (предпочтительно С 1-С 12 алкила, более предпочтительно C1-C6 алкила),алкокси (предпочтительно С 1-С 12 алкокси, более предпочтительно C1-С 6 алкокси), C1-С 6 перфторированного алкила (предпочтительно -СF3),ОН или их C1-C4 сложных эфиров или алкиловых простых эфиров, CN, -O-R1, -O-Ar, -S-R1,-S-Ar, -SO-R1, -SO-Ar, -SO2-R1 , -SO2-Ar, -CO-R1,-CO-Ar, -CO2-R1 или -CO2-Ar; где R7 и R8 независимо выбраны из группы Н,C1-С 6 алкила или фенила.b) пятичленного насыщенного, ненасыщенного или частично ненасыщенного гетероцикла, включающего вплоть до двух гете 003937-О-, -NH-, -N(C1-C4 алкила)-, -N= и -S(O)n-, где n является целым числом от 0 до 2, необязательно замещенных 1-3 заместителями, независимо,выбранными из группы, состоящей из водорода,гидроксила, галогена, С 1-С 4 алкила, тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, С 1 С 4 ацилокси, С 1-С 4 алкилтио, С 1-С 4 алкилсульфинила, C1-C4 алкилсульфонила, гидрокси (C1-C4) алкила, фенила, необязательно замещенного 1-3c) шестичленного насыщенного, ненасыщенного или частично ненасыщенного гетероцикла, включающего вплоть до двух гетероатомов, выбранных из группы, состоящей из-О-, -NH-, -N(C1-C4 алкил)-, -N= и -S(O)n-, где n является целым числом от 0 до 2, необязательно замещенных 1-3 заместителями, независимо выбранными из группы, состоящей из водорода,гидроксила, галогена, С 1-С 4 алкила, тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, С 1-С 4 ацилокси, С 1-С 4 алкилтио, С 1-С 4 алкилсульфинила, С 1-С 4 алкилсульфонила, гидрокси (C1-C4) алкила, фенила, необязательно замещенного 1-3d) семичленного насыщенного, ненасыщенного или частично ненасыщенного гетероцикла, включающего вплоть до двух гетероатомов, выбранных из группы, состоящей из-О-, -NH-, -N(C1-C4 алкила)-, -N= и -S(O)n-, где n является целым числом от 0 до 2, необязательно замещенных 1-3 заместителями, независимо выбранными из группы, состоящей из водорода,гидроксила, галогена, С 1-С 4 алкила, тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, С 1-С 4 ацилокси, С 1-С 4 алкилтио, С 1-С 4 алкилсульфинила, C1-C4 алкилсульфонила, гидрокси(C1-C4) алкила, фенила, необязательно замещенного 1-3(C1-C4)алкилом, -CO2H, -CN, -CONHR1, -NH2,C1-C4 алкиламино,C1-C4 диалкиламино,-NHSO2R1, -NHCOR1, -NO2; или е) бициклического гетероцикла, содержащего от 6 до 12 атомов углерода, либо с внутренней мостиковой связью, либо конденсированного, и включающего вплоть до двух гетероатомов, выбранных из группы, состоящей из-О-, -NH-, -N(C1-C4 алкила)- и -S(O)n-, где n является целым числом от 0 до 2, необязательно замещенных 1-3 заместителями, независимо выбранными из группы, состоящей из водорода,гидроксила, галогена, С 1-С 4 алкила, тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, С 1-С 4 ацилокси, С 1-С 4 алкилтио, C1-С 4 алкилсульфинила, С 1-С 4 алкилсульфонила, гидрокси(C1-C4) алкила, фенила, необязательно замещенного 1-3 5 и их фармацевтически приемлемые соли. В наиболее общем описании выше и в других местах настоящего описания, в каждом случае, когда они будут упоминаться, подразумевается, что R1 и R2 выбирают независимо из группы перечисленных заместителей. Любой R1,перечисленный в любой структуре настоящего описания, не должен обязательно представлять собой такой же заместитель, как и другой R1,или любой R2 не должен обязательно быть таким же заместителем, как и любой другой R2,даже если больше одного R1 или R2 находятся в одной и той же структуре. В описании выше символ "Аr" обозначает моноциклические или полициклические арильные или гетероарильные группы, которые могут быть необязательно замещены одним или несколькими заместителями, выбранными из галогена, C1-C6 алкила или -СF3. Примеры предпочтительных арильных групп включают антраценильные и фенантренильные группы, а также более предпочтительные фенильные, куменильные, мезитильные, толильные, ксилильные и нафталинильные группы. Примеры предпочтительных гетероарильных групп включают индолизинильные, индазолильные, пуринильные,хинозинильные, изохинолинильные, хинолинильные, фталозинильные, нафтиридинильные,хиноксалинильные, хиназолинильные, циннолинильные и птеридинильные группы, и тому подобное, а также более предпочтительные пиридильные, пиразинильные, пиримидинильные,пиридизинильные и индолильные группы. Настоящее изобретение включает приемлемые солевые формы, образованные при реакции присоединения либо с неорганическими,либо с органическими кислотами. Могут быть использованы неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота,серная кислота, фосфорная кислота, азотная кислота, а также органические кислоты, такие как уксусная кислота, пропионовая кислота,лимонная кислота, малеиновая кислота, яблочная кислота, винная кислота, фталевая кислота,янтарная кислота, метансульфоновая кислота,толуолсульфоновая кислота, нафталинсульфоновая кислота, камфорсульфоновая кислота,бензолсульфоновая кислота. Известно, что соединения, обладающие основным азотом, могут быть комплексно связанными со многими различными кислотами (как с протонными, так и с апротонными), и обычно является предпочтительным вводить соединение по настоящему изобретению в форме его аддитивной соли кислоты. Кроме того, настоящее изобретение включает четвертичные аммонийные соли соединений по настоящему изобретению, которые могут быть получены путем взаимодействия боковой цепи нуклеофильных аминов с соответствующим реакционно-способным алкилирую 003937 6 щим агентом, таким как алкилгалогенид или бензилгалогенид. Предпочтительными соединениями по настоящему изобретению являются соединения формулы (I)R1 и R2 независимо выбраны из Н; С 1-С 12 алкила, предпочтительно C1-С 6 алкила, илиC1-С 6 перфторированного алкила, предпочтительно -СF3; Х представляет собой отщепляемую группу, такую как галоген, -О-SO2-СН 3, -O-SO2-СF3 или остаток структуры:m является целым числом от 0 до 3, предпочтительно 1; где R7 и R8 независимо выбраны из группы Н,C1-С 6 алкила или фенила;b) группы, выбранной из тиофена, фурана,пиррола, имидазола, пиразола, тиазола, изотиазола, изоксазола или оксатиолана, группа является необязательно замещенной 1-3 заместителями, независимо выбранными из группы, состоящей из водорода, гидроксила, галогена, С 1 С 4 алкила, тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, С 1-С 4 ацилокси, С 1-С 4 алкилтио,C1-C4 алкилсульфинила, С 1-С 4 алкилсульфонила,гидрокси (C1-C4)алкила, фенила, необязательно замещенного 1-3 (C1-C4)алкилом, -CO2H, -CN,-CONHR1, -NH2, С 1-С 4 алкиламино, С 1-С 4 диалкиламино, -NHSO2R1, -NHCOR1, -NO2;c) группы, выбранной из пиридина, пиразина, пиримидина, пиридазина, пиперидина,морфонина и пирана, группа является необязательно замещенной 1-3 заместителями, независимо выбранными из группы, состоящей из водорода, гидроксила, галогена, С 1-С 4 алкила, тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, С 1-С 4 ацилокси, С 1-С 4 алкилтио, С 1-С 4 алкилсульфинила, C1-C4 алкилсульфонила, гидрокси(C1-C4)алкила, фенила, необязательно замещенного 1-3 (C1-C4)алкилом, -CO2H, -CN,-CONHR1, -NH2, C1-C4 алкиламино, С 1-С 4 диалкиламино, -NHSO2R1, -NHCOR1, -NO2;d) группы, выбранной из азепина, диазепина, оксазепина, тиазепина, оксапина и тиепина, группа является необязательно замещенной 7 1-3 заместителями, независимо выбранными из группы, состоящей из водорода, гидроксила,галогена, С 1-С 4 алкила, тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, С 1-С 4 ацилокси, С 1 С 4 алкилтио, С 1-С 4 алкилсульфинила, С 1-С 4 алкилсульфонила, гидрокси(C1-C4)алкила, фенила,необязательно замещенного 1-3 (C1-C4) алкилом, -СО 2 Н, -CN, -CONHR1, -NH2, С 1-С 4 алкиламино, C1-C4 диалкиламино, -NHSO2R1,-NHCOR1, -NO2; илиe) бициклического гетероцикла, выбранного из бензофурана, изобензофурана, бензотиофена, индола, изоиндола, индолизина, индазола,пурина, хинолизина, изохинолизина, хинолина,фталазина, нафтридина, хиноксалина, хиназолина и циннолина, группа является необязательно замещенной 1-3 заместителями, независимо выбранными из группы, состоящей из водорода, гидроксила, галогена, С 1-С 4 алкила, тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, С 1-С 4 ацилокси, С 1-С 4 алкилтио, С 1-С 4 алкилсульфинила, C1-C4 алкилсульфонила, гидрокси(C1-C4)алкила, фенила, необязательно замещенного 1-3 (C1-C4)алкилом, -CO2H, -CN,-CONHR1, -NH2, C1-C4-алкиламино, С 1-С 4 диалкиламино, -NHSO2R1, -NHCOR1, -NO2; и их фармацевтически приемлемые соли. Дальнейшими предпочтительными соединениями по настоящему изобретению являются соединения формулы (I):R1 и R2 независимо выбраны из Н; С 1-С 12 алкила, предпочтительно C1-С 6 алкила, или C1 С 6 перфторированного алкила, предпочтительно 8 независимо, выбранными из группы, состоящей из водорода, гидроксила, галогена, C1-C4 алкила,тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, C1-C4 ацилокси, С 1-С 4 алкилтио, С 1-С 4 алкилсульфинила, С 1-С 4 алкилсульфонила, гидрокси(С 1-С 4)алкила, фенила, необязательно замещенного 1-3 (С 1-С 4)алкилом, -CO2H, -CN,-CONHR1, -NH2, C1-C4 алкиламино, С 1-С 4 диалкиламино, -NHSO2R1, -NHCOR1, -NO2; и их фармацевтически приемлемые соли. Среди наиболее предпочтительных соединений по настоящему изобретению находятся соединения, имеющие общую формулуR1 и R2 независимо выбраны из Н, C1-С 6 алкила или C1-C6 перфторированного алкила,предпочтительно, перфторированных алкильных групп, -СF3;R3, R4, R5 и R6 независимо выбраны из Н,ОН или их C1-C4 сложных эфиров или их алкиловых простых эфиров, галогена, -CN, C1-С 6 алкила или трифторметила;m является целым числом от 0 до 3, предпочтительно 1;R7 и R8 независимо выбраны из Н, C1-С 6 алкила или соединены с помощью -(СН 2)p-, где р является целым числом от 2 до 6, формируя таким образом кольцо, являющееся необязательно замещенным вплоть до трех заместителями, выбранными из группы, состоящей из водорода, гидроксила, галогена, С 1-С 4 алкила,тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, C1-C4 алкилтио, С 1-С 4 алкилсульфинила,С 1-С 4 алкилсульфонила, гидрокси(C1-C4)алкила,-СO2 Н, -CN, -CONH(C1-C4), -NH2, C1-C4 алкиламино,С 1-С 4 диалкиламино,-NHSO2(C1-C4),-NHCO(C1-C4) и -NO3; и Х является таким, как определено выше; и их фармацевтически приемлемые соли. Среди наиболее предпочтительных соединений по настоящему изобретению также находятся соединения, имеющие общую формулуm является целым числом от 0 до 3, предпочтительно 1; где R7 и R8 независимо выбраны из группы Н,C1-С 6 алкила или фенила; илиb) группы, выбранной из тиофена, фурана,пиррола, имидазола, пиразола, тиазола, пиридина, пиразина, пиримидина, пиридазина, пиперидина, индола или бензофурана, группа является необязательно замещенной 1-3 заместителями,R1 и R2 независимо выбраны из Н, C1-С 6 алкила или C1-C6 перфторированного алкила,предпочтительно, из перфорированных алкильных групп, -СF3;R3, R4, R5 и R6 независимо выбирают из Н,ОН или их C1-C4 сложных эфиров или алкиловых простых эфиров, галогена, -CN, C1-C6 алкила или трифторметила;m является целым числом от 0 до 3, предпочтительно 1; А выбирают из -S-, -SO- или -SO2-;R7 и R8 независимо выбраны из Н, C1-С 6 алкила или соединены с помощью -(СН 2)p-, где р является целым числом от 2 до 6, формируя таким образом кольцо, являющееся необязательно замещенным вплоть до трех заместителями, выбранными из группы водорода, гидроксила, галогена, С 1-C4 алкила, тригалогенметила,С 1-С 4 алкокси, тригалогенметокси, C1-C4 алкилтио, С 1-С 4 алкилсульфинила, С 1-С 4 алкилсульфонила, гидрокси(C1-C4)алкила, -СO2 Н, -CN,-CONH(C1-C4), -NH3, С 1-С 4 алкиламино, С 1-С 4 диалкиламино, -NHSO2(C1-C4), -NHCO(C1-C4) и-NO2; и Х является таким, как определено выше; и их фармацевтически приемлемые соли. Среди наиболее предпочтительных соединений настоящего изобретения находятся соединения, имеющие структурные формулы II или III, выше, где R3 - R6 являются такими, как определено выше; Х выбирают из группы Сl,-СF3 или -СН 3; и Y представляет собой остаток: и R7 и R8 соединены вместе как -(СН 2)r, где r является целым числом от 4 до 6, с образованием кольца, необязательно замещенного вплоть до трех заместителями, выбранными из группы водорода, гидроксила, галогена, С 1-С 4 алкила,тригалогенметила, С 1-С 4 алкокси, тригалогенметокси, С 1-С 4 алкилтио, C1-C4 алкилсульфинила,С 1-С 4 алкилсульфонила, гидрокси(C1-C4)алкила,-СO2 Н, -CN, -CONH(C1-C4), -NH3, С 1-С 4 алкиламино, С 1-С 4 диалкиламино, -NHSO2(C1-C4),-NHCO(C1-C4) и -NO2; и их фармацевтически приемлемые соли. Далее, является предпочтительным, чтобы в случае, когда R7 и R3 соединены вместе как-(CH2)p- или -(CH2)r-, образованное таким образом кольцо было необязательно замещено 1-3 заместителями, выбранными из группы, включающей C1-С 3 алкил, трифторметил, галоген,водород, фенил, нитро, -CN. Настоящее изобретение также включает способ получения указанных выше соединений. Соединения по настоящему изобретению могут быть получены одним из следующих способов: а) превращение спирта формулы: где m, A, Y и R1-6 являются такими, как определено выше, в соответствующее соединение формулы (I), где Х является отщепляемой группой, с помощью соответствующих средств; например, используя галогенирующий, сульфони 003937 10 лирующий или ацилирующий агент, содержащий отщепляемую группу X; илиb) окисление соединения формулы I, где А является S, с получением соответствующего соединения формулы I, где А является SO илиc) превращение соединения формулы (I) в его фармацевтически приемлемую соль. Соединения формулы (А) могут быть получены взаимодействием фенола формулы: где Р представляет собой гидрокси защитную группу, и R1-6 являются такими, как определено выше (например, R1 и R2 каждый являются Н или C1-C12 алкилом), с соединением формулы: где Y, R1, R2 и m являются такими, как определено выше и галоген является F, Сl, Вr или I, и удаления защитной группы. Соединения настоящего изобретения, в которых "А" является кислородом, могут быть синтезированы с помощью следующих стадий способа: а) алкилирование соответствующего гидроксибензальдегида формулы где Y, R1, R2 и m являются такими, как определено в основной общей и побочных группах выше, и галоген может быть Сl, F, Вr или I, с получением альдегида формулы:b) окисление альдегида, полученного на стадии а), с получением соответствующего спирта, имеющего формулу с) превращение спирта из стадии b) в его хлоргидратную соль, например, с помощью НСl/ТГФ; иd) превращение спирта в предпочтительную отщепляемую группу, например, с помощью обработки метансульфонилхлоридом, толуолсульфонилхлоридом или трифторуксусным ангидридом, в присутствии основания, подобного пиридину или триэтиламину. Подобно этому, настоящее изобретение предусматривает способ получения соединений по настоящему изобретению, где "А" представляет собой серу, осуществляя стадии: а) алкилирования соединения формулы: 12 творители для конкретных стадий приведены только в иллюстративных целях и могут быть заменены другими реагентами и растворителями, известными специалистам в данной области. Схема I где Y и m являются такими, как определено выше, и галоген выбирают из Cl, F, Вr или I, с получением альдегида формулыb) восстановления альдегида, полученного на стадии а), например, с помощью боргидрида натрия, до спирта формулы Схема IIа с) обработки спирта со стадии b) газообразным НСl с получением его хлоргидрата; иd) превращением хлоргидрата спирта, полученного на стадии с), в предпочтительную отщепляемую группу, например, путем обработки метансульфонилхлоридом, толуолсульфонилхлоридом или трифторуксусным ангидридом, в присутствии основания, подобного пиридину или триэтиламину, или продолжения обработки НСl с получением соответствующего бензилхлорида; и,е) необязательного завершения контролируемого окисления серы до сульфоксида или до сульфона, например, с помощью м-хлорпербензойной кислоты. Исходный материал, тиофеноксидальдегид со стадии а) выше, может быть получен из его соответствующего тиофенолальдегида, например, с помощью гидрида натрия, что может рассматриваться или не рассматриваться в качестве стадии описанного выше процесса. Подробное описание изобретения Следующие далее схемы реакций от I доIV демонстрируют синтез соединений по настоящему изобретению, используя различные значения для переменной "Y". Реагенты и рас Схема IIа предлагает альтернативный путь синтеза бензиловых спиртов по настоящему изобретению на примере синтеза 4-(2-пиперидинилетокси) бензилового спирта. При этом синтезе 4-гидроксибензиловый спирт обрабатывают с помощью желаемого ариламиноалкилхлорида с получением соответствующего алкоксибензилового спирта. В конкретном примере схемы IIа 4-гидроксибензиловый спирт может быть обработан 1-(2-хлорэтил)пиперидин хлоргидратом в присутствии К 2 СО 3/Ме 3 СО с получением 4-(2 пиперидинилетокси)бензилового спирта. Схема IIа также более конкретно иллюстрирует другое предпочтительное воплощение настоящего изобретения. Настоящее изобретение также включает способ получения полезных для использования спиртовых соединений формулы где Y представляет собой все Y группы и их необязательные заместители, как описано выше в наиболее общем виде. В предпочтительной подгруппе этого способа, Y представляет собой: а) остаток где R7 и R8 независимо выбраны из группы Н,C1-С 6 алкила или фенила; илиb) пяти-, шести- или семичленное ненасыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее один или два атома азота, гетероциклическое кольцо является соединенным с помощью этоксимостика с атомом азота в кольце и является необязательно замещенным от 1 до 3 группами, выбранными из галогена, C1-С 6 алкила, C1-С 6 алкокси, C1-С 6 тиоалкила, -СF3 или -NO2. Предпочтительными Y группами по данному способу являются азепин, пиррол, имидазолин, имидазолидин, гексаметиленимин, пирролидин, пиразолидин, пиразолин, пиперидин,пиперазин. Способ включает взаимодействие, в щелочной среде, 4-гидроксибензилового спирта с солью, такой как ацетатная, хлоргидратная,бромгидратная или йодгидратная соль, соединения формулы Используя подобные же стадии, соединение по настоящему изобретению, где "А" является серой, может быть получено так, как показано ниже на схеме V. На первой стадии тиофеноксид может быть получен с помощью гидрида натрия с последующим алкилированием и восстановлением до соответствующего альдегида,например, с помощью боргидрида натрия, или каталитически, с помощью водорода и никеля Ренея, или платины, или палладия на угле. Получаемый в результате спирт может быть затем обработан газообразным НСl с получением его хлоргидрата, с последующей обработкой НСl до образования бензилхлорида. Конечный продукт может затем быть получен путем контролируемого окисления серы до сульфоксида, а затем до сульфона, например, с помощью м-хлорпербензойной кислоты. Схема V где Y является таким, как определено выше. Эту реакцию проводят в органическом растворителе или системе растворителей, например, в ацетоне, диметилформамиде или тетрагидрофуране. Предпочтительно, рН среды поддерживают выше рН, равного 8, более предпочтительно, выше рН, равного 9. Схема III Следующие примеры представлены скорее для иллюстрации, чем для ограничения предмета изобретения. В процедурах, выше, соединения формулы(I), где R1 и R2, соседствующие с остатком X,представляют собой водород, получают из первичных спиртов (например, схема I, соединения 3 а-с), которые сами по себе получают путем восстановления предшественников-альдегидов(например, схема I, соединения 2 а-с). Аналогичные соединения формулы (I), где один из R1 и R2, соседствующих с остатком X,представляет собой алкил или перфторалкил, а другой является водородом, могут быть получены из соответствующих вторичных спиртов,которые сами по себе могут быть получены из 15 соответствующих кетонов, например, из соединений, имеющих COR1 остаток, где R1 является алкилом или перфторалкилом. Аналоги соединений формулы (I), где обаR1 и R2, соседствующие с остатком X, выбраны,каждый, из алкила и перфторалкила, могут быть получены из соответствующих третичных спиртов. Пример 1. 4-(2-Пиперидин-1-илэтокси) бензилальдегид (2 а). К хорошо перемешиваемой суспензии пгидроксибензальдегида (83,5 г, 0,68 моль, 1,05 экв.) и К 2 СО 3, (224 г, 1,6 моль, 2,5 экв.) в ДМФ(1 л) добавляют хлоргидрат 1-(2-хлорэтил)пиперидина (120 г, 0,65 моль, 1,0 экв.). Реакционную смесь нагревают с обратным холодильником в течение 2 ч с энергичным механическим перемешиванием. ТСХ на этом этапе показывает наличие, в основном, продукта без присутствия исходного материала, (EtOAc/гексан 1:1). Реакционную смесь фильтруют через целит,разбавляют EtOAc (2 л) и промывают водой (3 х 500 мл). Органический слой концентрируют с помощью роторного испарителя с получением 147 г (97 %) альдегида (2 а) в виде желтого масла. 1H ЯМР (CDCl3/TMS): 9,87 (с, 1 Н), 7,81 (д,2 Н, J = 8,7 Гц), 7.01 (д, 2 Н, J = 8,7 Гц), 4,18 (т,2 Н, J = 6,03 Гц), 2,79 (т, 2 Н, J = 6,03 Гц), 2,51 (м,4 Н), 1,6-1,4 (м, 6 Н). Пример 2. 4-(2-Гексаметиленимин-1-илэтокси)бензилальдегид (2b). К хорошо перемешиваемой суспензии NaH(65 г, 60 % масляная дисперсия, 1,6 моль, 2,2 экв.) в ДМФ (500 мл) добавляют по каплям при 0 С раствор хлоргидрата п-гидроксибензальдегида (90 г, 0,74 моль, 1,0 экв.). Реакционную смесь перемешивают в течение 30 мин, затем добавляют по частям 4-[2(гексаметиленимино)]этилхлорид (153 г, 0,77 моль, 1,0 экв.). Реакционную смесь перемешивают в течение 1 ч. ТСХ на данный момент показывает основное наличие продукта и малые количества исходного материала, (EtOAc/гексан 1:1). Реакционную смесь разбавляют водой (1 л) и экстрагируют эфиром (5 л). Органический слой сушат над МgSO4 и концентрируют с помощью роторного испарителя с получением 176,8 г (97 %) альдегида (2b) в виде желтого масла. 1H ЯМР (CDCl3/TMS): 9,87 (с, 1 Н), 7,81 (д,2 Н, J = 8,7 Гц), 7,02 (д, 2 Н, J = 8,7 Гц), 4,14 (т,2 Н, J = 6,09 Гц), 2,98 (т, 2 Н, J= 6,14 Гц), 2,78 (м,4 Н), 1,66-1,61 (м, 8 Н). Пример 3. 4-(2-Диметиламиноэтокси)бензилальдегид (2 с). К хорошо перемешиваемой суспензии пгидроксибензальдегида (9,54 г, 0,078 моль, 1,00 экв.) и К 2 СО 3 (27 г, 0,195 моль, 2,5 экв.) в ДМФ(100 мл) добавляют хлоргидрат 1-(2-хлорэтил) диметиламина (11,26 г, 0,078 моль, 1,0 экв.). Реакционную смесь перемешивают в течение 2 16 ч при 60-70 С. ТСХ на этом этапе показывает наличие, в основном продукта и отсутствие исходного материала, (EtOAc/гексан/Et3N 3:7:1). Реакционную смесь выливают в смесь вода/лед(200 мл) и экстрагируют Et2O (3 х 200 мл). Органический слой сушат над MgSO4 и концентрируют с помощью роторного испарителя с получением 5,9 г (39%) альдегида (2 с) в виде розоватой жидкости. 1H ЯМР (CDCl3/TMS): 9,88 (с, 1 Н), 7,8 (д,2 Н, J = 8,7 Гц), 7,02 (д, 2 Н, J = 8,7 Гц), 4,15 (т,2 Н, J = 5,64 Гц), 2,77 (т, 2 Н, J= 5,64 Гц), 2,35 (с,6 Н). Пример 4. 4-(2-Пиперидин-1-илэтокси) бензиловый спирт (3 а). К перемешиваемому раствору альдегида 2 а(115 г, 0,494 моль, 1,0 экв.) в метаноле (360 мл) при 0/+5 С добавляют по частям боргидрид натрия (9,44 г, 0,249 моль, 0,5 экв.). Реакционную смесь перемешивают в течение 30 мин. ТСХ на этот момент показывает, в основном продукт и не показывает исходный материал, (EtOAc/ гексан/триэтиламин 3:7:1). Реакционную смесь выливают в воду (1,1 л), экстрагируют метиленхлоридом (3 х 550 мл) и сушат над MgSO4. Раствор концентрируют с помощью роторного испарителя с получением 91,6 г (80 %) спирта 3 а в виде густого масла, которое кристаллизуется непосредственно при введении затравки. 1H ЯМР (CDCl3/TMS): 7,23 (д, 2 Н, J = 8,5 Гц), 6,80 (д, 2 Н, J = 8,5 Гц), 4,56 (с, 2 Н) 3,99 (т,2 Н, J = 6,12 Гц), 2,69 (т, 2 Н, J = 6,14 Гц), 2,47 (м,4 Н), 1,6-1,25 (м, 6 Н). 13 С ЯМР (ДМСО-d6): 158,23, 135,34,128,70, 114,84, 66,42, 63,44, 58,27, 55,29, 26,45,24,80. Пример 5. 4-(2-Пиперидин-1-илэтокси) бензиловый спирт (3 а). 4-Гидроксибензиловый спирт (6,2 г, 0,05 моль) растворяют в водном растворе гидроксида натрия (5 н., 30 мл). Добавляют толуол (30 мл), а затем хлоргидрат 1-(2-хлорэтил)пиперидина(9,29 г, 0,05 моль) и бензилтриэтиламмоний бромид (0,3 г). Реакционную смесь нагревают с энергичным перемешиванием в течение 1,5 ч. Слои отделяют, водный слой экстрагируют толуолом (2 х 15 мл). Объединенные органические слои промывают водой (50 мл), насыщенным солевым раствором (50 мл), сушат над сульфатом натрия и концентрируют с помощью роторного испарителя с получением 8,725 г (75%) спирта (3 а) в виде желтовато-коричневого масла. Пример 6. 4-(2-Гексаметиленимин-1-илэтокси)бензиловый спирт (3b). К перемешиваемому раствору альдегида 2b (200 г, 0,72 моль, 1,0 экв.) в метаноле (400 мл) добавляют по частям при 0/+5 С боргидрид натрия (15,6 г, 0,41 моль, 0,57 экв.). Реакционную смесь перемешивают в течение 30 мин. Результаты ТСХ в этом случае демонстрируют в основном продукт без наличия исходного мате 17 риала, (EtOAc/гексан/триэтиламин 3:7:1). Реакционную смесь разбавляют водой (400 мл), экстрагируют метиленхлоридом (3 х 400 мл) и сушат над MgSO4. Раствор концентрируют с помощью роторного испарителя с получением 201 г(100%) спирта 3b в виде густого масла. 1 Н ЯМР (CDCl3/TMS): 7,27 (д, 2 Н, J = 8,5 Гц), 6,87 (д, 2 Н, J = 8,5 Гц), 4,60 (с, 2 Н), 4,05 (т,2 Н, J = 6,21 Гц), 2,93 (т, 2 Н, J = 6,15 Гц), 2,77 (м,4 Н), 1,7-1,5 (м, 8 Н). Пример 7. 4-(2-Диметиламиноэтокси) бензиловый спирт (3c). К перемешиваемому раствору альдегида 2 с(5,9 г, 0,031 моль, 1,0 экв.) в метаноле (20 мл) при 22 С добавляют по частям боргидрид натрия (0,58 г, 0,015 моль, 0,5 экв.). Реакционную смесь перемешивают в течение 30 мин. ТСХ на этот момент показывает главным образом продукт без присутствия исходного материала,(EtOAc/гексан/триэтиламин 5:5:1). Реакционную смесь разбавляют водой (50 мл), экстрагируют метиленхлоридом (3 х 40 мл) и сушат надMgSO4. Раствор концентрируют с помощью роторного испарителя с получением 5,25 гH ЯМР (CDCl3/TMS): 7,25 (д, 2 Н, J = 8,64 Гц), 6,85 (д, 2 Н, J = 8,64 Гц), 4,52 (с, 2 Н), 3,99 (т,2 Н, J = 5,88 Гц), 2,67 (т, 2 Н, J = 5,79 Гц), 2,29 (с,6 Н). Пример 8. Хлоргидрат (4-хлорметилфенокси)этилпиперидин-1-ила (1 а). Раствор спирта 3a (61,3 г, 0,26 моль, 1 экв.) в ТГФ (500 мл) охлаждают до 0/-5 С (баня ледвода) и барботируют газообразный НСl. Барботирование продолжают до тех пор, пока не происходит дальнейшего загустения реакционной смеси. Охлаждающую баню удаляют. Тионилхлорид (29 мл, 0,39 моль, 1,5 экв.) добавляют к густой суспензии хлоргидрата 4 а и смесь нагревают до 50 С до тех пор, пока она не станет прозрачным. Реакционную смесь охлаждают до-3 С и перемешивают в течение 30 мин. Полученный белый твердый продукт фильтруют и сушат с получением 72 г (96 %) хлорида 1 а. 4 а: 1H ЯМР (ДМСО-d6): 10,9 (с, HCl), 7,25(д, 2 Н, J = 8,5 Гц), 6,94 (д, 2 Н, J =8,5 Гц), 4,42 (м,4 Н), 3,41 (м, 4 Н). 1 а: 1H ЯМР (ДМСО-d6): 11 (ушир. с, HСl),7,39 (д, 2 Н, J = 8,5 Гц), 6,99 (д, 2 Н, J = 8,5 Гц),4,74 (с, 2 Н), 4,46 (м, 2 Н), 3,45 (м, 4 Н), 2,69 (м,2 Н) и 1,9-1,2 (м, 6 Н). Пример 9. Хлоргидрат (4-хлорметилфенокси)этилгексаметиленимин-1-ила (1b). К раствору спирта 3b (179 г, 0,72 моль, 1 экв.) в ТГФ (300 мл) добавляют по каплям раствор НСl (26,3 г НСl в 263 мл ТГФ, 0,72 моль,1,0 экв.) при 0/+10 С. Образуется белый осадок. Тионилхлорид (80 мл, 1,1 моль, 1,5 экв.) добавляют к густой суспензии хлоргидрата 4b и смесь нагревают до 50 С до тех пор, пока она не станет прозрачной. Реакционную смесь концентрируют до 350 мл и держат в холодильнике в те 003937 18 чение ночи. Полученный белый твердый продукт фильтруют, промывают холодным ТГФ(с, 2 Н), 4,44 (т, 2 Н, J = 5,25), 3,64 - 3,39 (м, 4 Н),3,25 - 3,17 (м, 2 Н), 1,84-1,54 (м, 8 Н). Пример 10. (4-Хлорметилфенокси)этилдиметиламинохлоргидрат (1 с). Через раствор спирта 3c (5,25 г, 0,027 моль, 1 экв.) в ТГФ барботируют при 0/+25 С в течение 15 мин (100 мл) газообразную НСl. Образуется белый осадок. Тионилхлорид (6 мл, 9,6 г, 0,081 моль, 3,0 экв.) добавляют к густой суспензии хлоргидрата 4 с, и смесь нагревают до 30 С до тех пор, пока не станет прозрачным. Реакционную смесь концентрируют до 350 мл, и держат в холодильнике в течение ночи. Полученный белый твердый продукт фильтруют,промывают холодным ТГФ (100 мл) и сушат с получением 4,57 г (68%) хлорида 1 с. Среди фармакологически активных соединений, которые могут быть получены с использованием соединений по настоящему изобретению, находятся 2-фенил-1-[4-(2-аминоэтокси) бензил]индольные соединения, которые полезны в качестве эстрогенных агентов. Указанные соединения включают соединения формул IV иR11 выбирают из Н, ОН или их C1-C12 сложных эфиров (с прямой или разветвленной цепью) или C1-C12 (с прямой или разветвленной цепью или циклических) алкиловых простых эфиров или галогенов; или галогенированных простых эфиров, включая трифторметиловый простой эфир и трихлорметиловый простой эфир.R12, R9 и R10 независимо выбирают из Н,ОН или их C1-C12 сложных эфиров (с прямой или разветвленной цепью) или C1-C12 алкиловых простых эфиров (с прямой или разветвленной цепью или циклических), галогенов или галогенированных простых эфиров, включая трифторметиловый простой эфир и трихлорметиловый простой эфир, циано, C1-С 6 алкил (с прямой или разветвленной цепью) или трифторметил,при условии, что в случае, когда R1 является Н,R2 не является ОН. 19 2-Фенил-1-[4-(2-аминоэтокси)бензил]индольные соединения этого типа являются частичными агонистами эстрогенов и демонстрируют высокое сродство к рецепторам эстрогенов. Однако в отличие от многих эстрогенов,эти соединения не вызывают увеличения мокрого веса матки. Такие соединения являются антиэстрогенными в матке и могут полностью антагонизировать трофические воздействия агонистов эстрогенов в ткани матки. Указанные соединения являются полезными для использования при лечении или предотвращении болезненных состояний или синдромов у млекопитающих, которые вызываются или связываются с дефицитом эстрогенов. Указанные соединения обладают способностью вести себя подобно агонистам эстрогенов, понижая уровень холестерина и предотвращая потери костной ткани. По этой причине,такие соединения являются полезными при лечении многих расстройств, включая остеопороз,гипертрофию простаты, бесплодие, рак груди,рак слизистой оболочки матки, сердечнососудистое заболевание, контрацепцию, болезнь Альцгеймера и меланому. Кроме того, данные соединения могут быть использованы для гормонзамещающей терапии у женщин в период после менопаузы или при других состояниях с дефицитом эстрогенов, где было бы полезно введение эстрогенов. 2-Фенил-1-[4-(2-аминоэтокси)бензил]индольные соединения, получаемые с помощью соединений по настоящему изобретению, могут быть также использованы в способах лечения потери костной ткани, которая может быть вызвана дисбалансом между формированием в организме новых костных тканей и резорбцией более старых тканей, что ведет в результате к суммарным потерям костной ткани. Такое истощение костей происходит у целого ряда индивидуумов, в частности, у женщин в период после менопаузы, у женщин, которые подвергались гистерэктомии, у тех, кто получает или получал продолжительное лечение кортикостероидами, у тех, кто испытывает дисгенезию гонад, и у тех, кто страдает синдромом Кушинга. Специфические потребности в замене костной ткани также могут быть удовлетворены, используя эти соединения, у индивидуумов с переломами костей, дефектными структурами костей и у тех, кто получает хирургическое лечение, связанное с костями, и/или имплантацию протеза. В дополнение к тем проблемам, которые описаны выше, эти соединения могут быть использованы при лечении остеоартрита, болезни Паже,остеомаляции, остеохолестероза, рака слизистой оболочки матки, множественной миеломы и других форм рака, имеющих отрицательное влияние на костные ткани. Способы лечения расстройств, перечисленных здесь, как подразумевается, включают введение индивидууму,нуждающемуся в таком лечении, фармацевтиче 003937 20 ски эффективного количества одного или нескольких из соединений по настоящему изобретению или его фармацевтически приемлемой соли. Настоящее изобретение также включает фармацевтические композиции, использующие одно или несколько из настоящих соединений,и/или их фармацевтически приемлемые соли вместе с одним или несколькими приемлемыми носителями, наполнителями и тому подобное. Является очевидным, что дозировка, режим и способ введения 2-фенил-1-[4-(2-аминоэтокси)бензил]индольных соединений будут изменяться в соответствии с расстройством и индивидуумом, подвергающимся лечению, и будут объектом выбора участвующего в лечении врача. Является предпочтительным, чтобы введение одного или нескольких упоминаемых здесь соединений начиналось с низкой дозы и увеличивалось бы до тех пор, пока не будут достигнуты желаемые воздействия. Эффективное введение этих соединений может осуществляться при дозах от около 0,1 мг/день до около 1000 мг/день. Предпочтительно, введение будет начинаться от около 50 мг/день до около 600 мг/день в единичной дозе или в двух или более разделенных дозах. Такие дозы могут вводиться любым способом, подходящим для направления упоминаемых здесь активных соединений в поток крови пациента, в том числе перорально, парэнтерально (включая внутривенные, внутрибрюшинные и подкожные инъекции) и трансдермально. Для целей настоящего описания трансдермальное введение,как подразумевается, включает все виды введения через поверхность тела и внутренние покрытия проходов в тело, включая эпителиальные и слизистые ткани. Такие введения могут производиться с использованием настоящих соединений или их фармацевтически приемлемых солей в виде примочек, кремов, пен, пластырей, суспензий, растворов и суппозиториев(ректальных и вагинальных). Препараты для перорального введения, содержащие активные соединения по настоящему изобретению, могут включать любые повсеместно используемые пероральные формы, включая таблетки, капсулы, леденцы, драже, лепешки и жидкости, суспензии или растворы для перорального использования. Капсулы могут содержать смеси активного соединения (соединений) с инертными наполнителями и/или разбавителями, такими как фармацевтически приемлемые крахмалы (например, кукурузный, картофельный или крахмал из тапиоки), сахара,искусственные подслащающие агенты, порошкообразные целлюлозы, такие как кристаллические и микрокристаллические целлюлозы, различные виды муки, желатина, смолы и тому подобное. Пригодные для использования таблетки препаратов могут быть изготовлены с помощью способов обычного прессования, влажного или сухого гранулирования и использовать 21 фармацевтически приемлемые разбавители, связывающие агенты, смазывающие вещества, разрыхлители, суспендирующие или стабилизирующие агенты, включая, но не ограничиваясь ими, стеарат магния, стеариновую кислоту,тальк, лаурилсульфат натрия, микрокристаллическую целлюлозу, кальций карбоксиметилцеллюлозу, поливинилпирролидон, желатин, альгиновую кислоту, смолу акации, ксан-тановую смолу, цитрат натрия, комплексные силикаты,карбонат кальция, глицин, декстрин, сахарозу,сорбитол, дикальцийфосфат, сульфат кальция,лактозу, каолин, маннитол, хлорид натрия,тальк, сухие крахмалы и порошкообразный сахар. Препараты для перорального введения,упоминаемые здесь, могут быть стандартными препаратами с контролируемым или замедленным временем высвобождения для изменения поглощения активного соединения(соединений). Препараты в виде суппозиториев могут быть сделаны из традиционных материалов,включая масло какао, с добавлением восков для изменения температуры плавления суппозитория и глицерина или без него. Могут также быть использованы основы для водорастворимых суппозиториев, такие как полиэтиленгликоли с различными молекулярными массами. Как показано на схеме VI, соединения этой группы могут быть синтезированы путем алкилирования индольного азота с помощью соединений по настоящему изобретению, как иллюстрируется в примерах 11-13, ниже, используя хлор гидрат (4-хлорметилфенокси)этилпипердин-1-ила из примера 8, хлоргидрат (4-хлорметилфенокси)этилгексаметиленимин-1-ила из Примера 9 и (4-хлорметилфенокси)этилдиметиламинохлоргидрат из примера 10, соответственно. Кроме NaH, могут быть использованы другие основания, включая т-бутоксид калия или т-бутоксид натрия. Схема VI Схемы VII и VIII демонстрируют пример синтеза хлоргидрата 1-[4-(2-азепан-1-илэтокси) бензил]2-(4-гидроксифенил)-3-метил-1H-индол 5-ола с использованием промежуточных соединений по настоящему изобретению. Схема VII иллюстрирует алкилирование 4 гидроксибензальдегида с помощью хлоргидрата 2-(гексометиламино)этилхлорида, которое может быть осуществлено в присутствии карбоната калия с получением соответствующего альдегида I (стадия 1). Когда реакция завершается,смесь может быть осветлена, перемешана с толуолом и промыта водой. Раствор толуола затем может быть концентрирован, и полученный в результате остаток нагревают с изопропанолом с получением раствора альдегида I. Раствор изопропанола из I может быть обработан для каталитического восстановления, например, с помощью никеля Ренея, с получением спирта II(стадия 2). Вслед за восстановлением, реакционная смесь может быть осветлена и концентрирована, при этом получаемый остаток растворяют в этилендихлориде с получением раствора, содержащего спирт II. Этот раствор может быть обработан тионилхлоридом с последующим концентрированием. Полученный в результате остаток может затем быть обработан 1,2-диметоксиэтаном с получением желтых кристаллов III (стадия 3). Схема VIII На схеме VIII, стадия 4, 4-бензилоксипропиофенон бромируют в уксусной кислоте бромом. Когда реакция завершается, смесь может быть погашена водой, и полученный осадок промывают разбавленной уксусной кислотой,водой и гептаном. Полученный твердый продукт сушат с получением соединения IV, хлоргидрата 4-бензилоксианилина. На стадии 5,смесь IV, N,N-диизопропилэтиламина и толуола нагревают с обратным холодильником с удалением воды. Когда реакция завершается, смесь может быть охлаждена и разбавлена метанолом. Полученный твердый продукт может быть собран, промыт метанолом и высушен с получением индольного соединения V. Смесь соединенийV и III может быть смешана на стадии 6 с третбутоксидом натрия в N,N-диметилформамиде и перемешиваться до тех пор, пока реакция не завершится. Затем смесь может быть погашена насыщенным солевым раствором и экстрагирована толуолом. Экстракты концентрируют и остаток разбавляют метанолом. Полученный твердый продукт может быть собран,растворен в этилацетате, осветлен и разбавлен метанолом. Твердый продукт может быть собран из этого разбавленного раствора и высушен с получением соединения VI. На стадии 7 (не показано) соединение VI в растворе этанола может быть гидрированно с помощью катализатора Рd-древесный уголь. После осветления, гидрогенированный материал может быть смешан с малым количеством аскорбиновой кислоты и обработан уксусной кислотой. Полученный в результате кристаллический осадок затем может быть собран, промыт этанолом и высушен с получением конечного продукта, хлоргидрата 1-[4-(2-азепан-1-илэтокси)бензил]-2-(4-гидроксифенил)-3-метил 1 Н-индол-5-ола. Продукт затем может быть кристаллизован из этанола, необязательно содержащего малое количество аскорбиновой кислоты, предпочтительно, например, от около 0,5 мас.% до около 3,0 мас.%. В приведенных выше методиках промежуточные соединения от III до VI могут быть легко изолированы в виде твердых продуктов. Все другие промежуточные соединения могут более предпочтительно быть использованы в виде растворов в органических растворителях. Схемы от IX до XII представляют синтез 2(4-гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси)бензил]-1 Н-индол-5-ола с использованием промежуточных соединений по настоящему изобретению. Схема IIа, описанная выше, может рассматриваться в качестве первой стадии схемы IX или стадии перед ней. На этой стадии 4-гидроксибензиловый спирт обрабатывают с помощью желаемого ариламиноалкилхлорида с получением соответствующего алкоксибензилового спирта. В конкретном примере схемы IIа 4-гидроксибензиловый спирт обрабатывают хлоргидратом 1-(2-хлорэтил)пиперидина в присутствии К 2 СО 3/Ме 2 СО с получением 4(2-пиперидинилэтокси)бензилового спирта. Толуол и насыщенный солевой раствор могут быть добавлены к полученной смеси спиртов для разделения ее фаз. Затем фаза толуола может быть промыта последовательно водным раствором щелочи и насыщенным солевым раствором. Полученный материал затем может быть концентрирован с последующим добавлением этилендихлорида для получения промежуточного соединения,4-(2-пиперидинилетокси)бензилового спирта. Раствор 4-(2-пиперидинилетокси)бензилового спирта в этилендихлориде может быть объединен с тионилхлоридом и нагреваться до 24 тех пор, пока реакция не завершится. При охлаждении смесь может быть концентрирована с последующим добавлением 1,2-диметоксиэтана и дополнительным концентрированием. Осадок может быть собран и высушен с получением промежуточного соединения, хлоргидрата 4-(2 пиперидинилетокси)бензилхлорида, как показано на схеме IX. Схема IX Как показано на схеме IX, раствор 4-(2 пиперидинилэтокси)бензилового спирт может быть объединен с этилендихлоридом и тионилхлоридом и нагрет для создания реакционной смеси. При охлаждении, реакционная смесь может быть обработана 1,2-диметоксиэтаном и повторно концентрирована. Полученный осадок хлоргидрата 4-(2-пиперидинилэтокси)бензилхлорида затем может быть собран и высушен. Схема X Схема Х изображает бромирование 4 бензилоксипропиофенона в уксусной кислоте с бромом с получением 4'-(бензилокси)-2-бромпропиофенона. Когда эта реакция завершится,смесь может быть погашена водой. Полученный осадок может быть собран, промыт разбавленной уксусной кислотой, водой и гептаном, и высушен. Схема XI 4'-(Бензилокси)-2-бромпропиофенон, получаемый на схеме X, может быть нагрет с хлоргидратом 4-бензилоксианилина в присутствии N,N-диизопропилэтиламина и толуола с обратным холодильником при азеотропном удалении воды, как показано на схеме XI. Когда реакция завершится, смесь может быть охлаждена и разбавлена метанолом. Полученный твердый продукт 3-метил-2-(4-бензилокси)фенил-5-бензилоксииндол может быть собран,промыт метанолом и высушен. 3-Метил-2-(4-бензилокси)фенил-5-бензилоксииндол, получаемый на схеме XI, может затем взаимодействовать с хлоргидратом 4-(2 пиперидинилетокси)бензилхлорида в присутствии трет-бутоксида натрия в N,N-диметилформамиде. Полученная смесь может быть погашена насыщенным солевым раствором и экстрагирована толуолом. После осветления, экстракты могут быть концентрированы и разбавлены метанолом. Полученный твердый продукт,5-бензилокси-2-(4-бензилоксифенил)-1-[4-(2 пиперидин-1-илэтокси)бензил]-1 Н-индол может быть собран, растворен в этилацетате, разбавлен метанолом и высушен. Этот твердый продукт может быть растворен в системе этанолтетрагидрофуран и гидрогенирован с помощью катализатора Pd-древесный уголь. Раствор затем может быть осветлен, необязательно смешан с небольшим количеством аскорбиновой кислоты,а затем обработан водным раствором НСl. Затем осадок может быть собран, промыт смесью этанол-тетрагидрофуран и водой и высушен с получением конечного продукта, 2-(4-гидроксифенил)-3-метил-1-[4-(2-пиперидин-1-илэтокси) бензил]-1 Н-индол-5-ола. Пример 11. 5-Бензилокси-2-(4-бензилоксифенил)-3-1-[4-(2-пиперидин-1-илэтокси) бензил]-1H-индол. К раствору 5-бензилокси-2-(4-бензилоксифенил)-3-метил-1H-индола (117,5 г, 0,28 моль, 1,0 экв.) в ДМФ (1,3 л), добавляют по частям NaH (28,0 г, 60% масляная дисперсия, 0,7 моль. 2,5 экв.) при -5/-8 С в течение 1 ч. Реакционную смесь перемешивают в течение 2 ч. Раствор хлорида из примера 8 в ТГФ (1,0 л) добавляют по каплям при -10/0 С в течение 2 ч. Реакционную смесь перемешивают при 25 С в течение ночи. ТСХ на этом этапе показывает 26 наличие, в основном, продукта и не показывает исходного материала (EtOAc/гексан 1:5). Реакционную смесь разбавляют водой (6 л), экстрагируют EtOAc (2 х 3 л) и сушат над Na2SO4. Раствор концентрируют до 1 л, выливают в МеОНH ЯМР (CDCl3/TMS); 7,64 - 6,63 (м, 21 Н),5,12 (с, 2 Н), 5,09 (с, 2 Н), 5,07 (с, 2 Н), 4,07 (т, 2 Н,J = 6,06 Гц), 2,72 (т, 2 Н, J = 6,06 Гц), 2,48 (м,4 Н), 2,24 (с, 3 Н), 1,62 - 1,24 (м, 6 Н). Пример 12. 5-Бензилокси-2-(4-бензилоксифенил)-3-1-[4-(2-гексаметиленимин-1-илтокси) бензил]-1 Н индол. К суспензии NaH (20,0 г, 60 % масляная дисперсия, 0,5 моль, 2,5 экв.) добавляют раствор 5-бензилокси-2-(4-бензилоксифенил)-3-метил 1 Н-индола (84 г, 0,2 моль, 1,0 экв.) в ДМФ (100 мл) при 0/+10 С в течение 1 ч. Реакционную смесь перемешивают в течение 30 мин. Раствор хлорида из примера 9 (67 г, 0,22 моль, 1,1 экв.) в ДМФ (200 мл) добавляют по каплям при 0/+10 С в течение 2 ч. Реакционную смесь перемешивают при 25 С в течение 2 ч. ТСХ в этом случае показывает, в основном, продукт и не показывает исходного материала, (EtOAc/ гексан 1:5). Реакционную смесь разбавляют водой (1 л), экстрагируют EtOAc(3 x 1 л) и сушат над МgSO4, Раствор концентрируют до 150 мл,выливают в МеОН (750 мл) и перемешивают в течение ночи. Осадок фильтруют и сушат с получением указанного в заглавии соединения (99 г, 76%). 1H ЯМР (CDCl3/TMS); 7,48 - 6,74 (м, 21 Н),5,13 (с, 2 Н), 5,11 (с, 2 Н), 5,09 (с, 2 Н), 4,00 (т, 2 Н,J = 6,24 Гц), 2,91 (т, 2 Н, J = 6,27 Гц), 2,75 (м,4 Н), 2,24 (с, 3 Н), 1,71 - 1,52 (м, 8 Н). Пример 13. 5-Бензилокси-2-(4-бензилоксифенил)-3-1-[4-(2-диметиламиноэтокси)бензил]1 Н индол. К суспензии NaH (1,1 г, 60% масляная дисперсия, 0,05 моль, 2,5 экв.) добавляют раствор 5-бензилокси-2-(4-бензилоксифенил)-3 метил-1H-индола (6,97 г, 0,017 моль, 1,0 экв.) в ДМФ (100 мл) при 0/+10 С в течение 0,5 ч. Реакционную смесь перемешивают в течение 30 мин. Раствор хлорида из примера 10 (4,57 г,0,018 моль. 1,1 экв.) добавляют по частям при 0/+10 С в течение 2 ч. Реакционную смесь перемешивают при 25 С в течение 0,5 ч. ТСХ в этом случае показывает, в основном, продукт и не показывает исходного материала (EtOAc/ гексан 1:5). Реакционную смесь разбавляют водой (200 мл), экстрагируют EtOAc (3 х 200 мл), и сушат над МgSO4, Раствор концентрируют до 150 мл, выливают в МеОН (300 мл) и перемешивают в течение ночи. Осадок фильтруют и сушат с получением 5,6 г (53 %) указанного в заглавии соединения. 1(45 г, 0,23 моль), 4'-бензилокси-2-бромфенилпропиофеноном (66414-19-5) (21 г, 0,066 моль) и 50 мл ДМФ. Реакционную смесь нагревают с обратным холодильником в течение 30 мин и затем охлаждают до комнатной температуры, а затем распределяют между 250 мл EtOAc и 100 мл 1 н. НСl (водн). EtOAc промывают NaHCO3(водн.) и насыщенным солевым раствором, сушат над МgSO4. Раствор концентрируют и остаток поглащают CH2Cl2 и добавляют гексаны для осаждения 25 г сырого твердого продукта. Твердый продукт растворяют в CH2Cl2 и упаривают на селикагеле, и подвергают хроматографии,используя смесь CH2Cl2/гексан (1:5) с получением 9,2 г желтовато-коричневого твердого продукта (33%): Т.пл. = 150-152 С; 1 Н ЯМР (ДМСО) 10,88 (с, 1 Н), 7,56 (д, 2 Н,J = 8,8 Гц), 7,48 (д, 4 Н, J = 7,9 Гц), 7,42-7,29 (м,6 Н), 7,21 (д, 1 Н, J = 7,0 Гц), 7,13 (д, 2 Н, J = 8,8 Гц), 7,08 (д, 1 Н, J = 2,2 Гц), 6,94 (дд, 1 Н, J = 8,8,2,4 Гц), 5,16 (c, 2 Н), 5,11 (с, 2 Н), 2,33 (с, 3 Н); IR(КВr) 3470, 2880, 2820, 1620 см-1; MS eI m/z 419. Пример 15. 2-(4-Гидроксифенил)-3-метил 1-[4-(2-пиперидин-1-илэтокси)бензил]-1 Ниндол-5-ол. Суспензию 10% Pd/C (1,1 г) в EtOH нагревают с раствором указанного в заглавии соединения из примера 11 (2,2 г, 3,4 ммоль) в ТГФ/EtOH. Добавляют циклогексадиен (6,0 мл,63 ммоль) и реакционную смесь перемешивают в течение 48 ч. Катализатор фильтруют через Целит и реакционную смесь концентрируют и подвергают хроматографии на силикагеле, используя градиентное элюирование смесьюMeOH/CH2Cl2 (от 1:19 до 1:10) с получением 0,8 г продукта в виде белого твердого продукта. Т.пл.=109-113 С;H ЯМР 9,64 (с, 1 Н), 8,67 (с, 1 Н), 7,14 (д,2 Н, J = 8,6 Гц), 7,05 (д, 1 Н, J = 8,6 Гц), 6,84 (д,2 Н, J = 8,8 Гц), 6,79 (д, 1 Н, J = 2,2 Гц), 6,74 (c,4 Н), 6,56 (дд, 1 Н, J = 8,8, 2,4 Гц), 5,09 (с, 2 Н),3,95-3,93 (м, 2 Н), 2,60-2,51 (м, 2 Н), 2,39-2,38 (м,4 Н), 2,09 (с, 3 Н), 1,46-1,45 (м, 4 Н), 1,35-1,34 (м,2 Н); IR (КВr) 3350 (ушир.), 2920, 1620, 1510 см-1; MS (El) m/z 456. Исследование связывания in vitro рецепторов эстрогена Приготовление рецепторов Клетки яичников китайского хомячка(ЯКХ) избыточно экспрессирующие рецепторы эстрогена выращивают в 150 мм 2 чашках в смеси из нагруженной DMEM и 10% декстраном 28 угольной пыли и фатальной (плодная) бычьей сыворотки. Планшеты промывают дважды фосфатным солевым буфером и один раз 10 мМ Трис-HCl, рН 7,4, 1 мМ ЭДТА. Клетки собирают путем соскабливания поверхности и затем клеточную суспензию помещают на лед. Клетки разрушают с помощью портативного электрического измельчителя тканей, используя два 10 секундных сеанса. Сырой препарат центрифугируют при 12000g в течение 20 мин, а затем путем 60 минутного вращения при 100000g с получением не содержащего рибосом цитозоля. Затем цитозоль замораживают и хранят при-80 С. Концентрация белков в цитозоле оценивается с использованием исследования ВСА со стандартным белком сравнения. Условия для исследования связывания Исследование конкурентного связывания производят на 96-луночном планшете (polystyrene), который связывает 2,0% от общего поступления [3H]-17-эстрадиола, и каждую точку данных получают троекратно. 100 мкг/100 мкл препарата рецептора аликвотируют на лунку. Добавляют насыщающую дозу из 2,5 нМ [3 Н]17-эстрадиол + конкурент (или буфер) в объеме 50 мкл при предварительной конкуренции,когда оценивают 100 х и 500 х конкурента, используют только 0,8 нМ [3H]17-эстрадиола. Планшет инкубируют при комнатной температуре в течение 2,5 ч. В конце этого инкубационного периода добавляют 150 мкл охлажденного на льду, покрытого декстраном древесного угля(5% активированного древесного угля, покрытого 0,05% 69 К декстрана) в каждую лунку, и планшет непосредственно центрифугируют при 99g в течение 5 мин при 4 С. 200 мкл раствора супернатанта затем удаляют для счета сцинцилляций. Отсчеты образцов производят до 2% или 10 мин, в зависимости от того, что происходит вначале. Поскольку полистирол поглощает малое количество [3 Н]17-эстрадиола, клетки, содержащие радиоактивность и цитозоль, но не обработанные древесным углем, включают в определяемые количества доступного изотопа. Кроме того, лунки, содержащие радиоактивность, но не цитозоль, обрабатывают древесным углем для оценки не удаляемого ДВМ [3H]17 эстрадиола. Используют 96-луночные планшетыCorning 25880-96, поскольку они, как показано,связывают наименьшее количество эстрадиола. Анализ результатов Отсчеты в минуту (ОВМ) радиоактивности автоматически преобразуют в число дезинтегрированных в минуту (ДВМ) с помощью Beckman LS 7500 Scintillation Counter с использованием набора погашенных стандартов для получения Н для каждого образца. Для вычисления% связывания эстрадиола в присутствии 100 кратного или 500-кратного конкурента используют следующую формулу: 29 ДВМ образец - ДВМ не удаленный с помощью древесного угля)/(ДВМ эстрадиол - ДВМ не удаленный с помощью древесного угля х 100% = % связывания эстрадиола Для получения кривых IC50 строят графики% связывания в зависимости от соединения. Зависимости IC50 строят для соединений, которые демонстрируют 30% конкуренцию при 500 х концентрации конкурента. Описание этих методов смотри в Hulme, B.C., ed. 1992, Receptor-Ligand Interactions: A Practical Approach. IRLPress, New York (смотри, в частности, главу 8). Ссылки ниже в таблицах на соединение из примера 1 относятся к конечному продукту, 2-(4 гидроксифенил)-3-метил-1-[4-(2-пиперидин-1 илэтокси)бензил]-1 Н-индол-5-олу. Афинность рецептора эстрогена (указывается как RBA: 17-эстрадиол=100) СоединениеEquilin 5,3 Пример 15 400 Исследование клеток Ишикавы на щелочную фосфатазу Поддержание жизнедеятельности и обработка клеток Клетки Ишикавы выдерживают в смесиDMEM/F12 (50%:50%), содержащей фенольный красный + 10% фетальной бычьей сыворотки, и среда дополняется 2 мМ Glutamax, 1% Pen/Strap и 1 мМ пирувата натрия. За пять дней перед началом каждого эксперимента (обработка клеток) среду заменяют сывороткой, разделенной в смеси DMEM/F12 + 10% древесного угля, покрытого декстраном, свободной от фенольного красного. В день перед обработкой клетки собирают с использованием 0,5% трипсин/ЭДТА и помещают с плотностью 5 х 104 клетка/лунка в 96-луночных планшетах для культур тканей. Исследуемые соединения дозируют при 10-6,10-7 и 10-8 М при добавлении к 10-6M (соединения) +10-9M 17-эстрадирола для оценки способности соединений к функционированию в качестве антиэстрогенов. Клетки обрабатывают в течение 48 ч перед исследованием. Каждый 96-луночный планшет содержит 17-эстрадиол в качестве контроля. Популяция образца в каждой дозе составляет n=8. Исследование щелочной фосфатазы В конце 48 часового периода среды отсасывают и клетки промывают три раза фосфатным солевым буфером (ФСБ). 50 Мкл лизирующего буфера (0,1 М Трис-HCl, рН 9,8, 0,2%Triton X-100) добавляют в каждую лунку. Планшеты выдерживают при -80 С в течение,самое меньшее, 15 мин. Планшеты размораживают при 37 С с последующим добавлением 150 мкл 0,1 М Трис-HCl, рН 9,8, содержащего 4 мМ паранитрофенилфосфата (пНФФ) в каждую лунку (конечная концентрация - 3 мМ пНФФ). Вычисления поглощения и крутизны кинетиче 003937 30 ской кривой осуществляют с использованием программы KineticCalc Application (Bio-Tek Instruments, Inc., Winooski, VT). Результаты выражают как среднее значение +/-среднеквадратичная дисперсия скорости ферментативной реакции (крутизна), усредненное по линейной части кинетической кривой (регистрации оптической плотности каждые 5 мин в течение регистрации поглощения за 30 мин). Результаты для соединений обобщены в форме процента отклика, относящегося к 1 нМ 17- эстрадиола. Различные соединения оценивают на эстрогенную активность с помощью метода щелочной фосфатазы и вычисляют соответствующие значенияED50 (95% C.I.). Четыре перечисленных ниже соединения используют в качестве стандартов для сравнения: 17-Эстрадиол Эстриол Описание этих методов изложено вHochberg, R.B. (1990) A simple and sensitive microtiter plate estrogen bioassay based on stimulation alkaline phosphatase in Ishikawa cells; Estrogen action of D5 adrenal steroids. Endocrinology,6:2757-2762. Исследование клеток Ишикавы на щелочную фосфатазу Соединение 17-эстрадиол Исследование трансфекции 2 Х VIT ERE Поддержание и обработка клеток Яйцеклетки китайского хомячка (ЯМС),которые стабильно трансфицированы рецептором эстрогена человека, выдерживают в DMEM+ 10% фетальной бычьей сыворотки (ФБС). За 48 ч перед обработкой среду для выращивания заменяют DMEM, где отсутствует фенольныи красный + 10% ФБС, на древесном угле, нагруженным декстраном (среда для обработки). Клетки помещают с плотностью 5000 клетка/лунка в 96-луночные планшеты, содержащие 200 мкл среда/лунка. Трансфекция фосфата кальция Репортерная ДНК (плазмид Promega pGL2,содержащий две тандемные копии вителлогенина ERE впереди минимального промотора тимидинкиназы, стимулирующего ген люциферазы) объединяют с плазмидом экспрессии Вгалактозидазы pCH110 (Pharmacia) и носителя ДНК (pTZ18U) в следующем отношении: 10 мкг репортерной ДНК 5 мкг ДНК pCH110 31 5 мкг pTZ18U 20 мкг ДНК/1 мл раствора для трансфекции ДНК (20 мкг) растворяют в 500 мкл 250 мМ стерильного раствора СаCl2 и добавляют по каплям к 500 мкл 2xHeBS (0,28 М NaCl, 50 мМHEPES, 1,5 мМ Na2HPO4, pH 7,05) и инкубируют при комнатной температуре в течение 20 мин. 20 Мкл этой смеси добавляют в каждую лунку с клетками и оставляют на клетках в течение 16 ч. В конце этой инкубации осадок удаляют, клетки промывают средой, среду для обработки заменяют свежей и клетки обрабатывают одним из носителей, 1 нМ 17-эстрадиола, 1 мкМ соединения или 1 мкМ соединения + 1 нМ 17-эстрадиола (тесты на антагонизм к эстрогену). Каждое условие обработки воспроизводят на 8 лунках (n=8), которые инкубируют в течение 24 ч перед исследованиями на люциферазу. Исследования на люциферазу После 24 ч соприкосновения с соединениями, среды удаляют, и каждую лунку промывают 2 х 125 мкл ФСБ, где отсутствуют Мg иCa. После удаления ФСБ добавляют в каждую лунку 25 мкл лизирующего буфера Promega и дают возможность стоять при комнатной температуре в течение 15 мин, затем 15 мин при -80 С и 15 мин при 37 С. 20 Мкл лизата переносят на матовый 96-луночный планшет для оценки активности люциферазы и оставшийся лизат (5 мкл) используют для оценки активности Вгалактозидазы (нормировка трансфекции). Субстрат люциферан (Promega) добавляют в 100 мкл аликвотах в каждую лунку автоматически с помощью люминометра и получающийся свет(относительные световые единицы) регистрируют через 10 с после добавления. Исследование инфекции люциферазы Соединение 17-эстрадиол эстриол Исследование В-галактозидазы К остающимся 5 мкл лизата добавляют 45 мкл ФСБ. Затем добавляют 50 мкл 2 х буфера для исследования В-галактозидазы Promega,тщательно перемешивают и инкубируют при 37 С в течение 1 ч. Для каждого эксперимента подбирают планшет, содержащий стандартную кривую (0,1 до 1,5 миллиединиц, трехкратно). Планшеты анализируют на спектрометрическом регистраторе планшетов Molecular Devices на длине волны 410 нм. Оптические плотности,которые неизвестны, преобразуют в миллиединицы активности путем математической экстраполяции от стандартной кривой. Анализ результатов Данные для люциферазы получают в форме относительных световых единиц (ОСЕ), собираемых в течение 10 с измерения и автомати 003937 32 чески переносимых в JMP (SAS Inc) файл, где вычитаются фоновые ОСЕ. Значение Вгалактозидазы автоматически импортируются в файл и эти значения делятся на ОСЕ для нормировки данных. Средние значения и стандартные отклонения определяют из n=8 для каждой обработки. Активность соединений сравнивают с 17-эстрадиолом для каждого планшета. Процент активности по сравнению с 17 эстрадиолом вычисляют с использованием формулы Эти методики описаны Tzukerman, M.T.,Esty, A., Santiso-Mere, D., Danielian, P., Parker,M.G., Stein, R.B., Pike, J.W. и McDonnel, D.P.(1994). Трансактивационная способность рецептора эстрогена человека определяют как в клеточном контексте, так и в контексте промотора,и опосредуют с помощью двух функционально различных интрамолекулярных регионов (смотри Molecular Endocrinology, 8:21-30). Биологические исследования на утеротрофность/антиутеротрофность на крысах Эстрогенные и антиэстрогенные свойства соединений определяют в исследовании на утеротрофность у не достигших зрелости крыс (4 дня), (как описано ранее L.J.Black и R.L.Goode.Life Sciences, 26, 1453 (1980. Не достигшие зрелости крысы линии Sprague-Dawley (самки,возраст 18 дней) исследуют в группах по шесть животных. Животных лечат с помощью ежедневных внутри-брюшинных инъекций с 10 мкг соединения, 100 мкг соединения, (100 мкг соединения + 1 мкг 17-эстрадиола) для проверки антиэстрогенности, и 1 мкг 17-эстрадиола с 50% ДМСО/50% физиологического раствора в качестве носителя при инъекции. На 4 день животных умерщвляют путем удушения с помощью СО 2 и их матки удаляют и избавляют от избытка липидов, удаляют всю жидкость и определяют влажный вес. Небольшую часть одного из роговидных отростков подвергают гистологическому исследованию и остаток используют для извлечения общей РНК в порядке оценки комплиментарного компонента 3 экспрессии гена. Модели крыс через 3 дня после удаления яичников Соединение[4-(1-пиперидинил)этокси]фенилметанона является представителем класса соединений, известных как селективные модуляторы рецепторов 33 эстрогенов, обладающих воздействиями, подобными агонистам эстрогенов на костные ткани и грубые липиды, при этом проявляя антагонизм к эстрогенам в тканях матки и груди. Palkowitz etal. предлагают в J. Med. Chem 1997, 40, 1407,активные аналоги препарата Raloxifen, которые также могут быть получены с использованием соединений по настоящему изобретению. Например, описанное ими соединение 4 а, хлоргидрат [2-(4-гидроксифенил)-6-гидроксибензо[b]тиен-3-ил][4-(1-пиперидинил)этокси]фенилметана, может быть получено согласно общей схеме реакции, представленной ниже. Пример 16. Метиловый сложный эфир 2(4-метоксибензолсульфониламино) бензойной кислоты. К раствору 2,00 г (0,013 моль) метилантранилата, растворенного в 20 мл хлороформа, добавляют 3,2 мл (0,039 моль) пиридина, а затем 2,733 г (0,013 моль) п-метоксибензолсульфонилхлорида. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч и затем промывают 3 н. НСl и водой. Затем органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Полученный в результате белый твердый продукт промывают эфиром и сушат в вакууме с получением 3,7 г(87%) желаемого сульфонамида. CI Массспектрометрия: 322 (М+Н). Пример 17. Метиловый сложный эфир 2(4-метоксибензолсульфониламино)-3-метилбензойной кислоты.(0,038 моль) метил 3 метилантранилата получают 6,21 г (49%) желаемого сульфонамида в виде белого твердого продукта. Электроспрей масс-спектрометрия 336,2 (М+Н). Пример 18. 4-(2-Пиперидин-1-илэтокси) бензилхлорид. К перемешиваемому раствору 4-гидроксибензальдегида (12,2 мг, 0,1 моль) и К 2 СО 3 (25 мг, избыток) в N,N-диметилформамиде (250 мл) добавляют монохлоргидрат 1-(2-хлорэтил) пиперидина (20,0 мг, 1,08 моль). Реакционную смесь нагревают до 80 С в течение 24 ч и охлаждают до комнатной температуры. Реакционную смесь гасят водой, смешанной со льдом и 34 экстрагируют хлороформом. Органические слои промывают водой, сушат над безводным МgSO4, фильтруют и концентрируют в вакууме. Остаток растворяют в метаноле и при 0 С медленно добавляют боргидрид натрия (10 г, избыток). Реакционную смесь промывают при комнатной температуре в течение 2 ч и затем гасят с помощью воды. Спирт экстрагируют хлороформом, органические слои промывают хорошо водой, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Сырой спирт, полученный таким образом,растворяют в ТГФ (200 мл) и пропускают газообразный НСl в течение 30 мин при 0 С. К суспензии полученного таким образом хлоргидрата медленно добавляют тионилхлорид (30 мл, избыток). Реакционную смесь нагревают с обратным холодильником в течение тридцати минут и охлаждают до комнатной температуры. Затем реакционную смесь концентрируют досуха и растирают с безводным эфиром. Осажденный твердый продукт фильтруют и сушат в вакууме при комнатной температуре с получением 25 г(86%) продукта в виде белого твердого вещества, т.пл. 145-148 С. Электроспрей масс-спектрометрия: 256 (М+Н). Пример 19. 4-(2-N,N-Диэтилэтокси)бензилхлорид. К перемешиваемому раствору 4-гидрокси бензальдегида (12,2 г, 0,1 моль) и К 2 СО 3 (25 г,избыток) в N,N-диметилформамиде (250 мл) добавляют 2-диэтиламиноэтилхлорид монохлоргидрат (20,0 г, 1,2 моль). Реакционную смесь нагревают при 80 С в течение 24 ч и охлаждают до комнатной температуры. Реакционную смесь гасят водой, смешанной со льдом, и экстрагируют хлороформом. Органические слои промывают водой, сушат над безводнымMgSO4, фильтруют и концентрируют в вакууме. Остаток растворяют в метаноле и медленно добавляют боргидрид натрия (10 г, избыток) при 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч и затем гасят водой. Спирт экстрагируют хлороформом,тщательно промывают водой, сушат, фильтруют и концентрируют в вакууме. Сырой спирт, полученный таким образом,растворяют в ТГФ (200 мл) и пропускают газообразный НСl в течение 30 мин при 0 С. К суспензии полученного таким образом хлоргидрата медленно добавляют тионилхлорид (30 мл, избыток). Реакционную смесь нагревают с обратным холодильником в течение тридцати минут и охлаждают до комнатной температуры. Затем реакционную смесь концентрируют досуха и растирают с безводным эфиром. Осажденный твердый продукт фильтруют и сушат в вакууме при комнатной температуре с получением 18 г(65%) продукта в виде белого твердого вещест 35 ва, т.пл. 76-79 С. Электроспрей массспектрометрия: 244 (М+Н). Пример 20. N-Гидрокси-2-(4-метоксифенил)сульфонил]4-[2-(1-пиперидинил)этокси] фенил]метил]амино]-3-метилбензамид. К раствору 1,00 г (2,985 ммоль) метилового сложного эфира 2-(4-метоксибензолсульфониламино)-3-метилбензойной кислоты в 5 мл ДМФ добавляют 0,952 г (3,284 ммоль) 4-(2 пиперидин-1-илэтокси)бензилхлорида и 1,65 г(11,9 ммоль) карбоната калия. Затем реакционную смесь перемешивают при комнатной температуре в течение 18 ч, разбавляют водой и экстрагируют эфиром. Затем органические слои экстрагируют раствором 6 н. НСl, а затем водный кислотный слой подщелачивают раствором 6 н. NaOH, а затем экстрагируют эфиром. Полученный в результате эфирный слой сушат над сульфатом натрия, фильтруют и концентрируют в вакууме с получением 0,965 г пиперидинового сложного эфира в виде бесцветного масла. Электроспрей масс-спектрометрия: 553,5(М+Н)+. К раствору 0,889 г (1,611 ммоль) пиперидинового сложного эфира в 7 мл ТГФ добавляют 0,203 г гидроксида моногидрата лития. Полученную в результате смесь нагревают с обратным холодильником в течение 15 ч и затем концентрируют в вакууме до получения сухого остатка. Остаток разбавляют водой, нейтрализуют раствором 5% НСl и экстрагируют дихлорметаном. Органический слой сушат надNa2SO4, фильтруют и концентрируют в вакууме с получением 0,872 г карбоновой кислоты в виде белой пены. Электроспрей масс-спектрометрия: 539,2 (М+Н)+. К раствору 0,814 г (1,513 ммоль) карбоновой кислоты в 10 мл ДМФ добавляют 0,245 г(1,82 ммоль) НОВТ и 0,386 г (2,01 ммоль) EDC. Реакционную смесь затем перемешивают в течение 1 ч при комнатной температуре и добавляют 0,46 мл (7,57 ммоль) 50% раствора гидроксиламина в воде. Реакционную смесь перемешивают в течение ночи и затем концентрируют в вакууме до получения сухого остатка. Остаток разбавляют EtOAc, промывают водой и раствором бикарбонатом натрия, сушат над Nа 2SO4,фильтруют и концентрируют в вакууме до получения сухого остатка. Остаток растворяют в 5 мл дихлорметана и добавляют 0,69 мл 1 н. раствора НСl в эфире. Через 1 ч реакционную смесь разбавляют эфиром и полученный в результате твердое вещество фильтруют и сушат в вакууме с получением 0,179 г гидроксаматаминовой соли в виде белого твердого вещества. Электроспрей масс-спектрометрия: 554,5(М+Н)+. Пример 21. 2-4-(2-Диэтиламиноэтокси) бензил]-(4-метоксибензолсульфонил)амино]-Nгидрокси-3-метилбензамид. К раствору 1,0 г (2,653 ммоль) метилового сложного эфира 2-(4-метоксибензолсульфо 003937 36 ниламино)-3-метилбензойной кислоты в 10 мл ДМФ добавляют 0,811 г (2,918 ммоль) 4-(2-N,Nдиэтилэтокси)бензилхлорида и 1,5 г (10,9 ммоль) карбоната калия. Затем реакционную смесь перемешивают при комнатной температуре в течение 18 ч, разбавляют водой и экстрагируют эфиром. Затем органические слои экстрагируют раствором 6 н. НСl и водный кислотный слой затем подщелачивают раствором 6 н.NaOH, а затем экстрагируют эфиром. Полученный в результате эфирный слой сушат над сульфатом натрия, фильтруют и концентрируют в вакууме с получением 0,575 г (37%) N,Nдиэтиламинового сложного эфира в виде желтовато-коричневой пены. Электроспрей массспектрометрия: 583,1 (М+Н)+. К раствору 0,539 г (0,926 ммоль) N,Nдиэтиламинового сложного эфира в дихлорметане добавляют 2 мл трифторуксусной кислоты. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч и затем концентрируют в вакууме до остатка. Остаток растирают с эфиром и полученный в результате твердый продукт собирают фильтрованием и сушат в вакууме с получением 0,369 г карбоновой кислоты в виде белого твердого вещества. Электроспрей масс-спектрометрия: 525,2 (М-Н)-. К раствору 0,328 г (0,513 ммоль) карбоновой кислоты в 6,5 мл дихлорметана добавляют 0,12 мл ДМФ, а затем 0,77 мл 2,0 М оксалилхлорида в СН 2 Сl2, и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. В отдельную колбу при 0 С добавляют к смеси 0,47 мл (7,7 ммоль) 50% раствора гидроксиламина в воде 8 мл ТГФ и 1,7 мл воды. После этого смесь перемешивают в течение 15 мин при 0 С, добавляют к ней за один раз раствор хлорангидрида, и полученному раствору дают возможность нагреться до комнатной температуры при перемешивании в течение ночи. Затем реакционную смесь подкисляют до рН 3 с помощью 10% НСl и экстрагируют EtOAc. Объединенные органические слои сушат над Na2SO4,фильтруют и концентрируют в вакууме до получения сухого остатка. Остаток растирают с эфиром с получением 0,194 г гидроксаматаминной соли в виде белого твердого вещества. Электроспрей масс-спектрометрия: 542,3(М+Н)+. Пример 22. Этиловый сложный эфир 2-(4 метоксифенилсульфанил)пропионовой кислоты. К перемешиваемому раствору 4-метоксибензолтиола (2,5 г, 14 ммоль) и безводному К 2 СО 3 (4,0 г, избыток) в сухом ацетоне (100 мл) в круглодонной колбе добавляют этил 2 бромпропионат (3,0 г, 16 ммоль) и реакционную смесь нагревают с обратным холодильником в течение 8 ч при хорошем перемешивании. В 37 конце реакционной смеси дают возможность охладиться, фильтруют и реакционную смесь концентрируют до получения сухого остатка. Остаток экстрагируют хлороформом и промывают Н 2 О, и органический слой сушат над МgSO4, фильтруют и концентрируют с получением этилового сложного эфира 2-(4 метоксифенилсульфанил)пропионовой кислоты в виде светло-желтого масла. Выход 3,6 г (94%). Пример 23. Этиловый сложный эфир 2-(4 метоксибензолсульфонил)пропионовой кислоты. К перемешиваемому раствору 12,0 г (50 ммоль) этилового сложного эфира 2-(4-метоксифенилсульфанил)пропионовой кислоты в 300 мл метиленхлорида при 0 С медленно добавляют при скорости, позволяющей контролировать выделение тепла. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч и разбавляют 600 мл гексанов. Реакционную смесь фильтруют, и фильтрат перемешивают с 500 мл насыщенного раствора Nа 2SO3 в течение 3 ч. Органический слой упаривают, тщательно промывают водой, сушат и упаривают в вакууме с получением 12 г полутвердого вещества. Пример 24. Этиловый сложный эфир 2-(4 метоксибензолсульфонил)-2-метил-3-[4-(2 пиперидин-1-илэтокси)фенил]пропионовой кислоты. Перемешиваемую смесь 2,7 г (10 ммоль) этилового сложного эфира 2-(4-метоксибензолсульфонил)пропионовой кислоты, 3,03 г (10 ммоль) 4-(2-пиперидин-1-илэтокси)бензилхлорида, 10 г К 2 СО 3 и 500 мг 18-краун-6 в 250 мл ацетона нагревают с обратным холодильником в течение 16 ч. В конце реакционную смесь фильтруют и ацетоновый слой концентрируют до получения сухого остатка. Остаток экстрагируют хлороформом, тщательно промывают водой, сушат над безводным MgSO4, фильтруют и концентрируют до получения сухого остатка. Полученный остаток очищают с помощью колоночной хроматографии на селикагеле с элюированием смесью 50% этилацетат-гексан с получением 4,8 г (92%) желаемого продукта в виде масла. MS: 490(M+H)+. Пример 25. 2-(4-Метоксибензолсульфонил)-2-метил-3-[4-(2-пиперидинил-1-илэтокси)фенил]пропионовая кислота. 38 К перемешиваемому раствору этилового сложного эфира 2-(4-метоксибензолсульфонил)2-метил-З-[4-(2-пиперидин-1-илэтокси)фенил] пропионовой кислоты (4,9 г, 10 ммоль) в метиловом спирте добавляют 10 н. NaOH (20 мл, избыток). Реакционную смесь перемешивают при комнатной температуре в течение 48 ч. В конце реакционную смесь концентрируют и осторожно нейтрализуют разбавленной НСl. Полученный остаток экстрагируют хлороформом, тщательно промывают водой, сушат и концентрируют. Полученный продукт очищают с помощью колоночной хроматографии на селикагеле с элюированием смесью этилацетат:метанол(95:5) и с получением продукта данного примера в виде бесцветных кристаллов, т.пл. 106 С; Масс-спектрометрия: 462,5 (М+Н)+. Выход 4,1 г, 88-1. Пример 26. 2-(4-Метоксибензолсульфонил)-2-метил-3-[4-(2-пиперидин-1-илэтокси)фенил]пропионамид.(100 мл) при 0C добавляют по каплям оксалилхлорид (1,2 г, 10 ммоль). После добавления реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Одновременно с этим, в отдельной колбе смесь хлоргидрата гидроксиламина (3,4 г, 50 ммоль) и триэтиламина(10,1 г, 100 ммоль) перемешивают в смеси ТГФ:вода (5:1, 50 мл) при 0 С в течение 1 ч. В конце 1 ч оксалилхлоридную реакционную смесь концентрируют и бледно-желтый остаток растворяют в 10 мл CH2Cl2 и медленно добавляют к гидроксиламину при 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 24 ч и концентрируют. Полученный остаток экстрагируют хлороформом и тщательно промывают водой. Полученный продукт очищают с помощью колоночной хроматографии на селикагеле и элюируют этилацетатом. Продукт данного примера выделяют в виде бесцветного твердого вещества, т.пл. 98 С; Выход,48%; MS: 477 (М+Н)+; 1H ЯМР (300 МГц, СDСl3): 1,2 (с, 3H), 3,51,5 (м, 16 Н), 3,9 (с, 3H), 4,4 (м, 1 Н); 6,5-7,8 (м,8 Н); 10,8 (ушир.с, 1 Н). Соединения по настоящему изобретению исследуют на биологическую активность согласно следующим процедурам. Исследования in vitro с помощью желатиназы Исследование основывается на расщеплении тиопептидного субстрата Ас-Рrо-Leu 39Gly(2-меркапто-4-метилпентаноил)-Leu-GlyOEt), Bachem Bioscience) с помощью фермента желатиназы, высвобождая субстратный продукт, который взаимодействует колориметрически с ДТНБ (5,5'-дитио-бис(2-нитробензойная кислота. Активность фермента измеряют с использованием скорости увеличения интенсивности цвета. Свежий тиопептидный субстрат приготавливают в виде 20 мМ питательной среды для культуры в 100% ДМСО и ДТНБ растворяют в 100% ДМСО как 100 мМ питательную среду, и хранят в темноте при комнатной температуре. Как субстрат, так и ДТНБ разбавляют вместе перед использованием до 1 мМ субстратным буфером (50 мМ HEPES рН 7,5, 5 мМCaCl2). Питательную среду с желатиназой нейтрофилов В человека разбавляют буфером для анализа (50 мМ HEPES, рН 7,5, 5 мМ CaCl2,0,02% Brij) до конечной концентрации 0,15 нМ. Буфер для анализа, фермент, ДТНБ/субстрат(конечная концентрация 500 мкМ) и носитель или ингибитор добавляют на 96-луночный планшет (общий объем реакции 200 мкл), и увеличение интенсивности цвета отслеживают спектрофотометрически в течение 5 мин на длине волны 405 нм с помощью планшетного ридера. Строят график увеличения OD405 и вычисляют крутизну кривой, которая соответствует скорости реакции. Линейность скорости реакции подтверждается (r20,85). Среднее значение скорости для контроля (хsem) вычисляют и сравнивают для статистической значимости (р 0,05) со скоростями для образцов, обработанных лекарством, и используя тест многократных сравнений Даннета. Соотношения доза-отклик могут быть получены с использованием многократного введения лекарства, и значения IC50 с 95% CI устанавливают с использованием линейной регрессии (IPRED, НТВ). Ссылки: Weingarten, Н и Feder, J., Spectrophotometric assay for vertebrate collagenase. Anal.In vitro исследования с помощью коллагеназы Исследование основывается на расщеплении пептидного субстрата Dnp-Pro-Cha-GlyCys(Me)-His-Ala-Lys(NMa)-NH2), Peptide International, Inc.) с помощью коллагеназы, приводящем к высвобождению флуоресцентной группы NMa, которая количественно характеризуется на флуориметре. Dnp гасит флуоресценциюNMa в интактном субстрате. Исследование осуществляют в буфере для анализа НСВС (50 мМ HEPES, рН 7,0, 5 мМ Са+2, 0,02% Brij, 0,5% цистеин) с рекомбинантной коллагеназой фибробласта человека (процессированная, mw= 18,828, WAR, Radnor). Субстрат растворяют в метаноле и хранят замороженным в 1 мМ аликвотах. Коллагеназу хранят замороженной в буфере в 25 мкМ аликвотах. Для анализа субстрат растворяют в буфере НСВС до конечной концентрации 10 мкМ, а коллагеназу до конечной 40 концентрации 5 нМ. Соединения растворяют в метаноле, ДМСО или НСВС. Метанол и ДМСО разбавляют НСВС до 1,0%. Соединения добавляют на 96-луночный планшет, содержащий фермент, и реакция начинается при добавлении субстрата. Реакцию регистрируют (возбуждение 340 нм, эмиссия 444 нм) в течение 10 мин, и график увеличения флуоресценции со временем строится как прямая линия. Вычисляют крутизну линии, и она соответствует скорости реакции. Линейность скорости реакции подтверждается (r20,85). Среднее значение скорости для контроля (хsem) вычисляют и сравнивают для статистической значимости (р 0,05) со скоростями для образцов, обработанных лекарством,и используя тест многократных сравнений Даннета. Соотношения доза-отклик могут быть получены с использованием многократного введения лекарства, и значения IC50 с 95% CI устанавливают с использованием линейной регрессии (IPRED, НТВ). Ссылки: Bickett, D. M. et al., A highBiochem. 212,58-64 (1993). Процедура измерения ингибирования ТАСЕ Используя 96-луночные черные планшеты для микротитрования, в каждую лунку вводят раствор, состоящий из 10 мкл ТАСЕ (Immunex,конечная концентрация 1 мкг/мл), 70 мкл Трисбуфера, рН 7,4, содержащего 10% глицерина(конечная концентрация 10 мМ) и 10 мкл раствора исследуемого соединения в ДМСО (конечная концентрация 1 мкМ, концентрация ДМСО 1%), и инкубируют в течение 10 мин при комнатной температуре. Реакция начинается при добавлении флуоресцентного пептидильного субстрата (конечная концентрация 100 мкМ) в каждую лунку с последующим перемешиванием в шейкере в течение 5 с. Реакцию регистрируют (возбуждение 340 нм, эмиссия 420 нм) в течение 10 мин, и график увеличения флуоресценции со временем строят как прямую линию. Крутизну линии вычисляют, и она соответствует скорости реакции. Линейность скорости реакции подтверждается (r20,85). Среднее значение скорости для контроля (хsem) вычисляют и сравнивают для статистической значимости (р 0,05) со скоростями для образцов,обработанных лекарством, и используя тест многократных сравнений Даннета. Соотношения доза-отклик могут быть получены с использованием многократного введения лекарства, и значения IC50 с 95% CI устанавливают с использованием линейной регрессии. Результаты, полученные вследствие этих стандартных экспериментальных процедур исследования, представлены в следующей таблице. Процедуры измерения ингибирования ММП 1, ММП-9 и ММП-13 Эти исследования основываются на расщеплении тиопептидных субстратов, таких как Ас-Рrо-Leu-Gly(2-меркапто-4-метилпентаноил)Leu-Gly-OEt с помощью матричных металлопротеиназ ММП-1, ММП-13 (коллагеназы) или ММП-9 (желатиназа), в результате чего высвобождается субстратный продукт, который взаимодействует колориметрически с ДТНБ 5,5'дитиобис(2-нитробензойная кислота. Активность фермента измеряют с использованием скорости увеличения интенсивности цвета. Приготавливают свежий тиопептидный субстрат в виде 20 мМ питательной среды для культуры в 100% ДМСО, и ДТНБ растворяют в 100% ДМСО как 100 мМ питательную среду, и хранят в темноте при комнатной температуре. Как субстрат, так и ДТНБ перед использованием разбавляют вместе до 1 мМ субстратным буфером (50 мМ HEPES рН 7,5, 5 мМ CaCl2). Питательную среду с ферментом разбавляют буфером для анализа (50 мМ HEPES, рН 7,5, 5 мМ CaCl2, 0,02% Brij) до желаемой конечной концентрации. Буфер для анализа, фермент, носитель или ингибитор и ДТНБ/субстрат вводят в указанном порядке на 96-луночный планшет(общий объем реакции 200 мкл) и увеличение интенсивности цвета отслеживают спектрофотометрически в течение 5 мин на длине волны 405 нм с помощью планшетного ридера. Альтернативно, используют флуоресцентный пептидный субстрат. При этом анализе пептидный субстрат содержит флуоресцентную группу и гасящую группу. При расщеплении субстрата с помощью ММП флуоресценция,которая генерируется, количественно характеризуется с помощью флуоресцентного планшетного ридера. Исследование осуществляют в буфере для анализа НСВС (50 мМ HEPES, рН 7,0, 5 мМ Са+2, 0,02% Brij, 0,5% цистеин) с рекомбинантной коллагеназой человека ММР-1,ММР-9 или ММР-13. Субстрат растворяют в метаноле и хранят замороженным в 1 мМ аликвотах. Для анализа субстрат и ферменты разбавляют буфером НСВС до желаемых концентраций. Соединения вводят на 96-луночный планшет, содержащий фермент, и реакция начинается при добавлении субстрата. Реакцию регистрируют (возбуждение 340 нм, эмиссия 444 нм) в течение 10 мин и график увеличения флуоресценции со временем строят как прямую линию. Либо для исследований с тиопептидами,либо с флуоресцентными пептидами, вычисляют крутизну линии, и она соответствует скорости реакции. Линейность скорости реакции подтверждается (r20,85). Среднее значение скорости для контроля (хsem) вычисляют и сравнивают для статистической значимости (р 0,05) со скоростями для образцов, обработанных лекар 003937 42 ством, и используя тест многократных сравнений Даннета. Соотношения доза-отклик могут быть получены с использованием многократного введения лекарства, и значения IC50 с 95% CI устанавливаются с использованием линейной регрессии. Ингибирование ММП in vivo 2 см кусок диализной трубки (предел молекулярной массы 12-14000, ширина в плоском состоянии 10 мм), содержащей фермент матричной металлопротеиназы (стромелизин, коллагеназа или желатиназа в 0,5 мл буфера), имплантируют либо внутрибрюшинно, либо подкожно (на спине) крысе (Sprague-Dawley, 150200 г) или мыши (CD-1, 25-50 г) под анестезией. Лекарства вводят перорально, внутрибрюшинно, подкожно или внутривенно через канюлю в яремной вене. Лекарства водят при объеме дозы от 0,1 до 0,25 мл/животное. Содержимое диализных трубок собирают и исследуют активность фермента. Вычисляют скорости ферментативной реакции для каждой диализной трубки. Трубки от не менее чем 3 различных животных используют для вычисления среднего значениясреднеквадратичный разброс (sem). Статическую значимость (р 0,05) значений для животных, которых лечили носителем, по отношению к животным, которых лечили лекарством, определяют путем анализа разброса (Agents и Actions 21: 331, 1987). Процедура измерения ингибирования ТАСЕ Используя 96-луночные черные планшеты для микротитрования, в каждую лунку вводят раствор, состоящий из 10 мкл ТАСЕ (Immunex,конечная концентрация 1 мкг/мл), 70 мкл Трис буфера, рН 7,4, содержащего 10% глицерина(конечная концентрация 10 мМ) и 10 мкл раствора исследуемого соединения в ДМСО (конечная концентрация 1 мкМ, концентрация ДМСО 1%) и инкубируют в течение 10 мин при комнатной температуре. Реакция начинается при добавлении флуоресцентного пептидильного субстрата (конечная концентрация 100 мкМ) в каждую лунку с последующим перемешиванием в шейкере в течение 5 с. Реакцию регистрируют (возбуждение 340 нм, эмиссия 420 нм) в течение 10 мин, и график увеличения флуоресценции со временем строят как прямую линию. Крутизну линии вычисляют,и она соответствует скорости реакции. Линейность скорости реакции подтверждается (r20,85). Среднее значение скорости для контроля (хsem) вычисляют и сравнивают для статистической значимости (р 0,05) со скоростями для образцов, обработанных лекарством, и используя тест многократных сравнений Даннета. Соотношения доза-отклик могут быть получены с использованием многократного введения лекарства, и значения IC50 с 95% CI устанавливаются с использованием линейной регрессии. 43 Результаты упомянутых выше фармакологических исследований ингибирования матричной металлопротеиназы и ингибирования ТАСЕin-vitro и in-vivo представлены ниже в табл. 1. Таблица 1. Ингибирование ММП и ТАСЕ In-vivo Пример ММП-11 ММП-91 ММП-131 ММР 2 ТАСЕ 1 20 176 6,9 56 277 21 96 2,3 8,8 215 1. IC50 нМ или % ингибирования при концентрации 1 мкМ; 2. % ингибирования в зависимости от ММП-9 (доза,мг/кг), ip = внутрибрюшинно, ро = перорально. 44 соединения формулы (I), в котором Х представляет отщепляемую группу, определенную в п.1,и, при необходимости, окисляют полученное соединение формулы I, в случае, если А представляет S, до соответствующего соединения формулы I, в котором А представляет -SO- или-SO2-; и необязательно превращают любое полученное соединение формулы (I) в его фармацевтически приемлемую соль. 6. Способ получения соединения по п.1,где А представляет -О-, включающий стадии: а) алкилирования гидроксибензальдегида формулыb) шестичленного насыщенного или частично ненасыщенного гетероцикла, включающего вплоть до двух гетероатомов азота;c) семичленного насыщенного или частично ненасыщенного гетероцикла, включающего вплоть до двух гетероатомов азота, и их фармацевтически приемлемые соли. 2. Соединение по п.1, представляющее собой хлоргидрат (4-хлорметилфенокси)этилпиперидин-1-ила. 3. Соединение по п.1, представляющее собой хлоргидрат (4-хлорметилфенокси)этилгексаметиленимин-1-ила. 4. Соединение по п.1, представляющее собой(4-хлорметилфенокси)этилдиметиламинхлоргидрат. 5. Способ получения соединения формулы(I) по любому из пп.1-4 или его фармацевтически приемлемой соли реакцией спирта формулыb) восстановления альдегида, полученного на стадии а) с получением спирта формулы с) превращения спирта со стадии b) в его хлоргидратную соль, иd) превращения спирта в соединении из стадии с) в отщепляемую группу. 7. Способ получения соединения по п.1,где А представляет S, осуществлением следующих стадий: а) алкилирования соединения следующей формулы где Y, R1 и R2 и m являются такими, как определено в п.1, галоген может быть Cl, F, Вr или I, с получением альдегида формулыc) обработки спирта со стадии b) газообразным НСl с получением его хлоргидрата; иd) превращения хлоргидрата спирта, полученного на стадии c), в отщепляемую группу. 8. Способ по п.7, дополнительно включающий стадию контролируемого окисления серы в хлоргидрате спирта со стадии d) до сульфоксида или до сульфона. 9. Способ по любому из пп.5-8, где спирт превращают в отщепляемую группу обработкой метансульфонилхлоридом, толуолсульфонилхлоридом или трифторуксусным ангидридом в присутствии пиридина или триэтиламина. 10. Способ по любому из пп.5-9, где галоген является Сl, и m равно 1. 11. Способ получения соединений формулыb) шести- или семичленное ненасыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее один или два атома азота,причем гетероциклическое кольцо, связано с этоксимостиком у атома азота кольца, и необязательно замещено от 1 до 3 группами, выбранными из C1-C6 алкила, C1-C6 алкокси, C1-С 6 тиоалкила, -СF3 или -NO2,включающий взаимодействие в щелочной среде 4-гидроксибензилового спирта с солью соединения формулы где Y является таким, как определено выше. 12. Способ по п.11, где щелочную среду поддерживают при рН равном 9 или более. 13. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как описано в любом из пп.1-4, и фармацевтически приемлемый носитель.
МПК / Метки
МПК: A61K 31/445, C07C 217/48, C07D 295/08
Метки: арилоксиалкилдиалкиламины, новые
Код ссылки
<a href="https://eas.patents.su/24-3937-novye-ariloksialkildialkilaminy.html" rel="bookmark" title="База патентов Евразийского Союза">Новые арилоксиалкилдиалкиламины</a>
Предыдущий патент: Препараты эстрамустинфосфата и сульфоалкиловых эфиров циклодекстринов для парентерального применения
Следующий патент: Способ получения гидразингидрата
Случайный патент: Лиганды, включая антитела, проявляющие реактивность в отношении эндокринных клеток












