Способы лечения рака и других заболеваний или патологических состояний с применением клевудина (lfmau) и телбивудина (ldt)
Формула / Реферат
1. Применение по меньшей мере одного соединения общей структурной формулы
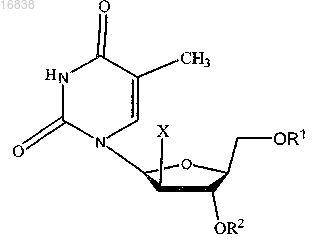
где X обозначает Н или F;
R1 и R2 независимо обозначают Н, С2-С21 ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу;
или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения у пациента рака, являющегося раком желудка, толстой кишки, прямой кишки, поджелудочной железы, легких, молочных желез, шейки матки, тела матки, яичников, простаты, яичек, мочевого пузыря, почек, мозга/центральной нервной системы, головы и шеи, горла, лимфогранулематозом, некоджкинской лимфомой, множественной миеломой, лейкемией, меланомой, саркомой Юинга, мелкоклеточным раком легкого, хориокарциномой, рабдомиосаркомой, аденомиоцистосаркомой, нейробластомой, лейкозом ворсистых клеток, раком ротовой полости/глотки, носоглотки, пищевода, гортани, почек и лимфомой.
2. Применение по п.1, в котором пациентом является человек и R1 и R2 независимо обозначают Н, С2-С18 ацильную или фосфатную группу.
3. Применение по п.2, в котором X обозначает F.
4. Применение по любому из пп.1-3, в котором указанное раковое заболевание является опухолью.
5. Применение по п.4, в котором раковое заболевание выбрано из группы, включающей рак толстой кишки, прямой кишки, поджелудочной железы и меланому.
6. Применение по любому из пп.1-3, в котором раковым заболеванием является рак поджелудочной железы или лейкемия.
7. Применение по п.4, в котором раковым заболеванием является рак поджелудочной железы.
8. Применение по п.4, в котором раковым заболеванием является рак толстой кишки.
9. Применение по п.4, в котором раковым заболеванием является рак мочевого пузыря.
10. Применение по п.4, в котором раковым заболеванием является рак простаты.
11. Применение по п.4, в котором раковым заболеванием является рак молочной железы.
12. Применение по п.4, в котором раковым заболеванием является рак легких.
13. Применение по п.4, в котором раковым заболеванием является рак носоглотки.
14. Применение по п.4, в котором раковым заболеванием является рак яичников.
15. Применение по п.4, в котором раковым заболеванием является лимфома.
16. Применение по п.4, в котором раковым заболеванием является меланома.
17. Применение эффективного количества по меньшей мере двух соединений при изготовлении лекарственного препарата для лечения рака, причем первое соединение выбирают из соединений общей структурной формулы
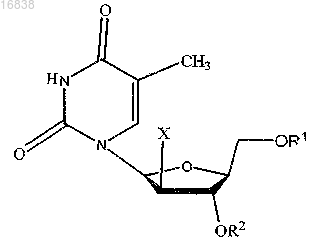
где X обозначает Н или F;
R1 и R2 независимо обозначают Н, С2-С21 ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу;
или их фармацевтически приемлемых солей и второго соединения, представляющего собой дополнительное противораковое вещество, в котором раковым заболеванием является рак желудка, толстой кишки, прямой кишки, поджелудочной железы, легких, молочных желез, шейки матки, тела матки, яичников, простаты, яичек, мочевого пузыря, почек, мозга/центральной нервной системы, головы и шеи, горла, лимфогранулематоз, некоджкинская лимфома, множественная миелома, лейкемия, меланома, саркома Юинга, мелкоклеточный рак легкого, хориокарцинома, рабдомиосаркома, аденомиоцистосаркома, нейробластома, лейкоз ворсистых клеток, рак ротовой полости/глотки, пищевода, гортани, почек или лимфома.
18. Применение по п.17, в котором пациентом является человек и R1 и R2 независимо обозначают Н или С2-С18-ацильную группу.
19. Применение по п.17, в котором пациентом является человек и R1 и R2 обозначают Н.
20. Применение по п.17, в котором указанное дополнительное противораковое вещество является антиметаболитом, ингибитором топоизомеразы I и II, алкилирующим веществом и микроканальным ингибитором.
21. Применение по п.20, в котором указанное дополнительное противораковое соединение выбрано из группы, включающей алдеслейкин; алемтузумаб; алитретионин; аллопуринол; алтретамин; амифостин; анастрозол; мышьяковистый ангидрид; аспарагиназу; BCG Live; бексаротен; блеомицин; бусульфан; калустерон; капецитабин; карбоплатин; кармустин; полифепрозан 20 с кармустином; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтинальфа; даунорубицин, дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; липосомный доксорубицин; дромостанолон пропионат; эпирубицин; эстрамустин эпоэтин альфа; этопозид фосфат; этопозид (VP-16); экземестан; филграстим; флоксуридин; флударабин; фторурацил (5-FU); фульвестрант; гемцитабин, гемтузумаб озогамицин; гливек; гозерелин ацетат; гидроксимочевину; ибритумомаб тиуксетан; идарубицин; ифосфамид; иматиниб мезилат; интерферон альфа-2а; интерферон альфа-2b; иринотекан; летрозол; лейковорин; ломустин (CCNU); меклоретамин (азотистый иприт); мегестрол ацетат; мелфалан (L-PAM); меркаптопурин (6-МР); месну; метотрексат: метоксален; митомицин С; митотан; митоксантрон; нандролон фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим, пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказа; ритуксимаб; сарграмостим; стрептозоцин; сурафениб; тальк; тамоксифен; тарцеву; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG); тиотепу; топотекан; торемифен; тозитумомаб; трастузумаб; третиноин (ATRA); урациловый иприт; валрубицин; валторцитабин (монозиготный LDC); винбластин; винорелбин; золедронат и их смеси.
22. Применение по п.21, в котором дополнительное противораковое соединение выбрано из группы, включающей алдеслейкин; алемтузумаб; алитретионин; аллопуринол; алтретамин; амифостин; анастрозол; мышьяковистый ангидрид; аспарагиназу; BCG Live; бексаротен; блеомицин; бусульфан; калустерон; капецитабин; карбоплатин; кармустин; полифепрозан 20 с кармустином; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтинальфа; даунорубицин, дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; дромостанолон пропионат; эпирубицин; эстрамустин эпоэтин альфа; этопозид фосфат; этопозид (VP-16); экземестан; филграстим; флоксуридин; флударабин; фторурацил (5-FU); фульвестрант; гемцитабин, гемтузумаб озогамицин; гливек; гозерелин ацетат; гидроксимочевину; ибритумомаб тиуксетан; идарубицин; ифосфамид; иматиниб мезилат; интерферон альфа-2а; интерферон альфа-2b; иринотекан; летрозол; лейковорин; ломустин (CCNU); меклоретамин (азотистый иприт); мегестрол ацетат; мелфалан (L-PAM); меркаптопурин (6-МР); месну; метотрексат; метоксален; митомицин С; митотан; митоксантрон; нандролон фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим; пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказу; ритуксимаб; сарграмостим; стрептозоцин; сурафениб; тальк; тамоксифен; тарцеву; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG), тиотепу; топотекан; торемифен; тозитумомаб; трастузумаб; третиноин (ATRA); урациловый иприт; валрубицин; валторцитабин (монозиготный LDC), винбластин; винорелбин; золедронат и их смеси.
23. Применение по п.22, в котором дополнительное противораковое соединение выбрано из группы, включающей алдеслейкин; алемтузумаб; алитретионин; аллопуринол; алтретамин; амифостин; анастрозол; мышьяковистый ангидрид; аспарагиназу; BCG Live; бексаротен; блеомицин; бусульфан; калустерон; капецитабин; карбоплатин; кармустин; полифепрозан 20 с кармустином; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтинальфа; даунорубицин, дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; дромостанолон пропионат; эпирубицин; эстрамустин эпоэтин альфа; этопозид фосфат; этопозид (VP-16); экземестан; филграстим; флоксуридин; флударабин; фторурацил (5-FU); фульвестрант; гемцитабин, гемтузумаб озогамицин; гливек; гозерелин ацетат; гидроксимочевину; ибритумомаб тиуксетан; идарубицин; ифосфамид; иматиниб мезилат; интерферон альфа-2а; интерферон альфа-2b; иринотекан; летрозол; лейковорин; ломустин (CCNU); меклоретамин (азотистый иприт); мегестрол ацетат; мелфалан (L-PAM); меркаптопурин (6-МР); месну; метотрексат; метоксален; митомицин С; митотан; митоксантрон; нандролон фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим; пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказу; ритуксимаб; сарграмостим; стрептозоцин; сурафениб; тальк; тамоксифен; тарцеву; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG); тиотепу; топотекан; торемифен; тозитумомаб; трастузумаб; третиноин (ATRA); урациловый иприт; валрубицин; валторцитабин (монозиготный LDC); винбластин; винорелбин; золедронат и их смеси.
24. Применение по п.17, в котором X обозначает F.
25. Применение по п.18, в котором X обозначает F.
26. Применение по п.19, в котором X обозначает F.
27. Применение по п.20, в котором X обозначает F.
28. Применение по п.17, в котором раковое заболевание является раковой опухолью.
29. Применение по п.17, в котором раковое заболевание выбрано из группы, включающей рак толстой кишки, прямой кишки, поджелудочной железы и меланому.
30. Применение по п.17, в котором раковое заболевание является раком толстой кишки.
31. Применение по п.17, в котором раковое заболевание является раком мочевого пузыря.
32. Применение по п.17, в котором раковое заболевание является раком простаты.
33. Применение по п.17, в котором раковое заболевание является раком молочной железы.
34. Применение по п.17, в котором раковое заболевание является раком поджелудочной железы.
35. Применение по п.17, в котором раковое заболевание является лейкемией.
36. Применение по п.17, в котором раковое заболевание является раком легких.
37. Применение по п.17, в котором раковое заболевание является раком носоглотки.
38. Применение по п.17, в котором раковое заболевание является раком яичников.
39. Применение по п.17, в котором раковое заболевание является лимфомой.
40. Применение по п.17, в котором раковое заболевание является меланомой.
41. Применение по п.17, в котором указанное дополнительное противораковое вещество является фторурацилом, оксалиплатином, гемцитабином или их смесями.
Текст
СПОСОБЫ ЛЕЧЕНИЯ РАКА И ДРУГИХ ЗАБОЛЕВАНИЙ ИЛИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ С ПРИМЕНЕНИЕМ КЛЕВУДИНА (LFMAU) И ТЕЛБИВУДИНА (LDT) Настоящее изобретение относится к применению по меньшей мере одного соединения общей структурной формулы где X обозначает Н или F; R1 и R2 независимо обозначают Н, С 2-С 21 ацильную группу, фосфатную,дифосфатную, трифосфатную или фосфодиэфирную группу, или его фармацевтически приемлемой соли. Соединение применяется для изготовлении лекарственного препарата для лечения у пациента рака, являющегося раком желудка, толстой кишки, прямой кишки, поджелудочной железы, легких,молочных желез, шейки матки, тела матки, яичников, простаты, яичек, мочевого пузыря, почек,мозга/центральной нервной системы, головы и шеи, горла, лимфогранулематозом, некоджкинской лимфомой, множественной миеломой, лейкемией, меланомой, саркомой Юинга, мелкоклеточным раком легкого, хориокарциномой, рабдомиосаркомой, аденомиоцистосаркомой, нейробластомой,лейкозом ворсистых клеток, раком ротовой полости/глотки, носоглотки, пищевода, гортани, почек и лимфомой. 016838 Область техники, к которой относится изобретение Настоящее изобретение относится к применению 2'-фтор-5-метилL-арабинофураносилуридина(LFMAU, или клевудина), либо его аналога, -L-2'-дезоксирибофуранозилтимидина (L-дезокситимидина,LDT, L-dT или телбивудина), либо конъюгатов, содержащих указанные вещества в отдельности или в сочетании с другими активными веществами или пролекарствами при лечении опухолей, включая рак,гиперпролиферативные заболевания, хронические воспалительные заболевания и определенные вирусные и иные микробные инфекции в отдельности или в сочетании с другим веществом. Родственные заявки По настоящей заявке испрашивается приоритет на основании предварительной заявки СШАUS 60/688159, поданной 7 июня 2005 г., и предварительной заявки СШАUS 60/741728, поданной 2 декабря 2005 г., при этом обе заявки инкорпорированы в данном документе путем отсылки во всей своей полноте. Предпосылки к созданию изобретения Опухоль представляет собой нерегулируемую и неорганизованную пролиферацию клеточного роста. Опухоль является злокачественной, или раковой, если она обладает свойствами инвазивности и метастазирования. Инвазивность относится к тенденции опухоли проникать в окружающую ткань, проходя через базальные пластинки, определяющие границы тканей, в результате чего они нередко проникают в сердечно-сосудистую систему организма. Метастазирование относится к тенденции опухоли распространяться в другие участки организма и создавать участки пролиферации на расстоянии от места начального появления. В настоящее время в Соединенных Штатах рак является вторым по распространенности заболеванием, приводящим к смерти. В Соединенных Штатах у 8000000 человек был диагностирован рак, при этом ожидается, что вновь диагностированный рак будет обнаружен у 1208000 человек в 1994. В этой стране ежегодно умирают от рака свыше 500000. Механизм заболевания раком еще не полностью понятен на молекулярном уровне. Известно, что воздействие на клетку канцерогена, такого как определенные вирусы, определенные химические вещества или радиоактивное облучение, приводит к изменению ДНК, инактивирующему "супрессивный" ген или активирующему "онкоген". Супрессивные гены являются генами-регуляторами роста, которые в результате мутации не в состоянии обеспечивать дальнейший контроль за клеточным ростом. Онкогены первоначально являются нормальными генами (называемыми проонкогенами), которые в результате мутации или измененного контекста экспрессии становятся трансформирующими генами. Продукты трансформирующих генов вызывают несоответствующий клеточный рост. В результате генетических изменений более двадцати нормальных клеточных генов могут стать онкогенами. Трансформированные клетки во многом отличаются от нормальных клеток, включая клеточную морфологию, межклеточные взаимодействие, содержание мембран, цитоскелетную структуру, секрецию белков, экспрессию генов и гибель клеток (трансформированные клетки могут расти бесконечно). Все из различных типов клеток организма могут быть трансформированы в клетки доброкачественных и злокачественных опухолей. Опухоли наиболее часто возникают в легких, далее в прямой кишке,молочных железах, простате, мочевом пузыре, поджелудочной железе и в яичниках. К другим основным типам рака относятся лейкемия, рак центральной нервной системы, включая рак мозга, меланому, лимфому, эритролейкемию, рак матки, рак головы и шеи. В настоящее время рак в основном лечат с применением одного или при сочетании трех типов методов лечения: хирургическое вмешательство, лучевая терапия и химиотерапия. Хирургическое вмешательство предусматривает удаление большого объема пораженной раком ткани. Несмотря на то что хирургическое вмешательство в некоторых случаях является эффективным при удалении опухолей в определенных частях организма, например в молочной железе, прямой кишке и на коже, оно не может быть использовано при лечении опухолей, расположенных в других участках организма, таких как позвоночник, а также при лечении диссеминированных неопластических состояний, таких как лейкемия. Химиотерапия предусматривает нарушение клеточной репликации, или клеточного метаболизма. Данный метод используют наиболее часто при лечении лейкемии, а также рака груди, легких и яичек. Существует пять основных классов химиотерапевтических веществ, используемых для лечения рака: природные продукты и их производные; антрациклины, алкилирующие вещества; антипролиферативы (также называемые антиметаболитами) и гормональные вещества. Химиотерапевтические вещества нередко называют антинеопластическими веществами. Считается, что алкилирующие вещества воздействуют путем алкилирования и сшивания гуанина и,возможно, иных оснований в ДНК, прекращая клеточное деление. Стандартные алкилирующие вещества включают азотистый иприт, соединения этиленимина, алкилсульфаты, цисплатин и различные нитрозомочевины. Недостаток указанных соединений заключается в том, что они не только атакуют злокачественные клетки, но также другие клетки, являющиеся естественно делящимися клетками, такими как клетки костного мозга, кожного покрова, желудочно-кишечной слизистой оболочки и ткани плода. Антиметаболиты обычно являются обратимыми или необратимыми ферментными ингибиторами,-1 016838 или соединениями, которые противодействуют репликации, трансляции или транскрипции нуклеиновых кислот. Было определено несколько синтетических нуклеозидов, проявляющих противораковую активность. Хорошо известным нуклеозидным производным, обладающим высокой противораковой активностью, является 5-фторурацил. 5-Фторурацил клинически использовали при лечении злокачественных опухолей, включая, например, карциномы, саркомы, рак кожи, рак пищеварительных органов и рак груди. Тем не менее, 5-фторурацил вызывает серьезные негативные реакции, такие как рвота, алопеция, диарея, стоматит, лейкоцитная тромбоцитопения, анорексия, пигментация и эдема. Описание производных фторурацила с противораковой активностью было приведено в патенте U.S. Pat. No. 4336381 и в публикации патента Японии Nos. 50-50383, 50-50384, 50-64281, 51-146482 и 53-84981. В патенте U.S. Pat. No. 4000137 раскрывается, что продукт перекисного окисления инозина, аденозин или цитидин, с метанолом или этанолом обладает активностью против лимфолейкоза. Цитозин-арабинозид (также называемый цитарабин, Ара-С и цитозар) является нуклеозидным аналогом дезоксицитидина, который впервые был синтезирован в 1950 г. и внедрен в клиническую медицину в 1963 г. В настоящее время он является важным лекарственным препаратом для лечения острой миеломной лейкемии. Он также является активным против острого лимфолейкоза и в меньшей степени он эффективен при лечении хронического миелолейкоза и некоджкинской лимфомы. Первичное действие Ара-С заключается в ингибировании синтеза нуклеарной ДНК, Handschumacher, R. and Cheng, Y., "Purineand Febigol, publishers. 5-Азацитидин является аналогом цитидина, используемым, в первую очередь, при лечении острого миелолейкоза и миелодиспластического синдрома. 2-Фтораденозин-5'-фосфат (флудара, которую также называют F-araA) является одним из наиболее активных веществ при лечении хронического лимфолейкоза. Соединение действует путем ингибирования синтеза ДНК. Лечение клеток с применением фара-А связано с накоплением клеток на границе фазG1/S и в S-фазе; таким образом, оно является S-фазоспецифическим лекарственным препаратом клеточного цикла. Включение активного метаболита в F-araATP замедляет удлинение цепи DNA. F-araA также является мощным ингибитором рибонуклеотидной редуктазы - основного фермента, ответственного за формирование dATP. 2-Хлордезоксиаденозин является эффективным при лечении высокодифференцированных Вклеточных неоплазм, таких как хронический лимфолейкоз, некоджкинская лимфома и лейкоз ворсистых клеток. Спектр воздействия аналогичен спектру флудара. Соединение ингибирует синтез ДНК в растущих клетках и ингибирует репарацию ДНК в дремлющих клетках. Несмотря на то что был определен ряд химиотерапевтических веществ, которые в настоящее время используются для лечения рака, ведется поиск новых веществ, которые явились бы эффективными и которые характеризовались бы низкой токсичностью по отношению к здоровым клеткам. В патентах США U.S. Pat. Nos. 5817667 и 6063787 раскрывается применение -LOddC для лечения опухолей, включая рак, или для лечения псориаза и относящихся к ним гиперпролиферативных заболеваний/состояний. Патенты США U.S.5558736; 5565438; 5587362 и 5567688 относятся к применению LFMAU и некоторых их производных в качестве противовирусных веществ при лечении заболеваний, вызванных вирусом гепатита В и вирусом Эпштейна-Барра, патент США U.S. pat. no. 6894159 относится к альтернативному синтезу LFMAU. Цели изобретения Таким образом, целью настоящего изобретения является создание соединений и лекарственных препаратов, проявляющих противоопухолевую и, в частности, противораковую и/или противогиперпролиферативную активность при заболеваниях, связанных с клеточным ростом. Другой целью настоящего изобретения является создание лекарственных препаратов для лечения рака и заболеваний, связанных с гиперпролиферативным клеточным ростом. Дополнительной целью настоящего изобретения является создание способа лечения рака и заболеваний, связанных с гиперпролиферативным клеточным ростом. Любая одна или несколько из указанных и/или иных целей настоящего изобретения могут быть очевидны из приведенного ниже описания изобретения. Краткое описание существа изобретения Настоящее изобретение относится к применению по меньшей мере одного соединения общей структурной формулыR1 и R2 независимо обозначают Н, С 2-С 21 ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу; или его фармацевтически приемлемой соли. Соединение применяется для изготовления лекарственного препарата для лечения у пациента рака,являющегося раком желудка, толстой кишки, прямой кишки, поджелудочной железы, легких, молочных желез, шейки матки, тела матки, яичников, простаты, яичек, мочевого пузыря, почек, мозга/центральной нервной системы, головы и шеи, горла, лимфогранулематозом, некоджкинской лимфомой, множественной миеломой, лейкемией, меланомой, саркомой Юинга, мелкоклеточным раком легкого, хориокарциномой, рабдомиосаркомой, аденомиоцистосаркомой, нейробластомой, лейкозом ворсистых клеток, раком ротовой полости/глотки, носоглотки, пищевода, гортани, почек и лимфомой. Предпочтительно пациентом является человек. R1 и R2 независимо обозначают Н, С 2-С 18 ацильную или фосфатную группу. Также предпочтительно X обозначает F. Предпочтительно указанное раковое заболевание является опухолью. Наиболее предпочтительно раковое заболевание выбрано из группы, включающей рак толстой кишки, прямой кишки, поджелудочной железы и меланому. Также предпочтительно, что раковым заболеванием является рак поджелудочной железы или лейкемия, рак толстой кишки, рак мочевого пузыря, рак простаты, рак молочной железы, рак легких, рак носоглотки, рак яичников, лимфома или меланома. Другим объектом изобретения является применение эффективного количества по меньшей мере двух соединений при изготовлении лекарственного препарата для лечения рака, причем первое соединение выбирают из соединений общей структурной формулыR1 и R2 независимо обозначают Н, С 2-С 21 ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу; или их фармацевтически приемлемых солей. Второе соединение представляет собой дополнительное противораковое вещество, в котором раковым заболеванием является рак желудка, толстой кишки, прямой кишки, поджелудочной железы, легких,молочных желез, шейки матки, тела матки, яичников, простаты, яичек, мочевого пузыря, почек, мозга/центральной нервной системы, головы и шеи, горла, лимфогранулематоз, некоджкинская лимфома,множественная миелома, лейкемия, меланома, саркома Юинга, мелкоклеточный рак легкого, хориокарцинома, рабдомиосаркома, аденомиоцистосаркома, нейробластома, лейкоз ворсистых клеток, рак ротовой полости/глотки, пищевода, гортани, почек или лимфома. Предпочтительно пациентом является человек. R1 и R2 независимо обозначают Н или С 2-С 18 ацильную группу. В одном усовершенствовании указанное дополнительное противораковое вещество является антиметаболитом, ингибитором топоизомеразы I и II, алкилирующим веществом и микроканальным ингибитором. В другом усовершенствовании дополнительное противораковое соединение выбрано из группы,включающей алдеслейкин; алемтузумаб; алитретионин; аллопуринол; алтретамин; амифостин; анастрозол; мышьяковистый ангидрид; аспарагиназу; BCG Live; бексаротен; блеомицин; бусульфан; калустерон; капецитабин; карбоплатин; кармустин; полифепрозан 20 с кармустином; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтин альфа; даунорубицин, дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; липосомный доксорубицин; дромостанолон пропионат; эпирубицин; эстрамустин эпоэтин альфа; этопозид фосфат; этопозид (VP-16); экземестан; филграстим; флоксуридин; флударабин; фторурацил (5FU); фульвестрант; гемцитабин, гемтузумаб озогамицин; гливек; гозерелин ацетат, гидроксимочевину;-3 016838 ибритумомаб тиуксетан; идарубицин; ифосфамид; иматиниб мезилат; интерферон альфа-2 а; интерферон альфа-2b; иринотекан; летрозол; лейковорин; ломустин (CCNU); меклоретамин (азотистый иприт); мегестрол ацетат; мелфалан (L-PAM); меркаптопурин (6-МР); месну; метотрексат; метоксален; митомицин С; митотан; митоксантрон; нандролон фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим; пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказа; ритуксимаб; сарграмостим; стрептозоцин; сурафениб; тальк; тамоксифен; тарцеву; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG); тиотепу; топотекан; торемифен; тозитумомаб; трастузумаб; третиноин (ATRA); урациловый иприт; валрубицин; валторцитабин (монозиготный LDC); винбластин; винорелбин; золедронат и их смеси. В еще одном усовершенствовании X обозначает F. В еще одном усовершенствовании указанное дополнительное противораковое вещество является фторурацилом, оксалиплатином, гемцитабином или их смесями. Предпочтительно раковое заболевание является раковой опухолью. Также предпочтительно раковое заболевание выбрано из группы, включающей рак толстой кишки,прямой кишки, поджелудочной железы и меланому. Наиболее предпочтительно раковое заболевание является раком толстой кишки, раком мочевого пузыря, раком простаты, раком молочной железы, раком поджелудочной железы, лейкемией, раком легких, раком носоглотки, раком яичников, лимфомой или меланомой. Лекарственные препараты, содержащие противораковое эффективное количество одного или нескольких соединений по формуле, выборочно (и предпочтительно) в сочетании с эффективным количеством как минимум одного дополнительного противоракового вещества в соответствии с описанием в настоящем патенте и как минимум одного носителя, добавки или наполнителя, являются дополнительными особенностями настоящего изобретения. Дополнительные особенности настоящего изобретения относятся к способам лечения гиперпролиферативных заболеваний, включающих опухоли, в частности злокачественные опухоли и рак. Указанная(-ые) особенность(-ти) настоящего изобретения направлена на создание способа(-ов) лечения опухолей, рака и гиперпролиферативных заболеваний, включающих псориаз, остроконечные кондиломы (папилломы), гиперпролиферативный рост клеток, такой как аномальная пролиферация клеток или рост нетрансформированных клеток, включающих предраковые клетки и иную клетку, экспрессирующую аномальный или чужеродный белок клеточной поверхности или антиген. Способы лечения хронических воспалительных заболеваний и вирусных, и иных микробных инфекций в отдельности или в сочетании с другим веществом являются дополнительными особенностями настоящего изобретения. Особенность способа предусматривает лечение гиперпролиферативных заболеваний, включающих псориаз, остроконечные кондиломы, и заболеваний пролиферативного роста клеток, включающих гиперпролиферативные кератиноцитные заболевания, такие как гиперкератоз, ихтиоз, кератодермия или красный плоский лишай, и хронических воспалительных заболеваний, таких как артрит, включая ревматоидный артрит и остеоартрит, а также инфекций, вызванных вирусом гепатита С, при этом способы включают введение пациенту, нуждающемуся в лечении, эффективного количества соединения в соответствии с настоящим изобретением выборочно в сочетании как минимум с одним дополнительным противораковым веществом, противогиперпролиферативным веществом или противовирусным веществом выборочно в сочетании с фармацевтически приемлемым носителем, добавкой или наполнителем. Практически любой рак может быть излечен с применением соединений в соответствии с настоящим изобретением. Иллюстративные типы рака, которые подвергаются лечению, включают, например,рак желудка, толстой кишки, прямой кишки, печени, поджелудочной железы, легких, молочных желез,шейки матки, тела матки, яичников, простаты, яичек, мочевого пузыря, почек, мозга/центральной нервной системы, головы и шеи, горла, лимфогранулематоз, некоджкинскую лимфому, множественную миелому, лейкемию, меланому, острый лимфолейкоз, острый миелобластный лейкоз, саркому Юинга, мелкоклеточный рак легкого, хориокарциному, рабдомиосаркому, аденомиоцистосаркому, нейробластому,лейкоз ворсистых клеток, рак ротовой полости/глотки, пищевода, гортани, почек, лимфому и т.д. Отмечено, что при применении LFMAU или его производного при лечении рака проявляется незначительная, если вообще проявляется, токсичность в организме-хозяине, а при введении в сочетании с другим противораковым веществом при лечении рака у пациента он в основном не является токсичным,и в некоторых случаях он фактически может проявлять токсичность в меньшей степени, чем другое противораковое вещество, вводимое отдельно, что является неожиданным результатом. Краткое описание чертежей Фиг. 1-6 - воздействие LFMAU либо в отдельности, либо в сочетании с другими противораковыми веществами на опухоли, как указано на чертежах и в экспериментальном разделе; фиг. 7-9 - воздействие L-dT и LFMAU или L-dT либо в отдельности, либо в сочетании с другими противораковыми веществами на опухоли, как указано на чертежах и в экспериментальном разделе; фиг. 10-12 - воздействие LFMAU в отдельности и в сочетании с гемцитабином на рост опухоли толстой кишки у мышей Rag 1.-4 016838 Подробное описание изобретения В настоящем описании термин "соединение", если не указано иное, относится к любому конкретному химическому соединению, приведенному в настоящем описании. В рамках его использования в настоящем контексте термин обычно относится к единичному соединению, предпочтительно к L- аномеру FMAU или к его различным, рацемическим, энантиомерно обогащенным (как минимум до 75, 85,95, 98, 99% или 99+% знантиомерного обогащения) пролекарственным или производным формам в соответствии с настоящим описанием. Соединения по формуле, используемые в настоящем изобретении,обычно называют L-FMAU, L-dT (также "LdT" или "LDT") или их производными. Неожиданным результатом является тот факт, что соединения в соответствии с настоящим изобретением проявляют низкую токсичность по отношению к клеткам-хозяевам, если вообще проявляют таковую, при лечении рака. В настоящем описании термин "эффективный", если не указано иное, используется для описания количества соединения, которое в данном контексте используют для достижения или получения запланированного результата независимо от того, относится ли этот результат к лечению гиперпролиферативного патологического состояния, хронического воспалительного заболевания, вирусной инфекции, такой как инфекция гепатита С, опухоли, включающей канцерогенную опухоль или иной тип рака, либо к лечению предопухолевых состояний или иной(ых) клетки(-ок), которые экспрессируют аномальные или чужеродные белки или иммуногены на клеточной поверхности. В соответствии с некоторыми особенностями, относящимися к совместному введению соединения в соответствии с настоящим изобретением с другим противораковым веществом, настоящее изобретение относится к усилению противоракового воздействия другого противоракового соединения. Указанный термин включает все другие термины эффективного количества или эффективной концентрации, описание которых приведено в настоящей заявке. Что касается противоракового эффекта, указанный эффект может представлять собой один или несколько эффектов, ингибирующих дальнейший рост опухолевых или раковых клеток, снижая вероятность или устраняя метастазы, либо вызывая гибель клеток в опухолевых или раковых клетках, что приводит к уменьшению опухоли, либо к снижению количества раковых клеток, либо к предотвращению повторного роста опухоли или рецидиву рака после того, как наступила ремиссия опухоли или рака пациента. Как указывалось, LFMAU, LDT или их производные могут проявлять противораковый эффект в отдельности и/или могут усиливать способность другого противоракового вещества проявлять аддитивный или синергетический противораковый эффект (т.е. более чем аддитивный). В случае противораковых эффективных количеств количества используемого активного вещества могут превышать в два раза, три раза,пять раз или даже десять раз или более количество, используемое для лечения противовирусных инфекций/показаний. Это связано с тем фактом, что при лечении рака пациент имеет возможность переносить значительно большие количества лекарственного препарата, которые не рекомендуются для использования при лечении противовирусных показаний, т.к. токсичность может создать проблему при более высоких уровнях концентрации (даже несмотря на то, что соединения обладают относительно низкой токсичностью). Термин "пациент" или "субъект" используют на протяжении всего текста настоящего описания изобретения для описания животного, в основном млекопитающего, и предпочтительно человека, которому предоставляется лечение, включая профилактическое лечение с применением композиций в соответствии с настоящим изобретением. Для лечения указанных инфекций, заболеваний или патологических состояний, являющихся специфическими для конкретного животного, такого как человеческий пациент,термин "пациент" относится к указанному конкретному животному. Термин "фармацевтически приемлемая соль" используется по всему тексту описания изобретения для описания формы соли одной или нескольких композиций (и в исключительно предпочтительных аспектах настоящего изобретения - фосфатные соли), которые представлены для повышения растворимости соединения в солевом растворе для парентеральной доставки или в желудочном соке желудочнокишечного тракта пациента с целью обеспечения растворения и биодоступности соединений. Фармацевтически приемлемые соли включают соли, полученные из фармацевтически приемлемых неорганических или органических оснований и кислот. Приемлемые соли включают соли, полученные из таких щелочных металлов, как калий и натрий, таких щелочно-земельных металлов, как кальций, магний, и, в частности, аммониевые соли других многочисленных кислот, хорошо известных в фармацевтической области. Натриевые и калиевые соли являются исключительно предпочтительными в качестве нейтрализующих солей карбоновых кислот и композиций, содержащих фосфат свободной кислоты в соответствии с настоящим изобретением. Термин "соль" означает любую соль, совместимую с применением соединений в соответствии с настоящим изобретением. В том случае, когда соединения применяют при фармацевтических показаниях, включая лечение неоплазии, в том числе рака, термин "соль" означает фармацевтически приемлемую соль, сольват или полиморф, совместимый с применением соединений в качестве фармацевтических веществ. Термин "фармацевтически приемлемое производное", или "производное", используют по тексту описания изобретения для описания любой фармацевтически приемлемой формы пролекарства (такой как сложный эфир, либо простой эфир, либо иная группа пролекарства), которая при введении пациенту обеспечивает непосредственное или косвенное поступление настоящего соединения или активного мета-5 016838 болита настоящего соединения. Термин "алкил" означает в своем контексте С 1-С 20, предпочтительно C1-C10 линейный, разветвленно-цепочечный или циклический полностью насыщенный углеводородный радикал, который выборочно может быть замещен, например, фенильной группой. Термин "простой эфир" означает C1-C20 эфирную группу, образованную из кислородной или алкильной группы в положении на сахарной части соединений в соответствии с настоящим изобретением, и предпочтительно содержащую как минимум одну кислородную группу внутри алкильной цепи. Термин "алкил" также включает аралкильные группы, такие как бензильные группы, фенильная группа которых может быть выборочно замещена. Термин "ацил" используют по всему тексту описания изобретения для описания группы в положении 5' или 3' аналога соединения по формуле (т.е. в положении свободного гидроокисла в синтоне сахара), содержащего С 1-С 20 линейную, разветвленную или циклическую алкильную цепь, или родственной группы в соответствии с приведенным в настоящем патенте описанием. Ацильная группа в положении 5' или 3' (R1 или R2) в сочетании с соответствующей гидроксильной группой приводит к образованию сложного эфира, который после применения может быть расщеплен с образованием свободной формы в соответствии с настоящим изобретением. Ацильные группы в соответствии с настоящим изобретением могут быть представлены следующей структурой: где R4 обозначает С 1-С 20 линейную, разветвленную или циклическую алкильную группу, алкоксиалкил, арилоксиалкил, такой как феноксиметил, арил, алкокси, все из которых, в частности, могут быть выборочно замещены. Предпочтительными ацильными группами являются группы, где R4 обозначает С 1-С 10 алкильную группу. Ацильные группы в соответствии с настоящим изобретением также включают, например, ацильные группы, полученные из бензойной кислоты и родственных кислот, 3-хлорбензойной кислоты, сукциновую, каприновую и капроновую, лауриновую, миристиновую, пальмитиновую, стеариновую и олеиновую группы, аминокислоты, в частности, в том числе определенные фармацевтически приемлемые сульфонатные группы, которые также считаются ацильными группами для целей настоящего описания. Специалистам в данной области техники должно быть очевидно, что ацильные группы, используемые в настоящем изобретении, предназначены либо для синтезирования целевых фармацевтических соединений, либо для использования в качестве пролекарственных форм в соответствии с настоящим изобретением. Термин "фосфатный эфир" или "фосфодиэфир" используют по всему тексту описания изобретения для описания монофосфатных групп в положении 5' или 3' рибозной части или сахарного синтона (предпочтительно в положении 5'), которые диэтерифицируют таким образом, чтобы фосфатная группа стала нейтральной, т.е. имела нейтральный заряд. Термин "неоплазия" или "рак" используют по всему тексту описания изобретения для обозначения патологического процесса, приводящего к образованию или росту раковой, или злокачественной неоплазмы, т.е. аномальной ткани, растущей за счет клеточной пролиферации, нередко быстрее, чем нормальная ткань, и продолжающей расти после исчезновения стимулов, инициировавших новый рост. В злокачественных неоплазмах частично или полностью отсутствует структурная организация и функциональная координация с нормальной тканью, и большинство из них проникает в окружающие ткани, метастазируют на несколько участков, вероятно, рецидивируют после попыток их удаления и вызывают летальный исход пациента в случае ненадлежащего лечения. В целях настоящего описания термин "неоплазия" используют для описания всех раковых патологических состояний, и он охватывает, или включает, патологический процесс, связанный со злокачественными, гематогенными, асцитическими и солидными опухолями. Репрезентативные типы рака включают, например, рак желудка, толстой кишки,прямой кишки, печени, поджелудочной железы, легких, молочных желез, шейки матки, тела матки, яичников, простаты, яичек, мочевого пузыря, почек, мозга/центральной нервной системы, головы и шеи,горла, лимфогранулематоз, некоджкинскую лимфому, множественную миелому, лейкемию, меланому,острый лимфолейкоз, острый миелобластный лейкоз, саркому Юинга, мелкоклеточный рак легкого, хориокарциному, рабдомиосаркому, аденомиоцистосаркому, нейробластому, лейкоз ворсистых клеток, рак ротовой полости/глотки, пищевода, гортани, почек, лимфому и т.д., которые могут подвергаться лечению с помощью одного или нескольких соединений в соответствии с настоящим изобретением. Термин "опухоль" используют для описания злокачественного или доброкачественного роста либо возникновения опухоли. Термин "гиперпролиферативное патологическое состояние" относится к патологическому состоянию, при котором происходит неконтролируемый рост клеток независимо от того, является ли этот рост раковым или нет. Такое патологическое состояние может быть выражено псориазом, остроконечными кондиломами или иными заболеваниями гиперпролиферативного клеточного роста, включающими гиперпролиферативные кератиноцитные заболевания, в том числе гиперкератоз, ихтиоз, кератодермию или красный плоский лишай, при этом все из указанных патологических состояний могут подвергаться лече-6 016838 нию с применением соединений в соответствии с настоящим изобретением. "Антигиперпролиферативный" относится к тому факту, что соединение предназначено для лечения гиперпролиферативных патологических состояний или заболеваний. Противораковые соединения с исключительно низким уровнем токсичности или не обладающие токсичностью также рассматриваются в качестве антигиперпролиферативных соединений в соответствии с настоящим изобретением. Термин "противораковое соединение" или "противораковое вещество" используется для описания любого соединения (включая его производные), которые могут быть применены для лечения рака. Противораковые соединения, предназначенные для использования в настоящем изобретении, могут вводиться с одним или несколькими L-FMAU или его производными с той целью, чтобы L-FMAU или его производные соединения обеспечили усиление эффекта противоракового соединения при лечении рака у пациента в соответствии с настоящим изобретением. Во многих случаях совместное введение L-FMAU или его производного и другого противоракового соединения приводит к синергетическому противораковому эффекту. Иллюстративные противораковые соединения, предназначенные для использования в настоящем изобретении для совместного введения с L-FMAU, или его производным, включают антиметаболиты, вещества, которые в широком смысле слова характеризуются как антиметаболиты, ингибиторы топоизомеразы I и II, алкилирующие вещества и микроканальные ингибиторы (например, таксол), а также ингибиторы тирозинкиназы (например, сурафениб), ингибиторы EGF киназы (например, тарцева или эрлотиниб) и ингибиторы ABL киназы (например, гливек или иматиниб). Противораковые соединения, предназначенные для использования в настоящем изобретении, включают, например, алдеслейкин; алемтузумаб; алитретионин: аллопуринол; алтретамин; амифостин; анастрозол; мышьяковистый ангидрид; аспарагиназу; BCG Live; бексаротен; блеомицин; бусульфан; калустерон; капецитабин; карбоплатин; кармустин; полифепрозан 20 с кармустином; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтинальфа; даунорубицин,дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; липосомный доксорубицин; дромостанолон пропионат; эпирубицин; эстрамустин эпоэтин альфа; этопозид фосфат; этопозид(L-PAM); меркаптопурин (6-МР); месна; метотрексат; метоксален; митомицин С; митотан; митоксантрон; нандролон фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим; пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказу; ритуксимаб; сарграмостим; стрептозоцин; сурафениб; тальк; тамоксифен; тарцеву; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG); тиотепу; топотекан; торемифен; тозитумомаб; трастузумаб; третиноин (ATRA); урациловый иприт; валрубицин; валторцитабин (монозиготный LDC); винбластин; винорелбин; золедронат и их смеси. Термин "биологически активный компонент" включает любой биологически активный компонент,в том числе пролекарство из активного компонента, которое может быть введено в сочетании либо сLFMAU, либо LDT, либо производным (таким как пролекарственная форма) в соответствии с настоящим изобретением, и может включать активные компоненты или их производные, образующие компоненты двойного действия, в которых биологически активный компонент или его производное соединение или его производные (в общем называемые конъюгатами), являются химически связанными в соответствии с приведенным описанием. Дополнительно к противораковым веществам в соответствии с вышеприведенным описанием биологически активные компоненты могут включать ряд противовирусных веществ, в том числе, например, нижеприведенные вещества, являющиеся полезными для лечения ВИЧ, вирусного гепатита В и иных вирусных инфекций, а также вещества, обеспечивающие лечение гиперпролиферативных заболеваний и хронических воспалительных заболеваний, таких как артрит, в том числе ревматоидный артрит и, в частности, остеоартрит. Дополнительно к описанным выше противораковым веществам иллюстративные биологически активные компоненты, которые могут быть химически связаны с LFMAU, либо с LDT, либо с производным в соответствии с приведенным описанием, включают, например: атазанавир (BMS-232632), в котором используется свободная вторичная гидроксильная группа;bis(POM)-PMEA (адефовир дипивоксил), в котором используется свободная аминная группа;bis(POC)-PMPA (тенофовир дизопроксил), в котором используется свободная аминная группа; этекавир, в котором используется первичная гидроксильная группа на карбоциклическом сахарном синтоне; индинавир (криксиван, MK-639 L-735,524, выпускаемый компанией Merck), в котором используется свободная вторичная гидроксильная группа;KHI-227 (киностатин, выпускаемый компанией Nikko Kyodo Co.), в котором используется свободная вторичная гидроксильная группа: 2-[3-[3-(S)-(тетрагидрофуранилокси)карбонил]амино]-4-фенил-2(R)-гидроксибутил-N-(1,1-диметилэтил)декагидро-3-изохинолинкарбоксамид (аналог фуранил уретана изохин-CON, выпускаемый компаниейMerck), в котором используется свободная вторичная гидроксильная группа; карбаминовая кислота, [3-[(4-метоксифенил)сульфонил](циклопенилметил)амино-2-гидрокси-1(фенилметил)пропил]-, эфир тетрагидрофуранила (VB-11,328, выпускаемый компанией Vertex), в котором используется свободная вторичная гидроксильная группа;KNI-174, выпускаемый компанией Nikko Kyodo Co., в котором используется свободная вторичная гидроксильная (или свободная аминная) группа;Val-Val-Sta, выпускаемый компанией Sandoz (Австрия), в котором используется свободная вторичная гидроксильная группа;CPG53820, выпускаемый компанией Ciba-Geigy, в котором используется свободная вторичная гидроксильная группа;bis-Val HOEt-N2 азапептид изостер, в котором используется свободная вторичная гидроксильная группа; производное фосфинового амида G2-Syrn компании Hoechst AG, в котором используется свободная аминогруппа; 2,5-диамино-N,N'-бис-(N-бензилаксикарбонилуелил)-1,6-дифенил-3(S),4(S)-гексанедиол BzOCValPhe[diCHOH(SS)PheValBzOC компании Abbott, в котором используется свободная вторичная гидроксильная группа; 2,5-диамино-N,N'-бис-(N-бенизоксикарбонилуелил)-1,6-дифенил-3(R),4(R)-гексанедиол BzOCValPhe[diCHOH(RR)PheValBzOC компании Abbott, в котором используется свободная аминогруппа; бис-(S-ацетил-2-тиоэтил)фофсотриэфир ddA или [бис-(SATE)ddAMP], в котором используется свободный амин;BILA 2186 BS (Bio-Mega/Boehringer Ingelheim), в котором используется свободная аминогруппа; агенераза (ампренавир; VX-478; 141W94) компаний Vertex/Kissei/Glaxo Wellcome на свободной вторичной гидроксильной или аминной группе; А-98881 (производное азациклической мочевины) компании Abbott, в котором используется свободная вторичная гидроксильная группа или фенольная гидроксильная группа; А-83962 (производное рифонавира) компании Abbott, в котором используется свободная аминогруппа; А-80987 (производное рифонавира) компании Abbott, в котором используется свободная аминогруппа;(2-нафтакарбонил)Asn[декарбонилфе-гидроксиэтил]ПроОтертБутил или 2NaphCOAsnPhe[CHOHCH2]Pro-OtBu компании Roche, в котором используется свободный вторичный гидроксил; производное Valyl Cbz 2-аминобензилстатина компании Sandoz, в котором используется свободный вторичный гидроксил или амин; производное Valyl Cbz 2-аминобензилстатина компании Sandoz, в котором используется свободный гидроксил; производное 10H-2(Cbz-ValNH)3PhPr [14] парациклофана компании Sandoz, в котором используется свободный вторичный гидроксил; производное 10H-2(Cbz-ValNH)3PhPr [13]парациклофана компании Sandoz, в котором используется свободный вторичный гидроксил; производное 10H-2(Cbz-ValNH)3PhPr [13]метациклофана компании Sandoz, в котором используется свободный вторичный гидроксил; производное 10H-2(Cbz-Tle)3PhPr [14]парациклофана компании Sandoz, в котором используется свободный вторичный гидроксил; 1-(20HPr)-4-замещенный пиперазин (циклопропил), производное тиенилкарбамата (компанииMerck), в котором используется свободная вторичная гидроксильная группа; 1-(20HPr)-4-замещенный пиперазин (циклобутил), производное тиенилкарбамата (компания Merck),в котором используется свободная вторичная гидроксильная группа; 1-(20HPr)-4-замещенный пиперазин (3-пентил), производное тиенилкарбамата (компания Merck), в котором используется свободная вторичная гидроксильная группа; производное 10H-2(Cbz-ValNH)3PhPr[17]парациклофана (компания Sandoz), в котором используется свободная вторичная гидроксильная группа; А-81525 (компания Abbott), в котором используется свободная вторичная гидроксильная группа; ХМ 323 (DMP-323 компании DuPont Merck), в котором используется свободная первичная или вторичная гидроксильная группы; типранавир (U-140690 или PHU-140690 компании PharmaciaUpjohn), в котором используется фенольная гидроксильная группа; производные тиенилуретанатиенопирида-CON (НОСН 2 СН 2 изостер компании Lilly) (бензилзамещенное производное или метилмеркаптофенилзамещенные производные), в котором используются свободные вторичные гидроксильные группы;SDZ PRI 053 (компания Sandoz), в котором используется свободная вторичная гидроксильная груп-8 016838 па;SD146 (компания DuPont Merck), в котором используется любая из свободных вторичных гидроксильных групп; телинавир (SC-52151 компании Searle/Monsanto), в котором используется свободная вторичная гидроксильная группа или амин;(R)2QuinCOAsnPhe[CHOHCH2]PipCONNtBu (компания Roche), в котором используется свободная вторичная гидроксильная группа или амин; сахинавир (инвираза или RO 31-8959 компании Roche), в котором используется свободная вторичная гидроксильная группа или амин; производное сахинавира/мелфинавира (компания Lilly), в котором используется свободная вторичная гидроксильная группа; аналог изохин-CON Thf-Thf уретана (компания Merck), в котором используется свободная вторичная гидроксильная группа; аналог изохин-CON тиенил уретана (компания Merck), в котором используется свободная вторичная гидроксильная группа;R-87366 (аналог АНРВА компании Sankyo), в котором используется свободная аминогруппа;DMP 460 (компании Dupont Merck/Avid), в котором используются свободные вторичные гидроксильные группы или любая из анилиновых аминогрупп;L685,434 (компания Merck), в котором используется свободная вторичная гидроксильная группа; производное L685,434-6-гидроксила (компания Merck), в котором используется свободная вторичная гидроксильная группа;L685,434-OEtNMe2 (компания Merck), в котором используется свободная вторичная гидроксильная группа; производное L685,434-OPrMorph (компания Merck), в котором используется свободная вторичная гидроксильная группа;L689,502 (компания Merck), в котором используется свободная вторичная гидроксильная группа; лазинавир (CGP 61755 компании CIBA/Novartis), в котором используется свободная вторичная гидроксильная группа; алувиран (лопинавир, АВТ-378, RS-346 A157378 компании Abbott), в котором используется свободная вторичная гидроксильная группа; аналог нелфинавироктагидротиенопиридина (компания Lilly), в котором используется свободная вторичная гидроксильная группа; Р 9941 (компания DuPot Merck), в котором используется любая из свободных вторичных гидроксильных групп; палинавир (BILA 2011 BS компаний BIO-MEGA/Boehringer Ingelheim), в котором используется свободная вторичная гидроксильная группа; пенициллин, аналог 2-изохин-OHPrNH2 (компания Glaxo Wellcome), в котором используется наряду с другими свободная вторичная гидроксильная группа. Вышеуказанные активные соединения и иные соответствующие биологически активные компоненты, предназначенные для использования в аспекте двойного антагониста настоящего изобретения, могут быть найдены на веб-сайте NIH по адресу: http://www.niaid.nih.gov/daids/dtpdb/, соответствующие части которых инкорпорированы в настоящее описание путем отсылки. Термин "совместное введение", или "комбинаторная терапия", используют для описания терапии,при которой применяют как минимум два активных соединения в эффективных количествах для лечения рака или иных патологических состояний или заболеваний, описание которых приведено в настоящем патенте. Несмотря на то что термин "совместное введение" включает одновременное введение двух активных соединений пациенту, необязательно, чтобы соединения вводились пациенту одновременно, хотя эффективные количества отдельных соединений будут одновременно присутствовать в организме пациента. Соединения в соответствии с настоящим изобретением могут быть введены с одним или несколькими противораковыми веществами, включающими антиметаболиты, алкилирующие вещества, ингибиторы топоизомеразы I и топоизомеразы II, а также, в частности, микроканальные ингибиторы. Противораковые соединения, предназначенные для использования в настоящем изобретении, включают, например, алдеслейкин; алемтузумаб; алитретионин; аллопуринол; алтретамин; амифостин; анастрозол; мышьяковистый ангидрид; аспарагиназу; BCG Live, бексаротен; блеомицин; бусульфан; калустерон; капецитабин; карбоплатин; кармустин; полифепрозан 20 с кармустином; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтинальфа; даунорубицин, дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; липосомный доксорубицин; дромостанолон пропионат; эпирубицин; эстрамустин эпоэтин альфа; этопозид фосфат; этопозид (VP-16); экземестан; филграстим; флоксуридин; флударабин; фторурацил (5FU); фульвестрант; гемцитабин, гемтузумаб озогамицин; гливек; гозерелин ацетат; гидроксимочевину; ибритумомаб тиуксетан; идарубицин; ифосфамид; иматиниб мезилат; интерферон альфа-2 а; интерферон альфа-2b; иринотекан; летрозол; лейковорин; ломустин (CCNU); меклоретамин (азотистый иприт); меге-9 016838 строл ацетат; мелфалан (L-PAM); меркаптопурин (6-МР); месну; метотрексат; метоксален; митомицин С; митотан; митоксантрон; нандролон фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим; пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказу; ритуксимаб; сарграмостим; стрептозоцин; сурафеииб; тальк; тамоксифен; тарцеву; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG); тиотепа; топотекан; торемифен; тозитумомаб; трастузумаб; третиноин (ATRA); урациловый иприт; валрубицин; валторцитабин (монозиготный LDC); винбластин; винорелбин; золедронат и их смеси. Настоящее изобретение включает лекарственные препараты, содержащие терапевтически приемлемые соли соединений настоящего изобретения. Кислоты, используемые для приготовления фармацевтически приемлемых солей присоединения кислоты вышеуказанных соединений, применяемых в настоящем изобретении, являются кислотами, образующими нетоксичные соли присоединения кислоты, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфанат, этансульфанат,бензолсульфанат, р-толуолсульфанат и памоат [т.е., в частности, соли 1,1'-метилен-бис-(2-гидрокси-3 нафтоат)]. Изобретение также включает лекарственные препараты, содержащие соли присоединения основания настоящих соединений. Химические основания, которые могут быть использованы в качестве реагентов для приготовления фармацевтически приемлемых солей оснований настоящих соединений, являющихся кислыми по своей природе, являются основания, образующие нетоксичные соли присоединения основания с такими соединениями. Такие нетоксичные соли присоединения основания включают без ограничений соли, полученные из таких фармакологически приемлемых катионов, как катионы щелочных металлов (например, калий и натрий) и катионы щелочно-земельных металлов (например, кальций и магний), аммоний, или водорастворимые соли присоединения амина, такие как N-метилглюкамин(меглумин), и низшие алканоаммониевые и иные соли присоединения основания фармацевтически приемлемых органических аминов. Лекарственные препараты в соответствии с настоящим изобретением могут быть составлены с применением известного способа и путем применения одного или нескольких фармацевтически приемлемых носителей, и они также могут быть совместно введены в рецептурах контролируемого высвобождения. Фармацевтически приемлемые носители, которые могут быть использованы в указанных фармацевтических композициях, включают без ограничения ионообменные вещества, окись алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как проламин сульфат, вторичный кислый фосфат натрия, вторичный кислый фосфат калия, хлорид натрия, соли цинка, коллоидная окись кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрийкарбокисметилцеллюлозу, полиакрилаты, воски, полиэтиленполиоксипропилен-блокполимеры и ланолин. Лекарственные препараты в соответствии с настоящим изобретением можно вводить перорально,парентерально, с помощью ингаляционных спреев, топикально, ректально, назально, буккально, вагинально или с помощью имплантированных сосудов. В настоящем описании термин "парентеральный" включает методы подкожной, внутривенной, внутримышечной, интраартикулярной, интрасуновиальной,интрастернальной, интратекальной, интрагепатической, интралезиональной и интракраниальной инъекции и инфузионные методы. Предпочтительным является пероральное, интраперитонеальное или внутривенное введение композиции. Стерильные инъецируемые формы лекарственных препаратов в соответствии с настоящим изобретением могут представлять собой водные или масляные суспензии. Рецептура суспензий может быть составлена с применением известных в данной области техники способов путем применения приемлемых диспергирующих или смачивающих веществ и суспендирующих веществ. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или стерильную инъецируемую суспензию в нетоксичном парентерально приемлемом растворителе или разбавителе, например, как раствор в 1,3-бутандиоле. В перечень приемлемых сред и растворителей, которые могут найти применение, входит вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели может быть применено безвкусное летучее масло, включая синтетические моно- или диглицериды. Такие жирные кислоты, как олеиновая кислота и ее глицеридные производные, являются полезными при приготовлении инъецируемых препаратов, также как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, в частности, в их полиоксиэтилированных вариантах. Указанные масляные растворы или суспензии могут также содержать длинноцепочечные спиртовые растворители или диспергаторы, такие как спирт Ph. Helv или аналогичный спирт. Лекарственные препараты в соответствии с настоящим изобретением могут быть введены перо- 10016838 рально в любой перорально приемлемой лекарственной форме, включая, без ограничений, капсулы, таблетки, водные суспензии или растворы. В случае применения таблеток для перорального приема наиболее часто используемые носители включают лактозу и кукурузный крахмал. Также обычно добавляют смазывающие вещества, такие как стеарат магния. Для перорального приема в капсульной форме полезные разбавители включают лактозу и высушенный кукурузный крахмал. При необходимости перорального приема водных суспензий активный ингредиент сочетают с эмульгирующими и суспендирующими веществами. При необходимости также могут быть добавлены определенные подсластители, ароматизаторы и красители. Кроме того, лекарственные препараты в соответствии с настоящим изобретением можно вводить в форме суппозиториев для ректального введения. Указанные фармацевтические композиции могут быть приготовлены путем смешивания вещества с приемлемым нераздражающим наполнителем, являющимся твердым при комнатной температуре, но разжижающимся при ректальной температуре, и, таким образом, указанные композиции расплавляются в прямой кишке, высвобождая лекарственное средство. Такие материалы включают кокосовое масло, пчелиный воск и полиэтиленгликоли. Лекарственные препараты в соответствии с настоящим изобретением можно вводить локально, в частности, для лечения рака кожи, псориаза и иных заболеваний, возникающих в коже или на коже. Приемлемые локальные рецептуры легко приготавливаются для каждого из указанных участков или органов. Локальное применение для нижней части кишечника может быть осуществлено в виде рецептуры ректального суппозитория (см. выше) или в виде приемлемой рецептуры, вводимой с помощью клизмы. Также могут быть использованы локально приемлемые трансдермальные пластыри. Для локального применения лекарственные препараты могут быть приготовлены в виде приемлемой мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Носители для локального применения соединений в соответствии с настоящим изобретением включают, без ограничений, минеральное масло, вазелиновое масло, жидкий вазелин, пропиленгликоль, полиоксиэтилен, соединение полиоксипропилена, эмульгирующий воск и воду. В альтернативных случаях лекарственные препараты могут быть составлены в виде жидкого крема или крема, содержащего активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически приемлемых носителя. Приемлемые носители включают, без ограничений,минеральное масло, моностеарат сорбитана, полисорбат 60, воск цетиловых сложных эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду. Для офтальмического использования лекарственные препараты могут быть составлены в виде микронизированных суспензий в изотоническом, рН отрегулированном стерильном солевом растворе, либо предпочтительно в виде растворов в изотоническом рН отрегулированном стерильном солевом растворе,либо с таким консервантом, как хлорид бензилалкония или без него. В альтернативных случаях для офтальмического применения фармацевтические композиции могут быть составлены в виде мази, такой как вазелин. Лекарственные препараты в соответствии с настоящим изобретением могут быть введены путем назальной аэрозоли или путем ингаляции. Такие композиции приготавливают с применением хорошо известных в данной области техники способов получения фармацевтических рецептур, и они могут быть приготовлены в виде растворов в солевом растворе с применением бензилового спирта или иных приемлемых консервантов, промоторов абсорбции с целью повышения биодоступности, фторуглеродов и/или иных известных солюбилизирующих или диспергирующих веществ. Количество соединения в лекарственных препаратах в соответствии с настоящим изобретением, которое может сочетаться с материалами носителя с целью получения монолитной лекарственной формы,изменяется в зависимости от организма-хозяина и заболевания, подлежащего лечению, а также конкретного способа введения. Предпочтительно лекарственные препараты должны быть составлены в рецептуру, содержащую от приблизительно 0,5 до приблизительно 750 мг, более предпочтительно от приблизительно 1 до приблизительно 600 мг и наиболее предпочтительно от приблизительно 10 до приблизительно 500 мг активного ингредиента. Специалистам в данной области техники также должно быть очевидно, что конкретные лекарственные дозы и режим лечения для любого конкретного пациента зависят от широкого ряда факторов, включающих активность конкретного применяемого соединения, возраст, вес тела, общее состояние здоровья,пол, питание, время приема, скорость экскреции, сочетание лекарственных средств, решение лечащего врача и степень тяжести конкретного заболевания или состояния, подлежащие лечению. Другие аспекты настоящего изобретения предусматривают создание способов лечения опухолей,рака, предраковых клеток и патологических изменений, клеток, экспрессирующих аномальный или чужеродный белок клеточной поверхности или антигены, псориаза, остроконечных кондилом (папиллом),хронических воспалительных заболеваний, таких как артрит, ревматоидный артрит и остеоартрит, заболеваний гиперпролиферативного роста клеток, включая гиперпролиферативные кератиноцитные заболевания, такие как гиперкератоз, ихтиоз, кератодермия или красный плоский лишай и инфекции, вызванные вирусом гепатита С, при этом способ включает введение пациенту, нуждающемуся в лечении, эффективного количества соединения в соответствии со следующей формулой:R1 и R2 независимо обозначают Н, С 2-С 21 ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу; или его фармацевтически приемлемой соли. В предпочтительных аспектах настоящего изобретения вышеуказанное соединение совместно вводят как минимум с одним дополнительным противораковым веществом или веществом, являющимся эффективным против заболеваний гиперпролиферативного роста клеток. В других предпочтительных аспектах настоящего изобретения R1 обозначает Н, C2-C18 ацильную группу или фосфатную группу и R2 обозначает Н. Конкретные примеры фармацевтически приемлемых производных LFMAU или LDT включают без ограничения соединения, в которых R1 и R2 независимо выбраны из группы, состоящей из алкила и ацила, в частности, включающих, без ограничения, метил, этил, пропил, бутил, пентил, гексил, изопропил,изобутил, сек-бутил, трет-бутил, изопентил, амил, трет-пентил, 3-метилбутирил, водородный сукцинат,3-хлорбензоат, циклопентил, циклогексил, бензоил, ацетил, пивалоил, мезилат, пропионил, бутирил, валерил, капроновую, каприловую, каприновую, лауриновую, миристиновую, пальмитиновую, стеариновую, олеиновую кислоты и аминокислоты, включающие без ограничения, аланил, валинил, лейцинил,изолейцинил, пролинил, фенилаланинил, триптофанил, метионинил, глицинил, серинил, треонинил, цистеинил, тирозинил, аспарагинил, глютаминил, аспартоил, глютаоил, лизинил, аргининил и гистидинил, и в которых один из R1 и R2 может обозначать Н.LFMAU, LDT и их производные могут быть получены в форме фармацевтически приемлемых солей. Для целей настоящего описания термин "фармацевтически приемлемые соли", или "комплексы",относится к солям или комплексам LFMAU и/или LDT, сохраняющим требуемую биологическую активность исходного соединения и создают минимальный нежелательный токсикологический эффект, если вообще создают такой эффект. Неограничивающие примеры таких солей включают: (а) соли присоединения кислоты, образованные органическими кислотами (например, хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т.д.), и соли,образованные органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфокислота, нафталиндисульфоновая кислота и полигалактуроновая кислота; (b) соли присоединения основания, образованные катионами поливалентных металлов, таких как цинк, кальций, висмут, барий, магний, алюминий,медь, кобальт, никель, кадмий, натрий, калий и т.д., либо органическим катионом, образованным из N,Nдибензилэтилендиамина, аммония или этилендиамина; либо (с) сочетания (а) и (b); например, соль танната цинка и т.д. Модификации активного соединения, в частности, в позициях 5'-0 и 3'-0 могут влиять на растворимость, биодоступность и скорость метаболизма активных видов (препаратов), тем самым обеспечивая контроль над доставкой активных видов. Кроме того, модификации могут влиять на противораковую активность соединения, в некоторых случаях повышая активность по сравнению с исходным соединением. Такая оценка может быть легко проведена путем получения производного и испытания его противораковой активности в соответствии с описанными способами или иным способом, известным специалистам в данной области техники. Получение и введение активных соединений и композиций LFMAU или его производных могут быть получены в соответствии с подробно раскрытыми способами в одном или нескольких патентах США U.S. pat. nos. 5565438; 5808040; 6894159; 5558736; 5587362 и 5567688, соответствующие части которых инкорпорированы в настоящее описание путем отсылки, или в соответствии с любым иным способом, известным специалистам в данной области техники. LDT или его производные могут быть легко приготовлены с применением хорошо известных в данной области техники способов. Соединения, содержащие два активных вещества, связывающих LFMAU или LDT или его производные с другим веществом, могут быть легко получены с применением стандартных способов. Могут быть легко использованы соответствующие блокирующие группы и вещества для формирования связывающих групп. Люди, лошади, собаки, жвачные животные и иные животные и, в частности, млекопитающие, болеющие раком, могут быть излечены путем введения в организм пациента (субъекта) эффективного количества LFMAU, LDT или его производного, включая их фармацевтически приемлемую соль выборочно в фармацевтически приемлемом носителе или разбавителе, либо в отдельности, либо в сочетании с другими известными противораковыми или фармацевтическими веществами. Указанное лечение может- 12016838 быть также проведено в сочетании с другими известными раковыми терапиями, такими как лучевая терапия или хирургическое вмешательство. Указанные соединения могут быть введены по соответствующему пути, например перорально, парентерально, внутривенно, интрадермально, подкожно или топикально в жидкой, кремообразной, гелеобразной или твердой форме или в форме аэрозоля. Активное соединение включено в фармацевтически приемлемый носитель или разбавитель в количестве, достаточном для доставки в организм пациента терапевтически эффективного количества для достижения требуемого показания, не вызывая тяжелых токсических эффектов у проходящего лечение пациента. Предпочтительная доза активного соединения в отношении всех упомянутых в данном описании заболеваний находится в пределах от приблизительно 10 нг/кг до 300 мг/кг, предпочтительно от 0,1 до 100 мг/кг в день, более предпочтительно от 0,5 до приблизительно 25 мг на 1 кг веса тела реципиента в день. Стандартная топическая доза находится в пределах 0,01-3% весового соотношения в приемлемом носителе. Обеспечивается удобное введение соединения в любой приемлемой стандартной лекарственной форме, включая, без ограничения, лекарственную форму, содержащую 1-3000 мг, предпочтительно 5-500 мг активного ингредиента на стандартную лекарственную форму. Пероральная доза в пределах приблизительно 25-250 мг обычно является удобной. Активный ингредиент предпочтительно вводят для достижения пиковых концентраций в плазме активного соединения в пределах приблизительно 0,00001-30 мМ, предпочтительно приблизительно 0,1-30 мкм. Такие концентрации могут быть достигнуты, например, путем внутривенной инъекции раствора или состава активного ингредиента выборочно в солевом растворе или в водной среде, либо путем введения в виде болюса активного ингредиента. Концентрация активного соединения в композиции лекарственного средства зависит от скорости абсорбции, распределения, инактивации и экскреции лекарственного средства, а также от других факторов, известных специалистам в данной области техники. Следует отметить, что значения доз также варьируются в зависимости от степени тяжести состояния, которое необходимо улучшить. Специалистам в данной области техники должно быть очевидно, что в отношении любого конкретного субъекта необходимо регулировать конкретные дозы с течением времени в соответствии с индивидуальными потребностями и профессиональным решением лица, вводящего или контролирующего ввод композиции, и что диапазоны концентраций, приведенные в настоящем описании, являются исключительно иллюстративными и не ограничивают объем или реализацию заявляемой композиции. Активный ингредиент может быть введен в виде одной дозы либо может быть разделен на ряд меньших по количеству доз для введения через различные интервалы времени. Пероральные композиции обычно включают инертный разбавитель или съедобный носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. В целях перорального терапевтического введения активное соединение или его пролекарственное производное могут быть включены в наполнители и использованы в форме таблеток, пастилок или капсул. В композицию в качестве ее части могут быть включены фармацевтически совместимые связывающие вещества и/или адъюванты. Таблетки, пилюли, капсулы, пластинки и т.д. могут содержать любой из следующих ингредиентов или соединений аналогичного характера: связующее вещество, такое как микрокристаллическая целлюлоза, трагакант или желатин; наполнитель, такой как крахмал или лактоза; диспергирующее вещество,такое как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или стеротес; вещества, способствующие скольжению, такие как коллоидальная двуокись кремния; подслащивающее вещество, такое как сахароза или сахарин; или ароматизирующее вещество,такое как перечная мята, метил салицилат или апельсиновый ароматизатор. В тех случаях, когда стандартная лекарственная форма представляет собой капсулу, дополнительно к материалу вышеуказанного типа она может содержать жидкий носитель, такой как нелетучее масло. Кроме того, стандартные лекарственные формы могут содержать другие различные материалы, модифицирующие физическую форму единичной дозы, например покрытия из сахара, шеллака или кишечно-растворимых веществ. Активное соединение или его фармацевтически приемлемая соль могут быть введены в виде компонента эликсира, суспензии, сиропа, облатки, жевательной резинки и т.д. Кроме активных соединений сироп может содержать сахарозу в качестве подслащивающего вещества и определенные консерванты,красители, пигменты и ароматизаторы. Активное соединение или его фармацевтически приемлемые соли также могут быть смешаны с другими активными материалами, не ослабляющими желаемого действия, или с материалами, дополняющими желаемое действие, такими как противораковые вещества, антибиотики, противогрибковые препараты, противовоспалительные препараты или противовирусные соединения. В предпочтительных аспектах настоящего изобретения LFMAU, LDT или их производные вводят совместно с другим противораковым веществом в соответствии с приведенным описанием. Растворы или суспензии, используемые для парентерального, интердермального, подкожного или топикального применения, могут включать следующие компоненты: стерильный растворитель, такой как вода для инъекций, солевой раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль- 13016838 или иные синтетические растворители; антибактериальные вещества, такие как бензиловый спирт или метиловые парабены; антиоксиданты, такие как аскорбиновая кислота или бисульфат натрия; хелатирующие вещества, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты; и вещества для регулирования тоничности, такие как хлорид натрия и декстроза. Исходный препарат может быть заключен в ампулы, одноразовые шприцы или флаконы лекарственных средств для многократного приема, изготовленные из стекла или пластика. При внутривенном введении предпочтительными носителями являются физиологический солевой раствор или физиологический раствор с фосфатным буфером (PBS). В одном примере осуществления настоящего изобретения активные соединения получают с носителями, защищающими соединение от быстрого выведения из организма, такими как составы контролируемого высвобождения, включающие импланты и системы микроинкапсулированной доставки. Могут быть использованы такие биоразлагаемые и биосовместимые полимеры, такие как этиленвинилацетат,полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы приготовления таких составов очевидны специалистам в данной области техники. Липосомальные суспензии также могут являться фармацевтически приемлемыми носителями. Они могут быть получены в соответствии со способами, известными специалистам в данной области техники,например, описанными в патенте U.S. Pat. No. 4522811 (который инкорпорирован в описание путем отсылки в его полноте). Например, липосомные составы могут быть получены путем растворения соответствующего(-их) липида(-ов) (таких как стеароилфосфатидилэтаноламин, стеароилфосфатидилхолин,арахадоилфосфатидилхолин и холестерин) в неорганическом растворителе, который затем выпаривают,в результате чего остается тонкая пленка высушенного липида на поверхности сосуда. Затем в сосуд вводят водный раствор активного соединения. Затем сосуд взбалтывают вручную для снятия липидного материала с боковых стенок сосуда и диспергирования липидных агрегатов, в результате чего образуется липосомальная суспензия. Биологическая активность Был использован широкий спектр биологических методов, которые были приняты специалистами в данной области техники, с целью оценки противораковой активности соединений. С целью оценки активности раскрытых в настоящем описании соединений может быть использован любой из этих методов. Одним широко распространенным методом оценки является применение тестовых панелей линий раковых клеток Национального института рака. Указанные тесты позволяют провести оценку противораковой активности in vitro конкретных соединений и получить прогнозные данные в отношении использования прошедших испытаний соединений in vivo. Другие методы включают проведение оценок in vivo воздействия соединений на опухолевые клетки человека и мыши, имплантированные или привитые бестимусным мышам. Примеры В этих примерах предмет настоящего изобретения, LFMAU и/или LDT, используют для определения эффекта на рост опухоли в ряде штаммов мышей. В основном был использован нижеприведенный протокол для имплантирования мышам линий опухолевых клеток и испытания лекарственных средств на предмет противоракового эффекта. Перенос Colon 38. Эту опухоль переносят из солидной опухоли, растущей в мышах. Несколько грамм (при допущении 1 г на 1 мл) продавливают через стерильное сито и суспендируют в среде культур ткани без фенолрота и фетальной телячьей сыворотки (сбалансированный солевой раствор) при 2 мл/г опухоли. Далее 0,1 мл указанной суспензии опухоли имплантировали в пах мыши. После имплантации спустя период времени от 10 дней до 2 недель (когда опухоли могли бы быть измерены с помощью штангенциркуля), если не указано иное, приступали к проведению лекарственной терапии. Имплантация человеческого HepG2. Гепатокарциному человека выращивали в тканевой культуре в виде монослоя в минимальной поддерживающей среде с 10% фетальной телячьей сывороткой. Клетки выращивали в нескольких колбах,далее собирали их панкреатином и ресуспендировали в сбалансированном солевом растворе при 108 на 1 мл. 0,1 мл указанной суспензии имплантировали в пах мыши бестимусной мыши (с недостатком Тклеток для выращивания тканей человека). Затем приблизительно спустя 10 дней, когда обеспечивалось измерение опухоли, приступали к лекарственной терапии. В целом, лекарственные средства доставляли со скоростью 0,1 мл на 10 г веса тела. Каждый день производили взвешивание мышей с целью определения инъецируемого количества и индекса токсичности. Объем опухоли рассчитывали исходя из измерений по следующей формуле: длина (мм)ширина (мм)ширина (мм)П/6 (в виде % 1-го дня). Эксперимент 1. Эксперимент был разработан для определения воздействия LFMAU на рост опухоли мыши (colon 38) в иммунокомпетентной мыши. На фиг. 1 показано, что LFMAU замедляет рост мышиной опухоли- 14016838 группе через 5 дней произошло увеличение размера опухоли в два раза, в то время как только у 5 из 15 мышей в группе, подвергшейся лечению с применением LFMAU, опухоль увеличилась в два раза. Эксперимент 2. Эксперимент 2 проводили для определения влияния LFMAU на повышение эффекта противоракового лекарственного средства (оксалиплатин) на рост colon 38 у самок мышей BDF1. На фиг. 2 приведены результаты эксперимента, из которых видно, что LFMAU определенно повысил противораковое воздействие оксалиплатина на colon 38. Эффект наблюдался в течение длительного времени после прекращения лечения с применением LFMAU. Эксперимент 3. Эксперимент 3 проводили для определения влияния LFMAU на повышение эффекта противоракового лекарственного средства (оксалиплатин) на рост colon 38 у мышей NCR Nu/Nu. На фиг. 3 приведены результаты эксперимента, из которых видно, что LFMAU определенно повысил противораковое воздействие оксалиплатина на colon 38 у бестимусных мышей. Данный эксперимент указывает на то, что действие LFMAU не является, вероятно, феноменом Т-клеток. Эффект наблюдался в течение длительного времени после прекращения лечения с применением LFMAU. Эксперименты 4 и 5. Проводили эксперимент по определению повышения противоопухолевого воздействия LFMAU с оксалиплатином в отношении других классов противораковых веществ. В ходе эксперимента определяли влияние LFMAU на повышение (эффекта) фторурацила (FU) (галогенированного урацила), гемцитабина(аналог D нуклеозида) и LOddC (аналог L нуклеозида) на colon 38 у самок мышей BCF1. На фиг. 4 и 5 приведены результаты эксперимента, из которых видно, что LFMAU определенно повысил противораковый эффект FU, LOddC и гемцитабина. В случае с FU эффект LFMAU наблюдался в течение длительного времени после прекращения лечения с применением LFMAU. В случае с LOddC LFMAU повышает противораковый эффект, и в случае с гемцитабином LFMAU уменьшает объем опухоли ниже ее начального уровня на 1-й день. Эксперимент 6. Данный эксперимент включает меланому В 16, которую подкожно инъецировали мышам С 57 BL6,прошедшим предварительное лечение в течение 5 дней с применением LFMAU (В.I.D. - два раза в день) и в последующем в течение десяти дней с применением LFMAU (B.I.D. - два раза в день) при 50 мг/кг при отсутствии другого противоракового соединения. В результате проведенного эксперимента было получено среднеквадратичное отклонение размеров опухоли 831 + 474,5 у мышей контрольной группы и 160 + 150,3 у мышей, проходивших лечение с применением LFMAU. LFMAU, определенно, продемонстрировал противораковый эффект на меланому В 156. Был проведен отдельный эксперимент по определению воздействия LFMAU на опухоли человека,на этот раз имплантация была произведена мышам NCR Nu/Nu (бестимусным мышам) с целью проверки воздействия LFMAU в отдельности и в сочетании с другими противораковыми веществами (фиг. 6). Эксперимент продемонстрировал, что LFMAU является эффективным против опухоли человека, и при сочетании с другими противораковыми лекарственными средствами было продемонстрировано, что имело место повышение эффекта, в ряде случаев произошло снижение начальных объемов опухоли по сравнению с днем 1-м. Эксперимент 7. Эксперимент был разработан для определения воздействия LDT и LFMAU в отдельности и в сочетании с 5-фторурацилом с лейковорином рескью на рост опухолей мыши (colon 38) у иммунокомпетентных мышей. Лекарственные средства вводили мышам в соответствии с нижеприведенным графиком: контрольная группа - только среда для лекарства; 5-фторурацил/лейковорин - 150 мг/кг каждого средства интраперитонеально один раз на день 1-й;LDT - 100 мг/кг перорально два раза в день в течение 5 дней;LFMAU - 50 мг/кг перорально два раза в день в течение 5 дней. Объединенные группы получали оба вида лечения в соответствии с вышеприведенным графиком. На фиг. 7 показано, что LDT (L-dT) и LFMAU замедляют рост мышиной опухоли colon 38 у иммунокомпетентных мышей. Эффект наблюдался в течение длительного времени после завершения лечения на 5 день. В каждом случае воздействие каждого из указанных веществ на противораковую активность 5 фторурацил/лейковорин оказался существенным (аддитивный или синергетический). Эксперимент 8. Эксперимент 8 проводили с целью определения влияния LDT (L-dT) и LFMAU (15 мг/кг каждого средства в соответствии с вышеприведенным графиком) на повышение эффекта противораковых лекарственных средств (оксалиплатин 10 мг/кг интраперитонеально один раз на день 1) на рост colon 38 у самок мышей C57BL6. На фиг. 8 приведены результаты эксперимента, в соответствии с которыми какLDT, так и LFMAU определенно повышают противоопухолевое воздействие оксалиплатина на colon 38(аддитивное или синергетическое). Эффект наблюдался в течение длительного времени после прекращения лечения указанными веществами. Эксперимент 9.- 15016838 Эксперимент 9 проводили с целью определения влияния LDT (15 мг/кг в соответствии с вышеприведенным графиком) на повышение эффекта противораковых лекарственных средств (оксалиплатин 10 мг/кг интраперитонеально один раз на день 1) на HepG2 у иммунодефицитных самцов мышей NCRNu/Nu. На фиг. 9 приведены результаты эксперимента, в соответствии с которыми LDT оказался эффективным в отдельности и в сочетании с оксалиплатином и определенно повысил противоопухолевое воздействие оксалиплатина на HepG2 (аддитивное или синергетическое). Эффект наблюдался после прекращения лечения указанными веществами. Эксперимент 10. Эксперимент 10 проводили с целью определения влияния L-FMAU на повышение воздействия противораковых лекарственных средств (гемцитабин 400 мг/кг интраперитонеально один раз на 1 день), как показано на фиг. 10-12, на мышей Rag 1 (тяжелая комбинированная иммунонедостаточность - отсутствие продуцирования зрелых Т-клеток или В-клеток). В данном эксперименте colon 38 мышиной опухоли был пересажен мышам Rag 1 и иммунодефицитным мышам С 57 В 1 (но с продуцированием зрелых Т-клеток). Мыши интраперитонеально получили гемцитабин один раз на первый день (400 мг/кг) и LFMAU получали на дни 1-5 при двух различных концентрациях (15 + 50 мг/кг). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение по меньшей мере одного соединения общей структурной формулыR1 и R2 независимо обозначают Н, С 2-С 21 ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу; или его фармацевтически приемлемой соли для изготовления лекарственного препарата для лечения у пациента рака, являющегося раком желудка, толстой кишки, прямой кишки, поджелудочной железы, легких, молочных желез, шейки матки, тела матки, яичников, простаты, яичек, мочевого пузыря, почек, мозга/центральной нервной системы, головы и шеи, горла, лимфогранулематозом, некоджкинской лимфомой, множественной миеломой, лейкемией, меланомой, саркомой Юинга, мелкоклеточным раком легкого, хориокарциномой, рабдомиосаркомой, аденомиоцистосаркомой, нейробластомой, лейкозом ворсистых клеток, раком ротовой полости/глотки, носоглотки, пищевода, гортани, почек и лимфомой. 2. Применение по п.1, в котором пациентом является человек и R1 и R2 независимо обозначают Н,С 2-С 18 ацильную или фосфатную группу. 3. Применение по п.2, в котором X обозначает F. 4. Применение по любому из пп.1-3, в котором указанное раковое заболевание является опухолью. 5. Применение по п.4, в котором раковое заболевание выбрано из группы, включающей рак толстой кишки, прямой кишки, поджелудочной железы и меланому. 6. Применение по любому из пп.1-3, в котором раковым заболеванием является рак поджелудочной железы или лейкемия. 7. Применение по п.4, в котором раковым заболеванием является рак поджелудочной железы. 8. Применение по п.4, в котором раковым заболеванием является рак толстой кишки. 9. Применение по п.4, в котором раковым заболеванием является рак мочевого пузыря. 10. Применение по п.4, в котором раковым заболеванием является рак простаты. 11. Применение по п.4, в котором раковым заболеванием является рак молочной железы. 12. Применение по п.4, в котором раковым заболеванием является рак легких. 13. Применение по п.4, в котором раковым заболеванием является рак носоглотки. 14. Применение по п.4, в котором раковым заболеванием является рак яичников. 15. Применение по п.4, в котором раковым заболеванием является лимфома. 16. Применение по п.4, в котором раковым заболеванием является меланома. 17. Применение эффективного количества по меньшей мере двух соединений при изготовлении лекарственного препарата для лечения рака, причем первое соединение выбирают из соединений общей структурной формулыR1 и R2 независимо обозначают Н, С 2-С 21 ацильную группу, фосфатную, дифосфатную, трифосфатную или фосфодиэфирную группу; или их фармацевтически приемлемых солей и второго соединения, представляющего собой дополнительное противораковое вещество, в котором раковым заболеванием является рак желудка, толстой кишки, прямой кишки, поджелудочной железы, легких, молочных желез, шейки матки, тела матки, яичников, простаты, яичек, мочевого пузыря, почек, мозга/центральной нервной системы, головы и шеи,горла, лимфогранулематоз, некоджкинская лимфома, множественная миелома, лейкемия, меланома, саркома Юинга, мелкоклеточный рак легкого, хориокарцинома, рабдомиосаркома, аденомиоцистосаркома,нейробластома, лейкоз ворсистых клеток, рак ротовой полости/глотки, пищевода, гортани, почек или лимфома. 18. Применение по п.17, в котором пациентом является человек и R1 и R2 независимо обозначают Н или С 2-С 18 ацильную группу. 19. Применение по п.17, в котором пациентом является человек и R1 и R2 обозначают Н. 20. Применение по п.17, в котором указанное дополнительное противораковое вещество является антиметаболитом, ингибитором топоизомеразы I и II, алкилирующим веществом и микроканальным ингибитором. 21. Применение по п.20, в котором указанное дополнительное противораковое соединение выбрано из группы, включающей алдеслейкин; алемтузумаб; алитретионин; аллопуринол; алтретамин; амифостин; анастрозол; мышьяковистый ангидрид; аспарагиназу; BCG Live; бексаротен; блеомицин; бусульфан; калустерон; капецитабин; карбоплатин; кармустин; полифепрозан 20 с кармустином; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтинальфа; даунорубицин, дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; липосомный доксорубицин; дромостанолон пропионат; эпирубицин; эстрамустин эпоэтин альфа; этопозид фосфат; этопозид (VP-16); экземестан; филграстим; флоксуридин; флударабин; фторурацил (5-FU); фульвестрант; гемцитабин, гемтузумаб озогамицин; гливек; гозерелин ацетат; гидроксимочевину; ибритумомаб тиуксетан; идарубицин; ифосфамид; иматиниб мезилат; интерферон альфа 2 а; интерферон альфа-2b; иринотекан; летрозол; лейковорин; ломустин (CCNU); меклоретамин (азотистый иприт); мегестрол ацетат; мелфалан (L-PAM); меркаптопурин (6-МР); месну; метотрексат: метоксален; митомицин С; митотан; митоксантрон; нандролон фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим, пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказа; ритуксимаб; сарграмостим; стрептозоцин; сурафениб; тальк; тамоксифен; тарцеву; темозоломид; тенипозид(VM-26); тестолактон; тиогуанин (6-TG); тиотепу; топотекан; торемифен; тозитумомаб; трастузумаб; третиноин (ATRA); урациловый иприт; валрубицин; валторцитабин (монозиготный LDC); винбластин; винорелбин; золедронат и их смеси. 22. Применение по п.21, в котором дополнительное противораковое соединение выбрано из группы,включающей алдеслейкин; алемтузумаб; алитретионин; аллопуринол; алтретамин; амифостин; анастрозол; мышьяковистый ангидрид; аспарагиназу; BCG Live; бексаротен; блеомицин; бусульфан; калустерон; капецитабин; карбоплатин; кармустин; полифепрозан 20 с кармустином; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтинальфа; даунорубицин, дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; дромостанолон пропионат; эпирубицин; эстрамустин эпоэтин альфа; этопозид фосфат; этопозид(L-PAM); меркаптопурин (6-МР); месну; метотрексат; метоксален; митомицин С; митотан; митоксантрон; нандролон фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим; пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказу; ритуксимаб; сарграмостим; стрептозоцин; сурафениб; тальк; тамоксифен; тарцеву; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG),тиотепу; топотекан; торемифен; тозитумомаб; трастузумаб; третиноин (ATRA); урациловый иприт; валрубицин; валторцитабин (монозиготный LDC), винбластин; винорелбин; золедронат и их смеси. 23. Применение по п.22, в котором дополнительное противораковое соединение выбрано из группы,включающей алдеслейкин; алемтузумаб; алитретионин; аллопуринол; алтретамин; амифостин; анастрозол; мышьяковистый ангидрид; аспарагиназу; BCG Live; бексаротен; блеомицин; бусульфан; калустерон; капецитабин; карбоплатин; кармустин; полифепрозан 20 с кармустином; целекоксиб; хлорамбуцил; цисплатин; кладрибин; циклофосфамид; цитарабин; дакарбазин; дактиномицин; актиномицин D; дарбепоэтинальфа; даунорубицин, дауномицин; денилейкин дифтитокс; дексразоксан; доцетаксел; доксорубицин; дромостанолон пропионат; эпирубицин; эстрамустин эпоэтин альфа; этопозид фосфат; этопозид(L-PAM); меркаптопурин (6-МР); месну; метотрексат; метоксален; митомицин С; митотан; митоксантрон; нандролон фенпропионат; нофетумомаб; LOddC; опрелвекин; оксалиплатин; паклитаксел; памидронат; пегадемазу; пегаспаргазу; пегфилграстим; пентостатин; пипоброман; пликамицин; митрамицин; порфимер натрия; прокарбазин; хинакрин; расбуриказу; ритуксимаб; сарграмостим; стрептозоцин; сурафениб; тальк; тамоксифен; тарцеву; темозоломид; тенипозид (VM-26); тестолактон; тиогуанин (6-TG); тиотепу; топотекан; торемифен; тозитумомаб; трастузумаб; третиноин (ATRA); урациловый иприт; валрубицин; валторцитабин (монозиготный LDC); винбластин; винорелбин; золедронат и их смеси. 24. Применение по п.17, в котором X обозначает F. 25. Применение по п.18, в котором X обозначает F. 26. Применение по п.19, в котором X обозначает F. 27. Применение по п.20, в котором X обозначает F. 28. Применение по п.17, в котором раковое заболевание является раковой опухолью. 29. Применение по п.17, в котором раковое заболевание выбрано из группы, включающей рак толстой кишки, прямой кишки, поджелудочной железы и меланому. 30. Применение по п.17, в котором раковое заболевание является раком толстой кишки. 31. Применение по п.17, в котором раковое заболевание является раком мочевого пузыря. 32. Применение по п.17, в котором раковое заболевание является раком простаты. 33. Применение по п.17, в котором раковое заболевание является раком молочной железы. 34. Применение по п.17, в котором раковое заболевание является раком поджелудочной железы. 35. Применение по п.17, в котором раковое заболевание является лейкемией. 36. Применение по п.17, в котором раковое заболевание является раком легких. 37. Применение по п.17, в котором раковое заболевание является раком носоглотки. 38. Применение по п.17, в котором раковое заболевание является раком яичников. 39. Применение по п.17, в котором раковое заболевание является лимфомой. 40. Применение по п.17, в котором раковое заболевание является меланомой. 41. Применение по п.17, в котором указанное дополнительное противораковое вещество является фторурацилом, оксалиплатином, гемцитабином или их смесями.
МПК / Метки
МПК: A01N 43/04, C07H 19/048, C07H 19/00, A61K 31/70
Метки: ldt, патологических, рака, состояний, заболеваний, лечения, способы, lfmau, других, клевудина, телбивудина, применением
Код ссылки
<a href="https://eas.patents.su/23-16838-sposoby-lecheniya-raka-i-drugih-zabolevanijj-ili-patologicheskih-sostoyanijj-s-primeneniem-klevudina-lfmau-i-telbivudina-ldt.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения рака и других заболеваний или патологических состояний с применением клевудина (lfmau) и телбивудина (ldt)</a>
Предыдущий патент: Способ обогащения и транспортировки твердого топлива на тепловую электростанцию
Следующий патент: Сжимаемые объекты, имеющие заданное внутреннее давление, в комбинации с буровой жидкостью для формирования бурового раствора переменной плотности
Случайный патент: 3-({[3-бутил-3-этил-7-(метилокси)-1,1-диоксидо-5-фенил-2,3,4,5-тетрагидpо-1,4-бензотиазепин-8-ил]метил}амино)пентандиовая кислота